Изобретение относится к металлургии цветных и редких металлов, физически и химически прочно связанных с природным или антропогенным сырьем. В частности, оно относится к способам извлечения металлов из технологически упорного сырья, особенно драгметаллов.
Наиболее близким по технической сущности к заявленному является способ извлечения металлов из технологически упорного сырья (RU 2113526 C1, опубл. 20.06.1998). В известном способе проводят термообработку руды и(или) ее концентрата в присутствии реагента водных хлоридов магния. Шихтовку измельченной руды и(или) ее концентрата с реагентом проводят в определенном соотношении, а термообработку - при 400-600° С в течение 20-40 мин.
К недостаткам известного способа можно отнести недостаточно высокую степень извлечения металлов.
Задачей изобретения является создание термоэлектрохимического технологического процесса вскрытия сырья для повышения коэффициента извлечения и рентабельности производства благородных металлов, сокращение затрат, уменьшение вредных выбросов в окружающую среду, увеличение запасов, а значит, и капитализации полезных ископаемых, вовлечение в промышленный оборот нерентабельных и нетрадиционных источников благородных и цветных металлов.
Поставленная задача решается тем, что способ извлечения металлов из технологически упорного сырья включает измельчение сырья, перемешивание с шихтой из солей и вскрытие смеси в электрической печи при нагреве, охлаждение спека, его выщелачивание при перемешивании реакционной пульпы горячей водой, отделение раствора от нерастворенной части и извлечение металлов из раствора и нерастворенной части, при этом измельчение исходного сырья производят до -0,2 мм, перемешивание ведут с шихтой из солей галогенидов и/или кислородосодержащих солей, состав которой рассчитывают исходя из химического и минералогического состава исходного сырья, вскрытие проводят путем помещения смеси в электрическую печь при температуре 100-120° С, установления со скоростью 8-10° С в минуту в автоматическом режиме температуры 450-560° С и выдержки в течение 1-7 часов при максимальном редокс-потенциале смеси, полученный при вскрытии и охлаждении спек измельчают и выщелачивание ведут в открытом агитационном аппарате.
Целесообразно, чтобы редокс-потенциал смеси был равен 1,8-2,6 В, вскрытие проводилось при подаче кислорода, а отходящие при вскрытии из печи газы, пар и пыль улавливали барботажными установками с извлечением из них легко возгоняемых соединений благородных металлов.
Целесообразно, чтобы при вскрытии создавали магнитное поле, а спек измельчали до -0,1 мм.
Предпочтительно, когда при выщелачивании соблюдают соотношение спека и объема емкости агитационного аппарата 3:10.
Предпочтительно, чтобы температура горячей воды была равна 80-90° С, а соотношение спека и воды равно 1:(2-3), показатель рН пульпы при выщелачивании находился в интервале 1-2, который достигают приливом соляной или серной кислоты.
Целесообразно также, когда отделение раствора от нерастворимой части ведут фильтрованием при температуре 40-60° С и отдельно выделяют из них благородные и цветные металлы, а после их выделения из раствора доизвлекают соли галогенидов, которые повторно используют для приготовления новой порции шихты.
Существующими способами не всегда достигается полнота вскрытия упорной части матрицы руды. И поэтому часть благородных металлов безвозвратно теряется. Например, при окислительном обжиге не обеспечивается полнота вскрытия, к тому же может привести к потерям благородных металлов с пылями, газами, парами. Гидрометаллургические и пирометаллургические процессы не обеспечивают достаточный уровень электрохимического потенциала восстановления и не преобразуют большинство компонентов упорных составляющих руды.
При восстановлении таких составляющих матрицы сырья, как оксиды кремния, алюминия, марганца, магния, различных соединений углерода необходимо иметь окислительный потенциал в пределах 1,3-2,6 В. Например, комплекс золото с алюминием имеет потенциал восстановления - 1,3 В, с титаном - 1,9 В, с кремнием - 2,6 В.
Однако цианированием достигается - 0,9 В, гипохлоритом - 1,3 В, свинцовым глетом - 1,69 В. Эти величины окислительных потенциалов не обеспечивают полноту вскрытия руды и соответственно полноту извлечения благородных металлов, включенные в такие компоненты.
В изобретении используются свойства расплавленных электролитов.
Электролит подбирается из составов: КСl - NaCl, KCl - NaCl - MgCl2, KCl - NaCl - ZnCl2, KCl - NaCl - FеСl3, LiCl - KCl, KCl - NaCl - CaCl2, других галогенидов или кислородосодержащих солей.
Температура плавления эвтектических смесей в двух- и трехкомпонентных системах должна быть в пределах 300 - 450° С.
Например, наиболее легкоплавкие смеси MgCl2 - KCl плавятся при температуре ≈ 425° С. Добавляя в смесь NaCI, получаем смесь, которая уже имеет температуру плавления 396°С. Электропроводность этой тройной смеси при 500° С от 1,3 до 1,9 Ом-1см-1. Она увеличивается с повышением содержания NaCl и уменьшается с повышением содержания MgCl2.
Условные стандартные потенциалы  в расплавленных галогенидах должны быть выбраны таким образом, чтобы они были достаточны для термоэлектрохимического вскрытия сырья и были в пределах от 1,8 до 2,6 В.
в расплавленных галогенидах должны быть выбраны таким образом, чтобы они были достаточны для термоэлектрохимического вскрытия сырья и были в пределах от 1,8 до 2,6 В.
Электрохимические ряды металлов в расплавленных средах NaCl-KCl; NaCl-KCl-MgCl2; LiCl-KCl (см.табл.1)
Электрохимические ряды металлов в расплавленных средах позволяют судить о последовательности выделения их из расплавленных электролитов.
В ионных расплавах происходят окислительные и восстановительные процессы в различных солевых смесях - растворителях. Наибольшие электродные потенциалы металлов в расплавленной эвтектической смеси LiCl-KCl при 450° С имеют литий, магний, алюминий, уран, марганец, цинк.
Все электрохимические процессы являются гетерогенными процессами, протекающими на разделе двух фаз. Такие двухфазные системы называются электродами. Они представляют собой твердые или жидкие материалы с электронной проводимостью металлической или полупроводниковой природы, которые находятся в непосредственном контакте с жидкими или твердыми электролитами, обладающими ионной проводимостью. Термоэлектрохимический процесс, протекающий в электропечи, представляет собой как бы развернутые половинки окислительно-восстановительных реакций: либо только восстановление (на катоде), либо окисление (на аноде).
В роли восстановителя (донора электронов) или окислителя (акцептора) выступает электрический ток, проходящий через электрод. При этом происходит либо ионизация вещества на электроде (например, металла на аноде или хлора на катоде), либо разряд или перезаряд ионов в электролите. В отсутствии внешнего тока на электроде устанавливается динамическое равновесие между одновременно идущими взаимно противоположными процессами окисления и восстановления:
Me↔ Ме
При высоких температурах в ионном обмене между галогенидными расплавами и металлами участвуют в соизмеримых количествах ионы не одной, а двух разных валентностей:
Me↔ xМе
Соотношение концентраций низшей и высшей валентности (n>m), переходящих в электролит, удовлетворяет условию равновесия реакции:
Ме
Металлы, входящие в состав сплава, из которого изготовлен электрод, обмениваются с электролитом своими ионами. При этом каждому составу электрода при равновесии отвечает строго определенное отношение активностей катионов в солевом расплаве.
Так, например, адсорбированный на подкладке хлор обменивается с электролитом своими ионами:
Сl(ад)+е-↔Сl
В среде расплавленных галогенидов при высоких температурах материалами электродов, которые принимали бы непосредственное участие в электродных реакциях, могут быть сульфиды, силициды, бориды, гидриды и другие соединения, составляющие матрицу сырья, с достаточно высокой электронной проводимостью.
Если в электролите в растворенном состоянии одновременно находятся и окисленная, и восстановленная формы, то на любом погруженном в него электроде с электронной проводимостью идут реакции
Ме
Cl2(распл)+2е-↔2Сl
Na
Здесь на границе раздела электрод-электролит возникает скачок электрического потенциала, который называется окислительно-восстановительным или редокс-потенциалом системы Men+/Mem+, Cl2/Cl, Na+/Na
 ,
,
Редокс-потенциал в галогенидных расплавах определяется состоянием окисленной и восстановленной форм химических элементов.
Потенциал любого металлического электрода, по отношению к его ионам при достижении равновесия становится равным окислительно-восстановительному потенциалу окружающего его электролита. Поэтому во время установления равновесного потенциала металлы восстанавливают окисленные формы электролита, в частности свои ионы высшей валентности, т.е. растворяются или, как говорят, коррелируют. Равновесный потенциал металлического электрода, обменивающегося с галогенидным расплавом катионами разных валентностей (Мm+ и Мn+), удовлетворяет равенству:
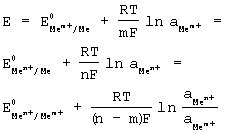
где α - равновесные активности указанных ионов в электролите.
Из этого следует, что между формальным редокс-потенциалом системы ионов Мm+/Мn+ и стандартным электродным потенциалом металла по отношению к этим ионам существует соотношение

Взаимодействие металлов с ионными расплавами протекают самопроизвольно за счет растворения металлов в этих средах.
В ионных расплавах протекают два вида коррозии: химическая и электрохимическая.
Химическая коррозия происходит за счет:
- Взаимодействия металлов с галлоидами с образованием галогенидов;
- Взаимодействия металлов с кислородом, растворенным в ионном расплаве, и кислородом воздуха за счет растворения в ионном расплаве новых порций кислорода;
- Термического разложения кислородосодержащих солей;
- Воды, растворенной в ионном расплаве.
Электрохимическая коррозия зависит от свойств металла и ионного расплава. В галогенидных расплавах окислителями могут являться ионы металлов, в том числе и щелочные, которые способны переходить в субионы. В этом случае коррозия металла может быть выражена такой реакцией:
Me+4Na+=Me2++2Na
на катоде 4Na++2e→ 2Na
на аноде Me→ Me2++2 e
В таком расплаве устанавливается окислительно-восстановительный потенциал

где Me - щелочной металл (Li, Na, К и др.).
В первый момент после погружения металла (Ti, Сu, Fe, Ni, Pt, Co, Au, Pd, Ag и др.) в солевой расплав, пока равновесие еще не установилось, потенциал металла имеет более отрицательное значение, чем редокс-потенциал среды. Поэтому происходит восстановление ионов щелочных металлов до субионов за счет окисления (растворения) погруженных в расплав металла, т.е. идет процесс коррозии.
По мере того как в электродном слое накапливаются ионы растворяющегося металла, его электродный потенциал смещается в сторону более положительных значений. В то же время величина окислительно-восстановительного потенциала смещается в сторону более отрицательных значений. Когда оба потенциала сравняются, наступит равновесие. Дальше коррозия металлов продолжается с постоянной скоростью, обусловленной диффузией. Электрохимической коррозии способствует наличие воды. Ионы водорода, также как и ионы щелочных металлов, можно рассматривать как окислители.
Некоторые металлы обмениваются с расплавленными солями ионами не одной, а нескольких валентностей. Такой солевой расплав может взаимодействовать с ионами более электроположительных металлов, с которыми коррелирующий металл образует сплавы.
Ниже приведены результаты технологического испытания проб термоэлектрохимическим способом. Опыты проводились на навесках не менее 100 г (табл.2)
1. Взяты стандартные образцы проб медно-никелевых руд и хвосты их обогащения:
Кроме благородных металлов переведены в раствор более 90% меди, никеля, кобальта, 76-81% серы. Всего в растворы перешли 70 элементов, в том числе 14 лантаноидов, уран и торий.
2. Взята проба с содержанием в % меди общей - 1.86, Fе2О3 - 4.05, SiO2 - 67.88, Аl2О3 - 10.35, MgO - 6.36, CaO - 1.32, K2O - 2.90, Na2O - 2.67. Серебро определено - 14.59 г/т, золото - 0.27 г/т.
Проба обработана термоэлектрохимическим способом. Из водно-кислого выщелачивания извлечено: 91% меди; 21,1 г/т серебра; 0,93 г/т золота.
3. Взяты пробы из хвостов металлургического горнообогатительного комбината с содержанием компонентов в %: TiO2 - 0.79, Fe - 6.29, V2O5 - 0.049, SiO2 - 46.90, Аl2О3 - 7.55, CaO - 19.4, MgO - 13.6. Содержание благородных металлов в г/т:Au<0.1, Ag=10-20, Pt=0.03-0.1, Pd=0.1-0.05.
Пробы смешивались с шихтой и подвергались термоэлектрохимической обработке. Извлечено: 0,3-0,4 г/т золота, 0,9-1,025 г/т платины, 0,35-0,4 г/т палладия, 0,176-0,190 г/т родия.
Технический результат изобретения:
- комплексно извлекаются благородные, цветные металлы и другие элементы, всего более 70 элементов, в том числе лантаноиды, уран, торий;
- извлекаются благородные металлы в товарный продукт, в 1,5-10 раз и более превышающих исходные содержания;
- извлекаются полезные компоненты из сульфидных, пиратиновых, пиритовых, глинистых, гранитовых, черносланцевых и других упорных руд и антропогенного сырья - хвостов ГОКов, клинкера цинковых производств, зол углей и горючих сланцев, эфелей и др.;
- используется в анализе при определении содержания благородных металлов в геологопоисковых, геологических и других работах, при утверждении и переутверждении запасов месторождений полезных ископаемых;
- сокращает вредные выбросы в окружающую среду;
- снижает энергозатраты, особенно в производстве цветных металлов;
- снижает удельные капиталовложения на производство единицы выпускаемой продукции.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПЕРЕРАБОТКИ СЫРЬЯ, СОДЕРЖАЩЕГО БЛАГОРОДНЫЕ МЕТАЛЛЫ И СУЛЬФИДЫ | 2013 |
|
RU2547056C1 |
| СПОСОБ ПЕРЕРАБОТКИ СУЛЬФИДНОГО СЫРЬЯ, СОДЕРЖАЩЕГО БЛАГОРОДНЫЕ МЕТАЛЛЫ | 2010 |
|
RU2447166C2 |
| СПОСОБ ГИДРОМЕТАЛЛУРГИЧЕСКОГО ИЗВЛЕЧЕНИЯ РЕДКИХ МЕТАЛЛОВ ИЗ ТЕХНОЛОГИЧЕСКИ УПОРНОГО СЫРЬЯ | 1995 |
|
RU2114196C1 |
| СПОСОБ ИЗВЛЕЧЕНИЯ ЗОЛОТА ИЗ ЗОЛОТОСОДЕРЖАЩЕГО ФЛОТАЦИОННОГО КОНЦЕНТРАТА | 2021 |
|
RU2763710C1 |
| Способ выделения благородных металлов из продуктов переработки руд | 2016 |
|
RU2632740C1 |
| СПОСОБ ПЕРЕРАБОТКИ УПОРНЫХ РУД БЛАГОРОДНЫХ МЕТАЛЛОВ | 1997 |
|
RU2113526C1 |
| СПОСОБ ПЕРЕРАБОТКИ ПЛАТИНОСОДЕРЖАЩИХ КОНЦЕНТРАТОВ | 2000 |
|
RU2169780C1 |
| СПОСОБ ИЗВЛЕЧЕНИЯ МЕТАЛЛИЧЕСКОГО ЦИНКА ИЗ ТВЕРДЫХ МЕТАЛЛУРГИЧЕСКИХ ОТХОДОВ | 2021 |
|
RU2830268C1 |
| СПОСОБ ВСКРЫТИЯ МАТЕРИАЛОВ, СОДЕРЖАЩИХ ДРАГОЦЕННЫЕ МЕТАЛЛЫ | 2008 |
|
RU2375476C1 |
| СПОСОБ КОМПЛЕКСНОЙ ПЕРЕРАБОТКИ ОСТАТКОВ ДОМАНИКОВЫХ ОБРАЗОВАНИЙ | 2013 |
|
RU2547369C2 |
Изобретение относится к способам извлечения металлов, особенно благородных, из технологически упорного сырья. Способ включает измельчение сырья до -0,2 мм, перемешивание с шихтой из солей галогенидов и/или кислородсодержащих солей и вскрытие смеси, охлаждение спека, его выщелачивание при перемешивании реакционной пульпы горячей водой и выделение металлов из раствора и из нерастворенной части. Вскрытие проводят путем помещения смеси в электрическую печь при температуре 100-120°С, установления со скоростью 8-10°С в минуту в автоматическом режиме температуры 450-560°С и выдержки в течение 1-7 часов при максимальном редокс-потенциале смеси. Полученный при вскрытии и охлаждении спек измельчают и выщелачивают в открытом агитационном аппарате. Целесообразно, чтобы при вскрытии редокс-потенциал смеси был равен 1,8-2,6 В. Техническим результатом является повышение извлечения металлов, снижение затрат, вовлечение в промышленный оборот нетрадиционных источников благородных и цветных металлов и сокращение вредных выбросов в окружающую среду. 10 з.п. ф-лы, 2 табл.
| СПОСОБ ПЕРЕРАБОТКИ УПОРНЫХ РУД БЛАГОРОДНЫХ МЕТАЛЛОВ | 1997 |
|
RU2113526C1 |
| SU 1540291 A1, 30.01.1994 | |||
| СПОСОБ ГИДРОМЕТАЛЛУРГИЧЕСКОГО ИЗВЛЕЧЕНИЯ РЕДКИХ МЕТАЛЛОВ ИЗ ТЕХНОЛОГИЧЕСКИ УПОРНОГО СЫРЬЯ | 1995 |
|
RU2114196C1 |
| US 4551213 A, 05.11.1985 | |||
| Полуавтомат для тарировки посуды из прозрачного материала | 1958 |
|
SU119685A1 |
| US 5458866 А, 17.10.1995. | |||
Авторы
Даты
2005-01-20—Публикация
2004-04-16—Подача