Область техники
Настоящее изобретение относится к новому классу металлоценовых соединений, к содержащему их катализатору для полимеризации олефинов и к способу полимеразции, осуществляемому в присутствии указанного катализатора. Данное изобретение относится также к соответствующим лигандам, используемым в качестве промежуточных веществ в процессе синтеза указанных металлоценовых соединений, а также к способам получения указанных лигандов и металлоценовых соединений.
Предпосылки изобретения
Металлоценовые соединения с двумя циклопентадиенильными группами являются известными компонентами катализаторов для полимеризации олефинов. В европейском патенте №129368, например, описана каталитическая система для полимеризации олефинов, содержащая (а) бисциклопентадиенильный координационный комплекс с переходным металлом и (b) алюмоксан. Две циклопентадиенильные группы могут быть связаны двухвалентной группой.
Недавно были описаны гетероциклические металлоценовые соединения, используемые для полимеризации альфа-олефинов. Например, в патенте США №5489659 описан класс кремнийсодержащих металлоценовых соединений, предназначенных для полимеризации альфа-олефинов, в которых атом кремния является частью неароматического кольца, конденсированного с циклопентадиенильным кольцом. Металлоцены данного типа используют при полимеризации пропилена. Активность указанных катализаторов на основе металлоценов является неудовлетворительной. В международной заявке на патент WO 98/22486 описан класс металлоценов, содержащих циклопентадиенильный радикал, непосредственно координирующий центральный атом металла, с которым сконденсировано одно или несколько колец, содержащих, по крайней мере, один гетероатом. Указанные металлоцены в сочетании с приемлемым сокатализатором используют для полимеризации таких олефинов, как пропилен. Однако при температурах полимеризации, представляющих промышленный интерес, можно получить лишь низкомолекулярные полимеры, непригодные для большинства применений, и активность указанных каталитических систем, используемых для полимеризации пропилена, является неудовлетворительной.
Желательно получить новый класс металлоценов, которые при использовании в катализаторах для полимеризации олефинов, в частности пропилена, обладают высокой активностью, благодаря чему количество катализатора, остающегося в полученном полимере, является минимальным. Кроме того, желательно иметь высокоактивный катализатор, позволяющий получить полимеры с высокой молекулярной массой, узким молекулярно-массовым распределением, высокой степенью стереорегулярности (изотактичности) и кристалличности.
Настоящее изобретение относится к открытию нового класса металлоценовых соединений, которые отвечают вышеуказанным и другим требованиям.
Первым объектом настоящего изобретения является металлоценовое соединение общей формулы (I):
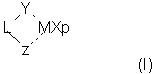
где:
Y означает фрагмент формулы (II)
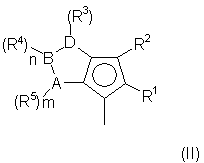
где:
А, В и D, имеющие одинаковые или различные значения, выбраны из элементов групп 14-16 периодической таблицы элементов (новая версия Международного союза теоретической и прикладной химии (IUРАС)) за исключением азота и кислорода;
R1, R2, R3, R4 и R5, имеющие одинаковые или различные значения, выбраны из группы, включающей водород, С1-C20aлкил, С3-С20циклоалкил, С2-С20алкенил, С6-С20арил, С7-С20алкиларил, С7-С20арилалкил, необязательно содержащий гетероатомы, относящиеся к группам 13-17 периодической таблицы элементов;
где два R3 могут образовывать кольцо, имеющее 4-8 атомов, или R3 и R4 могут образовывать кольцо, содержащее 4-8 атомов, которые способны иметь заместители; при условии, что, когда s равно 0 или R3 означает водород, R2 не является водородом;
m, n и s, имеющие одинаковые или различные значения, выбраны из 0, 1 и 2;
m, n и s равны 0, когда А, В и D выбраны соответственно из элементов группы 16 периодической таблицы элементов (новая версия IUРАС) ;
m, n и s равны 1, когда А, В и D выбраны соответственно из элементов группы 15 периодической таблицы элементов (новая версия IUРАС);
m, n и s равны 1 или 2, когда А, В и D выбраны соответственно из элементов группы 14 периодической таблицы элементов (новая версия IUРАС);
и кольцо, содержащее А, В и D, может иметь двойные связи в любых возможных положениях ароматического типа;
Z выбран из вышеуказанного фрагмента формулы (II) и фрагмента формулы (III):
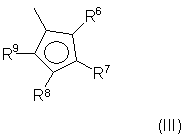
где:
R6, R7, R8 и R9, имеющие одинаковые или различные значения, выбраны из группы, включающей водород, С1-С20алкил, С3-С20циклоалкил, С2-С20алкенил, С6-С20арил, С7-С20алкиларил, С7-С20арилалкил, необязательно содержащий гетероатомы, относящиеся к группам 13-17 периодической таблицы элементов, причем R7 не является водородом; R6 и R7 или R7 и R8 могут необязательно образовывать кольцо, содержащее 4-8 атомов углерода, которые способны иметь заместители;
и когда Z означает фрагмент формулы (II), Y и Z могут иметь одинаковые или различные значения;
L означает дву cхвалентную мостиковую группу, которая предпочтительно выбрана из группы, включающей С1-С20 алкилиден, С3-С20циклоалкилиден, С6-С20арилиден, С7-С20 алкиларилиден, С7-С20арилалкилиден, необязательно содержащие гетероатомы, относящиеся к группам 13-17 периодической таблицы элементов, и силилиден, содержащий до 5 атомов кремния, такой как SiMe2, SiPh2, SiМе2SiМе2;
М означает атом переходного металла, выбранный из элементов, относящихся к группе 3, 4, 5, 6 или к группам лантанидов или актинидов в периодической таблице элементов (новая версия IUРАС);
X, имеющий одинаковые или различные значения, означает атом водорода, атом галогена, группу R10, OR10, 0S02СF3 ОСОR10, SR10, NR
р равно целому числу от 0 до 3, предпочтительно от 1 до
3, и равно степени окисления металла М минус 2; р предпочтительно равно 2;
Переходный металл М предпочтительно является титаном, цирконием или гафнием. Более предпочтительно переходный металл является цирконием.
Заместители Х предпочтительно являются атомами хлора, метильными группами или бензильными группами.
Двухвалентная мостиковая группа L предпочтительно является >Si(R17}2 или >С(R17)2, где R17, имеющий одинаковые или различные значения, выбран из группы, включающей водород, С1-С20алкил, С3-С20циклоалкил, С2-С20aлкенил, С6-С20арил, С7-С20алкиларил, С7-С20арилалкил, необязательно содержащий гетероатомы, относящиеся к группам 13-17 периодической таблицы элементов; и два R17 могут образовывать цикл, содержащий 3-8 атомов, которые способны иметь заместители.
Более предпочтительно двухвалентная мостиковая группа L выбрана из группы, включающей >Si(СН3)2, >Si(С6Н5)2, >СН2 и >С(СН3)2.
А предпочтительно выбран из серы, селена, теллура и полония; более предпочтительно А является серой.
В и В предпочтительно выбраны из группы 14 периодической таблицы элементов (новая версия IUРАС); более предпочтительно В и D являются атомами углерода.
Когда Z означает группу формулы (III), он предпочтительно выбран из соединений формулы (IV):
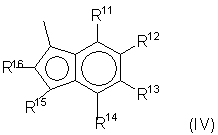
где:
R11, R12, R13, R14, R15 и R16, имеющие одинаковые или различные значения, выбраны из группы, включающей водород, С1-С20алкил, С3-С20циклоалкил, С2-С20aлкенил, С6-С20арил, С7-С20 алкиларил, С7-С20арилалкил, необязательно содержащий гетероатомы, относящиеся к группам 13-17 периодической таблицы элементов; причем R11 и R12, R12 и R13 или R13 и R14 могут образовывать кольцо, содержащее 4-8 атомов, которые способны иметь заместители. R14 и R16 предпочтительно не являются водородом. Более предпочтительно R14 является С6-С20 арильной группой, такой как фенильная или нафтильная группа, и R16 является С1-С20алкильной группой, такой как метильная группа.
Неограничивающими примерами металлоценов по настоящему изобретению являются:
дихлорид диметилсиландиилбис-6-(3-метилциклопентадиенил[1,2-b]тиофен)циркония и метил;
дихлорид диметилсиландиилбис-6-(4-метилциклопентадиенил[1,2-b]тиофен)циркония и метил;
дихлорид диметилсиландиилбис-6-(4-изопропилциклопента-диенил[1,2-b]тиофен)циркония и метил;
дихлорид диметилсиландиилбис-6-(4-трет-бутилциклопента-диенил[1,2-b]тиофен)циркония и метил;
дихлорид диметилсиландиилбис-6-(3-изопропилциклопентадиенил[1,2-b]тиофен)циркония и метил;
дихлорид диметилсиландиилбис-6-(3-фенилциклопента-диенил[1,2-b]тиофен)циркония и метил;
дихлорид диметилсиландиилбис-6-(2,5-диметил-3-фенил-циклопентадиенил[1,2-b]тиофен)циркония и метил;
дихлорид диметилсиландиилбис-6-[2,5-диметил-3-(2-метилфенил)циклопентадиенил[1,2-b]тиофен]циркония и метил;
дихлорид диметилсиландиилбис-6-[2,5-диметил-3-(2,4,6-триметилфенил)циклопентадиенил[1,2-b]тиофен]циркония и метил;
дихлорид диметилсиландиилбис-6-[2,5-диметил-3-мезитиленциклопентадиенил[1,2-b]тиофен]циркония и метил;
дихлорид диметилсиландиилбис-6-(2,4,5-триметил-3-фенилциклопентадиенил[1,2-b]тиофен)циркония и метил;
дихлорид диметилсиландиилбис-6-(2,5-диэтил-3-фенилциклопентадиенил[1,2-b]тиофен)циркония и метил;
дихлорид диметилсиландиилбис-6-(2,5-диизопропил-3-фенилциклопентадиенил[1,2-b]тиофен)циркония и метил;
дихлорид диметилсиландиилбис-6-(2,5-ди-трет-бутил-3-фенилциклопентадиенил[1,2-b]тиофен)циркония и метил;
дихлорид диметилсиландиилбис-6-[2,5-дитриметилсилил-3-фенилциклопентадиенил[1,2-b]тиофен)циркония и метил;
дихлорид диметилсиландиилбис-6-(3-метилциклопентадиенил[1,2-b]силол)циркония и метил;
дихлорид диметилсиландиилбис-6-(3-изопропилциклопента-диенил[1,2-b]силол)циркония и метил;
дихлорид диметилсиландиилбис-6-(3-диметил-3-фенилциклопентадиенил[1,2-b]силол)циркония и метил;
дихлорид диметилсиландиилбис-6-[2,5-диметил-3-фенилциклопентадиенил[1,2-b]силол)циркония и метил;
дихлорид диметилсиландиилбис-6-[2,5-диметил-3-(2-метил-фенил)циклопентадиенил[1,2-b]силол]циркония и метил;
дихлорид диметилсиландиилбис-6-[2,5-диметил-3-(2,4,6-триметилфенил)циклопентадиенил[1,2-b]силол])циркония и метил;
дихлорид диметилсиландиилбис-6-(2,5-триметил-3-мезитиленциклопентадиенил[1,2-b]силол)циркония и метил;
дихлорид диметилсиландиилбис-6-(2,4,5-диэтил-3-фенилциклопентадиенил[1,2-b]силол)циркония и метил ;
дихлорид диметилсиландиилбис-6-(2,5-диэтил-3-фенил-циклопентадиенил[1,2-b]силол)циркония и метил;
дихлорид диметилсиландиилбис-6-(2,5-диизопропил-3-фенил-циклопентадиенил[1,2-b]силол)циркония и метил;
дихлорид диметилсиландиилбис-6-(2,5-ди-трет-бутил-3-фенилциклопентадиенил[1,2-b]силол)циркония и метил;
дихлорид диметилсиландиилбис-6-(2,5-дитриметилсилил-3-фенилциклпентадиенил[1,2-b]силол)циркония и метил;
дихлорид диметилсиландиилбис-6-(3-метилциклопентадиенил[1,2-b]теллурофен)циркония и метил;
дихлорид диметилсиландиилбис-6-(3-изопропилциклопентадиенил[1,2-b]теллурофен)циркония и метил;
дихлорид диметилсиландиилбис-6-(3-фенилциклопентадиенил[1,2-b]теллурофен)циркония и метил;
дихлорид диметилсиландиилбис-6-(2,5-диметил-3-фенил-циклопентадиенил[1,2-b]теллурофен)циркония и метил;
дихлорид диметилсиландиилбис-6-[2,5-диметил-3-(2-метил-фенил)циклопентадиенил[1,2-b]теллурофен]циркония и метил;
дихлорид диметилсиландиилбис-6-[2,5-диметил-3-(2,4,6-триметилфенил)циклопентадиенил[1,2-b]теллурофен]циркония и метил;
дихлорид диметилсиландиилбис-6-[2,5-диметил-3-мезитиленциклопентадиенил[1,2-b]теллурофен]циркония и метил;
дихлорид диметилсиландиилбис-6-(2,4,5-триметил-3-фенил-циклопентадиенил[1,2-b]теллурофен)циркония и метил;
дихлорид диметилсиландиилбис-6-(2,5-диэтил-3-фенил-циклопентадиенил[1,2-b]теллурофен)циркония и метил;
дихлорид диметилсиландиилбис-6-(2,5-диизопропил-3-фенил-циклопентадиенил[1,2-b]теллурофен)циркония и метил;
дихлорид диметилсиландиилбис-6-(2,5-ди-трет-бутил-3-фенилциклопентадиенил[1,2-b]теллурофен)циркония и метил;
дихлорид диметилсиландиилбис-6-(2,5-дитриметилсилил-3-фенилциклопентадиенил[1,2-b]теллурофен)циркония и метил;
дихлорид диметилсиландиилбис-6-(3-метилциклопентадиенил[1,2-b]теллурофен)циркония и метил;
дихлорид диметилсиландиилбис-6-(3-изопропилциклопента-диенил[1,2-b]теллурофен)циркония и метил;
дихлорид диметилсиландиилбис-6-(3-фенилциклопентадиенил[1,2-b]теллурофен)циркония и метил;
дихлорид диметилсиландиилбис-6-(2,5-диметил-3-фенилциклопентадиенил[1,2-b]теллурофен)циркония и метил;
дихлорид диметилсиландиилбис-6-[2,5-диметил-3-(2-метил-фенил)циклопентадиенил[1,2-b]теллурофен]циркония и метил;
дихлорид диметилсиландиилбис-6-[2,5-диметил-3-(2,4,6-триметилфенил)циклопентадиенил[1,2-b]теллурофен]циркония и метил;
дихлорид диметилсиландиилбис-6-[2,5-диметил-3-мезитиленциклопентадиенил[1,2-b]теллурофен]циркония и метил;
дихлорид диметилсиландиилбис-6-(2,4,5-триметил-3-фенилциклопентадиенил[1,2-b]теллурофен)циркония и метил;
дихлорид диметилсиландиилбис-6-(2,5-диэтил-3-фенилциклопентадиенил[1,2-b]теллурофен)циркония и метил;
дихлорид диметилсиландиилбис-6-(2,5-диизопропил-3-фенилциклопентадиенил[1,2-b]теллурофен)циркония и метил;
дихлорид диметилсиландиилбис-6-(2,5-ди-трет-бутил-3-фенилциклопентадиенил[1,2-b]теллурофен)циркония и метил;
дихлорид диметилсилил-6-(2,5-диметил-3-фенилциклопентадиенил[1,2-b]теллурофен)-1-(2-метил-4-фенилинденил)циркония и метил;
дихлорид диметилсиландиилбис-6-(2,5-дитриметилсилил-3-фенилциклопентадиенил[1,2-b]теллурофен)циркония и метил;
дихлорид диметилсиландиилбис-6-(3-метилциклопентадиенил[1,2-b]фосфол)циркония и метил;
дихлорид диметилсиландиилбис-6-(3-изопропилциклопентадиенил[1,2-b]фосфол)циркония и метил;
дихлорид диметилсиландиилбис-6-(3-фенилциклопентадиенил[1,2-b]фосфол)циркония и метил;
дихлорид диметилсиландиилбис-6-(2,5-диметил-3-фенил-циклопентадиенил[1,2-b]фосфол)циркония и метил;
дихлорид диметилсиландиилбис-6-[2,5-диметил-3-(2-метил-фенил)циклопентадиенил[1,2-b]фосфол]циркония и метил;
дихлорид диметилсиландиилбис-6-[2,5-диметил-3-(2,4,6-триметилфенил)циклопентадиенил[1,2-b]фосфол]циркония и метил;
дихлорид диметилсиландиилбис-6-[2,5-диметил-3-мезитиленциклопентадиенил[1,2-b]фосфол]циркония и метил;
дихлорид диметилсиландиилбис-6-(2,4,5-триметил-3-фенилциклопентадиенил[1,2-b]фосфол)циркония и метил;
дихлорид диметилсиландиилбис-6-(2,5-диэтил-3-фенилциклопентадиенил[1,2-b]фосфол)циркония и метил;
дихлорид диметилсиландиилбис-6-(2,5-диизопропил-3-фенилциклопентадиенил[1,2-b]фосфол)циркония и метил;
дихлорид диметилсиландиилбис-6-(2,5-ди-трет-бутил-3-фенилциклопентадиенил[1,2-b]фосфол)циркония и метил;
дихлорид диметилсилил-6-(2,5-диметил-3-фенилциклопентадиенил[1,2-b]фосфол)-1-(2-метил-4-фенилинденил)циркония и метил;
дихлорид диметилсиландиилбис-6-(2,5-дитриметилсилил-3-фенилциклопентадиенил[1,2-b]фосфол)циркония и метил;
дихлорид изопропилиденбис-6-(3-метилциклопентадиенил[1,2-b]тиофен)циркония и метил;
дихлорид изопропилидебис-6-(3-изопропилциклопентадиенил[1,2-b]тиофен)циркония и метил;
дихлорид изопропилиденбис-6-(3-фенилциклопентадиенил[1,2-b]тиофен)циркония и метил;
дихлорид изопропилиденбис-6-(2,5-диметил-3-фенилциклопентадиенил[1,2-b]тиофен)циркония и метил;
дихлорид изопропилиденбис-6-[2,5-диметил-3-(2-метилфенил)циклопентадиенил[1,2-b]тиофен]циркония и метил;
дихлорид изопропилиденбис-6-[2,5-диметил-3-(2,4,6-триметилфенил)циклопентадиенил[1,2-b]тиофен)циркония и метил;
дихлорид изопропилиденбис-6-[2,5-диметил-3-мезитиленциклопентадиенил[1,2-b]тиофен]циркония и метил;
дихлорид изопролиденбис-6-(2,4,5-триметил-3-фенилциклопентадиенил[1,2-b]тиофен)циркония и метил;
дихлорид изопропилиденбис-6-(2,5-диэтил-3-фенилциклопентадиенил[1,2-b]тиофен)циркония и метил;
дихлорид изопропилиденбис-6-(2,5-диизопропил-3-фенилциклопентадиенил[1,2-b]тиофен)циркония и метил;
дихлорид изопропилиденбис-6-(2,5-ди-трет-бутил-3-фенилциклопентадиенил[1,2-b]тиофен)циркония и метил;
дихлорид изопропилиденбис-6-(2,5-дитриметилсилил-3-фенилциклопентадиенил[1,2-b]тиофен)циркония и метил;
дихлорид изопропилиденбис-6-(3-метилциклопентадиенил[1,2-b]силол)циркония и метил;
дихлорид изопропилиденбис-6-(3-метилциклопентадиенил[1,2-b]силол)циркония и метил;
дихлорид изопропилиденбис-6-(3-фенилциклопентадиенил[1,2-b]силол)циркония и метил;
дихлорид изопропилиденбис-6-(2,5-диметил-3-фенилциклопентадиенил[1,2-b]силол)циркония и метил;
дихлорид изопропилиденбис-6-[2,5-диметил-3-(2-метил-фенил)циклопентадиенил[1,2-b]силол)циркония и метил;
дихлорид изопропилиденбис-6-[2,5-диметил-3-(2,4,6-триметилфенил)циклопентадиенил[1,2-b]силол]циркония и метил;
дихлорид изопропилиденбис-6-[2,5-диметил-3-мезитиленциклопентадиенил[1,2-b]силол]циркония и метил;
дихлорид изопропилиденбис-6-[2,4,5-триметил-3-фенилциклопентадиенил[1,2-b]силол)циркония и метил;
дихлорид изопропилиденбис-6-(2,5-диэтил-3-фенилциклопентадиенил[1,2-b]силол)циркония и метил;
дихлорид изопропилиденбис-6-(2,5-диозопропил-3-фенилциклопентадиенил[1,2-b]силол)циркония и метил;
дихлорид изопропилиденбис-6-(2,5-ди-трет-бутил-3-фенилциклопентадиенил[1,2-b]силол)циркония и метил;
дихлорид изопропилиденбис-6-(2,5-дитриметилсилил-3-фенилциклопентадиенил[1,2-b]силол)циркония и метил;
дихлорид изопропилиденбис-6-(3-метилциклопентадиенил[1,2-b]теллурофен)циркония и метил;
дихлорид изопропилиденбис-6-(3-изопропилциклопентадиенил[1,2-b]теллурофен)циркония и метил;
дихлорид изопропилиденбис-6-(3-фенилциклопентадиенил[1,2-b]теллурофен)циркония и метил;
дихлорид изопропилиденбис-6-(2,5-димел-3-фенилциклопентадиенил[1,2-b]теллурофен)циркония и метил;
дихлорид изопропилиденбис-6-[2,5-диметил-3-метилфенил)циклопентадиенил[1,2-b]теллурофен)циркония и метил;
дихлорид изопропилиденбис-6-[2,5-диметил-3-(2,4,6-триметилфенил)циклопентадиенил[1,2-b]теллурофен]циркония и метил;
дихлорид изопропилиденбис-6-[2,5-диметил-3-мезитиленциклопентадиенил[1,2-b]теллурофен]циркония и метил;
дихлорид изопропилиденбис-6-(2,4,5-триметил-3-фенилциклопентадиенил[1,2-b]теллурофен)циркония и метил;
дихлорид изопропилиденбис-6-(2,5-диэтил-3-фенилциклопентадиенил[1,2-b]теллурофен)циркония и метил;
дихлорид изопропилиденбис-6-(2,5-диизопропил-3-фенилциклолентадиенил[1,2-b]теллурофен)циркония и метил;
дихлорид изопропилиденбис-6-(2,5-ди-трет-бутил-3-фенилциклопентадиенил[1,2-b]теллурофен)циркония и метил;
дихлорид изопропилиденбис-6-(2,5-дитриметилсилил-3-фенилциклопентадиенил[1,2-b]теллурофен)циркония и метил;
дихлорид изопропилиденбис-6-(3-метилциклопентадиенил[1,2-b]теллурофен)циркония и метил;
дихлорид изопропилиденбис-6-(3-изопропилциклопентадиенил[1,2-b]теллурофен)циркония и метил;
дихлорид изопропилиденбис-6-(3-фенилциклопентадиенил[1,2-b]теллурофен)циркония и метил;
дихлорид изопропилиденбис-6-(2,5-диметил-3-фенилциклопентадиенил[1,2-b]теллурофен)циркония и метил;
дихлорид изопропилиденбис-6-[2,5-димдетил-3-(2-метил-фенил)циклопентадиенил[1,2-b]теллурофен]циркония и метил;
дихлорид изопропилиденбис-6-[2,5-диметил-3-(2,4,6-триметилфенил)циклопентадиенил[1,2-b]теллурофен]циркония и метил;
дихлорид изопропилиденбис-6-[2,5-диметил-3-мезитиленциклопентадиенил[1,2-b]теллурофен]циркония и метил;
дихлорид изопропилиденбис-6-(2,4,5-триметил-3-фенил-циклопентадиенил[1,2-b]теллурофен)циркония и метил;
дихлорид изопропилиденбис-6-(2,5-диэтил-3-фенилциклопентадиенил[1,2-b]теллурофен)циркония и метил;
дихлорид изопропилиденбис-6-[2,5-диизопропил-3-фенилциклопентадиенил[1,2-b]теллурофен)циркония и метил;
дихлорид изопропилиденбис-6-(2,5-ди-трет-бутил-3-фенилциклопентадиенил[1,2-b]теллурофен)циркония и метил;
дихлорид изопропилиденбис-6-(2,5-дитриметилсилил-3-фенилциклопентадиенил[1,2-b]теллурофен)циркония и метил;
дихлорид изопропилиденбис-6-(3-метилциклопентадиенил[1,2-b]фосфол)циркония и метил;
дихлорид изопропилиденбис-6-(3-изопропилциклопентадиенил[1,2-b]фосфол)циркония и метил;
дихлорид изопропилиденбис-6-(3-фенилциклопентадиенил[1,2-b]фосфол)циркония и метил;
дихлорид изопропилиденбис-6-(2,5-диметил-3-фенилцикло-пентадиенил[1,2-b]фосфол)циркония и метил;
дихлорид изопропилиденбис-6-[2,5-диметил-3-(2-метилфенил)циклопентадиенил[1,2-b]фосфол]циркония и метил;
дихлорид изопропилиденбис-6-[2,5-диметил-3-(2,4,6-триметилфенил)циклопентадиенил[1,2-b]фосфол]циркония и метил ;
дихлорид изопропилиденбис-6-[2,5-диметил-3-мезитиленциклопентадиенил[1,2-b]фосфол]циркония и метил;
дихлорид изопропилиденбис-6-(2,4,5-триметил-3-фенилциклопентадиенил[1,2-b]фосфол)циркония и метил;
дихлорид изопропилиденбис-6-(2,5-диэтил-3-фенилциклопентадиенил[1,2-b]фосфол)циркония и метил;
дихлорид иэопропилиденбис-6-(2,5-диизопропил-3-фенил-циклопентадиенил[1,2-b]фосфол)циркония и метил;
дихлорид изопропилиденбис-6-(2,5-ди-трет-бутил-3-фенил-циклопентадиенил[1,2-b]фосфол)циркония и метил;
дихлорид изопропилиденбис-6-(2,5-дитриметилсилил-3-фенил циклопентадиенил[1,2-b]фосфол)циркония и метил;
дихлорид диметилсиландиилбис-5-(2-метилциклопентадиенил [c]теофен)циркония и метил;
дихлорид диметилсиландиилбис-5-(2-изопропилциклопентадиенил[c]теофен)циркония и метил;
дихлорид диметилсиландиилбис-5-(2-фенилциклопентадиенил [c]тиофен)циркония и метил;
дихлорид диметилсиландиилбис-5-(2,4-диметилциклопентадиенил[c]тиофен)циркония и метил;
дихлорид диметилсиландиилбис-5-[(2-метилфенил)-4-метил-циклопентадиенил[с]тиофен]циркония и метил;
дихлорид диметилсиландиилбис-5-[2-(2,4,6-триметилфенил)циклопентадиенил[с]тиофен)циркония и метил;
дихлорид диметилсиландиилбис-5-[2-мезитилен-4-метилциклопентадиенил[с]тиофен] циркония и метил;
дихлорид диметилсиландиилбис-5-(2,4-диизопропилциклопентадиенил[с]тиофен)циркония и метил;
дихлорид диметилсиландиилбис-5-(2,4-ди-трет-бутилциклопентадиенил[с]тиофен)циркония и метил;
дихлорид диметилсиландиилбис-5-(2,4-дитриметилсилилциклопентадиенил[с]тиофен)циркония и метил;
дихлорид диметилсиландиилбис-5-(2-метилциклопентадиенил [с]фосфол)циркония и метил;
дихлорид диметилсиландиилбис-5-(2-изопропилциклопентадиенил[с]фосфол)циркония и метил;
дихлорид диметилсиландиилбис-5-(2-фенилциклопентадиенил [с]фосфол)циркония и метил;
дихлорид диметилсиландиилбис-5-(2,4-диметилциклопентадиенил[с]фосфол)циркония и метил;
дихлорид диметилсиландиилбис-5-[(2-метилфенил)-4-метилциклопентадиенил[с]фосфол]циркония и метил;
дихлорид диметилсиландиилбис-5-[2-(2,4,6-триметилфенил) циклопентадиенил[с]фосфол]циркония и метил;
дихлорид диметилсиландиилбис-5-[2-мезитилен-4-метилциклопентадиенил[с]фосфол]циркония и метил;
дихлорид диметилсиландиилбис-5-(2,4-диизопропилциклопентадиенил[с]фосфол)циркония и метил;
дихлорид диметилсиландиилбис-5-(2,4-ди-трет-бутилцикло
пентадиенил[с]фосфол)циркония и метил;
дихлорид диметилсиландиилбис-5-(2,4-дитриметилсилилциклопентадиенил[с]фосфол)циркония и метил;
дихлорид диметилсиландиилбис-5-(2-метилциклопентадиенил [с]теллурофен)циркония и метил;
дихлорид диметилсиландиилбис-5-(2-изопропилциклопентадиенил[с]теллурофен)циркония и метил;
дихлорид диметилсиландиилбис-5-(2-фенилциклопентадиенил [с]теллурофен)циркония и метил;
дихлорид диметилсиландиилбис-5-(2,4-диметилциклопентадиенил[с]теллурофен)циркония и метил;
дихлорид диметилсиландиилбис-5-[(2-метилфенил)-4-метилциклопентадиенил[с]теллурофен]циркония и метил;
дихлорид диметилсиландиилбис-5-[2-[2,4,6-триметилфенил)циклопентадиенил[с]теллурофен)циркония и метил;
дихлорид диметилсиландиилбис-5-[2-мезитилен-4-метилциклопентадиенил[с]теллурофен]циркония и метил;
дихлорид диметилсиландиилбис-5-(2,4-диизопропилциклопентадиенил[с]теллурофен)циркония и метил;
дихлорид диметилсиландиилбис-5-(2,4-ди-трет-бутилциклопентадиенил[с]теллурофен)циркония и метил;
дихлорид диметилсилил-5-(2,4-диметилциклопентадиенил[с] теллурофен)-1-(2-метил-4-фенилинденил)циркония и метил;
дихлорид диметилсиландиилбис-5-(2,4-дитриметилсилил-циклопентадиенил[с]теллурофен)циркония и метил;
дихлорид метиленбис-5-(2-метилциклопентадиенил[с]тиофен)циркония и метил;
дихлорид метиленбис-5-(2-изопропилциклопентадиенил[с]тиофен)циркония и метил;
дихлорид метиленбис-5-(2-фенилциклопентадиенил[с]тиофен)циркония и метил;
дихлорид метиленбис-5-(2,4-диметилциклопентадиенил[с]тиофен)циркония и метил;
дихлорид метиленбис-5-[(2-метилфенил)-4-метилциклопентадиенил[с]тиофен]циркония и метил;
дихлорид метиленбис-5-[2-(2,4,6-триметилфенил)циклопентадиенил[с]тиофен]циркония и метил;
дихлорид метиленбис-5-[2-мезитилен-4-метилциклопентадиенил[с]-тиофен]циркония и метил;
дихлорид метиленбис-5-(2,4-диизопропилциклопентадиенил [с]тиофен)циркония и метил;
дихлорид метиленбис-5-(2,4-ди-трет-бутилциклопентадиенил [с]тиофен)циркония и метил;
дихлорид метиленбис-5-(2,4-дитриметилсилилциклопентадиенил[с]тиофен)циркония и метил;
дихлорид метиленбис-5-(2-метилциклопентадиенил[с]фосфол) циркония и метил;
дихлорид метиленбис-5-(2-изопропилциклопентадиенил[с]фосфол)циркония и метил;
дихлорид метиленбис-5-(2-фенилциклопентадиенил[с]фосфол) циркония и метил;
дихлорид метиленбис-5-(2,4-диметилциклопентадиенил[с]фосфол)циркония и метил;
дихлорид метиленбис-5-[(2-метилфенил)-4-метилциклопентадиенил[с]фосфол]циркония и метил;
дихлорид метиленбис-5-[2-(2,4,6-триметилфенил)циклопентадиенил[с]фосфол] циркония и метил;
дихлорид метиленбис-5-[2-мезитилен-4-метилциклопентадиенил[с]фосфол] циркония и метил;
дихлорид метиленбис-5-(2,4-диизопропилциклопентадиенил[с]фосфол)циркония и метил;
дихлорид метиленбис-5-(2,4-ди-трет-бутилциклопентадиенил[с]фосфол)циркония и метил;
дихлорид метиленбис-5-(2,4-дитриметилсилилциклопентадиенил[с]фосфол)циркония и метил;
дихлорид метиленбис-5-(2-метилциклопентадиенил[с]теллурофен)циркония и метил;
дихлорид метиленбис-5-(2-изопропилциклопентадиенил[с]теллурофен)циркония и метил;
дихлорид метиленбис-5-(2-фенилциклопентадиенил[с]теллурофен)циркония и метил;
дихлорид метиленбис-5-(2,4-диметилциклопентадиенил[с]теллурофен)циркония и метил;
дихлорид метиленбис-5-[(2-метилфенил)-4-метилциклопентадиенил[с]теллурофен]циркония и метил;
дихлорид метиленбис-5-[2-(2,4,6-триметилфенил)циклопентадиенил[с]теллурофен]циркония и метил;
дихлорид метиленбис-5-[2-мезитилен-4-метилциклопентадиенил[с]теллурофен 3 циркония и метил;
дихлорид метиленбис-5-(2,4-диизопропилциклопентадиенил[с]теллурофен)циркония и метил;
дихлорид метиленбис-5-(2,4-ди-трет-бутилциклопентадиенил[с]теллурофен)циркония и метил;
дихлорид диметилсилил-5-(2,4-диметилциклопентадиенил[с]теллурофен)-1-(2-метил-4-фенилинденил)циркония и метил;
дихлорид метиленбис-5-(2,4-дитриметилсилилциклопентадиенил[с]теллурофен)циркония и метил;
дихлорид диметилсиландиилбис-4-(циклопентадиенил[2,1-b]тиофен)циркония и метил;
дихлорид диметилсиландиилбис-4-(2-метилциклопентадиенил[2,1-b]тиофен)циркония и метил;
дихлорид диметилсиландиилбис-4-(2,5-диметилциклопентадиенил[2,1-b]тиофен)циркония и метил;
дихлорид диметилсиландиилбис-4-(2,5-диизопропилциклопентадиенил[2,1-b]тиофен)циркония и метил;
дихлорид диметилсиландиилбис-4-(2,5-ди-трет-бутил-циклопентадиенил[2,1-b]тиофен)циркония и метил;
дихлорид диметилсиландиилбис-4-(2,5-дитриметилсилилциклопентадиенил[2,1-b]тиофен)циркония и метил;
дихлорид диметилсилил-4-(2,5-дитриметилсилилциклопентадиенил[2,1-b]тиофен)-1-(2-метил-4-фенил)циркония и метил;
дихлорид диметилсиландиилбис-4-(циклопентадиенил[2,1-b]теллурофен)циркония и метил;
дихлорид диметилсиландиилбис-4-(2-метилциклопентадиенил[2,1-b]теллурофен)циркония и метил;
дихлорид диметилсиландиилбис-4-(2,5-диметилциклопентадиенил[2,1-b]теллурофен)циркония и метил;
дихлорид диметилсиландиилбис-4-(2,5-диизопропилциклопентадиенил[2,1-b]теллурофен)циркония и метил;
дихлорид диметилсиландиилбис-4-(2,5-ди-трет-бутилциклопентадиенил[2,1-b]теллурофен)циркония и метил;
дихлорид диметилсиландиилбис-4-(2,5-дитриметилсилилциклопентадиенил[2,1-b]теллурофен)циркония и метил;
дихлорид диметилсиландиил-6-(2,5-диметил-3-фенилциклопентадиенил[1,2-b]тиофен)(3-метилциклопентадиенил)циркония и метил;
дихлорид диметилсиландиил-6-(2,5-диметил-3-фенилциклопентадиенил[1,2-b]тиофен)(3-трет-бутилциклопентадиенил)циркония и метил;
дихлорид диметилсиландиил-6-(2,5-диметил-3-фенилциклопентадиенил[1,2-b]тиофен)-1-(2-метил-4-фенилинденил)циркония и метил;
дихлорид диметилсиландиил-6-(2,5-диметил-3-фенилциклопентадиенил[1,2-b]тиофен)-1-(бензоинденил)циркония и метил;
дихлорид диметилсиландиил-6-(2,5-диметил-3-фенилциклопентадиенил[1,2-b]силол)-1-(2-метил-4-фенилинденил)циркония и метил;
дихлорид диметилсиландиил-6- (2, 5-диметил-3-фенилциклопентадиенил[1,2-b]силол)-1-(бензоинденил)циркония и метил;
дихлорид диметилсиландиил-6-(2,5-диметил-3-фенилциклопентадиенил[1,2-b]теллурофен)-1-(2-метил-4-фенилинденил)циркония и метил;
дихлорид диметилсиландиил-6-(2,5-диметил-3-фенилциклопентадиенил[1,2-b]тиофен)-1-(2-метил-4-фенилинденил)циркония и метил;
дихлорид диметилсиландиил-6-(2,5-диметил-3-фенилциклопентадиенил[1,2-b]силол)-1-(2-метил-4-фенилинденил)циркония и метил;
дихлорид диметилсиландиил-6-(2,5-диметил-3-фенилциклопентадиенил[1,2-b]теллурофен)-1-(2-метил-4-фенилинденил)циркония и метил;
дихлорид диметилсиландиил-6-(2,5-диметил-3-фенилциклопентадиенил[1,2-b]фосфол)-1-(2-метил-4-фенилинденил)циркония и метил;
дихлорид диметилсиландиил-6-(2,5-диметил-3-фенилциклопентадиенил[1,2-b]фосфол)-1-(бензоинденил)циркония и метил;
дихлорид диметилсиландиил-5-[2,4-диметилциклопентадиенил [с]тиофен)-1-(2-метил-4-фенилинденил)циркония и метил;
дихлорид диметилсиландиил-5-[2,4-диметилциклопентадиенил [с]фосфол)-1-(2-метил-4-фенилинденил)циркония и метил;
дихлорид диметилсиландиил-5-(2,4-диметилциклопентадиенил[с]тиофен)-1-(2-метил-4-фенилинденил)циркония и метил;
дихлорид диметилсиландиил-5-(2,4-диметилциклопентадиенил [с]фосфол)-1-(2-метил-4-фенилинденил)циркония и метил;
дихлорид диметилсиландиил-5-[2,4-диметилциклопентадиенил[с]фосфол)-1-(бензоинденил)циркония и метил;
дихлорид диметилсиландиил-4-(2,5-дитриметилсилилциклопентадиенил[2,1-b]теллурофен)-1-(2-метил-4-фенил)циркония и метил;
Представляющий интерес класс металлоценовых соединений по настоящему изобретению имеет формулу (I), в которой Y и Z оба означают фрагмент формулы (II), R1 означает С1-С20алкильную группу, предпочтительно метильную группу. R2 означает водород. R3 не является водородом, В и D означают атомы углерода, А означает элемент группы 16 периодической таблицы элементов (новая версия IUРАС), предпочтительно серу, m равно 0, n и s равны 1. R3 предпочтительно означает С6-С20 арильную группу, такую как фенильная или нафтильная группа, или С7-С20алкиларильную группу, в которой алкильная группа орто-замещена у арильного заместителя и является, например, орто-метилфенильной группой, или арильная группа является 2,4-дизамещенной фенильной группой, такой как 2,4-диметилфенил. R4 предпочтительно не является водородом. R5 предпочтительно означает водород.
В данном классе металлоценов по настоящему изобретению кольцо, содержащее гетероатом, имеет двойную связь и, таким образом, относится к ароматическому типу.
Неограничивающими примерами указанного класса соединений являются:
дихлорид диметилсиландиилбис-6-(2,5-диметил-3-фенилциклопентадиенил[1,2-b]тиофен)циркония;
дихлорид диметилсиландиилбис-6-(3,5-диметилциклопентадиенил[1,2-b]тиофен)циркония;
дихлорид диметилсиландиилбис-6-[2,5-диметил-3-(2'-метил-фенилциклопентадиенил[1,2-b]тиофен}циркония.
К другому особенно предпочтительному классу металлоценов по настоящему изобретению относятся соединения, в которых Y и Z означают фрагмент формулы (II), L означает группу >C(R17), R1 означает атом водорода, R2 не является водородом.
Неограничивающими примерами указанного класса соединений являются:
дихлорид изопропилиденбис-6-(4-метилциклопентадиенил[1,2-b]тиофен)циркония и метил;
дихлорид изопропилиденбис-6-(4-изопропилциклопентадиенил[1,2-b]тиофен)циркония и метил;
дихлорид изопропилиденбис-6-(4-трет-бутилциклопентадиенил[1,2-b]тиофен)циркония и метил;
дихлорид изопропилиденбис-6-(4-фенилциклопентадиенил[1,2-b]тиофен)циркония и метил;
дихлорид метиленбис-6-(4-метилциклопентадиенил[1,2-b]тиофен)циркония и метил;
дихлорид метиленбис-6-(4-изопропилциклопентадиенил[1,2-b]тиофен)циркония и метил;
дихлорид метиленбис-6-{4-трет-бутилциклопентадиенил[1,2-b]тиофен)циркония и метил;
дихлорид метиленбис-6-(4-фенилциклопентадиенил[1,2-b]тиофен)циркония и метил.
К еще одному особенно предпочтительному классу металлоценовых соединений по настоящему изобретению относятся соединения формулы (I), в которой Y и Z оба означают фрагмент формулы (II), m равно 2 и R5 не является водородом.
Неограничивающими примерами указанного класса соединений являются:
дихлорид диметилсиландиилбис-6-(1,1,2,5-тетраметил-3-фенилциклопентадиенил[1,2-b]силол)циркония и метил;
дихлорид диметилсиландиилбис-6-(1,1,2,5-тетраметил-3-фенилциклопентадиенил[1,2-b]циклопентадиен)циркония и метил;
дихлорид изопропилиденбис-6-(1,1,2,5-тетраметил-3-фенилциклопентадиенил[1,2-b]силол)циркония и метил;
дихлорид изопропилиденбис-6-(1,1,2,5-тетраметил-3-фенилциклопентадиенил[1,2-b]циклопентадиен)циркония и метил;
Другим объектом настоящего изобретения является класс лигандов формулы (V):
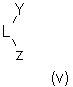
где Y' означает фрагмент формулы (VI):
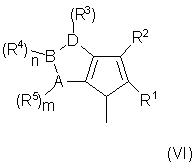
где R1, R2, R3, R4, R5, А, В, D, n, m, и s имеют указанные выше значения и кольцо, содержащее А, В и D, может иметь двойные связи в любых допустимых пололожениях и относится к ароматическому типу;
и/или его изомеры с двойными связями;
Z' выбран из фрагмента формулы (VI) и фрагмента формулы (VII):
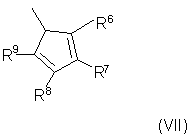
и/или его изомеров с двойными связями;
R6, R7, R8 и R9 имеют указанные выше значения;
когда Z' аналогичен Y', А, В и D в Y' и Z' могут иметь одинаковые или различные значения;
L является вышеуказанным двухвалентным мостиком. Z' предпочтительно аналогичен Y'; R1 означает С1-С20 алкильную группу, предпочтительно метильную группу, R2 означает водород. R3 не является водородом, В и D означают атомы углерода, А означает элемент группы 16 периодической таблицы элементов (новая версия IUРАС), предпочтительно серу, m равно 0, n и s равны 1. R3 более предпочтительно означает С6-С20арильную группу, такую как фенильная или нафтильная группа, или С7-С20алкиларильную группу, в которой алкильная группа ортозамещена или орто- и метазамещена у арильного заместителя и является, например, ортометилфенильной группой или 2,4-метилфенильной группой. R4 предпочтительно не является водородом. R5 предпочтительно означает водород.
Когда Z' отличается от Y', он предпочтительно означает
фрагмент формулы (VIII):
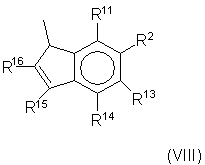
и/или его изомеры с двойными связями;
где R11, R12, R13, R14, R15 и R16 имеют указанные выше
значения.
Неограничивающими примерами указанного класса соединений являются:
диметилбис-6-(3-метилциклопентадиенил[1,2-b]тиофен) силан;
диметилбис-6-(3-изопропилциклопентадиенил[1,2-b]тиофен) силан;
диметилбис-6-(3-фенилциклопентадиенил[1,2-b]тиофен) силан;
диметилбис-6-(2,5-диметил-3-фенилциклопентадиенил[1,2-b] тиофен)силан;
диметилбис-6-[2,5-диметил-3-(2-метилфенил)циклопентадиенил[1,2-b]тиофен]силан;
диметилбис-6-[2,5-диметил-3-(2,4,6-триметилфенил)циклопентадиенил[1,2-b]тиофен]силан;
диметилбис-6-[2,5-диметил-3-мезитиленциклопентадиенил[1,2-b]тиофен]силан;
диметилбис-6-(2,4,5-триметил-3-фенилциклопентадиенил[1,2-b]тиофен)силан;
диметилбис-6-(2,5-диэтил-3-фенилциклопентадиенил[1,2-b]тиофен)силан;
диметилбис-6-(2,5-диизопропил-3-фенилциклопентадиенил[1,2-b]тиофен)силан;
диметилбис-6-(2,5-ди-трет-бутил-3-фенилциклопентадиенил[1,2-b]тиофен)силан;
диметилбис-6-(2,5-дитриметилсилил-3-фенилциклопентадиенил[1,2-b]тиофен)силан;
диметилбис-6-(3-метилциклопентадиенил[1,2-b]силол)силан;
диметилбис-6-(3-изопропилциклопентадиенил[1,2-b]силол) силан;
диметилбис-6-(3-фенилциклопентадиенил[1,2-b]силол)силан;
диметилбис-6-(2,5-диметил-3-фенилциклопентадиенил[1,2-b]силол)силан;
диметилбис-6-[2,5-диметил-3-(2-метилфенил)циклопентадиенил[1,2-b]силол]силан;
диметилбис-6-[2,5-диметил-3-(2,4,6-триметилфенил)циклопентадиенил[1,2-b]силол]силан;
диметилбис-6-[2,5-диметил-3-мезитиленциклопентадиенил[1,2-b]силол]силан;
диметилбис-6-(2,4,5-триметил-З-фенилциклопентадиенил[1,2-b]силол)силан;
диметилбис-6-(2,5-диэтил-3-фенилциклопентадиенил[1,2-b]силол)силан;
диметилбис-6-(2,5-диизопропил-3-фенилциклопентадиенил[1,2-b]силол)силан;
диметилбис-6-(2,5-ди-трет-бутил-3-фенилциклопентадиенил[1,2-b]силол)силан;
диметилсилил-6-(2,5-диметил-3-фенилциклопентадиенил[1,2-b]силол)-1-(2-метил-4-фенилинденил)силан;
диметилбис-6-(2,5-дитриметилсилил-3-фенилциклопентадиенил[1,2-b]силол)силан;
диметилбис-6-(3-метилциклопентадиенил[1,2-b]теллурофен)силан;
диметилбис-6-(3-изопропилциклопентадиенил[1,2-b]теллурофен)силан;
диметилбис-6-(3-фенилциклопентадиенил[1,2-b]теллурофен)силан;
диметилбис-6-(2,5-диметил-3-фенилциклопентадиенил[1,2-b]теллурофен)силан ;
диметилбис-6-[2,5-диметил-3-(2-метилфенил)циклопентадиенил[1,2-b]теллурофен)силан;
диметилбис-6-[2,5-диметил-3-(2,4,6триметилфенил)циклопентадиенил[1,2-b]теллурофен)силан;
диметилбис-6-[2,5-диметил-3-мезитиленциклопентадиенил[1,2-b]теллурофен]силан;
диметилбис-6-(2,4,5-триметил-3-фенилциклопентадиенил[1,2-b]теллурофен)силан;
диметилбис-6-(2,5-диэтил-3-фенилциклопентадиенил[1,2-b]теллурофен)силан;
диметилбис-6-(2,5-диизопропил-3-фенилциклопентадиенил[1,2-b]теллурофен)силан;
диметилбис-6-(2,5-ди-трет-бутил-3-фенилциклопентадиенил[1,2-b]теллурофен)силан;
диметилбис-6-(2,5-дитриметилсилил-3-фенилциклопентадиенил[1,2-b]теллурофен)силан;
диметилбис-6-(3-метилциклопентадиенил[1,2-b]теллурофен)силан;
диметилбис-6-(3-изопропилциклопентадиенил[1,2-b]теллурофен)силан;
диметилбис-6-(3-фенилциклопентадиенил[1,2-b]теллурофен)силан;
диметилбис-6-(2,5-диметил-3-фенилциклопентадиенил[1,2-b]теллурофен)силан;
диметилбис-6-[2,5-диметил-3-(2-метилфенил)циклопентадиенил[1,2-b]теллурофен]силан;
диметилбис-6-[2,5-диметил-3-(2,4,6-триметилфенил)циклопентадиенил[1,2-b]теллурофен]силан ;
диметилбис-6-[2,5-диметил-3-мезитиленциклопентадиенил[1,2-b]теллурофен]силан;
диметилбис-6-(2,4,5-триметил-3-фенилциклопентадиенил[1,2-b]теллурофен)силан;
диметилбис-6-(2,5-диэтил-3-фенилциклопентадиенил[1,2-b]теллурофен)силан;
диметилбис-6-(2,5-диизопропил-3-фенилциклопентадиенил[1,2-b]теллурофен)силан;
диметилбис-6-(2,5-ди-трет-бутил-3-фенилциклопентадиенил[1,2-b]теллурофен)силан;
диметилсилил-6-(2,5-диметил-3-фенилциклопентадиенил[1,2-b]теллурофен)-1-(2-метил-4-фенилинденил)силан;
диметилбис-6-(2,5-дитриметилсилил-3-фенилциклопентадиенил[1,2-b]теллурофен)силан;
диметилбис-6-(3-метилциклопентадиенил[1,2--b)силан;
диметилбис-6-(3-изопропилциклопентадиенил[1,2-b]фосфол)силан;
диметилбис-6-(3-фенилциклопентадиенил[1,2-b]фосфол}силан ;
диметилбис-6-(2,5-диметил-3-фенилциклопентадиенил[1,2-b]фосфол)силан;
диметилбис-6-[2,5-диметил-3-{2-метилфенил)циклопентадиенил[1,2-b]фосфол]силан ;
диметилбис-6-[2,5-диметил-3-(2,4,6-триметилфенил)циклопентадиенил[1,2-b]фосфол]силан;
диметилбис-6-[2,5-диметил-3-мезитиленциклопентадиенил[1,2-b]фосфол]силан;
диметилбис-6-(2,4,5-триметил-3-фенилциклопентадиенил[1,2-b]фосфол)силан ;
диметилбис-6-(2,5-диэтил-3-фенилциклопентадиенил[1,2-b]фосфол)силан;
диметилбис-6-(2,5-диизопропил-3-фенилциклопентадиенил[1,2-b]фосфол)силан;
диметилбис-6-(2,5-ди-трет-бутил-3-фенилциклопентадиенил[1,2-b]фосфол)силан;
диметилбис-6-(2,5-дитриметилсилил-3-фенилциклопентадиенил[1,2-b]фосфол)силан;
диметилсиландиил-6-(2,5-диметил-3-фенилциклопентадиенил[1,2-b]тиофен)-1-(2-метил-4-фенилинденил)силан;
диметилсиландиил-6-(2,5-диметил-3-фенилциклопентадиенил[1,2-b]фосфол)-1-(2-метил-4-фенилинденил)силан;
диметилсиландиил-6-(2,5-диметил-3-фенилциклопентадиенил[1,2-b]-теллурофен)-1-(2-метил-4-фенилинденил)силан;
Наиболее предпочтительными лигандами по настоящему изобретению являются
диметилбис-6-(2,5-диметил-3-фенилциклопентадиенил[1,2-b] тиофен)силан;
диметилбис-6-[2,5-диметил-3-(2'-метилфенил)циклопентадиенил[1,2-b]тиофен]силан;
диметилбис-6-(3,5-диметилциклопентадиенил[1,2-b]тиофен) силан.
Вышеуказанные соединения формулы (V) особенно пригодны в качестве промежуточных лигандов для получения металлоценовых соединений формулы (I).
Еще одним объектом настоящего изобретения является способ получения лиганда формулы (V), где L Y' и Z' имеют указанные выше значения при условии, что R2 означает водород и D означает атом углерода, который включает нижеследующие стадии:
а) контактирование соединения формулы (IХ)
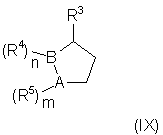
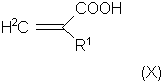
где двойные связи могут находиться в любых допустимых положениях; А, В, R3, R4, R5, n и m имеют указанные выше значения, с соединением общей формулы (X):
где R1 имеет указанные выше значения; в присутствии циклизующего агента, что дает соединение общей формулы (XI):
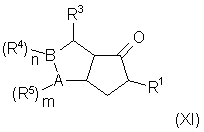
где двойные связи могут находиться в любых допустимых положениях;
b) превращение полученного соединения в соединение формулы (XII):
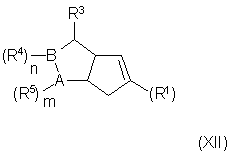
где двойные связи могут находиться в любых допустимых
положениях; и
когда Z' аналогичен Y', а А и В в Y' и Z' имеют одинаковые или различные значения:
с1) производят обработку соединения формулы (XII) основанием, выбираемым из гидроксидов и гидридов щелочных и щелочноземельных металлов, металлического натрия и калия и металлорганических солей лития, и осуществляют последующее контактирование с соединением формулы LQ2 (XIII), в которой L имеет указанные выше значения и Q означает атом галогена, выбираемый из хлорида, иодида и бромида, предпочтительно бром, причем молярное соотношение между соединениями формул (XII) и (XIII) равно по крайней мере 2;
или когда Z' является соединением формулы (VII):
с2) производят обработку соединения формулы (XII) основанием, указанным в пункте с1) и осуществляют последующее контактирование с соединением формулы Z'LQ (XIV), в которой L имеет указанные выше значения и Q означает атом галогена, выбираемый из хлорида, иодида и бромида.
В способе по настоящему изобретению циклизующий агент предпочтительно выбирают из фосфорпентоксидметансульфоновой кислоты (РРМА) и полифосфорной кислоты (РРА).
В способе по настоящему изобретению соединение общей формулы (X) выбирают из α,β -ненасыщенных кислот. Наиболее предпочтительной является метакриловая кислота.
В способе по настоящему изобретению соединение общей формулы (IX) предпочтительно является 1-метил-3-бромтиофеном.
В способе по настоящему изобретению превращение в соединение формулы (XII) предпочтительно осуществляют в присутствии восстановителя и моногидрада паратолуолсульфоновой кислоты.
В способе по настоящему изобретению восстановитель предпочтительно является алюмогидридом лития (LiА1Н4).
Неограничивающими примерами соединений формулы LQ2 (XIII) являются диметилдихлорсилан, дифенилдихлорсилан, диметилдихлоргерманий, 2,2-дихлорпропан и 1,2-дибромэтан.
В способе по настоящему изобретению соединение формулы LQ2 (XIII) предпочтительно является диметилдихлорсиланом.
Неограничивающими примерами соединений, способных образовывать анионное соединение формулы (XII), являются гидроксиды и гидриды щелочных и щелочноземельных металлов, металлический натрий и калий и металлорганические соли лития. Предпочтительным соединением является бутиллитий.
Неограничивающими примерами связующих агентов, используемых на стадии а), являются связующие агенты на основе Ni, Рd или Рt. Широко применяемые связующие агенты указаного типа описаны в "Соmргеhensive оrganic synthesis" Еds. В.М. Тrоst and I. Fleming, Pergamon, Охfоrа, (1991),Vо1 3, Раr1: 1.6, р 241.
Предпочтительным связующим агентом является бис(дифенилфосфино)пропан)]дихлорникель(II) (Ni(dРРР)).
Вышеуказанные мостиковые лиганды предпочтительно синтезируют, добавляя раствор органического соединения лития в аполярном растворителе к раствору соединения (XII) в апротонном полярном растворителе. Полученный таким образом раствор, содержащий соединение (XII) в анионной форме затем добавляют к раствору соединения формулы LQ2 (XIII) в апротонном полярном растворителе. Мостиковый лиганд можно отделить известными методами.
Неограничивающими примерами апротонных полярных растворителей, которые можно использовать в вышеуказанном способе, являются тетрагидрофуран, диметоксиэтан, диэтиловый эфир, толуол и дихлорметан. Неограничивающими примерами аполярных растворителей, пригодных для использования в вышеуказанном способе, являются пентан, гексан и бензол.
На протяжении выполнения всего способа температура предпочтительно находится в интервале от -180°С до 80°С, более предпочтительно от -20 до 40°.
Еще одним объектом настоящего изобретения является способ получения металлоценовых соединений формулы (I) взаимодействием вышеописанного лиганда формулы (V) с соединением, способным образовывать соответствующее дианионное соединение, и затем с соединением формулы МXp+2 где М, Х и р имеют указанные выше значения.
Соединение, способное образовывать указанный дианион, выбирают из группы, включающей гидроксиды и гидриды щелочных и щелочноземельных металлов, металлический натрий и калий и металлорганические соли лития, причем указанный анион предпочтительно является н-бутиллитием.
Неограничивающими примерами соединений формулы МХр+2 являются тетрахлорид титана, тетрахлорид циркония и тетрахлорид гафния.
В частности, указанные мостиковые лиганды растворяют в апротонном полярном растворителе и к полученному раствору добавляют раствор органического соединения лития в аполярном растворителе. Полученное таким образом анионное соединение отделяют, растворяют в апротонном полярном растворителе и затем добавляют к суспензии соединения МХр+2 в апротонном полярном растворителе. В конце реакции образовавшийся твердый продукт отделяют от реакционной смеси методами, обычно используемыми в данной области техники.
Неограничивающими примерами апротонных полярных растворителей, пригодных для использования в вышеуказанных способах, являются тетрагидрофуран, диметоксиэтан, диэтиловый эфир, толуол и дихлорметан. Неограничивающими примерами аполярных растворителей, пригодных для использования в вышеуказанном способе, являются пентан, гексан и бензол.
На протяжении выполнения всего способа температура предпочтительно находится в интервале от -180°С до 80°С, более предпочтительно от -20°С до 40°С.
Когда, по крайней мере, один заместитель Х в металлоценовом соединении формулы (I) не является галогеном, необходимо заместить, по крайней мере, один заместитель Х в полученном металлоцене, по крайней мере, одним другим заместителем, не являющимся галогеном. Такую реакцию замещения осуществляют методами, известными в данной области техники. Например, когда заместители Х являются алкильными группами, металлоцены можно подвергать взаимодействию с алкилмагнийгалогенидами (реактивы Гриньяра) или с литийалкильными соединениями.
На протяжении выполнения всего способа температура предпочтительно находится в интервале от -180°С до 80°С более предпочтительно от -20°С до 40°С.
Гетероциклические металлоценовые соединения по настоящему изобретению можно эффективно использовать в качестве компонентов катализаторов для полимеризации олефинов.
Таким образом, еще одним объектом настоящего изобретения является катализатор для полимеризации олефинов, полученный в результате контактирования:
А) металлоценового соединения формулы (I) и
В) алюмоксана и/или соединения, способного образовывать алкильный катион металлоцена.
Алюмоксан, используемый в качестве компонента (В), можно получить, подвергая воду взаимодействию с алюминийорганическим соединением формулы НjАlR
Молярное соотношение между алюминием и металлом в металлоцене составляет от около 10:1 до около 20000:1, более предпочтительно от около 100:1 до около 5000:1. Можно использовать более высокое молярное соотношение алюминий/цирконий с достижением хороших результатов, даже если оно не применяется в промышленном масштабе.
Алюмоксаны, используемые в катализаторе по данному изобретению, являются линейными соединениями, соединениями с разветвленной цепью или циклическими соединениями, содержащими, по крайней мере, одну группу типа:
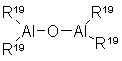
где заместители R19, имеющие одинаковые или различные значения, означают атомы водорода, С1-С20алкил, С3-С20 циклоалкил, С6-С20арил, С7-С20алкиларил или С7-С20арилалкил, необязательно содержащие атомы кремния или германия, или группу -О-Аl(R19)2 и там, где это возможно, некоторые заместители R19 могут быть атомами галогена.
В частности, алюмоксаны формулы:
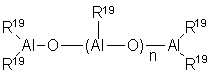
можно использовать в качестве линейных соединений, в
которых n равно 0 или является целым числом от 1 до 40 и заместители R19 имеют указанные выше значения, или алюмоксаны формулы:
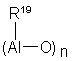
можно использовать в качестве циклических соединений, в которых n является целым числом от 2 до 40 и заместители R6 имеют указанные выше значения.
Примерами алюмоксанов, пригодных для использования в настоящем изобретении, являются метилалюмоксан (МАО), тетра(изобутил)алюмоксан (ТIВАО), тетра(2,4,4-триметилпентил) алюмоксан (ТIOАО), тетра (2, 3-ди-метилбутил) алюмоксан (ТDМВАО), тетра(2,3,3-триметилбутил)алюмоксан (ТТМВАО).
Другими представляющими интерес алюмоксанами являются соединения, полученные взаимодействием воды с алюминийорганическим соединением, описанным в международной заявке на патент РСТ/ЕРОО/09111, таким как трис(2-фенилпропил)алюминий, трис[2-(4-фторфенил)пропил]алюминий, трис[2-(4-хлорфенил)пропил]алюминий, трис[2-(3-изопропилфенил)пропил]алюминий, трис(2-фенилбутил)алюминий, трис(3-метил-2-фенилбутил)алюминий, трис(2-фенилпентил)алюминий, трис[2-(пентафторфенил)пропил]алюминий, трис[2,2-дифенилэтил] алюминий и трис[2-фенил-2-метилпропил]алюминий. Другие представляющие интерес сокатализаторы, в которых алкильные группы имеют специфические структуры разветвленной цепи, описаны в заявке на патент WO 99/21899.
Неограничивающими примерами соединений алюминия, описанными в указанной заявке на патент РСТ, являются трис(2,3,3-триметилбутил)алюминий, три с(2,3-диметилгексил) алюминий, трис(2,3-диметилбутил)алюминий, трис(2,3-диметилпентил)алюминий, трис(2,3-диметилгептил)алюминий, трис(2-метил-3-этилпентил)алюминий, трис(2-метил-3-этил-гексил) алюминий, трис(2-метил-З-этилгептил)алюминий, трис(2-метил-3-пропилгексил)алюминий, трис(2-этил-3-метилбутил)алюминий, трис(2-этил-3-метилпентил)алюминий, трис(2,3-диэтилпентил) алюминий, трис(2-пропил-З-метилбутил)алюминий, трис{2-изопропил-3-метилбутил)алюминий, трис(2-изобутил-3-метил-пентил)алюминий, трис(2,3,3-триметилпентил)алюминий, трис(2, 3,3-триметилгексил)алюминий, трис(2-этил-3,3-диметилбутил) алюминий, трис(2-этил-3,3-диметилпентил) алюминий, трис(2-изопропил-3,3-диметилбутил)алюминий, трис(2-триметилсилил-пропил)алюминий, трис(2-метил-3-фенилбутил)алюминий, трис(2-этил-3-фенилбутил)алюминий, трис(2,3-диметил-3-фенилбутил) алюминий, а также соответствующие соединения, в которых одна из гидрокарбильных групп замещена атомом водорода, и соединения, в которых одна или две гидрокарбильные группы замещены изобутильной группой.
Другими представляющими интерес соединениями алюминия являются соединения, в которых R18 содержит арильную группу, такие как трис-(2-фенилпропил)алюминий, трис[2-(4-фторфенил) пропил]алюминий, трис-[2-(4-хлорфенил)пропил]алюминий, трис[2-(3-изопропилфенил)пропил]алюминий, трис(2-фенилбутил)алюминий, трис(3-метил-2-фенилбутил)алюминий, трис(2-фенилпентил)алюминий, трис[2-(пентафторфенил)пропил]алюминий, трис[2,2-дифенилэтил]алюминий и трис[2-фенил-2-метилпропил] алюминий. Среди вышеуказанных соединений алюминия предпочтительными являются триметилалюминий (ТМА), триизобутилалюминий (TIBAL), трис(2,4,4-триметилпентил) алюминий (ТI0А), трис(2,3-диметилбутил)алюминий (ТDМВА), трис(2,3,3-триметилбутил)алюминий (ТТМВА), трис(2-фенил-пропил)алюминий (ТРРА), трис[2-(4-фторфенил)пропил]алюминий (ТFРРА).
Неограничивающими примерами соединений, способных образовывать алкильный катион металлоцена являются соединения формулы D+Е-, где D+ означает кислоту Бронстеда, которая способна высвобождать протон и необратимо взаимодействовать с заместителем Х металлоцена формулы (I), и Е- означает совместимый анион, который способен стабилизировать активные каталитические формы, образующиеся в результате взаимодействия двух соединений, и является достаточно лабильным для удаления олефиновым мономером. Анион V- предпочтительно содержит один или несколько атомов бора. Более предпочтительно анион V- является анионом формулы Bar
Катализаторы, используемые в способе по настоящему изобретению, можно также наносить на инертные носители. Такие катализаторы получают, нанося металлоцен (А) или продукт его взаимодействия с компонентом (В), либо компонент (В) и затем металлоцен (А) на такой носитель, как, например, диоксид кремния, оксид алюминия, сополимеры стирола и дивинилбензола, полиэтилен или полипропилен. Полученное таким образом твердое соединение в сочетании с последующим добавлением соединения алкилалюминия в чистом виде или предварительно подвергнутого взаимодействию с водой можно эффективно использовать в газофазной полимеризации.
Катализаторы по настоящему изобретению можно эффективно использовать в реакциях гомополимеризации и сополимеризации олефинов. Поэтому еще одним объектом настоящего изобретения является способ полимеризации одного или нескольких олефинов, который включает осуществление реакции полимеризации одного или нескольких олефиновых мономеров в присутствии вышеописанного катализатора.
Катализаторы по настоящему изобретению можно использовать при осуществлении реакции гомополимеризации олефинов, таких как этилен, для получения НВРЕ или альфа-олефинов, таких как пропилен и 1-бутен. Особенно интересные результаты могут быть получены при полимеризации пропилена, осуществляемой в присутствии вышеописанного катализатора, содержащего металлоцен по настоящему изобретению.
Было обнаружено, что, когда полимеризацию пропилена проводят в присутствии металлоценовых соединений по настоящему изобретению, полученные полипропилены имеют высокую неожиданно молекулярную массу. Характеристическая вязкость (I.V.) полученного полипропилена обычно выше 0,5 дл/г, предпочтительно равна 1 дл/г и может достигать значений более 5 дл/г и даже выше.
Полученные пропиленовые полимеры характеризуются высокими значениями изотактичности. Так, количество последовательностей mrrm (в мол.%) является исключительно низким. Количество последовательностей mrrm (в мол.%) обычно меньше 1, предпочтительно меньше 0,5.
Когда полимеризацию пропилена осуществляют в присутствии металлоценовых соединений по настоящему изобретению, полученный полипропилен имеет значительно высокую температуру плавления. Температура плавления полученного полипропилена превышает 145°С и может достигать 160°С и даже выше.
Особенно интересные результаты можно получить, используя катализатор по настоящему изобретению, в котором Y и Z имеют формулу (II) и R3 означает С6-С20арил, С7-С20алкиларил или С7-С20арилалкил, вместе с соединениями, способными образовывать алкильный катион металлоцена формулы Т+V-, где Т и V имеют указанные выше значения. Используя указанный сокатализатор, можно получить в высшей степени изоспецифические полимеры с очень низким значением ошибки структурирования.
Отличительной особенностью металлоценов по данному изобретению является также то, что использование небольшого количества водорода, помимо регулирования молекулярной массы, значительно увеличивает активность полимеризации.
Катализаторы по настоящему изобретению можно также использовать в вышеописанном способе для сополимеризации пропилена с одним или несколькими альфа-олефинами, такими как, например, этилен, 1-бутен, 1-пентен, 4-метил-1-пентен, 1-гексен, 1-октен, 1-децен, 1-додецен, 1-тетрадецен, 1-эзадецен, 1-октадецен, 1-эйкозен, аллилциклогексен, циклопентен, стирол, циклогексен, норборнен и 4,6-диметил-1-гептен. Сополимеры пропилен/этилен и пропилен/1-бутен являются предпочтительными. При использовании в качестве сомономера 1-бутена получают сополимеры с относительно высокой молекулярной массой, но относительно низкой температурой плавления.
При получении сополимеров пропилен/этилен добавление этилена существенно уменьшает молекулярную массу сополимеров, из чего следует, что этилен можно использовать также для регулирования молекулярной массы.
Другим интересным применением катализаторов по настоящему изобретению является их использование для сополимеризации этилена с высшими олефинами. В частности, катализаторы по данному изобретению можно использовать для получения LLDРЕ.
Приемлемыми олефинами, используемыми в качестве сомономеров, являются а-олефины формулы СН2=СНR20, где R20 означает алкильный радикал с 1-10 атомами углерода или арильный радикал с 6-20 атомами углерода, и циклоолефины. Примерами указанных олефинов являются пропилен, 1-бутен, 1-пентен, 4-метил-1-пентен, 1-гексен, 1-октен, 1-децен, 1-додецен, 1-тетрадецен, 1-эзадецен, 1-октадецен, 1-эйкозен, аллилциклогексен, циклопентен, стирол, циклогексен, норборнен и 4,6-диметил-1-гептен.
Сополимеры могут также содержать небольшие количества звеньев, полученных из полиенов, в частности из диенов с прямой цепью или циклических диенов, диенов с сопряженными или несопряженными двойными связями, таких как 1,4-гексадиен, изопрен, 1,3-бутадиен, 1,5-гексадиен и 1,6-гептадиен.
Звенья, полученные из α-олефинов формулы СН2=СНR20, где R20 означает алкильный радикал с 1-10 атомами углерода или арильный радикал с 6-20 атомами углерода, циклоолефинов и/или полиенов, предпочтительно присутствуют в сополимерах в количествах от 1 до 20 мол.%.
Насыщенные эластомерные сополимеры могут содержать этиленовые звенья, α-олефины и/или диолефины с несопряженными двойными связями, способные образовывать циклические полимеры. Ненасыщенные эластомерные сополимеры могут содержать наряду со звеньями, полученными в результате полимеризации этилена и α-олефинов, небольшие количества ненасыщенных звеньев, полученных в результате сополимеризации одного или нескольких полиенов. Ненасыщенные звенья предпочтительно составляют от 0 до 5 мас.%.
Неограничивающими примерами приемлемых α-олефинов являются пропилен, 1-бутен и 4-метил-1-пентен. Приемлемыми диолефинами с несопряженными двойными связями, которые способны образовывать циклические полимеры, являются 1,5-гексадиен, 1,6-гептадиен и 2-метил-1,5-гексадиен.
Неограничивающими примерами приемлемых полиенов являются:
(i) полиены, способные высвобождать ненасыщенные звенья, такие как:
линейные диены, диены с несопряженными двойными связями, такие как транс-1,4-гексадиен, цис-1,4-гексадиен, 6-метил-1,5-гептадиен, 3,7-ди-метил-1,6-октадиен и 11-метил-1,10-додекадиен;
бициклические диолефины, такие как 4,5,8,9-тетрагидроинден, 6- и 7-метил-4,5,8,9-тетрагидроинден;
алкенил- или алкилиденнорборнены, такие как 5-этилиден-2-норборнен, 5-изопропилиден-2-норборнен и эксо-5-изопропенил-2-норборнен ;
- полициклические диолефины, такие как дициклопентадиен, трицикло-[6.2.1.O2.7]4,9-ундекадиен и их 4-метильное производное;
(ii) диолефины с несопряженными двойными связями, способные образовывать циклические полимеры, такие как 1,5-гексадиен, 1,6-гептадиен и 2-метил-1,5-гексадиен;
(iii) диолефины с сопряженными двойными связями, такие как бутадиен и изопрен.
Катализатор по настоящему изобретению можно также использовать для получения гомополимера 1-бутена.
Катализаторы по настоящему изобретению можно также использовать для получения полимеров циклоолефина. Моноциклические и полициклические олефиновые мономеры можно гомополимеризовать или сополимеризовать с линейными олефиновыми мономерами.
Способы полимеризации по настоящему изобретению можно осуществлять в газовой или жидкой фазе необязательно в присутствии инертного углеводородного растворителя, в частности, ароматического (такого как толуол) или алифатического (такого как пропан, гексан, гептан, изобутан и циклогексан).
Температура полимеризации обычно находится в интервале от около 0°С до около 250°С. В частности, в процессе полимеризации пропилена температура обычно находится в интервале от 20°С до 150°С, предпочтительно от 40°C до 90°С.
Давление полимеризации составляет от 0,5 до 100 бар, предпочтительно от 2 до 50 бар и более предпочтительно от 4 до 30 бар.
Молекулярную массу полимеров можно изменять, изменяя температуру полимеризации, тип или концентрацию компонентов катализатора или используя регуляторы молекулярной массы, такие как, например, водород.
Молекулярно-массовое распределение можно изменять, используя смеси разных металлоценов, осуществляя полимеризацию в несколько этапов при разных температурах полимеризации и/или используя регулятор молекулярной массы в разных концентрациях.
Выходы продукта полимеризации зависят от чистоты металлоценового компонента катализатора. Поэтому для того, чтобы увеличить выходы продукта полимеризации, металлоцены обычно используют после очистки.
Компоненты катализатора могут быть введены во взаимодействие до полимеризации. Предполимеризационное взаимодействие обычно осуществляют при концентрациях от 1 до 10-8 моль/л металлоценового компонента (А) и от 10 до 10-8 моль/л компонента (В). Предварительное контактирование обычно осуществляют в присутствии углеводородного растворителя и, если это возможно, небольших количеств мономера. Время предварительного контактирования обычно составляет от 1 минуты до 24 часов.
Нижеследующие примеры приведены только для иллюстрации и не ограничивают объем изобретения.
Экспериментальная часть
Вещества и способы
Все синтезы выполнены в атмосфере азота в предварительно высушенной стеклянной посуде за исключением особо оговоренных случаев. Растворители для чувствительных к воздействию воздуха соединений очищены следующим образом: ТГФ, простой эфир и толуол очищают перегонкой от натрия/бензофенона, пентан очищают перегонкой от натрия/бензофенона/триглима, дихлорметан перегоняют от СаН2 и хранят над ситами 4А.
Метилалюмоксан (10 мас.% раствор в толуоле) производится фирмой Witco Соrр.
МС. Масс-спетры промежуточных органических соединений измерены устройством НР 6890 серии 6С, оснащенным избирательным детектором масс-спектра 5973.
Синтез алюминийорганических соединений для примеров 41-48
Общий способ
Все реакции осуществляют в атмосфере азота в защитной камере с перчатками или в условиях Шленка с использованием высушенной в печи стеклянной посуды. Толуол, используемый в качестве растворителя, сушат над молекулярным ситом 4А. Все алкены сушат над молекулярным ситом 4А перед использованием.
Трис(2-метилпропоил)алюминий (ТIВА) производится фирмой Аldriсh и используется в виде чистого соединения. Трис (2-фенилпропил) алюминий - Аl(СН2СНМeРh)3 (ТРРА)
В защитной камере с перчатками альфа-метилстирол (283 г, 2,3 моль, Аldrich, высушенный над ситом) растворяют в сухом толуоле (примерно 300 мл) в 3-горлой колбе емкостью 1 л. Через 10 минут Аl {СН2СНМе2}3 (ТIВА, 100 мл, 0,395 ммоль, ех-Witco) добавляют шприцем к быстро перемешиваемому раствору при комнатной температуре. Реакционную колбу вынимают из защитной камеры с перчатками, при этом обратный холодильник и трубопровод подачи азота присоединяют к вытяжному шкафу. Изобутеновый продукт собирают, используя градуированный сосуд, погруженный в баню со смесью ацетона и сухого льда при -78°С. Реакционную смесь нагревают в течение 90 минут до достижения внутренней температуры 110,7°С. Реакционную смесь кипятят с обратным холодильником в течение 16 часов (конечная температура дефлегмации 126,4°С), получая при этом примерно 100% теоретического максимального выхода изобутена (примерно 3,0 эквивалента/Аl). Оставшийся олефин и растворитель удаляют в вакууме (50°С, 0,05 мбар, 90 мин), используя баню со смесью сухого льда и ацетона, что дает 162 г трис(2-фенилпропил)алюминия.
Трис [ 2 - ( 4 -фторфенил) пропил ] алюминий - Аl [СН2СНМе(4-F-С6H4)]3
(ТlРРА)
В защитной камере с перчатками 2-(4-фторфенил)пропилен (65,1 г, 0,48 моль, АсF, высушенный над ситом) растворяют в сухом толуоле (примерно 70 мл) в 3-горлой колбе емкостью 250 мл. Через 10 минут Аl{СН2СНМе2}3 (ТIВА, 27,9 мл, 0,120 моль, ех-Witсо) добавляют шприцем к быстро перемешиваемому раствору. Реакционную колбу вынимают из защитной камеры с перчатками, при этом обратный холодильник и трубопровод подачи азота присоединяют к вытяжному шкафу. Изобутеновый продукт собирают, используя градуированный сосуд, погруженный в баню со смесью ацетона и сухого льда при -78°С. Реакционную смесь нагревают в течение 90 минут до достижения внутренней температуры 119,6°С. Реакционную смесь кипятят с обратным холодильником в течение 16 часов (конечная температура дефлегмации 123,5°С), получая при этом примерно 100% теоретического максимального выхода изобутена. Оставшийся олефин и растворитель удаляют в вакууме (60°, 0,05 мбар, 90 мин), используя баню со смесью сухого льда и ацетона, что дает 50 г трис[2-(4-фторфенил)пропил]алюминия.
Трис (2,3-диметилбутил) алюминий (ТDМВА)
Трис(2,3-диметилбутил)алюминий получают способом, описанным в заявке на патент WO 99/21899.
Трис(2,4,4-триметилпентил)алюминий {ТIOА)
Данное соединение алюминия получают способом, описанным в Liebigs Аnn. Сhеm., Volume 629, 1960, Zieglem еt: аl. "Аluminiumtrialkyle und Dialkyl-aluminiumhydride aus Alminiumisobutyl-Verbindungen [Аluminum trialkyls and dialkyl-aluminum hydrides from аluminum isobutyl соmpounds]", раges 14-19.
Получение металлоценов
Пример 1
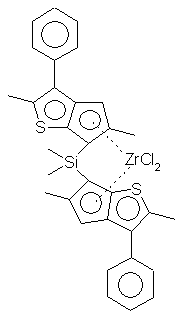
Синтез дихлорида диметилсиландиилбис-6-(2,5-диметил-3-фенил-циклопентадиенил[1,2-b]тиофен) циркония - {(2,5-Ме2-3-Рh-циклопенто [2,3-b] тиофен-6-ил)2 SiMe2} ZrСl2 (С3)
Синтез 3-бром-2-метилтиофена
К раствору, содержащему 62,0 г (610 ммоль, 88 мл) диизопропиламина, растворенного в 150 мл ТГФ, добавляют 2,5М раствор бутиллития в гексане (610 ммоль, 210 мл) при 0°C. Закончив добавление, раствор перемешивают в течение 30 минут. Колбу, содержащую LDА, охлаждают до -78°С и по каплям добавляют раствор, содержащий 100 г (610 ммоль) 3-бромтиофена, растворенного в 60 мл ТГФ. Закончив добавление, раствор нагревают до 0°С (на бане со льдом) и перемешивают в течение 30 минут. Температуру реакцинной суспензии понижают до -78°С и одной порцией добавляют раствор, содержащий 86,5 г (610 ммоль) изометана, растворенного в 40 мл ТГФ. Реакционную смесь перемешивают в течение 30 минут при -78°С, нагревают до комнатной температуры и продолжают перемешивать еще 1 час. Органический слой собирают диэтиловым эфиром, промывают водой, сушат над сульфатом магния, фильтруют и растворители удаляют в вакууме. Получают светло-оранжевое масло (89,8 г, 90,7%, ГХ). Выход: 74,8%. Спектр 1H-ЯМР (СDС13): δ 7,1 (д, 1Н), 6,9 (д, 1Н), 2,4 (с, 3Н). Спектр 13С-ЯМР (СD2С2): δ 134,6, 130,3, 123,3, 109,8, 14,8. ЕI-МС: m/z (%) 176,178 (М+ 57), 97 (100), 81 (4), 69 (12), 53 (14).
Синтез 2-Ме-3-фенилтиофена
К суспензии, содержащей 3-бром-2-метилтиофен (89,8 г, 460 ммоль) и 1 г [бис(дифенилфосфино)пропан)]дихлорникеля (Ni(DРРР)Сl2 в 200 мл диэтилового эфира по каплям добавляют раствор, содержащий фенилмагнийбромид в диэтиловом эфире (456 ммоль, 3 М, 152 мл). Закончив добавление, содержимое реакционной колбы перемешивают в течение 1 часа и гасят водой. Органическую фракцию экстрагируют дихлорметаном, промывают водой, сушат над сульфатом магния и растворители удаляют в вакууме. Получают темно-оранжевое масло (77,13 г, 87,2%, ГХ). Выход: 84,7%. Спектр 1H-ЯМР (м.д., СDНСl2): δ 7,3-7,6 (м, 5Н), 7,1-7,25 (м, 2Н), 2,6 (с, 3Н), Спектр 13С-ЯМР (СD2Cl2): δ 139,1, 137,2, 134,6, 129,6, 129,2, 129,1, 128,9, 128,8, 127,7, 127,5, 127,1, 122,0, 14,4. ЕI-МС: m/z (%) 176 (6), 175 (18), 174 (100), 173 (98), 172 (6), 171 (14), 158 (2), 147 (9), 141 (15), 135 (4), 129 (18), 115 (15).
Синтез 2,5-Мe2-3-Рh-5,6-дигидроциклопента [1,2-b]тиофен-4-она
Раствор, содержащий 2-Ме-3-фенилтиофен (124,7 г, 542 ммоль), метакриловую кислоту (61,7 г, 715 ммоль) и 200 мл дихлорметана, медленно добавляют к 1000 г суперполифосфорной кислоты (супер-РРА), перемешивая смесь при 70°С. Колбу с содержимым нагревают с обратным холодильником в течение 10 часов и во время реакции дополнительно добавляют 208 г метакриловой кислоты в 250 мл дихлорметана в виде 60 или 75 г порций. Реакционную смесь перемешивают в течение 10 часов и выливают на лед. Органический слой собирают 20% (об./об.) дихлорметана в гексане, промывают водой, насыщенным раствором гидрокарбоната натрия и водой. Органический слой сушат над сульфатом магния, фильтруют и растворители удаляют в вакууме, получая при этом темно-коричневое масло. Выход: 202,9 г (81,7%, ГХ, 95,6%). Полученное масло используют на последующих стадиях без дополнительной очистки. Примечание: два изомера из 16 выделяют с соотношением 3:1. Спектр 1Н-ЯМР (СD2Сl2): δ 7,05-7,4 (м, 5Н), 2,6-3,0 (м, 2Н), 2,3 (с, 3Н), 1,7-1,85 (м, 1Н), 1,1 (д, 3Н), Спектр 13С-ЯМР (СD2Сl2): δ 199,9, 167,6, 152,1, 136,5, 134,6, 130,4, 129,6, 139,4-127,1, 46,5, 33,8, 17,1, 17,0, 16,2. ЕI-МС: m/z (%) 242 (100), 227 (54), 214 (10), 213 (17), 199 (38), 185 (21), 184 (11), 165 (14), 152 (8), 139 (4), 128 (5), 115 (12).
Синтез 2,5-Мe2-3-Рh-4,5,6-тригидроциклопента
[1,2-b]тиофен-4-ола
1,0 М раствор алюмогидрида лития в простом эфире (300 ммоль, 300 мл) добавляют по каплям при 0°С к 202 г 2,5-Ме2-3-Рh-5,6-дигидроциклопента[1,2-b]тиофен-4-она, растворенного в 300 мл ТГФ. Закончив добавление, температуру реакционной колбы повышают до комнатной температуры и смесь перемешивают в течение 2 часов. Реакционную смесь гасят водой, органический слой собирают простым эфиром, промывают водой, сушат над сульфатом магния, фильтруют и растворители удаляют в вакууме. Получают несколько изомеров продукта. Выполняя повторную промывку сферических частиц лития, дополнительно получают 16 г вещества. Продукт получают в виде желтого твердого вещества. Выход: 139,1 (75%), 78,5% по результатам ГХ. Полученное вещество используют на последующих стадиях без дополнительной очистки. Спектр 1Н-ЯМР (СD2Сl2): δ 7,2-7,8 (м, 4Н), 4,9 (0,5Н), 4,8 (0,5Н), 2,6-3,2 (м, 3Н) 2,4-2,6 (м, 3Н), 1,1-1,3 (м, 3Н), Спектр 13С-ЯМР (СD2Сl2): δ 146,8, 140,2, 136,4, 129,5, 129-127, 80,8, 74,4, 73,7, 49,0, 43,9, 35,7, 35,4, 35,2, 19,4, 15,3, 15,27, 14,7. ЕI-МС: m/z (%) 244 (100), 229 (48), 211 (26), 201 (21), 188 (10), 187 (12), 185 (15), 184 (14), 178 (16), 171 (13), 167 (12), 165 (16), 153 (11), 152 (13), 115 (17).
Синтез 2,5-Ме2-3-Рh-6-гидроциклопента
[1,2-b] тиофена
К раствору, содержащему 28 г (114,3 ммоль) 2,5-Ме2-3-Рh-4,5,6-тригидроциклопента[1,2-b]тиофен-4-ола в 100 мл толуола, добавляют 1 г порцию п-толуолсульфоновой кислоты (р-ТSА) и смесь нагревают с обратным холодильником в течение 30 минут. Реакционную смесь гасят водой и органический слой отделяют. Органический слой промывают бикарбонатом, водой, сушат (МgSO4) и растворители удаляют в вакууме. Получают темно-красное масло (два изомера). Выход: 26,6 (90%), 87% по результатам ГХ. Спектр 1H-ЯМР (СD2Cl2): δ 6,8-7,6 (м, 5Н), 6,1-6,3 (2с, 1Н), 3,1, 2,9, (с, 2Н), 2,3 (м, 3Н), 1,9 (м, 3Н). Спектр 13С-ЯМР (СD2Cl2): δ 150,6, 146,9, 145,9, 145,6, 141,0, 137,0, 136,8, 135,8, 134,3, 131,3, 129,5, 129,1, 128,8, 127,1, 126,9, 123,5, 122,4, 41,0, 40,8, 17,2, 17,1, 15,1, 15,0. ЕI-МС: m/z (%) 227 (20), 226 (100), 225 (34), 211 (34), 210 (17), 209 (10), 193 (19), 178 (28).
Синтез (2,5-Ме2-3-Рh-6-гидроциклопента
[2,3-b] тиофен-6-ил)2 SiMe2
К раствору, содержащему 22,6 г (100 ммоль) 2,5-Ме2-3-Рh-6-гидроциклопента[1,2-b]тиофена в ТГФ (80 мл) добавляют 2,5 М раствор н-бутиллития в гексане (100 ммоль, 40 мл) при комнатной температуре. Содержимое колбы перемешивают в течение 5 часов. В отдельную колбу добавляют 6,45 г (50 ммоль) дихлордиметилсилана, растворенного в ТГФ (40 мл). Температуру понижают до -78°С и по каплям добавляют раствор в ТГФ, содержащий полученный выше анион. Закончив добавление, колбу с содержимым оставляют нагреваться до комнатной температуры и перемешивают в течение 6 часов. Реакционную смесь выливают в воду, органическую фракцию собирают дихлорметаном, сушат над сульфатом магния и концентрируют в вакууме. Твердые вещества перекристаллизовывают из простого эфира, собирают на фильтре из среднезернистой стеклянной фритты и сушат в вакууме, получая при этом не совсем белый порошок. Выход: 11,33 г (45%), 99% по результатам ГХ. Спектр
1H-ЯМР (СD2Cl2): δ 7,2-7,6 (м, 10Н), 6,2, 6,5, 6,55 (с, 2Н), 3,85, 4,08 (с, 2Н), 2,5 (с, 6Н), 2,1-2,4 (м, 6Н), -0,2, -0,55, -0,75 (с, 6Н). Спектр 13С-ЯМР (СD2Сl2): δ 136,9, 135,7, 129,5-122,44, 123,4-121,7, 68,2, 40,8, 40,7, 18,1, 17,7, 15,0, -202, -2,5. ЕI-МС: m/z (%) 509,1 (9), 508 (22), 283 (100), 255 (10), 241 (6), 210 (6), 178 (18), 152 (3).
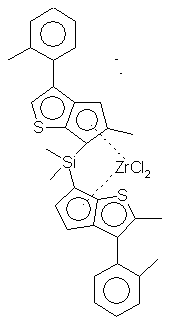
Синтез {(2,5-Мe2-3-Рh-циклопенто [2,3-b] тиофен-6-ил)2SiМе2}ZrСl2
К раствору, содержащему 1,82 г (3,6 ммоль) (2,5-Ме2-3-Рh-6-гидроциклопента[2,3-b]тиофен-6-ил)2SiМе2, суспендированного в 100 мл диэтилового эфира, по каплям добавляют 2,5 М раствор н-бутиллития в гексане (2,9 мл, 7,2 ммоль) при комнатной температуре. Смесь перемешивают в течение 5 часов и медленно добавляют 0,83 г (3,6 ммоль) тетрахлорида циркония в виде сухого порошка. Реакционную смесь перемешивают в течение 3 часов, после чего раствор фильтруют. Твердые вещества, собранные указанным образом, промывают простым эфиром и растворители удаляют в вакууме, получая при этом 770 мг смеси рацемат/мезомер (3:5). Твердые вещества, оставшиеся на фильтре, суспендируют в дихлорметане, фильтруют и растворители удаляют из раствора в вакууме. Получают 350 мг чистого рацемата. Выход: 1,12 г (47%). Спектр 1H-ЯМР (СD2Сl2): δ 7,25-7,6 (м, 10Н, рацемат), 6,58 (с, 2Н, рацемат), 2,55 (с, 3Н, рацемат), 2,3 (с, 3Н, рацемат), 1,05 (с, 6Н, рацемат). Спектр 13С-ЯМР (СD2Сl2): δ 168,8, 147,6, 145,3, 135,5, 135,4, 129,95, 129,47, 128,2, 119,0, 85, 19,9, 16,0, 0,0. ЕI-МС: m/z (%) 669 (М++1 теоретического значения).
Пример 2
Синтез дихлорида диметилсиландиилбис-6-[2,5-диметил-3-(2'-метилфенил) циклопентадиенил [ 1,2-b] тиофен] циркония - {(2,5-Ме2-3-(2МeРh)циклопенто [2,3-b] тиофен-6-ил)2SiMe2} ZrСl2 (С4)
Синтез 2-Ме-3-(2-МeРh)тиофена
Раствор о-толилмагнийбромида в простом эфире (350 мл, 2,0 М, 0,7 моль) медленно добавляют к смеси предварительно полученного 3-бром-2-метилтиофена (123 г, 0,7 моль) и 1,2 г Ni(DРРР)Сl2 в 50 мл простого эфира. Реакционную смесь перемешивают в течение ночи и медленно добавляют воду (200 мл) при комнатной температуре. Органический слой отделяют, промывают насыщенным раствором соли (рассолом)(100 мл) и сушат (МgSO4). Растворители удаляют в вакууме. Выход: 136 г. Полученное вещество используют без дальнейшей очистки. Спектр 1H-ЯМР (СD2Сl2): d 7,2-7,4 (м, 4Н), 7,18 (т, 1Н), 6,98 (т, 1Н), 2,35 (д, 3Н), 2,27 (д, ЗН). ЕI-МС: m/z (%) 188 ([М+], 100), 173 (62), 155 (34), 141 (9), 128 (33), 115 (15).
Синтез 2,5-Мe2-3- (2-МеРh) -5,6-дигидроциклопента[1,2-b] тиофен-4-она
Раствор 2-Ме-3-(2-МеРh)тиофена (80 г, 0,43 моль) и метакриловой кислоты (44 г, 0,51 моль) в 100 мл дихлорэтана по каплям добавляют к 1000 г супер-РРА при 80°С и перемешивают в течение 5 часов. Темно-красную смесь выливают на измельченный лед (1000 г) и перемешивают до полного разложения РРА. Продукт экстрагируют 30% (об./об.) дихлорметана в гексане (2 х 400 мл). Объединенные органические фракции промывают насыщенным водным раствором NаНСО3 и сушат (МgSO4). Растворители удаляют на роторном испарителе, получая при этом 74 г продукта, используемого без дальнейшей очистки. Спектр 1H-ЯМР (СDС13): δ 7,1-7,3 (м, 3Н), 7,0 (д, 1Н), 2,7-3,0 (м, 2Н), 2,25 (с, 3Н), 2,18 (м, 1Н), 2,05 (с, 3Н), 1,2 (д, 3Н). Спектр 13С-ЯМР (СDСl3): δ 199,6, 167,3, 152,2, 136,6, 135,9, 133,4, 130,2, 129,7, 128,1, 125,8, 46,1, 46,0, 32,8, 19,5, 16,9, 15,4. ЕI-МС: m/z (%) 256 ([М+], 85), 241 (100), 227 (6), 213 (35), 199 (22), 184 (7), 165 (15), 152 (9), 128 (11).
Синтез 2,6-Ме2-3-(2-МeРh)-6-гидроциклопекта [ 1,2-b] тиофена
Раствор 2,5-Ме2-3-(2-МеРh)-5,6-дигидроциклопента[1,2-b] тиофен-4-она (74 г, 0,286 моль) в 200 мл ТГФ обрабатывают 145 мл LiАlН4 в ТГФ (1,0 М, 0,145 моль) при 0°С. Смесь перемешивают при комнатной температуре в течение 3 часов, осторожно добавляют воду (50 мл) и полученную суспензию фильтруют. ТГФ выпаривают из фильтрата и твердую фильтровальную лепешку промывают дихлорметаном (3 х 150 мл). Дихлорметановые промывные воды и фильтратный осадок объединяют, промывают водой (50 мл) сушат {МgSO4) и упаривают до коричневой жидкости (67,2 г). Сырой продукт вновь растворяют в 250 мл толуола и перемешивают с 2,0 г р-ТSА при 70°С в течение 1,5 часов. Раствор в толуоле охлаждают, промывают водой (50 мл), раствором NaНСО3 (50 мл), насыщенным раствором соли (50 мл) и сушат (МgSO4). Растворители удаляют на роторном испарителе, получая при этом коричневое масло. В результате перегонки (120°С, ~0,05 тор) получают светло-желтую жидкость. Выход: 47 г (68%). Два изомера. Спектр 1Н-ЯМР (СDСl3); δ 7,1-7,3 (м, 4Н), 6,7 (м 1Н), 6,4 (м, 1Н), 3,6 (с, 2Н), 3,2 (cc, 2Н), 2,6 (с, 3Н), 2,55 (с, 3Н), 2,47 (с, 3Н), 2,46 (с, 3Н), 2,42 (с, 3Н), 2,40 (с, 3Н). Спектр 13С-ЯМР (СDСl3): δ 146,2, 145,2, 137,0, 136,4, 134,2, 133,7, 130,2, 130,0, 129,5, 127,5, 127,4, 125,7, 123,4, 122,4, 40,1, 19,9, 17,1, 14,4. ЕI-МС: m/z (%) 240 ([М+], 100), 225 (65), 210 (10), 192 (20), 178 (8), 165 (15), 149 (5), 128 (5). Аналитические данные для литиевой соли 2,5-Ме2-3-(2-МеРh)-6-гидроциклопента[1,2-b]тиофена, полученной при взаимодействии с н-бутиллитием. Спектр 1Н-ЯМР (ТГФ-d8): δ 7,2 (м, 2Н), 7,1 (м, 2Н), 5,5 (д, 1Н), 5,22 (д, 1Н), 2,19 (с, 3Н), 2,18 (с, 3Н), 2,15 (с, 3Н), Спектр 13С-ЯМР (ТГФ-d8): δ 140,3, 137,9, 131,2, 130,5, 126,8, 125,7, 124,1, 120,1, 117,2, 92,4, 91,9, 20,6, 16,4, 15,2.
Синтез (2, 5-Мe2-3- (2МеРh)-6-гидроциклопента [2,3-b]тиофен-6-ил)2SiМe2
Раствор 2,5-Ме2-3-(2-МеРh)-6-гидроциклопента[1,2-b] тиофена (36,9 г, 0,154 моль) в 150 мл ТГФ охлаждают до -78°С и обрабатывают 62 мл н-бутиллития в гексанах (2,5 М, 0,155 моль). Раствор перемешивают в течение 16 часов при комнатной температуре и добавляют по каплям к раствору дихлордиметилсилана (9,94 г, 0,077 моль) в 70 мл ТГФ, перемешивая при -78°С. Реакционную смесь медленно нагревают до комнатной температуры и перемешивают в течение 2 дней. Медленно добавляют насыщенный водный раствор NH4Сl (10 мл) и большую часть ТГФ удаляют на роторном испарителе. Остаток распределяют между простым эфиром (500 мл) и водой (150 мл). Водный слой отделяют, повторно экстрагируют свежим простым эфиром (100 мл) и объединенные эфирные фракции сушат (МgSO4). Растворитель выпаривают, получая при этом 41 г продукта в виде не совсем белого твердого вещества (чистота 91% по результатам ГХ). 18,7 г сырого продукта хроматографируют на силикагеле (5% СН2Сl2/гексан), получая при этом 13,3 г целевого соединения в виде смеси изомеров. ЕI-МС: m/z (%) 536 ([М+], 22), 297 (100), 281 (6), 223 (5), 192 (12), 165 (6). Спектр протонного ЯМР показывает наличие комплексной смеси изомеров. Аналитические данные для литиевой соли (2,5-Ме2-3-(2МеРh)-6-гидроциклопента[2,3-b]тиофен-6-ил)2SiМе2, полученной при взаимодействии с н-бутиллитием. Спектр 1Н-ЯМР (ТГФ-d8): δ 7,08-7,18 (м, 8Н), 5,43 (с, 2Н), 2,28 (д, 3Н), 2,21 (д, 3Н), 1,19 (с, 3Н), 0,89 (д, 3Н), 0,63 (с, 3Н).
Синтез {(2,5-Ме2-3- (2МеРh) циклопенто [2,3-b]тиофен-6-ил)2Si-Ме2} ZrСl2
Раствор (2,5-Ме2-3-(2-МеРh)-6-гидроциклопента[2,3-b]тиофен-6-ил)2SiMe2 (27,6 г, 51,5 ммоль) в 200 мл простого эфира охлаждают до -78°С и обрабатывают 42 мл н-бутиллития в гексанах (2,5 М, 105 ммоль) Смесь перемешивают в течение ночи при комнатной температуре, растворители удаляют в вакууме и добавляют пентан (150 мл). Желтую суспензию охлаждают до -78°С и обрабатывают ZrCl4 (11,7 г, 50,2 ммоль). Реакционную смесь нагревают до комнатной температуры, перемешивают в течение 18 часов и фильтруют через мелкозернистую фритту. Желтое твердое вещество промывают пентаном (60 мл) и сушат в вакууме, получая при этом 33,8 г сырого продукта. Сырой продукт перемешивают в 400 мл дихлорметана при комнатной температуре и фильтруют через целит. Фильтрат упаривают при пониженном давлении и получают продукт в виде смеси рацемат/мезомер (50:50) (27,9 г, 78,5%). Изомеры разделяют, для чего порцию смеси рацемат/мезомер растворяют в дихлорметане, добавляют равный объем гексана и частично выпаривают дихлорметан при пониженном давлении. Мезомер осаждают из раствора и удаляют фильтрованием. После второго фильтрования растворители удаляют из фильтрата, получая рацемат с чистотой около 95%. Спектр 1Н-ЯМР (СD2Сl2): δ 7,65 (м, 2Н, мезомер), 7,60 (м, 2Н, рацемат), 7,27 (м, 6Н, мезомер), 7,26 (м, 6Н, рацемат), 6,33 (с, 2Н, рацемат), 6,18 (с, 2Н, мезомер), 2,34 (с, 6Н, рацемат), 2,32 (с, 6Н, мезомер), 2,30 (с, 6Н, рацемат), 2,25 (с, 6Н, мезомер), 2,09 (с, 6Н, рацемат), 2,03 (с, 6Н, мезомер), 1,17 (с, 3Н, мезомер), 1,13 (с, 3Н, мезомер), 1,08 (с, 6Н, рацемерат). Спектр 13С-ЯМР (СD2Сl2): δ (рацемат) 148,1, 145,6, 137,3, 134,6, 134,4, 130,8, 130,4, 129,6, 128,2, 126,3, 125,2, 118,5, 19,5, 19,47, 15,2, -0,57. ЕI-МС: m/z (%) 697 [M++1 теоретического значения).
Пример 3
Синтез дихлорида диметилсиландиилбис-6-[3,5-диметил-цихлопентадиенил [ 1,2 -b]тиофен]циркония-SiМе2(Ме2Ср-тиофен)ZrСl2 (С6)
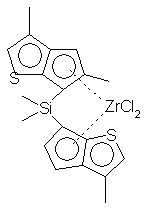
Синтез 3,5-диметил-6-гидроциклопента[1,2-b]тиофен-4-она
В колбу, содержащую 950 г 84% полифосфорной кислоты (Аldriсh), добавляют 180 г Р2О5. Суспензию нагревают до 140°С в течение 4 часов (до растворения Р2О5,) и охлаждают до 70°С.
По каплям добавляют раствор, содержащий 100 г (1,01 моль) 3-метилтиофена, 86 г (1 моль) метакриловой кислоты и 60 мл дихлорметана. Смесь нагревают с обратным холодильником в течение 2 часов и раствор выливают на лед. Органический слой собирают смесью 30% дихлорметан/гексан, который промывают водой, насыщенным раствором бикарбоната натрия, водой, сушат над сульфатом магния, фильтруют и растворители удаляют в вакууме, получая при этом 143 г темно-коричневого масла. Масло перегоняют при 78°С (500 микрон) и получают 10,2 г бледно-желтого масла (выход 6,1%). Указанное в заголовке соединение анализируют спектроскопией 1Н-ЯМР.
Синтез 3,5-диметил-4-сульфоногидразид-6-гидроциклопента [1,2-b]тиофена
В колбу, содержащую 9,5 г (57 ммоль) 3,5-диметил-6-дигидроциклопента[1,2-b]тиофен-4-она, растворенного в 100 мл этанола, добавляют 10,6 г (57 ммоль) пара-толуол-сульфоногидразида и каталитическое количество (0,6 г) моногидрата пара-толуолсульфоновой кислоты. Реакционную смесь нагревают с обратным холодильником в течение 2 часов и охлаждают до комнатной температуры. Охлажденный раствор фильтруют и белый осадок собирают фильтрованием. Твердые вещества сушат в вакууме и получают таким образом 12,8 г (выход: 67,4%) вещества. Указанное в заголовке соединение анализируют спектроскопией 1Н-ЯМР.
Синтез 3,5-диметил-6-гидроциклопента[1,2-b]тиофена
В колбу, содержащую 11,1 г (33,3 ммоль) 2-сульфоногидразид-3,5-диметил-4-гидроциклопента[1,2-b]тиофена, растворенного в 50 мл ТГФ, добавляют раствор, содержащий 2,5 М н-бутиллития (96 ммоль, 38,4 мл) в гексане. Реакционную смесь перемешивают в течение 18 часов и гасят раствором, содержащим 18 г (1 моль) воды, растворенной в 48 мл ТГФ, который добавляют при 0°C. Добавляют еще 100 мл воды и ТГФ удаляют в вакууме. Органическую фракцию собирают раствором 20% дихлорметана в гексане, промывают водой, насыщенным раствором бикарбоната натрия и снова водой, сушат над сульфатом магния и фильтруют. Растворители удалают на роторном испарителе, получая при этом 2,9 г темно-оранжевого масла, которое используют на последующих стадиях без дальнейшей очистки. Указанное в заголовке соединение анализируют спектроскопией 1Н-ЯМР.
Синтез бис(3,5-диметилтиопентален)диметилсилана
К 2,9 г (20 ммоль) 3,4-диметил-6-гидроциклопента[1,2-b]тиофена, растворенного в 20 мл диэтилового эфира, добавляют 2,5 М раствор, содержащий н-бутиллитий (20 ммоль, 8 мл) в гексане. Смесь перемешивают в течение 2 часов и растворители удаляют в вакууме. Высушенные твердые вещества промывают пентаном и растворяют в 10 мл ТГФ. В отдельную колбу по каплям добавляют раствор, содержащий 1,2 г (10 ммоль) дихлордиметилсилана и раствор в ТГФ, содержащий анион. Смесь перемешивают в течение 18 часов и растворители удаляют в вакууме. Твердые вещества промывают пентаном и пентан удаляют в вакууме, получая при этом 3,0 г желтовато-коричневого свободнотекучего порошка. Указанное в заголовке соединение анализируют спектроскопией 1Н-ЯМР.
Синтез дихлорида диметилсиландиилбис (3,5-диметилтиопентален)циркония
В 250 мл колбу вводят 3,0 г (8,41 ммоль) бис(3,5-диметилциклопента[1,2-b]тиофен)диметилсилана, растворенного в 60 мл диэтилового эфира. При комнатной температуре по каплям добавляют раствор, содержащий 2,5 М бутиллития в гексане (16,8 ммоль, 7 мл). Раствор перемешивают в течение 1,5 часов и растворители удаляют в вакууме. Твердые вещества промывают пентаном и получают дианион в виде светло-коричневого порошка. Указанное в заголовке соединение анализируют спектроскопией 1Н-ЯМР.
Дианион (полученный выше) суспендируют в пентане (70 мл) и медленно добавляют тетрахлорид циркония (1,96 г, 8,41 ммоль) в виде сухого порошка. Затем добавляют несколько капель ТГФ и суспензию перемешивают в течение 18 часов. Растворители удаляют в вакууме и получают 4,5 г ярко-желтого твердого вещества. 3,5 г порцию указанного вещества очищают, фильтруя из дихлорметана, и растворители снова удаляют в вакууме, получая 1,3 г смеси рацемат/мезомер (50:50); рассчитанный выход 1,68 г (38,8%). Кристаллы рацемера получают, медленно упаривая раствор смеси рацемат/мезомер в дихлорметане. Указанное в заголовке соединение анализируют спектроскопией 1Н-ЯМР.
Пример 4
Синтез дихлорида диметилсиландиилбис-6-[2,5-диметил-3-(2',5' -диметилфенил)циклопентадиенил[1,2-b]тиофен]циркония (С5)
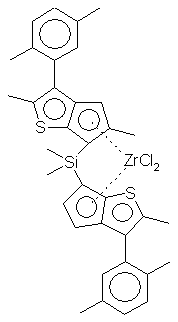
Синтез 2-Ме-3- (2,5-Mе2Ph) тиофена
Раствор 2,5-диметилфенилмагнийбромида в простом эфире (400 мл 0,6 М, 0,24 моль) медленно добавляют к смеси 3-бром-2-метилтиофена (42,5 г, 0,24 моль) и 1,2 г Ni(DРРР)Сl2 в 100 мл простого эфира. Смесь перемешивают в течение ночи, осторожно добавляют воду (200 мл), органический слой отделяют, промывают насыщенным раствором соли (100 мл) и сушат (МgSO4). Растворитель выпаривают и из исходного вещества получают 47 г продукта, используемого без дальнейшей очистки. ЕI-МС: m/z (%) 202 [М+ 100), 187 (78), 171 (29), 154 (15), 128 (16), 115 (13).
Синтез 2,5-Ме2-3- (2,5-Мe2Ph) -5,6-дигидроциклопента [1,2-b] тиофен-4-она
Раствор 2-Ме-3-(2,5-Ме2Рh)тиофена (47 г, 0,23 моль) и метакриловой кислоты (24 г, 0,28 моль) в 125 мл дихлорэтана по каплям добавляют к 1000 г супер-РРА при 90°С и перемешивают в течение 24 часов. Темно-красную смесь выливают на измельченный лед (1000 г) и перемешивают до полного разложения РРА. Продукт экстрагируют 25% (в объемном отношении) дихлорметана в гексане (2 х 400 мл). Объединенные органические фракции промывают насыщенным водным раствором NаНСО3 и сушат (МgSO4). Растворители удаляют на роторном испарителе, получая при этом 59 г коричневого масла. Продукт очищают хроматографией на силикагеле, используя 50% (об./об.) дихлорметана в гексане. Выход: 26,1 г (42%). Спектр 1Н-ЯМР (СDCl3): δ 7,0 (д, 1Н), 7,15 (д, 1Н), 6,92 (с, 1Н), 2,95 (м, 2Н), 2,5 (м, 1Н), 2,38 (с, 1Н), 2,35 (с, 3Н), 2,1 (с, 3Н), 1,32 (с, 3Н). Спектр 13С-ЯМР (СDСl3): δ 152,1, 136,2, 135,9, 135,3, 133,5, 133,3, 130,22, 130,20, 130,11, 128,9, 122,5, 46,1, 32,9, 20,8, 19,1, 16,9, 15,4. ЕI-МС: m/z (%) 270 (М+, 86), 255 (100), 241 (6), 227 (37), 213 (25), 198 (11), 179 (10), 141 (7), 128 (15).
Синтез 2,5-Мe2-3- (2,5-Me2Ph)-6-гидроциклопента
[1,2-b]тиофена
Раствор 2,5-Ме2-3-(2,5-Ме2Ph)-5,6-дигидроциклопента[1,2-b]тиофен-4-она (26,1 г, 97 ммоль) в 75 мл ТГФ обрабатывают 48 мл LiАlН4 в простом эфире (1,0 М раствор, 48 ммоль) при 0°С. Смесь перемешивают при комнатной температуре в течение 5 часов, осторожно добавляют воду (10 мл) и полученную суспензию фильтруют через прессованный целит. ТГФ выпаривают из фильтрата и фильтровальную лепешку промывают дихлорметаном (3 х 50 мл). Фракции в дихлорметане объединяют с фильтратным остатком и промывают водой (50 мл). Реакционную смесь сушат (МgSO4) и растворитель удаляют на роторном испарителе. Продукт растворяют в толуоле (60 мл) и перемешивают с 0,4 г р-ТSА при 60°С в течение 3 часов. Раствор в толуоле охлаждают, промывают водой (50 мл), раствором NаНСО3 (50 мл), насыщенным раствором соли (50 мл) и сушат (МgSO4). Толуол удаляют на роторном испарителе и продукт очищают перегонкой (110°С, ~0,05 тор). Выход: 11,5 г (47%). Спектр 1H-ЯМР (СDСl3): δ 7,19 (д, 1Н), 7,1 (д, 1Н), 7,0 (с, 1Н), 6,41 (с, 1Н), 2,93 и 2,90 (cc, 2Н, 2 изомера), 2,35 (с, 3Н), 2,25 (с, 3Н), 2,12 (с, 6Н). Спектр 13С-ЯМР (СDСl3): δ 146,0, 144,9, 140,1, 136,0, 134,8, 134,1, 133,6, 133,3, 130,4, 129,8, 128,0, 122,1, 39,9, 20,9, 19,1, 16,9, 14,2. ЕI-МС: m/z (%) 254 (М+, 100), 239 (75), 224 (16), 206 (20), 191 (11), 178 (10), 165 (10), 149 (6), 128 (9).
Синтез (2,5-Мe2-3-(2,5-Ме3Рh)-6-гидроциклопента [2,3-b]тиофен-6-ил)2SiМе2
Раствор 2,5-Ме2-3-(2,5-Ме2Рh)-6-гидроциклопента[1,2-b]тиофена (10,6 г, 41,7 ммоль) в 60 мл ТГФ охлаждают до -78°С и обрабатывают 17 мл н-бутиллития в гексанах (2,5М раствор, 42,5 ммоль). Реакционную смесь перемешивают в течение 16 часов при комнатной температуре и добавляют по каплям к раствору дихлордиметилсилана (2,69 г, 20,9 ммоль) в 30 мл ТГФ при -78°С. Холодную баню удаляют, смесь продолжают перемешивать в течение 18 часов при комнатной температуре и гасят насыщенным водным раствором NH4Сl (10 мл). Реакционный продукт разбавляют простым эфиром (250 мл) и промывают водой (100 мл). Смесь сушат (МgSO4) и растворители удаляют на роторном испарителе. Продукт очищают хроматографией на силикагеле, используя 5% (об./об.) дихлорметана в гексане. Выход: 7,0 г (59%). Основной изомер - Спектр 1H-ЯМР (СDСl3): δ 6,9-7,2 (м, 6Н), 6,2 (с, 2Н), 3,85 (с, 2Н), 2,35 (с, 6Н), 2,25 (с, 6Н), 2,20 (с, 6Н), 2,10 (с, 6Н), -0,12 (м, 6Н). Спектр 13С-ЯМР (СDС13): δ 149,7, 146,2, 145,9, 135,8, 135,6, 134,9, 134,8, 130,8, 129,9, 127,8, 123,0, 122,1, 46,2, 20,9, 19,4, 18,0, 14,3, -7,5, -8,9. ЕI-МС: m/z (%) 564 (М+, 25), 311 (100), 282 (6), 253 (4), 237 (5), 206 (12), 189 (5), 165 (3), 128 (3).
Синтез {Ме2Si(2,5-Ме2-3-(2,5-Ме2Рh)циклопенто[2,3-b] тиофен-6-ил)2}ZrCl2
Раствор (2,5-Ме2-3-(2,5-Ме2Ph)-6-гидроциклопента[2,3-b]тиофен-6-ил)2SiМе2 (2,33 г, 4,1 ммоль) в 50 мл простого эфира обрабатывают 3,4 мл н-бутиллития в гексанах (2,5 М раствор, 8,5 ммоль). Смесь перемешивают в течение ночи при комнатной температуре, растворители удаляют в вакууме и добавляют ZrСl4 (0,96 г, 4,1 ммоль). Добавляют пентан (60 мл) и смесь перемешивают в течение 24 часов. Твердые вещества собирают на мелкозернистой фритте, промывают пентаном и сушат в вакууме.
Сырой продукт перемешивают в 100 мл дихлорметана и фильтруют через целит. Растворитель удаляют при пониженном давлении и получают продукт в виде желтого твердого вещества (2,5 г, смесь рацемат/мезомер, 50:50). Порцию продукта вновь растворяют в дихлорметане и обрабатывают гептаном, получая при этом светло-желтый осадок, который удаляют фильтрованием. Фильтрат концентрируют при пониженном давлении, пока раствор не становится мутным. После выстаивания смеси рацемат кристаллизуется из раствора и его собирают на мелкозернистой фритте. Спектр 1Н-ЯМР (СD2Сl2): δ 7,43 (с, 2Н, мезомер), 7,40 (с, 2Н, рацемат), 7,16 (д, 2Н, рацемат), 7,15 (д, 2Н, мезомер), 7,10 (д, 2Н, рацемат), 7,09 (д, 2Н, мезомер), 6,32 (с, 2Н, рацемат), 6,19 (с, 2Н, мезомер), 2,34 (ее, 12Н, мезомер), 2,33 (cc, 12Н, рацемат), 2,29 (с, 6Н, рацемат), 2,25 (с, 6Н, мезомер), 2,02 (с, 6Н, рацемат), 1,19 (с, 3Н, мезомер), 1,15 (с, 3Н, мезомер), 1,10 (с, 6Н, рацемат), Спектр 13С-ЯМР (СD2Сl2): δ (рацемат) 148,0, 145,5, 135,7, 134,5, 134,2, 134,1, 131,3, 130,3, 129,9, 128,9, 125,2, 118,5, 21,1, 19,5, 19,3, 15,2, -0,58. ЕI-МС: m/z (%) 725 (М++1 теоретического значения).
Пример 5
Синтез 5-Ме-5,6-дигидроциклопента[1,2-b]селенофен-4-она
Раствор селенофена (9,9 г/ 75,6 ммоль) и метакриловой кислоты (7,8 г, 90 ммоль) в 50 мл дихлорэтана по каплям добавляют к 250 г суперполифосфорной кислоты (супер-РРА) при 80°С и перемешивают в течение 1,5 часов. Смесь выливают на измельченный лед и перемешивают до полного разложения РРА. Продукт экстрагируют 30% (об./об.) дихлорметана в гексане. Объединенные органические фракции промывают насыщенным водным раствором NаНСО3 и сушат (МgSO4). Растворители удаляют на роторном испарителе, получая при этом 5,25 г сырого продукта, содержащего 35% продукта по результатам анализа ГХ. Сырой продукт хроматографируют на силикагеле (используя дихлорметан в качестве растворителя) и получают 3,02 г целевого продукта. Выход: 35%. Спектр 1H-ЯМР (СD2Сl2): δ 8,6 (д, 1Н), 7,25 (д, 1Н), 3,25 (дд, 1Н), 2,9 (м, 1Н), 2,58 (дд, 1Н), 1,3 (д, 3Н). Спектр 13С 201,8, 169,5, 145,5, 144,7, 143,3, 126,3, 45,9, 34,4, 16,8. ЕI-МС: m/z (%) 200 (88), 185 (100), 171 (13), 157 (22), 145 (7), 130 (9), 120 (11), 91 (55).
Синтез 5-Ме-5,6-дигидроциклопента[1,2-b]селенофен-4-ола
В 250 мл колбу вводят 20 г (100 ммоль) 5-Ме-5,6-дигидроциклопента[1,2-b]селенофен-4-она, растворенного в 60 мл диэтилового эфира. По каплям добавляют раствор, содержащий алюмогидрид лития (1,0М раствор в диэтиловом эфире, 100 ммоль, 100 мл), при -78°С. Закончив добавление, смесь оставляют нагреваться до комнатной температуры и перемешивают в течение 3 часов. Затем медленно добавляют воду (50 мл), органическую часть фильтруют через целит, собирают диэтиловым эфиром, промывают водой и сушат (сульфат магния). Растворители удаляют в вакууме, получая при этом 12,86 г темно-красного масла (два изомера, 98,6% по результатам ГХ). ЕI-МС: m/z (%, основной изомер) 205 (2), 204 (19), 203 (14), 202 (100), 201 (21), 200 (51), 199 (26), 198 (22), 187 (51), 186 (8), 185 (40), 184 (29), 183 (41), 182 (17), 181 (19), 180 (10), 175 (5), 174 (9), 173 (24), 172 (6), 171 (16), 170 (9), 169 (15).
Синтез 5-Ме-3-гидроциклопента[1,2-b]селенофена
В 500 мл колбу вводят 13 г (65 ммоль) 5-Ме-5,6-дигидроциклопента[1,2-b]селенофен-4-ола, растворенного в 70 мл толуола, и 0,2 г моногидрата пара-толуолсульфоновой кислоты. Содержимое колбы перемешивают при комнатной температуре в течение 18 часов, реакционную смесь промывают водой, органическую часть собирают диэтиловым эфиром, сушат над сульфатом магния, фильтруют и растворители удаляют в вакууме. Получают 12,3 г темно-красного масла. 11 г продукта хроматографируют гексаном через силикагель и собирают 0,6 г светло-желтого масла из выбранных фракций: 90% по результатам ГХ. ЕI-МС: m/z (%, основной изомер) 186 (2), 185,9 (18), 184,8 (25), 183,9 (100), 182,9 (92), 181,9 (92), 181,9 (60), 180,9 (63), 179,9 (45), 178,9 (23), 168,8 (27), 166,9 (13).
Синтез Ме2Si(2-метилтгидроциклопента [1,2-b] селенопенталена)2 (мостиковый лиганд)
В 200 мл колбу, содержащую 0,6 г (3,2 ммоль) 5-метил-4-гидроциклопента[1,2-b]селенопенталена, растворенного в 40 мл диэтилового эфира, по каплям добавляют раствор н-бутиллития (2,5М раствор в гексане, 3,2 ммоль, 1,3 мл) при комнатной температуре. Содержимое колбы перемешивают в течение 1 часа. Добавляют небольшое количество ТГФ, чтобы растворить твердые вещества и облегчить взаимодействие. В отдельную 250 мл колбу с 125 мл капельной воронкой добавляют 0,21 г (1,6 ммоль) дихлордиметилсилана, растворенного в 40 мл ТГФ. Раствор охлаждают до -78 и по каплям добавляют раствор, содержащий полученный выше дианион. Содержимое колбы оставляют нагреваться до комнатной температуры и перемешивают в течение 18 часов. Реакционную смесь гасят 40 мл насыщенного раствора хлорида аммония (добавляемого по каплям). Органическую часть, выделенную из реакционной смеси, собирают диэтиловым эфиром, промывают водой, сушат над сульфатом магния, фильтруют и растворители удаляют в вакууме. Собирают 0,56 г темно-оранжевого масла, которое хроматографируют на силикагеле, используя гексан в качестве элюента. Получают 0,3 г продукта (50% по результатам ГХ). ЕI-МС: m/z (%) 426,9 (1), 425,8 (4), 424,8 (2), 423,8 (10), 422,8 (3), 421,8 (9), 242,9 (13), 241,9 (12), 240,9 (59), 239,9 (12), 238,9 (31), 237,9 (15), 236,9 (13), 160 (20), 159 (100), 157 (2).
Синтез дихлорида Ме2Si(2-метилгидроциклопента [1,2-b] селенопентален)2циркония
В 100 мл колбу вводят 0,3 г (0,71 ммоль) Ме2Si(2-метилгидроциклопента[1,2-b]селенопенталена)2, растворенного в диэтиловом эфире. По каплям добавляют раствор, содержащий н-бутиллитий (1,2 мл, 2,5М раствор в гексане, 3 ммоль). Реакционную смесь перемешивают в течение 20 минут и растворители удаляют в вакууме. Твердые вещества промывают пентаном и вновь суспендируют в свежем пентане. К перемешиваемой суспензии медленно добавляют 0,2 г (0,8 ммоль) тетрахлорида циркония в виде сухого порошка. Реакционную смесь перемешивают в течение ночи и фильтруют, твердые вещества собирают и промывают пентаном. Твердые вещества растворяют в диэтиловом эфире, фильтруют и растворители удаляют в вакууме. Собирают 0,48 г продукта, который используют в последующих исследованиях полимеризации. Спектр 1H-ЯМР (СD2Сl2): δ 7,0-7,4 (м, 6Н), 2,38 (с, 6Н), 0,5 {с, 6Н).
Пример 6 (сравнительный)
Дихлорид диметилсиландиилбис-4-(2,5-диметил-1-фенилциклопентадиенил[2,1-b]пиррол) циркония - {Мe2Si(2,5-Ме2-1-Рh-циклопенто[ 3,2-b]пиррол-4-ил)2}ZrCl2 N1
Данное соединение получают способом по примеру 13, описанным в заявке на патент WО 98/22486.
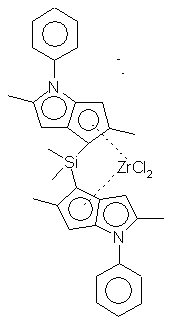
Пример 7 (сравнительный)
Синтез дихлорида диметилсиландиилбис-4-(3-метил-1-фенилциклопентадиенил [2,1-b]пиррол) циркония - {Ме2Si(5-Ме-1-Рh-циклопенто[3,2-b]пиррол-4-ил)2}ZrСl2 N2
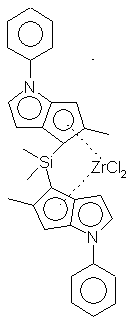
1-Фенилпиррол-2-карбальдегид
РОСl3 (107,3 г, 0,70 моль) по каплям добавляют к 76 мл ДМФ (71,7 г, 0,98 моль) и перемешивают в течение 10 минут. Температуру понижают до 0°С и медленно добавляют раствор 1-фенилпиррола (100 г, 0,70 моль) в 100 мл дихлорметана. Вязкий раствор медленно нагревают до 50°С и продолжают перемешивать в течение 1 часа. Колбу охлаждают до комнатной температуры, открывают для доступа воздуха и вводят 750 г измельченного льда. Осторожно добавляют 20 мас.% раствор NаОН (885 мл), смесь сразу же нагревают до 85-90°С и перемешивают в течение 10 минут. Растворитель отгоняют в ходе указанного процесса. Колбу помещают на баню со льдом, охлаждают до комнатной температуры и реакционную смесь экстрагируют дихлорметаном (2 х 200 мл). Объединенные органические фракции промывают водой и сушат (МgSO4). Растворитель выпаривают и получают 114 г продукта в виде оранжевого масла, содержащего примерно 10% изомера 1-фенилпиррол-3-карбальдегида. Полученный продукт используют без дальнейшей очистки. Спектр 1Н-ЯМР (СDСl3): δ 9,5 (с, 1Н), 7,4 (м, 3Н), 7,3 (м, 2Н), 7,1 (дд, 1Н), 7,0 (т, 1Н), 6,35 (дд, 1Н), Спектр 13С-ЯМР (СDСl3): δ 178,1, 138,1, 131,9, 130,4, 128,4, 127,5, 125,4, 121,3, 110,3. ЕI-МС: m/z (%) 171 (М+ 100), 154 (7), 142 (8), 115 (50), 93 (42), 77 (16).
Этил [2Z]-2-Ме-3-[1-фенилпиррол-2-ил]проп-2-еноат
Раствор триэтил 2-фосфонопропионата (153 мл, 0,714 моль) в 75 мл ТГФ медленно добавляют к смеси гидрида натрия (24,3 г, 1,0 моль) в 60 мл ТГФ при 0°С. Суспензию нагревают до комнатной температуры и перемешивают в течение 1 часа. Температуру понижают до -10°С и по каплям добавляют раствор 1-фенилпиррол-2-карбальдегида (113 г, 0,665 моль) в 200 мл ТГФ. Реакционную смесь нагревают до комнатной температуры в течение 30 минут, получая при этом густой осадок. Осторожно добавляют насыщенный водный раствор N4НСl (100 мл) и получают двухфазный раствор. ТГФ отгоняют и сырой продукт экстрагируют простым эфиром (2 х 200 мл). Эфирный экстракт промывают насыщенным раствором соли и сушат (МgSO4). Растворитель выпаривают и сырой продукт промывают гексаном, получая при этом продукт в виде белого кристаллического твердого вещества. Выход: 89% (151 г). Спектр 1H-ЯМР (СDСk3): δ 7,4 (м, 4Н), 7,3 (м, 2Н), 7,0 (дд, 1Н), 6,7 (дд, 1Н), 6,4 (т, 1Н), 4,1 (кв, 2Н), 2,2 (с, 3Н), 1,2 (т, 3Н), Спектр 13С-ЯМР (СDСl3): δ 168,6, 139,0, 129,4, 129,0, 127,3, 126,1, 126,0, 124,8, 122,8, 114,1, 109,9, 60,2, 14,1. ЕI-МС: m/z. (%) 255 (М+, 50), 226 (5), 210 (23), 182 (100), 167 (47), 154 (12), 115 (7), 77 (18), т.п. 73°С.
Этил 2-Ме-3-[1-фенилпиррол-2-ил]пропаноат
Смесь этил[2Z]-2-Ме-3-[1-фенилпиррол-2-ил]проп-2-еноата (55 г, 0,22 моль) и 10% Рd/С (2,3 г) в 300 мл дихлорметана перемешивают под давлением водорода 5,6 атм (80 фунт/кв.дюйм) в течение 4 часов. Кататизатор отфильтровывают и промывают дихлорметаном, растворитель удаляют на роторном испарителе, получая при этом требуемый продукт. Выход: 54 г (97%). Спектр 1H-ЯМР (СDСl3): δ 7,4 (м, 3Н), 7,2 (м, 2Н), 6,7 (м, 1Н), 6,1 (м, 1Н), 6,0 (м, 2Н), 4,0 (кв, 2Н), 2,9 (м, 1Н), 2,5 (м, 2Н), 1,2 (т, 3Н), 1,0 (д, 3Н). Спектр 13С-ЯМР (СDСl3): δ 175,6, 128,9, 127,0, 126,0, 121,8, 107,8, 60,0, 39,3, 30,3, 16,7, 13,9. Е1-МС: m/z (%) 257 (М+ 9), 216 (7), 184 (6), 146 (100), 77 (16).
2-Ме-3-[1-фенилпиррол-2-ил]пропановая кислота
Этил 2-Ме-3-[1-фенилпиррол-2-ил]пропаноат (42,1 г, 0,164 моль) обрабатывают 78 мл реагента Клайзена и нагревают до 90-95°С. Раствор перемешивают в течение 1 часа, выливают на измельченный лед и подкисляют до рН 1-2 6 н.раствором НСl. Осажденную свободную кислоту экстрагируют простым эфиром (2×200 мл), промывают насыщенным раствором соли и сушат (МgSO4). Простой эфир удаляют из продукта, выпаривая на роторном испарителе. Выход: 27,9 г (75%). Спектр 1Н-ЯМР (СDСl3): δ 7,2-7,6 (м, 5Н), 6,7 (д, 1Н), 6,2 (т, 1Н), 6,1 (д, 1Н), 3,0 (м, 1Н), 2,6 (м, 2Н), 1,1 (д, 3Н).
5-Мe-1-Рh-5,6-дигидроциклопента [1,2-b] пиррол-4-он
Раствор 2-Ме-3-[1-фенилпиррол-2-ил]пропановой кислоты (43 г, 0,188 моль) в 75 мл дихлорэтана по каплям добавляют к 1000 г супер-РРА при 100°С. Смесь перемешивают в течение 5 часов, охлаждают до 60°С и медленно выливают на измельченный лед. Продукт экстрагируют 30% (об./об.) дихлорметана в гексане (2×200 мл). Объединенные органические фракции промывают насыщенным водным раствором NаНСО3 и сушат (МgSO4). Растворители удаляют на роторном испарителе, получая при этом продукт в виде желтовато-коричневого твердого вещества. Выход: 37 г (93%). Спектр 1H-ЯМР (СDСl3): δ 7,5 (м, 2Н), 7,4 (м, 3Н), 7,1 (д, 1Н), 6,4 (д, 1Н), 3,3 (дд, 1Н), 3,0 (м, 1Н), 2,6 (дд, 1Н), 1,3 (д, 3Н). Спектр 13С-ЯМР (СDСl3): δ 199,6, 156,6, 138,8, 129,8, 129,2, 127,9, 127,2, 122,0, 104,1, 47,5, 30,8, 17,1. ЕI-МС: m/z (%) 211 (М+ 100), 196 (55), 182 (33), 167 (27), 154 (12), 120 (23), 105 (38), 77 (46), т.п. 120°С.
Тозилгидразон 5-Ме-1-Рh-5,6-дигидроциклопента[1,2-b]пиррол-4-она
5-Ме-1-Рh-5,6-дигидроциклопента[1,2-b]пиррол-4-он(36 г, 0,171 моль), п-толуолсульфонгидразид (33 г, 0,177 моль) и моногидрат п-толуолсульфоновой кислоты (6,6 г, 0,035 моль) перемешивают в 220 мл этанола при 70°С в течение 16 часов. Смесь охлаждают до комнатной температуры и оставляют выстаиваться на несколько часов, осажденный продукт собирают на фильтровальной воронке, промывают простым эфиром и сушат в вакууме. Растворители выпаривают из фильтрата и дополнительный продукт получают, растирая остаток с толуолом. Получают желтовато-коричневое твердое вещество. Выход: 58,9 г (91%). Спектр 1H-ЯМР (СDСl3): δ 7,9 (д, 2Н), 7,1-7,6 (м, 7Н), 7,1 (д, 1Н), 6,7 (д, 1Н), 3,5 (м, 1Н), 3,2 (дд, 1Н), 2,6 (дд, 1Н), 2,4 (c, 3Н), 1,3 (д, 3Н), Спектр 13С-ЯМР (СDСl3): δ 162,2, 147,0, 143,5, 138,9, 135,5, 129,7, 129,2, 128,1, 126,9, 126,3, 121,8, 121,4, 105,5, 42,8, 32,4, 21,5, 19,7; т.п. 186°С (разложение).
5-Ме-1-Рh-4-гидроциклопента [2,1-b] пиррол
К раствору тозилгидразона (32,5 г, 0,086 моль) в ТГФ (200 мл) добавляют 76 мл н-бутиллития в гексанах (2,5 М, 0,189 моль) при -78°С. Реакционную смесь медленно нагревают до комнатной температуры и перемешивают в течение 16 часов. По каплям добавляют насыщенный водный раствор NН4Сl (20 мл) и отгоняют органические растворители. Добавляют воду (100 мл) и смесь экстрагируют простым эфиром (2 х 100 мл). Объединенные эфирные фракции сушат (МgSO4) и растворитель удаляют на роторном испарителе. Коричневый маслянистый остаток интенсивно перемешивают с гексаном (150 мл) в течение 1 часа. Нерастворимые продукты удаляют фильтрованием и гексан выпаривают, получая при этом продукт в виде светло-желтого масла. Выход: 12 г (72%). Два изомера. Спектр 1Н-ЯМР (СDСl3): δ 7,5 (м, 4Н), 7,3 (м, 1Н), 7,1 (д, 1Н), 7,0 (д, 1Н), 6,6 (с, 1Н), 6,4 (с, 1Н), 6,3 (д, 1Н), 6,2 (д, 1Н), 3,3 (с, 1Н), 3,1 (с, 1Н), 2,2 (с, 3Н), 2,17 (с, 3Н), ЕI-МС: m/z (%) 195 (М+, 100), 180 (28), 167 (7), 152 (10), 139 (2), 127 (3), 116 (3), 91 (12), 77 (8).
(5-Ме-1-Рh-4-гидроциклопента [3,2-b] пиррол-4-ил) SiMe2Cl
Раствор 5-Ме-1-Рh-4-гидроциклопента[2,1-b]пиррола (11,2 г, 0,057 моль) в 100 мл простого эфира обрабатывают 28 мл н-бутиллития в гексанах (2,5 М, 0,070 моль) при -10°С и перемешивают при комнатной температуре в течение 16 часов. К реакционной смеси добавляют пентан (50 мл), образовавшуюся соль лития оставляют осаждаться и жидкость удаляют при помощи фильтровальной планки. Осадок вновь растворяют в простом эфире (150 мл), охлаждают до -78°С и шприцем добавляют дихлордиметилсилан (10,5 мл, 0,086 моль). Реакционную смесь нагревают до комнатной температуры и кипятят с обратным холодильником в течение 2 часов. Смесь охлаждают и фильтруют, летучие вещества удаляют из фильтрата в вакууме (100 миллитор, 40°C), получая при этом продукт в виде бесцветного масла. Выход: 12,7 г (77%). Спектр 1Н-ЯМР (СD2Cl2): δ 7,5 (м, 4Н), 7,3 (м, 1Н), 7,0 (д, 1Н), 6,6 (с, 1Н), 6,3 (д, 1Н), 3,3 (с, 1Н), 2,3 (с, 3Н), 0,5 (с, 3Н), 0,1 (с, 3Н). Спектр 13С-ЯМР (СD2Cl2): δ 144,9, 129,9, 125,5, 121,1, 120,6, 117,9, 106,2, 45,0, 18,0, 0,95, -1,25.
(5-Ме-1-Рh-4-гидроциклопента[3,2-b]пиррол-4-ил)2SiМе2
Раствор 5-Ме-1-Рh-4-гидроциклопента[2,1-b]пиррола (4,7 г, 24 ммоль) в 60 мл простого эфира обрабатывают 11,2 мл н-бутиллития в гексанах (2,5 М, 28 ммоль) и перемешивают в течение 16 часов. Добавляют пентан (50 мл) и суспензию фильтруют через воронку из мелкозернистой фритты. Желтовато-коричневую соль лития вновь растворяют в 50 мл ТГФ, охлаждают до -78°С и обрабатывают (5-Ме-1-Рh-4-гидроциклопента[3,2-b] пиррол-4-ил)2SiMe2 (6,7 г, 24 ммоль), растворенным в 50 мл ТГФ. Темно-коричневый раствор медленно нагревают до 50°С и перемешивают в течение 16 часов. Летучие вещества удаляют в вакууме и остаток экстрагируют дихлорметаном, чтобы удалить iCl. Растворитель выпаривают, получая при этом продукт в виде белого твердого вещества. Выход: 8,5 г (81%). Два изомера. Спектр 1H-ЯМР (СD2Сl2): δ 7,5 (м, 8Н), 7,25 (м, 2н), 7,05 (д, 1Н), 6,95 (д, 1Н), 6,6 (с, 2Н), 6,5 (д, 1Н), 6,3 (д, 1Н), 3,45 (с, 2Н), 2,3 (с, 3Н), 2,2 (с, 3Н), -0,20 (с, 3Н), -0,22 (с, 3Н). Спектр 13С-ЯМР (СD2Cl2): δ 146,3, 146,2, 141,3, 140,7, 130,3, 129,9, 125,2, 120,9, 120,2, 120,1, 117,0, 106,4, 106,2, 42,8, 42,5, 18,3, 18,25, -6,9, -7,2. ЕI-МС: m/z(%) 446 (М+, 18), 252 (100), 237 (8), 224 (7), 194 (7), 165 (3).
{Ме2Si (5-Ме-1-Рh-4-циклопенто [3,2-b]пиррол-4-ил)2}ZrСl2
Раствор (5-Ме-1-Рh-4-гидроциклопента[3,2-b]пиррол-4-ил)2SiМе2 (4,0 г, 9,0 ммоль) в 100 мл простого эфира охлаждают до -78°С, обрабатывают 8,0 мл бутиллития в гексанах (2,5 М, 20 ммоль) и нагревают до комнатной температуры. Смесь перемешивают в течение ночи и понижают давление для выпаривания растворителей. Остаток промывают пентаном (40 мл) и сушат в вакууме, получая при этом свободнотекучий желтовато-коричневый порошок. В колбу добавляют ZrСl4 (2,09 г, 9,0 ммоль) и содержимое перемешивают в течение ночи в смеси пентана (75 мл) и простого эфира (1,5 мл). Твердые вещества собирают на воронке из мелкозернистой фритты, промывают пентаном и сушат в вакууме, получая при этом оранжевое твердое вещество (5,9 г). Порцию сырого продукта (5,65 г) перемешивают в дихлорметане (75 мл) и фильтруют. Фильтрат концентрируют до небольшого объема и добавляют пентан для осаждения комплекса. Выход: 4,1 г (79%, смесь рацемат/мезомер, 50:50). Кристаллы рацемата получают, медленно выпаривая раствор дихлорметан/толуол комплекса рацемат/мезомер. Спектр 1Н-ЯМР (СD2Сl2): δ 7,3-7,5 (м, 8Н, рацемат и мезомер), 7,38 (д, J=3,5 Гц, 2Н, рацемат), 7,15-7,25 (м, 2Н, рацемат и мезомер), 7,12 (д, J=3,5 Гц, 2Н, мезомер), 6,45 (с, 2Н, рацемат), 6,4 (с, 2Н, мезомер), 6,32 (д, J=3,5 Гц, 2Н, рацемат), 6,2 (д, J=3,5 Гц, 2Н, мезомер), 2,4 (с, 6Н, мезомер), 2,2 (с, 6Н, рацемат), 1,125 (с, ЗН, мезомер), 1,118 (с, 3Н, мезомер), 1,10 (с, 6Н, рацемат), Элементный анализ: вычислено для С30Н28Сl2N2SiZr: С, 59,38; Н, 4,65. Найдено: М, 59,78; Н, 4,74.
Способы полимеризации
Общие способы и характеристики
Пропилен сорта, предназначенного для полимеризации, был приобретен на фирме Маtheson Gas Со. и подвергнут дальнейшей очистке, в процессе которой его пропускали через колонки с молекулярными ситами 3 ангстрема и оксидом алюминия. Метилалюмоксан (раствор в толуоле, 10% МАО, 4,92% Аl) был приобретен на фирме Vitro Соrр. и использован без дальнейшей очистки. Аl(LiBu)3 (24,5% раствор в гептане) был приобретен на фирме Аkzo Nobel Сhеmicals. [СРh3] [В(С6F5)4] был приобретен на фирме Аsahi Glass Со.
Спектроскопия ЯМР
Для анализа полимера при помощи ЯМР спектры 13С-ЯМР раствора исследовали при 75,4 МГц на спектрометре ЯМР Varian UNITY-300. Образцы анализировали в виде 10%. (маc./об.) растворов в ортодихлорбензоле-d4 при 130°С. Химические сдвиги сравнивали с тетраметилсиланом (ТМS), используя вторичный эталон, СН3 метиловый пик полипропилена при 21,8 м.д. Для каждого спектра было получено 5000 переходных состояний с 10-секундной выдержкой времени между импульсами. Во время сбора данных всегда производилась спиновая развязка, поэтому имело место ядерное усиление Оверхаузера.
Характеристическую вязкость [η]0 раствора полимерных образцов определяли в декалине при 135°С. Значения характеристической вязкости превращали в средневесовую молекулярную массу (Мw) при помощи гельпроникающей хроматографии (ГПХ), используя эмпирическую корреляцию Мw и [η]0 для катализированных металлоценом гомополимеров полипропилена (lоg10[η]0=-3,8996+(0,7748·lоg10{Мw})
Для примеров 49-56 углеродные спектры ЯМР исследовали в спектрометре Вruker DРХ-400, действующем в режиме преобразования Фурье при 120°С и 100,61 МГц. Образцы растворяли в С2D2Сl4 в концентрации 8% маc./об.
Спектры получали при 90° импульсе 15-секундной выдержке времени между импульсами. Для каждого спектра получено примерно 1500 (или 3000 для полипропилена и полибутена) переходных состояний.
Пик углерода в метиле РРР или ответвления СН2 для полибутена использовали в качестве внутреннего эталона соответственно при 21,80 и 27,73 м.д. Числовые значения задавали в соответствии с H.N. Cheng, J. Роlуm. Sсience: Роlуmеr рhysics еdition 21, 573 (1983) аnd. J.C. Randall, Масrоmоlесu1еs ll, 592 (1978).
Характеристическая вязкость (I.V.)
Значения характеристической вязкости превращали в средневесовую молекулярную массу (Мw) при помощи гельпроникающей хроматографии (ГПХ), используя эмпирическую корреляцию Мw и [η]0 для катализированных металлоценом гомополимеров полипропилена.
Дифференциальная сканирующая калориметрия (DSС)
Температуру перехода, энтальпию плавления и кристаллизации полимерных образцов измеряли, используя программное обеспечение для режима компенсации мощности Реrkin Еlmеr (РЕ) DSС-7 и РЕ РYRIS (версия 3.03). Для охлаждения использовали устройство РЕ Intеrcoolеr II (модель FС100РЕА). Данное устройство было калибровано в отношении сертифицированного (1) индия с параметрами Теim=156,60°С; Нf=28,71 Дж/г и (2) олова с параметрами Теim=231,88°С; Нf=60,46 Дж/г. Скорость динамического нагрева/охлаждения была равна 20°С/мин. Для продувки использовали газообразный азот, подаваемый со скоростью 20±2 см3/мин. Производили трехкратное изменение температуры (нагрев-охлаждение-повторный нагрев), при этом нижний и верхний пределы температуры были равны соответственно 25°С и 235°С. Время изотермальной задержки между изменениями температуры составляло 3 минуты. Ниже приведены результаты второго нагрева.
Анализ ГПХ (для примеров 41-48): анализы при помощи высокотемпературной ГПХ выполняли, используя нижеследующие условия выполнения хроматографии:
Колонка: РLgel 2 х смешанный слой-В, 30 см, 10 микрон
Растворитель: 1,2-дихлорбензол с антиоксидантом
Скорость потока: 1,0 мл/мин
Температура: 140°С
Детектор: показатель преломления
Калибровка: полистирол
Примеры 8-31
Полимеризацию выполняют в реакторе из нержавеющей стали емкостью 4 л, оснащенном пневматической магнитной мешалкой и рубашкой с регулируемой температурой пара/воды. Автоклав продувают сухим аргоном при 90°С в течение 1 часа до полимеризации. Цирконоцен растворяют в 10 мас.% растворе МАО в толуоле, встряхивают в течение 10 минут и вводят в реактор при 15°С. Добавляют пропилен (2,2 л) и смесь начинают перемешивать (500 оборотов/минуту), после чего реактор и его содержимое нагревают до температуры полимеризации в течение 5-7 минут. Во всех испытаниях полимеризации газообразную окись углерода вводят в реактор через 1 час после достижения температуры полимеризации. Остаточный мономер удаляют во время охлаждения реактора до комнатной температуры. Полимер удаляют и сушат в вакуумной печи при 50°С в течение 1 часа до взвешивания. Величины активности высчитывают на основании массы полимера и цирконоцена. Характеристические данные полученного полимера приведены в таблице 1.
Примеры 32-34 (сравнительные)
Полимеризацию выполняют вышеописанным способом, используя металлоцены, приведенные в таблице 1. Характеристические данные полученного полимера приведены в таблице 1.
Пример 35
Полимеризацию выполняют в реакторе из нержавеющей стали емкостью 4 л, оснащенном пневматической магнитной мешалкой и рубашкой с регулируемой температурой пара/воды. Автоклав продувают сухим аргоном при 90°С в течение 1 часа до полимеризации. С3 (0,05 мг) растворяют в 10 мас.% растворе МАО в толуоле (10 мл), встряхивают в течение 10 минут и переносят в автоклав из нержавеющей стали для образца, присоединенный к реактору. В охлажденный реактор (20°С) добавляют пропилен (2,2 л) и смесь начинают перемешивать (500 оборотов/минуту). Затем в реактор вводят катализатор с газообразным этеном до достижения давления, которое на 7 атм-г (100 фунт/кв.дюйм-г) выше давления пара пропена в реакторе.
Реактор и его содержимое нагревают до 50°С в течение 5-7 минут и подачу этена регулируют с возможностью достижения избыточного давления, которое на 7 атм-г (100 фунт/кв.дюйм-г) превышает давление пара пропена. Через 1 час в реактор вводят газообразную окись углерода для прекращения испытания и остаточный мономер удаляют. Реактор охлаждают до комнатной температуры и, прежде чем открыть, в течение нескольких минут продувают потоком аргона. Полимер удаляют и сушат в вакуумной печи при 80°С в течение 1 часа до взвешивания. Выход - 254 г полимера (19,9 мас.% этена по результатам выполнения инфракрасного анализа).
Примеры 36-40
Полимеризацию выполняют в реакторе из нержавеющей стали емкостью 4 л, оснащенном пневматической магнитной мешалкой и рубашкой с регулируемой температурой пара/воды. Автоклав продувают сухим аргоном при 90°С в течение 1 часа до полимеризации. В реактор вводят раствор цирконоцена и Аl(LiBu)3 в толуоле при 15°С и затем 2,2 л пропилена. Смесь начинают перемешивать (500 оборотов/мин), после чего в реактор вводят раствор [СРh3] [В(С6F5)4] в толуоле с 100 мл пропана и содержимое нагревают до температуры полимеризации в течение 5-7 минут. Во всех испытаниях полимеризации газообразную окись углерода вводят в реактор через 1 час после достижения температуры полимеризации. Остаточный мономер удаляют во время охлаждения реактора до комнатной температуры. Полимер удаляют и сушат в вакуумной печи при 50°С в течение 1 часа до взвешивания. Результаты активности высчитывают на основании масс полимера и цирконоцена. Характеристические данные полученного полимера приведены в таблице 2.
Пример 41
Реактор емкостью 5 литров, оснащенный турбомешалкой, регулятором температуры пара/воды и системой впрыскивания катализатора, нагревают до 150-160°С в течение ночи, продувая азотом, охлаждают и протравливают при 70°С смесью ТIВА (0,25 г), толуола (20 мл) и пропилена (500 г). Травильную смесь удаляют и в реактор вводят 1650 г жидкого пропилена, повышая температуру от 20°С до 30°С. Затем добавляют 4-5% водорода в газовую шапку, имея в виду 1-1,5% водорода в газовой шапке при 70°С. Через две минуты после добавления водорода в реактор впрыскивают 1 ммоль ТIВА (198 мг), используя 20 мл толуола.
Отдельно 2,00 г трис{2-фенилпропила} АlСН2СНМе(С6H5]3 (5,20 ммоль) растворяют в 20,0 г толуола в склянке, закрытой крышкой с мембраной. Раствор охлаждают до 0-4°С на бане со льдом и двумя порциями добавляют 47 микролитров воды (2,61 ммоль), используя 100 микролитровый шприц и поддерживая температуру ниже 15°С.
Одновременно с этим 13,1 мг рацемат-С3 (19,4 микромоль) растворяют в 23,3 г толуола и 0,717 г полученного раствора, содержащего 0,75 микромоль комплекса циркония, подвергают взаимодействию с 28 мг ТIOА (76,5 микромоль), в результате чего цвет смеси из желтого становится светло-желтым. Через 5 минут к раствору добавляют 1,59 г смеси гидролизованного алкилалюминия, содержащей 0,38 ммоль алюминоксана. Через двадцать минут после введения в реактор ТIВА впрыскивают раствор (используя 20 мл толуола) алкилированного цирконоцена (подвергнутого старению в течение 5 минут) при температуре 30°С. Через 0,5 минуты температуру повышают в течение 6-7 минут до 70°С и полимеризацию продолжают в течение 1 часа, перемешивая смесь со скоростью 840-1100 оборотов/минуту и поддерживая концентрацию водорода в газовой шапке, равной 1%, Полимеризацию прекращают, впрыскивая 5-10 мл метанола. Реактор перестают нагревать, пропилен быстро удаляют и порошкообразный полипропилен собирают. Загрязненное вещество удаляют, используя горячий ксилол и производя осаждение метанолом. Полипропиленовые фракции сушат (70-80°С, 200 мбар, продувка азотом) и объединяют, что дает общий выход полипропилена. Условия полимеризации и данные, относящиеся к полученным полимерам, приведены в таблице 3.
Пример 42
Эксперимент выполняют аналогично примеру 39, используя алюминоксан, полученный в результате взаимодействия трис{2,3-диметилбутил}алюминия Аl[СН2СНМеСНМе2]3 с водой. Катализатор рацемат-С3 (0,72 микромоль), предварительно обработанный ТIOА (76,5 микромоль), затем алюминоксаном (0,38 ммоль), добавляют в реактор, содержащий акцептор ТIOВА (1 ммоль). Условия полимеризации и данные, относящиеся к полученным полимерам, приведены в таблице 3.
Пример 43
Реактор емкостью 5 литров, оснащенный турбомешалкой, регулятором температуры пара/воды и системой впрыскивания катализатора, нагревают до 150-160°С в течение ночи, продувая азотом, охлаждают и протравливают при 70°С смесью ТIВА (0,25 г), толуола (20 мл) и пропилена (500 г). Травильную смесь удаляют и в реактор вводят 1650 г жидкого пропилена, повышая температуру от 20°С до 30°С. Затем добавляют 4-5% водорода в газовую шапку, направляя 1-1,5% водорода в газовую шапку при 70°С.
Отдельно 1,98 г трис{2-(п-фторфенил)пропила} Аl[СН2СНМе(4-F-С6Н4)]3 (4,5 ммоль) растворяют в 20 мл толуола в склянке, закрытой крышкой с мембраной. Раствор охлаждают до 0-4°С на бане со льдом и двумя порциями добавляют 41 микролитр воды (2,28 ммоль), используя 100 микролитровый шприц и поддерживая температуру ниже 15°С. Полученный раствор вводят в реактор при помощи системы впрыскивания, которую промывают 20 мл толуола.
Одновременно с этим 13,3 мг рацемат-С4 (19 микромоль) растворяют в 24,34 г толуола и 0,304 г полученного раствора, содержащего 0,24 микромоль комплекса циркония, подвергают взаимодействию с 0,11 г ТIOА (0,3 ммоль), в результате чего цвет смеси из желтого становится светло-желтым. Через 10 минут после введения смеси гидролизованного алкилалюминия, содержащей 4,5 ммоль алюминоксана, в реактор (используя 20 мл толула) впрыскивают раствор алкилированного цирконоцена (подвергнутого старению в течение 5 минут) при температуре 30°С. Через 0,5 минуты температуру повышают в течение 6-7 минут до 70°С и полимеризацию продолжают в течение 26 минут, перемешивая смесь со скоростью 840-1100 оборотов/минуту и поддерживая концентрацию водорода в газовой шапке, равной 1%. Полимеризацию прекращают, впрыскивая 5-10 мл метанола. Реактор перестают нагревать, пропилен быстро удаляют и порошкообразный полипропилен собирают. Загрязненное вещество удаляют, используя горячий ксилол и производя осаждение метанолом. Полипропиленовые фракции сушат (70-80°С, 200 мбар, продувка азотом) и объединяют, что дает общий выход полипропилена. Условия полимеризации и данные, относящиеся к полученным полимерам, приведены в таблице 3.
Пример 44
Экперимент выполняют аналогично примеру 41, используя алюминоксан, полученный в результате взаимодействия трис{2,3-диметилбутил}алюминия Аl [СН2СНМе(4-F-С6Н4)]3 с водой. Катализатор рацемат-С4 (0,72 микромоль}, предварительно обработанный ТIBА (76,5 микромоль), затем алюминоксаном (0,38 ммоль), добавляют в реактор, содержащий акцептор ТIВА (1 ммоль). Выход продукта и свойства приведены в таблице 3. Условия полимеризации и данные, относящиеся к полученным полимерам, приведены в таблице 3.
Пример 45
Полимеризацию выполняют аналогично примеру 41, за исключением того, что вместо соединения С4 используют соединение С5.
Пример 46
Полимеризацию выполняют аналогично примеру 42, за исключением того, что вместо соединения С4 используют соединение С5.
Пример 47
Полимеризацию выполняют аналогично примеру 42, за исключением того, что вместо соединения С4 используют соединение С5 и соотношение алюминий/цирконий равно 250.
Пример 48
Полимеризацию выполняют аналогично примеру 42, за исключением того, что вместо соединения С4 используют соединение С5 и вместо ТFРРА используют МАО.
Пример 49
Получение системы катализатора на носителе, содержащей С3 и
МАО, нанесенные на полиэтиленовый полимер (РЕ)
Носитель
Для получения катализатора на носителе А и В используют полимер РЕ с нижеследующими физическими свойствами:
средний размер частиц 151 мкм
пористость 0,357 см3/г (24,2% об./об.)
площадь поверхности 1,4 м2/г
средний диаметр пор 1,5 мкм
Устройство для нанесения катализатора на носитель
Устройство для нанесения катализатора на носитель состоит из двух зон. В первой зоне находится колонна для пропитки, оснащенная механическим устройством, в которое непрерывно подается каталитический раствор и находится предназначенный для пропитки форполимер, во второй зоне происходит нагревания для выпаривания растворителя. При осуществлении полунепрерывного процесса после загрузки носителя каталитический раствор непрерывно подается к форполимеру в колонне для пропитки, из которой пропитанный форполимер пневматически переносится в зону для выпаривания растворителя и затем снова рециркулируется в первую зону после отделения от газового потока при помощи циклона (описанного в "Реrrу's сhemical еngineers' hаndbook" sixthх edition, раgе 18-73). Обе зоны реактора с циркуляцией снабжены рубашками и имеют разную температуру для оптимизации процесса, происходящего в каждой зоне, а именно пропитки или выпаривания. Содержимое колонны для пропитки перемешивают для достижения быстрого и равномерного поглощения каталитического раствора.
Получение катализатора А
40,8 г форполимера РЕ вводят в вышеописанное оборудование, при этом температуру рубашки колонны для пропитки и зоны испарения поддерживают равной соответственно 45°С и 90°С. Рециркуляцию твердого вещества в реакторе с циркуляцией начинают, продувая азот через испарительную колонну. После достижения заданной температуры в обеих зонах через каждые 15 минут при помощи дозирующего насоса вводят 20 мл 100 г/л раствора МАО в толуоле (WIТСО). Исходное количество МАО взаимодействует с остаточной водой, присутствующей в носителе (обычно 300-400 частей на миллион), во избежание разрушения активного катализатора во время нанесения катализатора на носитель. Каталитический раствор получают в атмосфере азота, растворяя 173 мг С3 в 60 мл раствора МАО. Ярко-оранжевый каталитический раствор наносят дозами на носитель в течение 1 часа. Пропитанный носитель рециркулируют на 15 минут без добавления каких-либо других компонентов, чтобы удалить последние следы растворителя. Анализ полученного катализатора на носителе показывает наличие 5,57 мас.% Аl и 470 частей на миллион Zr при молярном соотношении Аl/Zr, равном 412.
Получение катализатора В
В устройство вводят 43,7 г форполимера РЕ и температуру внутри устройства повышают до требуемого значения (аналогично предыдущему способу получения), рециркулируя твердое вещество в реакторе с циркуляцией. Кроме того, в данном способе получения общее количество раствора МАО, добавляемого к носителю, составляет 80 мл, причем указанное количество вводят на протяжении 3 последовательных стадий добавления: сначала вводят 15 мл для удаления остаточной воды, присутствующей на носителе, затем 50 мл в растворе для предварительного контактирования (который получают, растворяя 180 мг С3) и наконец 15 мл одного МАО после введения всего каталитического раствора. Три раствора дозированно наносят на носитель в течение 1,5 часов при постоянной скорости подачи. Прежде чем удалить катализатор на носителе твердое вещество рециркулируют в течение 15 минут до полного высушивания. Конечный катализатор имеет следующий состав: 6,5 мас.% Аl, 407 частей на миллион Zr при молярном соотношении Аl/Zr, равном 538.
Примеры 50-53
Сополимеризация пропилена и 1-бутена с катализатором на носителе С3/МАО
4 мл 0,5 М раствор ТIВА (2 ммоль) в гексане, а также пропилен и бутен в количествах, указанных в таблице 4, (соответствующих 2,5 л жидких мономеров при 70°С) вводят в реактор из нержавеющей стали емкостью 4,25 л с мешалкой при 30°С. Твердый катализатор (см. таблицу 4) впрыскивают в реактор под действием избыточного давления азота через трубку из нержавеющей стали, которую затем промывают 5 мл гексана, после чего температуру в реакторе повышают до 70°С в течение 10 минут. Полимеризацию выполняют при 70°С в течение 60 минут и прекращают, добавляя 1 л СО, затем реактор вентилируют и охлаждают, свободнотекучий сферический продукт собирают и сушат (вакуумная печь, 2 часа, 70°С).
Значения активности катализатора и характеристики полученных полимеров суммированы в таблице 4.
Пример 54
Полимеризация 1-бутена с катализатором на носителе С3/МАО
4 мл 0,5 М раствора ТIВА (2 ммоль) в гексане и 850 г 1-бутена вводят в реактор из нержавеющей стали емкостью 4,25 л с мешалкой при 30°С. Твердый катализатор В (266 мг) впрыскивают в реактор под действием избыточного давления азота через трубку из нержавеющей стали, которую затем промывают 5 мл гексана, после чего температуру в реакторе повышают до 70°С в течение 10 минут. Полимеризацию выполняют при 70°С в течение 60 минут и прекращают, добавляя 1 л СО, затем реактор вентилируют и охлаждают. 7 г изотактического полибутена собирают и сушат (вакуумная печь, 2 часа, 70°С). Полученный продукт имеет характеристическую вязкость 1,12 дл/г, т.п.=101°С, Н=82 Дж/г.
Примеры 55-57
Сополимеризация пропилена и этилена с катализатором на
носителе С3/МАО
4 мл 0,5 М раствора ТIВА (2 ммоль) в гексане и пропилен в количестве, указанном в таблице 5, (соответствующем 3 л жидких мономеров при 70°С) вводят в реактор из нержавеющей стали емкостью 4,25 л с мешалкой при 30°С. Твердый катализатор (см. таблицу 5) впрыскивают в реактор под действием избыточного давления азота через трубку из нержавеющей стали, которую затем промывают 5 мл гексана, после чего температуру в реакторе повышают до температуры полимеризации в течение 10 минут. Этилен подают, поддерживая постоянное избыточное давление на протяжении всех испытаний полимеризации. Полимеризацию выполняют в течение 60 минут при постоянной температуре и прекращают, добавляя 1 л СО, затем реактор вентилируют и охлаждают, свободнотекучий сферический продукт собирают и сушат (вакуумная печь, 2 часа, 70°С).
Значения активности катализатора и характеристики полученных полимеров суммированы в таблице 5.
Результаты полимеризации пропена в массе с сокатализатором на основе алюмоксана
ход, г
а) ммоль водорода, добавляемого в реактор.
н.о. - не определено
N1: смесь рацемат/мезомер (50/50) - {Ме2Si(2,5-Ме2-1-Рh-циклопенто[3,2-b]пиррол-4-ил)2}ZrСl2
N2: смесь рацемат/мезомер (50/50) - {Ме2Si(5-Ме-1-Рh-циклопенто[3,2-b]пиррол-4-ил)2}ZrСl2
Результаты полимеризация пропена в кассе с сокатализатором на основе бора
мер
(0,10)
(0,20)
(0,10)
(0,10)
(0,20)
а) ммоль водорода, добавляемого в реактор; b) [Рh3С][В(С6F5)4].
Полимеризация пропилена
mm %
Сополимеризация пропилена и 1-бутена с катализатором на носителе СЗ/МАО
а) только 4,1-вставка
Сополимеризация пропилена и этилена с катализатором на носителе С3/МАО
Настоящее изобретение относится к классу металлоценовых соединений общей формулы (I), в которой Y означает фрагмент формулы (II), где А – атом серы или селена, В – атом углерода; D - атом углерода, R1, R2, R3, R4 и R5 - водород или углеводородные группы; Z выбран из фрагмента формулы (II) и фрагмента формулы (III), где R6, R7, R8 и R9 - водород или углеводородные группы; L – двухвалентная мостиковая группа; М - атом циркония; Х - галоген, р=2. Описанные выше металлоцены особенно пригодны для полимеризации пропилена.
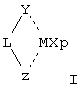
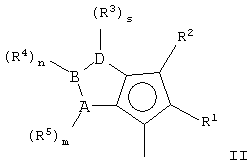
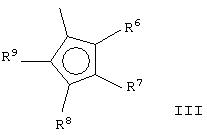
5 с. и 10 з.п. ф-лы, прим, 5 табл.
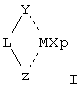
где Y означает фрагмент формулы (II)
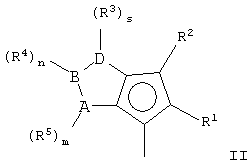
где
А представляет атом серы или селена;
В представляет атом углерода;
D представляет атом углерода;
R1 представляет С1-С4алкил; R2 представляет атом водорода; R3 представляет С1-С4алкил, С6-С20арил, который может быть необязательно орто-замещен или 2,4-дизамещен фенилом с С1-С4алкилом; R4 представляет С1-С4алкил и R5 представляет атом водорода;
n и s равны 1;
m равно 0; и
s, одинаковые или различные, равны 0, 1 или 2;
и кольцо, содержащее А, В и D, может иметь двойные связи в любых возможных положениях;
Z выбран из фрагмента формулы (II), указанной выше и фрагмента формулы (IV)
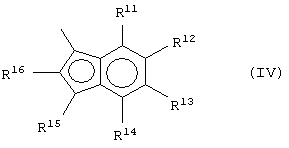
где
R16 представляет С1-С4алкил; R14 представляет С6-С20арил; и
R11, R12, R13 и R15 представляют атомы водорода; и
когда Z представляет группу формулы (II), Y и Z могут быть одинаковыми или различными;
L представляет двухвалентную мостиковую группу >Si(R17)2, где R17, одинаковые или различные, выбраны из водорода или C1-С4алкила;
М представляет атом циркония;
X, одинаковые или различные, представляют атом галогена;
р равно 2.
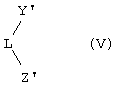
где
Y’ означает фрагмент формулы (VI)
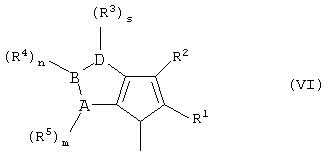
и/или его изомеры с двойной связью;
R1, R2, R3, R4, R5, A, B, D, n, m и s имеют значения, указанные в п.1;
Z’ выбран из фрагмента формулы (VI) и фрагмента формулы (VII)
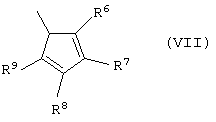
и/или его изомеров с двойными связями;
где
R11, R12, R13, R14, R15 и R16 имеют значения, указанные в п.1;
когда Z’ аналогичен Y’, А, В и D в Y’ и Z’ могут иметь одинаковые или различные значения;
L означает двухвалентный мостик по п.1.
A) металлоценового соединения формулы (I) по любому из пп.1-5 и
B) алюмоксана.
| WO 9822486 A, 28.05.1998 | |||
| WO 9940129 A, 12.08.1999 | |||
| WO 9924446 A, 20.05.1999. |
Авторы
Даты
2005-01-27—Публикация
2000-12-07—Подача