Ссылка на родственные заявки
По данной заявке испрашивается приоритет предварительной заявки на патент №60/191302, поданной 21 марта 2000, в соответствии со статьей 35 кодекса United States Code 119(е).
Техническое обоснование
Настоящее изобретение касается соединений, полезных при лечении заболеваний, связанных с активностью металлопротеазы, в частности активностью цинк-металлопротеазы. Изобретение касается также фармацевтических композиций, включающих соединения, и способов лечения, связанных с металлопротеазой болезней путем применения соединений или фармацевтических композиций.
Предпосылки изобретения
Ряд структурно родственных металлопротеаз производит разрушение структурных белков. Эти металлопротеазы часто действуют на межклеточный матрикс и таким образом вовлекаются в разрушение тканей и реконструкцию. Такие белки называются металлопротеазами или MPs - МП.
Существует несколько различных семейств МП, классифицируемых по гомологии последовательностей, известных из уровня техники. Эти МП включают металлопротеазы матрикса (MMPs - ММП); цинк-металлопротеазы; многие из мембраносвязанных металлопротеаз; ФНО-превращающие ферменты; ангиотекзин-превращающие ферменты (ACEs АПФ); дезинтегрины, включая ADAMs (смотри, Wolfsberg et al, 131 J. Cell Bio. 275-78 October, 1995) и энкефалиназы. Примеры МП включают коллагеназу фибробластов кожи человека, желатиназу фибробластов кожи человека, коллагеназу, аггреканазу и желатиназу слюны человека и стромелизин человека. Считается, что коллагеназы, стромелизин, аггреканаза и схожие ферменты являются важным связующим звеном в симптоматологии ряда заболеваний.
В литературе обсуждаются потенциальные терапевтические показания к применению ингибиторов. МП Смотри, например, патенты США 5506242 (Ciba Geigy Corp.) и 5403952 (Kerck & Co.); следующие опубликованные патентные заявки РСТ: WO 96/06074 (British Bio Tech Ltd.); WO 96/00214 (Ciba Geigy), WO 95/35275 (British Bio Tech Ltd.), WO 95/35276 (British Bio Tech Ltd.), WO 95/33731 (Koffman-LaRoche), WO 95/33709 (Hoffman-LaRoche), WO 95/32944 (British Bio Tech Ltd), WO 95/26989 (Merck), WO 9529892 (DuPont Merck), WO 95/24921 (Inst. Opthamology), WO 95/23790 (SmithKiine Beecham), WO 95/22966 (Sanofi Winthrop), WO 95/19965 (Glycomed), WO 95 19956 (British Bio Tech Ltd), WO 95/19957 (British Bio Tech Ltd.), WO 95/19961 (British Bio Tech Ltd.), WO 95/13289 (Chiroscience Ltd.), WO 95/12603 (Syntex), WO 95/09633 (Florida State Univ.), WO 95/09620 (Florida State Univ.), WO 95/04033 (Celltech), WO 94/25434 (Celltech), WO 94/25435 (Celltech); WO 93/14112 (Merck), WO 94/0019 (Glaxo)/ WO 93/21942 (British Bio Tech Ltd.), WO 92/22523 (Res. Corp. Tech Inc.), WO 94/10990 (British Bio Tech Ltd.), WO 93/09090 (Yamanouchi); патенты Великобритании GB 2282598 (Merck) и GB 2268934 (British Bio Tech Ltd.); опубликованные европейские патентные заявки ЕР 95/684240 (Hoffman LaRoche), EP 574758 (Hoffman LaRoche) и ЕР 575844 (Hoffman LaRoche); опубликованные японские патентные заявки JP 08053403 (Fujusowa Pharm. Co. Ltd.) и JP 7304770 (Kanebo Ltd.); и Bird et al., J. Med. Chem.. vol.37, pp.158-69 (1994).
Примеры потенциального терапевтического применения ингибиторов МП включают ревматоидный артрит Mullins, D.Е., et al, Biochim. Biophys. Acta. (1983) 695: 117-214; остеоартрит - Henderson, В., et al., Drugs of the Future (1990) 15:495-508; раковую опухоль - Yu, A. E. et al.. Matrix Metalloproteinases Novel Targets for Directed Cancer Therapy, Drugs & Aging. Vol.11(3), p.229-244 (Sept. 1997), Chambers, A.F. and Matrisian, L.M., Review: Changing Views of the Role of Matrix Metalloproteinases in Metastasis, J. of the Nat’1 Cancer Inst., Vol.89(17), p.1260-1270 (Sept. 1997), Bramhall, S.R., The Matrix Metalloproteinases and Their Inhibitors in Pancreatic Cancer, Internat’1 J. of Pancreatology. Vol.4, p.1101-1109 (May 1998), Nemunaitis, J. et al., Combined Analysis of Studies of the Effects of the Matrix Metalloproteinase Inhibitor Marimastat on Serum Tumor Markers in Advanced Cancer: Selection of a Biologically Active and Tolerable Dose for Longer-term Studies, Clin. Cancer Res. Vol 4, p.1101-1109 (May 1998) и Rasmussen, H.S. и McCann, P.P, Matrix Metalloproteinase Inhibition as a Novel Anticancer Strategy: A Review with Special Focus on Batimastat and Marimastat, Pharmacol. Ther. Vol 75(1), p.69-75 (1997); метастазы опухолевых клеток там же, Broadhurst, М.J., et al., европейская патентная заявка 276436 (опубликована 1987), Reich, R., еt al,. Cancer Res. Vol.48, p.3307-3312 (1988); множественный склероз Gijbels et al., J. Clin. Invest., vol.94, p.2177-2182 (1994) и различные язвы или состояния изъязвления ткани. Например, состояния изъязвления могут возникать на роговице в результате ожога щелочью или в результате заражения вирусом Pseudomonas aeruginosa, Acanthamoeba, герпеса и коровьей оспы. Другие примеры состояний, характеризующихся нежелательной активностью металлопротеазы, включают периодонтальное заболевание, врожденный буллезный эпидермолиз, лихорадку, воспаление и склерит (например, DeCicco еt al., опубликованная патентная заявка РСТ, публикация WO 95/29S92, опубликована 9 ноября 1995).
Ввиду вовлеченности указанных металлопротеаз в патологические процессы в ряде заболеваний были предприняты попытки получения ингибиторов для этих ферментов. Ряд таких ингибиторов описан в литературе. Примеры включают патент США №5183900, выданный 2 февраля 1993 Galardy; патент США №4996358, выданный 26 февраля 1991 Handa et al.; патент США №4771038, выданный 13 сентября 1988 Wolanin et al.; патент США №4743587, выданный 10 мая 1988 Dickens et al., европейскую патентную заявку №575844, опубликованную 29 декабря 1993 Broadhurst et al.; международную патентную заявку №WO 93/09090, опубликованную 13 мая, 1993 Isomura et al.; World Patent Publication 92/17460, опубликованную 15 октября 1992 Markwell et al. и европейскую патентную заявку №498665, опубликованную 12 августа 1992 Beckett et al.
Было бы полезно ингибировать указанные металлопротеазы при лечении заболеваний, связанных с нежелательной активностью металлопротеаз. Хотя получено множество ингибиторов МП, продолжает существовать непреходящая потребность в эффективных ингибиторах металлопротеаз матрикса, полезных при лечении заболеваний, связанных с активностью металлопротеазы.
Краткое описание изобретения
Изобретение предлагает соединения, являющиеся потенциальными ингибиторами металлопроtеаз и эффективные при лечении состояний, характеризующихся избыточной активностью указанных ферментов. В частности, настоящее изобретение касается соединений, имеющих структуру, соответствующую формуле (I):
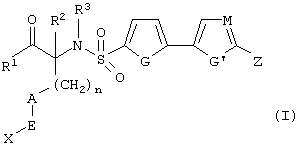
где (A) R1 выбирают из -ОН и -NHOH;
(B) R2 выбирают из группы, включающей водород, алкил, алкенил, алкинил, гетероалкил, галогеналкил, циклоалкилалкил, гетероциклоалкилалкил, арилалкил и гетероарилалкил; или R2 может быть связан с А, как описано в (D);
(C) R3 выбирают из группы, включающей алкил, алкенил, алкинил, гетероалкил, галогеналкил, циклоалкил, гетероциклоалкил, арилалкил и гетероарилалкил;
D) А означает замещенный или незамещенный моноциклический гетероциклоалкил с 3-8 атомами в цикле, из которых 1-3 являются гетероатомами; или А связан с R2, где они вместе образуют замещенный или незамещенный моноциклический гетероциклоалкил с 3-8 атомами в цикле, из которых 1-3 являются гетероатомами;
(Е) n равно 0~4;
(F) Е выбирают из группы, включающей ковалентную связь, С1-С4-алкил, -С(=O)-, -С(=O)O-, С(=O)N(R4)-, -SО2 или -С(=S)N(R4)-, где R4 выбирают из группы, включающей водород, алкил, алкенил, алкинил, гетероалкил, галогеналкил, циклоалкил, гетероциклоалкил, арил, арилалкил, гетероарил и гетероарилалкил; или R4 и Х соединены с образованием цикла, как указано в (G) (2);
(G) (1) X выбирают из группы, включающей водород, алкил, алкенил, алкинил, гетероалкил, галогеналкил, арил, арилалкил, гетероарил, гетероарилалкил, циклоалкил и гетероциклоалкил; или (2) Х и R4 соединены, образуя замещенный или незамещенный моноциклический гетероциклоалкил с 3-8 атомами в цикле, из которых 1-3 являются гетероатомами;
(Н) G выбирают из группы, включающей -S-, -О-, -N(R5)-, -C(R5)=C(R5’)-, -N=C(R5)и -N=N-, где каждый из R и R5 независимо выбирают из группы, включающей водород, алкил, алкенил, алкинил, гетероалкил, арил, гетероарил, циклоалкил и гетероциклоалкил;
(I) G’ выбирают из группы, включающей -S-, -О-, -N(R6)-, -С (R6)C(R6’)-, -N=C(R6)- и -N=N-, где каждый из R6 и R6’ независимо выбирают из группы, включающей водород, алкил, алкенил, алкинил, гетероалкил, арил, гетероарил, циклоалкил и гетероциклоалкил;
(J) М выбирают из –СН- и -N-; и
(К) Z означает (CR7R7’)a-L-R8, где
(1) а равно 0-4;
(2) каждый из R7 и R7’ независимо выбирают из группы, включающей водород, алкил, алкенил, алкинил, арил, гетероалкил, гетероарил, циклоалкил, гетероциклоалкил, галоген, галогеналкил, гидрокси и алкокси;
(3) L выбирают из группы, включающей ковалентную связь, -О-, -SОb-, -С(=O)-, C(=O)N(R9)-, -N(R9)и -N(R9)С(=O)-, где b равно 0-2 и R9 выбирают из группы, включающей водород, алкил, алкенил, алкинил, арил, гетероарил, гетероалкил, гетероарил, циклоалкил, гетероциклоалкил и галогеналкил; или R7 и R9, вместе с атомами, к которым они химически присоединены, вместе образуют необязательно замещенный гетероцикл, содержащий 5-8 атомов, из которых 1-3 являются гетероатомами;
и
(4) R8 выбирают из группы, включающей водород, алкил, алкенил, алкинил, галоген, гетероалкил, галогеналкил, арил, гетероарил, циклоалкил и гетероциклоалкил; или R8 и R9, вместе с атомами, к которым они химически присоединены, объединяются, образуя необязательно замещенный гетероцикл, содержащий 5-8 атомов, из которых 1-3 являются гетероатомами;
или оптического изомера, диастереомера или энантиомера для формулы (I), или их фармацевтически приемлемой соли, или биогидролизуемого амида, сложного эфира или имида.
Настоящее изобретение включает также оптические изомеры, диастереомеры и энантиомеры вышеуказанной формулы и их фармацевтически приемлемые соли, биогидрслизуемые амиды, сложные эфиры и имиды.
Соединения по настоящему изобретению полезны для лечения болезней или нарушений, характеризующихся нежелательной активностью металлопротеазы. Следовательно, в изобретении также предлагаются фармацевтические композиции, содержащие указанные соединения. Кроме того, в изобретении предлагаются способы лечения связанных с металлопротеазой заболеваний.
Подробное описание изобретения
1. Термины и определения
Далее приведен перечень используемых здесь определений и терминов.
"Ацил" или "карбонил" означает радикал, образованный удалением гидроксигруппы из карбоновой кислоты (т.е., R-C(=O)-). Предпочтительные ацильные группы включают (например) ацетил, формил и пропионил.
"Алкил" означает насыщенную углеводородную цепь с 1-15 атомами углерода, предпочтительно, 1-10, более желательно, 1-4 атомами углерода. "Алкен" означает углеводородную цепь, имеющую, по меньшей мере, одну (предпочтительно только одну) двойную углерод-углеродную связь и содержащую 2-15 атсмов углерода, предпочтительно, 2-10, более желательно, 2-4 атома углерода. "Алкин" означает углеводородную цепь, имеющую, по меньшей мере, одну (предпочтительно только одну) тройную углерод-углеродную связь и содержащую 2-15 атомов углерода, предпочтительно, 2-10, более желательно, 2-4 атома углерода. Алкильные, алкеновые и алкиновые цепи (называемые в совокупности "углеводородные цепи") могут быть линейными или разветвленными и могут быть незамещенными или замещенными. Предпочтительные разветвленные алкильные, алкеновые и алкиновые цепи имеют одну или две ветви, желательно одну ветвь. Предпочтительными цепями являются алкильные. Каждая из алкильных, алкеновых и алкиновых цепей может быть незамещенной или замещенной 1-4 заместителями, где предпочтительными замещенными цепями являются моно-, ди- или тризамещенные. Каждая из алкильных, алкеновых и алкиновых цепей может быть замещена радикалом, выбираемым из группы, включающей галоген, гидрокси, арилокси (например, фенокси), гетероарилокси, ацилокси (например, ацетокси), карбокси, арил (например, фенил), гетероарил, циклоалкил, гетероциклоалкил, спироцикл, амино, амидо, ациламино, кето, тиокето, циано или любую их комбинацию. Предпочтительные углеводородные группы включают метил, этил, пропил, изопропил, бутил, винил, аллил, бутенил и экзометиленил.
Также при использовании этого термина здесь "низшая" алкильная, алкеновая или алкиновая группа (например, "низший алкил") означает цепь, состоящую из 1-6, предпочтительно, 1-4 атомов углерода в случае алкила и 2-6, предпочтительно, 2-4 атомов углерода в случае алкена и алкина.
"Алкокси" означает кислородный радикал, имеющий углеводородный заместитель, где углеводородная цепь означает алкил или алкенил (например, -О-алкил или -О-алкенил). Предпочтительные алкоксигруппы включают (например) метокси, этокси, пропокси и аллилокси.
"Арил" означает ароматический углеводородный цикл. Арильные циклы представляют собой моноциклическую или конденсированную бициклическую системы. Моноциклические арильные кольца содержат 6 атомов углерода в цикле. Моноциклические арильные кольца называются также фенильными кольцами. Бициклические арильные кольца содержат 8-17 атомов углерода, предпочтительно 9-12 атомов углерода в цикле. Бициклические арильные кольца включают циклические системы, где один цикл является арильным, а другой цикл означает арил, циклоалкил или гетероциклоалкил. Предпочтительные бициклические арильные кольца содержат 5-, 6- или 7-членные циклы, конденсированные с 5-, 6- или 7-членными циклами.
Арильные циклы могут быть незамещенными или замещенными 1-4 заместителями на цикл. Арил может быть замещен радикалом, выбранным из группы, включающей галоген, циано, нитро, гидрокси, карбокси, амино, ациламино, алкил, гетероалкил, галогеналкил, фенил, арилокси, алкокси, гетероалкилокси, карбамил, галогеналкил, метилендиокси, гетероарилокси или любую их комбинацию. Предпочтительные арилькые циклы включают нафтил, толил, ксилил и фенил. Наиболее предпочтительным арильным циклическим радикалом является фенил.
"Арилокси" означает кислородный радикал, имеющий арильный заместитель (т.е., -О-арил). Предпочтительные арилоксигруппы включают (например) фенокси, нафтилокси, метоксифенокси и метилендиоксифенокси.
"Циклоалкил" означает насыщенный или ненасыщенный углеводородный цикл. Циклоалкильные кольца являются неароматическими. Циклоалкилькые кольца являются моноциклическими или конденсированными, спиро- или мостиковыми бициклическими системами. Моноциклические циклоалкильные кольца содержат порядка 3-9 атомов углерода, предпочтительно, 3-7 атомов углерода в цикле. Бициклические циклоалкильные кольца содержат порядка 7-17 атомов углерода, предпочтительно, 7-12 атомов углерода в цикле. Предпочтительные бициклические циклоалкильные кольца включают 4-, 5, 6- или 7-членные циклы, конденсированные с 5-, 6- или 7-членными циклами. Циклоалкильные кольца могут быть незамещенными или замещенными 1-4 заместителями на цикл.
Циклоалкил может быть замещен радикалом, выбираемым из группы, включающей галоген, циано, алкил, гетероалкил, галогеналкил, фенил, кето, гидрокси, карбокси, амино, ациламино, арилокси, гетероарилокси или любую их комбинацию. Предпочтительные циклоалкильные кольца включают циклопропил, циклопентил и циклогексил.
"Галоид" или "галоген" означает фтор, хлор, бром или иод. Предпочтительными галогенами являются фтор, хлор и бром; обычно более предпочтительны хлор и фтор, в особенности, фтор.
"Галогеналкил" означает линейный, разветвленный или циклический углеводород, замещенный одним или более галогенсвыми заместителями. Предпочтительными являются С1-С12-галогеналкилы; более предпочтительны C1-С6-галогеналкилы; еще более предпочтительны C1-С3-галогеналкилы. Предпочтительными галогеновыми заместителями являются фтор и хлор. Наиболее предпочтительным галогеналкилом является трифторметил.
"Гетероатом" означает атом азота, серы или кислорода. Группы, имеющие более одного гетероатома, могут содержать различные гетероатомы.
"Гетероалкил" означает насыщенную или ненасыщенную цепь, содержащую углерод и, по меньшей мере, один гетероатом, где два гетероатома не могут быть смежными. Гетероалкильные цепи содержат 2-15 атомов (углерод и гетероатомы), членов цепи, предпочтительно 2-10, более желательно, 2-5.
Например, алкокси- (т.е. -О-алкил или -О-гетероалкил) радикалы относятся к гетероалкилу. Гетероалкильные цепи могут быть линейными или разветвленными. Предпочтительный разветвленный гетероалкил имеет одну или две ветви, желательно одну ветвь. Предпочтительный гетероалкил является насыщенным. Ненасыщенный гетероалкил имеет одну или более двойных углерод-углеродных связей и/или одну или более тройных углерод-углеродных связей. Предпочтительные ненасыщенные гетероалкилы имеют одну или две двойные связи или одну тройную связь, более предпочтительно, одну двойную связь. Гетероалкильные цепи могут быть незамещенными или замещенными 1-4 заместителями. Предпочтительными замещенными гетероалкилами являются моно-, ди- или тризамещенные. Гетероалкил может быть замещен радикалом, выбранным из группы, включающей низший алкил, галогеналкил, галоген, гидрокси, арилокси, гетероарилокси, ацилокси, карбокси, моноциклический арил, гетероарил, циклоалкил, гетероциклоалкил, спироцикл, амино, ациламино, амидо, кето, тиокето, циано или любую их комбинацию.
"Гетероарил" означает ароматический цикл, содержащий атомы углерода и приблизительно 1-6 гетероатомов в цикле. Гетероарильные циклы являются моноциклическими или конденсированными бициклическими системами. Моноциклические гетероарильные циклы содержат порядка 5-9 атомов (углерод и гетероатомы) - членов цикла, предпочтительно 5 или 6 атомов - членов цикла. Бициклические гетероарильные циклы содержат 8-17 атомов членов цикла, предпочтительно 8-12 атомов-членов цикла. Бициклические гетероарильные циклы включают циклические системы, где одним циклом является гетероарил, а другим циклом является арил, гетероарил, циклоалкил или гетероциклоалкил. Предпочтительные бициклические системы с гетероарильными циклами содержат 5-, 6- или 7-членные циклы, конденсированные с 5-, 6- или 7-членными циклами. Гетероарильные циклы могут быть незамещенными или замещенными 1-4 заместителями на цикл. Гетероарил может быть замещен радикалом, выбранным из группы, включающей галоген, циано, нитро, гидрокси, карбокси, амино, ациламино, алкил, гетероалкил, галогеналкил, фенил, алкокси, арилокси, гетероарилокси или любую их комбинацию. Предпочтительные гетероарильные циклы включают, но без ограничения указанными, следующие:
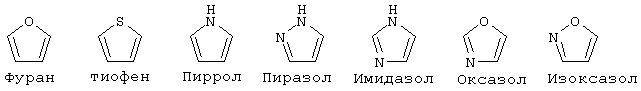
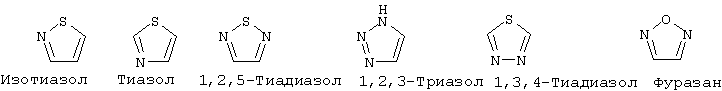

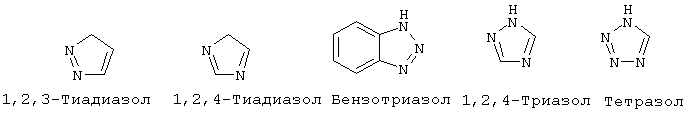
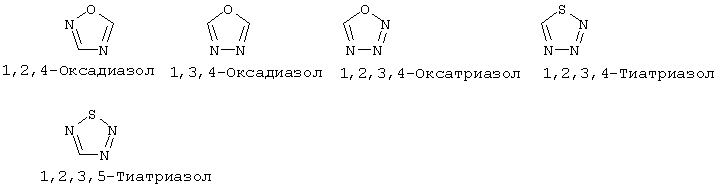
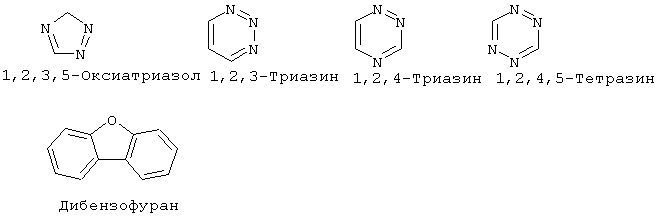
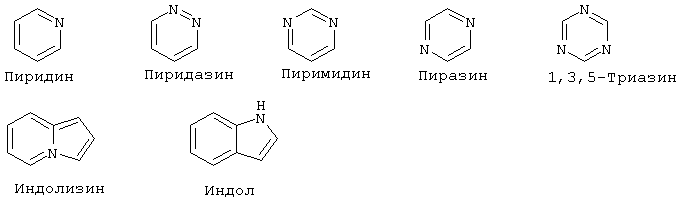
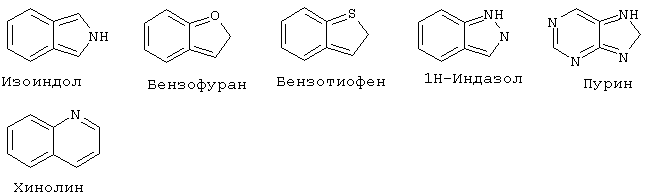
 "Гетероарилокси" означает кислородный радикал, имеющий гетероарильный заместитель (т.е., -О-гетероарил).
"Гетероарилокси" означает кислородный радикал, имеющий гетероарильный заместитель (т.е., -О-гетероарил).
Предпочтительные гетероарилоксигруппы включают (например) пиридилокси, фуранилокси, (тиофен)окси, (оксазол)окси, (тиазол)окси, (изоксазол)окси, пиримидинилокси, пиразинилокси и бензотиазолилокси.
"Гетероциклоалкил" означает насыщенный или ненасыщенный цикл, содержащий атомы углерода и приблизительно 1-4 (предпочтительно, 1-3) гетероатома в цикле. Гетероциклоалкильные кольца являются неароматическими. Гетероциклоалкильные кольца являются моноциклическими или конденсированными, соединенными мостиковой связью или спиробициклическими системами. Моноциклические гетероциклоалкильные кольца содержат от около 3 до около 9 атомов (углерод и гетероатомы) - членов цикла, предпочтительно 5-7 атомов членов цикла. Бициклические гетероциклоалкильные кольца содержат 7-17 атомов-членов цикла, предпочтительно 7-12 атомов-членов цикла. Бициклические гетероциклоалкильные кольца содержат от около 7 до около 17 атомов-членов цикла, предпочтительно 7-12 атомов-членов цикла. Бициклические гетероциклоалкильные кольца могут быть конденсированными, спиро- или мостиковыми бициклическими системами. Предпочтительные бициклические гетероциклоалкильные кольца содержат 5-, 6- или 7-членные циклы, конденсированные с 5-, 6- или 7-членными циклами. Гетероциклоалкильные кольца могут быть незамещенными или замещенными 1-4 заместителями на цикл. Гетероциклоалкил может быть замещен радикалом, выбранным из группы, включающей галоген, циано, гидрокси, карбокси, кето, тиокето, амино, ациламино, ацил, амидо, алкил, гетероалкил, галогеналкил, фенил, алкокси, арилокси или любую их комбинацию. Предпочтительные заместители на гетероциклоалкиле включают галоген и галогеналкил. Предпочтительные гетероциклоалкильные кольца включают, но без ограничения указанными, следующие:
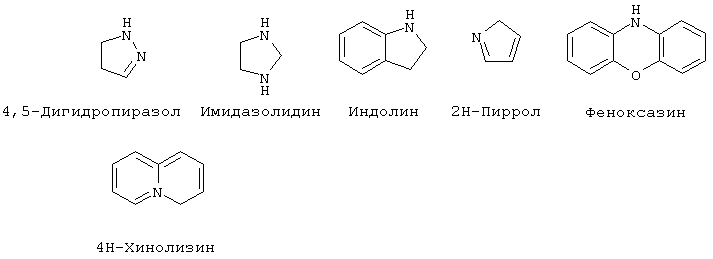
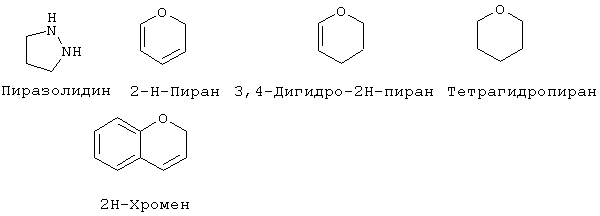
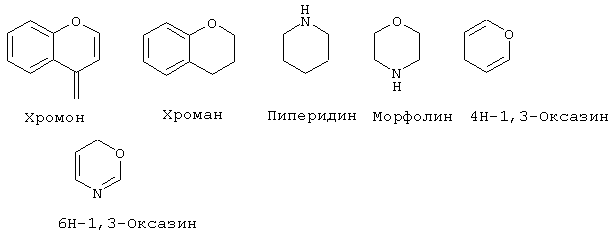
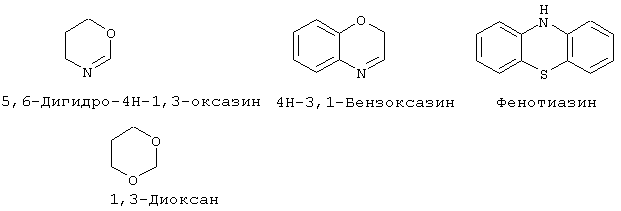
Как он используется здесь, термин "металлопротеаза млекопитающих" означает протеазу, описанную в разделе "Предпосылки изобретения" данной заявки. Соединения по настоящему изобретению преимущественно активны против "металлопротеаз млекопитающих", включая любой металлсодержащий (предпочтительно цинксодержащий) фермент, найденный у животных, преимущественно млекопитающих, способный в подходящих условиях испытания катализировать разрушение коллагена, желатина или протеогликана. Подходящие условия испытания могут быть найдены, например, в патенте США 4743587, в котором ссылаются на методику Cawston’a, et al., Anal. Biochem. (1979) 99:340-345; применение синтетического субстрата описано в Weingarten, H., et al., Biochem. Biophv. Res. Comin. (1984) 139:1184-1187. Смотри также Knight, C.G. et al., "A Novel Coumarin-Labelled Peptide for Sensitive Continuous Assays of the Matrix Metalloproteases", FEBS Letters. Vol.296, pp.263-266 (1992). Конечно, может быть использован любой стандартный способ анализа разрушения этих структурных белков. Рассматриваемые соединения преимущественно активны против ферментов-металлопротеаз, представляющих собой цинксодержащие протеазы, которые подобны по структуре, например, человеческому стромелизину или коллагеназе фибробластов кожи. Способность представленных соединений ингибировать активность металлопротеазы, естественно, может быть исследована вышеуказанным анализом. Выделенные ферменты металлопротеаз могут быть использованы для подтверждения ингибирующей активности соединений по изобретению, либо могут быть использованы сырые экстракты, содержащие ряд ферментов, способных разрушать ткань.
"Спироцикл" означает алкильный или гетероалкильный бирадикальный заместитель алкила или гетероалкила, где указанный бирадикальный заместитель присоединен в геминальном положении и образует цикл, причем указанный цикл содержит 4-8 атомов членов цикла (углерод или гетероатом), предпочтительно, 5 или 6 атомов членов цикла.
Хотя алкильные, гетероалкильные, циклоалкильные и гетероциклоалкильные группы могут быть замещены гидрокси-, амино-, и амидогруппами, как указано выше, изобретением не рассматриваются следующие структуры:
1. Енолы (ОН соединен с углеродом, несущим двойную связь).
2. Аминогруппы, присоединенные к углероду, несущему двойную связь (за исключением амидов-гомологов винилоамидов).
3. Более чем одна гидрокси-, амино- или амидогруппа, присоединенная к одному атому углерода (за исключением, когда два атома азота присоединены к одному атому углерода и все три атома являются членами, образующими гетероциклоалкильнсе кольцо).
4. Гидрокси-, амино-, или амидогруппа, присоединенная к углероду, который также имеет соединенный с ним гетероатом.
5. Гидрокси-, амино- или амидогруппа, присоединенная к углероду, который также имеет соединенный с ним галоген.
"Фармацевтически приемлемая соль" означает катионную соль, образованную любой кислотной группой (например, гидроксамовой или карбоновой кислоты), или анионную соль, образованную любой основной (например, амино) группой. Многие такие соли известны из уровня техники и описаны в World Patent Publication 87/05297, Johnston et al., опубликованной 11 сентября 1987, включенной здесь в качестве ссылки. Предпочтительные катионные соли включают соли щелочных металлов (таких, как натрий и калий), соли щелочноземельных металлов (таких, как магний и кальций) и органические соли. Предпочтительные анионные соли включают галогениды (такие, как хлоридные соли), сульфонаты, карбоксилаты, фосфаты и тому подобные.
Указанные соли хорошо известны специалистам, и специалист способен получить ряд солей на основании известных в данной области сведений. Кроме того, понятно, что специалист может предпочесть одну соль другой из соображений растворимости, стабильности, легкости формулирования и тому подобного. Определение и оптимальный выбор соли относятся к области компетенции специалиста во врачебной практике.
"Биогидролизуемый амид" означает амид ингибитора металлопротеазы, содержащего гидроксамовую кислоту (т.е., R1 в формуле (I) означает -NHOH), который не мешает ингибирующей активности соединения или который легко подвергается превращению in vivo, в организме животного, предпочтительно, млекопитающего, более предпочтительно, человека, с получением активного ингибитора металлопротеазы. Примерами указанных амидных производных являются алкоксиамиды, где гидроксильный водород гидроксамовой кислоты в формуле (I) заменен алкильным радикалом, и ацилоксиамиды, где гидроксильный водород заменен ацильным радикалом (т.е., R-C(=O)-).
"Биогидролизуемый гидроксиимид" означает имид ингибитора металлопротеазы, содержащего гидроксамовую кислоту, который не мешает ингибирующей активности этих соединений в отношении металлопротеаз, или который легко подвергается превращению in vivo, в организме животного, предпочтительно, млекопитающего, более предпочтительно, человека, с получением активного ингибитора металлопротеазы. Примерами указанных имидных производных являются производные, где водород аминогруппы гидроксамовой кислоты в формуле (I) заменен ацильным радикалом (т.е. R-C(=O)-).
"Биогидролизуемый сложный эфир" означает сложный эфир ингибитора металлопротеазы, содержащего карбоновую кислоту (т.е., R’ в формуле (I) означает -ОН), который не мешает ингибирующей активности этих соединений в отношении металлопротеаз, или который легко подвергается превращению в организме животного с образованием активного ингибитора металлопротеазы. Такие сложные эфиры включают низшие алкиловые сложные эфиры, низшие ацилоксиалкиловые сложные эфиры (такие, как ацетоксиметиловые, ацетоксиэтиловые, аминокарбонилоксиметиловые, пивалоилоксиметиловые и пивалоилоксиэтиловые сложные эфиры), лактониловые сложные эфиры (такие, как фталидиловые и тиофталидиловые сложные эфиры), низшие алкоксиацилоксиалкиловые сложные эфиры (такие, как метоксикарбонилоксиметиловые, этоксикарбонилоксиэтиловые и изопропоксикарбонилоксиэтилоаые сложные эфиры), алкоксиалкиловые сложные эфиры, холиновые сложные эфиры и алкилациламиноалкиловые сложные эфиры (такие, как ацетамидометиловые сложные эфиры).
"Сольват" означает комплекс, полученный объединением растворенного вещества (например, ингибитора металлопротеаз) и растворителя (например, воды). Смотри, J. Honig et al.. The Van Nostrand Chemist’s Dictionary, p.650 (1953).
Фармацевтически приемлемые растворители, используемые по данному изобретению, включают растворители, не препятствующие биологической активности ингибитора металлопротеаз (например, вода, этанол, уксусная кислота, N,N-диметилформамид и другие известные или легко подбираемые специалистом растворители).
Термины "оптический изомер", "стереоизомер" и "диастереомер" имеют общепринятые в данной области значения (смотри, например, Hawley’s Condensed Chemical Dictionary, 11th Ed.). Иллюстративные примеры специфических защищенных форм и других производных по настоящему изобретению не рассматриваются как ограничивающие. Применение других полезных защитных групп, форм солей и тому подобного находится в рамках квалификации специалиста.
II. Соединения
Рассматриваемое изобретение включает соединения формулы (I):
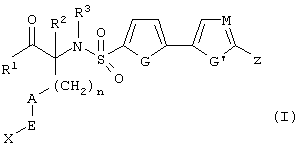
где R1, R2, R3, n, А, Е, X, G, G’, М и Z принимают вышеуказанные значения. Далее приведено описание особенно предпочтительных значений групп, не рассматриваемых как ограничивающие объем изобретения.
R1 выбирают из -ОН и -NHOH, предпочтительно -ОН.
R2 выбирают из группы, включающей водород, алкил, алкенил, алкинил, гетероалкил, галогеналкил, циклоалкилалкил, гетероциклоалкилалкил, арилалкил и гетероарилалкил; предпочтительно, водород или алкил, более предпочтительно, водород.
R3 выбирают из группы, включающей алкил, алкенил, алкикил, гетероалкил, галогеналкил, циклоалкил, гетероциклоалкил, арилалкил и гетероарилалкил;
предпочтительно, алкил, гетероалкил, гетероциклоалкилалкил, арилалкил или гетероарилалкил.
n равно 0~4, предпочтительно, 0 или 1, более желательно 0.
А означает замещенный или незамещенный моноциклический гетероциклоалкил с 3-8 атомами в цикле, из которых 1-3 являются гетероатомами. Предпочтительно А содержит 5-8 атомов в цикле, более желательно, 6 или 8 атомов в цикле. А означает предпочтительно замещенный или незамещенный пиперидин, тетрагидропиран, тетрагидротиопиран или пергидроазоцин; более предпочтительно, пиперидин, тетрагидропиран или тетрагидротиопиран. Альтернативно, А и R2 могут вместе образовывать замещенный или незамещенный моноциклический гетероциклоалкил с 3-8 (предпочтительно, 5-8, более предпочтительно, 6 или 8) атомами в цикле и 1-3 гетероатомами. Из указанных циклов предпочтительны те, в которых А не объединяется с R2, образуя цикл.
Е выбирают из группы, включающей ковалентную связь, С1-С4-алкил, -С(=O)-, -С(=O)O-, C(=O)N(R4)-, -SO2 или -С(=S)N(R4)-. В предпочтительном варианте выполнения Е выбирают из группы, включающей связь, C1-С3-алкил, -С(=O), -С (=O)O-, -C(=O)N(R4)- или –SO2-, более предпочтительно, Е означает С1-С2-алкил, -С(=O)-, -С(=O)O- или -С(=O)N(R4)-.
R4 выбирают из группы, включающей водород, алкил, алкенил, алкинил, гетероалкил, галогеналкил, циклоалкил, гетероциклоалкил, арил, арилалкил, гетероарил и гетероарилалкил; предпочтительно, водород или низший алкил.
Х выбирают из группы, включающей водород, алкил, алкенил, алкинил, гетероалкил, галогеналкил, арил, арилалкил, гетероарил, гетероарилалкил, циклоалкил и гетероциклоалкил. Х предпочтительно означает водород, алкил, гетероалкил, арил, арилалкил, гетероарил, гетероарилалкил, циклоалкил или гетероциклоалкил; наиболее предпочтительно, алкил, гетероалкил, арил, арилалкил, гетерсарил или гетероарилалкил. Альтернативно и предпочтительно, Х и R4 объединяются, образуя замещенный или незамещенный моноциклический гетероциклоалкил с 3-8 атомами в цикле, из которых 1-3 являются гетероатомами. Когда Х и R4 образуют цикл, предпочтительны 5-7-членные циклы с 1 или 2 гетероатомами.
G выбирают из группы, включающей -S-, -О-, -N(R5)-, -С(R5)=C(R51)-, -N=C(R5)- и -N=N-; в предпочтительном варианте выполнения G означает –S- или -С(R5)=C(R51)-. Каждый из R5 и R5’ независимо выбирают из группы, включающей: водород, алкил, алкенил, алкинил, гетероалкил, арил, гетероарил, циклоалкил и гетероциклоалкил, предпочтительно, по меньшей мере, один из R5 и R5’ означает водород, более предпочтительно, оба означают водород.
G’ выбирают из группы, включающей -S-, -О-, -N(R6)-, -С(R6)=C(R6’)-, -N=C(R6)- и -N=N-; в предпочтительном варианте выполнения G’ означает –S- или -С(R6)=С(R6’)-. Каждый из R6 и R6’ независимо выбирают из группы, включающей водород, алкил, алкенил, алкинил, гетероалкил, арил, гетероарил, циклоалкил и гетероциклоалкил; предпочтительно, по меньшей мере, один из R6 и R6’ означает водород, более предпочтительно, оба означают водород.
М выбирают из –СН- и -N-; предпочтительно М означает -СН-.
Z означает (CR7R7’)a-L-R8, где а равно 0~4, предпочтительно, 0 или 1. Каждый из R7 и R7’ независимо выбирают из группы, включающей водород, алкил, алкенил, алкинил, арил, гетероалкил, гетероарил, циклоалкил, гетероциклоалкил, галоген, галогеналкил, гидрокси и алкокси; предпочтительно каждый из R7 означает водород и каждый из R7’ независимо означает водород или низший алкил.
L выбирают из группы, включающей ковалентную связь, -О-, -SОb-, -С(=O)-, -C(=O)N(R9)-, -N(R9)- и -N(R9)С(=O)-; предпочтительно L означает -О-, -S-, -SO2-, -С(=O)N(R9)-, -N(R9)- и -N(R9)С(=O)-; более предпочтительно, L означает -O-или -S-. b равно 0-2. R9 выбирают из группы, включающей водород, алкил, алкенил, алкинил, арил, гетероарил, гетероалкил, гетероарил, циклоалкил, гетероциклоалкил и галогеналкил; R9 предпочтительно означает водород, низший алкил или арил. Альтернативно, R7 и R9, вместе с атомами, к которым они присоединены, объединяются, образуя необязательно замещенный гетероцикл, содержащий 5-8 (предпочтительно 5 или 6) атомов, из которых 1-3 (предпочтительно 1 или 2) являются гетероатомами.
R8 выбирают из группы, включающей водород, алкил, алкенил, алкинил, галоген, гетероалкил, галогеналкил, арил, гетероарил, циклоалкил и гетероциклоалкил; предпочтительно R8 означает галоген, низший алкил, низший гетероалкил или арил. Альтернативно, R8 и R, вместе с атомами, к которым они присоединены, объединяются, образуя необязательно замещенный гетероцикл, содержащий 5-8 (предпочтительно 5 или 6) атомов, из которых 1-3 (предпочтительно 1 или 2) являются гетероатомами.
III. Получение соединений
Соединения по изобретению могут быть получены с применением различных способов. Исходные материалы, используемые для получения соединений по изобретению, являются известными, могут быть получены известными способами или выпускаются промышленно. В особенности предпочтительные синтезы описаны следующими общими реакционными схемами (группы R, используемые для иллюстрации реакционных схем, не обязательно соотносятся с соответствующими группами R, используемыми для описания различных вариантов соединений формулы (I). То есть, например, R1 в формуле (I) не означает те же группы, что R1 в данном разделе). Конкретные примеры получения соединений по настоящему изобретению приведены ниже в разделе VII.
Схема 1
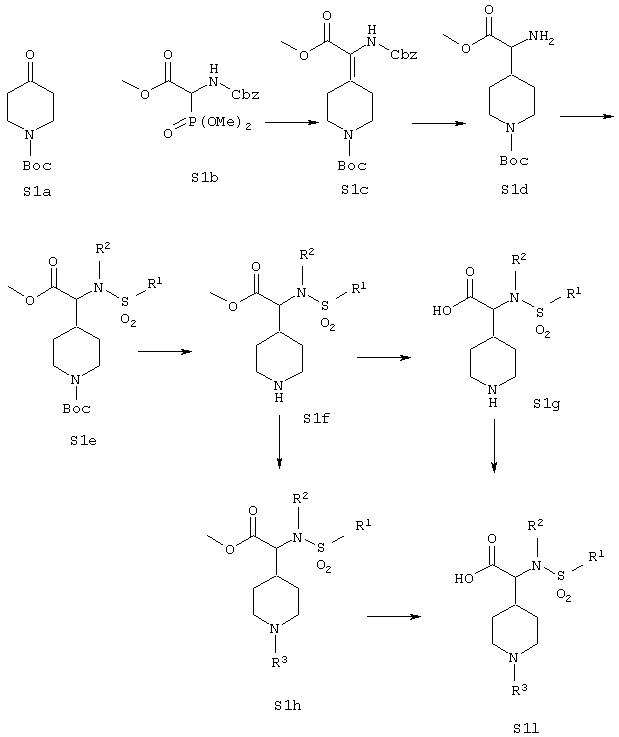
По схеме 1 кетон S1a является промышленно выпускаемым материалом. Путем взаимодействия с фссфонатом S1b указанный кетон может быть превращен в ненасыщенный сложный эфир S1c с очень хорошим выходом. Гидрогенолиз этого материала в стандартных условиях дает сложный аминоэфир S1d. На данной стадии могут быть введены заместители R1 и R2 путем применения восстановительного аминирования с последующим сульфонилированием, или наоборот, сульфонилирования с последующим алкилированием сульфонамидной группы.
Защитная группа Воc для сульфонамида S1e может быть удалена в стандартных условиях, хорошо известных в технике, что приводит к образованию сложного аминоэфира S1f. Метильная сложноэфирная группа данного соединения может быть гидролизована в стандартных условиях, что дает аминокислоту S1g. На данной стадии заместитель R3 азотного атома пиперазина может быть введен при разнообразных условиях. Так, реакции восстановительного аминирования, ацилирования, арилирования, карбамоилирования, сульфонилирования и образования мочевины все с хорошим выходом приводят к целевой карбоновой кислоте S1i.
Альтернативно, заместитель R3 может быть введен, в стандартных условиях, на стадии получения сложного метилового эфира S1f, что приводит к соединению с полным набором функциональностей S1i.
Схема 2

По схеме 2 кетон S2a является промышленно выпускаемым материалом. Путем взаимодействия с фосфонатом S2b указанный кетон может быть превращен в ненасыщенный сложный эфир S2c с очень хорошим выходом. Может также быть выполнено окисление гетероатома Х (Х=S), что дает X=SO2. Гидрогенолиз этого материала в стандартных условиях дает сложный аминоэфир S2d. На данной стадии могут быть введены заместители R1 и R2 путем применения восстановительного аминирования с последующим сульфонилированием, или, наоборот, сульфонилирования с последующим алкилированием сульфонамидной группы. Сульфонамид S2f может затем быть превращен в требуемую карбоновую кислоту S2g с применением стандартных условий гидролиза сложных эфиров.
Схема 3
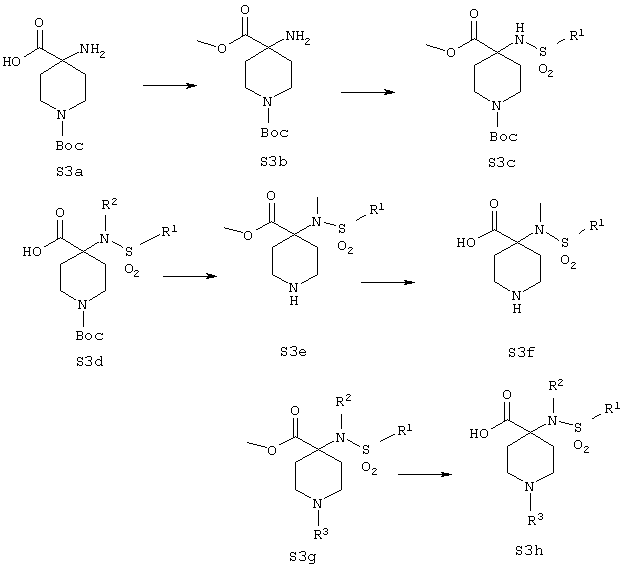
В схеме 3 аминокислота S3a является промышленно выпускаемым материалом. Могут быть использованы стандартные условия для превращения S3a в соответствующий метиловый сложный эфир S3b. На данной стадии заместитель R1 может быть введен в реакции сульфонилирования с получением удобного промежуточного соединения S3c. Если необходимо, может быть введен более сложный заместитель R’ путем применения последовательности из нескольких стадий синтеза. Заместитель R2 может быть затем введен в стандартных условиях алкилирования, что приводит к промежуточному соединению S3d.
Защитная Вос-группа сульфонамида S3d может быть удалена в стандартных условиях, хорошо известных в технике, что приводит к образованию сложного аминоэфира S3е. Сложноэоирная группа данного соединения может быть гидролизована в стандартных условиях, что дает аминокислоту S3f. На данной стадии заместитель R3 азотного атома пиперазина может быть введен при разнообразных условиях. Так, реакции восстановительного аминирования, ацилирования, арилирования, карбамоилирования, сульфонилирования и образования мочевины все с хорошим выходом приводят к целевому сложному эфиру карбоновой кислоты S3g. Стандартный гидролиз сложноэфирной функциональности S3g ведет к целевой карбоновой кислоте S3h.
Сложный метиловый эфир S3g служит общепринятым промежуточным соединением для синтеза гидроксамовой кислоты S3h. Так, обработка S3h основным раствором гидроксиламина в метаноле приводит к соответствующей гидроксамовой кислоте за одну стадию. Альтернативно, карбоновая кислота S3h может быть превращена в гидроксамовую кислоту двухстадийным превращением, включающим: 1) сочетание с O-защищенной формой гидроксиламина и 2) снятие защитной группы. Для указанного превращения могут быть использованы защитные группы, хорошо известные в данной области (например, бензил, трет-бутил, трет-бутилдиметилсилил).
Эти стадии могут изменяться с целью повышения выхода требуемого продукта. Для специалиста очевидно, что разумный выбор реагентов, растворителей и температур является важной составляющей любого успешного синтеза. Определение оптимальных условий и т.д. является повседневной практикой.
Таким образом, специалист может получить различные соединения, используя указания к приведенным выше схемам.
Очевидно, что специалист в области органического синтеза легко может осуществить стандартные превращения органических соединений без дополнительных указаний; то есть осуществление таких превращений относится к сфере компетенции специалиста. Указанные превращения включают, но не в порядке ограничения, восстановление карбонильных соединений до их соответствующих спиртов, окисления гидроксилов и тому подобного, ацилирование, ароматические замещения, как электрофильные, так и нуклеофильные, этерификацию, эстерификацию и омыление, и тому подобное. Примеры указанных превращений описаны в стандартных методиках, таких, как March, Advanced Organic Chemistry (Wiley), Carey and Sundberg, Advanced Organic Chemistry (Vol.2), и других источниках, известных специалистам в данной области техники.
Специалист также хорошо знает, что некоторые взаимодействия лучше всего осуществлять, когда другие потенциально реакционно-способные функциональности на молекуле замаскированы или защищены, что помогает избежать любых нежелательных побочных реакций и/или повысить выход реакции. Часто специалисты применяют защитные группы для достижения повышенных выходов или чтобы избежать нежелательных взаимодействий. Такие реакции приведены в литературе и также входят в компетенцию специалиста. Примеры многих таких превращений могут быть найдены, например, в Т. Greene, Protecting Groups in Organic Synthesis. Конечно, используемые в качестве исходного материала аминокислоты с реакционными боковыми цепями предпочтительно блокируют, предупреждая нежелательные побочные реакции.
Соединения по изобретению могут иметь один или более хиральных центров. В результате может быть выборочно получен один оптический изомер, включая диастереомер и энантиомер, преобладающий над другим, например, путем применения хиральных исходных материалов, катализаторов или растворителей, либо могут быть получены оба стересизомера или оба оптических изомера, включая диастереомеры и энантиомеры, одновременно (рацемическая смесь). Поскольку соединения по изобретению могут существовать в виде рацемических смесей, смеси оптических изомеров, включающие диастереомеры и энантиомеры, или стереоизомеры, могут быть разделены с применением известных приемов, таких, как хиральные соли, хиральная хроматография и тому подобное.
Кроме того, очевидно, что один оптический изомер, включая диастереомер и энантиомер, или стереоизомер, может обладать превосходящими свойствами. Поэтому, когда в описании или приложенных пунктах изобретения упоминается только рацемическая смесь, совершенно ясно, что оба оптических изомера, включая диастереомеры и энантиомеры, или стереоизомеры, по существу свободные друг от друга, также имеются в виду.
IV. Способы применения
Металлопротеазы (МП), обнаруженные в организме, вызывают, в частности, разрушение межклеточного матрикса, включающего межклеточные белки и гликопротеины. Ингибиторы металлопротеаз полезны при лечении болезней, вызванных, по крайней мере, отчасти, разрушением указанных белков к гликопротеинов. Эти белки и гликопротеины играют важную роль в поддержании размера, формы, структуры и стабильности ткани тела. Таким образом, МП непосредственно вовлечены в реконструкцию ткани.
Отмечается, что в результате указанного воздействия МП активны при многих заболеваниях, включающих либо:
(1) разрушение тканей, включая болезни глаз; дегенеративные заболевания, такие, как артрит, множественный склероз и тому подобное; и метастазы или мобильность тканей в организме, либо (2) реконструкцию ткани, включая болезни сердца, фиброзное заболевание, рубцевание, доброкачественную гиперплазию и тому подобное.
Соединения по настоящему изобретению предупреждают или лечат нарушения, болезни и/или нежелательные состояния, характеризующиеся нежелательной или повышенной активностью МП. Например, соединения могут быть использованы для ингибирования МП, которые:
1. разрушают структурные белки (т.е. белки, поддерживающие стабильность ткани и структуру);
2. препятствуют внутриклеточной/межклеточной передаче сигнала, включая МП, вовлеченные в позитивную регуляцию цитокинов, и/или процессинг цитокинов и/или воспалительный процесс, разрушение ткани и другие болезни [Mohler KM, et al, Nature 370 (1994) 218-220, Gearing AJH, et al, Nature 370 (1994) 555-557 McGeehan GM, et al. Nature 370 (1994) 558-561]; и
3. способствуют процессам, которые нежелательны у проходящих лечение больных, например процессу созревания спермы, оплодотворения яйцеклетки и тому подобному.
Как он используется здесь, термин "связанное с МП нарушение" или "связанное с МП заболевание" означает состояние, связанное с нежелательной или повышенной активностью МП в биологическом проявлении болезни или нарушения; в биологическом каскаде, ведущем к нарушению; или в виде симптома болезни. Эта связь МП включает:
1. Нежелательную или повышенную активность МП как "причину" болезни или биологического проявления, где активность повышена генетически по причине инфекции, аутоиммунной реакции, травмы, биомеханических факторов, образа жизни [например, ожирения] или по некоторым другим причинам;
2. МП как часть видимого проявления болезни или нарушения. То есть, болезнь или нарушение измеримы в терминах повышенной активности МП. С клинической точки зрения, нежелательные или повышенные уровни МП свидетельствуют о болезни, однако, МП не обязательно является "критерием" болезни или нарушения; или
3. Нежелательная или повышенная активность МП является частью биохимического или клеточного каскада, что приводит или имеет отношение к болезни или нарушению. В этом отношении ингибирование активности МП прерывает каскад и, тем самым, регулирует заболевание.
Термин "лечение" (обработка), как он используется здесь, означает, что введение соединения по настоящему изобретению, по меньшей мере, облегчает болезнь, связанную с нежелательной или повышенной активностью МП у больного млекопитающего, преимущественно, человека. Таким образом, термин "лечение" включает: предупреждение возникновения МП-опосредованного заболевания у млекопитающего, в особенности, когда млекопитающее предрасположено к заболеванию, но заболевание пока не выявлено; ингибирование МП-опосредованного заболевания и/или смягчение МП-опосредованного заболевания или восстановление после МП-опосредованного заболевания. Постольку поскольку способы по настоящему изобретению направлены на предупреждение болезни, связанной с нежелательной активностью МП, следует понимать, что теомин "предупреждение" не предполагает, что болезнь полностью пресекается. (Смотри Webster’s Ninth Collegiate Dictionary.). Скорее, термин "предупреждение", как он использован здесь, означает возможность для специалиста идентифицировать популяцию, восприимчивую к МП-опосредованным нарушениям, так что введение соединений по настоящему изобретению может осуществляться до начала заболевания. Термин не подразумевает, что заболевания можно будет полностью избежать. Например, остеоартрит (ОА) является наиболее распространенным ревматоидным заболеванием с некоторыми изменениями в суставах, рентгенологически обнаружимыми у 80% людей в возрасте старше 55 лет. Fife, R.S., "A Short History of Osteoarthritis", Osteoarthritis: Diagnosis and Medical/Surgical Management, R.W.Moskowitz, D.S.Howell, V.M.Goldberg and H.J.Mankin Eds., p 11-14 (1992). Обший фактор риска, повышающий заболеваемость ОА, представляет травматическое повреждение сустава. Хирургическое удаление мениска после повреждения колена повышает риск рентгенологически обнаружимого ОА, и этот риск возрастает с течением времени. Roos, H et al. "Knee Osteoarthritis After Menisectomy: Prevalence of Radiographic Changes After Twenty-one Years, Compared with Matched Controls." Arthritis Rheum., Vol.41, pp 687-693; Roos, H et al. "Osteoarthritis of the Knee After Injury to the Anterior Cruciate Ligament or Meniscus: The Influence of Time and Age." Osteoarthritis Cartilege., Vol.3, pp 261-267 (1995). Таким образом, эта группа больных идентифицируема, и ей можно вводить соединения по настоящему изобретению до начала развития болезни. Следовательно, развитие ОА у таких пациентов может быть "предупреждено".
Удобно, что многие МП не распределяются равномерно по всему телу. Поэтому распределение МП, экспрессированных в различных тканях, часто является специфическим для этих тканей. Например, распределение металлопротеаз, вовлеченных в разрушение тканей суставов, не такое же, как распределение металлопротеаз, найденных в других тканях. Хотя и необязательно для проявления активности или эффективности лекарственных средств, некоторые болезни, нарушения и нежелательные состояния предпочтительно лечить соединениями, которые действуют на специфические МП, найденные в пораженных тканях или участках тела. Например, найдено, что соединение, проявляющее большую степень активности и ингибирования МП, обнаруженных в суставах (например, хондроцитов), будет более удобно для лечения болезни, нарушения или нежелательного состояния, чем другие соединения, которые менее специфичны.
Вдобавок, одни ингибиторы являются биологически более доступными по отношению к некоторым тканям, чем другие. Выбор ингибитора МП, который биологически более доступен для определенной ткани и действует на специфические МП, найденные в этой ткани, обеспечивает специфическое лечение болезни, нарушения или нежелательного состояния. Например, соединения по изобретению варьируются по своей способности проникать в центральную нервную систему. Таким образом, могут быть подобраны соединения для оказания воздействия посредством МП, найденных, в частности, за пределами центральной нервной системы.
Определение специфичности ингибитора конкретной МП осуществляется специалистом в данной области. Соответствующие условия испытания могут быть найдены в литературе. В частности, известны испытания на стромелизин и коллагеназу. Например, патент США №4743587 дает ссылку на методику Cawston, et al. Anal Biochem (1979) 99:340-345. Смотри также, Knight, C.G. et al., "A Novel Coumarin-Labelled Peptide for Sensitive Continuous Assays of the Matrix Metalloproteases", FEES Letters. Vol.296, pp.263-266 (1992). Применение синтетического субстрата в испытаниях описано Weingarten, Н., et al., Biochem Biophy Res comm (1984) 139: 1184-1187. Конечно, может быть использован любой стандартный способ анализа на разрушение структурных белков металлопротеазами. Способность соединений по изобретению ингибировать активность металлопротеаз несомненно может быть исследована в тестах, указанных в литературе, либо по измененным методикам. Для подтверждения ингибирующей активности соединений по изобретению могут быть использованы выделенные ферменты металлопротеаз, либо могут быть использованы сырые экстракты, содержащие ряд ферментов, способных разрушать ткань.
Соединения по настоящему изобретению полезны также для профилактики или лечения острых заболеваний. Указанные соединения вводят любым удобным для специалиста в области медицины и фармакологии способом. Для специалиста совершенно очевидно, что предпочтительные способы введения зависят от требующего лечения состояния и выбранной лекарственной формы. Предпочтительные способы системного введения включают пероральное или парентеральное введение.
Кроме того, специалист оценит по достоинству преимущество введения ингибитора МП непосредственно на/в пораженный участок при многих заболеваниях, нарушениях или нежелательных состояниях. Например, может быть удобно вводить ингибиторы МП непосредственно на/в такой участок заболевания, нарушения или нежелательного состояния, как участок, получивший хирургическую травму (например, реконструкция сосудов), участок рубцевания, ожога (например, местного на коже), или при глазных или периодонтальных показаниях.
Поскольку в реконструкцию костей вовлечены МП, соединения по изобретению полезны для предупреждения расшатывания протеза. В данной области известно, что с течением времени протез расшатывается, становится болезненным для пациента и способным привести к дополнительному повреждению кости, поэтому требуется его замена. Требующие замены протезы включают такие протезы, как восполнители суставов (например, восполнители бедренного, коленного и плечевого суставов), зубные протезы, включая искусственные зубы, мосты и протезы, укрепляющие верхнюю и/или нижнюю челюсть.
МП активны также при реконструкции сердечно-сосудистой системы (например, при застойной сердечной недостаточности). Предполагается, что одна из причин того, что пластическая операция на сосудах дает большее, чем ожидается, замедление сердечного ритма (большее время повторного включения) состоит в том, что активность МП является нежелательной или повышенной, что при ответной реакции может быть распознано телом как "повреждение" базальной мембраны сосуда. Таким образом, регулирование активности МП при таких показаниях, как расширенная кардиомиопатия, застойная сердечная недостаточность, атеросклероз, разрыв бляшки, нарушение реперфузии, ишемия, хроническое обструктивное заболевание легкого, рестеноз после пластической операции на сосудах и аневризма аорты, может усилить долговременный успех любого другого лечения, или может служить лечением само по себе.
При уходе за кожей МП вовлекаются в реконструкцию или "обновление" кожи. В результате регулирование МП улучшает лечение состояний кожи, включая, но не в порядке ограничения, удаление морщин, сдерживание, предупреждение и устранение вызванных ультрафиолетом повреждений кожи. Такое лечение включает профилактическую обработку или лечение до того, как физиологические проявления становятся заметными. Например, МП может использоваться как лечение до облучения для предупреждения вызванного ультрафиолетом поражения и/или во время или после облучения для предупреждения или сведения к минимуму поражения ультрафиолетом. Кроме того, МП вовлечены в кожные нарушения и болезни, связанные с аномальными тканями, возникающими при аномальном обновлении, которые включают активно действующую металлопротеазу, такие, как врожденный буллезный эпидермолиз, псориаз, склеродермия и атонический дерматит. Соединения по изобретению полезны также для лечения последствий "обычных" повреждений кожи, включая рубцевание или "стягивание" ткани, например, после ожога. МП ингибиторы полезны также при нарушающих кожу хирургических операциях для предупреждения рубцевания и стимуляции роста здоровой ткани, включая такие применения, как при операции по реплантации конечностей и рефракторной операции (с помощью лазера или разреза).
В дополнение к этому МП связаны с нарушениями, включающими нерегулярную реконструкцию других тканей, таких, как кости, например, при отосклерозе и/или остеопорозе, или тканей конкретных органов, так, как при заболевании циррозом печени и пневмофиброзом. Аналогично, при таких заболеваниях, как множественный склероз, МП могут быть вовлечены в нерегулярную реконструкцию гематоэнцефалического барьера и/или миелинового слоя нервной ткани. Таким образом, способ регулирования активности МП может быть использован для лечения, предупреждения и сдерживания указанного заболевания.
Предполагается также, что МП вовлечены во многие инфекционные процессы, включая цитомегаловирус [CMV-ЦМВ]; ретинит; HIV и проистекающий синдром, AIDS-СПИД.
МП могут также быть вовлечены в экстраваскуляризацию, где ткань окружающей среды должна быть разрушена, что дает возможность образования новых кровеносных сосудов, как, например, при ангиофиброме и гемангиоме.
Поскольку МП разрушают внеклеточный матрикс, предполагается, что ингибиторы для данных ферментов могут быть использованы в качестве агентов регулирования деторождения, например, для предупреждения овуляции, предупреждения проникновения спермы внутрь внеклеточной среды и через внеклеточную среду яйцеклетки, имплантации оплодотворенной яйцеклетки и для предупреждения созревания спермы.
Кроме того, предполагается, что МП также полезны для предупреждения или остановки преждевременных родов и при родах.
Поскольку МП вовлечены также в воспалительную реакцию и в процессинг цитокинов, соединения также полезны в качестве противовоспалительных средств для применения при болезнях, где воспалительный процесс является преобладающим, включая воспалительное заболевание кишечника, болезнь Крона, неспецифический язвенный колит, панкреатит, дивертикулит, астму или родственные заболевания легких, ревматоидный артрит, подагру и болезнь Рейтера.
Когда причиной заболевания является аутсиммунная реакция, иммунная реакция часто инициирует активность МП и цитокинов. Регулирование МП при таких аутоиммунных нарушениях является полезным способом лечения. Так, МП ингибиторы могут быть использованы для лечения нарушений, включающих красную волчанку, анкилозирующий спондилоартрит и аутоиммунный кератит. Иногда побочные эффекты аутоиммунной терапии приводят к обострению других состояний, опосредованных МП, здесь терапия МП ингибиторами также эффективна, например, при фиброзе, вызванном аутоиммунной терапией.
Кроме того, терапии указанного типа поддаются другие фиброзные заболевания, включая легочную недостаточность, бронхит, эмфизему, кистозный фиброз, острый респираторный дистресс-синдром (в особенности, реакцию на острой стадии).
Когда МП вовлечены в нежелательное разрушение ткани посредством экзогенных агентов, они могут быть обработаны ингибиторами МП. Например, ингибиторы МП эффективны в качестве противоядия при укусе гремучей змеи, средства против нарывов, при лечении аллергических воспалительных заболеваний, септицемии и шока. Кроме того, они полезны в качестве противопаразитарных средств (например, при малярии) и антибактериальных средств. Например, считается, что они полезны при лечении или профилактике вирусной инфекции, включая инфекцию, приводящую к герпесу, "простуде" (например, риновирусная инфекция), менингит, гепатит, ВИЧ-инфекция и СПИД.
Ингибиторы МП считаются также полезными при лечении болезни Альцгеймера, бокового амиотрофическсго склероза (ALS БАС), мышечной дистрофии, осложнений, возникающих в результате или являющихся следствием диабета, в особенности, включающие утрату жизнеспособности ткани, коагуляции, гомологичной болезни ("трансплантат против хозяина"), лейкоза, кахексии, анорексии, протеинурии и, возможно, для регулирования роста волос.
При некоторых заболеваниях, состояниях или нарушениях ингибиторы МП рассматриваются как предпочтительные способы лечения. Такие заболевания, состояния или нарушения включают артрит (включая остеоартрит и ревматоидный артрит), рак (в особенности, для предупреждения или задержки роста опухолей или метастаэов), глазные болезни (в особенности, язва роговицы, слабое заживление роговицы, дегенерация желтого пятна и птеригий) и болезни десен (в особенности, периодонтальное заболевание и гингивит).
Предпочтительными, но не рассматриваемыми в порядке ограничения, соединениями для лечения артрита (включая остеоартрит и ревматоидный артрит) являются те соединения, которые селективны в отношении металлопротеаз матрикса и дезинтегрин-металлопротеаз.
Предпочтительными, но не рассматриваемыми в порядке ограничения, соединениями для лечения раковой опухоли (в особенности, профилактики или задержки роста опухоли и метастазов) являются те соединения, которые преимущественно ингибируют желатиназы или ксллагеназы типа IV.
Предпочтительными, но не рассматриваемыми в порядке ограничения, соединениями для лечения глазных болезней (в особенности, язвы роговицы, слабого заживления роговицы, дегенерации желтого пятна и птеригия) являются те соединения, которые ингибируют широкий круг металлопротеаз. Желательно эти соединения вводить местно, более предпочтительно, в виде капель или геля.
Предпочтительными, но не рассматриваемыми в порядке ограничения, соединениями для лечения болезней десен (в особенности, периодонтального заболевания и гингивита) являются те соединения, которые предпочтительно ингибируют коллагенады.
V. Композиции
Композиции по изобретению включают:
(a) безопасное и эффективное количество соединения по изобретению и
(b) фармацевтически приемлемый носитель.
Как обсуждалось выше, известны многочисленные заболевания, опосредованные избыточной или нежелательной активностью металлопротеазы. Эти заболевания включают метастазы опухолей, остеоартрит, ревматоидный артрит, воспалительные заболевания кожи, язвы, в частности, роговицы, реакцию на инфекцию, периодонтит и тому подобное. Таким образом, соединения по изобретению полезны для терапии в отношении состояний, связанных с такой нежелательной активностью.
Следовательно, соединения по изобретению могут быть приготовлены в виде фармацевтических композиций с целью применения для лечения или профилактики указанных состояний. Используют стандартные технологии приготовления фармацевтических составов, такие, как описаны в Remington’s Pharmaceutical Sciences. Mack Publishing Company, Easton, Pa., latest edition.
"Безопасное и эффективное количество" соединения формулы (I) означает количество, являющееся эффективным для ингибирования металлопротеаз на участке (участках) активности в организме животного, предпочтительно млекопитающего, более предпочтительно, человека, и не обладающее нежелательными побочными эффектами (такими, как токсичность, возбудимость или аллергическая реакция), соразмерное с разумным соотношением польза/риск при применении согласно способу по настоящему изобретению. Точное "безопасное и эффективное количество", очевидно, будет изменяться в соответствии с такими факторами, как конкретное требующее лечения состояние, физическое состояние пациента, длительность лечения, природа сопутствующей терапии (если есть), конкретная используемая лекарственная форма, используемый носитель, растворимость в нем соединения формулы (I) и желательная для композиции схема приема лекарственного средства.
В дополнение к рассмотренным соединениям композиции по настоящему изобретению содержат фармацевтически приемлемый носитель. Термин "фармацевтически приемлемый носитель", как он используется здесь, означает один или несколько совместимых твердых или жидких наполнителей, разбавителей или инкапсулирующих веществ, подходящих для введения животному, предпочтительно млекопитающему, более предпочтительно, человеку. Термин "совместимый", как он используется здесь, означает, что компоненты композиции способны смешиваться с соединением по изобретению и друг с другом так, что при этом отсутствует взаимодействие, способное существенно снижать фармацевтическую эффективность композиции в условиях обычного применения. Фармацевтически приемлемые носители должны, конечно, иметь достаточно высокую чистоту и достаточно низкую токсичность для того, чтобы быть пригодными для введения нуждающемуся в лечении животному, предпочтительно млекопитающему, более предпочтительно, человеку.
Некоторыми примерами веществ, которые могут служить фармацевтически приемлемыми носителями или их компонентами, являются сахара, такие, как лактоза, глюкоза и сахароза; крахмалы, такие, как кукурузный крахмал и картофельный крахмал; целлюлоза и ее производные, такие, как натрий-карбоксиметилцеллюлоза, этилцеллюлоза и метилцеллюлоза; порошкообразный трагакант; солод; желатин; тальк; твердые смазывающие вещества, такие, как стеариновая кислота и стеарат магния; сульфат кальция; растительные масла, такие, как арахисовое масло, хлопковое масло, кунжутовое масло, оливковое масло, кукурузное масло и масло какао; полиолы, такие, как пропиленгликоль, глицерин, сорбит, маннит и полиэтиленгликоль; альгиновая кислота; эмульгаторы, такие, как Tweens®; смачивающие агенты, такие, как натрийлаурилсульфат; красители; корригенты; таблетирующие агенты, стабилизаторы; антиоксиданты; консерванты; апирогенная вода; изотонический солевой раствор и растворы фосфатного буфера.
Выбор фармацевтически приемлемого носителя, используемого в сочетании с соединением по изобретению, в основном определяется предлагаемым способом введения соединения.
Если соединение по изобретению предназначено для введения путем инъекции, предпочтительным фармацевтически приемлемым носителем является стерильный физиологический раствор, содержащий совместимый с кровью суспендирующий агент, рН которого доведен приблизительно до 7,4.
В частности, фармацевтически приемлемые носители для системного введения включают сахара, крахмалы, целлюлозу и ее производные, солод, желатин, тальк, сульфат кальция, растительные масла, синтетические масла, полиолы, альгиновую кислоту, растворы фосфатного буфера, эмульгаторы, изотонический солевой раствор и апирогенную воду. Предпочтительные носители для парентерального введения включают пропиленгликоль, этилолеат, пирролидон, этанол и кунжутовое масло. Предпочтительно фармацевтически приемлемый носитель в композиции для парентерального введения составляет, по меньшей мере, примерно 90 массовых % от всей композиции.
Композиции по настоящему изобретению предпочтительно представлены в стандартной лекарственной форме. Как он используется здесь, термин "стандартная лекарственная форма" означает композицию по изобретению, содержащую количество соединения формулы (I), подходящее для введения животному, предпочтительно млекопитающему, более предпочтительно, человеку, в разовой дозе, в соответствии с настоящей медицинской практикой. Указанные композиции предпочтительно содержат приблизительно от 5 мг (миллиграммов) до 1000 мг, более предпочтительно от 10 мг до 500 мг, еще более предпочтительно, приблизительно от 10 мг до 300 мг, соединения формулы (I).
Композиции по настоящему изобретению могут быть представлены в любой из множества существующих форм, подходящих (например) для перорального, ректального, местного, назального, глазного или парентерального введения. В зависимости от желаемого конкретного способа введения могут быть использованы разнообразные фармацевтически приемлемые носители, хорошо известные в данной области. Указанные носители включают твердые или жидкие наполнители, разбавители, гидротропные соединения, поверхностно-активные вещества и инкапсулирующие вещества. Могут быть включены необязательные фармацевтически активные материалы, по существу, не влияющие на ингибирующую активность соединения формулы (I). Количество носителя, используемого в сочетании с соединением формулы (I), является достаточным для обеспечения удобного для практического применения количества материала с целью введения соединения формулы (I) в разовой дозе. Технологии и композиции для приготовления лекарственных форм в соответствии со способами по данному изобретению, описаны в следующей литературе, включенной сюда в качестве ссылок: Modern Pharmaceutics. Chapters 9 and 10 (Banker & Rhodes, editors, 1979); Lieberman et al., Pharmaceutical Dosage Forms: Tablets (1981); and Ansel, Introduction to Pharmaceutical Dosage Forms 2d Edition (1976).
Могут быть использованы разнообразные пероральные лекарственные формы, включая такие твердые формы, как таблетки, капсулы, гранулы и насыпные порошки. Указанные пероральные формы включают безопасное и эффективное количество, обычно не менее порядка 5% и, предпочтительно, от 25% до 50%, соединения формулы (I). Таблетки могут быть прессованными, растертыми в порошок таблетками, покрытыми энтеросолюбильным слоем, покрытыми сахаром, покрытыми пленкой или составными прессованными, содержащими подходящие связующие вещества, смазывающие вещества, разбавители, разрыхлители, красящие агенты, корригенты, обеспечивающие сыпучесть агенты и агенты, придающие способность таять во рту. Жидкие пероральные лекарственные формы включают водные растворы, эмульсии, суспензии, растворы и/или суспензии, восстановленные из нешипучих гранул, и шипучие препараты, восстановленные из шипучих гранул, содержащие подходящие растворители, консерванты, эмульгаторы, суспендирующие средства, разбавители, подсластители, агенты, придающие способность таять во рту, красители и корригенты.
Фармацевтически приемлемые носители, подходящие для получения стандартных лекарственных форм, предназначенных для перорального введения, хорошо известны в данной области. Таблетки обычно включают общепринятые фармацевтически приемлемые вспомогательные средства, в качестве инертных разбавителей, такие, как карбонат кальция, карбонат натрия, маннит, лактоза и целлюлоза; связующие вещества, такие, как крахмал, желатин и сахароза; разрыхлители, такие, как крахмал, альгиновая кислота и кроскармелоза; смазывающие средства, такие, как стеарат магния, стеариновая кислота и тальк. Для улучшения характеристик сыпучести порошкообразной смеси могут быть использованы средства для скольжения, такие, как двуокись кремния. Красящие средства, такие, как красители FD&C, могут быть добавлены для улучшения внешнего вида. Подсластители и корригенты, такие, как аспартам, сахарин, ментол, перечная мята и фруктовые вкусовые добавки, являются полезными вспомогательными средствами для жевательных таблеток. Капсулы обычно включают один или несколько вышеуказанных твердых разбавителей. Выбор компонентов-носителей определяется второстепенными соображениями, такими, как вкус, цена и срок хранения, которые не являются решающими, и может быть легко произведен специалистом в данной области.
Пероральные композиции также включают жидкие растворы, эмульсии, суспензии и тому подобное. Фармацевтически приемлемые носители, подходящие для получения указанных композиций, хорошо известны в данной области. Типичные компоненты носителей для сиропов, эликсиров, эмульсий и суспензий включают этанол, глицерин, пропиленгликоль, жидкую сахарозу, сорбит и воду. Для суспензий обычные суспендирующие агенты включают метилцеллюлозу, натрийкарбоксиметилцеллюлозу, Avicel" RC-591, трагакант и альгинат натрия; характерные смачивающие средства включают лецитин и полисорбат 80; и типичные консерванты включают метилпарабен и бензоат натрия. Пероральные жидкие композиции могут также содержать один или несколько компонентов, таких, как вышеуказанные подсластители, корригенты и красители.
Указанные композиции могут также быть покрыты оболочкой общепринятым способом, обычно покрытиями, обеспечивающими зависимость от рН или от времени, так что соединение по изобретению высвобождается в желудочно-кишечном тракте в месте требуемого локального применения, или в различные периоды времени для продления требуемого действия. Указанные лекарственные формы обычно включают, но не в порядке ограничения, покрытия из одного или нескольких соединений, включающих фталат ацетатцеллюлозы, поливинилацетатфталат, фталат гидроксипропилметилцеллюлозы, этилцеллюлозу, Eudragit, воск и шеллак.
Композиции по настоящему изобретению могут необязательно включать другие лекарственные активные ингредиенты.
Другие композиции, полезные для обеспечения системной доставки соединений по изобретению, включают подъязычные, трансбуккальные и назальные лекарственные формы. Указанные композиции обычно включают одно или несколько растворимых соединений-наполнителей, таких, как сахароза, сорбит и маннит; и связующих веществ, таких, как сок акации, микрокристаллическая целлюлоза и гидроксипропилметилцеллюлоза. Также могут быть включены вышеуказанные средства для скольжения, смазывающие вещества, подсластители, красители, антиоксиданты и корригенты.
Композиции по данному изобретению могут также быть введены больному местно, например, путем непосредственного нанесения или намазывания композиции на эпидермальную или эпителиальную ткань больного или путем трансдермального введения посредством "пластыря". Указанные композиции включают, например, лосьоны, кремы, растворы, гели и твердые вещества. Эти местные композиции предпочтительно включают безопасное и эффективное количество, обычно не менее приблизительно 0,1% и предпочтительно примерно от 1% до 5%, соединения формулы (I). Подходящие носители для местного введения преимущественно остаются на месте, на коже, в качестве сплошной пленки и устойчивы к удалению под действием пота или при погружении в воду. Обычно носитель имеет органическую природу и способен диспергировать или растворять соединение формулы (I). Носитель может включать фармацевтически приемлемые мягчители, эмульгаторы, загустители, растворители и тому подобное.
VI. Способы введения
В настоящем изобретении предлагаются также способы лечения или предупреждения нарушений, связанных с избыточной или нежелательной активностью металлопротеазы в организме человека или другого млекопитающего, путем введения безопасного и эффективного количества соединения формулы (I) указанному пациенту. Как он используется здесь, термин "нарушение, связанное с избыточной или нежелательной активностью металлопротеазы" означает любое нарушение, характеризующееся разрушением белка матрикса. Способы по изобретению полезны для лечения или предупреждения вышеуказанных нарушений.
Композиции по данному изобретению могут быть введены местно или системно. Системное применение включает любой способ введения соединения формулы (I) в ткани тела, например, внутрисуставное (в особенности, при лечении ревматоидного артрита), внутрикапсульное, эпидуральное, внутримышечное, трансдермальное, внутривенное, интраперитонеальное, подкожное, подъязычное, ректальное или пероральное введение. Соединения формулы (I) по настоящему изобретению предпочтительно вводят перорально.
Конкретная вводимая доза ингибитора, равно как длительность лечения и определение, будет ли лечение местным или системным, являются взаимозависимыми факторами. Доза и схема приема лекарственных средств зависят также от таких факторов, как конкретное используемое соединение формулы (I), лечебные показания, способность соединения формулы (I) достигать минимальных ингибируюших концентраций на участке нахождения ингибируемой металлопротеазы, личных особенностей пациента (таких, как масса), соответствие со схемой лечения и наличие и тяжесть побочных эффектов лечения.
Обычно для взрослого человека (весящего приблизительно 70 килограммов) вводят примерно от 5 мг до 3000 мг, более предпочтительно, примерно от 5 мг до 1000 мг, еще предпочтительней, примерно от 10 мг до 100 мг соединения формулы (I) в день при системном введении. Понятно, что указанные пределы доз приведены только с целью примера и что суточное введение может уточняться с учетом вышеуказанных факторов.
Предпочтительным способом введения для лечения ревматоидного артрита является пероральное введение или парентеральное посредством внутрисуставной инъекции. Как известно и практикуется в данной области, все составы для парентерального введения должны быть стерильны. Для млекопитающих, в особенности человека (в расчете на приблизительную среднюю массу тела 70 кг) предпочтительны индивидуальные дозы, приблизительно от 10 мг до 1000 мг.
Предпочтительным способом системного введения является пероральный. Предпочтительны индивидуальные дозы приблизительно от 10 мг до 1000 мг, более желательно, приблизительно от 10 мг до 300 мг.
Местное введение может быть использовано для системной доставки соединения формулы (I) или локального лечения пациента. Количества вводимого местно соединения формулы (I) зависят от таких факторов, как чувствительность кожи, тип и расположение обрабатываемой ткани, вводимые композиция и носитель (если есть), конкретное вводимое соединение формулы (I), а также конкретное нарушение, требующее лечения, и пределы, в которых желательны системные (в отличие от местных) эффекты.
Ингибиторы по изобретению могут быть направлены на специфические участки, где аккумулируется металлопротеаза, за счет использования направленных лигандов. Например, чтобы сконцентрировать ингибиторы в опухоли, содержащей металлопротеазы, ингибитор конъюгируют с антителом или его фрагментом, который вступает в иммунную реакцию с маркером опухоли, как обычно подразумевается при получении иммунотоксинов в целом. Направленные лиганды могут также быть лигандами, подходящими для присутствующего на опухоли рецептора. Для введения в намеченную ткань могут быть использованы любые направленные лиганды, которые специфически взаимодействуют с маркером. Способы сцепления соединения по изобретению с направленными лигандами хорошо известны и подобны способам, описанным ниже для сцепления с носителем. Конъюгаты готовят и вводят, как описано выше.
Для локализованных состояний предпочтительно местное введение. Например, для лечения изъязвленной роговицы может быть использовано прямое нанесение на пораженный глаз состава в виде глазных капель или аэрозоля. Для лечения роговицы соединения по изобретению могут быть также приготовлены в виде гелей, каплей или мазей или могут быть включены в коллагеновый или гидрофильный полимерный контейнер. Материалы могут также быть введены в виде контактных линз или резервуара, или в виде субконъюнктивального состава. Для лечения воспалительных заболеваний кожи соединение наносят местно или локально в виде геля, пасты, крема или мази. Для лечения заболеваний полости рта соединение может применяться локально в виде геля, пасты, полоскания для рта или имплантата. Таким образом, способ лечения отражает природу состояния, и в данной области имеются в распоряжении подходящие составы для любого выбранного способа.
Разумеется, во всех вышеуказанных случаях, соединения по изобретению могут быть введены отдельно или в виде смесей, и композиции могут дополнительно включать добавочные лекарственные средства или наполнители, соответствующие показанию.
Некоторые соединения по изобретению ингибируют также бактериальные металлопротеазы. Некоторые бактериальные металлопротеазы могут быть менее зависимы от стереохимии ингибитора, тогда как найдены существенные различия между диастереомерами в их способности инактивировать протеазы млекопитающих. Таким образом, данная особенность активности может быть использована для установления различий между ферментами млекопитающих и бактериальными ферментами.
VII. Примеры - Получение соединений
В данном описании использованы следующие обозначения:
МеОН: метанол
EtOAc: этилацетат
Ph: фенил
DMF: N,N-диметилформамид (ДМФА)
DME: диметоксиэтан (ДМЭ)
conc.: концентрированный (конц.)
DCC: 1,3-дициклогексилкарбодиимид
Et3N: триэтиламин
Et2О: диэтиловый эфир
bос: трет-бутилоксикарбонил
асас: этилацетат
dil.: разбавленный (разб.)
wrt: в отношении
НОВТ: 1-гидроксибензотриазол
Группы R, используемые для иллюстрации примеров соединений, не соотносятся с соответствующими группами R, используемыми для описания различных составляющих формулы (I). То есть, например, R1 и R2, используемые для описания формулы (I) в разделе "Краткое описание изобретения" и в разделе II "Подробное описание", не означают те же группы, что R1 и R2 в данном разделе VII.
ПРИМЕРЫ 1-16
Следующая таблица 1 показывает структуру соединений, полученных по методикам, описанным в примерах 1-16. В этих примерах А в формуле (I) означает пиперидиновый цикл.
Таблица 1
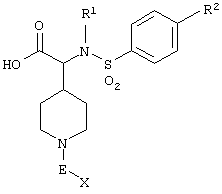
Пример 1
[(4’-Метоксидифенил-4-сульфонил)метиламино]-[1-(морфолин-4-карбонил)пиперидин-4-ил]уксусная кислота
а) трет-Бутиловый эфир 4-(бензилоксикарбониламинометоксикарбонилметилен)пиперидин-1-карбоновой кислоты.
К раствору 4-Вос-пиперидона (30 г) и фосфоната (50 г) в дихлорметане (100 мл), охлажденному до 0°С, добавляют по каплям диазабициклоундекан (32,16 г). Полученную смесь перемешивают при комнатной температуре в течение 5 дней. Растворитель удаляют при пониженном давлении и смесь растворяют в EtOAc. Органические экстракты промывают водой, после этого - насыщенным раствором соли, затем сушат (Na2SO4). Сырой продукт, полученный после упаривания растворителя, очищают хроматографией на силикагеле, используя смесь 3/2 гексан/EtOAc, что дает требуемый продукт в виде белого твердого вещества.
b) трет-Бутиловый эфир 4-(аминометоксикарбонилметил) пиперидин-1-карбоновой кислоты
Трет-бутиловый эфир
4-(бензилоксикарбониламинометоксикарбонилметилен)пиперидин-1-карбоновой кислоты (49,1 г) растворяют в метаноле (100 мл) и добавляют 10% палладий на угле (2,36 г). Колбу заполняют водородом и реакционную смесь перемешивают при комнатной температуре в течение 12 часов. Реакционную смесь фильтруют через пробку из целита и растворитель упаривают при пониженном давлении, получая требуемый продукт, который используют в последующей реакции без очистки.
c) трет-Бутиловый эфир 4-[(4’-метоксидифенил-4-сульфониламино)метоксикарбонилметил]пиперидин-1-карбоновой кислоты
К раствору трет-бутилового эфира 4-(аминометоксикарбонилметил)пиперидин-1-карбоновой кислоты (5,42 г) в дихлорметане (80 мл) добавляют триэтиламин (3,05 г), затем 4’-метоксидифенил-4-сульфонилхлорид (6,19 г). Реакционную смесь перемешивают при комнатной температуре в течение ночи, промывают последовательно 1 н. соляной кислотой, водой, 5% водным бикарбонатом натрия и насыщенным раствором соли, затем сушат (Na2SO4). Сырой продукт, полученный после упаривания растворителя, очищают хроматографией на силикагеле, используя смесь 3/2 гексан/EtOAc, что дает требуемый продукт в виде бесцветного твердого вещества.
d) Соль метилового эфира (4’-метоксидифенил-4-сульфониламино)пиперидин-4-илуксусной кислоты с ТФУ
К раствору соли трет-бутилового эфира 4-[(4’-метоксидифенил-4-сульфониламино)метоксикарбонилметил] пиперидин-1-карбоновой кислоты с ТФУ (трифторуксусной кислотой) (6,7 г) в дихлорметане (60 мл) добавляют трифторуксусную кислоту (60 мл) и реакционную смесь перемешивают при комнатной температуре в течение 3 часов. Растворители удаляют при пониженном давлении и сырой продукт, затвердевающий при хранении, используют на следующей стадии без дополнительной очистки.
e) Метиловый эфир (4’-метоксидифенил-4-сульфониламино)-[1-(морфолин-4-карбонил)пиперидин-4-ил]уксусной кислоты
К суспензии соли метилового эфира (4’-метоксидифенил-4-сульфониламино)пиперидин-4-илуксусной кислоты с ТФУ (5,02 г) в дихлорметане (30 мл) добавляют триэтиламин (2,5 мл) с последующим добавлением морфолинкарбамоилхлорида (1,4 г), и реакционную смесь перемешивают при комнатной температуре в течение 4 часов. Растворители удаляют при пониженном давлении и остаток разбавляют этилацетатом и промывают последовательно 1 н. соляной кислотой, водой, насыщенным раствором соли и затем сушат (Na2SO4). Сырой продукт, полученный после упаривания растворителя, очищают кристаллизацией из метанола, получая требуемый продукт в виде бесцветного твердого вещества.
f) Метиловый эфир [(4’-метоксидифенил-4-сульфонил)метиламино]-[1-(морфолин-4-карбонил)пиперидин-4-ил]уксусной кислоты
К раствору метилового эфира (4’-метоксидифенил-4-сульфониламино)-[1-(морфолин-4-карбонил)пиперидин-4-ил]уксусной кислоты (1,04 г) в диметилформамиде (8 мл) добавляют безводный карбонат цезия (0,75 г) с последующим добавлением метилиодида (0,85 мл), и реакционную смесь перемешивают при комнатной температуре в течение ночи. Растворители удаляют при пониженном давлении и остаток разбавляют метиленхлоридом и промывают последовательно водой, насыщенным раствором соли, и затем сушат (Nа2SO4). Сырой продукт, полученный после упаривания растворителей, очищают, используя RP-HPLC - ОФ-ВЭЖХ, что дает требуемый продукт в виде бесцветного твердого вещества.
g) [(4’-Метоксидифенил-4-сульфонил)метиламино]-[1-(морфолин-4-карбонил)пиперидин-4-ил]уксусная кислота
К раствору метилового эфира [(4’-метоксидифенил-4-сульфонил)метиламино]-[1-(морфолин-4-карбонил)пиперидин-4-ил]уксусной кислоты (323 мг) в тетрагидрофуране (10 мл) добавляют 50% гидроксид натрия (3 мл) и реакционную смесь перемешивают при комнатной температуре в течение 2 часов. Растворители удаляют при пониженном давлении и остаток разбавляют этилацетатом и промывают последовательно водой, насыщенным раствором соли, а затем сушат (Na2S04). Сырой продукт, полученный после упаривания растворителей, очищают, используя ОФ-ЗЭЖХ, что дает требуемый продукт в виде бесцветного твердого вещества.
Пример 2
[Бензил-(4’-метоксидифенил-4-сульфонил)амино]-[1-(морфолин-4-карбонил) пиперидин-4-ил]уксусная кислота
а) Метиловый эфир [бензил-(4’-метоксидифенил-4-сульфонил) амино]-[1-(морфолин-4-карбонил)пиперидин-4-ил]уксусной кислоты
К раствору метилового эфира (4’-метоксидифенил-4-сульфониламино)-[1-(морфолин-4-карбонил)пиперидин-4-ил]-уксусной кислоты (493 мг) в диметилформамиде (6 мл) добавляют безводный карбонат цезия (300 мг) с последующим добавлением бензилбромида (353 мг), и реакционную смесь перемешивают при комнатной температуре в течение 3 дней. Растворители удаляют при пониженном давлении и остаток разбавляют этилацетатом и промывают последовательно водой, насыщенным раствором соли, и затем сушат (Na2SO4). Сырой продукт, полученный после упаривания растворителей, очищают, используя ОФ-ВЭЖХ, что дает требуемый продукт в виде бесцветного твердого вещества.
b) [Бенэил-(4’-метоксидифенил-4-сульфонил)амино]-[1-(морфолин-4-карбонил)пиперидин-4-ил]уксусная кислота
К раствору метилового эфира [бензил-(4’-метоксидифенил-4-сульфонил)амино]-[1-(морфолин-4-карбонил)пиперидин-4-ил]уксусной кислоты (196 мг) в тетрагидрофуране (10 мл) добавляют 50% гидроксид натрия (4 мл) и реакционную смесь перемешивают при комнатной температуре в течение ночи. Растворители удаляют при пониженном давлении и остаток разбавляют этилацетатом и последовательно промывают водой, насыщенным раствором соли, а затем сушат (Na2SO4). Сырой продукт, полученный после упаривания растворителей, очищают, используя ОФ-ВЭЖХ, что дает требуемый продукт в виде бесцветного твердого вещества.
Пример 3
Продукт примера 3 получают из продукта примера 1е, следуя методике, описанной в примере 1, и используя этилиодид на стадии 1f.
Пример 4
Продукт примера 4 получают из продукта примера 1b, следуя методике, описанной в примере 1, и используя бромдифенилсульфонилхлорид на стадии 1с.
Пример 5
Продукт примера 5 получают из продукта примера 1d, следуя методике, описанной в примере 1, и используя метоксиэтилхлоркарбонат на стадии 1е.
Пример 6
Продукт примера 6 получают из продукта примера 1d, следуя методике, описанной в примере 1, и используя метоксиэтилхлоркарбонат на стадии 1е и этилиодид на стадии 1f.
Пример 7
Продукт примера 7 получают из продукта примера 1d, следуя методике, описанной в примере 1, и используя метоксиэтилхлоркарбонат на стадии 1е и н.-бутилиодид на стадии 1f.
Пример 8
Продукт примера 8 получают из продукта примера 1d, следуя методике, описанной в примере 1, и используя метоксиэтилхлоркарбонат на стадии 1е и 2-метоксиэтилхлорид - на стадии 1f.
Пример 9
Продукт примера 9 получают из продукта примера 1d, следуя методике, описанной в примере 1, и используя метоксиэтилхлоркарбонат на стадии 1е и бензилбромид на стадии 1f.
Пример 10
Продукт примера 10 получают из продукта примера 1d, следуя методике, описанной в примере 1, и используя метоксиэтилхлоркарбонат на стадии 1е и фенилэтилбромид на стадии 1f.
Пример 11
Продукт примера 11 получают из продукта примера 1d, следуя методике, описанной в примере 1, и используя метоксиэтилхлоркарбонат на стадии 1е и 2-пиколилхлорид на стадии 1f.
Пример 12
Продукт примера 12 получают из продукта примера 1d, следуя методике, описанной в примере 1, и используя метоксиэтилхлоркарбонат на стадии 1е и 3-пиколилхлорид на стадии 1f.
Пример 13
Продукт примера 13 получают из продукта примера 1с, следуя методике, описанной в примере 12, и используя 4-(2-хлорэтил)морфолин на стадии 1f.
Пример 14
Продукт примера 14 получают из продукта примера 1b, следуя стадиям 1с, 1f и 1g, описанным в примере 1, и используя фтордифенилсульфонилхлорил на стадии 1с.
Пример 15
Продукт примера 15 получают из продукта примера 1d, следуя методике, описанной в примере 1, и используя бензилсульфонилхлорид на стадии 1е.
Пример 16
[(4’-Метоксидифенил-4-сульфонил)метиламино]-(1-фенетилпиперидин-4-ил)уксусная кислота
а) Метиловый эфир (4’-Метоксидифенил-4-сульфониламино)-(1-фенетилпиперидин-4-ил)уксусной кислоты
К перемешиваемому раствору соли метилового эфира (4’-метоксидифенил-4-сульфониламино)пиперидин-4-илуксусной кислоты с ТФУ (1d) (5,02 г, 9,15 ммоль) в метаноле (30 мл) добавляют фенилацетальдегид (1,80 г, 15,0 ммоль) и пиридин (1 мл). Затем добавляют по каплям комплекс боран-пиридин (~8 М ВН3, 2 мл) и раствор перемешивают при комнатной температуре. Спустя четыре часа добавляют еще 0,5 мл комплекса ВН3-пиридин и реакционную смесь оставляют перемешиваться в течение ночи. Растворитель удаляют при пониженном давлении и полученный белый твердый продукт поглощают этилацетатом, промывают 1н. соляной кислотой и водой. Добавление 1н. гидроксида натрия к этилацетату приводит к образованию белого осадка, который фильтруют, промывают диэтиловым эфиром и сушат в вакууме, получая требуемый продукт.
b) [(4’-Метоксидифенил-4-сульфонил)метиламино]-(1-фенетилпиперидин-4-ил)уксусная кислота
К раствору метилового эфира (4’-метоксидифенил-4-сульфониламино)-(1-фенетилпиперидин-4-ил)уксусной кислоты (522 мг, 1,0 ммоль) в N,N-диметилформамиде (5 мл) добавляют карбонат цезия (326 мг, 1,0 ммоль) и метилиодид (142 мг, 1,0 ммоль). Смесь перемешивают в течение четырех часов, затем разбавляют водой и экстрагируют дихлорметаном. Органические экстракты объединяют, промывают насыщенным раствором соли, сушат над сульфатом натрия, фильтруют и концентрируют в вакууме, получая требуемый продукт в виде белого твердого вещества.
с) Метиловый эфир [(4’-метоксидифенил-4-сульфонил) метиламино]-(1-фенетилпиперидин-4-ил)уксусной кислоты
К перемешиваемому раствору [(4’-метоксидифенил-4-сульфонил) метиламино]-(1-фенетилпиперидин-4-ил)уксусной кислоты (125 мг, 0,23 ммоль) в тетрагидрофуране (4 мл) добавляют водный гидроксид натрия (50% масс./масс., 200 мкл), метанол (0,5 мл). Слегка мутную смесь перемешивают затем в течение ночи. Реакционную смесь подкисляют 1н. соляной кислотой и экстрагируют дихлорметаном. Органическую фазу промывают насыщенным раствором соли, сушат над сульфатом натрия, фильтруют и концентрируют в вакууме. Сырой продукт очищают, используя препаративную ОФ-ВЭЖХ, что дает требуемый продукт в виде белого стекловидного твердого вещества.
ПРИМЕРЫ 17-22
Следующая таблица 2 показывает структуру соединений, полученных по методикам, описанным в примерах 17-22. Б этой формуле А и R2 формулы (I) образуют гетероциклоалкил, содержащий А’, который означает гетероатом в цикле.
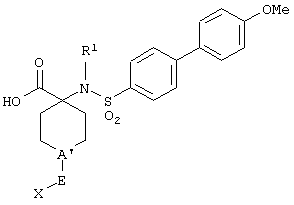
Пример 17
4-[(4’-Метоксидифенил-4-сульфонил)метиламино]тетрагидропиран-4-карбоновая кислота
Продукт примера 17 получают по методике, аналогичной приведенной ниже в примере 18.
Пример 18
4-[(4’-Метоксидифенил-4-сульфонил)метиламино]-1-(морфолин-4-карбонил)пиперидин-4-карбоновая кислота
а) 1-трет-Бутиловый эфир, 4-метиловый эфир 4-аминопиперидин-1,4-дикарбоновой кислоты
К суспензии моно-трет-бутилового эфира 4-аминопиперидин-1,4-дикарбоновой кислоты (13,9 г) в метаноле (150 мл) и тетрагидрофуране (100 мл), охлажденной до 0°С, добавляют по каплям в течение 4 часов 2 М триметилсилилдиазометан в гексане (57 мл) с последующим добавлением 4-нитрофенилсульфонилхлорида (2,0 г). Растворители упаривают в вакууме и сырой продукт используют на следующей стадии без дополнительной очистки.
b) 1-трет-Бутиловый эфир, 4-метиловый эфир 4(4’-метоксидифенил-4-сульфониламино) пиперидин-1,4-дикарбоновой кислоты
К раствору 1-трет-бутилового эфира, 4-метилового эфира 4-аминопиперидик-1,4-дикарбоновой кислоты (155 мг) в дихлорметане (10 мл) добавляют триэтиламин (125 л), с последующим добавлением п-метоксидифенилсульфонилхлорида (187 мг). Реакционную смесь перемешивают в течение ночи при комнатной температуре, промывают водой и насыщенным раствором соли, затем сушат (MgSO4). Сырой продукт, полученный после упаривания растворителя, очищают хроматографией на силикагеле, используя смесь 4/1 гексан/EtOAc, что дает требуемый продукт в виде бесцветного твердого вещества.
c) ТФУ соль метилового эфира 4-(4’-метоксидифенил-4-сульфониламино)пиперидин-4-карбоновой кислоты
1-трет-Бутиловый эфир, 4-метиловый эфир 4(4’-метоксидифенил-4-сульфониламино)пиперидин-1,4-дикарбоновой кислоты (3,12 г, 6,19 ммоль) растворяют в CH2Cl2 (15 мл) в колбе на 100 мл. К раствору добавляют анизол (1,35 мл, 12,4 ммоль), с последующим добавлением трифторуксусной кислоты (15 мл), по каплям, с помощью шприца, и смесь перемешивают при 22°С в течение 8 часов. Желтую реакционную смесь концентрируют приблизительно до са. 4-5 мл перед добавлением ее по каплям к перемешиваемому раствору диэтиловый эфир/гексан (25 мл/475 мл). Осадок собирают фильтрованием и промывают смесью 10:90 диэтиловый эфир/гексан, получая спектроскопически чистую ТФУ соль.
d) Метиловый эфир 4-(4’-метоксидифенил-4-сульфониламино)-1-(морфолин-4-карбонил)пиперидин-4-карбоновой кислоты
ТФУ соль метилового эфира 4-(4’-метоксидифенил-4-сульфониламино)пиперидин-4-карбоновой кислоты (313 мг, 0,60 ммоль) перемешивают с СН2Сl2 (25 мл) в круглодонной колбе на 200 мл. Добавляют морфолинкарбонилхлорид (85 л, 0,72 ммоль) и триэтиламин (211 л, 1,52 ммоль), и смесь перемешивают при комнатной температуре в течение 17 часов. Реакционную смесь разбавляют дополнительным количеством метиленхлорида (50 мл) и экстрагируют водой (3×75 мл). Экстракты промывают насыщенным раствором соли, сушат над МgSО4, фильтруют и концентрируют в вакууме до образования твердого остатка. Хроматография на силикагеле с применением элюента этилацетат/гексан дает требуемое соединение в виде бесцветного твердого вещества.
e) Метиловый эфир 4-[(4’-метоксидифенил-4-сульфонил) метиламино]-1-(морфолин-4-карбонил)пиперидин-4-карбоновой кислоты
Метиловый эфир 4-(4’-метоксидифенил-4-сульфониламино)-1-(морфолин-4-карбонил)пиперидин-4-карбоновой кислоты (65 мг, 0,13 ммоль) растворяют в ДМФА (2 мл) в конической реакционной пробирке на 10 мл. К раствору добавляют карбонат цезия (82 мг, 0,25 ммоль), с последующим добавлением иодметана (40 л, 1,2 ммоль) с помощью шприца, и смесь перемешивают при комнатной температуре в течение 16 часов. Реакционную смесь разбавляют этилацетатом (75 мл) и экстрагируют четыре раза водой (75 мл). Экстракты промывают насыщенным раствором соли, сушат над MgSO4, фильтруют и концентрируют в вакууме, получая в остатке требуемое соединение в виде твердого вещества.
f) 4-[(4’-Метоксидифенил-4-сульфонил)метиламино]-1-(иорфолин-4-карбонил)пиперидин-4-карбоновой кислоты
Метиловый эфир 4-[(4’-метоксидифенил-4-сульфонил) метиламино]-1-(морфолин-4-карбонил)пиперидин-4-карбоновой кислоты (215 мг, 0,49 ммоль) растворяют в ТГФ (5 мл) в круглодонной колбе на 50 мл. Добавляют раствор моногидрата гидроксида лития (210 мг, 5,0 ммоль) в 5 мл воды и смесь нагревают на масляной бане до 70°С при перемешивании в течение 4 часов. После удаления большей части ТГФ при пониженном давлении остается водный слой, который дважды промывают диэтиловым эфиром. Водный слой разбавляют водой (50 мл) и этилацетатом (100 мл) и помещают в колбу Эрленмейера. При перемешивании добавляют по каплям 6 н. НСl с последующим добавлением 1 н. НСl для достижения в водном слое значений рН 2-3. Слои разделяют и водный слой экстрагируют дополнительным количеством этилацетата. Экстракты промывают насыщенным раствором соли, сушат над MgSO4, фильтруют и концентрируют в вакууме до получения твердого остатка.
Очистка путем препаративной ВЭЖХ дает требуемое соединение в виде бесцветного твердого вещества.
Пример 19
Продукт примера 19 получают из продукта примера 18d, следуя методике, описанной в примере 18, и используя бензилбромид (1,5 экв.) вместо метилиодида на стадии 18е.
Пример 20
Продукт примера 20 получают из продукта примера 18с, следуя методике, описанной в примере 18, и используя в качестве замены метоксиэтилхлоркарбонат на стадии 18d и бензилбромид на стадии 18е.
Пример 21
Продукт примера 21 получают из продукта примера 18с, следуя методике, описанной в примере 18, и используя в качестве замены метоксиэтилхлоркарбонат на стадии 18d и метоксиэтилбромид на стадии 18е.
Пример 22
Продукт примера 22 получают из продукта примера 18с, следуя методике, описанной в примере 18, и используя в качестве замены бензилбромид на стадии 18d и бензилбромид - на стадии 18е.
ПРИМЕРЫ 23-33
Следующая таблица 3 показывает структуру соединений, полученных по методикам, описанным в примерах 23-33.
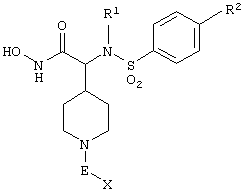
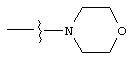
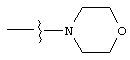
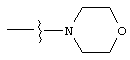
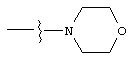
Пример 23
N-Гидрокси-2-[(4’-метоксидифенил-4-сульфонил)метиламино]-2-[1-(морфолин-4-карбонил)пиперидин-4-ил]ацетамид
Метиловый эфир [(4’-метоксидифенил-4-сульфонил)метиламино]-[1-(морфолин-4-карбонил)пиперидин-4-ил]уксусной кислоты (311 мг) обрабатывают метанольным раствором гидроксиламина (1,76 М, 3 мл) и реакционную смесь перемешивают 12 часов при комнатной температуре. Реакционную смесь концентрируют при пониженном давлении, разбавляют этилацетатом и промывают последовательно 1н. соляной кислотой, водой, насыщенным раствором соли и затем сушат (Na2SO4). Сырой продукт, полученный после упаривания растворителя, очищают, используя ОФ-ЗЭЖХ, что дает требуемый продукт в виде бесцветного твердого вещества.
Примеры 24-33
Продукты примеров 24-33 получают из соответствующих метиловых эфиров, следуя методике, описанной в примере 23.
ПРИМЕРЫ 34-38
Следующая таблица 4 показывает структуру соединений, полученных по методикам, описанным в примерах 34-38. Представлены соединения формулы (I), где R1 означает -ОН, n равно 0, R2 означает Н и А означает изображенный ниже Х-содержащий цикл.
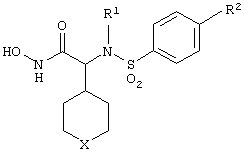
Пример 34
[(4’-Метоксидифенил-4-сульфонил)метиламино]
(тетрагидропиран-4-ил)уксусная кислота
а) Метиловый эфир бензилоксикарбониламино (тетрагидропиран-4-илиден)уксусной кислоты
В круглодонной колбе на 50 мл получают раствор в ацетонитриле (10 мл) триметилового эфира N-(бензилоксикарбонил)фосфоноглицина (1000 мг, 3,02 ммоль), к которому добавляют 1,8-диазабицикло[5.4.0]ундец-7-ен (0,45 мл, 3,02 ммоль). Смесь оставляют перемешиваться на 10 минут, после чего добавляют тетрагидро-4Н-пиран-4-он (299 мг, 2,95 ммоль), и реакционную смесь перемешивают в течение 2 дней. Затем раствор разбавляют EtOAc (75 мл) и впоследствии промывают 1 н. раствором Н2SО4. Затем раствор сушат, промывая насыщенным раствором соли и перемешивая с MqSO4. После фильтрования и концентрации фильтрата путем упаривания на роторном испарителе образовавшееся темное красновато-коричневое масло разбавляют этилацетатом и гексаном (1:1) и фильтруют через пробку из силикагеля для удаления избытка сложного фосфорилглицинового эфира, используя в качестве элюента смесь 1:1 этилацетат/гексан. Растворитель удаляют в вакууме, получая требуемое соединение.
b) Метиловый эфир амино(тетрагидропиран-4-ил)уксусной кислоты
Метиловый эфир бензилоксикарбониламинс(тетрагидропиран-4-илиден)уксусной кислоты (361 мг, 1,18 ммоль) добавляют в колбу аппарата Парра для гидрирования, содержащую безводный метанол (6 мл), и раствор дегазируют аргоном в течение 10 минут. Затем в колбу добавляют катализатор 5% палладий/уголь. Затем растворитель помещают под защитный слой водорода при давлении 3 атм и встряхивают в течение ночи. После этого катализатор удаляют фильтрованием через целит. Удаление органического растворителя при пониженном давлении и последующая сушка в вакууме дают маслянистый остаток, ЯМР и масс-спектрометрический анализы которого показывают, что получен требуемый сложный эфир. Сырой продукт используют без дальнейшей очистки.
c) Метиловый эфир (4’-метоксидифенил-4-сульфониламино) (тетрагидропиран-4-ил)уксусной кислоты
В 100 мл круглодонной колбе растворяют в атмосфере азота сырой метиловый эфир амино(тетрагидропиран-4-ил)уксусной кислоты (288 мг, 1,17 ммоль) в безводном CH2Cl2 (8 мл). После добавления триэтиламина (330 л, 2,35 ммоль), добавляют п-метоксидифенилсульфонилхлорид (499 мг, 1,76 ммоль) и раствор перемешивают в течение ночи при комнатной температуре. Реакционную смесь промывают водой и насыщенным раствором соли и сушат над MgSO4. Сырой материал, полученный после удаления растворителей, очищают флэш-хроматографией (растворитель 40:60 этилацетат:гексан), что дает требуемый продукт в виде белого твердого вещества.
d) Метиловый эфир [(4’-метоксидифенил-4-сульфонил) метиламино](тетрагидропиран-4-ил)уксусной кислоты
Метиловый эфир (4’-метоксидифенил-4-сульфониламино) (тетрагидропиран-4-ил)уксусной кислоты (231 мг, 0,55 ммоль) растворяют в ДМФА (4 мл) в конической реакционной пробирке на 10 мл. К раствору добавляют карбонат цезия (359 мг, 1,12 ммоль), с последующим добавлением метилиодида (343 л, 5,51 ммоль) с помощью шприца, и смесь перемешивают при 67°С в течение 16 часов. Реакционную смесь разбавляют этилацетатом (100 мл) и экстрагируют четыре раза водой (75 мл). Промывают насыщенным раствором соли и сушат над MgSO4, фильтруют и концентрируют в вакууме, получая в остатке требуемое соединение в виде сырого твердого вещества.
е) [(4’-Метоксидифенил-4-сульфонил)метиламино] (тетрагидропиран-4-ил) уксусная кислота
Метиловый эфир [(4’-метоксидифенил-4-сульфонил) метиламино](тетрагидропиран-4-ил)уксусной кислоты (215 мг, 0,49 ммоль) растворяют в ТГФ (5 мл) в круглодонной колбе на 50 мл. Добавляют раствор моногидрата гидроксида лития (210 мг, 5,0 ммоль) в 5 мл воды и смесь перемешивают на масляной бане при 70°С в течение 4 часов. После удаления большей части ТГФ путем упаривания на роторном испарителе водный слой дважды промывают диэтиловым эфиром. Водный слой разбавляют водой (50 мл) и этилацетатом (100 мл) и помещают в колбу Эрленмейера. При перемешивании добавляют по каплям 6 н. НСl с последующим добавлением 1 н. НСl для достижения в водном слое значений рН 2-3. Слои разделяют и водный слой экстрагируют дополнительным количеством этилацетата. Промывают насыщенным раствором соли и сушат над MgSО4, фильтруют и концентрируют в вакууме до получения твердого остатка. Очистка путем препаративной ВЭЖХ дает требуемое соединение в виде бесцветного твердого вещества.
Пример 35
Продукт примера 35 получают из продукта примера 34 с, следуя методике, описанной в примере 34 и используя в качестве замены бензилбромид на стадии 34d.
Пример 36
Продукт примера 36 получают из продукта примера 34с, следуя методике, описанной в примере 34 и используя в качестве замены, метоксиэтилбромид на стадии 34d.
Пример 37
Продукт примера 37 получают из продукта примера 34с, следуя методике, описанной в примере 34, и используя в качестве замены 3-пиколилбромид на стадии 34d.
Пример 38
Продукт примера 38 получают из продукта примера 34с, следуя методике, описанной в примере 34, и используя в качестве замены морфолинилэтилбромид на стадии 34d.
Дополнительные примеры получения соединений
Дополнительный пример 1
2-Метоксиэтиловый эфир (4-{карбокси-[(4’-метокси-бифенил-4-сульфонил)-(2-метоксиэтил)амино]метил}пиперидин-1-карбоновой кислоты (соединение по примеру 8).
а) Метиловый эфир бензилоксикарбониламино-(1-трет-бутоксикарбонил-пиперидин-4-илиден)-уксусной кислоты. К раствору 4-Вос-пиперидона (6 г, 30 ммоль) и триметилового эфира N-(бензилоксикарбонил)-α-фосфоноглицина (10 г, 30 ммоль) в дихлорметане (25 мл) добавляли по каплям диазабициклоундекан (6,9 г, 42 ммоль). Полученную смесь
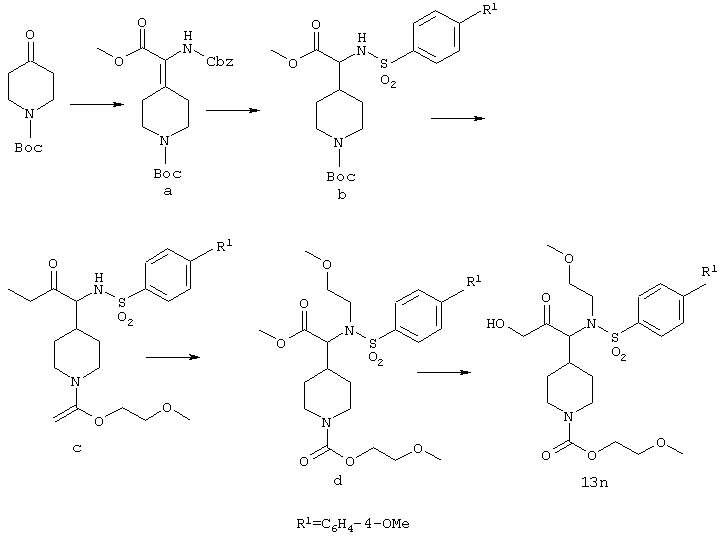
перемешивали при комнатной температуре в течение 2 дней и растворитель удаляли при пониженном давлении. Остаток растворяли в EtOAc и органическую фазу промывали водой, 1 н. раствором хлористоводородной кислоты, насыщенным раствором бикарбоната натрия и насыщенным солевым раствором и затем сушили над безводным сульфатом натрия. Неочищенный продукт, полученный после выпаривания растворителей, очищали хроматографией на силикагеле с использованием 3/2 гексан/EtOAc с получением 11,2 г (выход 93,2%) желаемого продукта в виде желтоватого твердого вещества. 1H ЯМР (СDСl3) δ 1,49 (м, 9Н), 2,04-2,22 (м, 2Н), 2,41-2,49 (м, 2Н), 2,90 (с, 2Н), 3,52 (с, 2Н), 3,79 (с, 3Н), 5,17 (с, 2Н), 7.37-7.42 (м, 5Н). MS m/z 305 [М+Н-(трет-ВuСO2)]+.
b) Метиловый эфир (1-трет-бутоксикарбонил-пиперидин-4-ил)-(4’-метокси-бифенил-4-сульфониламино)-уксусной кислоты. Метиловый эфир бензилоксикарбониламино-(1-трет-бутоксикарбонил-пиперидин-4-илиден)-уксусной кислоты (11,05 г, 27,3 ммоль) растворяли в метаноле (100 мл) и добавляли 10% палладий на угле (0,75 г). Колбу продували водородом и создавали давление до 45 фунт/кв.дюйм, и реакционную смесь перемешивали при комнатной температуре в течение 12 час. Реакционную смесь фильтровали через слой целита и растворитель выпаривали при пониженном давлении с получением неочищенного продукта, который использовали на следующей стадии без дополнительной очистки.
Неочищенный продукт (5,44 г, 20 ммоль) растворяли в дихлорметане (80 мл) и к смеси добавляли триэтиламин (3,05 г, 21,8 ммоль) с последующим добавлением 4'-метокси-бифенил-4-сульфонилхлорида (5,94 г, 21 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре, последовательно промывали 1 н. раствором хлористоводородной кислоты, водой, 5% водным раствором бикарбоната натрия и насыщенным солевым раствором, затем сушили над безводным сульфатом натрия. Неочищенный продукт, полученный после выпаривания растворителя, очищали хроматографией на силикагеле с использованием 3/2 гексан/EtOAc с получением 8,22 г (объединенный выход 58%) желаемого продукта в виде бесцветного твердого вещества. 1H ЯМР (CDCl3) δ 1,24-1,34 (м, 2Н), 1,43-1,59 (м, 10Н), 1,65-1,86 (м, 2Н), 2,52-2,71 (м, 2Н), 3,45 (с, 3Н), 3,74-3,88 (м, 1Н), 3,94 (с, 3Н), 4,11-4,24 (м, 2Н), 5,19 (д, J-10,1 Гц, 1Н), 7,01 (д, J=8,8 Гц, 2Н), 7,58 (д, J=8,8 Гц, 2Н), 7,69 (д, J=8,6 Гц, 2Н), 7,86 (д, J=8,6 Гц, 2Н). MS m/z 419 [М+Н-(трет-ВuСO2)]+.
с) Метиловый эфир (4’-метокси-бифенил-4-сульфониламино)-[1-(2-метокси-этоксикарбонил)-пиперидин-4-ил]-уксусной кислоты. К раствору метилового эфира (1-трет-бутоксикарбонил-пиперидин-4-ил)-(4’-метокси-бифенил-4-сульфониламино)-уксусной кислоты (6,1 г, 11,7 ммоль) в дихлорметане (15 мл) при комнатной температуре добавляли трифторуксусную кислоту (ТФУК) (8 мл) и реакционную смесь перемешивали в течение 4 час. Растворители выпаривали в вакууме и полученное масло растирали с диэтиловым эфиром. Полученный осадок собирали, промывали диэтиловым эфиром и сушили в вакууме с получением 6.2 г неочищенной соли ТФУК.
Соль ТФУК суспендировали в дихлорметане (30 мл) и добавляли триэтиламин (3,9 мл, 28 ммоль) с последующим добавлением метоксиэтилкарбамоилхлорида (1,78 г, 12,9 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 4 час и затем концентрировали при пониженном давлении. Остаток разбавляли этилацетатом и раствор промывали последовательно 1 н. раствором хлористоводородной кислоты, водой, насыщенным солевым раствором и затем сушили над безводным сульфатом натрия. Неочищенный продукт, полученный после выпаривания растворителей, очищали кристаллизацией из метанола с получением 5,24 г (объединенный выход 86%) желаемого продукта в виде бесцветного твердого вещества. 1Н ЯМР (СDСl3) δ 1,22-1,87 (м, 5Н), 2,73 (ушир.с, 2Н), 3,41 (с, 3Н), 3,47 (с, 3Н), 3,62 (т, J=4,8 Гц, 2Н), 3,81-3,86 (м, 1Н), 3,89 (с, 3Н), 4,18-4,32 (м, 4Н), 5,20 (д, J=10,1 Гц), 7,03 (д, J=8,8 Гц, 2Н), 7,58 (д, J=8,8 Гц, 2Н), 7,69 (д, J=8,4 Гц, 2Н), 7,86 (д, J=8,4 Гц, 2Н). MS m/z 521 [М+H]+.
d) Метиловый эфир [(4’-Метокси-бифенил-4-сульфонил)-(2-метоксиэтил)-амино]-[1-(2-метоксиэтоксикарбонил)-пиперидин-4-ил]-уксусной кислоты. К раствору метилового эфира (4’-метокси-бифенил-4-сульфониламино)-[1-(2-метокси-этоксикарбонил)-пиперидин-4-ил]-уксусной кислоты (1,04 г, 2 ммоль) в диметилформамиде (8 мл) добавляли безводный карбонат цезия (0,75 г, 2,3 ммоль) с последующим добавлением 2-метоксиэтилбромида (282 мкл, 3 ммоль), реакционную смесь перемешивали при комнатной температуре в течение 12 час и затем концентрировали при пониженном давлении. Остаток разбавляли метиленхлоридом и промывали последовательно водой, насыщенным солевым раствором и затем сушили над безводным сульфатом натрия. Неочищенный продукт, полученный после выпаривания растворителей, очищали хроматографией на силикагеле с использованием 3/2 гексан/EtOAc с получением 1,27 г (выход 91%) желаемого продукта в виде бесцветного твердого вещества.
1H ЯМР (СDСl3) δ 1,22-1,30 (м, 2Н), 1,46-1,60 (м, 2Н), 2,04-2,08 (м, 1Н), 2,79-2,99 (м, 2Н), 3,33 (с, 3Н), 3,39 (с, 3Н), 3,41 (с, 3Н), 3,51-3,64 (м, 6Н), 3,90 (с, 3Н), 4,19-4,28 (м, 5Н), 7,04 (д, J=8,8 Гц, 2Н), 7,58 (д, J=8,9 Гц, 2Н), 7,68 (д, J=8,4 Гц, 2Н), 7,87 (д, J=8,2 Гц, 2Н). MS m/z 579 [М+Н]+.
e) [(4’-Метокси-бифенил-4-сульфонил)-(2-метоксиэтил)-амино]-[1-(2-метоксиэтоксикарбонил)-пиперидин-4-ил]-уксусная кислота. К раствору метилового эфира [(4’-метокси-бифенил-сульфонил)-(2-метоксиэтил)-амино]-[1-(2-метоксиэтоксикарбонил)-пиперидин-4-ил]-уксусной кислоты (323 мг, 0,558 ммоль) в тетрагидрофуране (10 мл) добавляли раствор гидроксида лития (67 мг, 2,8 ммоль) в смеси метанол-вода (0,7 мл, 5:2 об/об) и реакционную смесь перемешивали при комнатной температуре в течение 12 час. Растворители удаляли при пониженном давлении и остаток растворяли в воде и промывали диэтиловым эфиром. Затем водный слой подкисляли 1 н. раствором хлористоводородной кислоты и несколько раз экстрагировали этилацетатом. Объединенные органические экстракты промывали насыщенным солевым раствором и затем сушили над безводным сульфатом натрия. Неочищенный продукт, полученный после выпаривания растворителей, очищали с использованием ОФ-ВЭЖХ с получением 256 мг (выход 81%) желаемого продукта в виде бесцветного твердого вещества. 1H ЯМР (СDСl3) δ 1,17-1,29 (м, 2Н), 1,65-1,71 (м, 1Н), 1,86-2,07 (м, 2Н), 2,85 (ушир.с, 2Н), 3,33 (с, 3Н), 3,39 (с, 3Н), 3,49-3,71 (м, 6Н), 3,89 (с, ЗН), 4,12-4,23 (м, 5Н), 7,03 (д, J=9,0 Гц, 2Н), 7,58 (д, J=8,8 Гц, 2Н), 7,68 (д, J=8,6 Гц, 2Н), 7,89 (д, J=8,6 Гц, 2Н); 13С ЯМР (СDСl3) δ 29,6, 36,6, 43,5, 43,8, 44,0, 46,2, 55,8, 59,1, 59,3, 71,3, 72,6, 114,9, 127,2, 128,5, 128,8, 131,8, 137,2, 145,8, 155,7, 160,6, 171,9; MS m/z 565 [М+Н]+. Анал. (C27H36N2O9S·0,5Н2O) С, Н, N.
Следующие аналоги были получены в соответствии с методикой, описанной в Дополнительном примере 1.
Дополнительный пример 2
[(4’-Метокси-бифенил-4-сульфонил)-метиламино]-[1-(2-метоксиэтоксикарбонил)-пиперидин-4-ил]-уксусная кислота (соединение по примеру 5). 1H ЯМР(СDСl3) δ 1,15-1,35 (м, 2Н), 1,75 (т, J=18,1 Гц, 2Н), 1,98-2,18 (м, 1Н), 2,88 (ушир.с, 2Н), 2,93 (с, 3Н), 3,40 (с, 3Н), 3,61-3,64 (м, 2Н), 3,87 (с, 3Н), 4,11-4,27 (м, 5Н), 7.С5 (д, J=9,0 Гц, 2Н), 7,66 (д, J=9,0 Гц, 2Н), 7,78 (д, J=8,8 Гц, 2Н), 7,88 (д, J=8,6 Гц, 2Н); 13С ЯМР (СD3ОD) δ 30,5, 31,1, 36,5, 44,9, 45,0, 56,2, 57,1, 59,5, 65,0, 66,1, 72,3, 114,6, 128,2, 129,6, 129,8, 133,2, 138,3, 146,9, 157,4, 162,1, 172,3; MS m/z 521 [М+H]+. Анал. (C25H32N2O8S·0,5H2O) С, Н, N.
Дополнительный пример 3
[(4’-Метокси-бифенил-4-сульфонил)-(пиридин-3-илметил)-амино]-[1-(2’метоксиэтоксикарбонил)-пиперидин-4-ил]-уксусная кислота (соединение по примеру 12). Выход 64,3%; 1H ЯМР (СDСl3) δ 0,82-0,98 (м, 1Н), 1,02-1,25 (м, 2Н), 1,70-1,55 (м, 2Н), 1,78-1,97 (м, 1Н), 2,84-2,51 (ушир.с, 1Н), 2,68-2,83 (ушир.с, 1Н), 3,30-3,42 (м, 4Н), 3,56-3,68 (м, 2Н), 3,92-3,98 (м, ЗН), 3,95-4,10 (м, 2Н), 4,15-4,25 (м, 2Н), 4,31-4,39 (м, 1Н), 4,64-4,72 (м, 1Н), 7,07 (д, J=8,8 Гц, 2Н), 7,41-7,50 (ушир.с, 1Н), 7,66 (д, J=8,8 Гц, 2Н), 7,73 (д, J=8,8 Гц, 2Н), 7,82 (д, J=8,8 Гц, 2Н), 8,01-8,12 (м, 1Н); 13С ЯМР (CD3OD) δ 30,5, 31,2, 37,6, 44,9, 47,8, 56,2, 59,5, 66,1, 66,4, 72,3, 115,8, 115,9, 127,7, 128,2, 129,6, 129,8, 133,1, 139,4, 140,3, 147,1, 148,9, 150,5, 157,3, 162,2; MS m/z 598 [М+Н]+. Анал. (C30H35N3O8S·0,8EtOAc·0.1HCl) С, Н, N.
Дополнительный пример 4
(R)-(1-трет-Бутоксикарбонил-пиперидин-4-ил)-(4’-метокси-бифенил-4-сульфониламино)-уксусная кислота (соединение A, R-энантиомер).
a) Метиловый эфир (R)-амино-(1-трет-бутоксикарбонил-пиперидин-4-ил)-уксусной кислоты. К раствору метилового эфира (R)-[(9Н-флуорен-9-илметоксикарбониламино)]-(1-трет-бутоксикарбонил-пиперидин-4-ил)-уксусной кислоты (402,9 мг, 0,838 ммоль) в метаноле при комнатной температуре добавляли триметилсилилдиазометан (3,4 ммоль) и раствор перемешивали, пока желтый цвет не обесцветился. Растворитель удаляли в вакууме с получением белого твердого вещества. Затем неочищенный эфир поглощали в этанол, добавляли каталитическое количество 10% Pd/C и смесь помещали в гидрогенизационную установку Парра (Parr) на ночь при давлении 40-45 фунт/кв.дюйм. Через 24 часа реакционную смесь фильтровали через слой Целита и концентрировали с получением неочищенного аминоэфира в виде белого твердого вещества.
b) Метиловый эфир (R)-(1-трет-Бутоксикарбонил-пиперидин-4-ил)-(4’-метокси-бифенил-4-сульфониламино)-уксусной кислоты. К раствору метилового эфира метил (R)-амино-(1-трет-бутоксикарбонил-пиперидин-4-ил)-уксусной кислоты (10 мл) добавляли раствор бикарбоната натрия (214 мг, 2,55 ммоль) в воде (10 мл). Смесь охлаждали до 0°С и к раствору добавляли 4'-метокси-бифенил-4-сульфонилхлорид (270 мг, 0,955 ммоль) в тетрагидрофуране (10 мл), затем реакционной смеси давали нагреться до комнатной температуры в течение ночи. Смесь концентрировали под вакуумом и полученную суспензию распределяли между этилацетатом и водой. Водную фазу экстрагировали этилацетатом (2×25 мл) и объединенные органические фазы промывали 1 н. раствором хлористоводородной кислоты, водой, насыщенным солевым раствором и сушили над безводным сульфатом натрия. Неочищенный продукт, полученный после выпаривания растворителей, очищали хроматографией на силикагеле (60:40 гексан:этилацетат) с получением 180 мг (41%, выход от трех стадий) желаемого продукта в виде белого твердого вещества. См. данные ЯМР для соединения b в синтезе Дополнительного примера 1 выше.
с) (R)-(1-трет-Бутоксикар6онил-пиперидин-4-ил)-(4’-метоксибифенил-4-сульфониламино)-уксусная кислота. К раствору метилового эфира метил (R)-(1-трет-бутоксикарбонил-пиперидин-4-ил)-(4’-метокси-бифенил-1-4-сульфониламино)-уксусной кислоты (180 мг, 0,347 ммоль) в тетрагидрофуране (15 мл) добавляли гидрат гидроксида лития и раствор перемешивали и нагревали до 50°С в течение ночи. После охлаждения растворители удаляли в вакууме и полученную суспензию разбавляли этилацетатом и подкисляли до рН 4. Водный слой экстрагировали этилацетатом (2×25 мл) и объединенные органические слои промывали насыщенным солевьм раствором и сушили. Растворители выпаривали в вакууме с получением 80 мг (выход 46%) желаемого продукта в виде белого твердого вещества: аD -46,9. 1H ЯМР (СDСl3) δ 1,14-1,46 (м, 2Н), 1,47 (с, 9Н), 1,62 (т, J=15,6 Гц, 2Н), 1,93 (м, 1Н), 2,75 (м, 2Н), 3,79 (д, J=5,9 Гц, 1Н), 3,90 (с, 3Н), 4,09 (ушир.д, J=13,6 Гц, 2Н), 7,05 (д, J=8,8 Гц, 2Н), 7,75 (д, J=8,8 Гц, 2Н), 7,65 (д, J=8,4 Гц, 2Н), 7,88 (д, 8,6 Гц, 2Н); 13С ЯМР (СD3ОD) δ 29,1, 30,3, 40,6, 56,2, 61,8, 81,5, 115,9, 128,1, 129,2, 129,8, 133,2, 140,3, 146,6, 156,8, 162,1, 174,9. Анал. (С25Н31N3O7S·0,5Н2O) С, Н, N.
(S)-(1-трет-Бутоксикарбонил-пиперидин-4-ил)-(4’-метокси-бифенил-4-сульфониламино)-уксусная кислота (соединение A, S-энантиомер). αD+46.9.
Дополнительный пример 5
[1-(2-Метоксиэтоксикарбонил)-пиперидин-4-ил]-(4’-метилсульфанил-бифенил-4-сульфониламино)-уксусная кислота (соединение Б). 92,3%; 1H ЯМР (СDСl3) δ 1,19-1,50 (м, 2Н), 1,57-1,73 (м, 2Н), 1,87-2,12 (м, 1Н), 2,54 (с, 3Н), 2,72-2,90 (ушир.с, 2Н), 3,35-3,40 (м, 3Н), 3,56-3,68(м, 2Н), 3,76-3,84 (м, 1Н), 4,10-4,26 (м, 4Н), 7,38 (д, J=8,4 Гц, 2Н), 7,65 (д, J=8,6 Гц, 2Н), 7,79 (д, J=8,6 Гц, 2Н), 7,92 (д, J=8,6 Гц, 2Н); 13С ЯМР (CD3OD) δ 15,7, 28,9, 30,2, 40,5, 45,2, 45,2, 59,5, 61,8, 66,1, 72,3, 128,1, 128,4, 129,3, 129,8, 137,4, 140,9, 141,5, 146,3, 157,3, 174,5; MS m/z 523 [М+Н]+. Анал. (C24H30N2O7S2) С, Н, N.
Примечание: соединения А и Б в дополнительных примерах 4 и 5 не являются в точности соединениями по настоящему изобретению, но весьма близки к ним. Они отвечают следующей структурной формуле:
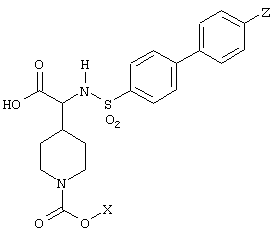
в которой Х соответствует группам трет-бутил (соединение А) и 2-метоксиэтил (-СH2СН2ОСН3) (соединение Б), a Z - группам -ОСН3 (соединение А) и -SСН3 (соединение Б). Как видно, различие состоит только в радикале R3 при атоме азота в сульфонамидной группе, который в соединениях А и Б является водородом.
Данные элементного анализа приведены в таблице 5.
Элементный анализ
VIII. Примеры - Биологическая активность соединений по изобретению
Исследования SAR в vitro. Соединения были испытаны на ингибирование коллагеназы -1, -2 и -3 (ММР-1, -8 и -13 соответственно), желатиназ А и В (ММР -2 и -9 соответственно), стромелизина (ММР-3) и матрилизина (ММР-7), как описано в литературе. Все показатели связывания были получены при рН 7,4 и представлены в Таблице 6.
Рассматриваемые соединения были получены и испытаны в виде рацемических смесей. Для соединения А были получены оба энантиомера ((R)- и (S)-антиподы). Оба изомера продемонстрировали достаточно небольшую разницу, отличающуюся на 1 порядок, в ингибировании ММР-3 и ММР-13, которые были основными мишенями.
Ингибирование in vitro фермента ММР IС50 (нМ)
Избранные соединения также были испытаны на растворимость в буфере с рН 7 и на связывание с белками плазмы, данные представлены в Таблице 7. Большинство из этих соединений обладает хорошей растворимостью и соответствует или превосходит минимально установленное значение 1 мг/мл. Определено, что связывание с белками плазмы является достаточно высоким (>90%) для всех соединений с замещенным пиперидиновым кольцом, что резко контрастирует с относительно низким связыванием белков (62%), наблюдаемым для незамещенного аналога. Интересно, что N-замещенные сульфонамиды показали относительно низкое связывание с белками в сравнении с незамещенными NH-сульфонамидами, что дает два ингибитора (соединения по примерам 12 и 8) с приемлемым уровнем связывания белков (93,2% и 90,7% соответственно).
Растворимость и связывание с белками плазмы избранных ингибиторов
IX. Примеры - Композиции и способы применения
Соединения по изобретению полезны для получения композиций для лечения болезней, связанных с нежелательной активностью МП. Следующие примеры композиций и способов не ограничивают изобретение, но представляют руководство для специалистов по получению и применению соединений, композиций и способов по изобретению. В каждом случае приведенное ниже соединение примера может быть заменено другими соединениями по изобретению, дающими аналогичные результаты. Для практикующего специалиста очевидно, что примеры дают общие указания и могут быть изменены в зависимости от требующего лечения состояния и пациента.
В данном разделе использованы следующие обозначения:
EDTA: этилендиаминтетрауксусная кислота (ЭДТК)
SDA: синтетически денатурированный спирт
USP: фармакопея США
Пример А
Согласно настоящему изобретению получают композицию в
виде таблетки, предназначенной для перорального применения,
включающую:
Компонент Количество
Соединение по примеру 31 15 мг
Лактоза 120 мг
Кукурузный крахмал 70 мг
Тальк 4 мг
Магний Stuart 1 мг
Пациентку массой 60 кг (132 фунта), болеющую ревматоидным артритом, лечили способом по изобретению. В частности, в течение 2 лет схема лечения указанной больной: перорально по три таблетки в день.
По окончании лечения пациентку обследовали, обнаружено ослабление воспалительного процесса при улучшенной подвижности, не сопровождающейся болью.
Пример В
Согласно настоящему изобретению получают капсулу для перорального применения, включающую:
Компонент Количество (% масс./масс.)
Соединение по примеру 2 15%
Полиэтиленгликоль 85%
Пациента массой 90 кг (198 фунтов), болеющего остеоартритом, лечили способом по изобретению. В частности, в течение 5 лет указанный больной принимал ежедневно капсулу, содержащую 70 мг соединения по примеру 3.
По окончании периода лечения пациента обследовали путем рентгена, артроскопии и/или MRI, обнаружено отсутствие дальнейшего прогрессирования эрозии/фибрилляции суставного хряща.
Пример С
Согласно настоящему изобретению получают композицию на основе физиологического раствора для местного применения, включающую:
Компонент Количество (% масс./масс.)
Соединение по примеру 10 5%
Поливиниловый спирт 15%
Физиологический раствор 80%
Пациент с глубокой эрозией роговицы закапывает по капле в каждый глаз дважды в день. Заживление ускоряется, без видимых осложнений.
Пример D
Согласно настоящему изобретению получают топическую композицию для местного применения, включающую:
Компонент Количество (% масс./масс.)
Соединение по примеру 21 0,20
Бензальконийхлорид 0,02
Тимерозал 0,002
d-Сорбит 5,00
Глицин 0,35
Ароматические соединения 0,075
Очищенная вода q.s.
Всего = 100,00
Пациенту с химическими ожогами наносят композицию при
каждой перевязке (b.i.d.). Рубцы значительно сокращаются.
Пример Е
Согласно настоящему изобретению получают композицию для аэрозольной ингаляции, включающую:
Компонент Количество (% масс./об.)
Соединение по примеру 18 5,0
Спирт 33,0
Аскорбиновая кислота 0,1
Ментол 0,1
Натрийсахарин 0,2
Пропеллент (F12, F114) q.s.
Всего = 100,00
Во время ингаляции больной астмой разбрызгивают в рот по 0,01 мл композиции из распылителя с накачкой. Симптомы астмы уменьшаются.
Пример F
Согласно настоящему изобретению получают глазную композицию для местного применения, включающую:
Компонент Количество (% масс./об.)
Соединение по примеру 30 0,10
Бензальконийхлорид 0,01
ЭДТК 0,05
Гидроксиэтилцеллюлоза (NATROSOL М) 0,50
Метабисульфит натрия 0,10
Хлорид натрия (0,9%) q.s.
Всего = 100,00
Пациента массой 90 кг (198 фунтов) с изъязвлениями роговицы лечат способом по изобретению. В частности, в течение 2 месяцев вводят в пораженный глаз указанного больного дважды в день физиологический раствор, содержащий 10 мг соединения по примеру 16.
Пример G
Получают композицию для парентерального введения, содержащую:
Компонент Количество
Соединение по примеру 27 100 мг/мл носителя
Носитель:
Буферный раствор цитрата натрия, содержащий (процент от массы носителя):
лецитин 0,48%
карбоксиметицеллюлоза 0,53
повидон 0,50
метилпарабен 0,11
пропилпарабен 0,011
Вышеуказанные ингредиенты смешивают, получая суспензию. Приблизительно 2,0 мл суспензии вводят путем инъекции пациенту с преметастатической опухолью. Место инъекции накладывают на место опухоли. Введение указанной дозы повторяют дважды в день в течение приблизительно 30 дней.
Спустя 30 дней симптомы болезни притупляются и дозу постепенно снижают, чтобы поддерживать состояние пациента.
Пример Н
Получают композицию для полоскания рта:
Компонент (% масс./об.)
Соединение по примеру 3 3,00
Спирт SDA 40 8,00
ЭДТК 0,05
Отдушка 0,08
Эмульгатор 0,08
Фторид натрия 0,05
Глицерин 10,00
Подсластитель 0,02
Бензойная кислота 0,05
Гидроксид натрия 0,20
Краситель 0,04
Вода до 100%
Пациент с болезнью десен использует 1 мл полоскания трижды в день для предупреждения дальнейшей оральной дегенерации.
Пример I
Получают композицию для лепешки:
Компонент (% масс./об.)
Соединение по примеру 20 0,01
Сорбит 17,50
Маннит 17,50
Крахмал 13,60
Подсластитель 1,20
Отдушка 11,70
Краситель 0,10
Кукурузный сироп до 100%
Пациент применяет лепешки для предупреждения расшатывания имплантата верхней челюсти.
Пример J
Композиция для жевательной резинки
Компонент % масс./об.
Соединение по примеру 6 0,03
Кристаллы сорбита 38,44
Основа для резинки Paloja 20,00
Сорбит (70% водный раствор) 22,00
Маннит 10,00
Глицерин 7,56
Отдушка 1,00
Пациент жует резинку для предупреждения расшатывания зубных протезов.
Пример К
Компонент (% масс./об.)
Соединение по примеру 33 4,0
USP Вода 50,656
Метилпарабен 0,05
Пропилпарабен 0,01
Ксантановая камедь 0,12
Гуаровая камедь 0,09
Карбонат кальция 12,38
Противовспениватель 1,27
Сахароза 15,0
Сорбит 11,0
Глицерин 5,0
Бензиловый спирт 0,2
Лимонная кислота 0,15
Хладагент 0,00888
Отдушка 0,0645
Краситель 0,0014
Композицию получают первоначальным смешиванием 80 кг глицерина и всего бензилового спирта и нагреванием до 65°С, затем медленным добавлением и перемешиванием вместе метилпарабена, пропилпарабена, воды, ксантановой камеди и гуаровой камеди. Смешивают эти ингредиенты приблизительно в течение 12 минут в прямоточном смесителе Сильверсона (Silverson). Затем медленно добавляют оставшиеся ингредиенты в следующем порядке: оставшийся глицерин, сорбит, противовспениватель С, карбонат кальция, лимонную кислоту и сахарозу. Отдельно объединяют отдушки и красители и затем медленно добавляют к другим ингредиентам. Перемешивают порядка 40 минут. Пациент принимает состав для предупреждения внезапного обострения колита.
Пример L
Пациентка, страдающая ожирением, предрасположенная к остеоартриту, принимает капсулу, описанную в примере В, для предупреждения симптомов остеоартрита. А именно, капсула принимается пациенткой ежедневно.
Пациентка обследована путем рентгена, артроскопии и/или MRI, обнаружено отсутствие заметного прогрессирования эрозии/фибрилляции суставного хряща.
Пример М
Пациент массой 90 кг (198 фунтов), имеющий спортивные травмы, получает капсулу, описанную в примере В, для предупреждения возникновения симптомов остеоартрита. А именно, капсула принимается пациентом ежедневно.
Пациент обследован путем рентгена, артроскопии и/или MRI, обнаружено отсутствие заметного прогрессирования эрозии/фибрилляции суставного хряща.
Все приведенные рекомендации упомянуты здесь для сведения.
Хотя описаны конкретные варианты выполнения рассматриваемого изобретения, для специалиста в данной области очевидно, что могут быть произведены различные изменения и модификации, не противоречащие сути изобретения и не выходящие за рамки объема настоящего изобретения. Подразумевается, что все такие модификации охватываются приложенными пунктами и входят в рамки объема настоящего изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СОДЕРЖАЩИЕ ГЕТЕРОЦИКЛИЧЕСКУЮ БОКОВУЮ ЦЕПЬ ИНГИБИТОРЫ МЕТАЛЛОПРОТЕИНАЗЫ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2001 |
|
RU2230736C2 |
| ПРОИЗВОДНЫЕ ПИРИДОПИРИМИДИНОВ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2002 |
|
RU2269527C2 |
| 6-АЛКОКСИПИРИДОПИРИМИДИНЫ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ АКТИВНОСТЬЮ ИНГИБИТОРОВ КИНАЗЫ МАР р38 | 2003 |
|
RU2324695C2 |
| АМИДЫ ФОСФИНОВЫХ КИСЛОТ И СПОСОБ ПРЕДУПРЕЖДЕНИЯ ИЛИ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЯ, СВЯЗАННОГО С НЕЖЕЛАТЕЛЬНОЙ АКТИВНОСТЬЮ МЕТАЛЛОПРОТЕАЗЫ | 1997 |
|
RU2170232C2 |
| ИЗБИРАТЕЛЬНО ДЕЙСТВУЮЩИЕ ИНГИБИТОРЫ ТРОМБИНА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1996 |
|
RU2142939C1 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ АНТАГОНИСТОВ CRTH2 РЕЦЕПТОРА | 2008 |
|
RU2451019C2 |
| АРОМАТИЧЕСКАЯ СУЛЬФОНГИДРОКСАМОВАЯ КИСЛОТА В КАЧЕСТВЕ ИНГИБИТОРА МЕТАЛЛОПРОТЕАЗ | 1998 |
|
RU2250105C2 |
| ФАРМАЦЕВТИЧЕСКОЕ СРЕДСТВО, СОДЕРЖАЩЕЕ ИНГИБИТОР НАТРИЙЗАВИСИМОГО ПЕРЕНОСЧИКА ФОСФАТА | 2015 |
|
RU2740008C2 |
| ПИПЕРИДИНИЛ НАФТИЛУКСУСНЫЕ КИСЛОТЫ | 2012 |
|
RU2628083C2 |
| ФАРМАЦЕВТИЧЕСКОЕ СРЕДСТВО, СОДЕРЖАЩЕЕ ИНГИБИТОР НАТРИЙЗАВИСИМОГО ПЕРЕНОСЧИКА ФОСФАТА | 2015 |
|
RU2811864C1 |
Изобретение относится к новым производным сульфонамидов формулы (I) или их фармацевтически приемлемым солям:
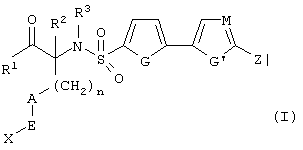 ,
,
где R1 означает -ОН или -NHOH;
R2 означает водород; R3 означает алкил, алкоксиалкил, арилалкил, пиридилалкил или морфолинилалкил; А означает пиперидил или тетрагидрофуранил; n равно 0; Е означает ковалентную связь; С1-С4-алкилен, -С(=O)-, -С(=O)O- или -SO2-; Х означает водород, алкил, арил, арилалкил, алкоксиалкил, морфолинил или тетрагидропиранил; каждый из G и G’ означает -C(R5)=C(R5), где R5 и R5 означают водород, М означает группу -CH-; z означает группу -(CR7R7’)a-L-R8, где а равно 0; каждый из R7 и R7 означает водород; L означает ковалентную связь; и R8 означает галоген или алкокси. Соединения формулы (I) являются ингибиторами металлопротеаз и могут найти применение для лечения артрит, раковых опухолей и других заболеваний. 2 н. и 13 з.п. ф-лы, 7 табл.
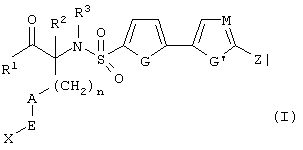
отличающееся тем, что
(A) R1 выбирают из -ОН и -NHOH;
(B) R2 представляет собой водород;
(C) R3 выбирают из группы, включающей алкил, алкоксиалкил, и арилалкил, пиридилалкил и морфолинилалкил;
(D) А означает пиперидил или тетрагидрофуранил;
(Е) n равно 0;
(F) Е выбирают из группы, включающей ковалентную связь, С1-С4-алкилен, -С(=O)-, -С(=O)O- и -SO2-;
(G) Х выбирают из группы, включающей водород, алкил, арил, арилалкил, алкоксиалкил, морфолинил или тетрагидропиранил;
(Н) каждый из G и G’ представляет собой группу -C(R5)=C(R5′-, где каждый из R5 и R5′ означает водород;
(I) М означает группу -СН-;
(J) Z означает группу -(CR7R7’)a-L-R, где а равно 0;
(К) каждый из R7 и R7′ представляет собой водород;
(L) L представляет ковалентную связь;
(М) R8 выбирают из группы, включающей галоген и алкокси;
или его фармацевтически приемлемая соль.
[(4’-метоксидифенил-4-сульфонил)метиламино]-[1-(морфолин-4-карбонил)пиперидин-4-ил]уксусная кислота;
[бензил-(4’-метоксидифенил-4-сульфонил)амино]-[1-(морфолин-4-карбонил)пиперидин-4-ил]уксусная кислота;
[этил-(4’-метоксидифенил-4-сульфонил)амино]-[1-(морфолин-4-карбонил)пиперидин-4-ил]уксусная кислота;
[(4’-бромдифенил-4-сульфонил)метиламино]-[1-(морфолин-4-карбонил)пиперидин-4-ил]уксусная кислота;
2-метоксиэтиловый эфир 4-{карбокси-[(4’-метоксидифенил-4-сульфонил)метиламино]метил}пиперидин-1-карбоновой кислоты;
2-метоксиэтиловый эфир 4-{карбокси-[этил-(4’-метоксидифенил-4-сульфонил)амино]метил}пиперидин-1-карбоновой кислоты;
2-метоксиэтиловый эфир 4-{[бутил-(4’-метоксидифенил-4-сульфонил)амино]карбоксиметил} пиперидин-1-карбоновой кислоты;
2-метоксиэтиловый эфир 4-{карбокси-[(4’-метоксидифенил-4-сульфонил)-(2-метоксиэтил)амино]метил}пиперидин-1-карбоновой кислоты;
2-метоксиэтиловый эфир 4-{[бензил-(4’-метоксидифенил-4-сульфонил)амино]карбоксиметил} пиперидин-1-карбоновой кислоты;
2-метоксиэтиловый эфир 4-{карбокси-[(4’-метоксидифенил-4-сульфонил)фенетиламино]метил}пиперидин-1-карбоновой кислоты;
[N-(2-пиридилметил)-N-(4’-метоксидифенил-4-сульфонил)]-амино-2-[N-(2-метоксиэтоксикарбонил)пиперидин-4-ил]уксусная кислота;
[N-(3-пиридилметил)-N-(4’-метоксидифенил-4-сульфонил)]-амино-2-[N-(2-мeтoкcиэтoкcикapбoнил)пипepидин-4-ил]yкcycнaя кислота;
трет-бутиловый эфир 4-{карбокси-[(4’-метоксидифенил-4-сульфонил)-(2-морфолин-4-илэтил)амино]метил}пиперидин-1-карбоновой кислоты;
трет-бутиловый эфир 4-{карбокси-[(4’-фтордифенил-4-сульфонил)метиламино]метил}пиперидин-1-карбоновой кислоты;
[(4’-метоксидифенил-4-сульфонил)метиламино]-[(1-фенил-метансульфонил)пиперидин-4-ил]уксусная кислота;
[(4’-метоксидифенил-4-сульфонил)метиламино]-[(1-фенетил)-пиперидин-4-ил]уксусная кислота;
4-[(4’-метоксидифенил-4-сульфонил)метиламино]тетрагидропиран-4-карбоновая кислота;
4-[(4’-метоксидифенил-4-сульфонил)метиламино]-1-(морфолин-4-карбонил)пиперидин-4-карбоновая кислота;
4-[бензил-(4’-метоксидифенил-4-сульфонил)амино]-1-(морфолин-4-карбонил)пиперидин-4-карбоновая кислота;
моно-2-метоксиэтиловый эфир 4-[бензил-(4’-метоксидифенил-4-сульфонил)амино]-пиперидин-1,4-дикарбоновой кислоты;
моно-2-метоксиэтиловый эфир 4-[(4’-метоксидифенил-4-сульфонил)-(2-метоксиэтил)амино]-пиперидин-1,4-дикарбоновой кислоты;
1-бензил-4-[бензил-(4’-метоксидифенил-4-сульфонил)амино]-пиперидин-4-карбоновая кислота;
N-гидрокси-2-[(4’-метоксидифенил-4-сульфонил)метиламино]-2-[1-(морфолин-4-карбонил)пиперидин-4-ил]ацетамид;
2-[бензил(4’-метоксидифенил-4-сульфонил)амино]-N-гидрокси-2-[1-(морфолин-4-карбонил)пиперидин-4-ил]ацетамид;
2-[этил(4’-метоксидифенил-4-сульфонил)амино]-N-гидрокси-2-[1-(морфолин-4-карбонил)пиперидин-4-ил]ацетамид;
2-[(4’-бромдифенил-4-сульфонил)метиламино]-N-гидрокси-2-[1-(морфолин-4-карбонил)пиперидин-4-ил]ацетамид;
2-метоксиэтиловый эфир 4-{гидроксикарбамоил-[(4’-метоксидифенил-4-сульфонил)-метиламино]метил}пиперидин-1-карбоновой кислоты;
2-метоксиэтиловый эфир 4-{[этил-(4’-метоксидифенил-4-сул ьфонил)амино]гидроксикарбамоилметил}пиперидин-1-карбоновой кислоты;
2-метоксиэтиловый эфир 4-{гидроксикарбамоил-[(4’-метоксидифенил-4-сульфонил)фенетиламино]метил}пиперидин-1-карбоновой кислоты;
трет-бутиловый эфир 4-{гидроксикарбамоил-[(4’-метоксидифенил-4-сульфонил)-метиламино]метил}пиперидин-1-карбоновой кислоты;
трет-бутиловый эфир 4-{[(4’-фтордифенил-4-сульфонил)-метиламино]гидроксикарбамоилметил}пиперидин-1-карбоновой кислоты;
[(4’-метоксидифенил-4-сульфонил)метиламино]-2-[(1-фенилметансульфонил)пиперидин-4-ил]ацетилгидроксамовая кислота;
[(4’-метоксидифенил-4-сульфонил)метиламино]-2-[(1-фенетил)пиперидин-4-ил]ацетилгидроксамовая кислота;
2-[(4’-метоксидифенил-4-сульфонил)метиламино]-2-(тетрагидропиран-4-ил)ацетилгидроксамовая кислота;
2-[(4’-метоксидифенил-4-сульфонил)бензиламино]-2-(тетрагидропиран-4-ил)ацетилгидроксамовая кислота;
2-[(4’-метоксидифенил-4-сульфонил)-2-метоксиэтиламино]-2-(тетрагидропиран-4-ил)ацетилгидроксамовая кислота;
2-[N-(3-пиридилметил)-N-(4’-метоксидифенил-4-сульфонил)]амино-2-(тетрагидропиран-4-ил)ацетилгидроксамовая кислота; и
[(4’-метоксидифенил-4-сульфонил)-2-(морфолин-4-ил)этиламино]-2-(тетрагидропиран-4-ил)ацетилгидроксамовая кислота.
| ПРОИЗВОДНЫЕ СУЛЬФОНАМИДА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ, СПОСОБ БЛОКИРОВАНИЯ ДЕЙСТВИЯ ФИБРИНОГЕНА И СПОСОБ ЛЕЧЕНИЯ ТРОМБОЗОВ У МЛЕКОПИТАЮЩИХ | 1992 |
|
RU2116296C1 |
| Устройство для монтажа элементов листовых конструкций | 1979 |
|
SU950656A1 |
| Способ выемки опорных целиков | 1980 |
|
SU877018A1 |
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
Авторы
Даты
2005-02-10—Публикация
2001-03-02—Подача