Изобретение относится к группе новых производных фенилпиперазина.
Известны фенилпиперазины, являющиеся сильными ингибиторами поглощения серотонина (DE 19730989 A1). Различные фенилпиперазиновые производные, обладающие как ингибирующей поглощение серотонина активностью, так и высоким сродством к 5-HT1A рецепторам, известны из DE 4333254 A1, WO-A-99/05140, в то время как ЕР-А-376607 раскрывает уже другую группу фенилпиперазинов с высоким сродством к 5-HT1A рецепторам.
Ни одно из соединений указанных патентов не обладает фармакологическим действием, которое может быть использовано для лечения как отрицательных, так и положительных симптомов психоза, viz комбинация высокого сродства к допамин-D2 рецепторам и высокой активностью как ингибитора поглощения серотонина.
Задачей настоящего изобретения является создание соединений, пригодных для лечения как отрицательных, так и положительных симптомов психоза.
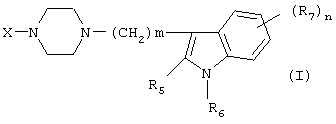
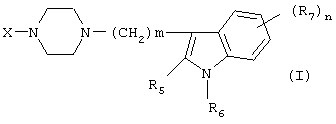
Настоящее изобретение относится к соединениям формулы (I):
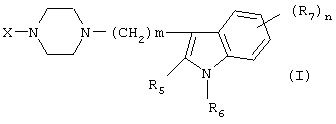
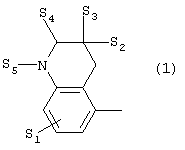
где X представляет собой 1) группу формулы
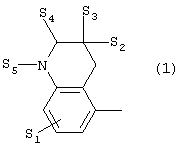
где S1 представляет собой атом водорода или галогена,
- S2 и S3 независимо друг от друга представляют собой атом
водорода, алкил(1-6С), фенил или бензил,
- S4 представляет собой два атома водорода или оксо-группу,
- S5 представляет собой Н или алкил(1-4С), и
- Y представляет собой СН2, О или S,
или 2) группу формулы
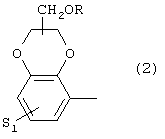
где S1 имеет приведенные выше значения, a R представляет собой Н, алкил(1-4С), алкоксиалкил(2-6С), алкенил(2-4С) или алкинил-(2-4С), или 3) группу формулы
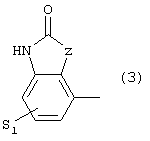
где S1 имеет приведенные выше значения, a Z представляет собой СН2, О или N, или 4) группу формулы
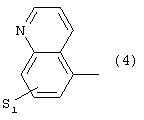
где S1 имеет приведенные выше значения,
или 5) группу формулы
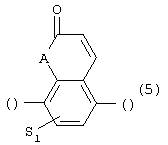
где S1 имеет приведенные выше значения и А представляет собой О или N, соединенную с пиперазиновым кольцом в положении 5 или 8, или 6) группу формулы
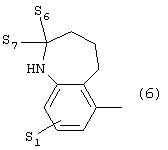
где S1 имеет приведенные выше значения, a S6 и S7 представляют собой атомы водорода или оксо-группу, или 7) группу формулы
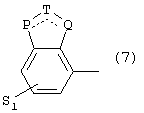
где одна из пунктирных линий может представлять собой двойную связь, S1 имеет приведенные выше значения, и
Р=Т=Q=азот; или Р=Т=азот и Q=СН или СН2
или Р=Q=азот и Т=СН, СН2, СН-СН3 или С-СН3
или Р=азот, и Т представляет собой СН или СН2,
Q = представляет собой серу,
- m имеет значения от 2 до 6; n имеет значения 0-2;
- R5 и R6 независимо друг от друга представляют собой Н или алкил(1-3С); или R5+R6 представляют собой группу -(СН2)р-, где р имеет значения 3-5, и
- R7 представляет собой алкил(1-3С), алкокси(1-3С), атом галогена или циано-группу; или R6+R7 (R7 в положении 7 индольной группы) представляют собой группу -(CH2)q, где q имеет значения 2-4, и их соли, которые проявляют высокое сродство к допамин-D2-рецептору и являются хорошими ингибиторами повторного поглощения серотонина (SRI).
Предпочтительными соединениями настоящего изобретения являются соединения, имеющие формулу (I), где Х представляет собой группу формул (1), (2) или (3), где символы имеют значения, приведенные выше, и их соли. Особенно предпочтительными являются соединения, имеющие формулу (I), где Х представляет собой группу формулы (1), где S1=H, S2=СН3, S3=Н, S4=оксо, S5=H и Y представляет собой атом кислорода, m равно 3, R5=R6= атом водорода, n равно 0 или 1, a R7 представляет собой 5-фтор, и их соли.
Установлено, что соединения в соответствии с настоящим изобретением проявляют высокое сродство как к допамин-D2-рецептору, так и к сайту повторного поглощения серотонина. Такое сочетание полезно при лечении шизофрении и других психических расстройств, что обеспечивает возможность более полного лечения всех симптомов заболевания (например, положительных симптомов и отрицательных симптомов).
Однако некоторые соединения, имеющие формулу (I), проявляют (частичную) агонистическую активность на рецепторах допамина, что делает их особенно полезными при лечении болезни Паркинсона.
Соединения проявляют активность как антагонисты допамин-D2-рецепторов, так как они эффективно действуют антагонистически на индуцированное апоморфином стремление к лазанию у мышей. Соединения также проявляют активность в качестве ингибиторов повторного поглощения серотонина, так как они делают возможным индуцированное 5-НТР поведение у мышей.
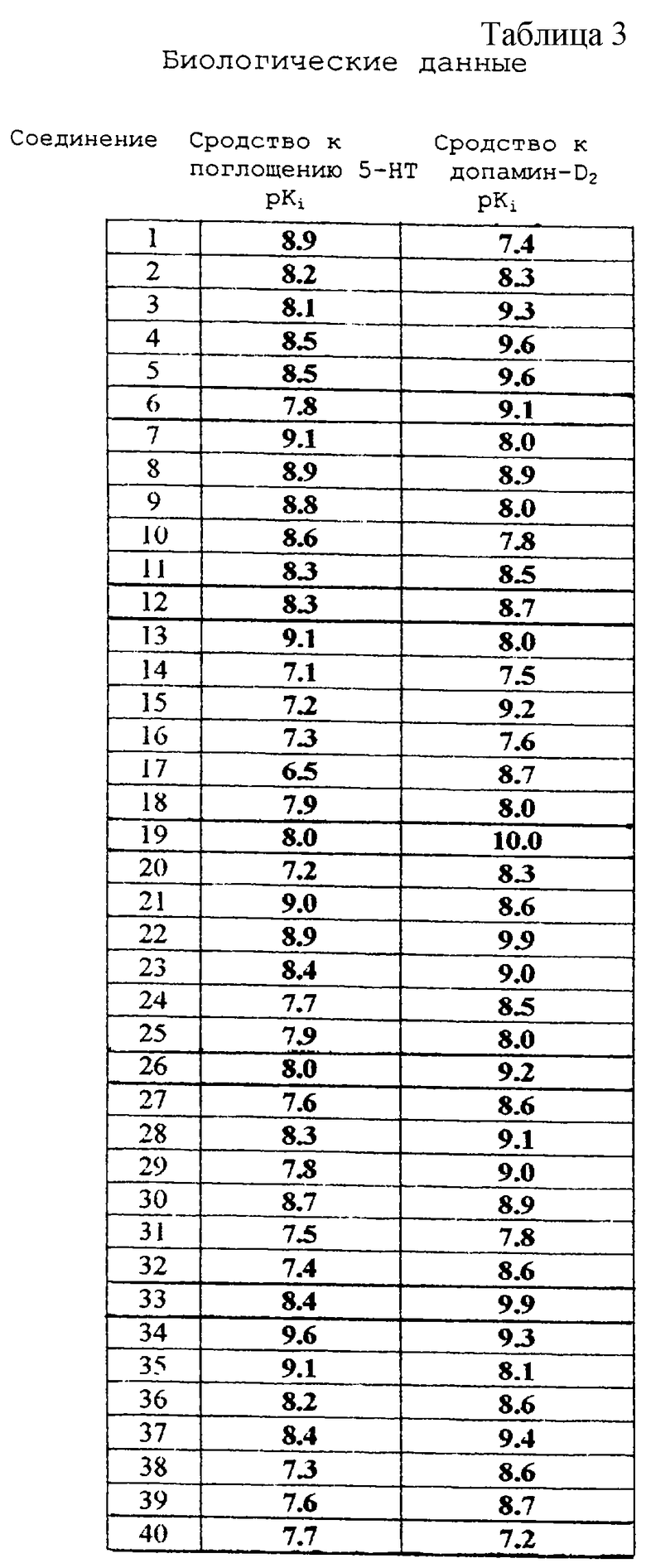
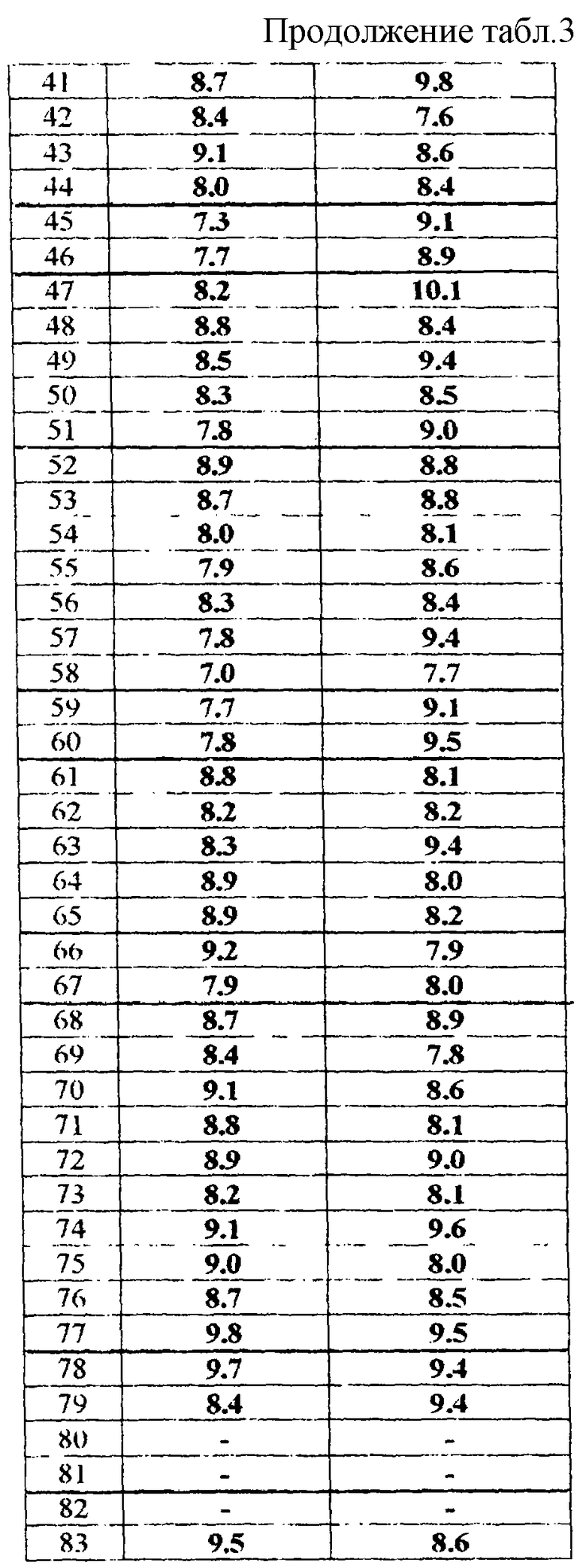
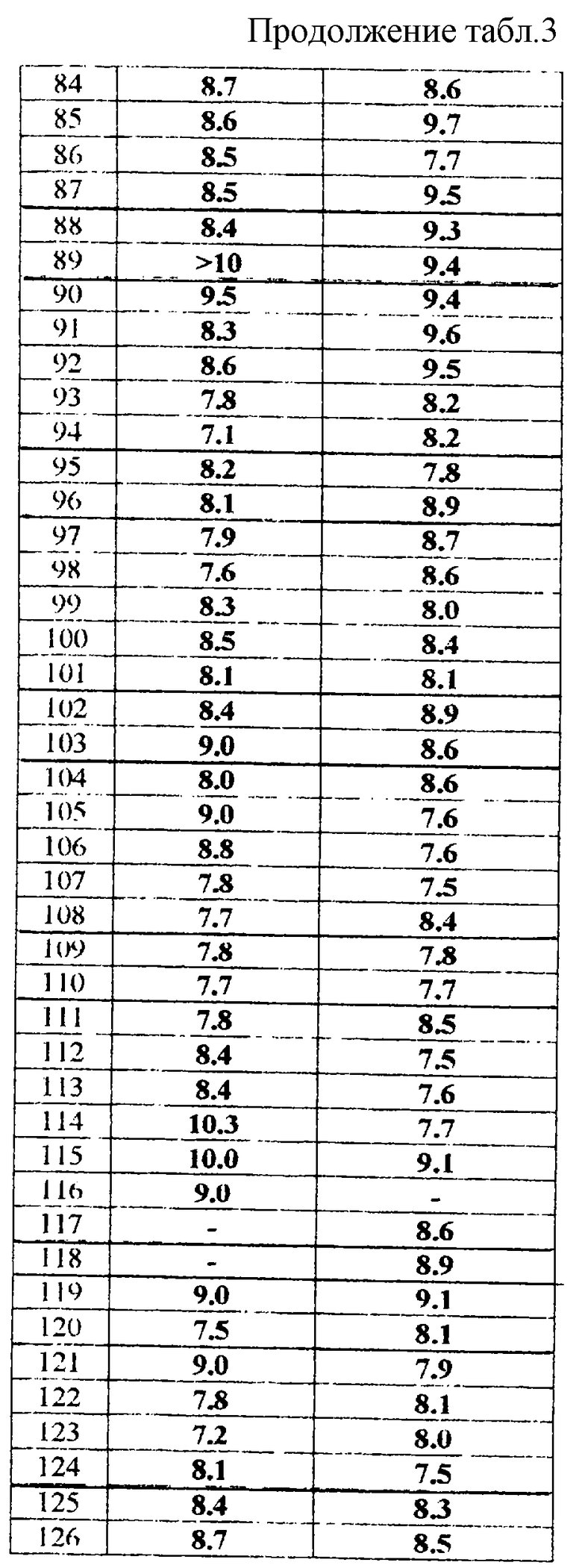
Соединения активны в терапевтических моделях, восприимчивых к клинически уместным антипсихотическим средствам (например, при условно-рефлекторном избегании; Van der Heyden & Bradford, Behav.Brain Res., 1988, 31:61-67) и антидепрессантам или анксиолитикам (например, при подавлении вызванного стрессом озвончения голоса; van der Poel et al., Psychopharmacology, 1989, 97: 147-148), данные приведены в таблице 3.
В отличие от клинически уместных антагонистов допамин-D2-рецепторов описанные соединения обладают низкой предрасположенностью вызывать оцепенение у грызунов и сами по себе они, по-видимому, вызывают менее заметные экстрапирамидальные побочные эффекты, чем существующие антипсихотические средства.
Ингибирующая активность относительно повторного поглощения серотонина, присущая этим соединениям, может быть причиной терапевтических эффектов, наблюдаемых в поведенческих моделях, восприимчивых к любым антидепрессантам или анксиолитикам.
Соединения могут быть использованы для лечения поражений или заболеваний центральной нервной системы, вызванных нарушением равновесия в системах, генерирующих или допамин, или серотонин, например: агрессии, страха, аутизма, головокружения, депрессии, расстройства познавательной способности или памяти, болезни Паркинсона и, в особенности, шизофрении и других психических заболеваний.
Фармакологически приемлемые кислоты, с которыми соединения настоящего изобретения могут образовывать подходящие кислотно-аддитивные соли, представляют собой, например, соляную кислоту, серную кислоту, фосфорную кислоту, азотную кислоту и органические кислоты, такие как лимонная кислота, фумаровая кислота, малеиновая кислота, винная кислота, уксусная кислота, бензойная кислота, п-толуолсульфоновая кислоты, метансульфоновая кислота и нафталинсульфоновая кислота.
Когда соединения содержат хиральный центр, то изобретение включает как рацемическую смесь, так и отдельные энантиомеры.
Соединения и их кислотно-аддитивные соли могут быть переведены в формы, приемлемые для введения с помощью подходящих способов, с использованием вспомогательных веществ, таких как жидкие и твердые носители.
Соединения, имеющие формулу (I), могут быть получены реакцией соединения формулы
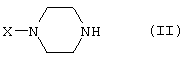
при основных условиях с соединением формулы
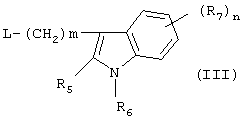
и в этой формуле символы имеют значения, приведенные выше, a L представляет собой уходящую группу, такую как атом галогена или мезилатная группа.
Пиперазиновые соединения, имеющие формулу (II), могут быть получены так, как описано в публикациях ЕР 0138280, ЕР 0189612 и/или ЕР 0900792, или аналогичными способами.
Получение пиперазинов, имеющих формулу (II), может быть осуществлено так, как указано в приведенных ниже схемах (i)-(iv). Некоторые пути приводят к оптически чистым пиперазиновым производным.
Схемы (i)-(iv)
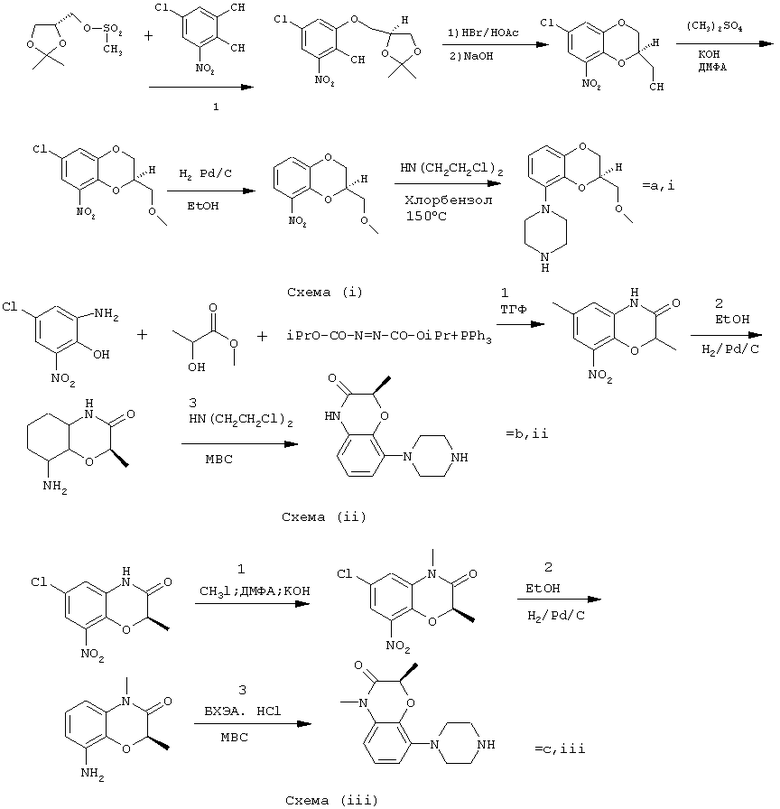
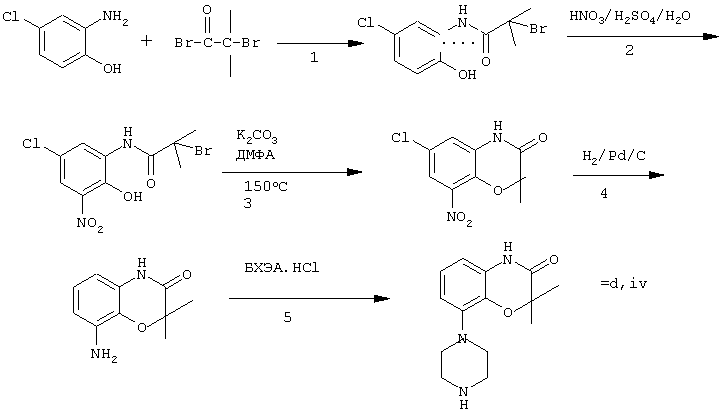
Схема (iv)
Исходные соединения, имеющие формулу (III), могут быть получены в соответствии со способами, известными для аналогичных соединений, которые описаны, например, в публикации Organic Process Res. and Dev., 1997(1), 300-310.
Изобретение пояснено с помощью следующих примеров.
Пример 1: получение соединения a,i (см. схему i)
Стадия 1 (схема i): К раствору хлорнитрокатехина (6,45 г, 34 ммоль) в сухом ДМСО (50 мл) добавляют порошкообразный NaOH (2,72 г, 68 ммоль). После перемешивания в течение 30 мин добавляют раствор мезилата R-глицеринкеталя (8,0 г, 38 ммоль) в ДМСО (20 мл) и полученную смесь нагревают при 80° С в течение 24 час. После охлаждения до комнатной температуры реакционную смесь выливают в воду (200 мл), подкисляют 1 н НСl и экстрагируют метил-трет-бутиловым эфиром. Органическую фракцию промывают водой и сушат над MgSО4. После удаления осушающего агента и растворителя в вакууме полученное масло подвергают флэш-хроматографии (SiO2, элюент ПЭ/ацетон = 3/1). Выход 9,29 г (90%) S-кеталя.
Стадия 2 (схема i): К раствору S-кеталя (31 г, 102 ммоль) в уксусной кислоте (120 мл) добавляют 35%-ную НВr в уксусной кислоте (80 мл), полученную смесь вращают 2 час на роторном испарителе в водяной бане с температурой 50° С. Реакционную смесь разбавляют этанолом (96%, 250 мл), охлаждают в смеси соль/лед, а затем медленно добавляют NaOH (50% в воде, 250 мл), поддерживая температуру ниже 15° С. После добавления этанола (250 мл) и воды (250 мл) реакционную смесь перемешивают при комнатной температуре 16 час. Затем добавляют концентрированную НСl (приблизительно 300 мл) и воду, смесь экстрагируют этилацетатом. После промывки органической фракции 5%-ным NaHCO3 (4× 500 мл) растворитель удаляют в вакууме и полученное масло подвергают флэш-хроматографии (SiO2, элюент ПЭ/ацетон = 3/1). Выход 20,5 г (81%) R-бензодиоксана в виде желтого масла.
Стадия 3 (схема i): К раствору R-бензодиоксана (20 г, 81 ммоль) в ДМФА (200 мл) добавляют КОН (4,56 г, 81 ммоль). После охлаждения добавляют красный раствор диметилсульфата в смеси лед/ацетон (23 мл) и реакционную смесь перемешивают 1,5 час при комнатной температуре. Затем добавляют еще КОН (4,56 г, при охлаждении) и смесь перемешивают при комнатной температуре 16 час. После добавления воды (700 мл) продукт экстрагируют этилацетатом. Этилацетат удаляют в вакууме и полученное масло подвергают флэш-хроматографии (SiO2, элюент ПЭ/ацетон = 4/1). Получают R-метоксиметилбензодиоксан (12,3 г, 58%) в виде желтого масла, [α ]
Стадия 4 (схема i): К раствору R-метоксиметилбензодиоксана (5 г, 19 ммоль) в этаноле (100 мл) и этилацетате (50 мл) добавляют каталитическое количество 10% Pd/C и раствор встряхивают при атмосферном давлении Н2 при комнатной температуре. После поглощения реакционной смесью расчетного количества H2 катализатор отфильтровывают и фильтрат концентрируют в вакууме. Выход 3,7 г (100%) соответствующего анилинового соединения.
Стадия 5 (схема i): Анилиновое соединение (4 г, 2 ммоль) и ВСЕА (БХЭА), то есть HN (CH2CH2Cl) 2·НСl (3,7 г, 2 ммоль), растворяют в хлорбензоле (100 мл). Смесь нагревают при 150° С 16 час, концентрируют в вакууме и очищают флэш-хроматографией (SiO2, элюент дихлорметан/метанол/гидроксид аммония = 92/7,5/0,5). Выход 3,67 г (68%) пиперазина a.i.
Пример 2: получение соединения №126
Способ получения описан выше, то есть взаимодействие соединения (II) с соединением (III). Мезилаты формулы (III) получают из соответствующих спиртов по стандартным методикам, например, с использованием МsСl/Еt3N.
Смесь пиперазина а.i (3,6 г, 13,6 ммоль), 5-фториндолмезилата (4,1 г, 15,1 ммоль), триэтиламина (2 мл) и каталитического количества KI в СН3СN (100 мл) нагревают при кипячении с обратным холодильником в течение 18 час, после чего реакционную смесь концентрируют в вакууме и очищают с помощью хроматографии (SiO2, элюент дихлорметан/метанол/гидроксид аммония = 92/7,5/0,5). Выход 3,77 г свободного основания (масло). Свободное основание растворяют в этаноле и добавляют 1 эквивалент фумаровой кислоты в этаноле. После удаления растворителя получают соединение №126 (4,3 г, 57%). [α ]
Пример 3: получение соединения b,ii (см. схему ii)
Стадия 1 (схема ii): Раствор аминофенола (37,3 г, 198 ммоль) метилового эфира S-молочной кислоты (20 мл) и трифенилфосфина (58 г, 220 ммоль) в ТГФ (2000 мл) охлаждают смесью лед/соль (температура <10° С). Затем медленно добавляют раствор эфира азодикарбоновой кислоты (DIAD, 43 мл, 218 ммоль) в ТГФ (400 мл). После перемешивания при комнатной температуре в течение 18 час реакционную смесь концентрируют в вакууме и к остатку добавляют этанол (500 мл) и 36%-ную НСl (125 мл). Смесь нагревают до 100° С (с выделением газа). После охлаждения соединение отфильтровывают и промывают 96%-ным этанолом (приблизительно 100 мл). Выход 42 г (87%).
Стадия 2 (схема ii): Эта стадия аналогична стадии 4, описанной в схеме i.
Стадия 3 (схема ii): Эта стадия аналогична стадии 5, описанной в схеме i, и приводит к образованию пиперазина b,ii.
Пример 4: получение соединения №89
Способ получения описан выше, то есть взаимодействие соединения (II) с соединением (III). Реакцию проводят, как описано в примере 2, исходя из пиперазина b,ii. Выход 58% соединения №89. [α ]
Пример 5: получение соединения с,iii (см. схему iii)
Стадия 1 (схема iii): Раствор бензоморфолинона (10 г, 41 ммоль, см. схему ii, стадия 1) и порошкообразного КОН (2,3 г, 41 ммоль) в ДМФА (100 мл) охлаждают льдом (температура <10° С). После добавления 1 эквивалента МеI (2,55 мл, 41 ммоль) реакционную смесь перемешивают при комнатной температуре в течение приблизительно 1,5 час и затем выливают в воду. Осадок отфильтровывают, промывают водой и сушат. Выход 10 г (95%) NСН3-соединения, т.пл. 191-192; [α ]
Стадия 2 (схема iii): Эта стадия аналогична стадии 4, описанной в схеме i.
Стадия 3 (схема iii): Эта стадия аналогична стадии 5, описанной в схеме i, и приводит к образованию пиперазина с, iii.
Пример 6: получение соединения №121
Способ получения описан выше, то есть взаимодействие соединения (II) с соединением (III). Реакцию проводят, как описано в примере 2, исходя из пиперазина с,iii. Выход 44% соединения №121. [α ]
Пример 7: получение соединения d, iv (см. схему iv)
Стадия 1 (схема iv): Пиридин (81 мл, 1 моль) добавляют к раствору 2-гидрокси-5-хлоранилина (143,5 г, 1 моль) в сухом CH2Cl2. Смесь охлаждают льдом (температура <10° С), и затем медленно добавляют раствор 2-бром-2-метилпропионилбромида (163 мл, 1 моль) в CH2Cl2 (100 мл). Смесь перемешивают при комнатной температуре в течение 18 час и затем выливают в СН2Сl2 (5000 мл) и воду (2000 мл). Органический слой промывают водой, сушат и концентрируют в вакууме приблизительно до 1 л. Осадок отфильтровывают, промывают CH2Cl2 и сушат. Выход 231 г (79%) бромпроизводного, т.пл. 172° С.
Стадия 2 (схема iv): К суспензии бромпроизводного (60 г, 205 ммоль) в воде (95 мл) медленно при охлаждении льдом добавляют концентрированную серную кислоту (7 мл), а затем 70%-ную НNО3 (16 мл) и перемешивают в течение 2 час при комнатной температуре. После охлаждения ледяной водой осадок отфильтровывают, промывают водой и очищают хроматографией (SiO2, элюент метил-трет-бутиловый эфир). Выход 49 г (71%) нитросоединения.
Стадия 3 (схема iv): К раствору нитросоединения (49 г, 145 ммоль) в ДМФА (500 мл) добавляют К2СОз. Полученную смесь нагревают при 150° С в течение одного часа, затем охлаждают и выливают в смесь вода/этилацетат. Органическую фракцию промывают бикарбонатом натрия (5% в воде), НСl (2 н) и водой в указанном порядке. Растворитель удаляют в вакууме и остаток очищают флэш-хроматографией (SiO2, метил-трет-бутиловый эфир/ПЭ = 1/1). Выход 23 г (62%).
Стадия 4 (схема iv): Эта стадия аналогична стадии 4, описанной в схеме i.
Стадия 5 (схема iv): Эта стадия аналогична стадии 5, описанной в схеме i, и приводит к образованию пиперазина d,iv.
Пример 8: получение соединения №115
Способ получения описан выше, то есть взаимодействие соединения (II) с соединением (III). Реакцию проводят, как описано в примере 2, исходя из пиперазина d,iv. Выход 20% соединения №115.
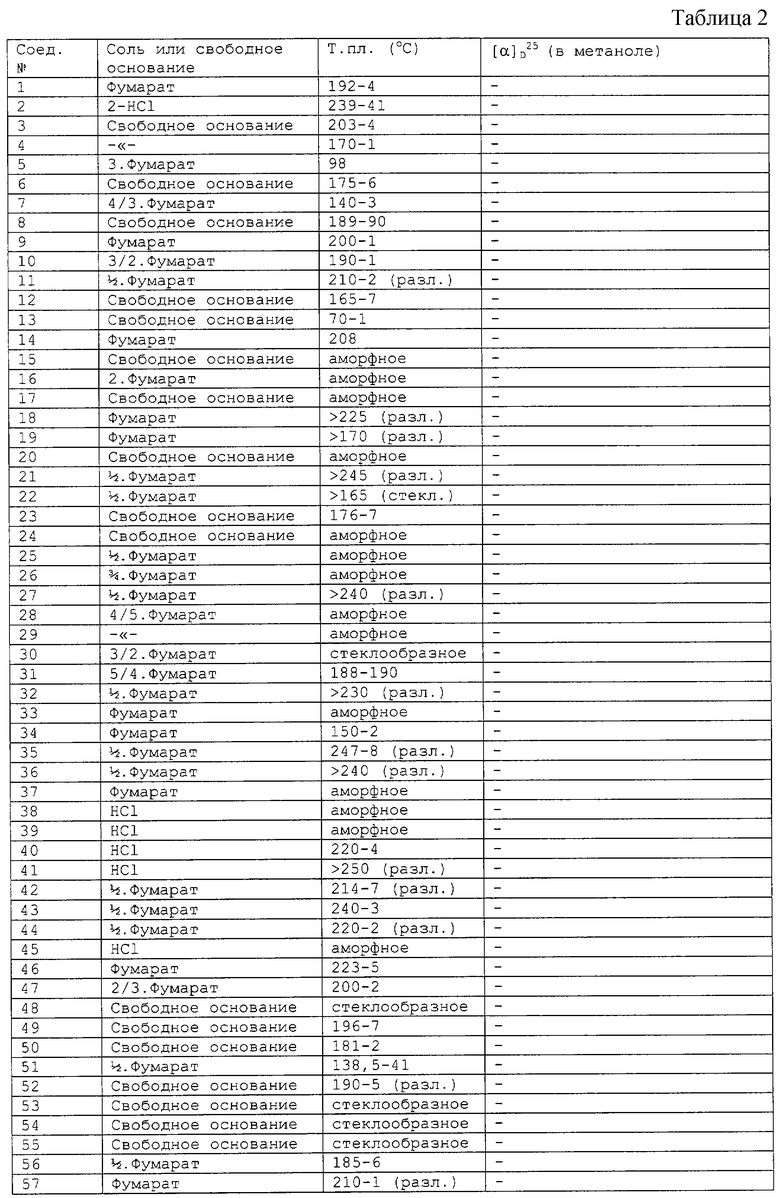
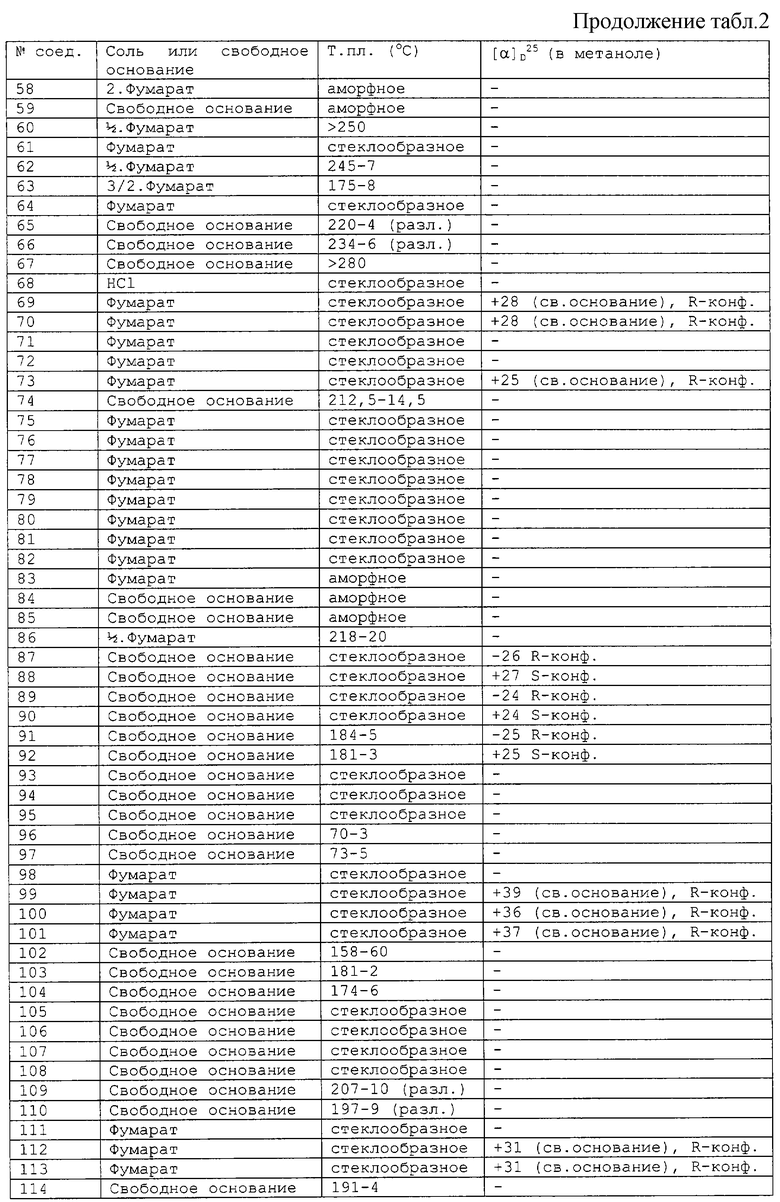
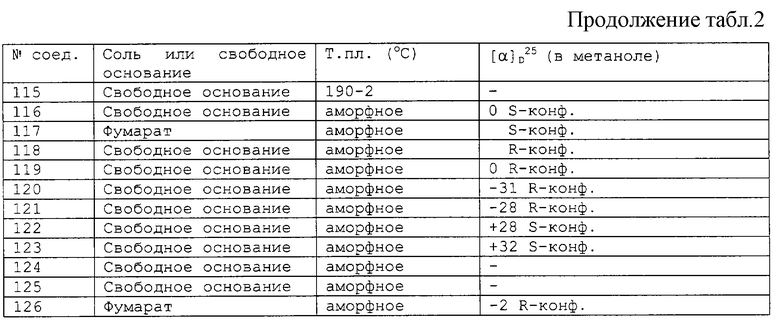
Соединения, перечисленные в приведенных ниже таблицах 1 и 2, получены в соответствии со способом описанных выше примеров.

| название | год | авторы | номер документа |
|---|---|---|---|
| 3-ТЕТРАГИДРОПИРИДИН-4-ИЛИНДОЛЫ ДЛЯ ЛЕЧЕНИЯ ПСИХОТИЧЕСКИХ НАРУШЕНИЙ | 1999 |
|
RU2222535C2 |
| АЛКИЛ-ПИПЕРАЗИНИЛ БЕНЗОКСАЗОЛОНОВЫЕ И АЛКИЛ-ПИПЕРИДИНИЛ БЕНЗОКСАЗОЛОНОВЫЕ ПРОИЗВОДНЫЕ, СПОСОБ ИХ ПОЛУЧЕНИЯ И СПОСОБ ЛЕЧЕНИЯ | 1999 |
|
RU2225406C2 |
| БИЦИКЛО-3.1.1-ГЕПТАН-ЗАМЕЩЕННЫЕ БЕНЗИМИДАЗОЛОН- И ХИНАЗОЛИНОН-ПРОИЗВОДНЫЕ АГОНИСТЫ ORL1 РЕЦЕПТОРОВ ЧЕЛОВЕКА | 2004 |
|
RU2357964C2 |
| ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛОНА И ХИНАЗОЛИНА КАК АГОНИСТЫ ORL1-РЕЦЕПТОРОВ ЧЕЛОВЕКА | 2004 |
|
RU2364593C2 |
| ПРОИЗВОДНЫЕ ПИПЕРАЗИНА | 1998 |
|
RU2197488C2 |
| ПРОИЗВОДНЫЕ ТЕТРАГИДРОИЗОХИНОЛИНА, СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ИНГИБИРОВАНИЯ СИНАПТИЧЕСКОГО ЗАХВАТА ДОПАМИНА И СПОСОБ ЛЕЧЕНИЯ | 2000 |
|
RU2293728C2 |
| ПРОИЗВОДНЫЕ 1,3,5-ТРИАЗИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И ИХ ПРИМЕНЕНИЕ | 2003 |
|
RU2312859C2 |
| ПРОИЗВОДНЫЕ ТЕТРАГИДРОНАФТАЛИНА И ТЕТРАГИДРОИЗОХИНОЛИНА В КАЧЕСТВЕ РАЗРУШИТЕЛЕЙ ЭСТРОГЕНОВОГО РЕЦЕПТОРА | 2017 |
|
RU2797244C2 |
| ПРОИЗВОДНЫЕ ОКСАДИАЗОЛА | 1997 |
|
RU2182905C2 |
| ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1987 |
|
RU2062778C1 |
Изобретение относится к новым производным фенилпиперазина формулы (I):
где:
- Х представляет собой 1) группу формулы
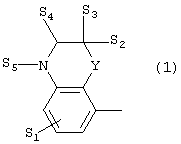
где
S1 означает водород, галоген;
S2 и S3 независимо друг от друга означают водород, алкил(1-6С), фенил или бензил;
S4 означает два атома водорода, оксо-группу;
S5 означает Н, алкил(1-4С), и
Y означает СН2, О, S;
или 2) группу формулы
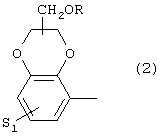
где S1 имеет приведенные выше значения, a R означает Н, алкил(1-4С), алкоксиалкил(2-6С), алкенил(2-4С) или алкинил(2-4С), или 3) группу формулы
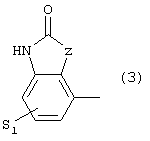
где S1 имеет приведенные выше значения, a Z означает CH2, О, N;
или 4) группу формулы
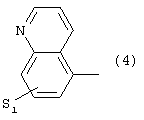
где S1 имеет приведенные выше значения,
или 5) группу формулы
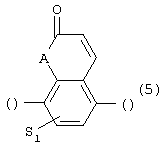
где S1 имеет приведенные выше значения, и А означает О, N, соединенную с пиперазиновым кольцом в положении 5 или 8, или 6) группу формулы
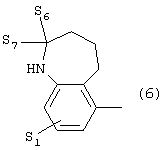
где S1 имеет приведенные выше значения, a S6 и S7 означают водород или оксо-группу,
или 7) группу формулы
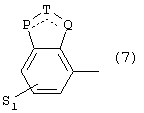
где одна из пунктирных линий может представлять собой двойную связь, S1 имеет приведенные выше значения, и
P=T=Q=азот,
или Р=Т=азот и Q=CH или СН2
или Р=Q-азот и Т=СН, СН2, СН-СН3, С-СН3
или Р=азот, и Т означает СН, СН2,
Q представляет собой серу,
m=2-6;
n=0-2;
R5 и R6 независимо друг от друга означают Н, алкил(1-3С); или R5+R6 представляют собой группу -(СН2)р-,
где р=3-5;
R7 означает алкил(1-3С), алкокси(1-3С), галоген, циано-группу; или R6+R7 (R7 в положении 7 индольной группы) означают группу -(CH2)q, где q=2-4, и их соли.
Соединения I проявляют высокое средство как к допамин-D2 рецептору, так и к сайту повторного поглощения серотонина, что позволяет использовать их при лечении заболеваний ЦНС. 3 н. и 2 з.п. ф-лы, 3 табл.
где X представляет собой 1) группу формулы
где S1 представляет собой атом водорода или галогена,
S2 и S3 независимо друг от друга представляют собой атом водорода, алкил(1-6С), фенил или бензил,
S4 представляет собой два атома водорода или оксогруппу,
S5 представляет собой Н или алкил(1-4С),
Y представляет собой СН2, О или S,
или 2) группу формулы
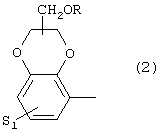
где S1 имеет приведенные выше значения, a R представляет собой Н, алкил(1-4С), алкоксиалкил(2-6С), алкенил(2-4С) или алкинил-(2-4С), или 3) группу формулы
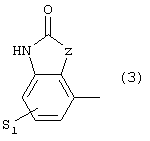
где S1 имеет приведенные выше значения, a Z представляет собой СН2, О или N,
или 4) группу формулы
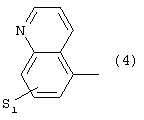
где S1 имеет приведенные выше значения,
или 5) группу формулы
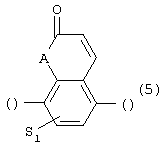
где S1 - имеет приведенные выше значения, а А представляет собой О или N, соединенную с пиперазиновым кольцом в положении 5 или 8, или 6) группу формулы
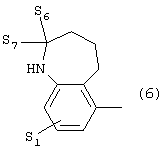
где S1 имеет приведенные выше значения, а S6 и S7 представляют собой атомы водорода или оксогруппу,
или 7) группу формулы
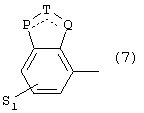
где одна из пунктирных линий может представлять собой двойную связь, S1 имеет приведенные выше значения, и
Р=Т=Q=азот:
или Р=Т=азот и Q=CH или СН2,
или Р=Q=азот и Т=СН, СН2, СН-СН3 или С-СН3,
или Р=азот и Т представляет собой СН или СН2
Q - представляет собой серу,
m имеет значения от 2 до 6;
n имеет значения 0-2;
R5 и R6, независимо друг от друга представляют собой Н или алкил(1-3С); или R5+R6 представляют собой группу -(СН2)р-, где
р имеет значения 3-5,
R7 представляет собой алкил(1-3С), алкокси(1-3С), атом галогена или цианогруппу; или R6+R7 (R7 в положении 7 индольной группы) представляют собой группу -(CH2)q, где q имеет значения 2-4, и их соли.
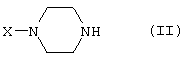
взаимодействует в основных условиях с соединением, имеющим формулу (III)
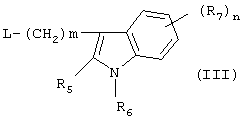
и в этих формулах символы имеют значения, приведенные в п.1, a L представляет собой уходящую группу.
| DE 19730989 А, 21.01.1999 | |||
| ВСЕСОЮЗНАЯ I | 0 |
|
SU376607A1 |
| ПРОИЗВОДНЫЕ ПИПЕРИДИНА И ПИПЕРАЗИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1994 |
|
RU2132848C1 |
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
Авторы
Даты
2005-02-20—Публикация
2000-08-22—Подача