ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится к конъюгату аналога инсулина и его применению.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Известно, что белки удаляются из организма различными способами, включая расщепление протеазами в крови, выделение почками, опосредованное рецепторами удаление и т.д. В этой связи предпринимали различные попытки улучшения терапевтических эффектов белков, увеличивая время полужизни физиологических белков путем избегания механизмов клиренса белков.
В целом, инсулин представляет собой гормон, который в человеческом организме секретируется поджелудочной железой, регулирует уровень глюкозы и поддерживает нормальный уровень глюкозы в крови, при этом обеспечивая поступление избытка глюкозы из крови в клетки для обеспечения клеток энергией. Однако у пациентов с диабетом инсулин не осуществляет свои функции должным образом из-за недостатка инсулина, инсулинорезистентности и нарушения функции бета-клеток. В результате пациенты с диабетом не могут утилизировать глюкозу крови в качестве источника энергии, но при этом демонстрируют симптомы гипергликемии, когда существует высокий уровень глюкозы в крови и экскреция глюкозы с мочой, что становится причиной различных осложнений. Соответственно, инсулинотерапия имеет принципиальное значение для пациентов с аномальной продукцией инсулина (I тип) или инсулинорезистентностью (II тип), и нормальная регуляция уровней глюкозы осуществляется путем введения инсулина.
Однако, как и другие белки и пептидные гормоны, инсулин имеет очень короткое время полужизни in vivo и поэтому не оказывает длительного терапевтического эффекта. Следовательно, для поддержания указанного эффекта требуется повторное введение инсулина. Такое частое введение доставляет пациентам болезненные ощущения и дискомфорт, и поэтому, с учетом таких аспектов, как комплаентность пациентов, безопасность и удобство, введение нуждается в улучшении.
В этой связи, исследования были сфокусированы на разработке различных белковых композиций, химических конъюгатов (например, конъюгата с жирными кислотами) и т.д., улучшающих терапевтические эффекты, а также качество жизни пациентов за счет снижения частоты введения благодаря увеличению времени полужизни in vivo таких белковых лекарственных средств, как инсулин.
Согласно недавнему докладу, 50% или более инсулина выводится через почки, а остальное выводится в ходе процесса рецептор-опосредованного клиренса (РОК) в сайтах-мишенях, таких как мышцы, жир, печень и т.д.
Согласно публикациям (J Pharmacol Exp Ther (1998) 286: 959, Diabetes Care (1990) 13: 923, Diabetes (1990) 39: 1033 и др.) во избежание РОК инсулина, снижают активность in vitro, тем самым увеличивая уровень инсулина в крови. Однако, предложенные в документах J Pharmacol Exp Ther (1998) 286: 959, Diabetes Care (1990) 13: 923 аналоги инсулина, имевшие по меньшей мере две аминокислотные замены, не приводили к достижению какого-то определенного результата, тогда как у описанных в документе Diabetes (1990) 39: 1033 аналогов инсулина в результате замены аминокислот, непосредственно вовлеченных в связывание с рецепторами инсулина, не было показано изменения аффинности их связывания с рецепторами либо их активность снижалась. Таким образом, по-прежнему существует необходимость в разработке аналогов инсулина с увеличенной продолжительностью действия.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Техническая задача
Задачей данного изобретения является обеспечение конъюгата аналога инсулина.
Другой задачей данного изобретения является обеспечение полинуклеотида, кодирующего конъюгат, вектора, включающего полинуклеотид, и трансформанта, включающего полинуклеотид или вектор, включающий полинуклеотид.
Еще одной задачей данного изобретения является обеспечение способа получения конъюгата.
Еще одной задачей данного изобретения является обеспечение композиции, например, фармацевтической композиции, включающей конъюгат аналога инсулина.
Еще одной задачей данного изобретения является обеспечение композиции пролонгированного действия, включающей конъюгат аналога инсулина, с увеличенной продолжительностью действия in vivo и/или стабильностью по сравнению с конъюгатом нативного инсулина.
Еще одной задачей данного изобретения является обеспечение фармацевтической композиции, включающей конъюгат аналога инсулина, для предупреждения или лечения заболевания, связанного с инсулином, например, диабета.
Еще одной задачей данного изобретения является обеспечение способа лечения заболевания, связанного с инсулином, например, диабета, включающего стадию введения конъюгата аналога инсулина или его композиции субъекту, нуждающемуся в этом.
Еще одной задачей данного изобретения является обеспечение применения конъюгата аналога инсулина для изготовления лекарственного средства.
Еще одной задачей данного изобретения является обеспечение применения конъюгата аналога инсулина в лечении заболевания, связанного с инсулином, в частности, диабета.
Техническое решение
Для решения задач, указанных выше, в одном аспекте данного изобретения предложен конъюгат аналога инсулина.
Более конкретно, в аспекте данного изобретения предложен конъюгат, представленный Формулой 1, приведенной ниже:
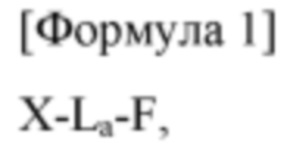
где в Формуле 1
X представляет собой аналог инсулина, имеющий модификацию одной или более чем одной аминокислоты, выбранной из группы, состоящей из 16-й аминокислоты В-цепи, 25-й аминокислоты В-цепи, 14-й аминокислоты А-цепи и 19-й аминокислоты А-цепи нативного инсулина;
L представляет собой линкер;
а представляет собой 0 или натуральное число, при условии, что, когда а равно 2 или более, каждый из L является независимым друг от друга, и
F представляет собой вещество, способное увеличивать время полужизни X.
В приведенном в качестве примера воплощении X имеет одну или более чем одну модификацию, выбранную из группы, состоящей из модификации 16-й аминокислоты В-цепи нативного инсулина, тирозина, на глутаминовую кислоту, серин, треонин или аспарагиновую кислоту; модификации 25-й аминокислоты В-цепи нативного инсулина, фенилаланина, на аспарагиновую кислоту или глутаминовую кислоту; модификации 14-й аминокислоты А-цепи нативного инсулина, тирозина, на гистидин, лизин, аланин или аспарагиновую кислоту и модификации 19-й аминокислоты А-цепи нативного инсулина, тирозина, на глутаминовую кислоту, серин или треонин.
В другом приведенном в качестве примера воплощении X представляет собой аналог инсулина, содержащий все комбинации А-цепи с последовательностью SEQ ID NO: 55, указанной в общей Формуле 2, и В-цепи с последовательностью SEQ ID NO: 56, указанной в общей Формуле 3 (за исключением нативного инсулина, что означает исключение пептида, в котором А-цепь, совпадает с SEQ ID NO: 53, тогда как В-цепь совпадает с SEQ ID NO: 54):
Общая Формула 2
Xaal-Ile-Val-Glu-Xaa5-Cys-Cys-Thr-Ser-Ile-Cys-Xaa12-Leu-Xaa14-Gln-Xaa16-Glu-Asn-Xaa19-Cys-Xaa21 (SEQ ID NO: 55), где в общей формуле 2
Xaa1 представляет собой аланин, глицин, глутамин, гистидин, глутаминовую кислоту или аспарагин;
Хаа5 представляет собой аланин, глутаминовую кислоту, глутамин, гистидин или аспарагин;
Xaa12 представляет собой аланин, сери, глутамин, глутаминовую кислоту, гистидин или аспарагин;
Xaa14 представляет собой тирозин, гистидин, лизин, аланин или аспарагиновую кислоту;
Xaa16 представляет собой аланин, лейцин, тирозин, гистидин, глутаминовую кислоту или аспарагин;
Xaa19 представляет собой тирозин, глутаминовую кислоту, серин или треонин; и Хаа21 представляет собой аспарагин, глицин, гистидин или аланин; и Общая Формула 3
Phe-Val-Asn-Gln-His-Leu-Cys-Gly-Ser-His-Leu-Val-Glu-Ala-Leu-Xaa16-Leu-Val-Cys-Gly-Glu-Arg-Gly-Phe-Xaa25-Tyr-Xaa27-Xaa28-Lys-Thr (SEQ ID NO: 56), где в общей формуле 3
Xaa16 представляет собой тирозин, глутаминовую кислоту, серни, треонин или аспарагиновую кислоту;
Хаа25 представляет собой фенилаланин, аспарагиновую кислоту или глутаминовую кислоту;
Хаа27 представляет собой треонин или отсутствует; и
Хаа28 представляет собой пролин, глутаминовую кислоту или аспарагиновую кислоту или отсутствует.
В еще одном приведенном в качестве примера воплощении X содержит А-цепь с последовательностью SEQ ID NO: 55, указанной в общей Формуле 2, и В-цепь с последовательностью SEQ ID NO: 54.
В еще одном приведенном в качестве примера воплощении X содержит А-цепь с последовательностью SEQ ID NO: 53, указанной в общей Формуле 2, и В-цепь с последовательностью SEQ ID NO: 56, указанной в общей формуле 3.
В еще одном приведенном в качестве примера воплощении в общей формуле 2
Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Xaa14 представляет собой тирозин, гистидин, лизин, аланин или аспарагиновую кислоту, Xaa16 представляет собой лейцин, Xaa19 представляет собой тирозин, глутаминовую кислоту, серин или треонин, и Хаа21 представляет собой аспарагин; и
в общей формуле 3
Xaa16 представляет собой тирозин, глутаминовую кислоту, серин, треонин или аспарагиновую кислоту; Хаа25 представляет собой фенилаланин, аспарагиновую кислоту или глутаминовую кислоту, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин.
В еще одном приведенном в качестве примера воплощении в общей формуле 2 Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Хаа14 представляет собой тирозин, Хаа16 представляет собой лейцин, Xaa19 представляет собой тирозин, глутаминовую кислоту или серин, и Хаа21 представляет собой аспарагин; и в общей формуле 3
Xaa16 представляет собой тирозин, глутаминовую кислоту, серин или аспарагиновую кислоту; Хаа25 представляет собой фенилаланин, аспарагиновую кислоту или глутаминовую кислоту, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин.
В еще одном приведенном в качестве примера воплощении X характеризуется тем,
что:
(1) в общей формуле 2 Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Xaa14 представляет собой гистидин, Xaa16 представляет собой лейцин, Xaa19 представляет собой тирозин, Хаа21 представляет собой аспарагин; и в общей формуле 3 Xaa16 представляет собой тирозин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(2) в общей формуле 2 Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Xaa14 представляет собой лизин, Xaa16 представляет собой лейцин, Xaa19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 3 Xaa16 представляет собой тирозин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(3) в общей формуле 2 Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Xaa14 представляет собой тирозин, Xaa16 представляет собой лейцин, Xaa19 представляет собой глутаминовую кислоту, и Хаа21 представляет собой аспарагин; и в общей формуле 3 Xaa16 представляет собой тирозин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(4) в общей формуле 2 Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Xaa14 представляет собой тирозин, Xaa16 представляет собой лейцин, Xaa19 представляет собой серин, и Хаа21 представляет собой аспарагин; и в общей формуле 3 Xaa16 представляет собой тирозин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(5) в общей формуле 2 Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Xaa14 представляет собой тирозин, Xaa16 представляет собой лейцин, Xaa19 представляет собой треонин, и Хаа21 представляет собой аспарагин; и в общей формуле 3 Xaa16 представляет собой тирозин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(6) в общей формуле 2 Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Xaa14 представляет собой тирозин, Xaa16 представляет собой лейцин, Xaa19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 3 Xaa16 представляет собой глутаминовую кислоту, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(7) в общей формуле 2 Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Xaa14 представляет собой тирозин, Xaa16 представляет собой лейцин, Xaa19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 3 Xaa16 представляет собой серин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(8) в общей формуле 2 Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Xaa14 представляет собой тирозин, Xaa16 представляет собой лейцин, Xaa19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 3 Xaa16 представляет собой треонин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(9) в общей формуле 2 Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Xaa14 представляет собой аланин, Xaa16 представляет собой лейцин, Xaa19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 3 Xaa16 представляет собой тирозин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(10) в общей формуле 2 Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Xaa14 представляет собой аспарагиновую кислоту, Xaa16 представляет собой лейцин, Xaa19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 3 Xaa16 представляет собой тирозин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(11) в общей формуле 2 Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Xaa14 представляет собой тирозин, Xaa16 представляет собой лейцин, Xaa19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 3 Xaa16 представляет собой аспарагиновую кислоту, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(12) в общей формуле 2 Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Xaa14 представляет собой тирозин, Xaa16 представляет собой лейцин, Xaa19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 3 Xaa16 представляет собой тирозин, Хаа25 представляет собой аспарагиновую кислоту, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(13) в общей формуле 2 Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Xaa14 представляет собой тирозин, Xaa16 представляет собой лейцин, Xaa19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 3 Xaa16 представляет собой тирозин, Хаа25 представляет собой глутаминовую кислоту, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин.
В еще одном приведенном в качестве примера воплощении X представляет собой аналог инсулина, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50 и 52.
В следующем приведенном в качестве примера воплощении в общей формуле 2 Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Xaa14 представляет собой тирозин, Xaa16 представляет собой лейцин, Xaa19 представляет собой глутаминовую кислоту, Хаа21 представляет собой аспарагин; и в общей формуле 3 Xaa16 представляет собой тирозин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин.
В следующем приведенном в качестве примера воплощении в общей формуле 2 Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Xaa14 представляет собой тирозин, Xaa16 представляет собой лейцин, Xaa19 представляет собой серин, Хаа21 представляет собой аспарагин; и в общей формуле 3 Xaa16 представляет собой тирозин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин.
В следующем приведенном в качестве примера воплощении в общей формуле 2 Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Xaa14 представляет собой тирозин, Xaa16 представляет собой лейцин, Xaa19 представляет собой треонин, и Хаа21 представляет собой аспарагин; и в общей формуле 3 Xaa16 представляет собой тирозин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин.
В следующем приведенном в качестве примера воплощении в общей формуле 2 Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Xaa14 представляет собой аспарагиновую кислоту, Xaa16 представляет собой лейцин, Xaa19 представляет собой тирозин, и Хаа21 представляет собой аспарагин;
и в общей формуле 3 Xaa16 представляет собой тирозин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин.
В следующем приведенном в качестве примера воплощении в общей формуле 2 Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Xaa14 представляет собой тирозин, Xaa16 представляет собой лейцин, Xaa19 представляет собой тирозин и Хаа21 представляет собой аспарагин; и в общей формуле 3 Xaa16 представляет собой тирозин, Хаа25 представляет собой аспарагиновую кислоту, Хаа27 представляет собой треонин и Хаа28 представляет собой пролин.
В следующем приведенном в качестве примера воплощении в общей формуле 2 Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Xaa14 представляет собой тирозин, Xaa16 представляет собой лейцин, Xaa19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 3 Xaa16 представляет собой тирозин, Хаа25 представляет собой глутаминовую кислоту, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин.
В следующем приведенном в качестве примера воплощении F выбран из группы, состоящей из полимера, жирной кислоты, холестерина, альбумина и его фрагмента, альбумин-связывающего вещества, полимера, состоящего из повторяющихся блоков конкретной аминокислотной последовательности, антитела, фрагмента антитела, FcRn-связывающего вещества, соединительной ткани in vivo, нуклеотида, фибронектина, трансферрина, сахарида, гепарина и эластина.
В следующем приведенном в качестве примера воплощении полимер выбран из группы, состоящей из полиэтиленгликоля, полипропиленгликоля, сополимера этиленгликоля и пропиленгликоля, полиоксиэтилированного полиола, поливинилового спирта, полисахарида, декстрана, поливинилэтилового эфира, биоразлагаемого полимера, липидного полимера, хитина, гиалуроновой кислоты, олигонуклеотида и их комбинации.
В еще одном приведенном в качестве примера воплощении F представляет собой Fc-фрагмент иммуноглобулина.
В еще одном приведенном в качестве примера воплощении F представляет собой Fc-фрагмент IgG.
В еще одном приведенном в качестве примера воплощении L выбран из группы, состоящей из пептида, жирной кислоты, сахарида, полимера, низкомолекулярного соединения, нуклеотида и их комбинации.
В еще одном приведенном в качестве примера воплощении полимер выбран из группы, состоящей из полиэтиленгликоля, полипропиленгликоля, сополимера этиленгликоля и пропиленгликоля, полиоксиэтилированного полиола, поливинилового спирта, полисахарида, декстрана, поливинилэтилового эфира, биоразлагаемого полимера, липидного полимера, хитина, гиалуроновой кислоты, олигонуклеотида и их комбинации.
В еще одном приведенном в качестве примера воплощении L представляет собой полиэтиленгликоль.
В еще одном приведенном в качестве примера воплощении полимер имеет молекулярную массу от 1 кДа до 100 кДа.
В еще одном приведенном в качестве примера воплощении линкер присоединен к N-концу В-цепи аналога инсулина или к остатку лизина в аналоге инсулина.
В еще одном приведенном в качестве примера воплощении F представляет собой Fc-фрагмент иммуноглобулина, а линкер присоединен к N-концу Fc-фрагмента иммуноглобулина.
В еще одном приведенном в качестве примера воплощении F представляет собой Fc-фрагмент, а конъюгат имеет структуру, в которой оба конца линкера присоединены к N-концу В-цепи аналога инсулина и к N-концу Fc-фрагмента иммуноглобулина.
В еще одном приведенном в качестве примера воплощении аналог инсулина представляет собой аналог, у которого аффинность связывания с рецептором нативного инсулина снижена по сравнению с нативным инсулином.
В еще одном приведенном в качестве примера воплощении аффинность связывания аналога инсулина с рецептором нативного инсулина составляет от приблизительно 10% до приблизительно 90% по сравнению с аффинностью нативного инсулина.
В еще одном приведенном в качестве примера воплощении конъюгат характеризуется тем, что F представляет собой Fc-фрагмент иммуноглобулина; L представляет собой полиэтиленгликоль, а аффинность связывания конъюгата с рецептором нативного инсулина составляет от 0,1% до 50% по сравнению с аффинностью нативного инсулина.
В еще одном приведенном в качестве примера воплощении конъюгат характеризуется тем, что F представляет собой Fc-фрагмент иммуноглобулина; L представляет собой полиэтиленгликоль, а X представляет собой аналог инсулина, имеющий последовательность, идентичную последовательности нативного инсулина, за исключением того, что 14-я аминокислота А-цепи представляет собой аспарагиновую кислоту.
В другом аспекте данного изобретения предложен полинуклеотид, кодирующий конъюгат; вектор, включающий полинуклеотид, и трансформант, включающий полинуклеотид или вектор, включающий полинуклеотид.
В еще одном аспекте данного изобретения предложен способ получения конъюгата.
В еще одном аспекте данного изобретения предложена композиция, содержащая конъюгат.
В приведенном в качестве примера воплощении композиция представляет собой фармацевтическую композицию.
В другом приведенном в качестве примера воплощении композиция представляет собой фармацевтическую композицию для предупреждения или лечения заболевания, связанного с инсулином.
В еще одном приведенном в качестве примера воплощении композиция представляет собой фармацевтическую композицию для предупреждения или лечения диабета.
В еще одном аспекте данного изобретения предложена композиция пролонгированного действия с увеличенной продолжительностью действия in vivo и/или стабильностью по сравнению с конъюгатом нативного инсулина, включающая конъюгат аналога инсулина.
В еще одном аспекте данного изобретения предложен способ лечения заболевания, связанного с инсулином, включающий стадию введения конъюгата аналога инсулина или его композиции субъекту, нуждающемуся в этом.
В приведенном в качестве примера воплощении заболевание, связанное с инсулином, представляет собой диабет.
В еще одном аспекте данного изобретения предложено применение конъюгата аналога инсулина для изготовления лекарственного средства.
В приведенном в качестве примера воплощении лекарственное средство предназначено для лечения заболевания, связанного с инсулином.
В другом приведенном в качестве примера воплощении лекарственное средство предназначено для предупреждения или лечения диабета.
В еще одном аспекте данного изобретения предложено применение конъюгата аналога инсулина в лечении заболевания, связанного с инсулином, в частности, диабета.
Полезные эффекты
Конъюгат не являющегося нативным аналога инсулина по данному изобретению может улучшать комплаентность пациентов, которым необходимо введение инсулина.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На Фиг. 1 показаны результаты анализа чистоты аналогов инсулина при электрофоретическом разделении белков, и в частности, результаты для репрезентативных аналогов инсулина 9, 10, 11 и 12 (дорожка 1: маркер размера фрагментов; дорожка 2: нативный инсулин; дорожка 3: аналог инсулина 9; дорожка 4: аналог инсулина 10; дорожка 5: аналог инсулина 11 и дорожка 6: аналог инсулина 12).
На Фиг. 2а - 2d показаны результаты анализа чистоты аналогов инсулина методом хроматографии высокого давления, и в частности, результаты для репрезентативных аналогов инсулина 9, 10, 11 и 12 (Фиг. 2а - 2d). На каждой из Фиг. в направлении сверху вниз приведены результаты высокоэффективной жидкостной хроматографии (ВЭЖХ) с обращенной фазой (С18), ВЭЖХ с обращенной фазой (С4) и эксклюзионной ВЭЖХ.
На Фиг. 3а - 3с представлены результаты сравнения фармакокинетических характеристик конъюгата «10 аналог инсулина-ПЭГ-Fc иммуноглобулина», который является репрезентативным конъюгатом аналога инсулина по данному изобретению, и конъюгата «нативный инсулин-ПЭГ-Fc иммуноглобулина», который является конъюгатом нативного инсулина, у нормальных мышей (Фиг. 3а), крыс SD (Фиг. 3b) и собак породы бигль (Фиг. 3с).
На Фиг. 4 представлены результаты сравнения способности снижать уровень глюкозы крови конъюгата «10 аналог инсулина-ПЭГ-Fc иммуноглобулина», который является репрезентативным конъюгатом аналога инсулина по данному изобретению, и конъюгата «нативный инсулин-ПЭГ-Fc иммуноглобулина», который является конъюгатом нативного инсулина, у крыс DIO/STZ.
Предпочтительные воплощения изобретения
Далее будут подробно описаны приведенные в качестве примера воплощения данного изобретения.
При этом каждое из объяснений и воплощений, приведенных в данном документе в качестве примера, может быть справедливо и для других объяснений и приведенных в качестве примера воплощений. Таким образом, все комбинации различных факторов, описанных в данном документе, входят в объем данного изобретения. Более того, объем данного изобретения не ограничивается конкретным описанием, приведенным ниже.
Кроме того, специалист в области техники может на основании рутинных методик обнаружить или подтвердить множество эквивалентов конкретных воплощений данного изобретения, описанных в данной заявке, и такие эквиваленты входят в объем данного изобретения.
В описании изобретения использованы стандартные 1-буквенные и 3-буквенные обозначения аминокислот. Кроме того, аминокислоты, упомянутые в данном документе, обозначаются аббревиатурами согласно правилам номенклатуры IUPAC-IUB.
В одном аспекте данного изобретения предложен конъюгат аналога инсулина.
В частности, конъюгат аналога инсулина может находиться в форме конъюгата, в котором аналог инсулина связан с биосовместимым материалом для увеличения времени полужизни аналога инсулина in vivo. В данном изобретении биосовместимый материал можно использовать взаимозаменяемо с носителем.
В данном изобретении конъюгат аналога инсулина может сохранять эффективность в течение более длительного времени по сравнению с аналогом инсулина, который не конъюгирован с носителем, и такой конъюгат в данном изобретении обозначают «конъюгат пролонгированного действия».
При этом, такой конъюгат может быть конъюгатом, не встречающимся в природе.
Более конкретно, в данном изобретении предложен конъюгат, представленный Формулой 1, приведенной ниже:
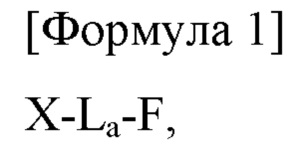
где в Формуле 1
X представляет собой аналог инсулина, имеющий модификацию одной или более чем одной аминокислоты, выбранной из группы, состоящей из 16-й аминокислоты В-цепи, 25-й аминокислоты В-цепи, 14-й аминокислоты А-цепи и 19-й аминокислоты А-цепи нативного инсулина;
L представляет собой линкер;
а представляет собой 0 или натуральное число, при условии, что, когда а равно 2 или более, каждый из L является независимым друг от друга, и
F представляет собой вещество, способное увеличивать время полужизни X.
В данном описании термин «аналог инсулина» относится к инсулину, не являющемуся нативным, который отличен от нативного инсулина. Аналог инсулина включает не являющийся нативным инсулин человека, который отличается от нативного инсулина человека. Аналог инсулина представляет собой группировку, образующую конъюгат по данному изобретению и соответствует X в Формуле 1.
Такой аналог инсулина включает аналоги, в которых некоторые аминокислоты нативного инсулина модифицированы в результате вставки, делеции или замены.
В частности, по сравнению с последовательностью нативного инсулина аналог инсулина по данному изобретению может обладать идентичностью по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94% или по меньшей мере 95%. Кроме того, аналог инсулина по данному изобретению может иметь более низкую аффинность связывания с нативным инсулиновым рецептором по сравнению с аффинностью нативного инсулина, при этом обладая указанной выше идентичностью с последовательностью нативного инсулина. Кроме этого, аналог инсулина может иметь способность абсорбировать глюкозу и/или способность снижать уровни глюкозы в крови in vivo, как показано для нативного инсулина.
В данном изобретении аффинность связывания какого-либо аналога инсулина с рецептором нативного инсулина относится к выраженному в процентах ингибированию связывания, которые демонстрируют аналог инсулина и нативный инсулин при определении уровней ингибирования связывания в условиях конкурентного ингибирования связывания с рецептором, где связывание любого детектируемого лиганда с рецептором нативного инсулина ингибируется в присутствии нативного инсулина или соответствующего аналога инсулина. Ингибирование связывания можно опосредовано определить по значениям, которые регистрируют при определении, происходит ли эффективное изменение сигналов, наблюдаемых при связывании лиганда с рецептором инсулина, согласно надлежащим критериям. Например, аффинность связывания можно определить по измеренному значению, выраженному в процентах (например, IC50 нативного инсулина в процентах относительно IC50 соответствующего аналога инсулина), полученному при определении, насколько увеличиваются или уменьшаются сигналы; что означает, что измеряют сигнал, испускаемый при связывании инсулина, меченного радиоактивным изотопом, с рецептором инсулина и определяют, насколько увеличивается или уменьшается каждый сигнал после добавления немеченого нативного инсулина или аналога инсулина (например, путем измерения значений IC50 снижения сигнала для нативного инсулина или аналога инсулина). Такое определение аффинности связывания с рецепторами методом конкурентного ингибирования хорошо известно в области техники. В приведенном в качестве примера воплощении данного изобретения в качестве рецептора нативного инсулина, необходимого для такого определения, можно применять клеточную мембрану, экспрессирующую нативный рецептор инсулина человека (изоформу А или изоформу В, или обе), например, клеточную мембрану клеток, которые были генетически модифицированы с целью повышенной экспрессии рецептора нативного инсулина человека. Кроме того, в качестве лиганда для детекции можно применять нативный инсулин, меченный йодом-125. В более конкретном воплощении изобретения для исследования конкурентного ингибирования связывания с рецептором можно применять сцинтилляционный анализ сближения (SPA). В следующем конкретном воплощении данного изобретения аффинность связывания с рецептором инсулина можно определять способом, описанным в Экспериментальном Примере 1.
Более конкретно, аналог инсулина по данному изобретению может демонстрировать аффинность связывания с рецептором инсулина, составляющую приблизительно 99% или ниже, приблизительно 95% или ниже, приблизительно 90% или ниже, приблизительно 85% или ниже, приблизительно 80% или ниже, приблизительно 75% или ниже, приблизительно 70% или ниже, приблизительно 65% или ниже, приблизительно 60% или ниже, приблизительно 55% или ниже, приблизительно 50% или ниже, приблизительно 45% или ниже, приблизительно 40% или ниже, приблизительно 35% или ниже, приблизительно 30% или ниже, приблизительно 25% или ниже, приблизительно 20% или ниже, приблизительно 15% или ниже, приблизительно 10% или ниже, приблизительно 9% или ниже, приблизительно 8% или ниже, приблизительно 7% или ниже, приблизительно 6% или ниже, приблизительно 5% или ниже, приблизительно 4% или ниже, приблизительно 3% или ниже, приблизительно 2% или ниже, приблизительно 1% или ниже, или приблизительно 0,1% или ниже по сравнению с аффинностью связывания нативного инсулина с рецептором инсулина (100%) (однако аффинность связывания аналога инсулина по данному изобретению с рецептором инсулина не равна 0%). В конкретном воплощении данного изобретения аффинность связывания аналога инсулина с рецептором нативного инсулина составляет от приблизительно 10% до приблизительно 90%, но не ограничивается указанными значениями. Кроме того, если аффинность связывания является слабой по сравнению с аффинностью нативного инсулина, аналог инсулина входит в объем данного изобретения. Если аффинность связывания слабее, чем у нативного инсулина, элиминация аналога инсулина, опосредованная инсулиновым рецептором, будет уменьшена, и поэтому можно ожидать улучшение времени полужизни в крови и устойчивость эффекта.
В одном воплощении данного изобретения линкер в составе конъюгата аналога инсулина может представлять собой полиэтиленгликоль; вещество, способное увеличивать время полужизни, может представлять собой Fc-фрагмент иммуноглобулина; и аффинность связывания с рецептором нативного инсулина может составлять приблизительно 99% или ниже, приблизительно 95% или ниже, приблизительно 90% или ниже, приблизительно 85% или ниже, приблизительно 80% или ниже, приблизительно 75% или ниже, приблизительно 70% или ниже, приблизительно 65% или ниже, приблизительно 60% или ниже, приблизительно 55% или ниже, приблизительно 50% или ниже, приблизительно 45% или ниже, приблизительно 40% или ниже, приблизительно 35% или ниже, приблизительно 30% или ниже, приблизительно 25% или ниже, приблизительно 20% или ниже, приблизительно 15% или ниже, приблизительно 10% или ниже, приблизительно 9% или ниже, приблизительно 8% или ниже, приблизительно 7% или ниже, приблизительно 6% или ниже, приблизительно 5% или ниже, приблизительно 4% или ниже, приблизительно 3% или ниже, приблизительно 2% или ниже, приблизительно 1% или ниже, или приблизительно 0,1% или ниже по сравнению с аффинностью связывания нативного инсулина (однако аффинность связывания конъюгата аналога инсулина по данному изобретению с рецептором инсулина не равна 0%). В конкретном воплощении данного изобретения аффинность связывания конъюгата аналога инсулина с рецептором нативного инсулина предпочтительно составляет от 0,1% до 50%, но не ограничивается указанными значениями. Кроме того, если аффинность связывания слабее по сравнению с аффинностью нативного инсулина, она входит в объем данного изобретения. Если аффинность связывания слабее, чем у нативного инсулина, элиминация конъюгата аналога инсулина, опосредованная инсулиновым рецептором, будет уменьшена, и поэтому можно ожидать улучшение времени полужизни в крови и устойчивость эффекта.
В данном описании термин «приблизительно» относится к диапазону, включающему ±0,5, ±0,4, ±0,3, ±0,2, ±0,1 и т.д. и поэтому включает все входящие в диапазон значения, которые являются эквивалентными или близкими значениям, указанным после этого термина, без ограничения.
Кроме того, аналог инсулина по данному изобретению может обладать способностью опосредовать захват глюкозы, как показано для нативного инсулина.
В частности, аналог инсулина по данному изобретению может обладать способностью опосредовать захват глюкозы, составляющей приблизительно 10% или выше, приблизительно 20% или выше, приблизительно 30% или выше, приблизительно 40% или выше, приблизительно 50% или выше, приблизительно 55% или выше, приблизительно 60% или выше, приблизительно 65% или выше, приблизительно 70% или выше, приблизительно 75% или выше, приблизительно 80% или выше, приблизительно 85% или выше, приблизительно 90% или выше, приблизительно 95% или выше, приблизительно 100% или выше, приблизительно 110% или выше, приблизительно 120% или выше, приблизительно 130% или выше, приблизительно 140% или выше, приблизительно 150% или выше, приблизительно 160% или выше, приблизительно 170% или выше, приблизительно 180% или выше, приблизительно 190% или выше или приблизительно 200% или выше по сравнению со способностью нативного инсулина опосредовать захват глюкозы (100%).
Способность опосредовать захват глюкозы можно измерять различными способами, известными в области техники.
В частности, аналог инсулина может представлять собой одну цепь, в которой оба из двух участков последовательностей, соответствующих А-цепи и В-цепи его нативной формы, связаны в одну полипептидную цепь, или может быть в форме двух полипептидных цепей, где каждый из двух участков последовательности образован отдельными полипептидными цепями. Далее при упоминании в данном описании А-цепи или В-цепи аналога инсулина следует интерпретировать в зависимости от контекста, что это относится к А-цепи или В-цепи соответствующего аналога инсулина, находящегося в форме двух полипептидных цепей, и что это относится к участку последовательности, соответствующему нативной А-цепи соответствующего одноцепочечного полипептида, или к участку последовательности, соответствующему нативной В-цепи соответствующего одноцепочечного полипептида, соответственно, даже когда аналог находится в одноцепочечной форме. Аналог инсулина по данному изобретению может быть в форме одной цепи или в форме двух полипептидных цепей, которые являются комбинацией одной цепи, выбранной из А-цепи нативного инсулина или соответствующего ей полипептида, и одной цепи, выбранной из В-цепи нативного инсулина или соответствующего ей полипептида. В частности, соответствие А-цепи или В-цепи нативного инсулина может, например, относиться к случаям, когда любая полипептидная цепь из двух полипептидных цепей обладает идентичностью по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94% или по меньшей мере 95% по сравнению с последовательностью А-цепи или В-цепи нативного инсулина, без конкретного ограничения, и специалист в области техники может легко установить это путем сравнения последовательности, составляющей соответствующий полипептид, и последовательности А-цепи или В-цепи нативного инсулина.
Как указано выше, приведенное ниже описание применимо ко всем описаниям, относящимся к подпонятиям аналога инсулина.
Нативный инсулин представляет собой гормон, секретируемый поджелудочной железой, который способствует внутриклеточному захвату глюкозы и ингибирует распад жира, тем самым контролируя уровни глюкозы крови in vivo. Инсулин, который способен контролировать уровни глюкозы крови, образуется в результате процессинга его предшественника, проинсулина, который не выполняет функцию контролирования уровней глюкозы крови. Инсулин состоит из двух полипептидных цепей, т.е. А-цепи и В-цепи, которые включают 21 и 30 аминокислот, соответственно, и связаны между собой дисульфидными мостиками. Каждая из А-цепи и В-цепи может включать аминокислотные последовательности, представленные SEQ ID NO: 53 и 54, приведенными ниже.
А-цепь:
Gly-Ile-Val-Glu-Gln-Cys-Cys-Thr-Ser-Ile-Cys-Ser-Leu-Tyr-Gln-Leu-Glu-Asn-Tyr-Cys-Asn (SEQ ID NO: 53)
В-цепь:
Phe-Val-Asn-Gln-His-Leu-Cys-Gly-Ser-His-Leu-Val-Glu-Ala-Leu-Tyr-Leu-Val-Cys-Gly-Glu-Arg-Gly-Phe-Phe-Tyr-Thr-Pro-Lys-Thr (SEQ ID NO: 54)
В приведенном в качестве примера воплощении аналоги инсулина, описанные в данном изобретении, могут представлять собой аналоги со сниженной аффинностью связывания с рецепторами, при этом выполняющие функцию контролирования уровней глюкозы крови in vivo, как нативный инсулин. Более конкретно, аналог инсулина может обладать способностью снижать уровни глюкозы крови in vivo.
Кроме того, в приведенном в качестве примера воплощении тип и размер аналогов инсулина не ограничивается каким-то конкретным, при условии, что они могут демонстрировать уменьшенную рецептор-опосредованную интернализацию или рецептор-опосредованный клиренс. Соответственно, аналоги инсулина по данному изобретению могут демонстрировать улучшенное время полужизни в крови по сравнению с нативным инсулином.
Аналоги инсулина по данному изобретению включают инвертированный инсулин, производные нативного инсулина, фрагменты нативного инсулина и т.д. Аналоги инсулина могут быть получены не только рекомбинантными способами, но также и при помощи твердофазного синтеза, и способы получения не ограничиваются указанными.
В данном описании термин «производные нативного инсулина» относится к пептиду, аминокислотная последовательность которого имеет по меньшей мере одно различие с нативным инсулином, к пептиду, полученному в результате модификации последовательности нативного инсулина, и миметику нативного инсулина, которые способны контролировать уровни глюкозы в крови in vivo как нативный инсулин. Такие производные нативного инсулина могут представлять собой производные, которые осуществляют функцию контролирования уровней глюкозы крови in vivo.
В частности, производные нативного инсулина могут быть получены посредством модификации части аминокислот нативного инсулина любым способом из: замены, вставки, делеции, модификации или комбинации способов.
В частности, производные нативного инсулина могут обладать гомологией 80% или выше с каждой из аминокислотных последовательностей А-цепи и В-цепи нативного инсулина и/или часть групп аминокислотных остатков может быть модифицирована путем химической замены (например, альфа-метилирования, альфа-гидроксилирования), делеции (например, дезаминирования) или модификации (например, N-метилирования) и т.д., без ограничения.
Производные нативного инсулина, используемые в данном изобретении, могут быть получены комбинацией различных способов, используемых для получения производных.
Кроме того, такие модификации для получения производных нативного инсулина включают модификацию с использованием аминокислот L-типа или D-типа и/или аминокислот искусственного происхождения; и/или модификацию нативной последовательности или пост-трансляционную модификацию (например, метилирование, ацилирование, убиквитинирование, межмолекулярные ковалентные связи и т.д.).
Кроме того, все производные нативного инсулина включают производные, в которых одна или более аминокислот добавлены к амино- и/или карбокси-концу нативного инсулина.
При замене или вставке аминокислот(ы) можно использовать не только 20 аминокислот, обычно встречающихся в белках человека, но также и нетипичные или имеющие искусственное происхождение аминокислоты. Коммерческими источниками атипичных аминокислот могут быть компании Sigma-Aldrich, ChemPep Inc. и Genzyme Pharmaceuticals. Последовательности пептидов, включающих указанные аминокислоты, а также типичных пептидов можно синтезировать или приобретать у компаний, осуществляющих синтез пептидов на коммерческой основе, например, American Peptide Company, Bachem (США) или Anygen (Корея), без конкретного ограничения.
В данном описании термин «фрагменты нативного инсулина или фрагменты производных нативного инсулина» относится к форме инсулина, в которой удалена по меньшей мере одна аминокислота на амино-конце или карбокси-конце нативного инсулина или производного нативного инсулина. Такой фрагмент инсулина может осуществлять функцию контролирования уровней глюкозы крови in vivo.
Кроме того, аналоги инсулина по данному изобретению могут представлять собой аналоги, полученные способами для получения производных и фрагментов нативного инсулина независимо друг от друга или в комбинации.
В частности, аналоги инсулина по данному изобретению могут включать аналоги, имеющие модификацию А-цепи и В-цепи нативного инсулина, описанную выше, и в частности, аналоги, в которых модифицированы конкретные аминокислотные остатки А-цепи нативного инсулина и/или модифицированы конкретные аминокислотные остатки В-цепи нативного инсулина.
В частности, аналоги инсулина могут представлять собой аналоги, в которых по меньшей мере одна аминокислота, выбранная из группы, состоящей из 16-й аминокислоты В-цепи нативного инсулина, 25-й аминокислоты В-цепи, 14-й аминокислоты А-цепи и 19-й аминокислоты А-цепи нативного инсулина замещена другой аминокислотой, и в частности, может быть замещена глутаминовой кислотой, серином, треонином, аспарагиновой кислотой, гистидином, лизином или аланином, без ограничения.
В частности, аналоги инсулина могут представлять собой аналоги, в которых по меньшей мере одна, по меньшей мере две, по меньшей мере три или по меньшей мере четыре аминокислоты из указанных выше аминокислот замещены другими аминокислотами.
В частности, модификация может представлять собой модификацию 16-й аминокислоты В-цепи инсулина (т.е. тирозина) на глутаминовую кислоту, серин, треонин или аспарагиновую кислоту; модификацию 25-й аминокислоты В-цепи инсулина (т.е. фенилаланина) на аспарагиновую кислоту или глутаминовую кислоту; модификацию 14-й аминокислоты А-цепи инсулина (т.е. тирозина) на гистидин, лизин, аланин или аспарагиновую кислоту или модификацию 19-й аминокислоты А-цепи инсулина (т.е. тирозина) на глутаминовую кислоту, серин или треонин.
Таким образом, аналог инсулина может включать модификацию 16-й аминокислоты В-цепи нативного инсулина (т.е. тирозина) на глутаминовую кислоту, серин, треонин или аспарагиновую кислоту; и/или модификацию 25-й аминокислоты В-цепи нативного инсулина (т.е. фенилаланина) на аспарагиновую кислоту или глутаминовую кислоту; и/или модификацию 14-й аминокислоты А-цепи нативного инсулина (т.е. тирозина) на гистидин, лизин, аланин или аспарагиновую кислоту и/или модификацию 19-й аминокислоты А-цепи нативного инсулина (т.е. тирозина) на глутаминовую кислоту, серин или треонин, без ограничения.
Более конкретно, аналоги инсулина могут представлять собой аналоги, включающие А-цепь последовательности SEQ ID NO: 55, представленной ниже общей Формулой 2, и В-цепь последовательности SEQ ID NO: 56, представленной ниже общей Формулой 3. Эти аналоги инсулина могут находиться в форме, где А-цепь и В-цепь связаны между собой дисульфидной связью, или в форме проинсулина, но не ограничиваться указанными.
Общая Формула 2
Xaal-Ile-Val-Glu-Xaa5-Cys-Cys-Thr-Ser-Ile-Cys-Xaa12-Leu-Xaa14-Gln-Xaa16-Glu-Asn-Xaa19-Cys-Xaa21 (SEQ ID NO: 55)
В общей формуле 2
Xaa1 представляет собой аланин, глицин, глутамин, гистидин, глутаминовую кислоту или аспарагин;
Хаа5 представляет собой аланин, глутаминовую кислоту, глутамин, гистидин или аспарагин;
Xaa12 представляет собой аланин, серин, глутамин, глутаминовую кислоту, гистидин или аспарагин;
Xaa14 представляет собой тирозин, гистидин, лизин, аланин или аспарагиновую кислоту;
Xaa16 представляет собой аланин, лейцин, тирозин, гистидин, глутаминовую кислоту или аспарагин;
Xaa19 представляет собой тирозин, глутаминовую кислоту, серин или треонин; и
Хаа21 представляет собой аспарагин, глицин, гистидин или аланин.
Общая Формула 3
Phe-Val-Asn-Gln-His-Leu-Cys-Gly-Ser-His-Leu-Val-Glu-Ala-Leu-Xaa16-Leu-Val-Cys-Gly-Glu-Arg-Gly-Phe-Xaa25-Tyr-Xaa27-Xaa28-Lys-Thr (SEQ ID NO: 56)
в общей формуле 3
Xaa16 представляет собой тирозин, глутаминовую кислоту, серин, треонин или аспарагиновую кислоту;
Хаа25 представляет собой фенилаланин, аспарагиновую кислоту или глутаминовую кислоту;
Хаа27 представляет собой треонин или отсутствует; и
Хаа28 представляет собой пролин, глутаминовую кислоту или аспарагиновую кислоту или отсутствует.
При этом, пептиды, в которых А-цепь совпадает с SEQ ID NO: 53, тогда как В-цепь при этом совпадает с SEQ ID NO: 54, могут исключаться.
Кроме того, пептиды, которые обладают гомологией 70% или выше, в частности, 80% или выше, более конкретно, 90% или выше и еще более конкретно, 95% или выше, с последовательностью соответствующего аналога инсулина, включающего А-цепь Общей Формулы 2, приведенной выше, и В-цепь Общей Формулы 3, приведенной выше, при этом включающие характерные модификации (т.е. аминокислотные остатки, не присутствующие в нативном инсулине) 14-й и/или 19-й аминокислот А-цепи и/или 16-й и/или 25-й аминокислот В-цепи, описанные выше, и обладающие пониженной аффинностью связывания с рецепторами по сравнению с нативным инсулином, также входят в объем данного изобретения.
В данном описании термин «гомология» относится к степени сходства с аминокислотной последовательностью белка дикого типа или кодирующей его нуклеотидной последовательностью, и охватывает последовательности, которые имеют указанную выше степень сходства последовательностей, выраженную в процентах, с аминокислотными последовательностями или нуклеотидными последовательностями по данному изобретению. Такую гомологию можно определять путем сравнения двух заданных последовательностей невооруженным глазом или можно определять при помощи биоинформационного алгоритма, который анализирует гомологию путем выравнивания двух последовательностей. Гомология между двумя аминокислотными последовательностями может быть указана в процентах. Существуют эффективные автоматизированные алгоритмы, которые можно применять как в программных модулях GAP, BESTFIT и FASTA пакета программ Wisconsin Genetics (Genetics Computer Group, Madison, WI, США), так и TFASTA. Автоматизированные алгоритмы выравнивания в указанных модулях включает алгоритмы выравнивания последовательностей Нидлмана и Вунша, Пирсона и Липмана, а также Смита и Ватермана. Другие автоматизированные алгоритмы, которые можно применять для выравнивания последовательностей и определения гомологии, включают FASTP, BLAST, BLAST2, PSIBLAST и CLUSTAL W.
В приведенном в качестве примера воплощении аналог инсулина может представлять собой аналог инсулина, включающий А-цепь последовательности SEQ ID NO: 55, представленной общей Формулой 2 выше, и В-цепь последовательности SEQ ID NO: 54; или аналог инсулина инсулина, включающий А-цепь последовательности SEQ ID NO: 53 и В-цепь последовательности SEQ ID NO: 56, представленной общей Формулой 3 выше, без конкретного ограничения.
Более конкретно, аналог инсулина может представлять собой аналог инсулина, где в общей формуле 2 Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Xaa14 представляет собой тирозин, гистидин, лизин, аланин или аспарагиновую кислоту, Xaa16 представляет собой лейцин, Xaa19 представляет собой тирозин, глутаминовую кислоту, серин или треонин; и Хаа21 представляет собой аспарагин; и в общей формуле 3 Xaa16 представляет собой тирозин, глутаминовую кислоту, серин, треонин или аспарагиновую кислоту; Хаа25 представляет собой фенилаланин, аспарагиновую кислоту или глутаминовую кислоту, Хаа27 представляет собой треонин и Хаа28 представляет собой пролин, но не ограничиваться таковым.
Более конкретно, аналог инсулина может представлять собой аналог инсулина, где в общей формуле 2 Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Xaa14 представляет собой тирозин, Xaa16 представляет собой лейцин, Xaa19 представляет собой тирозин, глутаминовую кислоту или серин, и Хаа21 представляет собой аспарагин; и в общей формуле 3 Xaa16 представляет собой тирозин, глутаминовую кислоту, серин или аспарагиновую кислоту; Хаа25 представляет собой фенилаланин, аспарагиновую кислоту или глутаминовую кислоту, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин, но не ограничиваться таковым.
Более конкретно, аналог инсулина может представлять собой аналог инсулина, где в общей формуле 2 Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Xaa14 представляет собой тирозин или аспарагиновую кислоту, Xaa16 представляет собой лейцин, Xaa19 представляет собой тирозин, глутаминовую кислоту, серин или треонин, и Хаа21 представляет собой аспарагин; и в общей формуле 3 Xaa16 представляет собой тирозин, Хаа25 представляет собой фенилаланин, аспарагиновую кислоту или глутаминовую кислоту, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин, но не ограничиваться таковым.
В приведенном в качестве примера воплощении аналог инсулина по данному изобретению может соответствовать следующим аналогам инсулина:
(1) в общей формуле 2 Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Xaa14 представляет собой гистидин, Xaa16 представляет собой лейцин, Xaa19 представляет собой тирозин, Хаа21 представляет собой аспарагин; и в общей формуле 3 Xaa16 представляет собой тирозин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(2) в общей формуле 2 Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Xaa14 представляет собой лизин, Xaa16 представляет собой лейцин, Xaa19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 3 Xaa16 представляет собой тирозин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(3) в общей формуле 2 Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Xaa14 представляет собой тирозин, Xaa16 представляет собой лейцин, Xaa19 представляет собой глутаминовую кислоту, и Хаа21 представляет собой аспарагин; и в общей формуле 3 Xaa16 представляет собой тирозин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(4) в общей формуле 2 Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Xaa14 представляет собой тирозин, Xaa16 представляет собой лейцин, Xaa19 представляет собой серин, и Хаа21 представляет собой аспарагин; и в общей формуле 3 Xaa16 представляет собой тирозин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(5) в общей формуле 2 Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Xaa14 представляет собой тирозин, Xaa16 представляет собой лейцин, Xaa19 представляет собой треонин, и Хаа21 представляет собой аспарагин; и в общей формуле 3 Xaa16 представляет собой тирозин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(6) в общей формуле 2 Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Xaa14 представляет собой тирозин, Xaa16 представляет собой лейцин, Xaa19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 3 Xaa16 представляет собой глутаминовую кислоту, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(7) в общей формуле 2 Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Xaa14 представляет собой тирозин, Xaa16 представляет собой лейцин, Xaa19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 3 Xaa16 представляет собой серин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(8) в общей формуле 2 Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Xaa14 представляет собой тирозин, Xaa16 представляет собой лейцин, Xaa19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 3 Xaa16 представляет собой треонин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(9) в общей формуле 2 Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Xaa14 представляет собой аланин, Xaa16 представляет собой лейцин, Xaa19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 3 Xaa16 представляет собой тирозин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(10) в общей формуле 2 Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Xaa14 представляет собой аспарагиновую кислоту, Xaa16 представляет собой лейцин, Xaa19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 3 Xaa16 представляет собой тирозин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(11) в общей формуле 2 Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Xaa14 представляет собой тирозин, Xaa16 представляет собой лейцин, Xaa19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 3 Xaa16 представляет собой аспарагиновую кислоту, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(12) в общей формуле 2 Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Xaa14 представляет собой тирозин, Xaa16 представляет собой лейцин, Xaa19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 3 Xaa16 представляет собой тирозин, Хаа25 представляет собой аспарагиновую кислоту, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин; и
(13) в общей формуле 2 Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Xaa14 представляет собой тирозин, Xaa16 представляет собой лейцин, Xaa19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 3 Xaa16 представляет собой тирозин, Хаа25 представляет собой глутаминовую кислоту, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин.
Кроме того, в приведенном в качестве примера воплощении аналог инсулина может представлять собой аналог инсулина, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50 и 52, без ограничения.
Аналог инсулина по данному изобретению может представлять собой аналог, включающий определенную последовательность, описанную выше, и аналог, (по существу) состоящий из описанной выше определенной последовательности, но не ограничиваться таковым.
Кроме того, хотя в данном изобретении он обозначается «пептидом, состоящим из определенной SEQ ID NO», он не исключает какой-либо вставки бессмысленной последовательности по ходу или против хода транскрипции относительно аминокислотной последовательности соответствующей SEQ ID NO или ее мутаций естественного происхождения или молчащих мутаций, при условии, что пептид обладает такой же или эквивалентной активностью, как и пептид, состоящий из аминокислотной последовательности соответствующей SEQ ID NO, и очевидно, что пептид, включающий такую вставку последовательности или мутацию также входит в объем данного изобретения.
При этом аналог инсулина включает все из перечисленного: собственно пептид, его соли (например, фармацевтически приемлемую соль пептида) или сольваты.
Кроме того, пептид может быть в любой фармацевтически приемлемой форме.
Тип соли не ограничивается каким-либо конкретным. Однако соль предпочтительно находится форме, которая безопасна и эффективна для субъекта (например, млекопитающих), но не ограничивается конкретными солями.
В данном описании термин «фармацевтически приемлемый» относится к веществу, который можно эффективно применять по целевому назначению в рамках медико-фармацевтического решения, не вызывая избыточной токсичности, раздражения, аллергического ответа и т.д.
В данном описании термин «фармацевтически приемлемая соль» включает соль, производную фармацевтически приемлемых неорганических кислот, органических кислот или оснований. Примеры подходящих солей могут включать соляную кислоту, бромноватую кислоту, серную кислоту, азотную кислоту, перхлорную кислоту, фумаровую кислоту, малеиновую кислоту, фосфорную кислоту, гликолевую кислоту, молочную кислоту, салициловую кислоту, янтарную кислоту, толуол-пара-сульфоновую кислоту, винную кислоту, уксусную кислоту, лимонную кислоту, метансульфоновую кислоту, муравьиную кислоту, бензойную кислоту, малоновую кислоту, нафталин-2-сульфоновую кислоту, бензолсульфоновую кислоту и т.д. Соли, являющиеся производными подходящих оснований, могут включать щелочные металлы, такие как натрий, калий и т.д., щелочно-земельные металлы, такие как магний, и т.д., аммоний и т.д.
Кроме того, в данном описании термин «сольват» относится к комплексу, образованному между пептидом по данному изобретению или его солью и молекулой растворителя.
Аналоги инсулина могут быть легко получены специалистом в области техники при помощи способов получения пептидов, известных в области техники. Например, аналоги инсулина могут быть получены способом, включающим следующие стадии:
a) экспрессию аналога инсулина посредством культивирования трансформанта, включающего нуклеиновую кислоту, кодирующую аналог инсулина; и
b) выделение и очистку экспрессированного аналога инсулина.
Среда, используемая в данном изобретении для культивирования трансформантов, может отвечать требованиям для культивирования клеток-хозяев соответствующим образом. Специалист в области техники может выбрать надлежащие источники углерода, которые должны содержаться в среде для роста клетки-хозяина, в зависимости от полученных трансформантов, и может выбрать надлежащие условия культивирования для контролирования продолжительности и масштабов культивирования.
Примеры используемого источника сахара могут включать сахара и углеводы, такие как глюкоза, сахароза, лактоза, фруктоза, мальтоза, крахмал и целлюлоза; масла и жиры, такие как соевое масло, масло семян подсолнечника, касторовое масло и кокосовое масло; жирные кислоты, такие как пальмитиновая кислота, стеариновая кислота и линолевая кислота; спирты, такие как глицерин и этанол; и органические кислоты, такие как уксусная кислота. Указанные вещества можно использовать в отдельности или в комбинации.
Примеры используемого источника азота могут включать пептон, дрожжевой экстракт, мясной экстракт, мальтозный экстракт, кукурузный экстракт, соевую муку и мочевину или неорганические соединения, такие как сульфат аммония, хлорид аммония, фосфат аммония, карбонат аммония и нитрат аммония. Источник азота также можно применять в отдельности или в комбинации.
Примеры используемого источника фосфора могут включать однозамещенный фосфат калия или двузамещенный фосфат калия или соответствующую натрий-содержащую соль. Кроме того, среда для культивирования может содержать соль металла, необходимую для роста трансформанта, такую как сульфат магния или сульфат железа.
Наконец, можно использовать незаменимые для роста вещества, такие как аминокислоты и витамины. Дополнительно можно также использовать надлежащие предшественники для культуральной среды. Указанные выше источники можно надлежащим образом добавлять в культуру в ходе культивирования партиями или непрерывной культуры. Можно надлежащим образом доводить рН культуры с помощью основного соединения, такого как гидроксид натрия, гидроксид калия и аммония, или кислотного соединения, такого как фосфорная кислота или серная кислота. Кроме того, для предупреждения образования пены можно добавлять пеногаситель, такой как сложный полигликолевый эфир жирной кислоты. Кроме того, для поддержания аэробного состояния культуры можно закачивать в культуру кислород или кислород-содержащий газ (например, воздух).
Трансформанты по данному изобретению можно культивировать при температуре от 20°С до 45°С, и в частности, от 25°С до 40°С. Кроме того, культивирование продолжают до тех пор, пока не будет получено максимальное количество продуцируемых целевых аналогов инсулина, и в этой связи культивирование обычно можно продолжать от 10 часов до 160 часов.
Как описано выше, трансформант по данному изобретению может продуцировать аналоги инсулина, когда обеспечены надлежащие условия культивирования, соответствующие клеткам-хозяевам, и продуцируемые аналоги инсулина могут секретироваться в цитоплазму или в периплазматическое пространство клетки-хозяина или внеклеточно в зависимости от состава вектора и характеристик клетки-хозяина.
Экспрессируемые внутрь клетки-хозяина или во внешнее пространство белки можно очищать стандартным способом. Примеры способа очистки могут включать высаливание (например, преципитацию сульфатом аммония, преципитацию фосфатом кальция и т.д.), преципитацию растворителем (например, преципитацию белковой фракции с применением ацетона или этанола и т.д.), диализ, гель-фильтрацию, хроматографию, такую как ионообменная хроматография или колоночная хроматография с обращенной фазой, ультрафильтрация и т.д. и указанные способы можно применять в отдельности или в комбинации.
В приведенном в качестве примера воплощении данное изобретение может дополнительно включать следующие стадии для выделения из трансформанта аналога инсулина, экспрессированного в форме телец включения, и его очистки:
b-1) получение трансформанта из культуры на стадии а) и его измельчение;
b-2) выделение экспрессированного аналога инсулина из лизата измельченных клеток с последующим его рефолдингом;
b-3) очистку прошедшего рефолдинг аналога инсулина при помощи катионообменной хроматографии;
b-4) обработку очищенного аналога инсулина трипсином и карбоксипептидазой В; и
b-5) последовательную очистку обработанного аналога инсулина при помощи катионообменной хроматографии и анионообменной хроматографии или хроматографии с обращенной фазой.
В данном изобретении нуклеиновая кислота, кодирующая аналог инсулина, включает нуклеотидные последовательности, представленные SEQ ID NOS: 27, 29, 31, 33, 35, 37, 39, 41, 43, 45, 47, 49 или 51. В приведенном в качестве примера воплощении нуклеиновая кислота по данному изобретению включает не только нуклеотидные последовательности, представленные SEQ ID NOS: 27, 29, 31, 33, 35, 37, 39, 41, 43, 45, 47, 49 или 51, но также включает все последовательности, которые обладают с указанными последовательностями гомологией по меньшей мере 70%, предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 90%, еще более предпочтительно по меньшей мере 95% и наиболее предпочтительно по меньшей мере 98%, где пептид, кодируемый вышеуказанной нуклеиновой кислотой демонстрирует сниженную аффинность связывания с рецепторами по сравнению с нативным инсулином, при этом по существу обладая функцией контролирования уровней глюкозы крови in vivo.
Рекомбинантный вектор по данному изобретению может быть построен как типичный вектор для клонирования или для экспрессии и может быть сконструирован как вектор для применения в эукариотических или прокариотических клетках-хозяевах.
В данном описании термин «вектор» относится к рекомбинантному вектору, способному экспрессировать целевой белок в соответствующей клетке-хозяине, представляющему собой нуклеиновокислотную конструкцию, включающую незаменимые факторы регуляции, функционально связанные с встроенной нуклеиновой кислотой для обеспечения ее экспрессии. В данном изобретении можно получать рекомбинантный вектор, который включает нуклеиновую кислоту, кодирующую аналог инсулина, и аналог инсулина по данному изобретению может быть получен посредством трансформации или трансфекции клетки-хозяина рекомбинантным вектором.
В данном изобретении нуклеиновая кислота, кодирующая аналог инсулина, может быть функционально связана с промотором.
Способ трансформации рекомбинантным вектором, включающим нуклеиновую кислоту, кодирующую аналог инсулина по данному изобретению не может ограничиваться указанными способами, напротив, может применяться любой способ трансформации или трансфекции, обычно используемый в области техники, без ограничения.
Трансформант по данному изобретению может быть получен путем введения рекомбинантного вектора, включающего целевую нуклеиновую кислоту, которая кодирует аналог инсулина, в клетку-хозяина.
Подходящий хозяин для применения в данном изобретении не ограничивается какими-либо конкретными, при условии, что он может экспрессировать нуклеиновую кислоту по данному изобретению. Примеры подходящих хозяев могут включать бактерии, относящиеся к роду Escherichia, такие как Е. coli; бактерии, относящиеся к роду Bacillus, такие как Bacillus subtilis; бактерии, относящиеся к роду Pseudomonas, такие как Pseudomonas putida; дрожжи, такие как Pichia pastoris, Saccharomyces cerevisiae и Schizosaccharomyces pombe; клетки насекомых, таких как Spodoptera frugiperda (Sf9), и клетки животных, такие как СНО, COS и BSC. В частности, в качестве клетки-хозяина можно использовать Е. coli, однако хозяева ими не ограничиваются.
При этом F в составе конъюгата представляет собой вещество, способное увеличивать время полужизни X; и соответствует группировке, составляющей часть конъюгата по данному изобретению.
F и X могут быть связаны друг с другом посредством ковалентной химической связи или нековалентной химической связи, и в качестве альтернативы F и X могут быть связаны друг с другом посредством ковалентной химической связи, нековалентной химической связи или их комбинации.
Более конкретно, X и L, а также L и F могут быть связаны друг с другом посредством ковалентной связи. Так, конъюгат представляет собой конъюгат, в котором X, L и F связаны друг с другом посредством ковалентной связи в порядке, указанном в Формуле 1.
Вещество, способное увеличивать время полужизни X, может представлять собой биосовместимый материал и, например, может быть выбрано из группы, состоящей из полимера, жирной кислоты, холестерина, альбумина и его фрагмента, альбумин-связывающего вещества, полимера, состоящего из повторяющихся блоков конкретной аминокислотной последовательности, антитела, фрагмента антитела, FcRn-связывающего вещества, соединительной ткани in vivo, нуклеотида, фибронектина, трансферрина, сахарида, гепарина и эластина, но не ограничивается перечисленным.
Что касается эластина, он может представлять собой тропоэластин человека, который является водорастворимым предшественником, и может представлять собой полимер части последовательности или части ее повторяющихся единиц. Например, эластин может включать эластин-подобный пептид, но не ограничивается им.
Примеры полимера включают полимер, выбранный из группы, состоящей из полиэтиленгликоля (ПЭГ), полипропиленгликоля, сополимера этиленгликоля и пропиленгликоля, полиоксиэтилированного полиола, поливинилового спирта, полисахарида, декстрана, поливинилэтилового эфира, биоразлагаемого полимера, липидного полимера, хитина, гиалуроновой кислоты, олигонуклеотида и их комбинации, но не ограничивается перечисленными.
Полиэтиленгликоль это общий термин, включающий все формы гомополимеров этиленгликоля, сополимера ПЭГ или полимера монометил-замещенного ПЭГ (мПЭГ), но не ограничивающийся перечисленным.
В дополнение, биосовместимый материал включает поли-аминокислоты, такие как поли-лизин, поли-аспарагиновая кислота и поли-глутаминовая кислота, но не ограничивается перечисленным.
В дополнение, жирная кислота может представлять собой жирную кислоту, способную связываться в организме с альбумином, но не ограничивается таковой.
В качестве более конкретного примера FcRn-связывающее вещество может представлять собой Fc-фрагмент иммуноглобулина и, более конкретно, Fc-фрагмент IgG, но не ограничивается перечисленным.
Для повышения растворимости in vivo и/или улучшения времени полужизни и/или биодоступности аналога инсулина биосовместимый материал может быть присоединен к боковой цепи одной или более чем одной аминокислоты в составе аналога инсулина по данному изобретению. Такие модификации могут также уменьшать клиренс белков и пептидов терапевтического назначения.
Биосовместимый материал, описанный выше, может быть водорастворимым (амфипатическим или гидрофильным) и/или нетоксичным и/или фармацевтически приемлемым.
F может быть непосредственно связан с X (т.е. а в Формуле 1 принимает значение 0) или может быть связан с X посредством линкера (L).
В частности, L может представлять собой пептидный линкер или непептидный линкер.
Когда L представляет собой пептидный линкер, он может включать в себя одну или более чем одну аминокислоту, например, от 1 до 1000 аминокислот, без ограничения. В данном изобретении для связывания F с X могут быть использованы различные известные пептидные линкеры. Например, могут быть включены [GS]x линкер, [GGGS]x линкер, [GGGGS]x линкер и т.д., а х в указанных выше линкерах может представлять собой натуральное число, больше или равное 1. Однако линкеры не ограничены приведенными выше примерами.
В данном изобретении «непептидный линкер» включает биосовместимый полимер, имеющий два или более повторяющихся блоков, связанных друг с другом. Повторяющиеся блоки связаны любой ковалентной связью, за исключением пептидной связи. Непептидный линкер может представлять собой группировку, составляющую часть конъюгата по данному изобретению, и соответствует L в Формуле 1. В данном изобретении, когда L представляет собой биосовместимый полимер в качестве непептидного линкера, дистальный конец непептидного линкера может дополнительно включать связывающий элемент для присоединения линкера L к аналогу инсулина X и/или F посредством ковалентной связи. Такой связывающий элемент не ограничивается какими-либо конкретными, при условии, что он представляет собой атом или группу атомов, которые не являются повторяющимся блоком биосовместимого полимера, и подходит для присоединения биосовместимого полимера к X и/или F посредством ковалентной связи.
В La, а может принимать значение 1 или более, и каждый L может быть независимым, когда а равен 2 или более.
В данном изобретении непептидный линкер можно использовать взаимозаменяемо с непептидным полимером.
Кроме того, в приведенном в качестве примера воплощении конъюгат может быть конъюгатом, в котором F и X ковалентно связаны друг с другом посредством непептидного линкера, включающего на обоих концах реакционноспособную группу, способную к конъюгации с F, в частности, с Fc-фрагмент иммуноглобулина, и X.
В частности, непептидный линкер может быть выбран из группы, состоящей из жирных кислот, сахаридов, полимеров, низкомолекулярных соединений, нуклеотидов и их комбинаций.
Полимер по данному изобретению может быть в диапазоне от 0 кДа до приблизительно 100 кДа или более, в частности, в диапазоне от приблизительно 1 кДа до приблизительно 100 кДа, и более конкретно, в диапазоне от приблизительно 1 кДа до приблизительно 20 кДа, без конкретного ограничения.
Непептидный линкер может быть выбран из группы, состоящей из биоразлагаемого полимера, такого как полиэтиленгликоль, полипропиленгликоль, сополимер этиленгликоля и пропиленгликоля, полиоксиэтилированный полиол, поливиниловый спирт, полисахарид, декстран, поливинилэтиловый эфир, полимолочная кислота (PLA) и полилактид-полигликолид (PLGA), липидный полимер, хитин, гиалуроновая кислота, олигонуклеотид и их комбинации, но не ограничивается перечисленным.
В приведенном в качестве примера воплощении непептидный полимер может представлять собой полиэтиленгликоль, но не ограничиваться им. Кроме того, в объем данного изобретения входят его производные, известные в области техники, и производные, легко получаемые способом, известным в области техники.
В данном изобретении можно использовать любой непептидный линкер без ограничений, при условии, что он представляет собой полимер, обладающий устойчивостью к протеолитическому ферменту in vivo. Молекулярная масса непептидного полимера по данному изобретению находится в диапазоне от 0 кДа до приблизительно 100 кДа и более, в частности, в диапазоне от приблизительно 1 кДа до приблизительно 100 кДа, и более конкретно, в диапазоне от приблизительно 1 кДа до приблизительно 20 кДа, без конкретного ограничения.
В данном описании термин «приблизительно» относится к диапазону, включающему ±0,5, ±0,4, ±0,3, ±0,2, ±0,1 и т.д. и поэтому может включать все входящие в диапазон значения, которые являются эквивалентными или близкими значениям, указанным после этого термина, без ограничения.
Кроме того, в качестве непептидного линкера по данному изобретению, который должен быть связан с полипептидом, соответствующим F, можно использовать не один тип полимера, но также и комбинацию различных типов полимеров.
Как указано выше, в приведенном в качестве примера воплощении каждый из двух концов непептидного линкера может быть присоединен к F и X опосредовано через связывающий элемент. Например, в конкретном воплощении данного изобретения конъюгат аналога инсулина по данному изобретению получен путем реакции (реакции присоединения) между Fc-фрагментом иммуноглобулина и/или аналога инсулина и непептидным полимером (непептидным полимером, обладающим реакционноспособной группой), имеющим реакционноспособную группу, способную образовывать ковалентную связь (т.е. реакционноспособная группа превращается в связывающий элемент конъюгата) с аминогруппой или тиоловой группой Fc-фрагмента иммуноглобулина и аминогруппой или тиоловой группой X в результате химической реакции на его конце. Таким образом, непептидный полимер, обладающий реакционноспособной группой, становится непептидным линкером, образующим часть конъюгата в результате реакции присоединения. Таким образом, непептидный линкер в составе конъюгата состоит из повторяющихся блоков и связывающего элемента непептидного полимера, обладающего реакционноспособной группой.
В частности, непептидный полимер, обладающий реакционноспособной группой, который можно использовать для получения конъюгата, может на обоих своих концах нести реакционноспособную группу, которая может связываться с F (например, Fc-фрагментом иммуноглобулина) и X, соответственно, и в частности, реакционноспособную группу, которая может связываться с аминогруппой, расположенной на N-конце, или остатком лизина или тиоловой группой остатка цистеина X; или с аминогруппой, расположенной на N-конце, или остатком лизина или тиоловой группой остатка цистеина F (например, Fc-фрагмента иммуноглобулина), но реакционноспособная группа не ограничивается перечисленными.
Кроме того, реакционноспособная группа непептидного полимера, способная образовывать ковалентную связь с F, т.е. Fc-фрагментом иммуноглобулина, и X, может быть выбрана из группы, состоящей из альдегидной группы, малеимидной группы и сукцинимидного производного, но не ограничивается перечисленными.
В указанном выше примеры альдегидной группы могут включать пропиональдегидную группу или бутиральдегидную группу, однако альдегидная группа не ограничена перечисленными.
Сукцинимидное производное может включать сукцинимидилвалерат, сукцинимидилметилбутаноат, сукцинимидилметилпропионат, сукцинимидилбутаноат, сукцинимидилпропионат, N-гидроксисукцинимид, гидроксисукцинимидил, сукцинимидилкарбоксиметил или сукцинимидилкарбонат, но не ограничивается перечисленным.
Непептидный линкер может быть присоединен к X и F посредством такого связывающего элемента в результате превращения реакционноспособной группы, но не ограничивается указанным.
Кроме того, конечный продукт, полученный восстановительным аминированием с помощью альдегидной связи, является более стабильным, чем тот, который присоединен амидной связью. Альдегидная реакционноспособная группа избирательно реагирует с N-концом при низких значениях рН и способна образовывать ковалентную связь с остатками лизина при высоких значениях рН, например, рН 9,0.
Кроме того, реакционноспособные группы на обоих концах непептидного полимера, имеющего реакционноспособную группу, могут быть одинаковыми или разными, например, он может иметь малеимидную группу на одном конце и альдегидную группу, пропиональдегидную группу или бутиральдегидную группу на другом конце. Однако реакционноспособные группы не обязательно ограничены, при условии, что F (т.е. Fc-фрагмент иммуноглобулина) и X могут присоединяться к обоим концам непептидного полимера, имеющего реакционноспособную группу.
Например, в качестве реакционноспособной группы на одном конце непептидного полимера, имеющего реакционноспособную группу, может быть включена малеимидная группа, а на другом конце может быть включена альдегидная группа, пропиональдегидная группа или бутиральдегидная группа и т.д.
Когда в качестве непептидного полимера используют полиэтиленгликоль, имеющий на обоих своих концах реакционноспособную гидрокси-группу, гидрокси-группу можно активировать при помощи известных химических реакций, известных в области техники, с образованием различных реакционноспособных групп, описанных выше, или можно получать белковый конъюгат пролонгированного действия по данному изобретению с использованием доступного для приобретения полиэтиленгликоля, имеющего модифицированные реакционноспособные группы.
В приведенном в качестве примера воплощении непептидный полимер может представлять собой полимер, присоединенный к X, например, к N-концевой области или остатку лизина аналога инсулина, но не ограничиваться таковым. В частности, непептидный полимер, например, ПЭГ, может быть присоединен к N-концевой области аналога инсулина, например, аминогруппе концевой аминокислоты или аминогруппе лизина, присутствующего в аналоге инсулина, но не ограничивается перечисленным.
Дополнительно в приведенном в качестве примера воплощении непептидный полимер может быть присоединен к N-концевой области F, например, к Fc-фрагмента иммуноглобулина, но не ограничиваться таковым. В частности, непептидный полимер может быть присоединен к N-концевой области Fc иммуноглобулина, в частности, к аминогруппе концевой аминокислоты, но не ограничивается таковым.
В данном описании термин «N-концевая область» относится к амино-концевой области аналога инсулина или Fc иммуноглобулина и также относится к положению, в котором для осуществления данного изобретения может присоединяться линкер. Например, N-концевая область может включать не только концевые аминокислотные остатки N-концевой области, но и аминокислотные остатки вблизи N-концевых аминокислотных остатков и, в частности, может включать с 1 по 20 аминокислотные остатки дистального конца, без ограничения.
Если альдегидная группа присутствует на одном конце непептидного полимера, имеющего реакционноспособную группу, и присоединена к аминогруппе, расположенной на N-конце аналога инсулина, альдегидная группа может быть присоединена к аминогруппе в результате реакции восстановительного аминирования. Кроме того, если альдегидная группа присутствует на другом конце непептидного полимера, имеющего реакционноспособную группу, и присоединена к аминогруппе, расположенной на N-конце Fc иммуноглобулина, альдегидная группа также может быть присоединена к аминогруппе в результате реакции восстановительного аминирования.
В воплощении данного изобретения непептидный полимер, имеющий реакционноспособную группу, который использовали для получения конъюгата, представляет собой ПЭГ, имеющий реакционноспособную группу на обоих концах, и поэтому конъюгат образуется в результате присоединения непептидного полимера к аминогруппе X и F в результате восстановительного аминирования. Таким образом, конъюгат имеет следующую структуру:
X-NHCH2-W-группа ПЭГ-Z-CH2NH-F,
где -CH2W- представляет собой связывающий элемент, соединяющий непептидный полимер с X; и -Z-CH2- представляет собой связывающий элемент, соединяющий непептидный полимер с F. Кроме того, W и Z отсутствуют или представляют собой двухвалентные функциональные группы, такие как алкилен, и др. Метилены -CH2W- и -Z-CH2- происходят из альдегидной реакционноспособной группы, а атомы азота X-NH и NH-F происходят из аминогрупп аналога инсулина и F, соответственно, которые использовались в реакции присоединения.
В приведенной выше структуре группировка ПЭГ может содержать не только структуру -(CH2CH2O)n-, но и атом кислорода, расположенный между связывающим элементом и -(CH2CH2O)n-.
В данном изобретении термин «Fc-фрагмент иммуноглобулина» относится к области, включающей константную область 2 тяжелой цепи (CH2) и/или константную область 3 тяжелой цепи (CH3), не включающей вариабельные области тяжелой цепи и легкой цепи иммуноглобулина. Fc-фрагмент иммуноглобулина может представлять собой один элемент, составляющий группировку конъюгата по данному изобретению.
Fc-фрагмент иммуноглобулина может включать шарнирный участок в константной области тяжелой цепи, но не ограничивается им. Кроме того, Fc-фрагмент иммуноглобулина по данному изобретению может представлять собой удлиненный Fc-фрагмент, включающий целиком или частично константную область 1 тяжелой цепи (СН1) и/или константную область 1 легкой цепи (CL), не включающий вариабельные области тяжелой цепи и легкой цепей иммуноглобулина, при условии, что он оказывает по существу такой же или улучшенный эффект по сравнению с нативным типом. Кроме того, Fc-фрагмент иммуноглобулина по данному изобретению может представлять собой фрагмент, в котором удалена довольно большая часть аминокислотной последовательности, соответствующей СН2 и/или СН3.
Например, Fc-фрагмент иммуноглобулина по данному изобретению может представлять собой 1) СН1 домен, СН2 домен, СН3 домен и СН4 домен, 2) СН1 домен и СН2 домен, 3) СН1 домен и СН3 домен, 4) СН2 домен и СН3 домен, 5) комбинацию одного или более чем одного домена из: СН1 домена, СН2 домена, СН3 домена и СН4 домена и шарнирного участка иммуноглобулина (или части шарнирного участка) и 6) димер всех доменов константной области тяжелой цепи и константной области легкой цепи, без ограничения.
Кроме того, в приведенном в качестве примера воплощении Fc-фрагмент иммуноглобулина может находиться в димерной форме, и одна молекула X может быть ковалентно связана с одним Fc-фрагментом в димерной форме, где Fc иммуноглобулина и X могут быть связаны друг с другом посредством непептидного полимера. При этом также возможно, что обе молекулы X симметрично присоединены к Fc-фрагменту в димерной форме. В частности, Fc и X иммуноглобулина могут быть связаны друг с другом через непептидный линкер, без ограничения приведенными выше примерами.
Кроме того, Fc-фрагмент иммуноглобулина по данному изобретению не только включает нативную аминокислотную последовательность, но и производные последовательности. Производное аминокислотной последовательности относится к аминокислотной последовательности, которая имеет отличие по меньшей мере в одной аминокислоте в результате делеции, вставки, неконсервативной или консервативной замене или их комбинации.
Например, подходящими сайтами для модификации могут служить аминокислотные остатки в положениях 214-238, 297-299, 318-322 или 327-331, которые, как известно, конъюгированы с Fc иммуноглобулина.
Кроме того, можно получить различные виды других производных путем делеции сайтов, участвующих в образовании дисульфидной связи, делеции нескольких аминокислот на N-конце нативного Fc, вставки остатка метионина на N-конце нативного Fc и т.д. Кроме того, для устранения эффекторных функций может быть произведена делеция сайта связывания комплемента, например, сайта связывания C1q или делеция сайта антитело-зависимой клеточно-опосредованной цитотоксичности (ADCC). Методики получения таких производных последовательности Fc-фрагмента иммуноглобулина изложены в международных публикациях W097/34631, WO 96/32478 и др.
В области техники известны аминокислотные замены в белках и пептидах, которые не изменяют полностью активность белков или пептидов (Н. Neurath, R.L. Hill, The Proteins, Academic Press, New York, 1979). Наиболее часто встречающимися заменами являются Ala/Ser, Val/Ile, Asp/Glu, Thr/Ser, Ala/Gly, Ala/Thr, Ser/Asn, Ala/Val, Ser/Gly, Thy/Phe, Ala/Pro, Lys/Arg, Asp/Asn, Leu/Ile, Leu/Val, Ala/Glu и Asp/Gly, в обоих направлениях. В зависимости от ситуации Fc-фрагмент может быть модифицирован путем фосфорилирования, сульфатирования, ацилирования, гликозилирования, метилирования, фарнезилирования, ацетилирования, амидирования и т.п.
Описанные выше производные Fc проявляют биологическую активность, идентичную таковой Fc-фрагмента по данному изобретению и могут обладать улучшенной структурной стабильностью, например, к нагреванию, рН и т.д.
Кроме того, Fc-фрагмент иммуноглобулина может быть получен из нативных форм, выделенных in vivo у человека и животных, таких как коровы, овцы, свиньи, мыши, кролики, хомяки, крысы, морские свинки и т.д., или может быть их рекомбинантными формами или производными, полученными из трансформированных клеток животных или микроорганизмов. Так, Fc-фрагмент может быть получен из нативного иммуноглобулина путем выделения целых иммуноглобулинов из организма живого человека или животного и обработки выделенного иммуноглобулина протеазой. Когда целый иммуноглобулин обрабатывают папаином, он расщепляется на фрагменты Fab и Fc, тогда как при обработке целого иммуноглобулина пепсином, он расщепляется на фрагменты pF'c и F(ab)2. Fc или pF'c могут быть выделены при помощи эксклюзионной хроматографии и т.д. В более конкретном воплощении Fc-фрагмент человеческого происхождения представляет собой Fc-фрагмент рекомбинантного иммуноглобулина, полученного из микроорганизма.
Кроме того, Fc-фрагмент иммуноглобулина может быть представлен формой, имеющей нативные гликаны, повышенное или пониженное количество гликанов по сравнению с нативной формой или может быть представлена дегликозилированной формой. Увеличение количества, уменьшение количества или удаление гликанов Fc иммуноглобулина может достигаться стандартными способами, такими как химический способ, ферментативный способ и генно-инженерный способ, в котором используют микроорганизмы. Fc-фрагмент иммуноглобулина, полученная при удалении гликанов Fc-фрагмента, демонстрирует существенное снижение аффинности связывания с C1q и снижение или потерю антитело-зависимой цитотоксичности или комплемент-зависимой цитотоксичности, и, следовательно, не вызывает ненужных иммунных ответов in vivo. В связи с этим Fc-фрагмент иммуноглобулина в дегликозилированной или агликозилированной форме может быть более подходящей формой для целей данного изобретения как носитель лекарства.
В данном описании термин «дегликозилирование» относится к ферментативному удалению углеводных группировок Fc-фрагмента, а термин «агликозилирование» означает, что Fc-фрагмент продуцируется в негликозилированной форме прокариотами, более конкретно, Е. coli.
При этом Fc-фрагмент иммуноглобулина может происходить от человека или других животных, включая крупный рогатый скот, коз, свиней, мышей, кроликов, хомяков, крыс и морских свинок. В более конкретном воплощении он имеет человеческое происхождение.
Также, Fc-фрагмент иммуноглобулина (Ig) может происходить из IgG, IgA, IgD, IgE и IgM, или быть их комбинацией или гибридом. В более конкретном воплощении он происходит из IgG или IgM, которые являются наиболее распространенными белками в крови человека и, в еще более конкретном воплощении он происходит из IgG, что, как известно, увеличивает время полужизни лиганд-связывающих белков. В еще более конкретном воплощении Fc-фрагмент иммуноглобулина представляет собой Fc-фрагмент IgG4, а в наиболее конкретном воплощении Fc-фрагмент IgG4 представляет собой агликозилированный Fc-фрагмент, происходящий из IgG4 человека, но не ограничивается им.
В частности, используемый в данном описании термин «комбинация» означает, что полипептиды, кодирующие Fc-фрагмент одноцепочечных иммуноглобулинов одного происхождения, связаны с одноцепочечным полипептидом другого происхождения с образованием димера или мультимера. Это означает, что димер или мультимер могут быть образованы из двух или более фрагментов, выбранных из группы, состоящей из Fc-фрагментов IgG, Fc-фрагментов IgA, Fc-фрагментов IgM, Fc-фрагментов IgD и Fc-фрагментов IgE.
В другом аспекте данного изобретения предложен полинуклеотид, кодирующий конъюгат; вектор, включающий полинуклеотид, и трансформант, включающий полинуклеотид или вектор, включающий полинуклеотид.
Конъюгат является таким же, как описано выше.
Полинуклеотид может кодировать конъюгат в форме слитого белка.
Кроме того, в объеме данного изобретения выделенный полинуклеотид, кодирующий конъюгат, включает в себя полинуклеотидную последовательность, идентичную соответствующей последовательности на 75% или более, в частности, на 85% или более, более конкретно, на 90% или более и еще более конкретно, на 95% или более.
Приведенное выше описание вектора и трансформанта также относится к данному воплощению.
В еще одном аспекте данного изобретения предложен способ получения конъюгата.
Конъюгат является таким, как описано выше.
В частности, способ может включать следующие стадии:
(a) реакцию непептидного полимера, имеющего две или более концевых реакционноспособных групп, с одним из: аналога инсулина и носителя, для получения непептидного полимера, к одному концу которого присоединен аналог инсулина или полимер, а на другом конце находится реакционноспособная концевая группа; и
(b) реакцию непептидного полимера, полученного на стадии (а), к одному концу которого присоединен аналог инсулина или полимер, а на другом конце находится реакционноспособная концевая группа, со вторым из: носителя или аналога инсулина, для получения конъюгата, в котором аналог инсулина и носитель соединены через непептидный полимер.
Непептидный полимер, носитель и аналог инсулина и сформированные из них образования являются такими, как описано выше.
В еще одном аспекте данного изобретения предложена композиция, включающая конъюгат.
Конъюгат является таким, как описано выше.
В данном изобретении композиция может представлять собой фармацевтическую композицию. В частности, композиция может представлять собой фармацевтическую композицию для предупреждения или лечения заболевания, связанного с инсулином. Более конкретно, композиция может представлять собой фармацевтическую композицию для предупреждения или лечения диабета.
В данном описании термин «заболевание, связанное с инсулином» относится к заболеванию, которое возникает или прогрессирует из-за низкой или отсутствующей биологической активности инсулина; и пример заболевания, связанного с инсулином, может включать диабет, но не ограничиваться им.
В данном описании термин «предупреждение» относится ко всем видам активности, подавляющей или отодвигающей возникновение заболевания, связанного с инсулином, благодаря введению указанного выше конъюгата или композиции, содержащей конъюгат, а термин «лечение» относится ко всем видам активности, улучшающей или благоприятным образом изменяющей симптомы заболевания, связанного с инсулином, благодаря введению указанного выше конъюгата или композиции, содержащей конъюгат.
Фармацевтическая композиция, содержащая конъюгат аналога инсулина по данному изобретению, может включать в себя фармацевтически приемлемый носитель. Такой носитель может иметь искусственное происхождение.
В данном описании термин «фармацевтически приемлемый» относится к свойствам проявлять терапевтический эффект в достаточном для этого количестве, не вызывая побочных эффектов, которое может быть без затруднений установлено специалистом в области техники на основании факторов, хорошо известных в области медицины, таких как тип заболевания, возраст, масса тела, состояние здоровья, пол, чувствительность пациента к лекарственному средству, путь введения, способ введения, частота введения, продолжительность лечения, лекарственное(ые) средство(а) для смешивания или одновременного введения и т.д.
Фармацевтически приемлемый носитель для перорального введения может включать связывающее вещество, смазывающее вещество, разрыхлитель, эксципиент, растворитель, диспергирующее вещество, стабилизатор, суспендирующее вещество, краситель, ароматизатор и т.д. В инъекционных препаратах фармацевтически приемлемый носитель может включать буферный агент, консервант, анальгетик, растворитель, изотонический агент и стабилизатор. В препаратах для местного введения фармацевтически приемлемый носитель может включать основу, эксципиент, смазывающее вещество, консервант и т.д. Фармацевтическая композиция по данному изобретению может быть представлена различными лекарственными формами в комбинации с вышеупомянутыми фармацевтически приемлемыми носителями. Например, фармацевтическая композиция для перорального введения может быть представлена в форме таблеток, пастилок, капсул, эликсиров, суспензий, сиропов или облаток. Фармацевтическая композиция для инъекций может находиться в однодозовых ампулах или в многодозовом контейнере. Фармацевтическая композиция также может быть представлена в виде растворов, суспензий, таблеток, пилюль, капсул и препаратов с пролонгированным высвобождением.
При этом примеры носителей, эксципиентов и разбавителей, подходящих для составления композиции, могут включать лактозу, декстрозу, сахарозу, сорбит, маннит, ксилит, эритрит, мальтит, крахмал, гуммиарабик, альгинат, желатин, фосфат кальция, силикат кальция, целлюлозу, метилцеллюлозу, микрокристаллическую целлюлозу, поливинилпирролидон, воду, метилгидроксибензоат, пропилгидроксибензоат, тальк, стеарат магния, минеральное масло и т.д. Кроме того, фармацевтические композиции могут дополнительно содержать наполнитель, антикоагулянт, смазывающее вещество, увлажняющее вещество, корригент, эмульгатор, консервант и т.д.
В данном описании термин «введение» относится к введению пациенту конкретного вещества любым надлежащим способом, и конъюгат по данному изобретению можно вводить любым обычным способом, при условии, что лекарственное средство поступит в ткань-мишень. Например, можно осуществлять внутрибрюшинное, внутривенное, внутримышечное, подкожное, внутрикожное, пероральное, местное, интраназальное, внутрилегочное или ректальное введение, однако способ введения не ограничивается перечисленными. Однако, поскольку пептиды при пероральном введении подвергаются перевариванию, активные ингредиенты композиции для перорального введения должны иметь покрытие или защиту от разложения в желудке. В частности, данную композицию можно вводить в инъекционной форме. Кроме того, фармацевтическую композицию можно вводить при помощи некоторых устройств, способных доставлять действующие вещества в клетку-мишень.
Кроме того, фармацевтическая композиция по данному изобретению может определяться типом активного ингредиента лекарственного средства, а также рядом факторов, включая тип заболевания, подлежащего лечению, путь введения, возраст, пол и массу тела пациента и тяжесть заболевания.
Суммарную эффективную дозу композиции по данному изобретению можно вводить пациенту в виде однократной дозы или можно вводить в течение длительного периода времени в виде многократных доз согласно протоколу лечения с дробным введением. Количество активного(ых) ингредиента(ов), содержащихся в фармацевтической композиции по данному изобретению, может варьировать в зависимости от тяжести заболевания. В частности, общая суточная доза конъюгата по данному изобретению может составлять от приблизительно 0,0001 мг до 500 мг на 1 кг массы тела пациента. При этом эффективную дозу конъюгата определяют с учетом различных факторов, включая, помимо пути введения и частоты введения фармацевтической композиции, возраст, массу тела, состояние здоровья, пол пациента, тяжесть заболевания, диету и скорость экскреции. В этой связи, специалисты в области техники могут без труда определить эффективную дозу, подходящую для конкретного применения фармацевтической композиции по данному изобретению. Фармацевтическая композиция по данному изобретению не ограничивается конкретной композицией и способом и путем введения, при условии, что она демонстрирует эффекты, описанные в данном изобретении.
Для осуществления данного изобретения в еще одном аспекте данного изобретения предложена композиция пролонгированного действия, включающая конъюгат аналога инсулина, с увеличенной продолжительностью действия in vivo и/или стабильностью по сравнению с конъюгатом нативного инсулина.
Аналог инсулина и конъюгат являются такими, как описано выше.
Для осуществления данного изобретения в еще одном аспекте данного изобретения предложен способ лечения заболевания, связанного с инсулином, включающий введение конъюгата аналога инсулина или его композиции субъекту, нуждающемуся в этом.
Аналог инсулина и конъюгат являются такими, как описано выше.
В одном воплощении заболевание, связанное с инсулином, представляет собой диабет, но не ограничивается им.
Для осуществления данного изобретения в другом аспекте данного изобретения предложено применение конъюгата аналога инсулина для изготовления лекарственного средства.
В одном воплощении лекарственное средство предназначено для предупреждения или лечения заболевания, связанного с инсулином, без конкретного ограничения.
В другом воплощении лекарственное средство предназначено для предупреждения или лечения диабета, но не ограничивается указанным заболеванием.
Для осуществления данного изобретения в другом аспекте данного изобретения предложено применение конъюгата аналога инсулина в лечении заболевания, связанного с инсулином, в частности, диабета.
Аналог инсулина, конъюгат и заболевание, связанное с инсулином, являются такими, как описано выше.
Далее данное изобретение будет описано более подробно с отсылкой к приведенным ниже примерам. Однако, данные примеры приведены лишь в целях иллюстрации и никоим образом не ограничивают объем изобретения.
Пример 1. Получение вектора, экспрессирующего одноцепочечный аналог инсулина
Для получения аналогов инсулина, имеющих единственную аминокислотную модификацию в А-цепи или В-цепи, соответственно, используя в качестве матрицы вектор, экспрессирующий нативный инсулин, синтезировали прямой и обратный олигонуклеотиды (Таблица 2) и затем провели ПЦР, таким образом амплифицируя гены аналогов.
Измененные аминокислотные последовательности А-цепи или В-цепи и названия аналогов представлены в Таблице 1 ниже. В Таблице 1 аналог 1 представляет аналог, в котором 14-я аминокислота А-цепи (т.е. тирозин, Y) заменена на гистидин (Н), а аналог 6 представляет аналог, в котором 16-я аминокислота В-цепи (т.е. тирозин, Y) заменена на глутаминовую кислоту (Е).

Праймеры для амплификации аналогов инсулина представлены в Таблице 2 ниже.
ПЦР-реакцию для амплификации аналогов инсулина проводили при условиях: 95°С в течение 30 секунд, 55°С в течение 30 секунд и 68°С в течение 6 минут, 18 повторяющихся циклов. Фрагменты аналогов инсулина, полученные в этих условиях, встраивали в вектор pET22b для экспрессии в виде внутриклеточных телец включения и полученные таким образом векторы экспрессии обозначали pET22b-аналоги инсулина с 1 по 13. Векторы экспрессии включали в себя нуклеиновые кислоты, кодирующие аминокислотные последовательности аналогов инсулина с 1 по 13 под контролем промотора Т7; а белки аналогов инсулина экспрессировались в клетках-хозяевах в форме телец включения, содержащих векторы экспрессии.
Последовательности ДНК и белковые последовательности аналогов инсулина с 1 по 13 приведены ниже в Таблице 3.
Каждую модификацию последовательности изучали путем секвенирования ДНК и в результате подтвердили, что последовательность каждого аналога инсулина была модифицирована в соответствии с предусмотренным назначением.
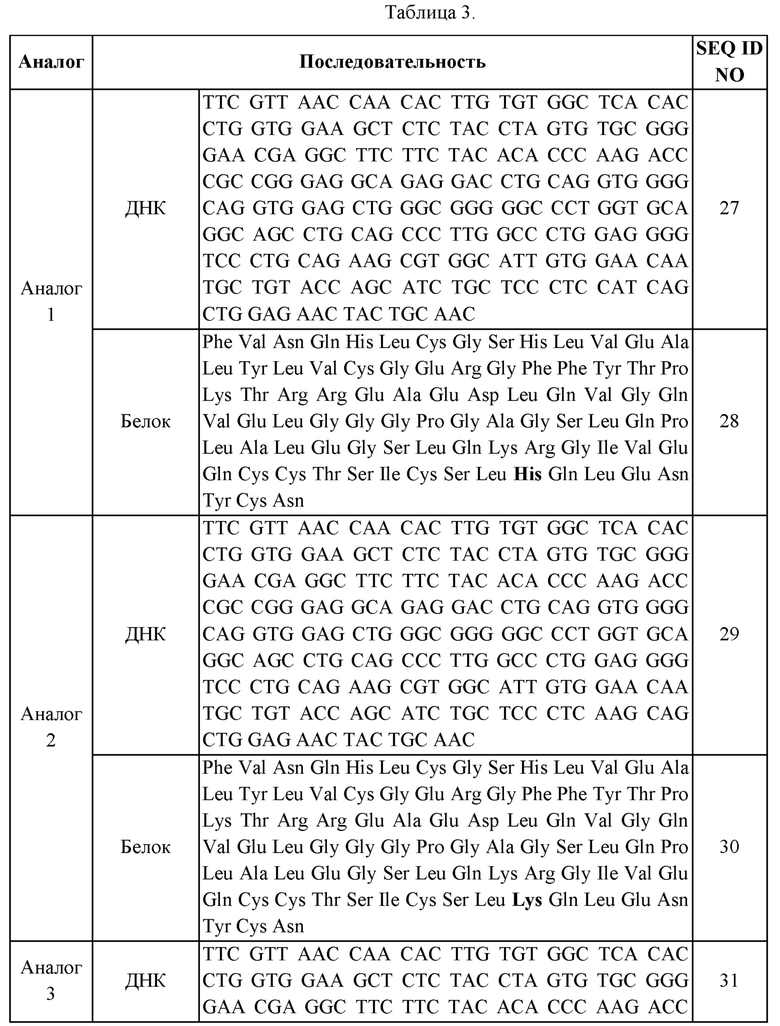
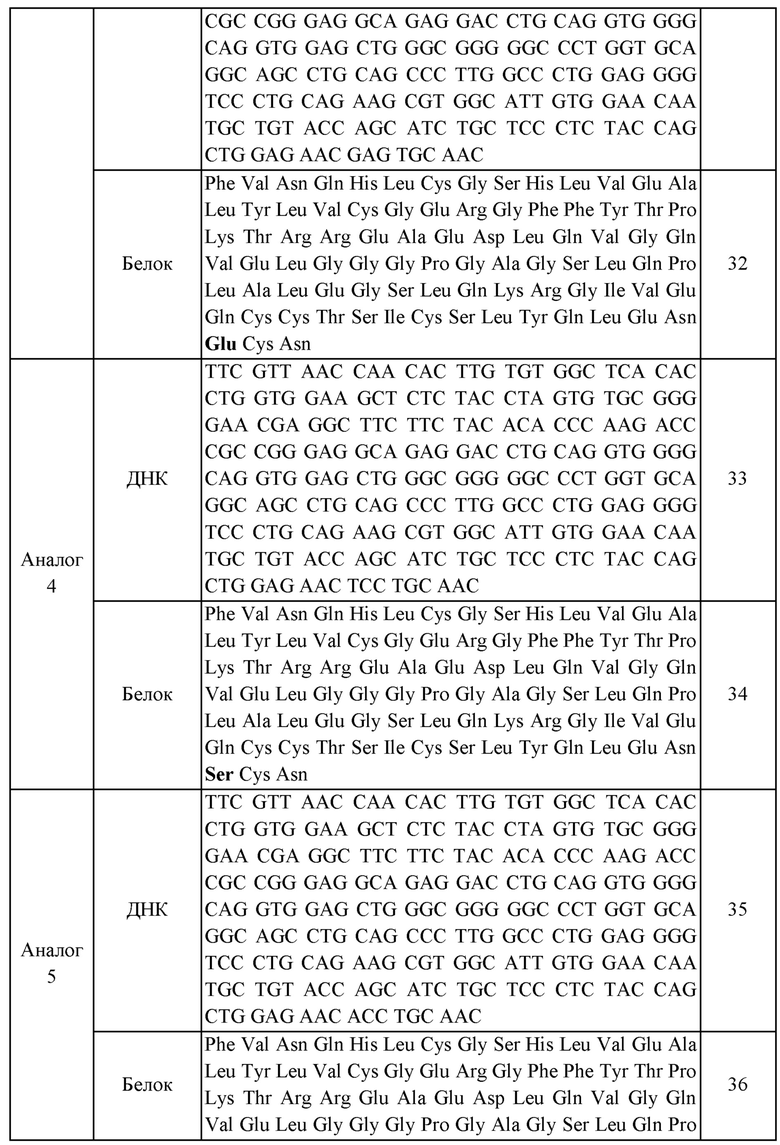
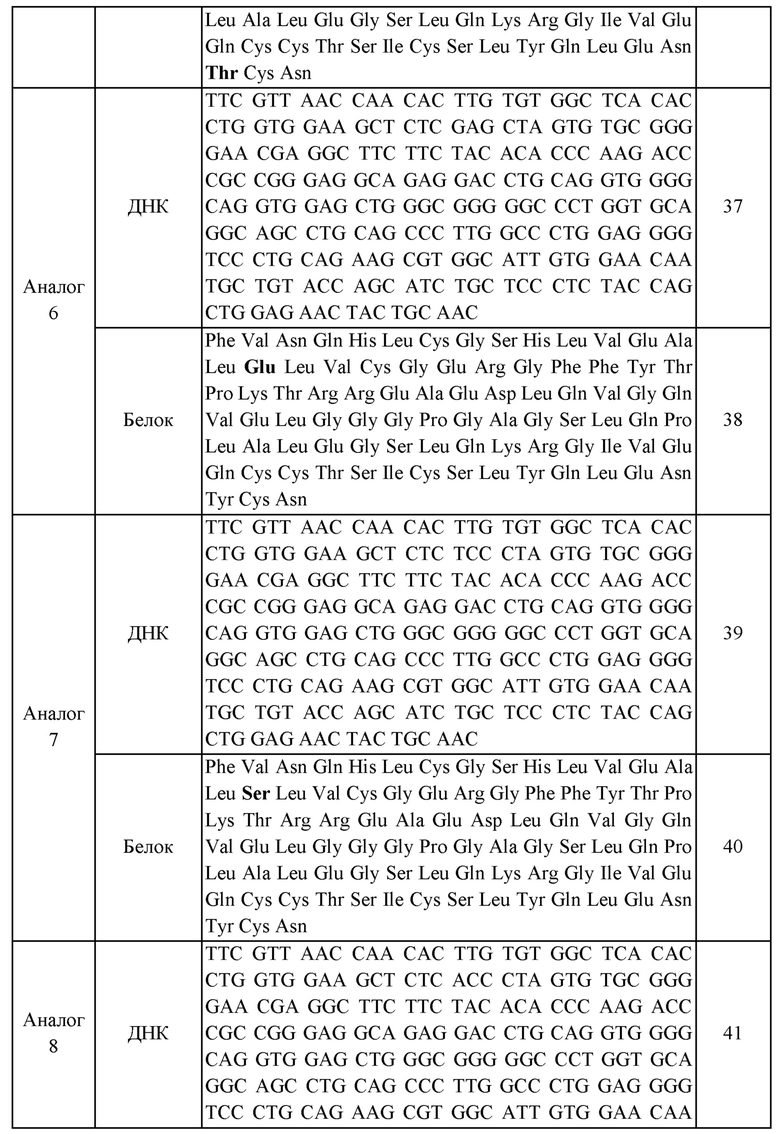

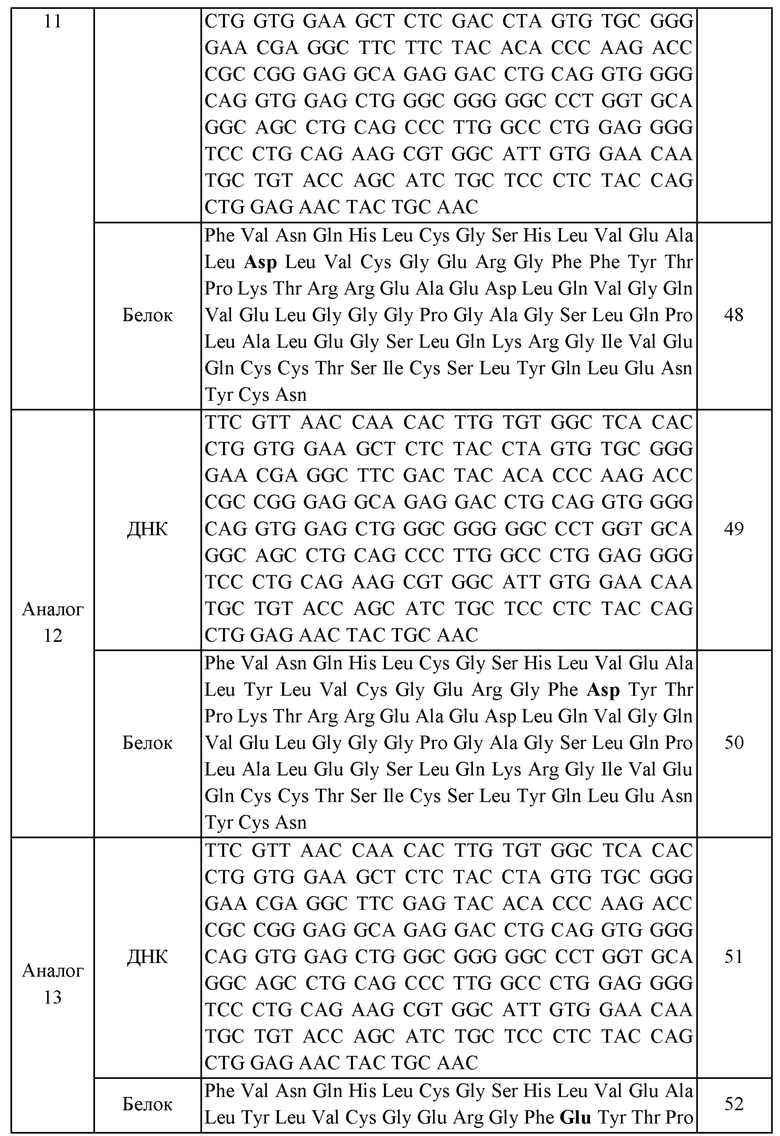

Пример 2. Экспрессия слитых пептидов рекомбинантных аналогов инсулина
Экспрессия рекомбинантных аналогов инсулина находилась под контролем промотора Т7. Е. coli BL21-DE3 (Е. coli В F-dcm ompT hsdS(rB-mB-) gal λDE3; Novagen) трансформировали каждым из векторов, экспрессирующих рекомбинантный аналог инсулина. Трансформацию проводили в соответствии с рекомендованным протоколом (Novagen). Для инокуляции среды 2Х Лурия (LB), содержащей ампициллин (50 мкг/мл), брали одиночные колонии, трансформированные каждым из рекомбинантных векторов экспрессии, и культивировали при 37°С в течение 15 часов. Культуральный бульон рекомбинантного штамма и среду 2Х LB, содержащую 30% глицерин, смешивали в соотношении 1:1 (об/об), каждую смесь разливали по 1 мл в криопробирки и хранили при -140°С в банке клеток для получения рекомбинантного слитого белка.
Для экспрессии рекомбинантных аналогов инсулина размораживали одну ампулу из банка клеток и инокулировали 500 мл среды 2Х Лурия и культивировали с перемешиванием при 37°С в течение 14-16 часов. Культивирование останавливали, когда OD600 достигала 5,0 или выше и культуральный бульон использовали в качестве затравочной культуры. Затравочную культуру использовали для инокуляции 17 л среды для ферментации, используя 50 л ферментер (MSJ-U2, B.E. MARUBISHI, Япония), и запускали первую партию ферментации. Условия культивирования: температура 37°С, скорость аэрации 20 л/мин (об/об/мин), скорость перемешивания 500 об/мин, значение рН 6,70 поддерживали с помощью 30% водного раствора аммиака. Осуществляли ферментацию в режиме периодического культивирования с подпиткой, добавляя питательный раствор при истощении питательных веществ в культуральном бульоне. За ростом штамма следили по значению оптической плотности (OD). При достижении OD значения 100 или выше вводили IPTG в конечной концентрации 500 мкМ. После введения продолжали дальнейшее культивирование в течение 23 - 25 часов. После завершения культивирования рекомбинантные штаммы собирали путем центрифугирования и хранили при -80°С до применения.
Пример 3. Выделение и рефолдинг рекомбинантных аналогов инсулина
Чтобы перевести рекомбинантные аналоги инсулина, экспрессированные в Примере 2, в растворимую форму, их подвергали рефолдингу после разрушения клеток. Клеточный осадок (вес во влажном состоянии 100 г) ресуспендировали в 1 л лизирующего буфера (50 мМ Tris-HCl (рН 9,0), 1 мМ EDTA (рН 8,0), 0,2 М NaCl и 0,5% Triton Х-100). Клетки разрушали при помощи микрофлюидизатора (Microfluidic Inc. Model М-110ЕН-30) при рабочем давлении 15000 фунтов на кв. дюйм (103421 кПа). Лизат разрушенных таким образом клеток центрифугировали при 7000 об/мин при температуре от 4°С до 8°С в течение 20 минут. Надосадочную жидкость отбрасывали и ресуспендировали осадок в 3 л отмывочного буфера (0,5% Triton Х-100 и 50 мМ Tris-HCl (рН 8,0), 0,2 М NaCl и 1 мМ EDTA. После центрифугирования при 7000 об/мин при температуре от 4°С до 8°С в течение 20 минут клеточный осадок ресуспендировали в дистиллированной воде, затем центрифугировали таким же образом. Полученный таким образом осадок ресуспендировали в буфере (1 М L-глицин, 3,78 г L-цистеин-HCl, рН 10,6) и перемешивали при комнатной температуре в течение 1 часа. Для выделения ресуспендированного таким образом рекомбинантного аналога инсулина к нему добавляли 8 М мочевину и перемешивали в течение 3-5 часов. Для рефолдинга растворенных рекомбинантных аналогов проинсулина проводили центрифугирование при 7000 об/мин при температуре от 4°С до 8°С в течение 30 минут, собирали надосадочную жидкость и обрабатывали 15 мМ L-цистеин-HCl, т.е. восстанавливающим агентом, в течение 1 часа. Добавляли предварительно заданный объем дистиллированной воды с помощью перистальтического насоса и перемешивали при температуре от 4°С до 8°С в течение по меньшей мере 12 часов.
Пример 4. Очистка при помощи катионообменной хроматографии
После завершения рефолдинга образец загружали в уравновешенную колонку SP FF (GE healthcare), уравновешенную 20 мМ буферным раствором цитрата натрия (рН 2,0), содержащим 45% этанол, и затем белки аналогов инсулина элюировали линейным градиентом (0-100%) 20 мМ буферного раствора цитрата натрия (рН 2,0), содержащего 0,5 М хлорид калия и 45% этанол (10 объемов колонки).
Пример 5. Обработка трипсином и карбоксипептидазой В
Элюированные образцы обессоливали с применением мембраны для ультрафильтрации с последующей заменой буферного раствора (10 мМ Tris-HCl, рН 8,0). Образец полученного таким образом белка обрабатывали трипсином в молярном отношении к количеству белка в образце, соответствующем приблизительно 30 000, и карбоксипептидазой В в молярном отношении к количеству белка в образце, соответствующем приблизительно 3000, и перемешивали при температуре от 4°С до 8°С в течение приблизительно 16 часов.
Пример 6. Очистка при помощи катионообменной хроматографии
После завершения реакции образец вновь загружали в уравновешенную колонку SP HP (GE healthcare), уравновешенную 20 мМ буферным раствором цитрата натрия (рН 2,0), содержащим 45% этанол, и затем белки аналогов инсулина элюировали линейным градиентом (0-100%) 20 мМ буферного раствора цитрата натрия (рН 2,0), содержащего 0,5 М хлорид калия и 45% этанол (10 объемов колонки).
Пример 7. Очистка при помощи хроматографии с обращенной фазой
Для чистого выделения чистого аналога инсулина из образца, полученного в Примере 6, его загружали в колонку для хроматографии с обращенной фазой Source30RPC (GE healthcare, USA), уравновешенную фосфатом натрия и изопропанолом, и элюировали белки аналога инсулина линейным градиентом с использованием буфера, содержащего фосфат натрия и изопропанол.
Очищенные таким образом аналоги инсулина анализировали при помощи белкового электрофореза (SDS-PAGE, Фиг. 1) и ВЭЖХ, данные о чистоте репрезентативных аналогов инсулина 9, 10, 11 и 12 показаны на Фиг. 2.
Пример 8. Получение конъюгата аналога инсулина пролонгированного действия
Конъюгаты аналогов инсулина, полученных в Примерах 1-7, получали следующим образом.
Конъюгат пролонгированного действия аналога 10 получали следующим репрезентативным способом.
Для ПЭГилирования N-конца В-цепи 10 аналога инсулина проводили реакцию между 10 аналогом инсулина в концентрации 5 мг/мл и 3.4K PEG-пропион-ALD(2) (ПЭГ (3,4 кДа), несущим пропиональдегидную группу на обоих концах; NOF Inc., USA) в молярном отношении к ПЭГ 1:4, при 4°С приблизительно в течение 2 часов. При этом реакция проходила при добавлении восстанавливающего агента 3 мМ цианборогидрида натрия (NaCNBH3) в смешанном растворителе, содержащем 50 мМ буферный раствор цитрата натрия (рН 5,0) и 45% изопропанол. Реакционный раствор очищали на колонках SP-HP (GE Healthcare) с помощью градиента концентрации KCl и буфера, содержащего цитрат натрия (рН 3,0) и 45% EtOH.
Для присоединения ПЭГ, к которому присоединен аналог инсулина, к N-концу Fc фрагмента иммуноглобулина молярное отношение очищенного моно-ПЭГилированного аналога инсулина и Fc фрагмента иммуноглобулина должно было составлять 1:1,2, реакцию проводили при 25°С в течение 15 часов, задав общую концентрацию белка 20 мг/мл. При этом в качестве реакционного раствора использовали 100 мМ буферный раствор HEPES (рН 8,2), в который добавляли 20 мМ цианборогидрид натрия в качестве восстанавливающего агента и хлорид натрия.
После завершения реакции реакционный раствор наносили на колонку Q-HP (GE, USA) с использованием буфера Tris-HCl (рН 7,5) и градиента концентрации NaCl и наносили на смолу Source 15ISO (GE, USA) с использованием сульфата аммония и градиента концентрации Tris-HCl (рН 7,5), таким образом получая очищенный конъюгат: аналог инсулина 10-3.4K PEG-Fc иммуноглобулина.
Сравнительный пример: получение конъюгата нативного инсулина пролонгированного действия
Для ПЭГилирования N-конца В-цепи нативного инсулина (Biocon Inc., India) проводили реакцию пегилирования с 3.4K PEG-nponnoH-ALD(2) (ПЭГ (3,4 кДа), несущим пропиональдегидную группу на обоих концах; NOF Inc., USA) и очищали моно-ПЭГилированный нативный инсулин на колонке, как в Примере 8.
Для присоединения ПЭГ, к которому присоединен нативный инсулин, к N-концу Fc фрагмента иммуноглобулина использовали условия реакции и колонку для очистки, описанные в Примере 8, и очищенный моно-ПЭГилированный нативный инсулин и Fc фрагмент иммуноглобулина, получая таким образом конъюгат: нативный инсулин-3.4K PEG-Fc иммуноглобулина.
Экспериментальный пример 1: сравнение аффинности связывания аналогов инсулина с рецепторами инсулина
Для определения аффинности связывания аналогов инсулина с рецепторами инсулина использовали сцинтилляционный анализ сближения (SPA). Вначале для получения клеточной мембраны, экспрессирующей изоформу В инсулинового рецептора, получали линию клеток СНО, сверхэкспрессирующих изоформу В инсулинового рецептора, трансфицируя клетки линии СНО с помощью липофектамина (Life Technology, USA). Полученные клетки затем гомогенизировали с помощью гомогенизатора (Wheaton, USA) и отделяли клеточную мембрану с использованием сахарозной подушки. Полученную клеточную мембрану клеток линии СНО, экспрессирующих В изоформу нативного человеческого рецептора к инсулину, и микрочастицы PVT SPA вносили в 96-луночные планшеты Pico (PerkinElmer, Model No. 6005162, USA). В качестве конкурента добавляли человеческий инсулин или каждый из аналогов инсулина, более чем в 10 различных концентрациях (50 мМ Tris-HCl рН 7,8, 150 мМ NaCl, 0,1% BSA) вместе с меченным радиоизотопом I125 нативным инсулином человека (PerkinElmer, Model No. NEX-420, USA), который использовали в качестве лиганда для детекции, и затем оставляли для конкурентной реакции при комнатной температуре в течение 4 часов. Через четыре часа определяли аффинность связывания с рецепторами к инсулину при помощи счетчика бета-частиц (PerkinElmer, Model No. C9904V1, USA). На основании значений, полученных для каждого вещества при помощи счетчика бета-частиц, рассчитывали IC50 с использованием программного обеспечения GraphPad Prism 6 и выражали относительную аффинность связывания аналогов инсулина с рецептором инсулина относительно инсулина человека как процентное отношение значений IC50.
В результате у 1 аналога инсулина аффинность связывания с рецептором инсулина составила 90% по сравнению с человеческим инсулином, у 2 аналога инсулина 95%, у 3 аналога инсулина 1,0%, у 4 аналога инсулина менее 0,1%, у 6 аналога инсулина 20%, у 7 аналога инсулина 8,5%, у 9 аналога инсулина 79%, у 10 аналога инсулина 79%; у 11 аналога инсулина 24%; у 12 аналога инсулина менее 0,1% и менее 0,1% у 13 аналога инсулина (Таблица 4). Следовательно, аналоги инсулина по данному изобретению имели сниженную аффинность связывания с инсулиновыми рецепторами по сравнению с нативным инсулином.
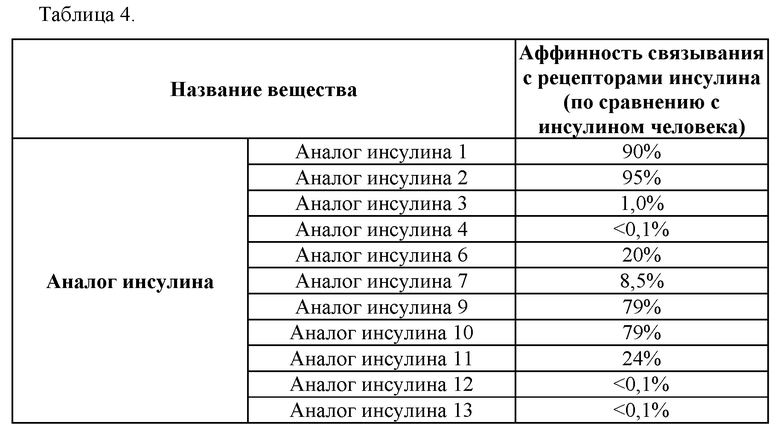
Экспериментальный пример 2: подтверждение аффинности связывания с рецептором для конъюгата аналога инсулина пролонгированного действия
Аффинность связывания аналога инсулина пролонгированного действия с рецептором инсулина и рецептором IGF-1 подтверждали способом, описанным выше в Экспериментальном Примере 1.
В результате по сравнению с нативным инсулином человека аффинность связывания с рецептором инсулина составляла 2,4±0,4% для конъюгата «нативный инсулин-PEG-Fc иммуноглобулина» и 1,3±0,2% для конъюгата «10 аналог инсулина-PEG-Fc иммуноглобулина». Кроме того, по сравнению с нативным человеческим IGF-1 аффинность связывания с рецептором IGF-1 составляла менее 1% для конъюгата «нативный инсулин-PEG-Fc иммуноглобулина» и для конъюгата «10 аналог инсулина-PEG-Fc иммуноглобулина». Соответственно, подтвердили, что в результате конъюгации с ПЭГ и Fc иммуноглобулина конъюгат «10 аналог инсулина-PEG-Fc иммуноглобулина» имел сниженную аффинность связывания с рецептором инсулина по сравнению с конъюгатом «нативный инсулин-PEG-Fc иммуноглобулина», и оба вещества имели сниженную аффинность связывания с рецептором IGF-1.
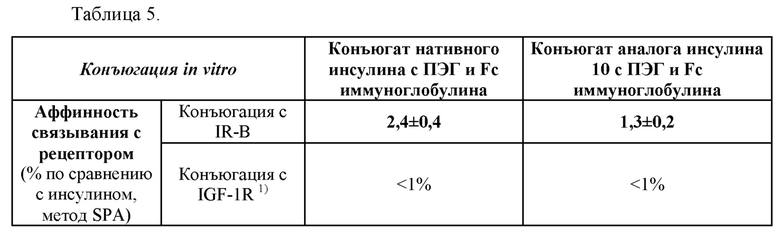
1) Точное значение не определялось, поскольку при наибольшей концентрации кривая зависимости «доза-эффект» не достигала уровня плато.
Экспериментальный пример 3: исследование фармакокинетики конъюгата аналога инсулина пролонгированного действия
Для подтверждения фармакокинетики конъюгата аналога инсулина пролонгированного действия проводили сравнительное исследование уровней концентрации в крови в течение времени у нормальных крыс (самцы крыс SD в возрасте 6 недель), нормальных мышей и собак, которым давали адаптироваться к лабораторным условиям в течение некоторого периода времени.
Конъюгат «нативный инсулин-ПЭГ-Fc иммуноглобулина» и конъюгат «10 аналог инсулина-ПЭГ-Fc иммуноглобулина» вводили подкожно мышам в концентрации 43,05 нмоль/кг и крысам в концентрации 65,1 нмоль/кг в однократной дозе. Затем брали образцы крови через 0, 1, 4, 8, 24, 48, 72, 96, 120, 144 и 168 часов. Кроме того, конъюгат «нативный инсулин-ПЭГ-Fc иммуноглобулина» и конъюгат «10 аналог инсулина-ПЭГ-Fc иммуноглобулина» вводили подкожно собакам в концентрации 6,3 нмоль/кг в однократной дозе. Затем брали образцы крови через 0, 1, 4, 8, 24, 48, 72, 96, 120, 144, 168, 192, 216 и 240 часов.
Определяли концентрации в крови конъюгата «нативный инсулин-ПЭГ-Fc иммуноглобулина» и конъюгата «10 аналог инсулина-ПЭГ-Fc иммуноглобулина» в каждый момент времени при помощи иммуноферментного анализа (ELISA) и в качестве набора для определения инсулина использовали набор ELISA производства ALPCO, USA. При этом в качестве детектирующего антитела использовали антитело мыши к IgG4 человека, конъюгированное с HRP (Alpha Diagnostic Intl, Inc, USA).
В результате по сравнению с конъюгатом «нативный инсулин-ПЭГ-Fc иммуноглобулина» время полужизни конъюгата «10 аналог инсулина-ПЭГ-Fc иммуноглобулина» увеличивалось в 1,9 раз, 1,2 раза и 1,6 раз у мышей, крыс и собак, соответственно, а среднее время удержания препарата в организме увеличивалось в 2,5 раза, 1,9 раза и 2,0 раза, соответственно. Соответственно, подтвердили, что продолжительность существования в крови конъюгата «аналог инсулина-ПЭГ-Fc иммуноглобулина» была выше по сравнению с конъюгатом «нативный инсулин-ПЭГ-Fc иммуноглобулина».
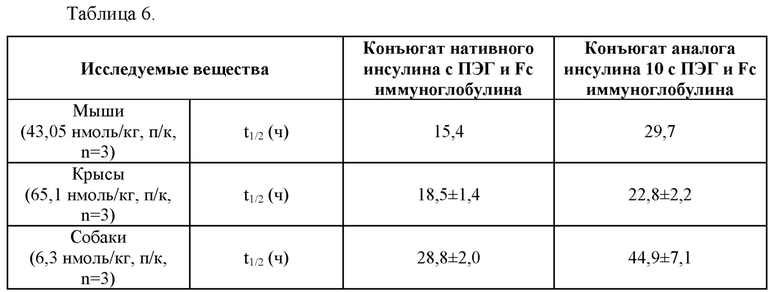
Экспериментальный пример 4: определение глюкозо-снижающего эффекта конъюгата аналога инсулина пролонгированного действия
Для подтверждения фармакодинамики конъюгата аналога инсулина пролонгированного действия на модели диабета 2 типа нормальным крысам (самцы крыс SD в возрасте 7 недель) давали рацион с высоким содержанием жира (60% жира) в течение 2 недель и вводили стрептозотоцин (STZ), способный разрушать бета-клетки поджелудочной железы в дозе 30 мг/кг дважды в неделю для создания модели диабета 2 типа (далее обозначаются крысами DIO/STZ). Для поддержания созданной модели диабета мышей непрерывно содержали на рационе с высоким содержанием жира.
Крысам DIO/STZ вводили подкожно 12,1 нмоль/кг конъюгата «нативный инсулин-ПЭГ-Fc иммуноглобулина» и 8,09 нмоль/кг конъюгата «10 аналог инсулина-ПЭГ-Fc иммуноглобулина» и введение повторяли с интервалом 3 суток. Для определения снижающего уровни глюкозы в крови эффекта in vivo при введении конъюгата «нативный инсулин-ПЭГ-Fc иммуноглобулина» и конъюгата «10 аналог инсулина-ПЭГ-Fc иммуноглобулина» брали образцы крови из хвостовой вены на 0, 1, 3, 6, 7, 9, 10, 12, 13, 15, 16, 21, 22, 24, 25, 27 и 28 сутки после введения и определяли уровни глюкозы в крови in vivo при помощи глюкометра OneTouch® Ultra® (LifeScan, Inc., USA).
В результате подтвердили, что эффект снижения уровня глюкозы в крови in vivo был эквивалентным у конъюгата «10 аналог инсулина-ПЭГ-Fc иммуноглобулина» и конъюгата «нативный инсулин-ПЭГ-Fc иммуноглобулина», даже при введении крысам DIO/STZ конъюгата в дозе 50%. На основании приведенных выше результатов подтвердили, что благодаря увеличенной продолжительности существования в крови in vivo превосходный эффект конъюгата «10 аналог инсулина 10-ПЭГ-Fc иммуноглобулина», выражающийся в снижении уровней глюкозы крови, сохранялся даже при более низких его дозах по сравнению с конъюгатом «нативный инсулин-ПЭГ-Fc иммуноглобулина».
На основании вышеизложенного материала специалисты в области техники поймут, что возможны и другие воплощения данного изобретения, без изменения технической концепции или существенных признаков данного изобретения. В этой связи приведенные в качестве примера воплощения служат исключительно для иллюстративных целей и не должны рассматриваться как ограничивающие объем изобретения. Напротив, данное изобретение охватывает не только приведенные в качестве примера воплощения, но также и различные альтернативы, модификации, эквиваленты и другие воплощения, которые могут быть в духе данного изобретения и входить в его объем, определяемый прилагающейся формулой изобретения.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> HANMI PHARM. CO., LTD.
<120> A conjugate of insulin analog with reduced affinity to insulin
receptor and use thereof
<130> OPA18124
<150> KR 10-2017-0037101
<151> 2017-03-23
<160> 56
<170> KoPatentIn 3.0
<210> 1
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 1
cagcatctgc tccctccatc agctggagaa ctac 34
<210> 2
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 2
gtagttctcc agctgatgga gggagcagat gctg 34
<210> 3
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 3
cagcatctgc tccctcaagc agctggagaa ctac 34
<210> 4
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 4
gtagttctcc agctgcttga gggagcagat gctg 34
<210> 5
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 5
ctaccagctg gagaacgagt gcaactgagg atcc 34
<210> 6
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 6
ggatcctcag ttgcactcgt tctccagctg gtag 34
<210> 7
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 7
ctaccagctg gagaactcct gcaactgagg atcc 34
<210> 8
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 8
ggatcctcag ttgcaggagt tctccagctg gtag 34
<210> 9
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 9
ctaccagctg gagaacacct gcaactgagg atcc 34
<210> 10
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 10
ggatcctcag ttgcaggtgt tctccagctg gtag 34
<210> 11
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 11
ctggtggaag ctctcgagct agtgtgcggg gaac 34
<210> 12
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 12
gttccccgca cactagctcg agagcttcca ccag 34
<210> 13
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 13
ctggtggaag ctctctccct agtgtgcggg gaac 34
<210> 14
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 14
gttccccgca cactagggag agagcttcca ccag 34
<210> 15
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 15
ctggtggaag ctctcaccct agtgtgcggg gaac 34
<210> 16
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 16
gttccccgca cactagggtg agagcttcca ccag 34
<210> 17
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 17
cagcatctgc tccctcgccc agctggagaa ctac 34
<210> 18
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 18
gtagttctcc agctgggcga gggagcagat gctg 34
<210> 19
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 19
cagcatctgc tccctcgacc agctggagaa ctac 34
<210> 20
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 20
gtagttctcc agctggtcga gggagcagat gctg 34
<210> 21
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 21
ctggtggaag ctctcgacct agtgtgcggg gaac 34
<210> 22
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 22
gttccccgca cactaggtcg agagcttcca ccag 34
<210> 23
<211> 33
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 23
ggggaacgag gcttcgacta cacacccaag acc 33
<210> 24
<211> 33
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 24
ggtcttgggt gtgtagtcga agcctcgttc ccc 33
<210> 25
<211> 33
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 25
ggggaacgag gcttcgagta cacacccaag acc 33
<210> 26
<211> 33
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 26
ggtcttgggt gtgtactcga agcctcgttc ccc 33
<210> 27
<211> 258
<212> DNA
<213> Artificial Sequence
<220>
<223> Аналог 1
<400> 27
ttcgttaacc aacacttgtg tggctcacac ctggtggaag ctctctacct agtgtgcggg 60
gaacgaggct tcttctacac acccaagacc cgccgggagg cagaggacct gcaggtgggg 120
caggtggagc tgggcggggg ccctggtgca ggcagcctgc agcccttggc cctggagggg 180
tccctgcaga agcgtggcat tgtggaacaa tgctgtacca gcatctgctc cctccatcag 240
ctggagaact actgcaac 258
<210> 28
<211> 86
<212> PRT
<213> Artificial Sequence
<220>
<223> Аналог 1
<400> 28
Phe Val Asn Gln His Leu Cys Gly Ser His Leu Val Glu Ala Leu Tyr
1 5 10 15
Leu Val Cys Gly Glu Arg Gly Phe Phe Tyr Thr Pro Lys Thr Arg Arg
20 25 30
Glu Ala Glu Asp Leu Gln Val Gly Gln Val Glu Leu Gly Gly Gly Pro
35 40 45
Gly Ala Gly Ser Leu Gln Pro Leu Ala Leu Glu Gly Ser Leu Gln Lys
50 55 60
Arg Gly Ile Val Glu Gln Cys Cys Thr Ser Ile Cys Ser Leu His Gln
65 70 75 80
Leu Glu Asn Tyr Cys Asn
85
<210> 29
<211> 258
<212> DNA
<213> Artificial Sequence
<220>
<223> Аналог 2
<400> 29
ttcgttaacc aacacttgtg tggctcacac ctggtggaag ctctctacct agtgtgcggg 60
gaacgaggct tcttctacac acccaagacc cgccgggagg cagaggacct gcaggtgggg 120
caggtggagc tgggcggggg ccctggtgca ggcagcctgc agcccttggc cctggagggg 180
tccctgcaga agcgtggcat tgtggaacaa tgctgtacca gcatctgctc cctcaagcag 240
ctggagaact actgcaac 258
<210> 30
<211> 86
<212> PRT
<213> Artificial Sequence
<220>
<223> Аналог 2
<400> 30
Phe Val Asn Gln His Leu Cys Gly Ser His Leu Val Glu Ala Leu Tyr
1 5 10 15
Leu Val Cys Gly Glu Arg Gly Phe Phe Tyr Thr Pro Lys Thr Arg Arg
20 25 30
Glu Ala Glu Asp Leu Gln Val Gly Gln Val Glu Leu Gly Gly Gly Pro
35 40 45
Gly Ala Gly Ser Leu Gln Pro Leu Ala Leu Glu Gly Ser Leu Gln Lys
50 55 60
Arg Gly Ile Val Glu Gln Cys Cys Thr Ser Ile Cys Ser Leu Lys Gln
65 70 75 80
Leu Glu Asn Tyr Cys Asn
85
<210> 31
<211> 258
<212> DNA
<213> Artificial Sequence
<220>
<223> Аналог 3
<400> 31
ttcgttaacc aacacttgtg tggctcacac ctggtggaag ctctctacct agtgtgcggg 60
gaacgaggct tcttctacac acccaagacc cgccgggagg cagaggacct gcaggtgggg 120
caggtggagc tgggcggggg ccctggtgca ggcagcctgc agcccttggc cctggagggg 180
tccctgcaga agcgtggcat tgtggaacaa tgctgtacca gcatctgctc cctctaccag 240
ctggagaacg agtgcaac 258
<210> 32
<211> 86
<212> PRT
<213> Artificial Sequence
<220>
<223> Аналог 3
<400> 32
Phe Val Asn Gln His Leu Cys Gly Ser His Leu Val Glu Ala Leu Tyr
1 5 10 15
Leu Val Cys Gly Glu Arg Gly Phe Phe Tyr Thr Pro Lys Thr Arg Arg
20 25 30
Glu Ala Glu Asp Leu Gln Val Gly Gln Val Glu Leu Gly Gly Gly Pro
35 40 45
Gly Ala Gly Ser Leu Gln Pro Leu Ala Leu Glu Gly Ser Leu Gln Lys
50 55 60
Arg Gly Ile Val Glu Gln Cys Cys Thr Ser Ile Cys Ser Leu Tyr Gln
65 70 75 80
Leu Glu Asn Glu Cys Asn
85
<210> 33
<211> 258
<212> DNA
<213> Artificial Sequence
<220>
<223> Аналог 4
<400> 33
ttcgttaacc aacacttgtg tggctcacac ctggtggaag ctctctacct agtgtgcggg 60
gaacgaggct tcttctacac acccaagacc cgccgggagg cagaggacct gcaggtgggg 120
caggtggagc tgggcggggg ccctggtgca ggcagcctgc agcccttggc cctggagggg 180
tccctgcaga agcgtggcat tgtggaacaa tgctgtacca gcatctgctc cctctaccag 240
ctggagaact cctgcaac 258
<210> 34
<211> 86
<212> PRT
<213> Artificial Sequence
<220>
<223> Аналог 4
<400> 34
Phe Val Asn Gln His Leu Cys Gly Ser His Leu Val Glu Ala Leu Tyr
1 5 10 15
Leu Val Cys Gly Glu Arg Gly Phe Phe Tyr Thr Pro Lys Thr Arg Arg
20 25 30
Glu Ala Glu Asp Leu Gln Val Gly Gln Val Glu Leu Gly Gly Gly Pro
35 40 45
Gly Ala Gly Ser Leu Gln Pro Leu Ala Leu Glu Gly Ser Leu Gln Lys
50 55 60
Arg Gly Ile Val Glu Gln Cys Cys Thr Ser Ile Cys Ser Leu Tyr Gln
65 70 75 80
Leu Glu Asn Ser Cys Asn
85
<210> 35
<211> 258
<212> DNA
<213> Artificial Sequence
<220>
<223> Аналог 5
<400> 35
ttcgttaacc aacacttgtg tggctcacac ctggtggaag ctctctacct agtgtgcggg 60
gaacgaggct tcttctacac acccaagacc cgccgggagg cagaggacct gcaggtgggg 120
caggtggagc tgggcggggg ccctggtgca ggcagcctgc agcccttggc cctggagggg 180
tccctgcaga agcgtggcat tgtggaacaa tgctgtacca gcatctgctc cctctaccag 240
ctggagaaca cctgcaac 258
<210> 36
<211> 86
<212> PRT
<213> Artificial Sequence
<220>
<223> Аналог 5
<400> 36
Phe Val Asn Gln His Leu Cys Gly Ser His Leu Val Glu Ala Leu Tyr
1 5 10 15
Leu Val Cys Gly Glu Arg Gly Phe Phe Tyr Thr Pro Lys Thr Arg Arg
20 25 30
Glu Ala Glu Asp Leu Gln Val Gly Gln Val Glu Leu Gly Gly Gly Pro
35 40 45
Gly Ala Gly Ser Leu Gln Pro Leu Ala Leu Glu Gly Ser Leu Gln Lys
50 55 60
Arg Gly Ile Val Glu Gln Cys Cys Thr Ser Ile Cys Ser Leu Tyr Gln
65 70 75 80
Leu Glu Asn Thr Cys Asn
85
<210> 37
<211> 258
<212> DNA
<213> Artificial Sequence
<220>
<223> Аналог 6
<400> 37
ttcgttaacc aacacttgtg tggctcacac ctggtggaag ctctcgagct agtgtgcggg 60
gaacgaggct tcttctacac acccaagacc cgccgggagg cagaggacct gcaggtgggg 120
caggtggagc tgggcggggg ccctggtgca ggcagcctgc agcccttggc cctggagggg 180
tccctgcaga agcgtggcat tgtggaacaa tgctgtacca gcatctgctc cctctaccag 240
ctggagaact actgcaac 258
<210> 38
<211> 86
<212> PRT
<213> Artificial Sequence
<220>
<223> Аналог 6
<400> 38
Phe Val Asn Gln His Leu Cys Gly Ser His Leu Val Glu Ala Leu Glu
1 5 10 15
Leu Val Cys Gly Glu Arg Gly Phe Phe Tyr Thr Pro Lys Thr Arg Arg
20 25 30
Glu Ala Glu Asp Leu Gln Val Gly Gln Val Glu Leu Gly Gly Gly Pro
35 40 45
Gly Ala Gly Ser Leu Gln Pro Leu Ala Leu Glu Gly Ser Leu Gln Lys
50 55 60
Arg Gly Ile Val Glu Gln Cys Cys Thr Ser Ile Cys Ser Leu Tyr Gln
65 70 75 80
Leu Glu Asn Tyr Cys Asn
85
<210> 39
<211> 258
<212> DNA
<213> Artificial Sequence
<220>
<223> Аналог 7
<400> 39
ttcgttaacc aacacttgtg tggctcacac ctggtggaag ctctctccct agtgtgcggg 60
gaacgaggct tcttctacac acccaagacc cgccgggagg cagaggacct gcaggtgggg 120
caggtggagc tgggcggggg ccctggtgca ggcagcctgc agcccttggc cctggagggg 180
tccctgcaga agcgtggcat tgtggaacaa tgctgtacca gcatctgctc cctctaccag 240
ctggagaact actgcaac 258
<210> 40
<211> 86
<212> PRT
<213> Artificial Sequence
<220>
<223> Аналог 7
<400> 40
Phe Val Asn Gln His Leu Cys Gly Ser His Leu Val Glu Ala Leu Ser
1 5 10 15
Leu Val Cys Gly Glu Arg Gly Phe Phe Tyr Thr Pro Lys Thr Arg Arg
20 25 30
Glu Ala Glu Asp Leu Gln Val Gly Gln Val Glu Leu Gly Gly Gly Pro
35 40 45
Gly Ala Gly Ser Leu Gln Pro Leu Ala Leu Glu Gly Ser Leu Gln Lys
50 55 60
Arg Gly Ile Val Glu Gln Cys Cys Thr Ser Ile Cys Ser Leu Tyr Gln
65 70 75 80
Leu Glu Asn Tyr Cys Asn
85
<210> 41
<211> 258
<212> DNA
<213> Artificial Sequence
<220>
<223> Аналог 8
<400> 41
ttcgttaacc aacacttgtg tggctcacac ctggtggaag ctctcaccct agtgtgcggg 60
gaacgaggct tcttctacac acccaagacc cgccgggagg cagaggacct gcaggtgggg 120
caggtggagc tgggcggggg ccctggtgca ggcagcctgc agcccttggc cctggagggg 180
tccctgcaga agcgtggcat tgtggaacaa tgctgtacca gcatctgctc cctctaccag 240
ctggagaact actgcaac 258
<210> 42
<211> 86
<212> PRT
<213> Artificial Sequence
<220>
<223> Аналог 8
<400> 42
Phe Val Asn Gln His Leu Cys Gly Ser His Leu Val Glu Ala Leu Thr
1 5 10 15
Leu Val Cys Gly Glu Arg Gly Phe Phe Tyr Thr Pro Lys Thr Arg Arg
20 25 30
Glu Ala Glu Asp Leu Gln Val Gly Gln Val Glu Leu Gly Gly Gly Pro
35 40 45
Gly Ala Gly Ser Leu Gln Pro Leu Ala Leu Glu Gly Ser Leu Gln Lys
50 55 60
Arg Gly Ile Val Glu Gln Cys Cys Thr Ser Ile Cys Ser Leu Tyr Gln
65 70 75 80
Leu Glu Asn Tyr Cys Asn
85
<210> 43
<211> 258
<212> DNA
<213> Artificial Sequence
<220>
<223> Аналог 9
<400> 43
ttcgttaacc aacacttgtg tggctcacac ctggtggaag ctctctacct agtgtgcggg 60
gaacgaggct tcttctacac acccaagacc cgccgggagg cagaggacct gcaggtgggg 120
caggtggagc tgggcggggg ccctggtgca ggcagcctgc agcccttggc cctggagggg 180
tccctgcaga agcgtggcat tgtggaacaa tgctgtacca gcatctgctc cctcgcccag 240
ctggagaact actgcaac 258
<210> 44
<211> 86
<212> PRT
<213> Artificial Sequence
<220>
<223> Аналог 9
<400> 44
Phe Val Asn Gln His Leu Cys Gly Ser His Leu Val Glu Ala Leu Tyr
1 5 10 15
Leu Val Cys Gly Glu Arg Gly Phe Phe Tyr Thr Pro Lys Thr Arg Arg
20 25 30
Glu Ala Glu Asp Leu Gln Val Gly Gln Val Glu Leu Gly Gly Gly Pro
35 40 45
Gly Ala Gly Ser Leu Gln Pro Leu Ala Leu Glu Gly Ser Leu Gln Lys
50 55 60
Arg Gly Ile Val Glu Gln Cys Cys Thr Ser Ile Cys Ser Leu Ala Gln
65 70 75 80
Leu Glu Asn Tyr Cys Asn
85
<210> 45
<211> 258
<212> DNA
<213> Artificial Sequence
<220>
<223> Аналог 10
<400> 45
ttcgttaacc aacacttgtg tggctcacac ctggtggaag ctctctacct agtgtgcggg 60
gaacgaggct tcttctacac acccaagacc cgccgggagg cagaggacct gcaggtgggg 120
caggtggagc tgggcggggg ccctggtgca ggcagcctgc agcccttggc cctggagggg 180
tccctgcaga agcgtggcat tgtggaacaa tgctgtacca gcatctgctc cctcgaccag 240
ctggagaact actgcaac 258
<210> 46
<211> 86
<212> PRT
<213> Artificial Sequence
<220>
<223> Аналог 10
<400> 46
Phe Val Asn Gln His Leu Cys Gly Ser His Leu Val Glu Ala Leu Tyr
1 5 10 15
Leu Val Cys Gly Glu Arg Gly Phe Phe Tyr Thr Pro Lys Thr Arg Arg
20 25 30
Glu Ala Glu Asp Leu Gln Val Gly Gln Val Glu Leu Gly Gly Gly Pro
35 40 45
Gly Ala Gly Ser Leu Gln Pro Leu Ala Leu Glu Gly Ser Leu Gln Lys
50 55 60
Arg Gly Ile Val Glu Gln Cys Cys Thr Ser Ile Cys Ser Leu Asp Gln
65 70 75 80
Leu Glu Asn Tyr Cys Asn
85
<210> 47
<211> 258
<212> DNA
<213> Artificial Sequence
<220>
<223> Аналог 11
<400> 47
ttcgttaacc aacacttgtg tggctcacac ctggtggaag ctctcgacct agtgtgcggg 60
gaacgaggct tcttctacac acccaagacc cgccgggagg cagaggacct gcaggtgggg 120
caggtggagc tgggcggggg ccctggtgca ggcagcctgc agcccttggc cctggagggg 180
tccctgcaga agcgtggcat tgtggaacaa tgctgtacca gcatctgctc cctctaccag 240
ctggagaact actgcaac 258
<210> 48
<211> 86
<212> PRT
<213> Artificial Sequence
<220>
<223> Аналог 11
<400> 48
Phe Val Asn Gln His Leu Cys Gly Ser His Leu Val Glu Ala Leu Asp
1 5 10 15
Leu Val Cys Gly Glu Arg Gly Phe Phe Tyr Thr Pro Lys Thr Arg Arg
20 25 30
Glu Ala Glu Asp Leu Gln Val Gly Gln Val Glu Leu Gly Gly Gly Pro
35 40 45
Gly Ala Gly Ser Leu Gln Pro Leu Ala Leu Glu Gly Ser Leu Gln Lys
50 55 60
Arg Gly Ile Val Glu Gln Cys Cys Thr Ser Ile Cys Ser Leu Tyr Gln
65 70 75 80
Leu Glu Asn Tyr Cys Asn
85
<210> 49
<211> 258
<212> DNA
<213> Artificial Sequence
<220>
<223> Аналог 12
<400> 49
ttcgttaacc aacacttgtg tggctcacac ctggtggaag ctctctacct agtgtgcggg 60
gaacgaggct tcgactacac acccaagacc cgccgggagg cagaggacct gcaggtgggg 120
caggtggagc tgggcggggg ccctggtgca ggcagcctgc agcccttggc cctggagggg 180
tccctgcaga agcgtggcat tgtggaacaa tgctgtacca gcatctgctc cctctaccag 240
ctggagaact actgcaac 258
<210> 50
<211> 86
<212> PRT
<213> Artificial Sequence
<220>
<223> Аналог 12
<400> 50
Phe Val Asn Gln His Leu Cys Gly Ser His Leu Val Glu Ala Leu Tyr
1 5 10 15
Leu Val Cys Gly Glu Arg Gly Phe Asp Tyr Thr Pro Lys Thr Arg Arg
20 25 30
Glu Ala Glu Asp Leu Gln Val Gly Gln Val Glu Leu Gly Gly Gly Pro
35 40 45
Gly Ala Gly Ser Leu Gln Pro Leu Ala Leu Glu Gly Ser Leu Gln Lys
50 55 60
Arg Gly Ile Val Glu Gln Cys Cys Thr Ser Ile Cys Ser Leu Tyr Gln
65 70 75 80
Leu Glu Asn Tyr Cys Asn
85
<210> 51
<211> 258
<212> DNA
<213> Artificial Sequence
<220>
<223> Аналог 13
<400> 51
ttcgttaacc aacacttgtg tggctcacac ctggtggaag ctctctacct agtgtgcggg 60
gaacgaggct tcgagtacac acccaagacc cgccgggagg cagaggacct gcaggtgggg 120
caggtggagc tgggcggggg ccctggtgca ggcagcctgc agcccttggc cctggagggg 180
tccctgcaga agcgtggcat tgtggaacaa tgctgtacca gcatctgctc cctctaccag 240
ctggagaact actgcaac 258
<210> 52
<211> 86
<212> PRT
<213> Artificial Sequence
<220>
<223> Аналог 13
<400> 52
Phe Val Asn Gln His Leu Cys Gly Ser His Leu Val Glu Ala Leu Tyr
1 5 10 15
Leu Val Cys Gly Glu Arg Gly Phe Glu Tyr Thr Pro Lys Thr Arg Arg
20 25 30
Glu Ala Glu Asp Leu Gln Val Gly Gln Val Glu Leu Gly Gly Gly Pro
35 40 45
Gly Ala Gly Ser Leu Gln Pro Leu Ala Leu Glu Gly Ser Leu Gln Lys
50 55 60
Arg Gly Ile Val Glu Gln Cys Cys Thr Ser Ile Cys Ser Leu Tyr Gln
65 70 75 80
Leu Glu Asn Tyr Cys Asn
85
<210> 53
<211> 21
<212> PRT
<213> Homo sapiens
<400> 53
Gly Ile Val Glu Gln Cys Cys Thr Ser Ile Cys Ser Leu Tyr Gln Leu
1 5 10 15
Glu Asn Tyr Cys Asn
20
<210> 54
<211> 30
<212> PRT
<213> Homo sapiens
<400> 54
Phe Val Asn Gln His Leu Cys Gly Ser His Leu Val Glu Ala Leu Tyr
1 5 10 15
Leu Val Cys Gly Glu Arg Gly Phe Phe Tyr Thr Pro Lys Thr
20 25 30
<210> 55
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Аналог инсулина, A-цепь
<220>
<221> MISC_FEATURE
<222> (1)
<223> Xaa представляет собой аланин, глицин, глутамин, гистидин, глутаминовую
кислоту или аспарагин
<220>
<221> MISC_FEATURE
<222> (5)
<223> Xaa представляет собой аланин, глутаминовую кислоту, глутамин, гистидин или
аспарагин
<220>
<221> MISC_FEATURE
<222> (12)
<223> Xaa представляет собой аланин, серин, глутамин, глутаминовую кислоту, гистидин или
аспарагин
<220>
<221> MISC_FEATURE
<222> (14)
<223> Xaa представляет собой тирозин, гистидин, лизин, аланин или аспарагиновую кислоту
<220>
<221> MISC_FEATURE
<222> (16)
<223> Xaa представляет собой аланин, лейцин, тирозин, гистидин, глутаминовую кислоту или
аспарагин
<220>
<221> MISC_FEATURE
<222> (19)
<223> Xaa представляет собой тирозин, глутаминовую кислоту, серин или треонин
<220>
<221> MISC_FEATURE
<222> (21)
<223> Xaa представляет собой аспарагин, глицин, гистидин или аланин
<400> 55
Xaa Ile Val Glu Xaa Cys Cys Thr Ser Ile Cys Xaa Leu Xaa Gln Xaa
1 5 10 15
Glu Asn Xaa Cys Xaa
20
<210> 56
<211> 30
<212> PRT
<213> Artificial Sequence
<220>
<223> Аналог инсулина, B-цепь
<220>
<221> MISC_FEATURE
<222> (16)
<223> Xaa представляет собой тирозин, глутаминовую кислоту, серин,
треонин или аспарагиновую кислоту
<220>
<221> MISC_FEATURE
<222> (25)
<223> Xaa представляет собой фенилаланин, аспарагиновую кислоту или
глутаминовую кислоту
<220>
<221> MISC_FEATURE
<222> (27)
<223> Xaa представляет собой треонин или отсутствует
<220>
<221> MISC_FEATURE
<222> (28)
<223> Xaa представляет собой пролин, глутаминовую кислоту или
аспарагиновую кислоту или отсутствует
<400> 56
Phe Val Asn Gln His Leu Cys Gly Ser His Leu Val Glu Ala Leu Xaa
1 5 10 15
Leu Val Cys Gly Glu Arg Gly Phe Xaa Tyr Xaa Xaa Lys Thr
20 25 30
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Аналоги инсулина с пониженной аффинностью к рецептору инсулина и их применение | 2017 |
|
RU2764197C1 |
| Конъюгат физиологически активного вещества длительного действия и его применение | 2018 |
|
RU2773823C2 |
| Фармацевтическая композиция, содержащая инсулин и глюкагон | 2019 |
|
RU2823246C2 |
| СПОСОБЫ ПОДАВЛЕНИЯ ГЛЮКАГОНА | 2000 |
|
RU2247575C9 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ЖЕЛУДОЧНО-КИШЕЧНЫХ РАССТРОЙСТВ | 2004 |
|
RU2543350C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ЖЕЛУДОЧНО-КИШЕЧНЫХ РАССТРОЙСТВ | 2004 |
|
RU2353383C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ЖЕЛУДОЧНО-КИШЕЧНЫХ РАССТРОЙСТВ | 2014 |
|
RU2763796C2 |
| КОМПОЗИЦИЯ И МИКРОСФЕРА С КОНТРОЛИРУЕМЫМ ВЫСВОБОЖДЕНИЕМ ЭКЗЕНДИНА И СПОСОБ ПОЛУЧЕНИЯ МИКРОСФЕРЫ | 2008 |
|
RU2463040C2 |
| ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ КОНЪЮГАТА ТРОЙНОГО АГОНИСТА ДЛИТЕЛЬНОГО ДЕЙСТВИЯ, ОБЛАДАЮЩЕГО АКТИВНОСТЯМИ В ОТНОШЕНИИ ВСЕХ ИЗ РЕЦЕПТОРОВ ГЛЮКАГОНА /GLP-1/GIP, ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЯ ЛЕГКОГО | 2020 |
|
RU2829342C1 |
| СПОСОБ ВВЕДЕНИЯ МОЛЕКУЛ GLP-1 | 2003 |
|
RU2332229C2 |

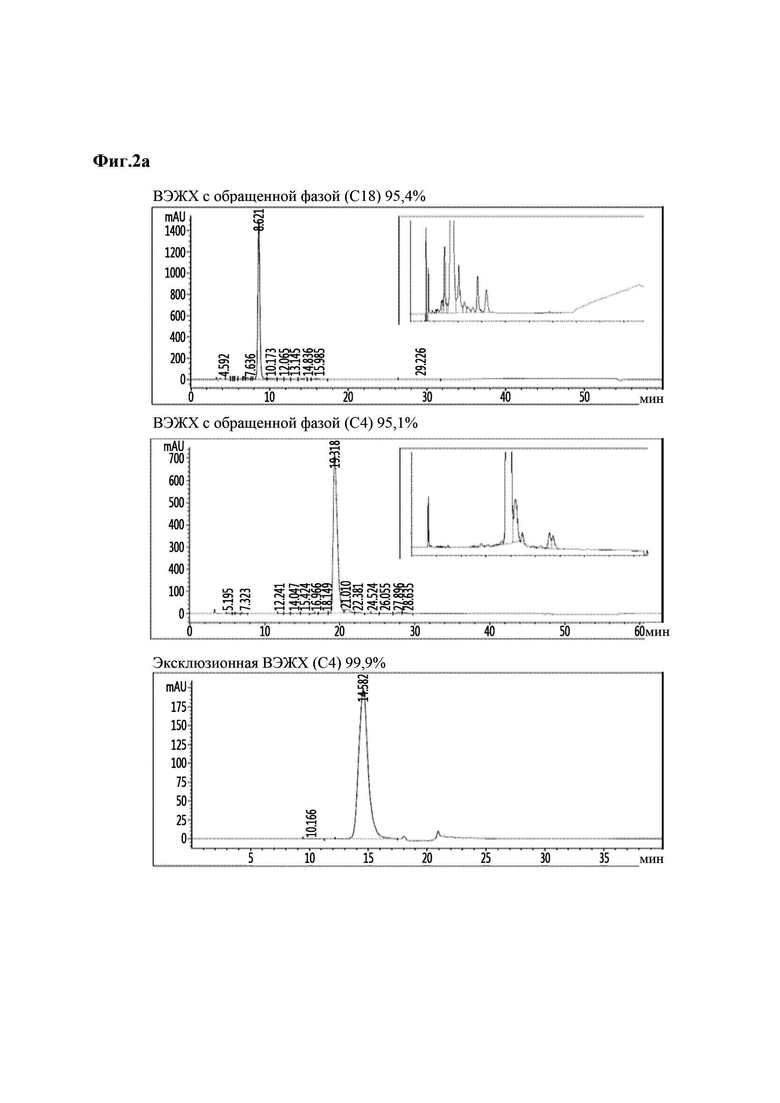
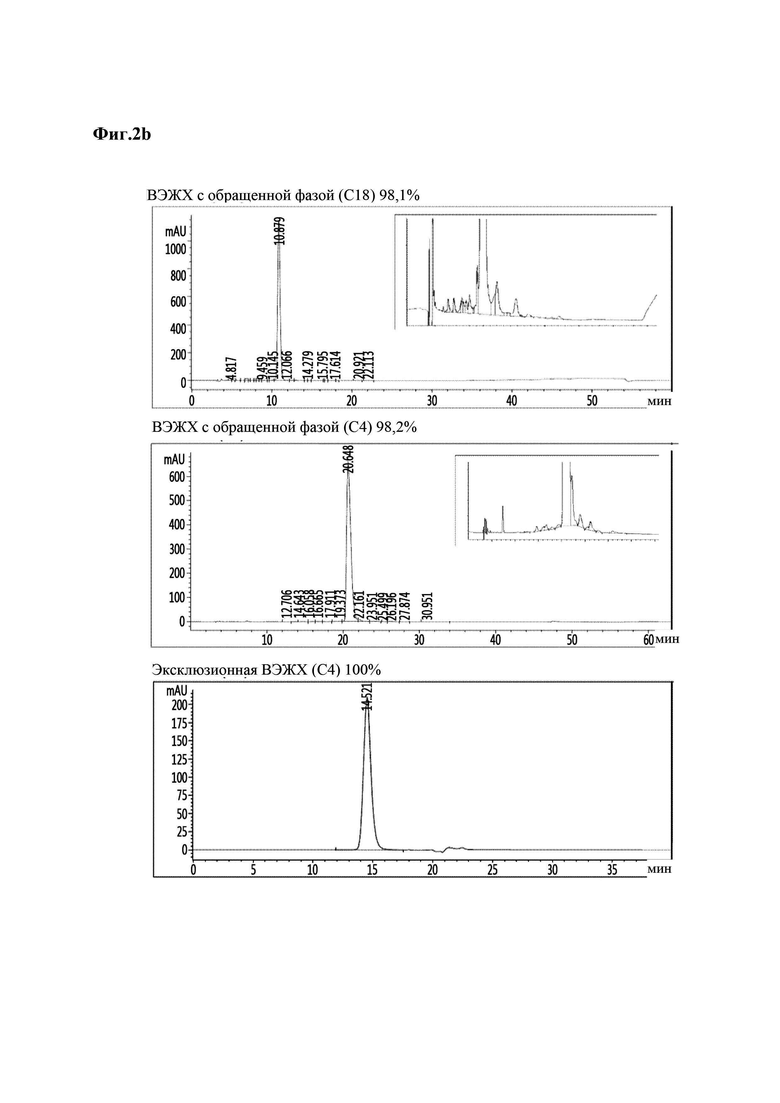
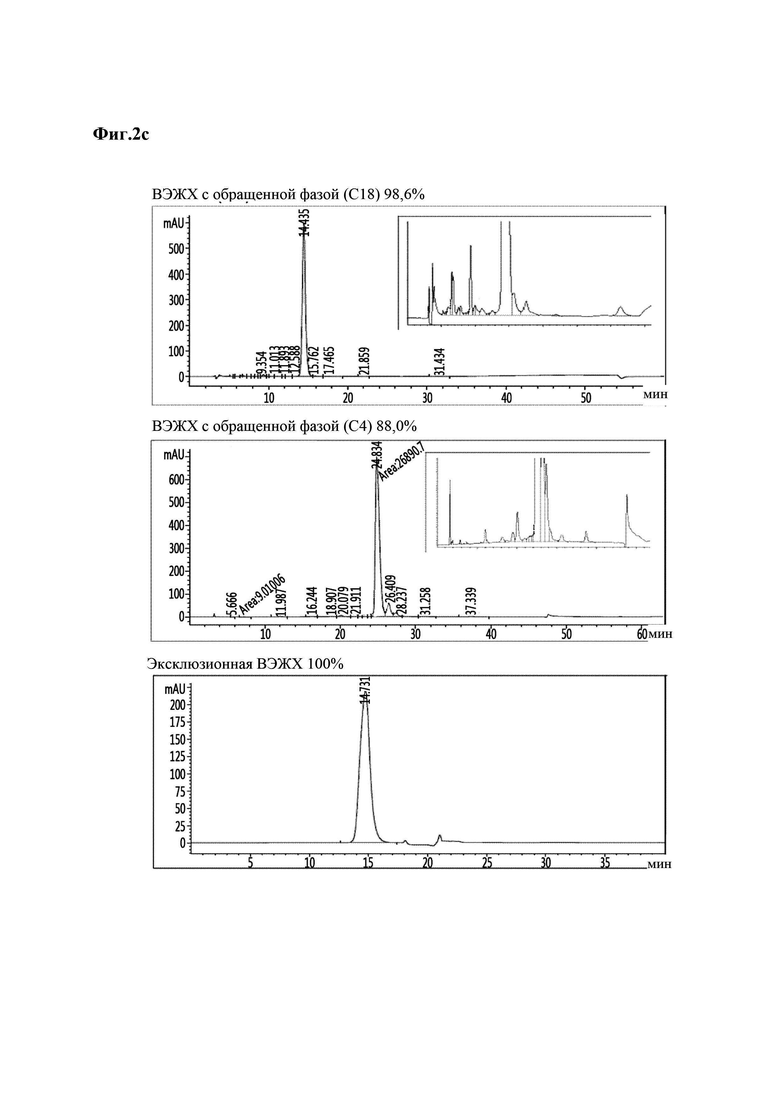
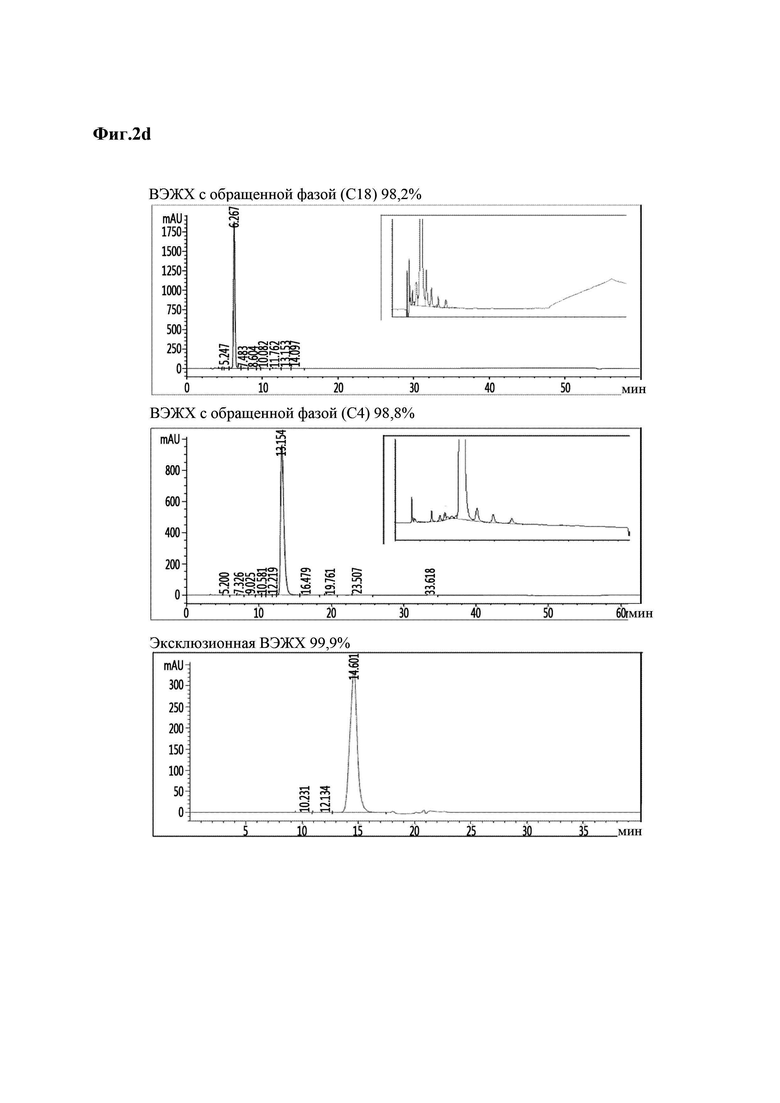
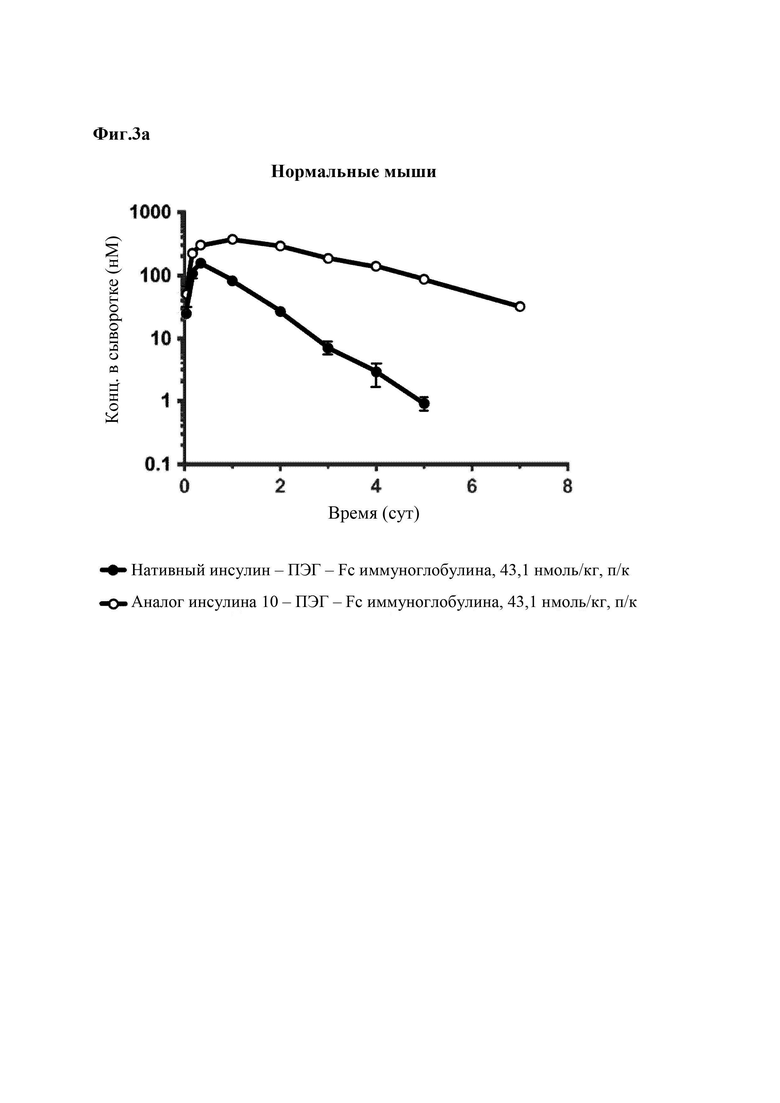
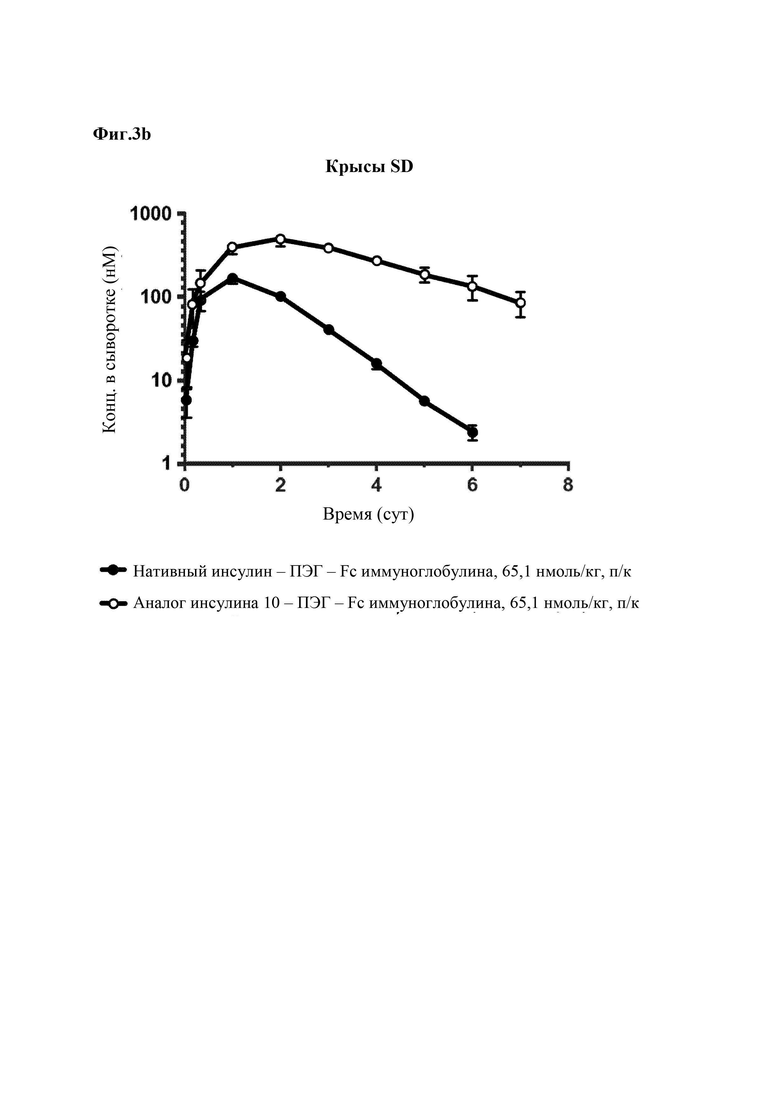
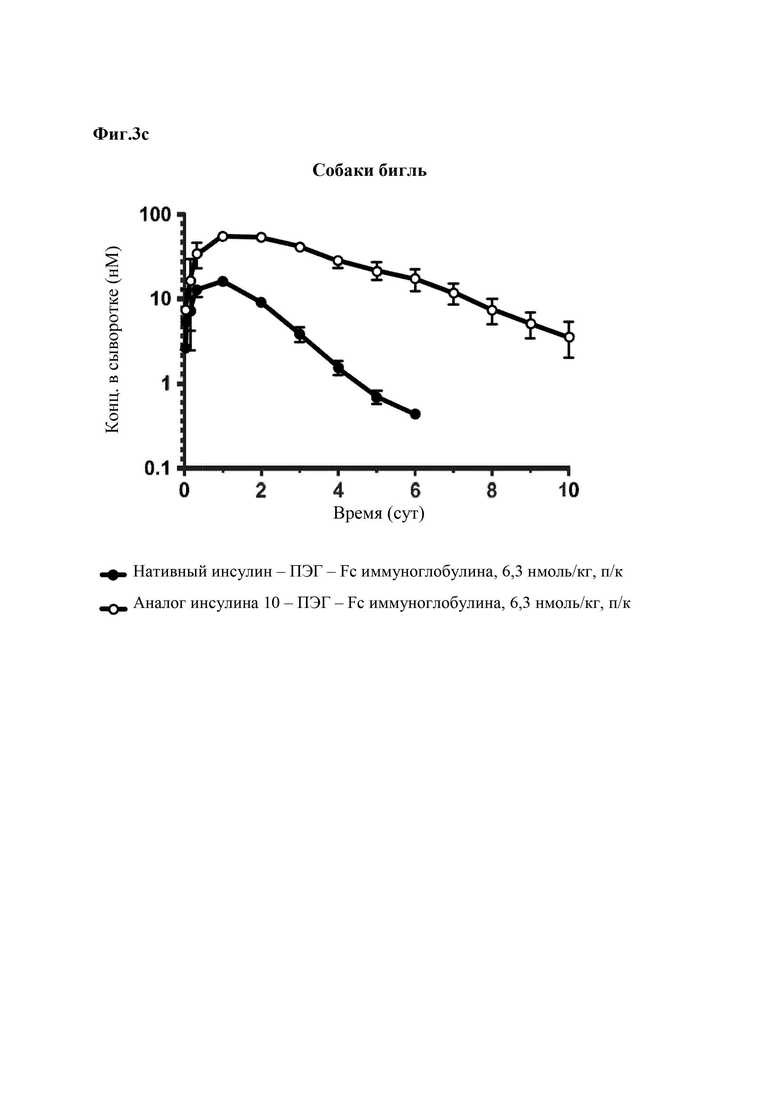
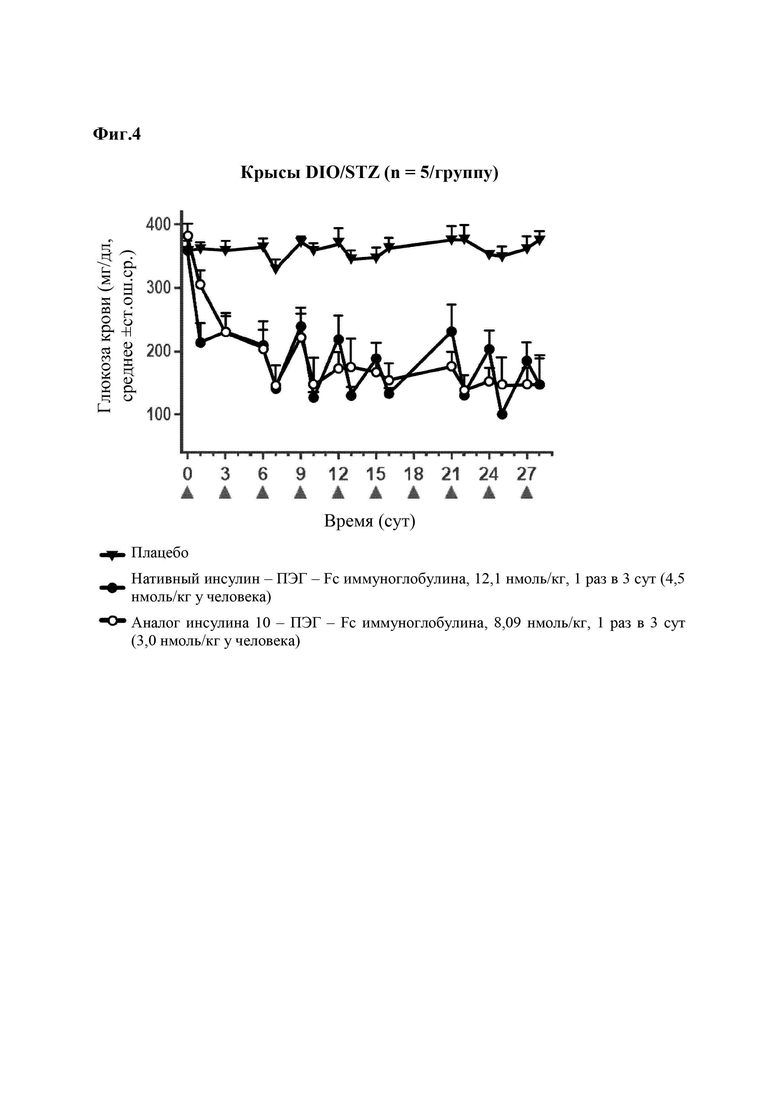
Изобретение относится к области биотехнологии, конкретно к получению конъюгатов инсулина, и может быть использовано в медицине для лечения диабета. Предложен конъюгат инсулина формулы X-L1-F (формула 1), где Х - аналог инсулина, имеющий такую же последовательность, как и нативный инсулин, за исключением того, что 14-я аминокислота А-цепи представляет собой аспарагиновую кислоту; L – полиэтиленгликоль в качестве линкера; F - Fc-фрагмент иммуноглобулина. В предложенном конъюгате X, L и F связаны друг с другом посредством ковалентной связи в порядке как указано в формуле 1 и оба конца указанного линкера присоединены к N-концу B-цепи указанного аналога инсулина и к N-концу указанного Fc-фрагмента иммуноглобулина. Полученный конъюгат инсулина пролонгированного действия неприродного происхождения позволяет улучшать комплаентность пациентов, которым необходимо введение инсулина. 3 н. и 3 з.п. ф-лы, 4 ил., 4 табл., 9 пр.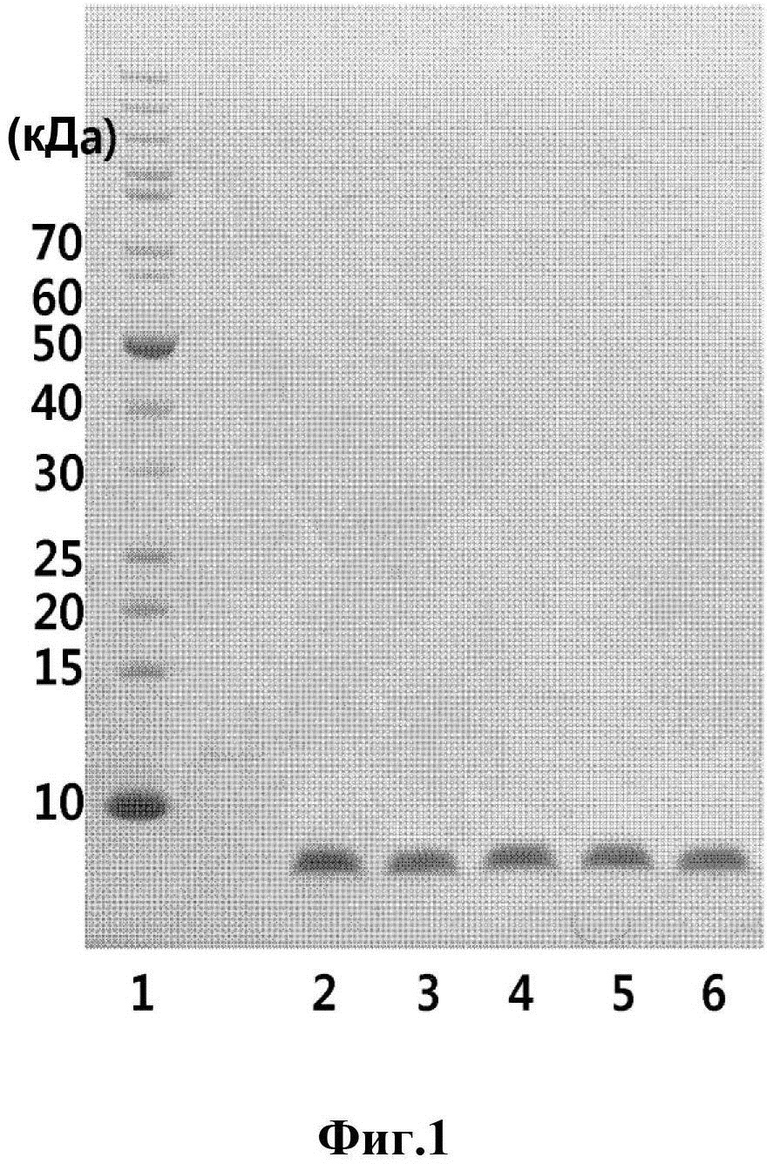
1. Конъюгат для лечения диабета, представленный Формулой 1:
[Формула 1]
X-La-F,
где в Формуле 1
Х представляет собой аналог инсулина, имеющий такую же последовательность, как и нативный инсулин, за исключением того, что 14-я аминокислота А-цепи представляет собой аспарагиновую кислоту;
L представляет собой линкер, где линкер представляет собой полиэтиленгликоль;
a представляет собой 1;
F представляет собой Fc-фрагмент иммуноглобулина; и
X, L и F связаны друг с другом посредством ковалентной связи в порядке, указанном в Формуле 1;
и оба конца указанного линкера присоединены к N-концу B-цепи указанного аналога инсулина и к N-концу указанного Fc-фрагмента иммуноглобулина.
2. Конъюгат по п. 1, где F представляет собой Fc-фрагмент IgG.
3. Конъюгат по п. 1, где L имеет молекулярную массу от 1 кДа до 100 кДа.
4. Конъюгат по любому из пп. 1-3, где аффинность связывания конъюгата с рецептором нативного инсулина составляет от 0,1% до 50% по сравнению с аффинностью нативного инсулина.
5. Фармацевтическая композиция для предупреждения или лечения диабета, содержащая эффективную дозу конъюгата по любому из пп. 1-4 и фармацевтически приемлемый носитель.
6. Способ лечения диабета, включающий введение эффективной дозы конъюгата по любому из пп. 1-4 или композиции по п. 5 субъекту, нуждающемуся в этом.
| WO 2016006963 A1, 14.01.2016, EA 201691374 A1, 30.12.2016, EA 201690116 A1, 29.07.2016, RU 2524150 C2, 27.07.2014, ИНСУЛИНОТЕРАПИЯ, ПОСОБИЕ ДЛЯ ВРАЧЕЙ, под ред | |||
| И.И | |||
| Дедова, 2004, Москва, 23 с., раздел "ВИДЫ ПРЕПАРАТОВ ИНСУЛИНА | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
Авторы
Даты
2022-09-07—Публикация
2018-03-23—Подача