Область техники
Настоящее изобретение относится к новому аналогу инсулина, его применению и способу получения данного аналога.
Предшествующий уровень техники
Известно, что белки в организме удаляются различными путями, включая расщепление протеазами в крови, экскрецию через почки, удаление рецепторами и т.д. В связи с этим были предприняты различные попытки улучшить терапевтическое действие белков посредством увеличения времени полужизни физиологических белков путем избегания механизмов захватывания белка.
В общем, инсулин представляет собой гормон, вырабатываемый поджелудочной железой человека, регулирующий уровень глюкозы в крови и обеспечивающий поддержание нормального уровня глюкозы в крови, в то же время перенося избыток глюкозы в крови в клетки для обеспечения клеток энергией. Однако у пациентов, больных диабетом, инсулин не функционирует должным образом из-за недостатка инсулина, резистентности к инсулину и потери функции бета-клетками, и, следовательно, глюкоза в крови не может быть использована в качестве источника энергии, и уровень глюкозы в крови повышается, приводя к гипергликемии. В результате пациенты с диабетом не могут использовать глюкозу в крови в качестве источника энергии, но проявляют симптомы гипергликемии с высоким уровнем глюкозы и выделяют глюкозу в моче, что становится причиной различных осложнений. Соответственно, инсулиновая терапия необходима для пациентов с аномальной секрецией инсулина (тип I) или резистентностью к инсулину (тип II), и уровень глюкозы в крови обычно можно регулировать путем введения инсулина.
Однако, как и другие белковые и пептидные гормоны, инсулин имеет очень короткое время полужизни in vivo и, таким образом, требует повторного введения. Такое частое введение вызывает сильную боль и дискомфорт у пациентов, и, следовательно, существует необходимость в улучшении введения с точки зрения соблюдения режима, безопасности и удобства для пациентов.
Соответственно, исследования были сосредоточены на разработке различных белковых препаратов, химических конъюгатов (например, конъюгата жирных кислот) и т.д. для улучшения терапевтических эффектов, а также качества жизни пациентов за счет снижения частоты введения инсулина путем увеличения времени полужизни in vivo таких белковых лекарственных средств, как инсулин.
Согласно предыдущему сообщению, 50% или более инсулина удаляется почками, а остальное удаляется с помощью процесса клиренса, опосредованного рецептором (RMC), в сайтах-мишениях, таких как мышцы, жир, печень и т.д.
В связи с этим появились сообщения (J Pharmacol Exp Ther (1998) 286: 959, Diabetes Саге (1990) 13: 923, и Diabetes (1990) 39: 1033, и др.), что активность инсулина in vitro снижается, чтобы избежать RMC инсулина, тем самым повышая уровень инсулина в крови. Однако, согласно J Pharmacol Exp Ther (1998) 286: 959, Diabetes Care (1990) 13: 923, предлагаемые в них аналоги инсулина либо имели замены по меньшей мере двух аминокислот, либо не было получено никакого конкретного результата, в то время как в Diabetes (1990) 39: 1033 аналоги инсулина не показали изменений в их аффинности связывания с рецепторами, или их активность была снижена посредством замены аминокислот, которые непосредственно участвовали в связывании с рецепторами инсулина.
Авторы настоящего изобретения разработали такие аналоги, которые могут снижать только аффинность связывания с рецепторами инсулина, заменив аминокислоты, которые непосредственно не участвуют в связывании с рецепторами инсулина, и подтвердили, что они снижают аффинность связывания с рецепторами инсулина, тем самым выполнив настоящее изобретение.
Описание изобретения
Техническая задача
Задача настоящего изобретения заключается в том, чтобы предложить новый аналог инсулина.
Еще одна задача настоящего изобретения заключается в том, чтобы предложить выделенную нуклеиновую кислоту, кодирующую аналог инсулина, рекомбинантный экспрессионный вектор, включающий эту нуклеиновую кислоту, и трансформант, включающий этот экспрессионный вектор.
Еще одна задача настоящего изобретения заключается в том, чтобы предложить способ получения аналога инсулина.
Еще одна задача настоящего изобретения заключается в том, чтобы предложить композицию, содержащую аналог инсулина в качестве активного ингредиента, например, фармацевтическую композицию.
Еще одна задача настоящего изобретения заключается в том, чтобы предложить фармацевтическую композицию для лечения заболеваний, связанных с инсулином (например, диабета), содержащую аналог инсулина в качестве активного ингредиента.
Еще одна задача настоящего изобретения заключается в том, чтобы предложить способ лечения диабета, включающий введение субъекту, нуждающемуся в этом, аналога инсулина или фармацевтической композиции, содержащей аналог инсулина в качестве активного ингредиента.
Еще одна задача настоящего изобретения заключается в том, чтобы предложить применение аналога инсулина в изготовлении лекарственного средства.
Еще одна задача настоящего изобретения заключается в том, чтобы предложить применение аналога инсулина в лечении заболеваний, связанных с инсулином, в частности, диабета.
Техническое решение
Для решения вышеуказанных задач, в одном аспекте настоящего изобретения предложен аналог инсулина и, конкретно, аналог инсулина, который включает по меньшей мере одну модификацию аминокислот(ы), выбранной(ых) из группы, состоящей из 16ой аминокислоты В-цепи, 25ой аминокислоты В-цепи, 14ой аминокислоты A-цепи и 19ой аминокислоты A-цепи нативного инсулина.
В одном из примеров воплощения модификация может представлять собой модификацию 16ой аминокислоты В-цепи нативного инсулина (то есть тирозина) в глутаминовую кислоту, серин, треонин или аспарагиновую кислоту; модификацию 25ой аминокислоты В-цепи нативного инсулина (то есть фенилаланина) в аспарагиновую или глутаминовую кислоту; модификацию 14ой аминокислоты A-цепи нативного инсулина (то есть тирозина) в гистидин, лизин, аланин или аспарагиновую кислоту; или модификацию 19ой аминокислоты A-цепи нативного инсулина (то есть тирозина) в глутаминовую кислоту, серин или треонин.
В другом примере воплощения аналог инсулина может представлять собой аналог инсулина, который включает все комбинации A-цепи SEQ ID NO: 55, представленной общей формулой 1 ниже, и В-цепи SEQ ID NO: 56, представленной общей формулой 2 ниже, исключая нативный инсулин, то есть, исключая пептид, в котором A-цепь соответствует SEQ ID NO: 53, и одновременно В-цепь соответствует SEQ ID NO: 54.
[Общая формула 1]:
Xaa1-Ile-Val-Glu-Xaa5-Cys-Cys-Thr-Ser-Ile-Cys-Xaa12-Leu-Xaa14-Gln-Xaa16-Glu-Asn-Xaa19-Cys-Xaa21 (SEQ ID NO: 55). В общей формуле 1:
Xaa1 представляет собой аланин, глицин, глутамин, гистидин, глутаминовую кислоту или аспарагин,
Хаа5 представляет собой аланин, глутаминовую кислоту, глутамин, гистидин или аспарагин,
Хаа12 представляет собой аланин, серин, глутамин, глутаминовую кислоту, гистидин или аспарагин,
Хаа14 представляет собой тирозин, гистидин, лизин, аланин или аспарагиновую кислоту,
Хаа16 представляет собой аланин, лейцин, тирозин, гистидин, глутаминовую кислоту или аспарагин,
Хаа19 представляет собой тирозин, глутаминовую кислоту, серин или треонин, и Хаа21 представляет собой аспарагин, глицин, гистидин или аланин. [Общая формула 2]:
Phe-Val-Asn-Gln-His-Leu-Cys-Gly-Ser-His-Leu-Val-Glu-Ala-Leu-Xaa16-Leu-Val-Cys-Gly-Glu-Arg-Gly-Phe-Xaa25-Tyr-Xaa27-Xaa28-Lys-Thr (SEQ ID NO: 56). В общей формуле 2:
Хаа16 представляет собой тирозин, глутаминовую кислоту, серин, треонин или аспарагиновую кислоту,
Хаа25 представляет собой фенилаланин, аспарагиновую кислоту или глутаминовую кислоту,
Хаа27 представляет собой треонин или отсутствует, и
Хаа28 представляет собой пролин, глутаминовую кислоту или аспарагиновую кислоту или отсутствует.
В еще одном примере воплощения аналог инсулина может представлять собой аналог инсулина, который включает A-цепь с SEQ ID NO: 55, представленную общей формулой 1 выше, и В-цепь с SEQ ID NO: 54.
В еще одном примере воплощения аналог инсулина может представлять собой аналог инсулина, который включает A-цепь с SEQ ID NO: 53 и В-цепь с SEQ ID NO: 56, представленную общей формулой 2 выше.
В еще одном примере воплощения аналог инсулина может представлять собой аналог инсулина, где:
в общей формуле 1, Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Хаа12 представляет собой серин, Хаа14 представляет собой тирозин, гистидин, лизин, аланин или аспарагиновую кислоту, Xaa16 представляет собой лейцин, Хаа19 представляет собой тирозин, глутаминовую кислоту, серин или треонин, и Хаа21 представляет собой аспарагин; и
в общей формуле 2, Xaa16 представляет собой тирозин, глутаминовую кислоту, серин, треонин или аспарагиновую кислоту, Хаа25 представляет собой фенилаланин, аспарагиновую кислоту или глутаминовую кислоту, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин.
В еще одном примере воплощения аналог инсулина может представлять собой аналог инсулина, где:
в общей формуле 1,
Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Хаа12 представляет собой серин, Хаа14 представляет собой тирозин, Xaa16 представляет собой лейцин, Хаа19 представляет собой тирозин, глутаминовую кислоту или серин, и Хаа21 представляет собой аспарагин; и
в общей формуле 2,
Хаа16 представляет собой тирозин, глутаминовую кислоту, серин или аспарагиновую кислоту, Хаа25 представляет собой фенилаланин, аспарагиновую кислоту или глутаминовую кислоту, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин.
В еще одном примере воплощения аналог инсулина может представлять собой аналог инсулина, где:
(1) в общей формуле 1, Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Хаа14 представляет собой гистидин, Хаа16 представляет собой лейцин, Хаа19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 2, Xaa16 представляет собой тирозин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, Хаа28 представляет собой пролин;
(2) в общей формуле 1, Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Хаа12 представляет собой серин, Хаа14 представляет собой лизин, Хаа16 представляет собой лейцин, Хаа19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 2, Xaa16 представляет собой тирозин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(3) в общей формуле 1, Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Хаа12 представляет собой серин, Хаа14 представляет собой тирозин, Xaa16 представляет собой лейцин, Xaa19 представляет собой глутаминовую кислоту, и Хаа21 представляет собой аспарагин; и в общей формуле 2, Хаа16 представляет собой тирозин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(4) в общей формуле 1, Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Хаа12 представляет собой серин, Xaa14 представляет собой тирозин, Хаа16 представляет собой лейцин, Хаа19 представляет собой серин, и Хаа21 представляет собой аспарагин; и в общей формуле 2, Хаа16 представляет собой тирозин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(5) в общей формуле 1, Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Хаа12 представляет собой серин, Xaa14 представляет собой тирозин, Хаа16 представляет собой лейцин, Хаа19 представляет собой треонин, и Хаа21 представляет собой аспарагин; и в общей формуле 2, Хаа16 представляет собой тирозин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(6) в общей формуле 1, Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Хаа12 представляет собой серин, Xaa14 представляет собой тирозин, Хаа16 представляет собой лейцин, Хаа19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 2, Хаа16 представляет собой глутаминовую кислоту, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(7) в общей формуле 1, Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Хаа12 представляет собой серин, Xaa14 представляет собой тирозин, Хаа16 представляет собой лейцин, Хаа19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 2, Хаа16 представляет собой серин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(8) в общей формуле 1, Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Хаа12 представляет собой серин, Xaa14 представляет собой тирозин, Хаа16 представляет собой лейцин, Хаа19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 2, Хаа16 представляет собой треонин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(9) в общей формуле 1, Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Xaa14 представляет собой аланин, Хаа16 представляет собой лейцин, Хаа19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 2, Хаа16 представляет собой тирозин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(10) в общей формуле 1, Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Хаа12 представляет собой серин, Хаа14 представляет собой аспарагиновую кислоту, Xaa16 представляет собой лейцин, Хаа19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 2, Хаа16 представляет собой тирозин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(11) в общей формуле 1, Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Хаа12 представляет собой серин, Xaa14 представляет собой тирозин, Хаа16 представляет собой лейцин, Хаа19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 2, Хаа16 представляет собой аспарагиновую кислоту, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(12) в общей формуле 1, Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Хаа12 представляет собой серин, Xaa14 представляет собой тирозин, Хаа16 представляет собой лейцин, Хаа19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 2, Хаа16 представляет собой тирозин, Хаа25 представляет собой аспарагиновую кислоту, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин; и
(13) в общей формуле 1, Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Хаа12 представляет собой серин, Хаа14 представляет собой тирозин, Хаа16 представляет собой лейцин, Хаа19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 2, Xaa16 представляет собой тирозин, Хаа25 представляет собой глутаминовую кислоту, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин.
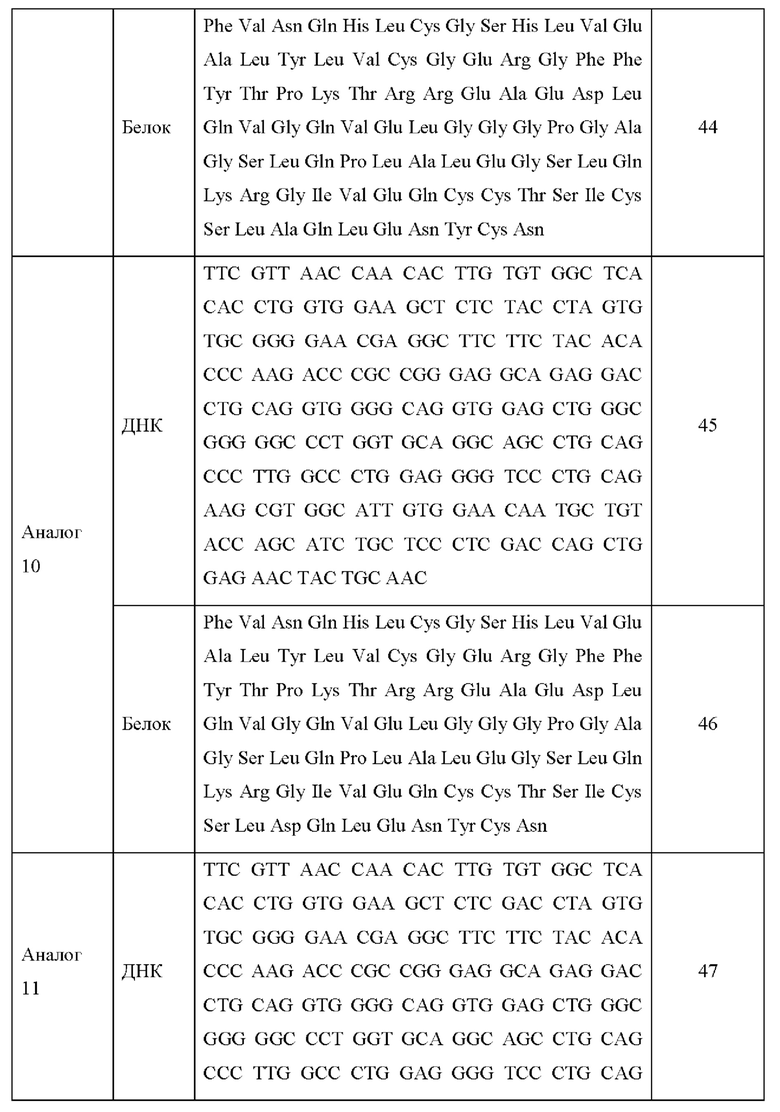
В еще одном примере воплощения аналог инсулина может представлять собой аналог инсулина, включающий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50 и 52.
В еще одном аспекте настоящее изобретение относится к выделенной нуклеиновой кислоте, кодирующей данный аналог инсулина.
В еще одном аспекте настоящего изобретения предложен рекомбинантный экспрессионный вектор, включающий данную нуклеиновую кислоту.
В еще одном аспекте настоящего изобретения предложен трансформант, включающий данный рекомбинантный экспрессионный вектор.
В одном примере воплощения трансформант может представлять собой Е. coli.
В еще одном аспекте настоящее изобретение относится к способу получения аналога инсулина, включающему:
а) экспрессию аналога инсулина путем культивирования трансформанта, включающего нуклеиновую кислоту, кодирующую аналог инсулина; и
б) выделение и очистку экспрессированного аналога инсулина.
В репрезентативном воплощении выделение и очистка могут включать:
6-1) получение трансформанта из культуры на стадии а) и его измельчение;
6-2) извлечение экспрессированного аналога инсулина из измельченного клеточного лизата с последующим его рефолдингом;
6-3) очистку аналога инсулина, подвергнутого рефолдингу, посредством катионообменной хроматографии;
6-4) обработку очищенного аналога инсулина трипсином и карбоксипептидазой В; и
6-5) последовательную очистку обработанного аналога инсулина катионообменной хроматографией и анионообменной хроматографией или обращенно-фазовой хроматографией.
В еще одном аспекте настоящего изобретения предложена композиция, содержащая аналог инсулина в качестве активного ингредиента, например, фармацевтическая композиция.
В еще одном аспекте настоящее изобретение относится к фармацевтической композиции для лечения заболеваний, связанных с инсулином (например, диабета), содержащей аналог инсулина в качестве активного ингредиента.
В еще одном аспекте настоящее изобретение относится к способу лечения связанных с инсулином заболеваний (например, диабета), включающему введение нуждающемуся в этом субъекту аналога инсулина или фармацевтической композиции, содержащей аналог инсулина в качестве активного ингредиента.
В еще одном аспекте настоящее изобретение относится к применению аналога инсулина в изготовлении лекарственного средства.
В одном воплощении лекарственное средство предназначено для профилактики или лечения заболеваний, связанных с инсулином.
В другом воплощении лекарственное средство предназначено для профилактики или лечения диабета.
В еще одном аспекте настоящее изобретение относится к применению аналога инсулина для лечения заболеваний, связанных с инсулином, в частности, диабета.
Положительный эффект изобретения
Ненативный аналог инсулина по настоящему изобретению может улучшить соблюдение режима лечения пациентами, нуждающимися в введении инсулина. Краткое описание графических материалов
На Фиг. 1 показаны результаты анализа чистоты аналогов инсулина посредством электрофореза белка и, конкретно, результаты репрезентативных аналогов инсулина 9, 10, 11 и 12 (дорожка 1: маркер размера молекулярной массы; дорожка 2: нативный инсулин; дорожка 3: аналог инсулина 9; дорожка 4: аналог инсулина 10; дорожка 5: аналог инсулина 11; и дорожка 6: аналог инсулина 12).
На Фиг. 2a-2d показаны результаты анализа чистоты аналогов инсулина посредством хроматографии высокого давления и, конкретно, результаты репрезентативных аналогов инсулина 9, 10, 11 и 12. На каждом рисунке результаты высокоэффективной хроматографии (ВЭЖХ) с обращенной фазой (С18), ВЭЖХ с обращенной фазой (С4) и эксклюзионной ВЭЖХ показаны в порядке сверху вниз.
На Фиг. 3 показаны экспериментальные результаты, подтверждающие способность человеческого инсулина и аналога инсулина 10 поглощать глюкозу.
На Фиг. 4 показаны экспериментальные результаты, подтверждающие стабильность человеческого инсулина и аналога инсулина 10 в клетке.
Подробное описание изобретения
Ниже подробно описаны репрезентативные воплощения настоящего изобретения.
При этом, каждое из пояснений и репрезентативных воплощений, раскрытых здесь, может быть применено к другим пояснениям и репрезентативным воплощениям. То есть все комбинации различных факторов, раскрытых в данном документе, входят в объем настоящего изобретения. Кроме того, объем настоящего изобретения не должен быть ограничен конкретным раскрытием, приведенным ниже.
Кроме того, специалисты в данной области техники смогут распознать или подтвердить, основываясь на рутинных экспериментах, многие эквиваленты конкретных воплощений настоящего изобретения, описанных в настоящей заявке, и такие эквиваленты предназначены для включения в объем настоящего изобретения.
Во всем описании используют общепринятые однобуквенные и трехбуквенные коды для аминокислот. Кроме того, аминокислоты, упомянутые здесь в сокращениях, описаны в соответствии с правилами IUPAC-IUB.
В одном аспекте настоящего изобретения предложен новый аналог инсулина и, конкретно, аналог инсулина, который включает по меньшей мере одну модификацию аминокислот(ы), выбранную(ых) из группы, состоящей из 16ой аминокислоты В-цепи, 25ой аминокислоты В-цепи, 14ой аминокислоты A-цепи и 19ой аминокислоты А-цепи нативного инсулина.
Используемый здесь термин "аналог инсулина" относится к ненативному инсулину, который отличается от нативного инсулина.
Аналог инсулина включает ненативный человеческий инсулин, который отличается от нативного человеческого инсулина. Такой аналог инсулина включает аналоги, в которых часть аминокислот нативного инсулина модифицирована путем добавления, делеции или замены.
Более конкретно, аналог инсулина по настоящему изобретению может быть таким, который имеет идентичность последовательности, составляющую по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94% или по меньшей мере 95% по сравнению с последовательностью нативного инсулина. Кроме того, аналог инсулина по настоящему изобретению может быть таким, который обладает пониженной аффинностью связывания с рецептором по сравнению с таковой у нативного инсулина, при этом имеет вышеуказанную идентичность последовательности. Кроме того, аналог инсулина может обладать способностью поглощать глюкозу, как и нативный инсулин, и/или способностью снижать уровень глюкозы в крови in vivo.
Более конкретно, аналог инсулина по настоящему изобретению может проявлять аффинность связывания с рецепторами инсулина, составляющую примерно 99% или менее, примерно 95% или менее, примерно 90% или менее, примерно 85% или менее, примерно 80% или менее, примерно 75% или менее, примерно 70% или менее, примерно 65% или менее, примерно 60% или менее, примерно 55% или менее, примерно 50% или менее, примерно 45% или менее, примерно 40% или менее, примерно 35% или менее, примерно 30% или менее, примерно 25% или менее, примерно 20% или менее, примерно 15% или менее, примерно 10% или менее, примерно 9% или менее, примерно 8% или менее, примерно 7% или менее, примерно 6% или менее, примерно 5% или менее, примерно 4% или менее, примерно 3% или менее, примерно 2% или менее, примерно 1% или менее, или примерно 0,1% или менее по сравнению с аффинностью связывания нативного инсулина с рецепторами инсулина (100%) (однако аффинность связывания аналога инсулина по настоящему изобретению с рецепторами инсулина не равна 0%).
Аффинность связывания аналогов инсулина с рецепторами инсулина можно оценить с помощью сцинтилляционного анализа сближения (SPA), где используется конкурентная реакция между аналогом инсулина и 125I-меченным инсулином в клеточной мембране, в которой сверхэкспрессируются рекомбинантные рецепторы человеческого инсулина. Этот метод также можно использовать для оценки аффинности связывания аналогов инсулина с рецепторами инсулина. В качестве иллюстративного воплощения способа может быть использован способ, представленный в Примере 8.
Используемый здесь термин "примерно" относится к диапазону, включающему ±0,5, ±0,4, ±0,3, ±0,2, ±0,1 и т.д., и термин "примерно" включает любое численное значение, которое эквивалентно или находится в диапазоне, близком к данному численному значению, но не ограничивается им.
Кроме того, аналог инсулина по настоящему изобретению может обладать способностью поглощать глюкозу, как и нативный инсулин.
Конкретно, аналогом инсулина по настоящему изобретению может быть аналог, который обладает способностью поглощать глюкозу, составляющей примерно 10% или более, примерно 20% или более, примерно 30% или более, примерно 40% или более, примерно 50% или более, примерно 55% или более, примерно 60% или более, примерно 65% или более, примерно 70% или более, примерно 75% или более, примерно 80% или более, примерно 85% или более, примерно 90% или более, примерно 95% или более, примерно 100% или более, примерно 110% или более, примерно 120% или более, примерно 130% или более, примерно 140% или более, примерно 150% или более, примерно 160% или более, примерно 170% или более, примерно 180% или более, примерно 190% или более, или примерно 200% или более по сравнению со способностью нативного инсулина поглощать глюкозу (100%).
Измерение способности поглощать глюкозу может быть выполнено различными способами измерения способности поглощать глюкозу, известными в данной области техники, и, например, может быть выполнено способом измерения способности поглощения глюкозы, описанным в Примере 9, но способ измерения не ограничивается этим.
В частности, аналоги инсулина, применяемые в настоящем изобретении, могут быть в форме одной полипептидной цепи или двух полипептидных цепей, более предпочтительно двух полипептидных цепей, но аналоги инсулина не ограничиваются конкретно этим.
Аналог инсулина в форме двух полипептидных цепей может состоять из двух полипептидов, то есть полипептида, соответствующего A-цепи нативного инсулина, и полипептида, соответствующего В-цепи нативного инсулина. В частности, соответствующая A-цепи или В-цепи нативного инсулина может относиться к случаям, в которых любая одна цепь полипептидов из двух полипептидных цепей обладает идентичностью последовательности, составляющей по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94% или по меньшей мере 95%, по сравнению с последовательностью A-цепи или В-цепи нативного инсулина, но не ограничивается этим, и специалисты в данной области техники могут легко определить это путем сравнения последовательности, составляющей данные две полипептидные цепи и последовательности A-цепи или В-цепи нативного инсулина.
Нативный инсулин представляет собой гормон, секретируемый поджелудочной железой и, как правило, способствует внутриклеточной абсорбции глюкозы и ингибирует расщепление жира, тем самым контролируя уровень глюкозы в крови in vivo. Инсулин, который может контролировать уровень глюкозы в крови, образуется в результате процессинга его предшественника, проинсулина, который не обладает функцией контроля за уровнем глюкозы в крови. Инсулин состоит из двух полипептидных цепей, то есть A-цепи и В-цепи, которые включают 21 и 30 аминокислот, соответственно, и связаны между собой двумя дисульфидными мостиками. Каждая из A-цепи и В-цепи может включать аминокислотные последовательности, представленные в SEQ ID NO: 53 и 54, показанные ниже.
А-цепь:
Gly-Ile-Val-Glu-Gln-Cys-Cys-Thr-Ser-Ile-Cys-Ser-Leu-Tyr-Gln-Leu-Glu-Asn-Tyr-Cys-Asn (SEQ ID NO: 53) В-цепь:
Phe-Val-Asn-Gln-His-Leu-Cys-Gly-Ser-His-Leu-Val-Glu-Ala-Leu-Туг-Leu-Val-Cys-Gly-Glu-Arg-Gly-Phe-Phe-Tyr-Thr-Pro-Lys-Thr (SEQ ID NO: 54)
В репрезентативном воплощении аналоги инсулина, описанные в настоящем изобретении, могут быть аналогами с пониженной аффинностью связывания с рецепторами, при этом они обладают функцией контроля за уровнем глюкозы в крови in vivo, подобно нативному инсулину. Более конкретно, аналог инсулина может обладать способностью снижать уровень глюкозы в крови in vivo.
Кроме того, в репрезентативном воплощении тип и размер аналогов инсулина могут не быть конкретно ограничены, при условии что они могут демонстрировать рецептор-опосредованную интернализацию или рецептор-опосредованный клиренс.Соответственно, аналоги инсулина по настоящему изобретению могут демонстрировать улучшенное время полужизни в крови по сравнению с нативным инсулином. Аналоги инсулина по настоящему изобретению включают инвертированный инсулин, производные нативного инсулина, фрагменты нативного инсулина и т.д. Аналоги инсулина могут быть получены не только рекомбинантный способом, но также твердофазным синтезом, и способ получения этим не ограничивается.
Используемый здесь термин "производные нативного инсулина" относится к пептиду, который имеет по меньшей мере одно различие в аминокислотной последовательности по сравнению с последовательностью нативного инсулина, пептиду, полученному посредством модификации последовательности нативного инсулина, и имитатору нативного инсулина, который может контролировать уровень глюкозы in vivo подобно нативному инсулину. Такими производными нативного инсулина могут быть производные, которые обладают функцией контроля за уровнем глюкозы в крови in vivo.
В частности, производные нативного инсулина могут быть получены посредством модификации с помощью любого способа замены, вставки, делеции и модификации части аминокислот нативного инсулина или посредством комбинации этих способов.
В частности, производные нативного инсулина могут иметь гомологию 80% или выше для каждой из аминокислотных последовательностей A-цепи и В-цепи нативного инсулина, и/или часть групп в аминокислотном остатке может быть модифицирована посредством химического замещения (например, альф а-метилирования, альфа-гидроксилирования), делеции (например, дезаминирования) или модификации (например, N-метилирования) и т.д., но не ограничивается этим.
Производные нативного инсулина, применяемые в настоящем изобретении, могут быть получены комбинацией различных способов, используемых для получения производных.
Кроме того, такая модификация для получения производных нативного инсулина включает модификацию с использованием аминокислот(ы) L-типа или D-типа и/или неприродной(ых) аминокислот(ы); и/или модификацию нативной последовательности или посттрансляционную модификацию (например, метилирование, ацилирование, убиквитинирование, межмолекулярную ковалентную связь и т.д.).
Кроме того, включены все те инсулины, в которых одна или несколько аминокислот добавлены к амино- и/или карбокси-концу нативного инсулина.
Для замены или вставки аминокислот(ы) могут быть использованы не только 20 аминокислот, обычно наблюдаемых в белках человека, но также и нетипичные или неприродные аминокислоты. Коммерческие атипичные аминокислоты могут включать аминокислоты от Sigma-Aldrich, ChemPep, Genzyme pharmaceuticals и т.д. Последовательности пептидов, содержащих эти аминокислоты и типичные пептиды, могут быть синтезированы или приобретены у коммерческих компаний по синтезу пептидов, таких как American Peptide Company, Bachem (США) и Anygen (Корея), но не ограничиваются ими.
Используемый здесь термин "фрагменты нативного инсулина или фрагменты производных нативного инсулина" относится к форме инсулина, в которой по меньшей мере одна аминокислота на амино-конце или карбокси-конце нативного инсулина или производного нативного инсулина удалена. Такой инсулиновый фрагмент может обладать функцией контроля за уровнем глюкозы в крови in vivo.
Кроме того, аналогами инсулина по настоящему изобретению могут быть такие аналоги, которые получены с использованием способа(ов) получения производных и фрагментов нативного инсулина раздельно или в комбинации.
Конкретно, аналоги инсулина по настоящему изобретению могут включать аналоги, имеющие модификацию в A-цепи и В-цепи нативного инсулина, описанные выше, и в частности, те, в которых определенный(е) аминокислотный(е) остаток(ки) А-цепи нативного инсулина модифицирован(ы), и/или определенный(е) аминокислотный(е) остаток(ки) В-цепи нативного инсулина модифицирован(ы).
Конкретно, аналогами инсулина могут быть такие, в которых по меньшей мере одна модификация в аминокислоте, выбранной из группы, состоящей из 16ой аминокислоты В-цепи, 25ой аминокислоты В-цепи, 14ой аминокислоты A-цепи и 19ой аминокислоты A-цепи нативного инсулина, заменена другой аминокислотой, и, в частности, она может быть заменена глутаминовой кислотой, серином, треонином, аспарагиновой кислотой, гистидином, лизином или аланином, но не ограничивается этим.
В частности, аналогами инсулина могут быть такие, в которых по меньшей мере одна, по меньшей мере две, по меньшей мере три или четыре аминокислоты среди аминокислот, описанных выше, заменена(ы) другой(ими) аминокислотой(ами).
В частности, модификация может представлять собой модификацию 16ой аминокислоты В-цепи инсулина (то есть тирозина) в глутаминовую кислоту, серин, треонин или аспарагиновую кислоту; модификацию 25ой аминокислоты В-цепи инсулина (то есть фенилаланина) в аспарагиновую или глутаминовую кислоту; модификацию 14ой аминокислоты А-цепи инсулина (то есть тирозина) в гистидин, лизин, аланин или аспарагиновую кислоту; или модификацию 19ой аминокислоты А-цепи инсулина (то есть тирозина) в глутаминовую кислоту, серин или треонин.
Соответственно, аналоги инсулина могут включать модификацию 16ой аминокислоты В-цепи нативного инсулина (то есть тирозина) в глутаминовую кислоту, серин, треонин или аспарагиновую кислоту; и/или модификацию 25ой аминокислоты В-цепи нативного инсулина (то есть фенилаланина) в аспарагиновую или глутаминовую кислоту; и/или модификацию 14ой аминокислоты A-цепи нативного инсулина (то есть тирозина) в гистидин, лизин, аланин или аспарагиновую кислоту; и/или модификацию 19ой аминокислоты A-цепи нативного инсулина (то есть тирозина) в глутаминовую кислоту, серин или треонин, но модификация ими не ограничивается.
Более конкретно, аналогами инсулина могут быть те, которые включают A-цепь с SEQ ID NO: 55, представленную общей формулой 1 ниже, и В-цепь с SEQ ID NO: 56, представленную общей формулой 2 ниже. Эти аналоги инсулина могут быть в форме, в которой A-цепь и В-цепь связаны дисульфидной связью, или в форме проинсулина, но не ограничиваются ими.
Общая формула 1:
Xaa1-Ile-Val-Glu-Xaa5-Cys-Cys-Thr-Ser-Ile-Cys-Xaa12-Leu-Xaa14-Gln-Xaa16-Glu-Asn-Xaa19-Cys-Xaa21 (SEQ ID NO: 55) В общей формуле 1,
Xaa1 представляет собой аланин, глицин, глутамин, гистидин, глутаминовую кислоту или аспарагин,
Хаа5 представляет собой аланин, глутаминовую кислоту, глутамин, гистидин или аспарагин,
Хаа12 представляет собой аланин, серин, глутамин, глутаминовую кислоту, гистидин или аспарагин,
Хаа14 представляет собой тирозин, гистидин, лизин, аланин или аспарагиновую кислоту,
Хаа16 представляет собой аланин, лейцин, тирозин, гистидин, глутаминовую кислоту или аспарагин,
Хаа19 представляет собой тирозин, глутаминовую кислоту, серин или треонин, и
Хаа21 представляет собой аспарагин, глицин, гистидин или аланин. Общая формула 2:
Phe-Val-Asn-Gln-His-Leu-Cys-Gly-Ser-His-Leu-Val-Glu-Ala-Leu-Xaa16-Leu-Val-Cys-Gly-Glu-Arg-Gly-Phe-Xaa25-Tyr-Xaa27-Xaa28-Lys-Thr (SEQ ID NO: 56) В общей формуле 2,
Хаа16 представляет собой тирозин, глутаминовую кислоту, серин, треонин или аспарагиновую кислоту,
Хаа25 представляет собой фенилаланин, аспарагиновую кислоту или глутаминовую кислоту,
Хаа27 представляет собой треонин или отсутствует, и
Хаа28 представляет собой пролин, глутаминовую кислоту или аспарагиновую кислоту или отсутствует.
В данном описании пептиды, включающие A-цепь с SEQ ID NO: 53 и В-цепь с SEQ ID NO: 54, могут быть исключены.
Кроме того, те пептиды, которые имеют гомологию 70% или выше, конкретно 80% или выше, более конкретно 90% или выше, и еще более конкретно 95% или выше, с последовательностью соответствующего аналога инсулина, включающего A-цепь с общей формулой 1, представленной выше, и В-цепь с общей формулой 2, представленной выше, в то же время включающего характерную модификацию (т.е. аминокислотные остатки, не присутствующие в нативном инсулине), описанную выше, в частности, 14ую и/или 19ую аминокислоты A-цепи и/или 16ую и/или 25ую аминокислоты В-цепи, и имеют пониженную аффинность связывания с рецепторами по сравнению с нативным инсулином, также включены в объем настоящего изобретения.
Используемый здесь термин "гомология" относится к уровню сходства аминокислотной последовательности белка дикого типа или полинуклеотидной последовательности, кодирующей его, и включает последовательности с таким же или более высоким вышеуказанным процентом сходства с аминокислотной или полинуклеотидной последовательностью по настоящему изобретению. Эта гомология может быть определена путем сравнения невооруженным глазом или может быть определена с помощью биоинформационного алгоритма, который анализирует степень гомологии путем совмещения двух последовательностей. Гомология между двумя аминокислотными последовательностями может быть указана в процентах. Применимые автоматизированные алгоритмы можно использовать, как в GAP, BESTFLT, так и в FASTA пакета программного обеспечения Wisconsin Genetics (Genetics Computer Group, Madison, WI, USA) и модуля программного обеспечения TFASTA. Автоматизированные алгоритмы включают алгоритмы выравнивания последовательностей Needleman & Wunsch, Pearson & Lipman и Smith & Waterman. Определение алгоритма и гомологии является автоматизированным в компьютерных программах, в том числе FASTP, BLAST, BLAST2, PSIBLAST и CLUSTAL W.
В примерном воплощении аналог инсулина может быть таким, который включает A-цепь с SEQ ID NO: 55, представленную вышеприведенной общей формулой 1, и В-цепь с SEQ ID NO: 54; или аналог инсулина включает A-цепь с SEQ ID NO: 53 и В-цепь с SEQ ID NO: 56, представленную вышеприведенной общей формулой 2, но не ограничивается этим.
Более конкретно, аналог инсулина может представлять собой аналог инсулина, в котором, в общей формуле 1, Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Хаа12 представляет собой серин, Хаа14 представляет собой тирозин, гистидин, лизин, аланин или аспарагиновую кислоту, Xaa16 представляет собой лейцин, Хаа19 представляет собой тирозин, глутаминовую кислоту, серин или треонин, и Хаа21 представляет собой аспарагин; и в общей формуле 2, Xaa16 представляет собой тирозин, глутаминовую кислоту, серин, треонин или аспарагиновую кислоту, Хаа25 представляет собой фенилаланин, аспарагиновую кислоту или глутаминовую кислоту, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин, но не ограничивается этим.
Более конкретно, аналог инсулина может представлять собой аналог инсулина, в котором, в общей формуле 1, Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Хаа12 представляет собой серин, Хаа14 представляет собой тирозин, Хаа16 представляет собой лейцин, Хаа19 представляет собой тирозин, глутаминовую кислоту или серин, и Хаа21 представляет собой аспарагин; и в общей формуле 2, Xaa16 представляет собой тирозин, глутаминовую кислоту, серин или аспарагиновую кислоту, Хаа25 представляет собой фенилаланин, аспарагиновую кислоту или глутаминовую кислоту, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин, но не ограничивается этим.
Более конкретно аналог инсулина может представлять собой аналог инсулина, в котором, в общей формуле 1, Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Хаа14 представляет собой тирозин или аспарагиновую кислоту, Xaa16 представляет собой лейцин, Хаа19 представляет собой тирозин, глутаминовую кислоту, серин или треонин, и Хаа21 представляет собой аспарагин; и в общей формуле 2, Xaa16 представляет собой тирозин, Хаа25 представляет собой фенилаланин, аспарагиновую кислоту или глутаминовую кислоту, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин, но не ограничивается этим.
В примерном воплощении аналог инсулина по настоящему изобретению может соответствовать следующим аналогам инсулина:
(1) в общей формуле 1, Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Хаа14 представляет собой гистидин, Хаа16 представляет собой лейцин, Хаа19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 2, Xaa16 представляет собой тирозин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(2) в общей формуле 1, Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Хаа12 представляет собой серин, Хаа14 представляет собой лизин, Хаа16 представляет собой лейцин, Хаа19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 2, Xaa16 представляет собой тирозин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(3) в общей формуле 1, Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Хаа12 представляет собой серин, Хаа14 представляет собой тирозин, Xaa16 представляет собой лейцин, Xaa19 представляет собой глутаминовую кислоту, и Хаа21 представляет собой аспарагин; и в общей формуле 2, Хаа16 представляет собой тирозин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(4) в общей формуле 1, Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Хаа12 представляет собой серин, Хаа14 представляет собой тирозин, Хаа16 представляет собой лейцин, Хаа19 представляет собой серин, и Хаа21 представляет собой аспарагин; и в общей формуле 2, Xaa16 представляет собой тирозин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(5) в общей формуле 1, Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Хаа12 представляет собой серин, Хаа14 представляет собой тирозин, Хаа16 представляет собой лейцин, Хаа19 представляет собой треонин, и Хаа21 представляет собой аспарагин; и в общей формуле 2, Xaa16 представляет собой тирозин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(6) в общей формуле 1, Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Хаа12 представляет собой серин, Хаа14 представляет собой тирозин, Хаа16 представляет собой лейцин, Хаа19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 2, Xaa16 представляет собой глутаминовую кислоту, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(7) в общей формуле 1, Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Хаа12 представляет собой серин, Хаа14 представляет собой тирозин, Хаа16 представляет собой лейцин, Хаа19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 2, Хаа16 представляет собой серин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(8) в общей формуле 1, Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Хаа12 представляет собой серин, Хаа14 представляет собой тирозин, Хаа16 представляет собой лейцин, Хаа19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 2, Xaa16 представляет собой треонин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(9) в общей формуле 1, Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Хаа12 представляет собой серин, Хаа14 представляет собой аланин, Хаа16 представляет собой лейцин, Хаа19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 2, Xaa16 представляет собой тирозин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(10) в общей формуле 1, Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Хаа12 представляет собой серин, Хаа14 представляет собой аспарагиновую кислоту, Xaa16 представляет собой лейцин, Xaa19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 2, Хаа16 представляет собой тирозин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(11) в общей формуле 1, Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Хаа12 представляет собой серин, Xaa14 представляет собой тирозин, Хаа16 представляет собой лейцин, Хаа19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 2, Хаа16 представляет собой аспарагиновую кислоту, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(12) в общей формуле 1, Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Хаа12 представляет собой серин, Xaa14 представляет собой тирозин, Хаа16 представляет собой лейцин, Хаа19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 2, Хаа16 представляет собой тирозин, Хаа25 представляет собой аспарагиновую кислоту, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин; и
(13) в ощей формуле 1, Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Хаа12 представляет собой серин, Xaa14 представляет собой тирозин, Хаа16 представляет собой лейцин, Хаа19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 2, Xaa16 представляет собой тирозин, Хаа25 представляет собой глутаминовую кислоту, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин.
Кроме того, в примерном воплощении аналог инсулина может представлять собой аналог инсулина, включающий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50 и 52, но не ограничивается этим.
Аналог инсулина по настоящему изобретению может представлять собой пептид, включающий конкретную последовательность, описанную выше, пептид, состоящий (по существу) из описанной выше конкретной последовательности, но не ограничивается этим.
В то же время, хотя он и описан как "пептид или аналог инсулина, состоящий из конкретной SEQ ID NO" в настоящем изобретении, не исключено добавление нонсенс-последовательностей перед или после аминокислотной последовательности соответствующей SEQ ID NO или встечающихся в природе мутаций или их молчащих мутаций, при условии что пептид обладает такой же или эквивалентной активностью, что и пептид или аналог инсулина, состоящий из аминокислотной последовательности соответствующей SEQ ID NO, и очевидно, что такое добавление или мутация последовательности также входит в объем настоящего изобретения.
При этом аналог инсулина включает сам пептид, его соли (например, фармацевтически приемлемую соль пептида) или их сольваты.
Кроме того, пептид или аналог инсулина могут быть в любой фармацевтически приемлемой форме.
Вид соли не ограничен особым образом. Однако предпочтительно, чтобы соль находилась в безопасной и эффективной форме для субъекта (например, млекопитающего), но не ограничивается этим.
Используемый здесь термин "фармацевтически приемлемый" относится к материалу, который можно эффективно использовать по желаемому назначению, не вызывая чрезмерной токсичности, раздражения, аллергической реакции и т.д., в рамках фармако-медицинской задачи.
Используемый здесь термин "фармацевтически приемлемая соль" включает соль, полученную из фармацевтически приемлемых неорганических кислот, органических кислот или оснований. Примеры подходящих кислот могут включать соляную кислоту, бромоводородную кислоту, серную кислоту, азотную кислоту, хлорную кислоту, фумаровую кислоту, малеиновую кислоту, фосфорную кислоту, гликолевую кислоту, молочную кислоту, салициловую кислоту, янтарную кислоту, пара-толуолсульфоновую кислоту, винную кислоту, уксусную кислоту, лимонную кислоту, метансульфоновую кислоту, муравьиную кислоту, бензойную кислоту, малоновую кислоту, нафталин-2-сульфоновую кислоту, бензолсульфоновую кислоту и др. Соли, полученные из подходящих оснований, могут включать щелочные металлы, такие как натрий, калий и т.д., щелочноземельные металлы, такие как магний и т.д., аммоний и т.д.
Кроме того, используемый здесь термин "сольват" относится к комплексу, который образуется между пептидом по настоящему изобретению или его солью и молекулой растворителя.
В другом аспекте настоящего изобретения предложены выделенная нуклеиновая кислота, кодирующая аналог инсулина, рекомбинантный экспрессионный вектор, включающий нуклеиновую кислоту, и трансформант, включающий рекомбинантный экспрессионный вектор.
Аналог инсулина является таким же, как описано выше.
Используемый здесь термин "нуклеиновая кислота" относится к дезоксирибонуклеотиду (ДНК) или рибонуклеотиду (РНК), присутствующему в форме одной цепи или двойной цепи, включая геномную ДНК, кДНК и РНК, транскрибируемую из них, и нуклеотид в качестве основного составляющего звена в молекуле нуклеиновой кислоты не только включает природные нуклеотиды, но также аналоги, имеющие модификации в сахаре или основании (Scheit, Nucleotide Analogs, John Wiley, New York, 1980; Uhlman and Peyman, Chemical Reviews, 90: 543-584, 1990). Нуклеиновая кислота по настоящему изобретению может быть выделена или получена с использованием стандартных технологий в молекулярной биологии. Например, нуклеиновая кислота по настоящему изобретению может быть получена посредством ПЦР-амплификации с использованием соответствующих последовательностей праймеров на основе последовательности гена нативного инсулина (NM 000207.2, NCBI) и может быть получена с помощью стандартной технологии синтеза с использованием автоматического синтезатора ДНК.
В частности, нуклеиновая кислота по настоящему изобретению включает нуклеотидные последовательности, представленные SEQ ID NO: 27, 29, 31, 33, 35, 37, 39, 41, 43, 45, 47, 49 или 51. В примерном воплощении нуклеиновая кислота по настоящему изобретению не только включает нуклеотидные последовательности, представленные SEQ ID NO: 27, 29, 31, 33, 35, 37, 39, 41, 43, 45, 47, 49 или 51, но также включает все последовательности, которые имеют гомологию последовательности по меньшей мере на 70% по отношению к вышеуказанным последовательностям, предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 90%, еще более предпочтительно по меньшей мере на 95% и наиболее предпочтительно по меньшей мере на 98%, где пептид, кодируемый вышеуказанной нуклеиновой кислотой, проявляет пониженную аффинность связывания с рецепторами по сравнению с нативным инсулином, в то же время по существу обладая функцией контроля за уровнем глюкозы в крови in vivo.
Рекомбинантный вектор по настоящему изобретению может быть сконструирован как вектор для типичного клонирования или для экспрессии и может быть сконструирован как вектор с использованием эукариотической клетки или прокариотической клетки в качестве клетки-хозяина.
Используемый здесь термин "вектор" относится к рекомбинантному вектору, способному экспрессировать белок-мишень в соответствующей клетке-хозяине, который представляет собой конструкцию нуклеиновой кислоты, включающую необходимые регуляторные факторы, функционально связанные для обеспечения экспрессии вставленной нуклеиновой кислоты. В настоящем изобретении может быть получен рекомбинантный вектор, который включает нуклеиновую кислоту, кодирующую аналог инсулина, и этот аналог инсулина по настоящему изобретению можно получить путем трансформации или трансфекции рекомбинантного вектора в клетку-хозяин.
В настоящем изобретении нуклеиновая кислота, кодирующая аналог инсулина, может быть функционально связана с промотором.
Используемый здесь термин "функционально связанный" относится к функциональной связи между регуляторной последовательностью для экспрессии нуклеиновой кислоты (например, промотором, сигнальной последовательностью, сайтом связывания рибосомы, последовательностью терминации транскрипции и т.д.) и другой нуклеотидной последовательностью, и эта регуляторная последовательность может регулировать транскрипцию и/или трансляцию указанной другой нуклеотидной последовательности.
Используемый здесь термин "промотор" относится к нетранслируемой последовательности нуклеиновой кислоты, которая может находиться выше кодирующей области, включает сайт связывания с полимеразой и обладает активностью инициирования транскрипции гена, расположенного ниже промотора, в мРНК, то есть, это область ДНК, с которой связывается полимераза и инициирует транскрипцию гена и которая может быть расположена в 5'-области инициации транскрипции мРНК.
Например, когда вектор по настоящему изобретению представляет собой рекомбинантный вектор и прокариотическую клетку используют в качестве клетки-хозяина, как правило, сильный промотор (например, tac промотор, lac промотор, lacUVS промотор, 1рр промотор, pLX промотор, pΒλ промотор, rac5 промотор, amp промотор, recA промотор, SP6 промотор, trp промотор, Т7 промотор, и др.), способный управлять транскрипцией, сайт связывания рибосомы для инициации трансляции и последовательности терминации транскрипции/трансляции в общем включены.
Кроме того, вектор для использования в настоящей изобретении может быть получен посредством плазмид (например, pSCl01, pGV1106, pACYC177, ColEl, pKT230, pME290, pBR322, pUC8/9, pUC6, pBD9, pHC79, pIJ61, pLAFRl, pHV14, серин pGEX, серин pET, серин pPICZa, pUC19, и т.д.), фагов (например, λgt4⋅λB, λ-Charon, λΔz1, M13, и т.д.) или вирусов (например, SV40, и т.д.), которые обычно используют в данной области техники.
При этом, когда вектор по настоящему изобретению представляет собой рекомбинантный вектор и эукариотическую клетку используют в качестве клетки-хозяина, могут быть использованы промоторы, имеющие происхождение из геномов клеток млекопитающих (например, металлотионеиновый промотор), или промоторы, имеющие происхождение из вирусов млекопитающих (например, промотор поздних генов аденовируса, 7.5К промотор папилломавируса, SV40 промотор, промотор цитомегаловируса и tk промотор HSV) и, как правило, вектор включает полиаденилированную последовательность (например, терминатор бычьего гормона роста и полиаденилированную последовательность, имеющую происхождение из SV40) в качестве последовательности терминации транскрипции.
Кроме того, рекомбинантный вектор по настоящему изобретению включает ген устойчивости к антибиотику, обычно используемый в данной области техники в качестве селективного маркера, и может содержать, например, гены, обладающие устойчивостью к ампициллину, гентамицину, карбенициллину, хлорамфениколу, стрептомицину, канамицину, генетицину, неомицину и тетрациклину.
Рекомбинантный вектор по настоящему изобретению может дополнительно включать другую последовательность для облегчения очистки собираемых целевых белков, то есть одноцепочечного аналога инсулина, проинсулина или его аналога. Последовательность для дополнительного включения может представлять собой последовательность метки для очистки белка, например, глутатион-8-трансферазу (Pharmacia, США), мальтозо-связывающий белок (NEB, США), FLAG (IBI, США), 6-гистидин и т.д., но виды последовательностей, необходимых для очистки целевых белков, этим не ограничиваются.
Слитые белки, экспрессируемые рекомбинантный вектором, включающим вышеуказанную последовательность метки, могут быть очищены аффинной хроматографией. Например, при использовании слияния с глутатион-8-трансферазой, может быть использован глутатион, который является субстратом для фермента, тогда как при использовании метки 6-гистидина необходимый белок-мишень может быть легко собран с помощью колонки Ni-NTA.
Используемый здесь термин "трансформация" относится к процессу введения ДНК в клетку-хозяина и превращения ДНК, реплицируемой в ней, в хромосомный фактор, или в результате хромосомной интеграции, которая представляет собой явление искусственной индукции генетический изменений при введении экзогенной ДНК в клетку.
Метод трансформации, используемый в настоящем изобретении, может представлять собой любой метод трансформации, и он может быть легко выполнен в соответствии с обычным методом, используемым в данной области техники. Примеры обычно используемых методов трансформации могут включать метод осаждения с помощью CaCl2, метод Ханахана с улучшенной эффективностью с использованием диметилсульфоксида (ДМСО) в качестве восстановителя в методе осаждения CaCl2, электропорацию, метод осаждения с помощью CaPO4, метод слияния протопластов, метод перемешивания с использованием карбидокремниевого волокна, трансформацию, опосредованную агробактериями, трансформацию с использованием полиэтиленгликоля (ПЭГ), декстрансульфата, липофектамина и трансформацию, опосредованную сушкой/супрессией и т.д.
Способ трансформации рекомбинантного вектора, включающего нуклеиновую кислоту, кодирующую аналог инсулина по настоящему изобретению, может не ограничиваться этими способами, но любой способ трансформации или трансфекции, обычно используемый в данной области техники, может быть использован без ограничения.
Трансформант по настоящему изобретению может быть получен путем введения рекомбинантного вектора, включающего целевую нуклеиновую кислоту, которая кодирует аналог инсулина, в клетку-хозяина.
Подходящий хозяин для использования в настоящем изобретении может не быть конкретно ограничен, при условии что он может экспрессировать нуклеиновую кислоту по настоящему изобретению. Примеры соответствующего хозяина могут включать бактерии, принадлежащие к роду Escherichia, например Е. coli, бактерии, принадлежащие к роду, Bacillus, например Bacillus subtilis, бактерии, принадлежащие к роду Pseudomonas, например Pseudomonas putida, дрожжи, такие как Pichia pastoris, Saccharomyces cerevisiae и Schizosaccharomyces pombe, клетки насекомых, такие как Spodoptera frugiperda (SF9), и клетки животных, такие как СНО, COS и BSC. В частности, Е. coli может быть использована в качестве клетки-хозяина, но не ограничивается этим.
В другом аспекте для достижения целей настоящего изобретения предложен способ получения аналогов инсулина с использованием трансформанта.
В частности, способ получения аналога инсулина может включать следующее:
а) экспрессию аналога инсулина путем культивирования трансформанта, включающего нуклеиновую кислоту, кодирующую аналог инсулина; и
б) выделение и очистку экспрессированного аналога инсулина.
Среда, используемая для культивирования трансформантов в настоящем изобретении, может соответствовать требованиям для культивирования клеток-хозяев. Источники углерода, которые должны содержаться в среде для роста клетки-хозяина, могут быть соответствующим образом выбраны по решению специалиста в данной области техники в соответствии с получаемыми трансформантами, и могут быть выбраны подходящие условия культивирования для контроля за периодом роста и количеством культивируемого трансформанта.
Примеры используемого источника сахара могут включать сахара и углеводы, такие как глюкоза, сахароза, лактоза, фруктоза, мальтоза, крахмал и целлюлоза; масла и жиры, такие как соевое масло, подсолнечное масло, касторовое масло и кокосовое масло; жирные кислоты, такие как пальмитиновая кислота, стеариновая кислота и линолевая кислота; спирты, такие как глицерин и этанол; и органические кислоты, такие как уксусная кислота. Эти вещества могут быть использованы отдельно или в комбинации.
Примеры используемого источника азота могут включать пептон, дрожжевой экстракт, мясную подливку, солодовый экстракт, кукурузный экстракт, соевую муку и мочевину или неорганические соединения, такие как сульфат аммония, хлорид аммония, фосфат аммония, карбонат аммония и нитрат аммония. Источник азота также может быть использован отдельно или в комбинации.
Примеры используемого источника фосфора могут включать дигидрофосфат калия или гидрофосфаткалия или соответствующую натрийсодержащую соль. Кроме того, питательная среда может содержать соль металла, такую как сульфат магния или сульфат железа, необходимую для роста трансформанта.
Наконец, могут быть использованы необходимые для роста вещества, такие как аминокислоты и витамины. Кроме того, можно также использовать подходящие предшественники для питательных сред. Указанные выше источники могут быть соответствующим образом добавлены к культуре во время культивирования посредством периодической культуры или непрерывной культуры. рН культуры может быть соответствующим образом скорректирован с использованием основного соединения, такого как гидроксид натрия, гидроксид калия и аммиак, или кислотного соединения, такого как фосфорная кислота или серная кислота. Кроме того, может быть добавлен пеногаситель, такой как сложный эфир полигликоля с жирной кислотой, для предотвращения пенообразования. Кроме того, для поддержания аэробного состояния в культуру может быть введен кислород или кислородсодержащий газ (например, воздух).
Трансформант по настоящему изобретению можно культивировать при температуре от 20 до 45°С и, в частности, от 25 до 40°С. Кроме того, культивирование продолжают вплоть до получения максимального количества необходимых аналогов инсулина, и в связи с этим культивирование может обычно продолжаться от 10 до 160 часов.
Как описано выше, трансформант по настоящему изобретению может продуцировать аналоги инсулина, когда соответствующие условия культивирования предоставляются в соответствии с требованиями клеток-хозяев, и аналоги инсулина, полученные в соответствии с конструкцией вектора и характеристиками клетки-хозяина, могут секретироваться в цитоплазму или в периплазматическое пространство клетки-хозяина или внеклеточно.
Белки, экспрессируемые внутри клетки-хозяина или вне ее, могут быть очищены обычным способом. Примеры способа очистки могут включать высаливание (например, осаждение сульфатом аммония, осаждение фосфатом аммония и т.д.), осаждение растворителем (например, осаждение белковой фракции ацетоном или этанолом и т.д.), диализ, гель-фильтрацию, ионный обмен или хроматографию, такую как обращенно-фазовая колоночная хроматография, ультрафильтрацию и т.д., и эти методы могут быть использованы по отдельности или в комбинации.
В примерном воплощении настоящее изобретение может дополнительно включать следующие этапы выделения и очистки аналога инсулина, экспрессированного в форме телец включения, от трансформанта:
6-1) получение трансформанта из культуры на стадии а) и измельчение его;
6-2) извлечение экспрессированного аналога инсулина из измельченного клеточного лизата с последующим его рефолдингом;
6-3) очистка подвергнутого рефолдингу аналога инсулина посредством катионообменной хроматографии;
6-4) обработка очищенного аналога инсулина трипсином и карбоксипептидазой В; и
6-5) последовательная очистка обработанного аналога инсулина посредством катионообменной хроматографии и анионообменной хроматографии или обращенно-фазовой хроматографии.
В еще одном аспекте настоящего изобретения предложена композиция (например фармацевтическая композиция) для лечения диабета, содержащая аналог инсулина в качестве активного ингредиента.
Фармацевтическая композиция может представлять собой фармацевтическую композицию для лечения заболеваний, связанных с инсулином (например, диабета).
Аналог инсулина является таким же, как описано выше.
Используемый здесь термин "заболевание, связанное с инсулином" относится к заболеванию, которое возникает или прогрессирует при отсутствии или низком уровне физиологической активности инсулина, например, в том числе диабет, но конкретно не ограничен им.
Фармацевтическая композиция, содержащая аналог инсулина по настоящему изобретению, может включать фармацевтически приемлемые носители.
Используемый здесь термин "фармацевтически приемлемый" относится к свойствам, присутствующим в достаточном количестве для проявления терапевтического эффекта и не вызывающим побочных эффектов, которые могут быть легко определены специалистом в данной области на основании факторов, хорошо известных в медицинской области, таких как вид заболевания, возраст, масса тела, состояние здоровья, пол, чувствительность пациента к лекарственным средствам, способ введения, путь введения, частота введения, продолжительность лечения, лекарственное(ые) средство(а), с которым(и) следует смешивать или вводить одновременно, и т.д.
Для перорального введения фармацевтически приемлемый носитель может содержать связующий агент, смазывающий агент, разрыхлитель, эксципиент, солюбилизатор, диспергирующий агент, стабилизатор, суспендирующий агент, краситель, отдушку и т.д. Для инъекционных препаратов фармацевтически приемлемый носитель может содержать буферный агент, консервант, анальгетик, солюбилизатор, изотонический агент и стабилизатор. Для препаратов для местного применения фармацевтически приемлемый носитель может содержать основу, эксципиент, смазывающее вещество, консервант и т.д. Фармацевтическая композиция по настоящему изобретению может быть изготовлена в виде различных лекарственных форм в сочетании с вышеупомянутыми фармацевтически приемлемыми носителями. Например, для перорального введения фармацевтическая композиция может быть изготовлена в виде таблеток, пастилок, капсул, эликсиров, суспензий, сиропов или облаток. Для инъекционных препаратов фармацевтическая композиция может быть изготовлена в виде однодозовой ампулы или многодозового контейнера. Фармацевтическая композиция также может быть изготовлена в виде растворов, суспензий, таблеток, пилюль, капсул и препаратов с замедленным высвобождением.
При этом, примеры носителей, эксципиентов и разбавителей, подходящих для композиции, могут включать лактозу, декстрозу, сахарозу, сорбит, маннит, ксилит, эритрит, мальтит, крахмал, камедь, альгинат, желатин, фосфат кальция, силикат кальция, целлюлозу, метилцеллюлозу, микрокристаллическую целлюлозу, поливинилпирролидон, воду, метилгидроксибензоат, пропилгидроксибензоат, тальк, стеарат магния, минеральные масла и др. Кроме того, фармацевтические композиции могут дополнительно содержать наполнитель, антикоагулянт, смазывающее вещество, увлажнитель, ароматизатор, эмульгатор, консервант и т.д.
Кроме того, аналоги инсулина по настоящей заявке могут быть включены в количестве от 0,001 до 10 масс. % в расчете на общую массу композиции по настоящей заявке, но количество конкретно этим не ограничивается.
В еще одном аспекте настоящее изобретение относится к способу лечения заболеваний, связанных с инсулином (например, диабета), включающему введение субъекту, нуждающемуся в этом, аналога инсулина или фармацевтической композиции, содержащей аналог инсулина.
Аналог инсулина и фармацевтическая композиция являются такими, как описано выше.
Используемый здесь термин "введение" относится к введению определенного вещества пациенту подходящим образом, и аналог инсулина по настоящему изобретению может быть введен любым из общепринятых способов, при условии что лекарственное средство может достичь целевой ткани. Например, может быть выполнено внутрибрюшинное, внутривенное, внутримышечное, подкожное, внутрикожное, пероральное, местное, интраназальное, внутрилегочное и интраректальное введение, но путь введения не ограничивается этим. Однако поскольку пептиды перевариваются при пероральном введении, активные ингредиенты композиции для перорального введения должны быть покрыты оболочкой или изготовлены для защиты от разложения в желудке. Предпочтительно, настоящую композицию можно вводить в форме для инъекций. Кроме того, фармацевтическую композицию можно вводить с использованием определенного устройства, способного транспортировать активные ингредиенты в клетку-мишень.
Кроме того, фармацевтическая композиция по настоящему изобретению может быть выбрана в зависимости от типа лекарственного средства в качестве активного компонента, а также от некоторых связанных факторов, включая тип заболевания, подлежащего лечению, путь введения, возраст, пол, массу тела пациента и тяжесть заболевания. Поскольку фармацевтическая композиция по настоящему изобретению имеет превосходный срок действия in vivo, ее использование может значительно снизить частоту введения и дозу фармацевтических препаратов по настоящему изобретению.
Общая эффективная доза композиции по настоящему изобретению может быть введена пациенту в виде однократной дозы или может быть введена в течение длительного периода времени в виде нескольких доз в соответствии с протоколом фракционного лечения. Количество активного(ых) ингредиента(ов), содержащегося(ихся) в фармацевтической композиции по настоящему изобретению, может варьировать в зависимости от тяжести заболевания. В частности, общая суточная доза аналога инсулина по настоящему изобретению может составлять примерно от 0,0001 до 500 мг на 1 кг массы тела пациента.
Однако, эффективная доза аналога инсулина определяется с учетом различных факторов, включая возраст пациента, массу тела, состояние здоровья, пол, тяжесть заболевания, тип питания и скорость выведения, помимо пути введения и частоты введения фармацевтической композиции. В этом отношении специалисты в данной области могут легко определить эффективную дозу, подходящую для конкретного применения фармацевтической композиции по настоящему изобретению. Фармацевтическая композиция по настоящему изобретению особым образом не ограничивается составом, путем и способом введения, при условии что она демонстрирует эффекты, обеспечиваемые настоящим изобретением.
Для достижения настоящего изобретения в другом аспекте настоящего изобретения предложено применение аналога инсулина в изготовлении лекарственного средства.
В одном воплощении лекарственное средство предназначено для предупреждения или лечения заболеваний, связанных с инсулином, но его применение конкретно этим не ограничивается.
В одном воплощении лекарственное средство предназначено для профилактики или лечения диабета, но его применение конкретно этим не ограничивается.
Для достижения настоящего изобретения в еще одном аспекте настоящего изобретения предложено применение аналога инсулина в лечении заболеваний, связанных с инсулином, в частности, диабета.
Аналог инсулина и связанные с инсулином заболевания являются такими, как описано выше.
Далее настоящее изобретение будет описано более подробно со ссылкой на следующие примеры. Однако эти примеры приведены только в иллюстративных целях, и объем настоящего изобретения никоим образом не должен быть ограничен ими.
Пример 1: Получение экспрессионного вектора с одноцепочечным аналогом инсулина
Чтобы получить аналоги инсулина, имеющие одну модифицированную аминокислоту в A-цепи или В-цепи, соответственно, с использованием в качестве матрицы экспрессирующего нативный инсулин вектора, были синтезированы прямые и обратные олигонуклеотиды (Таблица 2), и затем выполняли ПЦР для амплификации каждого из генов данных аналогов.
Аминокислотные последовательности, модифицированные в A-цепи или В-цепи, и названия аналогов приведены в Таблице 1 ниже. В Таблице 1, Аналог 1 представляет собой аналог, в котором 14ая аминокислота A-цепи (то есть тирозин, Y) замещена гистидином (Н), и Аналог 6 представляет собой аналог, в котором 16ая аминокислота В-цепи (то есть тирозин, Y) замещена глутаминовой кислотой (Е).
Праймеры для амплификации аналогов инсулина показаны в Таблице 2 ниже.

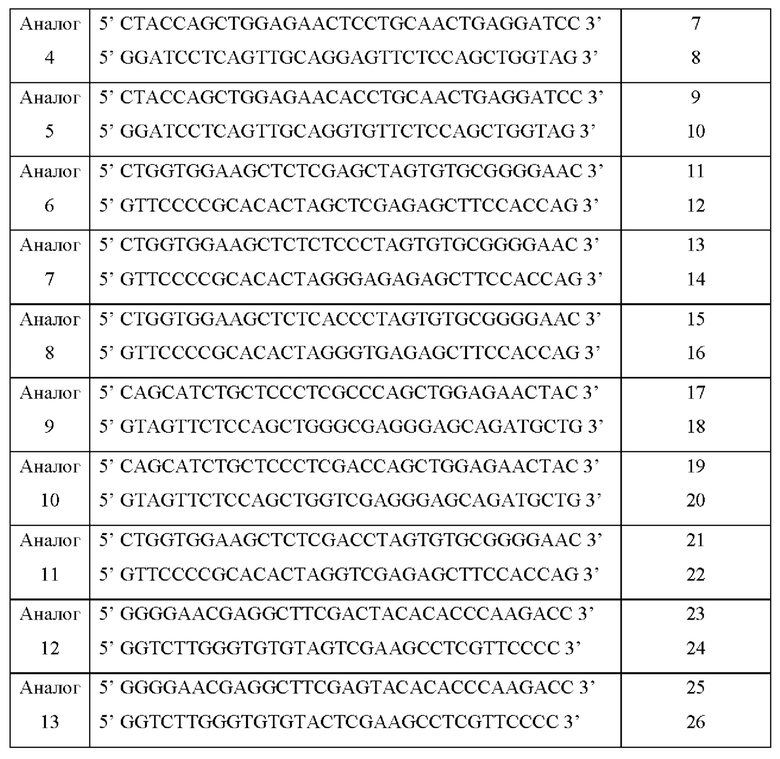
При проведении реакции ПЦР для амплификации аналогов инсулина выполняли 18 повторных циклов при условиях 95°С в течение 30 секунд, 55°С в течение 30 секунд и 68°С в течение 6 минут. Фрагменты аналога инсулина, полученные в этих условиях, были вставлены в вектор pET22b для экспрессии в виде внутриклеточных телец включения, и полученные таким образом экспрессионные векторы были названы аналогами pET22b-инсулина 1-13. Экспрессионные векторы содержали нуклеиновые кислоты, кодирующие аминокислотные последовательности аналогов инсулина 1-13 под контролем промотора Т7, а белки аналогов инсулина экспрессировались в виде телец включения в клетках-хозяевах, включающих эти экспрессионные векторы.
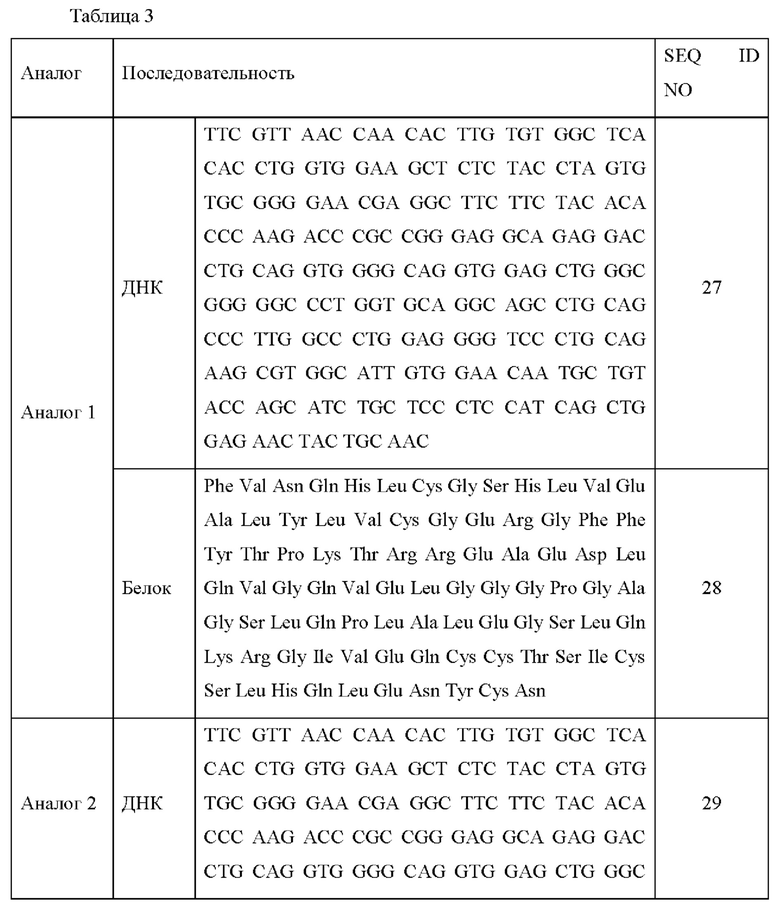
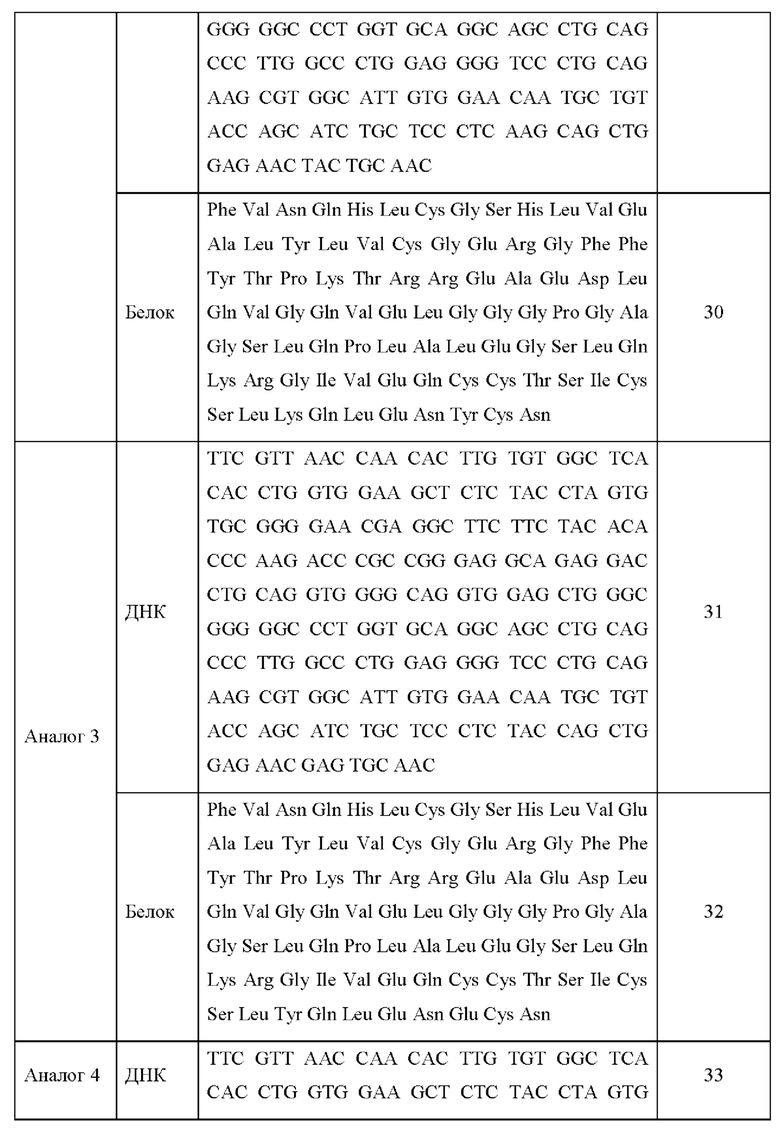
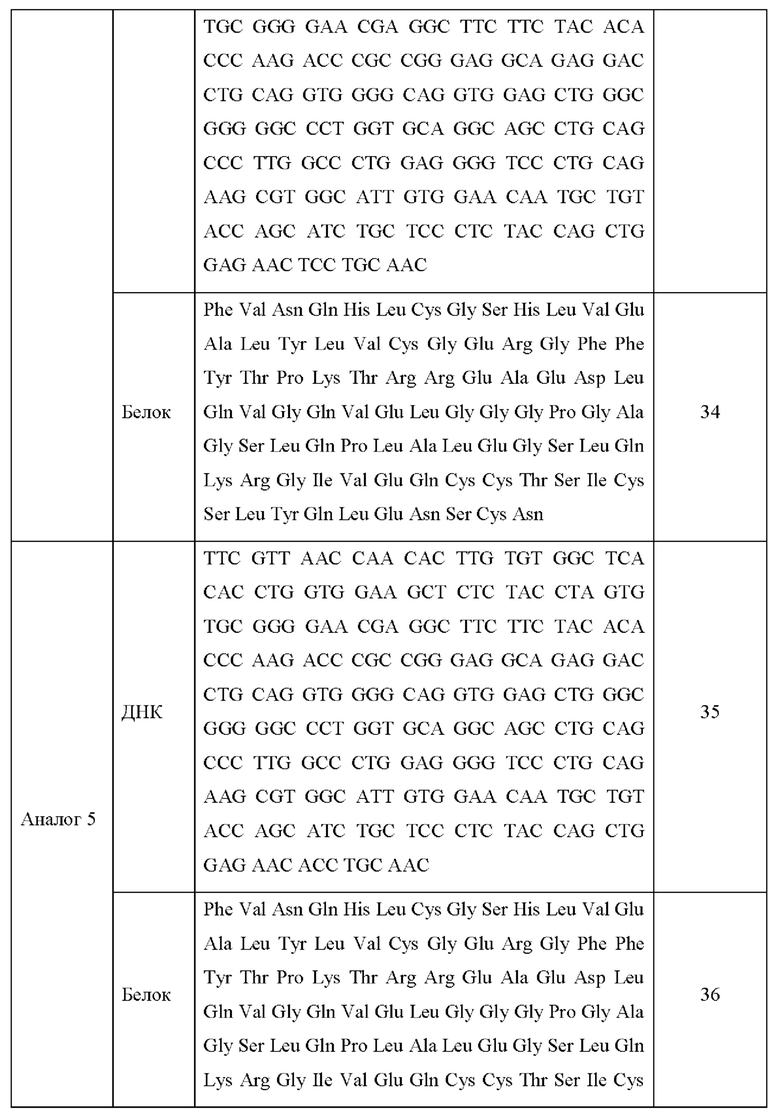
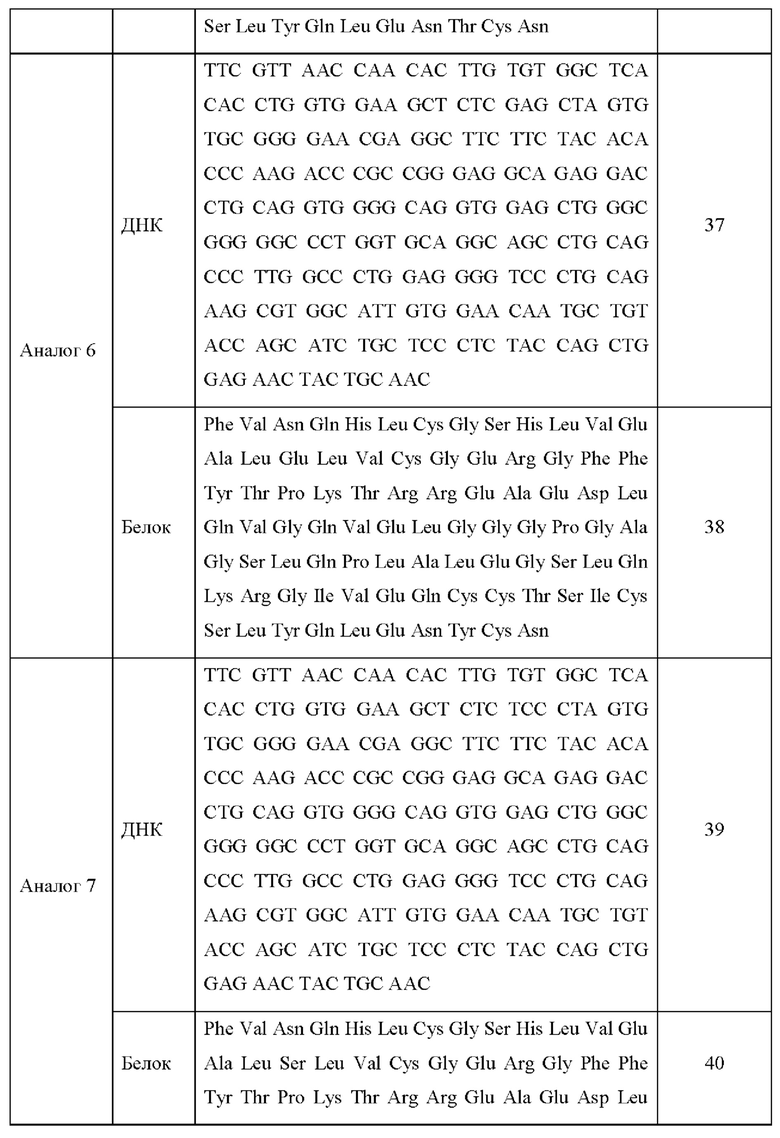
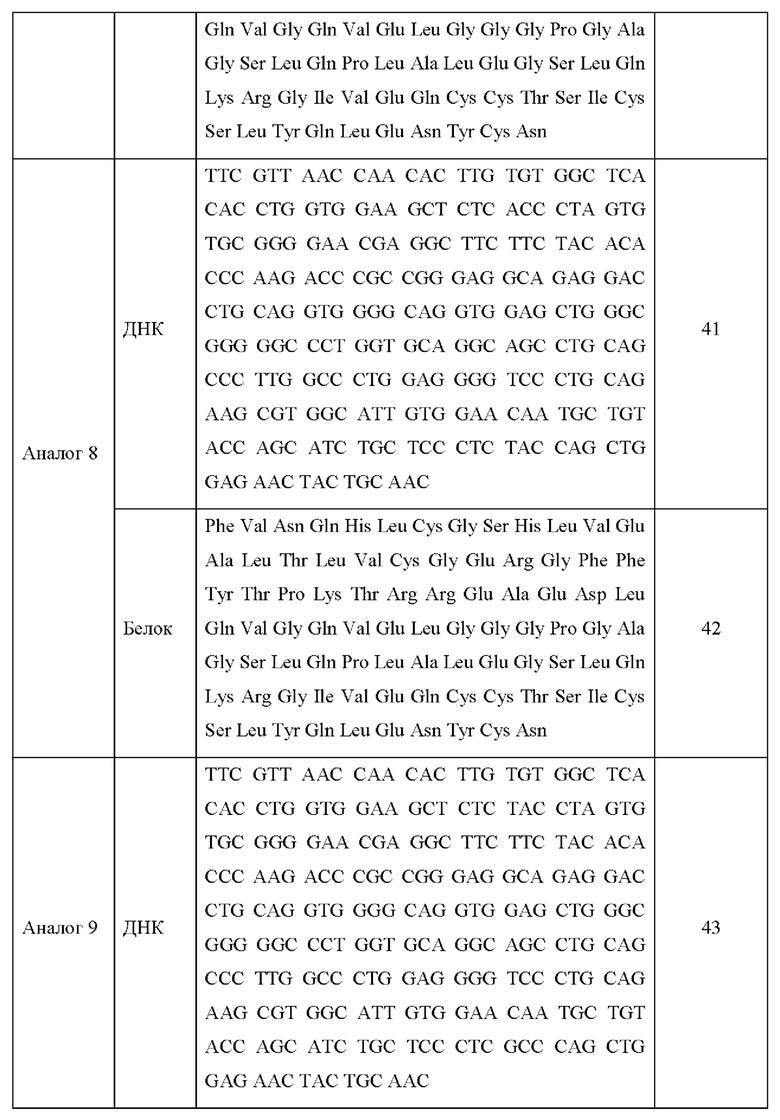
Последовательности ДНК и белковые последовательности аналогов инсулина 1-13 приведены в Таблице 3 ниже.
Каждую модификацию последовательности исследовали посредством анализа последовательности ДНК, и в результате было подтверждено, что каждая последовательность аналогов инсулина была модифицирована в соответствии с предполагаемым назначением.
Пример 2: Экспрессия рекомбинантных слитых пептидов аналога инсулина Экспрессию рекомбинантных аналогов инсулина выполняли под контролем промотора Т7. Е. coli BL21-DE3 (E. coli В F-dcm ompT hsdS(rB-mB-) gal λDE3; Novagen) трансформировали каждым из векторов, экспрессирующих рекомбинантный аналог инсулина. Трансформацию проводили в соответствии с рекомендованным протоколом (Novagen). Одиночные колонии, трансформированные каждым рекомбинантным экспрессионным вектором, собирали, инокулировали в 2Х бульоне Луриа (LB), содержащем ампициллин (50 мкг/мл), и культивировали при 37°С в течение 15 часов. Культуральный бульон рекомбинантного штамма и среду 2Х LB, содержащую 30% глицерина, смешивали в соотношении 1:1 (об./об.), распределяли по 1 мл смеси в криопробирки и хранили при -140°С, которые использовали в качестве клеточного запаса для продуцирования рекомбинантного слитого белка.
Для экспрессии рекомбинантных аналогов инсулина один флакон каждой клеточной массы оттаивали и инокулировали в 500 мл 2Х бульона Луриа и культивировали при встряхивании при 37°С в течение от 14 часов до 16 часов. Культивирование прекращали, когда показатель OD 600 достигал 5,0 или выше, и культуральный бульон использовали в качестве бульона для посевной культуры. Бульон для посевной культуры инокулировали в 17 л ферментационной среды с использованием 50 л ферментатора (MSJ-U2, B.E.MARUBISHI, Япония) и начинали исходную ферментацию. Условия культивирования поддерживали при температуре 37°С, скорости потока воздуха 20 л/мин (1 об/мин), скорости перемешивания 500 об/мин и при рН 6,70 с использованием 30% раствора аммония. Ферментацию проводили в стационарном режиме с подпиткой, добавляя питательный раствор, когда питательные вещества были истощены в культуральном бульоне. Рост штамма контролировали по значению OD. IPTG (изопропилтиогалактозид) вводили до конечной концентрации 500 мкМ, когда значение OD достигало 100 или выше. После введения культивирование продолжали в течение примерно от 23 до 25 часов. По окончании культивирования рекомбинантные штаммы собирали центрифугированием и хранили при -80°С до использования.
Пример 3: Восстановление и рефолдинг рекомбинантных аналогов инсулина Чтобы перевести рекомбинантные аналоги инсулина, экспрессированные в Примере 2, в растворимые формы, клетки разрушали с последующим рефолдингом. Клеточный осадок (100 г; масса во влажном состоянии) ресуспендировали в 1 л лизисного буфера (50 мМ Трис-HCl (рН 9,0), 1 мМ этилендиаминтетрауксусной кислоты (ЭДТА) (рН 8,0), 0,2 M NaCl и 0,5% Тритон Х-100). Клетки разрушали с использованием микрофлюидизатора (Microfluidic Corp.Model М-ПОЕН-ЗО) при рабочем давлении 15000 фунтов на квадратный дюйм. Разрушенный таким образом клеточный лизат центрифугировали при 7000 об/мин при температуре от 4 до 8°С в течение 20 минут.Супернатант отбрасывали и осадок ресуспендировали в 3 л промывочного буфера (0,5% Triton Х-100 и 50 мМ Трис-HCl (рН 8,0), 0,2 M NaCl и 1 мМ ЭДТА). После центрифугирования при 7000 об/мин при температуре от 4 до 8°С в течение 20 минут осадок клеток ресуспендировали в дистиллированной воде с последующим центрифугированием при таких же условиях. Полученный таким образом осадок ресуспендировали в буфере (1 M L-глицин, 3,78 г L-цистеин-НО, рН 10,6) и перемешивали при комнатной температуре в течение 1 часа. Для извлечения рекомбинантного аналога инсулина, ресуспендированного таким образом, к нему добавляли 8 M мочевину и перемешивали в течение от 3 часов до 5 часов. Для рефолдинга солюбилизированных рекомбинантных аналогов проинсулина проводили центрифугирование при 7000 об/мин при температуре от 4°С до 8°С в течение 30 минут, супернатант собирали и обрабатывали 15 мМ L-цисте ином-НС1, т.е. восстановителем в течение одного часа. К нему добавляли предварительно определенный объем дистиллированной воды с использованием перистальтического насоса и перемешивали при температуре от 4 до 8°С в течение по меньшей мере 12 часов.
Пример 4: Очистка посредством катионообменной хроматографии После завершения рефолдинга образец загружали в колонку SP FF (GE Health), уравновешенную буфером 20 мМ цитрата натрия (рН 2,0), содержащим 45% этанола, а затем белки аналога инсулина элюировали 10 объемами колонки с использованием линейного градиента от 0% до 100% с использованием буфера 20 мМ цитрата натрия (рН 2,0), содержащего 0,5 M хлорида калия и 45% этанола.
Пример 5: Обработка трипсином и кар бокс ипептидазой В
Соли удаляли из элюированных образцов с использованием ультрафильтрационной мембраны с последующей заменой буферного раствора (10 мМ Трис-HCl, рН 8,0). Полученный таким образом образец белка обрабатывали трипсином, соответствующим молярному соотношению примерно 30000 относительно количества белка в образце, и кар бокс ипептидазой В, соответствующей молярному соотношению примерно 3000 молярного отношения по отношению к количеству белка в образце, и перемешивали при температуре от 4°С до 8°С в течение менее 16 часов.
Пример 6: Очистка посредством катионообменной хроматографии После завершения реакции образец повторно загружали в колонку SP HP (GE Healthcare), уравновешенную буфером 20 мМ цитрата натрия (рН 2,0), содержащим 45% этанола, и белки аналога инсулина элюировали 10 объемами колонки с использованием линейного градиента от 0% до 100% с использованием 20 мМ цитрата натрия (рН 2,0), содержащего 0,5 M хлорида калия и 45% этанола.
Пример 7: Очистка посредством обращенно-фазовой хроматографии Для полного выделения чистого аналога инсулина, полученного в Примере 6, его загружали в колонку для обращенно-фазовой хроматографии Source30RPC (GE healthcare, USA), которую уравновешивали фосфатом натрия и изопропанолом, и белки аналога инсулина элюировали с использованием линейного градиента с использованием буфера, содержащего фосфат натрия и изопропанол.
Очищенные таким образом аналоги инсулина анализировали с помощью электрофореза белков (электрофорез в полиакрил амид ном геле с додецилсульфатом натрия (SDS-PAGE), Фиг. 1) и ВЭЖХ, и среди них была определена чистота репрезентативных аналогов инсулина под номерами 9, 10, 11 и 12, и результаты показаны на Фиг. 2.
Пример 8: Сравнение аффинности связывания аналогов инсулина с рецепторами инсулина
Для измерения аффинности связывания аналогов инсулина с рецепторами инсулина проводили сцинтилляционный анализ сближения (SPA). Клеточную мембрану линии клеток СНО, в которой экспрессировались рецепторы инсулина, и PVT SPA-шарики добавляли вместе в 96-луночный пикопланшет. Чтобы определить аффинность связывания с рецепторами инсулина, человеческий инсулин и каждый из аналогов инсулина, разведенных в более чем 10 различных концентрациях, а также меченный радиоактивным изотопом I125 инсулин, в качестве конкурента, добавляли вместе и давали им конкурентно взаимодействовать при комнатной температуре в течение 4 часов. Через четыре часа аффинность связывания с рецепторами инсулина измеряли с использованием бета-счетчика. Аффинность связывания каждого аналога рассчитывали в IC50 с использованием программного обеспечения GraphPad Prism 6 и преобразовывали в цифровом виде как аффинность связывания по отношению к связыванию человеческого инсулина с рецепторами инсулина.
В результате по сравнению с человеческим инсулином было показано, что аффинность связывания с рецепторами инсулина составляет 90% для аналога инсулина (№. 1); 95% для аналога инсулина (№. 2); 1,0% для аналога инсулина (№3); менее 0,1% для аналога инсулина (№4); 20% для аналога инсулина (№6); 8,5% для аналога инсулина (№7); 79% для аналога инсулина (№9), 79% для аналога инсулина (№10); 24% для аналога инсулина (№11); менее 0,1% для аналога инсулина (№12); и менее 0,1% для аналога инсулина (№13) (Таблица 4). Соответственно, было обнаружено, что аналоги инсулина по настоящему изобретению имеют пониженную аффинность связывания с рецепторами инсулина по сравнению с нативным инсулином.
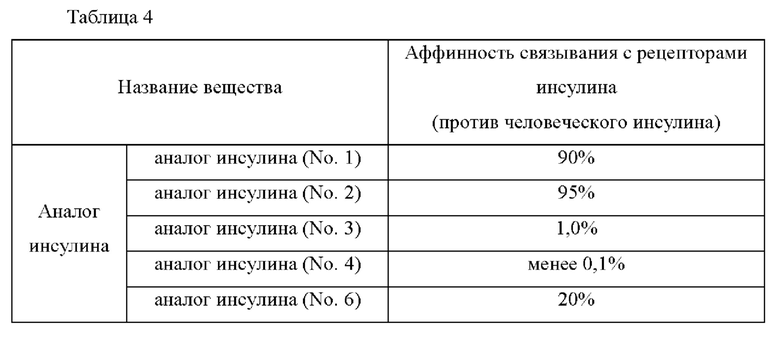

Пример 9: Сравнение in vitro эффективности аналога инсулина 10 Чтобы оценить in vitro эффективность аналога инсулина 10, использовали мышиную клеточную линию 3T3-L1, дифференцированную в адипоциты, для проверки способности к поглощению глюкозы или синтеза липидов. Клетки 3T3-L1 пересевали в среде Игла, модифицированной по Дульбекко (DMEM, Gibco, Cat. No, 12430), содержащей 10% сыворотки новорожденного теленка (NBCS) 2 или 3 раза в неделю и поддерживали в ней. Клетки 3T3-L1 суспендировали в среде для дифференцировки (10% FBS-содержащей DMEM) и затем инокулировали при концентрации 5×104 клеток на лунку в 48-луночный планшет и культивировали в течение 48 часов. Для дифференцировки клеток в адипоциты 1 мкг/мл человеческого инсулина (Sigma, кат.№19278), 0,5 мкМ 3-изобутил-1-метилксантина (IBMX, Sigma, кат.№15879) и 1 мкМ дексаметазона (Sigma, кат. №D4902) смешивали со средой для дифференцировки и 250 мкл смеси добавляли в каждую лунку после удаления находящейся там среды. Через 48 часов среду заменяли средой для дифференцировки, дополненной только 1 мкг/мл человеческого инсулина. После этого индукцию дифференцировки в адипоциты исследовали в течение 12 суток, в то же время заменяя каждые 48 часов данную среду на среду для дифференцировки, дополненную 1 мкг/мл человеческого инсулина. Для тестирования способности к поглощению глюкозы дифференцированные клетки промывали один раз бессывороточной средой DMEM, а затем добавляли 250 мкл бессывороточной среды DMEM, чтобы вызвать истощение сыворотки в течение 4 часов. Бессывороточную среду DMEM использовали для выполнения 10-кратных серийных разведений от 10 мкМ до 0,001 нМ для человеческого инсулина и аналога инсулина 10. 250 мкл каждого из приготовленных таким образом образцов добавляли к клеткам и культивировали в инкубаторе с 5% СО2 при 37°С в течение 24 часов. Чтобы измерить оставшееся количество глюкозы в среде после инкубации, отбирали по 200 мкл каждой среды и разбавляли D-PBS в 5 раз с последующим анализом GOPOD (GOPOD Assay Kit, Megazyme, Cat. No. K-GLUC). На основании показателя поглощения стандартного раствора глюкозы была пересчитана концентрация оставшейся в среде глюкозы, и были рассчитаны значения ЕС50 в отношении способности человеческого инсулина и аналога инсулина 10, соответственно, поглощать глюкозу.
Всего было выполнено 3 повтора данного теста, и в результате были получены значения ЕС50 для человеческого инсулина и аналога инсулина 10, равные 14,4±1,0 нМ и 7,8±0,7 нМ, соответственно. То есть, было подтверждено, что способность аналога инсулина 10 поглощать глюкозу соответствует 185,5 ±25,7% по сравнению с человеческим инсулином (Фиг. 3).
Пример 10: Сравнение стабильности аналога инсулина 10 в клетках
Для подтверждения стабильности аналога инсулина 10 в клетках проводили тест с использованием клеточной линии HepG2 человеческого происхождения. Сначала клетки HepG2 пересевали в среде DMEM, содержащей 10% FBS, 2-3 раза в неделю. 300 мкл поли-L-лизина (Trevigen, Cat. No. 3438-100-01) добавляли в 24-луночный планшет и покрывали при 37°С в течение 2 часов. После двукратного промывания холодным раствором D-PBS клетки HepG2 суспендировали в культуральной среде (DMEM, содержащей 10% FBS) и инокулировали на 24-луночный планшет в концентрации 1×105 клеток на лунку и культивировали в течение 24 часов. После промывания клеток контрольной средой (DMEM, содержащей 2% FBS) в каждую лунку добавляли 500 мкл контрольной среды, содержащей 500 нМ человеческого инсулина и аналога инсулина 10. После инкубации клеток в инкубаторе с 5% СО2 при 37°С в течение 0, 2, 6, 9, 24 и 48 часов среду извлекали и хранили в замороженном виде после завершения инкубации. Для определения количества инсулина, оставшегося в среде, выполняли 100-кратное разведение PBS-T и анализировали с использованием набора ELISA (Alpco, Cat. No. 80-INSHU-E10.1) для человеческого инсулина.
Всего было выполнено 3 повтора данного теста, и в результате количество инсулина, оставшегося в культуральной среде, составило 20,9±11,4% и 72,7±5,7% для человеческого инсулина и аналога инсулина 10, соответственно, после инкубации в течение 48 часов по сравнению с данными на 0 часов. То есть, было подтверждено, что аналог инсулина 10 имеет более высокую стабильность в клетках по сравнению с человеческим инсулином (Фиг. 4).
Исходя из вышеизложенного, специалисту в области техники, к которой относится настоящее изобретение, понятно, что настоящее изобретение может быть воплощено в других конкретных формах без изменения технической концепции или существенных характеристик настоящего изобретения. В этом отношении примерные воплощения, раскрытые в данном документе, предназначены только для иллюстративных целей и не должны рассматриваться как ограничивающие объем настоящего изобретения. Напротив, настоящее изобретение предназначено охватывать не только примерные воплощения, но также различные альтернативы, модификации, эквиваленты и другие воплощения, которые могут быть включены в пределах сущности и объема настоящего изобретения, как определено в прилагаемой формуле изобретения.
--->
<110> HANMI PHARM. CO., LTD.
Sanofi-Aventis Deutschland GmbH
<120> Insulin analogs with reduced affinity to insulin receptor and
use thereof
<130> OPA17190
<150> KR 10-2016-0122484
<151> 2016-09-23
<160> 56
<170> KoPatentIn 3.0
<210> 1
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 1
cagcatctgc tccctccatc agctggagaa ctac 34
<210> 2
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 2
gtagttctcc agctgatgga gggagcagat gctg 34
<210> 3
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 3
cagcatctgc tccctcaagc agctggagaa ctac 34
<210> 4
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 4
gtagttctcc agctgcttga gggagcagat gctg 34
<210> 5
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 5
ctaccagctg gagaacgagt gcaactgagg atcc 34
<210> 6
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 6
ggatcctcag ttgcactcgt tctccagctg gtag 34
<210> 7
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 7
ctaccagctg gagaactcct gcaactgagg atcc 34
<210> 8
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 8
ggatcctcag ttgcaggagt tctccagctg gtag 34
<210> 9
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 9
ctaccagctg gagaacacct gcaactgagg atcc 34
<210> 10
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 10
ggatcctcag ttgcaggtgt tctccagctg gtag 34
<210> 11
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 11
ctggtggaag ctctcgagct agtgtgcggg gaac 34
<210> 12
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 12
gttccccgca cactagctcg agagcttcca ccag 34
<210> 13
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 13
ctggtggaag ctctctccct agtgtgcggg gaac 34
<210> 14
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 14
gttccccgca cactagggag agagcttcca ccag 34
<210> 15
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 15
ctggtggaag ctctcaccct agtgtgcggg gaac 34
<210> 16
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 16
gttccccgca cactagggtg agagcttcca ccag 34
<210> 17
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 17
cagcatctgc tccctcgccc agctggagaa ctac 34
<210> 18
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 18
gtagttctcc agctgggcga gggagcagat gctg 34
<210> 19
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 19
cagcatctgc tccctcgacc agctggagaa ctac 34
<210> 20
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 20
gtagttctcc agctggtcga gggagcagat gctg 34
<210> 21
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 21
ctggtggaag ctctcgacct agtgtgcggg gaac 34
<210> 22
<211> 34
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 22
gttccccgca cactaggtcg agagcttcca ccag 34
<210> 23
<211> 33
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 23
ggggaacgag gcttcgacta cacacccaag acc 33
<210> 24
<211> 33
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 24
ggtcttgggt gtgtagtcga agcctcgttc ccc 33
<210> 25
<211> 33
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 25
ggggaacgag gcttcgagta cacacccaag acc 33
<210> 26
<211> 33
<212> DNA
<213> Artificial Sequence
<220>
<223> Праймер
<400> 26
ggtcttgggt gtgtactcga agcctcgttc ccc 33
<210> 27
<211> 258
<212> DNA
<213> Artificial Sequence
<220>
<223> Аналог 1
<400> 27
ttcgttaacc aacacttgtg tggctcacac ctggtggaag ctctctacct agtgtgcggg 60
gaacgaggct tcttctacac acccaagacc cgccgggagg cagaggacct gcaggtgggg 120
caggtggagc tgggcggggg ccctggtgca ggcagcctgc agcccttggc cctggagggg 180
tccctgcaga agcgtggcat tgtggaacaa tgctgtacca gcatctgctc cctccatcag 240
ctggagaact actgcaac 258
<210> 28
<211> 86
<212> PRT
<213> Artificial Sequence
<220>
<223> Аналог 1
<400> 28
Phe Val Asn Gln His Leu Cys Gly Ser His Leu Val Glu Ala Leu Tyr
1 5 10 15
Leu Val Cys Gly Glu Arg Gly Phe Phe Tyr Thr Pro Lys Thr Arg Arg
20 25 30
Glu Ala Glu Asp Leu Gln Val Gly Gln Val Glu Leu Gly Gly Gly Pro
35 40 45
Gly Ala Gly Ser Leu Gln Pro Leu Ala Leu Glu Gly Ser Leu Gln Lys
50 55 60
Arg Gly Ile Val Glu Gln Cys Cys Thr Ser Ile Cys Ser Leu His Gln
65 70 75 80
Leu Glu Asn Tyr Cys Asn
85
<210> 29
<211> 258
<212> DNA
<213> Artificial Sequence
<220>
<223> Аналог 2
<400> 29
ttcgttaacc aacacttgtg tggctcacac ctggtggaag ctctctacct agtgtgcggg 60
gaacgaggct tcttctacac acccaagacc cgccgggagg cagaggacct gcaggtgggg 120
caggtggagc tgggcggggg ccctggtgca ggcagcctgc agcccttggc cctggagggg 180
tccctgcaga agcgtggcat tgtggaacaa tgctgtacca gcatctgctc cctcaagcag 240
ctggagaact actgcaac 258
<210> 30
<211> 86
<212> PRT
<213> Artificial Sequence
<220>
<223> Аналог 2
<400> 30
Phe Val Asn Gln His Leu Cys Gly Ser His Leu Val Glu Ala Leu Tyr
1 5 10 15
Leu Val Cys Gly Glu Arg Gly Phe Phe Tyr Thr Pro Lys Thr Arg Arg
20 25 30
Glu Ala Glu Asp Leu Gln Val Gly Gln Val Glu Leu Gly Gly Gly Pro
35 40 45
Gly Ala Gly Ser Leu Gln Pro Leu Ala Leu Glu Gly Ser Leu Gln Lys
50 55 60
Arg Gly Ile Val Glu Gln Cys Cys Thr Ser Ile Cys Ser Leu Lys Gln
65 70 75 80
Leu Glu Asn Tyr Cys Asn
85
<210> 31
<211> 258
<212> DNA
<213> Artificial Sequence
<220>
<223> Аналог 3
<400> 31
ttcgttaacc aacacttgtg tggctcacac ctggtggaag ctctctacct agtgtgcggg 60
gaacgaggct tcttctacac acccaagacc cgccgggagg cagaggacct gcaggtgggg 120
caggtggagc tgggcggggg ccctggtgca ggcagcctgc agcccttggc cctggagggg 180
tccctgcaga agcgtggcat tgtggaacaa tgctgtacca gcatctgctc cctctaccag 240
ctggagaacg agtgcaac 258
<210> 32
<211> 86
<212> PRT
<213> Artificial Sequence
<220>
<223> Аналог 3
<400> 32
Phe Val Asn Gln His Leu Cys Gly Ser His Leu Val Glu Ala Leu Tyr
1 5 10 15
Leu Val Cys Gly Glu Arg Gly Phe Phe Tyr Thr Pro Lys Thr Arg Arg
20 25 30
Glu Ala Glu Asp Leu Gln Val Gly Gln Val Glu Leu Gly Gly Gly Pro
35 40 45
Gly Ala Gly Ser Leu Gln Pro Leu Ala Leu Glu Gly Ser Leu Gln Lys
50 55 60
Arg Gly Ile Val Glu Gln Cys Cys Thr Ser Ile Cys Ser Leu Tyr Gln
65 70 75 80
Leu Glu Asn Glu Cys Asn
85
<210> 33
<211> 258
<212> DNA
<213> Artificial Sequence
<220>
<223> Аналог 4
<400> 33
ttcgttaacc aacacttgtg tggctcacac ctggtggaag ctctctacct agtgtgcggg 60
gaacgaggct tcttctacac acccaagacc cgccgggagg cagaggacct gcaggtgggg 120
caggtggagc tgggcggggg ccctggtgca ggcagcctgc agcccttggc cctggagggg 180
tccctgcaga agcgtggcat tgtggaacaa tgctgtacca gcatctgctc cctctaccag 240
ctggagaact cctgcaac 258
<210> 34
<211> 86
<212> PRT
<213> Artificial Sequence
<220>
<223> Аналог 4
<400> 34
Phe Val Asn Gln His Leu Cys Gly Ser His Leu Val Glu Ala Leu Tyr
1 5 10 15
Leu Val Cys Gly Glu Arg Gly Phe Phe Tyr Thr Pro Lys Thr Arg Arg
20 25 30
Glu Ala Glu Asp Leu Gln Val Gly Gln Val Glu Leu Gly Gly Gly Pro
35 40 45
Gly Ala Gly Ser Leu Gln Pro Leu Ala Leu Glu Gly Ser Leu Gln Lys
50 55 60
Arg Gly Ile Val Glu Gln Cys Cys Thr Ser Ile Cys Ser Leu Tyr Gln
65 70 75 80
Leu Glu Asn Ser Cys Asn
85
<210> 35
<211> 258
<212> DNA
<213> Artificial Sequence
<220>
<223> Аналог 5
<400> 35
ttcgttaacc aacacttgtg tggctcacac ctggtggaag ctctctacct agtgtgcggg 60
gaacgaggct tcttctacac acccaagacc cgccgggagg cagaggacct gcaggtgggg 120
caggtggagc tgggcggggg ccctggtgca ggcagcctgc agcccttggc cctggagggg 180
tccctgcaga agcgtggcat tgtggaacaa tgctgtacca gcatctgctc cctctaccag 240
ctggagaaca cctgcaac 258
<210> 36
<211> 86
<212> PRT
<213> Artificial Sequence
<220>
<223> Аналог 5
<400> 36
Phe Val Asn Gln His Leu Cys Gly Ser His Leu Val Glu Ala Leu Tyr
1 5 10 15
Leu Val Cys Gly Glu Arg Gly Phe Phe Tyr Thr Pro Lys Thr Arg Arg
20 25 30
Glu Ala Glu Asp Leu Gln Val Gly Gln Val Glu Leu Gly Gly Gly Pro
35 40 45
Gly Ala Gly Ser Leu Gln Pro Leu Ala Leu Glu Gly Ser Leu Gln Lys
50 55 60
Arg Gly Ile Val Glu Gln Cys Cys Thr Ser Ile Cys Ser Leu Tyr Gln
65 70 75 80
Leu Glu Asn Thr Cys Asn
85
<210> 37
<211> 258
<212> DNA
<213> Artificial Sequence
<220>
<223> Аналог 6
<400> 37
ttcgttaacc aacacttgtg tggctcacac ctggtggaag ctctcgagct agtgtgcggg 60
gaacgaggct tcttctacac acccaagacc cgccgggagg cagaggacct gcaggtgggg 120
caggtggagc tgggcggggg ccctggtgca ggcagcctgc agcccttggc cctggagggg 180
tccctgcaga agcgtggcat tgtggaacaa tgctgtacca gcatctgctc cctctaccag 240
ctggagaact actgcaac 258
<210> 38
<211> 86
<212> PRT
<213> Artificial Sequence
<220>
<223> Аналог 6
<400> 38
Phe Val Asn Gln His Leu Cys Gly Ser His Leu Val Glu Ala Leu Glu
1 5 10 15
Leu Val Cys Gly Glu Arg Gly Phe Phe Tyr Thr Pro Lys Thr Arg Arg
20 25 30
Glu Ala Glu Asp Leu Gln Val Gly Gln Val Glu Leu Gly Gly Gly Pro
35 40 45
Gly Ala Gly Ser Leu Gln Pro Leu Ala Leu Glu Gly Ser Leu Gln Lys
50 55 60
Arg Gly Ile Val Glu Gln Cys Cys Thr Ser Ile Cys Ser Leu Tyr Gln
65 70 75 80
Leu Glu Asn Tyr Cys Asn
85
<210> 39
<211> 258
<212> DNA
<213> Artificial Sequence
<220>
<223> Аналог 7
<400> 39
ttcgttaacc aacacttgtg tggctcacac ctggtggaag ctctctccct agtgtgcggg 60
gaacgaggct tcttctacac acccaagacc cgccgggagg cagaggacct gcaggtgggg 120
caggtggagc tgggcggggg ccctggtgca ggcagcctgc agcccttggc cctggagggg 180
tccctgcaga agcgtggcat tgtggaacaa tgctgtacca gcatctgctc cctctaccag 240
ctggagaact actgcaac 258
<210> 40
<211> 86
<212> PRT
<213> Artificial Sequence
<220>
<223> Аналог 7
<400> 40
Phe Val Asn Gln His Leu Cys Gly Ser His Leu Val Glu Ala Leu Ser
1 5 10 15
Leu Val Cys Gly Glu Arg Gly Phe Phe Tyr Thr Pro Lys Thr Arg Arg
20 25 30
Glu Ala Glu Asp Leu Gln Val Gly Gln Val Glu Leu Gly Gly Gly Pro
35 40 45
Gly Ala Gly Ser Leu Gln Pro Leu Ala Leu Glu Gly Ser Leu Gln Lys
50 55 60
Arg Gly Ile Val Glu Gln Cys Cys Thr Ser Ile Cys Ser Leu Tyr Gln
65 70 75 80
Leu Glu Asn Tyr Cys Asn
85
<210> 41
<211> 258
<212> DNA
<213> Artificial Sequence
<220>
<223> Аналог 8
<400> 41
ttcgttaacc aacacttgtg tggctcacac ctggtggaag ctctcaccct agtgtgcggg 60
gaacgaggct tcttctacac acccaagacc cgccgggagg cagaggacct gcaggtgggg 120
caggtggagc tgggcggggg ccctggtgca ggcagcctgc agcccttggc cctggagggg 180
tccctgcaga agcgtggcat tgtggaacaa tgctgtacca gcatctgctc cctctaccag 240
ctggagaact actgcaac 258
<210> 42
<211> 86
<212> PRT
<213> Artificial Sequence
<220>
<223> Аналог 8
<400> 42
Phe Val Asn Gln His Leu Cys Gly Ser His Leu Val Glu Ala Leu Thr
1 5 10 15
Leu Val Cys Gly Glu Arg Gly Phe Phe Tyr Thr Pro Lys Thr Arg Arg
20 25 30
Glu Ala Glu Asp Leu Gln Val Gly Gln Val Glu Leu Gly Gly Gly Pro
35 40 45
Gly Ala Gly Ser Leu Gln Pro Leu Ala Leu Glu Gly Ser Leu Gln Lys
50 55 60
Arg Gly Ile Val Glu Gln Cys Cys Thr Ser Ile Cys Ser Leu Tyr Gln
65 70 75 80
Leu Glu Asn Tyr Cys Asn
85
<210> 43
<211> 258
<212> DNA
<213> Artificial Sequence
<220>
<223> Аналог 9
<400> 43
ttcgttaacc aacacttgtg tggctcacac ctggtggaag ctctctacct agtgtgcggg 60
gaacgaggct tcttctacac acccaagacc cgccgggagg cagaggacct gcaggtgggg 120
caggtggagc tgggcggggg ccctggtgca ggcagcctgc agcccttggc cctggagggg 180
tccctgcaga agcgtggcat tgtggaacaa tgctgtacca gcatctgctc cctcgcccag 240
ctggagaact actgcaac 258
<210> 44
<211> 86
<212> PRT
<213> Artificial Sequence
<220>
<223> Аналог 9
<400> 44
Phe Val Asn Gln His Leu Cys Gly Ser His Leu Val Glu Ala Leu Tyr
1 5 10 15
Leu Val Cys Gly Glu Arg Gly Phe Phe Tyr Thr Pro Lys Thr Arg Arg
20 25 30
Glu Ala Glu Asp Leu Gln Val Gly Gln Val Glu Leu Gly Gly Gly Pro
35 40 45
Gly Ala Gly Ser Leu Gln Pro Leu Ala Leu Glu Gly Ser Leu Gln Lys
50 55 60
Arg Gly Ile Val Glu Gln Cys Cys Thr Ser Ile Cys Ser Leu Ala Gln
65 70 75 80
Leu Glu Asn Tyr Cys Asn
85
<210> 45
<211> 258
<212> DNA
<213> Artificial Sequence
<220>
<223> Аналог 10
<400> 45
ttcgttaacc aacacttgtg tggctcacac ctggtggaag ctctctacct agtgtgcggg 60
gaacgaggct tcttctacac acccaagacc cgccgggagg cagaggacct gcaggtgggg 120
caggtggagc tgggcggggg ccctggtgca ggcagcctgc agcccttggc cctggagggg 180
tccctgcaga agcgtggcat tgtggaacaa tgctgtacca gcatctgctc cctcgaccag 240
ctggagaact actgcaac 258
<210> 46
<211> 86
<212> PRT
<213> Artificial Sequence
<220>
<223> Аналог 10
<400> 46
Phe Val Asn Gln His Leu Cys Gly Ser His Leu Val Glu Ala Leu Tyr
1 5 10 15
Leu Val Cys Gly Glu Arg Gly Phe Phe Tyr Thr Pro Lys Thr Arg Arg
20 25 30
Glu Ala Glu Asp Leu Gln Val Gly Gln Val Glu Leu Gly Gly Gly Pro
35 40 45
Gly Ala Gly Ser Leu Gln Pro Leu Ala Leu Glu Gly Ser Leu Gln Lys
50 55 60
Arg Gly Ile Val Glu Gln Cys Cys Thr Ser Ile Cys Ser Leu Asp Gln
65 70 75 80
Leu Glu Asn Tyr Cys Asn
85
<210> 47
<211> 258
<212> DNA
<213> Artificial Sequence
<220>
<223> Аналог 11
<400> 47
ttcgttaacc aacacttgtg tggctcacac ctggtggaag ctctcgacct agtgtgcggg 60
gaacgaggct tcttctacac acccaagacc cgccgggagg cagaggacct gcaggtgggg 120
caggtggagc tgggcggggg ccctggtgca ggcagcctgc agcccttggc cctggagggg 180
tccctgcaga agcgtggcat tgtggaacaa tgctgtacca gcatctgctc cctctaccag 240
ctggagaact actgcaac 258
<210> 48
<211> 86
<212> PRT
<213> Artificial Sequence
<220>
<223> Аналог 11
<400> 48
Phe Val Asn Gln His Leu Cys Gly Ser His Leu Val Glu Ala Leu Asp
1 5 10 15
Leu Val Cys Gly Glu Arg Gly Phe Phe Tyr Thr Pro Lys Thr Arg Arg
20 25 30
Glu Ala Glu Asp Leu Gln Val Gly Gln Val Glu Leu Gly Gly Gly Pro
35 40 45
Gly Ala Gly Ser Leu Gln Pro Leu Ala Leu Glu Gly Ser Leu Gln Lys
50 55 60
Arg Gly Ile Val Glu Gln Cys Cys Thr Ser Ile Cys Ser Leu Tyr Gln
65 70 75 80
Leu Glu Asn Tyr Cys Asn
85
<210> 49
<211> 258
<212> DNA
<213> Artificial Sequence
<220>
<223> Аналог 12
<400> 49
ttcgttaacc aacacttgtg tggctcacac ctggtggaag ctctctacct agtgtgcggg 60
gaacgaggct tcgactacac acccaagacc cgccgggagg cagaggacct gcaggtgggg 120
caggtggagc tgggcggggg ccctggtgca ggcagcctgc agcccttggc cctggagggg 180
tccctgcaga agcgtggcat tgtggaacaa tgctgtacca gcatctgctc cctctaccag 240
ctggagaact actgcaac 258
<210> 50
<211> 86
<212> PRT
<213> Artificial Sequence
<220>
<223> Аналог 12
<400> 50
Phe Val Asn Gln His Leu Cys Gly Ser His Leu Val Glu Ala Leu Tyr
1 5 10 15
Leu Val Cys Gly Glu Arg Gly Phe Asp Tyr Thr Pro Lys Thr Arg Arg
20 25 30
Glu Ala Glu Asp Leu Gln Val Gly Gln Val Glu Leu Gly Gly Gly Pro
35 40 45
Gly Ala Gly Ser Leu Gln Pro Leu Ala Leu Glu Gly Ser Leu Gln Lys
50 55 60
Arg Gly Ile Val Glu Gln Cys Cys Thr Ser Ile Cys Ser Leu Tyr Gln
65 70 75 80
Leu Glu Asn Tyr Cys Asn
85
<210> 51
<211> 258
<212> DNA
<213> Artificial Sequence
<220>
<223> Аналог 13
<400> 51
ttcgttaacc aacacttgtg tggctcacac ctggtggaag ctctctacct agtgtgcggg 60
gaacgaggct tcgagtacac acccaagacc cgccgggagg cagaggacct gcaggtgggg 120
caggtggagc tgggcggggg ccctggtgca ggcagcctgc agcccttggc cctggagggg 180
tccctgcaga agcgtggcat tgtggaacaa tgctgtacca gcatctgctc cctctaccag 240
ctggagaact actgcaac 258
<210> 52
<211> 86
<212> PRT
<213> Artificial Sequence
<220>
<223> Аналог 13
<400> 52
Phe Val Asn Gln His Leu Cys Gly Ser His Leu Val Glu Ala Leu Tyr
1 5 10 15
Leu Val Cys Gly Glu Arg Gly Phe Glu Tyr Thr Pro Lys Thr Arg Arg
20 25 30
Glu Ala Glu Asp Leu Gln Val Gly Gln Val Glu Leu Gly Gly Gly Pro
35 40 45
Gly Ala Gly Ser Leu Gln Pro Leu Ala Leu Glu Gly Ser Leu Gln Lys
50 55 60
Arg Gly Ile Val Glu Gln Cys Cys Thr Ser Ile Cys Ser Leu Tyr Gln
65 70 75 80
Leu Glu Asn Tyr Cys Asn
85
<210> 53
<211> 21
<212> PRT
<213> Homo sapiens
<400> 53
Gly Ile Val Glu Gln Cys Cys Thr Ser Ile Cys Ser Leu Tyr Gln Leu
1 5 10 15
Glu Asn Tyr Cys Asn
20
<210> 54
<211> 30
<212> PRT
<213> Homo sapiens
<400> 54
Phe Val Asn Gln His Leu Cys Gly Ser His Leu Val Glu Ala Leu Tyr
1 5 10 15
Leu Val Cys Gly Glu Arg Gly Phe Phe Tyr Thr Pro Lys Thr
20 25 30
<210> 55
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Аналог инсулина, A-цепь
<220>
<221> MISC_FEATURE
<222> (1)
<223> Xaa представляет собой аланин, глицин, глутамин, гистидин,
глутаминовую кислоту или аспарагин
<220>
<221> MISC_FEATURE
<222> (5)
<223> Xaa представляет собой аланин, глутаминовую кислоту, глутамин,
гистидин или аспарагин
<220>
<221> MISC_FEATURE
<222> (12)
<223> Xaa представляет собой аланин, серин, глутамин, глутаминовую
кислоту, гистидин или аспарагин
<220>
<221> MISC_FEATURE
<222> (14)
<223> Xaa представляет собой тирозин, гистидин, лизин, аланин или
аспарагиновую кислоту
<220>
<221> MISC_FEATURE
<222> (16)
<223> Xaa представляет собой аланин, лейцин, тирозин, гистидин,
глутаминовую кислоту или аспарагин
<220>
<221> MISC_FEATURE
<222> (19)
<223> Xaa представляет собой тирозин, глутаминовую кислоту, серин или
треонин
<220>
<221> MISC_FEATURE
<222> (21)
<223> Xaa представляет собой аспарагин, глицин, гистидин или аланин
<400> 55
Xaa Ile Val Glu Xaa Cys Cys Thr Ser Ile Cys Xaa Leu Xaa Gln Xaa
1 5 10 15
Glu Asn Xaa Cys Xaa
20
<210> 56
<211> 30
<212> PRT
<213> Artificial Sequence
<220>
<223> Аналог инсулина, B-цепь
<220>
<221> MISC_FEATURE
<222> (16)
<223> Xaa представляет собой тирозин, глутаминовую кислоту, серин,
треонин или аспарагиновую кислоту
<220>
<221> MISC_FEATURE
<222> (25)
<223> Xaa представляет собой фенилаланин, аспарагиновую кислоту или
глутаминовую кислоту
<220>
<221> MISC_FEATURE
<222> (27)
<223> Xaa представляет собой треонин или отсутствует
<220>
<221> MISC_FEATURE
<222> (28)
<223> Xaa представляет собой пролин, глутаминовую кислоту или аспарагиновую
кислоту или отсутствует
<400> 56
Phe Val Asn Gln His Leu Cys Gly Ser His Leu Val Glu Ala Leu Xaa
1 5 10 15
Leu Val Cys Gly Glu Arg Gly Phe Xaa Tyr Xaa Xaa Lys Thr
20 25 30
<---

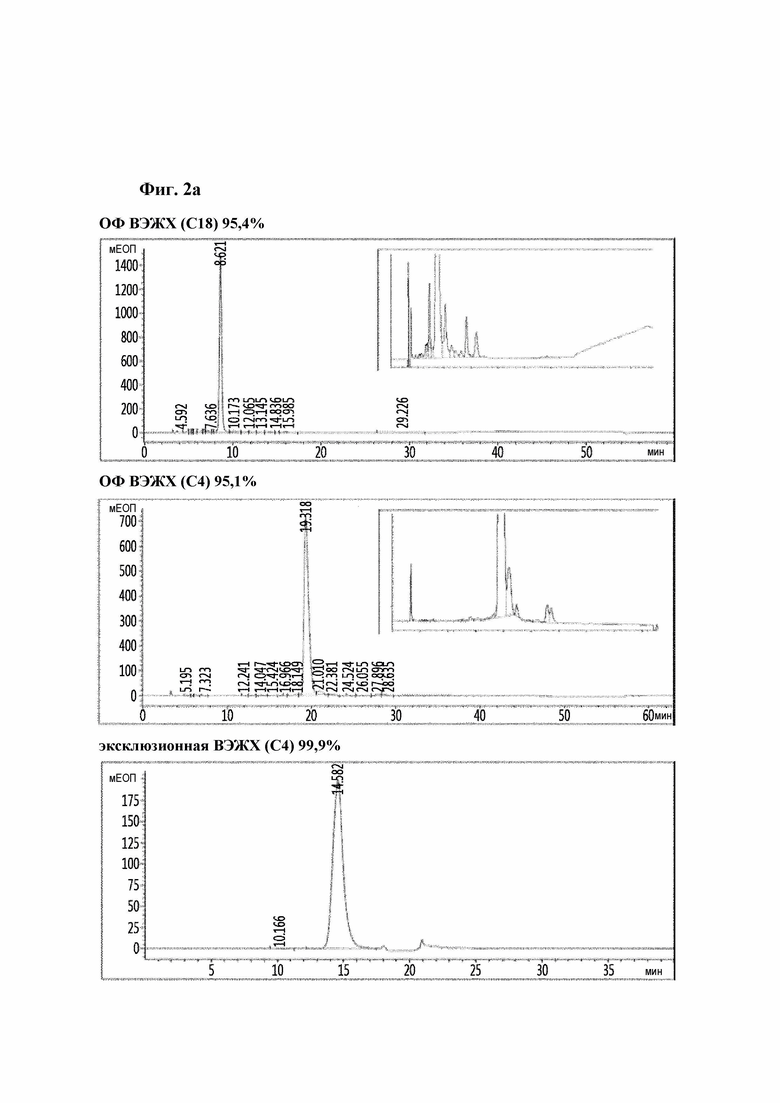
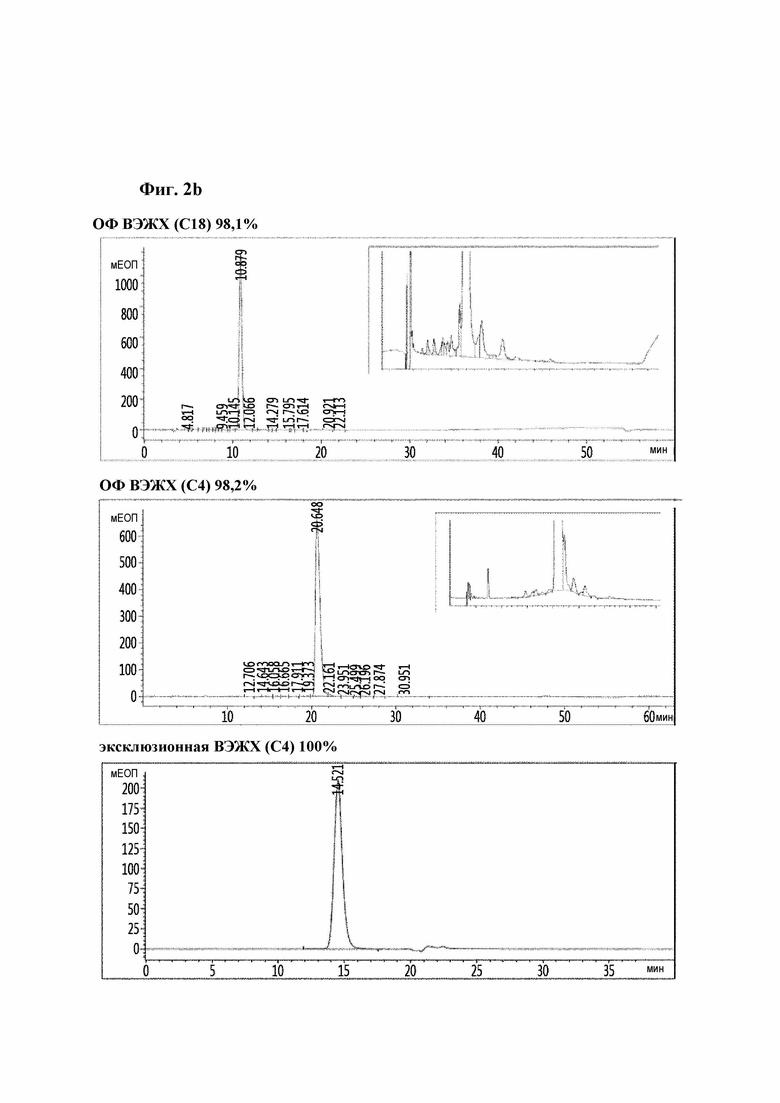
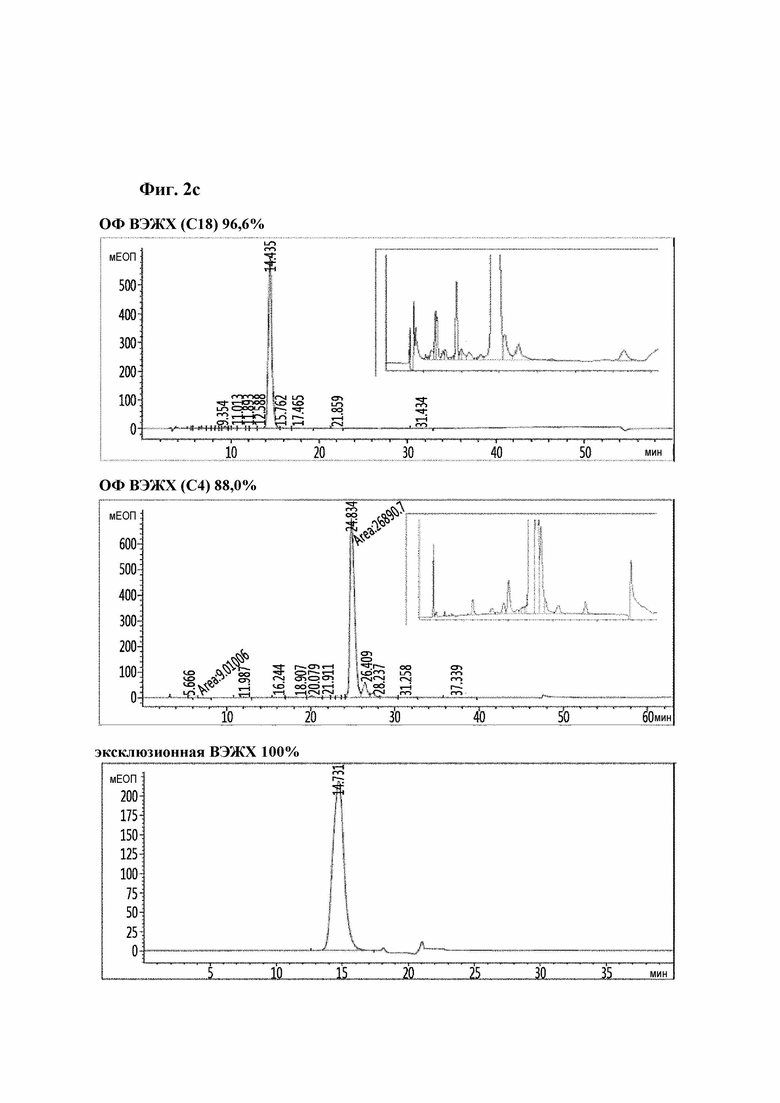
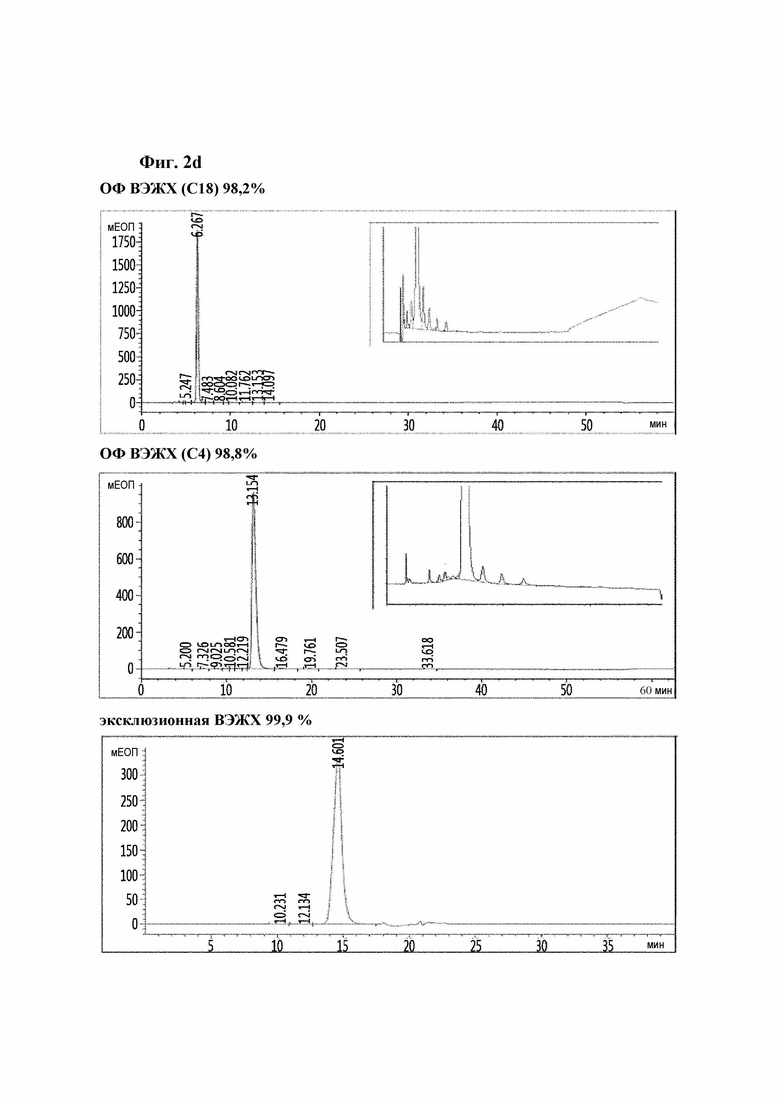
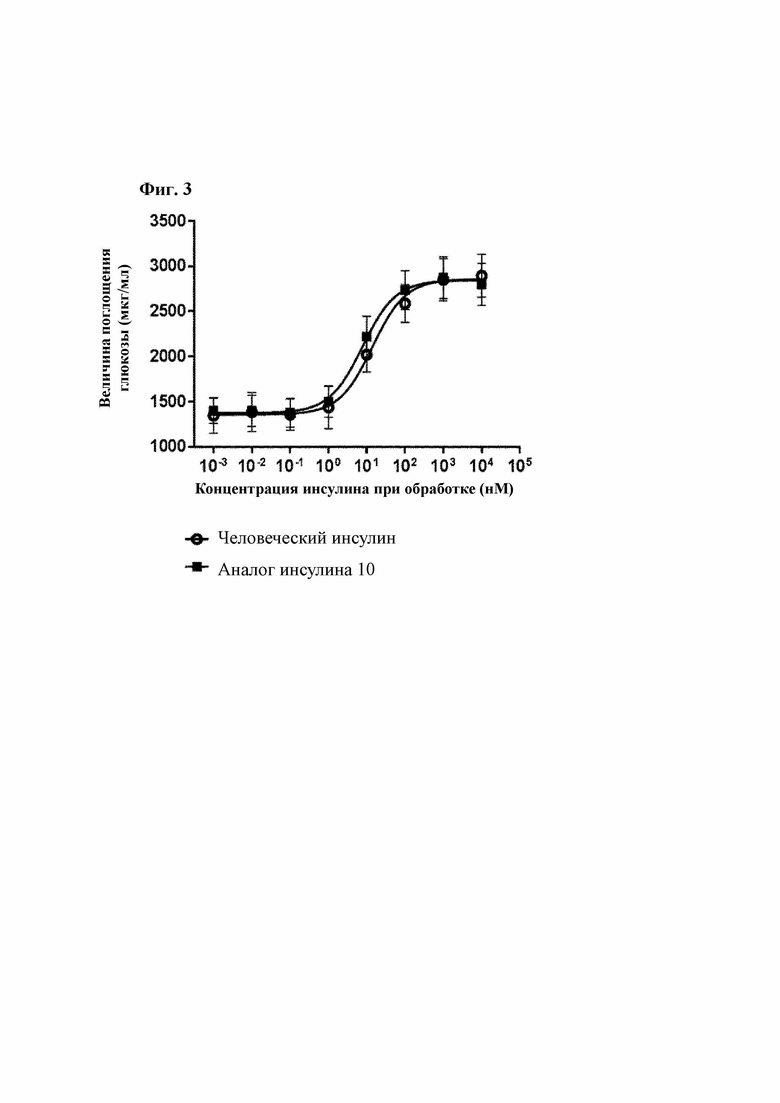
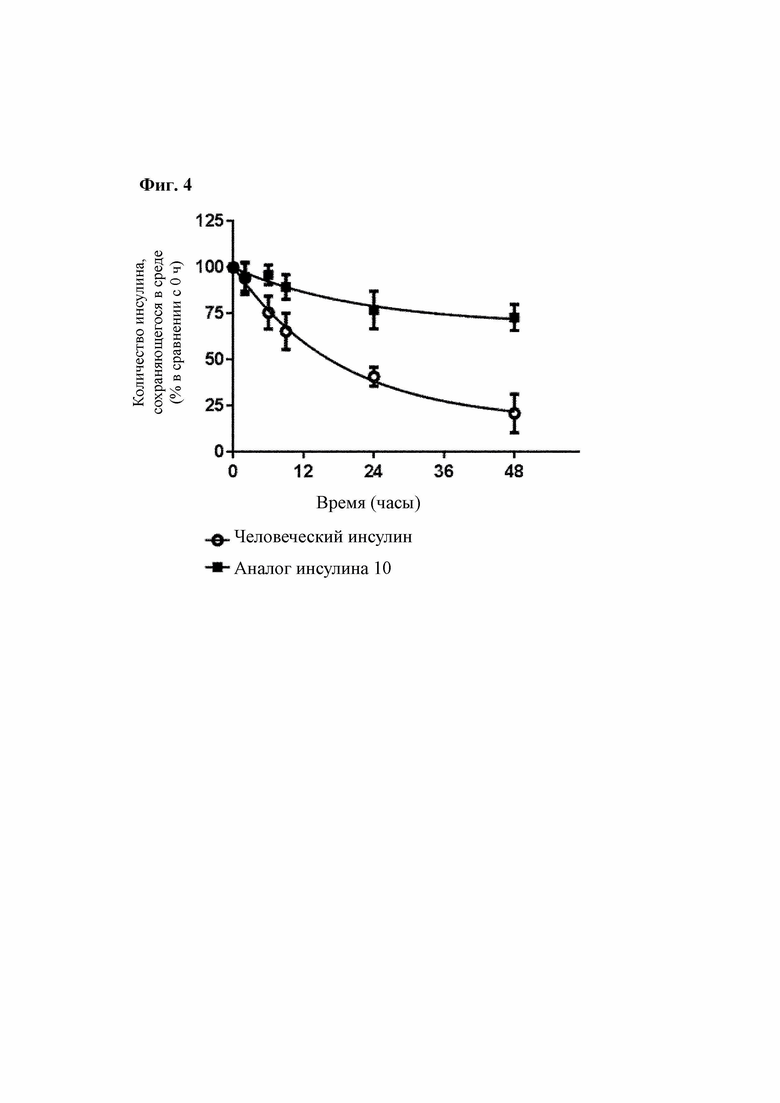
Настоящее изобретение относится к области биотехнологии, в частности к новому аналогу инсулина, и может быть использовано в медицине. Изобретение позволяет получить аналог инсулина, аминокислотная последовательность которого подразумевает по меньшей мере одну модификацию аминокислот, выбранных из группы, состоящей из 16-й аминокислоты В-цепи, 25-й аминокислоты В-цепи, 14-й аминокислоты A-цепи и 19-й аминокислоты A-цепи нативного инсулина. Такой аналог обладает сниженной аффинностью связывания по отношению к рецепторам инсулина, однако в сравнении с нативным инсулином имеет большую стабильность и увеличенное время жизни in vivo. Изобретение может быть применимо в медицинской практике при лечении субъектов, страдающих от диабета. 7 н. и 14 з.п. ф-лы, 4 табл., 4 ил., 10 пр.
1. Аналог инсулина с пониженной аффинностью связывания с рецепторами инсулина по сравнению с нативным инсулином, содержащий по меньшей мере одну модификацию в аминокислоте, выбранной из группы, состоящей из 16-й аминокислоты В-цепи, 25-й аминокислоты В-цепи, 14-й аминокислоты А-цепи и 19-й аминокислоты А-цепи нативного инсулина, где аналог инсулина
содержит А-цепь с SEQ ID NO: 55, указанную в следующей общей формуле 1, и В-цепь с SEQ ID NO: 56, указанную в следующей общей формуле 2, при условии, что пептид, в котором А-цепь соответствует SEQ ID NO: 53 и одновременно В-цепь соответствует SEQ ID NO: 54, исключен:
[общая формула 1]
Xaa1-Ile-Val-Glu-Xaa5-Cys-Cys-Thr-Ser-Ile-Cys-Xaa12-Leu-Xaa14-Gln-Xaa16-Glu-Asn-Xaa19-Cys-Xaa21 (SEQ ID NO: 55), где в общей формуле 1:
Xaa1 представляет собой аланин, глицин, глутамин, гистидин, глутаминовую кислоту или аспарагин;
Хаа5 представляет собой аланин, глутаминовую кислоту, глутамин, гистидин или аспарагин;
Хаа12 представляет собой аланин, серин, глутамин, глутаминовую кислоту, гистидин или аспарагин;
Хаа14 представляет собой тирозин, гистидин, лизин, аланин или аспарагиновую кислоту;
Хаа16 представляет собой аланин, лейцин, тирозин, гистидин, глутаминовую кислоту или аспарагин;
Хаа19 представляет собой тирозин, глутаминовую кислоту, серин или треонин; и
Хаа21 представляет собой аспарагин, глицин, гистидин или аланин; и
[общая формула 2]
Phe-Val-Asn-Gln-His-Leu-Cys-Gly-Ser-His-Leu-Val-Glu-Ala-Leu-Xaa16-Leu-Val-Cys-Gly-Glu-Arg-Gly-Phe-Xaa25-Tyr-Xaa27-Xaa28-Lys-Thr (SEQ ID NO: 56),
где в общей формуле 2:
Хаа16 представляет собой тирозин, глутаминовую кислоту, серин, треонин или аспарагиновую кислоту;
Хаа25 представляет собой фенилаланин, аспарагиновую кислоту или глутаминовую кислоту;
Хаа27 представляет собой треонин или отсутствует; и
Хаа28 представляет собой пролин, глутаминовую кислоту или аспарагиновую кислоту или отсутствует.
2. Аналог инсулина по п. 1, содержащий А-цепь с SEQ ID NO: 55, указанную в общей формуле 1, и В-цепь с SEQ ID NO: 54.
3. Аналог инсулина по п. 1, содержащий А-цепь с SEQ ID NO: 53 и В-цепь с SEQ ID NO: 56, указанную в общей формуле 2.
4. Аналог инсулина по п. 1,
где в общей формуле 1:
Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Хаа12 представляет собой серин, Xaa14 представляет собой тирозин, гистидин, лизин, аланин или аспарагиновую кислоту, Xaa16 представляет собой лейцин, Xaa19 представляет собой тирозин, глутаминовую кислоту, серин или треонин, и Хаа21 представляет собой аспарагин; и
в общей формуле 2:
Хаа16 представляет собой тирозин, глутаминовую кислоту, серин, треонин или аспарагиновую кислоту, Хаа25 представляет собой фенилаланин, аспарагиновую кислоту или глутаминовую кислоту, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин.
5. Аналог инсулина по п. 1, где в общей формуле 1:
Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Хаа12 представляет собой серин, Хаа14 представляет собой тирозин, Xaa16 представляет собой лейцин, Xaa19 представляет собой тирозин, глутаминовую кислоту или серин, и Хаа21 представляет собой аспарагин; и
в общей формуле 2:
Хаа16 представляет собой тирозин, глутаминовую кислоту, серин или аспарагиновую кислоту, Хаа25 представляет собой фенилаланин, аспарагиновую кислоту или глутаминовую кислоту, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин.
6. Аналог инсулина по п. 1, где:
(1) в общей формуле 1, Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Хаа12 представляет собой серин, Хаа14 представляет собой гистидин, Хаа16 представляет собой лейцин, Хаа19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 2, Xaa16 представляет собой тирозин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(2) в общей формуле 1, Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Хаа12 представляет собой серин, Хаа14 представляет собой лизин, Хаа16 представляет собой лейцин, Хаа19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 2, Хаа16 представляет собой тирозин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(3) в общей формуле 1, Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Хаа12 представляет собой серин, Хаа14 представляет собой тирозин, Хаа16 представляет собой лейцин, Хаа19 представляет собой глутаминовую кислоту, и Хаа21 представляет собой аспарагин; и в общей формуле 2, Хаа16 представляет собой тирозин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(4) в общей формуле 1, Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Xaa14 представляет собой тирозин, Хаа16 представляет собой лейцин, Хаа19 представляет собой серин, и Хаа21 представляет собой аспарагин; и в общей формуле 2, Хаа16 представляет собой тирозин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(5) в общей формуле 1, Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Хаа12 представляет собой серин, Хаа14 представляет собой тирозин, Хаа16 представляет собой лейцин, Хаа19 представляет собой треонин, и Хаа21 представляет собой аспарагин; и в общей формуле 2, Хаа16 представляет собой тирозин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(6) в общей формуле 1, Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Xaa14 представляет собой тирозин, Хаа16 представляет собой лейцин, Хаа19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 2, Xaa16 представляет собой глутаминовую кислоту, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(7) в общей формуле 1, Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Xaa14 представляет собой тирозин, Хаа16 представляет собой лейцин, Хаа19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 2, Xaa16 представляет собой серин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(8) в общей формуле 1, Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Xaa14 представляет собой тирозин, Хаа16 представляет собой лейцин, Хаа19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 2, Хаа16 представляет собой треонин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(9) в общей формуле 1, Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Хаа12 представляет собой серин, Xaa14 представляет собой аланин, Хаа16 представляет собой лейцин, Хаа19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 2, Xaa16 представляет собой тирозин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(10) в общей формуле 1, Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Хаа12 представляет собой серин, Хаа14 представляет собой аспарагиновую кислоту, Хаа16 представляет собой лейцин, Хаа19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 2, Хаа16 представляет собой тирозин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(11) в общей формуле 1, Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Xaa14 представляет собой тирозин, Хаа16 представляет собой лейцин, Хаа19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 2, Xaa16 представляет собой аспарагиновую кислоту, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин;
(12) в общей формуле 1, Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Xaa14 представляет собой тирозин, Хаа16 представляет собой лейцин, Хаа19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 2, Xaa16 представляет собой тирозин, Хаа25 представляет собой аспарагиновую кислоту, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин; и
(13) в общей формуле 1, Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Xaa14 представляет собой тирозин, Хаа16 представляет собой лейцин, Хаа19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 2, Xaa16 представляет собой тирозин, Хаа25 представляет собой глутаминовую кислоту, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин.
7. Аналог инсулина по п. 1, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50 и 52.
8. Аналог инсулина по п. 1, где
в общей формуле 1, Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Хаа14 представляет собой тирозин, Хаа16 представляет собой лейцин, Хаа19 представляет собой глутаминовую кислоту, и Хаа21 представляет собой аспарагин; и в общей формуле 2, Xaa16 представляет собой тирозин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин.
9. Аналог инсулина по п. 1, где
в общей формуле 1, Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Хаа14 представляет собой тирозин, Хаа16 представляет собой лейцин, Хаа19 представляет собой серин, и Хаа21 представляет собой аспарагин; и в общей формуле 2, Xaa16 представляет собой тирозин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин.
10. Аналог инсулина по п. 1, где
в общей формуле 1, Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Хаа14 представляет собой тирозин, Хаа16 представляет собой лейцин, Хаа19 представляет собой треонин, и Хаа21 представляет собой аспарагин; и в общей формуле 2, Хаа16 представляет собой тирозин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин.
11. Аналог инсулина по п. 1, где
в общей формуле 1, Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Хаа12 представляет собой серин, Хаа14 представляет собой аспарагиновую кислоту, Хаа16 представляет собой лейцин, Хаа19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 2, Xaa16 представляет собой тирозин, Хаа25 представляет собой фенилаланин, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин.
12. Аналог инсулина по п. 1, где
в общей формуле 1, Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Хаа14 представляет собой тирозин, Хаа16 представляет собой лейцин, Хаа19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 2, Хаа16 представляет собой тирозин, Хаа25 представляет собой аспарагиновую кислоту, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин.
13. Аналог инсулина по п. 1, где:
в общей формуле 1, Xaa1 представляет собой глицин, Хаа5 представляет собой глутамин, Xaa12 представляет собой серин, Хаа14 представляет собой тирозин, Хаа16 представляет собой лейцин, Хаа19 представляет собой тирозин, и Хаа21 представляет собой аспарагин; и в общей формуле 2, Хаа16 представляет собой тирозин, Хаа25 представляет собой глутаминовую кислоту, Хаа27 представляет собой треонин, и Хаа28 представляет собой пролин.
14. Выделенная нуклеиновая кислота, кодирующая аналог инсулина по любому из пп. 1-13.
15. Рекомбинантный экспрессионный вектор, содержащий нуклеиновую кислоту по п. 14.
16. Клетка-хозяин для продуцирования аналога инсулина, содержащая рекомбинантный экспрессионный вектор по п. 15.
17. Клетка-хозяин по п. 16, представляющая собой Е. coli.
18. Способ получения аналога инсулина по любому из пп. 1-13, включающий:
а) экспрессию аналога инсулина путем культивирования клетки-хозяина по п. 16 или 17; и
б) выделение и очистку экспрессированного аналога инсулина.
19. Способ получения аналога инсулина по п. 18, где выделение и очистка включают:
б-1) получение клетки-хозяина из культуры на стадии а) и ее измельчение;
б-2) извлечение экспрессированного аналога из измельченного клеточного лизата с последующим его рефолдингом;
б-3) очистку подвергнутого рефолдингу аналога инсулина посредством катионообменной хроматографии;
б-4) обработку очищенного аналога инсулина трипсином и карбоксипептидазой В; и
б-5) последовательную очистку обработанного аналога инсулина путем катионообменной хроматографии и анионообменной хроматографии или обращенно-фазовой хроматографии.
20. Фармацевтическая композиция для лечения диабета, содержащая аналог инсулина по любому из пп. 1-13 в качестве активного ингредиента в эффективном количестве.
21. Способ лечения диабета, включающий введение субъекту, нуждающемуся в этом, аналога инсулина по любому из пп. 1-13 или композиции по п. 20.
| WO 2016006963A1, 14.01.2016 | |||
| WO 2015199511A1, 30.12.2015 | |||
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| АНАЛОГИ ИНСУЛИНА, УСТОЙЧИВЫЕ К ПРОТЕАЗАМ | 2007 |
|
RU2524150C2 |
Авторы
Даты
2022-01-14—Публикация
2017-09-22—Подача