Область техники, к которой относится изобретение
Настоящее изобретение относится к новым соединениям с препятствующими ожирению и гипохолестеринемическими свойствами, их производным, их аналогам, их таутомерным формам, их стереоизомерам, их полиморфам, их фармацевтически приемлемым солям, их фармацевтически приемлемым сольватам и фармацевтически приемлемым составам, содержащим их. Более конкретно, настоящее изобретение относится к новым β-арил-α-оксизамещенным алкилкарбоновым кислотам общей формулы (1), их производным, их аналогам, их таутомерным формам, их стереоизомерам, их полиморфам, их фармацевтически приемлемым солям, их фармацевтически приемлемым сольватам и фармацевтически приемлемым составам, содержащим их.
Настоящее изобретение относится также к способу получения упомянутых выше новых соединений, их производных, их аналогов, их таутомерных форм, их стереоизомеров, их полиморфов, их фармацевтически приемлемых солей, их фармацевтически приемлемых сольватов и фармацевтически приемлемых составов, содержащих их.
Соединения по настоящему изобретению снижают общий холестерин (ТС); увеличивают уровень липопротеина высокой плотности (HDL) и снижают уровень липопротеина низкой плотности (LDL), которые оказывают благоприятное воздействие на ишемическую болезнь сердца и атеросклероз.
Соединения общей формулы (I) применимы для снижения веса тела и для лечения и/или профилактики таких заболеваний, как гипертензия, ишемическая болезнь сердца, атеросклероз, удар, поражения периферических сосудов и родственных нарушений. Эти соединения применимы для лечения семейной гиперхолестеринемии, гипертриглицеридемии, снижения атерогенных липопротеинов, VLDL (липопротеина очень низкой плотности) и LDL. Соединения по настоящему изобретению могут применяться для лечения некоторых почечных заболеваний, включая гломерулонефрит, гломерулосклероз, нефротический синдром, гепертензивный нефросклероз, ретинопатию и нефропатию. Соединения общей формулы (I) применимы также для лечения и/или профилактики инсулиновой резистентности (диабета типа 2), лептиновой резистентности, нарушенной глюкозной толерантности, дислипидемии, нарушений, связанных с синдромом X, таких, как гипертензия, ожирение, инсулиновая резистенция, поражение коронарной артерии и другие сердечно-сосудистые заболевания. Эти соединения могут также применяться в качестве ингибиторов альдозоредуктазы, для улучшения познавательной функции при деменции, для лечения диабетических осложнений, осложнений, связанных с ативацией клеточного эндотелия, псориаза, поликистозного синдрома яичников (PCOS), воспалительных заболеваний брюшной полости, остеопороза, мышечной дистрофии, панкреатита, атеросклероза, ксантомы и для лечения рака. Соединения по настоящему изобретению применимы для лечения и/или профилактики упомянутых выше заболеваний в комбинации/совместном применении с одним или несколькими ингибиторами HMG-CoA [(DL-3-гидрокси-3-метилглутарил)-коэнзима-А] и/или гиполипидемическими/гиполипопротеинемическими агентами, такими, как производные фибриновой кислоты, никотиновой кислоты, холестериламина, колестипола или пробукола.
Уровень техники
Атеросклероз и другие заболевания периферических сосудов являются основной причиной, воздействующей на качество жизни миллионов людей. Поэтому большое внимание уделяется пониманию этиологии гиперхолестеринемии и гиперлипидемии и созданию эффективной терапевтической стратегии.
Гиперхолестеринемия определяется как уровень холестерина в плазме, превышающий произвольно установленное значение, названное “нормальным” уровнем. Недавно было принято, что “идеальные” уровни холестерина в плазме намного ниже “нормального” уровня холестерина у обычной популяции, и опасность поражения коронарной артерии (CAD) возрастает по мере увеличения уровня холестерина выше “оптимального” (или “идеального”) значения. Существует совершенно четкая зависимость причина-эффект между гиперхолестеринемией и CAD, особенно для пациентов с множественными факторами риска. Большая часть холестерина присутствует в этерифицированной форме с различными липопротеинами, такими, как липопротеин низкой плотности (LDL), липопротеин промежуточной плотности (IDL), липопротеин высокой плотности (HDL) и частично как липопротеин очень низкой плотности (VLDL). Исследования четко указывают на то, что существует обратная корреляция между CAD, атеросклерозом и концентрациями HDL-холестерина (Stampfer и др., N. Engl. J. Med. 325 (1991), 373-381), и опасность CAD увеличивается с увеличением уровней LDL и VLDL.
При CAD в сонной, коронарной и церабральной артериях обычно находят “жирные полоски”, которые вначале представляют собой свободный и этерифицированный холестерин. Miller и др. (Br. Med. J., 282 (1981), 1741-1744) показали, что увеличение числа частиц HDL может уменьшить количество участков стеноза в коронарных артериях человека, и высокий уровень HDL-холестерина может защитить от прогрессирования атеросклероза. Picardo и др. (Arteriosclerosis, 6 (1986), 434-441) показали с помощью эксперимента in vitro, что HDL способен удалять холестерин из клеток. Они предположили, что HDL может лишать ткани избытка холестерина и переносить его в печень (Macikinnon и др., J. Biol. Chem., 261 (1986), 2548-2552). Следовательно, соединения, увеличивающие уровень HDL-холестерина, были бы терапевтически значимы для лечения гиперхолестеринемии и поражений коронарных артерий (CAD).
Ожирение является заболеванием, широко распространенным в обществе изобилия и в развивающемся мире, и составляет основную причину заболеваемости и смертности. Ожирение является состоянием накопления избыточного жира тела. Причины ожирения не выяснены. Считается, что они могут быть генетического происхождения или провоцироваться взаимодействием между генотипом и окружающей средой. Независимо от причины, результатом является отложение жира вследствие дисбаланса между поглощением энергии и ее расходом. Диета, физические упражнения и подавления аппетита были частью лечения ожирения. Необходима эффективная терапия для того, чтобы победить эту болезнь, поскольку она может привести к ишемической болезни сердца, диабету, удару, гиперлипидемии, подагре, остеоартриту, сниженной фертильности и многим другим психологическим и социальным проблемам.
Диабет и инсулиновая резистентность являются еще одним заболеванием, которое оказывает тяжелое воздействие на качество жизни большого количества людей в мире. Инсулиновая резистентность означает сниженную способность инсулина проявлять свое биологическое действие в широком интервале концентраций. При инсулиновой резистентности для компенсации этого дефекта организм секретирует аномально высокие количества инсулина; в отсутствие эффекта неизбежно поднимается уровень глюкозы в плазме, приводя к выраженному диабету. Для развитых стран сахарный диабет является общей проблемой и ассоциируется с различными аномалиями, включая ожирение, гипертензию, гиперлипидемию (J. din. Invest., (1985) 75:809-817; N. Engl. J. Med., (1987) 317:350-357; J. Clin. Endocrinol. Metab, (1988) 66:580-583; J. Clin. Invest., (1975) 68:957-969) и почечные осложнения (см. международную заявку на патент 95/21608). Сейчас становится все более очевидным, что инсулиновая резистентность и соответственная гиперинсулинемия вносят вклад в ожирение, гипертензию и сахарный диабет типа 2. Связь инсулиновой резистентности с ожирением, гипертензией и стенокардией описана как синдром, включающий инсулиновую резистентность в качестве центрального патогенного звена синдрома X.
Гиперлипидемия является первопричиной сердечно-сосудистого заболевания (CVD) и других заболеваний периферических сосудов. Высокий риск CVD связывают с более высоким уровнем LDL (липопротеина низкой плотности) и VLDL (липопротеина очень низкой плотности), наблюдаемым при гиперлипидемии. Пациенты, у которых, помимо гиперлипидемии, наблюдается непереносимость глюкозы/инсулиновая резистентность, имеют повышенный риск CVD. Многочисленные исследования прошлых лет показали, что снижение уровня триглицеридов плазмы и общего холестерина, в частности, LDL и VLDL и увеличение уровня HDL (липопротеина высокой плотности) способствует предупреждению сердечно-сосудистых заболеваний.
Пероксисомальные пролиферативные активированные рецепторы (PPAR) являются членами ядерного суперсемейства рецепторов. Изоформа γ (PPARγ) вовлечена в регуляцию дифференцировки адипоцитов (Endocrinology, (1994) 135:798-800) и гомеостаз энергии (Cell, (1995) 83:803-812), тогда как изоформа α (PPARα) опосредует окисление жирных кислот (Trend. Endocrin. Metab., (1993) 4:291-296), приводя тем самым к снижению количества циркулирующей в плазме жирной кислоты (Current Biol., (1995) 5:618-621). Показано, что агонисты PPARα применимы для лечения ожирения (международная заявка WO 97/36579). Недавно раскрыты сведения о существовании синергизма для молекул, которые являются агонистами как PPARα, так и PPARγ, и предложено их применение для лечения синдрома Х (международная заявка WO 97/25042). Подобный синергизм наблюдался для инсулинового сенсибилизатора (агониста PPARγ) и ингибитора HMG-CoA-редуктазы, который может применяться для лечения атеросклероза и ксантомы (Европейский патент 0753298).
Известно, что PPARγ играет важную роль в дифференцировке адипоцитов (Cell, (1996) 87, 377-389). Активации PPAR с помощью лиганда достаточно для того, чтобы вызвать полную терминальную дифференцировку (Cell, (1994) 79, 1147-1156), включая остановку клеточного цикла. Рецептор PPARγ согласованно экспрессируется в некоторых клетках, и активация этого ядерного рецептора его агонистами стимулировала бы терминальную дифференцировку предшественников адипоцитов и вызывала морфологические и молекулярные изменения, характерные для более дифференцированного, менее злокачественного состояния (Molecular Cell, (1998), 465-470); Carcinogenesis, (1998), 1949-1953; Proc. Natl. Acad. Sci., (1997) 94, 237-241), и ингибировала экспрессию ткани рака простаты (Cancer Research (1998), 58:3344-3352). Это могло бы найти применение в лечении некоторых видов рака, при которых экспрессируется PPARγ, и привести к достаточно нетоксичной химиотерапии.
Лептиновая резистентность является состоянием, при котором клетки-мишени не способны отвечать на сигнал лептина. Это может привести к ожирению вследствие избытка поглощаемой пищи и сниженного расхода энергии и вызвать нарушение переносимости глюкозы, диабет типа 2, сердечно-сосудистые заболевания и другие подобные взаимосвязанные осложнения. Kallen и др. (Proc. Natl. Acad. Ci., (1996) 93, 5793-5796) сообщили, что инсулиновые сенсибилизаторы, действие которых, возможно, связано с экспрессией агонистов PPAR, снижают вследствие этого концентрации лептина в плазме. Однако, недавно было сообщено, что соединения, обладающие инсулин-сенсибилизирующим свойством, обладают также и лептин-сенсибилизирующей активностью. Они снижают концентрации лептина, циркулирующего в плазме, путем улучшения ответа клетки-мишени на лептин (международная заявка WO 98/02159).
Сообщено, что некоторые арилгидроксипропионовые кислоты, их производные и их аналоги применимы для лечения гипергликемии и гиперхолестеринемии. Некоторые из описанных в этой области знаний соединений приведены ниже:
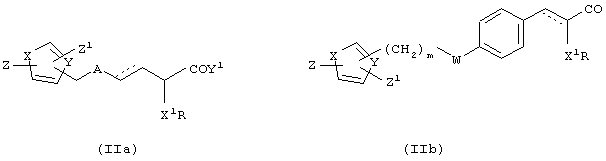
i) патент США 5306726, международная заявка WO 91/19702 раскрывают несколько производных 3-арил-2-гидроксипропионовых кислот общей формулы (IIа) и (IIb) в качестве гиполипидемических и гипогликемических агентов.
Примеры таких соединений представлены формулами (IIс) и (IId):
ii) международные заявки на патент WO 95/03038 и WO 96/04260 раскрывают соединения формулы (IIе):
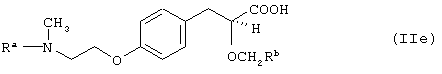
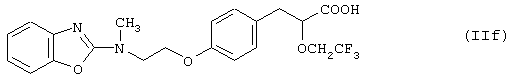
где Ra означает 2-бензоксазолил или 2-пиридил, и Rb означает трифторметил, метоксиметил или метил. Типичным примером является (S)-3-[4-[2-[N-(2-бензоксазолил)-N-метиламино]этокси]фенил]-2-(2,2,2-трифторэтокси)пропановая кислота (IIf):
iii) международные заявки на патент WO 94/13650, WO 94/01420 раскрывают соединения общей формулы (IIg):
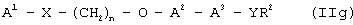
где А1 означает ароматический гетероцикл, А2 означает замещеное бензольное кольцо, и А3 означает остаток формулы (CH2)m-CH-(OR1), где R1 означает алкильные группы, m означает целое число; Х означает замещенный или незамещенный атом азота; Y означает карбонил (С=O) или тиокарбонил (C=S); R2 означает OR3, где R3 может быть алкильной, аралкильной или арильной группой; n означает целое число в интервале 2-6. Пример этих соединений представлен формулой (IIh):

Сущность изобретения
С целью создания новых соединений для снижения уровня холестерина и уменьшения веса тела с полезными эффектами при лечении и/или профилактике болезней, связанных с повышенными уровнями липидов, атеросклероза, поражений коронарной артерии, синдрома X, нарушенной глюкозной толерантности, инсулиновой резистентности, инсулиновой резистентности, приводящей к диабету типа 2, и осложнений, вызываемых диабетом, для лечения заболеваний, при которых инсулиновая резистентность является патофизиологическим механизмом, для лечения гипертензии, атеросклероза и повреждений коронарной артерии, осуществляемого с большей эффективностью, возможностями и меньшей токсичностью, заявители сконцентрировали свои усилия на создании новых соединений, эффективных в лечении упомянутых выше заболеваний. Усилия в этом направлении привели к соединениям, имеющим общую формулу (I).
Следовательно, основной целью настоящего изобретения является получение новых арилоксизамещенных алкилкарбоновых кислот, их производных, их аналогов, их таутомерных форм, их стереоизомеров, их полиморфов, их фармацевтически приемлемых солей, их фармацевтически приемлемых сольватов и содержащих их фармацевтически приемлемых составов или их смесей.
Другой целью настоящего изобретения является обеспечение новых арилоксизамещенных алкилкарбоновых кислот, их производных, их аналогов, их таутомерных форм, их стереоизомеров, их полиморфов, их фармацевтически приемлемых солей, их фармацевтически приемлемых сольватов и содержащих их фармацевтически приемлемых составов или их смесей, которые могут обладать агонистической активностью в отношении PPARα и/или PPARγ и, возможно (необязательно), ингибировать HMG-CoA-редуктазу наряду с агонистической активностью в отношении PPARα и/или PPARγ.
Другой целью настоящего изобретения является обеспечение новых арилоксизамещенных алкилкарбоновых кислот, их производных, их аналогов, их таутомерных форм, их стереоизомеров, их полиморфов, их фармацевтически приемлемых солей, их фармацевтически приемлемых сольватов и содержащих их фармацевтически приемлемых составов, или их смесей, имеющих повышенную активность, без проявления токсичности или со сниженным токсическим эффектом.
Еще одной целью настоящего изобретения является способ получения новых арилоксизамещенных алкилкарбоновых кислот формулы (I), их производных, их аналогов, их таутомерных форм, их стереоизомеров, их полиморфов, их фармацевтически приемлемых солей, их фармацевтически приемлемых сольватов.
Еще одной целью настоящего изобретения является обеспечение фармацевтических составов, содержащих соединения общей формулы (I), их аналоги, их производные, их таутомерные формы, их стереоизомеры, их полиморфы, их соли, сольваты и другие средства, обычно используемые при получении таких составов.
Другой целью настоящего изобретения является обеспечение новых промежуточных соединений, способа получения и использования этих промежуточных соединений в процессах получения β-арил-α-оксизамещенных алкилкарбоновых кислот формулы (I), их производных, их аналогов, их таутомерных форм, их стереоизомеров, их полиморфов, их солей и их фармацевтически приемлемых сольватов.
Подробное описание изобретения
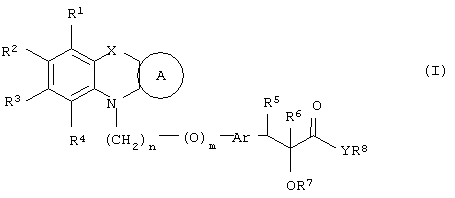
α-Оксизамещенные пропионовые кислоты, их производные и их аналоги по настоящему изобретению имеют общую формулу (I)
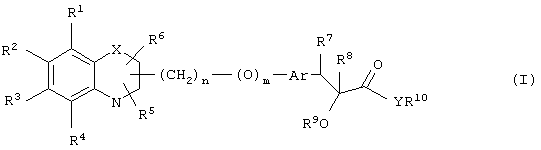
где группы R1, R2, R3, R4 и группы R5 и R6, когда они присоединены к атому углерода, могут быть одинаковыми или разными и означают водород, галоид, гидрокси, нитро, циано, формил или, необязательно, замещенные группы, выбранные из алкила, циклоалкила, алкокси, циклоалкокси, арила, арилокси, аралкила, аралкокси, гетероциклила, гетероарила, гетероаралкила, гетероарилокси, гетероаралкокси, ацила, ацилокси, гидроксиалкила, амино, ациламино, алкиламино, ариламино, аралкиламино, аминоалкила, алкоксикарбонила, арилоксикарбонила, аралкоксикарбонила, алкоксиалкила, арилоксиалкила, аралкоксиалкила, алкилтио, тиоалкила, алкоксикарбониламино, арилоксикарбониламино, аралкоксикарбониламино, карбоновой кислоты либо ее производных или сульфоновой кислоты либо ее производных; один или оба заместителя R5 и R6 могут также означать оксогруппу, если они присоединены к атому углерода, R5 и R6, если они присоединены к атому азота, означают водород, гидрокси, формил или, необязательно замещенные группы, выбранные из алкила, циклоалкила, алкокси, циклоалкокси, арила, аралкила, гетероциклила, гетероарила, гетероаралкила, ацила, ацилокси, гидроксиалкила, амино, ациламино, алкиламино, ариламино, аралкиламино, аминоалкила, арилокси, аралкокси, гетероарилокси, гетероаралкокси, алкоксикарбонила, арилоксикарбонила, аралкоксикарбонила, алкоксиалкила, арилоксиалкила, аралкоксиалкила, алкилтио, тиоалкила, производных карбоновой кислоты или производных сульфоновой кислоты; Х означает гетероатом, выбранный из кислорода, серы или NR11, где R11 выбран из водорода или, необязательно, замещенных групп, выбранных из алкильной, циклоалкильной, арильной, аралкильной, ацильной, алкоксикарбонильной, арилалкоксикарбонильной или аралкоксикарбонильной групп; Аr означает необязательно замещенную двухвалентную одинарную или конденсированную ароматическую или гетероциклическую группу; R7 означает атом водорода, гидрокси, алкокси, галоид, низший алкил, необязательно замещенную аралкильную группу или образует связь вместе со смежной группой R8; R8 означает водород, гидрокси, алкокси, галоид, низшую алкильную группу, ацил или необязательно замещенный аралкил или R8 образует связь вместе с R7; R9 означает водород или необязательно замещенные группы, выбранные из алкильной, циклоалкильной, арильной, аралкильной, алкоксиалкильной, алкоксикарбонильной, арилоксикарбонильной, алкиламинокарбонильной, ариламинокарбонильной, ацильной, гетероциклильной, гетероарильной или гетероаралкильной групп; R10 означает водород или необязательно замещенные группы, выбранные из алкильной, циклоалкильной, арильной, аралкильной, гетероциклильной, гетероарильной или гетероаралкильной групп; Y означает кислород или NR12, где R12 означает водород, алкильную, арильную, гидроксиалкильную, аралкильную, гетероциклильную, гетероарильную или гетероаралкильную группы; R10 и R12 вместе могут образовать пяти- или шестичленную циклическую структуру, содержащую атомы углерода, которая, необязательно содержит один или несколько гетероатомов, выбранных из кислорода, серы или азота; связывающая группа, представленная формулой -(CH2)n-(O)m-, может быть присоединена или через атом азота, или через атом углерода, n целое означает число, изменяющееся в интервале 1-4, и m означает целое число от 0 до 1.
Соответствующие группы, представленные R1-R4, и группы R5 и R6, если они присоединены к атому углерода, могут быть выбраны из атома водорода, атома галоида, такого, как фтор, хлор, бром или иод; гидрокси, циано, нитро, формила; замещенной или незамещенной (С1-C12)-алкильной группы, особенно линейной или разветвленной (С1-С6)-алкильной группы, такой, как метил, этил, н-пропил, изопропил, н-бутил, изобутил, н-пентил, изопентил, гексил и тому подобное; цикло(С3-С6)алкильной группы, такой, как циклопропил, циклобутил, циклопентил, циклогексил и тому подобное, циклоалкильная группа может быть замещенной; цикло(С3-С6)алкоксигруппы, такой, как циклопропилокси, циклобутилокси, циклопентилокси, циклогексилокси и тому подобное, циклоалкоксигруппа может быть замещенной; арильной группы, такой, как фенил или нафтил, арильная группа может быть замещенной; аралкильной группы, такой, как бензильная или фенетильная, С6Н5СН2СН2СН2, нафтилметильная и тому подобное, аралкильная группа может быть замещенной, и замещенная аралкильная группа означает такую группу, как CH3C6H4CH2, Наl-С6Н4СН2, СН3ОС6H4СН2, СН3ОС6Н4СН2СН2 и тому подобное; гетероарильной группы, такой, как пиридил, тиенил, фурил, пирролил, оксазолил, тиазолил, имидазолил, оксадиазолил, тетразолил, бензопиранил, бензофуранил и тому подобное, гетероарильная группа может быть замещенной; гетероциклильных групп, таких, как азиридинил, пирролидинил, морфолинил, пиперидинил, пиперазинил и тому подобное, гетероциклильная группа может быть замещенной; аралкоксигруппы, такой, как бензилокси, фенетилокси, нафтилметилокси, фенилпропилокси и тому подобное, аралкоксигруппа может быть замещенной, гетероаралкильной группы, такой, как фуранметил, пиридинметил, оксазолметил, оксазолэтил и тому подобное, гетероаралкильная группа может быть замещенной; аралкиламиногруппы, такой, как С6Н5CH2NН, С6Н5СН2CH2NH, C6H5CH2NCH3 и тому подобное, которые могут быть замещенными; алкоксикарбонила, такого, как метоксикарбонил, этоксикарбонил и тому подобное, которые могут быть замещенными; арилоксикарбонильной группы, такой, как необязательно замещенный феноксикарбонил, нафтилоксикарбонил и тому подобное; аралкоксикарбонильной группой, такой, как бензилоксикарбонил, фенетилоксикарбонил, нафтилметоксикарбонил и тому подобное, которые могут быть замещенными; (C1-С6)-алкиламиногруппы, такой, как NНСН3, NНС2Н5, NНС3Н7, NHC6H13 и тому подобное, которые могут быть замещенными; (С1-С6)-диалкиламиногруппы, такой, как N(СН3)2, NCH3(C2H5), N(С2Н5)2 и тому подобное, которые могут быть замещенными; алкоксиалкильной группы, такой, как метоксиметил, этоксиметил, метоксиэтил, этоксиэтил и тому подобное, которые могут быть замещенными; арилоксиалкильной группы, такой, как С6Н5OСН2, С6Н5OСН2СН2, нафтилоксиметил и тому подобное, которые могут быть замещенными; аралкоксиалкильной группы, такой, как С6H5СН2ОСН2, С6Н5СН2ОСН2СН2 и тому подобное, которые могут быть замещенными; гетероарилокси и гетероаралкокси, где гетероарильная часть имеет приведенное ранее значение и может быть замещенной; арилоксигруппы, такой, как фенокси, нафтилокси и тому подобное, арилоксигруппа может быть замещенной; ариламиногруппы, такой, как HNC6H5, NCH3(C6H5), NНС6H4-Наl и тому подобное, которые могут быть замещенными; аминогруппы, которая может быть замещенной; амино(С1-С6)-алкила, который может быть замещенным; гидрокси(С1-С6)-алкила, который может быть замещенным; (С1-С6)-алкоксигруппы, такой, как метокси, этокси, пропилокси, бутилокси, изопропилокси и тому подобное, которые могут быть замещенными; тио(С1-С6)-алкила, который может быть замещенным; (С1-С6)алкилтиогруппы, которая может быть замещенной; ацильной группы, такой, как ацетил, пропионил или бензоил и тому подобное, ацильные группы могут быть замещенными; ациламиногруппы, такой, как NHCOCH3, NHCOC2H5, NНСОС3Н7, NHCOC6H5 и тому подобное, которые могут быть замещенными; аралкоксикарбониламиногруппы, такой, как NHСООСН2С6Н5, NHCOOCH2CH2C6H5, N(СН3)СООСН2С6Н5, N(С2Н5)СООСН2С6Н5, NHCOOCH2C6H4CH3, NHCOOCH2C6H4OCH3 и тому подобное, которые могут быть замещенными; арилоксикарбониламиногруппы, такой, как NНСООС6Н5, NCH3COOC6H5, NC2H5СООС6Н5, NНСООС6H4CH3, NHСООС6Н4OСН3 и тому подобное, которые могут быть замещенными; алкоксикарбониламиногруппы, такой, как NHCOOC2H5, NНСООСН3 и тому подобное, которые могут быть замещены; карбоновой кислоты или ее производных, таких, как амиды, подобные CONH2, CONHMe, CONMe2, CONHEt, CONEt2, CONHPh и тому подобное, которые могут быть замещенными; ацилоксигруппы, такой, как СООМе, COOEt, COOPh и тому подобное, которые могут быть замещенными; сульфоновой кислоты или ее производных, таких, как SO2NH2, SO2NHMe, SO2NMe2, SO2NHCF3 и тому подобное, производные сульфоновых кислот могут быть замещенными. Один или оба заместителя R5 и R6 могут также быть оксогруппой.
Если группы, обозначенные R1-R4, и группы R5 и R6 соединены с углеродным атомом и замещены, то заместители могут быть выбраны из галоида, гидрокси или нитро либо из необязательно замещенных групп, выбранных из алкильной, циклоалкильной, алкокси, циклоалкокси, аралкокси, арильной, аралкильной, аралкоксиалкильной, гетероциклильной, гетероарильной, гетероаралкильной, ацильной, ацилокси, гидроксиалкильной, амино, ациламино, ариламино, аминоалкильной, арилокси, алкоксикарбонильной, алкиламино, алкоксиалкильной, алкилтио, тиоалкильной групп, карбоновой кислоты, либо ее производных или сульфоновой кислоты либо ее производных.
Предпочтительно, чтобы заместители при R1-R6 были атомом галоида, таким, как фтор, хлор, бром; алкильной группой, такой, как метил, этил, изопропил, н-пропил, н-бутил; циклоалкильной группой, такой, как циклопропил; арильной группой, такой, как фенил; аралкильной группой, такой, как бензил; (С1-С3)-алкокси, бензилокси, гидроксигруппой, ацильной или ацилоксигруппами.
Соответствующие заместители R5 и R6, если они присоединены к атому азота, выбирают из водорода, гидрокси, формила; замещенной или незамещенной (С1-С12)-алкильной группы, особенно линейной или разветвленной (C1-С6)-алкильной группы, такой, как метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет.-бутил, н-пентил, изопентил, гексил и тому подобное; цикло(С3-С6)-алкильной группы, такой, как циклопропил, циклобутил, циклопентил, циклогексил и тому подобное, циклоалкильная группа может быть замещенной; цикло(С3-С6)-алкоксигруппы, такой, как циклопропилокси, циклобутилокси, циклопентилокси, циклогексилокси и тому подобное, циклоалкоксигруппа может быть замещенной; арильной группы, такой, как фенил, нафтил и тому подобное; арильная группа может быть замещенной; аралкильной группы, такой, как бензил или фенетил, C6H5CH2CH2CH2, нафтилметил и тому подобное, аралкильная группа может быть замещенной, и замещенная аралкильная группа означает такую группу, как СН3С6Н4СН2, Hal-С6Н4СН2, СН3ОС6Н4СН2, СН3ОС6H4СH2СН2 и тому подобное; гетероарильной группы, такой, как пиридил, тиенил, фурил, пирролил, оксазолил, тиазолил, имидазолил, оксадиазолил, тетразолил, бензопиранил, бензофуранил и тому подобное, гетероарильная группа может быть замещенной, гетероциклильных групп, таких, как азиридинил, пирролидинил, морфолинил, пиперидинил, пиперазинил и тому подобное, гетероциклильная группа может быть замещенной; аралкоксигруппы, такой, как бензилокси, фенетилокси, нафтилметилокси, фенилпропилокси и тому подобное, аралкоксигруппа может быть замещенной; гетероаралкильной группы, такой, как фуранметил, пиридинметил, оксазолметил, оксазолэтил и тому подобное, гетероаралкильная группа может быть замещенной; аралкиламиногруппы, такой, как C6H5CH2NH2, С6Н5СН2СН2NН2, C6H5CH2NCH3 и тому подобное, которые могут быть замещенными; алкоксикарбонила, такого, как метоксикарбонил, этоксикарбонил и тому подобное, которые могут быть замещенными; арилоксикарбонильной группы, такой, как необязательно замещенный феноксикарбонил, нафтилоксикарбонил и тому подобное; аралкоксикарбонильной группы, такой, как бензилоксикарбонил, фенетилоксикарбонил, нафтилметоксикарбонил и тому подобное, которые могут быть замещенными; (С1-С6)-алкиламиногруппы, такой, как NНСН3, N(СН3)2, NСН3(C2H5), NHC2H5, NHC3H7, NHC6H13 и тому подобное, которые могут быть замещенными; алкоксиалкильной группы, такой, как метоксиметил, этоксиметил, метоксиэтил, этоксиэтил и тому подобное, которые могут быть замещенными; арилоксиалкильной группы, такой, как С6Н5OСН2, С6Н5ОСН2СН2, нафтилоксиметил и тому подобное, которые могут быть замещенными; аралкоксиалкильной группы, такой, как С6Н5СН2OСН2, С6Н5СН2OСН2СН2 и тому подобное, которые могут быть замещенными; гетероарилокси и гетероаралкокси, где гетероарильная часть имеет приведенное ранее значение и может быть замещенной; арилоксигруппы, такой, как фенокси, нафтилокси и тому подобное, арилоксигруппа может быть замещенной; ариламиногруппы, такой, как НNС6Н5, NСН3(С6Н5), NНС6H4СН3, NНС6H4-Hаl и тому подобное, которые могут быть замещенными; аминогруппы, которая может быть замещенной; амино(С1-С6)-алкила, который может быть замещенным; гидрокси(С1-С6)-алкила, который может быть замещенным; (С1-С6)-алкоксигруппы, такой, как метокси, этокси, пропилокси, бутилокси, изопропилокси и тому подобное, которые могут быть замещенными, тио(С1-С6)-алкила, который может быть замещенным; (С1-С6)алкилтиогруппы, которая может быть замещенной; ацильной группы, такой, как ацетил, пропионил, бензоил и тому подобное, ацильная группа может быть замещенной; ациламиногрупп, таких, как NHCOCH3, NHCOC2H5, NHCOC3H7, NНСОС6Н5 и тому подобное, которые могут быть замещенными; производными карбоновой кислоты, такими, как амиды, как CONH2, CONHMe, CONMe2, CONHEt, CONEt2, CONHPh и тому подобное, производные карбоновых кислот могут быть замещенными; ацилокси группы, такой, как ООСМе, OOCEt, OOCPh и тому подобное, которые могут быть замещенными; производными сульфоновой кислоты, такими, как SO2NH2, SO2NHMe, SO2NMe2, SO2NHCF3 и тому подобное, производные сульфоновых кислот могут быть замещенными.
Если группы, обозначенные R5 и R6, соединены с атомом азота и являются замещенными, то предпочтительные заместители могут быть выбраны из галоида, такого, как фтор, хлор; гидрокси, ацильной, ацилокси или аминогруппы.
Соответствующий заместитель Х включает кислород, серу или группу NR11, обозначенную выше, предпочтительно кислород и серу. Соответствующий заместитель R11 означает водород, (С1-С6)-алкильную, (С3-С6)-циклоалкильную, арильную группу, такую, как фенил или нафтил, аралкильную группу, такую, как бензил или фенетил; ацильную группу, такую, как ацетил, пропаноил, бутироил, бензоил и тому подобное; (С1-С6)-алкоксикарбонил; арилоксикарбонил, такой, как феноксикарбонил, СН3ОС6H4ОСО, Наl-С6Н4OСО, СН3С6H4ОСО, нафтилоксикарбонил и тому подобное; аралкоксикарбонил, такой, как бензилоксикарбонил, фенетилоксикарбонил и тому подобное; группы, обозначенные R11, могут быть замещенными или незамещенными. Если группы, обозначенные R11, являются замещенными, то заместители могут быть выбраны из галоида, необязательно галоидированного низшего алкила, гидрокси и необязательно галоидированных (С1-С3)алкоксигрупп.
Предпочтительно, чтобы группа, обозначенная Аr, была замещенной или незамещенной и выбиралась из двухвалентного фенилена, нафтилена, пиридила, хинолинила, бензофуранила, дигидробензофурила, бензопиранила, дигидробензопиранила, индолила, индолинила, азаиндолила, азаиндолинила, пиразолила, бензотиазолила, бензоксазолила и тому подобного. Заместители в группе, обозначенной Аr, могут быть выбраны из линейного или разветвленного необязательно галоидированного (С1-С6)-алкила, необязательно галоидированного (С1-С3)-алкоксила, галоида, ацила, амино, ациламино, тиогруппы или карбоновой либо сульфоновой кислот или их производных.
Более предпочтительно, чтобы Аr означал замещенную или незамещенную двухвалентную фениленовую, нафтиленовую, бензофуранильную, индолильную, индолинильную, хинолинильную, азаиндолильную, азаиндолинильную, бензотиазолильную или бензоксазолильную группы.
Еще более предпочтительно, чтобы Аr означал двухвалентную фениленовую или бензофуранильную группу, которая, необязательно замещена метильной, галоидметильной, метоксильной или галоидметоксильной группами.
Соответствующий R7 включает водород, низшие алкильные группы, такие, как метил, этил или пропил; гидрокси, (С1-С3)-алкоксигруппу; атом галоида, такой, как фтор, хлор, бром, иод; аралкил, такой, как бензил, фенетил, который, необязательно замещен, или R7 вместе с R8 означает связь.
Соответствующий R8 может быть водородом, низшими алкильными группами, такими, как метил, этил или пропил; гидрокси, (С1-С3)-алкоксигруппой; атомом галоида, таким, как фтор, хлор, бром, иод; ацильной группой, такой, как линейная или разветвленная (С2-С10)-ацильная группа, такая, как ацетил, пропаноил, бутаноил, пентаноил, бензоил и тому подобное; аралкилом, таким, как бензил, фенетил, который, необязательно замещен, или вместе с R7 образует связь.
Соответствующие группы, обозначенные R9, могут быть выбраны из водорода, линейного или разветвленного (С1-С16)-алкила, предпочтительно из (C1-С12)-алкильной группы, такой, как метил, этил, н-пропил, изопропил, н-бутил, изобутил, пентил, гексил, октил и тому подобное; (С3-С7)-циклоалкильной группы, такой, как циклопропил, циклобутил, циклопентил, циклогексил и тому подобное, циклоалкильная группа может быть замещенной; арильной группы, такой, как фенил, нафтил, арильная группа может быть замещенной; гетероарильной группы, такой, как пиридил, тиенил, фурил и тому подобное, гетероарильная группа может быть замещенной; гетероаралкильной группы, такой, как фуранметил, пиридинметил, оксазолметил, оксазолэтил и тому подобное, гетероаралкильная группа может быть замещенной; аралкильной группы, такой, как бензил и фенетил и тому подобное, где алкильная часть может содержать 1-6 атомов углерода, где арильная часть может быть замещенной; гетероциклильной группы, такой, как азиридинил, пирролидинил, пиперидинил и тому подобное, гетероциклильная группа может быть замещенной; (С1-С6)алкокси(С1-С6)-алкильной группы, такой, как метоксиметил, этоксиметил, метоксиэтил, этоксипропил и тому подобное, алкоксиалкильная группа может быть замещенной; линейной или разветвленной (С2-С16)-ацильной группы, такой, как ацетил, пропаноил, бутаноил, бензоил, октаноил, деканоил и тому подобное, которые могут быть замещенными; (C1-С6)-алкоксикарбонила, алкильная группа может быть замещенной; арилоксикарбонила, такого, как феноксикарбонил, нафтилоксикарбонил и тому подобное, арильная группа может быть замещенной; (С1-С6)-алкиламинокарбонила, алкильная группа может быть замещенной; ариламинокарбонила, такого, как PhNHCO, нафтиламинокарбонил и тому подобное, арильная часть может быть замещенной. Заместители могут быть выбраны из галоида, гидроксигруппы или необязательно замещенных групп, выбранных из алкильной, циклоалкильной, алкокси, циклоалкокси, арильной, аралкильной, аралкоксиалкильной, гетероциклильной, гетероарильной, гетероаралкильной, ацильной, ацилокси, гидроксиалкильной, амино, ациламино, ариламино, аминоалкильной, арилокси, алкоксикарбонильной, алкиламино, алкоксиалкильной, алкилтио, тиоалкильной групп, карбоновой кислоты либо ее производных или сульфоновой кислоты либо ее производных.
Соответствующие группы, обозначенные R10, могут быть выбраны из водорода, линейного или разветвленного (С1-С16)-алкила, предпочтительно из (C1-С12)-алкильной группы, такой, как метил, этил, н-пропил, изопропил, н-бутил, изобутил, пентил, гексил, октил и тому подобное; (С3-С7)-циклоалкильной группы, такой, как циклопропил, циклопентил, циклогексил и тому подобное, циклоалкильная группа может быть замещенной, арильной группы, такой, как фенил, нафтил и тому подобное, арильная группа может быть замещенной; гетероарильной группы, такой, как пиридил, тиенил, фурил и тому подобное, гетероарильная группа может быть замещенной; гетероаралкильной группы, такой, как фуранметил, пиридинметил, оксазолметил, оксазолэтил и тому подобное, гетероаралкильная группа может быть замещенной; аралкильной группы, такой, как бензил и фенетил и тому подобное, аралкильная группа может быть замещенной, и гетероциклильной группы, такой как азиридинил, пирролидинил, пиперидинил и тому подобное, гетероциклильная группа может быть замещенной. Заместители при R10 могут быть выбраны из той же группы, что R1-R6.
Соответствующие группы, обозначенные R12, могут быть выбраны из водорода, линейного или разветвленного (С1-С16)-алкила, предпочтительно из (C1-С12)-алкила; гидрокси(С1-С6)-алкила; арильной группы, такой, как фенил, нафтил и тому подобное; аралкильной группы, такой, как бензил, фенетил и тому подобное; гетероциклильной группы, такой, как азиридинил, пирролидинил, пиперидинил и тому подобное; гетероарильной группы, такой, как пиридил, тиенил, фурил и тому подобное, и гетероаралкильной группы, такой, как фуранметил, пиридинметил, оксазолметил, оксазолэтил и тому подобное.
Соответствующие кольцевые структуры, образованные R10 и R12 вместе, могут быть выбраны из пирролидинила, пиперидинила, морфолинила, пиперазинила и тому подобного.
Соответствующим m является целое число, изменяющееся в интервале 0-1. Предпочтительно, что при m=0 Аr означает двухвалентную бензофуранильную, бензоксазолильную, бензтиазолильную, индолильную, индолинильную, дигидробензофурильную или дигидробензпиранильную группу, и при m=1 Аr означает замещенные или незамещенные группы, выбранные из двухвалентного фенилена, нафтилена, пиридила, хинолинила, бензфуранила, дигидробензфурила, бензпиранила, дигидробензпиранила, индолила, индолинила, азаиндолила, азаиндолинила, пиразолила, бензтиазолила, бензоксазолила и тому подобного.
Соответствующим n является число, изменяющееся в интервале 1-4, предпочтительно n означает 1 или 2.
Предпочтительно, чтобы при m=1 n означал 2.
Предпочтительно также, чтобы при m=0 n означал 1.
Фармацевтически приемлемые соли, составляющие часть данного изобретения, включают соли по остатку карбоновой кислоты с такими щелочными металлами, как литий, натрий и калий, щелочно-земельными металлами, как кальций и магний, с органическими основаниями, такими, как лизин, аргинин, гуанидин, диэтаноламин, холин и тому подобное, аммонием или замещенным аммонием и соли с алюминием. В тех случаях, когда это возможно, соли могут также образовываться при присоединении кислоты с образованием сульфатов, нитратов, фосфатов, перхлоратов, боратов, гидрогалоидов, ацетатов, тартратов, малеатов, цитратов, сукцинатов, пальмоатов, метансульфонатов, бензоатов, салицилатов, гидроксинафтоатов, бензолсульфонатов, аскорбатов, глицерофосфатов, кетоглутаратов и тому подобного. Фармацевтически приемлемые сольваты могут быть гидратами или содержащими другие растворители кристаллизации, такие, как спирты.
Особо полезные соединения по настоящему изобретению включают:
этил-(Е/Z)-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропеноат;
(±)метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропаноат;
(+)метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропаноат;
(-)метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропаноат;
этил-(Е/Z)-3-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]метилбензофуран-5-ил]-2-этоксипропеноат;
этил-(Е/Z)-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропеноат;
(±)метил-3-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)метилбензофуран-5-ил]-2-этоксипропаноат;
(+)метил-3-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)метилбензофуран-5-ил]-2-этоксипропаноат;
(-)метил-3-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)метилбензофуран-5-ил]-2-этоксипропаноат;
(±)метил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропаноат;
(+)метил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропаноат;
(-)метил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропаноат;
(±)метил-2-метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропаноат;
(+)метил-2-метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропаноат;
(-)метил-2-метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропаноат;
(±)метил-2-(2-фторбензил)-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропаноат;
(+)метил-2-(2-фторбензил)-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропаноат;
(-)метил-2-(2-фторбензил)-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропаноат;
этил-(Е/Z)-3-[4-[2-(3-оксо-2Н-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропеноат;
(±)метил-3-[4-[2-(3-оксо-2Н-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропаноат;
(+)метил-3-[4-[2-(3-оксо-2Н-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропаноат;
(-)метил-3-[4-[2-(3-оксо-2Н-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропаноат;
этил-(Е/Z)-3-[6-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]нафтил]-2-этоксипропеноат;
(±)метил-3-[6-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]нафтил]-2-этоксипропаноат;
(+)метил-3-[6-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]нафтил]-2-этоксипропаноат;
(-)метил-3-[6-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]нафтил]-2-этоксипропаноат;
этил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-гидроксипропаноат;
этил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-гидроксипропаноат;
этил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-бензилоксипропаноат;
этил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-бутоксипропаноат;
этил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-гексилоксипропаноат;
этил-(Е/Z)-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-феноксипропеноат;
(±)метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-феноксипропаноат;
(+)метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-феноксипропаноат;
(-)метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-феноксипропаноат;
этил-(Е/Z)-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-феноксипропеноат;
(±)метил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-феноксипропаноат;
(+)метил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-феноксипропаноат;
(-)метил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-феноксипропаноат;
этил-(Е/Z)-3-[4-(4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метоксифенил]-2-этоксипропеноат;
(±)метил-3-[4-(4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метоксифенил]-2-этоксипропаноат;
(+)метил-3-[4-(4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метоксифенил]-2-этоксипропаноат;
(-)метил-3-[4-(4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метоксифенил]-2-этоксипропаноат;
этил-(Е/Z)-3-[4-(4-бензил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метоксифенил]-2-этоксипропеноат;
(±)метил-3-[4-(4-бензил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метоксифенил]-2-этоксипропаноат;
(+)метил-3-[4-(4-бензил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метоксифенил]-2-этоксипропаноат;
(-)метил-3-[4-(4-бензил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метоксифенил]-2-этоксипропаноат;
(±)3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропановую кислоту и ее соли;
(+)3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропановую кислоту и ее соли;
(-)3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропановую кислоту и ее соли;
(±)3-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)метилбензофуран-5-ил]-2-этоксипропановую кислоту и ее соли;
(+)3-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)метилбензофуран-5-ил]-2-этоксипропановую кислоту и ее соли;
(-)3-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)метилбензофуран-5-ил]-2-этоксипропановую кислоту и ее соли;
(±)3-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)метилбензофуран-5-ил]-2-этоксипропановую кислоту и ее соли;
(+)3-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)метилбензофуран-5-ил]-2-этоксипропановую кислоту и ее соли;
(-)3-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)метилбензофуран-5-ил]-2-этоксипропановую кислоту и ее соли;
(±)3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропановую кислоту и ее соли;
(+)3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропановую кислоту и ее соли;
(-)3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропановую кислоту и ее соли;
(±)3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропанамид;
(+)3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропанамид;
(-)3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропанамид;
(±)N-метил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропанамид;
(+)N-метил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропанамид;
(-)N-метил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропанамид;
(±)3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропанамид;
(+)3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропанамид;
(-)3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропанамид;
(±)N-метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропанамид;
(+)N-метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропанамид;
(-)N-метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропанамид;
(±)N-бензил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропанамид;
(+)N-бензил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропанамид;
(-)N-бензил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропанамид;
(±)N-бензил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропанамид;
(+)N-бензил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропанамид,
(-)N-бензил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропанамид;
2-метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропановую кислоту и ее соли;
2-(2-фторбензил)-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропановую кислоту и ее соли;
(±)3-[4-[2-(3-оксо-2Н-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропановую кислоту и ее соли;
(+)3-[4-[2-(3-оксо-2Н-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропановую кислоту и ее соли;
(-)3-[4-[2-(3-оксо-2Н-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропановую кислоту и ее соли;
(±)3-[4-[2-(3-оксо-2Н-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропановую кислоту и ее соли;
(+)3-[4-[2-(3-оксо-2Н-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропановую кислоту и ее соли;
(-)3-[4-[2-(3-оксо-2Н-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропановую кислоту и ее соли;
(±)3-[6-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]нафтил]-2-этоксипропановую кислоту и ее соли;
(+)3-[6-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]нафтил]-2-этоксипропановую кислоту и ее соли;
(-)3-[6-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]нафтил]-2-этоксипропановуто кислоту и ее соли;
(±)3-[6-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]нафтил]-2-этоксипропановую кислоту и ее соли;
(+)3-[6-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]нафтил]-2-этоксипропановую кислоту и ее соли;
(-)3-[6-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]нафтил]-2-этоксипропановую кислоту и ее соли;
(±)3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-гидроксипропановую кислоту и ее соли;
(+)3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-гидроксипропановую кислоту и ее соли;
(-)3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-гидроксипропановую кислоту и ее соли;
(±)3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-гидроксипропановую кислоту и ее соли;
(+)3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-гидроксипропановую кислоту и ее соли;
(-)3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-гидроксипропановую кислоту и ее соли;
(±)3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-бензилоксипропановую кислоту и ее соли;
(+)3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-бензилоксипропановую кислоту и ее соли;
(-)3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-бензилоксипропановую кислоту и ее соли;
(±)3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-бутоксипропановую кислоту и ее соли;
(+)3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-бутоксипропановую кислоту и ее соли;
(-)3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-бутоксипропановую кислоту и ее соли;
(±)3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-гексилоксипропановую кислоту и ее соли;
(+)3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-гексилоксипропановую кислоту и ее соли;
(-)3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-гексилоксипропановую кислоту и ее соли;
(±)3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-феноксипропановую кислоту и ее соли;
(+)3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-феноксипропановую кислоту и ее соли;
(-)3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-феноксипропановую кислоту и ее соли;
(±)3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-феноксипропановую кислоту и ее соли;
(+)3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-феноксипропановую кислоту и ее соли;
(-)3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-феноксипропановую кислоту и ее соли;
(±)метил-2-метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-феноксипропаноат;
(+)метил-2-метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-феноксипропаноат;
(-)метил-2-метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-феноксипропаноат;
(±)2-метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-феноксипропановую кислоту и ее соли;
(+)2-метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-феноксипропановую кислоту и ее соли;
(-)2-метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-феноксипропановую кислоту и ее соли;
(±)метил-2-метил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-феноксипропаноат;
(+)метил-2-метил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-феноксипропаноат;
(-)метил-2-метил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-феноксипропаноат;
(±)2-метил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-феноксипропановую кислоту и ее соли,
(+)2-метил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-феноксипропановую кислоту и ее соли;
(-)2-метил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-феноксипропановую кислоту и ее соли;
(±)4-нитрофенил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропаноат,
(+)4-нитрофенил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропаноат;
(-)4-нитрофенил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропаноат;
(±)3-[4-(4-бензил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метоксифенил]-2-этоксипропановую кислоту и ее соли;
(+)3-[4-(4-бензил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метоксифенил]-2-этоксипропановую кислоту и ее соли;
(-)3-[4-(4-бензил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метоксифенил]-2-этоксипропановую кислоту и ее соли;
(±)4-нитрофенил-3-[4-(4-бензил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метоксифенил]-2-этоксипропаноат;
(+)4-нитрофенил-3-[4-(4-бензил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метоксифенил]-2-этоксипропаноат;
(-)4-нитрофенил-3-[4-(4-бензил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метоксифенил]-2-этоксипропаноат.
В соответствии с отличительным признаком настоящего изобретения соединение общей формулы (I), где R7 и R8 вместе образуют связь, Y означает атом кислорода, R1, R2, R3, R4, R5, R6, R9, R10, X, n, m и Аr имеют описанные ранее обозначения, может быть получено по одному из следующих путей, показанных на схеме I.
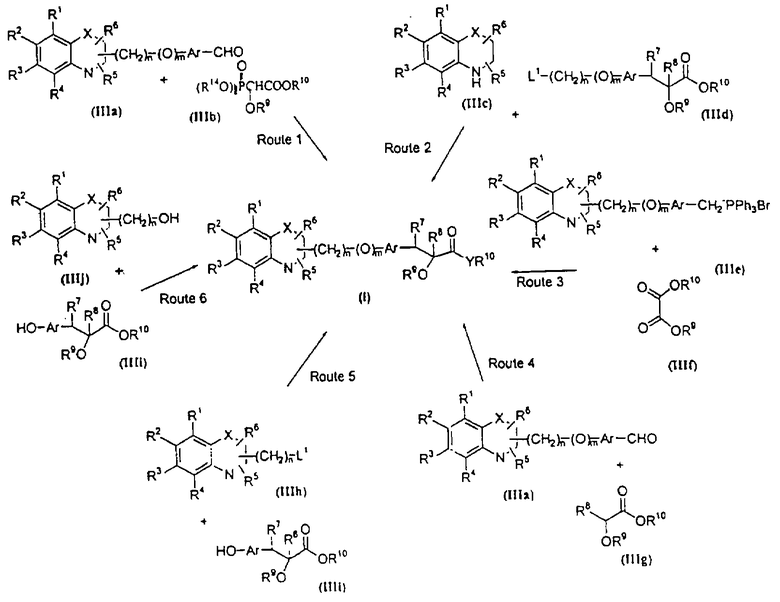
Путь (1): реакция соединения общей формулы (IIIa), где все символы обозначены ранее, с соединением формулы (IIIb), где R9, R10 обозначены ранее и R14 означает (С1-С6)-алкил, с образованием соединения общей формулы (I), где R7, R8 вместе означают связь, Y означает атом кислорода, может быть эффективно осуществлена в присутствии основания, такого, как гидрид щелочного металла, как гидрид натрия либо гидрид калия, или литийорганических соединений, как метиллитий, бутиллитий и тому подобное, или алкоксидов, таких, как метилат натрия (NaOMe), этилат натрия (NaOEt), бутилат калия (K+BuO-) или их смеси. Реакция может быть осуществлена в присутствии растворителей, таких, как тетрагидрофуран (THF), диоксан, диметилформамид (DMF), диметилсульфоксид (DMSO), диметоксиэтан (DME) и тому подобное, или их смесей. В качестве со-растворителя может использоваться гексаметилфосфамид (НМРА). Температура реакции может меняться в интервале от -78°С до 50°С, предпочтительно в интервале от -10°С до 30°С. Реакция более эффективна в безводных условиях. Соединение общей формулы (IIIb) может быть получено в соответствии с процедурой, описанной в литературе (Annalen Chemie, (1996) 53, 699).
Путь (2): реакция соединения общей формулы (IIIс), где все символы обозначены ранее, с соединением общей формулы (IIId), где R7, R8 вместе означают связь, и где все символы обозначены ранее, и L1 означает уходящую группу, такую, как атом галоида, n-толуолсульфонат, метансульфонат, трифторметансульфонат и тому подобное, предпочтительно атом галоида, с образованием соединения общей формулы (I), приведенной выше, может быть осуществлена в присутствии растворителей, таких, как DMSO, DMF, DME, THF, диоксан, эфир и тому подобное, или их смесей. Реакция может осуществляться в инертной атмосфере, которая может устанавливаться с использованием инертного газа, такого, как азот, аргон или гелий. Реакция может осуществляться в присутствии основания, такого, как щелочь, как гидроксид натрия, гидроксид калия; карбонаты щелочных металлов, как карбонат натрия или карбонат калия; гидриды щелочных металлов, такие, как гидрид натрия или гидрид калия; металлоорганические основания, такие, как н-бутиллитий; амиды щелочных металлов, как амид натрия, или их смеси. Количество основания может меняться в интервале от 1 до 5 эквивалентов, в зависимости от количества соединения формулы (IIIс), предпочтительно количество основания изменяется от 1 до 3 эквивалентов. Могут добавляться межфазные катализаторы, такие, как тетраалкиламмонийгалоид или тетраалкиламмонийгидроксид. Реакция может осуществляться при температуре в интервале от 0°С до 150°С, предпочтительно при температуре от 15°С до 100°С. Продолжительность реакции может изменяться в интервале от 0.25 часа до 48 часов, предпочтительно от 0.25 часа до 12 часов.
Путь (3): реакция соединения общей формулы (IIIе), где все символы определены ранее, с соединением формулы (IIIf), где R9=R10 и обозначены ранее, с образованием соединения формулы (I), где R7 и R8 вместе означают связь, может быть осуществлена без растворителя в присутствии основания, такого, как гидриды щелочных металлов, как гидрид натрия, гидрид калия или литийорганические соединения, как метиллитий, бутиллитий и тому подобное, или алкоксидов, как метилат натрия, этилат натрия, бутилат калия и тому подобное, или их смеси. Реакция может осуществляться в присутствии апротонных растворителей, таких, как THF, диоксан, DMF, DMSO, DME и тому подобное, или их смесей. В качестве со-растворителя может использоваться НМРА. Температура реакции может меняться в интервале от -78°С до 100°С, предпочтительно в интервале от -10°С до 50°С.
Путь (4): реакция соединения общей формулы (IIIa), где все символы определены ранее, с соединением формулы (IIIg), где R8 означает атом водорода, R9 и R10 обозначены ранее, может быть осуществлена в присутствии основания. Природа основания не является существенной. Может использоваться любое основание, применяемое обычно в реакции альдольной конденсации; могут быть использованы такие основания, как гидриды металлов, как гидрид натрия или гидрид калия; алкоксиды металлов, как метилат натрия, бутилат калия или этилат натрия; амиды металлов, как амид лития или диизопропиламид лития. Реакция может осуществляться в присутствии апротонных растворителей, таких, как THF, эфир или диоксан. Реакция может осуществляться в инертной атмосфере, которая может устанавливаться с использованием инертного газа, такого, как азот, аргон или гелий, и реакция более эффективна в безводных условиях. Температура может быть в интервале от -80°С до 35°С. Образующийся первоначально β-гидроксипродукт может быть дегидратирован в обычных условиях дегидратации, таких, как обработка с PTSA (n-толуолсульфокислота) в таких растворителях, как бензол или толуол. Природа растворителя и дегидратирующего агента не является существенной. Реакцию проводят при температуре в интервале от 20°С до температуры кипения растворителя, предпочтительно при температуре кипения растворителя с непрерывным удалением воды с помощью насадки Дина-Старка.
Путь (5): реакция соединения (IIIh), где все символы определены ранее и L1 означает уходящую группу, такую, как атом галоида, n-толуолсульфонат, метансульфонат, трифторметансульфонат и тому подобное, с соединением формулы (IIIi), где R7 и R8 вместе означают связь, и R9, R10 и Аr обозначены ранее, с образованием соединения формулы (I), где m=1, а все другие символы определены выше, может быть осуществлена в присутствии апротонных растворителей, таких, как THF, DMF, DMSO, DME и тому подобное, или их смесей. Реакция может осуществляться в инертной атмосфере, которая может устанавливаться с использованием инертного газа, такого, как азот, аргон или гелий. Реакция может быть осуществлена в присутствии основания, такого, как карбонат калия, карбонат натрия или гидрид натрия, или их смеси. Ацетон может использоваться в качестве растворителя, если карбонат натрия или карбонат калия используется в качестве основания. Температура реакции может меняться в интервале от 0°С до 120°С, предпочтительно в интервале 30-100°С. Продолжительность реакции может меняться в интервале от 1 до 24 часов, предпочтительно от 2 до 12 часов. Соединение формулы (IIIi) может быть получено в соответствии с известной процедурой реакции Виттига-Хорнера между защищенным по гидроксигруппе арилальдегидом, таким, как бензилоксиарилальдегид, и соединением формулы (IIIb) с последующим деблокированием.
Путь (6): реакция соединения общей формулы (IIIj), где все символы определены ранее, с соединением общей формулы (IIIi), где где R7 и R8 вместе означают связь, и R9, R10 и Аr обозначены ранее, с образованием соединения формулы (I), где m=1, а все другие символы определены выше, может быть осуществлена с использованием соответствующих конденсирующих агентов, таких, как дициклогексилмочевина, триарилфосфин/диалкилазадикарбоксилат, такой, как трифенилфосфин/диэтилазадикарбоксилат, и тому подобное. Реакция может быть осуществлена в присутствии растворителей, таких, как THF, DME, хлористый метилен, хлороформ, толуол, ацетонитрил, четыреххлористый углерод и тому подобное. Инертная атмосфера может устанавливаться с помощью инертного газа, такого, как азот, аргон или гелий. Реакция может осуществляться в присутствии DMAP (диметиламинопиридина), НОВТ (гидроксибензтриазола), которые могут использоваться в количестве от 0.05 до 2 эквивалентов, предпочтительно от 0.25 до 1 эквивалента. Температура реакции может меняться в интервале от 0°С до 100°С, предпочтительно в интервале от 20°С до 80°С. Продолжительность реакции может меняться в интервале от 0.5 до 24 часов, предпочтительно от 6 до 12 часов.
В еще одном варианте воплощения настоящего изобретения соединение общей формулы (I), где R1, R2, R3, R4, R5, R6, R9, R10, X, n, m определены ранее, R7 означает атом водорода, гидрокси, алкокси, галоид, низший алкил, необязательно замещенную аралкильную группу, R8 означает атом водорода, гидрокси, алкокси, галоид, низшую алкильную группу, ацил или необязательно замещенный аралкил, и Аr обозначен ранее, и Y означает атом кислорода, может быть получено с помощью одного или нескольких процессов, показанных на схеме II:
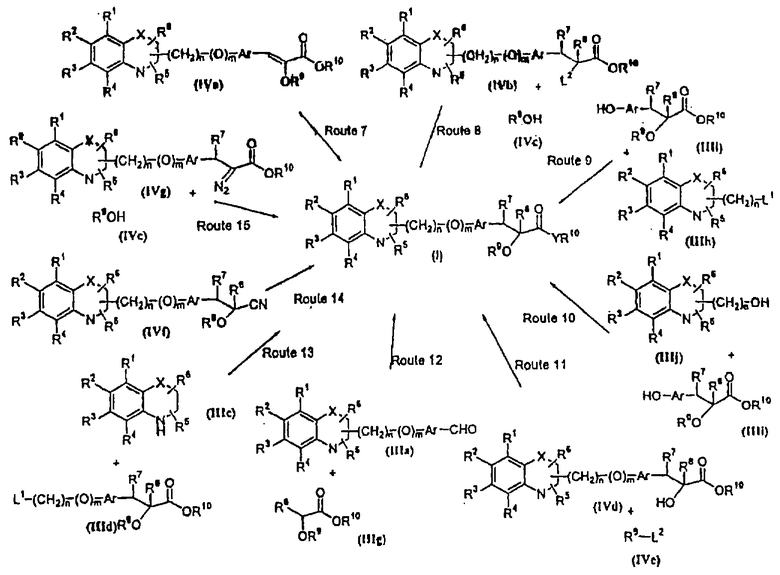
Путь 7: восстановление соединения формулы (IVa), которое представляет соединение формулы (I), где R7 и R8 вместе означают связь, Y означает атом кислорода, и все другие символы определены ранее, полученное, как описано ранее (схема I), с образованием соединения общей формулы (I), где R7 и R8 каждый означает атом водорода, и все символы определены ранее, может осуществляться в присутствии газообразного водорода и катализатора, такого, как Pd/C, Rh/C, Pt/C, и тому подобного. Могут применяться смеси катализаторов. Реакция может также проводиться в присутствии растворителей, таких, как диоксан, уксусная кислота, этилацетат и тому подобное. Используют давление в интервале между атмосферным и 551,6 кПа (80 psi). Предпочтительно катализатором служит 5-10% Pd/C, и количество катализатора может изменяться в интервале 50-300% весовых. Реакция восстановления может также осуществляться с помощью металла в растворителе, такого, как магний в спирте или амальгама натрия в спирте, предпочтительно в метаноле. Для получения соединения формулы (I) в оптически активной форме гидрирование может осуществляться в присутствии металлического катализатора, содержащего хиральный лиганд. Металлический катализатор может содержать родий, рутений, индий и тому подобное. Хиральные лиганды предпочтительно могут быть хиральными фосфинами, такими, как (2S,3S)-бис(дифенилфосфино)бутан, 1,2-бис(дифенилфосфино)этан, 1,2-бис(2-метоксифенилфенилфосфино)этан, (-)-2,3-изопропилиден-2,3-дигидрокси-1,4-бис(дифенилфосфино)бутан и тому подобное. Может использоваться любой соответствующий хиральный катализатор, который обеспечит оптическую чистоту продукта (I) (Principles of Asymmetric Synthesis, Tet. Org. Chem. Series, 14, 311-316, Ed. Baldwin J.E.).
Путь 8: реакция соединения формулы (IVb), где все символы определены ранее, и L2 означает уходящую группу, такую, как атом галоида, со спиртом общей формулы (IVc), где R9 определен ранее, для получения соединения формулы (I), определенной ранее, может осуществляться в присутствии растворителей, таких, как THF, DMF, DMSO, DME и тому подобное, и их смесей. Реакция может осуществляться в инертной атмосфере, которая может устанавливаться путем использования инертных газов, таких, как азот, аргон или гелий. Реакция может осуществляться в присутствии основания, такого, как гидроксид калия, гидроксид натрия, метилат натрия, этилат натрия, бутилат калия или гидрид натрия, или их смесей. Можно использовать межфазовый катализатор, такой, как тетраалкиламмонийгалоид или тетраалкиламмонийгидроксид. Температура реакции может меняться в интервале от 20°С до 120°С, предпочтительно в интервале 30-100°С. Продолжительность реакции может меняться в интервале от 1 до 12 часов, предпочтительно от 2 до 6 часов. Соединение общей формулы (IVb) и его получение раскрыты в одновременно рассматриваемой заявке США 08/982910.
Путь 9: реакция соединения формулы (IIIh), определенной ранее, с соединением формулы (IIIi), где все символы определены ранее, с образованием соединения формулы (I), где m=1, и все другие символы определены выше, может быть осуществлена в присутствии растворителей, таких, как THF, DMF, DMSO, DME и тому подобное, или их смесей. Реакция может осуществляться в инертной атмосфере, которая устанавливается с использованием инертных газов, таких, как азот, аргон или гелий. Реакция может осуществляться в присутствии основания, такого, как карбонат калия, карбонат натрия, гидрид натрия или их смесей. Ацетон может использоваться в качестве растворителя, если карбонат калия или карбонат натрия применяются в качестве основания. Температура реакции может меняться в интервале от 20°С до 120°С, предпочтительно в интервале 30-80°С. Продолжительность реакции может меняться в интервале от 1 до 24 часов, предпочтительно от 2 до 12 часов. Соединение формулы (IIIi) может получаться по реакции Виттига-Хорнера между защищенным гидроксиарилальдегидом и соединением формулы (IIIb) с последующим восстановлением двойной связи и деблокированием. В качестве альтернативы соединение формулы (IIIi) может быть получено с помощью следующей процедуры, раскрытой в международной заявке WO 94/01420.
Путь 10: реакция соединения общей формулы (IIIj), определенной ранее, с соединением общей формулы (IIIi), где все символы определены ранее, с образованием соединения формулы (I), где m=1 и все другие символы определены выше, может быть осуществлена с применением соответствующих конденсирующих агентов, таких, как дициклогексилмочевина, триарилфосфин/диалкилаза-дикарбоксилат, такой как трифенилфосфин/диэтилазадикарбоксилат, и тому подобное. Реакция может быть осуществлена в присутствии растворителей, таких, как THF, DME, хлористый метилен, хлороформ, толуол, ацетонитрил, четыреххлористый углерод и тому подобное. Инертная атмосфера может устанавливаться с использованием инертных газов, таких, как азот, аргон или гелий. Реакция может осуществляться в присутствии DMAP, HOBT, и они могут применяться в количестве от 0.05 до 2 эквивалентов, предпочтительно от 0.25 до 1 эквивалента. Температура реакции может меняться в интервале от 0°С до 100°С, предпочтительно в интервале 20-80°С. Продолжительность реакции может меняться в интервале от 0.5 до 24 часов, предпочтительно от 6 до 12 часов.
Путь 11: реакция соединения формулы (IVd), которая представляет соединение формулы (I), где R9 означает атом водорода, а все другие символы определены ранее, с соединением формулы (IVe), где R9 определено ранее, и L2 означает уходящую группу, такую, как атом галоида, может осуществляться в присутствии растворителей, таких, как THF, DMF, DMSO, DME и тому подобное. Инертная атмосфера может устанавливаться с использованием инертных газов, таких, как азот, аргон или гелий. Реакция может осуществляться в присутствии основания, такого, как гидроксид калия (КОН), гидроксид натрия (NaOH), метилат натрия (NaOMe), бутилат калия (K+BuO-), гидрид натрия (NaH) и тому подобное. Может применяться межфазовый катализатор, такой, как тетраалкиламмонийгалоид или тетраалкиламмонийгидроксид. Температура реакции может меняться в интервале от 20°С до 150°С, предпочтительно в интервале 30-100°С. Продолжительность реакции может меняться в интервале от 1 до 24 часов, предпочтительно от 2 до 6 часов.
Путь 12: реакция соединения общей формулы (IIIa), определенной выше, с соединением формулы (IIIg), где R8, R9 и R10 определены ранее, может осуществляться в обычных условиях. Природа основания не является существенной. Может использоваться любое основание, применяемое в реакции альдольной конденсации, гидрид металла, такой, как гидрид натрия или гидрид калия; алкоксиды металлов, такие, как метилат натрия, бутилат калия или этилат натрия; амиды металлов, такие, как амид лития или диизопропиламид лития. Может применяться апротонный растворитель, такой, как THF. Может использоваться инертная атмосфера, такая, как аргон, и реакция более эффективна в безводных условиях. Температура реакции может быть в интервале от -80°С до 25°С. β-Гидроксиальдольный продукт может быть дегидроксилирован с использованием общеизвестных методов, обычно путем ионного гидрирования, такого, как обработка с триалкилсиланом в присутствии кислоты, такой, как трифторуксусная кислота. Можно использовать растворитель, такой, как хлористый метилен. Удобно, чтобы реакция проходила при 25°С. Может использоваться более высокая температура, если реакция протекает медленно.
Путь 13: реакция соединения общей формулы (IIIс), где все символы определены ранее, с соединением общей формулы (IIId), где L1 означает уходящую группу, такую, как атом галоида, n-толуолсульфонат, метансульфонат, трифторметансульфонат и тому подобное, предпочтительно L1 означает атом галоида, и все другие символы определены ранее, с образованием соединения общей формулы (I) может осуществляться в присутствии растворителей, таких, как DMSO, DMF, DME, THF, диоксан, эфир и тому подобное, или их смесей. Реакция может осуществляться в инертной атмосфере, которая может устанавливаться с использованием инертных газов, таких, как азот, аргон или гелий. Реакция может осуществляться в присутствии основания, такого, как щелочи, как гидроксид натрия или гидроксид калия, карбонаты щелочных металлов, как карбонат натрия или карбонат калия; гидриды щелочных металлов, такие, как гидрид натрия или гидрид калия; металлоорганические основания, как н-бутиллитий, амиды щелочных металлов, как амид натрия, или их смеси. Количество основания может меняться в интервале от 1 до 5 эквивалентов в зависимости от количества соединения формулы (IIIс), предпочтительно количество основания изменяется в интервале от 1 до 3 эквивалентов. Реакция может проводиться при температуре в интервале от 0°С до 150°С, предпочтительно при температуре в интервале от 15°С до 100°С. Продолжительность реакции может меняться в интервале от 0.25 до 24 часов, предпочтительно от 0.25 до 12 часов.
Путь 14: превращение соединения формулы (IVf) в соединение формулы (I) может быть осуществлено или в присутствии основания, или в присутствии кислоты, и выбор кислоты или основания не является существенным. Может быть использовано любое основание, применяемое для гидролиза нитрила в кислоту, такое, как гидроксид металла, такой, как гидроксид натрия или гидроксид калия, в водном растворе, или может быть использована любая кислота, обычно применяемая для гидролиза нитрила в эфир, такая, как раствор сухого хлористого водорода в избытке спирта, такого, как метанол, этанол, пропанол и т.д. Реакция может быть осуществлена при температуре в интервале от 0°С до температуры кипения растворителя, предпочтительно при температуре в интервале от 25°С до температуры кипения используемого растворителя. Продолжительность реакции может меняться в интервале от 0.25 часа до 48 часов.
Путь 15: реакция соединения формулы (IVg), где все символы определены ранее, с соединением формулы (IVc), где R9 определен ранее, с получением соединения формулы (I) (с помощью реакции включения, опосредованной карбеноидом родия) может быть осуществлена в присутствии солей родия(II), таких как ацетат родия(II). Реакция может быть осуществлена в присутствии растворителей, таких, как бензол, толуол, диоксан, эфир, THF и тому подобное, или их комбинации, или, когда это осуществимо, в присутствии R9OH в качестве растворителя при любой температуре, обеспечивающей достаточную скорость образования требуемого продукта, обычно при повышенной температуре, такой, как температура кипения растворителя. Инертная атмосфера может быть установлена с использованием инертных газов, таких, как азот, аргон или гелий. Продолжительность реакции может меняться от 0.5 часа до 24 часов, предпочтительно от 0.5 часа до 6 часов.
Соединение общей формулы (I), где Y означает атом кислорода и R10 определено ранее, может быть превращено в соединение формулы (I), где Y означает NR12 путем реакции с соответствующими аминами формулы NHR10R12, где R10 и R12, определены ранее. Соответственно соединение формулы (I), где YR10 означает гидроксильную группу, может быть превращено в галоидангидрид кислоты, предпочтительно YR10=Cl, путем реакции с соответствующими реагентами, такими, как оксалилхлорид, тионилхлорид и тому подобное, с последующей обработкой аминами. В качестве альтернативы смешанные ангидриды могут быть получены из соединения формулы (I), где YR10 означает гидроксильную группу, а все другие символы определены ранее, при обработке хлорангидридами кислот, такими, как ацетилхлорид, ацетилбромид, пивалоилхлорид, дихлорбензоилхлорид и тому подобное. Реакция может осуществляться в присутствии сответствующего основания, такого, как пиридин, триэтиламин, диизопропилэтиламин и тому подобное. Могут использоваться растворители, такие, как галогенированные углеводороды, как хлороформ или хлористый метилен, углеводороды, такие, как бензол, толуол, ксилол и тому подобное. Реакция может осуществляться при температуре в интервале от -40°С до 40°С, предпочтительно при температуре в интервале от 0°С до 20°С. Полученный таким образом хлорангидрид или смешанный ангидрид могут быть в дальнейшем обработаны соответствующими аминами.
В другом варианте осуществления настоящего изобретения обеспечивается новое промежуточное соединение формулы (IVf)
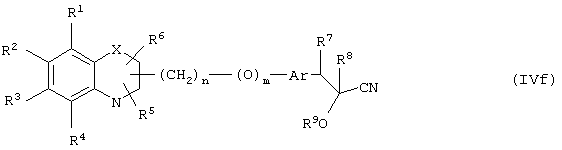
где группы R1, R2, R3, R4 и группы R5, и R6, когда они присоединены к атому углерода, могут быть одинаковыми или разными и означают атом водорода, галоид, гидрокси, нитро, циано, формил или необязательно замещенные группы, выбранные из алкила, циклоалкила, алкокси, циклоалкокси, арила, арилокси, аралкила, аралкокси, гетероциклила, гетероарила, гетероаралкила, гетероарилокси, гетероаралкокси, ацила, ацилокси, гидроксиалкила, амино, ациламино, алкиламино, ариламино, аралкиламино, аминоалкила, алкоксикарбонила, арилоксикарбонила, аралкоксикарбонила, алкоксиалкила, арилоксиалкила, аралкоксиалкила, алкилтио, тиоалкила, алкоксикарбониламино, арилоксикарбониламино, аралкоксикарбониламино, карбоновой кислоты либо ее производных или сульфоновой кислоты либо ее производных; R5 и R6, когда они присоединены к атому азота, означают водород, гидрокси, формил или необязательно замещенные группы, выбранные из алкильной, циклоалкильной, алкокси, циклоалкокси, арильной, аралкильной, гетероциклильной, гетероарильной, гетероаралкильной, ацильной, ацилокси, гидроксиалкильной, амино, ациламино, алкиламино, ариламино, аралкиламино, аминоалкильной, арилокси, аралкокси, гетероарилокси, гетероаралкокси, алкоксикарбонильной, арилоксикарбонильной, аралкоксикарбонильной, алкоксиалкильной, арилоксиалкильной, аралкоксиалкильной, алкилтио, тиоалкильной групп, производных карбоновой кислоты или сульфоновой кислоты; один или оба заместителя R5 и R6 могут также означать оксогруппу, если они присоединены к атому углерода, Х означает гетероатом, выбранный из кислорода, серы или группы NR11, где R11 выбирают из водорода или необязательно замещенных групп, выбранных из алкильной, циклоалкильной, арильной, аралкильной, ацильной, алкоксикарбонильной, арилоксикарбонильной или аралкоксикарбонильной групп; Аr означает необязательно замещенную двухвалентную моноциклическую или конденсированную ароматическую или гетероциклическую группу; R7 означает атом водорода, гидрокси, алкокси, галоид, низшую алкильную или необязательно замещенную аралкильную группу; R8 означает водород, гидрокси, алкокси, галоид, низшую алкильную группу, ацильную, необязательно замещенную аралкильную группу; R9 означает водород или необязательно замещенные группы, выбранные из алкильной, циклоалкильной, арильной, аралкильной, алкоксиалкильной, алкоксикарбонильной, арилоксикарбонильной, алкиламинокарбонильной, ариламинокарбонильной, ацильной, гетероциклильной, гетероарильной или гетероаралкильной групп; связывающая группа, представленная -(СН2)n-(O)m-, может быть присоединена или через атом азота, или через атом углерода; n означает целое число в интервале 1-4, и m означает целое число от 0 до 1; и способ его получения и его применение для получения β-арил-α-замещенных гидроксиалкановых кислот.
Соединение формулы (IVf), где R7 и R8 каждый означает атом водорода, а все другие символы определены ранее, получают способом, представленным на схеме III:
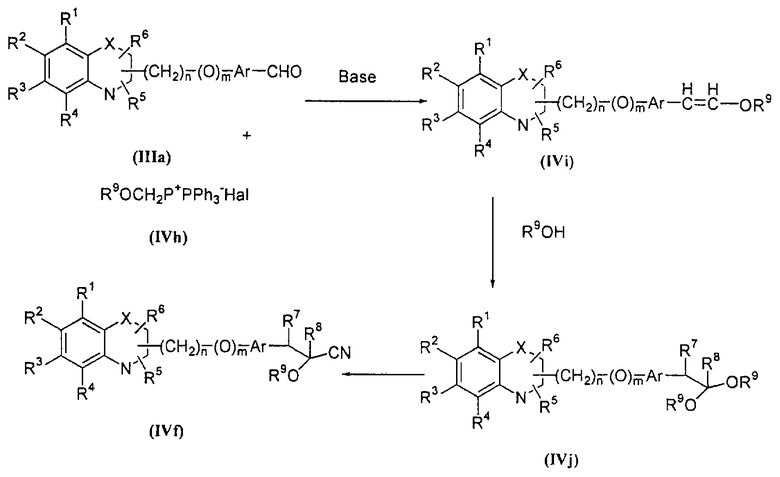
Реакция соединения формулы (IIIa), где все символы определены ранее, с соединением формулы (IVh), где R9 определен ранее, и Hal означает атом галоида, такого, как хлор, бром или иод, может быть осуществлена в обычных условиях в присутствии основания. Природа основания не является существенной. Может использоваться любое основание, обычно применяемое в реакции Виттига, гидрид металла, такой, как гидрид натрия или гидрид калия; алкоксиды металлов, такие, как метилат натрия, трет.-бутилат калия или этилат натрия; или амиды металлов, такие, как амид лития или диизопропиламид лития. Могут быть использованы апротонные растворители, такие, как THF, DMSO, диоксан, DME и тому подобное. Могут применяться смеси растворителей. В качестве со-растворителя может применяться НМРА. Может использоваться инертная атмосфера, такая, как аргоновая, и реакция более эффективна в безводных условиях. Температура может изменяться в интервале от -80°С до 100°С.
Соединение (IVi), где все символы определены ранее, может быть превращено в соединение формулы (IVj), где R7 и R8 означают атомы водорода и все другие символы определены ранее, путем обработки со спиртом в безводных условиях в присутствии абсолютно безводной кислоты, такой, как n-толуолсульфокислота.
Соединение формулы (IVj), обозначенной выше, при обработке с триалкилсилилцианидом, таким, как триметилсилилцианид, образует соединение формулы (IVf), где R7 и R8 означают атомы водорода, а все другие символы определены ранее.
Еще в одном варианте воплощения настоящего изобретения обеспечивается новое промежуточное соединение формулы (IVg)
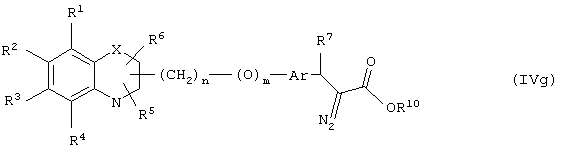
где группы R1, R2, R3, R4 и группы R5, и R6, когда они присоединены к атому углерода, могут быть одинаковыми или разными и означают атом водорода, галоид, гидрокси, нитро, циано, формил или необязательно замещенные группы, выбранные из алкила, циклоалкила, алкокси, циклоалкокси, арила, арилокси, аралкила, аралкокси, гетероциклила, гетероарила, гетероаралкила, гетероарилокси, гетероаралкокси, ацила, ацилокси, гидроксиалкила, амино, ациламино, алкиламино, ариламино, аралкиламино, аминоалкила, алкоксикарбонила, арилоксикарбонила, аралкоксикарбонила, алкоксиалкила, арилоксиалкила, аралкоксиалкила, алкилтио, тиоалкила, алкоксикарбониламино, арилоксикарбониламино, аралкоксикарбониламино, карбоновой кислоты, либо ее производных или сульфоновой кислоты, либо ее производных; один или оба заместителя R5 и R6, когда они присоединены к атому углерода, могут быть также оксогруппой; R5 и R6, когда они присоединены к атому азота, означают водород, гидрокси, формил или необязательно замещенные группы, выбранные из алкильной, циклоалкильной, алкокси, циклоалкокси, арильной, аралкильной, гетероциклильной, гетероарильной, гетероаралкильной, ацильной, ацилокси, гидроксиалкильной, амино, ациламино, алкиламино, ариламино, аралкиламино, аминоалкильной, арилокси, аралкокси, гетероарилокси, гетероаралкокси, алкоксикарбонильной, арилоксикарбонильной, аралкоксикарбонильной, алкоксиалкильной, арилоксиалкильной, аралкоксиалкильной, алкилтио, тиоалкильной групп, производных карбоновой кислоты или сульфоновой кислоты; X означает гетероатом, выбранный из кислорода, серы или группы NR11, где R11 выбирают из водорода или необязательно замещенных групп, выбранных из алкильной, циклоалкильной, арильной, аралкильной, ацильной, алкоксикарбонильной, арилоксикарбонильной или аралкоксикарбонильной групп; Аr означает необязательно замещенную двухвалентную моноциклическую или конденсированную ароматическую или гетероциклическую группу; R7 означает атом водорода, гидрокси, алкокси, галоид, низшую алкильную или необязательно замещенную аралкильную группу; R10 означает водород или необязательно замещенные группы, выбранные из алкильной, циклоалкильной, арильной, аралкильной, гетероциклильной, гетероарильной или гетероаралкильной групп; Y означает кислород; связывающая группа, представленная -(СН2)n-(O)m-, может быть присоединена или через атом азота, или через атом углерода; n означает целое число в интервале 1-4, и m означает целое число от 0 до 1; и способ его получения и его применение для получения β-арил-α-замещенных гидроксиалкановых кислот.
Соединение формулы (IVg), где все символы определены ранее, может быть получено реакцией соединения формулы (IVk)
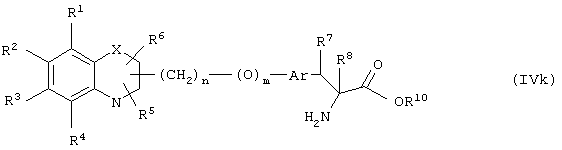
где R8 означает атом водорода, а все другие символы определены ранее, с соответствующим диазотирующим агентом.
Реакция диазотирования может проводиться при обычных условиях. Подходящим диазотирующим агентом является алкилнитрил, такой, как изоамилнитрил. Реакция может осуществляться в присутствии растворителя, такого, как THF, диоксан, эфир, бензол и тому подобное, или их смеси. Температура может быть в интервале от -50°С до 80°С. Реакция может осуществляться в инертной атмосфере, которая может устанавливаться с использованием инертных газов, таких, как азот, аргон или гелий. Продолжительность реакции может меняться в интервале от 1 до 24 часов, предпочтительно от 1 до 12 часов.
Соединение формулы (IVk) может быть также получено реакцией между соединением формулы (IIIh), где все символы определены ранее, и соединением
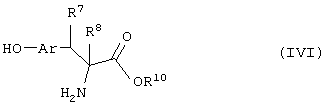
где R8 означает атом водорода, а все другие символы определены ранее.
Реакция между соединением формулы (IIIh), где все символы определены ранее, и соединением формулы (IV1), где все символы определены ранее, может быть осуществлена в присутствии растворителей, таких, как THF, DMF, DMSO и тому подобное, или их смесей. Реакция может осуществляться в инертной атмосфере, которая устанавливается с использованием инертных газов, таких, как азот, аргон или гелий. Реакция может осуществляться в присутствии основания, такого, как карбонат калия, карбонат натрия или гидрид натрия или их смесей. Ацетон может применяться в качестве растворителя, если карбонат калия или карбонат натрия используется в качестве основания. Температура реакции может меняться в интервале от 20°С до 120°С, предпочтительно в интервале 30°С-80°С. Продолжительность реакции может меняться в интервале от 1 до 24 часов, предпочтительно от 2 до 12 часов.
Термин “без разбавления (неразбавленный)”, как он используется в данной заявке, означает, что реакция осуществляется без использования растворителя. Фармацевтически приемлемые соли получают взаимодействием соединения формулы (I) с 1-4 эквивалентами основания, такого, как гидроксид натрия, метилат натрия, гидрид натрия, трет.-бутилат калия, гидроксид кальция, гидроксид магния и тому подобное, в таких растворителях, как эфир, THF, метанол, трет.-бутанол, диоксан, изопропанол, этанол и т.д. Могут применяться смеси растворителей. Такие органические основания, как лизин, аргинин, диэтаноламин, холин, гуанидин, их производные и т.д., также могут применяться. В качестве альтернативы, образующиеся при присоединении кислот соли, где бы они ни были применимы, получают путем обработки с кислотами, такими, как хлористоводородная кислота, бромистоводородная кислота, азотная кислота, серная кислота, фосфорная кислота, n-толуолсульфокислота, метансульфоновая кислота, уксусная кислота, лимонная кислота, малеиновая кислота, салициловая кислота, гидроксинафтоевая кислота, аскорбиновая кислота, пальмитиновая кислота, янтарная кислота, бензойная кислота, бензолсульфоновая кислота, винная кислота и тому подобное, в растворителях, таких как этилацетат, эфир, спирты, ацетон, THF, диоксан и т.д. Смеси растворителей могут также использоваться.
Стереоизомеры соединений, составляющие часть данного изобретения, могут быть получены путем использования в процессе реагентов в одной энантиомерной форме, если это возможно, или путем проведения реакции в присутствии реагентов или катализаторов в одной энантиомерной форме, или путем разделения смеси стереоизомеров с помощью общеизвестных методов. Некоторые из предпочтительных методов включают микробное разделение, разделение диастереомерных солей, образованных с хиральными кислотами, такими, как миндальная кислота, камфорсульфоновая кислота, винная кислота, молочная кислота и тому подобное, где бы они ни были применимы, или с хиральными основаниями, такими, как бруцин, цинхоновые алкалоиды и их производные и тому подобное. Применяемые обычно методы собраны Jaques и др. в “Enantiomers, Racemates and Resolution” (Wiley Interscience, 1981). Более конкретно, соединение формулы (I), где YR10 означает гидроксильную группу, может быть превращено в смесь диастереомерных амидов (1:1) путем обработки с хиральными аминами, аминокислотами, аминоспиртами, полученными из аминокислот; для превращения кислоты в амид могут применяться обычные условия; диастереомеры могут быть разделены или фракционной кристаллизацией, или хроматографией, и стереоизомеры соединения формулы (I) могут быть получены путем гидролиза чистого диастереомерного амида.
Различные полиморфные формы соединения общей формулы (I), составляющие часть данного изобретения, могут быть получены кристаллизацией соединения формулы (I) в различных условиях. Например, путем использования для перекристаллизации различных обычно применяемых растворителей или их смесей; путем кристаллизации при различных температурах; при различных способах охлаждения при кристаллизации, изменяющихся от очень быстрого до очень медленного охлаждения. Полиморфные формы могут также быть получены путем нагревания или расплавления соединения, сопровождающегося постепенным или быстрым охлаждением. Присутствие полиморфных форм можно определить с помощью ЯМР-спектроскопии твердого образца, ИК-спектроскопии, дифференциальной сканирующей калориметрии, рентгено-структурного анализа на порошке или других подобных методов.
Соединения общей формулы (I) применимы для лечения и/или профилактики инсулиновой резистентности (диабета типа II), лептиновой резистентности, нарушенной переносимости глюкозы, дислипидемии, нарушений, связанных с синдромом X, таких, как гипертензия, ожирение, инсулиновая резистентность, ишемическая болезнь сердца и другие сердечно-сосудистые нарушения. Эти соединения могут также применяться в качестве ингибиторов альдозоредуктазы, для улучшения познавательной способности при деменции, лечении осложнений диабета, нарушений, связанных с активацией эндотелиальных клеток, псориаза, синдрома поликистоза яичников (PCOS), воспалительных заболеваний брюшной полости, остеопороза и при лечении рака. Соединения по настоящему изобретению в комбинации с одним или несколькими ингибиторами HMG-CoA-редуктазы, гиполипидемических/гиполипопротеинемических агентов, таких, как производные фибровой кислоты, никотиновая кислота, холестирамин или пробукол, применимы для лечения и/или профилактики атеросклероза и/или ксантомы. Соединения по настоящему изобретению в комбинации с ингибиторами HMG-CoA-редуктазы и/или гиполипидемическими либо гиполипопротеинемическими агентами, могут вводиться вместе или в течение такого периода времени, когда обеспечивается синергизм их действия. Ингибиторы HMG-CoA-редуктазы могут быть выбраны из тех соединений, которые применяются для лечения или предупреждения гиперлипидемии, таких, как ловастатин, провастатин, симвастатин, флувастатин, аторвастатин, церивастатин и их аналоги. Соответствующими производными фибровой кислоты могут служить гемфиброзил, клофибрат, фенофибрат, ципрофибрат, бензафибрат и их аналоги.
Настоящее изобретение обеспечивает также фармацевтические композиции, содержащие соединения общей формулы (I), описанные выше, их таутомерные формы, их стереоизомеры, их полиморфные формы, их фармацевтически приемлемые соли или их фармацевтически приемлемые сольваты в сочетании с обычно используемыми фармацевтическими наполнителями, разбавителями и тому подобное.
Фармацевтические композиции могут быть в виде обычно применяемых форм, таких, как таблетки, капсулы, порошки, сиропы, растворы, суспензии и тому подобное, могут содержать ароматизаторы, подсластители и т.д. в соответствующих твердых или жидких наполнителях или разбавителях, или в соответствующей стерильной среде при получении инъекционных растворов или суспензий. Такие композиции обычно содержат от 1 до 20%, предпочтительно от 1 до 10% весовых активного соединения, причем остальная часть состава является фармацевтически приемлемыми наполнителями, разбавителями или растворителями.
Соединение формулы (I), описанное выше, в клинических условиях вводят млекопитающим, включая человека, пероральным или парентеральным путем.
Предпочтительным является пероральный путь введения, поскольку он более удобен и позволяет избежать возможных при инъекции боли и раздражения. Однако, при обстоятельствах, когда пациент не может проглотить лекарство, или при нарушении абсорбции после введения, как в случае болезни или других аномалий, важно, чтобы препарат был введен парентерально. При любом способе введения дозу в интервале от примерно 0.01 до примерно 50 мг/кг веса тела пациента в день или предпочтительно примерно от 0.01 до примерно 30 мг/кг веса тела в день вводят однократно или в виде разделенных доз. Однако, оптимальная доза для лечения каждого пациента будет определяться лицом, ответственным за лечение, обычно меньшие дозы, введенные в первый и последующие разы, позволяют определить наиболее подходящую дозу.
Соответствующие фармацевтически приемлемые наполнители включают твердые наполнители или разбавители и стерильные водные или органические растворы. Активное соединение будет присутствовать в таких фармацевтических композициях в эффективных количествах, достаточных для обеспечения требуемой дозы в интервале, описанном выше. Таким образом, для перорального введения соединение может быть соединено с соответствующим твердым, жидким наполнителем или разбавителем для того, чтобы образовать капсулы, таблетки, порошки, сиропы, растворы, суспензии и тому подобное. При необходимости фармацевтические композиции могут содержать дополнительные компоненты, такие, как ароматизаторы, подсластители, наполнители и тому подобное. Для парентерального введения соединения могут быть соединены со стерильной водной или органической средой для того, чтобы образовать растворы или суспензии для инъекции. Например, могут использоваться растворы в кунжутном или арахисовом масле, водном пропиленгликоле и тому подобном, а также водные растворы водорастворимых фармацевтически приемлемых солей, образованных присоединением кислот, или солей с основаниями. Полученные таким образом инъекционные растворы могут затем вводиться внутривенно, внутрибрюшинно, подкожно или внутримышечно, причем предпочтительным введением для человека является внутримышечное введение.
Сведения, подтверждающие возможность осуществления изобретения
Изобретение объясняется подробно в примерах, приведенных ниже, которые являются только иллюстрацией и поэтому не должны рассматриваться в качестве ограничения области изобретения.
Методика 1
4-[2-(3-Оксо-2H-1,4-бензоксазин-4-ил)этокси]бензальдегид
Смесь, состоящую из 2Н-1,4-бензоксазин-3-(4Н)-она (1.6 г, 10.7 ммоль), 4-(2-бромэтокси)бензальдегида (2.95 г, 12,8 ммоль) и карбоната калия (5,93 г, 42.97 ммоль) в сухом диметилформамиде (30 мл) перемешивали при 80°С в течение 10 часов. Прибавляли воду (100 мл) и экстрагировали этилацетатом (2×75 мл).
Объединенные органические слои промывали водой (50 мл), солевым раствором (50 мл), сушили над сульфатом натрия, фильтровали и упаривали растворитель. Остаток хроматографировали на силикагеле, используя смесь этилацетат-петролейный эфир (2:8) и получая целевое соединение (2.9 г, 91%) в виде бесцветного твердого вещества, т.пл. 75-78°С.
1Н-ЯМР (СDСl3, 200 МГц): 4.37 (с, 4Н), 4.62 (с, 2Н), 6.96-7.26 (м, 6Н), 7,82 (д, 2Н, J=8.4 Гц), 9.89 (с, 1Н).
Методика 2
6-[2-(2,3-Дигидро-1,4-бензотиазин-4-ил)этокси]цианонафталин
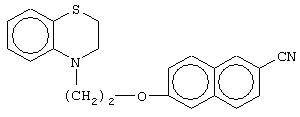
Смесь, состоящую из 2-(2,3-дигидро-1,4-бензотиазин-4-ил)этилметансульфоната (0.49 г, 1.82 ммоль), 2-гидрокси-6-цианонафталина (0.28 г, 1.65 ммоль) и карбоната калия (1.15 г, 8.28 ммоль) в сухом диметилформамиде (15 мл), перемешивали при 80°С в течение 12 часов. Прибавляли воду (50 мл) и экстрагировали этилацетатом (2×25 мл). Объединенные органические экстракты промывали водой (25 мл), солевым раствором (20 мл), сушили над сульфатом натрия, фильтровали и упаривали растворитель при пониженном давлении. Остаток хроматографировали на силикагеле, используя смесь этилацетат-петролейный эфир и получая целевое соединение (0.41 г, 72%) в виде бледно-желтого твердого вещества, т.пл. 94-96°С.
1Н-ЯМР (CDCl3, 200 МГц): 3.05 (т, 2Н, J=5.21 Гц), 3.79-3.85 (м, 4Н), 4.31 (т, 2Н, J=5.82 Гц), 6.64-6.78 (м, 2Н), 6.97-7.25 (м, 4Н), 7,53-7.80 (м, 3Н), 8.13 (с, 1Н).
Методика 3
6-[2-(2,3-Дигидро-1,4-бензотиазин-4-ил)этокси]нафтальдегид
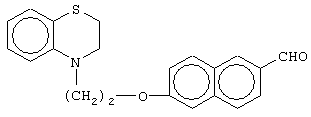
К раствору 6-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]цианонафталина (8 г, 22.9 ммоль), полученному по методике 2, в сухом тетрагидрофуране (15 мл) прибавляли диизобутилалюминийгидрид (93 мл, 20% в толуоле) при -70°С в течение 1 часа. После прибавления реакционную смесь перемешивали при 25°С в течение 16 часов. В конце этого периода прибавляли этилформат (20 мл) и перемешивали в течение 1 часа при 25°С. Прибавляли насыщенный раствор хлористого аммония (15 мл). Реакционную смесь подкисляли 10% серной кислотой и экстрагировали этилацетатом (2×75 мл). Объединенные органические экстракты промывали водой (2×50 мл), солевым раствором (50 мл), сушили над сульфатом натрия, фильтровали и упаривали растворитель при пониженном давлении.
Остаток хроматографировали на силикагеле, используя смесь этилацетат-петролейный эфир (10:90), получали целевое соединение (4.5 г, 56%) в виде бледно-желтого твердого вещества, т.пл. 100-102°С.
1Н-ЯМР (СDСl3, 200 МГц): 3.06 (т, 2Н, J=5.2 Гц), 3.72-3.86 (м, 4Н), 4.33 (т, 2Н, J=5.67 Гц), 6.60-6.79 (м, 2Н), 6.97-7.25 (м, 4Н), 7.74-7.93 (м, 3Н), 8.25 (с, 1Н), 10.09 (с, 1Н).
Методика 4
4-[4-Метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил]метоксибензадьдегид

К раствору 4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-метанола (6.0 г, 33.51 ммоль) в дихлорметане (20 мл) прибавляли триэтиламин (10.15 г, 100.5 ммоль) в атмосфере азота при 25°С. К реакционной смеси прибавляли при 0°С метансульфонилхлорид (5.75 г, 50.25 ммоль) и продолжали перемешивание последующие 10 часов при 25°С. Прибавляли воду (50 мл) и экстрагировали хлороформом (2×25 мл). Объединенные органические эктракты промывали водой (50 мл), сушили над сульфатом натрия, фильтровали и упаривали растворитель при пониженном давлении. Остаток хроматографировали на силикагеле, используя смесь этилацетат-гексан (2:8), получали (4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метилметансульфонат (3.7 г, 43%) в виде сиропа.
1Н-ЯМР (CDCl3, 200 МГц): 2.88 (с, 3Н), 3.07 (с, 3Н), 3.13-3.31 (м, 2Н), 4.41 (д, 2Н, J=5.2 Гц), 4.53-4.55 (м, 1Н), 6.81-6.89 (м, 4Н). Смесь (4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метилметансульфоната (3.7 г, 14.39 ммоль), 4-гидроксибензальдегида (2.6 г, 21.29 ммоль) и карбоната калия (5.9 г, 42.7 ммоль) в сухом диметилфорамиде (30 мл) перемешивали при 80°С в течение 10 часов. Прибавляли воду (100 мл) и экстрагировали этилацетатом (2×70 мл). Объединенные органические экстракты промывали водой (50 мл), солевым раствором (50 мл), сушили над сульфатом натрия, фильтровали и упаривали растворитель при пониженном давлении. Остаток хроматографировали на силикагеле, используя смесь этилацетат-петролейный эфир (2:8) и получая целевое соединение (1.3 г, 32%) в виде густой жидкости,
1Н-ЯМР (CDCl3, 200 МГц): 2.93 (с, 3Н), 3.24-3.46 (м, 2Н), 4.14-4.37 (м, 2Н), 4.68-4.71 (м, 1Н), 6.72-7.10 (м, 6Н), 7.86 (д, 2Н, J=8.8 Гц), 9.92 (с, 1Н).
Методика 5
4-[4-Бензил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил]метоксибензальдегид
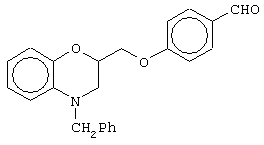
Целевое соединение (3.2 г, 80%) получали в виде бледно-желтого твердого вещества из 4-бензил-3,4-дигидро-2Н-1,4-бензоксазин-2-метанола (4.0 г, 15.68 ммоль) способом, подобным тому, который описан в методике 4, т.пл. 92-94°С.
1H-ЯМР (СDСl3, 200 МГц): 3.38-3.43 (м, 2Н), 4.14-4.32 (м, 2Н), 4.46 (д, 2Н, J=7.8 Гц), 4.60-4.65 (м, 1Н), 6.65-6.89 (м, 4Н), 7.00 (д, 2Н, J=8.8 Гц). 7,32 (с, 5Н), 7.83 (д, 2Н, J=8.8 Гц), 9.90 (с, 1Н).
Пример 1
Этил-(Е/Z)-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропеноат
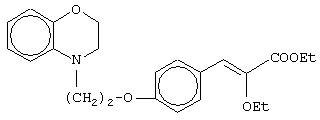
Раствор триэтил-2-этоксифосфоноацетата (W.Grell, H.Machleidt, Annalen Chemie, 1960, 699, 53) (7.8 г, 29.1 ммоль) в сухом тетрагидрофуране (15 мл) медленно прибавляли к перемешиваемой и охлажденной льдом суспензии гидрида натрия (60% дисперсия масле) (1.39 г, 29.1 ммоль) в сухом тетрагидрофуране (5 мл) в атмосфере азота. Смесь перемешивали при 0°С в течение 30 минут с последующим прибавлением раствора 4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]бензальдегида (7.5 г, 26.5 ммоль), который получали в соответствии с процессом, описанным в методике 1, раскрытой в заявке на патент США 08/982910, в сухом тетрагидрофуране (20 мл). Смеси давали нагреться до 25°С и перемешивали последующие 20 часов. Растворитель упаривали, остаток суспендировали в воде (100 мл) и экстрагировали этилацетатом (2×75 мл). Объединенные органические слои промывали водой (75 мл), солевым раствором, сушили над сульфатом натрия, фильтровали и упаривали растворитель при пониженном давлении. Остаток хроматографировали на силикагеле, используя смесь этилацетат-петролейный эфир (2:8) в качестве элюента, получали целевое соединение (8.0 г, 75%) в виде смолистого вещества в виде смеси геометрических изомеров в соотношении Z:E=65:35 (R.A.Aitken, G.L.Thom, Synthesis, 1989, 958).
1Н-ЯМР (CDCl3, 200 МГц): 1.18, 1.36 (2т, перекрыты, 6Н, изомерные OEt, сигналы триплета), 3.51 (т, 2Н, J=4.48 Гц), 3,71 (т, 2Н, J=5.39 Гц), 3.89-4-03 (м, 2Н), 4.10-4.34 (м, 6Н), 6.07 (с, 0.35Н, олефиновый протон изомера Е), 6.63-7.14 (м, 6.65Н), 7.73 (д, 2Н, J=8.72 Гц).
Пример 2
Метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропаноат
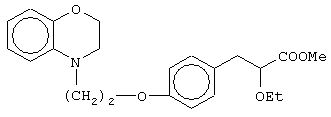
Смесь полученного в примере 1 этил-(Е/Z)-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропеноата (8.0 г, 20.0 ммоль) и магниевой стружки (9.64 г, 396.7 ммоль) в сухом метаноле (50 мл) перемешивали при 25°С в течение 20 часов. В конце этого периода прибавляли воду (50 мл) и доводили значение рН примерно до 7.0, используя 10% водную соляную кислоту, раствор экстрагировали этилацетатом (2×10 мл). Объединенный органический экстракт промывали водой (75 мл), солевым раствором (75 мл), сушили над сульфатом натрия, фильтровали и удаляли растворитель при пониженном давлении. Остаток хроматографировали на силикагеле, используя смесь этилацетат-петролейный эфир (2:8) в качестве элюента, получали целевое соединение (5.0 г, 64%) в виде вязкой жидкости.
1Н-ЯМР (CDCl3, 200 МГц): 1.15 (т, 3Н, J=7.0 Гц), 2.93 (д, 2Н, J=6.64 Гц), 3.23-3.38 (м, 1Н), 3.43-3.72 (м,8Н), 3.97 (т, 1H, J=6.9 Гц), 4.14 (т, 2Н, J=5.81 Гц), 4.19 (т, 2Н, J=4.2 Гц), 6.55-6.83 (м, 6Н), 7.13 (д, 2Н, J=8.39 Гц).
Пример 3
Этил-(Е/Z)-3-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)метилбензофуран-5-ил]-2-этоксипропеноат

Целевое соединение (0.8 г, 58%) получали в виде смолистого вещества из 5-формил-2-(2,3-дигидро-1,4-бензоксазин-4-ил)метилбензофурана (1.0 г, 3.41 ммоль) способом, аналогичным описанному в примере 1.
1Н-ЯМР (СDСl3, 200 МГц): 1.06, 1.38 (2т, 6Н, 2ОEt), 3.48 (т, 2Н, J=4.98 Гц), 3.89-4.18 (м, 2Н), 4.28-4.40 (м, 4Н), 4.54, 4.56 (перекрыты. 2Н, NCH2), 6.20 (0.5Н, олефиновый протон изомера Е), 6.52, 6.59 (перекрыты, 1Н), 6.65-6.83 (м, 2.5Н), 7.08-7.11 (м, 1 Н), 7.32-7.44 (м, 2Н), 7.69 (д, 1Н, J=8.3 Гц), 7.99 (с, 1Н).
Пример 4
Этил-(Е/Z)-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропеноат

Целевое соединение получали в виде смеси геометрических изомеров в соотношении 38:62 (по данным 1H-ЯМР) (3.2 г, 71%) в виде смолистого вещества из 4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]бензальдегида (3.3 г, 11.03 ммоль), полученного в соответствии с процессом, описанным в методике 2, раскрытой в заявке на патент 08/982910, по методу, аналогичному описанному в примере 1.
1Н-ЯМР (CDCl3, 200 МГц): 1.14, 1.35 (2т, перекрыты, 6Н, 2OEt), 3.02 (т, 2Н, J=4.9 Гц), 3.69-3.88 (м, 4Н), 3.92-4.03 (м, 2Н), 4.12-4.33 (м, 4Н), 6.06 (с, 0.38Н, олефиновый протон изомера Е), 6.61-7.14 (м, 6.62Н), 7.73 (д, 2Н, J=8.81 Гц).
Пример 5
Метил-3-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)метилбензофуран-5-ил]-2-этоксипропаноат

Целевое соединение (0.6 г, 78%) получали в виде смолистого вещества из полученного в примере 3 этил-(Е/Z)-3-[2-(2,3-дигидро-1,4-бензоксазин-4-ила)метилбензофуран-5-ил]-2-этоксипропеноата (0.8 г, 1.96 ммоль) по методу, аналогичному описанному в примере 2.
1Н-ЯМР (CDCl3, 200 МГц): 1.15 (т, 3Н, J=7.0 Гц). 3.07 (д, 2Н, J=5.8 Гц), 3.28-3,67 (м, 4Н), 3.70 (с, 3Н), 4.03 (т, 1Н, J=6.0 Гц), 4.28 (т, 2Н, J=4.47 Гц), 4.54 (с, 2Н), 6.52 (с, 1Н), 6.62-6.89 (м, 4Н), 7.10 (д, 1Н, J=7.05 Гц), 7.35 (м, 2Н).
Пример 6
Метил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропаноат
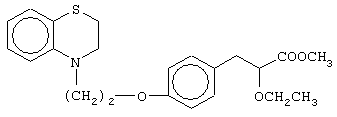
Целевое соединение (2.3 г, 76%) получали в виде вязкой жидкости из полученного в примере 4 этил-(Е/Z)-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропеноата (3.1 г, 7.50 ммоль) по методу, аналогичному описанному в примере 2.
1Н-ЯМР (CDCl3 200 МГц): 1.15 (т, 3Н, J=7.01 Гц), 2.93 (д, 2Н, J=6.65 Гц), 3.03 (т, 2Н, J=5.21 Гц), 3.23-3.41 (м, 1Н), 3.52-3.80 (м, 8Н), 3.97 (т, 1Н, J=7.01 Гц), 4,14 (т, 2Н, J=5.81 Гц), 6.61-6.82 (м, 4Н), 6,92-7.05 (м, 2Н), 7.13 (д, 2Н, J=8.53 Гц).
Пример 7
Метил-2-метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропаноат

К раствору полученного в примере 2 метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропаноата (0,6 г, 1,5 ммоль) в сухом тетрагидрофуране (5 мл) прибавляли диизопропиламид лития (0.5 мл раствора в THF/гексане) при -78°С. После перемешивания в течение 1 часа при -78°С прибавляли иодистый метил (0.75 мл), реакционной смеси давали нагреться до комнатной температуры (примерно 25°С) и перемешивали при этой температуре последующие 20 часов. Прибавляли воду (20 мл), подкисляли 1 н. соляной кислотой и экстрагировали этилацетатом (2×25 мл). Объединенный органический слой промывали водой (25 мл), солевым раствором (25 мл), сушили над сульфатом натрия, фильтровали и упаривали при пониженном давлении, получая целевое соединение (0.5 г, 80%) в виде масла.
1Н-ЯМР (CDCl3, 200 МГц): 1.21 (т, 3Н, J=6,97 Гц), 1.31 (с, 3Н), 2.95 (с, 2Н), 3.32-3.58 (м, 4Н), 3.62-3.84 (м, 5Н), 4.14 (т, 2Н, J=5.81 Гц), 4.22 (т, 2Н, J=4.25), 6.55-6.88 (м, 6Н), 7.08 (д, 2Н, J=8.63).
Пример 8
Метил-2-(2-фторбензил)-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил]этокси]фенил]-2-этоксипропаноат

Целевое соединение (0.6 г, 78%) получали в виде коричневой жидкости из полученного в примере 2 3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропаноата (0.6 г, 1.5 ммоль) методом, аналогичным описанному в примере 7.
1Н-ЯМР (СDСl3, 200 МГц): 1.22 (т, 3Н, J=6.96 Гц), 3.03-3.18 (м, 4Н), 3.51 (т, 2Н, J=4.2 Гц), 3.59-3.71 (м, 7Н), 4.14 (т, 2Н, J=5.81 Гц), 4.22 (т, 2Н, J=4.24 Гц), 6,42-6.85 (м, 6Н), 6.90-7.32 (м, 6Н).
Пример 9
Этил-(Е/Z)-3-[4-[2-(3-оксо-2Н-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропеноат

Целевое соединение (3.9 г, 97%) получали в виде смеси изомеров E/Z в соотношении 32:68 в виде белого твердого вещества из полученного по методике 1 4-[2-(3-оксо-2Н-1,4-бензоксазин-4-ил)этокси]бензальдегида (2.9 г, 9.7 ммоль) методом, аналогичным описанному в примере 1, т.пл. 92-95°С.
1Н-ЯМР (CDCl3, 200 МГц): 1.13-1,43 (м, 6Н), 3.88-4.02 (м, 2Н), 4.07-4.40 (м, 6Н), 4,60 (с, 2Н), 6.05 (с, 0.32Н, олефиновый протон изомера Е), 6.76-7.32 (м, 6.68Н), 7.71 (д, 2Н, J=8.72 Гц).
Пример 10
Метил-3-[4-[2-(3-оксо-2Н-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропаноат
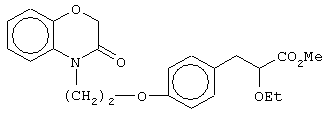
Целевое соединение (1.0 г, 51%) получали в виде бесцветного сиропа из полученного в примере 9 этил-(Е/Z)-3-[4-[2-(3-оксо-2Н-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропеноата (2.0 г, 4.8 ммоль) методом, аналогичным описанному в примере 2.
1Н-ЯМР (CDCl3, 200 МГц): 1.14 (т, 3Н, J=7.0 Гц), 2.92 (д. 2Н, J=6.6 Гц), 3.25-3.41 (м, 1Н), 3.53-3.61 (м, 1Н), 3.68 (с, 3Н), 3.96 (т, 1Н, J=7.0 Гц), 4.21-4.32 (м, 4Н), 4.68 (с, 2Н), 6.77 (д, 2Н, J=8.63 Гц), 6.98-7.33 (м, 6Н).
Пример 11
Этил-(Е/Z)-3-[6-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]нафтил]-2-этоксипропеноат
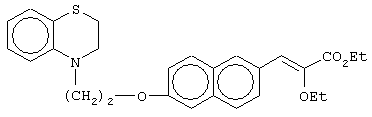
Целевое соединения в виде смеси изомеров E/Z в соотношении 1:1 (1.74 г, 87%) получали в виде коричневого сиропа из описанного в методике 3 6-[2-(2.3-дигидро-1,4-бензотиазин-4-ил)этокси]нафтальдегида (1.5 г, 4.29 ммоль) методом, описанным в примере 1.
1Н-ЯМР (CDCl3, 200 МГц): 0.99-1.47 (м, 6Н), 3.06 (т, 2Н, J=4.98 Гц), 3.79-3.95 (м, 4Н), 3.99-4.18 (м, 2Н), 4.25-4.37 (м, 4Н), 6.23 (с, 0.5Н, олефиновый протон изомера Е), 6.59-6.79 (м, 2Н), 6.97-7.29 (м, 4.5Н), 7.57-7.95 (м, 3Н), 8.14 (с, 1Н).
Пример 12
Метил-3-[6-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]нафтил]-2-этоксипропаноат
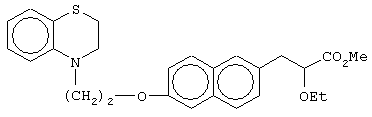
Целевое соединение (1.25 г, 75%) получали в виде бесцветного сиропа из полученного в примере 11 этил-(Е/Z)-3-[6-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]нафтил]-2-этоксипропеноата (1.7 г, 3.67 ммоль) методом, аналогичным описанному в примере 2,
1Н-ЯМР (CDCl3, 200 МГц): 1.14 (т, 3Н, J=7.06 Гц), 3.06 (т, 2Н, J=5.21 Гц), 3.13 (д, 2Н, J=7.15 Гц), 3.29-3.37 (м, 1Н), 3.57-3.64 (м, 1Н), 3.70 (с, 3Н), 3.77-3.83 (м, 4Н), 4.09 (т, 1Н, J=7.2 Гц), 4.25 (т, 2Н, J=5.81 Гц), 6.62-6.79 (м, 2Н), 6.96-7.36 (м, 5Н), 7.60-7.70 (м, 3Н).
Пример 13
Этил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-гидроксипропаноат
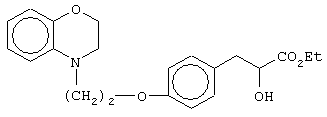
Целевое соединение (0.14 г, 32%) получали в виде вязкой жидкости из 2-(2,3-дигидро-1.4-бензоксазин-4-ил)этилметансульфоната (0.36 г, 1.42 ммоль), карбоната калия (0.80 г, 5.8 ммоль) и этил-2-гидрокси-3-(4-гидроксифенил)пропаноата (0.3 г, 1.42 ммоль), используя условия, аналогичные описанным в методике 2.
1Н-ЯМР (CDCl3, 200 МГц): 1.24 (т, ЗН, J=7.15 Гц), 2.71 (д, 1Н, J=6.23 Гц, обменивается в D2О), 2.84-3.10 (м, 2Н), 3.50 (т, 2Н, J=4.47 Гц), 3.67 (т, 2Н, J=5.48 Гц), 4.11-4.26 (м, 6Н), 4,37-4.39 (м, 1Н), 6.61-6.86 (м, 6Н), 7.11 (д, 2Н, J=8.62 Гц).
Пример 14
Этил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-гидроксипропаноат
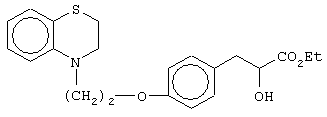
Целевое соединение (1.9 г, 17%) получали в виде вязкой жидкости из 2-(2,3-дигидро-1,4-бензотиазин-4-ил)этилметансульфоната (8.2 г, 30.0 ммоль), карбоната калия (20.7 г, 150 ммоль) и этил-2-гидрокси-3-(4-гидроксифенил)пропаноата (6.3 г, 30,0 ммоль), используя условия, аналогичные описанным в методике 2.
1Н-ЯМР (CDCl3, 200 МГц): 1.29 (т, 3Н, J=7.11 Гц), 2.70-2.80 (уш. с, 1Н, обменивается в D2O), 2.82-3.15 (м, 4Н), 3.65-3.82 (м, 4Н), 4.10-4.30 (м, 4Н), 4.28-4.40 (м, 1Н), 6.62-6.89 (м, 4Н), 6.92-7.18 (м, 4Н).
Пример 15
Этил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-бензилоксипропаноат
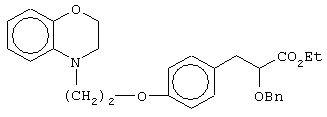
Раствор этил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-гидроксипропаноата (0.5 г, 1.34 ммоль), полученного в примере 13, в сухом диметилформамиде (5 мл) прибавляли к перемешиваемой и охлажденной льдом суспензии гидрида натрия (60% дисперсия в масле) (0.08 г, 1.66 ммоль) в сухом диметилформамиде (3 мл) в атмосфере азота. Реакционную смесь перемешивали при 0°С в течение 30 минут с последующим прибавлением бензилбромида (0.46 г, 2.69 ммоль). Смеси давали нагреться до 25°С и продолжали перемешивание последующие 18 часов. Прибавляли воду (25 мл) и экстрагировали этилацетатом (2×50 мл). Объединенный органический слой промывали водой (50 мл), солевым раствором (50 мл), сушили над сульфатом натрия и фильтровали. Растворитель упаривали при пониженном давлении, и остаток хроматографировали на силикагеле, используя смесь этилацетат-петролейный эфир (2:8) в качестве элюента, получали целевое соединение (0.3 г) наряду с бензил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-бензилоксипропаноатом. Эту смесь (1:1) без разделения использовали в примере 47.
1Н-ЯМР (CDCl3, 200 МГц): 1.23 (т, 1.5Н, J=7.05 Гц), 2.99 (д, 4Н, J=7.06 Гц), 3.10-3.72 (м, 8Н), 4.05-4.30 (м, 12Н), 4.32-4.71 (м, 4Н), 5.13 (с, 2Н), 6.55-6.89 (м, 12Н), 7.05-7.36 (м, 19Н).
Пример 16
Этил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-бутоксипропаноат
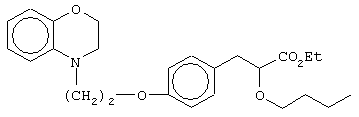
Целевое соединение (0.4 г, 52%) получали в виде вязкой жидкости из 2-(2,3-дигидро-1,4-бензоксазин-4-ил)этилметансульфоната (0.46 г, 1.78 ммоль), карбоната калия (0.98 г, 7.12 ммоль) и этил-2-бутокси-3-(4-гидроксифенил)пропаноата (0.47 г, 1.78 ммоль), используя условия, аналогичные описанным в методике 2.
1Н-ЯМР (CDCl3, 200 МГц): 0.84 (т, 3Н, J=7.53 Гц), 1.19-1.34 (м, 5Н), 1.43-1.55 (м, 2Н), 2.92 (д, 2Н, J=6.32 Гц), 3.22-3.36 (м, 1Н), 3.48-3.59 (м, 3Н), 3.68 (т, 2Н, J=5.82 Гц), 3.93 (т, 1Н, J=6.2 Гц), 4.11-4.24 (м, 6Н), 6.61-6.86 (м, 6Н), 7.13 (д, 2Н, J-8.3 Гц).
Пример 17
Этил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-гексилоксипропаноат
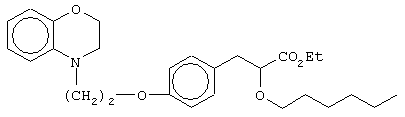
Целевое соединение (0.31 г, 50%) получали в виде бесцветного сиропа из 2-(2,3-дигидро-1,4-бензоксазин-4-ил)этилметансульфоната (0.35 г, 1.3 ммоль), карбоната калия (0.75 г, 5.4 ммоль) и этил-2-гексилокси-3-(4-гидроксифенил)пропаноата (0.4 г, 1.3 ммоль), используя условия, аналогичные описанным в методике 2.
1H-ЯМР (СDСl3, 200 МГц): 0.85 (т, 3Н, J=5.72 Гц), 1.20-1.34 (м, 7Н), 1.40-1.66 (м, 4Н), 2.93 (д, 2Н, J=6.0 Гц), 3.21-3.31 (м, 1Н), 3.49-3.60 (м, 3Н), 3.68 (т, 2Н, J=5.72 Гц), 3.93 (т, 1Н, J=5.81 Гц), 4.11-4.24 (м, 6Н), 6.62-6.81 (м, 5Н), 7.09-7.16 (м, 3Н).
Пример 18
Этил-(Е/Z)-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-феноксипропеноат
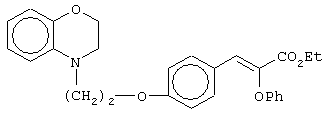
Целевое соединение (0.92 г, 58%) получали в виде смеси изомеров E/Z (40:60) в виде сиропообразной жидкости из 4-[2-(2,3-дигидро-1.4-бензоксазин-4-ил)этокси]бензальдегида (1.0 г, 3.0 ммоль) и триэтил-2-феноксифосфоноацетата (A.G.Schultz, и др., J. Org. Chem., 1983, 48, 3408) (1.3 г, 4.0 ммоль) способом, аналогичным описанному в примере 1.
1Н-ЯМР (CDCl3, 200 МГц): 1.06, 1.18 (2т, перекрываются, 3Н, изомерные OEt), 3.43-3.57 (м, 2Н), 3.64-3.75 (м, 2Н), 4.06-4.28 (м, 6Н), 6.60-6.90 (м, 8Н), 6.94-7.12 (м, 2Н), 7.22-7.45 (м, 3Н), 7.64 (д, 1Н, J=8.72 Гц).
Пример 19
Метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-феноксипропаноат
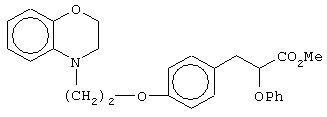
Целевое соединение (0.49 г, 57%) получали в виде смолообразного вещества из полученного в примере 18 этил-(Е/Z)-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-феноксипропеноата (0.9 г, 2.0 ммоль) методом, аналогичным описанному в примере 2.
1Н-ЯМР (CDCl3, 200 МГц): 3.17 (д, 2Н, J=6.2 Гц), 3.50(т, 2Н, J=4.3 Гц), 3.65-3.70 (м, 5Н), 4.14 (т, 2Н, J=5.76 Гц), 4.21 (т, 2Н, J=4.15 Гц), 4.75 (т, 1Н, J=6.4 Гц), 6.61-6.98 (м, 9Н), 7.17-7.27 (м, 4Н).
Пример 20
Этил-(Е/Z)-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-феноксипропеноат
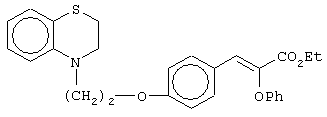
Целевое соединение (3.7 г, 60%) получали в виде смеси изомеров E/Z (35:65) в виде сиропообразного вещества из 4-[2-(2,3-дигидро-1.4-бензотиазин-4-ил)этокси]бензальдегида (4.0 г, 13.0 ммоль) и триэтил-2-феноксифосфоноацетата (A.G. Schultz, и др., J. Org. Chem., 1983, 48, 3408) (5.07 г, 16.0 ммоль) способом, аналогичным описанному в примере 1.
1Н-ЯМР (СDСl3, 200 МГц): 1.05-1.36 (м, 3Н), 3.00-3.11 (м, 2Н), 3.64-3.85 (м, 4Н), 4.09-4.30 (м, 4Н), 6.58-7.13 (м, 8Н), 7.20-7.46 (м, 4Н), 7.65 (д, 2Н, J=8.7 Гц).
Пример 21
Метил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-феноксипропаноат
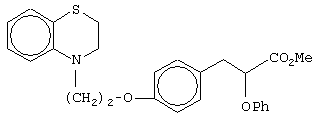
Целевое соединение (2.3 г, 64%) получали в виде смолообразного вещества из полученного в примере 20 этил-(Е/Z)-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-феноксипропеноата (3,7 г, 8.0 ммоль) методом, аналогичным описанному в примере 2.
1Н-ЯМР (CDCl3, 200 МГц): 2.99 (т, 2Н, J=5.439 Гц), 3.15 (д, 2Н, J=5.99 Гц), 3.60-3.78 (м, 7Н), 4.13 (т, 2Н. J=5.4 Гц), 4,74 (т, 1Н, J=6.23 Гц), 6.58-6.89 (м, 6Н), 6.90-7.06 (м,2Н), 7.11-7.30 (м, 5Н).
Пример 22
Этил-(Е/Z)-3-[4-(4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метоксифенил]-2-этоксипропеноат
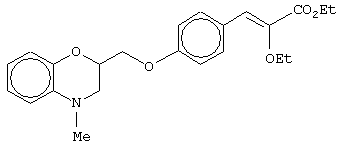
Целевое соединение (0.4 г, 25%) получали в виде смеси изомеров E/Z (1:1) в виде коричневой жидкости из полученного по методике 4 4-(4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метоксибензальдегида (1.2 г, 4.24 ммоль) методом, аналогичным описанному в примере 1.
1Н-ЯМР (CDCl3, 200 МГц): 1.36 (т, 6Н, J=7.1 Гц), 2.90 (с, 3Н), 3.26-3.45 (м, 2Н), 3.99 (к, 2Н, J=7.2 Гц), 4.10-4.38 (м, 4Н), 4.50-4,60 (м, 1Н), 6.70 (д, 2Н, J=7.47 Гц), 6.81-6.90 (м, 5Н), 7.75 (д, 2Н, J=8.8 Гц).
Пример 23
Метил-3-[4-(4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метоксифенил]-2-этоксипропаноат
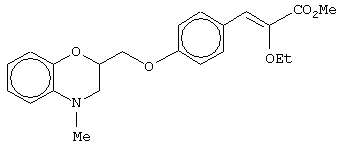
Целевое соединение (0.25 г, 65%) получали в виде густой жидкости из полученного в примере 22 этил-(Е/Z)-3-[4-(4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метоксифенил]-2-этоксипропеноата (0.4 г, 1.0 ммоль) методом, аналогичным описанному в примере 2.
1Н-ЯМР (CDCl3, 200 МГц): 1.16 (т, 3Н, J=7.0 Гц), 2.89 (с, 3Н), 2.95 (д, 2Н, J=6.2 Гц), 3.19-3.41 (м, 3Н), 3.55-3.66 (м, 1Н), 3.70 (с, 3Н), 3.95-4.24 (м, 3Н), 4.60-4.64 (м, 1Н), 6.64-7.08 (м, 6Н), 7.15 (д, 2Н, J=8.4 Гц).
Пример 24
Этил-(Е/Z)-3-[4-(4-бензил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метоксифенил]-2-этоксипропеноат
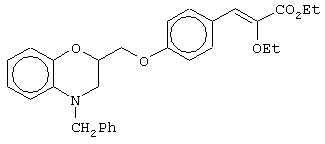
Целевое соединение (3.0 г, 76%) получали в виде смеси изомеров E/Z (1:1) в виде сиропообразной жидкости из полученного по методике 5 4-(4-бензил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метоксибензальдегида (3.0 г, 8.35 ммоль) методом, аналогичным описанному в примере 1.
1Н-ЯМР (CDCl3, 200 МГц): 1,33-1.40 (м, 6Н), 3.39-3.44 (м, 2Н), 3.99 (к, 2Н, J=7.0 Гц), 4.11-4.38 (м, 4Н), 4.46 (д, 2Н, J=5.0 Гц), 4.52-4.66 (м, 1Н), 6.60-6.97 (м, 7Н), 7.28 (с, 5Н), 7,75 (д, 2Н, J=8.8 Гц).
Пример 25
Метил-3-[4-(4-бензил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метоксифенил]-2-этоксипропаноат
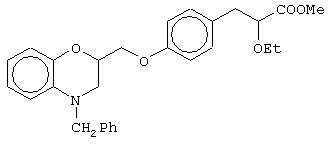
Целевое соединение (1.5 г, 100%) получали из синтезированного в примере 24 этил-(Е/Z)-3-[4-(4-бензил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метоксифенил]-2-этоксипропеноата (1.5 г, 3.17 ммоль) методом, аналогичным описанному в примере 2.
1Н-ЯМР (CDCl3, 200 МГц): 1.17 (т, 3Н, J=7.0 Гц), 2.96 (д, 2Н, J=6.6 Гц), 3.31-3.57 (м, 3Н), 3.60-3.70 (м, 1Н), 3.71 (с, 3Н), 3.97-4.26 (м, 3Н), 4.47 (д, 2Н, J=4.0 Гц), 4.56-4.61 (м, 1Н), 6.68-6.90 (м, 6Н), 7.15 (д, 2Н, J=8.5 Гц), 7.29 (с, 5Н).
Пример 26
3-[4-[2-(2,3-Дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропановая кислота

К раствору метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропаноата (4.7 г, 12.2 ммоль), полученного в примере 2, в метаноле (50 мл) прибавляли водный 10% гидроксид натрия (28 мл). Смесь перемешивали при 25°С в течение 3 часов. Растворитель удаляли при пониженном давлении, остаток подкисляли 2 н. соляной кислотой, экстрагировали этилацтатом (2×100 мл). Объединенные органические слои промывали водой (75 мл), солевым раствором (50 мл), сушили над сульфатом натрия, фильтровали, растворитель упаривали при пониженном давлении. Остаток хоматографировали на силикагеле, используя этилацетат, получали целевое соединение (3.0 г, 66%) в виде вязкой жидкости.
1Н-ЯМР (CDCl3, 200 МГц): 1.17 (т, 3Н, J=6.96 Гц), 2.85-3.12 (м, 2Н), 3.40-3.61 (м, 4Н), 3.69 (т, 2Н, J=5.72 Гц), 4.04 (дд, 1Н, J=7.38 и 4.27 Гц), протон группы СООН не наблюдается вследствие уширения.
Пример 27
3-[4-[2-(2,3-Дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропановая кислота, натриевая соль
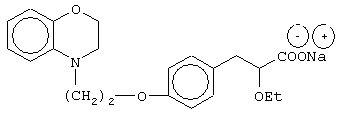
Смесь, состоящую из 3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропановой кислоты (0.15 г, 0.4 ммоль), полученной в примере 26, и метилата натрия (23.4 мг) в метаноле (5 мл), перемешивали при 25°С в течение 2 часов. Растворитель удаляли, остаток обрабатывали сухим эфиром (3×10 мл). Образовавшиеся осадки фильтровали, промывали сухим эфиром (2×5 мл) и сушили над пятиокисью фосфора в вакууме, получая целевое соединение (0.12 г, 75%) в виде бесцветного гигроскопичного твердого вещества.
1Н-ЯМР (DMSO-d6, 200 МГц): 0.98 (т, 3Н, J=6.83 Гц), 2.60-2.69 (м, 1Н), 2.78-2.92 (м, 1Н), 3.05-3.21 (м, 2Н), 3.41-3.75 (м, 5Н), 4.08-4.21 (м, 4Н), 6.49-6.85 (м,6Н), 7.12 (д,2Н, J=8.3Гц).
Пример 28
3-[2-(2,3-Дигидро-1,4-бензоксазин-4-ил)метилбензофуран-5-ил]-2-этоксипропановая кислота
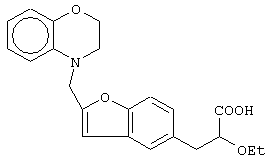
Целевое соединение (0.5 г, 87%) получали в виде смолообразного вещества из полученного в примере 5 метил-3-[2-(2,3-дигидро-1.4-бензоксазин-4-ил)метилбензофуран-5-ил]-2-этоксипропаноата (0.6 г, 1.5 ммоль) методом, аналогичным описанному в примере 26.
1Н-ЯМР (CDCl3, 200 МГц): 1.26 (т, 3Н, J=7.06 Гц), 3.05-3.28 (м, 2Н), 3.40-3.68 (м, 4Н), 4.09 (дд, 1Н, J=7.47 и 4.24 Гц), 4.28 (т, 2Н, J=4.15 Гц), 4.53 (с, 2Н), 6.52 (с, 1Н), 6.60-6.90 (м, 4Н), 7.13 (д, 1Н, J=8.7 Гц), 7.32-7.36 (м, 2Н), протон СООН не наблюдается вследствие уширения.
Пример 29
3-[4-[2-(2,3-Дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропановая кислота
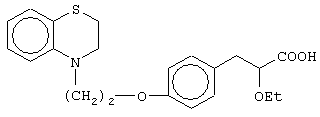
Целевое соединение (1.4 г, 63%) получали в виде смолообразного вещества из полученного в примере 6 метил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропаноата (2.3 г, 5.73 ммоль)методом, аналогичным описанному в примере 26.
1H-ЯМР (CDCl3, 200 МГц): 1.18 (т, 3Н, J=7,0 Гц), 2.82-3.15 (м, 4Н), 3.40-3.68 (м, 2Н), 3.70-3.81 (м, 4Н), 4.05 (дд, 1Н, J=7.29 и 4.33 Гц), 4.16 (т, 2Н, J=5.72 Гц), 6.68-6.74 (м, 2Н), 6.81 (д, 2Н, J=8.5 Гц), 6.94-7.06 (м, 2Н), 7.14 (д, 2Н, J=8.5 Гц), протон СООН не наблюдается вследствие уширения.
Пример 30
3-[4-[2-(2,3-Дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропановая кислота, натриевая соль
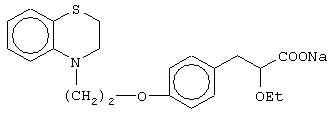
Целевое соединение (0.42 г, 81%) получали из полученной в примере 29 3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропановой кислоты (0.5 г, 1.30 ммоль) методом, аналогичным описанному в примере 27.
1Н-ЯМР (CDCl3, 200 МГц): 0.98 (т, 3Н, J=7.0 Гц). 2.72-3.25 (м, 5Н), 3.30-3.51 (м, 1Н), 3.61-3.73 (м, 4Н), 3.82-3.91 (м, 1Н), 4.04 (т, 2Н, J=5.72 Гц), 6.52-6.79 (м, 4Н), 6.91-7.03 (м, 2Н), 7.10 (д, 2Н, J=8.4 Гц).
Пример 31
3-[4-[2-(2,3-Дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропанамид
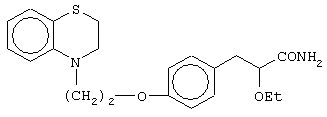
Раствор оксалилхлорида (0.28 г, 3.1 ммоль) и 3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропановой кислоты (0.6 г, 1.55 ммоль), полученной в примере 29, в сухом дихлорметане (10 мл) нагревали при кипении в течение 2 часов. Растворитель и избыток оксалилхлорида удаляли при пониженном давлении. Остаток растворяли в дихлорметане и перемешивали с водным аммиаком (5 мл) в течение 30 минут. Реакционную смесь экстрагировали хлороформом (2×25 мл). Объединенные органические слои промывали водой (25 мл), сушили над сульфатом натрия, фильтровали и упаривали растворитель при уменьшенном давлении. Остаток хроматографировали на силикагеле, используя смесь этилацетат-петролейный эфир (7:3) в качестве элюента, получали целевое соединение (0.32 г, 54%) в виде белого твердого вещества, т.пл. 120-122°С.
1Н-ЯМР (CDCl3, 200 МГц): 1.15 (т, 3Н, J=6.96 Гц), 2.81-3.20 (м, 4Н), 3.38-3.58 (м, 2Н), 3.71-3.90 (м, 4Н), 3.91 (дд, 1Н, J=7.38 и 3.73 Гц), 4.16 (т, 2Н, J=5.58 Гц), 5.54 (уш.с, 1Н, обменивается в D2O), 6.44 (уш.с, 1Н, обменивается в D2О), 6.59-6.84 (м, 4Н), 6.92-7.19 (м, 4Н).
Пример 32
N-Метил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропанамид
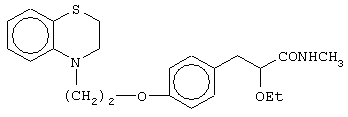
К охлажденному льдом раствору 3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропановой кислоты (0.3 г, 0.78 ммоль), полученной в примере 29, и триэтиламина (0.162 г, 1.6 ммоль) в сухом хлорметане (10 мл) прибавляли пивалоилхлорид (0.10 г, 0.86 ммоль), продолжали перемешивание в течение 30 минут при 0°С. К упомянутой выше реакционной смеси прибавляли метиламин (40% раствор) (0.124 мл) при 25°С и продолжали перемешивание в течение 1 часа при 25°С. Прибавляли воду (20 мл) и экстрагировали этилацетатом (2×20 мл). Объединенный органический экстракт промывали водой (10 мл), солевым раствором (10 мл), сушили над сульфатом натрия, фильтровали и упаривали растворитель в вакууме при пониженном давлении. Остаток хроматографировали на силикагеле, используя смесь этилацетат-петролейный эфир (1:1), получали целевое соединение в виде бесцветного твердого вещества, т.пл. 80-82°С.
1Н-ЯМР (CDCl3, 200 МГц): 1.11 (т, 3Н, J=7.0 Гц), 2.76 (д, 3Н, J=4.89 Гц), 2.81-2.88 (м, 1Н), 3.01-3.12 (м, 3Н), 3.39-3.52 (м, 2Н), 3.70-3.81 (м, 4Н), 3.86-3.91 (м, 1H), 4.14 (т, 2H, J=5.81 Гц), 6.48 (уш. с, 1Н), 6.61-6.81 (м, 4Н), 6.94-7.14 (м, 4Н).
Пример 33
3-[4-[2-(2,3-Дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропанамид
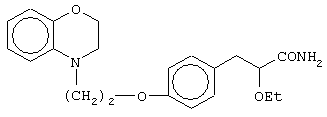
Целевое соединение (0.2 г, 80%) получали в виде белого твердого вещества из полученной в примере 26 3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропановой кислоты (0.25 г, 0.67 ммоль) и водного аммиака (4 мл) методом, аналогичным описанному в примере 31, т.пл. 107-109°С.
1Н-ЯМР (CDCl3, 200 МГц): 1.13 (т, 3Н, J=6.96 Гц), 2.81-2.93 (м, 1Н), 3.03-3.19(м, 1Н), 3.34-3.59 (м, 4Н), 3.69 (т, 2Н, J=5.53 Гц), 3.88 (дд, 1H, J=7.43 и 3.7 Гц), 4.15 (т, 2Н, J=5.58 Гц), 4.28 (т, 2Н, J=4.24 Гц), 5.49 (уш.с, 1Н, обменивается в D2O), 6.43 (уш.с, 1Н, обменивается в D2O), 6.68-6.87 (м, 6Н), 7.15 (д, 2Н, J=8.49 Гц).
Пример 34
N-Метил-3-[4-[2-(2,3-дигидро-1.4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропанамид
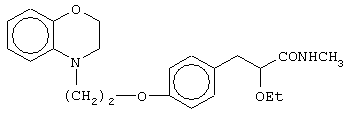
Целевое соединение (0.23 г, 74%) получали в виде белого твердого вещества из полученной в примере 26 3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропановой кислоты (0.3 г, 0.8 ммоль) и метиламина (40% раствор) (2 мл) методом, аналогичным описанному в примере 32, т.пл. 97-99°С.
1Н-ЯМР (CDCl3, 200 МГц): 1.14 (т, 3Н, J=7.0 Гц), 2.76 (д, 3Н, J=4.98 Гц), 4.80-4.90 (м, 1Н), 3.02-3.14 (м, 1Н), 3.35-3.45 (м, 2Н), 3.52 (т, 2Н, J=4.57 Гц), 3.68 (т, 2Н, J=5.81 Гц), 7.88 (дд, 1Н, J=7.06 и 3.74 Гц), 4.14 (т, 2Н, J=5.72 Гц), 4.22 (т, 2Н, J=4.15 Гц), 6.50 (уш.с, 1Н), 6.55-6.89 (м, 6Н), 7.11 (д, 2Н, J=8.3 Гц).
Пример 35
N-Бензил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропанамид
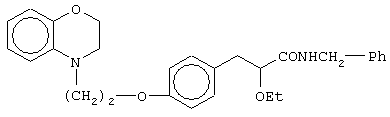
Целевое соединение (0.25 г, 67%) получали в виде белого твердого вещества из полученной в примере 26 3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропановой кислоты (0.3 г, 0.8 ммоль) и бензиламина (0.095 г, 0.88 ммоль) методом, аналогичным описанному в примере 32, т.пл. 94-96°С.
1Н-ЯМР (СDСl3, 200 МГц): 1.11 (т, 3Н, J=7.0 Гц), 2.82-3.18 (м, 2Н), 3.40-3.55 (м, 4Н), 3.70 (т, 2Н, J=5.49 Гц), 3.94-3.98 (м. 1Н), 4.14 (т, 2Н, J=5.72 Гц), 4.23 (т, 2Н, J=4.24 Гц), 4.28-4.52 (м, 2Н), 6.60-6.87 (м, 6Н), 7.06-7.32 (м, 7Н), протон CONH не наблюдается вследствие уширения.
Пример 36
N-Бензил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропанамид
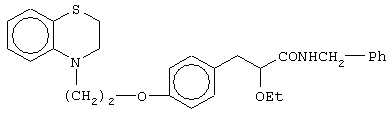
Целевое соединение (0.22 г, 74%) получали в виде белого твердого вещества из полученной в примере 29 3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропановой кислоты (0.25 г, 0.65 ммоль) и бензиламина (0.076 г, 0.71 ммоль) методом, аналогичным описанному в примере 32, т. пл. 92-93°С.
1Н-ЯМР (CDCl3, 200 МГц): 1.15 (т, 3Н, J=7.0 Гц), 2.88-3.20 (м, 4Н), 3.42-3.60 (м, 2Н), 3.73-3.87 (м, 4Н), 3.98-4.06 (м, 1Н), 4.18 (т, 2Н, J=5.72), 4.30-4.56 (м, 2Н), 6,61-6.90 (м, 4Н), 7.00-7.43 (м, 9Н), протон CONH не наблюдается вследствие уширения.
Пример 37
2-Метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропановая кислота
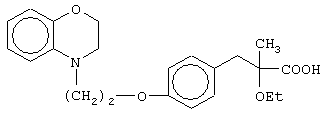
Целевое соединение (0.3 г, 62%) получали в виде вязкой жидкости из полученного в примере 7 метил-2-метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропаноата (0.5 г, 1.2 ммоль) методом, аналогичным описанному в примере 26.
1H-ЯМР (CDCl3, 200 МГц): 1.24 (м, 6Н), 2.98, 3.04 (2д, 2Н, J=14.1 Гц), 3.51 (т, 2Н, J=4.25 Гц), 3.49-3,71 (м, 4Н), 4.15 (т, 2Н, J=5.63 Гц), 4.22 (т, 2Н, J=4.48 Гц), 6.60-6.87 (м, 6Н), 7.07 (д, 2Н, J=8.67 Гц), протон СООН не наблюдается вследствие уширения.
Пример 38
2-Метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропановая кислота, натриевая соль
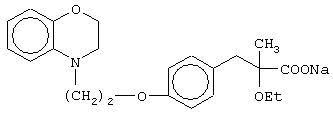
Целевое соединение (0.12 г, 51%) получали в виде белого твердого вещества из полученной в примере 37 2-метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропановой кислоты (0.22 г, 0.57 ммоль) методом, аналогичным описанному в примере 27.
1Н-ЯМР (CDCl3, 200 МГц): 0.96-1.08 (м, 6Н), 2.79 (с, 2Н), 3.28-3.52 (м, 4Н), 3.64 (т, 2Н, J=5.3 Гц), 4.05-4.19 (м, 4Н), 6.48-6.59 (м, 1Н), 6.62-6.86 (м, 4Н), 7.03-7.28 (м, 3Н).
Пример 39
2-(2-Фторбензил)-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропановая кислота
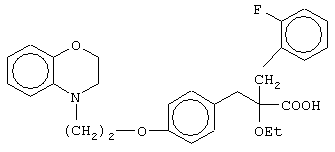
Целевое соединение (0.25 г, 42%) получали в виде вязкой жидкости из полученного в примере 8 метил-2-(2-фторбензил)-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропаноата (0.6 г, 1.2 ммоль) методом, аналогичным описанному в примере 26.
1Н-ЯМР (CDCl3, 200 МГц): 1.12 (т, 3Н, J=6.82), 1.65 (уш. с, 1Н, обменивается в D2O), 3.11-3.42 (м, 4Н), 3.50 (т, 2Н, J=4.34 Гц), 3.68 (т, 2Н, J=5.67 Гц), 3.70-3.89 (м, 2Н), 4.14 (т, 2Н, J=5.67 Гц), 4.21 (т, 2Н, J-4.15 Гц), 6.62-6.86 (м, 6Н), 7.03-7.12 (м, 4Н), 7.18-7.30 (м, 2Н).
Пример 40
2-(2-Фторбензил)-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропановая кислота, натриевая соль
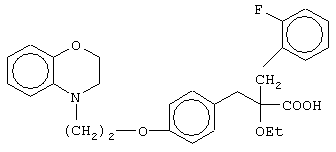
Целевое соединение (0.11 г, 48%) получали в виде белого твердого вещества из полученной в примере 39 2-(2-фторбензил)-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропановой кислоты (0.22 г, 0.45 ммоль) методом, аналогичным описанному в примере 27.
1Н-ЯМР (CDCl3, 200 МГц): 1.02 (т, 3Н, J=6.65 Гц), 2.75-2.92 (м, 4Н), 3.39-3.58 (м, 4Н), 3.62 (уш.с, 2Н), 4.04-4.20 (м, 4Н), 6.49-6.82 (м, 5Н), 6.90-7.28 (м, 6Н), 7.49-7.13 (м, 1Н).
Пример 41
3-[4-[2-(3-Оксо-2Н-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропановая кислота
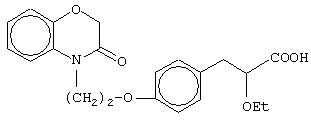
Целевое соединение (0.75 г, 77%) получали в виде белого твердого вещества из полученного в примере 10 метил-3-[4-[2-(3-оксо-2Н-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропаноата (1.0 г, 2.5 ммоль) методом, аналогичным описанному в примере 26, т.пл. 90-93°С.
1Н-ЯМР (СDCl3, 200 МГц): 1.18 (т, 3Н, J=6.96 Гц), 2.88-3.13 (м, 2Н), 3,41-3.63 (м, 2Н), 4.06 (дд, 1Н, J=7.43 и 4.33 Гц), 4.25-4.52 (м, 4Н), 4.61 (с, 2Н), 6.80 (д, 2Н, J=8.62 Гц), 7.00-7.34 (м, 6Н), протон СООН не наблюдается вследствие уширения.
Пример 42
3-[4-[2-(3-Оксо-2Н-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропановая кислота, натриевая соль
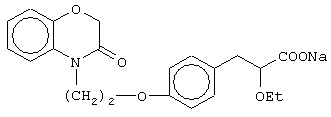
Целевое соединение (0.12 г, 56%) получали в виде белого твердого вещества из полученной в примере 41 3-[4-[2-(3-оксо-2Н-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропановой кислоты (0.2 г, 0.51 ммоль) методом, аналогичным описанному в примере 27.
1Н-ЯМР (CDCl3, 200 МГц): 0.99 (т, 3Н, J=6.97 Гц), 2.61-2.80 (м, 2Н), 3.32-3.57 (м, 1Н), 3.60-3.72 (м, 1Н), 3.65-3.70 (м, 1Н), 4.18 (уш.с, 2Н), 4.30 (уш.с, 2Н), 4.68 (с, 2Н), 6.78 (д, 2Н, J=8.4 Гц), 7.03-7.14 (м, 5Н), 7.42 (д, 1Н, J=7.06 Гц).
Пример 43
3-[6-[2-(2,3-Дигидро-1,4-бензотиазин-4-ил)этокси]нафтил]-2-этоксипропановая кислота

Целевое соединение (0.8 г, 69%) получали в виде белого твердого вещества из полученного в примере 12 метил-3-[6-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]нафтил]-2-этоксипропаноата (1.2 г, 2.66 ммоль) методом, аналогичным описанному в примере 26, т. пл. 102-104°С.
1Н-ЯМР (CDCl3, 200 МГц): 1.15 (т, 3Н, J=7.01 Гц), 3.06 (т, 2Н, J=4.98 Гц), 3.08-3.63 (м, 4Н), 3.77-3.83 (м, 4Н), 4.15 (дд, 1Н, J=4.15 и 4.18 Гц), 4.28 (т, 2Н, J=5.95 Гц), 6.59-6.79 (м, 2Н), 6.96-7.36 (м, 5Н), 7.61-7.79 (м, 3Н), протон СООН не наблюдается вследствие уширения.
Пример 44
3-[6-[2-(2,3-Дигидро-1,4-бензотиазин-4-ил)этокси]нафтил]-2-этоксипропановая кислота, натриевая соль
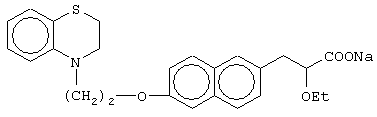
Целевое соединение (0.16 г, 76%) получали в виде белого твердого вещества из полученной в примере 43 3-[6-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]нафтил]-2-этоксипропановой кислоты (0.2 г, 0.457 ммоль) методом, аналогичным описанному в примере 27, т.пл. 138-140°С.
1Н-ЯМР (DMSO-d6, 200 МГц): 0.98 (т, 3Н, J=7.06 Гц), 2.72-2.90 (м, 1Н), 2.92-3.21 (м, 3Н), 3.32-3.54 (м, 2Н), 3.61-3.91 (м, 5Н), 4.28 (уш.с, 2Н), 6.56 (т, 1Н, J=7.00 Гц), 6.73-7.00 (м, 3Н), 7,05-7.30 (м, 2Н), 7.38 (д, 1Н, J=8.3 Гц), 7.60-7.82 (м, 3Н).
Пример 45
3-[4-[2-(2,3-Дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-гидроксипропановая кислота
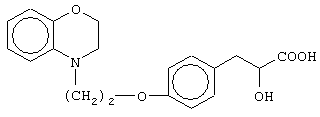
Целевое соединение (0.06 г, 43%) получали в виде коричневой вязкой жидкости из полученного в примере 13 этил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-гидроксипропаноата (0.15 г, 0.40 ммоль) методом, аналогичным описанному в примере 26.
1H-ЯМР (СDСl3, 200 МГц): 2.85-3.19 (м, 2Н), 3.43 (т, 2Н, J=4.15 Гц), 3.61 (т, 2Н, J=5.49 Гц), 4.07 (т, 2Н, J=5.40 Гц), 4.16 (т, 2Н, J=4.48 Гц), 4.45 (уш. с, 1Н), 6.50-6.82 (м, 6Н), 7.08 (д, 2Н, J=7.88 Гц), протоны СООН и ОН не наблюдаются вследствие уширения.
Пример 46
3-[4-[2-(2,3-Дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-гидроксипропановая кислота

Целевое соединение (0.7 г, 46%) получали в виде белого твердого вещества из полученного в примере 14 этил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-гидроксипропаноата (1.7 г, 4.39 ммоль) методом, аналогичным описанному в примере 26, т.пл. 74-76°С.
1Н-ЯМР (CDCl3, 200 МГц): 2.88-3,18 (м, 4Н), 3.69-3.79 (м, 4Н), 4.15 (т, 2Н, J=5.72 Гц), 4.45 (дд, 1Н, J=6.73 и 4.79 Гц), 4.51-4.97 (уш.с, 1Н, обменивается в D2o), 6.65-6.89 (м, 4Н), 6.94-7.17 (м, 4Н), протон СООН не наблюдается вследствие уширения.
Пример 47
3-[4-[2-(2,3-Дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-бензилоксипропановая кислота

Целевое соединение (0.15 г, 67%) получали в виде густой жидкости из полученного в примере 15 этил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-бензилоксипропаноата (0.24 г, 0.52 ммоль) методом, аналогичным описанному в примере 26.
1Н-ЯМР (CDCl3, 200 МГц): 1.40-2.80 (уш.с, 1Н, обменивается в D2O), 2.99-3.18 (м, 2Н), 3.51 (т, 2Н, J=4.34 Гц), 3.70 (т, 2Н, J=5.82 Гц), 4.13-4.24 (м, 5Н), 4.51 (д, 2Н, J=17.0 Гц), 6,60-6,89 (м, 6Н), 7.10-7.37 (м, 7Н).
Пример 48
3-[4-[2-(2,3-Дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-бензилоксипропановая кислота, натриевая соль
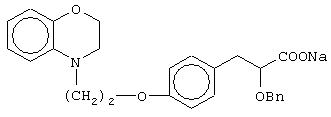
Целевое соединение (0.1 г, 73%) получали в виде гигроскопичного твердого вещества кремового цвета из полученной в примере 47 3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-бензилоксипропановой кислоты (0.13 г, 0.30 ммоль) методом, аналогичным описанному в примере 27.
1Н-ЯМР (DMSO-d6, 200 МГц): 2.62-2.74 (м, 1Н), 2.89-2.98 (м, 1Н), 3.48 (т, 2Н, J=4.2 Гц), 3.67 (т, 2Н, J=5.48 Гц), 4.12-4.26 (м, 5Н), 4.65 (д, 2Н, J=12.45 Гц), 6.45-6.84 (м, 6Н), 7.12-7.25 (м, 7Н).
Пример 49
3-[4-[2-(2,3-Дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-бутоксипропановая кислота
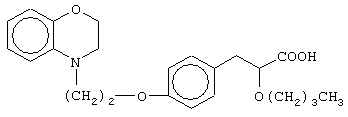
Целевое соединение (0.25 г, 67%) получали в виде вязкой жидкости из полученного в примере 16 этил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-бутоксипропаноата (0.4 г, 0.93 ммоль) методом, аналогичным описанному в примере 26.
1Н-ЯМР (CDCl3, 200 МГц): 0.87 (т, 3Н, J=7.15 Гц), 1.25-1.40 (м, 2Н), 1.49-1.66 (м, 2Н), 2.95-3.15 (м, 2Н), 3.43-3.53 (м, 4Н), 3.68 (т, 2Н, J=5,49 Гц), 4.00-4.12 (м, 1Н), 4.14 (т, 2Н, J=5.65 Гц), 4.22 (т, 2Н, J=4.25 Гц), 6.60-6,89 (м, 6Н), 7.12 (д, 2Н, J=8.39 Гц), протон СООН не наблюдается вследствие уширения.
Пример 50
3-[4-[2-(2,3-Дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-бутоксипропановая кислота, натриевая соль
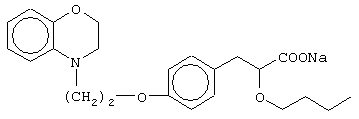
Целевое соединение (0.12 г, 57%) получали в виде гигроскопичного твердого вещества кремового цвета из полученной в примере 49 3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-бутоксипропановой кислоты (0.2 г, 0.5 ммоль) методом, аналогичным описанному в примере 27.
1Н-ЯМР (DMSO-d6, 200 МГц): 0.78 (т, 3Н, J=7.06 Гц), 1.16-1.56 (м, 4Н), 2.52-2.64 (м, 1Н), 2.79-2.87 (м, 1Н), 2.99-3,18 (м, 2Н), 3.40 (уш.с, 2Н), 3.66 (т, 2Н, J=5.31 Гц), 4.10-4.25 (м, 5Н), 6.52-6.90 (м, 6Н), 7.12 (д, 2Н, J=8.3 Гц).
Пример 51
3-[4-[2-(2,3-Дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-гексилоксипропановая кислота
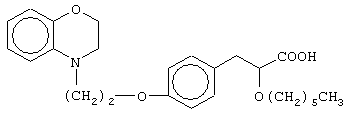
Целевое соединение (0.17 г, 60%) получали в виде зеленоватой жидкости из полученного в примере 17 этил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-гексилоксипропаноата (0.3 г, 0.65 ммоль) методом, аналогичным описанному в примере 26.
1H-ЯМР (CDCl3, 200 МГц): 0.86 (т, 3Н, J=5.72 Гц), 1.25-1.33 (м, 4Н), 1.41-1.75 (м, 4Н), 2.94-3.06 (м, 2Н), 3.36-3.58 (м, 4Н), 3.68 (т, 2Н, J=5.49 Гц), 4.01-4.06 (м, 1Н), 4.14 (т, 2Н, J=5.7 Гц), 4.22 (т, 2Н, J=4.15 Гц), 6.71-7.08 (м, 6Н), 7.12 (д, 2Н, J=8.4 Гц), протон СООН не наблюдается вследствие уширения.
Пример 52
3-[4-[2-(2,3-Дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-гексилоксипропановая кислота, натриевая соль

Целевое соединение (0.1 г, 52%) получали в виде белого гигроскопичного твердого вещества из полученной в примере 51 3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-гексилоксипропановой кислоты (0.18 г, 0.42 ммоль) методом, аналогичным описанному в примере 27.
1Н-ЯМР (DMSO-d6, 200 МГц): 0.82 (т, 3Н, J=5.72 Гц), 1.10-1.45 (м, 8Н), 2.75-2.96 (м, 2Н), 3.35-3.56 (м, 4Н), 3.67 (т, 2Н, J=5.3 Гц), 4.08-4.21 (м, 5Н), 6.50-6.82 (м, 6Н), 7.12 (д, 2Н, J=8.0 Гц).
Пример 53
3-[4-[2-(2,3-Дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-феноксипропановая кислота
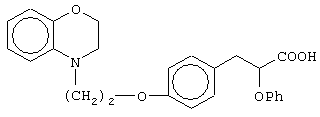
Целевое соединение (0.1 г, 53%) получали в виде бесцветной жидкости из полученного в примере 19 метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-феноксипропаноата (0.2 г, 0.461 ммоль) методом, аналогичным описанному в примере 26.
1Н-ЯМР (CDCl3, 200 МГц): 2.40-2.80 (уш.с, 1Н, обменивается в D2O), 3.22 (д, 2Н, J=5.8 Гц), 3.49 (т, 2Н, J=4.25 Гц), 3.67 (т, 2Н, J=5.81 Гц), 4.14 (т, 2Н, J=5.81 Гц), 4.21 (т, 2Н, J=4.16 Гц), 4.82 (т, 1Н, J=5.9 Гц), 6.61-7.02 (м, 8Н), 7.17-7.30 (м, 5Н).
Пример 54
3-[4-[2-(2,3-Дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-феноксипропановая кислота
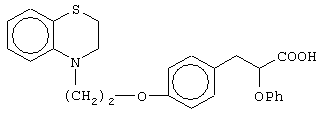
Целевое соединение (0.2 г, 51%) получали в виде смолообразного твердого вещества из полученного в примере 21 метил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-феноксипропаноата (0.4 г, 0.9 ммоль) методом, аналогичным описанному в примере 26.
1H-ЯМР (CDCl3, 200 МГц): 3.02 (т, 2Н, J=5.0 Гц), 3.22 (д, 2Н, J=6.25 Гц), 3.68-3.78 (м, 4Н), 4,14 (т, 2Н, J=5.81 Гц), 4.50 (т, 1Н, J=6.19 Гц), 4.90-5.40 (уш.с, 1Н, обменивается в D2О), 6.58-6.86 (м, 7Н), 6.94-7.07 (м, 2Н), 7.18-7.29 (м, 4Н).
Пример 55
3-[4-[2-(2,3-Дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-феноксипропановая кислота, натриевая соль
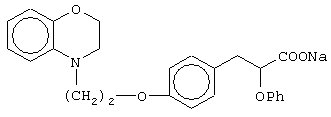
Целевое соединение (0.05 г, 48%) получали в виде гигроскопичного твердого вещества из полученной в примере 53 3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-феноксипропановой кислоты (0.1 г, 0.24 ммоль) методом, аналогичным описанному в примере 27.
1Н-ЯМР (DMSO-d6, 200 МГц): 2.81-3.09 (м, 2Н), 3.42 (уш.с, 2Н), 3.65 (т, 2Н, J=4.5 Гц), 4.12 (уш.с, 4Н), 4.22-4.32 (м, 1Н), 6.50-6.92 (м, 8Н), 7.10-7.33 (м, 5Н).
Пример 56
Метил-2-метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-феноксипропаноат
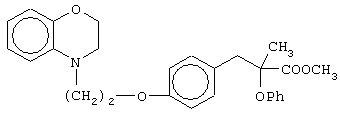
Целевое соединение (0.27 г, 87%) получали в виде вязкой жидкости из полученного в примере 19 метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-феноксипропаноата (0.3 г, 0.69 ммоль) методом, аналогичным описанному в примере 7.
1Н-ЯМР (CDCl3, 200 МГц): 1.39 (с, 3Н), 3.09, 3.26 (2д, 2Н, J=13.7 Гц), 3.51 (т, 2Н, J=4.3 Гц), 3.66-3.73 (м, 5Н), 4.15 (т, 2Н, J=5.5 Гц), 4.22 (т, 2Н, J=4.24 Гц), 6.61-7.01 (м, 9Н), 7.12-7.22 (м, 4Н).
Пример 57
2-Метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-феноксипропановая кислота
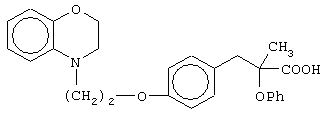
Целевое соединение (0.13 г, 50%) получали в виде бледно-желтого гигроскопичного твердого вещества из полученного в примере 56 метил-2-метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-феноксипропаноата (0.27 г, 0.60 ммоль) методом, аналогичным описанному в примере 26.
1Н-ЯМР (СDСl3, 200 МГц): 1.42 (с, 3Н), 3.12-3.29 (2д, 2Н, J=14.1 Гц), 3.50 (т, 2Н, J=4.5 Гц), 3.69 (т, 2Н, J=5.6 Гц), 4.16 (т, 2Н, J=5.81 Гц), 4.22 (т, 2Н, J=4.5 Гц), 6.62-7.17 (м, 9Н), 7.21-7.30 (м, 4Н), протон СООН не наблюдается вследствие уширения.
Пример 58
2-Метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-феноксипропановая кислота, натриевая соль
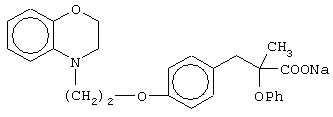
Целевое соединение (0.055 г, 46%) получали в виде бледно-желтого гигроскопичного порошка из полученной в примере 57 2-метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-феноксипропановой кислоты (0.13 г, 0.28 ммоль) методом, аналогичным описанному в примере 27.
1Н-ЯМР (СDСl3, 200 МГц): 1.15 (с, 3Н), 2.99-3.21 (м, 2Н), 3.47 (уш. с, 2Н), 3.67 (уш. с, 2Н), 4.14 (уш. с, 4Н), 6.53-6.9 (м, 9Н), 7.08-7.30 (м, 4Н).
Пример 59
Метил-2-метил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-феноксипропаноат
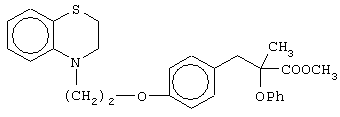
Целевое соединение (0.96 г, 93%) получали в виде бледно-желтой жидкости из полученного в примере 21 метил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-феноксипропаноата (1.0 г, 2.22 ммоль) методом, аналогичным описанному в примере 7.
1Н-ЯМР (CDCl3, 200 МГц): 1.40 (с, 3Н), 3.03 (т, 2Н, J=4.9 Гц), 3.09, 3.27 (2д, 2Н, J=13.7 Гц), 3.70-3.85 (м, 7Н), 4.16 (т, 2Н, J=5.81 Гц), 6.60-6.89 (м, 6Н), 6.96-7.30 (м, 7Н).
Пример 60
2-Метил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-феноксипропановая кислота
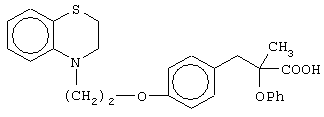
Целевое соединение (0.6 г, 65%) получали в виде вязкой жидкости из полученного в примере 59 метил-2-метил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-феноксипропаноата (0.96 г, 2.00 ммоль) методом, аналогичным описанному в примере 26.
1H-ЯМР (CDCl3, 200 МГц): 1.42 (с, 3Н), 3.03 (т, 2Н, J=5.0 Гц), 3.12, 3.30 (2д, 2Н, J=13.8 Гц), 3.70-3.80 (м, 4Н), 4.15 (т, 2Н, J=5.5 Гц), 6.58-7.08 (м, 8Н), 7.18-7.30 (м, 5Н), протон СООН не наблюдается вследствие уширения.
Пример 61
4-Нитрофенил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропаноат
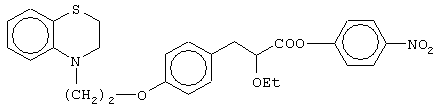
Целевое соединение (0.15 г, 38%) получали в виде желтой жидкости из полученной в примере 29 3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропановой кислоты (0.3 г, 0.77 ммоль) и 4-нитрофенола методом, аналогичным описанному в примере 32.
1Н-ЯМР (CDCl3, 200 МГц): 1.24 (т, 3Н, J=6.92 Гц), 3.04 (т, 2Н, J=5.16 Гц), 3.12 (д, 2Н, J=6.63 Гц), 3.46-3.65 (м, 1Н), 3.70-3.86 (м, 5Н), 4.16 (т, 2Н, J=5.23 Гц), 4.26 (т, 1Н, J=5.5 Гц), 6.62-6.74 (м, 2Н), 6.84 (д, 2Н, J=8.62 Гц), 6.94-7.22 (м, 6Н), 8.23 (д, 2Н, J=9.0 Гц).
Пример 62
3-[4-(4-Бензил-3,4-дигидро-2Н-1,4-бензотиазин-2-ил)метоксифенил]-2-этоксипропановая кислота
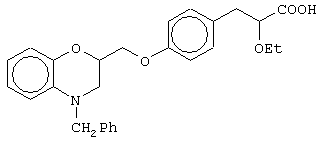
Целевое соединение (0.4 г, 57%) получали в виде вязкой жидкости из полученного в примере 25 метил-3-[4-(4-бензил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метоксифенил]-2-этоксипропаноата (0.8 г, 2.16 ммоль) методом, аналогичным описанному в примере 26.
1Н-ЯМР (CDCl3, 200 МГц): 1.17 (т, 3Н, J=7.0 Гц), 2.99-3.13 (м, 2Н), 3.31-3.65 (м, 4Н), 4.01-4.24 (м, 3Н), 4.45 (д, 2Н, J=3.4 Гц), 4.52-4.59 (м, 1Н), 6.62-6.68 (м, 6Н), 7.14 (д, 2Н, J=8.6 Гц), 7.27 (с, 5Н), протон СООН не наблюдается вследствие уширения.
Пример 63
3-[4-(4-Бензил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метоксифенил]-2-этоксипропановая кислота, натриевая соль
Целевое соединение (0.15 г, 75%) получали в виде бесцветного гигроскопичного твердого вещества из полученной в примере 62 3-[4-(4-бензил-3,4-дигидро-2Н-1,4-бензоксазин-4-ил)метоксифенил]-2-этоксипропановой кислоты (0.2 г, 0.44 ммоль) методом, аналогичным описанному в примере 27.
1Н-ЯМР (DMSO-d6, 200 МГц): 0.99 (т, 3Н, J=6.97 Гц), 2.60-2.90 (м, 2Н), 3.30-3.65 (м, 5Н), 4.16 (д, 2Н, J=5.0 Гц), 4.40-4.65 (м, 3Н), 6.55-6.89 (м, 6Н), 7.14 (д, 2Н, J=8.5 Гц), 7.32 (с, 5Н).
Пример 64
4-Нитрофенил-3-[4-(4-бензил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метоксифенил]-2-этоксипропаноат
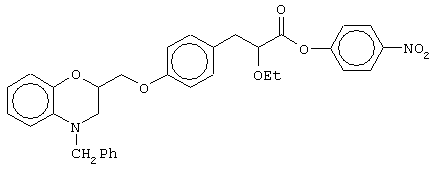
Целевое соединение (0.6 г, 100%) получали в виде темно-коричневой жидкости из полученной в примере 62 3-[4-(4-бензил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метоксифенил]-2-этоксипропановой кислоты (0.5 г, 1.34 ммоль) и 4-нитрофенола методом, аналогичным описанному в примере 32.
1Н-ЯМР (CDCl3, 200 МГц): 1.25 (т, 3Н, J=7.0 Гц), 3.14 (д, 2Н, J=6.6 Гц), 3.33-3.55 (м, 3Н), 3.69-3.77 (м, 1Н), 4.05-4.31 (м, 3Н), 4.46 (д, 2Н, J=3.4 Гц), 4.55-4.61 (м, 1Н), 6.63-6.68 (м, 6Н), 7.11-7.28 (м, 7Н), 7.52 (д, 2Н, J=7.6 Гц), 8.23 (д, 2Н, J=9.0 Гц).
Соединения по настоящему изобретению снижали произвольно выбранный уровень сахара в крови, триглицеридов, общего холестерина, LDL, VLDL и повышенный уровень HDL. Это было продемонстрировано в экспериментах in vitro, а также in vivo.
Демонстрация эффективности соединений
A) In vitro
а) Определение активности hPPRα
Связывающий лиганд домен hPPRα соединяли с дрожжевым фактором транскрипции GAL4 в эукариотическом экспрессионном векторе. Используя суперфект (фирмы Quiagen, Германия) в качестве трансфицирующего реагента, клетки линии НЕК-293 трансфицировали этой плазмидой и репортерной плазмидой, несущей ген люциферазы, контролируемый специфическим промотором GAL4. Соединение прибавляли в различных концентрациях после 24 часов трансфекции и инкубировали в течение ночи. Люциферазную активность измеряли как функцию связывания соединения/активационной способности PPRα, используя набор Packard Luclite (фирмы Packard, США) в счетчике Top Count (I.Sadowski, В.Bell, P.Broag, M.Hollis. Gene, 1992, 118:137-141; Superfect Transfection Reagent Handbook. February, 1997. Quiagen, Германия).
б) Определение активности hPPRγ
Связывающий лиганд домен hPPRγ соединяли с дрожжевым фактором транскрипции GAL4 в эукариотическом экспрессионном векторе. Используя липофектамин (фирмы Gibco BRL, США) в качестве трансфицирующего реагента, клетки линии НЕК-293 трансфицировали этой плазмидой и репортерной плазмидой, несущей ген люциферазы, контролируемый специфическим промотором GAL4. Соединение прибавляли в концентрации 1 мкМ через 48 часов после трансфекции и инкубировали в течение ночи, Люциферазную активность измеряли как функцию связывания препарата/активационной способности PPRγ, используя набор Packard Luclite (фирмы Packard, США) в счетчике Packard Top Count (I.Sadowski, B.Bell, P.Broag, M.Hollis. Gene, 1992, 118:137-141; Guide to Eukaryotic Transfections with Cationic Lipid Reagents. Life Technologies, GIBCO BRL, США).
в) Определение ингибирующей активности в отношении HMG-CoA-редуктазы
Редуктазу, связанную с микросомами печени, получали от крыс, получавших с кормом 2% холестирамин при средне-темновом цикле. Спектрофотометрические измерения проводили в смеси, состоящей из 10 мМ КН2РO4, 4 мМ DTT, 0.2 мМ NADPH, 0.3 мМ HMG-CoA и 125 мкг фермента из микросом печени. Общий объем реакционной смеси составлял 1 мл. Реакцию начинали прибавлением HMG-CoA. Реакционную смесь инкубировали при 37°С в течение 30 минут и регистрировали уменьшение поглощения при 340 нм. Реакционную смесь без субстрата использовали в качестве слепой пробы (J.L, Goldstein, M.S. Brown. “Progress in understanding the LDL receptor and HMG-CoA-reductase, two membrane proteins that regulate the plasma cholesterol” J. lipid Res. 1984, 25:1450-1461). Исследуемые соединения ингибировали фермент HMG-CoA-редуктазу.
Б) In vivo
а) Эффективность на животных моделях
Мутации в колониях лабораторных животных и различная чувствительность к пищевым режимам привели к созданию животных моделей с инсулиннезависимым диабетом и гиперлипидемией, связанной с ожирением и возможной резистентностью к инсулину. В различных лабораториях были созданы генетические модели, такие, как мыши db/db и ob/ob (Diabetes, 1982, 31(1):1-6) и крысы Zucker fa/fa, для понимания патофизиологии заболевания и определения эффективности новых антидиабетических соединений (Diabetes, 1983, 32:830-838; Ann. Rep, Sankyo Res. Lab., 1994, 46:1-57). Гомозиготные животные, мыши линии C57BL/KsJ-db/db, полученные в Jackson Laboratory, США, характеризуются ожирением, гипергликемией, гиперинсулинемией и инсулиновой резистентностью (J. Clin. Invest., 1990, 85:962-967), тогда как гетерозиготные характеризуются худобой и нормальной гликемией. На модели db/db у мышей с возрастом прогрессивно развивается инсулинопения, признак, который обычно наблюдается на поздней стадии диабета типа II у людей, когда уровни сахара в крови контролируются недостаточно. Состояние поджелудочной железы и ее функция изменяются в зависимости от модели. Поскольку эта модель напоминает сахарный диабет типа II, соединения по настоящему изобретению исследовались на активность, связанную со снижением сахара и триглицеридов в крови.
В опыте использовали мышей-самцов линии C57BL/KsJ-db/db в возрасте от 8 до 14 недель, имеющих вес в интервале от 35 до 60 г, выведенных в питомнике Dr. Reddy’s Research Foundation (DRF). Мыши получали стандартный корм (из Национального института питания (NIN), Хайдерабад, Индия) и подкисленную воду по усмотрению исполнителя. Для исследования использовали животных, имеющих более 350 мг/дал сахара в крови. В каждой группе было 4 животных.
Исследуемые соединения суспендировали в 0.25% карбоксиметилцеллюлозе и вводили исследуемой группе в дозе от 0.1 мг/кг до 30 мг/кг через оральный зонд ежедневно в течение 6 дней. Контрольная группа получала наполнитель (в дозе 10 мл/кг). На шестой день через час после введения исследуемого соединения или наполнителя брали образцы крови для оценки биологической активности.
Произвольные уровни сахара крови и триглицеридов измеряли путем отбора крови (100 мкл) через глазничный синус, используя гепаринизированный капилляр, в пробирки, содержащие EDTA, которые центрифугировали для получения плазмы. Уровни глюкозы и триглицеридов в плазме определяли спектрофотометрически с помощью соответственно глюкозооксидазы и глицерин-3-фосфатоксидазы/пероксидазы (наборы Dr. Reddy’s Laboratory, Diagnostic Division, Хайдарабад, Индия).
Активность исследуемого соединения в снижении уровней сахара крови и триглицеридов рассчитывали по формуле.
В описанном выше опыте не наблюдалось никаких побочных эффектов ни для одного из упомянутых соединений по изобретению.
Мышей ob/ob получали в пятинедельном возрасте от фирмы Bomholtgard (Дания) и использовали в возрасте 8 недель. Жирных крыс линии Zucker fa/fa получали от фирмы IffaCredo (Франция) в десятинедельном возрасте и использовали в возрасте 13 недель. Животных содержали при 12-часовом световом-темновом цикле при 25±1°С. Животные получали стандартный лабораторный корм (NIN, Хайдарабад, Индия) и воду по усмотрению исполнителя (Т.Fujiwara, S.Yoshioka, Т.Yoshioka, I.Ushiyama, H.Horikoshi. “Characterization of new oral antidiabeticagent CS-045”. Исследования на мышах КК и ob/ob и на жирных крысах Zucker.” Diabetes, 1988, 37:1549-1558).
Исследуемые соединения вводили в дозе 0.1-30 мг/кг/день в течение 9 дней. Контрольные животные получали наполнитель (0.25% карбоксиметилцеллюлоза, доза 10 мл/кг) через оральный зонд.
Образцы крови брали у сытых животных через 1 час после введения препарата на нулевой и девятый день обработки. Кровь брали из ретро-глазничного синуса через гепаринизированный капилляр в содержащие EDTA пробирки. После центрифугирования образцы плазмы делили на части для определения триглицеридов, глюкозы, свободных жирных кислот, общего холестерина и инсулина. Измерения в плазме триглицеридов, глюкозы, общего холестерина проводили с использованием коммерческих наборов (Dr. Reddy’s Laboratory, Diagnostic Division, Хайдарабад, Индия). Свободную жирную кислоту в плазме определяли с использованием коммерческого набора от фирмы Boehringer Mannheim, Германия. Инсулин в плазме определяли с использованием набора для RIA (радиоиммуноанализа) (фирмы BARC, Индия). Снижение исследованных параметров рассчитывали по формуле, приведенной ниже.
У мышей ob|ob тест переносимости вводимой перорально глюкозы осуществляли через 9 дней обработки. Мышей подвергали пятичасовому голоданию и нагружали 3 мг/кг глюкозы перорально. Через 0, 15, 30, 60 и 120 минут брали образцы крови для определения уровней глюкозы в плазме.
Результаты экспериментов с мышами db/db, ob|ob и крысами Zucker fa/fa предполагают, что новые соединения по настоящему изобретению имеют также терапевтическое применение для профилактики или регулярного лечения диабета, ожирения, сердечно-сосудистых нарушений, таких, как гипертензия, гиперлипидемия, и других заболеваний; из литературы известно, что такие заболевания являются взаимосвязанными.
Уровни глюкозы в крови и триглицеридов снижаются также при дозах выше 10 мг/кг. Обычно кривая снижения частично является дозозависимой и при определенной дозе выходит на плато.
б) Активность по снижению уровней триглицеридов плазмы и холестерина на гиперхолестеринемических крысиных моделях
Крыс-самцов линии Sprague Dawley (NIN) разводили в питомнике DRF. Животных содержали при 12-часовом световом-темновом цикле при 25±1°С. В опытах использовали крыс весом 180-200 г. У животных вызывали гиперхолестеринемию, скармливая им 2% холестерин и 1% холат натрия, смешанные со стандартным лабораторным кормом (Национальный институт питания (NIN), Хайдерабад, Индия) в течение 6 дней. В течение всего эксперимента животных держали на одной и той же диете (D.Petit, V.N.Bonnefis, С.Rey, R.Inflante. “Effects of ciprofibrate on liver lipids and lipoprotein synthesis in normo- and hyperlipidemic rats”. Atherosclerosis. 1988, 74:215-225).
Исследуемые соединения вводили перорально в дозе 0.1-30 мг/кг/день в течение 3 дней. Контрольная группа получала только наполнитель (0.25% кабоксиметилцеллюлозу; доза 10 мл/кг).
Образцы крови брали у сытых животных через 1 час после введения препарата на нулевой и третий день обработки. Кровь брали из ретро-глазничного синуса через гепаринизированный капилляр в содержащие EDTA пробирки. После центрифугирования образцы плазмы делили на части для определения общего холестерина, HDL и триглицеридов. Измерения плазменных тригицеридов, общего холестерина и HDL проводили с использованием коммерческих наборов (Dr. Reddy’s Laboratory, Diagnostic Division, Хайдарабад, Индия). Содержание холестерина LDL и VLDL рассчитывали на основании данных, полученных для общего холестерина, HDL и триглицеридов. Снижение различных исследованных параметров рассчитывали по формуле.
в) Активность по снижению уровней триглицеридов плазмы и общего холестерина у мышей линии Швейцарские альбиносы и морских свинок
Мышей-самцов линии Швейцарские альбиносы (SAM) и морских свинок-самцов получали из NIN и содержали в виварии DRF. Всех этих животных содержали при 12-часовом световом-темновом цикле при 25±1°С. Животные получали стандартный лабораторный корм (NIN, Хайдерабад, Индия) и воду по усмотрению исполнителя. Использовали SAM весом 20-25 г и морских свинок весом 500-700 г (Р.Oliver, M.O.Plancke, D.Marzin, V.Clavey, J.Sauzieres, J.C.Fruchart. “Effects of fenofibrate, gemfibrozil and nicotinic and on plasma lipoprotein levels in normal and hyperlipidemic mice”. Atherosclerosis. 1988, 70:107-114).
Исследуемые соединения вводили перорально мышам линии Швейцарские альбиносы в дозе 0,3-30 мг/кг/день в течение 6 дней. Контрольная группа получала только наполнитель (0.25% карбоксиметилцеллюлозу; доза 10 мл/кг). Исследуемые соединения вводили перорально морским свинкам в дозе 0.3-30 мг/кг/день в течение 6 дней. Контрольная группа получала только наполнитель (0.25% карбоксиметилцеллюлозу; доза 5 мл/кг).
Образцы крови брали у сытых животных через 1 час после введения препарата на нулевой и шестой день обработки. Кровь брали из ретро-глазничного синуса через гепаринизированный капилляр в содержащие EDTA пробирки. После центрифугирования образцы плазмы делили на части для определения триглицеридов и общего холестерина (О. Wieland. “Methods of Enzymatic analysis”. H.О. Bergermeyer, Ed., 1963, 211-214; P.Trinder, Ann. Clin. Biochem., 1969, 6:24-27). Измерение триглицеридов плазмы, общего холестерина и HDL проводили с использованием коммерческих наборов (Dr. Reddy’s Laboratory, Diagnostic Division, Хайдерабад, Индия).
г) Эффект снижения веса тела у хомяков, получавших холестерин
Сирийских хомяков-самцов получали из NIN, Хайдерабад, Индия. Животных содержали в виварии DRF при 12-часовом световом-темновом цикле при 25±1°C со свободным доступом к корму и воде. С первого дня опыта животные получали стандартный лабораторный корм (NIN), содержащий 1% холестерина.
Исследуемые соединения вводили перорально в дозе 1-30 мг/кг/день в течение 15 дней. Контрольная группа получала только наполнитель (воду Mill Q; доза 10 мл/кг/день). Вес тела измеряли каждый третий день.
Формулы для расчета:
1. Процент снижения в крови сахара/триглицеридов/общего холестерина/веса тела рассчитывали по формуле:
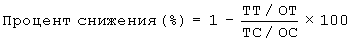
ОС - значение контрольной группы в нулевой день
ОТ - значение обработанной группы в нулевой день
ТС - значение контрольной группы в день опыта
ТТ - значение обработанной группы в день опыта
2. Уровни холестерина LDL и VLDL рассчитывали по формуле:
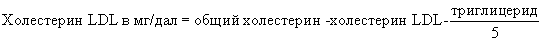
Холестерин VLDL в мг/дал = общий холестерин - холестерин HDL – холестерин LDL.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЗАМЕЩЕННЫЕ БИЦИКЛИЧЕСКИЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ) И ПРИМЕНЕНИЕ В КАЧЕСТВЕ СРЕДСТВ ПРОТИВ ОЖИРЕНИЯ И ГИПЕРХОЛЕСТЕРИНЕМИИ | 2000 |
|
RU2278114C2 |
| БЕТА-АРИЛ-АЛЬФА-ОКСИЗАМЕЩЕННЫЕ АЛКИЛКАРБОНОВЫЕ КИСЛОТЫ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБЫ ЛЕЧЕНИЯ ИЛИ ПРЕДУПРЕЖДЕНИЯ ЗАБОЛЕВАНИЙ НА ОСНОВЕ НОВЫХ СОЕДИНЕНИЙ | 1998 |
|
RU2235094C2 |
| БЕНЗОКСАЗИНОВЫЕ ИЛИ ПИРИДООКСАЗИНОВЫЕ СОЕДИНЕНИЯ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, ОБЛАДАЮЩИЕ АНТИБАКТЕРИАЛЬНОЙ АКТИВНОСТЬЮ, СПОСОБЫ ЛЕЧЕНИЯ БАКТЕРИАЛЬНЫХ ИНФЕКЦИЙ | 1996 |
|
RU2191179C2 |
| ПРОИЗВОДНЫЕ ИНДОЛА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ | 2001 |
|
RU2259998C2 |
| СПОСОБ ПОЛУЧЕНИЯ ХИРАЛЬНЫХ 1,4-ДИЗАМЕЩЕННЫХ ПИПЕРАЗИНОВ | 2003 |
|
RU2315044C2 |
| ПРОИЗВОДНЫЕ ПИРРОЛПИРИМИДИНОНА, СПОСОБ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ | 2001 |
|
RU2263676C2 |
| 4-(ИМИДАЗО[1,2-а]ПИРИДИН-3-ИЛ)-ПИРИМИДИНОВЫЕ ПРОИЗВОДНЫЕ | 2020 |
|
RU2822388C2 |
| 6,7-ДИГИДРО-5H-ПИРИДО[2,3-C]ПИРИДАЗИНОВЫЕ ПРОИЗВОДНЫЕ И РОДСТВЕННЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ БЕЛКОВ BCLXL И ПРОАПОПТОТИЧЕСКИХ СРЕДСТВ ДЛЯ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ | 2020 |
|
RU2832191C2 |
| ФАРМАЦЕВТИЧЕСКОЕ СРЕДСТВО, СОДЕРЖАЩЕЕ ИНГИБИТОР НАТРИЙЗАВИСИМОГО ПЕРЕНОСЧИКА ФОСФАТА | 2015 |
|
RU2811864C1 |
| ПОЛИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И СПОСОБЫ ЦЕЛЕНАПРАВЛЕННОЙ ДЕГРАДАЦИИ ПОЛИПЕПТИДОВ БЫСТРО УСКОРЕННОЙ ФИБРОСАРКОМЫ | 2019 |
|
RU2830173C2 |
Изобретение относится к области органической химии, конкретно, к производным арилкарбоновых кислот. Описывается соединение формулы (I)

где группы R1, R2, R3, R4 и группы R5 и R6, когда они присоединены к атому углерода, могут быть одинаковыми или различными и означают водород, галоген, гидрокси или необязательно замещенную группу, выбранную из алкила, алкокси, фенила, карбоновой кислоты или сульфоновой кислоты; один или оба заместителя R5 и R6 могут также означать оксогруппу, если они присоединены к атому углерода; R5 и R6, если они присоединены к атому азота, означают водород, гидрокси или, необязательно, замещенный алкил или бензил; Х означает гетероатом, выбранный из кислорода, серы или NH; Ar означает необязательно замещенную двухвалентную одинарную или конденсированную ароматическую или гетероциклическую группу, в которой ароматическое кольцо представляет собой фенил, нафтил, а гетероциклическая группа представляет собой фуран; R7 означает водород, галоген, алкокси, алкил или образует связь вместе с соседней группой R8; R8 означает водород, гидрокси, алкокси, алкил или необязательно замещенный бензил или R8 образует связь вместе с R7; R9 означает водород или необязательно замещенную группу, выбранную из алкильной, фенильной или бензильной групп; R10 означает водород или необязательно замещенную группу, выбранную из алкильной, фенильной или бензильной групп; Y означает кислород или NR12, где R12 означает водород, алкил или бензил; R10 и R12 вместе могут образовать пяти- или шестичленную циклическую структуру, содержащую атомы углерода, которая необязательно содержит один или несколько гетероатомов, выбранных из кислорода, серы или азота; связывающая группа, представленная формулой -(CH2)n-(O)m-, может быть присоединена или через атом азота, или через атом углерода, n означает целое число, изменяющееся в интервале 1-4, и m означает целое число от 0 до 1; при условии, что когда связывающая группа присоединена через атом углерода, и либо R5, либо R6 представляет собой оксо группу, a Y означает кислород, R9 не является водородом, или его производные, его аналоги, его таутомерные формы, его стереоизомеры, его полиморфные формы, его фармацевтически приемлемые соли, его фармацевтически приемлемые сольваты. Также описываются способы получения соединений общей формулы I, промежуточные соединения и способы их получения, фармацевтическая композиция, обладающая активностью в отношении hPPRα, hPPRγ и ингибирующей активностью в отношении HMG-GoA-редуктазы, включающая соединение формулы (I), способы предупреждения и лечения различных заболеваний, обусловленных вышеуказанной активностью, способ снижения общего холестерина и способ снижения уровней глюкозы. Технический результат – получены новые соединения, обладающие полезными биологическими свойствами. 17 н. и 10 з.п. ф-лы.

где группы R1, R2, R3, R4 и группы R5 и R6, когда они присоединены к атому углерода, могут быть одинаковыми или различными и означают водород, галоген, гидрокси или необязательно замещенную группу, выбранную из алкила, алкокси, фенила, карбоновой кислоты или сульфоновой кислоты; один или оба заместителя R5 и R6 могут также означать оксогруппу, если они присоединены к атому углерода; R5 и R6, если они присоединены к атому азота, означают водород, гидрокси или, необязательно, замещенный алкил или бензил; Х означает гетероатом, выбранный из кислорода, серы или NH; Аr означает необязательно замещенную двухвалентную одинарную или конденсированную ароматическую или гетероциклическую группу, в которой ароматическое кольцо представляет собой фенил, нафтил, а гетероциклическая группа представляет собой фуран; R7 означает водород, галоген, алкокси, алкил или образует связь вместе с соседней группой R8; R8 означает водород, гидрокси, алкокси, алкил или необязательно замещенный бензил или R8 образует связь вместе с R7; R9 означает водород или необязательно замещенную группу, выбранную из алкильной, фенильной или бензильной групп; R10 означает водород или необязательно замещенную группу, выбранную из алкильной, фенильной или бензильной групп; Y означает кислород или NR12, где R12 означает водород, алкил или бензил; R10 и R12 вместе могут образовать пяти- или шестичленную циклическую структуру, содержащую атомы углерода, которая необязательно содержит один или несколько гетероатомов, выбранных из кислорода, серы или азота; связывающая группа, представленная формулой -(CH2)n-(O)m-, может быть присоединена или через атом азота, или через атом углерода, n означает целое число, изменяющееся в интервале 1-4, и m означает целое число от 0 до 1; при условии, что, когда связывающая группа присоединена через атом углерода и либо R5, либо R6 представляет собой оксогруппу, a Y означает кислород, R9 не является водородом, или его производные, его аналоги, его таутомерные формы, его стереоизомеры, его полиморфные формы, его фармацевтически приемлемые соли, его фармацевтически приемлемые сольваты.
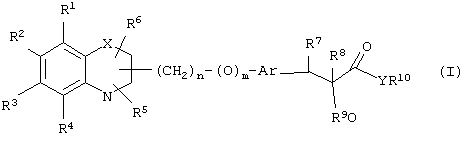
где R1, R2, R3, R4, R5, R6, n, m, Аr, X, R9 и R10 имеют значения, определенные в п.1; R7 и R8 вместе означают связь; Y означает кислород; связывающая группа, представленная формулой -(CH2)n-(O)m-, может быть присоединена или через атом азота, или через атом углерода при условии, что, когда связывающая группа присоединена через атом углерода и либо R5, либо R6 представляет собой оксо группу, R9 не является водородом, включающий
а) взаимодействие соединения формулы (IIIа)
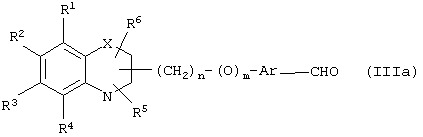
где все символы определены выше,
с соединением формулы (IIIb)

где R9 и R10 определены выше
и R14 означает (С1-С6)-алкил,
с образованием соединения формулы (I), обозначенной выше; и необязательно
б) превращение полученного соединения формулы (I) в фармацевтически приемлемую соль или фармацевтически приемлемый сольват.

где R1, R2, R3, R4, R5, R6, n, Аr, X, R9 и R10 имеют значения, определенные в п.1; R7 и R8 вместе означают связь; Y означает кислород; связывающая группа, представленная формулой -(CH2)n-(O)m-, может быть присоединена или через атом азота, или через атом углерода и m означает 1 при условии, что когда связывающая группа присоединена через атом углерода и либо R5, либо R6 представляет собой оксогруппу, R9 не является водородом, включающий
а) взаимодействие соединения формулы (IIIh)
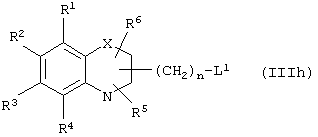
где все символы определены ранее, и L1 означает уходящую группу,
с соединением формулы (IIIi)
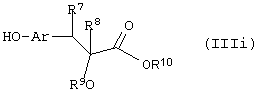
где R7 и R8 вместе означают связь, R9, R10 и Аr имеют указанные ранее значения,
с образованием соединения формулы (I), обозначенной выше; и необязательно
б) превращение полученного соединения формулы (I) в фармацевтически приемлемую соль или фармацевтически приемлемый сольват.
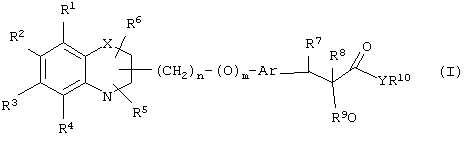
где R1, R2, R3, R4, R5, R6, n, Ar, X, R9 и R10 имеют значения, определенные в п.1; R7 и R8 вместе означают связь; Y означает кислород; связывающая группа, представленная формулой -(СН2)n-(O)m-, может быть присоединена или через атом азота, или через атом углерода и m означает 1 при условии, что когда связывающая группа присоединена через атом углерода и либо R5 , либо R6 представляет собой оксо группу, R9 не является водородом
включающий
а) взаимодействие соединения формулы (IIIj)
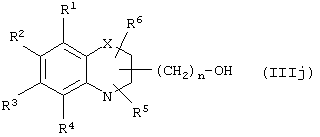
где все символы определены выше,
с соединением формулы (IIIi)
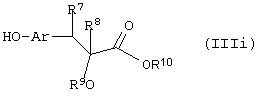
где R7 и R8 вместе означают связь, R9, R10 и Аr имеют указанные ранее значения,
с образованием соединения формулы (I), обозначенной выше; и, необязательно,
б) превращение полученного соединения формулы (I) в фармацевтически приемлемую соль или фармацевтически приемлемый сольват.
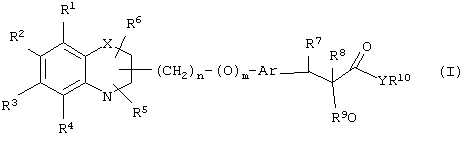
где R1, R2, R3, R4, R5, R6, n, m, Ar, X, R9 и R10 имеют значения, определенные в п.1; R7 и R8 означают водород; Y означает кислород; связывающая группа, представленная формулой -(СН2)n-(O)m-, может быть присоединена или через атом азота, или через атом углерода при условии, что когда связывающая группа присоединена через атом углерода, и либо R5, либо R6 представляет собой оксогруппу, R9 не является водородом
включающий:
а) восстановление соединения формулы (IVa)
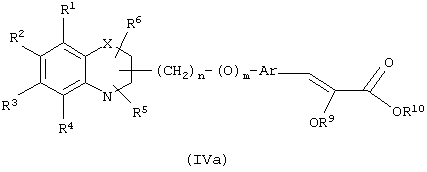
которое означает соединение формулы (I), где R7 и R8 вместе означают связь, Y означает кислород, и все другие символы определены выше,
полученное по любому из способов, охарактеризованных в пп.5-7, с образованием соединения формулы (I), где R7 и R8 каждый означает водород, и все другие символы определены выше; и, необязательно,
б) разделение полученного соединения формулы (I) на его стереоизомеры и, необязательно,
в) превращение полученного соединения формулы (I) или его стереоизомеров в фармацевтически приемлемую соль или фармацевтически приемлемый сольват.
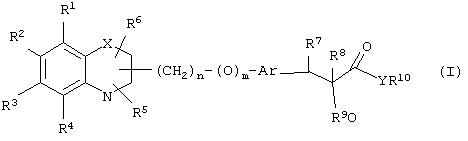
где группы R1, R2, R3, R4, R5, R6, R7, R8, R9, n, m, Ar и Х имеют значения, определенные в пункте 1; Y означает NR12, где R12 означает водород, алкил или бензил, R10 и R12 вместе могут образовать пяти- или шестичленную циклическую структуру, содержащую атомы углерода, которая необязательно содержит один или несколько гетероатомов, выбранных из кислорода, серы или азота; и связывающая группа, представленная формулой -(СH2)n-(О)m-, может быть присоединена или через атом азота, или через атом углерода; включающий
а) взаимодействие соединения формулы (I)
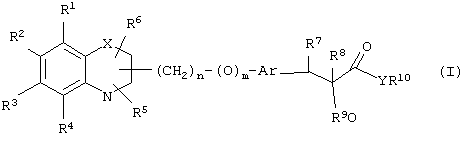
где все символы определены выше, Y означает атом кислорода, YR10 означает галоген или COYR10 означает смешанную ангидридную группу с соответствующим амином формулы NHR10R12, где R10 и R12 определены выше; и, необязательно,
б) разделение соединения формулы (I), полученного выше, на стереоизомеры и, необязательно,
в) превращение соединения формулы (I), полученного выше, в фармацевтически приемлемую соль или фармацевтически приемлемый сольват.
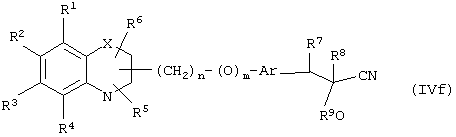
где группы R1, R2, R3, R4 и группы R5 и R6, когда они присоединены к атому углерода, могут быть одинаковыми или различными и означают водород, галоген, гидрокси или необязательно замещенную группу, выбранную из алкила, алкокси, фенила, карбоновой кислоты или сульфоновой кислоты; один или оба заместителя R5 и R6 могут также означать оксогруппу, если они присоединены к атому углерода; R5 и R6, если они присоединены к атому азота, означают водород, гидрокси или, необязательно, замещенный алкил или бензил; Х означает гетероатом, выбранный из кислорода, серы или NH; Аr означает необязательно замещенную двухвалентную одинарную или конденсированную ароматическую или гетероциклическую группу, в которой ароматическое кольцо представляет собой фенил, нафтил, а гетероциклическая группа представляет собой фуран; R7 означает водород, галоген, алкокси, алкил или образует связь вместе с соседней группой R8; R8 означает водород, гидрокси, алкокси, алкил или необязательно замещенный бензил или R8 образует связь вместе с R7; R9 означает водород или необязательно замещенную группу, выбранную из алкильной, фенильной или бензильной групп; связывающая группа, представленная формулой -(CH2)n-(O)m-, может быть присоединена или через атом азота, или через атом углерода, n означает целое число, изменяющееся в интервале 1-4, и m означает целое число от 0 до 1.
а) взаимодействие соединения формулы (IIIа)
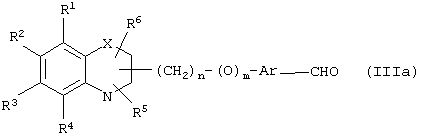
где все символы определены выше,
с соединением формулы (IVh)
R9OCH2P+Ph3Hal-,(IVh)
где R9 означает необязательно замещенную группу, выбранную из алкильной, фенильной или бензильной группы, и Hal означает галоген,
с образованием соединения формулы (IVi)
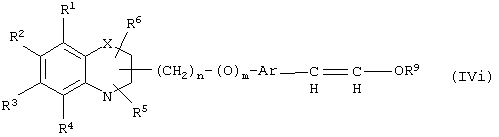
где все символы определены выше;
б) взаимодействие соединения формулы (IVi) со спиртом формулы R9OH, где R9 определен выше,
с образованием соединения формулы (IVj)
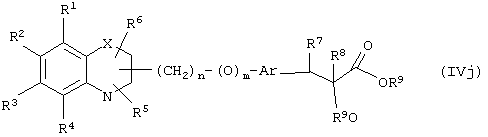
где все символы определены выше;
в) взаимодействие соединения формулы (IVj), полученного выше, где все символы определены ранее, с триалкилсилилцианидом с образованием соединения формулы (IVf), где все символы определены выше.
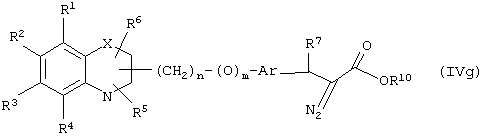
где группы R1, R2, R3, R4 и группы R5 и R6, когда они присоединены к атому углерода, могут быть одинаковыми или различными и означают водород, галоген, гидрокси или необязательно замещенную группу, выбранную из алкила, алкокси, фенила, карбоновой кислоты или сульфоновой кислоты; один или оба заместителя R5 и R6 могут также означать оксогруппу, если они присоединены к атому углерода; R5 и R6, если они присоединены к атому азота, означают водород, гидрокси или, необязательно, замещенный алкил или бензил; Х означает гетероатом, выбранный из кислорода, серы или NH; Аr означает необязательно замещенную двухвалентную одинарную или конденсированную ароматическую или гетероциклическую группу, в которой ароматическое кольцо представляет собой фенил, нафтил, а гетероциклическая группа представляет собой фуран; R7 означает водород, галоген, алкокси, алкил; R10 означает водород или необязательно замещенную группу, выбранную из алкильной, фенильной или бензильной групп; связывающая группа, представленная формулой -(СН2)n-(O)m-, может быть присоединена или через атом азота, или через атом углерода, n означает целое число, изменяющееся в интервале 1-4, и m означает целое число от 0 до 1.
а) взаимодействие соединения формулы (IIIh)
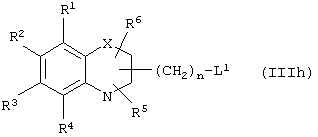
где L1 означает уходящую группу, и все другие символы определены в п.10, с соединением формулы (IVl)
где R8 означает водород, и все другие символы определены в п.10, с образованием соединения формулы (IVk)
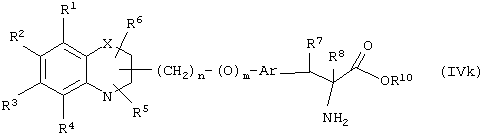
где R8 означает водород, и все другие символы определены выше;
б) взаимодействие соединения формулы (IVk), полученного выше, с диазотирующим агентом.
этил-(Е/Z)-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропеноат;
(±)метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропаноат;
(+)метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропаноат;
(-)метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропаноат;
этил-(Е/Z)-3-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)метилбензофуран-5-ил]-2-этоксипропеноат;
этил-(Е/Z)-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропеноат;
(±)метил-3-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)метилбензофуран-5-ил]-2-этоксипропаноат;
(+)метил-3-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)метилбензофуран-5-ил]-2-этоксипропаноат;
(-)метил-3-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)метилбензофуран-5-ил]-2-этоксипропаноат;
(±)метил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропаноат;
(+)метил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропаноат;
(-)метил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропаноат;
(±)метил-2-метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропаноат;
(+)метил-2-метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропаноат;
(-)метил-2-метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропаноат;
(±)метил-2-(2-фторбензил)-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропаноат;
(+)метил-2-(2-фторбензил)-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропаноат;
(-)метил-2-(2-фторбензил)-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси] фенил] -2-этоксипропаноат;
этил-(Е/Z)-3-[4-[2-(3-оксо-2Н-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропеноат;
(±)метил-3-[4-[2-(3-оксо-2Н-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропаноат;
(+)метил-3-[4-[2-(3-оксо-2Н-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропаноат;
(-)метил-3-[4-[2-(3-оксо-2Н-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропаноат;
этил-(Е/Z)-3-[6-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]нафтил]-2-этоксипропеноат;
(±)метил-3-[6-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]нафтил]-2-этоксипропаноат;
(+)метил-3-[6-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]нафтил]-2-этоксипропаноат;
(-)метил-3-[6-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]нафтил]-2-этоксипропаноат;
(±)этил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-гидроксипропаноат;
(+)этил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-гидроксипропаноат;
(-)этил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-гидроксипропаноат;
(±)этил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-гидроксипропаноат;
(+)этил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-гидроксипропаноат;
(-)этил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-гидроксипропаноат;
(±)этил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-бензилоксипропаноат;
(+)этил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-бензилоксипропаноат;
(-)этил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-бензилоксипропаноат;
(±)этил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-бутоксипропаноат;
(+)этил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-бутоксипропаноат;
(-)этил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-бутоксипропаноат;
(±)этил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-гексилоксипропаноат;
(+)этил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-гексилоксипропаноат;
(-)этил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-гексилоксипропаноат;
этил-(Е/Z)-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-феноксипропеноат;
(±)метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-феноксипропаноат;
(+)метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-феноксипропаноат;
(-)метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-феноксипропаноат;
этил-(Е/Z)-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-феноксипропеноат;
(±)метил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-феноксипропаноат;
(+)метил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-феноксипропаноат;
(-)метил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-феноксипропаноат;
этил-(Е/Z)-3-[4-(4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метоксифенил]-2-этоксипропеноат;
(±)метил-3-[4-(4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метоксифенил] -2-этоксипропаноат;
(+)метил-3-[4-(4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метоксифенил]-2-этоксипропаноат;
(-)метил-3-[4-(4-метил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метоксиф енил]-2-этоксипропаноат;
этил-(Е/Z)-3-[4-(4-бензил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метоксифенил]-2-этоксипропеноат;
(±)метил-3-[4-(4-бензил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метоксифенил]-2-этоксипропаноат;
(+)метил-3-[4-(4-бензил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метоксифенил]-2-этоксипропаноат;
(-)метил-3-[4-(4-бензил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метоксифенил]-2-этоксипропаноат;
(±)3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропановую кислоту и ее соли;
(+)3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропановую кислоту и ее соли;
(-)3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропановую кислоту;
(±)3-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)метилбензофуран-5-ил]-2-этоксипропановую кислоту и ее соли;
(+)3-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)метилбензофуран-5-ил]-2-этоксипропановую кислоту и ее соли;
(-)3-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)метилбензофуран-5-ил]-2-этоксипропановую кислоту и ее соли;
(±)3-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)метилбензофуран-5-ил]-2-этоксипропановую кислоту и ее соли;
(+)3-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)метилбензофуран-5-ил]-2-этоксипропановую кислоту и ее соли;
(-)3-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)метилбензофуран-5-ил]-2-этоксипропановую кислоту и ее соли;
(±)3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропановую кислоту и ее соли;
(+)3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропановую кислоту и ее соли;
(-)3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропановую кислоту и ее соли;
(±)3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропанамид;
(+)3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропанамид;
(-)3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропанамид;
(±)N-метил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропанамид;
(+)N-метил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропанамид;
(-)N-метил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропанамид;
(±)3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропанамид;
(+)3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропанамид;
(-)3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропанамид;
(±)N-метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропанамид;
(+)N-метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропанамид;
(-)N-метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропанамид;
(±)N-бензил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропанамид;
(+)N-бензил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропанамид;
(-)N-бензил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропанамид;
(±)N-бензил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропанамид;
(+)N-бензил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропанамид;
(-)N-бeнзил-3-[4-[2-(2,3-дигидpo-1,4-бeнзoтиaзин-4-ил)этoкcи]фeнил]-2-этoкcипропанамид;
(±)2-метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропановую кислоту и ее соли;
(+)2-метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропановую кислоту и ее соли;
(-)2-метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропановую кислоту и ее соли;
(±)2-(2-фторбензил)-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропановую кислоту и ее соли;
(+)2-(2-фторбензил)-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропановую кислоту и ее соли;
(-)2-(2-фторбензил)-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропановую кислоту и ее соли;
(±)3-[4-[2-(3-оксо-2Н-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропановую кислоту и ее соли;
(+)3-[4-[2-(3-оксо-2Н-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропановую кислоту и ее соли;
(-)3-[4-[2-(3-оксо-2Н-1,4-бензоксазин-4-ил)этокси]фенил]-2-этоксипропановую кислоту и ее соли;
(±)3-[4-[2-(3-оксо-2Н-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропановую кислоту и ее соли;
(+)3-[4-[2-(3-оксо-2Н-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропановую кислоту и ее соли;
(-)3-[4-[2-(3-оксо-2Н-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропановую кислоту и ее соли;
(±)3-[6-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]нафтил]-2-этоксипропановую кислоту и ее соли;
(+)3-[6-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]нафтил]-2-этоксипропановую кислоту и ее соли;
(-)3-[6-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]нафтил]-2-этоксипропановую кислоту и ее соли;
(±)3-[6-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]нафтил]-2-этоксипропановую кислоту и ее соли;
(+)3-[6-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]нафтил]-2-этоксипропановую кислоту и ее соли;
(-)3-[6-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]нафтил]-2-этоксипропановую кислоту и ее соли;
(±)3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-гидроксипропановую кислоту и ее соли;
(+)3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-гидроксипропановую кислоту и ее соли;
(-)3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-гидроксипропановую кислоту и ее соли;
(±)3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-гидроксипропановую кислоту и ее соли;
(+)3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-гидроксипропановую кислоту и ее соли;
(-)3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-гидроксипропановую кислоту и ее соли;
(±)3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-бензилоксипропановую кислоту и ее соли;
(+)3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-бензилоксипропановую кислоту и ее соли;
(-)3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-бензилоксипропановую кислоту и ее соли;
(±)3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-бутоксипропановую кислоту и ее соли;
(+)3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-бутоксипропановую кислоту и ее соли;
(-)3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-бутоксипропановую кислоту и ее соли;
(±)3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-гексилоксипропановую кислоту и ее соли;
(+)3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-гексилоксипропановую кислоту и ее соли;
(-)3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-гексилоксипропановую кислоту и ее соли;
(±)3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-феноксипропановую кислоту и ее соли;
(+)3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-феноксипропановую кислоту и ее соли;
(-)3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-феноксипропановую кислоту и ее соли;
(±)3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-феноксипропановую кислоту и ее соли;
(+)3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-феноксипропановую кислоту и ее соли;
(-)3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-феноксипропановую кислоту и ее соли;
(±)метил-2-метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-феноксипропаноат;
(+)метил-2-метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-феноксипропаноат;
(-)метил-2-метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-феноксипропаноат;
(±)2-метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-феноксипропановую кислоту и ее соли;
(+)2-метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-феноксипропановую кислоту и ее соли;
(-)2-метил-3-[4-[2-(2,3-дигидро-1,4-бензоксазин-4-ил)этокси]фенил]-2-феноксипропановую кислоту и ее соли;
(±)метил-2-метил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-феноксипропаноат;
(+)метил-2-метил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2- феноксипропаноат;
(-)метил-2-метил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-феноксипропаноат;
(±)2-метил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-феноксипропановую кислоту и ее соли;
(+)2-метил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-феноксипропановую кислоту и ее соли;
(-)2-метил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-феноксипропановую кислоту и ее соли;
(±)4-нитрофенил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропаноат;
(+)4-нитрофенил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропаноат;
(-)4-нитрофенил-3-[4-[2-(2,3-дигидро-1,4-бензотиазин-4-ил)этокси]фенил]-2-этоксипропаноат;
(±)3-[4-(4-бензил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метоксифенил]-2-этоксипропановую кислоту и ее соли;
(+)3-[4-(4-бензил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метоксифенил]-2-этоксипропановую кислоту и ее соли;
(-)3-[4-(4-бензил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метоксифенил]-2-этоксипропановую кислоту и ее соли;
(±)4-нитрофенил-3-[4-(4-бензил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метоксифенил] -2-этоксипропаноат;
(+)4-нитрофенил-3-[4-(4-бензил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метоксифенил]-2-этоксипропаноат;
(-)4-нитрофенил-3-[4-(4-бензил-3,4-дигидро-2Н-1,4-бензоксазин-2-ил)метоксифенил]-2-этоксипропаноат.
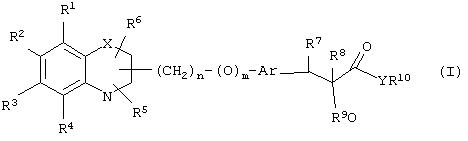
по любому из пп.1-4 или 14 и фармацевтически приемлемый носитель, разбавитель, наполнитель или сольват.

где группы R1, R2, R3, R4 и группы R5 и R6, когда они присоединены к атому углерода, могут быть одинаковыми или различными и означают водород, галоген, гидрокси или необязательно замещенную группу, выбранную из алкила, алкокси, фенила, карбоновой кислоты или сульфоновой кислоты; один или оба заместителя R5 и R6 могут также означать оксогруппу, если они присоединены к атому углерода; R5 и R6, если они присоединены к атому азота, означают водород, гидрокси или, необязательно, замещенный алкил или бензил; Х означает гетероатом, выбранный из кислорода, серы или NH; связывающая группа, представленная формулой -(СН2)n-, присоединена через атом азота, n означает целое число, изменяющееся в интервале 1-4.
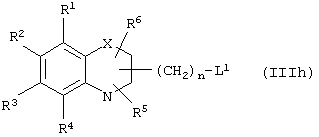
где группы R1, R2, R3, R4 и группы R5 и R6, когда они присоединены к атому углерода, могут быть одинаковыми или различными и означают водород, галоген, гидрокси или необязательно замещенную группу, выбранную из алкила, алкокси, фенила, карбоновой кислоты или сульфоновой кислоты; один или оба заместителя R5 и R6 могут также означать оксогруппу, если они присоединены к атому углерода; R5 и R6, если они присоединены к атому азота, означают водород, гидрокси или, необязательно, замещенный алкил или бензил; Х означает гетероатом, выбранный из кислорода, серы или NH; связывающая группа, представленная формулой -(СН2)n-, присоединена через атом азота, n означает целое число, изменяющееся в интервале 1-4, и L1 означает уходящую группу.
| Приспособление в пере для письма с целью увеличения на нем запаса чернил и уменьшения скорости их высыхания | 1917 |
|
SU96A1 |
| Огнетушитель | 0 |
|
SU91A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| RU 2059627 A1, 10.05.1996. | |||
Авторы
Даты
2005-03-10—Публикация
1998-10-26—Подача