Изобретение относится к области катализаторов, в частности катализаторов для получения 2,3-диалкилхинолинов (1), которые могут найти применение в тонком органическом синтезе при получении лекарственных средств, хинолиновых алкалоидов, а также в промышленном органическом синтезе при получении цианиновых красителей, растворителей для S, Р, Аs2О3 и др.
Известен трехкомпонентный катализатор [У.М.Джемилев, Ф.А.Селимов, Р.А.Хуснутдинов. Комплексы редкоземельных элементов в синтезе хинолинов. Изв. АН. Серия хим., 1980, №10, 2447-2448] для получения 2,3-диалкилхинолинов, состоящий из хлорида празеодима (PrCl3), трифенилфосфина (Ph3Р) и диметилформамида (ДМФА).
Недостатком известного катализатора является труднодоступность PrCl3 и Ph3P. Из соединений редкоземельных элементов (РЗЭ) более доступными являются нитратные комплексы, которые получают в промышленных условиях обработкой соответствующей породы РЗЭ азотной кислотой (НNО3). Трифенилфосфин (Ph3P) в стране не производится, синтезируют его исходя из пирофорного фенилмагнийгалогенида (PhMgHal) и легко гидролизующегося галогенида фосфора (РНаl3) в две стадии.
Известен трехкомпонентный катализатор [У.М.Джемилев, Ф.А.Селимов, Р.А.Хуснутдинов, А.А.Фатыхов, Л.М.Халилов, Г.А.Толстиков. Синтез замещенных хинолинов конденсацией анилинов с алифатическими и ароматическими альдегидами под действием катализаторов на основе переходных и редкоземельных элементов. Изв. АН. Серия хим. 1991, №6, 1407-1417] для получения 2,3-диалкилхинолинов, состоящий из хлорида самария (SmCl3), трифенилфосфина (Ph3P) и диметилформамида (ДМФА).
Недостатком известного катализатора является труднодоступность SmCl3 и Рh3Р.
Предлагается новый катализатор для получения 2,3-диалкилхинолинов (1).
Предлагаемый катализатор состоит из доступного комплекса [Sm(NО3)5]·[C5H5NH]2, содержащего нитрат самария (Sm(NO3)3), пиридин (C5H5N) и азотную кислоту (НNО3), взятых в мольном соотношении 1:2:2 соответственно. При другом соотношении исходных компонентов комплекс вида [Sm(NO3)5]·[C5H5NH]2 не формируется.
В присутствии указанного катализатора образуются 2,3-диалкилхинолины (1) с выходами 51-66%. Реакция осуществляется в инертной атмосфере при взаимодействии анилина (PhNH2) с альдегидами (RCH2CHO, где R=С2Н5, н-С3Н7, н-С4Н9), взятыми в мольном соотношении PhNH2:RСН2СНО=10:20, при температуре 100°С в бензоле в течение 6 ч по схеме
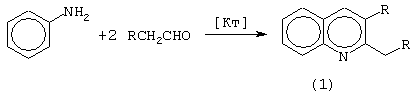
R=С2Н5, н-С3Н7, н-С4Н9; [Кт]=[Sm(NO3)5]·[C5H5NH]2
Количество катализатора, необходимое для проведения реакции, составляет 1-3 мол.% по отношению к исходному анилину.
Отличия предлагаемого катализатора от известных
Предлагаемый катализатор состоит из доступного комплекса [Sm(NO3)5]·[C5H5NH]2, который получают смешиванием выпускаемого в стране Sm(NО3)3 (при извлечении самария из руды, последнюю подвергают обработке азотной кислотой, при этом образуется нитрат самария), производимых в промышленных масштабах пиперидина (С5Н5N) и азотной кислоты (НNО3).
Изобретение иллюстрируется примерами:
Пример 1. Приготовление катализатора.
В стеклянный реактор объемом ~100 мл, установленный на магнитной мешалке, помещают 20 мл воды, 20 ммоль пиридина (C5H5N), прикапывают при перемешивании 20 ммоль HNO3, выдерживают ~1 час, затем добавляют 10 ммоль Sm(NО3)3, выдерживают при перемешивании ~1 час, удаляют при пониженном давлении воду до образования сухого остатка, представляющий собой комплекс состава [Sm(NO3)5]·[C5H5NH]2. Комплекс образуется практически с количественным выходом.
Пример 2. Синтез 2,3-диалкилхинолинов.
Полученный катализатор, состоящий из комплекса [Sm(NО3)5]·[C5H5NH]2, взятый в количестве 2 мол.% по отношению к анилину, помещают в стальной автоклав, куда предварительно загружают 10 ммолей анилина, 20 ммолей масляного альдегида и 4 мл бензола. Автоклав нагревают 6 часов при температуре 100°С и постоянном перемешивании, затем охлаждают. Получают 2-н-пропил-3-этилхинолин с выходом 58%.
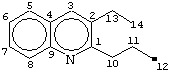
(Спектр ЯМР 13С 2-н-пропил-3-этилхинолина (1) (δ, м. д.):161.81 (С1), 135.26 (С2), 134.11 (С3), 127.65 (С4), 127.21 (С5), 126.69 (С6), 128.88 (С7), 125.51 (С8), 145.91 (С9), 37.06 (С10), 22.71 (С11), 13,49 (С12), 24.78 (С13), 14,069 (С14).
Другие примеры, подтверждающие способ, приведены в таблице.
Синтез 2,3-диалкилхинолинов проводили в бензоле в качестве растворителя при температуре 100°С в течение 6 часов в "пальчиковом" автоклаве при постоянном перемешивании.
| название | год | авторы | номер документа |
|---|---|---|---|
| КАТАЛИЗАТОР ДЛЯ ПОЛУЧЕНИЯ 2,3-ДИАЛКИЛХИНОЛИНОВ | 2003 |
|
RU2249474C2 |
| КАТАЛИЗАТОР ДЛЯ ПОЛУЧЕНИЯ 2,3-ДИАЛКИЛХИНОЛИНОВ | 2003 |
|
RU2249475C2 |
| КАТАЛИЗАТОР ДЛЯ ПОЛУЧЕНИЯ 2,3-ДИАЛКИЛ-1,10-ФЕНАНТРОЛИНОВ | 2003 |
|
RU2249479C2 |
| КАТАЛИЗАТОР ДЛЯ ПОЛУЧЕНИЯ 2,3-ДИАЛКИЛ-1,10-ФЕНАНТРОЛИНОВ | 2003 |
|
RU2249478C2 |
| КАТАЛИЗАТОР ДЛЯ ПОЛУЧЕНИЯ 2,3-ДИАЛКИЛ-5,6-БЕНЗО-1,7 НАФТИРИДИНОВ | 2003 |
|
RU2249480C2 |
| КАТАЛИЗАТОР ДЛЯ ПОЛУЧЕНИЯ 2,3-ДИАЛКИЛ-7,8-БЕНЗО-1,6-НАФТИРИДИНОВ | 2003 |
|
RU2249477C2 |
| СПОСОБ ПОЛУЧЕНИЯ 2,3-ДИАЛКИЛХИНОЛИНОВ | 2006 |
|
RU2309952C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-ПРОПИЛ-3-ЭТИЛХИНОЛИНА | 2009 |
|
RU2409567C2 |
| СПОСОБ ПОЛУЧЕНИЯ АЛКИЛПРОИЗВОДНЫХ ХИНОЛИНА | 2005 |
|
RU2283836C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2,3-ДИАЛКИЛ-7,8-БЕНЗО-1,6-НАФТИРИДИНОВ | 2006 |
|
RU2313526C1 |
Предлагаемый катализатор состоит из комплекса [Sm(NO3)5]·[C5H5NH]2, полученного из нитрата самария Sm(NO3)3, пиридина C5H5N и азотной кислоты HNO3 в мольном соотношении 1:2:2, соответственно. Преимуществом катализатора является его доступность. 1 табл.
Катализатор для получения 2,3-диалкилхинолинов, отличающийся тем, что он состоит из комплекса [Sm(NO3)5]·[С5Н5NН]2, полученного из нитрата самария Sm(NО3)3, пиридина (C5H5N) и азотной кислоты (НNO3) в мольном соотношении 1:2:2 соответственно.
| У.М.ДЖЕМИЛЕВ, Ф.А.СЕЛИМОВ, Р.А.ХУСНУТДИНОВ, А.А.ФАТЫХОВ, Л.М.ХАЛИЛОВ, Г.А.ТОЛСТИКОВ | |||
| Синтез замещенных хинолинов конденсацией анилинов с алифатическими и ароматическими альдегидами под действием катализаторов на основе переходных и редкоземельных элементов | |||
| Изв | |||
| АН | |||
| Серия хим | |||
| Циркуль-угломер | 1920 |
|
SU1991A1 |
| Способ получения алкилпроизводных хинолина | 1990 |
|
SU1735287A1 |
| Способ получения 2-, 2,3- или 2,3,6-алкилхинолинов | 1990 |
|
SU1816759A1 |
| US 6500956 A, 31.12.2002. | |||
Авторы
Даты
2005-04-10—Публикация
2003-04-22—Подача