Изобретение относится к области диагностической медицины, а именно к разработке неинвазивных способов ранней диагностики различных заболеваний человека, в частности к выявлению предраковых состояний и ранних стадий рака, патологии беременности, а также мониторинга эффективности противораковой терапии.
Онкологические, аутоиммунные и наследственные болезни возникают вследствие нарушений функционирования генетического аппарата клетки. Способы, ориентированные на исследование нуклеиновых кислот (НК), таким образом, выявляют причину дисфункции и являются способами ранней диагностики, поскольку позволяют выявлять нарушения в функционировании генетического аппарата задолго до проявления клинических признаков заболевания.
Раннее выявление в крови специфических последовательностей нуклеиновых кислот, ассоциированных с различными заболеваниями, является важной проблемой в диагностической медицине. В то время как прямой анализ пораженных тканей бывает затруднен или недоступен (нет симптоматики), периферическая кровь является легкодоступным биологическим материалом для получения нуклеиновых кислот, которые могут быть использованы в амплификационном анализе.
Известен способ диагностики рака предстательной железы путем выявления мутантных генов раковых клеток методами ПЦР-анализа (1). Известно, что на поздних стадиях рака метастатические клетки циркулируют в крови, поэтому для анализа используют клеточную фракцию крови, из которой выделяют РНК одним из известных способов, а затем проводят мультиплексную ОТ-ПЦР. При раке предстательной железы у 84% пациентов (43/51) со злокачественной опухолью были выявлены значительные количества (3800 копий/0.5 мл крови) PSA и hK2 мРНК, тогда как лишь у одного из 19 пациентов (5%) с доброкачественной опухолью было обнаружено присутствие фрагментов PSA и hK2 мРНК в количестве 1500 и 3100 копий/0,5 мл крови. Главным недостатком этого способа является то, что требуется обязательное наличие метастатических, циркулирующих в крови больного раковых клеток (для негематологических опухолей), что ограничивает использование амплификационного анализа для больных в предраковом состоянии и с раком на начальной стадии.
Известно, что в плазме крови циркулируют нуклеиновые кислоты (2), количества которых в 10-100 раз выше у раковых больных (3, 4). При этом количество внеклеточных нуклеиновых кислот (ВНК) в плазме крови коррелирует со стадией развития рака и размером опухоли (5). На ранних стадиях возникновения рака количества ВНК в плазме относительно нормы практически не увеличиваются. Циркулирующие ВНК крови, выделенные из плазмы крови, используют для уточнения диагноза при онкологических, аутоиммунных и наследственных заболеваниях (6).
Известен способ диагностики онкозаболеваний путем выявления мутантных онкогенов ras в плазме периферической крови с помощью аллельспецифичной ПЦР с последующим секвенированием полученных фрагментов ДНК (7). Недостатками этого способа являются большая трудоемкость и длительность выделения ДНК, а также низкая достоверность результатов диагностики раковых и особенно предраковых состояний из-за небольшого удельного содержания специфических последовательностей НК, что затрудняет клиническое использование данного способа.
Известен способ диагностики преэклампсии путем оценки количества ВНК, циркулирующих в плазме беременных женщин, методами амплификации (8). Для анализа используют ДНК плазмы, выделенную любым известным способом, а затем проводят количественный ПЦР анализ. Недостатком данного способа является низкая достоверность результатов диагностики ранней патологии беременности.
Наиболее близким к заявленному способу - прототипом - является способ диагностики онкозаболеваний путем выявления онкоспецифических маркеров в плазме или сыворотке крови амплификационными методами (9), включающий следующие стадии: разделение крови на форменные элементы и плазму, выделение внеклеточной циркулирующей ДНК из плазмы сорбцией на мелкодисперсном стекле (ММС), выявление мутантной ДНК методами амплификационного анализа (полимеразная цепная реакция, лигазная цепная реакция, мультиплексная ПЦР и другие), с последующим анализом продуктов реакции и проведением, в случае необходимости, рестрикционного анализа.
Недостатком прототипа является низкая достоверность результатов диагностики ранних стадий онкозаболеваний, так как основная доля циркулирующих ВНК крови ассоциирована с клеточной поверхностью форменных элементов крови, что снижает удельное содержание специфических последовательностей НК в плазме и приводит к получению ложноотрицательных результатов.
Технической задачей изобретения является повышение достоверности ранней диагностики заболеваний, связанных с нарушением функционирования генетического аппарата клетки.
Поставленная техническая задача достигается предлагаемым способом, который заключается в следующем.
Производят забор крови, разделяют собранную кровь на плазму и фракцию клеток крови при помощи центрифугирования, затем фракцию клеток крови разделяют на эритроциты и лейкоциты при помощи центрифугирования в градиенте плотности. Далее элюируют ВНК, связанные с поверхностью эритроцитов в две стадии: сначала элюцию осуществляют 10 объемами фосфатного буферного раствора (ФБР), содержащего 5 мМ ЭДТА (этилендиаминтетрауксусная кислота) при 4°С, с последующим осаждением клеток центрифугированием и сбором супернатанта, а затем элюцию проводят равным объемом 0,25% раствора трипсина при 4°С, с последующим добавлением ингибитора фермента, осаждением клеток центрифугированием и сбором супернатанта. Элюцию ВНК, связанных с поверхностью лейкоцитов, также проводят в две стадии: сначала элюцию осуществляют 10 объемами ФБР, содержащим 5 мМ ЭДТА при 4°С, с последующим осаждением клеток центрифугированием и сбором супернатанта, а затем элюцию проводят равным объемом 0,125% раствора трипсина при 4°С, с последующим добавлением ингибитора фермента, осаждением клеток центрифугированием и сбором супернатанта.
Далее выделяют ВНК из полученных супернатантов (элюатов) и проводят амплификационный анализ не менее 2-х специфических последовательностей НК с использованием соответствующего метода (полимеразная цепная реакция, лигазная цепная реакция, мультиплексная ПЦР и другие).
Использование для анализа ВНК, связанных с поверхностью клеток крови, особенно эффективно для диагностики ранних стадий патогенеза, в частности рака, когда основная масса ВНК крови связана с клеточной поверхностью.
Определяющими отличительными признаками предлагаемого способа по сравнению с прототипом являются:
1. Использование в качестве диагностического объекта ВНК, связанных с поверхностью клеток крови (эритроцитов и лейкоцитов), что позволяет значительно повысить достоверность выявления специфических последовательностей НК на ранних стадиях заболеваний, связанных с нарушением функционирования генетического аппарата клетки, когда основная масса ВНК связана с клеточной поверхностью эритроцитов и лейкоцитов, а в плазме находятся лишь незначительные ее количества.
ВНК, связанные с поверхностью клеток крови, могут быть связаны с клеточной поверхностью в виде свободных НК, а также в составе комплексов с белками, липидами, липопротеинами (протеолипидами), в виде рибонуклеопротеиновых комплексов, нуклеосом и апоптических телец (10, 11). В прототипе анализируют специфические последовательности НК, выделенных из плазмы.
2. Разделение клеточной фракции крови на эритроциты и лейкоциты, что позволяет повысить достоверность диагностики за счет увеличения удельного содержания специфических последовательностей НК для дальнейшего амплификационного анализа.
3. Последовательная двухстадийная элюция ВНК с поверхности эритроцитов и лейкоцитов, что позволяет уменьшить количество балластных нуклеиновых кислот из нормальных клеток крови и увеличить удельное содержание выявляемых специфических последовательностей.
4. Проведение ПЦР-анализа не менее чем по двум известным специфическим последовательностям НК, вовлеченным в патогенез, и при их выявлении диагностирование наличия соответствующего заболевания.
Использование нового диагностического объекта - ВНК крови, связанных с клеточной поверхностью, позволяет увеличить чувствительность детекции специфических последовательностей ДНК и РНК за счет их повышенного удельного содержания на ранних стадиях патологенеза.
Изобретение иллюстрируется следующими примерами конкретного выполнения способа.
Пример 1
При проведении ежегодного обследования рабочих (производство плутония и, как следствие, риск онкозаболеваний дыхательных путей) в 1999 и 2000 годах были взяты образцы крови. Целью обследования было выявление среди рабочих с неопределенными хроническими заболеваниями легких (группа риска) профиля гиперметилирования генов (АРС и RASSF1A), вовлеченных в регуляцию онкообразований.
Взятую кровь, разделяли на плазму и фракцию клеток крови при помощи центрифугирования в течение 20 мин при 400 g, затем фракцию клеток крови разделяли на эритроциты и лейкоциты при помощи центрифугирования через среду для разделения лимфоцитов (Flow, USA) в течение 30 мин при 400 g. Далее элюировали ВНК, связанные с поверхностью эритроцитов в две стадии: сначала отмывали клетки добавлением 10 объемов ФБР, содержащего 5 мМ ЭДТА при 4°С, с последующим осаждением клеток центрифугированием и сбором супернатанта, а затем элюцию проводили равным объемом 0,25% раствора трипсина при 4°С, с последующим добавлением ингибитора фермента, осаждением клеток центрифугированием и сбором супернатанта. Элюцию ВНК, связанных с поверхностью лейкоцитов, также провели в две стадии: сначала элюировали ВНК 10 объемами ФБР, содержащего 5 мМ ЭДТА при 4°С, с последующим осаждением клеток центрифугированием и сбором супернатанта, а затем элюировали прочносвязанные ВНК равным объемом 0,125% раствора трипсина при 4°С, с последующим добавлением ингибитора фермента, осаждением клеток центрифугированием и сбором супернатанта.
ДНК выделяли из полученных элюатов, а также плазмы (для сравнения) методом сорбции на мелкодисперсном стекле (12). ДНК модифицировали обработкой бисульфитом натрия, при которой неметилированные цитозины в 5 положении превращаются в урацил (20 минут при 75°С в присутствии 3М NaOH; 4 часа при 56°С в присутствии Nа2S2О5; 30 минут при 37°С в присутствии 3М NaOH).
После начальной термической обработки модифицированной ДНК в течение 5 минут при 95°С добавляли 1 ед. Taq ДНК полимеразы (производства Института Цитологии и Генетики СО РАН, Россия) и проводили 55 циклов полимеразной цепной реакции в следующем режиме:
- для гена АРС - 45 секунд при 95.5°С, 45 секунд при 64°С, 45 секунд при 72°С; были использованы праймеры (13):
метилированная пара - 5’-TATTGCGGAGTGCGGGTC-3’ (Пр1),
5’-TCGACGAACTCCCGACGA-3’ (Пр2);
неметилированная пара - 5’-GTGTTATTGTGGAGTGTGGGTT-3’ (Пр1),
5’-ССААТСААСАААСТСССААСАА-3’ (Пр2);
- для гена RASSF1A - 45 секунд при 95.5°С, 45 секунд при 64°С (для метелированной пары праймеров), 45 секунд при 59°С (для неметилированной пары праймеров), 45 секунд при 72°С; были использованы праймеры (14):
метилированная пара - 5’-GGGTTTTGCGAGAGCGCG-3’ (Пр1),
5’-GCTAACAAACGCGAACCG-3’ (Пр2);
неметилированная пара - 5’-GGTTTTGTGAGAGTGTGTTTAG-3’ (Пр1),
5’-САСТААСАААСАСАААССАААС-3’ (Пр2);
После окончания 55 циклов полимеразной цепной реакции реакционную смесь инкубировали 5 минут при 72°С и охлаждали до 4°С.
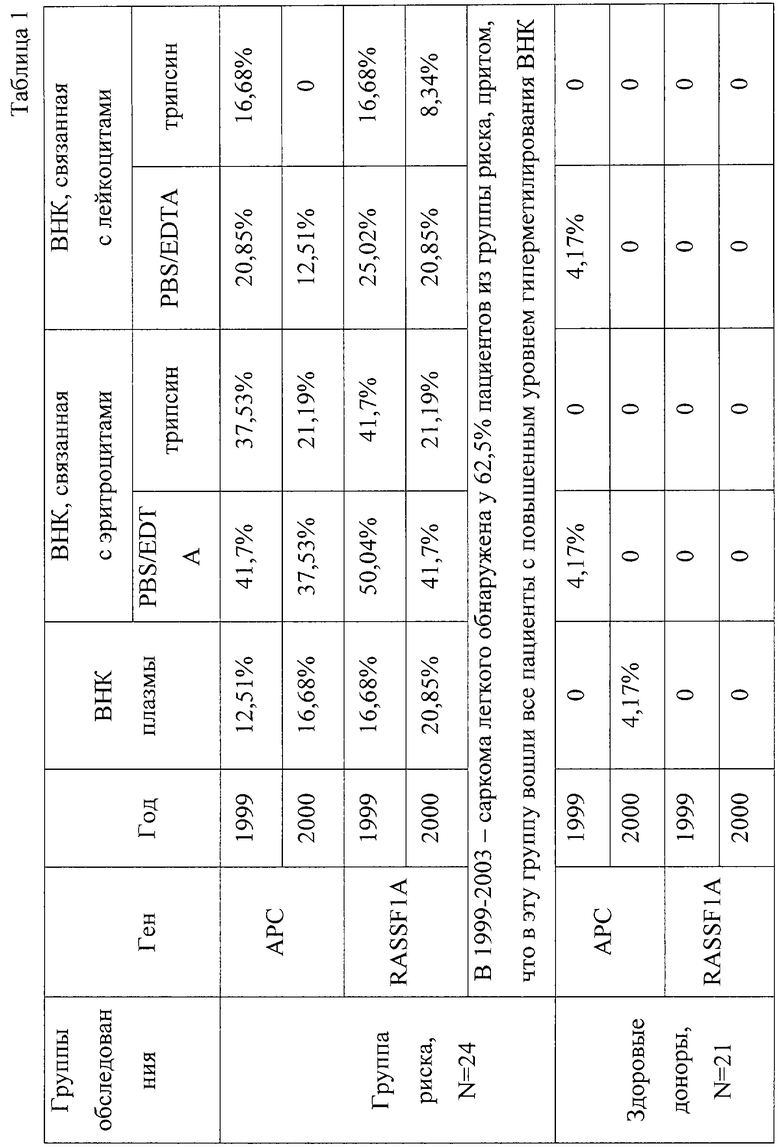
Полученные данные представлены в табл.1, из которой видно, что метилированные маркеры АРС и RASSF1A, ассоциированные с легочным канцерогенезом, выявляются с большой частотой (до 50,04%) в элюатах ВПК, связанных с клеточной поверхностью, на ранней стадии заболевания (обследование 1999 г.), что позволило поставить предварительный диагноз. Через год при повторном обследовании более высокий процент гиперметилированных маркеров в группе риска (до 20,85%) выявлялся уже и в образцах плазмы, что объясняется уменьшением количества ВНК, связанных с клеточной поверхностью. В течение 5 лет с момента первого взятия крови у 60% пациентов из группы риска был клинически подтвержден рак легкого. У всех больных, показавших положительный профиль гиперметилирования, был диагностирован рак легкого. Наиболее эффективное выявление специфических последовательностей обнаружено во фракции, содержащей ВНК, элюированные с поверхности эритроцитов обработкой ФБР/ЭДТА.
Данный пример иллюстрирует, что заявляемый способ может быть использован для ранней диагностики рака легкого, что способствует своевременному выбору правильной стратегии лечения.
Пример 2
У группы женщин (N=32), успешно прооперированных два года назад по поводу раковой опухоли груди и прошедших курс химиотерапии, были взяты образцы крови с профилактической целью, так как пациентки с раком груди входят в группу онкобольных с высоким риском повторных новообразований. Выделение ВНК, циркулирующих в плазме (для сравнения) и связанных с поверхностью эритроцитов и лейкоцитов, проводили аналогично примеру 1.
Для оценки экспрессии онкогенов, имеющих важное прогностическое значение при раке груди, мультиплексный количественный ПЦР-анализ провели с использованием праймеров, специфичных для генов с-mус и с-еrbВ2.
Без предварительной термической денатурации в реакционную смесь добавляли 1 ед. Tfl ДНК полимеразы (производства Tpicentre Technologies) и проводили 30 циклов полимеразной цепной реакции в следующем режиме:
- для гена c-myc - 1 минута при 94°С, 1 минута при 65°С, 2 минуты при 72°С; были использованы праймеры (15):
5’-CTCGAATTCCTTCCAGATATCCTCGCTG-3’ (Пр1);
5’-CACTGCGCGCTGCGCCAGGTTT-3’ (Пр2);
- для гена c-erbB2 - 1 минута при 94°С, 1 минута при 56°С, 2 минуты при 72°С; были использованы праймеры (16):
5’-CAGGTAGTTTGGCGTAAAAATAAA-3’ (Пр1);
5’-CAAAATCCAGGGTTTTTTAAGAGGT-3’ (Пр2).
После окончания 30 циклов ПЦР продукты были разделены в агарозном геле методом электрофореза, окрашены бромистым этидием и количественно оценены при помощи Системы Gel Doc 2000 (Bio-Rad) и компьютерной программы Quantity One (Bio-Rad).
Процент выявленной у пациенток (N=32) сверхэкспрессии исследованных генов представлен в табл.2
Из табл.2 видно, что анализ ДНК, связанной с клеточной поверхностью, как эритроцитов, так и лейкоцитов, выявил сверхэкспрессию исследованных генов у 9% женщин (3/32), в то время как при анализе плазмы тех же пациенток были получены отрицательные результаты. В течение последующих двух лет у 9% пациенток были клинически диагностированы повторные метастазы в региональных лимфоузлах. При этом обнаружена одинаковая эффективность выявления специфических последовательностей из фракций, содержащих элюаты с поверхности и эритроцитов, и лейкоцитов.
Данный пример иллюстрирует, что разработанный способ может быть использован для оценки эффективности хирургического вмешательства и постоперационной терапии.
Пример 3
У 38 пациентов с подозрением на рак прямой кишки (группа риска) и у контрольной группы здоровых доноров были взяты образцы крови.
Выделение РНК, связанных с поверхностью эритроцитов и лейкоцитов, проводили аналогично примеру 1. Выявление двух маркерных последовательностей мРНК, цитокератина19 (СК19) и карциномоэмбрионального антигена (СЕА), проводили методом RT-PCR.
В реакционную смесь сразу добавляли 0,5 ед. Amply Taq Gold ДНК полимеразы и 3 ед. MultiScribe обратной транскриптазы (РЕ Diosystems, USA). Затем реакционную смесь последовательно инкубировали 12 минут при 42°С и денатурировали 9 минут при 95°С, после чего проводили 43 цикла (для СК19) и 40 циклов (для СЕА) полимеразной цепной реакции в следующих режимах:
- для гена СК19 - 30 секунд при 95°С, 30 секунд при 58°С, 1 минута при 72°С; были использованы праймеры (17):
5’-GTGGAGGTGGATTCCGTCC-3’ (Пp1),
5’-TGGCAATCTCCTGCTCCAGC-3’ (Пр2);
- для гена СЕА - 30 секунд при 95°С, 30 секунд при 65°С, 1 минута при 72°С; были использованы праймеры (17):
5’-TCTGGAACTTCTCCTGGTCTCTCAGCTGG-3’ (Пр1),
5’-TGTAGCTGTTGCAATGCTAAGGAAGAAGC-3’ (Пр2);
После окончания 43(40) циклов полимеразной цепной реакции реакционную смесь инкубировали 11 минут при 72°С.
Далее ПЦР продукты были разделены в полиакриламидном геле методом электрофореза и оценены денситометрически при помощи Системы GS-690 Imaging Densitometry (Bio-Rad) и компьютерной программы Multi-Analyst/PC (Bio-Rad).
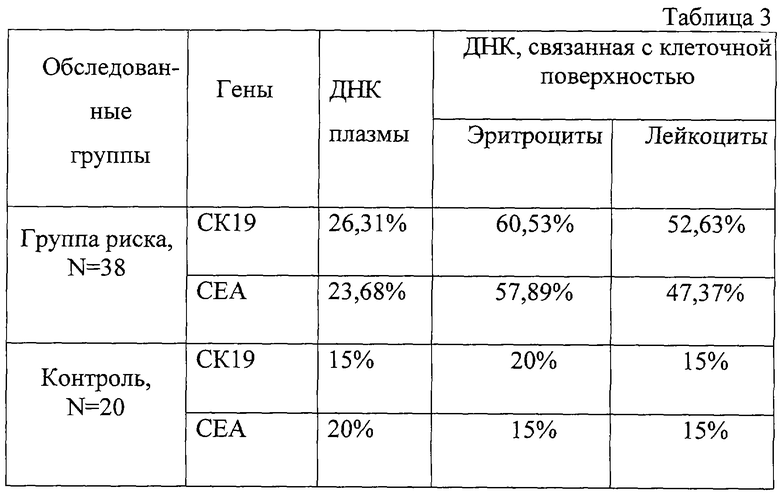
Полученные данные представлены в табл.3. Из табл.3 видно, что по результатам исследования ВНК, связанных с клеточной поверхностью, 60,53% предраковых пациентов имеют положительный результат хотя бы по одному из маркеров, в то же время в плазме выявляется только 26,31%. При этом более эффективное выявление специфических последовательностей обнаружено во фракции, содержащей ВНК, элюированные с поверхности эритроцитов.
Данный пример иллюстрирует, что разработанный способ может быть использован для диагностики онкозаболеваний на ранних стадиях.
Пример 4
У 32 женщин с преэклампсией были взяты образцы крови, 8 случаев были диагностированы как тяжелые. Для контроля были взяты пробы крови у женщин с нормально протекающей беременностью. Выделение ВНК, связанных с поверхностью эритроцитов и лейкоцитов, проводили аналогично примеру 1. Количественное определение (эквивалент генома на 1 мл крови) суммарной внеклеточной ДНК и мужской плодной внеклеточной ДНК, связанной с поверхностью клеток, проводили методом TaqMan real-time ПЦР с использованием праймеров, специфичных для генов SRY (локализация на Y-хромосоме) и GAPDH.
В реакционную смесь сразу добавлялась Amply Taq Gold ДНК полимераза (Perkin Eimer) из расчета 0, 025 ед. на 1 μl и AmpErase урацил-N-гликозилаза (Perkin Eimer) из расчета 0,01 ед. на 1 μl. Затем реакционную смесь последовательно инкубировали 2 минуты при 50°С и денатурировали 10 минут при 95°С, после чего для обоих генов проводили 40 циклов полимеразной цепной реакции в следующем режиме: 1 минута при 60°С и 15 секунд при 95°С; были использованы следующие праймеры и флуоресцентные зонды (8):
- для гена GAPDH-
5’-CCCCACACACATGCACTTACC-3’ (Пр1);
5’-CCTAGTCCCAGGGCTTTGATT-3’ (Пр2);
5’-(FAM)AAAGAGCTAGGAAGGACAGGCAACTTGGG(TAMPA)-3’ (зонд).
- для гена SRY-
5’-TCCTCAAAAGAAACCGTGCAT-3’ (Пр1);
5’-AGATTAATGGTTGCTAAGGACTGGAT-3’ (Пр2);
5’-(6-carboxyfluorescein; FAM) CACCAGCAGTAACTCCCCACAACCTCTTT (6-carboxytetramethylrhodamine; TAMPA)-3’ (зонд).
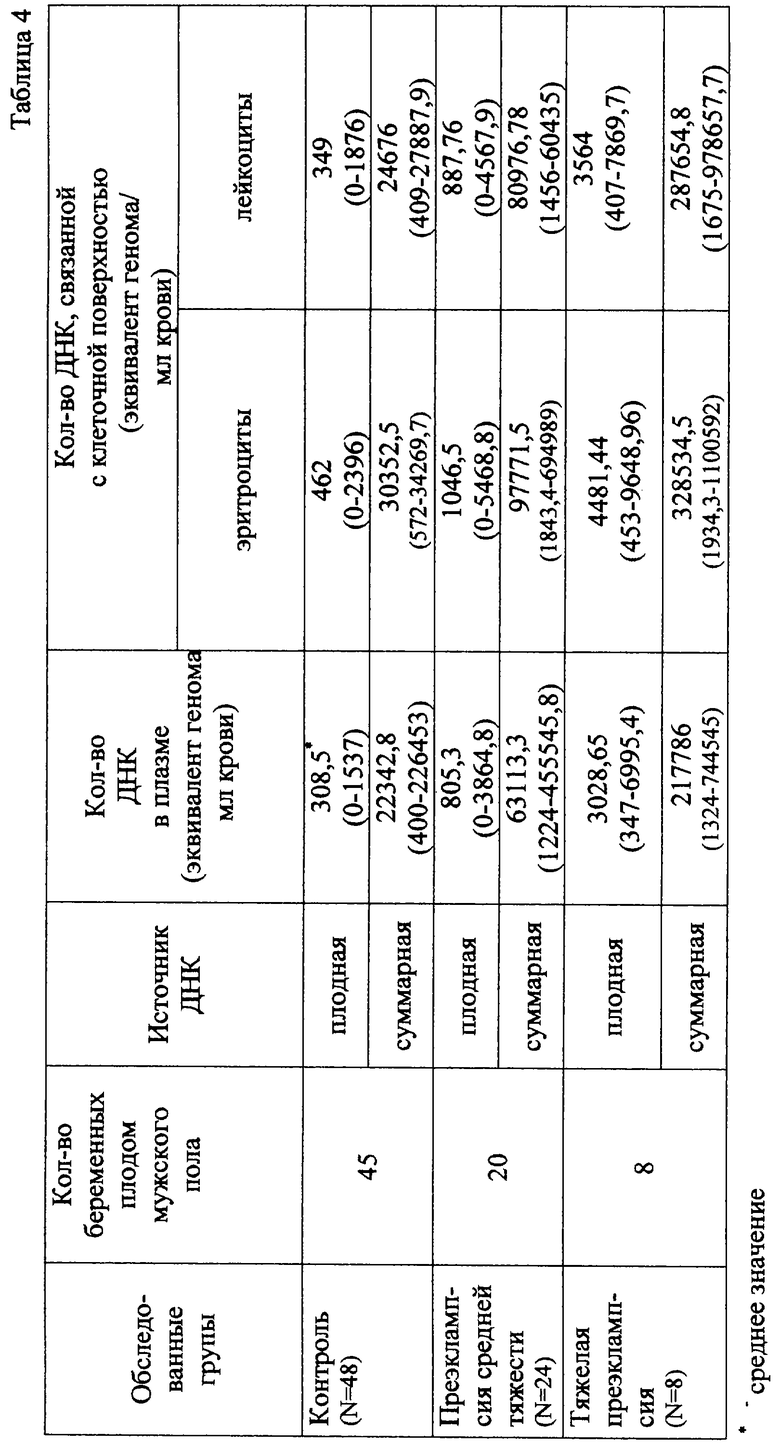
Полученные данные представлены в табл.4. Из табл.4 видно, что количества ДНК, связанной с клеточной поверхностью (как суммарной, так и плодной), в группе женщин с тяжелой преэклампсией повышены в 10 раз по сравнению с группой женщин, беременность которых протекает нормально.
Данный пример иллюстрирует, что разработанный способ может быть использован для оценки тяжести патологии беременности, уточнения диагноза и мониторинга эффективности терапии.
Использование предлагаемого способа позволит по сравнению с прототипом повысить достоверность ранней диагностики заболеваний, связанных с нарушением функционирования генетического аппарата клетки, за счет:
- уменьшения количества балластных нуклеиновых кислот из нормальных клеток крови;
- увеличения удельного содержания выявляемых специфических последовательностей ВНК, связанных с клеточной поверхностью, по сравнению с содержанием специфических последовательностей ВНК, выделенных из плазмы крови;
- увеличения чувствительности детекции специфических (маркерных) последовательностей ДНК и РНК, связанных с клеточной поверхностью эритроцитов и лейкоцитов, что особенно важно на ранних стадиях развития патологий, когда основная масса внеклеточных кислот связана с поверхностью клеток крови.
ИСТОЧНИКИ ИНФОРМАЦИИ
1. Ylikoski A, Pettersson К, Nurmi J, Irjala К, Karp M, Lilja H, Lovgren Т, Nurmi M. Simultaneous quantification of prostate-specific antigen and human glandular kallikrein 2 mRNA in blood samples from patients with prostate cancer and benign disease // Clin. Chem. 2002, V.48 (8): 1265-71.
2. Leon SA, Shapiro B, Sklaroff DM, Yaros MJ. Free DNA in the serum of cancer patients and the effect of therapy // Cancer Res. 1977, V.37 (3): 646-50.
3. Shapiro B, Chakrabarty M, Cohn EM, Leon SA. Determination of circulating DNA levels in patients with benign or malignant gastrointestinal disease // Cancer, V.51: 2116-20.
4. Stroun M, Anker P, Maurice P, Lyautey J, Lederrey С, Beljanski M. Neoplastic characteristics of the DNA found in the plasma of cancer patients // Oncology, 1989, V.6 (5): 318-22.
5. Sozzi G, Conte D, Mariani L, Lo Vullo S, Roz L, Lombardo C, Pierotti MA, Tavecchio L. Analysis of Circulating Tumor DNA in Plasma at Diagnosis and during Follow-Up of Lung Cancer Patients // Cancer Research. 2001, V.61 (15): 4675-4678.
6. Allan JM, Hardie LJ, Briggs JA, Davidson LA, Watson JP, Pearson SB, Muers MF, Wild CP. Genetic alterations in bronchial mucosa and plasma DNA from individuals at high risk of lung cancer // Int. J. Cancer, 2001, 91(3): 359-365.
7. Sorenson GD, Pribish DM, Valone FH, Memoli VA, Bzik DJ, Yao SL. Soluble normal and mutated DNA sequences from single-copy genes in human blood // Cancer Epidemiology, Biomarkers & Prevention, 1994, V.3: 67-71.
8. Zhong XZ, Lavuori H, Livingston JC, Ylikorkala O, Sibai BM, Holzgreve W, Hahn S. Elevation of maternal and fetal extracellular circulating deoxyribonucleic acid concentrations in the plasma of pregnant women with preeclampsia // Am. J. Obstet. Gynecol. 2001, V.184 (3): 414-419.
9. Kopreski MS, Benko FA, Borys DJ, Khan A, McGarrity TJ, Gocke CD. Somatic mutation screening: identification of individuals harboring K-ras mutations with the use of plasma DNA // Journal of the National Cancer Institute 2000, V.92: 11.
10. Juckett DA, Rosenberg B. Actions of cis-diamminedichloroplatinum on cell surface nucleic acids in cancer cells as determined by cell electrophoresis techniques // Cancer Res 1982, V.42 (9): 3565-73.
11. Laktionov PP, Dazard JE, Vives E, Rykova EY, Piette J, Vlassov VV, Lebleu B. Characterisation of membrane oligonucleotide-binding proteins and oligonucleotide uptake in keratinocytes // Nucleic Acids Res. 1999, V.27 (11): 2315-24.
12. Boom R., Sol C.J.A. Rapid and simple method for purification nucleic acids // J. Clin. Microbiol. 1990. V.28. P.495-503.
13. Virmani AK, Rathi A, Sathyanarayana UG, Padar A, Huang CX, Cunnigham HT, Farinas AJ, Milchgrub S, Euhus DM, Gilcrease M, Herman J, Minna JD, Gazdar AF. Aberrant methylation of the adenomatous polyposis coli (APC) gene promoter 1A in breast and lung carcinomas // Clin. Canc. Res. 2001, V.7 (7): 1998-2004.
14. Burbee, D.G.; Forgacs, E.; Zochbauer-Muller, S.; Shivakumar, L.; Fong, K.; Gao, В.; Randle, D.; Kondo, M.; Virmani, A.; Bader, S.; Sekido, Y; Latif, F.; Milchgrub, S.; Toyooka S, Gazdar AF, Lerman MI, Zabarovsky E, White M, Minna JD. Epigenetic inactivation of RASSFIA in lung and breast cancers and malignant phenotype suppression // J. Natl. Canc. Inst. 2001, V.93 (9): 691-699.
15. Kowara R, Golebiowski F, Chrzan P, Skokowski J, Karmolinski A, Awelczyk T. Abnormal FHIT gene transcript and c-myc and c-erbB2 amplification in breast cancer // Acta Biochimica Polonica, 2002, V.49 (2): 341-350.
16. Lonn U, Lonn S, Nilsson B, Stenkvist B. Prognostic value of erb-B2 and myc amplification in breast cancer imprints. Cancer, 1995, V.75 (11): 2681-2687.
17. Silva JM, Rodriguez R, Garcia JM, Munoz C, Dominguez G, Provencio M, Espana P, Bonilla F. Detection of epithelial tumour RNA in the plasma of colon cancer patients is associated with advanced stages and circulating tumour cells // Gut, 2002, V.50: 530-534.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ВЫДЕЛЕНИЯ ВНЕКЛЕТОЧНЫХ ДЕЗОКСИРИБОНУКЛЕИНОВЫХ КИСЛОТ ИЗ КРОВИ | 2008 |
|
RU2372405C1 |
| СПОСОБ ВЫДЕЛЕНИЯ ВНЕКЛЕТОЧНЫХ НУКЛЕИНОВЫХ КИСЛОТ ИЗ МОЧИ | 2006 |
|
RU2311640C1 |
| СПОСОБ РАННЕЙ ДИАГНОСТИКИ И МОНИТОРИНГА ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2003 |
|
RU2251696C2 |
| СПОСОБ РАННЕГО ОПРЕДЕЛЕНИЯ ПОЛА БУДУЩЕГО РЕБЕНКА | 2006 |
|
RU2317334C1 |
| СПОСОБ ПОЛУЧЕНИЯ СУММАРНОЙ ФРАКЦИИ ВНЕКЛЕТОЧНЫХ НУКЛЕИНОВЫХ КИСЛОТ ИЗ КРОВИ | 2014 |
|
RU2554746C1 |
| СПОСОБ ДИАГНОСТИКИ И МОНИТОРИНГА ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ С ИСПОЛЬЗОВАНИЕМ ЭКЗОСОМ КРОВИ | 2014 |
|
RU2571507C1 |
| Способ ранней диагностики опухолей предстательной железы | 2021 |
|
RU2756643C1 |
| Способ диагностики рака легкого | 2016 |
|
RU2633693C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭКЗОСОМ ИЗ КРОВИ | 2014 |
|
RU2556825C1 |
| СПОСОБ ДИАГНОСТИКИ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2016 |
|
RU2642989C1 |
Изобретение относится к области диагностической медицины, а именно к разработке неинвазивных способов ранней диагностики различных заболеваний человека, в частности к выявлению ранних стадий рака, патологии беременности, а также мониторинга эффективности терапии. Сущность способа заключается в том, что после забора крови ее разделяют на плазму и фракцию клеток крови, затем фракцию клеток крови разделяют на эритроциты и лейкоциты, далее последовательно элюируют внеклеточные нуклеиновые кислоты, связанные с поверхностью эритроцитов и лейкоцитов, из полученных элюатов выделяют фракции внеклеточных нуклеиновых кислот и проводят амплификационный анализ не менее 2-х известных специфических последовательностей нуклеиновых кислот, ассоциированных с определенным заболеванием, с использованием соответствующего метода (полимеразная цепная реакция, лигазная цепная реакция, мультиплексная ПЦР и др.). Преимущество изобретения заключается в повышении точности диагностики. 5 з.п. ф-лы, 4 табл., 1 ил.

| KOPRESKI M.S | |||
| et al., Somatic mutation screening: identification of individuals harboring K-ras mutations with the use of plasma DNA, J | |||
| of the Nat | |||
| Cancer Justitute, 2000, v.92, p.11 | |||
| ГЕН MTS, МУТАЦИИ ДАННОГО ГЕНА И СПОСОБЫ ДИАГНОСТИКИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ С ИСПОЛЬЗОВАНИЕМ ПОСЛЕДОВАТЕЛЬНОСТИ ГЕНА MTS | 1995 |
|
RU2164419C2 |
| US 2002132227 A, 19.09.2002. | |||
Авторы
Даты
2005-04-10—Публикация
2003-08-18—Подача