Изобретение относится к области биотехнологии, генной инженерии и может быть использовано для получения антиоксидантного препарата пероксиредоксина, предназначенного для лечения заболеваний, связанных с окислительным стрессом.
Известно, что при неполном восстановлении молекулярного кислорода в процессе клеточного дыхания образуются активные формы кислорода - супероксидный анион радикал (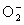 ), перекись водорода (H2O2), гидроксильный радикал (НО·), которые являются крайне токсичными для клеток. Аэробные организмы выработали защитные механизмы для обезвреживания этих веществ. Одним из таких защитных механизмов является восстановление активных форм кислорода в результате реакций, катализируемых ферментами - антиоксидантами. Эти белки играют важную роль в поддержании окислительно-восстановительного потенциала клетки. К ним относятся хорошо изученные антиоксиданты, такие как супероксиддисмутаза, каталаза, глутатионпероксидаза, а, кроме того, открытые в последнее десятилетие пероксиредоксины [Chae H.Z., Robison К., Poole L.B., Church G., Storz G., and Rhee S.G. (1994) Proc. Natl. Acad. Sci. USA, 91, 7017-7021].
), перекись водорода (H2O2), гидроксильный радикал (НО·), которые являются крайне токсичными для клеток. Аэробные организмы выработали защитные механизмы для обезвреживания этих веществ. Одним из таких защитных механизмов является восстановление активных форм кислорода в результате реакций, катализируемых ферментами - антиоксидантами. Эти белки играют важную роль в поддержании окислительно-восстановительного потенциала клетки. К ним относятся хорошо изученные антиоксиданты, такие как супероксиддисмутаза, каталаза, глутатионпероксидаза, а, кроме того, открытые в последнее десятилетие пероксиредоксины [Chae H.Z., Robison К., Poole L.B., Church G., Storz G., and Rhee S.G. (1994) Proc. Natl. Acad. Sci. USA, 91, 7017-7021].
Пероксиредоксины - новое семейство белков, которое в настоящее время насчитывает более 100 представителей, обнаруженных во всех живых организмах от архебактерий до человека и являющихся тиоловыми пероксидазами [Lee S.P., Hwang Y.S., Kim Y.J., Kwon K.S., Kim H.J., Kim K., Chae H.Z. (2001) J. Biol. Chem., 276, 29826-29832].
У млекопитающих выявлено 6 типов пероксиредоксинов, различающихся по аминокислотной последовательности, механизму действия и локализации в организме и в клетке. Все пероксиредоксины в своей последовательности содержат высоко консервативный участок, являющийся активным центром ферментов, в состав которого входят один или два остатка Cys. В тестах in vitro было показано, что пероксиредоксины предотвращают инактивацию глутаминсинтетазы в присутствии Fe3+, О2 и дитиотреитол (ДТТ) - модельной окислительной системе, генерирующей свободные радикалы [Kim К, Kim I.H., Lee K.Y., Rhee S.G., Stadtman E.R. (1988) J. Biol. Chem., 263, 4704-4711].
К настоящему времени 1-Cys пероксиредоксин (пероксиредоксин VI, PrxVI) идентифицирован во многих органах и тканях млекопитающих. Первые природные индивидуальные белковые препараты PrxVI млекопитающих были выделены из обонятельного эпителия [Peshenko I.V., Novoselov V.I., Evdokimov V.A., Nikolaev Yu.V.. Shuvaeva T.M., Lipkin V.M., Fesenko E.E. (1996) FEBS Letters, 381, 12-14] и легких крысы [Kim T.S., Sundaresh C.G., Feinstein S.I., Dodia C., Skach W.R., Jain M.R., Nagase Т., Seki N.. Isherawa K., Nomura N., Fisher A.B. (1997) J. Biol. Chem., 272, 2542-2550]. Эти способы включают в себя накопление и гомогенизацию ткани, экстракцию целевого белка, а также тонкое фракционирование препарата с помощью трех последовательных хроматографических стадий. И хотя ткани, непосредственно контактирующие с кислородом воздуха, наиболее обогащены PrxVI [Novoselov S.V., Peshenko I.V., Popov V.I., Novoselov V.I., Bystrova M.F., Evdokimov V.J., Kamzalov S.S., Merkulova M.I., Shuvaeva T.M., Lipkin V.M., Fesenko E.E. (1999) Cell Tissue Res., 298, 471-480], эти трудоемкие и промышленно невоспроизводимые способы имеют лишь теоретическое значение. Основными недостатками получения PrxVI из природных источников являются: необходимость накопления животных тканей, малый конечный выход чистого препарата (0,01 мг на одно животное) и возможность возникновения аллергических реакций при использовании чужеродного белка для лечения человека.
В настоящее время препаративные количества PrxVI млекопитающих получают более предпочтительными генноинженерными методами, позволяющими нарабатывать нужные количества однородного генетического материала (выбранного вектора, соединенного со структурным геном полипептида) и, как следствие, конечного продукта - белка.
Так, в клетках штамма Е. coli BL21 (DE3) был осуществлен биосинтез полноразмерного рекомбинантного PrxVI человека (PrxVIhum) [Chen L.-W., Dodia С., Feinstein S.I., Jain M.K., Fisher A.B. (2000) J. Biol. Chem., 275, 28421-28427]. Для этого был взят фрагмент кДНК PrxVIhum (PrxVIhum) HA0683 (GenBank™ D14662) длиной 1653 п.о., содержащий открытую рамку считывания для PrxVIhum (224 а.о.) размером 672 п.о. Большая часть исходного фрагмента (длиной 1044 п.о.) была встроена в экспрессирующий вектор рЕТ28с по сайту рестрикции HindIII. Полученная конструкция обеспечивала наработку рекомбинантного белка, который, наряду с аминокислотной последовательностью PrxVIhum, содержал 42 дополнительных аминокислотных остатка, включая шесть остатков His на N-конце полипептидной цепи белка. Взяв за основу тот же фрагмент-PrxVIhum и искусственно введя сайты для узнавания рестриктаз NdeI и XhoI, авторы амплифицировали кодирующую область. Полученный фрагмент был клонирован по этим сайтам в экспрессирующий вектор рЕТ21b. В результате рекомбинантный белок, биосинтез которого детерминировала эта плазмида, содержал только два дополнительных аминокислотных остатка, помимо шести остатков His на С-конце полипептидной цепи продукта. После трансформации Е. coli полученными рекомбинантными ДНК и индукции экспрессии генов изопропилтиогалактозидом (ИПТГ) клетки наращивали в течение 6 ч и разрушали; белковые препараты подвергали последовательной очистке хроматографическими методами. К недостаткам обоих полученных продуктов можно отнести то, что, хотя и введение в состав полипептидной цепи дополнительных остатков His значительно упрощает выделение рекомбинантных белков, такого рода модификации заметно смещают изоэлектрическую точку белковых продуктов по сравнению с природным и, как следствие, меняют их электростатическое микроокружение. Кроме того, введение дополнительных аминокислотных остатков (42-х в первой конструкции и 2-х - во второй) увеличивает молекулярную массу продукта и, как следствие, ухудшает его проникновение в клетку.
Экспрессия рекомбинантного PrxVI была осуществлена также в бакуловирусной системе [Fujii Т., Fujii J., Taniguchi N. (2001) Eur. J. Biochem., 268, 218-224]. Для этого из различных тканей крысы была выделена смесь мРНК, по которой обратной полимеразной реакцией синтезировали комплементарную цепь ДНК. Затем эту кДНК субклонировали в бакуловирусный челночный вектор pVL1392. Полученная конструкция обеспечивала наработку полноразмерного PrxVI крысы при инфекции эукариотических клеток Sf21. С помощью высаживания, фракционированием на ионообменной смоле с последующими стадиями гель-фильтрации функционально активный рекомбинантный белок был выделен из культуральной жидкости этих клеток. К недостаткам этого метода можно отнести длительность получения (5 дней) препарата, необходимость использования дорогостоящих питательных сред, невысокий по сравнению с бактериальными системами выход целевого продукта и возможность возникновения побочных аллергических реакций при использовании в лекарственных композициях крысиного PrxVI.
Наиболее близким по технической сущности к предлагаемому изобретению является полипептид массой 25034 Да, представляющий собой полноразмерный рекомбинантный PrxVIhum и кодирующая его рекомбинантная плазмидная ДНК pET23-a(+)/PrxVIhum [Меркулова М.И., Шуваева Т.М., Радченко В.В., Янин В.А., Бондарь А.А., Софин А.Д., Липкин В.М. (2002) Биохимия, 67, 1496-1501]. Получаемый пероксиредоксин обладает высокой антиоксидантной активностью. Однако высокая молекулярная масса, препятствующая проникновению молекулы антиоксиданта в клетки организма человека, ограничивает его применение.
Задачей предлагаемого изобретения является конструирование плазмиды, детерминирующей синтез укороченного полипептида PrxVIhum, сохраняющего антиоксидантную активность полноразмерного PrxVIhum, a также создание высокопродуктивного штамма-продуцента для получения полипептида пероксиредоксина человека VI, являющегося N-концевым фрагментом PrxVIhum.
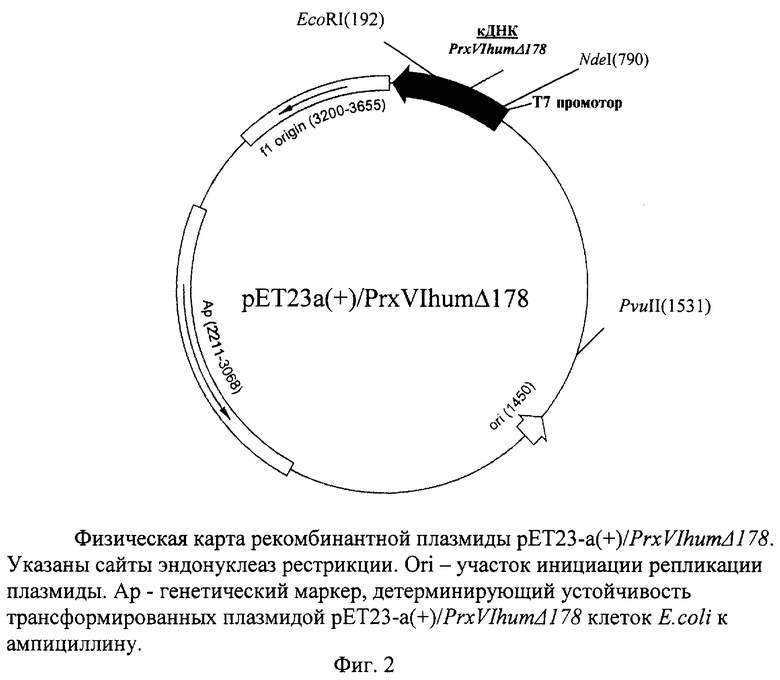
Поставленная задача решается за счет конструирования рекомбинантной плазмидной ДНК pET23-a(+)/PrxVIhumΔ178, кодирующей N-концевой фрагмент пероксиредоксина VI человека с молекулярной массой 19691,61 Да, содержащей ЕсоRI-NdeI-фрагмент плазмиды рЕТ23-а(+), включающий промотор РНК-полимеразы фага Т7, участок инициации репликации (ori) и терминатор транскрипции рибосомального оперона E.coli, Ndel-EcoRl - фрагмент гена PrxVIhum длиной 552 п.о., кодирующий PrxVIhumΔ178, генетический маркер - Ар, детерминирующий устойчивость трансформированных плазмидой рЕТ23-a(+)/PrxVIhumΔ178 клеток E.coli к ампициллину, уникальные сайты узнавания рестрикционными эндонуклеазами со следующими координатами: NdeI-790, EcoRI-192, PvulI-1531, а также за счет штамма Е. coli BL21/DE3/pET23-a(+)/PrxVIhumΔ178- продуцента N-концевого фрагмента пероксиредоксина VI человека, обеспечивающего синтез N-концевого фрагмента PrxVIhum размером 177 аминокислотных остатков (PrxVIhumΔ178) с уровнем экспрессии в 30% от суммарного клеточного белка (30 мг/л культуральной жидкости).
Преимуществом заявленного технического решения является возможность получения антиоксиданта - пероксиредоксина VI человека с сохранением антиоксидантной активности полноразмерного пероксиредоксина при пониженной молекулярной массе, что обеспечивает проникновение препарата в клетки организма человека.
Исходной плазмидой для конструирования новой последовательности ДНК, кодирующей полипептид PrxVIhumΔ178, служит плазмида рЕТ23-а(+)/PrxVIhum, детерминирующая экспрессию полноразмерного рекомбинантного PrxVIhum. Эту плазмиду конструируют на основе векторной плазмиды рЕТ23-а(+)[Studier F.W., Moffatt, B.A. (1986) J. Mol. Biol., 189, 113-130]. Фрагмент PrxVIhum, предназначенный для клонирования с сохранением рамки считывания в экспрессирующем векторе, получают методом полимеразной цепной реакции (ПЦР) [Taylor G. In: Polymerase Chain Reaction. A Practical Approach, v.1, McPherson M.J., Quirke P., Taylor G. R. eds. Oxford Univ. Press. Oxford. 1994] с использованием в качестве праймеров олигонуклеотидов, в последовательности которых введены точечные замены для создания соответствующих участков рестрикции. В качестве прямого праймера используют 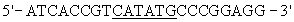 (подчеркнут сайт узнавания рестриктазы NdeI), в качестве обратного -5'-CCA
(подчеркнут сайт узнавания рестриктазы NdeI), в качестве обратного -5'-CCA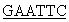 TTAAGGCTGGGGTGTG-3' (подчеркнут участок узнавания рестриктазы EcoRI). В качестве матрицы для проведения ПЦР используют плазмиду, содержащую последовательность PrxVIhum HA0683 (GenBank™ D 14662). Реакционная смесь для проведения ПЦР содержит (в объеме 50 мкл): 1 нг плазмидной ДНК, 20 пмоль каждого праймера, 5 мкл буфера для ПЦР фирмы “Promega”, 200 мкМ каждого dNTP, 5 единиц Taq-полимеразы. Реакцию начинают со стадии предварительной денатурации ДНК - 94°С, 5 мин, затем проводят 30 циклов ПЦР при следующих параметрах температурного цикла: денатурация - 30 с при 94°С, отжиг с праймерами - 30 с при 60°С, элонгация - 45 с при 72°С с последующей инкубацией при 72°С в течение 5 мин. После обработки продукта реакции соответствующими рестриктазами PrxVIhum клонируют в плазмиду рЕТ23-а(+) по сайтам NdeI-EcoRI.
TTAAGGCTGGGGTGTG-3' (подчеркнут участок узнавания рестриктазы EcoRI). В качестве матрицы для проведения ПЦР используют плазмиду, содержащую последовательность PrxVIhum HA0683 (GenBank™ D 14662). Реакционная смесь для проведения ПЦР содержит (в объеме 50 мкл): 1 нг плазмидной ДНК, 20 пмоль каждого праймера, 5 мкл буфера для ПЦР фирмы “Promega”, 200 мкМ каждого dNTP, 5 единиц Taq-полимеразы. Реакцию начинают со стадии предварительной денатурации ДНК - 94°С, 5 мин, затем проводят 30 циклов ПЦР при следующих параметрах температурного цикла: денатурация - 30 с при 94°С, отжиг с праймерами - 30 с при 60°С, элонгация - 45 с при 72°С с последующей инкубацией при 72°С в течение 5 мин. После обработки продукта реакции соответствующими рестриктазами PrxVIhum клонируют в плазмиду рЕТ23-а(+) по сайтам NdeI-EcoRI.
Рекомбинантная плазмидная ДНК рЕТ23-а(+)/PrxVIhumΔ178 характеризуется следующими признаками:
имеет размер 4210 п.о.
кодирует N-концевой фрагмент PrxVIhum длиной 177 а.о.
состоит из EcoRI-NdeI-фрагмента плазмиды рЕТ23-а(+), включающего промотор РНК-полимеразы фага Т7, участок инициации репликации (ori) и терминатор транскрипции рибосомального оперона E.coli, Ndel-EcoRI-фрагмента длиной 552 п.о. с последовательностью, кодирующей PrxVIhumΔ178.
содержит генетический маркер - Ар, детерминирующий устойчивость трансформированных плазмидой pET23-a(+)/PrxVIhumΔ178 клеток E.coli к ампициллину, а также уникальные сайты узнавания рестрикционными эндонуклеазами со следующими координатами: NdeI-790, EcoRI-192, PvuII-1531.
Преимущества предложенной конструкции достигаются за счет того, что входящий в ее состав фрагмент PrxVIhumΔ178 кодирует укороченный по сравнению с PrxVIhum полипептид, сохраняющий антиоксидантную активность природного белка. Это, во-первых, упрощает хроматографическую очистку PrxVIhumΔ178; во-вторых, делает более технологичным его использование в составе лечебных композиций за счет лучшей проницаемости в ткани и увеличения времени циркуляции с биологическими жидкостями по сравнению с полноразмерным белком; в-третьих, увеличивает долю целевого продукта в общей биомассе штамма-продуцента, что в свою очередь ведет к снижению себестоимости конечного продукта.
Для получения штамма-продуцента полипептида PrxVIhumΔ178 компетентные клетки Е. coli BL21/DE3 трансформируют рекомбинантной плазмидной ДНК pET23-a(+)/PrxVIhumΔ178.
Полученный штамм Е. coli BL2\/DE3/pET23-a(+)/PrxVIhumΔ178 характеризуется следующими признаками.
Морфологические признаки: клетки мелкие палочковидной формы, грамотрицательные, неспороносные, 1×3,5 мкм, подвижные.
Культуральные признаки: при росте на агаризованной среде LB колонии круглые, гладкие, полупрозрачные, блестящие, серые. Край ровный, диаметр колоний 1-3 мм, консистенция пастообразная. Рост в жидких средах (LB, минимальная среда с глюкозой) характеризуется ровным помутнением, осадок легко седиментирует.
Физико-биохимические признаки: клетки растут при 4-42°С, оптимум рН 6,8-7,6. В качестве источника азота используют как минеральные соли азота, так и органические соединения: аминокислоты, пептон, триптон, дрожжевой экстракт. В качестве источника углерода при росте на минимальной среде используют глицерин, углеводы, аминокислоты.
Устойчивость к антибиотикам: клетки штамма-продуцента проявляют устойчивость к ампициллину (до 300 мг/мл), обусловленную наличием в плазмиде гена β-лактамазы (bla).
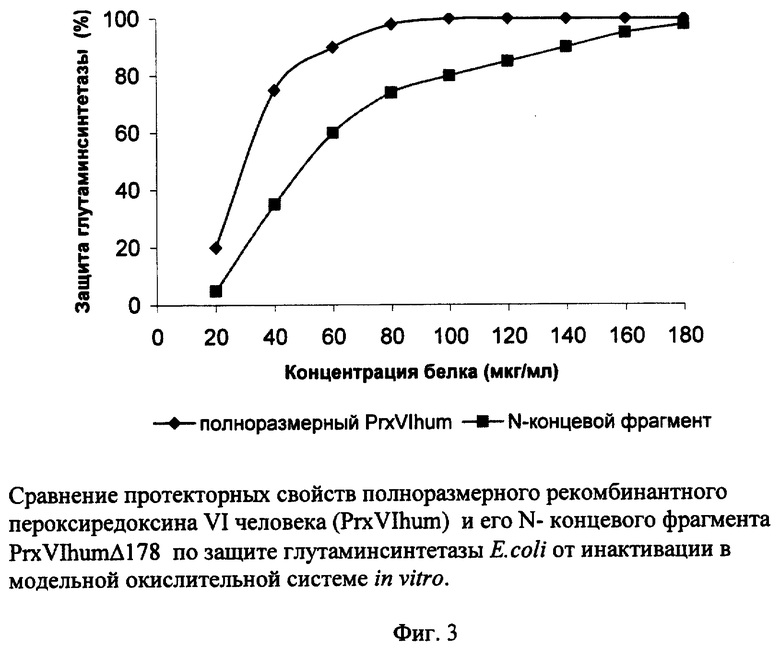
На фиг.1 представлена нуклеотидная последовательность NdeI-ЕсоRI-фрагмента плазмиды pET23-a(+)/PrxVIhumΔ178 и кодируемая им аминокислотная последовательность полипептида PrxVIhumΔ178; на фиг.2 - физическая карта полученной плазмиды; на фиг.3 - результаты сравнительного исследования протекторных свойств рекомбинантного полноразмерного PrxVI человека и его N-концевого фрагмента (PrxVIhumΔ178) по защите глутаминсинтетазы E.coli от инактивации в модельной окислительной системе in vitro.
Изобретение иллюстрируется следующими примерами.
Пример 1. Конструирование рекомбинантной плазмидной ДНК рЕТ23-a(+)/PrxVIhumΔ178, кодирующей N-концевой фрагмент Рrх VI человека. Используют фрагмент кДНК Рrх VI человека, который ранее был клонирован с сохранением рамки считывания в экспрессирующем векторе [Меркулова М.И., Шуваева Т.М., Радченко В.В., Янин В.А., Бондарь А.А., Софин А.Д., Липкин В.М.(2002) Биохимия, 67, 1496-1501]. Этот вектор, pET23-a(+)/PrxVJhum, используют в качестве матрицы для ПЦР. Полученный таким образом фрагмент ДНК кодирует N-концевой фрагмент Ргх VI длиной 177 аминокислотных остатков. В качестве прямого праймера на этой стадии используют 5'-GCG ААА ТТА АТА CGA CTC ACT ATA GGG -3' (комплементарный промоторной области вектора pET23-a(+)/PrxVIhum). В качестве обратного для PrxVIΔ178 - 5'-ССА ТСС ТТС 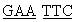 ААС ТТА GGT GGC-3' (подчеркнут сайт рестриктазы EcoRI, выделен стоп-кодон). Реакционная смесь содержит (в объеме 50 мкл): ~1 нг плазмидной ДНК, 20 пмоль каждого праймера, 5 мкл буфера для ПЦР (“Promega”, США), 200 мкМ каждого dNTP, 5 единиц Taq-полимеразы. Реакцию начинают с предварительной денатурации ДНК при 94°С в течение 3 мин, затем проводят 10 циклов ПЦР при следующих параметрах температурного цикла: денатурация - 30 с при 94°С, отжиг с праймерами - 30 с при 55°С, элонгация - 45 с при 72°С, затем еще 10 циклов реакции: денатурация - 30 с при 94°С, отжиг с праймерами - 30 с при 62°С, элонгация - 45 с при 72°С с последующей инкубацией при 72°С в течение 5 мин. После обработки соответствующими рестриктазами фрагмент PrxVIhumΔ178 лигируют с NdeI-EcoRI-фрагментом плазмиды рЕТ23-а(+) с использованием ДНК-лигазы фага Т4. Точность сборки конструкции проверяют рестрикционным анализом и секвенированием полученой вставки по модифицированному методу Сенгера [Чемерис А.В., Ахунов Э.Д., Вахитов В.А. Секвенирование ДНК, М., “Наука”, 1999]. На фиг.2 представлена физическая карта рекомбинантной плазмиды pET23-a(+)/PrxVIhumΔ178.
ААС ТТА GGT GGC-3' (подчеркнут сайт рестриктазы EcoRI, выделен стоп-кодон). Реакционная смесь содержит (в объеме 50 мкл): ~1 нг плазмидной ДНК, 20 пмоль каждого праймера, 5 мкл буфера для ПЦР (“Promega”, США), 200 мкМ каждого dNTP, 5 единиц Taq-полимеразы. Реакцию начинают с предварительной денатурации ДНК при 94°С в течение 3 мин, затем проводят 10 циклов ПЦР при следующих параметрах температурного цикла: денатурация - 30 с при 94°С, отжиг с праймерами - 30 с при 55°С, элонгация - 45 с при 72°С, затем еще 10 циклов реакции: денатурация - 30 с при 94°С, отжиг с праймерами - 30 с при 62°С, элонгация - 45 с при 72°С с последующей инкубацией при 72°С в течение 5 мин. После обработки соответствующими рестриктазами фрагмент PrxVIhumΔ178 лигируют с NdeI-EcoRI-фрагментом плазмиды рЕТ23-а(+) с использованием ДНК-лигазы фага Т4. Точность сборки конструкции проверяют рестрикционным анализом и секвенированием полученой вставки по модифицированному методу Сенгера [Чемерис А.В., Ахунов Э.Д., Вахитов В.А. Секвенирование ДНК, М., “Наука”, 1999]. На фиг.2 представлена физическая карта рекомбинантной плазмиды pET23-a(+)/PrxVIhumΔ178.
Пример 2. Экспрессия PrxVIhumΔ178-фрагмента кДНК РгхVI человека. Для экспрессии фрагмента PrxVIhum в качестве штамма-хозяина выбирают штамм E.coli BL-21(DE-3), несущий в хромосоме ген РНК-полимеразы фага Т7 под контролем индуцибельного lac-промотора [Studier F.W., Moffatt B.A. (1986) J. Mol. Biol., 189, 113-130]. Трансформацию компетентных клеток E.coli BL-21(DE-3) осуществляют химическим методом с использованием хлорида кальция [Sambrook J., Fritsch E., Maniatis T. (1989) Molecular Cloning, Cold Spring Harbor Laboratory Press, N.-Y.]. Для наработки рекомбинантного белка клетки выращивают при 37°С до достижения в жидкой культуре значения поглощения А6000,6. Затем для индукции экспрессии белков добавляют индуктор lac-промотора ИПТГ до конечной концентрации 0,4 мМ и продолжают инкубацию еще 5 ч. После этого суспензию клеток подвергают центрифугированию. Осадок, содержащий клетки штамма-продуцента, разрушают ультразвуком и повторно центрифугируют. Белковую фракцию, содержащую в своем составе целевой продукт, высаживают насыщенным раствором (NH4)2SO4 и диализуют против 12 мМ Трис-НСl буфера (рН 7,8), в состав которого входят 1 мМ MgCl2 и 1 мМ ДДТ. Белковую смесь хроматографируют на ДЭАЭ-сефарозе в градиенте хлорида натрия. Фракции, содержащие целевой полипептид, подвергают дальнейшей очистке с помощью гель-фильтрации на сефакриле S-200 и анализируют с помощью полиакриламидного гель-электрофореза в присутствии додецилсульфата натрия.
Пример 3. Сравнение протекторных свойств рекомбинантного полноразмерного PrxVIhum и его N-концевого фрагмента PrxVIhumΔ178 по защите глутаминсинтетазы Е. coli от инактивации в модельной окислительной системе in vitro.
Глутаминсинтетазу выделяют из клеток E.coli штамма DH5α [Streicher S.L., Tyier В. (1980) J. Bacteriol., 142, 69-78] и инактивируют в присутствии Fe3+, О2 и ДТТ - в модельной окислительной системе, генерирующей свободные радикалы [Kim К., Kim I.H., Lee K.Y., Rhee S.G., Stadtman E.R. (1988) J. Biol. Chem., 263, 4704-4711]. Реакцию инактивации глутаминсинтетазы проводят в объеме 60 мкл реакционной смеси, содержащей 5 мкг фермента, 50 мМ Hepes (рН 7,4), 3 мМ ДТТ и 3 мкМ FеСl3, в присутствии разных концентраций пероксиредоксина в течение 10 мин при 37°С. Затем определяют оставшуюся активность глутаминсинтетазы E.coli. Протекторные свойства пероксиредоксина по защите глутаминсинтетазы E.coli от инактивации определяют как отношение оставшейся активности фермента после инактивации в присутствии разных концентраций пероксиредоксина к активности неинактивированной глутаминсинтетазы. Результаты теста представлены на фиг.3.
Пример 4. Определение продуктивности штамма-продуцента PrxVIhumΔ178.
С целью улучшения аэрации в 5 мл жидкой среды LB, содержащей 100 мкг/мл ампициллина, вносят индивидуальную колонию клеток E.coli BL21/DE3, содержащую сконструированную плазмиду pET23-a(+)/PrxVIhumΔ178.
Выращивают при 37°С на качалке при 180 об/мин в течение 2,5 ч до достижения в жидкой культуре значения поглощения A600 0,6. Затем добавляют ИПТГ до концентрации 0,4 мМ и продолжают инкубацию в тех же условиях в течение 6 ч. Отбирают пробу 1 мл и центрифугируют 5 мин при 6000 об/мин, после чего клетки суспендируют в 100 мкл буфера, содержащего 125 мМ Трис-НСl (рН 6,8), 20% глицерина, 3% додецилсульфата натрия и 0,01% бромфенолового синего. Клеточную суспензию прогревают 10 мин на кипящей водяной бане. Отбирают образцы 2,5 мкл, 5 мкл, 7,5 мкл, 10 мкл и 15 мкл и анализируют электрофорезом в 15%-ном полиакриламидном геле, содержащем 0,1% додецилсульфата натрия [Laemmli U.K. (1970) Nature, 227, 680-687]. Гель окрашивают Кумасси R-250 и сканируют на лазерном денситометре Ultrascan XL. По данным сканирования полипептид PrxVIhumΔ178 составлял 30% суммарного клеточного белка, что соответствует выходу конечного чистого белкового продукта 30 мг/л культуры клеток.
Изобретение относится к области биотехнологии и генной инженерии и может быть использовано в фармацевтической промышленности. Сконструирована плазмидная ДНК pET23-a(+)/PrxVIhumΔ178 с молекулярной массой 19691, 61 Da, которая содержит промотор РНК-полимеразы Т7, участок инициации репликации, генетический маркер, детерминирующий устойчивость трансформированных данной плазмидой клеток и ампициллину, и последовательность нуклеотидов, кодирующих N-концевой фрагмент пероксиредоксина VI человека размером 177 аминокислотных остатков. Путем трансформации клеток E.coli плазмидной ДНК pET23-a(+)/PrxVIhumΔ178 получен штамм E.coli BL21/DE3/PeT23-a (+)/PrxVIhumΔ178 - продуцент N-концевого фрагмента пероксиредоксина VI человека. Использование предложенного изобретения позволяет получить фрагмент пероксиредоксина VI человека, обладающий антиоксидантной активностью полноразмерного пероксиредоксина при пониженной молекулярной массе, что обеспечивает лучшую проницаемость в ткани. 2 н.п. ф-лы, 3 ил.

| БИОХИМИЯ, 2002, 67 (11) | |||
| JP 2001285205, 19.09.2001 | |||
| ЕР 1217068, 26.06.2002. |
Авторы
Даты
2005-04-20—Публикация
2003-07-29—Подача