Изобретение относится к биотехнологии, в частности к генетической инженерии, конкретно, к получению человеческого белка SLURP-1, который может быть использован в медицине в качестве лекарственного препарата.
Известны регуляторные белки семейства SLURP, эндогенные модуляторы работы никотинового ацетилхолинового рецептора (нАХР), обнаруженные в плазме крови и моче человека [Adermann К, Wattler F, Wattler S, Heine G, Meyer M, Forssmann WG, Nehls M. (1999) Protein Sci. 8(4): 810-9], а также в клетках кожи и слизистой ткани [Mastrangeli R, Donini S, Kelton CA, He C, Bressan A, Milazzo F, Ciolli V, Borrelli F, Martelli F, Biffoni M, Serlupi-Crescenzi O, Serani S, Micangeli E, El Tayar N, Vaccaro R, Renda T, Lisciani R, Rossi M, Papoian R. (2003) Eur J Dermatol. 13(6): 560-70]. Эти белки обладают всеми характерными структурными особенностями нейротоксинов яда змей: они содержат остаток лейцина на N-конце молекулы и 10 остатков цистеинов, образующих токсиноподобную систему из 5-ти дисульфидных связей. Белки семейства SLURP обладают очень интересными с фармакологической точки зрения функционально-биологические свойствами. В отличие от альфа-нейротоксинов, эти белки в присутствии агонистов (ацетилхолина или никотина) не блокируют, а наоборот, активируют канал нАХР [Chimienti F, Hogg RC, Plantard L, Lehmann C, Brakch N, Fischer J, Huber M, Bertrand D, Hohl D. (2003) Hum Mol Genet 12(22): 3017-24].
Известен способ получения SLURP-1 человека, основанный на экспрессии в трансформированных клетках млекопитающих НЕК 293Т [Chimienti F, Hogg RC, Plantard L, Lehmann C, Brakch N, Fischer J, Huber M, Bertrand D, Hohl D. (2003) Hum Mol Genet. 12(22): 3017-24]. Недостатком этого метода является крайне низкий выход целевого продукта (0,1 мг белка с 1 л бактериальной культуры).
Изобретение решает задачу получения рекомбинантного человеческого белка SLURP-1.
Поставленная задача решается за счет конструирования рекомбинантной плазмидной ДНК pET22b(+)/SLURP-1, кодирующей белок SLURP-1 человека (5660 п.о.), и штамма бактерий Escherichia coli BL21(DE3)/pET22b(+)/SLURP-1 - продуцента белка SLURP-1 человека, обеспечивающего синтез этого белка с уровнем экспрессии не ниже 10% суммарного клеточного белка.
Рекомбинантная плазмидная ДНК pET22b(+)/SLURP-1, кодирующая белок SLURP-1 человека, характеризуется следующими признаками (Фиг.1):
имеет молекулярную массу 5660 п.о.;
кодирует аминокислотную последовательность SLURP-1 человека;
содержит: lac-промотор Е.coli, ген bla β-лактамазы, определяющий устойчивость трансформированных плазмидой pET22b(+)/SLURP-1 клеток к ампициллину, участок ori инициации репликации; уникальные сайты узнавания рестрикционными эндонуклеазами, имеющие следующие координаты: XhoI - 158, HindIII - 173, EcoRI - 192, BamHI - 198, NdeI - 430, BglII - 534, MluI - 1256, PstI - 4495.
Экспрессия гена SLURP-1 человека в клетках Е.coli сопровождается накоплением искусственного нейромодулятора в бактериальной цитоплазме в виде нерастворимых телец включения. Для его выделения необходимо использование денатурирующих агентов.
Для получения штамма-продуцента полипептида со структурой SLURP-1 человека компетентные клетки Escherichia coli BL21(DE3) трансформируют рекомбинантной плазмидой pET22b(+)/SLURP-1.
Полученный штамм Escherichia coli BL21(DE3)/pET22b(+)/SLURP-1 характеризуется следующими признаками.
Морфологические признаки. Клетки мелкие палочковидной формы, грамотрицательные, неспороносные, 1 х 3-5 мкм, подвижные.
Культуральные признаки. При росте на плотной среде LA колонии круглые, гладкие, полупрозрачные, блестящие, серые, край ровный, диаметр колоний 1-3 мм; консистенция пастообразная. Рост в жидкой среде LB характеризуется ровным помутнением с образованием легкого осадка.
Физико-биохимические признаки. Клетки растут при температуре 4-42°С при оптимуме рН 6,8-7,2. В качестве источника азота используют как минеральные соли в аммонийной форме, так и органические соединения в виде пептона, триптона, дрожжевого экстракта, аминокислот. В качестве источника углерода используют аминокислоты, глицерин, углеводы.
Устойчивость к антибиотикам. Клетки проявляют устойчивость к ампициллину (до 200 мкг/мл), обусловленную наличием в плазмиде гена бета-лактамазы.
Штамм Е.coli BL21(DE3)/pET22b(+)/SLURP-1 обеспечивает индуцибельный синтез белка SLURP-1 человека в количестве не менее 10% от суммарного клеточного белка.
Полученный рекомбинантный белок SLURP-1 может быть использован для лечения псориаза, онкологических заболеваний, некоторых форм эпилепсии.
Изобретение иллюстрируют графические материалы:
На фиг.1 представлена физическая карта рекомбинантной плазмиды pET22b(+)/SLURP-1;
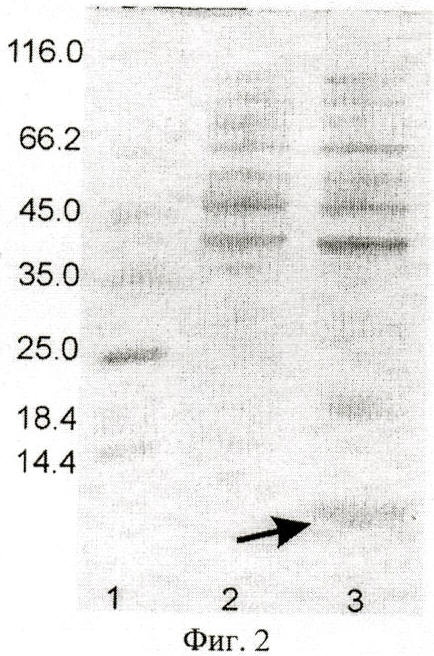
на фиг.2 - электрофореграмма лизатов клеток штамма-реципиента Е.coli BL21(DE3) (дорожка 2), штамма-продуцента Е.coli BL21(DE3)/pET22b(+)/SLURP-1 (дорожка 3) в 13%-ном полиакриламидном геле, дорожка 1 - белковые маркеры молекулярной массы; стрелкой указан белок SLURP-1;
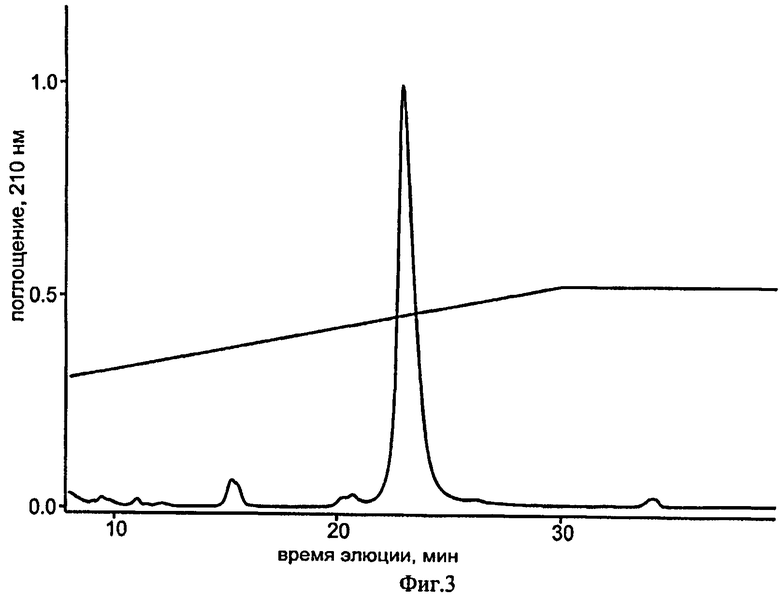
на фиг.3 - очистка рекомбинантного SLURP-1 после ренатурации методом ВЭЖХ на колонке JupiterC4 (4,6×150, мм, Phenomenex, США) в линейном градиенте концентрации ацетонитрила от 10% до 45% за 30 мин в присутствии 0,1%-ной ТФУ, скорость элюции - 0,3 мл/мин. Регистрация оптической плотности элюата при 210 нм;
Изобретение иллюстрируют следующие примеры.
Пример 1. Конструирование гена SLURP-1 человека.
Ген белка SLURP-1, содержащего на N-конце дополнительный остаток метионина, конструируют из 6 синтетических перекрывающихся олигонуклеотидов с использованием трехстадийной ПЦР. На первой стадии в результате последовательной амплификации праймеров 1 (SEQ №1) и 2 (SEQ №2), 3 (SEQ №3) и 4 (SEQ №4), 5 (SEQ №5) и 6 (SEQ №6) нарабатывают ПЦР фрагменты А, Б и В, соответственно. На второй стадии фрагменты А и Б амплифицируют с использованием праймеров 1 и 4 для получения ПЦР продукта, содержащего фрагмент Г. Фрагменты Б и В амплифицируют с использованием праймеров 3 и 6 для получения ПЦР продукта, содержащего фрагмент Д. На заключительной стадии фрагменты Г и Д амплифицируют с использованием праймеров 1 и 6 для получения фрагмента, содержащего ген SLURP-1. Во всех ПЦР реакционная смесь в объеме 50 мкл содержит по 140 нг праймеров, по 10 нмоль каждого из четырех дезоксинуклеозидтрифосфатов и 1 ед. акт. Pfu ДНК-полимеразы в буфере для Pfu-полимеразы: 20 мМ Трис-HCl, 2 мМ MgSO4, 10 мМ KCl, 10 мМ (NH4)2SO4, 0.1% тритон Х-100, 200 мкг/мл бычьего сывороточного альбумина (БСА), рН 8.75. Цикл амплификации включает в себя денатурацию ДНК при 95°С (1 мин), отжиг при 52°С (1 мин) и элонгацию при 68°С (1 мин). Всего проводят 30 циклов реакции. Реакционную смесь наносят на агарозный гель для разделения электрофорезом и нужные фрагменты вырезают из геля скальпелем, затем ДНК выделяют из геля с помощью Wizard SV Gel Clean Up System (Promega).
Пример 2. Конструирование рекомбинантной плазмидной ДНК pET22b(+)/SLURP-1.
50 нг ПЦР-фрагмента ДНК, содержащего ген SLURP-1 (SEQ №7), обрабатывают последовательно рестриктазами NdeI и BamHI (Fermentas, Литва) и из полученного гидролизата выделяют в 2%-ном геле легкоплавкой агарозы фрагмент длиной 257 п.о., содержащий ген SLURP-1.
2 мкг плазмидной ДНК pET22b(+) обрабатывают последовательно рестриктазами NdeI и BamHI и из полученного гидролизата выделяют в 1%-ном геле легкоплавкой агарозы векторную ДНК длиной 5403 п.о.
Полученный фрагмент и векторную ДНК соединяют при помощи лигазной реакции в 10 мкл буфера для лигирования (Fermentas), содержащего 1 ед. Т4 ДНК-лигазы. 1 мкл реакционной смеси используют для трансформации 100 мкл компетентных клеток XL-1 Blue. 1/10 клеток, использованных для трансформации, высевают на LB-агар, содержащий 100 мкг/мл ампициллина. Из выросших клонов выделяют целевую плазмидную ДНК pET22b(+)/SLURP-1 и анализируют ее путем обработки набором эндонуклеаз рестрикции NdeI и BamHI с последующим электрофоретическим анализом длин рестрикционных фрагментов в 2% агарозном геле.
Окончательно структуру рекомбинантной ДНК pET22b(+)/SLURP-1 подтверждают определением нуклеотидной последовательности в области встроенного фрагмента, содержащего синтетический ген SLURP-1 человека.
Пример 3. Получение и определение продуктивности штамма-продуцента SLURP-1 человека.
Рекомбинантной плазмидной ДНК pET22b(+)/SLURP-1 трансформируют компетентные клетки Escherichia coli BL21(DE3) (Novagen). Для этого к 200 мкл компетентных клеток добавляют 20 нг плазмидной ДНК pET22b(+)/SLURP-1, хорошо перемешивают и инкубируют во льду в течение 30 мин. Затем клетки подвергают тепловому шоку в течение 90 сек при 42°С, после чего вновь помещают в лед и инкубируют 4-5 мин. Затем к клеточной суспензии добавляют 300 мкл среды SOB и инкубируют клетки в течение 60 мин при 37°С и хорошей аэрации. Затем клетки высевают по 100 мкл на чашки Петри с питательной твердой средой, содержащей ампициллин (100 мкг/мл). В результате получают штамм-продуцент SLURP-1 человека.
Собранные с чашек Петри колонии с клетками Е.coli BL21(DE3)/pET22b(+)/SLURP-1 ресуспендируют в 50 мл жидкой среды Terrific Brouth (ТВ), содержащей ампициллин (100 мкг/мл). Культивирование проводят при 37°С с умеренным перемешиванием (250 об./мин.) до достижения клеточной плотности в культуре, соответствующей величине поглощения при 600 нм 0.6. Далее клеточную культуру переносят в 1 л ТВ и продолжают выращивание в ферментере (Bioflow 3000, New Bronswick Scientific, США). Культивирование осуществляют при 37°С в условиях автоматического поддержания относительного содержания кислорода в системе не менее 30% от максимально достижимого. Регулируемыми параметрами являются обороты мешалки и скорость подачи воздуха. Экспрессию гена SLURP-1 индуцируют добавлением изопропилтио-β-D-галактопиранозида до конечной концентрации 0.025 мМ при клеточной плотности в культуре, соответствующей величине поглощения при 600 нм 1.0. После индукции культивирование клеток осуществляют в течение 8 часов.
Отбирают пробу 1 мл и центрифугируют 5 мин при скорости 6000 об/мин, после чего клетки суспендируют в 100 мкл буфера, содержащего 125 мМ трис-HCl, рН 6,8, 20% глицерин, 3% додецилсульфат натрия, 3% меркаптоэтанол, 0,005% бромфеноловый синий, инкубируют 10 мин в кипящей водяной бане, образцы объемом 5 мкл анализируют электрофорезом в 13% полиакриламидном геле с додецилсульфатом натрия. Гель окрашивают Кумасси G-250 (фиг.2), сканируют и рассчитывают процентное содержание рекомбинантного белка в лизатах с использованием программы Scion Image (Scion Corp., США). По данным сканирования белок SLURP-1 составляет 10% от общего клеточного белка (фиг.2).
Пример 4. Выделение рекомбинантного белка SLURP-1 человека.
Клетки собирают центрифугированием (10000 g, 20 мин, 4°С) и ресуспендируют в холодном буфере 20 мМ Tris/HCl, 100 мМ NaCI, 1 мМ EDTA, рН 8.0 в соотношении 10 мл буфера на 1 г осадка. Далее суспензию клеток дезинтегрируют ультразвуком (Branson Digital Sonifier, США) при выходной мощности 50 Вт и 4°С в течение 5 минут. Полученную взвесь центрифугируют при 36000 g в течение 20 мин. Образовавшийся осадок ресуспендируют в исходном буфере с добавлением 2 М мочевины. Суспензию переносят в охлажденный стакан, дезинтегрируют 10 секунд и центрифугируют в тех же условиях, что и ранее. Процедуру повторяют дважды. После отмывания 2 М мочевиной осадок два раза промывают исходным буфером, содержащим 1% Тритон Х-100, и затем два раза деионизованной водой (MilliQ, Millipore, США). Отмытые тельца включения хранят при -70°С.
Отмытые тельца включения ресуспендируют в 30 мМ трис-глициновом буфере, рН 9.2, содержащем 8 М мочевину (Carl Roth, Германия), из расчета 10 мл буфера на 1 г телец включения. Суспензию дезинтегрируют при выходной мощности прибора 50 Вт и 4°С в течение 30 сек. Затем суспензию тел включения сульфируют добавлением 0,4 М сульфита натрия, цистина до концентрации 0.4 мМ и NiCl2 до концентрации 5 мМ. В таком виде тельца оставляют на 18 часов в открытом стакане при перемешивании и 25°С. Затем смесь центрифугируют при 36000 g 1 час и супернатант разводят в 10 раз 2 М мочевиной. После этого сульфированный SLURP-1 наносят на колонку с ДЕАП-Сферонит-ОН, предварительно уравновешенную 30 мМ Tris-HCl, рН 8.0 (буфер A). SLURP-1 элюируют буфером А, содержащим 300 мМ NaCI и 8 М мочевину.
Во фракцию белка, содержащую SLURP-1, добавляют дитиотреитол до конечной концентрации 50 мМ и дополнительно чистят с помощью обратнофазной ВЭЖХ с помощью хроматографической колонки Jupiter C4, А300, 10×250 мм (Phenomenex, США) на приборе "Smartline" (Knauer, Германия). Элюцию SLURP-1 проводят градиентом ацетонитрила от 10% до 45% за 30 мин в присутствии 0,1% трифторуксусной кислоты. Полученный препарат SLURP-1 с восстановленными дисульфидными связями лиофилизуют.
Пример 5. Ренатурация рекомбинантного белка SLURP-1 человека.
Лиофилизованный и восстановленный SLURP-1 растворяют в буфере для ренатурации, содержащем 50 мМ Tris/HCl, 2 М мочевину, 0.5 М L-аргинин, 4 мМ GSH и 1 мМ GSSG, рН 7.0, до конечной концентрации белка 0.1 мг/мл. Ренатурацию проводят при 4°C в течение 6 суток.
Раствор SLURP-1 концентрируют в 4 раза на концентрационной ячейке с размером пор мембраны 1 кДа (Millipore, США). Очистку ренатурированного SLURP-1 проводят с помощью обратнофазной ВЭЖХ на колонке Jupiter C4, А300, 4,6×250 мм (Phenomenex, США). Элюцию вдЛинкс-1 проводят градиентом ацетонитрила от 20% до 45% за 30 мин в присутствии 0,1% трифторуксусной кислоты (Фиг.3). Полученный препарат ренатурированного SLURP-1 лиофилизуют.
Описываемый способ выделения позволяет получить 1.4 мг ренатурированного SLURP-1 из 1 г влажной биомассы, что соответствует 1.4 мг белка из 100 мг лиофилизированной биомассы.
Спектры, измеренные на времяпролетном масс-спектрометре UltraFlex TOF/TOF фирмы Bruker Daltonics (Германия), оснащенном источником ионизации MALDI, доказали соответствие молекулярной массы рекомбинантного SLURP-1 расчетным данным, полученным для аминокислотной последовательности SEQ №8.
Пример 6. Анализ вторичной структуры рекомбинантного ренатурированного SLURP-1 методами спектроскопии кругового дихроизма.
Спектр КД измеряют с помощью спектрополяриметра J-810 (Jasco, Япония) в кювете с длиной оптического пути 0,01 см в диапазоне длин волн 190-250 нм с шагом 1 нм. Исследуют конформацию SLURP-1 в водном растворе (рН~4,0). Концентрация SLURP-1 в воде составляет 0,09 мМ. Оценку содержания элементов вторичной структуры (см. табл.) проводят по программе CONTINLL [Provencher, S.W., Glocker, J. Estimation of globular protein secondary structure from circular dichroism. // Biochemistry. - 1982. - Vol.20. - P.33-37].
Анализ полученного спектра показывает, что в водной среде рекомбинантный ренатурированный SLURP-1 обладает упорядоченной структурой типа β-складок (таблица). Содержание β-структуры близко к структуре, наблюдаемой у структурных гомологов SLURP-1, змеиных нейротоксинов.
Таким образом, заявляемое техническое решение позволяет получить белок со структурой, идентичной структуре природного SLURP-1 человека, и при этом уровень его бактериального синтеза составляет не менее 10% от суммарного клеточного белка. Это позволяет получать в миллиграммовых количествах рекомбинантный SLURP-1, который может быть использован в медицине в качестве нейромодулятора для лечения заболеваний нервной системы, а также для лечения псориаза и онкологических заболеваний.
| название | год | авторы | номер документа |
|---|---|---|---|
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pET22b(+)/slurp-2, КОДИРУЮЩАЯ БЕЛОК SLURP-2, И ШТАММ БАКТЕРИЙ Escherichia coli BL21(DE3) pET22b(+)/slurp-2- ПРОДУЦЕНТ БЕЛКА SLURP-2 ЧЕЛОВЕКА | 2015 |
|
RU2583307C2 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pET22b(+)/вд-ЛИНКС1, КОДИРУЮЩАЯ БЕЛОК СО СВОЙСТВАМИ ЛИНКС1, И ШТАММ БАКТЕРИЙ Escherichia coli BL21(DE3)/pET22b(+)/вд-ЛИНКС1-ПРОДУЦЕНТ БЕЛКА СО СВОЙСТВАМИ ЛИНКС1 ЧЕЛОВЕКА | 2009 |
|
RU2404246C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК PES4-4, КОДИРУЮЩАЯ ПОЛИПЕПТИД ИНТЕРФЕРОН АЛЬФА-2B ЧЕЛОВЕКА, И ШТАММ ESCHERICHIA COLI BDEES4 - ПРОДУЦЕНТ РЕКОМБИНАНТНОГО ИНТЕРФЕРОНА АЛЬФА-2B ЧЕЛОВЕКА | 2003 |
|
RU2258081C1 |
| Рекомбинантный белок для ускорения миграции клеток кожи | 2020 |
|
RU2741778C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК, КОДИРУЮЩАЯ ГИБРИДНЫЙ БЕЛОК L-HEP, ШТАММ ESCHERICHIA COLI ПРОДУЦЕНТ УКАЗАННОГО БЕЛКА И СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО БЕЛКА | 2019 |
|
RU2716975C1 |
| РЕКОМБИНАНТНЫЕ ПЛАЗМИДНЫЕ ДНК, КОДИРУЮЩИЕ ГИБРИДНЫЕ ПОЛИПЕПТИДЫ СО СВОЙСТВАМИ КРАСНОГО ФЛУОРЕСЦЕНТНОГО БЕЛКА mCherry, ДЛЯ ПРОДУЦИРОВАНИЯ ГИБРИДНЫХ ФЛУОРЕСЦЕНТНЫХ БЕЛКОВ В Escherichia coli | 2013 |
|
RU2527171C1 |
| ПОЛИНУКЛЕОТИД, КОДИРУЮЩИЙ МУТАНТНУЮ РЕКОМБИНАНТНУЮ IgA1 ПРОТЕАЗУ Neisseria meningitidis СЕРОГРУППЫ В, РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК, СОДЕРЖАЩАЯ УКАЗАННЫЙ ПОЛИНУКЛЕОТИД, КЛЕТКА-ХОЗЯИН, СОДЕРЖАЩАЯ УКАЗАННУЮ ПЛАЗМИДНУЮ ДНК, РЕКОМБИНАНТНАЯ IgA1 ПРОТЕАЗА Neisseria memingitidis СЕРОГРУППЫ В, СПОСОБ ПОЛУЧЕНИЯ ЗРЕЛОЙ ФОРМЫ IgA1 ПРОТЕАЗЫ | 2011 |
|
RU2486243C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pES6-1, КОДИРУЮЩАЯ ПОЛИПЕПТИД ИНТЕРФЕРОН БЕТА-1b ЧЕЛОВЕКА, И ШТАММ Escherichia coli BDEES6 - ПРОДУЦЕНТ РЕКОМБИНАНТНОГО ИНТЕРФЕРОНА БЕТА-1b ЧЕЛОВЕКА | 2004 |
|
RU2261913C1 |
| Рекомбинантная плазмидная ДНК pERIG-PGS, кодирующая гибридный белок, способный к автокаталитическому расщеплению с образованием антиангиогенного пептида пигастина - производного фрагмента [44-77] фактора роста пигментного эпителия человека, штамм Escherichia coli BL21(DE3)/pERIG-PGS - продуцент указанного белка, и способ получения рекомбинантного антиангиогенного пептида | 2017 |
|
RU2664199C1 |
| РЕКОМБИНАНТНАЯ ДНК, КОДИРУЮЩАЯ ГРАНУЛОЦИТАРНЫЙ КОЛОНИЕСТИМУЛИРУЮЩИЙ ФАКТОР ЧЕЛОВЕКА (G-CSF) И РЕКОМБИНАНТНАЯ ПЛАЗМИДА рAS017, ОБЕСПЕЧИВАЮЩАЯ СИНТЕЗ G-CSF В КЛЕТКАХ Escherichia coli | 2011 |
|
RU2529363C2 |


Изобретение относится к области биотехнологии, конкретно к получению белков, обладающих нейромодуляторным действием по отношению к никотиновым ацетилхолиновым рецепторам человека, и может быть использовано в медицине. Пептид SLURP-1 получают путем трансформации компетентных клеток Escherichia coli BL21(DE3) рекомбинантной плазмидной ДНК pET22b(+)/SLURP-1. Изобретение позволяет повысить эффективность синтеза белка SLURP-1 в клетках Escherichia coli. 2 н.п. ф-лы, 3 ил., 1 табл., 6 пр.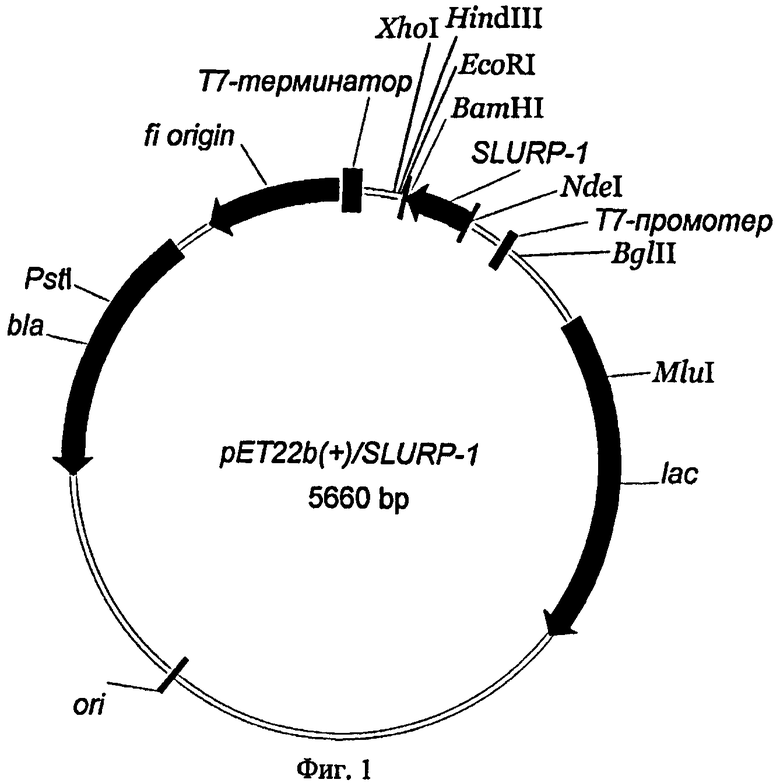
1. Рекомбинантная плазмидная ДНК pET22b(+)/SLURP-1, кодирующая белок SLURP-1 человека 5660 п.о., состоящая из NdeI/BamHI - фрагмента ДНК плазмиды pET22b(+) длиной 5403 п.о., содержащего lac-промотор E.coli, ген bla β-лактамазы, фрагмент гена lacI E.coli, участок ori инициации репликации и искусственную последовательность ДНК, кодирующую NdeI/BamHI фрагмент длиной 257 п.о., включающий синтетический ген SLURP-1 человека в виде SEQ ID NO: 7; содержащая уникальные сайты узнавания рестрикционными эндонуклеазами, имеющие следующие координаты: XhoI - 158, HindIII - 173, EcoRI - 192, BamHI - 198, NdeI - 430, BglII - 534, MluI - 1256, PstI - 4495.
2. Штамм бактерий Escherichia coli BL21(DE3)/pET22b(+)/SLURP-1 - продуцент белка SLURP-1 человека, полученный путем трансформации компетентных клеток Escherichia coli BL21(DE3) рекомбинантной плазмидной ДНК pET22b(+)/SLURP-1.
| CHIMIENTI F | |||
| et al., Identification of SLURP-1 as an epidermal neuromodulator explains the clinical phenotype of Mal de Meleda, Hum | |||
| Mol | |||
| Genet., 2003, v.12, n.22, p.3017-3024 | |||
| LYUKMANOVA E.N., Bacterial Expression, NMR, and Electrophysiology Analysis of Chimeric Short/Long-chain alpha-Neurotoxins Acting on Neuronal Nicotinic Receptors, The Journal |
Авторы
Даты
2012-06-20—Публикация
2010-08-19—Подача