Настоящее изобретение относится к производным адамантана, способу их получения, фармацевтическим композициям, содержащим их, способу получения фармацевтических композиций и их использованию в терапии.
Производные адамантана известны в данной области, например, из WO 95/04720 для использования в качестве лигандов рецепторов гастрина и холецистокинина, из Chem. Abs. (1977), Volume 86, №13 (86:89560d) для использования в качестве аналгезирующих средств и из US-A-3464998 в качестве антибиотиков.
Р2Х7-рецептор (ранее известный как Р2Z-рецептор), который является лигандоткрываемым ионным каналом, присутствует на различных типах клеток, преимущественно на типах клеток, которые, как известно, принимают участие в воспалительном, иммунном процессе, особенно, макрофагах, тучных клетках и лимфоцитах (Т и В). Активация Р2Х7-рецептора внеклеточными нуклеотидами, особенно, аденозинтрифосфатом, приводит к высвобождению интерлейкина-1β (IL-1β) и образованию гигантских клеток (макрофагов/глиальных макрофагов), дегрануляции (тучных клеток) и пролиферации (Т-клеток), апоптозу и L-селектиновой терминальной стадии (лимфоцитов). Р2Х7-рецепторы расположены также на антигенпредставляющих клетках (АРС), кератиноцитах, слюнных, ацинарных клетках (околоушных клетках), гепатоцитах и мезангиальных клетках.
Было бы желательно получить соединения, эффективные в качестве антагонистов рецепторов Р2Х7, для использования при лечении воспалительных, иммунных или сердечно-сосудистых заболеваний, в этиологии которых Р2Х7-рецептор может играть роль.
Поэтому в соответствии с настоящим изобретением, предложено соединение общей формулы
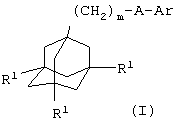
где m равно 1, 2 или 3, предпочтительно, 1 или 2;
каждый R1 независимо представляет атом водорода или галогена (например, фтора, хлора, брома или иода), предпочтительно, атом водорода;
А представляет С(О)NH или, предпочтительно, NHC(O);
Ar представляет группу
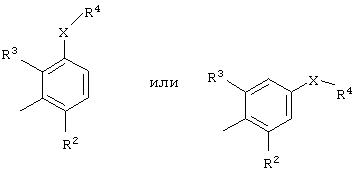
Х представляет связь, атом кислорода или группу СО, (СН2)1-6, СН=, (СН2)1-6О, О(СН2)1-6, О(СН2)2-6О, О(СН2)2-3О(СН2)1-3, CR'(OH), (СН2)1-3O(СН2)1-3, (СН2)1-3O(СН2)2-3O, NR5, (СН2)1-6NR5, NR5(СН2)1-6, (СН2)1-3NR5(СН2)1-3, O(СН2)2-6NR5, O(СН2)2-3NR5(СН2)1-3, (СН2)1-3NR5(СН2)2-3O, NR5(СН2)2-6O, NR5(СН2)2-3O(СН2)1-3, CONR5, NR5CO, S(O)n, S(O)nCH2, CH2S(O)n, SO2NR5 или NR5SO2;
n равно 0, 1 или 2;
R представляет атом водорода или С1-С6-алкильную, предпочтительно, метильную группу;
один из R2 и R3 представляет галоген, циано, нитро, амино, гидроксил или группу, выбранную из (i) С1-С6-алкила, необязательно замещенного, по меньшей мере, одним С3-С6-циклоалкилом, (ii) С3-С8-циклоалкила, (iii) С1-С6-алкилокси, необязательно замещенного, по меньшей мере, одним С3-С6-циклоалкилом, и (iv) С3-С8-циклоалкилокси, причем каждая из указанных групп необязательно замещена одним или более атомами фтора, и другой из R2 и R3 представляет атом водорода или галогена;
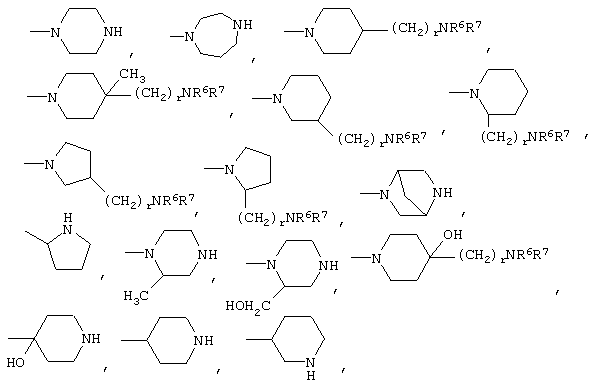
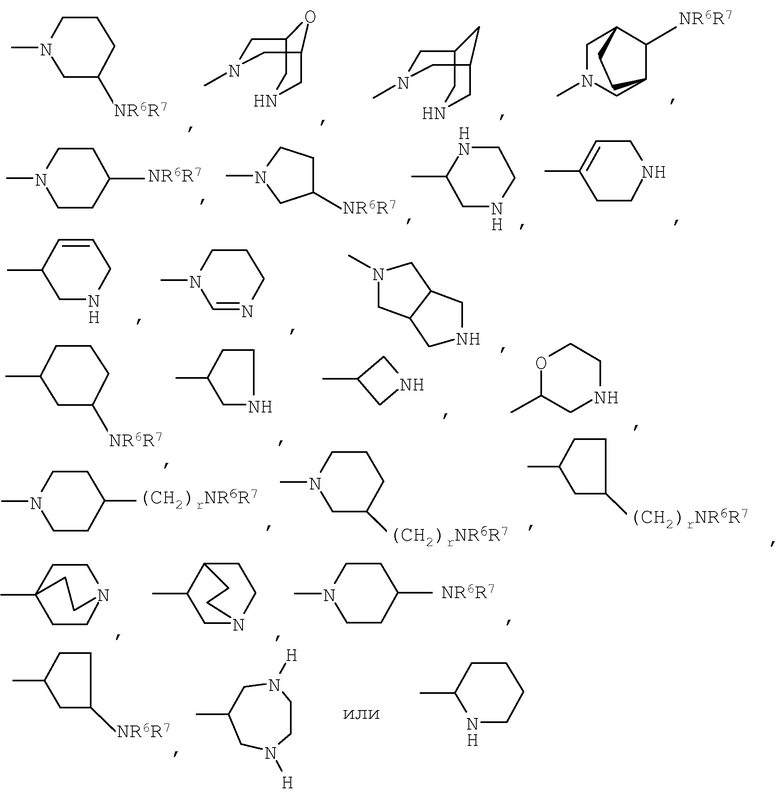
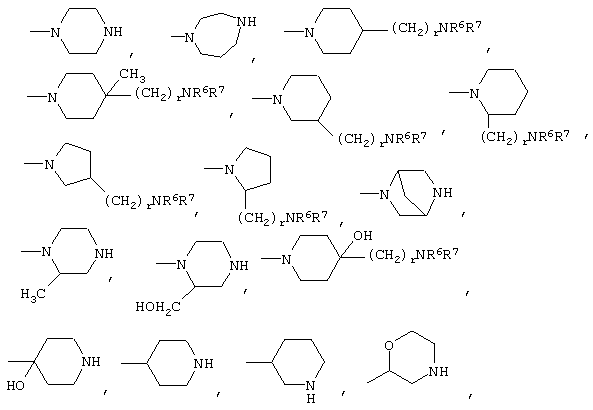
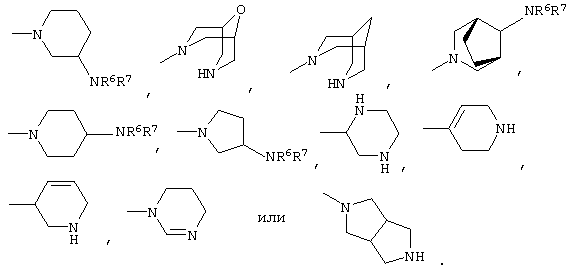
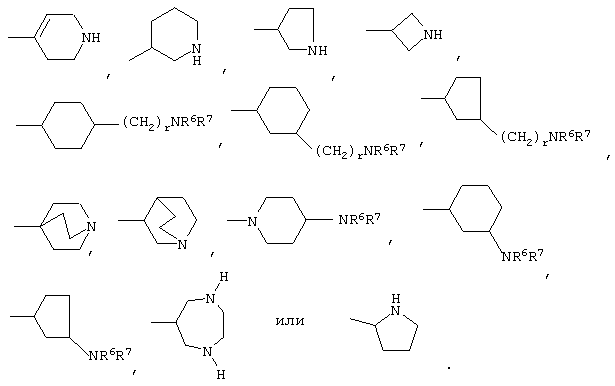
либо R4 представляет 3-9-членную насыщенную или ненасыщенную алифатическую гетероциклическую кольцевую систему, содержащую один или два атома азота и необязательно атом кислорода, причем гетероциклическая кольцевая система необязательно замещена одним или более заместителями, независимо выбранными из атомов фтора, гидроксила, карбоксила, циано, С1-С6-алкила, С1-С6-гидроксиалкила, -NR6R7, -(CH2)rNR6R7 и -CONR6R7,
либо R4 представляет 3-8-членную насыщенную карбоциклическую кольцевую систему, замещенную одним или более заместителями, независимо выбранными из -NR6R7, -(CH2)rNR6R7 и -CONR6R7, кроме того данная кольцевая система необязательно замещена одним или более заместителями, независимо выбранными из атомов фтора, гидроксила и С1-С6-алкила;
r равно 1, 2, 3, 4, 5 или 6;
R5 представляет атом водорода или С1-С6-алкильную или С3-С8-циклоалкильную группу;
R6 и R7 каждый независимо представляет атом водорода или С1-С6-алкильную, С2-С6-гидроксиалкильную или С3-С8-циклоалкильную группу, или R6 и R7 вместе с атомом азота, к которому они присоединены, образуют 3-8-членное насыщенное гетероциклическое кольцо;
при условии, что
(а) когда А представляет С(О)NH и R4 представляет незамещенную 3-8-членную насыщенную алифатическую гетероциклическую кольцевую систему, содержащую один атом азота, тогда Х иной, чем связь, и
(b) когда А представляет С(О)NH и Х представляет группу (СН2)1-6 или О(СН2)1-6, тогда R4 не является незамещенной имидазолильной, незамещенной морфолинильной, незамещенной пиперидинильной или незамещенной пирролидинильной группой, и
(с) когда А представляет NHС(О) и R4 представляет незамещенную 3-8-членную насыщенную алифатическую гетероциклическую кольцевую систему, содержащую один атом азота, тогда Х иной, чем связь, и
(d) когда А представляет NHС(О) и Х представляет O(СН2)1-6, NH(CH2)1-6 или SСН2, тогда R4 не является незамещенной 1-пиперидинильной или незамещенной 1-пирролидинильной группой, и
(е) когда А представляет NHC(O) и Х представляет O(CH2)2-3NH(CH2)2, тогда R4 не является имидазолильной группой;
или его фармацевтически приемлемая соль или сольват.
В контексте настоящего описания, если не оговорено особо, алкильный заместитель или алкильная часть в группе-заместителе может быть прямой или разветвленной. Примеры алкильных групп/частей, содержащих до 6 атомов углерода, включают метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил и гексил. Когда один из R2 и R3 представляет С1-С6-алкил/С1-С6-алкилокси, необязательно замещенный, по меньшей мере, одним С3-С6-циклоалкилом, подразумевается, что одна или обе из алкильной и циклоалкильной частей могут быть необязательно замещены атомами фтора. Что касается R4, 3-9-членная насыщенная или ненасыщенная алифатическая гетероциклическая кольцевая система, содержащая один или два атома азота и необязательно атом кислорода, может быть моноциклической или бициклической кольцевой системой. Далее, что касается R4, 3-8-членная насыщенная карбоциклическая кольцевая система может быть моноциклической или бициклической кольцевой системой. Когда R6 или R7 представляет С2-С6-гидроксиалкил в заместителе NR6R7, -(CH2)rNR6R7 или -CONR6R7, следует принимать во внимание, что гидроксильная группа не может быть связана с тем же самым атомом углерода, что и атом азота. Когда R6 и R7 вместе с атомом азота, к которому они присоединены, образуют 3-8-членное насыщенное гетероциклическое кольцо, то образованное кольцо является моноциклическим.
Х, предпочтительно, представляет связь, атом кислорода или группу СО, (СН2)1-6, СН=, О(СН2)1-6, О(СН2)2-6О, О(СН2)2-3О(СН2)1-3, CR'(OH), NR5, (СН2)1-6NR5, CONR5, S(O)n или S(O)nCH2.
Один из R2 и R3 представляет галоген (например, фтор, хлор, бром или иод), циано, нитро, амино, гидроксил или группу, выбранную из (i) С1-С6-алкила, предпочтительно, С1-С4-алкила, необязательно замещенного, по меньшей мере, одним (например, 1, 2 или 3) С3-С6-циклоалкилом (например, циклопропилом, циклобутилом, циклопентилом или циклогексилом), (ii) С3-С8-циклоалкила (например, циклопропила, циклобутила, циклопентила или циклогексила), (iii) С1-С6-алкилокси, предпочтительно, С1-С4-алкилокси, необязательно замещенного, по меньшей мере, одним (например, 1, 2 или 3) С3-С6-циклоалкилом (например, циклопропилом, циклобутилом, циклопентилом или циклогексилом), и (iv) С3-С8-циклоалкилокси (например, циклопропилокси, циклобутилокси, циклопентилокси или циклогексилокси), причем каждая из указанных групп необязательно замещена одним или более (например, 1, 2, 3 или 4) атомами фтора, и другой из R2 и R3 представляет атом водорода или галогена (например, фтора, хлора, брома или иода).
Один из R2 и R3, предпочтительно, представляет атом галогена (особенно, хлора или брома) или нитро, амино или С1-С6-алкильную группу (особенно, метильную или этильную) и другой из R2 и R3 представляет атом водорода.
R4 может представлять 3-9-членную насыщенную или ненасыщенную алифатическую гетероциклическую кольцевую систему, содержащую один или два атома азота и необязательно атом кислорода, причем гетероциклическая кольцевая система необязательно замещена одним или несколькими (например, 1, 2, 3 или 4) заместителями, независимо выбранными из атомов фтора, гидроксила, карбоксила, циано, С1-С6-алкила, предпочтительно, С1-С4-алкила, С1-С6-гидроксиалкила, предпочтительно, С1-С4-гидроксиалкила, -NR6R7, -(CH2)rNR6R7 и -CONR6R7.
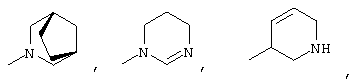
3-9-Членная насыщенная или ненасыщенная алифатическая гетероциклическая кольцевая система в группе R4 может быть моноциклической кольцевой системой, такой как пирролидинил (например, 1-пирролидинил, 2-пирролидинил или 3-пирролидинил), пиперидинил (например, 1-пиперидинил, 2-пиперидинил, 3-пиперидинил или 4-пиперидинил), 4-пипериден-3-ил, пиперазинил (например, 1-пиперазинил), гомопиперазинил,
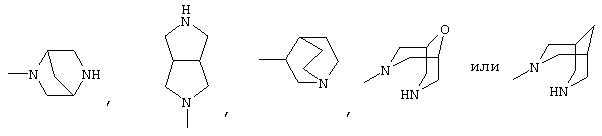
или бициклической кольцевой системой, такой как
Альтернативно R4 может представлять 3-8-членную насыщенную карбоциклическую кольцевую систему, замещенную одним или более (например, 1, 2 или 3) заместителями, независимо выбранными из NR6R7, -(CH2)rNR6R7 и -CONR6R7, причем кольцевая система необязательно дополнительно замещена одним или более (например, 1, 2, 3 или 4) заместителями, независимо выбранными из атомов фтора, гидроксила и С1-С6-алкила, предпочтительно, С1-С4-алкила.
3-8-Членное насыщенное карбоциклическое кольцо в группе R4 представляет, предпочтительно, моноциклическую кольцевую систему, такую как циклопентильное или циклогексильное кольцо.
Конкретные примеры групп R4 включают:
Когда Х представляет связь или группу СО, (СН2)1-6, О(СН2)2-6, О(СН2)2-3О(СН2)2-3, (СН2)1-3O(СН2)2-3, NR5(СН2)2-6, (СН2)1-3NR5(СН2)2-3, O(СН2)2-3NR5(СН2)2-3, NR5(СН2)2-3O(СН2)2-3, NR5CO, SO2 или NR5SO2, R4, предпочтительно, представляет группу:
Когда Х представляет атом кислорода или серы или группу СН=, (СН2)1-6О, ОСН2, О(СН2)2-6О, О(СН2)2-3ОСН2, CR'(OH), (СН2)1-3OСН2, (СН2)1-3O(СН2)2-3O, NR5, (СН2)1-6NR5, О(СН2)2-6NR5, NR5СН2, (СН2)1-3NR5СН2, O(СН2)2-3NR5CH2, (СН2)1-3NR5(СН2)2-3O, NR5(СН2)2-6O, NR5(СН2)2-3OСН2, CONR5, SO, S(O)nCH2, CH2S(O)n или SO2NR5, R4, предпочтительно, представляет группу:
R5 представляет атом водорода или С1-С6-, предпочтительно, С1-С4-алкильную (например, метильную, этильную, пропильную, бутильную, пентильную или гексильную) или С3-С8-, предпочтительно, С3-С6-циклоалкильную (например, циклопропильную, циклобутильную, циклопентильную или циклогексильную) группу.
R6 и R7, каждый независимо, представляет атом водорода или С1-С6-, предпочтительно, С1-С4-алкильную (например, метильную, этильную, пропильную, бутильную, пентильную или гексильную), С2-С6-гидроксиалкильную или С3-С8-, предпочтительно, С3-С6-циклоалкильную (например, циклопропильную, циклобутильную, циклопентильную или циклогексильную) группу или R6 и R7 вместе с атомом азота, к которому они присоединены, образуют 3-8-членное, предпочтительно, 3-6-членное насыщенное гетероциклическое кольцо, такое как пирролидинильное или пиперидинильное кольцо.
Предпочтительные соединения изобретения включают:
2-Нитро-3-пиперазин-1-ил-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид,
Дигидрохлоридную соль 2-амино-3-пиперазин-1-ил-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
2-Хлор-3-пиперазин-1-ил-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид,
2-Хлор-5-пиперазин-1-ил-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид,
Гидрохлоридную соль 2-хлор-5-(гексагидро-1Н-1,4-диазепин-1-ил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 5-(4-амино-1-пиперидинил)-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль (+/-)-5-(3-амино-1-пирролидинил)-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 2-хлор-5-пиперазин-1-илметил-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 2-хлор-5-[(гексагидро-1Н-1,4-диазепин-1-ил)метил]-N-(трицикло[3.3.1.13,7]дец-1- илметил)бензамида,
Гидрохлоридную соль 5-[(4-амино-1-пиперидинил)метил]-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 5-[(3-амино-1-пирролидинил)метил]-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 2-хлор-5-(4-пиперидинилокси)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль (R)-2-хлор-5-(2-пирролидинилметокси)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль (S)-2-хлор-5-(2-пирролидинилметокси)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 2-хлор-5-(3-пиперидинилметокси)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль цис-5-[(4-аминоциклогексил)окси]-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 2-метил-5-(1-пипиперазинилметил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 2-хлор-5-(1-пипиперазинилметил)-N-(2-трицикло[3.3.1.13,7]дец-1-илэтил)бензамида,
Гидрохлоридную соль (+/-)-2-хлор-5-(3-пирролидинилокси)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль (+/-)-2-хлор-5-(3-пиперидинилокси)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
транс-5-[(4-Аминоциклогексил)окси]-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид,
цис-(+/-)-5-[(3-Аминоциклопентил)окси]-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид,
Гидрохлоридную соль (S,S)-2-хлор-5-(2,5-диазабицикло[2.2.1]гепт-2-ил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 2-хлор-5-(2-метил-1-пиперазинил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль (+/-)-2-хлор-5-(3-пирролидиниламино)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
(+/-)-5-(3-Амино-1-пиперидинил)-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид,
(+/-)-2-Хлор-5-(3-пиперидиниламино)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид,
2-Хлор-5-[гексагидропирроло[3,4-с]пиррол-2(1Н)-ил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид,
Гидрохлоридную соль N-[2-метил-5-(4-пиперидинилокси)фенил]трицикло[3.3.1.13,7]декан-1-ацетамида,
Гидрохлоридную соль N-[2-хлор-5-(4-пиперидинилокси)фенил]трицикло[3.3.1.13,7]декан-1-ацетамида,
Дигидрохлоридную соль 2-хлор-5-[(4-пиперидиниламино)метил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Дигидрохлоридную соль 5-[[[4-(аминометил)циклогексил]амино]метил]-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Дигидрохлоридную соль 5-[[(4-аминоциклогексил)амино]метил]-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
5-[(1-Азабицикло[2.2.2]окт-3-иламино)метил]-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид,
Дигидрохлоридную соль N-[4-(3-аминопирролидин-1-ил)-2-метилфенил]-2-(трицикло[3.3.1.13,7]дец-1-ил)ацетамида,
Дигидрохлоридную соль N-(2-метил-4-пиперазин-1-илфенил)-2-(трицикло[3.3.1.13,7]дец-1-ил)ацетамида,
Гидрохлоридную соль цис-4-(3-аминоциклопентилокси)-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 2-хлор-4-(4-пиперидинилокси)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
(+/-)-2-Хлор-4-(пирролидин-3-илокси)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид,
Гидрохлоридную соль 2-хлор-4-(пиперидин-3-илокси)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 2-хлор-4-(4-пиперазин-1-ил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 2-хлор-4-(3-пирролидиниламино)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 2-хлор-4-(гексагидро-1Н-1,4-диазепин-1-ил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль (±)-5-[(3-амино-1-пиперидинил)метил]-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 2-хлор-5-(2,5-диазабицикло[2.2.1]гепт-2-илметил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 2-хлор-5-(9-окса-3,7-диазабицикло[3.3.1]нон-3-илметил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 2-хлор-5-(3,7-диазабицикло[3.3.1]нон-3-илметил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль транс-2-хлор-5-[[8-(метиламино)-3-азабицикло[3.2.1]окт-3-ил]метил]-N-(трицикло[3.3.1.13,7 ]дец-1-илметил)бензамида,
Гидрохлоридную соль цис-2-хлор-5-[(гексагидропирроло[3,4-с]пиррол-2(1Н)-ил)метил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 2-хлор-5-(4-пиперидинилиденметил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 2-хлор-5-(4-пиперидинилметил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 2-хлор-5-(4-гидроксипиперидин-4-ил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 2-хлор-5-(1,2,3,6-тетрагидропиридин-4-ил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 2-этил-5-пиперазин-1-илметил-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 2-хлор-5-(пиперидин-4-илсульфанил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
2-Хлор-5-(пиперидин-4-илсульфинил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид,
Гидрохлоридную соль 2-хлор-5-(пиперидин-4-илсульфонил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 2-хлор-5-(пиперидин-4-илметилсульфанил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 2-хлор-5-(пиперидин-4-илметансульфонил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 2-хлор-5-(пиперазин-1-карбонил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 2-хлор-5-([1,4]диазепан-1-карбонил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 4-хлор-N1-(пиперидин-4-ил)-N2-(трицикло[3.3.1.13,7]дец-1-илметил)изофталамида,
Гидрохлоридную соль 2-хлор-5-(гидрокси-4-пиперидинилметил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль (±)-2-хлор-5-(гидрокси-3-пиперидинилметил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 2-бром-5-пиперазин-1-илметил-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 2-хлор-5-[2-(1-пиперазинил)этил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 2-хлор-5-[2-(2,5-диазабицикло[2.2.1]гепт-2-ил)этил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 5-[2-(4-амино-1-пиперидинил)этил]-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Дигидрохлоридную соль 2-хлор-5-[2-(3-пиперидиниламино)этил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 5-[2-(3-амино-1-пиперидинил)этил]-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Дигидрохлоридную соль 2-хлор-5-[2-(3-пирролидиниламино)этил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 5-[2-[(3R)-3-аминопирролидинил)этил]-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 2-хлор-5-[2-[2-(гидроксиметил)-1-пиперазинил]этил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 2-хлор-5-(гексагидро-1Н-1,4-диазепин-1-ил)-N-(2-трицикло[3.3.1.13,7]дец-1-илэтил)бензамида,
Гидрохлоридную соль (+/-)-5-(3-амино-1-пирролидинил)-2-хлор-N-(2-трицикло[3.3.1.13,7]дец-1-илэтил)бензамида,
Гидрохлоридную соль 2-хлор-5-(4-пиперидинилкарбонил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 2-хлор-5-[1-гидрокси-1-(4-пиперидинил)этил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 2-хлор-5-[2-(1-пиперазинил)этокси]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 2-хлор-5-[2-(4-пиперидинил)этокси]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 2-хлор-5-[2-(4-пиперидинилокси)этокси]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 2-хлор-5-[2-[2-(1-пиперазинил)этокси]этокси]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
2-Хлор-5-[(5,6-дигидро-1(4Н)-пиримидинил)метил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид,
Гидрохлоридную соль 2-хлор-5-[[4-[(2-гидроксиэтил)амино]-1-пиперидинил]метил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
2-Хлор-5-[[4-гидрокси-4-[[(1-метилэтил)амино]метил]-1-пиперидинил]метил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 2-хлор-5-[(1,2,3,6-тетрагидро-3-пиридинил)метил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Ацетатную соль 2-хлор-5-(3-пиперидинилметил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
2-Бром-5-[[4-[(2-гидроксиэтил)амино]-1-пиперидинил]метил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид и
2-Хлор-5-[(Е)-3-пиперидинилиденметил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид.
Настоящее изобретение относится к способу получения соединения формулы (I), как определено выше, который включает:
(i) когда Х представляет СН2-группу, R4 представляет 3-9-членную насыщенную или ненасыщенную алифатическую гетероциклическую кольцевую систему, содержащую один или два атома азота и необязательно атом кислорода, причем гетероциклическая кольцевая система необязательно замещена одним или более заместителями, независимо выбранными из атомов фтора, гидроксила, карбоксила, циано, С1-С6-алкила, С1-С6-гидроксиалкила, -NR6R7, -(CH2)rNR6R7 и -CONR6R7, и R4 связан с Х через атом азота, взаимодействие соединения общей формулы
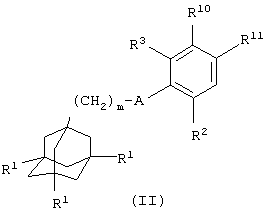
где один из R10 и R11 представляет атом водорода и другой из R10 и R11 представляет группу -СН2L1, в которой L1 представляет уходящую группу (например, атом галогена), и m, A, R1, R2 и R3 имеют значения, указанные в формуле (I), с соединением общей формулы
R4'-H (III)
в присутствии основания (например, диизопропилэтиламина), где R4' представляет 3-9-членную насыщенную или ненасыщенную алифатическую гетероциклическую кольцевую систему, содержащую один или два атома азота и необязательно атом кислорода, причем гетероциклическая кольцевая система необязательно замещена одним или более заместителями, независимо выбранными из атомов фтора, гидроксила, карбоксила, циано, С1-С6-алкила, С1-С6-гидроксиалкила, -NR6R7, -(CH2)rNR6R7 и -CONR6R7, и где R6 и R7 имеют значения, указанные в формуле (I); или
(ii) когда Х представляет атом кислорода или группу О(СН2)1-6, О(СН2)2-6О, О(СН2)2-3О(СН2)1-3, О(СН2)2-6NR5 или O(CH2)2-3NR5(CH2)1-3, взаимодействие соединения общей формулы
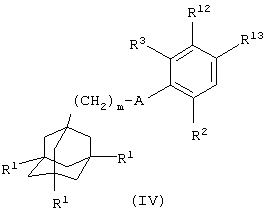
где один из R12 и R13 представляет атом водорода и другой из R12 и R13 представляет гидроксильную группу и m, A, R1, R2 и R3 имеют значения, указанные в формуле (I), с соединением общей формулы
R4-Y-OH (V)
где Y представляет связь или группу (СН2)1-6, О(СН2)2-6, (СН2)1-3О(СН2)2-3, NR5(СН2)2-6 или (CH2)1-3NR5(CH2)2-3 и R4 имеет значения, указанные в формуле (I), в присутствии 1,1-(азодикарбонил)дипиперидина и трибутилфосфина (в условиях реакции Мицунобу: Tetrahedron Lett. (1993), 34, 1639); или
(iii) когда Х представляет связь, атом кислорода или группу О(СН2)1-6, О(СН2)2-6О, О(СН2)2-3О(СН2)1-3, NR5, NR5(CH2)1-6, NR5(СН2)2-6O или NR5(CH2)2-3O(CH2)1-3 и А представляет NHC(O), взаимодействие соединения общей формулы
где один из R14 и R15 представляет группу -X'-R4 и другой из R14 и R15 представляет атом водорода, X' представляет связь, атом кислорода или группу О(СН2)1-6, О(СН2)2-6О, О(СН2)2-3О(СН2)1-3, NR5, NR5(CH2)1-6, NR5(СН2)2-6O или NR5(CH2)2-3O(CH2)1-3, L2 представляет уходящую группу (например, гидроксильную или хлоридную уходящую группу) и R2, R3, R4 и R5 имеют значения, указанные в формуле (I), с соединением общей формулы
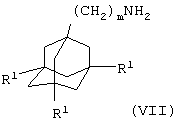
где m и R1 имеют значения, указанные в формуле (I), необязательно в присутствии агента сочетания (например, 1,1'-карбонилдиимидазола); или
(iv) когда Х представляет связь, атом кислорода или группу О(СН2)1-6, О(СН2)2-6О, О(СН2)2-3О(СН2)1-3, NR5, NR5(CH2)1-6, NR5(СН2)2-6O или NR5(CH2)2-3O(CH2)1-3 и А представляет C(O)NH, взаимодействие соединения общей формулы
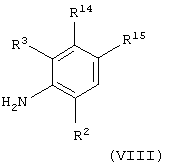
где R2 и R3 имеют значения, указанные в формуле (I), и R14 и R15 имеют значения, указанные в формуле (VI) в приведенном выше (iii), с соединением общей формулы
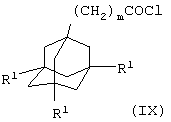
где m и R1 имеют значения, указанные в формуле (I), в присутствии основания (например, диизопропиламина); или
(v) когда Х представляет связь или группу NR5, NR5(CH2)1-6, NR5(СН2)2-6O или NR5(CH2)2-3O(CH2)1-3, взаимодействие соединения общей формулы
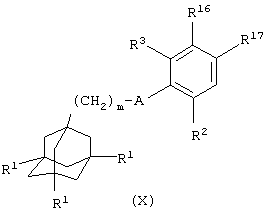
где один из R16 и R17 представляет уходящую группу L3, такую как атом галогена, и другой из R16 и R17 представляет атом водорода, и m, A, R1, R2 и R3 имеют значения, указанные в формуле (I), с соединением общей формулы
R4-Z (XI)
где Z представляет атом водорода или группу NНR5, (CH2)1-6NHR5, O(СН2)2-6NHR5 или группу (CH2)1-3O(CH2)2-3NHR5 и R4 и R5 имеют значения, определенные в формуле (I), необязательно в присутствии палладиевого катализатора (например, ацетата палладия), фосфинового лиганда (например, BINAP) и основания (например, карбоната цезия); или
(vi) когда Х представляет группу СН2О, взаимодействие соединения формулы II, как определено выше в (i), с соединением формулы (V), как определено выше в (ii), где Y представляет связь, в присутствии основания (например, гидрида натрия) или в присутствии соли металла (например, трифторметансульфоната серебра); или
(vii) когда Х представляет группу СН2NR5, взаимодействие соединения формулы (II), как определено выше в (i), с соединением формулы (ХI), как определено выше в (v), где Z представляет группу NHR5; или
(viii) когда Х представляет группу СН2О(СН2)1-3 или СН2О(СН2)2-3О, взаимодействие соединения формулы (II), как определено выше в (i), с соединением формулы (V), как определено выше в (ii), где Y представляет группу (СН2)1-3 или О(СН2)2-3, в присутствии основания (например, гидрида натрия) или в присутствии соли металла (например, трифторметансульфоната серебра); или
(ix) когда Х представляет группу СН2NR5CH2 или CH2NR5(CH2)2-3O, взаимодействие соединения формулы (II), как определено выше в (i), с соединением формулы (XI), как определено выше в (v), где Z представляет группу СН2NHR5 или O(CH2)2-3NHR5; или
(х) когда Х представляет группу СН2 и R4 представляет незамещенную 4-6-членную насыщенную алифатическую гетероциклическую кольцевую систему, содержащую один атом азота, взаимодействие соединения формулы (II), как определено выше в (i), с соединением общей формулы
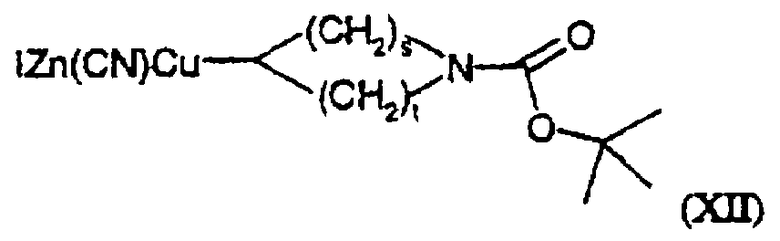
где s и t, независимо, равно 1 или 2; или
(xi) когда Х представляет группу СО, СОNR5, NR5CO, SO2, NR5SO2 или SO2NR5 и А представляет NHC(O), взаимодействие соединения общей формулы
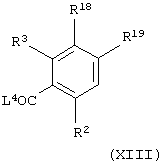
где один из R18 и R19 представляет группу -Х»-R4 и другой из R18 и R19 представляет атом водорода, Х» представляет группу СО, СОNR5, NR5CO, SO2, NR5SO2 или SO2NR5, L4 представляет уходящую группу (например, гидроксильную или хлоридную уходящую группу) и R2, R3, R4 и R5 имеют значения, указанные в формуле (I), с соединением формулы (VII), как определено выше в (iii), необязательно в присутствии агента сочетания (например, 1,1'-карбонилдиимидазола); или
(xii), когда Х представляет группу СО, СОNR5, NR5CO, SO2, NR5SO2 или SO2NR5 и А представляет С(О)NH, взаимодействие соединения общей формулы
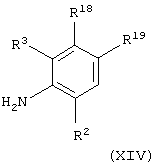
где R2 и R3 имеют значения, указанные в формуле (I), и R18 и R19 имеют значения, указанные в формуле (XIII), приведенной выше в (xi), с соединением формулы (IX), как определено выше в (iv), в присутствии основания (например, диизопропиламина), или
(xiii) когда Х представляет атом серы, взаимодействие соединения формулы (Х), как определено выше в (v), с литийорганическим реагентом, таким как н-бутиллитий (например, при -70°С) и затем с соединением общей формулы
R4-S-SO2-Tol (XV)
где Tol представляет толильную группу (4-метилфенильную) и R4 имеет значения, указанные в формуле (I), или
(xiv) когда Х представляет группу СНОН или СН2, взаимодействие соединения формулы (Х), как определено выше в (v), с литийорганическим реагентом (например, метиллитием/ трет-бутиллитием или н-бутиллитием при -70°С) и затем с соединением общей формулы
R4-CHO (XVI)
где R4 имеет значения, указанные в формуле (I), необязательно с последующей реакцией восстановления, например, метилоксалилхлоридом или триэтиламином и затем с трибутилоловогидридом в присутствии азобисизобутиронитрила; или
(xv) когда Х представляет связь, взаимодействие соединения формулы (Х), как определено выше в (v), с литийорганическим реагентом, таким как н-бутиллитий (например, при -70°С) и затем с соединением общей формулы
R4=O (XVII)
где R4 имеет значения, указанные в формуле (I), необязательно с последующей реакцией восстановления, например, метилоксалилхлоридом и триэтиламином и затем трибутилоловогидридом в присутствии азобисизобутиронитрила; или
(xvi) когда Х представляет группу SO, окисление соответствующего соединения формулы (I), в которой Х представляет атом серы (например, с использованием в качестве окисляющего агента 3-хлорпероксибензойной кислоты или пероксимоносульфата калия (коммерчески продается под товарным знаком «OXONE»); или
(xvii) когда Х представляет группу SCH2, взаимодействие соединения формулы (Х), как определено выше в (v), с литийорганическим реагентом (например, с метиллитием и/или трет-бутиллитием при -70°С) и затем с соединением общей формулы
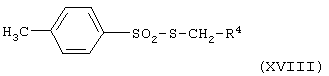
где R4 имеет значения, указанные в формуле (I); или
(xviii) когда Х представляет группу SOCH2 или SO2CH2, окисление соответствующего соединения формулы (I), в которой Х представляет группу SCH2 (например, с использованием в качестве окисляющего агента 3-хлорпероксибензойной кислоты или пероксимоносульфата калия (коммерчески продается под товарным знаком «OXONE»); или
(xix) когда Х представляет группу СН=, взаимодействие соединения формулы (II), как определено выше в (i), с триметилфосфитом и затем с соединением формулы (XVII), как определено выше в (xv), в присутствии основания (например, диизопропиламида лития); или
(хх) когда Х представляет группу (СН2)1-6, взаимодействие соединения общей формулы
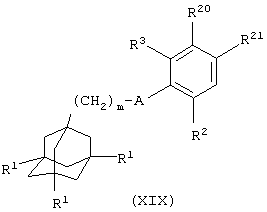
где один из R20 и R21 представляет группу СНО или группу (СН2)1-5СНО и другой из R20 и R21 представляет атом водорода и m, А, R1, R2 и R3 имеют значения, указанные в формуле (I), с соединением общей формулы (ХХ), R4-H, где R4 имеет значения, указанные в формуле (I), в присутствии восстанавливающего агента (например, триацетоксиборогидрида натрия, в подходящем растворителе, таком как дихлорэтан); или
(xxi) когда Х представляет группу (CH2)1-6NR5, (СН2)1-3NR5(CH2)1-3 или (CH2)1-3NR5(CH2)2-3O, взаимодействие соединения формулы (XIX), как определено выше в (хх), с соединением общей формулы (XXI), R4-Z, где Z' представляет группу NHR5, (CH2)1-3NHR5, O(CH2)2-3NHR5 и R4 и R5 имеют значения, указанные в формуле (I), в присутствии восстанавливающего агента (например, триацетоксиборогидрида натрия, в подходящем растворителе, таком как дихлорэтан); или
(xxii) когда Х представляет группу (СН2)1-3О(СН2)1-3 или (СН2)1-3О(СН2)2-3О, взаимодействие соединения формулы (XIX), как определено выше в (хх), в которой один из R20 и R21 представляет группу СНО или группу (СН2)1-2СНО и другой из R20 и R21 представляет атом водорода, с восстанавливающим агентом (таким как борогидрид натрия) с последующим взаимодействием с соединением общей формулы (XXII), R4-E, где Е представляет группу (CH2)1-3L5 или О(СН2)2-3L5, L5 представляет уходящую группу (такую как атом галогена или сульфонатная эфирная группа, например, п-толуолсульфонатная) и R4 имеет значения, указанные в формуле (I), в присутствии основания (такого как гидрид натрия); или
(xxiii) когда Х представляет группу (СН2)1-6, взаимодействие соединения формулы (II), как определено выше в (i), с триметилфосфитом и затем с соединением формулы (XVI), как определено выше в (xiv), с соединением формулы (XVII), как определено выше в (xv), или соединением общей формулы (XVIA), R4(CH2)1-4CHO, в котором R4 имеет значения, указанные в формуле (I), в присутствии основания (например, диизопропиламида лития) с последующей реакцией восстановления (например, с водородом и оксидом платины в качестве катализатора); или
(xxiv) когда Х представляет группу (СН2)2-6О, взаимодействие соединения общей формулы
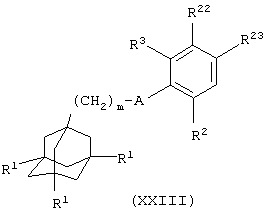
где один из R22 и R23 представляет группу (СН2)2-6L6 и другой из R22 и R23 представляет атом водорода, L6 представляет уходящую группу (например, атом галогена или сульфонатную эфирную группу, такую как п-толуолсульфонатная) и m, A, R1, R2 и R3 имеют значения, указанные в формуле (I), с соединением формулы (V), как определено выше в (ii), в котором Y представляет связь; или
(xxv) когда Х представляет группу CR'(OH), в которой R' представляет С1-С6-алкильную группу, окисление соответствующего соединения формулы (I), в которой Х представляет СН(ОН) (например, с использованием в качестве окислителя комбинации диметилсульфоксид/оксалилхлорид) с последующим взаимодействием с С1-С6-алкиллитиевым реагентом; или
(xxvi) когда Х представляет группу CH2S, взаимодействие соединения формулы (II), как определено выше в (i), с соединением общей формулы (XXIV), R4-SH, где R4 имеет значения, указанные в формуле (I), в присутствии основания (например, гидрида натрия); или
(xxvii) когда Х представляет группу CH2SO или СН2SO2, окисление соответствующего соединения формулы (I), в которой Х представляет группу CH2S (например, с использованием в качестве окисляющего агента 3-хлорпероксибензойной кислоты или пероксимоносульфата калия (коммерчески продается под торговым названием «OXONE»); или
(xxviii) когда Х представляет группу СН2 и R4 представляет 3-пиперидинильную или 2-пиперазинильную группу, взаимодействие соединения формулы (II), как определено выше в (i), с реагентом, образованным сочетанием пиридина или пиразина с алюминийгидридным реагентом (например, литийалюминийгидридом), с последующей реакцией восстановления (например, водородом и платиновым катализатором); или
(xxix) когда Х представляет группу СН= и R4 представляет 3-пиперидинильную группу, взаимодействие соединения общей формулы
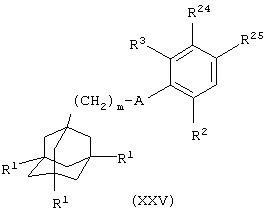
где один из R24 и R25 представляет альдегидную группу -СНО и другой из R24 и R25 представляет атом водорода и m, A, R1, R2 и R3 имеют значения, указанные в формуле (I), с 2,3,4,5-тетрагидропиридином (Bull. Chem. Soc. Jpn. 1983, 56, 3199) с последующей реакцией восстановления (например, борогидридом натрия в протонном растворителе, таком как метанол); или
(ххх) когда Х представляет связь, NR5 или NR5(CH2)1-6 и R4 представляет связанную через углерод пиперидильную или пиперазинильную группу, восстановление соединения общей формулы
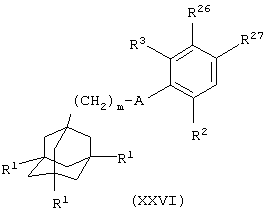
где один из R26 и R27 представляет пиридильную, пиразинильную, NR5-пиридильную, NR5-пиразинильную, NR5(CH2)1-6-пиридильную или NR5(CH2)1-6-пиразинильную группу и другой из R26 и R27 представляет атом водорода и m, A, R1, R2 и R3 имеют значения, указанные в формуле (I), источником водорода и катализатором гидрирования (таким, как оксид платины); или
(xxxi) когда Х представляет группу СН2О(СН2)1-3 или СН2О(СН2)2-3О и А представляет NHC(O), взаимодействие соединения общей формулы
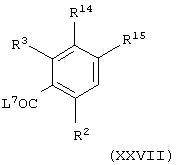
где один из R28 и R29 представляет группу -X′′′-R4 и другой из R28 и R29 представляет атом водорода, X′′′ представляет группу СН2О(СН2)1-3 или СН2О(СН2)2-3О, L7 представляет уходящую группу (например, гидроксильную или хлоридную уходящую группу) и R2, R3 и R4 имеют значения, указанные в формуле (I), с соединением формулы (VII), как определено выше в (iii), необязательно в присутствии агента сочетания (например, 1,1'-карбонилдиимидазола); или
(xxxii) когда Х представляет группу СН2О(СН2)1-3 или СН2О(СН2)2-3О и А представляет С(О)NH, взаимодействие соединения общей формулы
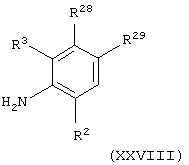
где R2 и R3 имеют значения, указанные в формуле (I), и R28 и R29 имеют значения, указанные в формуле (XXVII), приведенной выше в (xxxi), с соединением формулы (IX), как определено выше в (iv), в присутствии основания (например, диизопропиламина);
и, необязательно, после (i), (ii), (iii), (iv), (v), (vi), (vii), (viii), (ix), (x), (xi), (xii), (xiii), (xiv), (xv), (xvi), (xvii), (xviii), (xix), (xx), (xxi), (xxii), (xxiii), (xxiv), (xxv), (xxvi), (xxvii), (xxviii), (xxix), (xxx), (xxxi) или (xxxii) превращение соединения формулы (I) в следующее соединение формулы (I) и, при желании, образование фармацевтически приемлемой соли или сольвата соединения формулы (I).
Способы изобретения можно подходящим образом проводить в растворителе, например, органическом растворителе, таком как дихлорметан, дихлорэтан, тетрагидрофуран, диоксан, ксилол или диметилформамид, при температуре, например, в диапазоне от 0 до 200°С, предпочтительно, в диапазоне от 0 до 150°С.
Соединения формулы (II), в которой А представляет NHC(O), можно получить взаимодействием соединения общей формулы
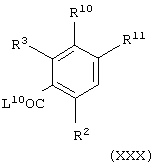
где L10 представляет уходящую группу (например, гидроксильную или хлоридную уходящую группу) и R2, R3, R10 и R11 имеют значения, указанные в формуле (II), с соединением формулы (VII), как определено выше, необязательно в присутствии агента сочетания (например, 1,1'-карбонилдиимидазола).
Соединения формулы (ХХХ), в которой один из R10 и R11 представляет атом водорода и другой из R10 и R11 представляет группу -CH2L1 и L1 представляет атом брома, можно получить взаимодействием соединения общей формулы
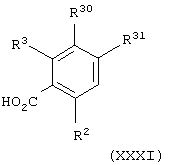
где один из R30 и R31 представляет атом водорода и другой из R30 и R31 представляет метильную группу и R2 и R3 имеют значения, указанные в формуле (I), с N-бромсукцинимидом и каталитическим азобисизобутиронитрилом или дибензоилпероксидом, необязательно с последующим хлорированием оксалилхлоридом и каталитическим диметилформамидом или тионилхлоридом.
Соединения формулы (II), в которой А представляет C(O)NH и L1 представляет, например, атом брома, можно получить взаимодействием соединения общей формулы
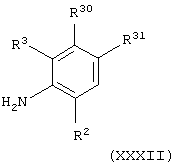
где R2 и R3 имеют значения, указанные в формуле (I), и R30 и R31 имеют значения, указанные в приведенной выше формуле (XXXI), с соединением формулы (IX), как определено выше, в присутствии основания (например, диизопропилэтиламина) с последующим взаимодействием с N-бромсукцинимидом и каталитическим азобисизобутиронитрилом или дибензоилпероксидом.
Соединения формулы (IV), в которой А представляет NHC(O), можно получить способом, аналогичным получению соединений формулы (II), в которой А представляет NHC(O), с использованием вместо промежуточного соединения формулы (ХХХ) промежуточного соединения общей формулы
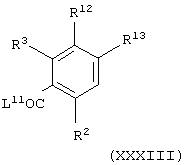
где L11 представляет уходящую группу (например, гидроксильную или хлоридную уходящую группу) и R2, R3, R12 и R13 имеют значения, указанные в формуле (IV).
Соединения формулы (IV), в которой А представляет С(О)NH, можно получить взаимодействием соединения общей формулы
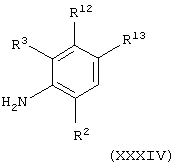
где R2, R3, R12 и R13 имеют значения, указанные в формуле (IV), с соединением формулы (IX), как определено выше, необязательно в присутствии основания (например, диизопропилэтиламина).
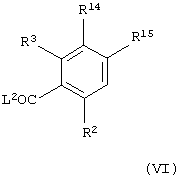
Соединения формулы (VI) можно получить взаимодействием соединения общей формулы
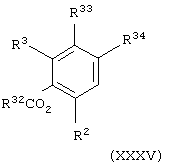
где R32 представляет атом водорода или С1-С6-алкильную группу, один из R33 и R34 представляет уходящую группу L12, такую как атом галогена (например, брома или иода) или трифторметансульфонатную группу и другой из R33 и R34 представляет атом водорода и R2 и R3 имеют значения, указанные в формуле (VI), с соединением общей формулы
Н-Х'-R4 (XXXVI)
где X' и R4 имеют значения, указанные в формуле (VI), в присутствии палладиевого катализатора (например, ацетата палладия), фосфинового лиганда (например, BINAP) и основания (например, карбоната цезия) (1996, J. Am. Chem. Soc., 7215-6; 1997, J. Am. Chem. Soc., 3395) с последующей реакцией гидролиза (например, гидроксидом натрия) и необязательно реакцией хлорирования (например, оксалилхлоридом и каталитическим диметилформамидом или тионилхлоридом).
Соединение формулы (VIII) можно подходящим образом получить взаимодействием соединения формулы (VI), в которой L2 представляет гидроксильную группу, с дифенилфосфорилазидом в присутствии основания, такого как триэтиламин.
Соединение формулы (Х), в которой А представляет NHC(O), можно получить способом, аналогичным получению соединений формулы (II), в которой А представляет NHC(O), с использованием вместе промежуточного соединения формулы (ХХХ) промежуточного соединения общей формулы
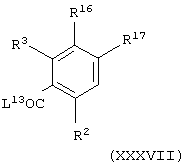
где L13 представляет уходящую группу (например, гидроксильную или хлоридную уходящую группу) и R2, R3, R16 и R17 имеют значения, указанные в формуле (Х).
Соединения формулы (Х), в которой А представляет С(О)NH, можно получить способом, аналогичным получению соединений формулы (IV), в которой А представляет C(O)NH, с использованием вместо промежуточного соединения формулы (ХХХIV) промежуточного соединения общей формулы
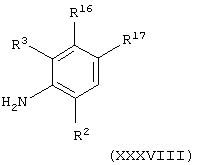
где R2, R3, R16 и R17 имеют значения, указанные в формуле (Х).
Соединения формулы (XII) можно получить, как описано в Syn. Lett. (1998) 379-380.
Соединения формулы (XIII), в которой X» представляет группу СО, CONR5, SO2 или SO2NR5, можно получить взаимодействием соединения общей формулы
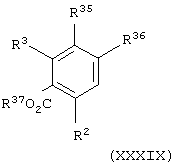
где один из R35 и R36 представляет группу COL14 или SO2L14 и другой из R25 и R26 представляет атом водорода, L14 представляет уходящую группу (например, атом галогена), R37 представляет атом водорода или С1-С6-алкильную группу и R2 и R3 имеют значения, указанные в формуле (XIII), с соединением формулы (XXXVI), в которой X' представляет связь или группу NR5, в присутствии основания, такого как диизопропилэтиламин, и каталитического диметиламинопиридина с последующей реакцией гидролиза (например, гидроксидом натрия) и необязательно реакцией хлорирования (например, оксалилхлоридом и каталитическим диметилформамидом или тионилхлоридом).
Соединения формулы (XIII), в которой X» представляет группу NR5CO или NR5SO2, можно получить взаимодействием соединения общей формулы
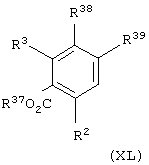
где один из R38 и R39 представляет группу NHR5 и другой из R38 и R39 представляет атом водорода, R37 имеет значения, указанные для соединения (XXXIX), и R2 и R3 имеют значения, указанные в формуле (XIII), с соединением общей формулы (ХLI), R4-J, где J представляет группу COCl или SO2Cl и R4 имеет значения, указанные в формуле (I), в присутствии основания, такого как диизопропилэтиламин.
Соединения формулы (XIV) можно удобно получить взаимодействием соединения формулы (XIII), в которой L4 представляет гидроксильную группу, с дифенилфосфорилазидом в присутствии основания, такого как триэтиламин.
Соединения формулы (XIX), в которой один из R20 и R21 представляет группу (СН2)1-5СНО и другой из R20 и R21 представляет атом водорода, можно получить окислением соединения общей формулы
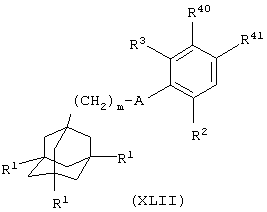
где один из R40 и R41 представляет группу (СН2)2-6ОН и другой из R40 и R41 представляет атом водорода, и m, A, R1, R2 и R3 имеют значения, указанные в формуле (I), с использованием в качестве окисляющего агента, например, реагента Dess Martin Periodinanе.
Соединения формулы (XLII), в которой один из R40 и R41 представляет группу (СН2)2ОН и другой из R40 и R41 представляет атом водорода, можно получить из соединения общей формулы (Х), как определено выше, взаимодействием с литийорганическим реагентом, таким как метиллитий (при -70°С), и затем н-бутиллитием (при -70°С) и затем обработкой этиленоксидом.
Соединения формулы (XLII), в которой один из R40 и R41 представляет группу (СН3)3-6ОН и другой из R40 и R41 представляет атом водорода, можно получить взаимодействием соединения общей формулы (Х), как определено выше, с соединением общей формулы
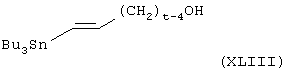
в присутствии палладиевого катализатора, такого как тетракис(трифенилфосфин)палладий(0), с последующим восстановлением, например, водородом и оксидом платины в качестве катализатора.
Соединения формулы (XIX), в которой один из R20 и R21 представляет группу СНО и другой из R20 и R21 представляет атом водорода (которые эквивалентны соединениям формулы (XXV)), можно получить из соединения общей формулы (Х), как определено выше, взаимодействием с литийорганическим реагентом, таким как метиллитий (при -70°С), затем с н-бутиллитием (при -70°С) и затем с диметилформамидом.
Соединения формулы (XXIII), в которой L6 представляет атом иода или п-толуолсульфонилоксигруппу, можно получить взаимодействием соединения формулы (XLII), как определено выше, со смесью иод/трифенилфосфин/имидазол или с сульфонилхлоридом, таким как п-толуолсульфонилхлорид, в присутствии основания, такого как диизопропилэтиламин.
Соединения формулы (XXVI), в которой один из R26 и R27 представляет пиридильную или пиразинильную группу и другой из R26 и R27 представляет атом водорода, можно получить из соединения формулы (Х), как определено выше, взаимодействием с пиридил- или пиразинилбороновой кислотой в присутствии палладиевого катализатора, такого как тетракис(трифенилфосфин)палладий(0).
Соединения формулы (XXVI), в которой один из R26 и R27 представляет NR5-пиридильную, NR5-пиразинильную, NR5(СН2)1-6-пиридильную или NR5(CH2)1-6-пиразинильную группу и другой из R26 и R27 представляет атом водорода, можно получить из соединения формулы (Х), как определено выше, взаимодействием с соединением NHR5-пиридил, NНR5-пиразинил, NНR5(CH2)1-6-пиридил или NHR5(CH2)1-6-пиразинил в присутствии палладиевого катализатора (например, ацетата палладия), фосфинового лиганда (например, BINAP) и основания (например, карбоната цезия).
Соединения формул (III), (V), (VII), (IX), (XI), (XV), (XVI), (XVIA), (XVII), (XVIII), (XX), (XXI), (XXII), (XXIV), (XXVII), (XXVIII), (XXXI), (XXXII), (XXXIII), (XXXIV), (XXXV), (XXXVI), (XXXVII), (XXXVIII), (XXXIX), (XL), (XLI), (XLII) и (XLIII) либо коммерчески доступны, хорошо известны в литературе, либо их можно легко получить с использованием известных методов.
Соединения формулы (I) можно превратить в следующие соединения формулы (I) с использованием стандартных процедур. Например, соединения формулы (I), в которой один из R2 и R3 представляет нитрогруппу, можно превратить в соединения формулы (I), в которой один из R2 и R3 представляет аминогруппу, восстановлением с использованием железного порошка и хлорида аммония в смеси этанол/вода при кипячении с обратным холодильником. Последние соединения можно, в свою очередь, превратить в соединения формулы (I), в которой один из R2 и R3 представляет атом галогена, например, хлор, диазотированием (например, нитритом натрия) и взаимодействием с хлоридом меди. Соединения формулы (I), в которой R6 или R7 представляет атом водорода, можно превратить в соединения формулы (I), в которой R6 или R7 представляет С1-С6-алкил, С2-С6-гидроксиалкил, С3-С8-циклоалкил или 3-8-членное насыщенное гетероциклическое кольцо, стандартными химическими процедурами.
Специалисту в данной области будет очевидно, что в способах настоящего изобретения некоторые функциональные группы, такие как гидроксильные или аминогруппы, в исходных реагентах или промежуточных соединениях может быть необходимо защитить защитными группами. Таким образом, получение соединений формулы (I) может включать, на соответствующей стадии, удаление одной или нескольких защитных групп.
Защита и снятие защиты функциональных групп описывается в «Protective Groups in Organic Chemistry», edited by J.W.F. McOmie, Plenum Press (1973) and «Protective Groups in Organic Synthesis», 2nd edition, T.W. Greene and P.G.M. Wuts, Wiley-Interscience (1991).
Соединения приведенной выше формулы (I) можно превратить в его фармацевтически приемлемую соль или сольват, предпочтительно, кислотно-аддитивную соль, такую как гидрохлорид, гидробромид, фосфат, ацетат, фумарат, малеат, тартрат, цитрат, оксалат, метансульфонат или п-толуолсульфонат, или соль щелочного металла, такую как натриевая или калиевая соль.
Некоторые соединения формулы (I) способны существовать в стереоизомерных формах. Должно быть понятно, что изобретение включает все геометрические и оптические изомеры соединений формулы (I) и их смеси, включающие рацематы. Таутомеры и их смеси также образуют аспект настоящего изобретения.
Соединения настоящего изобретения обладают фармакологической активностью. Они, следовательно, служат в качестве фармацевтических средств для использования при лечении ревматоидного артрита, остеоартрита, псориаза, аллергического дерматита, астмы, хронического закупоривающего легочного заболевания (COPD), повышенной восприимчивости дыхательных путей, септического шока, гломерулонефрита, воспалительного заболевания кишечника, болезни Крона, язвенного колита, атеросклероза, роста и метастазов злокачественных клеток, миобластного лейкоза, диабета, болезни Альцгеймера, менингита, остеопороза, ожогового повреждения, ишемического заболевания сердца, удара и варикозных вен.
В соответствии с этим, настоящее изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли или сольвату, как определено выше, для использования в терапии.
В другом аспекте изобретение относится к использованию соединения формулы (I) или его фармацевтически приемлемой соли или сольвата, как определено выше, для приготовления лекарственного средства для использования в терапии.
В контексте настоящего изобретения термин «терапия» включает также «профилактику», если только, в противоположность, не имеется конкретных указаний. Термин «терапевтический» и «терапевтически» должны истолковываться соответственно.
Изобретение далее относится к способу иммуносупрессии (например, при лечении ревматоидного артрита, воспалительного заболевания кишечника, атеросклероза или псориаза), который включает введение пациенту терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли или сольвата, как определено выше.
Изобретение относится также к способу лечения обструктивного заболевания дыхательных путей (например, астмы или COPD), который включает введение пациенту терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли или сольвата, как определено выше.
Для указанных выше терапевтических использований введенная доза, конечно, будет изменяться в зависимости от используемого соединения, способа введения, требуемого лечения и указанного нарушения. Суточная доза соединения формулы (I)/соли/сольвата (активный ингредиент) может быть в диапазоне от 0,001 мг/кг до 30 мг/кг.
Соединения формулы (I) и их фармацевтически приемлемые соли и сольваты можно использовать как таковые, но обычно их вводят в форме фармацевтической композиции, в которой соединение формулы (I)/соль/сольват (активный ингредиент) находится в сочетании с фармацевтически приемлемым адъювантом, разбавителем или носителем. В зависимости от способа введения, фармацевтическая композиция будет, предпочтительно, включать от 0,05 до 99 мас.% (процентов по массе), более предпочтительно, от 0,10 до 70 мас.%, активного ингредиента и от 1 до 99,95 мас.%, более предпочтительно, от 30 до 99,90% масс. фармацевтически приемлемого адъюванта, разбавителя или носителя, причем все массовые проценты основаны на общей композиции.
Таким образом, настоящее изобретение относится к фармацевтической композиции, включающей соединение формулы (I) или его фармацевтически приемлемую соль или сольват, как определено выше, в сочетании с фармацевтически приемлемым адъювантом, разбавителем или носителем.
Изобретение далее относится к способу получения фармацевтической композиции изобретения, который включает смешивание соединения формулы (I) или его фармацевтически приемлемой соли или сольвата, как определено выше, с фармацевтически приемлемым адъювантом, разбавителем или носителем.
Фармацевтическую композицию изобретения можно вводить местно (например, в легкие и/или дыхательные пути или в кожу) в форме растворов, суспензий, гептафторалкановых аэрозолей или готовых препаративных форм в виде сухого порошка, или системно, например, пероральным введением в форме таблеток, капсул, сиропов, порошков или гранул, или парентеральным введением в форме растворов или суспензий, или подкожным введением, или ректальным введением в форме суппозиториев, или чрескожно.
Настоящее изобретение далее поясняется со ссылкой на следующие иллюстративные примеры.
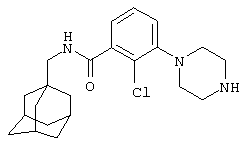
Пример 1
2-Нитро-3-пиперазин-1-ил-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид
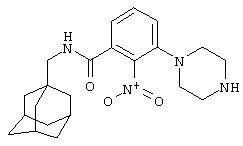
а) 3-Хлор-2-нитро-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид
К суспензии 3-хлор-2-нитробензойной кислоты (2,68 г) в дихлорметане (10 мл) при 0°С добавляют оксалилхлорид (3 мл) и диметилформамид (1 капля). Образовавшуюся смесь перемешивают при комнатной температуре в атмосфере азота в течение 1 часа, затем концентрируют при пониженном давлении с получением твердого вещества. Твердое вещество растворяют в дихлорметане (10 мл) и охлаждают до 0°С. Порциями добавляют раствор 1-адамантанметиламина (2,19 г) и N,N-диизопропилэтиламина (11 мл) в дихлорметане (10 мл) и образовавшийся раствор оставляют для перемешивания при комнатной температуре в атмосфере азота в течение 2 ч. Реакционную смесь выливают в воду и органическую фазу отделяют и промывают 2 н. хлористоводородной кислотой, 10% водным гидроксидом натрия и насыщенным раствором соли. Органическую фазу затем сушат над сульфатом натрия, фильтруют и концентрируют при пониженном давлении и образовавшееся твердое вещество перекристаллизовывают из изопропанола с получением указанного в подзаголовке соединения в виде твердого вещества (3,52 г).
МС (APCI+ve) 349 (M+H)+
1Н ЯМР (ДМСО-d6) δ 8,74 (1Н, т); 7,89 (1Н, м); 7,75-7,69 (2Н, м),; 2,91 (2Н, д); 1,93 (3Н, шир.с); 1,64 (6Н, дд); 1,47 (6Н, д)
b) 3-(4-[{1,1-Диметилэтил}оксикарбонил]пиперазин-1-ил)-2-нитро-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид
Смесь 3-хлор-2-нитро-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (2,80 г, пример 1а) и трет-бутилового эфира пиперазин-1-карбоновой кислоты (7,47 г) в сухом диметилсульфоксиде (10 мл) нагревают при 120°С в атмосфере азота в течение 24 ч. Охлажденную реакционную смесь разбавляют водой и экстрагируют трижды этилацетатом. Объединенные экстракты промывают водой, сушат над сульфатом натрия, фильтруют и фильтрат концентрируют при пониженном давлении с получением твердого вещества. Очистка хроматографией на силикагеле с элюированием смесью изогексан/этилацетат (2:1) дает указанное в подзаголовке соединение в виде твердого вещества (3,8 г).
МС (APCI+ve) 499 (M+H)+
1Н ЯМР (ДМСО-d6) δ 8,55 (1Н, т); 7,62-7,59 (2Н, м); 7,43 (1Н, дд); 3,38 (4Н, шир.т); 2,90-2,84 (6Н, м); 1,93 (3Н, шир.с); 1,63 (6Н, дд); 1,47 (6Н, д); 1,41 (9Н, с).
с) 2-Нитро-3-пиперазин-1-ил-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид
Раствор 3-(4-[{1,1-диметилэтил}оксикарбонил]пиперазин-1-ил)-2-нитро-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (0,58 г, пример 1b) и хлористоводородной кислоты (6,4 мл, 4 н. в диоксане) в тетрагидрофуране (20 мл) перемешивают при комнатной температуре в атмосфере азота в течение 18 ч. Реакционную смесь концентрируют при пониженном давлении и остаток растворяют в воде, делают основным твердым бикарбонатом натрия и экстрагируют дихлорметаном три раза. Объединенные органические экстракты сушат над сульфатом магния, фильтруют и фильтрат концентрируют при пониженном давлении с получением твердого вещества. Очистка хроматографией на силикагеле с элюированием 10% метанолом в дихлорметане дает указанное в заголовке соединение в виде твердого вещества (0,165 г).
МС (APCI+ve) 399 (M+H)+
1Н ЯМР (ДМСО-d6) δ 8,52 (1Н, т); 7,59 (1Н, т); 7,51 (1Н, д); 7,35 (1Н, д); 2,88 (2Н, д); 2,81 (4Н, м); 2,37 (4Н, м); 1,93 (3Н, шир.с); 1,67 (3Н, д); 1,60 (3Н, д); 1,47 (6Н, с).
Пример 2
Дигидрохлоридная соль 2-амино-3-пиперазин-1-ил-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
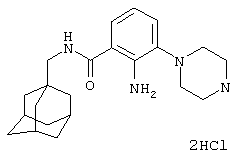
а) 2-Амино-3-(4-[{1,1-диметилэтил}оксикарбонил]пиперазин-1-ил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид
Суспензию 3-(4-[{1,1-диметилэтил}оксикарбонил]пиперазин-1-ил)-2-нитро-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (3,8 г, пример 1b), железного порошка (2,13 г) и хлорида аммония (2,04 г) в смеси 2:1 этанол/вода (90 мл) нагревают при кипячении с обратным холодильником в атмосфере азота в течение 2 ч. Охлажденную реакционную смесь фильтруют и фильтрат распределяют между водой и этилацетатом. Органический слой отделяют и промывают далее дважды водой, сушат над сульфатом магния, фильтруют и фильтрат концентрируют при пониженном давлении с получением остатка. Очистка остатка хроматографией на силикагеле с элюированием 20% этилацетатом в изогексане дает указанное в подзаголовке соединение в виде твердого вещества (2,27 г).
МС (APCI + ve) 469 (М+Н)+.
b) Дигидрохлоридная соль 2-амино-3-пиперазин-1-ил-N-(трицикло [3.3.1.13,7]дец-1-илметил)бензамида
Получение проводят, как описано в примере 1с) с использованием 2-амино-3-(4-[{1,1-диметилэтил}оксикарбонил]пиперазин-1-ил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (0,2 г, пример 2а) и хлористоводородной кислоты (5 мл 4 н. в диоксане). Реакционную смесь концентрируют при пониженном давлении с получением твердого вещества, которое при растирании с диэтиловым эфиром дает указанное в заголовке соединение в виде твердого вещества (0,2 г).
МС (APCI+ve) 369 (M-2HCl)+
1Н ЯМР (ДМСО-d6) δ 9,16 (2Н, шир.с); 8,14 (1Н, т); 7,37 (1Н, д); 7,07 (1Н, д); 6,64 (1Н, т); 3,27 (4Н, шир.с); 2,98 (4Н, шир.с); 2,95 (2Н, д); 1,93 (3Н, шир.с); 1,67 (3Н, д); 1,59 (3Н, д); 1,48 (6Н, с).
Пример 3
2-Хлор-3-пиперазин-1-ил-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид
а) 2-Хлор-3-(4-[{1,1-диметилэтил}оксикарбонил]пиперазин-1-ил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид
К раствору 2-амино-3-(4-[{1,1-диметилэтил}оксикарбонил] пиперазин-1-ил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (1 г, пример 2а) в тетрагидрофуране (23 мл) добавляют 1 М водную хлористоводородную кислоту (2,78 мл) и воду (10 мл). Раствор охлаждают до 0°С и порциями добавляют нитрит натрия (1,91 г) при поддержании внутренней температуры ниже 5°С. После перемешивания при 0-5°С в течение 0,5 ч предварительно охлажденную суспензию хлорида меди(I) (10,58 г) и хлорида меди(II) в воде (20 мл) добавляют порциями к бледно-желтой суспензии. Смесь перемешивают при 0°С в течение 0,5 ч, затем при комнатной температуре в течение 0,5 ч. Реакционную смесь выливают в смесь воды и дихлорметана и 1/1:0,88 аммиак/вода до тех пор, пока водная фаза не станет гомогенной. Слои разделяют и водную фазу экстрагируют дважды дихлорметаном. Объединенные органические экстракты промывают раствором 1/1:0,88 аммиак/вода до тех пор, пока водный слой не станет бесцветным, сушат над сульфатом натрия, фильтруют и концентрируют при пониженном давлении с получением масла. Очистка хроматографией на силикагеле с элюированием 20-35% раствором этилацетат/изогексан дает указанное в подзаголовке соединение в виде твердого вещества (0,45 г).
МС (APCI+ve) 388 (M-ВОС)+
1Н ЯМР (ДМСО-d6) δ 8,27 (1Н, т); 7,32 (1Н, т); 7,19 (1Н, д); 7,04 (1Н, д); 3,48 (4Н, м); 2,93-2,91 (6Н, м); 1,94 (3Н, шир.с); 1,64 (3Н, д); 1,59 (3Н, д); 1,52 (6Н, с); 1,43 (9Н, с).
b) 2-Хлор-3-пиперазин-1-ил-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид
К раствору 2-хлор-3-(4-[{1,1-диметилэтил}оксикарбонил] пиперазин-1-ил)-2-нитро-N-(трицикло[3.3.1.13,7]дец-1-илметил) бензамида (0,45 г, пример 3а) в дихлорметане (10 мл) добавляют трифторуксусную кислоту (5 мл). После перемешивания при комнатной температуре в атмосфере азота реакционную смесь концентрируют при пониженном давлении с получением смолы. Смолу распределяют между водой и дихлорметаном и делают основной твердым бикарбонатом натрия. Слои разделяют и водный слой далее экстрагируют дважды дихлорметаном. Объединенные органические экстракты промывают дважды водой, насыщенным раствором соли, затем сушат над сульфатом магния, фильтруют и фильтрат концентрируют при пониженном давлении с получением пены. Пену очищают ВЭЖХ с нормальной фазой (0-20% этанол/дихлорметан) и хроматографируют на силикагеле с элюированием 10% метанолом в дихлорметане с получением указанного в заголовке соединения в виде пены (0,05 г).
МС (APCI+ve) 388/90 (M+H)+
1Н ЯМР (ДМСО-d6) δ 8,24 (1Н, т); 7,31 (1Н, т); 7,15 (1Н, д); 7,00 (1Н, д); 2,96-2,87 (10Н, м); 1,93 (3Н, шир.с); 1,67 (3Н, д); 1,59 (3Н, д); 1,52 (6Н, с).
Пример 4
2-Хлор-5-пиперазин-1-ил-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид
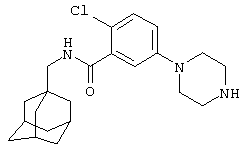
а) 2-Хлор-5-нитро-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид
К раствору 2-хлор-5-нитробензойной кислоты (1,22 г) в N,N-диметилформамиде (1,5 мл) добавляют карбонилдиимидазол (1,0 г). Образовавшуюся реакционную смесь перемешивают в течение 2,5 ч и затем добавляют 1-адамантанметиламин (1,0 г). Спустя 14 ч реакционную смесь распределяют между этилацетатом и водой и органический слой отделяют, промывают водой и насыщенным раствором соли и затем сушат над сульфатом натрия (Na2SO4). Органический слой концентрируют при пониженном давлении с получением остатка, который очищают хроматографией на силикагеле (элюирование 3-10% метанолом в дихлорметане) с получением указанного в подзаголовке соединения в виде желтого вещества (1,7 г).
МС (APCI+ve) 348/350 (M+H)+
1Н ЯМР (CdCl3) δ 8,53 (1Н, д), 8,2 (1Н, дд), 7,6 (1Н, д), 6,2 (1Н, шир.с), 3,2 (2Н, д), 2,0 (3Н, шир.с), 1,8 (12Н, м).
b) 5-Амино-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид
Раствор нитросоединения из примера 4а (0,50 г) и хлорида аммония (0,5 г) растворяют в 50% водном этаноле. Добавляют железный порошок (0,5 г) и смесь перемешивают при температуре флегмы в течение 3 ч до охлаждения и твердое вещество удаляют фильтрованием. Маточный раствор обрабатывают 10% раствором гидроксида натрия и продукт экстрагируют этилацетатом. Органический раствор промывают насыщенным раствором соли, сушат над сульфатом натрия (Na2SO4) и концентрируют с получением остатка, который очищают хроматографией на силикагеле с получением указанного в заголовке соединения в виде белого твердого вещества (0,4 г).
МС (APCI+ve) 319/21 (M+H)+
1Н ЯМР (ДМСО-d6) δ 8,14 (1Н, т); 7,03 (1Н, дд); 6,56 (2Н, м); 5,36 (2Н, с); 2,89 (2Н, д); 1,95 (3Н, с); 1,7 (12Н, м).
с) 2-Хлор-5-пиперазин-1-ил-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид
К раствору 5-амино-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (1,00 г, пример 4b) в ксилоле (20 мл) добавляют гидрохлоридную соль бис-(2-хлорэтил)амина (0,620 г). Смесь нагревают при 150°С в течение 12 ч (получают темный раствор). Холодный раствор промывают 2 М HCl, водный слой промывают этилацетатом, затем подщелачивают бикарбонатом натрия и экстрагируют дважды дихлорметаном. Органический слой сушат над сульфатом магния, фильтруют и фильтрат концентрируют при пониженном давлении с получением пены. Сырой материал очищают на силикагеле (0-10% этанол/дихлорметан) с получением указанного в заголовке соединения в виде белого твердого вещества (0,90 г).
МС (APCI+ve) 388/90 (M+H)+
1Н ЯМР (ДМСО-d6) δ 8,22 (1Н, т); 7,22 (1Н, д); 6,96 (1Н, дд); 6,84 (1Н, д); 3,50-3,20 (7Н, м); 3,00-2,90 (2Н, т); 2,91 (2Н, д); 1,94 (3Н, шир.с); 1,67 (3Н, д); 1,59 (3Н, д); 1,52 (6Н, с).
Пример 5
Гидрохлоридная соль 2-хлор-5-(гексагидро-1Н-1,4-диазепин-1-ил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
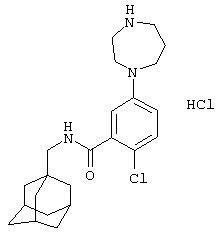
а) 1,1-Диметилэтиловый эфир 4-[4-хлор-3-(этоксикарбонил)фенил]гексагидро-1Н-1,4-диазепин-1-карбоновой кислоты
Смесь этилового эфира 5-бром-2-хлорбензойной кислоты (0,50 г), 1,1-диметилэтилового эфира гексагидро-1Н-1,4-диазепин-1-карбоновой кислоты (0,46 г), карбоната цезия (0,86 г), ацетата палладия (II) (8,5 мг) и (R)-BINAP (35 мг) в толуоле (3 мл) нагревают при 100°С в течение 14 ч в автоклаве, продутом струей водорода. Охлажденную реакционную смесь выливают в воду и экстрагируют (3 раза) этилацетатом. Объединенные органические экстракты промывают насыщенным раствором хлорида натрия и затем сушат над сульфатом магния. Упаривание при пониженном давлении дает масло, которое очищают хроматографией на силикагеле с элюированием 20% этилацетатом в изогексане с получением указанного в подзаголовке соединения в виде масла (0,21 г).
МC (APCI + ve) 282/284 (M-BOC)+.
b) 1,1-Диметилэтиловый эфир 4-(3-карбокси-4-хлорфенил)гексагидро-1Н-1,4-диазепин-1-карбоновой кислоты
Суспензию 1,1-диметилэтилового эфира 4-[4-хлор-3-(этоксикарбонил)фенил]гексагидро-1Н-1,4-диазепин-1-карбоновой кислоты (пример 5а, 0,21 г), моногидрата гидроксида лития (1,05 мл 3 М раствора в воде) в смеси 1:1 этанол/вода (7 мл) перемешивают при комнатной температуре в течение 14 ч. Добавляют еще моногидрат гидроксида лития (0,55 мл 3 М раствора в воде) и затем тетрагидрофуран (1 мл). Образовавшийся раствор перемешивают в течение 4 ч при комнатной температуре, затем выливают в воду и экстрагируют диэтиловым эфиром. Водную фазу отделяют, подкисляют 2 М хлористоводородной кислотой и затем экстрагируют три раза дихлорметаном. Объединенные слои дихлорметана сушат над сульфатом магния и упаривают при пониженном давлении с получением указанного в подзаголовке соединения в виде стекла.
МС (APCI + ve) 298/300 (M-tBu)+
c) 1,1-Диметилэтиловый эфир гексагидро-4-[4-метил-3-[[(трицикло[3.3.1.13,7]дец-1-илметил)амино]карбонил]фенил]-1Н-1,4-диазепин-1-карбоновой кислоты
Раствор 1,1-диметилэтилового эфира 4-(3-карбокси-4-хлорфенил)гексагидро-1Н-1,4-диазепин-1-карбоновой кислоты (пример 5b, 0,10 г) и N,N'-карбонилдиимидазола (0,045 г) в диметилформамиде (3 мл) перемешивают при комнатной температуре в течение 2 ч. Затем добавляют 1-адамантанметиламин (0,050 мл) и перемешивание продолжают в течение 14 ч. Реакционную смесь выливают в воду и экстрагируют этилацетатом три раза. Слои этилацетата объединяют и промывают 2 М хлористоводородной кислотой, 10% водным гидроксидом натрия и насыщенным раствором соли, затем сушат над сульфатом магния и концентрируют при пониженном давлении. Очистка хроматографией на силикагеле с элюированием 20-30% этилацетата в изогексане дает указанное в подзаголовке соединение в виде смолы, которая кристаллизуется при стоянии.
МС (APCI + ve) 502/504 (M+H)+.
d) Гидрохлоридная соль 2-хлор-5-(гексагидро-1Н-1,4-диазепин-1-ил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
1,1-Диметилэтиловый эфир гексагидро-4-[4-метил-3-[[(трицикло[3.3.1.13,7]дец-1-илметил)амино]карбонил]фенил]-1Н-1,4-диазепин-1-карбоновой кислоты (из примера 5с) растворяют в метаноле (5 мл) и добавляют хлористоводородную кислоту (0,5 мл 4 н. раствора в диоксане). После перемешивания при комнатной температуре в течение 14 ч смесь упаривают до 2/3 начального объема при пониженном давлении. К раствору постепенно добавляют диэтиловый эфир и образовавшийся осадок собирают фильтрованием, промывают диэтиловым эфиром и сушат в вакууме с получением указанного в заголовке соединения в виде твердого вещества (0,027 г).
МС (APCI+ve) 402/404 (M+H)+
1Н ЯМР (ДМСО-d6) δ 9,11 (2Н, шир.с); 8,18 (1Н, т); 7,24 (1Н, д); 6,81 (1Н, дд); 6,71 (1Н, д); 3,71 (2Н, т); 3,50 (2Н, т); 3,19 (2Н, шир.с); 2,93 (2Н, шир.с); 2,92 (2Н, д); 2,08 (2Н, м); 1,94 (3Н, шир.с); 1,67 (3Н, д); 1,59 (3Н, шир.с); 1,52 (6Н, с).
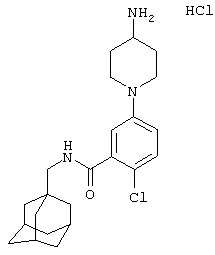
Пример 6
Гидрохлоридная соль 5-(4-амино-1-пиперидинил)-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
а) Этиловый эфир 2-хлор-5-[4-[[(1,1-диметилэтокси)карбонил]амино]-1-пиперидинил]бензойной кислоты
Получение проводят, как описано в примере 5а), с использованием этилового эфира 5-бром-2-хлорбензойной кислоты (0,50 г), 1,1-диметилэтилового эфира 4-пиперидинилкарбаминовой кислоты (0,46 г), карбоната цезия (0,86 г), ацетата палладия(II) (8,5 мг) и (R)-BINAP (35 мг) и толуола (3 мл) с получением указанного в подзаголовке соединения в виде масла (0,17 г).
МС (APCI + ve) 383/385 (М+Н)+.
b) 2-Хлор-5-[4-[[(1,1-диметилэтокси)карбонил]амино]-1-пиперидинил]бензойная кислота
Получение проводят, как описано в примере 5b), с использованием этилового эфира 2-хлор-5-[4-[[(1,1-диметилэтокси)карбонил]амино]-1-пиперидинил]бензойной кислоты (пример 6а, 0,17 г), моногидрата гидроксида лития (0,88 мл 3 М раствора в воде), смеси 1:1 этанол/вода (7 мл) и тетрагидрофурана (1 мл) с получением указанного в подзаголовке соединения в виде твердого вещества (0,14 г).
МС (APCI+ve) 354/356 (М+Н)+.
с) 1,1-Диметилэтиловый эфир [1-[4-хлор-3-[[(трицикло[3.3.1.13,7]дец-1-илметил)амино]карбонил]фенил]-4-пиперидинил]карбаминовой кислоты
Получение проводят, как описано в примере 5с), с использованием 2-хлор-5-[4-[[(1,1-диметилэтокси)карбонил]амино]-1-пиперидинил]бензойной кислоты (пример 6b, 0,065 г), N,N'-карбонилдиимидазола (0,030 г), 1-адамантанметиламина (0,032 мл) и диметилформамида (3 мл) с получением указанного в подзаголовке соединения в виде твердого вещества.
МС (APCI+ve) 501/503 (М+Н)+.
d) Гидрохлоридная соль 5-(4-амино-1-пиперидинил)-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
Получение проводят, как описано в указанном выше примере 5d), с использованием 1,1-диметилэтилового эфира [1-[4-хлор-3-[[(трицикло[3.3.1.13,7]дец-1-илметил)амино]карбонил]фенил]-4-пиперидинил]карбаминовой кислоты (пример 6с), хлористоводородной кислоты (0,5 мл 4 н. раствора в диоксане) и метанола (10 мл). Смесь нагревают при кипячении с обратным холодильником в течение 15 мин для завершения реакции. После упаривания до двух третей начального объема при стоянии кристаллизуется твердое вещество, которое собирают фильтрованием и сушат в вакууме с получением указанного в заголовке соединения в виде твердого вещества (0,025 г).
МС (APCI+ve) 402/404 (M-HCl)+
1Н ЯМР (ДМСО-d6) δ 8,23 (1Н, т); 8,11 (1Н, шир.с); 7,28 (1Н, д); 7,03 (1Н, дд); 6,94 (1Н, с); 3,74 (2Н, д); 3,20 (1Н, м); 2,91 (2Н, д); 2,83 (2Н, т); 1,98 (2Н, шир.с); 1,94 (3Н, шир.с); 1,69-1,58 (8Н, м); 1,52 (6Н, с).
Пример 7
Гидрохлоридная соль (+/-)-5-(3-амино-1-пирролидинил)-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
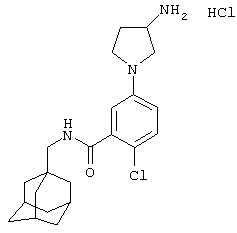
а) Этиловый эфир (+/-)-2-хлор-5-[3-[[(1,1-диметилэтокси)карбонил]амино]-1-пирролидинил]бензойной кислоты
Получение проводят, как описано в примере 5а), с использованием этилового эфира 5-бром-2-хлорбензойной кислоты (0,50 г), 1,1-диметилэтилового эфира 3-пирролидинилкарбаминовой кислоты (0,42 г), карбоната цезия (0,86 г), ацетата палладия(II) (21 мг) и (R)-BINAP (88 мг) и толуола (3 мл) с получением указанного в подзаголовке соединения в виде масла (0,25 г).
МС (APCI+ve) 311/313 (М-ВОС)+.
(b) (+/-)-2-Хлор-5-[3-[[(1,1-диметилэтокси)карбонил]амино]-1-пирролидинил]бензойная кислота
Получение проводят, как описано в примере 5b), с использованием этилового эфира (+/-)-2-хлор-5-[3-[[(1,1-диметилэтокси)карбонил]амино]-1-пирролидинил]бензойной кислоты (пример 7а, 0,25 г), моногидрата гидроксида лития (1,36 мл 3 М раствора в воде), смеси 1:1 этанол/вода (7 мл) и тетрагидрофурана (1 мл) с получением указанного в подзаголовке соединения в виде твердого вещества (0,23 г).
МС (APCI+ve) 248/286 (M-BOC)+.
с) 1,1-Диметилэтиловый эфир (+/-)-[1-[4-хлор-3-[[(трицикло[3.3.1.13,7]дец-1-илметил)амино]карбонил]фенил]-3-пирролидинил]карбаминовой кислоты
Получение проводят, как описано в примере 5с), с использованием (+/-)-2-хлор-5-[3-[[(1,1-диметилэтокси) карбонил]амино]-1-пирролидинил]бензойной кислоты (пример 7b, 0,070 г), N,N'-карбонилдиимидазола (0,033 г), 1-адамантанметиламина (0,036 мл) и диметилформамида (3 мл) с получением указанного в подзаголовке соединения в виде смолы.
МС (APCI+ve) 487/489 (M+H)+.
d) Гидрохлоридная соль (+/-)-5-(3-амино-1-пирролидинил)-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
Получение проводят, как описано в примере 5d), с использованием 1,1-диметилэтилового эфира (+/-)-[1-[4-хлор-3-[[(трицикло[3.3.1.13,7]дец-1-илметил)амино]карбонил]фенил]-3-пирролидинил]карбаминовой кислоты (пример 7с), хлористоводородной кислоты (0,5 мл 4 н. раствора в диоксане) и метанола (5 мл). Упаривание при пониженном давлении дает твердое вещество после растирания с диэтиловым эфиром. Перекристаллизация из смеси метанол/диэтиловый эфир дает указанное в заголовке соединение в виде твердого вещества (0,030 г).
МС (APCI+ve) 388/390 (M+H)+
1Н ЯМР (ДМСО-d6) δ 8,24 (3Н, шир.с); 8,20 (1Н, т); 7,25 (1Н, д); 6,61 (1Н, дд); 6,51 (1Н, д); 3,94 (1Н, м); 3,55-3,32 (2Н, м); 3,29 (2Н, м); 2,92 (2Н, д); 2,37-2,27 (1Н, м); 2,13-2,05 (1Н, м); 1,94 (3Н, шир.с); 1,68 (3Н, д); 1,59 (3Н, д); 1,52 (6Н, с).
Пример 8
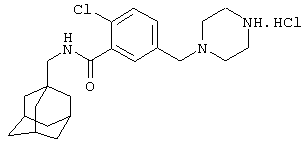
Гидрохлоридная соль 2-хлор-5-пиперазин-1-илметил-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
К перемешиваемому раствору 2-хлор-5-метилбензойной кислоты (25 г) в хлороформе (500 мл) при 50°С добавляют N-бромсукцинимид (27,40 г). Колбу продувают азотом и одной порцией добавляют азобисизобутиронитрил (0,10 г). Раствор нагревают при кипячении с обратным холодильником в течение 1 ч. Добавляют еще азобисизобутиронитрил (0,10 г) и смесь нагревают дополнительные 3 ч. Раствор концентрируют в вакууме, снова растворяют в диэтиловом эфире и фильтруют для удаления нерастворенного сукцинимида. Эфирный раствор промывают 2 н. водным раствором хлористоводородной кислоты, затем насыщенным раствором соли, затем сушат над сульфатом магния. Раствор концентрируют до объема 150 мл, затем разбавляют изогексаном. После дальнейшего частичного концентрирования начинается кристаллизация. Смесь оставляют на ледяной бане в течение 1 ч. Образовавшиеся кристаллы фильтруют, промывают изогексаном и сушат в вакууме с получением указанного в подзаголовке соединения (17 г).
b) 5-Бромметил-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид
К перемешиваемому раствору 5-бромметил-2-хлорбензойной кислоты (пример 8а, 12,4 г) в дихлорметане (250 мл) и диметилформамиде (0,12 мл) при 0°С добавляют оксалилхлорид (8,7 мл). Охлаждающую баню удаляют и раствору дают возможность нагреться до комнатной температуры. После прекращения выделения газа раствор концентрируют в вакууме. Остаток снова растворяют в дихлорметане (300 мл), охлаждают до 0°С и обрабатывают диизопропилэтиламином (12,4 мл) и адамантилметиламином (7,54 мл). Спустя 15 мин при 0°С раствор выливают в диэтиловый эфир (1 л) и промывают 1 н. водной хлористоводородной кислотой и затем насыщенным раствором соли. Органическую часть сушат над сульфатом магния и концентрируют в вакууме с получением указанного в заголовке соединения в виде белого порошка (19 г).
МС (APCI+ve) 396/398 (M+H)+
1Н ЯМР (ДМСО-d6) δ 8,39 (1Н, т); 7,50-7,40 (2Н, м); 4,74 (2Н, с); 2,92 (2Н, д); 2,50 (3Н, с); 1,94 (3Н, шир.с); 1,67 (3Н, д); 1,59 (3Н, д); 1,52 (6Н, с).
с) 2-Хлор-5-(4-[{1,1-диметилэтил}оксикарбонил]пиперазин-1-ил)метил-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид
Смесь 5-бромметил-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (пример 8b, 0,130 г), 1-трет-бутилоксикарбонилпиперазина (0,074 г) и диизопропилэтиламина (6,3 мл) в диметилформамиде (3 мл) нагревают при 60°С в течение 3 ч. Смесь разбавляют водой (10 мл) и экстрагируют этилацетатом (3 х 10 мл). Органический слой сушат над сульфатом магния, фильтруют и фильтрат концентрируют при пониженном давлении. Сырой материал очищают на силикагеле с элюированием смесью дихлорметан/этанол (градиент 0-20%) с получением указанного в заголовке соединения в виде белой пены (0,112 г).
МС (APCI+ve) ММ 502/504 (M+H)+
1Н ЯМР (ДМСО-d6) δ 8,28 (1Н, т); 7,40 (1Н, д); 7,32 (1Н, дд); 7,29 (1Н, д); 3,74 (2Н, с); 3,28 (4Н, т); 2,90 (2Н, д); 2,31 (4Н, т); 1,92 (3Н, шир.с); 1,70-1,50 (6Н, м); 1,59 (6Н, д); 1,37 (9Н, с).
d) Гидрохлоридная соль 2-хлор-5-пиперазин-1-илметил-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
2-Хлор-5-(4-[{1,1-диметилэтил}оксикарбонил]пиперазин-1-ил)метил-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид (пример 8с, 0,080 г) растворяют в метаноле (3 мл), добавляют 4 н. HCl в диоксане (1 мл) и смесь перемешивают при комнатной температуре в течение 1,5 ч. Растворитель удаляют в вакууме и образовавшееся твердое вещество растирают с эфиром с получением указанного в заголовке соединения в виде белого порошка (0,062 г).
МС (APCI+ve) ММ 402/404 (M+H)+
1Н ЯМР (ДМСО-d6) δ 8,30 (1Н, т); 7,63 (2Н, шир.с); 7,55 (1Н, д); 4,33 (1Н, шир.с); 4,05 (4Н, м); 3,50-3,00 (4Н, м); 3,50-3,40 (1Н, м); 2,92 (2Н, д); 1,92 (3Н, шир.с); 1,70-1,50 (6Н, м); 1,57 (6Н, шир.с).
В соответствии с процедурой, описанной в примере 8, получают следующие соединения.
Пример 9
Гидрохлоридная соль 2-хлор-5-[(гексагидро-1Н-1,4-диазепин-1-ил)метил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
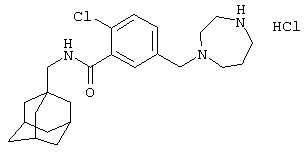
МС (APCI+ve) ММ 416/418 (M+H)+
1Н ЯМР (ДМСО-d6) δ 11,62 (шир.с, 1Н), 9,57 (шир.с, 1Н); 9,30 (шир.с, 1Н); 8,34 (1Н, т); 7,80-7,60 (2Н, м); 7,59 (1Н, д); 4,50-4,30 (шир.с, 2Н); 3,80-3,00 (м, 8Н); 2,94 (2Н, д); 2,25-2,10 (м, 2Н); 1,94 (3Н, шир.с); 1,66 (3Н, д); 1,58 (3Н, д); 1,54 (6Н, с).
Пример 10
Гидрохлоридная соль 5-[(4-амино-1-пиперидинил)метил]-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
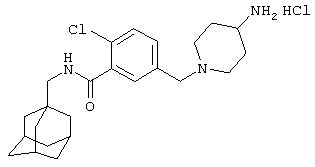
МС (APCI+ve) ММ 416/418 (M+H)+
1Н ЯМР (ДМСО-d6) δ 8,35 (1Н, т); 8,30 (2Н, шир.с); 7,66 (1Н, д); 7,65 (1Н, с); 7,59 (1Н, д); 4,28 (д, 2Н); 3,65-3,18 (м, 4Н); 3,10-2,90 (1Н, м); 2,95 (2Н, д); 2,15-2,05 (2Н, м); 2,05-1,90 (1Н, м); 1,94 (3Н, шир.с); 1,68 (3Н, д); 1,61 (3Н, д); 1,54 (6Н, с).
Пример 11
Гидрохлоридная соль 5-[(3-амино-1-пирролидинил)метил]-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
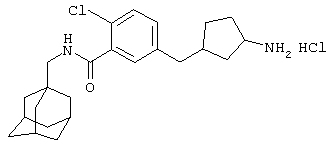
МС (APCI+ve) ММ 402/404 (M+H)+
1Н ЯМР (ДМСО-d6) δ 8,56 (1Н, шир.с); 8,42 (2Н, шир.с); 8,35 (1Н, т); 7,66 (2Н, шир.с); 7,59 (1Н, д); 4,60-4,40 (м, 2Н); 4,20-3,00 (м, 5Н); 2,94 (2Н, д); 2,35-1,95 (м, 2Н); 1,95 (3Н, шир.с); 1,68 (3Н, д); 1,61 (3Н, д); 1,54 (6Н, с).
Пример 12
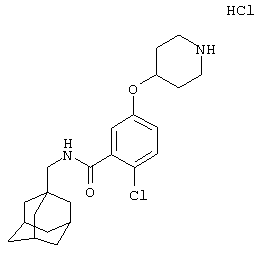
Гидрохлоридная соль 2-хлор-5-(4-пиперидинилокси)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
а) 2-Хлор-5-гидрокси-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид
К раствору 2-хлор-5-гидроксибензойной кислоты (3,12 г) в N,N-диметилформамиде (50 мл) добавляют 1,1'-карбонилдиимидазол (3,0 г). Образовавшуюся реакционную смесь перемешивают в течение 2,5 ч и затем добавляют 1-адамантанметиламин (3,0 г). Перемешивание продолжают в течение 14 ч. Реакционную смесь распределяют между этилацетатом и водой и органический слой отделяют, промывают водой и насыщенным раствором соли и затем сушат над сульфатом натрия (Na2SO4). Органический слой концентрируют при пониженном давлении с получением остатка, который очищают хроматографией на силикагеле (элюирование 3-10% метанолом в дихлорметане) с получением указанного в подзаголовке соединения в виде белого твердого вещества (0,15 г).
МС (APCI+ve) 319/321 (M+H)+
1Н ЯМР (ДМСО-d6) δ 9,85 (1Н, с), 8,25 (1Н, т), 7,24 (1Н, д), 6,76-6,82 (2Н, м), 2,90 (2Н, д), 1,93 (3Н, с), 1,67 (3Н, д), 1,57 (3Н, д), 1,51 (6Н, с).
b) Гидрохлоридная соль 2-хлор-5-(4-пиперидинилокси)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
К раствору 2-хлор-5-гидрокси-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (0,20 г, пример 12а), 1,1-диметилэтилового эфира 4-гидрокси-1-пиперидинкарбоновой кислоты (0,19 г) и трибутилфосфина (0,23 мл) в сухом тетрагидрофуране (6 мл) добавляют 1-[[(1-пиперидинилкарбонил)азо]карбонил]пиперидин (0,24 г). Оранжевый раствор нагревают при 60°С в атмосфере азота в течение 2 ч. В этой точке добавляют дополнительный 1,1-диметилэтиловый эфир 4-гидрокси-1-пиперидинкарбоновой кислоты (0,19 г), трибутилфосфин (0,23 мл) и 1-[[(1-пиперидинилкарбонил)азо]карбонил]пиперидин (0,24 г). Нагревание продолжают и процедуру, описанную выше, повторяют до завершения реакции по данным ЖХ/МС. Охлажденную реакционную смесь разбавляют диэтиловым эфиром, затем фильтруют. Фильтрат концентрируют и очищают ВЭЖХ с нормальной фазой (0-2% метанол/дихлорметан) и затем хроматографией на силикагеле (0-2% метанол/дихлорметан) с получением трет-бутилоксикарбонил (ВОС)-защищенного соединения в виде бесцветной пены. Пену растворяют в метаноле (5 мл) и добавляют 4 н. хлористоводородную кислоту в диоксане (0,25 мл). Раствор перемешивают при комнатной температуре в атмосфере азота до завершения реакции по данным ЖХ/МС. Выпаривание растворителя с последующим растиранием с диэтиловым эфиром дает указанное в заголовке соединение в виде бесцветного твердого вещества (0,15 г).
МС (APCI+ve) 417/419 (M+H)+
1Н ЯМР (ДМСО-d6) δ 8,65 (2Н, шир.с); 8,30 (1Н, т); 7,39 (1Н, д); 7,07 (1Н, дд); 6,99 (1Н, д); 4,72-4,67 (1Н, м); 3,21 (2Н, шир.м); 3,07 (2Н, шир.м); 2,92 (2Н, д); 2,12-2,07 (2Н, м); 1,94 (3Н, шир.с); 1,88-1,80 (2Н, м); 1,67 (3Н, д); 1,59 (3Н, д); 1,52 (6Н, с).
Пример 13
Гидрохлоридная соль (R)-2-хлор-5-(пирролидинилметокси)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
Получение проводят, как описано в примере 12b, с использованием 2-хлор-5-гидрокси-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (0,20 г, пример 12а), N-трет-ВОС-D-пролинола (0,19 г) и трибутилфосфина (0,23 мл), сухого тетрагидрофурана (6 мл) и 1-[[(1-пиперидинилкарбонил)азо]карбонил]пиперидина (0,24 г) с получением бутилоксикарбонил(ВОС)-защищенного соединения с последующей обработкой 4 н. хлористоводородной кислотой в диоксане (0,4 мл) и метанолом (5 мл) с получением указанного в заголовке соединения в виде бесцветного твердого вещества (0,14 г).
МС (APCI+ve) 403/405 (M+H)+
1Н ЯМР (CD3OD) δ 8,45 (1Н, шир.т); 7,46 (1Н, д); 7,14-7,10 (2Н, м); 4,41 (1Н, дд); 4,18 (1Н, т); 4,10-4,04 (1Н, м); 3,41 (2Н, т); 3,10 (2Н, м); 2,36-2,28 (1Н, м); 2,25-2,08 (2Н, д); 2,03 (3Н, с); 2,00-1,90 (1Н, м); 1,83 (3Н, м); 1,74 (3Н, д); 1,68 (6Н, с).
Пример 14
Гидрохлоридная соль (S)-2-хлор-5-(2-пирролидинилметокси)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида

Получение проводят, как описано в примере 12b, с использованием 2-хлор-5-гидрокси-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (0,20 г, пример 12а), N-трет-ВОС-L-пролинола (0,19 г) и трибутилфосфина (0,23 мл), сухого тетрагидрофурана (6 мл) и 1-[[(1-пиперидинилкарбонил)азо]карбонил]пиперидина (0,24 г) с получением трет-бутилоксикарбонил(ВОС)-защищенного соединения и последующей обработкой 4 н. хлористоводородной кислотой в диоксане (0,5 мл) и метанолом (5 мл) с получением указанного в заголовке соединения в виде бесцветного твердого вещества (0,07 г).
МС (APCI+ve) 403/405 (M+H)+
1Н ЯМР (CD3OD) δ 8,45 (1Н, шир.т); 7,46 (1Н, д); 7,14-7,10 (2Н, м); 4,41 (1Н, дд); 4,18 (1Н, т); 4,10-4,04 (1Н, м); 3,41 (2Н, т); 3,10 (2Н, м); 2,36-2,28 (1Н, м); 2,25-2,08 (2Н, д); 2,03 (3Н, с); 2,00-1,90 (1Н, м); 1,83 (3Н, м); 1,74 (3Н, д); 1,68 (6Н, с).
Пример 15
Гидрохлоридная соль 2-хлор-5-(3-пиперидинилметокси)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
Получение проводят, как описано в примере 12b, с использованием 2-хлор-5-гидрокси-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (0,20 г, пример 12а), 3-пиперидинметанола (0,20 г) и трибутилфосфина (0,23 мл), сухого тетрагидрофурана (6 мл) и 1-[[(1-пиперидинилкарбонил)азо]карбонил]пиперидина (0,24 г) с получением трет-бутилоксикарбонил(ВОС)-защищенного соединения. Данное соединение обрабатывают 4 н. хлористоводородной кислотой в диоксане (0,5 мл) и метанолом (5 мл) с получением указанного в заголовке соединения в виде бесцветного твердого вещества (0,09 г).
МС (APCI+ve) 417/19 (M+H)+
1Н ЯМР (ДМСО-d6) δ 8,34 (2Н, шир.с); 8,29 (1Н, т); 7,38 (1Н, д); 7,01 (1Н, дд); 6,93 (1Н, д); 3,99-3,95 (1Н, м); 3,91-3,87 (1Н, м); 3,34 (1Н, м); 3,23 (1Н, шир.д); 2,92 (2Н, д); 2,82-2,71 (2Н, м); 2,22 (1Н, м); 1,94 (3Н, с); 1,82 (2Н, д); 1,72-1,66 (4Н, м); 1,59 (3Н, д); 1,52 (6Н, с); 1,39-1,32 (1Н, м).
Пример 16
Гидрохлоридная соль цис-5-[(4-аминоциклогексил)окси]-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
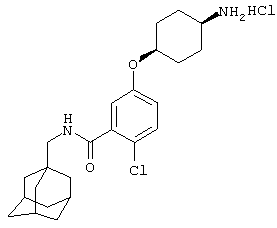
Получение проводят, как описано в примере 12b, с использованием 2-хлор-5-гидрокси-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (0,20 г, пример 12а), транс-4-аминоциклогексанола (0,20 г) и трибутилфосфина (0,23 мл), сухого тетрагидрофурана (6 мл) и 1-[[(1-пиперидинилкарбонил)азо]карбонил]пиперидина (0,24 г) с получением трет-бутилоксикарбонил(ВОС)-защищенного соединения. Данное соединение обрабатывают 4 н. хлористоводородной кислотой в диоксане (0,5 мл) и метанолом (5 мл) с получением указанного в заголовке соединения в виде бесцветного твердого вещества (0,065 г).
МС (APCI+ve) 417/19 ВР 417
1Н ЯМР (ДМСО-d6) δ 8,30 (1Н, т); 7,97 (3Н, шир.с); 7,38 (1Н, д); 7,02 (1Н, дд); 6,92 (1Н, д); 4,62 (1Н, шир.с); 3,11 (1Н, шир.с); 2,92 (2Н, д); 1,94 (5Н, с); 1,76-1,58 (12Н, м); 1,52 (6Н, с).
Пример 17
Гидрохлоридная соль 2-метил-5-(1-пиперазинилметил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
К раствору 2-бром-5-(4-[{1,1-диметилэтил}окси-карбонил]пиперазин-1-ил)метил-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (0,20 г, пример 65b) и тетракис(трифенилфосфин)палладия(0) (2 мг) в сухом толуоле (6 мл) добавляют тетраметилолово (0,2 мл). Раствор нагревают при 130°С в запаянной трубке в течение 18 час. Охлажденную реакционную смесь упаривают и остаток обрабатывают 10% раствором KF в ацетоне и перемешивают в течение 45 мин. Смесь концентрируют и хроматографируют на силикагеле (изогексан, затем смесь 60% этилацетата/40% изогексана) с получением трет-бутилоксикарбонил(ВОС)-защищенного соединения в виде бесцветного масла. Масло растворяют в метаноле (2 мл) и добавляют 4 н. хлористоводородную кислоту в диоксане (1 мл). Раствор перемешивают при комнатной температуре в атмосфере азота до завершения реакции по данным ЖХ/МС. Выпаривание растворителя с последующим растиранием с диэтиловым эфиром дает указанное в заголовке соединение в виде бесцветного твердого вещества (0,03 г).
МС (APCI+ve) 382 (M+H)+
1Н ЯМР (CD3OD) δ 7,61 (1Н, с); 7,55 (1Н, д); 7,39 (1Н, д); 4,45 (2Н, с); 3,67-3,46 (8Н, шир.м); 3,08 (2Н, с); 2,45 (3Н, с); 1,99 (3Н, с); 1,78 (3Н, д); 1,71 (3Н, д); 1,62 (6Н, с).
Пример 18
Гидрохлоридная соль 2-хлор-5-(1-пиперазинилметил)-N-(2-трицикло[3.3.1.13,7]дец-1-илэтил)бензамида
а) 5-(Бромметил)-2-хлор-N-(2-трицикло[3.3.1.13,7]дец-1-илэтил)бензамид
К раствору 2-хлор-5-(бромметил)бензойной кислоты (1,0 г) в дихлорметане (25 мл) при 0°С добавляют диметилформамид (0,05 мл) и затем оксалилхлорид (0,52 мл). Реакционной смеси дают возможность нагреться до комнатной температуры и перемешивают в течение 30 мин. Летучие компоненты удаляют в вакууме и остаток сушат в высоком вакууме. Ацилхлорид растворяют в дихлорметане (20 мл) и добавляют к раствору гидрохлоридной соли 2-адамантанэтиламина (0,95 г) в дихлорметане (20 мл) и диизопропилэтиламине (2 мл) при 0°С. Реакционной смеси дают возможность нагреться до комнатной температуры и перемешивают в течение 2 ч. Органическую часть промывают водой (20 мл), затем насыщенным водным раствором хлорида аммония и органический слой сушат над сульфатом магния, затем фильтруют. Фильтрат концентрируют при пониженном давлении до получения твердого вещества. Сырой материал перекристаллизовывают из смеси дихлорметан/гексан с получением указанного в подзаголовке соединения в виде белого твердого вещества (1,3 г).
b) 1,1-Диметилэтиловый эфир 4-[[4-хлор-3-[[(2-трицикло[3.3.1.13,7]дец-1-илэтил)амино]карбонил]фенил]метил]-1-пиперазинкарбоновой кислоты
Смесь 5-(бромметил)-2-хлор-N-(2-трицикло[3.3.1.13,7]дец-1-илэтил)бензамида (пример 18а, 0,35 г), 1-трет-бутилоксикарбонилпиперазина (0,213 г), карбоната калия (0,20 г) и иодида калия (10 г) в ацетоне (5 мл) нагревают при 60°С в течение 2 ч. Ацетон удаляют в вакууме, остаток растворяют в дихлорметане и твердое вещество удаляют фильтрованием. Сырой материал очищают на силикагеле с элюированием смесью дихлорметан/этанол (градиент 0-10%) с получением указанного в подзаголовке соединения в виде белой пены (0,383 г).
МС (APCI+ve) ММ 516/518 (M+H)+
1Н ЯМР (CDCl3) δ 7,63 (1Н, шир.с); 7,34 (2Н, шир.с); 6,09 (1Н, шир.с); 3,60-3,30 (8Н, м); 2,50-2,30 (4Н, шир.с); 1,97 (3Н, шир.с); 1,72 (3Н, д); 1,68 (3Н, д); 1,56 (6Н, шир.с); 1,44 (9Н, с); 1,50-1,35 (2Н, м).
c) Гидрохлоридная соль 2-хлор-5-(1-пиперазинилметил)-N-(2-трицикло[3.3.1.13,7]дец-1-илэтил)бензамида
1,1-Диметилэтиловый эфир 4-[[4-хлор-3-[[(2-трицикло[3.3.1.13,7]дец-1-илэтил)амино]карбонил]фенил]метил]-1-пиперазинкарбоновой кислоты (пример 18b, 0,270 г) растворяют в метаноле (3 мл), добавляют 4 н. HCl в диоксане (2 мл) и смесь перемешивают в течение 14 ч при комнатной температуре. Растворитель удаляют в вакууме и образовавшееся твердое вещество растирают с эфиром с получением указанного в заголовке соединения в виде белого порошка (0,207 г).
МС (APCI+ve) ММ 416/418 (M+H)+
1Н ЯМР (CD3OD) δ 7,69 (1Н, с); 7,66 (1Н, д); 7,60 (1Н, д); 4,86 (2Н, с); 3,70-3,50 (8Н, м); 3,50-3,35 (2Н, м); 1,98 (3Н, шир.с); 1,78 (3Н, д); 1,70 (3Н, д); 1,62 (6Н, шир.с); 1,50-1,35 (2Н, м).
Пример 19
Гидрохлоридная соль (+/-)-2-хлор-5-(3-пирролидинилокси)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
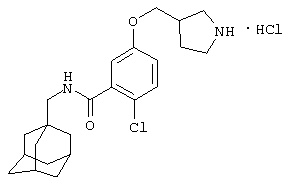
Получение проводят, как описано в примере 12b, с использованием 2-хлор-5-гидрокси-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (0,155 г, пример 12а), трибутилфосфина (0,23 мл) 1,1-диметилэтилового эфира (+/-)-3-гидрокси-1-пирролидинкарбоновой кислоты (0,19 г), 1-[[(1-пиперидинилкарбонил)азо]карбонил]пиперидина (0,24 г) и сухого тетрагидрофурана (10 мл) с получением трет-бутилоксикарбонил(ВОС)-защищенного соединения в виде бесцветной пены. Данное соединение обрабатывают 4 н. хлористоводородной кислотой в диоксане (0,5 мл) и метанолом (5 мл) с получением указанного в заголовке соединения в виде бесцветного твердого вещества (0,075 г).
МС (APCI+ve) 389/391 (M+H)+
1Н ЯМР (CD3OD) δ 8,42 (1Н, шир.т); 7,42 (1Н, д); 7,09-7,03 (2Н, м); 5,23 (1Н, шир.м); 3,59-3,41 (4Н, м); 3,07 (2Н, д); 2,36-2,30 (2Н, м); 1,99 (3Н, шир.с); 1,79 (3Н, д); 1,70 (3Н, д); 1,63 (6Н, д).
Пример 20
Гидрохлоридная соль (+/-)-2-хлор-5-(3-пиперидинилокси)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
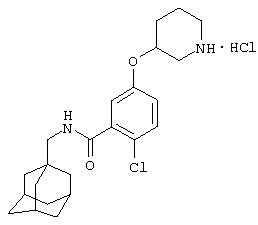
Получение проводят, как описано в примере 12b, с использованием 2-хлор-5-гидрокси-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (0,15 г, пример 12а), трибутилфосфина (2×0,18 мл), 1,1-диметилэтилового эфира 3-гидрокси-1-пиперидинкарбоновой кислоты (2×0,14 г), 1-[[(1-пиперидинилкарбонил)азо]карбонил]пиперидина (2×0,18 г) и сухого тетрагидрофурана (6 мл) с получением трет-бутилоксикарбонил(ВОС)-защищенного соединения в виде бесцветной пены. Данное соединение обрабатывают 4 н. хлористоводородной кислотой в диоксане (0,25 мл) и метанолом (5 мл) с получением указанного в заголовке соединения в виде бесцветной пены (0,042 г).
МС (APCI+ve) 403/405 (M+H)+
1Н ЯМР (CD3OD) δ 8,42 (1Н, т); 7,41 (1Н, д); 7,14-7,10 (2Н, м); 4,82 (1Н, шир.м); 3,51-3,39 (1Н, м); 3,38 (2Н, м); 3,20-3,17 (1Н, м); 3,06 (2Н, д); 2,10-2,04 (2Н, м); 2,00 (3Н, шир.с); 1,94-1,89 (1Н, м); 1,84-1,68 (7Н, д); 1,64 (6Н, д).
Пример 21
транс-5-[(4-Аминоциклогексил)окси)-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид
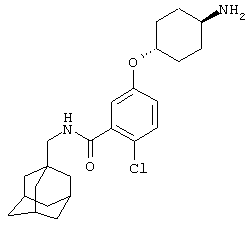
Получение проводят, как описано в примере 12b, с использованием 2-хлор-5-гидрокси-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (0,15 г, пример 12а), трибутилфосфина (3×0,18 мл), 1,1-диметилэтилового эфира цис-4-(гидроксициклогексил)карбаминовой кислоты (3×0,15 г), 1-[[(1-пиперидинилкарбонил)азо]карбонил]пиперидина (3×0,18 г) и сухого тетрагидрофурана (6 мл) с получением трет-бутилоксикарбонил(ВОС)-защищенного соединения в виде бесцветной пены. Данное соединение обрабатывают 4 н. хлористоводородной кислотой в диоксане (0,5 мл) и метанолом (3 мл) с получением указанного в заголовке соединения в виде бесцветной пены (0,080 г).
МС (APCI+ve) 417/419 (M+H)+
1Н ЯМР (CD3OD) δ 8,38 (1Н, т); 7,34 (1Н, д); 6,98 (1Н, дд); 6,96 (1Н, д); 4,30 (1Н, м); 3,17 (1Н, м); 3,04 (2Н, д); 2,22 (2Н, шир.м); 2,09 (2Н, м); 1,98 (3Н, шир.с); 1,77 (3Н, д); 1,68 (3Н, д); 1,62 (6Н, с); 1,55 (4Н, м).
Пример 22
цис-(+/-)-5-[(3-Аминоциклопентил)окси]-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид
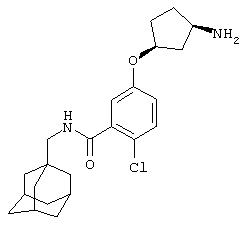
Получение проводят, как описано в примере 12b, с использованием 2-хлор-5-гидрокси-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (0,20 г, пример 12а), трибутилфосфина (0,24 мл), 1,1-диметилэтилового эфира транс-(+/-)-(3-гидроксициклопентил)карбаминовой кислоты (0,19 г), 1-[[(1-пиперидинилкарбонил)азо]карбонил]пиперидина (0,24 г) и сухого тетрагидрофурана (3 мл) с получением трет-бутилоксикарбонил(ВОС)-защищенного соединения в виде бесцветной пены. Данное соединение обрабатывают 4 н. хлористоводородной кислотой в диоксане (0,5 мл) и метанолом (5 мл) с получением указанного в заголовке соединения в виде бесцветной пены (0,15 г).
МС (APCI+ve) 403/405 (M+H)+
1Н ЯМР (CD3OD) δ 7,36 (1Н, д); 7,02-6,98 (2Н, м); 4,94-4,90 (1Н, м); 3,75-3,68 (1Н, м); 3,04 (2Н, с); 2,55 (1Н, м); 2,24-2,17 (1Н, м); 2,09-2,03 (2Н, м); 1,98-1,86 (5Н, м); 1,76 (3Н, д); 1,68 (3Н, д); 1,62 (6Н, д).
Пример 23
Гидрохлоридная соль (S,S)-2-хлор-5-(2,5-диазабицикло[2.2.1]гепт-2-ил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
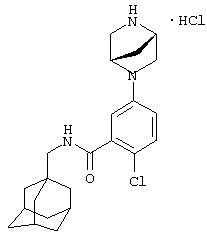
а) 5-Бром-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид
Получают, как в примере 1а, из 5-бром-2-хлорбензойной кислоты (7,17 г), оксалилхлорида (5,3 мл), дихлорметана (150 мл), диметилформамида (0,05 мл), диизопропилэтиламина (6 мл) и адамантилметиламина (5 мл) с получением указанного в подзаголовке соединения в виде белых бесцветных игл (7,3 г).
МС (APCI-ve) 382/384 (М-Н)+
b) Гидрохлоридная соль (S,S)-2-хлор-5-(2,5-диазабицикло[2.2.1]гепт-2-ил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
Смесь 5-бром-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (1,70 г, пример 23а), 1,1-диметилэтилового эфира 2,5-диазабицикло[2.2,1]гептан-2-карбоновой кислоты (1,06 г), карбоната цезия (2,20 г), (R)-(+)-2,2'-бис(дифенилфосфино)-1,1'-бинафтил((R)-(+)-BINAP, 0,20 г) и ацетата палладия(II) (0,050 г) в сухом толуоле (10 мл) нагревают при 100°С в атмосфере азота в течение 24 ч. Охлажденную реакционную смесь фильтруют, промывая остаток этилацетатом. Фильтрат промывают водой и насыщенным раствором соли, сушат (MgSO4) и упаривают при пониженном давлении с получением оранжевого масла. Масло очищают хроматографией на силикагеле с элюированием раствором 0,5% метанол/дихлорметан с получением трет-бутилоксикарбонил(ВОС)-защищенного соединения в виде бесцветной пены. Пену растворяют в метаноле (20 мл) и добавляют 4 н. хлористоводородную кислоту в диоксане (2,5 мл). Раствор перемешивают при комнатной температуре до завершения реакции (ЖХ/МС). Раствор затем упаривают при пониженном давлении и остаток растирают с диэтиловым эфиром с получением указанного в заголовке соединения в виде не совсем белого твердого вещества (0,92 г).
МС (APCI+ve) 400/402 (M+H)+
1Н ЯМР (CD3OD) δ 8,32 (1Н, т); 7,30 (1Н, д); 6,77-3,70 (2Н, м); 4,69 (1Н, с); 4,50 (1Н, с); 3,73 (1Н, дд); 3,67 (2Н, с); 3,06 (2Н, д); 2,30 (1Н, шир.д); 2,06 (1Н, шир.д); 1,99 (3Н, шир.с); 1,78 (3Н, д); 1,70 (3Н, д); 1,64 (3Н, с); 1,55 (4Н, м). Пик метанола экранирует другой 1Н-сигнал.
Пример 24
Гидрохлоридная соль 2-хлор-5-(2-метил-1-пиперазинил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
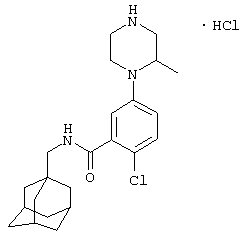
Получение проводят, как описано в приведенном выше примере 23, из 5-бром-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (0,30 г, пример 23а), 1,1-диметилэтилового эфира 3-метил-1-пиперазинкарбоновой кислоты (0,20 г), карбоната цезия (0,36 г), (R)-(+)-2,2'-бис(дифенилфосфино)-1,1'-бинафтила ((R)-(+)-BINAP, 0,036 г), ацетата палладия(II) (0,009 г) и сухого толуола (10 мл) с получением трет-бутилоксикарбонил(ВОС)-защищенного соединения. Данное соединение обрабатывают 4 н. хлористоводородной кислотой в диоксане (0,5 мл) и метанолом (5 мл) с получением указанного в заголовке соединения в виде твердого вещества (0,025 г).
МС (APCI+ve) 402/404 (M-HCl)+
1Н ЯМР (CD3OD) δ 8,40 (1Н, т); 7,37 (1Н, д); 7,11 (1Н, дд); 7,07 (1Н, д); 4,00-3,96 (1Н, м); 3,43-3,39 (3Н, м); 3,28-3,19 (3Н, м); 3,06 (2Н, д); 1,98 (3Н, шир.с); 1,77 (3Н, д); 1,70 (3Н, д); 1,63 (6Н, с); 1,10 (3Н, д).
Пример 25
Гидрохлоридная соль (+/-)-2-хлор-5-(3-пирролидиниламино)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
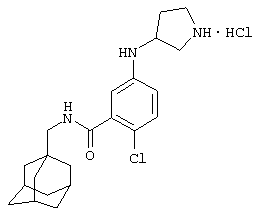
Получение проводят, как описано в приведенном выше примере 23, из 5-бром-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (0,30 г, пример 23а), 1,1-диметилэтилового эфира 3-амино-1-пирролидинкарбоновой кислоты (0,18 г), карбоната цезия (0,36 г), (R)-BINAP (0,036 г), безводного толуола (3 мл) и ацетата палладия(II) (0,009 г); смесь нагревают в течение 14 ч в автоклаве, продутом азотом. Добавляют дополнительные количества (R)-BINAP (0,036 г) и ацетата палладия(II) (0,009 г) и нагревание продолжают в течение дополнительных 24 ч. Охлажденную реакционную смесь выливают в воду и экстрагируют три раза этилацетатом. Органические фракции объединяют и промывают водой, затем насыщенным раствором соли и сушат (MgSO4). Упаривание при пониженном давлении дает масло, которое очищают ВЭЖХ с нормальной фазой (0-5% метанол/дихлорметан) с получением трет-бутилоксикарбонил(ВОС)-защищенного соединения в виде бесцветной пены. Пену растворят в метаноле (5 мл) и добавляют 4 н. хлористоводородную кислоту в диоксане (0,5 мл). Раствор перемешивают при комнатной температуре в атмосфере азота до завершения реакции по данным ЖХ/МС. Упаривание с последующим растиранием с диэтиловым эфиром и метанолом дает указанное в заголовке соединение в виде не совсем белого твердого вещества/пены (0,040 г).
МС (APCI+ve) 388/390 (M-HCl)+
1Н ЯМР (CD3OD) δ 8,20 (1Н, шир.т); 7,12 (1Н, д); 6,63-6,60 (2Н, м); 4,76-4,08 (1Н, м); 3,43-3,38 (2Н, м); 3,35-3,28 (1Н, м); 3,25 (1Н, м); 2,94 (2Н, с); 2,31-2,22 (1Н, м); 2,01-1,94 (1Н, м); 1,89 (3Н, шир.с); 1,67 (3Н, д); 1,60 (3Н, д); 1,53 (6Н, с).
Пример 26
(+/-)-5-(3-Амино-1-пиперидинил)-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид
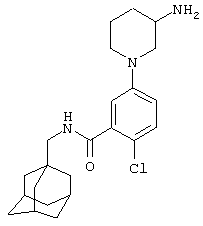
Получение проводят, как описано в приведенном выше примере 23, из 5-бром-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (0,20 г, пример 23а), 1,1-диметилэтилового эфира 3-пиперидинилкарбаминовой кислоты (0,12 г), карбоната цезия (0,24 г), (R)-(+)-2,2'-бис(дифенилфосфино)-1,1'-бинафтила ((R)-(+)-BINAP, 0,024 г), ацетата палладия(II) (0,006 г) и сухого толуола (3 мл) с получением трет-бутоксикарбонил(ВОС)-защищенного соединения. трет-Бутоксикарбонил(ВОС)-защищенное соединение растворяют в метаноле (5 мл) и хлористоводородной кислоте (0,5 мл 4 н. раствора в диоксане). После перемешивания при комнатной температуре в течение 24 ч смесь упаривают и остаток распределяют между этилацетатом и насыщенным бикарбонатом натрия. Слои разделяют и водную фазу подкисляют 2 М хлористоводородной кислотой и экстрагируют этилацетатом. Органическую фазу сушат над сульфатом магния и затем упаривают при пониженном давлении с получением смолы. Очистка хроматографией на силикагеле с элюированием 4-10% метанолом в смеси дихлорметан/водный аммиак дает указанное в заголовке соединение в виде твердого вещества (0,036 г).
МС (APCI+ve) 402/404 (M+H)+
1Н ЯМР (CD3OD) δ 7,25 (1Н, д); 7,00 (1Н, дд); 6,96 (1Н, д); 3,59 (1Н, дд); 3,48-3,45 (1Н, м); 3,04 (2Н, д); 2,91-2,85 (1Н, м); 2,82-2,75 (1Н, м); 2,58 (1Н, дд); 1,98-1,93 (4Н, м); 1,85-1,75 (3Н, д); 1,70-1,62 (10Н, д); 1,34-1,25 (1Н, д).
Пример 27
(+/-)-2-Хлор-5-(3-пиперидиниламино)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид
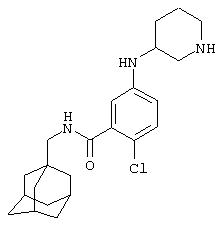
Получение проводят, как описано в приведенном выше примере 23, из 5-бром-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (0,30 г, пример 23а), 1,1-диметилэтилового эфира 3-амино-1-пиперидинкарбоновой кислоты (0,19 г), карбоната цезия (0,36 г), (R)-(+)-2,2'-бис(дифенилфосфино)-1,1'-бинафтила ((R)-(+)-BINAP, 0,036 г), ацетата палладия(II) (0,008 г) и сухого толуола (3 мл) с получением трет-бутилоксикарбонил(ВОС)-защищенного соединения. Данное соединение обрабатывают метанолом (5 мл) и хлористоводородной кислотой (0,5 мл 4 М раствора в диоксане) с последующей обработкой кислотой/основанием. Очистка хроматографией на силикагеле с элюированием 4-10% метанолом в смеси дихлорметан/водный аммиак дает указанное в заголовке соединение в виде твердого вещества (0,008 г).
МС (APCI+ve) 402/404 (M+H)+
1Н ЯМР (CD3OD) δ 7,14 (1Н, д); 6,68-6,65 (2Н, м); 3,47-3,40 (1Н, м); 3,25 (1Н, м); 3,05-3,02 (3Н, м); 2,72-2,65 (1Н, м); 2,52-2,47 (1Н, м); 2,08-2,04 (1Н, м); 1,97 (3Н, шир.с); 1,89-1,82 (1Н, м); 1,77 (3Н, д); 1,70-1,62 (10Н, д); 1,50-1,40 (1Н, м).
Пример 28
2-Хлор-5-[гексагидропирроло[3,4-c]пиррол-2(1Н)-ил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид
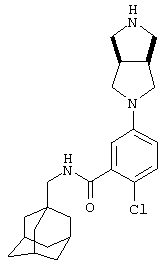
Получение проводят, как описано в приведенном выше примере 23, из 5-бром-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (0,15 г, пример 23а), 1,1-диметилэтилового эфира гексагидропирроло[3,4-c]пиррол-2(1Н)-карбоновой кислоты (0,17 г), карбоната цезия (0,33 г), (R)-(+)-2,2'-бис(дифенилфосфино)-1,1'-бинафтила ((R)-(+)-BINAP, 0,018 г), ацетата палладия(II) (0,004 г) и сухого толуола (2 мл) с получением трет-бутилоксикарбонил(ВОС)-защищенного соединения. Данное соединение обрабатывают метанолом (5 мл) и хлористоводородной кислотой (0,5 мл 4 М раствора в диоксане) с последующей обработкой кислотой/основанием. Растирание остатка с дихлорметаном дает указанное в заголовке соединение в виде твердого вещества (0,020 г).
МС (APCI+ve) 414/416 (M+H)+
1Н ЯМР (CD3OD) δ 8,17 (1Н, т); 7,20 (1Н, д); 6,63 (1Н, дд); 6,54 (1Н, д); 3,36 (2Н, м); 3,02 (2Н, дд); 2,95-2,90 (4Н, м); 2,80 (2Н, м); 2,60 (2Н, дд); 1,94 (3Н, шир.с); 1,67 (3Н, д); 1,59 (3Н, д); 1,52 (6Н, д).
Пример 29
Гидрохлоридная соль N-[2-метил-5-(4-пиперидинилокси)фенил]трицикло[3.3.1.13,7]декан-1-ацетамида
Получение проводят, как описано в примере 12b, с использованием N-(5-гидрокси-2-метилфенил)трицикло[3.3.1.13,7]декан-1-ацетамида (0,51 г, пример 12, WO 99/29660), трибутилфосфина (0,64 мл), 1-[[(1-пиперидинилкарбонил)азо]карбонил]пиперидина (0,65 г), 1,1-диметилэтилового эфира 4-гидрокси-1-пиперидинкарбоновой кислоты (0,52 г) и сухого тетрагидрофурана (10 мл) с получением трет-бутоксикарбонил(ВОС)-защищенного соединения в виде бесцветного твердого вещества. Данное соединение обрабатывают 4 н. хлористоводородной кислотой в диоксане (0,5 мл) и метанолом (5 мл) с получением указанного в заголовке соединения в виде бесцветного твердого вещества (0,13 г).
МС (APCI+ve) 383 (M-HCl)+
1Н ЯМР (CD3OD) δ 7,19 (1Н, д); 7,12 (1Н, д); 6,83 (1Н, дд); 4,71-4,66 (1Н, м); 3,46-3,40 (2Н, м); 3,28-3,22 (2Н, м); 2,25 (3Н, с); 2,21 (1Н, с); 2,21-2,14 (2Н, м); 2,11-2,04 (5Н, м); 1,84-1,73 (12Н, м).
Пример 30
Гидрохлоридная соль N-[2-хлор-5-(4-пиперидинилокси)фенил]трицикло[3.3.1.13,7]декан-1-ацетамида
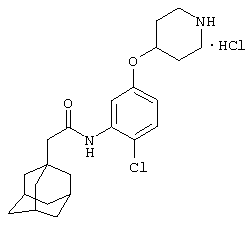
Получение проводят, как описано в примере 12b, с использованием N-(2-хлор-5-гидроксифенил)трицикло[3.3.1.13,7]декан-1-ацетамида (0,25 г, пример 28, WO 99/29660), трибутилфосфина (0,29 мл), 1-[[(1-пиперидинилкарбонил)азо]карбонил]пиперидина (0,30 г), 1,1-диметилэтилового эфира 4-гидрокси-1-пиперидинкарбоновой кислоты (0,24 г) и сухого тетрагидрофурана (10 мл) с получением трет-бутилоксикарбонил(ВОС)-защищенного соединения в виде бесцветного твердого вещества. Данное соединение обрабатывают 4 н. хлористоводородной кислотой в диоксане (1 мл) и метанолом (20 мл) с получением указанного в заголовке соединения в виде бесцветного твердого вещества (0,08 г).
МС (APCI+ve) 375/377 (M-HCl)+
1Н ЯМР (CD3OD) δ 7,55 (1Н, д); 7,41 (1Н, д); 6,88 (1Н, дд); 4,76-4,70 (1Н, м); 3,48-3,39 (2Н, м); 3,30-3,22 (2Н, м); 2,25 (2Н, с); 2,22-2,16 (2Н, м); 2,14-2,03 (2Н, м); 1,84-1,72 (12Н, м).
Пример 31
Дигидрохлоридная соль 2-хлор-5-[(4-пиперидинил-амино)метил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
а) 2-Хлор-5-формил-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид
Раствор 5-бром-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (3,25 г, пример 23а) в безводном тетрагидрофуране (150 мл) охлаждают до -78°С в атмосфере азота. На протяжении 2 мин добавляют раствор метиллития (1,4 М в диэтиловом эфире, 6,1 мл). Смесь перемешивают при -78°С в течение 10 мин, затем по каплям добавляют раствор трет-бутиллития (1,7 М в пентане, 10,0 мл). Смесь перемешивают при -78°С в течение дополнительных 10 мин, затем добавляют диметилформамид (1,0 мл). Образовавшийся раствор перемешивают при -78°С в течение 30 мин, гасят насыщенным водным раствором хлорида аммония (100 мл) и экстрагируют этилацетатом. Объединенные экстракты сушат над безводным сульфатом магния, фильтруют и фильтрат концентрируют при пониженном давлении с получением указанного в подзаголовке соединения в виде твердого вещества (2,76 г).
МС (APCI+ve) 332 (M+H)+
1Н ЯМР (ДМСО-d6) δ 10,04 (1Н, с); 8,49 (1Н, т); 7,96-7,91 (2Н, м); 7,74 (1Н, д); 2,96 (2Н, д); 1,95 (3Н, с); 1,64 (6Н, АВ); 1,53 (6Н, д).
b) 1,1-Диметилэтиловый эфир 4-[[[4-хлор-3-[[(трицикло[3.3.1.13,7]дец-1-илметил)амино]карбонил]фенил]метил]амино]-1-пиперидинкарбоновой кислоты
2-Хлор-5-формил-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид (0,270 г, пример 31а) и 1,1-диметилэтиловый эфир 3-амино-1-пирролидинкарбоновой кислоты (0,325 г, Journal of Medicinal Chemistry, 1998, 41(22), 4273-4278) растворяют в 1,2-дихлорэтане (30 мл) в атмосфере азота. Добавляют триацетоксиборогидрид натрия (0,24 г) и смесь перемешивают в течение 14 ч при комнатной температуре. Добавляют воду и дихлорметан и слои разделяют. Органические экстракты сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток очищают ВЭЖХ с элюированием с градиентом 0-10% этанола в дихлорметане, затем хроматографией на силикагеле с элюированием смесью этилацетат:изогексан (1:1), затем смесью этилацетат:этанол (98:2) с получением указанного в подзаголовке соединения в виде бесцветного масла (0,158 г).
МС (APCI+ve) 516 (М+Н)+
с) Дигидрохлоридная соль 2-хлор-5-[(4-пиперидиниламино)метил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
Получение проводят из 1,1-диметилэтилового эфира 4-[[[4-хлор-3-[[(трицикло[3.3.1.13,7]дец-1-илметил)амино]карбонил]фенил] метил]амино]-1-пиперидинкарбоновой кислоты (0,158 г, пример 31b), метанола (3 мл) и 4 н. раствора хлористоводородной кислоты в диоксане (2 мл). Растворители удаляют при пониженном давлении и остаток растирают с этилацетатом, изогексаном и диэтиловым эфиром с получением указанного в заголовке соединения в виде белого твердого вещества (0,126 г).
МС (APCI+ve) 416 (M+Н-2HCl)+
1Н ЯМР (CD3OD) δ 8,47 (1Н, т); 7,62-7,56 (3Н, м); 4,33 (2Н, с); 3,58-3,55 (3Н, м); 3,12 (2Н, т); 3,07 (2Н, д); 2,44 (2Н, д); 2,03-1,92 (5Н, м); 1,73 (6Н, кв); 1,63 (6Н, д).
Пример 32
Дигидрохлоридная соль 5-[[[4-(аминометил)циклогексил]амино]метил]-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
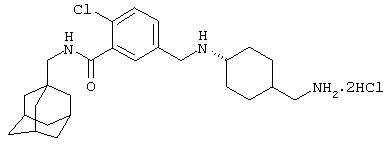
а) 1,1-Диметилэтиловый эфир [[4-[[[4-хлор-3-[[(трицикло[3.3.1.13,7]дец-1-илметил)амино]карбонил]фенил]метил] амино]циклогексил]метил]карбаминовой кислоты
Получение проводят по способу, описанному в примере 31b, из 2-хлор-5-формил-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (0,30 г, пример 31а) и 1,1-диметилэтилового эфира [(4-аминоциклогексил)метил]карбаминовой кислоты (0,207 г, WO 97/32882), триацетоксиборогидрида натрия (0,135 г) и 1,2-дихлорэтана (10 мл). Остаток очищают хроматографией на силикагеле с элюированием смесью этилацетат:изогексан (1:1), затем этилацетат:этанол (9:1) с получением указанного в подзаголовке соединения в виде бесцветного масла (0,26 г).
МС (APCI+ve) 544 (M+H)+
b) Дигидрохлоридная соль 5-[[[4-аминометил)циклогексил]амино]метил]-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
Получение проводят из 1,1-диметилэтилового эфира [[4-[[[4-хлор-3-[[(трицикло[3.3.1.13,7]дец-1-илметил)амино]карбонил]фенил]метил]амино]циклогексил]метил]карбаминовой кислоты (0,26 г, пример 32а), метанола (5 мл) и 4 н. раствора хлористоводородной кислоты в диоксане (2 мл). Растворители удаляют при пониженном давлении и остаток растирают с диэтиловым эфиром с получением указанного в заголовке соединения в виде белого порошка (0,191 г).
МС (APCI+ve) 444 (M+H-2HCl)+
1Н ЯМР (CD3OD) δ 7,60-7,58 (3Н, м); 4,29 (2Н, с); 3,28-3,12 (1Н, м); 3,09 (2Н, с); 2,84 (2Н, д); 2,31 (2Н, шир.д); 2,00 (5Н, шир.с); 1,75 (6Н, кв); 1,65 (6Н, д); 1,71-1,65 (1Н, м); 1,63-1,44 (2Н, м); 1,31-1,12 (2Н, м).
Пример 33
Дигидрохлоридная соль 5-[[(4-аминоциклогексил)амино]метил]-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
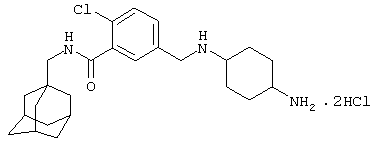
а) 1,1-Диметилэтиловый эфир [4-[[[4-хлор-3-[[(трицикло [3.3.1.13,7]дец-1-илметил)амино]карбонил]фенил]метил] амино]циклогексил]карбаминовой кислоты
Получение проводят по способу, описанному в примере 31b, из 2-хлор-5-формил-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (0,30 г, пример 31а) и 1,1-диметилэтилового эфира (4-аминоциклогексил)карбаминовой кислоты (0,194 г, Journal of Organic Chemistry, 1996, 61(25), 8811-8818), триацетоксиборогидрида натрия (0,135 г) и 1,2-дихлорэтана (10 мл). Остаток очищают хроматографией на силикагеле с элюированием смесью этилацетат:изогексан (1:1), затем этилацетат:этанол (95:5) с получением указанного в подзаголовке соединения в виде бесцветного масла (0,24 г).
МС (APCI+ve) 530 (M+H)+.
b) Дигидрохлоридная соль 5-[[(4-аминоциклогексил)амино]метил]-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
Получение проводят из 1,1-диметилэтилового эфира [4-[[[4-хлор-3-[[(трицикло[3.3.1.13,7]дец-1-илметил)амино]карбонил]фенил]метил]амино]циклогексил]карбаминовой кислоты (0,26 г, пример 33а), метанола (5 мл) и раствора 4 н. хлористоводородной кислоты в диоксане (1 мл). Растворители удаляют при пониженном давлении и остаток растирают с диэтиловым эфиром с получением указанного в заголовке соединения в виде белого порошка (0,190 г).
МС (APCI+ve) 430 (M+H-2HCl)+
1Н ЯМР (CD3OD) δ 7,61-7,59 (3Н, м); 4,30 (2Н, с); 3,28-3,11 (2Н, м); 3,08 (2Н, с); 2,40-2,32 (2Н, м); 2,21-2,17 (2Н, м); 2,00 (3Н, с); 1,74 (6Н, кв); 1,64 (6Н, д); 1,63-1,48 (4Н, м).
Пример 34
5-[(1-Азабицикло[2.2.2]окт-3-иламино)метил]-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид
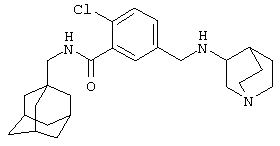
Получение проводят по способу, описанному в примере 31b из 2-хлор-5-формил-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (0,30 г, пример 31а), дигидрохлоридной соли 1-азабицикло[2.2.2]октан-3-амина (0,18 г), триацетоксиборогидрида натрия (0,135 г) и 1,2-дихлорэтана (10 мл). Остаток очищают хроматографией на силикагеле с элюированием смесью этилацетат:изогексан (1:1), затем смесью этилацетат:этанол (95:5). Повторная очистка хроматографией на силикагеле с элюированием смесью дихлорметан:метанол (95:5), затем (9:1) дает указанное в заголовке соединение в виде белой смолы (0,013 г).
МС (APCI+ve) 442 (M+H)+
1Н ЯМР (CDCl3) δ 7,68 (1Н, д); 7,39 (1Н, д); 7,31 (1Н, дд); 6,41 (1Н, т); 3,75 (2Н, с); 3,42-3,31 (2Н, м); 3,25-3,09 (6Н, м); 2,94 (1Н, д); 2,38-2,23 (2Н, м); 2,22-2,14 (1Н, м); 2,01 (3Н, с); 1,92-1,83 (2Н, м); 1,69 (6Н, кв); 1,59 (6Н, д).
Пример 35
Дигидрохлоридная соль N-[4-(3-аминопирролидин-1-ил)-2-метилфенил]-2-(трицикло[3.3.1.13,7]дец-1-ил)ацетамида
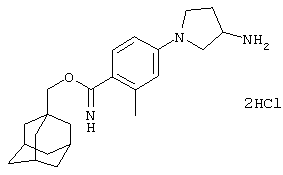
а) трет-Бутиловый эфир [1-(3-метил-4-нитрофенил)пирролидин-3-ил]карбаминовой кислоты
4-Фтор-2-метил-1-нитробензол (1 г), трет-бутиловый эфир пирролидин-3-илкарбаминовой кислоты (1,2 г), карбонат калия (1,79 г) и диметилсульфоксид (10 мл) нагревают вместе при 80°С в атмосфере азота в течение 15 ч. Смесь затем охлаждают, разбавляют этилацетатом (200 мл), промывают 2 н. водной хлористоводородной кислотой (200 мл), сушат (MgSO4), затем концентрируют. Очистка остатка хроматографией на силикагеле (элюирование 20% этилацетатом в изогексане) дает указанное в подзаголовке соединения (1,744 г).
1Н ЯМР (ДМСО-d6) δ 8,03-8,00 (1Н, д), 7,28-7,21 (1Н, шир.д), 6,51-6,47 (2Н, м), 4,20-4,12 (1Н, шир.м), 3,61-3,16 (4Н, м), 2,56 (3Н, с), 2,20-2,08 (1Н, м), 1,98-1,85 (1Н, м), 1,39 (9Н, с).
b) трет-Бутиловый эфир [1-(4-амино-3-метилфенил)пирролидин-3-ил]карбаминовой кислоты
трет-Бутиловый эфир [1-(3-метил-4-нитрофенил)пирролидин-3-ил]карбаминовой кислоты (1,744 г, пример 35а), железный порошок (1,52 г), хлорид аммония (1,45 г), этанол (50 мл) и воду (50 мл) кипятят вместе с обратным холодильником в атмосфере азота в течение 2 ч. Смесь охлаждают и железо отделяют фильтрованием. К остатку добавляют воду (200 мл) и продукт экстрагируют в этилацетат (3×200 мл), сушат (MgSO4) и концентрируют с получением указанного в подзаголовке соединения (1,56 г).
1Н ЯМР (CDCl3) δ 6,65 (1Н, шир.с), 6,38 (2Н, шир.м), 4,80 (1Н, м), 4,33 (2Н, шир.м), 3,60-2,80 (5Н, м), 2,31-2,17 (4Н, м), 1,92-1,82 (1Н, м), 1,45 (9Н, шир.с).
c) трет-Бутиловый эфир {1-[4-(2-(трицикло[3.3.1.13,7]дец-1-ил)ацетиламино)-3-метилфенил]пирролидин-3-ил}карбаминовой кислоты
К раствору адамантан-1-илуксусной кислоты (0,46 г) в дихлорметане (10 мл) при 0°С добавляют диметилформамид (0,1 мл), затем оксалилхлорид (2,50 мл). Реакционной смеси дают возможность нагреться до комнатной температуры и перемешивают в течение 30 мин. Летучие компоненты удаляют в вакууме и остаток сушат в высоком вакууме. Остаток растворяют в дихлорметане (10 мл) и добавляют к раствору трет-бутилового эфира [1-(4-амино-3-метилфенил)пирролидин-3-ил]карбаминовой кислоты (0,70 г, пример 35b) в дихлорметане (10 мл) и триэтиламине (0,8 мл) при 0°С. Реакционной смеси дают возможность нагреться до комнатной температуры и перемешивают в течение 3 ч. Раствор промывают 2 н. водной хлористоводородной кислотой (20 мл), затем насыщенным раствором соли (20 мл) и органический слой сушат над сульфатом магния и фильтруют. Фильтрат концентрируют при пониженном давлении. Сырой материал очищают хроматографией на силикагеле (элюирование 1% метанолом в дихлорметане) с получением указанного в подзаголовке соединения (1,1 г).
МС (APCI+ve) ММ 468 (M+H)+
1Н ЯМР (ДМСО-d6) δ 8,86 (1Н, с); 7,01-6,98 (1Н, д); 7,18-7,14 (1Н, шир.д); 6,33-6,27 (3Н, м); 4,15-4,04 (1Н, м); 3,42-3,15 (3Н, м); 3,00-2,97 (1Н, м); 2,12 (3Н, с); 2,00 (2Н, с); 1,99-1,80 (5Н, м); 1,70-1,61 (12Н, м); 1,39 (9Н, с).
d) Дигидрохлоридная соль N-[4-(3-аминопирролидин-1-ил)-2-метилфенил]-2-(трицикло[3.3.1.13,7]дец-1-ил)ацетамида
трет-Бутиловый эфир {1-[4-(2-(трицикло[3.3.1.13,7]дец-1-ил)ацетиламино)-3-метилфенил]пирролидин-3-ил}карбаминовой кислоты (0,20 г, пример 35с) растворяют в метаноле (5 мл) и добавляют хлористоводородную кислоту (0,5 мл 4 н. раствора в диоксане). После перемешивания при комнатной температуре в течение 14 ч смесь упаривают до 2/3 начального объема при пониженном давлении. К раствору постепенно добавляют диэтиловый эфир и образовавшийся осадок собирают фильтрованием, промывают диэтиловым эфиром и сушат в вакууме с получением указанного в заголовке соединения в виде твердого вещества (0,15 г).
МС (APCI+ve) 368 (M+H)+
1Н ЯМР (ДМСО-d6) δ 8,92 (1Н, с); 8,21 (2Н, шир.с); 7,07-7,04 (1Н, д); 6,41-6,35 (2Н, м); 3,91 (1Н, шир.м); 3,50-3,39 (2Н, м); 3,29-3,20 (2Н, м); 2,37-2,27 (2Н, м); 2,14 (3Н, с); 2,02 (2Н, с); 1,94 (3Н, с); 1,70-1,58 (12Н, м).
Пример 36
Дигидрохлоридная соль N-(2-метил-4-пиперазин-1-илфенил)-2-(трицикло[3.3.1.13,7]дец-1-ил)ацетамида
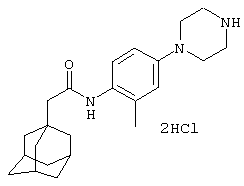
а) трет-Бутиловый эфир 4-(3-метил-4-нитрофенил)пиперазин-1-карбоновой кислоты
4-Фтор-2-метил-1-нитробензол (2 г), трет-бутиловый эфир пиперазин-1-карбоновой кислоты (4,8 г), карбонат калия (3,57 г) и диметилсульфоксид (20 мл) нагревают вместе при 80°С в атмосфере азота в течение 15 ч. Смесь затем охлаждают, разбавляют этилацетатом (200 мл) промывают 2 н. водной хлористоводородной кислотой (200 мл), сушат (MgSO4) и концентрируют с получением указанного в подзаголовке соединения (4,10 г).
МС (APCI+ve) 321 (M)+
1Н ЯМР (ДМСО-d6) δ 8,02-7,98 (1Н, д), 6,89-6,86 (2Н, м), 3,45 (8Н, с), 2,55 (3Н, с), 1,42 (9Н, с).
b) трет-Бутиловый эфир 4-(4-амино-3-метилфенил)пиперазин-1-карбоновой кислоты
трет-Бутиловый эфир 4-(3-метил-4-нитрофенил)пиперазин-1-карбоновой кислоты (2 г, пример 36а), железный порошок (1,74 г), хлорид аммония (1,67 г), этанол (50 мл) и воду (50 мл) кипятят вместе с обратным холодильником в атмосфере азота в течение 2 ч. Смесь охлаждают и железо отделяют фильтрованием. К остатку добавляют воду (200 мл) и продукт экстрагируют в этилацетат (3×200 мл), сушат (MgSO4) и концентрируют с получением указанного в подзаголовке соединения (1,22 г).
1Н ЯМР (ДМСО-d6) δ 6,62-6,52 (3Н, м), 4,38 (2Н, с), 3,41 (4Н, шир.с), 2,83 (4Н, шир.с), 2,02 (3Н, с), 1,41 (9Н, с).
с) трет-Бутиловый эфир 4-[4-(2-(трицикло[3.3.1.13,7]дец-1-ил)ацетиламино)-3-метилфенил]пиперазин-1-карбоновой кислоты
К раствору адамантан-1-илуксусной кислоты (0,40 г) в дихлорметане (10 мл) при 0°С добавляют диметилформамид (0,1 мл), затем оксалилхлорид (2,00 мл). Реакционной смеси дают возможность нагреться до комнатной температуры и перемешивают в течение 30 мин. Летучие компоненты удаляют в вакууме и остаток сушат в высоком вакууме. Остаток растворяют в дихлорметане (10 мл) и добавляют к раствору трет-бутилового эфира 4-(4-амино-3-метилфенил)пиперазин-1-карбоновой кислоты (0,60 г, пример 36b) в дихлорметане (10 мл) и триэтиламине (0,7 мл) при 0°С. Реакционной смеси дают возможность нагреться до комнатной температуры и перемешивают в течение 3 ч. Раствор промывают 2 н. водной хлористоводородной кислотой (20 мл), затем насыщенным раствором соли (20 мл) и органический слой сушат над сульфатом магния, затем фильтруют. Фильтрат концентрируют при пониженном давлении. Сырой материал очищают хроматографией на силикагеле (элюирование 1% метанолом в дихлорметане) с получением указанного в подзаголовке соединения (0,42 г).
МС (APCI+ve) ММ 468 (M+H)+
1Н ЯМР (ДМСО-d6) δ 8,96 (1Н, с); 7,14-7,11 (1Н, д); 6,79-6,72 (2Н, м); 3,47-3,40 (4Н, м); 3,20-3,00 (4Н, м); 2,14 (3Н, с); 2,03 (2Н, с); 1,94 (3Н, шир.с); 1,70-1,56 (12Н, м); 1,42 (9Н, с).
d) Дигидрохлоридная соль N-(2-метил-4-пиперазин-1-илфенил)-2-(трицикло[3.3.1.13,7]дец-1-ил)ацетамида
трет-Бутиловый эфир 4-[4-(2-(трицикло[3.3.1.13,7]дец-1-ил)ацетиламино)-3-метилфенил]пиперазин-1-карбоновой кислоты (0,05 г, пример 36с) растворяют в метаноле (2 мл) и добавляют хлористоводородную кислоту (0,5 мл 4 н. раствора в диоксане). После перемешивания при комнатной температуре в течение 14 ч смесь упаривают до 2/3 начального объема при пониженном давлении. К раствору постепенно добавляют диэтиловый эфир и образовавшийся осадок собирают фильтрованием, промывают диэтиловым эфиром и сушат в вакууме с получением указанного в заголовке соединения в виде твердого вещества (0,043 г).
МС (APCI+ve) 368 (M+H)+
1Н ЯМР (ДМСО-d6) δ 9,01 (3Н, шир.с); 7,18-7,15 (1Н, д); 6,84-6,82 (1Н, д); 6,79-6,76 (1Н, дд); 3,31-3,29 (4Н, м); 3,28-3,16 (4Н, м); 2,16 (3Н, с); 2,04 (2Н, с); 1,94 (3Н, шир.с); 1,69-1,58 (12Н, м).
Пример 37
Гидрохлоридная соль цис-4-(3-аминоциклопентилокси)-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
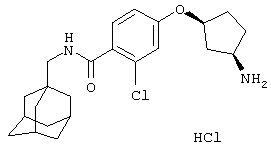
а) 2-Хлор-4-гидрокси-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид
К раствору 2-хлор-4-гидроксибензойной кислоты (3,30 г) в диметилформамиде (20 мл) добавляют 1,1'-карбонилдиимидазол (3,30 г). Реакционную смесь перемешивают в течение 2,5 ч и затем добавляют 1-адамантанметиламин (3,4 мл). Спустя 14 ч реакционную смесь распределяют между этилацетатом и 2 н. водной хлористоводородной кислотой и органический слой отделяют, промывают водой, затем насыщенным раствором соли и сушат (MgSO4). Органический слой концентрируют при пониженном давлении с получением остатка, который очищают хроматографией на силикагеле (элюирование 10-70% этилацетатом в дихлорметане) с получением белого твердого вещества, которое растирают с этилацетатом с получением указанного в подзаголовке соединения в виде белого твердого вещества (3,6 г).
МС (APCI+ve) 320/322 (M+H)+
1Н ЯМР (ДМСО-d6) δ 10,12 (1Н, с), 8,10-8,06 (1Н, т), 7,27-7,24 (1Н, д), 6,81 (1Н, д), 6,77-6,73 (1Н, дд), 2,91-2,88 (2Н, д), 1,93 (3Н, шир.с), 1,69-1,56 (6Н, шир.кв), 1,50 (6Н, шир.с).
b) Гидрохлоридная соль цис-4-(3-аминоциклопентилокси)-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
К раствору 2-хлор-4-гидрокси-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (0,20 г, пример 37а), трет-бутилового эфира транс-(3-гидроксициклопентил)карбаминовой кислоты (0,19 г) и трибутилфосфина (0,23 мл) в сухом тетрагидрофуране (6 мл) добавляют 1-[[(1-пиперидинилкарбонил)азо]карбонил]пиперидин (0,24 г). Оранжевый раствор нагревают при 60°С в атмосфере азота в течение 2 ч. Добавляют дополнительный трет-бутиловый эфир транс-(3-гидроксициклопентил)карбаминовой кислоты (0,19 г), трибутилфосфин (0,23 мл) и 1-[[(1-пиперидинилкарбонил)азо]карбонил]пиперидин (0,24 г). Нагревание продолжают и описанную выше процедуру повторяют до завершения реакции по данным ЖХ/МС. Охлажденную реакционную смесь разбавляют диэтиловым эфиром, затем фильтруют. Фильтрат концентрируют и очищают хроматографией на силикагеле (25-33% этилацетат/гексан) с получением трет-бутилоксикарбонил(ВОС)-защищенного соединения в виде бесцветной пены. Пену растворяют в метаноле (5 мл) и добавляют 4 н. хлористоводородную кислоту в диоксане (0,25 мл). Раствор перемешивают при комнатной температуре в атмосфере азота до завершения реакции по данным ЖХ/МС. Выпаривание растворителя с последующим растиранием с диэтиловым эфиром дает указанное в заголовке соединение в виде бесцветного твердого вещества (0,24 г).
МС (APCI+ve) 403/405 (M+H)+
1Н ЯМР (ДМСО-d6) δ 8,18 (1Н, т); 7,96 (2Н, шир.с); 7,37-7,34 (1Н, д); 7,05 (1Н, м); 6,97-6,94 (1Н, м); 4,87 (1Н, шир.м); 3,72-3,40 (2Н, м); 2,93-2,90 (2Н, д); 2,04-1,51 (19Н, м); 1,22 (2Н, м).
Пример 38
Гидрохлоридная соль 2-хлор-4-(4-пиперидинилокси)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
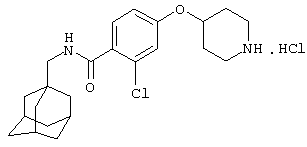
К раствору 2-хлор-4-гидрокси-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (0,20 г, пример 37а), 1,1-диметилэтилового эфира 4-гидрокси-1-пиперидинкарбоновой кислоты (0,19 г) и трибутилфосфина (0,25 мл) в сухом тетрагидрофуране (6 мл) добавляют 1-[[(1-пиперидинилкарбонил)азо]карбонил]пиперидин (0,24 г). Оранжевый раствор нагревают при 50°С в атмосфере азота в течение 2 ч. Добавляют дополнительное количество 1,1-диметилэтилового эфира 4-гидрокси-1-пиперидинкарбоновой кислоты (0,19 г), трибутилфосфина (0,25 мл) и 1-[[(1-пиперидинилкарбонил)азо]карбонил]пиперидина (0,24 г). Нагревание продолжают и описанную выше процедуру повторяют до завершения реакции по данным ЖХ/МС. Охлажденную реакционную смесь разбавляют диэтиловым эфиром, затем фильтруют. Фильтрат концентрируют и очищают хроматографией на силикагеле (изогексан/этилацетат, 3:1) с получением трет-бутилоксикарбонил(ВОС)-защищенного соединения в виде бесцветной пены. Пену растворяют в метаноле (10 мл) и добавляют 4 н. хлористоводородную кислоту в диоксане (10 мл). Раствор перемешивают при комнатной температуре в атмосфере азота до завершения реакции по данным ЖХ/МС. Выпаривание растворителя с последующим растиранием с диэтиловым эфиром дает указанное в заголовке соединение в виде бесцветного твердого вещества (0,165 г).
МС (APCI+ve) 403 (M+H)+
1Н ЯМР (ДМСО-d6) δ 8,80 (2Н, шир.с); 8,21-8,16 (1Н, т); 7,37-7,34 (1Н, д); 7,16 (1Н, м); 7,03-6,99 (1Н, м); 4,80-4,68 (1Н, м); 3,25-3,18 (2Н, м); 3,17-3,01 (2Н, м); 2,93-2,90 (2Н, д); 2,17-2,02 (2Н, м); 1,93 (3Н, шир.с); 1,87-1,73 (2Н, м); 1,69-1,57 (6Н, АВ); 1,51 (6Н, с).
Пример 39
(+/-)-2-Хлор-4-(пирролидин-3-илокси)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид
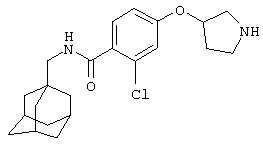
Получение проводят, как описано в примере 38, из 2-хлор-4-гидрокси-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (0,20 г, пример 37а), 1,1-диметилэтилового эфира (+/-)-3-гидрокси-1-пирролидинкарбоновой кислоты (0,18 г), трибутилфосфина (0,25 мл), сухого тетрагидрофурана (6 мл) и 1-[[(1-пиперидинилкарбонил)азо]карбонил]пиперидина (0,24 г) с получением трет-бутилоксикарбонил(ВОС)-защищенного соединения. Данное соединение обрабатывают 4 н. хлористоводородной кислотой в диоксане (10 мл) и метанолом (10 мл) с получением указанного в заголовке соединения в виде бесцветного твердого вещества (0,165 г).
МС (APCI+ve) 389 (M+H)+
1Н ЯМР (ДМСО-d6) δ 8,19-8,15 (1Н, т); 7,35-7,32 (1Н, д); 6,99 (1Н, м); 6,93-6,90 (1Н, м); 4,94-4,89 (1Н, м); 3,24 (1Н, с); 3,08-3,02 (1Н, дд); 2,92-2,90 (2Н, д); 2,88-2,72 (3Н, м); 2,08-1,98 (1Н, м); 1,93 (3Н, с); 1,76-1,57 (7Н, м); 1,51 (6Н, с).
Пример 40
Гидрохлоридная соль 2-хлор-4-(пиперидин-3-илокси)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
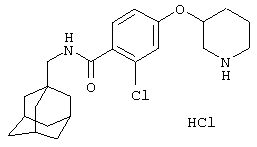
К раствору 2-хлор-4-гидрокси-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (0,20 г, пример 37а), трет-бутилового эфира 3-гидроксипиперидин-1-карбоновой кислоты (0,189 г) и трибутилфосфина (0,23 мл) в сухом тетрагидрофуране (6 мл) добавляют 1-[[(1-пиперидинилкарбонил)азо]карбонил]пиперидин (0,24 г). Оранжевый раствор нагревают при 60°С в атмосфере азота в течение 2 ч. Добавляют дополнительные количества трет-бутилового эфира 3-гидроксипиперидин-1-карбоновой кислоты (0,19 г), трибутилфосфина (0,23 мл) и 1-[[(1-пиперидинилкарбонил)азо]карбонил]пиперидина (0,24 г). Нагревание продолжают и описанную выше процедуру повторяют до завершения реакции по данным ЖХ/МС. Охлажденную реакционную смесь разбавляют диэтиловым эфиром, затем фильтруют. Фильтрат концентрируют и очищают хроматографией на силикагеле (25% этилацетат:изогексан), затем ВЭЖХ с нормальной фазой (0-1% этанол в дихлорметане) с получением трет-бутилоксикарбонил(ВОС)-защищенного соединения в виде бесцветной пены. Пену растворяют в метаноле (5 мл) и добавляют 4 н. хлористоводородную кислоту в диоксане (0,25 мл). Раствор перемешивают при комнатной температуре в атмосфере азота до завершения реакции по данным ЖХ/МС. Выпаривание растворителя с последующим растиранием с диэтиловым эфиром дает указанное в заголовке соединение в виде бесцветного твердого вещества (0,006 г).
МС (APCI+ve) 403/405 (M+H)+
1Н ЯМР (ДМСО-d6) δ 8,84 (2Н, шир.с), 8,21 (1Н, т); 7,38 (1Н, д); 7,18 (1Н, с); 7,05 (1Н, дд); 4,82 (1Н, шир.с); 3,24 (1Н, д); 3,20 (1Н, дд); 3,06 (2Н, шир.с); 2,92 (2Н, д); 1,94-1,51 (19Н, м).
Пример 41
Гидрохлоридная соль 2-хлор-4-(4-пиперазин-1-ил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
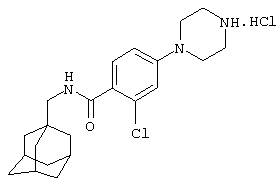
а) 4-Бром-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид
К суспензии 4-бром-2-хлорбензойной кислоты (5,00 г) в дихлорметане (25 мл) при 0°С добавляют оксалилхлорид (3,7 мл) и диметилформамид (5 капель). Образовавшуюся смесь перемешивают при комнатной температуре в атмосфере азота в течение 1 часа, затем концентрируют при пониженном давлении с получением твердого вещества. Твердое вещество растворяют в дихлорметане (20 мл) и добавляют по каплям к раствору 1-адамантанметиламина (3,36 г) и N,N-диизопропилэтиламина (5,55 мл) в дихлорметане (20 мл). Образовавшийся раствор оставляют для перемешивания при комнатной температуре в атмосфере азота в течение 20 ч. Реакционную смесь разбавляют дихлорметаном и промывают водой, 10% водным карбонатом калия, 10% водным гидросульфатом калия и насыщенным раствором соли. Органическую фазу затем сушат над сульфатом натрия, фильтруют и концентрируют при пониженном давлении с получением указанного в заголовке соединения в виде твердого вещества (4,28 г).
МС (APCI+ve) 382/384 (M+H)+
1Н ЯМР (ДМСО-d6) δ 8,39-8,34 (1Н, т); 7,78 (1Н, м); 7,62-7,59 (1Н, м); 7,37-7,34 (1Н, д); 2,94-2,92 (2Н, д); 1,94 (3Н, шир.с); 1,69-1,57 (6Н, шир. АВ); 1,52 (6Н, с).
b) Гидрохлоридная соль 2-хлор-4-(4-пиперазин-1-ил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
К суспензии 4-бром-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (пример 41а, 0,30 г), 1,1-диметилэтилового эфира пиперазин-1-карбоновой кислоты (0,18 г), карбоната цезия (0,36 г) и (R)-BINAP (0,036 г) в безводном толуоле (3 мл) добавляют ацетат палладия(II) (0,009 г) и смесь нагревают при 100°С в течение 14 ч в автоклаве, продутом азотом. Охлажденную реакционную смесь упаривают при пониженном давлении с получением масла, которое очищают хроматографией на силикагеле (изогексан:этилацетат, 2:1) с получением трет-бутилоксикарбонил(ВОС)-защищенного соединения в виде бесцветной пены. Пену растворяют в метаноле (15 мл) и добавляют 4 н. хлористоводородную кислоту в диоксане (15 мл). Раствор перемешивают при комнатной температуре в атмосфере азота до завершения реакции по данным ЖХ/МС. Упаривание с последующим растиранием с диэтиловым эфиром и метанолом дает указанное в заголовке соединение в виде не совсем белого твердого вещества/пены (0,161 г).
МС (APCI+ve) 388/390 (M+H)+
1Н ЯМР (ДМСО-d6) δ 8,98 (2Н, шир.с); 8,11-8,07 (1Н, т); 7,33-7,31 (1Н, д); 7,05 (1Н, м); 6,99-6,95 (1Н, м); 3,46-3,43 (4Н, м); 3,20 (4Н, шир.с); 1,94 (3Н, шир.с); 1,69-1,57 (6Н, шир.АВ); 1,51 (6Н, шир.с).
Пример 42
Гидрохлоридная соль 2-хлор-4-(3-пирролидиниламино)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
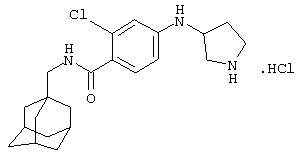
Получение проводят по способу, описанному в примере 41b, из 4-бром-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (0,25 г, пример 41а), 1,1-диметилэтилового эфира 3-амино-1-пирролидинкарбоновой кислоты (0,182 г, Journal of Medicinal Chemistry, 1998, 41(22), 4273-4278), карбоната цезия (0,347 г), (R)-(+)-2,2'-бис(дифенилфосфино)-1,1'-бинафтила (0,036 г), ацетата палладия(II) (0,009 г) и безводного толуола (3 мл). Остаток очищают ВЭЖХ с градиентным элюированием 0-5% этанолом в дихлорметане. Продукт растворяют в метаноле и перемешивают при комнатной температуре в течение 3 ч в присутствии 4 н. раствора хлористоводородной кислоты в диоксане (2 мл). Раствор концентрируют при пониженном давлении и растирают с диэтиловым эфиром с получением указанного в заголовке соединения в виде белого порошка (0,057 г).
МС (APCI+ve) 388 (M+H-HCl)+
1Н ЯМР (CD3OD) δ 7,33 (1Н, д); 6,71 (1Н, д); 6,63 (1Н, дд); 4,27-4,21 (1Н, м); 3,57-3,40 (3Н, м); 3,23 (1Н, дд); 3,05 (2Н, с); 2,43-2,33 (1Н, м); 2,33-2,01 (1Н, м); 1,99 (3Н, шир.с); 1,73 (6Н, кв); 1,62 (6Н, д).
Пример 43
Гидрохлоридная соль 2-хлор-4-(гексагидро-1Н-1,4-диазепин-1-ил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
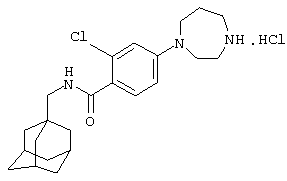
Получение проводят по способу, описанному в примере 41b, из 4-бром-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (0,25 г, пример 41а), 1,1-диметилэтилового эфира гексагидро-1Н-1,4-диазепин-1-карбоновой кислоты (0,182 г), карбоната цезия (0,347 г), (R)-(+)-2,2'-бис(дифенилфосфино)-1,1'-бинафтила (0,036 г), ацетата палладия (II) (0,009 г) и безводного толуола (3 мл). Остаток очищают ВЭЖХ с градиентным элюированием 0-5% этанола в дихлорметане. Продукт растворяют в метаноле и перемешивают при комнатной температуре в течение 3 ч в присутствии 4 н. раствора хлористоводородной кислоты в диоксане (2 мл). Раствор концентрируют при пониженном давлении и растирают с диэтиловым эфиром с получением указанного в заголовке соединения в виде белого порошка (0,17 г).
МС (APCI+ve) 402 (M+H-HCl)+
1Н ЯМР (CD3OD) δ 7,41 (1Н, д); 6,88 (1Н, д); 6,81 (1Н, дд); 3,83 (2Н, т); 3,63 (2Н, т); 3,40 (2Н, т); 3,30 (2Н, т); 3,06 (2Н, с); 2,24-2,16 (2Н, м); 1,99 (3Н, шир.с); 1,74 (6Н, кв); 1,63 (6Н, д).
В соответствии с процедурой, описанной в примере 8, получают следующие соединения:
Пример 44
Гидрохлоридная соль (±)-5-[(3-амино-1-пиперидинил)метил]-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
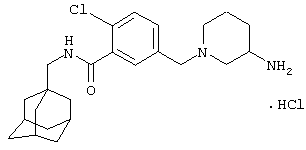
МС (APCI+ve) ММ 416/418 (M+H)+
1Н ЯМР (CD3OD) δ 7,70 (1Н, шир.с); 7,67 (1Н, дд); 7,60 (1Н, д); 4,49 (1Н, д); 4,45 (1Н, д); 3,73-3,58 (2Н, м); 3,57-3,45 (1Н, м); 3,14-2,95 (4Н, м); 2,25-2,04 (2Н, м); 1,98 (4Н, шир.с); 1,76 (3Н, д); 1,73-1,58 (1Н, м); 1,70 (3Н, д); 1,63 (6Н, шир.с).
Пример 45
Гидрохлоридная соль 2-хлор-5-(2,5-диазабицикло[2.2.1]гепт-2-илметил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
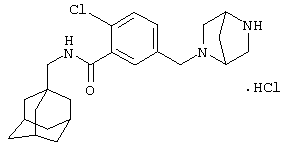
МС (APCI+ve) ММ 414/416 (M+H)+
1Н ЯМР (CD3OD) δ 7,74 (1Н, д); 7,72 (1Н, дд); 7,60 (1Н, д); 4,70-4,55 (3Н, м); 4,45 (1Н, д); 4,00 (1Н, д); 3,73 (1Н, д); 3,60-3,50 (2Н, м); 3,07 (2Н, с); 2,71 (1Н, д); 2,27 (1Н, д); 1,98 (3Н, шир.с); 1,77 (3Н, д); 1,69 (3Н, д); 1,63 (6Н, шир.с).
Пример 46
Гидрохлоридная соль 2-хлор-5-(9-окса-3,7-диазабицикло[3.3.1]нон-3-илметил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
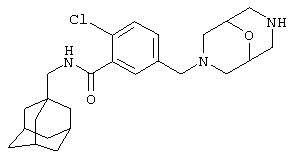
МС (APCI+ve) ММ 442/446 (M+H)+
1Н ЯМР (CD3OD) δ 7,60-7,40 (3Н, м); 4,25-4,00 (2Н, м); 3,70-3,40 (2Н, м); 3,46 (4Н, м); 3,07 (2Н, с); 3,15-2,90 (2Н, м); 2,80-2,50 (2Н, м); 2,00 (3Н, шир.с); 1,78 (3Н, д); 1,71 (3Н, д); 1,63 (6Н, шир.с).
Пример 47
Гидрохлоридная соль 2-хлор-5-(3,7-диазабицикло[3.3.1]нон-3-илметил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
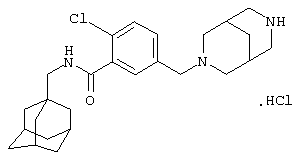
МС (APCI+ve) ММ 442/444 (M+H)+
1Н ЯМР (CD3OD) δ 7,91 (1Н, с); 7,78 (1Н, д); 7,56 (1Н, д); 7,46 (1Н, шир.с); 4,44 (2Н, шир.с); 3,65-3,28 (8Н, м); 3,08 (2Н, шир.с); 2,48 (2Н, шир.с); 2,05-1,90 (5Н, м); 1,77 (3Н, д); 1,71 (3Н, д); 1,64 (6Н, шир.с).
Пример 48
Гидрохлоридная соль транс-2-хлор-5-[[8-(метиламино)-3-азабицикло[3.2.1]окт-3-ил]метил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
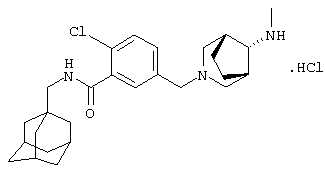
МС (APCI+ve) ММ 456/458 (M+H)+
1Н ЯМР (CD3OD) δ 7,79 (1Н, д); 7,77 (1Н, дд); 7,58 (1Н, д); 4,71 (2Н, шир.с); 3,80 (2Н, д); 3,40 (1Н, т); 3,25 (2Н, дд); 3,07 (2Н, с); 2,86 (3Н, с); 2,70 (2Н, шир.с); 2,10-1,90 (7Н, м); 1,77 (3Н, д); 1,70 (3Н, д); 1,63 (6Н, шир.с).
Пример 49
Гидрохлоридная соль цис-2-хлор-5-[(гексагидропирроло[3,4-c]пиррол-2(1Н)-ил)метил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
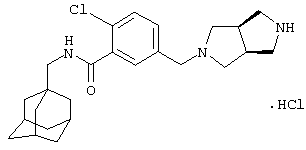
МС (APCI+ve) ММ 428/430 (M+H)+
1Н ЯМР (ДМСО-d6) δ 8,00 (1Н, т); 7,65 (1Н, с); 7,63 (1Н, д); 7,52 (1Н, д); 4,34 (2Н, шир.с); 3,60-3,05 (10Н, м); 2,97 (2Н, д); 1,95 (3Н, шир.с); 1,70 (3Н, д); 1,63 (3Н, д); 1,57 (6Н, с).
Пример 50
Гидрохлоридная соль 2-хлор-5-(4-пиперидинилиденметил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
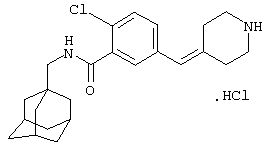
а) Диметиловый эфир [[4-хлор-3-[[(трицикло[3.3.1.13,7]дец-1-илметил)амино]карбонил]фенил]метил]фосфоновой кислоты
5-Бромметил-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид (5,70 г, пример 8b) в 100 мл триметилфосфита нагревают при кипячении с обратным холодильником в течение 15 ч. Растворитель удаляют азеотропной перегонкой с толуолом в высоком вакууме с получением указанного в подзаголовке соединения в виде желтого твердого вещества.
МС (APCI+ve) ММ 426/428 (M+H)+
1Н ЯМР (ДМСО-d6) δ 8,34 (1Н, т); 7,42 (1Н, д); 7,35-7,27 (2Н, м); 3,63 (3Н, с); 3,58 (3Н, с); 3,42 (2Н, д); 2,92 (2Н, д); 1,94 (3Н, шир.с); 1,67 (3Н, д); 1,59 (3Н, д); 1,52 (6Н, шир.с).
b) 1,1-Диметилэтиловый эфир 4-[[4-хлор-3-[[(трицикло[3.3.1.13,7]дец-1-илметил)амино]карбонил]фенил]метилен]-1-пиперидинкарбоновой кислоты
К раствору сырого диметилового эфира [[4-хлор-3-[[(трицикло[3.3.1.13,7]дец-1-илметил)амино]карбонил]фенил]метил] фосфоновой кислоты (2,50 г, пример 50а) в тетрагидрофуране (50 мл) при -78°С добавляют раствор диизопропиламида лития (7,30 мл, 2 М в тетрагидрофуране). Реакционной смеси дают возможность нагреться до комнатной температуры и перемешивают в течение 15 мин. Затем добавляют N-трет-бутоксикарбонилпиперидин-4-он (1,52 г) в тетрагидрофуране (5 мл) и смесь перемешивают в течение 24 ч. Реакционную смесь разбавляют водой и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли и сушат над сульфатом магния. Сырой материал очищают на силикагеле (от 0 до 5% метанола в дихлорметане) с получением указанного в подзаголовке соединения в виде белой пены.
МС (APCI+ve) ММ 443/445 (M+H)+
1Н ЯМР (ДМСО-d6) δ 7,52 (1Н, д); 7,34 (1Н, д); 7,16 (1Н, дд); 6,30 (1Н, с); 6,25 (т, 1Н); 3,48 (2Н, т); 3,40 (2Н, т); 3,40 (2Н, т); 3,18 (2Н, д); 2,42 (т, 2Н); 2,32 (т, 2Н); 2,05 (3Н, шир.с); 1,73 (3Н, д); 1,64 (д, 3Н); 1,59 (6Н, с); 1,47 (9Н, шир.с).
с) Гидрохлоридная соль 2-хлор-5-(4-пиперидинилиденметил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
Раствор 1,1-диметилэтилового эфира 4-[[4-хлор-3-[[(трицикло[3.3.1.13,7]дец-1-илметил)амино]карбонил]фенил]метилен]-1-пиперидинкарбоновой кислоты (0,10 г, пример 50b) в метаноле (3 мл) обрабатывают 4 н. раствором хлористоводородной кислоты в диоксане (1 мл) и перемешивают в течение 14 ч при комнатной температуре. Реакционную смесь концентрируют в вакууме и остаток перекристаллизовывают из смеси изопропанол/эфир с получением указанного в заголовке соединения в виде белого твердого вещества (0,071 г).
МС (APCI+ve) ММ 399/401 (M+H)+
1Н ЯМР (ДМСО-d6) δ 7,52 (1Н, д); 7,34 (1Н, д); 7,16 (1Н, дд); 6,30 (1Н, с); 6,25 (т, 1Н); 3,48 (2Н, т); 3,40 (2Н, т); 3,40 (2Н, т); 3,18 (2Н, д); 2,42 (т, 2Н); 2,32 (т, 2Н); 2,05 (3Н, шир.с); 1,73 (3Н, д); 1,64 (д, 3Н); 1,59 (6Н, с); 1,47 (9Н, шир.с).
Пример 51
Гидрохлоридная соль 2-хлор-5-(4-пиперидинилметил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
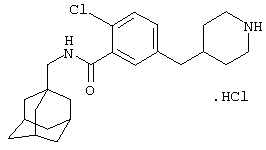
К раствору гидрохлоридной соли 2-хлор-5-(4-пиперидинилиденметил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (0,10 г, пример 50с) в этаноле (10 мл) добавляют оксид платины (2 мг). Сосуд помещают в атмосферу водорода при давлении 3 бар на 3 часа. Катализатор удаляют фильтрованием через подушку целита, промывают этанолом и раствор концентрируют в вакууме. Сырой материал перекристаллизовывают из изопропанола с получением белого твердого вещества. трет-Бутоксикарбонилзащищенное соединение растворяют в метаноле (10 мл) и обрабатывают 4 н. раствором HCl в диоксане (2 мл). Реакционную смесь перемешивают в течение 14 час при комнатной температуре, летучие компоненты удаляют в вакууме и остаток перекристаллизовывают из смеси изопропанол/эфир с получением гидрохлоридной соли в виде белого порошка (0,065 г).
МС (APCI+ve) ММ 402/404 (M+H)+
1Н ЯМР (CD3OD) δ 8,38 (1Н, т); 7,38 (1Н, д); 7,30-7,20 (2Н, м); 3,35 (2Н, д); 3,05 (2Н, д); 2,92 (2Н, тд); 2,63 (2Н, д); 1,98 (3Н, шир.с); 1,95-1,80 (1Н, м); 1,85 (2Н, д); 1,77 (3Н, д); 1,68 (3Н, д); 1,62 (6Н, с); 1,40 (2Н, кв).
Пример 52
Гидрохлоридная соль 2-хлор-5-(4-гидроксипиперидин-4-ил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
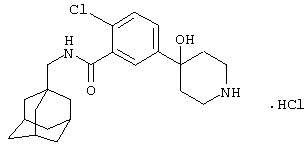
К раствору 5-бром-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (0,30 г, пример 23а) в безводном тетрагидрофуране (10 мл) при -78°С по каплям добавляют раствор н-бутиллития в гексанах (2,5 М, 0,72 мл). Спустя 10 мин добавляют раствор трет-бутоксикарбонил-4-пиперидона (0,21 г) в тетрагидрофуране (2 мл). Раствор перемешивают дополнительные 20 мин, затем обрабатывают насыщенным водным раствором хлорида аммония. Смеси дают возможность нагреться до комнатной температуры, затем распределяют между этилацетатом и насыщенным водным раствором хлорида аммония. Органические экстракты сушат над сульфатом магния и концентрируют в вакууме. Остаток хроматографируют на диоксиде кремния (этилацетат:изогексан, градиент от 1:4 до 1:2) с получением трет-бутоксикарбонилзащищенного продукта (0,153 г). Данный продукт снова растворяют в метаноле (4 мл) и обрабатывают в течение 14 ч 4 н. HCl в диоксане (1 мл). Раствор частично концентрируют в вакууме и продукт осаждают диэтиловым эфиром. Раствор фильтруют и белое твердое вещество промывают диэтиловым эфиром с получением указанного в заголовке соединения (0,091 г).
МС (APCI+ve) ММ 403 (M+H)+
1Н ЯМР (CD3OD) δ 8,43 (1Н, м, шир.); 7,59 (1Н, м); 7,55 (1Н, д); 7,49 (1Н, д); 3,52-3,30 (4Н, м); 3,09 (2Н, д); 2,23 (2Н, м); 2,04-1,88 (5Н, м); 1,95-1,80 (1Н, м); 1,84-1,66 (6Н, м); 1,65 (6Н, д).
Пример 53
Гидрохлоридная соль 2-хлор-5-(1,2,3,6-тетрагидропиридин-4-ил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
Раствор гидрохлоридной соли 2-хлор-5-(4-гидроксипиперидин-4-ил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (0,25 г, пример 52) в концентрированной хлористоводородной кислоте (10 мл) нагревают при 100°С в течение 5 ч. Раствору дают возможность медленно охладиться. Выделяются бесцветные кристаллы. Кристаллы отделяют фильтрованием, промывают диэтиловым эфиром, затем ацетонитрилом и сушат с получением указанного в заголовке соединения (0,031 г).
МС (APCI+ve) ММ 385 (M+H)+
1Н ЯМР (CD3OD) δ 8,44 (1Н, м, шир.); 7,55-7,45 (3Н, м); 6,23 (1Н, м); 3,85 (2Н, м); 3,47 (2Н, т); 3,07 (2Н, д); 2,79 (2Н, м); 1,98 (3Н, м); 1,77 (3Н, м); 1,69 (3Н, м); 1,63 (6Н, с, шир.).
Пример 54
Гидрохлоридная соль 2-этил-5-пиперазин-1-илметил-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
2-Бром-5-(4-[{1,1-диметилэтил}оксикарбонил]пиперазин-1-ил)метил-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид (пример 65b, 0,89 г) растворяют в сухом тетрагидрофуране. Добавляют гидрид натрия (60% дисперсия, 0,07 г) и смесь перемешивают при комнатной температуре в течение 5 мин. Смесь охлаждают до -70°С в атмосфере азота и добавляют трет-бутиллитий (1,9 мл 1,7 М раствор). Спустя 5 мин добавляют этилиодид (0,5 мл) и смесь перемешивают при -70°С в течение 30 мин. Добавляют водный раствор хлорида аммония и продукт экстрагируют диэтиловым эфиром, сушат (MgSO4) и концентрируют в вакууме. Хроматография на силикагеле дает трет-бутилоксикарбонил(ВОС)-защищенное соединение в виде пены. Пену растворяют в метаноле (5 мл) и добавляют 4 н. HCl в диоксане (1 мл). Смесь перемешивают при комнатной температуре в течение 14 ч. Раствор частично концентрируют в вакууме и продукт осаждают диэтиловым эфиром. Образовавшееся твердое вещество фильтруют и промывают эфиром с получением указанного в заголовке соединения в виде белого порошка (0,040 г).
1Н ЯМР (ДМСО) δ 9,59 (2Н, с, шир.); 8,15 (1Н, т); 7,58 (2Н, с, шир.); 7,35 (1Н, д); 4,37 (2Н, с, шир.); 3,49 (м); 3,25 (2Н, м, шир.); 2,95 (2Н, д); 2,72 (2Н, кв); 1,94 (3Н, с, шир.); 1,69-1,59 (6Н, м); 1,52 (6Н, с); 1,165 (3Н, т).
Пример 55
Гидрохлоридная соль 2-хлор-5-(пиперидин-4-илсульфанил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
а) трет-Бутиловый эфир 4-(толуол-4-сульфонилсульфанил)пиперидин-1-карбоновой кислоты
трет-Бутиловый эфир 4-иодпиперидин-1-карбоновой кислоты (1,3 г) и толуол-4-тиосульфонат калия (1,0 г) смешивают в этаноле (10 мл) с цис-дициклогексан-18-краун-6 (10 мг) и нагревают при кипячении с обратным холодильником в течение 12 ч. После охлаждения реакционную смесь распределяют между этилацетатом и водой, органический слой отделяют, промывают водой и насыщенным раствором соли, сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле (элюирование смесью изогексан/этилацетат, от 4:1 до 7:3) с получением указанного в подзаголовке соединения в виде масла (0,65 г).
МС (APCI+ve) 315 (M+H-tBu)+
1Н ЯМР (CDCl3) δ 7,80-7,85 (2Н, м), 7,30-7,40 (2Н, м), 3,95-4,10 (1Н, м), 3,75-3,85 (1Н, м), 3,40-3,50 (1/2Н, м), 3,10-3,20 (1/2Н, м), 2,95-3,05 (1Н, м), 2,80-2,90 (1Н, м), 2,46 (3Н, с), 1,90-2,10 (2Н, м), 1,50-1,70 (2Н, м), 1,43 и 1,45 (9Н, пара с).
b) 2-Хлор-5-(4-[{1,1-диметилэтил}оксикарбонил]пиперидин-4-илсульфанил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид
К раствору 5-бром-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (0,30 г, пример 23а) в безводном тетрагидрофуране (10 мл) при -78°С по каплям добавляют раствор н-бутиллития в гексанах (2,5 М, 0,72 мл). Спустя 10 мин добавляют раствор трет-бутилового эфира 4-(толуол-4-сульфонилсульфанил)пиперидин-1-карбоновой кислоты (0,38 г, пример 55а) в тетрагидрофуране (7 мл). После выдерживания в течение следующего 1 часа при -78°С реакционную смесь нагревают до температуры окружающей среды и гасят добавлением воды (5 мл). Реакционную смесь разбавляют этилацетатом и дважды промывают насыщенным водным раствором гидрокарбоната натрия, затем насыщенным раствором соли и сушат над сульфатом магния. Органический слой концентрируют при пониженном давлении с получением остатка, который очищают хроматографией на силикагеле (элюирование 0-5% этанолом в дихлорметане) с получением указанного в подзаголовке соединения (0,20 г).
МС (APCI+ve) 419/21 (M+H-ВОС)+
с) Гидрохлоридная соль 2-хлор-5-(пиперидин-4-илсульфанил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
2-Хлор-5-(4-[{1,1-диметилэтил}оксикарбонил]пиперидин-4-илсульфанил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид (0,20 г, пример 55b) растворяют в метаноле (15 мл) и добавляют хлористоводородную кислоту (1,0 мл 4 н. раствора в диоксане). После перемешивания при комнатной температуре в течение 14 ч реакционную смесь делают основной насыщенным раствором гидрокарбоната натрия и дважды экстрагируют дихлорметаном. Органический слой концентрируют при пониженном давлении с получением остатка, который очищают хроматографией на силикагеле (элюирование 0-100% метанолом в дихлорметане). Остаток растворяют в дихлорметане (5 мл) и добавляют хлористоводородную кислоту (1 н. в диэтиловом эфире, 2 мл). Выпаривание досуха дает указанное в заголовке соединение в виде гидрохлоридной соли (0,050 г).
МС (APCI+ve) 419/21 (M+H)+
1Н ЯМР (ДМСО-d6) δ 8,75 (2Н, шир.д), 8,38 (1Н, т), 7,48 (2Н, с), 7,37 (1Н, с), 3,50-3,60 (1Н, м), 3,30 (2Н, шир.д), 2,92-3,05 (4Н, м), 2,06 (2Н, шир.д), 1,94 (3Н, с), 1,57-1,75 (8Н, м), 1,52 (6Н, с).
Пример 56
2-Хлор-5-(пиперидин-4-илсульфинил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид
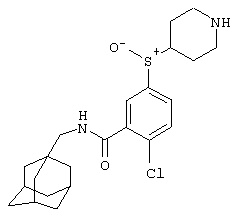
м-Хлорпероксибензойную кислоту (166 мг) добавляют к раствору 2-хлор-5-(пиперидин-4-илсульфанил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (0,35 г, пример 55с) в дихлорметане (5 мл). Через 2 ч добавляют гидроксид кальция (0,20 г) и спустя 30 мин соли удаляют фильтрованием. Фильтрат концентрируют при пониженном давлении с получением остатка, который очищают хроматографией на силикагеле (элюирование 0-25% этанолом в дихлорметане). Остаток растворяют в метаноле (5 мл) и добавляют хлористоводородную кислоту (0,5 мл 4 н. раствора в диоксане). После перемешивания при комнатной температуре в течение 14 ч раствор концентрируют при пониженном давлении и растирают с диэтиловым эфиром с получением указанного в заголовке соединения в виде гидрохлоридной соли (0,030 г).
МС (APCI+ve) 435/37 (M+H)+
1Н ЯМР (ДМСО-d6) δ 8,88 (1Н, шир.с), 8,47 (2Н, шир.т), 7,76 (1Н, д), 7,67 (1Н, дд), 7,61 (1Н, д), 3,30-3,40 (2Н, м), 3,13 (91Н, т), 2,98 (2Н, д), 2,80-2,90 (2Н, м), 2,15 (1Н, д), 1,95 (3Н, м), 1,50-1,85 (15Н, м).
Пример 57
Гидрохлоридная соль 2-хлор-5-(пиперидин-4-илсульфонил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
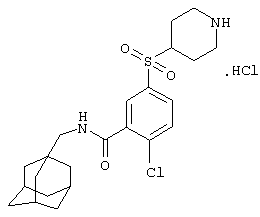
м-Хлорпероксибензойную кислоту (0,30 г) добавляют к раствору 2-хлор-5-(пиперидин-4-илсульфинил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (0,30 г) в дихлорметане (10 мл). Через 2 ч добавляют гидроксид кальция (170 мг) и спустя 30 мин соли удаляют фильтрованием. Фильтрат концентрируют при пониженном давлении с получением остатка, который очищают хроматографией на силикагеле (элюирование 0-2% этанолом в дихлорметане). Остаток растворяют в метаноле (5 мл) и добавляют хлористоводородную кислоту (0,25 мл 4 н. раствора в диоксане). После перемешивания при комнатной температуре в течение 14 ч раствор концентрируют при пониженном давлении и растирают с диэтиловым эфиром с получением указанного в заголовке соединения (0,03 г).
МС (APCI+ve) 451/53 (M+H)+
1Н ЯМР (ДМСО-d6) δ 8,89 (1Н, шир.с), 8,57 (1Н, т), 8,50 (1Н, шир.с), 7,87 (2Н, АВкв), 7,75 (1Н, д), 3,71 (1Н, тд), 3,40 (2Н, д), 3,00 (2Н, д), 2,80-2,90 (2Н, м), 1,95-2,05 (5Н, м), 1,50-1,90 (14Н, м).
Пример 58
Гидрохлоридная соль 2-хлор-5-(пиперидин-4-илметилсульфанил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
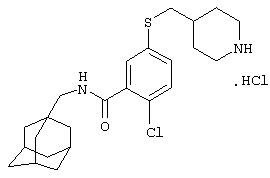
а) 2-Хлор-5-(4-[{1,1-диметилэтил}оксикарбонил]пиперидин-4-илметилсульфанил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид
Ангидрид трифторуксусной кислоты (2 мл) добавляют к раствору 2-хлор-5-метилсульфинил-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (0,53 г, пример 58а, WO 99/29661) в дихлорметане (10 мл) и нагревают при кипячении с обратным холодильником в течение 1,5 ч, охлаждают и концентрируют. Образовавшийся остаток растворяют в метаноле (30 мл), оставляют стоять в течение 1 часа, затем концентрируют. Образовавшийся остаток растворяют в ацетоне (10 мл) и добавляют карбонат калия (0,60 г) и трет-бутиловый эфир 4-иодметилпиперидин-1-карбоновой кислоты (0,94 г). Реакционную смесь нагревают при кипячении с обратным холодильником в течение 3 ч, охлаждают и концентрируют. Образовавшийся остаток растворяют в этилацетате, промывают дважды 10 мас.%/мас. раствором KHSO4, дважды насыщенным раствором гидрокарбоната натрия, один раз насыщенным раствором соли и сушат над сульфатом магния. Органический слой концентрируют при пониженном давлении с получением остатка, который очищают хроматографией на силикагеле (элюирование 0-2% этанолом в дихлорметане) с получением указанного в подзаголовке соединения (0,46 г).
МС (APCI+ve) 433/35 (M+H-ВОС)+
1Н ЯМР (CDCl-d3) δ 7,61 (1Н, д), 7,25-7,31 (2Н, м), 6,27 (1Н, шир.т), 4,09 (2Н, шир.д), 3,17 (2Н, д), 2,86 (2Н, д), 2,66 (2Н, т), 2,01 (3Н, с), 1,60-1,90 (15Н, м), 1,45 (9Н, с), 1,18 (2Н, дкв).
b) Гидрохлоридная соль 2-хлор-5-(пиперидин-4-илметилсульфанил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
Хлористоводородную кислоту (4 н. в диоксане, 0,5 мл) добавляют к раствору 2-хлор-5-(4-[{1,1-диметилэтил}оксикарбонил]пиперидин-4-илметилсульфанил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (0,235 г, пример 58а) в метаноле (10 мл). Спустя 24 ч реакционную смесь концентрируют, затем растирают с эфиром с получением указанного в заголовке соединения (0,20 г).
МС (APCI+ve) 433/35 (M+H)+
1Н ЯМР (ДМСО-d6) δ 8,76 (1Н, шир.с), 8,48 (1Н, шир.с), 8,35 (1Н, т), 7,40 (2Н, АВкв), 7,28 (1Н, д), 3,24 (2Н, д), 3,00 (2Н, д), 2,92 (2Н, д), 2,84 (2Н, кв), 1,94 (5Н, шир.с), 1,75-1,82 (1Н, м), 1,65 (6Н, кв), 1,52 (6Н, с), 1,40 (2Н, кв).
Пример 59
Гидрохлоридная соль 2-хлор-5-(пиперидин-4-илметансульфонил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
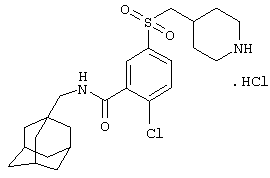
м-Хлорпероксибензойную кислоту (0,19 г) добавляют к раствору 2-хлор-5-(4-[{1,1-диметилэтил)оксикарбонил]пиперидин-4-илметилсульфанил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (0,165 г, пример 58а) в хлороформе (10 мл). Через 5 ч добавляют гидроксид кальция (120 мг) и спустя 30 мин соли удаляют фильтрованием. Реакционную смесь концентрируют, затем растворяют в метаноле (10 мл) и добавляют хлористоводородную кислоту (1,0 мл 4 н. раствора в диоксане). После перемешивания при комнатной температуре в течение 14 ч концентрирование при пониженном давлении дает указанное в заголовке соединение (0,075 г).
МС (APCI+ve) 465/67 (M+H)+
1Н ЯМР (ДМСО-d6) δ 8,70 (1Н, шир.с), 8,55 (1Н, т), 8,48 (1Н, шир.с), 7,95 (1Н, дд), 7,88 (1Н, д), 7,82 (1Н, д), 3,47 (2Н, д), 3,21 (2Н, д), 2,97 (2Н, д), 2,89 (2Н, д), 2,10-2,25 (1Н, м), 1,95 (5Н, шир.с), 1,40-1,80 (14Н, м).
Пример 60
Гидрохлоридная соль 2-хлор-5-(пиперазин-1-карбонил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
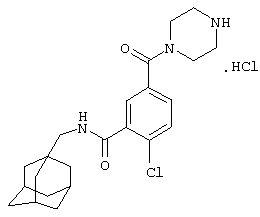
а) 4-Хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)изофталамовая кислота
н-Бутиллитий (3 мл, 2 М в гексанах) добавляют при -78°С к раствору 5-бром-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (1,0 г, пример 23а) в тетрагидрофуране (20 мл). Спустя 10 мин реакционную смесь декантируют на сухой твердый диоксид углерода и дают возможность нагреться до температуры окружающей среды. Реакционную смесь подкисляют концентрированной хлористоводородной кислотой и экстрагируют эфиром. Органическую часть отделяют, сушат над сульфатом магния и концентрируют при пониженном давлении с получением остатка, который очищают хроматографией на силикагеле (элюирование смесью изогексан/этилацетат, от 3:1 до 1:1, + 1% АсОН) с получением указанного в подзаголовке соединения в виде твердого вещества (0,45 г).
МС (APCI+ve) 348/350 (M+H)+
1Н ЯМР (ДМСО-d6) δ 13,33 (1Н, с), 8,44 (1Н, т), 7,94 (1Н, дд), 7,87 (1Н, д), 7,63 (1Н, д), 2,95 (2Н, д), 1,95 (3Н, с), 1,63 (6Н, кв), 1,53 (6Н, с).
b) Гидрохлоридная соль 2-хлор-5-(пиперазин-1-карбонил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
Этилдиизопропиламин (0,3 мл) добавляют при температуре окружающей среды к раствору 4-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)изофталамовой кислоты (0,15 г, пример 60а), трет-бутилового эфира пиперазин-1-карбоновой кислоты (0,16 г) и PyBrOP (0,40 г) в N-метилпирролидиноне (10 мл). Спустя 5 ч реакционную смесь разбавляют этилацетатом и промывают дважды водой, дважды 10% раствором KHSO4, дважды насыщенным раствором NaHCO3 и один раз насыщенным раствором соли, затем сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле (элюирование этанолом (0-5%) в дихлорметане), затем снова растворяют в метаноле (10 мл) и обрабатывают хлористоводородной кислотой (4 н. раствор в диоксане, 1 мл). Спустя 48 ч реакционную смесь концентрируют при пониженном давлении и перекристаллизовывают из смеси изогексан/пропан-2-ол с получением указанного в заголовке соединения в виде твердого вещества (0,10 г).
МС (APCI+ve) 416/418 (M+H)+
1Н ЯМР (ДМСО-d6) δ 9,18 (1Н, т), 8,42 (1Н, т), 7,59 (1Н, д), 7,47-7,52 (2Н, м), 3,50-3,90 (4Н, шир.с), 3,05-3,25 (4Н, шир.с), 2,94 (2Н, д), 1,95 (3Н, с), 1,63 (6Н, кв), 1,52 (6Н, с).
Аналогичным способом получают следующие соединения.
Пример 61
Гидрохлоридная соль 2-хлор-5-([1,4]диазепан-1-карбонил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
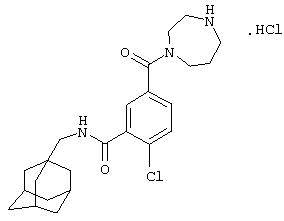
МС (APCI+ve) 430/432 (M+H)+
1Н ЯМР (ДМСО-d6) δ 9,10 (2Н, шир.с), 8,06 (1Н, шир.с), 7,53 (1Н, д), 7,45-7,48 (2Н, м), 3,78 (2Н, шир.с), 3,54 (2Н, шир.с), 3,20-3,25 (4Н, м), 2,97 (2Н, д), 2,00 (2Н, м), 1,95 (3Н, с), 1,65 (6Н, кв), 1,55 (6Н, с).
Пример 62
Гидрохлоридная соль 4-хлор-N1-(пиперидин-4-ил)-N2-(трицикло[3.3.1.13,7]дец-1-илметил)изофталамида
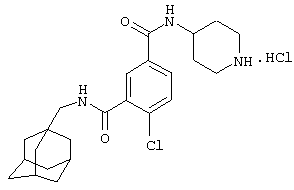
МС (APCI+ve) 430/432 (M+H)+
1Н ЯМР (ДМСО-d6) δ 8,66-8,76 (3Н, м), 8,42 (1Н, т), 7,89-7,93 (2Н, м), 7,60 (1Н, д), 4,01-4,09 (1Н, м), 3,29 (2Н, д), 2,95-3,05 (4Н, м), 1,95 (5Н, шир.с), 1,47-1,82 (14Н, м).
Пример 63
Гидрохлоридная соль 2-хлор-5-(гидрокси-4-пиперидинилметил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
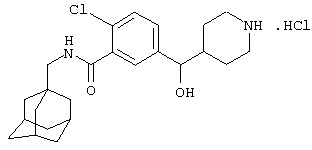
а) 2-Хлор-5-[4-[[{1,1-диметилэтил}оксикарбонил]пиперидинил] гидроксиметил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид
К раствору 5-бром-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (1,5 г, пример 23а) в безводном тетрагидрофуране (50 мл) в атмосфере азота при -78°С добавляют по каплям раствор н-бутиллития (2,5 М в гексанах, 3,4 мл). Смесь перемешивают в течение 10 мин при -78°С, затем по каплям добавляют раствор 1,1-диметилэтилового эфира 4-формил-1-пиперидинкарбоновой кислоты (1,09 г, Journal of Medicinal Chemistry, 1999, 42(12), 2180-2190) в безводном тетрагидрофуране (10 мл). Реакционную смесь перемешивают при -78°С в течение 30 мин, затем гасят насыщенным водным раствором хлорида аммония (100 мл). Продукт экстрагируют дважды этилацетатом (2×100 мл). Органические экстракты объединяют, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле с элюированием смесью изогексан:этилацетат (2:1), затем (1:2), затем очищают далее ВЭЖХ с элюированием градиентом 0-5% этанол в дихлорметане с получением указанного в подзаголовке соединения в виде белой пены (0,61 г).
МС (APCI+ve) 517 (M+H)+
1Н ЯМР (ДМСО-d6) δ 8,28 (1Н, т); 7,40 (1Н, д); 7,33-7,27 (2Н, м); 5,33 (1Н, д); 4,34 (1Н, т); 3,93 (3Н, шир.с), 2,93 (2Н, д); 2,61 (2Н, шир.с); 1,94 (3Н, шир.с); 1,63 (6Н, кв); 1,53 (6Н, д); 1,37 (9Н, с); 1,34-1,23 (2Н, м); 1,09 (2Н, дт).
b) Гидрохлоридная соль 2-хлор-5-(гидрокси-4-пиперидинилметил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
Раствор 2-хлор-5-[4-[[{1,1-диметилэтил}оксикарбонил] пиперидинил]гидроксиметил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (0,10 г, пример 63а) в метаноле (3 мл) обрабатывают 4 н. раствором хлористоводородной кислоты в диоксане (1 мл). Спустя 14 ч растворители удаляют при пониженном давлении и остаток растирают с диэтиловым эфиром с получением указанного в заголовке соединения в виде белого порошка (0,062 г).
МС (APCI+ve) 417 (M+H-HCl)+
1Н ЯМР (ДМСО-d6) δ 8,70 (1Н, шир.с); 8,29 (2Н, шир.т); 7,44 (1Н, д); 7,33 (2Н, дт); 5,53 (1Н, д); 4,40 (1Н, т); 3,23 (2Н, шир.с); 2,93 (2Н, д); 2,76 (2Н, шир.д); 1,94 (3Н, шир.с); 1,77-1,36 (1Н, м); 1,53 (6Н, с).
Пример 64
Гидрохлоридная соль (±)-2-хлор-5-(гидрокси-3-пиперидинилметил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
Получение проводят способом, аналогичным примеру 63, с использованием 1,1-диметилэтилового эфира 3-формил-1-пиперидинкарбоновой кислоты.
МС (APCI+ve) ММ 417/419 (M+H)+
1Н ЯМР (CD3OD) δ 8,41 (1Н, т); 7,46 (1Н, д); 7,41 (1Н, д); 7,39 (1Н, с); 4,65 (0,5Н, д); 4,50 (0,5Н, д); 3,74 (0,5Н, тд); 3,66 (1Н, кв); 3,57 (0,5Н, т); 3,44 (0,5Н, шир.д); 3,18 (0,5Н, шир.д); 3,06 (2Н, д); 2,86 (2Н, квд); 2,10-1,87 (м, 2Н); 1,98 (3Н, шир.с); 1,77 (3Н, д); 1,68 (3Н, шир.д); 1,63 (6Н, с), 1,60-1,50 (м, 1Н); 1,50-1,36 (м, 1Н).
Пример 65
Гидрохлоридная соль 2-бром-5-пиперазин-1-илметил-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
а) 2-Бром-5-бромметил-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид
К раствору 2-бром-5-бромметилбензойной кислоты (6,1 г) в дихлорметане (100 мл) при 0°С добавляют диметилформамид (0,2 мл), затем оксалилхлорид (3 мл). Реакционную смесь перемешивают при комнатной температуре в течение 0,5 часа и концентрируют в вакууме. Ацилхлорид снова растворяют в дихлорметане (100 мл) и при 0°С добавляют диизопропилэтиламин (6 мл), затем адамантанметиламин (3,5 мл). Смесь перемешивают при 0°С в течение 10 мин, затем распределяют между диэтиловым эфиром и 1 н. водной хлористоводородной кислотой. Органический слой сушат над сульфатом магния и концентрируют в вакууме. Сырой продукт очищают перекристаллизацией из смеси дихлорметан/этилацетат/изогексан с получением указанного в заголовке соединения в виде белого твердого вещества (6,5 г) (образец содержит некоторое количество соответствующего бензилхлорида).
b) 2-Бром-5-(4-[{1,1-диметилэтил}оксикарбонил]пиперазин-1-ил)метил-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид
Смесь 2-бром-5-бромметил-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (пример 65а, 5,0 г), 1-трет-бутилоксикарбонилпиперазина (2,3 г), карбоната калия (3,2 г), иодида калия (0,30 г) и ацетона (75 мл) кипятят с обратным холодильником в темноте в течение 14 ч. Смесь концентрируют в вакууме, распределяют между этилацетатом и водой, затем промывают насыщенным раствором соли. Органический слой сушат над сульфатом магния и концентрируют в вакууме. Перекристаллизация из смеси этилацетат:изогексан дает указанное в подзаголовке соединение в виде бесцветного твердого вещества (4,7 г).
МС (APCI+ve) ММ 546 (М+Н)+.
с) Гидрохлоридная соль 2-бром-5-пиперазин-1-илметил-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
2-Бром-5-(4-[{1,1-диметилэтил}оксикарбонил]пиперазин-1-ил)метил-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид (пример 65b, 0,40 г) растворяют в метаноле (15 мл) и добавляют 4 н. HCl в диоксане (3 мл). Смесь перемешивают при комнатной температуре в течение 14 ч. Растворитель удаляют в вакууме и образовавшееся твердое вещество растирают с эфиром с получением указанного в заголовке соединения в виде белого порошка (0,23 г).
МС (APCI+ve) ММ 447 (M+H)+
1Н ЯМР (ДМСО-d6) δ 9,53 (1Н, с, шир.); 8,31 (1Н, т); 7,72 (1Н, д); 7,60 (1Н, м), 4,33 (1Н, м); 3,50-3,00 (4Н, м); 3,50-3,40 (1Н, м); 2,94 (2Н, д); 1,94 (3Н, шир.с); 1,71-1,58 (6Н, м); 1,54 (6Н, шир.с).
Пример 66
Гидрохлоридная соль 2-хлор-5-[2-(1-пиперазинил)этил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
а) 2-Хлор-5-(2-гидроксиэтил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид
Раствор 5-бром-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (3,0 г, пример 23а) в безводном тетрагидрофуране (100 мл) охлаждают до -78°С в атмосфере азота. На протяжении 2 мин добавляют раствор метиллития (1,4 М в диэтиловом эфире, 4,9 мл). Смесь перемешивают при -78°С в течение 10 мин, затем по каплям добавляют раствор трет-бутиллития (1,7 М в пентане, 9,3 мл). Смесь перемешивают при -78°С в течение дополнительных 10 мин, затем добавляют оксид этилена (1,0 мл). Образовавшийся раствор перемешивают при -78°С в течение 30 мин, затем нагревают до 0°С и перемешивают в течение дополнительных 6 ч. Реакционную смесь гасят насыщенным водным раствором хлорида аммония (70 мл) и экстрагируют этилацетатом (3×100 мл). Объединенные экстракты сушат над безводным сульфатом магния, фильтруют и фильтрат концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле с элюированием смесью дихлорметан:этанол (98:2) с получением указанного в подзаголовке соединения в виде бледно-желтого твердого вещества (0,89 г).
МС (APCI+ve) 348 (M+H)+
1Н ЯМР (ДМСО-d6) δ 8,27 (1Н, т), 7,36 (1Н, д); 7,28-7,23 (2Н, м); 4,65 (1Н, т); 3,60 (2Н, кв); 2,92 (2Н, д); 2,73 (2Н, т); 1,94 (3Н, шир.с); 1,63 (6Н, кв); 1,52 (6Н, д).
b) 2-Хлор-5-(2-оксоэтил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид
К раствору 2-хлор-5-(2-гидроксиэтил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (1,07 г, пример 66а) в безводном дихлорметане (20 мл) добавляют реагент Dess-Martin periodinan (1,95 г) и смесь перемешивают при комнатной температуре в течение 1 ч. Тиосульфат натрия (3,43 г) растворяют в водном растворе бикарбоната натрия (28 мл) и добавляют к реакционной смеси. Затем добавляют диэтиловый эфир (50 мл) и смесь перемешивают в течение 10 мин. Слои разделяют и органический слой промывают водой, затем насыщенным раствором соли. Органические экстракты затем сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении с получением указанного в подзаголовке соединения в виде белого твердого вещества (1,06 г).
МС (APCI+ve) 346 (M+H)+
1Н ЯМР (ДМСО-d6) δ 9,69 (1Н, с); 8,32 (1Н, т); 7,45 (1Н, д); 7,30-7,24 (2Н, м); 3,84 (2Н, с); 2,92 (2Н, д); 1,94 (3Н, шир.с); 1,63 (6Н, кв); 1,52 (6Н, д).
с) Гидрохлоридная соль 2-хлор-5-[2-(1-пиперазинил)этил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
К раствору 2-хлор-5-(2-оксоэтил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (0,101 г, пример 66b) в безводном 1,2-дихлорэтане (5 мл) добавляют 1,1-диметилэтиловый эфир 1-пиперазинкарбоновой кислоты (0,108 г), затем триацетоксиборогидрид натрия (0,086 г). Реакционную смесь перемешивают в течение 14 ч при комнатной температуре. Добавляют воду (10 мл) и дихлорметан (10 мл) и слои разделяют. Органический экстракт сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток очищают ВЭЖХ с элюированием c градиентом 0-5% этанол в дихлорметане, затем хроматографией на силикагеле с элюированием этилацетатом. Полученный белый порошок растворяют в метаноле (5 мл) и добавляют раствор хлористоводородной кислоты в диоксане (4 н., 1 мл). Смесь перемешивают в течение 14 ч при комнатной температуре. Растворители затем удаляют при пониженном давлении и полученный продукт растирают с диэтиловым эфиром с получением указанного в заголовке соединения в виде белого порошка (0,047 г).
МС (APCI+ve) 416 (M+H)+
1Н ЯМР (CD3OD) δ 8,42 (1Н, т); 7,46 (1Н, д); 7,41-7,38 (2Н, м); 3,63-3,49 (8Н, м); 3,48-3,45 (2Н, м); 3,19-3,14 (2Н, м); 3,06 (2Н, с); 1,99 (3Н, шир.с); 1,73 (6Н, кв); 1,63 (6Н, д).
Пример 67
Гидрохлоридная соль 2-хлор-5-[2-(2,5-диазабицикло[2.2.1]гепт-2-ил)этил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
Получение проводят по способу, описанному в примере 66с, из 2-хлор-5-(2-оксоэтил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (0,094 г, пример 66b), 1,1-диметилэтилового эфира 2,5-диазабицикло[2.2.1]гептан-2-карбоновой кислоты (0,108 г), триацетоксиборогидрида натрия (0,081 г) и 1,2-дихлорэтана (2 мл). После обработки остаток очищают ВЭЖХ с элюированием с градиентом 0-5% этанол в дихлорметане. Полученный белый порошок растворяют в метаноле (2 мл) и добавляют раствор хлористоводородной кислоты в диоксане (4 н., 1 мл). Смесь перемешивают в течение 14 ч при комнатной температуре. Растворители затем удаляют при пониженном давлении и полученный продукт растирают с диэтиловым эфиром с получением указанного в заголовке соединения в виде белого порошка (0,067 г).
МС (APCI+ve) 428 (M+H)+
1Н ЯМР (CD3OD) δ 7,49-7,40 (3Н, м); 4,64 (2Н, д); 3,92 (2Н, д); 3,77-3,48 (4Н, м); 3,18 (2Н, т); 3,08 (2Н, с); 2,61 (1Н, шир.д); 2,28 (1Н, шир.д); 2,00 (3Н, шир.с); 1,75 (6Н, кв); 1,64 (6Н, д).
Пример 68
Гидрохлоридная соль 5-[2-(4-амино-1-пиперидинил)этил]-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
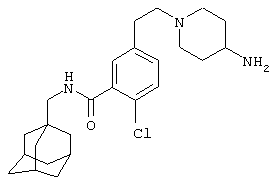
Получение проводят по способу, описанному в примере 66с, из 2-хлор-5-(2-оксоэтил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (0,094 г, пример 66b), 1,1-диметилэтилового эфира 4-пиперидинилкарбаминовой кислоты (0,109 г), триацетоксиборогидрида натрия (0,081 г) и 1,2-дихлорэтана (2 мл). После обработки остаток очищают ВЭЖХ с элюированием с градиентом 0-5% этанол в дихлорметане. Полученный белый порошок растворяют в метаноле (2 мл) и добавляют раствор хлористоводородной кислоты в диоксане (4 н., 1 мл). Смесь перемешивают в течение 14 ч при комнатной температуре. Растворители затем удаляют при пониженном давлении и полученный продукт растирают с диэтиловым эфиром с получением указанного в заголовке соединения в виде белого порошка (0,065 г).
МС (APCI+ve) 430 (M+H)+
1Н ЯМР (CD3OD) δ 8,43 (1Н, т); 7,49-7,38 (3Н, м); 3,78 (2Н, шир.д); 3,64-3,42 (2Н, м); 3,41-3,35 (2Н, м); 3,23-3,14 (3Н, м); 3,08 (2Н, с); 2,33-2,29 (2Н, м); 2,13-2,04 (2Н, м); 2,00 (3Н, шир.с); 1,75 (6Н, кв); 1,64 (6Н, д).
Пример 69
Дигидрохлоридная соль 2-хлор-5-[2-(3-пиперидиниламино)этил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
Получение проводят по способу, описанному в примере 66с, из 2-хлор-5-(2-оксоэтил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (0,094 г, пример 66b), 1,1-диметилэтилового эфира 3-амино-1-пиперидинкарбоновой кислоты (0,109 г), триацетоксиборогидрида натрия (0,081 г) и 1,2-дихлорэтана (2 мл). После обработки остаток очищают ВЭЖХ с элюированием с градиентом 0-5% этанол в дихлорметане. Полученный белый порошок растворяют в метаноле (2 мл) и добавляют раствор хлористоводородной кислоты в диоксане (4 н., 1 мл). Смесь перемешивают в течение 14 ч при комнатной температуре. Растворители затем удаляют при пониженном давлении и полученный продукт растирают с диэтиловым эфиром с получением указанного в заголовке соединения в виде белого порошка (0,065 г).
МС (APCI+ve) 430 (M+H)+
1Н ЯМР (CD3OD) δ 7,49-7,46 (1Н, м); 7,42-7,38 (2Н, м); 3,76 (1Н, шир.д); 3,64-3,54 (1Н, м); 3,44-3,34 (3Н, м); 3,19-2,98 (4Н, м); 3,08 (2Н, с); 2,34 (1Н, шир.д); 2,18-2,12 (1Н, м); 2,00 (3Н, шир.с); 1,89-1,78 (2Н, м); 1,74 (6Н, кв); 1,64 (6Н, д).
Пример 70
Гидрохлоридная соль 5-[2-(3-амино-1-пиперидинил)этил]-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
Получение проводят по способу, описанному в примере 66с, из 2-хлор-5-(2-оксоэтил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (0,094 г, пример 66b), 1,1-диметилэтилового эфира 3-пиперидинилкарбаминовой кислоты (0,109 г), триацетоксиборогидрида натрия (0,081 г) и 1,2-дихлорэтана (2 мл). После обработки остаток очищают ВЭЖХ с элюированием градиентом 0-5% этанол в дихлорметане, затем ВЭЖХ с элюированием с градиентом 0-2% этанол в дихлорметане. Полученный белый порошок растворяют в метаноле (2 мл) и добавляют раствор хлористоводородной кислоты в диоксане (4 н., 1 мл). Смесь перемешивают в течение 14 ч при комнатной температуре. Растворители затем удаляют при пониженном давлении и полученный продукт растирают с диэтиловым эфиром с получением указанного в заголовке соединения в виде белого порошка (0,032 г).
МС (APCI+ve) 430 (M+H)+
1Н ЯМР (CD3OD) δ 7,49-7,46 (1Н, м); 7,42-7,39 (2Н, м); 3,80-3,67 (3Н, м); 3,46 (2Н, т); 3,19 (2Н, т); 3,08 (2Н, с); 3,09-3,04 (1Н, м); 2,14 (1Н, шир.т); 2,00 (3Н, шир.с); 1,74 (6Н, кв); 1,77-1,68 (2Н, м); 1,64 (6Н, д).
Пример 71
Дигидрохлоридная соль 2-хлор-5-[2-(3-пирролидиниламино)этил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
Получение проводят по способу, описанному в примере 66с, из 2-хлор-5-(2-оксоэтил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (0,094 г, пример 66b), 1,1-диметилэтилового эфира 3-амино-1-пирролидинкарбоновой кислоты (0,101 г), триацетоксиборогидрида натрия (0,081 г) и 1,2-дихлорэтана (2 мл). После обработки остаток очищают ВЭЖХ с элюированием с градиентом 0-5% этанол в дихлорметане. Полученный бледно-оранжевый порошок растворяют в метаноле (2 мл) и добавляют раствор хлористоводородной кислоты в диоксане (4 н., 1 мл). Смесь перемешивают в течение 14 ч при комнатной температуре. Растворители затем удаляют при пониженном давлении и полученный продукт растирают с диэтиловым эфиром с получением указанного в заголовке соединения в виде бледно-оранжевого порошка (0,033 г).
МС (APCI+ve) 416 (M+H)+
1Н ЯМР (CD3OD) δ 7,46-7,39 (3Н, м); 4,12 (1Н, шир.с); 3,78-3,71 (1Н, м); 3,69-3,57 (2Н, м); 3,43-3,42 (4Н, м); 3,13 (2Н, шир.т); 3,06 (2Н, с); 2,62-2,51 (1Н, м); 2,38-2,29 (1Н, м); 1,98 (3Н, с); 1,73 (6Н, кв); 1,63 (6Н, с).
Пример 72
Гидрохлоридная соль 5-[2-[(3R)-3-аминопирролидинил]этил]-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
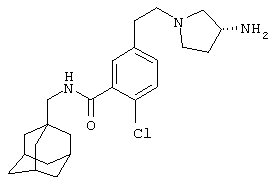
Получение проводят по способу, описанному в примере 66с, из 2-хлор-5-(2-оксоэтил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (0,094 г, пример 66b), 1,1-диметилэтилового эфира (3R)-пирролидинилкарбаминовой кислоты (0,101 г), триацетоксиборогидрида натрия (0,081 г) и 1,2-дихлорэтана (2 мл). После обработки остаток очищают ВЭЖХ с элюированием с градиентом 0-5% этанол в дихлорметане. Полученный белый порошок растворяют в метаноле (2 мл) и добавляют раствор хлористоводородной кислоты в диоксане (4 н., 1 мл). Смесь перемешивают в течение 14 ч при комнатной температуре. Растворители затем удаляют при пониженном давлении и полученный продукт растирают с диэтиловым эфиром с получением указанного в заголовке соединения в виде белого порошка (0,060 г).
МС (APCI+ve) 416 (M+H)+
1Н ЯМР (CD3OD) δ 7,49-7,41 (3Н, м); 4,86 (1Н, шир.с); 4,05-3,80 (2Н, м); 3,58 (4Н, шир.с); 3,17 (2Н, т); 3,08 (2Н, с); 2,66 (1Н, шир.с); 2,28 (1Н, шир.с); 2,00 (3Н, с); 1,74 (6Н, кв); 1,64 (6Н, с).
Пример 73
Гидрохлоридная соль 2-хлор-5-[2-[2-(гидроксиметил)-1-пиперазинил]этил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
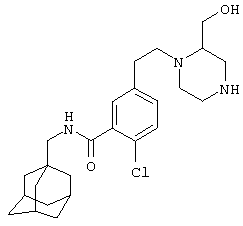
Получение проводят по способу, описанному в примере 66с, из 2-хлор-5-(2-оксоэтил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (0,094 г, пример 66b), 1,1-диметилэтилового эфира 3-(гидроксиметил)-1-пиперазинкарбоновой кислоты (0,117 г), триацетоксиборогидрида натрия (0,081 г) и 1,2-дихлорэтана (2 мл). После обработки остаток очищают ВЭЖХ с элюированием с градиентом 0-5% этанол в дихлорметане, затем хроматографией с элюированием этилацетатом, затем смесью этилацетат:этанол (95:5). Полученный белый порошок растворяют в метаноле (2 мл) и добавляют раствор хлористоводородной кислоты в диоксане (4 н., 1 мл). Смесь перемешивают в течение 14 ч при комнатной температуре. Растворители затем удаляют при пониженном давлении и полученный продукт растирают с диэтиловым эфиром с получением указанного в заголовке соединения в виде белого порошка (0,016 г).
МС (APCI+ve) 446 (M+H)+
1Н ЯМР (CD3OD) δ 8,43 (1Н, т); 7,48-7,40 (3Н, м); 4,14 (1Н, шир.д); 3,93 (1Н, шир.д); 3,81-3,76 (2Н, м); 3,74-3,58 (5Н, м); 3,57-3,45 (2Н, м); 3,28-3,19 (1Н, м); 3,17-3,11 (1Н, м); 3,07 (2Н, с); 1,99 (3Н, шир.с); 1,73 (6Н, кв); 1,64 (6Н, с).
Пример 74
Гидрохлоридная соль 2-хлор-5-(гексагидро-1Н-1,4-диазепин-1-ил)-N-(2-трицикло[3.3.1.13,7]дец-1-илэтил)бензамида
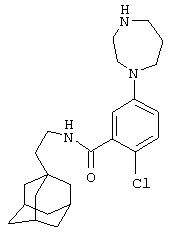
а) 1,1-Диметилэтиловый эфир 4-[4-хлор-3-[[(2-трицикло[3.3.1.13,7]дец-1-илэтил)амино]карбонил]фенил]гексагидро-1Н-1,4-диазепин-1-карбоновой кислоты
Раствор 1,1-диметилэтилового эфира 4-(3-карбокси-4-хлорфенил)гексагидро-1Н-1,4-диазепин-1-карбоновой кислоты (0,075 г, пример 5b) и 1,1'-карбонилдиимидазола (0,034 г) в диметилформамиде (3 мл) перемешивают при комнатной температуре 2,5 ч. Затем добавляют гидрохлоридную соль трицикло[3.3.1.13,7]декан-1-этанамина (0,045 г) и N,N-диизопропилэтиламин (0,037 мл) и перемешивание продолжают в течение 14 ч. Реакционную смесь выливают в воду и экстрагируют три раза этилацетатом. Слои этилацетата объединяют и промывают 2 М хлористоводородной кислотой, 10% водным гидроксидом натрия и насыщенным раствором соли, затем сушат над сульфатом магния и концентрируют при пониженном давлении. Очистка хроматографией на силикагеле с элюированием 20% этилацетатом в изогексане дает указанное в подзаголовке соединение в виде желтого масла (0,053 г).
МС (APCI+ve) 460/462 (M-tBu)-.
b) Гидрохлоридная соль 2-хлор-5-(гексагидро-1Н-1,4-диазепин-1-ил)-N-(2-трицикло[3.3.1.13,7]дец-1-илэтил)бензамида
1,1-Диметилэтиловый эфир 4-[4-хлор-3-[[(2-трицикло[3.3.1.13,7]дец-1-илэтил)амино]карбонил]фенил]гексагидро-1Н-1,4-диазепин-1-карбоновой кислоты (0,053 г, пример 74а) растворяют в метаноле (5 мл) и добавляют хлористоводородную кислоту (0,5 мл 4 н. раствора в диоксане). После перемешивания при комнатной температуре в течение 14 ч смесь упаривают до 3/4 начального объема при пониженном давлении. К раствору постепенно добавляют диэтиловый эфир и образовавшийся осадок собирают фильтрованием, промывают диэтиловым эфиром и сушат в вакууме с получением указанного в заголовке соединения в виде твердого вещества кремового цвета (0,017 г).
МС (APCI+ve) 416/418 (M-HCl)+
1Н ЯМР (ДМСО-d6) δ 9,07 (2Н, шир.с); 8,18 (1Н, т); 7,22 (1Н, д); 6,80 (1Н, дд); 6,71 (1Н, д); 3,70 (2Н, м); 3,50 (2Н, т); 3,25-3,17 (4Н, м); 3,07 (2Н, м); 2,09-2,06 (2Н, м); 1,93 (3Н, шир.с); 1,68 (3Н, д); 1,61 (3Н, д); 1,51 (6Н, с); 1,34-1,28 (2Н, м).
Пример 75
Гидрохлоридная соль (+/-)-5-(3-амино-1-пирролидинил)-2-хлор-N-(2-трицикло[3.3.1.13,7]дец-1-илэтил)бензамида
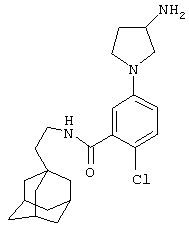
Получение проводят, как описано в примере 74, с использованием (+/-)-2-хлор-5-[3-[[(1,1-диметилэтокси)карбонил]амино]-1-пирролидинил]бензойной кислоты (0,090 г), 1,1'-карбонилдиимидазола (0,043 г), гидрохлоридной соли трицикло[3.3.1.13,7]декан-1-этанамина (0,057 г), N,N-диизопропилэтиламина (0,046 мл) и диметилформамида (3 мл). Данное соединение обрабатывают 4 н. хлористоводородной кислотой в диоксане (0,5 мл) и метанолом (5 мл) с получением указанного в заголовке соединения (0,025 г).
МС (APCI+ve) 402/404 (M-HCl)+
1Н ЯМР (ДМСО-d6) δ 8,24 (3Н, шир.с); 8,18 (1Н, т); 7,24 (1Н, д); 6,60 (1Н, дд); 6,49 (1Н, д); 3,93 (1Н, м); 3,54-3,37 (2Н, м); 3,31-3,17 (4Н, м); 2,37-2,28 (1Н, м); 2,07 (1Н, м); 1,93 (3Н, шир.с); 1,68 (3Н, д); 1,61 (3Н, д); 1,51 (6Н, с); 1,34-1,28 (2Н, м).
Пример 76
Гидрохлоридная соль 2-хлор-5-(4-пиперидинилкарбонил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
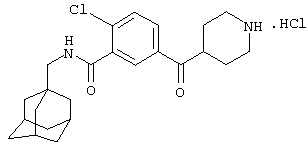
а) 1,1-Диметилэтиловый эфир 4-[4-хлор-3-[[(трицикло[3.3.1.13,7]дец-1-илметил)амино]карбонил]бензоил]-1-пиперидинкарбоновой кислоты
К диметилсульфоксиду (0,155 мл) в безводном дихлорметане (11 мл) при -78°С добавляют оксалилхлорид (0,086 мл) и смесь перемешивают в течение 5 мин при -78°С. По каплям добавляют раствор 1,1-диметилэтилового эфира 4-[[4-хлор-3-[[(трицикло[3.3.1.13,7]дец-1-илметил)амино]карбонил]фенил]гидроксиметил]-1-пиперидинкарбоновой кислоты (0,47 г, пример 64) в безводном дихлорметане (3 мл) и смесь перемешивают в течение 15 мин при -78°С. Затем добавляют триэтиламин (0,633 мл) и раствор нагревают до комнатной температуры. Спустя 45 мин реакционную смесь при комнатной температуре выливают в воду и слои разделяют. Органический экстракт сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток очищают ВЭЖХ с элюированием с градиентом 0-5% этанол в дихлорметане с получением указанного в подзаголовке соединения в виде белой пены (0,31 г).
МС (APCI+ve) 415 (M+H)+
1Н ЯМР (ДМСО-d6) δ 8,46 (1Н, т); 8,06-8,01 (1Н, м); 7,95-7,92 (1Н, м); 7,70-7,65 (1Н, м); 3,97 (2Н, шир.д); 3,72-3,61 (1Н, м); 2,97 (2Н, т); 2,92 (2Н, шир.с); 1,96 (3Н, шир.с); 1,77 (2Н, д); 1,65 (6Н, кв); 1,55 (6Н, с); 1,41 (9Н, с); 1,48-1,33 (2Н, м).
b) Гидрохлоридная соль 2-хлор-5-(4-пиперидинилкарбонил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
Раствор 1,1-диметилэтилового эфира 4-[4-хлор-3-[[(трицикло[3.3.1.13,7]дец-1-илметил)амино]карбонил]бензоил]-1-пиперидинкарбоновой кислоты (0,07 г, пример 76а) в метаноле (3 мл) обрабатывают 4 н. раствором хлористоводородной кислоты в диоксане (1 мл). Спустя 14 ч растворители удаляют при пониженном давлении и остаток растирают с диэтиловым эфиром с получением указанного в заголовке соединения в виде белого порошка (0,025 г).
МС (APCI+ve) 415 (M+H-HCl)+
1Н ЯМР (ДМСО-d6) δ 8,90 (1Н, шир.с); 8,64 (1Н, шир.с); 8,46 (1Н, т); 8,03 (1Н, д); 7,95 (1Н, с); 7,69 (1Н, д); 3,81 (1Н, т); 3,24-3,18 (2Н, м); 3,09-2,99 (2Н, м); 2,96 (2Н, д); 2,01 (2Н, дд); 1,95 (3Н, с); 1,79 (2Н, т); 1,64 (6Н, кв); 1,45 (6Н, с).
Пример 77
Гидрохлоридная соль 2-хлор-5-[1-гидрокси-1-(4-пиперидинил)этил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
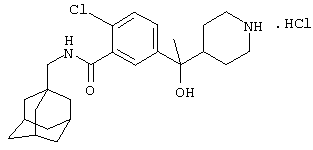
а) 1,1-Диметилэтиловый эфир 4-[1-[4-хлор-3-[[(трицикло[3.3.1.13,7]дец-1-илметил)амино]карбонил]фенил]-1-гидроксиэтил]-1-пиперидинкарбоновой кислоты
К метилмагнийбромиду (3 М раствор в диэтиловом эфире, 0,225 мл) в безводном диэтиловом эфире (7 мл) в атмосфере азота медленно добавляют 1,1-диметилэтиловый эфир 4-[4-хлор-3-[[(трицикло[3.3.1.13,7]дец-1-илметил)амино]карбонил]бензоил]-1-пиперидинкарбоновой кислоты (0,23 г, пример 76а) в безводном диэтиловом эфире (7 мл). Реакционную смесь перемешивают в течение 14 ч при комнатной температуре, затем выливают на измельченный лед. Добавляют 10% водный раствор гидросульфата калия для поддержания рН раствора >4. Слои разделяют и водный слой экстрагируют этилацетатом (4×25 мл). Органические экстракты объединяют, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток растворяют в метаноле (3 мл) и хлористоводородной кислоте (4 н. раствор в диоксане, 2 мл) и перемешивают в течение 14 ч при комнатной температуре. Растворители затем удаляют при пониженном давлении и продукт (0,11 г) снова растворяют в дихлорметане (3 мл). Добавляют триэтиламин (0,066 мл), затем ди-трет-бутилдикарбонат (0,055 г) и реакционную смесь перемешивают в течение 1 часа при комнатной температуре. Добавляют воду и слои разделяют. Органический экстракт сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток очищают ВЭЖХ с элюированием с градиентом 0-5% этанол в дихлорметане, затем ОФ-ВЭЖХ с элюированием с градиентом 75-5% 0,1% водного ацетата аммония в ацетонитриле с получением указанного в подзаголовке соединения в виде белой пеной (0,06 г).
МС (APCI+ve) 431 (М+Н-ВОС)+.
b) Гидрохлоридная соль 2-хлор-5-[1-гидрокси-1-(4-пиперидинил)этил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
К раствору 1,1-диметилэтилового эфира 4-[1-[4-хлор-3-[[(трицикло[3.3.1.13,7]дец-1-илметил)амино]карбонил]фенил]-1-гидроксиэтил]-1-пиперидинкарбоновой кислоты (0,07 г, пример 77а) в метаноле (3 мл) добавляют 4 н. раствор хлористоводородной кислоты в диоксане (1 мл). Спустя 14 ч растворители удаляют при пониженном давлении и остаток растирают с диэтиловым эфиром с получением указанного в заголовке соединения в виде белого порошка (0,038 г).
МС (APCI+ve) 431 (M+H-HCl)+
1Н ЯМР (ДМСО-d6) δ 8,78 (1Н, шир.с); 8,28 (1Н, т); 7,44-7,40 (3Н, м); 5,21 (1Н, с); 3,25 (1Н, д); 3,16 (1Н, д); 2,98-2,89 (2Н, м); 2,79-2,67 (2Н, м); 1,94 (3Н, шир.с); 1,84-1,75 (2Н, м); 1,63 (6Н, кв); 1,53 (6Н, с); 1,42 (3Н, с); 1,53-1,31 (3Н, м).
Пример 78
Гидрохлоридная соль 2-хлор-5-[2-(1-пиперазинил)этокси]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
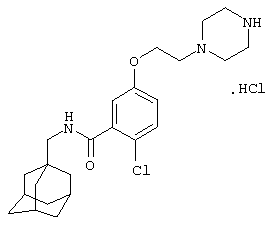
Получение проводят, как описано в примере 12b, с использованием 2-хлор-5-гидрокси-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (пример 12а) и 1,1-диметилэтилового эфира 4-(2-гидроксиэтил)-1-пиперазинкарбоновой кислоты.
МС (APCI+ve) 432 (M+H)+
1Н ЯМР (CD3OD) δ 8,40 (1Н, т); 7,41 (1Н, д); 7,14-7,06 (2Н, м); 4,45 (2Н, т); 3,76-3,58 (10Н, м); 3,07-3,03 (2Н, м); 1,98 (3Н, с); 1,77 (3Н, д); 1,69 (3Н, д); 1,62 (6Н, с).
Пример 79
Гидрохлоридная соль 2-хлор-5-[2-(4-пиперидинил)этокси]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
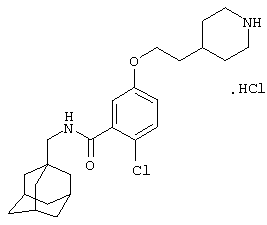
Получение проводят, как описано в примере 12b, с использованием 2-хлор-5-гидрокси-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (пример 12а) и 1,1-диметилэтилового эфира 4-(2-гидроксиэтил)-1-пиперидинкарбоновой кислоты.
МС (APCI+ve) 431 (M+H)+
1Н ЯМР (ДМСО-d6) δ 8,75 (1Н, шир.с); 8,49 (1Н, шир.с); 8,27 (1Н, т); 7,37 (1Н, д); 6,99 (1Н, дд); 6,91 (1Н, д); 4,03 (2Н, т); 3,22 (2Н, д); 2,92 (2Н, д); 2,82 (2Н, т); 1,94 (3Н, с); 1,82 (2Н, д); 1,79-1,70 (1Н, м); 1,69-1,64 (5Н, м); 1,59 (3Н, д); 1,53 (6Н, с); 1,43-1,30 (2Н, м).
Пример 80
Гидрохлоридная соль 2-хлор-5-[2-(4-пиперидинилокси)этокси]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
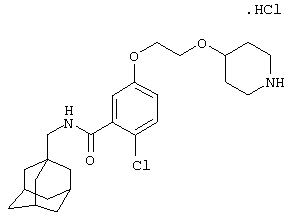
Получение проводят, как описано в примере 12b, с использованием 2-хлор-5-гидрокси-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (пример 12а) и 1,1-диметилэтилового эфира 4-(2-гидроксиэтокси)-1-пиперидинкарбоновой кислоты.
МС (APCI+ve) 447 (M+H)+
1Н ЯМР (CD3OD) δ 8,39 (1Н, шир.т); 7,38-7,33 (1Н, м); 7,06-6,98 (2Н, м); 4,22-4,16 (2Н, м); 3,88-3,82 (2Н, м); 3,80-3,71 (1Н, м); 3,36-3,24 (2Н, м); 3,16-3,04 (4Н, м); 1,99 (3Н, с); 2,08-1,86 (4Н, м); 1,78 (3Н, д); 1,69 (3Н, д); 1,62 (6Н, с).
Пример 81
Гидрохлоридная соль 2-хлор-5-[2-[2-(1-пиперазинил)этокси]этокси]-N-(трицикло[3.3.1.13,7 ]дец-1-илметил)бензамида
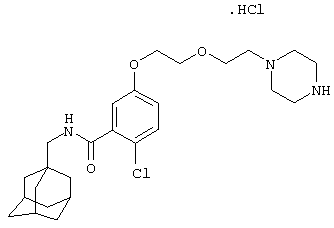
Получение проводят, как описано в примере 12b, с использованием 2-хлор-5-гидрокси-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (0,20 г, пример 12а) и 1,1-диметилэтилового эфира 4-[2-(2-гидроксиэтокси)этил]-1-пиперазинкарбоновой кислоты (0,26 г).
МС (APCI+ve) 476 (M+H)+
1Н ЯМР (CD3OD) δ 7,7 (1Н, дд); 7,04-7,01 (2Н, м); 4,25-4,18 (2Н, м); 3,94 (2Н, т); 3,91-3,87 (2Н, м); 3,80-3,43 (10Н, м); 3,06 (2Н, с); 1,99 (3Н, с); 1,75 (3Н, д); 1,67 (3Н, д); 1,62 (6Н, с).
Пример 82
2-Хлор-5-[(5,6-дигидро-1(4Н)-пиримидинил)метил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид
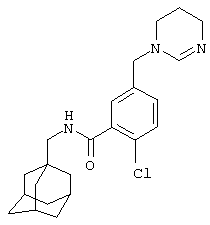
Получение проводят по способу, описанному в примере 8, из 5-бромметил-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (пример 8b) и 1,4,5,6-тетрагидропиримидина.
МС (APCI+ve) 400/402 (M+H)+
1Н ЯМР (CDCl3) δ 7,84 (1Н, с); 7,60 (1Н, д); 7,43 (1Н, д); 7,29 (1Н, дд); 6,51 (1Н, т); 4,39 (2Н, с); 3,40-3,10 (3Н, м); 3,17 (2Н, д); 3,14 (1Н, т); 2,01 (3Н, с); 1,91 (кв, 2Н); 1,74 (3Н, д); 1,64 (3Н, д); 1,59 (6Н, шир.с).
Пример 83
Гидрохлоридная соль 2-хлор-5-[[4-[(2-гидроксиэтил)амино]-1-пиперидинил]метил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
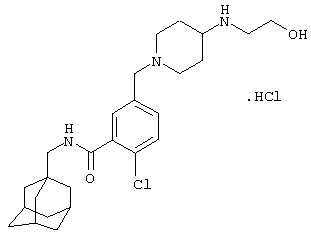
а) 2-Хлор-5-[(4-оксо-1-пиперидинил)метил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид
Получение проводят по способу, описанному в пример 8с, из 5-бромметил-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (пример 8b) и 4-пиперидинона.
МС (APCI+ve) 456/458 (M+H)+.
b) Гидрохлоридная соль 2-хлор-5-[[4-[(2-гидроксиэтил)амино]-1-пиперидинил]метил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
К раствору 2-хлор-5-[(4-оксо-1-пиперидинил)метил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (0,150 г, пример 83а) в метаноле (3 мл) при комнатной температуре добавляют этаноламин (0,11 мл) и цианоборогидрид натрия (0,068 г). рН регулируют до 6 добавлением 4 н. раствора хлорида водорода в диоксане и реакционную смесь перемешивают в течение 48 ч. Реакционную смесь подкисляют концентрированной хлористоводородной кислотой до прекращения выделения газа. Осадок удаляют фильтрованием и фильтрат концентрируют в вакууме. Остаток распределяют между этилацетатом и водой. Водный слой подщелачивают 5% водным гидроксидом натрия и экстрагируют дихлорметаном. Органическую часть промывают насыщенным раствором соли и сушат над сульфатом магния. Сырой материал очищают на силикагеле (5% 7 н. аммиака в метаноле/95% дихлорметана) с получением белой пены, которую растворяют в смеси эфир/метанол и обрабатывают 4 н. раствором хлорида водорода в диоксане с получением указанного в заголовке соединения (0,135 г).
МС (APCI+ve) 460/462 (M+H)+
1Н ЯМР (CD3OD) δ 8,47 (1Н, т); 7,67 (1Н, д); 7,64 (1Н, дд); 7,60 (1Н, д); 4,39 (2Н, с); 3,81 (2Н, т); 3,62 (2Н, шир.д); 3,52 (1Н, т); 3,23-3,10 (4Н, м); 3,09 (2Н, д); 2,39 (2Н, д); 2,07 (2Н, кв); 1,99 (с, 3Н); 1,77 (3Н, д); 1,70 (3Н, д); 1,64 (6Н, д).
Пример 84
2-Хлор-5-[[4-гидрокси-4-[[(1-метилэтил)амино]метил]-1-пиперидинил]метил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид
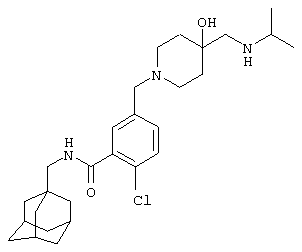
а) 2-Хлор-5-(1-окса-6-азаспиро[2.5]окт-6-илметил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид
К диметилсульфоксиду (2 мл) добавляют гидрид натрия (0,033 г, 60% в масле) при комнатной температуре. Смесь перемешивают в течение 5 мин при такой температуре и добавляют раствор иодида триметилсульфоксония (0,178 г) в диметилсульфоксиде (2 мл). Спустя 30 мин добавляют 2-хлор-5-[(4-оксо-1-пиперидинил)метил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид (0,28 г, пример 83а) в диметилсульфоксиде (2 мл) и реакционную смесь перемешивают при комнатной температуре в течение 3 ч до гашения смесью лед/вода (20 мл). Смесь экстрагируют три раза этилацетатом, объединенные органические слои промывают насыщенным раствором соли и сушат над сульфатом магния. Сырой материал очищают на силикагеле с элюированием этилацетатом с получением указанного в подзаголовке соединения в виде белой пены (0,25 г).
МС (APCI+ve) 429/431 (M+H)+
1Н ЯМР (CDCl3) δ 7,68 (1Н, с); 7,40-7,30 (2Н, м); 6,27 (1Н, т); 3,54 (2Н, с); 3,18 (2Н, д); 2,70-2,50 (6Н, м); 2,00 (с, 3Н); 1,90-1,75 (2Н, м); 1,74 (3Н, д); 1,66 (3Н, д); 1,59 (6Н, шир.с); 1,80-1,50 (м, 2Н).
b) 2-Хлор-5-[[4-гидрокси-4-[[(1-метилэтил)амино]метил]-1-пиперидинил]метил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид
В запаянной трубке 2-хлор-5-(1-окса-6-азаспиро[2.5]окт-6-илметил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид (пример 84а, 0,15 г) растворяют в смеси этанола (4 мл) и диизопропиламина (1 мл) и нагревают при 65°С в течение 14 ч. Летучие компоненты удаляют в вакууме и остаток очищают на силикагеле (5% 7 н. аммиака в метаноле/95% дихлорметана) с получением указанного в заголовке соединения в виде белого твердого вещества (0,115 г).
МС (APCI+ve) 488/490 (M+H)+
1Н ЯМР (CD3OD) δ 7,45-7,35 (3Н, м); 3,55 (2Н, с); 3,06 (2Н, с); 2,76 (1Н, кв); 2,70-2,55 (2Н, м); 2,54 (2Н, с); 2,50-2,35 (2Н, м); 1,99 (с, 3Н); 1,77 (3Н, д); 1,70 (3Н, д); 1,63 (10Н, шир.с); 1,07 (м, 2Н).
Пример 85
Гидрохлоридная соль 2-хлор-5-[(1,2,3,6-тетрагидро-3-пиридинил)метил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
К пиридину (6 мл) при 0°С добавляют порциями литийалюминийгидрид (0,24 г). Смеси дают возможность нагреться до комнатной температуры и перемешивают в течение 24 ч. Добавляют иодид лития (0,220 г) и пиридин (1 мл) и реакционную смесь перемешивают в течение еще 1 ч. К раствору при комнатной температуре добавляют 5-бромметил-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид (0,30 г, пример 8b) в сухом пиридине (2 мл). Спустя 2 ч смесь гасят при 0°С холодным 15% водным раствором уксусной кислоты, перемешивают в течение часа и концентрируют в вакууме. Остаток растворяют в 1 н. гидроксиде натрия, экстрагируют дихлорметаном и органические слои сушат над сульфатом магния. Сырой материал очищают на силикагеле (2-10% 7 н. аммиака в смеси метанол/дихлорметан), затем обрабатывают 4 н. раствором хлорида водорода в диоксане и метанолом с получением указанного в заголовке соединения (0,20 г).
МС (APCI+ve) 399/401 (M+H)+
1Н ЯМР (CD3OD) δ 8,42 (1Н, т); 7,43 (1Н, дд); 7,32 (1Н, дд); 7,30 (д, 1Н); 5,89 (1Н, д); 5,80 (1Н, д); 3,64 (2Н, с); 3,40-3,30 (1Н, м); 3,06 (4Н, д); 1,99 (с, 3Н); 1,78 (3Н, д); 1,68 (3Н, д); 1,63 (6Н, д).
Пример 86
Ацетатная соль 2-хлор-5-(3-пиперидинилметил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
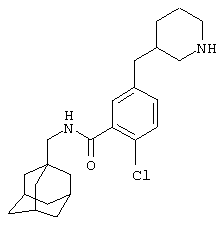
а) Ацетатная соль 2-хлор-5-(3-пиридинилметил)-N-(трицикло [3.3.1.13,7]дец-1-илметил)бензамида
К пиридину (12 мл) при 0°С добавляют порциями литийалюминийгидрид (0,46 г). Смеси дают возможность нагреться до комнатной температуры и перемешивают в течение 24 ч. Добавляют иодид лития (0,44 г) и пиридин (5 мл) и реакционную смесь перемешивают в течение еще 1 ч. Раствор охлаждают до -10°С и добавляют 5-бромметил-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид (пример 8b, 0,5 г) в сухом пиридине (5 мл). Спустя 1 час смесь гасят при -10 градусах холодной водой, затем 1 н. гидроксидом натрия. Раствор перемешивают в течение 1 ч, затем концентрируют в вакууме. Остаток растворяют в воде, экстрагируют дихлорметаном и органические слои сушат над сульфатом магния. Сырой материал очищают на силикагеле (этилацетат:изогексан, 4:1) с получением указанного в подзаголовке соединения в виде белой пены (0,355 г).
b) Ацетатная соль 2-хлор-5-(3-пиперидинилметил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида
2-Хлор-5-(3-пиридинилметил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид (0,10 г, пример 86а) растворяют в метаноле и обрабатывают 4 н. раствором хлорида водорода в диоксане. Гидрохлоридную соль выделяют и гидрируют в этаноле над оксидом платины с последующим проведением процедуры, описанной в примере 51, с получением указанного в заголовке соединения в виде ацетатной соли после очистки ВЭЖХ с обращенной фазой (0,1% водный ацетат аммония/ацетонитрил) (0,053 г).
МС (APCI+ve) 401/403 (M+H)+
1Н ЯМР (CD3OD) δ 7,42 (1Н, д); 7,31-7,25 (2Н, м); 3,38-3,28 (1Н, м); 3,28-3,18 (1Н, 2м); 3,07 (2Н, с); 2,86 (1Н, дт); 2,72-2,61 (1Н, м); 2,65 (1Н, д); 2,13-2,05 (1Н, м); 2,01 (3Н, с); 1,94 (3Н, с); 1,90-1,85 (1Н, м); 1,85-1,60 (2Н, м); 1,80 (3Н, д); 1,71 (3Н, д); 1,64 (6Н, д); 1,29 (1Н, квд).
Пример 87
2-Бром-5-[[4-[(2-гидроксиэтил)амино]-1-пиперидинил]метил-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид
Получение проводят по способам, описанным в примере 83a и 83b, из 2-бром-5-бромметил-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (пример 65а), 4-пиперидона и этаноламина.
МС (APCI+ve) ММ 505/506 (M+H)+
1Н ЯМР (CDCl3) δ 7,53 (1Н, д); 7,52 (1Н, д); 7,26 (1Н, дд); 6,05 (1Н, т); 3,65 (2Н, т); 3,46 (2Н, с); 3,17 (2Н, д); 2,82 (2Н, т); 2,60-2,45 (1Н, м); 2,20-1,95 (7Н, м); 1,95-1,82 (2Н, шир.д); 1,75 (3Н, д); 1,66 (3Н, д); 1,61 (6Н, д); 1,50-1,35 (2Н, квд).
Пример 88
2-Хлор-5-[(E)-3-пиперидинилиденметил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид
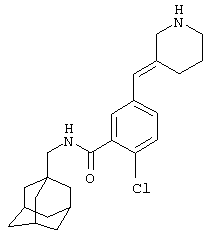
а) 2-Хлор-5-[(E)-(5,6-дигидро-3(4Н)-пиридинилиден)метил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид
2-Хлор-5-формил-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид (0,152 г, пример 31а) и тример 2,3,4,5-тетрагидропиридина (Org. Synth., 1977, Vol. 56, 118-122, 0,038 г) растворяют в метаноле (3 мл) и нагревают при кипячении с обратным холодильником в течение 4 ч. Смесь упаривают при пониженном давлении, затем очищают ВЭЖХ с элюированием с градиентом 0-5% этанол в дихлорметане с получением указанного в подзаголовке соединения в виде белой пены (0,046 г).
МС (APCI+ve) 397 (M+H)+
1Н ЯМР (CD3OD) δ 7,98 (1Н, с); 7,51 (3Н, с); 6,83 (1Н, с); 3,66-3,62 (2Н, м); 3,07 (2Н, с); 2,78-2,73 (2Н, м); 1,99 (3Н, шир.с); 1,73 (6Н, кв); 1,77-1,69 (2Н, м); 1,64 (6Н, с).
b) 2-Хлор-5-[(E)-3-пиперидинилиденметил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид
Борогидрид натрия (0,009 г) в метаноле (0,5 мл) добавляют к раствору 2-хлор-5-[(E)-(5,6-дигидро-3(4Н)-пиридинилиден)метил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида (0,046 г, пример 88а) в метаноле (1,5 мл). Реакционную смесь перемешивают в течение 4 ч в атмосфере азота при комнатной температуре. Добавляют концентрированную хлористоводородную кислоту (0,01 мл) и смесь упаривают при пониженном давлении. Для повторного подщелачивания остатка добавляют водный раствор гидроксида натрия (2 М, 2 мл), затем воду (10 мл) и дихлорметан (10 мл). Слои разделяют и водный слой экстрагируют далее дихлорметаном (2×10 мл). Органические экстракты объединяют, сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении с получением указанного в заголовке соединения в виде белого порошка (0,024 г).
МС (APCI+ve) 399 (M+H)+
1Н ЯМР (CD3OD) δ 7,43 (1Н, д); 7,29-7,26 (2Н, м); 6,38 (1Н, с); 3,45 (2Н, с); 3,07 (2Н, с); 2,96 (2Н, т); 2,55 (2Н, т); 2,00 (3Н, шир.с); 1,75 (6Н, кв); 1,81-1,64 (2Н, м); 1,64 (6Н, с).
Фармакологический анализ
Известно, что некоторые соединения, такие как бензоилбензоиладенозинтрифосфат (ббATФ), являются агонистами Р2Х7-рецептора, оказывающего влияние на образование пор в мембране плазмы (Drug Development Research (1996), 37(3), р. 126). Следовательно, когда рецептор активируется с использованием ббАТФ в присутствии бромида этидия (флуоресцентный зонд ДНК), наблюдают повышение флуоресценции связанного с внутриклеточными ДНК бромида этидия. Повышение флуоресценции можно использовать для измерения активации Р2Х7-рецептора и, следовательно, количественно определить влияние соединения на Р2Х7-рецептор.
Таким способом каждое из указанных в заголовке соединений примеров 1-88 испытали на антагонистическую активность в отношении Р2Х7-рецептора. Таким образом, испытание проводили в 96-луночных титрационных микропланшетах, имеющих лунки с плоским дном, причем лунки наполняли 250 мкл испытуемого раствора, включающего 200 мкл суспензии ТНР-1-клеток (2,5×106 клеток/мл), содержащих 10-4М бромид этидия, 25 мкл буферного раствора с высоким содержанием калия, содержащего 10-5 М ббАТФ и 25 мкл буфера с высоким содержанием калия, содержащего 3×10-5М испытуемого соединения. Планшет закрывали пластиковой пластинкой и инкубировали при 37°С в течение одного часа. Данные планшета затем считывали в флуоресцентном планшете-ридере Perkin-Elmer, возбуждение 520 нм, эмиссия 595 нм, ширина щели: Ех 15 нм, Еm 20 нм. С целью сравнения ббАТФ (агонист Р2Х7-рецептора) и пиридоксаль-5-фосфат (антагонист Р2Х7-рецептора) использовали по отдельности в испытании в качестве контролей. Из полученных показаний значение pIC50 вычисляли для каждого испытуемого соединения, причем данное значение является отрицательным логарифмом концентрации испытуемого соединения, необходимой для снижения агонистической активности ббАТФ на 50%. Каждое из соединений примеров 1-88 демонстрировало антагонистическую активность, имея значение рIc50 >4,50.
Получение фармацевтической композиции по изобретению в форме таблетки для орального введения.
Исходные компоненты.
Ингредиенты, входящие в состав композиции, тщательно смешивают и таблетируют в таблетирующей машине в соответствии с известными методиками.
Изобретение относится к органической химии, в частности к производным адамантана общей формулы
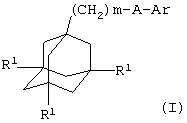
где m равно 1 или 2; каждый R1 независимо представляет атом водорода; А представляет C(O)NH или NHC(O); Ar представляет группу
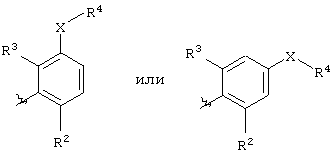
X представляет связь, атом кислорода или группу СО, (CH2)1-6, CH=, O(CH2)1-6, O(СН2)2-6О, O(СН2)2-3О(СН2)1-3, CR'(OH), NR5, (CH2)1-6NR5, CONR5, S(O)n, S(O)nCH2, CH2S(O)n; n равно 0, 1 или 2; R' представляет атом водорода; один из R2 и R3 представляет галоген, нитро, C1-C6-алкил, и другой из R2 и R3 представляет атом водорода или галогена; либо R4 представляет 3-9-членную насыщенную или ненасыщенную алифатическую гетероциклическую кольцевую систему, содержащую один или два атома азота и необязательно атом кислорода, причем гетероциклическая кольцевая система необязательно замещена одним или более заместителями, независимо выбранными из атомов гидроксила, C1-С6-алкила, C1-С6-гидроксиалкила, -NR6R7, -(СН2)rNR6R7; либо R4 представляет 3-8-членную насыщенную карбоциклическую кольцевую систему, замещенную одним или более заместителями, независимо выбранными из -NR6R7, -(CH2)rNR6R7, r равно 1; R5 представляет атом водорода; R6 и R7, каждый независимо, представляет атом водорода или C1-С6-алкильную, или С2-С6-гидроксиалкильную группу, обладающих антагонистическим действием в отношении R2Х7-рецептора. Также описан способ их получения, фармацевтическая композиция, содержащая их, способ получения фармацевтической композиции и их применение в терапии для лечения ревматоидного артрита и обструктивного заболевания дыхательных путей. 6 н. и 7 з.п. ф-лы.
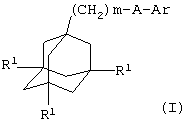
где m равно 1 или 2;
каждый R1 независимо представляет атом водорода;
А представляет C(O)NH или NHC(O);
Ar представляет группу
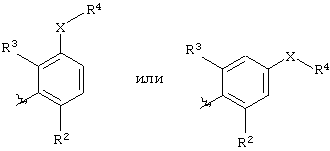
X представляет связь, атом кислорода или группу СО, (CH2)1-6, CH=, O(CH2)1-6, O(СН2)2-6О, O(СН2)2-3О(СН2)1-3, CR'(OH), NR5, (CH2)1-6NR5, CONR5, S(O)n, S(O)nCH2, CH2S(O)n;
n равно 0, 1 или 2;
R' представляет атом водорода;
один из R2 и R3 представляет галоген, нитро, C1-C6-алкил, и другой из R2 и R3 представляет атом водорода или галогена;
либо R4 представляет 3-9-членную насыщенную или ненасыщенную алифатическую гетероциклическую кольцевую систему, содержащую один или два атома азота и необязательно атом кислорода, причем гетероциклическая кольцевая система необязательно замещена одним или более заместителями, независимо выбранными из атомов гидроксила, C1-С6-алкила, C1-С6-гидроксиалкила, -NR6R7, -(СН2)rNR6R7,
либо R4 представляет 3-8-членную насыщенную карбоциклическую кольцевую систему, замещенную одним или более заместителями, независимо выбранными из -NR6R7, -(CH2)rNR6R7, r равно 1;
R5 представляет атом водорода;
R6 и R7, каждый независимо, представляет атом водорода или C1-С6-алкильную, или С2-С6-гидроксиалкильную группу;
при условии, что
(a) когда А представляет C(O)NH и R4 представляет незамещенную 3-8-членную насыщенную алифатическую гетероциклическую кольцевую систему, содержащую один атом азота, тогда Х иной, чем связь, и
(b) когда А представляет C(O)NH и Х представляет группу (CH2)1-6 или O(CH2)1-6, тогда R4 не является незамещенной имидазолильной, незамещенной морфолинильной, незамещенной пиперидинильной или незамещенной пирролидинильной группой, и
(c) когда А представляет NHC(O) и R4 представляет незамещенную 3-8-членную насыщенную алифатическую гетероциклическую кольцевую систему, содержащую один атом азота, тогда Х иной, чем связь, и
(d) когда А представляет NHC(О) и Х представляет O(CH2)1-6 или SCH2, тогда R4 не является незамещенной 1-пиперидинильной или незамещенной 1-пирролидинильной группой, и
или его фармацевтически приемлемая соль или сольват.
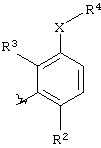
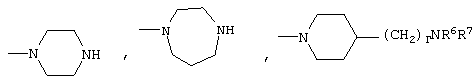
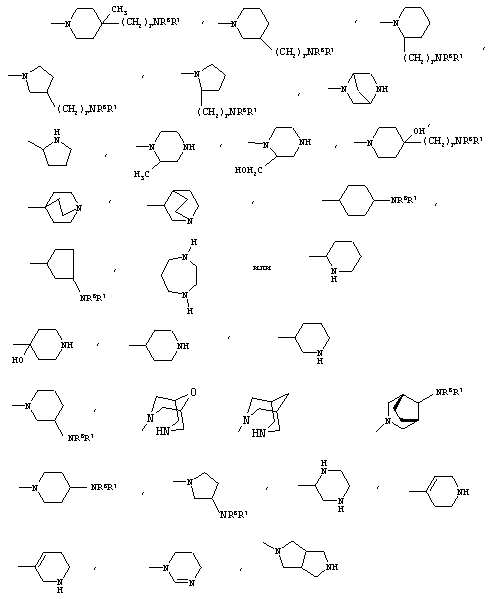
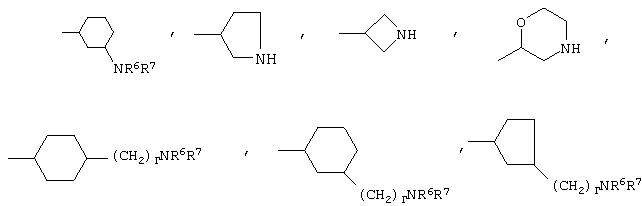
2-Нитро-3-пиперазин-1-ил-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид,
Дигидрохлоридную соль 2-амино-3-пиперазин-1-ил-N-(трицикло [3.3.1.13,7]дец-1-илметил)бензамида,
2-Хлор-3-пиперазин-1-ил-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид,
2-Хлор-5-пиперазин-1-ил-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамид,
Гидрохлоридную соль 2-хлор-5-(гексагидро-1H-1,4-диазепин-1-ил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 5-(4-амино-1-пиперидинил)-2-хлор-N-(трицикло [3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль (+/-)-5-(3-амино-1-пирролидинил)-2-хлор-N-(трицикло [3.3.1. 13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 2-хлор-5-пиперазин-1-илметил-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 2-хлор-5-[(гексагидро-1H-1,4-диазепин-1-ил)метил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 5-[(4-амино-1-пиперидинил)метил]-2-хлор-N-(трицикло [3.3.1.13,7]дец-1-илметил) бензамида,
Гидрохлоридную соль 5-[(3-амино-1-пирролидинил)метил]-2-хлор-N-(трицикло [3.3.1.I3,7]дец-1-илметил) бензамида,
Гидрохлоридную соль 2-хлор-5-(4-пиперидинилокси)-N-(трицикло[3.3.1.13,7] дец-1-илметил) бензамида,
Гидрохлоридную соль (R)-2-хлор-5-(2-пирролидинилметокси)-N-(трицикло [3.3.1.13,7]дец-1-илметил) бензамида,
Гидрохлоридную соль (S)-2-хлор-5-(2-пирролидинилметокси)-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамида,
Гидрохлоридную соль 2-хлор-5-(3-пиперидинилметокси)-N-(трицикло[3.3.1.13,7] дец-1-илметил) бензамида,
Гидрохлоридную соль цис-5-[(4-аминоциклогексил)окси]-2-хлор-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамида,
Гидрохлоридную соль 2-метил-5-(1-пиперазинилметил)-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамида,
Гидрохлоридную соль 2-хлор-5-(1-пиперазинилметил)-N-(2-трицикло[3. 3.1.13'7] дец-1-илэтил) бензамида,
Гидрохлоридную соль (+/-)-2-хлор-5-(3-пирролидинилокси)-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамида,
Гидрохлоридную соль (+/-)-2-хлор-5-(3-пиперидинилокси)-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамида,
транс-5-[(4-Аминоциклогексил)окси]-2-хлор-N-(трицикло[3.3.1.13,7] дец-1-илметил)бензамид,
цис-(+/-)-5-[(3-Аминоциклопентил)окси]-2-хлор-N-(трицикло[3.3.1.13,7] дец-1-илметил) бензамид,
Гидрохлоридную соль (S,S)-2-хлор-5-(2,5-диазабицикло[2.2.1] гепт-2-ил)-N-(трицикло [3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 2-хлор-5-(2-метил-1-пиперазинил)-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамида,
Гидрохлоридную соль (+/-)-2-хлор-5-(3-пирролидиниламино)-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамида,
(+/-)-5-(З-Амино-1-пиперидинил)-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-лметил) бензамид,
(+/-)-2-Хлор-5-(3-пиперидиниламино)-N-(трицикло[3.3.1.13,7]дец-1-илметил) бензамид,
2-Хлор-5-[гексагидропирроло[3,4-с]пиррол-2(1Н)-ил]-N-(трицикло[3.3.1.13,7] дец-1-илметил) бензамид,
Гидрохлоридную соль N-[2-метил-5-(4-пиперидинил-окси)фенил]трицикло [3.3.1.13,7] декан-1-ацетамида,
Гидрохлоридную соль N-[2-хлор-5-(4-пиперидинил-окси)фенил]трицикло [3.3.1.13,7] декан-1-ацетамида,
Дигидрохлоридную соль 2-хлор-5-[(4-пиперидинил-амино)метил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Дигидрохлоридную соль 5-[[[4-(аминометил)цикло-гексил]амино]метил]-2-хлор-N-(трицикло [3.3.1.13,7]дец-1-илметил)бензамида,
Дигидрохлоридную соль 5-[[(4-амино-циклогексил)амино]метил]-2-хлор-N-(трицикло [3.3.1.13,7] дец-1-илметил)бензамида,
5-[(1-Азабицикло[2.2.2]окт-3-иламино)метил]-2-хлор-N-(трицикло[3.3.1.13,7] дец-1-илметил) бензамид,
Дигидрохлоридную соль N-[4-(3-аминопирролидин-1-ил)-2-метилфенил]-2-(трицикло [3.3.1.13,7] дец-1-ил) ацетамида,
Дигидрохлоридную соль N-(2-метил-4-пиперазин-1-илфенил)-2-(трицикло [3.3.1.13,7] дец-1-ил)ацетамида,
Гидрохлоридную соль цис-4-(3-аминоциклопентилокси)-2-хлор-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамида,
Гидрохлоридную соль 2-хлор-4-(4-пиперидинилокси)-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамида,
(+/-)-2-Хлор-4-(пирролидин-3-илокси)-N-(трицикло[3.3.1.13,7]дец-1-илметил) бензамид,
Гидрохлоридную соль 2-хлор-4-(пиперидин-3-илокси)-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамида,
Гидрохлоридную соль 2-хлор-4-(4-пиперазин-1-ил)-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамида,
Гидрохлоридную соль 2-хлор-4-(3-пирролидиниламино)-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамида,
Гидрохлоридную соль 2-хлор-4-(гексагидро-1H-l,4-диазепин-1-ил)-N-(трицикло [3.3.1.13'7] дец-1-илметил) бензамида,
Гидрохлоридную соль (±)-5-[(3-амино-1-пиперидинил)метил]-2-хлор-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 2-хлор-5-(2,5-диазабицикло[2.2.1]гепт-2-илметил)-N-(трицикло[3.3.1.13,7]дец-1-илметил) бензамида,
Гидрохлоридную соль 2-хлор-5-(9-окса-3,7-диазабицикло[3.3.1]нон-3-илметил)-N-(трицикло [3.3.1.13,7] дец-1-илметил)бензамида,
Гидрохлоридную соль 2-хлор-5-(3,7-диазабицикло[3.3.1]нон-3-илметил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль транс-2-хлор-5-[[8-(метиламино)-3-азабицикло [3.2.1] окт-3-ил]метил]-N-(трицикло [3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль цис-2-хлор-5-[(гексагидропирроло[3,4-с]пиррол-2(1Н)-ил)метил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 2-хлор-5-(4-пиперидинилиденметил)-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамида,
Гидрохлоридную соль 2-хлор-5-(4-пиперидинилметил)-N-(трицикло [3.3.1.13,7] дец-1-илметил)бензамида,
Гидрохлоридную соль 2-хлор-5-(4-гидроксипиперидин-4-ил)-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамида,
Гидрохлоридную соль 2-хлор-5-(1,2,3,6-тетрагидропиридин-4-ил)-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамида,
Гидрохлоридную соль 2-этил-5-пиперазин-1-илметил-1-(трицикло [3.3.1.13,7] дец-1-илметил)бензамида,
Гидрохлоридную соль 2-хлор-5-(пиперидин-4-илсульфанил)-N-(трицикло [3.3.1.13,7]дец-1-илметил) бензамида,
2-Хлор-5-(пиперидин-4-илсульфинил)-N-(трицикло[3.3.1.13,7]дец-1-илметил) бензамид,
Гидрохлоридную соль 2-хлор-5-(пиперидин-4-илсульфонил)-N-(трицикло [3.3.1.13,7]дец-1-илметил) бензамида,
Гидрохлоридную соль 2-хлор-5-(пиперидин-4-илметил-сульфанил)-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамида,
Гидрохлоридную соль 2-хлор-5-(пиперидин-4-илметан-сульфонил)-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 2-хлор-5-(пиперазин-1-карбонил)-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамида,
Гидрохлоридную соль 2-хлор-5-([1,4]диазепан-1-карбонил)-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамида,
Гидрохлоридную соль 4-хлор-N1-(пиперидин-4-ил)-N2-(трицикло [3.3.1.13,7] дец-1-илметил) изофталамида,
Гидрохлоридную соль 2-хлор-5-(гидрокси-4-пиперидинил-метил)-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамида,
Гидрохлоридную соль (±)-2-хлор-5-(гидрокси-3-пиперидинил-метил)-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамида,
Гидрохлоридную соль 2-бром-5-пиперазин-1-илметил-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамида,
Гидрохлоридную соль 2-хлор-5-[2-(1-пиперазинил)этил]-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамида,
Гидрохлоридную соль 2-хлор-5-[2-(2,5-диазабицикло[2.2.1]гепт-2-ил) этил]-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамида,
Гидрохлоридную соль 5-[2-(4-амино-1-пиперидинил)этил]-2-хлор-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамида,
Дигидрохлоридную соль 2-хлор-5-[2-(3-пиперидинил-амино)этил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 5-[2-(3-амино-1-пиперидинил)этил]-2-хлор-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамида,
Дигидрохлоридную соль 2-хлор-5-[2-(3-пирролидинил-амино)этил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 5-[2-[(3R)-3-аминопирролидинил)этил]-2-хлор-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамида,
Гидрохлоридную соль 2-хлор-5-[2-[2-(гидроксиметил)-1-пиперазинил] этил]-N-(трицикло [3.3.1.13,7] дец-1-илметил)бензамида,
Гидрохлоридную соль 2-хлор-5-(гексагидро-1H-1,4-диазепин-1-ил)-N-(2-трицикло [3.3.1.13,7] дец-1-илэтил) бензамида,
Гидрохлоридную соль (+/-)-5-(3-амино-1-пирролидинил)-2-хлор-N-(2-трицикло [3.3.1.13,7] дец-1-илэтил) бензамида,
Гидрохлоридную соль 2-хлор-5-(4-пиперидинилкарбонил)-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамида,
Гидрохлоридную соль 2-хлор-5-[1-гидрокси-1-(4-пиперидинил) этил]-N-(трицикло [3.3.1.13,7] дец-1-илметил)бензамида,
Гидрохлоридную соль 2-хлор-5-[2-(1-пиперазинил)этокси]-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамида,
Гидрохлоридную соль 2-хлор-5-[2-(4-пиперидинил)этокси]-N-(трицикло [3.3.1.13,7] дец-1-илметил) бензамида,
Гидрохлоридную соль 2-хлор-5-[2-(4-пиперидинил-окси)этокси]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 2-хлор-5-[2-[2-(1-пиперазинил)этокси]этокси]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
2-Хлор-5-[(5,6-дигидро-1(4Н)-пиримидинил)метил]-N-(трицикло [3.3.1.13,7]дец-1-илметил)бензамид,
Гидрохлоридную соль 2-хлор-5-[[4-[(2-гидроксиэтил)амино]-1-пиперидинил]метил]-N-(трицикло [3.3.1.13,7]дец-1-илметил)бензамида,
2-Хлор-5-[[4-гидрокси-4-[[(1-метилэтил)амино]метил]-1-пиперидинил]метил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Гидрохлоридную соль 2-хлор-5-[(1,2,3,6-тетрагидро-3-пиридинил)метил]-N-(трицикло[3.3.1.13,7]дец-1-илметил)бензамида,
Ацетатную соль 2-хлор-5-(3-пиперидинилметил)-N-(трицикло [3.3.1.13,7] дец-1-илметил)бензамида,
2-Бром-5-[[4-[(2-гидроксиэтил)амино]-1-пиперидинил] метил]-N-(трицикло [3.3.1.13,7]дец-1-илметил)бензамид и
2-Хлор-5-[(Е)-3-пиперидинилиденметил]-N-(трицикло [3.3.1.13,7] дец-1-илметил)бензамид.
когда Х представляет CH2-группу, R4 представляет 3-9-членную насыщенную или ненасыщенную алифатическую гетероциклическую кольцевую систему, содержащую один или два атома азота и необязательно атом кислорода, причем гетероциклическая кольцевая система необязательно замещена одним или более заместителями, независимо выбранными из атомов гидроксила, C1-C6-алкила, C1-C6-гидроксиалкила, -NR6R7, -(СН2)rNR6R7, и R4 связан с Х через атом азота, взаимодействие соединения общей формулы
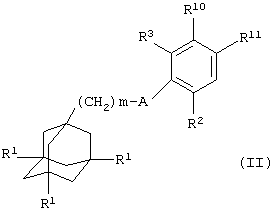
где один из R10 и R11 представляет атом водорода и другой из R10 и R11 представляет группу -CH2L1, в которой L1 представляет уходящую группу, и m, A, R1, R2 и R3 имеют значения, указанные в формуле (I), с соединением общей формулы
R4'-H (III)
в присутствии основания, где R4' представляет 3-9-членную насыщенную или ненасыщенную алифатическую гетероциклическую кольцевую систему, содержащую один или два атома азота и необязательно атом кислорода, причем гетероциклическая кольцевая система необязательно замещена одним или более заместителями, независимо выбранными из атомов гидроксила, C1-C6-алкила, C1-C6-гидроксиалкила, -NR6R7, -(СН2)rNR6R7, и где R6 и R7 имеют значения, указанные в формуле (I).
Приоритет по признакам пп. 1-11 и 15 формулы изобретения (первоначальной редакции) установлен от 09.04.1999 и от 01.02.2000 согласно корреспонденции заявителя от 28.04.2004.
| EP 0 395 093 A1, 28.04.1989.US 3 464 998 A, 02.09.1969.SU 1 646 256 A1, 10.06.1996. |
Авторы
Даты
2005-06-20—Публикация
2000-04-06—Подача