Изобретение относится к производным адамантана, способу их получения, фармацевтическим композициям, содержащим их, способу получения фармацевтических композиций и их использованию в терапии.
Производные адамантана известны в технике, в частности из патента US-A-3789072 в качестве ингибиторов серотонина, в качестве ингибиторов воспаления и отеков или анальгетиков из публикации Chem. Abs. (1974), Vol. 80, N 5 (26871m), в качестве противовирусных средств из публикации Chem. Abs. (1975), Vol. 82, N 1 (3851J) и Chem. Abs. (1977), Vol. 86, N 17 (120855е), а также из публикаций в Chem. Abs. (1968), Vol. 69, N 1 (2562h), Chem. Abs. (1975), Vol. 82, N 3 (16510v) и Tetrahedron (1988), 44, N 23, 7234-7242.
Рецептор Р2Х7 (ранее известный как рецептор P2Z), который является лиганд-запирающим ионным каналом, представлен рядом типов клеток и в основном в тех, которые, как известно, участвуют в воспалительном/иммунитетном процессе и, в частности, в макрофагах, тучных клетках и лимфоцитах (Т и В). Активация рецептора Р2Х7 внеклеточными нуклеотидами, в частности аденозинтрифосфатом, приводит к высвобождению интерлейкина-1β (ИЛ-1β) и к образованию гигантских клеток (макрофагов/микроглиальных клеток), дегрануляции (тучных клеток) и экранированию L-селектинов (лимфоцитов). Рецепторы Р2Х7 расположены также на антиген-несущих клетках (АРС), в кератиноцитах, в ацинарных клетках слюны (клетки околоушной железы) и в гепатоцитах.
Желательно получить соединения, которые были бы эффективны как антагонисты рецептора Р2Х7, для использования их при лечении воспалительных заболеваний, болезней, связанных с нарушением иммунитета, или сердечно-сосудистой системы, в этиологии которых может играть роль рецептор Р2Х7.
Настоящее изобретение относится к соединению общей формулы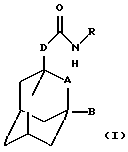
где А обозначает группу CH2 или атом кислорода;
В обозначает атом водорода или галогена (например, фтора, хлора, йода и особенно брома);
D обозначает группу СН2, ОСН2, NНСН2 или СН2СН2, в частности группу СН2, ОСН2 или NHCH2;
R обозначает фенильную, бензотиазолильную, индолильную, индазолильную, пуринильную, пиридильную, пиримидинильную или тиофенильную группу, каждая из которых может быть необязательно замещена одним или большим числом заместителей, выбранных, независимо друг от друга, из атома галогена или циано, карбоксильной, гидроксильной, нитро, галоген-С1-С6-алкильной, -N(R1)-C(= C)-R2, -C(O)NR3R4, -NR5R6, С3-С8-циклоалкильной, 3-8-членной гетероциклильной, С3-С8-циклоалкилокси, C1-С6-алкилкарбонильной, фенокси, бензильной, C1-С6-алкилтио, фенилтио, C1-С6-алкоксикарбонильной, C1-С6-алкилсульфинильной или C1-С6-алкилсульфонильной группы или C1-С6-алкильной или C1-С6-алкоксигруппы, необязательно замещенной одним или более заместителями, выбранными, независимо друг от друга, из атома галогена или амино, карбоксильной, гидроксильной, C1-С6-алкокси, (ди)C1-С6-алкиламино, C1-С6-алкоксикарбонильной, имидазолильной, морфолинильной, пиперидинильной или пирролидинильной групп, где
R1 обозначает атом водорода или C1-С6-алкильную или С3-С8-циклоалкильную группу;
R2 обозначает C1-С6-алкильную или С3-С8-циклоалкильную группу и
R3, R4, R5 и R6 обозначают, каждый, независимо друг от друга, атом водорода или C1-С6-алкильную или С3-С8-циклоалкильную группу;
при условии, что
(i) когда А обозначает CH2, В обозначает Н и D обозначает СН2, то R не обозначает фенильную, орто-карбоксифенильную, орто-нитрофенильную, орто-аминофенильную, орто-(диметиламиноэтил)фенильную, метилфенильную или пара-феноксифенильную группу,
(ii) когда А обозначает СН2, В обозначает Вr и D обозначает СН2, то R не обозначает орто-карбоксифенильную группу,
(iii) когда А обозначает СН2, В обозначает Н и D обозначает СН2СН2, то R не обозначает фенильную группу,
(iv) когда А обозначает СН2, D обозначает СН2 или СН2СН2 и R обозначает замещенную фенильную группу, присутствующие заместитель или заместители не включают в орто-положении C1-С6-алкоксигруппу, замещенную амино, (ди)C1-С6-алкиламино, имидазолильной, морфолинильной, пиперидинильной или пирролидинильной группой;
или к его фармацевтически приемлемой соли или сольвату.
В контексте настоящего описания, если особо не оговорено иное, алкильный заместитель или алкильный фрагмент в группе заместителя может быть линейным или разветвленным. Кроме того, (цикло)алкильные фрагменты в диалкиламино, дициклоалкиламино, диалкиламидо или дициклоалкиламидо замещающей группе могут быть одинаковыми или разными. Когда D обозначает группу OCH2 или NHCH2, указанная группа ориентирована таким образом, что атом кислорода или азота непосредственно присоединяется к адамантильной группе. В контексте настоящего описания термин "3-8-членная гетероциклильная группа" означает алифатическую гетероциклическую систему, содержащую один гетероатом, выбранный из азота, кислорода или серы. Термин "в орто-положении" обозначает такое положение в фенильном кольце R, которое является соседним относительно точки присоединения амидной связующей группы к R, например, как показано на структурной форме, приведенной ниже, где звездочки обозначают "орто-положение":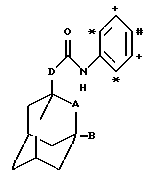
Аналогично, мета- и пара-положения в фенильной группе R определяются относительно точки присоединения амидной связующей группы к R, и они указаны на приведенной выше формуле символами + и # соответственно.
Предпочтительно R обозначает фенильную, бензотиазолильную, индолильную, инда золильную, пуринильную, пиридильную, пиримидинильную или тиофенильную группу, каждая из которых может быть необязательно замещена одним, двумя, тремя или четырьмя заместителями, выбранными, независимо друг от друга, из атома галогена (например, фтора, хлора, брома или йода) или циано, карбоксильной, гидроксильной, нитро, галогeн-C1-С6-алкильной (например, трифторметильной), -N(R1)-C(= O)-R2, -C(O)NR3R4, -NR5R6, С3-С8-циклоалкильной (например, циклопропильной, циклобутильной, циклопентильной или циклогексильной), 3-8-членной гетероциклильной (например, азиридинильной, пирролидинильной, пиперидинильной), С3-С8-циклоалкилокси (например, циклопропилокси, циклобутилокси, циклопентилокси или циклогексилокси), C1-С6-алкилкарбонильной (например, метил-, этил-, пропил-, бутил-, пентил- или гексилкарбонильной), фенокси, бензильной, C1-С6-алкилтио (например, метил-, этил-, пропил-, бутил-, пентил- или гексилтио), фенилтио, C1-С6-алкоксикарбонильной (например, метокси-, этокси-, пропокси-, бутокси-, пентокси- или гексоксикарбонильной), C1-С6-алкилсульфинильной (например, метил-, этил-, пропил-, бутил-, пентил- или гексилсульфинильной) или C1-С6-алкилсульфонильной (например, метил-, этил-, пропил-, бутил-, пентил- или гексилсульфонильной) группы или C1-С6-алкильной (например, метильной, этильной, пропильной, бутильной, пентильной или гексильной) группы, или C1-С6-алкокси (например, метокси-, этокси-, пропокси-, бутокси-, пентокси- или гексокси-) группы, необязательно замещенной одним, двумя, тремя или четырьмя заместителями, выбранными, независимо друг от друга, из атома галогена (например, фтора, хлора, брома, йода) или амино, карбоксильной, гидроксильной, C1-С6-алкокси (например, метокси, этокси, пропокси, бутокси, пентокси или гексокси), (ди)C1-С6-алкиламино (например, (ди)метиламино или (ди)этиламино), C1-С6-алкоксикарбонильной (например, метокси-, этокси-, пропокси-, бутокси-, трет-бутокси-, пентокси- или гексоксикарбонильной), имидазолильной, морфолинильной, пиперидинильной или пирролидинильной группы.
Более предпочтительно R обозначает фенильную, бензотиазолильную, индолильную, индазолильную, пуринильную, пиридильную или тиофенильную группу, каждая из которых может быть необязательно замещена одним, двумя или тремя заместителями, выбранными, независимо друг от друга, из атома галогена (в особенности хлора) или гидроксильной, нитро или С1-С4-алкоксикарбонильной (в особенности метоксикарбонильной) группы или С1-С4-алкильной (наиболее предпочтительно C1-С2-алкильной) или С1-С4-алкокси (наиболее предпочтительно C1-С3-алкокси) группы, необязательно замещенной одним или двумя заместителями, выбранными, независимо друг от друга, из атома галогена или амино, карбоксильной, гидроксильной, С1-С4-алкокси (в особенности метокси), (ди)С1-С4-алкиламино (в частности, метиламино или диметиламино), С1-С4-алкоксикарбонильной (в особенности трет-бутоксикарбонильной), имидазолильной, морфолинильной, пиперидинильной или пирролидинильной группы.
Предпочтительно, чтобы R1 обозначал атом водорода или С1-С4-алкильную (например, метильную, этильную, пропильную или бутильную) или С3-С6-циклоалкильную (например, циклопентильную или циклогексильную) группу.
Предпочтительно R2 обозначает С1-С4-алкильную (например, метильную, этильную, пропильную или бутильную) или С3-С6-циклоалкильную (например, циклопентильную или циклогексильную) группу.
Предпочтительно R3, R4, R5 и R6 обозначают, каждый независимо друг от друга, атом водорода или С1-С4-алкильную (например, метильную, этильную, пропильную или бутильную) или С3-С6-циклоалкильную (например, циклопентильную или циклогексильную) группу.
Предпочтительные соединения по настоящему изобретению включают:
N-(2-метил-6-бензотиазолил)-трицикло[3.3.1.13,7]декан-1-ацетамид,
N-(3-(3-(аминопропилокси)-2-метилфенил)-трицикло[3.3.1.13,7] декан-1-ацетамида гидрохлорид,
N-(2-хлорфенил)-трицикло[3.3.1.13,7]декан-1-ацетамид,
N-(2,4,5-триметилфенил)-трицикло[3.3.1.13,7]декан-1-ацетамид,
N-(5-метокси-2-метилфенил)-трицикло[3.3.1.13,7]декан-1-ацетамид,
N-(2,3-диметилфенил)-трицикло[3.3.1.13,7]декан-1-ацетамид,
N-(5-индолил)-трицикло[3.3.1.13,7]декан-1-ацетамид,
N-(2,3-диметил-5-индолил)-трицикло[3.3.1.13,7]декан-1-ацетамид,
N-[5-(3-N, N-диметиламинопропокси)-2-метилфенил]-трицикло[3.3.1.13,7]декан-1-ацетамида гидрохлорид,
N-(5-индазолил)-трицикло[3.3.1.13,7]декан-1-ацетамид,
N-(6-индазолил)-трицикло[3.3.1.13,7]декан-1-ацетамид,
N-(5-гидрокси-2-метилфенил)-трицикло[3.3.1.13,7]декан-1-ацетамид,
N-(1Н-индол-4-ил)-трицикло[3.3.1.13,7]декан-1-ацетамид,
4-метил-3-[[1-oксo-2-(трицикло[3.3.1.13,7] дек-1-ил)этил] -амино] феноксиуксусной кислоты гидрохлоридная соль,
N-(1-метил-1Н-индол-5-ил)-трицикло[3.3.1.13,7]декан-1-ацетамид,
N-(1-(N,N-диметиламино)этил-1Н-индо-5-ил)-трицикло[3.3.1.13,7]декан-1-ацетамид,
5-[[1-окco-2-(трицикло[3.3.1.13,7] дек-1-ил)этил] амино] -1Н-индол-1-уксусной кислоты 1,1-диметилэтиловый эфир,
N-(3-(2-хлорпиридил))-трицикло[3.3.1.13,7]декан-1- ацетамид,
N-(3-(N, N-диметиламино)метил-1Н-индо-5-ил)-трицикло[3.3.1.13,7] декан-1-ацетамид,
N-(4-метокси-2-метилфенил)-трицикло[3.3.1.13,7]декан-1-ацетамид,
N-(2-хлор-5-метоксифенил)-трицикло[3.3.1.13,7]декан-1-ацетамид,
N-(4-гидрокси-2-метилфенил)-трицикло[3.3.1.13,7]декан-1- ацетамид,
N-(3-гидроксиметил-2-метилфенил)-трицикло[3.3.1.13,7]декан-1-ацетамид,
N-(5-метокси-2-метил-3-нитрофенил)-трицикло[3.3.1.13,7]декан-1-ацетамид,
N-(5-гидроксиметил-2-метилфенил)-трицикло[3.3.1.13,7]декан-1-ацетамид,
N-(3-гидрокси-2-метилфенил)-трицикло[3.3.1.13,7]декан-1-ацетамид,
N-(2-метил-5-(1-пирролидинметил)фенил)-трицикло[3.3.1.13,7] декан-1-ацетамида гидрохлорид,
N-(2-хлор-5-гидроксифенил)-трицикло[3.3.1.13,7]декан-1-ацетамид,
N-(2-хлор-4-гидроксифенил)-трицикло[3.3.1.13,7]декан-1-ацетамид,
N-(2-метил-3-(2-(1-пирролидино)этилокси)фенил)-трицикло[3.3.1.13,7] декан-1-ацетамида гидрохлорид,
N-(5-метоксиметил-2-метилфенил)-трицикло[3.3.1.13,7]декан-1-ацетамид,
N-(2-метил-3-(2-(1-морфолино)этилокси)фенил)трицикло[3.3.1.13,7] декан-1-ацетамида гидрохлорид,
N-(2-метил-3-(2-(1-пиперидино)этилокси)фенил)-трицикло-[3.3.1.13,7] декан-1-ацетамида гидрохлорид,
N-(2-метил-5-(1-морфолинометил)фенил)-трицикло[3.3.1.13,7] декан-1-ацетамида гидрохлорид,
N-(5-(3-(2-N,N-диметиламиноэтил)индолил))-трицикло[3.3.1.13,7]декан-1-ацетамида гидрохлорид,
Метил 4-метил-3-[[1-оксо-2-(трицикло[3.3.1.13,7] дек-1-ил)этил] амино] тиофен-2-карбоксилат,
N-(3-метокси-2-метилфенил)-трицикло[3.3.1.13,7]декан-1-ацетамид,
N-(2-метил-3-(2-(1-имидазоло)этилокси)фенил)трицикло [3.3.1.13,7] декан-1-ацетамид,
N-(2,4,6-триметилфенил)-трицикло[3.3.1.1.3,7]декан-1-ацетамид,
N-(5-(3-аминопропилокси)-2-метилфенил)-трицикло[3.3.1.13,7] декан-1-ацетамида гидрохлорид,
N-(5-(3-(N-метиламино)пропилокси)-2-метилфенил)-трицикло[3.3.1.13,7] декан-1-ацетамида гидрохлорид,
N-(6-(трицикло[3.3.1.13,7]декан-1-ацетил)-аденин,
N-(3,5-диметокси-2-метилфенил)-трицикло[3.3.1.13,7]декан-1-ацетамид,
N-(3-(3-(N-метиламино)пропилокси)-2-метилфенил)-трицикло[3.3.1.13,7] декан-1-ацетамида гидрохлорид,
N-(5-(3-(N,N-диметиламино)пропилокси)-2-метилфенил)-трицикло [3.3.1.13,7]декан-1-ацетамида гидрохлорид,
N-(5-метокси-2-метифенил)-трицикло[3.3.1.13,7]деканилокси-1-ацетамид,
N-(5-метокси-2-метилфенил)-(3-бром-трицикло[3.3.1.13,7] -декан)-1-ацетамид,
N-(5-метокси-2-метилфенил)-(2-окса-трицикло[3.3.1.13,7] -декан)-1-ацетамид,
N-(5-метокси-2-метилфенил)-2-(трицикло[3.3.1.13,7]декан-1-амино)ацетамид,
N-(3,5-диметоксифенил)-трицикло[3.3.1.13,7]декан-1-ацетамид,
N-(3,5-дигидроксифенил)-трицикло[3.3.1.13,7]декан-1-ацетамид,
N-(3,5-диметоксифенил)-трицикло[3.3.1.13,7]деканилокси-1-ацетамид,
N-(3,5-бис-(3-аминопропилокси)фенил)-трицикло[3.3.1.13,7] декан-1-ацетамид,
N-(2,4,5-триметилфенил)-трицикло[3.3.1.13,7]деканилокси-1-ацетамид,
N-(5-гидрокси-2-метилфенил)- трицикло[3.3.1.13,7]деканилокси-1-ацетамид,
N-(5-(2-(N-метиламино)этилокси)-2-метилфенил)-трицикло-[3.3.1.13,7] декан-1-ацетамида гидрохлорид,
N-(5-(2-(N-метиламино)этилокси)-2-метилфенил)-трицикло-[3.3.1.13,7] -деканилокси-1-ацетамид,
N-(5-(3-(N-метиламино)пропилокси)-2-метилфенил)-трицикло[3.3.1.13,7] деканилокси-1-ацетамид и
N-(3,5-дигидрокси-2-метилфенил)-трицикло[3.3.1.13,7]-декан-1-ацетамид.
Настоящее изобретение также относится к способу получения соединения формулы (I), определенного выше, который включает взаимодействие соединения общей формулы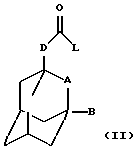
где L обозначает удаляемую группу (например, атом галогена, такого как хлор, или имидазольную группу) и А, В и D определены в формуле (I), с соединением общей формулы (III) -R-NH2, где R определен в формуле (I), и необязательно с образованием фармацевтически приемлемой соли или сольвата.
Указанный процесс может быть достаточно удобно проведен в растворителе (например, в ацетонитриле, N,N-диметилформамиде или дихлорметане) и необязательно в присутствии основания (например, триэтиламина, 4-диметиламинопиридина или диизопропилэтиламина). Способ достаточно легко осуществляется при температуре в диапазоне от 0oС до 100oС, предпочтительно в диапазоне от 10oС до 80oС и в особенности при температуре окружающей среды (20oС).
Соединения формул (II) и (III) являются известными соединениями или могут быть получены способами, известными в настоящем уровне техники.
Специалистам в данной области очевидно, что при осуществлении способа по настоящему изобретению определенные функциональные группы, такие как гидроксильные и аминогруппы, в промежуточных соединениях необходимо защищать с помощью защитных групп. Таким образом, окончательная стадия получения соединения формулы (I) может включать удаление одной или нескольких защитных групп.
Защита и удаление защитных групп описаны в литературе ("Protective Groups in Organic Chemistry", edited by J.W.F. McOmie, Plenum Press (1973) and "Protective Groups in Organic Synthesis", 2nd edition, T.W. Greene and P.G.M. Wuts, Wiley-Interscience (1991)).
Соединения формулы (I) могут быть превращены в фармацевтически приемлемую соль или сольват, предпочтительно в соль кислоты, такую как гидрохлорид, гидробромид, фосфат, ацетат, фумарат, малеат, тартрат, цитрат, оксалат, метансульфонат или п-толуолсульфонат, или соль щелочного металла, такую как натриевая или калиевая соль.
Некоторые соединения формулы (I) могут существовать в виде стереоизомерных форм. Следует иметь в виду, что настоящее изобретение охватывает все геометрические и оптические изомеры соединений формулы (I) и их смеси, включая рацематы. Таутомеры и их смеси также включены в настоящее изобретение.
Соединения по настоящему изобретению обладают фармакологической активностью. По этой причине они могут использоваться как фармацевтические средства при лечении или предупреждении ревматоидного артрита, остеоартрита, псориаза, аллергического дерматита, астмы, сверхчувствительности дыхательных путей, септического шока, гломерулонефрита, раздражения кишечника, болезни Крона, язвенного колита, атеросклероза, роста и метастаз злокачественных клеток, ишемии миокарда, миобластного лейкоза, диабета, болезни Альцгеймера, остеопороза, ожогового поражения, кровоизлияния, варикозного расширения вен и менингита.
В этой связи настоящее изобретение относится к соединению формулы (I) или к его фармацевтически приемлемой соли или сольвату, определенным выше, для использования в терапии.
В другом аспекте настоящее изобретение относится к использованию соединений формулы (I) или его фармацевтически приемлемой соли или сольвата, определенных выше, в производстве лекарственного средства, применяемого в терапии.
Настоящее изобретение также относится к способу воздействия на иммуносупрессию (например, при лечении ревматоидного артрита, раздражения кишечника, атеросклероза или псориаза), которая включает введение пациенту терапевтически эффективного соединения формулы (I) или его фармацевтически приемлемой соли или соль вата, определенных выше.
Для цели вышеуказанного терапевтического использования вводимая дозировка средства может варьировать в зависимости от применяемого соединения, способа его введения, особенностей лечения и заболевания.
Соединения формулы (I) и их фармацевтически приемлемые соли и сольваты могут использоваться сами по себе, но в основном вводятся в виде фармацевтической композиции, в которой соединение формулы (I)/соль/сольват (активный ингредиент) объединен с фармацевтически приемлемым адъювантом, разбавителем или носителем. В зависимости от способа введения фармацевтическая композиция предпочтительно включает от 0,05 до 99 вес.% (весовых процентов), более предпочтительно от 0,10 до 70 вес.% активного ингредиента и от 1 до 99,95 вес. %, более предпочтительно от 30 до 99,90 вес.% фармацевтически приемлемого адъюванта, разбавителя или носителя, при этом все проценты приведены в весовых частях относительно общего веса всей композиции.
Таким образом, настоящее изобретение относится также к фармацевтической композиции, включающей соединение формулы (I) или его фармацевтически приемлемую соль или сольват, определенные выше, в сочетании с фармацевтически приемлемым адъювантом, разбавителем или носителем.
Изобретение также относится к способу получения фармацевтической композиции по настоящему изобретению, который включает смешивание соединений формулы (I) или его фармацевтически приемлемой соли или сольвата, определенных выше, с фармацевтически приемлемым адъювантом, разбавителем или носителем.
Фармацевтическая композиция по настоящему изобретению может вводиться местно (например, в легкое и/или в дыхательные пути, или на кожу) в виде растворов, суспензий, гептафторалкановых аэрозолей и сухих порошковых композиций или системно, например при пероральном введении в виде таблеток, капсул, сиропов, порошков или гранул или при парентеральном введении в виде растворов или суспензий, или при подкожном введении, или путем ректального введения в виде суппозиториев, или чрескожно.
Настоящее изобретение поясняется с помощью примеров, в которых МС, ЯМР, CDCl3 и ДМСО обозначают соответственно масс-спектрометрию, ядерный магнитный резонанс, хлороформ-d и диметилсульфоксид.
Пример 1
N-(2-метил-6-бензотиазолил)-трицикло[3.3.1.13,7]декан-1-ацетамид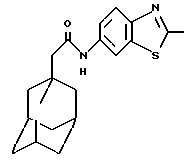
а) 1-адамантанацетилхлорид
Раствор 1-адамантануксусной кислоты (4,5 г) в тионилхлориде (20 мл) нагревают при температуре кипения с обратным холодильником в течение 24 часов и затем охлаждают до температуры окружающей среды. Избыток тионилхлорида удаляют при пониженном давлении с получением соединения а) в виде сиропа (4,9 г).
б) N-(2-метил-6-бензотиазолил)-трицикло[3.3.1.13,7]декан-1-ацетамид
К раствору 1-адамантанацетилхлорида (0,5 г), полученного в соответствии с процедурой а), в ацетонитриле (10 мл) добавляют триэтиламин (0,38 мл) и 6-амино-2-метилбензотиазол (0,39 г). Реакционную смесь перемешивают при температуре окружающей среды в течение 1 часа и затем разбавляют этилацетатом. После этого органическую фазу промывают разбавленной соляной кислотой и водой, высушивают над сульфатом магния (MgSО4) и в конце процедуры концентрируют под пониженным давлением с получением целевого соединения в виде белого твердого вещества (0,12 г).
Точка плавления: 172oС
MS (APCI+ve) 341 (M+H)+
1Н ЯМР (СDСl3) 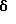 : 8,45 (1Н, д.), 7,84 (1H, д.), 7,19 (2Н, м.), 2,81 (3Н, с.), 2,13 (2Н, с.), 2,00 (3Н, с.), 1,75 (12Н, м.).
: 8,45 (1Н, д.), 7,84 (1H, д.), 7,19 (2Н, м.), 2,81 (3Н, с.), 2,13 (2Н, с.), 2,00 (3Н, с.), 1,75 (12Н, м.).
Пример 2
N-(3-(3-(аминопропилокси)-2-метилфенил)-трицикло[3.3.1.13,7] декан-1-ацетамида гидрохлорид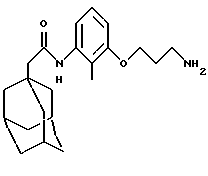
К раствору N-(3-гидрокси-2-метилфенил)-трицикло [3.3.1.13,7]декан-1-ацетамида (0,408 г, пример 26), трет-бутил N-(3-гидроксипропил)карбамата (1,11 г) и трифенилфосфина (1,74 г) в тетрагидрофуране (5 мл) добавляют диэтилазодикарбоксилат (1,0 мл). После перемешивания в течение ночи при комнатной температуре реакционную смесь концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем, проводя элюцию смесью дихлорметан:этилацетат (9:1) и затем проводят дальнейшую очистку методом ВЭЖХ на колонке Динамакс® (Dynamax®) с использованием системы Waters Prer 4000, проводя элюцию смесью изогексан:этилацетат (7:3) с получением продукта реакции Мицунобу (Mitsunobu) (0,34 г), который растворяют в метаноле (10 мл). Затем к последнему раствору добавляют раствор хлористого водорода (который образуется при медленном добавлении ацетил хлорида (12 мл) к метанолу (10 мл) при 0oС, следует соблюдать осторожность, так как реакция высоко экзотермическая) и реакционную смесь перемешивают при комнатной температуре в течение 2 часов. Реакционный продукт распределяют между насыщенным водным раствором кислого карбоната натрия (100 мл) и этилацетатом (100 мл), проводя экстракцию последним. Органический экстракт высушивают над безводным сульфатом натрия, фильтруют и концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле, проводя элюцию смесью дихлорметан: этанол: триэтиламин (18: 2: 1) с получением желтого масла. Указанное масло растворяют в метаноле (10 мл) и дихлорметане (2 мл) и обрабатывают эфирным раствором хлористого водорода (1 М, 5 мл). Через 2 минуты растворитель удаляют при пониженном давлении. Остаточную камедь перемешивают в смеси эфир: изогексан (1: 1) в течение ночи, после чего растворитель удаляют фильтрованием с получением целевого соединения в виде твердого вещества (0,186 г), которое отделяют декантированием растворителя и затем высушивают остаток.
MS (APCI+ve) 357 (M-HCl+H)+
1H ЯМР (ДМСО-d6) δ: 9,20 (1Н, с.), 7,97 (3Н, шс.), 7,10 (1Н, т.), 6,94 (1Н, д.), 6,77 (1Н, д.), 4,05 (2Н, т.), 3,05-2,9 (2Н, м.), 2,1-2,0 (7Н, м.), 1,94 (3Н, с.), 1,75-1,55 (12Н, м.).
Пример 3
N-(2-хлорфенил)-трицикло[3.3.1.13,7]декан-1-ацетамид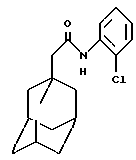
Следуют процедуре Примера 1б) с использованием 1-адамантанацетилхлорида (0,2 г) и 2-хлоранилина (0,12 г) с получением целевого соединения в виде твердого белого вещества (0,05 г).
Точка плавления: 122-124oС
MS (APCI+ve) 304/306 (М+Н)+
1Н ЯМР (CDCl3) δ: 8,40 (1Н, д.), 7,55 (1H, с.), 7,40 (1Н, дд.), 7,3 (1H, м.), 7,05 (1H, м.), 2,16 (2Н, с.), 2,00 (3Н, с.), 1,75 (12Н, м.)
Пример 4
N-(2,4,5-триметилфенил)-трицикло[3.3.1.13,7]декан-1-ацетамид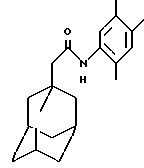
Следуют процедуре Примера 1б), начиная с 1-адамантанацетилхлорида (0,2 г) и 2,4,5-триметиланилина (0,13 г), с получением целевого соединения в виде белого твердого вещества (0,042 г).
Точка плавления: 158oС
MS (APCI+ve) 312 (М+Н)+
1Н ЯМР (ДМСО-d6) δ: 9,00 (1Н, с.), 7,08 (1H, с.), 6,94 (1Н, с.), 2,14 (6Н, с.), 2,10 (3Н, с.), 2,04 (2Н, с.), 1,98 (3Н, с.), 1,75 (12Н, м.).
Пример 5
N-(5-метокси-2-метилфенил)-трицикло[3.3.1.1.3,7]декан-1-ацетамид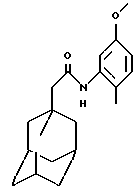
Следуют процедуре Примера 1б), начиная с 1-адамантанацетилхлорида (0,2 г) и 5-метокси-2-метиланилина (0,13 г), с получением целевого соединения в виде белого твердого вещества (0,043 г).
Точка плавления: 147oС
MS (APCI+ve) 314 (М+Н)+
1Н ЯМР (ДМСО-d6) 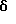 : 9,00 (1H, с.), 7,07 (1H, д.), 7,04 (1H, д.), 6,65 (1H, дд.), 3,69 (3Н, с.), 2,13 (3Н, с.), 2,09 (2Н, с.), 1,95 (3Н, с.), 1,75 (12Н, м.).
: 9,00 (1H, с.), 7,07 (1H, д.), 7,04 (1H, д.), 6,65 (1H, дд.), 3,69 (3Н, с.), 2,13 (3Н, с.), 2,09 (2Н, с.), 1,95 (3Н, с.), 1,75 (12Н, м.).
Пример 6
N-(2,3-диметилфенил)-трицикло[3.3.1.1.3,7]декан-1-ацетамид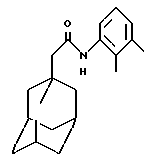
Следуют процедуре Примера 1б), начиная с 1-адамантанацетилхлорида (0,2 г) и 2,3-диметиланилина (0,11 г), с получением целевого соединения в виде белого твердого вещества (0,034 г).
Точка плавления: 170oС
MS (APCI+ve) 298 (М+Н)+
1Н ЯМР (ДМСО-d6) δ: 9,20 (1Н, с.), 7,20-6,95 (3Н, м.), 2,23 (3Н, с.), 2,07 (5Н, с.), 1,95 (3Н, с.), 1,75 (12Н, м.).
Пример 7
N-(5-индолил)-трицикло[3.3.1.1.3,7]декан-1-ацетамид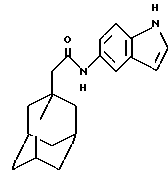
Следуют процедуре Примера 1б), начиная с 1-адамантанацетилхлорида (0,076 г) и 5-аминоиндола (0,05 г), с получением целевого соединения в виде белого твердого вещества (0,05 г).
Точка плавления: 184oС-185oС
MS (APCI+ve) 309 (М+Н)+
1Н ЯМР (ДМСО-d6) δ: 10,95 (1Н, с.), 9,51 (1H, с.), 7,85 (1Н, с.), 7,28 (2Н, м. ), 7,16 (1H, дд. ), 6,35 (1H, т.), 2,04 (2Н, с.), 1,94 (3Н, с.), 1,70-1,50 (12Н, м.).
Пример 8
N-(2,3-диметил-5-индолил)-трицикло[3.3.1.1.3,7]декан-1-ацетамид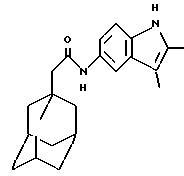
К раствору 1-адамантануксусной кислоты (0,30 г) в дихлорметане (10 мл) добавляют 4-диметиламинопиридин (0,19 г) и 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид (0,30 г). Реакционную смесь перемешивают в течение 0,5 часа, после чего добавляют 5-амино-2,3-диметилиндол (0,25 г). Перемешивание продолжают в течение ночи при температуре окружающей среды. На следующий день реакционную смесь промывают разбавленной соляной кислотой, водой и солевым раствором, высушивают над сульфатом натрия (Na2SO4) и в итоге концентрируют под пониженным давлением с получением остатка. Очистка остатка гель-хроматографией на силикагеле с проведением элюции 40% этилацетатом в изогексанах дает целевое соединение в виде белого твердого вещества (0,14 г).
Точка плавления: 234oС-235oС
MS (APCI+ve) 337 (М+Н)+
1H ЯМР (ДМСО-d6) δ: 10,50 (1Н, с.), 9,46 (1H, с.), 7,67 (1Н, с.), 7,08 (2Н, м. ), 2,28 (3Н, с. ), 2,03 (3Н, с.), 1,99 (2Н, с.), 1,94 (3Н, с.), 1,70-1,50 (12Н, м.).
Пример 9
N-[5-(3-N, N-диметиламинопропокси)-2-метилфенил] -трицикло[3.3.1.1. 3,7] декан-1-ацетамида гидрохлорид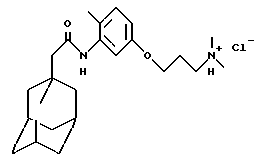
К раствору N-(5-метокси-2-метилфенил)-трицикло[3.3.1.1. 3,7]декан-1-ацетамида, полученного по методу Примера 5, (1,00 г) в дихлорметане (20 мл) добавляют трибромид бора (4 мл 1,0 М раствора в дихлорметане) при -78oС в инертной атмосфере. Реакционную смесь перемешивают в течение 24 часов и затем нагревают до температуры окружающей среды, и промывают солевым раствором. Затем органический слой высушивают над сульфатом магния (МgSO4) и концентрируют при пониженном давлении с получением остатка. К раствору остатка (200 мг) в N,N-диметилформамиде (10 мл) добавляют карбонат калия (0,185 г) и гидрохлорид N, N-диметил-3-хлорпропиламина (0,11 г), и реакционную смесь нагревают при перемешивании при 80oС в течение 4 часов. При охлаждении смеси ее сразу разбавляют этилацетатом и промывают насыщенным солевым раствором. Отделяют органическую фазу, высушивают над сульфатом магния (МgSО4) и затем пропускают через картридж NH2 для твердофазной экстракции "Изолют" ("ISOLUTE") (торговая марка) при проведении элюции этилацетатом. Выпаривание элюэнта и последующая обработка 1,0 М хлористым водородом в эфире и в конце процедуры концентрирование под пониженным давлением дают целевое соединение в виде белого твердого вещества (0,02 г).
Точка плавления: 139oС-140oС
MS (APCI+ve) 385 (М+Н)+ (для свободного основания)
1H ЯМР (ДМСО-d6) δ: 10,38 (1Н, с.), 9,05, (1H, с.), 7,08 (2Н, д.+с.), 3,95 (4Н, м.), 3,2 (2Н, м.), 2,78 (6Н, 2с.), 2,13 (3Н, с.), 2,10 (2Н, с.), 1,95 (3Н, с.), 1,6 (12Н, м.).
Пример 10
N-(5-индазолил)-трицикло [3.3.1.1.3,7]декан-1-ацетамид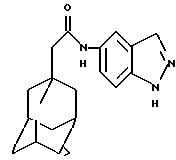
Следуют процедуре Примера 1б), начиная с 1-адамантанацетилхлорида (0,1 г) и 5-аминоиндазола (0,067 г), с получением целевого соединения в виде белого твердого вещества (0,12 г).
Точка плавления: 265oС
MS (APCI+ve) 310 (М+Н)+
1H ЯМР (ДМСО-d6) δ: 12,93 (1Н, с.), 9,73 (1Н, с.), 8,12 (1Н, с.), 7,99 (1Н, с.), 7,40 (2Н, м.), 2,04 (2Н, с.), 1,94 (3Н, с.), 1,70-1,50 (12Н, м.).
Пример 11
N-(6-индазолил)-трицикло[3.3.1.1.3,7]декан-1-ацетамид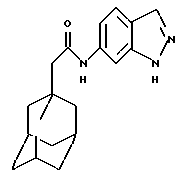
Следуют процедуре Примера 1б), начиная с 1-адамантанацетилхлорида (0,2 г) и 6-аминоиндазола (0,13 г), с получением целевого соединения в виде белого твердого вещества (0,064 г).
Точка плавления: 245oС
MS (APCI+ve) 310 (M+H)+
1H ЯМР (ДМСО-d6) δ: 12,84 (1Н, с.), 9,87 (1H, с.), 8,16 (1Н, с.), 7,94 (1H, с. ), 7,62 (1H, д. ), 7,05 (1H, дд.), 2,04 (2Н, с.), 1,94 (3Н, с.), 1,70-1,50 (12Н, м.).
Пример 12
N-(5-гидрокси-2-метилфенил)-трицикло[3.3.1.1.3,7]декан-1-ацетамид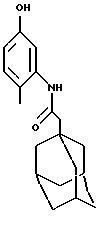
К раствору N-(5-метокси-2-метилфенил)-трицикло[3.3.1.1. 3,7]декан-1-ацетамида, приготовленного по методу Примера 5, (1,00 г) в дихлорметане (20 мл) добавляют трибромид бора (4 мл 1,0 М раствора в дихлорметане) при -78oС в инертной атмосфере. Реакционную смесь перемешивают в течение 24 часов, нагревают до температуры окружающей среды и затем промывают солевым раствором. Органический слой высушивают над сульфатом магния (МgSO4) и концентрируют при пониженном давлении с получением остатка. Растирание с диэтиловым эфиром дает твердое вещество (0,335 г). Часть этого материала (0,050 г) подвергают дальнейшей очистке жидкостной хроматографией при сверхвысоких температурах с использованием колонки Циано (Суаnо), проводя элюцию градиентом метанола в двуокиси углерода при сверхвысокой температуре с получением целевого соединения в виде белого твердого вещества (0,030 г).
Точка плавления: 255oС-256oС
MS (APCI+ve) 300 (M+H)+
1H ЯМР (ДМСО-d6) δ: 9,11 (1Н, с.), 8,92 (1H, с.), 6,92 (1Н, м.), 6,45 (1H, дд.), 2,04 (5Н, с.), 1,94 (3Н, с.), 1,70-1,50 (12Н, м.).
Пример 13
N-(1Н-индол-4-ил)-трицикло[3.3.1.1.3,7]декан-1-ацетамид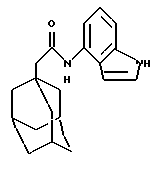
Следуют процедуре Примера 1б), начиная с 1-адамантанацетилхлорида (0,074 г) и 4-аминоиндола гидрохлорида (0,059 г), с получением целевого соединения в виде белого твердого вещества (0,068 г).
Точка плавления: 211oС-213oС
MS (APCI+ve) 309 (М+Н)+
1H ЯМР (ДМСО-d6)  : 11,07 (1H, с.), 9,35 (1H, с.), 7,53 (1H, д.), 7,27 (1H, т. ), 7,12 (1H, д.), 6,99 (1H, с.), 6,66 (1H, с.), 2,19 (2Н, с.), 1,94 (3Н, с.), 1,68 (6Н, д.), 1,68-1,58 (6Н, м.).
: 11,07 (1H, с.), 9,35 (1H, с.), 7,53 (1H, д.), 7,27 (1H, т. ), 7,12 (1H, д.), 6,99 (1H, с.), 6,66 (1H, с.), 2,19 (2Н, с.), 1,94 (3Н, с.), 1,68 (6Н, д.), 1,68-1,58 (6Н, м.).
Пример 14
4-метил-3-[[1-оксо-2-(трицикло[3.3.1.1. 3,7] дек-1-ил)-этил]амино]феноксиуксусной кислоты гидрохлоридная соль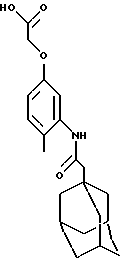
К раствору N-(5-гидрокси-2-метилфенил)-трицикло[3.3.1.1.3,7]декан-1-ацетамида из Примера 12 (0,20 г) добавляют карбонат калия (0,106 г) и этилбромацетат (0,3 мл). Реакционную смесь перемешивают и нагревают при температуре 80oС в течение 24 часов. При охлаждении реакционную смесь сразу же разбавляют этилацетатом и промывают насыщенным солевым раствором. Отделяют органическую фазу, высушивают ее над сульфатом магния (МgSO4) и выпаривают при пониженном давлении с получением остатка, который очищают хроматографией на силикагеле, проводя элюцию изогексаном/диэтиловым эфиром (1: 1), с получением белого твердого вещества. Указанное твердое вещество растворяют в диоксане (20 мл), и раствор обрабатывают 2 М раствором гидроксида натрия, реакционную смесь перемешивают при температуре окружающей среды в течение 24 часов, подкисляют (2 М соляной кислотой) и экстрагируют этилацетатом. Органическую фазу промывают солевым раствором, высушивают ее над сульфатом магния (MgSO4) и выпаривают при пониженном давлении. Остаток растирают с диэтиловым эфиром с образованием целевого соединения в виде белого твердого вещества (0,079 г).
Точка плавления: 204oС-205oС
MS (APCI+ve) 358 (М+Н)+
1H ЯМР (ДМСО-d6) δ: 12,95 (1Н, с.), 9,03 (1Н, с.), 7,05 (2Н, м.), 6,60 (1Н, дд. ), 4,58 (2Н, с.), 2,12 (3Н, с.), 2,090 (2Н, с.), 1,94 (3Н, с.), 1,70-1,50 (12Н, м.).
Пример 15
N-(1-метил-1Н-идол-5-ил)-трицикло[3.3.1.1.3,7]декан-1-ацетамид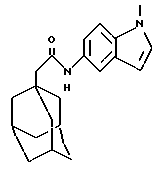
а) 1-метил-5-нитро-1Н-индол
К раствору 5-нитроиндола (0,20 г) в тетрагидрофуране (2 мл) добавляют гидрид натрия (0,06 г 60% дисперсии в масле) и отмечают выделение газа. После перемешивания в течение 30 минут к темно-коричневой реакционной смеси добавляют метилйодид
(0,086 мл) и нагревают указанную реакционную смесь до 65oС в течение 2 часов, после чего охлаждают до комнатной температуры и распределяют между дихлорметаном и водой. Отделяют органическую фазу, промывают ее раствором тиосульфата натрия (Na2SO4) и концентрируют с получением соединения а) в виде желтого твердого вещества (0,20 г).
1H ЯМР (ДМСО-d6) δ: 8,58 (1Н, д.), 8,04 (1Н, дд.), 7,65 (1Н, д.), 7,61 (1Н, д.), 6,75 (1Н, дд.), 3,88 (3Н, с.).
б) N-(1-метил-1Н-индол-5-ил)-трицикло[3.3.1.1.3,7]декан-1-ацетамид
К раствору 1-метил-5-нитроиндола со стадии а) (0,11 г) в этаноле (10 мл) добавляют 10% палладий на угле (0,023 г), и полученную суспензию перемешивают под давлением водорода 4 бара в течение 0,75 часа, после чего катализатор отфильтровывают и смесь концентрируют при пониженном давлении. Полученный остаток конденсируют с 1-адамантанацетилхлоридом (0,10 г) в соответствии с методом Примера 1б) с получением целевого соединения в виде белого твердого вещества (0,11 г).
Точка плавления: 183oС-184oС
MS (APCI+ve) 323 (M+H)+
1H ЯМР (ДМСО-d6) δ: 9,55 (1Н, с.), 7,87 (1H, д.), 7,32 (1Н, д.), 7,26 (1H, д.), 7,23 (1H, дд.), 6,34 (1H, дд.), 3,75 (3Н, с.), 2,04 (2Н, с.), 1,94 (3Н, с.), 1,75-1,50 (12Н, м.).
Пример 16
N-(1-(N, N-диметиламино)этил-1Н-индо-5-ил)-трицикло[3.3.1.1. 3,7]декан-1-ацетамид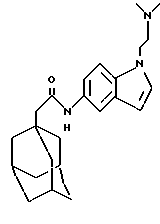
а) 1-(N,N-диметиламино)этил-5-нитро-1Н-индол
Следуют процедуре Примера 1б), начиная с 5-нитроиндола (0,217 г) и диметиламиноэтилхлорида гидрохлорида (0,21 г), с получением подцелевого соединения в виде оранжевого/коричневого твердого вещества (0,24 г).
1H ЯМР (ДМСО-d6) δ: 8,56 (1Н, д.), 8,02 (1H, дд.), 7,71 (1Н, д.), 7,61 (1H, д.), 6,74 (1H, дд.), 4,35 (2Н, т.), 2,62 (2Н, т.), 2,17 (6Н, с.).
б) N-(1-(N, N-диметиламино)этил-1Н-индо-5-ил)-трицикло-[3.3.1.1.3,7]декан-1-ацетамид
Следуют процедуре Примера 1б), начиная с 1-(N,N-диметиламино)этил-5-нитроиндола (0,23 г) и 1-адамантанацетилхлорида (0,21 г), с получением целевого соединения в виде белого твердого вещества (0,22 г).
Точка плавления: 125oС-127oС
MS (APCI+ve) 380 (M+H)+
1H ЯМР (ДМСО-d6) δ: 9,54 (1H, д.), 7,85 (1H, д.), 7,36 (1H, д.), 7,32 (1H, д.), 7,20 (1H, дд.), 6,33 (1Н, д.), 4,20 (2Н, т.), 2,58 (2Н, т.), 2,17 (6Н, с.), 2,04 (2Н, с.), 1,94 (3Н, с.), 1,65 (12Н, м.).
Пример 17
5-[[1-оксо-2-(трицикло[3.3.1.1. 3,7] дек-1-ил)этил]амино]-1Н-индол-1-уксусной кислоты 1,1-диметилэтиловый эфир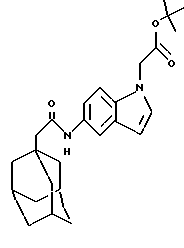
а) 5-нитро-1Н-индол-1-уксусной кислоты 1,1-диметилэтиловый эфир
Следуют процедуре Примера 15а), начиная с 5-нитроиндола (0,207 г) и 2-бромуксусной кислоты 1,1-диметилэтилового эфира (0,23 мл), с получением подцелевого соединения в виде желтого маслянистого твердого вещества (0,29 г).
1H ЯМР (ДМСО-d6) δ: 8,58 (1H, д.), 8,04 (1H, дд.), 7,60 (2Н, м.), 6,77 (1H, дд.), 3,15 (2Н, с.), 1,42 (9Н, с.).
б) 5-[[1-оксо-2-(трицикло[3.3.1.1.3,7]дек-1-ил)этил]амино]-1Н-индол-1-уксусной кислоты 1,1-диметилэтиловый эфир
Следуют процедуре Примера 15б), начиная с 5-нитро-1Н-индол-1-уксусной кислоты 1,1-диметилэтилового эфира (0,29 г) и 1-адамантанацетилхлорида (0,20 г), с получением целевого соединения в виде белого твердого вещества (0,24 г).
Точка плавления: 199oС
MS (APCI+ve) 423 (M+H)+
1H ЯМР (ДМСО-d6) δ: 9,56 (1H, с.), 7,86 (1H, д.), 7,27 (1Н, д.), 7,22 (2Н, м. ), 6,38 (1H, д.), 4,94 (2Н, с.), 2,04 (2Н, с.), 1,94 (3Н, с.), 1,65 (12Н, м.), 1,41 (9Н, с.).
Пример 18
N-(3-(2-хлорпиридил))-трицикло[3.3.1.1.3,7]декан-1-ацетамид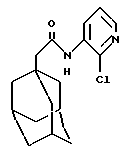
Следуют процедуре Примера 1б), начиная с 1-адамантанацетилхлорида (0,5 г) и 2-хлор-3-аминопиридина (0,31 г), с получением целевого соединения в виде белого твердого вещества (0,27 г).
Точка плавления: 135oС-136oС
MS (APCI+ve) 305 (М+Н)+
lH ЯМР (ДМСО-d6) 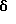 : 9,51 (1H, с.), 8,22 (1H, дд.), 8,15 (1H, дд.), 7,4 (1H, дд.), 2,20 (2Н, с.), 1,98 (3Н, с.), 1,60 (12Н, м.).
: 9,51 (1H, с.), 8,22 (1H, дд.), 8,15 (1H, дд.), 7,4 (1H, дд.), 2,20 (2Н, с.), 1,98 (3Н, с.), 1,60 (12Н, м.).
Пример 19
N-(3-(N, N-диметиламино)метил-1Н-индо-5-ил)-трицикло[3.3.1.1.3,7]декан-1-ацетамид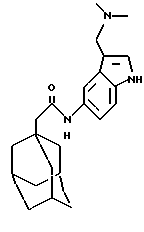
К суспензии амида индола из Примера 7 (0,163 г) в уксусной кислоте (0,20 мл) добавляют водный диметиламин (0,065 мл 40% раствора), водный формальдегид (0,043 мл 37% раствора) и уксусную кислоту (0,10 мл) и полученную реакционную смесь нагревают до 60oС в течение 2 часов, после чего охлаждают до температуры 0-5oС. Реакционную смесь подщелачивают добавлением водного раствора аммиака и распределяют ее между этилацетатом и водой. Отделяют органическую фазу, промывают ее солевым раствором, высушивают (Na2SO4) и концентрируют, после чего остаток очищают хроматографией на Аl2O3, проводя элюцию 0-10% метанолом в дихлорметане, с получением целевого соединения в виде коричневого твердого вещества (0,07 г).
Точка плавления: 194oС-213oС (разлож.)
MS (APCI+ve) 366 (М+H)+
1Н ЯМР (ДМСО-d6) δ: 11,24 (1Н, с.), 9,62 (1Н, с.), 8,00 (1Н, с.), 7,46 (1H, д.), 7,32 (1H, д.), 7,21 (1Н, дд.), 4,12 (2Н, шс.), 2,55 (6Н, с.), 2,06 (2Н, с.), 1,94 (3Н, с.), 1,70-1,58 (12Н, м.).
Пример 20
N-(4-метокси-2-метилфенил)-трицикло[3.3.1.1.3,7]декан-1-ацетамид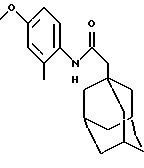
Следуют процедуре Примера 1б), начиная с 1-адамантанацетилхлорида (2,0 г) и 4-метокси-2-метиланилина (1,29 г), с получением целевого соединения в виде белого твердого вещества (1,37 г).
Точка плавления: 156oС-157oС
MS (APCI+ve) 314 (М+H)+
1H ЯМР (ДМСО-d6) δ: 9,01 (1H, с.), 7,15 (1H, д.), 6,80 (1H, д.), 6,7 (1H, дд. ), 3,7 (3Н, с.), 2,20 (3Н, с.), 2,05 (2Н, с.), 1,95 (3Н, с.), 1,60 (12Н, м.).
Пример 21
N-(2-хлор-5-метоксифенил)-трицикло[3.3.1.1.3,7]декан-1-ацетамид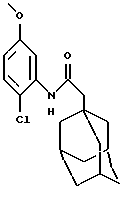
Следуют процедуре Примера 1б), начиная с 1-адамантанацетилхлорида (2,0 г) и 2-хлор-5-метоксианилина (1,49 г), с получением целевого соединения в виде белого твердого вещества (0,60 г).
Точка плавления: 122oC-123oC
MS (APCI+ve) 334 (M+H)+
1H ЯМР (ДМСО-d6) δ: 9,20 (1Н, с.), 7,36 (2Н, м.), 6,76 (1Н, дд.), 6,7 (1H, дд.), 3,73 (3Н, с.), 2,20 (2Н, с.), 1,95 (3Н, с.), 1,60 (12Н, м.).
Пример 22
N-(4-гидрокси-2-метилфенил)-трицикло[3.3.1.1.3,7]декан-1-ацетамид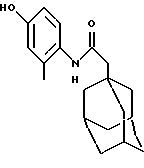
К раствору N-(4-метокси-2-метилфенил)-трицикло [3.3.1.1.3,7]декан-1-ацетамида из Примера 20 (1,20 г) в дихлорметане (50 мл) при -78oС добавляют трибромид бора (4 мл 1,0 М раствора в дихлорметане) в инертной атмосфере. Реакционную смесь перемешивают в течение 24 часов, затем нагревают до температуры окружающей среды и промывают солевым раствором. Органический слой высушивают затем над сульфатом магния (MgSO4) и концентрируют при пониженном давлении с получением остатка, который очищают хроматографией на силикагеле, проводя элюцию изогексаном/диэтиловым эфиром (1:1), с получением целевого соединения в виде белого твердого вещества (0,54 г).
Точка плавления: 205oС-206oС
MS (APCI+ve) 300 (М+Н)+
1H ЯМР (ДМСО-d6) 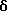 : 9,15 (1Н, с.), 8,91 (1Н, с.), 7,00 (1Н, д.), 6,54 (2Н, м.), 2,53 (3Н, с.), 2,03 (2Н, с.), 1,94 (3Н, с.), 1,70-1,50 (12Н, м.).
: 9,15 (1Н, с.), 8,91 (1Н, с.), 7,00 (1Н, д.), 6,54 (2Н, м.), 2,53 (3Н, с.), 2,03 (2Н, с.), 1,94 (3Н, с.), 1,70-1,50 (12Н, м.).
Пример 23
N-(3-гидроксиметил-2-метилфенил)-трицикло[3.3.1.1.3,7]декан-1-ацетамид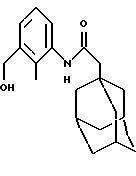
Следуют процедуре Примера 1б), начиная с 1-адамантанацетилхлорида (2,0 г) и 3-амино-2-метилбензилового спирта (1,29 г). Хроматография на силикагеле с проведением элюции 5%-ным этилацетатом в дихлорметане дает целевое соединения в виде белого твердого вещества (0,80 г).
Точка плавления: 205oС-206oС
MS (APCI+ve) 314 (M+H)+
1H ЯМР (ДМСО-d6) δ: 9,16 (1Н, с.), 7,20-7,05 (3Н, м.), 5,07 (1Н, шс.), 4,47 (2Н, с.), 2,09 (2Н, с.), 2,08 (3Н, с.), 1,95 (3Н, с.), 1,60 (12Н, м.).
Пример 24
N-(5-метокси-2-метил-3-нитрофенил)-трицикло[3.3.1.1. 3,7] -декан-1-ацетамид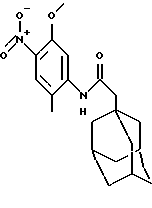
Следуют процедуре Примера 1б), начиная с 1-адамантанацетилхлорида (2,0 г) и 5-метокси-2-метил-4-нитроанилина (1,71 г). Хроматография на силикагеле с проведением элюции изогексаном/диэтиловым эфиром (1:1) дает целевое соединение в виде желтого твердого вещества (1,10 г).
Точка плавления: 141oС-142oС
MS (APCI+ve) 359 (М+H)+
1H ЯМР (ДМСО-d6) δ: 9,26 (1Н, с.), 7,82 (1H, с.), 7,76 (1Н, с.), 3,86 (3Н, с.), 2,23 (3Н, с.), 2,08 (2Н, с.), 1,95 (3Н, с.), 1,60 (12Н, м.).
Пример 25
N-(5-гидроксиметил-2-метилфенил)-трицикло[3.3.1.1.3,7]декан-1-ацетамид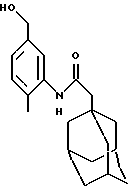
Следуют процедуре Примера 1б), начиная с 1-адамантанацетилхлорида (2,0 г) и 3-амино-4-метилбензилового спирта (1,29 г). Хроматография на силикагеле с проведением элюции 5%-ным этилацетатом в дихлорметане дает целевое соединение в виде белого твердого вещества (1,10 г).
Точка плавления: 190oС
MS (APCI+ve) 314 (М+Н)+
1H ЯМР (ДМСО-d6) δ: 8,54 (1Н, шс.), 7,46 (1H, с.), 7,1 (2Н, м.), 4,70 (1H, шс. ), 4,54 (2Н, д.), 2,24 (3Н, с.), 2,15 (2Н, с.), 2,0 (3Н, с.), 1,70 (12Н, м.).
Пример 26
N-(3-гидрокси-2-метилфенил)-трицикло[3.3.1.1.3,7]декан-1-ацетамид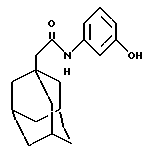
Следуют процедуре Примера 1б), начиная с 1-адамантанацетилхлорида (0,81 г) и 3-амино-2-метилфенола (0,5 г), с получением целевого соединения в виде белого твердого вещества (0,5 г).
Точка плавления: 211oС
MS (APCI+ve) 300 (М+Н)+
1H ЯМР (ДМСО-d6) 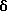 : 9,28 (1Н, шс.), 9,04 (1H, шc.), 6,91 (1H, т.), 6,8 (1H, д. ), 6,6 (1H, д.), 2,05 (2Н, с.), 1,98 (3Н, с.), 1,94 (3Н, шс.), 1,6 (12Н, м.).
: 9,28 (1Н, шс.), 9,04 (1H, шc.), 6,91 (1H, т.), 6,8 (1H, д. ), 6,6 (1H, д.), 2,05 (2Н, с.), 1,98 (3Н, с.), 1,94 (3Н, шс.), 1,6 (12Н, м.).
Пример 27
N-(2-метил-5-(1-пирролидинметил)фенил)-трицикло[3.3.1.1. 3,7] декан-1-ацетамида гидрохлорид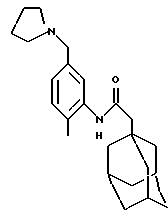
К раствору N-(5-гидроксиметил-2-метилфенил)-трицикло-[3.3.1.1. 3,7]декан-1-ацетамида из Примера 25 (1,0 г) в ацетонитриле добавляют трифенилфосфин (0,93 г) и тетрабромид углерода (1,2 г). Реакционную смесь перемешивают при температуре окружающей среды в течение 24 часов и выпаривают при пониженном давлении. Остаток очищают хроматографией на силикагеле, проводя элюцию изогексаном/диэтиловым эфиром с получением белого твердого вещества. Часть (0,1 г) указанного твердого вещества растворяют в ацетонитриле (3 мл) и обрабатывают пирролидином (0,2 мл). Реакционную смесь перемешивают и нагревают при 80oС в течение 24 часов. Сразу при охлаждении реакционную смесь разбавляют этилацетатом и промывают насыщенным солевым раствором. Отделяют органическую фазу, высушивают ее над сульфатом магния (МgSO4), обрабатывают раствором хлористого водорода в диэтиловом эфире (1 мл 1,0 М) и выпаривают при пониженном давлении с получением остатка, который растирают с изогексаном с получением целевого соединения в виде желтовато-белого твердого вещества (0,030 г).
Точка плавления: 214oС-215oС
MS (APCI+ve) 367 (М+Н)+ для свободного основания
1H ЯМР (ДМСО-d6) δ: 9,22 (1Н, с.), 7,60 (1Н, с.), 7,27 (2Н, с.), 4,27 (2Н, д.), 3,35 (2Н, м.), 3,05 (2Н, м.), 2,21 (3Н, с.), 2,1 (2Н, с.), 2,0-1,8 (7Н, м.), 1,60 (12Н, м.).
Пример 28
N-(2-хлор-5-гидроксифенил)-трицикло[3.3.1.1.3,7]декан-1-ацетамид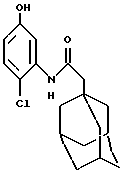
Следуют процедуре Примера 1б), начиная с 1-адамантанацетилхлорида (2,9 г) и 2-хлор-4-гидроксианилина (2,0 г). Хроматография на силикагеле при проведении элюции 30%-ным диэтиловым эфиром в изогексане с последующей повторной кристаллизацией из ацетонитрила дает целевое соединение в виде белого твердого вещества (0,15 г).
Точка плавления: 224oС-225oС
MS (APCI+ve) 320 (М+Н)+
1Н ЯМР (ДМСО-d6) δ: 9,76 (1Н, с.), 9,14 (1Н, с.), 7,26 (1Н, д.), 6,83 (1Н, д.), 6,69 (1Н, дд.), 2,05 (2Н, с.), 1,95 (3Н, с.), 1,60 (12Н, м.).
Пример 29
N-(2-хлор-4-гидроксифенил)-трицикло[3.3.1.1.3,7]декан-1-ацетамид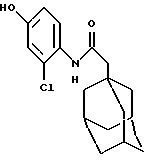
Следуют процедуре Примера 1б), начиная с 1-адамантанацетилхлорида (2,9 г) и 2-хлор-4-гидроксианилина, с получением целевого соединения в виде белого твердого вещества (0,15 г).
Точка плавления: 224-225oС
MS (APCI+ve) 320 (М+Н)+
1H ЯМР (ДМСО-d6) δ: 9,65 (1Н, с.), 9,09 (1Н, с.), 7,23 (2Н, м.), 6,55 (1Н, дд.), 2,20 (2Н, с.), 1,95 (3Н, с.), 1,60 (12Н, м.).
Пример 30
N-(2-метил-3-(2-(1-пирролидино)этилокси)фенил)-трицикло-[3.3.1.1.3,7]декан-1-ацетамида гидрохлорид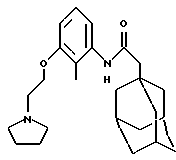
К раствору N-(3-гидрокси-2-метилфенил)-трицикло[3.3.1.1.3,7]декан-1-ацетамида из Примера 26 (0,060 г) в ацетонитриле (3 мл) добавляют карбонат цезия (0,196 г) и N-(2-хлорэтил)-пирролидина гидрохлорид (0,068 г). Реакционную смесь перемешивают и нагревают при 80oС в течение 24 часов. После охлаждения реакционную смесь разбавляют этилацетатом и промывают водой. Органическую фазу высушивают над сульфатом магния и выпаривают под пониженным давлением с получением остатка, который подвергают очистке с помощью жидкостной хроматографии при сверхвысоких температурах с использованием градиентной элюции 0,1% (объем/объем) раствором диэтиламина в метаноле и двуокиси углерода при сверхвысокой температуре на колонке Циано (Суаnо). Чистый продукт растворяют в дихлорметане, обрабатывают 1,0 М раствором хлористого водорода в диэтиловом эфире и выпаривают при пониженном давлении с получением целевого соединения в виде белого твердого вещества (0,010 г).
Точка плавления: 105-107oС
MS (APCI+ve) 391 (М+Н)+ для свободного основания
1H ЯМР (ДМСО-d6)  : 9,22 (1Н, с.), 7,12 (2Н, т.), 6,97 (1Н, д.), 6,81 (1Н, д. ), 4,30 (2Н, т.), 3,60 (4Н, м.), 3,10 (2Н, м.), 2,05 (6Н, с.), 1,95 (6Н, м.), 1,60 (12Н, м.).
: 9,22 (1Н, с.), 7,12 (2Н, т.), 6,97 (1Н, д.), 6,81 (1Н, д. ), 4,30 (2Н, т.), 3,60 (4Н, м.), 3,10 (2Н, м.), 2,05 (6Н, с.), 1,95 (6Н, м.), 1,60 (12Н, м.).
Пример 31
N-(5-метоксиметил-2-метилфенил)-трицикло[3.3.1.1.3,7]декан-1-ацетамид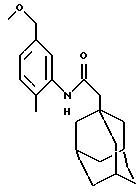
К раствору бензилбромида, полученного в Примере 27, (0,10 г) в метаноле (5 мл) добавляют метоксид натрия (0,020 г). Реакционную смесь перемешивают при температуре окружающей среды в течение 2 часов и затем выпаривают при пониженном давлении с получением остатка, который растворяют в этилацетате и промывают с использованием 2 М соляной кислоты. Органическую фазу высушивают над сульфатом магния и выпаривают при пониженном давлении, а остаток растирают с диэтиловым эфиром с получением целевого соединения в виде белого твердого вещества (0,015 г).
Точка плавления: 127-128oС
MS (APCI+ve) 328 (M+H)+
1H ЯМР (ДМСО-d6) δ: 9,10 (1H, с.), 7,33 (1Н, с.), 7,15 (1H, д.), 6,99 (1H, д. ), 4,34 (3Н, с.), 2,20 (3Н, с.), 2,10 (2Н, с.), 1,95 (6Н, м.), 1,60 (12Н, м.).
Пример 32
N-(2-метил-3-(2-(1-морфолино)этилокси)фенил)-трицикло[3.3.1.1. 3,7] декан-1-ацетамида гидрохлорид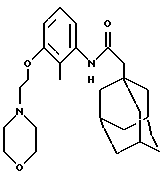
Процедуру проводят по методу Примера 30 с использованием N-(3-гидрокси-2-метилфенил)-трицикло [3.3.1.1.3,7]декан-1-ацетамида (0,060 г) и N-(2-хлорэтил)-морфолина гидрохлорида (0,075 г) с получением целевого соединения в виде белого твердого вещества (0,024 г).
Точка плавления: 195-197oС
MS (APCI+ve) 413 (М+H)+ для свободного основания
1H ЯМР (ДМСО-d6) δ: 11,36 (1Н, шс.), 9,23 (1Н, с.), 7,15 (1Н, т.), 6,99 (1Н, д. ), 6,83 (1Н, д.), 4,42 (2Н, т.), 4,10-3,0 (12Н, м.), 2,08 (2Н, с.), 2,07 (3Н, с.), 1,95 (3Н, с.), 1,60 (12Н, м.).
Пример 33
N-(2-метил-3-(2-(1-пиперидино)этилокси)фенил)-трицикло-[3.3.1.13,7] декан-1-ацетамида гидрохлорид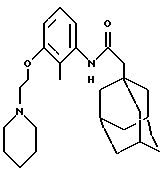
Процедуру проводят по методу Примера 30 с использованием N-(3-гидрокси-2-метилфенил)-трицикло[3.3.1.13,7]декан-1-ацетамида (0,060 г) и N-(2-хлорэтил)-пиперидина гидрохлорида (0,074 г) с получением целевого соединения в виде белого твердого вещества (0,036 г).
Точка плавления: 105-106oС
MS (APCI+ve) 412 (M+H)+ для свободного основания
1H ЯМР (ДМСО-d6) δ: 10,62 (1Н, шс.), 9,24 (1Н, с.), 7,12 (1Н, т.), 6,97 (1Н, д. ), 6,82 (1Н, д.), 4,42 (2Н, т.), 3,50 (4Н, м.), 3,05 (2Н, м.), 2,10 (2Н, с.), 2,05 (3Н, с.), 2,0 (3Н, с.), 1,90-1,50 (18Н, м.).
Пример 34
N-(2-метил-5-(1-морфолинометил)фенил)-трицикло[3.3.1.1. 3,7]декан-1-ацетамида гидрохлорид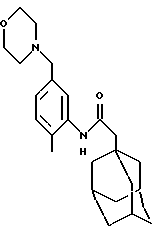
Процедуру проводят по методу Примера 27 с использованием N-(5-гидроксиметил-2-метилфенил)-трицикло[3.3.1.13,7] декан-1-ацетамида и морфолина гидрохлорида (0,040 г). Очистку проводят с помощью жидкостной хроматографии при сверхвысоких температурах с использованием градиентной элюции 0,1% (объем/объем) раствором диэтиламина в метаноле и двуокиси углерода при сверхвысокой температуре на колонке Циано (Суаnо) с получением чистого продукта, который растворяют в дихлорметане, обрабатывают 1,0 М раствором хлористого водорода в диэтиловом эфире и выпаривают при пониженном давлении с получением целевого соединения в виде белого твердого вещества (0,085 г).
Точка плавления: 204-205oС
MS (APCI+ve) 384 (М+Н)+ для свободного основания
1H ЯМР (ДМСО-d6) 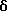 : 9,22 (1Н, с.), 7,60 (1H, с.), 7,27 (2Н, с.), 4,30 (2Н, д.), 4,0 (2Н, м.), 3,8-3,6 (4Н, м.), 3,40-2,8 (7Н, м.), 2,25 (3Н, с.), 2,15 (2Н, с.), 2,0 (3Н, с.), 1,60 (12Н, м.).
: 9,22 (1Н, с.), 7,60 (1H, с.), 7,27 (2Н, с.), 4,30 (2Н, д.), 4,0 (2Н, м.), 3,8-3,6 (4Н, м.), 3,40-2,8 (7Н, м.), 2,25 (3Н, с.), 2,15 (2Н, с.), 2,0 (3Н, с.), 1,60 (12Н, м.).
Пример 35
N-(5-(3-(2-N, N-диметиламиноэтил)индолил))-трицикло[3.3.1.13,7]декан-1-ацетамида гидрохлорид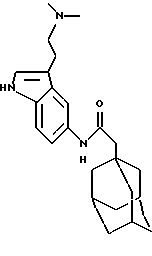
Процедуру проводят по методу Примера 1б) с использованием 1-адамантанацетилхлорида (0,040 г) и 5-амино-3-(2-диметиламиноэтил)индола гидрохлорида (0,18 г). Очистку проводят с помощью жидкостной хроматографии при сверхвысоких температурах с использованием градиентной элюции 0,1% (объем/объем) раствором диэтиламина в метаноле и двуокиси углерода при сверхвысокой температуре на колонке Циано (Суаnо) с получением чистого продукта, который растворяют в дихлорметане, обрабатывают 1,0 М раствором хлористого водорода в диэтиловом эфире и выпаривают при пониженном давлении с получением целевого соединения в виде бледно-желтого вещества (0,031 г).
Точка плавления: 145-147oС
MS (APCI+ve) 380 (M+H)+ для свободного основания
1H ЯМР (ДМСО-d6) δ: 10,89 (1Н, с.), 9,58 (1H, с.), 7,95 (1Н, д.), 7,25 (1H, дд.), 7,15 (1H, д.), 7,12 (1H, дд.), 3,33 (2Н, м.), 3,05 (2Н, м.), 2,85 (6Н, 2с.), 2,03 (2Н, с.), 1,95 (3Н, с.), 1,60 (12Н, м.).
Пример 36
Метил 4-метил-3-[[1-оксо-2-(трицикло[3.3.1.13,7]дек-1-ил)этил]амино]тиофен-2-карбоксилат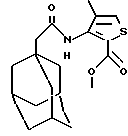
Раствор 1-адамантанацетилхлорида (0,2 г), полученный по процедуре Примера 1а), добавляют к раствору метил 3-амино-4-метилтиофен-2-карбоксилата (0,16 г) в пиридине (2 мл) и дихлорметане (4 мл). Реакционную смесь перемешивают при температуре окружающей среды в течение 2 дней, после чего разбавляют этилацетатом. Затем органическую фазу промывают разбавленной соляной кислотой и водой, высушивают над сульфатом магния (MgSO4) и в итоге концентрируют при пониженном давлении с получением масла. Очистка остатка гель-хроматографией на силикагеле с проведением элюции 10% этилацетатом в изогексанах дает целевое соединение в виде белого твердого вещества (0,049 г).
Точка плавления: 124-124,5oС
MS (APCI+ve) 348 (M+H)+
1H ЯМР (CDCl3) δ: 8,76 (1Н, с.), 7,13 (1Н, с.), 3,86 (3Н, с.), 2,23 (3Н, с.), 2,18 (2Н, с.), 2,0 (3Н, шс.), 1,70 (12Н, м.).
Пример 37
N-(3-метокси-2-метилфенил)-трицикло[3.3.1.1.3,7]декан-1-ацетамид
Добавляют диэтилазодикарбоксилат (0,20 мл) к раствору N-(3-гидрокси-2-метилфенил)-трицикло[3.3.1.13,7] декан-1-ацетамида (0,20 г, Пример 26), метанола (0,10 мл) и трифенилфосфина (0,41 г) в толуоле (10 мл) и тетрагидрофуране (5 мл). После 2-часового перемешивания при комнатной температуре добавляют еще трифенилфосфин (0,20 г) и диэтилазодикарбоксилат (0,10 мл) и раствор перемешивают 2 часа. Реакционную смесь концентрируют при пониженном давлении и остаток очищают хроматографией на силикагеле с проведением элюции смесью дихлорметан:этилацетат (19:1) с получением целевого соединения в виде бесцветного твердого вещества (0,20 г).
Точка плавления: 173-175oС
MS (APCI+ve) 314 (М+Н)+
1H ЯМР (CDCl3) δ: 7,48 (1Н, д.), 7,16 (1Н, т.), 6,86 (1Н, шс.), 6,69 (1Н, д.), 3,82 (3Н, с.), 2,13 (5Н, с.), 2,00 (3Н, с.), 1,75-1,6 (12Н, м.).
Пример 38
N-(2-метил-3-(2-(1-имидазоло)этилокси)фенил)-трицикло[3.3.1.13,7] декан-1-ацетамид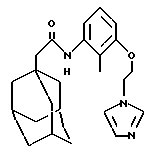
Добавляют диэтилазодикарбоксилат (0,060 мл) к раствору N-(3-гидрокси-2-метилфенил)-трицикло[3.3.1.13,7] декан-1-ацетамида (0,100 г, Пример 26), 1-(2-гидроксиэтил)имидазола (0,048 г, J. Heterocyclic Chem., 1990, 27, 215) и трифенилфосфина (0,097 г) в тетрагидрофуране (4 мл). После 24-часового перемешивания при комнатной температуре добавляют еще трифенилфосфин (0,100 г) и диэтилазодикарбоксилат (0,060 мл) и раствор перемешивают в течение 6 дней. Реакционную смесь концентрируют при пониженном давлении и остаток очищают методом ВЭЖХ с НФ на колонке Новапак® (Novapak®), проводя элюцию 0-10% этанолом с использованием автоматизированной хроматографической системы для элюции Gilson и получают масло, которое растирают с эфиром, что дает целевое соединение в виде бесцветного твердого вещества (0,041 г).
Точка плавления: 119,5-121oС
MS (APCI+ve) 394 (M+H)+
1H ЯМР (СDСl3)  : 7,60 (1Н, с.), 7,51 (1H, д.), 7,14 (1Н, т.), 7,08 (1H, с.), 7,03 (1H, с.), 6,85 (1H, шс.), 6,61 (1H, д.), 4,37 (2Н, т.), 4,21 (2Н, т.), 2,13 (2Н, с.), 2,09 (3Н, с.), 2,00 (3Н, с.), 1,8-1,6 (12Н, м.).
: 7,60 (1Н, с.), 7,51 (1H, д.), 7,14 (1Н, т.), 7,08 (1H, с.), 7,03 (1H, с.), 6,85 (1H, шс.), 6,61 (1H, д.), 4,37 (2Н, т.), 4,21 (2Н, т.), 2,13 (2Н, с.), 2,09 (3Н, с.), 2,00 (3Н, с.), 1,8-1,6 (12Н, м.).
Пример 39
N-(2,4,6-триметилфенил)-трицикло [3.3.1.13,7]декан-1-ацетамид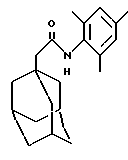
Добавляют тионилхлорид (3 мл) к 1-адамантануксусной кислоте (0,50 г) и реакционную смесь нагревают при температуре кипения с обратным холодильником в течение 2 минут. Избыток тионилхлорида удаляют концентрированном при пониженном давлении и затем остаток растворяют в дихлорметане (5 мл). Указанный раствор добавляют к раствору 2,4,6-триметиланилина (0,72 мл) в дихлорметане (20 мл) и триэтиламине (1 мл) при комнатной температуре в течение 1 минуты. Через 5 минут реакционную смесь концентрируют при пониженном давлении и остаток наносят на колонку с силикагелем. После этого смесь хроматографируют с проведением элюции дихлорметаном и затем смесью дихлорметан: этилацетат (9: 1) с получением целевого соединения в виде бесцветного твердого вещества (0,469 г).
Точка плавления: 212-215oС
MS (APCI+ve) 312 (M+H)+
1H ЯМР (ДМСО-d6) δ: 8,97 (1H, с.), 6,85 (2Н, с.), 2,21 (3Н, с.), 2,10 (6Н, с.), 2,06 (2Н, с.), 1,95 (3Н, с.), 1,8-1,5 (12Н, м.).
Пример 40
N-(5-(3-аминопропилокси)-2-метилфенил)-трицикло[3.3.1.13,7] декан-1-ацетамида гидрохлорид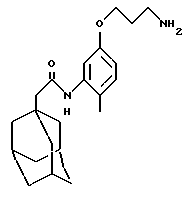
Следуют процедуре Примера 2 с использованием диэтилазодикарбоксилата (1,05 мл), N-(5-гидрокси-2-метилфенил)-трицикло[3.3.1.1.3,7]декан-1-ацетамида (0,506 г, Пример 12), трет-бутил N-(3-гидроксипропил)карбамата (1,15 г) и трифенилфосфина (1,75 г) с получением целевого соединения в виде желтого твердого вещества (0,21 г).
Точка плавления: 145oС
MS (APCI+ve) 357 (M+H)+
1H ЯМР (ДМСО-d6) δ: 9,05 (1Н, с.), 7,91 (3Н, шс.), 7,15-7,05 (2Н, м.), 6,66 (1Н, дд.), 3,99 (2Н, т.), 2,94 (2Н, т.), 2,13 (3Н, с.), 2,10 (2Н, с.), 2,05-1,9 (5Н, м.), 1,75-1,55 (12Н, м.).
Пример 41
N-(5-(3-(N-метиламино] пропилокси)-2-метилфенил)-трицикло[3.3.1.13,7]декан-1-ацетамида гидрохлорид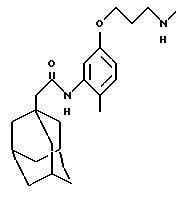
Добавляют диэтилазодикарбоксилат (0,50 мл) к раствору N-(5-гидрокси-2-метилфенил)-трицикло[3.3.1.1. 3,7] декан-1-ацетамида (0,50 г, Пример 12), трет-бутил N-(3-гидроксипропил)-N-метилкарбамата (0,50 г, J. Organic Chem., 1988, 53(10), 2229) и трифенилфосфина (0,88 г) в тетрагидрофуране (5 мл). После 19-часового перемешивания при комнатной температуре добавляют еще трифенилфосфин (0,90 г) и диэтилазодикарбоксилат (0,50 мл). После перемешивания в течение 4 часов при комнатной температуре вновь добавляют трифенилфосфин (0,90 г) и диэтилазодикарбоксилат (0,50 мл) и реакционную смесь перемешивают в течение 3 дней. Затем указанную реакционную смесь концентрируют при пониженном давлении и остаток очищают хроматографией на силикагеле при проведении элюции смесью дихлорметан:этилацетат (9:1) с получением материала, который далее очищают хроматографией на колонке Динамакс® (Dynamax®), проводя элюцию смесью изогексан:этилацетат (4:1) с использованием автоматизированной хроматографической системы для элюции Gilson, и получают продукт реакции Мицунобу (Mitsunobu) (0,29 г), который растворяют в метаноле (10 мл). Затем к последнему раствору добавляют раствор хлористого водорода (который образуется при медленном добавлении ацетилхлорида (12 мл) к метанолу (10 мл) при 0oС, при этом следует соблюдать осторожность, так как это высоко экзотермическая реакция) и реакционную смесь перемешивают при комнатной температуре в течение 1 часа. После этого реакционную смесь концентрируют при пониженном давлении с получением целевого соединения в виде желтого твердого вещества (0,13 г).
MS (APCI+ve) 371 (M+H)+
1H ЯМР (ДМСО-d6) δ: 9,05 (1Н, с.), 8,76 (2Н, шс.), 7,15-7,05 (2Н, м.), 6,66 (1Н, дд. ), 3,99 (2Н, т.), 3,1-2,95 (2Н, м.), 2,6-2,5 (3Н, м.), 2,13 (3Н, с.), 2,10 (2Н, с.), 2,1-2,0 (2Н, м.), 1,94 (3Н, м.), 1,75-1,55 (12Н, м. ).
Пример 42
N6-(трицикло[3.3.1.13,7]декан-1-ацетил)аденин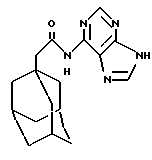
К раствору 1-адамантанацетилхлорида из Примера 1а) (0,226 г) в дихлорметане (5 мл) добавляют 4-нитрофенол (0,149 г), и реакционную смесь перемешивают при комнатной температуре в течение 1 часа, после чего концентрируют при пониженном давлении. Полученный сложный эфир 4-нитрофенола используют без дальнейшей очистки. К суспензии сложного эфира 4-нитрофенола (0,209 г), аденина (0,09 г) в диметилсульфоксиде (1,4 мл) добавляют триэтиламин (0,19 мл), и реакционную смесь нагревают до 90oС в течение 2 дней, после чего охлаждают до комнатной температуры. Реакционную смесь вливают в водный раствор кислого карбоната натрия и проводят экстракцию этилацетатом. Органические экстракты объединяют, промывают водой (3 раза), солевым раствором, высушивают (Na2SO4) и концентрируют под пониженным давлением. Растирание остатка с изогексаном и этиловым эфиром дает продукт в виде бледно-желтого твердого вещества (0,036 г).
Точка плавления: 309oС (разлож.)
MS (APCI+ve) 312 (М+Н)+
1H ЯМР (ДМСО-d6) 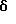 : 12,10 (1Н, с.), 11,06 (1Н, с.), 8,61 (1Н, с.), 8,40 (1Н, с.), 2,29 (2Н, с.), 1,92 (3Н, с.), 1,66 (6Н, д.), 1,60 (6Н, м.).
: 12,10 (1Н, с.), 11,06 (1Н, с.), 8,61 (1Н, с.), 8,40 (1Н, с.), 2,29 (2Н, с.), 1,92 (3Н, с.), 1,66 (6Н, д.), 1,60 (6Н, м.).
Пример 43
N-(3,5-диметокси-2-метилфенил)-трицикло[3.3.1.13,7]декан-1-ацетамид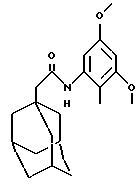
а) 3,5-диметокси-2-метилбензойная кислота
К раствору метил 3,5-диметокси-2-метилбензоата (5,83 г, J.C.S. Perkin I, 1973, 2853) в метаноле (80 мл) добавляют водный раствор гидроксида натрия (10%, 80 мл), и реакционную смесь перемешивают при комнатной температуре в течение 1 часа. Затем реакционную смесь концентрируют при пониженном давлении до примерно половины исходного объема, после чего добавляют водную соляную кислоту (200 мл). Образовавшийся белый осадок экстрагируют этилацетатом (2•250 мл). Объединенные экстракты высушивают над безводным сульфатом магния, фильтруют и концентрируют под пониженным давлением с получением соединения а) в виде бесцветного твердого вещества (5,41 г).
1H ЯМР (CDCl3) δ: 7,10 (1Н, д.), 6,64 (1H, д.), 3,84 (6Н, с.), 2,45 (3Н, с.).
б) N-(3,5-диметокси-2-метилфенил)-трицикло[3.3.1.13,7]декан-1-ацетамид
К раствору 3,5-диметокси-2-метилбензойной кислоты (1,0 г) в трет-бутаноле (30 мл) добавляют триэтиламин (0,8 мл) и затем дифенилфосфорилазид (1,2 мл), и полученную смесь нагревают при температуре кипения с обратным холодильником в течение 12 часов. Реакционную смесь охлаждают и концентрируют при пониженном давлении. Остаток распределяют между водным гидроксидом натрия (2 М, 100 мл) и дихлорметаном (300 мл). Органическую фазу высушивают над безводным сульфатом натрия, фильтруют и концентрируют при пониженном давлении с получением масла (0,74 г), которое растворяют в метаноле (10 мл). Затем к последнему раствору добавляют раствор хлористого водорода (который образуется при медленном добавлении ацетилхлорида (12 мл) к метанолу (10 мл) при 0oС, при этом следует соблюдать осторожность, так как это высоко экзотермическая реакция) и реакционную смесь перемешивают при комнатной температуре в течение 1 часа. Затем реакционную смесь концентрируют при пониженном давлении и остаток распределяют между насыщенным водным раствором кислого карбоната натрия (100 мл) и дихлорметаном (100 мл). Органическую фазу высушивают над сульфатом магния, фильтруют и концентрируют при пониженном давлении с получением масла (0,5 г), которое растворяют в дихлорметане (10 мл) и триэтиламине (2 мл). К последнему раствору добавляют раствор 1-адамантанацетилхорида (который образуется из 1-адамантануксусной кислоты (0,50 г) и тионилхлорида) в дихлорметане (5 мл), и смесь перемешивают при комнатной температуре в течение 2 часов. После этого реакционную смесь разбавляют дихлорметаном (100 мл), и раствор промывают водной соляной кислотой (2 М, 50 мл) и затем насыщенным водным раствором кислого карбоната натрия (50 мл). Органическую фазу высушивают над сульфатом магния, фильтруют и концентрируют при пониженном давленнии. Остаток очищают хроматографией на колонке с силикагелем, проводя элюцию смесью дихлорметан:этилацетат (19:1), с получением целевого соединения в виде бесцветного твердого вещества (0,54 г).
Точка плавления: 201-203oС
MS (APCI+ve) 344 (M+H)+
1H ЯМР (ДМСО-d6) δ: 9,08 (1Н, с.), 6,61 (1H, д.), 6,38 (1Н, д.), 3,76 (3Н, с.), 3,70 (3Н, т.), 2,07 (2Н, с.), 1,94 (6Н, с.), 1,75-1,55 (12Н, м.).
Пример 44
N-(3-(3-(N-метиламино)пропилокси)-2-метилфенил)-трицикло[3.3.1.1.3,7]декан-1-ацетамида гидрохлорид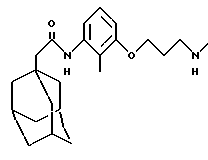
Сухой дихлорметан (40 мл), трифенилфосфин (3,28 г), имидазол (1,05 г) и йод (3,85 г) объединяют в указанном порядке. Добавляют раствор трет-бутил N-(3-гидроксипропил)-N-метилкарбамат (1,90 г, J. Org. Chem., 1988, 53(10), 2229) в дихлорметане (10 мл), и полученную реакционную смесь перемешивают при комнатной температуре в течение 1 часа. Затем добавляют водный раствор кислого сульфита натрия (6 г в 100 мл воды) и отделяют органический слой. Указанный слой высушивают над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем, проводя элюцию смесью изогексан:диэтиловый эфир (7:3), с получением трет-бутил N-(3-йодпропил)-N-метилкарбамата (2,54 г), который сразу же используют.
К суспензии N-(3-гидрокси-2-метилфенил)-трицикло[3.3.1.1.3,7]декан-1-ацетамида (0,453 г, Пример 26) в ацетонитриле (35 мл) добавляют карбонат цезия (0,655 г), и смесь нагревают при 100oС в течение 10 минут. После охлаждения до комнатной температуры добавляют раствор трет-бутил N-(3-йодпропил)-N-метилкарбамата (0,600 г) в ацетонитриле (5 мл), и реакционную смесь нагревают при температуре кипения с обратным холодильником в течение 90 минут. Затем реакционную смесь концентрируют при пониженном давлении и остаток распределяют между дихлорметаном (100 мл) и водой (100 мл). Органический слой высушивают над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток очищают хроматографией на силикагеле, проводя элюцию смесью дихлорметан:этилацетат (9:10), с получением твердого вещества, которое растворяют в метаноле (10 мл). Затем к последнему раствору добавляют раствор хлористого водорода (который образуется при медленном добавлении ацетилхлорида (12 мл) к метанолу (15 мл) при 0oС, при этом следует соблюдать осторожность, так как это высоко экзотермическая реакция) и реакционную смесь перемешивают при комнатной температуре в течение 1 часа. После этого реакционную смесь концентрируют при пониженном давлении с получением камеди, которую выскребают из смеси этиловый эфир:гексан (1:1) (20 мл) с получением целевого соединения в виде бледно-желтого порошка (0,477 г).
MS (APCI+ve) 371 (M-HC1+H)+
1H ЯМР (ДМСО-d6) δ: 9,05 (1Н, с.), 8,82 (2Н, шс.), 7,10 (1Н, т.), 6,94 (1H, д. ), 6,78 (1Н, д.), 4,05 (2Н, т.), 3,15-3,0 (2Н, м.), 2,58 (3Н, т.), 2,15-2,0 (7Н, м.), 1,94 (3Н, м.), 1,75-1,55 (12Н, м.).
Пример 45
N-(5-(3-(N,N-диметиламино)пропилокси)-2-метилфенил)-трицикло[3.3.1.13,7] декан-1-ацетамида гидрохлорид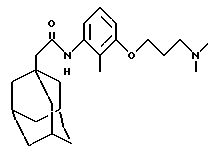
К суспензии N-(3-гидрокси-2-метилфенил)- трицикло[3.3.1.1.3,7]декан-1-ацетамида (0,473 г, Пример 26) в ацетонитриле (35 мл) добавляют карбонат цезия (1,31 г), и смесь нагревают при 80oС в течение 5 минут. После охлаждения до комнатной температуры добавляют твердый N,N-диметил-3-хлорпропиламин (0,274 г), и реакционную смесь нагревают при температуре кипения с обратным холодильником в течение ночи. Затем реакционную смесь концентрируют при пониженном давлении и остаток распределяют между дихлорметаном (100 мл) и водой (100 мл). Органический слой высушивают над безводным сульфатом натрия, фильтруют и концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем, проводя элюцию смесью дихлорметан:этанол: триэтиламин (95: 4:1), с получением желтой камеди. Указанную камедь растворяют в метаноле (10 мл) и обрабатывают избытком эфирного хлористого водорода (1 М, 5 эквивалентов). Затем раствор концентрируют при пониженном давлении с получением камеди, которую перемешивают в течение 2 дней в эфире (20 мл) с получением твердого вещества, которое отделяют фильтрованием (0,588 г).
MS (APCI+ve) 385 (M-HCl+H)+
1H ЯМР (ДМСО-d6) δ: 10,33 (1Н, шс.), 9,21 (1H, с.), 7,10 (1H, т.), 6,94 (1H, д. ), 6,78 (1H, д.), 4,04 (2Н, т.), 3,3-3,1 (2Н, м.), 2,79 (6Н, д.), 2,2-2,1 (2Н, м. ), 2,08 (2Н, с.), 2,05 (3Н, с.), 1,95 (3Н, с.), 1,75-1,55 (12Н, м.).
Пример 46
N-(5-метокси-2-метилфенил)- трицикло[3.3.1.13,7]деканилокси-1-ацетамид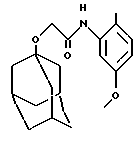
Добавляют тионилхлорид (3 мл) к 1-адамантилоксиуксусной кислоте (0,38 г, СА 1966, 65, 2149а) и реакционную смесь нагревают при температуре кипения с обратным холодильником в течение 2 минут. Избыток тионилхлорида удаляют концентрированием при пониженным давлении и остаток затем растворяют в дихлорметане (2,5 мл). Указанный раствор добавляют к раствору 5-метокси-2-метиланилина (0,37 мл) в дихлорметане (20 мл) и триэтиламине (1 мл) при комнатной температуре в течение 1 минуты. Через 3 дня реакционную смесь концентрируют при пониженном давлении и остаток наносят на колонку с силикагелем. После этого смесь хроматографируют с проведением элюции вначале дихлорметаном и затем смесью дихлорметан:этилацетат (19:1) с получением твердого вещества. Указанное твердое вещество растворяют в дихлорметане (75 мл), и раствор промывают водной соляной кислотой (2 М, 2•30 мл). Органический раствор высушивают над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток промывают смесью диэтиловый эфир:гексан (1: 1) с получением целевого соединения в виде бесцветного твердого вещества (0,40 г).
Точка плавления: 128-130oС
MS (APCI+ve) 330 (M+H)+
1H ЯМР (ДМСО-d6)  : 8,81 (1Н, с.), 7,46 (1H, д.), 7,12 (1Н, д.), 6,65 (1H, дд.), 4,04 (2Н, с.), 3,71 (3Н, с.), 2,15-2,12 (6Н, м.), 1,78 (6Н, д.), 1,7-1,5 (6Н, м.).
: 8,81 (1Н, с.), 7,46 (1H, д.), 7,12 (1Н, д.), 6,65 (1H, дд.), 4,04 (2Н, с.), 3,71 (3Н, с.), 2,15-2,12 (6Н, м.), 1,78 (6Н, д.), 1,7-1,5 (6Н, м.).
Пример 47
N-(5-метокси-2-метилфенил)-(3-бром-трицикло[3.3.1.13,7] -декан)-1-ацетамид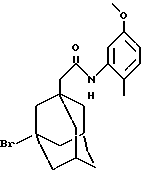
К раствору 3-бромадамантануксусной кислоты (CN 17768-3-2) (0,123 г) в дихлорметане (5 мл) добавляют оксалилхлорид (0,5 мл), и полученную реакционную смесь нагревают при температуре кипения с обратным холодильником в течение 2 часов, после чего концентрируют при пониженном давлении. Остаток растворяют в дихлорметане (5 мл) и добавляют по каплям смесь 5-метокси-2-метиланилина (0,062 г) и триэтиламина (0,2 мл) в дихлорметане (2 мл), и реакционную смесь перемешивают при комнатной температуре в течение 18 часов, после чего ее вливают в разбавленную НСl и проводят экстракцию диэтиловым эфиром. Органические экстракты объединяют, промывают водой, 15% раствором NaOH, солевым раствором, высушивают (Na2SO4) и концентрируют с образованием твердого вещества, которое растирают с диэтиловым эфиром с получением целевого соединения в виде белого твердого вещества (0,07 г).
Точка плавления: 133oС
MS (APCI+ve) 392/394 (М+Н)+
1H ЯМР (ДМСО-d6) δ: 9,13 (1Н, с.), 7,09 (1Н, д.), 7,05 (1Н, д.), 6,65 (1Н, дд.), 3,70 (3Н, с.), 2,28-2,13 (11Н, м.), 2,18 (2Н, с.), 1,68-1,55 (6Н, м.).
Пример 48
N-(5-метокси-2-метилфенил)-(2-окса-трицикло[3.3.1.1. 3,7] -декан)-1-ацетамид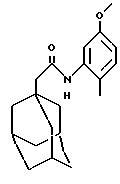
а) Этил (2-окса-трицикло [3.3.1.13,7]декан)-1-ацетат
Добавляют боргидрид натрия (0,093 г) к раствору этил 7-оксобицикло[3.3.1] нон-3-илиденацетата (0,113 г, Chem. Pharm. Bull., 1979, 27, 824) в этаноле (2 мл), и реакционную смесь оставляют перемешиваться при комнатной температуре в течение 3 дней. Затем реакционную смесь разбавляют дихлорметаном (60 мл) и промывают насыщенным водным раствором хлорида аммония (20 мл). Органическую фазу высушивают над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем, проводя элюцию вначале дихлорметаном и затем смесью дихлорметан: этиловый эфир (9: 1) с получением соединения а) в виде масла (0,078 г).
1Н ЯМР (ДМСО-d6) δ: 4,15 (2Н, к.), 4,09 (1Н, шс.), 2,37 (2Н, с.), 2,16 (2Н, шс.), 2,2-1,5 (10Н, м. ), 1,27 (3Н, т.).
б) N-(5-метокси-2-метилфенил)-(2-окса-трицикло[3.3.1.1.3,7] декан)-1-ацетамид
Водный раствор гидроксида натрия (10%, 2 мл) добавляют к раствору этил (2-окса-трицикло[3.3.1.13,7]декан)-1-ацетата (66 мг) в этаноле (2 мл). После перемешивания при комнатной температуре в течение 1 часа растворитель удаляют при пониженном давлении. Остаток распределяют между водной соляной кислотой (2 М, 6 мл) и дихлорметаном (2•20 мл). Органические экстракты высушивают над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении с получением (2-окса-трицикло[3.3.1.13,7]декан)-1-уксусной кислоты. К указанной кислоте добавляют тионилхлорид (3 мл), и реакционную смесь нагревают при температуре кипения с обратным холодильником в течение 2 минут. Избыток тионилхлорида удаляют концентрированием при пониженном давлении и остаток затем растворяют в дихлорметане (5 мл). Указанный раствор затем добавляют в течение 1 минуты к раствору 5-метокси-2-метиланилина (69 мг) в дихлорметане (5 мл) и триэтиламине (1 мл) при комнатной температуре и оставляют на 20 минут. После этого реакционную смесь разбавляют дихлорметаном до объема 60 мл и промывают водной соляной кислотой (2 М, 30 мл). Органическую фазу высушивают над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем, проводя элюцию вначале дихлорметаном и затем смесью дихлорметан: диэтиловый эфир (19:1) с получением после растирания с изогексаном бесцветного твердого вещества (0,05 г).
Точка плавления: 108-109,5oС
MS (APCI+ve) 316 (М+Н)+
1H ЯМР (ДМСО-d6) δ: 9,12 (1Н, с.), 7,39 (1Н, д.), 7,08 (1Н, д.), 6,61 (1Н, дд.), 4,09 (1Н, шс.), 3,69 (3Н, с.), 2,37 (2Н, с.), 2,15-2,05 (2Н, м.), 2,13 (3Н, с.), 1,9-1,55 (10Н, м.).
Пример 49
N-(5-метокси-2-метилфенил)-2-(трицикло[3.3.1.13,7]декан-1-амино)ацетамид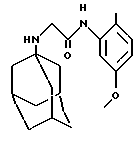
а) N-(5-метокси-2-метилфенил)-2-хлорацетамид
К раствору 5-метокси-2-метиланилина (7,62 г) и триэтиламина (15,5 мл) в дихлорметане (150 мл) при 0-5oС добавляют по каплям хлорацетилхлорид (5,0 мл), после чего убирают ледяную баню. Полученную реакционную смесь перемешивают в течение 45 минут и затем вливают в разбавленную НСl и проводят экстракцию дихлорметаном. Органические экстракты объединяют, промывают водой, высушивают (Na2SO4) и концентрируют с образованием коричневого твердого вещества, которое растирают с диэтиловым эфиром с получением подцелевого соединения в виде бежевого твердого вещества (5,7 г).
Точка плавления: 89-91oС
1H ЯМР (ДМСО-d6) δ: 9,58 (1Н, с.), 7,12 (1Н, д.), 7,05 (1Н, д.), 6,71 (1Н, дд.), 4,30 (2Н, с.), 3,71 (3Н, с.), 2,13 (3Н, с.).
б) N-(5-метокси-2-метилфенил)-2-(трицикло[3.3.1.13,7] декан-1-амино)ацетамид
Раствор хлорамида, полученного на стадии а) (0,092 г), адамантанамина (0,13 г), диизопропилэтиламина (0,17 мл) и тетрагидрофурана (1,5 мл) нагревают в запаянной ампуле Витона (Wheaton vial) до 100oC в течение 18 часов. Затем реакционную смесь охлаждают до комнатной температуры и вливают в воду, после чего экстрагируют диэтиловым эфиром. Органические экстракты объединяют, промывают солевым раствором, высушивают (Na2SO4), концентрируют и остаток очищают хроматографией на колонке с силикагелем, проводя элюцию 0-2% метанолом в дихлорметане, с получением целевого соединения в виде белого твердого вещества (0,034 г).
Точка плавления: 158oС
MS (APCI+ve) 329 (M+H)+
1H ЯМР (ДМСО-d6) δ: 9,92 (1Н, с.), 7,76 (1H, д.), 7,10 (1Н, д.), 6,57 (1H, дд.), 3,69 (3Н, с.), 3,22 (2Н, с.), 2,27 (1H, шс.), 2,18 (3Н, с.), 2,01 (3Н, с.), 1,58 (12Н, с.).
Пример 50
N-(3,5-диметоксифенил)-трицикло[3.3.1.1.3,7]декан-1-ацетамид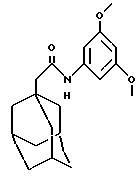
Следуют процедуре Примера 39 с использованием 1-адамантануксусной кислоты (3,0 г) и 3,5-диметоксианилина (3,0 г) с получением целевого соединения в виде белого твердого вещества (4,2 г).
Точка плавления: 144-146oС
MS (APCI+ve) 330 (M+H)+
1H ЯМР (ДМСО-d6) δ: 9,69 (1Н, с.), 6,86 (2Н, д.), 6,18 (1Н, т.), 3,70 (6Н, с.), 2,02 (2Н, с.), 1,93 (3Н, с.), 1,68-1,57 (12Н, м.).
Пример 51
N-(3,5-дигидроксифенил)-трицикло[3.3.1.1.3,7]декан-1-ацетамид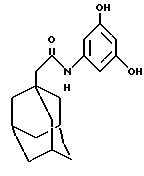
К раствору N-(3,5-диметоксифенил)-трицикло[3.3.1.1.3,7]-декан-1-ацетамида (2,22 г) в дихлорметане (200 мл) при -78oС добавляют трибромид бора (60 мл 1 М раствора в дихлорметане). Убирают охлаждающую баню и перемешивают реакционную смесь при комнатной температуре в течение 3 дней. Затем реакцию гасят добавлением льда (230 г). После энергичного перемешивания в течение 30 минут добавляют этилацетат (700 мл), отделяют органический слой, высушивают его (МgSO4) и концентрируют. Остаток очищают хроматографией на колонке с силикагелем, проводя элюцию 5% этанолом в дихлорметане, с получением белого твердого вещества (1,95 г). Часть указанного вещества повторно кристаллизуют из горячего этилацетата с получением целевого соединения в виде желтовато-белого твердого вещества.
Точка плавления: 239-242oС
MS (APCI+ve) 302 (М+Н)+
1H ЯМР (ДМСО-d6) δ: 9,42 (1Н, с.), 9,09 (2Н, с.), 6,55 (2Н, д.), 5,87 (1Н, т.), 1,99 (2Н, с.), 1,92 (3Н, с.), 1,69-1,56 (12Н, м.).
Пример 52
N-(3,5-диметоксифенил)-трицикло[3.3.1.1.3,7]деканилокси-1-ацетамид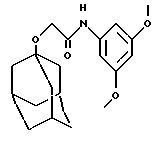
Следуют процедуре Примера 46 с использованием 1-адамантануксусной кислоты (2,0 г) и 3,5-диметоксианилина (1,75 г), получая целевое соединение в виде масла (2,5 г).
MS (APCI+ve) 346 (М+Н)+
1H ЯМР (ДМСО-d6)  : 9,23 (1Н, с.), 6,94 (2Н, с.), 6,23 (1Н, с.), 3,98 (2Н, с.), 3,71 (6Н, с.), 2,12 (3Н, с.), 1,76 (6Н, д.), 1,59 (6Н, м.).
: 9,23 (1Н, с.), 6,94 (2Н, с.), 6,23 (1Н, с.), 3,98 (2Н, с.), 3,71 (6Н, с.), 2,12 (3Н, с.), 1,76 (6Н, д.), 1,59 (6Н, м.).
Пример 53
N-(3,5-бис-(3-аминопропилокси)фенил)-трицикло[3.3.1.13,7] декан-1-ацетамид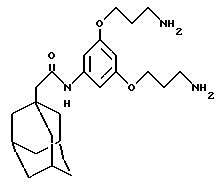
Следуют процедуре Примера 2 с использованием N-(3,5-дигидроксифенил)-трицикло[3.3.1.13,7] декан-1-ацетамида из Примера 51 (0,60 г), трет-бутил N-(3-гидроксипропил)карбамата (1,43 г), трибутилфосфита (2,0 мл) и 1,1'-(азодикарбонил)дипиперидина (2,05 г), получая целевое соединение в виде желтовато-коричневого твердого вещества (0,12 г).
MS (APCI+ve) 416 (M+H)+
1H ЯМР (ДМСО-d6) δ: 9,81 (1H, с.), 8,00 (6Н, шс.), 6,91 (2Н, д.), 6,22 (1H, т.), 4,00 (4Н, т.), 2,93 (4Н, т.), 2,04-1,98 (9Н, м.), 1,69-1,56 (12Н, м.).
Пример 54
N-(2,4,5-триметилфенил)-трицикло[3.3.1.13,7]деканилокси-1-ацетамид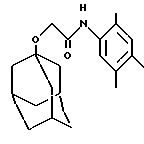
Целевое соединение получают по методу Примера 46 из 2,4,5-триметиланилина (0,30 г) и 1-адамантилоксиуксусной кислоты (0,38 г, СА 1966, 65, 2149а) в виде бесцветного твердого вещества (0,41 г).
Точка плавления: 138-140oС
MS (APCI+ve) 328 (М+Н)+
1H ЯМР (ДМСО-d6) δ: 8,76 (1Н, с.), 7,42 (1H, с.), 6,98 (1Н, с.), 4,00 (2Н, с.), 2,2-2,1 (12Н, м.), 1,8-1,75 (6Н, м.), 1,65-1,55 (6Н, м.).
Пример 55
N-(5-гидрокси-2-метилфенил)-трицикло[3.3.1.13,7] деканилокси-1-ацетамид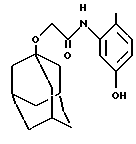
Добавляют тионилхлорид (5 мл) к 1-адамантилоксиуксусной кислоте (2,00 г, СА 1966, 65, 2149а), и реакционную смесь нагревают при температуре кипения с обратным холодильником в течение 5 минут. Избыток тионилхлорида удаляют концентрированием при пониженном давлении и остаток затем растворяют в дихлорметане (10 мл). Указанный раствор добавляют в течение 5 минут к раствору 2-метил-5-гидроксианилина гидрохлорида (1,00 г, J. Chem. Soc. Perkin Trans.2, 1972, 539) в дихлорметане (20 мл) и триэтиламине (10 мл) при 0oС. Затем дают раствору нагреться до комнатной температуры и после 30-минутного перемешивания его концентрируют при пониженном давлении. Остаток растворяют в метаноле (20 мл) и тетрагидрофуране (10 мл), после чего обрабатывают раствором метоксида натрия в метаноле (25 вес.%, 10 мл). После 15-минутного перемешивания реакционную смесь обрабатывают муравьиной кислотой (4 мл) и затем концентрируют при пониженном давлении. Полученный остаток распределяют между водной соляной кислотой (2 М, 90 мл), этилацетатом (90 мл) и тетрагидрофураном (50 мл). Отделяют органическую фазу, промывают ее насыщенным водным раствором хлорида натрия (50 мл), высушивают над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении с получением твердого вещества (2,62 г). Указанное вещество очищают хроматографией на колонке с силикагелем, проводя элюцию смесью дихлорметан:этилацетат (4: 1), с получением бесцветного твердого вещества (1,39 г).
Точка плавления: 258oС
MS (APCI+ve) 316 (М+Н)+
1H ЯМР (ДМСО-d6) δ: 9,22 (1Н, с.), 8,71 (1Н, с.), 7,37 (1Н, д.), 6,98 (1Н, д. ), 6,45 (1Н, дд.), 4,02 (2Н, с.), 2,13 (3Н, шс.), 2,10 (3Н, с.), 2,15-2,12 (6Н, м.), 1,78 (6Н, д.), 1,7-1,5 (6Н, м.).
Пример 56
N-(5-(2-(N-метиламино)этилокси)-2-метилфенил)-трицикло[3.3.1.1. 3,7] декан-1-ацетамида гидрохлорид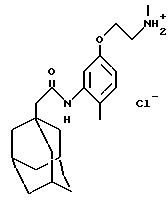
Объединяют трет-бутил N-(2-гидроксиэтил)-N-метилкарбамат (1,05 г, Synth. Commun. , 1993, 23(17), 2443), N-(5-гидрокси-2-метилфенил)-трицикло[3.3.1.1. 3,7] декан-1-ацетамид (1,00 г, Пример 12), тетрагидрофуран (40 мл) и трибутилфосфин (1,35 мл), полученную массу охлаждают в смеси лед/вода, добавляют к ней 1,1'-(азодикарбонил)дипиперидин (1,39 г), и перемешивают реакционную смесь в течение 10 минут. После 90-минутного перемешивания при комнатной температуре добавляют еще трет-бутил N-(2-гидроксиэтил)-N-метилкарбамат (1,04 г) и трибутилфосфин (1,35 мл), и раствор вновь охлаждают в смеси лед/вода перед добавлением 1,1'-(азодикарбонил)дипиперидина (1,39 г), и все перемешивают в течение 10 минут в смеси лед/вода и затем при комнатной температуре в течение ночи. После этого реакционную смесь разбавляют изогексаном (50 мл) и фильтруют. Остаток промывают диэтиловым эфиром (100 мл), и объединенные органические слои концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем, проводя элюцию смесью изогексан:этилацетат (7:3), после чего хроматографируют на колонке с силикагелем с проведением элюции смесью дихлорметан:этилацетат (9:1) с получением сопряженного продукта (0,57 г), который растворяют в метаноле (10 мл). Затем к последнему раствору добавляют раствор хлористого водорода (который образуется при медленном добавлении ацетилхлорида (10 мл) к метанолу (15 мл) при 0oС, при этом следует соблюдать осторожность, так как это очень экзотермическая реакция), и реакционную смесь перемешивают при комнатной температуре в течение 2 часов. Затем реакционную смесь концентрируют при пониженном давлении и растирают с диэтиловым эфиром (100 мл) с получением целевого соединения в виде бесцветного твердого вещества (0,35 г).
Точка плавления: 193-195oС
MS (APCI+ve) 357 (М+Н)+ в виде свободного основания
1H ЯМР (ДМСО-d6) 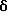 : 9,06 (1Н, с.), 8,91 (2Н, шс.), 7,19 (1Н, c.), 7,12 (1Н, д. ), 6,70 (1H, дд.), 4,17 (2Н, т.), 3,4-3,25 (2Н, м.), 2,61 (3Н, с.), 2,15 (3Н, с.), 2,11 (2Н, с.), 1,95 (3Н, с.), 1,75-1,55 (12Н, м.).
: 9,06 (1Н, с.), 8,91 (2Н, шс.), 7,19 (1Н, c.), 7,12 (1Н, д. ), 6,70 (1H, дд.), 4,17 (2Н, т.), 3,4-3,25 (2Н, м.), 2,61 (3Н, с.), 2,15 (3Н, с.), 2,11 (2Н, с.), 1,95 (3Н, с.), 1,75-1,55 (12Н, м.).
Пример 57
N-(5-(2-(N-метиламино)этилокси)-2-метилфенил)-трицикло [3.3.1.13,7] деканилокси-1-ацетамид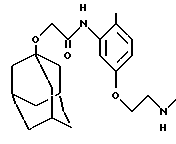
а) N-(5-гидрокси-2-метилфенил)- трицикло[3.3.1.1. 3,7]деканилокси-1-ацетамид
Добавляют тионилхлорид (5 мл) к 1-адамантилоксиуксусной кислоте (2,00 г, СА 1966, 65, 2149а), и реакционную смесь нагревают при температуре кипения с обратным холодильником в течение 5 минут. Избыток тионилхлорида удаляют концентрированием при пониженном давлении и остаток затем растворяют в дихлорметане (10 мл). Указанный раствор добавляют в течение 5 минут к раствору 5-гидрокси-2-метиланилина гидрохлорида (1,00 г, J. Chem. Soc. Perkin Trans. 2, 1972, 539) в дихлорметане (20 мл) и триэтиламине (10 мл) при 0oС. Затем дают раствору нагреться до комнатной температуры и после 30-минутного перемешивания его концентрируют при пониженном давлении. Остаток растворяют в метаноле (20 мл) и тетрагидрофуране (10 мл), после чего обрабатывают раствором метоксида натрия в метаноле (25 вес.%, 10 мл). После 15-минутного перемешивания реакционную смесь обрабатывают муравьиной кислотой (4 мл) и затем концентрируют при пониженном давлении. Полученный остаток распределяют между водной соляной кислотой (2 М, 90 мл), этилацетатом (90 мл) и тетрагидрофураном (50 мл). Отделяют органическую фазу, промывают ее насыщенным водным раствором хлорида натрия (50 мл), высушивают над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем, проводя элюцию смесью дихлорметан:этилацетат (4: 1), с получением соединения а) в виде бесцветного твердого вещества (1,39 г).
Точка плавления: 258oС
MS (APCI+ve) 316 (М+Н)+
1H ЯМР (ДМСО-d6) δ: 9,22 (1Н, с.), 8,71 (1H, с.), 7,37 (1Н, д.), 6,98 (1H, д. ), 6,45 (1H, д. ), 4,02 (2Н, с.), 2,13 (3Н, шс.), 2,10 (3Н, с.), 2,15-2,12 (6Н, м.), 1,78 (6Н, д.), 1,7-1,5 (6Н, м.)
б) N-(5-(2-(N-метиламино)этилокси)-2-металфенил)-трицикло[3.3.1.1. 3,7] деканилокси-1-ацетамид
Получают по методу, описанному в Примере 2, с использованием трет-бутил N-(2-гидроксиэтил)-N-метилкарбамата (1,05 г, Synth. Commun., 1993, 23(17), 2443) и N-(5-гидрокси-2-метилфенил)-трицикло[3.3.1.1. 3,7]деканилокси-1-ацетамида (1,00 г, часть а), что дает целевое соединение в виде бесцветного твердого вещества (0,54 г).
Точка плавления: 155-158oС
MS (APCI+ve) 373 (М-НСl+Н)+
1H ЯМР (ДМСО-d6) δ: 9,07 (2Н, шс.), 8,84 (1H, с.), 7,57 (1H, д.), 7,16 (1H, дд.), 6,71 (1H, дд.), 4,20 (2Н, т.), 4,05 (2Н, с.), 3,30 (2Н, т.), 2,60 (3Н, т.), 2,17 (3Н, с.), 2,13 (3Н, с.), 1,78 (6Н, д.), 1,65-1,55 (6Н, м.).
Пример 58
N-(5-(3-(N-метиламино)пропилокси-2-метилфенил)-трицикло [3.3.1.1. 3,7] деканилокси-1-ацетамид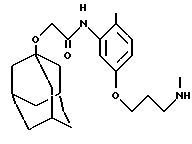
Следуют процедуре Примера 56, начиная с трет-бутил N-(3-гидроксипропил)-N-метилкарбамата (1,01 г, J. Org. Chem., 1988, 53(10), 2229) и N-(5-гидрокси-2-метилфенил)-трицикло[3.3.1.13,7] деканилокси-1-ацетамида (1,00 г, Пример 55), с получением целевого соединения в виде бесцветного твердого вещества (0,50 г).
Точка плавления: 151-154oС
MS (APCI+ve) 387 (M-HCl+H)+
1H ЯМР (ДМСО-d6) δ: 8,91 (2Н, шс.), 8,82 (1Н, с.), 7,49 (1H, д.), 7,13 (1H, д.), 6,67 (1H, дд.), 4,04 (2Н, с.), 4,01 (2Н, т.), 3,03 (2Н, квинтет.), 2,55 (3Н, т.), 2,15 (3Н, с.), 2,13 (3Н, с.), 2,06 (2Н, квинтет.), 1,78 (6Н, д.), 1,65-1,55 (6Н, м.).
Пример 59
N-(3,5-дигидрокси-2-метилфенил)-трицикло[3.3.1.1. 3,7] деканилокси-1-ацетамид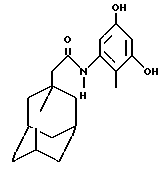
Раствор диметокси эфира из Примера 43 (2,0 г) в 50% бромистоводородной кислоте нагревают при 100oС в течение 12 часов. Раствор концентрируют под вакуумом, остаток смывают водой и экстрагируют этилацетатом. Органические слои высушивают над сульфатом магния, фильтруют и концентрируют под вакуумом. Неочищенный материал очищают на силикагеле при проведении элюции дихлорметаном/этилацетатом, что дает целевое соединение в виде белого твердого вещества.
Точка плавления: 270oС
MS (APCI+ve) 316 (М+Н)+
1H ЯМР (CDCl3) δ: 9,09 (1H, с.), 8,91 (1Н, с.), 8,86 (1H, шс.), 6,35 (1H, д. ), 6,11 (4Н, д. ), 2,04 (2Н, с.), 1,94 (3Н, шс.), 1,87 (3Н, с.), 1,80-1,50 (12Н, м.).
Пример 60
Фармакологический анализ
Некоторые соединения, такие как бензоилбензоиладенозинтрифосфат (ббАТФ), известны как агонисты рецептора Р2Х7, воздействующие на образование пор в плазматической мембране (Drug Development Research (1996), 37(3), р. 126). Вследствие этого, при активации рецептора с помощью ббАТФ в присутствии бромистого этидия (флюоресцентной метки ДНК) наблюдается усиление флюоресценции внутриклеточной ДНК, связанной с бромистым этидием. Такое усиление флюоресценции можно использовать как показатель, указывающий на степень активации рецептора Р2Х7 и, следовательно, как метод количественной характеристики воздействия соединения на рецептор Р2Х7.
Указанным способом тестируют каждое из целевых соединений из Примеров 1-59 на активность в отношении рецептора Р2Х7. Тест проводят на 96-ячеечном микротитрационном плато с плоским дном, в каждую ячейку вносят по 250 мкл исследуемого растора, который включает 250 мкл суспензии ТНР-1 клеток (2,5•10е клеток/мл) с содержанием 10-4 М бромистого этидия, 25 мкл буферного раствора с высоким содержанием калия, включающего 10-5 М ббАТФ, и 25 мкл буферного раствора с высоким содержанием калия, включающего 3•10-5 M исследуемого соединения. Пластинки покрывают пластиковой крышкой и инкубируют в течение одного часа. После этого измеряют флюоресценцию на устройстве для микротитрационных плато Perkin-Ehner с длиной волны возбуждения 520 нм, длиной волны эмиссии 595 нм и шириной полос Ех 15 нм, Ет 20 нм. Для сравнения в тесте в качестве отдельных контролей используют ббАТФ (агонист рецептора Р2Х7) и пиридоксаль-5-фосфат (антагонист рецептора Р2Х7). На основании результатов измерения флюоресценции для каждого исследуемого соединения вычисляют значение пИК50 (pIC50), значение, которое представляет собой отрицательный логарифм концентрации исследуемого соединения, необходимой для снижения ббАТФ-агонистской активности на 50%. При этом для каждого исследованного соединения из Примеров 1-59 была выявлена агонистская активность со значением пИК50>4,50.
Примеры фармацевтических композиций.
Свечи
Расплавляют смесь 20 г соединения, полученного в примере 5, и 100 г соевого лецитина и 1400 г масла какао, разливают в формы и охлаждают. Каждая свеча содержит 20 мг биологически активного вещества.
Таблетки
Смешивают 1 кг соединения, полученного по примеру 30, 4 кг лактозы, 1,2 кг картофельного крахмала, 0,2 кг талька и 0,1 кг стеарата магния, обычным образом прессуют в таблетки так, что каждая таблетка содержит 10 мг биологически активного вещества.
Изобретение относится к новым соединениям формулы (I), где А обозначает группу СН2 или атом О, В обозначает Н или галоген, D обозначает СН2, OCH2, NHCH2, CH2CH2, R обозначает фенил, бензотиазолил, индолил, индазолил, пуринил, пиридил, пиримидил, тиофенил, каждая из этих групп может быть замещенной или незамещенной. Изобретение охватывает также способ получения этих соединений, который заключается во взаимодействии соединения формулы (II), где L обозначает удаляемую группу, с соединением -R-NH2. Эти соединения обладают антагонистической активностью в отношении рецептора Р2Х7 и благодаря этому свойству могут использоваться в качестве активного ингредиента в фармкомпозиции и в способе воздействия на иммуносупрессию. 5 с. и 6 з.п.ф-лы.
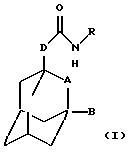
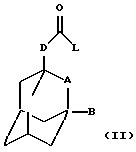
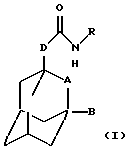
где А обозначает группу СН2 или атом кислорода;
В обозначает атом водорода или галогена;
D обозначает группу СН2, ОСН2, NHCH2 или СН2СН2;
R обозначает фенильную, бензотиазолильную, индолильную, индазолильную, пуринильную, пиридильную, пиримидинильную или тиофенильную группу, каждая из которой может быть необязательно замещена одним или большим числом заместителей, выбранных, независимо друг от друга, из атома галогена или карбоксильной, гидроксильной, нитро, C1-С6-алкильной, C1-С6-алкилкарбонильной, C1-С6-алкбксикарбонильной группы, или C1-С6-алкоксигруппы, необязательно замещенной одним или более заместителями, выбранными, независимо друг от друга, из атома галогена или амино, карбоксильной, гидроксильной, C1-С6-алкокси, (ди)C1-С6-алкиламино, C1-С6-алкоксикарбонильной, имидазолильной, морфолинильной, пиперидинильной или пирролидинильной групп;
при условии, что (i) когда А обозначает СН2, В обозначает Н и D обозначает СН2, то R не обозначает фенильную, орто-карбоксифенильную, орто-нитрофенильную, орто-аминофенильную, орто-(диметиламиноэтил) фенильную, метилфенильную или пара-феноксифенильную, орто-гидроксифенильную, орто-(3-хлорпропокси)-фенильную группу, и (ii) когда А обозначает СН2, В обозначает Вr и D обозначает СН2, то R не обозначает орто-карбоксифенильную группу, и (iii) когда А обозначает СН2, В обозначает Н и D обозначает СН2СН2, то R не обозначает фенильную группу, и (iv) когда А обозначает СН2, D обозначает СН2 или СН2СН2 и R обозначает замещенную фенильную группу, присутствующие заместитель или заместители не включают в орто-положении C1-C6-алкоксигруппу, замещенную амино, (ди)C1-С6-алкиламино, имидазолильной, морфолинильной, пиперидинильной или пирролидинильной группой,
или их фармацевтически приемлемые соли или сольваты.
N-(2-мeтил-6-бeнзaтиaзoлил)-тpициклo[3.3.1.13,7] дeкaн-1-ацетамид,
N-(3-(3-(аминопропилокси)-2-метилфенил)-трицикло[3.3.1.13,7] декан-1-ацетамида гидрохлорид,
N-(2-хлорфенил)-трицикло[3.3.1.13,7] декан-1-ацетамид,
N-(2,4,5-триметилфенил)-трицикло[3.3.1.13,7] декан-1-ацетамид,
N-(5-метокси-2-метилфенил)-трицикло[3.3.1.13,7] декан-1-ацетамид,
N-(2,3-диметилфенил)-трицикло[3.3.1.13,7] декан-1-ацетамид,
N-(5-индолил)-трицикло[3.3.1.13,7] декан-1-ацетамид,
N-(2,3-диметил-5-индолил)-трицикло[3.3.1.13,7] декан-1-ацетамид,
N-[5-(3-N, N-диметиламинопропокси)-2-метилфенил] -трицикло[3.3.1.13,7] декан-1-ацетамида гидрохлорид,
N-(5-индазолил)-трицикло[3.3.1.13,7] декан-1-ацетамид,
N-(6-индазолил)-трицикло[3.3.1.13,7] декан-1-ацетамид,
N-(5-гидрокси-2-метилфенил)-трицикло[3.3.1.13,7] декан-1-ацетамид,
N-(1Н-индол-4-ил)-трицикло[3.3.1.13,7] декан-1-ацетамид,
4-метил-3-[[1-оксо-2-(трицикло[3.3.1.13,7] дек-1-ил)этил] -амино] феноксиуксусной кислоты гидрохлоридная соль,
N-(1-метил-1Н-индол-5-ил)-трицикло[3.3.1.13,7] дeкан-1-ацетамид,
N-(1-(N, N-диметиламино)этил-1Н-индо-5-ил)-трицикло[3.3.1.13,7] декан-1-ацетамид,
5-[[1-оксо-2-(трицикло[3.3.1.13,7] дек-1-ил)этил] амино] -1Н-индол-1-уксусной кислоты 1,1-диметилэтиловый эфир,
N-(3-(2-хлорпиридил))-трицикло[3.3.1.13,7] декан-1-ацетамид,
N-(3-(N, N-диметиламино)метил-1Н-индо-5-ил)-трицикло[3.3.1.13,7] декан-1-ацетамид,
N-(4-метокси-2-метилфенил)-трицикло[3.3.1.13,7] декан-1-ацетамид,
N-(2-хлор-5-метоксифенил)-трицикло[3.3.1.13,7] декан-1-ацетамид,
N-(4-гидрокси-2-метилфенил)-трицикло[3.3.1.13,7] декан-1-ацетамид,
N-(3-гидроксиметил-2-метилфенил)-трицикло[3.3.1.13,7] декан-1-ацетамид,
N-(5-метокси-2-метил-3-нитрофенил)-трицикло[3.3.1.13,7] декан-1-ацетамид,
N-(5-гидроксиметил-2-метилфенил)-трицикло[3.3.1.13,7] декан-1-ацетамид,
N-(3-гидрокси-2-метилфенил)-трицикло[3.3.1.13,7] дeкaн-l-ацетамид,
N-(2-метил-5-(1-пирролидинметил)фенил)-трицикло[3.3.1.13,7] декан-1-ацетамида гидрохлорид,
N-(2-хлор-5-гидроксифенил)-трицикло[3.3.1.13,7] декан-1-ацетамид,
N-(2-хлор-4-гидроксифенил)-трицикло[3.3.1.13,7] декан-1-ацетамид,
N-(2-метил-3-(2-(1-пирролидино)этилокси)фенил)-трицикло-[3.3.1.13,7] декан-1-ацетамида гидрохлорид,
N-(5-метоксиметил-2-метилфенил)-трицикло[3.3.1.13,7] декан-1-ацетамид,
N-(2-метил-3-(2-(1-морфолино)этилокси)фенил)-трицикло[3.3.1.13,7] декан-1-ацетамида гидрохлорид,
N-(2-метил-3-(2-(1-пиперидино)этилокси)фенил)-трицикло[3.3.1. l3,7] дeкaн-1-aцeтaмидa гидрохлорид,
N-(2-метил-5-(1-морфолинометил)фенил)-трицикло[3.3.1.13,7] декан-1-ацетамида гидрохлорид,
N-(5-(3-(2-N, N-диметиламиноэтил)индолил))-трицикло[3.3.1.13,7] дeкaн-1-ацетамида гидрохлорид,
Метил 4-метил-3-[[1-оксо-2-(трицикло[3.3.1.13,7] дек-1-ил)этил] амино] тиофен-2-карбоксилат,
N-(3-метокси-2-метилфенил)-трицикло[3.3.1.13,7] декан-1-ацетамид,
N-(2-метил-3-(2-(1-имидазоло)этилокси)фенил)-трицикло[3.3.1.13,7] декан-1-ацетамид,
N-(2,4,6-триметилфенил)-трицикло[3.3.1.13,7] декан-1-ацетамид,
N-(5-(3-аминопропилокси)-2-метилфенил)-трицикло[3.3.1.13,7] декан-1-ацетамида гидрохлорид,
N-(5-(3-(N-метиламино)пропилокси)-2-метилфенил)-трицикло[3.3.1.13,7] дeкaн-1-aцeтaмидa гидрохлорид,
N-6-(трицикло[3.3.1.13,7] декан-1-ацетил)-аденин,
N-(3,5-диметокси-2-метилфенил)-трицикло[3.3.1.13,7] декан-1-ацетамид,
N-(3-(3-(N-метиламино)пропилокси)-2-метилфенил)-трицикло[3.3.1.13,7] декан-1-ацетамида гидрохлорид,
N-(5-(3-(N, N-диметиламино)пропилокси)-2-метилфенил)-трицикло[3.3.1.13,7] декан-1-ацетамида гидрохлорид,
N-(5-метокси-2-метифенил)-трицикло[3.3.1.13,7] деканилокси-1-ацетамид,
N-(5-метокси-2-метилфенил)-(3-бром-трицикло[3.3.1.13,7] -декан)-1-ацетамид,
N-(5-метокси-2-метилфенил)-(2-окса-трицикло[3.3.1.13,7] -декан)-1-ацетамид,
N-(5-метокси-2-метилфенил)-2-(трицикло[3.3.1.13,7] декан-1-амино)ацетамид,
N-(3,5-диметоксифенил)-трицикло[3.3.1.13,7] декан-1-ацетамид,
N-(3,5-дигидроксифенил)-трицикло[3.3.1.13,7] дeкaн-l-aцeтамид,
N-(3,5-диметоксифенил)-трицикло[3.3.1.13,7] деканилокси-1-ацетамид,
N-(3,5-бис-(3-аминопропилокси)фенил)-трицикло[3.3.1.13,7] декан-1-ацетамид,
N-(2,4,5-триметилфенил)-трицикло[3.3.1.13,7] деканилокси-1-ацетамид,
N-(5-гидрокси-2-метилфенил)-трицикло[3.3.1.13,7] дeкaнил-окси-1-ацетамид,
N-(5-(2-(N-метиламино)этилокси)-2-метилфенил)-трицикло-[3.3.1.13,7] декан-1-ацетамида гидрохлорид,
N-(5-(2-(N-метиламино)этилокси)-2-метилфенил)-трицикло-[3.3.1.13,7] деканилокси-1-ацетамид,
N-(5-(3-(N-метиламино)пропилокси)-2-метилфенил)-трицикло[3.3.1.13,7] деканилокси-1-ацетамид и
N-(3,5-дигидрокси-2-метилфенил)-трицикло[3.3.1.13,7] -декан-1-ацетамид.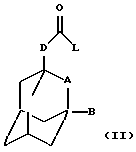
где L обозначает удаляемую группу и А, В и D определены в формуле (I),
с соединением общей формулы (III) R-NH2, где R определен в формуле (I), и необязательно с образованием фармацевтически приемлемой соли или сольвата.
| V.L | |||
| Narayanan, Journal of Medical Chemistry, 1972, vol.15, N11, p.1180-1182 | |||
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ РЯДА ОРТОПЕДИЧЕСКИХ ЗАБОЛЕВАНИЙ И ПОСЛЕДСТВИЙ ТРАВМ | 0 |
|
SU395093A1 |
| STN International, File CAPLUS, CAPLUS accession no | |||
| Сплав для отливки колец для сальниковых набивок | 1922 |
|
SU1975A1 |
| US 3789072 A1, 29.01.1974 | |||
| STN International, File CAPLUS, CAPLUS accession no | |||
| ПРИБОР ДЛЯ ЗАПИСИ И ВОСПРОИЗВЕДЕНИЯ ЗВУКОВ | 1923 |
|
SU1974A1 |
| STN International, File CAPLUS, CAPLUS accession no | |||
| Приспособление для контроля движения | 1921 |
|
SU1968A1 |
| 1-(4'-АМИНОФЕНИЛ)-3-АМИНОЭТИЛАДАМАНТАН - МОНОМЕР ДЛЯ СИНТЕЗА ПОЛИИМИДОВ И СОПОЛИИМИДОВ С ПОВЫШЕННОЙ ГИДРОЛИТИЧЕСКОЙ УСТОЙЧИВОСТЬЮ | 1994 |
|
RU2068840C1 |
Авторы
Даты
2003-01-27—Публикация
1998-12-01—Подача