Область техники, к которой относится изобретение
Настоящее изобретение относится к способу получения производного хинолилакрилонитрила из производного хинолинкарбальдегида. Производное хинолилакрилонитрила, полученное способом по изобретению, пригодно в качестве исходного соединения для получения производного хинолилпропеналя, которое используют для синтеза холестерин-восстанавливающего агента (ингибитора HMG-CoA-редуктазы).
Известный уровень техники
Известно, что до сих пор производное хинолилпропеналя получали двухстадийным способом, включающим стадию восстановления хинолинакрилата с помощью диизобутилалюмогидрида с получением хинолилпропенола и последующую стадию окисления хинолилпропенола с применением сочетания оксалилхлорида и диметилсульфоксида или диоксида марганца (J. Med. Chem., 34, 367 (1991)).
Известен также прием селективного восстановления цианогруппы до формил-группы путем использования восстанавливающего агента, диизобутилалюмогидрида, с сохранением двойной связи акрилонитрильного соединения для получения пропеналь-соединения (Heterocycles, 29, 691 (1989)).
Оба, и вышеуказанный способ, и прием, не удобны с точки зрения промышленного получения, поскольку в вышеуказанном способе и приеме используют диизобутилалюмогидрид или диоксид марганца, которые требуют осторожного обращения и сложной последующей обработки.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение касается способа получения 3-[2-циклопропил-4-(4-фторфенил)-3-хинолил]проп-2-еннитрила, который включает стадии взаимодействия 2-циклопропил-4-(4-фторфенил)хинолин-3-карбальдегида с ацетонитрилом в присутствии основания с получением смеси 3-[2-циклопропил-4-(4-фторфенил)-3-хинолил]проп-2-еннитрила и 3-[2-циклопропил-4-(4-фторфенил)-хинолин-3-ил]-3-гидроксипропионитрила и дегидратации смеси в присутствии дегидратирующего агента.
Исходное соединение для взаимодействия по изобретению, а именно 2-циклопропил-4-(4-фторфенил)хинолин-3-карбальдегид [здесь далее называемый производным хинолинкарбальдегида], промежуточный продукт, а именно 3-[2-циклопропил-4-(4-фторфенил)-3-хинолин-3-ил]-3-гидроксипропионитрил [здесь далее называемый производным хинолилгидроксипропионитрила], и требуемое соединение, а именно 3-[2-циклопропил-4-(4-фторфенил)-3-хинолил]проп-2-еннитрил [здесь далее называемый производным хинолилакрилонитрила], являются соединениями, представленными, соответственно, следующими формулами (1), (2) и (3):
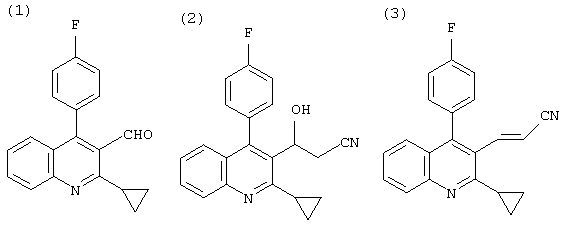
Кроме того, изобретение касается также вышеупомянутого 3-[2-циклопропил-4-(4-фторфенил)-3-хинолин-3-ил]-3-гидроксипропионитрила.
Далее изобретение касается способа получения 3-[2-циклопропил-4-(4-фторфенил)-3-хинолил]проп-2-еннитрила, который включает стадии взаимодействия 2-циклопропил-4-(4-фторфенил)хинолин-3-карбальдегида с ацетонитрилом в присутствии основания и дегидратацию полученного продукта в присутствии дегидратирующего агента.
Кроме того, изобретение касается способа получения 3-[2-циклопропил-4-(4-фторфенил)-3-хинолил]проп-2-еннитрила, который включает взаимодействие 2-циклопропил-4-(4-фторфенил)хинолин-3-карбальдегида с ацетонитрилом в органическом растворителе в присутствии основания.
Производное хинолилакрилонитрила формулы (3) {т.е., 3-[2-циклопропил-4-(4-фторфенил)-3-хинолил]проп-2-еннитрил}, полученное по настоящему изобретению, может быть превращено в 3-[2-циклопропил-4-(4-фторфенил)-3-хинолил]проп-2-еналь путем восстановления указанного производного с применением никеля Ренея в присутствии комбинации из муравьиной кислоты и воды [в количестве от 0,25 до 1 объемной части на объемную часть муравьиной кислоты].
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
2-Циклопропил-4-(4-фторфенил)хинолин-3-карбальдегид формулы (1), являющийся исходным материалом для взаимодействия по изобретению, описан в JP-A-1-279866, ЕР-А-304063 и США 5.011.930 и уже известен.
Примеры основания, используемого при взаимодействии, включают гидрид металла, такой как гидрид лития, гидрид натрия, гидрид калия или гидрид кальция; амид металла, такой как амид лития, амид натрия, литийдиизопропиламид, литийбис-(триметилсилил)амид или калийбис(триметилсилил)амид; алкоголят металла, такой как метилат натрия, этилат натрия, трет-бутилат натрия, трет-бутилат калия, метилат магния или этилат магния; алкиллития, такой как метиллитий, бутиллитий или трет-бутиллитий; или гидроксид металла, такой как гидроксид лития, гидроксид натрия, гидроксид калия или гидроксид кальция. Предпочтительны гидрид металла, алкоголят металла и гидроксид металла. Особенно предпочтительны гидрид металла и алкоголят металла.
Основание используют в количестве, предпочтительно, от 0,9 до 3,0 молей, более желательно, 1,0-2,0 молей на один моль исходного соединения, т.е. производного хинолинкарбальдегида.
При взаимодействии ацетонитрил используют в количестве, предпочтительно, от 0,9 до 100 молей, более желательно, от 1,0 до 60 молей на один моль исходного соединения, т.е., производного хинолинкарбальдегида.
При взаимодействии функция дегидратирующего агента состоит в дегидратации указанного ниже производного хинолилгидроксипропионитрила, имеющего гидроксильную группу, которое очевидно получается при взаимодействии в качестве промежуточного продукта, с получением требуемого продукта [производного хинолилакрилонитрила, имеющего двойную связь], как иллюстрируется приведенной ниже реакционной схемой (4):
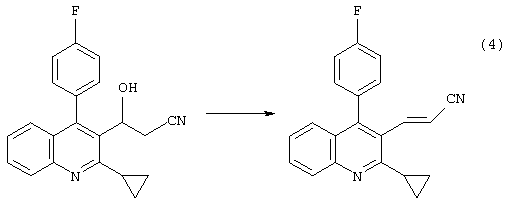
Примеры дегидратирующих агентов включают неорганические кислоты, такие как соляная кислота и серная кислота; органические кислоты, такие как муравьиная кислота, уксусная кислота и трифторуксусная кислота; сложный эфиры органических кислот, такие как метилформиат, этилформиат, пропилформиат и этилацетат; амиды, такие как N,N-диметилформамид; ангидриды органических кислот, такие как ангидрид уксусной кислоты и ангидрид трифторуксусной кислоты; хлорангидриды кислот, такие как мезилхлорид, тионилхлорид и ацетилхлорид; третичные амины, такие как триметиламин, триэтиламин, этилдииэопропиламин, диэтилизопропиламин и бензилдиметиламин; и силановые соединения, такие как 1,1,1,3,3,3-гексаметилдисилазан. Предпочтительны сложные эфиры органических кислот и сочетание хлорангидрида кислоты и третичного амина. Более предпочтительны эфиры органических кислот. Особенно предпочтительны эфиры муравьиной кислоты. Дегидратирующий агент используют в количестве, предпочтительно, 0,1-100 моль, более предпочтительно, 0,2-50 моль на моль исходного соединения, т.е. производного хинолинкарбальдегида.
Взаимодействие по изобретению может быть осуществлено путем реакции производного хинолинкарбальдегида и ацетонитрила в присутствии основания с получением смеси производного хинолилгидроксипропионитрила (промежуточного продукта) и производного хинолилакрилонитрила (требуемого продукта) и завершения взаимодействия путем добавления дегидратирующего агента при атмосферном давлении или повышенном давлении. Температура реакции находится в пределах, предпочтительно, -78°С - 80°С, более предпочтительно, -30°С - 50°С.
Взаимодействие исходных соединений (производного хинолинкарбальдегида и ацетонитрила) в присутствии основания может быть выполнено в органическом растворителе, что приводит непосредственно (подразумевается "без применения дегидратирующего агента") к требуемому продукту. Органический растворитель является растворителем, отличным от ацетонитрила.
Органический растворитель предпочтительно имеет диэлектрическую проницаемость 10 или ниже в интервале температур от 20 до 25°С (при этом температуру не обязательно выбирать из указанного интервала). Подробности, связанные с "диэлектрической проницаемостью", описаны в "Chemistry Handbook, Basic Issue, 4th edition (II) "(Maruzen Publishing) и "Solvent Handbook, 1st edition" (Kodansha Scientific). Примеры органических растворителей включают алифатические растворители, такие как гексан, гептан, циклогексан, метиленхлорид, хлороформ и четыреххлористый углерод; ароматические растворители, такие как бензол, толуол, ксилол, хлорбензол и дихлорбензол; и простые эфирные растворители, такие как метилаль, тетрагидрофуран и диоксан. Более предпочтительны ароматические растворители. Наиболее желателен толуол. Органические растворители могут быть использованы по отдельности или в сочетании.
Органический растворитель может быть использован в количестве, предпочтительно, от 0,5 до 50 массовых частей, более предпочтительно, от 1 до 20 массовых частей на одну массовую часть производного хинолинкарбальдегида (исходного соединения).
Реакция может быть осуществлена путем взаимодействия производного хинолинкарбальдегида и ацетонитрила при атмосферном давлении или повышенном давлении в органическом растворителе в присутствии основания. Температура реакции находится в пределах, предпочтительно, 30-140°С, более предпочтительно, 40-120°С.
В реакции с применением органического растворителя основание используют предпочтительно в количестве от 0,5 до 3,0 молей, более предпочтительно, от 0,8 до 2,0 молей на одну моль производного хинолинкарбальдегида (исходного соединения). В реакции с применением органического растворителя ацетонитрил используют предпочтительно в количестве от 0,9 до 50 молей, более предпочтительно, от 1,0 до 30 молей на одну моль производного хинолинкарбальдегида (исходного соединения).
Реакционный продукт (требуемый продукт) взаимодействия по изобретению, то есть производное хинолилакрилонитрила, может быть выделен и очищен после завершения реакции общепринятым способом, таким как перекристаллизация или хроматография на колонке.
[Пример 1] Получение 3-[2-никлопропил-4-(4-фторфенил)-3-хинолил] проп-2-еннитрила
В стеклянную колбу на 100 мл, снабженную мешалкой, термометром и капельной воронкой, вводят в атмосфере аргона 1,94 г (6,66 ммоль) 2-циклопропил-4-(4-фторфенил)хинолин-3-карбальдегида, 10 мл ацетонитрила и 0,422 г (10,6 ммоль) гидрида натрия (чистота: 60%). Содержимое перемешивают при комнатной температуре в течение 2 часов. Полученную смесь охлаждают до -10°С. К охлажденной смеси добавляют 20 мл (248 ммоль) этилформиата и смесь перемешивают в течение 4 часов при той же температуре. Затем к смеси медленно добавляют 11 мл соляной кислоты (1 моль/л), предварительно охлажденной на ледяной бане. Органическую часть смеси отделяют от водной части. Выделяют органическую часть, промывают двумя порциями по 10 мл насыщенного водного раствора хлорида натрия и сушат над безводным сульфатом магния. Органическую часть фильтруют и анализируют методом высокоэффективной жидкостной хроматографии (абсолютный количественный анализ). Анализ подтверждает, что получено 1,71 г (выход: 85%) 3-[2-циклопропил-4-(4-фторфенил)-3-хинолил]проп-2-еннитрила. Органическую часть концентрируют при пониженном давлении, получая остаток в виде желтого твердого вещества. Твердый остаток перекристаллизовывают из смеси толуол/гексан (1/8, объемн. соотношение), получая 1,79 г 3-[2-циклопропил-4-(4-фторфенил)-3-хинолил]проп-2-еннитрила в виде желтого кристаллического продукта (чистота: 97%).
Полученный 3-[2-циклопропил-4-(4-фторфенил}-3-хинолил] -проп-2-еннитрил имеет следующие характеристики:
Т.пл.: 174,5-175,0°С
EI-MC(m/e): 314 (М), Cl-MC(m/e): 315 (М+1)
ИК (KBr, см-1): 2223, 1513, 1490, 1224, 1161, 846, 768.
Элементный анализ: С 80,31%, Н 4,74%, N 8,89% (теоретическое значение для C21H15N2F: С 80,24%, Н 4,81%, N 8,91%)
1Н-ЯМР (CDCl3, δ(м.д.)): 1,06-1,15 (2Н, м), 1,36-1,46 (2Н, м), 2,23-2,33 (1Н, м), 5,29 (1Н, д, J=17,0 Гц), 7,18-7,32 (4Н, м), 7,34-7,39 (1Н, м), 7,52 (1Н, д, J=17,0 Гц), 7,60-7,73 (1Н, м), 7,97 (1H, д, J=8,3 Гц).
[Пример 2] Получение 3-[2-циклопропил-4-(4-фторфенил)-3-хинолил] проп-2-еннитрила
В колбу, аналогичную используемой по примеру 1, вносят в атмосфере аргона 1,96 г (6,73 ммоль) 2-циклопропил-4-(4-фторфенил)хинолин-3-карбальдегида, 10 мл ацетонитрила и 0,434 г (10,9 ммоль) гидрида натрия (чистота: 60%). Содержимое перемешивают при комнатной температуре в течение 2 часов. Полученную смесь охлаждают до 0°С. К охлажденной смеси добавляют 0,85 мл (10,5 ммоль) этилформиата и смесь перемешивают в течение 4 часов при той же температуре. Затем к смеси медленно добавляют 10 мл охлажденной воды. После чего смесь экстрагируют 30 мл этилацетата, предварительно охлажденного на ледяной бане. Органическую часть сушат над безводным сульфатом магния и фильтруют. Фильтрат анализируют методом высокоэффективной жидкостной хроматографии (абсолютный количественный анализ). Анализ подтверждает, что получено 1,74 г (выход: 82%) 3-[2-циклопропил-4-(4-фторфенил)-3-хинолил]проп-2-еннитрила.
[Пример 3] Получение 3-[2-циклопропил-4-(4-фторфенил)-3-хинолил]проп-2-еннитрила
В стеклянную колбу на 50 мл, снабженную мешалкой и термометром, вносят в атмосфере аргона 200 мг (0,69 ммоль) 2-циклопропил-4-(4-фторфенил)хинолин-3-карбальдегида, 2 мл ацетонитрила и 41,5 мг (1,04 ммоль) гидрида натрия (чистота: 60%). Содержимое перемешивают при комнатной температуре в течение 2 часов. Полученную смесь охлаждают до 0°С. К охлажденной смеси добавляют 0,08 мл (1,03 ммоль) метансульфонилхлорида и 0,15 мл (1/08 ммоль) триэтиламина и смесь перемешивают в течение 3 часов при той же температуре. Затем к смеси медленно добавляют 5 мл охлажденной воды и смесь экстрагируют тремя порциями этилацетата (15 мл), предварительно охлажденного на ледяной бане. Смесь сушат над безводным сульфатом магния. Затем органическую часть фильтруют, и фильтрат анализируют методом высокоэффективной жидкостной хроматографии (абсолютный количественный анализ). Анализ подтверждает, что получено 180 мг (выход: 83%) 3-[2-циклопропил-4-(4-фторфенил)-3-хинолил]проп-2-еннитрила.
[Пример 4] Получение 3-[2-циклопропил-4-(4-фторфенил)-3-хинолин-3-ил]-3-гидроксипропионитрила
В стеклянную колбу на 50 мл, снабженную мешалкой и термометром, вносят в атмосфере аргона 0,20 г (0,68 ммоль) 2-циклопропил-4-(4-фторфенил)хинолин-3-карбальдегида, 2 мл ацетонитрила и 0,042 г (1,06 ммоль) гидрида натрия (чистота: 60%). Содержимое перемешивают при комнатной температуре в течение 2 часов. Полученную смесь охлаждают до 0°С. К охлажденной смеси добавляют 0,08 мл (1,40 ммоль) уксусной кислоты и смесь перемешивают в течение 5 минут при той же температуре. Затем к смеси медленно добавляют 10 мл охлажденной воды и смесь экстрагируют 20 мл этилацетата, предварительно охлажденного на ледяной бане. Органическую часть промывают последовательно 5 мл насыщенного водного раствора бикарбоната натрия и 5 мл насыщенного водного раствора хлорида натрия и сушат над безводным сульфатом магния. Затем органическую часть фильтруют и концентрируют при пониженном давлении. Концентрат очищают хроматографией на колонке с силикагелем [колонка Wakogel C-200, выпускаемая Wako Junyaku Co., Ltd., элюирующий растворитель: этилацетат/гексан (7/93-15/85, объемн. соотношение)], получая 0,17 г (выход 75%) 3-[2-циклопропил-4-(4-фторфенил)хинолин-3-ил]-3-гидроксипропионитрила в виде белого твердого вещества.
Полученный 3-[2-циклопропил-4-(4-фторфенил)-хинолин-3-ил]-3-гидроксипропионитрил имеет следующие характеристики:
Т.пл.: 200°С
ЕТ-МС(m/е): 332 (М), CI-MC (т/е): 333 (М+1)
ИК (KBr, см-1): 3496, 2253, 1512, 1491, 1226, 1078, 778.
Элементный анализ: С 75,90%, Н 5,17%, N 8,39% (теоретическое значение для C21H17N2OF: С 75,89%, Н 5,16%, N 8,43%)
1H-ЯМР (CDCl3, δ(м.д.)): 1,07-1,17 (3Н, м), 1,79-1,84 (1Н, м), 2,48 (1H, д, J=4,2 Гц), 2,87-2,96 (1Н, м), 3,01 (1H, дд, J=6,6, 16,9 Гц), 3,26 (1H, дд, J=8,6, 16,9 Гц), 5,25-5,35 (1H, м), 7,12 -7,36 (6Н, м), 7,63 (1H, м), 7,94 (1H, д, J=8,6 Гц).
1H-ЯМР (CDCl3-D2O, δ(м.д.)): 1,07-1,20 (3Н, м), 1,76-1,84 (1H, м), 2,87-2,96 (1H, м), 3,00 (1H, дд, J=6,6, 16,9 Гц), 3,26 (1H, дд, J=8,6, 16,9 Гц), 5,27 (1H, дд, J=6,6, 8,6 Гц), 7,11-7,36 (6Н, м), 7,64 (1Н, м), 7,94 (1H, д, J=9,0 Гц).
[Стандартный пример 1] Получение 3-[2-циклопропил-4-(4-фторфенил)-3-хинолил]проп-2-еналя
В стеклянную колбу на 5 мл, снабженную мешалкой, термометром и капельной воронкой, вносят в атмосфере азота 314 мг (1,0 ммоль) 3-[2-циклопропил-4-(4-фторфенил)-3-хинолил]проп-2-еннитрила (получен по примеру 1), 2,25 мл муравьиной кислоты (60 ммоль, моль рассчитан на 100% муравьиную кислоту), 0,75 мл воды и 620 мг (5,3 ммоль в расчете на атом никеля) воды, содержащей полученный никель Ренея (NDHT-90, содержание никеля 50 масс.%, поставляемый Kawaken Fine Chemical Co., Ltd.). Содержимое подвергают взаимодействию при 80°С в течение 1,5 часов. После завершения взаимодействия содержимое охлаждают до комнатной температуры. После добавления 9 мл воды и 9 мл соляной кислоты (1 моль/л) катализатор удаляют фильтрованием с применением целита. Целит промывают двумя порциями 2-бутанола (1 мл) и двумя порциями толуола (9 мл). Органическую часть сушат над безводным сульфатом магния. Высушенную органическую часть фильтруют и фильтрат концентрируют при пониженном давлении, получая 307 мг (выход 91%) 3-[2-циклопропил-4-(4-фторфенил)-3-хинолил]проп-2-еналя в виде желтого твердого вещества (чистота 97%, по процентной доле площади согласно высокоэффективной жидкостной хроматографии).
Полученный 3-[2-циклопропил-4-(4-фторфенил)-3-хинолил]проп-2-еналь имеет следующие характеристики:
CI-MC (m/e): 318 (М+1)
1H-ЯМР (CDCl3, δ(м.д.)): 1,07-1,13 (2Н, м), 1,40-1,45 (2Н, м), 2,32-2,37 (1Н, м), 6,43 (1Н, дд, J=7,8, 16,2 Гц), 7,22-7,26 (4Н, м), 7,35 -7,38 (2Н, м), 7,55 (1Н, д, J=16,2 Гц), 7,644-7,69 (1Н, м), 7,97 (1H, д, J=8,4 Гц), 9,51 (1Н, д, J=7,5 Гц).
[Пример 5] Получение 3-[2-цихлопропил-4-(4-фторфенил)-3-хинолил]проп-2-еннитрила
В стеклянную колбу на 200 мл, снабженную мешалкой и термометром, вносят в атмосфере аргона 9,2 г (31,6 ммоль) 2-циклопропил-4-(4-фторфенил)хинолин-3-карбальдегида, 7,5 мл (143 ммоль) ацетонитрила, 45 мл толуола (диэлектрическая проницаемость при 25°С: 2,38) и 1,99 г (36,8 ммоль) метилата натрия. Содержимое подвергают взаимодействию при 50°С в течение 8 часов. Образовавшуюся смесь охлаждают на ледяной бане. К охлажденной смеси медленно добавляют при перемешивании последовательно 40 мл толуола и 34,0 мл (34,0 ммоль) соляной кислоты (1 моль/л). Отбирают отделенную органическую часть. После промывания 30 мл насыщенного водного раствора хлорида натрия органическую часть сушат над безводным сульфатом магния. Органическую часть фильтруют и анализируют методом высокоэффективной жидкостной хроматографии (абсолютный количественный анализ). Анализ подтверждает, что получено 9,52 г (выход: 96%) 3-[2-циклопропил-4-(4-фторфенил)-3-хинолил]проп-2-еннитрила. Органическую часть концентрируют при пониженном давлении, остаток кристаллизуют из смеси этилацетат/гексан (15/85, объемн. соотношение), получая 9,29 г (выход: 88%) 3-[2-циклопропил-4-(4-фторфенил)-3-хинолил]проп-2-еннитрила в виде желтого кристаллического продукта (чистота: 94%, измерено высокоэффективной жидкостной хроматографией).
Полученный 3-[2-циклопропил-4-(4-фторфенил)-3-хинолил]проп-2-еннитрил имеет почти те же характеристики, что указаны в примере 1.
[Пример 6] Получение 3-[2-циклопропил-4-(4-фторфенил)-3-хинолил] проп-2-еннитрила
В стеклянную колбу на 50 мл, снабженную мешалкой и термометром, вносят в атмосфере аргона 1,75 г (6,01 ммоль) 2-циклопропил-4-(4-фторфенил)хинолин-3-карбальдегида, 2,5 мл (47,5 ммоль) ацетонитрила, 13,5 мл метилаля (диэлектрическая проницаемость при 20°С: 2,7) и 0,56 г (10,3 ммоль) метилата натрия. Содержимое подвергают взаимодействию при 41°С в течение 9 часов. Образовавшуюся смесь охлаждают на ледяной бане. К охлажденной смеси медленно добавляют при перемешивании последовательно 30 мл толуола и 7,0 мл (7,0 ммоль) соляной кислоты (1 моль/л). Отбирают отделенную органическую часть. После промывания двумя порциями насыщенного водного раствора хлорида натрия (10 мл) органическую часть сушат над безводным сульфатом магния. Затем органическую часть фильтруют и анализируют методом высокоэффективной жидкостной хроматографии (абсолютный количественный анализ). Анализ подтверждает, что получено 1,79 г (выход: 96%) 3-[2-циклопропил-4-(4-фторфенил)-3-хинолил]проп-2-еннитрила.
[Пример 7] Получение 3-[2-циклопропил-4-(4-фторфенил)-3-хинолил] проп-2-еннитрила
В колбу, аналогичную используемой по примеру 6, вносят в атмосфере аргона 1,74 г (5,98 ммоль) 2-циклопропил-4-(4-фторфенил)хинолин-3-карбальдегида, 0,80 мл (15,2 ммоль) ацетонитрила, 8,0 мл тетрагидрофурана (диэлектрическая проницаемость при 25°С: 7,58) и 0,41 г (7,55 ммоль) метилата натрия. Содержимое подвергают взаимодействию при 52°С в течение 4,5 часов. Образовавшуюся смесь охлаждают на ледяной бане. К охлажденной смеси медленно добавляют при перемешивании последовательно 30 мл толуола и 7,0 мл (7,00 ммоль) соляной кислоты (1 моль/л). Отбирают отделенную органическую часть. После промывания двумя порциями насыщенного водного раствора хлорида натрия (10 мл) органическую часть сушат над безводным сульфатом магния. Затем органическую часть фильтруют и анализируют методом высокоэффективной жидкостной хроматографии (абсолютный количественный анализ). Анализ подтверждает, что получено 1,64 г (выход: 88%) 3-[2-циклопропил-4-(4-фторфенил)-3-хинолил]проп-2-еннитрила.
Промышленная применимость
Согласно способу получения по изобретению известный 3-[2-циклопропил-4-(4-фторфенил)-3-хинолил]проп-2-еннитрил получают из известного производного хинолинкарбальдегида простым способом. Производное хинолилакрилонитрила может быть эффективно использовано для получения известного производного хинолилпропеналя.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ХИНОЛИНКАРБАЛЬДЕГИДА | 1999 |
|
RU2217423C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНОГО ХИНОЛИНКАРБОКСАЛЬДЕГИДА И ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ | 2002 |
|
RU2264391C2 |
| СПОСОБ ПОЛУЧЕНИЯ 3-((2-ЦИКЛОПРОПИЛ-4-(4-ФТОРФЕНИЛ)-3-ХИНОЛИЛ)ПРОП-2-ЕНАЛЯ И ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ | 1999 |
|
RU2214402C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ МЕВАЛОНОВОЙ КИСЛОТЫ, ИНГИБИРУЮЩИХ ГМГ-СОА РЕДУКТАЗУ | 2003 |
|
RU2335500C2 |
| СПОСОБ ПОЛУЧЕНИЯ ИНГИБИТОРОВ HMG-COA РЕДУКТАЗЫ | 2003 |
|
RU2299196C2 |
| ПРОИЗВОДНЫЕ 2-АМИНОПИРИДИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ЛЕЧЕНИЯ | 2001 |
|
RU2250898C2 |
| ПРОИЗВОДНЫЕ 6-АМИНОХИНАЗОЛИНА ИЛИ 3-ЦИАНОХИНОЛИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРА РЕЦЕПТОРНЫХ ТИРОЗИНКИНАЗ EGFR ИЛИ HER-2 | 2010 |
|
RU2536102C2 |
| ПРОИЗВОДНЫЕ ХИНОЛИНА | 1995 |
|
RU2137770C1 |
| ПРОИЗВОДНЫЕ АМИДА ФЕНИЛЦИКЛОГЕКСИЛКАРБОНОВОЙ КИСЛОТЫ, СМЕСЬ ИХ ИЗОМЕРОВ ИЛИ ОТДЕЛЬНЫЕ ИЗОМЕРЫ И ИХ СОЛИ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ С АНТИАРТЕРИОСКЛЕРОТИЧЕСКОЙ И АНТИРЕСТЕНОЗНОЙ АКТИВНОСТЬЮ | 1996 |
|
RU2158261C2 |
| АРИЛ-ЗАМЕЩЕННЫЕ КАРБОКСАМИДНЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ БЛОКАТОРОВ КАЛЬЦИЕВЫХ ИЛИ НАТРИЕВЫХ КАНАЛОВ | 2010 |
|
RU2575168C2 |
Изобретение относится к способу получения 3-[2-циклопропил-4-(4-фторфенил)-3-хинолил]проп-2-еннитрила, который заключается во взаимодействии 2-циклопропил-4-(4-фторфенил)хинолин-3-карбальдегида с ацетонитрилом в присутствии основания с получением смеси 3-[2-циклопропил-4-(4-фторфенил)-3-хинолил]проп-2-еннитрила и 3-[2-циклопропил-4-(4-фторфенил)-хинолин-3-ил]-3-гидроксипропионитрила, и с последующим добавлением дегидратирующего агента к реакционной смеси для проведения дегидратации. В обычных условиях новый 3-[2-циклопропил-4-(4-фторфенил)хинолин-3-ил]-3-гидрокси-пропионитрил образуется в вышеуказанной реакции в качестве промежуточного соединения. Однако, если вышеуказанное взаимодействие проводят в органическом растворителе, имеющем диэлектрическую проницаемость 10 или ниже в интервале температур от 20 до 25°С, образуется непосредственно 3-[2-циклопропил-4-(4-фторфенил)-3-хинолил]-проп-2-еннитрил. 3-[2-Циклопропил-4-(4-фторфенил)-3-хинолил]-проп-2-еннитрил используется в качестве исходного соединения для получения производного хинолилпропеналя, которое используют для синтеза холестерин-восстанавливающего агента.
Технический результат - упрощение способа получения 3-[2-циклопропил-4-(4-фторфенил)-3-хинолил]-проп-2-еннитрила. 4 н. и 14 з.п. ф-лы.
взаимодействия 2-циклопропил-4-(4-фторфенил)хинолин-3-карбальдегида с ацетонитрилом в присутствии основания с получением смеси 3-[2-циклопропил-4-(4-фторфенил)-3-хинолил]проп-2-еннитрила и 3-[2-циклопропил-4-(4-фторфенил)-хинолин-3-ил]-3-гидроксипропионитрила; и
дегидратации смеси в присутствии дегидратирующего агента.
взаимодействия 2-циклопропил-4-(4-фторфенил)хинолин-3-карбальдегида с ацетонитрилом в присутствии основания и
дегидратации полученного продукта в присутствии дегидратирующего агента.
| US 5008270 A, 16.04.1991.US 5286721 A, 15.02.1994.WO 9106548 A1, 16.05.1991.DE 3905908 A, 06.09.1990.RU 2114620 C1, 10.07.1998. |
Авторы
Даты
2005-09-10—Публикация
2001-01-24—Подача