Изобретение относится к биологии и медицине, конкретно к средам для перепрограммирования стволовых клеток человека и животных.
Известны среды для перепрограммирования стволовых клеток человека и животных, содержащие солевую основу, аминокислоты, липиды, углеводы, витамины, микроэлементы, антибиотики, сульфаниламиды, эмбриональную телячью сыворотку, дифференцирующие факторы, например, модифицированные среды D-MEM [1, 2]. Однако данные среды содержат только один дифференцирующий фактор, например диметилсульфоксид, дексаметазон. Это приводит к тому, что перепрограммированию в направлении миогенеза и кардиомиогенеза подвержены не более 20-30% стволовых клеток [3, 4].
Наиболее близкой по составу к предлагаемой среде является среда для биохимического перепрограммирования клеток, которая содержит среду DI-MEM, 10% эмбриональную телячью сыворотку, антибиотики, дифференцирующий фактор в концентрации 0,1-100 ммоль/л, 5-азацитидин и вспомогательные факторы в концентрации 1 ммоль/л инсулин или 10 нг/мл трансформирующий фактор роста [5, 6]. Данная среда, благодаря наличию дифференцирующего фактора, приводит к перепрограммированию стволовых клеток в миоциты и кардиомиоциты. Однако дозы 5-азацитидина, превышающие концентрацию 50 ммоль/л вызывают гибель более 50% клеток. Используемое в указанной среде сочетание и концентрация компонентов, а также присутствие указанного дифференцирующего фактора является причиной недостаточно высокого выхода клеток с требуемыми свойствами, таким образом способствует перепрограммированию только 30-50% стволовых клеток в направлении кардиомиогенеза.
Новая техническая задача - повышение эффективности перепрограммирования стволовых клеток в направлении кардиомиогенеза за счет повышения выхода кардиомиоцитов.
Поставленную задачу решают применением новой среды, содержащей среду DI-MEM, эмбриональную телячью сыворотку, антибиотики и сульфаниламиды, инсулин, 5-азацитидин, L-глютамин, причем она дополнительно содержит среду F-12, диметилсульфоксид, дексаметазон, гидрокортизон, N6-2'-дибутирил 3'5 циклический монофосфат, этаноламид при следующем соотношении компонентов (г/л):
Отличие предлагаемого изобретения от прототипа заключается в том, что среда дополнительно содержит среду F-12, диметилсульфоксид, дексаметазон, гидрокортизон, N6-2'-дибутирил 3'5 циклический монофосфат, этаноламид при следующем соотношении компонентов (г/л):
Сравнение заявляемого технического решения с известными показывает, что предлагается описание композиции ингредиентов среды для перепрограммирования клеток человека и животных, позволяющей повысить эффективность перепрограммирования стволовых клеток, в направлении кардиомиогенеза, не обнаружено в известных литературных источниках. С учетом изложенного, следует считать заявляемое решение соответствующее критерию «существенные отличия».
Применение данной среды в эксперименте на клетках животных и человека показало, что она соответствует критерию «промышленно применимо» при проведении процедуры перепрограммирования стволовых клеток.
Технология приготовления среды для перепрограммирования стволовых клеток включает следующие операции:
Получение культуры in vitro стволовых клеток человека по общепринятой технологии [7];
- смешивание ингредиентов среды для перепрограммирования стволовых клеток до полного растворения веществ в количествах согласно предлагаемой формуле изобретения,
- добавление перепрограммируемой среды в культуру ткани стволовых клеток и инкубация в ней в течение 1-14 суток при 37°С, 100% влажности, 5% СО2;
- определение доли мышечных клеток в культуре и использование клеток в соответствии с поставленными задачами (клеточный банк, клеточная терапия и т.п.).
Полученная среда для перепрограммирования стволовых клеток содержит (г/л):
Концентрации компонентов в предлагаемой среде для перепрограммирования стволовых клеток человека и животных подобраны на основании интерпретации данных экспериментальных исследований.
В качестве среды для сравнения (прототипа) использовали известный состав, предложенный Р.Zuk с соавт. (2001) [8]. При этом содержание эмбриональной сыворотки, 5-азацитидина, инсулина, антибиотиков и L-глютамина в каждом из экспериментов соответствовало их содержанию в предлагаемой среде для перепрограмирования стволовых клеток.
Пример 1
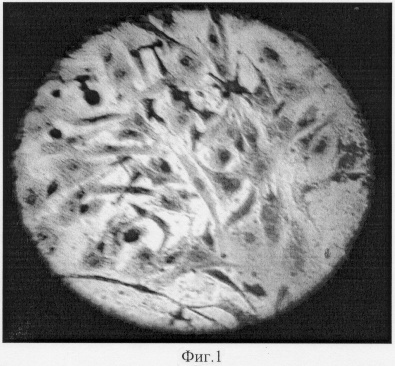
Культуру стволовых клеток из костного мозга крыс породы «Вистар» получали по стандартной методике путем культивирования кариоцитов в 50 мл культуральных флаконах в течение 14 суток при 37°С, 100% влажности, 5% СО2. Использовали среду состоящую из 80% среды D-MEMLG, 20% эмбриональной телячьей сыворотки, 40 мкг/мл гентамицина, 200 мг/мл L-глютамина [8]. Через 14 суток наблюдался рост колоний, состоящих из мезенхимальных фибробластоподобных клеток (рис.1) (эффективность клонирования 1-4×105 клеток на мл). На Фиг.1 (см. приложение) представлен фрагмент колонии фибробластоподобных стволовых клеток, выросших на 14 сутки из клеток костного мозга крыс породы «Вистар». Окраска азур-II эозин, ув. 40х.
На 14 сутки удалили надосадочную жидкость и заменяли средой для биохимического перепрограммирования стволовых клеток, содержащей (г/л):
Через 1-14 суток после культивирования материал фиксировали, окрашивали азур-II эозином или проводили электронно-микроскопическое исследование для определения доли мышечных клеток.
В контроле использовали среду-прототип, содержащую (г/л):
Структурно-функциональный анализ культуры полученных клеток показал, что количество перепрограммируемых клеток в прототипе составило 33,34±2,7%, а в предлагаемой среде 47,5±3,3 (Pu<0,05), что достоверно выше, чем у прототипа.
На фиг.2. представлена электронная микроскопия культуры стволовых клеток, обработанных средой для культивирования, дифференцирующихся в кардиомиоциты на 28 сутки культивирования in vitro (см. приложение).
Пример 2
Культуру стволовых клеток из костного мозга крыс породы «Вистар» получали по стандартной методике путем культивирования кариоцитов в 50 мл культуральных флаконах в течение 14 суток при 37°С, 100% влажности, 5% CO2. Использовали среду, содержащую 80% среды D-MEMLG, 20% эмбриональной телячьей сыворотки, 40 мкг/мл гентамицина, 200 мг/мл L-глютамина [8]. Через 14 суток наблюдался рост колоний (эффективность клонирования 1-4×105 клеток на мл), состоящих из мезенхимальных фибробластоподобных клеток.
На 14 сутки удалили надосадочную жидкость и заменяли средой для перепрограммирования стволовых клеток, содержащей (г/л):
Через 1-14 суток после культивирования материал фиксировали, окрашивали азур-II эозином или проводили электронно-микроскопическое исследование для определения доли мышечных клеток.
Структурно-морфологический анализ выросших культур показал, что количество перепрограммируемых клеток в прототипе составило 42,6±3,5%, в предлагаемой среде 61,54±2,3% (Pu<0,05), что достоверно выше, чем у прототипа.
Пример 3
Культуру стволовых клеток из костного мозга человека, взятого во время операции из бедренной кости получали по стандартной методике путем культивирования кариоцитов в 50 мл культуральных флаконах в течение 14 суток 37°С, 100% влажности, 5% СО2. Использовали среду, состоящую из 80% среды D-MEMLG, 20% эмбриональной телячьей сыворотки, 40 мкг/мл гентамицина, 200 мг/мл L-глютамина [8]. Через 14 суток наблюдался рост колоний (эффективность клонирования 1-4×105 клеток на мл), состоящих из мезенхимальных фибробластоподобных клеток.
На 14 сутки удалили надосадочную жидкость и заменяли средой для перепрограммирования стволовых клеток, содержащей (г/л):
Через 1-14 суток после культивирования материал фиксировали, окрашивали азур-II эозином или проводили электронно-микроскопическое исследование для определения доли мышечных клеток.
В контроле использовали среду-прототип, содержащую (г/л):
Структурно-морфологический анализ выросших культур показал, что количество перепрограммируемых клеток в прототипе составило 45,3±1,1%, в предлагаемой среде 55,3,5±1,9 (Pu<0,05), что достоверно выше, чем у прототипа.
Обоснование выбора ингредиентов
Диметилсульфоксид является стабилизатором внутриклеточной воды в клетках, а также фактором, способствующим мышечной дифференцировке стволовых клеток. Патогенетический механизм действия на родоначальные клетки не известен [4, 5].
Дексаметазон и гидрокортизон являются глюкокортикоидами, принимающими участие в процессах пролиферации и дифференцировки стволовых клеток. Существуют внутриядерные рецепторы в клетках-мишенях к данным гормонам. В дозах более 0,001 г/л вызывают угнетение клеточных функций [1, 6].
N 6-2'-дибутирил 3'5 циклический монофосфат является внутриклеточным мессенджером, принимающим участие в экспрессии генов, ответственных за миогенез [1, 7].
Этаноламид - кофактор, способствующий кардиомиогенезу [1, 8].
Среда F-12 используется в сочетании со средой D-MEM или DI-MEM для выращивания клеток мезенхимальной природы [1].
Таким образом, применение предлагаемой среды для перепрограммирования стволовых клеток человека и животных позволяет увеличить выход образования мышечных клеток за счет взаимного усиления дифференцировочного воздействия в сторону кардиомиогенеза.
Список используемой литературы
1. Культура животных клеток. Методы/ Р.Фрешни. - М.: Мир. - 1989.
2. Биология развития млекопитающих. Методы/ М.Манк. - М.: Мир, 1990.
3. Leiden J.M. Beating the odds: a cardiomyocytes cell line at last// J. clin. Invest. - 199. - V.103. - P.591-592.
4. Pittenger M.F., Mackay A.M., Beck S.C. et al. Multilineage potential of adult mesen-chymal cells// Science. - 1999. - V.284. - P.143-147.
5. Makino S., Fukuda K., Miyoshi S. et al. Cardiomyocytes can be generated from marrow stromal cells in vitro//J. Clin. Invest. - 1999. - V.103. - P.697-705.
6. Wang J., Shum-Tim D., Galipeau J. et al. Marrow stromal cell for cellular cardiomyoplasty: fasibility and potential clinical advantages // J. Thoracic and Cardiovascular Surgery. - V.120. - P.999-1007.
7. Гольдберг Е.Д., Дыгай A.M., Шахов В.П. Методы культуры ткани в гематологии. Томск, ТГУ, 1992.
8. Zuk P., Zyu A., Mizido H. et al. Multilineage cell from human adipose tissue implicactions for cell-based therapies// Tissue engineering. - 2001. - V.7. - P.211-228.
| название | год | авторы | номер документа |
|---|---|---|---|
| СРЕДА ДЛЯ КРИОКОНСЕРВАЦИИ КЛЕТОК ЧЕЛОВЕКА И ЖИВОТНЫХ | 2002 |
|
RU2237712C2 |
| КУЛЬТУРА КЛЕТОК, СОДЕРЖАЩАЯ КЛЕТКИ-ПРЕДШЕСТВЕННИКИ ОСТЕОГЕНЕЗА, ИМПЛАНТАТ НА ЕЕ ОСНОВЕ И ЕГО ИСПОЛЬЗОВАНИЕ ДЛЯ ВОССТАНОВЛЕНИЯ ЦЕЛОСТНОСТИ КОСТИ | 2003 |
|
RU2240135C1 |
| ЛЕЧЕНИЕ С ПРИМЕНЕНИЕМ ПЕРЕПРОГРАММИРОВАННЫХ ЗРЕЛЫХ И ДИФФЕРЕНЦИРОВАННЫХ КЛЕТОК | 2009 |
|
RU2635317C2 |
| Состав бессывороточной питательной среды для культивирования мезенхимных стволовых клеток свиньи | 2022 |
|
RU2795065C1 |
| БИОТРАНСПЛАНТАТ, СОДЕРЖАЩИЙ ЯДРОСОДЕРЖАЩИЕ КЛЕТКИ КОСТНОГО МОЗГА, В ТОМ ЧИСЛЕ ПРЕДДИФФЕРЕНЦИРОВАННЫЕ В ЭНДОТЕЛИАЛЬНОМ И КАРДИОМИОЦИТАРНОМ НАПРАВЛЕНИИ, СПОСОБ ЕГО ПОЛУЧЕНИЯ (ВАРИАНТЫ) И СПОСОБ ЛЕЧЕНИЯ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ (ВАРИАНТЫ) | 2006 |
|
RU2314816C2 |
| КЛЕТОЧНЫЙ ПРОДУКТ ИНСУЛИН-ПРОДУЦИРУЮЩИХ КЛЕТОК МЛЕКОПИТАЮЩИХ И ЕГО ИСПОЛЬЗОВАНИЕ ДЛЯ ТЕРАПИИ САХАРНОГО ДИАБЕТА | 2017 |
|
RU2663118C1 |
| БИОТРАНСПЛАНТАТ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И СПОСОБ ЛЕЧЕНИЯ ХРОНИЧЕСКОГО ГЕПАТИТА И ЦИРРОЗА ПЕЧЕНИ (ВАРИАНТЫ) | 2004 |
|
RU2272638C1 |
| СПОСОБЫ И ПРЕПАРАТЫ ДЛЯ ТРАНСФЕКЦИИ КЛЕТОК | 2012 |
|
RU2624139C2 |
| СПОСОБЫ И ПРЕПАРАТЫ ДЛЯ ТРАНСФЕКЦИИ КЛЕТОК | 2012 |
|
RU2691027C2 |
| Среда для культивирования клеток костного мозга, предназначенных для клеточной терапии | 2020 |
|
RU2756926C1 |
Изобретение относится к биологии и медицине, конкретно к средам для перепрограммирования стволовых клеток человека и животных. Среда для биохимического перепрограммирования стволовых клеток человека и животных наряду со средой DI-MEM, эмбриональной телячьей сывороткой, инсулином, 5-азацитидином, L-глютамином дополнительно содержит среду F-12, диметилсульфоксид, дексаметазон, гидрокортизон, N 6-2'-дибутирил 3'5 циклический монофосфат, этаноламид при заданном соотношении компонентов. Изобретение позволяет повысить эффективность перепрограммирования стволовых клеток в направлении кардиоминогенеза. 2 ил.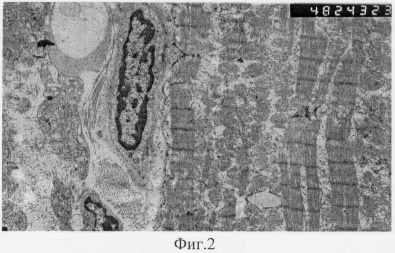
Среда для перепрограммирования стволовых клеток человека и животных, содержащая среду DI-MEM, эмбриональную телячью сыворотку, инсулин, 5-азацитидин, L-глютамин, гентамицин, отличающаяся тем, что она дополнительно содержит среду F-12, диметилсульфоксид, дексаметазон, гидрокортизон, N 6-2'-дибутирил 3'5 циклический монофосфат, этаноламид при следующем соотношении компонентов, г/л:
| ZUK P., ZYU A., MISIDO H | |||
| et | |||
| al | |||
| Multilineage cell from human adipose tissue implicactions for cell-based therapies | |||
| Tissbe engineering | |||
| Перекатываемый затвор для водоемов | 1922 |
|
SU2001A1 |
| MAKING S., FUKUDA K., MIYOSCHI S | |||
| et | |||
| al | |||
| Cardiomyocytes can be generated from marrow stromal cells in vitro | |||
| J | |||
| Clin | |||
| Invest | |||
| Металлический водоудерживающий щит висячей системы | 1922 |
|
SU1999A1 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ, ФИБРОБЛАСТ, СПОСОБ ОТДЕЛЕНИЯ КЛЕТОК | 1991 |
|
RU2164240C2 |
| Культура | |||
Авторы
Даты
2005-09-20—Публикация
2003-07-31—Подача