Изобретение относится к области биотехнологии, а именно к области разработки искусственных бессывороточных питательных сред для культивирования мезенхимных стволовых клеток млекопитающих и может быть использовано в фармацевтической и биотехнологической промышленности.
В настоящее время клеточные питательные среды повсеместно используются как биотехнологическими, так и фармацевтическими компаниями для получения различных продуктов, таких как гормоны, ферменты, антигены, антитела и др. Питательные среды для роста клеток млекопитающих обычно представляют собой смесь питательных веществ органического и неорганического происхождения, эмульгированных или растворенных в жидкой или полутвердой фазе. Для культивирования мезенхимных стволовых клеток (далее МСК) используют адаптированные питательные среды, которые должны обеспечивать способность МСК к пролиферации и дифференцировке в специализированные клетки (сосудистые, нервные, липидные, костные, хрящевые и др.). Важность сбалансированного и стабильного состава питательных сред особенно актуальна при их использовании в биотехнологических процессах в условиях биореакторов особенно при масштабном промышленном производстве. Сегодня основной добавкой в питательную среду является сыворотка крови, например, эмбриональной телячьей или крупного рогатого скота (КРС), которую обычно добавляют в количестве не более 10%. Однако кроме положительных свойств применение сыворотки крови в качестве добавки к питательным средам имеет и отрицательный аспект, который заключатся в неконтролируемом составе компонентов, специфичности, контаминации, наличии ингибиторов роста и сложности стандартизации от партии к партии. В связи с вышеизложенным растет спрос на разработку альтернативных питательных сред без добавления сыворотки крови млекопитающих. Эта потребность частично удовлетворяется коммерческими продуктами, например, AdvanceSTEMTM(HyClone), Advanced Stem Cell Media, NutriStem XF, доступными в настоящее время. Однако они не полностью покрывают потребности биотехнологической промышленности и требуют тонкой адаптации МСК к питательной среде.
Описание аналога. Известна бессывороточная среда для мезенхимных стволовых клеток животных, патентная заявка № CN106282102A, в которой используется базовая питательная среда DMEM и MCDB201 (1:1) с добавлением факторов роста (фактор роста фибробластов -FGF, тромбоцитарный фактор роста BB - PDGF-BB, трансформирующий фактор роста бета - TGF-β, фактор роста гепатоцитов - HGF), липидного концентрата, гормонов (инсулина, дексаметазона), бычьего сывороточного альбумина, витамина Е и поверхностно-активных веществ (Плюроник-F (полоксамер), Твин 80).
Недостатками аналога является качественный и количественный состав питательной бессывороточной среды, в которую входят такие компоненты как факторы роста и гормон дексаметазон. Включение факторов роста и дексаметазона в состав питательной среды не только способствуют пролиферации мезенхимных стволовых клеток, но и активируют процессы их дифференцировки в различные типы клеток (Bella Е., Buetti-Dinh А., Licandro G. Dexamethasone Induces Changes in Osteogenic Differentiation of Human Mesenchymal Stromal Cells via SOX9 and PPARG, but Not RUNX2 // Int. J. Mol. Sci. 2021. N 22(9), 4785). Поэтому факторы роста не желательно вводить в состав питательной среды на этапе масштабирования клеточной биомассы МСК, они должны использоваться только на этапе дифференцировки МСК в требуемый тип клетки. Наряду с этим в качестве базовой питательной среды используют коммерческую питательную среду DMEM и MCDB201 (1:1). Однако более сбалансированным составом для разработки бессывороточной питательной среды является базовая питательная среда DMEM/F12 (Butler M. Serum-free media: standardizing cell culture systems // Pharm. Bioprocess. 2013. N 1(4). P. 1-4). Дополнительным отрицательным фактором данной питательной среды является наличие только одного белка транспортера – сывороточного бычьего альбумина. Необходимо отметить, что на эффективность транспорта биомолекул оказывает влияние и видовое различие альбуминов быка и свиньи (Robertson A., Karp W., Brodersen R. Comparison of the binding characteristics of serum albumins from various animal species // Dev Pharmacol Ther. 1990. N 15(2). P. 106-11). Таким образом, использование бычьего альбумина снижает эффективность транспорта минеральных солей, жирных кислот, гормонов и микроэлементов при культивировании мезенхимных стволовых клеток свиньи (свМСК) .
Описание прототипа. Наиболее близким по своим признакам, принятым за прототип, является бессывороточная питательная среда описанная в патентной заявке № CN107574145A, в которой используют базовую питательную среда DMEM/F12 с добавлением факторов роста (фактор роста фибробластов - FGF, эпидермальный фактор роста - EGF, тромбоцитарный фактор роста BB - PDGF-BB, трансформирующий фактор роста бета - TGF-β, ингибирующий фактор лейкемии – LIF, инсулиноподобный фактор роста-1 – IGF-1), гормонов (гидрокортизон, инсулин, прогестерон, дексаметазон), белков (сывороточного альбумина человека, трансферрина, фетуина), липидного концентрата и адгезивных веществ (фибронектин, ламинин, коллаген, кадгерин). Данная питательная среда не может быть применена для культивирования мезенхимных стволовых клеток свиньи с сохранением мультипотентности и потенциала к дифференцировке, так как содержит факторы роста и дексаметазон стимулирующие свМСК к дифференцировке в различные типы клеток (Keum-Seok B., Joon-Beom P., Hyun-Soo K. et al. Neuron-Like Differentiation of Bone Marrow-Derived Mesenchymal Stem Cells // Yonsei Medical Journal. 2011. 52(3) P. 401-412). Также данная питательная среда содержит сывороточный альбумин человека, что снижает эффективность транспорта минеральных солей, жирных кислот и гормонов из-за видового различия альбуминов человека и свиньи (Robertson A., Karp W., Brodersen R. Comparison of the binding characteristics of serum albumins from various animal species // Dev Pharmacol Ther. 1990. N 15(2). P. 106-11).
Задачей предлагаемого изобретения является получение нового состава бессывороточной питательной среды для культивирования мезенхимных стволовых клеток свиньи (свМСК).
Технический результат - получение нового состава бессывороточной питательной среды для культивирования мезенхимных стволовых клеток свиньи (свМСК) с сохранением пролиферативной активности и дифференцировочного потенциала.
Технический результат достигается при добавлении к базовой питательной среде DMEM/F12 (1:1), содержащей дополнительно белки и гормоны, следующих компонентов (мг/л), а именно
- аминокислоты: L-Aланин - 4,45, L-Аргинин - 73,75, L-Аспарагин - 7,50, L-Аспарагиновая кислота - 6,65, L-Цистин - 31,29, L-Глютаминовая кислота - 7,35, L-Глютамин - 182,5, L-Цистеин - 8,78, L Глицин - 9,38, L-Гистидин - 15,74, L-Изолейцин - 27,24, L-Лейцин - 29,53, L-Лизин HCl - 45,63, L-Метионин - 8,62, L-Фенилаланин - 17,74, L-Пролин - 8,63, L-Серин - 13,13, L-Треонин - 26,73, L-Триптофан - 4,51, L-Тирозин - 27,90, L-Валин - 26,43;
- транспортные белки: Свиной сывороточный альбумин - 1000-2000, Трансферин - 50-100, Фетуин - 500-1000;
- гормоны: Гидрокортизон - 0,1-0,5, Прогестерон - 0,1-0,5, Инсулин - 5-10.
Предлагаемый состав бессывороточной питательной среды позволяет обеспечить пролиферативную активность свМСК за счет увеличения в 2 раза заменимых и не заменимых аминокислот по сравнению с базовой питательной средой DMEM/F12 и введения дополнительно транспортных белков и гормонов, обеспечивающих эффективное увеличение клеточной биомассы свМСК без запуска процесса дифференцировки в другие типы клеток, но с сохранением дифференцировочного потенциала свМСК за счет исключения из состава питательной среды факторов роста и синтетического гормона дексаметазона.
Из уровня техники заявленный состав бессывороточной питательной среды для культивирования мезенхимных стволовых клеток свиньи (свМСК) не известен, что подтверждает соответствие условию новизна. Также неочевидно влияние входящих в заявленный состав ингридиентов на достижение технического результата - возможность культивирования мезенхимных стволовых клеток свиньи (свМСК) с сохранением пролиферативной активности и дифференцировочного потенциала полученной биомассы, что подтверждает соответствие условию изобретательский уровень.
Изобретение характеризуют следующие графические материалы.
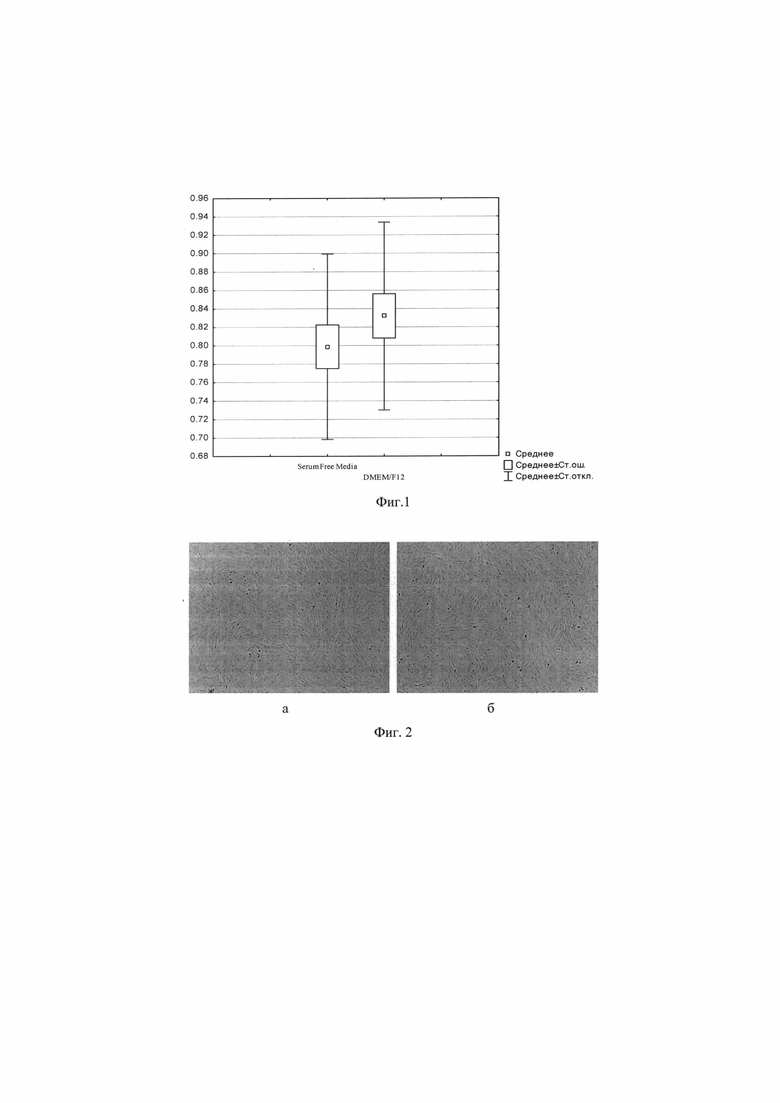
Фиг. 1. Диаграмма оценки пролиферативной активности свМСК, культивированных в питательной среде DMEM/F12, с содержанием 10% сыворотки КРС и 1% раствора пенициллина-стрептомицина и в предложенной бессывороточной питательной среде Serum Free Media, с содержанием 1% раствора пенициллина-стрептомицина.
Фиг. 2. Фотограммы – свМСК на 9 день культивирования. Фиг.1а - свМСК культивированные в питательной среде DMEM/F12 с содержанием 10% сыворотки КРС. Фиг.1б – свМСК, культивированные в разработанной бессывороточной питательной среде. Видно, что в каждом случае свМСК плотно покрывают всё поле зрения на поверхности дна культурального флакона, имеют типичную морфологию и представлены веретеновидными фибробластоподобными клетками.
Фиг. 3. Диаграмма оценки дифференцировочного потенциала свМСК в остеогенном направлении, культивированных в питательной среде DMEM/F12 с содержанием 10% сыворотки КРС с остеоиндуктивной добавкой DMEM/F12+OST и в разработанной бессывороточной питательной среде с остеоиндуктивной добавкой Serum Free Media+OST. Контроль питательная среда DMEM/F12 с содержанием 10% сыворотки КРС без остеоиндуктивной добавки DMEM/F12.
Изобретение осуществляют следующим образом.
Мезенхимные стволовые клетки свиньи (свМСК) были получены из красного костного мозга бедренных костей свиньи возрастом 7 дней и хранились в морозильной камере в криосреде при температуре минус 80°C. Для апробации разработанного бессывороточного состава питательной среды, включающей DMEM/F12 (1:1), содержащей дополнительно белки и гормоны, следующих компонентов (мг/л), а именно
- аминокислоты: L-Aланин - 4,45, L-Аргинин - 73,75, L-Аспарагин - 7,50, L-Аспарагиновая кислота - 6,65, L-Цистин - 31,29, L-Глютаминовая кислота - 7,35, L-Глютамин - 182,5, L-Цистеин - 8,78, L Глицин - 9,38, L-Гистидин - 15,74, L-Изолейцин - 27,24, L-Лейцин - 29,53, L-Лизин HCl - 45,63, L-Метионин - 8,62, L-Фенилаланин - 17,74, L-Пролин - 8,63, L-Серин - 13,13, L-Треонин - 26,73, L-Триптофан - 4,51, L-Тирозин - 27,90, L-Валин - 26,43;
- транспортные белки: Свиной сывороточный альбумин - 1000-2000, Трансферин - 50-100, Фетуин - 500-1000,
- гормоны: Гидрокортизон - 0,1-0,5, Прогестерон - 0,1-0,5, Инсулин - 5-10, криопробирку извлекли из морозильной камеры, разморозили суспензию свМСК и добавили в культуральные флаконы площадью 25 см2 (Eppendorf, Германия). Плотность посева свМСК составляла 0,7 х 106. В первую серию флаконов (2 шт.) добавляли 5 мл свежей питательной среды DMEM/F12 (ООО «Биолот», РФ), содержащей 10% сыворотки КРС (ООО «Биолот», РФ) и 1% раствора пенициллина-стрептомицина (ООО «Биолот», РФ). Во вторую серию флаконов (2 шт.) добавляли 5 мл разработанной бессывороточной питательной среды, содержащей 1% раствора пенициллина-стрептомицина. Флаконы с свМСК помещали в СО2-инкубатор и культивировали при температуре +37°C в увлажненной атмосфере 5% CO2 в течение 9 дней. Среду меняли на свежую каждые три дня.
Для оценки пролиферативной активности свМСК использовали МТТ-тест, для оценки дифференцировочного потенциала определяли способность свМСК к дифференцировке в остеогенном направлении окрашиванием на щелочную фосфатазу.
Пример 1
Для проведения исследования готовили свМСК следующим образом: свМСК снимали со дна флакона (25 см2) аспирировали питательную среду, добавляли к клеткам 1 мл раствора Хенкса без фенолового красного (ООО НПП «ПанЭко»), инкубировали клетки с раствором в течение 1 минуты, по окончании времени инкубации раствор аспирировали. Затем к свМСК добавляли 3 мл раствора Версена-трипсина (1:1) (ООО «Биолот»), инкубировали в течение 4-5 минут, контролировали открепление клеток от дна флакона под микроскопом. По окончанию времени инкубации блокировали действие трипсина путем добавления к суспензии 3 мл полной питательной среды DMEM/F-12 (ООО НПП «ПанЭко»), содержащей 5% сыворотки КРС. Полученную суспензию переносили в пробирку, центрифугировали в течение 5 мин при 1000 об/мин, надосадочную жидкость удаляли в асептических условиях, в пробирку добавляли 2 мл полной питательной среды, тщательно ресуспендировали, подсчитывали число клеток в суспензии с помощью камеры Горяева.
Пример 2
Оценку пролиферативной активности свМСК, подготовленную по примеру 1, проводили фотометрическим методом с определением оптической плотности при помощи микропланшетного фотометра (Multiskan FC, Thermo Scientific) при длине волны 450 нм (референсная длина волны 620 нм) и реагента WST-1 (Cell Proliferation Reagent WST-1 протокол, Roche). Мезенхимные стволовые клетки свиньи культивировали в 96-луночном планшете. Для этого в каждую лунку планшета вносили по 0,02х106 свМСК. Для контроля 50% лунок планшета были заполнены питательной средой DMEM/F12 (ООО «Биолот», РФ), содержащей 10% сыворотки КРС (ООО «Биолот», РФ). Затем заполнили другие 50% лунок планшета предложенной бессывороточной питательной средой. Мезенхимные стволовые клетки свиньи культивировали в 96-луночном планшете в условиях CO2-инкубатора при 95% влажности, температуре 37°С, 5% СО2 в течение 72 часов. Пролиферативную активность рассчитывали по формуле:
коэффициент пролиферации (%) = (А) тест/(Б) контроль x 100%,
где (А) тест — культивирование в предложенной питательной среде, (Б) контроль — стандартная питательная среда DMEM/F12, с содержанием 10% сыворотки КРС.
В ходе оценки пролиферативной активности свМСК достоверных различий между группами установлено не было. Оптическая плотность в группе свМСК культивированных в питательной среде DMEM/F12, с содержанием 10% сыворотки КРС и 1% раствора пенициллина-стрептомицина составила 0,83±0,1 у.е.. В группе свМСК, культивированных в предложенной бессывороточной питательной среде, содержащей 1% раствор пенициллина-стрептомицина оптическая плотность равнялась 0,79±0,1 у.е., что свидетельствует о сохранении клетками пролиферативной активности (фиг.1).
Коэффициент пролиферации свМСК, культивированных в предложенной бессывороточной питательной среде, содержащей 1% раствора пенициллина-стрептомицина составил 95,2%, что свидетельствует о высокой пролиферативной активности без запуска процесса дифференцировки в другие типы клеток (фиг.2).
Пример 3
Оценку дифференцировочного потенциала свМСК, полученной по примеру 1, проводили в остеогенном направлении путем добавления к питательной среде остеоиндуктивной добавки, содержащей 0,1 мкМ - дексаметазон, 50 мкМ аскорбиновая кислота, 10 мМ β-глицерофосфат натрия (Пинаев Г.П., Богданова М.С. Методы культивирования клеток / Г.П. Пинаев, М.С. Богданова. – СПб.: Изд-во Политехн. ун-та, 2008. – 278 с.). Для этого в каждую лунку 96-луночного планшета вносили по 0,02х106 свМСК. При этом 50% лунок планшета были заполнены питательной средой DMEM/F12 (ООО «Биолот», РФ), содержащей 10% сыворотки КРС (ООО «Биолот», РФ) с остеоиндуктивной добавкой (положительный контроль), другие 50% лунок планшета - разработанной бессывороточной питательной средой с той же остеоиндуктивной добавкой. Отрицательным контролем служили лунки без остеоиндуктивной добавки в питательную среду DMEM/F12 (ООО «Биолот», РФ), содержащей 10% сыворотки КРС (ООО «Биолот», РФ). Культивировали свМСК в 96-луночном планшете в условиях CO2-инкубатора при 95% влажности, температуре 37°С, 5% СО2, в течение 6 суток. Дифференцировку свМСК в остеогенном направлении оценивали по накоплению щелочной фосфатазы при помощи реагента BCIP®/NBT-Blue Liquid Substrate System for Membranes (Sigma) с использованием фотометрического метода с определением оптической плотности при помощи микропланшетного фотометра (Multiskan FC, Thermo Scientific) при длине волны 450 нм. Дифференцировочный потенциал клеток рассчитывали по формуле:
коэффициент дифференцировки (%) = (А) тест/(Б) контроль x 100%, где (А) тест — культивирование свМСК в питательных средах с остеоиндуктивной добавкой,
(Б) контроль — стандартная питательная среда DMEM/F12, 10% сыворотки КРС.
В ходе оценки дифференцировочного потенциала свМСК в остеогенном направлении были установлены достоверные различия с увеличением оптической плотности у свМСК, культивированных в питательных средах с остеоиндуктивной добавкой по сравнению с клетками, культивированными в питательных средах без остеоиндуктивной добавки (при р≤0,05). Оптическая плотность была больше в группе при культивировании свМСК в разработанной бессывороточной среде - 0,43±0,04 у.е. и в группе положительного контроля 0,44±0,03 у.е., по сравнению с группой отрицательного контроля - 0,05±0,02 у.е., что свидетельствует о сохранении клетками дифференцировочного потенциала (фиг.3). Коэффициент дифференцировки свМСК культивированных в разработанной бессывороточной питательной среде составил 860%, у свМСК культивированных в питательной среде DMEM/F12, содержащей 10% сыворотки КРС (положительный контроль) равнялся 880%, что свидетельствует об эффективности разработанного состава бессывороточной питательной среды позволяющего сохранить дифференцировочный потенциал свМСК.
Таким образом, предлагаемый состав бессывороточной питательной среды обеспечивает культивирование свМСК в стандартных условиях (95% влажность, 37°С температура, 5% СО2) с сохранением пролиферативной активности и дифференцировочного потенциала.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ формирования трабекулярного костного органоида | 2023 |
|
RU2818357C1 |
| СПОСОБ ПОЛУЧЕНИЯ РЕГЕНЕРАТИВНОГО ВЕТЕРИНАРНОГО ПРЕПАРАТА НА ОСНОВЕ ЭКСТРАКТА МЕЗЕНХИМАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК И КОНДИЦИОННОЙ СРЕДЫ | 2016 |
|
RU2662172C2 |
| СРЕДА КУЛЬТИВИРОВАНИЯ МУЛЬТИПОТЕНТНЫХ СТРОМАЛЬНЫХ КЛЕТОК ИЗ ЖИРОВОЙ ТКАНИ ЧЕЛОВЕКА И СПОСОБ КУЛЬТИВИРОВАНИЯ ЭТИХ КЛЕТОК С ЕЕ ИСПОЛЬЗОВАНИЕМ | 2010 |
|
RU2418855C1 |
| ВЫДЕЛЕНИЕ СТВОЛОВЫХ КЛЕТОК/КЛЕТОК-ПРЕДШЕСТВЕННИКОВ ИЗ АМНИОТИЧЕСКОЙ МЕМБРАНЫ ПУПОВИНЫ | 2005 |
|
RU2416638C2 |
| ДИФФЕРЕНЦИРОВКА ЭМБРИОНАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК ЧЕЛОВЕКА | 2008 |
|
RU2465323C2 |
| ЭКВИВАЛЕНТ КОЖИ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2006 |
|
RU2342164C2 |
| Способ получения тканеинженерной надкостницы из клеточных сфероидов для восстановления костных дефектов субъекта | 2022 |
|
RU2819284C2 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ КЛЕТОК СЛЮННОЙ ЖЕЛЕЗЫ ЧЕЛОВЕКА | 2016 |
|
RU2631005C1 |
| КЛЕТОЧНЫЙ ПРОДУКТ ИНСУЛИН-ПРОДУЦИРУЮЩИХ КЛЕТОК МЛЕКОПИТАЮЩИХ И ЕГО ИСПОЛЬЗОВАНИЕ ДЛЯ ТЕРАПИИ САХАРНОГО ДИАБЕТА | 2017 |
|
RU2663118C1 |
| Способ получения тканеинженерной надкостницы из клеточных сфероидов для восстановления костных дефектов пациентов | 2023 |
|
RU2818176C1 |

Изобретение относится к области биотехнологии. Представлен состав бессывороточной питательной среды для культивирования мезенхимных стволовых клеток свиньи (свМСК), который включает базовую питательную среду DMEM/F12 (1:1). А также дополнительно содержит следующие компоненты (мг/л): аминокислоты: L-Aланин - 4,45, L-Аргинин - 73,75, L-Аспарагин - 7,50, L-Аспарагиновая кислота - 6,65, L-Цистин - 31,29, L-Глютаминовая кислота - 7,35, L-Глютамин - 182,5, L-Цистеин - 8,78, L Глицин - 9,38, L-Гистидин - 15,74, L-Изолейцин - 27,24, L-Лейцин - 29,53, L-Лизин HCl - 45,63, L-Метионин - 8,62, L-Фенилаланин - 17,74, L-Пролин - 8,63, L-Серин - 13,13, L-Треонин - 26,73, L-Триптофан - 4,51, L-Тирозин - 27,90, L-Валин - 26,43; транспортные белки: Свиной сывороточный альбумин - 1000-2000, Трансферин - 50-100, Фетуин - 500-1000; гормоны: Гидрокортизон - 0,1-0,5, Прогестерон - 0,1-0,5, Инсулин - 5-10. Изобретение позволяет получить новый состав бессывороточной питательной среды для культивирования мезенхимных стволовых клеток свиньи (свМСК) с сохранением пролиферативной активности и дифференцировочного потенциала. 3 ил., 3 пр.
Состав бессывороточной питательной среды для культивирования мезенхимных стволовых клеток свиньи (свМСК), включающий базовую питательную среду DMEM/F12 (1:1) и также дополнительно содержащий следующие компоненты (мг/л):
- аминокислоты: L-Aланин - 4,45, L-Аргинин - 73,75, L-Аспарагин - 7,50, L-Аспарагиновая кислота - 6,65, L-Цистин - 31,29, L-Глютаминовая кислота - 7,35, L-Глютамин - 182,5, L-Цистеин - 8,78, L Глицин - 9,38, L-Гистидин - 15,74, L-Изолейцин - 27,24, L-Лейцин - 29,53, L-Лизин HCl - 45,63, L-Метионин - 8,62, L-Фенилаланин - 17,74, L-Пролин - 8,63, L-Серин - 13,13, L-Треонин - 26,73, L-Триптофан - 4,51, L-Тирозин - 27,90, L-Валин - 26,43;
- транспортные белки: Cвиной сывороточный альбумин - 1000-2000, Трансферин - 50-100, Фетуин - 500-1000;
- гормоны: Гидрокортизон - 0,1-0,5, Прогестерон - 0,1-0,5, Инсулин - 5-10.
| CN 107574145 A, 12.01.2018 | |||
| ROBERTSON A., KARP W., BRODERSEN R | |||
| Comparison of the binding characteristics of serum albumins from various animal species // Dev Pharmacol Ther | |||
| Способ приготовления консистентных мазей | 1919 |
|
SU1990A1 |
| Прибор для нагревания перетягиваемых бандажей подвижного состава | 1917 |
|
SU15A1 |
| P | |||
| Светоэлектрический измеритель длин и площадей | 1919 |
|
SU106A1 |
| СПОСОБЫ И ПРЕПАРАТЫ ДЛЯ ТРАНСФЕКЦИИ КЛЕТОК | 2012 |
|
RU2624139C2 |
Авторы
Даты
2023-04-28—Публикация
2022-07-01—Подача