Изобретение относится к области генетической инженерии растений и может быть использовано для создания трансгенных растений с заданными свойствами.
Обзор
Основной ущерб сельскохозяйственным культурам причиняется вирусными, бактериальными и грибными патогенами, причем наносимый вред существенно превышает таковой от насекомых и других вредителей вместе взятых. В свою очередь, грибы-патогены по вредоносности занимают первое место среди прочих возбудителей заболеваний.
Например, эффективное возделывание земляники ограничивается несколькими болезнями: фитофторозное увядание (Phytophthora fragariae), вертициллярное увядание (Verticillium alboatrum), пятнистость листьев (Mycosphaerella fragariae), листовой ожог (Diplocarpon earliana), скручивание листовых пластинок (Dendrophoma obscurans), серая гниль (Botrytis cinerea), мучнистая роса (Sphaerotheca humuli) и др. Грибы возбудители заболеваний растений не только влияют на рост и развитие растительного организма, но зачастую значительно снижают продуктивность культурных насаждений.
В современном сельском хозяйстве эффективный контроль над грибными патогенами достигается комплексным подходом. С одной стороны, методами традиционной селекции выводятся новые сорта, обладающие повышенной устойчивостью к определенным расам грибов. Однако на получение одного сорта таким способом уходит в среднем около 10 лет. За это время патогены зачастую успевают мутировать и новый сорт теряет резистентность и быстро устаревает. Альтернативный подход - генетическая инженерия. Способ генетической трансформации растений позволяет переносить в них отдельные гены резистентности и получать растения с повышенной устойчивостью к широкому спектру фитопатогенов за короткое время.
Получение трансгенных растений с повышенной устойчивостью обычно сталкивается с проблемами воспроизводимости известных способов и с проблемами получения растений с низким уровнем сомаклональных отклонений.
Известны публикации, посвященные оптимизации способа генетической трансформации земляники садовой, разработанного James et al. (1990) и Nehra et al. (1990). В способе трансформации изменяли: 1) состав минеральной и/или гормональной среды для регенерации и селекции трансформантов, 2) тип и концентрацию селективного агента, 3) генотип сорта, 4) тип штамма и векторную конструкцию, 5) тип и концентрацию углеводов, 6) тип экспланта (листья, черешки, сегменты усов, меристема).
Du Plessis et al. (1997) изменили способ агробактериальной трансформации, заменив в среде селекции и регенерации трансформантов 6-бензиламинопурин на синтетический регулятор роста - тидиазурон. Он оказался более эффективным регулятором роста для земляники. Вместо агробактериального штамма LBA4404 авторы стали использовать C58/PGV2260. Разработанный способ обладает существенным недостатком - очень высокой частотой сомаклональных изменений среди трансформантов.
Dier et al. (2001) показали, что смена сахарозы на глюкозу, в средах мультипликации, кокультивации, селекции и регенерации трансформантов, значительно повышает частоту регенерации трансгенных побегов. Известно решение, в котором авторы делают попытки снизить частоту сомаклональных изменений путем замены сахарозы на мальтозу (Stuart et al. US Patent 4801545, 1989).
Mathews et al. (1998) показали, что концентрация и тип селективного агента в культуральной среде оказывают большое влияние на процесс регенерации трансгенных побегов. Также имеет значение и продолжительность культивирования на селективной среде. Изменение системы селекции позволило получать чистые, нехимерные линии, состоящие только из трансгенных клеток.
Dolgov et al. (1999), используя способ, описанный в работах James et al. (1990) и Nehra et al. (1990), разработанный для сорта Redcoat, получили трансгенное растение земляники садовой сорта Фейерверк. Эффективность метода трансформации для сорта Фейерверк оказалась менее 1%, в то время как для сорта Redcoat эффективность разработанного метода составляла 6,5%.
De Mesa et al. (2000) изменили способ генетической трансформации, скомбинировав способ, разработанный James et al. (1990) и Nehra et al. (1990), с баллистическим методом. Механические повреждения на листовых дисках они наносили микрочастицами.
В перечисленных способах подготовка эксплантов основана на единовременной процедуре подготовки всего числа эксплантов (James et al. 1990 и Nehra et al. 1990). Известен способ, при котором в качестве эксплантов используют целые листовые пластинки, на которые одновременно наносится максимальное количество механических повреждений (Trinh et al. 2001). Оба эти способа повышают частоту некроза.
Humara et al. (1999) показали, что нанесение микротравм ультразвуком на нежную ткань семядольных эксплантах сосны сопровождается более низкой частотой некроза. Способ применим только для эмбриональных тканей зародышей или любых других случаев, когда регенерация идет из эпителиальных клеток.
Известны публикации, в которых способ генетической трансформации оптимизируют для предотвращения некротических реакций при подготовке растительных эксплантов и инокуляции их в агробактериальной суспензии.
Peri et al. (1996) пытались снизить частоту некроза за счет использования антиоксидантов. Добавление в среду кокультивации одновременно таких компонентов, как DTT и PVPP позволило полностью ингибировать некроз и добиться получения фертильных трансгенных растений винограда. Однако способ воспроизводим только на растительном материале одного сорта Superior Seedless.
Olhoft et al. (2001) обнаружили, что соединения с тиоловыми группами, например L-цистеин, способны повышать частоту трансформации агробактериями клеток Glycine max. Эффект проявляется только на стадии кокультивации эксплантов с агробактериями. Авторы обнаружили также, что не только L-цистеин при добавлении в среду кокультивации может позитивно влиять на процесс трансформации. Аналогичную активность проявляли такие вещества, как глутатион, DTT, натрия тиосульфат, ионы меди и хелаты железа. Перечисленные вещества ингибируют активность растительных полифенолоксидаз и пероксидаз, подавляя тем самым развитие некротических реакций, вызванных поранением или патогенами.
Однако все перечисленные химические компоненты, добавляемые в питательную среду, не только влияют на процесс взаимодействия бактерий с растительными клетками, но и оказывают негативное влияние на саму растительную ткань эксплантов.
Известен комбинированный подход для устранения некроза (Hansen, US Pat 6162965). Согласно способу на этапе агробактериальной трансформации используют химические ингибиторы некроза или выбирают агробактериальный штамм, который не индуцирует выраженный некроз, или используют генетический подход, при котором вместе с интересующим геном в растительные клетки переносится ген специфического фактора ингибирования некроза. Такие факторы известны давно, но они обладают крайне узким видоспецифичным характером активности. Автор не приводит данных по влиянию снижения некроза на снижение общего уровня сомаклональных отклонений.
Известные модификации способов трансформации оказывали влияние чаще всего на частоту регенерации трансгенных побегов, либо на частоту формирования трансгенного каллуса. Ни один усовершенствованный способ не приводил к значительному снижению сомаклональных отклонений и морфологических изменений трансгенных растений с повышенной устойчивостью к грибам-фитопатогенам. Например, при экспрессии тауматина в трансгенных растениях огурца (Szwacka et al. 2002) повышение устойчивости к Pseudoperonospora cubensis обнаруживались только у части трансгенных линий, а уровень экспрессии рекомбинантного белка не коррелировал с уровнем устойчивости.
Известно большое число растительных белков, которые в той или иной степени токсичны для фитопатогенов и могут быть использованы при получении растений, устойчивых к грибам-патогенам. Сюда в первую очередь относится обширная группа PR-протеинов (pathogenesis-related proteins), включающая пять семейств (Linthorst 1991). Также к ним относятся антимикробные пептиды (тионины, дефензины и лектины) и рибосомо-инактивирующие протеины. Антигрибная активность лучше всего изучена у белков, относящихся к двум семействам PR-3 (глюканазы) и PR-4 (хитиназы). Оба типа белков относятся по механизму активности к гидролизующим ферментам, разрушающим структурные компоненты клеточной стенки грибов.
Семейство PR-5 или тауматин-подобные белки в этом плане изучены значительно слабее. Они могут проявлять антигрибную активность против широкого спектра грибов патогенов (Abad et al. 1996), например, таких как Alternaria solani, Aspergillus flavus, Aspergillus parasitica, Bipolaris maydis, Bipolaris zeicola, Phytophthora fragariae, Verticillium alboatrum, Mycosphaerella fragariae, Diplocarpon earliana, Dendrophoma obscurans, Botrytis cinerea, Sphaerotheca humuli, Fusarium graminiarum, Fusarium oxysporum, и др. Нет однозначных сообщений и об антибактериальной активности тауматин-подобных белков в трансгенных растениях. Известно, что, как и остальные группы PR белков они, по-видимому, выполняют в растительных клетках защитную функцию. Например, известно, что экспрессия PR-5 (TL) протеинов в растениях активируется атаками патогенов, механическими повреждениями, а также такими метаболитами, как салициловая кислота и АВА (Stintzi et al. 1993). Также известно, что такой тауматин-подобный белок из кукурузы, как зеаматин, проявляет антигрибную активность in vitro, но лишь в сочетании с антибиотиком никкомицин Z ингибирующим синтез хитина (Roberts et al. 1990). Таким образом, зеаматин выступает кофактором, усиливающим действие сублетальной концентрации антибиотика. В таких же условиях проявляет антигрибную активность и тауматин.
Известно, что перенос и экспрессия гена табачного осмотина в трансгенных растениях картофеля повышала их устойчивость к Phytophthora infestans, а в трансгенных растениях табака не влияла на защитные механизмы организма (Liu et al. 1994).
Из работы Datta et al. (1998) известно, что трансгенные растения риса с геном рисового тауматин-подобного белка tlp под контролем 35S промотора обладают повышенной устойчивостью к Rhizoctonia solani.
Dolgov et al. (1999) переносили ген тауматина в растения яблони, моркови, груши и земляники. Авторы подтвердили только интеграцию гена в геном растений, но экспрессия белка в трансгенных тканях не анализировалась.
Schestibratov et al. (2001), используя известный способ генетической трансформации (James et al. 1990 и Nehra et al. 1990), получили растения земляники садовой с геном тауматина. Только у нескольких трансгенных линий была подтверждена экспрессия рекомбинантного белка.
Ни один из известных способов не дает возможности получать трансгенные растения, например земляники садовой, с экспрессией тауматин-подобных белков и в частности тауматина, проявляющие повышенную устойчивость к фитопатогенам и с низким уровнем сомаклональных отклонений.
Известен US Patent 5856154 (Ryals et al. 1999) на способ защиты растений от патогенов, в основе которого лежит создание химерных генов, кодирующих белки группы PR-1, и применение химических агентов для создания условий развития системно индуцируемой резистентности (SAR). Авторы осуществляют выбор типа генетических конструкций с учетом использования фактов по системно индуцируемой резистентности растений, которая вырабатывается растениями в ответ на влияние внешних факторов.
Известен также способ создания трансгенных растений путем введения в растение двух генов, продуцирующих эффект SAR (Baker et al. US Patent Appl. 20020004944, 2002). Тем не менее, в данных работах нет данных, подтверждающих тот факт, что трансформируемые растения в итоге обладают не только устойчивостью, но и сохраняют все морфологические характеристики.
Раскрытие изобретения
Одним из объектов изобретения является усовершенствованный способ агробактериальной трансформации и регенерации трансгенных растений, который характеризуется низкой частотой некроза эксплантов, повышенной частотой транзиентной экспрессии, повышенной частотой регенерации трансгенных побегов, более высокой долей прямых трансформантов, за счет формирования в листовых дисках индуцируемой резистентности к абиотическим и биотическим стрессам, что в конечном итоге приводит к снижению частоты сомаклональных изменений в трансгенном растении.
В соответствии с усовершенствованным способом этапы подготовки, инокуляции и кокультивации эксплантов содержат следующие стадии:
i) стадию выбора одного или более листовых сегментов для подготовки эксплантов; ii) подготовку листовых дисков путем отделения от каждого листового диска сегмента и последующей инокуляции и кокультивации листовых дисков с агробактериями; iii) стадию удаления с листовых дисков избытка агробактерий, отделения со стороны первого среза первой партии эксплантов; iv) стадию переноса эксплантов на среду селекции и регенерации; v) подготовку последующих партий эксплантов в соответствии с пунктами ii) и iv) до формирования последней партии эксплантов из выбранных листовых дисков; причем подготовка каждой из последующих партий эксплантов выполняется после временного интервала, необходимого для трансформации растительных клеток и формирования в листовых дисках индуцируемой резистентности к абиотическим и биотическим стрессам.
К следующему объекту изобретения относится векторная конструкция, которая содержит генетический материал, кодирующий, по крайней мере, один белок, входящий в группу целевых белков и/или белков, ответственных за повышение устойчивости к фитопатогенам и/или снижение некроза.
К другому аспекту изобретения относится то, что генетический материал кодирует устойчивость трансгенного растения к грибам, выбираемым из группы: Phytophthora fragariae, Verticillium alboatrum, Mycosphaerella fragariae, Diplocarpon earliana, Dendrophoma obscurans, Botrytis cinerea, Sphaerotheca humuli.
Другим объектом изобретения является способ получения трансгенного растения, входящего в группу двудольных растений яблони, груши, земляники садовой, моркови и томатов.
К следующему объекту изобретения относится способ получения трансгенного растения земляники садовой, выбираемого из группы сортов: Selekta, Chambly, Oka, Joliette, Yamaska, L'Acadie, L'Authentique Orleans, Rosalyne, Roseberry, Saint-Pierre, Donna, Enzed Levin, Enzed Lincoln, Vilanova, Durval, Redcrest, Bountiful, Redgem, Pelican, Primtime, Mohawk, Latestar, Winoma, Фейерверк.
Краткое описание чертежей
Фиг.1А. Схема плазмиды pUR528.
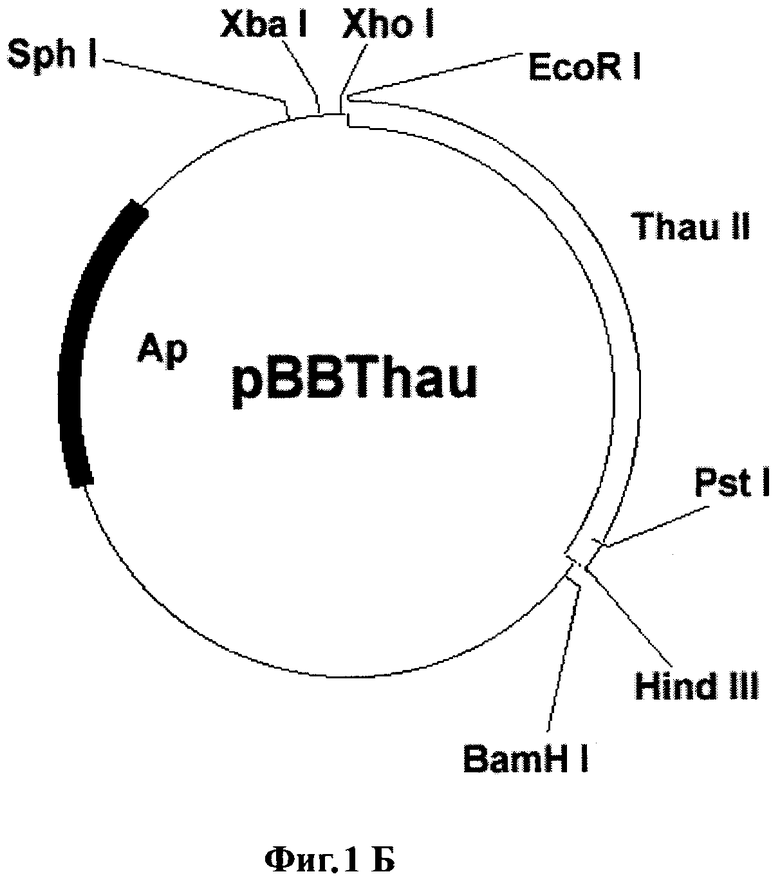
Фиг.1Б. Схема плазмиды pBBThau.
Фиг.1В. Рестрикционный фрагмент XbaI-BamHI из плазмиды pBBThau, несущий последовательность preprothaumatin II.
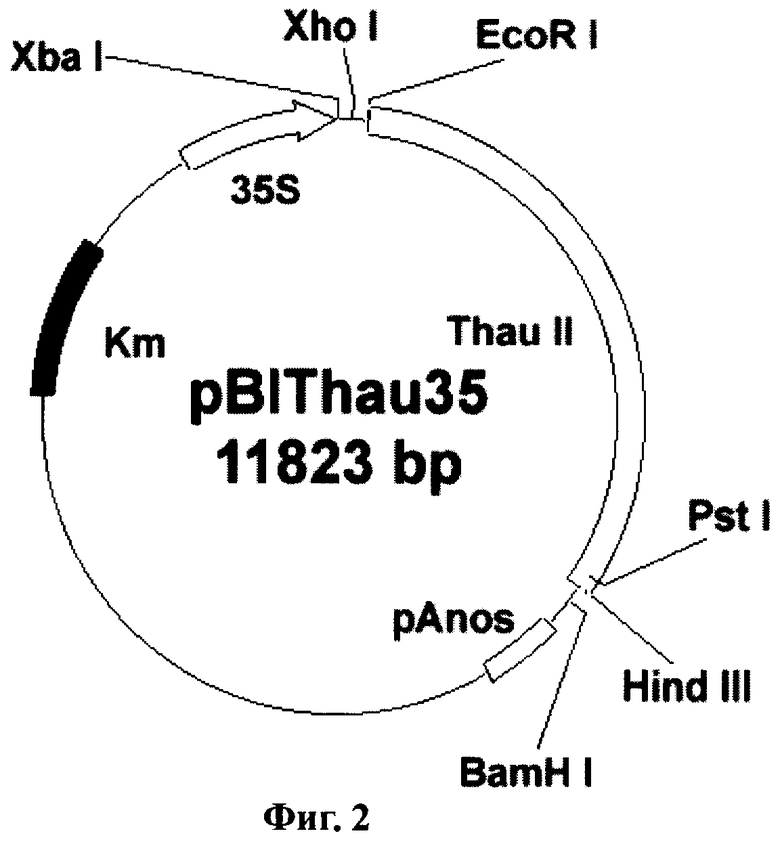
Фиг.2. Схема бинарного вектора pBIThau35. LB и RB - левый и правый краевые повторы Т-ДНК; pAnos - терминатор из гена нопалинсинтетазы; pNOS - промотор из гена нопалинсинтетазы; p35S - промотор 35S РНК вируса мозаики цветной капусты; nptII - ген растительного селективного маркера неомицинфосфотрансферазы; thaull - последовательность preprothaumatin II, кодирующая суперсладкий белок тауматин II.
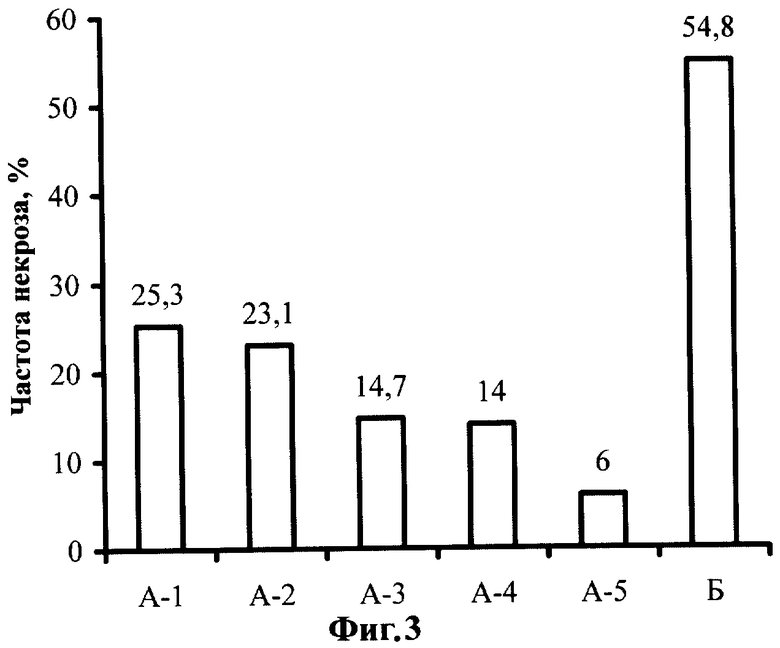
Фиг.3. Влияние постадийной кокультивации с Agrobacterium tumefaciens на частоту некроза в тканях эксплантов земляники садовой сорта Фейерверк.
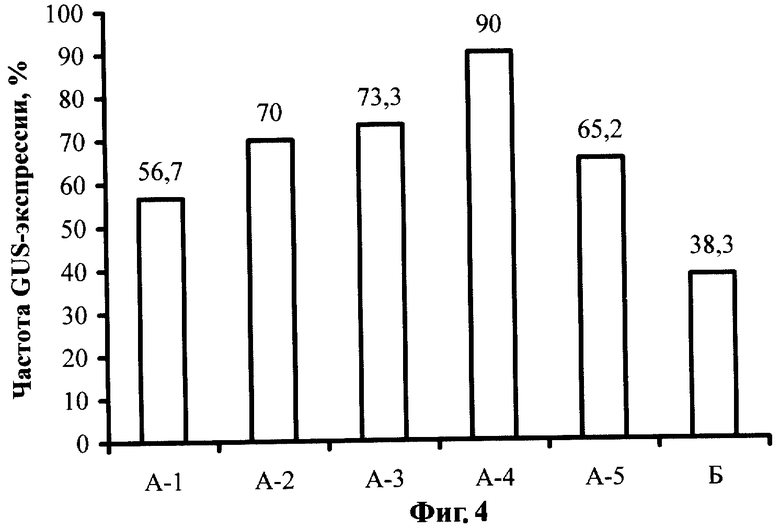
Фиг.4. Влияние постадийной кокультивации с A. tumefaciens на транзиентную GUS-экспрессию в тканях эксплантов земляники садовой сорта Фейерверк.
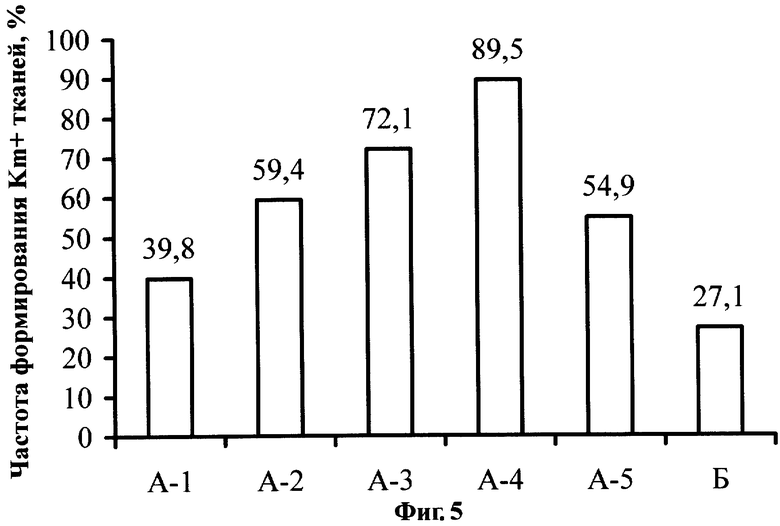
Фиг.5. Влияние постадийной кокультивации на частоту формирования тканей, устойчивых к канамицину (Km+), на исходных эксплантах земляники садовой сорта Фейерверк.
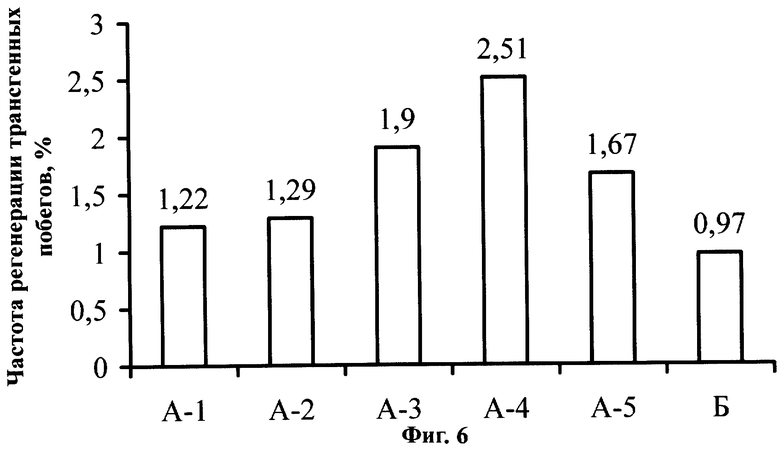
Фиг.6. Влияние постадийной кокультивации с Agrobacterium tumefaciens на частоту регенерации трансгенных побегов земляники садовой сорта Фейерверк.
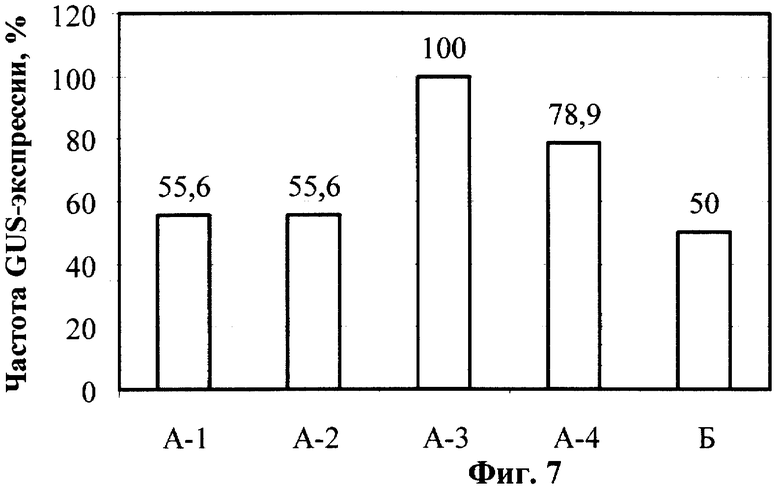
Фиг.7. Влияние постадийной кокультивации с Agrobacterium tumefaciens на транзиентную GUS-экспрессию в тканях эксплантов яблони.
Варианты осуществления изобретения.
В основе усовершенствованного способа получения трансгенных растений, на примерах земляники садовой и яблони, лежит применение естественных молекулярных механизмов, которые активируются в растениях в процессе развития локально индуцируемой резистентности к абиотическим и биотическим стрессам.
Способ получения трансгенных растений с улучшенными агрономическими характеристиками состоит из следующих этапов.
На первом этапе осуществляют выбор свойств трансгенного растения и создают векторные конструкции для переноса необходимого генетического материала в растительные клетки.
На втором этапе проводят выбор сорта (генотипа), осуществляют подготовку маточных растений для их последующей стерилизации и введения в культуру in vitro, проводят микроклональное размножение растительного материала и подготовку укорененных растений in vitro, которые послужат источником листовых эксплантов.
На третьем этапе осуществляют агробактериальную трансформацию с использованием сконструированных векторных плазмид. С этой целью проводят подготовку бактериальной суспензии, проводят сбор и подготовку листьев и осуществляют постадийную инокуляцию и кокультивацию эксплантов в соответствии с усовершенствованным способом.
На следующем этапе осуществляют селекцию трансгенной ткани, отбор трансформантов и элиминацию агробактерий и проводят микроклональное размножение отобранных трансформантов.
После получения трансгенных растений проводят молекулярно-генетический анализ трансгенных линий. С этой целью осуществляют выделение тотальной ДНК из тканей трансгенных линий, проводят ПЦР анализ интеграции гетерологичной ДНК и гистохимический анализ GUS-активности, а также проводят процедуру Westem-блоттинга для анализа экспрессии целевого гена в листьях и плодах трансгенных линий.
На заключительном этапе с целью селекции линий без сомаклональных отклонений проводят биологическое тестирование: анализ устойчивости к фитопатогенам; органолептический анализ плодов; оценку вегетативной и генеративной активностей трансгенных растений в полевых условиях.
В усовершенствованном способе трансформации стадия подготовки, инокуляции и кокультивации эксплантов с агробактериями выполняется постадийно следующим образом.
Экспланты из одних и тех же листьев нарезаются не единовременно, перед инокуляцией, а, по крайней мере, за более двух независимых подходов с периодичностью в 1 до 5 суток, более предпочтительно через 3 суток. Количество шагов выбирают в диапазоне от 2 до 5, более предпочтительно от 3 до 4.
Ширину экспланта выбирают в пределах от 0,5 до 10 мм. Предпочтительно ширину экспланта выбирают в пределах от 1 до 3 мм. Соотношение между длиной среза и площадью экспланта выбирают в диапазоне от 0,1 до 2 мм/мм2, более предпочтительное значение составляет 0,5 мм/мм2.
С целью повышения эффективности трансформации в состав среды селекции и регенерации входят регуляторы роста и/или селективные агенты. В качестве регуляторов роста используют цитокинины и/или ауксины. Например, в качестве цитокининов могут быть использованы синтетические производные фенилмочевины, а в качестве ауксинов - ИМК, ИУК, НУК, 2,4-Д и их конъюгаты с аминокислотами. Тем не менее, для повышения индуцируемой резистентности к абиотическим и биотическим стрессам регуляторы роста могут быть исключены из состава среды кокультивации. Селективный агент выбирают из группы, в которую входят: неомицин, канамицин, гигромицин, фосфинотрицин. Комбинация, соотношение и концентрация перечисленных компонентов подбираются в зависимости от генотипа.
Например, в случае трансформации земляники садовой концентрацию ТДЗ выбирают в диапазоне от 1 до 10 мг/л. Оптимальная концентрация ТДЗ составляет 5 мг/л. Концентрацию ИМК выбирают в диапазоне от 0 до 2 мг/л. Оптимальная концентрация ИМК составляет 0,3 мг/л. Концентрацию канамицина выбирают в диапазоне от 10 до 100 мг/л. Оптимальная концентрация канамицина составляет 50 мг/л.
Для получения трансгенного растения с заданными свойствами используют векторные конструкции, созданные известным способом (Maniatis Т. et al. 1982), содержащие в своем составе генетический материал, который выбирают из группы, состоящей из: а) генетического материала, кодирующего по крайней мере один целевой белок; б) генетического материала, кодирующего по крайней мере один белок, который содействует снижению некроза на стадии трансформации; в) генетического материала, кодирующего, по крайней мере, один белок, который повышает устойчивость растения к фитопатогенам и который выбирают из группы: PR-1, PR-2, PR-3, PR-4, PR-5; г) генетического материала, кодирующая последовательность которого может состоять из комбинации по крайней мере двух последовательностей, относящихся к подпунктам а) и б), или а) и в), или б) и в), или а), б), в).
Для получения растения с повышенной устойчивостью к патогенам в состав генетической конструкции входят гены, кодирующие устойчивость к грибам, которые выбирают из группы, состоящей из Phytophthora fragariae, Verticillium alboatrum, Mycosphaerella fragariae, Diplocarpon earliana, Dendrophoma obscurans, Botrytis cinerea, Sphaerotheca humuli.
Например, для получения трансгенного растения земляники садовой с повышенной устойчивостью к Botrytis cinerea используют векторную конструкцию pBIThau35, в состав которой входит ген thaumatin II (Schestibratov et al. 2002).
В результате генетической трансформации получают растения, которые содержат генетический материал, кодирующий, по крайней мере, один белок, входящий в группу целевых белков и/или белков, ответственных за повышение устойчивости к фитопатогенам и/или снижение некроза.
В качестве целевого продукта могут быть использованы белки, которые: а) повышают пищевую ценность, б) улучшают вкус, в) придают устойчивость к гербицидам, г) имеют фармацевтическое значение.
Усовершенствованный способ генетической трансформации может быть использован для растений, относящихся к группам однодольных и двудольных.
Для создания трансгенных растений с повышенной пищевой ценностью, улучшенным вкусом и повышенной устойчивостью к фитопатогенам могут быть выбраны двудольные растения.
Например, для трансформации используют растения, выбираемые из группы: яблони, груши, земляники садовой, моркови и томатов.
Могут быть получены трансгенные растения земляники садовой, выбираемые из группы сортов: Selekta, Chambly, Oka, Joliette, Yamaska, L'Acadie, L'Authentique Orleans, Rosalyne, Roseberry, Saint-Pierre, Donna, Enzed Levin, Enzed Lincoln, Vilanova, Durval, Redcrest, Bountiful, Redgem, Pelican, Primtime, Mohawk, Latestar, Winoma, Фейерверк.
Примеры в детальном описании приводятся для земляники садовой сортов Фейерверк и Selekta и яблони сорта Мельба.
Для практического применения могут быть использованы компоненты трансгенного растения: трансгенные клетки, органы (листья, стебли, корни, цветки), целые растения, семена и плоды.
Внесенные изменения в способ агробактериального переноса позволяют получить следующие улучшения в параметрах как самого способа, так и в характеристиках трансгенных растений. Способ позволяет: снизить частоту развития некротических реакций на трансформируемых эксплантах (Фиг.3); повысить частоту транзиентной экспрессии интродуцируемых генов (Фиг.4); повысить частоту формирования новых трансгенных тканей на исходных эксплантах (Фиг.5); повысить соотношения прямых регенерантов по отношению к числу регенерантов, полученных через каллусную стадию (Таблица 6); повысить частоту регенерации трансгеных побегов (Фиг.6); наконец, среди трансгенных линий увеличить долю растений без сомаклональных изменений (Таблица 11).
Экспериментальные протоколы
Данные экспериментальные протоколы относятся к способам, условиям и компонентам сред для процедуры получения трансгенных растений с повышенной устойчивостью к фитопатогенам и улучшенными вкусовыми свойствами на примере земляники садовой. Данные протоколы включают, но не ограничивают изменения параметров концентраций, временных условий и других изменений, которые очевидны из общего уровня техники и входят в область защиты данного изобретения.
А. Материалы и способы используемые при получении трансгенного растения
Конструирование векторной плазмиды для переноса в растительные клетки последовательности preprothaumatin II, кодирующей белок тауматин II.
Ген тауматин II кодирует суперсладкий белок, который в природе встречается в плодах Thaumatococcus danielli, из которых он и был выделен, охарактеризован. Последовательность представляет собой preprothaumatin II - предшественник зрелого тауматина, в состав которого входит нативный сигнальный пептид. Клонирование кДНК тауматина описано в статье (Edens et al. 1982). Применение для экспрессии в клетках E.coli показано Verrips et al. (US Patent 4891316).
Векторная плазмида для переноса в растительные клетки последовательности preprothaumatin II, кодирующей белок тауматин II, конструировалась с использованием хорошо известных методов молекулярного клонирования (Sambrook et aL, 1989).
Для переноса данного гена в растительные клетки за основу была взята плазмида рВI121 (фирма Clontech). Последовательность гена gus в ней заменялась фрагментом preprothaumatin II из плазмиды pUR528 (Unilever Research Laboratorium, The Netherlands; Edens et al. 1982); (Фиг.1А). Фрагмент preprothaumatin II из плазмиды pUR528 вырезался по сайтам EcoRI и HindIII. Промежуточный вектор рВВ (селективный маркер Ар), несущий в своем составе полилинкер SphI-XbaI-XhoI-EcoRI-SmaI-AvaI-BamHI-Xbal-SauI-PstI-HindIII-BamHI-BstXI-Ncil, инкубировался с рестриктазами EcoRI и HindIII. Фрагмент: preprothaumatin II с липкими концами по сайтам EcoRI и HindIII дотировался в линеаризованный вектор рВВ по тем же сайтам. Полученную плазмиду pBBThau (Фиг.1Б) инкубировали с рестриктазами Xbal и BamHI, для того чтобы снова вырезать фрагмент preprothaumatin II, только уже с новыми липкими концами (Фиг.1В). Бинарный вектор рВН21 сначала инкубировали с рестриктазами Smal и SacI, затем лигировали по тупым концам линеаризованную форму плазмиды, затем препарат инкубировали с рестриктазами Xbal и BamHI. В линеаризованный вектор рВI121 лигировали фрагмент XbaI-BamHI последовательности preprothaumatin II, предварительно вырезанный из вектора pBBThau. Схема вектора pBIThau35 представлена на Фиг.2.
Среды культивирования земляники садовой in vitro и проведения генетической трансформации.
Среды мультипликации (М), элонгации и укоренения (ER), кокультивации (СС) и регенерации трансформантов (RT) готовят в соответствии с данными, приведенными в таблице 1. рН во всех средах доводится до 5,7.
Среды культивирования земляники садовой in vitro и проведения генетической трансформации.
Выбор сорта и подготовка маточных растений.
В экспериментах по генетической трансформации земляники использовался материал in vitro растений: а) сорта Фейерверк (Зубов А.А., ВНИИ генетики и селекции плодовых растений им. И.В. Мичурина, г. Мичуринск) и б) сорта Selekta (Evans E., Южная Африка, 1973 г., PI 551873).
Введение земляники садовой в культуру in vitro проводили путем стерилизации молодых верхушечных почек с усов растений открытого грунта. Для этого концевые почки срезали с небольшим фрагментом побега не более 5-10 мм, затем очищали от поверхностных листочков, замачивали в водном растворе Tween 20 на 1 час, после чего промывали под проточной водой в течение 2 часов. Отмытые экспланты для стерилизации выдерживали 1-5 мин, в зависимости от их размера и возраста, в 2%-ном растворе гипохлорита натрия. После чего их промывали трижды в 100 мл стерильной дистиллированной воды.
Поверхностно стерилизованные побеги рассаживали раздельно в пробирки с 10 мл среды для мультипликации (среда М, см. Таблицу 1). Основные компоненты данной среды соответствуют усовершенствованной по Boxus (1974) среде MS (Murashige et al. 1962), только с двумя изменениями: во-первых, глюкоза в концентрации 22 г/л заменена 30 г/л сахарозы; во-вторых, для стимуляции мультипликации среда дополнена 5 мМ нитрата аммония. После месяца в культуре незараженные экспланты с вновь сформировавшимися побегами целиком пересаживали на среду элонгации и укоренения (среда ER, см. Таблицу 1), которая отличается от среды М отсутствием регуляторов роста, добавочного нитрата аммония и сниженной концентрацией сахарозы (2%). В среднем через 4-6 недель подросшие побеги отделяют друг от друга и рассаживают на свежую среду того же состава для стимуляции укоренения. Укорененные растения использовали в качестве источника листовых дисков в последующих экспериментах по регенерации и трансформации. Такие растения культивируют на среде ER в течение 7-8 месяцев с ежемесячной пересадкой на свежую среду. Для выращивания стерильного материала земляники использовали специальные культуральные банки производства HortiMic (Финляндия) емкостью 250 мл, закрывающиеся пластиковой закручивающейся крышкой.
Подготовка бактериальной суспензии.
Для генетической трансформации бинарными векторами рВI121 и pBIThau35 использовали супервирулентный штамм Agrobacterium thumefaciens СВЕ21 (Ревенкова и др. 1994), сконструированный на основе дикого штамма A. thumefaciens с Ti-плазмидой pTiBo542.
Бактериальные суспензии штаммов СВЕ21/pBIThau35 и СВЕ21/рВI121 для инокуляции эксплантов наращивали в течение ночи в 50 мл среды LB (Таблица 2) при 28°С. Перед инокуляцией суспензию клеток центрифугировали при 5 т.о. в течение 5 минут. Осадок промывали дважды 50 мл жидкой среды MS для удаления остатков среды LB. Промытый осадок клеток ресуспендировали в жидкой среде MS, затем плотность суспензии доводили до ОП600 равной 1.
Среда LB для культивирования агробактерий.
Сбор и подготовка листьев.
С маточных растений, приготовленных описанным выше способом, непосредственно перед постановкой генетической трансформации срезали молодые трехлистники, полностью развернувшиеся. Размер отдельного листового диска в каждом трехлистнике варьировал в пределах 10-15 мм (по направлению центральной жилки). Чтобы уменьшить усыхание листьев в процессе последующих операций, их содержат в закрытых чашках Петри с небольшим количеством (20 мл) жидкой среды MS. Листья с растений срезают не чаще двух раз в месяц. Маточные растения до и после сбора листьев культивируют в одинаковых условиях, при 16-часовом световом дне.
Подготовка, инокуляция и кокультивация эксплантов.
Срезанные трехлистники разделяют на отдельные листовые диски, которые в свою очередь разрезают скальпелем на экспланты различными способами.
Усовершенствованный способ подготовки, инокуляции и кокультивации эксплантов.
В предлагаемом способе листовые диски разрезают скальпелем на чашке Петри в присутствии небольшого количества жидкой среды MS. От каждого листового диска размером 10-15 мм по (направлению центральной жилки) отрезают узкую полоску шириной не более 2 мм и затем выбрасывают. Оставшуюся большую часть листового диска (эксплант А-5) используют в дальнейшем для инокулирования.
На первом шаге экспланты А-5 непосредственно после срезки края переносят аккуратно пинцетом в бактериальную суспензию и замачивают 30 мин. Затем экспланты А-5 переносят в чистые чашки Петри с бумажными фильтрами и подсушивают в течение 5 минут для удаления избытка бактерий, после чего раскладывают в чашки Петри со средой СС, поверхность которой покрыта бумажным фильтром. Чашки заматывают парафильмом и инкубируют в термостате в темноте при температуре 25-28°С в течение 3 суток.
Затем экспланты А-5 переносят в стакан с жидкой средой MS, в течение 3-5 минут интенсивно перемешивают для удаления избытка бактерий. Отмытые экспланты переносят в чашки Петри с небольшим количеством жидкой среды MS. Co стороны первого среза от каждого из эксплантов А-5 скальпелем отрезают полоску шириной около 2 мм, формируя экспланты первой стадии. Экспланты А-1 собирают в стакан с жидкой средой MS с добавлением 500 мг/л цефотаксима и интенсивно перемешивают для удаления остатков агробактерий. После этого экспланты А-1 раскладывают в чашки Петри на поверхность среды RT тыльной стороной к среде. Чашки заматывают парафильмом и инкубируют в термостате в темноте при температуре 23-25°С. Экспланты А-5 снова возвращают на ту же среду СС, где предварительно меняют бумажный фильтр. Чашки заматывают парафильмом и инкубируют в термостате в темноте при температуре 25-28°С в течение следующих 3-х суток.
На втором шаге экспланты А-5 переносят в стакан с жидкой средой MS, в течение 3-5 минут интенсивно перемешивают для удаления избытка бактерий. Отмытые экспланты переносят в чашки Петри с небольшим количеством жидкой среды MS. Co стороны первого среза от эксплантов А-5 скальпелем отрезают следующую полоску шириной от 1 до 2 мм, формируя экспланты второй стадии. Экспланты А-2 собирают в стакан с жидкой средой MS с добавлением 500 мг/л цефотаксима и интенсивно перемешивают для удаления остатков агробактерий. После этого экспланты А-2 раскладывают в чашки Петри на поверхность среды RT тыльной стороной к среде. Чашки заматывают парафильмом и инкубируют в термостате в темноте при температуре 23-25°С. Экспланты А-5 снова возвращают на ту же среду СС, где предварительно меняют бумажный фильтр. Чашки заматывают парафильмом и инкубируют в термостате в темноте при температуре 25-28°С в течение следующих 3-х суток.
На третьем и четвертом шагах из эксплантов А-5 формируют экспланты третьей А-3 и четвертой А-4 стадий в соответствии с процедурой, описанной для второго шага.
На пятом шаге производят обработку последнего экспланта А-5, который переносят в стакан с жидкой средой MS, в течение 3-5 минут интенсивно перемешивают для удаления избытка бактерий, после этого промывают жидкой средой MS с добавлением 500 мг/л цефотаксима для удаления остатков агробактерий. После этого экспланты А-5 раскладывают в чашки Петри на поверхность среды RT тыльной стороной к среде. Чашки заматывают парафильмом и инкубируются в термостате в темноте при температуре 23-25°С.
В качестве контрольного варианта используют известный способ подготовки, инокуляции и кокультивации эксплантов (James et al. 1990 и Nehra et al. 1990).
Селекция трансгенной ткани, отбор трансформантов и элиминация агробактерий.
Экспланты после инокуляции и кокультивации с агробактериями раскладывают в чашки Петри на поверхность среды RT, дополненную 600 мг/л гидролизата казеина, 500 мг/л цефотоксима и 50 мг/л канамицина. Чашки заматывают парафильмом и инкубируют в термостате в темноте при температуре 23-25°С. Цефотоксим используют для элиминации остатков агробактерий на эксплантах. Его концентрацию изменяют в течение пассажей: с каждым месячным пассажем уровень снижают на 100 мг/л от исходных 500 мг/л до конечных 0 мг/л. Канамицин выступает в роли селективного агента, поскольку в векторных конструкциях в качестве селективного маркера используется ген неомицинфосфотрансферазы nptII. Рабочая концентрация канамицина, достаточная для подавления роста нетрансгенной ткани земляники садовой, составляет 50 мг/л. Однако для стимуляции регенерации адвентивных побегов концентрацию канамицина в среде снижют вдвое после отделения каллусных кусочков от исходной ткани эксплантов и переноса их на свежую среду. Отделение трансгенного каллуса от отмирающей ткани эксплантов является ключевым моментом процесса селекции и регенерации трансформантов. Эффективность трансформации без этой процедуры существенно снижается.
Регенерация трансформантов земляники может протекать двумя способами: непосредственно из клеток эксплантов и/или через промежуточную каллусную стадию. В первом случае трансформанты появляются с первого по второй месяц селекции. Регенерация через каллусную стадию значительно растянута во времени, трансформанты могут появляться с третьего по шестой месяц культивирования на селективной среде.
Мультипликация трансформантов.
Регенерировавшие побеги отделяют от исходной ткани эксплантов и переносят для мультипликации на среду М (Таблица 1), дополненную 0,1 мг/л ТДЗ и 25 мг/л канамицина. После месячного пассажа размножившиеся побеги целыми кластерами переносят на среду ER для стимуляции элонгации побегов. После 4-5 недель подросшие побеги отделяют друг от друга и рассаживают раздельно на свежей среде того же состава для стимуляции укоренения. Укоренение протекает в течение 4-6 недель. Укорененные растения используются в дальнейшем для адаптации к условиям теплицы и последующего молекулярно-генетического анализа и биологического тестирования.
Б. Материалы и способы, используемые для анализа свойств трансгенного растения
Выделение тотальной растительной ДНК земляники садовой.
Для экстракции геномной ДНК использовался растительный материал как in vitro, так и in vivo. Из условий in vitro для растирания в жидком азоте брались целые побеги, культивируемые на среде для мультипликации. С тепличных растений срезались молодые, еще не развернувшиеся листочки. В обоих случаях на чистоту препаратов сильное влияние оказывали возраст и физиологическое состояние растительной ткани. Для стерильного материала оптимальный возраст побегов составлял 3-4 недели, а для тепличного возраст листочков не более 5-6 дней. Выделение проводилось по модифицированному нами протоколу. За основу бралась методика Rogers et al. (1994) с применением 2х СТАВ-буфера.
В отличие от протокола Rogers et al. (1994) гомогенизированная ткань ресуспендируется в 1 мл промывочного буфера: 100 мМ ацетата калия, рН 4.5, 20 мМ ЭДТА, 1% PVP, 1% 2-МЭ. Полученная суспензия центрифугируется 5 мин при 4,5 т.о. Надосадочная жидкость удаляется. Осадок снова ресуспендируется в 600 мкл экстракционного СТАВ-буфера следующего состава: 100 мМ трис-HCl, рН 8, 2.5 М NaCl, 20 мМ ЭДТА, 2% СТАВ, 40 мМ 2-МЭ.
ПЦР-анализ трансгенных линий.
Линии, полученные с помощью любой из использованных векторных конструкций, анализируют двумя парами праймеров: на вставку селективного маркера (nptll) и на вставку смыслового (thaull) или репортерного генов (uidA).
ПЦР-анализ интеграции различных гетерологичных последовательностей в геном земляники садовой проводят в реакционной смеси, которая содержит: 67 мМ Tris-HCl, pH 9.0, 16 мМ (NH4)2SO4, 2 мМ MgCl2, 0,01% желатина, по 200μМ каждого dNTP. Концентрации праймеров и полимеразы, а также температурный режим подбирают для каждого конкретного случая.
Для амплификации фрагмента гена nptII в реакционную смесь вносят праймеры до 0,6 μM конечной концентрации и 0,05 U/μl Taq полимеразы. Режим амплификации: 5 мин денатурации при 94°С (горячий старт), 30 с денатурации при 93°С, отжиг - 45 с 62°С, элонгация 45 с 72°С, циклов амплификации 30. Ожидаемый размер амплифицируемого фрагмента 742 п.н.
Вставка thauII определялась при условиях, по большей части схожих с таковыми для nptII, только концентрация праймеров составляла 0,9 μM каждого, 0,1 U/μl полимеразы, а температурный режим изменен следующим образом: горячий старт 2 мин 94°С, денатурация 30 с 93°С, отжиг 40 с 63°С, элонгация 35 с 72°С, 35 циклов амплификации. Ожидаемый размер амплифицируемого фрагмента 878 нуклеотидов (Schestibratov et al 2002).
Гистохимический анализ GUS-активности.
Гистохимическое определение активности GUS проводили по способу Jefferson (1987). Гистохимическое определение GUS активности проводили с использованием 5-бром-4-хлор-3-индолилглюкуронида (X-GLUC, Duchefa). Для этого растительную ткань помещали в буфер 50 mM NaPO4, pH 7.0, 10 mM Na2EDTA, 0.1% тритон Х-100, содержащий 1 мг/л X-GLUC, инкубировали в течение 6 часов при 37°С. После чего несколько раз промывали 50% этанолом и хранили окрашенные ткани при 4°С в 70% этаноле.
Органолептический анализ плодов земляники садовой.
Плоды для проведения органолептичекого анализа собирали с трансгенных растений, культивируемых в полевых условиях на сертифицированном полигоне испытания трансгенных культур на территории карантинного питомника ВНИИСПК (г. Орел). Дегустировались плоды первого сбора урожаев первого и второго годов культивирования. Плоды 12 независимых трансгенных линий и контрольных растений оценивали по их вкусовым качествам, в первую очередь сладость. Сладость мякоти оценивали по пятибалльной системе, исходя из сортовой характеристики Фейерверка, согласно которой вкус среднеспелых плодов первого сбора не превышает оценки 3,8-4,0.
В связи со специфическими свойствами тауматина, формирующего длительное послевкусие, органолептический анализ проводили попарно. Для этого брались плоды двух различных растений и составлялись пары: а) линия с экспрессией тауматина - линия без экспрессии тауматина; б) линия с экспрессией тауматина - нетрансгенное растение.
Комбинации составлялись произвольно, с учетом только данных о присутствии или отсутствии белка. Между каждым образцом дегустаторы полоскали ротовую полость дистиллированной водой. Чтобы исключить или, по крайней мере, снизить влияние различий в спелости на корректность анализа, для дегустации выбирали плоды одного размера и окраски. Вес плодов колебался от 10 до 15 грамм. Одному дегустатору для сравнения на каждую линию предоставлялось по четыре дольки, каждая от разных плодов. Дегустаторы выставляли независимые оценки, средняя арифметическая из которых являлась оценкой вкуса для данного образца.
Анализ влияния экспрессии тауматина II на антигрибную устойчивость земляники садовой к Botrytis cinerea.
Культуру фитопатогена Botrytis cinerea выделяют из зараженных плодов земляники садовой сорта Фейерверк. Повторная реинокуляция незараженных плодов и листьев земляники подтвердила вирулентность выделенного и очищенного патогена. Культуру патогена в условиях in vitro поддерживали на картофельной среде PDA, в темноте при 28°С. Для приготовления этой среды использовали отвар очищенного картофеля в водопроводной воде (200 г картофеля на 1 литр воды, варить 30 мин после закипания). К отвару добавляли 10 г/л глюкозы и 20 г/л бактериологического агара. Среду автоклавировали при давлении в 1 а. при 120°С в течение 20 мин. После автоклавирования к среде добавляли гидролизат казеина до конечной концентрации 300 мг/л.
Для приготовления суспензии спор использовали культуру гриба в возрасте 7-8 дней. После пассажа на свежую среду из спор в течение недели развивается новый мицелий и на 7-8 день начинается спороношение. Споры собирали стерильным шпателем, который каждый раз предварительно ополоскивают в растворе в 25 мМ ацетата натрия (рН 5,2) с 0,5% глюкозы и детергента (2 капли Triton X100 на 20 мл). Плотность суспензии для всех биотестов доводилась до 2-3×106 спор/мл. Подсчет плотности проводили в камере Горяева.
Трансгенные растения, полученные с помощью векторной конструкции pBIThau35, анализировались на устойчивость к фитопатогену Botrytis cinerea no способу (Peng et al. 1991) с дополнительными усовершенствованиями, которые описаны ниже. Материал для тестирования брали с тепличных растений возрастом не более 4-6 месяцев. Перед инокуляцией листья слегка подвяливались при комнатной температуре. Инокуляцию проводили путем смачивания листьев суспензией спор в течение 1-2 мин. Инокулированные листья раскладывали в чашки Петри на влажные фильтры и инкубировали в течение суток в темноте при 28°С. Затем листья стерилизовали в 0,5% растворе гипохлорита натрия в течение 2 мин. Стерилизующий агент отмывали трижды 100 мл стерильной дистиллированной воды. С листьев нарезали листовые диски пробковым сверлом диаметром 7 мм. С каждого трехлистника по 10 дисков. В отличие от известного способа диски раскладывались на увлажненные фильтры, а не на агаризованную среду с добавками параквата и хлорамфеникола.
Опытный и контрольный материал сравнивался попарно в пределах одной чашки Петри, чтобы избежать влияния флуктуации влажности фильтров и воздуха внутри камеры. Уже нарезанные и разложенные листовые диски инкубировали при тех же условиях, что и целые листья. На десятый день проводили оценку развития инфекции на основе трех критериев: 1) степени развития поверхностного мицелия; 2) площади некротического поражения листовых дисков; 3) степени спороношения. Первый и третий критерии оценивались в баллах от 0 до 5. Степень некроза оценивали в процентах площади пораженной части диска.
Полевые испытания трансгенных растений земляники садовой с геном суперсладкого белка тауматин II.
Большая часть трансгенных растений, полученных с помощью вектора pBIThau35, была передана в карантинный питомник ВНИИСПК (г. Орел) для высадки в открытый грунт и проведения полевых испытаний. При посадке трансгенных линий и контрольных растений проводили рандомизацию.
Растения, предназначенные для посадки, (5-10 для отдельной линии) распределяли на три группы, каждую из которых высаживали в разных местах сертифицированного участка.
От каждого маточного растения укореняли по четыре новых розетки от сформировавшихся усов. Остальные усы регулярно удаляли, чтобы не загущалась посадка. Перед началом цветения участок накрывался защитным материалом для предотвращения распространения пыльцы трансгенных растений. Над каждым из трех рядов сооружали отдельное покрытие высотой около 60 см. После сбора первого урожая плодов проводили оценку вегетативной и репродуктивной активностей высаженных растений. У каждого маточного растения подсчитывали количество розеток в кусте, число цветоносов, а также среднюю высоту куста. Через месяц после сбора второго урожая плоды первого и второго сборов использовали для анализа экспрессии тауматина способом Westem-блоттинга, а также для органолептической оценки влияния гетерологичного белка на вкус плодов.
Примеры
Пример 1. Влияние постадийной кокультивации с Agrobacterium tumefaciens на частоту некроза в тканях эксплантов земляники садовой сорта Фейерверк.
Частота некроза эксплантов оценивалась визуально после 15 дней культивирования на селективной среде. Сравнивали растительный материал, трансформируемый по стандартному и усовершенствованному способам. Из полученных данных можно сделать вывод, что усовершенствование стадий инокуляции и кокультивации положительно сказывается на выживании эксплантов и предотвращении развития некротических реакций в местах поранений. Данные по средней частоте некроза эксплантов, трансформируемых по усовершенствованному (А)-16,6% и известному (Б) - 54,8% способам, показывают, что некроз тканей снижен почти в 3,5 раза. Данные представлены на Фиг.3.
Пример 2. Влияние постадийной кокультивации с Agrobacterium tumefaciens на транзиентную GUS-экспрессию в тканях эксплантов земляники садовой сорта Фейерверк.
При генетической трансформации с использованием Agrobacterium tumefaciens Т-ДНК с необходимыми гетерологичными последовательностями переносится в растительные клетки преимущественно в участках поранения, где обеспечивается прямой контакт бактерий с поврежденными клетками. Для оценки эффективности предлагаемого способа проводился гистохимический анализ GUS-активности в тканях эксплантов по окончанию периода кокультивации. Такой анализ позволяет оценить частоту переноса и экспрессии рекомбинантных генов в составе Т-ДНК из бактерий в растительные клетки. Растительный материал для анализа отбирают по истечении 3-суточного периода кокультивациию, сразу же после отмывки эксплантов от бактерий. Гистохимическое окрашивание эксплантов проводят в течение 7 часов при 37°С в растворе X-Gluc для гистохимического анализа GUS-активности. Результаты анализа приведены на Фиг.4.
Пример 3. Влияние постадийной кокультивации с Asrobacterium tumefaciens на частоту формирования устойчивых к канамицину тканей (Km+) на исходных эксплантах земляники садовой сорта Фейерверк.
При последующем культивировании (после их постадийной кокультивации с агробактериями) на среде RT, дополненной цефотаксимом 500 мг/л и канамицином 50 мг/л, в течение первых двух месячных пассажей на эксплантах происходит формирование прямых трансформантов и неорганизованных каллусных групп. Km+ ткани (регенеранты и каллусные группы) формируется преимущественно по участкам поранения.
К концу второго пассажа проводился подсчет доли эксплантов, на которых формировалась трансгенная ткань. От стадии А-1 до А-4 наблюдается стабильное возрастание частоты формирования Km+ тканей. По-видимому, это связано, во-первых, с уменьшением интенсивности некротических реакций в ответ на поранение и последующую кокультивацию с агробактериями, во-вторых, с возможным повышением морфогенного потенциала. На стадии А-4 зафиксирована максимальная доля эксплантов, сформировавших трансгенные ткани (89,5%, см. Фиг.5). Снижение доли эксплантов, сформировавших трансгенные ткани в группе А-5 (54,9%), объясняется тем, что на пятой стадии уже снижается количество растительных клеток, компетентных для генетической трансформации. В контрольной группе Б трансгенная ткань формировались на 27,1% эксплантов, что хорошо коррелирует с высокой частотой некроза (54,8%, см. Пример 1).
Пример 4. Влияние постадийной кокультивации с Agrobacterium tumefaciens на частоту регенерации трансгенных побегов земляники садовой сорта Фейерверк.
Частота регенерации трансгенных побегов является одним из основных показателей эффективности способа генетической трансформации. Она складывается из эффективностей отдельных этапов, начиная с подготовки эксплантов и заканчивая составом среды селекции и регенерации трансформантов, и отражает число стабильных независимых трансформантов при пересчете на исходное число инокулированных эксплантов.
Общее число трансформантов подсчитывалось после четырехмесячных пассажей на среде RT и одного пассажа на среде М, дополненной цефотаксимом и канамицином. Данные приводятся на Фиг.6. Из диаграммы видно, что от группы А-1 до А-4 эффективность трансформации плавно возрастает, а затем при переходе к А-5 незначительно уменьшается. Последнее, скорее всего, связано со снижением частоты транзиентной GUS-экспрессии в этой группе, что в свою очередь снижает частоту формирования трансгенных тканей. Другая возможная причина - снижение морфогенного потенциала при длительном культивировании на безгормональной среде СС. Однако показатель в любом случае выше, чем в контрольной группе Б. Средний показатель для групп А-1 - А-5 составляет 1,72%, что почти в два раза выше контрольного варианта. Таким образом, постадийная кокультивация эксплантов повышает частоту регенерации трансгенных побегов.
Пример 5. Влияние постадийной кокультивации с Agrobacterium tumefaciens на соотношение прямых трансформантов и трансформантов, полученных через каллусную стадию.
Известно, что соотношение прямых трансформантов и трансформантов, полученных через каллусную стадию, зависит главным образом от генотипических особенностей растения (Marcotrigiano et al. 1987; Sutter et al. 1997; Morozova, 2002). Разработанный метод генетической трансформации земляники садовой с модифицированным протоколом подготовки, инокуляции и кокультивации эксплантов характеризуется более высокой долей прямых трансформантов (Таблица 3).
Влияние постадийной кокультивации с Agrobacterium tumefaciens на соотношение прямых трансформантов и трансформантов, полученных через каллусную стадию.
Пример 6. Данные ПЦР анализа трансгенных растений земляники садовой сорта Фейерверк, полученных с помощью бинарного вектора pBIThau35.
Schestibratov et al. (2002), используя усовершенствованный способ генетической трансформации, получили трансгенные растения земляники садовой с геном тауматина. С целью изучения встраивания Т-ДНК в геном канамицин-резистентных линий, полученных в результате генетических трансформаций посредством бинарного вектора pBIThau35, проводился ПЦР-анализ образцов тотальной ДНК. Поскольку данный вектор обеспечивает перенос в ядерный геном двух генов nptII и thauII, интродукция Т-ДНК анализировалась отдельно по каждой последовательности.
Все 23 независимые трансгенные линии получены при поэтапной селекции на канамицине концентрацией 50 и 25 мг/л соответственно в первом и последующих пассажах. В последующем полученные регенеранты укоренялись на среде с 25 мг/л канамицина. ПЦР-анализ образцов тотальной ДНК на предмет присутствия фрагмента в 742 п.о. гена nptII показал, что все линии содержат геномную вставку изучаемой последовательности. Результаты ПЦР-анализа представлены в Таблице 4.
Анализ тех же образцов тотальной ДНК с использованием пары праймеров к последовательности гена thauII выявил, что не все nptII-положительные линии содержат вставку гена тауматина II. ПЦР-анализ показал, что амплифицируемый фрагмент размером 878 п.о. присутствовал в 18 из 23 анализируемых образцов. Трансгенные линии Клон 6, Клон 9, Клон 13, Клон 17 и Клон 20 несмотря на присутствие функционирующей вставки гена nptII не содержали последовательность тауматина II. Результаты ПЦР-анализа представлены в Таблице 4.
Пример 7. Данные Western-blot анализа трансгенных растений земляники садовой сорта Фейерверк, полученных с помощью бинарного вектора pBIThau35.
Функциональность интродуцированной экспрессирующей кассеты 35S-thaumatin-3 'nos анализировалась способом Western-блоттинга. Иммунодетекция белка в вегетативных тканях (листьях) показала, что экспрессирующая кассета функционирует и белок синтезируется в 15 из 18 thauII-положительных незивисимых линий. В трансгенных линиях Клон 2, Клон 4 и Клон 12 тауматин не экспрессируется. Причиной, объясняющей этот факт, может быть дефектная вставка кассеты 35S-thaumatin-3 'nos или эндогенная супрессия гомологичными последовательностями. В листьях нетрансгенных растений так же, как и в линиях Клон 6, Клон 9, Клон 13, Клон 17 и Клон 20 без вставки 35S-thaumatin-3'nos, присутствие тауматина II не обнаружено. Сводные результаты проведенного Western-блоттинг анализа в листьях трансгенных линий приводятся в Таблице 4.
Иммунологический анализ экспрессии тауматина в плодах трансгенных линий также подтвердил присутствие белка (Таблица 4). Данные коррелируют с экспрессией тауматина в листьях.
Пример 8. Данные органолептического анализа плодов земляники садовой сорта Фейерверк.
Дегустации проводились на урожаях земляники садовой за два года культивирования на полигоне испытаний генетически усовершенствованных растений (ВНИИСПК, г. Орел). Результаты дегустаций первого года приведены в Таблице 5. Ограниченное количество ягод урожая первого года не позволило провести органолептический анализ статистически достоверно, однако средние баллы, оценивающие сладость плодов, подтверждают изменение вкусовых качеств плодов у ряда трансгенных линий. Сладость мякоти оценивалась по пятибалльной системе, исходя из сортовой характеристики Фейерверка, согласно которой вкус среднеспелых плодов первого сбора оценивается в среднем на 4 балла.
Результаты ПЦР и Western-блоттинг анализов трансгенных линий земляники садовой (клоны 1-23) и сорта Фейерверк.
Органолептический анализ сладости плодов земляники садовой урожая первого года.
Попарное сравнение сладости ягод с экспрессией тауматина с контрольными плодами показало, что во всех случаях оценки опытных образцов либо превышают контрольные (6 из 9 пар), либо равны им (3 из 9 пар). Максимальное превышение сладости плодов с экспрессией тауматина равняется 0,2 балла. Такая разница зафиксирована в четырех парах: Клон 3/Клон 12; Клон 22/Фейерверк; Клон 1/Клон 17; Клон 3/Клон 6. В двух случаях разница равнялась 0,1 балла: Клон 16/Фейерверк; Клон 21/Клон 12. Учитывая, во-первых, что для сорта Фейерверк оценка вкуса ягод выше 4 баллов не характерна, а во-вторых, максимальная оценка, используемая в селекционной практике, равна 4,5, средний балл 4,2 по вкусу для Клона 22 существенно превышает оригинальные сортовые характеристики.
Урожай второго года оказался более обильным и позволил провести статистически достоверный органолептический анализ плодов. Данные приводятся в Таблице 6.
Две дегустации второго года показали достоверное отличие пяти линий с экспрессией тауматина из шести выбранных от контрольных нетрансгенных растений и линий без экспрессии тауматина, за исключением пары 3/13. Оценки дегустации второго года в среднем на 0,2 балла превышают таковые дегустации первого года. Это может быть обусловлено более благоприятными погодными условиями, способствующими накоплению сахаров.
Органолептический анализ сладости плодов трансгенной земляники садовой урожая второго года и сорта Фейерверк.
Пример 9. Влияние экспрессии тауматина II на устойчивость трансгенных линий земляники садовой сорта Фейерверк к Botrytis cinerea.
Основываясь на результатах ПЦР-анализа и Western-блоттинга, из полученных усовершенствованным способом трансгенных линий земляники (Schestibratov et al. 2002) были выбраны три клона с уровнем экспрессии тауматина не менее 0,2 мкг на мг суммарного белка, а именно Клон 3, Клон 7 и Клон 8, а также один клон без экспрессии (Клон 17). В качестве отрицательного контроля использовались листья с растений дикого типа, линии без экспрессии тауматина (Клон 17) и трансгенной линии Клон GUS, полученной с использованием векторной конструкции рВI121.
Предварительные эксперименты показали, что на результаты анализов сильное влияние оказывают не только возраст растительной ткани и состояние инокулюма Botrytis cinerea, а также условия, в которых инкубируются зараженные листовые диски. В роли ключевого фактора в данном случае выступает влажность камеры и фильтровальных подложек. Этот фактор оказывал влияние не столько на характер инфекции, сколько на скорость колонизации листовых дисков. Визуальная оценка развития патогена проводилась через определенные промежутки времени, по этой причине влажность оказывала решающее влияние на результаты сравнения. Визуальная оценка некроза, проводимая на шестой день после инокуляции, дала следующие результаты: средняя площадь поражения составляла 27,5±12,9% для Клона GUS, тогда как на дисках Клона 7 некрозные зоны еще не сформировались. Данные по этой и двум другим парам приводятся в Таблице 7.
Данные по степени спороношения, приведенные в Таблице 10, снимались на девятый день после инокуляции (в отличие от данных по некрозу), поскольку конидиофоры формируются на мицелии с задержкой в несколько суток после появления некротических зон на листовых дисках. Средние баллы спороношения, например, для пары Клон 7/Клон GUS составляли 0,13±0,06/0,47±0,21 для опытного и контрольного вариантов соответственно.
Таким образом, данные по некрозу листовых дисков подтверждают статистически достоверные различия не только внутри сравниваемых пар, но и между всеми трансгенными линиями с экспрессией тауматина, с одной стороны, и контрольными растениями, с другой. Второй критерий, используемый нами для оценки устойчивости растений к инфекции Botrytis cinerea, также подтверждает достоверные различия внутри сравниваемых пар, причем на листовых дисках растений с экспрессией тауматина спороношение существенно ингибировалось.
Результаты теста на устойчивость листовых дисков трансгенной земляники садовой и сорта Фейерверк к Botrytis cinerea.
Пример 10. Данные полевых испытаний трансгенных растений.
Полевые испытания трансгенных растений проводили на сертифицированном полигоне полевых испытаний трансгенных растений, созданном на базе карантинного питомника ВНИИСПК, г. Орел. Оценку вегетативной и генеративной активностей полевых растений проводили по четырем основным критериям: количество розеток в кусту; средняя высота куста; среднее количество цветоносов; вес спелых ягод первого сбора. После двух лет роста в условиях открытого грунта большая часть трансгенных линий не проявила нежелательных фенотипических отклонений (Таблица 8). Однако несколько линий (Клон 9, Клон 14, Клон 15, Клон 18, Клон 19, Клон 20, Клон 23) по основным показателям отличались от контрольных нетрансгенных растений и большинства других трансгенных растений земляники. Линии с сомаклональными изменениями визуально выявлялись в основном по высоте куста и урожайности (весу спелых ягод первого сбора). В итоге, анализ соответствия сортотипу показал, что 16 трансгенных линий из 23 по основным показателям вегетативной и генеративной активностей соответствуют сорту Фейерверк. Таким образом, оптимизированный способ генетической трансформации земляники садовой, описанный в данном изобретении, характеризуется эффективностью получения растений без сомаклональных отклонений, равной примерно 70%.
Результаты полевых испытаний трансгенных растений земляники садовой и сорта Фейерверк: оценка вегетативной и генеративной активностей.
Пример 11. Влияние постадийной кокультивации с Agrobacterium tumefaciens на транзиентную GUS-экспрессию в тканях эксплантов яблони.
При генетической трансформации яблони сорта Мельба с использованием усовершенствованного протокола на стадии транзиентной GUS-экспрессии наблюдалась более высокая ее частота в группах А-3 и А-4 варианта А (относительно контрольного варианта Б). Результаты анализа приведены на Фиг.7. Так же, как и в случае с земляникой садовой, частота GUS-экспрессии оценивалась в пересчете на число срезов, подвергшихся взаимодействию с агробактериями, а не число эксплантов. Помимо увеличения частоты GUS-экспрессии наблюдалось также изменение в интенсивности GUS-активности. В варианте А параллельно с ростом частоты имело место увеличение силы GUS-окрашивания эксплантов после инкубации в растворе X-Gluc.
Пример 12. Данные ПЦР и Western-blotting анализов трансгенных растений яблони, полученных с помощью бинарного вектора pBIThau35.
Усовершенствованным методом генетической трансформации было получено 2 независимые трансгенные линии яблони. Полученные регенеранты укоренялись на среде с 25 мг/л канамицина. ПЦР-анализ образцов тотальной ДНК на предмет присутствия фрагмента в 742 п.о. гена nptII и фрагмента гена thaull размером 878 п.о. показал, что все линии содержат геномные вставки двух последовательностей (Таблица 9). Иммунодетекция белка в вегетативных тканях (листьях) растений in vitro и in vivo показала, что экспрессирующая кассета функционирует и белок синтезируется в обеих линиях (Таблица 9).
Результаты ПЦР и Western-блоттинг анализов трансгенных линий яблони сорта Мельба.
Пример 13. Данные ПЦР анализа трансгенных растений сорта Selekta, полученных с помощью бинарного вектора pBIThau35.
Используя усовершенствованный способ генетической трансформации, было получено 15 независимых трансгенных линий. Полученные регенеранты укоренялись на среде с 25 мг/л канамицина. ПЦР-анализ образцов тотальной ДНК на предмет присутствия фрагмента в 742 п.о. гена nptII показал, что все линии содержат геномную вставку изучаемой последовательности. Результаты ПЦР-анализа представлены в Таблице 10.
Анализ тех же образцов тотальной ДНК с использованием пары праймеров к последовательности гена thauII выявил, что не все nptII-положительные линии содержат вставку гена тауматина II. ПЦР-анализ показал, что амплифицируемый фрагмент размером 878 п.о. присутствовал в 13 из 15 анализируемых образцов. Трансгенные линии Клон S4, Клон S9 несмотря на присутствие функционирующей вставки гена nptII не содержали последовательность тауматина II. Результаты ПЦР-анализа представлены в Таблице 10.
Пример 14. Данные Western-blot анализа трансгенных растений сорта Selekta, полученных с помощью бинарного вектора pBIThau35.
Иммунодетекция белка в вегетативных тканях (листьях) показала, что экспрессирующая кассета функционирует и белок синтезируется во всех (13) thauII-положительных незивисимых линий. В листьях нетрансгенных растений так же, как и в линиях Клон S4, Клон S9 без вставки 35S-thciumatin-3 'nos, присутствие тауматина II не обнаружено. Результаты проведенного Western-блоттинг анализа в листьях трансгенных линий приводятся в Таблице 10.
Результаты ПЦР и Western-блоттинг анализов трансгенных линий земляники садовой (клоны S1-S15) и сорта Selekta.
Иммунологический анализ экспрессии тауматина в плодах трансгенных линий также подтвердил присутствие белка. Данные коррелируют с экспрессией тауматина в листьях.
Результаты полевых испытаний трансгенных растений земляники садовой (линии S1-S15) и сорта Selekta: оценка вегетативной и генеративной активностей.
Пример 15. Данные полевых испытаний трансгенных растений сорта Selekta.
Оценку вегетативной и генеративной активностей полевых растений проводили по четырем основным критериям: средняя высота куста; среднее количество цветоносов; средний вес ягоды. Анализ соответствия сортотипу показал, что 10 трансгенных линий из 15 по основным показателям вегетативной и генеративной активностей соответствуют сорту Selekta. Линии с сомаклональными изменениями визуально выявлялись в основном по высоте куста, количеству цветоносов, среднему весу ягод (Таблица 11). Таким образом, оптимизированный способ генетической трансформации земляники садовой, описанный в данном изобретении, характеризуется эффективностью получения растений без сомаклональных отклонений, равной 66,7%, что хорошо согласуется с данными по сорту Фейерверк.
Пример 16. Данные органолептического анализа плодов трансгенных линий земляники садовой сорта Selekta.
Попарное сравнение сладости ягод с экспрессией тауматина с контрольными плодами продемонстрировало, что показатели опытных образцов либо превышают контрольные, либо равны им. Дегустация показала достоверное усиление сладости в двух линиях (Клоны S2 и S3) из пяти с экспрессией тауматина, выбранных для анализа (Таблица 12). Максимальное превышение сладости плодов с экспрессией тауматина равняется 0,3 балла.
Органолептический анализ сладости плодов трансгенных линий земляники садовой и сорта Selekta.
Промышленная применимость
Усовершенствованный способ подготовки, инокуляции и кокультивации эксплантов повысил все показатели, характеризующие эффективность способа генетической трансформации. Данный способ характеризуется низкой частотой некроза эксплантов, повышенной частотой транзиентной экспрессии, повышенной частотой формирования трансгенных тканей, повышенной частотой регенерации трансгенных побегов, более высокой долей прямых трансформантов, низкой частотой сомаклональных изменений.
Способ генетической трансформации, описываемый в данном изобретении, позволил получить достаточное число трансгенных линий земляники садовой сортов Фейерверк и Selekta и получить подтверждение эффективности способа при генетической трансформации яблони сорта Мельба. В процессе лабораторных и полевых испытаний сортов Фейерверк и Selekta удалось отобрать ряд линий с ярко выраженными улучшенными агрономическими характеристиками (улучшенный вкус ягод, повышенная устойчивость к серой гнили). Более того, эти линии не обладали нежелательными фенотипическими отклонениями, которые часто возникают при регенерации in vitro земляники садовой через каллусную стадию.
Усовершенствованный способ трансформации предоставляет широкую возможность выбора генетического материала для создания устойчивых к фитопатогенам растений, растений, ориентированных на синтез белков, используемых в фармакологии.
Литература
Ревенкова Е.В. и др. (1994) Development of a new vector system based on Agrobacterium tumefaciens A281 strain. Разработка новой векторной системы на базе штамма Agrobacterium tumefaciens A281: [Докл.] Тез. ежегод. конф. направления "Ген. и клеточ. инж." Гос.науч.-техн. прогр. России "Нов. методы биоинж.", Москва, 1994.
Abad L. R. et al. (1996) Antifungal activity of tobacco osmotin has specificity and involves plasma membrane permeabilization. Plant Science 118: 11-23.
Boxus P.H. (1974) The production of strawberry plants by in vitro propagation. J. Hort. Sci. 49: 209-210.
De Mesa MC. et al. (2000) Agrobacterium cells as microprojectile coating stable transfromation rates in strawberry. Aust.J.Plant Physiol. 27: 1093-1100.
Dier et al. (2001) Methods for strawberry transformation using Agrobacterium tumefaciens. USA patent N 6274791.
Dolgov S.V. et al. (1999). Expression of thaumatinll gene in horticultural crops. In: Developments in plant breeding. Vol. 8 "Genetics and Breeding for Crop Quality and Resistance" ed. S. Mugnozza, E. Porceddu and M. Pagnotta. Kluwer Ac. Publ. Dordrecht,, Boston, London, pp 165-172.
du Plessis H.J. et al. (1997). Efficient genetic transformation of strawberry (Fragaria x ananassa duch.) Cultivar Selekta. Acta Hort. (ISHS) 447:289-294.
Edens L. et al. (1982) Cloning of cDNA encoding the sweet-tasting plant protein thaumatin and its expression in E. coli. Gene. 18(1):1-12.
Humara J.M. et al. (1999) Agrobacterium tumefaciens-medisted transformation of Pinus pinea L. cotyledons: an assessment of factors influencing the efficiency of uidA gene transfer Plant Cell Reports 19: 51-58.
James DJ. et al. (1990) Agrobacterium-mediated transformation of the cultivated strawberry (Fragaria ananassa Duch.) using disarmed binary vectors. Plant Sci 69: 79-94.
Jefferson R.A. (1987) Assaying chimeric genes in plants: the GUS gene fusion system. Plant Molecular Biology Reporter 5: 387-405.
Linthorst HJM et al. (1989) Constitutive expression of pathogenesis-related proteins PR-1, GRP and PR-S in tobacco has no effect on virus infection. Plant Cell 1: 285-291.
Maniatis T. et al. (1982) Molecular Cloning: A laboratory manual, Cold Spring Harbor Press, New York.
Marcotrigiano M. et al. (1987) Histogenic instability in tissue culture proliferated strawberry plants. J. Amer.Soc.Hort.Sci. 112: 583-587.
Mathews H. et al. Plant genetic transformation methods and transgenic plants. US patent 5750870. (May 12, 1998).
Morozova T. (2002). Genetic stability of pure lines of Fragaria vesca. in micropropagation and long-term storage in vitro. Acta Hort. (ISHS) 567:85-88.
Mussinan CJ et al. (1975) Organic acid from fresh California strawberries. J Agric Food Chem 23: 482-482.
Murashige T. et al. (1962) A revised medium for rapid growth and bioassay with tobacco tissue culture. Physiol. Plant., 15: 473-497.
Nehra NS et al. (1990b) Genetic transformation of strawberry by Agrobacterium tumefaciens using a leaf disk regeneration system. Plant Cell Rep 9: 293-298.
Olhoft P.M. et al. (2001) The role of thiol compounds in increasing Agrobacterium-mediated transformation of soybean cotyledonary-node cells. Plant Cell Rep 20:731-737.
Peng G. et al. (1991) Evaluation of microorganisms for biocontrol of Botrytis cinerea in strawberry. Canadian journal of plant pathology 13: 247-257.
Perl A et al. (1996) Establishment of an Agrobacterium-mediated transformation system for grape (Vitis vinifera L.): the role of antioxidants during grape-Agrobacterium interactions. Nat Biotechnol May;14(5):624-8.
Roberts W. K. et al. (1990) Zeamatin, an antifungal protein from maize with membrane-permebealizing activity. J. Gen. Microbiol. 136: 1771-1778. Linthorst HJM (1991) Pathogenesis-related proteines of plants. Crit Rev Plant Sci 10: 123-150.
Rogers S. et al. (1995) Extraction of total cellular DNA from plants, algae and fungi. // Gelvin S., Schiperoort R. (eds) Plant Molecular Biology Manual. Kluwer Academic Publishers Dordrecht, Boston, London. Section 7-1.
Schestibratov К et al. (2001) Plant regeneration from excised cotyledons ofpinus radiata. / in Abstracts of 43rd ETCS Congress, Granada, Spain, September 30-October 3, 2001.
Schestibratov K.A. et al. (2002) Molecular breeding of strawberry cv. Firework for enchanced disease resistance and taste improvement by introduction of thaull and rs-afр3 genes./ in Abstracts of The Agricultural Biotechnology International Conference, Saskatoon, Canada, September 15-18, 2002.
Stintzi A et al. (1993) Plant "pathogenesis-related" proteins and their role in defense against pathogens. Biochemie 75: 687-706.
Sutter, E. et al. (1997) Direct regeneration of strawberry (Fragaria x ananassa duch.) from leaf disks. Acta Hort. (ISHS) 447:243-246.
Szwacka M et al. (2002) Variable properties of transgenic cucumber plants containing the thaumatin II gene from Thaumatococcus daniellii. Acta Physiologiae Plantarum, 24 (2) pp. 173-185, 2002.
Trinh H. et al. (2001) Regeneration and transformation methods. / EMBO Practical Course on the New Plant Model System Medicago truncatula Gif-sur-Yvette France (november 19 - december 1st 2001).
Sambrook, J et al. (1989) Molecular cloning: a laboratory Manual, 2nd Edition, Cold Spring Harbor Laboratory, Cold Spring Harbor, New York.
Hansen G. Plant transformation methods US Patent 6162965 (December 19, 2000).
Baker, В. J. et al. Non-pathogen induced systemic acquired resistance (SAR) in plants. US Patent Appl.20020004944 (January 10, 2002).
Ryals J.A.et al. Method of protecting plants from oomycete pathogens US Patent 5856154 (January 5, 1999).
Stuart D.A. et al. Enhanced somatic embryogenesis using maltose US Patent 4801545 (January 31, 1989).
Verrips C.T. et al. DNA sequences encoding the various allelic forms of mature thaumatin, and cloning vehicles, etc. US Patent 4891316 (January 2, 1990).
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения генетически модифицированных древесных растений | 2015 |
|
RU2619175C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГЕНЕТИЧЕСКИ МОДИФИЦИРОВАННЫХ ДРЕВЕСНЫХ РАСТЕНИЙ | 2013 |
|
RU2582263C2 |
| Способ получения безмаркерных трансгенных растений каланхоэ перистого, экспрессирующих ген цекропина Р1 | 2015 |
|
RU2624042C2 |
| СПОСОБ СОЗДАНИЯ ТРАНСГЕННЫХ РАСТЕНИЙ С ВЫСОКИМ УРОВНЕМ ЭКСПРЕССИИ ТРАНСГЕННОГО БЕЛКА | 2011 |
|
RU2507736C2 |
| СПОСОБ ПОЛУЧЕНИЯ ТРАНСГЕННЫХ РАСТЕНИЙ, УСТОЙЧИВЫХ К ВИРУСНОЙ ИНФЕКЦИИ | 2005 |
|
RU2300567C1 |
| Промотор pro-SmAMP-D1 из растения звездчатка средняя (Stellaria media L.) для биотехнологии растений | 2022 |
|
RU2799014C1 |
| Способ получения безмаркерных трансгенных растений каланхоэ перистого, экспрессирующих ген цекропина Р1 | 2015 |
|
RU2631929C2 |
| Промотор pro-SmAMP-X из растения звездчатка белая (Stellaria media L.) для экспрессии рекомбинантных генов в клетках растений | 2020 |
|
RU2766095C1 |
| СИЛЬНЫЙ РАСТИТЕЛЬНЫЙ ПРОМОТОР PRO-SMAMP2 ИЗ СОРНОГО РАСТЕНИЯ STELLARIA MEDIA | 2014 |
|
RU2615456C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТРАНСГЕННЫХ РАСТЕНИЙ ТАБАКА С ПОВЫШЕННЫМ СОДЕРЖАНИЕМ ПРОЛИНА | 2006 |
|
RU2324736C1 |

Изобретение относится к области генной инженерии, в частности к способу получения трансгенных растений. Выбирают сорт заданного растения. Проводят подготовку маточных растений и осуществляют микроклональное размножение растительного материала для получения листовых эксплантов. Затем создают вектор для переноса генетического материала, экспрессирующий целевой белок, повышающий устойчивость растений к фитопатогенам, и осуществляют агробактериальную трансформацию эксплантов агробактерией Agrobacterium tumifaciens с дальнейшим отбором трансгенной ткани и размножением трансформантов. На этапе трансформации используют постадийную кокультивацию эксплантов, количество шагов которой выбирают в диапазоне от 2 до 5, причем в качестве эксплантов используют листовые диски, у которых соотношение длины среза к площади диска лежит в диапазоне от 0,1 мм/мм2 до 2 мм/мм2. Изобретение позволяет получить трасгенные растения с повышенной устойчивостью к фитопатогенам, а также повысить частоту трансгенной экспрессии, частоту формирования трансгенных тканей, частоту регенерации трансгенных побегов, долю прямых тансформантов, а также снизить частоту сомаклональных изменений. 4 з.п.ф-лы, 7 ил., 12 табл.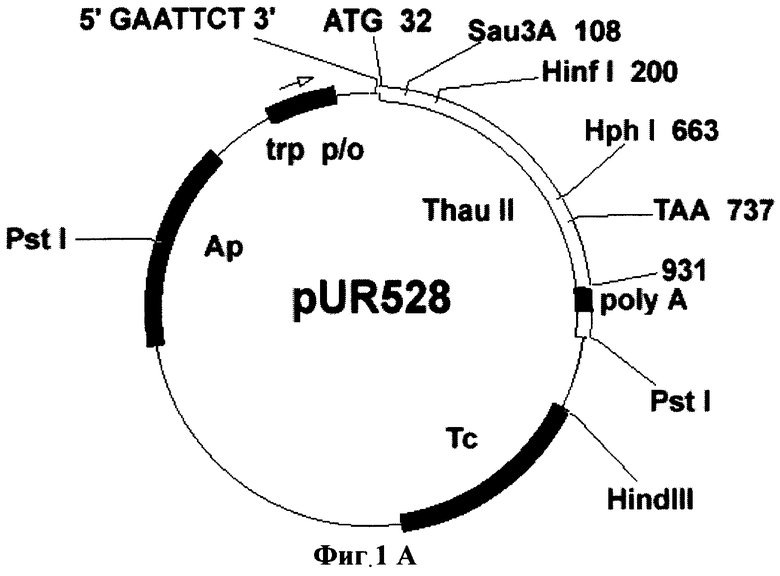
i) стадию выбора одного или более листовых сегментов для подготовки эксплантов;
ii) подготовку листовых дисков путем отделения от каждого листового диска сегмента, в котором соотношение длины среза к площади экспланта лежит в диапазоне от 0,1 мм / мм2 до 2 мм / мм2 или составляет величину 0,5 мм / мм2, последующую инокуляцию и кокультивацию листовых дисков с агробактерией Agrobacterium tumefaciens, которая содержит вектор, экспрессирующий по крайней мере один белок, выбираемый из группы, состоящей из: а) целевого белка, б) белка, который содействует снижению некроза на стадии трансформации, в) белка, который повышает устойчивость растения к фитопатогенам или комбинации белков в пп.а) -в);
iii) стадию удаления с листовых дисков избытка агробактерий и последующего отделения со стороны первого среза первой партии эксплантов;
iv) стадию переноса эксплантов на среду селекции и регенерации, в которой концентрацию тидиозурона выбирают от 1 до 10 мг/л, концентрацию индолил масляной кислоты выбирают от 0 до 2 мг/л., концентрацию канамицина выбирают от 10 до 100 мг/л;
v) подготовку последующих партий эксплантов в соответствии с пунктами iii) и iv) до формирования последней партии эксплантов из выбранных листовых дисков,
причем, подготовка каждой из последующих партий эксплантов выполняется после временного интервала от 1 до 5 суток или после временного интервала 3 суток, необходимого для трансформации растительных клеток и формирования в листовых дисках двудольных растений, выбираемых из группы, состоящей из яблони, груши, земляники садовой, моркови и томатов индуцируемой резистентности к абиотическим и биотическим стрессам и снижения частоты сомаклональных изменений в трансгенном растении.
| US 6441275 27.08.2002.US 5516671 14.05.1996.RU 2176669 12.10.2001.WO 9305153 18.03.1993. |
Авторы
Даты
2005-09-27—Публикация
2002-10-24—Подача