Область техники, к которой относится изобретение
Настоящее изобретение в целом относится к поликетидам и генам, участвующим в их синтезе. В частности настоящее изобретение относится к выделению и получению характеристик новой поликетид-синтазы и нерибосомных генов кислота-аминокислота-лигаз из Sorangium cellulosum, которые необходимы для биосинтеза эпотилонов А и В.
Предпосылки создания изобретения
Поликетиды представляют собой соединения, которые синтезируются из элементарных звеньев, содержащих два атома углерода, в которых β-углерод всегда несет кетогрупу, поэтому их называют поликетиды. К этим соединениям относятся многочисленные важные антибиотики, иммунодепрессанты, противораковые химиотерапевтические агенты и другие соединения, обладающие широким спектром биологических активностей. Чрезвычайно большое структурное разнообразие обусловлено различием длин поликетидных цепей, различием встроенных боковых цепей (либо в начале процесса синтеза в виде части элементарных звеньев, содержащих два атома углерода, либо после формирования каркаса поликетона) и стереохимическим строением таких групп. Кетогруппы также могут быть восстановлены до гидроксилов, еноилов или полностью удалены. Каждый цикл добавления двух атомов углерода осуществляется с помощью комплекса ферментов, называемых поликетид-синтазой (PKS), с помощью процесса, аналогичного биосинтезу жирных кислот.
Гены биосинтеза, обеспечивающие увеличение количества поликетидов, были выделены и секвенированы. Например, см. патенты US 5639949, 5693774 и 5716849, все они включены в настоящее описание в виде ссылки, в которых описаны гены биосинтеза сорафена. См., также публикацию Schupp и др., FEMS Microbiology Letters 159: 201-207 (1998) и WO 98/07868, где описаны гены биосинтеза рифамицина, и патент US 5876991, в котором описаны гены биосинтеза тилактона, все они включены в настоящее описание в виде ссылки. Кодируемые протеины обычно подразделяют на два типа: тип I и тип II. Протеины типа I являются полифункциональными с несколькими каталитическими доменами, осуществляющими различные ферментативные стадии, которые ковалентно связаны друг с другом (например, PKS эритромицина, сорафена, рифамицина и авермектина (MacNeil и др., в: Industrial Microorganisms: Basic and Applied Molecular Genetics, (ред. Baltz и др.), American Society for Microbiology, Washington D.С., стр.245-256 (1993)); в то время как протеины типа II являются монофункциональными (Hutchinson и др., в: Industrial Microorganisms: Basic and Applied Molecular Genetics, (ред. Baltz и др.), American Society for Microbiology, Washington D.С., стр.203-216 (1993)).
Для простых поликетидов, таких как актинородин (который продуцируется Streptomyces coelicolor), осуществляют несколько циклов добавлений двух атомов углерода с повторным использованием PKS-ферментов, кодируемых одним набором PKS-генов. В противоположность этому синтез более сложных соединений, таких как эритромицин и сорафен, включает PKS-ферменты, которые организованы в модули, причем каждый модуль осуществляет одни цикл добавления двух атомов углерода (обзор литературных данных см. у Hopwood и др., в: Industrial Microorganisms: Basic and Applied Molecular Genetics, (ред. Baltz и др.), American Society for Microbiology, Washington D. С., с.267-275 (1993)).
Сложные поликетиды и вторичные метаболиты обычно могут содержать подструктуры, происходящие из аминокислот, а не из простых карбоновых кислот. Включение этих элементарных звеньев осуществляют с помощью нерибосомных кислота-аминокислота-лигаз (NRPSs). NRPSs представляют собой полиферменты, организованные в модули. Каждый модуль ответствен за добавление (и при необходимости за дополнительное процессирование) одного элементарного аминокислотного звена. NRPSs активируют аминокислоты путем образования аминоациладенилатов и захвата ацилированных аминокислот по тиольным группам фосфопантетеинильных простатических групп доменов пептидильного протеина-носителя. Кроме того, NRPSs модифицируют аминокислоты с помощью эпимеризации, N-метилирования или при необходимости циклизации и катализируют образование пептидных связей между связанными с ферментом аминокислотами. NRPSs ответственны за биосинтез пептидных вторичных метаболитов, таких как циклоспорин, за образование терминирующих звеньев поликетидной цепи, например, в рапамицине, или могут формировать смешанные системы типа PKS, например, в пути биосинтеза йерсиниабактина.
Эпотилоны А и В представляют собой 16-членные макроциклические поликетиды с являющимся производным ацилцистеина стартовым звеном, которые продуцируются штаммом бактерии Sorangium cellulosum So ce90 (Gerth и др., J. Antibiotics 49: 560-563 (1996), публикация включена в настоящее описание в виде ссылки). Строение эпотилона А и В, где R обозначает водород (эпотилон А) или метил (эпотилон В), представлено формулой
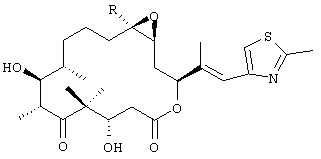
Эпотилоны имеют узкий спектр противогрибковой активности, и их основной особенностью является высокая цитотоксичность в отношении культур клеток животных (см., Höfle и др., DE 4138042 (1993), включен в настоящее описание в виде ссылки). Чрезвычайно важно, что эпотилоны имитируют биологическую активность таксола, как in vivo, так и в культуре клеток (Bollag и др., Cancer Research 55: 2325-2333 (1995), публикация включена в настоящее описание в виде ссылки). Таксол и таксотер, которые стабилизируют клеточные микротрубки, представляют собой противораковые химиотерапевтические агенты, обладающие высокой активностью в отношении различных твердых опухолей человека (Rowinsky и др., J. Natl. Cancer Inst. 83: 1778-1781 (1991)). Конкурентные исследования позволили установить, что эпотилоны действуют в качестве конкурентных ингибиторов связывания таксола с микротрубками, что согласуется с представлением о том, что они обладают таким же сайтом связывания микротрубок и таким же сродством к микротрубкам, что и таксол. Однако эпотилоны имеют значительное преимущество по сравнению с таксолом, состоящее в том, что эпотилоны существенно в меньшей степени, чем таксол, теряют эффективность в отношении линии клеток, обладающей множественной устойчивостью к лекарствам (Bollag и др. (1995)). Кроме того, эпотилоны в существенно меньшей степени по сравнению с таксолом экспортируются из клеток с Р-гликопротеином (Gerth и др. (1996)). Более того, было синтезировано несколько аналогов эпотилона, которые обладают более высокой цитотоксичностью по сравнению с эпотилоном А или эпотилоном В, что доказано по их более высокой способности индуцировать полимеризацию и стабилизацию микротрубок (WO 98/25929, документ включен в настоящее описание в виде ссылки).
Несмотря на доказанную перспективность эпотилонов в качестве противораковых агентов, их коммерческую доступность ограничивают существующие в настоящее время проблемы, связанные с получением этих соединений. Соединения являются слишком сложными для промышленного химического синтеза, и поэтому их необходимо получать с помощью ферментации. Методы генетической манипуляции с миксобактериями, такими как Sorangium cellulosum, описаны в патенте US 5686295, включенном в настоящее описание в виде ссылки. Однако Sorangium cellulosum, как известно, обладает слабой способностью к ферментации и в результате продуцирует низкие уровни эпотилонов. Рекомбинантное получение эпотилонов в гетерологичных хозяевах, которые обладают более высокой способностью к ферментации, может решить существующие в настоящее время проблемы, связанные с производством эпотилонов. Однако гены, которые кодируют полипептиды, ответственные за биосинтез эпотилона, к настоящему времени не выявлены. Кроме того, штамм, который продуцирует эпотилоны, т.е. So ce90, также продуцирует по меньшей мере один дополнительный поликетид, спирангиен, который, как ожидается, сильно затрудняет выделение генов, непосредственно участвующих в биосинтезе эпотилонов.
Таким образом, в свете вышеизложенного одним из объектов настоящего изобретения является выделение генов, которые участвуют в синтезе эпотилонов, прежде всего генов, которые участвуют в синтезе эпотилонов А и В в миксобактериях группы Sorangium/Polyangium, т.е. в штамме Sorangium cellulosum So ce90. Еще одним объектом изобретения является способ рекомбинантного получения эпотилонов с целью их применения в противораковых композициях.
Краткое изложение сущности изобретения
Для осуществления вышеуказанных и других объектов изобретения при создании изобретения неожиданно удалось преодолеть указанные выше трудности и впервые получить молекулу нуклеиновой кислоты, включающую нуклеотидную последовательность, которая кодирует по меньшей мере один полипептид, участвующий в биосинтезе эпотилона. Согласно предпочтительному варианту осуществления нуклеотидную последовательность выделяют из видов, принадлежащих к Myxobacteria, наиболее предпочтительно Sorangium cellulosum.
Согласно другому предпочтительному варианту осуществления настоящее изобретение относится к выделенной молекуле нуклеиновой кислоты, которая включает нуклеотидную последовательность, кодирующую по меньшей мере один полипептид, участвующий в биосинтезе эпотилона, где этот полипептид содержит аминокислотную последовательность, практически аналогичную аминокислотной последовательности, выбранной из ряда, включающего: SEQ ID NO:2, аминокислоты 11-437 SEQ ID NO:2, аминокислоты 543-864 SEQ ID NO:2, аминокислоты 974-1273 SEQ ID NO:2, аминокислоты 1314-1385 SEQ ID NO:2, SEQ ID NO:3, аминокислоты 72-81 SEQ ID NO:3, аминокислоты 118-125 SEQ ID NO:3, аминокислоты 199-212 SEQ ID NO:3, аминокислоты 353-363 SEQ ID NO:3, аминокислоты 549-565 SEQ ID NO:3, аминокислоты 588-603 SEQ ID NO:3, аминокислоты 669-684 SEQ ID NO:3, аминокислоты 815-821 SEQ ID NO:3, аминокислоты 868-892 SEQ ID NO:3, аминокислоты 903-912 SEQ ID NO:3, аминокислоты 918-940 SEQ ID NO:3, аминокислоты 1268-1274 SEQ ID NO:3, аминокислоты 1285-1297 SEQ ID NO:3, аминокислоты 973-1256 SEQ ID NO:3, аминокислоты 1344-1351 SEQ ID NO:3, SEQ ID NO:4, аминокислоты 7-432 SEQ ID NO:4, аминокислоты 539-859 SEQ ID NO:4, аминокислоты 869-1037 SEQ ID NO:4, аминокислоты 1439-1684 SEQ ID NO:4, аминокислоты 1722-1792 SEQ ID NO:4, SEQ ID NO:5, аминокислоты 39-457 SEQ ID NO:5, аминокислоты 563-884 SEQ ID NO:5, аминокислоты 1147-1399 SEQ ID NO:5, аминокислоты 1434-1506 SEQ ID NO:5, аминокислоты 1524-1950 SEQ ID NO:5, аминокислоты 2056-2377 SEQ ID NO:5, аминокислоты 2645-2895 SEQ ID NO:5, аминокислоты 2932-3005 SEQ ID NO:5, аминокислоты 3024-3449 SEQ ID NO:5, аминокислоты 3555-3876 SEQ ID NO:5, аминокислоты 3886-4048 SEQ ID NO:5, аминокислоты 4433-4719 SEQ ID NO:5, аминокислоты 4729-4974 SEQ ID NO:5, аминокислоты 5010-5082 SEQ ID NO:5, аминокислоты 5103-5525 SEQ ID NO:5, аминокислоты 5631-5951 SEQ ID NO:5, аминокислоты 5964-6132 SEQ ID NO:5, аминокислоты 6542-6837 SEQ ID NO:5, аминокислоты 6857-7101 SEQ ID NO:5, аминокислоты 7140-7211 SEQ ID NO:5, SEQ ID NO:6, аминокислоты 35-454 SEQ ID NO:6, аминокислоты 561-881 SEQ ID NO:6, аминокислоты 1143-1393 SEQ ID NO:6, аминокислоты 1430-1503 SEQ ID NO:6, аминокислоты 1522-1946 SEQ ID NO: 6, аминокислоты 2053-2373 SEQ ID NO:6, аминокислоты 2383-2551 SEQ ID NO:6, аминокислоты 2671-3045 SEQ ID NO:6, аминокислоты 3392-3636 SEQ ID NO:6, аминокислоты 3673-3745 SEQ ID NO:6, SEQ ID NO:7, аминокислоты 32-450 SEQ ID NO:7, аминокислоты 556-877 SEQ ID NO:7, аминокислоты 887-1051 SEQ ID NO:7, аминокислоты 1478-1790 SEQ ID NO:7, аминокислоты 1810-2055 SEQ ID NO:7, аминокислоты 2093-2164 SEQ ID NO:7, аминокислоты 2165-2439 SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:10, SEQ ID NO:11 и SEQ ID NO:22.
Согласно наиболее предпочтительному варианту осуществления настоящее изобретение относится к выделенной молекуле нуклеиновой кислоты, которая включает нуклеотидную последовательность, кодирующую по меньшей мере один полипептид, участвующий в биосинтезе эпотилона, где этот полипептид содержит аминокислотную последовательность, выбранную из ряда, включающего: SEQ ID NO:2, аминокислоты 11-437 SEQ ID NO:2, аминокислоты 543-864 SEQ ID NO:2, аминокислоты 974-1273 SEQ ID NO:2, аминокислоты 1314-1385 SEQ ID NO:2, SEQ ID NO:3, аминокислоты 72-81 SEQ ID NO:3, аминокислоты 118-125 SEQ ID NO:3, аминокислоты 199-212 SEQ ID NO:3, аминокислоты 353-363 SEQ ID NO:3, аминокислоты 549-565 SEQ ID NO:3, аминокислоты 588-603 SEQ ID NO:3, аминокислоты 669-684 SEQ ID NO:3, аминокислоты 815-821 SEQ ID NO:3, аминокислоты 868-892 SEQ ID NO:3, аминокислоты 903-912 SEQ ID NO:3, аминокислоты 918-940 SEQ ID NO:3, аминокислоты 1268-1274 SEQ ID NO:3, аминокислоты 1285-1297 SEQ ID NO:3, аминокислоты 973-1256 SEQ ID NO:3, аминокислоты 1344-1351 SEQ ID NO:3, SEQ ID NO:4, аминокислоты 7-432 SEQ ID NO:4, аминокислоты 539-859 SEQ ID NO:4, аминокислоты 869-1037 SEQ ID NO:4, аминокислоты 1439-1684 SEQ ID NO:4, аминокислоты 1722-1792 SEQ ID NO:4, SEQ ID NO:5, аминокислоты 39-457 SEQ ID NO:5, аминокислоты 563-884 SEQ ID NO:5, аминокислоты 1147-1399 SEQ ID NO:5, аминокислоты 1434-1506 SEQ ID NO:5, аминокислоты 1524-1950 SEQ ID NO:5, аминокислоты 2056-2377 SEQ ID NO:5, аминокислоты 2645-2895 SEQ ID NO:5, аминокислоты 2932-3005 SEQ ID NO:5, аминокислоты 3024-3449 SEQ ID NO:5, аминокислоты 3555-3876 SEQ ID NO:5, аминокислоты 3886-4048 SEQ ID NO:5, аминокислоты 4433-4719 SEQ ID NO:5, аминокислоты 4729-4974 SEQ ID NO:5, аминокислоты 5010-5082 SEQ ID NO:5, аминокислоты 5103-5525 SEQ ID NO:5, аминокислоты 5631-5951 SEQ ID NO:5, аминокислоты 5964-6132 SEQ ID NO:5, аминокислоты 6542-6837 SEQ ID NO:5, аминокислоты 6857-7101 SEQ ID NO:5, аминокислоты 7140-7211 SEQ ID NO:5, SEQ ID NO:6, аминокислоты 35-454 SEQ ID NO:6, аминокислоты 561-881 SEQ ID NO:6, аминокислоты 1143-1393 SEQ ID NO:6, аминокислоты 1430-1503 SEQ ID NO:6, аминокислоты 1522-1946 SEQ ID NO: 6, аминокислоты 2053-2373 SEQ ID NO:6, аминокислоты 2383-2551 SEQ ID NO:6, аминокислоты 2671-3045 SEQ ID NO:6, аминокислоты 3392-3636 SEQ ID NO:6, аминокислоты 3673-3745 SEQ ID NO:6, SEQ ID NO:7, аминокислоты 32-450 SEQ ID NO:7, аминокислоты 556-877 SEQ ID NO:7, аминокислоты 887-1051 SEQ ID NO:7, аминокислоты 1478-1790 SEQ ID NO:7, аминокислоты 1810-2055 SEQ ID NO:7, аминокислоты 2093-2164 SEQ ID NO:7, аминокислоты 2165-2439 SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:10, SEQ ID NO:11 и SEQ ID NO:22.
Согласно еще одному предпочтительному варианту осуществления настоящее изобретение относится к выделенной молекуле нуклеиновой кислоты, которая включает нуклеотидную последовательность, кодирующую по меньшей мере один полипептид, участвующий в биосинтезе эпотилона, где эта нуклеотидная последовательность практически аналогична нуклеотидной последовательности, выбранной из ряда, включающего: комплемент нуклеотидов 1900-3171 SEQ ID NO:1, нуклеотидов 3415-5556 SEQ ID NO:1, нуклеотидов 7610-11875 SEQ ID NO:1, нуклеотидов 7643-8920 SEQ ID NO:1, нуклеотидов 9236-10201 SEQ ID NO:1, нуклеотидов 10529-11428 SEQ ID NO:1, нуклеотидов 11549-11764 SEQ ID NO:1, нуклеотидов 11872-16104 SEQ ID NO:1, нуклеотидов 12085-12114 SEQ ID NO:1, нуклеотидов 12223-12246 SEQ ID NO:1, нуклеотидов 12466-12507 SEQ ID NO:1, нуклеотидов 12928-12960 SEQ ID NO:1, нуклеотидов 13516-13566 SEQ ID NO:1, нуклеотидов 13633-13680 SEQ ID NO:1, нуклеотидов 13876-13923 SEQ ID NO:1, нуклеотидов 14313-14334 SEQ ID NO:1, нуклеотидов 14473-14547 SEQ ID NO:1, нуклеотидов 14578-14607 SEQ ID NO:1, нуклеотидов 14623-14692 SEQ ID NO:1, нуклеотидов 15673-15693 SEQ ID NO:1, нуклеотидов 15724-15762 SEQ ID NO:1, нуклеотидов 14788-15639 SEQ ID NO:1, нуклеотидов 15901-15924 SEQ ID NO:1, нуклеотидов 16251-21749 SEQ ID NO:1, нуклеотидов 16269-17546 SEQ ID NO:1, нуклеотидов 17865-18827 SEQ ID NO:1, нуклеотидов 18855-19361 SEQ ID NO:1, нуклеотидов 20565-21302 SEQ ID NO:1, нуклеотидов 21414-21626 SEQ ID NO:1, нуклеотидов 21746-43519 SEQ ID NO:1, нуклеотидов 21860-23116 SEQ ID NO:1, нуклеотидов 23431-24397 SEQ ID NO:1, нуклеотидов 25184-25942 SEQ ID NO:1, нуклеотидов 26045-26263 SEQ ID NO:1, нуклеотидов 26318-27595 SEQ ID NO:1, нуклеотидов 27911-28876 SEQ ID NO:1, нуклеотидов 29678-30429 SEQ ID NO:1, нуклеотидов 30539-30759 SEQ ID NO:1, нуклеотидов 30815-32092 SEQ ID NO:1, нуклеотидов 32408-33373 SEQ ID NO:1, нуклеотидов 33401-33889 SEQ ID NO:1, нуклеотидов 35042-35902 SEQ ID NO:1, нуклеотидов 35930-36667 SEQ ID NO:1, нуклеотидов 36773-36991 SEQ ID NO:1, нуклеотидов 37052-38320 SEQ ID NO:1, нуклеотидов 38636-39598 SEQ ID NO:1, нуклеотидов 39635-40141 SEQ ID NO:1, нуклеотидов 41369-42256 SEQ ID NO:1, нуклеотидов 42314-43048 SEQ ID NO:1, нуклеотидов 43163-43378 SEQ ID NO:1, нуклеотидов 43524-54920 SEQ ID NO:1, нуклеотидов 43626-44885 SEQ ID NO:1, нуклеотидов 45204-46166 SEQ ID NO:1, нуклеотидов 46950-47702 SEQ ID NO:1, нуклеотидов 47811-48032 SEQ ID NO:1, нуклеотидов 48087-49361 SEQ ID NO:1, нуклеотидов 49680-50642 SEQ ID NO:1, нуклеотидов 50670-51176 SEQ ID NO:1, нуклеотидов 51534-52657 SEQ ID NO:1, нуклеотидов 53697-54431 SEQ ID NO:1, нуклеотидов 54540-54758 SEQ ID NO:1, нуклеотидов 54935-62254 SEQ ID NO:1, нуклеотидов 55028-56284 SEQ ID NO:1, нуклеотидов 56600-57565 SEQ ID NO:1, нуклеотидов 57593-58087 SEQ ID NO:1, нуклеотидов 59366-60304 SEQ ID NO:1, нуклеотидов 60362-61099 SEQ ID NO:1, нуклеотидов 61211-61426 SEQ ID NO:1, нуклеотидов 61427-62254 SEQ ID NO:1, нуклеотидов 62369-63628 SEQ ID NO:1, нуклеотидов 67334-68251 SEQ ID NO:1 и нуклеотидов 1-68750 SEQ ID NO:1.
Согласно особенно предпочтительному варианту осуществления настоящее изобретение относится к молекуле нуклеиновой кислоты, которая включает нуклеотидную последовательность, кодирующую по меньшей мере один полипептид, участвующий в биосинтезе эпотилона, где нуклеотидную последовательность выбирают из ряда, включающего: комплемент нуклеотидов 1900-3171 SEQ ID NO:1, нуклеотидов 3415-5556 SEQ ID NO:1, нуклеотидов 7610-11875 SEQ ID NO:1, нуклеотидов 7643-8920 SEQ ID NO:1, нуклеотидов 9236-10201 SEQ ID NO:1, нуклеотидов 10529-11428 SEQ ID NO:1, нуклеотидов 11549-11764 SEQ ID NO:1, нуклеотидов 11872-16104 SEQ ID NO:1, нуклеотидов 12085-12114 SEQ ID NO:1, нуклеотидов 12223-12246 SEQ ID NO:1, нуклеотидов 12466-12507 SEQ ID NO:1, нуклеотидов 12928-12960 SEQ ID NO:1, нуклеотидов 13516-13566 SEQ ID NO:1, нуклеотидов 13633-13680 SEQ ID NO:1, нуклеотидов 13876-13923 SEQ ID NO:1, нуклеотидов 14313-14334 SEQ ID NO:1, нуклеотидов 14473-14547 SEQ ID NO:1, нуклеотидов 14578-14607 SEQ ID NO:1, нуклеотидов 14623-14692 SEQ ID NO:1, нуклеотидов 15673-15693 SEQ ID NO:1, нуклеотидов 15724-15762 SEQ ID NO:1, нуклеотидов 14788-15639 SEQ ID NO:1, нуклеотидов 15901-15924 SEQ ID NO:1, нуклеотидов 16251-21749 SEQ ID NO:1, нуклеотидов 16269-17546 SEQ ID NO:1, нуклеотидов 17865-18827 SEQ ID NO:1, нуклеотидов 18855-19361 SEQ ID NO:1, нуклеотидов 20565-21302 SEQ ID NO:1, нуклеотидов 21414-21626 SEQ ID NO:1, нуклеотидов 21746-43519 SEQ ID NO:1, нуклеотидов 21860-23116 of SEQ ID NO:1, нуклеотидов 23431-24397 SEQ ID NO:1, нуклеотидов 25184-25942 SEQ ID NO:1, нуклеотидов 26045-26263 SEQ ID NO:1, нуклеотидов 26318-27595 SEQ ID NO:1, нуклеотидов 27911-28876 SEQ ID NO:1, нуклеотидов 29678-30429 SEQ ID NO:1, нуклеотидов 30539-30759 SEQ ID NO:1, нуклеотидов 30815-32092 SEQ ID NO:1, нуклеотидов 32408-33373 SEQ ID NO:1, нуклеотидов 33401-33889 SEQ ID NO:1, нуклеотидов 35042-35902 SEQ ID NO:1, нуклеотидов 35930-36667 SEQ ID NO:1, нуклеотидов 36773-36991 SEQ ID NO:1, нуклеотидов 37052-38320 SEQ ID NO:1, нуклеотидов 38636-39598 SEQ ID NO:1, нуклеотидов 39635-40141 SEQ ID NO:1, нуклеотидов 41369-42256 SEQ ID NO:1, нуклеотидов 42314-43048 SEQ ID NO:1, нуклеотидов 43163-43378 SEQ ID NO:1, нуклеотидов 43524-54920 SEQ ID NO:1, нуклеотидов 43626-44885 SEQ ID NO:1, нуклеотидов 45204-46166 SEQ ID NO:1, нуклеотидов 46950-47702 SEQ ID NO:1, нуклеотидов 47811-48032 SEQ ID NO:1, нуклеотидов 48087-49361 SEQ ID NO:1, нуклеотидов 49680-50642 SEQ ID NO:1, нуклеотидов 50670-51176 SEQ ID NO:1, нуклеотидов 51534-52657 SEQ ID NO:1, нуклеотидов 53697-54431 SEQ ID NO:1, нуклеотидов 54540-54758 SEQ ID NO:1, нуклеотидов 54935-62254 SEQ ID NO:1, нуклеотидов 55028-56284 SEQ ID NO:1, нуклеотидов 56600-57565 SEQ ID NO:1, нуклеотидов 57593-58087 SEQ ID NO:1, нуклеотидов 59366-60304 SEQ ID NO:1, нуклеотидов 60362-61099 SEQ ID NO:1, нуклеотидов 61211-61426 SEQ ID NO:1, нуклеотидов 61427-62254 SEQ ID NO:1, нуклеотидов 62369-63628 SEQ ID NO:1, нуклеотидов 67334-68251 SEQ ID NO:1 и нуклеотидов 1-68750 SEQ ID NO:1.
Согласно еще одному предпочтительному варианту осуществления настоящее изобретение относится к выделенной молекуле нуклеиновой кислоты, которая включает нуклеотидную последовательность, кодирующую по меньшей мере один полипептид, участвующий в биосинтезе эпотилона, где эта нуклеотидная последовательность включает область нуклеотидной последовательности, состоящую из 20, 25, 30, 35, 40, 45 или 50 (предпочтительно 20) последовательных пар оснований, идентичную области нуклеотидной последовательности, состоящей из 20, 25, 30, 35, 40, 45 или 50 (предпочтительно 20) последовательных пар оснований нуклеотидной последовательности, выбранной из ряда, включающего: комплемент нуклеотидов 1900-3171 SEQ ID NO:1, нуклеотидов 3415-5556 SEQ ID NO:1, нуклеотидов 7610-11875 SEQ ID NO:1, нуклеотидов 7643-8920 SEQ ID NO:1, нуклеотидов 9236-10201 SEQ ID NO:1, нуклеотидов 10529-11428 SEQ ID NO:1, нуклеотидов 11549-11764 SEQ ID NO:1, нуклеотидов 11872-16104 SEQ ID NO:1, нуклеотидов 12085-12114 SEQ ID NO:1, нуклеотидов 12223-12246 SEQ ID NO:1, нуклеотидов 12466-12507 SEQ ID NO:1, нуклеотидов 12928-12960 SEQ ID NO:1, нуклеотидов 13516-13566 SEQ ID NO:1, нуклеотидов 13633-13680 SEQ ID NO:1, нуклеотидов 13876-13923 SEQ ID NO:1, нуклеотидов 14313-14334 SEQ ID NO:1, нуклеотидов 14473-14547 SEQ ID NO:1, нуклеотидов 14578-14607 SEQ ID NO:1, нуклеотидов 14623-14692 SEQ ID NO:1, нуклеотидов 15673-15693 SEQ ID NO:1, нуклеотидов 15724-15762 SEQ ID NO:1, нуклеотидов 14788-15639 SEQ ID NO:1, нуклеотидов 15901-15924 SEQ ID NO:1, нуклеотидов 16251-21749 SEQ ID NO:1, нуклеотидов 16269-17546 SEQ ID NO:1, нуклеотидов 17865-18827 SEQ ID NO:1, нуклеотидов 18855-19361 SEQ ID NO:1, нуклеотидов 20565-21302 SEQ ID NO:1, нуклеотидов 21414-21626 SEQ ID NO:1, нуклеотидов 21746-43519 SEQ ID NO:1, нуклеотидов 21860-23116 SEQ ID NO:1, нуклеотидов 23431-24397 SEQ ID NO:1, нуклеотидов 25184-25942 SEQ ID NO:1, нуклеотидов 26045-26263 of SEQ ID NO:1, нуклеотидов 26318-27595 SEQ ID NO:1, нуклеотидов 27911-28876 SEQ ID NO:1, нуклеотидов 29678-30429 SEQ ID NO:1, нуклеотидов 30539-30759 SEQ ID NO:1, нуклеотидов 30815-32092 SEQ ID NO:1, нуклеотидов 32408-33373 SEQ ID NO:1, нуклеотидов 33401-33889 SEQ ID NO:1, нуклеотидов 35042-35902 SEQ ID NO:1, нуклеотидов 35930-36667 SEQ ID NO:1, нуклеотидов 36773-36991 SEQ ID NO:1, нуклеотидов 37052-38320 SEQ ID NO:1, нуклеотидов 38636-39598 SEQ ID NO:1, нуклеотидов 39635-40141 SEQ ID NO:1, нуклеотидов 41369-42256 SEQ ID NO:1, нуклеотидов 42314-43048 SEQ ID NO:1, нуклеотидов 43163-43378 SEQ ID NO:1, нуклеотидов 43524-54920 SEQ ID NO:1, нуклеотидов 43626-44885 SEQ ID NO:1, нуклеотидов 45204-46166 SEQ ID NO:1, нуклеотидов 46950-47702 SEQ ID NO:1, нуклеотидов 47811-48032 SEQ ID NO:1, нуклеотидов 48087-49361 SEQ ID NO:1, нуклеотидов 49680-50642 SEQ ID NO:1, нуклеотидов 50670-51176 SEQ ID NO:1, нуклеотидов 51534-52657 SEQ ID NO:1, нуклеотидов 53697-54431 SEQ ID NO:1, нуклеотидов 54540-54758 SEQ ID NO:1, нуклеотидов 54935-62254 SEQ ID NO:1, нуклеотидов 55028-56284 SEQ ID NO:1, нуклеотидов 56600-57565 SEQ ID NO:1, нуклеотидов 57593-58087 SEQ ID NO:1, нуклеотидов 59366-60304 SEQ ID NO:1, нуклеотидов 60362-61099 SEQ ID NO:1, нуклеотидов 61211-61426 SEQ ID NO:1, нуклеотидов 61427-62254 SEQ ID NO:1, нуклеотидов 62369-63628 SEQ ID NO:1, нуклеотидов 67334-68251 SEQ ID NO:1 и нуклеотидов 1-68750 SEQ ID NO:1.
Настоящее изобретение также относится к химерному гену, включающему гетерологичную промоторную последовательность, функционально связанную с молекулой нуклеиновой кислоты по изобретению. Кроме того, настоящее изобретение относится к рекомбинантному вектору, включающему такой химерный ген, где вектор обладает способностью стабильно трансформировать клетку-хозяина. Настоящее изобретение также относится к рекомбинантной клетке-хозяину, включающей такой химерный ген, где клетка-хозяин обладает способностью экспрессировать нуклеотидную последовательность, которая кодирует по меньшей мере один полипептид, необходимый для биосинтеза эпотилона. Согласно предпочтительному варианту рекомбинантная клетка-хозяин представляет собой бактерию, принадлежащую к отряду Actinomycetales, и согласно более предпочтительному варианту рекомбинантная клетка-хозяин представляет собой штамм Streptomyces. Согласно другому предпочтительному варианту рекомбинантная клетка-хозяин представляет собой любую другую бактерию, способную к ферментации, такую как псевдомонада или Е.coli. Кроме того, настоящее изобретение относится к клону Вас (бактериальная искусственная хромосома), включающему молекулу нуклеиновой кислоты по изобретению, предпочтительно к Вас-клону рЕРO15.
Другим объектом настоящего изобретения является выделенная молекула нуклеиновой кислоты, включающая нуклеотидную последовательность, которая кодирует домен эпотилон-синтазы.
Согласно одному из вариантов осуществления домен эпотилон-синтазы представляет собой домен β-кетоацилсинтазы (KS), содержащий аминокислотную последовательность, практически аналогичную аминокислотной последовательности, выбранной из ряда, включающего: аминокислоты 11-437 SEQ ID NO:2, аминокислоты 7-432 SEQ ID NO:4, аминокислоты 39-457 SEQ ID NO:5, аминокислоты 1524-1950 SEQ ID NO:5, аминокислоты 3024-3449 SEQ ID NO:5, аминокислоты 5103-5525 SEQ ID NO:5, аминокислоты 35-454 SEQ ID NO:6, аминокислоты 1522-1946 SEQ ID NO: 6 и аминокислоты 32-450 SEQ ID NO:7. Согласно этому варианту осуществления KS-домен предпочтительно содержит аминокислотную последовательность, выбранную из ряда, включающего: аминокислоты 11-437 SEQ ID NO:2, аминокислоты 7-432 SEQ ID NO:4, аминокислоты 39-457 SEQ ID NO:5, аминокислоты 1524-1950 SEQ ID NO:5, аминокислоты 3024-3449 SEQ ID NO:5, аминокислоты 5103-5525 SEQ ID NO:5, аминокислоты 35-454 SEQ ID NO:6, аминокислоты 1522-1946 SEQ ID NO: 6 и аминокислоты 32-450 SEQ ID NO:7. Кроме того, согласно этому варианту осуществления указанная нуклеотидная последовательность предпочтительно практически аналогична нуклеотидной последовательности, выбранной из ряда, включающего: нуклеотиды 7643-8920 SEQ ID NO:1, нуклеотиды 16269-17546 SEQ ID NO:1, нуклеотиды 21860-23116 SEQ ID NO:1, нуклеотиды 26318-27595 SEQ ID NO:1, нуклеотиды 30815-32092 SEQ ID NO:1, нуклеотиды 37052-38320 SEQ ID NO:1, нуклеотиды 43626-44885 SEQ ID NO:1, нуклеотиды 48087-49361 SEQ ID NO:1 и нуклеотиды 55028-56284 SEQ ID NO:1. Согласно этому варианту осуществления эта нуклеотидная последовательность более предпочтительно содержит область нуклеотидной последовательности, состоящую из 20, 25, 30, 35, 40, 45 или 50 (предпочтительно 20) последовательных пар оснований, идентичную области нуклеотидной последовательности, состоящей из 20, 25, 30, 35, 40, 45 или 50 (предпочтительно 20) последовательных пар оснований нуклеотидной последовательности, выбранной из ряда, включающего: нуклеотиды 7643-8920 SEQ ID NO:1, нуклеотиды 16269-17546 SEQ ID NO:1, нуклеотиды 21860-23116 SEQ ID NO:1, нуклеотиды 26318-27595 SEQ ID NO:1, нуклеотиды 30815-32092 SEQ ID NO:1, нуклеотиды 37052-38320 SEQ ID NO:1, нуклеотиды 43626-44885 SEQ ID NO:1, нуклеотиды 48087-49361 SEQ ID NO:1 и нуклеотиды 55028-56284 SEQ ID NO:1. Кроме того, согласно этому варианту осуществления эту нуклеотидную последовательность наиболее предпочтительно выбирают из ряда, включающего: нуклеотиды 7643-8920 SEQ ID NO:1, нуклеотиды 16269-17546 SEQ ID NO:1, нуклеотиды 21860-23116 SEQ ID NO:1, нуклеотиды 26318-27595 SEQ ID NO:1, нуклеотиды 30815-32092 SEQ ID NO:1, нуклеотиды 37052-38320 SEQ ID NO:1, нуклеотиды 43626-44885 SEQ ID NO:1, нуклеотиды 48087-49361 SEQ ID NO:1 и нуклеотиды 55028-56284 SEQ ID NO:1.
Согласно еще одному варианту осуществления домен эпотилон-синтазы представляет собой домен ацилтрансферазы (AT), содержащий аминокислотную последовательность, практически аналогичную аминокислотной последовательности, выбранной из ряда, включающего; аминокислоты 543-864 SEQ ID NO:2, аминокислоты 539-859 SEQ ID NO:4, аминокислоты 563-884 SEQ ID NO:5, аминокислоты 2056-2377 SEQ ID NO:5, аминокислоты 3555-3876 SEQ ID NO:5, аминокислоты 5631-5951 SEQ ID NO:5, аминокислоты 561-881 SEQ ID NO:6, аминокислоты 2053-2373 SEQ ID NO:6 и аминокислоты 556-877 SEQ ID NO:7. Согласно этому варианту осуществления этот АТ-домен предпочтительно содержит аминокислотную последовательность, выбранную из ряда, включающего: аминокислоты 543-864 SEQ ID NO:2, аминокислоты 539-859 SEQ ID NO:4, аминокислоты 563-884 SEQ ID NO:5, аминокислоты 2056-2377 SEQ ID NO:5, аминокислоты 3555-3876 SEQ ID NO:5, аминокислоты 5631-5951 SEQ ID NO:5, аминокислоты 561-881 SEQ ID NO:6, аминокислоты 2053-2373 SEQ ID NO:6 и аминокислоты 556-877 SEQ ID NO:7. Кроме того, согласно этому варианту осуществления указанная нуклеотидная последовательность практически аналогична нуклеотидной последовательности, выбранной из ряда, включающего: нуклеотиды 9236-10201 SEQ ID NO:1, нуклеотиды 17865-18827 SEQ ID NO:1, нуклеотиды 23431-24397 SEQ ID NO:1, нуклеотиды 27911-28876 SEQ ID NO:1, нуклеотиды 32408-33373 SEQ ID NO:1, нуклеотиды 38636-39598 SEQ ID NO:1, нуклеотиды 45204-46166 SEQ ID NO:1, нуклеотиды 49680-50642 SEQ ID NO:1 и нуклеотиды 56600-57565 SEQ ID NO:1. Согласно этому варианту осуществления эта нуклеотидная последовательность более предпочтительно содержит область нуклеотидной последовательности, состоящую из 20, 25, 30, 35, 40, 45 или 50 (предпочтительно 20) последовательных пар оснований, идентичную области нуклеотидной последовательности, состоящей из 20, 25, 30, 35, 40, 45 или 50 (предпочтительно 20) последовательных пар оснований нуклеотидной последовательности, выбранной из ряда, включающего: нуклеотиды 9236-10201 SEQ ID NO:1, нуклеотиды 17865-18827 SEQ ID NO:1, нуклеотиды 23431-24397 SEQ ID NO:1, нуклеотиды 27911-28876 SEQ ID NO:1, нуклеотиды 32408-33373 SEQ ID NO:1, нуклеотиды 38636-39598 SEQ ID NO:1, нуклеотиды 45204-46166 SEQ ID NO:1, нуклеотиды 49680-50642 SEQ ID NO:1 и нуклеотиды 56600-57565 SEQ ID NO:1.
Кроме того, согласно этому варианту осуществления эту нуклеотидную последовательность наиболее предпочтительно выбирают из ряда, включающего: нуклеотиды 9236-10201 SEQ ID NO:1, нуклеотиды 17865-18827 SEQ ID NO:1, нуклеотиды 23431-24397 SEQ ID NO:1, нуклеотиды 27911-28876 SEQ ID NO:1, нуклеотиды 32408-33373 SEQ ID NO:1, нуклеотиды 38636-39598 SEQ ID NO:1, нуклеотиды 45204-46166 SEQ ID NO:1, нуклеотиды 49680-50642 SEQ ID NO:1 и нуклеотиды 56600-57565 SEQ ID NO:1.
Согласно еще одному варианту осуществления домен эпотилон-синтазы представляет собой домен еноилредуктазы (ER), содержащий аминокислотную последовательность, практически аналогичную аминокислотной последовательности, выбранной из ряда, включающего: аминокислоты 974-1273 SEQ ID NO:2, аминокислоты 4433-4719 SEQ ID NO:5, аминокислоты 6542-6837 SEQ ID NO:5 и аминокислоты 1478-1790 SEQ ID NO:7. Согласно этому варианту осуществления этот ER-домен предпочтительно содержит аминокислотную последовательность, выбранную из ряда, включающего: аминокислоты 974-1273 SEQ ID NO:2, аминокислоты 4433-4719 SEQ ID NO:5, аминокислоты 6542-6837 SEQ ID NO:5 и аминокислоты 1478-1790 SEQ ID NO:7. Кроме того, согласно этому варианту осуществления указанная нуклеотидная последовательность предпочтительно практически аналогична нуклеотидной последовательности, выбранной из ряда, включающего: нуклеотиды 10529-11428 SEQ ID NO:1, нуклеотиды 35042-35902 SEQ ID NO:1, нуклеотиды 41369-42256 SEQ ID NO:1 и нуклеотиды 59366-60304 SEQ ID NO:1. Согласно этому варианту осуществления эта нуклеотидная последовательность более предпочтительно содержит область нуклеотидной последовательности, состоящую из 20, 25, 30, 35, 40, 45 или 50 (предпочтительно 20) последовательных пар оснований, идентичную области нуклеотидной последовательности, состоящей из 20, 25, 30, 35, 40, 45 или 50 (предпочтительно 20) последовательных пар оснований нуклеотидной последовательности, выбранной из ряда, включающего: нуклеотиды 10529-11428 SEQ ID NO:1, нуклеотиды 35042-35902 SEQ ID NO:1, нуклеотиды 41369-42256 SEQ ID NO:1 и нуклеотиды 59366-60304 SEQ ID NO:1. Кроме того, согласно этому варианту осуществления эту нуклеотидную последовательность наиболее предпочтительно выбирают из ряда, включающего: нуклеотиды 10529-11428 SEQ ID NO:1, нуклеотиды 35042-35902 SEQ ID NO:1, нуклеотиды 41369-42256 SEQ ID NO:1 и нуклеотиды 59366-60304 SEQ ID NO:1.
Согласно еще одному варианту осуществления домен эпотилон-синтазы представляет собой домен протеина-носителя ацила (АСР), содержащий аминокислотную последовательность, практически аналогичную аминокислотной последовательности, выбранной из ряда, включающего: аминокислоты 1314-1385 SEQ ID NO:2, аминокислоты 1722-1792 SEQ ID NO:4, аминокислоты 1434-1506 SEQ ID NO:5, аминокислоты 2932-3005 SEQ ID NO:5, аминокислоты 5010-5082 SEQ ID NO:5, аминокислоты 7140-7211 SEQ ID NO:5, аминокислоты 1430-1503 SEQ ID NO:6. аминокислоты 3673-3745 SEQ ID NO:6 и аминокислоты 2093-2164 SEQ ID NO:7. Согласно этому варианту осуществления этот АСР-домен предпочтительно содержит аминокислотную последовательность, выбранную из ряда, включающего: аминокислоты 1314-1385 SEQ ID NO:2, аминокислоты 1722-1792 SEQ ID NO:4, аминокислоты 1434-1506 SEQ ID NO:5, аминокислоты 2932-3005 SEQ ID NO:5, аминокислоты 5010-5082 SEQ ID NO:5, аминокислоты 7140-7211 SEQ ID NO:5, аминокислоты 1430-1503 SEQ ID NO:6, аминокислоты 3673-3745 SEQ ID NO:6 и аминокислоты 2093-2164 SEQ ID NO:7. Кроме того, согласно этому варианту осуществления указанная нуклеотидная последовательность практически аналогична нуклеотидной последовательности, выбранной из ряда, включающего: нуклеотиды 11549-11764 SEQ ID NO:1, нуклеотиды 21414- 21626 SEQ ID NO:1, нуклеотиды 26045-26263 SEQ ID NO:1, нуклеотиды 30539-30759 SEQ ID NO:1, нуклеотиды 36773-36991 SEQ ID NO:1, нуклеотиды 43163-43378 SEQ ID NO:1, нуклеотиды 47811-48032 SEQ ID NO:1, нуклеотиды 54540-54758 SEQ ID NO:1 и нуклеотиды 61211-61426 SEQ ID NO:1. Согласно этому варианту осуществления эта нуклеотидная последовательность более предпочтительно содержит область нуклеотидной последовательности, состоящую из 20, 25, 30, 35, 40, 45 или 50 (предпочтительно 20) последовательных пар оснований, идентичную области нуклеотидной последовательности, состоящей из 20, 25, 30, 35, 40, 45 или 50 (предпочтительно 20) последовательных пар оснований нуклеотидной последовательности, выбранной из ряда, включающего: нуклеотиды 11549-11764 SEQ ID NO:1, нуклеотиды 21414-21626 SEQ ID NO:1, нуклеотиды 26045-26263 SEQ ID NO:1, нуклеотиды 30539-30759 SEQ ID NO:1, нуклеотиды 36773-36991 SEQ ID NO:1, нуклеотиды 43163-43378 SEQ ID NO:1, нуклеотиды 47811-48032 SEQ ID NO:1, нуклеотиды 54540-54758 SEQ ID NO:1 и нуклеотиды 61211-61426 SEQ ID NO:1. Кроме того, согласно этому варианту осуществления эту нуклеотидную последовательность наиболее предпочтительно выбирают из ряда, включающего: нуклеотиды 11549-11764 SEQ ID NO:1, нуклеотиды 21414-21626 SEQ ID NO:1, нуклеотиды 26045-26263 SEQ ID NO:1, нуклеотиды 30539-30759 SEQ ID NO:1, нуклеотиды 36773-36991 SEQ ID NO:1, нуклеотиды 43163-43378 SEQ ID NO:1, нуклеотиды 47811-48032 SEQ ID NO:1, нуклеотиды 54540-54758 SEQ ID NO:1, нуклеотиды 61211-61426 SEQ ID NO:1.
Согласно еще одному варианту осуществления домен эпотилон-синтазы представляет собой домен дегидратазы (DH), содержащий аминокислотную последовательность, практически аналогичную аминокислотной последовательности, выбранной из ряда, включающего: аминокислоты 869-1037 SEQ ID NO:4, аминокислоты 3886-4048 SEQ ID NO:5, аминокислоты 5964-6132 SEQ ID NO:5, аминокислоты 2383-2551 SEQ ID NO:6 и аминокислоты 887-1051 SEQ ID NO:7. Согласно этому варианту осуществления этот DH-домен предпочтительно содержит аминокислотную последовательность, выбранную из ряда, включающего: аминокислоты 869-1037 SEQ ID NO:4, аминокислоты 3886-4048 SEQ ID NO:5, аминокислоты 5964-6132 SEQ ID NO:5, аминокислоты 2383-2551 SEQ ID NO:6 и аминокислоты 887-1051 SEQ ID NO:7. Кроме того, согласно этому варианту осуществления указанная нуклеотидная последовательность предпочтительно практически аналогична нуклеотидной последовательности, выбранной из ряда, включающего: нуклеотиды 18855-19361 SEQ ID NO:1, нуклеотиды 33401-33889 SEQ ID NO:1, нуклеотиды 39635-40141 SEQ ID NO:1, нуклеотиды 50670-51176 SEQ ID NO:1 и нуклеотиды 57593-58087 SEQ ID NO:1. Согласно этому варианту осуществления эта нуклеотидная последовательность более предпочтительно содержит область нуклеотидной последовательности, состоящую из 20, 25, 30, 35, 40, 45 или 50 (предпочтительно 20) последовательных пар оснований, идентичную области нуклеотидной последовательности, состоящей из 20, 25, 30, 35, 40, 45 или 50 (предпочтительно 20) последовательных пар оснований нуклеотидной последовательности, выбранной из ряда, включающего: нуклеотиды 18855-19361 SEQ ID NO:1, нуклеотиды 33401-33889 SEQ ID NO:1, нуклеотиды 39635-40141 SEQ ID NO:1, нуклеотиды 50670-51176 SEQ ID NO:1 и нуклеотиды 57593-58087 SEQ ID NO:1. Кроме того, согласно этому варианту осуществления эту нуклеотидную последовательность наиболее предпочтительно выбирают из ряда, включающего: нуклеотиды 18855-19361 SEQ ID NO:1, нуклеотиды 33401-33889 SEQ ID NO:1, нуклеотиды 39635-40141 SEQ ID NO:1, нуклеотиды 50670-51176 SEQ ID NO:1 и нуклеотиды 57593-58087 SEQ ID NO:1.
Согласно еще одному варианту осуществления домен эпотилон-синтазы представляет собой домен β-кеторедуктазы (KR), содержащий аминокислотную последовательность, практически аналогичную аминокислотной последовательности, выбранной из ряда, включающего: аминокислоты 1439-1684 SEQ ID NO:4, аминокислоты 1147-1399 SEQ ID NO:5, аминокислоты 2645-2895 SEQ ID NO:5, аминокислоты 4729-4974 SEQ ID NO:5, аминокислоты 6857-7101 SEQ ID NO:5, аминокислоты 1143-1393 SEQ ID NO:6, аминокислоты 3392-3636 SEQ ID NO:6 и аминокислоты 1810-2055 SEQ ID NO:7. Согласно этому варианту осуществления KR-домен предпочтительно содержит аминокислотную последовательность, выбранную из ряда, включающего: аминокислоты 1439-1684 SEQ ID NO:4, аминокислоты 1147-1399 SEQ ID NO:5, аминокислоты 2645-2895 SEQ ID NO:5, аминокислоты 4729-4974 SEQ ID NO:5, аминокислоты 6857-7101 SEQ ID NO:5, аминокислоты 1143-1393 SEQ ID NO:6, аминокислоты 3392-3636 SEQ ID NO:6 и аминокислоты 1810-2055 SEQ ID NO:7. Кроме того, согласно этому варианту осуществления указанная нуклеотидная последовательность предпочтительно практически аналогична нуклеотидной последовательности, выбранной из ряда, включающего: нуклеотиды 20565-21302 SEQ ID NO:1, нуклеотиды 25184-25942 SEQ ID NO:1, нуклеотиды 29678-30429 SEQ ID NO:1, нуклеотиды 35930-36667 SEQ ID NO:1, нуклеотиды 42314-43048 SEQ ID NO:1, нуклеотиды 46950-47702 SEQ ID NO:1, нуклеотиды 53697-54431 SEQ ID NO:1 и нуклеотиды 60362-61099 SEQ ID NO:1. Согласно этому варианту осуществления эта нуклеотидная последовательность более предпочтительно содержит область нуклеотидной последовательности, состоящую из 20, 25, 30, 35, 40, 45 или 50 (предпочтительно 20) последовательных пар оснований, идентичную области нуклеотидной последовательности, состоящей из 20, 25, 30, 35, 40, 45 или 50 (предпочтительно 20) последовательных пар оснований нуклеотидной последовательности, выбранной из ряда, включающего: нуклеотиды 20565-21302 SEQ ID NO:1, нуклеотиды 25184-25942 SEQ ID NO:1, нуклеотиды 29678-30429 SEQ ID NO:1, нуклеотиды 35930-36667 SEQ ID NO:1, нуклеотиды 42314-43048 SEQ ID NO:1, нуклеотиды 46950-47702 SEQ ID NO:1, нуклеотиды 53697-54431 SEQ ID NO:1 и нуклеотиды 60362-61099 SEQ ID NO:1. Кроме того, согласно этому варианту осуществления эту нуклеотидную последовательность наиболее предпочтительно выбирают из ряда, включающего: нуклеотиды 20565-21302 SEQ ID NO:1, нуклеотиды 25184-25942 SEQ ID NO:1, нуклеотиды 29678-30429 SEQ ID NO:1, нуклеотиды 35930-36667 SEQ ID NO:1, нуклеотиды 42314-43048 SEQ ID NO:1, нуклеотиды 46950-47702 SEQ ID NO:1, нуклеотиды 53697-54431 SEQ ID NO:1 и нуклеотиды 60362-61099 SEQ ID NO:1.
Согласно дополнительному варианту осуществления домен эпотилон-синтазы представляет собой домен метилтрансферазы (МТ), содержащий аминокислотную последовательность, практически аналогичную аминокислотам 2671-3045 SEQ ID NO:6. Согласно этому варианту осуществления МТ-домен предпочтительно содержит аминокислоты 2671-3045 SEQ ID NO:6. Кроме того, согласно этому варианту осуществления указанная нуклеотидная последовательность предпочтительно практически аналогична нуклеотидам 51534-52657 SEQ ID NO:1. Согласно этому варианту осуществления эта нуклеотидная последовательность более предпочтительно содержит область нуклеотидной последовательности, состоящую из 20, 25, 30, 35, 40, 45 или 50 (предпочтительно 20) последовательных пар оснований, идентичную области нуклеотидной последовательности, состоящей из 20, 25, 30, 35, 40, 45 или 50 (предпочтительно 20) последовательных пар оснований нуклеотидной последовательности, представленной нуклеотидами 51534-52657 SEQ ID NO:1. Кроме того, согласно этому варианту осуществления эта нуклеотидная последовательность наиболее предпочтительно представляет собой нуклеотиды 51534-52657 SEQ ID NO:1.
Согласно еще одному варианту осуществления домен эпотилон-синтазы представляет собой домен тиоэстеразы (ТЕ), содержащий аминокислотную последовательность, практически аналогичную аминокислотам 2165-2439 SEQ ID NO:7. Согласно этому варианту осуществления ТЕ-домен предпочтительно содержит аминокислоты 2165-2439 SEQ ID NO:7. Кроме того, согласно этому варианту осуществления указанная нуклеотидная последовательность предпочтительно практически аналогична нуклеотидам 61427-62254 SEQ ID NO:1. Согласно этому варианту осуществления эта нуклеотидная последовательность более предпочтительно содержит область нуклеотидной последовательности, состоящую из 20, 25, 30, 35, 40, 45 или 50 (предпочтительно 20) последовательных пар оснований, идентичную области нуклеотидной последовательности, состоящей из 20, 25, 30, 35, 40, 45 или 50 (предпочтительно 20) последовательных пар оснований нуклеотидной последовательности, представленной нуклеотидами 61427-62254 SEQ ID NO:1. Кроме того, согласно этому варианту осуществления эта нуклеотидная последовательность наиболее предпочтительно представляет собой нуклеотиды 61427-62254 SEQ ID NO:1.
Согласно еще одному варианту осуществления настоящее изобретение относится к выделенной молекуле нуклеиновой кислоты, включающей нуклеотидную последовательность, которая кодирует нерибосомную кислота-аминокислота-лигазу, где аминокислотная последовательность этой нерибосомной кислота-аминокислота-лигазы содержит аминокислотную последовательность, практически аналогичную аминокислотной последовательности, выбранной из ряда, включающего: SEQ ID NO:3, аминокислоты 72-81 SEQ ID NO:3, аминокислоты 118-125 SEQ ID NO:3, аминокислоты 199-212 SEQ ID NO:3, аминокислоты 353-363 SEQ ID NO:3, аминокислоты 549-565 SEQ ID NO:3, аминокислоты 588-603 SEQ ID NO:3, аминокислоты 669-684 SEQ ID NO:3, аминокислоты 815-821 SEQ ID NO:3, аминокислоты 868-892 SEQ ID NO:3, аминокислоты 903-912 SEQ ID NO:3, аминокислоты 918-940 SEQ ID NO:3, аминокислоты 1268-1274 SEQ ID NO:3, аминокислоты 1285-1297 SEQ ID NO:3, аминокислоты 973-1256 SEQ ID NO:3 и аминокислоты 1344-1351 SEQ ID NO:3. Согласно этому варианту осуществления нерибосомная кислота-аминокислота-лигаза предпочтительно содержит аминокислотную последовательность, выбранную из ряда, включающего: SEQ ID NO:3, аминокислоты 72-81 SEQ ID NO:3, аминокислоты 118-125 SEQ ID NO:3, аминокислоты 199-212 SEQ ID NO:3, аминокислоты 353-363 SEQ ID NO:3, аминокислоты 549-565 SEQ ID NO:3, аминокислоты 588-603 SEQ ID NO:3, аминокислоты 669-684 SEQ ID NO:3, аминокислоты 815-821 SEQ ID NO:3, аминокислоты 868-892 SEQ ID NO:3, аминокислоты 903-912 SEQ ID NO:3, аминокислоты 918-940 SEQ ID NO:3, аминокислоты 1268-1274 SEQ ID NO:3, аминокислоты 1285-1297 SEQ ID NO:3, аминокислоты 973-1256 SEQ ID NO:3 и аминокислоты 1344-1351 SEQ ID NO:3. Кроме того, согласно этому варианту осуществления указанная нуклеотидная последовательность предпочтительно практически аналогична нуклеотидной последовательности, выбранной из ряда, включающего: нуклеотиды 11872-16104 SEQ ID NO:1, нуклеотиды 12085-12114 SEQ ID NO:1, нуклеотиды 12223-12246 SEQ ID NO:1, нуклеотиды 12466-12507 SEQ ID NO:1, нуклеотиды 12928-12960 SEQ ID NO:1, нуклеотиды 13516-13566 SEQ ID NO:1, нуклеотиды 13633-13680 SEQ ID NO:1, нуклеотиды 13876-13923 SEQ ID NO:1, нуклеотиды 14313-14334 SEQ ID NO:1, нуклеотиды 14473-14547 SEQ ID NO:1, нуклеотиды 14578-14607 SEQ ID NO:1, нуклеотиды 14623-14692 SEQ ID NO:1, нуклеотиды 15673-15693 SEQ ID NO:1, нуклеотиды 15724-15762 SEQ ID NO:1, нуклеотиды 14788-15639 SEQ ID NO:1 и нуклеотиды 15901-15924 SEQ ID NO:1. Согласно этому варианту осуществления эта нуклеотидная последовательность более предпочтительно содержит область нуклеотидной последовательности, состоящую из 20, 25, 30, 35, 40, 45 или 50 (предпочтительно 20) последовательных пар оснований, идентичную области нуклеотидной последовательности, состоящей из 20, 25, 30, 35, 40, 45 или 50 (предпочтительно 20) последовательных пар оснований нуклеотидной последовательности, выбранной из ряда, включающего: нуклеотиды 11872-16104 SEQ ID NO:1, нуклеотиды 12085-12114 SEQ ID NO:1, нуклеотиды 12223-12246 SEQ ID NO:1, нуклеотиды 12466-12507 SEQ ID NO:1, нуклеотиды 12928-12960 SEQ ID NO:1, нуклеотиды 13516-13566 SEQ ID NO:1, нуклеотиды 13633-13680 SEQ ID NO:1, нуклеотиды 13876-13923 SEQ ID NO:1, нуклеотиды 14313-14334 SEQ ID NO:1, нуклеотиды 14473-14547 SEQ ID NO:1, нуклеотиды 14578-14607 SEQ ID NO:1, нуклеотиды 14623-14692 SEQ ID NO:1, нуклеотиды 15673-15693 SEQ ID NO:1, нуклеотиды 15724-15762 SEQ ID NO:1, нуклеотиды 14788-15639 SEQ ID NO:1 и нуклеотиды 15901-15924 SEQ ID NO:1. Кроме того, согласно этому варианту осуществления эту нуклеотидную последовательность наиболее предпочтительно выбирают из ряда, включающего: нуклеотиды 11872-16104 SEQ ID NO:1, нуклеотиды 12085-12114 SEQ ID NO:1, нуклеотиды 12223-12246 SEQ ID NO:1, нуклеотиды 12466-12507 SEQ ID NO:1, нуклеотиды 12928-12960 SEQ ID NO:1, нуклеотиды 13516-13566 SEQ ID NO:1, нуклеотиды 13633-13680 SEQ ID NO:1, нуклеотиды 13876-13923 SEQ ID NO:1, нуклеотиды 14313-14334 SEQ ID NO:1, нуклеотиды 14473-14547 SEQ ID NO:1, нуклеотиды 14578-14607 SEQ ID NO:1, нуклеотиды 14623-14692 SEQ ID NO:1, нуклеотиды 15673-15693 SEQ ID NO:1, нуклеотиды 15724-15762 SEQ ID NO:1, нуклеотиды 14788-15639 SEQ ID NO:1 и нуклеотиды 15901-15924 SEQ ID NO:1.
Настоящее изобретение также относится к выделенной молекуле нуклеиновой кислоты, включающей нуклеотидную последовательность, которая кодирует полипептид, содержащий аминокислотную последовательность, выбранную из ряда, включающего последовательности SEQ ID NO:2-23.
Еще одним объектом изобретения являются способы получения рекомбинантных поликетидов, таких как эпотилоны, в количествах, достаточно больших для того, чтобы можно было произвести их очистку и применять в фармацевтических композициях, например, предназначенных для лечения рака. Основным преимуществом этих способов получения является хиральность полученных молекул; получение в трансгенных организмах позволяет избежать образования популяций рацемический смесей, в которых некоторые энантиомеры могут иметь пониженную активность. В частности, настоящее изобретение относится к способу гетерологичной экспрессии эпотилона в гетерологичном хозяине, который предусматривает: (а) интродукцию в хозяина химерного гена, включающего гетерологичную промоторную последовательность, функционально связанную с молекулой нуклеиновой кислоты по изобретению, которая включает нуклеотидную последовательность, которая кодирует по меньшей мере один полипептид, участвующий в биосинтезе эпотилона, и (б) выращивание хозяина в условиях, которые позволяют осуществить биосинтез эпотилона в хозяине. Настоящее изобретение также относится к способу получения эпотилона, предусматривающему: (а) экспрессию эпотилона в рекомбинантном хозяине с помощью вышеописанного способа и (б) экстракцию эпотилона из рекомбинантного хозяина.
Еще одним объектом изобретения является выделенный полипептид, включающий аминокислотную последовательность, которая содержит домен эпотилон-синтазы.
Согласно еще одному варианту осуществления домен эпотилон-синтазы представляет собой домен β-кетоацилсинтазы (KS), содержащий аминокислотную последовательность, практически аналогичную аминокислотной последовательности, выбранной из ряда, включающего: аминокислоты 11-437 SEQ ID NO:2, аминокислоты 7-432 SEQ ID NO:4, аминокислоты 39-457 SEQ ID NO:5, аминокислоты 1524-1950 SEQ ID NO:5, аминокислоты 3024-3449 SEQ ID NO:5, аминокислоты 5103-5525 SEQ ID NO:5, аминокислоты 35-454 SEQ ID NO:6, аминокислоты 1522-1946 SEQ ID NO: 6 и аминокислоты 32-450 SEQ ID NO:7. Согласно этому варианту осуществления KS-домен предпочтительно содержит аминокислотную последовательность, выбранную из ряда, включающего: аминокислоты 11-437 SEQ ID NO:2, аминокислоты 7-432 SEQ ID NO:4, аминокислоты 39-457 SEQ ID NO:5, аминокислоты 1524-1950 SEQ ID NO:5, аминокислоты 3024-3449 SEQ ID NO:5, аминокислоты 5103-5525 SEQ ID NO:5, аминокислоты 35-454 SEQ ID NO:6, аминокислоты 1522-1946 SEQ ID NO: 6 и аминокислоты 32-450 SEQ ID NO:7.
Согласно еще одному варианту осуществления домен эпотилон-синтазы представляет собой домен ацилтрансферазы (AT), содержащий аминокислотную последовательность, практически аналогичную аминокислотной последовательности, выбранной из ряда, включающего: аминокислоты 543-864 SEQ ID NO:2, аминокислоты 539-859 SEQ ID NO:4, аминокислоты 563-884 SEQ ID NO:5, аминокислоты 2056-2377 SEQ ID NO:5, аминокислоты 3555-3876 SEQ ID NO:5, аминокислоты 5631-5951 SEQ ID NO:5, аминокислоты 561-881 SEQ ID NO:6, аминокислоты 2053-2373 SEQ ID NO:6 и аминокислоты 556-877 SEQ ID NO:7. Согласно этому варианту осуществления АТ-домен предпочтительно содержит аминокислотную последовательность, выбранную из ряда, включающего: аминокислоты 543-864 SEQ ID NO:2, аминокислоты 539-859 SEQ ID NO:4, аминокислоты 563-884 SEQ ID NO:5, аминокислоты 2056-2377 SEQ ID NO:5, аминокислоты 3555-3876 SEQ ID NO:5, аминокислоты 5631-5951 SEQ ID NO:5, аминокислоты 561-881 SEQ ID NO:6, аминокислоты 2053-2373 SEQ ID NO:6 и аминокислоты 556-877 SEQ ID NO:7.
Согласно следующему варианту осуществления домен эпотилон-синтазы представляет собой домен еноилредуктазы (ER), содержащий аминокислотную последовательность, практически аналогичную аминокислотной последовательности, выбранной из ряда, включающего: аминокислоты 974-1273 SEQ ID NO:2, аминокислоты 4433-4719 SEQ ID NO:5, аминокислоты 6542-6837 SEQ ID NO:5 и аминокислоты 1478-1790 SEQ ID NO:7. Согласно этому варианту осуществления ER-домен предпочтительно содержит аминокислотную последовательность, выбранную из ряда, включающего: аминокислоты 974-1273 SEQ ID NO:2, аминокислоты 4433-4719 SEQ ID NO:5, аминокислоты 6542-6837 SEQ ID NO:5 и аминокислоты 1478-1790 SEQ ID NO:7.
Согласно еще одному варианту осуществления домен эпотилон-синтазы представляет собой домен протеина-носителя ацила (АСР), содержащий аминокислотную последовательность, практически аналогичную аминокислотной последовательности, выбранной из ряда, включающего: аминокислоты 1314-1385 SEQ ID NO:2, аминокислоты 1722-1792 SEQ ID NO:4, аминокислоты 1434-1506 SEQ ID NO:5, аминокислоты 2932-3005 SEQ ID NO:5, аминокислоты 5010-5082 SEQ ID NO:5, аминокислоты 7140-7211 SEQ ID NO:5, аминокислоты 1430-1503 SEQ ID NO:6, аминокислоты 3673-3745 SEQ ID NO:6 и аминокислоты 2093-2164 SEQ ID NO:7. Согласно этому варианту осуществления АСР-домен предпочтительно содержит аминокислотную последовательность, выбранную из ряда, включающего: аминокислоты 1314-1385 SEQ ID NO:2, аминокислоты 1722-1792 SEQ ID NO:4, аминокислоты 1434-1506 SEQ ID NO:5, аминокислоты 2932-3005 SEQ ID NO:5, аминокислоты 5010-5082 SEQ ID NO:5, аминокислоты 7140-7211 SEQ ID NO:5, аминокислоты 1430-1503 SEQ ID NO:6, аминокислоты 3673-3745 SEQ ID NO:6 и аминокислоты 2093-2164 SEQ ID NO:7.
Согласно еще одному варианту осуществления домен эпотилон-синтазы представляет собой домен дегидратазы (DH), содержащий аминокислотную последовательность, практически аналогичную аминокислотной последовательности, выбранной из ряда, включающего: аминокислоты 869-1037 SEQ ID NO:4, аминокислоты 3886-4048 SEQ ID NO:5, аминокислоты 5964-6132 SEQ ID NO:5, аминокислоты 2383-2551 SEQ ID NO:6 и аминокислоты 887-1051 SEQ ID NO:7. Согласно этому варианту осуществления DH-домен предпочтительно содержит аминокислотную последовательность, выбранную из ряда, включающего: аминокислоты 869-1037 SEQ ID NO:4, аминокислоты 3886-4048 SEQ ID NO:5, аминокислоты 5964-6132 SEQ ID NO:5, аминокислоты 2383-2551 SEQ ID NO:6 и аминокислоты 887-1051 SEQ ID NO:7.
И согласно еще одному варианту осуществления домен эпотилон-синтазы представляет собой домен β-кеторедуктазы (KR), содержащий аминокислотную последовательность, практически аналогичную аминокислотной последовательности, выбранной из ряда, включающего: аминокислоты 1439-1684 SEQ ID NO:4, аминокислоты 1147-1399 SEQ ID NO:5, аминокислоты 2645-2895 SEQ ID NO:5, аминокислоты 4729-4974 SEQ ID NO:5, аминокислоты 6857-7101 SEQ ID NO:5, аминокислоты 1143-1393 SEQ ID NO:6, аминокислоты 3392-3636 SEQ ID NO:6 и аминокислоты 1810-2055 SEQ ID NO:7. Согласно этому варианту осуществления KR-домен предпочтительно содержит аминокислотную последовательность, выбранную из ряда, включающего: аминокислоты 1439-1684 SEQ ID NO:4, аминокислоты 1147-1399 SEQ ID NO:5, аминокислоты 2645-2895 SEQ ID NO:5, аминокислоты 4729-4974 SEQ ID NO:5, аминокислоты 6857-7101 SEQ ID NO:5, аминокислоты 1143-1393 SEQ ID NO:6, аминокислоты 3392-3636 SEQ ID NO:6 и аминокислоты 1810-2055 SEQ ID NO:7.
Согласно дополнительному варианту осуществления домен эпотилон-синтазы представляет собой домен метилтрансферазы (МТ), содержащий аминокислотную последовательность, практически аналогичную аминокислотам 2671-3045 SEQ ID NO:6. Согласно этому варианту осуществления МТ-домен предпочтительно содержит аминокислоты 2671-3045 SEQ ID NO:6.
Согласно другому варианту осуществления домен эпотилон-синтазы представляет собой домен тиоэстеразы (ТЕ), содержащий аминокислотную последовательность, практически аналогичную аминокислотам 2165-2439 SEQ ID NO:7. Согласно этому варианту осуществления ТЕ-домен предпочтительно содержит аминокислоты 2165-2439 SEQ ID NO:7.
Другие объекты и преимущества настоящего изобретения станут очевидными специалистам в данной области после изучения следующего описания изобретения и не ограничивающих его объема примеров.
Определения
В описании настоящего изобретения используются следующие понятия, которые имеют указанные ниже значения.
"Функционально связанные/соединенные с": Относится к двум последовательностям ДНК, которые связаны физически или функционально. Например, говорят, что промотор или регуляторная последовательность ДНК "соединена с" последовательностью ДНК, которая кодирует РНК или протеин, если две последовательности функционально связаны или расположены так, что регуляторная последовательность ДНК может оказывать воздействие на уровень экспрессии кодирующей или структурной последовательности ДНК.
"Химерный ген": Рекомбинантная последовательность ДНК, в которой промотор или регуляторная последовательность ДНК функционально связаны или соединены с последовательностью ДНК, которая кодирует мРНК или которая экспрессируется в виде протеина, так что регуляторная последовательность ДНК обладает способностью регулировать транскрипцию или экспрессию связанной последовательности ДНК. Регуляторная последовательность ДНК химерного гена функционально связана или соединена с последовательностью ДНК не так, как это имеет место в естественных условиях.
Кодирующая последовательность ДНК: Последовательность ДНК, которая транслируется в организме с образованием протеина.
Домен: Часть поликетид-синтазы, необходимая для проявления определенной активности. Примеры включают домены протеина-носителя ацила (АСР), β-кетосинтазы (KS), ациилтрансферазы (AT), β-кеторедуктазы (KR), дегидратазы (DH), еноилредуктазы (ER) и тиоэстеразы (ТЕ).
Эпотилоны: 16-членные макроциклические поликетиды, которые в естественных условиях продуцируются штаммом бактерии Sorangium cellulosum So ce90, напоминающие по биологической активности таксол. В настоящем описании понятие "эпотилон" относится к классу поликетидов, который включает эпотилон А и эпотилон В, а также их аналоги, которые описаны в WO 98/25929.
Эпотилон-синтаза: Поликетид-синтаза, ответственная за биосинтез эпотилона.
Ген: Определенная область, которая локализована внутри генома и которая, помимо вышеуказанной кодирующей последовательности ДНК, включает другие, прежде всего регуляторные последовательности ДНК, ответственные за контроль экспрессии, т.е. за транскрипцию и трансляцию кодирующей области.
Гетерологичная последовательность ДНК: Последовательность ДНК, не встречающаяся в естественных условиях в клетке-хозяине, в который ее интродуцируют, включая не встречающиеся в естественных условиях множественные копии встречающейся в естественных условиях последовательности ДНК.
Гомологичная нуклеотидная последовательность: Последовательность ДНК, встречающаяся в естественных условиях в клетке-хозяине, в который ее интродуцируют.
Гомологичная рекомбинация: Реципрокный обмен фрагментами ДНК между гомологичными молекулами ДНК.
Выделенный: в контексте настоящего изобретения выделенная молекула нуклеиновой кислоты или выделенный фермент обозначает молекулу нуклеиновой кислоты или фермент, которые благодаря человеку существуют вне их естественного окружения и, следовательно, не являются природными продуктами. Выделенная молекула нуклеиновой кислоты или фермент могут существовать в очищенной форме или могут существовать в неестественном окружении, таком как, например, рекомбинантная клетка-хозяин.
Модуль: Генетический элемент, кодирующий все различные виды активностей, необходимые для одного цикла биосинтеза поликетида, т.е. одной стадии конденсации и всех связанных с этим стадий процессинга β-карбонила. Каждый модуль кодирует активность АСР, KS и AT, которые необходимы для осуществления стадии конденсации пути биосинтеза и определенные активности, необходимые для осуществления следующих за конденсацией стадий процессинга β-карбонила.
NRPS: Нерибосомная кислота-аминокислота-лигаза, которая представляет собой комплекс ферментативных активностей, ответственных за включение аминокислот во вторичные метаболиты, включая, например, домены аденилирования аминокислот, эпимеризации, N-метилирования, циклизации, протеина-носителя пептидила и конденсации. Функционально активная NRPS катализирует включение аминокислоты во вторичный метаболит.
Ген NRPS: Один или несколько генов, кодирующих NRPS, что приводит к получению функционально активных вторичных метаболитов, например эпотилонов А и В, когда они находятся под контролем одного или нескольких совместимых контролирующих элементов.
Молекула нуклеиновой кислоты: Линейный сегмент одно- или двухцепочечной ДНК или РНК, который может быть выделен из любого источника. В контексте настоящего изобретения молекула нуклеиновой кислоты предпочтительно представляет собой сегмент ДНК.
ORF: Открытая рамка считывания
PKS: Поликетид-синтаза, которая представляет собой комплекс ферментативных активностей (доменов), ответственных за биосинтез поликетидов, включая, например, кеторедуктазу, дегидратазу, протеин-носитель ацила, еноилредуктазу, кетоацил-АСР-синтазу и ацилтрансферазу. Функционально активная PKS представляет собой синтазу, которая катализирует синтез поликетида.
Гены PKS: Один или несколько генов, кодирующих различные полипептиды, необходимые для получения функционально активных поликетидов, например эпотилонов А и В, когда они находятся под контролем одного или нескольких совместимых контролирующих элементов.
Практически аналогичная: в отношении нуклеиновых кислот относится к молекуле нуклеиновой кислоты, последовательность которой по меньшей мере на 60% идентична молекуле нуклеиновой кислоты, с которой проводится сравнение. В предпочтительном варианте осуществления практически аналогичная молекула ДНК по меньшей мере на 80% идентична молекуле ДНК, с которой проводится сравнение; в более предпочтительном варианте осуществления практически аналогичная молекула ДНК 90% идентична молекуле ДНК, с которой проводится сравнение; и в наиболее предпочтительном варианте осуществления практически аналогичная молекула ДНК по меньшей мере на 95% идентична молекуле ДНК, с которой проводится сравнение. Практически аналогичная последовательность ДНК предпочтительно кодирует протеин или пептид, имеющий практически такую же активность, что и протеин или пептид, кодируемый последовательностью ДНК, с которой проводится сравнение. Практически аналогичная нуклеотидная последовательность, как правило, гибридизуется с молекулой нуклеиновой кислоты, с которой проводится сравнение, или с ее фрагментом при следующих условиях: гибридизация в 7%-ном додецилсульфате натрия (ДСН), 0,5М NaPO4, pH 7,0, 1 мМ ЭДТК при 50°С; отмывка двукратным SSC (2xSSC), 1%-ным ДСН при 50°С. В отношении протеинов или пептидов практически аналогичная аминокислотная последовательность обозначает аминокислотную последовательность, которая по меньшей мере на 90% идентична аминокислотной последовательности протеина или пептида, с которым проводится сравнение, и обладает практически такой же активностью, что и активность протеина или пептида, с которым проводится сравнение.
Трансформация: Процесс интродукции гетерологичной нуклеиновой кислоты в клетку-хозяина или в организм.
Трансформированный/трансгенный/рекомбинантный: Относится к организму хозяина, такому, как бактерия, в который интродуцирована гетерологичная молекула нуклеиновой кислоты. Молекула нуклеиновой кислоты может быть стабильно интегрирована в геном хозяина, или молекула нуклеиновой кислоты также может присутствовать в виде внехромосомной молекулы. Такая внехромосомная молекула может представлять собой самореплицирующуся молекулу. Подразумевается, что понятие трансформированные клетки, ткани или растения включает не только конечный продукт процесса трансформации, но также и их трансгенное потомство. Понятия "нетрансформированный", "нетрансгенный" или "нерекомбинантный" хозяин обозначает организм дикого типа, например бактерию, который не содержит гетерологичную молекулу нуклеиновой кислоты.
Нуклеотиды обозначены по их основаниям с помощью следующих стандартных сокращений: аденин (А), цитозин (С), тимин (Т) и гуанин (G). Аминокислоты также обозначены следующими стандартными сокращениям: аланин (Ala; А), аргинин (Arg; R), аспарагин (Asn; N), аспарагиновая кислота (Asp; D), цистеин (Cys; С), глутамин (Gln; Q), глутаминовая кислота (Glu; E), глицин (Gly; G), гистидин (His; H), изолейцин (Ile; I), лейцин (Leu; L), лизин (Lys; К), метионин (Met, М), фенилаланин (Phe, F); пролин (Pro, Р); серин (Ser, S); треонин (Thr, Т); триптофан (Trp; W), тирозин (Tyr; Y) и валин (Val; V). Кроме того, (Хаа; X) обозначает любую аминокислоту.
Описание последовательностей, приведенных в перечне последовательности
SEQ ID NO:1 представляет собой нуклеотидую последовательность длиной 68750 пар оснований в виде набора последовательностей фрагментов, содержащего 22 открытые рамки считывания (ORF), которая включает гены биосинтеза эпотилона.
SEQ ID NO:2 представляет собой последовательность протеина поликетид-синтазы типа I (EPOS А), кодируемую ероА (нуклеотиды 7610-11875 SEQ ID NO:1).
SEQ ID NO:3 представляет собой последовательность протеина нерибосомной кислота-аминокислота-лигазы (EPOS Р), кодируемой ероР (нуклеотиды 11872-16104 SEQ ID NO:1).
SEQ ID NO:4 представляет собой последовательность протеина поликетид-синтазы типа I (EPOS В), кодируемую ероВ (нуклеотиды 16251-21749 SEQ ID NO:1).
SEQ ID NO:5 представляет собой последовательность протеина поликетид-синтазы типа I (EPOS С), кодируемую ероС (нуклеотиды 21746-43519 SEQ ID NO:1).
SEQ ID NO:6 представляет собой последовательность протеина поликетид-синтазы типа I (EPOS D), кодируемую epoD (нуклеотиды 43524-54920 SEQ ID NO:1).
SEQ ID NO:7 представляет собой последовательность протеина поликетид-синтазы типа I (EPOS E), кодируемую ероЕ (нуклеотиды 54935-62254 SEQ ID NO:1).
SEQ ID NO:8 представляет собой последовательность протеина гомолога цитохром Р450 оксидазы (EPOS F), кодируемую epoF (нуклеотиды 62369-63628 SEQ ID NO:1).
SEQ ID NO:9 представляет собой последовательность протеина (частичная Orf 1), кодируемую orf1 (нуклеотиды 1-1826 SEQ ID NO:1).
SEQ ID NO:10 представляет собой последовательность протеина (Orf 2), кодируемую orf2 (нуклеотиды 3171-1900 на обратной комплементарной цепи SEQ ID NO:1).
SEQ ID NO:11 представляет собой последовательность протеина (Orf 3), кодируемую orf3 (нуклеотиды 3415-5556 SEQ ID NO:1).
SEQ ID NO:12 представляет собой последовательность протеина (Orf 4), кодируемую orf4 (нуклеотиды 5992-5612 обратной комплементарной цепи SEQ ID NO:1).
SEQ ID NO:13 представляет собой последовательность протеина (Orf 5), кодируемую orf5 (нуклеотиды 6226-6675 SEQ ID NO:1).
SEQ ID NO:14 представляет собой последовательность протеина (Orf 6), кодируемую orf6 (нуклеотиды 63779-64333 SEQ ID NO:1).
SEQ ID NO:15 представляет собой последовательность протеина (Orf 7), кодируемую orf7 (нуклеотиды 64290-63853 обратной комплементарной цепи SEQ ID NO:1).
SEQ ID NO:16 представляет собой последовательность протеина (Orf 8), кодируемую orf8 (нуклеотиды 64363-64920 SEQ ID NO:1).
SEQ ID NO:17 представляет собой последовательность протеина (Orf 9), кодируемую orf9 (нуклеотиды 64727-64287 обратной комплементарной цепи SEQ ID NO:1).
SEQ ID NO:18 представляет собой последовательность протеина (Orf 10), кодируемую orf10 (нуклеотиды 65063-65767 SEQ ID NO:1).
SEQ ID NO:19 представляет собой последовательность протеина (Orf 11), кодируемую orf11 (нуклеотиды 65874-65008 обратной комплементарной цепи SEQ ID NO:1).
SEQ ID NO:20 представляет собой последовательность протеина (Orf 12), кодируемую orf12 (нуклеотиды 66338-65871 обратной комплементарной цепи SEQ ID NO:1).
SEQ ID NO:21 представляет собой последовательность протеина (Orf 13), кодируемую orf13 (нуклеотиды 66667-67137 SEQ ID NO:1).
SEQ ID NO:22 представляет собой последовательность протеина (Orf 14), кодируемую encoded by orf14 (нуклеотиды 67334-68251 SEQ ID NO:1).
SEQ ID NO:23 представляет собой частичную последовательность протеина (частичная Orf 15), кодируемую orf15 (нуклеотиды 68346-68750 SEQ ID NO:1).
SEQ ID NO:24 представляет собой последовательность универсального "обратного" (обеспечивающего синтез против хода транскрипции) ПЦР-праймера.
SEQ ID NO:25 представляет собой последовательность универсального "прямого" (обеспечивающего синтез по ходу транскрипции) ПЦР-праймера.
SEQ ID NO:26 представляет собой последовательность ПЦР-праймера "В" NH24-конца.
SEQ ID NO:27 представляет собой последовательность ПЦР-праймера "А" NH2-конца.
SEQ ID NO:28 представляет собой последовательность ПЦР-праймера "В" NH2-конца.
SEQ ID NO:29 представляет собой последовательность ПЦР-праймера "В" pEPO15-NH6-конца.
SEQ ID NO:30 представляет собой последовательность ПЦР-праймера "А" рЕРO15-Н2.7-конца.
Информации о депонировании
Следующие продукты были депонированы в Agricultural Research Service, Patent Culture Collection (NRRL), 1815 North University Street, Peoria, Illinois 61604, в соответствии с Будапештским договором о международном признании депонирования микроорганизмов для целей процедуры патентования (the Budapest Treaty on the International Recognition of the Deposit of Microorganisms for the Purposes of Patent Procedure). Все ограничения по доступности депонированного продукта должны быть бесповоротно устранены после выдачи патента.
Подробное описание изобретения
Гены, принимающие участие в биосинтезе эпотилонов, могут быть выделены с использованием способов по настоящему изобретению. Согласно наиболее предпочтительной процедуре выделения генов биосинтеза эпотилонов требуется выделение геномной ДНК из организма, выявленного в качестве продуцента эпотилонов А и В, и перенос выделенной ДНК с использованием пригодных плазмиды или вектора в организм-хозяин, который в норме не продуцирует поликетид, с последующей идентификацией колоний трансформированного хозяина, которым придана способность продуцировать эпотилон. С использованием такой методики, как λ::Тn5-транспозонный мутагенез (de Bruijn и Lupski, Gene 27: 131-149 (1984)), может быть более точно определена конкретная область трансформирующей, обусловливающей синтез эпотилона ДНК. В альтернативном или в дополнительном варианте трансформирующая, обусловливающая синтез эпотилона ДНК, может быть расщеплена на более мелкие фрагменты и наименьший из них, который сохраняет способность обусловливать синтез эпотилона, может быть дополнительно охарактеризован. В то время как организм-хозяин, лишенный способности продуцировать эпотилон, может представлять собой виды, отличные от организма, из которого поликетид получен, вариация этого способа включает трансформацию ДНК хозяина этого же самого хозяина, у которого способность продуцировать эпотилон нарушена в результате мутагенеза. Согласно этому варианту способа продуцирующий эпотилон организм подвергают мутации и выделяют мутанты, не способные продуцировать эпотилон. Затем их подвергают комплементации с помощью геномной ДНК, выделенной из продуцирующего эпотилон родительского штамма.
Еще один пример метода, который может использоваться для выделения генов, необходимых для биосинтеза эпотилона, основан на транспозонном мутагенезе для получения мутантов продуцирующего эпотилон организма, которые после мутагенеза теряют способность продуцировать поликетид. Например, область генома хозяина, ответственную за производство эпотилона, метят с помощью транспозона, и она может быть выделена и применяться в качестве зонда для выделения нативных генов из родительского штамма. PKS-гены, которые необходимы для синтеза поликетидов и которые аналогичны известным PKS-генам, могут быть выделены на основе гомологии их последовательности с генами биосинтеза, последовательность которых является известной, например, с генами биосинтеза рифамицина или сорафена. Методы, пригодные для выделения на основе гомологии, включают стандартный скрининг библиотеки путем гибридизации ДНК.
Предпочтительным для применения в качестве молекулы-зонда является фрагмент ДНК, который может быть получен из гена или другой последовательности ДНК, которая играет роль в синтезе известного поликетида. Предпочтительная молекула-зонд включает ДНК-фрагмент Smal длиной 1,2 т.п.н., кодирующий домен кетосинтазы четвертого модуля PKS сорафена (патент US 5716849), и более предпочтительная молекула-зонд включает домены β-кетоацилсинтазы из первого и второго модулей PKS рифамицина (Schupp и др., FEMS Microbiology Letters 159: 201-207 (1998)). Они могут использоваться в качестве зонда библиотеки генов продуцирующего эпотилон микроорганизма для выделения PKS-генов, ответственных за биосинтез эпотилона.
Несмотря на хорошо известные трудности, связанные с выделением PKS-генов в целом, и несмотря на трудности, которые, как ожидается, должны быть связаны с выделением генов биосинтеза эпотилона, в частности, с помощью способов, представленных в настоящем описании, неожиданно было установлено, что гены биосинтеза эпотилонов А и В могут быть клонированы из микроорганизма, продуцирующего поликетид. С помощью способов манипуляции генами и получения рекомбинантов, которые приведены в настоящем описании, клонированные PKS-гены могут быть модифицированы и экспрессированы в трансгенных организмах-хозяевах.
Выделенные гены биосинтеза эпотилона могут экспрессироваться в гетерологичных хозяевах, обладающих способностью продуцировать поликетид с повышенной эффективностью по сравнению с той, которую можно ожидать в нативных хозяевах. Методики таких генетических манипуляций специфичны для различных доступных хозяев и известны в данной области. Например, гетерологичные гены могут экспрессироваться в Streptomyces и в других актиномицетах с использованием методов, описанных у McDaniel и др., Science 262: 1546-1550 (1993) и Као и др., Science 265: 509-512 (1994), обе публикации включены в настоящее описание в виде ссылки, см. также Rowe и др., Gene 216: 215-223 (1998); Holmes и др., EMBO Journal 12(8); 3183-3191 (1993) и Bibb и др., Gene 38: 215-226 (1985), все публикации включены в настоящее описание в виде ссылки.
В альтернативном варианте гены, ответственные за биосинтез поликетидов, т.е. гены биосинтеза эпотилона, также могут экспрессироваться в других организмах-хозяевах, таких как псевдомонады и Е.coli. Методики таких генетических манипуляций специфичны для различных доступных хозяев и известны в данной области. Например, PKS-гены были с успехом экспрессированы в Е.coli с использованием вектора рТ7-7, в котором используется промотор фага Т7 (см. Tabor и др., Proc. Natl. Acad. Sci. USA 82: 1074-1078 (1985), публикации включены в настоящее описание в виде ссылки. Кроме того, экспрессионные векторы рКК.223-3 и рКК.223-2 могут применяться для экспрессии гетерологичных генов в Е.coli, либо в транскрипционном, либо в трансляционном слиянии, под контролем промотора tac или trc. Для экспрессии оперонов, кодирующих множество ORF, самый простой метод основан на встраивании оперона в такой вектор, как рКК223-3, в транскрипционном слиянии, что позволяет использовать родственный сайг связывания рибосомы гетерологичных генов. Методы сверхэкспрессии в грамположительных видах, таких как Bacillus, также являются известными в данной области и могут применяться согласно настоящему изобретению (Quax и др., в: Industrial Microorganisms: Basic and Applied Molecular Genetics, ред. Baltz и др., American Society for Microbiology, Washington (1993)).
Другие системы экспрессии, которые могут применяться с генами биосинтеза эпотилона по изобретению, включают системы экспрессии дрожжей и бакуловирусов (см., например, "The Expression of Recombinant Proteins in Yeasts", Sudbery, P.E., Curr. Opin. Biotechnol. 7(5): 517-524 (1996); "Methods for Expressing Recombinant Proteins in Yeast, Mackay, и др., ред.: Carey, Paul R., Protein Eng. Des. 105-153, Publisher: Academic, San Diego, Calif (1996); "Expression of heterologous gene products in yeast", Pichuantes, и др., ред.: Cleland, J. L., Craik, C. S., Protein Eng. 129-161, Publisher: Wiley-Liss, New York, N. Y (1996); WO 98/27203; Kealey и др., Proc. Natl. Acad. Sci. USA 95: 505-509 (1998); "Insect Cell Culture: Recent Advances, Bioengineering Challenges And Implications In Protein Production", Palomares, и др., ред.: Galindo, Enrique; Ramirez, Octavio Т., Adv. Bioprocess Eng. Vol.II, Invited Pap.Int. Symp., 2-й (1998) 25-52, изд.: Kluwer, Dordrecht, Neth; "Baculovirus Expression Vectors", Jarvis, Donald L., ред: Miller, Lots K., Baculoviruses 389-431, изд.: Plenum, New York, N. Y. (1997); "Production Of Heterologous Proteins Using The Baculovirus/Insect Expression System", Grittiths, и др., Methods Mol. Biol. (Totowa, N.J.) 75 (Basic Cell Culture Protocols (2-е изд.) 427-440 (1997); и "Insect Cell Expression Technology", Luckow, Verne A., Protein Eng. 183-218, изд.: Wiley-Liss, New York, N.Y. (1996); все эти публикации включены в настоящее описание в виде ссылки.
Другим важным фактором для экспрессии PKS-генов в гетерологичном хозяине является необходимость наличия ферментов для посттрансляционной модификации ферментов PKS путем фосфопантетеинилирования до того, как они смогут синтезировать поликетиды. Однако ферменты, ответственные за модификацию ферментов PKS типа I, фосфопантетеинил (Р-pant)-трансферазы, в норме не присутствуют во многих хозяевах, таких как E.coli. Эта проблема может быть решена путем совместной экспрессии P-pant-трансферазы и PKS-генов в гетерологичном хозяине, как описано у Kealey и др., Proc. Natl. Acad. Sci. USA 95: 505-509 (1998), публикация включена в настоящее описание в виде ссылки.
Таким образом, для получения поликетидов важными критериями выбора организма-хозяина являются простота манипуляции с ним, быстрый рост (т.е. ферментация), наличие или пригодность молекулярного механизма для таких процессов, как посттрансляционная модификация, и отсутствие у него чувствительности к поликетиду при его сверхпроизводстве. Наиболее предпочтительными организмами являются актиномицеты, такие как штаммы Streptomyces. Другими предпочтительными организмами-хозяева являются Pseudomonads и Е.coli. Перечисленные выше способы получения поликетидов имеют значительные преимущества по сравнению с известными к настоящему времени методами, применяемые для получения этих соединений. Эти преимущества включают существенно меньшую стоимость получения, возможность получать большие количества соединений и возможность получать соединения в виде предпочтительных с точки зрения биологической активности энантиомеров в противоположность рацемическим смесям, неизбежно получаемым с помощью органического синтеза. Соединения, которые продуцируются гетерологичными хозяевами, могут применяться в медицинской (например, для лечения рака в случае эпотилонов), а также в сельскохозяйственной практике.
Экспериментальная часть
Изобретение дополнительно описано со ссылкой на приведенные ниже подробные примеры. Эти примеры даны только с целью иллюстрации и не направлены на ограничение каким-либо образом объема изобретения, если не указано иное. Стандартные примененные методы рекомбинантной ДНК и молекулярного клонирования являются хорошо известными в данной области и описаны у Ausubel (ред.), Current Protocols in Molecular Biology, John Wiley and Sons, Inc. (1994); Т. Maniatis, Е. F. Fritsch и у J. Sambrook, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor laboratory, Cold Spring Harbor, NY (1989); и у T.J.Silhavy, M.L.Berman и L.W.Enquist, Experiments with Gene Fusions, Cold Spring Harbor Laboratory, Cold Spring Harbor, NY (1984).
Пример 1: Культивирование продуцирующего эпотилон штамма Sorangium cellulosum
Штамм Sorangium cellulosum strain 90 (DSM 6773, Немецкая коллекция микроорганизмов и клеточных культур, Брауншвейг (Deutsche Sammlung von Mikroorganismen und Zellkulturen, Braunschweig)) сеют штрихом и выращивают (30°С) на агаровой пластинке в среде SolE (0,35% глюкозы, 0,05% триптона, 0,15% MgSO4·7H2O, 0,05% сульфата аммония, 0,1% CaCl2, 0,006% К2НРО4, 0,01% дитионата натрия, 0,0008% Fe-ЭДТК, 1,2% HEPES, 3,5% [об./об.] супернатанта стерилизованной стационарной культуры S.cellulosum) pH до 7,4. Отбирают клетки с площади примерно 1 см2 и инокулируют в 5 мл жидкой среды G51t (0,2% глюкозы, 0,5% крахмала, 0,2% триптона, 0,1% пробиона S, 0,05% CaCl2·2H2O, 0,05% MgSO4·H2O, 1,2% HEPES, pH до 7,4) и инкубируют при 30°С при перемешивании со скоростью 225 об/мин. Через 4 дня культуру переносят в 50 мл среды G51t и инкубируют в указанных выше условиях в течение 5 дней. Эту культуру используют для инокуляции 500 мл G51t и инкубируют в указанных выше условиях в течение 6 дней. Культуру центрифугируют в течение 10 мин при 4000 об/мин и клеточный дебрис ресуспендируют в 50 мл среды G51t.
Пример 2: Получение библиотеки бактериальной искусственной хромосомы (Вас)
Для получения библиотеки Вас клетки S.cellulosum, культивированные, как описано выше в примере 1, вносят в агарозные блоки, лизируют и высвободившуюся геномную ДНК частично расщепляют с помощью рестриктазы HindIII. Расщепленную ДНК разделяют на агарозном геле с помощью электрофореза в переменном токе. Из агарозного геля выделяют крупные (примерно 90-150 т.п.н.) фрагменты ДНК и встраивают путем лигирования в вектор pBelobacII. pBelobacII содержит ген, кодирующий устойчивость к хлорамфениколу, множественный сайт клонирования и ген lacZ, позволяющий осуществлять отбор голубых/белых колоний на соответствующей среде, а также гены, необходимые для репликации и поддержания присутствия 1 или 2 копий плазмиды на клетку. Для трансформации электрокомпетентных клеток Escherichia coli DH10B согласно стандартным методам электропорации применяют смесь для лигирования. Устойчивые к хлорамфениколу рекомбинантные колони (белые, lacZ-мутант) переносят на положительно заряженный фильтр в виде найлоновой мембраны формата 384 3×3. Колонии лизируют и ДНК перекрестие сшивают с фильтрами. Эти же колонии также сохраняют в виде жидких культур при -80°С.
Пример 3: Скрининг библиотеки Вас Sorangium cellulosum 90 в присутствии последовательностей, родственных поликетид-синтазе типа I
Фильтры библиотеки Вас зондируют с помощью стандартной Саузерн-гибридизации. Примененные ДНК-зонды кодируют домены β-кетоацилсинтазы из первого и второго модулей поликетид-синтазы рифамицина (Schupp и др., FEMS Microbiology Letters 159: 201-207 (1998)). ДНК-зонды получают с помощью ПЦР с использованием праймеров, фланкирующих каждый домен кетосинтазы, и плазмиды pNE95 в качестве матрицы (pNE95 соответствует космиде 2, описанной у Schupp и др. (1998)). Выделяют 25 нг амплифицированной с помощью ПЦР ДНК из 0,5%-ного агарозного геля и метят с помощью 32Р-дЦТФ с использованием набора для мечения случайным примированием (фирма Gibco-BRL, Бетезда штат Мэриленд, США) согласно инструкциям производителя. Гибридизацию проводят при 65°С в течение 36 ч и мембраны отмывают в строгих условиях (3 раза 0,1×SSC и 0,5%-ным ДСН в течение 20 мин при 65°С). Меченый блот экспонируют на чувствительный к изотопу фосфора экран и определяют сигналы с помощью устройства Phospholmager 445SI (экран и устройство 445SI фирмы Molecular Dynamics). Эта процедура приводит к гибридизации определенных клонов Вас с зондами. Эти клоны отбирают и культивируют в течение ночи в 5 мл бульона Луриа (LB) при 37°С. ДНК Вас из представляющих интерес клонов Вас выделяют с помощью обычной miniprep-процедуры. Клетки ресуспендируют в 200 мкл раствора лизоцима (50 мМ глюкоза, 10 мМ ЭДТК, 25 мМ Трис-HCl, 5 мг/мл лизоцим), лизируют в 400 мкл раствора для лизиса (0,2 н. NaOH и 2% ДСН), протеины осаждают (3,0 М ацетат натрия, значение рН которого доведено до 5,2 с помощью уксусной кислоты) и ДНК Вас осаждают изопропанолом. ДНК ресуспендируют в 20 мкл не содержащей нуклеазы дистиллированной воды, расщепляют с помощью BamHI (фирма New England Biolabs, Inc.) и разделяют на 0,7%-ном агарозном геле. Гель блоттируют Саузерн-гибридизацией, как описано выше, и зондируют в описанных выше условиях с использованием в качестве зонда SmaI-фрагмента ДНК длиной 1,2 т.п.н., который кодирует домен кетосинтазы в четвертом модуле поликетид-синтазы сорафена (см. патент US 5716849). Обнаружено пять различных схем гибридизации. Один клон, характерный для каждой из пяти схем, отбирают и обозначают как рЕРO15, рЕРO20, рЕРO30, рЕРO31 и рЕРО33 соответственно.
Пример 4: Субклонирование BamHI-фрагментов из рЕРO15, рЕРO20, рЕРО30, рЕРО31 и рЕРО33
ДНК пяти отобранных клонов Вас расщепляют с помощью BamHI и случайные фрагменты субклонируют в pBluescript II SK+ (фирма Stratagene) в сайте BamHI. Субклоны, несущие вставки размером от 2 до 10 т.п.н., отбирают для секвенирования фланкирующих концов вставок и также зондируют с помощью Smal-зонда размером 1,2 т.п.н., как описано выше. Субклоны, для которых обнаружен высокий уровень гомологии последовательности с известными поликетид-синтазами и/или высокий уровень гибридизации с доменом кетосинтазы сорафена, используют для экспериментов по разрушению гена.
Пример 5: Получение устойчивых к стрептомицину случайных мутантов штамма Sorangium cellulosum So ce90
0,1 мл трехдневной культуры штамма Sorangium cellulosum So ce90, выращенного в жидкой среде (0,2% экстракта дрожжей, 0,2% обезжиренной соевой муки, 0,8% картофельного крахмала, 0,2% глюкозы, 0,1% MgSO4·7H2O, 0,1% CaCl2·2Н2О, 0,008% Fe-ЭДТК, рН до 7,4 с помощью КОН), сеют на агаровые пластинки со средой SolE, дополненной 100 мкг/мл стрептомицина. Пластинки инкубируют при 30°С в течение 2 недель. Колонии, выросшие на этой среде, представляют собой устойчивые к стрептомицину мутанты, которые высевают штрихом и повторно культивируют на этой же агаровой среде со стрептомицином для очистки. Отбирают один из этих устойчивых к стрептомицину мутант и обозначают как ВСЕ28/2.
Пример 6: Разрушение генов в Sorangium cellulosum BCE28/2 с использованием субклонированных BamHI-фрагментов
BamHI-вставки из субклонов, полученных, как описано выше, из пяти отобранных клонов Вас, выделяют и встраивают путем лидирования в уникальный сайт BamHI плазмиды рСIВ132 (см., патент US 5716849). Несущими вставки производными рСIВ132 трансформируют штамм Escherichia coli ED8767, содержащий хелперную плазмиду pUZ8 (Hedges и Matthew, Plasmid 2: 269-278 (1979). Трансформантов используют в качестве доноров в экспериментах по конъюгации, в которых в качестве реципиентов применяют Sorangium cellulosum BCE28/2. Для конъюгации 5-10×109 клеток Sorangium cellulosum BCE28/2 из культуры, находящейся на ранней стационарной фазе (при достижении концентрации примерно 5×108 клеток/мл), выращенной при 30°С в жидкой среде G51b (G51b соответствует среде G51t, в которой триптон заменен пептоном), смешивают при соотношении клеток 1:1 с культурой, находящейся на поздней логарифмической фазе (в жидкой среде LB), штамма Е.coli ED8767, содержащей производные рСIВ132, которые несут субклонированные BamHI-фрагменты и хелперную плазмиду pUZ8. Затем смешанные клетки центрифугируют при 4000 об/мин в течение 10 мин и ресуспендируют в 0,5 мл среды G51b. Затем эту клеточную суспензию вносят в виде капли в центр пластинки Sol Е-агаром, содержащим 50 мг/л канамицина. Собирают клетки, полученные после инкубации в течение 24 ч при 30°С, и ресуспендируют в 0,8 мл среды G51bd и 0,1-0,3 мл этой суспензии помещают на твердую среду для отбора SolE, которая содержит флеомицин (30 мг/л), стрептомицин (300 мг/л) и канамицин (50 мг/л). Встречная селекция штамма-донора Escherichia coli происходит при добавлении стрептомицина. Колонии, которые растут на этой среде для отбора после инкубации в течение 8-12 дней при температуре 30°С, выделяют с помощью пластиковой петли и сеют штрихом и культивируют на этой же агаровой среде для второго цикла отбора и очистки. Полученные из культур колонии, которые растут на этой агаровой среде для отбора после инкубации в течение 7 дней при температуре 30°С, представляют собой трансконъюгаты со штаммом Sorangium cellulosum BCE28/2, который имеет приобретенную устойчивость к флеомицину в результате переноса посредством конъюгации производных рСIВ132, несущих субклонированные BamHI-фрагменты.
Интеграцию полученных из рСIВ132 плазмид в хромосому Sorangium cellulosum BCE28/2 путем гомологичной рекомбинации подтверждают Саузерн-гибридизацией. Для этого эксперимента выделяют полную ДНК их 5-10 трансконъюгатов на 1 перенесенный BamHI-фрагмент (из 10 мл культур, выращенных в среде G52-H в течение 3 дней), используя метод, описанный у Pospiech и Neumann, Trends Genet. 11:217 (1995). Для Саузерн-блоттинга выделенную, как описано выше, ДНК расщепляют с помощью рестриктаз BglII, ClaI или NotI и соответствующие BamHI-вставки или рСIВ132 используют в качестве меченных с помощью 32P зондов.
Пример 7: Анализ воздействия интегрированных BamHI-фрагментов на производство эпотилона Sorangium cellulosum после разрушения гена
Клетки-трансконъюгаты, выращенные примерно на 1 см2 поверхности пластинок со средой для отбора SolE при втором цикле селекции (см. пример 6), переносят с помощью стерильной пластиковой петли в 10 мл среды G52-H в колбу Эрленмейера объемом 50 мл. После инкубации при 30°С и 180 об/мин в течение 3 дней культуру переносят в 50 мл среды G52-H в колбу Эрленмейера объемом 200 мл. После инкубации при 30°С и 180 об/мин в течение 4-5 дней 10 мл этой культуры переносят в 50 мл среды 23В3 (0,2% глюкозы, 2% картофельного крахмала, 1,6% обезжиренной соевой муки, 0,0008% Fe-ЭДТК, натриевая соль, 0,5% HEPES (4-(2-гидроксиэтил)пиперазин-1-этансульфоновая кислота), 2 об.% полистироловую смолу XAD16 (фирма Rohm и Haas), значение рН доведено до 7,8 с помощью NaOH) в колбу Эрленмейера объемом 200 мл.
Количественное определение производства эпотилона проводят после инкубации культур при 30°С и 180 об/мин в течение 7 дней. Полный культуральный бульон фильтруют под вакуумом через найлоновый фильтр с размером пор 150 мкм. Оставшуюся на фильтре смолу затем ресуспендируют в 10 мл изопропанола и экстрагируют встряхиванием суспензии при 180 об/мин в течение 1 ч. Из этой суспензии отбирают 1 мл и центрифугируют при 12000 об/мин на микроцентрифуге Эппендорфа. Количество эпотилонов А и В в ней определяют с помощью ЖХВР и выявляют при 250 нм с помощью детектора типа UV-DAD (ЖХВР на колонке Waters-Symetry C18 и в градиенте 0,02%-ной фосфорной кислоты от 60% до 0% и ацетонитрила от 40% до 100%).
Трансконъюгаты с тремя различными интегрированными BamHI-фрагментами, субклонированные из рЕРO15, т.е. трансконъюгаты с BamHI-фрагментом плазмиды рЕРO15-21, трансконъюгаты с BamHI-фрагментом плазмиды рЕРO15-4-5 и трансконъюгаты с BamHI-фрагментом плазмиды рЕРO15-4-1, тестируют описанным выше методом. ЖХВР-анализ показал, что все трансконъюгаты уже не могли продуцировать эпотилон А или В. В противоположность этому эпотилон А и В обнаружены в концентрации 2-4 мг/л в трансконъюгатах с BamHI-фрагментами, полученными из рЕРO20, рЕРО30, рЕРО31, рЕРО33, в родительском штамме ВСЕ28/2.
Пример 8: Определение нуклеотидной последовательности клонированных фрагментов и конструирование наборов последовательностей фрагментов
А. BamHI-вставка плазмиды рЕРO15-21
Плазмидную ДНК выделяют из штамма Escherichia coli DH10B [рЕРO15-21] и определяют нуклеотидую последовательность BamHI-вставки размером 2.3 т.п.н. в рЕРO15-21. Автоматическое секвенирование ДНК осуществляют с использованием в качестве матрицы двухцепочечной ДНК методом на основе разрыва дидезоксинуклеотидной цепи с помощью секвенаторов Applied Biosystems, модель 377. Примененные праймеры представляют собой универсальный "обратный" праймер (5'-GGA AAC AGC TAT GAC CAT G-3' (SEQ ID NO:24)) и универсальный "прямой" праймер (5'-GTA AAA CGA CGG ССА GT-3' (SEQ ID NO:25)). В последующих циклах реакций секвенирования для удлинения и соединения наборов последовательностей фрагментов применяют синтезированные обычным образом олигонуклеотиды, сконструированные для 3'-концов ранее определенных последовательностей. Обе цепи секвенируют полностью и каждый нуклеотид секвенируют по меньшей мере дважды. Нуклеотидную последовательность компилируют с использованием программы Sequencher vers. 3.0 (фирма Gene Codes Corporation) и анализируют с помощью программ, разработанных генетической компьютерной группой университета штата Висконсин (University of Wisconsin Genetics Computer Group). Нуклеотидая последовательность вставки размером 2213 пар оснований соответствует нуклеотидам 20779-22991 SEQ ID NO:1.
Б. BamHI-вставка плазмиды рЕРO15-4-1
Плазмидную ДНК выделяют из штамма Escherichia coli DH10B [рЕР015-4-1] и нуклеотидую последовательность BamHI-вставки размером 3,9 т.п.н. в рЕРO15-4-1 определяют, как описано выше в разделе (А). Нуклеотидная последовательность вставки размером 3909 пар оснований соответствует нуклеотидам 16876-20784 SEQ ID NO:1.
В. BamHI-вставка плазмиды рЕРO15-4-5
Плазмидную ДНК выделяют из штамма Escherichia coli DH10B [рЕРO15-4-5] и нуклеотидную последовательность BamHI-вставки размером 2,3 т.п.н в рЕРO15-4-5 определяют, как описано выше в разделе (А). Нуклеотидная последовательность вставки размером 2233 пары оснований соответствует нуклеотидам 42528-44760 SEQ ID NO:1.
Пример 9: Субклонирование и определение расположения фрагментов ДНК плазмиды рЕРO15 содержащей гены биосинтеза эпотилона
рЕРO15 полностью расщепляют с помощью рестриктазы HindIII и образовавшиеся фрагменты субклонируют в pBluescript II SK- или pNEB193 (фирма New England Biolabs), предварительно расщепленных с помощью HindIII и дефосфорилированных с помощью щелочной фосфатазы из кишки теленка. Получают 6 различных клонов, которые обозначают как pEPO15-NH1, рЕРO15-NH2, pEPO15-NH6, pEPO15-NH24 (основой всех является pNEB193) и рЕРO15-Н2.7 и рЕР015-Н3.0 (основой обоих является pBluescript II SK-).
BamHI-вставку рЕРO15-21 выделяют и метят с помощью DIG (система нерадиоактивного мечения и определения ДНК фирмы Boehringer Mannheim), и используют в качестве зонда в экспериментах по гибридизации ДНК в строгих условиях с pEPO15-NH1, pEPO15-NH2, pEPO15-NH6, pEPO15-NH24, рЕРO15-Н2.7 и рЕРO15-Н3.0. Сильный сигнал гибридизации обнаружен для pEPO15-NH24, что свидетельствует о том, что рЕРO15-21 содержится внутри pEPO15-NH24.
BamHI-вставку рЕРO15-4-1 выделяют и метят с помощью DIG, как описано выше, и используют в качестве зонда в экспериментах по гибридизации ДНК в строгих условиях с pEPO15-NH1, pEPO15-NH2, pEPO15-NH6, рЕРO15-NH24, рЕРO15-Н2.7 и рЕРO15-Н3.0. Сильные сигналы гибридизации обнаружены для pEPO15-NH24 и рЕРO15-Н2.7. Данные о нуклеотидной последовательности, полученные для одного из концов каждого клона pEPO15-NH24 и рЕРO15-Н2.7, также полностью согласуются с данными о строении ранее определенной последовательности BamHI-вставки рЕРO15-4-1. Эти эксперименты свидетельствуют о том, что рЕРO15-4-1 (который содержит один внутренний сайт HindIII) перекрывает рЕРO15-Н2.7 и pEPO15-NH24 и что рЕРO15-Н2.7 и pEPO15-NH24 по расположению являются смежными.
BamHI-вставку рЕРO15-4-5 выделяют и метят с помощью DIG, как описано выше, и используют в качестве зонда в экспериментах по гибридизации ДНК в строгих условиях с pEPO15-NH1, pEPO15-NH2, pEPO15-NH6, pEPO15-NH24, рЕРO15-Н2.7 и рЕРO15-Н3.0. Сильный сигнал гибридизации обнаружен для pEPO15-NH2, что свидетельствует о том, что рЕРO15-21 содержится внутри pEPO15-NH2.
Данные о нуклеотидной последовательности получают для обоих концов pEPO15-NH2 и для конца pEPO15-NH24, который не перекрывается рЕРO15-4-1. На основе этих последовательностей создают ПЦР-праймеры, т.е. "В" для NH24-конца: GTGACTGGCGCCTGGAATCTGCATGAGC (SEQ ID NO:26), "А" для NH2-конца: AGCGGGAGCTTGCTAGACATTCTGTTTC (SEQ ID NO:27), и "В" для NH2-конца: GACGCGCCTCGGGCAGCGCCCCAA (SEQ ID NO:28), обозначенные относительно сайтов HindIII, и применяют в реакциях амплификации с использованием рЕРO15, а в других экспериментах с использованием геномной ДНК Sorangium cellulosum So ce90 в качестве матриц. Специфическая амплификация обнаружена при использовании пары праймеров "В" для NH24-конца и "А" для NH2-конца с обеими матрицами. Полученные в результате амплификации фрагменты (амплимеры) клонируют в pBluescript II SK- и полностью секвенируют. Последовательности амплифицированных фрагментов являются идентичными и также полностью соответствуют концам последовательностей pEPO15-NH24 и pEPO15-NH2, слитых с сайтом HindIII, что свидетельствует о том, что HindIII-фрагменты pEPO15-NH2 и pEPO15-NH24 по своему расположению являются смежными.
HmdIII-вставку рЕРO15-Н2.7 вьщеляют и метят с помощью DIG, как описано выше, и используют в качестве зонда в экспериментах по гибридизации ДНК в строгих условиях с рЕР015, расщепленном с помощью NotI. Для NotI-фрагмента размером примерно 9 т.п.н. выявлена сильная гибридизация и его затем субклонируют в pBluescript II SK-, предварительно расщепленном с помощью NotI и дефосфорилированном с помощью щелочной фосфатазы из кишки теленка, получая pEPO15-N9-16. NotI-вставку pEPO15-N9-16 выделяют и метят с помощью DIG, как описано выше, и используют в качестве зонда в экспериментах по гибридизации ДНК в строгих условиях с pEPO15-NH1, pEPO15-NH2, pEPO15-NH6, pEPO15-NH24, рЕРO15-Н2.7 и рЕРO15-Н3.0. Сильные сигналы гибридизации обнаружены для pEPO15-NH6, а также, как это и ожидалось, для клонов рЕРO15-Н2.7 и pEPO15-NH24. Данные о нуклеотидной последовательности получают для обоих концов pEPO15-NH6 и для конца рЕРO15-Н2.7, который не перекрывается рЕРO15-4-1. Конструируют ПЦР-праймеры, обозначенные относительно сайтов HindIII, и применяют для реакций амплификации с использованием рЕРO15, а в других экспериментах с использованием геномной ДНК Sorangium cellulosum So ce90 в качестве матриц. Специфическая амплификация обнаружена при использовании пары праймеров "В" для pEPO15-NH6-конца: CACCGAAGCGTCGATCTGGTCCATC (SEQ ID NO:29) и "А" для рЕРO15-Н2.7-конца: CGGTCAGATCGACGACGGGCTTTCC (SEQ ID NO:30) с обеими матрицами. Амплифицированные фрагменты клонируют в Bluescript II SK- и полностью секвенируют. Последовательности амплифицированных фрагментов являются идентичными и также полностью соответствуют концам последовательностей pEPO15-NH6 и рЕРO15-Н2.7, слитых с сайтом HindIII, что свидетельствует о том, что HindIII-фрагменты pEPO15-NH6 и рЕРO15-Н2.7 по своему расположению являются смежными.
Все эти эксперименты, взятые вместе, позволяют определить набор последовательностей HindIII-фрагментов, перекрывающий область размером примерно 55 т.п.н. и состоящий из HindIII-вставок pEPO15-NH6, рЕРO15-Н2.7, pEPO15-NH24 и pEPO15-NH2, расположенных в указанном порядке. Установлено, что вставки двух оставшихся HindIII-субклонов, т.е. pEPO15-NH1 и рЕРO15-Н3.0, не являются частями этого набора последовательностей фрагментов.
Пример 10: Дополнительное удлинение субклона набора последовательностей фрагментов, перекрывающего гены биосинтеза эпотилона
BamHI - HindIII-фрагмент, полученный из расположенного по ходу транскрипции конца вставки pEPO15-NH2 и, таким образом, представляющий собой расположенный по ходу транскрипции конец субклона набора последовательностей фрагментов, описанного в примере 9, выделяют, метят с помощью DIG и используют в экспериментах по Саузерн-гибридизации с ДНК рЕРO15 и pEPO15-NH2, расщепленными с помощью нескольких ферментов. Во всех случаях сильно гибридизующиеся полосы имеют одинаковый размер для двух ДНК-мишеней, что свидетельствует о том, что фрагмент геномной ДНК Sorangium cellulosum So ce90, клонированный в рЕРO15, заканчивается сайтом HindIII на расположенном по ходу транскрипции конце pEPO15-NH2.
С помощью обычных процедур создают космидную библиотеку ДНК Sorangium cellulosum So ce90 в pScosTriplex-II (Ji и др., Genomics 31: 185-192 (1996)). Вкратце метод состоит в следующем: высокомолекулярную геномную ДНК Sorangium cellulosum So ce90 частично расщепляют с помощью рестриктазы Sau3AI, получая фрагменты со средним размером примерно 40 т.п.н., и встраивают путем лигирования в расщепленную с помощью BamHI и XbaI плазмиду pScosTriplex-II. Смесь для лигирования упаковывают в Gigapack III XL (фирма Stratagene) и применяют для трансфекции клеток Е.coli XL1 Blue MR.
Космидную библиотеку подвергают скринингу с использованием BamHI-HindIII-фрагмента размером примерно 2,2 т.п.н., полученного из расположенного по ходу транскрипции конца pEPO15-NH2-вставки, в качестве зонда для гибридизации колонии. Отбирают клон, для которого обнаружен сильный сигнал гибридизации, обозначенный как рЕРO4Е7.
ДНК клона рЕРO4Е7 выделяют, расщепляют с помощью рестриктаз и зондируют в экспериментах по Саузерн-гибридизации с помощью BamHI-HindIII-фрагмента размером 2,2 т.п.н. Отбирают Notl-фрагмент размером 9 т.п.н., для которого обнаружен сильный сигнал гибридизации, и субклонируют в pBluescript II SK-, получая pEPO4E7-N9-8. Дополнительные эксперименты с использованием Саузерн-гибридизации свидетельствуют о том, что Notl-вставка размером примерно 9 т.п.н. pEPO4E7-N9-8 перекрывает NotI - HindIII-фрагмент длиной свыше 6 т.п.н. pEPO15-NH2, в то время как оставшийся HindIII - NotI-фрагмент размером примерно 3 т.п.н., как ожидается, должен перекрывать субклон набора последовательностей фрагментов, описанный в примере 9. Однако окончательное секвенирование показало, что расположенная по ходу транскрипции рЕРO4Е7-N9-8-вставка содержит BamHI - NotI-полилинкер pScosTriplex-II, что свидетельствует о том, что геномная ДНК-вставка рЕР04Е7 заканчивается в сайге Sau3AI внутри удлиняющего HindIII - NotI-фрагмента и что сайт NotI происходит из pScosTriplex-II.
PstI - SalI-фрагмент размером примерно 1,6 т.п.н., происходящий из удлиняющего HindIII - NotI - подфрагмента размером примерно 3 т.п.н. pEPO4E7-N9-8, который содержит только происходящие из Sorangium cellulosum So ce90 последовательности без вектора, применяют в качестве зонда для библиотеки бактериальной искусственной хромосомы, описанной в примере 2. Помимо ранее выделенного клона ЕРO15, обнаружено, что клон Вас, обозначенный как ЕРO32, сильно гибридизуется с зондом. рЕРO32 выделяют, расщепляют с использованием нескольких рестриктаз и подвергают гибридизации с PstI - SalI - зондом размером примерно 1,6 т.п.н. Обнаружено, что HindIII - EcoRV-фрагмент размером примерно 13 т.п.н. дает сильный сигнал гибридизации с зондом и его субклонируют в pBluescript II SK-, расщепленном с помощью HindIII и Hindi, получая pEPO32-HEV15.
Конструируют олигонуклеотидные праймеры, основываясь на расположенной по ходу транскрипции концевой последовательности pEPO15-NH2 и на расположенной против хода транскрипции (HindIII) концевой последовательности, полученной из pEPO32-HEV15, и используют их в реакциях секвенирования с pEPO4E7-N9-8 в качестве матрицы. Последовательности позволяют обнаружить присутствие небольшого HindIII-фрагмента (ЕРO4Е7-Н0.02) размером 24 пары оснований, который не мог быть обнаружен с помощью стандартных рестрикционных анализов, отделяющего сайт HindIII на расположенном по ходу транскрипции конце pEPO15-NH2 от сайта HindIII на расположенном против хода транскрипции конце pEPO32-HEV15.
Таким образом, субклон набора последовательностей фрагментов, описанный в примере 9, удлиняют, включая HindIII-фрагмент ЕРO4Е7-Н0.02 и рЕРO32-НЕV15-вставку, в результате чего он содержит вставки: pEPO15-NH6, рЕРO15-Н2.7, pEPO15-NH24, pEPO15-NH2, ЕРO4Е7-Н0.02 и pEPO32-HEV15, расположенные в указанном порядке.
Пример 11: Определение нуклеотидной последовательности субклона набора последовательностей фрагментов, перекрывающего гены биосинтеза эпотилона
Нуклеотидные последовательности субклона набора последовательностей фрагментов, описанного в примере 10, определяют следующим образом:
рЕРO15-Н2.7. Плазмидную ДНК выделяют из штамма Escherichia coli DH10B [рЕРO15-Н2.7] и определяют нуклеотидную последовательность BamHI-вставки в рЕРO15-Н2.7 размером 2,7 т.п.н. Автоматическое секвенирование ДНК осуществляют с использованием в качестве матрицы двухцепочечной ДНК методом на основе разрыва дидезоксинуклеотидной цепи с помощью секвенаторов Applied Biosystems, модель 377. Примененные праймеры представляют собой универсальный "обратный" праймер (5'-GGA ААС AGC TAT GAC CAT G-3' (SEQ ID NO:24)) и универсальный "прямой" праймер (5'-GTA ААА CGA CGG ССА GT-3' (SEQ ID NO:25)). В последующих циклах реакций секвенирования для удлинения и соединения наборов последовательностей фрагментов применяют синтезированные обычным образом олигонуклеотиды, сконструированные для 3'-концов ранее определенных последовательностей.
pEPO15-NH6, pEPO15-NH24 и pEPO15-NH2. HmdIII - вставки этих плазмид выделяют и подвергают случайной фрагментации, используя устройство типа Hydroshear (фирма Genomic Instrumentation Services, Inc.), получая фрагменты, средний размер которых составляет 1-2 т.п.н. Репарируют концы фрагментов, используя ДНК-полимеразу фага Т4 и ДНК-полимеразу Кленова в присутствии дезоксинуклеотидтрифосфатов и фосфорилируют с помощью ДНК-киназы фага Т4 в присутствии рибо-АТФ. Фрагменты размером от 1,5 до 2,2 т.п.н. выделяют из агарозных гелей и встраивают путем лигирования в вектор pBluescript II SK-, предварительно расщепленный с помощью EcoRV и дефосфорилированный. Произвольные субклоны секвенируют, используя универсальный "обратный" и универсальный "прямой" праймеры.
pEPO32-HEV15. pEPO32-HEV15 расщепляют с помощью HindIII и SspI и выделяют фрагмент размером примерно 13,3 т.п.н., который содержит HindIII - EcoRV - вставку из So. cellulosum So се90 размером ˜13 т.п.н., и Hindi - SspI - фрагмент из pBluescript II SK- размером 0,3 т.п.н. и частично расщепляют с помощью HaeIII, получая фрагменты, средний размер которых составляют 1-2 т.п.н. Фрагменты размером 1,5-2,2 т.п.н. выделяют из агарозных гелей и встраивают путем лигирования в вектор Bluescript II SK-, предварительно расщепленный с помощью EcoRV и десфорилированный. Произвольные субклоны секвенируют, используя универсальный "обратный" и универсальный "прямой" праймеры.
Хроматограммы анализируют и объединяют в наборы последовательностей фрагментов с помощью программ Phred, Phrap и Consed (Ewing и др., Genome Res. 8(3); 175-185 (1998); Ewing и др., Genome Res. 8(3): 186-194 (1998); Gordon и др., Genome Res. 8(3): 195-202 (1998)). Бреши в наборах последовательностей фрагментов заполняют, имеющие противоречие последовательности расщепляют и области, для которых получены недостаточно надежные данные, повторно секвенируют, используя сконструированные обычным образом олигонуклеотидные праймеры для секвенирования либо исходных субклонов, либо клонов, выбранных из случайных библиотек субклонов. Обе цепи полностью секвенируют и каждую пару оснований характеризуют по крайней мере минимальным обобщенным баллом Фреда (Phred), равным 40 (уровень значимости 99,99%).
Нуклеотидная последовательность набора последовательностей фрагментов размером 68750 пар оснований представлена в SEQ ID NO:1.
Пример 12: Анализ нуклеотидной последовательности генов биосинтеза эпотилона
Установлено, что SEQ ID NO:1 содержит 22 ORF, что подробно представлено ниже в таблице 1:
ероА (нуклеотиды 7610-11875 SEQ ID NO:1) кодирует EPOS A (SEQ ID NO:2), поликетид-синтазу типа I, состоящую из одного модуля и несущую следующие домены: β-кетоацилсинтазы (KS) (нуклеотиды 7643-8920 SEQ ID NO:1, аминокислоты 11-437 SEQ ID NO:2); ацилтрансферазы (AT) (нуклеотиды 9236-10201 SEQ ID NO:1, аминокислоты 543-864 SEQ ID NO:2); еноилредуктазы (ER) (нуклеотиды 10529-11428 SEQ ID NO:1, аминокислоты 974-1273 SEQ ID NO:2) и домен, гомологичный домену протеина-носителя ацила (АСР) (нуклеотиды 11549-11764 SEQ ID NO:1, аминокислоты 1314-1385 SEQ ID NO:2). Сравнение последовательностей и анализ мотивов (Haydock и др. FEBS Lett.374: 246-248 (1995); Tang и др., Gene 216: 255-265 (1998)) свидетельствует о том, что AT, кодируемая EPOS А, является малонил-СоА-специфичной. EPOS A должна быть включена в инициацию биосинтеза эпотилона путем введения ацетатного звена в многоферментный комплекс, который должен в конце концов образовать часть 2-метилтиазольного кольца (С26 и С20).
ероР (нуклеотиды 11872-16104 SEQ ID NO:1) кодирует EPOS P (SEQ ID NO:3), нерибосомную кислота-аминокислота-лигазу, содержащую один модуль. EPOS P несет следующие домены:
- домен образования пептидной связи, соответствующий мотиву К (аминокислоты 72-81 [FPLTDIQESY] SEQ ID NO:3, соответствующие нуклеотидам 12085-12114 SEQ ID NO:1); мотиву L (аминокислоты 118-125 [VVARHDML] SEQ ID NO:3, соответствующие нуклеотидам 12223-12246 SEQ ID NO:1); мотиву М (аминокислоты 199-212 [SIDLINVDLGSLSI] SEQ ID NO:3, соответствующие нуклеотидам 12466-12507 SEQ ID NO:1), и мотиву О (аминокислоты 353-363 [GDFTSMVLLDI] SEQ ID NO:3, соответствующие нуклеотидам 12928-12960 SEQ ID NO:1);
- домен образования аминоациладенилата, соответствующий мотиву А (аминокислоты 549-565 [LTYEELSRRSRRLGARL] SEQ ID NO:3, соответствующие нуклеотидам 13516-13566 SEQ ID NO:1); мотиву В (аминокислоты 588-603 [VAVLAVLESGAAYVPI] SEQ ID NO:3, соответствующие нуклеотидам 13633-13680 SEQ ID NO:1); мотиву С (аминокислоты 669-684 [AYVIYTSGSTGLPKGV] SEQ ID NO:3, соответствующие нуклеотидам 13876-13923 SEQ ID NO:1); мотиву D (аминокислоты 815-821 [SLGGATE] SEQ ID NO:3, соответствующие нуклеотидам 14313-14334 SEQ ID NO:1); мотиву Е (аминокислоты 868-892 [GQLYIGGVGLALGYWRDEEKTRKSF] SEQ ID NO:3, соответствующие нуклеотидам 14473-14547 SEQ ID NO:1); мотиву F (аминокислоты 903-912 [YKTGDLGRYL] SEQ ID NO:3, соответствующие нуклеотидам 14578-14607 SEQ ID NO:1); мотиву G (аминокислоты 918-940 [EFMGREDNQIKLRGYRVELGEIE] SEQ ID NO:3, соответствующие нуклеотидам 14623-14692 SEQ ID NO:1); мотиву Н (аминокислоты 1268-1274 [LPEYMVP] SEQ ID NO:3, соответствующие нуклеотидам 15673-15693 SEQ ID NO:1), и мотиву I (аминокислоты 1285-1297 [LTSNGKVDRKALR] SEQ ID NO:3, соответствующие нуклеотидам 15724-15762 SEQ ID NO:1);
- неизвестный домен, встроенный между мотивами G и Н домена образования аминоациладенилата (аминокислоты 973-1256 SEQ ID NO:3, соответствующие нуклеотидам 14788-15639 SEQ ID NO:1); и
- домен, гомологичный домену протеина-носителя пептидила (РСР), соответствующий мотиву J (аминокислоты 1344-1351 [GATSIHIV] SEQ ID NO:3, соответствующие нуклеотидам 15901-15924 SEQ ID NO:1).
Предполагается, что EPOS P принимает участие в активации цистеина путем аденилирования, связывания активированного цистеина в виде аминоацил-S-PCP, образования пептидной связи между связанным ферментом цистеином и ацетил-S-ACP, поставляемым EPOS А, и образования начального тиазолинового кольца посредством внутримолекулярной гетероциклизации. Неизвестный домен EPOS P обладает очень слабыми гомологиями с NAD(P)H-оксидазами и редуктазами видов Bacillus. Таким образом, неизвестный домен и/или ER-домен EPOS А могут принимать участие в окислении начального 2-метилтиазолинового кольца с образованием 2-метилтиазола.
ероВ (нуклеотиды 16251-21749 SEQ ID NO:1) кодирует EPOS В (SEQ ID NO:4), поликетид-синтазу типа I, состоящую из одного модуля и несущего следующие домены: KS (нуклеотиды 16269-17546 SEQ ID NO:1, аминокислоты 7-432 SEQ ID NO:4); AT (нуклеотиды 17865-18827 SEQ ID NO:1, аминокислоты 539-859 SEQ ID NO:4); дегидратазы (DH) (нуклеотиды 18855-19361 SEQ ID NO:1, аминокислоты 869-1037 SEQ ID NO:4); β-кеторедуктазы (KR) (нуклеотиды 20565-21302 SEQ ID NO:1, аминокислоты 1439-1684 SEQ ID NO:4) и АСР (нуклеотиды 21414-21626 SEQ ID NO:1, аминокислоты 1722-1792 SEQ ID NO:4). Сравнение последовательностей и анализ мотивов свидетельствует о том, что AT, кодируемая EPOS А, является метилмалонил-СоА-специфичной. EPOS А может быть вовлечена в первое удлинение поликетидной цепи путем катализа конденсации типа реакции Кляйзена исходной группы, т.е. 2-метил-4-тиазолкарбоксил-S-PCP, с метилмалонил-S-ACP и последующего восстановления b-кето-группы С17 до еноила.
ероС (нуклеотиды 21746-43519 SEQ ID NO:1) кодирует EPOS С (SEQ ID NO:5), поликетид-синтазу типа I, состоящую из 4 модулей. Первый модуль несет домены KS (нуклеотиды 21860-23116 SEQ ID NO:1, аминокислоты 39-457 SEQ ID NO:5); малонил-СоА-специфической AT (нуклеотиды 23431-24397 SEQ ID NO:1, аминокислоты 563-884 SEQ ID NO:5); KR (нуклеотиды 25184-25942 SEQ ID NO:1, аминокислоты 1147-1399 SEQ ID NO:5) и АСР (нуклеотиды 26045-26263 SEQ ID NO:1, аминокислоты 1434-1506 SEQ ID NO:5). Этот модуль включает ацетатное звено-удлинитель (С14-С13) и восстанавливает β-кетогруппу в положении С15 с образованием гидроксильной группы, которая принимает участие в окончательной лактонизации макролактонового кольца эпотилона. Второй модуль EPOS С несет домены KS (нуклеотиды 26318-27595 SEQ ID NO:1, аминокислоты 1524-1950 SEQ ID NO:5); малонил-СоА-специфической AT (нуклеотиды 27911-28876 SEQ ID NO:1, аминокислоты 2056-2377 SEQ ID NO:5); KR (нуклеотиды 29678-30429 SEQ ID NO:1, аминокислоты 2645-2895 SEQ ID NO:5) и АСР (нуклеотиды 30539-30759 SEQ ID NO:1, аминокислоты 2932-3005 SEQ ID NO:5). Этот модуль включает ацетатное звено-удлинитель (С12-С11) и восстанавливает β-кетогруппу в положении С13 с образованием гидроксильной группы. Таким образом, образующаяся поликетидная цепь эпотилона соответствует эпотилону А, а для включения метильной боковой цепи в положении С12 в эпотилон В требуется наличие С-метилтрансферазной активности после воздействия PKS. Для формирования эпоксикольца в положениях С13-С12 также требуется стадия окисления после воздействия PKS. Третий модуль EPOS С несет домены KS (нуклеотиды 30815-32092 SEQ ID NO:1, аминокислоты 3024-3449 SEQ ID NO:5); малонил-СоА-специфической AT (нуклеотиды 32408-33373 SEQ ID NO:1, аминокислоты 3555-3876 SEQ ID NO:5); DH (нуклеотиды 33401-33889 SEQ ID NO:1, аминокислоты 3886-4048 SEQ ID NO:5); ER (нуклеотиды 35042-35902 SEQ ID NO:1, аминокислоты 4433-4719 SEQ ID NO:5); KR (нуклеотиды 35930-36667 SEQ ID NO:1, аминокислоты 4729-4974 SEQ ID NO:5) и АСР (нуклеотиды 36773-36991 SEQ ID NO:1, аминокислоты 5010-5082 SEQ ID NO:5). Этот модуль включает ацетатное звено-удлинитель (С10-С9) и полностью восстанавливает β-кетогруппу в положении С11. Четвертый модуль EPOS С несет домены KS (нуклеотиды 37052-38320 SEQ ID NO:1, аминокислоты 5103-5525 SEQ ID NO:5); метилмалонил-СоА-специфической AT (нуклеотиды 38636-39598 SEQ ID NO:1, аминокислоты 5631-5951 SEQ ID NO:5); DH (нуклеотиды 39635-40141 SEQ ID NO:1, аминокислоты 5964-6132 SEQ ID NO:5); ER (нуклеотиды 41369-42256 SEQ ID NO:1, аминокислоты 6542-6837 SEQ ID NO:5); KR (нуклеотиды 42314-43048 SEQ ID NO:1, аминокислоты 6857-7101 SEQ ID NO:5) и АСР (нуклеотиды 43163-43378 SEQ ID NO:1, аминокислоты 7140-7211 SEQ ID NO:5). Этот модуль включает пропионатное звено-удлинитель (С24 и С8-С7) и полностью восстанавливает β-кетогруппу в положении С9.
epoD (нуклеотиды 43524-54920 SEQ ID NO:1) кодирует EPOS D (SEQ ID NO:6), поликетид-синтазу типа I, состоящую из 2 модулей. Первый модуль несет домены KS (нуклеотиды 43626-44885 SEQ ID NO:1, аминокислоты 35-454 SEQ ID NO:6); метилмалонил-СоА-специфической AT (нуклеотиды 45204-46166 SEQ ID NO:1, аминокислоты 561-881 SEQ ID NO:6); KR (нуклеотиды 46950-47702 SEQ ID NO:1, аминокислоты 1143-1393 SEQ ID NO:6) и АСР (нуклеотиды 47811-48032 SEQ ID NO:1, аминокислоты 1430-1503 SEQ ID NO:6). Этот модуль включает пропионатное звено-удлинитель (С23 и С6-С5) и восстанавливает β-кетогруппу в положении С7 с образованием гидроксильной группы. Второй модуль несет домены KS (нуклеотиды 48087-49361 SEQ ID NO:1, аминокислоты 1522-1946 SEQ ID NO:6); метилмалонил-СоА-специфической AT (нуклеотиды 49680-50642 SEQ ID NO:1, аминокислоты 2053-2373 SEQ ID NO:6); DH (нуклеотиды 50670-51176 SEQ ID NO:1, аминокислоты 2383-2551 SEQ ID NO:6); метилтрансферазы (МТ, нуклеотиды 51534-52657 SEQ ID NO:1, аминокислоты 2671-3045 SEQ ID NO:6); KR (нуклеотиды 53697-54431 SEQ ID NO:1, аминокислоты 3392-3636 SEQ ID NO:6) и АСР (нуклеотиды 54540-54758 SEQ ID NO:1, аминокислоты 3673-3745 SEQ ID NO:6). Этот модуль включает пропионатное звено-удлинитель (С21 или С22 и С4-С3) и восстанавливает β-кетогруппу в положении С5 с образованием гидроксильной группы. Это восстановление является в определенной степени неожиданным, поскольку эпотилоны содержат кетогруппу в положении С5. Однако такого типа несоответствия между предсказанными восстановительными способностями модулей PKS и восстановительно-окислительным статусом соответствующих положений в конечных поликетидных продуктах известны из литературы (см., например, Schwecke и др., Proc. Natl. Acad. Sci. USA 92: 7839-7843 (1995) и Schupp и др., FEMS Microbiology Letters 159: 201-207 (1998)). Важной особенностью эпотилонов является присутствие гем-метильных боковых групп в положении С4 (С21 и С22). Второй модуль EPOS D, вероятно, включает пропионатное звено в растущую поликетидную цепь, обеспечивая появление одной метильной боковой цепи в положении С4. Этот модуль также содержит домен метилтрансферазы, интегрированный в PKS между доменами DH и KR, в ориентации аналогичной обнаруженной для йерсиниабактин-синтазы HMWP1 (Gehring A.M., DeMoll E., Fetherston J.D., Mori I., Mayhew G.F., Blattner F.R., Walsh C.T. и Perry, R.D.: Iron acquisition in plague: modular logic in enzymatic biogenesis of yersiniabactin by Yersinia pestis. Chem. Biol. 5, 573-586, 1998). Этот МТ-домен в EPOS D, вероятно, ответствен за включение второй метильной боковой группы (С21 или С22) в положении С4.
ероЕ (нуклеотиды 54935-62254 SEQ ID NO:1) кодирует EPOS E (SEQ ID NO:7), поликетид-синтазу типа I, состоящую из одного модуля, несущего домены KS (нуклеотиды 55028-56284 SEQ ID NO:1, аминокислоты 32-450 SEQ ID NO:7); малонил-СоА-специфической AT (нуклеотиды 56600-57565 SEQ ID NO:1, аминокислоты 556-877 SEQ ID NO:7); DH (нуклеотиды 57593-58087 SEQ ID NO:1, аминокислоты 887-1051 SEQ ID NO:7); вероятно не функционально активной ER (нуклеотиды 59366-60304 SEQ ID NO:1, аминокислоты 1478-1790 SEQ ID NO:7); KR (нуклеотиды 60362-61099 SEQ ID NO:1, аминокислоты 1810-2055 SEQ ID NO:7), АСР (нуклеотиды 61211-61426 SEQ ID NO:1, аминокислоты 2093-2164 SEQ ID NO:7) и тиоэстеразы (ТЕ) (нуклеотиды 61427-62254 SEQ ID NO:1, аминокислоты 2165-2439 SEQ ID NO:7). ER-домен в этом модуле несет мотив сайтов с некоторыми совершенно необычными аминокислотными заменами, что, вероятно, делает этот домен неактивным. Модуль включает ацетатное звено-удлинитель (С2-С1) и восстанавливает β-кетогруппу в положении С3 с образованием еноильной группы. Эпотилоны содержат гидроксильную группу в положении С3, поэтому это восстановление, вероятно, является избыточным, как обсуждалось для второго модуля EPOS D. ТЕ-домен EPOS E принимает участие в высвобождении и циклизации растущей поликетидной цепи путем образования лактона между карбоксильной группой в положении С1 и гидроксильной группой в положении С15.
В секвенированной области против хода транскрипции ероА обнаружено 5 ORF. Частично секвенированная orf1 не имеет гомологичных последовательностей в банках данных. Выведенный протеиновый продукт (Orf 2, SEQ ID NO:10) orf2 (нуклеотиды 3171-1900 на обратной комплементарной цепи SEQ ID NO:1) проявляет заметные аналогии с гипотетическими ORF из Mycobacterium и Streptomyces coelicolor и более отдаленные аналогии с карбоксипептидазами и DD-пептидазами различных бактерий. Выведенный протеиновый продукт orf3 (нуклеотиды 3415-5556 SEQ ID NO:1), Orf 3 (SEQ ID NO:11), обладает гомологией с Na/H-антипортерами различных бактерий. Orf 3 может принимать участие в экспорте эпотилонов из штамма-продуцента. orf4 и orf5 не имеют гомологичных последовательностей в банках данных.
В секвенированной области по ходу транскрипции ероЕ обнаружено 11 ORF. epoF (нуклеотиды 62369-63628 SEQ ID NO:1) кодирует EPOS F (SEQ ID NO:8), выведенный протеин, обладающий выраженными аналогиями последовательности с цитохром Р450 оксигеназами. EPOS F может принимать участие в регуляции окислительно-восстановительного статуса углеродов С12, С5 и/или С3. Выведенный протеиновый продукт orf14 (нуклеотиды 67334-68251 SEQ ID NO:1), Orf 14 (SEQ ID NO:22) проявляет заметные аналогии с GI:3293544, гипотетическим протеином из Streptomyces coelicolor с неизвестной функцией, а также с человеческим протеином из легких эмбриона GI:2654559. Он также имеет более отдаленное родство с протеинами системы выхода катионов типа GI:2623026 из Methanobacterium thermoautotrophicum, поэтому он также может принимать участие в экспорте эпотилонов из клеток-продуцентов. Остальные ORF (orf6-orf13 и orf15) не имеют гомологичных последовательностей в банках данных.
Пример 13: Рекомбинантная экспрессия генов биосинтеза эпотилона
Гены эпотилон-синтазы по настоящему изобретению экспрессируют в гетерологичных организмах с целью получения эпотилона в больших количествах, чем при ферментации с использованием Sorangium cellulosum. Предпочтительным хозяином для гетерологичной экспрессии является Streptomyces, например, Streptomyces coelicolor, вид, который в естественных условиях продуцирует поликетид актинородин. Методики рекомбинантной экспрессии гена PKS в этом хозяине описаны у McDaniel и др., Science 262: 1546-1550 (1993) и Као и др., Science 265: 509-512 (1994) (см. также Holmes и др., ЕМВО Journal 12(8): 3183-3191 (1993) и Bibb и др., Gene 38: 215-226 (1985), а также в патентах US 5521077, 5672491 и 5712146, которые включены в настоящее описание в виде ссылки.
Согласно одному из способов конструируют штамм гетерологичного хозяина, имеющего хромосомную делецию кластера генов актинородина (act). Экспрессионные плазмиды, содержащие гены эпотилон-синтазы по изобретению, конструируют путем переноса ДНК из чувствительной к температуре плазмиды-донора в челночный (бифункциональный) вектор-реципиент в Е.coli (McDaniel и др. (1993) и Као и др. (1994)), так что гены синтазы получают путем гомологичной рекомбинации в векторе. В альтернативном варианте кластер генов эпотилон-синтазы интродуцируют в вектор путем лигирования рестрикционных фрагментов. После селекции, проведенной, например, как описано у Као и др. (1994), ДНК из вектора интродуцируют в штамм Streptomyces coelicolor act-минус согласно протоколам, приведенным у Hopwood и др., Genetic Manipulation of Streptomyces. A Laboratory Manual (John Innes Foundation, Norwich, United Kingdom, 1985), публикация включена в настоящее описание в виде ссылки. Рекомбинантный штамм Streptomyces выращивают в среде R2YE (Hopwood и др. (1985)) и получают эпотилоны.
В другом варианте гены эпотилон-синтазы по настоящему изобретению экспрессируют в других организмах-хозяевах, таких как Pseudomonads, Bacillus, дрожжи, клетки насекомых и/или Е.coli. Гены PKS и NRPS предпочтительно экспрессируют в Е. coli, используя вектор рТ7-7, в который входит промотор Т7 (см. Tabor и др., Proc. NatL Acad. Sci. USA 82: 1074-1078 (1985). Согласно другому варианту осуществления для экспрессии генов PKS и NRPS в Е.coli, в слиянии, которое обеспечивает транскрипцию или трансляцию, под контролем промотора tac или trc, применяют экспрессионные векторы рКК223-3 и рКК223-2. Для экспрессии генов PKS и NRPS в гетерологичных хозяевах, которые в естественных условиях не имеют фосфопантетеинил-(Р-pant)-трансфераз, которые необходимы для посттрансляционной модификации ферментов PKS, требуется совместная экспрессия в хозяине P-pant-трансферазы, как описано у Kealey и др., Proc. NatL Acad. Sci. USA 95: 505-509 (1998).
Пример 14: Выделение эпотилонов из штаммов-продуцентов
Примеры методов культивирования, ферментации и экстракции для выделения поликетидов, которые могут применяться для экстракции эпотилонов как из естественных, так и из рекомбинантных хозяев по настоящему изобретению, даны в WO 93/10121, включенной в настоящее описание в виде ссылки, в примере 57 патента US 5639949 и у Gerth и др., J. Antibiotics 49: 560-563 (1996), а также в заявке на патент SE 396/98, поданной 19 февраля 1998 г., в заявке на патент US 09/248, 910 (в которой также описаны предпочтительные мутантные штаммы Sorangium cellulosum), обе заявки включены в настоящее описание в виде ссылки. Ниже приведены процедуры, которые могут применяться для выделения эпотилонов из культивируемых штаммов Sorangium cellulosum, таких как So ce90, и которые также могут использоваться для выделения эпотилонов из рекомбинантных хозяев.
А: Культивирование продуцирующих эпотилон штаммов:
Штамм: Sorangium cellulosum Soce-90 или рекомбинантный штамм-хозяин по настоящему изобретению.
Консервация штамма: В жидком N2.
Среда: Предварительные культуры и промежуточные культуры G52
Основная культура: 1В12
Среда G52:
значение рН 7,4 скорректировано с помощью КОН
Стерилизация: 20 мин при 120°С
Среда 1В12:
значение рН 7,8 скорректировано с помощью КОН
Стерилизация: 20 мин при 120°С.
Добавление циклодекстринов и циклодекстриновых производных:
Различные концентрации циклодекстринов (фирма Fluka, Buchs, Щвейцария или Wacker Chemie, Munich, Германия) стерилизуют отдельно и добавляют в среду 1В12 до посева культуры.
Культивирование: 1 мл супернатанта штамма Sorangium cellulosum Soce90 ВСЕ33/10 из ампулы с жидким N2 переносят в 10 мл среды G52 (в колбе Эрленмейера объемом 50 мл) и инкубируют в течение 3 дней в мешалке со смещением 25 мм при скорости вращения 180 об/мин и при 30°С. 5 мл этой культуры переносят в 45 мл среды G52 (в колбе Эрленмейера объемом 200 мл) и инкубируют в течение 3 дней в мешалке со смещением 25 мм при скорости вращения 180 об/мин и при 30°С. 50 мл этой культуры затем добавляют к 450 мл среды G52 (в колбе Эрленмейера объемом 2 л) и инкубируют в течение 3 дней в мешалке со смещением 50 мм при скорости вращения 180 об/мин и при 30°С.
Поддерживающая культура: Культуры пересевают каждые 3-4 дня, добавляя 50 мл культуры к 450 мл среды G52 (в колбе Эрленмейера объемом 2 л). Все эксперименты и процессы ферментации проводят, используя в качестве исходной эту поддерживающую культуру.
Опыты в колбе:
(I) Предварительная культура во встряхиваемой колбе:
Используя в качестве исходной 500 мл поддерживающей культуры, 1×450 мл среды G52 засевают с помощью 50 мл поддерживающей культуры и инкубируют в течение 4 дней в мешалке со смещением 50 мм при скорости вращения 180 об/мин и при 30°С.
(II) Основная культура во встряхиваемой колбе:
40 мл среды 1 В12 плюс 5 г/л порошка 4-морфолинпропансульфоновой кислоты (MOPS) (в колбе Эрленмейера объемом 200 мл) смешивают с 5 мл 10-кратного концентрированного раствора циклодекстрина, высевают 10 мл предварительной культуры и инкубируют в течение 5 дней в мешалке со смещением 50 мм при скорости вращения 180 об/мин и при 30°С.
Ферментация: Процессы ферментации осуществляют в объемах 10 л, 100 л и 500 л. Ферментации в 20 л и в 100 л служат в качестве промежуточной стадии культивирования. В то время как предварительные культуры и промежуточные культуры высевают в виде поддерживающей среды в концентрация 10 об.%, основную культуру засевают с помощью 20 об.%-ной промежуточной культуры. Важно отметить: в противоположность к перемешиваемым культурами ингредиенты сред для ферментации рассчитывают по отношению к конечному объему культуры, включая инокулят. Например, если объединяют 18 л среды +2 л инокулята, то вещества взвешивают из расчета 20 л, однако смешивают только с 18 л.
Предварительная культура во встряхиваемой колбе:
Используя в качестве исходной 500 мл поддерживающей культуры, 4х450 мл среды G52 (в колбе Эрленмейера объемом 200 мл) засевают с помощью 50 мл этой культуры и инкубируют в течение 4 дней в мешалке со смещением 50 мм при скорости вращения 180 об/мин и при 30°С.
Промежуточная культура. 20-литровая или 100-литровая:
20-литровая: 18 л среды G52 в ферментере, имеющем общий объем 30 л, засевают с помощью 2 л предварительной культуры. Культивирование продолжают в течение 3-4 дней в следующих условиях; 30°С, 250 об/мин, 0,5 л воздуха на 1 л жидкой среды в мин, избыточное давление 0,5 бар, без контроля рН.
100-литровая: 90 л среды G52 в ферментере, имеющем общий объем 150 л, засевают с помощью 10 л 20-литровой предварительной культуры. Культивирование продолжают в течение 3-4 дней в следующих условиях: 30°С, 150 об/мин, 0,5 л воздуха на 1 л жидкой среды в мин, избыточное давление 0,5 бар, без контроля рН.
Основная культура, 10-, 100- или 500-литровая:
10-литровая: Ингредиенты для получения 10 л среды 1В12 стерилизуют в 7 л воды, затем добавляют 1 л стерильного 10%-ного раствора 2-(гидроксипропил)-β-циклодекстрина (ГП-β-ЦД) и засевают с помощью 2 л 20-литровой промежуточной культуры. Продолжительность культивирования основной культуры составляет 6-7 дней в следующих условиях: 30°С, 250 об/мин, 0,5 л воздуха на 1 л жидкой среды в мин, избыточное давление 0,5 бар, контроль рН с помощью H2SO4/KOH до рН 7,6±0,5 (т.е. без контроля при значении рН от 7,1 до 8,1).
100-литровая: Ингредиенты для получения 100 л среды 1В12 стерилизуют в 70 л воды, затем добавляют 10 л стерильного 10%-ного раствора 2-(гидроксипропил)-β-циклодекстрина и засевают с помощью 20 л 20-литровой промежуточной культуры. Продолжительность культивирования основной культуры составляет 6-7 дней в следующих условиях: 30°С, 200 об/мин, 0,5 л воздуха на 1 л жидкой среды в мин, избыточное давление 0,5 бар, контроль рН с помощью H2SO4/KOH до рН 7,6±0,5. Последовательность посевов для 100-литрового ферментера схематично приведена ниже:
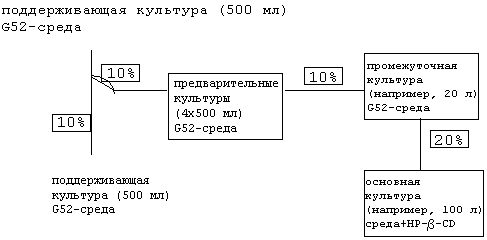
500-литровая: Ингредиенты для получения 500 л среды 1В12 стерилизуют в 350 л воды, затем добавляют 50 л стерильного 10%-ного раствора 2- (гидроксипропил)-β-циклодекстрина и засевают с помощью 100 л 100-литровой промежуточной культуры. Продолжительность культивирования основной культуры составляет 6-7 дней в следующих условиях: 30°С, 120 об/мин, 0,5 л воздуха на 1 л жидкой среды в мин, избыточное давление 0,5 бар, контроль рН с помощью Н2SO4/КОН до рН 7,6±0,5.
Анализ продуктов:
Приготовление образца:
50 мл образцов смешивают с 2 мл полистирола Amberlite XAD16 (фирма Rohm и Haas, Frankfurt, Германия) и встряхивают при 180 об/мин в течение 1 ч при 30°С. Полистирол затем фильтруют, используя найлоновое сито с размером пор 150 мкм, промывают 1 л воды и затем смешивают с фильтром в пробирке типа Nunc объемом 15 мл.
Элюдия продукта из полистирола:
В пробирку с фильтром и полистиролом добавляют 10 мл изопропанола (>99%). После этого закрытую пробирку встряхивают в течение 30 мин при комнатной температуре на роторном смесителе типа Rota-Mixer (фирма Labinco BV, Нидерланды). Затем 2 мл жидкости удаляют центрифугированием и добавляют супернатант с помощью пипетки в пробирки для ЖХВР.
ЖХВР-анализ:
Колонка: Waters-Symetry C18, 100×4 мм, 3,3 мкм WAT066220+предварительная колонка 3,9×20 мм WAT054225
Температура термостата: 30°С
Определение: 250 нм, УФ-DAD-определение
Объем вводимой пробы: 10 мкл
Время удерживания: эпотилон А: 4,30 мин; эпотилон В: 5,38 мин
Б. Воздействие добавления циклодекстрина и циклодекстриновых производных на концентрации полученных эпотилонов
Циклодекстрины представляют собой циклические (α-1,4)-связанные олигосахариды α-D-глюкопиранозы с относительно гидрофобной центральной полостью и гидрофильной областью внешней поверхности.
Следует отметить, в частности (цифрами в скобках обозначено количество остатков глюкозы на молекулу): α-циклодекстрин (6), β-циклодекстрин (7), γ-циклодекстрин (8), δ-циклодекстрин (9), ε-циклодекстрин (10), ζ-циклодекстрин (11), η-циклодекстрин (12) и θ-циклодекстрин (13). Наиболее предпочтительными являются δ-циклодекстрин и особенно α-циклодекстрин, β-циклодекстрин или γ-циклодекстрин или их смеси.
Циклодекстриновые производные прежде всего представляют собой вышеперечисленные циклодекстрины, особенно α-циклодекстрин, β-циклодекстрин или γ-циклодекстрин, прежде всего циклодекстрины, в которых одна или большее количество вплоть до всех гидроксигрупп (3 на радикал глюкозы) преобразованы с образованием простого или сложного эфира. Простые эфиры прежде всего представляют собой алкиловые простые эфиры, предпочтительно (низш.) алкиловые эфиры, такие как метиловый или этиловый эфир, а также пропиловый или бутиловый эфир; и арилгидроксиалкиловые эфиры, такие как фенилгидрокси(низш.)алкиловый, предпочтительно фенилгидроксиэтиловый эфир; гидроксиалкиловые эфиры, в частности гидрокси (низш,) алкиловые эфиры, предпочтительно 2-гидроксиэтиловый, гидроксипропиловый, такой как 2-гидроксипропиловый, или гидроксибутиловый, такой как 2-гидроксибутиловый эфир; карбоксиалкиловые эфиры, в частности карбокси (низш.) алкиловые эфиры, предпочтительно карбоксиметиловый или карбоксиэтиловый эфир; дериватизированные карбоксиалкиловые эфиры, в частности дериватизированный карбокси (низш.)алкиловый эфир, в котором дериватизированная карбоксигруппа является этерифизированной или амидированной карбоксигруппой (прежде всего аминокарбонилом, моно- или ди-(низш.)алкиламинокарбонил, морфолино-, пиперидино-, пирролидино- или пиперазинокарбонилом, или алкоксикарбонилом), в частности (низш.)алкокси-карбонил-(низш) алкиловые эфиры, например, метилоксикарбонилпропиловый эфир или этилкарбонилпропиловый эфир; сульфоалкиловые эфиры, в частности сульфо(низш.)алкиловые эфиры, предпочтительно сульфобутиловый эфир; циклодекстрины, в которых одна или большее количество ОН-групп этерифизировано с помощью радикала формулы
-O-[алк-O]n-Н
где алк обозначает алкил, предпочтительно (низш.)алкил и n обозначает целое число от 2 до 12, предпочтительно 2-5, в частности 2 или 3; циклодекстрины, в которых одна или большее количество ОН-групп этерифизировано с помощью радикала формулы
где R' обозначает атом водорода, гидрокси, -O-(алк-O)z-Н, -O-(алк(-R)-O)p-Н или -O-(алк(-R)-O)q-алк-СО-Y; алк во всех случаях обозначает алкил, предпочтительно (низш.) алкил; m, n, p, q и z обозначают целое число от 1 до 12, предпочтительно 2-5, в частности 2 или 3; и Y обозначает OR1 или NR2R3, где R1, R2 и R3 независимо друг от друга обозначают атом водорода или (низш.) алкил или R2 и R3 вместе с присоединенным атом азота обозначают морфолино, пиперидино, пирролидино или пиперазино; или разветвленные циклодекстрины, в которых присутствуют эфирные группы или ацетали, образованные с другими молекулами сахаров, предпочтительно глюкозил-, диглюкозил(G2-β-циклодекстрин), мальтозил- или димальтозилциклодекстрин или N-ацетилглюкозаминил- глюкозаминил-, N-ацетилгалактотозаминил или галактозаминилциклодекстрин.
Сложные эфиры прежде всего представляют собой алканоиловые эфиры, в частности (низш.) алканоиловые эфиры, такие как ацетиловые эфиры или циклодекстрины.
Также возможно использовать циклодекстрины, в которых два или большее количество указанных различных групп простых эфиров и групп сложных эфиров присутствует одновременно.
Смеси из двух или большего количества этих циклодекстринов и/или циклодекстриновых производных также могут применяться.
Предпочтение отдается, в частности α-, β- или γ-циклодекстринам или их простым (низш.)алкиловым эфирам, таким как метил-β-циклодекстрин или особенно предпочтительно 2,6-ди-О-метил-β-циклодекстрин, или предпочтительно их простым гидрокси(низш.)алкиловым эфирам, таким как 2-гидроксипропил-α-, 2-гидроксипропил-β- или 2-гидроксипропил-γ-циклодекстрин.
Циклодекстрины или циклодекстриновые производные добавляют в культуральную среду предпочтительно в концентрации 0,02-10, предпочтительно 0,05-5, особенно предпочтительно 0,1-4, например, 0,1-2% (мас./об.).
Циклодекстрины или циклодекстриновые производные являются известными или могут быть получены с помощью известных методов (см., например, US 3459731; US 4383992; US 4535152; US 4659696; EP 0094157; EP 0149197; EP 0197571; EP 0300526; EP 0320032; EP 0499322; EP 0503710; EP 0818469; WO 90/12035; WO 91/11200; WO 93/19061; WO 95/089993; WO 96/14090; GB 2189245; DE 3118218; DE 3317064 и указанные в них ссылки, которые также относятся к синтезу циклодекстринов или циклодекстриновых производных, или также у Т. Loftsson и М.Е.Brewster (1996): Pharmaceutical Applications of Cyclodextrins: Drug Solubilization and Stabilisation: Journal of Pharmaceutical Science 85 (10): 1017-1025; R.A.Rajewski и VJ. Stella (1996) Pharmaceutical Applications of Cyclodextrins: In vivo Drug Delivery: Journal of Pharmaceutical Science 85 (11):1142-1168).
Все изученные циклодекстриновые производные получены от компании Fluka, Buchs, CH. Опыты проводят во встряхиваемых колбах объемах 200 мл. В качестве контролей используют колбы с адсорбентом - смолой (полистиролом) Amberlite XAD16 (фирма Rohm & Haas, Frankfurt, Германия) и без добавления абсорбента. После инкубации в течение 5 дней с помощью ХЖВР могут быть определены следующие титры эпотилонов:
Некоторые из изученных циклодекстринов (2,6-ди-орто-метил-β-циклодекстрин, метил-β-циклодекстрин) в изученных концентрациях не обладают никаким действием или оказывают отрицательное действие на производство эпотилона. Как видно из примеров, добавление 1-2% 2-гидроксипропил-β-циклодекстрина повышает производство в 6-8 раз по сравнению с производством без использования циклодекстринов.
В: Ферментация 10-литровой культуры с добавлением 1% 2-гидроксипропил-β-циклодекстрина
Ферментацию проводят в 15-литровом стеклянном ферментере. Среда содержит 10 г/л 2-(гидроксипропил)-β-циклодекстрина, полученного от фирмы Wacker Chemie, Munich, Германия. Изменение выхода продукта в процессе ферментации представлено в таблице 2. Ферментацию заканчивают через 6 дней и производят обработку продукта.
Г: Ферментация 100-литровой культуры с добавлением 1% 2-гидроксипропил-β-диклодекстрина
Ферментацию проводят в 150-литровом ферментере. Среда содержит 10 г/л 2-(гидроксипропил)-β-циклодекстрина. Изменение выхода продукта в процессе ферментации представлено в таблице 3. Ферментацию заканчивают через 7 дней и производят обработку продукта.
Д: Ферментация 500-литровой культуры с добавлением 1% 2-гидроксипропил-β-циклодекстрина
Ферментацию проводят в 750-литровом ферментере. Среда содержит 10 г/л 2-(гидроксипропил)-β-циклодекстрина. Изменение выхода продукта в процессе ферментации представлено в таблице 4. Полученный в результате ферментации продукт собирают через 7 дней и производят его обработку.
Е: Сравнительный пример ферментации 10-литровой культуры без добавления адсорбента
Ферментацию проводят в 15-литровом стеклянном ферментере. Среда не содержит никакого циклодекстрина или другого адсорбента. Изменение выхода продукта в процессе ферментации представлено в таблице 5. Полученный в результате ферментации продукт не собирают и не обрабатывают.
Ж: Обработка эпотилонов: выделение из 500-литровой основной культуры:
Выход 500-литровой основной культуры, описанной в примере 2Г, составляет 450 л, его отделяют с помощью очищающего сепаратора Westfalia типа SA-20-06 (скорость вращения 6500 об/мин) на жидкую фазу (центрифугат + промывочная вода) и твердую фазу (клетки примерно 15 кг). Основная часть эпотилонов обнаружена в центрифугате. Полученная после центрифугирования клеточная масса содержит <15% от установленного количества эпотилонов и ее далее не обрабатывали. Центрифугат объемом 650 л затем помещают в резервуар с мешалкой объемом 4000 л, смешивают с 10 л Amberlite XAD16 (объемное соотношение центрифугата: смолы (полистирола) =65:1) и перемешивают.После контакта в течение примерно 2 ч смолу удаляют центрифугированием с помощью центрифуги со сливом типа Heine (вместимость корзины 40 л, скорость вращения 2800 об/мин). Смолу удаляют из центрифуги и промывают 10-15 л деионизированной воды. Десорбцию осуществляют, перемешивая смолу дважды в стеклянных резервуарах с мешалкой объемом 30 л по 30 мин, каждый раз используя по 30 л изопропанола. Отделение изопропанольной фазы от смолы проводят с помощью всасывающего фильтра. Затем изопропанол удаляют из объединенных изопропанольных фаз, добавляя 15-20 л воды в вакуумном испарителе с циркуляцией (фирма Schmid-Verdampfer) и полученную водную фазу объемом примерно 10 л экстрагируют трижды, используя каждый раз по 10 л этилацетата. Этилацетатный экстракт концентрируют до объема 3-5 л в вакуумном испарителе с циркуляцией (фирма Schmid-Verdampfer) и после этого концентрируют досуха на роторном испарителе (типа Büchi). В результате получают 50,2 г этилацетатного экстракта. Этилацетатный экстракт растворяют в 500 мл метанола, нерастворимые фракции отфильтровывают с помощью складчатого фильтра и раствор вносят в 10-кг колонку Sephadex LH 20 (Pharmacia, Ippsala, Швеция) (диаметр колонки 20 см, уровень заполнения примерно 1,2 м). Элюцию осуществляют, используя в качестве элюента метанол. Эпотилоны А и В в основном присутствуют во фракциях 21-23 (при размере фракции 1 л). Эти фракции концентрируют досуха в вакууме на роторном испарителе (общая масса 9,0 г). После чего эти сефадексные фракции с максимальным содержанием эпотилонов (9,0 г) растворяют в 92 мл смеси ацетонитрил: вода: метиленхлорид (50:40:2), раствор фильтруют через складчатый фильтр и вносят в RP-колонку (устройство типа Prepbar 200, фирма Merck; 2,0 кг LiChrospher RP-18, Merck, размер гранул 12 мкм, диаметр колонки 10 см, уровень заполнения 42 см; фирма Merck, Darmstadt, Германия). Элюцию осуществляют смесью ацетонитрил: вода (3:7) (скорость потока 500 мл/мин; время удерживания эпотилона А примерно 51-59 мин; время удерживания эпотилона В примерно 60-69 мин). Фракционирование контролируют с помощью УФ-детектора при длине волны 250 нм. Фракции концентрируют досуха в вакууме с помощью роторного испарителя типа Büchi. Масса эпотилона А во фракции с максимальным содержанием составляет 700 мг, что согласно полученным с помощью ЖХВР (с внутренним стандартом) соответствует 75,1%. Масса эпотилона В во фракции с максимальным содержанием составляет 1980 мг, что согласно полученным с помощью ЖХВР (с внутренним стандартом) соответствует 86,6%. И наконец фракцию эпотилона А (700 мг) кристаллизуют из 5 мл смеси этилацетат:толуол (2:3) и получают 170 мг эпотилона А в виде чистого кристаллизата [содержание по данным ЖХВР (площадь, %) составляет 94,3%]. Кристаллизацию эпотилона В (1980 мг) осуществляют с помощью 18 мл метанола, получая 144 мг эпотилона В в виде чистого кристаллизата [содержание по данным ЖХВР (площадь, %) составляет 99,2%], tпл (эпотилон В): например, 124-125°С; 1Н-ЯМР для эпотилона В:
500 МГц-ЯМР, растворитель: ДМСО-d6. Химический сдвиг δ в част./млн относительно TMS. s обозначает синглет; d обозначает дублет; m обозначает мультиплет
Пример 15: Медицинское применение полученных рекомбинантным путем эпотилонов
Фармацевтические препараты или композиции, включающие эпотилоны, применяют, например, для лечения злокачественных заболеваний, таких как различные твердые опухоли у человека. Такие противораковые композиции содержат, например, эпотилон в качестве действующего вещества в сочетании с одним или с несколькими органическими или неорганическими жидкими или твердыми фармацевтически приемлемыми носителями. Такие композиции вводят, например, энтерально, назально, ректально, орально или парентерально, прежде всего внутримышечно или внутривенно. Доза действующего вещества зависит от веса тела, возраста и физического и фармакокинетического состояния пациента, а также от пути введения. Поскольку эпотилоны напоминают по биологическим воздействиям таксол, эпотилоны могут использоваться для замены таксола в композициях и методах применения таксола для лечения рака (см., например, патенты US 5496804, 5565478 и 5641803, которые включены в настоящее описание в виде ссылки).
Например, для лечения эпотилон В поставляют в отдельных стеклянных ампулах объемом 2 мл в виде бесцветного концентрата (1 мг/мл) для внутривенного введения. Приготавливают форму вещества в полиэтиленгликоле 300 (ПЭГ 300) и разбавляют 50 или 100 мл 0,9%-ного раствора хлорида натрия для инъекций фармакопеи США (Sodium Chloride Injection, USP), получая требуемую конечную концентрацию лекарства, предназначенного для инфузии. Его вводят в виде однократной 30-минутной внутривенной инфузии каждые 21 день (3-недельная обработка) в виде 6 циклов или в виде однократной 30-минутной внутривенной инфузии каждые 7 дней (еженедельная обработка).
Для еженедельной обработки предпочтительно доза находится в диапазоне от примерно 0,1 до примерно 6, предпочтительно от примерно 0,1 до примерно 5 мг/м2, более предпочтительно от примерно 0,1 до примерно 3 мг/м2, еще более предпочтительно от 0,1 до 1,7 мг/м2, наиболее предпочтительно от примерно 0,3 до примерно 1 мг/м2; для трехнедельной обработки (обработка каждые 3 недели или каждую третью неделю) доза находится в диапазоне от примерно 0,3 до примерно 18 мг/м2, предпочтительно от примерно 0,3 до примерно 15 мг/м2, более предпочтительно от примерно 0,3 до примерно 12 мг/м2, еще более предпочтительно от примерно 0,3 до примерно 7,5 мг/м2 и еще более предпочтительно от примерно 0,3 до примерно 5 мг/м2, наиболее предпочтительно от примерно 1,0 до примерно 3,0 мг/м2. Эту дозу предпочтительно вводят человеку внутривенно (i.v.) в течение 2-180 мин, предпочтительно 2-120 мин, более предпочтительно в течение от примерно 5 до примерно 30 мин, наиболее предпочтительно в течение от примерно 10 до примерно 30 мин, например, в течение примерно 30 мин.
Хотя настоящее изобретение описано со ссылкой на конкретные варианты осуществления, должно быть очевидно, что могут быть сделаны многочисленные изменения, модификации и варианты и, следовательно, все такие изменения, модификации и варианты подпадают под сущность и объем изобретения.






























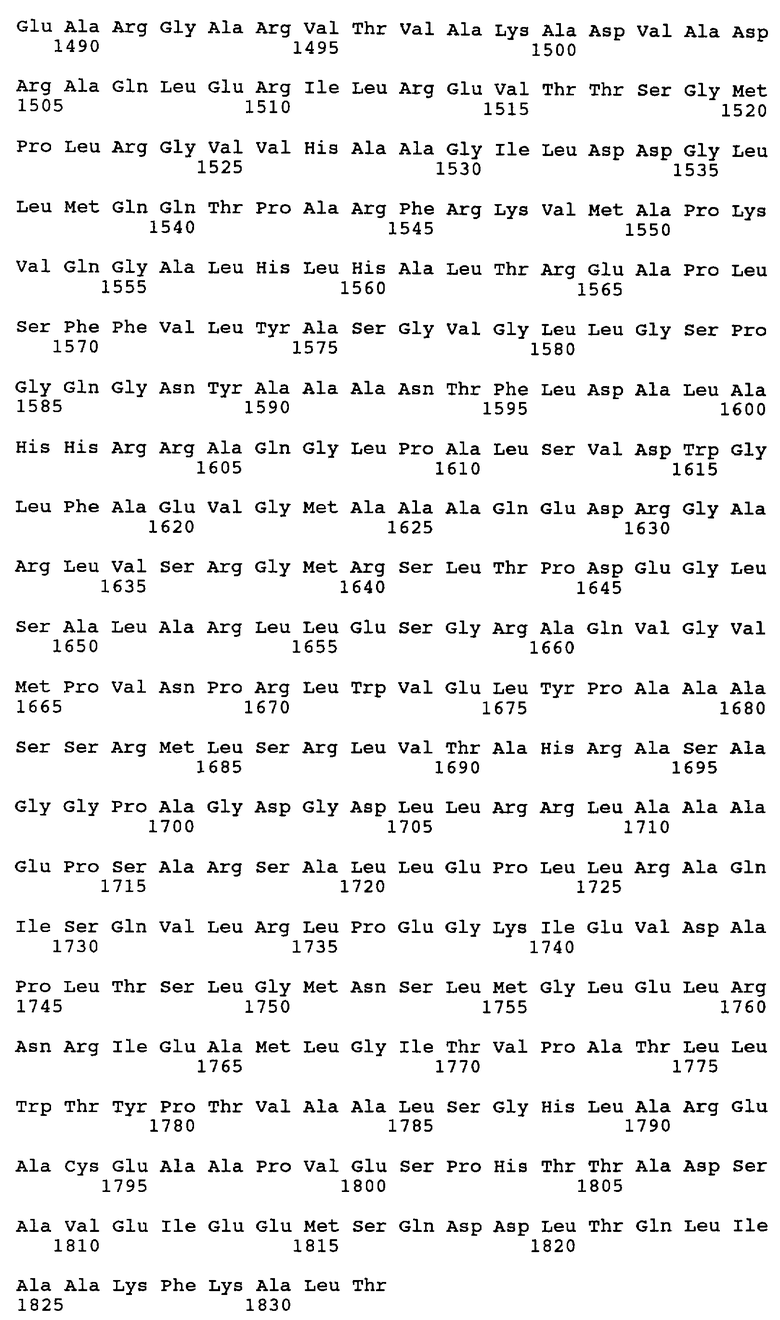









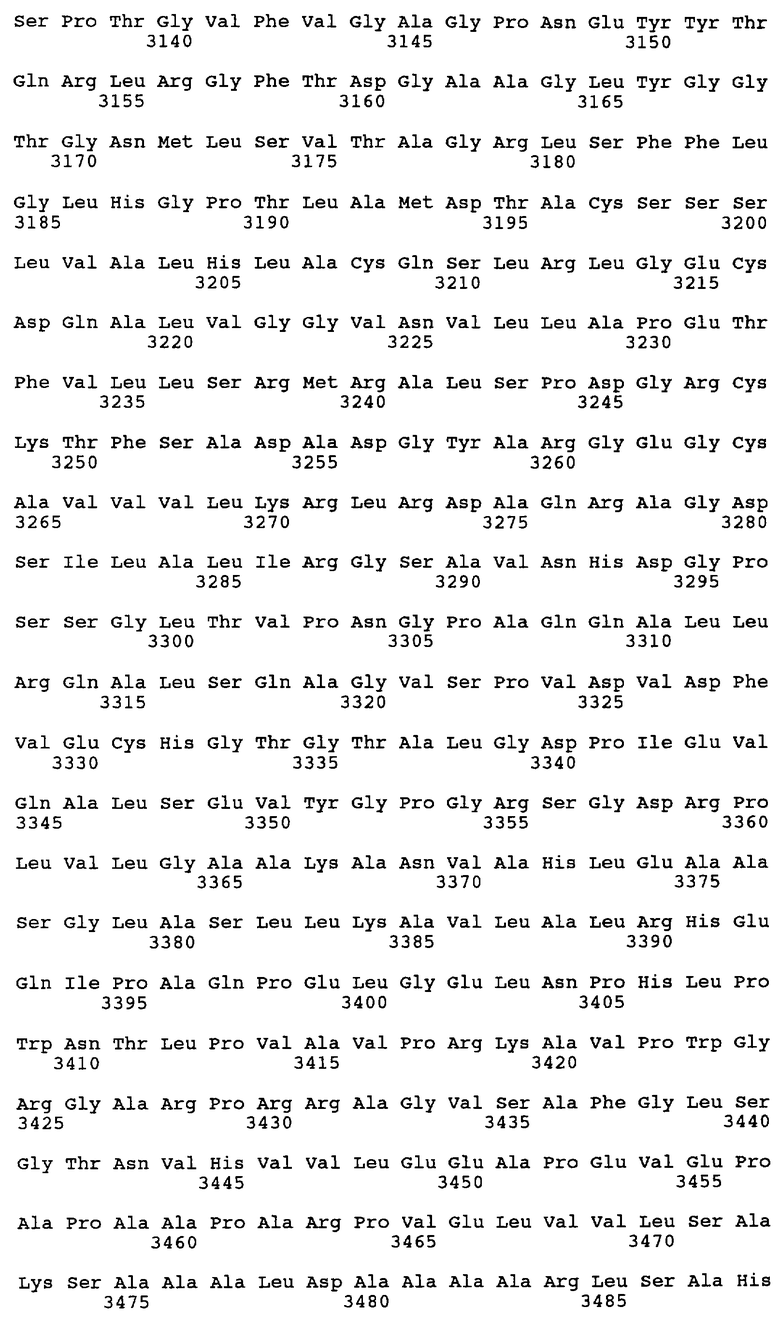













































Изобретение относится к биотехнологии. Описаны рекомбинантные клетки-хозяева, включающие химерный ген, включающий гетерологичную промоторную последовательность, функционально связанную с молекулой нуклеиновой кислоты, которая кодирует, по меньшей мере, один полипептид, вовлеченный в биосинтез эпотилонов, или экспрессируемый рекомбинантным путем полипептид, вовлеченный в биосинтез эпотилонов, а также клоны Вас. Использование изобретения позволяет реализовать способ получения эпотилонов с высокой степенью эффективности. 3 н. и 6 з.п. ф-лы, 6 табл.
Приоритет по пунктам:
| SCHUPT Т | |||
| et al, J.Bacteriol., vol.177, №13, 1995, p.p.3673-3679 | |||
| МАНИАТИС Т | |||
| и др | |||
| Методы генетической инженерии | |||
| Молекулярное клонирование | |||
| М.: Мир, 1984, с.9, 291-332. |
Авторы
Даты
2005-11-27—Публикация
1999-06-16—Подача