Изобретение относится к химии производных халкона, а именно к новому способу получения замещенных 3-м-феноксифенил-1-фенил-2-пропен-1-онов общей формулы
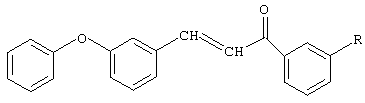
где R=Н, Br, Cl, NO2
которые являются полупродуктами для синтеза биологически активных веществ и могут использоваться в медицине в качестве антибактериальных средств.
Известен способ получения 1,3-дифенилпропен-2-он-1 с достаточно высоким выходом, с использованием сложного катализатора - комплекса ацетата Со(2+) с сополимером 4-винилпиридинстиролом и дивинилбензолом [Irie Kazuo, Imazawa Atsushi, Watanabe Ken-ichi. Aldol condensations with Co(II)-polymer complex catalysts. "Chem. Lett.", 1979, №11, p.1401-1404].
Недостатками данного метода являются прежде всего сложность используемого катализатора и относительно невысокие выходы ряда целевых продуктов. Кроме того, данный катализатор активен в реакциях с замещенными альдегидами, содержащими электронно-акцепторные заместители (93-98%), а альдегиды с электронно-донорными заместителями менее реакционноспособны (35-38%).
Также известен способ получения 3-(4-метилфенил)-2-(ар)алкилпропан-1-олов альдольной конденсацией при температуре 150-250°С и давлении Н2 250-350 бар [Заявка 4236889 ФРГ, МКИ5 С 07 С 33/20, 33/24, опубл. 05.05.94].
Недостатками данного метода является проведение процесса при высоких температурах и сильном избыточном давлении.
Известен способ получения N-фенил-м-феноксифенилметанимина, который осуществляется взаимодействием м-феноксибензальдегида с анилином в отсутствии растворителя и катализатора при температуре 100-110°С в течение 2 часов [а.с. №2116999, МКИ С 07 С 251/24, 1996].
Недостатками данного метода является низкая конверсия исходных реагентов и как следствие - невысокие выходы основного продукта. Высокий температурный режим процесса ведет к протеканию побочных реакций.
Наиболее близким к предлагаемому изобретению по структуре и способу является получение производных халкона в качестве антибактериальных средств конденсацией 2,4-диокси-5-бромацетофенона и салицилового или дибромсалицилового альдегида в среде метанола и катализатора - водного раствора гидроокиси натрия при комнатной температуре, [а.с. №593425, МКИ С 07 С 49/82, 1982].
Недостатками данного метода является низкая конверсия исходных реагентов, и как следствие - невысокие выходы основного продукта. Применение полярного растворителя - метанола ведет к протеканию побочных реакций.
Задачей предлагаемого изобретения является разработка технологичного мало энергоемкого одностадийного метода синтеза замещенных 3-м-феноксифенил-1-фенил-2-пропен-1-онов с высоким выходом.
Техническим результатом является обеспечение высокого выхода заявляемых соединений, а также упрощение способа получения.
Поставленный технический результат достигается в новом способе получения замещенных 3-м-феноксифенил-1-фенил-2-пропен-1-онов общей формулы
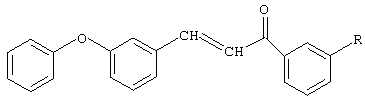
где R=H, Br, Cl, NO2
заключающийся во взаимодействии м-феноксибензальдегида с ацетофеноном или соответствующим замещенным ацетофеноном: м-бромацетофеноном, м-хлорацетофеноном, м-нитроацетофеноном, причем процесс проводят в присутствии катализатора гидроксида натрия, при мольном соотношении - ацетофенон или замещенный ацетофенон: м-феноксибензальдегид: катализатор равном (1,0-1,2):(1,2-1,5):(0,05-0,1) соответственно, в среде смешанного растворителя - диоксан-метанол при массовом соотношении 10:1, при комнатной температуре в течение 20 часов с последующим выделением целевого продукта.
Сущностью метода является процесс взаимодействия между альдегидом и кетоном в присутствии щелочного катализатора. Катализ щелочью состоит в том, что гидроксильная группа щелочного агента вырывает протон из α-звена кетона, а полученный карбанион атакует карбонильный углерод альдегида.
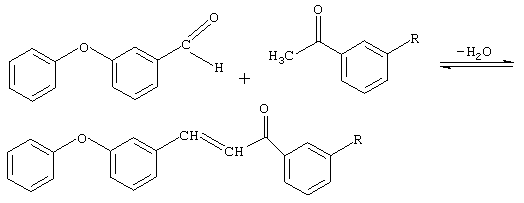
Таким образом, в реакцию конденсации вовлекается α-метиленовая группа кетона и оксо-группа альдегида.
Проведение реакции конденсации м-ФБА с замещенными ацетофенонами в растворителе позволяет получать замещенные 3-м-феноксифенил-1-фенил-2-пропен-1-оны с высокими выходами в достаточно мягких условиях.
Преимуществом данного метода является высокий выход (86-94%), а также возможность получения практически любых гомологов данного ряда, которые также являются полупродуктами для синтеза биологически активных веществ, что обуславливается наличием карбоксильной группы и непредельной связи в молекуле замещенного 3-м-феноксифенил-1-фенил-2-пропен-1-она.
Обнаружено, что на выход целевого замещенного 3-м-феноксифенил-1-фенил-2-пропен-1-она влияет строение замещенного кетона. Так, при неизменных остальных условиях реакции, в случае взаимодействия м-феноксибензальдегида с ацетофеноном выход целевого продукта составил 94%, а с м-хлорацетофеноном - 86%. Это можно объяснить тем, что наличие электронно-акцепторной группы в фенильном радикале приводит к росту электроотрицательных свойств замещенного ацетофенона. Это затрудняет отрыв протона от метильной группы ацетофенона. Аналогично реагирует и м-бромпроизводное ацетофенона (86%). Таким образом найдено, что оптимальным и технологичным условием проведения реакции м-феноксибензальдегида с замещенными ацетофенонами является ее осуществление в среде смеси апротонного неполярного растворителя - диоксана и полярного протонного растворителя - метанола в соотношении 10:1. Мольное соотношение исходных реагентов ацетофенон или замещенный ацетофенон: м-феноксибензальдегид: катализатор - (1,0-1,2):(1,2-1,5):(0,05-0,1). Дальнейшее изменение соотношения компонентов реакции приводит к снижению выхода целевого продукта вследствие протекания побочных реакций. Оптимальной температурой реакции является комнатная температура, что исключает образование побочных продуктов реакции. Оптимальная продолжительность реакции 20 часов. Дальнейшее увеличение продолжительности реакции нецелесообразно, так как это не приводит к существенному увеличению выхода целевого продукта. Протекание данной реакции чрезвычайно чувствительно к полярности растворителя. Не рекомендуется использовать в качестве растворителя такие соединения, как диметилформамид, диметилсульфоксид и спирты. Смешанный растворитель - диоксан-метанол при массовом соотношении 10:1 обеспечивает гомофазность процесса и увеличивает селективность и конверсию реакции.
Способ осуществляется следующим образом.
Оба исходных реагента - ацетофенон (замещенный ацетофенон) и м-феноксибензальдегид, растворитель - 1,4-диоксан подвергают очистке, в виде перегонки в вакууме (м-феноксибензальдегид) и при атмосферном давлении (замещенный ацетофенон и 1,4-диоксан). Затем, после смешивания, в реакционную массу добавляют каталитическое количество свежеприготовленного раствора катализатора - гидроокиси натрия в метаноле, и перемешивают 20 часов при комнатной температуре. Стадия выделения продукта состоит из последующей нейтрализации реакционной массы уксусной кислотой; отгонки растворителя, в вакууме при температуре не выше 25°С, который может быть пригоден для повторного использования в аналогичном синтезе и перекристаллизации соответствующих 3-м-феноксифенил-1-фенил-2-пропен-1-онов из спирта. Выход данных продуктов составляет до 94%.
Изобретение иллюстрируется следующими примерами.
Пример 1.
Синтез 3-м-феноксифенил-1-фенил-2-пропен-1-она.
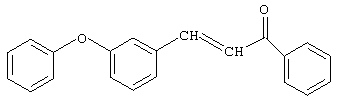
К раствору, содержащему 30 г (0,25 моль) ацетофенона и 59,4 г (0,3 моль) м-феноксибензальдегида в 100 мл 1,4-диоксана, при хорошем перемешивании прибавляют из капельной воронки 1 г (0,025 моль) 10%-го раствора едкого натра в метаноле при температуре 20-25°С (соотношение исходных реагентов ацетофенон: м-феноксибензальдегид: катализатор -1,0:1,2:0,1 соответственно). Реакционную смесь перемешивают при комнатной температуре 20 часов, нейтрализуют ледяной уксусной кислотой, отгоняют 1,4-диоксан при температуре 20-25°С и вакууме 1-2 мм рт.ст. Перекристаллизация из спирта. Получают 73,3 г (94%) 3-м-феноксифенил-1-фенил-2-пропен-1-она.
Найдено, %: С, 83,77; Н, 5,32. C21H16O2
Вычислено, %: С, 83,98; Н, 5,37; О, 10,65.
ИК-спектр ν, см-1: 3060 (Сар), 1680 (С=O), 1590 (С=С), 1100 (С-О-С).
Пример 2.
Синтез 3-м-феноксифенил-1-м-бромфенил-2-пропен-1-она.
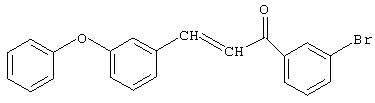
К раствору, содержащему 49,8 г (0,25 моль) м-бромацетофенона и 74,25 г (0,375 моль) м-феноксибензальдегида в 100 мл 1,4-диоксана, при хорошем перемешивании прибавляют из капельной воронки 1 г (0,025 моль) 10%-ного раствора едкого натра в метаноле при температуре 20-25°С (соотношение исходных реагентов м-бромацетофенон:м-феноксибензальдегид:катализатор - 1,0:1,5:0,1 соответственно). Реакционную смесь перемешивают при комнатной температуре 20 часов, нейтрализуют ледяной уксусной кислотой, отгоняют 1,4-диоксан при температуре 20-25°С и вакууме 1-2 мм рт.ст. Перекристаллизация из спирта. Получают 81,5 г (86%) 3-м-феноксифенил-1-м-бромфенил-2-пропен-1-она.
Найдено, %: С, 65,98; Н, 4,05; Br, 22,07. C21H15O2Br
Вычислено, %: С, 66,51; Н, 3,99; Br, 21,07; О, 8,44.
ИК-спектр ν, см-1: 3060 (Сар), 1670 (С=O), 1590 (С=С), 1100 (С-О-С).
Пример 3.
Синтез 3-м-феноксифенил-1-м-хлорфенил-2-пропен-1-она.
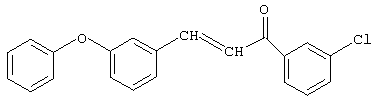
К раствору, содержащему 45,6 г (0,3 моль) м-хлорацетофенона и 59,4 г (0,3 моль) м-феноксибензальдегида в 100 мл 1,4-диоксана, при хорошем перемешивании прибавляют из капельной воронки 1 г (0,025 моль) 10%-го раствора едкого натра в метаноле при температуре 20-25°С (соотношение исходных реагентов м-хлорацетофенон:м-феноксибензальдегид:катализатор - 1,2:1,2:0,1 соответственно). Реакционную смесь перемешивают при комнатной температуре 20 часов, нейтрализуют ледяной уксусной кислотой, отгоняют 1,4-диоксан при температуре 20-25°С и вакууме 1-2 мм рт.ст. Получают 84,3 г (86%) 3-м-феноксифенил-1-м-хлорфенил-2-пропен-1-она.
Найдено, %: С, 75,25; Н, 4,57; Cl, 10,64. C21H15O2Cl
Вычислено, %: С, 75,34; Н, 4,52; Cl, 10,59; О, 9,56.
ИК-спектр ν, см-1: 3060 (Сар), 1670 (С=O), 1590 (С=С), 1100 (С-О-С).
Пример 4.
Синтез 3-м-феноксифенил-1-м-нитрофенил-2-пропен-1-она.
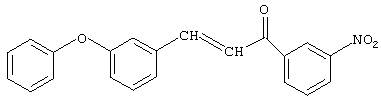
К раствору, содержащему 41,25 г (0,25 моль) м-нитроацетофенона и 59,4 г (0,3 моль) м-феноксибензальдегида в 100 мл 1,4-диоксана, при хорошем перемешивании прибавляют из капельной воронки 0,6 г (0,012 моль) 10%-ного раствора едкого натра в метаноле при температуре 20-25°С (соотношение исходных реагентов м-нитроацетофенон:м-феноксибензальдегид:катализатор - 1,0:1,2:0,1 соответственно). Реакционную смесь перемешивают при комнатной температуре 20 часов, нейтрализуют ледяной уксусной кислотой, отгоняют 1,4-диоксан при температуре 20-25°С и вакууме 1-2 мм рт.ст. Получают 81,1 г (94%) 3-м-феноксифенил-1-м-нитрофенил-2-пропен-1-она.
Найдено, %: С, 73,08; Н, 4,34; N, 4,12. C21H15O4N
Вычислено, %: С, 73,03; Н, 4,38; N, 4,06; О, 18,53.
ИК-спектр ν, см-1: 3060 (Сар), 1670 (С=O), 1590 (С=С), 1525 (NO2), 1100 (С-О-С).
ВЫВОДЫ
Разработан технологичный малоэнергоемкий одностадийный метод синтеза замещенных 3-м-феноксифенил-1-фенил-2-пропен-1-онов, а также соединений, имеющих в своей структуре м-феноксифенильный фрагмент, протекающий с высоким выходом. Структура описанных соединений подтверждена ИК-спектрами (прибор Perkin-Elmer) и элементным анализом. Чистота - методом жидкостной хроматографии.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 1-М-ФЕНОКСИФЕНИЛ-2-НИТРОАЛКЕНОВ | 2004 |
|
RU2263661C1 |
| Способ получения производных @ -тетрагидро-1,2,4-триазинона-3 | 1981 |
|
SU988815A1 |
| СПОСОБ ПОЛУЧЕНИЯ 3-АРОИЛЦИКЛОПРОПАН-1,1,2,2-ТЕТРАКАРБОНИТРИЛОВ | 2011 |
|
RU2468001C1 |
| Способ получения производных 1-карбонил-1-феноксифенил-2-азолилэтанола | 1983 |
|
SU1331427A3 |
| 3-ФЕНОКСИФЕНИЛСОДЕРЖАЩИЕ 1,3-ДИКЕТОНЫ В КАЧЕСТВЕ ИСХОДНЫХ СОЕДИНЕНИЙ ДЛЯ ПОЛУЧЕНИЯ ИХ ХЕЛАТНЫХ КОМПЛЕКСОВ С ИОНАМИ МЕДИ (II) И СПОСОБ ПОЛУЧЕНИЯ 3-ФЕНОКСИФЕНИЛСОДЕРЖАЩИХ 1,3-ДИКЕТОНОВ | 2012 |
|
RU2475473C1 |
| 4-АРИЛ-1-ФЕНИЛАЛКИЛ-1,2,3,6-ТЕТРАГИДРОПИРИДИНЫ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И ПРОМЕЖУТОЧНЫЕ ВЕЩЕСТВА | 1996 |
|
RU2163237C2 |
| Способ синтеза α-хлорацетофенона (варианты) | 2017 |
|
RU2644778C1 |
| Z-1,2,-ДИАРИЛАЛЛИЛХЛОРИДЫ | 1992 |
|
RU2096401C1 |
| ХЛОРМЕТИЛДИАРИЛОКСИРАНЫ | 1991 |
|
RU2125997C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-(2-МЕТИЛ-4-ФЕНОКСИФЕНИЛ)-БУТАН-1,3-ДИОНА | 2012 |
|
RU2478606C1 |
Изобретение относится к химии производных халкона, используемых в синтезе биологически активных веществ, а именно к способу получения халконов на основе м-феноксибензальдегида общей формулы:
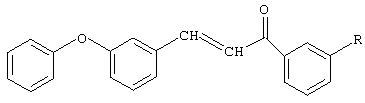
где R=H, Br, Cl, NO2.
Способ включает взаимодействие м-феноксибензальдегида с ацетофеноном или соответствующим замещенным ацетофеноном: м-бромацетофеноном, м-хлорацетофеноном, м-нитроацетофеноном. Процесс проводят в присутствии катализатора гидроксида натрия. Мольное соотношение - ацетофенон или замещенный ацетофенон: м-феноксибензальдегид: катализатор, равном (1,0-1,2):(1,2-1,5):(0,05-0,1). Используют смешанный растворитель - диоксан: метанол при массовом соотношении 10:1. Процесс ведут при комнатной температуре в течение 20 часов с последующим выделением целевого продукта. Технический результат - способ одностадийный, с низкой энергоемкостью, обеспечивает высокий выход и чистоту конечных продуктов.
Способ получения замещенных 3-м-феноксифенил-1-фенил-2-пропен-1-онов общей формулы
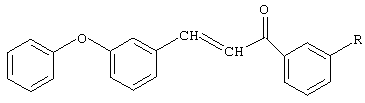
где R=H, Br, Cl, NO2,
заключающийся во взаимодействии м-феноксибензальдегида с ацетофеноном или соответствующим замещенным ацетофеноном: м-бромацетофеноном, м-хлорацетофеноном, м-нитроацетофеноном, причем процесс проводят в присутствии катализатора гидроксида натрия, при мольном соотношении - ацетофенон или замещенный ацетофенон: м-феноксибензальдегид: катализатор, равном (1,0-1,2):(1,2-1,5):(0,05-0,1) соответственно, в среде смешанного растворителя - диоксан-метанол при массовом соотношении 10:1, при комнатной температуре в течение 20 ч с последующим выделением целевого продукта.
| Производные халкона в качестве антибактериальных средств | 1976 |
|
SU593425A1 |
| СПОСОБ ПОЛУЧЕНИЯ α,β -НЕНАСЫЩЕННЫХ КЕТОНОВ АРОМАТИЧЕСКОГО ИЛИ ГЕТЕРОАРОМАТИЧЕСКОГО РЯДА | 1994 |
|
RU2082710C1 |
| Способ получения 1-арил-3,3-дифенилпропанонов-1 | 1975 |
|
SU536160A1 |
| Производные халкона в качестве противовоспалительных и капилляроукрепляющих средств | 1979 |
|
SU750960A1 |
Авторы
Даты
2005-12-27—Публикация
2004-06-28—Подача