Данное изобретение относится к новому соединению, способу его получения, ингибитору синтезирующего сквален фермента, ингибитору биосинтеза холестерина и ингибитору биосинтеза триглицеридов, содержащих такое новое соединение, а также к лекарственной композиции, содержащей их. Более конкретно, данное соединение относится к профилактическим и лечебным средствам для лечения гиперлипидемии, включая заболевания, связанные с артериосклерозом, и ишемические заболевания сердца.
Предшествующий уровень техники
Холестерин является стеролом, который образуется в результате биосинтеза во всех животных клетках, за исключением красных кровяных клеток, и является фактором, существенным для сохранения плазматических мембран и для синтеза стероидных гормонов. Холестерин растворим в жирах и существует в виде гипобарического липопротеина (ЛПНП=LDL), гипербарического липопротеина (ЛПВП=HLD) и тому подобного в крови. ЛПНП в крови включается в клетки через акцептор на поверхности клеток и регенерируется в свободный холестерин после разложения на составные части. Это является основным путем включения холестерина снаружи в клетки. Также известно, что основной фермент, который участвует в биосинтезе акцепторного белка для ЛПНП и холестерина, подвергается действию обратной связи концентрации холестерина, который является результирующим продуктом. Таким образом, уровень холестерина в клетках поддерживается и регулируется полностью механизмом регуляции путем обратной связи акцетора ЛПНП и типа биосинтеза фермента на основе равновесия между биосинтезом самой клетки и включением ЛПНП снаружи клетки.
В последние годы было установлено, что холестерин является главной причиной гиперлипидемии, а также является наиболее опасным фактором, вызывающим артериосклеротические заболевания (например, заболевания с поражением коронарных сосудов, заболевания с поражением сосудов мозга, заболевания с поражением аорты и заболевания с поражением периферических артерий) и ишемические болезни сердца (например, стенокардия и инфаркт сердца), создающим серьезную проблему. Гиперлипидемия определяется по любому одному из следующих показателей: холестерин в крови составляет 220 мг/дл или более, нейтральные липиды составляют 150 мг/дл или более и гипербарический липопротеиновый (ЛПВП)-холестерин составляет менее 35 мг/дл (Руководство Японского общества по атеросклерозу), и является катастрофическим заболеванием, вызывающим атеросклероз и т.п. Одной из основных причин является повышение уровня ЛПНП-холестерина в крови (высокая холестеринемия) и отложение холестерина на внутренней стенке кровеносного сосуда. В настоящее время полагают, что лечение, проводимое для снижения холестерина в сыворотке, эффективно для профилактики развития и прогрессирования артериосклероза и т.п. В последние годы были получены хорошие результаты с применением ингибитора биосинтеза холестерина, особенно ингибитора фермента, редуцирующего 3-гидрокси-3-метилглютарил-КоА (ГМГ-КоА), такого как правастатин, вместо общепринятых лекарственных средств фибратного типа и препаратов никотиновой кислоты. Ингибитор фермента, редуцирующего ГМГ-КоА, конкурентно подавляет редуцирующий ГМГ-КоА фермент, который является ферментом, ограничивающим скорость биосинтеза холестерина в печени, для снижения скорости биосинтеза холестерина, тем самым снижается способность печени синтезировать акцепторы ЛПНП, в результате чего снижается ЛПНП в сыворотке. Однако подавление продуцирования мевалоновой кислоты на основе подавления фермента, редуцирующего ГМГ-КоА, воздействует на продуцирование изопрена, включающего фарнезилдифосфорную кислоту (ФДФ). Поэтому существует опасение как в отношении влияния, например, на другие метаболические вещества, такие как убихинон, долихол, гем А, изопентил т-РНК и пренилпротеин, получаемые через изопрен в качестве промежуточного соединения. Кроме того, было указано на риск побочных эффектов, таких как катаракта и миопатия.
Синтезирующий сквален фермент является связанным с мембраной ферментом с молекулярной массой 47 кДа и редуцирующе катализирует конденсацию голова-к-голове двух молекул ФДФ для синтеза сквалена, который является промежуточным соединением для синтеза холестерина. В системе биосинтеза холестерина синтезирующий сквален фермент расположен в направлении системы, генерирующей редуцирующий ГМГ-КоА фермент и изопрен, и поэтому ингибитор синтезирующего сквален фермента, как считается, почти не оказывает воздействия на метаболические системы, иные, чем система метаболизма холестерина, и поэтому, как ожидается, будет работать как новый депрессор холестерина, который решит проблемы, связанные с ингибитором фермента, редуцирующего ГМГ-КоА. Ингибитор синтезирующего сквален фермента, о котором впервые сообщено, что он является соединением - аналогом ФДФ и сквалена. Однако данные аналогичные соединения обладают активностью подавления образования пренилпротеина и тому подобное в дополнение к подавляющему действию на фермент, синтезирующий сквален, и трудно применить данные аналогичные соединения на практике. Между тем, недавно было описано замещенное фенилэтинилхинуклидиновое соединение и замещенное пиридинилэтинилхинуклидиновое соединение определенного типа, пригодное в качестве ингибитора синтезирующего сквален фермента, в JP-A 7-502283, 8-502731, 8-504803 (патент США 5731323) и 8-509488. Однако до сих пор не был создан ингибитор синтезирующего сквален фермента, который может давать эффект в качестве лекарственного препарата при гиперлипидемии.
Таким образом, объектом данного изобретения является поиск и обнаружение соединения, которое обладает более сильной подавляющей активностью на синтезирующий сквален фермент и сильным действием по снижению холестерина по сравнению с теми соединениями, которые используются в настоящее время, и пригодно в качестве лекарственного средства для лечения гиперлипидемии.
Описание изобретения
Ввиду вышеизложенной ситуации проведены серьезнейшие исследования и в результате обнаружено, что специфические хинуклидиновые соединения и их соли обладают беспрецедентно сильной подавляющей активностью в отношении синтезирующего сквален фермента. Было также обнаружено, что данные соединения и их соли обладают сильной активностью подавления биосинтеза холестерина, активностью подавления биосинтеза триглицеридов и действием по снижению сывороточного холестерина и триглицеридов на основе активности по подавлению синтеза сквалена. Таким образом, было осуществлено данное изобретение. Соединение по данному изобретению пригодно в качестве лекарственного средства для лечения гиперлипидемии.
Соответственно, данное изобретение относится к:
(1) соединению (I), представленному следующей формулой:
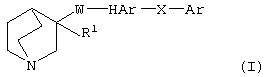
(в которой R1 представляет (1) атом водорода или (2) гидроксильную группу; HAr представляет ароматический гетероцикл, который может быть замещенным 1-3 группами; Ar представляет необязательно замещенное ароматическое кольцо; W представляет цепь, представленную (1) -CH2-CH2-, которая может быть замещена, (2) -СН=СН-, которая может быть замещена, (3) 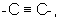 (4) -NH-CO-, (5) -CO-NH-, (6) -NH-CH2-, (7) -CH2-NH-, (8) -CH2-CO-, (9) -CO-CH2-, (10) -NH-S(O)l-, (11) -S(O)l-NH-, (12) -CH2-S(O)l- или (13) -S(O)l-CH2- (l означает 0, 1 или 2); и Х представляет цепь, представленную (1) одинарной связью, (2) необязательно замещенной С1-6 алкиленовой цепью, (3) необязательно замещенной С2-6 алкениленовой цепью, (4) необязательно замещенной С2-6 алкиниленовой цепью, (5) формулой -Q- (где Q представляет атом кислорода, атом серы, СО или N(R2) (где R2 представляет С1-6 алкильную группу или С1-6 алкоксигруппу)), (6) -NH-CO-, (7) -CO-NH-, (8) -NH-CH2-, (9) -СН2-NH-, (10) -CH2-CO-, (11) -CO-CH2-, (12) -NH-S(O)m-, (13) -S(O)m-NH-, (14) -CH2-S(O)m-, (15) -S(O)m-СН2- (где m означает 0, 1 или 2) или (16) -(СН2)n-O- (где n означает целое число от 1 до 6), или его соли или их гидрату,
(4) -NH-CO-, (5) -CO-NH-, (6) -NH-CH2-, (7) -CH2-NH-, (8) -CH2-CO-, (9) -CO-CH2-, (10) -NH-S(O)l-, (11) -S(O)l-NH-, (12) -CH2-S(O)l- или (13) -S(O)l-CH2- (l означает 0, 1 или 2); и Х представляет цепь, представленную (1) одинарной связью, (2) необязательно замещенной С1-6 алкиленовой цепью, (3) необязательно замещенной С2-6 алкениленовой цепью, (4) необязательно замещенной С2-6 алкиниленовой цепью, (5) формулой -Q- (где Q представляет атом кислорода, атом серы, СО или N(R2) (где R2 представляет С1-6 алкильную группу или С1-6 алкоксигруппу)), (6) -NH-CO-, (7) -CO-NH-, (8) -NH-CH2-, (9) -СН2-NH-, (10) -CH2-CO-, (11) -CO-CH2-, (12) -NH-S(O)m-, (13) -S(O)m-NH-, (14) -CH2-S(O)m-, (15) -S(O)m-СН2- (где m означает 0, 1 или 2) или (16) -(СН2)n-O- (где n означает целое число от 1 до 6), или его соли или их гидрату,
(2) соединению, описанному в (1), его соли или их гидрату, где R1 представляет (1) атом водорода или (2) гидроксильную группу; HAr представляет 5-14-членный ароматический гетероцикл, который содержит 1-4 атома, выбранных из атома азота, атома серы, атома кислорода, и может быть замещен 1-3 группами, выбранными из (1) атома галогена, (2) гидроксильной группы, (3) тиольной группы, (4) нитрогруппы, (5) нитрильной группы, (6) С1-6 углеводородной группы, которая может быть замещена, (7) С3-8 циклической углеводородной группы, которая может быть замещена, (8) С6-14 ароматической циклической углеводородной группы, которая может быть замещена, (9) 5-14-членной ароматической гетероциклической группы, которая может быть замещена, (10) 4-10-членной неароматической гетероциклической группы, которая может быть замещена, (11) С1-6 алкоксигруппы, которая может быть замещена, (12) С3-8 циклоалкилоксигруппы, которая может быть замещена, (14) С3-8 циклической углеводородтиогруппы, которая может быть замещена, (15) С6-14 ароматической углеводородоксигруппы, которая может быть замещена, (16) 5-14-членный гетероцикл-оксигруппы, которая может быть замещена, (17) С6-14 ароматической углеводородтиогруппы, которая может быть замещена, (18) 5-14-членный гетероцикл-тиогруппы, которая может быть замещена, (19) аминогруппы, которая может быть замещена, (20) азидной группы, (21) гуанидиногруппы, (22) карбамидной группы, (23) формильной группы, (24) С1- 6имидоильной группы, которая может быть замещена, (25) замещенной карбонильной группы, (26) замещенной карбонилоксигруппы, (27) карбоксильной группы, которая может образовывать соль, (28) карбамоильной группы, которая может быть замещена, (29) С1-4 алкилендиоксигруппы, которая может быть замещена, (30) сульфинильной группы, которая может быть замещена и (31) сульфонильной группы, которая может быть замещена; Ar является С6-14 ароматическим углеводородным кольцом или 5-14-членным ароматическим гетероциклом, который может быть замещен одной или более группами, выбранными из (1) гидроксильной группы, (2) атома галогена, (3) С1-6 углеводородной группы, которая может быть замещена, (4) С3-8 циклической углеводородной группы, которая может быть замещена, (5) С1-6 алкоксигруппы, которая может быть замещена, (6) С3-8 циклоалкоксигруппы, которая может быть замещена, (7) С1-6 углеводородтиогруппы, которая может быть замещена, (8) С3-8 циклической углеводородтиогруппы, (9) С6-14 ароматической углеводородной циклической группы, которая может быть замещена, (10) 5-14-членной гетероциклической группы, которая может быть замещена, (11) аминогруппы, которая может быть замещена С1-6 алкильной группой, (12) С1-4 алкилендиоксигруппы; W является цепью, представленной (1) -СН2-СН2-, которая может быть замещена, (2) -СН=СН-, которая может быть замещена, (3) 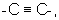 (4) -NH-CO-, (5) -CO-NH-, (6) -NH-CH2-, (7) -CH2-NH-, (8) -СН2-СО-, (9) -СО-СН2-, (10) -NH-S(O)l-, (11) -S(O)l-NH-, (12) -CH2-S(0)l- или (13) -S(O)l-CH2- (l означает 0, 1 или 2); X представляет цепь, представленную (1) одиночной связью, (2) С1-6 алкиленовой цепью, которая может быть замещена, (3) С2-6 алкениленовой цепью, которая может быть замещена, (4) С2-6 алкиниленовой цепью, которая может быть замещена, (5) формулой -Q- (где Q представляет атом кислорода, атом серы, СО или N(R2) (где R2 представляет С1-6 алкильную группу или С1-6 алкоксигруппу)), (6) -NH-CO-, (7) -CO-NH-, (8) -NH-CH2-, (9) -CH2-NH-, (10) -СН2-СО-, (11) -СО-СН2-, (12) -NH-S(O)m-, (13) -S(O)m-NH-, (14) -CH2-S(O)m-, (15) -S(O)m-СН2- (где m означает 0, 1 или 2) или (16) -(CH2)n-O- (где n представляет целое число от 1 до 6),
(4) -NH-CO-, (5) -CO-NH-, (6) -NH-CH2-, (7) -CH2-NH-, (8) -СН2-СО-, (9) -СО-СН2-, (10) -NH-S(O)l-, (11) -S(O)l-NH-, (12) -CH2-S(0)l- или (13) -S(O)l-CH2- (l означает 0, 1 или 2); X представляет цепь, представленную (1) одиночной связью, (2) С1-6 алкиленовой цепью, которая может быть замещена, (3) С2-6 алкениленовой цепью, которая может быть замещена, (4) С2-6 алкиниленовой цепью, которая может быть замещена, (5) формулой -Q- (где Q представляет атом кислорода, атом серы, СО или N(R2) (где R2 представляет С1-6 алкильную группу или С1-6 алкоксигруппу)), (6) -NH-CO-, (7) -CO-NH-, (8) -NH-CH2-, (9) -CH2-NH-, (10) -СН2-СО-, (11) -СО-СН2-, (12) -NH-S(O)m-, (13) -S(O)m-NH-, (14) -CH2-S(O)m-, (15) -S(O)m-СН2- (где m означает 0, 1 или 2) или (16) -(CH2)n-O- (где n представляет целое число от 1 до 6),
(3) соединению, описанному в (1) или (2), его соли или их гидрату, в котором R1 является гидроксильной группой,
(4) соединению, описанному в (1) или (2), его соли или их гидрату, в котором W представляет-СН2-СН2-, -СН=СН- или 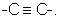
(5) соединению, описанному в (1) или (2), его соли или их гидрату, в котором Х является простой связью, -СН2-, -СН2-СН2-, -СН=СН- или -СО-,
(6) соединению, описанному в (1) или (2), его соли или их гидрату, где HAr является 5-14-членным ароматическим гетероциклом, содержащим 1-4 атома, выбранных из атома азота, атома серы и атома кислорода, и может быть замещен 1-3 группами, выбранными из (1) гидроксильной группы, (2) атома галогена, (3) тиольной группы, (4) нитрогруппы, (5) нитрильной группы, (6) С1-6 алкильной группы, С2-6 алкенильной группы или С2-6 алкинильной группы, которые могут быть замещены одной или двумя группами, выбранными из (а) гидроксильной группы, которая может быть защищена, (b) атома галогена, (с) нитрильной группы, (d) карбоксильной группы, (е) С3-8 циклоалкильной группы, С3-8 циклоалкенильной группы или С3-8 циклоалкинильной группы, которые могут быть гидроксилированными или галогенированными, (f) С1-6 алкоксигруппы, которая может быть замещена группой, выбранной из атома галогена, гидроксильной группы, С6-14 арильной группы, 5-14-членной гетероарильной группы и С6-14 арил-С1-6 алкоксигруппы, (g) С3-8 циклоалкилоксигруппы, которая может быть галогенированной или гидроксилированной, (h) С3-8 циклоалкенилоксигруппы, которая может быть галогенированной или гидроксилированной, (i) 5-14-членный арилоксигруппы, которая может быть галогенированной или гидроксилированной, (j) 5-14-членной неароматической цикл-оксигруппы, которая может быть галогенированной или гидроксилированной, (k) С1-6 алкоксикарбонильной группы, (l) С1-4 алкилендиоксигруппы, которая может быть галогенированной, (m) С1-6 алканоильной группы, которая может быть замещена группой, выбранной из гидроксильной группы, С1-6 алкоксигруппы и С1-6 алканоилоксигруппы, (n) С6-14 арильной группы, которая может быть замещена группой, выбранной из атома галогена, С1-6 алкалкильной группы и С1-6 алкоксигруппы, (о) 5-14-членной ароматической гетероциклической группы, которая может быть замещена группой, выбранной из атома галогена, С1-6 алкильной группы, С3-8 алкенильной группы, С3-8 алкинильной группы и С1-6 алкоксигруппы, (р) 5-10-членной неароматической гетероциклической группы, которая может быть замещена группой, выбранной из атома галогена, С1-6 алкильной группы, С3-8 алкенильной группы, С3-8 алкинильной группы и С1-6 алкоксигруппы, (q) группы (EtO)2РО-, (r) ацетильной группы, (s) сульфонильной группы, которая может быть замещена группой, выбранной из С1-6 углеводородной группы, моно-(С1-6 углеводород)аминогруппы, (t) аминогруппы, которая может быть замещена С1-6 углеводородной группой, (u) С1-6 углеводород-тиогруппы, которая может быть гидроксилированной или галогенированной, и (v) карбамоильной группы, которая может быть замещена С1-6 углеводородной группой, (7) С3-8 циклоалкильной группы или С3-8 циклоалкенильной группы, которые могут быть замещены одной или двумя группами, выбранными из (а) гидроксильной группы, (b) атома галогена, (с) нитрильной группы, (d) карбоксильной группы, (е) С1-6 алкильной группы, которая может быть замещена группой, выбранной из C1-6 алкоксигруппы, которая может быть гидроксилированной или галогенированной, С1-6 углеводородтиогруппы, которая может быть галогенированной, аминогруппы, которая может быть замещена С1-6 углеводородной группой и С1-6 алканоильной группой, (f) С2-6 алкенильной группы, которая может быть замещена группой, выбранной из С1-6 алкоксигруппы, которая может быть гидроксилированной или галогенированной, С1-6 углеводородтиогруппы, которая может быть галогенированной, аминогруппы, которая может быть замещена С1-6 углеводородной группой и С1-6 алканоильной группой, (g) С2-6 алкинильной группы, которая может быть замещена группой, выбранной из С1-6 алкоксигруппы, которая может быть гидроксилированной или галогенированной, С1-6 углеводородтиогруппы, которая может быть галогенированной, аминогруппы, которая может быть замещена С1-6 углеводородной группой и С1-6 алканоильной группой, (h) аминогруппы, которая может быть замещена группой, выбранной из С1-6 алкоксигруппы, которая может быть гидроксилированной или галогенированной, С1-6 углеводородтиогруппы, которая может быть галогенированной, С1-6 алканоильной группы, которая может быть замещена С1-6 углеводородной группой, (i) С1-6 алкоксигруппы, которая может быть замещена группой, выбранной из С1-6 алкильной группы, которая может быть гидроксилированной или галогенированной, С1-6 алкоксигруппы, которая может быть гидроксилированной или галогенированной, С1-6 углеводородтиогруппы, которая может быть галогенированной, аминогруппы, которая может быть замещена С1-6 углеводородной группой и С1-6 алканоильной группой, (j) С1-6 углеводородтиогруппы, которая может быть замещена группой, выбранной из С1-6 алкильной группы, которая может быть гидроксилированной или галогенированной, С2-6 алкенильной группы, которая может быть галогенированной, С1-6 алкоксигруппы, которая может быть гидроксилированной или галогенированной, С1-6 углеводородтиогруппы, которая может быть галогенированной, аминогруппы, которая может быть замещена С1-6 углеводородной группой и С1-6 алканоильной группой, (k) С1-6 алканоильной группы, которая может быть замещена группой, выбранной из гидроксильной группы, С1-6 алкоксигруппы и С1-6 алканоилоксигруппы, (l) С6-14 арильной группы, которая может быть замещена группой, выбранной из атома галогена, С1-6 алкалкильной группы и С1-6 алкоксигруппы, (m) 5-14-членной ароматической гетероциклической группы, которая может быть замещена группой, выбранной из атома галогена, С1-6 алкильной группы, С3-8 алкенильной группы, С3-8 алкинильной группы и С1-6 алкоксигруппы, (n) неароматической гетероциклической группы, которая может быть замещена группой, выбранной из атома галогена, С1-6 алкильной группы, С3-8 алкенильной группы, С3-8 алкинильной группы и С1-6 алкоксигруппы, (о) С1-6 алкоксикарбонильной группы, (р) С1-4 алкилендиоксигруппы, которая может быть галогенированной, (q) группы (EtO)2PO- и (r) ацетильной группы, (8) С6-14 ароматической углеводородной группы, которая может быть замещена одной или более группами, выбранными из (а) гидроксильной группы, (b) атома галогена, (с) С1-6 алкилсульфонильной группы, С2-6 алкенилсульфонильной группы и С2-6 алкинилсульфонильной группы, которые могут быть галогенированными, (d) С1-4 алкилендиоксигруппы, которая может быть галогенированной, (е) С1-6 алкоксигруппы, которая может быть галогенированной, (f) С1-6 углеводородтиогруппы, которая может быть галогенированной, (g) С1-6 алкоксикарбонильной группы, (h) С6-14 арил-С1-6 алкоксигруппы, (i) С1-7 алканоил-аминогруппы, (j) С1-6 алкилкарбамоильной группы, (k) С2-6 алкенилкарбамоильной группы, (l) С2-6 алкинилкарбамоильной группы и (m) аминогруппы, которая может быть замещена С1-6 углеводородной группой, (9) 5-14-членной ароматической гетероциклической группы, которая может быть замещена одной или более группами, выбранными из (а) гидроксильной группы, (b) атома галогена, (с) нитрильной группы, (d) С1-6 алкильной группы, С2-6 алкенильной группы или С2-6 алкинильной группы, которые могут быть галогенированными, (е) С1-6 алкоксигруппы, которая может быть галогенированной, (f) С1-6 алкилтиогруппы, С2-6 алкенилтиогруппы или С2-6 алкинилтиогруппы, которые могут быть галогенированными, (g) С1-6 алкокси-С1-6 алкильной группы, (h) ацетильной группы (i) С1-6 алканоильной группы, (j) моно-(С1-6 углеводород) аминогруппы, (k) ди(С1-6 углеводород) аминогруппы и (l) три-(С1-6 углеводород) аминогруппы, (10) 4-10-членной неароматической гетероциклической группы, которая может быть замещена одной или более группами, выбранными из (а) гидроксильной группы, (b) атома галогена, (с) нитрильной группы, (d) С1-6 алкильной группы, С2-6 алкенильной группы или С2-6 алкинильной группы, которые могут быть галогенированными, (e) С1-6 алкоксигруппы, которая может быть галогенированной, (f) С1-6 алкилтиогруппы, С2-6 алкенилтиогруппы или С2-6 алкинилтиогруппы, которые могут быть галогенированными, (g) С1-6 алкокси-С1-6 алкильной группы, (h) ацетильной группы, (i) С1-6 алканоильной группы, (j) моно-(С1-6 углеводород) аминогруппы, (k) ди-(С1-6 углеводород) аминогруппы, (l) три-(С1-6 углеводород)аминогруппы, (m) С1-4 алкилендиоксигруппы и (n) оксогруппы, (11) С1-6 алкоксигруппы, которая может быть замещена одной или более группами, выбранными из (а) гидроксильной группы, (b) атома галогена, (с) С1-6 алкильной группы, С2-6 алкенильной группы или С2-6 алкинильной группы, которые могут быть замещены группой, выбранной из гидроксильной группы, атома галогена, 5-14-членной ароматической гетероциклической группы и 4-10-членной неароматической гетероциклической группы, (d) С3-8 циклоалкильной группы или С3-8 циклоалкенильной группы, которые могут быть гидроксилированными или галогенированными, (е) С1-6 алкоксигруппы, которая может быть гидроксилированной или галогенированной, (f) С1-6 алкилтиогруппы, С2-6 алкенилтиогруппы или С2-6 алкинилтиогруппы, которые могут быть галогенированными, (g) С3-8 циклоалкилоксигруппы или С3-8 циклоалкенилоксигруппы, которые могут быть галогенированными, (h) С3-8 циклоалкилтиогруппы или С3-8 циклоалкенилтиогруппы, которые могут быть галогенированными, (i) С6-14 арильной группы, (j) С1-6 алкалканоильной группы, которая может быть галогенированной, (k) 5-14-членной ароматической гетероциклической группы, (12) С3-8 циклоалкилоксигруппы, которая может быть замещена одной или двумя группами, выбранными из (а) гидроксильной группы, (b) атома галогена, (с) С1-6 углеводородной группы, которая может быть замещена группой, выбранной из гидроксильной группы, атома галогена, С1-6 алкоксигруппы и С1-6 алканоильной группы, (d) С1-6 алкоксигруппы, которая может быть замещена группой, выбранной из атома галогена, С1-6 алкоксигруппы и С1-6 алканоильной группы и (е) С1-6 углеводородтиогруппы, которая может быть замещена группой, выбранной из атома галогена, С1-6 алкоксигруппы и С1-6 алканоильной группы, (13) С1-6 алкилтиогруппы, С2-6 алкенилтиогруппы или С2-6 алкинилтиогруппы, которые могут быть замещены одной или двумя группами, выбранными из (а) гидроксильной группы, (b) атома галогена, (с) С1-6 алкильной группы, С2-6 алкенильной группы или С2-6 алкинильной группы, которые могут быть замещены группой, выбранной из гидроксильной группы, атома галогена, 5-14-членной ароматической гетероциклической группы и 4-10-членной неароматической гетероциклической группы, (d) С3-8 циклоалкильной группы, С3-8 циклоалкенильной группы или С3-8 циклоалкинильной группы, которые могут быть гидроксилированными или галогенированными, (е) С1-6 алкоксигруппы, которая может быть гидроксилированной или галогенированной, (f) С1-6 алкилтиогруппы, С2-6, алкенилтиогруппы или С2-6 алкинилтиогруппы, которые могут быть галогенированными, (g) С3-8 циклоалкилоксигруппы или С3-8 циклоалкенилоксигруппы, которые могут быть галогенированными, (h) С3-8 циклоалкилтиогруппы или С3-8 циклоалкенилтиогруппы, которые могут быть галогенированными, (i) С6-14 арильной группы, (j) С1-6 алканоильной группы, которая может быть галогенированной, (k) 5-14-членной ароматической гетероциклической группы и (l) 4-10-членного неароматического гетероцикла, (14) С3-8 циклоалкилтиогруппы или С3-8 циклоалкенилтиогруппы, которые могут быть замещены одной или двумя группами, выбранными из (а) гидроксильной группы, (b) атома галогена, (с) С3-8 алкильной группы, С3-8 алкенильной группы или С3-8 алкинильной группы, которые могут быть галогенированными, (d) С1-6 алкоксигруппы, которая может быть галогенированной, (е) С1-6 углеводородтиогруппы, которая может быть галогенированной, и (f) С1-6 алкалканоильной группы, которая может быть галогенированной, (15) аминогруппы, представленной формулой -N(R3)R4 (где R3 и R4 являются одинаковыми или различными, и каждая представляет группу, выбранную из (а) ароматической гетероциклической группы, (b) неароматической гетероциклической группы, (с) С1-6 алкильной группы, С2-6 алкенильной группы или С1-6 алкинильной группы, которые могут быть замещены атомом галогена или С1-6 алкоксигруппой, (d) С3-8 циклоалкильной группы или С3-8 циклоалкенильной группы, которые могут быть галогенированными, (е) карбонильной группы, которая может быть замещена С1-6 алкильной группой, С2-6 алкенильной группой или С2-6 алкинильной группой, которые могут быть галогенированными, С3-8 циклоалкильной группой или С3-8 циклоалкенильной группой, которые могут быть галогенированными, С6-14 арильной группой или ароматической гетероциклической группой, (f) С1-6 алканоильной группы, которая может быть замещена группой, выбранной из С6-14 арильной группы и ароматической гетероциклической группы, (g) карбамоильной группы, которая может быть замещена С1-6 алкильной группой, С2-6 алкенильной группой или С2-6 алкинильной группой, С6-14 арильной группой или ароматической гетероциклической группой и (h) сульфонильной группы, которая может быть замещена С1-6 алкильной группой, С2-6 алкенильной группой или С2-6 алкинильной группой, а также (i) R3 и R4 могут быть соединенными и объединенными с образованием 3-10-членного кольца, и циклическая аминогруппа может быть замещена одной или более группами, выбранными из гидроксильной группы, атома галогена, С1-6 алкильной группы, С2-6 алкенильной группы, С2-6 алкинильной группы, C1-6 алкоксигруппы, C1-6 углеводородтиогруппы и C1-4 алкилендиоксигруппы, (16) С6-14 арилоксигруппы, которая может быть замещена одной или более группами, выбранными из (а) гидроксильной группы, (b) атома галогена, (с) C1-6 алкилсульфонильной группы, С1-6 алкенилсульфонильной группы или С1-6 алкинилсульфонильной группы, которые могут быть галогенированными, (d) C1-4 алкилендиоксигруппы, которая может быть галогенированной, (е) C1-6 алкоксигруппы, которая может быть галогенированной, (f) C1-6 углеводородтиогруппы, которая может быть галогенированной, (g) C1-6 алкоксикарбонильной группы, (h) С6-14 арил-С1-6 алкоксигруппы, (i) C1-7 алканоиламиногруппы, (j) C1-6 алкилкарбамоильной группы, (k) C2-6 алкенилкарбамоильной группы, (l) С2-6 алкинилкарбамоильной группы и (m) аминогруппы, которая может быть замещена C1-6 углеводородной группой, (17) С6-14 арилтиогруппы, которая может быть замещена одной или более группами, выбранными из (а) гидроксильной группы, (b) атома галогена, (с) C1-6 алкилсульфонильной группы, С2-6 алкенилсульфонильной группы или С2-6 алкинилсульфонильной группы, которые могут быть галогенированными, (d) C1-4 алкилендиоксигруппы, которая может быть галогенированной, (е) C1-6 алкоксигруппы, которая может быть галогенированной, (f) C1-6 углеводородтиогруппы, которая может быть галогенированной, (g) C1-6 алкоксикарбонильной группы, (h) С6-14 арил-C1-6 алкоксигруппы, (i) C1-7 алканоиламиногруппы, (j) C1-6 алкилкарбамоильной группы, (k) C2-6 алкенилкарбамоильной группы, (l) С2-6 алкинилкарбамоильной группы и (m) аминогруппы, которая может быть замещена C1-6 углеводородной группой, (18) 5-15-членной ароматической гетероцикл-оксигруппы, которая может быть замещена одной или более группами, выбранными из (а) гидроксильной группы, (b) атома галогена, (с) нитрильной группы, (d) C1-6 алкильной группы, С2-6 алкенильной группы или С2-6 алкинильной группы, которые могут быть галогенированными, (e) C1-6 алкоксигруппы, которая может быть галогенированной, (f) C1-6 алкилтиогруппы, С2-6 алкенилтиогруппы или С2-6 алкинилтиогруппы, которые могут быть галогенированными, (g) C1-6 алкокси-C1-6 алкильной группы, (h) ацетильной группы, (i) C1-6 алканоильной группы, (j) моно-(C1-6 углеводород) аминогруппы, (k) ди-(C1-6 углеводород) аминогруппы и (l) три-(C1-6 углеводород) аминогруппы, (19) 5-15-членный ароматический гетероцикл-тиогруппы, которая может быть замещена одной или более группами, выбранными из (а) гидроксильной группы, (b) атома галогена, (с) нитрильной группы, (d) C1-6 алкильной группы, С2-6 алкенильной группы или С2-6 алкинильной группы, которые могут быть галогенированными, (е) C1-6 алкоксигруппы, которая может быть галогенированной, (f) C1-6 алкилтиогруппы, С2-6 алкенилтиогруппы или С2-6 алкинилтиогруппы, которые могут быть галогенированными, (g) C1-6 алкокси- C1-6 алкильной группы, (h) ацетильной группы, (i) C1-6 алканоильной группы, (j) моно-(C1-6 углеводород) аминогруппы, (k) ди-(C1-6 углеводород) аминогруппы и (l) три-(C1-6 углеводород) аминогруппы, (20) 4-10-членный неароматический гетероцикл-оксигруппы, которая может быть замещена одной или более группами, выбранными из (а) гидроксильной группы, (b) атома галогена, (с) нитрильной группы, (d) C1-6 алкильной группы, С2-6 алкенильной группы или С2-6 алкинильной группы, которые могут быть галогенированными, (e) C1-6 алкоксигруппы, которая может быть галогенированной, (f) C1-6 алкилтиогруппы, С2-6 алкенилтиогруппы или С2-6 алкинилтиогруппы, которые могут быть галогенированными, (g) C1-6 алкокси-C1-6 алкильной группы, (h) ацетильной группы, (i) C1-6 алканоильной группы, (j) моно-(C1-6 углеводород) аминогруппы, (k) ди-(C1-6 углеводород) аминогруппы и (l) три-(C1-6 углеводород)аминогруппы, (21) 4-10-членный неароматический гетероцикл-тиогруппы, которая может быть замещена одной или более группами, выбранными из (а) гидроксильной группы, (b) атома галогена, (с) нитрильной группы, (d) C1-6 алкильной группы, С2-6 алкенильной группы или С2-6 алкинильной группы, которые могут быть галогенированными, (е) C1-6 алкоксигруппы, которая может быть галогенированной, (f) C1-6 алкилтиогруппы, С2-6 алкенилтиогруппы или C2-6 алкинилтиогруппы, которые могут быть галогенированными, (g) C1-6 алкокси-C1-6 алкильной группы, (h) ацетильной группы, (i) C1-6 алканоильной группы, (j) моно-(C1-6 углеводород) аминогруппы, (k) ди- (C1-6 углеводород) аминогруппы и (l) три-(C1-6 углеводород) аминогруппы, (22) азидной группы, (23) гуанидиногруппы, (24) карбамидной группы, (25) формильной группы, (26) C1-6 имидоильной группы, которая может быть замещена, (27) C1-6 алканоильной группы, которая может быть замещена C1-6 алкоксигруппой, (28) C1-6 алканоилоксигруппы, которая может быть замещена C1-6 алкоксигруппой, (29) карбоксильной группы, которая может образовывать соль, (30) карбонильной группы, которая замещена группой, выбранной из (а) C1-6 алкоксигруппы, (b) С6-14 арильной группы и (с) 5-15-членный ароматической гетероциклической группы, (31) карбамоильной группы, представленной формулой -CO-N(R5)R6 (где R5 и R6 являются одинаковыми или различными, и каждый представляет группу, выбранную из (а) атома водорода, (b) C1-6 алкильной группы, (с) C2-6 алкенильной группы, (d) C2-6 алкинильной группы, (е) С3-8 циклоалкильной группы, (f) С3-8 циклоалкенильной группы, (g) С6-14 арильной группы и (h) ароматической гетероциклической группы, или (i) R5 и R6 могут соединяться и объединяться с образованием 3-8-членного кольца, (32) C1-4 алкилендиоксигруппы, которая может быть замещена (а) гидроксильной группой или (b) атомом галогена, (33) сульфинильной группы, которая может быть замещена группой, выбранной из (а) C1-6 углеводородной группы, которая может быть галогенированной, и (b) аминогруппы, которая может быть монозамещена или дизамещена C1-6 углеводородной группой, которая может быть галогенированной, и (34) сульфонильной группы, которая может быть замещена (a) C1-6 углеводородной группой, которая может быть галогенированной, или (b) аминогруппой, которая может быть монозамещена или дизамещена C1-6 углеводородной группой, которая может быть галогенированной,
(7) соединению, описанному в (1) или (2), его соли или их гидрату, где HAr является 5-14-членным ароматическим гетероциклом, который может быть замещен, в дополнение к заместителю -Х-Ar, 1-3 группами, выбранными из (1) 5- или 6-членных ароматических гетероциклов, которые могут быть замещены C1-6 алкильной группой, (2) 5-6-членным неароматическим гетероциклом, который может быть замещен одной или более группами, выбранными из (а) гидроксильной группы, (b) C1-6 алкильной группы и (с) C1-6 алкоксигруппы, (3) C6-10 ароматического углеводородного кольца, которое может быть замещено одной или более группами, выбранными из (а) атома галогена, (b) C1-6 алкоксигруппы, (с) C1-4 алкилендиоксигруппы и (d) сульфонильной группы, которая может быть замещена C1-6 алкильной группой, (4) C1-6 алкильной группы, которая может быть замещена одной или более группами, выбранными из (а) гидроксильной группы, (b) атома галогена, (с) 5-6-членного ароматического гетероцикла и (d) C1-6 алкоксигруппы и (5) C1-6 алкоксигруппы, которая может быть замещена (а) атомом галогена или (b) C1-6 алкоксигруппой,
(8) соединению, описанному в (1) или (2), его соли или их гидрату, где HAr представляет 5-10-членный ароматический гетероцикл, который может быть замещен, в дополнение к заместителю -Х-Ar, 1-3 группами, выбранными из (1) бензольного кольца, которое может быть замещено C1-4 алкилендиоксигруппой, (2) пиридинового кольца, (3) пиримидинового кольца, (4) пиридазинового кольца, (5) пиразинового кольца, (6) тиофенового кольца, (7) пиперидинового кольца, которое может быть замещено C1-6 алкоксигруппой, (8) пиперазинового кольца, которое может быть замещено C1-6 алкоксигруппой, (9) пирролидинового кольца, которое может быть замещено C1-6 алкоксигруппой, (10) пиперидинового кольца, которое может быть замещено гидроксильной группой и C1-6 алкоксигруппой, (11) пиперазинового кольца, которое может быть замещено гидроксильной группой и C1-6 алкоксигруппой, (12) пирролидинового кольца, которое может быть замещено гидроксильной группой и C1-6 алкоксигруппой, (13) морфолинового кольца, (14) C1-6 алкильной группы, которая может быть замещена C1-6 алкоксигруппой, и (15) C1-6 алкоксигруппы, которая может быть замещена гидроксильной группой и C1-6 алкоксигруппой,
(9) соединению, описанному в (1) или (2), его соли или их гидрату, в котором HAr представляет пиридиновое кольцо, пиримидиновое кольцо, пиридазиновое кольцо, пиразиновое кольцо, индольное кольцо, хинолиновое кольцо, тиофеновое кольцо или бензотиофеновое кольцо, которое может быть замещено 1-3 группами,
(10) соединению, описанному в (1) или (2), его соли или их гидрату, в которых HAr представляет пиридиновое кольцо, пиримидиновое кольцо, пиридазиновое кольцо, пиразиновое кольцо, индольное кольцо, хинолиновое кольцо, тиофеновое кольцо или бензотиофеновое кольцо, которые могут быть замещены, в дополнение к заместителю -Х-Ar, 1-3 группами, выбранными из (1) 5-6-членного ароматического гетероцикла, который может быть замещен C1-6 алкильной группой, (2) 5-6-членного ароматического гетероцикла, который может быть замещен одной или более группами, выбранными из (а) гидроксильной группы, (b) C1-6 алкильной группы и (с) C1-6 алкоксигруппы, (3) C6-10 ароматического углеводородного кольца, которое может быть замещено одной или более группами, выбранными из (а) атома галогена, (b) C1-6 алкоксигруппы, (с) C1-6 алкилендиоксигруппы и (d) сульфонильной группы, которая может быть замещена C1-6 алкильной группой, (4) C1-6 алкильной группы, которая может быть замещена одной или более группами, выбранными из (а) гидроксильной группы, (b) атома галогена, (с) 5- или 6-членного гетероцикла и (d) C1-6 алкоксигруппы, и (5) C1-6 алкоксигруппы, которая может быть замещена (а) атомом галогена и (b) C1-6 алкоксигруппой,
(11) соединению, описанному в (1) или (2), его соли или их гидрату, где Ar представляет С6-14 ароматическое углеводородное кольцо или 5-14-членный ароматический гетероцикл, который может иметь 1-3 заместителя, выбранных из (1) атома галогена, (2) C1-6 алкильной группы, С2-6 алкенильной группы или С2-6 алкинильной группы, которые могут быть замещены одной или более группами, выбранными из (а) атома галогена, (b) C1-6 алкоксигруппы и (с) сульфонильной группы, которая может быть замещена, (3) C1-6 алкоксигруппы, которая может быть галогенированной, (4) моно-(C1-6 алкил) аминогруппы, (5) ди-(C1-6 алкил) аминогруппы и (6) C1-4 алкилендиоксигруппы, которая может быть галогенированной,
(12) соединению, описанному в (1) или (2), его соли или их гидрату, в котором Ar представляет необязательно замещенное бензольное кольцо или пиридиновое кольцо,
(13) соединению, описанному в (1) или (2), его соли или их гидрату, в котором Ar представляет С6-14 ароматическое углеводородное кольцо или 5-14-членный ароматический гетероцикл, который может иметь 1-3 заместителя, выбранных из (1) атома галогена, (2) C1-6 алкильной группы, C2-6 алкенильной группы или С2-6 алкинильной группы, которые могут быть замещены одной или более группами, выбранными из (а) атома галогена, (b) C1-6 алкоксигруппы и (с) сульфонильной группы, которая может быть замещена, (3) C1-6 алкоксигруппы, которая может быть галогенированной, (4) моно-(C1-6 алкил) аминогруппы, (5) ди-(C1-6 алкил) аминогруппы и (6) C1-4 алкилендиоксигруппы, которая может быть галогенированной,
(14) соединению, описанному в (1) или (2), его соли или их гидрату, в котором Х представляет-СН2-; и Ar является бензольным кольцом,
(15) соединению, описанному в (1) или (2), причем соединение представлено следующей формулой:
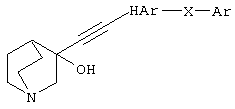
(в которой HAr представляет 5-10-членный ароматический гетероцикл, содержащий 1-4 атома, выбранных из атома азота, атома серы и атома кислорода, и он может быть замещен 1-3 группами, выбранными из (1) атома галогена, (2) гидроксильной группы, (3) тиольной группы, (4) нитрогруппы, (5) нитрильной группы, (6) C1-6 углеводородной группы, (7) С3-8 циклической углеводородной группы, которая может быть замещена, (8) C6-14 ароматической циклической углеводородной группы, которая может быть замещена, (9) 5-14-членной ароматической гетероциклической группы, которая может быть замещена, (10) 4-10-членной неароматической гетероциклической группы, которая может быть замещена, (11) C1-6 алкоксигруппы, которая может быть замещена, (12) C3-8 циклоалкилоксигруппы, которая может быть замещена, (13) C1-6 углеводородтиогруппы, которая может быть замещена, (14) С3-8 циклической углеводородтиогруппы, которая может быть замещена, (15) C6-14 ароматической углеводородоксигруппы, которая может быть замещена, (16) 5-14-членный гетероцикл-оксигруппы, которая может быть замещена, (17) C6-14 ароматической углеводородтиогруппы, которая может быть замещена, (18) 5-14-членный гетероцикл-тиогруппы, которая может быть замещена, (19) аминогруппы, которая может быть замещена, (20) азидной группы, (21) гуанидиногруппы, (22) карбамидной группы, (23) формильной группы, (24) C1-6 имидоильной группы, которая может быть замещена, (25) замещенной карбонильной группы, (26) замещенной карбонилоксигруппы, (27) карбоксильной группы, которая может образовывать соль, (28) карбамоильной группы, которая может быть замещена, (29) C1-4 алкилендиоксигруппы, которая может быть замещена, (30) сульфинильной группы, которая может быть замещена, и (31) сульфонильной группы, которая может быть замещена;
Ar представляет C6-14 ароматическое углеводородное кольцо или 5-14-членный ароматический гетероцикл, который может быть замещен группой, выбранной из (1) гидроксильной группы, (2) атома галогена, (3) C1-6 углеводородной группы, которая может быть замещена, (4) С3-8 циклической углеводородной группы, которая может быть замещена, (5) C1-6 алкоксигруппы, которая может быть замещена, (6) С3-8 циклоалкилоксигруппы, которая может быть замещена, (7) C1-6 углеводородтиогруппы, которая может быть замещена, (8) С3-8 циклической углеводородтиогруппы, (9) С6-14 ароматической углеводородной циклической группы, которая может быть замещена, (10) 5-14-членной гетероциклической группы, которая может быть замещена, (11) аминогруппы, которая может быть замещена C1-6 алкильной группой, (12) C1-4 алкилендиоксигруппы; и
Х представляет цепь, представленную (1) одинарной связью, (2) C1-6 алкиленовой цепью, которая может быть замещена, (3) C2-6 алкениленовой цепью, которая может быть замещена, (4) C2-6 алкиниленовой цепью, которая может быть замещена, (5) формулой -Q- (где Q представляет атом кислорода, атом серы, СО или N(R2) (где R2 представляет C1-6 алкильную группу или C1-6 алкоксигруппу)), (6) -NH-CO-, (7) -CO-NH-, (8) -NH-CH2-, (9) -CH2-NH-, (10) -CH2-CO-, (11) -CO-CH2-, (12) -NH-S(O)n-, (13) -S(O)m-NH-, (14) -СН2-S(О)m-, (15) -S(O)m-CH2- (где m равно 0, 1 или 2) или (16) -(СН2)n-O- (где n обозначает целое число от 1 до 6), его соли или их гидрату,
(16) соединению, описанному в (15), его соли или их гидрату, в котором HAr является пиридиновым кольцом, пиразиновым кольцом, пиримидиновым кольцом или пиридазиновым кольцом, которое может быть замещено, в дополнение к заместителю -Х-Ar, одной или более группами, выбранными из (1) 5- или 6-членного ароматического гетероцикла, (2) 5- или 6-членного ароматического гетероцикла, который может быть замещен C1-6 алкоксигруппой, и (3) C6-10 ароматического углеводородного кольца; Ar является бензольным кольцом или пиридиновым кольцом, которое может быть галогенированным; и Х представляет -СН2-,
(17) соединению, описанному в (15), его соли или их гидрату, в котором HAr является пиридиновым кольцом, пиразиновым кольцом, пиримидиновым кольцом или пиридазиновым кольцом, которые могут быть замещены, в дополнение к заместителю -Х-Ar, группой, выбранной из (1) C1-6 алкоксигруппы, которая может быть замещена гидроксильной группой, (2) C1-6 алкокси- C1-6 алкоксигруппы и (3) C1-6 алкокси- C1-6 алкиламиногруппы; Ar является необязательно галогенированным бензольным или пиридиновым кольцом; и Х представляет -СН2-,
(18) соединению, описанному в (15), его соли или их гидрату, в котором HAr является пиридиновым кольцом, пиразиновым кольцом, пиримидиновым кольцом или пиридазиновым кольцом, которое может быть замещено, в дополнение к заместителю -Х-Ar, 1-3 группами, выбранными из (1) бензольного кольца, которое может быть замещено C1-4 алкилендиоксигруппой, (2) пиридинового кольца, (3) пиримидинового кольца, (4) пиридазинового кольца, (5) пиразинового кольца, (6) тиофенового кольца, (7) пиперидинового кольца, которое может быть замещено C1-6 алкоксигруппой, (8) пиперазинового кольца, которое может быть замещено C1-6 алкоксигруппой, (9) пирролидинового кольца, которое может быть замещено C1-6 алкоксигруппой, (10) пиперидинового кольца, которое может быть замещено гидроксильной группой и C1-6 алкоксигруппой, (11) пиперазинового кольца, которое может быть замещено гидроксильной группой и C1-6 алкоксигруппой, (12) пирролидинового кольца, которое может быть замещено гидроксильной группой и C1-6 алкоксигруппой, (13) морфолинового кольца, (14) C1-6 алкильной группы, которая может быть замещена C1-6 алкоксигруппой, и (15) C1-6 алкоксигруппы, которая может быть замещена гидроксильной группой или C1-6 алкоксигруппой; Ar является бензольным кольцом или пиридиновым кольцом, которое может быть галогенированным; и Х представляет -СН2-,
(19) соединению, описанному в (1), его соли или их гидрату, причем данное соединение является любым соединением, выбранным из: 3-(4-бензил-2-фенил-5-пиримидил)этинил-3-хинуклидинола; 3-[4-бензил-2-(2-пиридил)-5-пиримидил]этинил-3-хинуклидинола; 3-[3-бензил-5-(2-пиридил)-2-пиридил]этинил-3-хинуклидинола;
3-(3-бензил-5-фенил-2-пиридил)этинил-3-хинуклидинола; 3-[3-бензил-5-(3-пиридил)-2-пиридил]этинил-3-хинуклидинола; 3-[3-бензил-5-(4-пиридил)-2-пиридил]этинил-3-хинуклидинола; 3-(3-бензил-5-пиразил-2-пиридил)этинил-3-хинуклидинола; 3-[3-бензил-5-(2-этоксикарбонилэтил)-2-пиридил]этинил-3-хинуклидинола; 3-[3-бензил-5-(3-оксобутил)-2-пиридил]этинил-3-хинуклидинола; 3-[3-бензил-5-(3-гидроксибутил)-2-пиридил]этинил-3-хинуклидинола; 3-[2-бензил-6-(3-метоксипропиламино)-3-пиридил]этинил-3-хинуклидинола; 3-[2-бензил-6-(2-метоксиэтилокси)-3-пиридил]этинил-3-хинуклидинола; 3-[2-бензил-6-(3-метоксипропилокси)-3-пиридил]этинил-3-хинуклидинола; 3-[2-бензил-6-(4-пиридил)-3-пиридил]этинил-3-хинуклидинола; 3-[2-бензил-6-(3-пиридил)-3-пиридил]этинил-3-хинуклидинола; 3-(2-бензил-6-пиразил-3-пиридил)этинил-3-хинуклидинола; 3-[2-бензил-6-(2-пиридил)-3-пиридил]этинил-3-хинуклидинола; 3-[4-бензил-2-(3-пиридил)-5-пиримидил]этинил-3-хинуклидинола; 3-[4-бензил-2-(3,4-метилендиоксифенил)-5-пиримидил]этинил-3-хинуклидинола; 3-[4-бензил-2-(3,4-метилендиоксифенил)-5-пиридил]этинил-3-хинуклидинола; 3-[4-бензил-2-(2-пиридил)-5-пиридил]этинил-3-хинуклидинола; 3-[4-бензил-2-(3-пиридил)-5-пиридил]этинил-3-хинуклидинола; 3-[4-бензил-2-пиразил-5-пиридил]этинил-3-хинуклидинола; 3-[4-бензил-2-(4-пиридил)-5-пиридил]этинил-3-хинуклидинола; 3-[4-бензил-2-(2-метоксиэтокси)-5-пиридил]этинил-3-хинуклидинола; 3-[2-бензил-6-(4-этоксикарбонилпиперидино)-3-пиридил]этинил-3-хинуклидинола; 3-[2-бензил-6-морфолино-3-пиридил]этинил-3-хинуклидинола;
3-[2-бензил-6-(4-метоксипиперидино)-3-пиридил]этинил-3-хинуклидинола; (3R)-3-[2-бензил-6-(2-метоксиэтил)окси-3-пиридил]этинил-3-хинуклидинола; (3R)-3-[2-бензил-6-(3-метоксипропил)окси-3-пиридил]этинил-3-хинуклидинола; (3S)-3-[2-бензил-6-(3-метоксипропил)окси-3-пиридил]этинил-3-хинуклидинола; (3R)-3-[2-бензил-6-(3-фторпропил)окси-3-пиридил]этинил-3-хинуклидинола; (3R)-3-[2-бензил-6-(1,3-диоксолан-2-ил)метилокси-3-пиридил]этинил-3-хинуклидинола; (3R)-3-[2-бензил-6-(3-гидроксипропил)окси-3-пиридил] этинил-3-хинуклидинола; 3-[2-бензил-6-[3-(3-метоксикарбонилпропаноилокси)пропил]окси-3-пиридил]этинил-3-хинуклидинола; 3-[2-бензил-6-[3-[N-(трет-бутоксикарбонил)-аланилокси]пропил]окси-3-пиридил]этинил-3-хинуклидинола; (3R)-3-[4-бензил-2-(3-пиридил)-5-пиридил]этинил-3-хинуклидинола; (3R)-3-[4-бензил-2-(2-пиридил)-5-пиридил]этинил-3-хинуклидинола; (3R)-3-[4-бензил-2-(3,4-метилендиоксифенил)-5-пиридил]этинил-3-хинуклидинола; (3R)-3-[2-бензил-6-[(3R,4R)-3-гидрокси-4-метоксипирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинола; (3R)-3-[2-бензил-6-[(3S,4R)-3-фтор-4-метоксипирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинола; (3R)-3-[2-бензил-6-[(3R,4R)-3-гидрокси-4-метоксипирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинола; (3R)-3-[2-бензил-6-[(3R,4R)-3,4-диметоксипирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинола; (3R)-3-[2-бензил-5-хлор-6-[(3R,4R)-3-гидрокси-4-метоксипирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинола; (3R)-3-[2-бензил-5-бром-6-[(3R,4R)-3-гидрокси-4-метоксипирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинола;
(3R)-3-[2-бензил-6-(3,3-этилендиоксипирролидин-1-ил)-3-пиридил]этинил-3-хинуклидинола; (3R)-3-[2-бензил-5-хлор-6-(3,3-этилендиоксипирролидин-1-ил)-3-пиридил]этинил-З-хинуклидинола; (3R)-3-[2-бензил-6-(цис-3,4-диметоксипирролидин-1-ил)-3-пиридил]этинил-3-хинуклидинола; (3R)-3-[2-бензил-6-[(3R,4R)-3,4-диметокси-2-пирролидинон-1-ил]-3-пиридил]этинил-3-хинуклидинола; (3R)-3-[2-бензил-6-[(3R,4R)-4-гидрокси-3-метокси-2-пирролидинон-1-ил]-3-пиридил]этинил-3-хинуклидинола; (3R)-3-[2-бензил-6-(3,3-этилендиокси-2-пирролидинон-1-ил)-3-пиридил]этинил-3-хинуклидинола; (3R)-3-[2-бензил-6-[(3R)-3-гидрокси-2-пирролидинон-1-ил]-3-пиридил]этинил-3-хинуклидинола; (3R)-3-[2-бензил-6-[(3R)-3-метокси-2-пирролидинон-1-ил]-3-пиридил]этинил-3-хинуклидинола; (3R)-3-[4-бензил-2-(1,4-диоксен-2-ил)-5-пиридил]этинил-3-хинуклидинола и (3R)-3-[4-бензил-2-[(3R,4R)-3-гидрокси-4-метоксипирролидин-1-ил]-3-пиримидил]этинил-3-хинуклидинола;
(20) ингибитору синтезирующего сквален фермента, содержащему соединение, описанное в любом из (1) - (19), его соли или их гидрату,
(21) лекарственной композиции, содержащей соединение (I), представленное следующей формулой:

(в которой R1 представляет (1) атом водорода или (2) гидроксильную группу; HAr представляет ароматический гетероцикл, который может быть замещен 1-3 группами; Ar представляет необязательно замещенное ароматическое кольцо; W представляет цепь, представленную (1) -СН2-СН2-, которая может быть замещена, (2) -СН=СН-, которая может быть замещена, (3)  (4) -NH-CO-, (5) -CO-NH-, (6) -NH-CH2-, (7) -CH2-NH-, (8) -СН2-СО-, (9) -СО-СН2-, (10) -NH-S(O)l-, (11) -S(O)l-NH-, (12) -CH2-S(O)l- или (13) -S(O)l-СН2- (l означает 0, 1 или 2); и X представляет цепь, представленную (1) одинарной связью, (2) необязательно замещенной C1-6 алкиленовой цепью, (3) необязательно замещенной С2-6 алкениленовой цепью, (4) необязательно замещенной С2-6 алкиниленовой цепью, (5) формулой -Q- (где Q представляет атом кислорода, атом серы, СО или N(R2) (где R2 представляет C1-6 алкильную группу или C1-6 алкоксигруппу)), (6) -NH-CO-, (7) -CO-NH-, (8) -NH-CH2-, (9) -CH2-NH-, (10) -СН2-СО-, (11) -СО-СН2-, (12) -NH-S(O)m-, (13) -S(O)m-NH-, (14) -СН2-S(O)m-, (15) -S(O)m-СН2- (где m означает 0, 1 или 2) или (16) -(СН2)n-O- (где n означает целое число от 1 до 6)), или его соль или их гидраты,
(4) -NH-CO-, (5) -CO-NH-, (6) -NH-CH2-, (7) -CH2-NH-, (8) -СН2-СО-, (9) -СО-СН2-, (10) -NH-S(O)l-, (11) -S(O)l-NH-, (12) -CH2-S(O)l- или (13) -S(O)l-СН2- (l означает 0, 1 или 2); и X представляет цепь, представленную (1) одинарной связью, (2) необязательно замещенной C1-6 алкиленовой цепью, (3) необязательно замещенной С2-6 алкениленовой цепью, (4) необязательно замещенной С2-6 алкиниленовой цепью, (5) формулой -Q- (где Q представляет атом кислорода, атом серы, СО или N(R2) (где R2 представляет C1-6 алкильную группу или C1-6 алкоксигруппу)), (6) -NH-CO-, (7) -CO-NH-, (8) -NH-CH2-, (9) -CH2-NH-, (10) -СН2-СО-, (11) -СО-СН2-, (12) -NH-S(O)m-, (13) -S(O)m-NH-, (14) -СН2-S(O)m-, (15) -S(O)m-СН2- (где m означает 0, 1 или 2) или (16) -(СН2)n-O- (где n означает целое число от 1 до 6)), или его соль или их гидраты,
(22) лекарственной композиции, описанной в (21), которая является профилактическим или лечебным средством в отношении заболеваний, для борьбы с которыми эффективно подавление синтезирующего сквален фермента,
(23) лекарственной композиции, описанной в (21), которая является ингибитором биосинтеза холестерина,
(24) лекарственной композиции, описанной в (21), которая является ингибитором биосинтеза триглицеридов,
(25) лекарственной композиции, описанной в (21), которая является средством для профилактики или лечения гиперлипидемии,
(26) лекарственной композиции, описанной в (21), которая является средством для профилактики или лечения заболеваний со склерозом артерий и ишемических заболеваний сердца,
(27) лекарственной композиции, описанной в (21), которая является средством для профилактики или лечения гипертензии, заболеваний с поражением коронарных сосудов, заболеваний с поражением сосудов головного мозга, заболеваний с поражением аорты, заболеваний с поражением периферических артерий, стенокардии, острых коронарных синдромов или инфаркта миокарда,
(28) способу получения хинуклидинового соединения (IV), представленного следующей формулой:
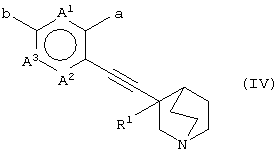
(в которой А1, А2, А3, а, b и R1 имеют те же значения, которые указаны выше), его соли или их гидратов, который включает стадию взаимодействия ароматического гетероциклического соединения (II), представленного формулой:
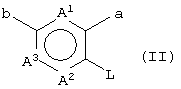
(в которой А1 и А3 являются одинаковыми или различными, и каждый обозначает 1) необязательно замещенный атом углерода или 2) гетероатом; А2 обозначает 1) необязательно замещенный атом углерода или 2) гетероатом или 3) одинарную связь; L обозначает удаляемую группу; и а и b являются различными и каждый обозначает 1) группу -Х-Ar (в которой Х представляет цепь, представленную (1) одинарной связью; (2) необязательно замещенной C1-6 алкиленовой цепью; (3) необязательно замещенной С2-6 алкениленовой цепью; (4) необязательно замещенной C2-6 алкиниленовой цепью; (5) формулой -Q- (где Q представляет атом кислорода, атом серы, СО или N(R2) (где R2 представляет C1-6 алкильную группу или C1-6 алкоксигруппу)); (6) -NH-CO-, (7) -CO-NH-, (8) -NH-CH2-, (9) -CH2-NH-, (10) -CH2-CO-, (11) -CO-CH2-, (12) -NH-S(O)m-, (13) -S(O)m-NH-, (14) -CH2-S(O)m-, (15) -S(O)m-СН2- (где m означает 0, 1 или 2) или (16) -(CH2)n-O- (где n означает целое число от 1 до 6); и Ar представляет необязательно замещенное ароматическое кольцо, соответственно), или 2) любую одну группу, выбранную из: (1) атома галогена; (2) гидроксильной группы; (3) тиольной группы; (4) нитрогруппы; (5) нитрильной группы; (6) необязательно замещенной линейной C1-6 углеводородной группы; (7) необязательно замещенной С3-8 циклической углеводородной группы; (8) необязательно замещенной С6-14 ароматической углеводородной циклической группы; (9) необязательно замещенной 5-14-членной ароматической гетероциклической группы; (10) необязательно замещенной 4-10-членной неароматической гетероциклической группы; (11) необязательно замещенной C1-6 алкоксигруппы; (12) необязательно замещенной С3-8 циклоалкилоксигруппы; (13) необязательно замещенной линейной C1-6 углеводородтиогруппы; (14) необязательно замещенной С3-8 циклической углеводородтиогруппы; (15) необязательно замещенной С6-14 ароматической углеводород-оксигруппы; (16) необязательно замещенной 5-14-членной гетероциклической оксигруппы; (17) необязательно замещенной С6-14 ароматической углеводородтиогруппы; (18) необязательно замещенной 5-14-членной гетероциклической тиогруппы; (19) необязательно замещенной аминогруппы; (20) азидной группы; (21) гуанидиногруппы; (22) карбамидной группы; (23) формильной группы; (24) необязательно замещенной C1-6 имидоильной группы; (25) замещенной карбонильной группы; (26) замещенной карбонилоксигруппы; (27) карбоксильной группы, которая образует соль; (28) необязательно замещенной карбамоильной группы; (29) необязательно замещенной C1-4 алкилендиоксигруппы; (30) необязательно замещенной сульфинильной группы и (31) необязательно замещенной сульфонильной группы, соответственно) и хинуклидинового соединения (III), представленного следующей формулой:
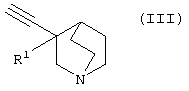
(где R1 обозначает атом водорода или гидроксильную группу) в присутствии Pd катализатора, соли меди и основания,
(29) способу получения хинуклидинового соединения (VI), представленного следующей формулой:
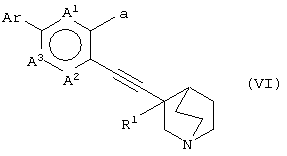
(в которой А1, А2, А3, а, Ar и R1 имеют те же значения, которые указаны выше), его соли или их гидратов, который включает стадию взаимодействия хинуклидинового соединения (V), представленного следующей формулой:
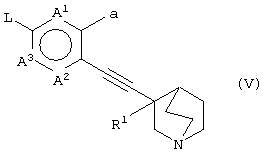
(в которой А1 и А3 являются одинаковыми или различными, и каждый обозначает 1) необязательно замещенный атом углерода или 2) гетероатом; А2 обозначает 1) необязательно замещенный атом углерода, 2) гетероатом или 3) одинарную связь; L обозначает удаляемую группу; и а обозначает группу -Х-Ar (где Х и Ar имеют одинаковые значения, которые указаны выше); и R1 обозначает атом водорода или гидроксильную группу, соответственно) и ароматического циклического соединения, представленного следующей формулой:
Ar-М
(в которой Ar обозначает необязательно замещенное ароматическое кольцо и М обозначает необязательно замещенный атом металла, соответственно) в присутствии Pd катализатора, и
(30) способу получения хинуклидинового соединения (VIII), представленного следующей формулой:
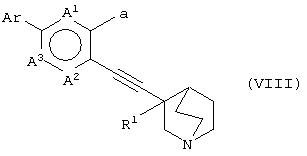
(в которой А1, А2, А3, а, Ar и R1 имеют те же значения, которые указаны выше), его соли или их гидратов, который включает стадию взаимодействия хинуклидинового соединения (VII), представленного следующей формулой:
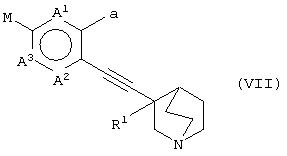
(в которой А1 и А3 являются одинаковыми или различными, и каждый обозначает 1) необязательно замещенный атом углерода или 2) гетероатом; А2 обозначает 1) необязательно замещенный атом углерода, 2) гетероатом или 3) одинарную связь; М обозначает необязательно замещенный атом металла; и а обозначает 1) группу -Х-Ar (где Х и Ar имеют одинаковые значения, которые указаны выше); и R1 обозначает атом водорода или гидроксильную группу, соответственно) и ароматического циклического соединения, представленного следующей формулой:
Ar-L
(в которой Ar обозначает необязательно замещенное ароматическое кольцо и L обозначает удаляемую группу, соответственно) в присутствии Pd катализатора.
Данное изобретение также представляет способ профилактики и лечения заболевания, при котором эффективно подавление синтезирующего сквален фермента, путем введения соединения, представленного приведенной выше формулой (I), его соли или их гидратов пациенту в фармакологически эффективном количестве и использование соединения, представленного приведенной выше формулой (I), его соли или их гидратов для производства профилактического и лечебного средства для лечения заболевания, при котором эффективно подавление синтезирующего сквален фермента.
В описании данного изобретения присутствует то обстоятельство, когда структурная формула соединения представляет определенный изомер. Однако данное изобретение включает изомеры, такие как геометрические изомеры, оптические изомеры, имеющие в основе асимметрический углерод, стереоизомеры и таутомеры, и не ограничивается формулами, приведенными в качестве иллюстраций для удобства.
Определения терминов, используемых в описании данного изобретения, будут объяснены ниже.
В описании данного изобретения группа, представленная R1 в приведенной выше формуле (I), означает атом водорода или гидроксильную группу и предпочтительно, гидроксильную группу.
В описании данного изобретения «ароматический гетероцикл, который может быть замещен 1-3 группами», представленный HAr в приведенной выше формуле (I), является предпочтительно, например, 5-14-членным ароматическим гетероциклом, который имеет 1-4 атома, необязательно выбранных из атома азота, атома серы и атома кислорода, и может быть замещен 1, 2 или 3 заместителями, и более предпочтительно является ароматическим гетероциклом, который может быть замещен 1-3 группами, выбранными из (1) атома галогена, (2) гидроксильной группы, (3) тиольной группы, (4) нитрогруппы, (5) нитрильной группы, (6) C1-6 углеводородной группы, которая может быть замещена, (7) С3-8 циклической углеводородной группы, которая может быть замещена, (8) C6-14 ароматической углеводородной циклической группы, которая может быть замещена, (9) 5-14-членной ароматической гетероциклической группы, которая может быть замещена, (10) 4-10-членной неароматической гетероциклической группы, которая может быть замещена, (11) C1-6 алкоксигруппы, которая может быть замещена, (12) С3-8 циклоалкоксигруппы, которая может быть замещена, (13) C1-6 углеводородтиогруппы, которая может быть замещена, (14) С3-8 циклической углеводородтиогруппы, которая может быть замещена, (15) С6-14 ароматической углеводородоксигруппы, которая может быть замещена, (16) 5-14-членный гетероцикл-оксигруппы, которая может быть замещена, (17) C6-14 ароматической углеводородтиогруппы, которая может быть замещена, (18) 5-14-членный гетероцикл-тиогруппы, которая может быть замещена, (19) аминогруппы, которая может быть замещена, (20) азидной группы, (21) гуанидиногруппы, (22) карбамидной группы, (23) формильной группы, (24) C1-6 имидоильной группы, которая может быть замещена, (25) карбонильной группы, которая может быть замещена, (26) карбонилоксигруппы, которая может быть замещена, (27) карбоксигруппы, которая может быть в виде соли, (28) карбамоильной группы, которая может быть замещена, (29) C1-4 алкилендиоксигруппы, которая может быть замещена, (30) сульфинильной группы, которая может быть замещена, и (31) сульфонильной группы, которая может быть замещена.
В приведенном выше определении HAr «ароматический гетероцикл» означает моноциклический тип, дициклический тип или трициклический тип ароматических гетероциклов. Их примеры включают 5-14-членные ароматические гетероциклические группы, содержащие 1-4 атома, выбранных из атома азота, атома серы и атома кислорода. А именно, ароматические гетероциклы, содержащие два или более различных атомов, выбранных из атома азота, атома серы и атома кислорода, такие как азотсодержащие ароматические гетероциклы, например пиррольное кольцо, пиридиновое кольцо, пиридоновое кольцо, пиридазиновое кольцо, пиримидиновое кольцо, пиразиновое кольцо, пиразольное кольцо, имидазольное кольцо, индольное кольцо, изоиндолильное кольцо, индолизиновое кольцо, пуриновое кольцо, индазольное кольцо, хинолиновое кольцо, изохинолиновое кольцо, хинолизиновое кольцо, фталазиновое кольцо, нафтиридиновое кольцо, хиноксалиновое кольцо, хиназолиновое кольцо, циннолиновое кольцо, птеридиновое кольцо, имидазотриазиновое кольцо, пиразинопиридазиновое кольцо, акридиновое кольцо, фенантридиновое кольцо, карбазольное кольцо, карбазолиновое кольцо, пиримидиновое кольцо, фенантролиновое кольцо и фенарсиновое кольцо; серусодержащие ароматические гетероциклы, например тиофеновое кольцо и бензотиофеновое кольцо; кислородсодержащие ароматические гетероциклы, например фурановое кольцо, пирановое кольцо, циклопентапирановое кольцо, бензофурановое кольцо, изобензофурановое кольцо; тиазольное кольцо, изотиазольное кольцо, бензотиазольное кольцо, бензотиадиазольное кольцо, фенотиазиновое кольцо, изоксазольное кольцо, фуразановое кольцо, феноксазиновое кольцо, пиразолоксазольное кольцо, имидазотиазольное кольцо, тиенофурановое кольцо, фуропиррольное кольцо и пиридоксазиновое кольцо. В качестве их предпочтительных примеров представлены пиррольное кольцо, пиридиновое кольцо, пиридоновое кольцо, пиримидиновое кольцо, имидазольное кольцо, индольное кольцо, хинолиновое кольцо, изохинолиновое кольцо, хинолизиновое кольцо, фталазиновое кольцо, нафтиридиновое кольцо, хиназолиновое кольцо, акридиновое кольцо, фенарсиновое кольцо, тиофеновое кольцо, бензотиофеновое кольцо, фурановое кольцо, пирановое кольцо, бензофурановое кольцо, тиазольное кольцо, бензотиазольное кольцо и фенотиазиновое кольцо. В качестве их более предпочтительных примеров представлены пиррольное кольцо, пиридиновое кольцо, тиофеновое кольцо, бензотиофеновое кольцо, тиазольное кольцо и бензотиазольное кольцо.
В приведенном выше определении «атом галогена» означает атомы галогенов, такие как атом фтора, атом хлора, атом брома и атом йода, и предпочтительно, атом фтора, атом хлора и атом брома.
«C1-6 Углеводородная группа» в «C1-6 углеводородной группе, которая может быть замещена», представленная в качестве заместителя HAr, означает «C1-6 алкильную группу», «С2-6 алкенильную группу» и «C2-6 алкинильную группу». В качестве «C1-6 алкильной группы», например, предпочтительными являются C1-6 алкильные группы с прямой или разветвленной цепью, такие как метильная группа, этильная группа, н-пропильная группа, изопропильная группа, втор-пропильная группа, н-бутильная группа, изобутильная группа, втор-бутильная группа, трет-бутильная группа, н-пентильная группа, изопентильная группа, втор-пентильная группа, трет-пентильная группа, н-гексильная группа, изогексильная группа, 1,2-диметилпропильная группа, 2-этилпропильная группа, 1-метил-2-этилпропильная группа, 1-этил-2-метилпропильная группа, 1,1,2-триметилпропильная группа, 1,1,2-триэтилпропильная группа, 1,1-диметилбутильная группа, 2,2-диметилбутильная группа, 2-этилбутильная группа, 1,3-диметилбутильная группа, 2-метилпентильная группа и 3-метилпентильная группа. В качестве «С2-6 алкенильной группы» предпочтительны С2-6 алкенильные группы с прямой или разветвленной цепью, такие как винильная группа, аллильная группа, изопренильная группа, 1-пропен-2-ильная группа, 1-бутен-1-ильная группа, 1-бутен-2-ильная группа, 1-бутен-3-ильная группа, 2-бутен-1-ильная группа и 2-бутен-2-ильная группа. В качестве «С2-6 алкинильной группы» предпочтительными являются этинильная группа, пропинильная группа, бутинильная группа, пентинильная группа и гексинильная группа. Причем термин «может быть замещена» означает, что может быть замещена одной или двумя группами, выбранными из, например, (1) гидроксильной группы, которая может быть защищенной, (2) атома галогена, (3) нитрильной группы, (4) карбоксильной группы, (5) С3-8 циклоалкильной группы, С3-8 циклоалкенильной группы или С3-8 циклоалкинильной группы, которые могут быть гидроксилированными или галогенированными, (6) C1-6 алкоксигруппы, которая может быть замещена группой, выбранной из атома галогена, гидроксильной группы, C6-14 арильной группы, 5-14-членной гетероарильной группы и С6-14 арил- C1-6 алкоксигруппы, (7) С3-8 циклоалкилоксигруппы, которая может быть галогенированной или гидроксилированной, (8) С3-8 циклоалкенилоксигруппы, которая может быть галогенированной или гидроксилированной, (9) C1-6 алкоксикарбонильной группы, (10) C1-4 алкилендиоксигруппы, которая может быть галогенированной, (11) C1-6 алканоильной группы, которая может быть замещена группой, выбранной из гидроксильной группы, C1-6 алкоксигруппы и C1-6 алканоилоксигруппы, (12) C6-14 арильной группы, которая может быть замещена группой, выбранной из атома галогена, C1-6 алкильной группы и C1-6 алкоксигруппы, (13) 5-14-членной ароматической гетероциклической группы, которая может быть замещена группой, выбранной из атома галогена, C1-6 алкильной группы, С3-8 алкенильной группы, С3-8 алкинильной группы и C1-6 алкоксигруппы, (14) 4-10-членной ароматической гетероциклической группы, которая может быть замещена группой, выбранной из атома галогена, C1-6 алкильной группы, С3-8 алкенильной группы, С3-8 алкинильной группы и C1-6 алкоксигруппы, (15) группы (EtO)2PO-, (16) ацетильной группы, (17) сульфонильной группы, которая может быть замещена группой, выбранной из C1-6 углеводородной группы, моно-(C1-6 углеводород)аминогруппы и ди-(C1-6 углеводород)аминогруппы, (18) аминогруппы, которая может быть замещена C1-6 углеводородной группой, (19) C1-6 углеводородтиогруппы, которая может быть гидроксилированной или галогенированной, и (20) карбамоильной группы, которая может быть замещена C1-6 углеводородной группой.
«C1-6 Углеводородная группа, которая может быть замещена» является, предпочтительно, C1-6 углеводородной группой, которая может быть замещена одной или двумя группами, выбранными из (1) гидроксильной группы, (2) атома галогена, (3) нитрильной группы, (4) C1-6 циклоалкильной группы, (5) C1-6 алкоксигруппы, (6) C1-6 алкокси-C1-6 алкоксигруппы, (7) C1-4 алкилендиоксигруппы, (8) C1-6 алкоксикарбонильной группы, (9) C1-6 алканоильной группы, (10) C1-6 алкокси-C1-6 алканоильной группы, (11) C1-6 алканоилоксигруппы, (12) C1-6 алканоилокси-C1-6 алканоильной группы, (13) 5-14-членной гетероциклической группы, (14) 5-10-членной конденсированной гетероциклической группы, которая может быть замещена C1-6 алкоксигруппой, (15) карбоксильной группы, (16) (EtO)2PO- и (17) C1-6 алкилсульфонильной группы, и более предпочтительно, замещенной C1-6 углеводородной группы, такой как (1) незамещенная C1-6 углеводородная группа, такая как этильная группа, пропильная группа и 2-пропен-1-ильная группа, (2) C1-6 углеводородные группы, замещенные C6-14 ароматической углеводородной группой, такой как фенильная группа, (3) C1-6 углеводородные группы, замещенные 5-14-членной ароматической гетероциклической группой, такой как пиридильная группа, и (4) замещенные C1-6 углеводородные группы, такие как C1-6 алкокси-C1-6 углеводородная группа.
В приведенном выше определении, например, «C1-6 углеводородная группа, которая может быть галогенированной» означает, что любой один из атомов углерода «C1-6 углеводородной группы» может быть замещен атомом галогена. Конкретные ее примеры включают трифторметильную группу, 2-хлорэтильную группу, 1,2-дихлорэтильную группу, 2-бромэтильную группу, 3-бромэтильную группу, 3,3,3-трифторпропильную группу, 4-хлорбутильную группу, 1,1-диметил-3-хлорэтильную группу, 2,2-диметил-4-бромбутильную группу и 3-хлор-2-пропенильную группу. Причем, «C1-6 алкоксигруппа, которая может быть галогенированной» означает, что любой один из атомов углерода «C1-6 алкоксигруппы» может быть замещен атомом галогена. Конкретные его примеры включают трифторметоксигруппу, 2-хлорэтоксигруппу, 1,2-дихлорэтоксигруппу, 2-бромэтоксигруппу, 3-бромпропилоксигруппу, 3,3,3-трифторпропилоксигруппу, 4-хлорбутилоксигруппу, 1,1-диметил-3-хлорэтоксигруппу и 2,2-диметил-4-бромбутилоксигруппу.
«С3-8 циклическая углеводородная группа» в «С3-8 циклической углеводородной группе, которая может быть замещена», представленая как заместитель HAr, означает «С3-8 циклоалкильную группу», «С3-8 циклоалкенильную группу» и т.п. В качестве «С3-8 циклоалкильной группы» предпочтительны такие 3-8-членные циклоалкильные группы, как циклопропанильная группа, циклобутанильная группа, циклопентанильная группа, циклогексанильная группа и циклогептанильная группа. В качестве «С3-8 циклоалкенильной группы» предпочтительны такие 3-8-членные циклоалкенильные группы, как циклопропенильная группа, циклобутенильная группа, циклопентенильная группа, циклогексенильная группа и циклогептенильная группа. А также термин «может быть замещена» означает, что приведенная выше «С3-8 циклическая углеводородная группа» может быть замещена одной или двумя группами, выбранными, например, из (1) гидроксильной группы, которая может быть защищенной, (2) атома галогена, (3) нитрильной группы, (4) карбоксигруппы, (5) C1-6 алкильной группы, которая может быть замещена группой, выбранной из гидроксильной группы, атома галогена, C1-6 алкоксигруппы, которая может быть галогенированной, C1-6 углеводородтиогруппы, которая может быть галогенированной, аминогруппы, которая может быть замещена C1-6 углеводородной группой и C1-6 алканоильной группой, (6) C2-6 алкенильной группы, которая может быть замещена группой, выбранной из гидроксильной группы, атома галогена, C1-6 алкоксигруппы, которая может быть галогенированной, C1-6 углеводородтиогруппы, которая может быть галогенированной, аминогруппы, которая может быть замещена C1-6 углеводородной группой и C1-6 алканоильной группой, (7) С2-6 алкинильной группы, которая может быть замещена группой, выбранной из гидроксильной группы, атома галогена, C1-6 алкоксигруппы, которая может быть галогенированной, C1-6 углеводородтиогруппы, которая может быть галогенированной, аминогруппы, которая может быть замещена C1-6 углеводородной группой и C1-6 алканоильной группой, (8) аминогруппы, которая может быть замещена группой, выбранной из гидроксильной группы, атома галогена, C1-6 алкоксигруппы, которая может быть галогенированной, C1-6 углеводородтиогруппы, которая может быть галогенированной, C1-6 алканоильной группы и C1-6 углеводородной группы, (9) C1-6 алкоксигруппы, которая может быть замещена группой, выбранной из гидроксильной группы, атома галогена, C1-6 алкильной группы, которая может быть галогенированной, C1-6 алкоксигруппы, которая может быть гидроксилированной или галогенированной, C1-6 углеводородтиогруппы, которая может быть галогенированной, аминогруппы, которая может быть замещена C1-6 углеводородной группой и C1-6 алканоильной группой, (10) C1-6 углеводородтиогруппы, которая может быть замещена группой, выбранной из гидроксильной группы, атома галогена, C1-6 алкильной группы, которая может быть галогенированной, C2-6 алкенильной группы, которая может быть галогенированной, С2-6 алкинильной группы, которая может быть галогенированной, C1-6 алкоксигруппы, которая может быть галогенированной, C1-6 углеводородтиогруппы, которая может быть галогенированной, аминогруппы, которая может быть замещена C1-6 углеводородной группой и C1-6 алканоильной группой, (11) C1-6 алканоильной группы, которая может быть замещена группой, выбранной из гидроксильной группы, атома галогена, C1-6 алкоксигруппы и C1-6 алканоилоксигруппы, (12) С6-14 арильной группы, которая может быть замещена группой, выбранной из атома галогена, C1-6 алкильной группы и C1-6 алкоксигруппы, (13) 5-14-членной ароматической гетероциклической группы, которая может быть замещена галогенной группой, C1-6 алкильной группой, С3-8 алкенильной группой, С3-8 алкинильной группой и C1-6 алкоксигруппой, (14) неароматической гетероциклической группы, которая может быть замещена группой, выбранной из атома галогена, C1-6 алкильной группы, С3-8 алкенильной группы, С3-8 алкинильной группы и C1-6 алкоксигруппы, (15) C1-6 алкоксикарбонильной группы, (16) C1-4 алкилендиоксигруппы, которая может быть галогенированной, (17) формулы (EtO)2PO- и (18) ацетильной группы.
Следует отметить, что в описании данного изобретения «углеводородная группа», представленная в формуле (I), обозначает как «C1-6 углеводородную группу», так и «С3-8 циклическую углеводородную группу», которые имеют те же определения, что и выше.
Предпочтительные примеры «С6-14 ароматической углеводородной циклической группы» в «С6-14 ароматической углеводородной циклической группе, которая может быть замещена», представленной в качестве заместителя HAr, включают фенильную группу, пенталенильную группу, инденильную группу, нафтильную группу, азуленильную группу, гепталенильную группу, бензоциклооктенильную группу и фенантренильную группу. Среди таких групп более предпочительны фенильная группа и нафтильная группа. Причем термин «может быть замещена» означает, что указанная выше «С6-14 ароматическая углеводородная циклическая группа» может быть замещена одной или более группами, выбранными из, например, (1) гидроксильной группы, (2) атома галогена, (3) C1-6 алкилсульфонильной группы, С2-6 алкенилсульфонильной группы, С2-6 алкинилсульфонильной группы, которые могут быть галогенированными, (4) C1-4 алкилендиоксигруппы, которая может быть галогенированной, (5) C1-6 алкоксигруппы, которая может быть галогенированной, (6) C1-6 углеводородтиогруппы, которая может быть галогенированной, (7) C1-6 алкоксикарбонильной группы, (8) С6-14 арил-C1-6 алкоксигруппы, (9) C1-7 алканоиламиногруппы, (10) C1-6 алкилкарбамоильной группы, (11) С2-6 алкенилкарбамоильной группы, (12) C2-6 алкинилкарбамоильной группы и (13) аминогруппы, которая может быть замещена C1-6 углеводородной группой. Предпочтительные примеры «C6-14 ароматической углеводородной циклической группы, которая может быть замещена» включают фенильные группы, превращаемые в нитрилы, галогенированную фенильную группу, фенильную группу, замещенную C1-6 алкильной группой, фенильную группу, замещенную C1-6 алкоксигруппой, такой как метоксигруппа, фенильную группу, замещенную C1-6 алкилендиоксигруппой, такой как 2,4-метилендиоксигруппа, и фенильную группу, замещенную ди-(C1-6 алкил)аминогруппой, такой как диметиламиногруппа.
Следует отметить, что в данном изобретении «С6-14 арильная группа», представленная в формуле (I), имеет то же значение, что и для указанной выше «С6-14 ароматической углеводородной циклической группы», и исключает ароматические гетероциклические группы.
«5-14-членная ароматическая гетероциклическая группа» в «5-14-членной ароматической гетероциклической группе, которая может быть замещена», представленая как заместитель HAr, означает ароматический гетероцикл, имеющий 1-4 атома, выбранные из атома азота, атома кислорода и атома серы. Конкретные ее примеры включают пирролильную группу, пиридинильную группу, пиридазинильную группу, пиримидинильную группу, пиразинильную группу, тиазолильную группу и оксазолильную группу. Причем термин «может быть замещена» означает, что указанная выше «5-14-членная ароматическая гетероциклическая группа» может быть замещена одной или более группами, выбранными из (1) гидроксильной группы, (2) атома галогена, (3) нитрильной группы, (4) C1-6 алкильной группы, С2-6 алкенильной группы или С2-6 алкинильной группы, которые могут быть галогенированными, (5) C1-6 алкоксигруппы, которая может быть галогенированной, (6) C1-6 алкилтиогруппы, С2-6 алкенилтиогруппы или С2-6 алкинилтиогруппы, которые могут быть галогенированными, (7) C1-6 алкокси-C1-6 алкильной группы, (8) ацетильной группы, (9) C1-6 алканоильной группы, (10) моно-(C1-6 углеводород)аминогруппы, (11) ди-(C1-6 углеводород)аминогруппы и (12) три-(C1-6 углеводород) аминогруппы. Предпочтительные примеры «замещенной 5-14-членная ароматической гетероциклической группы» включают ароматические гетероциклы, превращенные в нитрилы, ароматические гетероциклы, замещенные C1-6 алкильной группой, ароматические гетероциклы, замещенные C1-6 алкоксигруппой, ароматические гетероциклы, замещенные C1-6 алкокси-C1-6 алкильной группой, ароматические гетероциклы, замещенные моно-(C1-6 углеводород) аминогруппой и ароматические гетероциклы, замещенные ди-(C1-6 алкил)аминогруппой.
В описании данного изобретения «C6-14 арильная группа», представленная в формуле (I), имеет то же значение, что и для указанной выше «5-14-членной ароматической гетероциклической группы».
Следует отметить, что в описании данного изобретения «ароматическое кольцо», представленное в формуле (I), означает все кольца, имеющие те же значения, что и для указанного выше «С6-14 ароматического углеводородного кольца» и «5-14-членной ароматической гетероциклической группы».
«4-10-членная неароматическая гетероциклическая группа в «4-10-членной неароматической гетероциклической группе, которая может быть замещена», представленая в качестве заместителя HAr, означает кольцо, которое имеет то же значение, что и в указанной выше «С3-8 циклической углеводородной группе», и в котором 1-4 атома углерода замещены атомом, выбранным из атома азота, атома кислорода и атома серы, а также означает, что оно включает ненасыщенное конденсированное кольцо. Предпочтительные конкретные ее примеры включают пирролидинильную группу, пирролинильную группу, пиперидинильную группу, пиперазинильную группу, имидазолинильную группу, пиразолидинильную группу, имидазолидинильную группу, морфолинильную группу, тетрагидропиранильную группу, азетидинильную группу, оксетанильную группу, оксатиоланильную группу, фталимид и сукцинимид. Более предпочтительные примеры включают пирролидинильную группу, пиперидинильную группу и морфолинильную группу. Причем термин «может быть замещена» означает, что указанная выше «4-10-членная ароматическая гетероциклическая группа» может быть замещена одной или более группами, выбранными из (1) гидроксильной группы, (2) атома галогена, (3) нитрильной группы, (4) C1-6 алкильной группы, С2-6 алкенильной группы или С2-6 алкинильной группы, которые могут быть галогенированными, (5) C1-6 алкоксигруппы, которая может быть галогенированной, (6) C1-6 алкилтиогруппы, C2-6 алкенилтиогруппы или С2-6 алкинилтиогруппы, которые могут быть галогенированными, (7) C1-6 алкокси-C1-6 алкильной группы, (8) ацетильной группы, (9) C1-6 алканоильной группы, (10) моно-(C1-6 углеводород)аминогруппы, (11) ди-(С1-6 углеводород)аминогруппы, (12) три-(C1-6 углеводород) аминогруппы и (13) оксогруппы, образующей карбонильную группу, N-оксидную группу, сульфоксидную группу или сульфонильную группу.
Следует отметить, что в описании данного изобретения «гетероцикл», представленный в формуле (I), означает как «5-14-членную гетероциклическую группу», так и «4-10-членную неароматическую гетероциклическую группу», которые имеют те же определения, что и выше.
«C1-6 алкоксигруппа» в «C1-6 алкоксигруппе, которая может быть замещена», представленная в качестве заместителя HAr, означает «алкоксигруппу», соответствующую «C1-6 углеводородной группе» в приведенном выше определении. Предпочтительные ее примеры включают C1-6 алкилоксигруппы, такие как метоксигруппа, этоксигруппа, н-пропоксигруппа, изопропоксигруппа, втор-пропоксигруппа, н-бутоксигруппа, изобутоксигруппа, втор-бутоксигруппа, трет-бутоксигруппа, н-пентоксигруппа, изопентоксигруппа, втор-пентоксигруппа, трет-пентоксигруппа, н-гексоксигруппа, изогексоксигруппа, 1,2-диметилпропоксигруппа, 2-этилпропоксигруппа, 1-метил-2-этилпропоксигруппа, 1-этил-2-метилпропоксигруппа, 1,1,2-триметилпропоксигруппа, 1,1,2-триметилпропоксигруппа, 1,1-диметилпропоксигруппа, 2,2-диметилпропоксигруппа, 2-этилбутоксигруппа, 1,3-диметил-бутоксигруппа, 2-метилпентоксигруппа и 3-метилпентоксигруппа; С2-6 алкенилоксигруппы, такие как винилоксигруппа, аллилоксигруппа, изопропоксигруппа, 1-пропенил-2-оксигруппа, 1-бутенил-1-оксигруппа, 1-бутенил-2-оксигруппа, 1-бутенил-3-оксигруппа, 2-бутенил-1-оксигруппа, 2-бутенил-1-оксигруппа и 2-бутенил-2-оксигруппа; и C2-6 алкинилоксигруппы, такие как этинилоксигруппа, пропинилоксигруппа, бутинилоксигруппа, пентинилоксигруппа и гексинилоксигруппа. Термин «может быть замещена» означает, что она может быть замещена одной или более группами, выбранными, например, из (1) гидроксильной группы, (2) атома галогена, (3) C1-6 алкильной группы, С2-6 алкенильной группы или С2-6 алкинильной группы, которые могут быть замещены группой, выбранной из гидроксильной группы, атома галогена, 5-14-членной ароматической гетероциклической группы и 4-10-членной неароматической гетероциклической группы, (4) С3-8 циклоалкильной группы или С3-8 циклоалкенильной группы, которые могут быть гидроксилированными или галогенированными, (5) C1-6 алкилоксигруппы, которая может быть гидроксилированной или галогенированной, (6) C1-6 алкилтиогруппы, С2-6 алкенилтиогруппы или С2-6 алкинилтиогруппы, которые могут быть галогенированными, (7) С3-8 циклоалкилоксигруппы, С3-8 циклоалкенилоксигруппы или С3-8 циклоалкинилоксигруппы, которые могут быть галогенированными, (8) С3-8 циклоалкилтиогруппы, С3-8 циклоалкенилтиогруппы или С3-8 циклоалкинилтиогруппы, которые могут быть галогенированными, (9) С6-14 арильной группы, (10) C1-6 алканоильной группы, которая может быть галогенированной, (11) 5-14-членной ароматической гетероциклической группы и (12) 4-10-членного неароматического гетероцикла. Предпочтительные примеры «C1-6 алкоксигруппы, которая может быть замещена» включают C1-6 алкоксигруппу, которая гидроксилирована, C1-6 алкоксигруппу, которая галогенирована, C1-6 алкоксигруппу, которая замещена гидрокси-С3-8 циклоалкильной группой, C1-6 алкоксигруппу, замещенную неароматической гетероцикл-оксигруппой, C1-6 алкокси-C1-6 алкоксигруппу, C1-6 алкоксигруппу, замещенную C1-6 алкоксикарбонильной группой, C1-6 алкоксигруппу, замещенную неароматической гетероциклической группой, и C1-6 алкоксигруппу, которая является формиламинированной.
«С3-8 циклоалкилоксигруппа» в «С3-8 циклоалкилоксигруппе, которая может быть замещена», представленная как заместитель HAr, означает «циклоалкилоксигруппу», соответствующую «C1-6 циклической углеводородной группе» в приведенном выше определении. Предпочтительные ее примеры включают С3-8 циклоалкилоксигруппы, такие как циклопропилоксигруппа, циклобутилоксигруппа, циклопентилоксигруппа и циклогексил-оксигруппа, и С3-8 циклоалкенилоксигруппы, такие как циклопропенилоксигруппа, циклобутенилоксигруппа, циклопентенилоксигруппа и циклогексенилоксигруппа. Причем, термин «может быть замещена» означает, что указанная выше С3-8 циклоалкилоксигруппа может быть замещена одной или двумя группами, выбранными из, например, (1) гидроксильной группы, (2) атома галогена, (3) C1-6 углеводородтиогруппы, которая может быть замещена группой, выбранной из гидроксильной группы, атома галогена, C1-6 алкоксигруппы и C1-6 алканоильной группы, (4) C1-6 алкоксигруппы, которая может быть замещена группой, выбранной из атома галогена, C1-6 алкоксигруппы и C1-6 алканоильной группы, и (5) C1-6 углеводородтиогруппы, которая может быть замещена группой, выбранной из атома галогена, C1-6 алкоксигруппы и C1-6 алканоильной группы. Предпочтительными являются С3-8 циклоалкилоксигруппа, которая может быть замещена C1-6 алкоксигруппой, и т.п.
«C1-6 Углеводородтиогруппа» в «C1-6 углеводородтиогруппе, которая может быть замещена», представленная как заместитель HAr, означает «C1-6 углеводородтиогруппу», соответствующую «C1-6 углеводородной группе» в приведенном выше определении, то есть «C1-6 алкилтиогруппе», «С2-6 алкенилтиогруппе» и «С2-6 алкинилтиогруппе». Конкретные ее примеры включают метилтиогруппу, этилтиогруппу, н-пропилтиогруппу, изопропилтиогруппу, втор-пропилтиогруппу, н-бутилтиогруппу, изобутилтиогруппу, втор-бутилтиогруппу, трет-бутилтиогруппу, 1,2-диметилпропилтиогруппу, 2-этилпропилтиогруппу, 1,1-диметилбутилтиогруппу, 2,2-диметилбутилтиогруппу, 2-этилбутилтиогруппу, 1,3-диметилбутилтиогруппу, изопропенилтиогруппу, этинилтиогруппу и пропинилтиогруппу. Причем термин «может быть замещена» означает, что она может быть замещена одной или двумя группами, выбранными, например, из (1) гидроксильной группы, (2) атома галогена, (3) C1-6 алкильной группы, С2-6 алкенильной группы или С2-6 алкинильной группы, которые могут быть замещены группой, выбранной из гидроксильной группы, атома галогена, 5-14-членной ароматической гетероциклической группы и 4-10-членной неароматической гетероциклической группы, (4) С3-8 циклоалкильной группы, С3-8 циклоалкенильной группы или С3-8 циклоалкинильной группы, которые могут быть гидроксилированными или галогенированными, (5) C1-6 алкилоксигруппы, которая может быть гидроксилированной или галогенированной, (6) C1-6 алкилтиогруппы, C2-6 алкенилтиогруппы, C2-6 алкинилтиогруппы, которые могут быть галогенированными, (7) С3-8 циклоалкилоксигруппы, С3-8 циклоалкенилоксигруппы или С3-8 циклоалкинилоксигруппы, которые могут быть галогенированными, (8) С3-8 циклоалкилтиогруппы, С3-8 циклоалкенилтиогруппы или С3-8 циклоалкинилтиогруппы, которые могут быть галогенированными, (9) С6-14 арильной группы, (10) C1-6 алканоильной группы, которая может быть галогенированной,
(11) 5-14-членной ароматической гетероциклической группы и
(12) 4-10-членной неароматической гетероциклической группы.
«C1-6 Углеводородтиогруппа, которая может быть замещена» является, предпочтительно, C1-6 углеводородтиогруппой, которая может быть гидроксилированной, C1-6 углеводородтиогруппой, которая может быть замещена C1-6 алкоксигруппой и т.п.
«С3-8 циклическая углеводородтиогруппа» в «С3-8 циклической углеводородтиогруппе, которая может быть замещена», представленная как заместитель HAr, означает С3-8 циклическую углеводородтиогруппу, соответствующую «С3-8 циклической углеводородной группе» в приведенном выше определении, то есть «С3-8 циклоалкилтиогруппе» и «С3-8 циклоалкенилтиогруппе». Конкретные ее примеры включают циклопропанилтиогруппу, циклобутанилтиогруппу, циклогексанилтиогруппу, циклопропенилтиогруппу, циклобутенилтиогруппу, циклопентенилтиогруппу и циклогексенилтиогруппу. «С3-8 циклическая углеводородтиогруппа, которая может быть замещена» является, предпочтительно, «С3-8 циклической углеводородтиогруппой», замещенной одной или двумя группами, выбранными из (1) гидроксильной группы, (2) атома галогена, (3) С3-8 алкильной группы, С3-8 алкенильной группы или С3-8 алкинильной группы, которые могут быть галогенированными, (4) C1-6 алкоксигруппы, которая может быть галогенированной, (5) C1-6 углеводородтиогруппы, которая может быть галогенированной, (6) C1-6 алканоильной группы, которая может быть галогенированной.
«С6-14 ароматическая углеводородоксигруппа» в «С6-14 ароматической углеводородоксигруппе, которая может быть замещена», представленная как заместитель HAr, означает «С6-14 циклическую углеводородоксигруппу», соответствующую «C6-14 ароматической углеводородной группе» в приведенном выше определении. Например, предпочтительными являются фенилоксигруппа, пенталенилоксигруппа и нафтилоксигруппа. В качестве «С6-14 ароматической углеводородоксигруппы, которая может быть замещена» предпочтительна «С6-14 ароматическая углеводородоксигруппа», которая замещена одной или более группами, выбранными из (1) гидроксильной группы, (2) атома галогена, (3) C1-6 алкилсульфонильной группы, С2-6 алкенилсульфонильной группы или С2-6 алкинилсульфонильной группы, которые могут быть галогенированными, (4) C1-4 алкилендиоксигруппы, которая может быть галогенированной, (5) C1-6 алкоксигруппы, которая может быть галогенированной, (6) C1-6 углеводородтиогруппы, которая может быть галогенированной, (7) C1-6 алкоксикарбонильной группы, (8) С6-14 арил-C1-6 алкоксигруппы, (9) C1-7 алканоиламиногруппы, (10) C1-6 алкилкарбамоильной группы, (11) С2-6 алкенилкарбамоильной группы, (12) С2-6 алкинилкарбамоильной группы и (13) аминогруппы, которая может быть замещена C1-6 углеводородной группой.
Необходимо отметить, что в описании данного изобретения «С6-14 арилоксигруппа», представленная в формуле (I), имеет то же значение, что и для «С6-14 ароматической углеводородоксигруппы» в приведенном выше определении.
«5-14-членный гетероцикл-оксигруппа» в «5-14-членный гетероцикл-оксигруппе, которая может быть замещена», представленая в качестве заместителя HAr, означает «5-14-членный гетероцикл-оксигруппу», соответствующую кольцу, имеющему то же значение, что и «5-14-членная гетероциклическая группа» и «4-10-членная неароматическая гетероциклическая группа» в приведенном выше определении. Конкретные ее примеры включают «ароматический гетероцикл-оксигруппу», такую как пирролилоксигруппа, пиридинилоксигруппа, пиридазинилоксигруппа, пиримидинилоксигруппа, пиразинилоксигруппа и тиазолилоксигруппа; и «неароматический гетероцикл-оксигруппу», такую как пирролидинилоксигруппа, пирролинилоксигруппа, пиперидинилоксигруппа, пиперазинилоксигруппа, имидазолинилоксигруппа, имидазолидинилоксигруппа, морфолинилоксигруппа и тетрагидропиранилоксигруппа. В качестве «5-14-членный гетероцикл-оксигруппы, которая может быть замещена» предпочтительна «5-14-членный гетероцикл-оксигруппа», которая может быть замещена одной или более группами, выбранными из (1) гидроксильной группы, (2) атома галогена, (3) нитрильной группы, (4) C1-6 алкильной группы, С2-6 алкенильной группы или С2-6 алкинильной группы, которые могут быть галогенированными, (5) C1-6 алкоксигруппы, которая может быть галогенированной, (6) C1-6 алкилтиогруппы, С2-6 алкенилтиогруппы или C2-6 алкинилтиогруппы, которые могут быть галогенированными, (7) C1-6 алкокси-С2-6 алкинильной группы, (8) ацетильной группы, (9) C1-6 алканоильной группы, (10) моно-(C1-6 углеводород)аминогруппы, (11) ди-(C1-6 углеводород)аминогруппы и (12) три-(C1-6 углеводород)аминогруппы.
«С6-14 ароматическая углеводородоксигруппа» в «С6-14 ароматической углеводородоксигруппе, которая может быть замещена», представленная как заместитель HAr, означает «С6-14 циклическую углеводородтиогруппу», соответствующую «С6-14 ароматической углеводородной группе» в приведенном выше определении. Например, предпочтительными являются фенилтиогруппа, пенталенилтиогруппа и нафтилтиогруппа. В качестве «С6-14 ароматической углеводородоксигруппы, которая может быть замещена» предпочтительна «С6-14 ароматическая углеводородоксигруппа», которая может быть замещена одной или более группами, выбранными из (1) гидроксильной группы, (2) атома галогена, (3) C1-6 алкилсульфонильной группы, С2-6 алкенилсульфонильной группы или С2-6 алкинилсульфонильной группы, которые могут быть галогенированными, (4) C1-4 алкилендиоксигруппы, которая может быть галогенированной, (5) C1-6 алкоксигруппы, которая может быть галогенированной, (6) C1-6 углеводородтиогруппы, которая может быть галогенированной, (7) C1-6 алкоксикарбонильной группы, (8) С6-14 арил-C1-6 алкоксигруппы, (9) C1-7 алканоиламиногруппы, (10) C1-6 алкилкарбамоильной группы, (11) C2-6 алкенилкарбамоильной группы, (12) С2-6 алкинилкарбамоильной группы и (13) аминогруппы, которая может быть замещена C1-6 углеводородной группой.
«5-14-членный гетероцикл-тиогруппа» в «5-14-членный гетероцикл-тиогруппе, которая может быть замещена», представленная как заместитель HAr, означает «5-14-членный гетероцикл-тиогруппу», соответствующую кольцу, имеющему то же значение, что и «5-14-членная ароматическая гетероциклическая группа» и «4-10-членная неароматическая гетероциклическая группа» в приведенном выше определении. Ее конкретные примеры включают «ароматическую гетероциклтиогруппу», такую как пирролилтиогруппа, пиридинилтиогруппа, пиридазинилтиогруппа, пиримидинилтиогруппа, пиразинилтиогруппа и тиазолилтиогруппа; и «неароматическую гетероциклтиогруппу», такую как пирролидинилтиогруппа, пирролинилтиогруппа, пиперидинилтиогруппа, пиперазинилтиогруппа, имидазолинилтиогруппа, имидазолидинилтиогруппа и морфолинилтиогруппа. Причем в качестве «5-14-членный гетероцикл-тиогруппы, которая может быть замещена», предпочтительна «5-14-членный гетероцикл-тиогруппа», которая может быть замещена одной или более группами, выбранными из (1) гидроксильной группы, (2) атома галогена, (3) нитрильной группы, (4) C1-6 алкильной группы, С2-6 алкенильной группы или С2-6 алкинильной группы, которые могут быть галогенированными, (5) C1-6 алкоксигруппы, которая может быть галогенированной, (6) C1-6 алкилтиогруппы, С2-6 алкенилтиогруппы или С2-6 алкинилтиогруппы, которые могут быть галогенированными, (7) C1-6 алкокси-С2-6 алкинильной группы, (8) ацетильной группы, (9) C1-6 алканоильной группы, (10) моно-(C1-6 углеводород)аминогруппы, (11) ди-(C1-6 углеводород)аминогруппы, (12) три-(C1-6 углеводород)аминогруппы и (13) оксогруппы.
«Аминогруппа, которая может быть замещена», представленная в качестве заместителя HAr, означает аминогруппу, представленную формулой -N(R3)R4 (где R3 и R4 являются одинаковыми или различными, и каждый представляет группу, выбранную из (1) ароматической гетероциклической группы, (2) неароматической гетероциклической группы, (3) C1-6 алкильной группы, C2-6 алкенильной группы или C2-6 алкинильной группы, которые могут быть замещены атомом галогена или C1-6 алкоксигруппой, (4) С3-8 циклоалкильной группы, С3-8 циклоалкенильной группы или С3-8 циклоалкинильной группы, которые могут быть галогенированными, (5) карбонильной группы, которая замещена C1-6 алкильной группой, C2-6 алкенильной группой или С2-6 алкинильной группой, которые могут быть галогенированными, С3-8 циклоалкильной группой, С3-8 циклоалкенильной группой или С3-8 циклоалкинильной группой, которые могут быть галогенированными, C1-6 алкоксигруппой, которая может быть галогенированной, С6-14 арильной группой или ароматической гетероциклической группой, (6) C1-6 алканоильной группы, которая может быть замещена группой, выбранной из С6-14 арильной группы или ароматической гетероциклической группы, (7) карбамоильной группы, которая может быть замещена C1-6 алкильной группой, С2-6 алкенильной группой, С2-6 алкинильной группой, С6-14 арильной группой или ароматической гетероциклической группой, и (8) сульфонильной группы, которая может быть замещена C1-6 алкильной группой, C2-6 алкенильной группой или С2-6 алкинильной группой. Причем (9) R3 и R4 могут быть соединены и объединены с образованием 3-10-членного кольца и циклическая аминогруппа может быть замещена одной или более группами, выбранными из гидроксильной группы, атома галогена, C1-6 алкильной группы, С2-6 алкенильной группы, С2-6 алкинильной группы, C1-6 алкоксигруппы, C1-6 углеводородтиогруппы и C1-4 алкилендиоксигруппы. Аминогруппа, R3 и R4 являются одинаковыми или различными, и каждый представляет группу, выбранную из C1-6 алкильной группы, C1-6 алкокси-С2-6 алкильной группы, C1-6 алкоксикарбонильной группы, C1-6 алканоильной группы, С6-14 арилкарбонильной группы, гетероарилкарбонильной группы, C1-6 алкилкарбонильной группы, C6-14 алкилкарбамоильной группы, С6-14 арилсульфонильной группы и 5-14-членной гетероциклической группы.
В качестве примера «C1-6 имидоильной группы» в «C1-6 имидоильной группе, которая может быть замещена», представленной как заместитель HAr, представлены формимидоил, гексанимидоил и сукцинимидоил. В качестве «C1-6 имидоильной группы, которая может быть замещена» предпочтительна C1-6 имидоильная группа, которая может быть замещена атомом галогена.
Примеры «замещенной карбонильной группы», представленной в качестве заместителя HAr, включают карбонильные группы, замещенные группой, выбранной из C1-6 алкильной группы, C2-6 алкенильной группы, С2-6 алкинильной группы, C1-6 алкокси-C1-6 алкильной группы, C1-6 алкоксигруппы, С6-14 арильной группы и 5-14-членной ароматической гетероциклической группы.
«Замещенная карбонильная группа» в «замещенной карбонилоксигруппе», представленная в качестве заместителя HAr, является карбонилом, имеющим то же значение, что и «замещенная карбонильная группа» в приведенном выше определении. Примеры «замещенной карбонилоксигруппы» включают C1-6 алкилкарбонилоксигруппу, С2-6 алкенилкарбонилоксигруппу, С2-6 алкинилкарбонилоксигруппу, C1-6 алкокси-С2-6 алкилкарбонилоксигруппу, C1-6 алкоксикарбонилоксигруппу, С6-14 арилкарбонилоксигруппу и 5-14-членный ароматический гетероцикл-карбонилоксигруппу. Предпочтительными примерами являются C1-6 алкилкарбонилоксигруппа, C2-6 алкенилкарбонилоксигруппа и С2-6 алкинилкарбонилоксигруппа.
Примеры «карбоксильной группы, которая может образовывать соль», представленной в качестве заместителя HAr, включают соли щелочных металлов, таких как литий, натрий и калий, соли щелочноземельных металлов, таких как магний и кальций, тетраметиламмониевые соли, соли четвертичного аммония, такие как тетраэтиламмониевая соль, соли аминокислот, такие как альгинаты, аспартаты, глютаматы и пролиновые соли, и, кроме того, бетаины с аминогруппами в молекуле.
«Карбамоильная группа, которая может быть замещена», представленная в качестве заместителя HAr, конкретно представляет карбамоильные группы, представляемые формулой -CO-N(R5)R6 (где R5 и R6 являются одинаковыми или различными и каждый представляет группу, выбранную из (1) атома водорода, (2) C1-6алкильной группы, (3) С2-6 алкенильной группы, (4) С2-6 алкинильной группы, (5) С3-8 циклоалкильной группы, (6) С3-8 циклоалкенильной группы, (7) С3-8 циклоалкинильной группы, (8) С6-14 арильной группы и (9) ароматической гетероциклической группы или (10) R5 и R6 могут быть соединенными и объединенными с образованием 3-8-членного кольца. Предпочтительна карбамоильная группа, где R5 и R6 являются одинаковыми или различными и каждый является группой, выбранной из C1-6 алкильной группы, С3-8 циклоалкильной группы или С6-14 арильной группы, которые могут быть галогенированными, и т.д.
В качестве примеров «C1-4 алкилендиоксигруппы» в «C1-4 алкилендиоксигруппе, которая может быть замещена», представленной в качестве заместителя HAr, представлены метилендиоксигруппа, этилендиоксигруппа и пропилендиоксигруппа. В качестве «C1-4 алкилендиоксигруппы, которая может быть замещена» предпочтительна C1-4 алкилендиоксигруппа, которая может быть гидроксилированной или галогенированной.
В качестве «сульфинильной группы, которая может быть замещена», представленной в качестве заместителя HAr, предпочтительна сульфинильная группа, которая может быть замещена группой, выбранной из (1) C1-6 углеводородной группы, которая может быть галогенированной, (2) аминогруппы, которая может быть моно- или дизамещена C1-6 углеводородной группой, которая может быть галогенированной.
В качестве сульфонильной группы, которая может быть замещена, представленной в качестве заместителя HAr, предпочтительна сульфонильная группа, которая может быть замещена группой, выбранной из (1) C1-6 углеводородной группы, которая может быть галогенированной, и (2) аминогруппы, которая может быть моно- или дизамещена C1-6 углеводородной группой, которая может быть галогенированной.
Определение для «ароматического гетероцикла, который может быть замещен», представленного в качестве заместителя HAr в формуле (I), является таким же, как приведенное выше. Предпочтительные примеры заместителя «ароматического гетероцикла» включают (1) C1-6 алкильную группу, С2-6 алкенильную группу или С2-6 алкинильную группу, которые могут быть замещены одной или двумя группами, выбранными из (а) гидроксильной группы, (b) атома галогена, (с) 5-14-членной гетероциклической группы, (d) 4-10-членной неароматической гетероциклической группы, (е) 5-10-членной конденсированной гетероциклической группы, которая может быть замещена C1-6 алкоксигруппой, и (f) C1-6 алкилсульфонилгруппы, (2) C1-6 алкоксигруппу, которая может быть замещена одной или более группами, выбранными из (а) гидроксильной группы, (b) атома галогена, (с) 4-10-членный неароматический гетероцикл-оксигруппы, (d) C1-6 алкоксигруппы, (е) C1-6 алкоксикарбонильной группы и (f) 4-10-членного неароматического гетероцикла, (3) С6-14 ароматическую углеводородную циклическую группу, которая может быть замещена одной или более группами, выбранными из (а) атома галогена, (b) C1-6 алкоксигруппы и (с) C1-4 алкилендиоксигруппы, (4) 5-14-членную ароматическую гетероциклическую группу, которая может быть замещена одной или более группами, выбранными из (а) гидроксильной группы, (b) нитрильной группы, (с) C1-6 алкильной группы, (d) C1-6 алкоксигруппы, (е) C1-6 алкокси-C1-6 алкильной группы, (f) C1-6 алканоильной группы, (g) C1-4 алкилендиоксигруппы, (h) моно-(C1-6 алкил) аминогруппы и (i) ди-(C1-6 алкил) аминогруппы, и (5) 4-10-членную неароматическую гетероциклическую группу, которая может быть замещена одной или более группами, выбранными из (а) гидроксильной группы, (b) нитрильной группы, (с) C1-6 алкильной группы, (d) C1-6 алкоксигруппы, (е) C1-6 алкокси-C1-6 алкильной группы, (f) C1-6 алканоильной группы, (g) C1-4 алкилендиоксигруппы, (h) моно-(C1-6 алкил) аминогруппы и (i) ди-(C1-6 алкил)аминогруппы. Более предпочтительные примеры включают C1-6 алкильную группу, которая может быть галогенированной, C2-6 алкенильную группу, которая может быть галогенированной, C1-6 алкокси-C1-6 алкильную группу, C1-6 алкильную группу, замещенную С6-14 ароматической углеводородной циклической группой, C1-6 алкильную группу, замещенную 5-6-членным ароматическим гетероциклом, C1-6 алкоксигруппу, которая может быть галогенированной, C1-6 алкокси-C1-6 алкоксигруппу, С6-14 ароматическую углеводородную группу, 5-6-членный ароматический гетероцикл, который может быть замещен C1-6 алкильной группой, и 4-10-членную неароматическую гетероциклическую группу, которая может быть замещена одной или более группами, выбранными из (а) гидроксильной группы, (b) нитрильной группы и (с) C1-6 алкоксигруппы.
Термины «атом галогена», «C1-6 углеводородная группа», «C1-6 алкильная группа», «С3-8 алкенильная группа», «С3-8 алкинильная группа», «С3-8 циклоалкенильная группа», «С3-8 циклоалкинильная группа», «C6-14 ароматическая углеводородная группа», «С6-14 арильная группа», «5-14-членная ароматическая гетероциклическая группа», «5-14-членная гетероарильная группа», «4-10-членная неароматическая гетероциклическая группа», «C1-6 алкоксигруппа», «С3-8 циклоалкоксигруппа», «С3-8 циклоалкилоксигруппа», «С3-8 циклоалкенилоксигруппа», «C1-6 углеводородтиогруппа», «C1-6 алкилтиогруппа», «С2-6 алкенилтиогруппа», «С3-8 алкинилтиогруппа», «С3-8 циклоалкилтиогруппа», «С3-8 циклоалкенилтиогруппа», «C1-6 алкоксикарбонильная группа», «C1-6 алканоильная группа», «C1-6 алканоилоксигруппа», «карбамоильная группа», «C1-6 имидоильная группа», «карбоксильная группа, которая может образовывать соль», «C1-4 алкилендиоксигруппа», «сульфонильная группа» и «сульфинильная группа», которые все использованы в приведенных выше определениях, касающихся заместителей ароматического гетероцикла HAr, имеют те же значения, которые указаны выше.
В описании данного изобретения «ароматическое кольцо» в «ароматическое кольцо, которое может быть замещено», представленное Ar в формуле (I), означает кольцо, имеющее то же значение, что и «ароматическое кольцо» в приведенном выше определении. Предпочтительными, например, являются бензольное кольцо, пиридиновое кольцо и т.п. Примеры «ароматического кольца, которое может быть замещено» включают ароматические кольца, которые могут быть замещены одной или более группами, выбранными из (1) гидроксильной группы, (2) атома галогена, (3) C1-6 углеводородной группы, которая может быть замещена, (4) С3-8 циклической углеводородной группы, которая может быть замещена, (5) C1-6 алкоксигруппы, которая может быть замещена, (6) С3-8 циклоалкоксигруппы, которая может быть замещена, (7) C1-6 углеводородтиогруппы, которая может быть замещена, (8) С3-8 циклической углеводородтиогруппы, (9) С6-14 ароматической углеводородной циклической группы, которая может быть замещена, (10) 5-14-членной ароматической гетероциклической группы, которая может быть замещена, (11) аминогруппы, которая может быть замещена C1-6 алкильной группой, и (12) C1-4 алкилендиоксигруппы, которая может быть замещена.
«C1-6 Углеводородная группа, которая может быть замещена», представленная в качестве заместителя Ar, означает группу, имеющую то же значение, что и «C1-6 углеводородная группа, которая может быть замещена», представленная в определении для HAr. В качестве «C1-6 углеводородной группы, которая может быть замещена» предпочтительны C1-6 алкильная группа, которая может быть галогенированной, С2-6 алкенильная группа, которая может быть галогенированной, С2-6 алкинильная группа, которая может быть галогенированной, и т.п.
«С3-8 циклическая углеводородная группа, которая может быть замещена», представленная в качестве заместителя Ar, означает группу, имеющую то же значение, что и для «С3-8 циклической углеводородной группы, которая может быть замещена», представленной в определении HAr. В качестве «С3-8 циклической углеводородной группы, которая может быть замещена» предпочтительны С3-8 циклоалкильная группа, которая может быть галогенированной, С3-8 циклоалкенильная группа, которая может быть галогенированной, и т.п.
«C1-6 алкоксигруппа, которая может быть замещена», представленная в качестве заместителя Ar, означает группу, имеющую то же значение, что и «C1-6 алкоксигруппа, которая может быть замещена», представленная в определении HAr. В качестве «C1-6 алкоксигруппы, которая может быть замещена» предпочтительны C1-6 алкоксигруппы, которые могут быть галогенированными, и т.п.
«С3-8 циклоалкоксигруппа, которая может быть замещена», представленная в качестве заместителя Ar, означает группу, имеющую то же значение, что и «С3-8 циклоалкоксигруппа, которая может быть замещена», представленная в определении HAr. В качестве «С3-8 циклоалкоксигруппы, которая может быть замещена» предпочтительны С3-8 циклоалкоксигруппы, которые могут быть галогенированными, и т.п.
«C1-6 Углеводородтиогруппа, которая может быть замещена», представленная в качестве заместителя Ar, означает группу, имеющую то же значение, что и «C1-6 углеводородтиогруппа, которая может быть замещена», представленная в определении HAr. В качестве «C1-6 углеводородтиогруппы, которая может быть замещена» предпочтительны C1-6 углеводородтиогруппы, которые могут быть галогенированными, и т.п.
«С3-8 циклическая углеводородтиогруппа», представленная в качестве заместителя Ar, означает группу, имеющую то же значение, что и «С3-8 циклическая углеводородтиогруппа, которая может быть замещена», представленная в определении HAr. В качестве «С3-8 циклической углеводородтиогруппы, которая может быть замещена» предпочтительны С3-8 циклические углеводородтиогруппы, которые могут быть галогенированными, и т.п.
«С6-14 ароматическая углеводородная циклическая группа, которая может быть замещена» и «5-14-членная ароматическая гетероциклическая группа, которая может быть замещена», представленные как заместители Ar, означают группы, имеющие те же значения, что и «С6-14 ароматическая углеводородная циклическая группа, которая может быть замещена» и «5-14-членная ароматическая гетероциклическая группа, которая может быть замещена», представленные в определении HAr, соответственно.
«Аминогруппа, которая может быть замещена C1-6 алкильной группой», представленная в качестве заместителя Ar, означает аминогруппу, монозамещенную C1-6 алкильной группой, такую как метиламиногруппа и этиламиногруппа, и дизамещенную C1-6 алкильной группой, такую как диметиламиногруппа и диэтиламиногруппа. Кроме того, атом азота может быть тризамещенным C1-6 алкильной группой с образованием соли аммония.
«C1-4 алкилендиоксигруппа, которая может быть замещена», представленная в качестве заместителя Ar, означает группу, имеющую то же значение, что и «C1-4 алкилендиоксигруппа, которая может быть замещена», представленная в определении HAr. Например, предпочтительна C1-4 алкилендиоксигруппа, которая может быть замещена атомом галогена, и т.д.
Как определено выше, «ароматическое кольцо, которое может быть замещено», представлено Ar в формуле (I). Предпочтительные примеры Ar включают бензольное кольцо, пиридиновое кольцо, пиразиновое кольцо, тиофеновое кольцо и тиазольное кольцо, которое может быть замещено группой, выбранной из гидроксильной группы, атома галогена, C1-6 алкильной группы, C1-6 алкоксигруппы и т.п.
В описании данного изобретения W в формуле (I) означает соединяющую цепь, в которой основная цепь построена из двух или более атомов. Их примеры включают, предпочтительно, цепь, представленную (1) -СН2-СН2-, которая может быть замещена, (2) -СН=СН-, которая может быть замещена, (3) 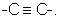 (4) -NH-CO-, (5) -CO-NH-, (6) -NH-CH2-, (7) -CH2-NH-, (8) -СН2-СО-, (9) -СО-СН2-, (10) -NH-S(O)l, (11) -S(O)l-NH-, (12) -CH2-S(O)l- и (13) -S(O)l-CH2- (l означает 0, 1 или 2), более предпочтительно (1) -СН2-СН2-, (2) -СН=СН- и (3) -С≡С- и еще более предпочтительно
(4) -NH-CO-, (5) -CO-NH-, (6) -NH-CH2-, (7) -CH2-NH-, (8) -СН2-СО-, (9) -СО-СН2-, (10) -NH-S(O)l, (11) -S(O)l-NH-, (12) -CH2-S(O)l- и (13) -S(O)l-CH2- (l означает 0, 1 или 2), более предпочтительно (1) -СН2-СН2-, (2) -СН=СН- и (3) -С≡С- и еще более предпочтительно 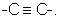
В описании данного изобретения примеры соединяющей группы Х в формуле (I) включают цепи, представленные (1) одинарной связью, (2) C1-6 алкиленовой цепью, которая может быть замещена, (3) С2-6 алкениленовой цепью, которая может быть замещена, (4) С2-6 алкиниленовой цепью, которая может быть замещена, (5) формулой -Q- (где Q представляет атом кислорода, атом серы, СО или N(R2) (где R2 представляет C1-6 алкильную группу или C1-6 алкоксигруппу)), (6) -NH-CO-, (7) -CO-NH-, (8) -NH-CH2-, (9) -CH2-NH-, (10) -CH2-CO-, (11) -CO-CH2-, (12) -NH-S(O)m-, (13) -S(O)m-NH-, (14) -CH2-S(O)m-, (15) -S(O)m-CH2- (где m означает 0, 1 или 2) или (16) -(CH2)n-O- (где n означает целое число от 1 до 6). В данном случае «C1-6 алкиленовая цепь», «C1-6 алкениленовая цепь» и «C1-6 алкиниленовая цепь» означают цепи, соответствующие C1-6 углеводородным группам, имеющим те же значения, что и «C1-6 алкильная группа», «С2-6 алкенильная группа» и «С2-6 алкинильная группа» в приведенных выше определениях. Соединяющая цепь Х представляет, предпочтительно, одинарную связь, C1-6 алкиленовую цепь, С2-6 алкениленовую цепь, -СО- или т.п., и более предпочтительно, простую связь, метиленовую цепь, этиленовую цепь или -СО-.
Аминогруппа в «аминогруппе, которая может быть замещена C1-6 алкильной группой или ацильной группой» означает аминогруппу, которая может быть замещена C1-6 алкильной группой, имеющей то же значение, что и приведенное выше определение, или ацильной группой, имеющей то же значение, что и приведенное выше определение. Конкретные их примеры включают N-формиламиногруппу, N-ацетиламиногруппу, N-пропиониламиногруппу, N-пивалоиламиногруппу, N-бензоиламиногруппу, N-метил-N-формиламиногруппу, N-метил-N-бензоиламиногруппу, N-метиламиногруппу, N,N-диметиламиногруппу, N-метил-N-этиламиногруппу, N-(н-пропил)аминогруппу, N-(изопропил)аминогруппу и N-(трет-бутил)аминогруппу.
«C1-6 алкоксикарбонильная группа» является алкоксикарбонильной группой, соответствующей C1-6 алкоксигруппе в приведенном выше определении. Конкретные ее примеры включают метоксикарбонильную группу, этоксикарбонильную группу, н-пропоксикарбонильную группу, изопропоксикарбонильную группу, втор-пропоксикарбонильную группу, н-бутоксикарбонильную группу, изобутоксикарбонильную группу, 1,2-диметилпропоксикарбонильную группу и 2-этилпропоксикарбонильную группу.
Определения R1, HAr, Ar, W и X, которые должны использоваться в формуле (I), имеют значения, как указано выше. Для более точного определения предпочтительных примеров в качестве -X-Ar- представлена бензильная группа (X = метиленовая цепь, Ar = бензольное кольцо), которая может быть замещена, а в качестве HAr, в дополнение к заместителю -Х-Ar, пиридиновое кольцо, пиримидиновое кольцо, пиридазиновое кольцо, пиразиновое кольцо, индольное кольцо, хинолиновое кольцо, тиофеновое кольцо или бензотиофеновое кольцо, которое может быть замещено одной или двумя группами, выбранными из (1) 5- или 6-членного ароматического гетероцикла, который может быть замещен C1-6 алкильной группой, (2) 5- или 6-членного неароматического гетероцикла, который может замещен одной или более группами, выбранными из (а) гидроксильной группы, (b) C1-6 алкильной группы и (с) C1-6 алкоксигруппы, (3) С6-10 ароматического углеводородного кольца, которое может быть замещено одной или более группами, выбранными из (а) атома галогена, (b) C1-6 алкоксигруппы, (с) C1-4 алкилендиоксигруппы и (d) сульфонильной группы, которая может быть замещена C1-6 алкильной группой, (4) C1-6 алкильной группы, которая может быть замещена одной или более группами, выбранными из (а) гидроксильной группы, (b) атома галогена, (с) 5- или 6-членного ароматического гетероцикла и (d) C1-6 алкоксигруппы, и (5) C1-6 алкоксигруппы, которая может быть замещена (а) атомом галогена и (b) C1-6 алкоксигруппой. Более предпочтительные примеры HAr включают пиридиновое кольцо, пиримидиновое кольцо, пиридазиновое кольцо, пиразиновое кольцо, индольное кольцо, хинолиновое кольцо, тиофеновое кольцо или бензотиофеновое кольцо, которое может быть замещено одной или двумя группами, выбранными из (1) бензольного кольца, которое может быть замещено C1-4 алкилендиоксигруппой, (2) пиридинового кольца, (3) пиримидинового кольца, (4) пиридазинового кольца, (5) пиразинового кольца, (6) тиофенового кольца, (7) пиперидинового кольца, которое может быть замещено C1-6 алкоксигруппой, (8) пиперазинового кольца, которое может быть замещено C1-6 алкоксигруппой, (9) пирролидинового кольца, которое может быть замещено C1-6 алкоксигруппой, (10) пиперидинового кольца, которое может быть замещено гидроксильной группой и C1-6 алкоксигруппой, (11) пиперазинового кольца, которое может быть замещено гидроксильной группой и C1-6 алкоксигруппой, (12) пирролидинового кольца, замещенного гидроксильной группой и C1-6 алкоксигруппой, (13) морфолинового кольца, (14) C1-6 алкильной группы, которая может быть замещена C1-6 алкоксигруппой, и (15) C1-6 алкоксигруппы, которая может быть замещена гидроксильной группой или C1-6 алкоксигруппой.
Соли в данном изобретении означают обычно фармакологически приемлемые соли. Примеры таких солей включают гидрогалогениды, такие как гидрофториды, гидрохлориды, гидробромиды и гидройодиды; соли неорганических кислот, такие как сульфаты, нитраты, перхлораты, фосфаты, карбонаты и гидрокарбонаты; органические карбоксилаты, такие как ацетаты, малеаты, тартраты и фумараты; органические сульфонаты, такие как метансульфонаты, трифторметансульфонаты, этансульфонаты, бензолсульфонаты и толуолсульфонаты; аминаты, такие как альгинаты, аспартаты и глютаматы; соли аминов, такие как триметиламиновые соли, триэтиламиновые соли, прокаиновые соли, пиримидиевые соли и фенетилбензиламиновые соли; соли щелочных металлов, такие как соли натрия и соли калия; и соли щелочноземельных металлов, такие как соли магния и соли кальция.
Общий способ получения
В качестве способа получения соединения, представленного формулой (I), по данному изобретению рассмотрены разные способы, и данное соединение может быть получено обычным способом органического синтеза. Для изложения типичного способа, может быть использован следующий метод получения данного соединения.
Способ получения 1

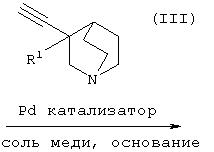

Приведенный выше способ получения является способом получения соединения (IV) в соответствии с изобретением данной патентной заявки путем сочетания ароматических гетероциклических соединений (II) и (III) друг с другом. В формуле А1, А2 и А3 являются одинаковыми или различными и каждый означает (1) атом углерода, который может быть замещен, или (2) гетероатом, такой как атом азота, атом серы или атом кислорода, причем в данном случае А2, кроме того, означает одинарную связь. Когда А2 означает одинарную связь, кольцо, к которому принадлежат А1, А2 и А3, является 5-членным кольцом. Здесь, в случае когда А1, А2 и А3, соответственно, представляют «атом углерода, который может быть замещен», термин «может быть замещен» означает, что он может быть замещен заместителем, представленным для HAr, определенном выше. В частности, атом углерода может быть замещен группой, выбранной из (1) атома галогена, (2) гидроксильной группы, (3) тиольной группы, (4) нитрогруппы, (5) нитрильной группы, (6) C1-6 углеводородной группы, (7) С3-8 циклической углеводородной группы, которая может быть замещена, (8) C6-14 ароматической углеводородной циклической группы, которая может быть замещена, (9) 5-14-членной ароматической гетероциклической группы, которая может быть замещена, (10) 4-10-членной неароматической гетероциклической группы, которая может быть замещена, (11) C1-6 алкоксигруппы, которая может быть замещена, (12) С3-8 циклоалкилоксигруппы, которая может быть замещена, (13) C1-6 углеводородтиогруппы, которая может быть замещена, (14) С3-8 циклической углеводородтиогруппы, которая может быть замещена, (15) С6-14 ароматической углеводородоксигруппы, которая может быть замещена, (16) 5-14-членной гетероцикл-оксигруппы, которая может быть замещена, (17) С6-14 ароматической углеводородтиогруппы, которая может быть замещена, (18) 5-14-членной гетероцикл-оксигруппы, которая может быть замещена, (19) аминогруппы, которая может быть замещена, (20) азидной группы, (21) гуанидиногруппы, (22) карбамидной группы, (23) формильной группы, (24) C1-6 имидоильной группы, которая может быть замещена, (25) карбонильной группы, которая может быть замещена, (26) карбонилоксигруппы, которая может быть замещена, (27) карбоксильной группы, которая может быть замещена, (28) карбамоильной группы, которая может быть замещена, (29) C1-4 алкилендиоксигруппы, которая может быть замещена, (30) сульфинильной группы, которая может быть замещена, и (31) сульфонильной группы, которая может быть замещена. L означает удаляемую группу, и R1 означает атом водорода или гидроксильную группу, а и b, соответственно, означают группу -Х-Ar (где Х и Ar имеют то же значение, которое указано выше) и заместитель HAr формулы (I), описанные в приведенном выше определении, или соответственно означают заместитель HAr и группу -Х-Ar (где Х и Ar имеют то же значение, которое указано выше) формулы (I), описанные в приведенном выше определении. Удаляемая группа L может быть любой группой при условии, что она известна как удаляемая группа в органическом синтезе, и конкретных ограничений не устанавливается. Их примеры включают атомы галогена, такие как атом хлора, атом брома и атом йода; замещенные или незамещенные ацетоксигруппы, такие как ацетоксигруппа и трифторацетоксигруппа; замещенные сульфонилоксигруппы, такие как метансульфонилоксигруппа, трифторметансульфонилоксигруппа, бензолсульфонилоксигруппа и п-толуолсульфонилоксигруппа, и замещенные фосфорилоксигруппы, такие как дифеноксифосфорилокси. Среди таких групп предпочтительны атомы галогена, такие как атом хлора, атом брома и атом йода, и трифторметансульфонилоксигруппа. В качестве палладиевого катализатора могут быть использованы, например, тетракис(трифенилфосфин)палладий (0) или хлорид бис(трифенилфосфин)палладия (II) в количестве 0,0001-0,1 моль-эквивалентов. Например, можно использовать 0,0001-0,1 моль-эквивалентов йодида меди (I) или хлорида меди (I) в качестве соли меди и, например, можно использовать 1-5 эквивалентов триэтиламина или N,N-диизопропилэтиламин в качестве основания. В качестве растворителя используется N,N-диметилформамид, N-метилпирролидон, тетрагидрофуран, метанол или смесь данных растворителей. Температура реакции, предпочтительно, составляет от 0° до 140°С.
Способ получения 2
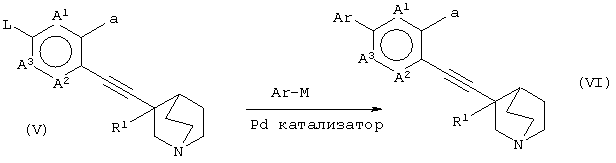
Способ получения 3
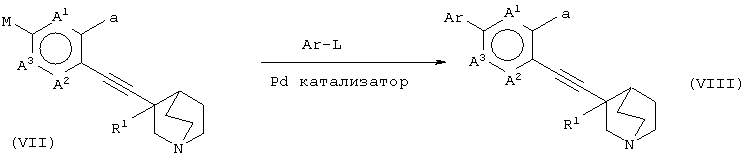
Представленные выше способы получения обеспечивают возможность получения соединений (VI) и (VIII) по данному изобретению. На схеме реакции L и а имеют те же значения, что и в приведенном выше определении. В качестве L, например, можно использовать атом хлора, атом брома, атом йода или трифторметансульфонилоксигруппу. М означает атом металла, который может иметь заместитель. Например, предпочтительны три-н-бутилолово или дигидроксибор. В качестве палладиевого катализатора, например, можно использовать тетракис-(трифенилфосфин)палладий (0) или хлорид бис(трифенилфосфин)-палладия (II) в количестве 0,0001-0,1 моль-эквивалентов.
Примеры растворителя включают толуол, ксилол, N,N-диметилформамид и N-метилпирролидон. Допустима температура реакции в интервале от 50°С до 150°С. Когда металл М является бором, в качестве основания используются неорганическое основание, такое как карбонат натрия, или органическое основание, такое как триэтиламин. В качестве растворителя используется также органический растворитель, содержащий воду.
Не устанавливается особых ограничений на дозированную форму соединения по данному изобретению и приемлемо или пероральное введение, или парентеральное введение способом, который обычно применяется. Соединение может быть переработано в препараты в виде таблеток, порошка, гранул, капсул, сиропа, лепешек, ингаляционного препарата, суппозиториев, инъекционных препаратов, мази, глазной мази, раствора для глаз, раствора для орошения полости носа, ушных капель, припарки и лосьона и применяться в таком виде. При изготовлении таких лекарственных форм могут использоваться наполнители, связующие вещества, замасливатели, подкрашивающие вещества, улучшающие вкус и запах вещества и, если необходимо, стабилизаторы, эмульгаторы, вещества, улучшающие всасывание, поверхностно-активные вещества, регуляторы рН, антисептики и антиоксиданты и т.д., и компоненты, которые обычно используются в качестве сырьевых материалов лекарственных препаратов, перерабатываются обычным способом. Примеры указанных компонентов включают животные жиры и растительные масла, такие как соевое масло, говяжье сало и синтетические глицериды; углеводороды, такие как вазелиновое масло, сквален и твердый парафин; сложные эфирные масла, такие как октилдодецилмиристат и изопропилмиристат; высшие спирты, такие как цетостеариловый спирт и бехениловый спирт; силиконовые смолы; силиконовые масла; поверхностно-активные вещества, такие как сложные эфиры полиоксиэтилена и жирных кислот, сложные эфиры сорбитана и жирных кислот, сложные эфиры глицерина и жирных кислот, сложные эфиры полиоксиэтиленсорбитана и жирных кислот, полиоксиэтилен, гидрированное касторовое масло и полиоксиэтилен, полиоксипропиленовые блоксополимеры; водорастворимые полимеры, такие как гидроксиэтилцеллюлоза, полиакриловая кислота, карбоксивиниловые полимеры, полиэтиленгликоль, поливинилпирролидон и метилцеллюлоза; низшие спирты, такие как этанол и изопропанол; многоатомные спирты, такие как глицерин, пропиленгликоль, дипропиленгликоль и сорбит; сахара, такие как глюкоза и сахароза, неорганические порошки, такие как ангидрид кремниевой кислоты, магний-алюминий силикат и алюмосиликат; и очищенная вода.
Лекарственное средство по данному изобретению вводят взрослому пациенту обычно в дозе примерно от 30 мкг до 10 г, предпочтительно, от 100 мкг до 5 г, а более предпочтительно от 100 мкг до 100 мг в случае перорального введения, и примерно от 30 мкг до 1 г, предпочтительно от 100 мкг до 500 мг и более предпочтительно от 100 мкг до 30 мг в случае инъекции один или несколько раз в сутки, хотя доза меняется в зависимости от выраженности симптомов, возраста, пола, веса, дозированной формы и вида заболевания.
Биохимическую активность соединения по данному изобретению и эффекты (активность синтезирующего сквален фермента, подавляющее действие на биосинтез холестерина и подавляющее действие на биосинтез холестерина и триглицеридов) соединения в виде лекарственного средства могут быть оценены следующими методами.
Пример испытания 1
Количественное определение активности по подавлению синтезирующего сквален фермента путем использования микросом печени крысы
(I) Реакция проводилась в объеме 500 мкл. Смешивали 200 мкл раствора, содержащего 125 мМ трис-соляной кислоты (рН 7,3), 2,5 мМ хлорида магния, 5 мМ фторида калия и 10 мМ восстановительного типа никотинамидоадениндинуклеотидфосфорной кислоты, 100 мкл раствора образца с 5-кратной концентрацией, 100 мкл дистиллированной воды и 50 мкл 0,4-1 мг/мл микросом печени, полученных следующим методом.
(II) Приведенную выше смесь предварительно инкубировали при 37°С в течение 10 минут, а затем к смеси добавляли 50 мкл 100 мкМ [3Н]-фарнезилпирофосфорной кислоты (30 мКи/ммоль, NEN) для начала реакции. Реакция проходила при 37°С в течение 10 минут. К полученной смеси добавляли 1 мл этанола для прекращения реакции и затем к реакционному раствору добавляли 1 мл дистиллированной воды и 3 мл петролейного эфира, который затем встряхивали в течение 30 минут. Водную фазу отделяли от масляной фазы, водную фазу замораживали при -70°С в сухом льду/метаноле и измеряли радиоактивность органической фазы, используя жидкостной сцинтиллятор. Органическую фазу выпаривали досуха, применяя газообразный азот и остаток растворяли в качестве маркера в 25 мкл хлороформа, содержащего сквален, фарнезол и холестерин. Образец наносили пятном на пластину для ТСХ (Merck) и проявляли, используя гептан, в течение 15-20 минут. Полосу сквалена вырезали из пластины, чтобы измерить радиоактивность, используя жидкостной сцинтилляционный счетчик. Данные выражали концентрацией (IC50), при которой подавлялось 50% радиоактивности контрольной группы.
Метод получения микросом печени крысы
Следующие операции проводились на льду, а центрифугирование выполняли при 4°С. Печень иссекали у самцов крыс Спрага-Доули (Spraugue-Dawly) (здесь далее называемых крысами 3D) (8-9-недельного возраста) и перфузировали 1,15% хлорида калия для удаления крови. Затем печень измельчали, используя ножницы, и измельченную печень гомогенизировали, используя тефлоновый гомогенизатор. Полученный образец центрифугировали при 16000хg дважды в течение 15 минут. Супернатант дополнительно центрифугировали при 105000хg в течение 60 минут. Полученный осадок определяли как фракцию микросом, которые суспендировали в 25 мМ растворе трис-соляной кислоты. Концентрацию белка определяли количественно методом Брэдфорда и концентрацию белка доводили до 20 мг/мл, используя тот же самый раствор. Полученный раствор хранили при 70°С.
Пример испытания 2
Количественное определение подавляющей активности в отношении биосинтеза холестерина
(I) Самцов крыс 3D категории SPF (гнотобионты, 4-недельного возраста, SLC = при последнем обследовании) разводили в течение более одной недели в комнате с переменой дня-ночи и подвергали эксперименту, проводимому в дневное время. Соединение, растворенное в 2% растворе твин-80, вводили (5 мл/кг) крысе, используя оральный зонд. Через один час внутрибрюшинно вводили натриевую соль [1-14C]уксусной кислоты (1,67-2,22 ГБк/ммоль, 37 МБк/мл, NEN), приготовленную путем разведения до 1,85 МБк/мл с использованием физиологического раствора соли (300 мкл/животное). Через один час крысам делали анестезию диэтиловым эфиром для того, чтобы провести обескровливание через абдоминальную аорту. Собранную кровь центрифугировали при 3000 об/мин в течение 10 минут для получения плазмы крови.
(II) К 2 мл плазмы крови добавляли 1 мл 4N КОН и 1 мл этанола, затем инкубировали при 65°С в течение одного часа, а затем добавляли 3 мл петролейного эфира. Плазму встряхивали в течение 30 минут. После того как водную фазу отделяли от органической фазы центрифугированием, ее замораживали при -80°С и измеряли радиоактивность органической фазы, используя жидкостной сцинтилляционный счетчик. Или органическую фазу выпаривали досуха, используя газообразный азот, а остаток растворяли в качестве маркера в 25 мкл хлороформа, содержащего сквален, фарнезол и холестерин. Образец наносили на пластину для ТСХ (Merck) и проявляли, используя толуол и изопропиловый эфир (1:1) в течение 15-20 минут. Полосу холестерина вырезали из пластины для определения радиоактивности, используя жидкостной сцинтилляционный счетчик. Активность подавления биосинтеза холестерина выражали степенью подавления (%) по отношению к контрольной группе.
Пример испытания 3
Количественное определение активности подавления биосинтеза холестерина и триглицеридов в клетках печени крыс
Клетки печени выделяли у самца крысы 3D обычным способом (метод перфузии коллагеназой) и проводили эксперимент.
Выделенные клетки печени высевали в количестве 500 мкл на каждую ячейку 24-луночного планшета с коллагеновым покрытием (плотность клеток: 4×105 клеток/мл). В качестве раствора для клеточной культуры использовали среду Е Уильямса (с рН, доведенным до 7,4), содержащую 10% ФТС (FCS), 1 мкМ инсулина, 1 мкМ дексаметазона, 100 Ед/мл пенициллина и 100 мкг/мл стрептомицина. После того как клетки печени инкубировали в CO2 термостате в течение 2 часов, разрушенные клетки удаляли и клетки печени дополнительно инкубировали в течение ночи.
После того как среду заменяли, образец разводили 10% ДМСО - 90% раствора клеточной культуры и добавляли в каждую лунку в количестве 5 мкл. В контрольную группу добавляли ДМСО (конечная концентрация 0,1%). В среду добавляли натриевую соль [1-14C]уксусной кислоты (5 мкКи/лунка) через 10 минут и спустя 4 часа добавляли образец для измерения подавляющего действия на синтез холестерина и для измерения подавляющего действия на синтез триглицеридов, соответственно, с последующим культивированием в течение еще 2 часов.
После того как культивирование заканчивалось, супернатант удаляли и клетки промывали дважды, используя ФБР(-) (забуференный фосфатом раствор соли (без Ca2+ и Mg2+)). К клеткам добавляли гексан/изопропиловый спирт (3:2, об/об) и клетки затем оставляли стоять на 10 минут для экстрагирования внтриклеточных липидов. Экстракт переносили в стеклянную пробирку и высушивали в потоке газообразного азота. Затем высушенный экстракт промывали петролейным эфиром, содержащим следующие компоненты: 0,01% сквалена, 0,3% свободного холестерина, 0,3% ацетата холестерина, 0,1% триолеина, 0,01% фарнезола и 0,3% ланостерола.
Полученный раствор наносили на пластину для ТСХ для осуществления операции выделения. Нанесенный раствор проявляли в течение 10 минут, используя толуол/изопропиловый эфир (1:1, об/об) в качестве растворителей, и в течение еще 15 минут, используя гептан вместо приведенного выше растворителя, затем высушивали, используя воздух.
После того как проявление заканчивалось, пластинку для ТСХ подвергали проявке с окрашиванием йодом. После того как подтверждалось каждое положение свободного холестерина и триолеина, которые использовали в качестве стандартов, изображение пластины для ТСХ переносили на пластину для получения изображения BAS 2000 (Fuji Film) путем экспозиции, выполняемой в течение 16 часов. Перенесенное изображение анализируют, используя считывающее устройство BAS 2000 IP и анализатор изображения II для измерения радиоактивности, содержащейся во фракциях свободного холестерина и триглицеридов.
Активность по подавлению биосинтеза холестерина выражали концентрацией (IC50), при которой устранялось 50% радиоактивности контрольной группы, и активность по подавлению биосинтеза триглицеридов выражали по степени подавления (%) по отношению к контрольной группе.
Результаты испытаний по примеру испытания 1 (Количественное определение активности по подавлению синтезирующего сквален фермента путем использования микросом печени крысы), по примеру испытания 2 (Количественное определение подавляющей активности в отношении биосинтеза холестерина) и примеру испытания 3 (Количественное определение активности подавления биосинтеза холестерина и триглицеридов в клетках печени крыс) представлены в табл.1-4.
Соединение по данному изобретению является весьма полезным в качестве ингибитора синтезирующего сквален фермента (таблица 1), а также, по сути, в качестве ингибитора биосинтеза холестерина (таблица 2 и таблица 3). Кроме того, оно также очень полезно в качестве ингибитора синтеза триглицеридов как нейтрального жира (таблица 4). Соответственно, соединение по данному изобретению пригодно в качестве профилактического и лечебного средства для лечения заболеваний, при которых эффективно подавление синтеза сквалена, подавление биосинтеза холестерина или подавление биосинтеза триглицеридов. Из приведенных выше результатов следует, что соединение по данному изобретению пригодно в качестве профилактического и лечебного средства для лечения гиперлипидемии, а также в качестве профилактического и лечебного средства при заболеваниях, связанных с артериосклерозом, или ишемических заболеваниях сердца.
ПРИМЕРЫ
Данное изобретение будет объяснено более детально и конкретно с помощью следующих примеров, однако, данное изобретение не ограничивается ими. Структурные формулы соединений из данных примеров перечислены в таблицах 5-10, представленных ниже.
Примеры получения
Пример получения 1: 4-Бензил-5-бром-2-пиридилтрифторметансульфонат
а) 4-Бензоил-2-хлорпиридин
102 г 2-хлорникотиновой кислоты суспендировали в 250 мл бензола. Добавляли 50 мл тионилхлорида с последующим кипячением с обратным холодильником в течение 7 часов. После остывания реакционный раствор выпаривали. Остаток растворяли в 250 мл бензола с последующим добавлением малыми порциями 200 г безводного хлорида алюминия при перемешивании на водяной бане. После стаяния реакционного раствора в течение ночи при комнатной температуре в него малыми порциями добавляли 2 л ледяной воды и смесь экстрагировали этилацетатом. Органическую фазу промывали разбавленной соляной кислотой, водным раствором бикарбоната натрия и насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли с получением 135 г целевого соединения.
1H-ЯМР (CDCl3) δ м.д.: 7,50-7,56 (3Н, м), 7,61 (1Н, дд, J=0,8, 1,2 Гц), 7,68 (1Н, т, J=8 Гц), 7,81 (2Н, д, J=8 Гц), 8,58 (1Н, дд, J=0,8, 5,2 Гц).
b) 4-Бензоил-2-метоксипиридин
К 28% метанольному раствору метоксида натрия при кипячении с обратным холодильником по каплям в течение одного часа добавляли смесь 135 г 4-бензоил-2-хлорпиридина и 150 мл метанола с последующим кипячением с обратным холодильником в течение 2 часов. После остывания реакционный раствор фильтровали для удаления нерастворенных веществ и растворитель удаляли. К остатку добавляли водный раствор бикарбоната натрия и смесь экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором соли, сушили над безводным сульфатом магния и затем растворитель удаляли с получением 130 г целевого соединения.
1H-ЯМР (CDCl3) δ м.д.: 4,00 (3Н, с), 7,00 (1Н, дд, J=0,8, 1,2 Гц), 7,16 (1Н, дд, J=1,2, 5,2 Гц), 7,50 (2Н, т, J=8 Гц), 7,63 (1Н, т, J=8 Гц), 7,83 (2Н, д, J=8 Гц), 8,32 (1Н, дд, J=0,8, 5,2 Гц)
c) 4-(α-Гидроксибензил)-2-метоксипиридин
9,4 г боргидрида натрия малыми порциями добавляли к смеси 130 г 4-бензоил-2-метоксипиридина и 300 мл метанола при перемешивании на ледяной бане. После того как добавление по каплям завершалось, смесь перемешивали в течение ночи. Реакционный раствор добавляли к 1 л воды и затем экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором соли, сушили над безводным сульфатом магния и затем растворитель удаляли с получением 104 г целевого соединения.
1H-ЯМР (CDCl3) δ м.д.: 2,39 (1Н, д, J=3 Гц), 3,92 (3Н, с), 5,74 (1Н, д, J=3 Гц), 6,82 (1Н, с), 6,86 (1Н, д, J=5 Гц), 7,28-7,36 (5Н, м), 8,08 (1Н, д, J=5 Гц).
d) 4-(α-Ацетоксибензил)-2-метоксипиридин
Смесь 104 г 4-(α-гидроксибензил)-2-метоксипиридина, 100 мл ангидрида уксусной кислоты и 100 мл пиридина нагревали при перемешивании в течение 5 часов на масляной бане с температурой 110°С. После того как реакционный раствор выпаривали, к остатку добавляли воду и смесь экстрагировали этилацетатом. Экстракт промывали водным раствором бикарбоната натрия и насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Остаток подвергали хроматографии на колонке с силикагелем, используя 5-20% этилацетат/гексан, с получением 112 г целевого соединения.
1H-ЯМР (CDCl3) δ м.д.: 2,18 (3Н, с), 3,92 (3Н, с), 6,73-6,76 (2Н, м), 6,79 (1Н, д, J=5 Гц), 7,28-7,38 (5Н, м), 8,10 (1Н, д, J=5 Гц)
e) 4-Бензил-2-метоксипиридин
5 г 10% палладия на угле и 500 мл метанола добавляли к 112 г 4-(α-ацетоксибензил)-2-метоксипиридина с последующим проведением гидрокрекинга в атмосфере водорода. Катализатор отфильтровывали и фильтрат выпаривали. Затем остаток нейтрализовали насыщенным водным раствором бикарбоната натрия и смесь экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли с получением 73 г целевого соединения.
1H-ЯМР (CDCl3) δ м.д.: 3,90 (5Н, с), 6,55 (1Н, с), 6,70 (1Н, д, J=5 Гц), 7,17 (2Н, д, J=8 Гц), 7,22 (1Н, т, J=8 Гц), 7,30 (2Н, т, J=8 Гц), 8,04 (1Н, д, J=5 Гц).
f) 4-Бензил-5-бром-2-метоксипиридин
Смешанный раствор 22 мл брома, 90 г бромида калия и 500 мл воды по каплям добавляли в смесь 73 г 4-бензил-2-метоксипиридина, 28 г гидроксида калия, 1,7 г хлорида тетраэтиламмония, 90 г бромида калия и 500 мл воды при перемешивании на ледяной бане. После перемешивания в течение ночи добавляли сульфит натрия и смесь экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле, используя 5-10% этилацетат/гексан, с получением 62 г целевого соединения.
1H-ЯМР (CDCl3) δ м.д.: 3,87 (3Н, с), 4,00 (2Н, с), 6,46 (1Н, с), 7,19 (2Н, д, J=7 Гц), 7,25 (1Н, т, J=7 Гц), 7,32 (2Н, т, J=7 Гц), 8,22 (1Н, с).
g) 4-Бензил-5-бром-2-гидроксипиридин
250 мл 47% бромистоводородной кислоты добавляли к 62 г 4-бензил-5-бром-2-метоксипиридина с последующим нагреванием при перемешивании в течение 3 часов на масляной бане, при температуре 100°С. После остывания реакционный раствор малыми порциями добавляли к водному раствору карбоната калия и нейтрализовали. Полученные осадки отфильтровывали с получением 59 г целевого соединения.
1H-ЯМР (CDCl3) δ м.д.: 3,87 (2Н, с), 6,20 (1Н, с), 7,21-7,36 (5Н, м), 7,72 (1Н, с).
h) 4-бензил-5-бром-2-пиридилтрифторметансульфонат
100 г N-фенилтрифторметансульфонимида добавляли малыми порциями к суспензии, содержащей 59 г 4-бензил˜5-бром-2-гидроксипиридина, 100 мл триэтиламина и 8 г 4-диметиламинопиридина в 200 мл дихлорметана. После перемешивания при комнатной температуре в течение 7 часов реакционный раствор выпаривали. Остаток подвергали колоночной хроматографии на силикагеле, используя 5-10% этилацетат/гексан, с получением 82 г целевого соединения.
1H-ЯМР (CDCl3) δ м.д.: 4,11 (2Н, с), 6,82 (1Н, с), 7,18 (2Н, д, J=7 Гц), 7,32 (1Н, т, J=7 Гц), 7,38 (2Н, т, J=7 Гц), 8,46 (1Н, с).
Пример получения 2: 2-бензил-6-пиридилтрифторметансульфонат
а) 2-Бром-6-метоксипиридин
250 мл 28% метанольного раствора метоксида натрия по каплям добавляли в смесь 200 г 2,6-дибромпиридина и 150 мл метанола при нагревании при 80°С и перемешивании на масляной бане с последующим перемешиванием при нагревании в течение 2 часов. После остывания смесь экстрагировали смесью диэтиловый эфир-вода, органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли с получением 150 г целевого соединения.
1H-ЯМР (CDCl3) δ м.д.: 3,94 (3Н, с), 6,68 (1Н, д, J=7 Гц), 7,06 (1Н, д, J=8 Гц), 7,40 (1Н, т, J=8 Гц).
b) 2-Бензил-6-метоксипиридин
Реактив Гриньяра, приготовленный из 123 мл бензилбромида, 30 г магния и 400 мл диэтилового эфира, медленно, по каплям добавляли к смеси 150 г 2-бром-6-метоксипиридина, 4,3 г хлорида 1,3-бис(дифенилфосфино)-пропанникеля (II) и 500 мл тетрагидрофурана при перемешивании на ледяной бане. После перемешивания в течение ночи смесь экстрагировали водным раствором хлорида аммония и гексана. Органическую фазу промывали водой и затем насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле, используя 1% и 1,5% этилацетат/гексан, с получением 150 г целевого соединения.
1H-ЯМР (CDCl3) δ м.д.: 3,92 (3Н, с), 4,03 (2Н, с), 6,54 (1Н, д, J=8 Гц), 6,65 (1Н, д, J=7 Гц), 7,18-7,32 (5Н, м), 7,44 (1Н, дд, J=7, 8 Гц).
c) 2-Бензил-6-гидроксипиридин
Смесь 59 г 2-бензил-6-метоксипиридина и 200 мл 47% бромистоводородной кислоты нагревали при перемешивании в течение 7 часов на масляной бане при температуре 100°С. После остывания добавляли 250 мл воды и полученные кристаллы отфильтровывали, промывали водой и сушили в вакууме с получением 38,9 г целевого соединения.
1H-ЯМР (CDCl3) δ м.д.: 3,78 (2Н, с), 5,96 (1Н, д, J=7 Гц), 6,15 (1Н, д, J=9 Гц), 7,20-7,36 (6Н, м).
d) 2-Бензил-6-пиридилтрифторметансульфонат
Смесь 10 г 2-бензил-6-гидроксипиридина, 23 г N-фенилтрифторметансульфонимида, 0,66 г 4-диметиламинопиридина, 23 мл триэтиламина и 100 мл дихлорметана перемешивали при комнатной температуре на водяной бане в течение одного часа. Реакционный раствор выпаривали и остаток подвергали колоночной хроматографии на силикагеле, используя 2-3% этилацетат/гексан, и дополнительно фильтровали через NH-силикагель (Fuji Silicia Kagaku) и элюировали 3% этилацетатом/гексаном. Элюат выпаривали с получением 11,7 г целевого соединения.
1H-ЯМР (CDCl3) δ м.д.: 4,13 (2Н, с), 6,99 (1Н, д, J=8 Гц), 7,16 (1Н, д, J=8 Гц), 7,22-7,34 (5Н, м), 7,75 (1Н, т, J=8 Гц).
Пример получения 3: 2-Бензил-З-бром-6-пиридилтрифторметансульфонат
а) 2-Бензил-3-бром-6-метоксипиридин
Смешанный раствор 17 мл брома, 90 г бромида калия и 450 мл воды по каплям добавляли в смесь 60 г 2-бензил-6-метоксипиридина (пример получения 2-b), 90 г бромида калия, 450 мл воды, 20 г гидроксида калия и 2,5 г тетрааммонийхлорида за 2 часа при перемешивании на ледяной бане. После перемешивания в течение ночи добавляли сульфит натрия и смесь экстрагировали гексаном. Органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле, элюируя 0,5-1,5% этилацетатом/гексаном, с получением 72,5 г целевого соединения.
1H-ЯМР (CDCl3) δ м.д.: 3,88 (3Н, с), 4,20 (2Н, с), 6,48 (1Н, д, J=8 Гц), 7,17-7,38 (5Н, м), 7,62 (1Н, д, J=8 Гц).
b) 2-Бензил-3-бром-6-гидроксипиридин
Смесь 72,5 г 2-бензил-3-бром-6-метоксипиридина и 300 мл 47% бромистоводородной кислоты нагревали при перемешивании в течение 4 часов на масляной бане при температуре 100°С. После остывания добавляли 500 мл воды. Полученные кристаллы отфильтровывали, промывали водой и диэтиловым эфиром, сушили на воздухе, а затем сушили при нагревании и пониженном давлении с получением 63,8 г целевого соединения.
1H-ЯМР (CDCl3) δ м.д.: 3,97 (2Н, с), 6,25 (1Н, д, J=9 Гц), 7,20-7,35 (5Н, м), 7,58 (1Н, д, J=9 Гц).
c) 2-Бензил-3-бром-6-пиридилтрифторметансульфонат
Смесь 1,2 г 2-бензил-3-бром-6-гидроксипиридина, 1,7 г N-фенилтрифторметансульфонимида, 1,9 мл триэтиламина, 28 мг 4-диметиламинопиридина и 15 мл дихлорметана перемешивали при комнатной температуре в течение 3 часов. К реакционному раствору добавляли силикагель и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле, используя 5% этилацетат/гексан, с получением 1,6 г целевого соединения.
1H-ЯМР (CDCl3) δ м.д.: 4,28 (2Н, с), 6,29 (1Н, д, J=8 Гц), 7,22-7,33 (5Н, м), 7,97 (1Н, д, J=8 Гц).
Пример получения 4: 4-Бензил-5-бром-2-йодпиримидин
a) трет-Бутил-2-(диметиламинометилен)-3-оксо-4-фенилбутират
Фенилацетатхлорид медленно, по каплям добавляли в смесь 110 г кислоты Мельдрума, 120 мл пиридина и 500 мл дихлорметана при перемешивании на ледяной бане. После перемешивания в течение ночи добавляли 650 мл водного раствора 1,2N соляной кислоты. Органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. К остатку добавляли 600 мл трет-бутанола с последующим кипячением с обратным холодильником в течение 3 часов. После остывания растворитель удаляли и в то же время добавляли этанол. К остатку добавляли 600 мл толуола и 110 мл N,N-диметилформамидодиметилацеталя с последующим нагреванием в течение 2 часов на масляной бане при температуре 100°С, в то же время удаляя метанол с помощью аппарата Дина-Старка. Ракционный раствор выпаривали и остаток подвергали колоночной хроматографии на силикагеле, используя 50-70% этилацетат/гексан, с получением 93 г целевого соединения.
1H-ЯМР (CDCl3) δ м.д.: 1,51 (9Н, с), 4,03 (2Н, с), 7,18-7,30 (5Н, м), 7,56 (1Н, с).
b) 4-бензил-2-аминопиримидин
Трифторуксусную кислоту медленно, по каплям добавляли в смесь 93 г трет-бутил-2-(диметиламинометилен)-3-оксо-4-фенилбутирата и 400 мл дихлорметана при перемешивании на ледяной бане. После перемешивания в течение ночи растворитель удаляли и остаток экстрагировали водным раствором бикарбоната натрия, этилацетатом и тетрагидрофураном. Органическую фазу промывали водой, насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. К остатку добавляли 500 мл этанола, 110 г гидрохлорида гуанидина и 96 г этоксида натрия с последующим энергичным кипячением с обратным холодильником в течение 20 часов. После остывания добавляли 800 мл воды, 150 мл гексана и 30 мл диэтилового эфира. После перемешивания в течение 30 минут при комнатной температуре полученные кристаллы отфильтровывали, промывали водой, сушили на воздухе, а затем в вакууме при нагревании с получением 26 г целевого соединения.
1H-ЯМР (CDCl3) δ м.д.: 3,91 (2Н, с), 5,01 (2Н, с), 6,41 (1Н, д, J=5 Гц), 7,23-7,35 (5Н, м), 8,15 (1Н, д, J=5 Гц).
с) 4-бензил-5-бром-2-йодпиримидин
60 мл метанольного раствора, содержащего 7,3 мл брома, медленно, по каплям добавляли в смесь 26 г 4-бензил-2-аминопиримидина, 24 г бикарбоната натрия и 150 мл N,N-диметилформамида при перемешивании на ледяной бане. После перемешивания в течение 10 минут на ледяной бане добавляли водный раствор тиосульфата натрия. После перемешивания при комнатной температуре в течение 30 минут нерастворимые вещества отфильтровывали и сушили в вакууме при нагревании. Смесь полученного неочищенного соединения, 51 мл изоамилнитрита, 51 мл дийодметана, 24 г йодида меди и 400 мл тетрагидрофурана нагревали при перемешивании в течение 2 часов на масляной бане при 65°С. После остывания добавляли 400 мл этилацетата и нерастворимые вещества отфильтровывали через целит. Фильтрат разделяли, добавляя к нему водный раствор тиосульфата натрия и водный раствор хлорида аммония. Органическую фазу промывали насыщенным раствором соли и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле и элюировали 6% этилацетатом/гексаном с получением 20 г целевого соединения.
1H-ЯМР (CDCl3) δ м.д.: 4,20 (2Н, с), 7,23-7,35 (5Н, м), 8,42 (1Н, с).
Пример получения 5: 3-Бензил-5-бром-2-пиридилтрифторметансульфоната
а) 3-Бензил-2-метоксипиридин
16 г хлорида алюминия добавляли к смеси 8,6 г 2-хлорникотиновой кислоты и 120 мл бензола на ледяной бане при перемешивании. После перемешивания при комнатной температуре в течение 2 часов добавляли воду и этилацетат. Нерастворимые вещества отфильтровывали через целит и органическую фазу промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. К остатку добавляли 100 мл метанола и 30 мл 28% метанольного раствора метоксида натрия с последующим кипячением с обратным холодильником в течение ночи. После остывания растворитель удаляли и смесь разделяли, добавляя к ней воду и этилацетат. Органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. К остатку добавляли 90 мл диэтиленгликоля, 6,8 г карбоната калия и 4,3 мл моногидрата гидразина. Смесь нагревали при перемешивании в течение одного часа на масляной бане при 100°С и затем в течение 3 часов на масляной бане при 170°С. После остывания смесь разделяли, добавляя к ней воду и этилацетат. Органическую фазу промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле и элюировали 10% этилацетатом/гексаном с получением 4,2 г целевого соединения.
1H-ЯМР (CDCl3) δ м.д.: 3,91 (2Н, с), 3,97 (3Н, с), 6,79 (1Н, дд, J=5,7 Гц), 7,18-7,32 (6Н, м), 8,03 (1Н, дд, J=2, 5 Гц).
b) 3-Бензил-5-бром-2-метоксипиридин
0,12 мл брома добавляли к смеси 430 мг 3-бензил-2-метоксипиридина, 460 мг бикарбоната натрия и 10 мл метанола при перемешивании на ледяной бане с последующим перемешиванием при комнатной температуре в течение 8 часов. Смесь разделяли, добавляя к ней водный раствор тиосульфата натрия и этилацетат. Органическую фазу промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле и элюировали 5% этилацетатом/гексаном с получением 140 г целевого соединения.
1H-ЯМР (CDCl3) δ м.д.: 3,87 (2Н, с), 3,92 (3Н, с), 7,17-7,34 (6Н, м), 8,05 (1Н, д, J=2 Гц).
с) 3-Бензил-5-бром-2-пиридилтрифторметансульфонат
Смесь 190 мг 3-бензил-5-бром-2-метоксипиридина и 2 мл 47% бромистоводородной кислоты перемешивали при нагревании на масляной бане при температуре 70°С, в течение 2 часов. После остывания смесь разделяли, добавляя к ней водный раствор карбоната калия и этилацетат. Органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. К остатку добавляли 300 мг N-фенилтрифторметансульфонимида, 8,4 мг 4-диметил-аминопиридина, 0,29 мг триэтиламина и 2 мл дихлорметана с последующим перемешиванием при комнатной температуре в течение одного часа. К реакционному раствору добавляли силикагель и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле, используя 5% этилацетат/гексан, с получением 220 мг целевого соединения.
1H-ЯМР (CDCl3) δ м.д.: 4,01 (2Н, с), 7,17-7,20 (2Н, м), 7,28-7,39 (3Н, м), 7,65-7,67 (1Н, м), 8,27 (1Н, д, J=2 Гц).
Пример получения 6: (3-Пиридил)трибутилолово
1,45 мл гексанового раствора, содержащего 1,54 М н-бутиллития, по каплям добавляли в 200 мл диэтилэфирного раствора, содержащего 10,0 г 3-бромпиридина, при -78°С в атмосфере азота в течение 10 минут. После добавления по каплям смесь перемешивали в течение 10 минут и затем туда по каплям добавляли 20 мл хлорида трибутилолова в течение 10 минут. Затем после перемешивания в течение 30 минут к реакционной смеси добавляли воду и затем экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле и элюировали гексаном, а затем гексаном/этилацетатом (7:1) с получением 21,9 г целевого соединения.
1H-ЯМР (CDCl3) δ м.д.: 0,87-0,94 (9Н, м), 1,07-1,11 (6Н, м), 1,26-1,38 (6Н, м), 1,50-1,58 (6Н, м), 7,22 (1Н, м), 7,73 (1Н, м), 8,50 (1Н, м), 8,59 (1Н, с).
Пример получения 7: (2-Пиридил)трибутилолово
Целевое соединение синтезировали таким же образом, что и в примере получения 6.
1H-ЯМР (CDCl3) δ м.д.: 0,87-0,94 (9Н, м), 1,09-1,14 (6Н, м), 1,28-1,37 (6Н, м), 1,52-1,58 (6Н, м), 7,10 (1Н, м), 7,40 (1Н, м), 7,48 (1Н, м), 8,73 (1Н, м).
Пример получения 8: (3,4-Метилендиоксифенил)трибутилолово
Целевое соединение синтезировали таким же образом, что и в примере получения 6, за исключением того, что растворитель для реакции (диэтиловый эфир) заменяли на тетрагидрофуран.
1H-ЯМР (CDCl3) δ м.д.; 0,87-0,90 (9Н, м), 1,00-1,04 (6Н, м), 1,30-1,37 (6Н, м), 1,49-1,56 (6Н, м), 5,61 (2Н, с), 6,83-6,93 (3Н, м).
Пример получения 9: (4-Пиридил)трибутилолово
9,0 мл гексанового раствора 2,52 М н-бутиллития добавляли по каплям в 20 мл тетрагидрофуранового раствора 3,2 мл диизопропиламина при охлаждении льдом в течение 10 минут в атмосфере азота. После перемешивания при охлаждении льдом в течение 20 минут туда по каплям добавляли 6,3 мл гидрированного трибутилолова в течение 10 минут с последующим перемешиванием при охлаждении льдом в течение еще 20 минут. Затем при охлаждении до -78°С туда по каплям добавляли суспензию 2,0 г гидрохлорида 4-бромпиридина и 30 мл тетрагидрофурана в течение 10 минут. После перемешивания в течение 2 часов к реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли и растворитель удаляли. Затем остаток подвергали колоночной хроматографии на NH-силикагеле, элюируя гексаном/этилацетатом (7:1), и дополнительно подвергали колоночной хроматографии на двуокиси кремния и элюировали гексаном/этилацетатом (2:1) с получением 580 мг (15%) целевого соединения.
1H-ЯМР (CDCl3) δ м.д.: 0,87-0,91 (9Н, м), 1,07-1,11 (6Н, м), 1,30-1,35 (6Н, м), 1,49-1,60 (6Н, м), 7,35-7,37 (2Н, м), 8,47-8,48 (2Н, м).
Пример получения 10: Пиразилтрибутилолово
5,0 г тетракистрифенилфосфинпалладия (0) добавляли к 50 мл ксилольного раствора, содержащего 8,0 г хлорпиразина и 200 г бис(трибутилолова), с последующим нагреванием при перемешивании при 140°С в течение одного часа в атмосфере азота. После охлаждения реакционной смеси до комнатной температуры растворитель удаляли. Остаток подвергали колоночной хроматографии на двуокиси кремния и элюировали гексаном, а затем гексаном/этилацетатом (10:1) с получением 9,5 г пиразилтрибутилолова.
1H-ЯМР (CDCl3) δ м.д.: 0,87-0,94 (9Н, м), 1,15-1,19 (6Н, м), 1,26-1,38 (6Н, м), 1,53-1,60 (6Н, м), 8,36 (1Н, м), 8,54 (1Н, м), 8,71 (1Н, м).
Пример получения 11: 2-Бензил-3-метоксиметилоксипиридин-6-карбоксиальдегид
a) 3-Бензилокси-2-гидроксиметил-6-метилпиридин
100 г 3-гидрокси-6-метил-2-пиридинметанола и 150 г карбоната калия суспендировали в 400 мл N,N-диметилформамида. При перемешивании и нагревании до 60°С на масляной бане по каплям добавляли 85 мл бензилбромида. Далее, после нагревания при перемешивании в течение 30 минут нерастворимые вещества отфильтровывали. К фильтрату добавляли воду и смесь экстрагировали этилацетатом. Органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Остаток перекристаллизовывали из смеси этанол/гексан с получением 145 г целевого соединения.
1H-ЯМР (CDCl3) δ: 2,49 (3Н, с), 4,48 (1Н, т, J=4 Гц), 4,77 (2Н, д, J=4 Гц), 5,09 (2Н, с), 6,98 (1Н, д, J=8 Гц), 7,08 (1Н, д, J=8 Гц), 7,28-7,45 (5Н, м).
b) 3-Бензилокси-6-метилпиридин-2-карбоксиальдегид
145 г 3-бензилокси-2-гидроксиметил-6-метилпиридина растворяли в 500 мл хлороформа. Добавляли 400 г двуокиси марганца при перемешивании и нагревании при 60°С на масляной бане с последующим нагреванием при перемешивании в течение одного часа. После остывания реакционный раствор фильтровали для удаления нерастворимых веществ и растворитель удаляли. Полученные кристаллы сушили в вакууме с получением 139 г целевого соединения.
1H-ЯМР (CDCl3) δ: 2,57 (3Н, с), 5,22 (2Н, с), 7,25-7,46 (7Н, м), 10,41 (1Н, с).
с) 3-бензилокси-2-(α-гидроксибензил)-6-метилпиридин
139 г 3-бензилокси-6-метилпиридин-2-карбоксиальдегида растворяли в 700 мл тетрагидрофурана с последующим охлаждением до -60°С или ниже. При перемешивании механической мешалкой по каплям добавляли 400 мл циклогексан/эфирного раствора, содержащего 1,8 моль фениллития. После перемешивания в течение 30 минут при охлаждении добавляли насыщенный водный раствор хлорида аммония и температуру повышали до комнатной. Далее туда добавляли воду и смесь экстрагировали этилацетатом. Полученную органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Остаток перекристаллизовывали из этанола при охлаждении с получением 116 г целевого соединения.
1H-ЯМР (CDCl3) δ: 2,53 (3Н, с), 4,92 (1Н, д, J=12 Гц), 4,98 (1Н, д, J=12 Гц), 5,80 (1Н, д, J=7 ГЦ), 5,91 (1Н, д, J=7 Гц), 6,99 (1Н, д, J=8 Гц), 7,04 (1Н, д, J=8 Гц), 7,07-7,14 (2Н, м), 7,20-7,36 (8Н, м).
d) 2-Бензоил-3-бензилокси-6-метилпиридин
116 г 3-бензилокси-2-(α-гидроксибензил)-6-метилпиридина растворяли в 500 мл хлороформа. При перемешивании добавляли 400 г двуокиси марганца с последующим нагреванием при перемешивании при 60°С в течение одного часа на масляной бане. После остывания реакционный раствор фильтровали для удаления нерастворимых веществ и растворитель удаляли. Полученные кристаллы сушили в вакууме с получением 113 г целевого соединения.
1H-ЯМР (CDCl3) δ: 2,53 (3Н, с), 5,06 (2Н, с), 7,13-7,3 0 (7Н, м), 7,45 (2Н, т, J=8 Гц), 7,58 (1Н, т, J=8 Гц), 7,87 (2Н, д, J=8 Гц).
е) 6-Гидроксиметил-2-бензоил-3-бензилоксипиридин
113 г 2-бензоил-3-бензилокси-6-метилпиридина растворяли в 600 мл дихлорметана. Добавляли 96 г 3-хлорпербензойной кислоты с последующим перемешиванием при нагревании при 50°С на масляной бане. После охлаждения на водяной бане к реакционному раствору добавляли водный раствор сульфита натрия и далее насыщенный водный раствор бикарбоната натрия. Органическую фазу отделяли, затем промывали насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли. Затем ее сушили над безводным сульфатом магния и растворитель удаляли. Полученный остаток растворяли в 200 мл уксусного ангидрида с последующим нагреванием при перемешивании при 150°С в течение 3 часов на масляной бане. Затем растворитель удаляли, добавляли 400 мл метанола и 200 мл 2N водного раствора гидроксида натрия с последующим нагреванием при перемешивании при 60°С в течение 3 часов на масляной бане. К реакционному раствору добавляли активированный уголь. После перемешивания в течение некоторого времени его отфильтровывали. К фильтрату добавляли воду для осаждения кристаллов. Полученные кристаллы отфильтровывали и сушили в вакууме с получением 116 г целевого соединения.
1H-ЯМР (CDCl3) δ: 3,18 (1Н, т, J=5 Гц), 4,74 (2Н, д, J=5 Гц), 5,12 (2Н, с), 7,17-7,30 (5Н, м), 7,32 (1Н, д, J=9 Гц), 7,39 (1Н, д, J=9 Гц), 7,46 (2Н, т, J=8 Гц), 7,60 (1Н, т, J=8 Гц), 7,85 (2Н, д, J=8 Гц).
f) 2-Бензоил-6-(трет-бутилдиметилсилил)оксиметил-3-бензилоксипиридин
116 г 6-гидроксиметил-2-бензоил-3-бензилоксипиридина растворяли в 450 мл N,N-диметилформамида. Добавляли 100 г имидазола и 85 г трет-бутилдиметилсилилхлорида с последующим перемешиванием при комнатной температуре в течение ночи. Растворитель удаляли, к остатку добавляли воду и смесь экстрагировали этилацетатом. Далее органическую фазу промывали разбавленной соляной кислотой, водой, водным насыщенным раствором бикарбоната натрия и насыщенным раствором соли, сушили над безводным сульфатом магния и выпаривали. Остаток сушили с получением 141 г целевого соединения.
1H-ЯМР (CDCl3) δ: 0,11 (6Н, с), 0,95 (9Н, с), 4,80 (2Н, с), 5,10 (2Н, с), 7,15-7,32 (5Н, м), 7,39 (1Н, д, J=9 Гц), 7,44 (2Н, т, J=8 Гц), 7,53-7,61 (2Н, м), 7,85 (2Н, д, J=8 Гц).
g) 2-(α-Ацетоксибензил)-6-(трет-бутилдиметилсилил)оксиметил-3-бензилоксипиридин
141 г 2-бензоил-6-(трет-бутилдиметилсилил)оксиметил-3-бензилоксипиридина растворяли в 500 мл метанола. При охлаждении льдом добавляли 4,9 г боргидрида натрия с последующим перемешиванием в течение 2 часов. После повышения температуры до комнатной добавляли воду и смесь экстрагировали этилацетатом. Далее органическую фазу промывали насыщенным раствором соли, сушили над безводным сульфатом магния и выпаривали. Полученный остаток растворяли в 200 мл пиридина и добавляли 100 мл уксусного ангидрида с последующим нагреванием при перемешивании в течение одного часа при 150°С на масляной бане. Растворитель удаляли, к остатку добавляли воду и смесь экстрагировали этилацетатом. Далее органическую фазу промывали разбавленной соляной кислотой, водой и насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, сушили над безводным сульфатом магния и выпаривали. Остаток сушили с получением 160 г целевого соединения.
1H-ЯМР (CDCl3) δ: 0,10 (6Н, с), 0,94 (9Н, с), 2,17 (3Н, с), 4,79 (2Н, с), 5,04 (1Н, д, J=12 ГЦ), 5,09 (1Н, д, J=12 Гц), 7,14-7,46 (13Н, м).
h) 2-Бензил-6-(трет-бутилдиметилсилил)оксиметил-3-гидроксипиридин
160 г 2-(α-ацетоксибензил)-6-(трет-бутилдиметилсилил)-оксиметил-3-бензилоксипиридина растворяли в смешанном растворителе из 200 мл тетрагидрофурана и 200 мл метанола. Добавляли 8 г 10% палладия на угле для проведения гидрокрекинга. После того как атмосферу в реакционной системе заменяли на азот, катализатор отфильтровывали и фильтрат выпаривали. Остаток растворяли в этилацетате, промывали насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, сушили над безводным сульфатом магния и выпаривали с получением 100 г целевого соединения.
1H-ЯМР (CDCl3) δ: 0,11 (6Н, с), 0,95 (9Н, с), 4,19 (2Н, с), 4,79 (2Н, с), 7,09 (1Н, д, J=8 Гц), 7,10-7,34 (6Н, м).
i) 2-Бензил-6-гидроксиметил-3-метоксиметилоксипиридин
К 100 г 2-бензил-6-(трет-бутилдиметилсилил)оксиметил-3-гидроксипиридина добавляли 63 г карбоната калия и 300 мл N,N-диметилформамида и в смесь по каплям добавляли 23 мл хлорметилметилового эфира при комнатной температуре при перемешивании с применением механической мешалки. После нагревания при перемешивании при 50°С в течение 2 часов на масляной бане добавляли воду и смесь экстрагировали этилацетатом. Далее органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Полученный остаток растворяли, добавляя 400 мл тетрагидрофурана, и добавляли 300 мл тетрагидрофуранового раствора, содержащего 1 моль фторида тетра-н-бутиламмония при охлаждении льдом. После перемешивания при охлаждении льдом добавляли воду и смесь экстрагировали этилацетатом. Далее органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и выпаривали. Остаток растворяли в смеси 50% этилацетат/гексан и фильтровали через силикагель. Фильтрат выпаривали и сушили с получением 73 г целевого соединения.
1H-ЯМР (CDCl3) δ: 3,29 (3Н, с), 4,17 (2Н, с), 4,79 (2Н, с), 5,12 (2Н, с), 7,14 (1Н, т, J=7 Гц), 7,18-7,32 (5Н, м), 7,37 (1Н, д, J=8 Гц).
j) 2-Бензил-3-метоксиметилоксипиридин-6-карбоксиальдегид
73 г 2-бензил-6-гидроксиметил-3-метоксиметилоксипиридина растворяли в 300 мл хлороформа с последующим добавлением 220 г двуокиси марганца после перемешивания. Затем смесь нагревали при перемешивании при 50°С в течение 1,5 часов на масляной бане. После остывания реакционный раствор фильтровали для удаления нерастворимых веществ и растворитель удаляли. Полученные кристаллы перекристаллизовывали из эфира/гексана с получением 30 г целевого соединения. Фильтрат, полученный при перекристаллизации, концентрировали. Остаток подвергали колоночной хроматографии на силикагеле, используя 5-10% этилацетат/гексан в качестве элюента, для разделения и очистки и перекристаллизовывали из смеси эфир/гексан с получением 11 г целевого соединения.
1H-ЯМР (CDCl3) δ: 3,29 (3Н, с), 4,27 (2Н, с), 5,25 (2Н, с), 7,18 (1Н, т, J=7 Гц), 7,26 (2Н, т, J=7 Гц), 7,31 (2Н, д, J=7 Гц), 7,45 (1Н, д, J=8 Гц), 7,85 (1Н, д, J=8 Гц), 10,00 (1Н, с).
Пример получения 12: 2-Бензил-3-метоксиметилокси-6-йодпиридин
a) 2-Бром-3-метоксиметилоксипиридин
50 г 2-бром-3-гидроксипиридина суспендировали в 200 мл тетрагидрофурана с последующим добавлением 33 мл хлорметилметилового эфира. При охлаждении до -20°С и перемешивании малыми порциями добавляли 17 г 60% масляной суспензии гидрида натрия. После добавления гидрида натрия охлаждающую среду удаляли с последующим перемешиванием при комнатной температуре в течение 3,5 часов. При охлаждении малыми порциями добавляли ледяную воду и смесь экстрагировали этилацетатом. Органическую фазу дополнительно промывали насыщенным раствором соли, сушили над безводным сульфатом натрия и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле, используя 10-15% этилацетат/гексан в качестве элюента, для разделения и очистки с получением 35 г целевого соединения.
1H-ЯМР (CDCl3) δ: 3,53 (3Н, с), 5,28 (2Н, с), 7,21 (1Н, дд, J=4,6, 8,2 Гц), 7,43 (1Н, дд, J=1,6, 8,2 Гц), 8,05 (1Н, дд, J=1,6, 4,6 Гц).
b) 2-Бензил-3-метоксиметилоксипиридин
Раствор бензилбромида магния в диэтиловом эфире, приготовленный из 38 мл бензилбромида, 8 г магния и 250 мл безводного диэтилового эфира, медленно, по каплям добавляли в смесь 35 г 2-бром-3-метоксиметилоксипиридина, 5 г хлорида 1,3-бис(дифенилфосфино)пропанникеля (II) и 200 мл тетрагидрофурана при перемешивании с охлаждением льдом в атмосфере азота. После перемешивания в течение 4,5 часов добавляли насыщенный водный раствор хлорида аммония и смесь экстрагировали этилацетатом. Органическую фазу далее промывали насыщенным раствором соли, сушили над безводным сульфатом натрия и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле, используя 8-20% этилацетат/гексан в качестве элюента, для разделения и очистки с получением 27 г целевого соединения.
1H-ЯМР (CDCl3) δ: 3,34 (3Н, с), 4,21 (2Н, с), 5,17 (2Н, с), 7,11-7,38 (7Н, м), 8,20 (1Н, дд, J=1,3, 4,8 Гц).
с) 2-Бензил-3-гидрокси-6-йодпиридин
60 мл трифторуксусной кислоты добавляли к 27 г 2-бензил-3-метоксиметилоксипиридина с последующим перемешиванием при комнатной температуре в течение 2 часов и затем нагреванием при перемешивании в течение одного часа при 50°С на масляной бане. Реакционный раствор добавляли к водному раствору карбоната калия, который охлаждали льдом, и полученные кристаллы отфильтровывали. Фильтрат выпаривали и к полученным кристаллам добавляли 19 г йодида натрия, 5 г гидроксида натрия и 200 мл метанола. При перемешивании с охлаждением льдом туда по каплям добавляли 158 мл 5% водного раствора гипохлорита натрия в течение 30 минут. После перемешивания в течение ночи добавляли 60 мл 5N соляной кислоты и затем добавляли насыщенный водный раствор тиосульфата натрия с последующим экстрагированием этилацетатом. Органическую фазу далее промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Полученные кристаллы отфильтровывали и сушили в вакууме с получением 17 г целевого соединения.
d) 2-Бензил-3-метоксиметилокси-6-йодпиридин
12 г 2-Бензил-3-гидрокси-6-йодпиридина растворяли в 50 мл тетрагидрофурана с последующим добавлением 3,8 мл хлорметилметилового эфира. Малыми порциями добавляли 2 г 60% масляной суспензии гидрида натрия при перемешивании с охлаждением льдом. После добавления гидрида натрия охлаждающую среду удаляли и смесь перемешивали при комнатной температуре в течение 2,5 часов. Затем туда малыми порциями добавляли ледяную воду при охлаждении с последующим экстрагированием этилацетатом. Органическую фазу дополнительно промывали насыщенным раствором соли, сушили над безводным сульфатом натрия и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле, используя 15% этилацетат/гексан в качестве элюента, для разделения и очистки с получением 13 г целевого соединения.
1H-ЯМР (CDCl3) δ: 3,28 (3Н, с), 4,14 (2Н, с), 5,11 (2Н, с), 7,04 (1Н, д, J=8,4 Гц), 7,14-7,30 (5Н, м), 7,48 (1Н, д, J=8,4 Гц).
Пример получения 13: 2-(4-Фторбензил)-3-бром-6-гидроксипиридин
Бензилбромид в примере получения 2-b заменяли на 4-фторбензилхлорид и одну за другой проводили те же процедуры, что и в примерах получения 3-а и 3-b, для синтеза соединения, названного в заголовке.
1H-ЯМР (CDCl3) δ: 4,15 (2Н, с), 6,36 (1Н, д, J=9 Гц), 6,99-7,03 (2Н, м), 7,33-7,37 (2Н, м), 7,51 (1Н, д, J=9 Гц).
Пример получения 14: 2-(3-Фторбензил)-3-бром-6-гидроксипиридин
Бензилбромид в примере получения 2-b заменяли на 3-фторбензилхлорид и затем проводили те же процедуры, что и в примерах получения 3-а и 3-b, для синтеза соединения, названного в заголовке.
1H-ЯМР (CDCl3) δ: 4,18 (2Н, с), 6,37 (1Н, д, J=9 Гц), 6,92-6,97 (1Н, м), 7,06-7,17 (2Н, м), 7,26-7,31 (1Н, м), 7,52 (1Н, д, J=9 Гц).
Пример получения 15: 4-Бензил-5-бром-2-хлорпиримидин
Целевое соединение синтезировали таким же образом, что и в примере получения 4, за исключением того, что изоамилнитрит заменяли на трет-бутилнитрит, дийодметан и йодид меди заменяли на хлорид меди, и тетрагидрофуран в качестве растворителя заменяли на ацетонитрил.
1H-ЯМР (CDCl3) δ: 4,75 (2Н, с), 7,25-7,35 (5Н, м), 7,70 (1Н, с).
Пример получения 16: 2-Бензил-3-бром-6-гидрокси-5-йодпиридин
1,19 г N-йодсукцинимида добавляли к смеси 1,16 г 2-бензил-3-бром-6-гидроксипиридина (пример получения 3-b) и 10 мл N,N-диметилформамида при комнатной температуре с последующим перемешиванием при той же температуре в течение ночи. К реакционному раствору добавляли 50 мл воды и полученные кристаллы отфильтровывали, промывали водой и затем сушили в вакууме с получением 1,47 г целевого соединения.
1H-ЯМР (CDCl3) δ: 4,02 (2Н, с), 7,30-7,37 (5Н, м), 8,11 (1Н, с).
Пример получения 17: 2-Бром-6-йод-3-пиридилтрифторметансульфонат
a) 2-Бром-3-гидрокси-6-йодпиридин
17,6 г хлорамина Т добавляли к смеси 10,9 г 2-бром-3-гидроксипиридина, 9,35 г йодида натрия и 110 мл N,N-диметилформамида при перемешивании на ледяной бане с последующим перемешиванием при той же температуре в течение 30 минут, а затем при комнатной температуре в течение 10 минут. Добавляли воду, этилацетат и 11 мл 6N водного раствора соляной кислоты и органическую фазу промывали насыщенным раствором соли и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле и элюировали 30% этилацетатом/гексаном с получением 16,5 г целевого соединения.
1H-ЯМР (CDCl3) δ: 5,58 (1Н, шир.с), 6,98-7,01 (1Н, м), 7,55-7,58 (1Н, м).
b) 2-Бром-6-йод-3-пиридилтрифторметансульфонат
19,7 г N-фенилтрифторметансульфонимида, 336 мг 4-диметиламинопиридина и 23,0 мл триэтиламина добавляли к смеси 16,5 г 2-бром-3-гидрокси-6-йодпиридина и 150 мл дихлорметана при комнатной температуре с последующим перемешиванием при комнатной температуре в течение 1,5 часов. К реакционному раствору добавляли силикагель и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле, используя 5% этилацетат/гексан, с получением 19,9 г целевого соединения.
1H-ЯМР (CDCl3) δ: 7,30 (1Н, д, J=9 Гц), 7,78 (1Н, д, J=9 Гц).
Пример получения 18: (2-Бензил-3-метоксиметилокси-6-пиридил)трибутилолово
Целевое соединение синтезировали таким же образом, что и в примере получения 6, за исключением того, что 3-бромпиридин заменяли на 2-бензил-6-йод-3-метоксиметилоксипиридин (пример получения 12).
1H-ЯМР (CDCl3) δ: 0,84-0,89 (9Н, м), 1,03-1,08 (6Н, м), 1,28-1,38 (6Н, м), 1,51-1,59 (6Н, м), 3,32 (3Н, с), 4,20 (2Н, с), 5,12 (1Н, с), 7,10-7,36 (7Н, м).
Пример получения 19: Пиразилацетилен
а) Пиразилтриметилсилилацетилен
10,1 г триметилсилилацетилена и 28,6 мл триэтиламина добавляли к смеси 6,11 мл хлорпиразина, 653 мг йодида меди, 3,96 г тетракис(трифенилфосфин)палладия (0) и 100 мл N,N-диметилформамида с последующим перемешиванием при 50°С в течение 3,5 часов. После остывания до комнатной температуры добавляли целит и гексан с последующим отфильтровыванием нерастворимых веществ через целит. После выпаривания растворителя остаток подвергали колоночной хроматографии на силикагеле и элюировали 10% этилацетатом/гексаном с получением 9,58 г целевого соединения.
1H-ЯМР (CDCl3) δ: 0,31 (9Н, с), 8,47 (1Н, с), 8,53 (1Н, с), 8,68 (1Н, с).
b) Пиразилацетилен
7,51 г карбоната калия добавляли к смеси 9,58 г пиразилтриметилсилилацетилена и 70 мл метанола при 0°С с последующим перемешиванием при комнатной температуре в течение 30 минут. Добавляли воду и диэтиловый эфир и органический слой промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель выпаривали с получением 2,50 г соединения, названного в заголовке.
1H-ЯМР (CDCl3) δ: 3,20 (1Н, с), 8,38 (1Н, с), 8,41 (1Н, с), 8,57 (1Н, с).
Пример получения 20: 2-Метоксиметилокси-1-йодбензол
216 мг 60% масляной суспензии гидрида натрия добавляли к смеси 1,65 г 2-йодфенола и 20 мл N,N-диметилформамида при охлаждении льдом с последующим перемешиванием при комнатной температуре в течение 30 минут. Добавляли 570 мкл хлорметилметилового эфира при охлаждении льдом с последующим перемешиванием в течение 30 минут при комнатной температуре. Туда добавляли воду и этилацетат. Органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли с получением 2,12 г целевого соединения.
1H-ЯМР (CDCl3) δ: 3,52 (3Н, с), 5,24 (2Н, с), 6,76 (1Н, дт, J=1,8 Гц), 7,07 (1Н, дд, J=1,8 Гц), 7,26-7,30 (1Н, м), 7,78 (1Н, дд, J=1,8 Гц).
Пример получения 21: 2-Метил-2-пропенилтрибутилолово
1,2-дибромметан (140 мкл) и 0,400 мл 1-хлор-2-метил-2-пропена добавляли к смеси 505 мг магния и 2 мл тетрагидрофурана с последующим нагреванием. После инициирования нагревание прекращали. Реакционный раствор разбавляли 5 мл тетрагидрофурана с последующим добавлением по каплям 8 мл тетрагидрофуранового раствора 1,18 мл 1-хлор-2-метил-2-пропена. После перемешивания при комнатной температуре в течение 30 минут к реакционному раствору добавляли хлорид трибутилолова с последующим перемешиванием при комнатной температуре в течение 4 часов. Добавляли водный раствор хлорида аммония и этилацетат и органическую фазу промывали насыщенным раствором бикарбоната натрия и насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли с получением 5,29 г целевого соединения.
1H-ЯМР (CDCl3) δ: 0,85-0,98 (9Н, м), 1,25-1,78 (23Н, м), 4,43-4,48 (2Н, м).
Пример получения 22: 2-Йод-1,3,4-тиадиазол
Смесь 19,2 г 2-амино-1,3,4-тиадиазола, 35,0 г йодида меди, 74,0 мл дийодметана, 74,0 мл изопентилнитрита и 500 мл тетрагидрофурана кипятили с обратным холодильником в течение 5 часов. После остывания к реакционному раствору добавляли 200 мл этилацетата. После отфильтровывания нерастворимых веществ фильтрат подвергали колоночной хроматографии на силикагеле и элюировали гексаном/этилацетатом (10:1) и затем гексаном/этилацетатом (1:2). Затем элюат кристаллизовали из смеси этилацетат/метанол/гексан с получением 15,7 г целевого соединения.
1H-ЯМР (CDCl3) δ м.д.: 9,13 (1Н, с).
Пример получения 23: (2-Пиримидил)три-н-бутилолово
3,2 мл гексанового раствора, содержащего 1,57 моль н-бутиллития, медленно, по каплям добавляли в 20 мл тетрагидрофуранового раствора, содержащего 707 мкл диизопропиламина, при охлаждении льдом. После перемешивания при 0°С в течение 30 минут медленно, по каплям туда же добавляли 1,4 мл гидрида три-н-бутилолова. После перемешивания при 0°С в течение 30 минут смесь охлаждали до -78°С и медленно, по каплям добавляли суспензию в 30 мл тетрагидрофурана, содержащую 2-хлорпиримидин. После перемешивания при -78°С в течение одного часа к реакционному раствору при 0°С в течение 2 часов добавляли воду. Смесь экстрагировали этилацетатом, органическую фазу промывали насыщенным раствором соли и растворитель удаляли. Затем остаток подвергали колоночной хроматографии на силикагеле и элюировали гексаном/этилацетатом (10:1), а затем гексаном/этилацетатом (7:1) с получением 654 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 0,86-0,90 (9Н, м), 1,15-1,20 (6Н, м), 1,30-1,36 (6Н, м), 1,54-1,61 (6Н, м), 7,12 (1Н, т, J=5 Гц), 8,68 (2Н, д, J=5 Гц).
Пример получения 24: (5-Пиримидил)три-н-бутилолово
Целевое соединение синтезировали таким же образом, что и при синтезе (2-пиримидил)три-н-бутилолова.
1H-ЯМР (CDCl3) δ: 0,87-0,91 (9Н, м), 1,12-1,16 (6Н, м), 1,30-1,38 (6Н, м), 1,50-1,59 (6Н, м), 8,67-8,71 (2Н, м), 9,12 (1Н, с).
Пример получения 25: (4-Пиримидил)три-н-бутилолово
5,8 мл гексанового раствора, содержащего 2,52 моль н-бутиллития, медленно, по каплям добавляли в 20 мл тетрагидрофуранового раствора, содержащего 2,5 мл 2,2,6,6-тетраметилпиперидина. После перемешивания при 0°С в течение 30 минут туда медленно, по каплям добавляли смесь 0,98 мл пиримидина, 4,6 мл хлорида три-н-бутилолова и 20 мл тетрагидрофурана. После перемешивания при -78°С в течение 4 часов к реакционному раствору добавляли воду и затем экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором соли и растворитель удаляли. Затем остаток подвергали колоночной хроматографии на силикагеле, элюируя 15% гексаном/этилацетатом (10:1), с получением 474 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 0,86-0,91 (9Н, м), 1,14-1,18 (6Н, м), 1,30-1,38 (6Н, м), 1,52-1,60 (6Н, м), 7,44 (1Н, дд, J=4,8 Гц, 1,6 Гц), 8,47 (1Н, д, J=4,8 Гц), 9,23 (1Н, д, J=1,6 Гц).
Пример получения 26: (3-Пиридазил)три-н-бутилолово
11,2 мл гексанового раствора, содержащего 2,52 моля н-бутиллития, медленно добавляли к 30 мл тетрагидрофуранового раствора, содержащего 4,8 мл 2,2,6,6-тетраметилпиперидина при -30°С с последующим перемешиванием при 0°С в течение 30 минут. Затем добавляли 7,3 мл N,N,N',N'-тетраметилэтилендиамина и затем к смеси при -78°С медленно добавляли смесь 1,74 мл пиридазина, 10,3 мл хлорида три-н-бутилолова и 10 мл тетрагидрофурана с последующим перемешиванием при -78°С в течение 3 часов. Затем к реакционному раствору добавляли воду и потом экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором соли и растворитель удаляли. Затем остаток подвергали колоночной хроматографии на NH-силикагеле (Fuji Silicia), элюируя гексаном/этилацетатом (10:1), и затем подвергали колоночной хроматографии на силикагеле, элюируя гексаном/этилацетатом (10:1) и затем гексаном/этилацетатом (1:1), с получением 660 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 0,86-0,91 (9Н, м), 1,14-1,22 (6Н, м), 1,24-1,38 (6Н, м), 1,54-1,61 (6Н, м), 7,24-7,28 (1Н, м), 7,48-7,50 (1Н, м), 9,03-9,04 (1Н, м).
Пример получения 27: (4-Пиридазил)три-н-бутилолово
58,0 мл гексанового раствора, содержащего 2,52 моль н-бутиллития, медленно, по каплям добавляли в 200 мл тетрагидрофуранового раствора, содержащего 25 моль 2,2,6,6-тетраметилпиперидина, при -30°С. После перемешивания при 0°С в течение 30 минут туда медленно, по каплям добавляли смесь 9,1 мл пиридазина, 46,0 мл хлорида три-н-бутилолова и 100 мл тетрагидрофурана при -78°С. После перемешивания при -78°С в течение 4 часов к реакционному раствору добавляли воду и затем экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором соли и растворитель удаляли. Затем остаток подвергали колоночной хроматографии на NH-силикагеле (Fuji Silica), элюируя гексаном/этилацетатом (10:1). Затем подвергали колоночной хроматографии на силикагеле и элюировали гексаном/этилацетатом (10:1) и затем гексаном/этилацетатом (1:1) с получением 6,6 г целевого соединения.
1H-ЯМР (CDCl3) δ: 0,87-0,91 (9Н, м), 1,13-1,18 (6Н, м), 1,31-1,36 (6Н, м), 1,50-1,58 (6Н, м), 7,53 (1Н, д, J=5 Гц), 9,02 (1Н, д, J=5 Гц), 9,17 (1Н, с).
Пример получения 28: (1,4-Диоксен-2-ил)три-н-бутилолово
5,8 мл пентанового раствора, содержащего 1,51 моль трет-бутиллития, медленно добавляли к 30 мл тетрагидрофуранового раствора, содержащего 1,0 г 1,4-диоксена, при -40°С. После перемешивания при -40°С в течение одного часа туда медленно, по каплям добавляли 1,7 мл три-н-бутилолова при -78°С. После перемешивания при -78°С в течение 3 часов к реакционному раствору добавляли воду и затем экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором соли и растворитель удаляли. Затем остаток фильтровали через силикагель и растворитель удаляли с получением 1,5 г целевого соединения.
1H-ЯМР (CDCl3) δ: 0,87-1,56 (27Н, м), 4,00-4,11 (4Н, м), 5,69 (1Н, с).
Пример получения 29: (3R)-3-Этинил-3-хинуклидинол
a) (3R)-3-Этинил-3-хинуклидинол · L-(+)-тартрат
15,1 г 3-этинил-3-хинуклидинола и 15 г L-(+)-винной кислоты растворяли при нагревании в 300 мл метанола. После остывания полученные кристаллы отфильтровывали и перекристаллизовывали из метанола три раза с получением 2,07 г соединения, названного в заголовке.
1H-ЯМР (DMSO-d6) δ м.д.: 1,45-1,54 (1Н, м), 1,68-1,78 (1Н, м), 1,83-2,03 (3Н, м), 2,83-3,01 (5Н, м), 3,21 (1Н, дд, J=2,14 Гц), 3,50 (1Н, с), 4,05 (2Н, с).
b) (3R)-3-Этинил-3-хинуклидинол
15,6 г (3R)-3-Этинил-3-хинуклидинол · L-(+)-тартрата растворяли в 150 мл воды и малыми порциями добавляли 20 г безводного карбоната калия при перемешивании. Полученные кристаллы отфильтровывали, промывали водой и затем сушили с получением 6,88 г соединения, названного в заголовке.
1H-ЯМР (DMSO-d6) δ м.д.: 1,20-1,30 (1Н, м), 1,47-1,55 (1Н, м), 1,70-1,90 (3,Н, м), 2,54-2,70 (4Н, м), 2,72 (1Н, дд, J=2,14 Гц), 2,93 (1Н, д, J=14 Гц), 3,29 (1Н, с), 5,47 (1Н, с).
[α]24 589=+58,3 (с=1,02, МеОН)
(литературные: [α]24 589=+54,5 (с=0,99, МеОН); Tetrahedron: Asymmetry, 6, (6), 1393, 1995).
Пример получения 30: (3S)-3-Этинил-3-хинуклидинол
Целевое соединение синтезировали из 3-этинил-3-хинуклидинола таким же образом, что и в примере получения 29, причем D-(-)-винную кислоту использовали в качестве агента оптического разделения.
1H-ЯМР (DMSO-d6) δ: 1,20-1,30 (1Н, м), 1,47-1,55 (1Н, м), 1,70-1,90 (3Н, м), 2,54-2,70 (4Н, м), 2,72 (1Н, дд, J=2,14 Гц), 2,93 (1Н, д, J=14 Гц), 3,29 (1Н, с), 5,47 (1Н, с).
[α]22,5 589=-56,9 (с=1,00, МеОН)
(литературные: [α]20 598=-56,1 (с=1,02, МеОН); Tetrahedron: Asymmetry, 6 (6), 1393, 1995).
ПРИМЕРЫ
Пример 1: 3-[4-Бензил-2-(3,4-метилендиоксифенил)-5-пиридил]этинил-3-хинуклидинол
a) 4-Бензил-5-бром-2-(3,4-метилендиоксифенил)пиридин
Смесь 400 мг 4-бензил-5-бром-2-пиридилтрифторметансульфоната, 410 мг (3,4-метилендиоксифенил)трибутилолова, 300 мг хлорида тетрабутиламмония, 20 мг тетракис(трифенилфосфин)-палладия (0) и 2 мл ксилола перемешивали при нагревании в течение 3 часов на масляной бане при температуре 140°С в атмосфере азота. Реакционный раствор подвергали колоночной хроматографии на силикагеле, используя 5-10% этилацетат/гексан, с получением 140 г целевого соединения.
1H-ЯМР (CDCl3) δ м.д.: 4,12 (2Н, с), 6,00 (2Н, с), 6,85 (1Н, д, J=8 Гц), 7,23 (2Н, д, J=8 Гц), 7,27 (1Н, т, J=7 Гц), 7,32-7,41 (5Н, м), 8,68 (1Н, с).
b) 3-[4-Бензил-2-(3,4-метилендиоксифенил)-5-пиридил]этинил-3-хинуклидинол
Смесь 140 мг 4-бензил-5-бром-2-(3,4-метилендиоксифенил)-пиридина, 70 мг 3-этинил-3-хинуклидинола, 10 мг тетракис-(трифенилфосфин)палладия (0), 1 мг йодида меди, 0,5 мл триэтиламина и 1 мл N,N-диметилформамида перемешивали при нагревании в течение 2 часов на масляной бане, при температуре 100°С в атмосфере азота. После остывания туда добавляли разбавленный водный раствор аммиака с последующим экстрагированием этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель выпаривали. Остаток подвергали колоночной хроматографии на NH-силикагеле, используя 50% этилацетат/гексан и затем этилацетат, с получением 40 мг целевого соединения.
1H-ЯМР (CDCl3) δ м.д.: 1,30-1,95 (3Н, м), 2,00-2,15 (2Н, м), 2,65-2,95 (4Н, м), 3,03 (1Н, д, J=14 Гц), 3,23 (1Н, д, J=14 Гц), 4,15 (2Н, с), 6,01 (2Н, с), 6,87 (1Н, д, J=8 Гц), 7,19 (2Н, д, J=8 Гц), 7,22-7,28 (1Н, м), 7,32 (2Н, т, J=7 Гц), 7,40 (1Н, с), 7,42-7,46 (2Н, м), 8,65 (1Н, с).
Пример 2: 3-[4-Бензил-2-(2-пиридил)-5-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали таким же образом, что и в примере 1.
1H-ЯМР (CDCl3) δ м.д.: 1,35-1,90 (3Н, м), 2,00-2,15 (2Н, м), 2,70-2,95 (4Н, м), 3,03 (1Н, д, J=14 Гц), 3,23 (1Н, дд, J=2, 14 Гц), 4,21 (2Н, с), 7,20-7,32 (6Н, м), 7,81 (1Н, дт, J=2, 8 Гц), 8,29 (1Н, с), 8,38 (1Н, д, J=8 Гц), 8,64-8,67 (1Н, м), 8,68 (1Н, с).
Пример 3: 3-[4-Бензил-2-(3-пиридил)-5-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали таким же образом, что и в примере 1.
1H-ЯМР (CDCl3) δ м.д.: 1,38-1,92 (3Н, м), 2,00-2,11 (2Н, м), 2,70-3,00 (4Н, м), 3,06 (1Н, д, J=14 Гц), 3,25 (1Н, дд, J=2, 14 Гц), 4,18 (2Н, с), 7,20 (2Н, д, J=7 Гц), 7,22-7,2 9 (1Н, м), 7,32 (2Н, т, J=7 Гц), 7,39 (1Н, дд, J=5, 7 Гц), 7,49 (1Н, с), 8,22-8,27 (1Н, м), 8,63 (1Н, дд, J=2, 5 Гц), 8,74 (1Н, с), 9,13 (1Н, дд, J=1,2 Гц).
Пример 4: 3-[4-Бензил-2-пиразил-5-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали таким же образом, что и в примере 1.
1H-ЯМР (CDCl3) δ м.д.: 1,37-1,90 (3Н, м), 2,00-2,11 (2Н, м), 2,70-2,96 (4Н, м), 3,05 (1Н, д, J=14 Гц), 3,24 (1Н, дд, J=2, 14 Гц), 4,20 (2Н, с), 7,18-7,33 (5Н, м), 8,20 (1Н, с), 8,56-8,60 (2Н, м), 8,73 (1Н, с), 9,61 (1Н, д, J=2 Гц)
Пример 5: 3-[4-Бензил-2-(4-пиридил)-5-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали таким же образом, что и в примере 1.
1H-ЯМР (CDCl3) δ м.д.: 1,41-1,43 (1Н, м), 1,61-1,67 (1Н, м), 1,84-1,87 (1Н, м), 2,04-2,06 (2Н, м), 2,77-2,85 (4Н, м), 3,05 (1Н, дд, J=2, 14 Гц), 3,25 (1Н, дд, J=2, 14 Гц), 4,20 (2Н, с), 7,19-7,35 (5Н, м), 7,55 (1Н, с), 7,80-7,82 (2Н, м), 8,69-8,70 (2Н, м), 8,74 (1Н, с).
Пример 6: 3-[4-Бензил-2-(2-метоксиэтокси)-5-пиридил]-этинил-3-хинуклидинол
a) 4-(α-Гидроксибензил)-2-(2-метоксиэтокси)пиридин
3 г натрия добавляли к 50 мл метоксиэтанола и смесь перемешивали при нагревании на масляной бане при температуре 100°С в атмосфере азота в течение 1 часа. После того как натрий растворялся, туда по каплям добавляли смесь 5,6 г 4-бензоил-2-хлорпиридина (пример получения 1-а) и 10 мл метоксиэтанола с последующим перемешиванием при нагревании на масляной бане при температуре 100°С в атмосфере азота в течение 3 часов. Реакционный раствор выпаривали и туда добавляли водный раствор гидрокарбоната натрия. Смесь экстрагировали этилацетатом и органический слой промывали насыщенным раствором соли и подвергали колоночной хроматографии на силикагеле, используя 10-50% этилацетат/гексан, с получением 5,9 г целевого соединения.
1H-ЯМР (CDCl3) δ м.д.: 2,55 (1Н, шир.с), 3,42 (3Н, с), 3,70-3,75 (2Н, м), 4,40-4,45 (2Н, м), 5/96 (1Н, шир.с), 7,18 (1Н, с), 7,24-7,40 (6Н, м), 8,12 (1Н, с).
b) 4-Бензил-5-бром-2-(2-метоксиэтокси)пиридин
7,32 г соединения, названного в заголовке, получали из 11,8 г 4-(α-гидроксибензил)-2-(2-метоксиэтокси)пиридина таким же образом, что и в примерах получения (1-d, e и f).
1H-ЯМР (CDCl3) δ м.д.: 3,40 (3Н, с), 3,66-3,70 (2Н, м), 3,98 (2Н, с), 4,37-4,42 (2Н, м), 6,50 (1Н, с), 7,15-7,35 (5Н, м), 8,18 (1Н, с).
с) 3-[4-Бензил-2-(2-метоксиэтокси)-5-пиридил]этинил-3-хинуклидинол
310 г соединения, названного в заголовке, получали из 1,38 г 4-бензил-5-бром-2-(2-метоксиэтокси)пиридина таким же образом, что и в примере 12.
1H-ЯМР (CDCl3) δ м.д.: 1,35-1,90 (3Н, м), 1,98-2,08 (2Н, м), 2,70-2,96 (4Н, м), 3,02 (1Н, д, J=14 Гц), 3,24 (1Н, дд, J=2, 14 Гц), 3,42 (3Н, с), 3,69-3,73 (2Н, м), 4,04 (2Н, с), 4,42-4,46 (2Н, м), 6,55 (1Н, с), 7,16 (2Н, д, J=7 Гц), 7,23 (1Н, т, J=7 Гц), 7,30 (2Н, т, J=7 Гц), 8,18 (1Н, с).
Пример 7: 3-[2-Бензил-6-(4-этоксикарбонилпиперидино)-3-пиридил]этинил-3-хинуклидинол
а) 2-Бензил-6-(4-этоксикарбонилпиперидино)пиридин
Смесь 5 г 2-бензил-6-пиридилтрифторметансульфоната, 3,6 мл этилизонипекотината, 3,3 г карбоната калия и 15 мл N-метилпирролидона нагревали при перемешивании на масляной бане при 100°С в атмосфере азота. После остывания смесь экстрагировали смесью этилацетат/вода. Органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и выпаривали. Остаток подвергали колоночной хроматографии на силикагеле и элюировали 1-5% этилацетатом/гексаном с получением 4,7 г целевого соединения.
1H-ЯМР (CDCl3) δ м.д.: 1,26 (3Н, т, J=7 Гц), 1,70-1,82 (2Н, м), 1,94-2,01 (2Н, м), 2,51 (1Н, тт, J=4, 11 Гц), 2,88-2,97 (2Н, м), 3,97 (2Н, с), 4,15 (2Н, кв, J=7 Гц), 4,22-4,29 (2Н, м), 6,38 (1Н, д, J=7 Гц), 6,46 (1Н, д, J=9 Гц), 7,16-7,22 (1Н, м), 7,26-7,31 (4Н, м), 7,34 (1Н, дд, J=7, 9 Гц),
b) 2-бензил-3-йод-6-(4-этоксикарбонилпиперидино)пиридин
После перемешивания на ледяной бане к смеси 1,2 г 2-бензил-6-(4-этоксикарбонилпиперидино)пиридина и 10 мл N,N-диметилформамида малыми порциями добавляли 1,25 г N-йодсукцинимида с последующим перемешиванием в течение ночи. Добавляли сульфит натрия и смесь экстрагировали смесью этилацетат-вода. Органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и выпаривали. Остаток подвергали колоночной хроматографии на силикагеле и элюировали 1-5% этилацетатом/гексаном с получением 1,42 г целевого соединения.
1H-ЯМР (CDCl3) δ м.д: 1,26 (3Н, т, J=7 Гц), 1,64-1,76 (2Н, м), 1,90-1,98 (2Н, м), 2,50 (1Н, тт, J=11 Гц, 4 Гц), 2,87-2,96 (2Н, м), 4,10-4,20 (6Н, м), 6,27 (1Н, д, J=9 Гц), 7,18 (1Н, т, J=7 Гц), 7,26 (2Н, т, J=7 Гц), 7,32 (2Н, д, J=7 Гц), 7,70 (1Н, д, J=9 Гц).
c) 3-[2-Бензил-6-(4-этоксикарбонилпиперидино)-3-пиридил]-этинил-3-хинуклидинол
Смесь 1,42 г 2-бензил-3-йод-6-(4-этоксикарбонилпиперидино)пиридина, 520 мг 3-этинил-3-хинуклидинола, 110 мг тетракис(трифенилфосфин)палладия (0), 3 мг йодида меди, 1,3 мл триэтиламина и 6 мл N,N-диметилформамида нагревали при перемешивании на масляной бане при температуре 80°С в течение 3 часов в атмосфере азота. После охлаждения смесь экстрагировали смесью этилацетат-разбавленный водный раствор аммиака. Органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и выпаривали. Остаток подвергали колоночной хроматографии на NH-силикагеле и элюировали 20-100% этилацетатом/гексаном и затем 2,5% метанолом/этилацетатом с получением 700 мг целевого соединения.
1H-ЯМР (CDCl3) δ м.д.: 1,26 (3Н, т, J=7 Гц), 1,34-1,45 (1Н, м), 1,53-1,78 (3Н, м), 1,83-2,08 (5Н, м), 2,53 (1Н, тт, J=4, 11 Гц), 2,69-3,04 (7Н, м), 3,23 (1Н, дд, J=2, 14 Гц), 4,10-4,18 (4Н, м), 4,22-4,30 (2Н, м), 6,43 (1Н, д, J=9 Гц), 7,16 (1Н, т, J=7 Гц), 7,25 (2Н, т, J=7 Гц), 7,30 (2Н, д, J=7 Гц), 7,43 (1Н, д, J=9 Гц).
Пример 8: 3-(2-Бензил-6-морфолино-3-пиридил)этинил-3-хинуклидинол
Целевое соединение синтезировали таким же образом, что и в примере 7.
1H-ЯМР (CDCl3) δ м.д.: 1,35-1,45 (1Н, м), 1,54-1,64 (1Н, м), 1,83-1,93 (1Н, м), 1,98-2,08 (2Н, м), 2,68-2,94 (4Н, м), 3,02 (1Н, д, J=14 Гц), 3,24 (1Н, дд, J=2, 14 Гц), 3,52 (4Н, т, J=5 Гц), 3,79 (4Н, т, J=5 Гц), 4,16 (2Н, с), 6,40 (1Н, д, J=8 Гц), 7,14-7,31 (5Н, м), 7,47 (1Н, д, J=8 Гц).
Пример 9: 3-[2-Бензил-6-(4-метоксипиперидино)-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали таким же образом, что и в примере 7.
1H-ЯМР (CDCl3) δ м.д.: 1,35-1,45 (1Н, м), 1,52-1,65 (3Н, м), 1,83-1,96 (3Н, м), 1,98-2,08 (2Н, м), 2,70-2,93 (4Н, м), 3,02 (1Н, д, J=14 Гц), 3,19-3,27 (3Н, м), 3,38 (3Н, с), 3,39-3,46 (1Н, м), 3,96-4,04 (2Н, м), 4,15 (2Н, с), 6,44 (1Н, д, J=9 Гц), 7,16 (1Н, т, J=7 Гц), 7,25 (2Н, т, J=7 Гц), 7,30 (2Н, д, J=7 Гц), 7,42 (1Н, д, J=9 Гц).
Пример 10: (3R)-3-[2-Бензил-6-[(3R,4R)-3-гидрокси-4-метоксипирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинол
а) 2-Бензил-6-[(3R,4R)-3,4-дигидроксипирролидин-1-ил]пиридин
11 мл 1,8-диазабицикло[5,4,0]-7-ундецена добавляли по каплям в смесь 11,3 г 2-бензил-6-пиридилтрифторметансульфоната, 11,3 г (3R,4R)-3,4-дигидроксипирролидинацетата (синтезированного из D-винной кислоты, как исходного вещества, Angew. Chem. Int. Ed. Engl., 23 (6), 435, 1984) и 10 мл N-метилпирролидона на масляной бане при температуре 100°С в атмосфере азота с последующим перемешиванием в течение 6 часов. После остывания смесь экстрагировали этилацетатом-водой. Органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и выпаривали. Остаток подвергали колоночной хроматографии на силикагеле и элюировали этилацетатом с получением 5,35 г целевого соединения.
1H-ЯМР (CDCl3) δ м.д.: 3,47 (2Н, дд, J=2, 11 Гц), 3,79 (2Н, дд, J=4, 11 Гц), 3,97 (2Н, с), 4,26-4,30 (2Н, м), 6,17 (1Н, д, J=8 Гц), 6,38 (1Н, д, J=8 Гц), 7,19 (1Н, т, J=7 Гц), 7,26-7,36 (5Н, м).
b) 2-Бензил-6-[(3R,4R)-3-гидрокси-4-метоксипирролидин-1-ил]пиридин
800 мг масляной суспензии (60%) гидрида натрия добавляли малыми порциями к смеси 5,35 г 2-бензил-6-[(3R,4R)-3,4-дигидроксипирролидин-1-ил]пиридина и 40 мл тетрагидрофурана при перемешивании с последующим перемешиванием в течение одного часа. Затем туда добавляли 1,24 мл метилйодида с последующим перемешиванием в течение ночи. Смесь экстрагировали этилацетатом-водой и органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и выпарвали. Остаток подвергали колоночной хроматографии на силикагеле и элюировали 30% этилацетатом/гексаном с получением 2,18 г целевого соединения.
1H-ЯМР (CDCl3) δ м.д.: 3,42 (3Н, с), 3,47-3,55 (2Н, м), 3,69-3,78 (2Н, м), 3,85-3,89 (1Н, м), 3,97 (2Н, с), 4,38-4,42 (1Н, м), 6,17 (1Н, д, J=8 Гц), 6,35 (1Н, д, J=7 Гц), 7,19 (1Н, т, J=7 Гц), 7,26-7,35 (5Н, м).
c) 2-Бензил-3-йод-6-[(3R,4R)-3-гидрокси-4-метоксипирролидин-1-ил]пиридин
При перемешивании на ледяной бане к смеси 3,11 г 2-бензил-6-[(3R,4R)-3-гидрокси-4-метоксипирролидин-1-ил]пиридина и 10 мл N,N-диметилформамида малыми порциями добавляли 2,5 г N-йодсукцинимида с последующим перемешиванием в течение ночи. Туда же добавляли сульфит натрия и смесь экстрагировали этилацетатом-водой. Органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и выпаривали. Остаток подвергали колоночной хроматографии на силикагеле и элюировали 30% этилацетатом/гексаном с получением 4,19 г целевого соединения.
1H-ЯМР (CDCl3) δ м.д.: 3,41 (3Н, с), 3,42-3,51 (2Н, м), 3,64-3,71 (2Н, м), 3,84-3,87 (1Н, м), 4,19 (2Н, с), 4,38-4,42 (1Н, м), 5,98 (1Н, д, J=8 Гц), 7,18 (1Н, т, J=7 Гц), 7,26 (2Н, т, J=7 Гц), 7,37 (2Н, д, J=7 Гц), 7,69 (1Н, д, J=8 Гц).
d) (3R)-3-[2-Бензил-6-[(3R,4R)-3-гидрокси-4-метоксипирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинол
Смесь 4,19 г 2-бензил-3-йод-6-[(3R,4R)-3-гидрокси-4-метоксипирролидин-1-ил]пиридина, 1,7 г (3R)-3-этинил-3-хинуклидинола, 500 мг тетракис(трифенилфосфин)палладия (0), 10 мг йодида меди, 4,2 мл триэтиламина и 13 мл N,N-диметилформамида нагревали при перемешивании на масляной бане при температуре 70°С в течение 3 часов в атмосфере азота. После остывания смесь экстрагировали смесью этилацетат-разбавленный водный раствор аммиака. Органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и выпаривали. Остаток подвергали колоночной хроматографии на NH-силикагеле и элюировали 20-100% этилацетатом/гексаном, а затем 5% метанолом/этилацетатом с получением 1,54 г целевого соединения.
1H-ЯМР (CDCl3) δ м.д.: 1,34-1,44 (1Н, м), 1,50-1,60 (1Н, м), 1,80-1,90 (1Н, м), 1,97-2,08 (2Н, м), 2,60-2,90 (4Н, м), 2,97 (1Н, д, J=14 Гц), 3,19 (1Н, дд, J=2,14 Гц), 3,40 (3Н, с), 3,41-3,54 (2Н, м), 3,62-3,73 (2Н, м), 3,82-3,85 (1Н, м), 4,13 (2Н, с), 4,34-4,37 (1Н, м), 6,09 (1Н, д, J=9 Гц), 7,14 (1Н, т, J=7 Гц), 7,23 (2Н, т, J=7 Гц), 7,29 (2Н, д, J=7 Гц), 7,39 (1Н, д, J=9 Гц).
Пример 11: 3-[2-Бензил-6-(3-метоксипропиламино)-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали таким же образом, что и в примере 7.
1H-ЯМР (CDCl3) δ м.д.: 1,34-1,44 (1Н, м), 1,52-1,66 (1Н, м), 1,81-1,91 (3Н, м), 1,97-2,07 (2Н, м), 2,67-2,93 (4Н, м), 3,01 (1Н, дд, J=2, 14 Гц), 3,21 (1Н, дд, J=2, 14 Гц), 3,34 (3Н, с), 3,36 (2Н, кв, J=6 Гц), 3,48 (2Н, т, J=6 Гц), 4,93 (1Н, т, J=6 Гц), 6,20 (1Н, д, J=8 Гц), 7,16 (1Н, т, J=7 Гц), 7,22-7,31 (4Н, м), 7,42 (1Н, д, J=8 Гц).
Пример 12: 3-[2-Бензил-6-(2-метоксиэтилокси)-3-пиридил]этинил-3-хинуклидинол
а) 2-Бензил-3-бром-6-(2-метоксиэтилокси)пиридин
Смесь 5 г 2-бензил-3-бром-6-гидроксипиридина, 3,9 г безводного карбоната калия, 2,7 мл 2-бромэтилметилового эфира и 20 мл N,N-диметилформамида нагревали при перемешивании на масляной бане при температуре 80°С в течение одного часа. После остывания смесь экстрагировали смесью этилацетат-вода. Органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и выпаривали. Остаток подвергали колоночной хроматографии на силикагеле и элюировали 1-3% этилацетатом/гексаном с получением 4,2 г целевого соединения.
1H-ЯМР (CDCl3) δ м.д.: 3,41 (3Н, с), 3,68 (2Н, т, J=5 Гц), 4,19 (2Н, с), 4,41 (2Н, т, J=5 Гц), 6,54 (1Н, д, J=9 Гц), 7,20 (1Н, т, J=7 Гц), 7,27 (2Н, т, J=7 Гц), 7,32 (2Н, д, J=7 Гц), 7,63 (1Н, д, J=9 Гц).
b) 3-[2-Бензил-6-(2-метоксиэтилокси)пиридил)этенил-3-хинуклидинол
Смесь 720 мг 2-бензил-3-бром-6-(2-метоксиэтилокси)-пиридина, 340 мг 3-этинил-3-хинуклидинола, 130 мг тетракис(трифенилфосфин)палладия (0), 42 мг йодида меди, 0,93 мл триэтиламина и 3 мл N,N-диметилформамида нагревали при перемешивании на масляной бане при температуре 80°С в течение 2 часов в атмосфере азота. После остывания смесь экстрагировали этилацетатом-разбавленным водным раствором аммиака. Органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и выпаривали. Остаток подвергали колоночной хроматографии на NH-силикагеле и элюировали 20-100% этилацетатом/гексаном и затем 2,5% метанолом/этилацетатом с получением 500 мг целевого соединения.
1H-ЯМР (CDCl3) δ м.д.: 1,35-1,45 (1Н, м), 1,55-1,65 (1Н, м), 1,83-1,93 (1Н, м), 1,98-2,08 (2Н, м), 2,7-2,93 (4Н, м), 3,02 (1Н, д, J=14 Гц), 3,23 (1Н, дд, J=2, 14 Гц), 3,41 (3Н, с), 3,69 (2Н, т, J=5 Гц), 4,19 (2Н, с), 4,45 (2Н, т, J=5 Гц), 6,59 (1Н, д, J=8 Гц), 7,14-7,3 (5Н, м), 7,53 (1Н, д, J=8 Гц).
Пример 13: 3-[2-Бензил-6-(3-метоксипропилокси)-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали таким же образом, что и в примере 12.
1H-ЯМР (CDCl3) δ м.д.: 1,38-1,48 (1Н, м), 1,58-1,69 (1Н, м), 1,82-1,93 (1Н, м), 2,00 (2Н, квинтет, J=6,4 Гц), 2,72-2,94 (6Н, м), 3,03 (1Н, дд, J=1,2, 14 Гц), 3,24 (1Н, дд, J=2,0, 14 Гц), 3,34 (3Н, с), 3,51 (2Н, т, J=6,4 Гц), 4,20 (2Н, с), 4,37 (2Н, т, J=6,4 Гц), 6,53 (1Н, д, J=8,4 Гц), 7,18-7,31 (5Н, м), 7,54 (1Н, д, J=8,4 Гц).
Пример 14: 3-[2-Бензил-6-(4-пиридил)-3-пиридил]этинил-3-хинуклидинол
а) 2-Бензил-3-бром-6-(4-пиридил)пиридин
Смесь 298 мг 2-бензил-3-бром-6-пиридилтрифторметансульфоната, 277 мг (4-пиридил)трибутилолова, 87 мг тетракис-(трифенилфосфин)палладия (0), 209 мг хлорида тетрабутиламмония и 5,0 мл ксилола нагревали при перемешивании на масляной бане при температуре 140°С в течение одного часа в атмосфере азота. После остывания растворитель удаляли, остаток подвергали колоночной хроматографии на NH-силикагеле и элюировали гексаном/этилацетатом (5:1) с получением 196 мг целевого соединения.
1H-ЯМР (CDCl3) δ м.д.: 4,42 (2Н, с), 7,23-7,39 (5Н, м), 7,54 (1Н, д, J=8 Гц), 7,88-7,90 (2Н, м), 7,93 (1Н, д, J=8 Гц), 8,71-8,72 (2Н, м).
b) 3-[2-Бензил-6-(4-пиридил)-3-пиридил]этинил-3-хинуклидинол
Смесь 196 мг 2-бензил-3-бром-6-(4-пиридил)пиридина, 100 мг 3-этинил-3-хинуклидинола, 70 мг тетракис(трифенилфосфин)-палладия (0), 11 мг йодида меди, 0,25 мл триэтиламина и 3,0 мл N,N-диметилформамида нагревали при перемешивании на масляной бане при температуре 85°С в течение одного часа в атмосфере азота. После остывания смесь экстрагировали этилацетатом-разбавленным водным раствором аммиака. Органическую фазу промывали насыщенным раствором соли и растворитель удаляли. Остаток подвергали колоночной хроматографии на NH-силикагеле и элюировали гексаном/этилацетатом (1:1) и затем метанолом/этилацетатом (20:1). После удаления растворителя остаток перекристаллизовывали из гексана/этилацетата с получением 178 мг целевого соединения.
1H-ЯМР (CDCl3) δ м.д.: 1,39-1,45 (1Н, м), 1,62-1,67 (1Н, м), 1,83-1,88 (1Н, м), 2,02-2,75 (2Н, м), 2,78-2,89 (4Н, м), 3,03 (1Н, д, J=14 Гц), 3,25 (1Н, дд, J=2, 14 Гц), 4,41 (2Н, с), 7,19-7,33 (5Н, м), 7,63 (1Н, д, J=8 Гц), 7,78 (1Н, д, J=8 Гц), 7,90-7,92 (2Н, м), 8,70-8,72 (2Н, м).
Пример 15: 3-[2-Бензил-6-(3-пиридил)-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали таким же образом, что и в примере 14.
1H-ЯМР (CDCl3) δ м.д.: 1,43-1,47 (1Н, м), 1,57-1,62 (1Н, м), 1,80-1,94 (1Н, м), 2,05-2,07 (2Н, м), 2,77-2,90 (4Н, м), 3,05 (1Н, д, J=14 Гц), 3,25 (1Н, д, J=14 Гц), 4,40 (2Н, с), 7,18-7,34 (5Н, м), 7,39-7,42 (1Н, м), 7,56 (1Н, д, J=8 Гц), 7,75 (1Н, д, J=8 Гц), 8,34-8,37 (1Н, м), 8,63 (1Н, дд, J=2, 5 Гц), 9,21 (1Н, д, J=2 Гц).
Пример 16: 3-[2-Бензил-6-пиразил-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали таким же образом, что и в примере 14.
1H-ЯМР (DMSO-d6) δ м.д.: 1,27-1,36 (1Н, м), 1,52-1,60 (1Н, м), 1,72-1,82 (1Н, м), 1,87-1,96 (1Н, м), 1,99-2,03 (1Н, м), 2,56-2,72 (4Н, м), 2,87 (1Н, д, J=14 Гц), 3,07 (1Н, д, J=14 Гц), 4,39 (2Н, с), 5,80 (1Н, с), 7,18-7,41 (5Н, м), 7,99 (1Н, д, J=8 Гц), 8,20 (1Н, д, J=8 Гц), 8,72 (1Н, д, J=3 Гц), 8,75 (1Н, м), 9,51 (1Н, с).
Пример 17: 3-[2-Бензил-6-(2-пиридил)-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали таким же образом, что и в примере 14.
1H-ЯМР (CDCl3) δ м.д.: 1,40-1,93 (3Н, м), 2,00-2,11 (2Н, м), 2,70-2,95 (4Н, м), 3,02 (1Н, д, J=14 Гц), 3,22 (1Н, дд, J=2, 14 Гц), 4,42 (2Н, с), 7,18-7,34 (6Н, м), 7,81 (1Н, д, J=8 Гц), 7,81 (1Н, дт, J=2, 8 Гц), 8,27 (1Н, д, J=8 Гц), 8,46 (1Н, д, J=8 Гц), 8,65-8,68 (1Н, м).
Пример 18: 3-[4-Бензил-2-(3-пиридил)-5-пиримидил]этинил-3-хинуклидинол
a) 4-Бензил-5-бром-2-(3-пиридил)пиримидин
Смесь 440 мг 4-бензил-5-бром-2-йодпиримидина, 430 мг (3-пиридил)трибутилолова, 68 мг тетракис(трифенилфосфин)-палладия (0) и 5 мл ксилола кипятили с обратным холодильником с течение одного часа в атмосфере азота. После остывания к реакционному раствору добавляли силикагель и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле и элюировали 30% этилацетатом/гексаном с получением 110 мг целевого соединения.
1H-ЯМР (CDCl3) δ м.д.: 4,33 (2Н, с), 7,21-7,42 (6Н, м), 8,66 (1Н, тд, J=2, 8 Гц), 8,71 (1Н, дд, J=2, 5 Гц), 8,80 (1Н, с), 9,62 (1Н, д, J=2 Гц).
b) 3-[4-Бензил-2-(3-пиридил)-5-пиримидил]этинил-3-хинуклидинол
Смесь 110 мг 4-бензил-5-бром-2-(3-пиридил)пиримидина, 59 мг 3-этинил-3-хинуклидинола, 19 мг тетракис-(трифенилфосфин)палладия (0), 10 мг йодида меди, 0,14 мл триэтиламина и 1,5 мл N,N-диметилформамида нагревали при перемешивании на масляной бане при температуре 100°С в течение 2 часов в атмосфере азота. После остывания к реакционному раствору добавляли NH-силикагель и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле, используя 2,5% метанол/этилацетат, с получением 62 мг целевого соединения.
1H-ЯМР (CDCl3) δ м.д.: 1,42-1,92 (3Н, м), 2,05-2,12 (2Н, м), 2,76-2,99 (4Н, м), 3,10 (1Н, д, J=14 Гц), 3,28 (1Н, дд, J=2, 14 Гц), 4,32 (2Н, с), 7,21-7,35 (5Н, м), 7,40-7,43 (1Н, м), 8,68-8,70 (2Н, м), 8,74 (1Н, с), 9,65-9,66 (1Н, м).
Пример 19: 3-[4-Бензил-2-(3,4-метилендиоксифенил)-5-пиримидил]этинил-3-хинуклидинол
Целевое соединение синтезировали таким же образом, что и в примере 18.
1H-ЯМР (CDCl3) δ м.д.: 1,40-1,70 (2Н, м), 1,84-1,92 (1Н, м), 2,04-2,12 (2Н, м), 2,74-2,91 (4Н, м), 3,05 (1Н, д, J=14 Гц), 3,25 (1Н, дд, J=2, 14 Гц), 4,29 (2Н, с), 6,04 (2Н, с), 6,91 (1Н, д, J=8 Гц), 7,21-7,34 (5Н, м), 7,94 (1Н, д, J=2 Гц), 8,08 (1Н, дд, J=2,8 Гц), 8,66 (1Н, с).
Пример 20: 3-[4-Бензил-2-фенил-5-пиримидил)этинил-3-хинуклидинол
Целевое соединение синтезировали таким же образом, что и в примере 18.
1H-ЯМР (CDCl3) δ м.д.: 1,43-1,70 (2Н, м), 1,84-1,92 (1Н, м), 2,02-2,11 (2Н, м), 2,75-2,92 (4Н, м), 3,06 (1Н, д, J=14 Гц), 3,26 (1Н, дд, J=2, 14 Гц), 4,33 (2Н, с), 7,21-7,36 (5Н, м), 7,48-7,50 (3Н, м), 8,45-8,48 (2Н, м), 8,73 (1Н, с).
Пример 21: 3-[4-Бензил-2-(2-пиридил)-5-пиримидил]этинил-3-хинуклидинол
Целевое соединение синтезировали таким же образом, что и в примере 18.
1H-ЯМР (CDCl3) δ м.д.: 1,40-1,48 (1Н, м), 1,61-1,88 (2Н, м), 2,00-2,08 (2Н, м), 2,76-2,95 (4Н, м), 3,06 (1Н, д, J=14 Гц), 3,25 (1Н, дд, J=2, 14 Гц), 4,40 (2Н, с), 7,21-7,33 (5Н, м), 7,39-7,42 (1Н, м), 7,86 (1Н, тд, J=2, 8 Гц), 8,54 (1Н, д, J=8 Гц), 8,85-8,87 (2Н, м).
Пример 22: 3-[3-Бензил-5-(2-пиридил)-2-пиридил]этинил-3-хинуклидинол
a) 3-[3-Бензил-5-бром-2-пиридил]этинил-3-хинуклидинол
Смесь 2,2 г 3-бензил-5-бром-2-пиридилтрифторметансульфоната, 840 мг 3-этинил-3-хинуклидинола, 920 мг тетракис-(трифенилфосфин)палладия (0), 170 мг йодида меди, 2,3 мл триэтиламина и 25 мл N,N-диметилформамида перемешивали при комнатной температуре в течение одного часа в атмосфере азота. К реакционному раствору добавляли NH-силикагель и растворитель удаляли. Остаток подвергали колоночной хроматографии на NH-силикагеле, используя 3,5% метанол/этилацетат, с получением 940 мг целевого соединения.
1H-ЯМР (CDCl3) δ м.д.: 1,35-1,44 (1Н, м), 1,56-1,65 (1Н, м), 1,80-1,90 (1Н, м), 1,98-2,09 (2Н, м), 2,70-2,92 (4Н, м), 3,04 (1Н, д, J=14 Гц), 3,25 (1Н, дд, J=2, 14 Гц), 4,11 (2Н, с), 7,14-7,17 (2Н, м), 7,23-7,34 (3Н, м), 7,57 (1Н, д, J=2 Гц), 8,50 (1Н, д, J=2 Гц).
b) 3-[3-Бензил-5-(2-пиридил)-2-пиридил]этинил-3-хинуклидинол
Смесь 150 мг 3-[3-бензил-5-бром-2-пиридил]этинил-3-хинуклидинол, 150 мг (2-пиридил)трибутилолова, 86 мг тетракис(трифенилфосфин)палладия (0) и 3,5 мл толуола нагревали при перемешивании на масляной бане при температуре 110°С в течение 2 часов в атмосфере азота. После остывания к реакционному раствору добавляли NH-силикагель и растворитель удаляли. Остаток подвергали колоночной хроматографии на NH-силикагеле, используя 2,5% метанол/этилацетат, с получением 100 мг целевого соединения.
1H-ЯМР (CDCl3) δ м.д.: 1,35-1,43 (1Н, м), 1,54-1,63 (1Н, м), 1,83-1,92 (1Н, м), 1,99-2,10 (2Н, м), 2,71-2,94 (4Н, м), 3,07 (1Н, д, J=14 Гц), 3,26 (1Н, дд, J=2, 14 Гц), 4,21 (2Н, с), 7,19-7,30 (6Н, м), 7,70 (1Н, д, J=8 Гц), 7,76 (1Н, тд, J=2, 8 Гц), 8,16 (1Н, д, J=2 Гц), 8,68-8,70 (1Н, м), 9,02 (1Н, д, J=2 Гц).
Пример 23: 3-(3-Бензил-5-фенил-2-пиридил)этинил-3-хинуклидинол
Целевое соединение синтезировали таким же образом, что и в примере 22.
1H-ЯМР (CDCl3) δ м.д.: 1,36-1,44 (1Н, м), 1,56-1,64 (1Н, м), 1,86-1,95 (1Н, м), 1,98-2,11 (2Н, м), 2,71-2,95 (4Н, м), 3,08 (1Н, д, J=14 Гц), 3,28 (1Н, дд, J=2, 14 Гц), 4,21 (2Н, с), 7,19-7,53 (10Н, м), 7,64 (1Н, д, J=2 Гц), 8,69 (1Н, д, J=2 Гц).
Пример 24: 3-[3-Бензил-5-(3-пиридил)-2-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали таким же образом, что и в примере 22.
1H-ЯМР (CDCl3) δ м.д.: 1,37-1,45 (1Н, м), 1,56-1,64 (1Н, м), 1,84-1,92 (1Н, м), 2,04-2,12 (2Н, м), 2,73-2,94 (4Н, м), 3,09 (1Н, д, J=14 Гц), 3,28 (1Н, дд, J=2, 14 Гц), 4,21 (2Н, с), 7,18-7,31 (5Н, м), 7,38 (1Н, ддд, J=l, 5, 8 Гц), 7,61 (1Н, д, J=2 Гц), 7,82 (1Н, тд, J=2, 8 Гц), 8,62 (1Н, дд, J=2, 5 Гц), 8,64 (1Н, д, J=2 Гц), 8,87 (1Н, дд, J=1,2 Гц).
Пример 25: 3-[3-Бензил-5-(4-пиридил)-2-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали таким же образом, что и в примере 22.
1H-ЯМР (CDCl3) δ м.д.: 1,37-1,45 (1Н, м), 1,57-1,65 (1Н, м), 1,85-1,92 (1Н, м), 2,00-2,11 (2Н, м), 2,73-2,93 (4Н, м), 3,08 (1Н, д, J=14 Гц), 3,28 (1Н, дд, J=2, 14 Гц), 4,22 (2Н, с), 7,18-7,34 (5Н, м), 7,42-7,44 (2Н, м), 7,67 (1Н, д, J=2 Гц), 8,67-8,69 (2Н, м), 8,70 (1Н, д, J=2 Гц).
Пример 26: 3-(3-Бензил-5-пиразил-2-пиридил)этинил-3-хинуклидинол
Целевое соединение синтезировали таким же образом, что и в примере 22.
1H-ЯМР (CDCl3) δ м.д.: 1,36-1,44 (1Н, м), 1,56-1,64 (1Н, м), 1,85-1,93 (1Н, м), 2,01-2,11 (2Н, м), 2,73-2,95 (4Н, м), 3,08 (1Н, д, J=14 Гц), 3,27 (1Н, дд, J=2, 14 Гц), 4,23 (2Н, с), 7,19-7,32 (5Н, м), 8,13 (1Н, д, J=2 Гц), 8,54 (1Н, д, J=2 Гц), 8,64 (1Н, дд, J=1,2 Гц), 9,04 (1Н, д, J=1 Гц), 9,08 (1Н, д, J=2 Гц).
Пример 27: 3-[3-Бензил-5-(2-этоксикарбонилэтил)-2-пиридил]этинил-3-хинуклидинол
а) 3-Бензил-5-формил-2-метоксипиридин
4,6 мл гексанового раствора 1,6 М бутиллития по каплям добавляли в смесь 1,0 г 3-бензил-5-бром-2-метоксипиридина (пример получения 5b) и 10 мл диэтилового эфира при -78°С. После перемешивания при той же температуре в течение одного часа добавляли 0,56 мл N,N-диметилформамида с последующим постепенным нагреванием до комнатной температуры. Реакционную смесь разделяли, добавляя воду и этилацетат. Органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли.
1H-ЯМР (CDCl3) δ м.д.: 3,94 (2Н, с), 4,03 (3Н, с), 4,00 (3Н, с), 7,19-7,33 (5Н, м), 7,77-7,78 (1Н, м), 8,49 (1Н, д, J=4 Гц), 9,90 (1Н, с).
b) 3-Бензил-5-(2-этоксикарбонилэтенил)-2-метоксипиридин
К 3-бензил-5-формил-2-метоксипиридину добавляли 0,92 мл триэтилфосфоноацетата, 11 мл метанола и 2,9 мл 21% этанольного раствора этоксида натрия с последующим перемешиванием при комнатной температуре в течение одного часа. Смесь разделяли, добавляя воду и этилацетат, и органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле и элюировали 5% этилацетатом/гексаном с получением 950 мг целевого соединения.
1H-ЯМР (CDCl3) δ м.д.: 1,32 (3Н, т, J=7 Гц), 3,92 (2Н, с), 4,00 (3Н, с), 4,23 (2Н, кв, J=7 Гц), 6,23 (1Н, д, J=16 Гц), 7,19-7,34 (5Н, м), 7,45 (1Н, д, J=2 Гц), 7,57 (1Н, д, J=16 Гц), 8,14 (1Н, д, J=2 Гц).
c) 3-Бензил-5-(2-этоксикарбонилэтил)-2-метоксипиридин
Смесь 950 мг З-бензил-5-(2-этоксикарбонилэтенил)-2-метоксипиридина, 90 мг 10% палладия на угле и 10 мл этанола перемешивали при комнатной температуре в течение одного часа в атмосфере водорода. После того как атмосферу в системе заменяли на азот, смесь фильтровали через целит. Растворитель удаляли с получением 950 мг целевого соединения.
1H-ЯМР (CDCl3) δ м.д.: 1,21 (3Н, т, J=7 Гц), 2,52 (2Н, т, J=7 ГЦ), 2,80 (2Н, т, J=7 Гц), 3,88 (2Н, с), 3,93 (3Н, с), 4,09 (2Н, кв, J=7 Гц), 7,12 (1Н, с), 7,18-7,30 (5Н, м), 7,86 (1Н, с).
d) 3-Бензил-5-(2-этоксикарбонилэтил)-2-гидроксипиридин
Смесь 240 мг 3-бензил-5-(2-этоксикарбонилэтил)-2-метоксипиридина, 2,5 мл 1,2-дихлорметана и раствора 1,0 М трибромида бора в 0,39 мл дихлорметана перемешивали при 50°С в течение 8 часов. К реакционному раствору добавляли воду и силикагель и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле, используя 75% этилацетат/гексан, с получением 86 мг целевого соединения.
1H-ЯМР (CDCl3) δ м.д.: 1,21 (3Н, т, J=7 Гц), 2,45 (2Н, т, J=7 Гц), 2,66 (2Н, шир.с), 3,89 (2Н, шир.с), 4,08 (2Н, кв, J=7 Гц), 6,99-7,34 (7Н, м).
e) 3-Бензил-5-(2-этоксикарбонилэтил)-2-пиридилтрифторметансульфонат
Смесь 86 мг 3-бензил-5-(2-этоксикарбонилэтил)-2-гидроксипиридина, 130 мг N-фенилтрифторметансульфонимида, 0,13 мл триэтиламина, 3,7 мг 4-диметиламинопиридина и 1,5 мл дихлорметана перемешивали при комнатной температуре в течение одного часа. К реакционному раствору добавляли силикагель и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле, используя 15% этилацетат/гексан, с получением 130 мг целевого соединения.
1H-ЯМР (CDCl3) δ м.д.: 1,21 (3Н, т, J=7 Гц), 2,58 (2Н, т, J=7 Гц), 2,92 (2Н, т, J=7 Гц), 4,00 (2Н, с), 4,09 (2Н, кв, J=7 Гц), 7,15-7,19 (2Н, м), 7,24-7,36 (3Н, м), 7,42 (1Н, д, J=2 Гц), 8,06 (1Н, д, J=2 Гц).
f) 3-[3-Бензил-5-(2-этоксикарбонилэтил)-2-пиридил]этинил-3-хинуклидинол
Смесь 180 мг 3-бензил-5-(2-этоксикарбонилэтил)-2-пиридилтрифторметансульфоната, 66 мг З-этинил-3-хинуклидинола, 100 мг тетракис(трифенилфосфин)палладия (0), 17 мг йодида меди, 0,18 мл триэтиламина и 2 мл N,N-диметилформамида нагревали при перемешивании при 70°С на масляной бане в течение одного часа в атмосфере азота. После остывания туда добавляли NH-силикагель и растворитель удаляли. Остаток подвергали колоночной хроматографии на NH-силикагеле, используя 2,5% метанол/этилацетат, с получением 120 мг целевого соединения.
1H-ЯМР (CDCl3) δ м.д.: 1,20 (3Н, т, J=7 Гц), 1,33-1,42 (1Н, м), 1,53-1,61 (1Н, м), 1,82-1,91 (1Н, м), 1,98-2,08 (2Н, м), 2,57 (2Н, т, J=7 Гц), 2,68-2,92 (6Н, м), 3,05 (1Н, д, J=14 Гц), 3,23 (1Н, дд, J=2, 14 Гц), 4,08 (2Н, кв, J=7 Гц), 7,12-7,16 (2Н, м), 7,19-7,31 (4Н, м), 8,31 (1Н, д, J=2 Гц).
Пример 28: 3-[3-Бензил-5-(3-оксобутил)-2-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали таким же образом, что и в примере 27.
1H-ЯМР (CDCl3) δ м.д.: 1,36-1,47 (1Н, м), 1,55-1,63 (1Н, м), 1,80-1,92 (1Н, м), 2,00-2,10 (2Н, м), 2,12 (3Н, с), 2,68-3,05 (8Н, м), 3,08 (1Н, дд, J=1,6, 14 Гц), 3,25 (1Н, дд, J=2,0, 14 Гц), 4,11 (2Н, с), 7,12-7,16 (2Н, м), 4,20-7,32 (4Н, м), 8,30 (1Н, д, J=2,2 Гц).
Пример 29: 3-[3-Бензил-5-(3-гидроксибутил)-2-пиридил]этинил-3-хинуклидинол
Смесь 314 мг гидрохлорида 3-[3-бензил-5-(3-оксобутил)-2-пиридил]этинил-3-хинуклидинола, 129 мг карбоната калия, 35 мг боргидрида натрия и 10 мл метанола перемешивали при комнатной температуре в течение одного часа. Добавляли небольшое количество воды и смесь выпаривали. Остаток подвергали колоночной хроматографии на NH-силикагеле, используя хлороформ, а затем хлороформ/метанол/водный концентрированный раствор аммиака (46:1:0,1), с получением 340 мг целевого соединения.
1H-ЯМР (CDCl3) δ м.д.: 1,21 (3Н, д, J=6,0 Гц), 1,33-1,41 (1Н, м), 1,52-1,61 (1Н, м), 1,65-1,80 (2Н, м), 1,80-1,91 (1Н, м), 2,00 2,10 (2Н, м), 2,58-2,94 (6Н, м), 3,06 (1Н, дд, J=1,2, 14 Гц), 3,24 (1Н, дд, J=2,0, 14 Гц), 3,72-3,81 (1Н, м), 4,11 (2Н, с), 7,13-7,30 (6Н, м), 8,30 (1Н, д, J=2,2 Гц).
Пример 30: 3-[3-(2-Тиенилметил)-2-пиридил]этинил-3-хинуклидинол
a) 2-Хлор-3-(2-тиенилкарбонил)пиридин
10 г хлорангидрида 2-хлорникотиновой кислоты добавляли к смеси 7,2 г хлорида алюминия и 100 мл дисульфида углерода при охлаждении льдом с последующим добавлением туда, медленно, по каплям 8,8 мл тиофена. После перемешивания при комнатной температуре в течение двух суток реакционный раствор медленно выливали в ледяную воду. Смесь экстрагировали этилацетатом и органическую фазу последовательно промывали насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли. После удаления растворителя остаток подвергали колоночной хроматографии на силикагеле и элюировали гексаном/этилацетатом (3:1) и затем гексаном/этилацетатом (2:1) с получением 1,64 г целевого соединения.
1H-ЯМР (CDCl3) δ: 7,15-7,17 (1Н, м), 7,37-7,40 (1Н, м), 7,42-7,44 (1Н, м), 7,78-7,83 (2Н, м), 8,54-8,57 (1Н, м).
b) 2-Метокси-3-(2-тиенилкарбонил)пиридин
Смесь 1,64 г 2-хлор-3-(2-тиенилкарбонил)пиридина, 4,5 мл метанольного раствора 28% метоксида натрия и 2,0 мл метанола нагревали при перемешивании в течение 30 минут. После остывания к реакционному раствору добавляли воду и смесь экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором соли и растворитель удаляли с получением 1,46 г целевого соединения.
1H-ЯМР (CDCl3) δ: 3,96 (3Н, с), 6,90-7,05 (1Н, м), 7,11-7,14 (1Н м), 7,48-7,50 (1Н, м), 7,72-7,76 (2Н, м), 8,30-8,33 (1Н, м).
с) 2-Метокси-3-[2-тиенил(гидрокси)метил]пиридин
303 мг боргидрида натрия малыми порциями добавляли к раствору, содержащему 1,46 г 2-метокси-3-(2-тиенилкарбонил)-пиридина и 10 мл этанола, при охлаждении льдом. После перемешивания при комнатной температуре в течение 2 часов туда медленно добавляли воду и смесь экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором соли и растворитель удаляли с получением 1,47 г целевого соединения.
1H-ЯМР (CDCl3) δ: 3,99 (3Н, с), 6,26 (1Н, д), 6,88-6,96 (3Н, м), 7,25 (1Н, м), 7,64 (1Н, дд), 8,12 (1Н, дд).
d) 2-Метокси-3-(2-тиенилметил)пиридин
Смесь 1,47 г 2-метокси-3-[2-тиенил(гидрокси)метил]-пиридина, 3,2 г йодида цинка, 3,4 г цианоборгидрида натрия и 30 мл 1,2-дихлорэтана перемешивали при комнатной температуре в течение двух суток. Нерастворимые вещества отфильтровывали и к фильтрату добавляли водный раствор гидроксида натрия. Смесь экстрагировали этилацетатом, органическую фазу промывали насыщенным раствором соли и растворитель выпаривали. Затем остаток подвергали колоночной хроматографии на силикагеле и элюировали гексаном, а затем гексаном/этилацетатом (40:1) с получением 734 г целевого соединения.
1H-ЯМР (CDCl3) δ: 3,99 (3Н, с), 4,10 (2Н, с), 6,79-6,84 (2Н, м), 6,92-6,95 (1Н, м), 7,13-7,16 (1Н, м), 7,35-7,36 (1Н, м), 8,04 (1Н, дд).
e) 3-(2-Тиенилметил)-2-пиридилтрифторметансульфонат
10 мл 47% бромистоводородной кислоты добавляли к 216 мг 2-метокси-3-(2-тиенилметил)пиридина с последующим нагреванием при перемешивании в течение 4 часов на масляной бане при температуре 80°С. После остывания реакционную смесь нейтрализовали осторожным добавлением туда карбоната калия. Туда же добавляли воду и смесь экстрагировали этилацетатом/тетрагидрофураном. Органическую фазу промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли с получением 140 мг неочищенного продукта. Смесь 140 мг неочищенного продукта, 314 мг N-фенилтрифторметансульфонимида, 153 мкл триэтиламина, 27 мг 4-диметиламинопиридина и 5,0 мл дихлорметана перемешивали при комнатной температуре в течение 3 часов. К реакционному раствору добавляли воду и экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором соли и растворитель удаляли. Остаток подвергали колоночной хроматографии на NH-силикагеле (Fuji Silicia) и элюировали гексаном, а затем гексаном/этилацетатом (40:1) с получением 89 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 4,23 (2Н, с), 6,86-6,89 (1Н, м), 6,96-6,99 (1Н м), 7,21-7,24 (1Н, м), 7,29-7,33 (1Н, м), 7,66-7,69 (1Н, м), 8,25 (1Н, дд).
f) 3-[3-(2-Тиенилметил)-2-пиридил]этинил-3-хинуклидинол
Смесь 89 мг 3-(2-тиенилметил)-2-пиридилтрифторметансульфоната, 50 мг 3-этинил-3-хинуклидинола, 64 мг тетракис(трифенилфосфин)палладия (0), 11 мг йодида меди, 105 мкл триэтиламина и 3,0 мл N,N-диметилформамида нагревали при перемешивании при 70°С в течение 1,5 часов в атмосфере азота. Реакционный раствор выливали в водный разбавленный раствор аммиака с последующим экстрагированием этилацетатом. Затем органическую фазу промывали насыщенным раствором соли и растворитель удаляли, а остаток подвергали колоночной хроматографии на NH-силикагеле (Fuji Silicia) и элюировали гексаном/этилацетатом (1:1) и затем этилацетатом/метанолом (15:1) с получением 88 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,35-1,45 (1Н, м), 1,56-1,68 (1Н, м), 1,86-1,99 (1Н, м), 2,02-2,13 (2Н, м), 2,73-2,94 (4Н, м), 3,05-3,10 (1Н, м), 3,29-3,33 (1Н, м), 4,32 (2Н, с), 6,76-6,79 (1Н, м), 6,92-6,95 (1Н, м), 7,15-7,23 (2Н, м), 7,55 (1Н, д), 8,46 (1Н, д).
Пример 31: 3-(6-Пиразил-3-бензил-2-пиридил)этинил-3-хинуклидинол
а) 6-Хлор-3-(α-гидроксибензил)-2-метоксипиридин
100 мл пентанового раствора, содержащего 1,56 моль трет-бутиллития, медленно, по каплям добавляли в 200 мл тетрагидрофураного раствора, содержащего 11,9 мл 2-бромомеситилена, при -78°С при охлаждении. После перемешивания при той же температуре в течение одного часа туда же медленно, по каплям добавляли 7,2 мл 2-хлор-6-метоксипиридина. После перемешивания при охлаждении льдом в течение одного часа, а затем при комнатной температуре в течение одного часа туда добавляли 8,5 мл бензальдегида при охлаждении льдом с последующим перемешиванием при комнатной температуре в течение еще одного часа. К реакционному раствору добавляли воду с последующим экстрагированием этилацетатом. Органическую фазу промывали насыщенным раствором соли и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле и элюировали гексаном и затем гексаном/этилацетатом (7:1) с получением 15,0 г целевого соединения.
1H-ЯМР (CDCl3) δ: 3,95 (3Н, с), 5,96 (1Н, д, J=4 Гц), 6,90-6,92 (1Н, м), 7,25-7,37 (5Н, м), 7,54-7,57 (1Н, м).
b) 6-хлор-3-бензоил-2-метоксипиридин
36,0 г оксида марганца (IV) добавляли к раствору 3,7 г 6-хлор-3-(α-гидроксибензил)-2-метоксипиридина в 80 мл тетрагидрофурана с последующим перемешиванием при комнатной температуре в течение 2 часов. Нерастворимые вещества отфильтровывали и затем растворитель выпаривали с получением 3,6 г соединения, названного в заголовке.
1H-ЯМР (CDCl3) δ: 3,90 (3Н, с), 7,04 (1Н, дд, J=0,4 Гц, 8 Гц), 7,44-7,48 (2Н, м), 7,56-7,62 (1Н, м), 7,70 (1Н, дд, J=0,4 Гц, 8 Гц), 7,76-7,81 (2Н, м).
c) (3-Бензоил-2-метокси-6-пиридил)трибутилолово
Смесь 3,6 г 6-хлор-З-бензоил-2-метоксипиридина, 42,1 г бис(трибутилолова), 1,7 г тетракис(трифенилфосфин)палладия (0) и 20 мл толуола кипятили с обратным холодильником в течение 2 часов. После остывания растворитель удаляли и остаток подвергали колоночной хроматографии на силикагеле и элюировали гексаном, а затем гексаном/этилацетатом (2:1) с получением 5,1 г целевого соединения.
1H-ЯМР (CDCl3) δ: 0,85-1,65 (27Н, м), 3,90 (3Н, с), 7,12-7,14 (1Н, м), 7,28-7,59 (4Н, м), 7,79-7,82 (2Н, м).
d) 6-Пиразил-3-бензоил-2-метоксипиридин
Смесь 5,1 г (3-бензоил-2-метокси-6-пиридил)трибутилолова, 5,4 мл хлорпиразина, 1,8 г тетракис(трифенилфосфин)палладия (0) и 30 мл ксилола кипятили с обратным холодильником в течение 2 часов. После остывания растворитель удаляли и остаток подвергали колоночной хроматографии на силикагеле и элюировали гексаном, а затем гексаном/этилацетатом (1:1) с получением 1,3 г целевого соединения.
1H-ЯМР (CDCl3) δ: 4,02 (3Н, с), 7,45-7,50 (2Н, м), 7,59-7,63 (1Н, м), 7,83-7,91 (3Н, м), 8,10-8,13 (1Н, м), 8,63-8,66 (2Н, м), 9,66 (1Н, д, J=1,4 Гц).
е) 6-Пиразил-3-бензил-2-метоксипиридин
Смесь 806 мг 6-пиразил-3-бензоил-2-метоксипиридина, 177 мкл гидразина, 421 мг карбоната калия и 35 мл диэтиленгликоля нагревали при перемешивании при 100°С в течение одного часа, затем при 170°С в течение 3 часов. После остывания к реакционному раствору добавляли воду с последующим экстрагированием этилацетатом. Органическую фазу промывали насыщенным раствором соли и растворитель удаляли, а остаток подвергали колоночной хроматографии на силикагеле и элюировали гексаном/этилацетатом (5:1), а затем гексаном/этилацетатом (4:1) с получением 234 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 3,98 (2Н, с), 4,08 (3Н, с), 7,21-7,33 (5Н, м), 7,44 (1Н, д, J=8 Гц), 7,89 (1Н, д, J=8 Гц), 8,53-8,57 (2Н, м), 9,60 (1Н, д, J=1,5 Гц).
f) 6-Пиразил-3-бензил-2-гидроксипиридин
5,0 мл 47% бромистоводородной кислоты добавляли к 234 мг 6-пиразил-3-бензил-2-метоксипиридин с последующим нагреванием при перемешивании в течение одного часа на масляной бане при температуре 80°С. После остывания реакционный раствор медленно добавляли к водному раствору карбоната калия. Полученные кристаллы отфильтровывали и сушили с получением 222 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 3,95 (2Н, с), 6,83 (1Н, д, J=7 Гц), 7,12-7,15 (1Н, м), 7,21-7,36 (5Н, м), 8,59-8,61 (2Н, м), 9,07 (1Н, д, J=1,3 Гц).
g) 6-Пиразил-3-бензил-2-пиридилтрифторметансульфонат
К 222 мг 6-пиразил-3-бензил-2-гидроксипиридина добавляли 365 мг N-фенилтрифторметансульфонимида, 178 мкл триэтиламина, 31 мг 4-диметиламинопиридина, 10 мл дихлорметана и 3,0 мл N,N-диметилформамида с последующим перемешиванием при комнатной температуре в течение 3 часов. К реакционному раствору добавляли воду с поледующим экстрагированием этилацетатом. Экстракт промывали насыщенным раствором соли и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле и элюировали гексаном, а затем гексаном/этилацетатом (4:1) с получением 336 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 4,11 (2Н, с), 7,22-7,42 (5Н, м), 7,75 (1Н, д, J=8 Гц), 8,36 (1Н, д, J=8 Гц), 8,59-8,63 (2Н, м), 9,50 (1Н, д, J=1,3 Гц).
h) 3-(6-пиразил-3-бензил-2-пиридил)этинил-3-хинуклидинол
Смесь 336 мг 6-пиразил-3-бензил-2-пиридилтрифторметансульфоната, 161 мг 3-этинил-3-хинуклидинола, 205 мг тетракис(трифенилфосфин)палладия (0), 34 мг йодида меди, 370 мкл триэтиламина и 5,0 мл N,N-диметилформамида нагревали при перемешивании при 80°С в течение 3 часов в атмосфере азота. После остывания растворитель удаляли и остаток подвергали колоночной хроматографии на NH-силикагеле (Fuji silicia) и элюировали этилацетатом/метанолом (20:1) с получением 204 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,39-1,79 (2Н, м), 1,89-1,96 (1Н, м), 2,06-2,14 (2Н, м), 2,75-2,94 (4Н, м), 3,07 (1Н, д, J=14 Гц), 3,29 (1Н, д, J=14 Гц), 4,23 (2Н, с), 7,18-7,34 (5Н, м), 7,62 (1Н, д, J=8 Гц), 8,25 (1Н, д, J=8 Гц), 8,59 (2Н, с), 9,64 (1Н, с).
Пример 32: 3-[3-Бензил-5-(3-тиенил)-2-пиридил]этинил-3-хинуклидинол
Смесь 127 мг 3-(3-бензил-5-бром-2-пиридил)этинил-3-хинуклидинола (пример 22а), 61,4 мг 3-тиофенбороновой кислоты, 55,4 мг тетракис(трифенилфосфин)палладия (0), 2 мл толуола, 0,5 мл метанола и 1 мл водного 2 М раствора карбоната натрия перемешивали при 80°С в течение 2 часов в атмосфере азота. К реакционному раствору добавляли NH-силикагель и растворитель удаляли. Остаток подвергали колоночной хроматографии на NH-силикагеле, используя 3% метанол/этилацетат, с получением 83,9 г целевого соединения.
1H-ЯМР (CDCl3) δ: 1,35-1,42 (1Н, м), 1,54-1,62 (1Н, м), 1,84-1,92 (1Н, м), 2,00-2,10 (2Н, м), 2,68-2,83 (3Н, м), 2,87-2,94 (1Н, м), 3,09 (1Н, д, J=14 Гц), 3,26 (1Н, дд, J=2, 14 Гц), 4,18 (2Н, с), 7,17-7,33 (6Н, м), 7,39-7,42 (1Н, м), 7,47-7,49 (1Н, м), 7,61 (1Н, с), 8,70 (1Н, д, J=2 Гц).
Пример 33: 3-[6-(Метиламино)-3-бензил-5-пиразил-2-пиридил]этинил-3-хинуклидинол
а) 6-(Ацетоксиметил)-3-бензоил-2-метоксипиридин
Смесь 5 г 6-метил-3-бензоил-2-метоксипиридина, синтезированного так же, как и в примере получения 1b, 4,3 г N-бромсукцинимида и 100 мл бензола облучали светом 200 Вт лампы накаливания в течение 30 минут и кипятили с обратным холодильником. После охлаждения нерастворимые вещества отфильтровывали и фильтрат концентрировали. К остатку добавляли 30 мл уксусной кислоты и 5 г ацетата натрия с последующим нагреванием на масляной бане при температуре 100°С в течение ночи. После концентрирования реакционного раствора его экстрагировали этилацетатом-водным насыщенным раствором бикарбоната натрия. Органическую фазу промывали насыщенным раствором соли, сушили над безводным сульфатом магния и выпаривали. Остаток подвергали колоночной хроматографии на силикагеле, используя 5-10% этилацетат/гексан, с получением 3,69 г целевого соединения.
1H-ЯМР (CDCl3) δ: 2,21 (3Н, с), 3,87 (3Н, с), 5,20 (2Н, с), 7,02 (1Н, д, J=8 Гц), 7,45 (2Н, т, J=8 Гц), 7,58 (1Н, т, J=8 Гц), 7,73 (1Н, д, J=8 Гц), 7,79 (2Н, д, J=8 Гц).
b) 6-(Ацетоксиметил)-3-бензил-2-метокси-5-пиразилпиридин
Смесь 3,93 г 6-(ацетоксиметил)-3-бензоил-2-метоксипиридина, 8,81 мл триэтилсилана и 30 мл трифторуксусной кислоты перемешивали при 60°С в течение одного часа. После остывания смесь нейтрализовали добавлением водного раствора карбоната калия. Туда же добавляли этилацетат, органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. После добавления к остатку 20 мл метанола и 3,48 г бикарбоната натрия добавляли 1,07 мл брома при охлаждении льдом с последующим перемешиванием при комнатной температуре в течение 30 минут. К реакционному раствору добавляли водный раствор тиосульфата натрия и этилацетат. Органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. К остатку добавляли 3,10 г пиразилтрибутилолова, 1,46 тетракис (трифенилфосфин)палладия (0) и 40 мл ксилола с последующим кипячением с обратным холодильником в течение 2,5 часов. К реакционному раствору добавляли силикагель и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле, используя 30% этилацетат/гексан, с получением 2,18 г целевого соединения.
1H-ЯМР (CDCl3) δ: 2,02 (3Н, с), 3,96 (2Н, с), 4,01 (3Н, с), 5,29 (2Н, с), 7,21-7,33 (5Н, м), 7,46 (1Н, с), 8,50 (1Н, д, J=2 Гц), 8,59-8,60 (1Н, м), 8,66 (1Н, д, J=1 Гц).
c) 3-Бензил-6-(трет-бутоксикарбониламино)-2-метокси-5-пиразилпиридин
6,24 мл 1N водного раствора гидроксида натрия добавляли к смеси 2,18 г 6-(ацетоксиметил)-3-бензил-2-метокси-5-пиразилпиридина и 20 мл метанола при комнатной температуре с последующим перемешиванием при той же температуре. К реакционному раствору добавляли воду и этилацетат и органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. К раствору остатка в 20 мл ацетона добавляли 14,1 мл реактива Джона с последующим перемешиванием при комнатной температуре в течение ночи. К реакционной смеси добавляли 6 мл 2-пропанола, после чего экстрагировали этилацетатом. Органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Смесь из остатка 25 мл трет-бутанола, 733 мкл триэтиламина и 1,13 г дифенилфосфорилазида перемешивали при комнатной температуре в течение 3 часов. После выпаривания растворителя остаток подвергали колоночной хроматографии на силикагеле, используя 25% этилацетат/гексан, с получением 212 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,51 (9Н, с), 3,93 (2Н, с), 4,08 (3Н, с), 7,19-7,31 (5Н, м), 7,65 (1Н, с), 8,42 (1Н, д, J=2 Гц), 8,52-8,54 (1Н, м), 8,80 (1H, д, J=1 Гц).
d) 3-[6-(Метиламино)-3-бензил-5-пиразил-2-пиридил]этинил-3-хинуклидинол
11,8 мг 60% масляной суспензии гидрида натрия добавляли к смеси 77,2 мг 3-бензил-6-(трет-бутоксикарбониламино)-2-метокси-5-пиразилпиридина и 1 мл N,N-диметилформамида при охлаждении льдом. После перемешивания при той же температуре в течение 5 минут туда добавляли 14,7 мкл метилйодида. После перемешивания при комнатной температуре в течение 2 часов туда добавляли воду и этилацетат. Органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Смесь остатка и 2 мл 48% бромистоводородной кислоты перемешивали при 80°С в течение 2 часов. После остывания ее нейтрализовали водным раствором карбоната калия. Полученные кристаллы отфильтровывали и сушили в вакууме. Затем туда добавляли 3 мл N,N-диметилформамида, 40,4 мг N-фенилтрифторметансульфонимида, 47,2 мкл триэтиламина и 1,4 мг 4-диметиламинопиридина с последующим перемешиванием при комнатной температуре в течение 13 часов. Реакционный раствор фильтровали через силикагель и растворитель выпаривали. Смесь остатка, 12,1 мг 3-этинил-3-хинуклидинола, 16,9 мг тетракис(трифенилфосфин)-палладия (0), 2,8 мг йодида меди, 30,5 мкл триэтиламина и 1 мл N,N-диметилформамида перемешивали при 70°С в течение одного часа в атмосфере азота. К реакционной смеси добавляли NH-силикагель, после чего удаляли растворитель. Остаток подвергали колоночной хроматографии на NH-силикагеле, используя 3% метанол/этилацетат, с получением 15,9 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,34-1,42 (1Н, м), 1,52-1,60 (1H, м), 1,83-1,92 (1H, м), 1,98-2,07 (2Н, м), 2,70-2,82 (4Н, м), 3,02 (1H, д, J=14 Гц), 3,11 (3Н, д, J=5 Гц), 3,25 (1H, дд, J=2, 14 Гц), 4,09 (2Н, с), 7,18-7,22 (3Н, м), 7,26-7,31 (2Н, м), 7,68 (1H, с), 8,44 (1H, д, J=2 Гц), 8,50-8,51 (1H, м), 8,53-8,55 (1H, м), 8,92 (1H, д, J=1 Гц).
Пример 34: 3-[3-Бензил-5-(1-гидроксициклопентил)этинил-2- пиридил]этинил-3-хинуклидинол
100 мг 3-(3-бензил-5-бром-2-пиридил)этинил-3-хинуклидинола (пример 22а), 55 мг 1-этинилциклопентанола, 50 мг тетракис(трифенилфосфин)палладия (0), 10 мг йодида меди и 1 мл триэтиламина смешивали в 5 мл N,N-диметилформамида с последующим перемешиванием на масляной бане при температуре 80°С в течение 1 часа. Добавляли водный раствор карбоната натрия с последующим экстрагированием этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над безводным сульфатом магния и выпаривали. Остаток подвергали колоночной хроматографии на NH-силикагеле и элюировали 10% метанолом/этилацетатом с получением 93 г целевого соединения.
1H-ЯМР (CDCl3) δ: 1,33-1,43 (1H, м), 1,52-1,62 (1H, м), 1,70-1,92 (5Н, м), 1,95-2,10 (6Н, м), 2,69-2,94 (4Н, м), 3,07 (1H, д, J=14 Гц), 3,26 (1H, дд, J=2, 14 Гц), 4,03 (2Н, с), 7,12 (2Н, д, J=7 Гц), 7,22 (1H, т, J=7 Гц), 7,29 (2Н, т, J=7 Гц), 7,43 (1H, д, J=2 Гц), 8,50 (1Н, д, J=2 Гц).
Пример 35: 3-[3-Бензил-5-(N-фенилкарбамоил)-2-пиридил]этинил-3-хинуклидинол
a) 3-Бензил-2-метоксипиридин-5-карбоновая кислота
11,1 г 3-бензил-5-бром-2-метоксипиридина (пример получения 5b) растворяли в 70 мл диэтилового эфира. Туда по каплям добавляли 30 мл гексанового раствора, содержащего 1,6 моль н-бутиллития, на бане с сухим льдом-ацетоном. Через один час реакционный раствор продували двуокисью углерода, затем добавляли воду. После промывания водной фазы диэтиловым эфиром туда добавляли 50 мл 1N соляной кислоты с последующим экстрагированием этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над безводным сульфатом магния и выпаривали. Остаток кристаллизовали из гексана-этилацетата с получением 7,76 г целевого соединения.
1H-ЯМР (CDCl3) 5: 3,93 (2Н, с), 4,04 (3Н, с), 7,18-7,33 (5Н, м), 7,92 (1Н, д, J=2 Гц), 8,77 (1Н, д, J=2 Гц).
b) 3-бензил-5-(N-фенилкарбамоил)-2-метоксипиридин
200 мг 3-бензил-2-метоксипиридин-5-карбоновой кислоты и 0,25 мл пиридина растворяли в 5 мл дихлорметана. При охлаждении льдом туда по каплям добавляли 0,073 мл тионилхлорида. После перемешивания в течение 30 минут добавляли 0,1 мл анилина. Температуру повышали до комнатной температуры и смесь перемешивали в течение 30 минут. После добавления воды смесь экстрагировали этилацетатом. Экстракт промывали 1N соляной кислотой и насыщенным раствором соли, сушили над безводным сульфатом магния и выпаривали с получением 275 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 3,97 (2Н, с), 4,04 (3Н, с), 7,15 (1Н, т, J=7 Гц), 7,20-7,40 (7Н, м), 7,58 (2Н, д, J=7 Гц), 7,81 (1Н, д, J=2 Гц), 8,55 (1Н, д, J=2 Гц).
c) 3-бензил-5-(N-фенилкарбамоил)-2-пиридилтрифторметансульфонат
275 мг 3-бензил-5-(N-фенилкарбамоил)-2-метоксипиридина растворяли в 5 мл 1,2-дихлорэтана. Туда же добавляли 0,5 мл дихлорметанового раствора, содержащего 1 моль трибромида бора, с последующим перемешиванием при 50°С в течение 3 часов. Добавляли водный раствор хлорида аммония и смесь экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли и затем выпаривали. К остатку добавляли 360 мг N-фенилтрифторметансульфонимида, 10 мг 4-диметиламинопиридина, 0,4 мл триэтиламина и 5 мл дихлорметана с последующим перемешиванием при комнатной температуре в течение ночи. Реакционный раствор подвергали колоночной хроматографии на силикагеле и элюировали 30% этилацетатом/гексаном с получением 150 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 4,09 (2Н, с), 7,17-7,42 (8Н, м), 7,57 (2Н, д, J=8 Гц), 7,69 (1Н, шир.с), 8,10 (1Н, д, J=2 Гц), 8,65 (1Н, д, J=2 Гц).
d) 3-[3-Бензил-5-(N-фенилкарбамоил)-2-пиридил]этинил-3-хинуклидинол
150 мг 3-бензил-5-(N-фенилкарбамоил)-2-пиридилтрифторметансульфоната, 60 мг 3-этинил-3-хинуклидинола, 50 мг тетракис(трифенилфосфин)палладия (0), 10 мг йодида меди и 0,15 мл триэтиламина добавляли к 2 мл N,N-диметилформамида с последующим перемешиванием в течение 3 часов на масляной бане при температуре 50°С. После остывания добавляли водный раствор аммиака и смесь экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над безводным сульфатом магния и выпаривали. Остаток подвергали колоночной хроматографии на NH-силикагеле с получением 90 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,35-1,92 (3Н, м), 1,98-2,10 (2Н, м), 2,70-2,95 (4Н, м), 3,07 (1Н, д, J=14 Гц), 3,27 (1Н, дд, J=2, 14 Гц), 4,20 (2Н, с), 7,14-7,19 (3Н, м), 7,24 (1Н, т, J=7 Гц), 7,31 (2Н, т, J=7 Гц), 7,36 (2Н, т, J=8 Гц), 7,58 (2Н, д, J=8 Гц), 7,98 (1Н, д, J=2 Гц), 8,00 (1Н, шир.с), 8,87 (1Н, д, J=2 Гц).
Пример 36: 3-[3-Бензил-5-[N-(4-фторфенил)карбамоил]-2-пиридил]этинил-3-хинуклидинол
Соединение, названное в заголовке, синтезировали так же, как и в примере 35.
1H-ЯМР (CDCl3) δ: 1,34-1,44 (1Н, м), 1,54-1,64 (1H, м), 1,78-1,89 (1H, м), 1,99-2,09 (2Н, м), 2,66-2,95 (4Н, м), 3,08 (1H, д, J=14 Гц), 3,25 (1H, дд, J=2, 14 Гц), 4,15 (2Н, с), 7,00 (2Н, т, J=8 Гц), 7,13 (2Н, д, J=7 Гц), 7,22 (1H, т, J=7 Гц), 7,28 (2Н, т, J=7 Гц), 7,48-7,56 (2Н, м), 7,93 (1Н, д, J=2 Гц), 8,48 (1H, шир.с), 8,80 (1Н, д, J=2 Гц).
Пример 37: 3-[3-Бензил-5-(N-циклогексилкарбамоил)-2-пиридил]этинил-3-хинуклидинол
Соединение, названное в заголовке, синтезировали так же, как и в примере 35.
1H-ЯМР (CDCl3) δ: 1,24-1,90 (11Н, м), 1,97-2,10 (4Н, м), 2,65-2,95 (4Н, м), 3,06 (1H, дд, J=2, 14 Гц), 3,24 (1H, дд, J=2, 14 Гц), 3,88-4,00 (1H, м), 4,16(2Н, с), 6,10 (1H, д, J=8 Гц), 7,14 (2Н, д, J=7 Гц), 7,22 (1H, т, J=7 Гц), 7,28 (2Н, т, J=7 Гц), 7,89 (1H, д, J=2 Гц), 8,72 (1H, д, J=2 Гц).
Пример 38: 3-[3-Бензил-5-(1-пирролидинилкарбамоил)-2-пиридил]этинил-3-хинуклидинол
Соединение, названное в заголовке, синтезировали так же, как и в примере 35.
1H-ЯМР (CDCl3) δ: 1,35-1,65 (2Н, м), 1,83-2,10 (7Н, м), 2,70-2,95 (4Н, м), 3,04 (1H, д, J=14 Гц), 3,27 (1H, дд, J=2,14 Гц), 3,38 (2Н, т, J=7 Гц), 3,62 (2Н, т, J=7 Гц), 4,18 (2Н, с), 7,17 (2Н, д, J=7 Гц), 7,24 (1H, т, J=7 Гц), 7,31 (2Н, т, J=7 Гц), 7,63 (1H, д, J=2 Гц), 8,62 (1H, д, J=2 Гц).
Пример 39: 3-[3-Бензил-5-метоксикарбонил-2-пиридил]этинил-3-хинуклидинол
а) 3-Бензил-2-метокси-5-метоксикарбонилпиридин
Смесь 2,1 г 3-бензил-2-метоксипиридин-5-карбоновой кислоты и 2,9 г карбоната калия суспендировали в 40 мл N,N-диметилформамида. Добавляли 1,1 мл метилйодида при комнатной температуре при перемешивании. После перемешивания в течение 40 минут туда добавляли воду и экстрагировали этилацетатом. Органическую фазу далее промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель выпаривали. Остаток подвергали колоночной хроматографии на силикагеле, используя 11-14% этилацетат/гексан в качестве элюента, для разделения и очистки с получением 2,2 г целевого соединения.
1H-ЯМР (CDCl3) δ: 3,87 (3Н, с), 3,92 (2Н, с), 4,02 (3Н, с), 7,18-7,32 (5Н, м), 7,90 (1Н, дд, J=2,3 Гц, 0,7 Гц), 8,70 (1Н, д, J=2,3 Гц).
b) 3-Бензил-2-гидрокси-5-метоксикарбонилпиридин
2,2 г 3-бензил-2-метокси-5-метоксикарбонилпиридина растворяли в 40 мл 1,2-дихлорэтана. Добавляли 8,5 мл дихлорметанового раствора, содержащего 1,0 моль трибромида бора, в атмосфере азота с последующим нагреванием при перемешивании при 50°С на масляной бане в течение ночи. После остывания туда добавляли воду, и растворитель удаляли при низкой температуре. Остаток подвергали колоночной хроматографии на силикагеле, используя 50-60% этилацетат/гексан в качестве элюента, для разделения и очистки с получением 1,2 г целевого соединения.
1H-ЯМР (CDCl3) δ: 3,83 (3Н, с), 3,87 (2Н, с), 7,20-7,34 (5Н, м), 7,73 (1Н, д, J=2,4 Гц), 8,11 (1Н, д, J=2,4 Гц).
c) 3-Бензил-5-метоксикарбонил-2-пиридилтрифторметансульфонат
1,2 г 3-бензил-2-гидрокси-5-метоксикарбонилпиридина растворяли в 40 мл 1,2-дихлорэтана. Добавляли 2,3 г N-фенилтрифторметансульфонимида, 202 мг 4-диметиламинопиридина и 0,9 мл триэтиламина с последующим перемешиванием при комнатной температуре в течение 3 часов. Затем растворитель удаляли и остаток подвергали колоночной хроматографии на силикагеле, используя 11% этилацетат/гексан в качестве элюента, для разделения и очистки с получением 2,0 г целевого соединения.
1H-ЯМР (CDCl3) δ: 3,93 (3Н, с), 4,05 (2Н, с), 7,16-7,43 (5Н, м), 8,20 (1Н, д, J=2,3 Гц), 8,82 (1Н, д, J=2,3 Гц).
d) 3-[3-Бензил-5-метоксикарбонил-2-пиридил]этинил-3-хинуклидинол
50 мл N,N-диметилформамида добавляли к смеси 2,0 г 3-бензил-5-метоксикарбонил-2-пиридилтрифторметансульфоната, 742 мг 3-этинил-3-хинуклидинола, 1,5 г тетракис(трифенилфосфин)-палладия (0), 374 мг йодида меди и 2,7 мл триэтиламина с последующим нагреванием при перемешивании в течение одного часа на масляной бане при температуре 60°С в атмосфере азота. После остывания туда добавляли этилацетат и водный раствор аммиака и смесь экстрагировали этилацетатом. Органическую фазу далее промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле, используя хлороформ/метанол/36% водный раствор аммиака (46:3:0,3) в качестве элюента, для разделения и очистки с получением 1,1 г целевого соединения.
1H-ЯМР (CDCl3) δ =1,38-1,48 (1Н, м), 1,58-1,68 (1Н, м), 1,82-1,92 (1Н, м), 2,00-2,14 (2Н, м), 2,70-2,98 (4Н, м), 3,09 (1Н, дд, J=14 Гц, 1,8 Гц), 3,27 (1Н, дд, J=14 Гц, 2,0 Гц), 3,92 (3Н, с), 4,19 (2Н, с), 7,12-7,74 (5Н, м), 8,09 (1Н, д, J=2,0 Гц), 9,04 (1Н, д, J=2,0 Гц).
Пример 40: 3-[3-Бензил-5-(N-метилбензоиламино)-2-пиридил]этинил-3-хинуклидинол
a) 3-Бензил-5-трет-бутоксикарбониламино-2-метоксипиридин
7,34 г 3-Бензил-2-метоксипиридин-5-карбоновой кислоты (пример 35а), 6,5 мл дифенилфосфорилазида и 4,2 мл триэтиламина смешивали в 100 мл трет-бутанола с последующим кипячением с обратным холодильником в течение ночи. После выпаривания реакционного раствора его разделяли, добавляя воду и этилацетат, промывали насыщенным раствором соли, сушили над безводным сульфатом магния и затем выпаривали. Остаток подвергали колоночной хроматографии на силикагеле с получением 9,37 г целевого соединения.
1H-ЯМР (CDCl3) δ: 1,48 (9Н, с), 3,89 (2Н, с), 3,92 (3Н, с), 6,25 (1Н, шир.с), 7,17-7,31 (5Н, м), 7,48 (1Н, шир.с), 7,92 (1Н, шир.с).
b) 3-Бензил-5-(N-метил-трет-бутоксикарбониламино)-2-метоксипиридин
970 мг 3-бензил-5-трет-бутоксикарбониламино-2-метоксипиридина растворяли в 10 мл N,N-диметилформамида с последующим добавлением туда 200 мг 60% масляной суспензии гидрида натрия. После перемешивания при комнатной температуре добавляли 0,192 мл метилйодида на ледяной бане. После нагревания до комнатной температуры добавляли воду и смесь экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над безводным сульфатом магния и выпаривали с получением 920 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,37 (9Н, шир.с), 3,17 (3Н, с), 3,89 (2Н, с), 3,96 (3Н, с), 7,13 (1Н, шир.с), 7,18-7,25 (3Н, м), 7,30 (2Н, д, J=7 Гц), 7,88 (1Н, д, J=2 Гц).
c) 3-Бензил-5-(N-метилбензоиламино)-2-метоксипиридин
920 мг 3-бензил-5-(N-метил-трет-бутоксикарбониламино)-2-метоксипиридина растворяли в 5 мл этилацетата с последующим добавлением туда же 10 мл 4N соляной кислоты/этилацетата. Полученное твердое вещество отфильтровывали. К твердому веществу (230 мг) добавляли 10 мл этилацетата, 150 мг бензоилхлорида и 0,5 мл пиридина на ледяной бане с последующим перемешиванием. После добавления туда воды смесь экстрагировали этилацетатом. Экстракт промывали 1N соляной кислотой, насыщенным водным раствором гидрокарбоната натрия и насыщенным раствором соли, сушили над безводным сульфатом магния и затем выпаривали с получением 270 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 3,42 (3Н, с), 3,75 (2Н, с), 3,89 (ЗН, с), 6,80-6,95 (3Н, м), 7,15-7,30 (8Н, м), 7,80 (1Н, шир.с).
d) 3-[3-Бензил-5-(N-метилбензоиламино)-2-пиридил]этинил-3-хинукдидинол
Целевое соединение синтезировали так же, как и в примере 35с.
1H-ЯМР (CDCl3) δ: 1,35-1,46 (1Н, м), 1,54-1,64 (1H, м), 1,75-1,85 (1H, м), 2,01-2,12 (2Н, м), 2,60-2,90 (4Н, м), 2,98 (1H, дд, J=2, 14 Гц), 3,15 (1H, дд, J=2, 14 ГЦ), 3,47 (3Н, с), 4,00 (2Н, с), 6,85-6,89 (2Н, м), 7,04 (1H, д, J=2 Гц), 7,18-7,27 (7Н, м), 7,31-7,35 (1H, м), 8,19 (1H, д, J=2 Гц).
Пример 41: 3-[3-Бензил-5-(N-метилбензолсульфониламино)-2-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 40.
1H-ЯМР (CDCl3) δ: 1,35-1,95 (3Н, м), 1,98-2,08 (2Н, м), 2,70-2,95 (4Н, м), 3,03 (1H, д, J=14 Гц), 3,15 (3Н, с), 3,25 (1H, дд, J=2,14 Гц), 4,11 (2Н, с), 7,11 (2Н, д, J=7 Гц), 7,22-7,33 (4Н, м), 7,42 (2Н, т, J=7 Гц), 7,50 (2Н, дд, J=2,8 ГЦ), 7,57 (1H, т, J=7 Гц), 8,16 (1H, д, J=3 Гц).
Пример 42: 3-(2-Аллил-6-пиразил-3-пиридил)этинил-3-хинуклидинол
а) 2-Аллил-6-пиразил-3-пиридилтрифторметансульфонат
Смесь 1,22 г 2-бром-6-йод-3-пиридилтрифторметансульфоната (пример получения 17), 1,04 г пиразилтрибутилолова, 326 г тетракис(трифенилфосфин)палладия (0) и 10 мл ксилола перемешивали при 140°С в течение 2 часов. После остывания до комнатной температуры смесь фильтровали, используя силикагель, и растворитель выпаривали. Смесь остатка, 868 мкл аллилтрибутилолова, 324 мг тетракис(трифенилфосфин)-палладия (0) и 10 мл толуола кипятили с обратным холодильником в течение 1,5 часов. После остывания до комнатной температуры к смеси добавляли силикагель и растворитель выпаривали. Остаток подвергали колоночной хроматографии на силикагеле и элюировали 20% этилацетатом/гексаном с получением 500 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 3,79 (2Н, д, J=6 Гц), 5,20-5,26 (2Н, м), 6,11-6,21 (1Н, м), 7,75 (1Н, д, J=12 Гц), 8,37 (1Н, д, J=12 Гц), 8,60-8,63 (2Н, м), 9,68 (1Н, с).
b) 3-(2-Аллил-6-пиразил-3-пиридил)этинил-3-хинуклидинол
Смесь 500 мг 2-аллил-6-пиразил-3-пиридилтрифторметансульфоната, 203 мг 3-этинил-3-хинуклидинола, 155 мг тетракис(трифенилфосфин)палладия (0), 25,5 мг йодида меди, 0,560 мл триэтиламина и 5 мл N,N-диметилформамида перемешивали при 65°С в течение 20 минут в атмосфере азота. После остывания к реакционной смеси добавляли NH-силикагель и растворитель удаляли. Остаток подвергали колоночной хроматографии на NH-силикагеле, используя 2,5% метанол/ этилацетат, с получением 428 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,42-1,50 (1Н, м), 1,66-1,75 (1H, м), 1,97-2,14 (3Н, м), 2,82-2,98 (4Н, м), 3,11 (1H, д, J=14 Гц), 3,36 (1H, дд, J=2, 14 Гц), 3,84 (2Н, д, J=6 Гц), 5,14-5,20 (2Н, м), 6,13-6,22 (1H, м), 7,83 (1H, д, J=12 Гц), 8,19 (1H, д, J=12 Гц), 8,57-8,60 (2Н, м), 9,68 (1H, с).
Пример 43: 3-(2-Аллил-6-фенил-3-пиридил)этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 42.
1H-ЯМР (CDCl3) δ: 1,42-2,16 (5Н, м), 2,82-2,96 (4Н, м), 3,10 (1Н, д, J=14 Гц), 3,34 (1H, дд, J=2, 14 Гц), 3,83 (2Н, д, J=6 Гц), 5,14-5,18 (2Н, м), 6,13-6,23 (1Н, м), 7,39-7,57 (5Н, м), 7,73 (1Н, д, J=8 Гц), 8,03 (1H, д, J=8 Гц).
Пример 44: 3-[2-Аллил-6-(3-пиридил)-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 42.
1H-ЯМР (CDCl3) δ: 1,42-1,50 (1H, м), 1,65-1,74 (1H, м), 1,96-2,13 (3Н, м), 2,81-2,95 (4Н, м), 3,10 (1H, д, J=14 Гц), 3,34 (1H, дд, J=2, 14 Гц), 3,79-3,80 (2Н, м), 5,11-5,19 (2Н, м), 6,11-6,21 (1H, м), 7,39-7,42 (1H, м), 7,52-7,56(1H, м), 7,72-7,76 (1H, м), 8,35-8,37 (1H, м), 8,63-8,64 (1H, м), 9,21 (1H, с).
Пример 45: 3-[2-(2-Метил-2-пропенил)-6-пиразил-3-пиридил]этинил-3-хинуклидинол
а) 2-(2-Метил-2-пропенил)-6-пиразил-3-пиридилтрифторметансульфонат
Смесь 220 мг 2-бром-6-йод-3-пиридилтрифторметансульфоната, 187 мг пиразилтрибутилолова, 58,7 мг тетракис(трифенилфосфин)палладия (0) и 2 мл ксилола перемешивали при 140°С в течение 2 часов. После остывания до комнатной температуры смесь фильтровали через силикагель и растворитель выпаривали. К остатку добавляли 1,20 мл 2-метил-2-пропенилтрибутилолова (пример получения 21), 60,2 мг тетракис(трифенилфосфин)палладия (0) и 3 мл ксилола с последующим кипячением с обратным холодильником в течение 2 часов. После остывания до комнатной температуры туда добавляли силикагель и растворитель выпаривали. Остаток подвергали колоночной хроматографии на силикагеле и элюировали 20% этилацетатом/гексаном с получением 83,1 г целевого соединения.
1H-ЯМР (CDCl3) δ: 1,83 (3Н, с), 3,71 (2Н, с), 4,73 (1Н, с), 4,92 (1Н, с), 7,75 (1Н, д, J=8 Гц), 8,36 (1Н, д, J=8 Гц), 8,60-8,62 (2Н, м), 9,66 (1Н, с).
b) 3-[2-(2-Метил-2-пропенил)-6-пиразил-3-пиридил]этинил-3-хинуклидинол
Смесь 83,1 мг 2-(2-метил-2-пропенил)-6-пиразил-3-пиридилтрифторметансульфоната, 35,0 мг 3-этинил-3-хинуклидинола, 13,3 мг тетракис(трифенилфосфин)палладия (0), 2,2 мг йодида меди, 96,6 мкл триэтиламина и 1 мл N,N-диметилформамида перемешивали при комнатной температуре в течение одного часа в атмосфере азота. К реакционному раствору добавляли NH-силикагель и растворитель удаляли. Остаток подвергали колоночной хроматографии на NH-силикагеле, используя 2,5% метанол/этилацетат, с получением 71,2 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,42-1,49 (1Н, м), 1,65-1,74 (1Н, м), 1,85 (3Н, с), 1,97-2,12 (3Н, м), 2,78-2,95 (4Н, м), 3,10 (1Н, д, J=14 Гц), 3,34 (1Н, дд, J=2, М Гц), 3,78 (2Н, с), 4,70 (1Н, с), 4,88 (1Н, с), 7,83 (1Н, д, J=8 Гц), 8,19 (1Н, д, J=8 Гц), 8,58-8,60 (2Н, м), 9,67 (1Н, д, J=2 Гц).
Пример 46: 3-[2-Бензил-6-(4-пиридазил)-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 14.
1H-ЯМР (CDCl3) δ: 1,41-1,48 (1H, м), 1,63-1,91 (2Н, м), 2,04-2,09 (2Н, м), 2,76-2,92 (4Н, м), 3,07 (1H, д, J=14 Гц), 3,26 (1H, д, J=14 Гц), 4,41 (2Н, с), 7,19-7,33 (5Н, м), 7,65 (1H, д, J=8 Гц), 7,80 (1H, д, J=8 Гц), 8,04-8,06 (1H, м), 9,27-9,29 (1H, м), 9,78-9,79 (1H, м).
Пример 47: (3R)-3-[2-Бензил-б-(3-пиридазил)-3-пиридил]-этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 14.
1H-ЯМР (CDCl3) δ: 1,43-1,47 (1H, м), 1,60-1,87 (2Н, м), 2,05-2,08 (2Н, м), 2,71-2,99 (4Н, м), 3,05 (1H, д, J=14 Гц), 3,25 (1H, дд, J=2, 14 Гц), 4,42 (2Н, с), 7,21-7,30 (5Н, м), 7,52-7,60 (1H, м), 7,87 (1H, д, J=8 Гц), 8,54-8,58 (2Н, м), 9,17-9,19 (1H, м).
Пример 48: 3-[2-Бензил-6-(1,4-диоксен-2-ил)-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 14.
1H-ЯМР (CDCl3) δ: 1,39-1,41 (1H, м), 1,59-1,61 (1H, м), 1,80-1,87 (1H, м), 2,01-2,05 (2Н, м), 2,72-2,87 (4Н, м), 3,00 (1H, д, J=14 Гц), 3,20 (1H, дд, J=2, 14 Гц), 4,16-4,27 (6Н, м), 7,16-7,27 (6Н, м), 7,34 (1H, с), 7,61 (1H, д, J=8 Гц).
Пример 49: 3-[2-Бензил-6-(3-оксо-1-циклогексенил)-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 14 путем использования (3-оксо-1-циклогексенил)трибутилолова, синтезированное по методу, описанному в литературе (Tetrahedron Letters, Vol.31, No.13, 1837 (1990)).
1H-ЯМР (CDCl3) δ: 1,42-1,44 (1Н, м), 1,63-1,99 (2Н, м), 2,00-2,17 (4Н, м), 2,49-2,52 (2Н, м), 2,77-2,91 (6Н, м), 3,04 (1Н, д, J=14 Гц), 3,24 (1Н, дд, J=2, 14 Гц), 4,34 (2Н, с), 6,81 (1Н, т, J=1 Гц), 7,19-7,32 (5Н, м), 7,44 (1Н, д, J=8 Гц), 7,71 (1H, д, J=8 Гц).
Пример 50: 3-[2-Бензил-6-(3,4-дигидро-2Н-6-пиранил)-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 14 путем использования (3,4-дигидро-2Н-6-пиранил) трибутилолова, синтезированное по методу, описанному в литературе (Synlett 152 (1994)).
1H-ЯМР (CDCl3) δ: 1,38-1,48 (1H, м), 1,66-1,82 (2Н, м), 1,89-2,04 (4Н, м), 2,52-2,30 (2Н, м), 2,74-2,94 (4Н, м), 3,00 (1H, д, J=14 Гц), 3,20 (1H, дд, J=2, 14 Гц), 4,17-4,20 (2Н, м), 4,32 (2Н, с), 6,15-6,17 (1H, м), 7,17-7,26 (5Н, м), 7,38 (1H, д, J=8 Гц), 7,65 (1H, д, J=8 Гц).
Пример 51: 3-[2-Бензил-6-(2-гидроксифенил)-3-пиридил]этинил-3-хинуклидинол
а) 2-Бензил-3-гидрокси-6-(2-гидроксифенил)пиридин
Смесь 641 мг (2-бензил-3-метоксиметилокси-6-пиридил)трибутилолова (пример получения 18), 327 мг 2-метоксиметилоксийодбензола (пример получения 20), 71,6 мг тетракис(трифенилфосфин)палладия (0) и 7 мл ксилола кипятили с обратным холодильником в течение одного часа в атмосфере азота. После остывания смесь фильтровали через силикагель и растворитель удаляли. К остатку добавляли 2 мл трифторуксусной кислоты с последующим перемешиванием при комнатной температуре в течение ночи. Реакционный раствор нейтрализовали водным раствором карбоната калия. Добавляли этилацетат и органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Остаток подвергали колоночной хроматографии, используя 30% этилацетат/гексан, с получением 54,5 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 4,24 (2Н, с), 6,85-6,90 (1Н, м), 6,96-6,99 (1Н, м), 7,21-7,27 (3Н, м), 7,33-7,34 (4Н, м), 7,68-7,70 (2Н, м).
b) 2-Бензил-6-(2-гидроксифенил)-3-пиридилтрифторметансульфонат
Смесь 54,5 мг 2-бензил-3-гидрокси-6-(2-гидроксифенил)-пиридина, 70,2 мг N-фенилтрифторметансульфонимида, 824 мкл триэтиламина, 1,2 мг 4-диметиламинопиридина и 1,5 мл дихлорметана перемешивали при комнатной температуре в течение 2,5 часов. К реакционному раствору добавляли силикагель и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле, используя 12% этилацетат/гексан, с получением 68,5 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 4,29 (2Н, с), 6,88-6,92 (1H, м), 6,95-6,98 (1Н, м), 7,28-7,32 (4Н, м), 7,35-7,39 (2Н, м), 7,70-7,76 (2Н, м), 7,83 (1H, д, J=8 Гц), 12,81 (1H, с).
с) 3-[2-Бензил-6-(2-гидроксифенил)-3-пиридил]этинил-3-хинуклидинол
Смесь 67,0 мг 2-бензил-6-(2-гидроксифенил)-3-пиридилтрифторметансульфоната, 24,7 мг 3-этинил-3-хинуклидинола, 19,0 мг тетракис(трифенилфосфин)палладия (0), 0,1 мг йодида меди, 68,6 мкл триэтиламина и 1,5 мл N,N-диметилформамида нагревали при перемешивании при 100°С в течение 3 часов в атмосфере азота. К реакционному раствору добавляли NH-силикагель и растворитель удаляли. Остаток подвергали колоночной хроматографии на NH-силикагеле, используя 3% метанол/этилацетат, с получением 56,8 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,40-1,48 (1H, м), 1,52-1,60 (1H, м), 1,88-2,10 (3Н, м), 2,80-2,90 (4Н, м), 3,08 (1H, д, J=14 Гц), 3,28 (1H, дд, J=2, 14 Гц), 4,36 (2Н, с), 6,85-6,89 (1H, м), 6,96 (1H, д, J=8 Гц), 7,24-7,34 (6Н, м), 7,67-7,72 (2Н, м), 7,78 (1H, д, J=8 Гц), 13,8 (1H, с).
Пример 52: (3R)-3-[2-Бензил-6-(1,3,4-тиадиазол-2-ил)-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 51, используя 2-йод-1,3,4-тиадиазол (пример получения 22).
1H-ЯМР (CDCl3) δ: 1,41-1,44 (1H, м), 1,62-1,98 (2Н, м), 2,01-2,07 (2Н, м), 2,50-2,95 (4Н, м), 3,05 (1H, д, J=14 Гц), 3,24 (1H, дд, J=2, 14 Гц), 4,37 (2Н, с), 7,19-7,29 (5Н, м), 7,82 (1Н, д, J=8 Гц), 8,18 (1H, д, J=8 Гц), 9,16 (1Н, с).
Пример 53: 3-[2-(4-Метоксибензил)-6-метил-3-пиридил]этинил-3-хинуклидинол
a) 3-Бензилокси-2-[(4-метоксифенил)гидроксиметил]-6-метилпиридин
1,6 М раствор н-бутиллития в гексане по каплям добавляли к смеси 2,43 4-броманизола и 20 мл диэтилового эфира при -50°С с последующим перемешиванием при -20°С в течение 30 минут. Далее туда добавляли смесь 2,27 г 3-бензилокси-6-метилпиридин-2-карбоксиальдегида (пример получения 11b) и 50 мл диэтилового эфира при -60°С в течение 15 минут. После перемешивания при той же температуре в течение 30 минут к реакционному раствору добавляли насыщенный водный раствор хлорида аммония. Смесь экстрагировали этилацетатом и органическую фазу промывали насыщенным раствором соли, сушили над безводным сульфатом магния и концентрировали. Остаток подвергали колоночной хроматографии на силикагеле, используя 5-20% этилацетат/гексан, с получением 1,16 г целевого соединения.
1H-ЯМР (CDCl3) δ: 2,52 (3Н, с), 3,77 (3Н, с), 4,92 (1Н, д, J=12 Гц), 4,98 (1Н, д, J=12 Гц), 5,75 (1Н, д, J=6 Гц), 5,87 (1Н, д, J=6 Гц), 6,79 (2Н, д, J=9 Гц), 6,98 (1Н, д, J=8 Гц), 7,03 (1H, д, J=8 Гц), 7,10-7,15 (2Н, м), 7,23 (2Н, д, J=9 Гц), 7,27-7,34 (3Н, м).
b) 3-Гидрокси-2-(4-метоксибензил)-6-метилпиридин
Смесь 0,87 г 3-бензилокси-2-[(4-метоксифенил)гидрокси-метил]-6-метилпиридина, 2,5 мл уксусного ангидрида и 20 мл пиридина нагревали при перемешивании в течение 4 часов на масляной бане при температуре 120°С. После выпаривания реакционного раствора добавляли воду. Смесь экстрагировали этилацетатом и органическую фазу промывали насыщенным раствором соли, сушили над безводным сульфатом магния и концентрировали. К остатку добавляли 20 мл метанола, 10 мл тетрагидрофурана и каталитическое количество 10% палладия на угле с последующим перемешиванием в течение 10 часов в атмосфере водорода. После того как катализатор отфильтровывали, фильтрат концентрировали. Затем кристаллы промывали диэтиловым эфиром с получением 320 мг целевого соединения.
1H-ЯМР (CDCl3-DMSO) δ: 2,32 (3Н, с), 3,69 (3Н, с), 3,92 (2Н, с), 6,80 (2Н, д, J=8 Гц), 6,92 (1Н, д, J=7 Гц), 7,07 (1Н, д, J=7 Гц), 7,14 (2Н, д, J=8 Гц).
с) 2-(4-Метоксибензил)-6-метил-3-пиридилтрифторметансульфонат
Смесь 160 мг 3-гидрокси-2-(4-метоксибензил)-6-метилпиридина, 300 мг N-фенилтрифторметансульфонимида, 146 мкл триэтиламина, 26 мг 4-диметиламинопиридина и 5,0 мл дихлорметана перемешивали при комнатной температуре в течение 2 часов. К реакционному раствору добавляли воду и смесь экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором соли и растворитель удаляли. Остаток подвергали колоночной хроматографии на NH-силикагеле (Fuji silicia), элюируя гексаном, а затем гексаном/этилацетатом (2:1), с получением 230 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 2,57 (3Н, с), 3,77 (3Н, с), 4,15 (2Н, с), 6,80-6,82 (2Н, м), 7,08 (1Н, д, J=8 Гц), 7,19-7,21 (2Н, м), 7,44 (1Н д, J=8 Гц).
d) 3-[2-(4-Метоксибензил)-6-метил-3-пиридил]этинил-3-хинуклидинол
Смесь 230 мг 2-(4-метоксибензил)-6-метил-3-пиридил-трифторметансульфоната, 116 мг 3-этинил-3-хинуклидинола, 147 мг тетракис(трифенилфосфин)палладия (0), 24 мг йодида меди, 266 мкл триэтиламина и 5,0 мл N,N-диметилформамида нагревали при перемешивании при 80°С в течение 3 часов в атмосфере азота. Реакционный раствор выливали в разбавленный водный раствор аммиака и смесь экстрагировали этилацетатом. Затем органическую фазу промывали насыщенным раствором соли и растворитель удаляли. Остаток подвергали колоночной хроматографии на NH-силикагеле (Fuji Silicia) и элюировали гексаном/этилацетатом (1:1), а затем этилацетатом/метанолом (20:1), с получением 192 г целевого соединения.
1H-ЯМР (CDCl3) δ: 1,35-1,44 (1Н, м), 1,54-1,65 (1Н, м), 1,77-1,89 (1Н, м), 2,02-2,04 (2Н, м), 2,54 (3Н, с), 2,75-2,95 (4Н, м), 3,02 (1Н, дд, J=2, 14 Гц), 3,23 (1Н, дд, J=2, 14 Гц), 3,75 (ЗН, с), 4,23 (2Н, с), 6,77-6,80 (2Н, м), 6,97 (1Н, д, J=8 Гц), 7,16-7,19 (2Н, м), 7,55 (1Н, д, J=8 Гц).
Пример 54: 3-[6-Метил-2-(2-пиридилметил)-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 53.
1H-ЯМР (CDCl3) δ: 1,38-1,44 (1H, м), 1,53-1,84 (2Н, м), 1,96-2,14 (2Н, м), 2,58 (3Н, с), 2,75-2,95 (4Н, м), 3,05 (1Н, д, J=14 Гц), 3,16 (1Н, дд, J=2, 14 Гц), 4,49 (2Н, с), 7,00 (1H, д, J=8 Гц), 7,11-7,15 (1H, м), 7,25-7,30 (1H, м), 7,49 (1H, д, J=8 Гц), 7,55-7,60 (1H, м), 7,44-8,47 (1H, м).
Пример 55: 3-[6-Метил-2-(3-пиридилметил)-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 53.
1H-ЯМР (CDCl3) δ: 1,31-1,39 (1H, м), 1,52-1,7 8 (2Н, м), 1,93-2,00 (2Н, м), 2,47 (3Н, с), 2,63-2,89 (4Н, м), 2,98 (1H, дд, J=2, 14 Гц), 3,15 (1H, дд, J=2, 14 Гц), 4,21 (2Н, с), 6,93 (1H, д, J=8 Гц), 7,09-7,19 (1H, м), 7,51 (1H, д, J=8 Гц), 7,53-7,63 (1H, м), 8,34-8,36 (1H, м), 8,50 (1H, д, J=2 Гц).
Пример 56: 3-[6-Метил-2-(4-пиридилметил)-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 53.
1H-ЯМР (CDCl3) δ: 1,36-1,45 (1H, м), 1,54-1,80 (2Н, м), 1,97-2,06 (2Н, м), 2,55 (3Н, с), 2,66-2,95 (4Н, м), 3,03 (1H, дд, J=2, 14 Гц), 3,19 (1H, дд, J=2, 14 Гц), 4,28 (2Н, с), 7,04 (1H, д, J=8 Гц), 7,13-7,15 (2Н, м), 7,61 (1H, д, J=8 Гц), 8,40-8,42 (2Н, м).
Пример 57: 3-[2-(2-Фенилэтил)-6-метил-3-пиридил]этинил-3-хинуклидинол
a) 3-Бензилокси-6-метил-2-стирилпиридин
1,5 г диэтилбензилфосфоната растворяли в 20 мл тетрагидрофурана с последующим добавлением 810 мг трет-бутоксида калия при комнатной температуре. После перемешивания в течение 15 минут туда добавляли 10 мл тетрагидрофуранового раствора, содержащего 1,2 г 3-бензилокси-6-метилпиридин-2-карбоксиальдегида (пример получения 11b), и затем перемешивали в течение 1,5 часов. Затем туда добавляли воду и смесь экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле, используя 10% этилацетат/гексан в качестве элюента, с получением 1,2 г целевого соединения.
1H-ЯМР (CDCl3) δ: 2,53 (3Н, с), 5,13 (2Н, с), 6,95 (1Н, д, J=8,4 Гц), 7,12 (1Н, д, J=8,4 Гц), 7,24-7,48 (8Н, м), 7,59 (2Н, д, J=8,4 Гц), 7,61 (1Н, д, J=16 Гц), 7,80 (1Н, д, J=16 Гц).
b) 3-Гидрокси-6-метил-2-(2-фенилэтил)пиридин
1,2 г 3-бензилокси-6-метил-2-стирилпиридина растворяли в 20 мл метанола. Туда добавляли 684 мг 10% палладия на угле и смесь гидрировали. Атмосферу в реакционной системе заменяли азотом и катализатор отфильтровывали. Фильтрат выпаривали с получением 695 мг целевого соединения.
c) 6-Метил-2-(2-фенилэтил)пиридилтрифторметансульфонат
Смесь 695 мг 3-гидрокси-6-метил-2-(2-фенилэтил)пиридина, 1,5 г N-фенилтрифторметансульфонимида, 121 мг 4-диметиламинопиридина и 0,6 мл триэтиламина растворяли в 20 мл дихлорметана с последующим перемешиванием при комнатной температуре в течение 5 часов. Затем растворитель удаляли и остаток подвергали колоночной хроматографии на силикагеле, используя 10% этилацетат/гексан в качестве элюента, с получением 1,2 г целевого соединения.
1H-ЯМР (CDCl3) δ: 2,59 (3Н, с), 3,02-3,09 (2Н, м), 3,12-3,19 (2Н, м), 7,08 (1Н, д, J=8,4 Гц), 7,20-7,31 (5Н, м), 7,44 (1Н, д, J=8,4 Гц).
d) 3-[2-(2-Фенилэтил)-6-метил-3-пиридил]этинил-3-хинуклидинол
10 мл N,N-диметилформамида добавляли к смеси 1,2 г 6-метил-2-(2-фенилэтил)пиридилтрифторметансульфоната, 522 мг 3-этинил-3-хинуклидинола, 400 мг тетракис(трифенилфосфин)-палладия (0), 217 мг йодида меди и 1,7 мл триэтиламина с последующим нагреванием при перемешивании при 50°С на масляной бане в течение одного часа в атмосфере азота. После остывания реакционный раствор разбрызгивали над силикагелем и подвергали колоночной хроматографии на силикагеле, используя хлороформ/метанол/водный 36% раствор аммиака (46:5:0,5) в качестве элюента для разделения и очистки, с получением 490 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,42-1,52 (1Н, м), 1,61-1,72 (1H, м), 1,89-2,02 (1H, м), 2,04-2,16 (2Н, м), 2,56 (3Н, с), 2,80-2,95 (4Н, м), 3,02-3,11 (3Н,м), 3,20-3,32 (3Н, м), 6,97 (1H, д, J=8,0 Гц), 7,18-7,28 (5Н, м), 7,54 (1H, д, J=8,0 Гц).
Пример 58: 3-(2-Стирил-6-метил-3-пиридил)этинил-3-хинуклидинол
a) 3-Гидрокси-6-метил-2-стирилпиридин
875 мг 3-бензилокси-6-метил-2-стирилпиридина (пример 57а) растворяли в 15 мл 1,2-дихлорэтана и туда добавляли 1,2 мл дихлорметанового раствора, содержащего 1,0 моль трибромида бора, в атмосфере азота с последующим нагреванием при перемешивании при 50°С на масляной бане в течение ночи. После остывания туда добавляли насыщенный водный раствор бикарбоната натрия и смесь экстрагировали 5% метанолом/дихлорметаном. Органическую фазу далее промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Остаток сушили в вакууме с получением 200 мг целевого соединения.
b) 3-(2-Стирил-6-метил-3-пиридил)этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как в примере 57.
1H-ЯМР (CDCl3) δ: 1,40-1,50 (1H, м), 1,66-1,80 (1H, м), 2,00-2,18 (3Н, м), 2,59 (3Н, с), 2,80-3,00 (4Н, м), 3,12 (1H, д, J=14 Гц), 3,38 (1H, дд, J=2, 14 Гц), 6,96 (1H, д, J=7,9 Гц), 7,30 (1H, д, J=7,3 Гц), 7,37 (2Н, дд, J=7,5 Гц, 7,3 Гц), 7,565 (1H, д, J=7,9 Гц), 7,572 (1H, д, J=7,5 Гц), 7,60 (1H, д, J=16 Гц), 7,97 (1H, д, 16 Гц).
Пример 59: 3-[2-Бензил-6-(3-метоксипропил)-3-пиридил]этинил-3-хинуклидинол
a) 2-Бензил-6-(2-этоксикарбонилэтенил)-3-метоксиметилоксипиридин
1,3 г этилдиэтилфосфоноацетат растворяли в 20 мл тетрагидрофурана с последующим добавлением 657 мг трет-бутоксида калия при комнатной температуре. После перемешивания в течение 15 минут туда же добавляли 10 мл тетрагидрофуранового раствора, содержащего 1,0 г 2-бензил-3-метоксиметилоксипиридин-6-карбоксальдегида (пример получения 11) с последующим перемешиванием в течение еще одного часа. Органическую фазу промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле, используя 17% этилацетат/гексан в качестве элюента для разделения и очистки, с получением 1,4 г целевого соединения.
b) 2-Бензил-6-(2-этоксикарбонилэтил)-3-метоксиметилоксипиридин
1,4 г 2-бензил-6-(2-этоксикарбонилэтенил)-3-метоксиметилоксипиридин растворяли в 20 мл этилацетата. Туда добавляли 457 мг 10% палладия-на-угле и смесь гидрировали. После того как атмосферу в реакционной системе заменяли азотом, катализатор отфильтровывали. Фильтрат дополнительно фильтровали через силикагель и фильтрат выпаривали с получением 1,3 г целевого соединения.
1H-ЯМР (CDCl3) δ: 1,22 (3Н, т, J=7,1 Гц), 2,76 (2Н, т, J=7,6 Гц), 3,05 (2Н, т, J=7,6 Гц), 3,30 (3Н, с), 4,13 (2Н, кв, J=7,1 Гц), 4,15 (2Н, с), 5,09 (2Н, с), 6,97 (1Н, д, J=8,4 Гц), 7,14-7,29 (6Н, м).
c) 2-Бензил-6-(3-гидроксипропил)-3-метоксиметилоксипиридин
205 мг литийалюмогидрида суспендировали в 20 мл безводного эфира. По каплям добавляли в 10 мл безводного эфирного раствора, содержащего 1,3 г 2-бензил-6-(2-этоксикарбонилэтил)-3-метоксиметилоксипиридина, при охлаждении льдом. После перемешивания в течение одного часа туда добавляли 0,2 мл воды, затем 0,2 мл водного 5N раствора гидроксида натрия и затем 0,6 мл воды при охлаждении льдом. Реакционный раствор фильтровали через фильтровальную бумагу для удаления нерастворимых веществ. После промывания эфиром органическую фазу выпаривали. Остаток подвергали колоночной хроматографии на силикагеле, используя 40% этилацетат/гексан в качестве элюента, для разделения и очистки с получением 1,0 г целевого соединения.
1H-ЯМР (CDCl3) δ: 1,94 (2Н, тт, J=6,5 Гц, 5,7 Гц), 2,91 (2Н, т, J=6,5 Гц), 3,34 (3Н, с), 3,70 (2Н, т, J=5,7 Гц), 4,15 (2Н, с), 5,13 (2Н, с), 6,97 (1Н, д, J=8,4 Гц), 7,15-7,31 (6Н, м).
d) 2-Бензил-6-(3-метоксипропил)-3-метоксиметилоксипиридин
527 мг 2-Бензил-6-(3-гидроксипропил)-3-метоксиметилоксипиридина растворяли в 5 мл N,N-диметилформамида и добавляли 108 мг 60% суспензии гидрида натрия в масле при комнатной температуре при перемешивании. Через 10 минут туда добавляли 0,16 мл метилйодида с последующим перемешиванием в течение одного часа при комнатной температуре. Затем туда добавляли воду и смесь экстрагировали этилацетатом. Органическую фазу далее промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле, используя 20% этилацетат/гексан в качестве элюента для разделения и очистки, с получением 389 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,98 (2Н, тт, J=7,8 Гц, 6,6 Гц), 2,79 (2Н, т, J=7,8 Гц), 3,31 (3Н, с), 3,34 (3Н, с), 3,41 (2Н, т, J=6,6 Гц), 4,17 (2Н, с), 5,09 (2Н, с), 6,95 (1Н, д, J=8, 4 Гц), 7,14-7,30 (6Н, м).
е) 3-[2-Бензил-6-(3-метоксипропил)-3-пиридил]этинил-3-хинуклидинол
У соединения, полученного, как описано выше, удаляли защиту, используя трифторуксусную кислоту, и последовательно проводили те же процедуры, что и в примере 57, для синтеза целевого соединения.
1H-ЯМР (CDCl3) δ: 1,35-1,45 (1H, м), 1,53-1,63 (1Н, м), 1,75-1,88 (1H, м), 1,98-2,05 (4Н, м), 2,67-2,92 (4Н, м), 2,85 (2Н, т, J=7,5 Гц), 3,00 (1H, дд, J=2, 14 Гц), 3,20 (1H, дд, J=2, 14 Гц), 3,32 (3Н, с), 3,40 (2Н, т, J=6,4 Гц), 4,31 (2Н, с), 6,99 (1H, д, J=7,9 Гц), 7,15-7,26 (5Н, м), 7,58 (1H, д, J=7,9 Гц).
Пример 60; 3-[2-Бензил-6-(5,6-дигидро-2Н-пиран-4-ил)-3-пиридил]этинил-3-хинуклидинол
а) 2-Бензил-6-(4-гидрокситетрагидро-4Н-пиран-4-ил)-3-метоксиметилоксипиридин
В 10 мл диэтилэфирного раствора, содержащего 1,79 г 2-бензил-6-йод-3-метоксиметилоксипиридина (пример получения 12), по каплям добавляли к смеси 4,25 мл гексанового раствора 1,54 моль н-бутиллития и 10 мл диэтилового эфира при -78°С. После перемешивания при той же температуре в течение 20 минут туда по каплям добавляли тетрагидро-4Н-пиран-4-он. Температуру полученной смеси поднимали до комнатной температуры и туда добавляли воду и диэтиловый эфир. Органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле, используя 30% этилацетат/гексан, с получением 1,39 г целевого соединения.
1H-ЯМР (CDCl3) δ: 1,47-1,56 (2Н, м), 2,05-2,12 (2Н, м), 3,38 (3Н, с), 3,90-4,01 (4Н, м), 4,19 (2Н, с), 5,18 (2Н, с), 7,14-7,30 (6Н, м), 7,41 (1Н, д, J=8 Гц).
b) 2-Бензил-3-гидрокси-6-(4-гидрокситетрагидро-4Н-пиран-4-ил)пиридин
Смешанный раствор 377 мг 2-бензил-6-(4-гидрокситетрагидро-4Н-пиран-4-ил)-3-метоксиметилоксипиридина, 2 мл дихлорметана и 2 мл трифторуксусной кислоты перемешивали при комнатной температуре в течение ночи. Реакционный раствор нейтрализовали водным раствором бикарбоната натрия и туда добавляли этилацетат. Органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле, используя 60% этилацетат/гексан, с получением 241 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,51-1,57 (2Н, м), 2,05-2,12 (2Н, м), 3,90-4,01 (4Н, м), 4,21 (2Н, с), 5,00 (1Н, с), 5,39 (1Н, с), 7,12 (2Н, с), 7,21-7,30 (5Н, м).
с) 2-Бензил-6-(4-гидрокситетрагидро-4Н-пиран-4-ил)-3-пиридилтрифторметансульфонат
Смесь 241 мг 2-бензил-3-гидрокси-6-(4-гидрокситетра-гидро-4Н-пиран-4-ил)пиридина, 302 мг N-фенилтрифторметан-сульфонимида, 353 мкл триэтиламина, 5,2 мг 4-диметиламинопиридина и 3 мл дихлорметана перемешивали при комнатной температуре в течение 2 часов. К реакционному раствору добавляли силикагель и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле, используя 30% этилацетат/гексан, с получением 332 г целевого соединения.
1H-ЯМР (CDCl3) δ: 1,53-1,56 (2Н, м), 2,08-2,17 (2Н, м), 3,92-3,97 (4Н, м), 4,26 (2Н, с), 4,60 (1Н, с), 7,23-7,36 (6Н, м), 7,65 (1Н, д, J=8 Гц).
d) 2-Бензил-6-(5,6-дигидро-2Н-пиран-4-ил)-3-пиридил-трифторметансульфонат
57,9 мкл метансульфонилхлорида по каплям добавляли к смеси 104 мг 2-бензил-6-(4-гидрокситетрагидро-4Н-пиран-4-ил)-3-пиридилтрифторметансульфоната, 139 мкл триэтиламина и 2 мл дихлорметана при охлаждении льдом. После перемешивания при комнатной температуре в течение 3 часов туда добавляли воду и этилацетат. Органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле, используя 15% этилацетат/гексан, с получением 60,7 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 2,60 (2Н, шир.с), 3,92 (2Н, т, J=5 Гц), 4,23 (2Н, с), 4,37 (2Н, с), 6,74 (1Н, с), 7,21-7,31 (6Н, м), 7,53 (1Н, д, J=8 Гц).
е) 3-[2-Бензил-6-(5,6-дигидро-2Н-пиран-4-ил)-3-пиридил]-этинил-3-хинуклидинол
Смесь 60,7 г 2-бензил-6-(5,6-дигидро-2Н-пиран-4-ил)-3-пиридилтрифторметансульфоната, 23,0 мг 3-этинил-3-хинуклидинола, 17,6 мг тетракис(трифенилфосфин)палладия (0), 2,9 мг йодида меди, 63,6 мкл триэтиламина и 1 мл N,N-диметилформамида перемешивали при 60°С в течение 1,5 часов в атмосфере азота. К реакционному раствору добавляли NH-силикагель и растворитель удаляли. Остаток подвергали колоночной хроматографии на NH-силикагеле, используя 3% метанол/этилацетат, с получением 40,7 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,33-1,44 (1Н, м), 1,56-1,64 (1Н, м), 1,80-1,88 (1Н, м), 2,00-2,07 (2Н, м), 2,60 (1Н, шир.с), 2,73-2,88 (4Н, м), 3,02 (1Н, д, J=14 Гц), 3,22 (1H, дд, J=2, 14 Гц), 3,93 (1H, т, J=5 Гц), 4,31 (2Н, с), 4,36-4,38 (2Н, м), 6,75-6,77 (1H, м), 7,12-7,29 (6Н, м), 7,61 (1H, д, J=8 Гц).
Пример 61: 3-[2-Бензил-6-(4-гидрокси-1-циклогексенил)-3-пиридил]этинил-3-хинуклидинол
а) 2-Бензил-3-гидрокси-6-(4-оксо-1-гидроксициклогексил)-пиридин
Целевое соединение синтезировали так же, как и в примере 60а и b, за исключением того, что тетрагидро-4Н-пиран-4-он заменяли 1,4-циклогександионмоноэтиленкеталем.
1H-ЯМР (CDCl3) δ: 2,00-2,06 (2Н, м), 2,14-2,22 (2Н, м), 2,35-2,41 (4Н, м), 2,95-3,04 (2Н, м), 4,21 (2Н, с), 7,05-7,31 (7Н, м).
b) 2-Бензил-6-(1,4-дигидроксициклогексил)-3-пиридин 67,4 мг боргидрида натрия добавляли к смеси 353 мг 2-бензил-3-гидрокси-6-(4-оксо-1-гидроксициклогексил)пиридина и 4 мл метанола при охлаждении льдом с последующим перемешиванием при той же температуре в течение одного часа. Туда же добавляли ацетон и растворитель удаляли. Затем остаток подвергали колоночной хроматографии на силикагеле, используя 20% гексан/этилацетат, с получением 193 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,30-1,95 (8Н, м), 3,70-3,75 (1Н, м), 4,20 (2Н, с), 7,06-7,31 (7Н, м).
c) 3-[2-Бензил-6-(4-гидрокси-1-циклогексенил)-3-пиридил]-этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 60-c, d и е, за исключением того, что 2-бензил-3-гидрокси-6-(4-гидрокситетрагидро-4Н-пиран-4-ил)пиридин заменяли 2-бензил-6-(1,4-дигидроксициклогексил)-3-гидроксипиридином.
1H-ЯМР (CDCl3) δ: 1,37-1,44 (1Н, м), 1,56-1,64 (1H, м), 1,77-1,88 (2Н, м), 2,00-2,06 (3Н, м), 2,24-2,31 (1H, м), 2,51-2,91 (7Н, м), 3,01 (1H, д, J=14 Гц), 3,22 (1H, дд, J=2, 14 Гц), 4,04-4,10 (1Н, м), 4,31 (2Н, с), 6,69 (1Н, с), 7,16-7,28 (6Н, м), 7,60 (1H, д, J=8 Гц).
Пример 62: 3-[2-Бензил-6-(тетрагидро-4Н-пиран-4-ил)-3-пиридил]этинил-3-хинуклидинол
a) 2-Бензил-6-(5,6-дигидро-2Н-пиран-4-ил)-3-метоксиметил-оксипиридин
716 мкл метансульфонилхлорида по каплям добавляли в смесь 1,02 г 2-бензил-6-(4-гидрокситетрагидро-4Н-пиран-4-ил)-3-метоксиметилоксипиридина (пример 60а), 1,72 мл триэтиламина и 10 мл дихлорметана при охлаждении льдом. После перемешивания в течение ночи при комнатной температуре туда добавляли воду и этилацетат. Органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле, используя 20% этилацетат/гексан, с получением 355 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 2,59-2,63 (2Н, м), 3,33 (3Н, с), 3,94 (2Н, т, J=5 Гц), 4,19 (2Н, с), 4,35-4,38 (2Н, м), 5,15 (2Н, с), 6,59-6,62 (1Н, м), 7,13-7,33 (7Н, м).
b) 2-Бензил-3-метоксиметилокси-6-(тетрагидро-4Н-пиран-4-ил)пиридин
20 мг 10% палладия на угле добавляли к смеси 197 мг 2-бензил-6-(5,6-дигидро-2Н-пиран-4-ил)-3-метоксиметилоксипиридина и 3 мл этанола с последующим перемешиванием при комнатной температуре в течение ночи в атмосфере водорода. После того как атмосферу в реакционной системе заменяли азотом, реакционный раствор фильтровали через целит. Растворитель удаляли и затем остаток подвергали колоночной хроматографии на силикагеле, используя 20% этилацетат/гексан, с получением 83,7 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,83-1,88 (4Н, м), 2,88-2,96 (1Н, м), 3,32 (3Н, с), 3,52-3,58 (2Н, м), 4,06-4,17 (4Н, м), 5,10 (2Н, с), 6,96 (1Н, д, J=8 Гц), 7,12-7,16 (1Н, м), 7,21-7,31 (5Н, м).
с) 3-[2-Бензил-6-(тетрагидро-4Н-пиран-4-ил)-3-пиридил]-этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 60b, с и е.
1H-ЯМР (CDCl3) δ: 1,36-1,44 (1Н, м), 1,55-1,63 (1H, м), 1,79-1,90 (5Н, м), 1,98-2,04 (2Н, м), 2,68-2,87 (5Н, м), 3,01 (1H, д, J=14 Гц), 3,22 (1H, дд, J=2, 14 Гц), 3,41-3,58 (2Н, м), 4,07-4,11 (2Н, м), 4,30 (2Н, с), 6,99 (1H, д, J=8 Гц), 7,15-7,27 (5Н, м), 7,62 (1H, д, J=8 Гц).
Пример 63: 3-[2-Бензил-6-(3-метокси-1-пропинил)-3-пиридил]этинил-3-хинуклидинол
Смесь 500 мг 2-бензил-3-бром-6-пиридилтрифторметансульфоната, полученного в примере получения 3, 0,12 мл метилпропаргилового эфира, 40 мг тетракис(трифенилфосфин)-палладия (0), 1,2 мг йодида меди, 0,53 мл триэтиламина и 1 мл N,N-диметилформамида перемешивали при комнатной температуре в течение ночи в атмосфере азота. К реакционному раствору добавляли этилацетат и водный разбавленный раствор аммиака для разделения. Органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и затем концентрировали. Остаток подвергали колоночной хроматографии на силикагеле, используя 1-10% этилацетат/гексан, с получением 170 мг 2-бензил-3-бром-6-(3-метокси-1-пропинил)пиридина.
Затем смесь 170 мг 2-бензил-3-бром-6-(3-метокси-1-пропинил)пиридина, 90 мг 3-этинил-3-хинуклидинола, 30 мг тетракис(трифенилфосфин)палладия (0), 1 мг йодида меди, 0,22 мл триэтиламина и 1 мл N,N-диметилформамида перемешивали в течение 2 часов на масляной бане при температуре 85°С в атмосфере азота. К реакционному раствору добавляли этилацетат и разбавленный водный раствор аммиака для разделения. Органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и концентрировали. Остаток подвергали колоночной хроматографии на силикагеле, элюируя 20-100% этилацетатом/гексаном и затем 2,5% метанолом/этилацетатом, с получением 120 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,35-1,84 (3Н, м), 1,96-2,06 (2Н, м), 2,64-2,92 (4Н, м), 2,99 (1Н, дд, J=2, 14 Гц), 3,17 (1Н, дд, J=2, 14 Гц), 3,47 (3Н, с), 4,33 (2Н, с), 4,36 (2Н, с), 7,15-7,28 (5Н, м), 7,30 (1Н, д, J=8 Гц), 7,64 (1Н, д, J=8 Гц).
Пример 64: 3-[2-Бензил-6-(4-гидрокси-1-бутинил)-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 63.
1H-ЯМР (CDCl3) δ: 1,34-1,84 (3Н, м), 1,96-2,06 (2Н, м), 2,64-2,92 (4Н, м), 2,73 (2Н, т, J=6 Гц), 2,99 (1Н, дд, J=2, 14 Гц), 3,16 (1Н, дд, J=2, 14 Гц), 3,85 (2Н, т, J=6 Гц), 4,31 (2Н, с), 7,14-7,28 (6Н, м), 7,60 (1Н, д, J=8 Гц).
Пример 65: 3-[2-(4-Фторбензил)-6-(3-гидрокси-1-бутинил)-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 63.
1H-ЯМР (CDCl3) δ: 1,35-1,85 (6Н, м), 1,95-2,08 (2Н, м), 2,68-2,93 (4Н, м), 3,03 (1Н, д, J=14 Гц), 3,21 (1Н, дд, J=2,14 Гц), 4,28 (2Н, с), 4,79 (1Н, кв, J=7 Гц), 6,94 (2Н, т, J=8 Гц), 7,20 (2Н, дд, J=6,8 Гц), 7,28 (1Н, д, J=8 Гц), 7,65 (1Н, д, J=8 Гц).
Пример 66: 3-[2-Бензил-6-(пиразилэтинил)-3-пиридил]этинил-3-хинуклидинол
а) 2-Бензил-3-бром-6-(пиразилэтинил)пиридин
Смесь 788 мг 2-бензил-3-бром-6-пиридилтрифторметансульфоната (пример получения 3), 207 мг пиразилацетилена (пример получения 19), 230 мг тетракис(трифенилфосфин)-палладия (0), 37,9 мг йодида меди, 832 мкл триэтиламина и 6 мл N,N-диметилформамида перемешивали при 80°С в течение одного часа в атмосфере азота. К реакционному раствору добавляли силикагель и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле, используя 25% этилацетат/гексан, с получением 443 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 4,39 (2Н, с), 7,19-7,39 (6Н, м), 7,87 (1Н, д, J=8 Гц), 8,54-8,56 (1H, м), 8,61-8,62 (1Н, м), 8,86 (1H, с).
b) 3-[2-Бензил-6-(пиразилэтинил)-3-пиридил]этинил-3-хинуклидинол
Смесь 109 мг 2-бензил-3-бром-6-(пиразилэтинил)пиридина, 47,1 мг 3-этинил-3-хинуклидинола, 35,9 мг тетракис-(трифенилфосфин)палладия (0), 5,9 мг йодида меди, 130 мкл триэтиламина и 1,5 мл N,N-диметилформамида перемешивали в течение 5 часов при 70°С в атмосфере азота. К реакционному раствору добавляли NH-силикагель и растворитель удаляли. Остаток подвергали колоночной хроматографии на NH-силикагеле, используя 3% метанол/этилацетат, с получением 61,0 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,37-1,43 (1H, м), 1,56-1,64 (1H, м), 1,75-1,83 (1H, м), 1,98-2,04 (2Н, м), 2,67-2,88 (4Н, м),3,01 (1H, д, J=14 Гц), 3,19 (1H, дд, J=2, 14 Гц), 4,38 (2Н, с), 7,17-7,28 (5Н, м), 7,48 (1H, д, J=8 Гц), 7,70 (1H, д, J=8 Гц), 8,53-8,54 (1H, м), 8,61-8,62 (1H, м), 8,85-8,86 (1H, м).
Пример 67: 3-[2-Бензил-6-(2-пиразилэтил)-3-пиридил]этинил-3-хинуклидинол
а) 2-Бензил-3-бром-6-(2-пиразилэтил)пиридин
12 мг оксида платины добавляли к смеси 230 мг 2-бензил-3-бром-6-(пиразилэтинил) пиридина (пример получения 66-а), 2,5 мл этилацетата и 2 мл метанола с последующим перемешиванием при комнатной температуре в течение ночи в атмосфере водорода. После того как атмосферу в реакционной системе заменяли азотом, реакционный раствор фильтровали через целит. После удаления растворителя остаток подвергали колоночной хроматографии на силикагеле, используя 50% этилацетат/гексан, с получением 85,4 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 3,20-3,30 (4Н, м), 4,30 (2Н, с), 6,84 (1Н, д, J=8 Гц), 7,17-7,28 (5Н, м), 7,66 (1Н, д, J=8 Гц), 8,34 (1Н, с), 8,38 (1Н, д, J=2 Гц), 8,47-8,48 (1Н, м).
b) 3-[2-Бензил-б-(2-пиразилэтил)-3-пиридил]этинил-3-хинуклидинол
Смесь 85,4 мг 2-бензил-3-бром-6-(2-пиразилэтил)пиридина, 36,4 мг 3-этинил-3-хинуклидинола, 27,8 мг тетракис-(трифенилфосфин)палладия (0), 4,6 мг йодида меди, 101 мкл триэтиламина и 1,5 мл N,N-диметилформамида перемешивали в течение 7 часов при 80°С в атмосфере азота. К реакционному раствору добавляли NH-силикагель и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле, используя 3% метанол/этилацетат, с получением 45,4 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,36-1,44 (1Н, м), 1,54-1,63 (1H, м), 1,78-1,86 (1H, м), 1,98-2,05 (2Н, м), 2,67-2,91 (4Н, м), 3,01 (1H, д, J=14 Гц), 3,20 (1H, дд, J=2, 14 Гц), 3,25-3,27 (4Н, м), 4,30 (2Н, с), 6,92 (1H, д, J=8 Гц), 7,16-7,28 (5Н, м), 7,54 (1H, д, J=8 Гц), 8,32 (1H, с), 8,36 (1H, д, J=2 Гц), 8,47-8,48 (1H, м).
Пример 68: 3-[2-Бензил-6-(4-метокси-3-оксобутил)-3-пиридил]этинил-3-хинуклидинол
a) Диметил 3-метокси-2-оксопропилфосфонат
108 мл гексанового раствора, содержащего 1,58 моль н-бутиллития, растворяли в 100 мл безводного тетрагидрофурана. К смеси по каплям добавляли смесь 15 мл диметилметилфосфоната и 50 мл безводного тетрагидрофурана в течение 45 минут в атмосфере азота, в то же время температуру смеси поддерживали равной -60°С. Далее, через 15 минут, к реакционному раствору по каплям добавляли смесь 16,5 мл метилметоксиацетата и 50 мл безводного тетрагидрофурана в течение 30 минут. Раствор перемешивали в течение 1,5 часов при охлаждении льдом. Затем охлаждающую среду удаляли и реакционный раствор перемешивали в течение ночи при комнатной температуре. Затем к реакционному раствору добавляли уксусную кислоту и воду, растворитель удаляли и экстрагировали дихлорметаном. Органическую фазу промывали насыщенным раствором соли, сушили над безводным сульфатом магния и подвергали колоночной хроматографии на силикагеле, используя 2% метанол/этилацетат в качестве элюента, с получением 17 г целевого соединения.
1H-ЯМР (CDCl3) δ: 3,18 (2Н, д, J=23 Гц), 3,44 (3Н, с), 3,79 (3Н, с) 3,82 (3Н, с), 4,14 (2Н, с).
b) 2-Бензил-3-метоксиметилокси-6-(4-метокси-3-оксо-1-бутенил)пиридин
6 г Диметил 3-метокси-2-оксопропилфосфоната растворяли в 200 мл тетрагидрофурана, в который затем добавляли 3,2 г трет-бутоксида калия. После перемешивания в течение 15 минут добавляли 50 мл тетрагидрофуранового раствора, содержащего 6 г 2-бензил-3-метоксиметилоксипиридин-6-карбоксиальдегида (пример получения 11), с последующим перемешиванием в течение еще одного часа. Затем добавляли воду, растворитель удаляли и смесь экстрагировали этилацетатом. Далее органическую фазу промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле, используя 17-33% этилацетат/гексан в качестве элюента, для разделения и очистки с получением 4,6 г целевого соединения.
1H-ЯМР (CDCl3) δ: 3,30 (3Н, с), 3,49 (3Н, с), 4,21 (2Н, с), 4,32 (2Н, с), 5,19 (2Н, с), 7,15-7,35 (8Н, м), 7,64 (1Н, д, J=16 Гц).
с) 2-Бензил-3-метоксиметилокси-6-(4-метокси-3-оксобутил)-пиридин
4,6 г 2-бензил-3-метоксиметилокси-6-(4-метокси-3-оксо-1-бутенил)пиридин растворяли в 100 мл этилацетата, добавляли 976 мг 10% палладия на угле и затем гидрировали. После того как атмосферу в реакционной системе заменяли азотом, катализатор отфильтровывали и фильтрат выпаривали. Полученный остаток подвергали колоночной хроматографии на силикагеле, используя 33% этилацетат/гексан в качестве элюента, для разделения и очистки с получением 1,8 г целевого соединения.
1H-ЯМР (CDCl3) δ: 2,86 (2Н, т, J=7,0 Гц), 3,05 (2Н, т, J=7,0 Гц), 3,31 (3Н, с), 3,37 (3Н, с), 4,01 (2Н, с), 4,14 (2Н, с), 5,10 (2Н, с), 6,97 (1Н, д, J=8,4 Гц), 7,15-7,27 (6Н, м).
d) 2-Бензил-6-(4-метокси-3-оксобутил)-3-пиридилтрифторметансульфонат
1,8 г 2-Бензил-3-метоксиметилокси-6-(4-метокси-3-оксобутил)пиридина растворяли в 50 мл метанола и добавляли 2 мл концентрированной соляной кислоты с последующим кипячением с обратным холодильником в течение 1,5 часов. После остывания смесь нейтрализовали насыщенным водным раствором бикарбоната натрия и экстрагировали этилацетатом. Далее органическую фазу промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Полученный остаток растворяли в 50 мл дихлорметана. Добавляли 2,7 г N-фенилтрифторметансульфонимида, 209 мг 4-диметиламинопиридина и 1 мл триэтиламина с последующим перемешиванием при комнатной температуре в течение 1,5 часов. Растворитель удаляли, остаток подвергали колоночной хроматографии на силикагеле, используя 25% этилацетат/гексан в качестве элюента, для разделения и очистки с получением 2,3 г целевого соединения.
1H-ЯМР (CDCl3) δ: 2,91 (2Н, т, J=6,8 Гц), 3,13 (2Н, т, J=6,8 Гц), 3,37 (3Н, с), 3,96 (2Н, с), 4,19 (2Н, с), 7,14 (1Н, д, J=8,4 Гц) 7,20-7,29 (5Н, м), 7,46 (1Н, д, J=8,4 Гц).
e) 3-[2-Бензил-6-(4-метокси-3-оксобутил)-3-пиридил]этинил-3-хинуклидинол
10 мл N,N-диметилформамида добавляли к смеси 1,9 г 2-бензил-6-(4-метокси-3-оксобутил)-3-пиридилтрифторметансульфоната, 773 мг 3-этинил-3-хинуклидинола, 525 мг тетракис(трифенилфосфин)палладия (0), 267 мг йодида меди и 2,2 мл триэтиламина с последующим перемешиванием в течение одного часа при 50°С на масляной бане в атмосфере азота. После остывания добавляли этилацетат. Смесь фильтровали через целит с последующим промыванием водой. Органическую фазу промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле, используя хлороформ/метанол/36% водный раствор аммиака (46:5:0,5) в качестве элюента, для выделения и очистки с получением 1,3 г целевого соединения.
1H-ЯМР (CDCl3) δ: 1,35-1,45 (1H, м), 1,54-1,64 (1Н, м), 1,75-1,86 (1Н, м), 1,95-2,05 (2Н, м), 2,67-2,90 (4Н, м), 2,89 (2Н, т, J=7,0 Гц), 3,00 (1Н, дд, J=2, 14 Гц), 3,11 (2Н, т, J=7,0 Гц), 3,20 (1Н, дд, J=2, 14 Гц), 3,37 (3Н, с), 4,00 (2Н, с), 4,27 (2Н, с), 7,01 (1Н, д, J=7,9 Гц), 7,17-7,26 (5Н, м), 7,57 (1Н, д, J=7,9 Гц).
Пример 69: 3-[2-Бензил-6-(2-этоксикарбонилэтенил)-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 68.
1H-ЯМР (CDCl3) δ: 1,34 (3Н, т, J=7,1 Гц), 1,44-1,53 (1Н, м), 1,62-1,72 (1H, м), 1,80-1,89 (1Н, м), 2,08-2,17 (2Н, м), 2,75-3,05 (4Н, м), 3,11 (1H, дд, J=2, 14 Гц), 3,25 (1H, дд, J=2, 14 Гц), 4,28 (2Н, кв, J=7,1 Гц), 4,33 (2Н, с), 6,94 (1H, д, J=16 Гц), 7,18-7,30 (6Н, м), 7,63 (1H, д, J=16 Гц), 7,66 (1Н, д, J=7,9 Гц).
Пример 70: 3-[2-Бензил-6-(2-цианоэтил)-3-пиридил]этинил-3- хинуклидинол
Целевое соединение синтезировали так же, как и в примере 68.
1H-ЯМР (CDCl3) δ: 1,36-1,46 (1Н, м), 1,56-1,66 (1H, м), 1,76-1,89 (1H, м), 1,98-2,08 (2Н, м), 2,69-2,95 (4Н, м), 2,84 (2Н, т, J=7,3 Гц), 3,02 (1H, дд, J=2, 14 Гц), 3,10 (2Н, т, J=7,3 Гц), 3,21 (1H, дд, J=2, 14 Гц), 4,31 (2Н, с), 7,04 (1H, д, J=7,9 Гц), 7,18-7,28 (5Н, м), 7,64 (1H, д, J=7,9 Гц).
Пример 71: 3-[2-Бензил-6-(3-оксобутил)-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 68.
1H-ЯМР (CDCl3) δ: 1,35-1,44 (1H, м), 1,52-1,62 (1H, м), 1,75-1,87 (1H, м), 1,98-2,08 (2Н, м), 2,13 (3Н, с), 2,68-2,95 (4Н, м), 2,88 (2Н, т, J=6,9 Гц), 3,00 (1H, дд, J=2, 14 Гц), 3,03 (2Н, т, J=6,9 Гц), 3,19 (1H, дд, J=2, 14 Гц), 4,27 (2Н, с), 6,99 (1H, д, J=7,9 Гц), 7,16-7,28 (5Н, м), 7,55 (1H, д, J=7,9 Гц).
Пример 72: 3-(2-Фенил-6-морфолино-3-пиридил)этинил-3-хинуклидинол
а) 2-Бром-6-морфолинопиридин
Смесь 10 г 2,6-дибромпиридина, 7,4 мл морфолина, 11,7 г безводного карбоната калия и 30 мл N-метил-2-пирролидидона нагревали при перемешивании в течение 5 часов на масляной бане при температуре 100°С в атмосфере азота. Смесь экстрагировали добавлением этилацетата и воды. Экстракт промывали водой и насыщенным раствором соли и затем концентрировали. Остаток подвергали колоночной хроматографии на силикагеле, используя 2-10% этилацетат/гексан, с получением 9,8 г целевого соединения.
1H-ЯМР (CDCl3) δ: 3,50 (4Н, т, J=5 Гц), 3,80 (4Н, т, J=5 Гц), 6,50 (1Н д, J=8 Гц), 6,79 (1Н, д, J=8 Гц), 7,31 (1Н, т, J=8 Гц).
b) 2-Фенил-6-морфолинопиридин
Смесь 1 г 2-бром-6-морфолинопиридина, 110 мг хлорида 1,3-бис(дифенилфосфино)пропанникеля (II) и 4 мл тетрагидрофурана перемешивали на ледяной бане в атмосфере азота. В смесь по каплям добавляли тетрагидрофурановый раствор фенилмагнийбромида, который получали из 0,65 мл бромбензола, 200 мг магния и 5 мл тетрагидрофурана, с последующим перемешиванием при комнатной температуре в течение ночи. Реакционный раствор экстрагировали насыщенным водным раствором хлорида аммония и этилацетатом, и органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и затем концентрировали. Остаток подвергали колоночной хроматографии на силикагеле, используя 2-10% этилацетат/гексан, с получением 750 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 3,62 (4Н, т, J=5 Гц), 3,86 (4Н, т, J=5 Гц), 6,60 (1Н д, J=8 Гц), 7,15 (1Н, д, J=8 Гц), 7,37 (1Н, т, J=7 Гц), 7,44 (2Н, т, J=7 Гц), 7,58 (1H, т, J=8 Гц), 8,01 (2Н, д, J=7 Гц).
с) 2-Фенил-6-морфолино-3-йодпиридин
Раствор 750 мг 2-фенил-6-морфолинопиридина и 5 мл N,N-диметилформамида перемешивали на ледяной бане и к смеси добавляли 740 мг N-йодсукцинимида с последующим перемешиванием при комнатной температуре в течение ночи. Кроме того, добавляли 70 мг N-йодсукцинимида с последующим перемешиванием при комнатной температуре в течение 5 часов. Реакционную смесь экстрагировали добавлением этилацетата, воды и сульфита натрия и органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и концентрировали. Остаток подвергали колоночной хроматографии на силикагеле, используя 5-10% этилацетат/гексан, с получением 1,1 г целевого соединения.
1H-ЯМР (CDCl3) δ: 3,52 (4Н, т, J=5 Гц), 3,80 (4Н, т, J=5 Гц), 6,37 (1H д, J=9 Гц), 7,36-7,45 (3Н, м), 7,60-7,65 (2Н, м), 7,93 (1H, д, J=9 Гц).
d) 3-(2-Фенил-6-морфолино-3-пиридил)этинил-3-хинуклидинол
Смесь 500 мг 2-фенил-6-морфолино-3-йодпиридина, 230 мг 3-этинил-3-хинуклидинола, 79 мг тетракис(трифенилфосфин)-палладия (0), 1,3 мг йодида меди, 0,57 мл триэтиламина и 1 мл N,N-диметилформамида нагревали при перемешивании в течение 4 часов на масляной бане при температуре 75°С в атмосфере азота. Смесь экстрагировали добавлением разбавленного водного раствора аммиака и этилацетата и органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и затем концентрировали. Остаток подвергали колоночной хроматографии на NH-силикагеле и элюировали 50% этилацетатом/гексаном, этилацетатом и затем 2,5% метанолом/этилацетатом с получением 296 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,32-1,82 (3Н, м), 1,94-2,03 (2Н, м), 2,65-2,91 (4Н, м), 2,95 (1Н, д, J=14 Гц), 3,19 (1Н, дд, J=2, 14 Гц), 3,62 (4Н, т, J=5 Гц), 3,82 (4Н, т, J=5 Гц), 6,54 (1Н, д, J=8 Гц), 7,34-7,44 (3Н, м), 7,62 (1Н, д, J=8 Гц), 7,92 (2Н, д, J=8 Гц).
Пример 73: 3-(2-Фенилокси-6-морфолино-3-пиридил)этинил-3-хинуклидинол
а) 2-Фенилокси-6-морфолино-3-пиридин
250 мг 60% масляной суспензии гидрида натрия добавляли к смеси 1 г 2-бром-6-морфолинопиридина, полученного в примере 72 а, 580 мг фенола, 80 мг йодида меди, 26 мг порошка меди и 3 мл N-метилпирролидина. После того как прекращалось вспенивание, смесь нагревали при перемешивании на масляной бане при 150°С в течение 3 часов в атмосфере азота. Добавляли разбавленный водный раствор аммиака и этилацетат и смесь экстрагировали. Органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и затем концентрировали. Остаток подвергали колоночной хроматографии на силикагеле, используя 5-7% этилацетат/гексан, с получением 1,1 г целевого соединения.
1H-ЯМР (CDCl3) δ: 3,40 (4Н, т, J=5 Гц), 3,76 (4Н, т, J=5 Гц), 6,11 (1Н, д, J=8 Гц), 6,28 (1H, д, J=8 Гц), 7,15-7,19 (3Н, м), 7,36 (2Н, т, J=8 Гц), 7,47 (1H, т, J=8 Гц).
b) 3-(2-Фенилокси-6-морфолино-3-пиридил)этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примерах 72 с и d.
1H-ЯМР (CDCl3) δ: 1,34-2,06 (5Н, м), 2,74-2,94 (4Н, м), 3,00 (1H, д, J=14 Гц), 3,27 (1H, дд, J=2, 14 Гц), 3,34 (4Н, т, J=5 Гц), 3,69 (4Н, т, J=5 Гц), 6,24 (1H, д, J=8 Гц), 7,09-7,17 (3Н, м), 7,34 (2Н, т, J=4 Гц), 7,56 (1H, д, J=8 Гц).
Пример 74: 3-[2-Бензил-6-(4-пиперидинон-1-ил)-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 7.
1H-ЯМР (CDCl3) δ: 1,36-1,96 (3Н, м), 2,00-2,10 (2Н, м), 2,46 (4Н, т, J=6 Гц), 2,72-2,96 (4Н, м), 3,04 (1H, д, J=14 Гц), 3,26 (1H, дд, J=2, 14 Гц), 3,92 (4Н, т, J=6 Гц), 4,18 (2Н, с), 6,54 (1H, д, J=8 Гц), 7,14-7,32 (5Н, м), 7,52 (1H, д, J=8 Гц).
Пример 75: 3-[2-Бензил-6-(2-метоксиэтил)амино-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 7.
1H-ЯМР (CDCl3) δ: 1,34-1,92 (3Н, м), 1,98-2,07 (2Н, м), 2,68-2,92 (4Н, м), 3,01 (1H, д, J=14 Гц), 3,22 (1H, дд, J=2, 14 Гц), 3,37 (3Н, с), 3,49 (2Н, кв, J=5 Гц), 3,55 (2Н, т, J=5 Гц), 4,14 (2Н, с), 4,93 (1Н, шир.т, J=5 Гц), 6,21 (1Н, д, J=8 Гц), 7,13-7,31 (5Н, м), 7,40 (1Н, д, J=8 Гц).
Пример 76: 3-[2-Бензил-6-(4-ацетилпиперидин-1-ил)-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 7.
1H-ЯМР (CDCl3) δ: 1,34-1,44 (1Н, м), 1,53-1,67 (3Н, м), 1,83-2,08 (5Н, м), 2,17 (3Н, с), 2,55 (1Н, тт, J=4, 11 Гц), 2,68-2,96 (6Н, м), 3,02 (1Н, д, J=14 Гц), 3,23 (1H, дд, J=2, 14 Гц), 4,15 (2Н, с), 4,35 (2Н, д, J=13 Гц), 6,43 (1H, д, J=8 Гц), 7,17 (1H, т, J=7 Гц), 7,22-7,32 (4Н, м), 7,43 (1H, д, J=8 Гц).
Пример 77: 3-[2-Бензил-6-[(2R)-2-метоксиметилпирролидин-1-ил)-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 7.
1H-ЯМР (CDCl3) δ: 1,36-2,10 (9Н, м), 2,74-2,95 (4Н, м), 3,04 (1H, д, J=14 Гц), 3,20-3,30 (ЗН, м), 3,32 (3Н, с), 3,40-3,49 (1H, м), 3,53 (1H, дд, J=3, 9 Гц), 4,06-4,30 (3Н, м), 6,18 (1H, д, J=9 Гц), 7,16 (1H, т, J=7 Гц), 7,25 (2Н, т, J=7 Гц), 7,33 (2Н, д, J=7 Гц), 7,40 (1H, д, J=9 Гц).
Пример 78: 3-[2-Бензил-6-(тиоморфолино)-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 191, используя 2-бензил-3-бром-6-пиридинтрифторметансульфоната (пример получения 3) в качестве исходного.
1H-ЯМР (CDCl3) δ: 1,36-1,95 (3Н, м), 1,97-2,08 (2Н, м), 2,58-2,63 (4Н, м), 2,70-2,95 (4Н, м), 3,03 (1Н, д, J=14 Гц), 3,25 (1Н, д, J=14 Гц), 3,94-3,99 (4Н, м), 4,15 (2Н, с), 6,40 (1Н, д, J=9 Гц), 7,14-7,32 (5Н, м), 7,45 (1Н, д, J=9 Гц).
Пример 79: 3-[2-Бензил-6-(3-гидроксипиперидино)-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 7.
1H-ЯМР (CDCl3) δ: 1,36-1,98 (7Н, м), 1,98-2,08 (2Н, м), 2,70-2,95 (4Н, м), 3,02 (1Н, д, J=14 Гц), 3,23 (1Н, д, J=14 Гц), 3,40-3,90 (5Н, м), 4,14 (2Н, с), 6,47 (1Н, д, J=9 Гц), 7,12-7,32 (5Н, м), 7,42 (1Н, д, J=9 Гц).
Пример 80: 3-[2-Бензил-6-(4-цианопиперидино)-3-пиридил]-этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 7.
1H-ЯМР (CDCl3) δ =1,36-2,10 (9Н, м), 2,70-2,95 (5Н, м), 3,03 (1Н, д, J=14 Гц), 3,24 (1Н, дд, J=2, 14 Гц), 3,47-3,55 (2Н, м), 3,81-3,89 (2Н, м), 4,16 (2Н, с), 6,45 (1Н, д, J=9 Гц), 7,15-7,31 (5Н, м), 7,47 (1Н, д, J=9 Гц).
Пример 81: 3-(2-Бензил-6-пиперидино-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 7.
1H-ЯМР (CDCl3) δ: 1,35-1,45 (1Н, м), 1,52-1,82 (7Н, м), 1,85-1,95 (1Н, м), 2,00-2,07 (2Н, м), 2,72-2,96 (4Н, м), 3,02 (1Н, д, J=14 Гц), 3,23 (1Н, дд, J=2, 14 Гц), 3,56 (4Н, дд, J=5,6 Гц, 4,8 Гц), 4,15 (2Н, с), 6,41 (1Н, д, J=8,8 Гц), 7,14-7,33 (5Н, м), 7,41 (1Н, д, J=8,8 Гц).
Пример 82: 3-[2-Бензил-6-(N-морфолинамино)-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 7.
1H-ЯМР (CDCl3) δ: 1,35-1,95 (3Н, м), 1,98-2,08 (2Н, м), 2,70-2,93 (4Н, м), 3,02 (1Н, д, J=14 Гц), 3,23 (1Н, дд, J=2, 14 Гц), 3,53 (4Н, т, J=5 Гц), 3,79 (4Н, т, J=5 Гц), 4,17 (2Н, с), 6,41 (1Н, д, J=9 Гц), 7,14-7,32 (5Н, м), 7,47 (1Н, д, J=9 Гц)
Пример 83: 3-[2-Бензил-6-(4-тетрагидропиранил)амино-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 7.
1H-ЯМР (CDCl3) δ: 1,35-1,95 (5Н, м), 1,96-2,08 (4Н, м), 2,70-2,93 (4Н, м), 3,02 (1Н, д, J=14 Гц), 3,23 (1Н, дд, J=2, 14 Гц), 3,50 (2Н, дт, J=2, 12 Гц), 3,75-3,85 (1Н, м), 3,98 (2Н, тд, J=4, 12 Гц), 4,14 (2Н, с), 4,53 (1H, д, J=8 Гц), 6,18 (1H, д, J=8 Гц), 7,14-7,32 (5Н, м), 7,41 (1H, д, J= Гц).
Пример 84; 3-[2-Бензил-6-(1-пирролидинил)-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 7.
1H-ЯМР (CDCl3) δ: 1,38-1,48 (1Н, м), 1,57-1,67 (1Н, м), 1,89-1,95 (1Н, м), 1,98 (4Н, т, J=6,2 Гц), 2,01-2,10 (2Н, м), 2,72-2,98 (4Н, м), 3,05 (1Н, д, J=14 Гц), 3,25 (1Н, д, J=14 Гц), 3,45 (4Н, т, J=6,2 Гц), 4,16 (2Н, с), 6,14 (1Н, д, J=8,6 Гц), 7,16-7,35 (5Н, м), 7,40 (1Н, д, J=8,6 Гц).
Пример 85: 3-[2-Бензил-6-(3-гидроксипирролидин-1-ил)-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 7.
1H-ЯМР (CDCl3) δ: 1,35-1,95 (3Н, м), 1,98-2,20 (4Н, м), 2,70-2,95 (4Н, м), 3,02 (1Н, д, J=14 Гц), 3,23 (1Н, д, J=14 Гц), 3,50-3,65 (4Н, м), 4,16 (2Н, с), 4,57-4,61 (1Н, м), 6,16 (1Н, д, J=9 Гц), 7,16 (1Н, т, J=7 Гц), 7,24 (2Н, т, J=7 Гц), 7,32 (2Н, д, J=7 Гц), 7,42 (1Н, д, J=9 Гц).
Пример 86: (3R)-3-[2-Бензил-6-[(3R)-3-гидроксипирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 7.
1H-ЯМР (CDCl3) δ: 1,35-1,95 (ЗН, м), 1,98-2,20 (4Н, м), 2,70-2,95 (4Н, м), 3,02 (1Н, д, J=14 Гц), 3,23 (1Н, д, J=14 Гц), 3,50-3,65 (4Н, м), 4,16 (2Н, с), 4,57-4,61 (1Н, м), 6,16 (1Н, д, J=9 Гц), 7,16 (1Н, т, J=7 Гц), 7,24 (2Н, т, J=7 Гц), 7,32 (2Н, д, J=7 Гц), 7,42 (1Н, д, J=9 Гц).
Пример 87: (3R)-3-[2-Бензил-6-[(3S)-3-гидроксипирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 7.
1H-ЯМР (CDCl3) δ: 1,35-1,95 (3Н, м), 1,98-2,20 (4Н, м), 2,70-2,95 (4Н, м), 3,02 (1Н, д, J=14 Гц), 3,23 (1Н, д, J=14 Гц), 3,50-3,65 (4Н, м), 4,16 (2Н, с), 4,57-4,61 (1Н, м), 6,16 (1Н, д, J=9 Гц), 7,16 (1Н, т, J=7 Гц), 7,24 (2Н, т, J=7 Гц), 7,32 (2Н, д, J=7 Гц), 7,42 (1Н, д, J=9 Гц).
Пример 88: 3-[2-Бензил-6-(1-азетидинил)-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 7.
1H-ЯМР (CDCl3) δ: 1,37-1,42 (1Н, м), 1,52-1,62 (1H, м), 1,78-1,86 (1H, м), 1,98-2,07 (2Н, м), 2,37 (2Н, квинтет, J=7,4 Гц), 2,70-2,92 (4Н, м), 3,00 (1H, д, J=14 Гц), 3,21 (1H, дд, J=2, 14 Гц), 4,03 (4Н, т, J=7,4 Гц), 4,16 (2Н, с), 6,05 (1H, д, J=8,5 Гц), 7,14-7,32 (5Н, м), 7,40 (1H, д, J=8,5 Гц).
Пример 89: (3R)-3-[2-Бензил-6-(1-азетидинил)-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 7.
1H-ЯМР (CDCl3) δ: 1,37-1,42 (1H, м), 1,52-1,62 (1H, м), 1,78-1,86(1Н, м), 1,98-2,07 (2Н, м), 2,37 (2Н, квинтет, J=7,4 Гц), 2,70-2,92 (4Н, м), 3,00 (1H, д, J=14 Гц), 3,21 (1H, дд, J=2, 14 Гц), 4,03 (4Н, т, J=7,4 Гц), 4,16 (2Н, с), 6,05 (1H, д, J=8,5 Гц), 7,14-7,32 (5Н, м), 7,40 (1H, д, J=8,5 Гц).
Пример 90: (3R)-3-[2-Бензил-6-(3-гидроксиазетидин-1-ил)-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 7.
1H-ЯМР (CDCl3) δ: 1,40-1,95 (3Н, м), 2,05-2,15 (2Н, м), 2,65-2,95 (4Н, м), 2,98-3,22 (2Н, м), 3,88 (2Н, дд, J=5, 10 Гц), 4,17 (2Н, с), 4,26 (2Н, дд, 3=6, 10 Гц), 4,65-4,75 (1Н, м), 6,13 (1H, д, J=9 Гц), 7,10-7,20 (1Н, м), 7,20-7,30 (4Н, м), 7,44 (1H, д, J=9 Гц).
Пример 91: 3-[2-Бензил-6-(3-метоксипирролидин-1-ил)-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 10.
1H-ЯМР (CDCl3) δ: 1,37-1,42 (1H, м), 1,52-1,62 (1H, м), 1,84-1,94 (1H, м), 1,98-2,20 (4Н, м), 2,72-2,94 (4Н, м), 3,01 (1H, д, J=14 Гц), 3,23 (1H, дд, J=2, 14 Гц), 3,36 (ЗН, с), 3,46-3,64 (4Н, м), 4,02-4,08 (1H, м), 4,15 (2Н, с), 6,13 (1H, д, J=8,6 Гц), 7,13-7,34 (5Н, м), 7,40 (1H, д, J=8,6 Гц).
Пример 92: (3R)-3-[2-Бензил-6-[(3S)-3-метоксипирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 10.
1H-ЯМР (CDCl3) δ: 1,37-1,42 (1H, м), 1,52-1,62 (1H, м), 1,84-1,94 (1H, м), 1,98-2,20 (4Н, м), 2,72-2,94 (4Н, м), 3,01 (1H, д, J=14 Гц), 3,23 (1H, дд, J=2, 14 Гц), 3,36 (3Н, с), 3,46-3,64 (4Н, м), 4,02-4,08 (1H, м), 4,15 (2Н, с), 6,13 (1H, д, J=8,6 Гц), 7,13-7,34 (5Н, м), 7,40 (1H, д, J=8,6 Гц).
Пример 93: (3R)-3-[2-Бензил-6-[(3R)-3-метоксипирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 10.
1H-ЯМР (CDCl3) δ: 1,37-1,42 (1Н, м), 1,52-1,62 (1H, м), 1,84-1,94 (1H, м), 1,98-2,20 (4Н, м), 2,72-2,94 (4Н, м), 3,01 (1H, д, J=14 Гц), 3,23 (1H, дд, J=2, 14 Гц), 3,36 (3Н, с), 3,46-3,64 (4Н, м), 4,02-4,08 (1H, м), 4,15 (2Н, с), 6,13 (1H, д, J=8,6 Гц), 7,13-7,34 (5Н, м), 7,40 (1H, д, J=8,6 Гц).
Пример 94: 3-[2-Бензил-6-(3-этоксипирролидин-1-ил)-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 10.
1H-ЯМР (CDCl3) δ: 1,21 (3Н, т, J=7,0 Гц), 1,35-1,45 (1H, м), 1,54-1,62 (1H, м), 1,85-1,95 (1H, м), 1,98-2,15 (4Н, м), 2,72-2,94 (4Н, м), 3,01 (1H, д, J=14 Гц), 3,23 (1H, дд, J=2, 14 Гц), 3,48-3,62 (6Н, м), 4,12-4,20 (3Н, м), 6,13 (1H, д, J=8,6 Гц), 7,13-7,34 (5Н, м), 7,40 (1H, д, J=8,6 Гц).
Пример 95: (3R)-3-[2-Бензил-6-[(3R)-3-этоксипирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 10.
1H-ЯМР (CDCl3) δ: 1,21 (3Н, т, J=7,0 Гц), 1,35-1,45 (1H, м), 1,54-1,62 (1H, м), 1,85-1,95 (1H, м), 1,98-2,15 (4Н, м), 2,72-2,94 (4Н, м), 3,01 (1H, д, J=14 Гц), 3,23 (1H, дд, J=2, 14 Гц), 3,48-3,62 (6Н, м), 4,12-4,20 (3Н, м), 6,13 (1H, д, J=8,6 ГЦ), 7,13-7,34 (5Н, м), 7,40 (1H, д, J=8,6 Гц).
Пример 96: (3R)-3-[2-Бензил-6-[(3S)-3-этоксипирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 10.
1H-ЯМР (CDCl3) δ: 1,21 (3Н, т, J=7 Гц), 1,35-1,45 (1Н, м), 1,54-1,62 (1Н, м), 1,85-1,95 (1Н, м), 1,98-2,15 (4Н, м), 2,72-2,94 (4Н, м), 3,01 (1Н, д, J=14 Гц), 3,23 (1Н, дд, J=2, 14 Гц), 3,48-3,62 (6Н, м), 4,12-4,20 (3Н, м), 6,13 (1Н, д, J=8,6 Гц), 7,13-7,34 (5Н, м), 7,40 (1Н, д, J=8,6 Гц).
Пример 97: (3R)-3-[2-Бензил-6-(этоксипиперидино)-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 7, используя (3R)-3-этинил-3-хинуклидинол.
1H-ЯМР (CDCl3) δ: 1,22 (3Н, т, J=7 Гц), 1,35-1,44 (1Н, м), 1,51-1,62 (3Н, м), 1,73-1,96 (3Н, м), 1,97-2,08 (2Н, м), 2,70-2,95 (4Н, м), 3,01 (1Н, д, J=14 Гц), 3,14-3,26 (3Н, м), 3,48-3,58 (3Н, м), 4,00-4,09 (2Н, м), 4,15 (2Н, с), 6,43 (1Н, д, J=9 Гц), 7,16 (1Н, т, J=7 Гц), 7,24 (2Н, т, J=7 Гц), 7,30 (2Н, д, J=7 Гц), 7,42 (1Н, д, J=9 Гц).
Пример 98: 3-[2-Бензил-6-(3-метоксиазетидин-1-ил)-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 10.
1H-ЯМР (CDCl3) δ: 1,35-1,90 (3Н, м), 1,97-2,08 (2Н, м), 2,70-2,95 (4Н, м), 3,01 (1Н, д, J=14 Гц), 3,21 (1Н, дд, J=2, 14 Гц), 3,34 (3Н, с), 3,90 (2Н, дд, J=4, 10 Гц), 4,16 (2Н, с), 4,21 (2Н, дд, J=6, 10 Гц), 4,30-4,35 (1Н, м), 6,10 (1H, д, J=9 Гц), 7,16 (1H, т, J=7 Гц), 7,22-7,32 (4Н, м), 7,42 (1H, д, J=9 Гц).
Пример 99: (3R)-3-[2-Бензил-6-(3-метоксиазетидин-1-ил)-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 10, используя (3R)-3-этинил-3-хинуклидинол.
1H-ЯМР (CDCl3) δ: 1,35-1,90 (3Н, м), 1,97-2,08 (2Н, м), 2,70-2,95 (4Н, м), 3,01 (1H, д, J=14 Гц), 3,21 (1H, дд, J=2, 14 Гц), 3,34 (3Н, с), 3,90 (2Н, дд, J=5, 10 Гц), 4,16 (2Н, с), 4,21 (2Н, дд, J=6, 10 Гц), 4,30-4,35 (1H, м), 6,10 (1H, д, J=9 Гц), 7,16 (1H, т, J=7 Гц), 7,22-7,32 (4Н, м), 7,42 (1H, д, J=9 Гц).
Пример 100: (3R)-3-[2-Бензил-6-(3-этоксиазетидин-1-ил)-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 10, используя (3R)-3-этинил-3-хинуклидинол.
1H-ЯМР (CDCl3) δ: 1,24 (3Н, т, J=7 Гц), 1,34-1,4 3 (1H, м), 1,51-1,64 (1H, м), 1,80-1,90 (1H, м), 1,97-2,08 (2Н, м), 2,66-2,93 (4Н, м), 3,00 (1H, д, J=14 Гц), 3,21 (1H, дд, J=2, 14 Гц), 3,49 (2Н, кв, J=7 Гц), 3,90 (2Н, дд, J=4, 10 Гц), 4,16 (2Н, с), 4,21 (2Н, дд, J=6, 10 Гц), 4,37-4,44 (1H, м), 6,09 (1H, д, J=8 Гц), 7,16 (1H, т, J=7 Гц), 7,24 (2Н, т, J=7 Гц), 7,29 (2Н, д, J=7 Гц), 7,41 (1H, д, J=8 Гц).
Пример 101: (3R)-3-[2-Бензил-6-(3-метоксиметилоксиазетидин-1-ил)-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 7.
1H-ЯМР (CDCl3) δ: 1,35-1,90 (3Н, м), 1,97-2,08 (2Н, м), 2,68-2,93 (4Н, м), 3,00 (1Н, д, J=14 Гц), 3,21 (1Н, дд, J=2, 14 Гц), 3,41 (3Н, с), 3,94 (2Н, дд, J=5, 10 Гц), 4,16 (2Н, с), 4,26 (2Н, дд, J=7, 10 Гц), 4,55-4,61 (1Н, м), 4,67 (2Н, с), 6,10 (1Н, д, J=8 Гц), 7,16 (1H,T,J=7 Гц), 7,22-7,32 (4Н, м), 7,42 (1H, д, J=9 Гц).
Пример 102: 3-[4-Бензил-2-[(3R,4R)-3-гидрокси-4-этилоксипирролидин-1-ил]-3-пиридил]этинил-3-хинукдидинол
Целевое соединение синтезировали так же, как и в примере 10, за исключением того, что метилйодид заменяли этилйодидом.
1H-ЯМР (CDCl3) δ: 1,26 (3Н, т, J=7 Гц), 1,38-1,63 (2Н, м), 1,84-1,93 (1H, м), 2,00-2,07 (2Н, м), 2,74-2,93 (4Н, м), 3,00-3,04 (1H, м), 3,21-3,25 (1H, м), 3,48-3,52 (2Н, м), 3,61 (2Н, кв, J=7 Гц), 3,71-3,77 (2Н, м), 3,94-3,96 (1H, м), 4,15 (2Н, с), 4,37-4,40 (1H, м), 6,15 (1H, д, J=8 Гц), 7,16-7,33 (5Н, м), 7,42 (1H, д, J=8 Гц).
Пример 103: (3R)-3-[2-Бензил-6-[(3R,4R)-3,4-дигидроксипирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 10.
1H-ЯМР (CDCl3) δ: 1,30-1,32 (1H, м), 1,52 (1H, м), 1,77-1,99 (ЗН, м), 2,56-2,72 (4Н, м), 2,82 (1H, д, J= Гц), 3,01 (1H, д, J=14 Гц), 3,50-3,53 (2Н, м), 4,01-4,11 (4Н, м), 5,10-5,11 (2Н, м), 6,26 (1H, д, J=8 Гц), 7,14-7,34 (5Н, м), 7,42 (1H, д, J=8 Гц).
Пример 104: (3R)-3-[2-Бензил-6-[(3R,4R)-3,4-диметоксипирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинол
а) 2-Бензил-6-[(3R,4R)-3,4-диметоксипирролидин-1-ил] пиридин
700 мг 60% масляной суспензии гидрида натрия и 1 мл метилйодида добавляли к смеси 1,78 г 2-бензил-6-[(3R,4R)-3,4-дигидроксипирролидин-1-ил]пиридина (пример 10а), 10 мл тетрагидрофурана и 10 мл N,N-диметилформамида. Смесь экстрагировали этилацетатом-водой. Органический слой промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и выпаривали. Остаток подвергали колоночной хроматографии на силикагеле и элюировали 15% этилацетатом/гексаном с получением 1,0 г целевого соединения.
1H-ЯМР (CDCl3) δ: 3,42 (6Н, с), 3,55 (2Н, дд, J=2, 11 Гц), 3,67 (2Н, дд, J=4, 11 Гц), 3,92-3,96 (2Н, м), 3,97 (2Н, с), 6,16 (1Н, д, J=9 Гц), 6,33 (1Н, д, J=7 Гц), 7,18 (1Н, т, J=7 Гц), 7,24-7,34 (5Н, м).
b) (3R)-3-[2-Бензил-6-[(3R,4R)-3,4-диметоксипирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 10.
1H-ЯМР (CDCl3) δ: 1,34-1,44 (1Н, м), 1,52-1,62 (1H, м), 1,82-1,92 (1H, м), 1,97-2,08 (2Н, м), 2,70-2,95 (4Н, м), 3,01 (1H, д, J=14 Гц), 3,23 (1H, дд, J=2, 14 Гц), 3,41 (6Н, с), 3,53-3,67 (4Н, м), 3,92-3,96 (2Н, м), 4,16 (2Н, с), 6,14 (1Н, д, J=9 Гц), 7,15 (1H, т, J=7 Гц), 7,24 (2Н, т, J=7 Гц), 7,31 (2Н, д, J=7 Гц), 7,40 (1H, д, J=9 Гц).
Пример 105: (3R)-3-[2-Бензил-6-[(3R,4R)-3,4-диэтоксипирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 104, используя (3R)-3-этинил-3-хинуклидинол.
1H-ЯМР (CDCl3) δ: 1,20 (6Н, т, J=7 Гц), 1,35-1,95 (3Н, м), 1,98-2,09 (2Н, м), 2,70-2,95 (4Н, м), 3,03 (1H, д, J=14 Гц), 3,24 (1H, дд, J=2, 14 Гц), 3,50-3,56 (2Н, м), 3,59 (4Н, кв, J=7 Гц), 3,67 (2Н, дд, J=4, 12 Гц), 4,02 (2Н, дд, J=2, 4 Гц), 4,15 (2Н, с), 6,14 (1H, д, J=9 Гц), 7,15 (1H, т, J=7 Гц), 7,24 (2Н, т, J=7 Гц), 7,32 (2Н, д, J=7 Гц), 7,40 (1H, д, J=9 Гц).
Пример 106: (3R)-3-[2-Бензил-6-[(3R,4S)-3-гидрокси-4-метоксипирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинол
а) 2-Бензил-3-йод-6-[(3S,4S)-3-(3-нитробензолсульфонил)окси-4-метоксипирролидин-1-ил]пиридин
300 мг 4-Диметиламинопиридина, 10 мл триэтиламина и 9,7 г 3-нитробензолсульфонилхлорида добавляли к раствору 10,0 г 2-бензил-3-йод-6-[(3S,4S)-3-гидрокси-4-метоксипирролидин-1-ил]пиридина, полученного таким же образом, как и в примере 10с, в 150 мл этилацетата с последующим перемешиванием при комнатной температуре в течение 3 дней. Реакционный раствор сначала фильтровали через 50 г силикагеля и промывали этилацетатом. Далее фильтрат пропускали через 50 г NH-силикагеля и промывали этилацетатом. Фильтрат концентрировали с получением 14,6 г целевого соединения.
1H-ЯМР (CDCl3) δ: 3,38 (3Н, с), 3,48 (1Н, д, J=12 Гц), 3,58-3,73 (3Н, м), 4,08-4,20 (3Н, м), 5,10-5,14 (1Н, м), 5,92 (1Н, д, J=8 Гц), 7,18 (1Н, т, J=7 Гц), 7,25 (2Н, т, J=7 Гц), 7,32 (2Н, д, J=7 Гц), 7,69 (1Н, д, J=8 Гц), 7,73 (1Н, т, J=8 Гц), 8,21 (1Н, д, J=8 Гц), 8,49 (1Н, д, J=8 Гц), 8,75 (1Н, с).
b) 2-Бензил-3-йод-6-[(3R,4S)-3-ацетокси-4-метоксипирролидин-1-ил]пиридин
4,2 мл Уксусной кислоты добавляли к смеси 7,9 г карбоната цезия и 15 мл диметилсульфоксида. После того как вспенивание прекращалось, добавляли смесь из 14,4 г 2-бензил-3-йод-6-[(3S,4S)-3-(3-нитробензолсульфонил)окси-4-метоксипирролидин-1-ил]пиридина и 35 мл диметилсульфоксида с последующим нагреванием при перемешивании в течение 6 часов на масляной бане при температуре 70°С в атмосфере азота. Реакционный раствор охлаждали и затем подвергали экстрагированию этилацетатом-водой. Органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и затем концентрировали. Остаток подвергали колоночной хроматографии на силикагеле, используя 10-15% этилацетат/гексан, с получением 7,5 г целевого соединения.
1H-ЯМР (CDCl3) δ: 2,12 (3Н, с), 3,42 (3Н, с), 3,37-3,7 3 (4Н, м), 4,04 (1Н, дт, J=4, 6 Гц), 4,19 (2Н, с), 5,42-5,47 (1Н, м), 5,96 (1Н, д, J=8 Гц), 7,19 (1Н, т, J=7 Гц), 7,27 (2Н, т, J=7 Гц), 7,38 (2Н, д, J=7 Гц), 7,70 (1Н, д, J=8 Гц).
с) 2-Бензил-3-йод-6-[(3R,4S)-3-гидрокси-4-метоксипирролидин-1-ил]пиридин
28% раствор метоксида натрия в 0,33 мл метанола добавляли к смеси 7,5 г 2-бензил-3-йод-6-[(3R,4S)-3-ацетокси-4-метоксипирролидин-1-ил]пиридина и 30 мл метанола с последующим перемешиванием при комнатной температуре в течение 30 минут в атмосфере азота. Добавляли воду и смесь экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором соли, сушили над безводным сульфатом магния и затем концентрировали. Остаток подвергали колоночной хроматографии на силикагеле, используя 20-50% этилацетат, с получением 6,7 г целевого соединения.
1H-ЯМР (CDCl3) δ: 2,63 (1Н, д, J=5 Гц), 3,38-3,67 (4Н, м), 3,47 (3Н, с), 3,93 (1Н, кв, J=5 Гц), 4,18 (2Н, с), 4,41 (1Н, квинт., J=5 Гц), 5,96 (1Н, д, J=9 Гц), 7,18 (1Н, т, J=7 Гц), 7,26 (2Н, т, J=7 Гц), 7,37 (2Н, д, J=7 Гц), 7,69 (1Н, д, J=9 Гц).
d) (3R)-3-[2-Бензил-6-[(3R,4S)-3-гидрокси-4-метоксипирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинол
Смесь 4,6 г 2-бензил-3-йод-6-[(3R,4S)-3-гидрокси-4-метоксипирролидин-1-ил]пиридина, 1,7 г (3R)-3-этинил-3-хинуклидинола, 130 мг тетракис(трифенилфосфин)палладия (0), 110 мг йодида меди и 3,1 мл триэтиламина перемешивали в течение 5 часов при комнатной температуре в атмосфере азота. Реакционный раствор экстрагировали разбавленным водным раствором аммиака-этилацетатом и органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и затем концентрировали. Остаток подвергали колоночной хроматографии на NH-силикагеле, используя 0-5% метанол/этилацетат, с получением 4,0 г целевого соединения.
1H-ЯМР (CDCl3) δ: 1,34-1,93 (3Н, м), 1,97-2,07 (2Н, м), 2,63-2,94 (5Н, м), 3,02 (1Н, д, J=14 Гц), 3,23 (1Н, дд, J=2, 14 Гц), 3,41-3,57 (2Н, м), 3,48 (3Н, с), 3,60-3,73 (2Н, м), 3,94 (1Н, кв, J=5 Гц), 4,41 (1Н, кв, J=5 Гц), 6,12 (1Н, д, J=9 Гц), 7,16 (1Н, т, J=7 Гц), 7,24 (2Н, т, J=7 Гц), 7,31 (2Н, д, J=7 Гц), 7,41 (1Н, д, J=9 Гц).
Пример 107: (3R)-3-[2-Бензил-6-[(3R,4R)-3,4-дифторпирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинол
а) 2-Бензил-6-[(3R,4R)-3,4-дифторпирролидин-1-ил]пиридин
3,0 мл дихлорметанового раствора, содержащего 481 мг 2-бензил-6-[(3S,4S)-3,4-дигидроксипирролидин-1-ил)-3-пиридина, медленно, по каплям добавляли в 5 мл дихлорметанового раствора, содержащего 235 мкл трифторида диэтиламиносеры, при -78°С. После перемешивания при нагревании в течение 30 минут при комнатной температуре смесь далее перемешивали в течение одного часа при 40°С. После остывания к реакционному раствору добавляли воду и смесь затем экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором соли и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле и элюировали гексаном/этилацетатом (5:1), а затем гексаном/этилацетатом (2:1) с получением 104 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 3,71-3,93 (4Н, м), 3,99 (2Н, с), 5,19-5,34 (2Н, м), 6,19 (1Н, д, J=8 Гц), 6,42 (1Н, д, J=7 Гц), 7,21-7,38 (6Н, м).
b) 2-Бензил-6-[(3R,4R)-3,4-дифторпирролидин-1-ил]-3-йодпиридин
94 мг имида N-йодянтарной кислоты малыми порциями добавляли к 5 мл N,N-диметилформамидного раствора, содержащего 104 мг 2-бензил-6-[(3R,4R)-3,4-дифторпирролидин-1-ил]пиридина при охлаждении льдом с последующим перемешиванием в течение ночи. К реакционному раствору добавляли воду и смесь экстрагировали этилацетатом. Органическую фазу промывали водным раствором тиосульфата натрия, водой и насыщенным раствором соли и растворитель удаляли. Остаток подвергали колоночной хроматографии на NH-силикагеле (Fuji Silicia) и элюировали гексаном/этилацетатом (10:1) с получением 152 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 3,66-3,86 (4Н, м), 4,20 (2Н, с), 5,18-5,33 (2Н, м), 6,01 (1Н, д, J=9 Гц), 7,18-7,38 (5Н, м), 7,74 (1Н, д, J=9 Гц).
с) (3R)-3-[2-Бензил-6-[(3R,4R)-3,4-дифторпирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинол
Смесь 152 мг 2-бензил-6-[(3R,4R)-3,4-дифторпирролидин-1-ил]-3-йодпиридина, 60 мг (3R)-3-этинил-3-хинуклидинола, 22 мг тетракис(трифенилфосфин)палладия (0), 7 мг йодида меди, 106 мкл триэтиламина и 1,5 мл метанола нагревали при перемешивании в течение 3 часов при 75°С в атмосфере азота. Реакционный раствор выливали в разбавленный водный раствор аммиака и затем экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли и растворитель удаляли. Остаток подвергали колоночной хроматографии на NH-силикагеле (Fuji Silicia), элюировали гексаном/этилацетатом (1:1), а затем этилацетатом/метанолом (15:1) и кристаллизовали из смеси гексан/этилацетат с получением 65 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,37-1,44 (1Н, м), 1,58 (1H, м), 1,88-1,89 (1Н, м), 2,02-2,05 (2Н, м), 2,75-2,88 (4Н, м), 3,03 (1H, д, J=14 Гц), 3,24 (1H, дд, J=2, 14 Гц), 3,75-3,93 (4Н, м), 4,18 (2Н, с), 5,19-5,34 (2Н, м), 6,19 (1H, д, J=9 Гц), 7,16-7,33 (5Н, м), 7,47 (1H д, J=9 Гц).
Пример 108: (3R)-3-[2-Бензил-6-[(3R)-3-фторпирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали из (3S)-1-бензил-3-пирролидинола так же, как и в примере 107.
1H-ЯМР (CDCl3) δ: 1,37-1,61 (2Н, м), 1,86-1,94 (1H, м), 2,00-2,19 (3Н, м), 2,33-2,42 (1H, м), 2,75-2,90 (4Н, м), 3,03 (1H, д, J=14 Гц), 3,25 (1H, дд, J=2, 14 Гц), 3,52-3,90 (4Н, м), 4,17 (2Н, с), 5,29-5,43 (1H, м), 6,18 (1H, д, J=8 Гц), 7,15-7,34 (5Н, м), 7,44 (1H, д, J=8 Гц).
Пример 109: (3R)-3-[2-Бензил-6-[(3S)-3-фторпирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали из (3R)-1-бензил-3-пирролидинола так же, как и в примере 107.
1H-ЯМР (CDCl3) δ: 1,37-1,60 (2Н, м), 1,86-1,93 (1Н, м), 1,99-2,19 (3Н, м), 2,32-2,42 (1H, м), 2,75-2,90 (4Н, м), 3,03 (1H, д, J=14 Гц), 3,25 (1H, дд, J=2, 14 Гц), 3,52-3,90 (4Н, м), 4,17 (2Н, с), 5,29-5,43 (1H, м), 6,18 (1H, д, J=8 Гц), 7,15-7,34 (5Н, м), 7,44 (1H, д, J=8 Гц).
Пример 110: (3R)-3-[2-Бензил-6-[(3S,4R)-3-фтор-4-метоксипирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали, используя 2-бензил-3-йод-6-[(3R,4R)-3-гидрокси-4-метоксипирролидин-1-ил]пиридин (пример получения 10 с) так же, как и в примере 107.
1H-ЯМР (CDCl3) δ: 1,39-1,44 (1H, м), 1,57-1,63 (1H, м), 1,87-1,93 (1H, м), 2,02-2,06 (2Н, м), 2,75-2,89 (4Н, м), 3,03 (1H, д, J=14 Гц), 3,24 (1H, дд, J=2, 14 Гц), 3,43 (3Н, с), 3,66-3,80 (4Н, м), 4,06-4,09 (1H, м), 4,16 (2Н, с), 5,08-5,21 (1H, м), 6,16 (1H, д, J=9 Гц), 7,14-7,32 (5Н, м), 7,43 (1H, д, J=9 Гц).
Пример 111: (3R)-3-[2-Бензил-6-[(3R,4S)-3-гидрокси-4-фторпирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинол
а) 2-Бром-6-[(3R,4R)-3,4-дигидроксипирролидин-1-ил]пиридин
Смесь 12,8 г 2,6-дибромпиридина, 8,87 г (3R,4R)-3,4-дигидроксипирролидинацетата, 10 мл 1,8-диазабицикло[5,4,0]-7-ундецена и 20 мл 1-метил-2-пирролидинона нагревали при перемешивании в течение 2 часов на масляной бане при 70°С. После охлаждения добавляли воду и смесь экстрагировали этилацетатом пять раз. Органические слои объединяли, промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и концентрировали. Остаток подвергали колоночной хроматографии на силикагеле, используя 10-100% этилацетат/гексан, с получением 10,1 г целевого соединения.
1H-ЯМР (CDCl3) δ: 1,86 (2Н, шир.с), 3,49 (2Н, д, J=11 Гц), 3,80 (2Н, дд, J=4, 11 Гц), 4,34 (2Н, шир.с), 6,26 (1Н, д, J=8 Гц), 6,71 (1Н, д, J=8 Гц), 7,26 (1Н, т, J=8 Гц).
b) 2-Бром-6-[(3R,4R)-3-метоксиметилокси-4-гидроксипирролидин-1-ил]пиридин
К смеси 10 г 2-бром-6-[(3R,4R)-3,4-дигидроксипирролидин-1-ил]пиридина и 100 мл тетрагидрофурана при комнатной температуре добавляли при перемешивании 1,54 г 60% масляной суспензии гидрида натрия и затем 3,0 мл хлорметилметилового эфира с последующим перемешиванием при той же температуре в течение одного часа. Реакционный раствор экстрагировали этилацетатом-водой и органическую фазу промывали насыщенным раствором соли, сушили над безводным сульфатом магния и затем концентрировали. Остаток подвергали колоночной хроматографии на силикагеле, используя 10-100% этилацетат/гексан, с получением 7,6 г целевого соединения.
1H-ЯМР (CDCl3) δ: 2,95 (1Н, д, J=4 Гц), 3,36-3,50 (2Н, м), 3,44 (3Н, с), 3,78-3,88 (2Н, м), 4,06-4,12 (1Н, м), 4,32-4,38 (1Н, м), 4,72 (1Н, д, J=7 Гц), 4,76 (1Н, д, J=7 Гц), 6,24 (1Н, д, J=8 Гц), 6,70 (1Н, д, J=8 Гц), 7,25 (1Н, т, J=8 Гц).
c) 2-Бензил-6-[(3R,4R)-3-метоксиметилокси-4-гидроксипирролидин-1-ил]пиридин
46,7 мл тетрагидрофуранового раствора, содержащего 1,07 моль бензилмагнийхлорида, по каплям добавляли в 50 мл тетрагидрофуранового раствора, содержащего 5,1 г 2-бром-6-[(3R,4R)-3-метоксиметилокси-4-гидроксипирролидин-1-ил] пиридина и 451 мг хлорида 1,3-бис(дифенилфосфино) пропанникеля (II) в течение 10 минут на ледяной бане. После остывания в течение ночи реакционный раствор выливали в насыщенный водный раствор хлорида аммония и экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором соли и растворитель удаляли. Остаток подвергали колоночной хроматографии на NH-силикагеле (Fuji Silicia) и элюировали гексаном/этилацетатом (10:1), а затем гексаном/этилацетатом (1:1) с получением 5,2 г целевого соединения.
1H-ЯМР (CDCl3) δ: 3,45 (3Н, с), 3,36-3,47 (2Н, м), 3,85-3,91 (2Н, м), 3,97 (2Н, с), 4,05-4,11 (1Н, м), 4,32-4,35 (1Н, м), 4,73-4,79 (2Н, м), 6,16 (1Н, д, J=8 Гц), 6,37 (1Н, д, J=8 Гц), 7,17-7,38 (6Н, м).
d) 2-Бензил-6-[(3R,4S)-3-метоксиметилокси-4-фторпирролидин-1-ил]пиридин и 2-бензил-6-[(3R,4S)-3-фторметокси-4-метоксипирролидин-1-ил]пиридин
5,0 мл дихлорметанового раствора 2-бензил-6-[(3R,4R)-3-метоксиметилокси-4-гидроксипирролидин-1-ил]пиридина по каплям добавляли в 10 мл дихлорметанового раствора, содержащего 278 мкл трифторида диэтиламиносеры при -78°С в течение 10 минут. После перемешивания при комнатной температуре в течение одного часа смесь нагревали при перемешивании при 40°С в течение одного часа. После остывания реакционный раствор выливали в воду. Смесь экстрагировали этилацетатом, органическую фазу промывали насыщенным раствором соли и растворитель удаляли. Затем остаток подвергали колоночной хроматографии на силикагеле и элюировали гексаном/этилацетатом (10:1), а затем гексаном/этилацетатом (2:1) с получением 56,7 мг 2-бензил-6-[(3R,4S)-3-метоксиметилокси-4-фторпирролидин-1-ил]пиридина (1H-ЯМР (CDCl3) δ: 3,38 (3Н, с), 3,65-3,82 (4Н, м), 3,97 (2Н, с), 4,41-4,43 (1Н, м), 4,69-4,75 (2Н, м), 5,18 (1Н, шир.д, J=49 Гц), 6,18 (1Н, д, J=8 Гц), 6,38 (1Н, д, J=7 Гц), 7,01-7,36 (6Н, м)) и 294 мг сырого продукта 2-бензил-6-[(3R,4S)-3-фторметокси-4-метоксипирролидин-1-ил]пиридина. Сырой продукт очищали тонкослойной хроматографией (с трехкратным проявлением, используя гексан/этилацетат (5/1) и три раза используя гексан/этилацетат (4/1)) с получением 47,8 г 2-бензил-6-[(3R,4S)-3-(фторметокси)-4-метоксипирролидин-1-ил]пиридина (1H-ЯМР (CDCl3) δ: 3,48 (3Н, с), 3,54-3,73 (4Н, м), 3,97 (2Н, с), 4,00-4,04 (1Н, м), 4,41-4,46 (1Н, м), 5,41 (2Н, д, J=56 Гц), 6,15 (1Н, д, J=8 Гц), 6,37 (1Н, д, J=7 Гц), 7,17-7,35 (6Н, м)).
e) 2-Бензил-6-[(3R,4S)-3-метоксиметилокси-4-фторпирролидин-1-ил]-3-йодпиридин
44,4 мг имида N-йодянтарной кислоты добавляли малыми порциями к раствору, содержащему 56,7 мг 2-бензил-6-[(3R,4S)-3-метоксиметилокси-4-фторпирролидин-1-ил]пиридина и 3,0 мл N,N-диметилформамида, при перемешивании при охлаждении льдом с последующим перемешиванием в течение ночи. К реакционному раствору добавляли воду и затем экстрагировали этилацетатом. Органическую фазу последовательно промывали водным раствором тиосульфата натрия, водой и насыщенным раствором соли и растворитель удаляли. Остаток элюировали этилацетатом через NH-силикагель (Fuji Silicia) с получением 73,4 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 3,36 (3Н, с), 3,58-3,76 (4Н, м), 4,19 (2Н, с), 4,37-4,41 (1Н, м), 4,70 (2Н, с), 5,09-5,22 (1Н, м), 6,00 (1Н, д, J=9 Гц), 7,16-7,38 (5Н, м), 7,70 (1Н, д, J=9 Гц).
f) 2-Бензил-6-[(3R,4S)-3-гидрокси-4-фторпирролидин-1-ил]-3-йодпиридин
Смесь 73,4 мг 2-бензил-6-[(3R,4S)-3-метоксиметилокси-4-фторпирролидин-1-ил]-3-йодпиридина и 5,0 мл трифторуксусной кислоты нагревали при перемешивании в течение 2 часов при 45°С. После остывания ее выливали в водный раствор карбоната калия и экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором соли и растворитель удаляли. Затем остаток подвергали колоночной хроматографии на силикагеле и элюировали гексаном/этилацетатом (5:1), а затем гексаном/этилацетатом (1:1) с получением 50 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 3,46-3,82 (4Н, м), 4,19 (2Н, с), 4,48-4,51 (1H, м), 5,04 (1H, шир.д, J=52 Гц), 6,00 (1Н, д, J=9 Гц), 7,16-7,38 (5Н, м), 7,71 (1Н, д, J=9 Гц).
g) (3R)-3-[2-Бензил-6-[(3R,4S)-3-гидрокси-4-фторпирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинол
Смесь 50 мг 2-бензил-6-[(3R,4S)-3-гидрокси-4-фторпирролидин-1-ил]-3-йодпиридина, 21 мг (3R)-3-этинил-3-хинуклидинола, 15 мг тетракис(трифенилфосфин)палладия (0), 1 мг йодида меди, 53 мкл триэтиламина и 3,0 мл N,N-диметилформамида нагревали при перемешивании в течение 3 часов при 75°С в атмосфере азота. Реакционный раствор выливали в разбавленный водный раствор аммиака, затем экстрагировали этилацетатом. Затем органическую фазу промывали насыщенным раствором соли и растворитель удаляли. Остаток подвергали колоночной хроматографии на NH-силикагеле (Fuji Silicia) и элюировали гексаном/этилацетатом (1:1), а затем этилацетатом/метанолом (15:1) с получением 37 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,35-1,43 (1Н, м), 1,56-1,58 (1H, м), 1,85-1,90 (1H, м), 2,01-2,16 (2Н, м), 2,73-2,86 (4Н, м), 2,97-3,00 (1H, м), 3,15-3,21 (1H, м), 3,57-3,86 (4Н, м), 4,15 (2Н, с), 4,47-4,49 (1H, м), 5,04 (1H, шир.д, J=52 Гц), 6,14 (1H, д, J=9 Гц), 7,15-7,32 (5Н, м), 7,42 (1H, д, J=9 Гц).
Пример 112: (3R)-3-[2-Бензил-6-[(3R,4S)-3-(фторметокси)-4-метоксипирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинол
а) 2-Бензил-6-[(3R,4S)-3-(фторметокси)-4-метоксипирролидин-1-ил]-3-йодпиридин
37,4 мг N-йодсукцинимида малыми порциями добавляли к раствору, содержащему 47,8 мг 2-бензил-6-[(3R,4S)-3-(фторметокси)-4-метоксипирролидин-1-ил]пиридина, полученного в примере 111, и 4,0 мл N,N-диметилформамида, при перемешивании на ледяной бане с последующим перемешиванием в течение ночи. К реакционному раствору добавляли воду и смесь экстрагировали этилацетатом. Органическую фазу последовательно промывали водным раствором тиосульфата натрия, водой и насыщенным раствором соли и растворитель удаляли. Остаток подвергали колоночной хроматографии на NH-силикагеле (Fuji Silicia) и элюировали гексаном/этилацетатом (5:1), а затем гексаном/этилацетатом (3:1) с получением 43,9 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 3,47 (Н, с), 3,48-3,64 (4Н, м), 3,97-4,03 (1Н, м), 4,19 (2Н, с), 4,41-4,42 (1Н, м), 5,40 (2Н, д, J=56 Гц), 5,97 (1Н, д, J=9 Гц), 7,17-7,38 (5Н, м), 7,70 (1Н, д, J=9 Гц).
b) (3R)-3-[2-Бензил-6-[(3R,4S)-3-(фторметокси)-4-метоксипирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинол
Смесь 43,9 мг 2-бензил-6-[(3R,4S)-3-(фторметокси)-4-метоксипирролидин-1-ил]-3-йодпиридина, 16,5 мг (3R)-3-этинил-3-хинуклидинола, 11,5 мг тетракис(трифенилфосфин)палладия (0), 0,9 мг йодида меди, 42 мкл триэтиламина и 3,0 мл М.М-диметилформамида нагревали при перемешивании в течение 1 часа при 75°С в атмосфере азота. Реакционный раствор выливали в разбавленный водный раствор аммиака и затем смесь экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором соли и растворитель удаляли. Остаток подвергали колоночной хроматографии на NH-силикагеле (Fuji Silicia) и элюировали гексаном/этилацетатом (1:1), а затем этилацетатом/метанолом (15:1) с получением 33 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,34-1,42 (1Н, м), 1,54-1,62 (1H, м), 1,85-1,90 (1H, м), 1,99-2,07 (2Н, м), 2,73-2,91 (4Н, м), 3,01 (1H, д, J=14 Гц), 3,23 (1H, дд, J=2, 14 Гц), 3,48 (3Н, с), 3,54-3,58 (1H, м), 3,65-3,69 (3Н, м), 3,99-4,03 (1H, м), 4,15 (2Н, с), 4,41-4,45 (1H, м), 5,40 (2Н, д, J=56 Гц), 6,13 (1H, д, J=9 Гц), 7,13-7,40 (5Н, м), 7,42 (1H, д, J=9 Гц).
Пример 113: (3R)-3-[2-Бензил-6-[(3S,4R)-3-хлор-4-метоксипирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинол
а) 2-Бензил-6-[(3S,4R)-3-(3-нитробензолсульфонил)окси-4-метоксипирролидин-1-ил]-3-йодпиридин
Смесь 1,0 г 2-бензил-3-йод-6-[(3R,4R)-3-гидрокси-4-метоксипирролидин-1-ил]пиридина (пример 10с), 1,0 г 3-нитробензолсульфонилхлорида, 0,1 г 4-диметиламинопиридина и 5 мл пиридина перемешивали при комнатной температуре в течение ночи. К реакционному раствору добавляли воду и смесь экстрагировали этилацетатом. Органическую фазу промывали водой и насыщенным раствором соли и растворитель удаляли. Остаток подвергали колоночной хроматографии на NH-силикагеле (Fuji Silicia) и элюировали гексаном/этилацетатом (5:1), а затем гексаном/этилацетатом (2:1) с получением 1,23 г целевого соединения.
1H-ЯНР (CDCl3) δ: 3,38 (3Н, с), 3,47-3,51 (1Н, м), 3,61-3,73 (3Н, м), 4,11-4,16 (3Н, м), 5,11-5,12 (1Н, м), 5,94 (1Н, д, J=9 Гц), 7,18-7,33 (5Н, м), 7,68-7,76 (2Н, м), 8,20-8,22 (1Н, м), 8,48-8,51 (1H, м), 8,75 (1Н, с).
b) 2-Бензил-6-[(3S,4R)-3-хлор-4-метоксипирролидин-1-ил]-3-йодпиридин
Смесь 553 г 2-бензил-6-[(3S,4R)-3-(3-нитробензолсульфонил)окси-4-метоксипирролидин-1-ил]-3-йодпиридина, 79 мг хлорида лития и 5,0 мл N,N-диметилформамида нагревали при перемешивании при 75°С в течение 9 часов. После остывания к реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Органическую фазу промывали водой и насыщенным раствором соли и растворитель удаляли. Остаток подвергали колоночной хроматографии на NH-силикагеле (Fuji Silicia) и элюировали гексаном/этилацетатом (10:1), а затем гексаном/этилацетатом (5:1) с получением 391 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 3,48 (3Н, с), 3,48-3,51 (1H, м), 3,65-3,69 (1H, м), 3,83-3,85 (2Н, м), 4,05-4,09 (1H, м), 4,19 (2Н, с), 4,55-4,58 (1H, м), 5,97 (1H, д, J=9 Гц), 7,18-7,38 (5Н, м), 7,72 (1H, д, J=9 Гц).
c) (3R)-3-[2-Бензил-6-[(3S,4R)-3-(3-хлор-4-метоксипирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинол
Смесь 391 мг 2-бензил-6-[(3S,4R)-3-хлор-4-метоксипирролидин-1-ил]-3-йодпиридина, 152 мг (3R)-3-этинил-3-хинуклидинола, 105 мг тетракис(трифенилфосфин)палладия (0), 9 мг йодида меди, 0,38 мл триэтиламина и 5,0 мл N,N-диметилформамида нагревали при перемешивании в течение 4 часов при 75°С в атмосфере азота с последующим удалением растворителя. Остаток подвергали колоночной хроматографии на NH-силикагеле (Fuji Silicia) и элюировали гексаном/этилацетатом (1:1), а затем этилацетатом/метанолом (20:1) и затем кристаллизовали из смеси гексан/этилацетат с получением 150 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,46-1,53 (1H, м), 1,64-1,92 (2Н, м), 2,04-2,12 (2Н, м), 2,82-2,97 (4Н, м), 3,11 (1H, д, J=14 Гц), 3,29 (1H, дд, J=2, 14 Гц), 3,49 (3Н, с), 3,52-3,56 (1H, м), 3,70-3,75 (1H, м), 3,85-3,91 (2Н, м), 4,06-4,11 (1H, м), 4,15 (2Н, с), 4,57-4,60 (1H, м), 6,15 (1H, д, J=9 Гц), 7,17-7,30 (5Н, м), 7,44 (1H, д, J=9 Гц).
Пример 114: (3R)-3-[2-Бензил-6-[(3R,4R)-3,4-этилендиоксипирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинол
а) 2-Бром-6-[(3R,4R)-3-метоксиметилокси-4-[2-(тетрагидро-2Н-2-пиранилокси)этил]оксипирролидин-1-ил]пиридин
3,88 г 60% масляной суспензии гидрида натрия малыми порциями добавляли к раствору в 50 мл N,N-диметилформамида, содержащему 14,7 г 2-бром-6-[(3R,4R)-3-метоксиметилокси-4-гидроксипирролидин-1-ил]пиридина (пример 111b), при перемешивании на ледяной бане. Смесь перемешивали в течение 10 минут на ледяной бане, а затем в течение 20 минут при комнатной температуре. Затем понемногу, по каплям добавляли 14,7 мл 2-(2-бромэтил)окситетрагидро-2Н-пирана на ледяной бане. Реакционный раствор перемешивали при комнатной температуре в течение 20 минут, а затем при 60°С в течение 20 минут. Далее при комнатной температуре добавляли 7,4 мл 2-(2-бромэтил)окситетрагидро-2Н-пирана с последующим нагреванием при перемешивании при 60°С в течение 30 минут. После остывания реакционный раствор выливали в воду и смесь экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором соли и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле и элюировали гексаном/этилацетатом (3:1) и затем гексаном/этилацетатом (2:1) с получением 17,58 г г целевого соединения.
1H-ЯМР (CDCl3) δ: 1,50-1,59 (4Н, м), 1,67-1,83 (2Н, м), 3,39 (3Н, с), 3,48-3,61 (4Н, м), 3,67-3,75 (4Н, м), 3,82-3,88 (2Н, м), 4,13-4,14 (1Н, м), 4,31-4,34 (1Н, м), 4,61-4,63 (1Н, м), 4,70-4,74 (2Н, м), 6,25 (1Н, д, J=8 Гц), 6,69 (1Н, д, J=7 Гц), 7,22-7,27 (1Н, м).
b) 2-Бром-6-[(3R,4R)-3-метоксиметилокси-4-[2-(гидрооксиэтил)оксипирролидин-1-ил]пиридин
2,26 г моногидрата п-толуолсульфоновой кислоты по каплям добавляли в 60 мл метанольного раствора, содержащего 17,09 г 2-бром-6-[(3R,4R)-3-метоксиметилокси-4-[2-(тетрагидро-2Н-2-пиранилокси)этил]оксипирролидин-1-ил]пиридина, на ледяной бане. После перемешивания в течение 30 минут при охлаждении льдом смесь перемешивали при комнатной температуре в течение 2 часов. Далее добавляли 377 мг моногидрата п-толуолсульфоновой кислоты с последующим перемешиванием в течение 2 часов. Затем реакционный раствор выливали в водный насыщенный раствор бикарбоната натрия и экстрагировали два раза этилацетатом. Органическую фазу промывали насыщенным раствором соли и растворитель удаляли. Остаток фильтровали через силикагель с получением 13,14 г целевого соединения.
1H-ЯМР (CDCl3) δ: 3,39 (3Н, с), 3,53-3,56 (2Н, м), 3,66-3,75 (6Н, м), 4,10-4,13 (1Н, м), 4,30-4,31 (1Н, м), 4,70-4,74 (2Н, м), 6,25 (1Н, д, J=8 Гц), 6,70 (1Н, д, J=8 Гц), 7,24-7,28 (1Н, м).
с) 2-Бром-6-[(3R,4R)-3-метоксиметилокси-4-[2-(метансульфонилокси)этил]оксипирролидин-1-ил]пиридин
7,9 мл триэтиламина медленно добавляли к раствору из 70 мл дихлорметана, содержащему 13,14 г 2-бром-6-[(3R,4R)-3-метоксиметилокси-4-[2-(гидрооксиэтил)оксипирролидин-1-ил]-пиридин, на ледяной бане. Затем медленно добавляли 3,2 мл метансульфонилхлорида с последующим перемешиванием в течение 15 минут. Затем реакционный раствор выливали в воду и дважды экстрагировали дихлорметаном. Органическую фазу промывали насыщенным раствором соли и растворитель удаляли. Остаток фильтровали через NH-силикагель с получением 15,66 г целевого соединения.
1H-ЯМР (CDCl3) δ: 3,00 (3Н, с), 3,38 (3Н, с), 3,52-3,59 (2Н, м), 3,66-3,72 (2Н, м), 3,82-3,84 (2Н, м), 4,10-4,15 (1Н, м), 4,28-4,30 (1Н, м), 4,33-4,35 (2Н, м), 4,71 (2Н, с), 6,25 (1Н, д, J=8 Гц), 6,71 (1Н, д, J=8 Гц), 7,24-7,28 (1Н, м).
d) 2-Бром-6-[(3R,4R)-3-гидрокси-4-[2-(метансульфонилоксиэтил)оксипирролидин-1-ил]пиридин
2,0 мл концентрированной серной кислоты медленно, по каплям добавляли в 160 мл метанольного раствора, содержащего 15,66 г 2-бром-6-[(3R,4R)-3-метоксиметилокси-4-(2-метансуль-фонилоксиэтил)оксипирролидин-1-ил]пиридина, при перемешивании на ледяной бане. Реакционный раствор перемешивали при комнатной температуре в течение 10 минут и затем при 50°С в течение 45 минут. Далее, после добавления туда по каплям 1,0 мл концентрированной серной кислоты смесь перемешивали при 50°С в течение одного часа. После остывания реакционную смесь выливали в водный раствор карбоната калия и дважды экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Остаток фильтровали через силикагель с получением 11,82 г целевого соединения.
1H-ЯМР (CDCl3) δ: 3,01 (3Н, с), 3,44-3,56 (2Н, м), 3,69-3,87 (4Н, м), 4,01-4,04 (1Н, м), 4,34-4,37 (2Н, м), 4,44-4,45 (1Н, м), 6,25 (1Н, д, J=8 Гц), 6,72 (1Н, д, J=7 Гц), 7,24-7,28 (1Н, м).
e) 2-Бром-6-[(3R,4R)-3,4-этилендиоксипирролидин-1-ил]-пиридин
1,49 г 60% масляной суспензии гидрида натрия малыми порциями добавляли к 150 мл N,N-диметилформамидного раствора, содержащего 11,82 г 2-бром-6-[(3R,4R)-3-гидрокси-4-(2-метансульфонилоксиэтил)оксипирролидин-1-ил]пиридина, при перемешивании на ледяной бане. Затем после перемешивания при комнатной температуре в течение одного часа добавляли 372 мг 60% масляной суспензии гидрида натрия. После перемешивания в течение еще 45 минут реакционную смесь выливали в воду и дважды экстрагировали этилацетатом. Органическую фазу промывали водой и насыщенным раствором соли и растворитель удаляли. Остаток кристаллизовали из смеси этилацетат/гексан с получением 5,35 г целевого соединения.
1H-ЯМР (CDCl3) δ: 3,20-3,25 (2Н, м), 3,73-3,92 (8Н, м), 6,23 (1Н, д, J=8 Гц), 6,73 (1Н, д, J=8 Гц), 7,25-7,29 (1Н, м).
f) 2-Бензил-6-[(3R,4R)-3,4-этилендиоксипирролидин-1-ил]-пиридин
26,6 моль тетрагидрофуранового раствора, содержащего 1,06 моль бензилмагнийхлорида, по каплям добавляли в 100 мл тетрагидрофуранового раствора, содержащего 5,3 г 2-бром-6-[(3R,4R)-3,4-этилендиоксипирролидин-1-ил]пиридина и 509 мг хлорида 1,3-бис(дифенилфосфино)пропанникеля (II), в течение 10 минут при охлаждении льдом. После перемешивания при комнатной температуре в течение ночи реакционный раствор выливали в насыщенный водный раствор хлорида аммония и экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором соли и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле и элюировали гексаном/этилацетатом (10:1), а затем гексаном/этилацетатом (1:2). Полученный сырой продукт кристаллизовали из смеси гексан/этилацетат с получением 4,84 г целевого соединения.
1H-ЯМР (CDCl3) δ: 3,20-3,25 (2Н, м), 3,72-3,91 (8Н, м), 3,96 (2Н, с), 6,13 (1Н, д, J=8 Гц), 6,39 (1Н, д, J=7 Гц), 7,17-7,36 (6Н, м).
g) 2-Бензил-6-[(3R,4R)-3,4-этилендиоксипирролидин-1-ил]-3-йодпиридин
4,04 г N-йодсукцинимид малыми порциями добавляли к 40 мл N,N-диметилформамидного раствора, содержащего 4,84 г 2-бензил-6-[(3R,4R)-3,4-этилендиоксипирролидин-1-ил]пиридина, при перемешивании на ледяной бане с последующим перемешиванием в течение ночи. Реакционный раствор выливали в воду и экстрагировали этилацетатом. Органическую фазу последовательно промывали водным раствором сульфита натрия, водой и насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Остаток подвергали фильтрованию, используя силикагель, и кристаллизовали из смеси гексан/этилацетат с получением 5,12 г целевого соединения.
1H-ЯМР (CDCl3) δ: 3,15-3,18 (2Н, м), 3,7 1-3,91 (8Н, м), 4,14-4,22 (2Н, м), 5,95 (1Н, д, J=9 Гц), 7,18-7,39 (5Н, м), 7,70 (1Н, д, J=9 Гц).
h) (3R)-3-[2-Бензил-6-[(3R,4R)-3,4-этилендиоксипирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинол
Смесь 5,12 г 2-бензил-6-[(3R,4R)-3,4-этилендиоксипирролидин-1-ил]-3-йодпиридина, 1,83 г (3R)-3-этинил-3-хинуклидинола, 140 мг тетракис(трифенилфосфин)палладия (0), 115 мг йодида меди, 3,4 мл триэтиламина и 12 мл метанола перемешивали при комнатной температуре в течение ночи в атмосфере азота. Реакционный раствор выливали в водный разбавленный раствор аммиака и смесь экстрагировали этилацетатом/тетрагидрофураном (1:1). Органическую фазу промывали насыщенным раствором соли и растворитель удаляли. Остаток кристаллизовали из смеси тетрагидрофуран/метанол/этилацетат с получением 3,59 г целевого соединения.
1H-ЯМР (CDCl3) δ: 1,37-1,44 (1H, м), 1,55-1,64 (1H, м), 1,87-1,91 (1H, м), 2,04-2,05 (2Н, м), 2,75-2,89 (4Н, м), 3,04 (1H, д, J=14 Гц), 3,18-3,28 (3Н, м), 3,73-3,91 (8Н, м), 4,11-4,21 (2Н, м), 6,12 (1H, д, J=9 Гц), 7,14-7,34 (5Н, м), 7,44 (1H, д, J=9 Гц).
Пример 115: (3R)-3-[2-Бензил-6-[(3R,4R)-3-гидрокси-4-циклопропилоксипирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинол
а) 2-Бензил-6-[(3R,4R)-3-метоксиметилокси-4-винилоксипирролидин-1-ил]пиридин
145 мг 60% масляной суспензии гидрида натрия добавляли к смеси 906 мг 2-бензил-6-[(3R,4R)-3,4-дигидроксипирролидин-1-ил]пиридина (пример 10 а) и 10 мл тетрагидрофурана при охлаждении льдом с последующим перемешиванием в течение одного часа при той же температуре. Туда добавляли 0,252 мл хлорметилметилового эфира с последующим перемешиванием при комнатной температуре в течение 1,5 часов. К реакционному раствору добавляли воду и этилацетат и органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. К остатку добавляли 4 мл этилвинилового эфира и 238 мг ацетата ртути с последующим перемешивание в течение двух ночей при комнатной температуре. К реакционному раствору добавляли водный насыщенный раствор бикарбоната натрия и диэтиловый эфир. Органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле, используя 15% этилацетат/гексан, с получением 229 г целевого соединения.
1H-ЯМР (CDCl3) δ: 3,39 (3Н, с), 3,51-3,61 (4Н, м), 3,97 (2Н, с), 4,12 (1Н, дд, J=2, 7 Гц), 4,42-4,46 (2Н, м), 4,54-4,55 (1Н, м), 4,71-4,76 (2Н, м), 6,17 (1Н, д, J=8 Гц), 6,34-6,42 (2Н, м), 7,16-7,34 (6Н, м).
b) 2-Бензил-6-[(3R,4R)-3-метоксиметилокси-4-циклопропилоксипирролидин-1-ил]пиридин
Смесь 229 мг 2-бензил-6-[(3R,4R)-3-метоксиметилокси-4-винилоксипирролидин-1-ил]пиридина, 217 мкл дийодметана, 1,35 мл гексанового раствора, содержащего 1,0 моль диэтилцинка, и 3 мл толуола перемешивали при 80°С в течение 3 часов. К реакционному раствору добавляли хлорид аммония, смесь промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле, используя 15% этилацетат/гексан, с получением 47,8 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 0,50-0,63 (4Н, м), 3,38-3,42 (4Н, м), 3,52-3,60 (2Н, м), 3,69-3,75 (2Н, м), 3,97 (2Н, с), 4,18-4,21 (1Н, м), 4,30-4,33 (1Н, м), 4,70-4,74 (2Н, м), 6,16 (1Н, д, J=8 Гц), 6,33 (1Н, д, J=8 Гц), 7,17-7,33 (6Н, м).
с) (3R)-3-[2-Бензил-6-[(3R,4R)-3-гидрокси-4-циклопропилоксипирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинол
Смесь 47,8 мг 2-бензил-6-[(3R,4R)-3-метоксиметилокси-4-циклопропилоксипирролидин-1-ил]пиридина, 1,5 мл дихлорметана и 0,156 мл трифторуксусной кислоты перемешивали в течение ночи при комнатной температуре. К реакционному раствору добавляли водный насыщенный раствор бикарбоната натрия и этилацетат и органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Остаток подвергали той же реакции, что и в примере 10, чтобы синтезировать целевое соединение.
1H-ЯМР (CDCl3) δ: 0,50-0,62 (4Н, м), 1,35-1,43 (1Н, м), 1,53-1,61 (1Н, м), 1,82-1,90 (1H, м), 1,99-2,06 (2Н, м), 2,71-2,91 (4Н, м), 2,98 (1Н, д, J=14 Гц), 3,20 (1H, дд, J=2, 14 Гц), 3,36-3,41 (1H, м), 3,43-3,47 (1H, м), 3,55-3,58 (1H, м), 3,68 (1H, дд, J=5, 11 Гц), 3,75 (1H, дд, J=5, 12 Гц), 4,06-4,15 (3Н, м), 4,39-4,42 (1H, м), 6,12 (1H, д, J=8 Гц), 7,13-7,32 (5Н, м), 7,40 (1H, д, J=8 Гц).
Пример 116: (3R)-3-[2-Бензил-5-хлор-6-[(3R,4R)-3-гидрокси-4-метоксипирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинол
a) 2-Бензил-5-хлор-3-йод-6-[(3R,4R)-3-гидрокси-4-метоксипирролидин-1-ил]пиридин
100 мг N-хлорсукцинимида малыми порциями добавляли к смеси 256 мг 2-бензил-3-йод-6-[(3R,4R)-3-гидрокси-4-метоксипирролидин-1-ил]пиридина (пример 10с) и 3 мл N,N-диметилформамида с последующим перемешиванием при 70°С в течение 2 часов. После остывания добавляли воду и этилацетат и смесь экстрагировали. Органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле, используя 25% этилацетат/гексан, с получением 132 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 3,39 (3Н, с), 3,64-3,69 (2Н, м), 3,76-3,79 (1Н, м), 3,86-3,90 (1Н, м), 3,94-3,97 (1Н, м), 4,14 (2Н, с), 4,30-4,33 (1Н, м), 7,18-7,33 (5Н, м), 7,74 (1Н, с).
b) (3R)-3-[2-Бензил-5-хлор-6-[(3R,4R)-3-гидрокси-4-метоксипирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинол
Смесь 132 мг 2-бензил-5-хлор-6-[(3R,4R)-3-гидрокси-4-метоксипирролидин-1-ил]пиридина, 49,4 мг (3R)-3-этинил-3-хинуклидинола, 17,2 мг тетракис(трифенилфосфин)палладия (0), 11,3 мг йодида меди, 124 мкл триэтиламина и 1,5 мл метанола кипятили с обратным холодильником в течение одного часа в атмосфере азота. После остывания к реакционной смеси добавляли воду и этилацетат. Органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Остаток подвергали колоночной хроматографии на NH-силикагеле, используя 3% метанол/этилацетат, с получением 125 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,36-1,44 (1Н, м), 1,56-1,63 (1H, м), 1,82-1,89 (1Н, м), 1,99-2,05 (2Н, м), 2,50-2,88 (4Н, м), 3,00 (1Н, д, J=14 Гц), 3,20 (1Н, дд, J=2, 14 Гц), 3,40 (3Н, с), 3,71-3,78 (3Н, м), 3,92-3,97 (1H, м), 4,00-4,04 (1Н, м), 4,09 (2Н, с), 4,30-4,32 (1Н, м), 7,17-7,29 (5Н, м), 7,45 (1Н, с).
Пример 117: (3R)-3-[2-Бензил-5-бром-6-[(3R,4R)-3-гидрокси-4-метоксипирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали таким же образом, что и в примере 116, за исключением того, что N-хлорсукцинимид заменяли N-бромсукцинимидом.
1H-ЯМР (CDCl3) δ: 1,36-1,44 (1Н, м), 1,58-1,64 (1H, м), 1,82-1,91 (1H, м), 1,99-2,06 (2Н, м), 2,72-2,93 (4Н, м), 3,02 (1H, д, J=14 Гц), 3,23 (1H, дд, J=2, 14 Гц), 3,40 (ЗН, с), 3,72-3,80 (3Н, м), 3,92-3,97 (1H, м), 4,01-4,06 (1H, м), 4,09 (2Н, с), 4,30-4,32 (1H, м), 7,16-7,30 (5Н, м), 7,67 (1H, с).
Пример 118: (3R)-3-[2-Бензил-6-[3,3-этилендиоксипирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинол
а) 2-Бром-6-[3,3-этилендиоксипирролидин-1-ил]-3-пиридин
Смесь 5,7 г 2,6-дибромпиридина, 2,5 г 3-гидроксипирролидина, 3,6 мл 1,8-диазабицикло[5,4,0]-7-ундецена (ДБУ) и 20 мл тетрагидрофурана нагревали при перемешивании в течение 11 часов на масляной бане при температуре 70°С. Смесь распределяли между этилацетатом-водой и органический слой промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и затем концентрировали. Остаток подвергали колоночной хроматографии на силикагеле, используя 10-30% этилацетат/гексан, с получением 5,9 г 2-бром-6-(3-гидроксипирролидин-1-ил)пиридина.
Затем 4,6 мл диметилсульфоксида по каплям добавляли в 100 мл дихлорметанового раствора, содержащего 2,8 мл оксалилхлорида, при перемешивании на бане с сухим льдом-ацетоном. Затем по каплям добавляли 50 мл дихлорметанового раствора, содержащего 5,9 г полученного 2-бром-6-(3-гидроксипирролидин-1-ил)пиридина. Наконец, по каплям добавляли 17 мл триэтиламина и температуру смеси повышали до комнатной температуры в течение одного часа. Реакционный раствор промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и затем концентрировали. К остатку добавляли 50 мл толуола, 7 мл этиленгликоля и каталитическое количество моногидрата п-толуолсульфоновой кислоты с последующим кипячением с обратным холодильником в течение 3 часов с отгонкой воды. После охлаждения смесь промывали насыщенным водным раствором бикарбоната натрия и насыщенным раствором соли, сушили над безводным сульфатом магния и затем концентрировали. Остаток подвергали колоночной хроматографии на силикагеле, используя 5-7% этилацетат/гексан, с получением 6,3 г целевого соединения.
1H-ЯМР (CDCl3) δ: 2,30 (2Н, т, J=7 Гц), 3,54 (2Н, с), 3,58 (2Н, т, J=7 Гц), 3,96-4,04 (4Н, м), 6,22 (1Н, д, J=8 Гц), 6,70 (1Н, д, J=8 Гц), 7,24 (1Н, т, J=8 Гц).
b) 2-Бензил-6-[3,3-этилендиоксипирролидин-1-ил]пиридин
Смесь 6,3 г 2-бром-6-[3,3-этилендиоксипирролидин-1-ил]пиридина, 240 мг хлорида 1,3-бис(дифенилфосфино)пропанникеля (II) и 20 мл тетрагидрофурана перемешивали на ледяной бане в атмосфере азота. В смесь по каплям добавляли раствор бензилмагнийбромида в диэтиловом эфире, приготовленный из 3,4 мл бензилбромида, 0,8 г магния и 15 мл диэтилового эфира, с последующим перемешиванием при комнатной температуре в течение ночи. Реакционный раствор распределяли между водным насыщенным раствором хлорида аммония и этилацетатом. Органическую фазу промывали насыщенным раствором соли, сушили над безводным сульфатом магния и затем концентрировали. Остаток подвергали колоночной хроматографии на силикагеле, используя 5-10% этилацетат/гексан, с получением 6,6 г целевого соединения.
1H-ЯМР (CDCl3) δ: 2,19 (2Н, т, J=7 Гц), 3,57 (2Н, с), 3,59 (2Н, т, J=7 Гц), 3,97 (2Н, с), 4,01 (4Н, с), 6,14 (1Н, д, J=8 Гц), 6,34 (1Н, д, J=7 Гц), 7,16-7,35 (6Н, м).
с) 2-Бензил-3-йод-6-[3,3-этилендиоксипирролидин-1-ил]-пиридин
Смесь 6,6 г 2-бензил-6-[3,3-этилендиоксипирролидин-1-ил]пиридина и 60 мл N,N-диметилформамида перемешивали на ледяной бане. В смесь по каплям добавляли 5,5 г N-йодсукцинимида с последующим перемешиванием при комнатной температуре в течение ночи. Добавляли 10 мл водного раствора, содержащего один моль тиосульфата натрия, и смесь распределяли между этилацетатом и водой. Органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и затем концентрировали. Остаток подвергали колоночной хроматографии на силикагеле, используя 5-10% этилацетат/гексан, с получением 6,7 г целевого соединения.
1H-ЯМР (CDCl3) δ: 2,17 (2Н, т, J=7 Гц), 3,50 (2Н, с), 3,54 (2Н, т, J=7 Гц), 4,00 (4Н, с), 4,18 (2Н, с), 5,95 (1Н, д, J=8 Гц), 7,18 (1Н, т, J=7 Гц), 7,26 (2Н, т, J=7 Гц), 7,37 (2Н, д, J=7 Гц), 7,68 (1Н, д, J=8 Гц).
d) (3R)-3-[2-Бензил-6-[3,3-этилендиоксипирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинол
Смесь 3,0 г 2-бензил-3-йод-6-[3,3-этилендиоксипирролидин-1-ил]пиридина, 1,07 г (3R)-3-этинил-3-хинуклидинола, 82 мг тетракис(трифенилфосфин)палладия (0), 68 мг йодида меди, 2,0 мл триэтиламина и 7 мл метанола перемешивали при комнатной температуре в течение ночи в атмосфере азота. Реакционный раствор распределяли между водным разбавленным раствором аммиака-этилацетатом, промывали водой, сушили над безводным сульфатом магния и затем концентрировали. К остатку добавляли 10 мл тетрагидрофурана для растворения при нагревании и к смеси добавляли 15 мл этилацетата. Смесь фильтровали через 10 г NH-силикагеля, промывали этилацетатом и концентрировали. Остаток кристаллизовали из этилацетата с получением 2,79 г целевого соединения.
1H-ЯМР (CDCl3) δ: 1,34-1,94 (3Н, м), 1,98-2/06 (2Н, м), 2,18 (2Н, т, J=8 Гц), 2,70-2,94 (4Н, м), 3,02 (1Н, д, J=14 Гц), 3,23 (1Н, дд, J=2, 14 Гц), 3,55 (2Н, с), 3,60 (2Н, т, J=8 Гц), 4,01 (4Н, с), 4,15 (2Н, с), 6,12 (1Н, д, J=8 Гц), 7,12-7,34 (5Н, м), 7,41 (1Н, д, J=8 Гц).
Пример 119: (3R)-3-[2-Бензил-5-хлор-6-[3,3-этилендиоксипирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинол
Смесь 500 мг 2-бензил-3-йод-6-(3,3-этилендиоксипирролидин-1-ил)пиридина, полученного в примере 118с, 174 мг N-хлорсукцинимида и 5 мл N,N-диметилформамида перемешивали при нагревании в течение 5 часов на масляной бане при температуре 60°С. К реакционному раствору добавляли 1 мл водного раствора, содержащего 1 моль тиосульфата натрия, смесь распределяли между этилацетатом и водой. Органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и затем концентрировали. Остаток подвергали колоночной хроматографии на силикагеле, используя 5-10% этилацетат/гексан, с получением 320 мг 2-бензил-3-йод-5-хлор-6-(3,3-этилендиоксипирролидин-1-ил)пиридина и затем получали соединение, названное в заголовке, по тем же методикам, что и в примере 118d.
1H-ЯМР (CDCl3) δ: 1,35-1,92 (3Н, м), 1,98-2,05 (2Н, м), 2,09 (2Н, т, J=7 Гц), 2,70-2,94 (4Н, м), 3,03 (1Н, д, J=14 Гц), 3,23 (1Н, дд, J=2, 14 Гц), 3,80 (2Н, с), 3,84 (2Н, т, J=7 Гц), 4,00 (4Н, с), 4,10 (2Н, с), 7,14-7,32 (5Н, м), 7,44 (1Н, с).
Пример 120: (3R)-3-[2-Бензил-6-[цис-3,4-диметоксипирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинол
а) 2-Бром-6-(3-пирролин-1-ил)пиридин
Смесь 12,4 г 2,6-дибромпиридина, 7,2 г 3-пирролина (чистота: 65%, Aldrich), 14,5 г карбоната калия и 100 мл 1-метил-2-пирролидинона нагревали при перемешивании при 125°С в течение 4 часов. После остывания реакционную смесь выливали в воду и экстрагировали этилацетатом. Органическую фазу промывали водой и насыщенным раствором соли и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле и элюировали гексаном, а затем гексаном/этилацетатом (10:1) с получением 11,6 г целевого соединения и 2-бром-6-(пирролидин-1-ил)пиридина.
b) 2-Бензил-6-(3-пирролин-1-ил)пиридин
72,3 мл тетрагидрофуранового раствора, содержащего 1,07 моль бензилмагнийхлорида, по каплям добавляли в смесь 11,6 г смеси 2-бром-6-(3-пирролидин-1-ил)пиридина и 2-бром-6'-(пирролидин-1-ил)пиридина и 20 мл тетрагидрофурана, содержащего 1,4 г хлорида 1,3-бис(дифенилфосфино)-пропанникеля (II), в течение 10 минут на ледяной бане. После охлаждения при комнатной температуре в течение ночи, реакционный раствор выливали в насыщенный водный раствор хлорида аммония и экстрагировали этилацетатом. Органическую фазу промывали насыщенным водным раствором хлорида натрия и растворитель удаляли. Остаток подвергали колоночной хроматографии на NH-силикагеле (Fuji Silicia) и элюировали гексаном и затем гексаном/этилацетатом (20:1) с получением 11,8 г целевого соединения в виде смеси с 2-бензил-6-(пирролидин-1-ил)пиридином.
c) 2-Бензил-6-(цис-3,4-дигидроксипирролидин-1-ил)пиридин
2,3 мл 2-метил-2-пропанолового раствора, содержащего 2,5% тетраксида осмия, медленно по каплям добавляли в смесь 11,8 г смеси 2-бензил-6-(3-пирролин-1-ил)пиридина и 2-бензил-6-(пирролидин-1-ил)пиридина, 23,5 г водного 50% раствора N-метилморфолин-N-оксида, 50 мл ацетона и 10 мл воды на ледяной бане. После перемешивания в течение 2 часов на ледяной бане смесь далее перемешивали при комнатной температуре в течение ночи. Водный раствор тиосульфата натрия добавляли к реакционному раствору с последующим перемешиванием при комнатной температуре в течение 30 минут. Затем смесь экстрагировали этилацетатом, органическую фазу промывали водой и насыщенным раствором соли и растворитель удаляли. Затем остаток подвергали колоночной хроматографии на силикагеле и элюировали гексаном/этилацетатом (5:1), а затем этилацетатом с получением 4,2 г целевого соединения.
1H-ЯМР (CDCl3) δ: 3,47-3,50 (2Н, м), 3,71-3,75 (2Н, m), 3,97 (2Н, с), 4,37-4,39 (2Н, м), 6,15 (1Н, д, J=8 Гц), 6,37 (1Н, д, J=7 Гц), 7,17-7,35 (6Н, м).
d) 2-Бензил-6-(цис-3,4-диметоксипирролидин-1-ил)пиридин
347 мг 60% масляной суспензии гидрида натрия малыми порциями добавляли к смеси 781 мг 2-бензил-6-(цис-3,4-дигидроксипирролидин-1-ил)пиридина, 536 мкл метилйодида и 6,0 мл N,N-диметилформамида на ледяной бане. После перемешивания при комнатной температуре в течении 2 часов к реакционному раствору малыми порциями добавляли воду и смесь экстрагировали этилацетатом. Органическую фазу промывали водой и насыщенным раствором соли и растворитель удаляли.
Затем остаток подвергали колоночной хроматографии на силикагеле и элюировали гексаном/этилацетатом (5:1), а затем гексаном/этилацетатом (1:1) с получением 783 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 3,47 (6Н, с), 3,60-3,65 (4Н, м), 3,97-4,02 (4Н, м), 6,16 (1Н, д, J=8 Гц), 6,34 (1Н, д, J=7 Гц), 7,18-7,34 (6Н, м).
e) 2-Бензил-6-(цис-3,4-диметоксипирролидин-1-ил)-3-йодпиридин
708 мг N-йодсукцинимида малыми порциями добавляли к смеси 783 мг 2-бензил-6-(цис-3,4-диметоксипирролидин-1-ил)пиридина и 7,0 мл N,N-диметилформамида при охлаждении льдом с последующим перемешиванием в течение ночи. Реакционный раствор выливали в воду и экстрагировали этилацетатом. Органическую фазу промывали тиосульфатом натрия, водой и насыщенным раствором соли и растворитель удаляли. Остаток подвергали колоночной хроматографии на NH-силикагеле (Fuji Silicia) и элюировали гексаном/этилацетатом (5:1), а затем гексаном/этилацетатом (3:1) с получением 995 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 3,46 (6Н, с), 3,54-3,55 (4Н, м), 3,97-4,01 (2Н, м), 4,19 (2Н, с), 5,97 (1Н, д, J=9 Гц), 7,16-7,38 (5Н, м), 7,69 (1Н, д, J=9 Гц).
f) (3R)-3-[2-Бензил-6-[цис-3,4-диметоксипирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинол
Смесь 510 мг 2-бензил-6-(цис-3,4-диметоксипирролидин-1-ил)-3-йодпиридина, 200 мг (3R)-3-этинил-3-хинуклидинола, 139 мг тетракис(трифенилфосфин)палладия (0), 11 мг йодида меди, 0,50 мл триэтиламина и 5,0 мл N,N-диметилформамида нагревали при 75°С в течение 2 часов в атмосфере азота. Реакционный раствор выливали в водный разбавленный раствор аммиака и экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли и растворитель удаляли. Остаток подвергали колоночной хроматографии на NH-силикагеле (Fuji Silicia) и элюировали гексаном/этилацетатом (1:1), а затем этилацетатом/метанолом (15:1) с получением 281 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,38-1,40 (1H, м), 1,57-1,68 (1Н, м), 1,87-1,92 (1H, м), 2,02-2,04 (2Н, м), 2,74-2,87 (4Н, м), 3,02 (1H, д, J=14 Гц), 3,23 (1H, д, J=14 Гц), 3,47 (6Н, с), 3,60 (4Н, м), 3,99 (2Н, м), 4,16 (2Н, с), 6,13-6,15 (1H, м), 7,14-7,33 (5Н, м), 7,42 (1H, д, J=9 Гц).
Пример 121: (3R)-3-[2-Бензил-6-[цис-3,4-метилендиоксипирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинол
a) 2-Бензил-6-[цис-3,4-метилендиоксипирролидин-1-ил] пиридин
Смесь 300 мг 2-бензил-6-[цис-3,4-дигидроксипирролидин-1-ил]-3-пиридина, 376 мг пара-формальдегида, 0,7 мл концентрированной серной кислоты и 5,0 мл уксусной кислоты нагревали при перемешивании при 90°С в течение 2 часов. После остывания реакционный раствор медленно добавляли к водному раствору карбоната калия. Смесь экстрагировали этилацетатом, органическую фазу промывали насыщенным раствором соли и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле и элюировали гексаном/этилацетатом (5:1), а затем гексаном/этилацетатом (3:1) с получением 221 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 3,37-3,41 (2Н, м), 3,90-3,93 (2Н, м), 3,97 (2Н, с), 4,81-4,82 (2Н, м), 4,97 (1Н, с), 5,11 (1Н, с), 6,26 (1Н, д, J=8 Гц), 6,43 (1Н, д, J=7 Гц), 7,17-7,37 (6Н, м).
b) 2-Бензил-6-[цис-3,4-метилендиоксипирролидин-1-ил]-3-йодпиридин
143 мг имида N-йодянтарной кислоты малыми порциями добавляли к смеси 150 мг 2-бензил-6-(цис-3,4-метилендиоксипирролидин-1-ил)пиридина и 5,0 мл N,N-диметилформамида при охлаждении льдом с последующим перемешиванием в течение ночи. Реакционный раствор выливали в воду и затем экстрагировали этилацетатом. Органическую фазу промывали тиосульфатом натрия, водой и насыщенным раствором соли и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле и элюировали гексаном и затем гексаном/этилацетатом (4:1) с получением 116 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 3,34-3,38 (2Н, м), 3,82-3,86 (2Н, м), 4,19 (2Н, с), 4,79-4,89 (2Н, м), 4,95 (1Н, с), 5,09 (1Н, с), 6,06 (1Н, д, J=9 Гц), 7,07-7,38 (5Н, м), 7,72 (1Н, д, J= Гц).
c) (3R)-3-[2-Бензил-6-[цис-3,4-метилендиоксипирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинол
Смесь 116 мг 2-бензил-6-[цис-3,4-метилендиоксипирролидин-1-ил]-3-йодпиридина, 47 мг (3R)-3-этинил-3-хинуклидинола, 33 мг тетракис(трифенилфосфин)палладия (0), 3 мг йодида меди, 0,12 мл триэтиламина и 3,0 мл N,N-диметилформамида нагревали при перемешивании при 75°С в течение 4 часов в атмосфере азота. Реакционный раствор выливали в разбавленный водный раствор аммиака и затем экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли и растворитель удаляли. Остаток подвергали колоночной хроматографии на NH-силикагеле (Fuji Silicia) и элюировали гексаном/этилацетатом (1:1), а затем этилацетатом/метанолом (20:1) с получением 38 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,40-1,43 (1Н, м), 1,63 (1Н, м), 1,80-1,88 (1Н, м), 2,00-2,12 (2Н, м), 2,72-2,85 (4Н, м), 3,03 (1Н, д, J=14 Гц), 3,11-3,23 (1Н, м), 3,41-3,44 (2Н, м), 3,88-3,91 (2Н, м), 4,16 (2Н, с), 4,81-4,82 (2Н, м), 4,96 (1Н, с), 5,10 (1Н, с), 6,23 (1Н, д, J=9 Гц), 7,17-7,32 (5Н, м), 7,45 (1Н, д, J=9 Гц).
Пример 122: (3R)-3-[2-Бензил-6-[цис-3-изопропилокси-4-гидроксипирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинол
а) 2-Бензил-6-[цис-3,4-(диметилметилендиокси)пирролидин-1-ил]пиридин
Смесь 2,5 г 2-бензил-6-[цис-3,4-дигидроксипирролидин-1-ил]пиридина, 2,3 г dl-10-камфорсульфоновой кислоты, 20 мл 2,2-диметоксипропана и 5,0 мл N,N-диметилформамида перемешивали при комнатной температуре в течение ночи. К реакционному раствору добавляли насыщенный водный раствор бикарбоната натрия и смесь экстрагировали этилацетатом. Органическую фазу промывали водой и насыщенным раствором соли и растворитель удаляли. Затем остаток фильтровали через силикагель и элюировали этилацетатом с получением 2,87 г целевого соединения.
1H-ЯМР (CDCl3) δ: 1,37 (3Н, с), 1,48 (3Н, с), 3,33-3,40 (2Н, м), 3,85-3,88 (2Н, м), 3,97 (2Н, с), 4,86-4,87 (2Н, м), 6,24 (1Н, д, J=8 Гц), 6,39 (1Н, д, J=7 Гц), 7,17-7,35 (6Н, м).
b) 2-Бензил-6-[цис-3-изопропилокси-4-гидроксипирролидин-1-ил]пиридин
Гексановый раствор, содержащий 1,5 моль диизобутилалюмогидрида малыми порциями добавляли к раствору в 5,0 мл диэтилового эфира, содержащему 460 мг 2-бензил-6-[цис-3,4-(диметилметилендиокси)пирролидин-1-ил]пиридина, при -20°С. После перемешивания при комнатной температуре в течение ночи реакционный раствор выливали в водный раствор хлорида аммония, смесь фильтровали через целит и экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором соли и растворитель удаляли. Затем остаток фильтровали через силикагель и элюировали этилацетатом с получением 369 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,22-1,27 (6Н, м), 3,44-3,50 (2Н, м), 3,63-3,84 (3Н, м), 3,97 (2Н, с), 4,09-4,15 (1Н, м), 4,33-4,37 (1Н, м), 6,13-6,15 (1Н, м), 6,34 (1Н, д, J=7 Гц), 7,17-7,32 (6Н, м).
c) 2-Бензил-6-(цис-3-изопропилокси-4-гидроксипирролидин-1-ил)-3-йодпиридин
342 мг N-йодсукцинимида малыми порциями добавляли к смеси 396 мг 2-бензил-6-(цис-3-изопропилокси-4-гидрокси-пирролидин-1-ил)пиридина и 5,0 мл N,N-диметилформамида при охлаждении льдом с последующим перемешиванием в течение ночи. Реакционный раствор выливали в воду и затем экстрагировали этилацетатом. Органическую фазу промывали тиосульфатом натрия, водой и насыщенным раствором соли и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле и элюировали гексаном и затем гексаном/этилацетатом (3:1) с получением 464 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,21-1,27 (6Н, м), 3,40-3,46 (2Н, м), 3,56-3,82 (3Н, м), 4,09-4,19 (3Н, м), 4,31-4,34 (1Н, м), 5,96 (1Н, д, J=8 Гц), 7,16-7,38 (5Н, м), 7,68 (1Н, д, J=8 Гц).
d) (3R)-3-[2-Бензил-6-(цис-3-изопропилокси-4-гидроксипирролидин-1-ил)-3-пиридил]этинил-3-хинуклидинол
Смесь 464 мг 2-бензил-6-(цис-3-изопропилокси-4-гидроксипирролидин-1-ил)-3-йодпиридина, 176 мг (3R)-3-этинил-3-хинуклидинола, 122 мг тетракис(трифенилфосфин)-палладия (0), 10 мг йодида меди, 0,44 мл триэтиламина и 5,0 мл N,N-диметилформамида нагревали при перемешивании в течение 2 часов при 75°С в атмосфере азота. Реакционный раствор выливали в разбавленный водный раствор аммиака и затем экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли и растворитель удаляли. Остаток подвергали колоночной хроматографии на NH-силикагеле (Fuji Silicia) и элюировали гексаном/этилацетатом (1:1), а затем этилацетатом/метанолом (20:1) с получением 168 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,21-1,27 (6Н, м), 1,50-1,97 (3Н, м), 2,04-2,17 (2Н, м), 2,75-2,98 (4Н, м), 3,12 (1Н, д, J=14 Гц), 3,28-3,31 (1Н, м), 3,41-3,64 (3Н, м), 3,73-3,81 (2Н, м), 4,11-4,14 (3Н, м), 4,36 (1Н, шир.с), 6,14 (1Н, д, J=9 Гц), 7,16-7,29 (5Н, м), 7,41 (1Н, д, J=9 Гц).
Пример 123: (3R)-3-[2-Бензил-6-[(3R,4R)-3,4-диметокси-2-пирролидинон-1-ил]-3-пиридил]этинил-3-хинуклидинол
а) 2-Бензил-3-метоксиметилокси-6-[(3R,4R)-3,4-диметилметилендиокси-2-пирролидинон-1-ил]пиридин
3,6 г 2-бензил-3-метоксиметилокси-6-йодпиридина (пример получения 12), 1,5 г (3R,4R)-3,4-диметилметилендиокси-2-пирролидинона, синтезированного по методу, известному из литературы (J. Org. Chem., 1969, 34, 675), 1,1 г йодида меди и 3,3 г карбоната калия суспендировали в 20 мл 1-метил-2-пирролидинона с последующим перемешиванием при 140°С в течение 20 минут на масляной бане в атмосфере азота. После остывания туда добавляли этилацетат и водный раствор аммиака и смесь экстрагировали этилацетатом. Органическую фазу далее промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле, используя 20-50% этилацетат/гексан в качестве элюента, для разделения и очистки с получением 2 г целевого соединения.
1H-ЯМР (CDCl3) δ: 1,42 (3Н, с), 1,46 (3Н, с), 3,37 (3Н, с), 4,08-4,13 (3Н, м), 4,26 (1Н, д, J=13 Гц), 4,80 (2Н, с), 5,14 (2Н, дд, J=6,8, 10 Гц), 7,17-7,31 (5Н, м), 7,42 (1Н, д, J=9,0 Гц), 8,22 (1Н, д, J=9,0 Гц).
b) 2-Бензил-6-[(3R,4R)-3,4-диметилметилендиокси-2-пирролидинон-1-ил]-3-пиридилтрифторметансульфонат
5 мл трифторуксусной кислоты добавляли к 2 г 2-бензил-3-метоксиметилокси-6-[(3R,4R)-3,4-диметилметилендиокси-2-пирролидинон-1-ил]пиридина с последующим перемешиванием при комнатной температуре в течение 6 часов. Затем смесь нейтрализовали водным раствором карбоната калия и экстрагировали этилацетатом. Далее органическую фазу промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. После растворения полученного остатка в 30 мл дихлорметана добавляли 2,1 г N-фенилтрифторметансульфонимида, 192 мг 4-диметиламинопиридина и 0,8 мл триэтиламина. После перемешивания при комнатной температуре в течение одного часа растворитель удаляли и остаток подвергали колоночной хроматографии на силикагеле, используя 25% этилацетат/гексан в качестве элюента, для разделения и очистки с получением 2,2 г целевого соединения.
1H-ЯМР (CDCl3) δ: 1,42 (3Н, с), 1,46 (3Н, с), 4,03 (1Н, дд, J=4,0, 13 Гц), 4,18 (2Н, с), 4,23 (1Н, д, J=13 Гц), 4,79-4,83 (2Н, м), 7,20-7,42 (5Н, м), 7,60 (1Н, д, J=9,2 Гц), 8,44 (1Н, д, J=9,2 Гц).
с) 2-Бензил-6-[(3R,4R)-3,4-диметокси-2-пирролидинон-1-ил]-3-пиридилтрифторметансульфонат (А) и 2-бензил-6-[(3R,4R)-4-гидрокси-3-метокси-2-пирролидинон-1-ил]-3-пиридилтрифторметансульфонат (В)
2,2 г 2-бензил-6-[(3R,4R)-3,4-диметилметилендиокси-2-пирролидинон-1-ил]-3-пиридилтрифторметансульфонат растворяли в 20 мл метанола и добавляли 5 мл 5N соляной кислоты с последующим перемешиванием при комнатной температуре в течение 1,5 часов и при 50°С на масляной бане в течение 2 часов. После остывания смесь нейтрализовали водным раствором карбоната калия и экстрагировали этилацетатом. Далее органическую фазу промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Полученный остаток растворяли в 20 мл ацетонитрила и добавляли 1,5 мл метилйодида и 5,6 г оксида серебра (I) с последующим нагреванием при перемешивании при 60°С на масляной бане в течение 1,5 часов. Нерастворимые вещества отфильтровывали через целит и фильтрат выпаривали. Остаток подвергали колоночной хроматографии на силикагеле, используя 33-50% этилацетат/гексан в качестве элюента, для разделения и очистки с получением 685 мг целевого соединения (А) и 599 мг целевого соединения (В).
Соединение (А): 1H-ЯМР (CDCl3) δ: 3,47 (3Н, с), 3,69 (3Н, с), 3,80 (1Н, дд, J=3,8, 12 Гц), 4,07-4,21 (5Н, м), 7,22-7,29 (5Н, м), 7,58 (1Н, д, J=9,2 Гц), 8,38 (1Н, д, J=9,2 Гц).
Соединение (В): 1H-ЯМР (CDCl3) δ: 3,48 (1Н, д, J=4,6 Гц), 3,74 (3Н, с), 3,86 (1H, дд, J=13 Гц, 4,0 Гц), 4,06-4,18 (4Н, м), 4,54-4,57 (1H, м), 7,24-7,30 (5Н, м), 7,59 (1H, д, J=9,0 Гц), 8,37 (1H, д, J=9,0 Гц).
d) (3R)-3-[2-Бензил-6-[(3R,4R)-3,4-диметокси-2-пирролидинон-1-ил]-3-пиридил]этинил-3-хинуклидинол
5 мл N,N-диметилформамида добавляли к смеси 685 мг 2-бензил-6-[(3R,4R)-3,4-диметокси-2-пирролидинон-1-ил]-3-пиридилтрифторметансульфоната, 293 мг 16,5 мг (3R)-3-этинил-3-хинуклидинола, 107 мг тетракис(трифенилфосфин)палладия (0), 22 мг йодида меди и 0,7 мл триэтиламина с последующим нагреванием при перемешивании при 60°С на масляной бане в течение 1,3 часа в атмосфере азота. После остывания туда добавляли этилацетат и водный раствор аммиака и экстрагировали этилацетатом. Органическую фазу далее промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Остаток подвергали колоночной хроматографии на NH-силикагеле, используя 66% этилацетат/гексан и 2% метанол/этилацетат в качестве элюентов, для разделения и очистки с получением 361 мг намеченного соединения.
1H-ЯМР (CDCl3) δ: 1,38-1,48 (1H, м), 1,57-1,67 (1H, м), 1,68-1,92 (1H, м), 2,00-2,19 (2Н, м), 2,70-2,95 (4Н, м), 3,03 (1H, д, J=14 Гц), 3,24 (1H, дд, J=1,6, 14 Гц), 3,48 (3Н, с), 3,70 (3Н, с), 3,84 (1H, дд, J=2,0, 13 Гц), 4,09 (1H, д, J=2,8 Гц), 4,15-4,17 (1H, м), 4,23-4,25 (3Н, м), 7,09-7,29 (5Н, м), 7,67 (1H, д, J=8,8 Гц), 8,24 (1H, д, J=8,8 Гц).
Пример 124: (3R)-3-[2-Бензил-6-[(3R,4R)-4-гидрокси-3-метокси-2-пирролидинон-1-ил]-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали таким же образом, как и в примере 123, с использованием 2-бензил-6-[(3R,4R)-4-гидрокси-3-метокси-2-пирролидинон-1-ил]-3-пиридилтрифторметансульфоната (пример 123с).
1H-ЯМР (CDCl3) δ: 1,36-1,47 (1Н, м), 1,58-1,68 (1Н, м), 1,82-1,93 (1H, м), 2,00-2,09 (2Н, м), 2,70-2,95 (4Н, м), 3,03 (1Н, д, J=14 Гц), 3,25 (1Н, дд, J=2,0, 14 Гц), 3,74 (3Н, с), 3,90 (1Н, дд, J=4,0, 13 Гц), 4,07 (1Н, д, J=3,6 Гц), 4,21 (1H, д, J=13 Гц), 4,24 (2Н, с), 4,55 (1H, дд, J=3,6, 4,0 Гц), 7,08-7,28 (5Н, м), 7,66 (1H, д, J=8,4 Гц), 8,21 (1H, д, J=8,4 Гц).
Пример 125: (3R)-3-[2-Бензил-6-[(3R,4R)-3,4-диметилметилендиокси-2-пирролидинон-1-ил]-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 123.
1H-ЯМР (CDCl3) δ: 1,35-1,45 (1H, м), 1,42 (3Н, с), 1,47 (3Н, с), 1,58-1,72 (1H, м), 1,82-1,92 (1H, м), 2,00-2,08 (2Н, м), 2,71-2,95 (4Н, м), 3,05 (1H, д, J=14 Гц), 3,26 (1H, дд, J=1,8, 14 Гц), 4,07 (1H, дд, J=4,0, 13 Гц), 4,25 (2Н, с), 4,29 (1H, д, J=13 Гц), 4,78-4,83 (2Н, м), 7,18-7,28 (5Н, м), 7,69 (1H, д, J=8,6 Гц), 8,29 (1H, д, J=8,6 Гц).
Пример 126: 3-[2-Бензил-6-(2-оксо-1,3-оксазолидин-3-ил)-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 123.
1H-ЯМР (CDCl3) δ =1,38-1,48 (1H, м), 1,60-1,70 (1Н, м), 1,85-1,95 (1Н, м), 2,00-2,13 (2Н, м), 2,74-2,98 (4Н, м), 3,04 (1Н, д, J=14 Гц), 3,25 (1Н, д, J=14 Гц), 4,23 (2Н, т, J=8,1 Гц), 4,24 (2Н, с), 4,47 (2Н, т, J=8,1 Гц), 7,17-7,28 (5Н, м), 7,66 (1Н, д, J=8,7 Гц), 8,02 (1Н, д, J=8,7 Гц).
Пример 127: 3-[2-Бензил-6-(2-пирролидинон-1-ил)-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 123.
1H-ЯМР (CDCl3) δ: 1,38-1,47 (1H, м), 1,58-1,70 (1Н, м), 1,85-1,95 (1H, м), 2,03-2,15 (2Н, м), 2,09 (2Н, тт, J=7,2, 8,1 Гц), 2,65 (2Н, т, J=8,1 Гц), 2,73-2,95 (4Н, м), 3,03 (1H, д, J=14 Гц), 3,24 (1H, дд, J=2,0, 14 Гц), 4,07 (2Н, т, J=7,2 Гц), 4,24 (2Н, с), 7,18-7,27 (5Н, м), 7,66 (1H, д, J=8,7 Гц), 8,24 (1H, д, J=8,7 Гц).
Пример 128: (3R)-3-[2-Бензил-6-(2-пирролидинон-1-ил)-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 123.
1H-ЯМР (CDCl3) δ: 1,38-1,47 (1H, м), 1,58-1,70 (1H, м), 1,85-1,95 (1H, м), 2,03-2,15 (2Н, м), 2,09 (2Н, тт, J=7,2, 8,1 Гц), 2,65 (2Н, т, J=8,1 Гц), 2,73-2,95 (4Н, м), 3,03 (1H, д, J=14 Гц), 3,24 (1H, дд, J=2,0, 14 Гц), 4,07 (2Н, т, J=7,2 Гц), 4,24 (2Н, с), 7,18-7,27 (5Н, м), 7,66 (1H, д, J=8,7 Гц), 8,24 (1H, д, J=8,7 Гц).
Пример 129: 3-[2-Бензил-6-(2-пиперидинон-1-ил)-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 123.
1H-ЯМР (CDCl3)δ: 1,38-1,48 (1Н, м), 1,58-1,65 (1H, м), 1,70-1,97 (5Н, м), 1,98-2,08 (2Н, м), 2,59 (2Н, т, J=6,4 Гц), 2,69-2,94 (4Н, м), 3,02 (1H, дд, J=1,5, 14 Гц), 3,22 (1Н, дд, J=2,0, 14 Гц), 3,93 (2Н, т, J=5,7 Гц), 4,25 (2Н, с), 7,17-7,27 (5Н, м), 7,63 (1Н, д, J=8,5 Гц), 7,74 (1H, д, J=8,5 Гц).
Пример 130: (3R)-3-[2-Бензил-6-(2-пиперидинон-1-ил)-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 123.
1H-ЯМР (CDCl3) δ: 1,38-1,48 (1Н, м), 1,58-1,65 (1H, м), 1,70-1,97 (5Н, м), 1,98-2,08 (2Н, м), 2,59 (2Н, т, J=6,4 Гц), 2,69-2,94 (4Н, м), 3,02 (1H, дд, J=1,5, 14 Гц), 3,22 (1H, дд, J=2,0, 14 Гц), 3,93 (2Н, т, J=5,7 Гц), 4,25 (2Н, с), 7,17-7,27 (5Н, м), 7,63 (1H, д, J=8,5 Гц), 7,74 (1H, д, J=8,5 Гц).
Пример 131: (3R)-3-[2-Бензил-6-[(4R)-4-гидрокси-2-пирролидинон-1-ил]-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 123.
1H-ЯМР (CDCl3) δ: 1,35-1,47 (1H, м), 1,53-1,63 (1H, м), 1,78-1,89 (1H, м), 2,00-2,09 (2Н, м), 2,63 (1H, дд, J=2,0, 18 Гц), 2,68-2,94 (4Н, м), 2,93 (1H, дд, J=6,2, 18 Гц), 2,99 (1H, дд, J=1,6, 14 Гц), 3,20 (1H, дд, J=2,0, 14 Гц), 4,09-4,18 (2Н, м), 4,20 (2Н, с), 4,50-4,56 (1H, м), 7,15-7,28 (5Н, м), 7,53 (1H, д, J=8,6 Гц), 8,12 (1H, д, J=8,6 Гц).
Пример 132: (3R)-3-[2-Бензил-6-[(4S)-4-гидрокси-2-пирролидинон-1-ил]-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 123.
1H-ЯМР (CDCl3) δ: 1,35-1,47 (1H, м), 1,53-1,63 (1H, м), 1,78-1,89 (1H, м), 2,00-2,09 (2Н, м), 2,63 (1H, дд, J=2,0, 18 Гц), 2,68-2,94 (4Н, м), 2,93 (1H, дд, J=6,2, 18 Гц), 2,99 (1H, дд, J=1, 6, 14 Гц), 3,20 (1H, дд, J=2,0, 14 Гц), 4,09-4,18 (2Н, м), 4,20 (2Н, с), 4,50-4,56 (1H, м), 7,15-7,28 (5Н, м), 7,53 (1H, д, J=8,6 Гц), 8,12 (1H, д, J=8,6 Гц).
Пример 133: 3-[2-Бензил-6-(2-оксо-2,5-дигидропиррол-1-ил)-3- пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 123, с использованием 2-бензил-6-(2-оксо-2,5-дигидропиррол-1-ил)-3-пиридилтрифторметансульфоната, который был побочно получен, когда синтезировали соединение из примера 131.
1H-ЯМР (CDCl3) δ: 1,35-1,47 (1H, м), 1,56-1,67 (1H, м), 1,83-2,10 (3Н, м), 2,72-2,95 (4Н, м), 3,04 (1H, д, J=14 Гц), 3,25 (1H, дд, J=14 Гц, 2,1 Гц), 4,24 (2Н, с), 4,64 (2Н, т, J=1,8 Гц), 6,23 (2Н, дт, J=6,0 Гц, 1,8 Гц), 7,18-7,29 (6Н, м), 7,67 (1H, д, J=8,6 Гц), 8,26 (1H, д, J=8,6 Гц).
Пример 134: (3R)-3-[2-Бензил-6-[(4S)-4-метокси-2-пирролидинон-1-ил)-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 123.
1H-ЯМР (CDCl3) δ: 1,35-1,49 (1Н, м), 1,57-1,68 (1Н, м), 1,78-1,92 (1Н, м), 1,98-2,10 (2Н, м), 2,70-2,98 (5Н, м), 3,04 (1Н, д, J=14 Гц), 3,25 (1Н, д, J=14 Гц), 3,38 (3Н, с), 4,07-4,22 (4Н, м), 4,25 (2Н, с), 7,08-7,29 (5Н, м), 7,67 (1Н, д, J=8,6 Гц), 8,23 (1Н, д, J=8,6 Гц).
Пример 135: 3-[2-Бензил-6-(1-имидазолил)-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 123.
1H-ЯМР (CDCl3) δ: 1,39-1,49 (1Н, м), 1,58-1,72 (1H, м), 1,82-1,92 (1H, м), 2,00-2,10 (2Н, м), 2,75-2,98 (4Н, м), 3,07 (1H, д, J=14 Гц), 3,27 (1H, дд, J=1,9, 14 Гц), 4,32 (2Н, с), 7,14 (1H, д, J=8,2 Гц), 7,18-7,30 (7Н, м), 7,78 (1H, д, J=8,2 Гц), 8,34 (1H, с).
Пример 136: 3-[2-Бензил-6-(2-оксо-1,2-дигидропирролидин-1-ил)-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 123.
1H-ЯМР (CDCl3) δ: 1,38-1,48 (1H, м), 1,58-1,68 (1H, м), 1,75-1,90 (1H, м), 2,00-2,09 (2Н, м), 2,69-2,95 (4Н, м), 3,04 (1H, д, J=14 Гц), 3,25 (1H, дд, J=1,8, 14 Гц), 4,34 (2Н, с), 6,29 (1H, дд, J=6,5, 7,2 Гц), 6,63 (1H, д, J=9,2 Гц), 7,16-7,34 (5Н, м), 7,37 (1H, ддд, J=2,1, 6,5, 9,2 Гц), 7,79 (1H, д, J=8,4), 7,89 (1H, д, J=8,4 Гц), 7,92 (1H, дд, J=2,1, 7,2 Гц).
Пример 137: 3-[2-Бензил-6-(1-пиразолил)-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 123.
1H-ЯМР (CDCl3) δ: 1,38-1,48 (1Н, м), 1,58-1,68 (1Н, м), 1,79-1,93 (1Н, м), 2,00-2,10 (2Н, м), 2,70-2,95 (4Н, м), 3,04 (1Н, д, J=14 Гц), 3,25 (1Н, дд, J=2,0, 14 Гц), 4,31 (2Н, с), 6,44 (1Н, дд, J=1,0, 1,6 Гц), 7,19-7,32 (5Н, м), 7,72-7,81 (3Н, м), 8,54 (1Н, дд, J=1,0 2,7 Гц).
Пример 138: (3R)-3-[2-Бензил-3-(3,3-этилендиокси-2-пирролидинон-1-ил)-3-пиридил]этинил-3-хинуклидинол
а) 2-Бензил-3-метоксиметилокси-6-[(3S)-3-гидрокси-2-пирролидинон-1-ил]пиридин
14,3 г 2-бензил-3-метоксиметилокси-6-йодпиридин (пример получения 12) и 4,1 г (3S)-3-гидрокси-2-пирролидинона, синтезированного по методу, хорошо известному из литературы (Synthesis, 1978, 614), 4,6 г йодида меди и 13,7 г карбоната калия суспендировали в 30 мл 1-метил-2-пирролидинона с последующим нагреванием при перемешивании при 140°С на масляной бане в течение 20 минут в атмосфере азота. После остывания туда добавляли этилацетат и водный раствор аммиака. Смесь экстрагировали этилацетатом, органическую фазу далее промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле, используя 50-60% этилацетат в качестве элюента, для разделения и очистки с получением 9,7 г целевого соединения.
1H-ЯМР (CDCl3) δ: 1,95-2,08 (1Н, м), 2,53-2,58 (1Н, м), 3,09 (1H, шир.с), 3,37 (3Н, с), 3,76 (1H, тд, J=10 Гц, 6,6 Гц), 4,12 (2Н, с), 4,19 (1H, т, J=9,2 Гц), 4,48 (1H, т, J=10 Гц), 5,14 (2Н, с), 7,17-7,30 (5Н, м), 7,42 (1H, д, J=9,0 Гц), 8,14 (1H, д, J=9,0 Гц).
b) 2-Бензил-6-(3,3-этилендиокси-2-пирролидинон-1-ил)-3-гидроксипиридин
1,1 г 2-бензил-3-метоксиметилокси-6-[(3S)-3-гидрокси-2-пирролидинон-1-ил]пиридина растворяли в 20 мл ацетона и добавляли 1 мл реактива Джона с последующим перемешиванием при комнатной температуре в течение 1,5 часов. Добавляли 2-пропанол и воду и затем экстрагировали этилацетатом. Органическую фазу далее промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Полученный остаток растворяли в 20 мл толуола. Добавляли 1 мл этиленгликоля и 198 мг п-толуолсульфоновой кислоты с последующим кипячением с обратным холодильником в течение 2 часов при удалении воды с использованием аппарата Дина-Старка. После остывания добавляли воду и смесь экстрагировали этилацетатом. Органическую фазу далее промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле, используя 30-40% этилацетат/гексан в качестве элюента, для разделения и очистки с получением 398 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 2,34 (2Н, т, J=6,9 Гц), 4,01 (2Н, т, J=6,9 Гц), 4,12 (4Н, с), 4,39 (2Н, с), 5,28 (1H, шир.с), 7,13 (1H, д, J=8,6 Гц), 7,18-7,30 (5Н, м), 8,11 (1H, д, J=8,6 Гц).
с) 2-Бензил-6-(3,3-этилендиокси-2-пирролидинон-1-ил)-3-пиридилтрифторметансульфонат
505 мг 2-Бензил-6-(3,3-этилендиокси-2-пирролидинон-1-ил)-3-гидроксипиридина растворяли в 10 мл дихлорметана и туда добавляли 757 мг N-фенилтрифторметансульфонимида, 61 мг 4-диметиламинопиридина и 0,3 мл триэтиламина с последующим перемешиванием при комнатной температуре в течение ночи. Затем растворитель удаляли и остаток подвергали колоночной хроматографии на силикагеле, используя 17% этилацетат/гексан в качестве элюента, для разделения и очистки с получением 1,1 г целевого соединения.
1H-ЯМР (CDCl3) δ: 2,34 (2Н, т, J=7,0 Гц), 3,96 (2Н, т, J=7,0 Гц), 4,10-4,21 (4Н, м), 4,34-4,42 (2Н, м), 7,20-7,42 (5Н, м), 7,59 (1H, д, J=9,2 Гц), 8,34 (1H, д, J=9,2 Гц).
d) (3R)-3-[2-Бензил-6-(3,3-этилендиокси-2-пирролидинон-1-ил)-3-пиридил]этинил-3-хинуклидинол
7 мл N,N-диметилформамида добавляли к смеси 1,1 г 2-бензил-6-(3,3-этилендиокси-2-пирролидинон-1-ил)-3-пиридилтрифторметансульфоната, 437 мг (3R)-3-этинил-3-хинуклидинола, 168 мг тетракис(трифенилфосфин)палладия (0), 24 мг йодида меди и 1,1 мл триэтиламина и нагревали при перемешивании при 60°С на масляной бане в течение 1,3 часа в атмосфере азота. После остывания добавляли этилацетат и водный раствор аммиака и смесь экстрагировали этилацетатом. Органическую фазу далее промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Остаток подвергали колоночной хроматографии на NH-силикагеле, используя 66% этилацетат/гексан и 2% метанол/этилацетат в качестве элюентов, для разделения и очистки с получением 669 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,35-1,45 (1H, м), 1,58-1,66 (1H, м), 1,82-1,92 (1Н, м), 1,95-2,09 (2Н, м), 2,34 (2Н, т, J=6,8 Гц), 2,71-2,95 (4Н, м), 3,03 (1Н, д, J=14 Гц), 3,26 (1H, дд, J=2,0, 14 Гц), 4,00 (2Н, т, J=6,8 Гц), 4,09-4,18 (2Н, м), 4,24 (2Н, с), 4,34-4,42 (2Н, м), 7,08-7,28 (5Н, м), 7,67 (1H, д, J=8,4 Гц), 8,22 (1H, д, J=8,4 Гц).
Пример 139: (3R)-3-[2-Бензил-6-[(3S)-3-фтор-2-пирролидинон-1-ил]-3-пиридил]этинил-3-хинуклидинол
а) 2-Бензил-3-метоксиметилокси-6-[(3S)-3-(3-нитробензолсульфонилокси)-2-пирролидинон-1-ил]пиридин
2,2 г 2-Бензил-3-метоксиметилокси-6-[(3S)-3-гидрокси-2-пирролидинон-1-ил]пиридина (пример 138а) растворяли в 20 мл этилацетата и добавляли 2,3 г 3-нитробензолсульфонилхлорида, 183 мг 4-диметиламинопиридина и 3 мл триэтиламина с последующим перемешиванием при комнатной температуре в течение ночи. Затем добавляли воду и смесь экстрагировали этилацетатом. Далее органическую фазу промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле, используя 25-33% этилацетат/гексан в качестве элюента, с получением 3,5 г целевого соединения.
1H-ЯМР (CDCl3) δ: 2,30-2,42 (1Н, м), 2,68-2,76 (1H, м), 3,35 (3Н, с), 3,87-3,94 (1H, м), 4,10 (2Н, с), 4,21 (1H, ддд, J=2,4, 9,2, 12 Гц), 5,14 (2Н, с), 5,32 (1H, т, J=8,2 Гц), 7,15-7,27 (5Н, м), 7,38 (1H, д, J=9,0 Гц), 7,81 (1H, т, J=7,9 Гц), 7,97 (1H, д, J=9,0 Гц), 8,38 (1H, д, J=7,9 Гц), 8,53 (1H, д, J=7,9 Гц), 8,88 (1H, с).
b) 2-Бензил-3-метоксиметилокси-6-[(3R)-3-ацетокси-2-пирролидинон-1-ил]пиридин
2,7 г карбоната цезия суспендировали в 20 мл диметилсульфоксида с последующим добавлением 1,2 мл уксусной кислоты. При перемешивании при комнатной температуре добавляли 20 мл диметилсульфоксидного раствора, содержащего 3,5 г 2-бензил-3-метоксиметилокси-6-[(3S)-3-(3-нитробензолсульфонилокси)-2-пирролидинон-1-ил]пиридина, с последующим нагреванием при перемешивании при 70°С на масляной бане в течение 3 часов в атмосфере азота. После остывания добавляли воду и смесь экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Остаток подвергали разделению и очистке, используя колоночную хроматографию на силикагеле, применяя 33% этилацетат/гексан в качестве элюента, с получением 2,2 г целевого соединения.
1H-ЯМР (CDCl3) δ: 2,00-2,18 (1H, м), 2,18 (3Н, с), 2,60-2,68 (1H м), 3,37 (3Н, с), 3,84-3,91 (1H, м), 4,11 (2Н, с), 4,20 (1Н, ддд, J=2,4, 9,2, 12 Гц), 5,15 (2Н, с), 5,51 (1Н, т, J=8,7 Гц), 7,18-7,29 (5Н, м), 7,43 (1H, д, J=9,0 Гц), 8,17 (1H, д, J=9,0 Гц).
с) 2-Бензил-3-метоксиметилокси-6-[(3R)-3-гидрокси-2-пирролидинон-1-ил]пиридин
453 мг 2-бензил-3-метоксиметилокси-6-[(3R)-3-ацетокси-2-пирролидинон-1-ил]пиридина растворяли в 5 мл метанола и туда добавляли две капли 28% метанольного раствора метоксида натрия при перемешивании при комнатной температуре с последующим перемешиванием в течение 30 минут. Затем добавляли воду и смесь экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Остаток подвергали разделению и очистке, используя колоночную хроматографию на силикагеле, применяя 66% этилацетат/гексан в качестве элюента, с получением 371 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,95-2,08 (1H, м), 2,53-2,58 (1H, м), 3,09 (1H, шир.с), 3,37 (3Н, с), 3,76 (1H, тд, J=10 Гц, 6,6 Гц), 4,12 (2Н, с), 4,19 (1H, т, J=9,2 Гц), 4,48 (1H, т, J=10 Гц), 5,14 (2Н, с), 7,17-7,30 (5Н, м), 7,42 (1H, д, J=9,0 Гц), 8,14 (1H, д, J=9,0 Гц).
d) 2-Бензил-3-метоксиметилокси-6-[(3S)-3-фтор-2-пирролидинон-1-ил]пиридин
3 мл дихлорметана добавляли к 0,18 мл трифторида диэтиламиносеры. В смесь по каплям добавляли раствор в 3 мл дихлорметана, содержащий 371 мг 2-бензил-3-метоксиметилокси-6-[(3R)-3-гидрокси-2-пирролидинон-1-ил]пиридина, при охлаждении на бане с этанолом/сухим льдом. Смесь нагревали до комнатной температуры и перемешивали в течение 2 часов. Затем туда добавляли воду и смесь экстрагировали этилацетатом. Далее органическую фазу промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворители удаляли. Остаток подвергали колоночной хроматографии на силикагеле, используя 17-20% этилацетат/гексан в качестве элюента, для разделения и очистки с получением 116 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 2,20-2/36 (1H, м), 2,52-2,64 (1H, м), 3,37 (3Н, с), 3,87-3,95 (1H, м), 4,12 (2Н, с), 4,17-4,22 (1H, м), 5,15 (2Н, с), 5,23 (1H, дт, J=53, 7,2 Гц), 7,17-7,29 (5Н, м), 7,44 (1H, д, J=9,0 Гц), 8,19 (1H, д, J=9,0 Гц).
е) (3R)-3-[2-Бензил-6-[(3S)-3-фтор-2-пирролидинон-1-ил]-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 138.
1H-ЯМР (CDCl3) δ: 1,38-1,48 (1H, м), 1,56-1,75 (1H, м), 1,82-1,92 (1H, м), 2,00-2,08 (2Н, м), 2,21-2,38 (1H, м), 2,55-2,68 (1H, м), 2,72-2,95 (4Н, м), 3,05 (1H, д, J=14 Гц), 3,26 (1H, дд, J=2,0, 14 Гц), 3,85-3,93 (1H, м), 4,19-4,28 (1H, м), 4,26 (2Н, с), 5,23 (1H, дт, J=7,9, 7,6 Гц), 7,08-7,28 (5Н, м), 7,71 (1H, д, J=8,6 Гц), 8,27 (1H, д, J=8,6 Гц).
Пример 140: (3R)-3-[2-Бензил-6-[(3R)-3-фтор-2-пирролидинон-1-ил]-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же как и в примере 139с, используя 2-бензил-3-метоксиметилокси-6-[(3S)-3-гидрокси-2-пирролидинон-1-ил]пиридин (пример 138а).
1H-ЯМР (CDCl3) δ: 1,38-1,48 (1Н, м), 1,56-1,75 (1Н, м), 1,82-1,92 (1Н, м), 2,00-2,08 (2Н, м), 2,21-2,38 (1Н, м), 2,55-2,68 (1H, м), 2,72-2,95 (4Н, м), 3,05 (1H, д, J=14 Гц), 3,26 (1Н, дд, J=2,0, 14 Гц), 3,85-3,93 (1H, м), 4,19-4,28 (1H, м), 4,26 (2Н, с), 5,23 (1H, дт, J=7,9, 7,6 Гц), 7,08-7,28 (5Н, м), 7,71 (1H, д, J=8,6 Гц), 8,27 (1H, д, J=8,6 Гц).
Пример 141: (3R)-3-[2-Бензил-6-[(3S)-3-гидрокси-2-пирролидинон-1-ил]-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 123.
1H-ЯМР (CDCl3) δ: 1,39-1,49 (1H, м), 1,50-1,78 (1H, м), 1,82-1,92 (1H, м), 1,98-2,09 (2Н, м), 2,52-2,61 (1H, м), 2,73-2,94 (4Н, м), 3,05 (1H, д, J=14 Гц), 3,26 (1H, дд, J=2,0, 14 Гц), 3,72-3,79 (1H, м), 4,12 (1H, дд, J=7,2, 14 Гц), 4,20-4,25 (1H, м), 4,25 (2Н, с), 4,49 (1H, дд, J=8,0, 10 Гц), 7,08-7,28 (5Н, м), 7,69 (1H, д, J=8,8 Гц), 8,22 (1H, д, J=8,8 Гц).
Пример 142: (3R)-3-[2-Бензил-6-[(3R)-3-гидрокси-2-пирролидинон-1-ил]-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 123, за исключением того, что обращали конфигурацию гидроксильной группы по методу примера 139.
1H-ЯМР (CDCl3) δ: 1,39-1,49 (1H, м), 1,50-1,78 (1H, м), 1,82-1,92 (1H, м), 1,98-2,09 (2Н, м), 2,52-2,61 (1H, м), 2,73-2,94 (4Н, м), 3,05 (1H, д, J=14 Гц), 3,26 (1H, дд, J=2,0, 14 Гц), 3,72-3,79 (1H, м), 4,12 (1H, дд, J=7,2, 14 Гц), 4,20-4,25 (1Н, м), 4,25 (2Н, с), 4,49 (1Н, дд, J=8,0, 10 Гц), 7,08-7,28 (5Н, м), 7,69 (1H, д, J=8,8 Гц), 8,22 (1Н, д, J=8,8 Гц).
Пример 143: (3R)-3-[2-Бензил-6-[(3S)-3-метокси-2-пирролидинон-1-ил]-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 123.
1H-ЯМР (CDCl3) δ: 1,38-1,48 (1H, м), 1,58-1,68 (1H, м), 1,85-2,10 (4Н, м), 2,41-2,52 (1H, м), 2,70-2,92 (4Н, м), 3,04 (1H, дд, J=2,0, 14 Гц), 3,25 (1H, дд, J=2,0, 14 Гц), 3,61 (3Н, с), 3,80-3,87 (1H, м), 4,10-4,18 (2Н, м), 4,24 (2Н, с), 7,08-7,27 (5Н, м), 7,68 (1H, д, J=8,8 Гц), 8,26 (1H, д, J=8,8 Гц).
Пример 144: (3R)-3-[2-Бензил-6-[(3R)-3-метокси-2-пирролидинон-1-ил]-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 123, за исключением того, что обращали конфигурацию гидроксильной группы по методу примера 139.
1H-ЯМР (CDCl3) δ: 1,38-1,48 (1H, м), 1,58-1,68 (1H, м), 1,85-2,10 (4Н, м), 2,41-2,52 (1H, м), 2,70-2,92 (4Н, м), 3,04 (1H, дд, J=2,0, 14 Гц), 3,25 (1H, дд, J=2,0, 14 Гц), 3,61 (ЗН, с), 3,80-3,87 (1H, м), 4,10-4,18 (2Н, м), 4,24 (2Н, с), 7,08-7,27 (5Н, м), 7,68 (1H, д, J=8,8 Гц), 8,26 (1H, д, J=8,8 Гц).
Пример 145: (3S)-3-[2-[2-Бензил-6-[(3R,4R)-3-гидрокси-4-метоксипирролидин-1-ил]-3-пиридил]этил-3-хинуклидинол
180 мг целевого соединения получали, используя 200 мг (3R)-3-[2-бензил-6-[(3R,4R)-3-гидрокси-4-метоксипирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинола (пример 10) в 2 мл метанола при нормальном давлении в атмосфере водорода, используя 10 мг оксида платины (IV) в качестве катализатора для проведения каталитического восстановления.
1H-ЯМР (CDCl3) δ: 1,15-2,03 (7Н, м), 2,37-2,91 (8Н, м), 3,42 (3Н, с), 3,45-3,55 (2Н, м), 3,66-3,77 (2Н, м), 3,85-3,88 (1Н, м), 4,05 (2Н, с), 4,35-4,39 (1Н, м), 6,22 (1Н, д, J=8 Гц), 7,13-7,18 (1Н, м), 7,20 (1H, д, J=8 Гц), 7,22-7,28 (4Н, м).
Пример 146: (3R)-3-[(Е)-2-[2-Бензил-6-[(3R,4R)-3-гидрокси-4-метоксипирролидин-1-ил]-3-пиридил]этенил-3-хинуклидинол
270 мг (3R)-3-[2-бензил-6-[(3R,4R)-3-гидрокси-4-метоксипирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинол (пример 10) растворяли в 10 мл этилового эфира. Добавляли 300 мг лития алюмогидрида с последующим кипячением с обратным холодильником в течение 6 часов. При перемешивании на ледяной бане добавляли 0,3 мл воды, 0,3 мл водного 5N раствора гидроксида натрия, 1 мл воды и 10 мл тетрагидрофурана. Смесь фильтровали и фильтрат концентрировали. Остаток подвергали колоночной хроматографии на NH-силикагеле и элюировали 10% метанолом/этилацетатом с получением 165 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,31-1,55 (3Н, м), 1,72-1,77 (1Н, м), 2,00-2,10 (1Н, м), 2,55-2,65 (1H, м), 2,67-2,83 (3Н, м), 2,85-2,97 (2Н, м), 3,42 (3Н, с), 3,47-3,59 (2Н, м), 3,68-3,79 (2Н, м), 3,84-3,89 (1H, м), 4,09 (2Н, с), 4,37-4,40 (1H, м), 5,97 (1H, J=16 Гц), 6,24 (1H, д, J=9 Гц), 6,65 (1H, д, J=16 Гц), 7,11-7,18 (1Н, м), 7,19-7,25 (4Н, м), 7,51 (1Н, д, J=9 Гц).
Пример 147: (3R)-3-[2-Бензил-6-(2-метоксиэтил)окси-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 12.
1H-ЯМР (CDCl3) δ: 1,35-1,45 (1Н, м), 1,55-1,65 (1H, м), 1,83-1,93 (1H, м), 1,98-2,08 (2Н, м), 2,7-2,93 (4Н, м), 3,02 (1H, д, J=14 Гц), 3,23 (1H, дд, J=2, 14 Гц), 3,41 (3Н, с), 3,69 (2Н, т, J=5 Гц), 4,19 (2Н, с), 4,45 (2Н, т, J=5 Гц), 6,59 (1H, д, J=8 Гц), 7,14-7,30 (5Н, м), 7,53 (1H, д, J=8 Гц).
Пример 148: (3R)-3-[2-Бензил-6-(3-метоксипропил)окси-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 12.
1H-ЯМР (CDCl3) δ: 1,38-1,48 (1H, м), 1,58-1,69 (1H, м), 1,82-1,93 (1H, м), 2,00 (2Н, квинтет, J=6,4 Гц), 2,72-2,94 (6Н, м), 3,03 (1H, дд, J=1,2, 14 Гц), 3,24 (1H, дд, J=2,0, 14 Гц), 3,34 (3Н, с), 3,51 (2Н, т, J=6,4 Гц), 4,20 (2Н, с), 4,37 (2Н, т, J=6,4 Гц), 6,53 (1H, д, J=8,4 Гц), 7,18-7,31 (5Н, м), 7,54 (1H, д, J=8,4 Гц).
Пример 149: (3S)-3-[2-Бензил-6-(3-метоксипропил)окси-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 12.
1H-ЯМР (CDCl3) δ: 1,38-1,48 (1H, м), 1,58-1,69 (1H, м), 1,82-1,93 (1H, м), 2,00 (2Н, квинтет, J=6,4 Гц), 2,72-2,94 (6Н, м), 3,03 (1H, дд, J=1,2, 14 Гц), 3,24 (1H, дд, J=2,0, 14 Гц), 3,34 (3Н, с), 3,51 (2Н, т, J=6,4 Гц), 4,20 (2Н, с), 4,37 (2Н, т, J=6,4 ГЦ), 6,53 (1Н, д, J=8,4 Гц), 7,18-7,31 (5Н, м), 7,54 (1Н, д, J=8,4 Гц).
Пример 150: (3R)-3-[2-Бензил-6-(3-фторпропил)окси-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 12.
1H-ЯМР (CDCl3) δ: 1,36-1,44 (1Н, м), 1,58-1,65 (1H, м), 1,85-1,93 (1H, м), 1,99-2,17 (4Н, м), 2,74-2,92 (4Н, м), 3,04 (1H, д, J=14 Гц), 3,25 (1H, д, J=14 Гц), 4,20 (2Н, с), 4,42 (2Н, т, J=6 Гц), 4,58 (2Н, тд, J=6, 47 Гц), 6,53 (1H, д, J=8 Гц), 7,16-7,31 (5Н, м), 7,55 (1H, д, J=8 Гц).
Пример 151: (3R)-3-[2-Бензил-6-(4-фторбутил)окси-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 12.
1H-ЯМР (CDCl3) δ: 1,38-1,46 (1H, м), 1,57-1,93 (6Н, м), 2,00-2,09 (2Н, м), 2,71-2,94 (4Н, м), 3,04 (1H, д, J=14 Гц), 3,25 (1H, дд, J=2, 14 Гц), 4,20 (2Н, с), 4,31-4,34 (2Н, м), 4,41-4,55 (2Н, м), 6,52 (1H, д, J=8 Гц), 7,17-7,31 (5Н, м), 7,54 (1H, д, J=8 Гц).
Пример 152: (3R)-3-[2-Бензил-6-(4-хлорбутил)окси-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 12.
1H-ЯМР (CDCl3) δ: 1,38-1,46 (1H, м), 1,58-1,94 (6Н, м), 2,00-2,09 (2Н, м), 2,72-2,94 (4Н, м), 3,04 (1H, д, J=14 Гц), 3,25 (1H, дд, J=2, 14 Гц), 4,21 (2Н, с), 4,31-4,34 (2Н, м), 4,41-4,55 (2Н, м), 6,53 (1H, д, J=8 Гц), 7,17-7,34 (5Н, м), 7,55 (1H, д, J=8 Гц).
Пример 153: (3R)-3-[2-Бензил-6-(1,3-диоксолан-2-ил)метилокси-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 12.
1H-ЯМР (CDCl3) δ: 1,38-1,46 (1H, м), 1,57-1,66 (1H, м), 1,85-1,92 (1H, м), 2,00-2,07 (2Н, м), 2,75-2,94 (4Н, м), 3,03 (1H, д, J=14 Гц), 3,25 (1H, дд, J=2, 14 Гц), 3,92-4,05 (4Н, м), 4,20 (2Н, с), 4,38 (2Н, д, J=4 Гц), 5,27 (1H, т, J=4 Гц), 6,62 (1H, д, J=8 Гц), 7,17-7,30 (5Н, м), 7,56 (1H, д, J=8 Гц).
Пример 154: (3R)-3-[2-Бензил-6-(2-пиридилметил)окси-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 12.
1H-ЯМР (CDCl3) δ: 1,38-1,46 (1H, м), 1,58-1,66 (1H, м), 1,86-1,94 (1H, м), 2,00-2,07 (2Н, м), 2,75-2,94 (4Н, м), 3,05 (1H, д, J=14 Гц), 3,27 (1H, дд, J=2, 14 Гц), 4,17 (2Н, с), 5,50 (2Н, с), 6,67 (1H, д, J=8 Гц), 7,15-7,22 (6Н, м), 7,33 (1H, д, J=8 Гц), 7,58 (1H, д, J=8 Гц), 7,62 (1H, дт, J=2, 8 Гц), 8,59-8,60 (1H, м).
Пример 155: (3R)-3-[2-(4-Фторбензил)-6-(3-фторпропилокси)-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 12, за исключением того, что 2-бензил-3-бром-6-гидроксипиридин заменяли 2-(4-фторбензил)-3-бром-6-гидроксипиридином.
1H-ЯМР (CDCl3) δ: 1,39-1,46 (1Н, м), 1,58-1,94 (2Н, м), 2,00-2,18 (4Н, м), 2,72-2,94 (4Н, м), 3,06 (1Н, д, J=14 Гц), 3,27 (1H, дд, J=2, 14 Гц), 4,16 (2Н, с), 4,41 (2Н, т, J=6 Гц), 4,59 (2Н, тд, J=6, 47 Гц), 6,54 (1H, д, J=8 Гц), 6,93-6,97 (2Н, м), 7,24-7,28 (2Н, м), 7,56 (1H, д, J=8 Гц).
Пример 156: (3R)-3-[2-(3-Фторбензил)-6-(3-фторпропил)окси-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 12, за исключением того, что 2-бензил-3-бром-6-гидроксипиридин заменяли 2-(3-фторбензил)-3-бром-6-гидроксипиридином.
1H-ЯМР (CDCl3) δ: 1,39-1,46 (1H, м), 1,58-1,94 (2Н, м), 2,00-2,18 (4Н, м), 2,72-2,94 (4Н, м), 3,06 (1H, д, J=14 Гц), 3,27 (1H, дд, J=2, 14 Гц), 4,19 (2Н, с), 4,40-4,44 (2Н, м), 4,52-4,64 (2Н, м), 6,56 (1H, д, J=8 Гц), 6,86-6,91 (1H, м), 6,98-7,09 (2Н, м), 7,20-7,28 (1H, м), 7,56 (1H, д, J=8 Гц).
Пример 157: (3R)-3-[2-(4-Фторбензил)-6-(2-метоксиэтил)окси-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 12, за исключением того, что 2-бензил-3-бром-6-гидроксипиридин заменяли 2-(4-фторбензил)-3-бром-6-гидроксипиридином.
1H-ЯМР (CDCl3) δ: 1,37-1,94 (3Н, м), 1,98-2,09 (2Н, м), 2,70-3,95 (4Н, м), 3,06 (1Н, д, J=14 Гц), 3,26 (1H, дд, J=2, 14 Гц), 3,42 (3Н, с), 3,69 (2Н, т, J=5 Гц), 4,16 (2Н, с), 4,43 (2Н, т, J=5 Гц), 6,61 (д, J=8 Гц), 6,94 (2Н, т, J=9 Гц), 7,25 (2Н, дд, J=6, 9 Гц), 7,55 (1H, д, J=8 Гц).
Пример 158: 3-[2-Бензил-6-(2-этоксиэтил)окси-3-пиридил]этинил-3-хинуклидинол
а) 2-Бром-6-(2-этоксиэтил)оксипиридин
1,7 г 60% масляной суспензии гидрида натрия суспендировали в 20 мл N,N-диметилформамида с последующим добавлением в 10 мл N,N-диметилформамидного раствора, содержащего 4,1 мл 2-этоксиэтанола, с перемешиванием при охлаждении льдом. После перемешивания в течение 20 минут добавляли в 10 мл N,N-диметилформамидного раствора, содержащего 5 г 2,6-дибромпиридина, и далее смесь перемешивали при комнатной температуре в течение одного часа. Затем добавляли воду и смесь экстрагировали этилацетатом. Органическую фазу далее промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле, используя 5% этилацетат/гексан в качестве элюента, для разделения и очистки с получением 4,8 г целевого соединения.
1H-ЯМР (CDCl3) δ: 1,24 (3Н, т, J=7,0 Гц), 3,59 (2Н, кв, J=7,0 Гц), 3,78 (2Н, т, J=4,8 Гц), 4,47 (2Н, т, J=4,8 Гц), 6,75 (1H, дд, J=8,0 Гц, 0,7 Гц), 7,05 (1H, дд, J=7,5 Гц, 0,7 Гц), 7,41 (1H, дд, J=8,0 Гц, 7,5 Гц).
b) 2-Бензил-6-(2-этоксиэтил)оксипиридин
1,09 мол. тетрагидрофуранового раствора, содержащего бензилмагнийхлорид, медленно, по каплям добавляли в смесь 1 г 2-бром-6-(2-этоксиэтил)оксипиридина, 145 мг хлорида 1,3-бис(дифенилфосфино)пропанникеля (II) и 5 мл тетрагидрофурана с перемешиванием при охлаждении льдом в атмосфере азота. После перемешивания в течение 2,5 часов добавляли насыщенный водный раствор хлорида аммония и смесь экстрагировали этилацетатом. Далее органическую фазу промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле, используя 5% этилацетат/гексан в качестве элюента, для разделения и очистки с получением 1 г целевого соединения.
1H-ЯМР (CDCl3) δ: 1,23 (3Н, т, J=7,0 Гц), 3,57 (2Н, кв, J=7,0 Гц), 3,76(2Н, т, J=4,9 Гц), 4,00 (2Н, с), 4,47 (2Н, т, J=4,9 Гц), 6,59 (1Н, д, J=8,2 Гц), 6,65 (1Н, д, J=7,2 Гц), 7,19-7,30 (5Н, м), 7,44 (1Н, дд, J=8,2 Гц, 7,2 Гц).
c) 2-Бензил-3-бром-6-(2-этоксиэтил)оксипиридин
Смесь 1 г 2-бензил-6-(2-этоксиэтил)оксипиридина, 125 мг тетраэтиламмонийхлорида и 279 мг гидроксида калия суспендировали в 5 мл водного раствора бромида калия (2,5 г бромида калия растворяли в 10 мл воды). В суспензию по каплям добавляли смесь 0,23 мл брома и 5 мл указанного выше водного раствора бромида калия через капельную воронку с перемешиванием при охлаждении льдом в течение 10 минут. Смесь нагревали до комнатной температуры и перемешивали в течение ночи. Затем добавляли водный раствор сульфита натрия и смесь экстрагировали этилацетатом. Далее органическую фазу промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле, используя 5% этилацетат/гексан в качестве элюента, для разделения и очистки с получением 1,2 г целевого соединения.
1H-ЯМР (CDCl3) δ: 1,22 (3Н, т, J=7,0 Гц), 3,55 (2Н, кв, J=7,0 Гц), 3,72 (2Н, т, J=4,8 Гц), 4,18 (2Н, с), 4,41 (2Н, т, J=4,8 Гц), 6,53 (1Н, д, J=8,6 Гц), 7,19-7,34 (5Н, м), 7,30 (1Н, д, J=8,6 Гц).
d) 3-[2-Бензил-3-(2-этоксиэтил)окси-3-пиридил]этинил-3-хинуклидинол
7 мл N,N-диметилформамида добавляли к смеси 2-бензил-3-бром-6-(2-этоксиэтил)оксипиридина, 601 мг 3-этинил-3-хинуклидинола, 406 мг тетракис(трифенилфосфин)палладия (0), 220 мг йодида меди и 1,7 мл триэтиламина с последующим нагреванием при перемешивании при 80°С на масляной бане в течение одного часа в атмосфере азота. После остывания добавляли этилацетат. Смесь фильтровали через целит и промывали водным раствором аммиака. Органическую фазу промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Остаток подвергали колоночной хроматографии на NH-силикагеле, используя этилацетат/гексан в качестве элюента, для разделения и очистки с получением 247 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,22 (3Н, т, J=7,1 Гц), 1,38-1,48 (1H, м), 1,57-1,67 (1H, м), 1,82-1,92 (1H, м), 1,98-2,08 (2Н, м), 2,71-2,95 (4Н, м), 3,03 (1H, д, J=14 Гц), 3,24 (1H, дд, J=2,0, 14 Гц), 3,56 (2Н, кв, J=7,1 Гц), 3,74 (2Н, т, J=4,8 Гц), 4,20 (2Н, с), 4,46 (2Н, т, J=4,8 Гц), 6,60 (1H, д, J=8,5 Гц), 7,18-7,30 (5Н, м), 7,54 (1H, д, J=8,5 Гц).
Пример 159: 3-[2-Бензил-6-(2-этоксипропил)окси-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 158.
1H-ЯМР (CDCl3) δ: 1,20 (3Н, т, J=6,9 Гц), 1,37-1,47 (1H, м), 1,5,7-1,65 (1H, м), 1,83-1,93 (1H, м), 2,01 (2Н, квинтет, J=6,4 Гц), 2,00-2,08 (2Н, м), 2,72-2,94 (4Н, м), 3,05 (1H, д, J=14 Гц), 3,24 (1H, дд, J=2,0, 14 Гц), 3,48 (2Н, кв, J=6, 9 Гц), 3,55 (2Н, т, J=6,4 Гц), 4,20 (2Н, с), 4,37 (2Н, т, J=6,4 Гц), 6,52 (1H, д, J=8,6 Гц), 7,18-7,31 (5Н, м), 7,53 (1H, д, J=8,6 Гц).
Пример 160: 3-[2-(4-Фторбензил)-6-[(3-тетрагидрофуранил)-метилокси-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 158.
1H-ЯМР (CDCl3) δ: 1,37-1,47 (1H, м), 1,58-1,92 (3Н, м), 1,98-2,12 (2Н, м), 2,62-2,95 (4Н, м), 3,05 (1H, дд, J=1,6, 14 Гц), 3,25 (1H, дд, J=2,0, 14 Гц), 3,65 (2Н, дд, J=5,2, 8,8 Гц), 3,72-3,96 (3Н, м), 4,09-4,18 (3Н, м), 4,27 (1H, дд, J=6,4, 11 Гц), 6,53 (1H, д, J=8,4 Гц), 6,95 (2Н, т, J=8,8 Гц), 7,24 (2Н, дд, J=5,5, 8,8 Гц), 7,55 (1Н, д, J=8,4 Гц).
Пример 161: 3-[2-Бензил-6-[(3-тетрагидрофуранил)метилокси-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 158.
1H-ЯМР (CDCl3) δ: 1,35-1,45 (1Н, м), 1,55-1,64 (1H, м), 1,67-1,75 (1H, м), 1,83-1,95 (1H, м), 1,98-2,10 (2Н, м), 2,62-2,92 (4Н, м), 3,02 (1H, д, J=14 Гц), 3,23 (1H, дд, J=2,0, 14 Гц), 3,65 (2Н, дд, J=5,7, 8,8 Гц), 3,73-3,92 (3Н, м), 4,10-4,21 (3Н, м), 4,28 (1H, дд, J=6,6, 11 Гц), 6,52 (1H, д, J=8,6 Гц), 7,15-7,32 (5Н, м), 7,54 (1H, д, J=8,6 Гц)
Пример 162: 3-[2-(3-Фторбензил)-6-(3-метоксипропил)окси-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 158.
1H-ЯМР (CDCl3) δ: 1,35-1,45 (1H, м), 1,58-1,68 (1H, м), 1,82-1,92 (1H, м), 2,00 (2Н, квинтет, J=6,4 Гц), 2,00-2,10 (2Н, м), 2,72-2,95 (4Н, м), 3,03 (1H, д, J=14 Гц), 3,23 (1H, дд, J=2,0, 14 Гц), 3,34 (3Н, с), 3,51 (2Н, т, J=6,4 Гц), 4,17 (2Н, с), 4,36 (2Н, т, J=6,4 Гц), 6,53 (1H, д, J=8,4 Гц), 6,82-7,25 (4Н, м), 7,53 (1H, д, J=8,4 Гц).
Пример 163: 3-[2-Бензил-6-(3-тетрагидрофуранил)окси-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 158.
1H-ЯМР (CDCl3) δ: 1,38-1,97 (3Н, м), 2,00-2,25 (4Н, м), 2,70-2,95 (4Н, м), 3,05 (1H, д, J=14 Гц), 3,26 (1H, дд, J=2, 14 Гц), 3,80-4,00 (4Н, м), 4,19 (2Н, с), 5,45-5,52 (1H, м), 6,54 (1H, д, J=8 Гц), 7,14-7,30 (5Н, м), 7,55 (1H, д, J=8 Гц).
Пример 164: 3-[2-Бензил-6-[2-(2-метоксиэтил)оксиэтил]окси-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 158.
1H-ЯМР (CDCl3) δ: 1,35-1,95 (3Н, м), 1,98-2,08 (2Н, м), 2,70-2,93 (4Н, м), 3,04 (1H, д, J=14 Гц), 3,25 (1H, дд, J=2, 14 Гц), 3,38 (ЗН, с), 3,54-3,57 (2Н, м), 3,65-3,69 (2Н, м), 3,81 (2Н, т, J=5 Гц), 4,19 (2Н, с), 4,48 (2Н, т, J=5 Гц), 6,59 (1H, д, J=8 Гц), 7,14-7,30 (5Н, м), 7,55 (1H, д, J=8 Гц).
Пример 165: 3-[2-Бензил-6-(3-гидроксипропил)окси-3-пиридил]этинил-3-хинуклидинол
а) 2-Бензил-3-бром-6-(3-гидроксипропил)оксипиридин
Смесь 1,0 г 2-бензил-3-бром-6-гидроксипиридина, полученного в примере 3b, 0,44 мл 3-бромпропанола, 780 мг безводного карбоната калия и 10 мл N,N-диметилформамида нагревали при перемешивании на масляной бане при температуре 80°С в течение одного часа в атмосфере азота. Реакционный раствор распределяли между этилацетатом-водой и органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и затем концентрировали. Остаток подвергали колоночной хроматографии на силикагеле, используя 10-20% этилацетат/гексан, с получением 860 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,94 (2Н, квинтет, J=6 Гц), 2,47 (1H, шир.с), 3,69 (2Н, шир.т, J=6 Гц), 4,20 (2Н, с), 4,43 (2Н, т, J=6 Гц), 6,49 (1H, д, J=8 Гц), 7,18-7,34 (5Н, м), 7,66 (1H, д, J=8 Гц).
b) 3-[2-Бензил-6-(3-гидроксипропил)окси-3-пиридил]этинил-3-хинуклидинол
Смесь 860 мг 2-бензил-3-бром-6-(3-гидроксипропил)-оксипиридина, 400 мг 3-этинил-3-хинуклидинола, 150 мг тетракис(трифенилфосфин)палладия (0), 10 мг йодида меди, 1,1 мл триэтиламина и 4 мл N,N-диметилформамида нагревали при перемешивании на масляной бане, при температуре 85°С в течение 3 часов в атмосфере азота. Реакционный раствор распределяли между этилацетатом-водным раствором аммиака и органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и затем концентрировали. Остаток подвергали колоночной хроматографии, используя NH-силикагель, и элюировали 50-100% этилацетатом/гексаном, а затем 2,5-5% метанолом/этилацетатом с получением 470 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,36-1,46 (1H, м), 1,55-1,66 (1H, м), 1,83-2,08 (5Н, м), 2,68-2,96 (4Н, м), 3,02 (1H, д, J=14 Гц), 3,24 (1H, дд, J=2, 14 Гц), 3,68 (2Н, т, J=6 Гц), 4,00 (2Н, с), 4,47 (2Н, т, J=6 Гц), 6,55 (1H, д, J=9 Гц), 7,16-7,30 (5Н, м), 7,57 (1H, д, J=9 Гц).
Пример 166: (3R)-3-[2-Бензил-6-(3-гидроксипропил)окси-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 165.
1H-ЯМР (CDCl3) δ: 1,36-1,46 (1Н, м), 1,55-1,66 (1H, м), 1,83-2,08 (5Н, м), 2,68-2,96 (4Н, м), 3,02 (1H, д, J=14 Гц), 3,24 (1H, дд, J=2, 14 Гц), 3,68 (2Н, т, J=6 Гц), 4,00 (2Н, с), 4,47 (2Н, т, J=6 Гц), 6,55 (1H, д, J=9 Гц), 7,16-7,30 (5Н, м), 7,57 (1H, д, J=9 Гц).
Пример 167: 3-[2-Бензил-6-(2-гидроксиэтил)окси-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 165.
1H-ЯМР (CDCl3) δ: 1,37-1,93 (3Н, м), 1,98-2,08 (2Н, м), 2,70-2,95 (4Н, м), 3,04 (1H, д, J=14 Гц), 3,26 (1H, дд, J=2, 14 Гц), 3,87-3,92 (2Н, м), 4,21 (2Н, с), 4,42-4,47 (2Н, м), 6,61 (1H, д, J=8 Гц), 7,16-7,32 (5Н, м), 7,59 (1H, д, J=8 Гц).
Пример 168: 3-[2-Бензил-6-[3-(3-метоксикарбонилпропаноилокси)пропил]окси-3-пиридил]этинил-3-хинуклидинол
а) 2-Бензил-3-бром-6-[3-(3-метоксикарбонилпропаноилокси)-пропил]оксипиридин
509 мг 2-бензил-3-бром-6-(3-гидроксипропил)оксипиридина (пример 165а) растворяли в 5 мл дихлорметана. При перемешивании с охлаждением льдом добавляли 0,33 мл триэтиламина и 0,29 мл 3-метоксикарбонилпропионилхлорида. После того как температура реакционного раствора повышалась до комнатной, реакционный раствор перемешивали в течение 30 минут, к реакционному раствору добавляли воду. Смесь экстрагировали этилацетатом и далее органическую фазу промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле, используя 20% этилацетат/гексан в качестве элюента, для разделения и очистки с получением 643 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 2,04 (2Н, тт, J=6,2, 6,4 Гц), 2,63 (4Н, с), 3,68 (3Н, с), 4,19 (2Н, с), 4,23 (2Н, т, J=6,4 Гц), 4,32 (2Н, т, J=6,2 Гц), 6,46 (1Н, д, J=8,6 Гц), 7,20-7,36 (5Н, м), 7,63 (1Н, д, J=8,6 Гц)
b) 3-[2-Бензил-6-[3-(3-метоксикарбонилпропаноилокси) пропил]окси-3-пиридил]этинил-3-хинуклидинол
5 мл N,N-диметилформамида добавляли к смеси 643 мг 2-бензил-3-бром-6-[3-(3-метоксикарбонилпропаноилокси)пропил]-оксипиридина, 245 мг 3-этинил-3-хинуклидинола, 84 мг тетракис(трифенилфосфин)палладия (0), 10 мг йодида меди и 0,72 мл триэтиламина с последующим нагреванием при перемешивании при 80°С на масляной бане в течение двух часов в атмосфере азота. После остывания добавляли этилацетат, смесь промывали водным раствором аммиака. Органическую фазу промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Остаток подвергали колоночной хроматографии на NH-силикагеле, используя 50% этилацетат/гексан и 2% метанол/этилацетат в качестве элюентов, для разделения и очистки с получением 223 мг намеченного соединения.
1H-ЯМР (CDCl3) δ: 1,38-1,48 (1Н, м), 1,57-1,67 (1H, м), 1,82-1,92 (1H, м), 1,97-2,15 (4Н, м), 2,61 (4Н, с), 2,70-2,94 (4Н, м), 3,04 (1H, д, J=14 Гц), 3,24 (1H, дд, J=2,0, 14 Гц), 3,68 (3Н, с), 4,20 (2Н, с), 4,23 (2Н, т, J=6,4 Гц), 4,36 (2Н, т, J=6,2 Гц), 6,53 (1H, д, J=8,4 Гц), 7,18-7,30 (5Н, м), 7,54 (1H, д, J=8,4 Гц).
Пример 169: 3-[2-Бензил-6-[3-[N-(трет-бутоксикарбонил)-аранидокси]пропил]окси-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 168.
1H-ЯМР (CDCl3) δ: 1,27 (3Н, д, J=7,1 Гц), 1,38-1,48 (1H, м), 1,44 (9Н, с), 1,58-1,68 (1H, м), 1,82-1,94 (1H, м), 2,00-2,10 (2Н, м), 2,08 (2Н, тт, J=6,2, 6,4 Гц), 2,72-2,95 (4Н, м), 3,03 (1H, д, J=14 Гц), 3,25 (1H, дд, J=2,0, 14 Гц), 4,20 (2Н, с), 4,22-4,35 (3Н, м), 4,36 (2Н, т, J=6,2 Гц), 5,04 (1H, шир.с), 6,53 (1H, д, J=8,4 Гц), 7,18-7,30 (5Н, м), 7,55 (1H, д, J=8,4 Гц).
Пример 170: 3-[2-Бензил-6-[3-[N-(бензилоксикарбонил)-глицилокси]пропил]окси-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 168.
1H-ЯМР (CDCl3) δ: 1,35-1,45 (1H, м), 1,55-1,65 (1H, м), 1,82-1,92 (1H, м), 1,98-2,10 (4Н, м), 2,70-2,95 (4Н, м), 3,03 (1H, д, J=14 Гц), 3,24 (1H, дд, J=2,0, 14 Гц), 3,96 (2Н, д, J=5,5 Гц), 4,19 (2Н, с), 4,29 (2Н, т, J=6,4 Гц), 4,35 (2Н, т, J=6,2 Гц), 5,12 (2Н, с), 5,28 (1H, шир.с), 6,51 (1H, д, J=8,4 Гц), 7,15-7,24 (10Н, м), 7,53 (1Н, д, J=8,4 Гц).
Пример 171: 3-[2-Бензил-6-[3-(пивалоилокси)пропил]окси-3-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 168.
1H-ЯМР (CDCl3) δ: 1,18 (9Н, с), 1,35-1,45 (1Н, м), 1,55-1,65 (1Н, м), 1,85-2,12 (5Н, м), 2,70-2,92 (4Н, м), 3,03 (1Н, д, J=14 Гц), 3,25 (1Н, дд, J=2,0, 14 Гц), 4,19 (2Н, т, J=6,2 Гц), 4,20 (2Н, с), 4,37 (2Н, т, J=6,4 Гц), 6,52 (1Н, д, J=8,4 Гц), 7,18-7,30 (5Н, м), 7,54 (1Н, д, J=8,4 Гц).
Пример 172: (3R)-3-[2-Бензил-6-[(тетрагидро-4Н-пиран-2-ил)метилокси]-3-пиридил]этинил-3-хинуклидинол
а) 2-Бензил-6-[(тетрагидро-4Н-пиран-2-ил)метилокси]-3-(метоксиметилокси)пиридин
Гидрид натрия добавляли к смеси 456 мг 2-бензил-6-йод-3-(метоксиметилокси)пиридина, 122 мг йодида меди и 3 мл тетрагидропиран-2-метанола с последующим перемешиванием при 90°С в течение 3 часов. К реакционному раствору добавляли водный раствор хлорида аммония и этилацетат с последующим перемешиванием при комнатной температуре в течение одного часа. Органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле, используя 15% этилацетат/гексан, с получением 383 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,36-1,64 (5Н, м), 1,84-1,90 (1Н, м), 3,40 (3Н, с), 3,43-3,49 (1H, м), 3,62-3,68 (1Н, м), 4,02-4,07 (3Н, м), 4,15-4,29 (2Н, м), 5,03 (2Н, с), 6,59 (1H, д, J=8 Гц), 7,14-7,34 (6Н, м).
b) 2-Бензил-6-[(тетрагидро-4Н-пиран-2-ил)метилокси]-3-пиридилтрифторметансульфонат
2 мл Трифторуксусной кислоты добавляли к смеси 378 мг 2-бензил-6-[(тетрагидро-4Н-пиран-2-ил)метилокси]-3-(метоксиметилокси)пиридина и 3 мл дихлорметана при комнатной температуре с последующим перемешиванием при той же температуре в течение ночи. Добавляли насыщенный водный раствор бикарбоната натрия и диэтиловый эфир для экстрагирования. Органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. К 5 мл дихлорметанового раствора, содержащего остаток, добавляли 424 мг N-фенилтрифторметансульфонимида, 301 мкл триэтиламина и 1,3 мг 4-диметиламинопиридина с последующим перемешиванием при комнатной температуре в течение 2 часов. К реакционному раствору добавляли силикагель и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле, используя 10% этилацетат/гексан, с получением 428 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,36-1,64 (5Н, м), 1,84-1,90 (1H, м), 3,41-3,48 (1H, м), 3,58-3,64 (1H, м), 4,01-4,06 (1H, м), 4,10 (2Н, с), 4,18-4,30 (2Н, м), 6,70 (1H, д, J=8 Гц), 7,20-7,29 (5Н, м), 7,44 (1H д, J=8 Гц).
с) (3R)-3-[2-Бензил-6-[(тетрагидро-4Н-пиран-2-ил)метилокси]-3-пиридил]этинил-3-хинуклидинол
Смесь 428 мг 2-бензил-6-[(тетрагидро-4Н-пиран-2-ил)метилокси]-3-пиридилтрифторметансульфоната, 180 мг (3R)-3-этинил-3-хинуклидинола, 57,3 мг тетракис(трифенилфосфин)-палладия (0), 1,9 мг йодида меди, 415 мкл триэтиламина и 5 мл N,N-диметилформамида перемешивали при 90°С в течение 3 часов в атмосфере азота. К реакционному раствору добавляли NH-силикагель и растворитель удаляли. Остаток подвергали колоночной хроматографии на NH-силикагеле, используя 3% метанол/этилацетат, с получением 305 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,34-1,65 (7Н, м), 1,85-1,91 (2Н, м), 1,98-2,07 (2Н, м), 2,75-2,90 (4Н, м), 3,03 (1Н, д, J=14 Гц), 3,24 (1Н, д, J=14 Гц), 3,42-3,49 (1Н, м), 3,61-3,68 (1Н, м), 4,02-4,07 (1Н, м), 4,18-4,34 (4Н, м), 6,62 (1Н, д, J=8 Гц), 7,14-7,29 (5Н, м), 7,54 (1H, д, J=8 Гц).
Пример 173: 3-[2-Бензил-6-(2-гидрокси-3-бутенил)окси-3-пиридил]этинил-3-хинуклидинол
а) 2-Бензил-6-(2-гидроксиэтил)окси-3-пиридилтрифторметансульфонат
Целевое соединение синтезировали так же как и в примере 172 а и b, за исключением того, что тетрагидропиран-2-метанол заменяли этиленгликолем.
1H-ЯМР (CDCl3) δ: 3,87-3,89 (2Н, м), 4,12 (2Н, с), 4,39-4,42 (2Н, м), 6,68 (1H, д, J=8 Гц), 7,21-7,32 (5Н, м), 7,49 (1H, д, J=8 Гц).
b) 2-Бензил-6-(2-гидрокси-3-бутенил)окси-3-пиридилтрифторметансульфонат
473 мг пиридинийдихромата добавляли к смеси 395 мг 2-бензил-6-(2-гидроксиэтил)окси-3-пиридилтрифторметансульфоната, 1,4 г молекулярных сит 4А и 5 мл дихлорметана при комнатной температуре с последующим перемешиванием в течение 3 часов. Смесь фильтровали через целит и растворитель удаляли. К 5 мл диэтилэфирного раствора, содержащего остаток, при 0°С добавляли 236 мкл тетрагидрофуранового раствора, содержащего 1,1 моль винилмагнийбромида с последующим перемешиванием при той же температуре в течение 40 минут. К реакционному раствору добавляли насыщенный водный раствор хлорида аммония и диэтиловый эфир, органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле, используя 30% этилацетат/гексан, с получением 46,5 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 2,67-2,68 (1Н, м), 4,13 (2Н, с), 4,19-4,24 (1Н, м), 4,37-4,41 (1Н, м), 4,46 (1Н, шир.с), 5,23-5,27 (1Н, м), 5,36-5,41 (1Н, м), 5,84-5,93 (1Н, м), 6,70 (1Н, д, J=8 Гц), 7,21-7,32 (5Н, м), 7,49 (1Н, д, J=8 Гц).
c) 3-[2-Бензил-6-(2-гидрокси-З-бутенил)окси-3-пиридил]-этинил-3-хинуклидинол
Смесь 46,5 мг 2-Бензил-6-(2-гидрокси-3-бутенил)окси-3-пиридилтрифторметансульфоната, 22,7 мг 3-этинил-3-хинуклидинола, 6,6 мг тетракис(трифенилфосфин)палладия (0), 0,1 мг йодида меди, 60,1 мкл диизопропилэтиламина и 1 мл N,N-диметилформамида перемешивали при 80°С в течение 3 часов в атмосфере азота. К реакционному раствору добавляли NH-силикагель и растворитель удаляли. Остаток подвергали колоночной хроматографии на NH-силикагеле, используя 5% метанол/этилацетат, с получением 10,7 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,38-1,46 (1Н, м), 1,58-1,66 (1H, м), 1,84-1,93 (1H, м), 1,99-2,08 (2Н, м), 2,75-2,91 (4Н, м), 3,04 (1H, д, J=14 Гц), 3,25 (1H, дд, J=2, 14 Гц), 4,21 (2Н, с), 4,24-4,28 (1H, м), 4,39-4,48 (2Н, м), 5,21-5,24 (1H, м), 5,36-5,41 (1H, м), 5,85-5,94 (1H, м), 6,60 (1H, д, J=8 Гц), 7,27-7,31 (5Н, м), 7,58 (1H, д, J=8 Гц).
Пример 174: 3-[2-Бензил-6-(3-метоксипропил)тио-3-пиридил]-этинил-3-хинуклидинол
a) 2-Бензил-3-бром-6-меркаптопиридин
Смесь 5,0 г 2-бензил-3-бром-6-гидроксипиридина, полученного в примере получения 3b, 5,7 г реактива Лоуссона и 50 мл толуола нагревали при перемешивании в течение 6 часов на масляной бане при температуре 100°С. К реакционному раствору добавляли хлороформ и силикагель и смесь концентрировали досуха. Остаток подвергали колоночной хроматографии на силикагеле, используя 10% этилацетат/толуол, с получением 3,5 г целевого соединения.
1H-ЯМР (CDCl3) δ: 4,15 (2Н, С), 7,21-7,27 (3Н, м), 7,30-7,42 (4Н, м).
b) 2-Бензил-3-бром-6-(3-метоксипропил)тиопиридин
Смесь 500 мг 2-бензил-3-бром-6-меркаптопиридина, 360 мг 3-метоксипропилметансульфоната, 370 мг безводного карбоната калия и 10 мл N,N-диметилформамида перемешивали при комнатной температуре в течение одного часа в атмосфере азота. Реакционный раствор распределяли между этилацетатом-водой и органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и затем концентрировали. Остаток подвергали колоночной хроматографии на силикагеле, используя 1-2% этилацетат/гексан, с получением 425 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,85 (2Н, квинтет, J=7 Гц), 3,13 (2Н, т, J=7 Гц), 3,32 (3Н, с), 3,41 (2Н, т, J=7 Гц), 4,25 (2Н, с), 6,88 (1Н, д, J=8 Гц), 7,17-7,34 (5Н, м), 7,56 (1Н, д, J=8 Гц).
с) 3-[2-Бензил-6-(3-метоксипропил)тио-3-пиридил]этинил-3-хинуклидинол
Смесь 425 мг 2-бензил-3-бром-6-(3-метоксипропил)-тиопиридина, 200 мг 3-этинил-3-хинуклидинола, 70 мг тетракис(трифенилфосфин)палладия (0), 4,6 мг йодида меди, 0,5 мл триэтиламина и 2,0 мл N,N-диметилформамида нагревали при перемешивании на масляной бане, при температуре 85°С, в течение 4 часов в атмосфере азота. Реакционный раствор распределяли между этилацетатом-водным раствором аммиака, органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и затем концентрировали. Остаток подвергали колоночной хроматографии, используя NH-силикагель, и элюировали 20-100% этилацетатом/гексаном, а затем 2,5% метанолом/этилацетатом с получением 300 мг намеченного соединения.
1H-ЯМР (CDCl3) δ: 1,36-1,93 (5Н, м), 1,98-2,08 (2Н, м), 2,70-2,94 (4Н, м), 3,03 (1Н, д, J=14 Гц), 3,18 (2Н, т, J=7 Гц), 3,24 (1Н, дд, J=2, 14 Гц), 3,32 (3Н, с), 3,42 (2Н, т, J=7 Гц), 4,26 (2Н, с), 6,97 (1H, д, J=8 Гц), 7,16-7,31 (5Н, м), 7,43 (1Н, д, J=8 Гц).
Пример 175: 3-[2-Бензил-6-(3-гидроксипропил)тио-3- пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 174.
1H-ЯМР (CDCl3) δ: 1,36-1,90 (5Н, м), 1,98-2,06 (2Н, м), 2,68-2,94 (4Н, м), 3,02 (1Н, д, J=14 Гц), 3,22 (1Н, дд, J=2, 14 Гц), 3,28 (2Н, т, J=6 Гц), 3,67 (2Н, т, J=6 Гц), 4,27 (2Н, с), 7,04 (1Н, д, J=8 Гц), 7,16-7,31 (5Н, м), 7,47 (1Н, д, J=8 Гц).
Пример 176: (3R)-3-[4-Бензил-2-(3-пиридил)-5-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 1.
1H-ЯМР (CDCl3) δ: 1,38-1,92 (3Н, м), 2,00-2,11 (2Н, м), 2,70-3,00 (4Н, м), 3,06 (1Н, д, J=14 Гц), 3,25 (1Н, дд, J=2, 14 Гц), 4,18 (2Н, с), 7,20 (2Н, д, J=7 Гц), 7,22-7,29 (1Н, м), 7,32 (2Н, т, J=7 Гц), 7,39 (1Н, дд, J=5, 7 Гц), 7,49 (1Н, с), 8,22-8,27 (1H, м), 8,63 (1Н, дд, J=2, 5 Гц), 8,74 (1Н, с), 9,13 (1H, дд, J=1, 2 Гц).
Пример 177: 3-[4-Бензил-2-(1-метил-2-оксо-1,2-дигидропиридин-5-ил)-5-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 1.
1H-ЯМР (CDCl3) δ: 1,36-1,46 (1Н, м), 1,56-1,89 (2Н, м), 1,99-2,10 (2Н, м), 2,68-2,96 (4Н, м), 3,05 (1Н, дд, J=2,14 Гц), 3,23 (1Н, дд, J=2, 14 Гц), 3,63 (3Н, с), 4,12 (2Н, с), 6,61 (1Н, д, J=10 Гц), 7,15-7,22 (3Н, м), 7,26 (1Н, т, J=7 Гц), 7,32 (2Н, т, J=7 Гц), 7,76(1Н, дд, J=2, 10 Гц), 8,15 (1Н, д, J=2 Гц), 8,54 (1H, с).
Пример 178: 3-[4-Бензил-2-(2-циано-5-пиридил)-5-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 1.
1H-ЯМР (CDCl3) δ: 1,38-1,92 (3Н, м), 2,00-2,17 (2Н, м), 2,70-3,00 (4Н, м), 3,06 (1H, дд, J=2, 14 Гц), 3,26 (1H, дд, J=2, 14 Гц), 4,21 (2Н, с), 7,20 (2Н, д, J=7 Гц), 7,28 (1H, т, J=7 Гц), 7,34 (2Н, т, J=7 Гц), 7,53 (1H, с), 7,77 (1H, дд, J=1, 8 Гц), 8,41 (1H, дд, J=2, 8 Гц), 8,74 (1H, с), 9,22 (1H, дд, J=1, 2 Гц).
Пример 179: (3R)-3-[4-Бензил-2-(2-пиридил)-5-пиридил]этинил- 3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 1.
1H-ЯМР (CDCl3) δ: 1,35-1,90 (3Н, м), 2,00-2,15 (2Н, м), 2,70-2,95 (4Н, м), 3,03 (1H, д, J=14 Гц), 3,23 (1H, дд, J=2, 14 Гц), 4,21 (2Н, с), 7,20-7,32 (6Н, м), 7,81 (1Н, дт, J=2, 8 Гц), 8,29 (1Н, с), 8,38 (1H, д, J=8 Гц), 8,64-8,67 (1Н, м), 8,68 (1H, с).
Пример 180: (3R)-3-[4-Бензил-2-(3,4-метилендиоксифенил)-5- пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 1.
1H-ЯМР (CDCl3) δ: 1,30-1,95 (3Н, м), 2,00-2,15 (2Н, м), 2,65-2,95 (4Н, м), 3,03 (1H, д, J=14 Гц), 3,23 (1H, д, J=14 Гц), 4,15 (2Н, с), 6,01 (2Н, с), 6,87 (1H, д, J=8 Гц), 7,19 (2Н, д, J=8 Гц), 7,22-7,28 (1H, м), 7,32 (2Н, т, J=7 Гц), 7,40 (1H, с), 7,42-7,46 (2Н, м), 8,65 (1H, с).
Пример 181: 3-[4-Бензил-2-(2-пиримидил)-5-пиридил]этинил-3- хинуклидинол
Целевое соединение синтезировали так же, как и в примере 1.
1H-ЯМР (CDCl3) δ: 1,32-1,44 (1H, м), 1,61-1,63 (1H, м), 1,84-1,99 (1H, м), 2,05-2,09 (2Н, м), 2,75-2,92 (4Н, м), 3,08 (1H, д, J=14 Гц), 3,24 (1H, дд, J=2, 14 Гц), 4,23 (2Н, с), 7,19-7,32 (6Н, м), 8,38 (1H, с), 8,84 (1H, с), 8,90 (2Н, д, J=5 Гц).
Пример 182: 3-[4-Бензил-2-(5-пиримидил)-5-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 1.
1H-ЯМР (CDCl3) δ: 1,42-1,46 (1H, м), 1,64-1,88 (2Н, м), 2,05-2,08 (2Н, м), 2,75-2,89 (4Н, м), 3,06 (1Н, д, J=14 Гц), 3,26 (1H, дд, J=2, 14 Гц), 4,12 (2Н, с), 7,18-7,3 6 (5Н, м), 7,48 (1Н, с), 8,74 (1H, с), 9,23 (1H, с), 9,26 (2Н, с).
Пример 183: 3-[4-Бензил-2-(4-пиримидил)-5-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 1.
1H-ЯМР (CDCl3) δ: 1,42-1,47 (1H, м), 1,62-1,86 (2Н, м), 2,05-2,06 (2Н, м), 2,74-2,91 (4Н, м), 3,05 (1H, дд, J=2, 14 Гц), 3,25 (1H, дд, J=2, 14 Гц), 4,23 (2Н, с), 7,21-7,33 (5Н, м), 8,33-8,35 (2Н, м), 8,71 (1H, с), 8,85 (1H, д, J=5 Гц), 9,25 (1H, д, J=1 Гц).
Пример 184: 3-[4-Бензил-2-(3-пиридазил)-5-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 1.
1H-ЯМР (CDCl3) δ: 1,42-1,47 (1H, м), 1,64-1,87 (2Н, м), 2,00-2,07 (2Н, м), 2,77-2,88 (4Н, м), 3,06 (1H, д, J=14 ГЦ), 3,26 (1H, дд, J=2, 14 Гц), 4,23 (2Н, с), 7,22-7,32 (5Н, м), 7,57-7,61 (1H, м), 8,53 (1H, дд, J=1,6, 8,6 Гц), 8,58 (1H, с), 8,70 (1H, с), 9,18 (1H, дд, J=1,6, 4,9 Гц).
Пример 185: 3-[4-Бензил-2-(4-пиридазил)-5-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 1.
1H-ЯМР (CDCl3) δ: 1,40-1,47 (1Н, м), 1,62-1,88 (2Н, м), 2,05-2,09 (2Н, м), 2,75-2,92 (4Н, м), 3,07 (1Н, дд, J=2, 14 Гц), 3,26 (1Н, дд, J=2, 14 Гц), 4,20 (2Н, с), 7,18-7,36 (5Н, м), 7,57 (1Н, с), 7,98 (1H, дд, J=2, 5 Гц), 8,76 (1H, с), 9,26 (1Н, дд, J=1, 5 Гц), 9,71 (1H, дд, J=1, 2 Гц).
Пример 186: (3R)-3-[4-Бензил-2-(1,4-диоксен-2-ил)-5-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 1.
1H-ЯМР (CDCl3) δ: 1,31-1,49 (1H, м), 1,57-1,90 (2Н, м), 2,02-2,08 (2Н, м), 2,73-2,87 (4Н, м), 3,01 (1H, д, J=14 Гц), 3,20 (1H, дд, J=2, 14 Гц), 4,09 (2Н, с), 4,15-4,24 (4Н, м), 7,15-7,31 (7Н, м), 8,47 (1H, с).
Пример 187: 3-[4-Бензил-2-(3-оксо-1-циклогексенил)-5-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 1, используя (3-оксо-1-циклогексенил)трибутилолово, синтезированное по методу, описанному в литературе (Tetrahedron Letters, Vol.31, No.13, 1837 (1990)).
1H-ЯМР (CDCl3) δ: 1,42-1,44 (1H, м), 1,62-1,89 (2Н, м), 2,02-2,16 (4Н, м), 2,47-2,50 (2Н, м), 2,76-2,87 (6Н, м), 3,05 (1H, д, J=14 Гц), 3,24 (1H, д, J=14 Гц), 4,14 (2Н, с), 6,63 (1H, с), 7,15-7,43 (6Н, м), 8,66 (1H, с).
Пример 188: 3-[4-Бензил-2-(3,4-дигидро-2Н-6-пиранил)-5-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 1, используя (3,4-дигидро-2Н-6-пиранил)трибутилолово, синтезированное по методу, описанному в литературе (Synlett 152 (1994)).
1H-ЯМР (CDCl3) δ: 1,37-1,40 (1Н, м), 1,52-1,89 (2Н, м), 1,89-1,96 (2Н, м), 2,01-2,05 (2Н, м), 2,24-2,28 (2Н, м), 2,51-2,94 (4Н, м), 3,01 (1Н, м), 3,19 (1Н, д, J=14 Гц), 4,10 (2Н, с), 4,13-4,18 (2Н, м), 6,04-6,06 (1Н, м), 7,14-7,30 (5Н, м), 7,38 (1Н, с), 8,55 (1Н, с).
Пример 189: 3-[4-Бензил-2-(3-гидрокси-1-бутинил)-5-пиридил]этинил-3-хинуклидинол
а) 4-Бензил-5-бром-2-(3-гидрокси-1-бутинил)пиридин
650 мг 4-бензил-5-бром-2-пиридилтрифторметансульфоната (пример получения 1), 115 мг 1-бутин-3-ола, 100 мг тетракис(трифенилфосфин)палладия (0), 30 мг йодида меди и 1 мл триэтиламина смешивали с 5 мл N,N-диметилформамида с последующим перемешиванием в течение одного часа на масляной бане при температуре 60°С. После остывания добавляли водный раствор аммиака и смесь экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли и затем выпаривали. Остаток подвергали колоночной хроматографии на силикагеле и элюировали 30% этилацетатом/гексаном с получением 410 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,54 (3Н, д, J=7 Гц), 2,01 (1Н, д, J=5 Гц), 4,05 (2Н, с), 4,67-4,77 (1Н, м), 7,12 (1Н, с), 7,18 (2Н, д, J=7 Гц), 7,29 (1Н, т, J=7 Гц), 7,35 (2Н, т, J=7 Гц), 8,63 (1Н, с).
b) 3-[4-Бензил-2-(3-гидрокси-1-бутинил)-5-пиридил]этинил-3-хинуклидинол
110 мг 4-бензил-5-бром-2-(3-гидрокси-1-бутинил)пиридина, 53 мг 3-этинил-3-хинуклидинола, 50 мг тетракис-(трифенилфосфин)палладия (0), 7 мг йодида меди и 0,5 мл триэтиламина добавляли к 2 мл 1-метил-2-пирролидинона с последующим перемешиванием в течение 1 часа на масляной бане при температуре 100°С. После остывания смесь выпаривали. Остаток подвергали колоночной хроматографии на NH-силикагеле и элюировали 5% метанолом/этилацетатом с получением 32 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,35-1,88 (6Н, м), 2,01-2,12 (2Н, м), 2,69-2,94 (4Н, м), 3,09 (1Н, д, J=14 Гц), 3,24 (1Н, дд, J=2, 14 Гц), 4,04 (2Н, с), 4,72 (1Н, кв, J=7 Гц), 7,12-7,16 (ЗН, м), 7,22-7,33 (3Н, м), 8,55 (1Н, д, J=2 Гц).
Пример 190: 3-[4-Бензил-2-(3-гидроксибутил)-5-пиридил]этинил-3-хинуклидинол
а) 4-Бензил-5-бром-2-(3-гидроксибутил)пиридин
200 мг 4-бензил-5-бром-2-(3-гидрокси-1-бутинил)пиридина (пример 189а) и 10 мг оксида платины (IV) добавляли к 10 мл метанола, 10 мл тетрагидрофурана и 10 мл этилацетата с последующим перемешиванием при комнатной температуре при нормальном давлении в атмосфере водорода в течение ночи. Катализатор отфильтровывали и фильтрат выпаривали с получением 50 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,20 (3Н, д, J=6 Гц), 1,70-1,89 (2Н, м), 2,77-2,89 (2Н, м), 3,25-3,38 (1Н, шир.с), 3,76-3,85 (1Н, м), 4,05 (2Н, с), 6,90 (1Н, с), 7,18 (2Н, д, J=7 Гц), 7,27 (1Н, т, J=7 Гц), 7,33 (2Н, т, J=7 Гц), 8,56 (1Н, с).
b) 3-[4-Бензил-2-(3-гидроксибутил)-5-пиридил]этинил-3-хинуклидинол
50 мг 4-бензил-5-бром-2-(3-гидроксибутил)пиридина, 20 мг 3-этинил-3-хинуклидинола, 20 мг тетракис(трифенилфосфин)-палладия (0), 5 мг йодида меди и 0,5 мл триэтиламина добавляли к 2 мл 1-метил-2-пирролидинона с последующим перемешиванием в течение 1 часа на масляной бане при температуре 100°С. После остывания смесь выпаривали. Остаток подвергали колоночной хроматографии на NH-силикагеле и элюировали 5% метанолом/этилацетатом с получением 30 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,20 (3Н, д, J=6 Гц), 1,35-1,90 (5Н, м), 1,99-2,09 (2Н, м), 2,68-2,95 (6Н, м), 3,04 (1Н, дд, J=2, 14 Гц), 3,22 (1Н, дд, J=2, 14 Гц), 3,76-3,85 (1Н, м), 4,09 (2Н, с), 6,94 (1Н, с), 7,15 (2Н, д, J=7 Гц), 7,24 (1Н, т, J=7 Гц), 7,31 (2Н, т, J=7 Гц), 8,56 (1Н, с).
Пример 191: 3-[4-Бензил-2-(4-гидроксипиперидино)-5-пиридил]этинил-3-хинуклидинол
а) 4-Бензил-5-бром-2-(3-гидроксипиперидино)пиридин
Смесь 550 мг 4-бензил-5-бром-2-пиридилтрифторметан-сульфоната (пример получения 1), 600 мг гидрохлорида 4-гидроксипиперидина, 1 мл триэтиламина и 2 мл N,N-диметилформамида нагревали при перемешивании в течение 3 часов на масляной бане при температуре 100°С в атмосфере азота. После остывания смесь экстрагировали этилацетатом/водой. Органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и выпаривали. Остаток подвергали колоночной хроматографии на силикагеле и элюировали 50% этилацетатом/гексаном с получением 270 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,44-1,60 (2Н, м), 1,88-1,97 (2Н, м), 3,03-3,12 (2Н, м), 3,75-3,96 (3Н, м), 3,99 (2Н, с), 6,41 (1Н, с), 7,19 (2Н, д, J=7 Гц), 7,25 (1Н, т, J=7 Гц), 7,32 (2Н, т, J=7 Гц), 8,20 (1Н, с).
b) 3-[4-Бензил-2-(4-гидроксипиперидино)-5-пиридил]этинил-3-хинуклидинол
Смесь 270 мг 4-бензил-5-бром-2-(4-гидроксипиперидино)-пиридина, 16,5 мг 3-этинил-3-хинуклидинола, 50 мг тетракис(трифенилфосфин)палладия (0), 2 мг йодида меди, 0,35 мл триэтиламина и 2,0 мл N,N-диметилформамида перемешивали при 100°С в течение 3 часов в атмосфере азота. После остывания реакционный раствор экстрагировали этилацетатом-разбавленным водным раствором аммиака. Органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и выпаривали. Остаток подвергали колоночной хроматографии на NH-силикагеле и элюировали 20-100% этилацетатом/гексаном, а затем 5% метанолом/этилацетатом с получением 120 мг намеченного соединения.
1H-ЯМР (CDCl3) δ: 1,33-1,87 (5Н, м), 1,90-2,05 (4Н, м), 2,65-2,94 (4Н, м), 2,98 (1Н, дд, J=2,14 Гц), 3,12-3,20 (3Н, м), 3,88-3,96 (1H, м), 3,98-4,07 (4Н, м), 6,41 (1H, с), 7,14-7,32 (5Н, м), 8,22 (1H, с).
Пример 192: 3-[4-Бензил-2-(морфолино)-5-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 191.
1H-ЯМР (CDCl3) δ: 1,34-1,87 (ЗН, м), 1,95-2,07 (2Н, м), 2,64-2,92 (4Н, м), 3,04 (1H, д, J=14 Гц), 3,18 (1H, дд, J=2, 14 Гц), 3,48 (4Н, т, J=5 Гц), 3,78 (4Н, т, J=5 Гц), 4,03 (2Н, с), 6,36 (1H, с), 7,17 (2Н, д, J=8 Гц), 7,22 (1H, т, J=8 Гц), 7,30 (2Н, т, J=8 Гц), 8,24 (1H, с).
Пример 193: 3-[4-Бензил-2-(3-метоксипропиламино)-5-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 191.
1H-ЯМР (CDCl3) δ: 1,33-1,89 (5Н, м), 1,97-2,07 (2Н, м), 2,65-2,93 (4Н, м), 2,99 (1H, дд, J=2, 14 Гц), 3,18 (1H, дд, J=2, 14 Гц), 3,32 (3Н, с), 3,35 (2Н, кв, J=6 Гц), 3,47 (2Н, т, J=6 Гц), 3,99 (2Н, с), 4,92 (1H, т, J=6 Гц), 6,11 (1H, с), 7,14-7,32 (5Н, м), 8,16 (1H, с).
Пример 194: 3-[4-Бензил-2-(тиоморфолино)-5-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 191.
1H-ЯМР (CDCl3) δ: 1,34-1,86 (3Н, м), 1,95-2,06 (2Н, м), 2,58-2,94 (8Н, м), 2,99 (1Н, дд, J=2,14 Гц), 3,17 (1H, дд, J=2,14 Гц), 3,89-3,94 (4Н, м), 4,02 (2Н, с), 6,35 (1H, с), 7,14-7,32 (5Н, м), 8,22 (1H, с).
Пример 195: (3R)-3-[4-Бензил-2-[(3R,4R)-3-гидрокси-4-метоксипирролидин-1-ил]-5-пиридил]этинил-3-хинуклидинол
a) 4-Бензил-5-бром-2-[(3R,4R)-3,4-дигидроксипирролидин-1-ил]пиридин
Смесь 4,0 г 4-бензил-5-бром-2-пиридилтрифторметансульфоната, 1,8 г (3R,4R)-3,4-дигидроксипирролидинацетата, 3 мл 1,8-диазабицикло[5,4,0]-7-ундецена и 5 мл тетрагидрофурана нагревали при перемешивании в течение 3 часов на масляной бане при температуре 70°С в атмосфере азота. После остывания реакционную смесь экстрагировали смесью этилацетат-вода. Органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и выпаривали. Остаток подвергали колоночной хроматографии на силикагеле и элюировали 10% метанолом/этилацетатом с получением 1,67 г целевого соединения.
1H-ЯМР (CDCl3) δ: 3,27-3,33 (2Н, м), 3,61-3,67 (2Н, м), 3,99 (2Н, с), 4,17-4,21 (2Н, м), 6,14 (1H, с), 7,20 (2Н, д, J=7 Гц), 7,24 (1H, т, J=7 Гц), 7,31 (2Н, т, J=7 Гц), 8,09 (1H, с).
b) 4-Бензил-5-бром-2-[(3R,4R)-3-гидрокси-4-метоксипирролидин-1-ил]пиридин
190 мг 60% масляной суспензии гидрида натрия и 0,3 мл метилйодида добавляли к раствору 1,67 г 4-бензил-5-бром-2-[(3R,4R)-3,4-дигидроксипирролидин-1-ил]пиридина в тетрагидрофуране с последующим перемешиванием в течение 6 часов. Затем реакционный раствор экстрагировали смесью этилацетат-вода, органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и выпаривали. Остаток подвергали колоночной хроматографии на силикагеле и элюировали 50% этилацетатом с получением 560 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 3,34-3,47 (2Н, м), 3,40 (3Н, с), 3,58-3,67 (2Н, м), 3,82-3,86 (1Н, м), 3,99 (2Н, с), 4,37-4,41 (1Н, м), 6,08 (1Н, с), 7,19 (2Н, д, J=7 Гц), 7,24 (1Н, т, J=7 Гц), 7,31 (2Н, т, J=7 Гц), 8,18 (1Н, с).
c) (3R)-3-[4-Бензил-2-[(3R,4R)-3-гидрокси-4-метоксипирролидин-1-ил]-5-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 191, используя (3R)-3-этинил-3-хинуклидинол.
1H-ЯМР (CDCl3+CD3OD) δ: 1,35-1,45 (1H, м), 1,52-1,62 (1Н, м), 1,78-1,88 (1H, м), 1,97-2,08 (2Н, м), 2,60-2,90 (4Н, м), 2,95 (1H, д, J=14 Гц), 3,13 (1H, дд, J=2, 14 Гц), 3,40 (3Н, с), 3,40-3,50 (2Н, м), 3,58-3,68 (2Н, м), 3,82-3,86 (1H, м), 4,02 (2Н, с), 4,32-4,36 (1H, м), 6,13 (1H, с), 7,17 (2Н, д, J=7 ГЦ), 7,21 (1H, т, J=7 Гц), 7,29 (2Н, д, J=7 Гц), 8,13 (1H, с).
Пример 196: (3R)-3-[4-Бензил-2-[(3R,4R)-3,4-диметоксипирролидин-1-ил]-5-пиридил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 195, используя два эквивалента метилйодида и гидрида натрия в отношении к 4-бензил-5-бром-2-[(3R,4R)-3,4-дигидроксипирролидин-1-ил]пиридину (пример 195а).
1H-ЯМР (CDCl3) δ: 1,30-1,88 (3Н, м), 1,95-2,08 (2Н, м), 2,60-2,90 (4Н, м), 2,99 (1Н, д, J=14 Гц), 3,17 (1Н, д, J=14 Гц), 3,40 (6Н, с), 3,50-3,65 (4Н, м), 3,92 (2Н, шир.с), 4,02 (2Н, с), 6,10 (1Н, с), 7,15-7,32 (5Н, м), 8,22 (1Н, с).
Пример 197: 3-[4-Бензил-2-(2-тиазолил)-5-пиримидил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 18.
1H-ЯМР (CDCl3) δ: 1,40-1,48 (1H, м), 1,61-1,69 (1Н, м), 1,79-1,87 (1H, м), 2,00-2,09 (2Н, м), 2,75-2,94 (4Н, м), 3,05 (1H, дд, J=1, 14 Гц), 3,23 (1H, дд, J=2, 14 Гц), 4,37 (2Н, с), 7,21-7,34 (5Н, м), 7,56 (1H, д, J=3 Гц), 8,06 (1H, д, J=3 Гц), 8,75 (1H, с).
Пример 198: 3-[4-Бензил-2-(2-тиенил)-5-пиримидил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 18.
1H-ЯМР (CDCl3) δ: 1,40-1,48 (1H, м), 1,61-1,68 (1H, м), 1,81-1,89 (1H, м), 2,01-2,08 (2Н, м), 2,73-2,95 (4Н, м), 3,06 (1H, д, J=14 Гц), 3,25 (1H, дд, J=2, 14 Гц), 4,27 (2Н, с), 7,15 (1H, дд, J=4, 5 Гц), 7,20-7,34 (5Н, м), 7,50 (1H, дд, J=1, 5 Гц), 8,01 (1H, дд, J=1, 4 Гц), 8,61 (1H, с).
Пример 199: 3-[4-Бензил-2-(2-фурил)-5-пиримидил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 18.
1H-ЯМР (CDCl3) δ: 1,39-1,47 (1Н, м), 1,60-1,68 (1H, м), 1,78-1,86 (1H, м), 2,01-2,08 (2Н, м), 2,70-2,94 (4Н, м), 3,04 (1H, дд, J=1, 14 Гц), 3,22 (1H, дд, J=2, 14 Гц), 4,30 (2Н, с), 6,58 (1H, дд, J=2, 3 Гц), 7,20-7,31 (5Н, м), 7,36 (1H, д, J=3 Гц), 7,65 (1H, д, J=2 Гц), 8,67 (1H, с).
Пример 200; 3-[4-Бензил-2-(2-метоксипиридин-5-ил)-5-пиримидил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 18, за исключением того, что (3-пиридил)трибутилолово заменяли (2-метоксипиридин-5-ил)трибутилоловом.
1H-ЯМР (CDCl3) δ: 1,40-1,48 (1H, м), 1,61-1,68 (1H, м), 1,83-1,92 (1H, м), 2,01-2,10 (2Н, м), 2,78-2,94 (4Н, м), 3,07 (1H, д, J=14 Гц), 3,28 (1H, дд, J=2, 14 Гц), 4,02 (3Н, с), 4,29 (2Н, с), 6,82 (1H, д, J=9 Гц), 7,20-7,36 (5Н, м), 8,57 (1H, дд, J=2, 9 Гц), 8,68 (1H, с), 9,25 (1H, д, J=2 Гц).
Пример 201: (3R)-3-[4-Бензил-2-[(3R,4R)-3-гидрокси-4-метоксипирролидин-1-ил)-3-пиримидил]этинил-3-хинуклидинол
а) 4-Бензил-5-бром-2-(3R,4R)-3,4-дигидроксипирролидин-1-ил)-3-пиримидин
644 мкл 1,8-диазабицикло[5,4,0]-7-ундецена добавляли к смеси 509 мг 4-бензил-5-бром-2-хлорпиримидина (пример получения 15), 351 мг (3R,4R)-3,4-дигидроксипирролидинацетата и 5 мл 1-метил-2-пирролидинона при комнатной температуре с последующим перемешиванием при 70°С в течение одного часа.
Добавляли воду и этилацетат и органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле, используя 20% гексан/этилацетат, с получением 766 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 3,60 (2Н, д, J=12 Гц), 3,85 (2Н, дд, J=4, 12 Гц), 4,08 (2Н, с), 4,31 (2Н, шир.с), 7,20-7,37 (5Н, м), 8,26 (1Н, с).
b) (3R)-3-[4-Бензил-2-[(3R,4R)-3-гидрокси-4-метоксипирролидин-1-ил)-3-пиримидил]этинил-3-хинуклидинол
70,0 мг 60% масляной суспензии гидрида натрия добавляли к смеси 766 мг 4-бензил-5-бром-2-[(3R,4R)-3,4-дигидроксипирролидин-1-ил]-3-пиримидина и 10 мл тетрагидрофурана при охлаждении льдом с последующим добавлением туда 99,6 мкл метилйодида. После перемешивания при комнатной температуре в течение 6 часов к реакционному раствору добавляли воду и этилацетат. Органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель выпаривали. Смесь остатка, 4,5 мг тетракис(трифенилфосфин)палладия (0), 0,1 мг йодида меди, 32,6 мкл триэтиламина и 1 мл N,N-диметилформамида перемешивали при 90°С в течение 3 часов в атмосфере азота. К реакционному раствору добавляли NH-силикагель и растворитель удаляли. Остаток подвергали колоночной хроматографии на NH-силикагеле, используя 5% этанол/этилацетат, с получением 22,0 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,36-1,43 (1H, м), 1,55-1,62 (1Н, м), 1,78-1,85 (1H, м), 2,01-2,08 (2Н, м), 2,67-2,90 (4Н, м), 2,95-3,00 (1H, м), 3,13-3,18 (1H, м), 3,41 (3Н, с), 3,64-3,84 (5Н, м), 4,06 (2Н, с), 4,37 (1H, шир.с), 7,18-7,30 (5Н, м), 8,29 (1H, с).
Пример 202: (3R)-3-[4-Бензил-2-(2-фурилметокси)-5-пиримидил]этинил-3-хинуклидинол
a) 4-Бензил-2-(2-фурилметокси)-5-бромпиримидин
14,1 мг 60% масляной суспензии гидрида натрия добавляли к смеси 73,3 мг 4-бензил-5-бром-2-хлорпиримидина (пример получения 15), 1 мл фурфурилового спирта и 14,8 мг йодида меди при комнатной температуре с последующим перемешиванием при 90°С в течение 2 часов. К реакционному раствору добавляли диэтиловый эфир и органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле, используя 10% этилацетат/гексан, с получением 50,9 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 4,19 (2Н, с), 5,33 (2Н, с), 6,32-6,37 (2Н, м), 7,22-7,41 (6Н, м), 8,48 (1H, с).
b) (3R)-3-[4-Бензил-2-(2-фурилметокси)-5-пиримидил]этинил-3-хинуклидинол
Смесь 50,9 мг 4-бензил-2-(2-фурилметокси)-5-бромпиримидина, 26,8 мг (3R)-3-этинил-3-хинуклидинола, 8,5 мг тетракис(трифенилфосфин)палладия (0), 0,3 мг йодида меди, 61,5 мкл триэтиламина и 1 мл N,N-диметилформамида перемешивали при 90°С в течение 4 часов в атмосфере азота. К реакционному раствору добавляли NH-силикагель и растворитель удаляли. Остаток подвергали колоночной хроматографии на NH-силикагеле, используя 3% метанол/этилацетат, с получением 29,0 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,38-1,46 (1Н, м), 1,60-1,89 (2Н, м), 2,00-2,07 (2Н, м), 2,73-2,93 (4Н, м), 3,05 (1Н, д, J=14 Гц), 3,25 (1Н, дд, J=2, 14 Гц), 4,19 (2Н, с), 5,38 (2Н, с), 6,32-6,39 (2Н, м), 7,21-7,30 (5Н, м), 7,40-7,41 (1Н, м), 8,48 (1Н, с).
Пример 203: (3R)-3-[4-Бензил-2-(3-гидроксипропилокси)-5-пиримидил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 202, за исключением того, что фурфуриловый спирт заменяли 1,3-пропандиолом.
1H-ЯМР (CDCl3) δ: 1,38-1,46 (1H, м), 1,58-1,67 (1Н, м), 1,79-1,89 (1H, м), 1,99-2,07 (4Н, м), 2,71-2,93 (4Н, м), 3,04 (1H, д, J=14 Гц), 3,22 (1H, д, J=14 Гц), 3,77 (2Н, т, J=6 Гц), 4,17 (2Н, с), 4,52 (2Н, т, J=6 Гц), 7,20-7,29 (5Н, м), 8,45 (1H, с).
Пример 204: 3-(3-Фенил-5-бензил-6-пиридазил]этинил-3-хинуклидинол
а) 3-Фенил-6-метоксипиридазин
Смесь 3,0 г 3-хлор-6-метоксипиридазина, 3,8 г фенилборной кислоты, 2,4 г тетракис(трифенилфосфин)-палладия (0), 160 мл толуола, 40 мл метанола, 80 мл 2 М водного раствора карбоната натрия и 30 мл тетрагидрофурана перемешивали при нагревании при 85°С в течение одного часа. После охлаждения реакционный раствор экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором соли и элюировали этилацетатом через NH-силикагель (Fiji Silicia). После удаления растворителя остаток кристаллизовали с получением 1,8 г целевого соединения.
1H-ЯМР (CDCl3) δ: 4,20 (3Н, с), 7,06 (1Н, д, J=9 Гц), 7,44-7,52 (3Н, м), 7,79 (1Н, д, J=9 Гц), 7,99-8,03 (2Н, м).
b) 5-(α-Гидроксибензил)-3-фенил-6-метоксипиридазин 7,7 мл гексанового раствора, содержащего 1,52 моль н-бутиллития, медленно, по каплям добавляли в 50 мл тетрагидрофуранового раствора, содержащего 2,0 мл 2,2,6,6-тетраметилпиперидина, при охлаждении льдом. После перемешивания в течение одного часа при охлаждении льдом эту смесь охлаждали до -78°С и медленно по каплям добавляли 10 мл тетрагидрофуранового раствора, содержащего 1,68 г 3-фенил-6-метоксипиридазина. После перемешивания при -78°С в течение 2 часов медленно, по каплям, добавляли бензальдегид. После перемешивания при -78°С в течение еще 30 минут смесь перемешивали при комнатной температуре в течение ночи. К реакционному раствору добавляли воду, экстрагировали этилацетатом и органическую фазу промывали насыщенным раствором соли. После удаления растворителя остаток подвергали хроматографии на NH-силикагеле (Fuji Silicia) и элюировали гексаном/этилацетатом (3:1), а затем гексаном/этилацетатом (1:1) с получением 1,39 г целевого соединения.
1H-ЯМР (CDCl3) δ: 4,15 (3Н, с), 5,99 (1Н, с), 7,17-7,69 (9Н, м), 7,99-8,04 (2Н, м).
c) 5-(α-Ацетоксибензил)-3-фенил-6-метоксипиридазин
5,0 мл ангидрида уксусной кислоты медленно, по каплям добавляли к раствору 1,39 г 5-(α-гидроксибензил)-3-фенил-6-метоксипиридазина, 174 мг 4-диметиламинопиридина и 1,0 триэтиламина в 10 мл дихлорметана при охлаждении льдом. После перемешивания при комнатной температуре в течение одного часа к реакционному раствору добавляли воду. После экстрагирования дихлорметаном органическую фазу промывали насыщенным раствором соли. После удаления растворителя остаток подвергали хроматографии на NH-силикагеле (Fuji Silicia) и элюировали этилацетатом с получением 1,58 г целевого соединения.
1H-ЯМР (CDCl3) δ: 2,20 (3Н, с), 4,16 (3Н, с), 7,02 (1Н, с), 7,34-7,54 (9Н, м), 8,00-8,02 (2Н, м).
d) 3-Фенил-5-бензил-6-метоксипиридазин
600 мг 10% палладия на угле добавляли к смеси 1,58 г 5-(α-ацетоксибензил)-3-фенил-6-метоксипиридазина, 2,0 мл триэтиламина и 10 мл этанола и смесь подвергали гидрокрекингу в атмосфере водорода. Катализатор отфильтровывали и растворитель удаляли. Затем остаток подвергали хроматографии на NH-силикагеле (Fuji Silicia) и элюировали этилацетатом с получением 1,31 г целевого соединения.
1H-ЯМР (CDCl3) δ: 3,98 (2Н, с), 4,22 (3Н, с), 7,23-7,73 (9Н, м), 7,89-7,93 (2Н, м).
e) 3-Фенил-5-бензил-6-пиридазилтрифторметансульфонат
10 мл 47% бромистоводородной кислоты добавляли к 1,31 г 3-фенил-5-бензил-6-метоксипиридазина с последующим нагреванием при перемешивании на масляной бане при температуре 90°с в течение 3 часов. После остывания реакционный раствор малыми порциями добавляли к водному раствору карбоната калия для нейтрализации. После экстрагирования этилацетатом органическую фазу промывали насыщенным раствором соли и растворитель удаляли с получением 1,18 г неочищенного продукта. Смесь 1,18 г неочищенного продукта, 1,93 г N-фенилтрифторметансульфонимида, 165 мг 4-диметиламинопиридина, 943 мкл триэтиламина и 10 мл дихлорметана перемешивали при комнатной температуре в течение ночи. После того как реакционный раствор концентрировали, остаток подвергали хроматографии на силикагеле с элюированием гексаном/этилацетатом (10:1) и затем гексаном/этилацетатом (7:1) с получением 484 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 4,12 (2Н, с), 7,23-7,64 (9Н, м), 7,94-7,96 (2Н, м).
f) 3-(3-Фенил-5-бензил-6-пиридазил)этинил-3-хинуклидинол
Смесь 484 мг 3-фенил-5-бензил-6-пиридазилтрифторметансульфоната, 223 мг 3-этинил-3-хинуклидинола, 284 мг тетракис(трифенилфосфин)палладия (0), 47 мг йодида меди, 513 мкл триэтиламина и 5,0 мл N,N-диметилформамида нагревали при перемешивании при 80°С в течение 2 часов в атмосфере азота. Реакционный раствор выливали в разбавленный водный раствор аммиака и смесь экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором соли и растворитель удаляли. Остаток подвергали колоночной хроматографии на NH-силикагеле (Fuji Silicia) и элюировали гексаном/этилацетатом (1:1), затем этилацетатом/метанолом (20:1) и кристаллизовали из смеси гексан/этилацетат с получением 413 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,25-1,99 (3Н, м), 2,02-2,15 (2Н, м), 2,78-2,95 (4Н, м), 3,08 (1Н, д, J=14 Гц), 3,30 (1Н, д, J=14 Гц), 4,18 (2Н, с), 7,07-7,38 (5Н, м), 7,48-7,52 (4Н, м), 7,99-8,02 (2Н, м).
Пример 205: 3-[3-(3-Пиридил)-5-бензил-6-пиридазил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 204.
1H-ЯМР (CDCl3) δ: 1,38-1,96 (3Н, м), 2,03-2,17 (2Н, м), 2,81-2,98 (4Н, м), 3,11 (1Н, д, J=14 Гц), 3,32 (1Н, дд, J=2, 14 Гц), 4,19 (2Н, с), 7,19-7,38 (5Н, м), 7,43-7,46 (1Н, м), 7,53 (1Н, с), 8,39-8,42 (1Н, м), 8,70-8,71 (1Н, м), 9,14 (1Н, д, J=2 Гц).
Пример 206: 3-(2-Бензил-3-тиенил)этинил-3-хинуклидинол
а) 2-Метоксикарбонил-3-тиенилтрифторметансульфонат
Смесь 4,12 г 3-гидрокси-2-метоксикарбонилтиофена, 9,76 г N-фенилтрифторметансульфонимида, 5,44 мл триэтиламина, 318 4-диметиламинопиридина и 70 мл дихлорметана перемешивали при комнатной температуре в течение ночи. К реакционному раствору добавляли силикагель и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле, используя 10% этилацетат/гексан, с получением 6,21 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 3,92 (3Н, с), 7,01 (1Н, д, J=5 Гц), 7,55 (1Н, д, J=5 Гц).
b) 2-Метоксикарбонил-3-(триметилсилилэтинил)тиофен
Смесь 2,07 г 2-метоксикарбонил-3-тиенилтрифторметансульфоната, 2,02 мл триметилсилилацетилена, 1,57 г тетракис(трифенилфосфин)палладия (0), 272 мг йодида меди, 2,98 мл триэтиламина и 30 мл N,N-диметилформамида перемешивали при 65°С в течение 3 часов в атмосфере азота. К реакционному раствору добавляли силикагель и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле, используя 6% этилацетат/гексан, с получением 1,78 г целевого соединения.
1H-ЯМР (CDCl3) δ: 0,29 (9Н, с), 3,90 (3Н, с), 7,14 (1Н, д, J=5 Гц), 7,41 (1Н, д, J=5 Гц).
c) 3-Этинил-2-(α-гидроксибензил)тиофен
131 мг литийалюмогидрида добавляли к смеси 821 мг 2-метоксикарбонил-3-(триметилсилилэтинил)тиофена и 10 мл тетрагидрофурана с последующим кипячением с обратным холодильником в течение 1,5 часов. После остывания последовательно добавляли 131 мкл воды, 131 мкл 1N водного раствора гидроксида натрия и 393 мкл воды с последующим фильтрованием через целит. После удаления растворителя 5,25 г диоксида марганца добавляли к 10 мл дихлорметанового раствора, содержащего остаток, с последующим перемешиванием при комнатной температуре в течение ночи. Смесь фильтровали через целит и растворитель удаляли. 3,5 мл циклогександиэтилэфирного раствора, содержащего 1,8 моль фениллития, по каплям добавляли к смеси остатка и 5 мл диэтилового эфира при -78°С с последующим перемешиванием при той же температуре в течение 20 минут. К реакционному раствору добавляли водный раствор хлорида аммония и температуру системы поднимали до комнатной температуры. Добавляли этилацетат и органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле, используя 10% этилацетат/гексан, с получением 85,7 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 2,59 (1Н, д, J=3 Гц), 3,26 (1H, с), 6,34 (1Н, д, J=3 Гц), 7,02 (1H, д, J=5 Гц), 7,17 (1H, д, J=5 Гц), 7,22-7,38 (3Н, м), 7,49-7,51 (3Н, м).
d) 2-Бензил-3-этинилтиофен
201 мг Цианотригидробората натрия добавляли к смеси 85,7 мг 3-этинил-2-(α-гидроксибензил)тиофена, 192 мг йодида цинка и 1,5 мл 1,2-дихлорэтана при комнатной температуре в течение ночи. К реакционному раствору добавляли 5 мл диэтилового эфира с последующим фильтрованием через целит. После того как растворитель удаляли, остаток подвергали колоночной хроматографии на силикагеле, используя 2% этилацетат/гексан, с получением 45,2 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 3,21 (1Н, с), 4,25 (2Н, с), 7,02 (1Н, д, J=5 Гц), 7,05 (1H, д, J=5 Гц), 7,21-7,32 (5Н, м).
е) 3-(2-Бензил-3-тиенил)этинил-3-хинуклидинол
0,200 мл Гексанового раствора, содержащего 1,8 моль бутиллития, по каплям добавляли к смеси 45,2 мг 2-бензил-3-этинилтиофена и 1 мл тетрагидрофурана при -78°С с последующим перемешиванием при той же температуре в течение 20 часов. К реакционному раствору по каплям добавляли 0,5 мл тетрагидрофуранового раствора, содержащего 39,9 мг 3-хинуклидинона, при той же температуре с последующим перемешиванием и затем при комнатной температуре в течение 4 часов. К реакционному раствору добавляли 0,5 мл воды и NH-силикагель и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле, используя этилацетат, с получением 39,5 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,36-1,44 (1H, м), 1,56-1,64 (1H, м), 1,86-1,95 (1H, м), 1,98-2,07 (2Н, м), 2,72-2,92 (4Н, м), 3,02 (1H, д, J=14 Гц), 3,24 (1H, дд, J=2, 14 Гц), 4,21 (2Н, с), 6,98 (1H, д, J=5 Гц), 7,06 (1H, д, J=5 Гц), 7,20 (5Н, м).
Пример 207: 3-(3-Бензил-5-пиразил-2-тиенил)этинил-3-хинуклидинол
а) 1-Фенил-1-(3-тиенил)метанол
10 мл 3-Тиофенкарбоксиальдегида растворяли в 50 мл тетрагидрофурана. К смеси по каплям добавляли 64 мл гексан/циклогексанового раствора, содержащего 1,8 моль фениллития, на бане с сухим льдом/ацетоном. После добавления к смеси водного раствора хлорида аммония экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над безводным сульфатом магния и выпаривали. Остаток подвергали колоночной хроматографии на силикагеле и элюировали 10% этилацетатом/гексаном с получением целевого соединения.
1H-ЯМР (CDCl3) δ: 2,20 (1H, д, J=4 Гц), 5,90 (1H, д, J=4 Гц), 7,00 (1H, дд, J=1,5 Гц), 7,17-7,21 (1H, м), 7,26-7,42 (6Н, м).
b) 3-Бензоилтиофен
6,2 г 1-фенил-1-(3-тиенил)метанола растворяли в 50 мл хлороформа. К смеси добавляли 30 г диоксида марганца с последующим перемешиванием в течение ночи. Диоксид марганца отфильтровывали и фильтрат выпаривали с получением 6,08 г целевого соединения.
1H-ЯМР (CDCl3) δ: 7,39 (1H, дд, J=3,5 Гц), 7,49 (2Н, т, J=7 Гц), 7,56-7,62 (2Н, м), 7,84-7,87 (2Н, м), 7,94 (1H, дд, J=1,3 Гц).
c) 3-Бензоил-5-бромтиофен
3,0 г 3-бензоилтиофена растворяли в 10 мл N,N-диметилацетамида и добавляли 1 мл уксусной кислоты и 2,83 г N-бромсукцинимида с последующим перемешиванием в течение ночи. К реакционному раствору добавляли воду с последующим экстрагированием диэтиловым эфиром. Экстракт промывали водным насыщенным раствором бикарбоната натрия, сушили над безводным сульфатом магния и выпаривали. Остаток подвергали колоночной хроматографии на силикагеле и элюировали 10% этилацетатом/гексаном с получением 2,7 г целевого соединения.
1H-ЯМР (CDCl3) δ: 7,50 (2Н, т, J=8 Гц), 7,55 (2Н, д, J=2 Гц), 7,60 (1Н, т, J=8 Гц) 7,79-7,84 (3Н, м).
d) 3-(3-Бензил-5-пиразил-2-тиенил)этинил-3-хинуклидинол
2,7 г 3-бензоил-5-бромтиофена, 3,0 г пиразилтрибутилолова и 1,0 г тетракис(трифенилфосфин)палладия (0) перемешивали с 30 мл ксилола с последующим кипячением с обратным холодильниокм в потоке азота. Реакционный раствор подвергали колоночной хроматографии на NH-силикагеле и элюировали 10% этилацетатом/гексаном с получением 1,23 г продукта. 500 мг Продукта растворяли в 5 мл тетрагидрофурана и 20 мл метанола. Добавляли 60 мг боргидрида натрия с последующим перемешиванием при комнатной температуре. К реакционному раствору добавляли воду и смесь экстрагировали этилацетатом. Экстракт сушили над безводным сульфатом магния и выпаривали. К остатку добавляли 1 мл триэтилсилана и 10 мл трифторуксусной кислоты с последующим перемешиванием на ледяной бане. После того как смесь нейтрализовали насыщенным водным раствором карбоната натрия, ее экстрагировали этилацетатом и выпаривали. К остатку добавляли 10 мл N,N-диметилформамида и далее к смеси добавляли 40 мг N-бромсукцинимида на ледяной бане с последующим перемешиванием в течение одного часа. Добавляли воду с последующим экстрагированием этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над безводным сульфатом магния и затем выпаривали. К остатку добавляли 300 мг 3-этинил-3-хинуклидинола, 100 мг тетракис(трифенилфосфин)палладия (0), 50 мг йодида меди, 1 мл триэтиламина и 10 мл N,N-диметилформамида и затем нагревали при перемешивании на масляной бане при температуре 100°С. Реакционный раствор выпаривали и остаток подвергали хроматографии на NH-силикагеле с получением 225 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,37-1,68 (2Н, м), 1,86-1,96 (1H, м), 1,98-2,10 (2Н, м), 2,76-2,96 (4Н, м), 3,06 (1Н, д, J=14 Гц), 3,29 (1H, дд, J=2, 14 Гц), 4,05 (2Н, с), 7,21-7,34 (5Н, м), 7,36 (1H, с), 8,39 (1H, д, J=3 Гц), 8,47 (1H, дд, J=1, 3 Гц), 8,83 (1H, д, J=1 Гц).
Пример 208: 3-[3-Бензил-6-(гидроксиметил)-4,5,6,7-тетрагидробензо[b]тиофен-2-ил]этинил-3-хинуклидинол
а) Этил-4-оксо-1-циклогексанкарбоксилат
120 мл реактива Джона по каплям добавляли в 800 мл ацетонового раствора, содержащего 81,1 г этил 4-гидроксициклогексанкарбоксилата, в течение 30 минут на ледяной бане. После перемешивания при той же температуре в течение 20 минут добавляли 2-пропанол. Реакционный раствор выливали в воду с последующим экстрагированием этилацетатом. Органическую фазу промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли с получением 80,0 г целевого соединения.
1H-ЯМР (CDCl3) δ: 1,28 (ЗН, т, J=7 Гц), 1,98-2,10 (2Н, м), 2,18-2,25 (2Н, м), 2,31-2,39 (2Н, м), 2,45-2,51 (2Н, м), 2,71-2,77 (1Н, м), 4,18 (2Н, кв, J=7 Гц)
b) 2-Амино-3-бензоил-6-этоксикарбонил-4,5,6,7-тетрагидро-бензо[b]тиофен
Смесь 25,2 г этил-4-оксо-1-циклогексанкарбоксилата, 21,4 г бензоилацетонитрила, 25,2 мл диэтиламина и 250 мл этанола кипятили с обратным холодильником в течение 45 минут. К смеси добавляли 4,7 г серы при одновременном кипячении с обратным холодильником с последующим кипячением с обратным холодильником в течение еще 2 часов. После остывания растворитель удаляли и остаток кристаллизовали из метанола с получением 13,4 г целевого соединения.
1H-ЯМР (CDCl3) δ: 1,24 (3Н, т, J=7 Гц), 1,52-1,61 (1Н, м), 1,82-1,99 (3Н, м), 2,05-2,79 (3Н, м), 4,10-4,18 (2Н, м), 6,66 (2Н, шир.с), 7,37-7,48 (5Н, м).
c) 3-(α-Гидроксибензил)-6-этоксикарбонил-4,5,6,7-тетрагидробензо[b]тиофен
Смесь 21,5 г 2-амино-3-бензоил-6-этоксикарбонил-4,5,6,7-тетрагидробензо[b]тиофена, 12,5 г йодида меди, 26,3 мл дийодметана, 26,3 мл изопентилнитрита и 250 мл тетрагидрофурана кипятили с обратным холодильником в течение 1,5 часов. После остывания к реакционному раствору добавляли 500 мл этилацетата. Нерастворимые вещества отфильтровывали, смесь подвергали колоночной хроматографии на силикагеле и элюировали гексаном, а затем гексаном/этилацетатом (10:1) с получением 17,4 г неочищенного продукта. К 200 мл этанольного раствора, содержащего 17,4 г неочищенного продукта, малыми порциями добавляли 1,5 г боргидрида натрия при охлаждении льдом. После перемешивания при комнатной температуре в течение одного часа растворитель удаляли. К остатку добавляли этилацетат и воду с последующим экстрагированием этилацетатом. Органическую фазу промывали насыщенным раствором соли и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле и элюировали гексаном, а затем гексаном/этилацетатом (4:1) с получением 11,2 г целевого соединения.
1H-ЯМР (CDCl3) δ: 1,23-1,28 (3Н, м), 1,72-1,85 (1Н, м), 2,09-2,28 (2Н, м), 2,47-2,76 (2Н, м), 2,93-3,06 (2Н, м), 4,13-4,18 (2Н, м), 5,75-5,76 (1Н, м), 7,27-7,38 (6Н, м).
d) 3-Бензил-6-этоксикарбонил-4,5,6,7-тетрагидробензо[b]тиофен
Смесь 8,3 г 3-(α-гидроксибензил)-6-этоксикарбонил-4,5,6,7-тетрагидробензо[b]тиофен, 12,5 г йодида цинка, 2,0 г цианоборгидрида натрия и 150 мл дихлорметана перемешивали при комнатной температуре в течение 3 часов. После добавления метанола к реакционному раствору нерастворимые вещества отфильтровывали. Растворитель удаляли и остаток подвергали колоночной хроматографии на силикагеле и элюировали гексаном, а затем гексаном/этилацетатом (10:1) с получением 5,9 г целевого соединения.
1H-ЯМР (CDCl3) δ: 1,26 (3Н, т, J=7 Гц), 1,77-1,87 (1Н, м), 2,16-2,22 (1Н, м), 2,33-2,42 (1Н, м), 2,54-2,75 (2Н, м), 2,93-3,06 (2Н, м), 3,75-3,86 (2Н, м), 4,16 (2Н, кв, J=7 Гц), 6,64 (1Н, с), 7,16-7,30 (5Н, м).
e) 3-Бензил-6-(гидроксиметил)-4,5,6,7-тетрагидробензо[b]тиофен
Раствор из 10 мл диэтилового эфира, содержащий 2,8 г 3-бензил-6-этоксикарбонил-4,5,6,7-тетрагидробензо[b]тиофена, медленно по каплям добавляли в суспензию в 100 мл диэтилового эфира, содержащую 421 мг литийалюмогидрида, при охлаждении льдом. После перемешивания в течение 30 минут к реакционному раствору последовательно добавляли 0,4 воды, 0,4 мл 1N водного раствора гидроксида натрия и 0,4 мл воды и смесь сушили над безводным сульфатом магния. После фильтрования растворитель удаляли с получением 2,5 г целевого соединения.
1H-ЯМР (CDCl3) δ: 1,39-1,50 (1Н, м), 1,94-2,09 (2Н, м), 2,32-2,59 (3Н, м), 2,88-2,94 (1Н, м), 3,63-3,64 (2Н, м), 3,77-3,86 (2Н м), 6,62 (1Н, с), 7,16-7,31 (5Н, м).
f) 2-Бром-3-бензил-6-гидроксиметил-4,5,6,7-тетрагидробензо[b]тиофен
103 мг N-бромсукцинимида малыми порциями добавляли к 5,0 мл N,N-диметилформамидного раствора, содержащего 136 мг 3-бензил-6-(гидроксиметил)-4,5,6,7-тетрагидробензо[b]тиофена, при охлаждении льдом. После перемешивания в течение одного часа к реакционному раствору добавляли воду и смесь экстрагировали этилацетатом. Органическую фазу промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Затем остаток подвергали колоночной хроматографии на силикагеле и элюировали гексаном, а затем гексаном/этилацетатом (2:1) с получением 164 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,34-1,44 (1Н, м), 1,87-1,99 (2Н, м), 2,23-2,8 (ЗН, м), 2,78-2,83 (1Н, м), 3,59-3,60 (2Н, м), 3,81-3,92 (2Н, м), 7,13-7,28 (5Н, м).
g) 3-[3-Бензил-6-(гидроксиметил)-4,5,6,7-тетрагидробензо[b]тиофен-2-ил]этинил-3-хинуклидинол
Смесь 164 мг 2-бром-3-бензил-6-гидроксиметил-4,5,6,7-тетрагидробензо[b]тиофена, 88 мг 3-этинил-3-хинуклидинола, 112 мг тетракис(трифенилфосфин)палладия (0), 19 мг йодида меди, 203 мкл триэтиламина и 5,0 мл N,N-диметилформамида нагревали при перемешивании при 80°С в течение 1 часа в атмосфере азота. После остывания растворитель удаляли и остаток подвергали колоночной хроматографии NH-силикагеле (Fuji Silicia) и элюировали гексаном/этилацетатом (1:1), а затем этилацетатом/метанолом (20:1) с получением 113 мг намеченного соединения.
1H-ЯМР (CDCl3) δ: 1,33-1,44 (2Н, м), 1,52-1,60 (1Н, м), 1,84-2,01 (5Н, м), 2,23-2,31 (1H, м), 2,39-2,45 (2Н, м), 2,71-2,90 (5Н, м), 2,99 (1Н, д, J=14 Гц), 3,23 (1H, дд, J=2, 14 Гц), 3,57-3,59 (2Н, м), 3,86-3,98 (2Н, м), 7,14-7,34 (5Н, м).
Пример 209: 3-(2-Бензил-7-пиразил-3-хинолил]этинил-3-хинуклидинол
а) 1-Метокси-3-фенил-2-пропанол
35 мл 28% Метанольного раствора метоксида натрия добавляли к 100 мл метанольного раствора, содержащего 14,0 г бензилоксирана, с последующим нагреванием при перемешивании в течение 2 часов на масляной бане при температуре 80°С. После остывания растворитель удаляли. Добавляли воду с последующим экстрагированием этилацетатом. Органическую фазу промывали насыщенным раствором соли и растворитель удаляли с получением 17,3 г целевого соединения.
1H-ЯМР (CDCl3) δ: 2,75-2,84 (2Н, м), 3,28-3,32 (1Н, м), 3,38 (3Н, с), 3,39-3,43 (1Н, м), 4,01-4,03 (1Н, м), 7,22-7,33 (5Н, м).
b) 1-Метокси-3-фенилацетон
20,4 мл реактива Джона медленно, по каплям добавляли в 200 мл ацетонового раствора, содержащего 5,1 г 1-метокси-3-фенил-2-пропанола. После перемешивания в течение 30 минут при комнатной температуре к реакционному раствору медленно добавляли 30 мл 2-пропанола. После удаления растворителя туда добавляли воду и смесь экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором соли и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле и элюировали гексаном/этилацетатом (6:1) с получением 3,7 г целевого соединения.
1H-ЯМР (CDCl3) δ: 3,39 (3Н, с), 3,76 (2Н, с), 4,06 (2Н, с), 7,22-7,36 (5Н, м).
c) 2-Амино-4-бромбензальдегид
16,1 мл водного 29% раствора аммиака добавляли к смеси 5,0 г 2-нитро-4-бромбензальдегида, 60,4 г гептагидрата сульфата железа (II), 200 мл метанола, 100 мл воды и 335 мкл концентрированной соляной кислоты на масляной бане при температуре 90°С с последующим нагреванием при перемешивании в течение 10 минут. После остывания нерастворимые вещества отфильтровывали через целит и фильтрат экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором соли и растворитель удаляли с получением 3,9 г целевого соединения.
1H-ЯМР (CDCl3) δ: 6,17 (2Н, шир.с), 6,84-6,89 (2Н, м), 7,33 (1Н, д, J=8 Гц), 9,82 (1Н, с).
d) 2-Бензил-7-бром-3-метоксихинолин
Смесь 3,3 г 2-амино-4-бромбензальдегида, 3,3 г 1-метокси-3-фенилацетона, водного раствора гидроксида калия (10 г гидроксида калия растворяли в 10 мл воды) и 20 мл этанола нагревали при перемешивании при 100°С в течение 4 часов в запаянной пробирке. После остывания реакционный раствор выливали в воду и смесь экстрагировали диэтиловым эфиром. Органическую фазу промывали насыщенным раствором соли и растворитель удаляли. Остаток кристаллизовали из смеси гексан/этилацетат с получением 3,7 г целевого соединения.
1H-ЯМР (CDCl3) δ: 3,90 (3Н, с), 4,34 (2Н, с), 7,15-7,27 (4Н, м), 7,32-7,35 (2Н, м), 7,51-7,56 (2Н, м), 8,20-8,21 (1Н, м).
e) 2-Бензил-7-пиразил-3-метоксихинолин
Смесь 200 мг 2-бензил-7-бром-3-метоксихинолина, 337 мг пиразилтрибутилолова, 141 мг тетракис(трифенилфосфин)палладия (0) и 10 мл ксилола нагревали при перемешивании в течение 3 часов на масляной бане при температуре 150°С в атмосфере азота. После остывания растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле и элюировали гексаном/этилацетатом (5:1) и затем гексаном/этилацетатом (1:1) с получением 126 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 3,95 (3Н, с), 4,39 (2Н, с), 7,16-7,28 (3Н, с), 7,35-7,39 (3Н, м), 7,83 (1Н, д, J=8 Гц), 8,20-8,23 (1Н, м), 8,53 (1Н, д, J=3 Гц), 8,66-8,68 (2Н, м), 9,22 (1Н, м).
f) 2-Бензил-7-пиразил-3-хинолилтрифторметансульфонат
Смесь 127 мг 2-бензил-7-пиразил-3-метоксихинолина, 40 мг н-гексадецил-три-н-бутилфосфонийбромида и 10 мл 47% бромистоводородной кислоты нагревали при перемешивании в течение 48 часов на масляной бане при температуре 120°С. Реакционный раствор медленно выливали в водный раствор карбоната калия, смесь экстрагировали диэтиловым эфиром и растворитель удаляли. К остатку добавляли 274 мг N-фенилтрифторметансульфонимида, 133 мкл триэтиламина, 23 мг 4-диметиламинопиридина, 10 мл дихлорметана и 3,0 мл N,N-диметилформамида с последующим перемешиванием при комнатной температуре в течение ночи. После удаления растворителя остаток подвергали колоночной хроматографии на силикагеле и элюировали гексаном/этилацетатом (4:1) и затем гексаном/этилацетатом (2:1) с получением 134 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 4,46 (2Н, с), 7,25-7,40 (5Н, м), 7,77 (1Н, д, J=8 Гц), 8,09 (1H, с), 8,34-8,37 (1Н, м), 8,61 (1H, д, J=2 Гц), 8,72-8,76 (2Н, м), 9,25 (1H, м).
g) 3-(2-Бензил-7-пиразил-3-хинолил)этенил-3-хинуклидинол
Смесь 134 мг 2-бензил-7-пиразил-3-хинолилтрифторметансульфоната, 55 мг 3-этинил-3-хинуклидинола, 70 мг тетракис(трифенилфосфин)палладия (0), 11 мг йодида меди, 126 мкл триэтиламина и 5,0 мл N,N-диметилформамида нагревали при перемешивании при 85°С в течение 30 минут в атмосфере азота. Реакционный раствор выливали в разбавленный водный раствор аммиака и смесь экстрагировали этилацетатом. Затем органическую фазу промывали насыщенным раствором соли и растворитель удаляли с получением 76 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,41-1,46 (1H, м), 1,60-1,93 (2Н, м), 2,05-2,06 (2Н, м), 2,77-2,89 (4Н, м), 3,04 (1H, д, J=14 Гц), 3,21-3,25 (1H, м), 4,55 (2Н, с), 7,20-7,36 (5Н, м), 7,89 (1H, д, J=9 Гц), 8,25 (1H, с), 8,27-8,29 (1H, м), 8,58 (1H, д, J=3 Гц), 8,69-8,71 (2Н, м), 9,24 (1H, д, J=1 Гц).
Пример 210; 3-(2-Бензил-7-этоксикарбонил-3-хинолил)этинил-3-хинуклидинол
а) 2-Бензил-7-бром-3-гидроксихинолин
Смесь 1,28 г 2-бензил-7-бром-3-метоксихинолина, полученного в примере 209d, 990 мг н-гексадецил-три-н-бутилфосфонийбромида, 12 мл 47% бромистоводородной кислоты и 10 мл уксусной кислоты кипятили с обратным холодильником в течение 12 часов. После остывания реакционный раствор медленно выливали в водный раствор карбоната калия и смесь экстрагировали диэтиловым эфиром. Органическую фазу промывали насыщенным раствором соли и растворитель удаляли с получением 1,8 г целевого соединения (содержащего н-гексадецил-три-н-бутилфосфонийбромид) в виде неочищенного продукта.
b) 2-Бензил-7-циано-3-гидроксихинолин
Смесь 370 мг 2-бензил-7-бром-3-гидроксихинолина (содержащего н-гексадецил-три-н-бутилфосфонийбромид), 208 мг цианида цинка, 272 мг тетракис(трифенилфосфин)палладия (0) и 10 мл N,N-диметилформамида нагревали при перемешивании в течение 7 часов на масляной бане при температуре 90°С. После остывания нерастворимые вещества отфильтровывали через целит и к фильтрату добавляли водный раствор карбоната калия. Смесь экстрагировали этилацетатом и органическую фазу промывали насыщенным раствором соли и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле и элюировали гексаном/этилацетатом (3:1) и затем гексаном/этилацетатом (2:1) с получением 203 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 4,28 (2Н, с), 7,15-7,30 (5Н, м), 7,54 (1Н, с), 7,71-7,74 (1Н, м), 7,95 (1Н, д, J=9 Гц), 8,37 (1Н, с).
c) 2-Бензил-7-этоксикарбонил-3-гидроксихинолин
Смесь 203 мг 2-бензил-7-циано-3-гидроксихинолина, 2,6 г гидроксида калия, 5,5 мл воды и 20 мл этанола кипятили с обратным холодильником в течение 2 часов. После остывания добавляли разбавленную соляную кислоту. Смесь экстрагировали диэтиловым эфиром и растворитель удаляли. К остатку добавляли 30 мл этанола и 3,0 мл концентрированной серной кислоты с последующим кипячением с обратным холодильником в течение одного часа. После остывания растворитель удаляли. Добавляли диэтиловый эфир и водный раствор карбоната калия с последующим экстрагированием диэтиловым эфиром. Органическую фазу промывали насыщенным раствором соли и растворитель удаляли с получением 204 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,43 (3Н, м), 4,40-4,45 (4Н, м), 7,20-7,38 (6Н, м), 7,67 (1Н, д, J=8 Гц), 8,05-8,08 (1Н, м), 8,79 (1Н, с).
d) 2-Бензил-7-этоксикарбонил-3-хинолилтрифторметансульфонат
204 мг 2-бензил-7-этоксикарбонил-3-гидроксихинолина, 285 мг N-фенилтрифторметансульфонимида, 134 мкл триэтиламина, 24 мг 4-диметиламинопиридина и 20 мл дихлорметана смешивали с последующим перемешиванием при комнатной температуре в течение 2 часов. После удаления растворителя остаток подвергали колоночной хроматографии на силикагеле и элюировали гексаном/этилацетатом (10:1) и затем гексаном/этилацетатом (5:1) с получением 220 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,46 (3Н, м), 4,44-4,50 (4Н, м), 7,21-7,34 (5Н, м), 7,87 (1Н, д, J=8 Гц), 8,08 (1Н, с), 8,19-8,22 (1Н, м), 8,84 (1Н, д, J=1 Гц).
e) 3-(2-Бензил-7-этоксикарбонил-3-хинолил)этинил-3-хинуклидинол
Смесь 220 мг 2-бензил-7-этоксикарбонил-3-хинолилтрифторметансульфоната, 83 мг 3-этинил-3-хинуклидинола, 116 мг тетракис(трифенилфосфин)палладия (0), 19 мг йодида меди, 209 мкл триэтиламина и 5,0 мл N,N-диметилформамида перемешивали при комнатной температуре в течение 45 минут в атмосфере азота. Реакционный раствор выливали в разбавленный водный раствор аммиака с последующим экстрагированием этилацетатом. Затем органическую фазу промывали насыщенным раствором соли и растворитель удаляли. Остаток подвергали колоночной хроматографии на NH-силикагеле (Fuji Silicia) и элюировали гексаном/этилацетатом (1:1), а затем этилацетатом/метанолом (15:1) с получением 220 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,41-1,68 (5Н, м), 1,81-1,88 (1Н, м), 2,01-2,09 (2Н, м), 2,73-2,92 (4Н, м), 3,02-3,06 (1Н, м), 3,19-3,24 (1H, м), 4,46 (2Н, кв), 4,54 (2Н, с), 7,20-7,58 (5Н, м), 7,80 (1H, д, J=8 Гц), 8,21-8,49 (1H, м), 8,23 (1H, с), 8,79-8,81 (1H, м).
Пример 211: 3-[4-Бензил-2-(3,4-метилендиоксифенил)-5-тиазолил)этинил-3-хинуклидинол
а) Бензилхлорметилкетон
100 мл Безводного диэтилового эфира добавляли к 12,4 г магния (используемого для получения реактива Гриньяра), затем по каплям добавляли смесь 45 мл бензилбромида и 50 мл безводного эфира, используя капельную воронку, в течение 30 минут в атмосфере азота таким образом, что раствор слабо дефлегмировал. Раствор бензилмагнийбромида в диэтиловом эфире по каплям добавляли к смеси 40 мл хлорацетилхлорида, 778 мг йодида меди и 100 мл тетрагидрофурана, используя капельную воронку, в течение 2 часов в атмосфере азота, так чтобы температура системы сохранялась на уровне -60°С. После того как добавление завершалось, смесь дополнительно перемешивали в течение 2,5 часов. Затем добавляли насыщенный водный раствор аммиака и смесь экстрагировали этилацетатом. Далее органическую фазу промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле, используя 1-3% этилацетат/гексан в качестве элюента, для разделения и очистки с получением 20,4 г целевого соединения.
1H-ЯМР (CDCl3) δ: 3,89 (2Н, с), 4,12 (2Н, с), 7,22-7,38 (5Н, м).
b) 3,4-Метилендиокситиобензамид
882 мг 3,4-Метилендиоксибензоилхлорида растворяли в 20 мл ацетона, к которому затем добавляли 1 мл 36% водного раствора аммиака и смесь перемешивали при комнатной температуре в течение 20 минут. Затем добавляли воду и смесь экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Полученный остаток растворяли в 20 мл тетрагидрофурана, затем добавляли 1,9 г реактива Лоуссона и смесь кипятили с обратным холодильником в течение 3 часов. После остывания растворитель удаляли и остаток подвергали колоночной хроматографии на силикагеле, используя 25% этилацетат/гексан в качестве элюента, для разделения и очистки с получением 637 мг целевого соединения.
c) 4-Бензил-2-(3,4-метилендиоксифенил)тиазол
Смесь 372 мг 3,4-метилендиокситиобензамида и 343 мг бензилхлорметилкетона растворяли в 20 мл этанола с последующим кипячением с обратным холодильником в течение 3 часов. После остывания растворитель удаляли и полученные кристаллы отфильтровывали с получением 367 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 4,53 (2Н, с), 6,11 (2Н, с), 6,73 (1Н, с), 6,99 (1Н, д, J=8,2 Гц), 7,27-7,40 (5Н, м), 7,80 (1Н, д, J=1,9 Гц), 8,03 (1Н, дд, J=1,9, 8,2 Гц).
d) 4-Бензил-5-бром-2-(3,4-метилендиоксифенил)тиазол
367 мг 4-бензил-2-(3,4-метилендиоксифенил)тиазол растворяли в 2 мл N,N-диметилформамида. Добавляли 244 мг N-бромсукцинимида при охлаждении льдом с последующим перемешиванием в течение ночи. Затем к реакционному раствору добавляли этилацетат с последующим промыванием водой. Органическую фазу промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле, используя 3% этилацетат/гексан в качестве элюента, для разделения и очистки с получением 377 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 4,12 (2Н, с), 6,01 (2Н, с), 6,82 (1Н, д, J=8,1 Гц), 7,19-7,37 (7Н, м).
е) 3-[4-Бензил-2-(3,4-метилендиоксифенил)-5-тиазолил]-этинил-3-хинуклидинол
5 мл N,N-диметилформамида добавляли к смеси 377 мг 4-бензил-5-бром-2-(3,4-метилендиоксифенил)тиазола, 178 мг 3-этинил-3-хинуклидинола, 68 мг тетракис(трифенилфосфин)палладия (0), 18 мг йодида меди и 0,5 мл триэтиламина с последующим нагреванием при перемешивании при 100°С на масляной бане в течение 15 минут в атмосфере азота. После остывания добавляли этилацетат и водный раствор аммиака и смесь экстрагировали этилацетатом. Органическую фазу промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. Полученные кристаллы отфильтровывали с получением 253 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 1,38-1,48 (1Н, м), 1,59-1,69 (1H, м), 1,85-1,98 (1H, м), 2,00-2,12 (2Н, м), 2,77-2,98 (4Н, м), 3,03 (1H, д, J=14 Гц), 3,25 (1H, дд, J=1,9, 14 Гц), 4,18 (2Н, с), 6,01 (2Н, с), 6,81 (1H, д, J=8,0 Гц), 7,19-7,40 (7Н, м).
Пример 212: 3-[4-Бензил-2-(2-пиридил)-5-тиазолил]этинил-3-хинуклидинол
а) 4-Бензил-2-(2-пиридил)тиазол
532 мг 2-Цианопиридина растворяли в 2 мл 1,3-диметил-2-имидазолидинона. Добавляли смесь 474 мг метоксида натрия, 2,2 мл бис(триметилсилил)сульфида и 4 мл 1,3-диметил-2-имидазолидинона с последующим нагреванием при перемешивании при 40°С на масляной бане в течение ночи. После остывания добавляли воду и смесь экстрагировали эфиром. Далее органическую фазу промывали насыщенным раствором соли, сушили над безводным сульфатом магния и растворитель удаляли. К полученному остатку добавляли 560 мг бензилхлорметилкетона (пример 211а) и 20 мл этанола с последующим кипячением с обратным холодильником в течение 5 часов. После остывания растворитель удаляли и остаток подвергали колоночной хроматографии на силикагеле, используя 11% этилацетат/гексан в качестве элюента, для разделения и очистки с получением 302 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 4,21 (2Н, с), 6,89 (1Н, с), 7,21-7,38 (6Н, м), 7,78 (1Н, дд, J=7,7, 9,3 Гц), 8,18 (1Н, д, J=7,7 Гц), 8,60 (1H, д, J=4,9 Гц).
b) 3-[4-Бензил-2-(2-пиридил)-5-тиазолил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 211.
1H-ЯМР (CDCl3) δ: 1,40-1,50 (1H, м), 1,62-1,72 (1H, м), 1,85-1,95 (1H, м), 2,02-2,10 (2Н, м), 2,78-2,95 (4Н, м), 3,04 (1H, д, J=14 Гц), 3,26 (1H, дд, J=2,0, 14 Гц), 4,24 (2Н, с), 7,20-7,35 (6Н, м), 7,76 (1H, дд, J=7,7, 9,3 Гц), 8,14 (1H, д, J=7,7 Гц), 8,57 (1H, д, J=4,0 Гц)
Пример 213: 3-[4-Бензил-2-(4-пиридил)-5-тиазолил]этинил-3-хинуклидинол
а) 4-Бензил-2-(4-пиридил)тиазол
1 г 4-Цианопиридина и 2 мл триэтиламина растворяли в 20 мл пиридина. Газообразный сероводород пропускали через раствор в течение 30 минут, причем реакционный раствор перемешивали при нагревании при 50°С на масляной бане. После остывания газообразный сероводород в системе заменяли газообразным азотом и растворитель удаляли. К полученному остатку добавляли 619 мг бензилхлорметилкетона (пример 211а) и 20 мл этанола с последующим кипячением с обратным холодильником в течение 3 часов. После остывания растворитель удаляли и остаток подвергали колоночной хроматографии на силикагеле, используя 20% этилацетат/гексан в качестве элюента, для разделения и очистки с получением 215 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 4,21 (2Н, с), 6,91 (1Н, с), 7,22-7,40 (5Н, м), 7,80 (2Н, дд, J=4,6 Гц, 1,6 Гц), 8,69 (2Н, дд, J=4,6 Гц, 1,6 Гц).
b) 3-[4-Бензил-2-(4-пиридил)-5-тиазолил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 211.
1H-ЯМР (CDCl3) δ: 1,40-1,50 (1H, м), 1,62-1,72 (1Н, м), 1,82-1,92 (1H, м), 2,00-2,10 (2Н, м), 2,78-2,95 (4Н, м), 3,06 (1H, д, J=14 Гц), 3,26 (1H, дд, J=14 Гц, 2,0 Гц), 4,23 (2Н, с), 7,20-7,35 (5Н, м), 7,71 (2Н, дд, J=1,6, 4,4 Гц), 8,66 (2Н, дд, J=1,6, 4,4 Гц).
Пример 214: 3-[4-Бензил-2-(3-пиридил)-5-тиазолил]этинил-3-хинуклидинол
a) 2-Амино-4-бензилтиазол
5,0 г бензилхлорметилкетона (пример 211а) растворяли в 20 мл этанола и добавляли 2,3 г тиомочевины с последующим кипячением с обратным холодильником в течение 3 часов. После остывания растворитель удаляли и остаток подвергали колоночной хроматографии на силикагеле, используя 50% этилацетат/гексан и этилацетат в качестве элюента, для разделения и очистки с получением 1,7 г целевого соединения.
1H-ЯМР (CDCl3) δ: 3,86 (2Н, с), 5,06 (2Н, шир.с), 6,01 (1Н, с), 7,21-7,32 (5Н, м).
b) 4-Бензил-2-йодтиазола
Смесь 504 мг 2-амино-4-бензилтиазола, 520 мг йодида меди, 1,1 мл дийодметана и 1,1 мл изоамилнитрита суспендировали в 10 мл тетрагидрофурана с последующим нагреванием при перемешивании на масляной бане при 80°С в течение одного часа в атмосфере азота. После остывания нерастворимые вещества отфильтровывали через целит. Фильтрат промывали тетрагидрофураном и растворитель удаляли. Полученный остаток подвергали колоночной хроматографии на силикагеле, используя 2-4% этилацетат/гексан в качестве элюента, для разделения и очистки с получением 468 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 4,15 (2Н, с), 6,73 (1Н, с), 7,24-7,35 (5Н, м).
c) 4-бензил-2-(3-пиридил)тиазол
5 мл Ксилола добавляли к смеси 468 мг 4-бензил-2-йодтиазола, 580 мг (3-пиридил)трибутилолова и 90 мг тетракис(трифенилфосфин)палладия (0) с последующим нагреванием при перемешивании на масляной бане при 150°С в течение 2,5 часов. После остывания нерастворимые вещества отфильтровывали через целит и растворитель удаляли. Остаток подвергали колоночной хроматографии на силикагеле, используя 20-25% этилацетат/гексан в качестве элюента, для разделения и очистки с получением 101 мг целевого соединения.
1H-ЯМР (CDCl3) δ: 4,21 (2Н, с), 6,84 (1Н, с), 7,33-7,40 (6Н, м), 8,24 (1Н, дд, J=1,7, 8,1 Гц), 8,64 (1H, дд, J=1,7, 4,9 Гц), 9,15 (1Н, с).
d) 3-[4-Бензил-2-(3-пиридил)-5-тиазолил]этинил-3-хинуклидинол
Целевое соединение синтезировали так же, как и в примере 211.
1H-ЯМР (CDCl3) δ: 1,48-1,58 (1Н, м), 1,60-1,70 (1H, м), 1,85-1,95 (1H, м), 2,03-2,12 (2Н, м), 2,75-2,98 (4Н, м), 3,06 (1H, д, J=14 Гц), 3,27 (1H, дд, J=2,0, 14 Гц), 4,20 (2Н, с), 7,19-7,38 (6Н, м), 8,12 (1H, дд, J=1,7, 8,0 Гц), 8,61 (1H, дд, J=1,7, 4,8 Гц), 9,06 (1H, с).
Структурные формулы по примерам приведены в табл.5-10.
Таблица 5
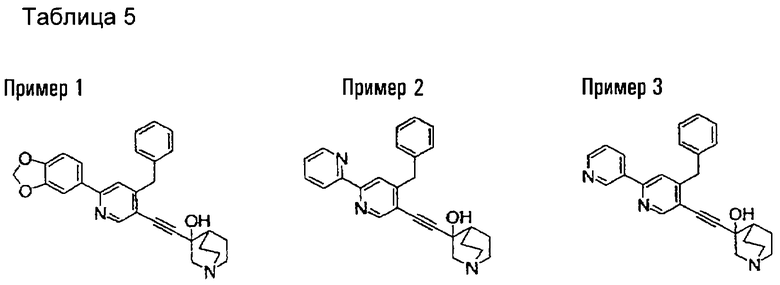
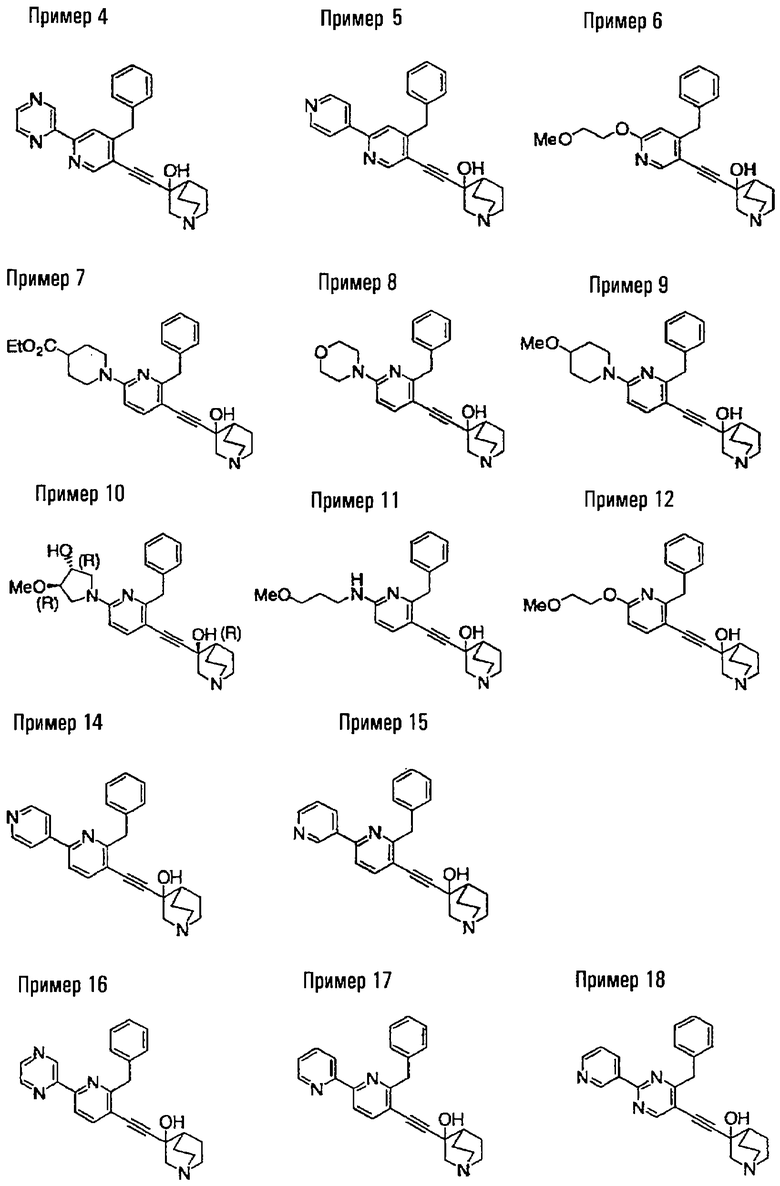
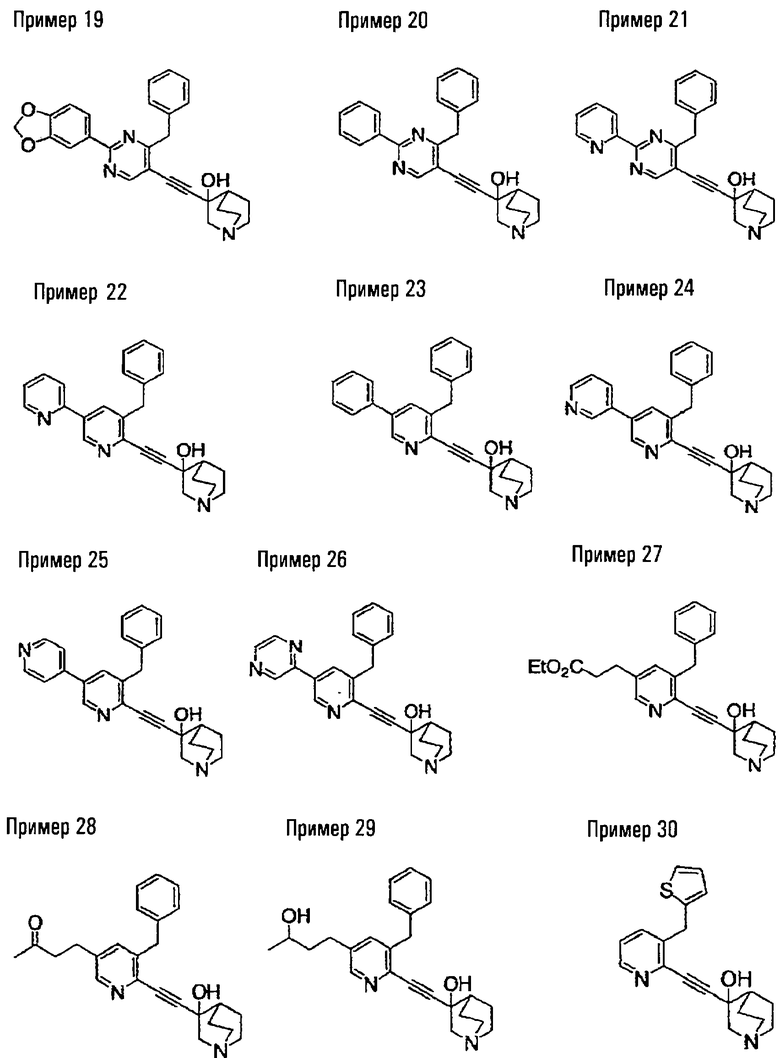
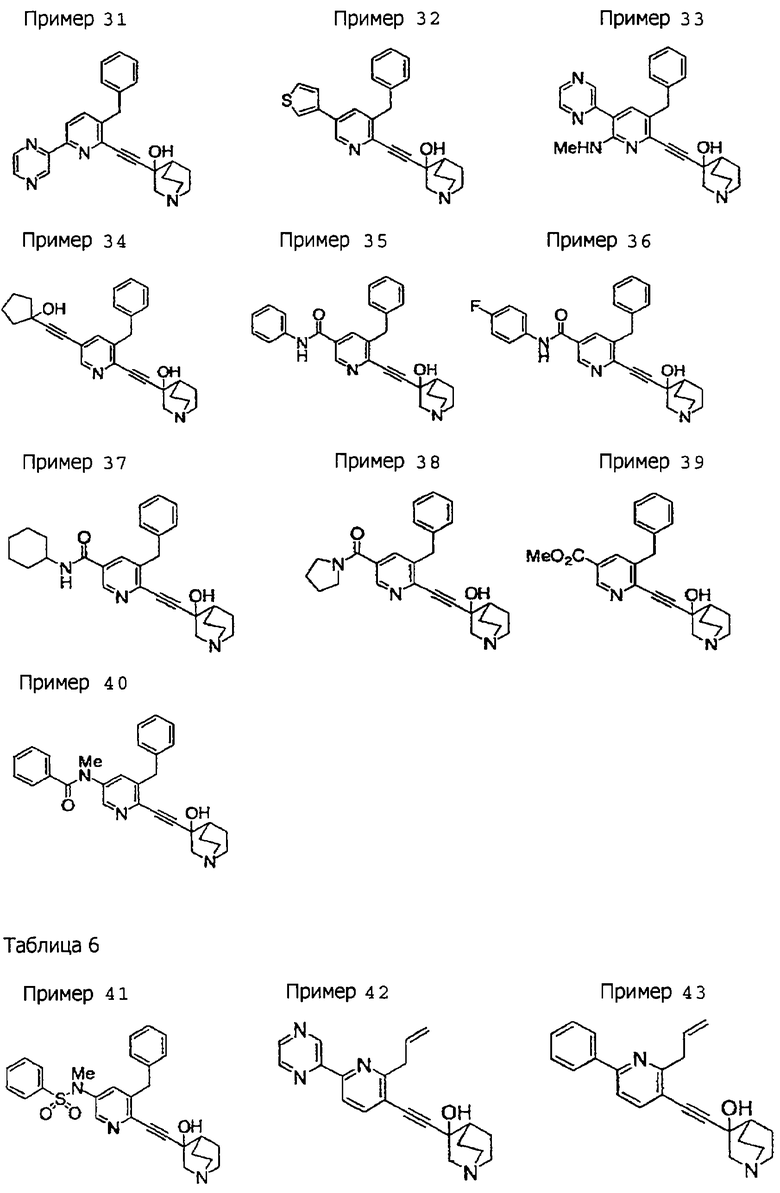
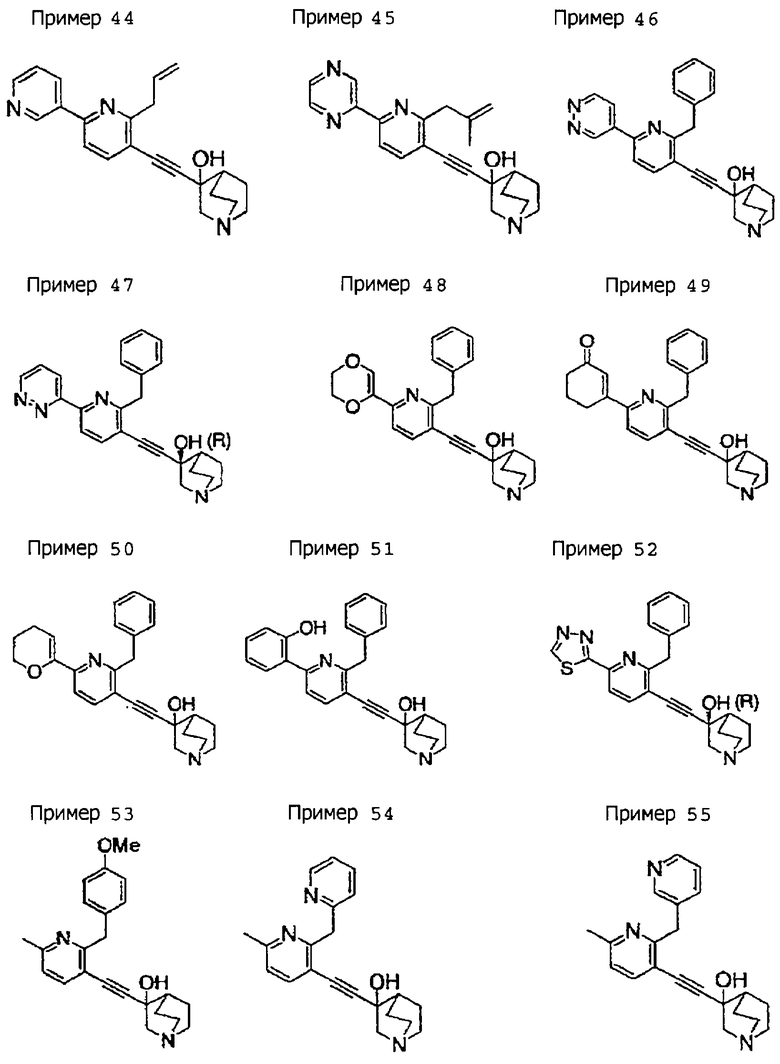
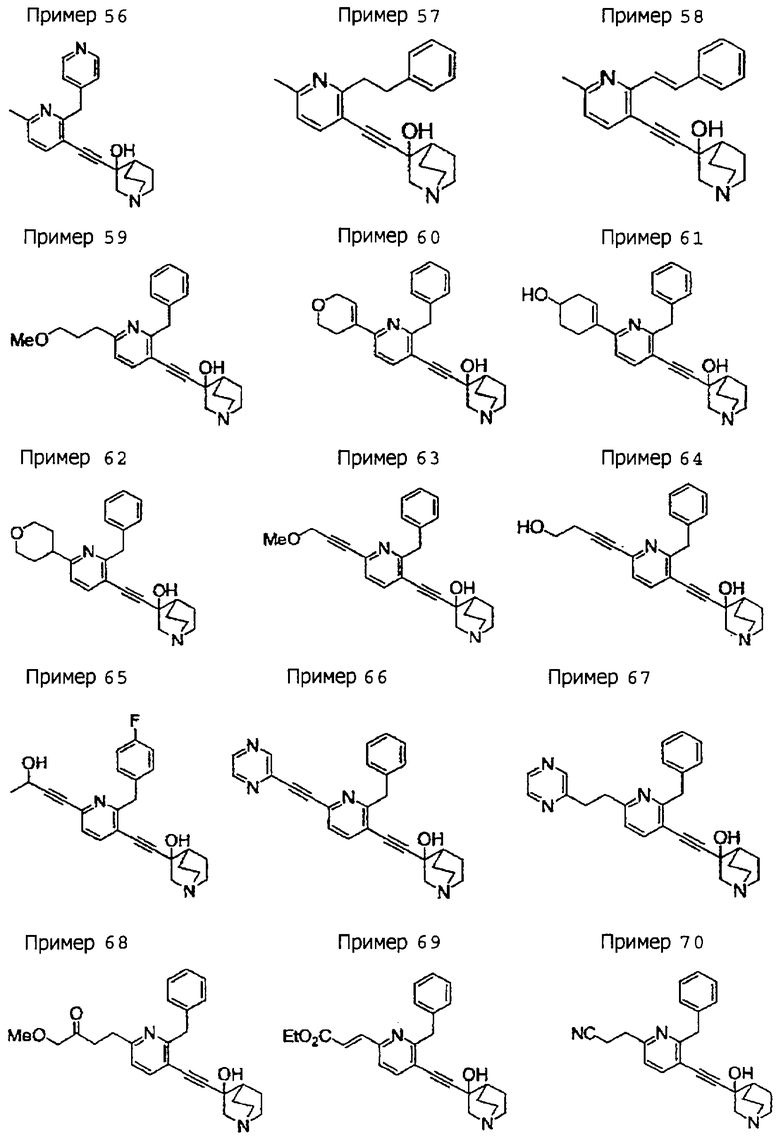
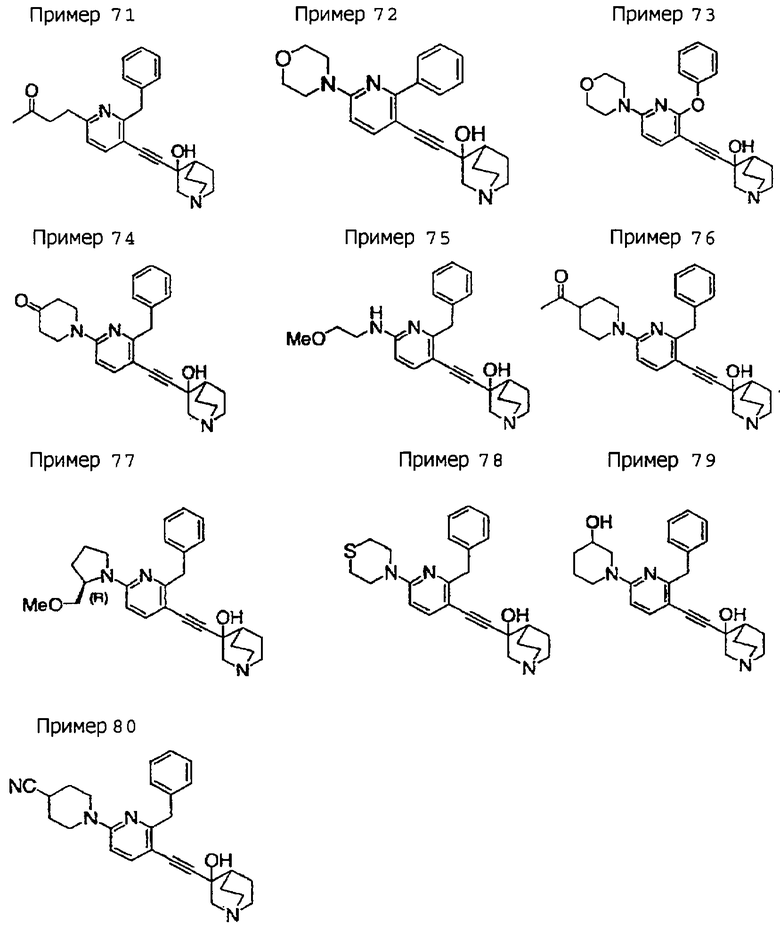
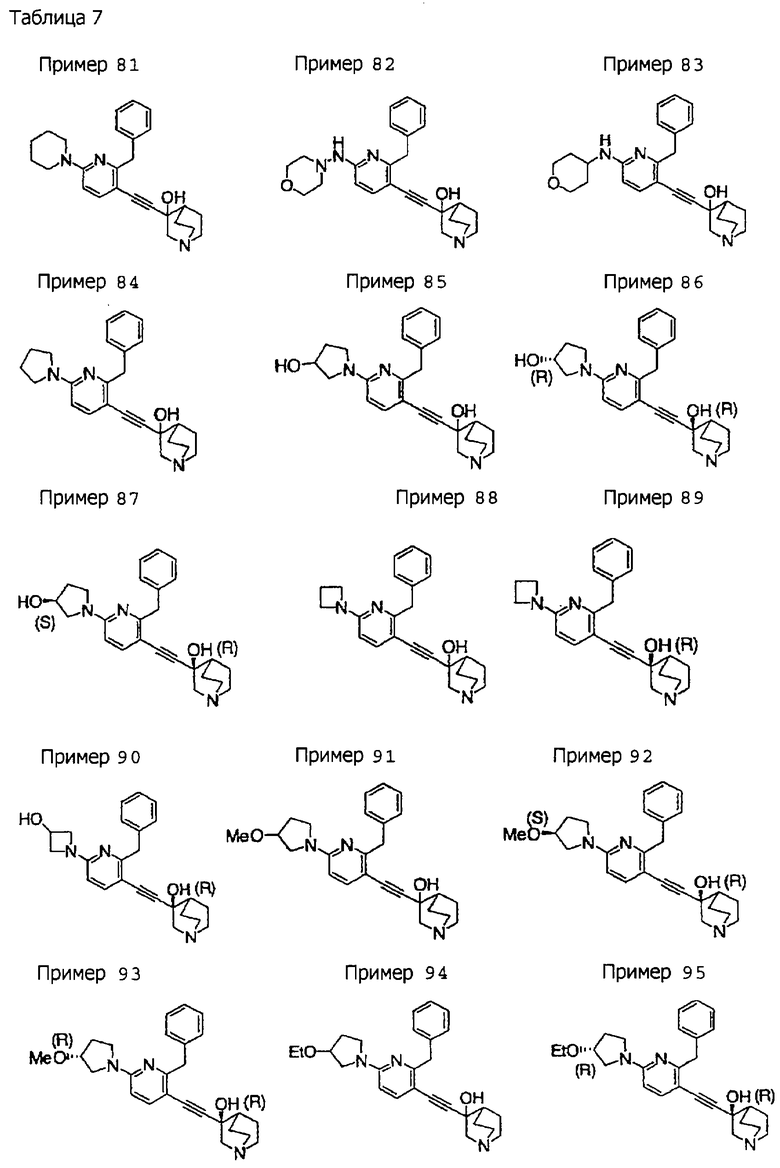
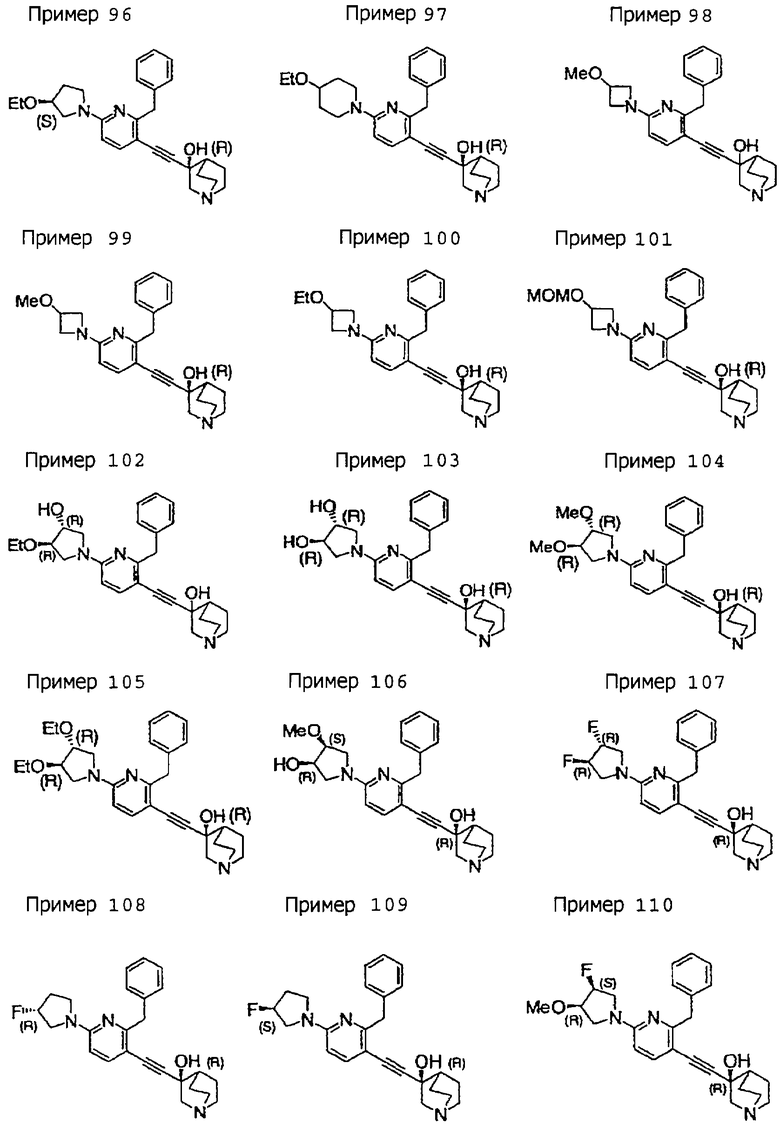
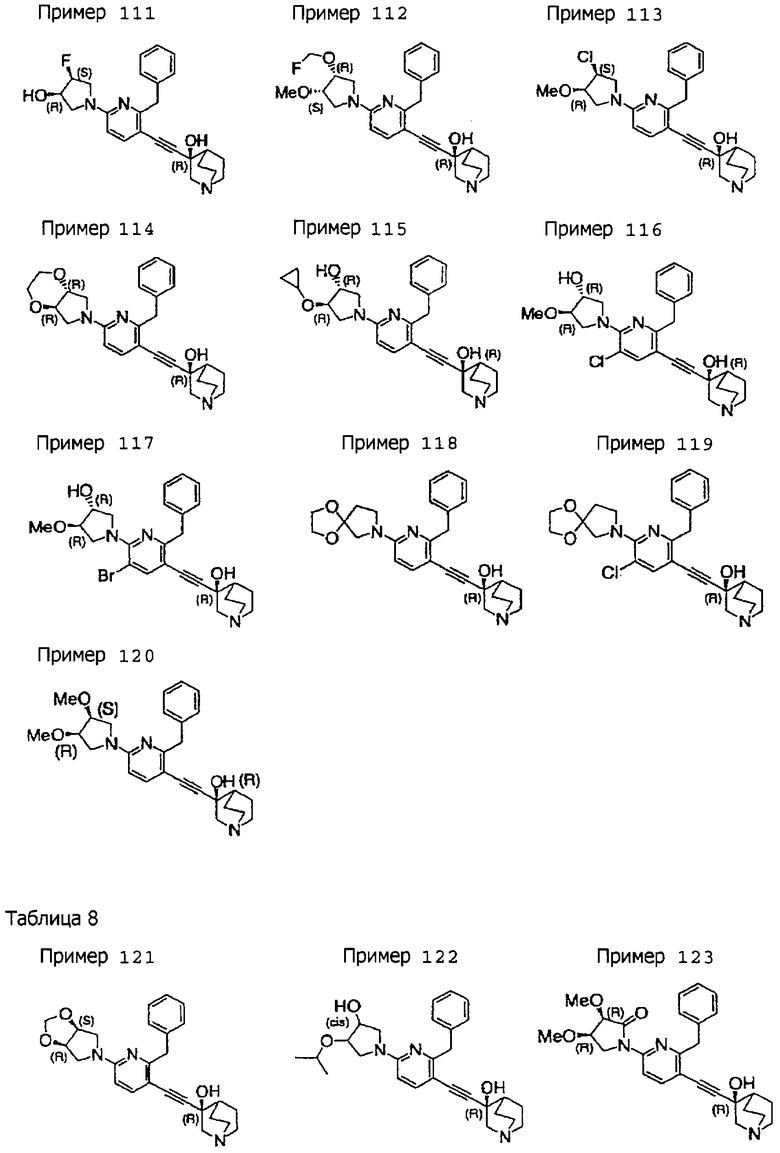
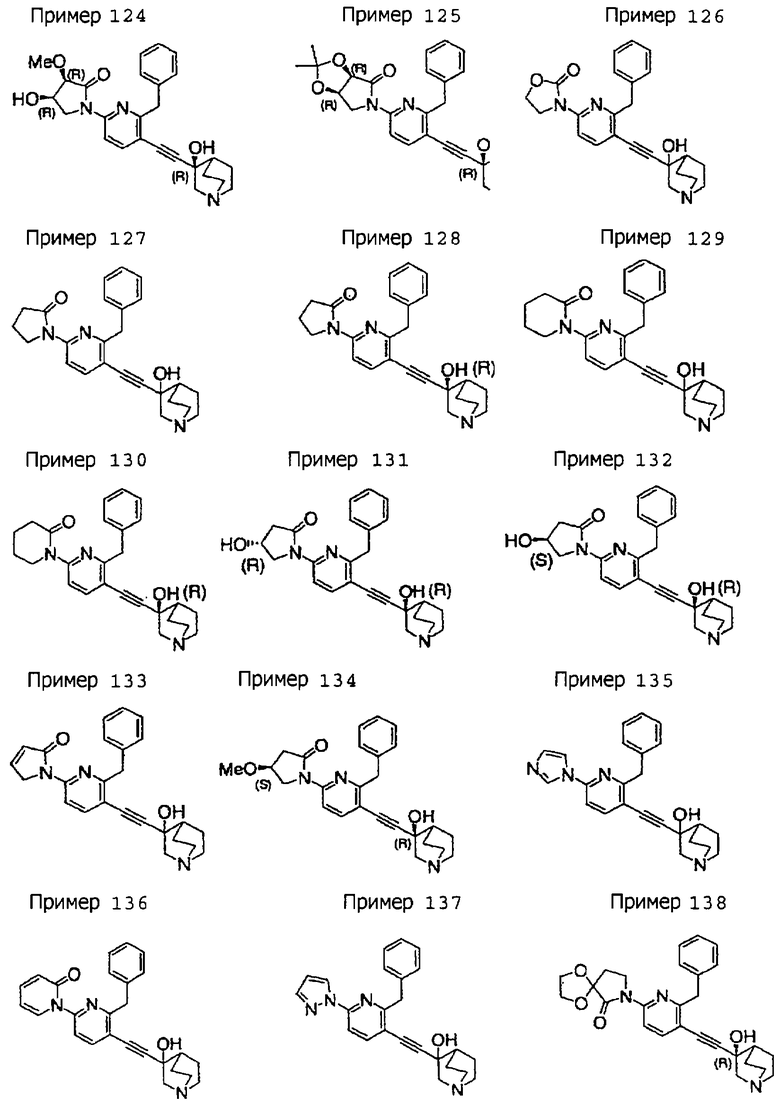
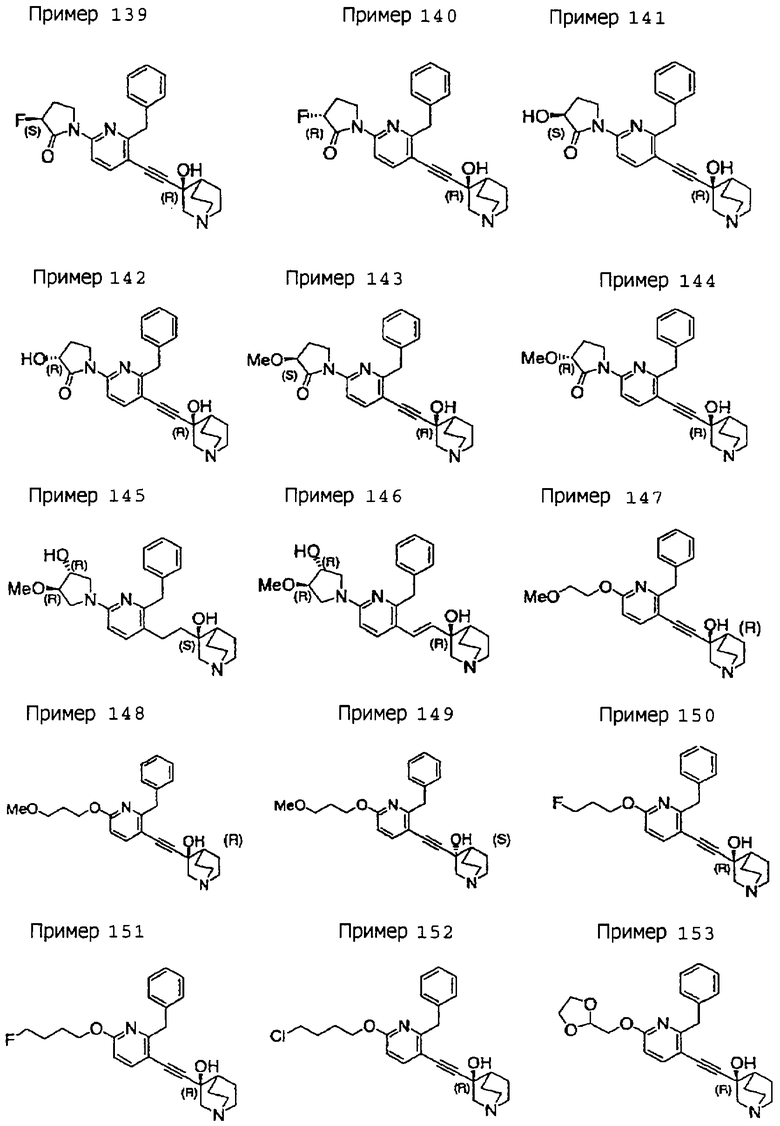
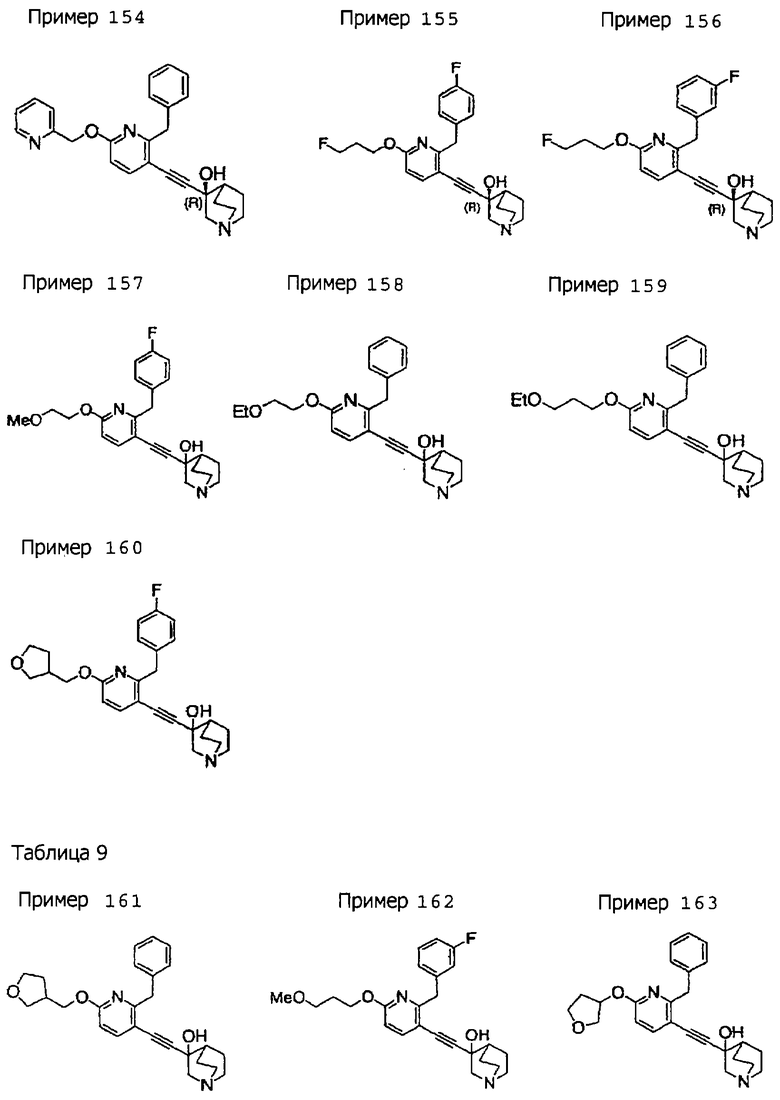
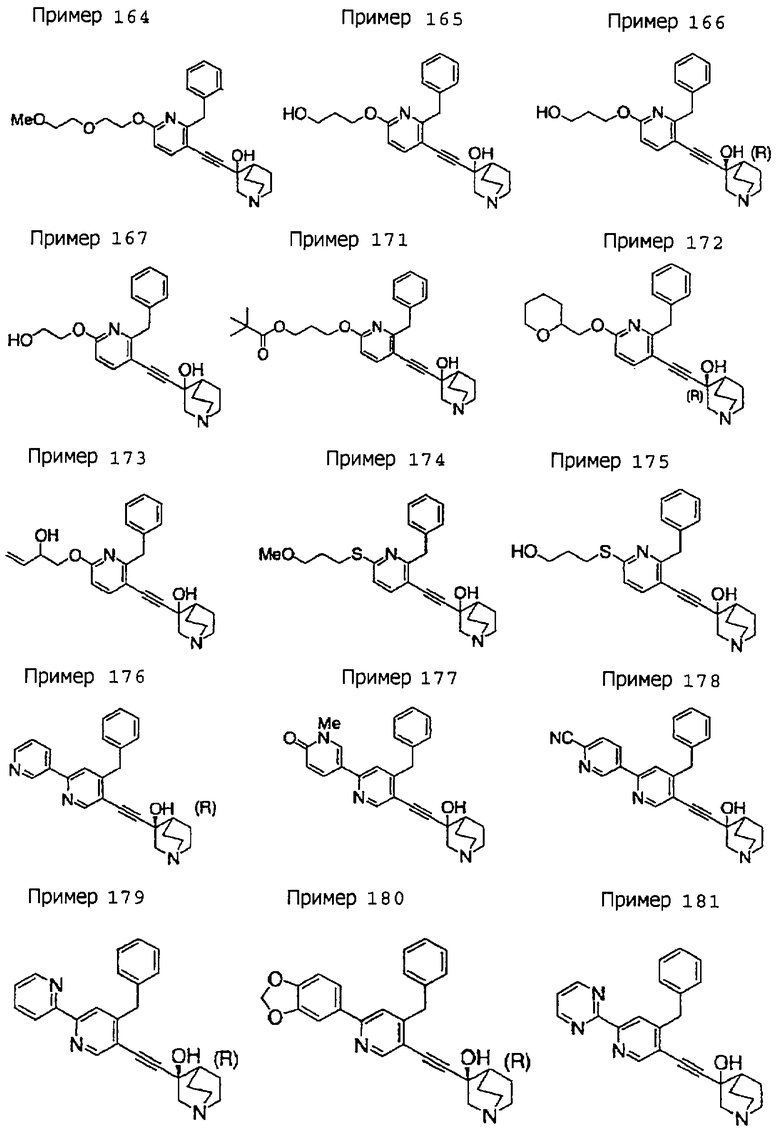
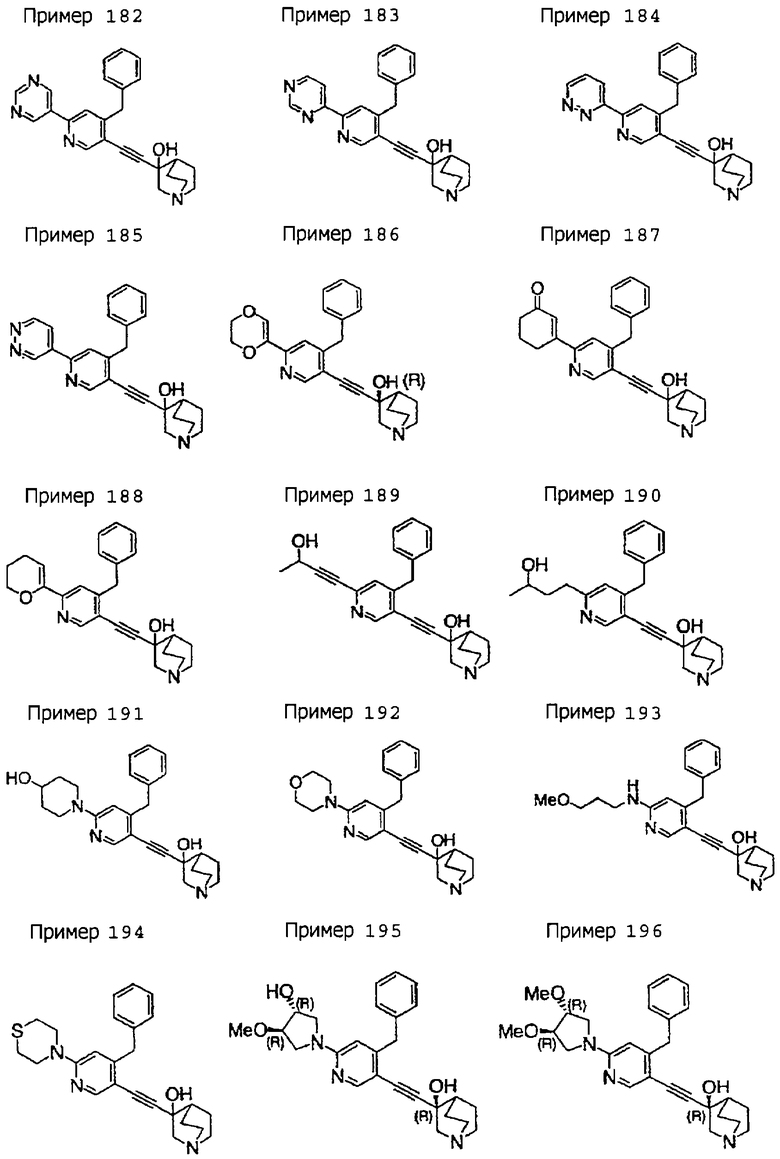
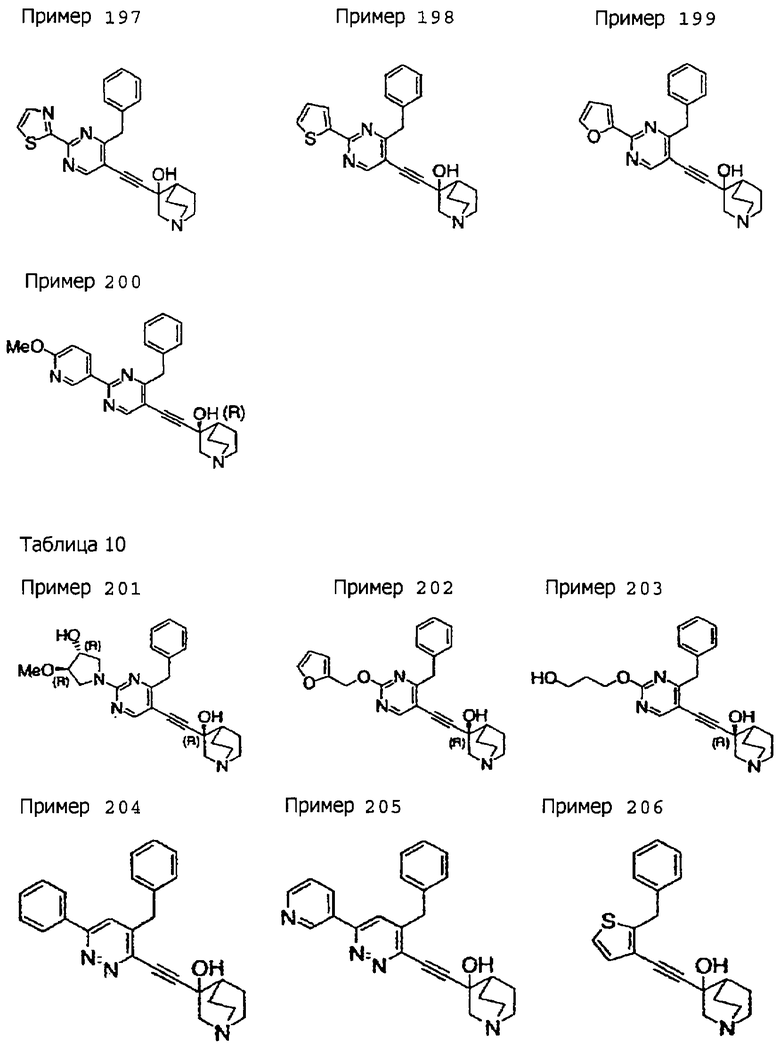
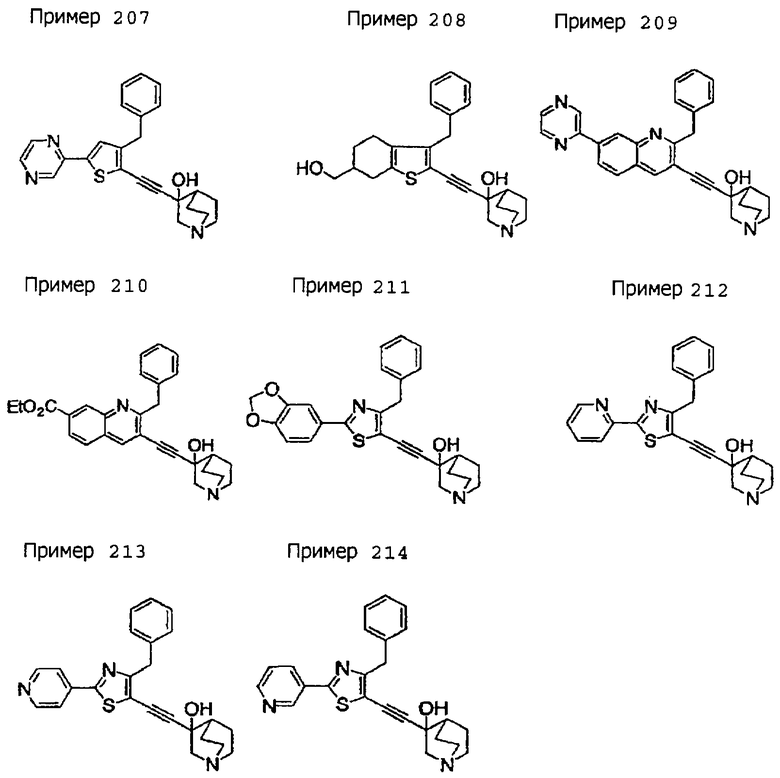
| название | год | авторы | номер документа |
|---|---|---|---|
| СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ПРЕДОТВРАЩЕНИЯ ГИБЕЛИ НЕРВНЫХ КЛЕТОК, СПОСОБ ПРОФИЛАКТИКИ | 2001 |
|
RU2230060C2 |
| ПИПЕРИДИНОВОЕ СОЕДИНЕНИЕ, СПОСОБ ЕГО ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ИНГИБИРОВАНИЯ НАТРИЕВЫХ КАНАЛОВ И КАЛИЕВЫХ КАНАЛОВ | 2001 |
|
RU2259365C2 |
| ТРИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ БЕНЗОПИРАНА В КАЧЕСТВЕ ПРОТИВОАРИТМИЧЕСКИХ АГЕНТОВ | 2005 |
|
RU2380370C2 |
| АЗОЛЬНЫЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ПРОТИВОГРИБКОВАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ ГРИБКОВОЙ ИНФЕКЦИИ | 1998 |
|
RU2189982C2 |
| ПРОИЗВОДНЫЕ АРОИЛПИПЕРАЗИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ЛЕЧЕНИЯ | 1998 |
|
RU2258702C2 |
| ПИРАЗОЛЬНОЕ СОЕДИНЕНИЕ И ЕГО ПРИМЕНЕНИЕ В ФАРМАЦЕВТИКЕ | 2012 |
|
RU2617678C2 |
| ПРОИЗВОДНЫЕ ПИРИДОПИРИМИДИНОНА И ИХ ИСПОЛЬЗОВАНИЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ РЕЦЕПТОРА АРОМАТИЧЕСКИХ УГЛЕВОДОРОДОВ | 2021 |
|
RU2818954C1 |
| СОЕДИНЕНИЯ 1,2-ДИГИДРОПИРИДИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ИСПОЛЬЗОВАНИЕ | 2001 |
|
RU2265015C2 |
| НОВОЕ СОЕДИНЕНИЕ БИФЕНИЛА ИЛИ ЕГО СОЛЬ | 2016 |
|
RU2726622C2 |
| АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 1996 |
|
RU2198878C2 |
Изобретение относится к хинуклидиновым соединениям формулы (I), его солям или их гидратам
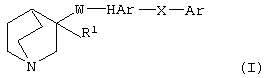
в которой R1 представляет гидроксильную группу; W представляет (1) -СН2-СН2-, 2) -СН=СН-, или (3) -С≡С-; HAr представляет 5-10-членный ароматический гетероцикл, который имеет 1-2 гетероатома, выбранных из атома азота и атома серы, который дополнительно к группе -Х-Ar может быть замещен 1-3 группами, выбранными из (1) атома галогена; (2) C1-6алкильной, C2-6алкенильной или C2-6 алкинильной группы, необязательно замещенной (а) гидрокси; (b) C1-6 алкоксикарбонилом; (с) C1-6 алканоилом, необязательно замещенным C1-6 алкокси; (d) гидроксилированным C3-8 циклоалкилом; (е) C1-6 алкокси; (f) 5-6-членным ароматическим гетероциклом, который имеет 1-3 гетероатома, выбранных из атома азота, атома серы и атома кислорода, или (g) циано, (3) C1-6 алкокси, необязательно замещенного (а) гидрокси; (b) C1-6 алкокси, необязательно замещенным C1-6 алкокси; (с) атомом галогена; (d) 4-6-членным неароматическим гетероциклом, который имеет 1-3 гетероатома, выбранных из атома азота, атома серы и атома кислорода; (е) 5-6-членным ароматическим гетероциклом, который имеет 1-3 гетероатома, выбранных из атома азота, атома серы и атома кислорода, (4) C1-6 алкилтиогруппы, необязательно замещенной C1-6 алкокси или гидрокси, (5) 5-6-членной гетероциклилоксигруппы, которая имеет 1-2 атома кислорода в гетероцикле, (6) аминогруппы, представленной формулой -N(R3)R4, где R3 и R4 являются одинаковыми или различными, и каждый представляет атом водорода или группу, выбранную из (а) C1-6алкильной группы, (b) C1-6 алкокси-C1-6алкильной группы, (с) карбонила, замещенного C6-14 арилом, (d) C6-14 арилсульфонила или (е) 4-6-членного неароматического гетероцикла, который имеет 1-3 гетероатома, выбранных из атома азота, атома серы и атома кислорода, (7) C3-8 циклоалкильной или циклоалкенильной углеводородной группы, необязательно замещенной (а) оксогруппой или (b) гидрокси, (8) C6-14 ароматического углеводородного кольца, необязательно замещенного (a) C1-4 алкилендиокси или (b) гидрокси, (9) 5-6-членного ароматического гетероцикла, который имеет 1-3 гетероатома, выбранных из атома азота, атома серы и атома кислорода, необязательно замещенного (а) циано или (b) C1-6 алкокси, (10) 4-6-членного неароматического гетероцикла, который имеет 1-3 гетероатома, выбранных из атома азота, атома серы и атома кислорода, необязательно замещенного одной или несколькими группами, выбранными из (а) гидрокси; (b) атома галогена; (с) циано; (d) C1-6 алкоксикарбонила; (е) C1-6 алкила; (f) C1-6 алкокси, который необязательно замещен атомом галогена или C1-6 алкокси; (g) C1-6 алканоила; (h) C1-6 алкокси-C1-6 алкила; (i) оксогруппы; (j) C1-4 алкилендиокси; (k) C3-8 циклоалкилалкокси или C3-8 циклоалкенилалкокси; (11) карбамоила формулы -CO-N(R5)R6, где R5 и R6 могут быть одинаковыми или различными и представляют атом водорода, C6-14арил, где указанный арил необязательно замещен атомом галогена, или C3-8 циклоалкил, или R5 и R6 вместе образуют 3-6-членное кольцо, и (12) карбонила, необязательно замещенного C1-6 алкокси, Х представляет (1) одинарную связь; (2) C1-6 алкиленовую цепь; (3) C1-6 алкениленовую цепь; (4) C1-6 алкиниленовую цепь; или (5) формулу -Q-, где Q представляет атом кислорода или атом серы, и Ar представляет (1) C6-14 ароматическое углеводородное кольцо, необязательно замещенное одной или несколькими группами, выбранными из (а) атома галогена, (b) C1-4 алкокси или (с) C1-6 алкилтиогруппы, или (2) 5-6-членный ароматический гетероцикл, который имеет 1-2 гетероатома, выбранных из атома азота и атома серы. Соединения формулы (I) обладают подавляющей активностью в отношении синтезирующего сквален фермента. Объектами изобретения также являются ингибитор синтезирующего сквален фермента и соответствующая лекарственная композиция на основе соединений изобретения, способ профилактики и лечения заболевания, при котором эффективно подавление синтезирующего сквален фермента. Кроме того, предложен ряд способов получения соединений формулы (I). 7 н. и 18 з.п. ф-лы, 10 табл.

в которой R1 представляет гидроксильную группу;
W представляет (1) -СН2-CH2-, (2) -СН=СН-, или (3) -С≡С-;
HAr представляет 5-10-членный ароматический гетероцикл, который имеет 1-2 гетероатома, выбранных из атома азота и атома серы, который дополнительно к группе -Х-Ar может быть замещен 1-3 группами, выбранными из
(1) атома галогена;
(2) C1-6алкильной, C2-6 алкенильной или C2-6 алкинильной группы, необязательно замещенной
(a) гидрокси;
(b) С1-6 алкоксикарбонилом;
(c) С1-6 алканоилом, необязательно замещенным С1-6 алкокси;
(d) гидроксилированным С3-8 циклоалкилом;
(e) С1-6 алкокси;
(f) 5-6-членным ароматическим гетероциклом, который имеет 1-3 гетероатома, выбранных из атома азота, атома серы и атома кислорода, или
(g) циано;
(3) С1-6 алкокси, необязательно замещенного
(a) гидрокси;
(b) С1-6 алкокси, необязательно замещенным С1-6 алкокси;
(c) атомом галогена;
(d) 4-6-членным неароматическим гетероциклом, который имеет 1-3 гетероатома, выбранных из атома азота, атома серы и атома кислорода;
(e) 5-6-членным ароматическим гетероциклом, который имеет 1-3 гетероатома, выбранных из атома азота, атома серы и атома кислорода;
(4) С1-6алкилтиогруппы, необязательно замещенной С1-6 алкокси или гидрокси;
(5) 5-6-членной гетероциклилоксигруппы, которая имеет 1-2 атома кислорода в гетероцикле;
(6) аминогруппы, представленной формулой -N(R3)R4, где
R3 и R4 являются одинаковыми или различными, и каждый представляет атом водорода или группу, выбранную из
(a) С1-6алкильной группы;
(b) С1-6алкокси-С1-6 алкильной группы;
(c) карбонила, замещенного С6-14 арилом;
(d) С6-14 арилсульфонила или
(e) 4-6-членного неароматического гетероцикла, который имеет 1-3 гетероатома, выбранных из атома азота, атома серы и атома кислорода;
(7) С3-8 циклоалкильной или циклоалкенильной углеводородной группы, необязательно замещенной
(a) оксогруппой или
(b) гидрокси;
(8) С6-14 ароматического углеводородного кольца, необязательно замещенного
(a) С1-4 алкилендиокси или
(b) гидрокси;
(9) 5-6-членного ароматического гетероцикла, который имеет 1-3 гетероатома, выбранных из атома азота, атома серы и атома кислорода, необязательно замещенного
(a) циано или
(b) С1-6 алкокси;
(10) 4-6-членного неароматического гетероцикла, который имеет 1-3 гетероатома, выбранных из атома азота, атома серы и атома кислорода, необязательно замещенного одной или несколькими группами, выбранными из
(a) гидрокси;
(b) атома галогена;
(c) циано;
(d) С1-6 алкоксикарбонила;
(e) С1-6 алкила;
(f) С1-6 алкокси, который необязательно замещен атомом галогена или C1-6 алкокси;
(g) С1-6 алканоила;
(h) С1-6 алкокси-С1-6 алкила;
(i) оксогруппы;
(j) С1-4 алкилендиокси;
(k) С3-8 циклоалкилалкокси или С3-8 циклоалкенилалкокси;
(11) карбамоила формулы -CO-N(R5)R6, где R5 и R6 могут быть одинаковыми или различными и представляют атом водорода, С6-14 арил, где указанный арил необязательно замещен атомом галогена, или С3-8 циклоалкил, или R5 и R6 вместе образуют 3-6-членное кольцо, и
(12) карбонила, необязательно замещенного С1-6 алкокси;
Х представляет
(1) одинарную связь;
(2) С1-6 алкиленовую цепь;
(3) С1-6 алкениленовую цепь;
(4) С1-6 алкиниленовую цепь или
(5) формулу -Q-, где Q представляет атом кислорода или атом серы, и Ar представляет
(1) С6-14 ароматическое углеводородное кольцо, необязательно замещенное одной или несколькими группами, выбранными из
(a) атома галогена,
(b) С1-4 алкокси или
(c) С1-6 алкилтиогруппы, или
(2) 5-6-членный ароматический гетероцикл, который имеет 1-2 гетероатома,
выбранных из атома азота и атома серы.
HAr представляет 5-10-членный ароматический гетероцикл, который имеет 1-2 гетероатома, выбранных из атома азота и атома серы, который дополнительно к группе - Х-Ar может быть замещен 1-3 группами, выбранными из
(1) 5-6-членного ароматического гетероцикла, определенного выше;
(2) 5-6-членного неароматического гетероцикла, определенного выше, который может быть замещен одной или более группами, выбранными из
(a) гидрокси;
(b) С1-6 алкила и (f) С1-6 алкокси;
(3) бензольного кольца, которое может быть замещено одной или более группами, выбранными из
(a) гидрокси и
(b) С1-4алкилендиокси.
(1) бензольного кольца, которое может быть замещено С1-4 алкилендиоксигруппой;
(2) пиридинового кольца;
(3) пиримидинового кольца;
(4) пиридазинового кольца;
(5) пиразинового кольца;
(6) тиофенового кольца;
(7) пиперидинового кольца, которое может быть замещено С1-6 алкоксигруппой;
(8) пиперазинового кольца, которое может быть замещено С1-6 алкоксигруппой;
(9) пирролидинового кольца, которое может быть замещено С1-6 алкоксигруппой;
(10) морфолинового кольца;
(11) С1-6 алкильной группы, которая может быть замещена С1-6 алкоксигруппой, и
(12) С1-6 алкоксигруппы, которая может быть замещена гидроксильной группой или С1-6 алкоксигруппой.
(1) 5-6-членного ароматического гетероцикла, определенного выше, который может быть замещен одной или более С1-6 алкоксигруппами;
(2) бензольного кольца, которое может быть замещено С1-4 алкилендиоксигруппой;
(3) С1-6 алкильной группы, которая может быть замещена одной или более группами, выбранными из
(a) гидроксигруппы и
(b) С1-6алкоксигруппы, и
(4) С1-6 алкоксигруппы, которая может быть замещена С1-6 алкоксигруппой.
(a) атома галогена,
(b) С1-4 алкокси или
(c) С1-6 алкилтиогруппы.
(1) бензольное кольцо или пиридиновое кольцо, которые могут иметь 1-3 заместителя, выбранных из
(a) атома галогена и
(b) С1-4 алкоксигруппы.
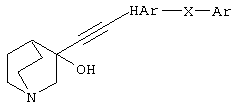
в которой HAr представляет 5-10-членный ароматический гетероцикл, содержащий 1-2 гетероатома, выбранных из атома азота и атома серы, который дополнительно к группе - Х-Ar может быть замещен 1-3 группами, выбранными из
(1) атома галогена,
(2) С1-6алкильной, С2-6 алкенильной или С2-6 алкинильной группы, необязательно замещенной
(a) гидрокси;
(b) С1-6 алкоксикарбонилом;
(c) С1-6 алканоилом, необязательно замещенным С1-6 алкокси;
(d) гидроксилированным С3-8 циклоалкилом;
(e) С1-6 алкокси;
(f) 5-6-членным ароматическим гетероциклом, который имеет 1-3 гетероатома, выбранных из атома азота, атома серы и атома кислорода;
(g) циано;
(3) С1-6 алкокси, необязательно замещенного
(a) гидрокси;
(b) С1-6 алкокси, необязательно замещенным С1-6 алкокси;
(c) атомом галогена;
(d) 4-6-членным неароматическим гетероциклом, который имеет 1-3 атома, выбранных из атома азота, атома серы и атома кислорода;
(e) 5-6-членным ароматическим гетероциклом, который имеет 1-3 атома, выбранных из атома азота, атома серы и атома кислорода;
(4) С1-6алкилтиогруппы, необязательно замещенной С1-6 алкокси или гидрокси;
(5) 5-6-членной гетероциклилоксигруппы, которая имеет 1-2 атома кислорода в гетероцикле;
(6) аминогруппы, представленной формулой -N(R3)R4, где R3 и R4 являются одинаковыми или различными, и каждый представляет атом водорода или группу, выбранную из
(a) С1-6алкильной группы;
(b) С1-6 алкокси-С1-6 алкильной группы;
(c) карбонила, замещенного С6-14 арилом;
(d) С6-14 арилсульфонила или
(e) 4-6-членного неароматического гетероцикла, который имеет 1-3 атома, выбранных из атома азота, атома серы и атома кислорода;
(7) С3-8 циклоалкильной или циклоалкенильной углеводородной группы, необязательно замещенной
(a) оксогруппой или
(b) гидрокси;
(8) С6-14 ароматического углеводородного кольца, необязательно замещенного
(a) С1-4 алкилендиокси или
(b) гидрокси;
(9) 5-6-членного ароматического гетероцикла, который имеет 1-3 гетероатома, выбранных из атома азота, атома серы и атома кислорода, необязательно замещенного
(a) циано или
(b) С1-6 алкокси;
(10) 4-6-членного неароматического гетероцикла, который имеет 1-3 гетероатома, выбранных из атома азота, атома серы и атома кислорода, необязательно замещенного одной или несколькими группами, выбранными из
(a) гидрокси;
(b) атома галогена;
(c) циано;
(d) С1-6 алкоксикарбонила;
(e) С1-6 алкила;
(f) С1-6 алкокси, который необязательно замещен атомом галогена или С1-6 алкокси;
(g) С1-6 алканоила;
(h) С1-6 алкокси-С1-6 алкила;
(i) оксогруппы;
(j) С1-4 алкилендиокси;
(k) С3-8 циклоалкилалкокси или С3-8 циклоалкенилалкокси;
(11) карбамоила формулы -CO-N(R5)R6, где R5 и R6 могут быть одинаковыми или различными и представляют атом водорода, С6-14 арил, где указанный арил необязательно замещен атомом галогена, или С3-8 циклоалкил, или R5 и R6 вместе образуют 3-8-членное кольцо;
(12) карбонила, необязательно замещенного С1-6 алкокси, Х представляет
(1) одинарную связь;
(2) С1-6 алкиленовую цепь;
(3) С1-6 алкениленовую цепь;
(4) С1-6 алкиниленовую цепь или
(5) формулу -Q-, где Q представляет атом кислорода или атом серы, и Ar представляет
(1) С6-14 ароматическое углеводородное кольцо, необязательно замещенное одной или несколькими группами, выбранными из
(a) атома галогена,
(b) С1-4 алкокси или
(c) С1-6 алкилтиогруппы, или
(2) 5-6-членный ароматический гетероцикл, который имеет 1-2 атома, выбранных из атома азота и атома серы.
(1) 5-6-членного ароматического гетероцикла, определенного выше, который может быть замещен одной или более С1-6 алкоксигруппами;
(2) бензольного кольца, которое может быть замещено С1-4 алкилендиоксигруппой;
(3) С1-6алкильной группы, которая может быть замещена одной или более группами, выбранными из
(a) гидрокси и
(b) С1-6 алкоксигруппы, и
(4) С1-6 алкоксигруппы, которая может быть замещена С1-6 алкоксигруппой;
Ar является необязательно галогенированным бензольным кольцом или пиридиновым кольцом и Х представляет -СН2-.
Ar является необязательно галогенированным бензольным кольцом или пиридиновым кольцом и Х представляет -СН2-.
(1) бензольного кольца, которое может быть замещено С1-4 алкилендиоксигруппой;
(2) пиридинового кольца;
(3) пиримидинового кольца;
(4) пиридазинового кольца;
(5) пиразинового кольца;
(6) тиофенового кольца;
(7) пиперидинового кольца, которое может быть замещено С1-6 алкоксигруппой;
(8) пиперазинового кольца, которое может быть замещено С1-6 алкоксигруппой;
(9) пирролидинового кольца, которое может быть замещено С1-6 алкоксигруппой;
(10) морфолинового кольца;
(11) С1-6 алкильной группы, которая может быть замещена С1-6 алкоксигруппой, и
(12) С1-6 алкоксигруппы, которая может быть замещена гидроксигруппой или С1-6 алкоксигруппой;
Ar является бензольным кольцом, которое может быть галогенированным или пиридиновым кольцом, и Х представляет -СН2-.
3-(4-бензил-2-фенил-5-пиримидил)этинил-3-хинуклидинола;
3-[4-бензил-2-(2-пиридил)-5-пиримидил]этинил-3-хинуклидинола;
3-[3-бензил-5-(2-пиридил)-2-пиридил]этинил-3-хинуклидинола;
3-(3-бензил-5-фенил-2-пиридил)этинил-3-хинуклидинола;
3-[3-бензил-5-(3-пиридил)-2-пиридил]этинил-3-хинуклидинола;
3-[3-бензил-5-(4-пиридил)-2-пиридил]этинил-3-хинуклидинола;
3-(3-бензил-5-пиразил-2-пиридил)этинил-3-хинуклидинола;
3-[3-бензил-5-(2-этоксикарбонилэтил)-2-пиридил]этинил-3-хинуклидинола;
3-[3-бензил-5-(3-оксобутил)-2-пиридил]этинил-3-хинуклидинола;
3-[3-бензил-5-(3-гидроксибутил)-2-пиридил]этинил-3-хинуклидинола;
3-[2-бензил-6-(3-метоксипропиламино)-3-пиридил]этинил-3-хинуклидинола;
3-[2-бензил-6-(2-метоксиэтилокси)-3-пиридил]этинил-3-хинуклидинола;
3-[2-бензил-6-(3-метоксипропилокси)-3-пиридил]этинил-3-хинуклидинола;
3-[2-бензил-6-(4-пиридил)-3-пиридил]этинил-3-хинуклидинола;
3-[2-бензил-6-(3-пиридил)-3-пиридил]этинил-3-хинуклидинола;
3-(2-бензил-6-пиразил-3-пиридил)этинил-3-хинуклидинола;
3-[2-бензил-6-(2-пиридил)-3-пиридил]этинил-3-хинуклидинола;
3-[4-бензил-2-(3-пиридил)-5-пиримидил]этинил-3-хинуклидинола;
3-[4-бензил-2-(3,4-метилендиоксифенил)-5-пиримидил]этинил-3-хинуклидинола;
3-[4-бензил-2-(3,4-метилендиоксифенил)-5-пиридил]этинил-3-хинуклидинола;
3-[4-бензил-2-(2-пиридил)-5-пиридил]этинил-3-хинуклидинола;
3-[4-бензил-2-(3-пиридил)-5-пиридил]этинил-3-хинуклидинола;
3-[4-бензил-2-пиразил-5-пиридил]этинил-3-хинуклидинола;
3-[4-бензил-2-(4-пиридил)-5-пиридил]этинил-3-хинуклидинола;
3-[4-бензил-2-(2-метоксиэтокси)-5-пиридил]этинил-3-хинуклидинола;
3-[2-бензил-6-(4-этоксикарбонилпиперидино)-3-пиридил]этинил-3-хинуклидинола;
3-[2-бензил-6-морфолино-3-пиридил]этинил-3-хинуклидинола;
3-[2-бензил-6-(4-метоксипиперидино)-3-пиридил]этинил-3-хинуклидинола;
(3R)-3-[2-бензил-6-(2-метоксиэтил)окси-3-пиридил]этинил-3-хинуклидинола;
(3R)-3-[2-бензил-6-(3-метоксипропил)окси-3-пиридил]этинил-3-хинуклидинола;
(3S)-3-[2-бензил-6-(3-метоксипропил)окси-3-пиридил]этинил-3-хинуклидинола;
(3R)-3-[2-бензил-6-(3-фторпропил)окси-3-пиридил]этинил-3-хинуклидинола;
(3R)-3-[2-бензил-6-(1,3-диоксолан-2-ил)метилокси-3-пиридил]этинил-3-хинуклидинола;
(3R)-3-[2-бензил-6-(3-гидроксипропил)окси-3-пиридил]этинил-3-хинуклидинола;
(3R)-3-[4-бензил-2-(3-пиридил)-5-пиридил]этинил-3-хинуклидинола;
(3R)-3-[4-бензил-2-(2-пиридил)-5-пиридил]этинил-3-хинуклидинола;
(3R)-3-[4-бензил-2-(3,4-метилендиоксифенил)-5-пиридил]этинил-3-хинуклидинола;
(3R)-3-[2-бензил-6-[(3R,4S)-3-гидрокси-4-метоксипирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинола;
(3R)-3-[2-бензил-6-[(3S,4R)-3-фтор-4-метоксипирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинола;
(3R)-3-[2-бензил-6-[(3R,4R)-3-гидрокси-4-метоксипирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинола;
(3R)-3-[2-бензил-6-[(3R,4R)-3,4-диметоксипирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинола;
(3R)-3-[2-бензил-5-хлор-6-[(3R,4R)-3-гидрокси-4-метоксипирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинола;
(3R)-3-[2-бензил-5-бром-6-[(3R,4R)-3-гидрокси-4-метоксипирролидин-1-ил]-3-пиридил]этинил-3-хинуклидинола;
(3R)-3-[2-бензил-6-(3,3-этилендиоксипирролидин-1-ил)-3-пиридил]этинил-3-хинуклидинола;
(3R)-3-[2-бензил-5-хлор-6-(3,3-этилендиоксипирролидин-1-ил)-3-пиридил]этинил-3-хинуклидинола;
(3R)-3-[2-бензил-6-(цис-3,4-диметоксипирролидин-1-ил)-3-пиридил]этинил-3-хинуклидинола;
(3R)-3-[2-бензил-6-(3,3-этилендиокси-2-пирролидинон-1-ил)-3-пиридил]этинил-3-хинуклидинола;
(3R)-3-[2-бензил-6-[(3R)-3-гидрокси-2-пирролидинон-1-ил]-3-пиридил]этинил-3-хинуклидинола;
(3R)-3-[2-бензил-6-[(3R)-3-метокси-2-пирролидинон-1-ил]-3-пиридил]этинил-3-хинуклидинола;
(3R)-3-[4-бензил-2-(1,4-диоксен-2-ил)-5-пиридил]этинил-3-хинуклидинола и
(3R)-3-[4-бензил-2-[(3R,4R)-3-гидрокси-4-метоксипирролидин-1-ил]-5-пиримидил]этинил-3-хинуклидинола.
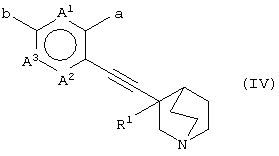
в которой А1 и А3 являются одинаковыми или различными, и каждый обозначает
1) атом углерода, необязательно замещенный заместителем, определенным для группы HAr в п.8, или
2) гетероатом, выбранный из атома азота и атома серы;
А2 обозначает
1) атом углерода, необязательно замещенный заместителем, определенным для группы HAr в п.8,
2) гетероатом, выбранный из атома азота, или
3) одинарную связь;
а и b являются различными и каждый обозначает
1) группу -Х-Ar (в которой Х представляет
(1) одинарную связь;
(2) С1-6 алкиленовую цепь;
(3) С1-6 алкениленовую цепь;
(4) С1-6 алкиниленовую цепь или
(5) формулу -Q-, где Q представляет атом кислорода или атом серы, и Ar представляет
(1) С6-14 ароматическое углеводородное кольцо, необязательно замещенное одной или несколькими группами, выбранными из
(a) атома галогена;
(b) С1-4 алкокси или
(c) С1-6 алкилтиогруппы, или
(2) 5-6-членный ароматический гетероцикл, который имеет 1-2 гетероатома, выбранных из атома азота или атома серы, или
необязательный заместитель, определенный для группы HAr в п.8; и
R1 представляет гидроксильную группу, его соли или их гидратов, который включает стадию взаимодействия ароматического гетероциклического соединения (II), представленного формулой
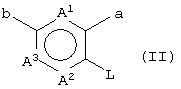
в которой А1, А2, А3, а и b определены выше;
L обозначает удаляемую группу,
и хинуклидинового соединения (III), представленного следующей формулой:
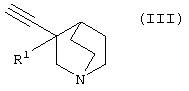
где R1 обозначает гидроксильную группу,
в присутствии Pd катализатора, соли
меди и основания.
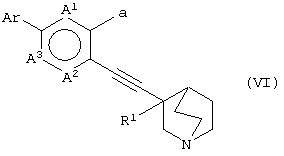
в которой А1, А2, А3, а и R1 имеют те же значения, которые указаны ниже,
Ar представляет С6-14 ароматическое углеводородное кольцо, необязательно замещенное
(a) С1-4 алкилендиокси или
(b) гидрокси, или
5-6-членный ароматический гетероцикл, который имеет 1-3 гетероатома, выбранных из атома азота, атома серы и атома кислорода, и который необязательно замещен
(a) циано или
(b) алкокси,
его соли или их гидратов, который включает стадию взаимодействия хинуклидинового соединения (V), представленного следующей формулой:
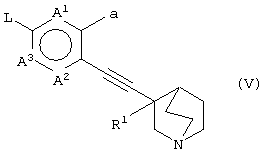
в которой А1 и А3 являются одинаковыми или различными, и каждый обозначает
1) атом углерода, необязательно замещенный заместителем, определенным для группы HAr в п.8, или
2) гетероатом, выбранный из атома азота и атома серы;
А2 обозначает
1) атом углерода, необязательно замещенный заместителем, определенным для группы HAr в п.8,
2) гетероатом, выбранный из атома азота, или
3) одинарную связь;
а обозначает группу -Х-Ar, в которой Х представляет
(1) одинарную связь;
(2) С1-6 алкиленовую цепь;
(3) С1-6 алкениленовую цепь;
(4) С1-6 алкиниленовую цепь или
(5) формулу -Q-, где Q представляет атом кислорода или атом серы, и Ar представляет
(1) С6-14 ароматическое углеводородное кольцо, необязательно замещенное одной или несколькими группами, выбранными из
(a) атома галогена,
(b) С1-4 алкокси или
(c) С1-6 алкилтиогруппы, или
(2) 5-6-членный ароматический гетероцикл, который имеет 1-2 гетероатома, выбранных из атома азота и атома серы, и
R1 представляет гидроксильную группу,
и ароматического циклического соединения, представленного следующей формулой:
Ar-М
в которой Ar обозначает С6-14 ароматическое углеводородное кольцо, необязательно замещенное
(a) С1-4 алкилендиокси или
(b) гидрокси, или
5-6-членный ароматический гетероцикл, который имеет 1-3 гетероатома, выбранных из атома азота, атома серы и атома кислорода, и который необязательно замещен
(a) циано или
(b) С1-6 алкокси, и
М обозначает три-н-бутилолово или дигидроксибор,
в присутствии Pd катализатора.
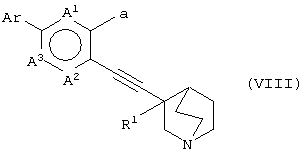
в которой А1, А2, А3, а и R1 имеют те же значения, которые указаны ниже,
Ar представляет С6-14 ароматическое углеводородное кольцо, необязательно замещенное
(a) С1-4 алкилендиокси или
(b) гидрокси,
или 5-6-членный ароматический гетероцикл, который имеет 1-3 гетероатома, выбранных из атома азота, атома серы и атома кислорода, и который необязательно замещен
(a) циано или
(b) алкокси,
его соли или их гидратов, который включает стадию взаимодействия хинуклидинового соединения (VII), представленного следующей формулой:
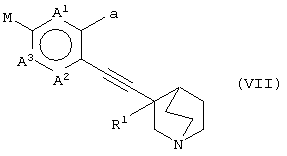
в которой А1 и А3 являются одинаковыми или различными, и каждый обозначает
1) атом углерода, необязательно замещенный заместителем, определенным для группы HAr в п.8,
2) гетероатом, выбранный из атома азота и атома серы, или
3) одинарную связь;
А2 обозначает
1) атом углерода, необязательно замещенный заместителем, определенньм для группы HAr в п.8,
2) гетероатом, выбранный из атома азота, или
3) одинарную связь;
а обозначает
1) группу -Х-Ar, в которой Х представляет
(1) одинарную связь;
(2) С1-6 алкиленовую цепь;
(3) С1-6 алкениленовую цепь;
(4) С1-6 алкиниленовую цепь или
(5) формулу -Q-, где Q представляет атом кислорода или атом серы, и Ar представляет
(1) С6-14 ароматическое углеводородное кольцо, необязательно замещенное одной или несколькими группами, выбранными из
(a) атома галогена,
(b) С1-4 алкокси или
(c) С1-6 алкилтиогруппы, или
(2) 5-6-членный ароматический гетероцикл, который имеет 1-2 атома, выбранных из атома азота или атома серы, и
R1 представляет гидроксильную группу,
М обозначает три-н-бутилолово или дигидроксибор,
и ароматического циклического соединения, представленного следующей формулой:
Ar-L
в которой Ar обозначает С6-14 ароматическое углеводородное кольцо, необязательно замещенное
(a) С1-4 алкилендиокси или
(b) гидрокси,или
5-6-членный ароматический гетероцикл, который имеет 1-3 гетероатома, выбранных из атома азота, атома серы и атома кислорода, и который необязательно замещен
(a) циано или
(b) С1-6 алкокси; и
L обозначает удаляемую группу,
в присутствии Pd катализатора.
Приоритет по пунктам:
| US 5731323 A, 24.03.1998, формула изобретения, кол.13, строка 23 - кол.16 строка 6 | |||
| US 5714496 A, 03.02.1998, формула изобретения | |||
| RU 9711167 A, 10.07.1997, формула изобретения | |||
| US 5135935 А, 04.08.1992. |
Авторы
Даты
2005-12-27—Публикация
2000-09-27—Подача