Настоящее изобретение относится к новым ароматическим соединениям и их фармацевтически приемлемым солям, обладающим ценными фармакологическими свойствами. Более конкретно, соединения настоящего изобретения являются антагонистами усиливающего боль действия простагландина Е-типа. Настоящее изобретение также относится к способу получения ароматических соединений и их фармацевтически приемлемых солей; к новым фармацевтическим композициям, содержащим эти соединения; и к использованию указанных соединений для ослабления боли.
Соединения настоящего изобретения могут быть использованы для устранения слабой или умеренной боли, ассоциируемой с заболеваниями суставов (такими, как ревматоидный артрит и остеоартрит), послеоперационной боли, послеродовой боли; боли, связанной с заболеваниями зубов (таких, как кариез и гингивит), боли, ассоциируемой с ожогами (включая солнечные ожоги); для лечения заболеваний костей (таких, как остеопороз, злокачественная гиперкальциемия, и болезнь Педжета); для ослабления боли, ассоциируемой со спортивными травами и растяжением связок; и для лечения любых других болезненных состояний, в которых простагландины Е-типа полностью или частично играют патофизиологическую роль.
Нестероидные противовоспалительные средства (НСПВС) и опиаты представляют собой основной класс препаратов, устраняющих слабую и умеренную боль. Однако обе эти группы соединений оказывают нежелательное побочное действие. Известно, что НСПВС вызывают раздражение желудочно-кишечного тракта, а опиаты, как известно, являются наркотическими средствами.
Нами был обнаружен класс соединений, которые структурно отличаются от НСПВС и опиатов, и которые могут быть использованы для устранения слабой или умеренной боли.
Соединения настоящего изобретения могут также обладать противовоспалительными, жаропонижающими, и противопоносными свойствами, и являются эффективными в лечении других состояний, в которых простагландин E2(PGE)2 полностью или частично играет патофизиологическую роль.
В Chemical Abstracts vol.101. (реферат 63594) раскрывается соединение 4-[5-карбокси-2-гидроксибензиламино]бензойной кислоты в качестве промежуточного химического соединения. В работе Mazumder и др. (Biochemistry, 1995, 34, 15111) раскрывается соединение 4-[2,5-дигидрокси-бензиламино]бензойной кислоты как ингибитора фермента протеинкиназы. В работе H.Chen и др. (J.Med. Chem. , 1993, 36, 4094) соединения 5-[2-гидроксибензиламино]-2-гидроксибензойной кислоты и 3-[2,5-дигидроксибензиламино]бензойной кислоты описаны как ингибиторы ЕСF-рецепторассоциированной тирозинкиназной активности. В работе Chin-Yi Hsu и др. (J.Biol.Chem., 1991, 266, 21105) раскрывается соединение 4-[2,5-дигидроксибензиламино]бензолкарбоксамид как ингибитор ECF-рецептор-ассоциированной тирозинкиназной активности. В работе М. Iskander и др. (Eur. J. Med. Chem. , 1991, 26, 129) раскрывается соединение 3-[2-гидроксибензиламино] бензойной кислоты как ингибитор GАВА-аминотрансферазы. В описании патента Великобритании 1393727 раскрывается соединение 4-[2,5-дигидроксибензиламино] -2-гидроксибензойной кислоты, предназначенное для использования в химических фотографических процессах. В работе G.Walker и др. (J.Med.Chem., 1966, 9, 624) раскрывается соединение 4-[2-гидроксибензиламино]-2-гидроксибензойной кислоты, но в этой работе не указывается на какую-либо фармакологическую активность указанного соединения. В Chemical Abstracts, v. 102, abstract 1871, указывается, что соединение 4-[2-гидроксибензиламино]бензойной кислоты является возможно ингибитором роста растений.
Настоящее изобретение относится к соединению формулы I: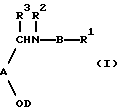
где А представляет необязательно замещенные:
фенил, нафтил, пиридил, пиразинил, пиридазинил, пиримидил, тиенил, тиазолил, оксазолил или тиадиазолил, имеющие, по крайней мере, два смежные кольцевых атома углерода; при условии, что группы -CH(R3)N(R2)B-R1 и -OD находятся в 1,2-положении по отношению друг к другу на кольцевых атомах углерода, а кольцевой атом, находящийся в ортоположении по отношению к -OD-связывающей группе (и следовательно в 3-положении по отношению к -CHR3R2- связывающей группе), является незамещенным;
В представляет необязательно замещенные: фенил, пиридил, тиазолил, оксазолил, тиенил, тиадиазолил, имидазолил, пиразинил, пиридазинил или пиримидил;
R1 находится на кольце B в 1,3- или 1,4-положении по отношению к -CH(R3)N(R2)-связывающей группе, и представляет карбокси, карбоксиС1-3алкил, тетразолил, тетразолил-С1-3алкил, тетроновую кислоту, гидроксаминовую кислоту, сульфоновую кислоту; либо R1 представляет группу формулы -CONRaRa1, где Ra представляет водород или С1-6алкил, a Ra1 представляет водород, С1-6алкил (необязательно замещенный галогеном, амино, С1-4алкиламино, ди-С1-4алкиламино, гидрокси, нитро, циано, трифторметилом, С1-4алкокси или С1-4алкоксикарбонилом), C2-6aлкeнил (при условии, что двойная связь не находится в 1-положении), С2-6алкинил (при условии, что тройная связь не находится в 1-положении), карбоксифенил, 5- или 6-членный гетероциклил С1-3алкил, 5- или 6-членный гетероарилС1-3алкил, 5- или 6-членный гетероциклил, или 5- или 6-членный гетероарил; Ra и Ra1, взятые вместе с атомом азота амидной группы, с которым они связаны (NRaRa1), образуют аминокислотный остаток или его сложный эфир, либо R1 представляет группу формулы -CONHSO2Rb, где Rb представляет С1-6алкил (необязательно замещенный галогеном, гидрокси, нитро, циано, амино, С1-4алкиламино, ди-С1-4aлкилaминo, трифторметилом, С1-4алкокси или С1-4алкоксикарбонилом), С2-6алкенил (при условии, что двойная связь не находится в 1-положении), С2-6алкинил (при условии, что тройная связь не находится в 1-положении), 5- или 6-членный гетероциклил С1-3алкил, 5- или 6-членный гетероарил С1-3алкилфенил С1-3алкил, 5- или 6-членный гетероциклил, 5- или 6-членный гетероарил, или фенил; где любая гетероциклическая или гетероарильная группа в Ra1 является необязательно замещенной галогеном, гидрокси, нитро, циано, трифторметилом, С1-4алкокси или С1-4алкоксикарбонилом; а любая фенильная, гетероциклическая или гетероарильная группа в Rb является необязательно замещенной галогеном, трифторметилом, нитро, гидрокси, амино, циано, С1-6алкокси, S(O)рС1-6алкилом (р=0, 1 или 2), С1-6алкилом, карбамоилом, С1-4алкилкарбамоилом, ди(С1-4алкил)карбамоилом, С2-6алкенилом, С2-6алкинилом, С1-4алкоксикарбониламино, С1-4алканоиламино, С1-4алканоил(N-С1-4алкил)амино, С1-4алкансульфонамидо, бензолсульфонамидо, аминосульфонилом, С1-4алкиламиносульфонилом, ди(С1-4алкил)аминосульфонилом, С1-4-алкоксикарбонилом, С1-4алканоилокси, С1-6алканоилом, формил-С1-4алкилом, гидроксииминоС1-6алкилом, С1-4алкоксииминоС1-6алкилом или С1-6алкилкарбамоиламино; либо R1 представляет группу формулы -SO2N(Rс)Rс1, где Rc представляет водород или С1-4алкил, a Rс1 представляет водород или С1-4алкил; либо R1 представляет группу формулы (1А), (1В) или (1С):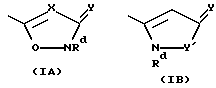
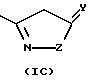
где X представляет СН или азот, Y представляет кислород или серу, Y' представляет кислород или NRd, a Z представляет СН2, NRd или кислород, при условии, что в кольце присутствует не более одного атома кислорода, и, по крайней мере, два гетероатома, и где Rd представляет водород или С1-4алкил;
R2 представляет водород, С1-6алкил, необязательно замещенный гидрокси-группой, циано-группой, или трифторметилом; С2-6алкенил (при условии, что двойная связь не находится в 1-положении), С2-6алкинил (при условии, что тройная связь не находится в 1-положении), фенилС1-3алкил или пиридил-С1-3алкил;
R3 представляет водород, метил или этил;
D представляет водород, необязательно замещенное 5-7-членное карбоциклическое кольцо, содержащее одну двойную связь, С1-3алкил, замещенный необязательно замещенным 5-7-членным карбоциклическим кольцом, содержащим одну двойную связь, либо D представляет группу формулы (CH2)nCH(R4)C(R5)=C(R6)R7, где
R4 представляет водород, метил или этил;
R5 представляет водород, метил, бром, хлор, фтор или трифторметил;
R6 представляет водород, С1-4алкил, бром, хлор, фтор, или трифторметил;
R7 представляет водород, С1-4алкил, бром, хлор, фтор, или трифторметил;
n=0 или 1;
и N-оксиды группы -NR2, где это химически возможно;
и S-оксиды серусодержащих колец, где это химически возможно; и их фармацевтически приемлемые соли и in vivo - гидролизуемые сложные эфиры и амиды; за исключением 4-[5-карбокси-2-гидроксибензиламино] бензойной кислоты, 4-[2,5-дигидроксибензиламино] бензойной кислоты, 5-[2-гидроксибензиламино]-2-гидроксибензойной кислоты, 3-[2,5-дигидроксибензиламино]бензойной кислоты, 4-[2,5-дигидрокси-бензиламино] бензолкарбоксамида, 3-[2-гидроксибензиламино] бензойной кислоты, 4-[2,5-дигидроксибензиламино]-2-гидроксибензойной кислоты, 4-[2-гидроксибензиламино] -2-гидроксибензойной кислоты и 4-[2-гидроксибензиламино]бензойной кислоты.
5- или 6-членной гетероарильной кольцевой системой является моноциклическая арильная кольцевая система, имеющая 5- или 6-кольцевых атомов, где 1, 2 или 3 кольцевых атома выбирают из атомов азота, кислорода и серы.
5- или 6-членным насыщенным или частично насыщенным гетероциклическим кольцом является кольцевая система, имеющая 5 или 6 кольцевых атомов, где 1, 2 или 3 кольцевых атома выбирают из атомов азота, кислорода и серы.
5-7-членным карбоциклическим кольцом, содержащим одну двойную связь является моноциклическое кольцо, которое содержит только одну двойную связь.
Конкретными 5- или 6-членными моноциклическими гетероарильными кольцами являются пирролил, имидазолил, пиразолил, изотиазолил, изоксазолил, пиридил, пиразинил, пиримидинил, пиридазинил, тиазолил, тиадиазолил, тиенил, фурил и оксазолил.
Конкретными 5- или 6-членными насыщенными или частично насыщенными гетероциклическими кольцевыми системами являются пирролидинил, пирролинил, имидазолидинил, пиразолидинил, пиперидил, пиперазинил и морфолинил.
Конкретными 5-7-членными карбоциклическими кольцевыми системами, содержащими одну двойную связь, являются циклогексен-3-ил, циклопентен-2-ил или циклопентен-3-ил.
Конкретными заместителями для кольцевых атомов углерода в А и гетероарильных или гетероциклических кольцах являются галоген, трифторметил, нитро, гидрокси, амино, С1-4-алкиламино, ди-С1-4aлкилaмино, циано, С1-6алкокси, S(O)pС1-6алкил (р=0, 1 или 2), С1-6алкил (необязательно замещенный гидрокси, амино, галогеном, нитро или циано), S(O)рСF3 (р=0, 1 или 2), карбамоил, С1-4алкилкарбамоил, ди-(С1-4алкил)карбамоил, С2-6алкенил, С2-6алкинил, С1-4алкоксикарбониламино, С1-4aлкaнoилaминo, С1-4алканоил(N-С1-4алкил)амино, С1-4алкансульфонамидо, бензолсульфонамидо, аминосульфонил, С1-4-алкиламиносульфонил, ди(С1-4алкил)аминосульфонил, С1-4алкоксикарбонил, С1-4алканоилокси, С1-6алканоил, формил-С1-4алкил, трифтор С1-3алкилсульфонил, гидроксиимино С1-6алкил, С1-4алкоксиимино-С1-6алкил и С1-6алкилкарбамоиламино.
Если кольцевой атом азота в А может быть замещен, не подвергаясь, при этом, кватернизации, то он является незамещенным или замещенным С1-4алкил-группой.
Конкретными заместителями для кольцевых атомов углерода в В являются галоген, трифторметил, нитро, гидрокси, С1-6алкокси, С1-6алкил, амино, С1-4алкиламино, ди(С1-4алкил)-амино, циано, -S(О)р-С1-6алкил (р=0, 1 или 2), карбамоил, С1-4алкилкарбамоил и ди(С1-4алкил) карбамоил.
В случае, когда кольцевой атом азота в В может быть замещен, не подвергаясь квартернизации, то он является незамещенным или замещенным С1-4алкильной группой.
Конкретными заместителями для 5-7-членного карбоциклического кольца, содержащего двойную связь (D), являются С1-4алкил, С2-4алкенил, С2-4алкинил, галоген, гидрокси, амино, С1-4алкиламино: ди-(С1-4алкил) амино, циано, трифторметил, оксо, С1-4алканоил, карбокси и карбамоил.
Термин "алкил", используемый в настоящем описании, означает заместители с прямой или разветвленной цепью, например, метил, этил, н-пропил, изопропил, н-бутил, и изобутил; при этом, функциональные группы на алкильной цепи могут присутствовать в любой части этой цепи, так, например, гидроксиимино-С1-6алкилом является 1-(гидроксиимино)пропил и 2-(гидроксиимино)пропил.
Аминокислотными остатками, образованными из Ra и Ra1, взятыми вместе с атомом азота, с которым они связаны, являются остатки ((-NHCH(R)COOH), натуральных или синтетических аминокислот. Примерами подходящих аминокислот являются глицин, аланин, серин, треонин, фенилаланин, глутаминовая кислота, тирозин, лизин и диметилглицин.
Подходящими кольцевыми системами формул (1А), (1В) или (1С) являются 5-оксо-4,5-дигидро-1,2,4-оксадиазол-3-ил; 3-оксо-2,3-дигидро-1,2,4-оксадиазол-5-ил; 3-тиоксо-2,3-дигидро-1,2,4-оксодиазол-5-ил; 5-оксо-4,5-дигидро-1,3,4-оксодиазол-2-ил; 5-оксо-4,5-дигидро-1,2,4-триазол-3-ил; 5-тиоксо-4,5-дигидро-1,3,4-оксадиазол-2-ил; 1,3,4-оксадиазол-2-ил; 3-гидрокси-2-метилпиразол-5-ил; 3-оксо-2,3-дигидроизоксазол-5-ил; 5-оксо-1,5-дигидроизоксазол-3-ил; и 5-оксо-2,3-дигидропиразол-3-ил.
Примерами С1-6алкоксикарбонила являются метоксикарбонил, этоксикарбонил и трет-бутоксикарбонил; примерами карбоксиС1-3алкила являются карбоксиметил, 2-карбоксиэтил, 1-карбоксиэтил и 3-карбоксипропил; примерами С1-6алкоксикарбонилС1-3алкила являются метоксикарбонилметил, этоксикарбонилметил и метоксикарбонилэтил; примерами тeтpaзoлил С1-3aлкилa являются тетразолилметил и 2-тетра-золилэтил; примерами С1-4алкокси являются метокси, этокси, пропокси, и изопропокси; примерами С2-6алкенила являются винил и аллил; примерами С2-6алкинила являются этинил и пропинил; примерами С1-4алканоила являются формил, ацетил, пропионил и бутирил; примерами галогена являются фтор, хлор, бром и йод; примерами С1-4алкиламино являются метиламино, этиламино, пропиламино и изопропиламино; примерами ди(С1-4алкил)амино являются диметиламино, диэтиламино, и этилметиламино; примерами S(О)pС1-4алкила являются метилтио, метилсульфинил, и метилсульфонил; примерами С1-4алкилкарбамоила являются метилкарбамоил и этилкарбамоил; примерами ди(С1-4алкил)карбамоила являются диметилкарбамоил, диэтилкарбамоил и этилметилкарбамоил, примерами С1-6алкила являются метил, этил, пропил и изопропил; примерами С1-4алкоксикарбониламино являются метоксикарбониламино и этоксикарбониламино; примерами С1-4-алканоиламино являются ацетамидо и пропионамидо; примерами С1-4алканоил(N-С1-4алкил)амино являются N-метилацетамидо и N-метилпропионамидо; примерами С1-4алкансульфонамидо являются метансульфонамидо и этансульфонамидо; примерами С1-4алкиламиносульфонила являются метиламиносульфонил, и этиламиносульфонил; примерами ди(С1-4алкил)аминосульфонила являются диметиламиносульфонил, диэтиламиносульфонил и этилметиламиносульфонил; примерами С1-4алканоилокси являются ацетилокси и пропионилокси; примерами формилС1-4алкила являются формилметил и 2-формилэтил; примерами гидроксииминоС1-6алкила являются гидроксииминометил и 2-(гидроксиимино)этил; и примерами С1-4алкоксииминоС1-6алкила являются метоксииминометил, этоксииминометил и 2-(метоксиимино)этил.
При этом, следует отметить, что если соединения формулы I имеют хиральный центр, то эти соединения настоящего изобретения могут существовать и могут быть выделены в оптически активной форме или рацемической форме. Настоящее изобретение включает любую оптически активную или рацемическую форму соединения формулы I, которая обладает болеутоляющими свойствами. Синтез оптически активных форм может быть осуществлен с помощью стандартных методов органической химии, хорошо известных специалистам, например, путем разделения рацемической формы, путем синтеза из оптически активных исходных соединений, или путем асимметрического синтеза. Кроме того, следует отметить, что некоторые соединения формулы I могут существовать в форме геометрических изомеров. Настоящее изобретение включает любой геометрический изомер соединений формулы I, который обладает болеутоляющими свойствами.
Следует также отметить, что некоторые соединения настоящего изобретения могут существовать в сольватированной форме, например, в виде гидратов, и в несольватированной форме. Кроме того, настоящее изобретение включает все указанные сольватированные формы, обладающие болеутоляющими свойствами.
Следует также отметить, что в объем настоящего изобретения входят таутомеры соединений формулы (I).
Предпочтительно, если А предсталяет необязательно замещенные: фенил, нафтил, тиадиазолил, тиенил, пиридил или пиримидил.
Предпочтительно, если В представляет необязательно замещенные: пиридил, фенил, тиазолил, тиенил, пиридазинил, или оксазолил.
Наиболее предпочтительно, если А представляет необязательно замещенные фенил или тиенил.
Более предпочтительно, если В представляет необязательно замещенные: пиридил, фенил, тиенил, пиридазинил или тиазолил.
В частности, А представляет необязательно замещенный фенил.
В частности, В представляет необязательно замещенные: пиридил-2,5-диил, пиридазин-3,6-диил, фен-1,4-диил, или тиен-2,5-диил.
Особенно предпочтительно, если В представляет необязательно замещенный пиридазин-3,6-диил или пирид-2,5-диил.
Особенно предпочтительно, если В является пиридазинилом.
Если D является водородом, то предпочтительно, если В представляет необязательно замещенный: пиридил, тиенил, пиридазинил или тиазолил.
Предпочтительными необязательными заместителями для кольцевых атомов углерода в А являются галоген, нитро, трифторметил, циано, амино, С1-6алкокси, карбамоил, С1-4алкилкарбамоил, ди(С1-4алкил) карбамоил, С1-4алканоиламино, С1-6алкил-S(О)p, С1-4алкансульфонамидо, бензолсульфонамидо, С1-6алканоил, С1-4алкоксииминоС1-4алкил и гидроксиимино-С1-4алкил.
Если А представляет 6-членное кольцо, то А является, предпочтительно, незамещенным или замещенным в 4-положении по отношению к группе -ОD.
Предпочтительными необязательными заместителями для кольцевых атомов углерода в B являются галоген, трифторметил, С1-4алкил, амино, С1-4алкиламино, ди-С1-4алкиламино, нитро, гидрокси, С1-6алкокси и циано.
Предпочтительно, если n=0.
Предпочтительно, если А является незамещенным или замещенным одним заместителем.
Более предпочтительно, если А является незамещенным, или замещен бромом, метансульфонилом, фтором, бромом или хлором.
Наиболее предпочтительно, если А является незамещенным, или замещен бромом или хлором.
Предпочтительно, если В является незамещенным или замещенным одним заместителем.
Наиболее предпочтительно, если В является незамещенным.
Предпочтительно, если R1 представляет карбокси, карбамоил или тетразолил, или R1 представляет группу формулы -CONRaRa1-, где Ra представляет водород или С1-6алкил, a Ra1 представляет С1-6алкил, необязательно замещенынй гидрокси-группой; С2-6алкенил, 1-морфолинил, 1-пиперидинил, 1-пирролидинил, пиридилС1-3алкил, либо R1 представляет группу формулы - -CONHSO2Rb, где Rb представляет необязательно замещенные С1-6алкил, фенил или 5- или 6-членный гетероарил.
В частности, R1 представляет карбокси, тетразолил или группу формулы -CONRaRa1, где Ra представляет водород, a Ra1 представляет С1-6алкил, необязательно замещенный гидрокси, или пиридилметил; либо R1 представляет группу формулы -CONHSO2Rb, где Rb представляет С1-6алкил (необязательно замещенный гидрокси или фтором), фенил (необязательно замещенный ацетамидо), изоксазолил (необязательно замещенный метилом), или 1,3,4-тиадиазолил (необязательно замещенный ацетамидо).
Наиболее предпочтительно, если R1 представляет карбокси, тетразол или группу формулы -CONHRBa1, где Ra1 представляет пиридилметил или С1-4алкил, необязательно замещенный гидрокси, или группу формулы -CONHSO2Rb, где Rb представляет С1-4алкил, 3,5-диметилизоксазол-4-ил, или 5-ацетамидо-1,3,4-тиадиазол-2-ил.
В другом аспекте настоящего изобретения, R1 представляет карбокси, карбамоил, или тетразолил, или R1 представляет группу формулы -CONRaRa1, где Ra представляет водород или С1-6алкил, а Ra1представляет С1-6алкил, необязательно замещенный гидрокси, С2-6алкенил, 1-морфолинил, 1-пиперидинил, 1-пирролидинил, пиpидил С1-3aлкил, либо R1 представляет группу формулы -CONHSO2Rb, где Rb представляет необязательно замещенные С1-6алкил или фенил.
Предпочтительно, если R2 представляет водород, метил, этил, 2,2,2-трифторэтил, цианометил, аллил или 3-пропинил.
Более предпочтительно, если R2 представляет водород, метил, этил или пропил. Еще более предпочтительно, если R2 представляет водород или этил.
Наиболее предпочтительно, если R2 представляет этил.
Предпочтительно, если R3 представляет водород.
Предпочтительно, если R4 представляет водород или метил.
Предпочтительно, если R5 представляет водород, метил, или хлор.
Предпочтительно, если R6 представляет водород, метил, или хлор.
Предпочтительно, если R7 представляет водород или метил.
Предпочтительно, если 5-7-членное карбоциклическое кольцо, содержащее одну двойную связь, необязательно замещено метилом.
Более предпочтительно, если 5-7-членное карбоциклическое кольцо, содержащее одну двойную связь, является незамещенным.
Предпочтительным D представляет 5-6-членное карбоциклическое кольцо, содержащее одну двойную связь (необязательно замещенное метилом); метил, замещенный 5-6-членным карбоциклическим кольцом, содержащим одну двойную связь (необязательно замещенное метилом); или группу формулы -СН2С(R5)=C(R6)R7.
Наиболее предпочтительно, если D представляет группу формулы: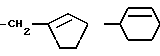
-CH2CH= CH2-CH= CHMe, -CH2CH=C(Me)2, -CH2C(Me)=CHMe, -CH2C(Me)=CHMe, -CH2C(Me)=CH2 или -CH2C(Cl)=CH2.
В одном аспекте настоящего изобретения, D представляет необязательно замещенное 5-7-членное карбоциклическое кольцо, содержащее одну двойную связь; С1-3алкил, замещенный 5-7-членным карбоциклическим кольцом; или группу формулы -(СН2)nСHR4C(R5)=C(R6)R7.
В другом аспекте изобретения, D представляет водород.
Предпочтительным классом соединений являются соединения формулы (II):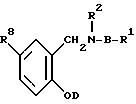
где R1, R2 и D определены выше, R8 представляет водород, или как было определено выше для заместителей кольцевых атомов углерода в А и В, представляет фенил, тиенил, пиридазинил, пиридил или тиазолил.
При этом следует отметить, что поскольку соединения формулы (I), определенные выше, могут существовать в оптически активной или рацемической формах благодаря тому, что соединения формулы (I) содержат асимметрический атом углерода, то определение активного ингредиента настоящего изобретения включает любую такую оптически активную или рацемическую форму, которая обладает болеутоляющими свойствами. Синтез таких оптически активных форм может быть осуществлен стандартными методами органической химии, хорошо известными специалистам, например, путем синтеза из оптически активных исходных соединений, или путем разделения рацемической формы. Аналогично, болеутоляющие свойства соединения могут быть оценены с использованием стандартной лабораторной техники, описанной ниже.
In vivo - гидролизуемым сложным эфиром соединения формулы (I), содержащим карбокси или гидрокси-группу, является, например, фармацевтически приемлемый сложный эфир, который гидролизуется в организме человека или животного с продуцированием исходной кислоты или спирта, например, фармацевтически приемлемый сложный эфир, образованный из кислоты с (С1-6)спиртом, таким, как метанол, этанол, этиленгликоль, пропанол или бутанол; либо фенолом или бензиловым спиртом, таким, как фенол или бензиловый спирт или замещенный фенол или бензиловый спирт, где заместителями являются, например, галоген (такой, как фтор или хлор), (С1-4)алкил (такой, как метил), или (С1-4)алкокси-группа (такая, как этокси-группа). Этот термин также включает α-ацилоксиалкиловые сложные эфиры, и исходные соединения, которые разлагаются с образованием исходной гидрокси-группы. Примерами α-ацилоксиалкиловых сложных эфиров являются ацетоксиметоксикарбонил и 2,2-диметилпропионилоксиметоксикарбонил.
In vivo - гидролизуемым сложным эфиром соединения формулы (I), содержащим гидрокси-группу, является, например, фармацевтически приемлемый сложный эфир, который гидролизуется в организме человека или животного с образованием исходного спирта. Этот термин включает неорганические сложные эфиры, такие, как сложные эфиры фосфорной кислоты и α-ацилоксиалкиловые простые эфиры, а также исходные соединения, которые образуются в результате in vivo - гидролиза сложного эфира, разлагаемого с образованием исходной гидрокси-группы. Примерами простых α-ацилоксиалкиловых эфиров являются ацетоксиметокси и 2,2-диметоксипропионилоксиметокси. Группы, образующие in vivo - гидролизуемый сложный эфир с получением гидрокси-группы, выбирают из алканоила, бензоила, фенилацетила, замещенного бензоила, замещенного фенилацетила, алкоксикарбонила (для получения сложных эфиров алкилкарбоновой кислоты), диалкилкарбамоила и N-(диалкиламиноэтил)-N-алкилкарбамоила (для получения карбаматов), диалкиламиноацетила и карбоксиацетила.
Подходящим in vivo - гидролизуемым амидом соединения формулы I, содержащего карбокси-группу, является, например, N-(С1-6)алкил или N, N-ди-(С1-6)алкиламид, такой, как N-метил-, N-этил-, N-пропил-, N,N-ди-метил-, N-этил-N-метил- или N,N-диэтиламид.
Подходящей фармацевтически приемлемой солью соединения (I) является, например, кислотно-аддитивная соль, соединения формулы (I), которое является достаточно основным, например, кислотно-аддитивная соль, образованная неорганической или органической кислотой, такой, как соляная, бромистоводородная, серная, трифторуксусная, лимонная, или малеиновая кислота; или, например, соль соединения формулы (I), которое является достаточно кислотным, например, соль щелочного или щелочноземельного металла, такая, как кальциевая, магниевая или аммониевая соль, либо соль, образованная органическим основанием, таким, как метиламин, диметиламин, триметиламин, пиперидин, морфолин или трис-(2-гидроксиэтил)-амин.
В другом своем аспекте, настоящее изоребретение относится к способу получения соединения формулы (I) или их фармацевтически приемлемых солей, их in vivo - гидролизуемых амидов или сложных эфиров; причем, указанный способ предусматривает деблокирование соединения формулы (III):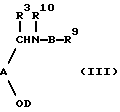
где R9 является таким же, как R1 или защищенным R1; R10 является таким же, как R2 или защищенным R2; a R3, R4, n, А, В и D являются такими, как они были определены выше, при этом, любые необязательные заместители являются необязательно замещенными, и присутствует, по крайней мере, одна защитная группа;
и кроме того, если это необходимо:
i) получение фармацевтически приемлемой соли;
ii) получение in vivo - гидролизуемого сложного эфира или
iii) превращение одного необязательного заместителя в другой необязательный заместитель.
Защитные группы могут быть выбраны из любых подходящих групп, описанных в литературе, и могут быть введены стандартными методами.
Защитные группы могут быть удалены любым известным методом, подходящим для удаления данной защитной группы, причем, этот метод должен быть выбран так, чтобы он давал возможность эффективно удалять защитную группу с минимальным воздействием на какие-либо другие группы в молекуле.
Подходящей группой для защиты гидрокси-группы является например, арилметильная группа (в частности, бензил), три-(С1-4)алкилсилильная группа (в частности, триметил- или трет-бутилдиметилсилил), арилди-(С1-4)алкилсилильная группа (в частности, диметилфенилсилил), диарил(С1-4)алкилсилильная группа (в частности, трет-бутилдифенилсилил), (С1-4)алкильная группа (в частности, метил), (С2-4)алкенильная группа (в частности, аллил), (С1-4)алкоксиметильная группа (в частности, метоксиметил), или тетрагидропиранильная группа (в частности, тетрагидропиран-2-ил). Условия снятия защиты для вышеуказанных защитных групп могут варьироваться в зависимости от выбора защитной группы. Так, например, арилметильная группа, такая, как бензильная группа, может быть удалена путем гидрогенизации в присутствии катализатора, такого, как палладий-на-угле. Альтернативно, триалкилсилильная или арилдиалкилсилильная группа, такая, как трет-бутилдиметилсилильная или диметилфенилсилильная группа, может быть удалена, например, путем, обработки подходящей кислотой, такой, как соляная, серная, фосфорная, или трифторуксусная кислота; или фторидом щелочного металла или аммония, таким, как фторид натрия или предпочтительно фторид тетрабутиламмония. Альтернативно, алкильная группа может быть удалена, например, путем обработки (С1-4)алкилсульфидом щелочного металла, таким, как тиоэтоксид натрия, или, например, путем обработки диарилфосфидом щелочного металла, такого, как дифенилфосфид лития, или, например, путем обработки тригалогенидом бора или алюминия, таким, как трибромид бора. Альтернативно, (С1-4) алкоксиметильная группа или тетрагидропиранильная группа может быть удалена, например, путем обработки подходящей кислотой, такой, как соляная кислота или трифторуксусная кислота.
Альтернативно, подходящей защитной группой для гидрокси-группы является, например, ацильная группа, например, (С1-4)алканоильная группа (в частности, ацетил), или ароильная группа (в частности, бензоил). Условия снятия защиты для вышеуказанных защитных групп могут варьироваться в зависимости от выбора защитной группой. Так, например, ацильная группа, такая, как алканоильная или ароильная группа может быть удалена, например, путем гидролиза с использованием основания, такого, как гидроксид щелочного металла, например, гидроксид лития или натрия.
Подходящей защитной группой для амино-, имино-, или алкиламино-группы является, например, ацильная группа, такая, как (С2-4)алканоильная группа (в частности, ацетильная группа), (С1-4)алкоксикарбонильная группа (в частности, метоксикарбонильная, этоксикарбонильная или трет-бутоксикарбонильная группа), арилметоксикарбонильная группа (в частности, бензилоксикарбонильная группа), или ароильная группа (в частности, бензоильная группа). Условия снятия защиты для вышеуказанных защитных групп могут варьироваться в зависимости от выбора защитной группы. Так, например, ацильная группа, такая, как алканоильная, алкоксикарбонильная или ароильная группа может быть удалена, например, путем гидролиза с использованием подходящего основания, такого, как гидроксид щелочного металла, например, гидроксида лития или натрия. Альтернативно, ацильная группа, такая, как трет-бутоксикарбонильная группа, может быть удалена, например, путем обработки подходящей кислотой, такой, как соляная, серная или фосфорная кислота, или трифторуксусная кислота, а арилметоксикарбонильная группа, такая, как бензилоксикарбонильная группа, может быть удалена, например, путем гидрогенизации в присутствии катализатора, такого, как палладий-на-угле.
Подходящей защитной группой для карбокси-группы является, например, этерифицирующая группа, например, (С1-4)алкильная группа (в частности, метильная или этильная группа), которая может быть удалена, например, путем гидролиза с использованием подходящего основания, такого, как гидроксид щелочного металла, например, гидроксида лития или натрия; а трет-бутильная группа может быть удалена, например, путем обработки подходящей кислотой, такой, как соляная, серная, фосфорная или трифторуксусная кислота.
В другом аспекте настоящего изобретения, соединения формул (I) или (III) могут быть получены способом, предусматривающим:
а) если B представляет активированный гетероцикл, a R10 представляет водород или С1-6алкил, осуществление реакции соединения формулы (IV) с соединением формулы (V)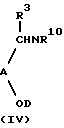
X-B-R9, (V)
где А, В, R3, R4, R7, R9 и n определены выше, а Х является уходящей группой;
b) осуществление реакции соединения формулы (VI) с соединением формулы (VII):
R10HN-B-R7, (VI)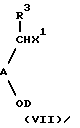
с) превращение X2 в R9 в соединении формулы (VIII):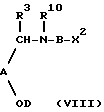
d) если R10 не является водородом, осуществление реакции соединения формулы R10X3 с соединением формулы (IX):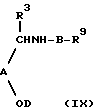
е) осуществление реакции соединения формулы (X) с соединением формулы (XI)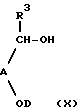
X4NH-B-R9, (XI)
f) осуществление реакции соединения формулы (ХII) с соединением формулы (ХIII):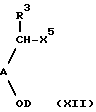
X6NH-B-R7, (XIII)
g) осуществление реакции соединения формулы (ХIV) с соединением формулы (ХV):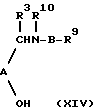
X7D, (XV)
где R3, R9, R10, А, В, D и n определены выше;
Х и Х1 являются уходящими группами, X2 является предшественником группы R9; X3 является уходящей группой; Х4 является удаляемой активирующей группой, Х5 является уходящей группой, Х6 является активирующей группой; а X7 представляет галоген или активированную гидрокси-группу; а затем, если необходимо:
i) удаление любых защитных групп;
ii) получение фармацевтически приемлемой соли;
iii) получение in vivo - гидролизуемого сложного эфира или амида;
iv) превращение необязательного заместителя в другой необязательный заместитель.
Конкретными уходящими группами являются галоген, например, хлор, бром, йод, сульфонаты, например, тозилат, п-бромбензолсульфонат, п-нитробензолсульфонат, метансульфонат и трифторацетат, или сложные эфиры фосфорной кислоты, такие, как сложный эфир диарилфосфорной кислоты.
Соединение формулы (IV) и соединение формулы (V) могут быть подвергнуты реакции в стандартных условиях, например, в апротонном растворителе, таком, как диметилформамид, в присутствии слабого основания, при температуре в пределах от комнатной температуры до 180oС. Подходящими Х являются галоген, тозилат, мезилат и трифторацетат. В частности, Х представляет хлор или бром.
Соединения формул (VI) и (VII) могут быть подвергнуты реакции в апротонном растворителе, таком, как ДМФ, в присутствии основания, такого, как карбонат калия, или гидрид натрия, при температуре от 0oС до 100oС. Подходящими Х1 являются галоген, тозилат, мезилат и трифторацетат. В частности, Х1 является бромом.
Предшественником группы R9 является группа, которая может быть превращена в R9.
Конкретными X2 являются циано, карбамоил, алкоксикарбонил, карбокси и активированные карбокси-группы, такие, как хлорангидриды и активированные сложные эфиры.
Циано-группа может быть превращена в тетразольное кольцо посредством реакции, например, с азидом аммония или азидом олова в апротонном растворителе, таком, как ДМФ, при температуре от 100oС до 130oС. Дополнительные сведения о синтезе тетразола можно найти в работах S.J. Wittenberger & B.J.Donner JOC, 1993, 58, 4139-4141; В.Е.Huff et al., Tet.Lett., 1993, 50, 8011-8014; и J.V.Duncia et al., JOC 1991, 56, 2395-2400.
Алкоксикарбонил может быть превращен в карбокси-группу путем кислотного или основного гидролиза. Так, например, основной гидролиз может быть осуществлен в органическом растворителе, таком, как метанол или тетрагидрофуран (ТГФ) при температуре в пределах от комнатной температуры до 100oС в присутствии гидроксида натрия или гидроксида калия.
Кислотный гидролиз может быть осуществлен, например, в чистой муравьиной кислоте или чистой трифторуксусной кислоте, необязательно, в инертном растворителе, таком, как дихлорметан.
Алкоксикарбонил или активированная карбокси-группа, такая, как хлорангидрид или активированный сложный эфир, или ацильная группа, такая, как алканоильная группа, могут быть превращены в амидную группу посредством реакции с соответствующим амином в инертном растворителе, таком, как диметилформамид или дихлорметан, при температуре от 0oС до 150oС, а предпочтительно при комнатной температуре, в присутствии основания, такого, как триэтиламин.
Соединения формул (IX) и R10X3 могут быть подвергнуты реакции в апротонном растворителе, таком, как ДМФ, в присутствии основания, такого, как карбонат натрия или гидрид натрия. Подходящими группами X3 являются галоген, тозилат, мезилат и трифторацетат, а в частности, галоген, такой, как йод.
Реакцию между соединениями формул (X) и (XI) обычно осуществляют в мягких условиях, известных, как реакция Митсунобу, например, в присутствии ди(С1-4алкил)азокарбоксилата и трифенилфосфина, или 11, 11-(азодикарбонил)дипиперидина и трибутилфосфина (Tet. Lett. 34, 1993, 1639-1642) в инертном растворителе, таком, как толуол, бензол, тетрагидрофуран или диэтилэфир, и в частности, толуол. Примерами удаляемых активирующих групп являются трет-бутоксикарбонил и трифторацетил.
Реакция между соединениями формул (ХII) и (ХIII) обычно протекает в присутствии сильного основания, такого, как гидрид натрия, диизопропиламид лития или LiN(SiМе3)2, в ДМФ или эфирном растворителе, таком, как этиловый эфир или ТГФ, при температуре в пределах от -78oС до комнатной температуры. Подходящим Х5 является например, галоген, метансульфонат или тозилат. Примерами активирующих групп для Х6 являются трет-бутоксикарбонил, галоген и трифторацетил.
Подходящими уходящими группами для X7 являются тозилат, мезилат, трифторацетат и галоген, например, хлор или бром. Реакция между соединениями формул (ХIV) и (ХV) может быть осуществлена в инертном органическом растворителе, таком, как ацетон или ДМФ, при температуре в пределах от комнатной температуры до 60oС, в присутствии слабого основания. Так, например, если X7 представляет бром, то реакцию между соединением (ХIV) и соединением (ХV) проводят в ДМФ, при комнатной температуре, в присутствии основания, такого, как карбонат калия. Альтернативно, может быть использована межфазная система. Х7 может быть гидрокси-группой, которая активируется in situ в условиях реакции Митсунобу (О.Synthesis, 1981, 1).
Соединения формулы (ХIV), где R9 является таким же как R1, a R10 является таким же, как R2, сами по себе обладают болеутоляющими свойствами.
Соединения формулы (VIII) могут быть получены способами a), b), d), e), f) или g) из соответствующего исходного соединения, в котором R9 заменен на X2.
Соединения формулы (IX) могут быть получены любым из способов а), b), с), e), p) или g) из соответствующих исходных соединений, в которых R10 представляет водород.
Соединения формулы (XI) могут быть легко получены из соединений формулы (VI).
Соединения формулы (V), (VI), (XI), (ХIII) и (ХV) являются, в основном, известными, либо они могут быть получены методами, используемыми в Примерах, либо методами, которые обычно применяются для получения родственных соединений. Некоторые соединения формулы (V), где Х представляет хлор или бром, могут быть получены путем превращения оксо-группы в кольцевой системе, в группу хлора или брома посредством реакции оксо-кольцевой системы с хлорирующим агентом, таким, как сульфонилхлорид, трихлорид фосфора, пентахлорид фосфора или Р(О)С13, или с бромирующим агентом, таким, как трибромид фосфора или Р(О)Вr3 в инертном апротонном растворителе.
Можно также синтезировать некоторые промежуточные соединения и даже защищенные соединения, используя сначала синтез кольца. Для справки см. краткое руководство "Chemistry of Heterocyclic Compounds" E.C.Taylor & A. Weissberger (опубликованное John Wiley & Sons);Comprehensive Heterocyclic Chemistry" A.R.Katritsky & C.W. Ress (опубликованное Pergamon Press).
Соединения формул (IV), (VII), (VIII), (IX), (X) и (ХII) могут быть получены посредством реакции соединения формулы (ХV) с соответствующим гидрокси-предшественником соединений формул (IV), (VII), (VIII), (IX), (X), (ХII) или (ХIV) с использованием реакционных условий, описанных в способе.
g) Соединения формулы (ХV) могут быть получены из соответствующих исходных материалов, образуя -CH(R3) N(R10)-B-R9 группу, используя один из способов а)-f).
Соединение формулы (ХV), в котором R10 представляет водород, может быть получено путем восстановления соединения формулы (ХVI):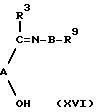
где R3-R7, R9 и n определены выше.
Соединения формулы (ХVI) могут быть восстановлены с использованием таких агентов, как борогидрид натрия или цианоборогидрид натрия. Соединения формулы (ХVI) могут быть получены посредством реакции соединения формулы (VI) с соединением формулы (ХVII):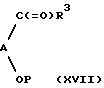
где R3 определен выше, а Р представляет гидрокси-защитную группу, с последующим деблокированием гидрокси-группы.
Реакция между соединениями формул (VI) и (ХVII) может быть осуществлена в стандартных условиях, обычно используемых для образования имина (основания Шиффа), который может быть восстановлен in situ. Так, например, образование и восстановление имина in situ может быть осуществлено в инертном растворителе, таком, как толуол или тетрагидрофуран, в присутствии восстановителя, такого, как цианоборогидрид натрия (NaCNBH3) в кислотных условиях (Synthesis 135, 1975; Org. Prep.Proceed.Int. 11, 201, 1979).
Необязательные заместители могут быть превращены в другие необязательные заместители. Так, например, алкилтиогруппа может быть окислена с образованием алкилсульфинильной или алкилсульфонильной группы, нитро-группа может быть восстановлена с образованием аминогруппы, гидрокси-группа может быть алкилирована с образованием метокси-группы, либо группа брома может быть превращена в алкилтио-группу.
Если это необходимо, то в соединения формулы (I) и (III) и в промежуточные соединения, образующиеся при получении соединений формул (I) и (III), могут быть введены различные заместители с использованием стандартных методов, известных специалистам. Так, например, ацильная группа или алкильная группа может быть введена в активированное бензольное кольцо с помощью реакции Фриделя-Крафтса; формильная группа может быть введена путем реакции формилирования с использованием тетрахлорида титана и дихлорметилэтилового простого эфира; нитро-группа может быть введена посредством реакции нитрования с использованием концентрированной азотной кислоты и концентрированной серной кислоты, а группа брома может быть введена путем бромирования с использованием брома или трибромида тетра(н-бутил)аммония.
При этом следует отметить, что для предупреждения побочных реакций, на некоторых стадиях реакционной схемы получения соединения формулы (I) может оказаться необходимым обеспечить защиту некоторых функциональных групп в промежуточных соединениях. Затем, если защита больше не нужна, то на соответствующей стадии реакционной схемы может быть осуществлено деблокирование.
Как указывалось выше, соединения формулы (I) являются антагонистами усиливающего боль действия простагландинов группы Е, и обладают способностью устранять слабую или умеренную боль, сопровождающую, например, воспалительные заболевания, такие, как ревматоидный артрит, или остеоартрит. Некоторые свойства соединений настоящего изобретения могут быть продемонстрированы с помощью нижеописанных тестов:
(a) In vitro-анализа с использованием подвздошной кишки морских свинок, который проводят для оценки ингибирующих свойств испытуемого соединения, направленных против PGE2-индуцированных сокращений подвздошной кишки. Для этого подвздошную кишку погружают в оксигенированный раствор Кребса, содержащий индометацин (4 мкг/мл) и атропин (1 мкМ), и выдерживают при 37oС; затем подвздошную кишку подвергают воздействию нагрузки в 1 г, и строят контрольную кривую дозовой зависимости для РGE2-индуцированного сокращения подвздошной кишки; после чего в раствор Кребса добавляют испытуемое соединение (растворенное в диметилсульфоксиде) и строят кривую дозовой зависимости для PGE2-индуцированного сокращения подвздошной кишки в присутствии испытуемого соединения; а затем вычисляют величину pA2 для испытуемого соединения;
b) in vivo-анализа на мышах, который проводят для оценки ингибирующих свойств испытуемого соединения, направленных против ответной реакции абдоминального сокращения, индуцированного путем внутрибрюшинного введения токсического фактора, такого, как уксусная кислота или фенилбензохинон (обозначаемый далее PBQ); при этом, указанный анализ проводили с использованием методики, описанной в Европейской патентной заявке 0218077.
Хотя фармакологические свойства соединений формулы I могут варьироваться в зависимости от их структуры, однако, в основном, активность этих соединений может быть продемонстрирована в одном или двух из вышеуказанных тестов (а) и (b) при следующих концентрациях или дозах:
Тест (а): pA1 > 5,3
Тест (b): ЕD30 в интервале, например, 0,01-100 мг/кг перорально.
В тесте (b), при введении соединений формулы I в дозах, которые в несколько раз превышают их минимальную ингибирующую дозу, какой-либо заметной токсичности или других неблагоприятных эффектов не наблюдалось.
Рецепторы простагландина, а в частности, рецепторы для РGЕ2 были ориентировочно охарактеризованы Kennedy и др. (Advances in Prostaglandin, Thromboxane and Leukotriene Research, 1983, 11, 327). Известный антагонист простагландина PGE2 C-19220 блокирует действие РGЕ2 в некоторых тканях таких, как подвздошная кишка морских свинок или брюшины собак, однако, в других тканях, например, в трахее кошек или в подвздошной кишке цыпленка такого эффекта не наблюдается. Было установлено, что ткани, являющиеся восприимчивыми к SC-19220-опосредованным эффектам, имеют рецепторы для ЕР1. Исходя из этого можно утверждать, что соединения настоящего изобретения, обладающие активностью в тесте (а), являются антагонистами ЕР1.
В соответствии с другим своим отличительным признаком, настоящее изобретение относится к фармацевтической композиции, содержащей соединение формулы (I) или его in vivo - гидролизуемый сложный эфир или амид, или его фармацевтически приемлемую соль, в сочетании с фармацевтически приемлемым разбавителем или носителем.
Эта композиция может быть получена в форме, подходящей для перорального введения, например, в виде таблетки, капсулы, водного или масляного раствора, суспензии или эмульсии; для местного применения, например, в виде крема, мази, геля, аэрозоля, масляного или водного раствора, или суспензии; для интраназального введения, например, в виде препарата для вдыхания через нос, аэрозолей или каплей в нос; для вагинального или ректального введения, например, в виде суппозитория или ректального аэрозоля; для введения путем ингаляции, например, в виде тонкодисперсного порошка или жидкого аэрозоля; для подъязычного и трансбуккального (через щеку) введения, например, в виде таблетки или капсулы; или для парентерального введения (включая внутривенные, подкожные, внутримышечные, внутрисосудистые инъекции или вливания), например, в виде стерильных водных или масляных растворов или суспензий. В основном, вышеуказанные композиции могут быть получены стандартными способами с использованием стандартных наполнителей.
Количество активного ингредиента (т.е., соединения формулы (I) или его фармацевтически приемлемой соли), которое объединяют с одним или несколькими наполнителями для получения нужной разовой лекарственной формы, может варьироваться в зависимости от конкретного пациента, подвергаемого лечению, а также от способа лечения. Так, например, композиция, предназначенная для перорального введения человеку, в основном, содержит от 0,5 мг до 2 г активного соединения, смешанного с соответствующим количеством наполнителей, которое может варьироваться в пределах от около 5 до около 98 мас.% по массе полной композиции.
В соответствии с другим своим отличительным признаком, настоящее изобретение относится к соединению формулы (I) или к его in vivo - гидролизуемому сложному эфиру или амиду, или его фармацевтически приемлемой соли, которые могут быть использованы в терапевтическом способе лечения животных (включая человека).
В соответствии с еще одним своим отличительным признаком, настоящее изобретение относится к способу ослабления боли у животного (включая человека), предусматривающему введение этому животному эффективного количества соединения формулы (I), или его in vivo - гидролизуемого сложного эфира или амида, или его фармацевтически приемлемой соли.
Как указывалось выше, соединение формулы (I) может быть использовано для устранения боли, которая, например, сопровождает воспалительные заболевания, такие, как ревматоидный артрит и остеоартрит. Ежедневная доза соединения формулы I, используемого в терапевтических или профилактических целях, обычно составляет, например, от 0,1 мг до 75 мг на кг массы тела, и может быть введена, если это необходимого, в виде дробных доз. Для парентерального введения используют, в основном, более низкие дозы. Так, например, для внутривенного введения может быть использована доза, составляющая, например, от 0,05-30 мг на кг массы тела. Аналогично, для введения соединения путем ингаляции может быть использована доза, составляющая, например, от 0,05 мг до 25 мг на кг массы тела.
Хотя соединения формулы (I), в основном, представляют собой терапевтические средства, предназначенные для введения теплокровным животным (включая человека), однако, они могут быть использованы во всех случаях, в которых требуется ингибирование действия PGE2 в рецепторе ЕР1, исходя из теста (а). Таким образом, эти соединения могут быть использованы в качестве фармакологических стандартов для разработки новых биологических тестов и новых фармакологических средств.
Благодаря своей способности устранять боль, соединения формулы I являются эффективными средствами для лечения некоторых воспалительных и невоспалительных заболеваний, которые в настоящее время лечат нестероидными противовоспалительными препаратами (НСПВС), ингибирующими действие циклооксигеназы, такими, как индометацин, кеторолак, ацетилсалициловая кислота, ибупрофен, сулиндак, толметин и пироксикам. Совместное введение соединения формулы I с НСПВС дает возможность снизить количество НСПВС, необходимое для продуцирования терапевтического эффекта. При этом, снижается также вероятность возникновения побочных эффектов, вызываемых НСПВС, например, желудочно-кишечных расстройств. Таким образом, в соответствии с другим своим отличительным признаком, обеспечивается фармацевтическая композиция, содержащая соединение формулы I, или его in vivo - гидролизуемые сложный эфир, или амид или его фармацевтически приемлемую соль в сочетании или в смеси с нестероидным противоспалительным средством, ингибирующим действие циклооксигеназы и фармацевтически приемлемым разбавителем или носителем.
Соединения настоящего изобретения могут быть также использованы в сочетании с другими противовоспалительныными средствами, такими, как ингибитор фермента 5-липоксигеназы (например, описанными в Европейских патентных заявках 0351194, 0375368, 0375404, 0375452, 0381375, 0385662, 0385663, 0385679, 0385680).
Соединения формулы (I) могут быть также использованы для лечения таких заболеваний, как ревматоидный артрит, с применением их в комбинации с противоартритными средствами, такими, как золото, метотрексат, стероиды, и пенициллинамин; а для лечения таких заболеваний, как остеоартрит, они могут быть использованы в комбинации со стероидами.
Соединения настоящего изобретения могут быть также введены при дегенеративных заболеваниях, например, при остеоартрите, в сочетании с хондропротективными, антидегенеративными и/или репаративными агентами, такими, как диацергеин, препараты гиалуроновой кислоты, такие, как гуалан (Hyalan), румалон (Rumalon), артепарон (Arteparon) и глюкозаминовые соли, такие, как антрил (Antril).
Композиции настоящего изобретения могут, кроме того, содержать одно или несколько других терапевтических средств или профилактических средств, которые, как известно, обладают болеутоляющим действием. Так, например, в фармацевтической композиции настоящего изобретения могут также присутствовать известные опиатные болеутоляющие средства (такие, как декстропропоксифен, дегидрокодеин или кодеин), или антагонисты других медиаторов боли или медиаторов воспаления, таких, как брадикинин, такикинин и пептиды, связанные с геном кальцитонина (CGRP), или агонист α2-адренорецептора, агонист GABAB-рецептора, блокатор кальциевых каналов, антагонист ССКB-рецептора, антагонист нейрокинина, или антагонист и модулятор действия глутамата NMDA-рецептор. Эти композиции могут быть использованы для устранения слабой, умеренной или даже, в случае использования некоторых комбинаций, сильной боли.
Соединения настоящего изобретения могут быть также введены при заболеваниях костей, таких, как остеопороз, в сочетании с кальцитонином и бифосфонатами.
Более подробно, настоящее изобретение проиллюстрировано в нижеследующих, но не ограничивающих его объема Примерах, в которых, если это не оговорено особо:
(i) выпаривание осуществляли в роторном вакуумном испарителе, а процедуры по обработке осуществляли после удаления остаточных твердых веществ путем фильтрации;
(ii) выходы даны лишь для иллюстрации, и не должны рассматриваться как максимально достижимые;
(iii) конечные продукты формулы I имеют удовлетворительные данные микроанализа, и их структуры были, в основном, подтверждены анализами, проводимыми методами ЯМР и масс-спектроскопии.
(iv) температуры плавления приводятся без поправок, и были определены с помощью автоматического специального прибора Mettler SP62 или прибора с использованием масляной бани; причем, температуры плавления для конечных продуктов были определены после перекристаллизации из стандартного органического растворителя, такого, как этанол, метанол, ацетон, эфир или гексан, взятых отдельно или в смеси друг с другом.
(v) при этом, были использованы следующие сокращения:
ДМФ - N,N-диметилформамид;
ТГФ - тетрагидрофуран;
ДМСО - диметилсульфоксид;
ТСХ - тонкослойная хроматография;
ЖХСД - жидкостная хроматография среднего давления.
ПРИМЕР 1
2-[N-(5-Бром-2-(2-хлораллилокси)бензил)-N-этиламино]-5-пиридилкарбоновая кислота
Раствор метил-2-[N-(5-бром-2-(2-хлораллилокси)-бензил-N-этиламино] -5-пиридилкарбоксилата (сравнительного примера 1) (0,8 г, 2,0 ммоль) в метаноле (3 мл) и ТГФ (3 мл) нагревали вместе с гидроксидом натрия (2 н. 5 мл). Реакционную смесь перемешивали в течение 18 часов при 40oС. Раствор выпаривали при пониженном давлении, и добавляли воду. Суспензию подкисляли уксусной кислотой и перемешивали в течение 30 минут. Осадок фильтровали и промывали водой, а затем осушали воздухом, в результате чего получали целевое соединение в виде белого твердого вещества (0,7 г).
Т. пл. 207-209oС.
МС (FАВ+): 425 (M+H)+.
ЯМР (200 МГц, ДMCO-d6) δ: 1,13 (т, 3Н), 3,61 (кв, 2Н), 4,77 (с, 2Н), 4,82 (с, 2Н), 5,55 (д, 1Н), 5,76 (д, 2Н), 6,65 (д, 1Н), 7,15 (м, 2Н), 7,41 (дд, 1Н), 8,62 (д, 1Н), 12,4 (шир. с, 1Н).
ПРИМЕР 2
Соединения, представленные в таблице 1, были получены способом, аналогичным описанному в Примере 1.
Примечания
а) Соединение, полученное из соединения Сравнительного Примера 2.
МС (FAB+): 405 (М+Н)+.
Элементный анализ:
Вычислено: (%) С 56,3; Н 5,22; N 6,91.
Найдено: (%) С 56,1; Н 5,3; N 6,7.
ЯМР (200 МГц, СDСl3) δ: 1,21 (t, J=7 Гц, 3Н), 1,44 (д, J=6 Гц, 3Н), 3,62 (кв, 2H), 4,75 (м, 3Н), 5,22 (м, 2H), 5,95 (м, 1Н), 6,42 (д, J=9 Гц, 1H), 6,75 (дд, J=3,8 Гц, 1Н), 7,13 (м, 1H), 7,26 (м, 1Н), 8,0 (м, 1Н), 8,87 (д, J=3 Гц, 1H).
b) Полученное из соединения Сравнительного Примера 2:
Т. пл. 167-169oС. МС (FAB+): 405 (М+Н)+.
Элементный анализ:
Вычислено (%): С 56,3; Н 5,22; N 6,91.
Найдено (%): С 56,1; Н 5,3; N 6,7.
ЯМР (смесь или Е+Z) δ: 1,12 (т, J=7 Гц, 3Н), 1,72 (дд, J=6,1 Гц, 3Н), 3,6 (кв, J=7 Гц, 2H), 4,55 (д, J=6 Гц, 1,6Н), 4,68 (м, 2,4Н), 5,75 (м, 2H), 6,63 (д, J=8 Гц, 1H), 7,0 (м, 2H), 7,38 (дд, J=3, 8 Гц, 1Н), 7,86 (дд, J=3,8 Гц, 1H), 8,62 (д, J=3 Гц, 1H), 12,38 (с, 1H).
с) Полученное из соединения Сравнительного примера 2:
Т. пл. 189-195oС.
МС (FAB+): 405 (М+Н)+.
Элементный анализ:
Вычислено (%): С 56,3; Н 5,22; N 6,91.
Найдено (%): С 56,3; Н 5,3; N 6,6.
ЯМР (200 МГц, ДМСО-d6) δ: 1,14 (т, J=7 Гц, 3Н), 1,8 (с, 3Н), 3,63 (кв, J=7 Гц, 2Н), 4,45 (с, 2Н), 4,98 (шир. с, 1Н), 5,1 (шир. с, 1Н), 6,64 (д, J=9 Гц, 1Н), 6,9 (д, J=9 Гц, 1Н), 7,03 (д, J=3 Гц, 1Н), 7,38 (дд, J=3, 8 Гц, 1Н), 7,92 [дд, J=8, 3 Гц, 1Н), 8,63 (д, J=3 Гц, 1H), 12,35 (шир. с., 1Н).
d) Полученное из соединения Сравнительного примера 2:
МС (FАВ+): 433 (М+Н)+.
ЯМР (200 МГц, ДМСО-d6) δ: 1,11 (т, J=7 Гц, 3Н), 1,61 (с, 3Н), 1,68 (с, 3Н), 2,41 (кв, J=7 Гц, 2Н), 3,59 (кв, J=7 Гц, 2Н), 4,00 (т, J=7 Гц, 2Н), 4,7 (с, 2Н), 5,21 (м, 1H), 6,64 (д, J=9 Гц, 1H), 6,98 (д, J=9 Гц, 1H), 7,05 (д, J= 2,5 Гц, 1H), 7,38 (дд, J=2,5, 9 Гц, 1H), 7,91 (дд, J= 2, 9 Гц, 1H), 8,61 (д, J=2 Гц, 1H).
е) Полученное из соединения Сравнительного примера 2:
МС (FАВ+): 433 (М+Na)+.
ЯМР (200 МГц, ДMCO-d6) δ: 1,09 (т, J=7 Гц, 3Н), 1,72 (с, 3Н), 1,75 (с, 3Н), 3,55 (м, 2Н), 4,61 (м, 4Н), 5,55 (м, 1H), 6,4 (д, J=9 Гц, 1H), 7,00 (м, 2Н), 7,35 (дд, J=3,9 Гц, 1H), 7,87 (дд, J=3, 9 Гц, 1H), 8,5 (д, J=3 Гц, 1Н).
f) Полученное из Сравнительного примера 2:
МС (FAB+): 405 (М+Н)+.
ЯМР (200 МГц, ДМСО-d6) δ: 1,11 (т, J=7 Гц, 3Н), 3,59 (кв, J=7 Гц, 2Н), 4,09 (т, J=6 Гц, 2Н), 4,71 (с, 2Н), 5,13 (м, 2Н), 5,90 (м, 1Н), 6,63 (д, J=9 Гц, 1Н), 7,03 (м, 2Н), 7,37 (дд, J=9 Гц, 2 Гц, 1Н), 7,91 (дд, J=2, 9 Гц, 1Н), 8,61 (д, J=2 Гц, 1Н), 12,37 (шир, с, 1Н). (2Н не проявляется растворителем).
g) Полученное из соединения Сравнительного примера 2:
Т. пл. 167oС. МС: 431 (М+Н)+.
ЯМР (200 МГц, ДМСО-d6) δ: 1,03 (т, J=7 Гц, 3Н), 1,65 (м, 4Н), 1,83 (м, 2Н), 3,51 (кв, J=7 Гц, 2Н), 4,6 (с, 2Н), 4,86 (м, 1Н), 5,76 (м, 1Н), 5,9 (м, 1Н), 6,54 (д, J=9 Гц, 1Н), 7,00 (м, 2Н), 7,29 (дд, J=2,5, 9 Гц, 1Н), 7,83 (дд, J=2,3 Гц, 9 Гц, 1Н), 8,52 (д, 2Н).
h) Полученное из соединения Сравнительного примера 4:
Т. пл. 94-100oС. МС: 445 (М+Н)+.
Элементный анализ:
Вычислено (%): С 59,3; Н 5,7; N 6,3.
Найдено (%): С 58,8; Н 5,7; N 6,0.
ЯМР (200 МГц, ДМСО-d6) δ: 1,1 (т, J=7 Гц, 3Н), 1,7 (м, 6Н), 1,95 (м, 13Н), 3,58 (кв, J=7 Гц, 2Н), 4,66 (с, 2Н), 4,9 (шир., с, 1H), 5,56 (шир.с, 1H), 6,62 (д, J=9 Гц, 1H), 7,07 (м, 2Н), 7,37 (дд, J=2 Гц, 1Н), 7,9 (дд, J= 2,9 Гц, 1H), 8,6 (д, J=2 Гц, 1H).
i) Полученное из соединения Сравнительного Примера 4:
МС: 485 (М+Н)+.
ЯМР (400 МГц, ДМСО-d6) δ: 1,10 (т, J=7 Гц, 3Н), 1,40 (м, 1H), 1,74 (м, 6Н), 1,9 (м, 1H), 2,07 (м, 1H), 2,20 (м, 1H), 2,35 (м, 1H), 3,62 (кв, J=7 Гц, 2Н), 4,77 (м, 5Н), 5,05 (м, 1H), 5,57 (м, 1H), 6,62 (д, J=9 Гц, 1H), 7,15 (м, 2Н), 7,44 (м, 1H), 7,94 (м, 1H), 8,65 (м, 1H), 12,35 (шир. с, 1H).
j) Полученное из соединения Сравнительного примера 4:
Т. пл. 94-98oС. МС (ХИ+): 473 (М+Н)-.
Элементный анализ:
Вычислено (%): С 60,9; Н 6,17; N 5,92.
Найдено (%): С 60,8; Н 6,2; N 6,1.
ЯМР (250 МГц, ДМСО-d6) δ: 0,95 (с, 3Н), 1,0 (с, 3Н), 1,1 (т, J=7 Гц, 3Н), 1,45 (м, 1H), 1,69 (с, 3Н), 1,8 (м, 3Н), 3,57 (кв, J=7 Гц, 2Н), 4,68 (с, 2Н), 4,93 (шир. с, 1H), 5,5 (шир. с, 1H), 6,6 (д, J=9 Гц, 1H), 7,04 (м, 2Н), 7,38 (дд, J=2, 9 Гц, 1H), 7,9 (дд, J=2, 9 Гц, 1H), 8,6 (д, J=2 Гц, 1H).
k) Полученное из соединения Сравнительного примера 2:
МС (ХИ+): 459 (M+H)+.
Элементный анализ:
Вычислено (%): С 47,0; Н 3,72; N 6,09.
Найдено (%): С 46,7; Н 3,5; N 5,9.
ЯМР (200 МГц, ДМСО-d6) δ: 1,13 (т, 3Н), 3,6 (кв, 2H), 4,75 (с, 2H), 5,0 (с, 2H), 6,62 (д, 1Н), 7,03 (с.), 7,05 (д, J=10 Гц) и 7,08 (д, J=2,6 Гц) (объединены с 3Н), 7,42 (дд, J=2,6, 10 Гц, 1Н), 7,91 (дд, J=2,6, 10 Гц, 1Н), 8,60 (д, J=2,5 Гц), 12,35 (шир. с, 1Н).
е) Полученное из соединения Сравнительного примера 2:
МС (ХИ+): 459 (М+Н)+.
Элементный анализ (%):
Вычислено: С 47,0; Н 3,72; N 6,09.
Найдено: C 47,2; H 3,2; N 5,8.
ЯМР (200 МГц, ДМСО-d6) δ: 1,13 (т, J=6,6 Гц, 3Н), 3,6 (кв., J=6,6 Гц, 2H), 4,75 (с, 2H), 4,9 (с, 1,7Н), 6,63 (д, J=10 Гц), 7,07 (м, 2H), 7,25 (с, 0,85Н), 7,4 (дд, J=2,6, 10 Гц, 1Н), 7,91 (дд, J=2,6, 10 Гц, 1Н), 8,60 (д, J= 2,6 Гц), 12,35 (шир. с, 1Н).
m) Получено из соединения Сравнительного Примера 6.
n) Получено из соединения Сравнительного примера 3.
o) Получено из соединения Сравнительного примера 4.
Т. пл. 122,2-124,4oС.
МС (ЭСП+): 406 (М+Н)+.
ЯМР (200 МГц, ДМСО-d6, HOAc-d4) δ: 1,13 (т, J=7 Гц, 3Н), 1,73 (с, 3Н), 3,63 (кв. , J=7 Гц, 2H), 4,5 (с, 2H), 4,81 (с, 2Н), 4,93 (с, 1H), 5,03 (с, 1Н), 6,93 (д, J=9 Гц, 1Н), 7,03 (д, J=9 Гц, 1Н), 7,08 (д, J=3 Гц, 1H), 7,33 (дд, J=3, 9 Гц, 1Н), 7,8 (д, J=9 Гц, 1Н).
p) Полученное из соединения Сравнительного примера 15:
МС (ЭСП+): 392/394 (М+Н)+.
ЯМР (250 МГц, ДМСО-d6) δ: 1,15 (т, 3Н), 3,17 (кв, 2Н), 4,64 (м, 2Н), 4,83 (с, 2Н), 5,25 (м, 1H), 5,42 (м, 1H), 6,05 (м, 1H), 7,0 (д, 1H), 7,1 (м, 2Н), 7,40 (дд, 1H), 7,83 (д, 1H).
g) Полученное из соединения Сравнительного примера 28:
ЯМР (200 МГц, ДМСО-d6) δ: 1,15 (т, 3Н), 1,7 (д, 3Н), 3,68 (кв, 2Н), 4,44 (д, 2Н), 4,66 (д, 2Н), 4,81 (с, 2Н), 5,55-5,75 (м, 1H), 5,74-5,95 (м, 1H), 7,00 (д, 1H), 7,04-7,15 (м, 2Н), 7,4 (дд, 1H), 7,82 (д, 1H).
ПРИМЕР 3
6-[N-(5-Бром-2-(2-хлорпроп-2-ен-1-илокси)бензил] -N-этил-амино] пиридазин-3-карбоновая кислота
н-Бутил-6-[N-(5-бром-2-(2-хлорпроп-2-ен-1-илокси)-бензил)-N-этиламино] пиридазин-3-карбоксилат (0,24 г, 0,5 ммоль) растворяли в метаноле (2 мл) и тетрагидрофуране (2 мл), а затем обрабатывали 2 миллилитрами 1 н. водного раствора гидроксида натрия. Полученный раствор оставляли на 1,5 часа при температуре окружающей среды, а затем выпаривали до небольшого объема, и полученный осадок растворяли в воде и подкисляли уксусной кислотой с получением смолистого осадка. После экстрагирования метиленхлоридом, органические экстракты осушали и выпаривали с образованием камеди. Это вещество растирали с эфиром и получали твердое вещество, которое фильтровали и осушали в вакууме, в результате чего получали целевое соединение в виде твердого белого продукта (0,16 г, 75%). МС: (FAB): 426, 428 (М+Н)+.
ЯМР (200 МГц, ДМСО-d6) δ: 1,15 (т, J=6,3 Гц, 3Н), 3,7 (кв., J=6,3 Гц, 2Н), 4,82 (с, 2Н), 4,88 (с, 2Н), 5,55 (д, J=1,25 Гц, 1Н), 5,75 (д, J=1,25 Гц, 1Н), 7,07 (д, J=9,6 Гц, 1Н), 7,12 (д, J=8,3 Гц, 1Н), 7,15 (д, J=2,1 Гц, 1Н), 7,43 (дд, J=2,1, 8,3 Гц, 1Н), 7,85 (д, J=9,6 Гц, 1Н).
ПРИМЕР 4
2-[N-(5-Бром-2-гидроксибензил)-N-этиламино]пиридин-5-карбоксамид
2-[N-(5-Бром-2-гидроксибензил)-N-этиламино] пиридин-5-карбоновую кислоту (Пример 7) (1,8 г, 5,1 ммоль) в тетрагидрофуране (40 мл) обрабатывали карбонилдиимидазолом (1,8 г, 11 ммоль) и нагревали с обратным холодильником в течение 4 часов. Полученную смесь охлаждали и добавляли к 0,88 М водному раствору аммиака (60 мл), а затем перемешивали в течение 1 часа при температуре окружающей среды, и выпаривали до небольшого объема. Образовавшееся белое твердое вещество разбавляли льдом/водой, фильтровали, промывали холодной водой, и осушали воздухом, в результате чего получали целевое соединение в виде белого твердого вещества (1,93 г, 100%). МС (ХИ+): 350, 352 (М+Н)+.
ПРИМЕР 5
5-[2-(N-(5-Бром-2-(2-хлорпроп-2-ен-1-илокси)бензил)-N-этиламино)-5-пиридил]тетразол
2-[N-(5-Бром-2-(2-хлорпроп-2-ен-1-илокси)бензил)-N-этиламино)-5-цианпиридин (сравнительный пример 8)(0,40 грамм, 0,96 ммоль) в осушенном молекулярными ситами N-метилпирролидоне (10 мл) обрабатывали азидом натрия (189 мг, 12,9 ммоль), а затем, хлоридом триэтиламмония (208 мг, 1,49 ммоль), и смесь нагревали при температуре 120oС (в масляной бане) в течение 8 часов. Красный раствор помещали в воду со льдом (12 мл), подкисляли концентрированной соляной кислотой до рН 1-2, два раза экстрагировали этилацетатом, а затем, объединенные экстракты дважды промывали водой, осушали сульфатом магния, и выпаривали, в результате чего получали светло-красную камедь (0,45 г). Эту камедь, предварительно адсорбированную на слое двуокиси кремния (1,2 г), очищали с помощью ЖХСД, в результате чего получали целевое соединение в виде бесцветной камеди (135 мг, 31%), которую затем отверждали. МС (ЭСП+): 449, 451 (М+Н)-.
ЯМР (200 МГц, ДМСО-d6) δ: 1,16 (т, J=6,7 Гц, 3Н), 3,65 (кв., J=6,7 Гц, 2Н), 4,78 (с, 2Н), 4,82 (с, 2Н), 5,57 (д, J=1,7 Гц, 1Н), 5,78 (д, J=1,7 Гц, 1Н), 6,85 (д, J=9,3 Гц, 1Н), 7,08 (д, J=9,3 Гц, 1Н), 7,11 (д, J=2,7 Гц, 1H), 7,42 (дд, J= 2,7, 9,3 Гц, 1Н), 8,02 (дд, J=2, 9,3 Гц, 1H), 8,7 (д, J=2 Гц, 1H).
ПРИМЕР 6
5-[2-(N-(5-Бром-2-(2-метилпроп-2-ен-1-илокси)бензил)-N-этиламино)-5-пиридил]тетразол
2-[N-(5-Бром-2-(2-метилпроп-2-ен-1-илокси)бензил)-N-этиламино] -5-цианопиридин (сравнительный пример 10) (0,45 г, 1,16 ммоль) в N-метилпирролидоне (12 мл) обрабатывали азидом натрия (228 мг, 3,5 ммоль), а затем, хлоридом триэтиламмония (251 мг, 1,8 ммоль), и полученную смесь нагревали при перемешивании при 120oС (в масляной бане) в течение 7 часов в атмосфере баллонного аргона. Полученный красный раствор выливали в воду со льдом (30 мл), подкисляли, и дважды экстрагировали этилацетатом (всего 50 мл). Объединенные органические экстракты дважды промывали водой, осушали сульфатом магния, и выпаривали в результате чего получали коричневую камедь. Эту камедь очищали посредством ЖХСД и получали целевое соединение в виде беловатой пены (150 мг, 30%).
МС (ЭСП+): 429, 431 (М+Н).
ЯМР (200 МГц, ДМСО-d6) δ: 1,27 (т, J=6,25 Гц, 3Н), 1,9 (с, 3Н), 3,73 (кв, J=6,25 Гц, 2Н), 4,64 (с, 2Н), 4,87 (с, 2Н), 5,08 (с, 1H), 5,2 (с, 1H), 6,91 [д, J= 8,75, 1H), 7,10 (д, J=8,3 Гц, 1H), 7,17 (s, J=2 Гц, 1H), 7,48 (дд, J=2, 8,3 Гц, 1H), 8,16 (дд, J=2, 8,75 Гц, 1H), 8,8 (д, J=2 Гц, 1H).
ПРИМЕР 7
2-[N-(5-Бром-2-гидроксибензил)-N-этиламино]пиридин-5-карбоновая кислота
Раствор метил-2-[N-(5-бром-2-гидроксибензил)-N-этиламино]пиридин-5-карбоксилата (см. сравнительный пример 7) (10,2 г, 0,55 ммоль) в ТГФ (3 мл) и метаноле (5 мл) обрабатывали 1 н. водным раствором гидроксида натрия (2,7 мл), и смесь нагревали до 40oС в течение 24 часов. Растворители выпаривали при пониженном давлении, и образовавшийся остаток обрабатывали 1 н. уксусной кислотой (2,7 мл), после чего, осадок фильтровали, промывали водой, и осушали воздухом, в результате чего получали целевое соединение (0,17 г, 92%).
МС (FAB+): 351 (М+Н)+.
ЯМР (200 МГц, ДМСО-d6) δ: 1,12 (т, J=7 Гц, 3Н), 3,6 (кв, J=7 Гц, 2Н), 4,64 (с, 2Н), 6,6 (д, J=9 Гц, 1Н), 6,83 (д, J=9 Гц, 1Н), 7,06 (д, J=2 Гц, 1Н), 7,23 (дд, J= 2, 9 Гц, 1Н), 7,92 (дд, J=2,9 Гц, 1Н), 8,59 (д, J=2 Гц, 1Н).
ПРИМЕР 8
6-[N-(5-Бром-2-гидроксибензил)-N-этиламино]пиридазин-3-карбоновая кислота
Раствор бутил-6-[N-(5-бром-2-гидроксибензил)-N-этиламино]пиридазин-3-карбоксилата (сравнительный пример 11) (0,36 г, 1,0 ммоль) в ТГФ (4 мл) и метаноле (4 мл) обрабатывали водным раствором гидроксида натрия (1 н, 4 мл), и выдерживали в течение полутора часов при температуре окружающей среды. Реакционную смесь выпаривали до небольшого объема, разводили водой, и подкисляли уксусной кислотой. После выдерживания в течение 18 часов, осадок фильтровали, промывали водой и эфиром, а затем осушали воздухом, и получали целевое соединение в виде белого твердого вещества (0,26 г, 71%). МС (ЭСП+): 352/354 (М+Н)+.
ЯМР (200 МГц, ДМСО-d6) δ: 1,15 (т, J=6,67 Гц, 3Н), 3,68 (кв, J=6,67 Гц, 2Н), 4,75 (с, 2Н), 6,83 (д, J=8,34 Гц, 1Н), 7,10 (д, J=8,34 Гц, 1Н), 7,13 (д, J= 2,33 Гц, 1H), 7,25 (дд, J=10,00, 2,33 Гц, 1Н), 7,83 (д, J=10,00 Гц, 1H).
Пример 9
5-[6-(N-(5-Бром-2-(2-метилпроп-2-ен-1-илокси)бензил)-N-этиламино)пиридазинил]тетразол
6-[N-(5-Бром-2-(2-метилпроп-2-ен-1-илокси)бензил)-N-этиламино] -3-цианопиридазин (сравнительного примера 13) (0,52 г, 1,34 ммоль) в N-метилпирролидоне (13 мл) обрабатывали азидом натрия (403 мг, 6,1 ммоль), а затем, хлоридом триэтиламмония (537 мг, 3,9 ммоль), после чего, смесь перемешивали в атмосфере аргона в течение 7 часов при 120oС. Эту смесь выливали в воду и подкисляли примерно до рН 2. Затем, смесь дважды экстрагировали этилацетатом, и объединенные органические экстракты дважды промывали водой, осушали, и выпаривали с образованием твердого вещества. Это твердое вещество очищали с помощью ЖХСД, и растирали со смесью (1:1) диэтилового эфира/этилацетата, в результате чего получали целевое соединение в виде беловатого твердого вещества (275 мг, 48%).
МС (ЭСП+): 430, 432 (М+Н)+.
ЯМР (ДМСО-d6) δ: 1,17 (т, J=8,3 Гц, 3Н), 1,77 (с, 3Н), 3,72 (кв, J=8,3 Гц, 2Н), 4,55 (с, 2Н), 4,85 (с, 2Н), 4,97 (с, 1Н), 5,08 (с, 1Н), 7,00 (д, J= 10,4 Гц, 1Н), 7,22 (д, J= 2,1 Гц, 1Н), 7,25 (д, J=10,4 Гц, 1Н), 7,40 (дд, J= 10,4, 2,1 Гц, 1Н), 8,0 (д, J=10,4 Гц, 1Н).
ПРИМЕР 10
5-[6-(N-(5-Бром-2-(циклогекс-2-енилокси)бензил)-N-этиламино] пиридазин-3-ил]тетразол
Целевое соединение получали из соединения Сравнительного примера 14 способом, аналогичным описанному в Примере 9, за исключением того, что очистку проводили с помощью ЖХСД, и получали камедь, которую отверждали путем выпаривания из дихлорметана, и которую затем растирали, фильтровали, и промывали диэтиловым эфиром и этилацетатом с получением белого твердого вещества (выход 43%).
МС (ЭСП+): 456, 458 (М+Н)+.
ЯМР (ДМСО-d6) δ: 1,15 (т, J=6,7 Гц, 3Н), 1,50-2,08 (3хм, 6Н), 3,7 (кв, J= 6,7 Гц, 2Н), 4,80 (с, 2Н), 4,93 (м, 1Н), 5,70-6,02 (м, 2Н), 7,10 (д, J=10 Гц, 1Н), 7,27 (дд, J=3,3, 10,00 Гц, 2Н), 7,40 (дд, J=8,3, 3,3 Гц, 1Н), 8,00 (д, J=10,0 Гц, 1Н).
ПРИМЕР 11
N-Пропансульфонил-6-[N-(5-бром-2-(2-метилпроп-2-ен-1-илокси)бензил)-N-этиламино]пиридазин-3-карбоксамид
6-[N-(5-Бром-2-(2-метилпроп-2-енилокси)бензил-N-этиламино] пиридазин-3-карбоновую кислоту (185 мг, 0,46 ммоль) растворяли в дихлорметане (20 мл), а затем добавляли 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид (EDAC), диметиламинопиридин (DMAP) (111 мг, 0,91 ммоль), и пропансульфонамид (68 мг, 0,55 ммоль). Полученную смесь перемешивали при температуре окружающей среды в атмосфере аргона в течение ночи, после чего, ТСХ (25% вода/СН3СН) указывала на завершение реакции. Реакционную смесь загружали непосредственно на ЖХСД-колонку (с двуокисью кремния), и после элюирования сначала 5% EtOH/СН2Сl2, а затем 5% EtOH/0,5% AcOH/CH2Cl2, было получено целевое соединение в виде прозрачного маслообразного вещества, которое отверждали путем растирания с гексаном, и получали бесцветный порошок (110 мг, 47%).
Т. пл. 113,5oС.
МС: 511 (М+Н)+.
Элементный анализ (%):
Вычислено: С 49,3; Н 5,32; N 11,0.
Найдено: С 49,1; Н 5,3; N 10,6.
ЯМР (200 МГц, ДМСО-d6) δ: 1,0 (т, 3Н), 1,2 (т, 3Н), 1,8 (м, 5Н), 3,4 (м, 2Н), 3,7 (кв, 2Н), 4,55 (с, 2Н), 4,90 (с, 2Н), 4,95 (с, 1Н), 5,1 (с, 1Н,) 7,0 (д, 1Н), 7,1 (м, 5Н), 7,4 (м, 1Н), 7,9 (д, 1Н).
ПРИМЕР 12
Соединения, представленные в таблице 2, были получены способом, описанным в Примере 11.
Примечания
а) Получено из соединения Примера 2:
Выход: 61%, т. пл. 162,5oС.
МС: 545 (М+Н)+.
Элементный анализ для C24H25BrN4O4S•1/2 H2O:
Вычислено (%): С 52,0; Н 4,69; N 10,1.
Найдено (%): С 51,7; Н 4,4; N 9,8.
ЯМР (МГц, ДМСО-d6) δ: 1,15 (т, 3Н), 1,8 (с, 3Н), 3,6 (кв, 2Н), 4,5 (с, 2Н), 4,8 (с, 2Н), 4,9 (с, 1Н), 5,1 (с, 1Н), 7,0 (м, 3Н), 7,2 (м, 1Н), 7,5 (м, 3Н), 7,7 (д, 1Н), 7,9 (д, 2Н).
b) Получено из соединения Примера 3:
Выход: 61%, т. пл. 153,8oС.
МС: 565 (М+Н)+.
Элементный анализ (%):
Вычислено: C 48,8; H 3,92; N 9,9.
Найдено: С 48,3; Н 3,7; N 9,8/
ЯМР (МГц, ДМСО-d6) δ: 1,15 (т, 3Н), 3,65 (кв, 2H), 4,75 (с, 2H), 4,8 (с, 2H), 5,5 (м, 1Н), 5,75 (м, 1Н), 7,1 (м, 3Н), 7,5 (м, 4Н), 7,75 (д, 1Н), 7,9 (м, 1Н).
c) Получено из соединения Примера 3:
Выход: 30%. Т. пл. 106,2oС.
МС: 532 (М+Н)+.
Элементный анализ (%):
Вычислено: С 45,2; Н 4,55; N 10,5.
Найдено: С 45,4; Н 4,2; N 10,1.
ЯМР (МГц, ДМСО-d6) δ: 1,0 (т, 3Н), 1,2 (т, 3Н), 1,7 (м, 2Н), 3,3 (м, 2Н), 3,7 (кв, 2Н), 4,8 (с, 2Н), 4,95 (м, 2Н), 5,6 (м, 1Н), 5,8 (м, 1Н), 7,1 (м, 3Н), 7,45 (м, 1Н), 7,8 (д, 1Н).
d) Получено из соединения Примера 16.1.
Выход: 19%. Т. пл. 105,2oС
Элементный анализ для C23H29BrN4O4S•1,5 H2O (%):
Вычислено: С 48,9; Н 5,6, N 9,9.
Найдено: С 49,2; Н 5,1; N 9,5.
ЯМР (МГц, ДМСО-d6) δ: 1,0 (м, 8Н), 1,8 (м, 8Н), 3,7 (кв, 2H), 4,8 (с, 2Н), 5,0 (м, 1Н), 5,8 (м, 1Н), 6,0 (м, 1Н), 7,1 (м, 3Н), 7,4 (м, 1Н), 7,8 (д, 1Н).
e) Получено из соединения Примера 16.1.
Выход: 28%. Т. пл. 148,9oС.
Элементный анализ для C25H27BrN4O4S3•1/2 H2O:
ЯМР (МГц, ДМСО-d6) δ: 1,1 (т, 3Н), 1,8 (м, 6Н), 3,6 (кв, 2H), 4,7 (с, 2H), 4,8 (м, 2H), 5,7 (м, 1Н), 5,9 (м, 1Н), 7,1 (м, 3Н), 7,4 (м, 1Н), 7,55 (м, 3Н), 7,7 (д, 1Н), 7,9 (м, 2H).
f) Получено из соединения Примера 2:
Выход: 80%. МС (ЭСП-): 550/552 (М+Н)+.
ЯМР (250 МГц, ДМСО-d6) δ: 1,14 (т, 3Н), 2,4 (с, 3Н), 2,6 (с, 3Н), 3,6 (кв, 2H), 4,62 (м, 2H), 4,86 (с, 2H), 5,25 (м, 1Н), 5,39 (м, 1Н), 6,0 (м, 1Н), 7,0 (д, 1Н), 7,13 (д, 1Н), 7,2 (д, 1Н), 7,4 (дд, 1Н), 7,82 (д, 1Н).
g) Получено из соединения Примера 2. Выход: 50%.
МС (ЭСП-): 596/598 (М+Н)+.
ЯМР (250 МГц, ДМСО-d6) δ: 1,14 (т, 3Н), 2,23 (с, 3Н), 3,46 (кв, 2Н), 4,6 (м, 2Н), 4,83 (с, 2Н), 5,23 (м, 1Н), 5,35 (м, 1Н), 6,00 (м, 1Н), 7,05 (д, 1Н), 7,25 (д, 1Н), 7,43 (дд, 1Н), 7,57 (д, 1Н), 8,05 (д, 1Н), 12,85 (шир. с, 1Н).
ПРИМЕР 13
N-Бензолсульфонил-2-[N-(5-бром-2-(2-метилпроп-2-ен-1-илокси)бензил)-N-этиламино]пиридин-5-карбоксамид
2-[N-(5-Бром-2-(2-метилпроп-2-ен-1-илокси)бензил)-N-этиламино] пиридин-5-карбоновую кислоту (200 мг, 0,49 ммоль) растворяли в дихлорметане (20 мл), и добавляли диметиламинопиридин (120 мг, 0,98 ммоль), EDAC (1,41 мг, 0,74 ммоль) и бензолсульфонамид (93 мг, 0,59 ммоль). Реакционную смесь перемешивали в течение ночи в атмосфере аргона при температуре окружающей среды, после чего, ТСХ (5% MeOH/CH2Cl2) свидетельствовала о завершении реакции.
После добавления разбавленной соляной кислоты (1 М, 40 мл) и воды (40 мл), реакционную смесь экстрагировали дихлорметаном (3•90 мл). Объединенные органические слои промывали водой (40 мл), осушали сульфатом магния, и концентрировали путем выпаривания. В результате очистки с помощью ЖХСД (двуокись кремния, 2,5% EtOH/CH2Cl2 --> 5% EtOH/CH2Cl2) было получено прозрачное маслообразное вещество, которое отверждали при растирании с эфиром и гексаном, в результате чего получали целевое соединение в виде белого порошка (26%). Т. пл. 192,8oС.
МС: 544 (М+Н)+, 566 (М+Na)+.
Элементный анализ (%):
Вычислено: С 55,2; Н 4,81; N 7,72.
Найдено: С 55,3; Н 5,0; N 7,4.
ЯМР (МГц, ДМСО-d6) δ: 1,1 (т, 3Н), 1,8 (с, 3Н), 3,6 (кв, 2Н), 4,55 (с, 2Н), 4,8 (с, 2Н), 5,0 (с, 1Н), 6,6 (д, 1Н), 7,0 (м, 2Н), 7,3 (дд, 1Н), 7,6 (м, 3Н), 7,9 (м, 3Н), 8,55 (с, 1Н).
ПРИМЕР 14
Соединения, представленные в таблице 3, были получены способом, аналогичным описанному в Примере 13.
Примечания
а) Получено из соединения примера 2.14. Выход: 36%. Т. пл. 125,5oС.
МС: 510 (M+H)+, 532 (M+Na)+.
ЯМР (МГц, ДМСО-d6) δ: 1,0 (т, 3Н), 1,15 (т, 3Н), 1,7 (м, 2Н), 1,8 (с, 3Н), 3,45 (м, 2Н), 3,6 (м, 2Н), 4,55 (с, 2Н), 4,75 (с, 2Н), 5,0 (с, 1Н), 5,1 (с, 1Н), 6,6 (д, 1Н), 7,0 (м, 2Н), 7,4 (м, 1Н), 8,0 (м, 1Н), 8,6 (д, 1Н), 11,65 (шир. с., 1Н).
b) Получено из соединения Примера 1: Выход: 59%. Т. пл. 192,4oС.
МС: 564 (M+H)+, 586 (М+Na)+.
ЯМР (МГц, ДМСО-d6) δ: 1,1 (т, 3Н), 3,6 (кв, 2Н), 4,75 (с, 2Н), 5,55 (м, 1Н), 5,8 (м, 1Н), 6,6 (д, 1Н), 7,05 (м, 2Н), 7,6 (м, 3Н), 8,6 (м, 1Н), 12,1 (шир. с, 1Н).
с) Получено из соединения примера 1. Выход: 56%. Т. пл. l45,4oC.
МС: 530 (М+Н)+, 553 (М+Na)+.
ЯМР (МГц, ДМСО-d6) δ: 1,0 (т, 3Н), 1,2 (т, 3Н), 1,8 (м, 2Н), 3,5 (м, 2Н), 3,7 (кв, 2Н), 4,75 (д, 4Н), 5,55 (д, 1Н), 5,8 (м, 1Н), 6,65 (д, 1Н), 7,0 (м, 2Н), 7,4 (м, 1Н), 8,0 (м, 1Н), 8,6 (д, 1Н).
ПРИМЕР 15
6-[N-(5-Бром-2-(2-метилпроп-2-ен-1-илокси)бензил)-N-этиламино] пиридазин-3-карбоновая кислота
6-[N-(5-Бром-2-гидроксибензил)-N-этиламино]-пиридазин-3-карбоксамид (843 мг, 2,4 ммоль) растворяли в ДМФ (15 мл) и в течение 10 минут по капле добавляли к суспензии гидрида натрия (192 мг, 2,88 ммоль, 60%-ная дисперсия в минеральном масле) в ДМФ (15 мл) и тетраметиленэтилендиамине (TMEDA) (0,72 мл, 8 ммоль) в атмосфере аргона. Полученную смесь перемешивали в течение одного часа, а затем добавляли 3-хлор-2-метилпроп-1-ен (0,47 мл, 5,59 ммоль), и смесь нагревали до температуры 100oС и выдерживали при этой температуре в течение 16 часов. Затем, смесь охлаждали до температуры окружающей среды, выливали в воду (150 мл) и подкисляли уксусной кислотой до рН 5. Водную смесь экстрагировали этилацетатом (3•120 мл), и объединенные органические слои промывали 50% солевым раствором (100 мл), осушали сульфатом магния, и выпаривали, в результате чего получали светло-желтое маслообразное вещество.
Полученное вещество очищали с помощью ЖХСД на двуокиси кремния (50% EtOAc/гексан) и получали 6-[N-(5-бром-2-(2-метилпроп-2-ен-1-илокси)бензил] -N-этиламино] -пиридазин-3-карбоксамид в виде бесцветной пены (440 мг, 40%). МС: 405 (М+Н)+.
ЯМР (МГц, ДМСО-d6) δ: 1,3 (т, 3Н), 1,8 (с, 3Н), 3,8 (кв, 2Н), 4,4 (с, 2Н), 4,8 (с, 2Н), 5,0 (м, 1Н), 5,1 (м, 1Н), 5,6 (шир. с, 1Н), 6,9 (м, 2Н), 7,1 (д, 1Н), 7,3 (м, 1Н), 7,7 (шир. с., 1Н), 7,9 (д, 1Н).
6-[N-(5-Бром-2-(2-метилпроп-2-ен-1-илокси)бензил)-N-этиламино] пиридазин-3-карбоксамид (430 мг, 1,09 ммоль) растворяли в ТГФ/метаноле (30 мл, 1: 1) и добавляли раствор гидроксида натрия (2,9 мл, 2 М, 5,8 ммоль). Полученную смесь нагревали с обратным холодильником в течение 72 часов, после чего охлаждали, и выпаривали. Остаток растворяли в воде (25 мл) и добавляли уксусную кислоту до рН 4. Раствор перемешивали в течение 16 часов, а затем, бесцветный осадок собирали путем фильтрации, промывали водой, и осушали в вакууме, в результате чего получали целевое соединение в виде бесцветного порошка (387 мг, 87%).
МС: 406 (М+Н)+.
ЯМР (МГц, ДМСО-d6) δ: 1,0 (т, 3Н), 1,7 (с, 3Н), 3,6 (кв., 2Н), 4,4 (с, 2Н), 4,7 (с, 2Н), 4,85 (с, 1Н), 5,0 (с, 1Н), 6,9 (д, 1Н), 7,0 (м, 2Н), 7,3 (м, 1Н), 7,7 (д, 1Н).
ПРИМЕР 16
Соединения представленные в таблице 4, получали способом, описанным в Примере 15.
а) ЯМР (ДМСО-d6) δ: 1,15 (т, 3Н), 3,6 (кв, 2Н), 4,75 (с, 2Н), 4,85 (с, 2Н), 5,5 (м, 1Н), 5,75 (м, 1Н), 7,1 (м, 3Н), 7,4 (м, 2Н), 7,8 (д, 1Н).
b) ЯМР (ДМСО-d6) δ: 1,1 (т, 3Н), 1,7 (м, 3Н), 2,0 (м, 3Н), 3,7 (кв, 2Н), 4,7 (с, 2Н), 4,9 (м, 1Н), 5,8 (м, 1Н), 6,0 (м, 1Н), 7,0 (м, 3Н), 7,3 (м, 1Н), 7,8 (д, 1Н).
ПРИМЕР 17
N-(3,5-Диметилизоксазол-4-илсульфонил)-6-[N-(5-бром-2-(2-метилпроп-2-ен-1-илокси)бензил)-N-этиламино]пиридазин-3-карбоксамид
6-[N-(5-Бром-2-(2-метилпроп-2-ен-1-илокси)бензил)-N-этиламино] пиридазин-3-карбоновую кислоту (пример 2, соединение 15) (187 мг, 0,46 ммоль) растворяли в дихлорметане (20 мл), а затем добавляли гидрохлорид (1-(3-ди-метиламинопропил)-3-этилкарбодиимида (EDAC) (133 мг, 0,69 ммоль), диметиламинопиридин ((DMAP) (113 мг, 0,92 ммоль), и 3,5-диметилизоксазол-4-илсульфонамид (98 мг, 0,56 ммоль). Смесь перемешивали при температуре окружающей среды в атмосфере аргона в течение 72 часов, после чего, ТСХ (25% вода/метанол) указывала на то, что реакция была завершена. Реакционную смесь загружали непосредственно на ЖХСД-колонку (с двуокисью кремния), и целевое соединение в виде камеди, полученное после элюирования (сначала 2,5% этанолом/дихлорметаном, а затем 0,5% уксусной кислотой/2,5% этанолом/дихлорметаном), растирали с гексаном, и получали целевой продукт в виде твердого вещества (98 мг, 38%).
Т. пл. 119,8oС.
МС (ЭСП+): 564 (М+Н)+.
Элементный анализ для C22H26BrN5O5S (%):
Вычислено: С 48,9; Н 4,64; N 12,4.
Найдено: С 48,3; Н 4,6; N 12,0.
ЯМР (250 МГц, ДМСО-d6) δ: 1,15 (т, J=7 Гц, 3Н), 1,8 (м, 2Н), 2,35 (с, 3Н), 2,65 (с, 3Н), 3,7 (кв, J=7 Гц, 2Н), 4,5 (с, 2Н), 4,8 (с, 2Н), 4,95 (с, 1Н), 5,15 (с, 1Н), 7,0 (д, J=8,5 Гц, 1Н), 7,15 (м, 2Н), 7,4 (дд, J=2,8 Гц, 1Н), 7,8 (д, J=8,5 Гц, 1Н).
ПРИМЕР 18
6-[N-(5-Хлор-2-(2-метилпроп-2-ен-1-илокси)бензил)-N-этиламино]пиридазин-3-карбоксамид
Смесь N-этил-5-хлор-2-(2-метилпроп-2-ен-1-илокси)-бензиламина (сравнительного примера 16) (13,8 г, 50 мМ), 6-хлорпиридазин-3-карбоксамида (7,9 г, 50 мМ), и диизопропилэтиламина (20,0 мл, 115 мМ) в ДМФ (50 мл) перемешивали или нагревании с обратным холодильником в течение 16 часов. Полученную смесь охлаждали и разводили водой (200 мл), в результате чего образовывалось маслообразное вещество, которое оставляли для отстаивания (1 час). Надосадочную жидкость сливали, а оставшуюся коричневую камедь растворяли в дихлорметане (250 мл) и промывали 2 н. соляной кислотой (100 мл). Органический слой элюировали на двуокиси кремния (растворитель: дихлорметан-изопропанол, 19:1), а затем, нужные фракции собирали, объединяли, и выпаривали, в результате чего получали целевое соединение в виде камеди (10,5 г, 58%).
МС (ЭСП+): 361/362 (М+Н)+.
ЯМР (200 МГц, ДМСО-d6) δ: 1,17 (т, J=7 Гц, 3Н), 1,80 (с, 3Н), 3,90 (кв, J= 7 Гц, 2Н), 4,55 (с, 2Н), 4,85 (с, 2Н), 4,98 (с., 1Н), 5,10 (с, 1Н), 7,00 (д, J=2 Гц, 1Н), 7,05 (д, J=9 Гц, 1Н), 7,14 (д, J=9 Гц, 1Н), 7,28 (дд, J=2,9 Гц, 1Н), 7,47 (широкий с., 1Н), 7,87 (д, J=9 Гц, 1Н), 8,10 (широкий синглет, 1Н).
ПРИМЕР 19
6-[N-(5-Хлор-2-(2-метилпроп-2-ен-1-илокси)бензил)-N-этиламино] пиридазин-3-карбоновая кислота
Смесь 6-[N-(5-хлор-2-(2-метилпроп-2-ен-1-илокси)-бензил)-N-этиламино]пиридазин-3-карбоксамида (пример 18) (10,05 г, 29,3 моль) и жидкого каустика (40 мас. %, 10 мл, 100 ммоль) в этаноле (150 мл) перемешивали в течение 16 часов при нагревании с обратным холодильником. После выпаривания растворителя при пониженном давлении, остаток распределяли между 2 н. соляной кислотой (70 мл) и дихлорметаном (200 мл). Органический слой осушали безводным сульфатом магния, фильтровали, и выпаривали, в результате чего получали коричневую камедь (10,0 г), которую снова растворяли в эфире (200 мл), и медленно кристаллизовали в течение 12 часов, в результате чего было получено целевое соединение в виде светло-желтого твердого вещества (4,6 г, 45%), т. пл. 130-131oС.
МС (ЭСП+): 362/264 (М+Н)+.
ЯМР (200 МГц, ДМСО-d6) δ: 1,17 (т, 7 Гц, 3Н), 1,78 (с, 3Н), 3,70 (кв, J= 7 Гц, 2Н), 4,55 (с, 2Н), 4,85 (с, 2Н), 4,98 (с, 1Н), 5,08 (с, 1Н), 7,02 (д, J= 2 Гц, 1Н), 7,05 (д, J=8 Гц, 1Н), 7,12 (д, J=9 Гц, 1Н), 7,27 (дд, J=2, 8 Гц, 1Н), 7,83 (д, J=9 Гц, 1Н).
ПРИМЕР 20
N-(2-(Пирролидино)этансульфонил)-6-[N-(5-хлор-2-(2-метилпроп-2-ен-1-илокси)бензил)-N-этиламино]пиридазин-3-карбоксамид
Смесь 6-[N-(5-хлор-2-(2-метилпроп-2-ен-1-илокси)бензил)-N-этиламино] пиридазин-3-карбоновой кислоты (пример 19) (2,0 г, 5,5 ммоль), 2-(пирролидино)этанпиридина (20 ммоль) и гидрохлорида этил-диметиламинопропилкарбодиимида (7,8 ммоль) в дихлорметане (25 мл), содержащем ДМФ (5 мл), перемешивали при температуре 40oС в течение 16 часов. Смесь разводили дихлорметаном (50 мл) и водой (50 мл), после чего перемешивали в течение 10 минут, и органический слой отделяли, промывали водой (50 мл), а затем осушали безводным сульфатом магния. После хроматографии на двуокиси кремния (элюент: 5% метанол в дихлорметане) было получено целевое соединение (1,2 г, 42%).
МС (ЭСП+): 522/524 (М+Н)+.
ЯМР (200 МГц, ДМСО-d6) δ: 1,16 (т, J=7 Гц, 3Н), 1,78 (с, 3Н), 2,00 (шир. , с., 4Н), 3,20 (м, 2Н), 3,30 (широкий с., 4Н), 3,50 (м, 2Н), 3,67 (кв, J=7 Гц, 2Н), 4,53 (с, 2Н), 4,81 (с, 2Н), 4,98 (с, 1Н), 5,08 (с, 1Н), 6,95-7,25 (м, 4Н), 7,82 (д, J=8 Гц, 1Н).
Пример 21
N-(2-(Морфолино)этаносульфонил)-6-[N-(5-хлор-2-(2-метилпроп-2-ен-1-илокси) бензил)-N-этиламино]пиридазин-3-карбоксамид
Целевое соединение получали в результате реакции 6-[N-(5-хлор-2-(2-метилпроп-2-енилокси)бензил)-N-этиламинов пиридазин-3-карбоновой кислоты (Примера 19) и 2-(морфолино)этансульфонамида способом, описанным в Примере 20 (выход: 43%).
МС (ЭСП+): 538/540 (М+Н)+.
ЯМР (200 МГц, ДМСО-d6) δ: 1,17 (т, J=7 Гц, 3Н), 1,78 (с, 3Н), 2,55 (м, 4Н), 2,87 (т, J=6 Гц, 2Н), 3,40 (т, J=6 Гц, 2Н), 3,55 (м, 4Н), 3,68 (кв, J=7 Гц, 2Н), 4,53 (с, 2Н), 4,83 (с, 2Н), 4,97 (с, 1Н), 5,08 (с, 1Н), 6,97 (д, J= 2 Гц, 1Н), 7,03 (д, J=8 Гц, 1Н), 7,12 (д, J=8 Гц, 1Н), 7,25 (дд, J=2, 8 Гц, 1Н), 7,86 (д, J=8 Гц, 1Н).
ПРИМЕР 22
6-[N-(5-Фтор-2-(2-метилпроп-2-ен-1-илокси)бензил)-N-этиламино]пиридазин-3-карбоновая кислота
Целевое соединение получали из соединения Сравнительного примера 17 способом, описанным в Примере 1 (выход 74%), т. пл. 121-122oС.
МС (ЭСП+): 344 (М+Н)-.
ЯМР (200 МГц, ДМСО-d6) δ: 1,18 (т, J=7 Гц, 3Н), 1,80 (с, 3Н), 3,70 (кв, J= 7 Гц, 2Н), 4,52 (с, 2Н), 4,85 (с, 2Н), 4,97 (с, 1Н), 5,10 (с, 1Н), 6,80 (дд, J=2, 8 Гц, 1Н), 7,0-7,13 (м, 3Н), 7,83 (д, J=8 Гц, 1Н).
Анализ (%):
Вычислено %: С 62,6; Н 5,8; N 12,2.
Найдено %: С 62,7; Н 5,9; N 11,9.
ПРИМЕР 23
6-[N-(5-Хлор-2-(циклогексен-3-илокси)бензил)-N-этиламино] пиридазин-3-карбоновая кислота
Целевое соединение получали из соединения Сравнительного примера 18 способом, описанным в Примере 1. Продукт экстрагировали дихлорметаном, осушали безводным сульфатом магния, и растирали с эфиром и гексаном (выход: 38%).
МС (ЭСП+): 388/390 (М+Н)+.
ЯМР (200 МГц, ДМСО-d6) δ: 1,13 (т, 3Н), 1,70 (м, 3Н), 1,85 (м, 1Н), 2,00 (шир. с, 2Н), 3,65 (кв, 2Н), 4,75 (с, 2Н), 4,90 (шир. с, 1Н), 5,80 (дд, 1Н), 5,94 (дт, 1Н), 7,04 (д, 1Н), 7,07 (д, 1Н), 7,13 (д, 1Н), 7,25 (дд, 1Н), 7,80 (д, 1Н).
ПРИМЕР 24
N-(3,5-Диметилизоксазол-4-илсульфонил)-6-[N-(5-хлор-2-(циклогексен-3-илокси)бензил)-N-этиламино]пиридазин-3-карбоксамид
Целевое соединение было получено из 6-[N-(5-хлор-2-(циклогексен-3-илокси)бензил-этиламино-3-пиридазин-3-карбоновой кислоты (пример 23) и 3,5-диметилизоксазол-4-илсульфонамида способом, описанным в Примере 11 (выход 22%).
МС (ЭСП+): 546/548 (М+Н)+.
ЯМР (200 МГц, ДМСО-d6) δ: 1,12 (т, 3Н), 1,20 (м, 3Н), 1,95 (м, 3Н), 2,35 (с, 3Н), 2,63 (с, 3Н), 3,65 (кв, 2Н), 4,77 (с, 2Н), 4,88 (шир. с, 1Н), 5,77 (дд, 1Н), 5,93 (дт, 1Н), 7,02 (д, 1Н), 7,10 (д, 1Н), 7,12 (д, 1Н), 7,25 (дд, 1Н), 7,76 (д, 1Н).
ПРИМЕР 25
5-[6-(N-[5-Хлор-2-(2-метилпроп-2-ен-1-илокси)бензил] -N-этиламино)пиридазин-3-ил]тетразол
К 6-[N-(5-xлop-2-(2-метилпроп-2-ен-1-илокси)бензил)-N-этиламино]-3-цианопиридазин] (сравнительный пример 19) в 1-метил-2-пирролидиноне (10 мл) добавляли азид натрия (330 мг, 5,1 ммоль) и гидрохлорид триэтиламина (320 мг, 0,2 ммоль), а затем, раствор перемешивали в течение 3 часов при 150oС. После добавления воды (50 мл), раствор подкисляли ледяной уксусной кислотой до рН 2. Полученный осадок выделяли, растворяли в дихлорметане, осушали безводным сульфатом магния, фильтровали, и растворитель удаляли в вакууме, в результате чего получали коричневое маслообразное вещество (140 мг). После растирания с эфиром было получено целевое соединение (50 мг, 17%) в виде кристаллов.
МС (ЭСП+): 386/388 (МН+).
ЯМР (200 МГц, ДМСО-d6) δ: 1,16 (т, 3Н), 1,28 (с, 3Н), 3,71 (кв, 2Н), 4,54 (с, 2Н), 4,85 (с, 2Н), 4,97 (2, 1Н), 5,08 (с, 1Н), 7,05 (м, 2Н), 7,27 (м, 2Н), 8,02 (д, 1Н).
ПРИМЕР 26
N-(3-5-Диметилизоксазол-4-илсульфонил)-6-[N-(5-хлор-2-(2-метилпроп-2-ен-1-илокси)бензил)N-этиламино]-пиридазин-3-карбоксамид
Целевое соединение получали из 6-[N-(5-хлор-2-(2-метилпроп-2-ен-1-илокси)бензил)-N-этиламино] пиридазин-3-карбоновой кислоты (пример 19), (210 мг, 0,58 ммоль)) и 3,5-диметилизоксазол-4-илсульфонамида способом, описанным в Примере 11. Это целевое соединение очищали с помощью колоночной хроматографии (элюент: 5% пропан-2-ол в дихлорметане) (80 мг, 27%).
МС (ЭСП+): 520/522 (МН+).
ЯМР (200 МГц, ДМСО-d6) δ: 1,13 (т, 3Н), 1,78 (с, 3Н), 2,28 (с, 3Н), 2,55 (с, 3Н), 3,62 (кв, 2Н), 4,02 (с, 2Н), 4,78 (2, 2Н), 4,98 (с, 1Н), 5,08 (с, 1Н), 6,92 (м, 2Н), 7,03 (д, 1Н), 7,24 (дд, 1Н), 7,81 (д, 1Н).
ПРИМЕР 27
N-(Трифторметансульфонил)-6-[N-(5-хлор-2-(2-метилпроп-2-ен-1-илокси)бензил)-N-этиламино]пиридазин-3-карбоксамид
Целевое соединение получали из 6-[N-(5-хлор-2-(2-метилпроп-2-ен-1-илокси)бензил)-N-этиламино] пиридазин-3-карбоновой кислоты (пример 19) и трифторметансульфонамида способом, описанным в Примере 11 (18%).
МС (ЭСП+): 493/495 (МН+).
ЯМР (200 МГц, ДМСО-d6) δ: 1,18 (т, 3Н), 1,80 (с, 3Н), 3,65 (кв, 2Н), 4,55 (с, 2Н), 4,83 (с, 2Н), 4,97 (с, 1Н), 5,10 (с, 1Н), 6,95 (д, 1Н), 7,02 (м, 2Н), 7,25 (дд, 1Н), 7,80 (д, 1Н).
Пример 28
N-(2-Карбоксифенил)-6-[N-(5-хлор-2-(2-метилпроп-2-ен-1-илокси)бензил)-N-этиламино]пиридазин-3-карбоксамид
Целевое соединение получали из N-(2-метоксикарбонилфенил)-6-[N-(5-хлор-2-(2-метилпроп-2-ен-1-илокси)бензил)-N-этиламино] пиридазин-3-карбоксамида способом, описанным в Примере 1 (19%).
МС (ЭСП+): 481/483 (МН+).
ЯМР (200 МГц, ДМСО-d6) δ: 1,18 (т, 3Н), 1,79 (с, 3Н), 3,72 (кв, 2Н), 4,53 (с, 2Н), 4,88 (с, 2Н), 4,97 (с, 1Н), 5,08 (с, 1Н), 6,98 (д, 1Н), 7,03 (д, 1Н), 7,20 (м, 3Н), 7,62 (тд, 1Н), 7,95 (д, 1Н), 8,04 (дд, 1Н), 8,81 (д, 1Н), 12,86 (с, 1Н).
ПРИМЕР 29
N-(1-Карбоксиэтил)-6-[N-(5-хлор-2-(2-метилпроп-2-ен-1-илокси)бензил)-N-этиламино]пиридазин-3-карбоксамид
Целевое соединение в виде камеди получали из N-(1-метоксикарбонилэтил)-6-[N-(5-хлор-2-(2-метилпроп-2-ен-1-илокси)бензил)-N-этиламино]пиридазин-3-карбоксамида способом, описанным в Примере 1 (выход: 15%).
МС (ЭСП+), 433/435 (МН+).
ЯМР (200 МГц, ДМСО-d6) δ: 1,15 (т, 3Н), 1,42 (д, 3Н), 1,78 (с, 3Н), 3,69 (кв, 2Н), 4,45 (дт, 1Н), 4,55 (с, 2Н), 4,85 (с, 2Н), 4,98 (с, 1Н), 5,10 (с, 1Н), 6,97 (д, 1Н), 7,04 (д, 1Н), 7,17 (д, 1Н), 7,83 (д, 1Н), 8,73 (д, 1Н).
Пример 30
N-(α-Карбоксибензил)-6-[N-(5-хлор-2-(2-метилпроп-2-ен-1-илокси)бензил)-N-этиламино]пиридазин-3-карбоксамид
Целевое соединение получали из N-(α-метоксикарбонилбензил)-6-[N-(5-хлор-2-(2-метилпроп-2-ен-1-илокси)-бензил)-N-этиламино] пиридазин-3-карбоксамида способом, описанным в Примере 1 (13%).
МС (ЭСП+): 495/497 (МН+).
ЯМР (200 МГц, ДМСО-d6) δ: 1,17 (т, 3Н), 1,24 (с, 3Н), 3,70 (кв, 2Н), 4,53 (с, 2Н), 4,83 (с, 2Н), 4,97 (с, 1Н), 5,08 (с, 1Н), 5,55 (д, 1Н), 7,45 (м, 9Н), 7,81 (д, 1Н), 8,89 (д, 1Н).
ПРИМЕР 31
N-(3,5-Диметилизоксазол-4-илсульфонил)-6-[N-(5-хлор-2-аллилоксибензил)-N-этиламино]пиридазин-3-карбоксамид
Целевое соединение получали из соответствующей карбоновой кислоты способом, описанным в Примере 12, за исключением того, что очистку проводили с помощью колоночной хроматографии в пропан-2-оле, метановой кислоте, и дихлорметане, а затем, соединение растирали с диэтиловым эфиром (250 мг, 33%).
МС (ЭСП+): 506/508.
ЯМР (250 МГц, ДМСО-d6) δ: 1,13 (т, 3Н), 2,27 (с, 3Н), 2,58 (с, 3Н), 3,64 (кв, 2Н), 4,63 (м, 2Н), 4,78 (с, 2Н), 5,28 (дд, J=10 Гц, 2 Гц, 1Н), 5,43 (дд, J= 16 Гц, 2 Гц, 1Н), 6,04 (м, 1Н), 6,95 (д, J=2 Гц, 1Н), 6,97 (д, J=8 Гц, 1Н), 7,03 (д, J=8 Гц, 1Н), 7,24 (дд, J=2 Гц, 8 Гц, 1Н), 7,79 (д, J=8 Гц, 1Н).
ПРИМЕР 32
6-[N-(5-Хлор-2-аллилоксибензил)-N-этиламино]пиридазин-3-карбоксамид
Целевое соединение получали способом, аналогичным описанному в Примере 18 (4,0 г, 35%).
МС (ЭСП+): 347/349 (МН+).
ЯМР (250 МГц, ДМСО-d6) δ: 1,16 (т, 3Н), 3,67 (кв, 2Н), 4,64 (м, 2Н), 4,81 (с, 2Н), 5,27 (дд, J=10 Гц, 2 Гц, 1Н), 5,42 (дд, J=16 Гц, 2 Гц, 1Н), 6,04 (м, 1Н), 6,99 (д, J=2 Гц, 1Н), 7,05 (д, J=8 Гц, 1Н), 7,13 (д, J=9 Гц, 1Н), 7,25 (дд, J=2 Гц, 8 Гц, 1Н), 7,41 (шир. с, 1Н), 7,82 (д, J=9 Гц, 1Н), 8,06 (шир. с, 1Н).
ПРИМЕР 33
6-[N-(5-Хлор-2-аллилоксибензил)-N-этиламино] пиридазин-3-карбоновая кислота
Целевое соединение получали из соответствующего амида (примера 32) способом, описанным в Примере 19, за исключением того, что полученное вещество кристаллизовали из дихлорметана/диэтилового эфира/гексана, а затем растирали с диэтиловым эфиром (900 мг, 45%). МС (ЭСП+): 348/350 (МН+).
ЯМР (250 МГц, ДМСО-d6) δ: 1,15 (т, 3Н), 3,70 (кв, 2Н), 4,63 (м, 2Н), 4,83 (с, 2Н), 5,27 (дд, J=10 Гц, 2Гц, 1Н), 5,40 (дд, J=16 Гц, 2 Гц, 1Н), 6,04 (м, 1Н), 7,00 (д, J=2 Гц, 1H), 7,05 (д, J=8 Гц, 1Н), 7,10 (д, J=8 Гц, 1Н), 7,26 (дд, J=2 Гц, 8 Гц, 1Н), 7,83 (д, J=8 Гц, 1Н).
ПРИМЕР 34
N-(4-Метилтиазол-5-илсульфонил)-6-[N-(5-бром-2-(2-метилпроп-2-ен-1-илокси)бензил)-N-этиламино]пиридазин-3-карбоксамид
Целевое соединение получали из соединения 15 Примера 2 способом, описанным в Примере 13 (выход: 54%).
Т. пл. 127,8oС.
МС: 566 (М+Н)+, 588 (М+Na)+.
ЯМР (250 МГц, ДМСО-d6) δ: 1,15 (т, 3Н), 1,8 (с, 3Н), 2,35 (с, 3Н), 3,7 (кв, 2Н), 4,5 (с, 2Н), 4,65 (с, 2Н), 4,95 (с, 1Н), 5,05 (с, 1Н), 7,0 (д, 1Н), 7,1 (д, 1Н), 7,3 (д, 1Н), 7,4 (дд, 1Н), 7,8 (д, 1Н), 9,25 (с, 1Н).
Элементный анализ для C22H24BrN5О4S2 (%):
Вычислено: С 46,6; Н 4,27; N 12,4.
Найдено: С 46,5; Н 4,3; N 12,5.
ПРИМЕР 35
5-[6-(N-[5-Бром-2-(2-метилпроп-2-ен-1-илокси)бензил] -N-этиламино)пиридазин-3-ил]-2-тиоксо-2,3-дигидро-1,3,4-оксадиазол
6-[N-(5-Бром-2-(2-метилпроп-2-ен-1-илокси)бензил)-N-этиламино] пиридазин-3-карбогидразид (сравнительный пример 26) (750 мг, 1,78 ммоль) растворяли в ТГФ (25 мл), после чего добавляли триэтиламин (0,57 мл, 3,91 ммоль), а затем тиофосген (0,1 мл, 1,96 ммоль). Раствор перемешивали при температуре окружающей среды в течение 3 часов в атмосфере аргона, а затем, тетрагидрофуран удаляли в вакууме, добавляли 75 мл воды, и по капле вводили уксусную кислоту до рН 5. Смесь экстрагировали этилацетатом (3•200 мл), и объединенные органические фазы промывали водой и насыщенным солевым раствором (100 мл - каждым), а затем осушали сульфатом магния, и концентрировали в вакууме, в результате чего получали целевое соединение в виде камеди (1,7 г), которую очищали посредством ЖХСД (дихлорметан-метанол, 98:2), и получали твердую пену (230 мг, 28%).
МС: 462 (М+Н)+, 484(M+Na)+.
ЯМР (МГц, ДМСО-d6) δ: 1,31 (т, 3Н), 1,56 (с, 3Н), 3,70 (кв, 2Н), 4,55 (с, 2Н), 4,85 (с, 2Н), 4,95 (с, 1Н), 5,1 (с, 1Н), 7,0 (д, 1Н), 7,15 (д, 1Н), 7,17 (д, 1Н), 7,37 (дд, 1Н), 7,82 (д, 1Н).
Элементный анализ для C19H20BrN5O2S•0,5H2O (%):
Вычислено: С 48,4; Н 4,5; N 14,9.
Найдено: С 48,0; Н 4,3; N 14,6.
ПРИМЕР 36
2-[6-(N-[5-Бром-2-(2-метилпроп-2-ен-1-илокси)бензил] -N-этиламино)пиридазин-3-ил]-1,3,4-оксадиазол
6-[N-(5-Бром-2-(2-метилпроп-2-ен-1-илокси)бензил)-N-этиламино] пиридазин-3-карбогидразид (сравнительный пример 26) (750 мг, 1,78 ммоль) растворяли в триэтилортоформиате (10 мл), а затем, раствор перемешивали в течение 5 часов при 170oС. Избыток триэтилортоформиата удаляли в вакууме, а остаток очищали посредством ЖХСД (дихлорметан/метанол =98:2), в результате чего образовывалась камедь (390 мг), которую растирали с эфиром/гексаном, и получали целевое соединение в виде твердого вещества (160 мг, 21%). Т. пл. 90-92oС
МС: 429 (М+Н)+.
ЯМР (МГц, ДМСО-d6) δ: 1,12 (т, 3Н), 1,75 (с, 3Н), 3,70 (кв, 2Н), 4,55 (с, 2Н), 4,85 (с, 2Н), 4,95 (с, 1Н), 5,08 (с, 1Н), 7,0 (д, 1Н), 7,15 (д, 1Н), 7,23 (д, 1Н), 7,42 (дд, 1Н), 8,05 (д, 1Н), 9,67 (с, 1Н).
Элементный анализ для C19H20BrN5O2 (%)
Вычислено: С 53,0; Н 4,7; N 16,3.
Найдено: С 53,4; Н 4,8; N 16,0.
ПРИМЕР 37
6-[N-(5-Хлор-2-(2-метилпроп-2-ен-1-илокси)бензил-N-этиламино] пиридазин-3-сульфонамид
Смесь N-этил-5-хлор-2-(2-метилпроп-2-ен-1-илокси)-бензиламина (2,76 г, 10 ммоль), 3-хлорпиридазин-6-сульфонамида [Archiv der Pharmazie (1966), 299, 646-650 и Европейский патент 96004] (1,5 г, 7,8 ммоль) и этилдиизопропиламина (10 мл, 57 мМ) в ДМФ (50 мл) перемешивали при 130oС в течение 16 часов в обратном холодильнике. После выпаривания растворителя при пониженном давлении, остаток распределяли между дихлорметаном (100 мл) и водой (100 мл). Органический слой отделяли, осушали безводным сульфатом магния, фильтровали, и выпаривали с образованием коричневой камеди (2,5 г). Полученную коричневую камедь очищали с помощью хроматографии на двуокиси кремния, элюируя градиентом О-->20% этилацетата в дихлорметане, в результате чего получали целевое соединение в виде желтого твердого продукта (600 мг).
ЯМР (200 МГц, ДМСО-d6) δ: 1,17 (т, J=7 Гц, 3Н), 1,79 (с, 3Н), 3,70 (кв, J=7 Гц, 2Н), 4,55 (с, 2Н), 4,97 (с, 1Н), 5,08 (с, 1Н), 7,0-7,3 (м, 4Н), 7,43 (с, 2Н), 7,74 (д, J=8 Гц, 1Н);
МС (ЭСП+): 397/399 (1•С1)МН+.
ПРИМЕР 38
5-[6-(N-(5-Бром-2-(2-метилпроп-2-ен-1-илокси)бензил)-N-этиламино)пиридазин-3-ил]-3-гидрокси-2-метилпиразол
Смесь этил-6-[N-(5-бром-2-(2-метилпроп-2-ен-1-илокси)бензил)-N-этиламино]пиридазин-3-карбоксилата (сравнительный пример 29) (1,2 г, 2,5 ммоль) и N-метил-гидразина (0,13 мл, 2,5 ммоль) в этаноле (25 мл) нагревали с обратным холодильником в течение 16 часов. После выпаривания растворителя при пониженном давлении, остаток распределяли между 50 мл дихлорметана и 50 мл 1 н. соляной кислоты, а затем органический слой отделяли, и осушали безводным сульфатом магния. Продукт очищали посредством хроматографии на двуокиси кремния, элюируя метанолом (10%) в дихлорметане, а затем кристаллизовали из этилацетана, в результате чего получали белый порошок (500 мг, т. пл. 151-152oС.
МС (ЭСП+): 458/460 (М+Н)+ (1•Вr).
Анализ (%):
Вычислено: С 55,0; Н 5,3; N 15,3.
Найдено: С 54,6; Н 5,1; N 15,1.
ЯМР (200 МГц, ДМСО-d6) δ: 1,15 (т, J=7 Гц, 3Н), 1,80 (с, 3Н), 3,58 (с, 3Н), 3,65 (кв, J=7 Гц, 2Н), 4,55 (с, 2Н), 4,78 (с, 2Н), 4,98 (с, 1H), 5,1 (с, 1Н), 5,90 (с, 1Н), 6,98 (д, J=8 Гц, 1Н), 7,1 (м, 2Н), 7,37 (дд, J=2,8 Гц, 1Н), 7,77 (широкий д, J=8 Гц, 1Н), 11,05 (широкий с., 1Н).
Сравнительный пример 1
Метил-2-[N-(5-бром-2-(2-хлораллилокси)бензил)-N-этиламино] -5-пиридилкарбоксилат
Раствор метил-2-[N-(5-бром-2-гидроксибензил)-N-этиламино]-5-пиридилкарбоксилата (сравнительный пример 7) (0,73 г, 2 мМ) в ДМФ (12 мл) обрабатывали К2СО3 (0,83 г, 6 мМ) и 2,3-дихлор-1-пропеном (0,490 г, 44 мМ). Полученную реакционную смесь перемешивали при температуре окружающей среды в течение 48 часов. Затем реакционную смесь выпаривали при пониженном давлении. Остаток хроматографировали (элюент: этилацетат/гексан) и получали целевое соединение в виде белого твердого вещества (0,8 г).
МС (ХИ+): 439 (М+Н)+.
ЯМР (200 МГц, CDCl3) δ: 1,23 (т, 3Н), 3,63 (кв, 2H), 3,87 (с, 3Н), 4,62 (с, 2H), 4,80 (с, 2H), 5,47 (м, 1Н), 5,55 (м, 1Н), 6,45 (д, 1Н), 6,75 (д, 1Н), 7,17 (д, 1Н), 7,32 (дд, 1Н), 8,0 (дд, 1Н), 8,82 (д, 1Н).
Сравнительный пример 2
Соединения, представленные в таблице 5, были получены способом, аналогичным описанному в Сравнительном примере 1, с использованием подходящего алкилирующего агента (где Х представляет уходящую группу).
Примечания:
а: ЯМР (250 МГц, СDСl3) δ: 1,22 (т, J=7 Гц, 3Н), 1,45 (д, J=6 Гц, 3Н), 3,64 (кв, J= 7 Гц, 2Н), 3,87 (с, 3Н), 4,76 (м, 3Н), 5,21 (м, 2Н), 5,9 (м, 1Н), 6,4 (д, J=8 Гц, 1Н), 6,75 (дд, J=3, 8 Гц, 1Н), 7,14 (м, 1Н), 7,28 (м, 1H), 7,95 (м, 1Н), 8,8 (д, J=3 Гц, 1Н).
b: ЯМР (250 МГц, CDCl3) δ: 1,22 (т, J=7 Гц, 3Н), 1,75 (м, 3Н), 3,64 (кв, J=7 Гц, 2Н), 3,87 (с, 3Н); [4,57 (м) и 4,63 (м) вместе, с 2H]; 4,74 (с, 2Н), 5,77 (м, 2Н), 6,40 (д, J=8 Гц, 1H), 6,75 (м, 1H), 7,13 (м, 1H), 7,28 (м, 1H), 7,95 (дд, J=2, 8 Гц, 1H), 8,82 (д, J=2 Гц, 1H).
с: МС (ХИ+): 414 (М+Н)+.
ЯМР (200 МГц, ДМСО-d6) δ: 1,13 (т, J=7 Гц, 3Н), 1,79 (с, 3Н), 3,63 (кв, J= 7 Гц, 2Н), 3,8 (с, 3Н), 4,54 (с, 2Н), 4,97 (шир. с, 1H), 5,1 (шир. с., 1H), 6,68 (д, J=9 Гц, 1H), 7,0 (д, J=8 Гц, 1H), 7,05 (д, J=3 Гц, 1H), 7,38 (дд, J= 9 Гц, 1H), 7,38 (дд, J=9 Гц, 3 Гц), 7,75 (дд, J=3, 9 Гц, 1H), 8,63 (д, J=3 Гц, 1H).
d: MC (FAB)+: 445 (М+Н)+.
ЯМР (200 МГц, ДМСО-d6) δ: 1,1 (т, J=7 Гц, 3Н), 1,8 (м, 6Н), 3,58 (кв, J= 7 Гц, 2Н), 3,78 (с, 3Н), 4,7 (с, 2Н), 4,93 (м, 1H), 5,9 (м, 2Н), 6,65 (д, J= 7 Гц, 1H), 7,07 (м, 2Н), 7,48 (дд, J=2, 9 Гц, 1H), 7,92 (дд, J=2, 9 Гц, 1H), 8,62 (д, J=2 Гц, 1H).
е: ЯМР (250 МГц, ДМСО-d6) δ: 1,12 (т, J=7 Гц, 3Н), 3,60 (кв, J=7 Гц, 2Н), 3,75 (с, 3Н), 4,75 (с, 2Н), 4,96 (с, 2Н), 6,67 (д, J=9 Гц, 1Н), 7,00 (с, 1Н), 7,05 (д, J=8 Гц, 1H), 7,1 (д, J=3 Гц, 1Н), 7,44 (дд, J=3 Гц, 8 Гц, 1H), 7,93 (дд, J=3 Гц, 8 Гц, 1H), 8,64 (д, J=3 Гц, 1H).
f: ЯМР (250 МГц, ДМСО-d6, Е-изомер): δ 1,12 (J=7 Гц, 3Н), 3,6 (кв, J=7 Гц, 2Н), 3,76 (с, 3Н), 4,75 (с, 2Н), 4,90 (с, 1,6Н), 6,66 (д, J=9 Гц, 1H), 7,08 (м, 2Н), 7,25 (с, 0,8Н), 7,42 (дд, J=3 Гц, 8 Гц, 1H), 7,93 (дд, J=3 Гц, 8 Гц), 8,63 (д, J=3 Гц, 1H).
Сравнительный пример 3
Метил-2-[N-(5-бром-2-(2-метилбут-2-ен-1-илокси)бензил-N-этиламино] -5-пиридилкарбоксилат
Раствор метил-2-[N-(5-бром-2-гидроксибензил)-N-этиламино] -5-пиридилкарбоксилата (сравнительный пример 7) (0,4 г, 1,1 ммоль) в ТГФ (10 мл) в атмосфере аргона обрабатывали трифенилфосфином (0,32 г, 1,2 ммоль) и диэтилазодикарбоксилатом (0,34 мл, 0,38 г, 2,2 ммоль). Затем добавляли раствор 2-метилбут-2-ен-1-ола (0,14 г, 1,6 ммоль) в ТГФ (2 мл). Реакционную смесь перемешивали при температуре окружающей среды в течение 60 часов. После этого, реакционную смесь выпаривали, а остаток растворяли в этилацетате и промывали водой. Водный слой дважды экстрагировали этилацетатом. Органические фазы объединяли, осушали сульфатом магния, и выпаривали. Остаток хроматографировали (элюент: этилацетат) и получали целевое соединение в виде светло-желтого маслообразного вещества (0,22 г, 45%).
МС (ХИ+): 433 (М+Н)+.
ЯМР (250 МГц, ДМСО-d6) δ: 1,15 (т, J=7 Гц, 3Н), 1,63 (д, J=7 Гц, 3Н), 1,68 (с, 3Н), 3,6 (кв, J=7 Гц, 2Н), 3,79 (с, 3Н), 4,46 (с, 2Н), 4,75 (с, 2Н), 5,69 (м, 1Н), 6,65 (д, J=9 Гц, 1Н), 6,97 (д, J=9 Гц, 1Н), 7,03 (дс, J=2 Гц, 1Н), 7,35 (дд, J=2, 9 Гц, 1Н), 7,93 (дд, J=2,9 Гц, 1Н), 8,63 (д, J=2 Гц, 1Н).
Сравнительный пример 4
Соединения, представленные в таблице 6, получали способом, аналогичным описанному в Сравнительном примере 3, с использованием соответствующего спирта в качестве исходного продукта.
a) ЯМР (250 МГц, ДМСО-d6) δ: 1,1 (т, J=7 Гц, 3Н), 1,63 (д, J=7 Гц, 3Н), 1,68 (с, 3Н), 3,6 (кв, J=7 Гц, 2Н), 3,79 (с, 3Н), 4,46 (с, 2Н), 4,75 (с, 2Н), 5,69 (м, 1Н), 6,65 (с, J=9 Гц, 1Н), 6,97 (д, J=9 Гц, 1Н), 7,03 (с, J=2 Гц, 1Н), 7,35 (дд, J=2, 9 Гц, 1Н), 7,93 (дд, J=2, 9 Гц, 1Н), 8,63 (д, J=2 Гц, 1Н).
b) ЯМР (250 МГц, ДМСО-d6) δ: 0,95 (с, 3Н), 1,0 (с, 3Н), 1,10 (т, J=7 Гц, 3Н), 1,42 (м, 1H), 1,67 (с, 3Н), 1,78 (м, 3Н), 3,56 (кв, J=7 Гц, 2Н), 3,79 (с, 3Н), 4,68 (с, 2Н), 4,93 (шир. с, 1Н), 5,5 (с, 1Н), 6,64 (д, J=9 Гц, 1Н), 7,05 (м, 2Н), 7,47 (дд, J=2, 9 Гц, 1Н), 7,92 (дд, J=2, 9 Гц, 1H), 8,63 (д, J=2 Гц, 1Н),
c) ЯМР (250 МГц, ДМСО-d6) δ: 1,09 (т, J=7 Гц, 3Н), 1,48 (м, 1H), 1,7 (м, 6Н), 1,8-2,4 (м, 4Н), 3,56 (кв, J=7 Гц, 2Н), 3,79 (с, 3Н), 4,77 (м, 4Н), 5,14 (м, 1H), 5,7 (м, 1H), 6,69 (д, J=9 Гц, 1H), 7,15 (м, 2Н), 7,44 (м, 1H), 7,94 (м, 1H), 8,65 (м, 1H).
d) МС (ЭСП+): 434 (М+Н)+.
ЯМР (250 МГц, ДМСО-d6) δ: 1,16 (т, J=7 Гц, 3Н), 1,32 (т, J=7 Гц, 3Н), 1,78 (с, 3Н), 3,7 (кв, J=7 Гц, 2Н), 4,33 (кв, J=7 Гц, 2Н), 4,55 (с, 2Н), 4,85 (с, 2Н), 4,98 (с, 1H), 5,07 (с, 1H), 6,99 (д, J=8 Гц, 1H), 7,1 (м, 2Н), 7,39 (дд, J=3,9 Гц, 1H), 7,43 (д, J=8 Гц, 1H).
e) Исходный продукт получен в сравнительном примере 11.
Сравнительный пример 5
4-Гидрокси-3-метилбут-2-ен
К суспензии алюмогидрида лития (0,47 г, 12,4 мМ) в тетрагидрофуране (30 мл) при 0oС добавляли раствор тиглиновой кислоты (1,0 г, 10 мМ) в ТГФ (20 мл). Реакционную смесь нагревали до температуры окружающей среды и перемешивали в течение ночи. Реакцию гасили путем добавления разбавленной соляной кислоты, а затем смесь три раза экстрагировали этилацетатом. Полученный таким образом 4-гидрокси-3-метилбут-2-ен использовали в последующей стадии без очистки (0,29 г, 30%).
МС (ЭИ+): 86 (М+).
ЯМР (250 МГц, ДМСО-d6) δ: 1,55 (м, 6Н), 3,98 (шир. с., 2Н), 4,55 (шир. с, 1Н).
Сравнительный пример 6
Метил-2-[N-(2-аллилокси-5-бромбензил)-N-этиламино]-5-пиридилкарбоксилат
Раствор 5-бромсалицилальдегида (20,1 г, 100 мМ) в ДМФ (50 мл) обрабатывали карбонатом калия (20,7 г, 150 мМ) и аллилбромидом (12,7 г, 10,5 мМ). Реакционную смесь перемешивали при температуре окружающей среды в течение 18 часов. Реакционную смесь распределяли между этилацетатом и водой. Органическую фазу четыре раза промывали водой, а затем осушали сульфатом магния, и выпаривали при пониженном давлении, в результате чего получали 2-аллилокси-5-бромбензойную кислоту в виде светло-желтого маслообразного вещества (10,0 г, 41%).
МС (ХИ+): 241 (М+Н)+.
ЯМР (200 МГц, ДМСО-d6) δ: 4,74 (м, 2Н), 5,37 (м, 2Н), 6,1 (м, 1Н), 7,20 (д, J=9 Гц, 1Н), 7,76 (м, 2Н), 10,3 (с, 1Н).
Раствор 2-аллилокси-5-бромбензальдегида (5,27 г, 21,9 ммоль) обрабатывали борогидридом натрия (0,145 г, 10,9 мМ). Реакционную смесь перемешивали при температуре окружающей среды в течение 2,5 часа, а затем добавляли воду, и растворитель удаляли при пониженном давлении. Остаток подкисляли до рН 1 и экстрагировали два раза этилацетатом. Органические слои объединяли, осушали сульфатом магния, и выпаривали, в результате чего получали 2-аллилокси-5-бромбензиловый спирт (5,12 г, 96%) в виде твердого белого вещества.
МС (ЭИ+): 242 (М+).
ЯМР (250 МГц, ДМСО-d6) δ: 4,5 (с, 2Н), 4,55 (м, 2Н), 5,15 (шир. с, 1Н), 5,3 (м, 2Н), 6,02 (м, 1Н), 6,9 (д, J=9 гц, 1Н), 7,35 (дд, J=2 Гц, 9 Гц, 1Н), 7,47 (д, J=2 Гц, 1Н).
Раствор 2-аллилокси-5-бромбензилового спирта (5,12 г, 21,1 мМ) в дихлорметане (25 мл) обрабатывали трифенилфосфином (6,15 г, 23,5 мМ) и тетрабромметаном (8,67 г, 26,13 мМ). Реакционную смесь перемешивали при температуре окружающей среды в течение ночи. Растворитель выпаривали при пониженном давлении, и полученный таким образом 2-аллилокси-5-бромбензилбромид использовали в последующей стадии без очистки.
Гидрид натрия (60%, 0,909 г, 22,7 мМ) три раза промывали гексаном и суспендировали в ДМФ (10 мл). После добавления по капле раствора метил-2-этиламино-5-пиридилкарбоксилата (4,02 г, 22,3 мМ), реакционную смесь перемешивали при температуре окружающей среды в течение 1 часа. После добавления раствора 2-аллилокси-5-бромбензилбромида (21,1 мМ), реакционную смесь перемешивали в течение 23 часов при температуре окружающей среды. Реакцию гасили водой, и смесь экстрагировали этилацетатом. Органический слой три раза промывали водой, осушали сульфатом магния, и выпаривали. После хроматографии (элюент: этилацетат/гексан) был получен метил-2-[N-(2-аллилокси-5-бромбензил)-N-этиламино] -5-пиридилкарбоксилат в виде темно-желтого маслообразного вещества, которое используется в последующей стадии без дополнительной очистки.
Сравнительный пример 7
Метил-2-[N-(5-бром-2-гидроксибензил)-N-этиламино]пиридин-5-карбоксилат
6-Хлорникотиновую кислоту (100 г, 0,63 моль) обрабатывали этиламином (70% в воде, 500 мл). Реакционную смесь герметично закрывали в автоклаве и нагревали до 170oС в течение 6 часов. Реакционную смесь выпаривали, частично нейтрализовали концентрированной соляной кислотой, и рН доводили до 5 путем добавления ледяной уксусной кислоты. Твердый продукт отфильтровывали и осушали в вакууме в течение 18 часов, в результате чего получали 6-(этиламино)никотиновую кислоту (87,8 г, выход 84%).
МС (ХИ+): 167 (М+Н)+.
ЯМР (250 МГц, ДМСО-d6) δ: 1,15 (т, J=7 Гц, 3Н), 3,3 (кв, J=7 Гц, 2Н), 6,45 (д, J=9 Гц, 1Н), 7,25 (шир. т., 1Н), 7,78 (дд, J=2, 9 Гц, 1Н), 8,54 (д, J=2 Гц, 1Н), 11,6 (шир. с, 1Н).
Суспензию 6-(этиламино)никотиновой кислоты (50 г, 0,3 моль) в метаноле (500 мл) обрабатывали концентрированной серной кислотой (30 мл). Реакционную смесь нагревали с обратным холодильником в течение 18 часов. Затем реакционную смесь выпаривали, выливали в воду со льдом (1 литр), и доводили до рН 8 путем добавления твердого бикарбоната натрия (с образованием пены). Водную смесь экстрагировали этилацетатом (3•300 мл), и органические слои объединяли, осушали сульфатом магния, и выпаривали, в результате чего получали метил-6-(этиламино)никотиноат в виде беловатого твердого продукта (45,5 г, 84%).
МС (ХИ+): 181 (М+Н)+.
ЯМР (200 МГц, ДМСО-d6) δ: 1,14 (т, J=7 Гц, 3Н), 3,3 (кв, J=7 Гц, 2Н), 3,76 (с, 3Н), 6,46 (д, J=9 Гц, 1Н), 7,39 (шир. т., 1Н), 7,80 (дд, J=3, 9 Гц, 1Н), 8,56 (д, J=3 Гц, 1Н).
Раствор 5-бромсалицилальдегида (12,0 г, 59,7 ммоль) в ДМФ (50 мл) обрабатывали К2СО3 (16,5 г, 120 ммоль) и бензилбромидом (11,2 г, 65,6 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 18 часов, а затем разбавляли этилацетатом, и фильтровали. Фильтрат промывали соляной кислотой (0,05 М), насыщенным водным раствором бикарбоната натрия, и солевым раствором. Органическую фазу осушали сульфатом натрия и выпаривали, после чего, остаток растирали с гексаном/этиловым эфиром. Продукт отфильтровывали и получали 2-бензилокси-5-бромбензальдегид в виде белого твердого вещества (15,8 г, 90%), т. пл. 70-72oС.
МС (ХИ+): 291 (М+Н)+.
ЯМР (200 МГц, ДМСО-d6) δ: 5,38 (с, 2Н), 7,5 (м, 6Н), 7,9 (м, 2Н), 10,41 (с, 1Н).
Суспензию 2-бензилокси-5-бромбензальдегида (14,5 г, 50,2 ммоль) в абсолютном этаноле (250 мл) обрабатывали борогидридом натрия (2,6 г, 68,8 ммоль). Реакционную смесь перемешивали и температуру медленно повышали до 33oС. Через один час, реакционную смесь выпаривали, и остаток растворяли в этилацетате и выливали в смесь воды со льдом (200 мл) и In HCl (25 мл). Органический слой отделяли, а затем промывали водным раствором бикарбоната натрия, и солевым раствором. После осушки сульфатом натрия и выпаривания получали 2-бензилокси-5-бромбензиловый спирт в виде светло-желтого маслообразного вещества (14,85 г - количественный выход).
МС (ХИ+): 292 (М+).
ЯМР (200 МГц, ДМСО-d6) δ: 4,52 (д, J=5 Гц, 2Н), 5,12 (с, 2Н), 5,17 (т, J=5 Гц, 1Н), 6,98 (д, J=9 Гц, 1Н), 7,4 (м, 6Н), 7,5 (д, 2Н, 1Н).
Раствор 2-бензилокси-5-бромбензилового спирта (14,75 г, 50,2 ммоль) в безводном этиловом эфире (150 мл) охлаждали до 4oС. Затем добавляли по капле раствор РВr3 (13,68 г, 50 ммоль) в безводном эфире (40 мл), поддерживая при этом температуру ниже 10oС. Реакционную смесь нагревали до температуры окружающей среды и перемешивали в течение 1 часа. Реакционную смесь фильтровали через силикатель (200 г). Затем силикагель промывали этиловым эфиром для удаления всех продуктов. Фильтрат промывали водой (1•150 мл), водным насыщенным раствором бикарбоната натрия (1•150 мл), и солевым раствором (11•150 мл). Органический слой осушали сульфатом натрия и выпаривали, в результате чего получали 2-бензилокси-5-бромбензилбромид в виде светло-желтого маслообразного вещества (15,2 г, 85%), которое кристаллизуется при отстаивании. МС (ЭИ+): 354 (М+).
ЯМР (200 МГц, ДМСО-d6) δ: 4,65 (с, 2Н), 5,2 (с, 2Н), 7,05 (д, J=9 Гц, 1Н), 7,4 (м, 6Н), 7,66 (д, J=3 Гц, 1Н).
Раствор метил-6-этиламиноникотиноата (15,2 г, 84,4 ммоль) в ДМФ (50 мл) охлаждали до 0oС и обрабатывали гидридом натрия (60%, 75 ммоль). Реакционную смесь перемешивали в течение одного часа и добавляли раствор 2-бензилокси-5-бромбензилбромида (25 г, 70,2 ммоль) в ДМФ (50 мл). Реакционную смесь нагревали до температуры окружающей среды и перемешивали в течение 18 часов. Реакцию завершали путем добавления воды, и смесь три раза экстрагировали этилацетатом. Органические слои объединяли, промывали водой и солевым раствором (дважды), а затем осушали сульфатом магния, и выпаривали с образованием белого твердого вещества. В результате перекристаллизации из этилацетата и гексана был получен метил-2-[N-(2-бензилокси-5-бромбензил)-N-этиламино]пиридин-5-карбоксилат (22,7 г, 71%).
МС (ХИ+): 455/457 (М+Н)+.
ЯМР (200 МГц, ДМСО-d6) δ: 1,1 (т, J=7 Гц, 3Н), 3,5 (кв, J=7 Гц, 2Н), 3,78 (с, 3Н), 4,77 (c, 2Н), 5,18 (с, 2Н), 6,65 (д, J=9 Гц, 1Н), 7,08 (м, 2Н), 7,4 (м, 6Н), 7,9 (дд, J=2, 9 Гц, 1Н), 8,62 (д, 1Н).
Раствор метил-2-[N-(2-бензилокси-5-бромбензил)-N-этиламино] -5-пиридилкарбоксилата (10,0 г, 22 мМ) в дихлорметане (150 мл) обрабатывали комплексом "диметилсульфид-трихлорид бора" (40 мл, 2 М, 80 мМ). Реакционную смесь перемешивали при температуре окружающей среды в течение 48 часов. После добавления насыщенного раствора бикарбоната натрия, слои разделяли. Водный слой промывали дихлорметаном. Органические слои объединяли, осушали сульфатом магния, и выпаривали, в результате чего получали беловатое твердое вещество. Это беловатое твердое вещество подвергали хроматографии (элюент: этилацетат/гексан) и получали целевое соединение (6,02 г, 75%).
МС (ХИ+): 365 (М+Н)+.
ЯМР (250 МГц, ДМСО-d6) δ: 1,14 (т, J=7 Гц, 3Н), 3,61 (кв, J=7 Гц, 2Н), 3,78 (с, 3Н), 4,66 (с, 2Н), 6,65 (д, J=9 Гц, 1Н), 6,8 (д, J=9 Гц, 1Н), 7,02 (д, J=2 Гц, 1Н), 7,2 (дд, J=2, 9 Гц, 1Н), 7,93 (дд, J=2, 9 Гц, 1H), 8,64 (д, J=2 Гц, 1Н), 10,13 (с, 1Н).
Сравнительный пример 8
2-[N-(5-Бром-2-(2-хлорпроп-2-ен-1-илокси)бензил)-N-этиламино]-5-цианпиридин
2-[N-(5-Бром-2-гидроксибензил)-N-этиламино]пиридин-5-карбоксамид (пример 4) (1,0 г, 2,85 ммоль) суспендировали в тетрагидрофуране (15 мл), и перемешанный раствор обрабатывали пиридином (0,46 мл, 0,46 г, 5,7 ммоль) и трифторуксусным ангидридом (0,9 мл, 1,35 г, 6,4 ммоль) при температуре окружающей среды (слабая экзотермическая реакция). После появления желтого оттенка, твердое вещество растворяли в тетрагидрофуране. Полученный раствор оставляли на ночь при температуре окружающей среды, а затем добавляли пиридин (0,46 мл, 5,7 ммоль) и TFAA (0,90 мл, 6,4 ммоль), после чего, реакционную смесь снова выдерживали в течение ночи. Полученную смесь выпаривали до меньшего объема и добавляли насыщенный раствор бикарбоната натрия. Затем смесь, перемешивали при температуре окружающей среды в течение 30 минут, после чего выпаривали до меньшего объема, и полученный белый осадок фильтровали, промывали водой, и осушали воздухом, в результате чего получали 2-[N-(5-бром-2-гидроксибензил)-N-этиламино] -5-цианпиридин в виде белого твердого вещества (1,0 г, 100%).
МС (ХИ+): 332, 334 (М+Н)+.
Циано-соединение от предыдущей стадии (0,52 г, 1,56 ммоль) в диметилацетамиде (10 мл) подвергали реакции с карбонатом калия (650 мг, 4,7 ммоль), а затем с 2,3-дихлор-1-пропеном (0,32 мл, 384 мг, 3,47 ммоль). Полученную смесь перемешивали при температуре окружающей среды в течение ночи, и выпаривали досуха, а затем остаток, предварительно абсорбированный на двуокиси кремния (1,5 г), очищали с помощью ЖХСД, в результате чего получали целевое соединение в виде белой камеди (0,4 г, 63%).
МС (ЭСП+): 406, 408 (М+Н)+.
Сравнительный пример 9
н-Бутил-6-[N-(5-бром-2-(2-хлорпроп-2-ен-1-илокси)бензил]-N-этиламино]пиридазин-3-карбоксилат
н-Бутил-6-[N-(5-бром-2-гидроксибензил)-N-этиламино] -пиридазин-3-карбоксилат (сравнит. пример 11) (0,28 г, 0,69 ммоль) в ДМФ (4 мл) обрабатывали карбонатом калия (2,05 ммоль), а затем 2,3-дихлорпроп-1-еном (168 мг, 140 мкл, 1,4 ммоль), и реакционную смесь оставляли на выходные дни для перемешивания при температуре окружающей среды. Затем реакционную смесь выпаривали досуха, а остаток абсорбировали на двуокиси кремния (1,5 г), и очищали с помощью ЖХСД с получением целевого соединения в виде бесцветной камеди (0,24 г, 72%).
МС (ХИ+): 482, 484 (М+Н)+.
Сравнительный пример 10
2-[N-(5-Бром-2-(2-метилпроп-2-ен-1-илокси)бензил)-N-этиламино] -5-цианопиридин
2-[N-(5-Бром-2-гидроксибензил)-N-этиламино]пиридин-5-карбоксамид (пример 4) (1,93 г, 5,5 ммоль) суспендировали в ТГФ (30 мл) и обрабатывали пиридином (1,15 г, 14,25 ммоль, 1,15 мл), а затем трифторуксусным ангидридом (3,4 г, 16 ммоль), при перемешивании при температуре окружающей среды. После растворения белого твердого вещества наблюдалась слабая экзотермическая реакция. Полученный раствор оставляли на ночь при температуре окружающей среды. Затем смесь выпаривали до небольшого объема, добавляли насыщенный водный раствор бикарбоната натрия, и смесь перемешивали 30 минут при температуре окружающей среды. Затем смесь снова выпаривали до небольшого объема, и осажденное белое твердое вещество фильтровали, промывали водой, и осушали в вакууме (1,68 г). Твердый продукт очищали с помощью ЖХСД на двуокиси кремния, в результате чего получали 2-[N-(5-бром-2-гидроксибензил)-N-этиламино] -5-цианпиридин в виде белого твердого вещества (1,15 г, 63%).
МС (ХИ+): 332, 334 (М+Н)+.
Циано-соединение от предыдущей стадии (0,52 г, 1,56 ммоль) в диметилацетамиде (10 мл) обрабатывали карбонатом калия (0,65 г, 4,7 ммоль), а затем 3-хлор-2-метилпроп-1-еном, и смесь перемешивали в течение 48 часов при температуре окружающей среды. Затем смесь выпаривали досуха, и остаток наносили непосредственно на колонку с двуокисью кремния, после чего очищали посредством ЖХСД, в результате чего получали 2-[N-(5-Бром-2-(2-метилпроп-2-ен-1-илокси)бензил)-N-этиламино] -5-цианпиридин (0,45 г, 75%), который затем кристаллизовали.
МС (ЭСП+): 386, 388 (M+H)+.
ЯМР (200 МГц, ДМСО-d6) δ: 1,15 (т, 3Н), 1,76 (шир., с., 3Н), 3,68 (шир. кв, 2Н), 4,53 (с, 2Н), 4,85 (с, 2Н), 4,97 (с, 1Н), 5,06 (с, 1Н), 7,0 (д, 1Н), 7,18 (м, 2Н), 7,4 (дд, 1Н), 7,83 (д, 1Н).
Сравнительынй пример 11
Бутил-6-[N-(5-бром-2-гидроксибензил)-N-этиламино]пиридазин-3-карбоксилат
Суспензию 6-хлорпиридазин-3-карбоксамида (сравнительного примера 13, параграф 1-3) (28,5 г, 0,18 моль) в метаноле (200 мл) обрабатывали водным раствором этиламина (70% раствор, 77 мл). Реакционную смесь нагревали с обратным холодильником в течение 3,5 часа. Затем реакционную смесь охлаждали до температуры окружающей среды, и выдерживали в течение ночи. Осадок фильтровали, промывали небольшим объемом воды, и осушали, в результате чего получали 6-(этиламино)пиридазин-3-карбоксамид в виде розового твердого вещества (8,9 г). [Фильтраты выпаривали до небольшого объема, а затем разводили холодной водой (100 мл), и дополнительное количество нужного твердого вещества отфильтровывали, промывали водой, и осушали (12,8 г). Полный выход (21,7 г, 72%)].
Раствор 6-(этиламино) пиридазин-3-карбоксамида (21,7 г, 0,131 моль) в н-бутаноле (109 мл) и ВF3•Et2O (54 мл) нагревали в конденсаторе с воздушным охлаждением (с выпариванием Et2O) при 120oС в течение 18 часов. Реакционную смесь выпаривали при пониженном давлении, и остаток растворяли в воде со льдом (400 мл) и нейтрализовали твердым бикарбонатом натрия при перемешивании. Маслянистый осадок экстрагировали дихлорметаном (250 мл), содержащим метанол (50 мл). Экстракты осушали сульфатом магния и выпаривали в вакууме, в результате чего получали немного клейкое твердое вещество, которое перекристаллизовывали из этилацетата (около 250 мл), и получали бутил-6-(этиламино)пиридазин-3-карбоксилат в виде беловатого твердого вещества (22,0 г, 75%).
Суспензию бутилового эфира предыдущей стадии (21 г, 0,094 моль) в уксусной кислоте (400 мл) обрабатывали 4-бромфенолом (65,5 г, 0,378 моль) и параформальдегидом (3,15 г, 0,105 моль). Реакционную смесь нагревали при 100oС в течение 4,5 часа, а затем добавляли дополнительную порцию параформальдегида (6,3 г, 0,21 моль), и реакционную смесь нагревали при 100oС в течение 16 часов. Полученную реакционную смесь, окрашенную в темный цвет, выпаривали, и получали темное маслообразное вещество. После хроматографии (элюент: диэтиловый эфир/гексан) получали другие нужные партии продуктов в виде маслообразного коричневого вещества. Маслообразное вещество растворяли в этилацетате (примерно 70 мл), и оставляли на ночь при температуре окружающей среды, в результате чего образовывался белый твердый осадок. Этот осадок фильтровали и промывали этилацетатом, а затем осушали, и получали нужный продукт, а именно, бутил-6-[N-(5-бром-2-гидроксибензил)-N-этиламино]пиридазин-3-карбоксилат (12,3 г, 32%).
Сравнительный пример 12
Бутил-6-[N-(5-бром-2-(2-хлорпроп-2-ен-1-илокси)бензил)-N-этиламино]пиридазин-3-карбоксилат
Бутил-6-[N-(5-бром-2-гидроксибензил)-N-этиламино] -пиридазин-3-карбоксилат (сравнительный пример 11), (0,28 г, 0,69 ммоль) в ДМФ (4 мл) обрабатывали карбонатом калия (0,28 г, 2,05 ммоль), а затем, 2,3-дихлор-1-пропеном (168 мг, 140 мкл, 1,4 ммоль), и смесь оставляли на выходные дни для перемешивания при температуре окружающей среды. Полученную смесь выпаривали в вакууме досуха, а затем, остаток предварительно абсорбированный на 1,5 г двуокиси кремния, очищали с помощью ЖХСД, и получали целевое соединение в виде бесцветной камеди (0,24 г, 72%).
МС (ХИ+): 482, 484 (М+Н)+.
Сравнительный пример 13
6-[N-(5-Бром-2-(2-метилпроп-2-ен-1-илокси)бензил)-N-этиламино] -3-цианопиридазин
1. Смесь 6-оксо-1,6-дигидропиридазин-3-карбоновой кислоты (117, 24 г) [См. Британский патент 856409], н-бутилацетата (293 мл), н-бутанола (410 мл) и концентрированной серной кислоты (5,9 мл) нагревали с обратным холодильником в течение одного часа. После выпаривания растворителя, остаток промывали н-бутилацетатом, и получали н-бутил-6-оксо-1,6-дигидропиридазин-3-карбоксилат (выход 79,6%, 130,6 г), т. пл. 79-80oС.
ЯМР (ДМСО-d6) δ: 0,93 (т, 3Н, J=7,5 Гц), 1,40 (секстет, 2Н, J=7,5 Гц), 1,67 (м, 2Н), 4,28 (т, 2Н, J=6,5 Гц), 6,96 (д, 1H, J=10 Гц), 7,83 (д, 1Н, J= 10 Гц), 13,56 (широкий с., 1Н).
2. К смеси оксихлорида фосфора (20 мл) и ацетонитрила (40 мл), нагретой с обратным холодильником, добавляли раствор н-бутил-6-оксо-1,6-дигидропиридазин-3-карбоксилата (20 г) в ацетонитриле (80 мл). Реакционную смесь нагревали с обратным холодильником в течение 30 минут, охлаждали, и добавляли к охлажденному льдом раствору К2СО3 (87,8 г) в воде (600 л) при энергичном перемешивании. Полученный продукт отфильтровывали, промывали водой и осушали при 60oС с получением н-бутил-6-хлорпиридазин-3-карбоксилата (17,5 г, выход 80%), температура плавления: 110-111oС.
ЯМР (CDСl3) δ: 1,99 (т, 3H, J=7,5 Гц), 1,48 (секстет, 2Н, J=7,5 Гц), 1,84 (м, 2Н), 4,49 (т, 2H, J=6,5 Гц), 7,71 (д, 1H, J=8,3 Гц), 8,18 (д, 1H, J=8,3 Гц).
3. К охлажденному в ледяной бане раствору н-бутил-6-хлорпиридазин-3-карбоксилата (40 г) в метаноле (280 мл) добавляли избыточное количество газообразного аммиака. Полученную смесь перемешивали при температуре окружающей среды в течение 4 часов, а затем остаток отфильтровывали, промывали метанолом (20 мл), и осушали, в результате чего получали 6-хлорпиридазин-3-карбоксамид (28,0,5 г, 95,5%), т. пл. 243-245oС.
ЯМР (ДМСО-d6) δ: 7,96 (широкий, 1Н), 8,07 (д, 1Н, J=8,3 Гц), 8,22 (д, 1H, J=8,3 Гц), 8,52 (широкий с., 1Н).
4. К смеси 5-бром-2-гидроксибензальдегида (100,5 г) и К2СО3 (207,5 г) в 1-метил-2-пирролидиноне (500 мл) при 30oС в течение одного часа по капле добавляли бензилбромид (71,4 мл). Смесь перемешивали в течение 3 часов при 35-40oС. К смеси в течение 30 минут при 35oС добавляли раствор гидрохлорида этиламина (57,1 г) в метаноле (250 мл), и эту смесь перемешивали в течение 3 часов при 35-40oС. К полученной смеси в течение 2 часов добавляли раствор борогидрида натрия (26,5 г) в 1-метил-2-пирролидиноне (300 мл) при 35-40oС, и смесь перемешивали в течение 2 часов при 40-45oС. Затем смесь охлаждали (10oС), разводили этилацетатом (200 мл), и подкисляли 2 н. НСl (3500 мл). Полученный осадок отфильтровывали, промывали толуолом и 40-60% петролейным эфиром, а затем осушали в вакууме при 60oС. Остаток очищали путем перемешивания в смеси ацетонитрила (140 мл) и толуола (700 мл) при 80oС в течение 30 минут, с последующим охлаждением до 10oС и отфильтровыванием продукта. Таким образом была получена гидрохлоридная соль N-этил-N-(2-бензилокси-5-бромбензил) амина (13,6 г, выход: 76,7%).
ЯМР (ДМСО-d6) δ: 1,20 (т, 3Н, J=7,3 Гц), 2,97 (кв, 2Н, J=7,3 Гц), 4,13 (с, 2Н), 5,20 (с, 2Н), 7,15 (д, 1Н, J=8,3 Гц), 7,22-7,60 (м, 6Н), 7,70 (д, 1H, J=2,5 Гц), 8,68 (широкий с., 1Н).
5. Смесь гидрохлоридной соли N-этил-N-(2-бензилокси-5-бромбензил)амина (87 г), 6-хлорпиридазин-3-карбоксамида (35 г), и NaHCО3 (41 г) в 1-метил-2-пирролидиноне нагревали в течение 24 часов при 115oС, а затем охлаждали до 20oС, и добавляли к воде (1100 мл) при энергичном перемешивании, поддерживая при этом температуру ниже 30oC с наружным охлаждением. После добавления этилацетата (725 мл), смесь перемешивали при 20oС в течение 2 часов. Осадок фильтровали, осушали, промывали 40 60%-ным петролейным эфиром, и осушали в вакууме при 65oС, в результате чего получали 6-[N-(2-бензилокси-5-бромбензил)-N-этиламино] пиридазин-3-карбоксамид (83 г, выход: 84,7%), т. пл. 171-172oС.
ЯМР (ДМСО-d6) δ: 1,12 (т, 3H, J=7,0 Гц), 3,66 (кв., 2Н, J=7,0 Гц), 3,66 (кв, 2H, J=7,0 Гц), 4,85 (с, 2Н), 5,19 (с, 2Н), 7,07-7,16 (м, 3Н), 7,30-7,51 (м, 7Н), 7,79 (д, 1Н, J=9 Гц, 8,10 (широкий с., 1Н).
6. 6-[N-(2-Бензилокси-5-бромбензил)-N-этиламино]пиридазин-3-карбоксамид (3,24 г, 7,3 ммоль) в дихлорметане (50 мл) обрабатывали комплексом "диметилсульфид-трихлорид бора" (18,5 мл, 2 М раствор) в дихлорметане (37 ммоль) и раствор перемешивали при температуре окружающей среды в течение 6 дней. Затем смесь осторожно обрабатывали избытком водного раствора бикарбоната натрия до рН 9. После добавления дихлорметана, органический и водный слои разделяли, а водный слой промывали дихлорметаном. Объединенные органические экстракты промывали солевым раствором, а затем осушали и выпаривали, в результате чего образовывалось клейкое твердое вещество. Это вещество обрабатывали диэтиловым эфиром (30 мл) и метанолом (3 мл), а затем оставляли на ночь при температуре окружающей среды. Полученное твердое вещество фильтровали, промывали диэтиловым эфиром, и осушали в вакууме, в результате чего получали 6-[N-(5-бром-2-гидроксибензил)-N-этиламино]пиридазин-3-карбоксамид (1,34 г, выход: 52%).
Фенол от предыдущей стадии (1,73 г, 4,9 ммоль) в ТГФ (30 мл) обрабатывали пиридином (0,82 мл, 0,82 г, 10,2 ммоль) а затем трифторуксусным ангидридом (1,61 мл, 2,42 г, 11,5 ммоль). После того, как смесь приобретала зеленый оттенок, ее оставляли на ночь при температуре окружающей среды. Затем смесь выпаривали до получения камеди, которую обрабатывали избытком водного раствора бикарбоната натрия, и перемешивали при температуре окружающей среды приблизительно в течение 30 минут. Полученное красное твердое вещество фильтровали, промывали водой, и осушали в вакууме (1,8 г), а затем остаток очищали посредством ЖХСД с получением 6-[N-(5-бром-2-гидроксибензил)-N-этиламино]-3-цианпиридазина (белое твердое вещество; 0,87 г, 53%).
МС (ЭСП+): 333, 335 (М+Н)+.
Продукт (полученный в предыдущей стадии) (0,52 г, 1,56 ммоль) в диметилацетамиде (10 мл) обрабатывали карбонатом калия (0,65 г, 4,7 ммоль), а затем 3-хлор-2-метилпропеном (340 мкл, 314 мг, 3,47 мМ) и смесь перемешивали в течение ночи при температуре окружающей среды.
Затем, смесь выпаривали в вакууме, и остаток, предварительно абсорбированный на двуокиси кремния, очищали с помощью ЖХСД, и получали 6-[N-(5-бром-2-(2-метилпроп-2-ен-1-илокси)бензил)-N-этиламино]3-цианпиридазин.
МС (ЭСП+): 387, 389 (М+Н)-.
Сравнительный пример 14
6-[N-(5-Бром-2-(циклогекс-2-енилокси)бензил)-N-этиламино]3-цианпиридазин
Целевое соединение получали способом, описанным в Сравнительном примере 13, за исключением того, что вместе 3-хлор-2-метилпропена использовали 3-бромциклогексен. Полученное соединение представляло собой светло-желтую камедь (97%).
МС (ЭСП+): 413, 415 (М+Н)-.
Сравнительный пример 15
Этил-6-[N-(5-бром-2-аллилоксибензил)-N-этиламино] пиридазин-3-карбоновая кислота
Целевое соединение получали из этил-6-[N-(5-бром-2-гидроксибензил)-N-этиламино] пиридазин-3-карбоксилата (пример 8) способом, описанным в сравнительном примере 3.
ЯМР (250 МГц, ДМСО-d6) δ: 1,15 (т, 3Н), 1.33 (т, 3Н), 3,69 (кв, 2Н), 4,84 (кв, 2Н), 4,62 (шир. д., 2Н), 4,84 (с, 2Н), 5,27 (м, 1Н), 5,91 (м, 1Н), 6,04 (м, 1Н), 7,00 (д, 1Н), 7,1 (м, 2Н), 7,4 (дд, 1Н), 7,83 (д, 1Н).
Сравнительный пример 16
N-Этил-5-хлор-2-(2-метилпроп-2-ен-1-илокси)бензиламин
Смесь 5-хлорсалицилальдегида (25,0 г, 0,16 моль), безводного карбоната калия (70,0 г, 0,5 моль), металлилхлорида (27,0, мл, 0,27 моль) и N-метилпирролидинона (250 мл) перемешивали в обратном холодильнике при 60-70oС в течение 16 часов. Затем смесь охлаждали до 20oС и осторожно обрабатывали раствором гидрохлорида этиламина (40,0 грамм, 0,49 моль) в 200 мл метанола (наблюдается образование пены). После прекращения добавления, смесь перемешивали один час при 20oС, а затем обрабатывали порциями борогидрида натрия (4,6 г, 0,12 моль) и небольших аликвот (примерно 10 мл) эфира для уменьшения пенообразования. Полученную смесь перемешивали один час при 20oС, и комплекс "бор-амин" разлагали путем осторожного добавления 6 н. НСl (200 мл), охлаждая, если это необходимо. Смесь перемешивали в течение 1 часа при температуре 20oС, а затем подщелачивали 2 н. гидроксидом натрия (NaOH) до рН 10, и экстрагировали дихлорметаном (3•250 мл). Объединенные органические экстракты промывали водой (3•250 мл), осушали безводным сульфатом магния, фильтровали, и выпаривали с образованием коричневого маслообразного вещества, которое растворяли в изопропаноле (200 мл). К раствору при перемешивании добавляли концентрированную соляную кислоту (36 мас.%/об., 10 мл), и этот раствор охлаждали при 5oС в течение 2 часов, в результате чего образовывались игольчатые кристаллы. Это вещество отфильтровывали, промывали изопропанолом и эфиром, и получали целевое соединение, а именно, соль соляной кислоты (18,0 г, 41%), т.пл. 135-136oС.
МС (ХИ+): 240/242 (М+Н)+.
ЯМР (200 МГц, ДМСО-d6) δ: 1,25 (т, J=6 Гц, 3Н), 1,80 (с, 3Н), 2,93 (кв, J= 6 Гц, 2Н), 4,07 (с, 2Н), 4,54 (с, 2Н), 4,97 (с, 1Н), 5,08 (С, 1H), 7,07 (д, J= 8 Гц, 1Н), 7,40 (дд, J=8 Гц, J=2 Гц, 1Н), 7,70 (д, J=2 Гц, 1Н), 9,47 (с, 2Н).
Анализ (%):
Вычислено: С 56,5; Н 6,9; N 5,1; Cl 25,7.
Найдено: С 56,7; Н 6,9; N 5,0; Cl 25,5.
Сравнительный пример 17
Бутил-6-[N-(5-фтор-2-(2-метилпроп-2-ен-1-илокси)бензил)-N-этиламино] пиридазин-3-карбоксилат
Смесь бутил-6-этиламинопиридазин-3-карбоксилата (описанного в сравнительном примере 13) (10,0 г, 44,8 ммоль) и пара-формальдегида (1,7 г, 56,6 ммоль) в TFA (100 мл) перемешивали в течение одного часа при температуре 50-60oС до образования прозрачного раствора. Этот раствор охлаждали до температуры окружающей среды и обрабатывали 4-фторфенолом (5,6 г, 50,0 ммоль), а затем перемешивали в течение 16 часов и выпаривали при пониженном давлении. Остаток распределяли между льдом и водой (200 г) и дихлорметаном (200 мл), а органический слой промывали насыщенным раствором бикарбоната натрия, осушали безводным сульфатом магния, и выпаривали с образованием желтой камеди. После хроматографии на двуокиси кремния (элюент: 10% эфир в дихлорметане) было получено твердое вещество, которое кристаллизовали из эфира, и получали бутил-6-[N-(5-фтор-2-гидроксибензил)-N-этиламино] пиридазин-3-карбоксилат в виде бледно-розовых игольчатых кристаллов (2,2 г).
МС (ЭСП+): 348 (М+Н)+.
ЯМР (200 МГц, ДМСО-d6) δ: 0,93 (т, J=7 Гц, 3Н), 1,27 (т, J=7 Гц, 3Н), 1,43 (м, 2Н), 1,70 (м, 2Н), 3,72 (кв, J=7 Гц, 2Н), 4,30 (т, J=7 Гц, 2Н), 4,77 (с, 2Н), 6,73-7,90 (м, 3Н), 7,10 (д, J=8 Гц, 1Н), 7,83 (д, J=8 Гц, 1Н), 9,83 (с, 1Н).
Целевое соединение было получено из бутил-6-[N-(5-фтор-2-гидроксибензил)-N-этиламино] пиридазин-3-карбоксилата способом, описанным в Сравнительном примере 1 (выход: 95%).
ЯМР (200 МГц, CDCl3) δ: 0,97 (т, J=8 Гц, 3Н), 1,28 (т, J=7 Гц, 3Н), 1,50 (м, 2Н), 1,80 (м, 2Н), 1,85 (с, 3Н), 3,80 (кв, J=6 Гц, 2Н), 4,40 (т, 2Н), 4,45 (с, 2Н), 4,85 (с, 2Н), 5,00 (с, 1Н), 5,10 (с, 1Н), 6,67 (д, J=8 Гц), 7,83 (д, J=8 Гц, 1Н).
Сравнительный пример 18
Бутил-6-[N-(5-хлор-2-(циклогексен-3-илокси)бензил)-N-этиламино] пиридазин-3-карбоксилат
Целевое соединение получали из бутил-6-[N-(5-хлор-2-гидроксибензил)-N-этиламино] пиридазин-3-карбоксилата (сравнительный пример 20) способом, описанным в сравнительном примере 1, за исключением того, что реакционную смесь оставляли на 80 часов при 50oС, а элюент, используемый в хроматографии, представлял 10% диэтиловый эфир/дихлорметан.
МС (ЭСП+): 444/446 (М+Н)+.
ЯМР (200 МГц, ДМСО-d6) δ: 0,98 (т, 3Н), 1,15 (т, 3Н), 1,45 (м, 2Н), 1,70 (м, 5Н), 1,90 (м, 1Н), 2,04 (м, 2Н), 3,66 (кв, 2H), 4,30 (т, 2H), 4,77 (с, 2Н), 4,93 (шир. с, 1Н), 5,83 (дд, 1Н), 5,95 (дт, 1Н), 7,05 (д, 1Н), 7,08 (д, 1Н), 7,13 (д, 1Н), 7,26 (дд, 1Н), 7,82 (д, 1Н).
Сравнительный пример 19
6-[N-(5-Хлор-2-(2-метилпроп-2-ен-1-илокси)бензил)-N-этиламино] -3-цианпиридин
К раствору 6-[N-(5-хлор-2-(2-метилпроп-2-ен-1-илокси)бензил)-N-этиламино] -пиридазин-3-карбоксамида (пример 18) (210 мг, 0,6 ммоль) в пиридине (10 мл) при 0oС добавляли метансульфонилхлорид (0,5 мл, 0,6 ммоль) и смесь оставляли для размешивания на 60 часов (медленно доводя до температуры окружающей среды по мере плавления льда). Раствор выливали в 2 н. соляную кислоту (50 мл) на льду, и продукт экстрагировали диэтиловым эфиром (200 мл), промывали водой (3•200 мл), осушали безводным сульфатом магния, и растворитель удаляли в вакууме, в результате чего получали целевое соединение в виде коричневой камеди (260 мг), которую использовали без дополнительной очистки.
Сравнительный пример 20
Бутил-6-[N-(5-хлор-2-гидроксибензил)-N-этиламино]пиридазин-3-карбоксилат
Целевое соединение получали из бутил-6-(этиламино)-пиридазин-3-карбоксилата и 4-хлорфенола способом, описанным в сравнительном примере 1, за исключением того, что к реакционной смеси добавляли 0,4 эквивалента трифторуксусной кислоты.
ЯМР (250 МГц, ДМСО-d6) δ: 0,94 (т, 3Н), 1,17 (т, 3Н), 1,43 (м, 2Н), 1,70 (м, 2Н), 3,7 (кв, 2Н), 4,28 (т, 2Н), 4,75 (с, 2Н), 6,85 (д, 1Н), 6,97 (д, 1Н), 7,1 (м, 2Н), 7,82 (д, 1Н), 10,1 (шир. с, 1Н).
Сравнительный пример 21
N-(2-Метоксикарбонилфенил)-6-[N-(5-хлор-2-(2-метилпроп-2-ен-1-илокси)бензил)-N-этиламино]пиридазин-3-карбоксамид
Целевое соединение получали из 6-[N-(5-хлор-2-(2-метилпроп-2-ен-1-илокси)бензил)-N-этиламино] пиридазин-3-карбоновой кислоты (пример 19) способом, описанным в Примере 11.
МС (ЭСП+): 495/497 (МН+).
ЯМР (200 МГц, ДМСО-d6) δ: 1,24 (т, 3Н), 1,78 (с, 3Н), 3,73 (кв, 2Н), 3,90 (с, 3Н), 4,55 (с, 2Н), 4,88 (с, 2Н), 4,97 (с, 1Н), 5,10 (с, 1Н), 6,97 (д, 1Н), 7,07 (д, 1Н), 7,22 (м, 3Н), 7,68 (тд, 1Н), 7,97 (д, 1Н), 8,04 (дд, 1Н), 8,83 (д, 1Н).
Сравнительный пример 22
N-(1-Метоксикарбонилэтил)-6-[N-(5-хлор-2-(2-метилпроп-2-ен-1-илокси)бензил)-N-этиламино]пиридазин-3-карбоксамид
Целевое соединение получали из 6-[N-(5-хлор-2-(2-метилпроп-2-енилокси)-бензил)-N-этиламино]пиридазин-3-карбоновой кислоты (пример 19) способом, описанным в Примере 11, за исключением того, что целевое соединение не очищали с помощью колоночной хроматографии.
МС (ЭСП+): 447/449 (МН+).
ЯМР (200 МГц, ДМСО-d6) δ: 1,16 (т, 3Н), 1,43 (д, 3Н), 1,78 (с, 3Н), 3,65 (с, 3Н), 3,71 (кв, 2Н), 4,55 (м, 1Н), 4,56 (с, 2Н), 4,85 (с, 2Н), 4,97 (с, 1Н), 5,08 (с, 1Н), 7,00 (д, 1Н), 7,05 (д, 1Н), 7,16 (д, 1Н), 7,26 (дд, 1Н), 7,82 (д, 1Н), 8,95 (д, 1Н).
Сравнительный пример 23
N(α-Метоксикарбонилбензил)-6-[N-(5-хлор-2-(2-метилпроп-2-ен-1-илокси)бензил)-N-этиламино]пиридазин-3-карбоксамид
Целевое соединение получали из 6-[N-(5-хлор-2-(2-метилпроп-2-ен-1-илокси)бензил)-N-этиламино] пиридазин-3-карбоновой кислоты (пример 19) способом, описанным в Примере 11, и очищали с помощью колоночной хроматографии (элюент: 2% iPrOH в дихлорметане).
МС: (ЭСП+): 509/511 (МН+).
ЯМР (200 МГц, ДМСО-d6) δ: 1,15 (т, 3Н), 1,78 (с, 3Н), 3,67 (с, 3Н), 3,69 (кв, 2Н), 4,53 (с, 2Н), 4,84 (с, 2Н), 4,97 (с, 1Н), 5,08 (с, 1Н), 5,69 (д, 1Н), 6,97 (д, 1Н), 7,04 (д, Н), 7,17 (д, 1Н), 7,25 (дд, 1Н), 7,38 (м, 1Н), 7,83 (д, 1Н), 9,03 (д, 1Н).
Сравнительный пример 24
N-Этил-5-хлор-2-аллилоксибензиламин
Целевое соединение получали способом, описанным в сравнительном примере 16, за исключением того, что в качестве растворителя использовали диметилформамид, а в качестве алкилирующего агента вместо металлилхлорида использовали аллилбромид. Также, продукт был выделен в виде свободного основания, а не в виде хлористоводородной соли. Выход: 67% (14,8 г). МС (ХИ+): 226/228 (МН+).
ЯМР (250 МГц, ДМСО-d6) δ: 1,04 (т, 3H), 2,57 (кв, 2Н), 3,68 (с, 2Н), 4,58 (м, 2Н), 5,29 (дд, J=10 Гц, 2 Гц, 1Н), 5,40 (дд, J=16 Гц, 2 Гц, 1Н), 6,04 (м, 1Н), 6,95 (д, J=8 Гц, 1Н), 7,19 (дд, J=8 Гц, 2 Гц, 1Н), 7,38 (д, J= 2 Гц, 1Н).
Сравнительный пример 25
4-Метилтиазол-5-илсульфонамид
2-Ацетиламино-4-метилтиазол-5-илсульфонамид (100 мг) растворяли в гидрате гидразина (1,1 мл), и раствор перемешивали при температуре окружающей среды в течение 2 часов. После добавления воды (20 мл), смесь экстрагировали этилацетатом (5•50 мл). Объединенные органические экстракты выпаривали, подвергали азеотропной перегонке с толуолом, и очищали с помощью ЖХСД (двуокись кремния; 5% этанол в дихлорметане), в результате чего получали 2-амино-4-метилтиазол-5-илсульфонамид в виде восковидного твердого вещества (170 мг, 46%).
МС: 192 (М+Н)+.
ЯМР (МГц, ДМСО-d6) δ: 2,3 (с, 3Н), 7,25 (шир. с, 2Н), 7,4 (шир. с, 2Н).
Раствор 2-амино-4-метилтиазол-5-илсульфонамида (150 мг, 0,78 ммоль) в ТГФ (5,5 мл) в течение 30 минут по капле при нагревании с обратным холодильником добавляли к раствору амилнитрита (0,23 мл, 1,56 ммоль). Полученную смесь нагревали с обратным холодильником в течение 3 часов, а затем добавляли дополнительную порцию амилнитрита (0,5 мл), и реакционную смесь нагревали еще 16 часов. После этого, смесь охлаждали, выпаривали досуха, и остаток очищали с помощью ЖХСД (5-10% этанол в дихлорметане), в результате чего получали целевое соединение в виде светло-коричневого восковидного твердого продукта (40 мг, 29%).
МС: 179 (М+Н)+.
ЯМР (МГц, ДМСО-d6) δ: 2,6 (с, 3Н), 7,8 (д, 2Н), 9,1 (шир, с., 1Н).
Сравнительный пример 26
6-[N-(5-Бром-2-(2-метилпроп-2-ен-1-илокси)бензил)-N-этиламино] пиридазин-3-карбогидразид
Бутил-6-[N-(5-бром-2-(2-метилпроп-2-ен-1-илокси)-бензил)-N-этиламино]пиридазин-3-карбоксилат (сравнительный пример 4) (4,3 г, 9,3 ммоль) растворяли в этаноле (170 мл) добавляли гидрат гидразина (17 мл, 330 ммоль), и смесь нагревали с обратным холодильником в течение 16 часов. После удаления растворителя в вакууме, остаток обрабатывали этилацетатом и водой (200 мл - каждым). Органическую фазу отделяли, а водную фазу повторно экстрагировали этилацетатом (2•200 мл). Объединенные органические фазы осушали сульфатом магния и концентрировали в вакууме, в результате чего получали целевое соединение в виде маслообразного вещества, которое кристаллизовали при отстаивании (3,66 г, 94%).
МС: 420 (М+Н)+, 442 (М+Na)+.
ЯМР (МГц, ДМСО-d6) δ: 1,31 (т, 3Н), 1,56 (с, 3Н), 3,67 (кв, 2Н), 4,85 (шир. с., 2Н), 4,52 (с, 2Н), 4,82 (с, 2Н), 4,97 (с, 1Н), 5,08 (с, 1Н), 6,97 (д, 1Н), 7,1 (м, 2Н), 7,37 (дд, 1Н), 7,77 (д, 1Н), 9,8 (с, 1Н).
Сравнительный пример 27
Этил-6-[N-(5-бром-2-гидроксибензил)-N-этиламино]пиридазин-3-карбоксилат
6-[N-(5-Бром-2-гидроксибензил)-N-этиламино]пиридазин-3-карбоновую кислоту (примера 8) (6,5 г) суспендировали в этаноле (30 мл) и осторожно обрабатывали концентрированной серной кислотой (1,5 мл). Реакционную смесь нагревали с обратным холодильником в течение ночи, а затем органический растворитель выпаривали. Остаток распределяли между этилацетатом и водой, и органическую фазу осушали сульфатом магния и выпаривали, в результате чего получали целевое соединение (5,86 г) в виде коричневого твердого вещества.
МС (ЭСП+): 380 (М+Н)+.
ЯМР (200 МГц, ДМСО-d6) δ: 1,16 (т, 3Н), 1,33 (т, 3Н), 3,7 (кв, 2Н), 4,35 (кв, 2Н), 4,76 (с, 2Н), 6,8 (д, 1Н), 7,1 (м, 2Н), 7,26 (дд, 1Н), 7,83 (д, 1Н), 10,19 (шир. с, 1Н).
Сравнительный пример 28
Бутил-6-[N-(5-бром-2-(бут-2-енилокси)бензил)-N-этиламино] пиридазин-3-карбоксилат
Целевое соединение получали из бутил-6-[N-(5-бром-2-гидроксибензил)-N-этиламино] пиридазин-3-карбоксилата способом, описанным в Сравнительном примере 9 (смесь Е:Z = 2:1).
ЯМР (200 МГц, ДМСО-d6) δ: 0,94 (т, 3Н), 1,15 (т, 3Н), 1,4 (м, 2Н), 1,7 (шир, м, 5Н), 3,69 (кв, 2Н), 4,3 (т, 2Н), 4,52 и 4,66 (2д, вместе с 2Н), 4,81 (с, 2Н), 5,7 (м, 2Н), 7,0 (д., 1Н), 7,07 (д, 1Н), 7,13 (д, 1Н), 7,4 (дд, 1Н), 7,82 (д, 1Н).
Сравнительный пример 29
Этил-6-[N-5-бром-2-(2-метилпроп-2-ен-1-илокси)бензил)-N-этиламино)пиридазин-3-карбоксилат
Смесь 6-[N-(5-бром-2-(2-метилпроп-2-ен-1-илокси)бензил)-N-этиламино] пиридазин-3-карбоновой кислоты (пример 2, соединение 15), (2,1 г, 5,2 ммоль) и карбонилдиимидазола (1,0 г, 5,9 ммоль) перемешивали в сухом ТГФ (25 мл) в атмосфере аргона в течение одного часа при температуре 40-50oС. Полученный раствор добавляли к еноляту магния, полученному из смеси этилмалоната калия (1,1 г, 6,5 ммоль), триэтиламина (1,2 мл, 8,6 ммоль) и безводного хлорида магния (0,7 г, 7,4 ммоль) в ацетонитриле (40 мл), а затем смесь перемешивали при температуре 20-25oС в течение 2 часов в атмосфере аргона.
Полученную смесь перемешивали в течение 16 часов при 25oС, нагревали с обратным холодильником в течение 30 минут, а затем охлаждали, и выпаривали при пониженном давлении. Остаток распределяли между дихлорметаном (100 мл) и 2 н. НСl (100 мл). Органический слой отделяли, осушали безводным сульфатом магния, и фильтровали через слой двуокиси кремния, промывая при этом эфиром. Объединенные фильтраты выпаривали и получали целевое соединение в виде бесцветной камеди (1,2 г).
| название | год | авторы | номер документа |
|---|---|---|---|
| АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ И СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 1996 |
|
RU2182574C2 |
| ПРОИЗВОДНЫЕ 4-МЕРКАПТОПИРРОЛИДИНА В КАЧЕСТВЕ ИНГИБИТОРОВ ФАРНЕЗИЛТРАНСФЕРАЗЫ | 1996 |
|
RU2191773C2 |
| ПРОИЗВОДНЫЕ ХИНАЗОЛИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СПОСОБ ДОСТИЖЕНИЯ АНТИАНГИОГЕННОГО И/ИЛИ ЭФФЕКТА СНИЖЕНИЯ ПРОНИЦАЕМОСТИ КРОВЕНОСНЫХ СОСУДОВ У ТЕПЛОКРОВНОГО ЖИВОТНОГО | 1997 |
|
RU2198879C2 |
| НОВОЕ ПРОИЗВОДНОЕ КУМАРИНА, ОБЛАДАЮЩЕЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2007 |
|
RU2428420C2 |
| ГЕРБИЦИДЫ ДЛЯ СОРНЯКОВ, УСТОЙЧИВЫХ К ГЕРБИЦИДУ НА ОСНОВЕ СУЛЬФОНИЛМОЧЕВИНЫ, СПОСОБ БОРЬБЫ С СОРНЯКАМИ, УСТОЙЧИВЫМИ К ГЕРБИЦИДУ НА ОСНОВЕ СУЛЬФОНИЛМОЧЕВИНЫ, СОЕДИНЕНИЯ | 2003 |
|
RU2292139C2 |
| ПРОИЗВОДНЫЕ 3-ОКСО-1-ЦИКЛОБУТЕНА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2002 |
|
RU2296753C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ ТЕТРАЗОЛА И ИХ ПРИМЕНЕНИЕ В ЛЕЧЕНИИ ТУБЕРКУЛЕЗА | 2018 |
|
RU2800930C2 |
| ПРОИЗВОДНЫЕ ХИНАЗОЛИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ИХ, И СПОСОБ ПОЛУЧЕНИЯ АНТИАНГИОГЕННОГО ЭФФЕКТА И/ИЛИ ЭФФЕКТА СНИЖЕНИЯ СОСУДИСТОЙ ПРОНИЦАЕМОСТИ С ИХ ПРИМЕНЕНИЕМ | 1996 |
|
RU2194701C2 |
| ВОДОРАСТВОРИМЫЕ ПРОИЗВОДНЫЕ ФЕНИЛПИРИДАЗИНА И СОДЕРЖАЩИЕ ИХ ЛЕКАРСТВЕННЫЕ СРЕДСТВА | 2002 |
|
RU2302413C2 |
| НОВОЕ ПРОИЗВОДНОЕ ПИПЕРИДИНА И СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ИНГИБИРОВАНИЯ АУТОТАКСИНА | 2022 |
|
RU2834850C2 |
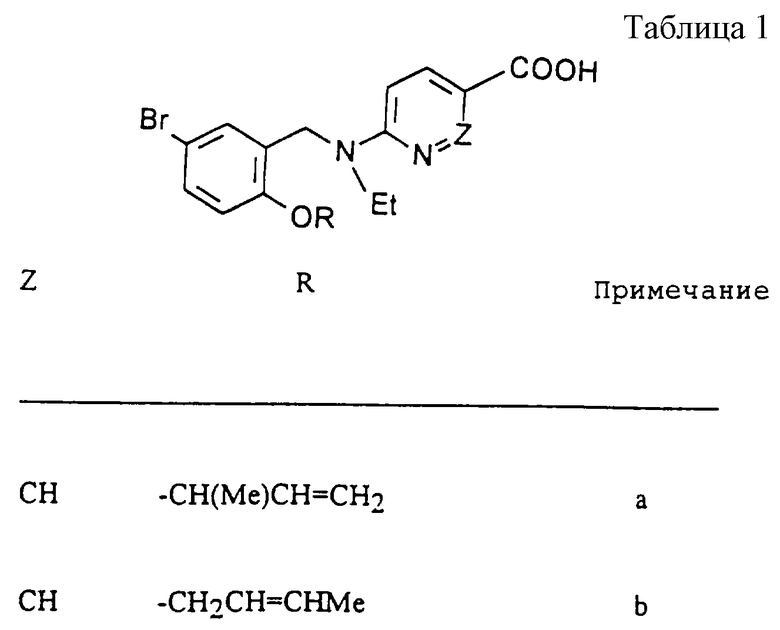
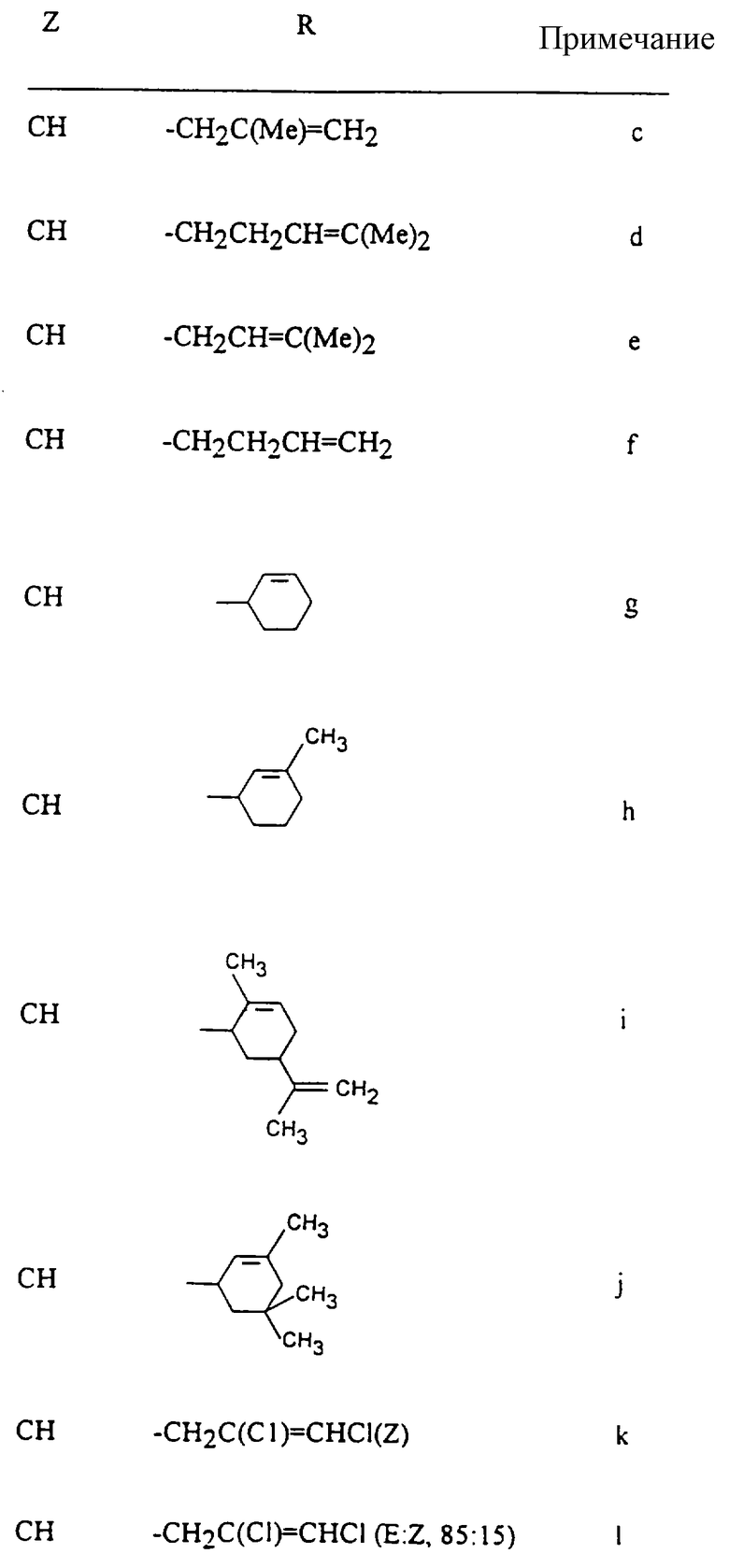
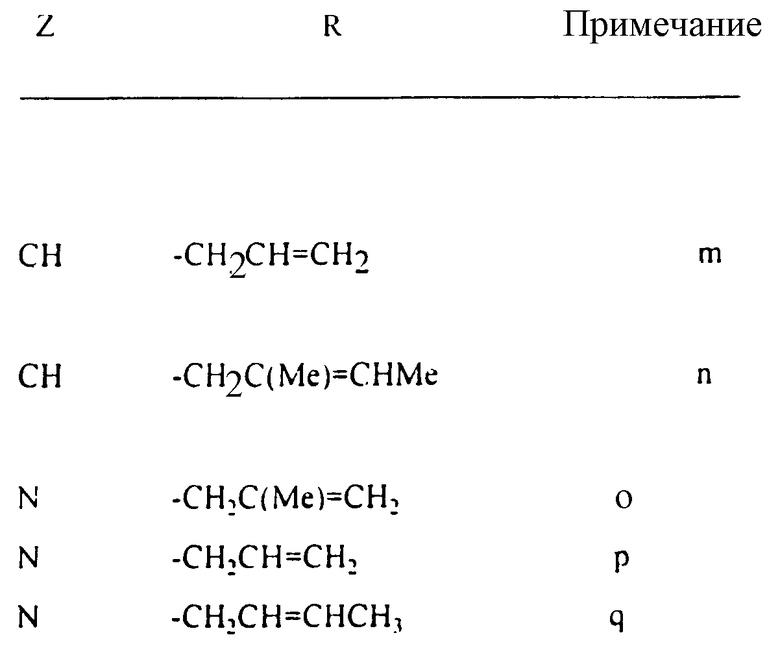
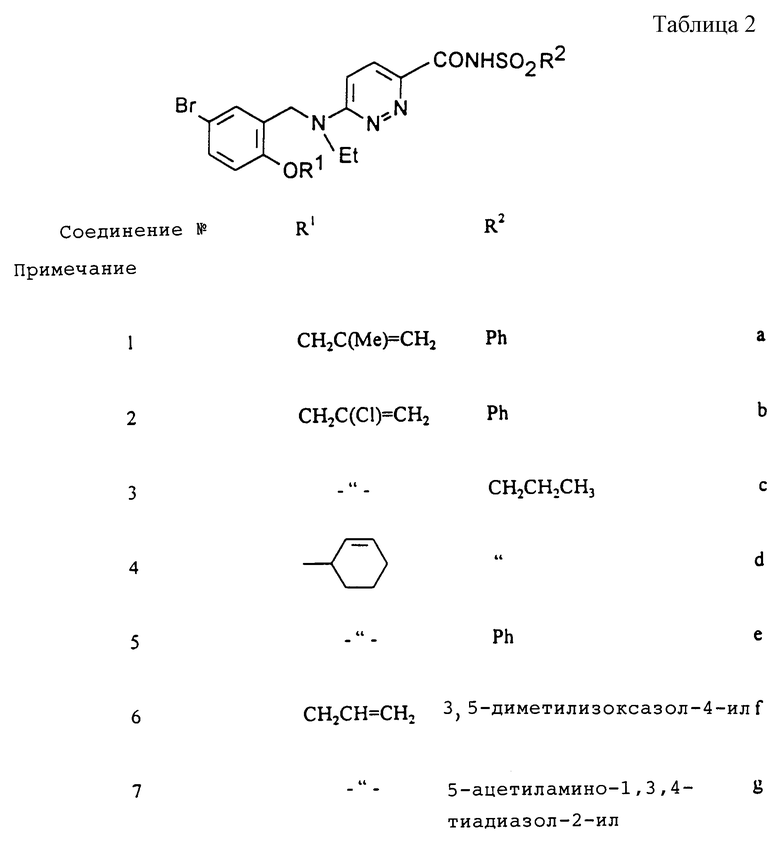
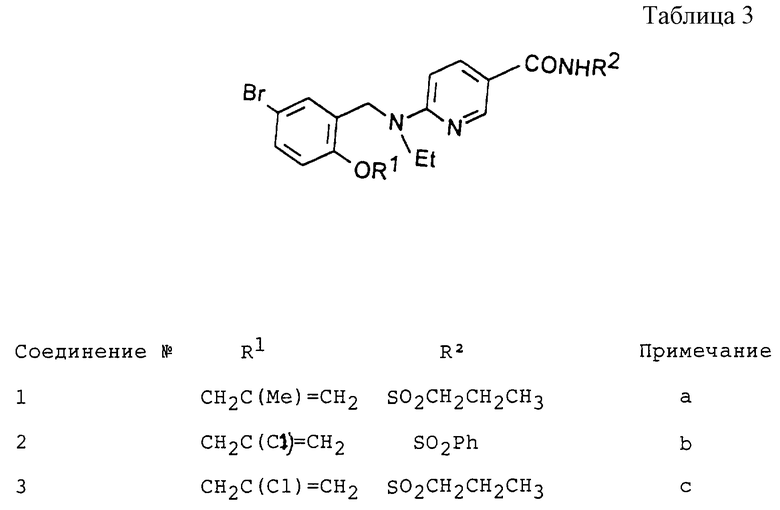
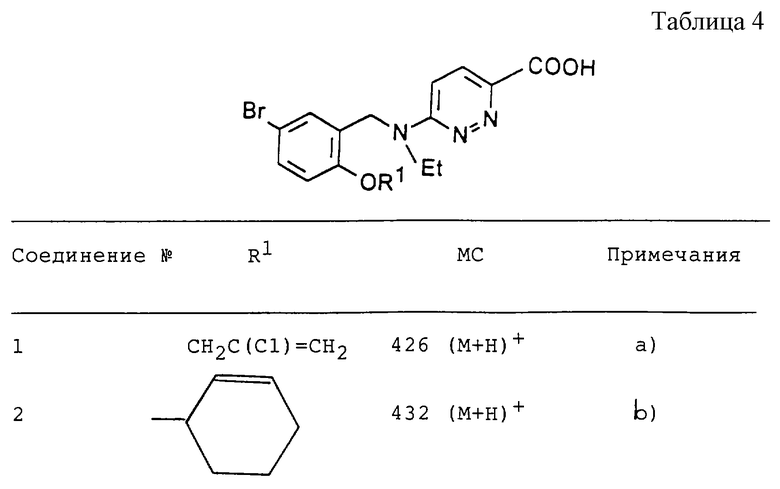

Настоящее изобретение относится к соединениям формулы I, где А представляет необязательно замещенный фенил, при условии, что группы -CH(R3)N(R2)B-R1 и -OD находятся в 1,2-положении по отношению к друг к другу на кольцевых атомах углерода, а кольцевой атом углерода, находящийся в ортоположении по отношению -OD-связывающей группе (следовательно в 3-положении по отношению к -СНR3NR2-связывающей группе) является незамещенным; В представляет пиридил или пиридазинил; R1 находится на кольце B в 1,4-положении по отношению к -СНR3NR2-связывающей группе и является таким, как он определен в п.1 формулы изобретения; R2 представляет С1-6алкил; R3 представляет водород; D представляет водород, необязательно замещенное 5-7-членное карбоциклическое кольцо, содержащее одну двойную связь, либо D представляет группу формулы (CH2)nCH(R4)C(R5)= C(R6)R7, где R4 представляет водород, метил или этил, R5 представляет водород, метил, бром, хлор, фтор, R6 представляет водород, С1-4алкил, R7 представляет водород, С1-4алкил, бром, хлор, фтор, n равно 0 или 1; или к их фармацевтически приемлемым солям или in vivo гидролизуемым сложным эфирам. Соединения изобретения являются антагонистами усиливающего боль действия простагландина Е-типа. Кроме того, изобретение относится к фармацевтической композиции для устранения боли на основе вышеописанных соединений и к способу лечения боли с использованием вышеописанных соединений. Предложен также способ получения соединений формулы I на основе вышеописанных соединений и их фармацевтически приемлемых солей или in vivo гидролизуемых сложных эфиров и промежуточные соединения, образующиеся в процессе их получения. 5 с. и 8 з.п. ф-лы, 6 табл.
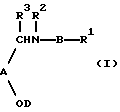
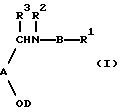
где А представляет необязательно замещенный фенил, где указанные необязательные заместители углеродных атомов кольца в А включают галоген, трифторметил, нитро, гидрокси, амино, С1-4алкиламино, диС1-4алкиламино, циано, C1-6алкокси, S(O)рС1-6алкил (р= 0, 1 или 2), C1-6алкил (необязательно замещенный гидрокси-, амино-, галогено-, нитро-, цианогруппами), S(O)pCF3 (р= 0, 1 или 2), карбамоил, С1-4алкилкарбамоил, ди(С1-4алкил)карбамоил, С2-6алкенил, С2-6алкинил, С1-4алкоксикарбониламино, С1-4алканоиламино, С1-4алканоил(N-С1-4алкил)амино, C1-4алкансульфонамидо, бензолсульфонамидо, аминосульфонил, С1-4алкиламиносульфонил, ди(С1-4алкил) аминосульфонил, C1-4aлкоксикарбонил, С1-4алканоилокси, C1-6алканоил, формилС1-4алкил, трифтopC1-3алкилсульфонил, гидроксииминоС1-6алкил, С1-4алкоксииминоC1-6алкил и C1-6алкилкарбамоиламино; при условии, что группы -CH(R3)N(R2)B-R1 и -OD находятся в 1,2-положении по отношению друг к другу на кольцевых атомах углерода, а кольцевой атом, находящийся в ортоположении по отношению к -OD-связывающей группе (и следовательно в 3-положении по отношению к -CHR3NR2-связывающей группе), является незамещенным;
В представляет пиридил, пиридазинил;
R1 находится на кольце B в 1,4-положении по отношению к -CH(R3)N(R2)-связывающей группе, и представляет карбокси, карбоксиС1-3алкил, тетразолил, тетразолилС1-3алкил, либо R1 представляет группу формулы -CONRaRa1, где Ra представляет водород или C1-6алкил, a Ra1 представляет водород, C1-6алкил, карбоксифенил, либо Ra1 и Ra взятые вместе с атомом азота амидной группы, с которым они связаны (NRaRa1), образуют аминокислотный остаток, такой, как глицин, аланин, фенилаланин или фенилглицин; либо R1 представляет группу формулы -CONHSO2Rb, где Rb представляет C1-6алкил, необязательно замещенный галогеном, гидрокси, нитро, циано, амино, С1-4алкиламино, ди-С1-4алкиламино, трифторметилом, С1-4алкокси или С1-4алкоксикарбонилом, 5- или 6-членный гетероциклил, 5- или 6-членный гетероциклилС1-3алкил, где гетероциклил означает пирролидинил или морфолинил гетероарилС1-3алкил, гетероарил, где гетероарил означает изоксазолил, тиазолил или тиадиазолил, фенил или фенил-C1-3алкил, причем любая гетероарильная группа в Rb необязательно замещена С1-4алканоиламино- или C1-6алкильной группой; либо R1 представляет группу формулы -SО2N(Rc)(Rc1), где Rc представляет водород или С1-4алкил, a Rc1 представляет водород или С1-4алкил, либо R1 представляет группу формулы (1А), (1В) или (1С):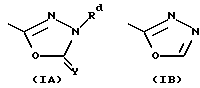
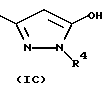
где Y представляет серу;
Rd представляет водород или C1-4алкил;
R2 представляет C1-6алкил;
R3 представляет водород;
D представляет водород, необязательно замещенное 5-7-членное карбоциклическое кольцо, содержащее одну двойную связь, где указанные необязательные заместители D включают C1-4алкил, C2-4алкенил, C2-4алкинил, галоген, гидрокси, амино, C1-4алкиламино, ди(C1-4алкил)амино, циано, трифторметил, оксо, C1-4алканоил, карбокси и карбамоил, либо D представляет группу формулы
(СН2)nСН(R4)С(R5)=С(R6)R7,
где R4 представляет водород, метил или этил;
R5 представляет водород, метил, бром, хлор, фтор;
R6 представляет водород, C1-4алкил;
R7 представляет водород, C1-4алкил, бром, хлор, фтор;
n=0 или 1,
или их фармацевтически приемлемые соли или in vivo гидролизуемый сложный эфир, где in vivo гидролизуемый эфир карбокси- или гидроксигруппы выбирают из фармацевтически приемлемого эфира, образованного C1-6спиртом, фенолом или бензиловым спиртом, замещенными фенолом или бензиловым спиртом, C1-4алкилом или C1-4алкокси или α-ацилоксиалкильным эфиром; in vivo гидролизуемый эфир гидроксигруппу выбирают из алканоила, бензоила, фенилацетила и замещенного бензоила и фенилацетила, алкоксикарбонила (давая алкилкарбонатные эфиры), диалкиламиноацетила и карбоксиацетила.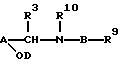
где R9 является защищенным карбокси;
R10 является таким, как R2, определенный в п.1, а R3, n, А, В, D являются такими, как они определены в п.1, с получением соединения формулы I, где R1 представляет карбокси, с последующим, если необходимо, превращением полученных соединений в соединении формулы I, где R1 представляет собой группу формулы CONRaRa1, либо группу формулы CONHSO2Rb, где Ra, Ra1, Rb имеют вышеуказанные значения и/или их фармацевтически приемлемые соли или in vivo гидролизуемый сложный эфир.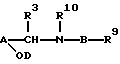
где R9 означает карбоксигруппу, защищенную этерификацирующей C1-4алкильной группой, R10 имеет значения, указанные для R2 в п.1 формулы, и R3, А, В, D имеют значения, указанные в п.1.
Приоритет по пунктам:
20.06.1995 - по п. 1 (за исключением соединений, где Rа1 представляет карбоксифенил, Rа1 и Rа, взятые вместе с атомом азота амидной группы, образуют указанный аминокислотный остаток, Rb представляет C1-6алкил, замещенный амино, C1-4алкиламино, ди-C1-4алкиламино, R1 - группа SO2N(Rс)Rс1, либо группы формул (IA), (IB), (IC), D представляет собой необязательно замещенное 5-7-членное карбоциклическое кольцо, содержащее одну двойную связь, R4 - этил, R5 - бром, фтор, R6 - C1-4алкил, R7 - C1-4алкил, бром, хлор, фтор), п. 2, п. 3 (за исключением соединений, где Rb необязательно замещенный C1-6алкил), п. 5, фармацевтическая композиция по п.9, которая содержит эти соединения, и способ устранения боли по п.10, где используют эти соединения, способ по п.11 (за исключением получения соединений формулы I, где Rа1 либо Rа1 и Rа, Rb и D имеют вышеуказанные значения);
25.01.1996 - по п.1 для соединений, где D представляет водород, необязательно замещенное 5-7-членное карбоциклическое кольцо, содержащее одну двойную связь, R4 - этил, R5 - бром, фтор, R6 - C1-4алкил, R7 - C1-4алкил, бром, хлор, фтор, п.6, пп.9-11 (где используют и получают эти соединения);
17.06.1996 - по п.1, где Rа1 представляет карбоксифенил, либо Rа1 и Rа, взятые вместе с атомом азота амидной группы, образуют указанный аминокислотный остаток, Rb представляет C1-6алкил, замещенный амино, C1-4алкиламино, ди-C1-4алкиламино, R1 - группа SO2N(Rс)Rс1, где Rс и Rс1 имеют значения, определенные в п.1, либо R1 группа формул (IA), (IB), (IC), по пп.4, 7, 8 и по пп.9-11 (где используют и получают эти соединения), по пп.12-13.
| Двухимпульсиый регулятор давления пара в системе концевых уплотнений турбины | 1960 |
|
SU135087A1 |
| Устройство для накатывания кольцевых канавок | 1973 |
|
SU475206A1 |
| RU 94035759 A1, 10.05.1996 | |||
| ПРОИЗВОДНЫЕ ПИРИДАЗИНАМИНОВ, А ТАКЖЕ ИХ СОЛИ ИЛИ СТЕРЕОХИМИЧЕСКИЕ ИЗОМЕРНЫЕ ФОРМЫ, АНТИВИРУСНАЯ КОМПОЗИЦИЯ И ГЕТЕРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ | 1990 |
|
RU2051149C1 |
| Способ получения фталазино (2,3-в) фталазин-5(14н), 12(7н)-диона | 1974 |
|
SU576933A3 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ИМИДАЗО (1,2-B)ПИРИДАЗИНА ИЛИ ИХ СОЛЕЙ И ПРОИЗВОДНЫЕ ИМИДАЗО (1,2-B)ПИРИДАЗИНА ИЛИ ИХ СОЛИ | 1990 |
|
RU2036924C1 |
| US 5037815 А, 06.08.1991. | |||
Авторы
Даты
2003-02-20—Публикация
1996-06-17—Подача