Предлагаемое изобретение относится к ветеринарной медицине и может быть использовано в нормальной и патологической анатомии, а также в ортопедии, травматологии и протезировании в операционный период по поводу состояния опорно-двигательного аппарата.
Известен способ прогнозирования исходов при механической травме [SU 1782547 A1, 5A 61 B 10/00, 23.12.1992], сущность которого заключается в измерении системного и диастолического артериального давления крови, расчете прогностического индекса (ПИ): 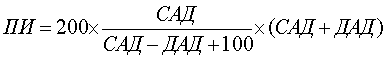 , где САД и ДАД систолическое и диастолическое давление, мм рт. ст., и прогнозировании исходов травматической болезни: при ПИ равном 0,86 и менее прогнозируется благоприятный исход, а при значениях ПИ 0,87 и более - неблагоприятный исход. Однако указанный способ не отражает морфологической картины, складывающейся в зоне травмы как таковой в целом и в суставе в частности, и не учитывает изменение структур компонентов сустава.
, где САД и ДАД систолическое и диастолическое давление, мм рт. ст., и прогнозировании исходов травматической болезни: при ПИ равном 0,86 и менее прогнозируется благоприятный исход, а при значениях ПИ 0,87 и более - неблагоприятный исход. Однако указанный способ не отражает морфологической картины, складывающейся в зоне травмы как таковой в целом и в суставе в частности, и не учитывает изменение структур компонентов сустава.
Наиболее близким к заявляемому является цитологический метод анализа хондроцитов [Annefeld M. Veranderungen in der Ultrastructur der Chondrocyten unter dem Einflub eines GAG-Peptid-Komplex / M.Annefeld, R.Raiss // Aktuelle Rheumatologie. - 1984. - S.2, Bd.9. - S.99-105.], сущность которого заключается в использовании параметров, отражающих ультраструктурную организацию хондроцитов для определения степени деструктивно-дистрофического поражения сустава. Однако указанный цитологический метод анализа хондроцитов требует высокой квалификации специалиста и больших затрат времени.
Задача предлагаемого изобретения - сокращение времени проведения исследования и повышение его точности, унификация оценки воздействия на компоненты суставов животных.
Сущность предлагаемого изобретения заключается в том, что определяют не только сохранность и целостность структурных зон хрящевого покрытия, но и ориентационную упорядоченность макромолекул межклеточного вещества и его гетерогенность в качестве показателя завершения процессов внутритканевой дифференцировки на основе коэффициента рефракции коллагена, степени его морфологической зрелости и ориентационной упорядоченности.
Способ осуществляют следующим образом. Гистологические срезы окрашивают красителями, молекулы которых являются диполями, и пропускают через них линейно поляризованный свет, чем вызывают возникновение эффекта оптической анизотропии и изучают ориентационную упорядоченность основных макромолекул матрикса суставного хряща и связочного аппарата в поляризованном свете под микроскопом "Polmy-А" (Польша) путем количественной оценки (с помощью компенсатора λ/4) величины рефракции (двойного лучепреломления) макромолекул, выявленных в гистологических реакциях; для коллагена - феноловая, с пикросириусом красным, для гликозаминогликанов - с толуидиновым синим (при рН 1,5; 2,5; 3,5) до и после компенсаторного воздейстия, и по формуле определяют диагностический критерий - коэффициент проявления компенсации (КПК): 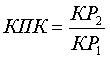 , где КР1 - коэффициент рефракции гликозаминогликанов до воздействия, КР2 - коэффициент рефракции после воздействия, при величине КПК менее 1,5 дают отрицательную оценку проявления компенсации, а при значении КПК 1,5 и более проявление компенсации считается адекватным.
, где КР1 - коэффициент рефракции гликозаминогликанов до воздействия, КР2 - коэффициент рефракции после воздействия, при величине КПК менее 1,5 дают отрицательную оценку проявления компенсации, а при значении КПК 1,5 и более проявление компенсации считается адекватным.
Пример. Предлагаемый способ был воспроизведен в серии экспериментов: первая - интактные животные (собаки); вторая - моделирование деструктивно-дистрофических поражений путем введения в коленный сустав преднизолона в дозе 15-25 мл 1-2 раза в две недели в течение месяца; третья - моделирование деструктивно-дистрофических поражений путем введения в коленный сустав преднизолона в дозе 15-25 мл 1-2 раза в две недели в течение месяца, введение буфера; четвертая - моделирование деструктивно-дистрофических поражений путем введения в коленный сустав преднизолона в дозе 15-25 мл 1-2 раза в две недели в течение месяца + глюкозамина гидрохлорид в дозе 15-25 мг/кг внутримышечно 1-2 раза в неделю в течение месяца. Животных выводили из эксперимента путем передозировки тиопентала натрия с соблюдением правил проведения работ с использованием экспериментальных животных и требований Министерства Здравоохранения Союза Советских Социалистических Республик №12000-496 от 2 апреля 1980 г. Контроль за состоянием суставов включал в себя комплекс методов, в том числе тонкое анатомическое препарирование с последующим описанием и функциональным анализом их структур.
Микроморфологическим исследованиям подвергают свежеизвлеченные образцы суставного хряща и субхондральной кости мыщелков бедренной кости и боковых связок от коленного сустава от 32 собак. Изучение общей морфологической картины в световом микроскопе (Jenamed-2, Karl-C, Jena) проводят после окраски срезов гематоксилином и эозином, фуксилином по Харту для оценки эластических волокон. Морфометрию структур осуществляли под микроскопом "МБИ-6" (окуляр (ок.) 7, 10, объектив (об.) 8, 10, 20) с использованием окуляр-микрометра 1*16. Изучение ориентационной упорядоченности основных макромолекул матрикса проводят в поляризованном свете под микроскопом "Polmy-A" (Польша) путем количественной оценки (с помощью компенсатора λ/4 по Senarmont) величины рефракции макромолекул, выявленных в гистологических реакциях: для коллагена - феноловая и с пикросириусом красным, с толуидиновым синим для гликозаминогликанов при рН 1,5; 2,5; 3,5.
Структура компонентов сустава в условиях моделирования деструктивного процесса путем внутрисуставного введения преднизолона. В результате проведенных исследований установлено, что внутрисуставные инъекции преднизолона вызывают в коленном суставе комплекс морфологических изменений деструктивного генеза, проявляющийся как на макроскопическом, так и на микроскопическом уровнях его организации. Так, по истечении месяца после интраартикулярного введения преднизолона отмечена тугоподвижность коленного сустава, который увеличен в объеме и отечен. Животные предпочитают не включать его в локомоторный акт. Капсула сустава гиперемирована и отечна, в области прикрепления к кости в ней выявлены участки темного цвета, определяемые нами как некротические очаги. Обнаружены внутрисуставные образования с признаками петехий и экхимозов, являющихся, возможно, следствием диапедеза.
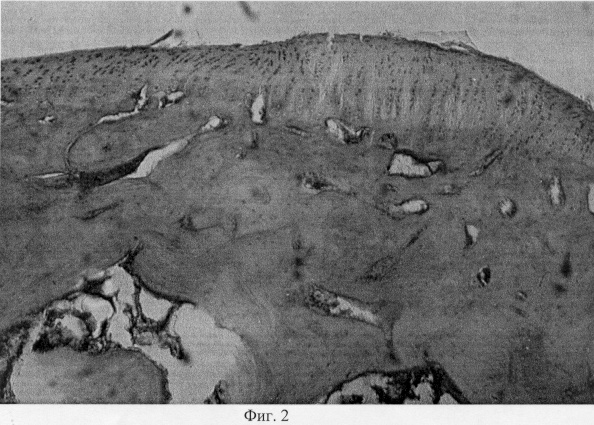
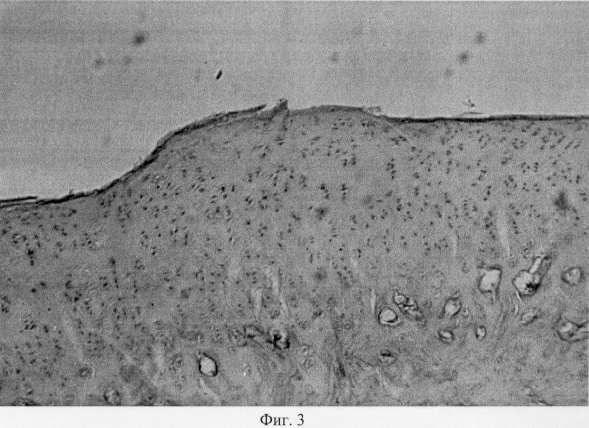
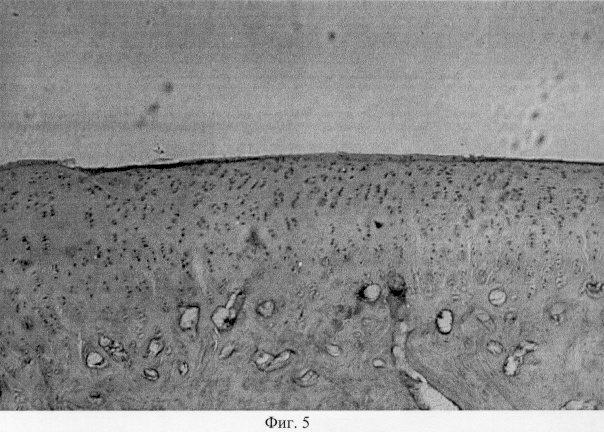
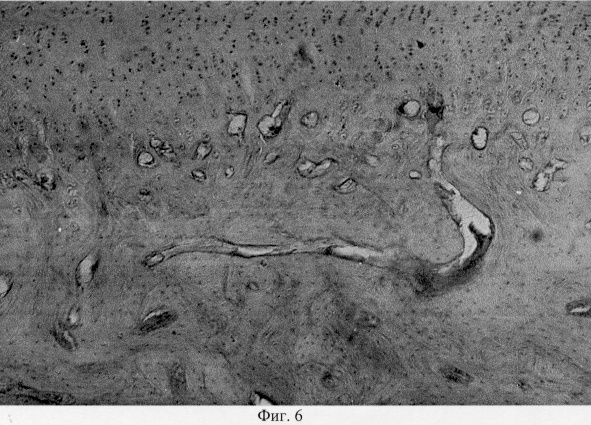
Суставной хрящ, покрывающий мыщелки, неравномерной толщины, местами скарифицирован до обнажения субхондральной кости. Хрящевое покрытие теряет блеск, имеет матовый оттенок и характеризуется изменением естественной окраски с серо-голубой до бурой. Зона дефекта выполнена регенератом белого цвета, структурное оформление которого напоминает эластическую соединительную ткань. При анализе гистопрепаратов поврежденных мыщелков показано, что деструктивные преобразования затрагивают все компоненты проксимального метаэпифиза: суставной хрящ, субхондральную кость и метафизарный хрящ. Так, суставной хрящ вариабелен по толщине, с очагами фибрилляции, трещинами и щелями различной конфигурации и протяженности. Необходимо также отметить, что выявленные микродефекты могут иметь продольное направление (фиг.1. Микроархитектоника суставного хряща в условиях моделирования экстремального воздействия. Об. 10, ок. 8. Узурация хряща, тангенциальные и поперечные трещины, разволокнение хряща). Разволокнение хряща преимущественно затрагивает его промежуточную зону, в то время как для поверхностной зоны характерна узурация хрящевой поверхности и нарушение ее рельефа (фиг.2. Микроархитектоника суставного хряща в условиях моделирования экстремального воздействия. Об. 10, ок. 8. Узурация хряща, тангенциальные и поперечные трещины, разволокнение хряща). В области трещин и разволокнений обращает на себя внимание нарушение цитоархитектоники хрящевой ткани, что проявляется в уменьшении количественного представительства хондроцитов и появлении их деструктивных форм (фиг.3. Деструкция суставного хряща после интраартикулярной инъекции преднизолона. Гематоксилин и эозин. Об. 10, ок. 8). В области повреждения суставной поверхности нетрудно видеть нарушение целостности базофильного раздела, что может привести к изменению минерализации хрящевого матрикса (фиг.4. Нарушение целостности базофильного раздела и узурация хряща после внутрисуставной инъекции преднизолона. Гематоксилин и эозин. Об. 10, ок. 8). Кроме того, в кальцифицированной зоне хрящевого покрытия отмечена инвазия сосудов, следствием чего является появление гипертрофированных хондроцитов, находящихся в состоянии пикноза и некроза, и замещение хрящевой ткани грубоволокнистой костной (фиг.5. Инвазия сосудов в глубокую зону хряща при экспериментальном моделировании экстремального воздействия. Гематоксилин и эозин. Об. 10, ок. 8, фиг.6. Инвазия сосудов в глубокую зону хряща при экспериментальном моделировании экстремального воздействия. Гематоксилин и эозин. Об. 10, ок. 8).
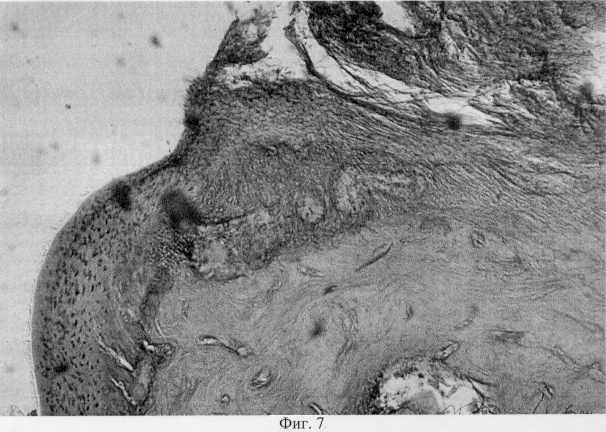
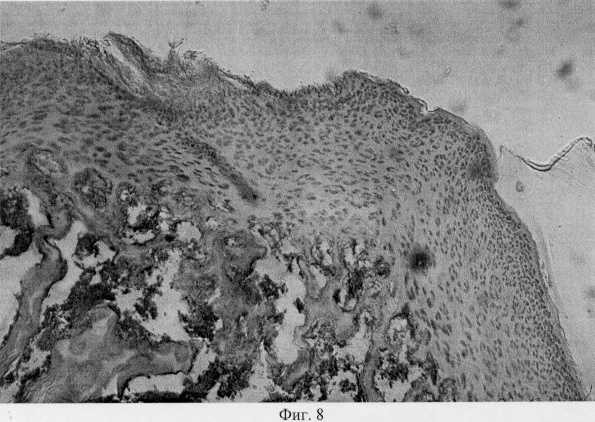
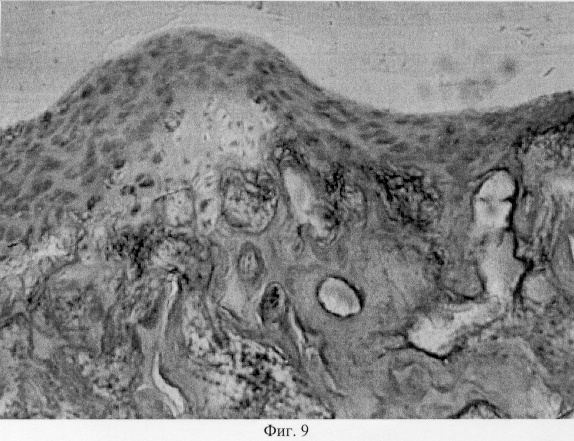
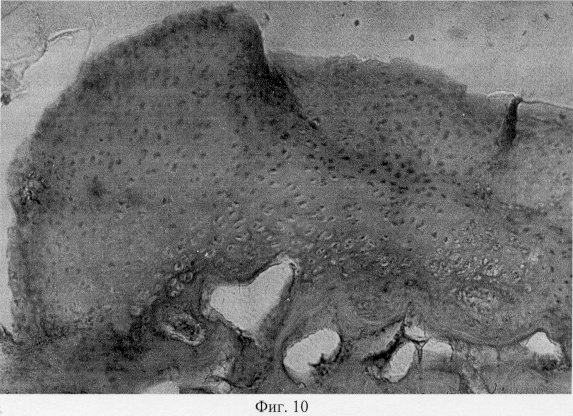
В участках хряща, смежных с поврежденными, выявлен регенерат, представленный хондроцитами, которые расположены в виде лентовидных скоплений в кальцифицированной зоне и волокнистых образований, локализованных в поверхностной зоне (фиг.7. Волокнистый регенерат в поверхностной зоне поврежденного хряща. Моделирование экстремального воздействия. Гематоксилин и эозин. Об. 10, ок. 8, фиг.8. Волокнистый регенерат в поверхностной зоне поврежденного хряща. Моделирование экстремального воздействия. Гематоксилин и эозин. Об. 10, ок. 8, фиг.9. Хондроидный пролиферат в глубоких зонах суставного хряща при моделировании внутрисуставного деструктивного процесса путем экстремального воздействия. Гематоксилин и эозин. Об. 10, ок. 8, фиг.10. Хондроидный пролиферат в глубоких зонах суставного хряща при моделировании внутрисуставного деструктивного процесса путем экстремального воздействия. Гематоксилин и эозин. Об. 10, ок. 8).
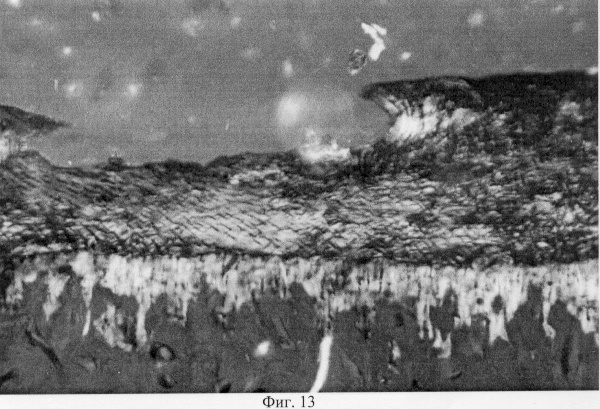
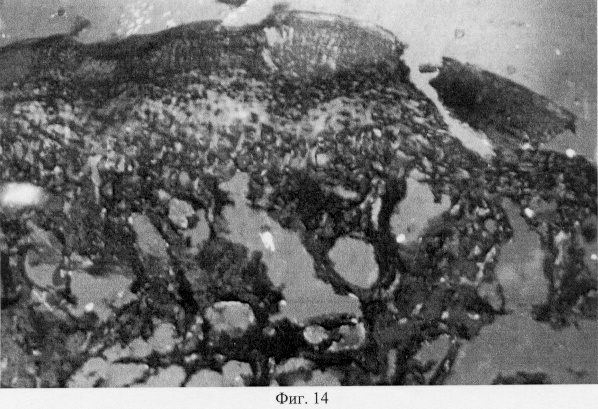
Поляризационно-оптический анализ препаратов убедительно продемонстрировал, что в области повреждения суставного хряща нарушается ориентация коллагеновых конструкций хрящевого матрикса, что выражается в их тангенциальном расположении в глубоких отделах, тогда как у интактных животных они имеют ориентацию вертикально свободной поверхности (фиг.11. Архитектоника коллагеновых волокон в поврежденном суставном хряще. Феноловая реакция (реакция Эбнера). Об. 10, ок. 8). В промежуточной зоне хряща отсутствует феномен рефракции, что может быть связано с ее обеднением коллагеновыми волокнами и ослаблением метаболических потенций. При окраске препаратов толуидиновым синим установлено, что поврежденный хрящ, выполненный регенератом, изменяет свои тинкториальные свойства (не обладает метахромазией), что может отражать перераспределение гликозаминогликанов и связанной воды, которая, как известно, определяет устойчивость хряща к силовым нагрузкам на сжатие (фиг.12. Распределение гликозаминогликанов в области повреждения суставного хряща. Толуидиновый синий. Об. 10, ок. 8). Данная особенность в структурной организации поврежденных участков может свидетельствовать об их несостоятельности в биомеханическом отношении. В области повреждения суставного хряща показано преобладание сульфатированных форм гликозаминогликанов, дающих γ-метахромазию. Этот факт может свидетельствовать о высокой биосинтезирующей активности данных участков, в сравнении со смежными зонами, в которых превалируют высокосульфатированные формы этих протеогликанов (фиг.13. Представительство гликозаминогликанов в поврежденных и смежных отделах суставного хряща при экспериментальном моделировании экстремального воздействия. Толуидиновый синий. Об. 10, ок. 8, фиг.14. Представительство гликозаминогликанов в поврежденных и смежных отделах суставного хряща при экспериментальном моделировании экстремального воздействия. Толуидиновый синий. Об. 10, ок. 8). Не исключено, что описанные изменения в содержании углеводно-белковых комплексов носят адаптивный характер. Есть основания полагать, что источником регенерата хряща может служить субхондральная кость в его центральных отделах и капсула сустава в периферических зонах. Вместе с тем, новые генерации хряща не успевают достичь той степени морфологической зрелости, которая свойственна хрящевому покрытию у интактных животных, что может быть связано с дополнительной травматизацией молодой хондроидной ткани, структурная организация которой не адекватна падающим на нее силовым нагрузкам.
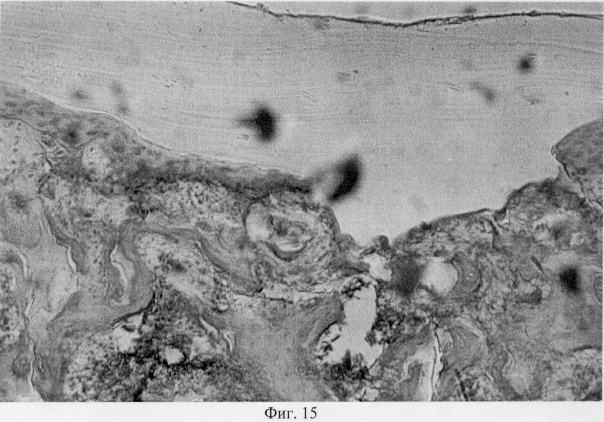
Структурные преобразования субхондральной кости заключаются в нарушении процессов остеогенеза. Это выражается в истончении и рассасывании костных трабекул с образованием резорбционных лакун, заполненных детритом, уменьшении количественного представительства бластических форм клеток, появлении очагов хондроида с пикноформными хондроцитами, обрамляющего поврежденные участки хрящевой поверхности (фиг.15. Деструкция субхондральной кости и хондроидный пролиферат в ней. Гематоксилин и эозин. Об. 10, ок. 8).
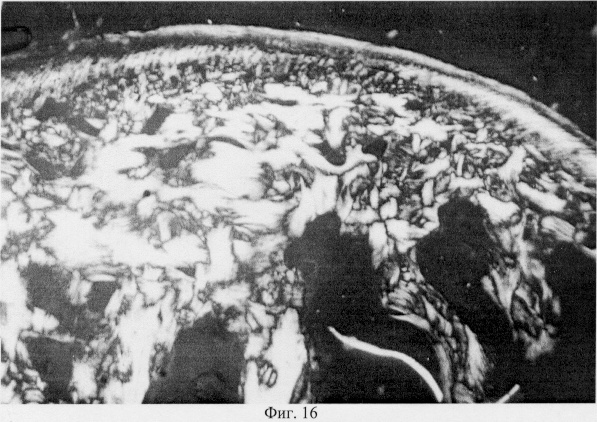
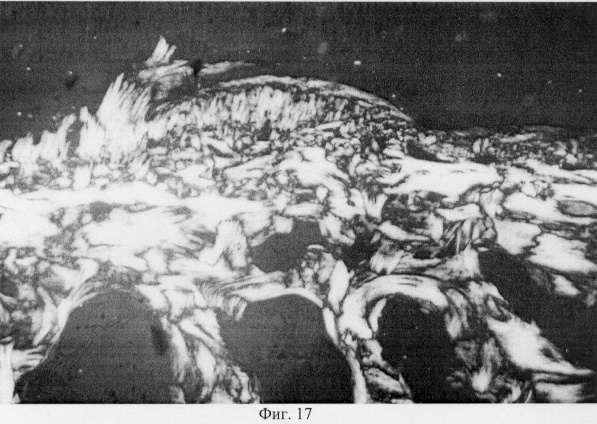
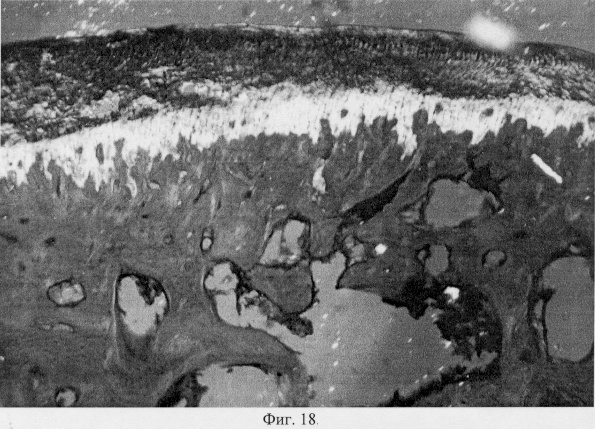
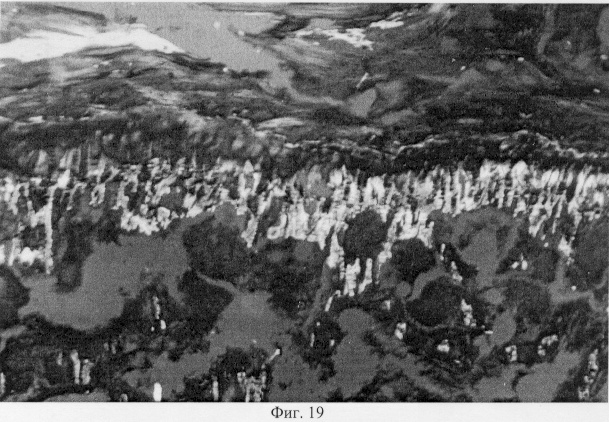
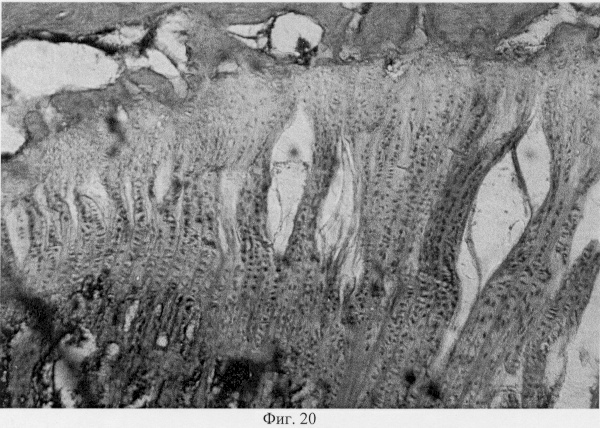
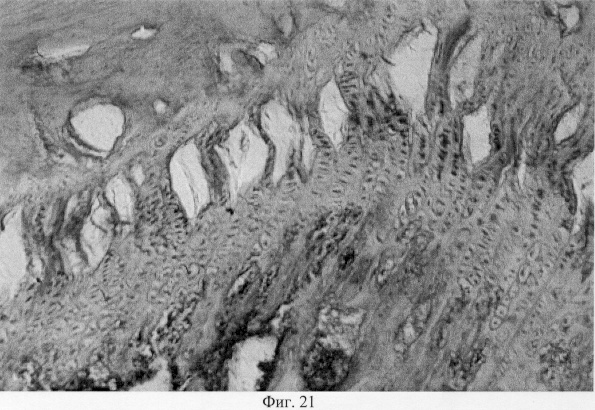
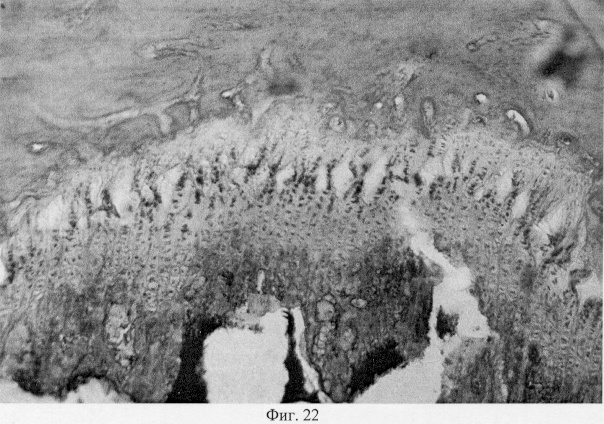
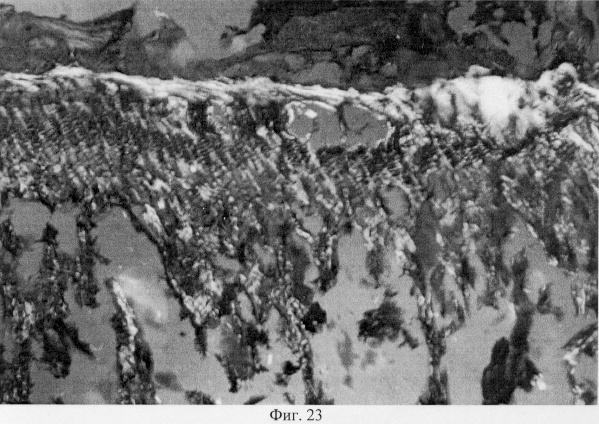
Использование методов поляризационной микроскопии позволило выявить компенсаторные преобразования в субхондральной кости, выражающиеся в склерозировании костных балок, расположенных в территориальной близости к участкам, имеющим более высокую степень рефракции коллагена (фиг.16. Субхондральный остеосклероз в области повреждения суставного хряща. Феноловая реакция (реакция Эбнера). Об. 10, ок. 8, фиг.17. Субхондральный остеосклероз в области повреждения суставного хряща. Феноловая реакция (реакция Эбнера). Об. 10, ок. 8), а также повышенное содержание несульфатированных форм гликозаминогликанов и гиалуроновой кислоты, закономерно возрастающее по мере приближения к поврежденным отделам (фиг.18. Содержание гликозаминогликанов в субхондральной кости по мере приближения к поврежденным отделам. Толуидиновый синий. Об. 10, ок. 8, фиг.19. Содержание гликозаминогликанов в субхондральной кости по мере приближения к поврежденным отделам. Толуидиновый синий. Об. 10, ок. 8). Выявленные особенности могут свидетельствовать об активно протекающих здесь процессах фибриллогенеза в сравнении с дистрофически измененными зонами кости, которые отличаются высоким представительством хондроитинсульфатов, содержание которых, как известно, дает наиболее ценную информацию при определении зрелости и потенций хрящевых клеток. Существенные изменения деструктивного генеза обнаружены со стороны метафизарного хряща, которые проявляются в его гипертрофическом развитии, нарушении соотношения структурных зон, среди которых наибольшее представительство имеет зона "монетных столбиков", содержащая обширные кистозные полости и измененные формы клеток (фиг.20. Структурная организация метафизарного хряща в условиях моделирования экстремального воздействия. Гематоксилин и эозин. Об. 10, ок. 8). Обращают на себя внимание зоны гипертрофированного и разрушенного хряща (фиг.21. Структурная организация метафизарного хряща в условиях моделирования экстремального воздействия. Гематоксилин и эозин. Об. 10, ок. 8, фиг.22. Структурная организация метафизарного хряща в условиях моделирования экстремального воздействия. Гематоксилин и эозин. Об. 10, ок. 8). Как показали наши исследования, зона роста отличается гетерогенностью распределения различных фракций гликозаминогликанов по площади гистологического среза (фиг.23. Распределение гликозаминогликанов в метафизарном хряще при моделировании экстремального воздействия. Толуидиновый синий. Об. 10, ок. 8, фиг.24. Распределение гликозаминогликанов в метафизарном хряще при моделировании экстремального воздействия. Толуидиновый синий. Об. 10, ок. 8), что может отражать специфику силовых нагрузок, падающих на кость в целом и отдельные ее зоны, вследствие повреждения последних в частности.
Таким образом, внутрисуставные инъекции преднизолона в дозе 15-25 мл 1-2 раза в две недели в течение месяца приводят к выраженным изменениям в суставах, параартикулярных тканях, которые можно квалифицировать как остеоартроз III степени, протекающий по типу асептического некроза. Вместе с тем, компенсаторные реакции поврежденных тканей могут свидетельствовать об их неполной регенерации и несостоятельности в биомеханическом отношении.
В серии экспериментов с введением буфера в сустав после моделирования деструктивного процесса выраженных отличий от вышеизложенных не обнаружено. В связи с этим, сравнительный анализ проведен в группе животных, у которых было смоделировано экстремальное воздействие преднизолоном с последующим введением глюкозамина гидрохлорида.
Структура компонентов сустава в условиях моделирования деструктивного процесса путем внутрисуставного введения преднизолона и действия глюкозамина гидрохлорида.
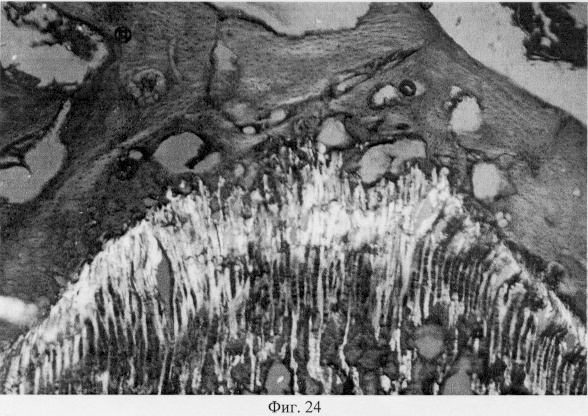
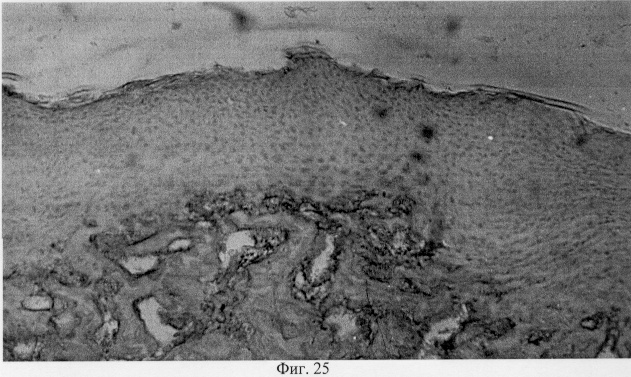
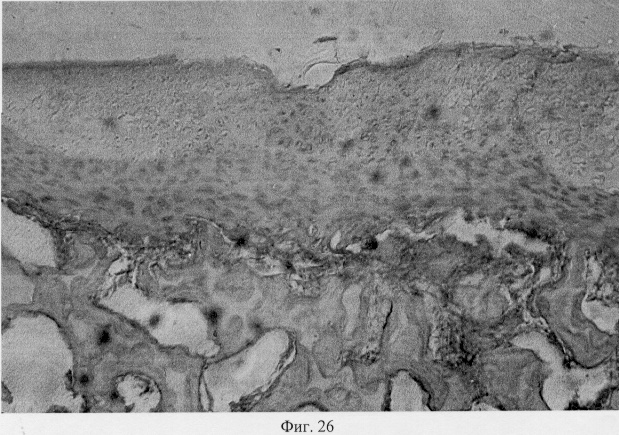
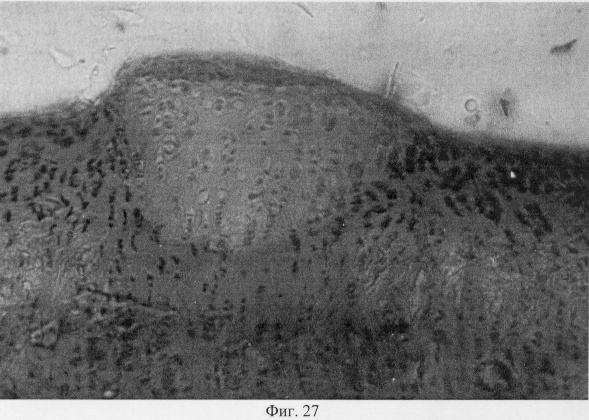
Проведенный анализ гистологических данных позволил заключить, что применение глюкозамина гидрохлорида у собак вызывает комплекс структурных преобразований в поврежденном суставе адаптационного генеза, который приводит в конечном итоге к полному или частичному восстановлению функциональной пригодности. Так, спустя месяц после первой инъекции препарата подвижность сустава была восстановлена частично или полностью. Пораженная конечность выполняет стато-локомоторную функцию. Суставной хрящ на значительном протяжении сохраняет блеск, тогда как его тусклость отмечена лишь вблизи от зоны дефекта. Гистологические исследования показали, что зона дефекта суставного хряща заполнена хондроидным пролифератом, характер которого имеет специфику структурного проявления, обусловленную размерами поврежденного участка (фиг.25. Хондроидный пролиферат в суставном хряще после использования глюкозамина гидрохлорида. Гематоксилин и эозин. Об. 10, ок. 8, фиг.26. Хондроидный пролиферат в суставном хряще после использования глюкозамина гидрохлорида. Гематоксилин и эозин. Об. 10, ок. 8). Клеточная популяция регенерата представлена в основном гипертрофированными хондроцитами, что может определять их оксифильные тинкториальные свойства. Незначительные по площади повреждения выполнены оксифильным регенератом, не отличающимся по своей морфологической организации от поверхностной и промежуточной зон интактной хрящевой поверхности. В территориальной близости от регенераторной зоны отмечены очаги хондроида, состоящие из пикноформных хондроцитов (фиг.27. Замещение дефекта пролифератом. Очаги хондроида вокруг поврежденного участка. Гематоксилин и эозин. Об. 10, ок. 10).
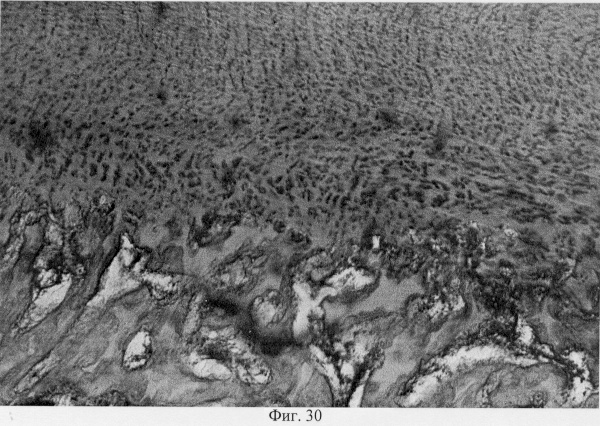
Если повреждения хрящевого покрытия затрагивают значительную площадь, то начальным этапом его репаративной регенерации является образование соединительнотканного регенерата, как бы связывающего между собой неповрежденные участки суставных поверхностей (фиг.28. Начальный этап регенерации суставного хряща после использования глюкозамина гидрохлорида. Гематоксилин и эозин. Об. 10, ок. 8), субрегенераторно дифференцируется волокнистый хрящ, волокна которого ориентированы в соответствии с линиями силовых нагрузок, испытываемых суставными поверхностями (фиг.29. Замещение дефекта волокнистым хрящом после использования глюкозамина гидрохлорида. Гематоксилин и эозин. Об. 10, ок. 10, фиг.30. Замещение дефекта волокнистым хрящом после использования глюкозамина гидрохлорида. Гематоксилин и эозин. Об. 10, ок. 10).
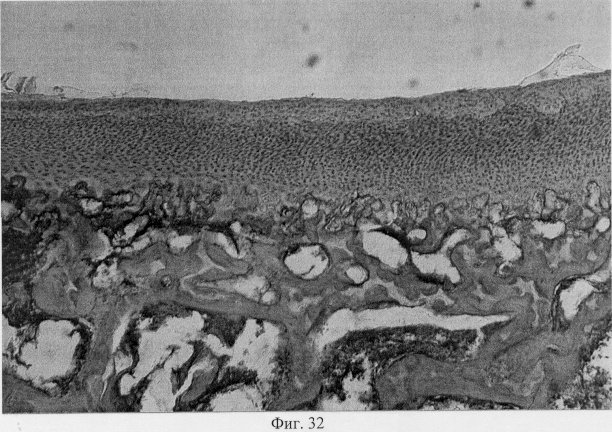
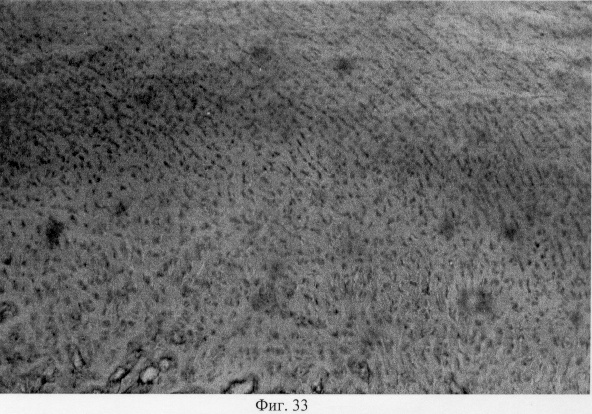
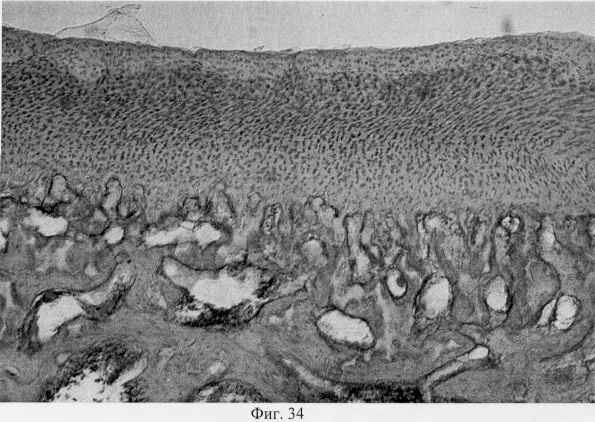
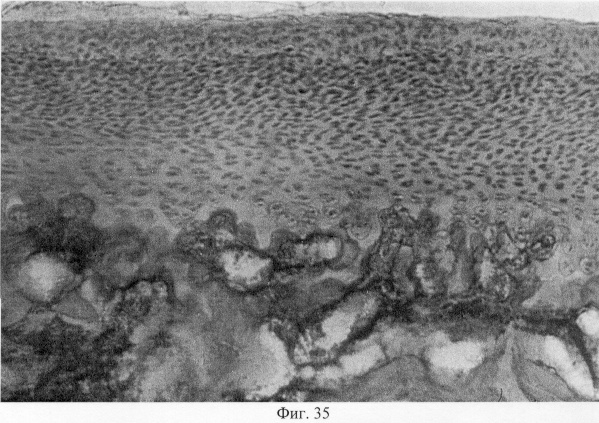
Результатом репаративных реактивных преобразований со стороны хряща является постепенное выравнивание нарушенных контуров суставной поверхности и образование целостного хрящевого покрытия (фиг.31. Формирование хрящевого покрытия после использования глюкозамина гидрохлорида. Гематоксилин и эозин. Об. 10, ок. 8, фиг.32. Формирование хрящевого покрытия после использования глюкозамина гидрохлорида. Гематоксилин и эозин. Об. 10, ок. 8). Однако важно подчеркнуть, что новообразованный суставной хрящ имеет тканеспецифические особенности, отличающие его от таковых у интактных особей. Так, после использования глюкозамина гидрохлорида хрящевое покрытие сустава имеет те же структурные зоны, что и у контрольных особей: поверхностную, промежуточную и глубокую. При этом поверхностная зона на начальных этапах регенераторного процесса имеет большее представительство и структуру, стереотипичную, характерную для волокнистого хряща. Но на более поздних этапах регенераторного процесса она приобретает клеточную специфику гиалиновой хрящевой ткани (фиг.33. Стадийность формирования поверхностной зоны суставного хряща при использовании глюкозамина гидрохлорида. Стадия волокнистого хряща. Гематоксилин и эозин. Об. 10, ок. 10, фиг.34. Стадийность формирования поверхностной зоны суставного хряща при использовании глюкозамина гидрохлорида. Стадия гиалинового хряща. Гематоксилин и эозин. Об. 10, ок. 8). Кроме того, промежуточная зона представлена в основном одиночно расположенными хондроцитами, изогенные группы и капсулы можно видеть лишь в ее глубоких отделах (фиг.35. Структурная организация суставного хряща после использования глюкозамина гидрохлорида. Гематоксилин и эозин. Об. 10, ок. 10).
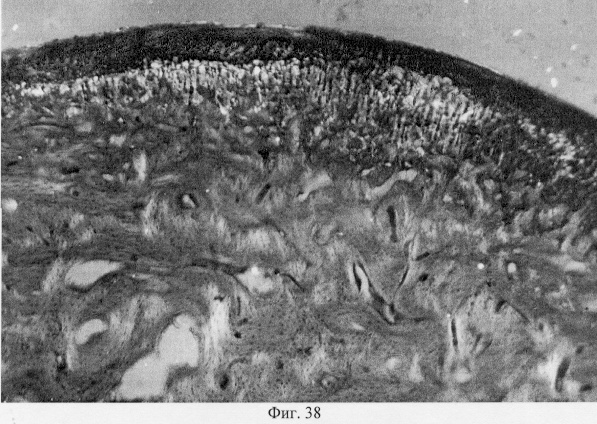
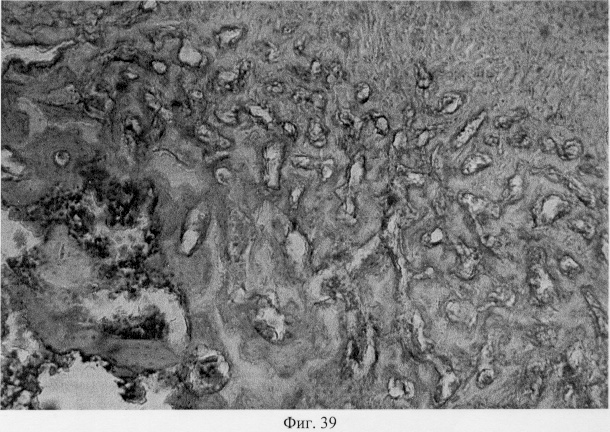
При анализе степени ориентационной упорядоченности макромолекул межклеточного вещества с помощью поляризационной микроскопии показано, что регенерат в суставном хряще представлен ориентированными коллагеновыми структурами, соответствующими контрольным особям: тангенциально в поверхностной и вертикально в промежуточной и глубокой зонах (фиг.36. Архитектоника коллагеновых конструкций в регенерировавшем хряще после использования глюкозамина гидрохлорида. Феноловая реакция (реакция Эбнера). Об. 10, ок. 8, фиг.37. Архитектоника коллагеновых конструкций в регенерировавшем хряще после использования глюкозамина гидрохлорида. Феноловая реакция (реакция Эбнера) Об. 10, ок. 10.). Вместе с тем, рефракция этого фибриллярного белка гетерогенна по площади гистологического среза, что может быть связано с неполным завершением процессов внутритканевой дифференцировки вновь образованного хряща. Сравнительное изучение препаратов, окрашенных толуидиновым синим, продемонстрировало высокое содержание в суставном хряще высокосульфатированных фракций гликозаминогликанов, что позволяет думать о его биомеханическом совершенстве (фиг.38. Распределение гликозаминогликанов в суставном хряще после использования глюкозамина гидрохлорида. Толуидиновый синий. Об. 10, ок. 8, фиг.39. Репаративная регенерация субхондральной кости после использования глюкозамина гидрохлорида. Гематоксилин и эозин. Об. 10, ок. 8). Проведенные исследования позволяют заключить, что источником образования хрящевого регенерата после использования глюкозамина гидрохлорида может явиться синовиальный паннус суставной капсулы, инициирующий в свою очередь стадийность репаративной регенерации суставного хряща, которая включает стадии волокнистого и гиалинового хряща. Показано также, что глюкозамина гидрохлорид стимулирует внутритканевую дифференцировку регенерата в сторону хондрогенеза, обеспечивая специфичность гуморального микроокружения суставной поверхности.
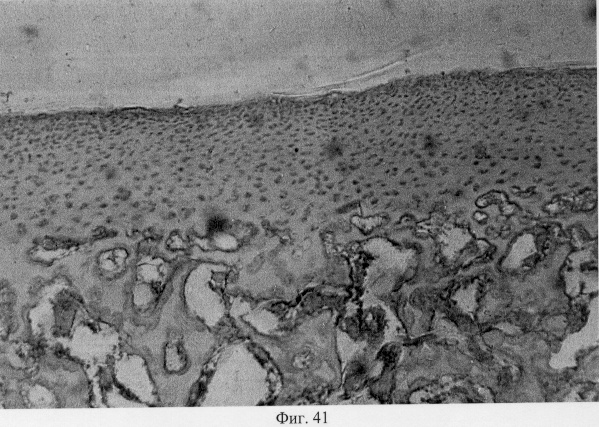
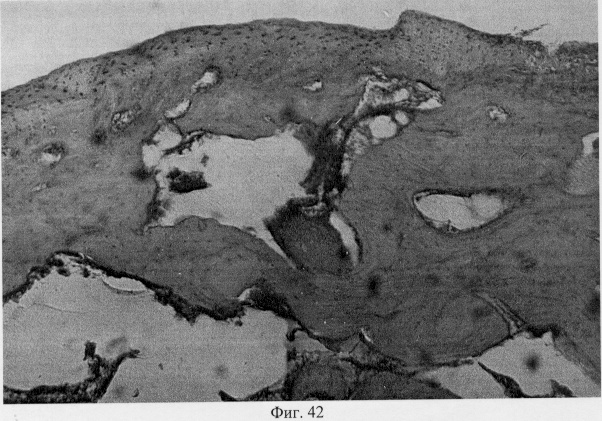
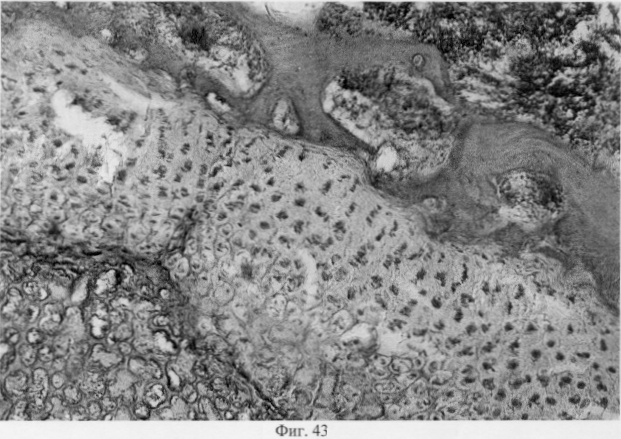
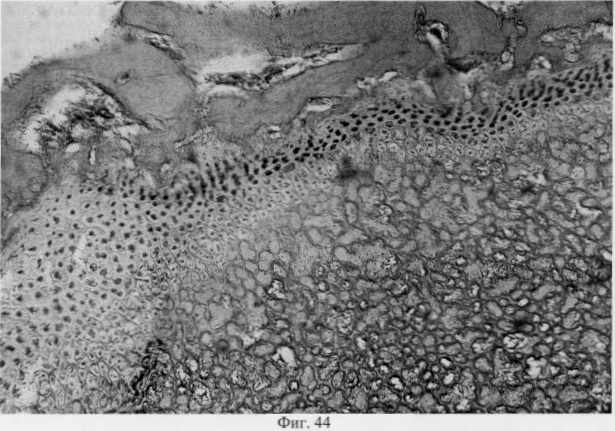
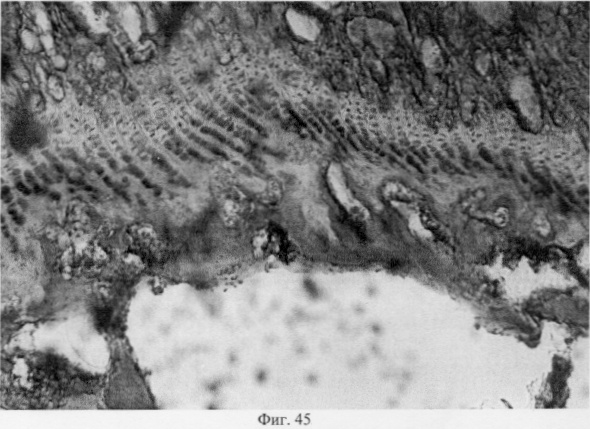
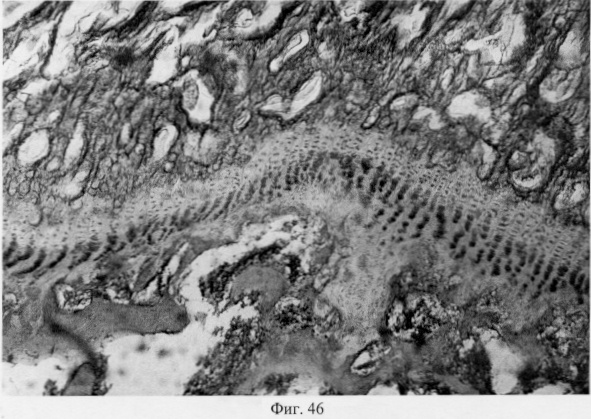
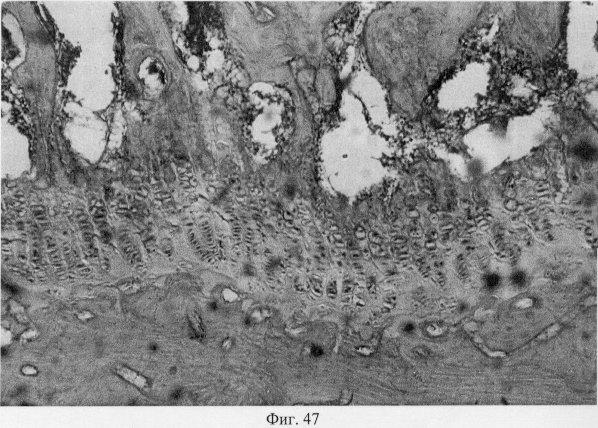
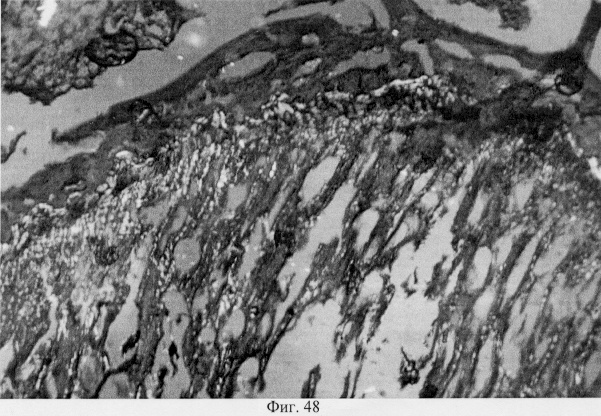
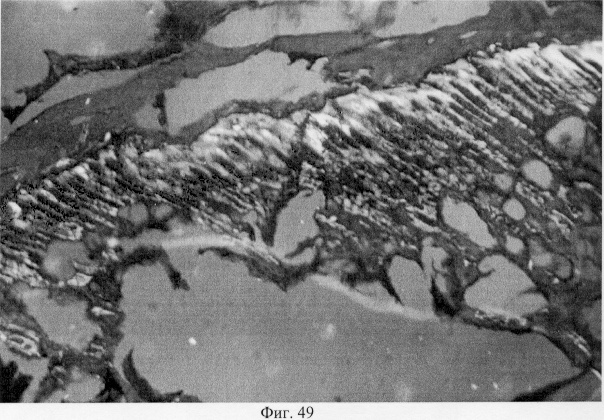
В субхондральной кости выявлены репаративные преобразования, заключающиеся в стазе и запустевании инвазированных сосудов, повышении плотности линий склеивания, увеличении количественного представительства остеобластов и остеоцитов (фиг.38. Распределение гликозаминогликанов в суставном хряще после использования глюкозамина гидрохлорида. Толуидиновый синий. Об. 10, ок. 8, фиг.39. Репаративная регенерация субхондральной кости после использования глюкозамина гидрохлорида. Гематоксилин и эозин. Об. 10, ок. 8, фиг.40. Восстановление микроархитектоники субхондральной костной ткани после введения глюкозамина гидрохлорида. Гематоксилин и эозин. Об. 10, ок. 8). В глубоких отделах сохраняются очаги деструкции кости, однако, вблизи них активно протекают процессы регенерации, выражающиеся в формировании новых генераций костной ткани (фиг.41. Репаративная регенерация субхондральной костной ткани после использования глюкозамина гидрохлорида. Гематоксилин и эозин. Об. 10, ок. 8, фиг.42. Репаративная регенерация субхондральной костной ткани после использования глюкозамина гидрохлорида. Гематоксилин и эозин. Об. 10, ок. 8). Кроме того, нами выявлены обширные зоны хондроидного пролиферата в субхондральной кости, состоящего из одиночных хондроцитов, изогенных групп, гипертрофированных форм и значительных по площади участков разрушенного хряща (фиг.43. Структурная организация хондроидного пролиферата в субхондральной кости. Гематоксилин и эозин. Об. 10, ок. 8, фиг.44. Структурная организация хондроидного пролиферата в субхондральной кости. Гематоксилин и эозин. Об. 10, ок. 8). Можно допустить, что подобные структуры являются гипертрофически развитым метафизарным хрящем, выполняющим роль местного резервуара хондроидных образований. При изучении пластинок роста показано увеличение их площади в сравнении с таковыми у животных, принятых за норму. Лишь в отдельных случаях сохраняется разволокнение хряща и деструктивные формы клеток (фиг.45. Структурная организация метафизарного хряща после использования глюкозамина гидрохлорида. Гематоксилин и эозин. Об. 10, ок. 8, фиг.46. Структурная организация метафизарного хряща после использования глюкозамина гидрохлорида. Гематоксилин и эозин. Об. 10, ок. 8), вместе с тем, на большом протяжении ростковых пластин зарегистрировано восстановление их структуры и зональной дифференцировки (фиг.47. Структурная организация метафизарного хряща после использования глюкозамина гидрохлорида. Гематоксилин и эозин. Об. 10, ок. 8). Кроме того, в их составе обнаружено высокое содержание кератан- и хондроитинсульфатов в сравнении с деструктивными локусами метафизарного хряща (фиг.48. Содержание высокосульфатированных форм гликозаминогликанов в метафизарном хряще после использования глюкозамина гидрохлорида. Толуидиновый синий. Об. 10, ок. 8, фиг.49. Содержание высокосульфатированных форм гликозаминогликанов в метафизарном хряще после использования глюкозамина гидрохлорида. Толуидиновый синий. Об. 10, ок. 8).
Итак, внутрисуставная инъекция преднизолона в дозе 15-25 мл 1-2 раза в две недели в течение месяца вызывает в коленном суставе у собак устойчивую картину остеоартроза III степени. Она проявляется комплексом структурных преобразований деструктивного генеза в суставных и параартикулярных тканях, характерных для некроза. Однако внутримышечное использование глюкозамина гидрохлорида в дозе 15-25 мг 1-2 раза в неделю в течение месяца индуцирует репаративные процессы в суставном хряще, не угнетая синтез коллагена, не вызывая ульцерогенного воздействия, оказывая стабильный хондромодулирующий эффект, что определяет явление репарации.
Количественное изучение рефракции гликозаминогликанов (смотрите таблицу) в данных сериях и оценка проявления компенсации при воздействии на компоненты суставов указанным способом 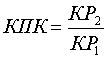 сокращает время проведения исследования и повышает его точность, унифицирует оценку воздействия на компоненты суставов у животных.
сокращает время проведения исследования и повышает его точность, унифицирует оценку воздействия на компоненты суставов у животных.

Источники информации
1. SU 1782547 A1, 5A 61 B 10/00, 23.12.1992.
2. Annefeld M. Veranderungen in der Ultrastructur der Chondrocyten unter dem Einflub eines GAG-Peptid-Komplex / M.Annefeld, R.Raiss // Aktuelle Rheumatologie. - 1984. - S.2, Bd.9. - S.99-105.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОЦЕНКИ КОМПЕНСАТОРНОГО ПРОЯВЛЕНИЯ ПРИ ВОЗДЕЙСТВИИ НА КОМПОНЕНТЫ СУСТАВОВ У ЖИВОТНЫХ В УСЛОВИЯХ МОДЕЛИРОВАНИЯ ДЕСТРУКТИВНОГО ПРОЦЕССА | 2004 |
|
RU2271139C1 |
| СПОСОБ КОРРЕКЦИИ ДЕСТРУКТИВНО-ДИСТРОФИЧЕСКИХ ПОРАЖЕНИЙ В СУСТАВАХ ЖИВОТНЫХ | 2003 |
|
RU2246305C1 |
| СПОСОБ КОРРЕКЦИИ ДЕСТРУКТИВНО-ДИСТРОФИЧЕСКИХ ИЗМЕНЕНИЙ В СУСТАВАХ ЖИВОТНЫХ | 2003 |
|
RU2246304C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ У ЖИВОТНЫХ ВНУТРИСУСТАВНОГО ДИСТРОФИЧЕСКОГО ПРОЦЕССА | 1994 |
|
RU2117997C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ПОСТТРАВМАТИЧЕСКОГО КОКСАРТРОЗА | 2008 |
|
RU2398288C1 |
| Средство, обладающее противовоспалительным, антиоксидантным и антиульцерогенным действием, способностью ингибировать развитие дегенеративно-деструктивных процессов тканей, представляющее собой 2-этил-6-метил-3-гидроксипиридиния-4-изобутилфенилпропаноат | 2023 |
|
RU2814495C1 |
| СПОСОБ ЛЕЧЕНИЯ КОНТРАКТУР СУСТАВОВ С ДЕГЕНЕРАТИВНЫМИ ИЗМЕНЕНИЯМИ | 2002 |
|
RU2235518C2 |
| СПОСОБ МОДЕЛИРОВАНИЯ ОСТЕОАРТРОЗА | 2015 |
|
RU2587039C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ОСТЕОАРТРОЗА ВИСОЧНО-НИЖНЕЧЕЛЮСТНОГО СУСТАВА | 2010 |
|
RU2463669C2 |
| СПОСОБ ВОССТАНОВЛЕНИЯ ГИАЛИНОВОГО ХРЯЩА ПРИ ЛЕЧЕНИИ ВНУТРИСУСТАВНЫХ ПЕРЕЛОМОВ | 2008 |
|
RU2364360C1 |









Изобретение относится к ветеринарной медицине. Определяют коэффициент рефракции гликозаминогликанов дважды: до и после компенсаторного воздействия и по формуле определяют диагностический критерий - коэффициент проявления компенсации (КПК):  , где КР1 - коэффициент рефракции гликозаминогликанов до воздействия, КР2 - коэффициент рефракции после компенсаторного воздействия, при величине КПК менее 1,5 дается отрицательная оценка проявления компенсации, а при значении КПК 1,5 и более проявление компенсации считается адекватным. Способ повышает точность и унифицирует оценку воздействия на компоненты суставов. 1 табл., 49 ил.
, где КР1 - коэффициент рефракции гликозаминогликанов до воздействия, КР2 - коэффициент рефракции после компенсаторного воздействия, при величине КПК менее 1,5 дается отрицательная оценка проявления компенсации, а при значении КПК 1,5 и более проявление компенсации считается адекватным. Способ повышает точность и унифицирует оценку воздействия на компоненты суставов. 1 табл., 49 ил.
Способ оценки проявления компенсации при воздействии на компоненты суставов у животных в условиях моделирования деструктивно-дистрофического процесса, заключающийся в том, что дважды определяют коэффициент рефракции гликозаминогликанов, до и после компенсаторного воздействия, и по формуле определяют диагностический критерий - коэффициент проявления компенсации (КПК): КПК=КР2/КР1, где KP1 - коэффициент рефракций гликозаминогликанов воздействия, KP2 - коэффициент рефракции после компенсаторного воздействия, при величине КПК менее 1,5 дают отрицательную оценку компенсаторного проявления, при величине КПК 1,5 и более проявление компенсации считают адекватным.
Авторы
Даты
2006-03-10—Публикация
2004-10-08—Подача