Настоящее изобретение относится к выделению, идентификации и характеристике рекомбинантных молекул ДНК, кодирующих ферменты, катализирующие перенос жирных кислот от фосфолипидов к диацилглицерину в биосинтетическом пути получения триацилглицерина.
Триацилглицерин (ТАГ) является наиболее распространенным в природе источником энергии, имеющим липидную основу. Считается, что основной путь синтеза ТАГ включает три последовательных переноса ацильной группы от ацил-СоА к глицериновому скелету (1, 2). В течение многих лет ацил-СоА: диацилглицерин ацил-трансфераза (ДАГАТ), катализирующая реакцию переноса третьей ацил-группы, считалась единственным ферментом, вовлеченным в синтез ТАГ. Он переводит диацилглицерин (ДАТ) из синтеза липида мембраны в ТАГ (2). Гены, кодирующие этот фермент, были недавно идентифицированы как у мышей (3), так и у растений (4, 5), и было показано, что закодированные белки аналогичны ацил-СоА: холестерин ацилтрансферазе (АХАТ). Также недавно сообщалось, что в масляном грибе Mortierella ramanniana существует другая ДАГАТ, не коррелирующая ни с ДАГАТ мыши, ни с семейством генов АХАТ или другим известным геном (6).
Настоящее изобретение относится к новому типу ферментов и генов для трансформации, кодирующих эти ферменты. Более конкретно, изобретение относится к использованию генов, кодирующих не описанный ранее тип ферментов, здесь и далее обозначенных как фосфолипид: диацилглицерин ацилтрансферазы (ФДАТ), причем эти ферменты катализируют ацил-СоА-независимую реакцию. Указанный тип генов, экспрессируемый отдельно в трансгенных организмах, увеличит общее количество масла (триацилглицеринов), производимого в клетке. При экспрессии в трансгенных организмах гены ФДАТ в комбинации с геном для синтеза редкой жирной кислоты повысят уровень редких жирных кислот в триацилглицеринах.
В мире существует значительный интерес к получению химического сырья, такого как жирные кислоты, для промышленных целей из возобновляемых растительных ресурсов, а не из невозобновляемых нефтепродуктов. Эта концепция имеет большую привлекательность для производителей и потребителей на основании консервации ресурсов и обеспечивает значительные возможности для развития новых промышленных культур для сельского хозяйства.
Существует разнообразное множество редких жирных кислот в маслах из диких видов растений, которые хорошо охарактеризованы. Многие из этих кислот обладают промышленным потенциалом, что привело к интересу к одомашниванию значимых видов растений для обеспечения агропромышленного производства конкретных жирных кислот.
Развитие методов генной инженерии совместно с более глубоким пониманием биосинтеза редких жирных кислот делает возможным перенос генов, кодирующих ключевые ферменты, участвующие в синтезе конкретной жирной кислоты, из диких видов в одомашненные масличные культуры. Таким путем отдельные жирные кислоты можно получать с высокой степенью чистоты и в больших количествах при умеренной стоимости.
Во всех культурах типа рапса, подсолнечника, масличной пальмы и т.д. масло (т.е. триацилглицерины) является наиболее ценным продуктом семян или плодов, а остальные компоненты, такие как крахмал, белок и волокно считаются побочными и менее ценными продуктами. Увеличение количества масла по отношению к весу за счет других соединений масличной культуры увеличит ценность этой культуры. Если бы работу генов, регулирующих направление восстановленного углерода в производство масла, можно было регулировать в сторону усиления, клетка аккумулировала бы большее количество масла за счет других продуктов. Такие гены можно использовать не только в клетках, продуцирующих большое количество масла, таких как клетки масличных культур, но при их помощи можно также индуцировать значительное продуцирование масла в культурах с низким или умеренным его содержанием, например в сое, овсе, кукурузе, картофеле, сахарной свекле, репе, а также в микроорганизмах.
Краткое содержание изобретения
Многие из представляющих интерес редких жирных кислот, например, жирные кислоты с цепью средней длины, гидрокси- жирные кислоты, эпокси- жирные кислоты и ацетилен- жирные кислоты, по физическим свойствам сильно отличаются от обычных жирных кислот растений. В настоящем изобретении обнаружено, что в видах растений, в природе аккумулирующих редкие жирные кислоты в масле семян (т.е. в триацилглицерине), эти кислоты в мембранных (фосфо)липидах семян отсутствуют или присутствуют в очень небольших количествах. Низкая концентрация этих кислот в мембранных липидах, вероятно, обусловливает определенную функцию мембраны и, таким образом, определенные функции клетки. Одним из аспектов изобретения является то, что семена трансгенных культур можно заставить накапливать большие количества редких жирных кислот, если эти кислоты эффективно удаляются из липидов мембраны и направляются в триацилглицерины семян.
Изобретателями обнаружен новый класс ферментов растений, катализирующих перенос жирных кислот от фосфолипидов к диацилглицерину в синтезе триацилглицерина через ацил-СоА-независимую реакцию, также обнаружено, что эти ферменты (фосфолипид:диацилглицерин апилтрансферазы, сокращенно ФДАТ) участвуют в удалении гидроксилированных, эпоксигенированных жирных кислот, а также, возможно, других редких жирных кислот, таких как жирные кислоты с цепью средней длины, из фосфолипидов растений.
Было показано, что эта ферментативная реакция присутствует в микросомальных препаратах их хлебопекарных дрожжей (Saccharomyces cerevisiae). Настоящее изобретение далее относится к ферменту, включающему аминокислотную последовательность, приведенную ниже под обозначением SEQ ID №2, или к его функциональному фрагменту, производному, аллели, гомологу или изоферменту. Был получен так называемый "нокаутный" мутант дрожжей, дефектный по соответствующему гену, и было показано, что в микросомальных мембранах мутанта полностью отсутствует активность ФДАТ. Шаким образом было доказано, что нарушенный ген кодирует фермент ФДАТ (последовательности SEQ ID №1 и 2). Кроме того, этот фермент ФДАТ характеризуется аминокислотной последовательностью, обозначенной далее SEQ ID №2, содержащей липазный участок консервативной последовательности FXKWVEA.
Настоящее изобретение также относится к ферменту, включающему аминокислотную последовательность, обозначенную SEQ ID №1a, 2b или 5а, или его функциональному фрагменту, производному, аллели, гомологу или изоферменту.
Далее были идентифицированы гены и/или белки, отвечающие за ранее не известную функцию, и они рассматриваются как составляющие суть настоящего изобретения. Был идентифицирован ген из Schizosaccharomyces pombe, SPBC776.14 (последовательность SEQ ID №3), и предполагаемая открытая рамка считывания SPBC776.14, САА22887 (последовательность SEQ ID №13). Далее были идентифицированы геномные последовательности Arabidopsis thaliana (последовательности SEQ ID №4,10 и 11), кодирующие предполагаемые белки, а также были идентифицированы предполагаемая открытая рамка считывания ААС 80628 из локуса АС 004557 A. thaliana (последовательность SEQ ID №14) и предполагаемая открытая рамка считывания AAD 10668 из докуса АС 003027 A. thaliana (последовательность SEQ ID №15).
Также были идентифицированы частично отсеквенированный кДНК клон из Neurospora crassa (последовательность SEQ ID №9) и клон Zea mays, содержащий EST (Expressed Sequence Tag - маркерная экспрессируемая последовательность), (последовательность SEQ ID №7) и соответствующая предполагаемая аминокислотная последовательность (SEQ ID №8). Кроме того, были идентифицированы два кДНК клона, EST клон Arabidopsis thaliana (последовательность SEQ ID №5 и соответствующая предсказанная аминокислотная последовательность SEQ ID №6) и EST клон Lycopersicon esculentum (последовательность SEQ ID №12). Далее, ферменты, обозначенные ФДАТ, кодируемые аминокислотной последовательностью из группы, включающей последовательности под номерами SEQ ID №2а, 3а, 5b, 6 и 7b, содержащие липазный участок FXKWVEA, рассматриваются как составляющие суть изобретения. Кроме того, фермент, включающий аминокислотную последовательность, кодируемую нуклеотидной последовательностью, ее частью, производным, аллелем или гомологом из группы, включающей последовательности под номерами SEQ ID №1, 1b, 3, 3b, 4, 4a, 4b, 5, 5b, 6b, 7, 8b, 9, 9b, 10, 10b, 11, 11b или 12 или функциональный фрагмент, производное, аллель, гомолог или изофермент кодирующей фермент аминокислотной последовательности составляют суть изобретения.
Под функциональным фрагментом данного фермента понимают любую полипептидную последовательность, обнаруживающую специфическую ферментную активность фосфолипид: диацилглицерин ацилтрансферазы (ФДАТ). Длина функционального фрагмента может варьировать в пределах от 660±10 аминокислот до 660±250 аминокислот, предпочтительно от 660±50 до 660±100 аминокислот, причем "базовое число" 660 аминокислот относится в данном случае к полипептидной цепи фермента ФДАТ (последовательность SEQ ID №2), кодируемого нуклеотидной последовательностью SEQ ID №1. Следовательно, "базовое число" функциональной полной длины фермента может варьировать в зависимости от кодирующей нуклеотидной последовательности.
Под частью данной нуклеотидной последовательности понимают любую нуклеотидную последовательность, кодирующую полипептид, обладающий специфической активностью фосфолипид:диацилглицерин ацилтрансферазы (ФДАТ). Длина части нуклеотидной последовательности может варьировать в широком диапазоне нескольких сот нуклеотидов, основываясь на кодирующей области гена или высококонсервативной последовательности. Например, длина варьирует в пределах от 1900±10 до 1900±1000 нуклеотидов, предпочтительно от 1900±50 до 1900±700, наиболее предпочтительно от 1900±100 до 1900±500 нуклеотидов, причем "базовое число" 1900 нуклеотидов соответствует в данном случае кодирующей нуклеотидной последовательности фермента ФДАТ SEQ ID №1. Следовательно, "базовое число" функциональной полной длины гена может варьировать.
Под аллельным вариантом данной нуклеотидной последовательности понимают любую другую нуклеотидную последовательность, кодирующую полипептид с функционально эквивалентной активностью. К аллелям относятся как встречающиеся в природе варианты данной нуклеотидной последовательности, так и синтетические нуклеотидные последовательности, полученные методами, известными в данной области техники. Также рассматриваются измененные нуклеотидные последовательности, приводящие к ферменту с измененной активностью и/или регуляцией или устойчивому к специфическим ингибиторам. Настоящее изобретение далее включает природные или синтетические мутации первоначально выделенной нуклеотидной последовательности. К этим мутациям относятся замена, добавление, деления, инверсия или вставка одного или более нуклеотидов.
Под гомологичной нуклеотидной последовательностью понимают комплементарную последовательность и/или последовательность, которая специфически гибридизуется с данной нуклеотидной последовательностью. Гибридизующиеся последовательности включают сходные нуклеотидные последовательности из группы ДНК или РНК, которые специфически взаимодействуют с данными нуклеотидными последовательностями в по крайней мере умеренно жестких условиях, известных в данной области техники. Предпочтительным неограничивающим примером жестких условий гибридизации являются следующие: гибридизация в 6 Х растворе хлорида натрия/цитрата натрия (SSC) при температуре около 45°С с последующей отмывкой один или более раз в растворе 0.2 Х SSC, 0.1% SDS при 50-60°С. Также сюда относятся короткие нуклеотидные последовательности, например длиной от 10 до 30 нуклеотидов, предпочтительно от 12 до 15 нуклеотидов. Также сюда относятся праймеры и гибридизационные зонды.
Гомологичная последовательность, составляющая суть настоящего изобретения - это последовательность, которая по крайней мере на 40%, предпочтительно по крайней мере на 50-60%, более предпочтительно по крайней мере на 70%, 80% или 90%, и наиболее предпочтительно по крайней мере на 95%, 96%, 97%, 98% или 99% или более гомологична нуклеотидной последовательности под номером SEQ ID №1.
Все вышеприведенные определения верны для аминокислотных последовательностей и функциональных ферментов и могут быть легко трансформированы специалистами в данной области техники.
Под изоферментами понимают ферменты с такой же или сходной субстратной специфичностью и/или каталитической активностью, но другой первичной структурой.
С одной стороны, данное изобретение направлено на последовательности нуклеиновых кислот, кодирующих ФДАТ. Сюда относятся как последовательности, кодирующие биологически активные ФДАТ, так и последовательности, используемые в качестве зондов, векторов для трансформации или промежуточных конструкций при клонировании. Кодирующая ФДАТ последовательность может кодировать полную или частичную последовательность, в зависимости от целей. Учитываются полная геномная последовательность или ее часть, последовательность к ДНК, предшественник ФДАТ и зрелая ФДАТ.
Далее изобретение включает нуклеотидную последовательность, выбираемую из группы, состоящей из последовательностей под номерами SEQ ID №1, 1b, 3, 3b, 4, 4a, 9b, 10, 10b или 11 или их частей, производных, аллелей или гомологов. К изобретению относится также неполная нуклеотидная последовательность, соответствующая нуклеотидной последовательности полной длины из группы последовательностей под номерами SEQ ID №1, 5, 5b, 6b, 7, 8b, 9, 11b или 12 или их частей, производных, аллелей или гомологов. Кроме того, нуклеотидная последовательность, включающая последовательность, по крайней мере, на 40% гомологичную нуклеотидной последовательности из группы последовательностей под номерами SEQ ID №1, 1b, 3, 3b, 4, 4a, 4b, 5, 5b, 6b, 7, 8b, 9, 9b, 10, 10b, 11, 11b или 12, также рассматривается в объеме изобретения.
К изобретению относится также генно-инженерная конструкция, включающая описанные нуклеотидные последовательности данного изобретения, оперативно связанная с гетерологичной нуклеиновой кислотой.
Термин "оперативно связанная" означает последовательную организацию, например из промотора, кодирующей последовательности, терминатора и/или других регуляторных элементов, причем каждый элемент может выполнять свою функцию при экспрессии нуклеотидной последовательности.
Далее, в объеме изобретения рассматривается вектор, включающий описанную нуклеотидную последовательность данного изобретения. Сюда относится как вектор экспрессии, так и вектор, включающий дополнительно ген селективного маркера и/или нуклеотидные последовательности для репликации в клетке-хозяина и/или интеграции в геном клетки-хозяина.
С другой стороны, данное изобретение относится к способу получения ФДАТ в клетке хозяина или ее потомстве, включая генетически измененные семена масличных культур, дрожжи и плесневые грибы или любые другие накапливающие масло организмы, путем экспрессии конструкции в клетке. Клетки, содержащие ФДАТ как результат продуцирования кодирующей ФДАТ последовательности, также рассматриваются как составляющие суть изобретения.
Далее изобретение включает трансгенную клетку или организм, содержащие описанную нуклеотидную последовательность и/или описанную генно-инженерную конструкцию и/или описанный вектор. Далее предметом настоящего изобретения является трансгенная клетка или организм, которые представляют собой эукариотическую клетку или организм. Предпочтительными трансгенными клетками или организмом являются дрожжевая клетка или клетка растения или растение. Настоящее изобретение далее включает описанную трансгенную клетку или организм с измененным биосинтетическим путем получения триацилглицерина. Трансгенная клетка или организм, обладающие измененным содержанием масла, также включены в объем изобретения.
Далее, изобретение включает трансгенную клетку или организм, в которых активность ФДАТ изменена. Эта измененная активность ФДАТ характеризуется изменением в экспрессии гена, каталитической активности и/или регуляции активности фермента. Более того, трансгенная клетка или организм включены в настоящее изобретение, причем измененный биосинтетический путь получения триацилглицерина характеризуется предотвращением накопления нежелательных жирных кислот в липидах мембраны.
С другой стороны, это изобретение относится также к способам использования последовательности ДНК, кодирующей ФДАТ, для увеличения содержания масла в клетке.
Другой аспект изобретения относится к переводу больших количеств редких жирных кислот в триацилглицерин, синтезируемый в клетке, путем введения последовательности ДНК, кодирующей ФДАТ, которая специфически удаляет эти жирные кислоты из липидов мембраны и переводит их в триацилглицерин. Клетки растений с такой модификацией также рассматриваются в объеме изобретения.
Далее, изобретение включает способ получения триацилглицерина, включающий выращивание описанной трансгенной клетки или организма в условиях, при которых экспрессируется описанная нуклеотидная последовательность и при которых в описанных трансгенных клетках работает указанный фермент, катализирующий перенос жирных кислот от фосфолипидов к диацилглицерину с образованием триацилглицерина.
Кроме того, триацилглицерины, получаемые описанным выше способом, включены в область настоящего изобретения.
Кроме того, объектом изобретения является использование описанной нуклеотидной последовательности и/или описанного фермента для получения триацилглицерина и/или триацилглицеринов о редкими жирными кислотами. Использование описанной нуклеотидной последовательности и/или описанного фермента для трансформации какой-либо клетки или организма с целью экспрессирования в этой клетке или организме, приводящее к измененному, предпочтительно возросшему, содержанию масла в клетке или организме, рассматривается в объеме настоящего изобретения.
ФДАТ настоящего изобретения включает любую аминокислотную последовательность, такую как белок, полипептид или пептидный фрагмент, получаемую из микроорганизма, животного или растительного источника, и обнаруживает способность катализировать получение триацилглицерина из фосфолипида и диацилглицерина в условиях работы фермента. Под "условиями работы фермента" понимают любые необходимые условия, возможные в окружающей среде (например, такие факторы как температура, рН, отсутствие ингибирующих веществ), позволяющие ферменту функционировать.
Из приведенных здесь специфических последовательностей можно получить другие ФДАТ. Кроме того, очевидно, что можно получить природные и синтетические ФДАТ, используя модифицированные аминокислотные последовательности и исходные материалы для моделирования синтетических белков из приведенных в качестве примера ФДАТ и из ФДАТ, получаемых при использовании приведенных в качестве примера последовательностей. Модифицированные аминокислотные последовательности включают последовательности, которые были мутированы, укорочены, увеличены или изменены сходным образом, в том случае, если последовательности были частично или полностью синтезированы. Последовательности, которые фактически получены из препаратов растений или идентичны им, или кодируют идентичные белки, в независимости от способа, использованного для получения белка или последовательности, рассматриваются как полученные естественным путем.
Далее, для поиска и выявления "гомологичных" или "взаимосвязанных" ФДАТ из различных растительных и микробных источников можно использовать нуклеотидные последовательности-зонды (ДНК или РНК) настоящего изобретения.
Далее, очевидно, что специалист в данной области техники при помощи информации, приведенной в настоящей заявке, может идентифицировать активность ФДАТ в любом организме, очистить фермент с этой активностью и таким образом идентифицировать "негомологичную" аминокислотную последовательность, кодирующую такой фермент.
Настоящее изобретение можно по существу охарактеризовать следующими аспекта.
1. Использование гена ФДАТ (геномный клон или кДНК) для трансформации.
2. Использование молекулы ДНК по п.1, где указанная ДНК используется для трансформации какого-либо организма с целью экспрессирования в данном организме и получения активного рекомбинантного фермента ФДАТ для увеличения содержания масла в организме.
3. Использование молекулы ДНК по п.1, где указанная ДНК используется для трансформации какого-либо организма с целью предотвращения накопления нежелательных жирных кислот в липидах мембраны.
4. Использование по п.1, где указанный ген ФДАТ используется для трансформации трансгенных накапливающих масло организмов, разработанных для получения какой-либо редкой жирной кислоты, которая является вредной при содержании в больших количествах в липидах мембраны, к таким кислотам относятся жирные кислоты с цепью средней длины, гидроксилированные жирные кислоты, эпоксигенированные жирные кислоты и ацетиленовые жирные кислоты.
5. Использование по п.1, где указанный ген ФДАТ используется для трансформации организмов, и где указанные организмы скрещивают с другими накапливающими масло организмами, разработанными для получения какой-либо редкой жирной кислоты, которая является вредной при содержании в больших количествах в липидах мембраны, к таким кислотам относятся жирные кислоты с цепью средней длины, гидроксилированные жирные кислоты, эпоксигенированные жирные кислоты и ацетиленовые жирные кислоты.
6. Использование по п.1, где фермент, кодируемый указанным геном ФДАТ или кДНК, кодирует ФДАТ с выраженной ацил-специфичностыо.
7. Использование по п.1, где указанный ген или кДНК, кодирующие ФДАТ, получены из Saccharomyces cerevisae или содержат нуклеотидные последовательности, кодирующие аминокислотные последовательности, которые на 30% или более идентичны аминокислотной последовательности ФДАТ, приведенной под номером SEQ ID №2.
8. Использование по п.1, где указанный ген или кДНК, кодирующие ФДАТ, получены из Saccharomyces cerevisae или содержат нуклеотидные последовательности, кодирующие аминокислотные последовательности, которые на 40% или более идентичны аминокислотной последовательности ФДАТ, приведенной под номером SEQ ID №2.
9. Использование по п.1, где указанный ген или кДНК, кодирующие ФДАТ, получены из Saccharomyces cerevisae или содержат нуклеотидные последовательности, кодирующие аминокислотные последовательности, которые на 60% или более идентичны аминокислотной последовательности ФДАТ, приведенной под номером SEQ ID №2.
10. Использование по п.1, где указанный ген или кДНК, кодирующие ФДАТ, получены из Saccharomyces cerevisae или содержат нуклеотидные последовательности, кодирующие аминокислотные последовательности, которые на 80% или более идентичны аминокислотной последовательности ФДАТ, приведенной под номером SEQ ID №2.
11. Использование по п.1, где указанный ген или к ДНК, кодирующие ФДАТ, получены из растений или содержат нуклеотидные последовательности, кодирующие аминокислотные последовательности, которые на 40% или более идентичны аминокислотной последовательности ФДАТ из Arabidopsis thaliana или белку, кодируемому полноразмерной копией частичных кДНК клонов Zea mays, Ly-copericon esculentum или Neurospora crassa.
12. Трансгенные накапливающие масло организмы, включающие в свой геном ген ФДАТ, перенесенный методом рекомбинантных ДНК или соматической гибридизацией.
13. Трансгенные накапливающие масло организмы по п.12, включающие в свой геном ген ФДАТ, обладающий особенной субстратной специфичностью к редким жирным кислотам, и ген указанной редкой жирной кислоты.
14. Трансгенные организмы по п.12 или 13 из группы, включающей грибки, растения и животных.
15. Трансгенные организмы по п.12 или 13 из группы, включающей сельскохозяйственные растения.
16. Трансгенные организмы по п.12 или 13 из группы, включающей сельскохозяйственные растения, причем указанный ген ФДАТ экспрессируется под контролем промотора, специфичного для органа накопления.
17. Трансгенные организмы по п.12 или 13 из группы, включающей сельскохозяйственные растения, причем указанный ген ФДАТ экспрессируется под контролем промотора из семени.
18. Масла из организмов по п.12-17.
19. Способ изменения ацил-специфичности ФДАТ путем изменения нуклеотидной последовательности встречающегося в природе кодирующего гена, и, как следствие такого изменения - получение гена, кодирующего фермент с новой ацил-специфичностью.
20. Белок, кодируемый молекулой ДНК по п.1 или его функциональный фрагмент.
21. Белок по п.20, обозначенный как фосфолипид: диацилглицерин ацилтрансфера.
22. Белок по п.21 с выраженной ацил-специфичностью.
23. Белок по п.22 с аминокислотной последовательностью, приведенной далее под номерами SEQ ID №2, 13, 14 или 15 (и белки, кодируемые полноразмерными или частичными генами, приведенными далее под номерами SEQ ID №1, 3, 4, 5, 7, 9, 10, 11 или 12) или аминокислотная последовательность, которая по крайней мере на 30% гомологична указанной аминокислотной последовательности.
24. Белок по п.23, выделенный из Saccharomyces cerevisae.
Общие методы:
Дрожжевые штаммы и плазмиды. В работе использовали дикие штаммы дрожжей FY1679 (МАТα his3-Δ200 leu2-Δ1 trp1-Δ6 urа3-52) или W303-1A (MATa ADE2-1 canl-100 his3-11, 15 leu2-3,112 trpl-1 ura3-1) (7). Штамм FVKT004-04C(AL) с нарушением YNR008w::KanMX2, согенный штамму FY1679, был получен из коллекции Euroscarf (8). Фрагмент длиной 2751 пара оснований, содержащий ген YNR008w, с фланкирующей ДНК в 583 пары оснований с 5' конца и 183 пары оснований с 3' конца был амплифицирован с геномной ДНК W303-1A при использовании Taq-полимеразы и последовательностей 5'-TCTCCATCTTCTGCAAAACCT-3' и 5'-CCTGTCAAAAACCTTCTCCTC-3' в качестве праймеров. Продукт ПЦР очищали электрофорезом в агарозном геле и клонировали по сайгу EcoRI в плазмиду pBluescript (pbluescript-pdat). Для исследования комплементации клонированный фрагмент вырезали из pBluescript по сайгам HindIII-SacI и клонировали по сайгам HindIII-SacI в плазмиду pFL39 (9), полученная плазмида обозначена как pUS1. Для сверхэкспрессии гена ФДАТ фрагмент EcoRI длиной 2202 пары оснований из плазмиды pBluescript, содержащий только 24 пары оснований 5'-фланкирующей ДНК, клонировали по сайгу BamHI в вектор экспрессии GAL1-TPK2 pJN92 (12), полученная конструкция обозначена как pUS4.
Микросомальные препараты. Микросомы из развивающихся семян подсолнечника (Helianthus annuus), Ricinus communis и Crepis palaestina получали способом, описанным Stobart и Stymne (11). Для получения микросом дрожжей 1 г дрожжевых клеток (свежий вес) ресуспендировали в 8 мл ледяного буфера (20 мМ Tris-Cl, pH 7.9,10 мМ MgCl2, 1 мМ ЭДТА, 5% (объемных) глицерина, 1 мМ ДТТ, 0.3 М сульфата аммония) в стеклянной пробирке объемом 12 мл. В эту пробирку добавляли 4 мл стеклянных бусин (диаметр 0,45-0,5 мм), затем пробирку интенсивно встряхивали (3×60с) в гомогенизаторе клеток MSK (В. Braun Melsungen AG, Германия). Гомогенизированную суспензию центрифугировали при 20000×g в течение 15 мин при 6°С, полученный супернатант снова центрифугировали при 100000×g в течение 2 ч при 6°С. Осадок, полученный при 100000×g, ресуспендировали в 0.1 М растворе фосфата калия (pH 7.2) и хранили при -80°С. Далее этот препарат назван неочищенной микросомальной дрожжевой фракцией.
Липидные субстраты. Радиоактивно меченные рицинолеиновую (12-гидроксиоктадециленовую) и вернолевую (12,13-эпокси-9-октадециленовую) кислоты получали ферментативно из [1-14C]олеиновой кислоты и линолевой кислоты соответственно путем инкубации с микросомальными препаратами из Ricinus communis и Crepis palaestina, соответственно (12). Синтез фосфатидилхолинов (ФХ) или фосфатидилэтаноламинов (ФЭ) с 14С-меченными ацильными группами в положении sn-2 проводили при использовании либо ферментативного (13), либо синтетического (14) ацилирования [14С]-олеиновой, [14С]рицинолеиновой или [14C]вернолевой кислот. Диолеил-ФХ, меченные по положению sn-1, синтезировали из sn-1-[14С]олеил-лизо-ФХ и немеченой олеиновой кислоты, как описано в работе (14). Sn-1-олеил-sn-2-[14С]-рицинолеил-ДАГ синтезировали из ФХ действием фосфолипазы С типа XI из В. Cereus (Sigma Chemical Co.), как описано в работе (15). Моновернолеил- и дивернолеил-ДАГ синтезировали из ТАГ, экстрагированных из семян Euphorbia lagascae, при использовании ТАГ-липазы (Rizhopus arrhizuz, Sigma Chemical Co.), как описано ранее (16). Монорицинолеил-ТАГ синтезировали тем же способом при использовании ТАГ, экстрагированного из касторовых бобов.
Липидный анализ. Для определения общего липидного состава дрожжей клетки собирали из 40 мл жидкой культуры, разрушали в шейкере со стеклянными бусинами и экстрагировали в хлороформ, как описано Bligh и Dyer (17), затем проводили разделение тонкослойной хроматографией в смеси гексана/диэтилового эфира/уксусной кислоты (80:20:1) при использовании предварительно покрытых пластин с силикагелем 60 (Merck). Области липидов выявляли быстрой экспозицией с парами I2 и идентифицировали при помощи соответствующих стандартов. Из пластин вырезали полярные липиды, стериновые эфиры и триацилглицерины, а также остающиеся минорные липидные классы, называемые другие липиды. Метиловые эфиры жирных кислот получали нагреванием сухого вырезанного материала при 85°С в течение 60 мин в 2% (объем/объем) серной кислоте в безводном метаноле. Метиловые эфиры экстрагировали гексаном и анализировали ГЖХ на 50 м × 0.32 мм кварцевой колонке CP-Wax58-CB (Chromopack), в качестве внутреннего стандарта использовали метилгептадекановую кислоту. Количественно оценивали содержание жирных кислот в каждой фракции, и эту величину использовали для вычисления относительного количества каждого класса липидов. Для определения общего содержания липидов аликвоты по 3 мл из дрожжевых культур собирали центрифугированием и полученные осадки промывали дистиллированной водой и лиофилизировали. Определяли вес сухих клеток и количественно оценивали содержание жирных кислот при помощи ГЖХ анализа после превращения метиловых эфиров, как это описано выше. Затем вычисляли содержание липидов как нмоль жирной кислоты (ЖК) на мг сухого веса дрожжей.
Ферментативные исследования. Аликвоты неочищенных микросомальных фракций (соответствующие 10 нмоль микросомальных ФХ) из развивающихся семян растений или дрожжевых клеток лиофилизировали в течение ночи. К высушенным микросомам затем добавляли 14C-меченные субстратные липиды, растворенные в бензоле. Бензол упаривали в потоке N2, оставляя липиды в прямом контакте с мембранами, и добавляли 0.1 мл 50 мМ фосфата калия (рН 7.2). Суспензию тщательно перемешивали и инкубировали при 30°С в течение определенного периода времени, до 90 мин. Из реакционной смеси липиды экстрагировали при помощи хлороформа и разделяли тонкослойной хроматографией в смеси гексана/диэтилового эфира/уксусной кислоты (35:70:1.5) на пластинах с силикагелем 60 (Merck). Радиоактивные липиды обнаруживали и количественно оценивали на пластинах при помощи электронной радиоавтографии (Instant Imager, Packard, US).
Культивирование дрожжей. Дрожжевые клетки растили при 28°С в роторном шейкере в жидкой среде YPD (1% дрожжевого экстракта, 2% пептона, 2% глюкозы), синтетической среде (18), содержащей 2% (объем/объем) глицерина и 2% (объем/объем) этанола, или в минимальной среде (19), содержащей 16 г/л глицерина.
Настоящее изобретение далее характеризуется следующими примерами, которые не являются ограничивающими:
Ацил-СоА-независимый синтез ТАГ микросомами масличных семян. В масличных семенах обнаруживают большое количество редких жирных кислот (20). Многие из этих жирных кислот, такие как рицинолеиновая (21) и вернолевая (22) кислоты, синтезируются при использовании в качестве непосредственного предшественника фосфатидилхолина (ФХ) с олеиловой или линолевой группами, этерифицированными по sn-2-положению, соответственно. Однако, хотя ФХ может быть субстратом для синтеза редких жирных кислот и является основным мембранным липидом в семенах, редкие жирные кислоты редко обнаруживают в мембранах. Вместо этого они в основном включаются в ТАГ. Таким образом, в масличных семенах, накапливающих редкие жирные кислоты, должен существовать механизм эффективного и селективного переноса этих редких ацильных групп от ФХ к ТАГ. Реакция переноса биохимически охарактеризована для семян касторовых бобов (Ricinus communis) и Crepis palaestina, растений, которые накапливают большие количества рисинолеиновой и вернолевой кислот соответственно, и подсолнечника (Helianthus annuus), растения, которое содержит в масле семян только обычные жирные кислоты. Неочищенные микросомальные фракции из развивающихся семян инкубировали с ФХ, у которого по sn-2 положению олеиловая, рицинолеиловая и вернолевая группы являются 14С-меченными. После инкубации липиды экстрагировали и анализировали тонкослойной хроматографией. Было обнаружено, что количество радиоактивности, включившейся в нейтральную липидную фракцию, линейно возрастало в течение 4 часов (данные не приведены). Распределение [14С]-ацильных групп внутри нейтральной липидной фракции анализировали через 80 мин (Фиг.1). Интересно, что количество и распределение радиоактивности между различными нейтральными липидами сильно зависело как от вида растений, так и от типа [14С]-ацильной цепи. Так, в микросомах подсолнечника большинство радиоактивности включилось в ДАТ, в независимости от типа [14С]ацильной группы. Напротив, в микросомах R. communis 14С-рицинолеиловая и [14С]вернолевая группы преимущественно включились в ТАГ, в то время как [14С]олеиловые группы в основном обнаружены в ДАТ. И наконец, в микросомах С. palaestina только [14С]вернолевые группы включились в ТАГ, в то время как [14С]-рицинолеиловые группы в основном обнаружены в виде свободных жирных кислот, а [14С]-олеиловые группы - в ДАТ. Это показывает, что высокие in vivo уровни рицинолеиновой кислоты и вернолевой кислоты в ТАГ фракции R.communis и С.Palaestina, соответственно, объясняются эффективным и селективным переносом соответствующих ацильных групп от ФХ к ТАГ в этих организмах.
In vitro синтез триацилглицеринов в микросомальных препаратах развивающихся касторовых бобов приведен в таблице 1.
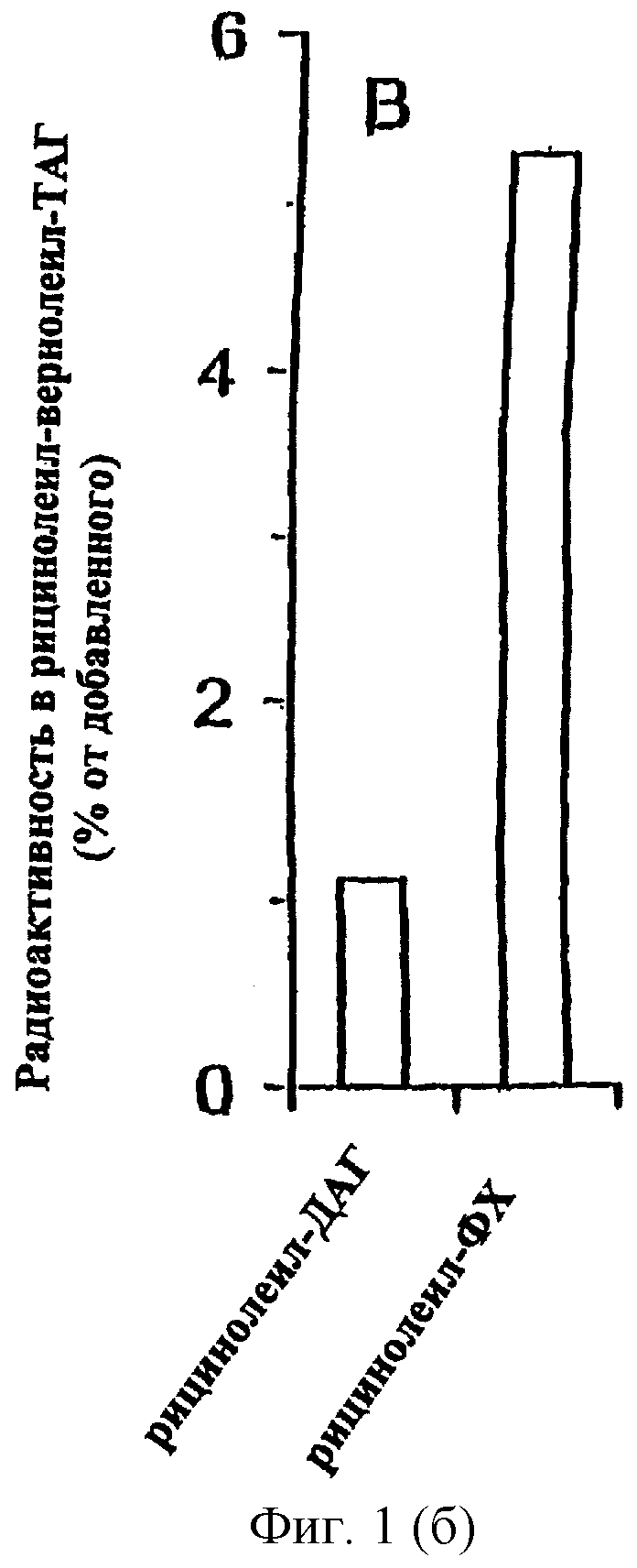
ФДАТ: новый фермент, катализирующий аиил-СоА независимый синтез ТАГ. Было проверено, может ли ДАТ служить как ацильным донором, так и ацильным акцептором в реакциях, катализируемых микросомами масличных семян. Для этого немеченый дивернолеил-ДАГ инкубировали либо с sn-1-олеил-sn-2-[14С]рицинолеил-ДАГ, либо с sn-1-олеил-sn-2-[14С]рицинолеил-ФХ в присутствии микросом R. communis. Синтез молекул ТАГ, содержащих как [14С]рицинолеиловую, так и вернолевую группы, был в 5 раз выше, когда ацил-донором служил [14С]рицинолеил-ФХ, по сравнению с [14С]рицинолеил-ДАГ (Фиг.1В). Эти данные предполагают, что ФХ является непосредственным ацил-донором, а ДАТ - ацил-акцептором в ацил-СоА независимом образовании ТАГ микросомами масличных семян. Таким образом, эта реакция катализируется новым ферментом, который был назван фосфолипид: диацилглицерин ацилтрансфераза (ФДАТ).
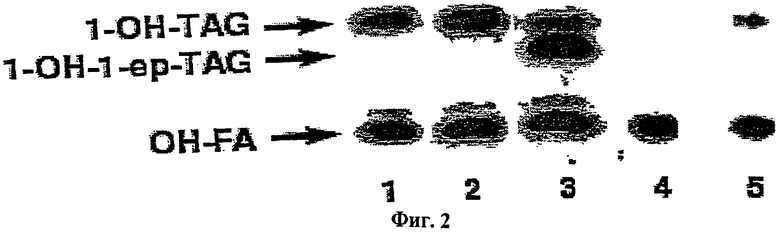
Активность ФДАТ в микросомах дрожжей. Дрожжевые клетки дикого типа культивировали в условиях, при которых индуцируется синтез ТАГ. Из этих клеток получали микросомальные мембраны, инкубировали с sn-2-[14С]рицинолеил-ФХ и ДАТ и анализировали образующиеся меченные продукты. Было обнаружено, что полученные из ФХ [14С]рицинолеиловые группы внутри нейтральной липидной фракции в основном находились в виде свободных жирных кислот или ТАГ, и что количество синтезируемого ТАГ зависело от количества введенного в реакцию ДАТ (Фиг.2). In vitro синтез ТАГ, содержащего как рицинолеиловую, так и вернолевую группы, типа ТАГ, не присутствующего in vivo, из экзогенного добавленного sn-2-[14С]-рицинолеил-ФХ и немеченого вернолеил-ДАГ (Фиг.2, дорожка 3) очевидно демонстрирует наличие в дрожжевых микросомальных мембранах ацил-СоА независимого синтеза ТАГ, включающего ФХ и ДАГ в качестве субстратов. Следовательно, синтез ТАГ в дрожжах может катализироваться ферментом, аналогичным ФДАТ, обнаруженной в растениях.
Ген, кодирующий ФДАТ в дрожжах. Известен ген (YNR00Sw) дрожжевого генома, но ничего неизвестно о функции YNR008w, кроме того, что ген не является необходимым для роста в нормальных условиях. Микросомальные мембраны получали из дрожжевого штамма FVKT004-04C(AL) (8), в котором этот ген с неизвестной функцией был нарушен. Активность ФДАТ в микросомах исследовали при использовании ФХ с радиоактивно меченными жирными кислотами в положении sn-2. В штамме с нарушенным геном активность полностью отсутствовала (Фиг.2, дорожка 4). Имеет значение тот факт, что активность можно частично восстановить присутствием YNR008Sw в однокопийной плазмиде pUS1 (Фиг.2, дорожка 5). Кроме того, ацильные группы фосфатидилэтаноламина (ФЭ) эффективно включались в ТАГ микросомами из дикого штамма, в то время как в мутантном штамме включения из этого субстрата не происходило (данные не приведены). Это показывает, что YNR008w кодирует дрожжевую ФДАТ, которая катализирует перенос ацильной группы из sn-2-положения фосфолипидов к ДАТ, образуя таким образом ТАГ. Следует заметить, что из радиоактивных ФХ не образовывались холестериновые эфиры, даже при инкубациях с добавлением эргостеринов, а также нарушение гена YNR008w не влияло на количество радиоактивных свободных жирных кислот, образующихся из ФХ (данные не приведены). Это указывает на то, что ФДАТ не обладает способностью синтезировать холестериновый эфир или фосфолипазной активностью.
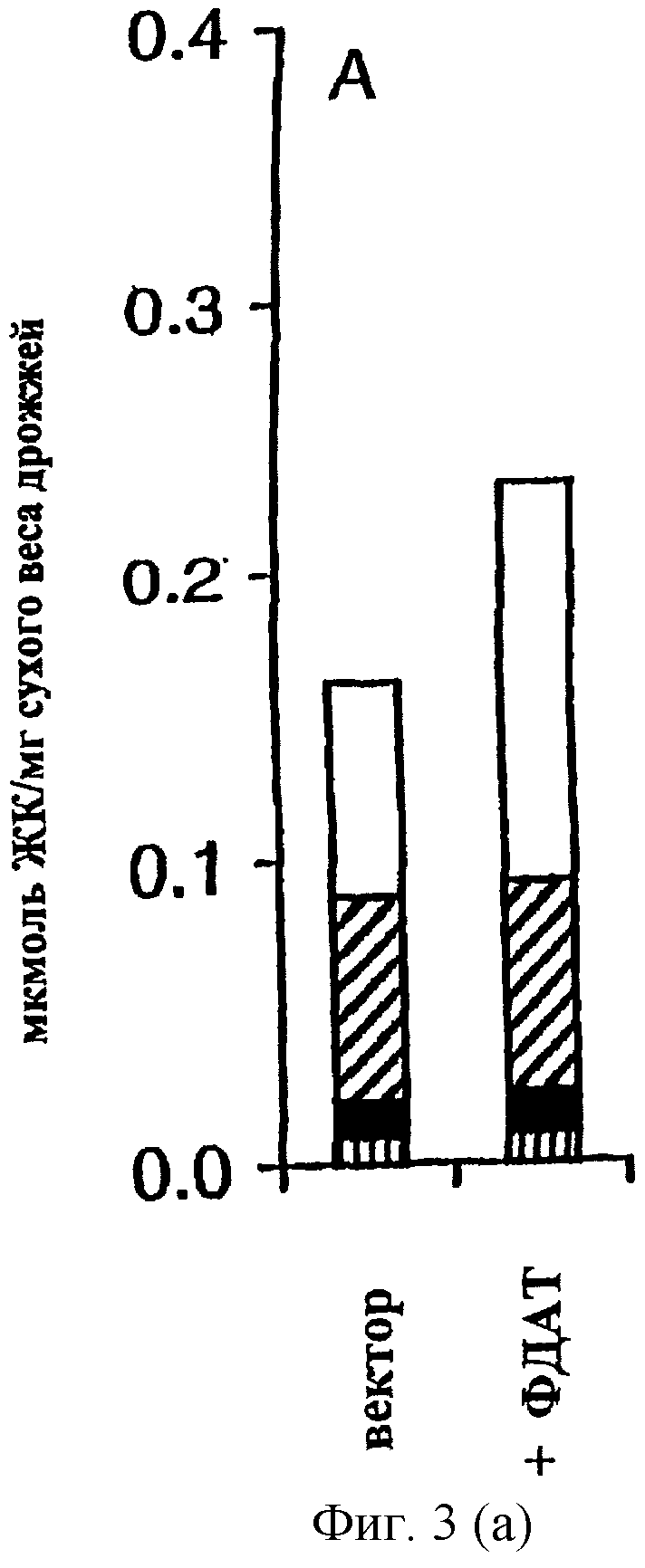
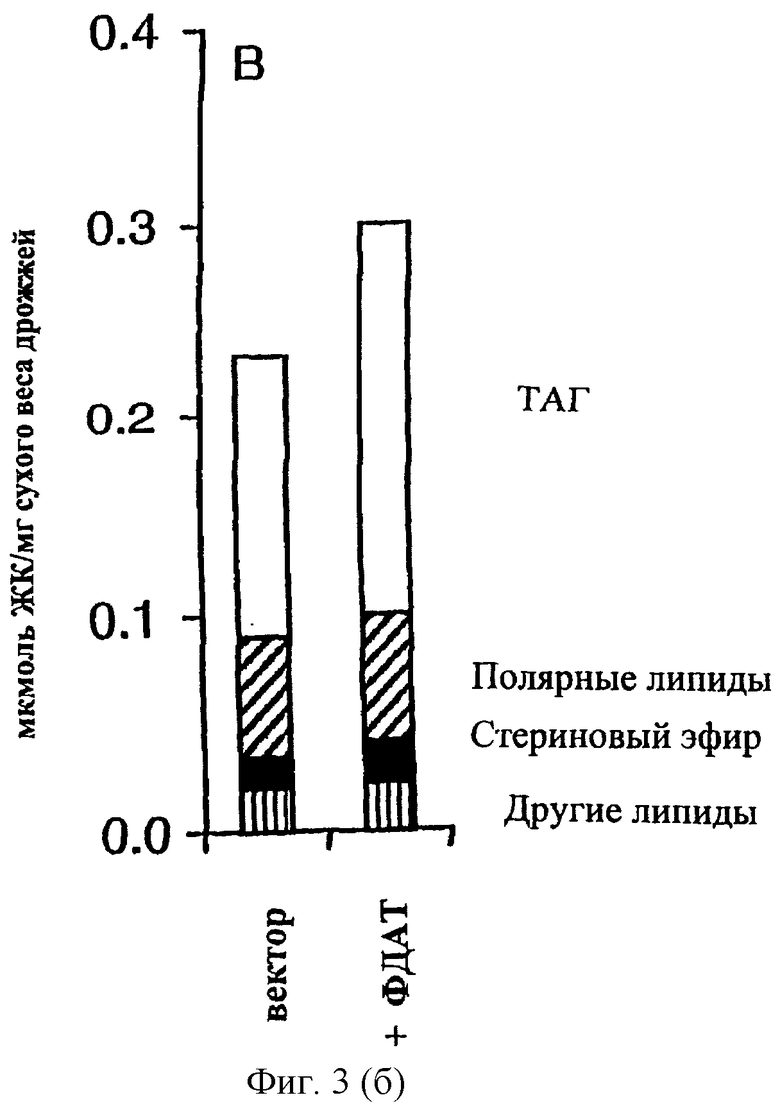
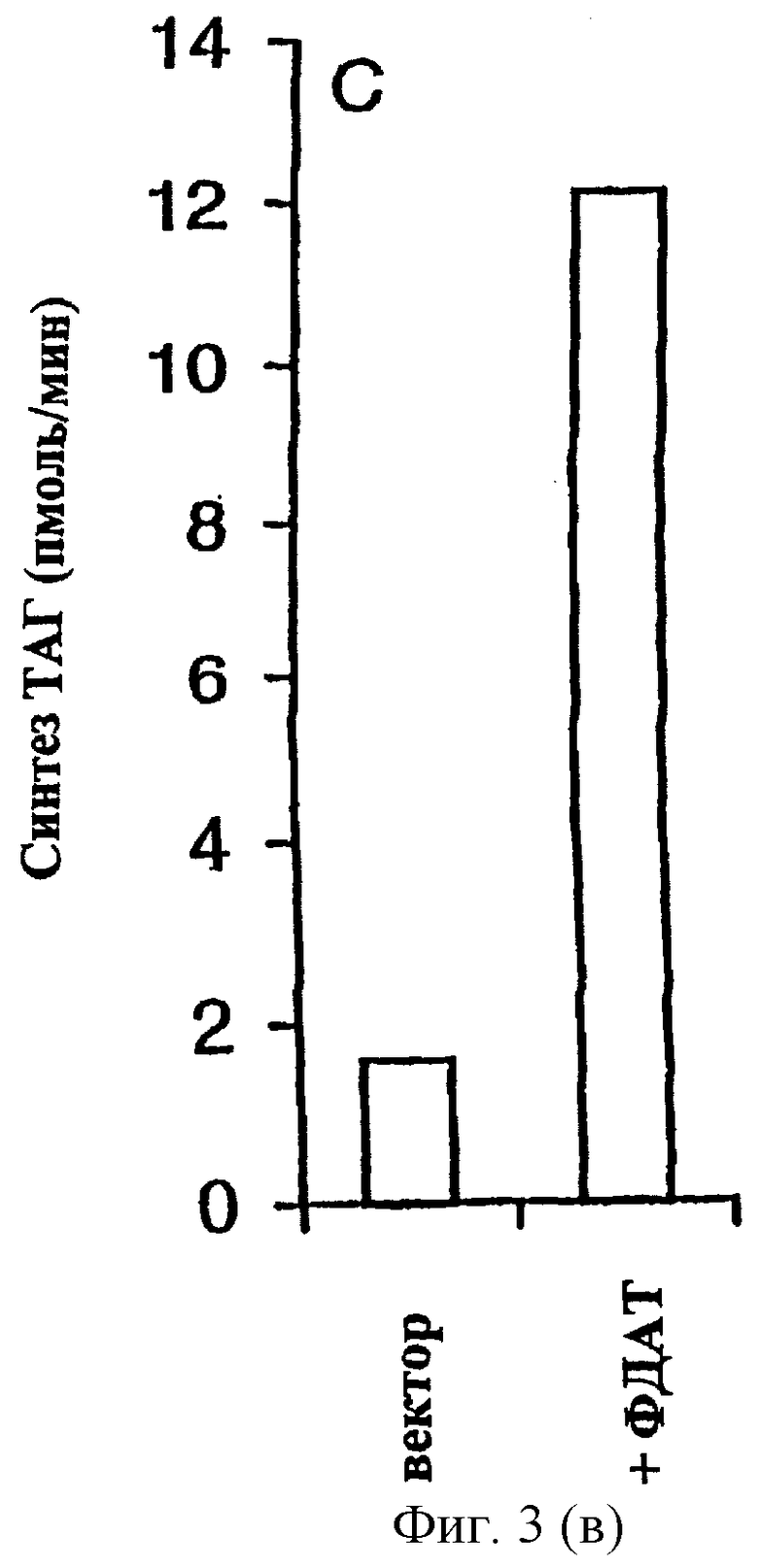
Повышенное содержание ТАГ в клетках дрожжей с сверхэкспрессией ФДАТ. Эффект сверхэкспрессии гена, кодирующего ФДАТ, изучали путем трансформации дрожжевого штамма дикого типа плазмидой pUS4, в которой ген экспрессируется с промотора GAL1:TPK2, индуцируемого галактозой. В качестве контроля использовали клетки, содержащие пустой вектор экспрессии. Клетки растили в синтетической среде с глицерином и этанолом, экспрессию гена индуцировали либо через 2 часа (ранняя логарифмическая фаза), либо через 25 часов (стационарная фаза) добавлением галактозы. Затем клетки инкубировали в течение еще 21 часа, после чего их собирали и проводили исследования. Было обнаружено, что сверхэкспрессия ФДАТ не оказывает значительного влияния на показатель роста, определяемый по оптической плотности. Однако, в штамме с сверхэкспрессией ФДАТ общее содержание липидов, измеряемое как мкмоль жирных кислот на мг сухого веса дрожжей, было на 47% (в логарифмической фазе) или на 29% (в стационарной фазе) выше, чем в контроле. Кроме того, сверхэкспрессия ФДАТ не влияла на содержание полярных липидов или стеринового эфира. Напротив, повышенное содержание липидов в этих клетках полностью зависит от повышенного содержания ТАГ (Фиг.3А, В). Так количество ТАГ возросло в 2 раза в клетках, сверхэкспрессирующих ФДАТ, в ранней логарифмической фазе и на 40% в клетках в стационарной фазе. Следует отметить, что при сверхэкспрессии ФДАТ значительное повышение содержания ТАГ достигалось даже в условиях (т.е. в стационарной фазе), когда индуцируется ДАГАТ и значительно способствует синтезу ТАГ. Активность ФДАТ in vitro, исследованная в микросомах из штамма, сверхэкспрессирующего ФДАТ, была в 7 раз выше, чем в контрольном штамме, это наблюдение согласуется с повышенными уровнями ТАГ, наблюдавшимися in vivo (Фиг.3С). Эти результаты ясно указывают на потенциальное использование гена ФДАТ для повышения содержания масла в трансгенных организмах.
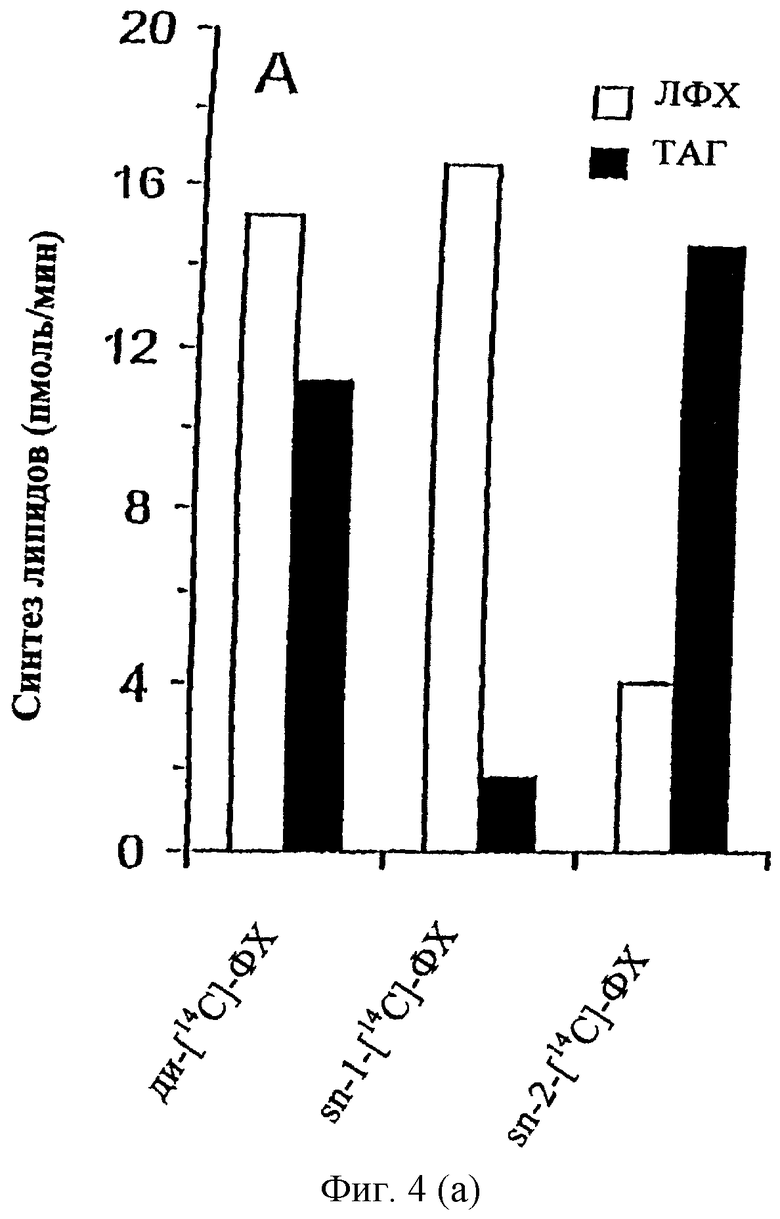
Субстратная специфичность дрожжевой ФДАТ. Субстратную специфичность дрожжевой ФДАТ исследовали при помощи микросом, полученных из штамма, сверхэкспрессирующего ФДАТ (Фиг.4). Уровень синтеза ТАГ в условиях, приведенных на Фиг.4, с диолеил-ФХ в качестве ацил-донора, составлял 0.15 нмоль в минуту на мг белка. При условии, когда обе олеил-группы ФХ являются мечеными, в данных условиях эксперимента было возможно обнаружить перенос 11 пмоль/мин [14С]олеил-цепи в ТАГ и образование 15 пмоль/мин лизо-ФХ. В микросомах из штамма, дефицитного по ФДАТ, не было обнаружено ТАГ, а лизо-ФХ был обнаружен в следовых количествах, что предполагает, что дрожжевая ФДАТ катализирует образование эквимолярных количеств ТАГ и лизо-ФХ при наличии ФХ и ДАТ в качестве субстратов. Тот факт, что лизо-ФХ образуется в несколько больших количествах, чем ТАГ, может объясняться присутствием в дрожжевых микросомах фосфо-липазы, которая продуцирует лизо-ФХ и неэтерифицированные жирные кислоты из ФХ.
Специфичность дрожжевой ФДАТ по отношению к различным положениям ацил-группы исследовали путем инкубации микросом с диолеил-ФХ, у которого [14С]цильная группа находится либо в положении sn-1 (Фиг.4А, полоса 2), либо в положении sn-2 (Фиг.4А, полоса 3). Было обнаружено, что в первом случае основным 14С-меченным продуктом был лизо-ФХ, а в последнем - ТАГ. Был сделан вывод о том, что дрожжевая ФДАТ обладает специфичностью к переносу ацил-группы из положения sn-2 фосфолипида к ДАТ, при этом образуются sn-1-лизо-ФХ и ТАГ. В данных условиях исследования из sn-1-меченного ФХ обратным действием CDP-холин (цитидиндифосфат-холин): холин фосфотрансферазы образуются следовые количества 14С-меченного ДАТ. Этот меченный ДАТ может быть далее превращен в ТАГ действием ФДАТ. Следовательно, невозможно отличить, образуются ли минорные количества меченного ТАГ в присутствии диолеил-ФХ, несущего [14С]-ацил-группу в sn-1 положении, синтезируются ли прямо из sn-1-меченного ФХ под действием ФДАТ, которая также может действовать по sn-1 положению, или он сначала переводится в sn-1-меченный ДАТ и затем ацилируется ФДАТ со строгой селективностью к переносу ацил-групп по sn-2-положению ФХ. Вместе эти факты указывают на то, что ФДАТ, кодируемая YNR008w, катализирует перенос ацил-группы от sn-2 положения ФХ к ДАТ, при этом образуются ТАГ и лизо-ФХ.
Далее изучали субстратную специфичность ФДАТ по отношению к головной группе ацил-донора, переносимой ацильной группе и ацильным цепям акцепторной молекулы ДАТ. ФХ и ФЭ являются двумя основными мембранными липидами S. cerevisiae, и, как показано на Фиг.4В (полосы 1 и 2), в реакции, катализируемой ФДАТ, диолеил-ФЭ в качестве ацил-донора примерно в 4 раза более эффективен, чем диолеил-ФХ. Кроме того, уровень переноса ацильной группы сильно зависит от типа переносимой ацил-группы. Так, рицинолеил-группа в положении sn-2 ФХ переносится в ТАГ в 2.5 раза более эффективно, чем олеил-группа в том же положении (Фиг.4В, полосы 1 и 3). Напротив, дрожжевая ФДАТ переносит вернолевую и олеиловую группы одинаково эффективно (Фиг.4В, полосы 1 и 4). Ацильная цепь акцепторной молекулы ДАТ также влияет на эффективность реакции. Так, ДАТ с рицинолеиловой или вернолевой группой является более эффективным ацил-акцептором, чем диолеил-ДАГ (Фиг.4В, полосы 1, 5 и 6). Вместе эти результаты ясно показывают, что эффективность переноса ацильной группы, катализируемого ФДАТ, сильно зависит от свойств субстратных липидов.
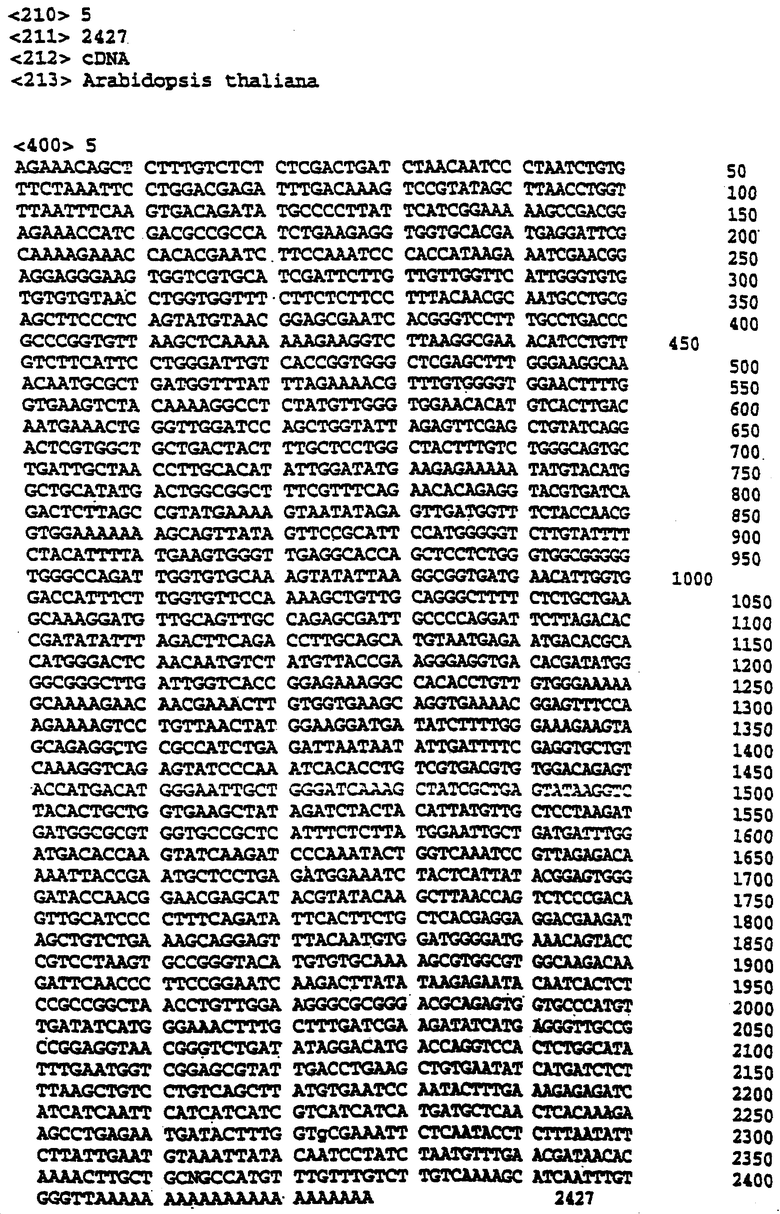
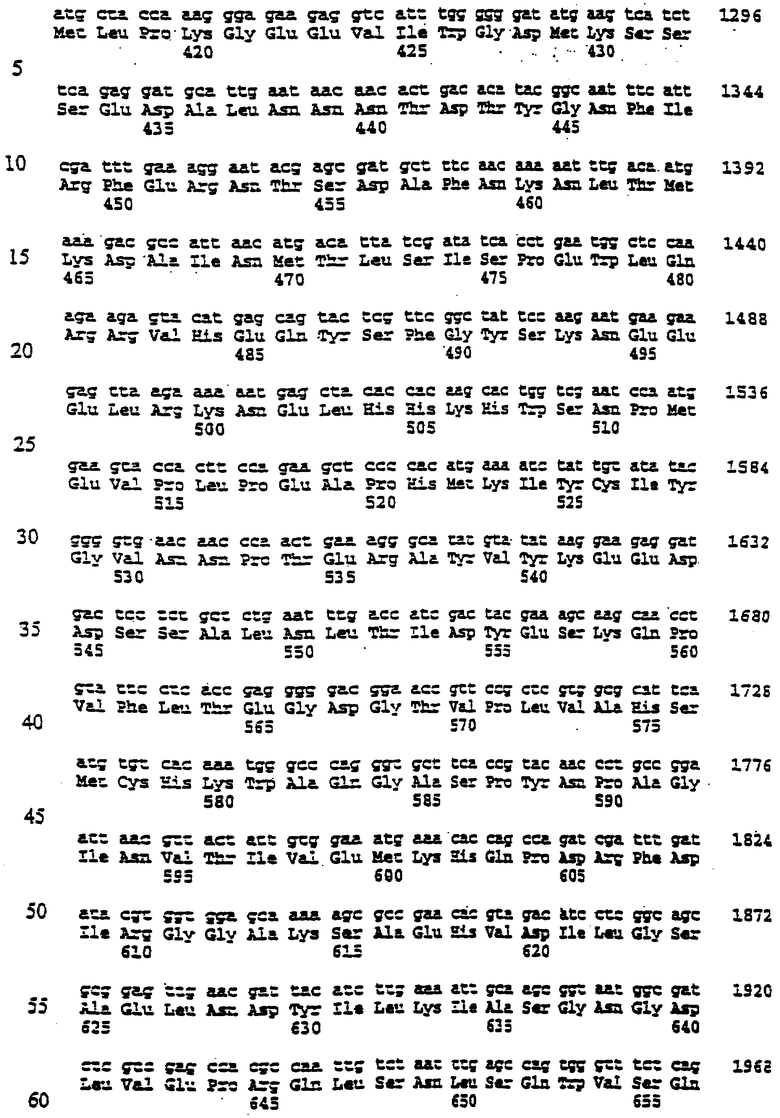
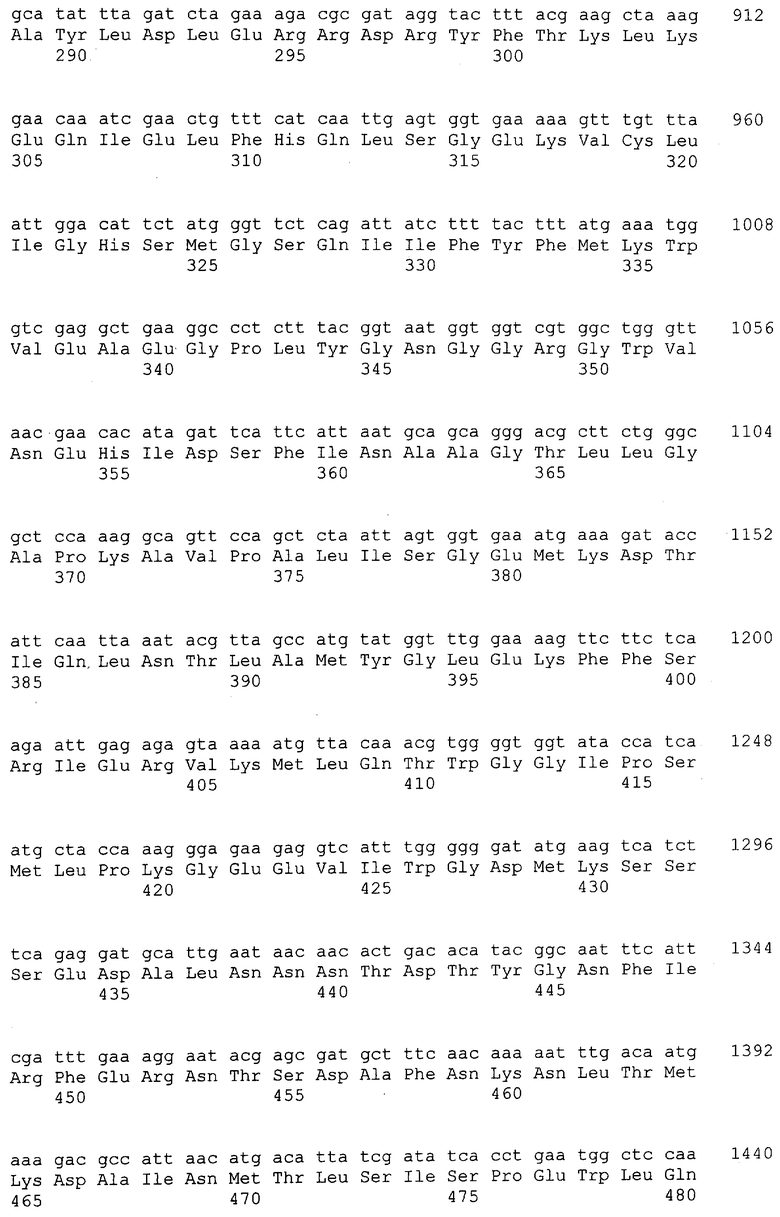
Гены ФДАТ. Нуклеотидные и аминокислотные последовательности нескольких генов ФДАТ приведены под номерами SEQ ID №1-15. Дальнейшие условные и/или частичные последовательности приведены под номерами SEQ ID №1а-5а и 1b-11b соответственно. Одна из геномных последовательностей Arabidopsis (SEQ ID №4) идентифицирована в EST кДНК клоне Arabidopsis, T04806. Этот кДНК клон полностью охарактеризован, нуклеотидная последовательность приведена под номером SEQ ID №5. Основываясь на гомологии последовательностей к ДНК T04806 и геномной последовательности Arebidopsis thaliana (SEQ ID №4), можно заметить, что в положении 417 в кДНК клоне присутствует дополнительный А (данные не приведены). При исключении этого вуклеотида получится аминокислотная последовательность, закодированная в последовательности под номером SEQ ID №6.
Повышенное содержание ТАГ в семенах Arabidopsis thaliana, экспрессирующих дрожжевую ФЛАТ. Для экспрессии гена дрожжевой ФДАТ в Arabidopsis thaliana фрагмент EcoRI из плазмиды pBlescript-PDAT клонировали вместе с napin-промотором (25) в вектор pGPTV'KAN (26). Отбирали плазмиду (pGNapPDAT) с геном дрожжевой ФДАТ в правильной ориентации и трансформировали ей Agrobacterium tumefaciens. Эти бактерии использовали для трансформации растений columbia Arabidopsis thaliana (С-24) методом корневой трансформации (27). В качестве контроля использовали растения, трансформированные пустым вектором.
Собирали семена первого поколения (Т1) и проращивали на среде, содержащей канамицин. От отдельных растений собирали семена второго поколения (Т2) и исследовали содержание в них жирных кислот путем количественной оценки метиловых эфиров этих кислот методом газо-жидкостной хроматографии после метилирования семян 2% серной кислотой в метаноле при 85°С в течение 1.5 часа. В качестве внутреннего стандарта при количественной оценке использовали метиловые эфиры гептадекановой кислоты.
После трансформации pGNapPDAT от одного растения Т1 (26-14) получили семь растений Т2, из которых 3 растения дали семена со статистически (по двустороннему критерию с табличной поправкой) более высоким содержанием масла по сравнению с семенами, полученными от растений Т2, происходящих от растения Т1 (32-4), трансформированного пустым вектором (таблица 2).
Ссылочные материалы, упомянутые в описании:
1. Bell. R.M. & Colemsn, R.A. (1980) Annu. Rev. Biochem. 49, 459-487.
2. Stymne. S. & Stoban, K (1987) in The biochemistry of plants: & comprehensive trestsie, Vol.9, ed. Stumpf. P.K. (Academic Press. New York), pp.175-214.
3. Cases, S. etal. (1998) Proc. NatI. Acad. Sci. USA 95, 13018-13023.
4. Hobbs, D.H., Lu. C. & Hills, M.J. (1999) FEBS Lett. 452; 145-9.
5. Zou. J.. Wei. Y., Jako, C., Kumar. A., Selvaraj, G. & Taylor, D.C. (1999) Plant J. 18, 645-653.
6. Lardizabal, К.. Hawkins. D., Mai, J., & Wagner. N. (1999) Abstract presented at the Biochem. Mol. Plant Fatty Acids Glycerolipids Symposium, South Lake Tahoe, USA.
7. Thomas. B.J. & Rotnstein. R. (1989) Cell 56, 619-630.
8. Entian, K.-D. & Kotter, Р. (1998) Meth. MIcrobiol. 26, 431-449.
9. Kem, L, de Montigny, J., Jund, R. & Lacroute, F. (1990) Gene 88, 149-157.
10. Ronne H., Carlberg, M., Hu. G.-Z. & Nehlin. J.O. (1991) Mol. CelL Biol 11, 4876-4884.
11. Stobart, К. & Stymne, S. (1990) in Method in Plant Biochemistry, vol 4. eds. Harwood, J.L. & Bowyer, J. R. (Academic press. London), pp.19-46.
12. Bafor, M., Smith. M.A., Jonsson. L. Stobrt. A.K. & Stymne, S. (1991) Biochem. J. 280, 507-514.
13. Banas, A., Johansson. I. & Stymne, S. (1992) Plant Science 84, 137-144.
14. Kanda, P. & Wells, M.A. (1981) J. Upid. Res. 22, 877-879.
15. Stahl, U., Ek, В. & Stymne. S. (1998) Plant Physlol. 117, 197-205.
16. Stobart, K., Mancha, M. & Lenman M, Dahlqvist, A. & Stymne, S. (1997) PIsnts 203, 58-66.
17. Bligh, E.G. & Dyer. W.J. (1959) Can. J. Biochem. Physiol. 37, 911-917.
18. Sherman. F., Fink, G. R. & Hicks, J. B. (1986) in Laboratory Course Manual for Methods in Yeast Genentics (Cold Spring Harbor Laboratory).
19. Meesters, P.A.E.P., Humberts, G.N.M. and Eggink, G. (1996; Appl. Microbiol. Blotechnol. 45, 575-579.
20. van de Loo. F.J., Fox, B.G. & Sdmmerville, C. (1993), in Lipid metabolism in plants, ed. Moore, T.S. (CRC Press, Inc.), pp.91-126.
21. van de Loo, F.J., Broun, P.. Tumer, S. & Sommerville. S. (1995) Proc. Natl. Acad. Sci. USA 95, 6743-6747.
22. Lee. M., Lenman, M., Banas, A., Bafor, M., Singh. S., Schweizer. M., Nilsson, R., Lilienberg. C., Dahlqvist, A., Gummeson, P-O., Sjödahl, S., Green. A., and Stymne, S. (1998) Saence 280, 915-918.
23. Thompson. J.D., Gibson. T.J., Plewniak. F., Jeanmougin. F. & Higgins, D.G. (1997) Nucl. Adds Res. 24. 4876-4882.
24. Saitou, N. & Nei. M. (1987) Mol. Biol. Evol. 4, 406-425.
25. Stalberg, К., Blerström, M., Josefsson, L. & Rask. L (1993) Plant Mol. Biol 23, 671.
26. Becker. D., Kemper, E., Schell. J., Masterson, R. (1992) Plant Mol. Biol. 20. 1995.
27. D. Vaivekens. M. Van Montagu, and Van Lusbettens (1988) Proc. Natl. Acad. Sci. U.S.A. 85, 5536.
Описание чертежей
ФИГ.1.
Метаболизм 14C-меченного ФХ в нейтральную липидную фракцию микросомами растений. (А) Микросомы из развивающихся семян подсолнечника, R.communis и С.palaestina инкубировали в течение 80 мин при 30°С с ФХ (8 нмоль) с олеиновой группой в sn-1 положении и 14C-меченной олеиновой, рицинолеиновой или вернолевой кислотой в положении sn-2. Методом тонкослойной хроматографии с последующей электронной радиоавтографией количественно оценивали радиоактивность, включившуюся в ТАГ (незаштрихованные полосы), ДАТ (закрашенные полосы) и неэтерифицированные жирные кислоты (заштрихованные полосы), данные приведены в процентах от внесенного меченного субстрата. (В) In vitro синтез ТАГ, несущего две вернолевые и одну [14С]рицинолеиловую группы, микросомами из R. communis. В качестве субстратов добавляли немеченый дивернолеил-ДАГ (5 нмоль) вместе либо с sn-1-олеил-sn-2-[14С]-рицинолеил-ДАГ (0.4 нмоль, 7700 (расп/мин)/нмоль), либо с sn-1-олеил-sn-2-[14С]рицинолеил-ФХ (0.4 нмоль, 7700 (расп/мин)/нмоль). Микросомы инкубировали с субстратами в течение 30 мин при 30°С, после чего отбирали образцы для липидного анализа, как описано в разделе "общие методы". Приведены средние значения двух экспериментов.
ФИГ.2.
Активность ФЛАТ в дрожжевых микросомах, определяемая радиоавтографией нейтральных липидных продуктов, разделенных ТСХ. Исследовали активность ФДАТ микросомальных мембран (10 нмоль ФХ) из дрожжевого штамма дикого типа FY1679 (дорожки 1-3), согенного дрожжевого штамма (FVKT004-04C(AL)) с нарушенным геном YNR008w (дорожка 4) или того же штамма с нарушением, трансформированного плазмидой pUSl, содержащей ген YNR008w после его нативного промотора (дорожка 5). В качестве субстратов использовали 2 нмоль sn-1-олеил-sn-2-[14С]-рипинолеил-ФХ вместе либо с 5 нмоль диолеил-ДАГ (дорожки 2,4 и 5), либо с rac-олеилвернолеил-ДАГ (дорожка 3). Исследование фермента и липидный анализ проводили, как описано в разделе Материалы и Методы. Клетки предварительно культивировали в течение 20 ч в жидкой среде YPD, собирали и ресуспендировали в равном объеме минимальной среды (19), содержащей 16 г/л глицерина. Затем клетки растили еще 24 часа и собирали. Селекцию по плазмиде проводили выращиванием клеток в синтетической среде без урацила (18). Сокращения: 1-OH-TAG, монорицинолеил-ТАГ; 1-OH-1-ep-TAG, монорицинолеилмоновернолил-ТАГ; OH-FA, неэтерифицированная рицинолеиновая кислота.
ФИГ.3.
Содержание липидов (А, В) и активность ФДАТ (С) в дрожжевых клетках с сверхэкспрессией ФДАТ. Ген ФДАТ в плазмиде pUS4 сверхэкспрессировался с индуцируемого галактозой промотора GAL1-TPK2 в штамме дикого типа W303-1A (7). Экспрессию индуцировали после (А) 2 часов или (В) 25 часов роста добавлением галактозы до конечной концентрации 2% (вес/объем). Затем клетки инкубировали еще 22 часа и собирали. Количество дипидов в собранных клетках определяли ГЖХ анализом жирных кислот и выражали в мкмоль жирных кислот на мг сухого веса в ТАГ (незаштрихованная полоса), полярных липидах (заштрихованная полоса), стериновых эфирах (закрашенная полоса) или в других липидах (полоса в полоску). Приведены средние значения результатов для трех независимых культур дрожжей. (С) In vitro синтез ТАГ микросомами, полученными из дрожжевых клеток, содержащих либо пустой вектор (вектор), либо плазмиду с ФДАТ (+ФДАТ). Клетки растили так же, как указано в описании ФИГ.3А. К аликвотам микросом (10 нмоль ФХ) добавляли субстратные липиды диолеил-ДАГ (2.5 нмоль) и sn-олеил-sn-2-[14С]-олеил-ФХ (2 нмоль) и проводили инкубацию при 28°С в течение 10 мин. Количество метки, включившееся в ТАГ, определяли электронной радиоавтографией. Приведены средние значения результатов двух экспериментов.
ФИГ.4.
Субстратная специфичность дрожжевой ФДАТ. Активность ФДАТ исследовали инкубацией аликвот лиофилизированных микросом (10 нмоль ФХ) с субстратными липидами при 30°С в течение 10 мин (А) или 90 мин (В). В качестве субстратов использовали немеченый ДАТ (2.5 нмоль) вместе с различными мечеными фосфолипидами, как показано на чертеже. (А) Специфичность дрожжевой ФДАТ к sn-положению по отношению к субстрату - ацил-донору. Диолеил-ДАГ вместе с sn-l-[14C]олеил-sn-2-[14С]олеил-ФХ (ди-[14С]ФХ), sn-1-[14C]олеил-sn-2-ФХ (sn1-[14С]-ФХ) или sn-1-олеил-sn-2-[14С]олеил-ФХ (sn2-[14С]-ФХ). (В) Специфичность дрожжевой ФДАТ по отношению к головной группе фосфолипида и ацил-группам фосфолипида, а также к диацилглицерину. Диолеил-ДАГ вместе с sn-1-олеил-, sn-2-[14С]-олеил-ФХ (олеил-ФХ), sn-олеил-sn-олеил-ФЭ (олеил-ФЭ), sn-1-олеил-sn-[14С]рицинолеил-ФХ (рицинолеил-ФХ) или sn-1-олеил-sn-[14С]вернолил-ФХ (вернолил-ФХ). В экспериментах, приведенных в двух крайних справа полосах, использовали монорицинолеил-ДАГ (рицинолеил-ДАГ) или моно-вернолеил-ДАГ (вернолеил-ДАГ) вместе с sn-олеил-sn-[14С]-олеил-ФХ. Метку, включившуюся в ТАГ (закрашенные полосы) и лизо-ФХ (ЛФХ, незакрашенные полосы), количественно оценивали электронной радиоавтографией. Приведены средние значения результатов двух экспериментов. Использовали микросомы из клеток W303-1A, сверх-экспрессирующих ген ФДАТ с промотора GAL1-TPK2, как это указано в описании Фиг.3. Экспрессию индуцировали в ранней стационарной фазе и собирали клетки после дополнительного наращивания в течение 24 часов.
ТАБ.1:
In vitro синтез триацилглицеринов в микросомальных препаратах из развивающихся касторовых бобов. Аликвоты микросом (20 нмоль ФХ) лиофилизировали и добавляли субстратные липиды в бензольном растворе: (А) 0.4 нмоль [14С]-ДАГ (7760 (расп/мин)/нмоль) и, где указано, 1.6 нмоль немеченого ДАТ; (В) 0.4 нмоль [14С]-ДАГ (7760 (расп/мин)/нмоль) и 5 нмоль немеченого ди-рицинолеил-ФХ и (С) 0.25 нмоль [14С]-ФХ (4000 (расп/мин/нмоль) и 5 нмоль немеченого ДАТ. Бензол упаривали N2 и добавляли 0.1 мл 50 мМ раствора фосфата калия, тщательно перемешивали и инкубировали при 30°С в течение (А) 20 мин; (В) и (С) 30 мин. Исследование останавливали экстракцией липидов в хлороформ. Затем липиды разделяли тонкослойной хроматографией на пластинах с силикагелем 60 (Merck; Darmstadt, Germany) в смеси гексана/диэтилового эфира/уксусной кислоты 35:70:1.5. Визуализировали радиоактивные липиды и количественно оценивали радиоактивность на пластине электронной радиоавтографией (Instant hnager, Packard, US). Приведены средние значения результатов двух экспериментов.
Радиоактивность в различных Типах образующихся триацилглицеринов (ТАГ). Используемые сокращения: 1-ОН-, моно-рицинолеил; 2-ОН, ди-рицинолеил-; 3-ОН-, тририцинолеил; 1-OH-1-ver-, мово-рипинолеил-моновернолеил-; 1-OH-2-ver-, моно-рицинолеил-дивернолеил-. Радиоактивно меченные ДАТ и ФХ получали ферментативным путем. Радиоактивно меченная рицинолеил-группа находится в sn-2-положении липида, а немеченая олеил-группа - в sn-1-положении. Немеченый ДАТ с вернолеил- или рицинолеил-цепями получали действием ТАГ липазы (6) на масло Euphorbia lagascae или касторового боба соответственно. Синтетический ди-рицинолеил-ФХ любезно предоставлен Metapontum Agribios (Италия).
Общее количество жирных кислот на мг семян растений Т2, полученных от отдельных растений Arabidopsis thaliana, трансформированных геном дрожжевой ФДАТ под контролем napin промотора (26-14) или трансформированных пустым вектором (32-4).
* = статистическое различие между контрольными растениями и растениями, трансформированными ФДАТ по двустороннему критерию с табличной поправкой при
α=5.
Описание последовательностей;
SEQ ID №1: Последовательность геномной ДНК и предполагаемая аминокислотная последовательность гена ФДАТ Saccharomyces cerevisae, YNR008w, номер в Gen-Bank Z7 1623 и Y13139, ID номер нуклеотидной последовательности 1302481.
SEQ ID №2: Аминокислотная последовательность в предполагаемой открытой рамке считывания YNR008w из Saccharomyces cerevisae.
SEQ ID №3: Последовательность геномной ДНК гена SPBC776.14 Schizosaccharo-myces pombe.
SEQ ID №4: Последовательность геномной ДНК части локуса Arabidopsis thaliana, номер в GenBank AB 006704.
SEQ ID №5: Нуклеотидная последовательность кДНК клона Arabidopsis thaliana, номер GenBank T0 4806, ID номер нуклеотидной последовательности 315966.
SEQ ID №6: Предсказанная аминокислотная последовательность кДНК клона Arabidopsis thaliana, номер в GenBank N04806.
SEQ ID №7: Нуклеотидная и аминокислотная последовательности EST клона Zea mays, номер в GenBank AI 491339, ID номер нуклеотадной последовательности 4388167.
SEQ ID №8: Предсказанная аминокислотная последовательность EST клона Zea mays, номер в GenBank AI 491339, ID номер нуклеотадной последовательности 4388167.
SEQ ID №9: Последовательность ДНК части EST клона Neospora crassa W07G1, номер в GenBank AI 398644, ID номер нуклеотадной последовательности 4241729.
SEQ ID №10: Последовательность геномной ДНК часта локуса Arabidopsis thaliana, номер в GenBank AC 004557.
SEQ ID №11: Последовательность геномной ДНК часта локуса Arabidopsis thaliana, номер в GenBank AC 003027.
SEQ ID №12: Последовательность ДНК части кДНК клона Lycopersicon esculentum, номер в GenBank AI 486635.
SEQ ID №13: Аминокислотная последовательность предполагаемой открытой рамки считывания САА 22887 гена SPBC 776.14 Schizosaccharomyces pombe.
SEQ ID №14: Аминокислотная последовательность предполагаемой открытой рамки считывания ААС 80628 Arabidopsis thaliana, полученной из локуса Arabidopsis thaliana с номером в GenBank AC 004557.
SEQ ID №15: Аминокислотная последовательность предполагаемой открытой рамки считывания ААС 80628 Arabidopsis thaliana, полученной из локуса Arabidopsis thaliana с номером в GenBank AC 003027.
Дополнительные условные и/или частичные последовательности:
SEQ ID №1а: Аминокислотная последовательность дрожжевой открытой рамки считывания (ORF) YNR008w из Saccharomyces cerevisae.
SEQ ID №2а: Аминокислотная последовательность области геномной последовательности Arabidopsis thaliana (AC 004557).
SEQ ID №3а: Аминокислотная последовательность области геномной последовательности Arabidopsis thaliana (АВ 006704).
SEQ ID №4а: Последовательность геномной ДНК и соответствующая аминокислотная последовательность дрожжевой ORF YNR008w из Saccharomyces cerevisae.
SEQ ID №5а: Аминокислотная последовательность дрожжевой ORF YNROOSw из Saccharomyces cerevisae, полученная из соответствующей последовательности геномной ДНК.
SEQ ID №1b: Геномная последовательность ДНК гена ФДАТ Saccharomyces cerevisae, YNR008w, ID номер нуклеотидной последовательности в GenBank 1302481, и предполагаемая аминокислотная последовательность.
SEQ ID №2b: Предполагаемая аминокислотная последовательность дрожжевого гена YNR008w из Saccharomyces cerevisae.
SEQ ID №3b: Последовательность геномной ДНК гена SPBC776.14 из Schizosac-charomyces pombe.
SEQ ID №4b: Последовательность геномной ДНК части локуса Arabidopsis thaliana, номер в GenBank AB 006704.
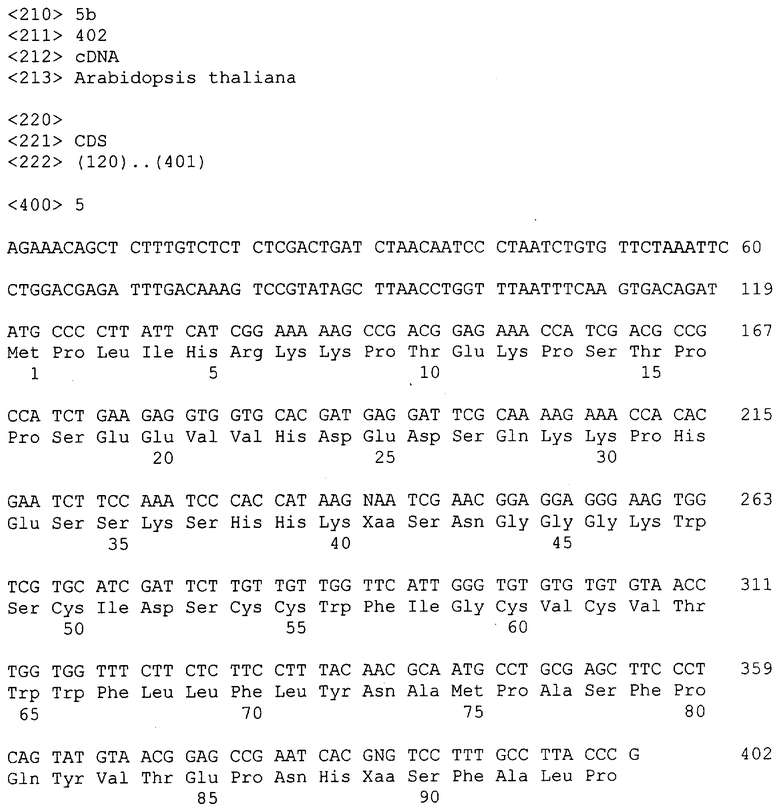
SEQ ID №5b: Нуклеотидная последовательность и соответствующая аминокислотная последовательность EST клона Arabidopsis thaliana, номер в GenBank T04806, ID номер 315966.
SEQ ID №6b: Нуклеотидная и аминокислотная последовательности кДНК клона Zea mays, ID номер в GenBank 4388167.
SEQ ID №7b: Аминокислотная последовательность кДНК клона Zea mays, ID номер BGenBank 4388167.
SEQ ID №8b: Последовательность ДНК части кДНК клона Neurospora crassa W07G1, ID номер 4241729.
SEQ ID №9b: Последовательность геномной ДНК части локуса Ardbidopsis thaliana с номером в GenBank AC004557.
SEQ ID №10b: Последовательность геномной ДНК части локуса Arabidopsis thaliana с номером в GenBank AC003027.
SEQ ID №11b: Последовательность ДНК части кДНК клона Lycopersicon esculentum с номером в GenBank AI486635.
Таб.1

















































| название | год | авторы | номер документа |
|---|---|---|---|
| МОДИФИКАЦИЯ ЛИПИДОВ РАСТЕНИЙ И МАСЕЛ СЕМЯН ПУТЕМ ИСПОЛЬЗОВАНИЯ ДРОЖЖЕВЫХ ГЕНОВ SLC | 1996 |
|
RU2190665C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЛИПИДОВ | 2012 |
|
RU2656996C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЛИПИДОВ | 2012 |
|
RU2804627C2 |
| Способы получения липидов | 2011 |
|
RU2636344C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ ПРОМЫШЛЕННЫХ ПРОДУКТОВ ИЗ РАСТИТЕЛЬНЫХ ЛИПИДОВ | 2015 |
|
RU2743384C2 |
| ПРИМЕНЕНИЕ ЛИПОЛИТИЧЕСКОГО ФЕРМЕНТА В ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ | 2005 |
|
RU2406759C2 |
| ЛИПОЛИТИЧЕСКИЕ ФЕРМЕНТЫ, ИХ ПРИМЕНЕНИЕ ПРИ ИСПОЛЬЗОВАНИИ ПИЩЕВЫХ ПРОДУКТОВ | 2010 |
|
RU2538144C2 |
| ПОЛУЧЕНИЕ ЛИЗОГЛИКОЛИПИДА И БИОКОНВЕРСИЯ ГЛИКОЛИПИДОВ С ИСПОЛЬЗОВАНИЕМ ЛИПОЛИТИЧЕСКОГО ФЕРМЕНТА | 2005 |
|
RU2548805C2 |
| НОВЫЕ ГЕНЫ АЦИЛТРАНСФЕРАЗЫ ЛИЗОФОСФАТИДНОЙ КИСЛОТЫ | 2008 |
|
RU2507263C2 |
| БЕЛОК, ОБЛАДАЮЩИЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ СТИМУЛЯЦИИ ЭЛОНГАЦИИ ЦЕПЕЙ ЖИРНЫХ КИСЛОТ, КОДИРУЮЩИЙ ЕГО ГЕН И ИХ ПРИМЕНЕНИЕ | 2012 |
|
RU2556375C1 |

Изобретение относится к биотехнологии. Предложено использование фермента фосфолипид: диацилглицерин ацилтрансферазы в качестве катализатора в ацил-СоА-независимой реакции переноса жирных кислот из фосфолипидов в диацилглицерин в процессе биосинтетического получения триацилглицерина. Заявленное изобретение позволяет получать триацилглицерин с высокой степенью эффективности. 8 ил., 2 табл.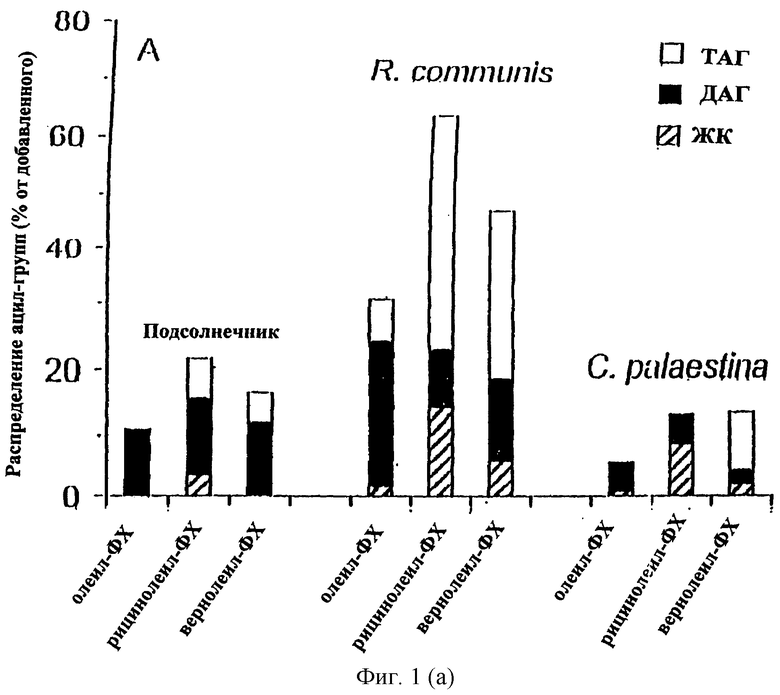
Применение фермента, кодируемого нуклеотидной последовательностью, выбранной из группы, включающей SEQ ID №1, SEQ ID №3, SEQ ID №4 и SEQ ID №5, в качестве катализатора в ацил-СоА-независимой реакции переноса жирных кислот из фосфолипидов в диацилглицерин в процессе биосинтетического получения триацилглицерина.
Приоритет по признакам:
| KEITH STOBART ET AL., Planta, vol 203, no 1, p.58-66, 1997 | |||
| WO 9855631 A1, 10.12.1998 | |||
| RU 95114524 A, 20.07.1997. |
Авторы
Даты
2006-03-20—Публикация
2000-03-28—Подача