ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к способу получения липидов. В частности, настоящее изобретение относится к способам увеличения концентрации одного или более неполярных липидов и/или общего содержания неполярных липидов в трансгенном организме или его части. В одном конкретном варианте реализации настоящее изобретение относится к любой комбинации одной или более моноацилглицерин-ацилтрансфераз (MGAT), диацилглицерин-ацилтрансфераз (DGAT), глицерин-3-фосфат-ацилтрансфераз (GPAT), белков масляного тельца и/или факторов транскрипции, регулирующих биосинтез липидов при подавлении ключевых ферментативных стадий в путях биосинтеза крахмала и десатурации жирных кислот, с увеличением концентрации одного или более неполярных липидов и/или общего содержания неполярных липидов, и/или содержания моно-ненасыщенных жирных кислот в растениях или любой их части, включая семена и/или листья растения, водоросли и грибы.
УРОВЕНЬ ТЕХНИКИ
Основная часть мировой энергии, в частности, используемая для транспорта, обеспечивается нефтяными топливами, которые имеют ограниченные запасы. Необходимы альтернативные, возобновляемые источники, такие как биологически производимые масла.
Биосинтез триацилглицерина
Триацилглицерины (TAG) составляют главную форму липидов в семенах и состоят из трех эстерифицированных ацильных цепей в скелете глицерина. Жирные кислоты синтезируются в пластиде в виде промежуточных ацил-ацильных белков-носителей (ACP), где они могут подвергаться первой катализируемой реакции десатурации. Эта реакция катализируется стеароил-ACP-десатуразой и дает олеиновую кислоту (С18:1Δ9). Затем ацильные цепи переносятся в цитозоль и эндоплазматический ретикулум (ER) в виде сложных эфиров ацил-коэнзима (CoA). Перед вхождением в основной путь биосинтеза TAG, известный также как путь Кеннеди или глицерин-3-фосфатный путь (G3P), ацильные цепи, как правило, встраиваются в фосфолипиды ER мембраны, где они могут подвергаться дальнейшей десатурации. Два основных фермента в выработке полиненасыщенных жирных кислот представляют собой мембраносвязанную FAD2- и FAD3-десатуразы, которые вырабатывают линолевую кислоту (С18:2Δ9,12) и α-линоленовую кислоту (С18:3Δ9,12,15), соответственно.
Биосинтез TAG через путь Кеннеди состоит из серии последовательных реакций ацилирования, в каждой из которых в качестве донора ацила используются сложные эфиры ацил-CoA. Первая стадия ацилирования обычно происходит в sn1-положении скелета G3P и катализируется глицерин-3-фосфат-ацилтрансферазой (sn1-GPAT). Продукт, sn1-лизофосфатидная кислота (sn1-LPA) служит в качестве субстрата для ацилтрансферазы лизофосфатидной кислоты (LPAAT), которая связывает вторую ацильную цепь в sn2-положении с образованием фосфатидной кислоты. Затем фосфатидная кислота дефосфорилируется до диацилглицерина (DAG) под действием фосфатазы фосфатидной кислоты (PAP), обеспечивая посредством этого субстрат для последней стадии ацилирования. Наконец, третья ацильная цепь эстерифицируется в sn3-положении DAG в реакции, катализируемой диацилглицерин-ацилтрансферазой (DGAT), с образованием TAG, который накапливается в масляных тельцах. Вторая ферментативная реакция, фосфатидил-глицерин-ацилтрансфераза (PDAT), также приводит к превращению DAG в TAG. Эта реакция не связана с DGAT, и в ней в качестве доноров ацила используются фосфолипиды.
Для максимизации выхода при промышленном производстве липидов существует необходимость в дополнительных средствах увеличения концентрации липидов, в частности, неполярных липидов, таких как DAG и TAG, в трансгенных организмах или их частях, таких как растения, семена, листья, водоросли и грибы. Попытки увеличения выхода нейтральных липидов в растениях концентрировались, главным образом, на отдельных критических ферментативных стадиях, участвующих в биосинтезе жирных кислот или сборке TAG. Однако эти стратегии привели к умеренному увеличению концентрации масла в семенах или листьях. Недавняя метаболическая исследовательская работа, выполненная на жировых дрожжах Yarrowia lipolytica, показала, что комбинированный подход увеличения выработки глицерин-3-фосфата и предотвращения расщепления TAG через β-окисление приводит к кумулятивному увеличению общего содержания липидов (Dulerno et al., 2011).
Растительные липиды, такие как триацилглицерины (TAG) масла семян, имеют многочисленные применения, например, применение в кулинарии (шортенинг, текстура, аромат), промышленные применения (в мылах, свечах, парфюмерии, косметике, пригодны в качестве высушивающих агентов, изоляторов, смазывающих агентов) и для обеспечения пищевой ценности. Растет интерес к использованию растительных липидов для производства биотоплива.
Для максимизации выхода при промышленном производстве липидов существует необходимость в дополнительных средствах увеличения концентрации липидов, в частности, неполярных липидов, таких как DAG и TAG, в трансгенных организмах или их частях, таких как растения, семена, листья, водоросли и грибы.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Авторы настоящего изобретения продемонстрировали существенное увеличение содержания липидов в различных организмах, в частности, в вегетирующих частях и семенах растений, за счет воздействия на пути биосинтеза жирных кислот и сборки липидов. Для достижения существенного увеличения содержания масла, которое имеет большое значение для производства биотоплива и других промышленных продуктов, выпускаемых из масла, использовали различные комбинации генов.
В первом аспекте настоящего изобретения представлен способ получения промышленного продукта из вегетирующей части растения или нечеловеческого организма или его части, содержащего высокие концентрации неполярных липидов.
В одном варианте реализации настоящего изобретения представлен способ получения промышленного продукта, включающий стадии:
i) получение вегетирующей части растения, имеющей общее содержание неполярных липидов по меньшей мере около 3%, предпочтительно по меньшей мере около 5% или по меньшей мере около 7% (масс./масс., сухой вес),
ii) превращение по меньшей мере некоторых липидов in situ в вегетирующей части растения в промышленный продукт путем нагревания, химическими или ферментативными средствами или любой их комбинацией, и
iii) выделение промышленного продукта,
с получением посредством этого промышленного продукта.
В другом варианте реализации способ получения промышленного продукта включает стадии:
i) получение вегетирующей части растения, имеющей общее содержание неполярных липидов по меньшей мере около 3%, предпочтительно по меньшей мере около 5% или по меньшей мере около 7% (масс./масс., сухой вес),
ii) физическая переработка вегетирующей части растения со стадии i),
iii) превращение по меньшей мере некоторых липидов в переработанной вегетирующей части растения в промышленным продукт путем использования нагревания, химических или ферментативных средств или любой их комбинации, в липиды в переработанной вегетирующей части растения, и
iv) выделение промышленного продукта,
с получением посредством этого промышленного продукта.
В другом варианте реализации способ получения промышленного продукта включает стадии:
i) получение нечеловеческого организма или его части, содержащей один или более экзогенный полинуклеотид (-ов), при этом каждый из одного или более экзогенных полинуклеотида (-ов) функционально связан с промотором, который может направлять экспрессию указанного полинуклеотида в нечеловеческом организме или его части, и при этом нечеловеческий организм или его часть имеет повышенную концентрации одного или более неполярных липидов относительно соответствующего нечеловеческого организма или его части, не имеющей одного или нескольких экзогенных полинуклеотида (-ов), и
ii) превращение по меньшей мере некоторых липидов in situ в нечеловеческом организме или его части в промышленный продукт путем нагревания, химическими или ферментативными средствами или любой их комбинацией, и
iii) выделение промышленного продукта,
с получением посредством этого промышленного продукта.
В дополнительном варианте реализации способ получения промышленного продукта включает стадии:
i) получение нечеловеческого организма или его части, содержащей один или более экзогенных полинуклеотидов, при этом указанный нечеловеческий организм или его часть имеет повышенную концентрацию одного или более неполярных липидов относительно соответствующего нечеловеческого организма или его части, не имеющей одного или нескольких экзогенных полинуклеотидов,
ii) физическая переработка нечеловеческого организма или его части со стадии i),
iii) превращение по меньшей мере некоторых липидов в переработанном нечеловеческом организме или его части в промышленный продукт путем использования нагревания, химических или ферментативных средств или любой их комбинации, в липиды в переработанном нечеловеческом организме или его части, и
iv) выделение промышленного продукта,
с получением посредством этого промышленного продукта.
В каждом из представленных выше вариантов реализации специалистам в данной области должно быть понятно, что стадия превращения может быть выполнена одновременно или после стадии физической переработки.
В каждом из представленных выше вариантов реализации общее содержание неполярных липидов в вегетирующей части растения или нечеловеческом организме или его части, предпочтительно в листьях растений или их части, стволе или клубне, составляет по меньшей мере около 3%, более предпочтительно по меньшей мере около 5%, предпочтительно по меньшей мере около 7%, более предпочтительно по меньшей мере около 10%, более предпочтительно по меньшей мере около 11%, более предпочтительно по меньшей мере около 12%, более предпочтительно по меньшей мере около 13%, более предпочтительно по меньшей мере около 14%, или более предпочтительно по меньшей мере около 15% (масс./масс., сухой вес). В дополнительном предпочтительном варианте реализации общее содержание неполярных липидов составляет от 5% до 25%, от 7% до 25%, от 10% до 25%, от 12% до 25%, от 15% до 25%, от 7% до 20%, от 10% до 20%, от 10% до 15%, от 15% до 20%, от 20% до 25%, около 10%, около 11%, около 12%, около 13%, около 14%, около 15%, около 16%, около 17%, около 18%, около 20% или около 22%, каждое значение в процентах от сухого веса. В особенно предпочтительном варианте реализации вегетирующая часть растения представляет собой лист (или листья) или их часть. В более предпочтительном варианте реализации вегетирующая часть растения представляет собой часть листьев, имеющую площадь поверхности по меньшей мере 1 см2.
Далее, в каждом из представленных выше вариантов реализации общее содержание TAG в вегетирующей части растения или нечеловеческом организме или его части, предпочтительно в листьях растений или их части, стволе или клубне, составляет по меньшей мере около 3%, более предпочтительно по меньшей мере около 5%, предпочтительно по меньшей мере около 7%, более предпочтительно по меньшей мере около 10%, более предпочтительно по меньшей мере около 11%, более предпочтительно по меньшей мере около 12%, более предпочтительно по меньшей мере около 13%, более предпочтительно по меньшей мере около 14%, более предпочтительно около 15% или более предпочтительно по меньшей мере около 17% (масс./масс., сухой вес). В дополнительном предпочтительном варианте реализации общее содержание TAG составляет от 5% до 30%, от 7% до 30%, от 10% до 30%, от 12% до 30%, от 15% до 30%, от 7% до 30%, от 10% до 30%, от 20% до 28%, от 18% до 25%, от 22% до 30%, около 10%, около 11%, около 12%, около 13%, около 14%, около 15%, около 16%, около 17%, около 18%, около 20% или около 22%, каждое значение в процентах от сухого веса. В особенно предпочтительном варианте реализации вегетирующая часть растения представляет собой лист (или листья) или их часть. В более предпочтительном варианте реализации вегетирующая часть растения представляет собой часть листьев, имеющую площадь поверхности по меньшей мере 1 см2.
Далее, в каждом из представленных выше вариантов реализации общее содержание липидов в вегетирующей части растения или нечеловеческом организме или его части, предпочтительно, в листьях растения или их части, стволе или клубне, составляет по меньшей мере около 3%, более предпочтительно по меньшей мере около 5%, предпочтительно по меньшей мере около 7%, более предпочтительно по меньшей мере около 10%, более предпочтительно по меньшей мере около 11%, более предпочтительно по меньшей мере около 12%, более предпочтительно по меньшей мере около 13%, более предпочтительно по меньшей мере около 14%, более предпочтительно по меньшей мере около 15%, более предпочтительно по меньшей мере около 17% (масс./масс., сухой вес), более предпочтительно по меньшей мере около 20%, более предпочтительно по меньшей мере около 25%. В дополнительном предпочтительном варианте реализации общее содержание липидов составляет от 5% до 35%, от 7% до 35%, от 10% до 35%, от 12% до 35%, от 25% до 35%, от 7% до 35%, от 10% до 20%, от 18% до 28%, от 20% до 28%, от 22% до 28%, около 10%, около 11%, около 12%, около 13%, около 14%, около 15%, около 16%, около 17%, около 18%, около 20%, около 22% или около 25%, каждое значение в процентах от сухого веса. Как правило, общее содержание липидов в вегетирующей части растения или нечеловеческом организме или его части на 2-3% выше, чем содержание неполярных липидов. В особенно предпочтительном варианте реализации вегетирующая часть растения представляет собой лист (или листья) или их часть. В более предпочтительном варианте реализации вегетирующая часть растения представляет собой часть листьев, имеющую площадь поверхности по меньшей мере 1 см2.
Промышленный продукт может представлять собой углеводородный продукт, такой как сложные эфиры жирных кислот, предпочтительно метиловые эфиры жирных кислот и/или этиловые эфиры жирных кислот, алкан, такой как метан, этан или длинноцепный алкан, смесь длинноцепных алканов, алкен, биотопливо, монооксид углерода и/или газообразный водород, биоспирт, такой как этанол, пропанол или бутанол, биоуголь или комбинацию монооксида углерода, водорода и биоугля. Промышленный продукт может быть смесью любых из этих компонентов, такой как смесь алканов или алканов и алкенов, предпочтительно смесью, которая преимущественно (>50%) представляет собой С4-С8 алканы или преимущественно представляет собой С6-С10 алканы, или преимущественно представляет собой С6-С8 алканы. Промышленный продукт не представляет собой диоксид углерода и воду, хотя эти молекулы могут образовываться вместе с промышленным продуктом. Промышленный продукт может представлять собой газ при атмосферном давлении/комнатной температуре или, предпочтительно, жидкость, или твердое вещество, такое как биоуголь, или в указанном способе может образовываться комбинация газообразного компонента, жидкого компонента и твердого компонента, такая как монооксид углерода, газообразный водород, алканы и биоуголь, которые могут быть впоследствии разделены. В одном варианте реализации углеводородный продукт преимущественно представляет собой метиловые эфиры жирных кислот. В альтернативном варианте реализации углеводородный продукт представляет собой продукт, отличный от метиловых эфиров жирных кислот.
Промышленный продукт может быть промежуточным продуктом, например, продуктом, содержащим жирные кислоты, которые могут быть затем превращены, например, в биотопливо, например, посредством транс-эстерификации в сложные эфиры жирных кислот.
В этом способе может быть использовано нагревание, такое как пиролиз, сжигание, газификации, или вместе с ферментативным расщеплением (включая анаэробное расщепление, компостирование, ферментация). Низкотемпературная газификация имеет место, например, при температурах от около 700°С до около 1000°С. Газификация при более высокой температуре происходит, например, при температуре от около 1200°С до около 1600°С. Низкотемпературный пиролиз (медленный пиролиз) происходит, например, при температуре около 400°С, тогда как высокотемпературный пиролиз имеет место, например, при температуре около 500°С. Мезофильное расщепление происходит, например, при температуре от около 20°С до около 40°С. Термофильное расщепление происходит, например, при температуре от около 50°С до около 65°С.
Химические средства включают, но не ограничиваясь этим, каталитический крекинг, анаэробное расщепление, ферментацию, компостирование и транс-эстерификацию. В одном варианте реализации в химических средствах используется катализатор или смесь катализаторов, которые могут быть использованы вместе с нагреванием. В этом способе может быть использован гомогенный катализатор, гетерогенный катализатор и/или ферментативный катализатор. В одном варианте реализации катализатор представляет собой катализатор на основе переходного металла, катализатор типа молекулярных сит, катализатор на основе активированного глинозема или карбонат натрия. Катализаторы включают кислотные катализаторы, такие как серная кислота, или щелочные катализаторы, такие как гидроксид калия или натрия, или другие гидроксиды. Химические средства могут включать транс-эстерификацию жирных кислот в липиды, и в этом процессе может быть использован гомогенный катализатор, гетерогенный катализатор и/или ферментативный катализатор. Указанное превращение может включать пиролиз, при котором используется нагревание и могут быть использованы химические средства, и может быть использован катализатор на основе переходного металла, катализатор типа молекулярных сит, катализатор на основе активированного глинозема и/или карбонат натрия.
Ферментативные средства включают, но не ограничиваясь этим, расщепление микроорганизмами, например, при анаэробном расщеплении, ферментации или компостировании, или с помощью рекомбинантных ферментативных белков.
Липид, который превращают в промышленный продукт, в этом аспекте настоящего изобретения может представлять собой некоторую часть или все неполярные липиды в вегетирующей части растения или нечеловеческом организме или его части, или предпочтительно указанное превращение происходит по меньшей мере в части неполярных липидов и по меньшей мере в части полярных липидов, и более предпочтительно практически все липиды (как полярные, так и неполярные) в вегетирующей части растения или нечеловеческом организме или его части превращаются в промышленный продукт (-ы).
В одном варианте реализации превращение липидов в промышленный продукт происходит in situ без физического разрушения вегетирующей части растения или нечеловеческого организма или его части. В этом варианте реализации вегетирующая часть растения или нечеловеческий организм или его часть может быть сначала высушена, например, с помощью нагревания, или вегетирующая часть растения или нечеловеческий организм или его часть может быть использована практически в собранном виде, без высушивания. В альтернативном варианте реализации указанный способ включает стадию физической переработки вегетирующей части растения или нечеловеческого организма или его части. Физическая переработка может включать одно или более из следующих: раскатывание, прессование, такое как расслоение, размол или измельчение вегетирующей части растения, нечеловеческого организма или его части, что может быть совмещено с высушиванием вегетирующей части растения или нечеловеческого организма или его части. Например, вегетирующая часть растения или нечеловеческий организм или его часть может быть сначала практически высушена, а затем измельчена на более мелкодисперсный материал для простоты последующей переработки.
В одном варианте реализации вес вегетирующей части растения или нечеловеческого организма или его части, используемой в процессе, составляет по меньшей мере 1 кг или предпочтительно по меньшей мере 1 тонну (сухой вес) объединенных вегетирующих частей растения или нечеловеческих организмов или их частей. Указанные способы могут дополнительно включать первую стадию сбора вегетирующих частей растения, например по меньшей мере из 100 или 1000 растений, растущих в поле, с получением совокупности по меньшей мере 1000 таких вегетирующих частей растения, то есть которые являются практически идентичными. Предпочтительно, вегетирующие части растения собирают в то время, когда выход неполярных липидов является наивысшим. В одном варианте реализации вегетирующие части растений собирают примерно во время цветения. В другом варианте реализации вегетирующие части растений собирают примерно от времени цветения примерно до времени начала увядания. В другом варианте реализации вегетирующие части растений собирают, когда растения находятся в возрасте по меньшей мере 1 месяца.
Указанный способ может дополнительно включать или не включать экстракцию некоторой части неполярных липидов вегетирующей части растения или нечеловеческого организма или его части перед стадией превращения. В одном варианте реализации указанный процесс дополнительно включает стадии:
(а) экстракция по меньшей мере некоторой части неполярных липидов вегетирующей части растения или нечеловеческого организма или его части в виде неполярных липидов, и
(b) выделение экстрагированных неполярных липидов,
при этом стадии (а) и (b) выполняют перед стадией превращения по меньшей мере некоторой части липидов в вегетирующей части растения или нечеловеческого организма или его части в промышленный продукт. Доля неполярных липидов, которые экстрагируются вначале, может составлять менее 50% или более 50%, или предпочтительно по меньшей мере 75% от общего содержания неполярных липидов в вегетирующей части растения или нечеловеческом организме или его части. В этом варианте реализации экстрагированные неполярные липиды содержат триацилглицерины, причем указанные триацилглицерины составляют по меньшей мере 90%, предпочтительно по меньшей мере 95% экстрагированных липидов. Экстрагированные липиды сами могут быть превращены в промышленный продукт, отличный от самих липидов, например, путем транс-эстерификации в сложные эфиры жирных кислот.
Во втором аспекте настоящего изобретения представлен способ получения экстрагированных липидов из нечеловеческого организма или его части.
В одном варианте реализации настоящего изобретения представлен способ получения экстрагированных липидов, включающий стадии:
i) получение нечеловеческого организма или его части, содержащей один или более экзогенный полинуклеотид (-ов) и повышенную концентрацию одного или более неполярного липида (-ов) относительно соответствующего нечеловеческого организма или его части, соответственно, не содержащей одного или нескольких экзогенных полинуклеотида (-ов),
ii) экстрагирование липидов из нечеловеческого организма или его части, и
iii) выделение экстрагированных липидов,
с получением посредством этого экстрагированных липидов, где каждый из одного или нескольких экзогенных полинуклеотидов функционально связан с промотором, который может направлять экспрессию полинуклеотида в нечеловеческом организме или его части, и при этом применяется одна или несколько, или все из следующих характеристик:
(а) один или более экзогенный полинуклеотид (-ов) содержат первый экзогенный полинуклеотид, который кодирует РНК или полипептид фактора транскрипции, который увеличивает экспрессию одного или более гликолитических или жирнокислотных биосинтетических генов в нечеловеческом организме или его части, и второй экзогенный полинуклеотид, который кодирует РНК или полипептид, участвующий в биосинтезе одного или более неполярных липидов,
(b) если нечеловеческий организм представляет собой растение, вегетирующая часть растения имеет общее содержание неполярных липидов по меньшей мере около 3%, более предпочтительно по меньшей мере около 5%, предпочтительно по меньшей мере около 7%, более предпочтительно по меньшей мере около 10%, более предпочтительно по меньшей мере около 11%, более предпочтительно по меньшей мере около 12%, более предпочтительно по меньшей мере около 13%, более предпочтительно по меньшей мере около 14% или более предпочтительно по меньшей мере около 15% (масс./масс., сухой вес),
(с) нечеловеческий организм представляет собой водоросли, выбранные из группы, состоящей из диатомовых водорослей (бациллариофиты), зеленых водорослей (хлорофиты), сине-зеленых водорослей (цианофиты), золотисто-коричневых водорослей (хризофиты), гаптофитов, коричневых водорослей и гетероконтных водорослей,
(d) один или несколько неполярный липид (-ов) содержит жирную кислоту, которая содержит гидроксильную группу, эпокси-группу, циклопропановую группу, двойную углерод-углеродную связь, тройную углерод-углеродную связь, сопряженные двойные связи, разветвленную цепь, такую как метилированная или гидроксилированная разветвленная цепь, или комбинацию двух или более из них, или любые две, три, четыре, пять или шесть из вышеупомянутых групп, связей или разветвленных цепей,
(е) общее содержание жирных кислот в неполярном липиде (-ах) составляет по меньшей мере на 2% больше олеиновой кислоты и/или по меньшей мере на 2% меньше пальмитиновой кислоты, чем неполярный липид (-ы) в соответствующем нечеловеческом организме или его части, не содержащей одного или более экзогенных полинуклеотидов,
(f) неполярный липид (-ы) содержит измененную концентрацию общих стеролов, предпочтительно свободных (не эстерифицированных) стеролов, стероиловых эфиров, стероил-гликозидов, относительно неполярного липида (-ов) в соответствующем нечеловеческом организме или его части, не содержащей одного или более экзогенных полинуклеотидов,
(g) неполярный липид (-ы) содержит воски и/или восковые эфиры,
(h) нечеловеческий организм или его часть представляет собой один член из объединенной популяции или группы по меньшей мере из 1000 таких нечеловеческих организмов или их частей, соответственно, из которых экстрагируют липид.
В варианте реализации представленного выше пункта (b) общее содержание неполярных липидов составляет от 5% до 25, от 7% до 25%, от 10% до 25%, от 12% до 25%, от 15% до 25%, от 7% до 20%, от 10% до 20%, около 10%, около 11%, около 12%, около 13%, около 14%, около 15%, около 16%, около 17%, около 18%, около 20% или около 22%, каждое значение в процентах от сухого веса.
В одном варианте реализации нечеловеческий организм представляет собой водоросли или организм, подходящий для ферментации, такой как грибы, или предпочтительно растение. Часть нечеловеческого организма может представлять собой семена, фрукты или вегетирующую часть растения. В предпочтительном варианте реализации часть растения представляет собой часть листьев, имеющую площадь поверхности по меньшей мере 1 см2. В другом предпочтительном варианте реализации указанный нечеловеческий организм представляет собой растение, указанная часть представляет собой семена растения, а указанный экстрагированный липид представляет собой масло семян. В более предпочтительном варианте реализации растение представляет собой растение из масличных видов, которые используются в промышленности или могут быть использованы в промышленности для производства масла. Такие виды могут быть выбраны из группы, состоящей из Acrocomia aculeate (пальма макауба), Arabidopsis thaliana, Aracinis hypogaea (арахис), Astrocaryum murumuru (мурумуру), Astrocaryum vulgare (тукума), Attalea geraensis (Indaiá-rateiro), Attalea humilis (американская масличная пальма), Attalea oleifera (andaiá), Attalea phalerata (урикури), Attalea speciosa (бабассу), Avena sativa (овес), Beta vulgaris (сахарная свекла), виды Brassica, такие как Brassica carinata, Brassica juncea, Brassica napobrassica, Brassica napus (канола), Camelina sativa (ложный лен), Cannabis sativa (конопля), Carthamus tinctorius (сафлор), Caryocar brasiliense (кариокар), Cocos nucifera (кокосовый орех), Crambe abyssinica (абиссинская капуста), Cucumis melo (дыня), Elaeis guineensis (африканская пальма), Glycine max (соя), Gossypium hirsutum (хлопок), виды Helianthus, такие как Helianthus annuus (подсолнечник), Hordeum vulgare (ячмень), Jatropha curcas (лекарственный орех), Joannesia princeps (ореховое дерево арара), виды Lemna (ряска), такие как Lemna aequinoctialis, Lemna disperma, Lemna ecuadoriensis, Lemna gibba (ряска горбатая), Lemna japonica, Lemna minor, Lemna minuta, Lemna obscura, Lemna paucicostata, Lemna perpusilla, Lemna tenera, Lemna trisulca, Lemna turionifera, Lemna valdiviana, Lemna yungensis, Licania rigida (ойтикика), Linum usitatissimum (лен), Lupinus angustifolius (люпин), Mauritia flexuosa (пальма бурити), Maximiliana maripa (пальма инайа), виды Miscanthus, такие как Miscantus x giganteus и Miscanthus sinensis, виды Nicotiana (табак), такие как Nicotiana tabacum или Nicotiana benthamiana, Oenocarpus bacaba (bacaba-do-azeite), Oenocarpus bataua (patauã), Oenocarpus distichus (bacaba-de-leque), виды Oryza (рис), такие как Oryza sativa и Oryza glaberrima, Panicum virgatum (просо прутьевидное), Paraqueiba paraensis (марь), Persea amencana (авокадо), Pongamia pinnata (индийский бук), Populus trichocarpa, Ricinus communis (клещевина обыкновенная), виды Saccharum (сахарный тростник), Sesamum indicum (кунжут), Solanum tuberosum (картофель), виды Sorghum, такие как Sorghum bicolor, Sorghum vulgare, Theobroma grandiforum (купуасу), виды Trifolium, Trithrinax brasiliensis (бразильская игольчатая пальма), виды Triticum (пшеница), такие как Triticum aestivum, и Zea mays (кукуруза). В одном варианте реализации растение Brassica napus представляет собой сорт Westar. В альтернативном варианте реализации, если растение представляет собой Brassica napus, оно представляет собой вариетет или сорт, отличный от Westar. В одном варианте реализации растение относится к видам, отличным от Arabidopsis thaliana. В другом варианте реализации растение относится к видам, отличным от Nicotiana tabacum. В другом варианте реализации растение относится к видам, отличным от Nicotiana benthamiana. В одном варианте реализации растение представляет собой многолетнее растение, например, просо прутьевидное. Каждая из характеристик, описанных для растения второго аспекта, может быть использована mutatis mutandis в отношении вегетирующей части растения первого аспекта.
В одном варианте реализации нечеловеческий организм представляет собой масличные грибы, такие как жировые дрожжи.
В предпочтительном варианте реализации липиды экстрагируют без высушивания нечеловеческого организма или его части перед экстракцией. Экстрагированные липиды затем могут быть высушены или фракционированы для уменьшения содержания влаги.
В дополнительных вариантах реализации этого аспекта в настоящем изобретении представлен способ получения экстрагированных липидов из определенных масличных растений. В одном варианте реализации настоящего изобретения представлен способ получения экстрагированного канолового масла, включающий стадии:
i) получение семян канолы, содержащих по меньшей мере 45 масс. % масла,
ii) экстракция масла из семян канолы, и
iii) выделение масла, причем выделенное масло содержит по меньшей мере 90% (масс./масс.) триацилглицеринов (TAG),
с получением посредством этого масла канолы. В предпочтительном варианте реализации семена канолы имеют содержание масла в весовом выражении по меньшей мере 46%, по меньшей мере 47%, по меньшей мере 48%, по меньшей мере 49%, по меньшей мере 50%, по меньшей мере 51%, по меньшей мере 52%, по меньшей мере 53%, по меньшей мере 54%, по меньшей мере 55% или по меньшей мере 56%. Содержание масла можно определить измерением количества масла, которое экстрагируется из семян, которые представляют собой обмолоченные зерна в обычном собранном виде, и расчетом в процентах от веса семян, то есть % (масс./масс.). Содержание влаги в семенах канолы составляет от 5% до 15% и предпочтительно составляет около 8,5%. В одном варианте реализации содержание олеиновой кислоты составляет от около 58% до 62% от общего содержания жирных кислот в каноловом масле, предпочтительно по меньшей мере 63%, а содержание пальмитиновой кислоты составляет от около 4% до около 6% от общего содержания жирных кислот в каноловом масле. Предпочтительное масло канолы имеет йодное число 110-120 и содержание хлорофилла менее 30 м.д.
В другом варианте реализации настоящего изобретения представлен способ получения экстрагированного кукурузного масла, включающий стадии:
i) получение кукурузных семян, содержащих по меньшей мере 5 масс. % масла,
ii) экстракция масла из семян кукурузы, и
iii) выделение масла, причем выделенное масло содержит по меньшей мере 80%, предпочтительно по меньшей мере 85% или по меньшей мере 90% (масс./масс.) триацилглицеринов (TAG),
с получением посредством этого кукурузного масла. В предпочтительном варианте реализации кукурузные семена имеют содержание масла относительно веса семян (масс./масс.) по меньшей мере 6%, по меньшей мере 7%, по меньшей мере 8%, по меньшей мере 9%, по меньшей мере 10%, по меньшей мере 11%, по меньшей мере 12% или по меньшей мере 13%. Содержание влаги в семенах кукурузы составляет от около 13% до около 17%, предпочтительно около 15%. Предпочтительное кукурузное масло содержит около 0,1% токоферолов.
В другом варианте реализации настоящего изобретения представлен способ получения экстрагированного соевого масла, включающий стадии:
i) получение соевых семян, содержащих по меньшей мере 20 масс. % масла,
ii) экстракция масла из семян сои, и
iii) выделение масла, причем выделенное масло содержит по меньшей мере 90% (масс./масс.) триацилглицеринов (TAG),
с получением посредством этого соевого масла. В предпочтительном варианте реализации соевые семена имеют содержание масла относительно веса семян (масс./масс.) по меньшей мере 21%, по меньшей мере 22%, по меньшей мере 23%, по меньшей мере 24%, по меньшей мере 25%, по меньшей мере 26%, по меньшей мере 27%, по меньшей мере 28%, по меньшей мере 29%, по меньшей мере 30% или по меньшей мере 31%. В одном варианте реализации содержание олеиновой кислоты составляет от около 20% до около 25% от общего содержания жирных кислот в соевом масле, предпочтительно по меньшей мере 30%, содержание линолевой кислоты составляет от около 45% до около 57%, предпочтительно менее 45%, а содержание пальмитиновой кислоты составляет от около 10% до около 15% от общего содержания жирных кислот в соевом масле, предпочтительно менее 10%. Предпочтительно, соевые семена имеют содержание белка около 40% в пересчете на сухой вес, а содержание влаги в соевых семенах составляет от около 10% до около 16%, предпочтительно около 13%.
В другом варианте реализации настоящего изобретения представлен способ получения экстрагированного масла семян люпина, включающий стадии:
i) получение семян люпина, содержащих по меньшей мере 10 масс. % масла,
ii) экстракция масла из семян люпина, и
iii) выделение масла, причем выделенное масло содержит по меньшей мере 90% (масс./масс.) триацилглицеринов (TAG),
с получением посредством этого масла семян люпина. В предпочтительном варианте реализации семена люпина имеют содержание масла относительно веса семян (масс./масс.) по меньшей мере 11%, по меньшей мере 12%, по меньшей мере 13%, по меньшей мере 14%, по меньшей мере 15% или по меньшей мере 16%.
В другом варианте реализации настоящего изобретения представлен способ получения экстрагированного арахисового масла, включающий стадии:
i) получение арахисовых орехов, содержащих по меньшей мере 50 масс. % масла,
ii) экстракция масла из арахисовых орехов, и
iii) выделение масла, причем выделенное масло содержит по меньшей мере 90% (масс./масс.) триацилглицеринов (TAG),
с получением посредством этого арахисового масла. В предпочтительном варианте реализации семена арахиса (арахисовые орехи) имеют содержание масла относительно веса семян (масс./масс.) по меньшей мере 51%, по меньшей мере 52%, по меньшей мере 53%, по меньшей мере 54%, по меньшей мере 55% или по меньшей мере 56%. В одном варианте реализации содержание олеиновой кислоты составляет от около 38% до 59% от общего содержания жирных кислот в арахисовом масле, предпочтительно по меньшей мере 60%, а содержание пальмитиновой кислоты составляет от около 9% до около 13% от общего содержания жирных кислот в арахисовом масле, предпочтительно менее 9%.
В другом варианте реализации настоящего изобретения представлен способ получения экстрагированного подсолнечного масла, включающий стадии:
i) получение семян подсолнечника, содержащих по меньшей мере 50 масс. % масла,
ii) экстракция масла из семян подсолнечника, и
iii) выделение масла, причем выделенное масло содержит по меньшей мере 90% (масс./масс.) триацилглицеринов (TAG),
с получением посредством этого подсолнечного масла. В предпочтительном варианте реализации семена подсолнечника имеют содержание масла относительно веса семян (масс./масс.) по меньшей мере 51%, по меньшей мере 52%, по меньшей мере 53%, по меньшей мере 54% или по меньшей мере 55%.
В другом варианте реализации настоящего изобретения представлен способ получения экстрагированного хлопкового масла, включающий стадии:
i) получение семян хлопка, содержащих по меньшей мере 41 масс. % масла,
ii) экстракция масла из семян хлопка, и
iii) выделение масла, причем выделенное масло содержит по меньшей мере 90% (масс./масс.) триацилглицеринов (TAG),
с получением посредством этого хлопкового масла. В предпочтительном варианте реализации семена хлопка имеют содержание масла относительно веса семян (масс./масс.) по меньшей мере 42%, по меньшей мере 43%, по меньшей мере 44%, по меньшей мере 45%, по меньшей мере 46%, по меньшей мере 47%, по меньшей мере 48%, по меньшей мере 49% или по меньшей мере 50%. В одном варианте реализации содержание олеиновой кислоты составляет от около 15% до 22% от общего содержания жирных кислот в хлопковом масле, предпочтительно по меньшей мере 22%, содержание линолевой кислоты составляет от около 45% до около 57%, предпочтительно менее 45%, а содержание пальмитиновой кислоты составляет от около 20% до около 26% от общего содержания жирных кислот в хлопковом масле, предпочтительно менее 18%. В одном варианте реализации хлопковое масло содержит также циклопропанированные жирные кислоты, такие как стеркуловая кислота и мальвалевая кислота, и может содержать небольшие количества госсипола.
В другом варианте реализации настоящего изобретения представлен способ получения экстрагированного сафлорового масла, включающий стадии:
i) получение сафлоровых семян, содержащих по меньшей мере 35 масс. % масла,
ii) экстракция масла из сафлоровых семян, и
iii) выделение масла, причем выделенное масло содержит по меньшей мере 90% (масс./масс.) триацилглицеринов (TAG),
с получением посредством этого сафлорового масла. В предпочтительном варианте реализации сафлоровые семена имеют содержание масла относительно веса семян (масс./масс.) по меньшей мере 36%, по меньшей мере 37%, по меньшей мере 38%, по меньшей мере 39%, по меньшей мере 40%, по меньшей мере 41%, по меньшей мере 42%, по меньшей мере 43%, по меньшей мере 44% или по меньшей мере 45%.
В другом варианте реализации настоящего изобретения представлен способ получения экстрагированного масла семян льна, включающий стадии:
i) получение семян льна, содержащих по меньшей мере 36 масс. % масла,
ii) экстракция масла из семян льна, и
iii) выделение масла, причем выделенное масло содержит по меньшей мере 90% (масс./масс.) триацилглицеринов (TAG),
с получением посредством этого масла семян льна. В предпочтительном варианте реализации семена льна имеют содержание масла относительно веса семян (масс./масс.) по меньшей мере 37%, по меньшей мере 38%, по меньшей мере 39% или по меньшей мере 40%.
В другом варианте реализации настоящего изобретения представлен способ получения экстрагированного рыжикового масла, включающий стадии:
i) получение семян Camelina sativa, содержащих по меньшей мере 36 масс. % масла,
ii) экстракция масла из семян Camelina sativa, и
iii) выделение масла, причем выделенное масло содержит по меньшей мере 90% (масс./масс.) триацилглицеринов (TAG),
с получением посредством этого рыжикового масла. В предпочтительном варианте реализации семена Camelina sativa имеют содержание масла относительно веса семян (масс./масс.) по меньшей мере 37%, по меньшей мере 38%, по меньшей мере 39%, по меньшей мере 40%, по меньшей мере 41%, по меньшей мере 42%, по меньшей мере 43%, по меньшей мере 44% или по меньшей мере 45%.
Способ в соответствии со вторым аспектом также может включать измерение содержания масла и/или белка в семенах с помощью ближней инфракрасной отражательной спектроскопии, как описано в публикации Hom et al. (2007).
В одном варианте реализации способ в соответствии со вторым аспектом настоящего изобретения включает частичное или полное высушивание вегетирующей части растения или нечеловеческого организма или его части, или семян, и/или одно или более из раскатывания, прессования, такого как расслоение, размол или измельчение вегетирующей части растения или нечеловеческого организма или его части, или семян, или любую комбинацию из этих способов, в процессе экстракции. В указанном способе в процессе экстракции может быть использован органический растворитель (например, гексан, такой как н-гексан или комбинация н-гексана с изогексаном, или только бутан, или в комбинации с гексаном) для экстракции липидов или масла или для увеличения эффективности процесса экстракции, в частности, в комбинации с предшествующим процессом высушивания для уменьшения содержания влаги.
В одном варианте реализации указанный способ включает выделение экстрагированных липидов или масла посредством его сбора в контейнер и/или очистку экстрагированных липидов или масла семян, как, например, с помощью дегумирования, обесцвечивания, высушивания и/или фракционирования экстрагированных липидов или масла, и/или путем удаления по меньшей мере части, предпочтительно практически всех восков и/или восковых эфиров из экстрагированных липидов или масла. Указанный способ может включать анализ состава жирных кислот в экстрагированных липидах или масле, такой как, например, посредством превращения жирных кислот в экстрагированных липидах или масле в метиловые эфиры жирных кислот и их анализ с помощью ГХ для определения состава жирных кислот. Состав жирных кислот в липидах или масле определяют до фракционирования липидов или масла, которое изменяет его состав жирных кислот. Экстрагированные липиды или масло могут содержать смесь различных типов липидов и/или одного или нескольких производных липидов, таких как свободные жирные кислоты.
В одном варианте реализации способ в соответствии со вторым аспектом настоящего изобретения обеспечивает значительные количества экстрагированных липидов или масла. В одном варианте реализации объем экстрагированных липидов или масла составляет по меньшей мере 1 литр, предпочтительно по меньшей мере 10 литров. В предпочтительном варианте реализации экстрагированные липиды или масло упаковывают в готовом для транспортировки или продажи виде.
В одном варианте реализации экстрагированные липиды или масло содержат по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95% или по меньшей мере 96 масс. % TAG. Экстрагированные липиды или масло могут содержать фосфолипиды в качестве неосновного компонента, до около 8 масс. %, предпочтительно менее 5 масс. % и более предпочтительно менее 3 масс. %.
В одном варианте реализации указанный способ обеспечивает экстрагированные липиды или масло, к которым применимы одна или более, или все из следующих характеристик:
(i) триацилглицерины составляют по меньшей мере 90%, предпочтительно по меньшей мере 95% или 96% от экстрагированных липидов или масла,
(ii) экстрагированные липиды или масло содержат свободные стеролы, стероиловые эфиры, стероил-гликозиды, воски или восковые эфиры или любую их комбинацию, и
(iii) общее содержание стерола и/или композиции в экстрагированных липидах или масле существенно отличается от содержания стерола и/или композиции в экстрагированных липидах или масле, полученных из соответствующего нечеловеческого организма или его части, или семян.
В одном варианте реализации указанный способ дополнительно включает превращение экстрагированных липидов или масла в промышленный продукт. То есть экстрагированные липиды или масло после экстракции превращают в другую химическую форму, которая представляет собой промышленный продукт. Предпочтительно, промышленный продукт представляет собой углеводородный продукт, такой как сложные эфиры жирных кислот, предпочтительно метиловые эфиры жирных кислот и/или этиловые эфиры жирных кислот, алкан, такой как метан, этан или длинноцепный алкан, смесь алканов с более длинной цепью, алкен, биотопливо, монооксид углерода и/или газообразный водород, биоспирт, такой как этанол, пропанол или бутанол, биоуголь, или комбинацию монооксида углерода, водорода и биоугля.
В способе по первому или второму аспекту настоящего изобретения вегетирующая часть растения или часть нечеловеческого организма может быть надземной частью растения или зеленой частью растения, такой как листья или стебель растения, древесной частью, такой как стебель, ветки или ствол, или корнями, или клубнями. Предпочтительно, растения выращивают в поле, а его части, такие как семена, собирают из растений в поле.
В одном варианте реализации указанный способ дополнительно включает стадию сбора вегетирующей части растения, нечеловеческого организма или его части, предпочтительно с помощью механической уборочной машины.
Предпочтительно, вегетирующие части растения собирают в то время, когда выход неполярных липидов является наивысшим. В одном варианте реализации вегетирующие части растения собирают примерно во время цветения. В другом варианте реализации вегетирующие части растений собирают примерно от времени цветения примерно до времени начала увядания. В другом варианте реализации вегетирующие части растений собирают, когда растения находятся в возрасте по меньшей мере 1 месяца.
Если организм представляет собой водорослевый или грибковый организм, клетки могут быть выращены в закрытом контейнере или в открытой системе, такой как пруд. Полученные организмы, содержащие неполярные липиды, могут быть собраны, например, с помощью способа, включающего фильтрацию, центрифугирование, осаждение, флотацию или флоккуляцию водорослевых или грибковых организмов, таким способом как регуляция рН среды. Осаждение менее предпочтительно.
В способе второго аспекта настоящего изобретения общее содержание неполярных липидов в нечеловеческом организме или его части, такой как вегетирующая часть растения или семена, увеличивается относительно соответствующей вегетирующей части растения, нечеловеческого организма или его части, или семян.
В одном варианте реализации вегетирующая часть растения или нечеловеческий организм или его часть, или семена по первому или второму аспектам настоящего изобретения дополнительно определяются тремя характеристиками, а именно: характеристика (i), характеристика (ii) и характеристика (iii), отдельно или в комбинации:
Характеристика (i) количественно определяет степень увеличения концентрации одного или более неполярных липидов или общего содержания неполярных липидов в вегетирующей части растения или нечеловеческом организме или его части, или в семенах, которая может быть выражена как степень увеличения в весовом выражении (в пересчете на сухой вес или на вес семян), или как относительное увеличение по сравнению с концентрацией в соответствующей вегетирующей части растения или нечеловеческом организме или его части, или в семенах. Характеристика (ii) определяет род или виды растения, или виды грибков или водорослей, или другие типы клеток, а характеристика (iii) определяет один или более конкретных липидов, которые повышаются в содержании неполярных липидов.
Для характеристики (i), в одном варианте реализации, степень увеличения одного или более неполярных липидов составляет по меньшей мере 0,5%, по меньшей мере на 1%, по меньшей мере на 2%, по меньшей мере на 3%, по меньшей мере на 4%, по меньшей мере на 5%, по меньшей мере на 6%, по меньшей мере на 7%, по меньшей мере на 8%, по меньшей мере на 9%, по меньшей мере на 10%, по меньшей мере на 11%, по меньшей мере на 12%, по меньшей мере на 13%, по меньшей мере на 14%, по меньшей мере на 15%, по меньшей мере на 16%, по меньшей мере на 17%, по меньшей мере на 18%, по меньшей мере на 19%, по меньшей мере на 20%, по меньшей мере на 21%, по меньшей мере на 22%, по меньшей мере на 23%, по меньшей мере на 24%, по меньшей мере на 25% или по меньшей мере на 26% больше в пересчете на сухой вес или вес семян, чем в соответствующей вегетирующей части растения или нечеловеческом организме или его части.
Также для характеристики (i), в предпочтительном варианте реализации, общее содержание неполярных липидов в вегетирующей части растения или нечеловеческом организме или его части, или в семенах, увеличивается по сравнению с соответствующей вегетирующей частью растения или нечеловеческим организмом или его частью, или семенами. В одном варианте реализации общее содержание неполярных липидов увеличивается по меньшей мере на 0,5%, по меньшей мере на 1%, по меньшей мере на 2%, по меньшей мере на 3%, по меньшей мере на 4%, по меньшей мере на 5%, по меньшей мере на 6%, по меньшей мере на 7%, по меньшей мере на 8%, по меньшей мере на 9%, по меньшей мере на 10%, по меньшей мере на 11%, по меньшей мере на 12%, по меньшей мере на 13%, по меньшей мере на 14%, по меньшей мере на 15%, по меньшей мере на 16%, по меньшей мере на 17%, по меньшей мере на 18%, по меньшей мере на 19%, по меньшей мере на 20%, по меньшей мере на 21%, по меньшей мере на 22%, по меньшей мере на 23%, по меньшей мере на 24%, по меньшей мере на 25% или по меньшей мере на 26% больше в пересчете на сухой вес или вес семян, чем в соответствующей вегетирующей части растения или нечеловеческом организме или его части, или в семенах.
Дополнительно, для характеристики (i), в одном варианте реализации, концентрация одного или более неполярных липидов и/или общее содержание неполярных липидов по меньшей мере на 1%, по меньшей мере на 2%, по меньшей мере на 3%, по меньшей мере на 4%, по меньшей мере на 5%, по меньшей мере на 6%, по меньшей мере на 7%, по меньшей мере на 8%, по меньшей мере на 9%, по меньшей мере на 10%, по меньшей мере на 11%, по меньшей мере на 12%, по меньшей мере на 13%, по меньшей мере на 14%, по меньшей мере на 15%, по меньшей мере на 16%, по меньшей мере на 17%, по меньшей мере на 18%, по меньшей мере на 19%, по меньшей мере на 20%, по меньшей мере на 21%, по меньшей мере на 22%, по меньшей мере на 23%, по меньшей мере на 24%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90% или по меньшей мере на 100% больше в относительном выражении, чем в соответствующей вегетирующей части растения или нечеловеческом организме или его части, или в семенах.
Также для характеристики (i) степень увеличения концентрации одного или более неполярных липидов и/или общего содержания неполярных липидов может быть по меньшей мере в 2 раза, по меньшей мере в 3 раза, по меньшей мере в 4 раза, по меньшей мере в 5 раз, по меньшей мере в 6 раз, по меньшей мере в 7 раз, по меньшей мере в 8 раз, по меньшей мере в 9 раз, по меньшей мере в 10 раз или по меньшей мере в 12 раз, предпочтительно по меньшей мере в около 13 раз или по меньшей мере в около 15 раз больше в относительном выражении, чем в соответствующей вегетирующей части растения или нечеловеческом организме или его части, или в семенах.
В результате увеличения концентрации одного или более неполярных липидов и/или общего содержания неполярных липидов, как описано в характеристике (i), общее содержание неполярных липидов в вегетирующей части растения или нечеловеческом организме или его части, или в семенах предпочтительно составляет от 5% до 25%, от 7% до 25%, от 10% до 25%, от 12% до 25%, от 15% до 25%, от 7% до 20%, от 10% до 20%, около 10%, около 11%, около 12%, около 13%, около 14%, около 15%, около 16%, около 17%, около 18%, около 20% или около 22%, каждое значение в процентах от сухого веса или веса семян.
Для характеристики (ii), в одном варианте реализации, нечеловеческий организм представляет собой растение, водоросль или организм, подходящий для ферментации, такой как дрожжи или другие грибы, предпочтительно масличные грибы, такие как жировые дрожжи. Растение может быть или вегетирующая часть растения может быть, например, из растения, которое представляет собой Acrocomia aculeate (пальма макауба), Arabidopsis thaliana, Aracinis hypogaea (арахис), Astrocaryum murumuru (мурумуру), Astrocaryum vulgare (тукума), Attalea geraensis (Indaiá-rateiro), Attalea humilis (американская масличная пальма), Attalea oleifera (andaiá), Attalea phalerata (урикури), Attalea speciosa (бабассу), Avena sativa (овес), Beta vulgaris (сахарная свекла), виды Brassica, такие как Brassica carinata, Brassica juncea, Brassica napobrassica, Brassica napus (канола), Camelina sativa (ложный лен), Cannabis sativa (конопля), Carthamus tinctorius (сафлор), Caryocar brasiliense (кариокар), Cocos nucifera (кокосовый орех), Crambe abyssinica (абиссинская капуста), Cucumis melo (дыня), Elaeis guineensis (африканская пальма), Glycine max (соя), Gossypium hirsutum (хлопок), виды Helianthus, такие как Helianthus annuus (подсолнечник), Hordeum vulgare (ячмень), Jatropha curcas (лекарственный орех), Joannesia princeps (ореховое дерево арара), виды Lemna (ряска), такие как Lemna aequinoctialis, Lemna disperma, Lemna ecuadoriensis, Lemna gibba (ряска горбатая), Lemna japonica, Lemna minor, Lemna minuta, Lemna obscura, Lemna paucicostata, Lemna perpusilla, Lemna tenera, Lemna trisulca, Lemna turionifera, Lemna valdiviana, Lemna yungensis, Licania rigida (ойтикика), Linum usitatissimum (лен), Lupinus angustifolius (люпин), Mauritia flexuosa (пальма бурити), Maximiliana maripa (пальма инайа), виды Miscanthus, такие как Miscantus x giganteus и Miscanthus sinensis, виды Nicotiana (табак), такие как Nicotiana tabacum или Nicotiana benthamiana, Oenocarpus bacaba (bacaba-do-azeite), Oenocarpus bataua (patauã), Oenocarpus distichus (bacaba-de-leque), виды Oryza (рис), такие как Oryza sativa и Oryza glaberrima, Panicum virgatum (просо прутьевидное), Paraqueiba paraensis (марь), Persea amencana (авокадо), Pongamia pinnata (индийский бук), Populus trichocarpa, Ricinus communis (клещевина обыкновенная), виды Saccharum (сахарный тростник), Sesamum indicum (кунжут), Solanum tuberosum (картофель), виды Sorghum, такие как Sorghum bicolor, Sorghum vulgare, Theobroma grandiforum (купуасу), виды Trifolium, Trithrinax brasiliensis (бразильская игольчатая пальма), виды Triticum (пшеница), такие как Triticum aestivum, и Zea mays (кукуруза). В одном варианте реализации растение Brassica napus представляет собой сорт Westar. В альтернативном варианте реализации, если растение представляет собой Brassica napus, оно представляет собой вариетет или сорт, отличный от Westar. В одном варианте реализации растение относится к видам, отличным от Arabidopsis thaliana. В другом варианте реализации растение относится к видам, отличным от Nicotiana tabacum. В другом варианте реализации растение относится к видам, отличным от Nicotiana benthamiana. В одном варианте реализации растение представляет собой многолетнее растение, например, просо прутьевидное. Каждая из характеристик, описанных для растения второго аспекта, может быть использована mutatis mutandis в отношении вегетирующей части растения первого аспекта.
Для характеристики (iii), TAG, DAG, TAG и DAG, MAG, общее содержание полиненасыщенных жирных кислот (PUFA) или определенной PUFA, такой как эйкозадиеновая кислота (EDA), арахидоновая кислота (ARA), альфа-линоленовая кислота (ALA), стеаридоновая кислота (SDA), эйкозатриеновая кислота (ETE), эйкозатетраеновая кислота (ETA), эйкозапентаеновая кислота (EPA), докозапентаеновая кислота (DPA), докозагексаеновая кислота (DHA), или жирной кислоты, которая содержит гидроксильную группу, эпокси-группу, циклопропановую группу, двойную углерод-углеродную связь, тройную углерод-углеродную связь, сопряженные двойные связи, разветвленную цепь, такую как метилированная или гидроксилированная разветвленная цепь, или комбинацию двух или более из них, или любые две, три, четыре, пять или шесть из вышеупомянутых групп, связей или разветвленных цепей, увеличивается (-ются) или уменьшается (-ются). Степень увеличения TAG, DAG, TAG и DAG, MAG, PUFA, определенной PUFA или жирной кислоты, описана выше в характеристике (i). В предпочтительном варианте реализации MAG представляет собой 2-MAG. Предпочтительно, DAG и/или TAG, более предпочтительно общее содержание DAG и TAG или MAG и TAG, увеличивается. В одном варианте реализации концентрации TAG увеличиваются без увеличения содержания MAG и/или DAG.
Также для характеристики (iii), в одном варианте реализации, общее содержание жирных кислот и/или содержание TAG в общем содержании неполярных липидов составляет (а) по меньшей мере на 2% больше, предпочтительно по меньшей мере на 5% больше, более предпочтительно по меньшей мере на 7% больше, наиболее предпочтительно по меньшей мере на 10% больше, по меньшей мере на 15% больше, по меньшей мере на 20% больше, по меньшей мере на 25% больше олеиновой кислоты или по меньшей мере на 30% больше относительно неполярного липида (-ов) в соответствующей вегетирующей части растения или нечеловеческом организме или его части, или в семенах, не содержащих одного или более экзогенных полинуклеотидов. В одном варианте реализации общее содержание жирных кислот в неполярном липиде (-ах) составляет (b) по меньшей мере на 2% меньше, предпочтительно по меньшей мере на 4% меньше, более предпочтительно по меньшей мере на 7% меньше, по меньшей мере на 10% меньше, по меньшей мере на 15% меньше или по меньшей мере на 20% меньше пальмитиновой кислоты относительно неполярного липида (-ов) в соответствующей вегетирующей части растения или нечеловеческом организме или его части, или в семенах, не содержащих одного или более экзогенных полинуклеотидов. В одном варианте реализации общее содержание жирных кислот в общем содержании неполярных липидов составляет (с) по меньшей мере на 2% меньше, предпочтительно по меньшей мере на 4% меньше, более предпочтительно по меньшей мере на 7% меньше, по меньшей мере на 10% меньше или по меньшей мере на 15% меньше ALA относительно неполярного липида (-ов) в соответствующей вегетирующей части растения или нечеловеческом организме или его части, или в семенах, не содержащих одного или более экзогенных полинуклеотидов. В одном варианте реализации общее содержание жирных кислот в общем содержании неполярных липидов составляет (d) по меньшей мере на 2% больше, предпочтительно по меньшей мере на 5% больше, более предпочтительно по меньшей мере на 7% больше, наиболее предпочтительно по меньшей мере на 10% больше или по меньшей мере на 15% больше LA относительно неполярного липида (-ов) в соответствующей вегетирующей части растения или нечеловеческом организме или его части, или в семенах, не содержащих одного или более экзогенных полинуклеотидов. Наиболее предпочтительно, общее содержание жирных кислот и/или содержание TAG в общем содержании неполярного липида имеет повышенную концентрацию олеиновой кислоты в соответствии с показателем, указанным в (а) и сниженное содержание пальмитиновой кислоты в соответствии с показателем, указанным в (b). В одном варианте реализации общее содержание стерола увеличивается по меньшей мере на 10% по сравнению с маслом из соответствующих семян. В одном варианте реализации экстрагированные липиды или масло содержат по меньшей мере 10 м.д. хлорофилла, предпочтительно по меньшей мере 30 м.д. хлорофилла. Хлорофилл может быть затем удален с помощью обесцвечивания экстрагированного липида или масла.
В предпочтительных вариантах реализации один или более неполярных липидов и/или общее содержание неполярных липидов определяется комбинацией характеристик (i), (ii) и (iii), или характеристик (i) и (ii), или характеристик (i) и (iii), или характеристик (ii) и (iii).
Способ второго аспекта настоящего изобретения предусматривает, в одном варианте реализации, что применима одна или более, или все из следующих характеристик:
(i) концентрация одного или более неполярных липидов в вегетирующей части растения или нечеловеческом организме или его части, или в семенах по меньшей мере на 0,5% больше в весовом выражении, чем концентрация в соответствующей вегетирующей части растения, нечеловеческом организме или его части, или в семенах, соответственно, не содержащих одного или более экзогенного полинуклеотида (-ов) или, предпочтительно, как дополнительно описано в характеристике (i),
(ii) концентрация одного или более неполярных липидов в вегетирующей части растения, нечеловеческом организме или его части, или в семенах по меньшей мере на 1% больше в относительном выражении, чем в соответствующей вегетирующей части растения, нечеловеческом организме или его части, или в семенах, соответственно, не содержащих одного или боле экзогенного полинуклеотида (-ов) или, предпочтительно, как дополнительно описано в характеристике (i),
(iii) общее содержание неполярных липидов в вегетирующей части растения, нечеловеческом организме или его части, или в семенах по меньшей мере на 0,5% больше в весовом выражении, чем концентрация в соответствующей вегетирующей части растения, нечеловеческом организме или его части, или в семенах, соответственно, не содержащих одного или более экзогенного полинуклеотида (-ов) или, предпочтительно, как дополнительно описано в характеристике (i),
(iv) общее содержание неполярных липидов в вегетирующей части растения, нечеловеческом организме или его части, или в семенах по меньшей мере на 1% больше в относительном выражении, чем в соответствующей вегетирующей части растения, нечеловеческом организме или его части, или в семенах, соответственно, не содержащих одного или более экзогенного полинуклеотида (-ов) или, предпочтительно, как дополнительно описано в характеристике (i),
(v) концентрация одного или более неполярных липидов и/или общее содержание неполярных липидов в вегетирующей части растения, нечеловеческом организме или его части, или в семенах по меньшей мере на 0,5% больше в весовом выражении и/или по меньшей мере на 1% больше в относительном выражении, чем в соответствующей вегетирующей части растения, нечеловеческом организме или его части, или в семенах, соответственно, которые не содержат один или более экзогенных полинуклеотидов и которые содержат экзогенный полинуклеотид, кодирующий DGAT1 Arabidopsis thaliana, или, предпочтительно, как дополнительно описано в характеристике (i),
(vi) содержание TAG, DAG, TAG и DAG, или MAG в липидах в вегетирующей части растения, нечеловеческом организме или его части, или в семенах, и/или в липидах, экстрагированных из них, по меньшей мере на 10% больше в относительном выражении, чем содержание TAG, DAG, TAG и DAG, или MAG в липидах в соответствующей вегетирующей части растения, нечеловеческом организме или его части, или в семенах, не содержащих одного или более экзогенного полинуклеотида (-ов), или в соответствующих липидах, экстрагированных из них, соответственно, или, предпочтительно, как дополнительно описано в характеристике (i), и
(vii) общее содержание полиненасыщенных жирных кислот (PUFA) в липидах в вегетирующей части растения, нечеловеческом организме или его части, или в семенах, и/или в липидах, экстрагированных из них, увеличивается (например, в присутствии MGAT) или снижается (например, в отсутствие MGAT) по сравнению с общим содержанием PUFA в липидах в соответствующей вегетирующей части растения, нечеловеческом организме или его части, или в семенах, не содержащих одного или более экзогенных полинуклеотида (-ов), или в соответствующих липидах, экстрагированных из них, соответственно, или, предпочтительно, как дополнительно описано в характеристике (i) или характеристике (iii).
В одном варианте реализации концентрация PUFA в вегетирующей части растения, нечеловеческом организме или его части, или в семенах, и/или в липидах, экстрагированных из них, увеличивается относительно концентрации PUFA в соответствующей вегетирующей части растения, нечеловеческом организме или его части, или в семенах, или в соответствующих липидах, экстрагированных из них, соответственно, при этом полиненасыщенная жирная кислота представляет собой эйкозадиеновую кислоту, арахидоновую кислоту (ARA), альфа-линоленовую кислоту (ALA), стеаридоновую кислоту (SDA), эйкозатриеновую кислоту (ETE), эйкозатетраеновую кислоту (ETA), эйкозапентаеновую кислоту (EPA), докозапентаеновую кислоту (DPA), докозагексаеновую кислоту (DHA) или комбинацию двух или более из них. Предпочтительно, степень увеличения является такой, как описано в характеристике (i).
В одном варианте реализации второго аспекта соответствующая вегетирующая часть растения или нечеловеческий организм или его часть, или семена представляют собой не трансгенную вегетирующую часть растения или нечеловеческий организм или его часть, или семена, соответственно. В предпочтительном варианте реализации соответствующая вегетирующая часть растения или нечеловеческий организм или его часть, или семена относятся к тому же сорту, штамму или вариетету, но не содержат одного или более экзогенных полинуклеотидов. В дополнительном предпочтительном варианте реализации соответствующая вегетирующая часть растения или нечеловеческий организм или его часть, или семена относятся к той же стадии развития, например, цветение, что и вегетирующая часть растения или нечеловеческий организм или его часть, или семена. В другом варианте реализации вегетирующие части растений собирают примерно от времени цветения примерно до времени начала увядания. В другом варианте реализации семена собирают, когда растения находятся в возрасте по меньшей мере около 1 месяца.
В одном варианте реализации часть нечеловеческого организма представляет собой сена, а общее содержание масла или общее содержание жирных кислот в семенах по меньшей мере на 0,5%-25% или по меньшей мере на 1,0%-24% больше в весовом выражении, чем соответствующие семена, не содержащие одного или более экзогенных полинуклеотидов.
В одном варианте реализации относительное содержание DAG в масле семян по меньшей мере на 10%, по меньшей мере на 10,5%, по меньшей мере на 11%, по меньшей мере на 11,5%, по меньшей мере на 12%, по меньшей мере на 12,5%, по меньшей мере на 13%, по меньшей мере на 13,5%, по меньшей мере на 14%, по меньшей мере на 14,5%, по меньшей мере на 15%, по меньшей мере на 15,5%, по меньшей мере на 16%, по меньшей мере на 16,5%, по меньшей мере на 17%, по меньшей мере на 17,5%, по меньшей мере на 18%, по меньшей мере на 18,5%, по меньшей мере на 19%, по меньшей мере на 19,5%, по меньшей мере на 20% больше в относительном выражении, чем в масле из соответствующих семян. В одном варианте реализации содержание DAG в семенах увеличивается на значение, описанное в характеристике (i), а семена относятся к роду и/или видам, описанным в характеристике (ii).
В одном варианте реализации относительное содержание TAG в семенах по меньшей мере на 5%, по меньшей мере на 5,5%, по меньшей мере на 6%, по меньшей мере на 6,5%, по меньшей мере на 7%, по меньшей мере на 7,5%, по меньшей мере на 8%, по меньшей мере на 8,5%, по меньшей мере на 9%, по меньшей мере на 9,5%, по меньшей мере на 10% или по меньшей мере на 11% больше в абсолютном выражении, по сравнению с соответствующими семенами. В одном варианте реализации содержание TAG в семенах увеличивается на значение, описанное в характеристике (i), а семена относятся к роду и/или видам, описанным в характеристике (ii).
В другом варианте реализации часть нечеловеческого организма представляет собой вегетирующую часть растения, а содержание TAG, DAG, TAG и DAG или MAG в вегетирующей части растения по меньшей мере на 10%, по меньшей мере на 11%, по меньшей мере на 12%, по меньшей мере на 13%, по меньшей мере на 14%, по меньшей мере на 15%, по меньшей мере на 16%, по меньшей мере на 17%, по меньшей мере на 18%, по меньшей мере на 19%, по меньшей мере на 20%, по меньшей мере на 21%, по меньшей мере на 22%, по меньшей мере на 23%, по меньшей мере на 24%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90% или по меньшей мере на 100% больше в относительном выражении, чем содержание TAG, DAG, TAG и DAG или MAG в соответствующей вегетирующей части растения, не содержащей одного или более экзогенных полинуклеотидов. В предпочтительном варианте реализации MAG представляет собой 2-MAG. В одном варианте реализации содержание TAG, DAG, TAG и DAG или MAG в вегетирующей части растения определяется по количеству этих липидных компонентов в экстрагируемых липидах вегетирующей части растения. В дополнительном варианте реализации содержание TAG, DAG, TAG и DAG или MAG в трансгенной вегетирующей части растения увеличивается на значение, описанное в характеристике (i).
В одном варианте реализации по меньшей мере 20% (мол.%), по меньшей мере 22% (мол.%), по меньшей мере 30% (мол.%), по меньшей мере 40% (мол.%), по меньшей мере 50% (мол.%) или по меньшей мере 60% (мол.%), предпочтительно по меньшей мере 65% (мол.%), более предпочтительно по меньшей мере 66% (мол.%), по меньшей мере 67% (мол.%), по меньшей мере 68% (мол.%), по меньшей мере 69% (мол.%) или по меньшей мере 70% (мол.%) от содержания жирных кислот в общем содержании неполярных липидов в вегетирующей части растения, нечеловеческом организме или его части, или в семенах, или в липидах или масле, экстрагированных из них, предпочтительно, фракции TAG, представляет собой олеиновую кислоту. Такие высокие содержания олеиновой кислоты предпочтительны для использования в биодизельных применениях.
В другом варианте реализации содержание PUFA в вегетирующей части растения или нечеловеческом организме или его части, или в семенах увеличивается (например, в присутствии MGAT) или уменьшается (например, в отсутствие MGAT), по сравнению с соответствующей вегетирующей частью растения или нечеловеческим организмом или его частью, или семенами. В этом контексте содержание PUFA включает как эстерифицированные PUFA (в том числе TAG, DAG и так далее) и не эстерифицированные PUFA. В одном варианте реализации содержание PUFA в вегетирующей части растения или нечеловеческом организме или его части, или в семенах предпочтительно определяется по количеству PUFA в экстрагируемых липидах вегетирующей части растения или нечеловеческого организма или его части, или семян. Степень увеличения содержания PUFA может быть такой, как описано в характеристике (i). Содержание PUFA может включать EDA, ARA, ALA, SDA, ETE, ETA, EPA, DPA, DHA или комбинацию двух или более из них.
В другом варианте реализации концентрация PUFA в вегетирующей части растения, нечеловеческом организме или его части, или в семенах, или в липидах или масле, экстрагированных из них, увеличивается или уменьшается по сравнению с соответствующей вегетирующей частью растения, нечеловеческим организмом или его частью, или семенами, или липидами или маслом, экстрагированными из них. PUFA может представлять собой EDA, ARA, ALA, SDA, ETE, ETA, EPA, DPA, DHA или комбинацию двух или более из них. Степень увеличения PUFA может быть такой, как описано в характеристике (i).
В другом варианте реализации концентрация жирных кислот в экстрагированных липидах или масле увеличивается по сравнению с липидами, экстрагированными из соответствующей вегетирующей части растения или нечеловеческого организма или его части, или из семян, и при этом указанная жирная кислота содержит гидроксильную группу, эпокси-группу, циклопропановую группу, двойную углерод-углеродную связь, тройную углерод-углеродную связь, сопряженные двойные связи, разветвленную цепь, такую как метилированная или гидроксилированная разветвленная цепь, или комбинацию двух или более из них, или любые две, три, четыре, пять или шесть из вышеупомянутых групп, связей или разветвленных цепей. Степень увеличения жирных кислот может быть такой, как описано в характеристике (i).
В одном варианте реализации концентрация одного или более неполярных липидов (таких как TAG, DAG, TAG и DAG, MAG, PUFA или определенной PUFA, или определенной жирной кислоты), и/или общее содержание неполярных липидов определяется анализом с использованием газовой хроматографии метиловых эфиров жирных кислот, полученных из экстрагированных липидов. Альтернативные способы определения любой из этих концентраций известны в данной области техники и включают способы, которые не требуют экстракции липидов из организма или его части, например, анализ по ближней инфракрасной (БИК) спектроскопии или ядерному магнитному резонансу (ЯМР).
В дополнительном варианте реализации концентрация одного или более неполярных липидов и/или общее содержание неполярных липидов в вегетирующей части растения или нечеловеческом организме или его части, или в семенах по меньшей мере на 0,5% больше в пересчете на сухой вес или вес семян и/или по меньшей мере на 1% больше в относительном выражении, предпочтительно по меньшей мере на 1% или 2% больше в пересчете на сухой вес или вес семян, чем в соответствующей вегетирующей части растения или нечеловеческом организме или его части, или в семенах, не содержащих одного или нескольких экзогенных полинуклеотидов, но содержащих экзогенный полинуклеотид, кодирующий DGAT1 Arabidopsis thaliana (SEG ID NO:83).
В дополнительном варианте реализации вегетирующая часть растения или нечеловеческий организм или его часть, или семена дополнительно содержат (i) одну или более внедренных мутаций и/или (ii) экзогенный полинуклеотид, который понижающе регулирует выработку и/или активность эндогенного фермента вегетирующей части растения или нечеловеческого организма или его части, указанный эндогенный фермент выбран из ацилтрансферазы жирных кислот, такой как DGAT, sn-1 глицерин-3-фосфат-ацилтрансфераза (sn-1 GPAT), 1-ацил-глицерин-3-фосфат-ацилтрансфераза (LPAAT), ацил-CoA:лизофосфатидилхолин-ацилтрансфераза (LPCAT), фосфатаза фосфатидной кислоты (PAP), фермента, участвующего в биосинтезе крахмала, такого как (АДФ)-глюкоза-пирофосфорилаза (АГФаза), десатуразы жирных кислот, такой как десатураза жирных кислот Δ12 (FAD2), полипептида, участвующего в разложении липидов и/или который снижает содержание липидов, такого как липаза, такая как полипептид CGi58 или сахарозависимая триацилглицерин-липаза 1, или комбинации двух или более из них. В альтернативном варианте реализации вегетирующая часть растения или нечеловеческий организм или его часть не содержит (i), описанную выше, или не содержит (ii), описанную выше, или не содержит (i), описанную выше, и не содержит (ii), описанную выше. В одном варианте реализации экзогенный полинуклеотид, который понижающе регулирует выработку АГФазы, не представляет собой полинуклеотид, описанный в публикации Sanjaya et al. (2011). В одном варианте реализации экзогенные полинуклеотиды в вегетирующей части растения или нечеловеческом организме или его части, или в семенах, не состоят из экзогенного полинуклеотида, кодирующего WRI1, и экзогенного полинуклеотида, кодирующего молекулу РНК, которая ингибирует экспрессию гена, кодирующего АГФазу.
В способе первого или второго аспектов вегетирующая часть растения или нечеловеческий организм или его часть, или семена, или экстрагированные липиды или масло, дополнительно определены в предпочтительных вариантах реализации. Следовательно, в одном варианте реализации применима одна или более, или все из следующих характеристик:
(i) олеиновая кислота составляет по меньшей мере 20% (мол.%), по меньшей мере 22% (мол.%), по меньшей мере 30% (мол.%), по меньшей мере 40% (мол.%), по меньшей мере 50% (мол.%) или по меньшей мере 60% (мол.%), предпочтительно по меньшей мере 65% (мол.%) или по меньшей мере 66% (мол.%) от общего содержания жирных кислот в неполярных липидах или масле вегетирующей части растения, нечеловеческого организма или его части, или в семенах,
ii) олеиновая кислота составляет по меньшей мере 20% (мол.%), по меньшей мере 22% (мол.%), по меньшей мере 30% (мол.%), по меньшей мере 40% (мол.%), по меньшей мере 50% (мол.%) или по меньшей мере 60% (мол.%), предпочтительно по меньшей мере 65% (мол.%) или по меньшей мере 66% (мол.%) от общего содержания жирных кислот в экстрагированных липидах или масле,
(iii) неполярные липиды или масло в вегетирующей части растения, нечеловеческом организме или его части, или в семенах, содержат жирную кислоту, которая содержит гидроксильную группу, эпокси-группу, циклопропановую группу, двойную углерод-углеродную связь, тройную углерод-углеродную связь, сопряженные двойные связи, разветвленную цепь, такую как метилированная или гидроксилированная разветвленная цепь, или комбинацию двух или более из них, или любые две, три, четыре, пять или шесть из вышеупомянутых групп, связей или разветвленных цепей, и
(iv) экстрагированные липиды или масло содержат жирную кислоту, которая содержит гидроксильную группу, эпокси-группу, циклопропановую группу, двойную углерод-углеродную связь, тройную углерод-углеродную связь, сопряженные двойные связи, разветвленную цепь, такую как метилированная или гидроксилированная разветвленная цепь, или комбинацию двух или более из них, или любые две, три, четыре, пять или шесть из вышеупомянутых групп, связей или разветвленных цепей. Состав жирных кислот в этом варианте реализации измеряют до какой-либо модификации состава жирных кислот, такой как, например, фракционирование экстрагированных липидов или масла для изменения состава жирных кислот. В предпочтительных вариантах реализации степень увеличения является такой, как описано в характеристике (i).
В одном варианте реализации концентрация липидов в вегетирующей части растения, нечеловеческом организме или его части, или в семенах, и/или в экстрагированных липидах или масле может быть определена анализом с помощью газовой хроматографии метиловых эфиров жирных кислот, полученных из экстрагированных липидов или масла. Указанный способ анализа предпочтительно является таким, как описано в Примере 1 настоящего документа.
Снова в отношении первого или второго аспектов, в настоящем изобретении представлен один или более экзогенных полинуклеотидов в вегетирующей части растения или нечеловеческом организме или его части, или в семенах, используемых в указанном способе. Следовательно, в одном варианте реализации вегетирующая часть растения или нечеловеческий организм или его часть, или семена содержат первый экзогенный полинуклеотид, который кодирует РНК или предпочтительно полипептид фактора транскрипции, который увеличивает экспрессию одного или более гликолитических или жирнокислотных биосинтетических генов в вегетирующей части растения или нечеловеческом организме или его части, или в семенах, соответственно, и второй экзогенный полинуклеотид, который кодирует РНК или полипептид, участвующий в биосинтезе одного или более неполярных липидов, причем и первый, и второй экзогенный полинуклеотиды функционально связаны с промотором, который может направлять экспрессию полинуклеотида в вегетирующей части растения или нечеловеческом организме или его части, или в семенах, соответственно. То есть первый и второй экзогенные полинуклеотиды кодируют различные факторы, которые вместе обеспечивают увеличение содержания неполярных липидов в вегетирующей части растения или нечеловеческом организме или его части, или в семенах.
Это увеличение предпочтительно является аддитивным, более предпочтительно синергетическим, по сравнению с присутствием либо только первого, либо только второго экзогенного полинуклеотида. Факторы, кодируемые первым и вторым полинуклеотидами, действуют по разным механизмам. Предпочтительно, полипептид фактора транскрипции увеличивает доступность субстратов для синтеза неполярных липидов, как, например, увеличение глицерин-3-фосфата и/или жирных кислот, предпочтительно в форме ацил-CoA, за счет увеличения экспрессии генов, например, по меньшей мере 5 или по меньшей мере 8 генов, участвующих в гликолизе или биосинтезе жирных кислот (таких как, но не ограничиваясь этим, одна или более из ACCазы, транспортеров сахарозы (SuSy, инвертазы клеточных стенок), кетоацил-синтазы (KAS), фосфофруктокиназы (PFK), пируват-киназы (PK) (например, (At5g52920, At3g22960), пируват-дегидрогеназа, транспортеры гексозы (например, GPT2 и PPT1), цитозольная фруктокиназа, цитозольная фосфоглицерат-мутаза, еноил-ACP-редуктаза (At2g05990) и фосфоглицерат-мутаза (At1g22170)), предпочтительно более одного гена для каждой категории. В одном варианте реализации первый экзогенный полинуклеотид кодирует фактор транскрипции Wrinkled 1 (WRI1), фактор транскрипции Leafy Cotyledon 1 (Lec1), фактор транскрипции Leafy Cotyledon 2 (LEC2), фактор транскрипции Fus3, фактор транскрипции ABI3, фактор транскрипции Dof4, фактор транскрипции BABY BOOM (BBM) или фактор транскрипции Dof11. В одном варианте реализации LEC2 не представляет собой LEC2 Arabidopsis. Как часть этого варианта реализации или самостоятельно, второй экзогенный полинуклеотид может кодировать полипептид, обладающий активностью ацилтрансферазы жирных кислот, например, активностью моноацилглицерин-ацилтренсферазы (MGAT) и/или активностью диацилглицерин-ацилтрансферазы (DGAT), или активностью глицерин-3-фосфат-ацилтрансферазы (GPAT). В одном варианте реализации DGAT не представляет собой DGAT Arabidopsis.
В предпочтительном варианте реализации вегетирующая часть растения или нечеловеческий организм или его часть, или семена первого или второго аспектов настоящего изобретения содержат два или более экзогенных полинуклеотида (-ов), один из которых кодирует полипептид фактора транскрипции, который увеличивает экспрессию одного или более гликолитических или жирнокислотных биосинтетических генов в вегетирующей части растения или нечеловеческом организме или его части, или в семенах, таких как фактор транскрипции Wrinkled 1 (WRI1), а второй из них кодирует полипептид, участвующий в биосинтезе одного или более неполярных липидов, таких как DGAT.
В одном варианте реализации вегетирующая часть растения, нечеловеческий организм или его часть, или семена первого или второго аспектов настоящего изобретения могут дополнительно содержать третий или более экзогенный полинуклеотид (-ы). Третий или более экзогенный полинуклеотид (-ы) может кодировать одно или более, или любую комбинацию из следующих:
i) дополнительную РНК или полипептид фактора транскрипции, который увеличивает экспрессию одного или более гликолитических или жирнокислотных биосинтетических генов в нечеловеческом организме или его части (например, если первый экзогенный полинуклеотид кодирует фактор транскрипции Wrinkled 1 (WRI1), то третий экзогенный полинуклеотид может кодировать LEC2 или фактор транскрипции BBM (предпочтительно, экспрессия LEC2 или BBM контролируется индуцибельным промотором или промотором, который не приводит к высоким концентрациям трансгенной экспрессии),
ii) дополнительную РНК или полипептид, участвующий в биосинтезе одного или более неполярных липидов (например, если второй экзогенный полинуклеотид кодирует DGAT, то третий экзогенный полинуклеотид может кодировать MGAT или GPAT, или могут присутствовать два дополнительных экзогенных полинуклеотида, кодирующих MGAT и GPAT),
iii) полипептид, который стабилизирует один или более неполярных липидов, предпочтительно олеозин, такой как полиолеозин или калеозин, более предпочтительно полиолеозин,
iv) молекулу РНК, которая ингибирует экспрессию гена, кодирующего полипептид, участвующий в биосинтезе крахмала, такой как полипептид АГФазы,
v) молекулу РНК, которая ингибирует экспрессию гена, кодирующего полипептид, участвующий в разложении липидов, и/или который снижает содержание липидов, такой как липаза, такая как полипептид CGi58 или сахарозависимая триацилглицерин-липаза 1, или
vi) полипептид молчащего супрессора,
при этом третий или более экзогенный полинуклеотид (-ы) функционально связан с промотором, который может направлять экспрессию полинуклеотида (-ов) в вегетирующей части растения или нечеловеческом организме или его части, или в семенах, соответственно.
В настоящем документе показан также ряд конкретных комбинаций генов, эффективных для увеличения содержания неполярных липидов. Следовательно, в отношении способа первого или второго аспектов настоящего изобретения, в одном варианте реализации, вегетирующая часть растения или нечеловеческий организм или его часть, или семена содержат один или более экзогенный полинуклеотид (-ов), которые кодируют:
i) фактор транскрипции Wrinkled 1 (WRI1) и DGAT,
ii) фактор транскрипции WRI1 и DGAT, и олеозин,
iii) фактор транскрипции WRI1, DGAT, MGAT и олеозин,
iv) моноацилглицерин-ацилтрансферазу (MGAT),
v) диацилглицерин-ацилтрансферазу 2 (DGAT2),
vi) MGAT и глицерин-3-фосфат-ацилтрансферазу (GPAT),
vii) MGAT и DGAT,
viii) MGAT, GPAT и DGAT,
ix) фактор транскрипции WRI1 и MGAT,
x) фактор транскрипции WRI1, DGAT и MGAT,
xi) фактор транскрипции WRI1, DGAT, MGAT, олеозин и GPAT,
xii) DGAT и олеозин, или
xiii) MGAT и олеозин, и
xiv) необязательно полипептид молчащего супрессора,
где каждый из одного или более экзогенного полинуклеотида (-ов) функционально связан с промотором, который может направлять экспрессию полинуклеотида в вегетирующей части растения или нечеловеческом организме или его части, или в семенах, соответственно. Предпочтительно, один или более экзогенных полинуклеотидов устойчиво интегрированы в геном вегетирующей части растения или нечеловеческого организма или его части, или семян, и более предпочтительно существуют в гомозиготном состоянии. Полинуклеотид может кодировать фермент, имеющий аминокислотную последовательность, которая является такой же, что и последовательность природного фермента, например, растительного, дрожжевого или животного происхождения. Дополнительно, полинуклеотид может кодировать фермент, имеющий одну или более консервативных мутаций, по сравнению с природным ферментом.
В одном варианте реализации,
(i) GPAT также обладает активностью фосфатазы для выработки MAG, такой как полипептид, имеющий аминокислотную последовательность GPAT4 или GPAT6 Arabidopsis, и/или
(ii) DGAT представляет собой DGAT1 или DGAT2, и/или
(iii) MGAT представляет собой MGAT1 или MGAT2.
В предпочтительном варианте реализации вегетирующая часть растения, нечеловеческий организм или его часть, или семена содержат первый экзогенный полинуклеотид, кодирующий WRI1, и второй экзогенный полинуклеотид, кодирующий DGAT, предпочтительно DGAT1.
В другом предпочтительном варианте реализации вегетирующая часть растения, нечеловеческий организм или его часть, или семена содержат первый экзогенный полинуклеотид, кодирующий WRI1, второй экзогенный полинуклеотид, кодирующий DGAT, предпочтительно DGAT1, и третий экзогенный полинуклеотид, кодирующий олеозин.
В дополнительном варианте реализации вегетирующая часть растения, нечеловеческий организм или его часть, или семена содержат первый экзогенный полинуклеотид, кодирующий WRI1, второй экзогенный полинуклеотид, кодирующий DGAT, предпочтительно DGAT1, третий экзогенный полинуклеотид, кодирующий олеозин, и четвертый экзогенный полинуклеотид, кодирующий MGAT, предпочтительно MGAT2.
В дополнительном варианте реализации вегетирующая часть растения, нечеловеческий организм или его часть, или семена содержат первый экзогенный полинуклеотид, кодирующий WRI1, второй экзогенный полинуклеотид, кодирующий DGAT, предпочтительно DGAT1, третий экзогенный полинуклеотид, кодирующий олеозин, и четвертый экзогенный полинуклеотид, кодирующий LEC2 или BBM.
В дополнительном варианте реализации вегетирующая часть растения, нечеловеческий организм или его часть, или семена содержат первый экзогенный полинуклеотид, кодирующий WRI1, второй экзогенный полинуклеотид, кодирующий DGAT, предпочтительно DGAT1, третий экзогенный полинуклеотид, кодирующий олеозин, четвертый экзогенный полинуклеотид, кодирующий MGAT, предпочтительно MGAT2, и пятый экзогенный полинуклеотид, кодирующий LEC2 или BBM.
В дополнительном варианте реализации вегетирующая часть растения, нечеловеческий организм или его часть, или семена содержат первый экзогенный полинуклеотид, кодирующий WRI1, второй экзогенный полинуклеотид, кодирующий DGAT, предпочтительно DGAT1, третий экзогенный полинуклеотид, кодирующий олеозин, и четвертый экзогенный полинуклеотид, кодирующий молекулу РНК, которая ингибирует экспрессию гена, кодирующего липазу, такую как полипептид CGi58.
В дополнительном варианте реализации вегетирующая часть растения, нечеловеческий организм или его часть, или семена содержат первый экзогенный полинуклеотид, кодирующий WRI1, второй экзогенный полинуклеотид, кодирующий DGAT, предпочтительно DGAT1, третий экзогенный полинуклеотид, кодирующий олеозин, четвертый экзогенный полинуклеотид, кодирующий молекулу РНК, которая ингибирует экспрессию гена, кодирующего липазу, такую как полипептид CGi58, и пятый экзогенный полинуклеотид, кодирующий LEC2 или BBM.
В дополнительном варианте реализации вегетирующая часть растения, нечеловеческий организм или его часть, или семена содержат первый экзогенный полинуклеотид, кодирующий WRI1, второй экзогенный полинуклеотид, кодирующий DGAT, предпочтительно DGAT1, третий экзогенный полинуклеотид, кодирующий олеозин, четвертый экзогенный полинуклеотид, кодирующий молекулу РНК, которая ингибирует экспрессию гена, кодирующего липазу, такую как полипептид CGi58, и пятый экзогенный полинуклеотид, кодирующий MGAT, предпочтительно MGAT2.
В дополнительном варианте реализации вегетирующая часть растения, нечеловеческий организм или его часть, или семена содержат первый экзогенный полинуклеотид, кодирующий WRI1, второй экзогенный полинуклеотид, кодирующий DGAT, предпочтительно DGAT1, третий экзогенный полинуклеотид, кодирующий олеозин, четвертый экзогенный полинуклеотид, кодирующий молекулу РНК, которая ингибирует экспрессию гена, кодирующего липазу, такую как полипептид CGi58, пятый экзогенный полинулеотид, кодирующий MGAT, предпочтительно MGAT2, и шестой экзогенный полинуклеотид, кодирующий LEC2 или BBM.
В одном варианте реализации семена содержат первый экзогенный полинуклеотид, кодирующий WRI1, второй экзогенный полинуклеотид, кодирующий DGAT, предпочтительно DGAT1, третий экзогенный полинуклеотид, кодирующий олеозин, и четвертый экзогенный полинуклеотид, кодирующий MGAT, предпочтительно MGAT2. Предпочтительно, семена дополнительно содержат пятый экзогенный полинуклеотид, кодирующий GPAT.
В соответствующих случаях вместо полинуклеотида, кодирующего молекулу РНК, которая ингибирует экспрессию гена, кодирующего липазу, такую как полипептид CGi58, вегетирующая часть растения, нечеловеческий организм или его часть, или семена содержат одну или более внедренных мутаций в гене липазы, таком как ген CGi58, который обеспечивает сниженные концентрации полипептида липазы, по сравнению с соответствующей вегетирующей частью растения, нечеловеческим организмом или его часть, или семенами, не имеющими мутации.
В предпочтительном варианте реализации экзогенные полинуклеотиды, кодирующие DGAT и олеозин, функционально связаны с конститутивным промотором или промотором, активным в зеленых тканях растения по меньшей мере до и вплоть до цветения, который может направлять экспрессию полинуклеотидов в вегетирующей части растения, нечеловеческом организме или его части, или в семенах. В дополнительном предпочтительном варианте реализации экзогенный полинуклеотид, кодирующий WRI1, молекулу РНК, которая ингибирует экспрессию гена, кодирующего липазу, такую как полипептид CGi58, функционально связан с конститутивным промотором, промотором, активным в зеленых тканях растения по меньшей мере до и вплоть до цветения, или с индуцибельным промотором, который может направлять экспрессию полинуклеотидов в вегетирующей части растения, нечеловеческом организме или его части, или в семенах. В дополнительном предпочтительно варианте реализации экзогенные полинуклеотиды, кодирующие LEC2, BBM и/или MGAT2, функционально связаны с индуцибельным промотором, который может направлять экспрессию полинуклеотидов в вегетирующей части растения, нечеловеческом организме или его части, или в семенах.
В каждом из представленных выше вариантов реализации полинуклеотиды могут быть представлены в виде отдельных молекул или могут быть представлены в виде одной непрерывной молекулы, как на одной молекуле Т-ДНК. В одном варианте реализации ориентация транскрипции по меньшей мере одного гена на молекуле Т-ДНК является противоположной к ориентации транскрипции по меньшей мере одного другого гена на молекуле Т-ДНК.
В каждом из представленных выше вариантов реализации общее содержание неполярных липидов вегетирующей части растения или нечеловеческого организма или его части, или семян, предпочтительно листьев растений или их части, стебля или клубней составляет по меньшей мере около 3%, более предпочтительно по меньшей мере около 5%, предпочтительно по меньшей мере около 7%, более предпочтительно по меньшей мере около 10%, более предпочтительно по меньшей мере около 11%, более предпочтительно по меньшей мере около 12%, более предпочтительно по меньшей мере около 13%, более предпочтительно по меньшей мере около 14% или более предпочтительно по меньшей мере около 15% (масс./масс., сухой вес). В дополнительном предпочтительном варианте реализации общее содержание неполярных липидов составляет от 5% до 25%, от 7% до 25%, от 10% до 25%, от 12% до 25%, от 15% до 25%, от 7% до 20%, от 10% до 20%, от 10% до 15%, от 15% до 20%, от 20% до 25%, около 10%, около 11%, около 12%, около 13%, около 14%, около 15%, около 16%, около 17%, около 18%, около 20% или около 22%, каждое значение в процентах от сухого веса или веса семян. В особенно предпочтительном варианте реализации вегетирующая часть растения представляет собой лист (или листья) или их часть. В более предпочтительном варианте реализации вегетирующая часть растения представляет собой часть листьев, имеющую площадь поверхности по меньшей мере 1 см2.
Далее, в каждом из представленных выше вариантов реализации общее содержание TAG вегетирующей части растения или нечеловеческого организма или его части, или семян, предпочтительно листьев растения или их части, стебля или клубня составляет по меньшей мере около 3%, более предпочтительно по меньшей мере около 5%, предпочтительно по меньшей мере около 7%, более предпочтительно по меньшей мере около 10%, более предпочтительно по меньшей мере около 11%, более предпочтительно по меньшей мере около 12%, более предпочтительно по меньшей мере около 13%, более предпочтительно по меньшей мере около 14%, более предпочтительно по меньшей мере около 15% или более предпочтительно по меньшей мере около 17% (масс./масс., сухой вес). В дополнительном предпочтительном варианте реализации общее содержание TAG составляет от 5% до 30%, от 7% до 30%, от 10% до 30%, от 12% до 30%, от 15% до 30%, от 7% до 30%, от 10% до 30%, от 20% до 28%, от 18% до 25%, от 22% до 30%, около 10%, около 11%, около 12%, около 13%, около 14%, около 15%, около 16%, около 17%, около 18%, около 20% или около 22%, каждое значение в процентах от сухого веса или веса семян. В особенно предпочтительном варианте реализации вегетирующая часть растения представляет собой лист (или листья) или их часть. В более предпочтительном варианте реализации вегетирующая часть растения представляет собой часть листьев, имеющую площадь поверхности по меньшей мере 1 см2.
Далее, в каждом из представленных выше вариантов реализации общее содержание липидов вегетирующей части растения или нечеловеческого организма или его части, или семян, предпочтительно листьев растения или их части, стебля или клубня составляет по меньшей мере около 3%, более предпочтительно по меньшей мере около 5%, предпочтительно по меньшей мере около 7%, более предпочтительно по меньшей мере около 10%, более предпочтительно по меньшей мере около 11%, более предпочтительно по меньшей мере около 12%, более предпочтительно по меньшей мере около 13%, более предпочтительно по меньшей мере около 14%, более предпочтительно по меньшей мере около 15%, более предпочтительно по меньшей мере около 17% (масс./масс., сухой вес), более предпочтительно по меньшей мере около 20%, более предпочтительно по меньшей мере около 25%. В дополнительном предпочтительном варианте реализации общее содержание липидов составляет от 5% до 35%, от 7% до 35%, от 10% до 35%, от 12% до 35%, от 15% до 35%, от 7% до 35%, от 10% до 20%, от 18% до 28%, от 20% до 28%, от 22% до 28%, около 10%, около 11%, около 12%, около 13%, около 14%, около 15%, около 16%, около 17%, около 18%, около 20%, около 22% или около 25%, каждое значение в процентах от сухого веса. Как правило, общее содержание липидов вегетирующей части растения или нечеловеческого организма или его части на 2-3% выше, чем содержание неполярных липидов. В особенно предпочтительном варианте реализации вегетирующая часть растения представляет собой лист (или листья) или их часть. В более предпочтительном варианте реализации вегетирующая часть растения представляет собой часть листьев, имеющую площадь поверхности по меньшей мере 1 см2.
В одном варианте реализации вегетирующая часть растения, нечеловеческий организм или его часть, или семена, предпочтительно вегетирующая часть растения, содержит первый экзогенный полинуклеотид, кодирующий WRI1, второй экзогенный полинуклеотид, кодирующий DGAT, предпочтительно DGAT1, третий экзогенный полинуклеотид, кодирующий MGAT, предпочтительно MGAT2, и четвертый экзогенный полинуклеотид, кодирующий олеозин, при этом вегетирующая часть растения, нечеловеческий организм или его часть, или семена обладают одной или более, или всеми из следующих характеристик:
i) общее содержание липидов составляет по меньшей мере 8%, по меньшей мере 10%, по меньшей мере 12%, по меньшей мере 14% или по меньшей мере 15,5% (масс. %),
ii) по меньшей мере в 3 раза, по меньшей мере в 5 раз, по меньшей мере в 7 раз, по меньшей мере в 8 раз или по меньшей мере в 10 раз более высокое общее содержание липидов в вегетирующей части растения или нечеловеческом организме, по сравнению с соответствующей вегетирующей частью растения или нечеловеческим организмом, не содержащим экзогенных полинуклеотидов,
iii) общее содержание TAG составляет по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 6,5% или по меньшей мере 7% (масс. % в пересчете на сухой вес или вес семян),
iv) по меньшей мере в 40 раз, по меньшей мере в 50 раз, по меньшей мере в 60 раз или по меньшей мере в 70 раз, или по меньшей мере в 100 раз более высокое общее содержание TAG, по сравнению с соответствующей вегетирующей частью растения или нечеловеческим организмом, не содержащим экзогенных полинуклеотидов,
v) олеиновая кислота составляет по меньшей мере 15%, по меньшей мере 19% или по меньшей мере 22 масс. % от жирных кислот в TAG,
vi) по меньшей мере в 10 раз, по меньшей мере в 15 раз или по меньшей мере в 17 раз более высокая концентрация олеиновой кислоты в TAG, по сравнению с соответствующей вегетирующей частью растения или нечеловеческим организмом, не содержащим экзогенных полинуклеотидов,
vii) пальмитиновая кислота составляет по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30% или по меньшей мере 33 масс. % от жирных кислот в TAG,
viii) по меньшей мере в 1,5 раза более высокая концентрация пальмитиновой кислоты в TAG, по сравнению с соответствующей вегетирующей частью растения или нечеловеческим организмом, не содержащим экзогенных полинуклеотидов,
ix) линолевая кислота составляет по меньшей мере 22%, по меньшей мере 25%, по меньшей мере 30% или по меньшей мере 34 масс. % от жирных кислот в TAG,
x) α-линоленовая кислота составляет менее 20%, менее 15%, менее 11% или менее 8 масс. % от жирных кислот в TAG, и
xi) по меньшей мере в 5 раз или по меньшей мере в 8 раз более низкая концентрация α-линоленовой кислоты в TAG, по сравнению с соответствующей вегетирующей частью растения или нечеловеческим организмом, не содержащим экзогенных полинуклеотидов. В этом варианте реализации, предпочтительно вегетирующая часть растения по меньшей мере обладает характеристикой (-ами) i), ii), iii), iv), i) и ii), i) и iii), i) и iv), i) - iii), i), iii) и iv), i) - iv), ii) и iii), ii) и iv), ii) - iv) или iii) и iv). В одном варианте реализации % от сухого веса представляет собой % от сухого веса листьев.
В дополнительном варианте реализации вегетирующая часть растения, нечеловеческий организм или его часть, или семена, предпочтительно вегетирующая часть растения содержит первый экзогенный полинуклеотид, кодирующий WRI1, второй экзогенный полинуклеотид, кодирующий DGAT, предпочтительно DGAT1, третий экзогенный полинуклеотид, кодирующий олеозин, при этом вегетирующая часть растения, нечеловеческий организм или его часть, или семена обладают одной или более, или всеми из следующих характеристик:
i) общее содержание TAG составляет по меньшей мере 10%, по меньшей мере 12,5%, по меньшей мере 15% или по меньшей мере 17% (масс. % от сухого веса или от веса семян),
ii) по меньшей мере в 40 раз, по меньшей мере в 50 раз, по меньшей мере в 60 раз или по меньшей мере в 70 раз, или по меньшей мере в 100 раз более высокое общее содержание TAG в вегетирующей части растения или нечеловеческом организме, по сравнению с соответствующей вегетирующей частью растения или нечеловеческим организмом, не содержащим экзогенных полинуклеотидов,
iii) олеиновая кислота составляет по меньшей мере 19%, по меньшей мере 22% или по меньшей мере 25 масс. % от жирных кислот в TAG,
iv) по меньшей мере в 10 раз, по меньшей мере в 15 раз, по меньшей мере в 17 раз или по меньшей мере в 19 раз более высокая концентрация олеиновой кислоты в TAG в вегетирующей части растения или нечеловеческом организме, по сравнению с соответствующей вегетирующей частью растения или нечеловеческим организмом, не содержащим экзогенных полинуклеотидов,
v) пальмитиновая кислота составляет по меньшей мере 20%, по меньшей мере 25% или по меньшей мере 28 масс. % от жирных кислот в TAG,
vi) по меньшей мере в 1,25 раза более высокая концентрация пальмитиновой кислоты в TAG в вегетирующей части растения или нечеловеческом организме, по сравнению с соответствующей вегетирующей частью растения или нечеловеческим организмом, не содержащим экзогенных полинуклеотидов,
vii) линолевая кислота составляет по меньшей мере 15% или по меньшей мере 20% (% по весу) от жирных кислот в TAG,
viii) α-линоленовая кислота составляет менее 15%, менее 11% или менее 8 масс. % от жирных кислот в TAG, и
ix) по меньшей мере в 5 раз или по меньшей мере в 8 раз более низкая концентрация α-линоленовой кислоты в TAG в вегетирующей части растения или нечеловеческом организме, по сравнению с соответствующей вегетирующей частью растения или нечеловеческим организмом, не содержащим экзогенных полинуклеотидов. В этом варианте реализации, предпочтительно вегетирующая часть растения по меньшей мере обладает характеристикой (-ами) i), ii) или i) и ii). В одном варианте реализации % сухого веса представляет собой % от сухого веса листьев.
Предпочтительно, указанные характеристики для двух представленных выше вариантов реализации являются таковыми на стадии цветения растения.
В альтернативном варианте реализации вегетирующая часть растения, нечеловеческий организм или его часть, или листья состоят из одного или более экзогенных полинуклеотидов, кодирующих DGAT1 и LEC2.
В предпочтительном варианте реализации экзогенный полинуклеотид, кодирующий WRI1, содержит одно или более из следующих:
i) нуклеотиды, последовательность которых представлена ниже как любая из SEQ ID NO: 231-278,
ii) нуклеотиды, кодирующие полипептид, содержащий аминокислоты, последовательность которых представлена ниже как любая из SEQ ID NO: 279-337, или их биологически активный фрагмент,
iii) нуклеотиды, последовательность которых по меньшей мере на 30% идентична i) или ii), и
iv) нуклеотиды, которые гибридизуются с любым из i) - iii) при жестких условиях.
В предпочтительном варианте реализации экзогенный полинуклеотид, кодирующий DGAT, содержит одно или более из следующих:
i) нуклеотиды, последовательность которых представлена далее как любая из SEQ ID NO: 204-211, 338-346,
ii) нуклеотиды, кодирующие полипептид, содержащий аминокислоты, последовательность которых представлена далее как любая из SEQ ID NO: 83, 212-219, 347-355, или их биологически активный фрагмент,
iii) нуклеотиды, последовательность которых по меньшей мере на 30% идентична i) или ii), и
iv) полинуклеотид, который гибридизуется с любым из i) - iii) при жестких условиях.
В другом предпочтительном варианте реализации экзогенный полинуклеотид, кодирующий MGAT, содержит одно или более из следующих:
i) нуклеотиды, последовательность которых представлена далее как любая из SEQ ID NO: 1-44,
ii) нуклеотиды, кодирующие полипептид, содержащий аминокислоты, последовательность которых представлена далее как любая из SEQ ID NO: 45-82 или их биологически активный фрагмент,
iii) нуклеотиды, последовательность которых по меньшей мере на 30% идентична i) или ii), и
iv) полинуклеотид, который гибридизуется с любым из i) - iii) при жестких условиях.
В другом предпочтительном варианте реализации экзогенный полинуклеотид, кодирующий GPAT, содержит одно или более из следующих:
i) нуклеотиды, последовательность которых представлена далее как любая из SEQ ID NO: 84-143,
ii) нуклеотиды, кодирующие полипептид, содержащий аминокислоты, последовательность которых представлена далее как любая из SEQ ID NO: 144-203 или их биологически активный фрагмент,
iii) нуклеотиды, последовательность которых по меньшей мере на 30% идентична i) или ii), и
iv) полинуклеотид, который гибридизуется с любым из i) - iii) при жестких условиях.
В другом предпочтительном варианте реализации экзогенный полинуклеотид, кодирующий DGAT2, содержит одно или более из следующих:
i) нуклеотиды, последовательность которых представлена далее как любая из SEQ ID NO: 204-211,
ii) нуклеотиды, кодирующие полипептид, содержащий аминокислоты, последовательность которых представлена далее как любая из SEQ ID NO: 212-219 или их биологически активный фрагмент,
iii) нуклеотиды, последовательность которых по меньшей мере на 30% идентична i) или ii), и
iv) полинуклеотид, который гибридизуется с любым из i) - iii) при жестких условиях.
В другом предпочтительном варианте реализации экзогенный полинуклеотид, кодирующий олеозин, содержит одно или более из следующих:
i) нуклеотиды, последовательность которых представлена далее как любая из SEQ ID NO: 389-408,
ii) нуклеотиды, кодирующие полипептид, содержащий аминокислоты, последовательность которых представлена далее как любая из SEQ ID NO: 362-388 или их биологически активный фрагмент,
iii) нуклеотиды, последовательность которых по меньшей мере на 30% идентична i) или ii), и
iv) полинуклеотид, который гибридизуется с любым из i) - iii) при жестких условиях.
В одном варианте реализации полипептид CGi58 содержит одно или более из следующих:
i) нуклеотиды, последовательность которых представлена далее как любая из SEQ ID NO: 422-428,
ii) нуклеотиды, кодирующие полипептид, содержащий аминокислоты, последовательность которых представлена далее как любая из SEQ ID NO: 429-436 или их биологически активный фрагмент,
iii) нуклеотиды, последовательность которых по меньшей мере на 30% идентична i) или ii), и
iv) полинуклеотид, который гибридизуется с любым из i) - iii) при жестких условиях.
В другом варианте реализации экзогенный полинуклеотид, кодирующий LEC2, содержит одно или более из следующих:
i) нуклеотиды, последовательность которых представлена далее как любая из SEQ ID NO: 437-439,
ii) нуклеотиды, кодирующие полипептид, содержащий аминокислоты, последовательность которых представлена далее как любая из SEQ ID NO: 442-444 или их биологически активный фрагмент,
iii) нуклеотиды, последовательность которых по меньшей мере на 30% идентична i) или ii), и
iv) полинуклеотид, который гибридизуется с любым из i) - iii) при жестких условиях.
В дополнительном варианте реализации экзогенный полинуклеотид, кодирующий BBM, содержит одно или более из следующих:
i) нуклеотиды, последовательность которых представлена далее как любая из SEQ ID NO: 440 или 441,
ii) нуклеотиды, кодирующие полипептид, содержащий аминокислоты, последовательность которых представлена далее как любая из SEQ ID NO: 445 или 446, или их биологически активный фрагмент,
iii) нуклеотиды, последовательность которых по меньшей мере на 30% идентична i) или ii), и
iv) полинуклеотид, который гибридизуется с любым из i) - iii) при жестких условиях.
Понятно, что последовательности, предпочтительные в одном варианте реализации, могут быть комбинированы с последовательностями, предпочтительными в другом варианте реализации, и более преимущественно могут быть дополнительно комбинированы с последовательностью, предпочтительной в совсем другом варианте реализации.
В одном варианте реализации один или более экзогенных полинуклеотидов кодируют мутантный MGAT и/или DGAT, и/или GPAT. Например, один или более экзогенных полинуклеотидов могут кодировать MGAT и/или DGAT, и/или GPAT, имеющий одно или более одного замещения консервативной аминокислоты, как показано на примере в Таблице 1, по сравнению с диким типом MGAT и/или DGAT, и/или GPAT, определенных представленными в настоящем документе SEQ ID NO. Предпочтительно, мутантный полипептид имеет эквивалентную или более высокую активность, по сравнению с немутантным полипептидом.
В одном варианте реализации вегетирующая часть растения, нечеловеческий организм или его часть, или семена содержат первый экзогенный полинуклеотид, который кодирует MGAT, и второй экзогенный полинуклеотид, который кодирует GPAT. Первый и второй полинуклеотиды могут быть представлены как отдельные молекулы или могут быть представлены в виде одной непрерывной молекулы, как на одной молекуле Т-ДНК. В одном варианте реализации ориентация транскрипции по меньшей мере одного гена на молекуле Т-ДНК является противоположной к ориентации транскрипции по меньшей мере одного другого гена на молекуле Т-ДНК. В предпочтительном варианте реализации GPAT представляет собой GPAT, обладающий активностью фосфатазы, такой как GPAT4 или GPAT6 Arabidopsis. GPAT, обладающий активностью фосфатазы, действует как катализатор образования MAG из G-3-P (то есть ацилирует G-3-P в форму LPA, а затем снимает фосфатную группу с образованием MAG) в нечеловеческом организме или его части. Затем MGAT действует как катализатор образования DAG в нечеловеческом организме или его части за счет ацилирования MAG ацильной группой, полученной из жирного ацил-CoA. MGAT, такой как MGAT1 A. thaliana может также действовать как катализатор образования TAG в нечеловеческом организме или его части, если он обладает также активностью DGAT.
Вегетирующая часть растения, нечеловеческий организм или его часть, или семена могут содержать третий экзогенный полинуклеотид, кодирующий, например, DGAT. Первый, второй и третий полинуклеотиды могут быть представлены как отдельные молекулы или могут быть представлены в виде одной непрерывной молекулы, как на одной молекуле Т-ДНК. DGAT действует как катализатор образования TAG в трансгенной вегетирующей части растения, нечеловеческом организме или его части, или в семенах за счет ацилирования DAG (предпочтительно образованного по пути MGAT) ацильной группой, полученной из жирного ацил-CoA. В одном варианте реализации ориентация транскрипции по меньшей мере одного гена молекулы Т-ДНК является противоположной к ориентации транскрипции по меньшей мере одного другого гена на молекуле Т-ДНК.
В другом варианте реализации вегетирующая часть растения, нечеловеческий организм или его часть, или семена содержат первый экзогенный полинуклеотид, который кодирует MGAT, и второй экзогенный полинуклеотид, который кодирует DGAT. Первый и второй полинуклеотиды могут быть представлены как отдельные молекулы или могут быть представлены в виде одной непрерывной молекулы, как на одной молекуле Т-ДНК. В одном варианте реализации ориентация транскрипции по меньшей мере одного гена на молекуле Т-ДНК является противоположной к ориентации транскрипции по меньшей мере одного другого гена на молекуле Т-ДНК. Вегетирующая часть растения, нечеловеческий организм или его часть, или семена могут содержать третий экзогенный полинуклеотид, кодирующий, например, GPAT, предпочтительно GPAT, обладающий активностью фосфатазы, такой как GPAT4 или GPAT6 Arabidopsis. Первый, второй и третий полинуклеотиды могут быть представлены как отдельные молекулы или могут быть представлены в виде одной непрерывной молекулы.
Далее, активность эндогенного гена в растении, вегетирующей части растения или нечеловеческом организме или его части, или в семенах, может понижающе регулироваться. Следовательно, в одном варианте реализации вегетирующая часть растения, нечеловеческий организм или его часть, или семена, содержат одно или более из:
(i) одна или более внедренных мутаций в гене, который кодирует эндогенный фермент растения, вегетирующей части растения, нечеловеческого организма или его части, или семян, соответственно, или
(ii) экзогенный полинуклеотид, который понижающе регулирует выработку и/или активность эндогенного фермента растения, вегетирующей части растения, нечеловеческого организма или его части, или семян, соответственно,
при этом каждый эндогенный фермент выбран из группы, состоящей из ацилтрансферазы жирных кислот, такой как DGAT, sn-1 глицерин-3-фосфат-ацилтрансфераза (sn-1 GPAT), 1-ацил-глицерин-3-фосфат-ацилтрансфераза (LPAAT), ацил-CoA:лизофосфатидилхолин-ацилтрансфераза (LPCAT), фосфатаза фосфатидной кислоты (PAP), фермента, участвующего в биосинтезе крахмала, такого как (АДФ)-глюкоза-пирофосфорилаза (АГФаза), десатуразы жирных кислот, такой как десатураза жирных кислот Δ12 (FAD2), полипептида, участвующего в разложении липидов и/или который снижает содержание липидов, такого как липаза, такая как полипептид CGi58 или сахарозависимая триацилглицерин-липаза 1, или комбинации двух или более из них. В одном варианте реализации экзогенный полинуклеотид выбран из группы, состоящей из антисмыслового полинуклеотида, смыслового полинуклеотида, каталитического полинуклеотида, микроРНК, полинуклеотида, который кодирует полипептид, который связывается с эндогенным ферментом, двухцепочечной молекулы РНК или процессированной молекулы РНК, полученной из нее. В одном варианте реализации экзогенный полинуклеотид, который понижающе регулирует выработку АГФазы, не представляет собой полинуклеотид, описанный в публикации Sanjaya et al. (2011). В одном варианте реализации экзогенные полинуклеотиды в вегетирующей части растения или нечеловеческом организме или его части, или в семенах не состоят из экзогенного полинуклеотида, кодирующего WRI1, и экзогенного полинуклеотида, кодирующего молекулу РНК, которая ингибирует экспрессию гена, кодирующего АГФазу.
Увеличение концентрации неполярных липидов важно для применений, подразумевающих определенные жирные кислоты. Поэтому в одном варианте реализации общие неполярные липиды, экстрагированные липиды или масло содержат:
(i) неполярный липид, который представляет собой TAG, DAG, TAG и DAG или MAG, и
(ii) определенную PUFA, которая представляет собой EDA, ARA, SDA, ETE, ETA, EPA, DPA, DHA, при этом определенная PUFA содержится в концентрации по меньшей мере 1% от общего содержания жирных кислот в неполярных липидах, или комбинацию двух или более из определенных PUFA, или
(iii) жирную кислоту, которая содержится в концентрации по меньшей мере 1% от общего содержания жирных кислот в неполярных липидах и которая содержит гидроксильную группу, эпокси-группу, циклопропановую группу, двойную углерод-углеродную связь, тройную углерод-углеродную связь, сопряженные двойные связи, разветвленную цепь, такую как метилированная или гидроксилированная разветвленная цепь, или комбинацию двух или более из них, или любые две, три, четыре, пять или шесть из вышеупомянутых групп, связей или разветвленных цепей.
В третьем аспекте настоящего изобретения представлены нечеловеческие организмы, предпочтительно растения или их части, такие как вегетирующие части растения или семена, которые применимы в способах первого и второго аспектов или в следующих аспектах, описанных далее в настоящем документе. Каждая из характеристик в вариантах реализации, описанных для первого и второго аспектов, может быть применена mutatis mutandis к нечеловеческим организмам, предпочтительно растениям или их частям, таким как вегетирующие части растений или семена, третьего аспекта. Конкретные варианты реализации выделены ниже.
В одном варианте реализации третьего аспекта в настоящем изобретении представлено растение, содержащее вегетирующую часть, или его вегетирующая часть, причем указанная вегетирующая часть имеет общее содержание неполярных липидов по меньшей мере около 3%, более предпочтительно по меньшей мере около 5%, предпочтительно по меньшей мере около 7%, более предпочтительно по меньшей мере около 10%, более предпочтительно по меньшей мере около 11%, более предпочтительно по меньшей мере около 12%, более предпочтительно по меньшей мере около 13%, более предпочтительно по меньшей мере около 14% или более предпочтительно по меньшей мере около 15% (масс./масс., сухой вес). В дополнительном предпочтительном варианте реализации общее содержание неполярных липидов составляет от 5% до 25%, от 7% до 25%, от 10% до 25%, от 12% до 25%, от 15% до 25%, от 7% до 20%, от 10% до 20%, около 10%, около 11%, около 12%, около 13%, около 14%, около 15%, около 16%, около 17%, около 18%, около 20% или около 22%, каждое значение в процентах от сухого веса. В особенно предпочтительном варианте реализации вегетирующая часть растения представляет собой лист (или листья) или его часть. В более предпочтительном варианте реализации вегетирующая часть растения представляет собой часть листьев, имеющих площадь поверхности по меньшей мере 1 см2. В дополнительном варианте реализации неполярные липиды содержат по меньше мере 90% триацилглицеринов (TAG). Предпочтительно растение представляет собой плодородное, морфологически нормальное и/или агротехнически пригодное растение. Семена растения предпочтительно прорастают практически с такой же скоростью, что и соответствующее растение дикого типа. Предпочтительно, вегетирующая часть представляет собой листья или стебли, или комбинацию этих двух частей, или корни, или клубни, такие как, например, клубни картофеля.
В другом варианте реализации нечеловеческий организм, предпочтительно растение или его часть, такая как вегетирующая часть растения или семена, содержит один или более экзогенных полинуклеотидов, как описано в настоящем документе, и имеет повышенную концентрацию одного или более неполярных липидов, и/или общее содержание неполярных липидов, которое по меньшей мере в 2 раза, по меньшей мере в 3 раза, по меньшей мере в 4 раза, по меньшей мере в 5 раз, по меньшей мере в 6 раз, по меньшей мере в 7 раз, по меньшей мере в 8 раз, по меньшей мере в 9 раз, по меньшей мере в 10 раз или по меньшей мере в 12 раз, предпочтительно по меньшей мере примерно в 13 раз или по меньшей мере примерно в 15 раз выше в относительном выражении, чем в соответствующем нечеловеческом организме, предпочтительно растении или его части, такой как вегетирующая часть растения или семена, не содержащих одного или более экзогенных полинуклеотидов.
В одном варианте реализации настоящего изобретения представлено растение канола, содержащее семена канолы, содержание масла в которых составляет по меньшей мере 45% в весовом выражении. Предпочтительно, растение канола или его семена обладают характеристиками, описанными в первом и втором аспектах настоящего изобретения.
В одном варианте реализации настоящего изобретения представлено растение кукуруза, содержащее семена кукурузы, содержание масла в которых составляет по меньшей мере 5% в весовом выражении. Предпочтительно, растение кукуруза или его семена обладают характеристиками, описанными в первом и втором аспектах настоящего изобретения.
В одном варианте реализации настоящего изобретения представлено растение соя, содержащее семена сои, содержание масла в которых составляет по меньшей мере 20% в весовом выражении. Предпочтительно, растение соя или его семена обладают характеристиками, описанными в первом и втором аспектах настоящего изобретения.
В одном варианте реализации настоящего изобретения представлено растение люпин, содержащее семена люпина, содержание масла в которых составляет по меньшей мере 10% в весовом выражении. Предпочтительно, растение люпин или его семена обладают характеристиками, описанными в первом и втором аспектах настоящего изобретения.
В одном варианте реализации настоящего изобретения представлено растение арахис, содержащее арахисовые орехи, содержание масла в которых составляет по меньшей мере 50% в весовом выражении. Предпочтительно, растение арахис или его семена обладают характеристиками, описанными в первом и втором аспектах настоящего изобретения.
В одном варианте реализации настоящего изобретения представлено растение подсолнечник, содержащее семена подсолнечника, содержание масла в которых составляет по меньшей мере 50% в весовом выражении. Предпочтительно, растение подсолнечник или его семена обладают характеристиками, описанными в первом и втором аспектах настоящего изобретения.
В одном варианте реализации настоящего изобретения представлено растение хлопок, содержащее семена хлопка, содержание масла в которых составляет по меньшей мере 41% в весовом выражении. Предпочтительно, растение хлопок или его семена обладают характеристиками, описанными в первом и втором аспектах настоящего изобретения.
В одном варианте реализации настоящего изобретения представлено растение сафлор, содержащее семена сафлора, содержание масла в которых составляет по меньшей мере 35% в весовом выражении. Предпочтительно, растение сафлор или его семена обладают характеристиками, описанными в первом и втором аспектах настоящего изобретения.
В одном варианте реализации настоящего изобретения представлено растение лен, содержащее семена льна, содержание масла в которых составляет по меньшей мере 36% в весовом выражении. Предпочтительно, растение лен или его семена обладают характеристиками, описанными в первом и втором аспектах настоящего изобретения.
В одном варианте реализации настоящего изобретения представлено растение Camelina sativa, содержащее Camelina sativa, содержание масла в которых составляет по меньшей мере 36% в весовом выражении. Предпочтительно, растение Camelina sativa или его семена обладают характеристиками, описанными в первом и втором аспектах настоящего изобретения.
В вариантах реализации растения могут быть дополнительно определенных по характеристикам (i), (ii) и (iii), описанными выше в настоящем документе. В предпочтительном варианте реализации растение или вегетирующая часть растения обладает одной или более, или всеми из следующих характеристик:
(i) олеиновая кислота в вегетирующей части или семенах растения, указанная олеиновая кислота существует в экстерифицированной или не эстерифицированной форме, причем по меньшей мере 20% (мол.%), по меньшей мере 22% (мол.%), по меньшей мере 30% (мол.%), по меньшей мере 40% (мол.%), по меньшей мере 50% (мол.%) или по меньшей мере 60% (мол.%), предпочтительно по меньшей мере 65% (мол.%) или по меньшей мере 66% (мол.%) от общей концентрации жирных кислот в содержании липидов в вегетирующей части или в семенах представляет собой олеиновую кислоту,
(ii) олеиновая кислота в вегетирующей части или семенах растения, указанная олеиновая кислота существует в эстерифицированной форме в неполярных липидах, причем по меньшей мере 20% (мол.%), по меньшей мере 22% (мол.%), по меньшей мере 30% (мол.%), по меньшей мере 40% (мол.%), по меньшей мере 50% (мол.%) или по меньшей мере 60% (мол.%), предпочтительно по меньшей мере 65% (мол.%) или по меньшей мере 66% (мол.%) от общей концентрации жирных кислот в содержании неполярных липидов в вегетирующей части или в семенах представляет собой олеиновую кислоту,
(iii) модифицированная жирная кислота в вегетирующей части или семенах растения, указанная модифицированная жирная кислота находится в эстерифицированной или не эстерифицированной форме, предпочтительно в эстерифицированной форме в неполярных липидах вегетирующей части или семян, причем указанная модифицированная жирная кислота содержит гидроксильную группу, эпокси-группу, циклопропановую группу, двойную углерод-углеродную связь, тройную углерод-углеродную связь, сопряженные двойные связи, разветвленную цепь, такую как метилированная или гидроксилированная разветвленная цепь, или комбинацию двух или более из них, или любые две, три, четыре, пять или шесть из вышеупомянутых групп, связей или разветвленных цепей, и
(iv) воски и/или восковые эфиры в неполярных липидах вегетирующей части или семян растения.
В одном варианте реализации растение или вегетирующая часть растения представляет собой члена популяции или совокупности по меньшей мере из 1000 таких растений или частей. То есть каждое растение или часть растения в популяции или совокупности обладает практически такими же свойствами или содержит такие же экзогенные нуклеиновые кислоты, что и другие члены популяции или совокупности. Предпочтительно, растения являются гомозиготными для экзогенных полинулкеотидов, что обеспечивает определенную степень однородности. Предпочтительно, растения выращивают в поле. Совокупность вегетирующих частей растения предпочтительно собирают из растений, растущих в поле. Предпочтительно, вегетирующие части растения собирают в то время, когда выход неполярных липидов является наивысшим. В одном варианте реализации вегетирующие части растения собирают примерно во время цветения. В другом варианте реализации вегетирующие части растения собирают, когда растения находятся в возрасте по меньшей мере около 1 месяца. В другом варианте реализации вегетирующие части растения собирают примерно от времени цветения примерно до времени начала увядания. В другом варианте реализации вегетирующие части растения собирают по меньшей мере примерно через 1 месяц после инициации экспрессии индуцибельных генов.
В дополнительном варианте реализации третьего аспекта настоящего изобретения представлена вегетирующая часть растения, нечеловеческий организм или его часть, или семена, содержащие один или более экзогенный полинуклеотид (-ов) и повышенную концентрацию одного или более неполярного липида (-ов) относительно соответствующей вегетирующей части растения, нечеловеческого организма или его части, или семян, не содержащих одного или более экзогенного полинуклеотида (-ов), причем каждый из одного или более экзогенных полинуклеотидов функционально связан с промотором, который может направлять экспрессию полинуклеотида в вегетирующей части растения, нечеловеческом организме или его части, или в семенах, и при этом применима одна или более, или все из следующих характеристик:
(i) один или более экзогенный полинуклеотид (-ы) включают первый экзогенный полинкулеотид, который кодирует РНК или полипептид фактора транскрипции, который увеличивает экспрессию одного или более гликолитических или жирнокислотных биосинтетических генов в вегетирующей части растения, нечеловеческом организме или его части, или в семенах, и второй экзогенный полинуклеотид, который кодирует РНК или полипептид, участвующий в биосинтезе одного или более неполярных липидов,
(ii) если нечеловеческий организм представляет собой растение, то вегетирующая часть растения имеет общее содержание неполярных липидов по меньшей мере около 3%, более предпочтительно по меньшей мере около 5%, предпочтительно по меньшей мере около 7%, более предпочтительно по меньшей мере около 10%, более предпочтительно по меньшей мере 11%, более предпочтительно по меньшей мере около 12%, более предпочтительно по меньшей мере около 13%, более предпочтительно по меньшей мере около 14% или более предпочтительно по меньшей мере около 15% (масс./масс., сухой вес),
(iii) нечеловеческий организм представляет собой водоросли, выбранные из группы, состоящей из диатомовых водорослей (бациллариофиты), зеленых водорослей (хлорофиты), сине-зеленых водорослей (цианофиты), золотисто-коричневых водорослей (хризофиты), гаптофитов, коричневых водорослей и гетероконтных водорослей,
(iv) неполярный липид (-ы) содержит жирную кислоту, которая содержит гидроксильную группу, эпокси-группу, циклопропановую группу, двойную углерод-углеродную связь, тройную углерод-углеродную связь, сопряженные двойные связи, разветвленную цепь, такую как метилированная или гидроксилированная разветвленная цепь, или комбинацию двух или более из них, или любые две, три, четыре, пять или шесть из вышеупомянутых групп, связей или разветвленных цепей,
(v) вегетирующая часть растения, нечеловеческий организм или его часть, или семена, содержащие олеиновую кислоту в эстерифицированной или не эстерифицированной форме в его липидах, при этом по меньшей мере 20% (мол.%), по меньшей мере 22% (мол.%), по меньшей мере 30% (мол.%), по меньшей мере 40% (мол.%), по меньшей мере 50% (мол.%) или по меньшей мере 60% (мол.%), предпочтительно по меньшей мере 65% (мол.%) или по меньшей мере 66% (мол.%) от общего содержания жирных кислот в липидах вегетирующей части растения, нечеловеческого организма или его части, или в семян представляет собой олеиновую кислоту,
(vi) вегетирующая часть растения, нечеловеческий организм или его часть, или семена содержат олеиновую кислоту в эстерифицированной форме в его неполярных липидах, при этом по меньшей мере 20% (мол.%), по меньшей мере 22% (мол.%), по меньшей мере 30% (мол.%), по меньшей мере 40% (мол.%), по меньшей мере 50% (мол.%) или по меньшей мере 60% (мол.%), предпочтительно по меньшей мере 65% (мол.%) или по меньшей мере 66% (мол.%) от общего содержания жирных кислот в неполярных липидах вегетирующей части растения, нечеловеческого организма или его части, или семян представляет собой олеиновую кислоту,
(vii) общее содержание жирных кислот в липидах вегетирующей части растения, нечеловеческого организма или его части, или семян составляет по меньшей мере на 2% больше олеиновой кислоты и/или по меньшей мере на 2% меньше пальмитиновой кислоты, чем в липидах в соответствующей вегетирующей части растения, нечеловеческом организме или его части, или в семенах, не содержащих одного или более экзогенных полинуклеотидов, и/или
(viii) общее содержание жирных кислот в неполярных липидах вегетирующей части растения, нечеловеческого организма или его части, или семян составляет по меньшей мере на 2% больше олеиновой кислоты и/или по меньшей мере на 2% меньше пальмитиновой кислоты, чем в неполярных липидах в соответствующей вегетирующей части растения, нечеловеческом организме или его части, или в семенах, не содержащих одного или более экзогенных полинуклеотидов,
(ix) неполярный липид (-ы) содержит измененную концентрацию общих стеролов, предпочтительно свободных стеролов, стероиловых эфиров и/или стероил-гликозидов,
(x) неполярный липид (-ы) содержит воски и/или восковые эфиры, и
(xi) нечеловеческий организм или его часть представляет собой одного члена популяции или совокупности по меньшей мере примерно из 1000 таких нечеловеческих организмов или их частей.
В одном варианте реализации один или более экзогенный полинуклеотид (-ов) содержит первый экзогенный полинуклеотид и второй экзогенный полинуклеотид, и при этом применима одна или более, или все из характеристик (ii)-(xi).
В одном варианте реализации описанной выше (ii) общее содержание неполярных липидов составляет от 5% до 25%, от 7% до 25%, от 10% до 25%, от 12% до 25%, от 15% до 25%, от 7% до 20%, от 10% до 20%, около 10%, около 11%, около 12%, около 13%, около 14%, около 15%, около 16%, около 17%, около 18%, около 20% или около 22%, каждое значение в процентах от сухого веса. В более предпочтительном варианте реализации вегетирующая часть растения представляет собой часть листьев, имеющих площадь поверхности по меньшей мере 1 см2.
В предпочтительных вариантах реализации нечеловеческий организм или его часть представляет собой растение, водоросли или организм, подходящий для ферментации, такой как грибы. Часть нечеловеческого организма может быть семенами, фруктами или вегетирующей частью растения, такой как надземная часть растения или зеленая часть, такая как лист или стебель. В другом варианте реализации указанная часть представляет собой клетку многоклеточного организма. В отношении части нечеловеческого организма, указанная часть содержит по меньшей мере одну клетку нечеловеческого организма. В дополнительных предпочтительных вариантах реализации нечеловеческий организм или его часть дополнительно определяется характеристиками, описанными в любом из вариантов реализации, описанных в первом и втором аспектах настоящего изобретения, включая, но не ограничиваясь этим, характеристики (i), (ii) и (iii), а экзогенные полинуклеотиды или комбинации экзогенных полинуклеотидов являются такими, как описано в любом из вариантов реализации, описанных в первом и втором аспектах настоящего изобретения.
В одном варианте реализации растение, вегетирующая часть растения, нечеловеческий организм или его часть, или семена содержат один или более экзогенных полинуклеотидов, которые кодируют:
i) фактор транскрипции Wrinkled 1 (WRI1) и DGAT,
ii) фактор транскрипции WRI1 и DGAT, и олеозин,
iii) фактор транскрипции WRI1, DGAT, MGAT и олеозин,
iv) моноацилглицерин-ацилтрансферазу (MGAT),
v) диацилглицерин-ацилтрансферазу 2 (DGAT2),
vi) MGAT и глицерин-3-фосфат-ацилтрансферазу (GPAT),
vii) MGAT и DGAT,
viii) MGAT, GPAT и DGAT,
ix) фактор транскрипции WRI1 и MGAT,
x) фактор транскрипции WRI1, DGAT и MGAT,
xi) фактор транскрипции WRI1, DGAT, MGAT, олеозин и GPAT,
xii) DGAT и олеозин, или
xiii) MGAT и олеозин, и
xiv) необязательно полипептид молчащего супрессора,
при этом каждый экзогенный полинуклеотид функционально связан с промотором, который может направлять экспрессию полинуклеотида в растении, вегетирующей части растения, нечеловеческом организме или его части, или в семенах, соответственно. Один или более экзогенных полинуклеотидов могут содержать нуклеотиды, последовательность которых определена в настоящем документе. Предпочтительно, растение, вегетирующая часть растения, нечеловеческий организм или его часть, или семена являются гомозиготными для одного или более экзогенных полинуклеотидов. Предпочтительно, экзогенные полинуклеотиды интегрированы в геном растения, вегетирующей части растения, нечеловеческого организма или его части, или семян. Один или более полинуклеотидов могут быть представлены как отдельные молекулы или могут быть представлены в виде одной непрерывной молекулы. Предпочтительно, экзогенные полинуклеотиды интегрированы в геном растения или организма в одном генетическом локусе или генетически связанных локусах, более предпочтительно в гомозиготном состоянии. Более предпочтительно, интегрированные экзогенные полинуклеотиды генетически связаны с селектируемым маркерным геном, таким как гербицидостойкий ген.
В предпочтительном варианте реализации вегетирующая часть растения, нечеловеческий организм или его часть, или семена содержат первый экзогенный полинуклеотид, кодирующий WRI1, и второй экзогенный полинуклеотид, кодирующий DGAT, предпочтительно DGAT1.
В другом предпочтительном варианте реализации вегетирующая часть растения, нечеловеческий организм или его часть, или семена содержат первый экзогенный полинуклеотид, кодирующий WRI1, второй экзогенный полинуклеотид, кодирующий DGAT, предпочтительно DGAT1, и третий экзогенный полинуклеотид, кодирующий олеозин.
В дополнительном варианте реализации вегетирующая часть растения, нечеловеческий организм или его часть, или семена содержат первый экзогенный полинуклеотид, кодирующий WRI1, второй экзогенный полинуклеотид, кодирующий DGAT, предпочтительно DGAT1, третий экзогенный полинуклеотид, кодирующий олеозин, и четвертый экзогенный полинуклеотид, кодирующий MGAT, предпочтительно MGAT2.
В дополнительном варианте реализации вегетирующая часть растения, нечеловеческий организм или его часть, или семена содержат первый экзогенный полинуклеотид, кодирующий WRI1, второй экзогенный полинуклеотид, кодирующий DGAT, предпочтительно DGAT1, третий экзогенный полинуклеотид, кодирующий олеозин, и четвертый экзогенный полинуклеотид, кодирующий LEC2 или BBM.
В дополнительном варианте реализации вегетирующая часть растения, нечеловеческий организм или его часть, или семена содержат первый экзогенный полинуклеотид, кодирующий WRI1, второй экзогенный полинуклеотид, кодирующий DGAT, предпочтительно DGAT1, третий экзогенный полинуклеотид, кодирующий олеозин, четвертый экзогенный полинуклеотид, кодирующий MGAT, предпочтительно MGAT2, и пятый экзогенный полинуклеотид, кодирующий LEC2 или BBM.
В дополнительном варианте реализации вегетирующая часть растения, нечеловеческий организм или его часть, или семена содержат первый экзогенный полинуклеотид, кодирующий WRI1, второй экзогенный полинуклеотид, кодирующий DGAT, предпочтительно DGAT1, третий экзогенный полинуклеотид, кодирующий олеозин, и четвертый экзогенный полинуклеотид, кодирующий молекулу РНК, которая ингибирует экспрессию гена, кодирующего липазу, такую как полипептид CGi58.
В дополнительном варианте реализации вегетирующая часть растения, нечеловеческий организм или его часть, или семена содержат первый экзогенный полинуклеотид, кодирующий WRI1, второй экзогенный полинуклеотид, кодирующий DGAT, предпочтительно DGAT1, третий экзогенный полинуклеотид, кодирующий олеозин, четвертый экзогенный полинуклеотид, кодирующий молекулу РНК, которая ингибирует экспрессию гена, кодирующего липазу, такую как полипептид CGi58, и пятый экзогенный полинуклеотид, кодирующий LEC2 или BBM.
В дополнительном варианте реализации вегетирующая часть растения, нечеловеческий организм или его часть, или семена содержат первый экзогенный полинуклеотид, кодирующий WRI1, второй экзогенный полинуклеотид, кодирующий DGAT, предпочтительно DGAT1, третий экзогенный полинуклеотид, кодирующий олеозин, четвертый экзогенный полинуклеотид, кодирующий молекулу РНК, которая ингибирует экспрессию гена, кодирующего липазу, такую как полипептид CGi58, и пятый экзогенный полинуклеотид, кодирующий MGAT, предпочтительно MGAT2.
В дополнительном варианте реализации вегетирующая часть растения, нечеловеческий организм или его часть, или семена содержат первый экзогенный полинуклеотид, кодирующий WRI1, второй экзогенный полинуклеотид, кодирующий DGAT, предпочтительно DGAT1, третий экзогенный полинуклеотид, кодирующий олеозин, четвертый экзогенный полинуклеотид, кодирующий молекулу РНК, которая ингибирует экспрессию гена, кодирующего липазу, такую как полипептид CGi58, пятый экзогенный полинулеотид, кодирующий MGAT, предпочтительно MGAT2, и шестой экзогенный полинуклеотид, кодирующий LEC2 или BBM.
В одном варианте реализации семена содержат первый экзогенный полинуклеотид, кодирующий WRI1, второй экзогенный полинуклеотид, кодирующий DGAT, предпочтительно DGAT1, третий экзогенный полинуклеотид, кодирующий олеозин, и четвертый экзогенный полинуклеотид, кодирующий MGAT, предпочтительно MGAT2. Предпочтительно, семена дополнительно содержат пятый экзогенный полинуклеотид, кодирующий GPAT.
В соответствующих случаях вместо полинуклеотида, кодирующего молекулу РНК, которая ингибирует экспрессию гена, кодирующего липазу, такую как полипептид CGi58, вегетирующая часть растения, нечеловеческий организм или его часть, или семена содержат одну или более внедренных мутаций в гене липазы, таком как ген CGi58, который обеспечивает сниженные концентрации полипептида липазы, по сравнению с соответствующей вегетирующей частью растения, нечеловеческим организмом или его часть, или семенами, не имеющими мутации.
В предпочтительном варианте реализации экзогенные полинуклеотиды, кодирующие DGAT и олеозин, функционально связаны с конститутивным промотором или промотором, активным в зеленых тканях растения по меньшей мере до и вплоть до цветения, который может направлять экспрессию полинуклеотидов в вегетирующей части растения, нечеловеческом организме или его части, или в семенах. В дополнительном предпочтительном варианте реализации экзогенный полинуклеотид, кодирующий WRI1, молекулу РНК, которая ингибирует экспрессию гена, кодирующего липазу, такую как полипептид CGi58, функционально связан с конститутивным промотором, промотором, активным в зеленых тканях растения по меньшей мере до и вплоть до цветения, или с индуцибельным промотором, который может направлять экспрессию полинуклеотидов в вегетирующей части растения, нечеловеческом организме или его части, или в семенах. В дополнительном предпочтительно варианте реализации экзогенные полинуклеотиды, кодирующие LEC2, BBM и/или MGAT2, функционально связаны с индуцибельным промотором, который может направлять экспрессию полинуклеотидов в вегетирующей части растения, нечеловеческом организме или его части, или в семенах.
В каждом из представленных выше вариантов реализации общее содержание неполярных липидов в вегетирующей части растения или нечеловеческом организме или его части, или в семенах, предпочтительно в листьях растения или их частях, стеблях или клубнях составляет по меньшей мере около 3%, более предпочтительно по меньшей мере около 5%, предпочтительно по меньшей мере около 7%, более предпочтительно по меньшей мере около 10%, более предпочтительно по меньшей мере около 11%, более предпочтительно по меньшей мере около 12%, более предпочтительно по меньшей мере около13%, более предпочтительно по меньшей мере около 14% или более предпочтительно по меньшей мере около 15% (масс./масс., сухой вес или вес семян). В дополнительном предпочтительном варианте реализации общее содержание неполярных липидов составляет от 5% до 25%, от 7% до 25%, от 10% до 25%, от 12% до 25%, от 15% до 25%, от 7% до 20%, от 10% до 20%, от 10% до 15%, от 15% до 20%, от 20% до 25%, около 10%, около 11%, около 12%, около 13%, около 14%, около 15%, около 16%, около 17%, около 18%, около 20% или около 22%, каждое значение в процентах от сухого веса или веса семян. В особенно предпочтительном варианте реализации вегетирующая часть растения представляет собой лист (или листья) или его часть. В более предпочтительном варианте реализации вегетирующая часть растения представляет собой часть листьев, имеющих площадь поверхности по меньшей мере 1 см2.
Далее, в каждом из представленных выше вариантов реализации общее содержание TAG в вегетирующей части растения или нечеловеческом организме или его части, или в семенах, предпочтительно в листьях растения или их части, стеблях или клубнях поставляет по меньшей мере около 3%, более предпочтительно по меньшей мере около 5%, предпочтительно по меньшей мере около 7%, более предпочтительно по меньшей мере около 10%, более предпочтительно по меньшей мере около 11%, более предпочтительно по меньшей мере около 12%, более предпочтительно по меньшей мере около 13% или более предпочтительно по меньшей мере около 14%, более предпочтительно по меньшей мере около 15% или более предпочтительно по меньшей мере около 17% (масс./масс., сухой вес или вес семян). В дополнительном предпочтительном варианте реализации общее содержание TAG составляет от 5% до 30%, от 7% до 30%, от 10% до 30%, от 12% до 30%, от 15% до 30%, от 7% до 30%, от 10% до 30%, от 20% до 28%, от 18% до 25%, от 22% до 30%, около 10%, около 11%, около 12%, около 13%, около 14%, около 15%, около 16%, около 17%, около 18%, около 20% или около 22%, каждое значение в процентах от сухого веса или веса семян. В особенно предпочтительном варианте реализации вегетирующая часть растения представляет собой лист (или листья) или его часть. В более предпочтительном варианте реализации вегетирующая часть растения представляет собой часть листьев, имеющих площадь поверхности по меньшей мере 1 см2.
Далее, в каждом из представленных выше вариантов реализации общее содержание липидов в вегетирующей части растения или нечеловеческом организме или его части, или в семенах, предпочтительно в листьях растения или их части, стеблях или клубнях составляет по меньшей мере около 3%, более предпочтительно по меньшей мере около 5%, предпочтительно по меньшей мере около 7%, более предпочтительно по меньшей мере около 10%, более предпочтительно по меньшей мере около 11%, более предпочтительно по меньшей мере около 12%, более предпочтительно по меньшей мере около 13%, более предпочтительно по меньшей мере около 14%, более предпочтительно по меньшей мере около 15%, более предпочтительно по меньшей мере около 17% (масс./масс., сухой вес или вес семян), более предпочтительно по меньшей мере около 20%, более предпочтительно по меньшей мере около 25%. В дополнительном предпочтительном варианте реализации общее содержание липидов составляет от 5% до 35%, от 7% до 35%, от 10% до 35%, от 12% до 35%, от 15% до 35%, от 7% до 35%, от 10% до 20%, от 18% до 28%, от 20% до 28%, от 22% до 28%, около 10%, около 11%, около 12%, около 13%, около 14%, около 15%, около 16%, около 17%, около 18%, около 20%, около 22% или около 25%, каждое значение в процентах от сухого веса или веса семян. Как правило, общее содержание липидов в вегетирующей части растения или нечеловеческом организме или его части примерно на 2-3% выше, чем содержание неполярных липидов. В особенно предпочтительном варианте реализации вегетирующая часть растения представляет собой лист (или листья) или его часть. В более предпочтительном варианте реализации вегетирующая часть растения представляет собой часть листьев, имеющих площадь поверхности по меньшей мере 1 см2.
В одном варианте реализации вегетирующая часть растения, нечеловеческий организм или его часть, или семена, предпочтительно вегетирующая часть растения содержит первый экзогенный полинуклеотид, кодирующий WRI1, второй экзогенный полинуклеотид, кодирующий DGAT, предпочтительно DGAT1, третий экзогенный полинуклеотид, кодирующий MGAT, предпочтительно MGAT2, и четвертый экзогенный полинуклеотид, кодирующий олеозин, при этом вегетирующая часть растения, нечеловеческий организм или его часть, или семена обладают одной или более, или всеми из следующих характеристик:
i) общее содержание липидов составляет по меньшей мере 8%, по меньшей мере 10%, по меньшей мере 12%, по меньшей мере 14% или по меньшей мере 15,5% (масс. % от сухого веса или веса семян),
ii) по меньшей мере в 3 раза, по меньшей мере в 5 раз, по меньшей мере в 7 раз, по меньшей мере в 8 раз или по меньшей мере в 10 раз более высокое общее содержание липидов в вегетирующей части растения или нечеловеческом организме, по сравнению с соответствующей вегетирующей частью растения или нечеловеческим организмом, не содержащим экзогенных полинуклеотидов,
iii) общее содержание TAG составляет по меньшей мере 5%, по меньшей мере 6%, по меньшей мере 6,5% или по меньшей мере 7% (масс. % от сухого веса или веса семян),
iv) по меньшей мере в 40 раз, по меньшей мере в 50 раз, по меньшей мере в 60 раз или по меньшей мере в 70 раз, или по меньшей мере в 100 раз более высокое общее содержание TAG, по сравнению с соответствующей вегетирующей частью растения или нечеловеческим организмом, не содержащим экзогенных полинуклеотидов,
v) олеиновая кислота составляет по меньшей мере 15%, по меньшей мере 19% или по меньшей мере 22 масс. % от жирных кислот в TAG,
vi) по меньшей мере в 10 раз, по меньшей мере в 15 раз или по меньшей мере в 17 раз более высокая концентрация олеиновой кислоты в TAG, по сравнению с соответствующей вегетирующей частью растения или нечеловеческим организмом, не содержащим экзогенных полинуклеотидов,
vii) пальмитиновая кислота составляет по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30% или по меньшей мере 33 масс. % от жирных кислот в TAG,
viii) по меньшей мере в 1,5 раза более высокая концентрация пальмитиновой кислоты в TAG, по сравнению с соответствующей вегетирующей частью растения или нечеловеческим организмом, не содержащим экзогенных полинуклеотидов,
ix) линолевая кислота составляет по меньшей мере 22%, по меньшей мере 25%, по меньшей мере 30% или по меньшей мере 34 масс. % от жирных кислот в TAG,
x) α-линоленовая кислота составляет менее 20%, менее 15%, менее 11% или менее 8 масс. % от жирных кислот в TAG, и
xi) по меньшей мере в 5 раз или по меньшей мере в 8 раз более низкая концентрация α-линоленовой кислоты в TAG, по сравнению с соответствующей вегетирующей частью растения или нечеловеческим организмом, не содержащим экзогенных полинуклеотидов. В этом варианте реализации, предпочтительно вегетирующая часть растения по меньшей мере обладает характеристикой (-ами) i), ii), iii), iv), i) и ii), i) и iii), i) и iv), i) - iii), i), iii) и iv), i) - iv), ii) и iii), ii) и iv), ii) - iv) или iii) и iv). В одном варианте реализации % от сухого веса представляет собой % от сухого веса листьев.
В дополнительном варианте реализации вегетирующая часть растения, нечеловеческий организм или его часть, или семена, предпочтительно вегетирующая часть растения содержит первый экзогенный полинуклеотид, кодирующий WRI1, второй экзогенный полинуклеотид, кодирующий DGAT, предпочтительно DGAT1, третий экзогенный полинуклеотид, кодирующий олеозин, при этом вегетирующая часть растения, нечеловеческий организм или его часть, или семена обладают одной или более, или всеми из следующих характеристик:
i) общее содержание TAG составляет по меньшей мере 10%, по меньшей мере 12,5%, по меньшей мере 15% или по меньшей мере 17% (масс. % от сухого веса или от веса семян),
ii) по меньшей мере в 40 раз, по меньшей мере в 50 раз, по меньшей мере в 60 раз или по меньшей мере в 70 раз, или по меньшей мере в 100 раз более высокое общее содержание TAG в вегетирующей части растения или нечеловеческом организме, по сравнению с соответствующей вегетирующей частью растения или нечеловеческим организмом, не содержащим экзогенных полинуклеотидов,
iii) олеиновая кислота составляет по меньшей мере 19%, по меньшей мере 22% или по меньшей мере 25 масс. % от жирных кислот в TAG,
iv) по меньшей мере в 10 раз, по меньшей мере в 15 раз, по меньшей мере в 17 раз или по меньшей мере в 19 раз более высокая концентрация олеиновой кислоты в TAG в вегетирующей части растения или нечеловеческом организме, по сравнению с соответствующей вегетирующей частью растения или нечеловеческим организмом, не содержащим экзогенных полинуклеотидов,
v) пальмитиновая кислота составляет по меньшей мере 20%, по меньшей мере 25% или по меньшей мере 28 масс. % от жирных кислот в TAG,
vi) по меньшей мере в 1,25 раза более высокая концентрация пальмитиновой кислоты в TAG в вегетирующей части растения или нечеловеческом организме, по сравнению с соответствующей вегетирующей частью растения или нечеловеческим организмом, не содержащим экзогенных полинуклеотидов,
vii) линолевая кислота составляет по меньшей мере 15% или по меньшей мере 20 масс. % от жирных кислот в TAG,
viii) α-линоленовая кислота составляет менее 15%, менее 11% или менее 8 масс. % от жирных кислот в TAG, и
ix) по меньшей мере в 5 раз или по меньшей мере в 8 раз более низкая концентрация α-линоленовой кислоты в TAG в вегетирующей части растения или нечеловеческом организме, по сравнению с соответствующей вегетирующей частью растения или нечеловеческим организмом, не содержащим экзогенных полинуклеотидов. В этом варианте реализации, предпочтительно вегетирующая часть растения по меньшей мере обладает характеристикой (-ами) i), ii) или i) и ii). В одном варианте реализации % сухого веса представляет собой % от сухого веса листьев.
Предпочтительно, указанные характеристики для двух представленных выше вариантов реализации являются таковыми на стадии цветения растения.
В четвертом аспекте настоящего изобретения представлены семена растения, способные прорастать в растение настоящего изобретения, или полученные из растения настоящего изобретения, например, нечеловеческий организм настоящего изобретения, который представляет собой растение. В одном варианте реализации семена содержат один или более экзогенных полинуклеотидов, описанных в настоящем документе.
В пятом аспекте настоящего изобретения представлен способ получения клетки с усиленной способностью к выработке одного или более неполярных липидов, включающий стадии:
a) внедрение в клетку одного или более экзогенных полинуклеотидов,
b) экспрессия одного или более экзогенных полинуклеотидов в клетке или ее клетках-потомках,
c) анализ содержания липидов в клетке или в клетках-потомках, и
d) отбор клетки или клетки-потомка, имеющей повышенную концентрацию одного или более неполярных липидов, по сравнению с соответствующей клеткой или клеткой-потомком, не содержащей экзогенных полинуклеотидов;
при этом один или более экзогенных полинуклеотидов кодируют
i) фактор транскрипции Wrinkled 1 (WRI1) и DGAT,
ii) фактор транскрипции WRI1 и DGAT, и олеозин,
iii) фактор транскрипции WRI1, DGAT, MGAT и олеозин,
iv) моноацилглицерин-ацилтрансферазу (MGAT),
v) диацилглицерин-ацилтрансферазу 2 (DGAT2),
vi) MGAT и глицерин-3-фосфат-ацилтрансферазу (GPAT),
vii) MGAT и DGAT,
viii) MGAT, GPAT и DGAT,
ix) фактор транскрипции WRI1 и MGAT,
x) фактор транскрипции WRI1, DGAT и MGAT,
xi) фактор транскрипции WRI1, DGAT, MGAT, олеозин и GPAT,
xii) DGAT и олеозин, или
xiii) MGAT и олеозин, и
xiv) необязательно полипептид молчащего супрессора,
при этом каждый экзогенный полинуклеотид функционально связан с промотором, который может направлять экспрессию экзогенного полинуклеотида в клетке или в клетке-потомке.
В одном варианте реализации выбранная клетка или клетка-потомок содержит:
i) первый экзогенный полинуклеотид, кодирующий WRI1, и второй экзогенный полинуклеотид, кодирующий DGAT, предпочтительно DGAT1,
ii) первый экзогенный полинуклеотид, кодирующий WRI1, второй экзогенный полинуклеотид, кодирующий DGAT, предпочтительно DGAT1, и третий экзогенный полинуклеотид, кодирующий олеозин,
iii) первый экзогенный полинуклеотид, кодирующий WRI1, второй экзогенный полинуклеотид, кодирующий DGAT, предпочтительно DGAT1, третий экзогенный полинуклеотид, кодирующий олеозин, и четвертый экзогенный полинуклеотид, кодирующий MGAT, предпочтительно MGAT2,
iv) первый экзогенный полинуклеотид, кодирующий WRI1, второй экзогенный полинуклеотид, кодирующий DGAT, предпочтительно DGAT1, третий экзогенный полинуклеотид, кодирующий олеозин, и четвертый экзогенный полинуклеотид, кодирующий LEC2 или BBM,
v) первый экзогенный полинуклеотид, кодирующий WRI1, второй экзогенный полинуклеотид, кодирующий DGAT, предпочтительно DGAT1, третий экзогенный полинуклеотид, кодирующий олеозин, четвертый экзогенный полинуклеотид, кодирующий MGAT, предпочтительно MGAT2, и пятый экзогенный полинуклеотид, кодирующий LEC2 или BBM,
vi) первый экзогенный полинуклеотид, кодирующий WRI1, второй экзогенный полинуклеотид, кодирующий DGAT, предпочтительно DGAT1, третий экзогенный полинуклеотид, кодирующий олеозин, и четвертый экзогенный полинуклеотид, кодирующий молекулу РНК, которая ингибирует экспрессию гена, кодирующего липазу, такую как полипептид CGi58,
vii) первый экзогенный полинуклеотид, кодирующий WRI1, второй экзогенный полинуклеотид, кодирующий DGAT, предпочтительно DGAT1, третий экзогенный полинуклеотид, кодирующий олеозин, четвертый экзогенный полинуклеотид, кодирующий молекулу РНК, которая ингибирует экспрессию гена, кодирующего липазу, такую как полипептид CGi58, и пятый экзогенный полинуклеотид, кодирующий LEC2 или BBM,
viii) первый экзогенный полинуклеотид, кодирующий WRI1, второй экзогенный полинуклеотид, кодирующий DGAT, предпочтительно DGAT1, третий экзогенный полинуклеотид, кодирующий олеозин, четвертый экзогенный полинуклеотид, кодирующий молекулу РНК, которая ингибирует экспрессию гена, кодирующего липазу, такую как полипептид CGi58, и пятый экзогенный полинуклеотид, кодирующий MGAT, предпочтительно MGAT2, или
ix) первый экзогенный полинуклеотид, кодирующий WRI1, второй экзогенный полинуклеотид, кодирующий DGAT, предпочтительно DGAT1, третий экзогенный полинуклеотид, кодирующий олеозин, четвертый экзогенный полинуклеотид, кодирующий молекулу РНК, которая ингибирует экспрессию гена, кодирующего липазу, такую как полипептид CGi58, пятый экзогенный полинуклеотид, кодирующий MGAT, предпочтительно MGAT2, и шестой экзогенный полинуклеотид, кодирующий LEC2 или BBM.
В дополнительном варианте реализации выбранная клетка или клетка-потомок представляет собой клетку семени растения и содержит первый экзогенный полинуклеотид, кодирующий WRI1, второй экзогенный полинуклеотид, кодирующий DGAT, предпочтительно DGAT1, третий экзогенный полинуклеотид, кодирующий олеозин, и четвертый экзогенный полинуклеотид, кодирующий MGAT, предпочтительно MGAT2. Предпочтительно, семена дополнительно содержат пятый экзогенный полинуклеотид, кодирующий GPAT.
В предпочтительном варианте реализации один или более экзогенных полинуклеотидов устойчиво интегрированы в геном клетки или клетки-потомка.
В предпочтительном варианте реализации указанный способ дополнительно включает стадию регенерации трансгенного растения из клетки или клетки-потомка, содержащей один или более экзогенных полинуклеотидов. Стадия регенерации трансгенного растения может быть выполнена перед стадией экспрессии одного или более экзогенных полинуклеотидов в клетке или ее клетке-потомке, и/или перед стадией анализа содержания липидов в клетке или клетке-потомке, и/или перед стадией отбора клетки или клетки-потомка, имеющей повышенное содержание одного или более неполярных липидов. Указанный способ может дополнительно включать стадию получения семян или растения-потомка из трансгенного растения, при этом семена или растение-потомок содержит один или более экзогенных полинуклеотидов.
Способ пятого аспекта может быть использован в качестве отборочного анализа для определения того, обладает ли полипептид, кодируемый экзогенным полинуклеотидом, заданной функцией. Один или более экзогенных полинуклеотидов в этом аспекте могут содержать последовательность, указанную выше. Кроме того, для одного или более экзогенных полинуклеотидов до указанного процесса может быть неизвестно, что они кодируют фактор транскрипции WRI1 и DGAT, фактор транскрипции WRI1 и MGAT, фактор транскрипции WRI1, DGAT и MGAT, фактор транскрипции WRI1, DGAT, MGAT и олеозин, фактор транскрипции WRI1, DGAT, MGAT, олеозин и GPAT, фактор транскрипции WRI1, DGAT и олеозин, DGAT и олеозин или MGAT и олеозин, скорее они могут быть кандидатами для этого. Поэтому указанный способ может быть использован в качестве анализа для идентификации или отбора полинуклеотидов, кодирующих фактор транскрипции WRI1 и DGAT, фактор транскрипции WRI1 и MGAT, фактор транскрипции WRI1, DGAT и MGAT, фактор транскрипции WRI1, DGAT, MGAT и олеозин, фактор транскрипции WRI1, DGAT, MGAT, олеозин и GPAT, фактор транскрипции WRI1, DGAT и олеозин, DGAT и олеозин или MGAT и олеозин. Потенциальные полинуклеотиды внедряют в клетку и анализируют продукты для определения того, обладают ли кандидаты заданной функцией.
В шестом аспекте настоящего изобретения представлена трансгенная клетка или трансгенное растение, полученное по способу настоящего изобретения, или вегетирующая часть растения или семена, полученные из них, которые содержат один или более экзогенных полинуклеотидов.
В седьмом аспекте настоящего изобретения представлено применение одного или более полинуклеотидов, кодирующих, или генетического конструкта, содержащего полинуклеотиды, кодирующие:
i) фактор транскрипции Wrinkled 1 (WRI1) и DGAT,
ii) фактор транскрипции WRI1 и DGAT, и олеозин,
iii) фактор транскрипции WRI1, DGAT, MGAT и олеозин,
iv) моноацилглицерин-ацилтрансферазу (MGAT),
v) диацилглицерин-ацилтрансферазу 2 (DGAT2),
vi) MGAT и глицерин-3-фосфат-ацилтрансферазу (GPAT),
vii) MGAT и DGAT,
viii) MGAT, GPAT и DGAT,
ix) фактор транскрипции WRI1 и MGAT,
x) фактор транскрипции WRI1, DGAT и MGAT,
xi) фактор транскрипции WRI1, DGAT, MGAT, олеозин и GPAT,
xii) DGAT и олеозин, или
xiii) MGAT и олеозин, и
xiv) необязательно полипептид молчащего супрессора,
для получения трансгенной клетки, трансгенного нечеловеческого организма или его части, или трансгенных семян, обладающих улучшенной способностью вырабатывать один или более неполярных липидов, по сравнению с соответствующей клеткой, нечеловеческим организмом или его частью, или с семенами, не содержащими одного или более полинуклеотидов, при этом каждый из одного или более полинуклеотидов является экзогенным для указанной клетки, нечеловеческого организма или его части, или для семян и функционально связан с промотором, который может направлять экспрессию полинуклеотида в клетке, нечеловеческом организме или его части, или в семенах, соответственно.
В одном варианте реализации настоящего изобретения представлено применение первого полинуклеотида, кодирующего РНК или полипептид фактора транскрипции, который увеличивает экспрессию одного или более гликолитических или жирнокислотных биосинтетических генов в клетке, нечеловеческом организме или его части, или в семенах, вместе со вторым полинуклеотидом, который кодирует РНК или полипептид, участвующий в биосинтезе одного или более неполярных липидов, для получения трансгенной клетки, трансгенного нечеловеческого организма или его части, или трансгенных семян, обладающих улучшенной способностью вырабатывать один или более неполярных липидов, по сравнению с соответствующей клеткой, нечеловеческим организмом или его частью, или с семенами, не содержащими первого и второго полинуклеотида, при этом и первый, и второй полинуклеотиды являются экзогенными для клетки, нечеловеческого организма или его части, или для семян, и каждый из них функционально связан с промотором, который может направлять экспрессию полинуклеотида в трансгенной клетке, трансгенном нечеловеческом организме или его части, или в трансгенных семенах, соответственно.
В дополнительном варианте реализации настоящего изобретения представлено применение одного или более полинуклеотидов для получения трансгенной клетки, трансгенного нечеловеческого организма или его части, или трансгенных семян, обладающих улучшенной способностью вырабатывать один или более неполярный липид (-ов), по сравнению с соответствующей клеткой, нечеловеческим организмом или его частью, или с семенами, не содержащими одного или более экзогенных полинуклеотидов, при этом каждый из одного или более полинуклеотидов является экзогенным для клетки, нечеловеческого организма или его части, или семян и функционально связан с промотором, который может направлять экспрессию полинуклеотида в клетке, нечеловеческом организме или его части, или в семенах, соответственно, и при этом неполярный липид (-ы) содержит жирную кислоту, которая содержит гидрокисльную группу, эпокси-группу, циклопропановую группу, двойную углерод-углеродную связь, тройную углерод-углеродную связь, сопряженные двойные связи, разветвленную цепь, такую как метилированная или гидроксилированная разветвленная цепь, или комбинацию двух или более из них, или любые две, три, четыре, пять или шесть из вышеупомянутых групп, связей или разветвленных цепей. Такое использование применимо также в скрининговых анализах.
В восьмом аспекте настоящего изобретения представлен способ получения семян, включающий:
i) выращивание растения, нескольких растений или нечеловеческого организма в соответствии с настоящим изобретением, и
ii) сбор семян из растения, растений или нечеловеческого организма.
В предпочтительном варианте реализации указанный способ включает выращивание популяции по меньшей мере из около 1000 таких растений в поле, и сбор семян из этой популяции растений. Собранные семена могут быть помещены в контейнер и вывезены с поля, например, экспортированы из страны, или могут храниться до использования.
В девятом аспекте настоящего изобретения представлен способ ферментации, включающий стадии:
i) обеспечение емкости, содержащей жидкую композицию, содержащую нечеловеческий организм настоящего изобретения, который пригоден для ферментации, и составляющие, необходимые для ферментации и биосинтеза жирных кислот, и
ii) обеспечение условий, благоприятных для ферментации жидкой композиции, содержащейся в указанной емкости.
В десятом аспекте настоящего изобретения представлены выделенные или экстрагированные липиды, которые могут быть получены по способу настоящего изобретения, или которые могут быть получены из вегетирующей части растения, нечеловеческого организма или его части, клетки или клетки-потомка, трансгенного растения или семян настоящего изобретения. Выделенные или экстрагированные липиды, предпочтительно масло, такое как масло семян, может иметь улучшенное содержание TAG, содержание DAG, содержание TAG и DAG, содержание MAG, содержание PUFA, содержание определенной PUFA или содержание определенной жирной кислоты, и/или общее содержание неполярных липидов. В предпочтительном варианте реализации MAG представляет собой 2-MAG. Степень увеличенного содержания TAG, содержания DAG, содержания TAG и DAG, содержания MAG, содержания PUFA, содержания определенной PUFA, содержания определенной жирной кислоты и/или общего содержания неполярных липидов может быть такой, как описано в характеристике (i).
В одиннадцатом аспекте настоящего изобретения представлен промышленный продукт, выпущенный по способу настоящего изобретения, предпочтительно который представляет собой углеводородный продукт, такой как сложные эфиры жирных кислот, предпочтительно метиловые эфиры жирных кислот и/или этиловые эфиры жирных кислот, алкан, такой как метан, этан или длинноцепный алкан, смесь длинноцепных алканов, алкен, биотопливо, монооксид углерода и/или газообразный водород, биоспирт, такой как этанол, пропанол или бутанол, биоуголь или комбинацию монооксида углерода, водорода и биоугля.
В двенадцатом аспекте настоящего изобретения представлено применение растения, вегетирующей части растения, нечеловеческого организма или его части, клетки или клетки-потомка, трансгенного растения, полученного по способу настоящего изобретения, или семян, или выделенных или экстрагированных липидов настоящего изобретения для производства промышленного продукта. Промышленный продукт может быть таким, как описано выше.
В тринадцатом аспекте настоящего изобретения представлен способ получения топлива, включающий:
i) взаимодействие липидов настоящего изобретения со спиртом, необязательно в присутствии катализатора, с образованием сложных алкильных эфиров, и
ii) необязательно смешивание сложных алкильных эфиров с нефтяным топливом. Сложные алкильные эфиры предпочтительно представляют собой метиловые эфиры. Топливо, полученное по такому способу, может содержать минимальную концентрацию липидов настоящего изобретения или углеводородного продукта, полученного из них, такую как по меньшей мере 10%, по меньшей мере 20% или по меньшей мере 30% по объему.
В четырнадцатом аспекте настоящего изобретения представлен способ получения синтетического дизельного топлива, включающий:
i) превращение липидов в вегетирующем растении, нечеловеческом организме или его части по настоящему изобретению в синтез-газ с помощью газификации, и
ii) превращение синтез-газа в биотоплива с использованием металлического катализатора или микробного катализатора.
В пятнадцатом аспекте настоящего изобретения представлен способ получения биотоплива, включающий превращение липидов в вегетирующей части растения, нечеловеческом организме или его части по настоящему изобретению в бионефть с помощью пиролиза, биоспирт с помощью ферментации или в биогаз с помощью газификации или анаэробного расщепления.
В шестнадцатом аспекте настоящего изобретения представлен способ получения кормового продукта, включающий смешивание растения, вегетирующей части растения, нечеловеческого организма или его части, клетки или клетки-потомка, трансгенного растения, полученного по способу настоящего изобретения, семян, выделенных или экстрагированных липидов, или экстракта или его части по меньшей мере с одним другим пищевым ингредиентом.
В семнадцатом аспекте настоящего изобретения представлены кормовые продукты, косметические или химические вещества, содержащие растение, его вегетирующую часть, нечеловеческий организм или его часть, клетку или клетку-потомка, трансгенное растение, полученное по способу настоящего изобретения, семена или выделенные или экстрагированные липиды настоящего изобретения, или экстракт или его часть.
Естественно, если вегетирующий материал или растение подлежит сбору из-за содержания в нем масла, желательно собирать этот материал тогда, когда концентрации липидов являются максимально высокими. Авторы настоящего изобретения отметили связь между блеском вегетирующей ткани растений настоящего изобретения и содержанием масла, причем высокие концентрации липидов связаны с высоким блеском. Следовательно, блеск вегетирующего материала может быть использован как маркер для облегчения определения времени сбора материала.
В дополнительном аспекте настоящего изобретения представлена рекомбинантная клетка, содержащая один или более экзогенный полинуклеотид (-ов) и повышенную концентрацию одного или более неполярного липида (-ов), по сравнению с соответствующей клеткой, не содержащей одного или более экзогенного полинуклеотида (-ов),
при этом каждый из одного или более экзогенных полинуклеотидов функционально связан с промотором, который может направлять экспрессию полинуклеотида в клетке, и при этом применима одна или более, или все из следующих характеристик:
(a) один или более экзогенный полинуклеотид (-ов) содержит первый экзогенный полинуклеотид, который кодирует РНК или полипептид фактора транскрипции, который увеличивает экспрессию одного или более гликолитических или жирнокислотных биосинтетических генов в нечеловеческом организме или его части, и второй экзогенный полинуклеотид, который кодирует РНК или полипептид, участвующий в биосинтезе одного или более неполярных липидов,
(b) если клетка представляет собой клетку вегетирующей части растения, то эта клетка имеет общее содержание неполярных липидов по меньшей мере около 3%, более предпочтительно по меньшей мере около 5%, предпочтительно по меньшей мере около 7%, более предпочтительно по меньшей мере около 10%, более предпочтительно по меньшей мере около 11%, более предпочтительно по меньшей мере около 12%, более предпочтительно по меньшей мере около 13%, более предпочтительно по меньшей мере около 14% или более предпочтительно по меньшей мере около 15% (масс./масс.),
(c) клетка представляет собой водоросль, выбранную из группы, состоящей из диатомовых водорослей (бациллариофиты), зеленых водорослей (хлорофиты), сине-зеленых водорослей (цианофиты), золотисто-коричневых водорослей (хризофиты), гаптофитов, коричневых водорослей и гетероконтных водорослей,
(d) один или более неполярный липид (-ов) содержит жирную кислоту, которая содержит гидроксильную группу, эпокси-группу, циклопропановую группу, двойную углерод-углеродную связь, тройную углерод-углеродную связь, сопряженные двойные связи, разветвленную цепь, такую как метилированная или гидроксилированная разветвленная цепь, или комбинацию двух или более из них, или любые две, три, четыре, пять или шесть из вышеупомянутых групп, связей или разветвленных цепей,
(е) общее содержание жирных кислот в неполярном липиде (-ах) составляет по меньшей мере на 2% больше олеиновой кислоты и/или по меньшей мере на 2% меньше пальмитиновой кислоты, чем неполярный липид (-ы) в соответствующей клетке, не содержащей одного или более экзогенных полинуклеотидов,
(f) неполярный липид (-ы) содержит измененную концентрацию общих стеролов, предпочтительно свободных (не эстерифицированных) стеролов, стероиловых эфиров, стероил-гликозидов, относительно неполярного липида (-ов) в соответствующей клетке, не содержащей одного или более экзогенных полинуклеотидов,
(g) неполярный липид (-ы) содержит воски и/или восковые эфиры, и
(h) клетка представляет собой один член из популяции или совокупности по меньшей мере из 1000 таких клеток.
В одном варианте реализации один или более экзогенный полинуклеотид (-ов) содержат первый экзогенный полинуклеотид и второй экзогенный полинуклеотид, и при этом применима одна или более, или все из характеристик (b)-(h).
В дополнительном аспекте настоящего изобретения представлен способ определения времени сбора растения для оптимизации количества липидов в вегетирующей ткани растения при уборке, включающий
i) измерение блеска вегетирующей ткани,
ii) сравнение указанного измерения с заранее определенной минимальной степенью блеска, и
iii) необязательно сбор растения.
В другом аспекте настоящего изобретения представлен способ прогнозирования количества липидов в вегетирующей ткани растения, включающий измерение блеска вегетирующей ткани.
В предпочтительном варианте реализации двух представленных выше аспектах, вегетирующая ткань представляет собой лист (листья) или их часть.
В дополнительном аспекте настоящего изобретения представлен способ продажи растения или его части, включающий получение растения или части, содержащей клетку настоящего изобретения, и продажу полученного растения или части растения для получения денежного дохода.
В одном варианте реализации указанный способ дополнительно включает одно или более, или все из:
i) выращивание растения,
ii) сбор части растения, полученной из растения,
iii) хранение растения или его части или
iv) перевозка растения или его части в другое место.
В дополнительном аспекте настоящего изобретения представлен способ получения закромов из частей растения, включающий:
а) сбор частей растения, содержащих клетку настоящего изобретения посредством сбора частей растений, полученных из растений, или посредством отделения частей растений от других частей растений,
b) необязательно отсеивание и/или сортировка собранных частей растения, и
c) погрузка частей растений пункта а) или отсеянных и/или сортированных частей растений пункта b) в закрома, с получением посредством этого закромов из частей растений.
Любой вариант реализации, описанный в настоящем документе, следует принимать mutatis mutandis с любым другим вариантом реализации, если специально не указано иное.
Настоящее изобретение не ограничивается в своем объеме конкретными вариантами реализации, описанными в настоящем изобретении, которые предназначены лишь для иллюстративных целей. Очевидны функционально эквивалентные продукты, композиции и способы, входящие в рамки настоящего изобретения, описанного в настоящем документе.
В тексте настоящего описания, если специально не указано иное или если из контекста не следует обратное, упоминание одной стадии, композиции веществ, группы стадий или группы композиций вещества следует понимать как охватывающее одну и множество (то есть одну или более) таких стадий, композиций веществ, групп стадий или групп композиций веществ.
Настоящее изобретение описано далее с помощью следующих не ограничивающих Примеров и со ссылкой на сопровождающие фигуры.
КРАТКОЕ ОПИСАНИЕ СОПРОВОЖДАЮЩИХ ЧЕРТЕЖЕЙ
Фигура 1. Иллюстрация различных способов синтеза липидов, большинство из которых сходятся у DAG, центральной молекуле в синтезе липидов. Эта модель включает один из возможных путей образования sn-2 MAG, который может быть использован бифунциональным MGAT/DGAT для образования DAG из глицерин-3-фосфата (G-3-P). Использованы следующие сокращения:
G-3-P; глицерин-3-фосфат
LysoPA; лизофосфатидная кислота
PA; фосфатидная кислота
MAG; моноацилглицерин
DAG; диацилглицерин
TAG; триацилглицерин
Ацил-CoA и FA-CoA; ацил-коэнзим А и жирный ацил-коэнзим А
PC; фосфатидилхолин
GPAT; глицерин-3-фосфат-ацилтрансфераза; глицерин-3-фосфат-O-ацилтрансфераза; ацил-CoA:sn-глицерин-3-фосфат-1-O-ацилтрансфераза; EC 2.3.1.15
GPAT4; глицерин-3-фосфат-ацилтрансфераза 4
GPAT6; глицерин-3-фосфат-ацилтрансфераза 6
LPAAT; 1-ацил-глицерин-3-фосфат-ацилтрансфераза; 1-ацилглицерин-3-фосфат-O-ацилтрансфераза; ацил-CoA:1-ацил-sn-глицерин-3-фосфат-2-O-ацилтрансфераза; EC 2.3.1.51
PAP; фосфатаза фосфатидной кислоты; фосфатидат-фосфатаза; аосфогидролаза фосфатидной кислоты; фосфатаза фосфатидной кислоты; EC 3.1.3.4
MGAT; ацилтрансфераза, обладающая активностью моноацилглицерин-ацилтрансферазы (MGAT; 2-ацилглицерин-O-ацилтрансфераза, ацил-CoA:2-ацилглицерин-O-ацилтрансфераза; EC 2.3.1.22)
M/DGAT; ацилтрансфереза, обладающая активностью моноацилглицерин-ацилтрансферазы (MGAT; 2-ацилглицерин-O-ацилтрансфераза; ацил-CoA:2-ацилглицерин-O-ацилтрансфераза; EC 2.3.1.22) и/или активностью диацилглицерин-ацилтрансферазы (DGAT; диацилглицерин-O-ацилтрансфераза; ацил-CoA:1,2-диацил-sn-глицерин-O-ацилтрансфераза; EC 2.3.1.20)
LPCAT; ацил-CoA:лизофосфатидилхолин-ацилтрансфераза; 1-ацилглицерофосфохолин-O-ацилтрансфераза; ацил-CoA:1-ацил-sn-глицеро-3-фосфохолин-O-ацилтрансфераза; EC 2.3.1.23
PLD-Z; фосфолипаза D зета; холин-фосфатаза; лецитиназа D; липофосфодиэстераза II; EC 3.1.4.4
CPT; CDP-холин:диацилглицерин-холинфосфотрансфераза; 1-алкил-2-ацетилглицерин-холинфосфотрансфераза; алкилацилглицерин-холинфосфотрансфераза; холинфосфотрансфераза; фосфорилхолин-глицерид-трансфераза; EC 2.7.8.2
PDCT; фосфатидилхолин:диацетилглицерин-холинфосфотрансфераза
PLC; фосфолипаза С; EC 3,1,4,3
PDAT; фосфолипид:диацилглицерин-ацилтрансфераза; фосфолипид:1,2-диацил-sn-глицерин-O-ацилтрансфераза; EC 2.3.1.158
Pi; неорганический фосфат
Фигура 2. Относительное увеличение DAG и TAG в ткани листьев Nicotiana benthamiana, трансформированных с помощью конструктов, кодирующих p19 (отрицательный контроль), DGAT1 Arabidopsis thaliana, MGAT1 Mus musculus и комбинации DGAT1 и MGAT1, каждый из которых экспрессирован из промотора 35S. Фермент MGAT1 был гораздо более активен, чем фермент DGAT1 при промотировании накопления DAG и TAG в ткани листьев. Экспрессия гена MGAT1 привела к двукратному увеличению накопления DAG и TAG в ткани листьев, по сравнению с экспрессией только DGAT1.
Фигура 3. Относительное увеличение TAG в листьях N. benthamiana, трансформированных с помощью конструктов, кодирующих p19 (отрицательный контроль, DGAT1 A. thaliana, MGAT2 M. musculus и комбинации MGAT2 и DGAT1. «Усы» ошибки обозначают стандартную погрешность для образцов в трех экземплярах.
Фигура 4. Радиоактивность (распадов в минуту) во фракциях MAG, DAG и TAG, выделенных из временно трансформированных лизатов листьев N. benthamiana, напитанных sn-2-MAG[14C], и немеченой олеиновой кислотой в зависимости от времени. Были использованы те же конструкты, что и для Фигуры 3.
Фигура 5. Как и для Фигуры 4, но напитанные [14C]G-3-P и немеченой олеиновой кислотой.
Фигура 6. Авторадиограмма ТСХ пластины, демонстрирующая образование TAG с помощью DGAT1 A. thaliana и MGAT1 M. musculus, но не MGAT2 M. musculus в анализе на дрожжах. Этот анализ описан в Примере 5.
Фигура 7. Концентрации TAG в семенах T2 и T3 Arabidopsis thaliana, трансформированных с помощью химерной ДНК, экспрессирующей MGAT2, по сравнению с исходным (не трансформированным) контрольным образцом. Семена собрали при созревании (сухие). SW: вес сухих семян. Концентрации TAG представлены в мкг TAG на 100 мкг веса семян.
Фигура 8. Общее содержание жирных кислот в семенах трансформированных растений Arabidopsis thaliana, трансформированных с помощью конструктов, кодирующих MGAT1 или MGAT2.
Фигура 9. Относительная концентрация TAG во временно трансформированной ткани листьев N. benthamiana, по сравнению со сверхэкспрессией DGAT1 Arabidopsis thaliana.
Фигура 10. Превращение TAG из sn-1,2-DAG в анализе DGAT из микросом ткани листьев N. benthamiana, экспрессирующих контрольный P19, DGAT1 Arabidopsis thaliana и DGAT2 Arabidopsis thaliana.
Фигура 11. Количественная оценка общего FAME в семенах A. Thaliana, трансформированных с помощью pJP3382 и pJP3383.
Фигура 12. Максимальные концентрации TAG, полученные для различных комбинаций генов, временно экспрессированных в листьях N. benthamiana. Отрицательный контроль V2 представляет собой среднюю концентрацию TAG на основании 15 независимых повторов.
Фигура 13. Совместная экспрессия генов, кодирующих для ацилтрансферазы DGAT1 Arabidopsis thaliana и фактора транскрипции WRI1 A. thaliana, которая привела к синергетическому действию на концентрации TAG в листьях Nicotiana benthamiana. Представленные данные являются средними значениями и стандартными отклонениями для пяти независимых пропиток.
Фигура 14. Концентрации TAG в устойчиво трансформированной надземной ткани сеянцев N. benthamiana. Общие липиды экстрагировали из надземных тканей сеянцев N. benthamiana и анализировали с помощью ТСХ-ПИД, используя внутренний стандарт DAGE для обеспечения точного сравнения между образцами.
Фигура 15. Общие концентрации жирных кислот в популяциях семян Т2 A. thaliana, трансформированных контрольным вектором (pORE04), MGAT1 M. musculus (35S:MGAT1) или MGAT2 M. musculus (35S:MGAT2).
Фигура 16. Карта области вставки между левой и правой границей pJP3502. TER Glyma-лектин обозначает лектиновый терминатор Glycine max; Arath-WRI1, кодирующая область фактора транскрипции WRI1 Arabidopsis thaliana; PRO Arath-Rubisco SSU, промотор малой субъединицы Rubisco A. thaliana; Sesin-олеозин, кодирующая область олеозина Sesame inducum; PRO CaMV35S-Ex2, промотор вируса мозаики цветной капусты 35S, имеющий двойную энхансерную область; Arath-DGAT1, кодирующая область ацилтрансферазы DGAT1 A. thaliana; TER Agrtu-NOS, терминатор нопалин-синтазы Agrobacterium tumefaciens.
Фигура 17. Схематическое изображение конструкта pJP3503, включающее область вставки между левой и правой границами pJP3503. TER Agrtu-NOS обозначает терминатор нопалин-синтазы Agrobacterium tumefaciens; Musmu-MGAT2, ацилтрансфераза MGAT2 Mus musculus; PRO CaMV24S-Ex2, двойная энхансерная область вируса мозаики цветной капусты 35S; TER Glyma-лектин, лектиновый терминатор Glycine max; Arath-WRI1, фактор транскрипции WRI1 Arabidopsis thaliana; PRO Arath-Rubisco SSU, промотор малой субъединицы Rubisco A. thaliana; Sesin-олеозин, олеозин Sesame inducum; Arath-DGAT1, ацилтрансфераза DGAT1 A. thaliana.
Фигура 18. Выходы TAG в листьях различного возраста для трех растений табака дикого типа (wt1-3) и трех первичных трансформантов pJP3503 (4, 29, 21). Стадии листьев обозначены «G», зеленый; «YG», желто-зеленый; «Y», желтый. Стадии растения во время отбора образцов были бутонизация, дикий тип 1; появление первых цветов, дикий тип 2; цветение, дикий тип 3; образование семянок (трансформанты pJP3503).
Фигура 19А. Вставка ДНК, содержащая кассеты экспрессии для DGAT2A Umbelopsis ramanniana, экспрессируемого промотором бета-конглицинина альфа-субъединицы Glycine max, WRI1 Arabidopsis thaliana, экспрессируемого промотором ингибитора трипсина Кунитца 3 Glycine max, и MGAT2 Mus musculus, экспрессируемого промотором бета-конглицинина альфа-субъединицы Glycine max. Кодирующие гены области и экспрессионные кассеты могут быть удалены рестриктазным расщеплением.
Фигура 19В. Вставка ДНК, содержащая кассеты экспрессии для генов LEC2 и фактора транскрипции WRI1 Arabidopsis thaliana, экспрессируемых индуцибельными промоторами Aspergillus alcA, DGAT1 Arabidopsis thaliana, экспрессируемого конститутивным промотором CaMV-35S, и гена Aspergillus alcR, экспрессируемого конститутивным промотором CsVMV. Экспрессирование факторов транскрипции LEC2 и WRI1 индуцируется этанолом или аналогичным соединением.
Фигура 20. Карта pJP3507.
Фигура 21. Карта pJP3569.
КЛЮЧ К ПЕРЕЧНЮ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
SEQ ID NO:1 Кодон-оптимизированный MGAT1 Mus musculus
SEQ ID NO:2 Кодон-оптимизированный MGAT2 Mus musculus
SEQ ID NO:3 Кодон-оптимизированный MGAT1 Ciona intestinalis
SEQ ID NO:4 Кодон-оптимизированный MGAT1 Tribolium castaneum
SEQ ID NO:5 Кодон-оптимизированный MGAT1 Danio rerio
SEQ ID NO:6 Кодон-оптимизированный MGAT2 Danio rerio
SEQ ID NO:7 Полинуклеотид MGAT1 Homo sapiens (AF384163)
SEQ ID NO:8 Полинуклеотид MGAT1 Mus musculus (AF384162)
SEQ ID NO:9 Вариант транскрипта полинуклеотида MGAT1 Pan troglodytes (XM_001166055)
SEQ ID NO:10 Вариант 2 транскрипта полинуклеотида MGAT1 Pan troglodytes (XM_0526044.2)
SEQ ID NO:11 Полинуклеотид MGAT1 Canis familiais (XM_545667.2)
SEQ ID NO:12 Полинуклеотид MGAT1 Bos Taurus (NM_001001153.2)
SEQ ID NO:13 Полинуклеотид MGAT1 Rattus norvegicus (NM_001108803.1)
SEQ ID NO:14 Полинуклеотид MGAT1 Danio rerio (NM_001122623.1)
SEQ ID NO:15 Полинуклеотид MGAT1 Caenorhabditis elegans (NM_073012.4)
SEQ ID NO:16 Полинуклеотид MGAT1 Caenorhabditis elegans (NM_182380.5)
SEQ ID NO:17 Полинуклеотид MGAT1 Caenorhabditis elegans (NM_065258.3)
SEQ ID NO:18 Полинуклеотид MGAT1 Caenorhabditis elegans (NM_075068.3)
SEQ ID NO:19 Полинуклеотид MGAT1 Caenorhabditis elegans (NM_072248.3)
SEQ ID NO:20 Полинуклеотид MGAT1 Kuyveromyces lactis (XM_455588.1)
SEQ ID NO:21 Полинуклеотид MGAT1 Ashbya gossypii (NM_208895.1)
SEQ ID NO:22 Полинуклеотид MGAT1 Magnaporthe oryzae (XM_368741.1)
SEQ ID NO:23 Полинуклеотид MGAT1 Ciona intestinalos (XM_002120843.1)
SEQ ID NO:24 Полинуклеотид MGAT2 Homo sapiens (AY157608)
SEQ ID NO:25 Полинуклеотид MGAT2 Mus musculus (AY157609)
SEQ ID NO:26 Полинуклеотид MGAT2 Pan troglodytes (XM_522112.2)
SEQ ID NO:27 Полинуклеотид MGAT2 Canis familiais (XM_542304.1)
SEQ ID NO:28 Полинуклеотид MGAT2 Bos Taurus (NM_001099136.1)
SEQ ID NO:29 Полинуклеотид MGAT2 Rattus norvegicus (NM_001109436.2)
SEQ ID NO:30 Полинуклеотид MGAT2 Gallus gallus (XM_424082.2)
SEQ ID NO:31 Полинуклеотид MGAT2 Danio rerio (NM_001006083.1)
SEQ ID NO:32 Полинуклеотид MGAT2 Drosophila melanogaster (NM_136474.2)
SEQ ID NO:33 Полинуклеотид MGAT2 Drosophila melanogaster (NM_136473.2)
SEQ ID NO:34 Полинуклеотид MGAT2 Drosophila melanogaster (NM_136475.2)
SEQ ID NO:35 Полинуклеотид MGAT2 Anopheles gambiae (XM_001688709.1)
SEQ ID NO:36 Полинуклеотид MGAT2 Anopheles gambiae (XM_315985)
SEQ ID NO:37 Полинуклеотид MGAT2 Tribolium castaneum (XM_970053.1)
SEQ ID NO:38 Полинуклеотид MGAT3 Homo sapiens (AY229854)
SEQ ID NO:39 Вариант 1 транскрипта полинуклеотида MGAT3 Pan troglodytes (XM_001154107.1)
SEQ ID NO:40 Вариант 2 транскрипта полинуклеотида MGAT3 Pan troglodytes (XM_001154171.1)
SEQ ID NO:41 Вариант 3 транскрипта полинуклеотида MGAT3 Pan troglodytes (XM_527842.2)
SEQ ID NO:42 Полинуклеотид MGAT3 Canis familiais (XM_845212.1)
SEQ ID NO:43 Полинуклеотид MGAT3 Bos Taurus (XM_870406.4)
SEQ ID NO:44 Полинуклеотид MGAT3 Danio rerio (XM_688413.4)
SEQ ID NO:45 Полипептид MGAT1 Homo sapiens (AAK84178.1)
SEQ ID NO:46 Полипептид MGAT1 Mus musculus (AAK84177.1)
SEQ ID NO:47 Изоформа 1 полипептида MGAT1 Pan troglodytes (XP_001166055.1)
SEQ ID NO:48 Изоформа 2 полипептида MGAT1 Pan troglodytes (XP_526044.2)
SEQ ID NO:49 Полипептид MGAT1 Canis familiais (XP_545667.2)
SEQ ID NO:50 Полипептид MGAT1 Bos Taurus (NP_001001153.1)
SEQ ID NO:51 Полипептид MGAT1 Rattus norvegicus (NP_001102273.1)
SEQ ID NO:52 Полипептид MGAT1 Danio rerio (NP_001116095.1)
SEQ ID NO:53 Полипептид MGAT1 Caenorhabditis elegans (NP_505413.1)
SEQ ID NO:54 Полипептид MGAT1 Caenorhabditis elegans (NP_872180.1)
SEQ ID NO:55 Полипептид MGAT1 Caenorhabditis elegans (NP_497659.1)
SEQ ID NO:56 Полипептид MGAT1 Caenorhabditis elegans (NP_507469.1)
SEQ ID NO:57 Полипептид MGAT1 Caenorhabditis elegans (NP_504649.1)
SEQ ID NO:58 Полипептид MGAT1 Kuyveromyces lactis (XP_455588.1)
SEQ ID NO:59 Полипептид MGAT1 Ashbya gossypii (NP_983542.1)
SEQ ID NO:60 Полипептид MGAT1 Magnaporthe oryzae (XP_368741.1)
SEQ ID NO:61 Полипептид MGAT1 Ciona intestinalis (XP_002120879)
SEQ ID NO:62 Полипептид MGAT2 Homo sapiens (AA023672.1)
SEQ ID NO:63 Полипептид MGAT2 Mus musculus (AA023673.1)
SEQ ID NO:64 Полипептид MGAT2 Pan troglodytes (XP_522112.2)
SEQ ID NO:65 Полипептид MGAT2 Canis familiaris (XP_542304.1)
SEQ ID NO:66 Полипептид MGAT2 Bos taunts (NP_001092606.1)
SEQ ID NO:67 Полипептид MGAT2 Rattus norvegicus (NP_001102906.2)
SEQ ID NO:68 Полипептид MGAT2 Gallus gallus (XP_424082.2)
SEQ ID NO:69 Полипептид MGAT2 Danio rerio (NP_001006083.1)
SEQ ID NO:70 Полипептид MGAT2 Drosophila melanogaster (NP_610318.1)
SEQ ID NO:71 Полипептид MGAT2 Drosophila melanogaster (NP_610317.1)
SEQ ID NO:72 Полипептид MGAT2 Drosophila melanogaster (NP_610319.2)
SEQ ID NO:73 Полипептид MGAT2 Anopheles gambiae (XP_001688761)
SEQ ID NO:74 Полипептид MGAT2 Anopheles gambiae (XP_315985.3)
SEQ ID NO:75 Полипептид MGAT2 Tribolium castaneum (XP_975146)
SEQ ID NO:76 Полипептид MGAT3 Homo sapiens (AA063579.1)
SEQ ID NO:77 Изоформа 1 полипептида MGAT3 Pan troglodytes (XP_001154107.1)
SEQ ID NO:78 Изоформа 2 полипептида MGAT3 Pan troglodytes (XP_001154171.1)
SEQ ID NO:79 Изоформа 3 MGAT3 Pan troglodytes (XP_527842.2)
SEQ ID NO:80 Полипептид MGAT3 Canis familiaris (XP_850305.1)
SEQ ID NO:81 Полипептид MGAT3 Bos taurus (XP_875499.3)
SEQ ID NO:82 Полипептид MGAT3 Danio rerio (XP_693505.1)
SEQ ID NO:83 Полипептид DGAT1 Arabidopsis thaliana (CAB44774.1)
SEQ ID NO:84 Полинуклеотид GPAT4 Arabidopsis thaliana (NM_100043.4)
SEQ ID NO:85 Полинуклеотид GPAT6 Arabidopsis thaliana (NM_129367.3)
SEQ ID NO:86 Полинуклеотид GPAT Arabidopsis thaliana (AF195115.1)
SEQ ID NO:87 Полинуклеотид GPAT Arabidopsis thaliana (AY062466.1)
SEQ ID NO:88 Полинуклеотид GPAT Oryza sativa (AC118133.4)
SEQ ID NO:89 Полинуклеотид GPAT Picea sitchensis (EF086095.1)
SEQ ID NO:90 Полинуклеотид GPAT Zea mays (BT067649.1)
SEQ ID NO:91 Полинуклеотид GPAT Arabidopsis thaliana (AK228870.1)
SEQ ID NO:92 Полинуклеотид GPAT Oryza sativa (AK241033.1)
SEQ ID NO:93 Полинуклеотид GPAT Oryza sativa (CM000127.1)
SEQ ID NO:94 Полинуклеотид GPAT Oryza sativa (CM000130.1)
SEQ ID NO:95 Полинуклеотид GPAT Oryza sativa (CM000139.1)
SEQ ID NO:96 Полинуклеотид GPAT Oryza sativa (CM000126.1)
SEQ ID NO:97 Полинуклеотид GPAT Oryza sativa (CM000128.1)
SEQ ID NO:98 Полинуклеотид GPAT Oryza sativa (CM000140.1)
SEQ ID NO:99 Полинуклеотид GPAT Selaginella moellendorffii (GL377667.1)
SEQ ID NO:100 Полинуклеотид GPAT Selaginella moellendorffii (GL377667.1)
SEQ ID NO:101 Полинуклеотид GPAT Selaginella moellendorffii (GL377648.1)
SEQ ID NO:102 Полинуклеотид GPAT Selaginella moellendorffii (GL377622.1)
SEQ ID NO:103 Полинуклеотид GPAT Selaginella moellendorffii (GL377590.1)
SEQ ID NO:104 Полинуклеотид GPAT Selaginella moellendorffii (GL377576.1)
SEQ ID NO:105 Полинуклеотид GPAT Selaginella moellendorffii (GL377576.1)
SEQ ID NO:106 Полинуклеотид GPAT Oryza sativa (NM_001051374.2)
SEQ ID NO:107 Полинуклеотид GPAT Oryza sativa (NM_001052203.1)
SEQ ID NO:108 Полинуклеотид GPAT8 Zea mays (NM_001153970.1)
SEQ ID NO:109 Полинуклеотид GPAT Zea mays (NM_001155835.1)
SEQ ID NO:110 Полинуклеотид GPAT Zea mays (NM_001174880.1)
SEQ ID NO:111 Полинуклеотид GPAT4 Brassica napus (JQ666202.1)
SEQ ID NO:112 Полинуклеотид GPAT8 Arabidopsis thaliana (NM_116264.5)
SEQ ID NO:113 Полинуклеотид GPAT Physcomitrella patens (XM_001764949.1)
SEQ ID NO:114 Полинуклеотид GPAT Physcomitrella patens (XM_001769619.1)
SEQ ID NO:115 Полинуклеотид GPAT Physcomitrella patens (XM_001769672.1)
SEQ ID NO:116 Полинуклеотид GPAT Physcomitrella patens (XM_001771134.1)
SEQ ID NO:117 Полинуклеотид GPAT Physcomitrella patens (XM_001780481.1)
SEQ ID NO:118 Полинуклеотид GPAT Vitis vinifera (XM_002268477.1)
SEQ ID NO:119 Полинуклеотид GPAT Vitis vinifera (XM_002275312.1)
SEQ ID NO:120 Полинуклеотид GPAT Vitis vinifera (XM_002275996.1)
SEQ ID NO:121 Полинуклеотид GPAT Vitis vinifera (XM_002279055.1)
SEQ ID NO:122 Полинуклеотид GPAT Populus trichocarpa (XM_002309088.1)
SEQ ID NO:123 Полинуклеотид GPAT Populus trichocarpa (XM_002309240.1)
SEQ ID NO:124 Полинуклеотид GPAT Populus trichocarpa (XM_002322716.1)
SEQ ID NO:125 Полинуклеотид GPAT Populus trichocarpa (XM_002323527.1)
SEQ ID NO:126 Полинуклеотид GPAT Sorghum bicolor (XM_002439842.1)
SEQ ID NO:127 Полинуклеотид GPAT Sorghum bicolor (XM_002458741.1)
SEQ ID NO:128 Полинуклеотид GPAT Sorghum bicolor (XM_002463871.1)
SEQ ID NO:129 Полинуклеотид GPAT Sorghum bicolor (XM_002464585.1)
SEQ ID NO:130 Полинуклеотид GPAT Ricinus communis (XM_002511827.1)
SEQ ID NO:131 Полинуклеотид GPAT Ricinus communis (XM_002517392.1)
SEQ ID NO:132 Полинуклеотид GPAT Ricinus communis (XM_002520125.1)
SEQ ID NO:133 Полинуклеотид GPAT Arabidopsis lyrata (XM_002872909.1)
SEQ ID NO:134 Полинуклеотид GPAT6 Arabidopsis lyrata (XM_002881518.1)
SEQ ID NO:135 Предполагаемый полинуклеотид GPAT8 Vernicia fordii (FJ479753.1)
SEQ ID NO:136 Полинуклеотид GPAT Oryza sativa (NM_001057724.1)
SEQ ID NO:137 Полинуклеотид GPAT4 Brassica napus (JQ666203.1)
SEQ ID NO:138 Полинуклеотид GPAT Populus trichocarpa (XM_002320102.1)
SEQ ID NO:139 Полинуклеотид GPAT Sorghum bicolor (XM_002451332.1)
SEQ ID NO:140 Полинуклеотид GPAT Ricinus communis (XM_002531304.1)
SEQ ID NO:141 Полинуклеотид GPAT4 Arabidopsis lyrata (XM_002889315.1)
SEQ ID NO:142 Полинуклеотид GPAT1 Arabidopsis thaliana (NM_100531.2)
SEQ ID NO:143 Полинуклеотид GPAT3 Arabidopsis thaliana (NM_116426.2)
SEQ ID NO:144 Полипептид GPAT4 Arabidopsis thaliana (NP_171667.1)
SEQ ID NO:145 Полипептид GPAT6 Arabidopsis thaliana (NP_181346.1)
SEQ ID NO:146 Полипептид GPAT Arabidopsis thaliana (AAF02784.1)
SEQ ID NO:147 Полипептид GPAT Arabidopsis thaliana (AAL32544.1)
SEQ ID NO:148 Полипептид GPAT Oryza sativa (AAP03413.1)
SEQ ID NO:149 Полипептид GPAT Picea sitchensis (ABK25381.1)
SEQ ID NO:150 Полипептид GPAT Zea mays (ACN34546.1)
SEQ ID NO:151 Полипептид GPAT Arabidopsis thaliana (BAF00762.1)
SEQ ID NO:152 Полипептид GPAT Oryza sativa (BAH00933.1)
SEQ ID NO:153 Полипептид GPAT Oryza sativa (EAY84189.1)
SEQ ID NO:154 Полипептид GPAT Oryza sativa (EAY98245.1)
SEQ ID NO:155 Полипептид GPAT Oryza sativa (EAZ21484.1)
SEQ ID NO:156 Полипептид GPAT Oryza sativa (EEC71826.1)
SEQ ID NO:157 Полипептид GPAT Oryza sativa (EEC76137.1)
SEQ ID NO:158 Полипептид GPAT Oryza sativa (EEE59882.1)
SEQ ID NO:159 Полипептид GPAT Selaginella moellendorffii (EFJ08963.1)
SEQ ID NO:160 Полипептид GPAT Selaginella moellendorffii (EFJ08964.1)
SEQ ID NO:161 Полипептид GPAT Selaginella moellendorffii (EFJ11200.1)
SEQ ID NO:162 Полипептид GPAT Selaginella moellendorffii (EFJ15664.1)
SEQ ID NO:163 Полипептид GPAT Selaginella moellendorffii (EFJ24086.1)
SEQ ID NO:164 Полипептид GPAT Selaginella moellendorffii (EFJ29816.1)
SEQ ID NO:165 Полипептид GPAT Selaginella moellendorffii (EFJ29817.1)
SEQ ID NO:166 Полипептид GPAT Oryza sativa (NP_001044839.1)
SEQ ID NO:167 Полипептид GPAT Oryza sativa (NP_001045668.1)
SEQ ID NO:168 Полипептид GPAT8 Zea mays (NP_001147442.1)
SEQ ID NO:169 Полипептид GPAT Zea mays (NP_001149307.1)
SEQ ID NO:170 Белок GPAT Zea mays (NP_001168351.1)
SEQ ID NO:171 Полипептид GPAT4 Brassica napus (AFH02724.1)
SEQ ID NO:172 Полипептид GPAT8 Arabidopsis thaliana (NP_191950.2)
SEQ ID NO:173 Полипептид GPAT Physcomitrella patens (XP_001765001.1)
SEQ ID NO:174 Полипептид GPAT Physcomitrella patens (XP_001769671.1)
SEQ ID NO:175 Полипептид GPAT Physcomitrella patens (XP_001769724.1)
SEQ ID NO:176 Полипептид GPAT Physcomitrella patens (XP_001771186.1)
SEQ ID NO:177 Полипептид GPAT Physcomitrella patens (XP_001780533.1)
SEQ ID NO:178 Полипептид GPAT Vitis vinifera (XP_002268513.1)
SEQ ID NO:179 Полипептид GPAT Vitis vinifera (XP_002275348.1)
SEQ ID NO:180 Полипептид GPAT Vitis vinifera (XP_002276032.1)
SEQ ID NO:181 Полипептид GPAT Vitis vinifera (XP_002279091.1)
SEQ ID NO:182 Полипептид GPAT Populus trichocarpa (XP_002309124.1)
SEQ ID NO:183 Полипептид GPAT Populus trichocarpa (XP_002309276.1)
SEQ ID NO:184 Полипептид GPAT Populus trichocarpa (XP_002322752.1)
SEQ ID NO:185 Полипептид GPAT Populus trichocarpa (XP_002323563.1)
SEQ ID NO:186 Полипептид GPAT Sorghum bicolor (XP_002439887.1)
SEQ ID NO:187 Полипептид GPAT Sorghum bicolor (XP_002458786.1)
SEQ ID NO:188 Полипептид GPAT Sorghum bicolor (XP_002463916.1)
SEQ ID NO:189 Полипептид GPAT Sorghum bicolor (XP_002464630.1)
SEQ ID NO:190 Полипептид GPAT Ricinus communis (XP_002511873.1)
SEQ ID NO:191 Полипептид GPAT Ricinus communis (XP_002517438.1)
SEQ ID NO:192 Полипептид GPAT Ricinus communis (XP_002520171.1)
SEQ ID NO:193 Полипептид GPAT Arabidopsis lyrata (XP_002872955.1)
SEQ ID NO:194 Полипептид GPAT6 Arabidopsis lyrata (XP_002881564.1)
SEQ ID NO:195 Полипептид GPAT Vernicia fordii (ACT32032.1)
SEQ ID NO:196 Полипептид GPAT Oryza sativa (NP_001051189.1)
SEQ ID NO:197 Полипептид GPAT4 Brassica napus (AFH02725.1)
SEQ ID NO:198 Полипептид GPAT Populus trichocarpa (XP_002320138.1)
SEQ ID NO:199 Полипептид GPAT Sorghum bicolor (XP_002451377.1)
SEQ ID NO:200 Полипептид GPAT Ricinus communis (XP_002531350.1)
SEQ ID NO:201 Полипептид GPAT4 Arabidopsis lyrata (XP_002889361.1)
SEQ ID NO:202 Полипептид GPAT1 Arabidopsis thaliana (NP_563768.1)
SEQ ID NO:203 Полипептид GPAT3 Arabidopsis thaliana (NP_192104.1)
SEQ ID NO:204 Полинуклеотид DGAT2 Arabidopsis thaliana (NM_115011.3)
SEQ ID NO:205 Полинуклеотид DGAT2 Ricinus communis (AY916129.1)
SEQ ID NO:206 Полинуклеотид DGAT2 Vernicia fordii (DQ356682.1)
SEQ ID NO:207 Полинуклеотид DGAT2 Mortierella ramanniana (AF391089.1)
SEQ ID NO:208 Полинуклеотид DGAT2 Homo sapiens (NM_032564.1)
SEQ ID NO:209 Полинуклеотид DGAT2 Homo sapiens (NM_001013579.2)
SEQ ID NO:210 Полинуклеотид DGAT2 Bos taurus (NM_205793.2)
SEQ ID NO:211 Полинуклеотид DGAT2 Mus musculus (AF384160.1)
SEQ ID NO:212 Полипептид DGAT2 Arabidopsis thaliana (NP_566952.1)
SEQ ID NO:213 Полипептид DGAT2 Ricinus communis (AAY16324.1)
SEQ ID NO:214 Полипептид DGAT2 Vernicia fordii (ABC94474.1)
SEQ ID NO:215 Полипептид DGAT2 Mortierella ramanniana (AAK84179.1)
SEQ ID NO:216 Полипептид DGAT2 Homo sapiens (Q96PD7.2)
SEQ ID NO:217 Полипептид DGAT2 Homo sapiens (Q58HT5.1)
SEQ ID NO:218 Полипептид DGAT2 Bos taurus (Q70VZ8.1)
SEQ ID NO:219 Полипептид DGAT2 Mus musculus (AAK84175.1)
SEQ ID NO:220 Трипептид YFP - мотив консервативной последовательности DGAT2 и/или MGAT1/2
SEQ ID NO:221 Тетрапептид HPHG - мотив консервативной последовательности DGAT2 и/или MGAT1/2
SEQ ID NO:222 Тетрапептид EPHS - мотив консервативной последовательности растений DGAT2
SEQ ID NO:223 RXGFX(K/R)XAXXXGXXX(L/V)VPXXXFG(E/Q) - длинный мотив консервативной последовательности DGAT2, который представляет собой часть предположительного глицерин-фосфолипидного домена
SEQ ID NO:224 FLXLXXXN - мотив консервативной последовательности мышиного DGAT2 и MGAT1/2, который представляет собой предположительный домен, связывающий нейтральные липиды
SEQ ID NO:225 Домен ацилтрансферазы plsC (PF01553) GPAT
SEQ ID NO:226 Домен GPAT суперсемейства HAD-подобной гидролазы (PF12710)
SEQ ID NO:227 Домен фосфосерин-фосфатазы (PF00702). GPAT4-8 содержат N-терминальную область, гомологичную к этому домену
SEQ ID NO:228 Консервативная аминокислотная последовательность GPAT GDLVICPEGTTCREP
SEQ ID NO:229 Консервативная аминокислотная последовательность GPAT/фосфатазы (мотив I)
SEQ ID NO:230 Консервативная аминокислотная последовательность GPAT/фосфатазы (мотив III)
SEQ ID NO:231 Полинуклеотид WRI1 Arabidopsis thaliana (NM_202701.2)
SEQ ID NO:232 Полинуклеотид WRI1 Arabidopsis thaliana (NM_001035780.2)
SEQ ID NO:233 Полинуклеотид WRI1 Arabidopsis thaliana (NM_115292.4)
SEQ ID NO:234 Полинуклеотид Arabidopsis lyrata, подвид lyrata (XM_002876205.1)
SEQ ID NO:235 Полинуклеотид WRI1 Brassica napus (DQ370141.1)
SEQ ID NO:236 Полинуклеотид WRI1 Brassica napus (HM370542.1)
SEQ ID NO:237 Полинуклеотид WRI1 Glycine max (XM_003530322.1)
SEQ ID NO:238 Полинуклеотид WRI1 Jatropha curcas (JF703666.1)
SEQ ID NO:239 Полинуклеотид WRI1 Ricinus communis (XM_002525259.1)
SEQ ID NO:240 Полинуклеотид WRI1 Populus trichocarpa (XM_002316423.1)
SEQ ID NO:241 Полинуклеотид WRI1 Brachypodium distachyon (XM_003578949.1)
SEQ ID NO:242 Полинуклеотид WRI1 Hordeum vulgare, подвид vulgare (AK355408.1)
SEQ ID NO:243 Полинуклеотид WRI1 Sorghum bicolor (XM_002450149.1)
SEQ ID NO:244 Полинуклеотид WRI1 Zea mays (EU960249.1)
SEQ ID NO:245 Полинуклеотид WRI1 Brachypodium distachyon (XM_003561141.1)
SEQ ID NO:246 Полинуклеотид WRI1 Sorghum bicolor (XM_002437774.1)
SEQ ID NO:247 Полинуклеотид WRI1 Sorghum bicolor (XM_002441399.1)
SEQ ID NO:248 Полинуклеотид WRI1 Glycine max (XM_003530638.1)
SEQ ID NO:249 Полинуклеотид WRI1 Glycine max (XM_003553155.1)
SEQ ID NO:250 Полинуклеотид WRI1 Populus trichocarpa (XM_002315758.1)
SEQ ID NO:251 Полинуклеотид WRI1 Vitis vinifera (XM_002270113.1)
SEQ ID NO:252 Полинуклеотид WRI1 Glycine max (XM_003533500.1)
SEQ ID NO:253 Полинуклеотид WRI1 Glycine max (XM_003551675.1)
SEQ ID NO:254 Полинуклеотид WRI1 Medicago truncatula (XM_003621069.1)
SEQ ID NO:255 Полинуклеотид WRI1 Populus trichocarpa (XM_002323800.1)
SEQ ID NO:256 Полинуклеотид WRI1 Ricinus communis (XM_002517428.1)
SEQ ID NO:257 Полинуклеотид WRI1 Brachypodium distachyon (XM_003572188.1)
SEQ ID NO:258 Полинуклеотид WRI1 Sorgum bicolor (XM_002444384.1)
SEQ ID NO:259 Полинуклеотид WRI1 Zea mays (NM_001176888.1)
SEQ ID NO:260 Полинуклеотид WRI1 Arabidopsis lyrata, подвид lyrata (XM_002889219.1)
SEQ ID NO:261 Полинуклеотид WRI1 Arabidopsis thaliana (NM_106619.3)
SEQ ID NO:262 Полинуклеотид WRI1 Arabidopsis lyrata, подвид lyrata (XM_002890099.1)
SEQ ID NO:263 Полинуклеотид WRI1 Thellungiella halophila (AK352786.1)
SEQ ID NO:264 Полинуклеотид WRI1 Arabidopsis thaliana (NM_101474.2)
SEQ ID NO:265 Полинуклеотид WRI1 Glycine max (XM_003530302.1)
SEQ ID NO:266 Полинуклеотид WRI1 Brachypodium distachyon (XM_003578094.1)
SEQ ID NO:267 Полинуклеотид WRI1 Sorgum bicolor (XM_002460191.1)
SEQ ID NO:268 Полинуклеотид WRI1 Zea mays (NM_001152866.1)
SEQ ID NO:269 Полинуклеотид WRI1 Glycine max (XM_003519119.1)
SEQ ID NO:270 Полинуклеотид WRI1 Glycine max (XM_003550628.1)
SEQ ID NO:271 Полинуклеотид WRI1 Medicago truncatula (XM_003610213.1)
SEQ ID NO:272 Полинуклеотид WRI1 Glycine max (XM_003523982.1)
SEQ ID NO:273 Полинуклеотид WRI1 Glycine max (XM_003525901.1)
SEQ ID NO:274 Полинуклеотид WRI1 Populus trichocarpa (XM_002325075.1)
SEQ ID NO:275 Полинуклеотид WRI1 Vitis vinifera (XM_002273010.2)
SEQ ID NO:276 Полинуклеотид WRI1 Populus trichocarpa (XM_002303830.1)
SEQ ID NO:277 Полинуклеотид WRI1 Lupinis angustifolius, частичная последовательность (NA-080818_Plate14f06.b1)
SEQ ID NO:278 Полинуклеотид WRI1 Lupinis angustifolius
SEQ ID NO:279 Полипептид WRI1 Arabidopsis thaliana (A8MS57)
SEQ ID NO:280 Полипептид WRI1 Arabidopsis thaliana (Q6X5Y6)
SEQ ID NO:281 Полипептид WRI1 Arabidopsis lyrata, подвид lyrata (XP_002876251.1)
SEQ ID NO:282 Полипептид WRI1 Brassica napus (ABD16282.1)
SEQ ID NO:283 Полипептид WRI1 Brassica napus (ADO16346.1)
SEQ ID NO:284 Полипептид WRI1 Glycine max (XP_003530370.1)
SEQ ID NO:285 Полипептид WRI1 Jatropha curcas (AEO22131.1)
SEQ ID NO:286 Полипептид WRI1 Ricinus communis (XP_002525305.1)
SEQ ID NO:287 Полипептид WRI1 Populus trichocarpa (XP_002316459.1)
SEQ ID NO:288 Полипептид WRI1 Vitis vinifera (CB129147.3)
SEQ ID NO:289 Полипептид WRI1 Brachypodium distachyon (XP_003578997.1)
SEQ ID NO:290 Полипептид WRI1 Hordeum vulgare, подвид vulgare (BAJ86627.1)
SEQ ID NO:291 Полипептид WRI1 Oryza sativa (EAY79792.1)
SEQ ID NO:292 Полипептид WRI1 Sorghum bicolor (XP_002450194.1)
SEQ ID NO:293 Полипептид WRI1 Zea mays (ACG32367.1)
SEQ ID NO:294 Полипептид WRI1 Brachypodium distachyon (XP_003561189.1)
SEQ ID NO:295 Полипептид WRI1 Brachypodium sylvaticum (ABL85061.1)
SEQ ID NO:296 Полипептид WRI1 Oryza sativa (BAD68417.1)
SEQ ID NO:297 Полипептид WRI1 Sorghum bicolor (XP_002437819.1)
SEQ ID NO:298 Полипептид WRI1 Sorghum bicolor (XP_002441444.1)
SEQ ID NO:299 Полипептид WRI1 Glycine max (XP_003530686.1)
SEQ ID NO:300 Полипептид WRI1 Glycine max (XP_003553203.1)
SEQ ID NO:301 Полипептид WRI1 Populus trichocarpa (XP_002315794.1)
SEQ ID NO:302 Полипептид WRI1 Vitis vinifera (XP_002270149.1)
SEQ ID NO:303 Полипептид WRI1 Glycine max (XP_003533548.1)
SEQ ID NO:304 Полипептид WRI1 Glycine max (XP_003551723.1)
SEQ ID NO:305 Полипептид WRI1 Medicago truncatula (XP_003621117.1)
SEQ ID NO:306 Полипептид WRI1 Populus trichocarpa (XP_002323836.1)
SEQ ID NO:307 Полипептид WRI1 Ricinus communis (XP_002517474.1)
SEQ ID NO:308 Полипептид WRI1 Vitis vinifera (CAN79925.1)
SEQ ID NO:309 Полипептид WRI1 Brachypodium distachyon (XP_003572236.1)
SEQ ID NO:310 Полипептид WRI1 Oryza sativa (BAD10030.1)
SEQ ID NO:311 Полипептид WRI1 Sorghum bicolor (XP_002444429.1)
SEQ ID NO:312 Полипептид WRI1 Zea mays (NP_001170359.1)
SEQ ID NO:313 Полипептид WRI1 Arabidopsis lyrata, подвид lyrata (XP_002889265.1)
SEQ ID NO:314 Полипептид WRI1 Arabidopsis thaliana (AAF68121.1)
SEQ ID NO:315 Полипептид WRI1 Arabidopsis thaliana (NP_178088.2)
SEQ ID NO:316 Полипептид WRI1 Arabidopsis lyrata, подвид lyrata (XP_002890145.1)
SEQ ID NO:317 Полипептид WRI1 Thellungiella halophila (BAJ33872.1)
SEQ ID NO:318 Полипептид WRI1 Arabidopsis thaliana (NP_563990.1)
SEQ ID NO:319 Полипептид WRI1 Glycine max (XP_003530350.1)
SEQ ID NO:320 Полипептид WRI1 Brachypodium distachyon (XP_003578142.1)
SEQ ID NO:321 Полипептид WRI1 Oryza sativa (EAZ09147.1)
SEQ ID NO:322 Полипептид WRI1 Sorghum bicolor (XP_002460236.1)
SEQ ID NO:323 Полипептид WRI1 Zea mays (NP_001146338.1)
SEQ ID NO:324 Полипептид WRI1 Glycine max (XP_003519167.1)
SEQ ID NO:325 Полипептид WRI1 Glycine max (XP_003550676.1)
SEQ ID NO:326 Полипептид WRI1 Medicago truncatula (XP_003610261.1)
SEQ ID NO:327 Полипептид WRI1 Glycine max (XP_003524030.1)
SEQ ID NO:328 Полипептид WRI1 Glycine max (XP_003525949.1)
SEQ ID NO:329 Полипептид WRI1 Populus trichocarpa (XP_002325111.1)
SEQ ID NO:330 Полипептид WRI1 Vitis vinifera (CBI36586.3)
SEQ ID NO:331 Полипептид WRI1 Vitis vinifera (XP_002273046.2)
SEQ ID NO:332 Полипептид WRI1 Populus trichocarpa (XP_002303866.1)
SEQ ID NO:333 Полипептид WRI1 Vitis vinifera (CBI25261.3)
SEQ ID NO:334 Sorbi-WRL1
SEQ ID NO:335 Lupan-WRL1
SEQ ID NO:336 Ricco-WRL1
SEQ ID NO:337 Полипептид WRI1 Lupin angustifolius
SEQ ID NO:338 Полинуклеотид DGAT Aspergillus fumigatus (XM_750079.1)
SEQ ID NO:339 Полинуклеотид DGAT Ricinus communis (AY366496.1)
SEQ ID NO:340 Полинуклеотид DGAT1 Vernicia fordii (DQ356680.1)
SEQ ID NO:341 Полинуклеотид DGAT1 Vernonia galamensis (EF653276.1)
SEQ ID NO:342 Полинуклеотид DGAT1 Vernonia galamensis (EF653277.1)
SEQ ID NO:343 Полинуклеотид DGAT1 Euonymus alatus (AY751297.1)
SEQ ID NO:344 Полинуклеотид DGAT1 Caenorhabditis elegans (AF221132.1)
SEQ ID NO:345 Полинуклеотид DGAT1 Rattus norvegicus (NM_053437.1)
SEQ ID NO:346 Полинуклеотид DGAT1 Homo sapiens (NM_012079.4)
SEQ ID NO:347 Полипептид DGAT1 Aspergillus fumigatus (XP_755172.1)
SEQ ID NO:348 Полипептид DGAT1 Ricinus communis (AAR11479.1)
SEQ ID NO:349 Полипептид DGAT1 Vernicia fordii (ABC94472.1)
SEQ ID NO:350 Полипептид DGAT1 Vernonia galamensis (ABV21945.1)
SEQ ID NO:351 Полипептид DGAT1 Vernonia galamensis (ABV21946.1)
SEQ ID NO:352 Полипептид DGAT1 Euonymus alatus (AAV31083.1)
SEQ ID NO:353 Полипептид DGAT1 Caenorhabditis elegans (AAF82410.1)
SEQ ID NO:354 Полипептид DGAT1 Rattus norvegicus (NP_445889.1)
SEQ ID NO:355 Полипептид DGAT1 Homo sapiens (NP_036211.2)
SEQ ID NO:356 Мотив WRI1 (R G V T/S R H R W T G R)
SEQ ID NO:357 Мотив WRI1 (F/Y E A H L W D K)
SEQ ID NO:358 Мотив WRI1 (D L A A L K Y W G)
SEQ ID NO:359 Мотив WRI1 (S X G F S/A R G X)
SEQ ID NO:360 Мотив WRI1 (H H H/Q N G R/K W E A R I G R/K V)
SEQ ID NO:361 Мотив WRI1 (Q E E A A A X Y D)
SEQ ID NO:362 Полипептид олеозина Brassica napus (CAA57545.1)
SEQ ID NO:363 Полипептид S1-1 олеозина Brassica napus (ACG69504.1)
SEQ ID NO:364 Полипептид S2-1 олеозина Brassica napus (ACG69503.1)
SEQ ID NO:365 Полипептид S3-1 олеозина Brassica napus (ACG69513.1)
SEQ ID NO:366 Полипептид S4-1 олеозина Brassica napus (ACG69507.1)
SEQ ID NO:367 Полипептид S5-1 олеозина Brassica napus (ACG69511.1)
SEQ ID NO:368 Полипептид 1 олеозина Arachis hypogaea (AAZ20276.1)
SEQ ID NO:369 Полипептид 2 олеозина Arachis hypogaea (AAU21500.1)
SEQ ID NO:370 Полипептид 3 олеозина Arachis hypogaea (AAU21501.1)
SEQ ID NO:371 Полипептид 5 олеозина Arachis hypogaea (ABC96763.1)
SEQ ID NO:372 Полипептид 1 олеозина Ricinus communis (EEF40948.1)
SEQ ID NO:373 Полипептид 2 олеозина Ricinus communis (EEF51616.1)
SEQ ID NO:374 Изоформа a полипептида олеозина Glycine max (P29530.2)
SEQ ID NO:375 Изоформа b полипептида олеозина Glycine max (P29531.1)
SEQ ID NO:376 Низкомолекулярная изоформа полипептида олеозина Linum usitatissimum (ABB01622.1)
SEQ ID NO:377 Аминокислотная последовательность высокомолекулярной изоформы полипептида олеозина Linum usitatissimum (ABB01624.1)
SEQ ID NO:378 Полипептид олеозина Helianthus annuus (CAA44224.1)
SEQ ID NO:379 Полипептид олеозина Zea mays (NP_001105338.1)
SEQ ID NO:380 Полипептид стеролеозина Brassica napus (ABM30178.1)
SEQ ID NO:381 Полипептид стеролеозина SLO1-1 Brassica napus (ACG69522.1)
SEQ ID NO:382 Полипептид стеролеозина SLO2-1 Brassica napus (ACG69525.1)
SEQ ID NO:383 Полипептид стеролеозина Sesamum indicum (AAL13315.1)
SEQ ID NO:384 Полипептид стеролеозина Zea mays (NP_001152614.1)
SEQ ID NO:385 Полипептид калеозина CLO-1 Brassica napus (ACG69529.1)
SEQ ID NO:386 Полипептид калеозина CLO-3 Brassica napus (ACG69527.1)
SEQ ID NO:387 Полипептид калеозина Sesamum indicum (AAF13743.1)
SEQ ID NO:388 Полипептид калеозина Zea mays (NP_001151906.1)
SEQ ID NO:389 Полинуклеотид олеозина Brassica napus (X82020.1)
SEQ ID NO:390 Полинуклеотид олеозина S1-1 Brassica napus (EU678256.1)
SEQ ID NO:391 Полинуклеотид олеозина S2-1 Brassica napus (EU678255.1)
SEQ ID NO:392 Полинуклеотид олеозина S3-1 Brassica napus (EU678265.1)
SEQ ID NO:393 Полинуклеотид олеозина S4-1 Brassica napus (EU678259.1)
SEQ ID NO:394 Полинуклеотид олеозина S5-1 Brassica napus (EU678263.1)
SEQ ID NO:395 Полинуклеотид олеозина 1 Arachis hypogaea (DQ097716.1)
SEQ ID NO:396 Полинуклеотид олеозина 2 Arachis hypogaea (AY722695.1)
SEQ ID NO:397 Полинуклеотид олеозина 3 Arachis hypogaea (AY722696.1)
SEQ ID NO:398 Полинуклеотид олеозина 5 Arachis hypogaea (DQ368496.1)
SEQ ID NO:399 Полинуклеотид олеозина Helianthus annuus (X62352.1)
SEQ ID NO:400 Полинуклеотид олеозина Zea mays (NM_001111868.1)
SEQ ID NO:401 Полинуклеотид стеролеозина Brassica napus (EF143915.1)
SEQ ID NO:402 Полинуклеотид стеролеозина SLO1-1 Brassica napus (EU678274.1)
SEQ ID NO:403 Полинуклеотид стеролеозина SLO2-1 Brassica napus (EU678277.1)
SEQ ID NO:404 Полинуклеотид стеролеозина Zea mays (NM_001159142.1)
SEQ ID NO:405 Полинуклеотид калеозина CLO-1 Brassica napus (EU678281.1)
SEQ ID NO:406 Полинуклеотид калеозина CLO-3 Brassica napus (EU678279.1)
SEQ ID NO:407 Полинуклеотид калеозина Sesamum indicum (AF109921.1)
SEQ ID NO:408 Полинуклеотид калеозина Zea mays (NM_001158434.1)
SEQ ID NO:409 Полная векторная последовательность pJP3502 (трехгенная)
SEQ ID NO:410 Полная векторная последовательность pJP3503 (четырехгенная)
SEQ ID NO:411 Последовательность ТДНК pJP3502 (вставленная в геном)
SEQ ID NO:412 Последовательность ТДНК pJP3503 (вставленная в геном)
SEQ ID NO:413 Векторная последовательность pJP3507
SEQ ID NO:414 Линкерная последовательность
SEQ ID NO:415 Соевая синергия
SEQ ID NO:416 12ABFJYC_pJP3569_вставка
SEQ ID NO:417 Частичная последовательность CGI-58 N. benthamiana, выбранная для подавления вмРНК-интерференции (pTV46)
SEQ ID NO:418 Частичная последовательность АГФазы N. tabacum, выбранная для подавления вмРНК-интерференции (pTV35)
SEQ ID NO:419 Мотив липазы GXSXG
SEQ ID NO:420 Мотив ацилтрансферазы HX(4)D
SEQ ID NO:421 Вероятный липид-связывающий мотив VX(3)HGF
SEQ ID NO:422 Полинуклеотид CGi58 Arabidopsis thaliana (NM_118548.1)
SEQ ID NO:423 Полинуклеотид CGi58 Brachypodium distachyon (XM_003578402.1)
SEQ ID NO:424 Полинуклеотид CGi58 Glycine max (XM_003523590.1)
SEQ ID NO:425 Полинуклеотид CGi58 Zea mays (NM_001155541.1)
SEQ ID NO:426 Полинуклеотид CGi58 Sorghum bicolor (XM_002460493.1)
SEQ ID NO:427 Полинуклеотид CGi58 Ricinus communis (XM_002510439.1)
SEQ ID NO:428 Полинуклеотид CGi58 Medicago truncatula (XM_003603685.1)
SEQ ID NO:429 Полипептид CGi58 Arabidopsis thaliana (NP_194147.2)
SEQ ID NO:430 Полипептид CGi58 Brachypodium distachyon (XP_003578450.1)
SEQ ID NO:431 Полипептид CGi58 Glycine max (XP_003523638.1)
SEQ ID NO:432 Полипептид CGi58 Zea mays (NP_001149013.1)
SEQ ID NO:433 Полипептид CGi58 Sorghum bicolor (XP_002460538.1)
SEQ ID NO:434 Полипептид CGi58 Ricinus communis (XP_002510485.1)
SEQ ID NO:435 Полипептид CGi58 Medicago truncatula (XP_003603733.1)
SEQ ID NO:436 Полипептид CGi58 Oryza sativa (EAZ09782.1)
SEQ ID NO:437 Полинуклеотид LEC2 Arabidopsis thaliana (NM_102595.2)
SEQ ID NO:438 Полинуклеотид LEC2 Medicago truncatula (X60387.1)
SEQ ID NO:439 Полинуклеотид LEC2 Brassica napus (HM370539.1)
SEQ ID NO:440 Полинуклеотид BBM Arabidopsis thaliana (NM_121749.2)
SEQ ID NO:441 Полинуклеотид BBM Medicago truncatula (AY899909.1)
SEQ ID NO:442 Полипептид LEC2 Arabidopsis thaliana (NP_564304.1)
SEQ ID NO:443 Полипептид LEC2 Medicago truncatula (CAA42938.1)
SEQ ID NO:444 Полипептид LEC2 Brassica napus (ADO16343.1)
SEQ ID NO:445 Полипептид BBM Arabidopsis thaliana (NP_197245.2)
SEQ ID NO:446 Полипептид BBM Medicago truncatula (AAW82334.1)
SEQ ID NO:447 Индуцибельный промотор alcA Aspergilus niger
SEQ ID NO:448 Индуктор AlcR, который активирует промотор AlcA в присутствии этанола
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Общие приемы и определения
Если специально не указано иное, все технические и научные термины, используемые в настоящем документе, следует понимать в том же значении, которое обычно понимается специалистами в данной области техники (например, в области клеточных культур, молекулярной генетики, иммунологии, иммуногистохимии, химии белков, химии липидов и жирных кислот, производства биотоплива и в биохимии).
Если не указано иное, то приемы работы с рекомбинантными белками, клеточными культурами и иммунологические приемы, использованные в настоящем изобретении, представляют собой стандартные процедуры, хорошо известные специалистам в данной области техники. Такие приемы описаны и объяснены в литературных источниках, таких как J. Perbal, A Practical Guide to Molecular Cloning, John Wiley and Sons (1984), J. Sambrook et al., Molecular Cloning: A Laboratory Manual, Cold Spring Harbour Laboratory Press (1989), T.A. Brown (редактор), Essential Molecular Biology: A Practical Approach, тома 1 и 2, IRL Press (1991), D.M. Glover and B.D. Hames (редакторы), DNA Cloning: A Practical Approach, тома 1-4, IRL Press (1995 и 1996), F.M. Ausubel et al. (редакторы), Current Protocols in Molecular Biology, Green Pub. Associates and Wiley-Interscience (1988, включая все обновления до настоящего времени), Ed Harlow and David Lane (редакторы) Antobodies: A Laboratory Manual, Cold Spring Harbour Laboratory, (1988), а также J.E. Coligan et al. (редакторы) Current Protocols in Immunology, John Wiley & Sons (включая все обновления до настоящего времени).
Некоторые определения
Термин «трансгенный нечеловеческий организм» относится, например, к целому растению, водоросли, нечеловеческому животному или организму, пригодному для ферментации, такому как дрожжи или грибы, содержащему экзогенный полинуклеотид (трансген) или экзогенный полипептид. В одном варианте реализации трансгенный нечеловеческий организм не представляет собой животное или его часть. В одном варианте реализации трансгенный нечеловеческий организм представляет собой фототрофный организм (например, растение или водоросль), способный получать энергию из солнечного света для синтеза органических веществ для питания. В другом варианте реализации трансгенный нечеловеческий организм представляет собой фотосинтезирующую бактерию.
Термин «экзогенный» в контексте полинуклеотида или полипептида относится к полинуклеотиду или полипептиду, содержащемуся в клетке, которая в природе не содержит указанный полинуклеотид или полипептид. Такая клетка упоминается в настоящем документе как «рекомбинантная клетка» или «трансгенная клетка». В одном варианте реализации экзогенный полинуклеотид или полипептид относится к другому роду, чем клетка, содержащая указанный экзогенный полинуклеотид или полипептид. В другом варианте реализации экзогенный полинуклеотид или пептид относится к другому виду. В одном варианте реализации экзогенный полинуклеотид или полипептид экспрессируется в растении-хозяине или в клетке растения, а экзогенный полинуклеотид или пептид относится к другому виду или роду. Экзогенный полинуклеотид или полипептид может быть не встречающимся в природе, таким как, например, синтетическая молекула ДНК, которую получают способами рекомбинантной ДНК. Молекула ДНК может, зачастую предпочтительно, содержать область, кодирующую белок, которая кодон-оптимизирована для экспрессии в клетке, вырабатывающую за счет этого полипептид, который имеет такую же аминокислотную последовательность, что и природный полипептид, даже несмотря на то, что нуклеотидная последовательность области, кодирующей белок, не встречается в природе. Экзогенный полинуклеотид может кодировать или экзогенный полипептид может представлять собой: диацилглицерин-ацилтрансферазу (DGAT), такую как DGAT1 или DGAT2, глицерин-3-фосфат-ацилтрансферазу (GPAT), такую как GPAT, которая может синтезировать MAG, фактор транскрипции Wrinkled 1 (WRI1), олеозин или полипептид молчащего супрессора. В одном варианте реализации экзогенный полипептид представляет собой экзогенный MGAT, такой как MGAT1 или MGAT2.
Используемый в настоящем документе термин «экстрагированный липид» относится к композиции, экстрагированной из трансгенного организма или его части, которая содержит по меньшей мере 60% (масс./масс.) липидов.
Используемый в настоящем документе термин «неполярный липид» относится к жирным кислотам и их производным, которые растворимы в органических растворителя, но нерастворимы в воде. Жирные кислоты могут быть свободными жирными кислотами и/или быть в эстерифицированной форме. Примеры эстерифицированных форм включают, но не ограничиваясь этим, триацилглицерин (TAG), диацилглицерин (DAG), моноацилглицерин (MAG). Неполярные липиды включают также стеролы, стероловые эфиры и восковые эфиры. Неполярные липиды известны также как «нейтральные липиды». Неполярный липид при комнатной температуре, как правило, является жидким. Предпочтительно, неполярный липид преимущественно (>50%) состоит из жирных кислот, которые имеют по меньшей мере 16 углеродных атомов в длину. Более предпочтительно, по меньшей мере 50% от всех жирных кислот в неполярных липидах представляют собой С18 жирные кислоты, например, олеиновую кислоту. В одном варианте реализации по меньшей мере 50%, более предпочтительно по меньшей мере 70%, более предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 91%, более предпочтительно по меньшей мере 92%, более предпочтительно по меньшей мере 93%, более предпочтительно по меньшей мере 94%, более предпочтительно по меньшей мере 95%, более предпочтительно по меньшей мере 96%, более предпочтительно по меньшей мере 97%, более предпочтительно по меньшей мере 98%, более предпочтительно по меньшей мере 99% от жирных кислот в неполярных липидах настоящего изобретения может встречаться в виде TAG. Неполярные липиды могут быть дополнительно очищены или обработаны, например, гидролизом с сильным основанием для высвобождения свободных жирных кислот, или фракционированием, перегонкой или тому подобными. Неполярные липиды могут содержаться или могут быть получены из частей растения, таких как семена, листья или фрукты, из рекомбинантных клеток или из нечеловеческих организмов, таких как дрожжи. Неполярные липиды настоящего изобретения могут образовывать часть «масла семян», если они получены из семян. Концентрации свободного и эстерифицированного стерола (например, ситостерола, кампестеола, стигмастерола, брассикастерола, Δ5-авенастерола, ситостанола, кампестанола и холестерола) в экстрагированных липидах могут быть такими, как описано в публикации Phillips et al., 2002. Стеролы в растительных маслах содержатся в виде свободных спиртов, сложных эфиров с жирными кислотами (эстерифицированные стеролы), гликозидов и ацилированных гликозидов стеролов. Концентрации стерола в природных растительных маслах (маслах семян) варьируются до максимального значения около 1100 мг/100 г. Гидрогенированное пальмовое масло имеет одну из самых низких концентраций природных растительных масел, составляющую около 60 мг/100 г. Выделенные или экстрагированные масла семян по настоящему изобретению предпочтительно содержат от около 100 до около 1000 мг общих стеролов/100 г масла. Для применения в качестве пищи или корма, предпочтительно, чтобы стеролы содержались, в основном, в свободной или эстерифицированной формах, а не в гликозилированных формах. В маслах семян по настоящему изобретению, предпочтительно, по меньшей мере 50% стеролов в маслах содержатся в виде эстерифицированных стеролов, за исключением соевого масла, содержащего около 25% эстерифицированных стеролов. Масло канолы и рапсовое масло по настоящему изобретению, предпочтительно, содержат от около 500 до около 800 мг общих стеролов/100 г, при этом ситостерол является основным стеролом, а следующим по распространенности является кампестерол. Кукурузное масло по настоящему изобретению, предпочтительно, содержит от около 600 до около 800 мг общих стеролов/100 г, при этом основным стеролом является ситостерол. Соевое масло по настоящему изобретению, предпочтительно, содержит от около 150 до около 350 мг общих стеролов/100 г, при этом ситостерол является основным стеролом, а следующим по распространенности является стигмастерол, при этом масло содержит больше свободных стеролов, чем эстерифицированных стеролов. Хлопковое масло по настоящему изобретению, предпочтительно, содержит от около 200 до около 350 мг общих стеролов/100 г, при этом основным стеролом является ситостерол. Кокосовое масло и пальмовое масло по настоящему изобретению, предпочтительно, содержат от около 50 до около 100 мг общих стеролов/100 г, при этом ситостерол является основным стеролом. Сафлоровое масло по настоящему изобретению, предпочтительно, содержит от около 150 до около 250 мг общих стеролов/100 г, при этом ситостерол является основным стеролом. Арахисовое масло по настоящему изобретению, предпочтительно, содержит от около 100 до около 200 мг общих стеролов/100 г, при этом ситостерол является основным стеролом. Кунжутное масло по настоящему изобретению, предпочтительно, содержит от около 400 до около 600 мг общих стеролов/100 г, при этом ситостерол является основным стеролом. Подсолнечное масло по настоящему изобретению, предпочтительно, содержит от около 200 мг до 400 мг общих стеролов/100 г, при этом ситостерол является основным стеролом. Масла, полученные из вегетирующих частей растения, в соответствии с настоящим изобретением, предпочтительно, содержат менее 200 мг общих стеролов/100 г, более предпочтительно менее 100 мг общих стеролов/100 г, и наиболее предпочтительно менее 50 мг общих стеролов/100 г, при этом основную часть стеролов представляют собой свободные стеролы.
Используемый в настоящем документе термин «масло семян» относится к композиции, полученной из семян/зерен растения, которая содержит по меньшей мере 60% (масс./масс.) липидов, или которая может быть получена из семян/зерен, если масло семян все еще содержится в семенах/зернах. То есть масло семян по настоящему изобретению включает масло семян, которое содержится в семенах/зернах или их части, а также масло семян, которое экстрагировано из семян/зерен. Масло семян предпочтительно представляет собой экстрагированное масло семян. Как правило, при комнатной температуре масло семян является жидким. Предпочтительно, общее содержание жирных кислот (TFA) в масле семян преимущественно (>50%) содержит жирные кислоты, которые по меньшей мере имеют 16 углеродных атомов в длину. Более предпочтительно, по меньшей мере 50% от общих жирных кислот в масле семян представляют собой С18 жирные кислоты, например, олеиновую кислоту. Жирные кислоты, как правило, находятся в эстерифицированной форме, такой как, например, TAG, DAG, ацил-CoA или фосфолипид. Жирные кислоты могут быть свободными жирными кислотами и/или могут быть в эстерифицированной форме. В одном варианте реализации по меньшей мере 50%, более предпочтительно по меньшей мере 70%, более предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 91%, более предпочтительно по меньшей мере 92%, более предпочтительно по меньшей мере 93%, более предпочтительно по меньшей мере 94%, более предпочтительно по меньшей мере 95%, более предпочтительно по меньшей мере 96%, более предпочтительно по меньшей мере 97%, более предпочтительно по меньшей мере 98%, более предпочтительно по меньшей мере 99% от жирных кислот в масле семян по настоящему изобретению может встречаться в виде TAG. В одном варианте реализации масло семян по настоящему изобретению представляет собой «по существу очищенное» или «очищенное» масло, которое отделено от одного или более других липидов, нуклеиновых кислот, полипептидов или других загрязняющих молекул, с которыми оно связано в семенах или в неочищенном экстракте. Предпочтительно, чтобы по существу очищенное масло семян было по меньшей мере на 60% чистым, более предпочтительно по меньшей мере на 75% чистым и более предпочтительно по меньшей мере на 90% чистым от других компонентов, с которыми оно связано в семенах или экстракте. Масло семян по настоящему изобретению может дополнительно содержать молекулы нежирных кислот, такие как, но не ограничиваясь этим, стеролы. В одном варианте реализации масло семян представляет собой масло канолы (виды Brassica, такие как Brassica carinata, Brassica juncea, Brassica napobrassica, Brassica napus), горчичное масло (Brassica juncea), другие масла Brassica (например, Brassica napobrassica, Brassica camelina), масло подсолнечника (виды Helianthus, такие как Helianthus annuus), льняное масло (Linum usitatissimum), соевое масло (Glycine max), сафлоровое масло (Carthamus tinctorius), кукурузное масло (Zea mays), табачное масло (виды Nicotiana, такие как Nicotiana tabacum или Nicotiana benthamiana), арахисовое масло (Arachis hypogaea), пальмовое масло (Elaeis guineensis), хлопковое масло (Gossypium hirsutum), кокосовое масло (Cocos nucifera), масло авокадо (Persea americana), оливковое масло (Olea europaea), масло кешью (Anacardium accidentale), масло макадамии (Macadamia intergrifolia), миндальное масло (Prunus amygdalus), масло из семян овса (Avena sativa), рисовое масло (виды Oryza, такие как Oryza sativa и Oryza glabettina), масло семян Arabidopsis (Arabidopsis thaliana) или масло из семян Acrocomia aculeate (пальма макауба), Aracinis hypogaea (арахис), Astrocaryum murumuru (мурумуру), Astrocaryum vulgare (тукума), Attalea geraensis (Indaiá-rateiro), Attalea humilis (американская масличная пальма), Attalea oleifera (andaiá), Attalea phalerata (урикури), Attalea speciosa (бабассу), Beta vulgaris (сахарная свекла), Camelina sativa (ложный лен), Caryocar brasiliense (кариокар), Crambe abyssinica (абиссинская капуста), Cucumis melo (дыня), Hordeum vulgare (ячмень), Jatropha curcas (лекарственный орех), Joannesia princeps (ореховое дерево арара), Licania rigida (ойтикика), Lupinus angustifolius (люпин), Mauritia flexuosa (пальма бурити), Maximiliana maripa (пальма инайа), виды Miscanthus, такие как Miscantus x giganteus и Miscanthus sinensis, Oenocarpus bacaba (bacaba-do-azeite), Oenocarpus bataua (patauã), Oenocarpus distichus (bacaba-de-leque), Panicum virgatum (просо прутьевидное), Paraqueiba paraensis (марь), Persea amencana (авокадо), Pongamia pinnata (индийский бук), Populus trichocarpa, Ricinus communis (клещевина обыкновенная), виды Saccharum (сахарный тростник), Sesamum indicum (кунжут), Solanum tuberosum (картофель), виды Sorghum, такие как Sorghum bicolor, Sorghum vulgare, Theobroma grandiforum (купуасу), виды Trifolium, Trithrinax brasiliensis (бразильская игольчатая пальма) и виды Triticum (пшеница), такие как Triticum aestivum. Масло семян может быть экстрагировано из семян/зерен любым способом, известным в данной области техники. Они обычно включают экстракцию неполярными растворителями, такими как диэтиловый эфир, петролейный эфир, хлороформ/метанол или бутанольные смеси, обычно относящуюся к первому измельчению семян. Липиды, связанные в зернах с крахмалом, могут быть экстрагированы водонасыщенным бутанолом. Масло семян может быть «дегуммировано» по способам, известным в данной области техники, для удаления полисахаридов, или может быть обработано другими способами для удаления загрязнений или для улучшения чистоты, стабильности или цвета. TAG и другие сложные эфиры в масле семян могут быть гидролизованы для высвобождения свободных жирных кислот, или масло семян гидрогенируют, обрабатывают химическим способом или ферментативным способом, как известно в данной области техники.
Используемый в настоящем документе термин «жирная кислота» относится к карбоновой кислоте с длинным алифатическим остатком, имеющим по меньшей мере 8 углеродных атомов в длину, который является насыщенным или ненасыщенным. Как правило, жирные кислоты имеют цепь из связанных друг с другом углеродных атомов, содержащую по меньшей мере 12 углеродных атомов в длину. Большинство природных жирных кислот имеют четное количество углеродных атомов, поскольку в их биосинтезе участвует ацетат, который имеет два углеродных атома. Жирные кислоты могут быть в свободном состоянии (не эстерифицированными) или в эстерифицированной форме, такой как часть связи TAG, DAG, MAG, ацил-CoA (тио-эфир) или в другой ковалентно связанной форме. При ковалентном связывании в эстерифицированной форме, жирные кислоты упоминаются в настоящем документе как «ацильная» группа. Жирная кислота может быть эстерифицирована как фосфолипид, такой как фосфатидилхолин (PC), фосфатидилэтаноламин, фосфатидилсерин, фосфатидилглицерин, фосфатидилинозитол или дифосфатидилглицерин. Насыщенные жирные кислоты не содержат никаких двойных связей или других функциональных групп в своей цепи. Термин «насыщенная» относится к водороду в том смысле, что все углеродные атомы (кроме группы карбоновой кислоты [ COOH)] содержат максимально возможное количество водородных атомов. Другими словами, омега-конец (ω)содержит 3 атома водорода (CH3-), а каждый углерод в цепи содержит 2 водорода (-CH2-). Ненасыщенные жирные кислоты имеют такую же форму, что и насыщенные жирные кислоты, за исключением того, что в цепи существует одна или более алкеновых функциональных групп, где каждый алкен заменяет однократно связанную «-CH2-CH2-» часть цепи на двукратно связанную «-CH=CH-» часть (то есть углерод, связанный с другим углеродом двойной связью). Два следующих углеродных атома в цепи, которые связаны с какой-либо стороной этой двойной связи, могут встречаться в цис или транс конфигурации.
Используемые в настоящем документе термины «полиненасыщенная жирная кислота» или «PUFA» относится к жирной кислоте, которая содержит по меньшей мере 12 углеродных атомов в своей углеродной цепи и по меньшей мере две алкеновые группы (двойные углерод-углеродные связи). Содержание PUFA в вегетирующей части растения или нечеловеческом организме или его части по настоящему изобретению может быть увеличено или уменьшено в зависимости от комбинации экзогенных полинуклеотидов, экспрессируемых в вегетирующей части растения или нечеловеческом организме или его части, или в семенах по настоящему изобретению. Например, если экспрессируется MGAT, то концентрация PUFA обычно увеличивается, тогда как если экспрессируется только DGAT1 или в комбинации с WRI1, то концентрация PUFA обычно снижается из-за увеличения концентрации олеиновой кислоты. Далее, если снижается активность десатуразы Δ12, например, за счет подавления эндогенной Δ12 десатуразы, то содержание PUFA маловероятно будет увеличиваться в отсутствие экзогенного полинуклеотида, кодирующего другую Δ12 десатуразу.
«Моноацилглицерид» или «MAG» представляет собой глицерид, в котором глицерин эстерифицирован одной жирной кислотой. При использовании в настоящем документе, MAG содержит гидроксильную группу в sn-1/3 (также упоминаемом в настоящем документе как sn-1 MAG или 1-MAG, или 1/3-MAG) или sn-2 положении (также упоминаемом в настоящем документе как 2-MAG), и, следовательно, MAG не включает фосфорилированные молекулы, такие как PA или PC. Поэтому MAG представляет собой компонент нейтральных липидов в клетке.
«Диацилглицерид» или «DAG» представляет собой глицерид, в котором глицерин эстерифицирован двумя жирными кислотами, которые могут быть одинаковыми или, предпочтительно, различными. При использовании в настоящем документе, DAG содержит гидроксильную группу в sn-1,3 или sn-2 положении и, следовательно, DAG не включает фосфорилированные молекулы, такие как PA или PC. Поэтому DAG представляет собой компонент нейтральных липидов в клетке. В пути Кеннеди синтеза DAG (Фигура 1) предшественник sn-глицерин-3-фосфат (G-3-P) эстерифицируется до двух ацильных групп, каждая из которых образуется из сложного эфира коэнзима А жирной кислоты, в первой реакции, катализируемой глицерин-3-фосфат-ацилтрансферазой (GPAT) в положении sn-1 с образованием LysoPA, с последующим вторым ацилированием в положении sn-2, катализируемым ацилтрансферазой лизофосфатидной кислоты (LPAAT) с образованием фосфатидной кислоты (PA). Это промежуточное соединение затем дефосфорилируется с образованием DAG. В альтернативном анаболическом пути (Фигура 1), DAG может быть образован за счет ацилирования либо sn-1 MAG, либо предпочтительно sn-2 MAG, катализируемого действием MGAT. DAG может быть также образован из TAG за счет удаления ацильной группы под действием липазы, или в сущности из PC за счет удаления холиновой концевой группы под действием любого из ферментов CPT, PDCT или PLC (Фигура 1).
«Триацилглицерид» или «TAG» представляет собой глицерид, в котором глицерин эстерифицирован тремя жирными кислотами, которые могут быть одинаковыми (например, как в три-олеине) или, более часто, различными. В пути Кеннеди синтеза TAG, DAG образуется так, как описано выше, а затем эстерифицируется третья ацильная группа к глицериновому скелету под действием DGAT. Альтернативные пути образования TAG включают путь, катализируемый ферментом PDAT, и путь MGAT, описанные в настоящем документе.
Используемый в настоящем документе термин «ацилтрансфераза» относится к белку, который может переносить ацильную группу с ацил-CoA на субстрат, и включает MGAT, GPAT и DGAT.
Используемый в настоящем документе термин «Wrinkled 1» или «WRI1», или «WRL1» относится к фактору транскрипции класса AP2/ERWEBP, который регулирует экспрессию нескольких ферментов, участвующих в гликолизе и de novo биосинтезе жирных кислот. WRI1 содержит два растение-специфичных ДНК-связывающих домена (AP2/EREB). WRI1 по меньшей мере в Arabidopsis регулирует также разложение сахарозы посредством гликолиза, регулируя таким образом доставку предшественников для биосинтеза жирных кислот. Другими словами, он контролирует поток углерода из первичных продуктов фотосинтеза к месту хранения липидов. Мутанты wri1 имеют фенотип сморщенных семян из-за дефекта внедрения сахарозы и глюкозы в TAG.
Примеры генов, которые транскрибируются под действием WRI1, включают, но не ограничиваясь этим, одну или более, предпочтительно все из: пируваткиназы (At5g52920, At3g22960), E1 альфа-субъединицы пируват-дегидрогеназы (PDH) (At1g01090), ацетил-CoA-карбоксилазы (ACCаза), субъединицы BCCP2 (At5g15530), еноил-ACP-редуктазы (At2g05990; EAR), фосфоглицерат-мутазы (At1g22170), цитозольной фруктокиназы и цитозольной фосфоглицерат-мутазы, синтазы сахарозы (SuSy) (см., например, Liu et al., 2010b; Baud et al., 2007; Ruuska et al., 2002).
WRL1 содержит консервативный домен AP2 (cd00018). AP2 представляет собой ДНК-связывающий домен, находящийся в регуляторах транскрипции растений, таких как APETALA2 и EREBP (этилен-чувствительный элемент-связывающий белок). В EREBP указанный домен специфически связывается с GCC-боксом 11bp этилен-чувствительного элемента (ERE), промотирующего элемента, необходимого для чувствительности к этилену. EREBP и фактор, связывающий С-повтор, CBF1, который участвует в реакции на стресс, содержат одну копию домена AP2. APETALA2-подобные белки, которые играют роль в развитии растения, содержат две копии.
Другие мотивы последовательностей в WRI1 его функциональных гомологах включают:
1. R G V T/S R H R W T G R (SEQ ID NO:356).
2. F/Y E A H L W D K (SEQ ID NO:357).
3. D L A A L K Y W G (SEQ ID NO:358).
4. S X G F S/A R G X (SEQ ID NO:359).
5. H H H/Q N G R/K W E A R I G R/K V (SEQ ID NO:360).
6. Q E E A A A X Y D (SEQ ID NO:361).
Используемый в настоящем документе термин «Wrinkled 1» или «WRI1» включает также «Wrinkled 1-подобные» или «WRI1-подобные» белки. Примеры белков WRI1 включают номера доступа: Q6X5Y6 (Arabidopsis thaliana; SEQ ID NO:280), XP_002876251.1 (Arabidopsis lyrata, подвид Lyrata; SEQ ID NO:281), ABD16282.1 (Brassica napus; SEQ ID NO:282), ADO16346.1 (Brassica napus; SEQ ID NO:283), XP_003530370.1 (Glycine max; SEQ ID NO:284), AEO22131.1 (Jatropha curcas; SEQ ID NO:285), XP_002525305.1 (Ricinus communis; SEQ ID NO:286), XP_002316459.1 (Populus trichocarpa; SEQ ID NO:287), CBI29147.3 (Vitis vinifera; SEQ ID NO:288), XP_003578997.1 (Brachypodium distachyon; SEQ ID NO:289), BAJ86627.1 (Hordeum vulgare, подвид vulgare; SEQ ID NO:290), EAY79792.1 (Oryza sativa; SEQ ID NO:291), XP_002450194.1 (Sorghum bicolor; SEQ ID NO:292), ACG32367.1 (Zea mays; SEQ ID NO:293, XP_003561189.1 (Brachypodium distachyon; SEQ ID NO:294), ABL85061.1 (Brachypodium sylvaticum; SEQ ID NO:295), BAD68417.1 (Oryza sativa; SEQ ID NO:296), XP_002437819.1 (Sorghum bicolor; SEQ ID NO:297), XP_002441444.1 (Sorghum bicolor; SEQ ID NO:298), XP_003530686.1 (Glycine max; SEQ ID NO:299), XP_003553203.1 (Glycine max; SEQ ID NO:300), XP_002315794.1 (Populus trichocarpa; SEQ ID NO:301), XP_002270149.1 (Vitis vinifera; SEQ ID NO:302), XP_003533548.1 (Glycine max; SEQ ID NO:303), XP_003551723.1 (Glycine max; SEQ ID NO:304), XP_003621117.1 (Medicago truncatula; SEQ ID NO:305), XP_002323836.1 (Populus trichocarpa; SEQ ID NO:306), XP_002517474.1 (Ricinus communis; SEQ ID NO:307), CAN79925.1 (Vitis vinifera; SEQ ID NO:308), XP_003572236.1 (Brachypodium distachyon; SEQ ID NO:309), BAD10030.1 (Oryza sativa; SEQ ID NO:310), XP_002444429.1 (Sorghum bicolor; SEQ ID NO:311), NP_001170359.1 (Zea mays; SEQ ID NO:312), XP_002889265.1 (Arabidopsis lyrata, подвид lyrata; SEQ ID NO:313), AAF68121.1 (Arabidopsis thaliana; SEQ ID NO:314), NP_178088.2 (Arabidopsis thaliana; SEQ ID NO:315), XP_002890145.1 (Arabidopsis lyrata, подвид lyrata; SEQ ID NO:316), BAJ33872.1 (Thellungiella halophila; SEQ ID NO:317), NP_563990.1 (Arabidopsis thaliana; SEQ ID NO:318), XP_003530350.1 (Glycine max; SEQ ID NO:319), XP_003578142.1 (Brachypodium distachyon; SEQ ID NO:320), EAZ09147.1 (Oryza sativa; SEQ ID NO:321), XP_002460236.1 (Sorghum bicolor; SEQ ID NO:322), NP_001146338.1 (Zea mays; SEQ ID NO:323), XP_003519167.1 (Glycine max; SEQ ID NO:324), XP_003550676.1 (Glycine max; SEQ ID NO:325), XP_003610261.1 (Medicago truncatula; SEQ ID NO:326), XP_003524030.1 (Glycine max; SEQ ID NO:327), XP_003525949.1 (Glycine max; SEQ ID NO:328), XP_002325111.1 (Populus trichocarpa; SEQ ID NO:329), CBI36586.3 (Vitis vinifera; SEQ ID NO:330), XP_002273046.2 (Vitis vinifera; SEQ ID NO:331), XP_002303866.1 (Populus trichocarpa; SEQ ID NO:332) и CBI25261.3 (Vitis vinifera; SEQ ID NO:333). Дополнительные примеры включают Sorbi-WRL1 (SEQ ID NO:334), Lupan-WRL1 (SEQ ID NO:335), Ricco-WRL1 (SEQ ID NO:336) и WRI1 Lupin angustifolius (SEQ ID NO:337).
Используемый в настоящем документе термин «моноацилглицерин-ацилтрансфераза» или «MGAT» относится к белку, который переносит жирную ацильную группу с ацил-CoA к субстрату MAG с образованием DAG. Следовательно, термин «активность моноацилглицерин-ацилтрансферазы» относится по меньшей мере к переносу ацильной группы от ацил-CoA к MAG с получением DAG. MGAT лучше всего известна по своей роли в поглощении жира в кишечнике млекопитающих, где жирные кислоты и sn-2 MAG, образованные в результате расщепления жира, входящего в рацион, пересинтезируются в TAG в энтероцитах для синтеза и секреции хиломикрона. MGAT катализирует первую стадию этого процесса, на которой ковалентно связывается ацильная группа от жирного ацила-CoA, образованного из жирных кислот и CoA, и sn-2 MAG. Используемый в настоящем документе термин «MGAT» включает ферменты, которые действуют на субстраты sn-1/3 MAG и/или sn-2 MAG с образованием sn-1,3 DAG и/или sn-1,2/2,3-DAG, соответственно. В предпочтительном варианте реализации MGAT имеет преимущество для субстрата sn-2 MAG, по сравнению с sn-1 MAG, или использует в качестве субстрата, в основном, только sn-2 MAG (примеры включают MGAT, описанные в публикации Cao et al., 2003 (специфичность мышиной MGAT1 для sn2-18:1-MAG > sn1/3-18:1-MAG (Фигура 5)); Yen and Farese, 2003 (общие активности мышиной MGAT1 и человеческой MGAT2 выше на подложках ацил-акцепторных подложках 2-MAG, чем на 1-MAG (Фигура 5); и Cheng et al., 2003 (активность человеческой MGAT3 на 2-MAG гораздо выше, чем на подложках 1/3-MAG (Фигура 2D)).
При использовании в настоящем документе, MGAT не включает ферменты, которые переносят ацильную группу, предпочтительно к LysoPA, по сравнению с MAG, такие ферменты известные как LPAAT. То есть MGAT преимущественно использует нефосфорилированные моноацильные субстраты, несмотря даже на то, что они могут обладать более низкой каталитической активностью на LysoPA. Предпочтительная MGAT не обладает поддающейся обнаружению активностью при ацилировании LysoPA. Как показано в настоящем документе, MGAT (то есть MGAT2 M. musculus) может также обладать функцией DGAT, но действует, в основном, как MGAT, то есть обладает более высокой каталитической активностью как MGAT, чем как DGAT, при выражении активности фермента в единицах нмоль продукта/мин./мг белка (см. также Yen et al., 2002).
Существует три известных класса MGAT, упоминаемые как MGAT1, MGAT2 и MGAT3, соответственно. Гомологи человеческого гена MGAT1 (AF384163; SEQ ID NO:7) присутствуют (то есть известны последовательности) по меньшей мере у шимпанзе, собак, коров, мышей, крыс, данио, Caenorhabditis elegans, Schizosaccharomyces pombe, Saccharomyces cerevisiae, Kluyveromyces lactis, Eremothecium gossypii, Magnaporthe grisea и Neurospora crassa. Гомологи человеческого гена MGAT2 (AY157608) присутствуют по меньшей мере у шимпанзе, собак, коров, мышей, крыс, кур, данио, плодовых мушек и москитов. Гомологи человеческого гена MGAT3 (AY229854) присутствуют по меньшей мере у шимпанзе, собак, коров и данио. Однако гомологи из других организмов могут быть легко идентифицированы по способам, известным в данной области техники для идентификации гомологичных последовательностей.
Примеры полипептидов MGAT1 включают белки, кодируемые генами MGAT1 из Homo sapiens (AF384163; SEQ ID NO:7), Mus musculus (AF384162; SEQ ID NO:8), Pan troglodytes (XM_001166055 и XM_0526044.2; SEQ ID NO:9 и SEQ ID NO:10, соответственно), Canis familiais (XM_545667.2; SEQ ID NO:11), Bos Taurus (NM_001001153.2; SEQ ID NO:12), Rattus norvegicus (NM_001108803.1; SEQ ID NO:13), MGAT1 Danio rerio (NM_001122623.1; SEQ ID NO:14), Caenorhabditis elegans (NM_073012.4, NM_182380.5, NM_065258.3, NM_075068.3 и NM_072248.3; SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18 и SEQ ID NO:19, соответственно), Kuyveromyces lactis (XM_455588.1; SEQ ID NO:20), Ashbya gossypii (NM_208895.1; SEQ ID NO:21), Magnaporthe oryzae (XM_368741.1; SEQ ID NO:22), предполагаемый Ciona intestinalos (XM_002120843.1; SEQ ID NO:23). Примеры полипептидов MGAT2 включают белки, кодируемые генами MGAT2 из Homo sapiens (AY157608; SEQ ID NO:24), Mus musculus (AY157609; SEQ ID NO:25), Pan troglodytes (XM_522112.2; SEQ ID NO:26), Canis familiais (XM_542304.1; SEQ ID NO:27), Bos Taurus (NM_001099136.1; SEQ ID NO:28), Rattus norvegicus (NM_001109436.2; SEQ ID NO:29), Gallus gallus (XM_424082.2; SEQ ID NO:30), Danio rerio (NM_001006083.1; SEQ ID NO:31), Drosophila melanogaster (NM_136474.2, NM_136473.2 и NM_136475.2; SEQ ID NO:32, SEQ ID NO:33, SEQ ID NO:34, соответственно), Anopheles gambiae (XM_001688709.1 и XM_315985; SEQ ID NO:35 и SEQ ID NO:36, соответственно), Tribolium castaneum (XM_970053.1; SEQ ID NO:37). Примеры полипептидов MGAT3 включают белки, кодируемые генами MGAT3 из Homo sapiens (AY229854; SEQ ID NO:38), Pan troglodytes (XM_001154107.1, XM_001154171.1 и XM_527842.2; SEQ ID NO:39, SEQ ID NO:40 и SEQ ID NO:41), Canis familiais (XM_845212.1; SEQ ID NO:42), Bos Taurus (XM_870406.4; SEQ ID NO:43), Danio rerio (XM_688413.4; SEQ ID NO:44).
Используемый в настоящем документе термин «путь MGAT» относится к анаболическому пути, отличному от пути Кеннеди, для образования TAG, в котором DAG образуется посредством ацилирования sn-1 MAG или предпочтительно sn-2 MAG, катализируемого действием MGAT. DAG может быть затем использован для образования TAG или других липидов. Путь MGAT иллюстрирован на Фигуре 1.
Используемый в настоящем документе термин «диацилглицерин-ацилтрансфераза» (DGAT) относится к белку, которые превращает жирную ацильную группу из ацил-CoA на субстрат DAG с образованием TAG. Следовательно, термин «активность диацилглицерин-ацилтрансферазы» относится к переносу ацильной группы с ацил-CoA к DAG с образованием TAG. DGAT также может обладать действием MGAT, но преимущественно действует как DGAT, то есть обладает большей каталитической активностью как DGAT, чем как MGAT, при выражении ферментативной активности в единицах нмоль продукта/мин./мг белка (см., например, Yen et al., 2005).
Существует три известных типа DGAT, упоминаемых как DGAT1, DGAT2 и DGAT3, соответственно. Полипептиды DGAT1, как правило, имеют 10 трансмембранных доменов, полипептиды DGAT2, как правило, имеют 2 трансмембранных домена, тогда как полипептиды DGAT3, как правило, не имеют их и считаются растворимыми в цитоплазме, не интегрированными в мембраны. Примеры полипептидов DGAT1 включают белки, кодируемые генами DGAT1 из Aspergillus fumigatus (XP_755172.1; SEQ ID NO:347), Arabidopsis thaliana (CAB44774.1; SEQ ID NO:83), Ricinus communis (AAR11479.1; SEQ ID NO:348), Vernicia fordii (ABC94472.1; SEQ ID NO:349), Vernonia galamensis (ABV21945.1 и ABV21946.1; SEQ ID NO:350 и SEQ ID NO:351, соответственно), Euonymus alatus (AAV31083.1; SEQ ID NO:352), Caenorhabditis elegans (AAF82410.1; SEQ ID NO:353), Rattus norvegicus (NP_445889.1; SEQ ID NO:354), Homo sapiens (NP_036211.2; SEQ ID NO:355), а также их варианты и/или мутанты. Примеры полипептидов DGAT2 включают белки, кодируемые генами DGAT2 из Arabidopsis thaliana (NP_566952.1; SEQ ID NO:212), Ricinus communis (AAY16324.1; SEQ ID NO:213), Vernicia fordii (ABC94474.1; SEQ ID NO:214), Mortierella ramanniana (AAK84179.1; SEQ ID NO:215), Homo sapiens (Q96PD7.2; SEQ ID NO:216) (Q58HT5.1; SEQ ID NO:217), Bos taurus (Q70VZ8.1; SEQ ID NO:218), Mus musculus (AAK84175.1; SEQ ID NO:219), а также их варианты и/или мутанты.
Примеры полипептидов DGAT3 включают белки, кодируемые генами DGAT3 из арахиса (Arachis hypogaea, Saha, et al., 2006), а также их варианты и/или мутанты. DGAT обладает слабой или не обнаруживаемой активностью MGAT, например, менее 300 пмоль/мин./мг белка, предпочтительно менее 200 пмоль/мин./мг белка, более предпочтительно менее 100 пмоль/мин./мг белка.
DGAT2, но не DGAT1, обладает высокой гомологией последовательностей с ферментами MGAT, что позволяет предположить, что гены DGAT2 и MGAT вероятно имеют общее генетическое происхождение. Хотя в катализ одной и той же стадии в синтезе TAG вовлечены многочисленные изоформы, они могут играть отдельные функциональные роли, как можно предположить по различному распределению в ткани и субклеточной локализации семейства ферментов DGAT/MGAT. У млекопитающих MGAT1 экспрессируется в основном в желудке, почках, адипозной ткани, тогда как MGAT2 и MGAT3 демонстрируют наивысшую экспрессию в тонком кишечнике. У млекопитающих DGAT1 повсеместно экспрессируется во многих тканях, с наивысшей экспрессией в тонком кишечнике, тогда как DGAT2 наиболее распространен в печени. По данным биоинформационных анализов, MGAT3 существует только у высших млекопитающих и людей, но не у грызунов. MGAT3 обладает более высокой гомологией последовательностей с DGAT2, чем MGAT1 и MGAT3. MGAT3 демонстрирует значительно более высокую активность DGAT, чем ферменты MGAT1 и MGAT2 (MGAT3 > MGAT1 > MGAT2), при использовании в качестве субстратов MAG или DAG, что позволяет предположить, что MGAT3 действует как предполагаемая TAG-синтаза.
Обе MGAT1 и MGAT2 принадлежат к одному классу ацилтрансфераз, как и DGAT2. Некоторые из мотивов в некоторых DGAT2, которые, как было показано, являются важными для каталитической активности DGAT2, также консервированы в MGAT-ацилтрансферазах. Особый интерес представляет собой предполагаемый домен, связывающий нейтральные липиды, с консенсусной последовательностью FLXLXXXN (SEQ ID NO:224), где каждый X независимо представляет собой любую аминокислоту, отличную от пролина, а N представляет собой любую неполярную аминокислоту, расположенную в пределах N-терминальной трансмембранной области, за которой следует предполагаемый домен глицерин/фосфолипид-ацилтрансферазы. Мотив FLXLXXXN (SEQ ID NO:224) обнаружен в мышиной DGAT2 (аминокислоты 81-88) и MGAT1/2, но не в DGAT2 дрожжей или растений. Он важен для активности мышиной DGAT2. Другие мотивы последовательностей DGAT2 и/или MGAT1/2 включают:
1. Высококонсервативный трипептид YFP (SEQ ID NO:220) в большинстве полипептидов DGAT2, а также в MGAT1 и MGAT2, например, представлен в виде аминокислот 139-141 в мышиной DGAT2. Мутация этого мотива в DGAT2 дрожжей на неконсервативные замещения обусловливает нефункциональность фермента.
2. Тетрапептид HPHG (SEQ ID NO:221), высококонсервативный в MGAT, а также в последовательностях DGAT2 животных и грибов, например, представлен в виде аминокислот 161-164 в мышиной DGAT2, и важен для каталитической активности по меньшей мере в DGAT2 дрожжей и мышей. Ацилтрансферазы DGAT2 растений вместо этого содержат консервативную последовательность EPHS (SEQ ID NO:222), поэтому допустимы консервативные изменения первой и четвертой аминокислот.
3. Более длинный консервативный мотив, который представляет собой часть предполагаемого глицерин-фосфолипидного домена. Пример этого мотива представляет собой RXGFX(K/R)XAXXXGXXX(L/V)VPXXXFG(E/Q) (SEQ ID NO:223), который присутствует как аминокислоты 304-327 в мышиной DGAT2. Этот мотив менее консервативен в аминокислотной последовательности, чем другие, что можно предположить по его длине, но по поиску мотива могут быть распознаны гомологи. Между более консервативными аминокислотами может варьироваться спейсинг, то есть в пределах указанного мотива может существовать дополнительно X аминокислот или может быть на X аминокислот меньше, по сравнению с представленной выше последовательностью
Используемый в настоящем документе термин «глицерин-3-фосфат-ацилтрансфераза» или «GPAT» относится к белку, который ацилирует глицерин-3-фосфат (G-3-P) с образованием LysoPA и/или MAG, последний продукт образуется в том случае, если GPAT обладает также активностью фосфатазы в отношении LysoPA. Перенесенная ацильная группа, как правило, получена из ацил-CoA. Следовательно, термин «активность глицерин-3-фосфат-ацилтрансферазы» относится к ацилированию G-3-P с образованием LysoPA и/или MAG. Термин «GPAT» охватывает ферменты, которые ацилируют G-3-P с образованием sn-1 LPA и/или sn-2 LPA, предпочтительно sn-2 LPA. В предпочтительном варианте реализации GPAT обладает активностью фосфатазы. В наиболее предпочтительном варианте реализации GPAT представляет собой sn-2 GPAT, обладающую активностью фосфатазы, которая образует sn-2 MAG.
Используемый в настоящем документе термин «sn-1 глицерин-3-фосфат-ацилтрансфераза» (sn-1 GPAT) относится к белку, который ацилирует sn-глицерин-3-фосфат (G-3-P) с предпочтительным образованием 1-ацил-sn-глицерин-3-фосфата (sn-1 LPA). Следовательно, термин «активность sn-1 глицерин-3-фосфат-ацилтрансферазы» относится к ацилированию sn-глицерин-3-фосфата с образованием 1-ацил-sn-глицерин-3-фосфата (sn-1 LPA).
Используемый в настоящем документе термин «sn-2 глицерин-3-фосфат-ацилтрансфераза» (sn-2 GPAT) относится к белку, который ацилирует sn-глицерин-3-фосфат (G-3-P) с предпочтительным образованием 2-ацил-sn-глицерин-3-фосфата (sn-2 LPA). Следовательно, термин «активность sn-2 глицерин-3-фосфат-ацилтрансферазы» относится к ацилированию sn-глицерин-3-фосфата с образованием 2-ацил-sn-глицерин-3-фосфата (sn-2 LPA).
Семейство GPAT является крупным, а все известные члены содержат два консервативных домена, домен ацилтрансферазы plsC (PF01553; SEQ ID NO:225) и домен суперсемейства HAD-подобной гидролазы (PF12710; SEQ ID NO:226). Помимо этого, в Arabidopsis thaliana, все домены GPAT4-8 содержат N-терминальную область, гомологичную к домену фосфосерин-фосфатазы (PF00702; SEQ ID NO:227). Обе GPAT4 и GPAT6 содержат консервативные остатки, которые, как известно, критичны для активности фосфатазы, в частности, консервативные аминокислоты (показанные жирным) в мотиве I (DXDX[T/V][L/V]; SEQ ID NO:229) и в мотиве III (K-[G/S][D/S]XXX[D/N]; SEQ ID NO:330), расположенные в N-конце (Yang et al., 2010). Предпочтительно, GPAT имеет sn-2 предпочтение и фосфатазную активность для получения sn-2 MAG (также упоминаемого в настоящем документе как «2-MAG») из глицерин-3-фосфата (G-3-P) (Фигура 1), например, GPAT4 (NP_171667.1; SEQ ID NO:144) и GPAT6 (NP_181346.1; SEQ ID NO:145) из Arabidopsis. Более предпочтительно, GPAT использует ацил-CoA в качестве жирнокислотного субстрата.
Гомологи GPAT4 (NP_171667.1; SEQ ID NO:144) и GPAT6 (NP_181346.1; SEQ ID NO:145) включают AAF02784.1 (Arabidopsis thaliana; SEQ ID NO:146), AAL32544.1 (Arabidopsis thaliana; SEQ ID NO:147), AAP03413.1 (Oryza sativa; SEQ ID NO:148), ABK25381.1 (Picea sitchensis; SEQ ID NO:149), ACN34546.1 (Zea mays; SEQ ID NO:150), BAF00762.1 (Arabidopsis thaliana; SEQ ID NO:151), BAH00933.1 (Oryza sativa; SEQ ID NO:152), EAY84189.1 (Oryza sativa; SEQ ID NO:153), EAY98245.1 (Oryza sativa; SEQ ID NO:154), EAZ21484.1 (Oryza sativa; SEQ ID NO:155), EEC71826.1 (Oryza sativa; SEQ ID NO:156), EEC76137.1 (Oryza sativa; SEQ ID NO:157), EEE59882.1 (Oryza sativa; SEQ ID NO:158), EFJ08963.1 (Selaginella moellendorffii; SEQ ID NO:159), EFJ08964.1 (Selaginella moellendorffii; SEQ ID NO:160), EFJ11200.1 (Selaginella moellendorffii; SEQ ID NO:161), EFJ15664.1 (Selaginella moellendorffii; SEQ ID NO:162), EFJ24086.1 (Selaginella moellendorffii; SEQ ID NO:163), EFJ29816.1 (Selaginella moellendorffii; SEQ ID NO:164), EFJ29817.1 (Selaginella moellendorffii; SEQ ID NO:165), NP_001044839.1 (Oryza sativa; SEQ ID NO:166), NP_001045668.1 (Oryza sativa; SEQ ID NO:167), NP_001147442.1 (Zea mays; SEQ ID NO:168), NP_001149307.1 (Zea mays; SEQ ID NO:169), NP_001168351.1 (Zea mays; SEQ ID NO:170), AFH02724.1 (Brassica napus; SEQ ID NO:171), NP_191950.2 (Arabidopsis thaliana; SEQ ID NO:172), XP_001765001.1 (Physcomitrella patens; SEQ ID NO:173), XP_001769671.1 (Physcomitrella patens; SEQ ID NO:174), XP_001769724.1 (Physcomitrella patens; SEQ ID NO:175), XP_001771186.1 (Physcomitrella patens; SEQ ID NO:176), XP_001780533.1 (Physcomitrella patens; SEQ ID NO:177), XP_002268513.1 (Vitis vinifera; SEQ ID NO:178), XP_002275348.1 (Vitis vinifera; SEQ ID NO:179), XP_002276032.1 (Vitis vinifera; SEQ ID NO:180), XP_002279091.1 (Vitis vinifera; SEQ ID NO:181), XP_002309124.1 (Populus trichocarpa; SEQ ID NO:182), XP_002309276.1 (Populus trichocarpa; SEQ ID NO:183), XP_002322752.1 (Populus trichocarpa; SEQ ID NO:184), XP_002323563.1 (Populus trichocarpa; SEQ ID NO:185), XP_002439887.1 (Sorghum bicolor;SEQ ID NO:186), XP_002458786.1 (Sorghum bicolor; SEQ ID NO:187), XP_002463916.1 (Sorghum bicolor; SEQ ID NO:188), XP_002464630.1 (Sorghum bicolor; SEQ ID NO:189), XP_002511873.1 (Ricinus communis; SEQ ID NO:190), XP_002517438.1 (Ricinus communis; SEQ ID NO:191), XP_002520171.1 (Ricinus communis; SEQ ID NO:192), XP_002872955.1 (Arabidopsis lyrata; SEQ ID NO:193), XP_002881564.1 (Arabidopsis lyrata; SEQ ID NO:194), ACT32032.1 (Vernicia fordii; SEQ ID NO:195), NP_001051189.1 (Oryza sativa; SEQ ID NO:196), AFH02725.1 (Brassica napus; SEQ ID NO:197), XP_002320138.1 (Populus trichocarpa; SEQ ID NO:198), XP_002451377.1 (Sorghum bicolor; SEQ ID NO:199), XP_002531350.1 (Ricinus communis; SEQ ID NO:200) и XP_002889361.1 (Arabidopsis lyrata; SEQ ID NO:201).
Консервативные мотивы и/или остатки могут быть использованы в качестве диагностических средств, основанных на последовательностях, для идентификации бифункциональных GPAT/фосфатазных ферментов. Альтернативно, может быть использован анализ, основанный на более строгой функции. Такие анализы включают, например, подкормку меченным глицерин-3-фосфатом клеток или микросом и количественное определение концентрации меченных продуктов с помощью тонкослойной хроматографии или аналогичного приема. Активность GPAT приводит к выработке меченного LPA, тогда как активность GPAT/фосфатазы приводит к выработке меченного MAG.
Используемый в настоящем документе термин «олеозин» относится к амфипатическому белку, содержащемуся в мембране масляных телец в запасающих тканях семян (см., например, Huang, 1996; Lin et al., 2005; Capuano et al., 2007; Lui et al., 2009; Shimada and Hara-Nishimura, 2010).
Семена растения накапливают TAG в субклеточных структурах, называемых масляными тельцами. Эти органеллы состоят из TAG ядра, окруженного фосфолипидным монослоем, содержащим несколько встроенных белков, включая олезины (Jolivet et al., 2004). Олеозины представляют собой наиболее распространенный белок в мембране масляных телец.
Олеозины имеют низкую Mr (15-26000). В семенах каждого вида, как правило, существует два или более олеозинов с различной Mr. Каждая молекула олеозина содержит относительно гидрофильный N-терминальный домен (например, около 48 аминокислотных остатков), центральный полностью гидрофобный домен (например, около 70-80 аминокислотных остатков), который особенно богат на алифатические аминокислоты, такие как аланин, глицин, лейцин, изолейцин и валин, и амфипатический α-спиральный домен (например, около 33 аминокислотных остатков) в С-конце или возле него. Как правило, центральное удлинение гидрофобных остатков встраивается в липидное ядро, а амфипатический N-конец и/или амфипатический С-конец расположены у поверхности масляных телец, при этом положительно заряженные остатки встроены в фосфолипидный монослой, а отрицательно заряженные остатки выставлены наружу.
Используемый в настоящем документе термин «олеозин» охватывает полиолеозины, которые содержат несколько олеозиновых полипептидов, гибридизованных вместе в виде одного полипептида, например, 2х, 4х или 6Х олеозиновые пептиды, а также калеозины, которые связывают кальций (Froissard et al., 2009), и стеролеозины, которе связывают стеролы. Однако, как правило, основная доля олеозинов в масляных тельцах приходится не на калеозины и/или стеролеозины.
Из многочисленных видов растений известно значительное количество последовательностей олеозиновых белков и нуклеотидных последовательностей, кодирующих их. Примеры включают, но не ограничиваясь этим, олеозины из Arabidopsis, канолы, кукурузы, риса, арахиса, клещевины, сои, льна, винограда, капусты, хлопка, подсолнечника, сорго и ячменя. Примеры олеозинов (с их номерами доступа) включают олеозин Brassica napus (CAA57545.1; SEQ ID NO:362), олеозин S1-1 Brassica napus (ACG69504.1; SEQ ID NO:363), олеозин S2-1 Brassica napus (ACG69503.1; SEQ ID NO:364), олеозин S3-1 Brassica napus (ACG69513.1; SEQ ID NO:365), олеозин S4-1 Brassica napus (ACG69507.1; SEQ ID NO:366), олеозин S5-1 Brassica napus (ACG69511.1; SEQ ID NO:367), олеозин 1 Arachis hypogaea (AAZ20276.1; SEQ ID NO:368), олеозин 2 Arachis hypogaea (AAU21500.1; SEQ ID NO:369), олеозин 3 Arachis hypogaea (AAU21501.1; SEQ ID NO:370), олеозин 5 Arachis hypogaea (ABC96763.1; SEQ ID NO:371), олеозин 1 Ricinus communis (EEF40948.1; SEQ ID NO:372), олеозин 2 Ricinus communis (EEF51616.1; SEQ ID NO:373), изоформа а олеозина Glycine max (P29530.2; SEQ ID NO:374), изоформа b олеозина Glycine max (P29531.1; SEQ ID NO:375), низкомолекулярная изоформа олеозина Linum usitatissimum (ABB01622.1; SEQ ID NO:376), высокомолекулярная изоформа олеозина Linum usitatissimum (ABB01624.1; SEQ ID NO:377), олеозин Helianthus annuus (CAA44224.1; SEQ ID NO:378), олеозин Zea mays (NP_001105338.1; SEQ ID NO:379), стеролеозин Brassica napus (ABM30178.1; SEQ ID NO:380), стеролеозин SLO1-1 Brassica napus (ACG69522.1; SEQ ID NO:381), стеролеозин SLO2-1 Brassica napus (ACG69525.1; SEQ ID NO:382), стеролеозин Sesamum indicum (AAL13315.1; SEQ ID NO:383), стеролеозин Zea mays (NP_001152614.1; SEQ ID NO:384), калеозин CLO-1 Brassica napus (ACG69529.1; SEQ ID NO:385), калеозин CLO-3 Brassica napus (ACG69527.1; SEQ ID NO:386), калеозин Sesamum indicum (AAF13743.1; SEQ ID NO:387), калеозин Zea mays (NP_001151906.1; SEQ ID NO:388).
Используемый в настоящем документе термин «полипептид, участвующий в биосинтезе крахмала» относится к любому полипептиду, понижающая регуляция которого в клетке до значений ниже нормальных (дикого типа) концентраций приводит к уменьшению уровня синтеза крахмала и к увеличению концентраций крахмала. Примером такого полипептида является АГФаза.
Используемый в настоящем документе термин «фосфорилаза АДФ-глюкозы» или «АГФаза» относится к ферменту, который регулирует биосинтез крахмала, катализируя превращение глюкоза-1-фосфата и АТФ в АДФ-глюкозу, которая служит в качестве строительного блока для крахмальных полимеров. Активная форма фермента АГФазы состоит из 2 крупных и 2 малых субъединиц.
Фермент АДФаза в растениях существует преимущественно как тетрамер, который состоит из 2 крупных и 2 малых субъединиц. Хотя эти субъединицы в зависимости от видов отличаются по их каталитической и регуляторной роли (Kuhn et al., 2009), в растениях малая субъединица, как правило, демонстрирует каталитическую активность. Молекулярный вес малой субъединицы составляет приблизительно 50-55 кДа. Молекулярный вес крупной субъединицы составляет приблизительно 55-60 кДа. Растительный фермент сильно активируется действием 3-фосфоглицерата (PGA), продукта фиксации диоксида углерода; в отсутствие PGA этот фермент демонстрирует лишь около 3% своей активности. АГФаза растений также сильно ингибируется неорганическим фосфатом (Pi). Напротив, АГФаза бактерий и водорослей существует в виде гомотетрамеров весом 50 кДа. Фермент водорослей, как и его растительный эквивалент, активируется действием PGA и ингибируется действием Pi, тогда как бактериальный фермент активируется фруктоза-1,6-бифосфатом (FBP) и ингибируется AMP и Pi.
Используемый в настоящем документе термин «полипептид, участвующий в разложении липида и/или который снижает содержание липидов» относится к любому полипептиду, понижающая регуляция которого в клетках до значений ниже нормальных (дикого типа) концентрации приводит к увеличению концентрации масла, такого как жирные кислоты и/или TAG в клетке, предпочтительно в клетке вегетирующей ткани растения. Приметы таких полипептидов включают, но не ограничиваясь этим, липазы или липазу, такую как полипептид CGi58, сахарозависимая триацилглицерин-липаза 1 (см., например, Kelly et al., 2012) или липаза, описанная в WO 2009/027335.
Используемый в настоящем документе термин «липаза» относится к белку, который гидролизует жиры в глицерин и жирные кислоты. Следовательно, термин «активность липазы» относится к гидролизу жиров в глицерин и жирные кислоты.
Используемый в настоящем документе термин «CGi58» относится к растворимой ацил-CoA-зависимой ацилтрансферазе лизофосфатидной кислоты, также известной в данной области техники как «At4g24160» (у растений) и «Ict1p» (у дрожжей). Растительный ген, такой как из генного локуса Arabidopsis, At4g24160, экспрессируется в двух альтернативных транскриптах: более длинной изоформе полной длины (At4g24160.1) и более короткой изоформе (At4g24160.2), в которой пропущена часть конца 3' (см. James et al., 2010; Ghosh et al., 2009; US 201000221400). Обе мРНК кодируют белок, который является гомологом к человеческому белку CGI-58 и к другим ортологичным членам этого семейства α/β-гидролаз (ABHD). В одном варианте реализации белок CGI58 (At4g24160) содержит три мотива, которые являются консервативными в различных видах растений: мотив липазы GXSXG (SEQ ID NO:419), мотив ацилтрансферазы HX(4)D (SEQ ID NO:420) и VX(3)HGF, предполагаемый липид-связывающий мотив (SEQ ID NO:421). Человеческий белок CGI-58 обладает активностью ацилтрансферазы лизофосфатидной кислоты (LPAAT), но не активностью липазы. Напротив, растительные и дрожжевые белки обладают каноническим мотивом липазной последовательности GXSXG (SEQ ID NO:419), то есть не содержат белков позвоночных животных (людей, мышей и данио). Хотя растительные и дрожжевые белки CGI58, как оказалось, содержат обнаруживаемые количества TAG липазы и обладают активностью фосфолипазы А, помимо активности LPAAT, человеческие белки не имеют этого.
Разрушение гомологичного гена CGI-58 в Arabidopsis thaliana приводит к накоплению капель нейтральных липидов в зрелых листьях. Масс-спектроскопия выделенных липидных капель из мутантов с утратой функции cgi-58 показала, что они содержат триацилглицерины с обычными, специфичными для листьев, жирными кислотами. Листья зрелых cgi-58 растений демонстрируют заметное увеличение абсолютных концентраций триацилглицеринов, более чем в 10 раз выше, чем в растениях дикого типа. Концентрации липидов в хранящих масло семенах растений с утратой функции cgi-58 были неизменными, и в отличие от мутаций в β-окислении, семена cgi-58 нормально прорастали и росли, не требуя помощи сахарозы (James et al., 2010).
Примеры полипептидов CGi58 включают белки из Arabidopsis thaliana (NP_194147.2; SEQ ID NO:429), Brachypodium distachyon (XP_003578450.1; SEQ ID NO:430), Glycine max (XP_003523638.1; SEQ ID NO:431) Zea mays (NP_001149013.1; SEQ ID NO:432), Sorghum bicolor (XP_002460538.1; SEQ ID NO:433), Ricinus communis (XP_002510485.1; SEQ ID NO:434), Medicago truncatula (XP_003603733.1; SEQ ID NO:435) и Oryza sativa (EAZ09782.1; SEQ ID NO:436).
Используемый в настоящем документе термин «листовой котиледон 2» или «LEC2» относится к В3 домену фактора транскрипции, который участвует в зиготическом и соматическом эмбриогенезе. Его эктопическая экспрессия облегчает эмбриогенез из вегетирующих тканей растения (Alemanno et al., 2008). LEC2 включает также ДНК-связывающую область, обнаруженную пока только в растительных белках. Примеры полипептидов LEC2 включают белки из Arabidopsis thaliana (NP_564304.1) (SEQ ID NO:442), Medicago truncatula (CAA42938.1) (SEQ ID NO:443) и Brassica napus (ADO16343.1) (SEQ ID NO:444).
Используемый в настоящем документе термин «BABY BOOM» или «BBM» относится к фактору транскрипции AP2/ERF, который вызывает регенерацию в условиях культиварования, которые обычно не поддерживают регенерацию в растениях дикого типа. Эктопическая экспрессия генов BBM Brassica napus (BnBBM) в B. napus и Arabidopsis вызывает самопроизвольный соматический эмбриогенез и органогенез из сеянцев, выращенных на не содержащей гормонов базальной среде (Boutilier et al., 2002). В табаке эктопическая экспрессия BBM является достаточной для инициации придаточного побега и регенерации корней на базальной среде, но для образования соматического зародыша (SE) необходим экзогенный цитокин (Srinivasan et al., 2007). Примеры полипептидов MMB включают белки из Arabidopsis thaliana (NP_197245.2) (SEQ ID NO:445) и Medicago truncatula (AAW82334.1) (SEQ ID NO:446).
Используемый в настоящем документе термин «FAD2» относится к мембрана-связанной дельта-12 десатуразе жирных кислот, которая десатурирует олеиновую кислоту (18:1Δ9) с образованием линолевой кислоты (С18:2Δ9,12).
Используемый в настоящем документе термин «эпоксигеназа» или «эпоксигеназа жирных кислот» относится к ферменту, который внедряет эпокси-группу в жирную кислоту, что приводит к образованию эпокси-жирной кислоты. В предпочтительном варианте реализации эпокси-группа внедряется у 12-ого углеродного атома цепи жирной кислоты, и в этом случае эпоксигеназа представляет собой Δ12-эпоксигеназу, особенно для цепей жирных кислот С16 и С18. Эпоксигеназа может быть Δ9-эпоксигеназой, Δ15-эпоксигеназой или действовать в различных положениях ацильной цепи, как известно в данной области техники. Эпоксигеназа может быть из класса P450. Предпочтительные эпоксигеназы относятся к классу моно-оксигеназ, описанных в WO98/46762. В данной области техники клонированы и известны многочисленные эпоксигеназы или предполагаемые эпоксигеназы. Дополнительные примеры эпоксигеназ включают белки, содержащие аминокислотную последовательность, представленную в SEQ ID NO:21 публикации WO 2009/129582, полипептиды, кодируемые генами из Crepis paleastina (CAA76156, Lee et al., 1998), Stokesia laevis (AAR23815, Hatanaka et al., 2004) (тип монооксигеназы), Euphorbia lagascae (AAL62063) (тип P450), Человеческий CYP2J2 (эпоксигеназа арахидоновой кислоты, U37143); человеческий CYPIA1 (эпоксигеназа арахидоновой кислоты, K03191), а также их варианты и/или мутанты.
Используемый в настоящем документе термин «гидроксилаза» или «гидроксилаза жирных кислот» относится к ферменту, который внедряет гидроксильную группу в жирную кислоту, что приводит к образованию гидроксилированной жирной кислоты. В предпочтительном варианте реализации гидроксильная группа внедряется у 2-ого, 12-ого и/или 17-ого углеродного атома цепи жирной кислоты С18. Предпочтительно, гидроксильная группа внедряется у 12-ого углеродного атома, и в этом случае гидроксилаза представляет собой Δ12-гидроксилазу. В другом предпочтительном варианте реализации гидроксильная группа внедряется у 15-ого углеродного атома цепи жирной кислоты С16. Гидроксилазы также могут обладать ферментативной активностью в качестве десатуразы жирных кислот. Примеры генов, кодирующих Δ-гидроксилазы, включают гены из Ricinus communis (AAC9010, van de Loo 1995); Physaria lindheimeri (ABQ01458, Dauk et al., 2007); Lesquerella fendleri (AAC32755, Broun et al., 1998); Daucus carota (AAK30206); гидроксилазы жирных кислот, которые гидроксилируют конец жирных кислот, например: CYP86A1 A. thaliana (P48422, ω-гидроксилаза жирных кислот); CYP94A1 Vicia sativa (P98188, ω-гидроксилаза жирных кислот); мышиный CYP2E1 (X62595, ω-1-гидроксилаза лауриновой кислоты); крысиный CYP4A1 (M57718, ω-гидроксилаза жирных кислот), а также их варианты и/или мутанты.
Используемый в настоящем документе термин «конъюгаза» или «конъюгаза жирных кислот» относится к ферменту, способному образовывать конъюгированную связь в ацильной цепи жирной кислоты. Примеры конъюгаз включают те, которые кодируются генами из Calendula officinalis (AF343064, Qiu et al., 2001); Vernicia fordii (AAN87574, Dyer et al., 2002); Punica granatum (AY178446, Iwabuchi et al., 2003) и Trichosanthes kirilowii (AY178444, Iwabuchi et al., 2003); а также их варианты и/или мутанты.
Используемый в настоящем документе термин «ацетиленаза» или «ацетиленаза жирных кислот» относится к ферменту, который внедряет тройную связь в жирную кислоту, что приводит к образованию ацетиленовой жирной кислоты. В предпочтительном варианте реализации тройная связь внедряется у 2-ого, 6-ого, 12-ого и/или 17-ого углеродного атома цепи жирной кислоты С18. Примеры ацетиленаз включают ацетиленазы из Helianthus annuus (AA038032, ABC59684), а также их варианты и/или мутанты.
Примеры таких генов, модифицирующих жирные кислоты, включают белки, соответствующие следующим номерам доступа, которые сгруппированы по предполагаемой функции, а также гомологи из других видов: Δ12-ацетиленазы ABC00769, CAA76158, AAO38036, AAO38032; Δ12-конъюгазы AAG42259, AAG42260, AAN87574; Δ12-десатуразы P46313, ABS18716, AAS57577, AAL61825, AAF04093, AAF04094, Δ12-эпоксигеназы XP_001840127, CAA76156, AAR23815; Δ12-гидросилазы ACF37070, AAC32755, ABQ01458, AAC49010; и Δ12 P450 ферменты, такие как AF406732.
Используемый в настоящем документе термин «вегетирующая ткань» или «вегетирующая часть растения» представляет собой любую ткань, орган или часть растения, отличную от органов для полового размножения растения, в частности, семеноносных органов, цветов, пыльцы, фруктов и семян. Вегетирующие ткани и части включают по меньшей мере листья растения, стебли (включая стрелки и отростки, но исключая шаровидные стебли), клубни и корни, но исключая цветы, пыльцу, семена, в том числе семенную оболочку, зародыш и эндосперм, фрукты, в том числе ткань мезокарпия, семеноносные коробочки и семеноносные головки. В одном варианте реализации вегетирующая часть растения представляет собой надземную часть растения. В другом или дополнительном варианте реализации вегетирующая часть растения представляет собой зеленую часть, такую как лист или стебель.
Используемый в настоящем документе термин «дикого типа» или различные его варианты относится к клетке или нечеловеческому организму, или к его части, которая не была генетически модифицирована.
Термин «соответствующий» относится к вегетирующей части растения, клетке или нечеловеческому организму или его части, или к семенам, которые имеют такой же генетический фон, что и вегетирующая часть растении, клетка или нечеловеческий организм или его часть, или семена настоящего изобретения, но которые были модифицированы так, как описано в настоящем документе (например, вегетирующая часть растения, клетки или нечеловеческий организм или его часть, или семена не содержат экзогенный полинуклеотид, кодирующий MGAT, или экзогенную MGAT). В предпочтительном варианте реализации вегетирующая часть растения, клетка или нечеловеческий организм или его часть, или семена находятся в одной стадии развития, что и вегетирующая часть растения, клетка, нечеловеческий организм или его часть, или семена настоящего изобретения. Например, если нечеловеческий организм представляет собой цветущее растение, то предпочтительно соответствующее растение также является цветущим. Соответствующая вегетирующая часть растения, клетка или нечеловеческий организм или его часть, или семена могут быть использованы в качестве контроля для сравнения концентраций нуклеиновых кислот или экспрессии белка, или степени и природы характерной модификации, например, выработки и/или содержания неполярных липидов, с вегетирующей частью растения, клеткой или нечеловеческим организмом или его частью, или с семенами, модифицированными так, как описано в настоящем документе. Специалисты в данной области могут легко определить надлежащую «соответствующую» клетку, ткань, орган или организм для такого сравнения.
Используемый в настоящем документе термин «по сравнению с» относится к сравнению концентраций неполярных липидов или общего содержания неполярных липидов трансгенного нечеловеческого организма или его части, экспрессирующей один или более экзогенных полинуклеотидов или экзогенных полипептидов, с трансгенным нечеловеческим организмом или его частью, не содержащей одного или более экзогенных полинуклеотидов или полипептидов.
Используемый в настоящем документе термин «усиленная способность вырабатывать неполярные липиды» представляет собой относительный термин, который относится к общему количеству неполярных липидов, вырабатываемых клеткой или нечеловеческим организмом или его частью в соответствии с настоящим изобретением, которое увеличено относительно соответствующей клетки или нечеловеческого организма или его части. В одном варианте реализации содержание TAG и/или полиненасыщенных жирных кислот в неполярных липидах увеличивается.
Используемый в настоящем документе термин «прорастает по существу с такой же скоростью, что и соответствующее растение дикого типа» относится к семенам растения настоящего изобретения, которые являются относительно плодородными, по сравнению с семенами растения дикого типа, не содержащими определенный экзогенный полинуклеотид (-ы). В одном варианте реализации количество прорастающих семян, например, при выращивании при оптимальных тепличных условиях для растительных видов, составляет по меньшей мере 75%, более предпочтительно по меньшей мере 90% от количества, по сравнению с соответствующими семенами дикого типа. В другом варианте реализации прорастающие семена, например, при выращивании в оптимальных тепличных условиях для растительных видов, растут со скоростью, которая, в среднем, составляет по меньшей мере 75%, более предпочтительно по меньшей мере 90% от скорости, по сравнению с растениями дикого типа.
Используемый в настоящем документе термин «выделенный или рекомбинантный полинуклеотид, который понижающе регулирует выработку и/или активность эндогенного фермента» или его варианты относится к полинуклеотиду, который кодирует молекулу РНК, которая понижающе регулирует выработку и/или активность (например, кодирующий миРНК, вмРНК-интерференцию), или сам понижающе регулирует выработку и/или активность (например, представляет собой миРНК, которая может быть напрямую доставлена, например, в клетку) эндогенного фермента, например, DGAT, sn-1-глицерин-3-фосфат-ацилтрансферазы (GPAT), 1-ацил-глицерин-3-фосфат-ацилтрансферазы (LPAAT), ацил-CoA:лизофосфатидилхолин-ацилтрансферазы (LPCAT), фосфатазы фосфатидной кислоты (PAP), АГФазы или дельта-12 десатуразы жирных кислот (FAD2), или комбинации двух или более из них.
Используемый в настоящем документе термин «в весовом выражении» относится к весу вещества (например, TAG, DAG, жирной кислоты) в процентах от веса композиции, содержащей это вещество (например, семена, листья). Например, если трансгенные семена содержат 25 мкг общих жирных кислот на 120 мкг веса семян; то процент общих жирных кислот в весовом выражении составляет 20,8%.
Используемый в настоящем документе термин «в относительном выражении» относится к количеству вещества в композиции, содержащей это вещество, в сравнении с соответствующей композицией, в процентах.
Используемый в настоящем документе термин «относительное нелипидное содержание» относится к выражению содержания неполярных липидов в клетке, организме или его части, или в экстрагированных из них липидах, по сравнению с соответствующей клеткой, организмом или его часть, или с липидами, экстрагированными из соответствующей клетки, организма или его части, в процентах. Например, если трансгенные семена содержат 25 мкг общих жирных кислот, тогда как соответствующие семена содержат 20 мкг общих жирных кислот; то увеличение содержания неполярных липидов в относительном выражении равно 25%.
Используемый в настоящем документе термин «биотопливо» относится к любому типу биотоплива, обычно используемого для приведения в действие машин, таких как автомобили, грузовики или двигатели, работающие на бензине, энергия которого образуется за счет связывания биологического углерода. Биотоплива включают топлива, полученные за счет конверсии биомассы, а также твердые биомассы, жидкие топлива и биогазы. Примеры биотоплив включают биоспирты, биодизель, синтетический дизель, растительное масло, биоэфиры, биогаз, синтез-газ, твердые биотоплива, топлива из водорослей, биоводород, биометанол, 2,5-диметилфуран (ДМФ), биодиметиловый эфир (биоДМЭ), дизель Фишера-Тропша, биоводородный дизель, смеси спиртов и древесный дизель.
Используемый в настоящем документе термин «биоспирт» относится к биологически полученным спиртам, например, этанолу, пропанолу и бутанолу. Биоспирты получают под действием микроорганизмов и/или ферментов за счет ферментации сахаров, гемицеллюлозы или целлюлозы.
Используемый в настоящем документе термин «биодизель» относится к композиции, содержащей метиловые или этиловые эфиры жирных кислот, полученные из неполярных липидов путем транс-эстерификации.
Используемый в настоящем документе термин «синтетический дизель» относится к дизельному топливу, которое получено из возобновляемого сырья, а не из ископаемого сырья, используемого в большинстве дизельных топлив.
Используемый в настоящем документе термин «растительное масло» включает чистое растительное масло (или растительное масло без присадок) или отработавшее растительное масло (побочный продукт других промышленностей).
Используемый в настоящем документе термин «биоэфиры» относится к соединениям, которые действуют как добавки для увеличения октанового числа.
Используемый в настоящем документе термин «биогаз» относится к метану или горючей смеси метана и других газов, полученных анаэробным расщеплением органического материала анаэробами.
Используемый в настоящем документе термин «синтез-газ» относится к смеси, которая содержит различные количества монооксида углерода и водорода и возможно другие углеводороды, полученной при частичном сжигании биомассы.
Используемый в настоящем документе термин «твердые биотоплива» включает древесину, древесные опилки, обрезки травы и непищевые энергетические злаки.
Используемый в настоящем документе термин «целлюлозный этанол» относится к этанолу, полученному из целлюлозы или гемицеллюлозы.
Используемый в настоящем документе термин «топливо из водорослей» относится к биотопливу, изготовленному из водорослей, и включает биодизель, биобутанол, биобензин, метан, этанол из водорослей, а также аналог растительного масла, полученный из водорослей.
Используемый в настоящем документе термин «биоводород» относится к водороду, полученному биологически, например, с помощью водорослей.
Используемый в настоящем документе термин «биометанол» относится к метанолу, полученному биологически. Биометанол может быть получен газификацией органических материалов в синтез-газ с последующим стандартным синтезом метанола.
Используемый в настоящем документе термин «2,5-диметилфуран» или «ДМФ» относится к гетероциклическому соединению формулы (CH3)2C4H2O. ДМФ представляет собой производное фурана, который может быть получен из целлюлозы.
Используемый в настоящем документе термин «биодиметиловый эфир» или «биоДМЭ», известный также как метоксиметан, относится к органическому соединению формулы CH3OCH3.
Синтез-газ может быть преобразован в метанол в присутствии катализатора (как правило, медного), с последующей дегидратацией метанола в присутствии различных катализаторов (например, из оксида кремния-алюминия), что приводит к образованию ДМЭ.
Используемый в настоящем документе термин «Фишера-Тропша» относится к группе химических реакций, в ходе которых смесь монооксида углерода и водорода превращается в жидкие углеводороды. Синтез-газ может быть сначала кондиционирован с помощью, например, конверсии водяного газа, для получения заданного соотношения H2/CO. Такое превращение имеет место в присутствии катализатора, как правило, железного или кобальтового. Температура, давление и катализатор определяют образование легкой или тяжелой синтетической сырой нефти. Например, при 330°С образуется, в основном, бензин и олефины, тогда как при 180°-250°С образуется, в основном, дизель и воски. Жидкие вещества, получаемые из синтез-газа, которые содержат различные фракции углеводородов, представляют собой очень чистые (не содержащие серы) неразветвленные углеводороды. Дизель Фишера-Тропша может быть получен напрямую, но более высокий выход достигается, если сначала получить воск Фишера-Тропша, а затем выполнить гидрокрекинг.
Используемый в настоящем документе термин «биоуголь» относится к углю, полученному из биомассы, например, пиролизом биомассы.
Используемый в настоящем документе термин «сырье» относится к материалу, например, биомассе или продукту ее превращения (например, синтез-газу), который используется для получения продукта, например, биотоплива, такого как биодизель или синтетический дизель.
Используемый в настоящем документе термин «промышленный продукт» относится к углеводородному продукту, который преимущественно получен из углерода и водорода, такому как метиловые и/или этиловые эфиры жирных кислот или алканы, такие как метан, смеси длинноцепных алканов, которые, как правило, представляют собой жидкости при комнатной температуре, биотопливо, монооксид углерода и/или водород, или биоспирт, такой как этанол, пропанол или бутанол, или биоуголь. Предусматривается, что термин «промышленный продукт» включает промежуточные продукты, которые могут быть преобразованы в другие промышленные продукты, например, синтез-газ сам считается промышленным продуктом, который может быть использован для синтез углеводородных продуктов, которые также считаются промышленным продуктом. Используемый в настоящем документе термин «промышленный продукт» включает как чистые формы представленных выше соединений, так и более распространенные смеси различных соединений и компонентов, например, углеводородный продукт может содержать несколько длин углеродной цепи, что хорошо понятно в данной области техники.
Используемый в настоящем документе термин «блеск» относится к оптическому явлению, обусловленному оценкой внешнего вида поверхности. Оценка блеска описывает способность поверхности отражать направленный свет.
В тексте настоящего описания слово «включает» или его варианты, такие как «содержит» или «содержащий», следует понимать как включение указанного элемента, целого числа или стадии, или группы элементов, целых чисел или стадий, но не как исключение любого другого элемента, целого числа или стадии, или группы элементов, целых чисел или стадий.
Термин «и/или», например, «X и/или Y» следует понимать как обозначение либо «X и Y», либо «X или Y», и считается выраженным подтверждением обоих значений или каждого значения.
Используемый в настоящем документе термин «около», если не указано иное, относится к +/- 10%, более предпочтительно +/- 5%, более предпочтительно +/- 2%, более предпочтительно +/- 1%, еще более предпочтительно +/- 0,5% от указанного значения.
Получение диацилглицеринов и триацилглицеринов
В одном варианте реализации вегетирующая часть растения, трансгенный нечеловеческий организм или его часть по настоящему изобретению вырабатывает более высокие концентрации неполярных липидов, таких как DAG или TAG, предпочтительно оба варианта, чем соответствующая вегетирующая часть растения, нечеловеческий организм или его часть. В одном примере трансгенные растения настоящего изобретения образуют семена, листья, части листьев с площадью поверхности по меньшей мере 1 см2, стебли и/или клубни, имеющие повышенное содержание неполярных липидов, таких как DAG или TAG, предпочтительно оба варианта, по сравнению с соответствующими семенами, листьями, частями листьев с площадью поверхности по меньшей мере 1 см2, стеблями или клубнями. Содержание неполярных липидов в вегетирующей части растения, нечеловеческом организме или его части по меньшей мере на 0,5% выше в весовом выражении, по сравнению с соответствующим нечеловеческим организмом или его частью, или как дополнительно описано в характеристике (i).
В другом варианте реализации вегетирующая часть растения, трансгенный нечеловеческий организм или его часть, предпочтительно растение или семена вырабатывают DAG и/или TAG, которые обогащены одной или более конкретными жирными кислотами. В DAG и/или TAG может быть внедрен широкий спектр жирных кислот, включая насыщенные и ненасыщенные жирные кислоты, а также короткоцепные и длинноцепные жирные кислоты. Некоторые не ограничивающие примеры жирных кислот, которые могут быть внедрены в DAG и/или TAG, и которые могут содержаться в повышенных концентрациях, включают: каприновую (10:0), лауриновую (12:0), миристиновую (14:0), пальмитиновую (16:0), пальмитолеиновую (16:1), стеариновую (18:0, олеиновую (18:1), вакценовую (18:1), ленолевую (18:2), элеостеариновую (18:3), γ-линоленовую (18:3), α-линоленовую (18:3ω3), стеаридоновую (18:4ω3), арахидиновую (20:0), эйкозадиеновую (20:2), дигомо-γ-линоленовую (20:3), эйкозатриеновую (20:3), арахидоновую (20:4), эйкозатетраеновую (20:4), эйкозапентаеновую (20:5ω3), бегеновую (22:0), докозапентаеновую (22:5ω), докозагексаеновую (22:6ω3), лигноцериновую (24:0), нервоновую (24:1), церотиновую (26:0) и монтановую (28:0) жирные кислоты. В одном варианте реализации настоящего изобретения вегетирующая часть растения, трансгенный организм или его части обогащены DAG и/или TAG, содержащими олеиновую кислоту или полиненасыщенные жирные кислоты.
В одном варианте реализации настоящего изобретения вегетирующая часть растения, трансгенный нечеловеческий организм или его часть, предпочтительно растение или семена трансформированы с помощью химерной ДНК, которая кодирует MGAT, которая может обладать или не обладать активностью DGAT. Экспрессия MGAT предпочтительно приводит к более высоким концентрациям неполярных липидов, таких как DAG или TAG, и/или к повышенному выходу неполярных липидов в указанной вегетирующей части растения, трансгенном организме или его части. В предпочтительном варианте реализации трансгенный нечеловеческий организм представляет собой растение.
В дополнительном варианте реализации вегетирующая часть растения, трансгенный нечеловеческий организм или его часть трансформирован с помощью химерной ДНК, которая кодирует GPAT или DGAT. Предпочтительно, вегетирующая часть растения или трансгенный нечеловеческий организм трансформирован обеими химерными ДНК, которые предпочтительно ковалентно связаны на одной молекуле ДНК, как, например, одной молекуле Т-ДНК.
Yang et al. (2010) описывают две глицерин-3-фосфат-ацилтрансферазы (GPAT4 и GPAT6) из Arabidopsis с sn-2 предпочтением и активностью фосфатазы, которые способны образовывать sn-2 MAG из глицерин-3-фосфата (G-3-P) (Фигура 1). Эти ферменты предположительно являются часть пути синтеза кутина. Было показано, что GPAT4 и GPAT6 Arabidopsis используют ацил-CoA в качестве субстрата жирных кислот (Zheng et al., 2003).
Комбинирование функциональной GPAT/фосфатазы с MGAT дает новый путь синтеза DAG с использованием G-3-P в качестве одного субстрата и двух ацильных групп, полученных из ацил-CoA, - в качестве других субстратов. Точно так же комбинирование такой бифункциональной GPAT/фосфатазы с MGAT, которая обладает активностью DGAT, дает новый путь синтеза TAG с использованием глицерин-3-фосфата в качестве одного субстрата и трех ацильных групп, полученных из ацил-CoA, - в качестве других субстратов.
Соответственно, в одном варианте реализации настоящего изобретения вегетирующая часть растения, трансгенный нечеловеческий организм или его часть совместно преобразована с бифункциональной GPAT/фосфатазой и с MGAT, которая не обладает активностью DGAT. Это приводит к образованию MAG под действием бифункциональной GPAT/фосфатазы, который затем превращается в DAG под действием MGAT, а затем в TAG под действием нативной DGAT или другой активности. Новое производство DAG может быть подтверждено и отобрано, например, для осуществления такого совместного преобразования в дрожжевом штамме, содержащем летальные нокауты SLC1+SLC4, как описано учеными Benghezal et al., (2007; Фигура 2). Фигура 2 публикации Benghezal et al., (2007) демонстрирует, что нокаутирование двух дрожжевых LPATS (SLC1 и SLC4) является летальным. Двойной дрожжевой мутант SLC1+SLC4 может быть сохранен только за счет дополняющей плазмиды, которая обеспечивает один из slc генов (в их случае SLC1), в транс. Негативный отбор за счет добавления к среде FOA приводит к потере этой дополняющей плазмиды (противоселекция маркера отбора Ura) и делает клетки нежизнеспособными.
В другом варианте реализации настоящего изобретения вегетирующая часть растения, трансгенный нечеловеческий организм или его часть, предпочтительно растение или семена совместно преобразованы с помощью хмерных ДНК, кодирующих бифункциональную GPAT/фосфатазу, и MGAT, которая обладает активностью DGAT. Это приводит к образованию MAG под действием бифункциональном GPAT/фосфатазы, который затем превращается в DAG, а затем в TAG под действием MGAT.
В дополнительном варианте реализации подавляют одну или более экзогенных GPAT с не обнаруживаемой активностью фосфатазы, например, подавляют один или более генов, кодирующих GPAT, которые ацилируют глицерин-3-фосфат с образованием LPA в пути Кеннеди (например, GPAT1 Arabidopsis).
В другом варианте реализации вегетирующая часть растения, трансгенный нечеловеческий организм или его часть, предпочтительно растение или семена преобразованы с помощью химерных ДНК, кодирующих DGAT1, DGAT2, фактор транскрипции Wrinkled 1 (WRI1), олеозин или полипептид молчащего супрессора. Химерные ДНК предпочтительно ковалентно связаны на одной молекуле ДНК, такой как, например, одна молекула Т-ДНК, а вегетирующая часть растения, трансгенный нечеловеческий организм или его часть предпочтительно является гомозиготной для одной молекулы ДНК, вставленной в его геном.
В новых путях синтеза DAG и TAG могут быть предусмотрены субстратные предпочтения, например, за счет обеспечения трансгенных дрожжевых штаммов H1246, экспрессирующих варианты MGAT в такой концентрации конкретной свободной жирной кислоты (например, DHA), которая предотвращает комплементацию геном MGAT дикого типа. Расти будут только эти варианты, которые могут использовать поставляемую жирную кислоту. Несколько циклов создания MGAT приводит к выработке MGAT с увеличенным предпочтением к конкретным жирным кислотам.
Различные комплементации и дополнения пути Кеннеди, описанные выше, могут быть выполнены в любом клеточном типе благодаря повсеместной природе исходного субстрата, глицерин-3-фосфата. В одном варианте реализации применение трансгенов приводит к увеличенной концентрации масла.
Полинуклеотиды
Термины «полинуклеотид» и «нуклеиновая кислота» используются взаимозаменяемо. Они относятся к полимерной форме нуклеотидов любой длины, как дезоксирибонуклеотидов, так и рибонуклеотидов, или их аналогов. Полинуклеотид настоящего изобретения может быть геномного, кДНК, полусинтетического или синтетического происхождения, двухспиральным или односприальным, и в силу своего происхождения или обработки: (1) не связан со всеми или частью полинуклеотидов, с которыми он связан в природе, (2) связан с полинуклеотидом, отличным от того, с которым он связан в природе, или (3) не встречается в природе. Далее представлены не ограничивающие примеры полинуклеотидов: кодирующие или некодирующие области гена или генного фрагмента, локусы (локус), определенные по анализу связывания, экзоны, интроны, матричные РНК (мРНК), транспортные РНК (тРНК), рибосомные РНК (рРНК), рибозимы, кДНК, рекомбинантные полинуклеотиды, разветвленные полинуклеотиды, плазмиды, векторы, выделенные ДНК любой последовательности, выделенные РНК любой последовательности, химерные ДНК любой последовательности, пробы нуклеиновых кислот и праймеры. Полинуклеотид может содержать модифицированные нуклеотиды, такие как метилированные нуклеотиды и нуклеотидные аналоги. При их наличии, модификации в структуре нуклеотида могут быть внесены до или после сборки полимера. Последовательность нуклеотидов может быть прервана ненуклеотидными компонентами. Полинуклеотид может быть дополнительно модифицирован после полимеризации, как, например, сопряжением с компонентом-меткой.
Под «выделенным полинуклеотидом» понимается полинуклеотид, который, в основном, отделен от полинуклеотидной последовательности, с которой он соединен или связан в своем природном состоянии. Предпочтительно, выделенный полинуклеотид по меньшей мере на 60%, более предпочтительно по меньшей мере на 75% и более предпочтительно по меньшей мере на 90% чист от полинуклеотидных последовательностей, с которыми он соединен или связан в природе.
Используемый в настоящем документе термин «ген» следует понимать в его самом широком контексте, и он включает дезоксирибонуклеотидные последовательности, содержащие транскрибированную область и, будучи транслированным, область, кодирующую белок структурного гена, и включая последовательности, расположенные рядом с кодирующей областью с 5' и 3' концов на расстоянии по меньшей мере около 2 т.н. на каждом конце, и которые участвуют в экспрессии указанного гена. В этом отношении ген включает контрольные сигналы, такие как промоторы, энхансеры, сигналы терминации и/или сигналы полиаденилирования, которые естественным образом связаны с данным геном, или гетерологичные контрольные сигналы, и в этом случае ген упоминается как «химерный ген». Последовательности, которые находятся в положении 5' области, кодирующей белок, и которые присутствуют на мРНК, упоминаются как 5' не транслированные последовательности. Последовательности, которые находятся в положении 3' или после области, кодирующей белок, и которые присутствуют на мРНК, упоминаются как 3' не транслированные последовательности. Термин «ген» охватывает как кДНК, так и геномные формы гена. Геномная форма или клон гена содержит кодирующую область, которая может быть прервана некодирующими последовательностями, называемыми «интронами», «прерывающими областями» или «прерывающими последовательностями». Интроны представляют собой сегменты гена, которые транскрибированы в ядерную РНК (яРНК). Интроны могут содержать регуляторные элементы, такие как энхансеры. Интроны удаляются или «сплайсируются» из нуклеарного или первичного транскрипта; поэтому в мРНК транскриптах отсутствуют интроны. мРНК действует во время трансляции для определения последовательности или порядка аминокислот в образующемся полипептиде. Термин «ген» включает синтетическую или гибридную молекулу, кодирующую все или часть белков настоящего изобретения, описанных в настоящем документе, и комплементарную нуклеотидную последовательность к любому из вышеперечисленных.
Используемый в настоящем документе термин «химерная ДНК» относится к любой молекуле ДНК, которая не встречается в природе; также упоминается в настоящем документе как «ДНК конструкт». Как правило, химерная ДНК содержит регуляторную и транскрибированную или белок-кодирующую последовательность, которые естественным образом не встречаются вместе в природе. Соответственно, химерная ДНК может содержать регуляторные последовательности и кодирующие последовательности, которые получены из различных источников, или регуляторные последовательности и кодирующие последовательности, полученные из одного источника, но расположенные другим способом, чем это встречается в природе. Открытая рамка считывания может быть связана или не связана с ее природными восходящими и нисходящими регуляторными элементами. Открытая рамка считывания может быть внедрена, например, в геном растения, в неприродное положение или в репликон или вектор, где она обычно не встречается, такой как бактериальная плазмида или вирусный вектор. Термин «химерная ДНК» не ограничивается ДНК молекулами, которые могут быть реплицированы в хозяине, но включает также ДНК, способную встраиваться в репликон, например, с помощью специфических адаптерных последовательностей.
«Трансген» представляет собой ген, который был внедрен в геном с помощью приема трансформации. Этот термин включает ген в клетке-потомке, растении, семенах, нечеловеческом организме или его части, который был внедрен в геном его клетки-предшественника. Такие клетки-потомки и так далее могут представлять собой по меньшей мере 3-е или 4-ое поколение потомков от клетки-предшественника, которая была первичной трансформированной клеткой. Потомки могут быть получены половым размножением или вегетативно, как, например, из клубней картофеля или отростки корней сахарного тростника. Термин «генетически модифицированный» и его варианты представляет собой широкий термин, который включает внедрение гена в клетку с помощью трансформации или трансдукции, мутации гена в клетке и генетического изменения или модулирования регуляции гена в клетке или в потомках любой клетки, модифицированной так, как описано выше.
«Геномная область», при использовании в настоящем документе, относится к положению в геноме, где в клетку или ее предшественник вставлен трансген или группа трансгенов (также упоминаемая в настоящем документе как кластер). Такие области содержат только нуклеотиды, которые были встроены за счет вмешательства человека, как, например, по способам, описанным в настоящем документе.
«Рекомбинантный полинуклеотид» настоящего изобретения относится к молекуле нуклеиновой кислоты, которая была создана или модифицирована искусственными рекомбинантными способами. Рекомбинантный полинуклеотид может содержаться в клетке в измененном количестве или экспрессироваться с измененной скоростью (например, в случае мРНК), по сравнению с его природным состоянием. В одном варианте реализации полинуклеотид внедрен в клетку, которая естественным образом не содержит полинуклеотид. Как правило, используют экзогенную ДНК в качестве «кальки» для транскрипции мРНК, которая затем транслируется в непрерывную последовательность аминокислотных остатков, кодирующую полипептид настоящего изобретения в трансформированной клетке. В другом варианте реализации полинуклеотид является эндогенным для клетки, и его экспрессия изменена рекомбинантными способами, например, внедрена восходящая экзогенная контролирующая последовательность рассматриваемого эндогенного гена для обеспечения возможности трансформированной клетки экспрессировать полипептид, кодируемый этим геном.
Рекомбинантный полинуклеотид настоящего изобретения включает полинуклеотиды, которые не были отделены от других компонентов в клеточной или бесклеточной экспрессионной системе, которые затем очищают по меньшей мере от некоторых других компонентов. Полинуклеотид может быть смежным фрагментом нуклеотидов, существующих в природе, или содержать два или более смежных фрагмента нуклеотидов из разных источников (природных и/или синтетических), объединенных с образованием одного полинуклеотида. Как правило, такие химерные полинуклеотиды содержат по меньшей мере открытую рамку считывания, кодирующую полипептид настоящего изобретения, функционально связанную с промотором, пригодным для направления транскрипции открытой рамки считывания в рассматриваемой клетке.
В отношении определенных полинуклеотидов следует понимать, что значения % идентичности, которые выше, чем значения, представленные выше, охватывают предпочтительные варианты реализации. Так, когда это применимо, в свете минимальных значений % идентичности предпочтительно, чтобы полинуклеотид содержал полинуклеотидную последовательность, которая по меньшей мере на 60%, более предпочтительно по меньшей мере на 65%, более предпочтительно по меньшей мере на 70%, более предпочтительно по меньшей мере на 75%, более предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 85%, более предпочтительно по меньшей мере на 90%, более предпочтительно по меньшей мере на 91%, более предпочтительно по меньшей мере на 92%, более предпочтительно по меньшей мере на 93%, более предпочтительно по меньшей мере на 94%, более предпочтительно по меньшей мере на 95%, более предпочтительно по меньшей мере на 96%, более предпочтительно по меньшей мере на 97%, более предпочтительно по меньшей мере на 98%, более предпочтительно по меньшей мере на 99%, более предпочтительно по меньшей мере на 99,1%, более предпочтительно по меньшей мере на 99,2%, более предпочтительно по меньшей мере на 99,3%, более предпочтительно по меньшей мере на 99,4%, более предпочтительно по меньшей мере на 99,5%, более предпочтительно по меньшей мере на 99,6%, более предпочтительно по меньшей мере на 99,7%, более предпочтительно по меньшей мере на 99,8% и еще более предпочтительно по меньшей мере на 99,9% идентична релевантно обозначенной SEQ ID NO.
Полинуклеотид настоящего изобретения или пригодный для настоящего изобретения может селективно гибридизоваться, при жестких условиях, с полинуклеотидом, описанным в настоящем документе. Используемые в настоящем документе жесткие условия представляют собой условия, в которых: (1) при гибридизации используют денатурирующий агент, такой как формамид, например, 50% (об./об.) формамида с 0,1% (вес/об.) бычьего сывороточного альбумина, 0,1% фиколла, 0,1% поливинилпирролидона, 50 мМ фосфатно-натриевого буфера с рН 6,5 с 750 мМ NaCl, 75 мМ цитрата натрия при 42°С; или (2) используют 50% формамид, 5 х SSC (0,75 NaCl, 0,075 М цитрата натрия), 50 мМ фосфат натрия (рН 6,8), 0,1% пирофосфата натрия, 5 х раствор Денхардта, обработанную ультразвуком ДНК из молок лососевых (50 г/мл), 0,1% SDS и 10% сульфата декстрана при 42°С в 0,2 х SSC и 0,1% SDS, и/или (3) используют низкую ионную силу и высокую температуру для промывания, например, 0,015 М NaCl/0,0015 М цитрат натрия/0,1% SDS при 50°С.
Полинуклеотиды настоящего изобретения могут обладать, в сравнении с природными молекулами, одной или более мутациями, такими как делеции, вставки или замещения нуклеотидных остатков. Полинуклеотиды, которые имеют мутации по сравнению с эталонной последовательностью, могут быть либо природными (то есть выделенными из природного источника), либо синтетическими (например, путем выполнения сайт-направленного мутагенеза или ДНК перестановки на нуклеиновой кислоте, как описано выше).
Полинуклеотид для снижения степени экспрессии эндогенных белков
РНК-интерференция
РНК-интерференция (РНКи) особенно применима для специального ингибирования выработки определенного белка. Не ограничиваясь какой-либо теорией, ученые Waterhouse et al., (1998) предложили модель для механизма, по которому для снижения выработки белков может быть использована дсРНК (двухспиральная РНК). Эта технология основывается на наличии дсРНК молекул, которые содержат последовательность, которая по существу идентична мРНК рассматриваемого гена или ее части. Условно, дсРНК может быть получена из одного промотора в рекомбинантном векторе или клетке-хозяине, где смысловая и антисмысловая последовательности фланкированы несвязанной последовательностью, которая обеспечивает возможность гибридизации смысловой и антисмысловой последовательностей с образованием молекулы дсРНК с несвязанной последовательностью, образующей петлевую структуру. Разработка и получение подходящих молекул дсРНК находятся в рамках возможностей специалистов в данной области техники, особенно с учетом публикаций Waterhouse et al., (1998), Smith et al., (2000), WO 99/32619, WO 99/53050, WO 99/49029 и WO 01/34815.
В одном примере внедряют ДНК, которая направляет синтез по меньшей мере частично двухспирального РНК продукта (-ов) с гомологией к целевому гену, подлежащему инактивации. Таким образом, ДНК содержит как смысловую, так и антисмысловую последовательности, которые, при транскрибировании в РНК, могут гибридизоваться с образованием двухспиральной области РНК. В одном варианте реализации настоящего изобретения смысловая и антисмысловая последовательности разделены спейсерной областью, которая содержит интрон, который, при транскрибировании в РНК, сплайсируется. Было показано, что такое расположение приводит к более высокой эффективности сайленсинга гена. Двухспиральная область может содержать одну или две молекулы РНК, транскрибированные из одной или двух ДНК областей. Наличие двухспиральной молекулы, предположительно, запускает реакцию от эндогенной системы, которая разрушает двухспиральную РНК, а также гомологичный РНК транскрипт из целевого гена, эффективно уменьшая или исключая активность целевого гена.
Длина смысловой и антисмысловой последовательностей, которые гибридизуются, должна составлять для каждой последовательности по меньшей мере 19 непрерывных нуклеотидов. Может быть использована последовательность полной длины, соответствующая полному генному транскрипту. Степень идентичности смысловой и антисмысловой последовательностей к целевому транскрипту должна составлять по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95-100%. Молекула РНК, конечно, может содержать несвязанные последовательности, которые могут действовать для стабилизации молекулы. Молекула РНК ожжет быть экспрессирована под контролем промотора РНК полимеразы II или промотора РНК полимеразы III. Примеры последнего включают промоторы тРНК или няРНК.
Предпочтительные малые интерферирующие РНК («миРНК») молекулы содержат нуклеотидную последовательность, которая идентична приблизительно 19-21 непрерывному нулклеотиду целевой мРНК. Предпочтительно, последовательность миРНК начинается с динуклеотида АА, включает содержание GC около 30-70% (предпочтительно 30-60%, более предпочтительно 40-60% и более предпочтительно около 45%-55%) и не имеет высокой процентной идентичности с какой-либо нуклеотидной последовательностью, отличной от цели в геноме организма, в который она должна быть внедрена, например, как можно определить стандартным поиском по BLAST.
микроРНК
МикроРНК (сокращенно микроРНК), как правило, представляют собой некодирующие РНК молекулы из 19-25 нуклеотидов (у растений обычно около 20-24 нуклеотидов), которые получены из более крупных предшественников, которые образуют несовершенные структуры «петли и стебля».
МикроРНК связываются с комплементарными последовательностями на целевых транскриптах матричной РНК (мРНК), что обычно приводит к подавлению трансляции или разрушению цели и сайленсингу гена.
Предположительно, в растительных клетках молекулы-предшественники микроРНК в значительной степени процессируются в ядрах. Первичные микроРНК (содержащие одну или более локальных двухцепочечных или «шпилечных» областей, а также стандартный «кэп» 5' и полиаденилированный хвост мРНК) процессируются в более короткие молекулы-предшественники микроРНК, которые также содержат структуру «петли и стебля» или структуру обращенных повторов и называются «пре-микроРНК». У растений пре-микроРНК расщепляются отдельными DICER-подобными (DCL) ферментами, что дает дуплексы микроРНК:микроРНК*. Перед транспортом из ядра эти дуплексы метилируются.
В цитоплазме цепь микроРНК из дуплекса микроРНК:микроРНК селективно встраивается в активный РНК-индуцированный сайленсинг-комплекс (RISC) для распознавания мишени. Комплексы RISC содержат определенное подмножество белков Argonaute, которые оказывают последовательность-специфическое подавление гена (см., например, Millar and Waterhouse, 2005; Pasquinelli et al., 2005; Almeida and Allshire, 2005).
Косупрессия
Гены могут подавлять экспрессию родственных эндогенных генов и/или трансгенов, уже присутствующих в геноме, и это явление называется сайленсингом гена в зависимости от гомологии. Большинство случаев зависящего от гомологии сайленсинга гена приходится на два класса - те, которые действуют на стадии транскрипции трансгена, и те, которые действуют пост-транскрипционно.
Пост-транскрипционный, зависящий от гомологии сайленсинг гена (то есть косупрессия) описывает снижение экспрессии трансгенных или родственных эндогенных или вирусных генов в трансгенных растениях. Косупрессия часто, хотя не всегда, возникает, если трансгенные транскрипты являются многокопийными, и, как правило, считается, что она запускается на стадии процессирования, локализации и/или разрушения мРНК. Существует несколько моделей, объясняющих действие косупрессии (см. в публикации Taylor, 1997).
В одной модели, «количественной» модели или модели «порога РНК» предположено, что клетки могут справляться с накоплением больших количеств трансгенных транскриптов, но только до определенной точки. После перехода за критический порог начинается зависящее от последовательности разрушение трансгенных и родственных эндогенных генных транскриптов. Было предположено, что эта схема косупрессии может запускаться после синтеза молекул комплементарной РНК (кРНК) за счет обратной транскрипции избыточной трансгенной мРНК, предположительно с помощью эндогенных РНК-зависимых РНК полимераз. Эти кРНК могут гибридизоваться с трансгенными и эндогенными мРНК, а необычные гибриды действуют на гомологичные транскрипты, разрушая их. Однако эта модель не учитывает отчеты, в которых предполагается, что косупрессия может явно возникать в отсутствие трансгенной транскрипции и/или без обнаруживаемого накопления трансгенных транскриптов.
Для учета этих данных во второй модели, «качественной» модели или модели «аберрантной РНК», предполагается, что взаимодействия между трансгенной РНК и ДНК и/или между эндогенными и внедренными ДНК приводит к метилированию транскрибированных областей генов. Метилированные гены, предположительно, вырабатывают РНК, которые некоторым образом являются аберрантными, их аномальные особенности запускают специфическое разрушение всех родственных транскриптов. Такие аберрантные РНК могут производиться сложными трансгенными локусами, в частности теми, которые содержат инвертированные повторы.
В третьей модели предположено, что косупрессию может запускать межмолекулярное спаривание основание между транскриптами, а не кРНК-мРНК гибриды, образованные за счет действия РНК-зависимой РНК полимеразы. Такое спаривание оснований может стать более распространенным при повышении содержания транскриптов, предположительные двухспиральные области запускают направленное разрушение гомологичных транскриптов. В похожей модели предположено внутримолекулярное спаривание оснований вместо межмолекулярного спаривания оснований между транскриптами.
Косупрессия затрагивает внедрение избыточных копий гена или его фрагмента в растение в смысловой ориентации относительно промотора для его экспрессии. Специалистам в данной области понятно, что размер смыслового фрагмента, его соответствие областям целевого гена и степень идентичности его последовательности к целевому гену может варьироваться. В некоторых случаях дополнительная копия генной последовательности пересекается с экспрессией целевого гена растения. Сделана ссылка на WO 97/20936 и EP 0465572, где описаны способы внедрения подходов косупрессии.
Антисмысловые полинуклеотиды
Термин «антисмысловый полинуклеотид» следует понимать как обозначение молекулы ДНК или РНК, или их комбинации, которая комплементарна по меньшей мере к части определенной молекулы мРНК, кодирующей эндогенный полипептид и способной интерферировать с пост-транскрипционным событием, таким как трансляция мРНК. Применение антисмысловых способов хорошо известно в данной области техники (см., например, G. Hartmann and S. Endres, Manual of Antisense Methodology, Kluwer (1999)). Применение антисмысловых приемов на растениях рассмотрено учеными Bourque (1995) и Senior (1998). Bourque (1995) перечисляет большое количество примеров того, как антисмысловые последовательности были использованы в растительных системах в качестве способа инактивации гена. Bourque также утверждает, что достижение 100% ингибирования активности фермента может не быть необходимым, поскольку частичное ингибирование скорее всего приведет к измеримому изменению в системе. Senior (1998) утверждает, что антисмысловые способы в настоящее время представляют собой общепринятый прием для манипуляции генной экспрессией.
В одном варианте реализации антисмысловый полинуклеотид гибридизуется при физиологических условиях, то есть антисмысловый полинуклеотид (который является полностью или частично односпиральным) по меньшей мере может образовывать двухспиральный полинуклеотид с мРНК, кодирующей белок, такой как эндогенный фермент, например, DGAT, GPAT, LPAA, LPCAT, PAP, АГФаза, при нормальных условиях в клетке.
Антисмысловые молекулы могут содержать последовательности, которые соответствуют структурным генам или последовательностям, которые осуществляют контроль над генной экспрессией или событием сплайсинга. Например, антисмысловая последовательность может соответствовать целевой кодирующей области эндогенного гена или 5'-нетранслируемой области (UTR), или 3'-UTR, или их комбинации. Она может быть частично комплементарна последовательностям интрона, которые могут быть сплайсированы во время или после транскрипции, предпочтительно только до экзоновых последовательностей целевого гена. С учетом обычно большей дивергенции UTR, таргетинг этих областей обеспечивает более высокую специфичность ингибирования гена.
Длина антисмысловой последовательность должна составлять по меньшей мере 19 непрерывных нуклеотидов, предпочтительно по меньшей мере 50 нуклеотидов и более предпочтительно по меньшей мере 100, 200, 500 или 1000 нуклеотидов. Может быть использована последовательность полной длины, комплементарная к целому генному транскрипту. Наиболее предпочтительная длина составляет 100-2000 нуклеотидов. Степень идентичности антисмысловой последовательности к целевому транскрипту должна составлять по меньшей мере 90% и более предпочтительно 95-100%. Молекула антисмысловой РНК, конечно, может содержать несвязанные последовательности, которые могут действовать для стабилизации молекулы.
Каталитические полинуклеотиды
Термин «каталитический полинуклеотид» относится к молекуле ДНК или к ДНК-содержащей молекуле (известной в данной области техники также как «дезоксирибозим», или к РНК или РНК-содержащей молекуле (также известной как «рибозим», которая специфически распознает отдельный субстрат и катализирует химическую модификацию этого субстрата. Основания нуклеиновой кислоты в каталитической нуклеиновой кислоте могут быть основаниями A, C, G, T (и U для РНК).
Как правило, каталитическая нуклеиновая кислота содержит антисмысловую последовательность для специфического распознавания целевой нуклеиновой кислоты и осуществления ферментативной активности, расщепляющей нуклеиновую кислоту (также упоминаемую в настоящем документе как «каталитический домен»). Типы рибозимов, которые особенно пригодны в настоящем изобретении, представляют собой рибозимы типа «головка молотка» (Haseloff and Gerlach, 1998; Perriman et al., 1992) и шпилечные рибозимы (Zolotukhin et al., 1996; Klein et al., 1998; Shippy et al., 1999).
Рибозимы, применимые в настоящем изобретении, и рибозимы, кодирующие ДНК, могут быть химически синтезированы по способам, хорошо известным в данной области техники. Рибозимы могут быть также получены из ДНК молекулы (которая при транскрипции образует молекулу РНК), функционально связанной с промотором РНК-полимераз, например, промотором для Т7 РНК-полимеразы или SP6 РНК-полимеразы. В отдельном варианте реализации ДНК может быть вставлена в экспрессионную кассету или транскрипционную кассету. После синтеза молекула РНК может быть модифицирована лигированием с молекулой ДНК, обладающей способностью стабилизировать рибозим и делать его устойчивым к РНазе.
Как и с антисмысловыми олигонуклеотидами, малой интерферирующей РНК и микроРНК, описанными в настоящем документе, каталитические полинуклеотиды, пригодные в настоящем изобретении, должны быть способны «гибридизоваться» с молекулой целевой нуклеиновой кислоты при «физиологических условиях», а именно при условиях в клетке растения, водоросли или грибов.
Рекомбинантные векторы
Один вариант реализации настоящего изобретения включает рекомбинантный вектор, который содержит по меньшей мере один полинуклеотид, описанный в настоящем документе, и который способен осуществлять доставку полинуклеотида в клетку-хозяин. Рекомбинантные векторы включают векторы экспрессии. Рекомбинантные векторы содержат гетерологичные полинуклеотидные последовательности, то есть полинуклеотидные последовательности, которые обычно находятся рядом с полинуклеотидом, описанным в настоящем документе, которые предпочтительно получены из различных видов. Вектор может быть РНК или ДНК, прокариотическим или эукариотическим, и обычно представляет собой вирусный вектор, полученный из вируса, или плазмиду. Плазмидные векторы, как правило, содержат дополнительные последовательности нуклеиновых кислот, которые предназначены для простоты отбора, амплификации и трансформации экспрессионной кассеты в прокариотических клетках, например, векторы, полученные из pUC, векторы, полученные из pSK, векторы, полученные из pGEM, векторы, полученные из pSP, векторы, полученные из pBS, или бинарные векторы, содержащие одну или более областей Т-ДНК. Дополнительные последовательности нуклеиновых кислот содержат точки начала репликации для обеспечения автономной репликации вектора, селектируемые маркерные гены, предпочтительно кодирующие антибиотическую или гербицидную устойчивость, уникальные сайты множественного клонирования, предназначенные для вставки нескольких сайтов в последовательности нуклеиновых кислот или гены, кодируемые в конструкте этих нуклеиновых кислот, а также последовательности, которые усиливают трансформацию прокариотических и эукариотических (особенно растительных) клеток.
Термин «функционально связанный», используемый в настоящем документе, относится к функциональной взаимосвязи между двумя или более сегментами нуклеиновых кислот (например, ДНК). Как правило, он относится к функциональной взаимосвязи транскрипционного регуляторного элемента (промотора) с транскрибированной последовательностью. Например, промотор функционально связан с кодирующей последовательностью полинуклеотида, описанного в настоящем документе, если он стимулирует или модулирует транскрипцию кодирующей последовательности в соответствующей клетке. Как правило, промоторные транскрипционные регуляторные элементы, которые функционально связаны с транскрибированной последовательностью, физически продолжают транскрибированную последовательность, то есть они являются цис-действующими. Однако некоторые транскрипционные регуляторные элементы, такие как энхансеры, не обязательно должны физически продолжать или располагаться в непосредственной близости с кодирующими последовательностями, транскрипцию которых они усиливают.
При наличии нескольких промоторов, каждый промотор может быть независимо таким же или другим.
Рекомбинантные векторы также могут содержать: (а) один или более секреторных сигналов, которые кодируют сигнальные пептидные последовательности, для обеспечения возможности секреции полипептида, описанного в настоящем документе, из клетки, которая вырабатывает этот полипептид, или которые предназначены для локализации экспрессированного полипептида, например, для удерживания полипептида в эндоплазматическом ретикулуме (ER) в клетке, или для переноса в пластиду, и/или (b) содержат гибридные последовательности, которые приводят к экспрессии молекул нуклеиновых кислот в виде гибридных белков. Примеры подходящих сигнальных сегментов включают любой сигнальный сегмент, способный направлять секрецию или локализацию пептида, описанного в настоящем документе. Предпочтительные сигнальные сегменты включают, но не ограничиваясь этим, сигнальный пептид Nicotiana nectarin (US 5939288), сигнал экстенсина табака или сигнал связывающего белка масляных телец соевого олеозина. Рекомбинантные векторы также могут содержать прерывающие и/или нетранслируемые последовательности, окружающие и/или находящиеся внутри последовательности нуклеиновой кислоты полинуклеотида, описанного в настоящем документе.
Для облегчения идентификации трансформантов, рекомбинантный вектор желательно содержит селектируемый или скринируемый маркерный ген в виде, или в дополнение к последовательности нуклеиновых кислот полинуклеотида, описанного в настоящем документе. Под «маркерным геном» подразумевается ген, который сообщает клеткам, экспрессирующим маркерный ген, определенный фенотип и, следовательно, позволяет отличать такие трансформированные клетки от клеток, которые не содержат маркер. Селектируемый маркерный ген сообщает характерную особенность, по которой можно «выбирать» на основании устойчивости к селективному агенту (например, гербициду, антибиотику, облучению, нагреванию или другому виду обработки, повреждающему нетрансформированные клетки). Скринируемый маркерный ген (или репортерный ген) сообщает характерную особенность, которую можно идентифицировать при наблюдении или тестировании, то есть посредством «скринирования» (например, активности β-глюкониразы, люциферазы, GFP или другого фермента, не содержащегося в нетрансформированных клетках). Рассматриваемый маркерный ген и нуклеотидная последовательность не обязательно должен быть связан, поскольку совместная трансформация несвязанных генов, как описано, например, в US 4399216, также представляет собой эффективный процесс, например, при трансформации растений. Фактический выбор маркера не критичен, поскольку он является функциональным (то есть селективным) в сочетании с выбранными клетками, такими как клетки растений.
Примеры бактериальных селектируемых маркеров представляют собой маркеры, которые сообщают устойчивость к антибиотикам, такую как устойчивость к ампициллину, эритромицину, хлорамфениколу или к тетрациклину, предпочтительно устойчивость к канамицину. Иллюстративные селектируемые маркеры для выбора растительных трансформантов включают, но не ограничиваясь этим, ген hyg, который кодирует устойчивость к гигромицину В; ген неомицин-фосфотрансферазы (nptII), сообщающий устойчивость к канамицину, паромомицину, G418; ген глутатион-S-трансферазы из печени крыс, сообщающий устойчивость к глутатионовым гербицидам, как описано, например, в EP 256223; ген глутамин-синтетазы, сообщающий при сверхэкспрессии устойчивость к ингибиторам глутамин-синтетазы, таким как фосфинотрицин, как описано, например, в WO 87/05327; ген ацетилтрансферазы из Streptomyces viridochromogenes, сообщающий устойчивость к селективному агенту фосфинотрицину, как описано, например, в EP 275957; ген, кодирующий синтазу 5-енолшикимат-3-фосфата (EPSPS), сообщающий переносимость N-фосфонометилглицина, как описано, например, учеными Hinchee et al., (1988); ген bar, сообщающий устойчивость против биалафоса, как описано, например, в WO91/02071 ген нитрилазы, такой как bxn из Klebsiella ozaenae, который сообщает устойчивость к бромксинилу (Stalker et al., 1988); ген дигидрофолат-редуктазы (DHFR), сообщающий устойчивость к метотрексату (Thillet et al., 1988); мутантный ген ацетолактат-синтазы (ALS), который сообщает устойчивость к имидазолинону, сульфонилмочевине или к другим ALS-ингибирующим химикатам (EP 154204); мутированный ген антранилат-синтазы, который сообщает устойчивость к 5-метилтриптофану; или ген далапон-дегалогеназы, который сообщает устойчивость к гербицидам.
Предпочтительные скринируемые маркеры включают, но не ограничиваясь этим, ген uidA, кодирующий фермент β-глюкуронидазу (GUS), для которого известны различные хромогенные субстраты; ген β-галактозидазы, кодирующий фермент, для которого известны хромогенные субстраты; ген экворин (Prasher et al., 1985), который может быть использован в кальций-чувствительном биолюминесцентном обнаружении; ген зеленого флуоресцентного белка (Niedz et al., 1995) или его производные; или ген люциферазы (luc) (Ow et al., 1986), который обеспечивает возможность биолюминесцентного обнаружения. Под «репортерной молекулой» подразумевается молекула, которая по своей химической природе обеспечивает аналитически идентифицируемый сигнал, который облегчает определение промоторной активности в соответствии с белковым продуктом.
Предпочтительно, рекомбинантный вектор устойчиво внедрен в геном клетки, такой как клетка растения. Соответственно, рекомбинантный вектор может содержать соответствующие элементы, которые обеспечивают возможность встраивания вектора в геном или в хромосому клетки.
Вектор экспрессии
Используемый в настоящем документе термин «вектор экспрессии» представляет собой вектор ДНК или РНК, который может трансформировать клетку-хозяина и влиять на экспрессию одного или более определенных полинуклеотидов. Предпочтительно, вектор экспрессии может также реплицироваться в клетке-хозяине. Векторы экспрессии могут быть прокариотическими или эукариотическими, и обычно представляют собой вирусы или плазмиды. Векторы экспрессии настоящего изобретения включают любые векторы, которые действую (то есть направляют генную экспрессию) в клетках-хозяевах настоящего изобретения, включая бактериальные, грибковые, эндопаразитные, артроподные, животные, водорослевые и растительные клетки.
Векторы экспрессии настоящего изобретения содержат регуляторные последовательности, такие как последовательности для контроля транскрипции, последовательности для контроля трансляции, точки начала репликации и другие регуляторные последовательности, которые совместимы с клеткой-хозяином и которые контролируют экспрессию полинуклеотидов настоящего изобретения. В частности, векторы экспрессии настоящего изобретения включают последовательности для контроля транскрипции. Последовательности для контроля транскрипции представляют собой последовательности, которые контролируют инициацию, элонгацию и терминацию транскрипции. Особенно важные последовательности для контроля транскрипции представляют собой те, которые контролируют инициацию транскрипции, такие как промоторные, энхансерные, операторные и репрессорные последовательности. Подходящие последовательности для контроля транскрипции включают любые последовательности для контроля транскрипции, которые могут действовать по меньшей мере в одной из рекомбинантных клеток настоящего изобретения. Выбор используемых регуляторных последовательностей зависит от целевого организма, такого как растение, и/или от рассматриваемого целевого органа или ткани. Такие регуляторные последовательности могут быть получены из любого эукариотического организма, такого как растения или растительные вирусы, или могут быть синтезированы химически. Специалистам в данной области техники известны многие такие последовательности для контроля транскрипции. Особенно предпочтительные последовательности для контроля транскрипции представляют собой промоторы, активные при направлении транскрипции в растениях, конститутивно или в специфично для стадии и/или ткани, в зависимости от применения растения или его части (-ей).
Описано множество векторов, пригодных для стабильной трансфекции растительных клеток или для создания трансгенных растений, например, в публикациях Pouwels et al., Cloning Vectors: A Laboratory Manual, 1985, доп. 1987, Weissbach and Weissbach, Methods for Plant Molecular Biology, Academic Press, 1989, и Gelvin et al., Plant Molecular Biology Manual, Kluwer Academic Publishers, 1990. Как правило, векторы экспрессии растений содержат, например, один или более клонированных растительных генов под транскрипционным контролем 5' и 3' регуляторных последовательностей и доминантный селектируемый маркер. Такие векторы экспрессии растений содержат также промоторную регуляторную область (например, регуляторную область, контролирующую индуцибельную или конститутивную, зависящую от условий или от развития, или специфичную для клеток или тканей экспрессию), старт-сайт инициации транскрипции, рибосомный связывающий сайт, РНК-процессирующий сигнал, сайт терминации транскрипции и/или сигнал полиаденилирования.
Описано множество конститутивных промоторов, активных в клетках растений. Подходящие промоторы для конститутивной экспрессии в растениях включают, но не ограничиваясь этим, промотор вируса 35S мозаики цветной капусты (CaMV), вируса мозаики норичника (FMV) 35S, промотор бациллярного вируса сахарного тростника, промотор вируса желтой крапчатости коммелины, светоиндуцибельный промотор из малой субъединицы карбоксилазы рибулоза-1,5-бис-фосфата, промотор цитозольной триосефосфат-изомеразы риса, промотор аденин-фосфорибозилтрансферазы Arabidopsis, промотор рисового гена актина 1, промоторы маннопин-синтазы и октопин-синтазы, промотор Adh, промотор синтазы сахарозы, промотор генного комплекса R и промотор гена α/β-связывающего белка хлорофилла. Эти промоторы могут быть использованы для создания векторов ДНК, которые экспрессируются в растениях, см., например, WO 84/02913. Все эти промоторы используются для создания различных типов рекомбинантных ДНК векторов, экспрессируемых в растениях.
Для экспрессии в тканях-источниках растения, таких как листья, семена, корень или стебель, предпочтительно, чтобы промоторы, используемые в настоящем изобретении, обладали относительно высокой экспрессией в этих конкретных тканях. Для этой цели можно выбирать из множества промоторов для генов с ткане- или клеточноспецифической, или -усиленной экспрессией. Примеры таких промоторов, описанные в литературе, включают промотор глутамин-синтетазы GS2 хлоропластов из гороха, промотор фруктоза-1,6-бифосфата хлоропластов из пшеницы, ядерный фотосинтетический промотор ST-LS1 из картофеля, промотор серин/треонин-киназы из промотор глюкоамилазы (CHS) из Arabidopsis thaliana. Описаны также активные в фотосинтетически активных тканях промотор карбоксилазы рибулоза-1,5-бифосфата из американское лиственницы (Larix laricana), промотор для гена Cab, Cab6, из сосны, промотор для гена Cab-1 из пшеницы, промотор для гена Cab-1 из шпината, промотор для гена Cab 1R из риса, промотор пируват, ортофосфат-дигиназы (PPDK) из Zea mays, промотор для гена табака Lhcb1*2, промотор симпортера сахарозы-H30 Suc2 Arabidopsis thaliana и промотор для белов тилакоидной мембраны из шпината (PsaD, PsaF, PsaE, PC, FNR, AtpC, AtpD, Cab, RbcS). В настоящем изобретении могут быть использованы также другие промоторы для α/β-связывающих белков хлорофилла, такие как промоторы для гена LhcB и гена PsbP из белой горчицы (Sinapis alba).
Для экспрессии генов РНК-связывающих белков в растительных клетках могут быть использованы также различные растительные промоторы генов, которые регулируются в ответ на сигналы среды, гормональные, химические и/или сигналы развития, включая промоторы, регулируемые (1) действием тепла, (2) действием света (например, промотор RbcS-3A гороха, промотор RbcS маиса), (3) действие гормонов, таких как абсцизовая кислота, (4) скарифицированием (например, WunI) или (5) химическими веществами, такими как метил-жасмонат, салициловая кислота, стероидные гормоны, спирт, антидоты (WO 97/06269), или может быть преимущественным использовать (6) орган-специфические промоторы.
Используемый в настоящем документе термин «промотор, специфичный к запасающему органу растения» относится к промотору, который преимущественно, по сравнению с другими тканями растения, направляет генную транскрипцию в запасающем органе растения. Предпочтительно, промотор направляет только экспрессию рассматриваемого гена в запасающем органе и/или экспрессия рассматриваемого гена в других частях растения, таких как листья, не обнаруживается по анализу нозерн-блоттинга и/или ПЦР в реальном времени. Как правило, промотор движет экспрессией генов во время роста и развития запасающего органа, в частности в течение фазы синтеза и накопления запасаемых соединений в запасающем органе. Такие промоторы могут направлять генную экспрессию в целом запасающем органе растения или только в его части, такой как оболочка семени, зародыш или котиледон (-ы) в семенах двудольных растений или в эндосперме или в алейроновом слое семян однодольных растений.
Для экспрессии в нефотосинтезирующих тканях растения, таких как клубни картофеля, плоды томата или семена сои, канолы, хлопка, Zea mays, пшеницы, риса и ячменя предпочтительно, чтобы промоторы, используемые в настоящем изобретении, обладали относительно высокой экспрессией в этих конкретных тканях. Известно множество промоторов для генов с клубнеспецифицеской или -усиленной экспрессией, включая промотор пататина I класса, промотор для генов ADPGPP картофельных клубней, для больших и малых субъединиц, промотор синтазы сахарозы, промотор для основных клубневых белков, включая белковые комплексы размером 22 кД и ингибиторы протеиназы, промотор для гена гранул-связанной синтазы крахмала (GBSS) и другие промоторы пататинов I и II класса. Также могут быть использованы другие промоторы для экспрессии белка в конкретных тканях, таких как семена или плоды. Может быть использован промотор для β-конглицинина или другие специфические к семенам промоторы, такие как промоторы напина, зеина, линина и фазеолина. Также могут быть использованы специфические к корням промоторы. Пример такого промотора представляет собой промотор для гена кислой хитиназы. Экспрессия в корневой ткани также может быть осуществлена за счет использования идентифицированных субдоменов промотора 35S CaMV, специфичных к корням.
В особенно предпочтительном варианте реализации промотор направляет экспрессию в тканях и органах, в которых происходит биосинтез липидов. Такие промоторы могут действовать при развитии семян в подходящее время для модификации липидного состава в семенах.
В одном варианте реализации промотор представляет собой промотор, специфический для запасающего органа растения. В одном варианте реализации промотор, специфический для запасающего органа растения, представляет собой промотор, специфический к семенам. В более предпочтительном варианте реализации промотор предпочтительно направляет экспрессию в котиледонах двудольного растения или в эндосперме однодольного растения, по сравнению с экспрессией в зародыше семян или по сравнению с другими органами растения, такими как листья. Предпочтительные промоторы для экспрессии, специфичной для семян, включают: 1) промоторы из генов, кодирующих ферменты, участвующие в биосинтезе липидов и их накоплении в семенах, таких как десатуразы и элонгазы, 2) промоторы из генов, кодирующих запасные белки семян, и 3) промоторы из генов, кодирующих ферменты, участвующие в биосинтезе углеводов и их накоплении в семенах. Подходящие промоторы, специфические для семян, представляют собой промотор гена напина семян рамса (US 5608152), промотор USP Vicia faba (Baumlein et al., 1991), промотор олеозина Arabidopsis (WO 98/45461), промотор фазеолина Phaseolus vulgaris (US 5504200), промотор Bce4 Brassica (WO 91/13980) или промотор легумина B4 (Baumlein et al., 1992), а также промоторы, которые приводят к экспрессии, специфичной для семян, в однодольных растениях, таких как маис, ячмень, пшеница, рожь, рис и тому подобные. Значимые пригодные промоторы представляют собой промотор гена lpt2 или lpt1 (WO 95/15389 и WO 95/23230) или промоторы, описанные в WO 99/16890 (промоторы из гена хордеина ячменя, ген глютелина риса, ген оризина риса, ген проламина риса, ген глиадина пшеницы, ген глютелина пшеницы, ген зеина маиса, ген глютелина овса, ген казирина сорго, ген секалина ржи). Другие промоторы включают промоторы, описанные в публикациях Broun et al. (1998), Potenza et al. (2004), US 20070192902 и US 20030159173. В одном варианте реализации промотор, специфичный к семенам, предпочтительно экспрессируется в определенных частях семени, таких как котиледон (-ы) или эндосперм. Примеры котиледон-специфичных промоторов включают, но не ограничиваясь этим, промотор FP1 (Ellerstrom et al., 1996), Промотор легумина гороха (Perrin et al., 2000) и промотор фитогемагглютинина фасоли (Perrin et al., 2000). Примеры эндосперм-специфичных промоторов включают, но не ограничиваясь этим, промотор зеинм-1 маиса (Chikwamba et al., 2003), промотор глютелина-1 риса (Yang et al., 2003), промотор D-хордеина ячменя (Horvath et al., 2000) и промоторы глютелина HMW пшеницы (Alvarez et al., 2000). В дополнительном варианте реализации специфичный к семенам промотор не экспрессируется или экспрессируется лишь в малых количествах в зародыше и/или после прорастания семени.
В другом варианте реализации промотор, специфичный к запасающему органу растения, представляет собой клубнеспецифический промотор. Примеры включают, но не ограничиваясь этим, промоторы пататина картофеля B33, PAT21 и GBSS, а также промотор спорамина сладкого картофеля (обзор представлен в публикации Potenza et al., 2004). В предпочтительном варианте реализации промотор направляет экспрессию предпочтительно в сердцевине клубня, по сравнению с внешними слоями (кожура, кора) или зародышем клубня.
В другом варианте реализации промотор, специфичный к запасающему органу растения, представляет собой промотор, специфичный к плоду. Примеры включают, но не ограничиваясь этим, промоторы полигалактуроназы томатов E8 и Pds, а также промотор оксидазы ACC яблок (обзор представлен в публикации Potenza et al., 2004). В предпочтительном варианте реализации промотор предпочтительно направляет экспрессию в съедобных частях плода, например, в сердцевине плода, по сравнению с кожурой плода или с семенами внутри плода.
В одном варианте реализации индуцибельный промотор представляет собой систему alc Aspergillus nidulans. Примеры индуцибельных систем экспрессии, которые могут быть использованы вместо системы alc Aspergillus nidulans, описаны в обзоре Padidam (2003) и Corrado and Karali (2009). Они включают системы на основе тетрациклинового репрессора (TetR) и тетрациклин-индуцибельные системы (gatz, 1997), системы на основе тетрациклинового репрессора и тетрациклин-инактивируемые системы (Weinmann et al., 1994), системы на основе глюкокортикоидного рецептора (picard, 1994), системы на основе эстрогенового рецептора и другие стероид-индуцибельные системы (Bruce et al., 2000), двойные контрольные системы на основе глюкокортикоидного рецептора, тетрациклинового рецептора (Bohner et al., 1999), инсектицид-индуцибельные системы на основе экдизонового рецептора (Martinez et al., 1999, Padidam et al., 2003, Unger et al., 2002, Riddiford et al., 2000, Dhadialla et al., 1998, Martinez and Jepson, 1999), этанол-индуцибельные системы на основе AlcR (Felenbok, 1991) и медь-индуцируемые системы на основе ACEI (Mett et al., 1993).
В другом варианте реализации индуцибельный промотор представляет собой антидот-индуцибельный промотор, такой как, например, промотор ln2-1 или ln2-2 маиса (Hershey and Stoner, 1991), антидот-индуцибельный промотор представляет собой промотор GST-27 маиса (Jepson et al., 1994) или промотор GH2/4 сои (Ulmasov et al., 1995).
Антидоты представляют собой группу структурно различных химических веществ, используемых для увеличения переносимости растениями токсического действия гербицидных соединений. Примеры таких соединений включают нафтойный ангидрид и N,N-диаллил-2,2-дихлорацетамид (DDCA), которые защищают маис и сорго от тиокарбаматных гербицидов; циометринил, который защищает сорго от метохлора; триапентенол, который защищает сою от метрибуцина; и замещенные бензолсульфонамиды, которые улучшают переносимость некоторых видов зерновых культур к сульфонилкарбамидным гербицидам.
В другом варианте реализации индуцибельный промотор представляет собой индуцибельный увяданием промотор, такой как, например, индуцибельный увяданием промотор SAG (ген, связанный с увяданием) 12 и SAG 13 из Arabidopsis (Gan, 1995; Gan and Amasino, 1995) и LSC54 из Brassica napus (Buchanan-Wollaston, 1994).
Для экспрессии в вегетирующей ткани могут быть использованы специфичные к листьям промоторы, такие как промоторы рибулоза-бифосфат-карбоксилазы (RBCS). Например, гены томатов RBCS1, RBCS2 и RBCS3А экспрессируются в листьях и выращенных на свету сеянцах (Meier et al., 1997). Могут быть использованы промоторы рибулоза-бифосфат-карбоксилазы, экспрессированные практически исключительно в мезофильных клетках пластин листа и листовых влагалищ в высоких концентрациях, описанные учеными Matsuoka et al., (1994). Другой специфичный к листьям промотор представляет собой промотор гена a/b-связывающего светособирающего белка хлорофилла (см. Shiina et al., 1997). Промотор myb-связанного гена Arabidopsis thaliana (Atmyb5), описанный учеными Li et al., (1996), является специфичным к листьям. Промотор Atmyb5 экспрессируется в развивающихся трихомах листьев, прилистниках и эпидермальных клетках и по краям молодых розеточных и стеблевых листьев, а также в незрелых семенах. Также может быть использован промотор листьев, идентифицированный в маисе учеными Busk et al. (1997).
В некоторых случаях, например при рекомбинантной экспрессии LEC2 или BBM, может быть желательно, чтобы трансген не экспрессировался в высоких концентрациях. Пример промотора, который может быть использован в таких случаях, представляет собой усеченный промотор напина А, который сохраняет образ специфичной к семенам экспрессии, но со сниженной степенью экспрессии (Tan et al., 2011).
5' нетранслируемая лидерная последовательность может быть получена из промотора, выбранного для экспрессии гетерологичной генной последовательности полинуклеотида настоящего изобретения, или может быть гетерологичной в отношении кодирующей области вырабатываемого фермента, и может быть при необходимости специфически модифицирована для увеличения трансляции мРНК. Обзор оптимизирующей экспрессии трансгенов представлен в публикации Koziel et al. (1996). 5' нетранслируемые области также могут быть получены из вирусных РНК растений (вирус табачной мозаики, вирус гравировки табака, вирус карликовой мозаики кукурузы, вирус мозаики люцерны, среди прочих) из подходящих эукариотических генов, растительных генов (главный ген a/b-связывающего белка хлорофилла пшеницы и маиса), или из синтетических генных последовательностей. Настоящее изобретение не ограничивается конструктами, в которых нетранслируемая область получена из 5' нетранслируемой последовательности, которая дополняет последовательность промотора. Лидерная последовательность также может быть получена из несвязанной промоторной или кодирующей последовательности. Лидерные последовательности, пригодные в контексте настоящего изобретения, включают лидерный Hsp70 маиса (US 5362865 и US 5859347), а также TMV-омега элемент.
Терминация транскрипции выполняется 3' нетранслируемой ДНК последовательностью, функционально связанной в векторе экспрессии с заданным полинуклеотидом. 3' нетранслируемая область рекомбинантной молекулы ДНК содержит сигнал полиаденилирования, который действует в растениях, вызывая добавление аденилатных нуклеотидов в 3'-конце РНК. 3' нетранслируемая область может быть получена из различных генов, которые экспрессируются в клетках растений. В этой роли обычно используют 3' нетранслируемую область нопалин-синтазы, 3' нетранслируемую область малой субъединицы гена Rubisco гороха, 3' нетранслируемую область гена запасного белка 7S семян сои. Пригодны также 3' транскрибированные, нетранслируемые области, содержащие полиаденилатный сигнал генов опухолеиндуцирующей плазмиды (Ti).
Технологии рекомбинантной ДНК могут быть использованы для улучшения экспрессии трансформированного полинуклеотида за счет управления, например, количеством копий полинуклеотида в клетке-хозяине, эффективности, с которой транскрибируется этот полинуклеотид, эффективности, с которой транслируются полученные транскрипты, и эффективности пост-трансляционных модификаций. Рекомбинантные приемы, пригодные для увеличения экспрессии полинуклеотидов, описанных в настоящем документе, включают, но не ограничиваясь этим, функциональное связывание полинуклеотида с многокопийной плазмидой, интеграцию молекулы полинуклеотида в одну или более хромосом клетки-хозяина, добавление последовательностей векторной стабильности в плазмиду, замещение или модификацию контрольных сигналов транскрипции (например, промоторов, операторов, энхансеров), замещение или модификацию контрольных сигналов трансляции (например, рибосома-связывающих сайтов, последовательностей Шайна-Дальгарно), модификацию полинуклеотида для его соответствия кодоновому применению клетки-хозяина, а также делецию последовательностей, которые дестабилизируют транскрипты.
Трансферные нуклеиновые кислоты
Трансферные нуклеиновые кислоты могут быть использованы для доставки экзогенного полинуклеотида в клетку и содержать одну, предпочтительно две пограничные последовательности и заданный полинуклеотид. Трансферная нуклеиновая кислота может кодировать или не кодировать селектируемый маркер. Предпочтительно, трансферная нуклеиновая кислота образует часть бинарного вектора в бактерии, где указанный бинарный вектор дополнительно содержит элементы, которые обеспечивают репликацию вектора в бактерии, селекцию или сохранение бактериальных клеток, содержащих бинарный вектор. При переносе в эукариотическую клетку, компонент трансферной нуклеиновой кислоты в бинарном векторе может интегрироваться в геном эукариотической клетки.
Используемый в настоящем документе термин «экстрахромосомная трансферная нуклеиновая кислота» относится к молекуле нуклеиновой кислоты, которая может быть перенесена из бактерии, такой как бактерия видов Agrobacterium, в эукариотическую клетку, такую как клетка листа растения. Экстрахромосомная трансферная нуклеиновая кислота представляет собой генетический элемент, который хорошо известен как элемент, способный переноситься с последующей интеграцией нуклеотидной последовательности, содержащейся в его пределах, в геном клетки-реципиента. В этом отношении трансферная нуклеиновая кислота фланкирована, как правило, двумя «пограничными» последовательностями, хотя в некоторых случаях может быть использована одна граница с одного конца, а второй конец перенесенной нуклеиновой кислоты случайным образом образуется в процессе переноса. Заданный полинуклеотид обычно располагается между левой пограничной последовательностью и правой пограничной последовательностью трансферной нуклеиновой кислоты. Полинуклеотид, содержащийся в трансферной нуклеиновой кислоте, может быть функционально связан с многочисленными различными регуляторными элементами промоторов и терминаторов, которые обгегчают его экспрессию, то есть транскрипцию и/или трансляцию полипептида. Трансферные ДНК (Т-ДНК) из видов Agrobacterium, таких как Agrobacterium tumefaciens или Agrobacterium rhizogenes, а также их искусственные варианты/мутанты, вероятно, представляют собой лучше всего описанные примеры трансферных нуклеиновых кислот. Другой пример представляет собой Р-ДНК («растительная ДНК»), которая содержит пограничные последовательности Т-ДНК из растений.
Используемый в настоящем документе термин «Т-ДНК» относится, например, к Т-ДНА Ti-плазмиды Agrobacterium tumefaciens или из Ri-плазмиды Agrobacterium rhizogenes, или ее искусственным вариантам, которые действуют как Т-ДНК. Т-ДНК может содержать целую Т-ДНК, включая правую и левую пограничные последовательности, но должна содержать лишь минимальные последовательности, необходимые в цис-положении для переноса, то есть правую и пограничную последовательность Т-ДНК. Т-ДНК настоящего изобретения содержат вставленный в них, в любом месте между правой и левой пограничной последовательностями (при ее наличии), заданный полинуклеотид, фланкированный целевыми сайтами для сайт-специфичной рекомбиназы. Последовательности, кодирующие факторы, необходимые в транс-положении для переноса Т-ДНК в клетку растения, такие как гены vir, могут быть вставлены в Т-ДНК или могут присутствовать на том же репликоне, что и Т-ДНК, или предпочтительно находятся в транс-положении на совместимом репликоне в хозяине Agrobacterium. Такие «бинарные векторные системы» хорошо известны в данной области техники.
Используемый в настоящем документе термин «Р-ДНК» относится к трансферной нуклеиновой кислоте, выделенной из генома растения, или к ее искусственным вариантам/мутантам, и содержит с каждого конца или только с одного конца пограничную последовательность Т-ДНК. Пограничная последовательность предпочтительно имеет по меньшей мере 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 90 или по меньшей мере на 95%, но менее 100% идентичность последовательностей с пограничной последовательностью Т-ДНК из видов Agrobacterium, таких как Agrobacterium tumefaciens или Agrobacterium rhizogenes. Следовательно. Р-ДНК могут быть использованы вместо Т-ДНК для переноса нуклеотидных последовательностей, содержащихся в Р-ДНК, например, из Agrobacterium, в другую клетку. Перед вставкой экзогенного полинуклеотида, который подлежит переносу. Р-ДНК может быть модифицирована для облегчения клонирования и предпочтительно не должна кодировать какие-либо белки. Р-ДНК характеризуется тем, что она содержит, по меньшей мере правую пограничную последовательность и предпочтительно также левую пограничную последовательность.
При использовании в настоящем документе, «пограничная» последовательность трансферной нуклеиновой кислоты может быть выделена из выбранного организма, такого как растение или бактерия, или может быть ее искусственным вариантом/мутантом. Пограничная последовательность промотирует и облегчает перенос полинуклеотида, с которым она связана, и может облегчать его интеграцию в геном клетки-реципиента. В одном варианте реализации пограничная последовательность имеет длину от 5 до 100 пар оснований (п.о.), 10-80 п.о. в длину, 15-75 п.о. в длину, 15-60 п.о. в длину, 15-50 п.о. в длину, 15-40 п.о. в длину, 15-30 п.о. в длину, 16-30 п.о. в длину, 20-30 п.о. в длину, 21-30 п.о. в длину, 22-30 п.о. в длину, 23-30 п.о. в длину, 24-30 п.о. в длину, 25-30 п.о. в длину или 26-30 п.о. в длину. Пограничные последовательности из Т-ДНК видов Agrobacterium хорошо известны в данной области и включают последовательности, описанные в публикациях Lacroix et al., (2008), Tzfira and Citovsky (2006) и Glevin (2003).
Хотя для переноса генов в клетки растений традиционно используют только виды Agrobacterium, в настоящее время существует большое количество идентифицированных/разработанных систем, которые действуют таким же образом, что и виды Agrobacterium. Недавно были генетически модифицированы несколько видов, не относящихся к Agrobacterium, которые могут быть способны осуществлять перенос генов (Chung et al., 2006; Broothaerts et al., 2005). Сюда входит вид Rhisobium NGR234, Sinorhizobium meliloti и Mezorhizobium loti. Эти бактерии созданы так, что они способны переносить ген за счет снабжения бактерий оборудованием, необходимым для процесса трансформации, то есть набором вирулентных генов, кодируемых Ti-плазмидой Agrobacterium и сегментом Т-ДНК, находящимся на отдельной, небольшой бинарной плазмиде. Созданные таким образом бактерии способны трансформировать различные ткани растения (листовые диски, каллусы и овальную ткань), однодольные или двудольные, а также различные виды растений (например, табак, рис).
Прямой перенос эукариотических экспрессионных плазмид из бактерии в эукариотические хозяева был впервые достигнут несколько десятилетий назад за счет гибридизации клеток млекопитающих и протопластов содержащих плазмиды Escherichia coli (Schaffner, 1980). С тех пор количество бактерий, способных доставлять гены в клетки млекопитающих, постоянно увеличивается (Weiss, 2003), что было открыто независимо четырьмя группами исследователей (Sizemore at al., 1995; Courvalin et al., 1995; Powell et al., 1996; Darji et al., 1997).
Было показано, что аттенуированные Shigella flexneri, Salmonella typhimurium или E. coli, которые были наделены инвазивностью с помощью плазмиды вирулентности (pWR100) S. flexneri, способны переносить экспрессионные плазмиды после инвазии клеток-хозяев и внутриклеточной гибели из-за метаболического ослабления. Применения на слизистых оболочках, назально или перорально, таких рекомбинантных Shigella или Salmonella вызывает иммунные реакции против антигена, который кодирован экспрессионными плазмидами. В то же время перечень бактерий, которые, как было показано, способны переносить экспрессионные плазмиды в клетки-хозяева млекопитающих in vitro и in vivo, был более чем удвоен и был зарегистрирован для S. typhi, S. choleraesuis, Listeria monocyrogenes, Yersinia pseudotuberculosis и Y. enterocolotica (Fennelly et al., 1999; Shiau et al., 2001; Dietrich et al., 1998; Hense et al., 2001; Al-Mariri et al., 2002).
В общем, можно предположить, что все бактерии, которые могут проникать в цитозоль клетки-хозяина (типа S. flexneri или L. monocytogenes) и лизироваться в этом клеточном отделе, могут переносить ДНК. Это явление известно как «абортивная» или «суицидальная» инвазия, поскольку бактерии должны лизироваться, чтобы состоялся перенос ДНК (Grillot-Courvalin et al., 1999). Кроме того, еще большее количество бактерий, которые сохраняются в фагоцитарной вакуоли (типа S. typhimurium), также могут действовать таким образом. Так, рекомбинантные лабораторные штаммы E. coli, которые были созданы инвазивными, но не способными к фагосомальному выходу, могут тем не менее доставлять их плазмидную нагрузку в ядро инфицированной клетки млекопитающего (Grillot-Courvalin et al., 1998). Более того, недавно было показано, что Agrobacterium tumefaciens внедряют трансгены в клетки млекопитающих (Kunik et al., 2001.
Используемые в настоящем документе термины «трансфекция», «трансформация» и их варианты обычно используются взаимозаменяемо. «Трансфицированные» или «трансформированные» клетки можно обработать для внедрения заданного полинуклеотида (-ов), или они могут быть клетками-потомками, полученными из них.
Рекомбинантные клетки
В настоящем изобретении представлена также рекомбинантная клетка, например, рекомбинантная клетка растения, которая представляет собой клетку-хозяин, трансформированную одним или более полинуклеотидами или векторами, описанными в настоящем документе, или их комбинацией. Термин «рекомбинантная клетка» используется в настоящем документе взаимозаменяемо с термином «трансгенная клетка». Пригодные клетки настоящего изобретения включают любые клетки, которые могут быть трансформированы полинуклеотидом или рекомбинантным вектором настоящего изобретения, кодирующим, например, полипептид или фермент, описанный в настоящем документе. Клетка предпочтительно представляет собой клетку, которая посредством этого может быть использована для выработки липидов. Рекомбинантная клетка может быть клеткой в культуре, клеткой in vitro или в организме, таком как, например, растение, или в органе, таком как, например, семена или листья. Предпочтительно, клетка находится в растении, более предпочтительно в семенах растения. В одном варианте реализации рекомбинантная клетка не является клеткой человека.
Клетки-хозяева, в которые внедряют полинуклеотид (-ы), могут быть либо нетрансформированными клетками, либо клетками, которые уже трансформированы по меньшей мере одной нуклеиновой кислотой. Такие нуклеиновые кислоты могут быть связаны с синтезом липидов, или могут быть не связанными с ним. Клетки-хозяева настоящего изобретения могут быть либо эндогенно (то есть по своей природе) способными вырабатывать полипептид (-ы), описанные в настоящем документе, и в этом случае рекомбинантная клетка, полученная из них, обладает улучшенной способностью вырабатывать полипептид (-ы), либо могут быть способными вырабатывать указанный полипептид (-ы) только после трансформации по меньшей мере одним полинуклеотидом настоящего изобретения. В одном варианте реализации рекомбинантная клетка настоящего изобретения обладает улучшенной способностью вырабатывать неполярные липиды.
Клетки-хозяева настоящего изобретения могут быть любой клеткой, способной вырабатывать по меньшей мере один белок, описанный в настоящем документе, и включают бактериальные, грибковые (в том числе дрожжевые), паразитные, артроподные, животные, водорослевые и растительные клетки. Клетки могут быть прокариотическими или эукариотическими. Предпочтительные клетки-хозяева представляют собой дрожжевые, водорослевые и растительные клетки. В предпочтительном варианте реализации растительная клетка представляет собой клетку семени, в частности, клетку в котиледоне или эндосперме семени. В одном варианте реализации клетка представляет собой клетку животного. Клетка животного может быть клеткой любого типа животного, такой как, например, нечеловеческая клетка животного, нечеловеческая клетка панцирного, нечеловеческая клетка млекопитающего или клетки водных животных, таких как рыбы или ракообразные, беспозвоночные, насекомые и так далее. Не ограничивающие примеры артроподных клеток включают клетки насекомых, такие как клетки Spodoptera frugiperda (Sf), например, Sf9, Sf21, клетки Trichoplusia ni и клетки Drosophila S2. Пример бактериальных клеток, пригодных в качестве клетки-хозяина настоящего изобретения, представляет собой клетку видов Synechococcus (также известных как виды Synechocystis), например, Synechococcus elongates. Примеры водорослевых клеток, пригодных в качестве клеток-хозяев настоящего изобретения, включают, например, клетки видов Chlamydomonas (например, Chlamydomonas reinhardtii), видов Dunaliella, видов Haematococcus, видов Chlorella, видов Thraustochytrium, видов Schizochytrium и видов Volvox.
Клетки-хозяева для экспрессии рассматриваемых нуклеиновых кислот могут включать микробные хозяева, которые растут на различных видах твердого субстрата, включая простые или сложные углеводы, органические кислоты и спирты и/или углеводороды в широком диапазоне температур и значений рН. Предпочтительные микробные хозяева представляют собой маслянистые организмы, которые естественным образом способны синтезировать неполярные липиды.
Клетки-хозяева могут быть клетками организма, пригодного для процесса ферментации, такого как, например, Yarrowia lipolytica или другие дрожжи.
Трансгенные растения
В настоящем изобретении представлено также растение, содержащее экзогенный полинуклеотид или полипептид настоящего изобретения, клетку настоящего изобретения, вектор настоящего изобретения или их комбинацию. Термин «растение» относится к целым растениям, тогда как термин «его часть» относится к органам растения (например, листьям, стеблям, корням, цветам, плодам), отдельным клеткам (например, пыльце), семенам, частям семян, таким как зародыш, эндосперм, щиток или оболочка семени, ткани растения, такой как сосудистая ткань, клеткам растения и его потомкам. При использовании в настоящем документе, части растения содержат клетки растения.
Используемый в настоящем документе термин «растение» используется в самом широком его смысле. Он включает, но не ограничиваясь этим, любые виды травы, орнаментальных или декоративных растений, зерновых или злаковых (например, масличные, маис, соя), кормовых или фуражных, фруктовых или овощных растений, пряных растений, древесных растений, цветочных растений или деревьев. Не подразумевается ограничение растения до какой-либо конкретной структуры. Этот термин относится также к одноклеточному растению (например, микроводоросли). Термин «его часть» в отношении растения относится к клетке растения и ее потомству, ко множеству клеток растения, которые по большей части дифференцированы в колонии (например, вольвокс), к структуре, которая присутствует на любой стадии развития растения, или к ткани растения. Такие структуры включают, но не ограничиваясь эти, листья, стебли, цветы, плоды, орехи, корни, семена, оболочки семян, зародыши. Термин «ткань растения» включает дифференцированные и недифференцированные ткани растений, включая ткани, содержащиеся в листьях, стеблях, цветах, плодах, орехах, корнях, семенах, например, зародышевая ткань, эндосперм, дермальная ткань (например, эпидермис, перидерма), сосудистая ткань (например, ксилема, флоэма) или покровная ткань (включающая клетки паренхимы, колленхимы и/или склеренхимы), а также клетки в культуре (например, одиночные клетки, протопласты, каллусы, зародыши и так далее). Ткань растения может быть in planta, в культуре органа, в культуре ткани или в культуре клеток.
«Трансгенное растение», «генетически модифицированное растение» или их варианты относятся к растению, которое содержит трансген, не встречающийся в растении дикого вида того же вида, вариетета или сорта. Трансгенные растения, по определению в контексте настоящего изобретения, включают растения и их потомство, которые были генетически модифицированы с помощью рекомбинантных приемов для инициации выработки по меньшей мере одного полипептида, описанного в настоящем документе, в заданном растении или его части. Части трансгенных растений имеют соответствующее значение.
Термины «семена» и «зерна» в настоящем документе используются взаимозаменяемо. «Зерно» относится к зрелому зерну, такому как собранное зерно или зерно, которое все еще находится на растении, но уже готово к уборке, а также может относиться к зерну после насыщения влагой или прорастания, в зависимости от контекста. Зрелое зерно обычно имеет содержание влаги по меньшей мере около 18-20%. В предпочтительном варианте реализации содержание влаги в зерне находится на уровне, который обычно считается безопасным для хранения, предпочтительно от 5% до 15%, от 6% до 8%, от 8% до 10% или от 12% до 15%. «Развивающееся семя», при использовании в настоящем документе, относится к семени до зрелости, обычно находящееся в репродуктивных структурах растения после опыления или цветения, но также может относиться к таким семенам до их зрелости, которые выделяют из растения. Зрелое семя обычно имеет содержание влаги по меньшей мере около 18-20%. В предпочтительном варианте реализации содержание влаги в семени находится на уровне, который обычно считается безопасным для хранения, предпочтительно 5% до 15%, от 6% до 8%, от 8% до 10% или от 12% до 15%.
Используемый в настоящем документе термин «запасающий орган растения» относится к части растения, специализирующейся на хранении энергии, например, в форме белков, углеводов, липидов. Примеры запасающих органов растения представляют собой семена, плоды, клубневидные корни и клубни. Предпочтительный запасающий орган растения по настоящему изобретению представляет собой семя.
Используемый в настоящем документе термин «фенотипически нормальный» относится к генетически модифицированному растению или его части, в частности, к запасающему органу, такому как семя, клубень или плод, по настоящему изобретению, не обладающему существенно сниженной способностью расти и размножаться, по сравнению с не модифицированным растением или его частью. В одном варианте реализации генетически модифицированное растение или его часть, которая является фенотипически нормальной, содержит рекомбинантный полинуклеотид, кодирующий молчащий супрессор, функционально связанный с промотором, специфичным для запасающего органа растения, и обладает способностью расти или размножаться, которая является по существу такой же, что и у соответствующего растения или его части, не содержащей указанный полинуклеотид. Предпочтительно, полученная биомасса, скорость роста, скорость прорастания, размер запасающего органа, размер семени и/или количество жизнеспособных семян составляет не менее 90% от соответствующего показателя для растения, не содержащего указанный рекомбинантный полинуклеотид, при выращивании при одинаковых условиях. Этот термин не охватывает характеристики растения, которые могут отличаться для растения дикого типа, но которые не влияют на пригодность растения для промышленных целей, такие как, например, фенотип балерины у листьев проростков.
Растения, предоставленные для или предназначенные для применения при практическом осуществлении настоящего изобретения, включают однодольные и двудольные. В предпочтительных вариантах реализации растения настоящего изобретения представляют собой зерновые растения (например, злаковые и зернобобовые, маис, пшеница, картофель, тапиока, рис, сорго, просо, маниок, ячмень или горох), или другие бобовые. Растения могут быть выращены для производства съедобных корней, клубней, листьев, стеблей, цветов или плодов. Растения могут быть овощными или декоративными растениями. Растениями настоящего изобретения могут быть: Acrocomia aculeate (пальма макауба), Arabidopsis thaliana, Aracinis hypogaea (арахис), Astrocaryum murumuru (мурумуру), Astrocaryum vulgare (тукума), Attalea geraensis (Indaiá-rateiro), Attalea humilis (американская масличная пальма), Attalea oleifera (andaiá), Attalea phalerata (урикури), Attalea speciosa (бабассу), Avena sativa (овес), Beta vulgaris (сахарная свекла), виды Brassica, такие как Brassica carinata, Brassica juncea, Brassica napobrassica, Brassica napus (канола), Camelina sativa (ложный лен), Cannabis sativa (конопля), Carthamus tinctorius (сафлор), Caryocar brasiliense (кариокар), Cocos nucifera (кокосовый орех), Crambe abyssinica (абиссинская капуста), Cucumis melo (дыня), Elaeis guineensis (африканская пальма), Glycine max (соя), Gossypium hirsutum (хлопок), виды Helianthus, такие как Helianthus annuus (подсолнечник), Hordeum vulgare (ячмень), Jatropha curcas (лекарственный орех), Joannesia princeps (ореховое дерево арара), виды Lemna (ряска), такие как Lemna aequinoctialis, Lemna disperma, Lemna ecuadoriensis, Lemna gibba (ряска горбатая), Lemna japonica, Lemna minor, Lemna minuta, Lemna obscura, Lemna paucicostata, Lemna perpusilla, Lemna tenera, Lemna trisulca, Lemna turionifera, Lemna valdiviana, Lemna yungensis, Licania rigida (ойтикика), Linum usitatissimum (лен), Lupinus angustifolius (люпин), Mauritia flexuosa (пальма бурити), Maximiliana maripa (пальма инайа), виды Miscanthus, такие как Miscantus x giganteus и Miscanthus sinensis, виды Nicotiana (табак), такие как Nicotiana tabacum или Nicotiana benthamiana, Oenocarpus bacaba (bacaba-do-azeite), Oenocarpus bataua (patauã), Oenocarpus distichus (bacaba-de-leque), виды Oryza (рис), такие как Oryza sativa и Oryza glaberrima, Panicum virgatum (просо прутьевидное), Paraqueiba paraensis (марь), Persea amencana (авокадо), Pongamia pinnata (индийский бук), Populus trichocarpa, Ricinus communis (клещевина обыкновенная), виды Saccharum (сахарный тростник), Sesamum indicum (кунжут), Solanum tuberosum (картофель), виды Sorghum, такие как Sorghum bicolor, Sorghum vulgare, Theobroma grandiforum (купуасу), виды Trifolium, Trithrinax brasiliensis (бразильская игольчатая пальма), виды Triticum (пшеница), такие как Triticum aestivum, Zea mays (кукуруза), люцерна (Medicago sativa), рожь (Secale cerale), сладкий картофель (Lopmoea batatus), маниок (Manihot esculenta), кофе (виды Cofea), ананас (Anana comosus), цитрусовые деревья (виды Citrus), какао (Theobroma cacao), чай (Camellia senensis), банан (виды Musa), авокадо (Persea Americana), инжир (Ficus casica), гуава (Psidium guajava), манго (Magnifer indica), олива (Olea europaea), папайя (Carica papaya), кешью (Anacardium occidentale), макадамия (Macadamia intergrifolia) и миндаль (Prunus amygdalus).
Другие предпочтительные растения включают травы С4, такие как, помимо вышеупомянутых, Andropon gerardi, Bouteloua curtipendula, B. gracilis, Buchloe dactyloides, Schizachyrium scoparium, Sorghastrum nutans, Sporobolus cryptandrus; травы С3, такие как Elymus canadensis, бобовые Lespedeza capitata и Petalostemum villosum, полукустарник Aster azureus; и древесные растения, такие как Quercus ellipsoidalis и Q. macrocarpa. Другие предпочтительные растения включают травы С3.
В предпочтительном варианте реализации растение является покрытосеменным.
В одном варианте реализации растение представляет собой масличное масло, предпочтительно зерновое масличное растение. Используемый в настоящем документе термин «масличное растение» представляет собой виды растения, используемые для промышленного производства липидов из семян растения. Масличное растение может быть, например, масличным рапсом (таким как канола), маисом, подсолнечником, сафлором, соей, сорго, льном (лен обыкновенный) или сахарной свеклой. Кроме того, масличное растение может быть другим растением Brassica, хлопком, арахисом, маком, брюквой, горчицей, клещевиной, кунжутом, сафлором или ореховым растением. Растение может вырабатывать высокие концентрации липидов в плодах, такое растение как олива, масличная пальма или кокос. Садовые растения, к которым может относиться настоящее изобретение, представляют собой салат-латук, цикорный салат или овощные Brassica, включая капусту, брокколи или цветную капусту. Настоящее изобретение может быть использовано в отношении табака, тыквы, моркови, клубники, томатов или перца.
В предпочтительном варианте реализации трансгенное растение является гомозиготным для всех и каждого гена, который был внедрен (трансген), так чтобы его потомство не выделялось из заданного фенотипа. Трансгенное растение также может быть гетерозиготным для внедренного трансгена (-ов), предпочтительно равномерно гетерозиготным для трансгена, такого как, например, в потомстве F1, которое было выращено из гибридных семян. Такие растения могут обеспечивать преимущества, такие как гибридная сила, хорошо известная в данной области техники.
В соответствующих случаях трансгенные растения также могут содержать дополнительные трансгены, кодирующие ферменты, участвующие в выработке неполярных липидов, такие как, но не ограничиваясь этим, LPAAT, LPCAT, PAP или фосфолипид: диацилглицерин-ацилтрансфераза (PDAT1, PDAT2 или PDAT3; см., например, Ghosal et al., 2007), или комбинацию двух или более из них. Трансгенные растения настоящего изобретения также могут экспрессировать олеозин из экзогенного полинуклеотида.
Трансформация растений
Трансгенные растения могут быть получены с помощью приемов, известных в данной области техники, таких как описаны, в основном, в публикации Slater et al., Plant Biotechnology - The Genetic Manipulation of Plants, Oxford University Press (2003), и Christou and Klee, Handbook of Plant Biotechnology, John Wiley and Sons (2004).
Используемые в настоящем документе термины «устойчивое трансформирование», «устойчиво трансформированный» и их варианты относятся к интеграции полинуклеотида в геном клетки, так что они переносятся к клетки-потомки при делении клетки без необходимости позитивного отбора на их наличие. Устойчивые трансформанты или их потомки могут быть отобраны по способам, известным в данной области техники, таким как саузерн-блоттинг на хромосомной ДНК или in situ гибридизация геномной ДНК.
Agrobacteium-опосредованный перенос представляет собой широко применяемую систему для внедрения генов в клетки растений, поскольку ДНК может быть внедрена в клетки тканей всего растения, органов растения или эксплантатов в клеточной культуре либо для их временной экспрессии, либо для устойчивой интеграции ДНК в геном клетки растения. Использование Agrobacteium-опосредованных растительных векторов интеграции для внедрения ДНК в клетки растения хорошо известно в данной области техники (см., например, US 5177010, US 5104310, US 5004863 или US 5159135). Область ДНК, подлежащая переносу, определяется пограничными последовательностями, а интронная ДНК (Т-ДНК) обычно вставляется в геном растения. Кроме того, интеграция Т-ДНК представляет собой относительно точный процесс, приводящий к небольшому количеству перегруппировок. В тех вариететах растений, в которых Agrobacteium-опосредованная трансформация является эффективной, она представляет собой оптимальный способ из-за простой и определенной природы переноса гена. Предпочтительные векторы трансформации Agrobacteium способны реплицироваться в E. coli, а также в Agrobacteium, обеспечивая возможность удобных манипуляций, описанных в литературе (Klee et al., в публикации: Plant DNA Infectious Agents, Hohn and Schell, ред., Springer-Verlag. Нью-Йорк, сс. 179-203 (1985)).
Способы ускорения, которые могут быть использованы, включают, например, бомбардировку микрочастицами и тому подобные. Один пример способа доставки молекул трансформирующих аминокислот в клетки растения представляет собой бомбардировку микрочастицами. Этот способ рассмотрен в публикации Yang et al., Particle Bombardment Technology for Gene Transfer, Oxford Press. Оксфорд. Англия (1994). Небиологические частицы (микрочастицы) могут быть покрыты нуклеиновыми кислотами и доставлены в клетки под действием реактивной силы. Иллюстративные частицы включают частицы, состоящие из вольфрама, золота, платины и тому подобные. Особое преимущество бомбардировки микрочастицами, помимо того, что она представляет собой эффективный способ воспроизводимой трансформации однодольных, заключается в том, что нет необходимости ни в выделении протопластов, ни в восприимчивости к инфицированию Agrobacteium. Иллюстративный вариант реализации способа доставки ДНК в клетки Zea Mays за счет ускорения представляет собой биолистическая система доставки α-частиц, которая может быть использована для продвижения частиц, покрытых ДНК, через экран, такой как экран из нержавеющей стали или Nytex, на поверхность фильтра, покрытую клетками зерновых, выращенных в суспензии. Конкретная система доставки, пригодная для применения с настоящим изобретением, представляет собой пушку с гелиевым ускорением PDS-1000/He, выпускаемую компанией Bio-Rad Laboratories.
Для бомбардировки клетки в суспензии могут быть концентрированы на фильтрах. Фильтры, содержащие клетки, подлежащие бомбардировке, располагают на соответствующем расстоянии под пластиной, останавливающей микрочастицы. При необходимости между пушкой и бомбардируемыми клетками располагают также один или более экранов.
Альтернативно, незрелые зародыши или другие целевые клетки могут быть расположены на твердой культуральной среде. Клетки, подлежащие бомбардировке, располагают на соответствующе расстоянии под пластиной, останавливающей микрочастицы. При необходимости, между ускорительным устройством и бомбардируемыми клетками размещают также один или более экранов. Используя приемы, описанные в настоящем документе, можно получить до 1000 или более очагов клеток, временно экспрессирующих маркерный ген. Количество клеток в очаге, которые экспрессируют генный продукт через 48 часов после бомбардировки, зачастую варьируется от одной до десяти и составляет в среднем от одной до трех.
При трансформации бомбардировкой можно оптимизировать условия выращивания до бомбардировки, а также параметры бомбардировки для получения максимального количества устойчивых трансформантов. Как физические, так и биологические параметры бомбардировки важны для этой технологии. Физические факторы представляют собой те, которые затрагивают действия с осадком ДНК/микрочастиц или те, которые влияют на полет и скорость макро- или микрочастиц. Биологические факторы включают все стадии, которые участвуют в действиях с клетками до и сразу после бомбардировки, осмотическую регулировку целевых клеток для облегчения смягчения травмы, связанной с бомбардировкой, а также природу трансформирующей ДНК, такую как линеаризованная ДНК или интактные суперспиральные плазмиды. Предполагается, что действия до бомбардировки особенно важны для успешной трансформации незрелых зародышей.
В другом альтернативном варианте реализации могут быть устойчиво трансформированы пластиды. Способы, описанные для трансформации пластид у высших растений, включают доставку генной пушкой ДНК, содержащей селектируемый маркер, и направление указанной ДНК в геном плазмиды с помощью гомологичной рекомбинации (US 5451513, US 5545818, US 5877402, US 5932479 и WO 99/05265).
Соответственно, подразумевается, что может быть необходима коррекция различных аспектов параметров бомбардировки в маломасштабных исследованиях для полной оптимизации условий. В частности, может быть необходима коррекция физических параметров, таких как воздушный зазор, дальность полета, расстояние до ткани и давление гелия. Также можно минимизировать факторы, уменьшающие травму, за счет модификации условий, которые влияют на физиологическое состояние клеток-реципиентов и которые, следовательно, могут влиять на эффективность трансформации и интеграции. Например, для оптимальной трансформации может быть отрегулировано осмотическое состояние, гидратация ткани и стадия субкультуры или клеточный цикл клеток-реципиентов. Осуществление других стандартных поправок известно специалистам в данной области в свете настоящего описания.
Трансформация протопластов растения может быть достигнута с помощью способов, основанных на осаждении фосфата кальция, обработке полиэтиленгликолем, электропорации и комбинаций этих способов обработки. Применение этих систем к различным вариететам растений зависит от способности регенерировать определенный сорт растения из протопластов. Иллюстративные способы регенерации зерновых из протопластов описаны в публикациях (Fujimura et al., 1985; Toriyama et al., 1986; Abdullah et al., 1986).
Также могут быть использованы другие способы клеточной трансформации, и они включают, но не ограничиваясь этим, внедрение ДНК в растения посредством прямого переноса ДНК в пыльцу, прямого впрыскивания ДНК в репродуктивные органы растения или прямого впрыскивания ДНК в клетки незрелых зародышей с последующей регидрацией высушенных зародышей.
Регенерация, развитие и выращивание растений из одних трансформантов протопласта растения или из различных трансформированных эксплантатов хорошо известны в данной области техники (Weissbach et al., в публикации: Methods for Plant Molecular Biology, Academic Press. Сан-Диего, штат Калифорния (1988)). Эти способы регенерации и выращивания обычно включают стадии отбора трансформированных клеток, выращивания этих выделенных клеток на обычных стадиях развития зародыша до стадии укоренившегося проростка. Трансгенные зародыши и семена регенерируют одинаково. Полученные трансгенные укоренившиеся проростки затем выращивают в подходящей среде для выращивания растения, такой как грунт.
Развитие или регенерация растений, содержащих инородный, экзогенный ген, хорошо известны в данной области техники. Предпочтительно, регенерированные растения являются самоопыляемыми с получением гомозиготных трансгенных растений. Или пыльца, полученная из регенерированных растений скрещивается с выращенными из семян растениями значимых в агротехники линий. И наоборот, пыльца из растений этих важных линий используют для опыления регенерированных растений. Трансгенное растение настоящего изобретения, содержащее заданный полинуклеотид, выращивают по способам, хорошо известным специалистам в данной области техники.
Способы трансформации двудольных растений, в основном, с помощью опухолеобразующих Agrobacteium, и получения трансгенных растений были опубликованы для хлопка (US 5004863, US 5159135, US 5518908), сои (US 5569834, US 5416011), Brassica (US 5463174), арахиса (Cheng et al., 1996) и гороха (Grant et al., 1995).
Способы трансформации зерновых растений, таких как пшеница и ячмень, для внедрения генетического изменения в растения посредством внедрения экзогенной нуклеиновой кислоты и для регенерации растений из протопластов или незрелых зародышей растения, хорошо известны в данной области техники, см., например, CA 2092588, AU 61781/94, AU 667939, US 6100447, WO 97/048814, US 5589617, US 6541257, а другие способы представлены в WO 99/14314. Предпочтительно, трансгенные растения пшеницы или ячменя получают с помощью способов трансформации, опосредованных опухолеобразующих Agrobacteium. Векторы, несущие заданный полинуклеотид, могут быть внедрены в регенерируемые клетки пшеницы тканей, выращиваемых в растениях или эксплантатах, или в подходящих растительных системах, таких как протопласты.
Регенерируемые клетки пшеницы предпочтительно получают из щитка незрелых зародышей, зрелых зародышей, каллуса, полученного из них, или из меристематической ткани.
Для подтверждения наличия трансгенов в трансгенных клетках и растениях может быть выполнена амплификация полимеразной цепной реакции (ПЦР) или саузерн-блоттинг анализ, с помощью способов, известных специалистам в данной области техники. Продукты экспрессии трансгенов могут быть обнаружены любым из многочисленных способов, в зависимости от природы продукта, и они включают вестерн-блоттинг и ферментный анализ. Одним из особенно подходящих способов для количественной оценки экспрессии белка и для обнаружения репликации в различных тканях растения является использование репортерного гена, такого как GUS. После получения трансгенных растений они могут быть выращены для получения тканей или частей растения, обладающих заданным фенотипом. Может быть собрана ткань растения или части растения, и/или могут быть собраны семена. Семена могут служить в качестве источника для выращивания дополнительных растений с тканями или частями, обладающими заданными характеристиками. Предпочтительно, вегетирующие части растения собирают в то время, когда выход неполярных липидов является наивысшим. В одном варианте реализации вегетирующие части растения собирают примерно во время цветения.
Трансгенное растение, полученное с помощью Agrobacteium или другого способа трансформации, обычно содержит один генетический локус на одной хромосоме. Такие трансгенные растения могут упоминаться как гемизиготные для добавленного гена (-ов). Более предпочтительным является трансгенное растение, которое является гомозиготным для добавленного гена (-ов), то есть трансгенное растение, которое содержит два добавленных гена, один ген в одном и том же локусе на каждой хромосоме в хромосомной паре. Гомозиготное трансгенное растение может быть получено посредством самооплодотворения гемизиготоного трансгенного растения, проращивания некоторых полученных семян и анализа полученных растений на заданный ген.
Следует также понимать, что два различных трансгенных растения, которые содержат два независимо сегрегированных экзогенных гена или локуса, также могут скрещиваться (сочетаться) с получением потомства, которое содержит оба набора генов или локусов. Самоопыление соответствующего потомства F1 может давать растения, которые являются гомозиготными для обоих экзогенных генов или локусов. Подразумевается также возвратное скрещивание с родительским растением и ауткроссинг с нетрансгенным растением, как и вегетативное размножение. Описания других способов скрещивания, которые обычно используются для различных признаков и зерновых, представлены в публикации Fehr: Breeding Methods for Cultivar Development, Wilcox J. ред., American Society of Agronomy. Мэдисон, штат Висконсин (1987).
TILLING
В одном варианте реализации могут быть использованы TILLING (направленно индуцированные очаговые поражения в геномах) для получения растений, в которых выключены эндогенные гены, например, гены, кодирующие DGAT, sn-1-глицерин-3-фосфат-ацилтрансферазу (GPAT), 1-ацил-глицерин-3-фосфат-ацилтрансферазу (LPAAT), ацил-CoA: лизофосфатидилхолин-ацилтрансферазу (LPCAT), фосфатазу фосфатидной кислоты (PAP) или комбинацию двух или более из них.
На первой стадии инициируют внедренные мутации, такие как новые одиночные изменения пар оснований, в группе растений посредством обработки семян (или пыльцы) химическим мутагеном, а затем разводят растения до поколения, в которой мутации наследуются устойчиво. Экстрагируют ДНК и хранят семена от всех членов группы для создания источника, к которому можно будет обратиться впоследствии.
Для анализа TILLING, разрабатывают ПЦР праймеры для специфической амплификации заданного одиночного гена-мишени. Специфичность является особенно важной, если мишень представляет собой члена генного семейства или часть полиплоидного генома. Затем меченные красителем праймеры могут быть использованы для амплификации продуктов ПЦР из объединенной ДНК нескольких индивидуумов. Эти продукты ПЦР денатурируют и вторично ренатурируют для обеспечения образования пар оснований, спаренных вопреки принципу комплементарности. Ошибочные пары, или гетеродуплексы, представляют собой как природный одиночный нуклеотидный полиморфизм (SNP) (например, вероятно, что несколько растений из группы несут одинаковый полиморфизм), так и индуцированный SNP (то есть вероятно, что лишь небольшое количество отдельных растений демонстрируют мутацию). После образования гетеродуплекса ключом для открытия новых SNP в популяции TILLING является использование эндонкулеазы, такой как CelI, которая распознает и расщепляет ошибочные ДНК.
Используя этот подход, можно проверить многие тысячи растений для идентификации любого отдельного растения с изменением одного основания, а также с небольшими вставками или делециями (1-30 п.о.) в любом гене или специфической области генома. Анализируемые геномные фрагменты могут варьироваться по размеру от 0,3 до 1,6 тыс. оснований. При 8-кратной группировке, фрагментах по 1,4 тыс. оснований (без учета концов фрагментов, в которых обнаружение SNP проблематично из-за шума) и 96 полосах на анализ, эта комбинация позволяет за один анализ проверять до миллиона пар оснований геномной ДНК, что делает TILLING высокопроизводительной методикой, TILLING дополнительно описан в публикациях Slade and Knauf (2005) и Henikoff et al. (2004).
Помимо обеспечения возможности эффективного обнаружения мутаций, высокопроизводительная технология TILLING идеальная для обнаружения природных полиморфизмов. Следовательно, проверка неизвестной гомологичной ДНК с помощью создания гетеродуплексов с известной последовательностью выявляет количество и положение полиморфных сайтов. Идентифицируются нуклеотидные изменения и небольшие вставки и делеции, включая по меньшей мере полиморфизмы с некоторым количеством повторений. Этот прием был назван Ecotilling (Comai et al., 2004).
Каждый SNP записывается по его приблизительному положению в нескольких нуклеотидах. Так, каждый гаплоид может быть архивирован по его подвижности. Данные о последовательности могут быть получены с относительно небольшими поэтапными затратами, с использованием алкивот той же амплифицированной ДНК, которая была использована для анализа расщепления ошибочных пар. Для одной реакции выбирают левый или правый секвенирующий праймер по его близости к полиморфизму. Программа Sequencher выполняет многократные анализы первичной структуры и обнаруживает изменения оснований, которые в каждом случае подтверждают полосой на геле.
Ecotilling может быть выполнен дешевле, чем полное секвенирование, которое представляет собой способ. используемый в настоящее время для большинства обнаружений SNP. Могут быть скринированы планшеты, содержащие упорядоченную экотипическую ДНК, а не пулы ДНК из мутагенных растений. Поскольку обнаружение выполняют на геле с приблизительным разрешением пар оснований, а фоновые структуры являются одинаковыми во всех линиях, то полосы, идентичные по размеру, могут быть совмещены, за счет чего происходит обнаружение и генотипирование SNP на одной стадии. Таким образом, суммарное секвенирование SNP является еще более простым и эффективным за счет того факта, что ДНК-секвенированию могут быть подвержены аликвоты тех же продуктов ПЦР, которые были использованы для скрининга.
Увеличение концентраций экзогенной РНК и стабилизированной экспрессии
Пост-транскрипционный сайленсинг гена (PTGS) представляет собой защитный механизм, специфический для нуклеотидной последовательности, который может быть направлен как на клеточную, так и на вирусную мРНК для ее разрушения. PTGS происходит в растениях или грибах, устойчиво или временно трансформированных рекомбинантным полинуклеотидом (-ами) и приводит к снижению накопления молекул РНК с такой же последовательностью, что и внедренный полинуклеотид. «Пост-транскрипционный» относится к механизму, действующему по меньшей мере частично, не обязательно исключительно после создания первоначального РНК транскрипта, например, во время процессинга первоначального РНК транскрипта или параллельно со сплайсированием или экспортом РНК в цитоплазму, или в цитоплазме за счет комплексов, связанных с белками Argonaute.
Концентрации молекулы РНК могут быть увеличены и/или концентрации молекулы РНК стабилизируются через несколько поколений или при других окружающих условиях за счет ограничения экспрессии молчащего супрессора в запасающем органе растения или его части. Используемый в настоящем документе термин «молчащий супрессор» представляет собой любой полинуклеотид или полипептид, который может быть экспрессирован в клетке растения, который увеличивает содержание продукта экспрессии из другого трансгена в клетке растения, в частности, при повторяющемся потомстве из первоначально трансформированного растения. В одном варианте реализации молчащий супрессор представляет собой вирусный молчащий супрессор или его мутант. В данной области техники известно большое количество вирусных молчащих супрессоров, и они включают, но не ограничиваясь этим, P19, V2, P38, Pe-Po и RPV-P0. Примеры подходящих вирусных молчащих супрессоров включают те, которые описаны в WO 2010/057246. Молчащий супрессор может быть устойчиво экспрессирован в растении или его части по настоящему изобретению.
Используемый в настоящем документе термин «устойчиво экспрессированный» или его варианты относится к концентрации молекулы РНК, которая является по существу такой же или более высокой в растениях-потомках при многократных поколениях, например, по меньшей мере трех, по меньшей мере пяти или по меньшей мере десяти поколениях, по сравнению с соответствующими растениями, не содержащими экзогенный полинуклеотид, кодирующий молчащий супрессор. Однако этот термин (-ы) не исключает возможности того, что при многократных поколениях не произойдет некоторое снижение содержания молекулы РНК, по сравнению с предыдущим поколением, например, не более чем 10% снижение на одно поколение.
Супрессор может быть выбран из любого источника, например, растения, вируса, млекопитающего и так далее. Супрессор может представлять собой, например, вирус flock house B2, латентный вирус сциндапсуса P14, латентный вирус сциндапсуса AC2, вирус мозаики африканского маниока AC4, болезнь желтой прожилковой мозаики bhendi C2, болезнь желтой прожилковой мозаики bhendi C4, болезнь желтой прожилковой мозаики bhendi βС1, вирус хлороза томата p22, вирус хлороза томата CP, вирус хлороза томата CPm, вирус золотистой мозаики томата AL2, вирус курчавости листьев томата Java βC1, вирус желтой курчавости листьев томата V2, вирус желтой курчавости листьев томата China C2, вирус желтой курчавости листьев томата China Y10, изолят βС1, вирус желтой курчавости листьев томата Israeli, изолят V2, вирус желтой мозаики золотистой фасоли Vigna AC2, вирус хлорозной кольцевой пятнистости гибискуса CP, вирус морщинистости репы P38, вирус мозаики цветной капусты P6, вирус пожелтения свеклы p21, вирус внезапного увядания цитрусовых p20, вирус внезапного увядания цитрусовых p21, вирус внезапного увядания цитрусовых CP, вирус мозаики коровьего гороха SCP, вирус хлорозной карликовости сладкого картофеля p22, вирус мозаики огурцов 2b, вирус аспермии томата HC-Pro, вирус курчавости верхушки свеклы L2, передающийся через почву вирус мозаики пшеницы 19K, вирус ложной штриховатости ячменя Gammab, полулатентный вирус мятлика Gammab, пеклувирус корней арахиса P15, вирус карликовости риса Pns10, переносимый тлями вирус пожелтения плодоносящих растений P0, западный вирус пожелтения свеклы P0, вирус картофеля X P25, вирус прожилкового пожелтения огурцов P1b, поксвирус слив HC-Pro, вирус мозаики сахарного тростника HC-Pro, вирус картофеля Y, штамм HC-Pro, вирус гравировки табака P1/HC-Pro, вирус мозаики репы P1/HC-Pro, вирус крапчатости сборной ежи P1, вирус крапчатости сборной ежи, норвежский изолят P1, вирус желтой крапчатости риса P1, вирус желтой крапчатости риса, нигерийский изолят P1, вирус белолистности риса NS3, вирус полосатости риса NS3, вирус мозаики табака, инфицирующий крестоцветные 126K, вирус мозаики табака, инфицирующий крестоцветные p122, вирус мозаики табака p122, вирус мозаики табака 126, вирус мозаики табака 130K, вирус погремковости табака 16K, вирус кустистой карликовости томата P19, вирус пятнистой бронзовости томата NSs, вирус хлорозной пятнистости листьев яблонь P50, вирус винограда А p10, связанный со скручиванием листьев винограда вирус-2, гомолог BYV p21, а также их варианты/мутанты. В представленном выше списке перечислены вирусы, из которых может быть получен супрессор, а также белок (например, B2, P14 и так далее) или обозначение кодирующей области для супрессора из каждого конкретного вируса. Другие потенциальные молчащие супрессоры могут быть получены изучением последовательностей вирусных геномов на полипептиды, кодируемые в таком же положении в вирусном геноме, относительно структуры родственного вирусного генома, содержащего известный молчащий супрессор, что понятно специалистам в данной области техники.
Молчащие супрессоры могут быть классифицированы по образу их действия. Такие супрессоры как V2, которые предпочтительно связываются с двухспиральной молекулой РНК, имеющей выступающие 5' концы, по сравнению с соответствующей двухспиральной молекулой РНК, имеющей тупые коны, являются особенно подходящими для усиления экспрессии трансгена при использовании в комбинации с сайленсингом гена (экзогенного полинуклеотида, кодирующего дсРНА). Другие супрессоры, такие как p19, которые предпочтительно связывают молекулу дсРНК, которая имеет 21 пару оснований в длину, по сравнению с молекулой дсРНК с другой длиной, также могут обеспечивать экспрессию трансгена в присутствии экзогенного полинуклеотида, кодирующего дсРНК, но обычно в меньшей степени, чем, например, V2. Это позволяет выбирать оптимальную комбинацию дсРНК, молчащего супрессора и сверхэкспрессированного трансгена для конкретной цели. Такие оптимальные комбинации могут быть определены по способу настоящего изобретения.
В одном варианте реализации молчащий супрессор предпочтительно связывается с двухспиральной молекулой РНК, имеющей выступающие 5' концы, по сравнению с соответствующей двухспиральной молекулой РНК, имеющей тупые концы. В этом контексте, соответствующая двухспиральная молекула РНК предпочтительно имеет такую же нуклеотидную последовательность, что и молекула с 5' выступающими концами, но без выступающих 5' концов. Анализы связывания выполняют стандартным образом, например, в in vitro анализах, по любому способу, известному специалистам в данной области техники.
Могут быть использованы многочисленные копии супрессора. Могут быть использованы различные супрессоры (например, в тандеме).
Практически любая молекула РНК, экспрессия которой необходима в запасающем органе растения, может быть совместно экспрессирована с молчащим супрессором. Молекула РНК может влиять на агрономический признак, устойчивость к насекомым, устойчивость к болезням, устойчивость гербицидам, стерильность, зерновые характеристики и тому подобное. Кодируемые полипептиды могут участвовать в метаболизме липидов, крахмала, углеводов, питательных веществ и так далее, или могут отвечать за синтез белков, пептидов, липидов, восков, крахмалов, сахаров, углеводов, вкусовых веществ, ароматических веществ, токсинов, каротеноидов, гормонов, полимеров, флавоноидов, запасных белков, фенольных кислот, алкалоидов, лигнинов, танинов, целлюлозы, гликопротеинов, гликолипидов и так далее.
В конкретном примере растения вырабатывают повышенные концентрации ферментов для выработки липидов в растениях, таких как Brassica, например, в семенах рапса или подсолнечника, сафлора, льна, хлопка, сои или маиса.
Растительная биомасса
Увеличение общего содержания липидов в растительной биомассе эквивалентно более высокому содержанию энергии, что делает ее применение в производстве биотоплива более экономичным.
Растительная биомасса представляет собой органические материалы, вырабатываемые растениями, такими как листья, корни, семена и стебли. Растительная биомасса представляет собой сложную смесь органических материалов, таких как углеводы, жиры и белки, наряду с небольшими количествами минералов, таких как натрий, фосфор, кальций и железо. Основные компоненты растительной биомассы представляют собой углеводы (приблизительно 75%, сухой вес) и лигнин (приблизительно 25%), которые могут варьироваться в зависимости от типа растения. Углеводы представляют собой, в основном, целлюлозные или гемицеллюлозные волокна, которые обеспечивают прочность структуры растения, и лигнин, который удерживает волокна вместе. Некоторые растения также запасают крахмал (другой углеводный полимер) и жиры в качестве источников энергии, в основном, в семенах и корнях (таких как кукуруза, соя и картофель).
Растительная биомасса обычно обладает низкой плотностью энергии из-за ее физической формы и содержания влаги. Это делает ее неудобной и неэффективной для хранения и транспортировки, а также, как правило, непригодной для применения без какой-либо предварительной переработки.
Существует несколько процессов, используемых для превращения биомассы в более удобную форму, в том числе: 1) физическая предварительная переработка (например, измельчение) или 2) превращение с помощью термических (например, сжигание, газификация, пиролиз) или химических (например, анаэробное расщепление, ферментация, компостирование, транс-эстерификация) способов. Таким образом, биомассу превращают в то, что можно описать как топливо из биомассы.
Сжигание
Сжигание представляет собой процесс, с помощью которого горючие материалы сжигают в присутствии воздуха или кислорода с выделением тепла. Основной процесс представляет собой окисление. Сжигание является самым простым способом, с помощью которого можно использовать биомассу для получения энергии, и его используют для получения тепла. Это тепло может быть само использовано многочисленными способами: 1) конвекционное отопление, 2) нагревание воды (или другой жидкости) для центрального или районного теплоснабжения или для получения технологического тепла, 3) генерации пара для выработки электричества или движущей энергии. Когда горючий топливный материал находится в форме биомассы, происходит, в основном, окисление углерода (С) и водорода (H) в целлюлозе, гемицеллюлозе, лигнине и других присутствующих молекулах, с образованием диоксида углерода (CO2) и воды (H2O).
Газификация
Газификация представляет собой процесс частичного окисления, посредством которого источник углерода, такой как растительная биомасса, разрушается до монооксида углерода (CO) и водорода (H2) плюс диоксид углерода (CO2), и возможно молекулы углеводорода, такого как метан (CH4). Если газификация происходит при относительно низкой температуре, такой как 700°С-1000°С, то образующийся газ содержит относительно высокую концентрацию углеводородов, по сравнению с высокотемпературной газификацией. В результате он может быть использован напрямую или может сжигаться для получения тепла или генерации электричества с помощью паровой турбины или, при соответствующей очистке газа, для использования в двигателе внутреннего сгорания для выработки электричества. Камера сгорания для простого котла может быть тесно связана с газификатором, или генераторный газ можно очистить от длинноцепных углеводородов (смол), транспортировать, хранить и сжигать удаленно. Система газификации может быть тесно интегрирована с газовой турбиной с комбинированным циклом для генерации электричества (IGCC - интегрированный комбинированный цикл газификации). Более высокая температура газификации (1200°С-1600°С) дает меньшее количество углеводородов в образующемся газе и более высокое содержание CO и H2. Этот продукт известен как синтез-газ (сингаз или биосингаз), поскольку он может быть использован для синтеза длинноцепных углеводородов по таким методикам как синтез Фишера-Тропша (ФТ). Если соотношение H2 и CO является верным (2:1), то синтез ФТ может быть использован для превращения синтез-газа в высококачественное синтетическое дизельное биотоплива, которое совместимо со стандартным дизелем из ископаемого сырья и с дизельными двигателями.
Пиролиз
Используемый в настоящем документе термин «пиролиз» означает процесс, в котором используется медленное нагревание в отсутствие кислорода с образованием газообразных, маслянистых и коксовых продуктов из биомассы. Пиролиз представляет собой термическую или термохимическую конверсию липидных, в частности, триглицеридных материалов. Продукты пиролиза включают газ, жидкость и твердый кокс, при этом пропорции каждого из них зависят от параметров процесса. При низких температурах (около 400°С) образуется большее количество твердого кокса (медленный пиролиз), тогда как при немного более высоких температурах (около 500°С) образуется гораздо большее количество жидкости (бионефть), если время контакта паров составляет до около 1 с или менее. После этого происходят вторичные реакции и увеличивается выход газа. Бионефть, выпущенная с помощью быстрого (высокотемпературного) пиролиза, представляет собой темно-коричневую подвижную жидкость с теплотворной способностью около половины от стандартного нефтяного топлива. Ее можно сжигать напрямую, сжигать совместно, улучшать до других топлив или газифицировать.
Пиролиз включает прямой термический крекинг липидов или комбинацию термического или каталитического крекинга. При температурах около 400-500°С происходит крекинг, с образованием коротких углеводородов, таких как алканы, алкены, алкадиены, ароматические вещества, олефины и карбоновые кислоты, а также монооксид углерода и диоксид углерода.
Могут быть использованы катализаторы четырех основных типов, включая катализаторы на основе переходных металлов, катализаторы типа молекулярных сит, активированный глинозем и карбонат натрия (Maher et al., 2007). Примеры представлены в публикации US 4102938. Глинозем (Al2O3), активируемый кислотами, представляет собой эффективный катализатор (US 5233109). Катализаторы типа молекулярных сит представляют собой пористые, высококристалличные структуры, которые демонстрируют селективность по размеру, так что через них могут проходить только молекулы определенного размера. Они включают цеолитные катализаторы, такие как ZSM-5 или HZSM-5, которые представляют собой кристаллические материалы, содержащие AlO4 и SiO4, а также другие катализаторы на основе оксидов кремния-алюминия. Активность и селективность этих катализаторов зависит от кислотности, размера пор и формы пор, и обычно они эксплуатируются при 300-500°С. Катализаторы на основе переходных металлов описаны, например, в US 4992605. Катализатор на основе карбоната натрия используется при пиролизе нефти (Dandik and Aksoy, 1998).
Транс-эстерификация
«Транс-эстерификация», при использовании в настоящем документе, представляет собой превращение липидов, в основном, триацилглицеринов, в метиловые эфиры или этиловые эфиры жирных кислот с помощью короткоцепных спиртов, таких как метанол или этанол, в присутствии катализатора, такого как щелочь или кислота. Метанол используют более широко благодаря низкой стоимости и доступности. Катализаторы могут быть гомогенными катализаторами, гетерогенными катализаторами или ферментативными катализаторами. Гомогенные катализаторы включают сульфат железа (III), затем KOH. Гетерогенные катализаторы включают CaO, K3PO4 и WO3/ZrO2. Ферментативные катализаторы включают новозим 435, вырабатываемый Candida Antarctica.
Анаэробное расщепление
Анаэробное расщепление представляет собой процесс, в котором бактерии разрушают органический материал в отсутствие воздуха, с образованием биогаза, содержащего метан. Продукты этого процесса представляют собой биогаз (в основном, метан (CH4) и диоксид углерода (CO2)), твердый остаток (волокна или дигестат), который похож, но не идентичен с компостом, и жидкий раствор, который может быть использован в качестве удобрения. Метан может сжигаться для производства тепла или генерации электричества. Твердый остаток процесса анаэробного расщепления может быть использован в качестве структурообразователя почвы или, альтернативно, может сжигаться в качестве топлива, или газифицироваться.
Анаэробное расщепление обычно выполняют на биологическом материале в водной суспензии. Однако растет количество сухих анаэробных перегнивателей. Мезофильное расщепление происходит при температурах от 20°С до 40°С и может занимать месяц или два до его завершения. Термофильное расщепление происходит при 50-65°С и происходит быстрее, но бактерии в этом случае более чувствительны.
Ферментация
В стандартных процессах ферментации для производства биоспирта используется крахмальные и сахарные компоненты зерен растений. При производстве биоспирта второго поколения перед этим выполняют кислотный и/или ферментный гидролиз гемицеллюлозы и целлюлозы в ферментируемые сахариды, чтобы использовать значительно большую часть доступной биомассы. Дополнительные подробности представлены ниже под заголовком «Процессы ферментации для производства липидов».
Компостирование
Компостирование представляет собой аэробное разрушение органического вещества под действием микроорганизмов. Как правило, его выполняют в относительно сухом материале, а не в суспензии. Вместо этого или в дополнение к этому, собирая выделяющийся горючий биогаз, можно использовать экзотермическую сущность процесса компостирования и использовать вырабатываемое тепло, как правило, с помощью теплового насоса.
Производство неполярных липидов
Приемы, которые обычно применяются в данной области техники, могут быть использованы для экстракции, переработки, очистки и анализа неполярных липидов, вырабатываемых клетками, организмами или их частями, в соответствии с настоящим изобретением. Такие приемы описаны и объяснены в различных литературных источниках, таких как Fereidoon Shahidi, Current Protocols in Food Analytical Chemistry, John Wiley & Sons, Inc, (2001) D1.1.1-D1.1.11, и Perez-Vich et al. (1998).
Производство масла из семян
Как правило, семена растений подвергают тепловой обработке, прессуют и/или экстрагируют для получения неочищенного масла семян, которое затем дегуммируют, очищают, обесцвечивают и дезодорируют. В основном, приемы измельчения семян известны в данной области техники. Например, масличные семена могут быть смягчены путем их орошения водой для увеличения содержания влаги, например, до 8,5%, и вальцованы с помощью гладкого ролика с зазором, установленным на 0,23-0,27 мм. В зависимости от типа семян перед измельчением может быть добавлена или не добавлена вода. Использование нагревания дезактивирует ферменты, облегчает дальнейшее разрушение клеток, вызывает коалесценцию липидных капель и агломерацию белковых частиц, и все это облегчает процесс экстракции.
В одном варианте реализации большую часть масла семян выделяют пропусканием через шнековый пресс. Куски, выталкиваемые из шнекового пресса, затем подвергают экстракции с растворителем, например, с гексаном, используя колонну с сопровождающимся подогревом. Альтернативно, неочищенное масло семян, полученное в результате операции прессования, может быть пропущено через отстойник с проволочной дренажной крышкой с прорезями для удаления твердых веществ, которые выдавливаются с маслом семян в процессе прессования. Осветленное масло семян может быть пропущено через пластинчатый и рамочный фильтр для удаления оставшихся мелкодисперсных твердых частиц. При необходимости масло семян, выделенное в процессе экстракции, может быть объединено с осветленным маслом семян для получения смешанного неочищенного масла семян.
После выпаривания растворителя из неочищенного масла семян, прессованные и экстрагированные порции объединяют и подвергают стандартным приемам переработки липидов (то есть дегумирование, щелочная рафинация, обесцвечивание и дезодорация).
В одном варианте реализации содержание масла и/или белка в семенах анализируют по ближней инфракрасной отражательной спектроскопии, как описано в публикации Hom et al. (2007).
Дегуммирование
Дегуммирование представляет собой раннюю стадию очистки масел и, в основном, оно предназначено для удаления большей части фосфолипидов из масла, которые могут содержаться в количестве около 1-2% от общих экстрагированных липидов. Добавление к неочищенному маслу ~2% воды, обычно содержащей фосфорную кислоту, при 70-80°С, приводит к отделению большей части фосфолипидов, вместе со следовыми металлами и пигментами. Нерастворимый материал, который удаляют, представляет собой, в основном, смесь фосфолипидов и триацилглицеринов и известен также как лецитин. Дегуммирование может быть выполнено путем добавления концентрированной фосфорной кислоты к неочищенному маслу семян для превращения негидратируемых фосфатидов в гидратируемую форму, и для хелатирования существующих второстепенных металлов. Смолу отделяют от масла семян центрифугированием. Масло семян может быть очищено с помощью добавления достаточного количества раствора гидроксида натрия для титрации всех жирных кислот и удаления мыл, образованных в результате этого.
Щелочная рафинация
Щелочная рафинация представляет собой один из процессов очистки для обработки неочищенного масла, который иногда упоминается также как нейтрализация. Обычно его выполняют после дегуммирования и до обесцвечивания. После дегуммирования масло семян может быть обработано путем добавления достаточного количества щелочного раствора для титрации всех жирных кислот, а также фосфорных кислот, и удаления мыл, образовавшихся в результате этого. Подходящие щелочные материалы включают гидроксид натрия, гидроксид калия, карбонат натрия, гидроксид лития, гидроксид кальция, карбонат кальция и гидроксид аммония. Этот процесс обычно выполняют при комнатной температуре, и в результате него удаляют фракцию свободных жирных кислот. Мыло удаляют центрифугированием или экстракцией в растворитель для мыла, а нейтрализованное масло промывают водой. При необходимости любой избыток щелочи в масле может быть нейтрализован подходящей кислотой, такой как хлороводородная кислота или серная кислота.
Обесцвечивание
Обесцвечивание представляет собой процесс очистки, в котором масла нагревают при 90-120°С в течение 10-30 минут в присутствии отбеливающей глины (0,2-2,0%) и в отсутствие кислорода, работая под азотом или паром, или в вакууме. Эта стадия переработки масла предназначена для удаления нежелательных пигментов (каротеноидов, хлорофилла, госсипола и так далее), и в этом процессе удаляются также продукты окисления, следовые металлы, серные соединения и следы мыла.
Дезодорация
Дезодорация представляет собой обработку масел и жиров при высокой температуре (200-260°С) и низком давлении (0,1-1 мм рт.ст.). Как правило, это достигается введением пара в масло семян со скоростью около 0,1 мл/минута/100 мл масла семян. Дезодорация может быть выполнена нагреванием масла семян до 260°С под вакуумом и медленным введением пара в масло семян со скоростью около 0,1 мл/минута/100 мл масла семян. Примерно через 30 минут барботажа, масло семян оставляют остывать под вакуумом. Масло семян обычно переносят в стеклянную емкость и продувают аргоном перед хранением при охлаждении. Если количество масла семян ограничено, то масло семян можно поместить под вакуум, например, в реакторе Парра, и нагревать до 260°С в течение такого же времени, как и при его дезодорации. Такая обработка улучшает цвет масла семян и удаляет большую часть летучих веществ или имеющих запах соединений, включая какие-либо оставшиеся свободные жирные кислоты, моноацилглицерины и продукты окисления.
Обеспечение холодостойкости
Обеспечение холодостойкости представляет собой процесс, иногда используемый в промышленном производстве масел для разделения масел и жиров на твердую (стеарин) и жидкую (олеин) фракции путем кристаллизации при температурах ниже комнатной. Первоначально ее использовали для хлопкового масла для получения продукта, не содержащего твердых веществ. Этот процесс обычно используют для снижения содержания насыщенных жирных кислот в масле.
Растительная биомасса для производства липидов
Части растений, участвующие в фотосинтезе (например, стебли и листья высших растений и водных растений, таких как водоросли), также могут быть использованы для производства липидов. Независимо от типа растения, существует несколько способ экстракции липидов из зеленой биомассы. Один из способов представляет собой физическую экстракцию, в которой зачастую не используется экстракция с растворителем. Она представляет собой «традиционный» способ с использованием нескольких различных типов механической экстракции. Экстракция на винтовом прессе представляет собой распространенный тип экстракции, как и способы экстракции на шнековом прессе и рамочном прессе. Количество жидкости, экстрагированной с помощью этих способов, варьируется в широком диапазоне, в зависимости от растительного материала и используемого механического процесса. Механическая экстракция обычно менее эффективна, чем экстракция с растворителем, описанная ниже.
При экстракции с растворителем органический растворитель (например, гексан) смешивают по меньшей мере с зеленой биомассой генетически модифицированных растений, предпочтительно после высушивания и измельчения зеленой биомассы. Конечно, можно измельчать и смешивать и другие части растений, помимо зеленой биомассы (например, семена, содержащие липиды). Растворитель растворяет липиды в биомассе и тому подобном, и этот раствор затем отделяют от биомассы с помощью механического действия (например, процессами прессования, описанными выше). Эта стадия разделения также может быть выполнена с помощью фильтрации (например, с фильтр-прессом или аналогичным устройством) или центрифугирования, и так далее. Органический растворитель затем может быть отделен от неполярных липидов (например, перегонкой). В результате этой второй стадии разделения получают неполярные липиды из растения и можно получать растворитель для повторного применения, если используется стандартное улавливание паров.
Если, например, вегетирующая ткань, описанная в настоящем документе, не предназначена для незамедлительной экстракции и/или переработки липидов, то ее предпочтительно обрабатывают после сбора урожая, чтобы содержание липидов не уменьшалось или чтобы возможное снижение содержания липидов было по возможности минимизировано (см., например, Christie, 1993). В одном варианте реализации вегетирующую ткань замораживают как можно быстрее после сбора урожая, используя, например, сухой лед или жидкий азот. В другом варианте реализации вегетирующую ткань хранят при низкой температуре, например, -20°С или -60°С, в атмосфере азота.
Водоросли для производства липидов
Водоросли могут вырабатывать в 10-100 раз больше массы в год, по сравнению с наземными растениями. Кроме того, что они представляют собой разрастающиеся организмы, водоросли способны также вырабатывать масла и крахмалы, которые могут быть превращены в биотопливо.
Конкретные водоросли, наиболее пригодные для производства биотоплива, известны как микроводоросли, состоящие из небольших, зачастую одноклеточных типов. Эти водоросли могут расти практически повсеместно. При более 100000 известных видов диатомовых (тип водорослей), 40000 известных видов похожих на растения зеленых водорослей и меньшем количестве других видов водорослей, водоросли быстро растут практически в любой среде, практически в любой воде. В частности, подходящие водоросли могут быть выращены в прибрежных районах с ограниченным количеством воды или с плохим качеством воды, как, например, в сухих и практически необитаемых областях американского юго-запада. Эти области также характеризуются большим количеством солнечного света для фотосинтеза. Вкратце, водоросли могут быть идеальным организмом для производства биотоплива - эффективно растущим, не нуждающимся в хорошей земле или воде, не конкурирующим с пищевыми культурами, нуждающимся в гораздо меньших площадях земли, чем пищевые культуры, и запасающим энергию в заданной форме.
Водоросли могут запасать энергию в своей клеточной структуре в форме масла или крахмала. Запасенное масло может составлять до 60 масс. % водорослей. Были идентифицированы некоторые виды, которые являются высокопродуктивными в отношении выработки масла или крахмала, и были испытаны условия роста. Были также разработаны процессы для экстракции и превращения этих материалов в топливо.
Наиболее распространенные водоросли, вырабатывающие масло, как правило могут включать или по существу состоять из диатомовых водорослей (бациллариофиты), зеленых водорослей (хлорофиты), сине-зеленых водорослей (цианофиты) и золотисто-коричневых водорослей (хризофиты). Помимо этого может быть использована пятая группа, известная как гаптофиты. Группы включают коричневые водоросли и гетероконтные водоросли. Конкретные не ограничивающие примеры водорослей включают классы: Chlorophyceae, Eustigmatophyceae, Prymnesiophyceae, Bacillariophycea. Бациллариофиты, способные вырабатывать масло, включают роды Amphipleura, Amphora, Chaetoceros, Cyclotella, Cymbella, Fragilaria, Hantzschia, Navicula, Nitzschia, Phaeodactylum и Thalassiosira. Конкретные не ограничивающие примеры хлорофитов, способных вырабатывать масло, включают Ankistrodesmus, Botryococcus, Chlorella, Chlorococcum, Dunaliella, Monoraphidium, Oocystis, Scenedesmus и Tetraselmis. В одном аспекте хлорофиты могут представлять собой Chlorella или Dunaliella. Конкретные не ограничивающие примеры цианофитов, способных вырабатывать масло, включают Oscillatoria и Synechococcus. Конкретный пример хризофитов, способных вырабатывать масло, включает Boekelovia. Конкретные не ограничивающие примеры гактофитов включают Isochysis и Pleurochyses.
Конкретные водоросли, применимые в настоящем изобретении, включают, например, виды Chlamydomonas, такие как Chlamydomonas reinhardtii, виды Dunaliella, такие как Dunaliella salina, Dunaliella tertiolecta, D. acidophila, D. bardawil, D. bioculata, D. lateralis, D. maritime, D. minuta. D. parva. D. peircei, D. polymorpha, D. primolecta, D. pseudosalina, D. quartolecta, D. viridis, виды Haematococcus, виды Chlorella, такие как Chlorella vulgaris, Chlorella sorokiniana или Chlorella protothecoides, виды Thraustochytrium, виды Schizochytrium, виды Volvox, виды Nannochloropsis, Botryococcus braunii, которые могут содержать более 60 вес. % липидов, Phaeodactylum tricornutum, Thalassiosira pseudonana, виды Isochrysis, виды Pavlova, виды Chlorococcum, виды Ellipsoidion, виды Neochloris, виды Scenedesmus.
Далее, вырабатывающие масло водоросли настоящего изобретения могут содержать комбинацию эффективного количества двух или более штаммов для максимизации преимущества каждого штамма. На практике может быть трудно достичь 100% чистоты одного штамма водорослей или комбинации заданных штаммов водорослей. Однако, при рассмотрении в настоящем документе, вырабатывающие масло водоросли подразумевают специально представленные штаммы водорослей, тогда как посторонние штаммы предпочтительно минимизированы и находятся на уровне ниже того количества, которое может неблагоприятно влиять на выход заданных, вырабатывающих масло водорослей и масла водорослей. Нежелательные штаммы водорослей можно контролировать и/или исключать с помощью ряда приемов. Например, тщательный контроль условий выращивания может уменьшать внедрение посторонних штаммов. Альтернативно или в дополнение к другим приемам, вирус, селективно выбранный для специфического воздействия только на посторонние штаммы, может быть введен в резервуары для выращивания в количестве, эффективном для снижения и/или исключения посторонних штаммов. Подходящий вирус может быть легко идентифицирован с помощью стандартных приемов. Например, образец посторонних водорослей чаще всего содержит небольшие количества вируса, который направлен на эту постороннюю водоросль. Этот вирус может быть выделен и выращен для получения количеств, которые бы эффективно контролировали популяцию посторонних водорослей среди более желательных вырабатывающих масло водорослей.
Альгакультура представляет собой форму аквакультуры, включающую выращивание видов водорослей (включая микроводоросли, также упоминаемые как фитопланктон, микрофиты или планктонные водоросли, и макроводоросли, известные также как морские водоросли).
Коммерческое и промышленное выращивание водорослей имеет многочисленные применения, включая производство пищевых ингредиентов, пищи и топлива из водорослей.
Моно- или смешанные культуры водорослей могут быть выращены в открытых прудах (таких как канальные пруды и озера) или в фотобиореакторах.
Водоросли могут быть собраны с помощью микросит, центрифугированием, флокуляцией (с использованием, например, хитозана, квасцов и хлорида железа (III) и пенной флотацией. Прерывая снабжение диоксидом углерода, можно вызывать самопроизвольную флокуляцию водоросле, которая называется «аутофлокуляцией». При пенной флотации агроном аэрирует воду в пену, а затем снимает водоросли сверху. В настоящее время разрабатываются ультразвуковые и другие способы сбора.
Липиды могут быть отделены от водорослей механическим измельчением. При высушивании водорослей они сохраняют содержащиеся в них липиды, которые затем могут быть «выжаты» с помощью маслоотжимного пресса. Поскольку различные штаммы водорослей широко варьируются по своим физическим характеристикам, то для конкретных типов водорослей лучше работают различные конфигурации прессов (шнек, выталкиватель, шток и так далее).
Для высвобождения из водорослей клеточных компонентов, таких как липиды, иногда используют осмотический шок. Осмотический шок представляет собой резкое уменьшение осмотического давления и может вызывать разрушение клеток в растворе.
Ультразвуковая экстракция может ускорять процессы экстракции, в частности ферментативных процессов экстракции, используемых для экстракции липидов из водорослей. Ультразвуковые волны используются для создания кавитационных пузырьков в материале растворителя. Когда эти пузырьки разрываются возле клеточных стенок, образующиеся ударные волны и струи жидкости вызывают разрушение этих клеточных стенок и высвобождение их составляющих в растворитель.
Химические растворители (например, гексан, бензол, петролейный эфир) зачастую используются при экстракции липидов из водорослей. Экстракция в аппарате Сокслета может быть использована для экстракции липидов из водорослей посредством многократного промывания или перколяции с органическим растворителем при нагревании с дефлегмацией в специальной стеклянной посуде.
Для экстракции липидов из водорослей может быть использована ферментативная экстракция. В ферментной экстракции используются ферменты для разрушения клеточных стенок водой, в присутствии воды, действующей как растворитель. Ферментативная экстракция может подкрепляться ультразвуковой обработкой.
В качестве растворителя также может быть использован сверхкритический CO2. В этом способе CO2 сжижают под давлением и нагревают до точки, когда он становится сверхкритическим (обладающим свойствами жидкости и газа), что позволяет ему действовать как растворитель.
Процессы ферментации для производства липидов
Используемый в настоящем документе термин «процесс ферментации» относится к любому процессу ферментации или к любому процессу, включающему стадию ферментации. Процесс ферментации включает, без ограничений, процессы ферментации, используемые для производства спиртов (например, этанола, метанола, бутанола), органических кислот (например, лимонной кислоты, уксусной кислоты, итаконовой кислоты, молочной кислоты, глюконовой кислоты), кетонов (например, ацетона), аминокислот (например, глутаминовой кислоты), газов (например, H2 и CO2), антибиотиков (например, пенициллина и тетрациклина), ферментов, витаминов (например, рибофлавина, бета-каротина) и гормонов. Процессы ферментации также включают процессы ферментации, используемые в промышленности потребляемого алкоголя (например, пива и вина), молочной промышленности (например, ферментированные молочные продукты), кожевенной промышленности и табачной промышленности. Предпочтительные процессы ферментации включают спиртовые процессы ферментации, которые хорошо известны в данной области техники. Предпочтительные процессы ферментации представляют собой анаэробные процессы ферментации, хорошо известные в данной области техники. Подходящие ферментирующие клетки, как правило, микроорганизмы, способны к ферментации, то есть превращению сахаров, таких как глюкоза или мальтоза, прямо или косвенно в заданный продукт ферментации.
Примеры ферментирующих микроорганизмов включают грибковые организмы, такие как дрожжи, предпочтительно маслянистые организмы. При использовании в настоящем документе, «маслянистый организм» представляет собой организм, который накапливает по меньшей мере 25% триглицеридов от его сухого веса. Используемый в настоящем документе термин «дрожжи» включает виды Saccharomyces, Saccharomyces cerevisiae, Saccharomyces carlberggensis, виды Candida, виды Kluveromyces, виды Pichia, виды Hansenula, виды Trichoderma, Lipomyces starkey и Yarrowia lipolytica. Предпочтительные дрожжи включают Yarrowia lipolytica или другие жировые дрожжи и штаммы видов Saccharomyces и, в частности, Saccharomyces cerevisiae.
В одном варианте реализации ферментирующий микроорганизм представляет собой трансгенный организм, который содержит один или более экзогенных полинуклеотидов, при этом трансгенный организм обладает повышенной концентрацией одного или более неполярных липидов, по сравнению с соответствующим организмом, не имеющим одного или более экзогенных полинуклеотидов. Трансгенный микроорганизм предпочтительно выращивают в условиях, которые оптимизируют активность генов биосинтеза жирных кислот и генов ацилтрансферазы жирных кислот. Это приводит к получению самого высокого и наиболее экономичного выхода липидов. Как правило, условия среды, которые могут быть оптимизированы, включают тип и количество источника углерода, тип и количество источника азота, соотношение углерода к азоту, концентрация кислорода, температура выращивания, рН, продолжительно фазы производства биомассы, продолжительность фазы накопления липидов и время сбора клеток.
Среда ферментации должна содержать подходящий источник углерода. Подходящие источники углерода могут включать, но не ограничиваясь этим: моносахариды (например, глюкоза, фруктоза), дисахариды (например, лактоза, сахароза), олигосахариды, полисахариды (например, крахмал, целлюлоза или их смеси), сахарные спирты (например, глицерин) или смеси из возобновляемых источников (например, фильтрат сырной сыворотки, жидкий кукурузный экстракт, меласса сахарной свеклы, ячменный солод). Дополнительно, источники углерода могут включать алканы, жирные кислоты, сложные эфиры жирных кислот, моноглицериды, диглицериды, триглицериды, фосфолипиды и различные промышленные источники жирных кислот, включая растительные масла (например, соевое масло) и животные жиры. Дополнительно, углеродистый субстрат может содержать субстраты с одним углеродным атомом (например, диоксид углерода, метанол, формальдегид, формиат, углеродсодержащие амины), для которых было показано метаболическое превращение в ключевые биохимические промежуточные соединения. Таким образом, подразумевается, что источник углерода, используемый в настоящем изобретении, может охватывать широкий ряд углеродсодержащих субстратов и ограничивается лишь выбором микроорганизма-хозяина. Хотя все из упомянутых выше углеродистых субстратов и их смеси предположительно являются пригодными в настоящем изобретении, предпочтительные углеродистые субстраты представляют собой сахара и/или жирные кислоты. Наиболее предпочтительной является глюкоза и/или жирные кислоты, содержащие от 10 до 22 углеродных атомов.
Азот может поставляться из неорганического (например, (NH4)2SO4) или органического источника (например, мочевина, глутамат). Помимо соответствующих источников углерода и азота, среда для ферментации может также содержать подходящие минералы, соли, кофакторы, буферы, витамины и другие компоненты, известные специалистам в данной области, пригодные для выращивания микроорганизмов и ускорения ферментативных путей, необходимых для выработки липидов.
Подходящий диапазон рН для ферментации обычно находится в диапазоне от около рН 4,0 до рН 8,0, при этом предпочтительно значение от рН 5,5 до рН 7,0 в качестве диапазона для первоначальных условий выращивания. Ферментация может быть выполнена в аэробных или анаэробных условиях, при этом предпочтительными являются микроаэробные условия.
Как правило, накопление высоких концентраций липидов в клетках маслянистых микроорганизмов требует двухстадийного процесса, поскольку метаболическое состояние должно быть «сбалансировано» между ростом и синтезом/накоплением жиров. Следовательно, наиболее предпочтительным является двухстадийный процесс для производства липидов в микроорганизмах. В этом подходе первая стадия ферментации предназначена для генерации и накопления клеточной массы и характеризуется быстрым клеточным ростом и делением клеток. На второй стадии ферментации предпочтительно установить условия азотной депривации в культуре для ускорения накопления высоких концентраций липидов. Эффект от азотной депривации заключается в снижении эффективной концентрации АМФ в клетках, за счет чего происходит снижение активности НАД-зависимой изоцитрат-дегидрогеназы в митохондриях. Когда это происходит, накапливается лимонная кислота, образуя посредством этого многочисленные скопления ацетил-CoA в цитоплазме и инициируя синтез жирных кислот. Таким образом, эта фаза характеризуется прекращением деления клеток с последующим синтезом жирных кислот и накоплением TAG.
Хотя клетки обычно выращивают при температуре около 30°С, в некоторых исследованиях было показано увеличение синтеза ненасыщенных жирных кислот при более низких температурах. На основании экономики процесса, такой температурный сдвиг вероятно происходит после первой фазы двухстадийной ферментации, когда достигнут необходимый объем роста микроорганизмов.
Подразумевается, что могут быть использованы различные схемы процесса ферментации, в которых необходимо промышленное производство липидов с помощью рассматриваемых нуклеиновых кислот. Например, промышленное производство липидов из рекомбинантного микробного хозяина может быть осуществлено периодическим, периодическим с подпиткой или непрерывным процессом ферментации.
Периодический процесс ферментации представляет собой закрытую систему, в которую в начале процесса помещена композиция среды и которая не подлежит дальнейшим пополнениям, помимо тех, которые необходимы для поддержания рН и концентрации кислорода в ходе процесса. Так, в начале процесса выращивания среду инокулируют заданным организмом и выращивают или обеспечивают возможность протекания метаболической активности, не добавляя в среду дополнительные субстраты (то есть источники углерода и азота). В периодических процессах композиции метаболитов и биомассы в системе постоянно изменяются до времени прекращения выращивания. В стандартном периодическом процессе клетки развиваются от статической латентной фазы до логарифмической фазы высокого роста и, наконец, до стационарной фазы, в которой скорость роста минимальна или остановлена. Оставленные без обработки, клетки в стационарной фазе в конечном итоге погибают. Вариант стандартного периодического процесса представляет собой периодический процесс с подпиткой, в котором субстрат непрерывно добавляют в ферментатор в течение процесса ферментации. Периодический процесс с подпиткой также пригоден в настоящем изобретении. Периодические процессы с подпиткой пригодны, если катаболитная репрессия может ингибировать метаболизм клеток или если необходимо иметь ограниченные количества субстрата в среде в любой промежуток времени. Измерение концентрации субстрата в периодических системах с подпиткой затруднительно, и поэтому оно может быть оценено по изменениям измеримых факторов, таких как рН, растворенный кислород и парциальное давление отработавших газов (например, CO2). Периодические способы и периодические способы выращивания с подпиткой являются общепринятыми и хорошо известными в данной области техники, а их примеры можно найти в публикации Brock, In Biotechnology: A Textbook of Industrial Microbiology, 2-ое изд,, Sinauer Associates. Сандерленд, штат Массачусетс, (1989); или Deshpande (1992).
Промышленное производство липидов с помощью рассматриваемых клеток также может быть выполнено с помощью непрерывного процесса ферментации, в котором определенную среду непрерывно добавляют в биореактор, тогда как эквивалентное количество объема культуры одновременно удаляют для выделения продукта. Непрерывное выращивание, как правило, поддерживает клетки на логарифмической фазе роста при постоянной плотности клеток. Непрерывный или полунепрерывный способы выращивания позволяют модулировать один фактор или любое количество факторов, которые влияют на клеточный рост или концентрацию конечного продукта. Например, один подход ограничивать источник углерода и обеспечивать возможность других параметров замедлять метаболизм. В других системах могут быть одновременно изменены несколько факторов, влияющих на рост, при этом клеточная концентрация, измеренная по мутности среды, остается постоянной. Непрерывные системы направлены на поддержание устойчивого состояния роста и, следовательно, скорость клеточного роста должна быть сбалансирована с уменьшением количества клеток в результате слива среды из культуры. Способы модулирования питательных веществ и факторов роста для непрерывных процессов выращивания, а также приемы для максимизации скорости образования продукта хорошо известны в области промышленной микробиологии, а различные способы подробно описаны в публикации Brock, supra.
Жирные кислоты, включая PUFA, могут встречаться в микроорганизме-хозяине в виде свободных жирных кислот или в эстерифицированных формах, таких как ацилглицерины, фосфолипиды, сульфолипиды или гликолипиды, и могут быть выделены из клетки-хозяина различными способами, хорошо известными в данной области техники.
В целом, способы очистки жирных кислот, в том числе PUFA, могут включать экстракцию с органическими растворителями, обработку ультразвуком, сверхкритическую жидкостную экстракцию (например, с использованием диоксида углерода), омыление и физические способы, такие как прессование, и их комбинации. Особый интерес представляет собой экстракция с метанолом и хлороформом в присутствии воды (Bligh and Dyer, 1959). При необходимости водный слой может быть подкислен для протонирования отрицательно заряженных частиц и увеличения посредством этого выделения заданных продуктов в органическом слое. После экстракции органические растворители можно удалить выпариванием под потоком азота. При выделении в конъюгированных формах, продукты могут быть ферментативно или химически расщеплены для высвобождения свободных жирных кислот или менее сложных необходимых конъюгатов, а затем могут быть подвержены дополнительным действиям с получением заданного конечного продукта. Желательно выполнять расщепление конъюгированных форм жирных кислот с помощью гидроксида калия.
При необходимости дополнительной очистки могут быть использованы стандартные способы. Такие способы могут включать экстракцию, обработку мочевиной, фракционную кристаллизацию. ВЭЖХ, фракционную перегонку, силикагелевую хроматографию, высокоскоростное центрифугирование или дистилляцию, или комбинации этих приемов. Защита реакционноспособных групп, таких как кислотные или алкенильные группы, может быть выполнена на любой стадии с помощью известных приемов (например, алкилирование, йодирование). Используемые способы включают метилирование жирных кислот с образованием метиловых эфиров. Точно так же, защитные группы могут быть удалены на любой стадии. При необходимости очистка фракций, содержащих GLA, STA, ARA, DHA и EPA, может быть выполнена обработкой мочевиной и/или фракционной перегонкой.
Пример использования растительной биомассы для производства суспензии биомассы с использованием дрожжей описана в WO 2011/100272.
Применение липидов
Липиды, полученные по описанным способам, имеют многочисленные применения. В некоторых вариантах реализации эти липиды используют в качестве пищевых масел. В других вариантах реализации липиды очищают и используют в качестве смазочных материалов или для других промышленных применений, таких как синтез пластмасс. В некоторых предпочтительных вариантах реализации липиды очищают для производства биодизеля.
Биотопливо
Используемый в настоящем документе термин «биотопливо» включает биодизель и биоспирт. Биодизель может быть произведен из масел, полученных из растений, водорослей и грибов. Биоспирт получают ферментацией сахара. Этот сахар может быть экстрагирован непосредственно из растений (например, сахарного тростника), получен из растительного крахмала (например, маис или пшеница) или получен из целлюлозы (например, древесина, листья или стебли).
В настоящее время производства биотоплива дороже, чем производство нефтяного топлива. Помимо производственных затрат, зерновые культуры для биотоплива необходимо выращивать, удобрять, обрабатывать пестицидами и гербицидами, убирать и транспортировать. Растения, водоросли и грибы настоящего изобретения могут снижать производственные затраты биотоплива.
Общие способы производства биотоплива представлены, например, в публикациях Maher and Bressler, 2007; Greenwell et al., 2010; Karmakar et al., 2010; Alonso et al., 2010; Lee and Mohamed, 2010; Liu et al., 2010a; Gong and Jiang, 2011; Endalew et al., 2011; Semwal et al., 2011.
Биоспирт
Производство биологически вырабатываемых спиртов, например, этанола, пропанола и бутанола, является общеизвестным. Этанол представляет собой наиболее распространенный биоспирт.
Основные стадии крупномасштабного производства этанола представляют собой: 1) микробная (например, дрожжевая) ферментация сахаров, 2) дистилляция, 3) обезвоживание и, необязательно, 4) денатурация. Перед ферментацией некоторые зерновые необходимо подвергать осахариванию или гидролизу углеводов, таких как целлюлоза и крахмал, в сахара. Осахаривание целлюлозы называется целлюлолиз. Для превращения крахмала в сахар могут быть использованы ферменты.
Ферментация
Биоспирт производят микробной ферментацией сахара. Микробная ферментация действует только напрямую с сахарами. Два основных компонента растений, крахмал и целлюлоза, состоят из сахаров и в принципе могут быть превращены в сахара для ферментации.
Перегонка
Для того, чтобы этанол можно было использовать в качестве топлива, необходимо удалить основную часть воды. Большая часть воды удаляется перегонкой, но чистота ограничена максимум до 95-96% из-за образования низкокипящего азеотропа воды (95,6% масс,/масс, (96,5% об./об.) этанола и 4,4% масс,/масс, (3,5% вес,/вес,) воды). Эта смесь называется гидратированным этанолом и может быть использована в качестве топлива самостоятельно, но, в отличие от безводного этанола, гидратированный этанол не смешивается во всех соотношениях с бензином, поэтому водную фракцию обычно удаляют при последующей очистке для сжигания вместе с бензином в бензиновых двигателях.
Обезвоживание
Вода может быть удалена из азеотропной смеси этанола/воды с помощью обезвоживания. Азеотропная перегонка, используемая во многих первых заводах по производству топливного этанола, состоит из добавления бензола или циклогексана к этой смеси. При добавлении к смеси этих компонентов образуется гетерогенная азеотропная смесь в равновесии пар-жидкость-жидкость, которая при перегонке образует безводный этанол в нижней части колонны и смесь паров воды и циклогексана/бензола. При конденсации она становится двухфазной жидкой смесью. Другой старый способ. называемый экстрактивной дистилляцией, состоит из добавления третьего компонента, который увеличивает относительную летучесть этанола. При перегонке тройной смеси образуется безводный этанол в верхнем потоке колонны.
Был разработан третий способ. и он внедрен на большинстве современных этанольных заводов. В этом новом способе используют молекулярные сита для удаления воды из топливного этанола. В этом процессе пары этанола под давлением проходят через слой гранул молекулярных сит. Поры гранул имеют определенный размер, обеспечивая возможность абсорбции воды, исключая этанол. Через определенное время слой регенерируют под вакуумом или в потоке инертной атмосферы (например, N2) для удаления абсорбированной воды. Зачастую используют два слоя, чтобы можно было абсорбировать воду на одном слое, а второй слой - регенерировать.
Биодизель
Производство биодизеля, или алкильных эфиров, является общеизвестным. Существует три основных способа производства сложных эфиров из липидов: 1) транс-эстерификация липидов с помощью спирта на щелочном катализаторе; 2) прямая эстерификация липидов метанолом на кислотном катализаторе; и 3) конверсия липидов в жирные кислоты, а затем в алкильные эфиры с помощью кислотных катализаторов.
Может быть использован любой способ получения алкильных эфиров жирных кислот и глицериловых эфиров (в которых этерифицирована одна, две или три из гидрокси-групп глицерина). Например, жирные кислоты могут быть получены, например, гидролизом или омылением триглицеридов с кислотными или щелочными катализаторам, соответственно, или с использованием фермента, такого как липаза или эстераза. Алкильные эфиры жирных кислот могут быть получены взаимодействием жирной кислоты со спиртом в присутствии кислотного катализатора. Алкильные эфиры жирных кислот также могут быть получены взаимодействием триглицерида со спиртом в присутствии кислотного или щелочного катализаторы. Эфиры глицерина могут быть получены, например, взаимодействием глицерина с алкил-галогенидом в присутствии основания, или с олефином или спиртом в присутствии кислотного катализатора.
В некоторых предпочтительных вариантах реализации липиды транс-эстерифицируют с получением метиловых эфиров и глицерина. В некоторых предпочтительных вариантах реализации липиды взаимодействуют со спиртом (таким как метанол или этанол) в присутствии катализатора (например, гидроксида калия или натрия) с образованием алкильных эфиров. Алкильные эфиры могут быть использованы для биодизеля или могут быть смешаны с нефтяным топливом.
Алкильные эфиры могут быть напрямую смешаны с дизельным топливом или могут быть перед смешиванием промыты водой или другими водными растворами для удаления различных примесей, включая катализаторы. Возможна нейтрализация кислотных катализаторов основанием. Однако в этом процессе образуется соль. Во избежание коррозии двигателя, предпочтительно минимизировать концентрацию соли в аддитивной композиции топлива. Соли могут быть по существу удалены из композиции, например, промыванием композиции водой.
В другом варианте реализации композицию после промывания высушивают, например, пропусканием композиции через высушивающий агент, такой как сульфат кальция.
В другом варианте реализации нейтральную топливную добавку получают без образования солей или применения стадии промывания, за счет использования полимерной кислоты, такой как Dowex 50TM, которая представляет собой смолу, содержащую группы сульфоновой кислоты. Катализатор легко удаляется фильтрацией после завершения реакций эстерификации и этерификации.
Растительные триацилглицерины в качестве источника биотоплива
Применение растительных триацилглицеринов для производства биотоплива рассмотрено в публикации Durret et al. (2008). Вкратце, растительные масла состоят, в основном, из различных триацилглицеринов (TAG), молекул, которые состоят из трех цепей жирных кислот (обычно имеющих 18 или 16 углеродных атомов в длину), эстерифицированных с глицерином. Жирные ацильные цепи химически похожи на алифатические углеводороды, которые составляют основу молекул, содержащихся в бензине и дизеле. Углеводороды в бензине содержат от 5 до 12 углеродных атомов на молекулу, и это летучее топливо смешивается с воздухом и воспламеняется искрой в стандартном двигателе. Напротив, компоненты дизельного топлива обычно имеют 10-15 углеродных атомов на молекулу и воспламеняются под очень высоким сжатием, достигаемым в дизельном двигателе. Однако большинство растительных TAG имеют диапазон вязкости, который гораздо выше, чем для стандартного дизеля: 17,3-32,9 мм2с-1, по сравнению с 1,9-4,1 мм2с-1, соответственно (ASTM D975; Knothe and Steidley, 2005). Эта более высокая вязкость приводит к слабой атомизации топлива в современных дизельных топливах, обусловливая проблемы из-за неполного сжигания, такие как отложение сажи и коксование (Ryan et al., 1984). Чтобы преодолеть эту проблему, TAG превращают в менее вязкие сложные эфиры жирных кислот путем эстерификации с первичным спиртом, наиболее часто метанолом. Полученное топливо обычно упоминается как биодизель и имеет динамическую вязкость в диапазоне от 1,9 до 6,0 мм2с-1 (ASTM D6751). Метиловые эфиры жирных кислот (FAME), которые содержатся в биодизеле, обладают высокой плотностью энергии, что выражается в их высокой теплоте сгорания, которая является такой же, если не больше, чем теплота сгорания обычного дизеля (Knothe, 2005). Точно также, цетановое число (мера качества воспламенения дизеля) FAME, содержащихся в биодизеле, превосходит цетановое число обычного дизеля (Knothe, 2005).
Растительные масла по большей части состоят из пяти основных жирных кислот, а именно пальмитата (16:0), стеарата (18:0), олеата (18:1), линолеата (18:2) и линолената (18:3), хотя, в зависимости от конкретных видов, основными компонентами могут быть также более длинные или короткие жирные кислоты. Эти жирные кислоты отличаются друг от друга по длине ацильной цепи и количеству двойных связей, что приводит к различным физическим свойствам. Следовательно, топливные свойства биодизеля, полученного из смеси жирных кислот, зависят от этого состава. Поэтому изменяя профиль жирных кислот можно улучшать топливные свойства биодизеля, такие как характеристики текучести при низких температурах, окислительная стабильность и выделение NOx. Изменяя состав жирных кислот TAG можно снижать вязкость растительных масел, избегая необходимость химической модификации, улучшая посредством этого экономичность биотоплива.
Большинство растительных масел получают из триацилглицеринов, накопленных в семенах. Однако в настоящем изобретении представлены также способы увеличения содержания масла в вегетирующих тканях. Ткани растения по настоящему изобретению обладают повышенным выходом общих липидов. Более того, концентрация олеиновой кислоты существенно увеличена, тогда как содержание полиненасыщенной жирной кислоты, альфа-линоленовой кислоты, снижено.
Во время развития листа он подвергается эволюционным изменениям от поглотителя (абсорбирующего питательные вещества) до источника (обеспечивающего сахара). В пищевых зерновых культурах большинство сахаров перенесено из первичных листьев для поддержания роста новых листьев, корней и плодов. Поскольку перенос углеводов представляет собой активный процесс, происходит потеря углерода и энергии во время переноса. Более того, после того, как развивающиеся семена поглотили углерод из растения, происходят дополнительные потери углерода и энергии, связанные с превращением углеводорода в масло, белок или другие главные компоненты семян (Goffman et al., 2005). Растения настоящего изобретения увеличивают содержание энергии в листьях и/или стеблях, так что может быть собрана и использована для производства биотоплива вся надземная часть растения.
Водоросли как источник биотоплива
Водоросли накапливают масло внутри клеточного тела, иногда, но не всегда, в везикулах. Это масло может быть выделено несколькими относительно простыми способами, включая растворители, нагревание и/или давление. Однако в этих способах обычно выделяется лишь около 80%-90% от запасенного масла. В данной области техники известны процессы, которые обеспечивают более эффективные способы экстракции масла, которые могут обеспечивать выделение близко к 100% запасенного масла при низких затратах. Эти процессы включают или состоят из деполимеризации, такой как биологическое разрушение стенок водорослевых клеток и/или масляных везикул, при их наличии, для высвобождения масла из вырабатывающих масло водорослей.
Кроме того, существует большое количество вирусов, которые вторгаются и разрушают клетки водорослей и, посредством этого, могут высвобождать содержимое клеток, в частности, запасенного масла или крахмала. Такие вирусы представляют собой неотъемлемую часть водорослевой экосистемы, и многие из этих вирусов являются специфичными к одному типу водорослей. Конкретные примеры таких вирусов включают вирус хлореллы PBCV-1 (Paramecium Bursaria Chlorella Virus), который специфичен к некоторым водорослям Chlorella, и цианофаги, такие как SM-1, P-60 и AS-1, специфичные к сине-зеленым водорослям Synechococcus. Конкретный выбранный вирус зависит от конкретных видов водорослей, которые используются в процессе выращивания. Один аспект настоящего изобретения заключается в применении такого вируса для разрушения водорослей, так чтобы масло, содержащееся в клеточной стенке водоросли, можно было выделить. В другом подробном аспекте настоящего изобретения может быть использована смесь биологических агентов для разрушения клеточной стенки водоросли и/или масляных везикул.
Для экстракции масла из масляных везикул вырабатывающих масло водорослей могут быть пригодны также механический размол, например, выталкивателем или прессом, стадия выделения с гексановым или бутановым растворителем, сверхкритическая жидкостная экстракция или тому подобные. Альтернативно, механические подходы могут быть использованы в комбинации с биологическими агентами для улучшения скорости реакции и/или разделения материалов. Независимо от конкретного выбранного биологического агента или агентов, они могут быть введены в количествах, эффективных для того, чтобы служить в качестве основных механизмов, по которым водорослевое масло высвобождается из масляных везикул в вырабатывающих масло водорослях, то есть не просто произвольное наличие любого из них.
После высвобождения масла из водорослей, его можно выделить или отделить 16 от суспензии остаточного материала водорослей, например, клеточного остатка, масла, ферментов, побочных продуктов и так далее. Это можно выполнить осаждением или центрифугированием, при этом центрифугирование обычно происходит быстрее. После таких же процессов разделения может следовать производство крахмала.
Источник питания водорослей может быть получен из источника питания, представляющего собой биомассу, а также из водорослевого источника питания. Биомасса из водорослевых или наземных источников может быть деполимеризована различными способами, такими как, но не ограничиваясь этим, осахаривание, гидролиз или тому подобные. Сырьевой материал может быть практически любой достаточно ценной целлюлозой, лигноцеллюлозой, полисахаридом или углеводом, гликопротеином или другим материалом, создающим клеточные стенки из сырьевого материала.
Стадия ферментации может быть обычной в смысле использования дрожжей для ферментации сахара в спирт. В процессе ферментации образуется диоксид углерода, спирт и водорослевые оболочки. Все эти продукты могут быть использованы в процессах и системах настоящего изобретения, при этом практически не остается неиспользованных материалов или сбрасываемого тепла. Альтернативно, при производстве таким способом этанола, его можно продавать в виде готового продукта или использовать для получения этилацетата для процесса транс-эстерификации. Такие же соображения относятся к другим спирта, отличным от этанола.
Водорослевое масло может быть преобразовано в биодизель с помощью процесса прямого гидрогенирования или транс-эстерификации водорослевого масла. Водорослевое масло находится в такой же форме, что и большинство растительных масел, которые находятся в форме триглицеридов. Триглицерид состоит из трех цепей жирных кислот, каждая из которых присоединена к одному из трех углеродных атомов в скелете глицерина. Эта форма масла может сжигаться напрямую. Однако свойства масла в этой форме неидеальны для применения в дизельном двигателе, а без модификации двигатель в скором времени начнет работать плохо или сломается. В соответствии с настоящим изобретением триглецирид преобразуют в биодизель, который является таким же, но превосходящим нефтяное дизельное топливо во многих отношениях.
Один способ превращения триглицерида в биодизель представляет собой транс-эстерификацию и включает взаимодействие триглицерида со спиртом или другим акцептором ацила с образованием эфиров свободных жирных кислот и глицерина. Свободные жирные кислоты находятся в форме алкильных эфиров жирных кислот (FAAE).
При химическом способе необходимы дополнительные стадии для отделения катализатора и осветления жирных кислот. Кроме того, при использовании этанола в качестве акцептора ацила, он должен быть практически сухим для предотвращения образования мыла за счет омыления в указанном процессе, а глицерин должен быть очищенным. Биологический процесс, для сравнения, может принимать этанол в менее высушенном состоянии, а осветление и очистка биодизеля и глицерина гораздо проще.
В транс-эстерификации зачастую используют простой спирт, обычно метанол, полученный из нефти. При использовании метанола полученный биодизель называется метиловым эфиром жирных кислот (FAME), и основная часть биодизеля, продаваемого в настоящее время, особенно в Европе, приходится на FAME. Однако в качестве спирта при транс-эстерификации может быть использован и этанол, и в этом случае биодизель представляет собой этиловый эфир жирных кислот (FAEE). В США эти два типа обычно не различают, и они известны под общим название алкильные эфиры жирных кислот (FAAE), и это название может быть использовано в качестве общего термина независимо от использованного акцептора ацила. Также может быть использовано прямое гидрирование для превращения по меньшей мере части водорослевого масла в биодизель. Следовательно, в одном аспекте, биодизельный продукт может содержать алкан.
Водорослевый триглицерид также может быть преобразован в биодизель прямым гидрогенированием. В этом способе продукты представляют собой алкановые цепи, пропан и воду. Глицериновый скелет гидрогенируется до пропана, поэтому в качестве побочного продукта практически не образуется глицерин. Более того, нет необходимости в использовании спирта или катализаторов транс-эстерификации. Вся биомасса может быть использована в качестве питательной среды для вырабатывающих масло водорослей без какой-либо необходимости в ферментации для получения спирта для транс-эстерификации. Полученные алканы представляют собой чистые углеводороды, без кислорода, поэтому биодизель, полученный по этому способу, обладает немного более высоким содержанием энергии, чем алкильные эфиры, разлагается более медленно, не гигроскопичен и обладает другими благоприятными химическими свойствами.
Пищевые продукты
Настоящее изобретение включает композиции, которые могут быть использованы в качестве пищевых продуктов. Для целей настоящего изобретения, «пищевые продукты» включают любую пищу или препарат для употребления человеком или животным (включая для энтерального и/или парентерального употребления), который при попадании в организм: (1) служит для питания или построения тканей, или доставки энергии и/или (2) сохранения, восстановления или поддержания правильного пищевого статуса, или метаболической функции. Пищевые продукты настоящего изобретения включают питательные композиции для младенцев и/или маленьких детей.
Пищевые продукты настоящего изобретения содержат, например, клетку настоящего изобретения, растение настоящего изобретения, часть растения настоящего изобретения, семена настоящего изобретения, экстракт настоящего изобретения, продукт способа настоящего изобретения, продукт процесса ферментации настоящего изобретения или композицию вместе с подходящим носителем (-ями). Термин «носитель» используется в его самом широком смысле и включает любой компонент, который может обладать или не обладать пищевой ценностью. Специалистам в данной области понятно, что носитель может быть подходящим для применения (или применяться в достаточно низкой концентрации) в пищевых продуктах, так что он не оказывает неблагоприятного эффекта на организм, который употребляет указанный пищевой продукт.
Пищевой продукт настоящего изобретения содержит липиды, полученные прямо или косвенно с использованием способов, клеток или организмов, описанных в настоящем документе. Композиция может быть в твердой или жидкой форме. Дополнительно, композиция может содержать съедобные питательные макроэлементы, витамины и/или минералы в количествах, предназначенных для конкретного применения. Количества этих ингредиентов варьируются в зависимости от того, предназначена ли эта композиция для применения здоровыми индивидуумами или для применения индивидуумами, имеющими специализированные потребности, такими как индивидуумы, страдающие от метаболических расстройств и тому подобного.
Примеры подходящих носителей с пищевой ценностью включают, но не ограничиваясь этим, питательные макроэлементы, такие как съедобные жиры, углеводы и белки. Примеры таких съедобных жиров включают, но не ограничиваясь этим, кокосовое масло, масло бурачника, грибковое масло, масло черной смородины, соевое масло и моно- и диглицериды. Примеры таких углеводов включают, но не ограничиваясь этим, глюкозу, съедобную лактозу и гидролизированный крахмал. Дополнительно, примеры белков, которые могут быть использованы в пищевой композиции настоящего изобретения, включают, но не ограничиваясь этим, соевые белки, сыворотку, отделенную электродиализом, обезжиренное молоко, отделенное электродиализом, молочную сыворотку или гидролизаты этих белков.
В отношении витаминов и минералов, к пищевым композициям настоящего изобретения могут быть добавлены следующие: кальций, фосфор, калий, натрий, хлорид, магний, марганец, железо, медь, цинк, селен, йод и витамины A, E, D, C и комплекс B. Также могут быть добавлены другие такие витамины и минералы.
Компоненты, используемые в композициях пищевых продуктов настоящего изобретения, могут быть полуочищенными и очищенными. Под полуочищенными или очищенными подразумеваются материалы, которые были получены очисткой природного материала или синтезом de novo.
Композиция пищевых продуктов настоящего изобретения также может быть добавлена в пищу, даже если нет необходимости в пополнении рациона. Например, композиция может быть добавлена в пищу любого типа, включая, но не ограничиваясь этим, маргарин, модифицированное сливочное масло, сыры, молоко, йогурт, шоколад, конфеты, снеки, салатные масла, кулинарные масла, кулинарные жиры, мясо, рыбу и напитки.
Род видов Saccharomyces используют при варении пива и вина, а также в качестве агента при выпечке, в частности, хлеба. Дрожжи представляют собой основной компонент растительных экстрактов. Дрожжи также могут быть использованы в качестве добавки к животным кормам. Понятно, что могут быть представлены генетически модифицированные штаммы дрожжей, которые адаптированы для синтеза липидов, как описано в настоящем документе. Эти штаммы дрожжей затем могут быть использованы в пищевых продуктах, а также в виноделии и пивоварении для получения продуктов с увеличенным содержанием липидов.
Дополнительно, липиды, полученные в соответствии с настоящим изобретением, или клетки-хозяева, трансформированные так, чтобы они содержали и экспрессировали заданные гены, также могут быть использованы в качестве добавки к животным кормам для изменения состава жирных кислот в животных тканях или молоке на более желательный для употребления людьми или животными. Примеры таких животных включают овец, коров, лошадей и тому подобные.
Кроме того, пищевые продукты настоящего изобретения могут быть использованы в аквакультуре для увеличения концентрации жирных кислот в рыбе для употребления людьми или животными.
Предпочтительные пищевые продукты настоящего изобретения представляют собой растения, семена и другие части растений, такие как листья, плоды и стебли, которые могут быть использованы напрямую в качестве пищи или корма для людей, или других животных. Например, животные могут пастись непосредственно на таких растениях, выращиваемых в поле, или могут получать более точные количества при контролируемом питании. Настоящее изобретение включает также применение таких растений и частей растений в качестве корма для увеличения концентраций полиненасыщенных жирных кислот в организме людей и других животных.
Композиции
Настоящее изобретение охватывает также композиции, в частности фармацевтические композиции, содержащие один или более липидов, полученных по способам настоящего изобретения.
Фармацевтическая композиция может содержать один или более липидов в комбинации со стандартным, общеизвестным, нетоксичным фармацевтически приемлемым носителем, адъювантов или жидким носителем, таким как фосфатно-солевой буферный раствор, вода, этанол, многоатомные спирты, растительные масла, увлажняющие агенты или эмульсии, такие как эмульсии вода/масло. Композиция может быть в жидкой или твердой форме. Например, композиция может быть в форме таблетки, капсулы, жидкости для проглатывания, порошка, мази или крема для местного применения. Надлежащая текучесть может поддерживаться, например, за счет сохранения заданного размера частиц в случае дисперсий и с помощью применения поверхностно-активных веществ. Также может потребоваться введение агентов изотоничности, например, сахаров, хлорида натрия и тому подобных. Помимо таких инертных разбавителей композиции также могут содержать адъюванты, такие как увлажняющие агенты, эмульгирующие и суспендирующие агенты, подсластители, ароматизаторы и отдушки.
Суспензии, помимо активных соединений, могут содержать суспендирующие агенты, такие как этоксилированные изостеариловые спирты, полиоксиэтилен-сорбит и сложные эфиры сорбита, микрокристаллическую целлюлозу, метагидроксид алюминия, бентонит, агар-агар и трагакант или смеси этих веществ.
Твердые лекарственные формы, такие как таблетки и капсулы, могут быть получены с помощью приемов, хорошо известных в данной области техники. Например, липиды, полученные в соответствии с настоящим изобретением, могут быть таблетированы со стандартными основами для таблеток, такими как лактоза, сахароза и кукурузный крахмал, в комбинации со связующими веществами, такими как гуммиарабик, кукурузный крахмал или желатин, средствами для улучшения распадаемости таблеток, такими как картофельный крахмал или альгиновая кислота, и смазывающими веществами, такими как стеариновая кислота или стеарат магния. Капсулы могут быть получены введением этих вспомогательных веществ в желатиновую капсулу вместе с антиоксидантами и релевантным липидом (-ами).
Для внутривенного введения липиды, полученные в соответствии с настоящим изобретением, или их производные могут быть введены в промышленные рецептуры.
Стандартная доза определенной жирной кислоты составляет от 0,1 до 20 г, которую принимают от одного до пяти раз в сутки (до 100 г в сутки), и предпочтительно находится в диапазоне от около 10 мг до около 1, 2, 5 или 10 г в сутки (которую принимают одной или несколькими дозами). Как известно в данной области техники, желательно принимать не менее, чем около 300 мг/сутки жирных кислот, особенно полиненасыщенных жирных кислот. Однако следует понимать, что для субъекта благоприятен прием любого количества жирных кислот.
Возможные способы введения фармацевтических композиций настоящего изобретения включают, например, энтеральный и парентеральный. Например, жидкий препарат может быть введен перорально. Кроме того, гомогенная смесь может быть полностью диспергирована в воде, смешана в стерильных условиях с физиологически приемлемыми разбавителями, консервантами, буферами или газами-вытеснителями для получения спрея или средства для ингаляций.
Доза композиции, подлежащей введению субъекту, может быть определена специалистами в данной области и зависит от различных факторов, таких как вес, возраст, общее состояние здоровья, анамнез, иммунный статус субъекта и так далее.
Кроме того, композиции настоящего изобретения могут быть использованы для косметических целей. Композиции могут быть добавлены к уже существующим косметическим композициям с образованием смеси, или жирные кислот, полученные в соответствии с настоящим изобретением, могут быть использованы в качестве единственного «активного» ингредиента в косметической композиции.
Полипептиды
Термины «полипептид» и «белок» обычно используются взаимозаменяемо.
Полипептид или класс полипептидов может быть определен по степени идентичности (% идентичности) его аминокислотной последовательности с эталонной аминокислотной последовательностью или по наличию у него более высокой % идентичности с одной эталонной аминокислотной последовательностью, чем с другой, % идентичности полипептида с эталонной аминокислотной последовательностью обычно определяют гэп-анализом (Needleman and Wunsch, 1970; программа GCG) с параметрами штрафа за открытие гэпа=5 и штрафом за продолжение гэпа=0,3. Искомая последовательность имеет по меньшей мере 100 аминокислот в длину, и гэп-анализ устанавливает соответствие двух последовательностей в областей по меньшей мере из 100 аминокислот. Еще более предпочтительно искомая последовательность имеет по меньшей мере 250 аминокислот в длину, и гэп-анализ устанавливает соответствие двух последовательностей в области по меньшей мере из 250 аминокислот. Еще более предпочтительно, гэп-анализ устанавливает соответствие двух последовательностей по всей их длине. Полипептид или класс полипептидов может иметь одинаковую ферментную активность или другую активность или не обладать активностью эталонного полипептида. Предпочтительно, полипептид обладает ферментной активностью, составляющей по меньшей мере 10% от активности эталонного полипептида.
Используемый в настоящем документе «биологически активный фрагмент» представляет собой часть полипептида настоящего изобретения, которая сохраняет определенную активность эталонного полипептида полной длины, например, активность MGAT. Биологически активные фрагменты, при использовании в настоящем документе, исключают полипептид полной длины. Биологически активные фрагменты могут представлять собой часть любого размера, пока они сохраняют заданную активность. Предпочтительно, биологически активный фрагмент сохраняет по меньшей мере 10% активности полипептида полной длины.
В отношении описанного полипептида или фермента следует понимать, что % идентичности, изображающий более высокое значение, чем представлено в настоящем документе, включает предпочтительные варианты реализации. Следовательно, если это применимо, в свете минимальных значений % идентичности, предпочтительно, чтобы полипептид/фермент содержал аминокислотную последовательность, которая по меньшей мере на 60%, более предпочтительно по меньшей мере на 65%, более предпочтительно по меньшей мере на 70%, более предпочтительно по меньшей мере на 75%, более предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 85%, более предпочтительно по меньшей мере на 90%, более предпочтительно по меньшей мере на 91%, более предпочтительно по меньшей мере на 92%, более предпочтительно по меньшей мере на 93%, более предпочтительно по меньшей мере на 94%, более предпочтительно по меньшей мере на 95%, более предпочтительно по меньшей мере на 96%, более предпочтительно по меньшей мере на 97%, более предпочтительно по меньшей мере на 98%, более предпочтительно по меньшей мере на 99%, более предпочтительно по меньшей мере на 99,1%, более предпочтительно по меньшей мере на 99,2%, более предпочтительно по меньшей мере на 99,3%, более предпочтительно по меньшей мере на 99,4%, более предпочтительно по меньшей мере на 99,5%, более предпочтительно по меньшей мере на 99,6%, более предпочтительно по меньшей мере на 99,7%, более предпочтительно по меньшей мере на 99,8% и еще более предпочтительно по меньшей мере на 99,9% идентична релевантной представленной SEQ ID NO.
Мутанты аминокислотных последовательностей полипептидов, описанных в настоящем документе, могут быть получены внедрением соответствующих нуклеотидных изменений в нуклеиновую кислоту, описанную в настоящем документе, или in vitro синтезом заданного полипептида. Такие мутанты включают, например, делеции, вставки или замещения остатков в аминокислотной последовательности. Может быть выполнена комбинация делеций, вставок и замещений для получения конечного конструкта, при условии, что конечный полипептидный продукт обладает заданными характеристиками.
Мутантные (измененные) полипептиды могут быть получены с помощью любого приема, известного в данной области техники, например, с использованием направленной эволюции или стратегий рационального проектирования (см. ниже). Продукты, полученные из мутированной/измененной ДНК, могут быть легко проверены с помощью приемов, описанных в настоящем документе, для определения того, обладают ли они активностью ацилтрансферазы жирных кислот, например, активностью MGAT, DGAT или GPAT/фосфатазы.
При разработке мутантов аминокислотных последовательностей местоположение сайта мутации и природы мутации зависит от характеристик (-и), подлежащих модификации. Сайты для мутации могут быть модифицированы по отдельности или сериями, например, (1) сначала заменой выбранных консервативных аминокислотных, а затем более радикальными отборами в зависимости от полученных результатов, (2) удалением целевого остатка, или (3) вставкой других остатков, соседних с определенным сайтом.
Делеции в аминокислотных последовательностях обычно находятся в диапазоне около 1-15 остатков, более предпочтительно около 1-10 остатков и обычно около 1-5 последовательных остатков.
Мутанты-замещения имеют по меньшей мере один удаленный аминокислотный остаток в полипептиде и другой остаток, вставленный на его место. Наиболее интересные сайты для заместительного мутагенеза включают сайты, идентифицированные как активный сайт (-ы). Другие представляющие интерес сайты представляют собой те, в которых конкретные остатки, полученные из различных штаммов или видов, являются идентичными. Эти положения могут быть важными для биологической активности. Эти сайты, особенно те, которых входят в последовательность по меньшей мере трех других идентично консервативных сайтов, предпочтительно замещают относительно консервативным образом. Такие консервативные замещения представлены в Таблице 1 под заголовком «иллюстративные замещения».
В предпочтительном варианте реализации мутантный/вариантный полипептид имеет одну или не более одной или двух, или трех, или четырех консервативных аминокислотных изменений, по сравнению с природным полипептидом. Подробности об изменениях консервативных аминокислот представлены в Таблице 1. Специалистам в данной области понятно, что такие незначительные изменения предположительно могут не изменять активность полипептидов при экспрессировании в рекомбинантной клетке.
Таблица 1. Иллюстративные замещения
Направленная эволюция
При направленной эволюции в отношении белка используют случайный мутагенез и используют режим отбора для сбора вариантов, которые обладают заданными свойствами, например, повышенной активностью ацилтрансферазы жирных кислот. Затем выполняют дополнительные серии мутаций и отбора. Стандартная стратегия направленной эволюции включает три стадии:
1) Диверсификация: Ген, кодирующий рассматриваемый белок мутирует и/или рекомбинируется случайным образом с образованием большой библиотеки генных вариантов. Библиотеки генных вариантов могут быть созданы с помощью допускающей ошибки ПЦР (см., например, Leung, 1989; Cadwell and Joyce, 1992), из пулов фрагментов, расщепленных ДНазой I, полученных из исходной «кальки» (Stemmer, 1994a; Stemmer, 1994b; Crameri et al., 1998; Coco et al., 2001), из вырожденных олигонуклеотидов (Ness et al., 2002, Coco, 2002) или из их смесей, или из нерасщепленной исходной «кальки» (Zhao et al., 1998; Eggert et al., 2005; Jézéquek et al., 2008), и обычно собираются при ПЦР. Библиотеки также могут быть получены из исходных последовательностей, рекомбинированных in vivo или in vitro с помощью гомологичной или негомологичной рекомбинации (Ostermeier et al., 1999; Volkov et al., 1999; Sieber et al., 2001). Библиотеки генных вариантов также могут быть созданы субклонированием рассматриваемого гена в подходящий вектор, трансформацией указанного вектора в штамм «мутатора», такой как E. coli XL-1 красный (Stratagene) и размножением трансформированных бактерий до подходящего количества поколений. Библиотеки генных вариантов также могут быть созданы перестановкой ДНК в рассматриваемом гене (то есть in vitro гомологичная рекомбинация пулов выбранных мутантных генов с помощью случайно фрагментации и повторной сборки), как подробно описано в публикации Harayama (1998).
2) Отбор: Библиотеку тестируют на наличие мутантов (вариантов). Обладающих заданным свойством, с помощью отбора или селекции. Отбор обеспечивает возможность идентификации и выделения высококачественных мутантов вручную, тогда как селекция автоматически исключает все нефункциональные мутанты. Отбор может включать скрининг на наличие известных консервативных аминокислотных мотивов. Альтернативно или дополнительно, отбор может включать экспрессию мутированного полинуклеотида в организм хозяина или его часть и анализ степени активности ацилтрансферазы жирных кислот, например, количественным определением концентрации образующегося продукта в липидах, экстрагированных из организма или его части, и определение содержания продукта в экстрагированных липидах из организма или его части, по сравнению с соответствующим организмом или его частью, не содержащей мутированный полинуклеотид и, необязательно, экспрессию исходного (немутированного) полинуклеотида. Альтернативно, отбор может включать питание организма или его части меченым субстратом и определение концентрации субстрата или продукта в организме, или его части, по сравнению с соответствующим организмом или его частью, не содержащей мутированный полинуклеотид и, необязательно, экспрессию исходного (немутированного) полинуклеотида.
3) Амплификация: Варианты, идентифицированные при селекции или отборе, многократно реплицируют, что дает возможность исследователям секвенировать их ДНК для понимания появившихся мутаций.
Все вместе, эти три стадии называются «раундом» направленной эволюции. Большая часть экспериментов подразумевает более одного раунда. В этих экспериментах «победители» предыдущего раунда диверсифицируются в следующем раунде для создания новой библиотеки. В конце эксперимента все образованные белковые или полинуклеотидные мутанты описывают с помощью биохимических методов.
Рациональное проектирование
Белок может быть спроектирован рационально, на основании известной информации о белковой структуре и укладке. Это может быть выполнено разработкой с нуля (расчет de novo) или повторным проектированием на основе нативных структур (см., например, Hellinga, 1997; и Lu and Berry, Protein Structure and Engineering, Handbook of Proteins 2, 1153-1157 (2007)). Проектирование белка обычно включает идентификацию последовательностей, которые складываются в данную или заданную структуру, и может быть выполнено с помощью компьютерных моделей. Компьютерные алгоритмы проектирования белка выполняют поиск последовательность-конформационного пространства для последовательностей, обладающих низкой энергией при укладке в заданную структуру. В компьютерных моделях проектирования белка используются модели энергетики белков для оценки того, как мутации повлияют на структуру и функцию белка. Эти энергетические функции обычно включают комбинацию молекулярно-механических, статистических (то есть основанных на знаниях) и других эмпирических терминов. Подходящее доступное программное обеспечение включает IPRO (Interactive Protein Redesign and Optimization), EGAD (A Genetic Algorithm for Protein Design), Rosetta Design, Sharpen и Abalone.
В рамки настоящего изобретения включены также полипептиды, описанные в настоящем документе, которые дифференциально модифицированы вовремя или после синтеза, например, с помощью биотинилирования, бензилирования, гликозилирования, ацетилирования, фосфорилирования, амидирования, дериватизации известными защитными/блокирующими группами, протеолитического расщепления, связывания с молекулой антитела или другими клеточными лигандами и так далее. Эти модификации могут служить для увеличения стабильности и/или биоактивности полипептида настоящего изобретения.
Идентификация ацилтрансфераз жирных кислот
В одном аспекте настоящего изобретения представлен способ идентификации молекулы нуклеиновой кислоты, кодирующей ацилтрансферазу жирной кислоты, обладающую повышенной способностью вырабатывать MAG, DAG и/или TAG в клетке.
Указанный способ включает получение клетки, содержащей молекулу нуклеиновой кислоты, кодирующей ацилтрансферазу жирных кислот, функционально связанную с промотором, который активен в клетке. Молекула нуклеиновой кислоты может кодировать природную ацилтрансферазу жирных кислот, такую как MGAT, GPAT и/или DGAT, или их мутант (-ы). Мутанты могут быть созданы с помощью стандартных в данной области способов (смотри выше), таких как выполнение случайного мутагенеза, направленного мутагенеза или насыщающего мутагенеза на известных заданных генах, или путем перестановки ДНК в различных генах. Например, полинуклеотид, содержащий последовательность, выбранную из любой из SEQ ID NO:1-44, которая кодирует MGAT, может быть мутирован и/или рекомбинирован случайным образом для создания крупной библиотеки генных вариантов (мутантов) с помощью, например, допускающей ошибки ПЦР и/или перестановки ДНК. Мутанты могут быть отобраны для дальнейшего исследования по тому признаку, что они содержат консервативный аминокислотный мотив. Например, в случае кандидата нуклеиновой кислоты, кодирующей MGAT, специалисты в данной области могут определить, содержит ли она последовательность, представленную в SEQ ID NO:220, 221, 222, 223 и/или 224, до испытания того, кодирует ли эта нуклеиновая кислота функциональный мутант MGAT (например, трансфекцией в клетку-хозяин, такую как клетка растения, и анализом на активность ацилтрансферазы жирных кислот (то есть MGAT), как описано в настоящем документе).
Прямое ПЦР секвенирование нуклеиновой кислоты или ее фрагмента также может быть использовано для определения точной нуклеотидной последовательности и вывода соответствующей аминокислотной последовательности и, посредством этого, идентификации консервативных аминокислотных последовательностей. Вырожденные праймеры, основанные на консервативных аминокислотных последовательностях, могут быть использованы для направленной ПЦР амплификации. Вырожденные праймеры также могут быть использованы в качестве проб при анализе гибридизации ДНК. Альтернативно, консервативная аминокислотная последовательность (-и) может быть определена в анализах гибридизации белков, в которых используется, например, антитело, которое специфически связывается с консервативной аминокислотной последовательностью (-ями), или субстрат, который специфически связывается с консервативной аминокислотной последовательностью (-ями), такой как, например, липид, который связывается с FLXLXXXN (предполагаемый домен, связывающий нейтральные липиды; SEQ ID NO:224).
В одном варианте реализации молекула нуклеиновой кислоты содержит последовательность нуклеотидов, кодирующую MGAT. Последовательность нуклеотидов может i) содержать последовательность, выбранную из любой из SEQ ID NO:1-44, ii) кодировать полипептид, содержащий аминокислоты, имеющие последовательность, представленную в любой из SEQ ID NO:45-82, или их биологически активный фрагмент, iii) быть по меньшей мере на 50% идентичной с i) или ii), или iv) гибридизоваться с любой из i) - iii) при жестких условиях. В другом или дополнительном варианте реализации молекула нуклеиновой кислоты содержит последовательность нуклеотидов, кодирующую одну или более консервативных DGAT2 и/или MGAT1/2 аминокислотных последовательностей, представленных в SEQ ID NO:220, 221, 222, 223 и 224. В предпочтительном варианте реализации молекула нуклеиновой кислоты содержит последовательность нуклеотидов, кодирующую консервативные аминокислотные последовательности, представленные в SEQ ID NO:220 и/или SEQ ID NO:224.
В другом варианте реализации молекула нуклеиновой кислоты содержит последовательность нуклеотидов, кодирующую GPAT, предпочтительно GPAT, которая обладает активностью фосфатазы. Последовательность нуклеотидов может i) содержать последовательность, выбранную из любой из SEQ ID NO:84-141, ii) кодировать полипептид, содержащий аминокислоты, имеющие последовательность, представленную в любой из SEQ ID NO:144-201, или их биологически активный фрагмент, iii) быть по меньшей мере на 50% идентичной с i) или ii), или iv) гибридизоваться с любой из i) - iii) при жестких условиях. В другом или дополнительном варианте реализации молекула нуклеиновой кислоты содержит последовательность нуклеотидов, кодирующую одну или более консервативных GPAT аминокислотных последовательностей, представленных в SEQ ID NO:225, 226 и 227, или последовательность аминокислот, которая по меньшей мере на 50%, предпочтительно по меньшей мере на 60%, более предпочтительно по меньшей мере на 65% идентична им.
В другом варианте реализации молекула нуклеиновой кислоты содержит последовательность нуклеотидов, кодирующую DGAT2. Последовательность нуклеотидов может содержать i) последовательность нуклеотидов, выбранную из любой из SEQ ID NO:204-211, ii) кодировать полипептид, содержащий аминокислоты, имеющие последовательность, представленную в любой из SEQ ID NO:212-219, или их биологически активный фрагмент, iii) быть по меньшей мере на 50% идентичной i) или ii), или iv) гибридизоваться с любой из i) - iii) при жестких условиях. В предпочтительном варианте реализации DGAT2 содержит последовательность нуклеотидов SEQ ID NO:204 и/или последовательность нуклеотидов, кодирующих полипептид, содержащий аминокислоты, имеющие последовательность, представленную SEQ ID NO:212.
Клетка, содержащая молекулу нуклеиновой кислоты, кодирующей ацилтрансферазу жирных кислот, функционально связанную с промотором, который активен в этой клетке, может быть получена с помощью стандартных в данной области техники приемов, таких как внедрение молекулы нуклеиновой кислоты в клетку, например, осаждением фосфата кальция, обработкой полиэтиленгликолем, электропорацией и комбинациями этих способов обработки. Также могут быть использованы другие способы трансформации клетки, и они включают, но не ограничиваясь этим, внедрение ДНК в растения посредством прямого переноса или инъекции ДНК. Трансформированные клетки растений также могут быть получены с помощью Agrobacterium-опосредованного переноса и способов акселерации, описанных в настоящем документе.
Указанный способ дополнительно включает определение того, увеличилась ли концентрация MAG, DAG и/или TAG, выработанного в клетке, по сравнению с соответствующей клеткой, не содержащей нуклеиновой кислоты, по способам, известным в данной области техники, таким как представлены в Примере 1. Например, липиды могут быть экстрагированы в раствор хлороформа/метанола, высушены и разделены тонкослойной хроматографией (ТСХ). Идентичность TAG, DAG, MAG, свободных жирных кислот и других липидов может быть сверена с внутренними стандартами липидов после окрашивания парами йода. Полученные хроматограммы можно анализировать с помощью PhosphorImager, а количество MAG, DAG и TAG можно количественно определить по известному количеству внутренних стандартов или, альтернативно, клетки можно напитать sn-2-моноолеоилглицерин[14C] или [14C]глицерин-3-фосфатом, а соответствующая радиоактивность может быть количественно определена подсчетом жидкостной сцинтилляции (то есть количественно определяют количество меченого MAG, DAG и TAG).
Указанный способ дополнительно включает идентификацию молекулы нуклеиновой кислоты, кодирующей ацилтрансферазу жирных кислот, обладающую увеличенной способностью вырабатывать MAG, DAG и/или TAG в клетке. В предпочтительном варианте реализации ацилтрансфераза жирных кислот катализирует ферментную реакцию в мути MGAT. В дополнительном предпочтительном варианте реализации DAG увеличивается на пути MGAT (например, ацилирование MAG жирным ацилом-CoA катализируется действием MGAT с образованием DAG). В другом или дополнительном варианте реализации субстрат MAG получают с помощью GPAT, которая также обладает активностью фосфатазы, и/или DAG ацилируют жирным ацилом-CoA с помощью DGAT и/или MGAT, обладающей активностью DGAT, с образованием TAG.
Блеск
Некоторые аспекты настоящего изобретения относятся к измерению блеска вегетирующего материала как показателя концентрации липидов в материале, при этом более высокие степени блеска ассоциируются с более высокими концентрациями липидов.
Блеск вегетирующего материала может быть определен с помощью известных способов. Блескомеры (рефлектометры) предполагают количественный способ измерения интенсивности блеска, обеспечивая соответствие измерений за счет определения точных условий освещения и наблюдения. Конфигурация углов источника освещения и восприятия при наблюдении обеспечивает возможность измерения в узком диапазоне от общего угла отражения. Результаты измерения блескомера связаны с количеством отраженного света от стандарта из черного стекла с определенным коэффициентом преломления. Отношение отраженного света к падающему на образец свету, по сравнению с соотношением для стеклянного стандарта, записывают в единицах блеска.
Шкала измерений блескомера, в единицах блеска (GU), представляет собой градацию на основе тщательно отполированного эталонного стандарта из черного стекла с определенным коэффициентом преломления, имеющего зрительное отражение 100 GU при определенном угле. Этот стандарт используют для определения верхней точки калибровки, составляющей 100, с нижней конечной точкой, установленной на 0 для совершенно матовой поверхности. Эта градация применима для большинства неметаллических материалов.
Очевидно, что оптимальная или ожидаемая степень блеска вегетирующего материала варьируется в зависимости от вида растения. Специалисты в данной области могут легко анализировать содержание липидов в вегетирующем материале из различных растений настоящего изобретения и идентифицировать подходящую, заранее определенную степень блеска, которую можно использовать в качестве стандарта в полевых условиях для оценки наилучшего времени для сбора вегетирующего материала из конкретных видов растений.
ПРИМЕРЫ
Пример 1. Общие материалы и способы
Экспрессия генов в клетках растений в системе с временной экспрессией
Гены экспрессировали в клетках растений, используя систему с временной экспрессией, по существу такую же, как описана в публикациях Voinnet et al. (2003) и Wood et al. (2009). Бинарные векторы, содержащие кодирующую область, подлежащую экспрессии сильным конститутивным промотором e35S, содержащим двойную энхансерную область, внедрили в штамм AGL1 Agrobacterium tumefaciens. Химерный бинарный вектор, 35S: p19, для экспрессии p19 вирусного молчащего супрессора, отдельно внедрили в AGL1, как описано в WO2010/057246. Химерный бинарный вектор, 35S:V2, для экспрессии V2 вирусного молчащего супрессора, отдельно внедрили в AGL1. Рекомбинантные клетки выращивали до стационарной фазы при 28°С в бульоне Лурия-Бертани (LB) с добавлением 50 мг/л канамицина и 50 мг/л рифампицина. Затем бактерии осадили центрифугированием при 5000 g в течение 5 минут при комнатной температуре, затем повторно суспендировали до ОП600=1,0 в пропиточном буфере, содержащем 10 мМ MES, рН 5, 7, 10 мМ MgCl2 и 100 мкМ ацетосирингона. Затем клетки инкубировали при 28°С при встряхивании в течение 3 часов, после чего измерили ОП600 и объем каждой культуры, включая добавленный в чистую пробирку конструкт вирусного супрессора 35S: p19 или 35S:V2, необходимые для достижения концентрации с ОП600=0,125. Конечный объем довели до полного с помощью описанного выше буфера. Затем листья пропитали культуральной смесью и выращивали растения, как правило, еще в течение трех-пяти дней после инфильтрации, а затем выделили листовые диски для приготовления очищенного клеточного лизата или для выделения общих липидов.
Анализ очищенного лизата листьев
Ткани листьев Nicotiana benthamiana, предварительно пропитанные так, как описано выше, измельчили в растворе, содержащем 0,1 М фосфатно-калиевого буфера (рН 7,2) и 0,33 М сахарозы, с помощью стеклянного гомогенизатора. Гомогенат листьев центрифугировали при 20000 g в течение 45 минут при 4°С, после чего собрали надосадочную жидкость. Содержание белка в каждой надосадочной жидкости измерили в соответствии с публикацией Bradford (1976), используя многозначный счетчик Wallac 1420 и красящий реагент для анализа белков Bio-Rad (Bio-Rad Laboratories. Геркулес, штат Калифорния. США). В анализах ацилтрансферазы использовали 100 мкг белка, в соответствии с публикацией Cao et al. (2007) с некоторыми модификациями. Реакционная среда содержала 100 мМ Tris-HCl (рН 7,0), 5 мМ MgCl2, 1 мг/мл бычьего сывороточного альбумина (BSA, без жирных кислот), 200 мМ сахарозы, 40 мМ холодного олеоил-CoA, 16,4 мкМ sn-2-моноолеоилглицерина[14C] (55 мКи/ммоль, American Radiochemicals. Сент-Луис, штат Миссури. США) или 6,0 мкМ [14C]глицерин-3-фосфата (G-3-P), динатриевой соли (150 мКи/ммоль, American Radiochemicals). Анализы выполняли в течение 7,5 15 или 30 минут.
Анализ липидов
Вкратце, использовали следующие способы для анализа липидов в семенах или вегетирующих тканях:
Семена Arabidopsis и любые другие семена похожего размера:
(i) Состав жирных кислоты - прямое метилирование жирных кислот в семенах, без измельчения семян.
(ii) Количественное определение общих жирных кислот или TAG - прямое метилирование жирных кислот в семенах, без имельчения семян, с использованием стандарта TAG 17:0.
Семена Canola , семена Cameliana и любые другие семена похожего размера:
(i) Состав жирных кислот в одном семени - прямое метилирование жирных кислот в семени после разрушения оболочки семени.
(ii) Состав жирных кислот в общих экстрагированных липидах в объединенных семенах - измельчение семян в CHCl3/MeOH и метилирование аликвот экстрагированных липидов.
(iii) Общее содержание липидов в объединенных семенах (содержание масла в семенах) - двукратная экстракция липидов для полного выделения липидов из семян после измельчения семян, из известного количества высушенных семян, с метилированием липидов из известного количестве семян вместе с 17:0 жирными кислотами в качестве внутреннего стандарта.
(iv) Количественное определение очищенного TAG в объединенных семенах - двукратная экстракция липидов для полного выделения липидов семян после измельчения семян, из известного количества высушенных семян, фракционирование TAG из липидов с помощью ТСХ и прямое метилирование TAG in silica с использованием 17:0 TAG в качестве внутреннего стандарта.
Образцы листьев:
(i) Состав жирных кислот в общих липидах - прямое метилирование жирных кислот в высушенных замораживанием образцах.
(ii) Количественное определение общих липидов - прямое метилирование жирных кислот в известной массе высушенных замораживанием образцов, с 17:0 FFA.
(iii) Количественное определение TAG - из-за наличия значительных количеств полярных липидов в листьях TAG фракционировали с помощью ТСХ из экстрагированных общих липидов и метилировали в присутствии 17:0 TAG в качестве внутреннего стандарта. Стадии: высушивание образцов замораживанием, взвешивание, экстракция липидов, фракционирование TAG из известного количества общих липидов, прямое метилирование TAG in silica вместе с 17:0 TAG в качестве внутреннего стандарта.
Способы подробно описаны ниже:
Анализ содержания масла в семенах Arabidopsis
Если содержание масла из семян необходимо было определить в небольших семенах, таких как семена Arabidopsis, то семена высушивали в эксикаторе в течение 24 часов и переносили приблизительно 4 мг семян в 2 мл стеклянную пробирку с покрытой тефлоном винтовой крышкой, 0,05 мг тригептадеканоина, растворенного в 0,1 мл толуола, добавили в пробирку в качестве внутреннего стандарта, FAME семян приготовили добавлением 0,7 мл 1 н, метанольного раствора HCl (Supelco) в пробирку, содержащую материал с семенами. Измельчение семян не было необходимым для таких мелких семян, как семена Arabidopsis. Смесь быстро встряхивали на вортексе и инкубировали при 80°С в течение 2 часов. После охлаждения до комнатной температуры в пробирку добавили 0,3 мл 0,9% NaCl (вес/об.) и 0,1 мл гексана и хорошо перемешивали в течение 10 минут на приборе Heidolph Vibramax 110, FAME собрали в 0,3 мл стеклянные вкладыши и анализировали с помощью ГХ с пламенно-ионизационным детектором (FID), упомянутым ранее.
Площадь пика отдельных FAME сначала скорректировали на основании площади пика, соответствующей известному количеству таких же FAME, содержащихся в промышленном стандарте GLC-411 (NU-CHEK PREP, INC., США). GLC-411 содержит равные количества 31 жирной кислоты (масс. %), в диапазоне от С8:0 до С22:6. В случае если жирные кислоты не были представлены в стандарте, использовали площадь пика, соответствующую наиболее схожему FAME. Например, площадь пика, соответствующую FAME 16:1d9, использовали для 16:1d7, а FAME, соответствующий C22:6 использовали для C22:5. Скорректированные площади использовали для расчета массы каждого FAME в образце путем сравнения с массой внутреннего стандарта. Масло хранится в основном в форме TAG, и его вес рассчитывали по весу FAME. Общее количество молей глицерина определили расчетом молей каждого FAME и делением общего количества молей FAME на три, TAG рассчитали как сумму фрагментов глицерина и жирных кислот, используя соотношение: масс. % масла=100х ((41х общее количество молей FAME/3)+(общее количество г FAME- (15х общее количество моль FAME)))/г семян, где 41 и 15 представляют собой молекулярные массы глицеринового фрагмента и метильной группы, соответственно.
Анализ содержания масла в семенах Cameliana и семенах канолы с помощью экстракции
После сбора во время зрелости растения, семена Camelina или канолы высушили выдерживанием семян в течение 24 часов при комнатной температуре в эксикаторе, содержащем силикагель в качестве высушивающего агента. Содержание влаги в семенах обычно составляет 6-8%. Общие липиды экстрагировали из высушенных семян с известным весом путем измельчения семян с помощью смеси хлороформа и метанола (2/1, об./об.) в пробирке Эппендорфа, используя прибор для лизиса тканей Reicht (частота/секунды 22 в течение 3 минут) и металлический шарик. Добавили один объем 0,1 М KCl и встряхивали смесь в течение 10 минут. Нижнюю неполярную фазу собрали после центрифугирования смеси в течение 5 минут при 3000 об./мин. Оставшуюся верхнюю (водную) фазу промыли 2 объемами хлороформа при перемешивании в течение 10 минут. Вторую неполярную фазу также собрали и объединили с первой. Из липидов в экстракте выпарили растворитель под потоком азота, а общие высушенные липиды растворили в известном объеме хлороформа.
Для измерения количества липидов в экстрагированном материале добавили известное количество 17:0 TAG в качестве внутреннего стандарта и инкубировали липиды из известного количества семян в 1 н, метанольном растворе HCl (Supelco) в течение 2 часов при 80°С. Полученные таким образом FAME экстрагировали в гексан и анализировали с помощью ГХ. Отдельные FAME количественно определили по количеству 17:0 TAG-FAME. Вес отдельных FAME, после вычитания веса эстерифицированных метильных групп из FAME, преобразовали в моли делением на молекулярный вес отдельного FAME. Общее количество молей всех FAME разделили на три для расчета количества молей TAG и, следовательно, глицерина. Затем количество молей TAG преобразовали в вес TAG. Наконец, рассчитал процентное содержание масла от веса семян, используя вес семян, предполагая, что все экстрагированные липиды представляют собой TAG или эквивалентны TAG для расчета содержания масла. Этот способ основан на публикации Li et al., (2006). Семена, отличные от семян Camelina или канолы, которые имеют схожий размер, также могут быть анализированы по этому способу.
Содержание масла в семенах канолы и в других семенах также может быть измерено с помощью приемов ядерного магнитного резонанса (Rossell and Pritchard, 1991), например, с помощью импульсного спектрометра NMS 100 Minispec (Brucker Pty Ltd Scientific Instruments. Германия), или ближней инфракрасной отражательной спектроскопии, как, например, с помощью монохроматора NIRSystems модели 5000. В способе ЯМР можно одновременно измерять содержание влаги. Содержание влаги также может быть измерено в образце из партии семян путем высушивания семян в образце в течение 18 часов при около 100°С, в соответствии с публикацией Li et al., (2006).
При необходимости определения состава жирных кислот для масла семян канолы может быть использован способ прямого метилирования, использованный для семян Arabidopsis (выше), модифицированный добавлением разрушения оболочки семян канолы. В этом способе из семян экстрагируется достаточное количество масла для обеспечения возможности выполнения анализа состава жирных кислот.
Анализ липидов из образцов лизата листьев
Липиды из образцов лизата экстрагировали с помощью хлороформа:метанола:0,1 М KCl (2:1:1) и выделили. Различные классы липидов в образцах разделили на пластинах для тонкослойной хроматографии (ТСХ) из силикагеля 60 (MERCK. Дармштадт. Германия), пропитанных 10% борной кислотой. Система растворителей, использованная для фракционирования TAG из экстракта липидов, состояла из хлороформа/ацетона (90/10 об./об.) Отдельные классы липидов визуализировали воздействием на пластины паров йода и идентифицировали с помощью параллельного выполнения достоверных стандартов на той же ТСХ пластине. На пластины воздействовали люминофорными визуализирующими экранами в течение ночи и анализировали на приборе для формирования изображения на люминесцентном фосфорном покрытии Fujifilm FLA-5000, затем выполнили подсчет жидкостной сцинтилляции для количественного определения DPM.
Выделение и фракционирование общих липидов
Ткани, включая образцы листьев, высушили замораживанием, взвесили (сухой вес) и экстрагировали общие липиды, как описано в публикации Bligh and Dyer (1959) или с помощью хлороформа:метанола:0,1 М KCl (CMK; 2:1:1) в качестве растворителя. Общие липиды экстрагировали из образцов листьев N. benthamiana, после высушивания замораживанием, путем добавления 900 мкл смеси хлороформа/метанола (2/1, об./об.) на образец листа размером 1 см в диаметре. В случае необходимости выполнения анализа ТСХ-FID добавили 0,8 мкг DAGE на 0,5 мг сухого веса листьев в качестве внутреннего стандарта. Образцы гомогенизировали с помощью диспергатора тканей IKA Ultra-turrax, после чего добавили 500 мкл 0,1 М KCl. Образцы перемешивали на вортексе, центрифугировали в течение 5 минут и собрали нижнюю фазу. Оставшуюся верхнюю фазу экстрагировали второй раз, добавив 600 мкл хлороформа, выполнив перемешивание на вортексе и центрифугирование в течение 5 минут. Нижнюю фазу выделили и вылили в предыдущую партию. Липиды высушили под потоком азота и повторно суспендировали в 2 мкл хлороформа на мг сухого веса листьев. Общие липиды из листьев N. tabacum или образцов листьев экстрагировали так, как описано выше, с некоторыми модификации. Если были объединены 4 или 6 дисков листьев (каждый с площадью поверхности приблизительно 1 см2), то использовали 1,6 мл растворителя CMK, если были объединены 3 или менее дисков листьев, то использовали 1,2 мл CMK. Ткани листьев, высушенные замораживанием, гомогенизировали в пробирке Эппендорфа с металлическим шариком с помощью диспергатора тканей Reicht (Qiagen) в течение 3 минут при частоте 20 в секунду.
Отделение нейтральных липидов с помощью ТСХ и трансметилирование
Известные объемы общих экстрактов листьев, такие как, например, 30 мкл, загрузили на ТСХ пластину из силикагеля 60 (1×20 см) (Merck KGaA. Германия). Нейтральные липиды отделили с помощью ТСХ в уравновешенной проявляющей камере, содержащей систему растворителей гексан/DEE/уксусная кислота (70/30/1, об./об./об.). Полосы TAG визуализировали по парам йода, соскребли с ТСХ пластины, перенесли в 2 мл ГХ пробирки и высушили с помощью N2. В каждую пробирку добавили 750 мкл 1 н, метанольного раствора HCl (Supelco analytical. США) вместе с известным количеством С17:0 TAG, таким как, например, 30 мкг, в качестве внутреннего стандарта для количественной оценки.
При анализе влияния на концентрации олеиновой кислоты определенной комбинации генов, с ТСХ пластин собрали полосы TAG и полярных липидов. Затем к образцам, таким как образцы TAG, образцы полярных липидов и 20 мкл экстракты общих липидов, добавили 15 мкг внутреннего стандарта С17:0. После высушивания под N2, добавили 70 мкл толуола и 700 мкл метанольного раствора HCl.
Образцы липидов для анализа состава жирных кислот с помощью ГХ трансметилировали инкубированием смесей при 80°С в течение 2 часов в присутствии метанольного раствора HCl. После охлаждения образцов до комнатной температуры, реакцию остановили добавлением 350 мкл H2O. Жирные ацильные метиловые эфиры (FAME) экстрагировали из смеси добавлением 350 мкл гексана, перемешиванием на вортексе и центрифугированием при 1700 об./мин, в течение 5 минут. Верхнюю гексановую фазу собрали и перенесли в ГХ пробирки с 300 мкл коническими вставками. После выпаривания образцы повторно суспендировали в 30 мкл гексана. Один мкл впрыснули в ГХ.
Количество отдельных и общих жирных кислот (TFA), содержащихся в липидных фракциях, количественно определили по ГХ путем определения площади под каждым пиком и рассчитали сравнением с площадью пика известного количества внутреннего стандарта. Содержание TAG в листьях рассчитали как сумму глицерина и жирных ацильных фрагментов в TAG фракции, используя отношение: масс. % TAG=100х ((41х общее количество моль FAME/3)+(общее количество г FAME - (15х общее количество моль FAME)))/г сухого веса листьев, где 41 и 15 представляют собой молекулярные веса глицеринового фрагмента и метильной группы, соответственно.
Капиллярная газожидкостная хроматография (ГХ)
FAME анализировали с помощью ГХ, используя газовый хроматограф Agilent Technologies 7890A (Palo Alto. Калифорния. США), оснащенный колонкой SGE BPX70 (70% цианопропил-полисилфенилен-силоксан) (30 м х вн, диам, 0,25 мм, толщина пленки 0,25 мкм), плазменно-ионизационным детектором (FID), инжектором для ввода проб с делением/без деления потока и автоматическим пробоотборником, и инжектором Agilent Technologies серии 7693. В качестве газа-носителя использовали гелий. Образцы впрыскивали в режиме с делением потока (соотношение 50:1) при температуре печи 150°С. После впрыскивания температуру печи выдерживали при 150°С в течение 1 минут, затем повышали до 210°С при 3°С, мин-1 и, наконец, до 240° при 50°С, мин-1. Пики количественно определили с помощью программы Agilent Technologies ChemStation (вер. В,04,03 (16), Palo Alto. Калифорния. США) на основании ответа от известного количества внешнего стандарта GLC-411 (Nucheck) и внутреннего стандарта С17:0-Me.
Количественное определение TAG с помощью Iatroscan
Один мкл экстракта липидов загрузили на стержень Chromarod-SII для ТСХ-FID IatroscanTM (Mitsubishi Chemical Medience Corporation - Япония). Держатель Chromarod затем перенесли в уравновешенную проявляющую камеру, содержащую 70 мл системы растворителей из гексана/CHCl3/2-пропанола/муравьиной кислоты (85/10,716/0,567/0,0567, об./об./об./об.). Через 30 минут инкубирования держатель Chromarod высушили в течение 3 минут при 100°С и сразу сканировали на ТСХ-FID анализаторе Iatroscan MK-6s (Mitsubishi Chemical Medience Corporation - Япония). Площади пиков для внутреннего стандарта DAGE и TAG интегрировали с помощью программы интегрирования SIC-480II (версия: 7,0-E SIC Systems instruments Co., LTD - Япония).
Количественное определение TAG выполнили за две стадии. Сначала сканировали DAGE во всех образцах для поправки выхода экстракции, после чего выбрали концентрированные образцы TAG и разбавили их. Затем выполнили количественное определение TAG в разбавленных образцах с помощью второго сканирования в соответствии со внешней калибровкой, используя глицерил-триленолеат в качестве внешнего стандарта (Sigma-Aldrich).
Количественное определение TAG в образцах листьев с помощью ГХ
Площадь пика отдельных FAME сначала скорректировали на основании ответов площадей пиков известных количеств тех же FAME, содержащихся в промышленном стандарте GLC-411 (NU-CHECK PREP, Inc., США). Поправленные площади использовали для расчета массы каждого FAME в образце путем сравнения с внутренним стандартом. Поскольку масло хранится преимущественно в форме TAG, то количество масла рассчитали по количеству FAME в каждом образце. Общее количество моль глицерина определили расчетом количества моль FAME и делением общего количества молей FAME на три. Количество TAG рассчитали как сумму глицерина и жирных ацильных фрагментов, используя формулу: масс. % масла=100х (41х общее количество моль FAME/3)+(общее количество г FAME - (15х общее количество моль FAME)))/г сухого веса листьев, где 41 и 15 представляют собой молекулярные веса глицеринового фрагмента и метильной группы, соответственно.
Анализ DGAT в H1246 Saccharomyces cerevisiae
Штамм Saccharomyces cerevisiae H1246 совершенно лишен активности DGAT и не содержит TAG и стерольных эфиров из-за нокаутных мутаций в четырех гена (DGA1, LRO1, ARE1, ARE2). Добавление свободной жирной кислоты (например, 1 мМ 18:1Δ9) к среде для выращивания H1246 является токсичным в отсутствие активности DGAT. Следовательно, выращивание на такой среде может быть использовано как индикатор или способ селекции на наличие активности DGAT в этом штамме дрожжей.
H1246 S. cerevisiae трансформировали конструктом pYES2 (отрицательный контроль), конструктом, кодирующим DGAT1 Arabidopsis thaliana в pYES2, или конструктом, кодирующим MGAT2 Mus musculus в pYES2. Трансформанты питали свободными жирными кислотами [14С]18:1Δ9.
В отдельном эксперименте H1246 S. cerevisiae трансформировали конструктом pYES2 (отрицательный контроль), конструктом, кодирующим DGAT1 Bernadia pulchella в pYES2, или конструктом, кодирующим MGAT1 M. musculus в pYES2, и питали свободными жирными кислотами 18:1Δ9. Штамм S288C S. cerevisiae дикого типа, трансформированный с помощью pYES2, использовали в качестве положительного контроля.
Трансформанты дрожжей повторно суспендировали в стерильной mQ воде и разбавили до оптической плотности ОП600=1. Образцы затем разбавили в четырех последовательных разбавлениях, каждое при 1/10, 2 мкл каждого разбавления нанесли на каждый из планшетов (YNBD, YNBG, YNBG+FA) вместе с 2 мкл mQ воды и 2 мкл нетрансформированной клеточной суспензии H1246 (ОП600=1). Планшеты инкубировали в течение 6 дней при 30°С, затем выполнили оценку роста.
Среда планшета, 40 мл среды на планшет
• YNBD: минимальная среда Dropout, не содержащая урацила и содержащая 2% глюкозы, 0,01% NP40 и 100 мкл этанола.
• YNBG: минимальная среда Dropout, не содержащая урацила и содержащая 2% галактозы, 1% раффинозы, 0,01% NP40 и 100 мкл этанола.
• YNBG+FA: минимальная среда Dropout, не содержащая урацила и содержащая 2% галактозы, 1% раффинозы, 0,01% NP40 и 1 мМ 18:1Δ9, растворенной в 100 мкл этанола.
Пример 2. Конститутивная экспрессия моноацилглицерил-ацилтрансферазы в клетках растений
MGAT1
Ферментную активность моноацилглицерин-ацилтрансферазы 1 (MGAT1), кодируемой геном из M. musculus (Yen et al., 2002), и диацилглицерин-ацилтрансферазы (DGAT1) (Bouvier-Nave et al., 2000), использованной в настоящем документе в качестве сравнения с MGAT1, показали на ткани листьев N. benthamiana, используя систему временной экспрессии, описанную в Примере 1.
Вектор, обозначенный 35S-pORE04, получили вставкой фрагмента Pst1, содержащего промотор 35S, в сайт SfoI вектора pORE04 после обработки Т4-ДНК полимеразы для затупления концов (Coutu et al., 2007). Химерную ДНК, кодирующую MGAT1 M. musculus, кодон-оптимизированную для Brassica napus, синтезировали в компании Geneart и обозначили как 0954364_MGAT_pMA. Химерную ДНК, обозначенную 35S:MGAT1 и кодирующую MGAT1 M. Musculus (код доступа Genbank № Q91ZV4) для экспрессии в клетках растений, получили вставкой целой кодирующей области 0954364_MGAT_pMA, содержащейся во фрагменте EcoRI, в 35S-pORE04 в сайте EcoRI. Вектор, содержащий конструкт 35S:MGAT1, обозначили как pJP3184. Точно так же, химерную ДНК 35S:DGAT1, кодирующую DGAT1 A. Thaliana (код доступа Genbank № AAF19262) для экспрессии в клетках растений, получили вставкой целой кодирующей области pXP513E, содержащейся во фрагменте BamHI-EcoRV, в 35S-pORE04 в сайте BamHI-EcoRV. Вектор, содержащий конструкт 35S:DGAT1, обозначили pIP2078.
Химерные векторы внедрили в штамм AGL1 A. tumefaciens, а клетками из их культур пропитывали ткань листьев растений N. benthamiana в среде для роста при 24°С. Для обеспечения возможности прямого сравнения между образцами и для уменьшения колебаний внутри листьев, образцы, подлежащие сравнению, пропитывали с любой стороны одного листа. Эксперименты выполняли в тех экземплярах. После пропитывания растения выращивали еще три дня, затем брали диски листьев, высушивали замораживанием, а липиды, экстрагированные из образцов, фракционировали и количественно оценивали так, как описано в Примере 1. Этот анализ выявил, что гены MGAT1 и DGAT1 функционировали для увеличения концентраций масла в листьях N. benthamiana следующим образом.
Ткань листьев, трансформированная только конструктом 35S:p19 (отрицательный контроль), содержала в среднем 4 мкг свободных жирных кислот (FFA), полученных из DAG/мг сухого веса листьев, и 5 мкг FFA, полученных из TAG/мг сухого веса листьев. Ткань листьев, трансформированная конструктами 35S:p19 и 35S:DGAT1 (контроль для экспрессии DGAT1), содержала в среднем 4 мкг FFA, полученных из DAG/мг сухого веса листьев, и 22 мкг FFA, полученных из TAG/мг сухого веса листьев. Ткань листьев, трансформированная конструктами 35S:p19 и 35S:MGAT1, содержала в среднем 8 мкг FFA, полученных из DAG/г сухого веса листьев, и 44 мкг FFA, полученных из TAG/г сухого веса листьев. Ткань листьев, трансформированная конструктами 35S:p19, 35S:DGAT1 и 35S:MGAT1, не содержала более высоких концентраций DAG или TAG, чем концентрации, наблюдаемые в пропитке 35S:p19 и 35S:MGAT1 (Фигура 2). Также было отмечено снижение концентрации сатуратов в семенах после экспрессии MGAT, по сравнению с контрольным p19 или DGAT1 образцом (Таблица 2).
Данные, описанные выше, демонстрируют, что фермент MGAT1 был гораздо более активным, чем фермент DGAT1 для промотирования накопления DAG и TAG в ткани листьев. Экспрессия гена MGAT привела к удвоению накопления TAG и DAG в ткани листьев, по сравнению со случаем экспрессии DGAT1. Этот результат был очень удивительным и неожиданным, с учетом того, что MGAT представляет собой фермент, экспрессируемый в кишечнике мышей, совершенно другой биологической системе, чем листья растений. Это исследование впервые показало эктопическую экспрессию MGAT в клетке растения.
Образцы листьев, пропитанных MGAT1 M. musculus, накапливали в два раза больше DAG и TAG, по сравнению с тканью листьев, пропитанную только DGAT1 A. thaliana. Эффективность выработки TAG была также удивительной и неожиданной, с учетом того, что мышиная MGAT обладает лишь очень слабой активностью в качестве DGAT. Ткань листьев, пропитанная генами, кодирующими MGAT1 и DGAT1, не накапливали существенно больших количеств TAG, чем образец листьев только с MGAT1. Фигура 1 представляет собой иллюстрацию различных путей накопления TAG, большинство из которых сходятся у DAG, центральной молекуле в синтезе липидов. Например, MAG, DAG и TAG могут взаимопревращаться за счет различной ферментной активности, включая транс-ацилирование, липазу, MGAT, DGAT и PDAT. Снижение концентрации сатуратов также было отмечено после экспрессии MGAT.
MGAT2
Химерную ДНК, обозначенную 35S:MGAT2 и кодирующую MGAT2 M. musculus для экспрессии в клетках растений, получили вставкой целой MGAT2 кодирующей области, содержащейся во фрагменте EcoRI, в 35S-pORE04 в сайте EcoRI. Ферментная активность моноацилглицерин-ацилтрансферазы 2 (MGAT2), кодируемой геном из M. musculus (Yen, 2003) (код доступа Genbank Q80W94) и DGAT1 A. thaliana (Bouvier-Nave et al., 2000), в настоящем документе использованная для сравнения с MGAT2, была также продемонстрирована в ткани листьев N. benthamiana, с использованием временной системы экспрессии, описанной в Примере 1.
По сравнению с контрольными образцами, экспрессия DGAT1 привела к увеличению TAG в листьях в 5,9 раза, MGAT2 - в 7,3 раза, и комбинации MGAT2+DGAT1 - в 9,8 раза (Фигура 3). Способность MGAT2 самостоятельно обеспечивать такое существенное увеличение TAG была неожиданной по многим причинам. Во-первых, количество субстрата MAG, содержащегося в ткани листьев, как известно, является низким, и нельзя ожидать большого увеличения накопления TAG из этого субстрата. Во-вторых, можно ожидать, что активность только MGAT (то есть добавление MGAT2, которая не обладает активностью DGAT) приведет к DAG, а не TAG, особенно в среде листьев, в которых обычно наблюдается небольшая нативная активность DGAT.
Обсуждение
Авторы настоящего изобретения неожиданно показали, что трансгенная экспрессия гена MGAT приводит к существенному увеличению выхода липидов в клетках растений. Авторы настоящего изобретения пришли к выводу, что ученые Tumaney et al., выделили DGAT с некоторой активностью MGAT, и что их попытки клонировать ген, кодирующий MGAT, описанный в настоящем документе, не увенчались успехом. Ученые Tumaney et al. (2001) описали активность MGAT в арахисе и выделили фермент, отвечающий за ее активность. Однако Tumaney et al. не опубликовали результаты испытаний активности DGAT и поэтому можно предположить, что описанный фермент представлял собой DGAT с некоторой активностью MGAT. Действительно, в предыдущей работе была сделана неудачная попытка идентифицировать какую-либо активность MGAT в других видах (Stobart et al., 1997). Более того, удивительно, что фермент, выделенный Tumaney et al., был растворимым, цитозольным ферментом, а не мембраносвязанным ферментом.
Недавно исследователи идентифицировали микросомальную мембраносвязанную моноацилглицерин-ацилтрансферазу (MGAT) из семян незрелого арахиса (Arachis hypogaea). Эта MGAT может быть солюбилизирована из микросомальных мембран с использованием комбинации хаотропного агента и цвиттер-ионного детергента, и был выделен и описан функционально активный мультипротеиновый комплекс 14S. Олеозин 3 (OLE3) идентифицировали как часть этого мультипротеинового комплекса, который способен выполнять бифункциональную активность, такую как ацилирование моноацилглицерина (MAG) в диацилглицерин (DAG) и фосфолипазу А2 (PLA2; Parthibane et al., 2012).
Пример 3. Биологическая демонстрация активности трансгенной MGAT в экстрактах листьев
Клеточные лизаты получили из ткани листьев N. benthamiana, пропитанных 35S:MGAT1, 35S:MGAT2 и 35S:DGAT1, как описано в Примере 1. Выполнили отдельные пропитки листьев, каждую в трех экземплярах, для штаммов, содержащих только конструкт 35S:p19 (отрицательный контроль), штамм 35S:MGAT2 вместе со штаммом 35S:p19, и смесь штаммов 35S:MGAT2 и 35S:DGAT1 Agrobacterium со штаммом 35S:p19. Образцы в трех экземплярах собрали через три дня и очистили полученный клеточный лизат с помощью механического лизиса ткани и центрифугирования. Активность MGAT очищенных клеточных лизатов сравнили с помощью подпитки лизатов [14C]MAG, как описано в Примере 1. Данные представлены на Фигуре 4.
В контрольном образце 35S:p19 наблюдали небольшую активность MGAT, поскольку большая часть радиоактивности сохранялась в MAG в течение всего анализа. Напротив, большая часть меченной MAG в образце 35S:MGAT2 быстро превратилась в DAG (Фигура 4, центральный график), что указывает на сильную активность MGAT, экспрессированной из конструкта 35S:MGAT2. Более того, образовалось также значительное количество TAG. Выработка TAG, наблюдаемая в образце 35S:MGAT2, вероятно была обусловлена нативной активностью DGAT N. benthamiana, или они были образованы по другому пути синтеза TAG. Количество выработки TAG было значительно повышено при дополнительном добавлении 35S:DGAT1 (Фигура 4, правый график), что указывает на то, что фермент MGAT2 вырабатывал DAG, доступный для превращения в TAG с помощью DGAT1 в вегетирующих тканях растения.
Пример 4. Биохимическая демонстрация выработки MGAT-доступных MAG в экстрактах листьев
В in vitro анализах, описанных в Примере 3 с использованием лизатов листьев, субстраты (sn-2 MAG и олеоил-CoA) подавали экзогенно, тогда как для in vivo активности MGAT в неповрежденных тканях растения может быть необходимо естественное наличие этих субстратов. Наличие низких концентраций MAG в различных тканях растений было описано ранее (Hirayama and Hujii, 1965; Panekina et al., 1978; Lakshminarayana et al., 1984; Perry & Harwood, 1993). Для проверки того, может ли MGAT2 иметь доступ к MAG, полученной естественным путем в организме растения, описанный выше эксперимент повторили, на этот раз подпитывая лизаты с помощью [14C]G-3-P. Полученные данные схематически изображены на Фигуре 5.
Выработку меченых MAG наблюдали во всех образцах, что указывает на de novo выработку MAG из G-3-P в лизатах листьев растений. Меченые продукты DAG и TAG также наблюдали во всех образцах, хотя их было относительно мало в контрольном образце 35S:p19, что указывает на то, что выработка этих нейтральных липидов по эндогенному пути Кеннеди была в этом образце относительно низкой. Напротив, большая часть меток в образцах MGAT2 и MGAT2+DGAT1 имела место в пулах DAG и TAG, что указывает на то, что экзогенно добавленная MGAT катализирует превращение MAG, выработанных из меченого G-3-P естественным путем в организме растения.
Примеры 2-4 демонстрируют несколько ключевых пунктов: 1) ткань листьев может синтезировать MAG из G-3-P, так что эти MAG доступны для экзогенной MGAT, экспрессируемой в ткани листьев; 2) даже MGAT, полученная из кишечника млекопитающих, может действовать в тканях растения, для которых неизвестно, что они обладают эндогенной MGAT, для чего необходимо успешное взаимодействие с другими факторами растения, участвующими в синтезе липидов; 3) DAG, выработанные за счет активности экзогенной MGAT, доступны для DGAT растения или для экзогенного DGAT для выработки TAG; и 4) экспрессия экзогенной MGAT может обеспечивать значительно более высокие концентрации TAG в тканях растения, такие концентрации, которые по меньшей мере настолько же велики, как и концентрации, достигаемы за счет экспрессии экзогенной DGAT1 A. thaliana.
Пример 5. Экспрессия DGAT1, MGAT1 и MGAT2 в дрожжах
Химерные дрожжевые векторы экспрессии создали путем вставки генов, кодирующих DGAT1 A. thaliana, MGAT1 M. musculus и MGAT2 M. musculus, в вектор pYES2 с получением pYES2:DGAT1, pYES2:MGAT1 и pYES2:MGAT2. Эти конструкты трансформировали в штамм H1246 Saccharomyces cerevisiae, который совершенно не обладает активностью DGAT и не содержит TAG и стерольных эфиров из-за нокаутных мутаций в четырех генах (DGA1, LRO1, ARE1, ARE2). Штамм дрожжей H1246 может синтезировать DAG из экзогенно добавленных жирных кислот, но не может превращать DAG в TAG из-за нокаутных мутаций. Трансформированные дрожжевые культуры подпитывали [14C]18:1Δ9, затем экстрагировали общие липиды и фракционировали с помощью ТСХ, как описано в Примере 1. Авторадиограмма иллюстративной ТСХ пластины представлена на Фигуре 6.
Образование TAG, указывающее на наличие активности DGAT, наблюдали для дрожжевых клеток, содержащих DGAT1 (положительный контроль) и MGAT1 млекопитающих, но не в клетках, содержащих MGAT2, кодируемую нативной кодирующей областью M. musculus. Сделали вывод, что MGAT1 из мышей также обладает активностью DGAT в дрожжевых клетках, и поэтому она функционирует как фермент двойного действия MGAT/DGAT, тогда как MGAT2 не обладает обнаруживаемой активностью DGAT и, следовательно, представляет собой только MGAT. Конструкт, который содержал кодирующую область MGAT2, которая представляла собой кодон-оптимизацию для экспрессии в дрожжах, демонстрировал активность MGAT (выработка DAG), при испытании in vitro с использованием дрожжевых микросом и меченого MAG субстрата, тогда как такой же конструкт, который был кодон-оптимизирован для экспрессии в B. napus, не продемонстрировал выработку DAG в дрожжевых микросомах. Этот эксперимент показал преимущество кодон-оптимизации для организма, в котором должны быть экспрессированы гетерологичные кодирующие области.
Пример 6. Экспрессия моноацилглицерин-ацилтрансферазы в растениях, семенах и грибах
Экспрессия MGAT1 в семенах Arabidopsis thaliana
Ген, кодирующий MGAT1 M. musculus, и управляемый специфичным для семян промотором (FP1, процессированный промотор напина Brassica napus), использовали для создания устойчиво трансформированных растений A. thaliana и семян-потомков. Вектор, обозначенный pJP374, получили вставкой фрагмента SalI, содержащего сайт EcoRI, фланкированный промотором FP1, и сигнал полиаденилирования лектина Glycine max в сайт SalI-XhoI вектора pCW141. Вектор pCW141 содержал также FP1-управляемый, интрон-прерванный, секретируемый семенами GFP в качестве отборочного маркерного гена. Химерный ген, обозначенный FP:MGAT1-GFP, получили вставкой целой кодирующей области конструкта 0954364_MGAT_pMA, содержащейся во фрагменте EcoRI, в pJP3174 в сайте EcoRI, получив pJP3179. Этот химерный вектор внедрили в штамм AGL1 A. tumefaciens, а клетки из культуры трансформированных Agrobacterium использовали для обработки растений A. thaliana (экотип Колумбия), используя способ погружения цветка для трансформации (Clough and Bent, 1998). После созревания семена из обработанных растений рассмотрели под препаровальной лупой Leica MZFLIII и ртутной лампой EBQ 100. Выделили пятнадцать трансгенных семян (сильно GFP-положительных) и пятнадцать не трансгенных (GFP-отрицательных) семян, и объединили каждую группу, GFP-положительный и GFP-отрицательный пулы анализировали на общее содержание жирных кислот, как описано в Примере 1. В результате анализа получили среднее содержание жирных кислот и состав семян, трансформированных конструктом MGAT, но в популяции, которая могла содержать как гемизиготные, так и гомозиготные трансформированные семена.
Этот анализ показал, что ген MGAT1 функционировал для увеличения содержания масла в семенах A. thaliana в пятнадцати не трансгенных семенах (контроль, то же, что и дикого типа), содержащих в среднем 69,4 мкг общих жирных кислот, тогда как пятнадцать трансгенных семян, трансформированных геном GFP, и, следовательно, вероятно содержащих генетический конструкт FP1:MGAT1, содержали в среднем 71,9 мкг общих жирных кислот. Это составило 3,5% увеличение содержания масла относительно контрольного образца (дикого типа). Этот анализ показал также, что ген MGAT функционировал для обогащения семян полиненасыщенными жирными кислотами, как можно видеть по составу жирных кислот в общих экстрагированных липидах, полученных из семян. В частности, количество содержащейся ALA в процентах от общих жирных кислот, экстрагированных из семян, увеличилось с 16,0 до 19,6%. Точно так же, процентное содержание жирной кислоты 20:2n6 увеличилось с 1,25% до 1,90%, а жирной кислоты 20:3n3 увеличилось с 0,26% до 0,51% (Таблица 2).
Таблица 2. Влияние экспрессии MGAT на состав жирных кислот семян
Выполнили дополнительный эксперимент, в котором химерную ДНК FP1:MGAT1-GFP модифицировали для удаления гена GFP. Этот генетический конструкт, обозначенный FP1:MGAT1, трансформировали в линию A. thaliana, которая была мутантом для FAD2. Общее содержание жирных кислот в семенах T2 из устойчивых к антибиотикам растений T1, а также в родительских линиях, выращенных вместе с этими растениями, определили в соответствии с Примером 1. Данные представлены в Таблице 3. Среднее содержание общих жирных кислот в семенах из контрольных линий составило 347,9 мкг/100 семян, тогда как среднее значение для трансгенных семян составило 381,0 мкг/100 семян. После исключения данных для контрольной линии С6 для определения среднего значения, среднее значение для контрольных образцов составило 370 мкг/100 семян. Содержание масла в трансгенных семенах показало увеличение примерно на 3% в относительном выражении, по сравнению с содержанием масла в не трансформированных семенах.
Таблица 3. Профили жирных кислот в трансгенных FP1:MGAT1 T2 и родительских контрольных семенах Arabidopsis thaliana и количественная оценка общих жирных кислот
Кодирующую область мышиного гена MGAT2, кодон-оптимизированного для экспрессии в клетках растений, использовали вместо кодирующей области MGAT1 в упомянутых выше конструктах и внедрили в Arabidopsis. Вырастили тридцать растений каждой трансгенной линии (растения Т1 и Т2, давшие начало семенам поколения Т2 и Т3) в теплице при распределении случайным образом и сравнили с контрольными растениями. Семена из трансгенных растений имели повышенное содержание масла, по сравнению с контрольными семенами (Фигура 7). Среднее процентное содержание TAG в трансгенных семенах Т3 продемонстрировало относительное увеличение примерно на 8%, по сравнению с процентным содержанием TAG в не трансформированных семенах (Таблица 4). Наблюдали значительное увеличение концентрации полиненасыщенных жирных кислот в TAG трансгенных семян, в частности, ALA, и снижение концентрации насыщенных жирных кислот, таких как пальмитиновая и стеариновая кислоты. Более того, увеличенные концентрации TAG и измененный состав жирных кислот был более выраженным в Т3 поколении, чем в семенах Т2, предположительно из-за гомозиготного состояния трансгена в семенах Т3.
Таблица 4. Концентрации TAG и состав жирных кислот в TAG, экстрагированных из семян Т2 и Т3 Arabidopsis thaliana, экспрессирующих MGAT2, по сравнению с не трансформированными контрольными семенами
Экспрессия MGAT1 в семенах Brassica napus
Вектор FP1:MGAT1, использованный для экспрессии MGAT1 M. musculus в семенах Arabidopsis thaliana, использовали для создания трансформированных растений B. napus. Этот вектор внедрили в штамм A. tumefaciens AGL1 с помощью стандартного приема элетропорации. Культуры выращивали в течение ночи при 28°С в среде Лурия-Бертани при перемешивании при 150 об./мин. Бактериальные клетки собрали центрифугированием при 4000 об./мин в течение 5 минут, промыли средой Винанса AB (Winans, 1988) и повторно суспендировали в 10 мл среды Винанса AB (рН 5,2) и выращивали с канамицином (50 мг/л) и рифампицином (25 мг/л) в течение ночи с добавлением 100 мкМ ацетосирингона. За два часа до инфицирования клеток Brassica добавили спермидин (120 мг/л), а конечную плотность бактерий довели до оптической плотности ОП при 600 нм 0,3-0,4 с помощью свежей среды АВ. Свежевыделенные котиледонарные черешки из 8-дневных проростков B. napus выращивали на 1/2 среде MS (Murashige-Skoog, 1962) или гипокотильные сегменты, предварительно кондиционированые в течение 3-4 дней на среде MS с 1 мг/л тидиазурона (TDZ)+0,1 мг/л альфа-нафталинуксусной кислоты (NAA), инфицировали с помощью 10 мл культуры Agrobacterium в течение 5 минут. Эксплантаты (котиледонарные черешки и гипокотиль), инфицированные Agrobacterium, затем нанесли на стерильную фильтровальную бумагу для удаления избытка Agrobacterium и перенесли в среду для совместного выращивания (среда MS с 1 мг/л TDZ+0,1 мг/л NAA+100 мкМ ацетосирингона), дополненную или не дополненную различными антиоксидантами (L-цистеина 50 мг/л и аскорбиновой кислоты 15 мг/л). Все планшеты закрыли парафильмом и инкубировали в темноте при 23-24°С в течение 48 часов.
Совместно выращенные эксплантаты (котиледонарные черешки и гипокотиль) затем промыли стерильной дистиллированной водой+500 мг/л цефотаксима+50 мг/л тиментина в течение 10 минут, промыли в стерильной дистиллированной воде в течение 10 минут, насухо промокнули стерильной фильтровальной бумагой, перенесли в среду для предварительной селекции (MS+1 мг/л TDZ+0,1 мг/л NAA+20 мг/л аденина сульфата (ADS)+1,5 мг/л AgNO3+250 мг/л цефотаксима и 50 мг/л тиментина) и выращивали в течение пяти дней при 24°С с фотопериодом 16 часов/8 часов. Затем их перенесли в среду для селекции (MS+1 мг/л TDZ+0,1 мг/л NAA+20 мг/л ADS+1,5 мг/л AgNO3+250 мг/л цефотаксима и 50 мг/л тиментина) с 1,5 мг/л глуфосината аммония и выращивали в течение 4 недель при 24°С с фотопериодом 16 часов/8 часов, выполняя пересеивание два раза в неделю на той же среде. Эксплантаты с зеленым каллюсом перенесли в среду для инициации побегов (MS+1 мг/л кинетина+20 мг/л ADS+1,5 мг/л AgNO3+250 мг/л цефотаксима+50 мг/л тиментина+1,5 мг/л глуфосината аммония) и выращивали еще 2-3 недели. Побеги, возникшие из устойчивых эксплантатов, перенесли в среду для удлинения побегов (среда MS с 0,1 мг/л гибберелловой кислоты+20 мг/л ADS+1,5 мг/л AgNO3+250 мг/л цефтоксима+1,5 мг/л глуфосината аммония) и выращивали еще две недели. Выбрали здоровые побеги длиной 2-3 см и перенесли в среду для выращивания корней (1/2 MS с 1 мг/л NAA+20 мг/л ADS+1,5 мг/л AgNO3+250 мг/л цефотаксима) и выращивали в течение 2-3 недель. Хорошо сформированные побеги с корнями перенесли в горшки (смесь для выращивания сеянцев) и выращивали в шкафу для выращивания в течение двух недель, а затем перенесли в теплицу. Подтвердили, что шестнадцать отдельных трансформантов сорта Оскар являются трансгенными для конструкта FP1:MGAT1, и они нормально росли в условиях теплицы. Рост растений был нормальным, и растения были способны к размножению, цветению и появлению семян. Растения выращивали до зрелости, а семена, полученные из трансформированных растений, собрали. Семена из некоторых трансформированных растений анализировали на содержание масла в семенах и на состав жирных кислот. Данные этих предварительных анализов показали вариабельность содержания масла и состава жирных кислот, вероятно из-за выращивания растений в разное время и при разных условиях окружающей среды. Для снижения вариабельности получили растения Т1, которые экспрессируют MGAT1, и их выращивали при тех же условиях, что и контрольные (дикого типа, сорт Оскар) растения того же генотипа, и сравнили содержание масла.
Экспрессия MGAT1 в семенах Gossypium hirsutum
Тот же специфичный к семенам химерный ген, который использовали для экспрессии MGAT1 M. musculus в семенах Arabidopsis thaliana, использовали для создания трансформированных растений Gossypium hirsutum. Вектор, обозначенный FP1:MGAT1, внедрили в штамм AGL1 A. tumefaciens с помощью стандартной методики электропорации, а клетки из культуры Agrobacterium использовали для внедрения химерных ДНК в клетки Gossypium hirsutum, вариетет Coker315. Котиледоны, вырезанные из 10-дневных проростков хлопка, использовали в качестве эксплантатов и инфицировали и совместно выращивали с A. tumefaciens в течение периода двух дней. После этого выполнили шестинедельную селекцию на среде MS (Marashige and Skoog, 1962), содержащей 0,1 мг/л 2,4-D, 0,1 мг/л кинетина, 50 мг/л канамицина сульфата и 25 мг/л цефотаксина. Здоровые каллюсы, полученные из котиледоновых эксплантатов, перенесли в среду MS, содержащую 5 мг/л 6-(γ,γ-диетилаллиламино)-пурин (2ip), 0,1 мг/л нафталинуксусной кислоты (NAA), 25 мг/л канамицина и 250 мг/л цефотаксима, в течение второго периода в шесть недель при 28°С. Соматические зародыши, которые сформировались примерно через шесть-десять недель выращивания, прорастили и выдерживали на той же среде, но без добавления фитогормона или антибиотиков. Проростки, выросшие из соматических зародышей, перенесли в почву и выдерживали в теплице как только появились листья и корни, при температуре выращивания 28°С/20°С (день/ночь). В теплице выросли десять независимых первичных трансгенных растений (Т0), содержащих конструкт FP1-MGAT1, зацвели и дали коробочки, содержащие семена. Семена собрали при созревании. Для улучшения достоверности анализа содержания масла из каждого из 10 первичных трансгенных растений вырастили 5 растений, а зрелые семена Т2 подвергли анализу на содержание масла. Специфичная к семенам экспрессия MGAT1 увеличивает содержание масла и повышает процентное содержание полиненасыщенных жирных кислот в масле семян хлопка.
Экспрессия генов MGAT1 и MGAT2 в растениях N. benthamiana после устойчивой трансформации
N. benthamiana устойчиво трансформировали конструктом 35S:MGAT1, описанным в Примере 2, 35S:MGAT1 внедрили в штамм AGL1 A. tumefaciens с помощью стандартного приема электропорации. Трансформированные клетки выращивали на среде Лурия-Бертани (LB) с добавлением канамицина (50 мг/л) и рифампицина (25 мг/л) и выращивали при 28°С в течение двух дней. Одну колонию использовали для инициации свежей культуры. Через 48 часов энергичного выращивания клетки собрали центрифугированием при 2000х g и удалили надосадочную жидкость. Клетки повторно суспендировали в свежем растворе, содержащем 50% среды LB и 50% среды MS при плотности ОП600=0,5.
Образцы листьев N. benthamiana, выращенные in vitro, отрезали и разрезали на квадратные сегменты размером около 0,5-1 см2 с помощью острого скальпеля, при этом листья были погружены в раствор A. tumefaciens. Разрезанные части листьев N. benthamiana, погруженные в A. tumefaciens, оставили стоять при комнатной температуре в течение 10 минут, затем насухо промокнули стерильной фильтровальной бумагой и перенесли на планшеты MS без добавок. После периода совместного выращивания в течение двух дней при 24°С, эксплантаты три раза промыли стерильной жидкой средой MS, затем насухо промокнули стерильной фильтровальной бумагой и поместили на селективный MS агар с добавлением 1,0 мг/л бензиламинопурина (BAP), 0,25 мг/л индолуксусной кислоты (IAA), 50 мг/л канамицина и 250 мг/л цефотаксима. Планшеты инкубировали при 24°С в течение двух недель, чтобы обеспечить возможность развития побегов из трансформированных частей листьев N. benthamiana.
Для формирования укоренившихся трансгенных растений in vitro, здоровые зеленые побеги отрезали и перенесли в 200 мл горшки для тканевых культур, содержащие MS агаровую среду с добавлением 25 мкг/л IAA, 50 мг/л канамицина и 250 мг/л цефотаксима. Из трансгенных побегов получили достаточно крупные диски листьев и высушили их замораживанием для фракционирования TAG и количественного анализа, описанного в Примере 1 (Таблице 5). Наилучшее растение 35S:MGAT1 N. benthamiana имело содержание TAG 204,85 мкг/100 мг сухого веса ткани листьев, по сравнению со средним содержанием TAG 85,02 мкг/100 мг сухого веса ткани листьев в контрольных линиях, что демонстрирует увеличение содержания TAG на 241%.
N. benthamiana также устойчиво трансформировали конструктом 35S:MGAT2, описанным в Примере 2, и контрольным бинарным вектором pORE4 (Таблица 6). Наилучшее растение 35S:MGAT2 N. benthamiana имело содержание TAG 79,0 мкг/100 мг сухого веса ткани листьев, по сравнению с содержанием TAG 9,5 мкг/100 мг сухого веса листьев в контрольной линии на той же стадии развития, что демонстрирует увеличение содержания TAG на 731%. Изменился также профиль жирных кислот для TAG фракций со значительно сниженными концентрациями насыщенных жирных кислот 16:0 и 18:0 и повышенными концентрациями полиненасыщенных жирных кислот, в частности 18:3ω3 (ALA) (Таблица 6). Профиль жирных кислот полярных липидов из тех же образцов листьев существенно не изменился, что указывает на то, что изменение состава жирных кислот в неполярных липидах действительно имело место. Контрольные растения в этом эксперименте были более мелкими и физиологически другими, чем в предыдущем эксперименте с конструктом 35S:MGAT1, и это может объяснять различное содержание масла в контрольных растениях от одного эксперимента к другому. Эксперименты для прямого сравнения конструктов 35S:MGAT1 и 35S:MGAT2 с контрольными растениями выполняют с использованием растений одинакового размера и физиологии.
Новый набор конститутивных бинарных факторов экспрессии получили с помощью промотора 35S с удвоенной энхансерной областью (e35S), 35S:MGAT1#2 (pJP3346), 35S:MGAT2#2 (pJP3347) b 35S:DGAT1#2 (pJP3352) получили первоначальным клонированием промотора e35S, содержащегося в фрагменте BamHI-EcoRI, в pORE04 в сайтах BamHI-EcoRI, с получением pJP3343. Затем получили pJP3346 и pJP3347 клонированием генов MGAT1 и MGAT2, соответственно, в сайт EcoRI pJP3343, pJP3352 получили клонированием DGAT1 A. thaliana, содержащейся в сайте XhoI-AsiSI, в сайты XhoI-AsiSI pJP3343.
pJP3346, pJP3347 и pJP3352 в штамме Agrobacterium AGL1 использовали для трансформации N. benthamiana, как описано выше. Четырнадцать подтвержденных трансгенных растений использовали для pJP3346 и 22 - для pJP3347. С pJP3352 получили множество устойчивых к канамицину, трансформированных побегов. На растениях, трансформированных MGAT1 или MGAT2, выполнили анализ экспрессии трансгенов. Выбрали растения с высокими степенями экспрессии. Выполнили анализ экспрессии на растениях, трансформированных DGAT1 A. thaliana. Эти растения нормально растут, и их выращивали до зрелости. При созревании собрали семена. Семена из высоко-экспрессирующего потомства высеяли непосредственно в почву для анализа липидов в Т2 сегрегирующей популяции, которая включает как гомозиготные, так и гетерозиготные растения. Содержание масла в листьях растений, экспрессирующих высокие концентрации MGAT1 или MGAT2, существенно увеличилось, по сравнению с растениями, трансформированными DGAT1 A. thaliana, или с контрольными растениями, MGAT2 трансгенные растения продемонстрировали существенное увеличение содержания ненасыщенной жирной кислоты 18:1 и 1% относительное увеличение общего содержания жирных кислот, по сравнению с событиями с нулевой вероятностью (Таблица 7).
pJP3346, pJP3347 и контрольных вектор в AGL1 также использовали для трансформации A. thaliana, как описано выше. Идентифицировали двадцать пять подтвержденных трансгенных Т2 растений, содержащих T-ДНК из pJP3346, и 43 трансгенных растения для pJP3347. На трансгенных растениях выполнили анализ экспрессии. Семена из высоко-экспрессирующего потомства собрали и высеяли непосредственно в почву. Выполнили анализ липидов, включая содержание масла в листьях из потомства Т2 и Т3, в том числе из сегрегантов, не содержащих трансгенов. В растениях, которые являются гомозиготными для MGAT трансгенов, получили высокие концентрации TAG.
Таблица 5. Профиль жирных кислот и количественное содержание TAG в ткани листьев Nicotiana benthamiana, устойчиво трансформированных конструктом 35S:MGAT1. Образцы «M» представляют собой 35S:MGAT1, а образцы «С» представляют собой родительские контрольные растения
1d11
3n3
100 мг сухого веса
Таблица 6. Профиль жирных кислот и количественное определение TAG в ткани листьев Nicotiana benthamiana, устойчиво трансформированных конструктом 35S:MGAT2. Образцы «М» представляют собой 35S:MGAT2, а образцы «С» представляют собой родительские контрольные растения. Из каждого растения взяли два листа и анализировали по отдельности
1d7
1d13t
3n3
1d11
Таблица 7. Общее количество жирных кислот (TFA) и состав жирных кислот в ткани листьев Nicotiana benthamiana, устойчиво трансформированной конструктом 35S:MGAT2
d9
d11
w3
изо
(мкг/100 мкг сухого веса)
Тринадцать растений каждой трансгенной линии вырастили, расположив в случайном порядке в теплице вместе с родительскими контрольными растениями. Семена Т2 анализировали за содержанием масла, и они продемонстрировали примерно 2% увеличение содержания масла (концентрация общих жирных кислот), по сравнению с содержанием общих жирных кислот в родительских семенах (Фигура 8).
Экспрессия MGAT1 в устойчиво трансформированных растениях Trifolium repens
Химерный ген, кодирующий MGAT1 M. musculus, использовали для трансформации Trifolium repens, другого двудольного растения. Векторы, содержащие химерные гены 35S:MGAT1 и 35S:DGAT1, внедрили в A. tumefaciens с помощью стандартного приема электропорации. Оба вектора содержали также селектируемый маркерный ген 35S:BAR. Трансформированные клетки Agrobacterium выращивали на твердой среде LB с добавлением канамицина (50 мг/л) и рифампицина (25 мг/л) и инкубировали при 28°C в течение двух дней. Одну колонию использовали для инициации свежей культуры для каждого конструкта. После 48 часов энергичного выращивания культуры Agrobacterium использовали для обработки котиледонов T. repens (сорт Haifa), которые отрезали от пропитанных семян, как описано в публикации Larkin et al. (1996). После совместного выращивания в течение трех дней эксплантаты подвергли воздействию 5 мг/л PPT для отбора трансформированных побегов, а затем перенесли в среду для формирования корней, затем перенесли в почву. Получили трансформированное растение, содержащее MGAT1. В клетках трансформированных растений конститутивно экспрессируется промотор 35S. Содержание масла увеличивается по меньшей мере в вегетирующих тканях, таких как листья.
Экспрессия MGAT в устойчиво трансформированных Hordeum vulgare
Химерный вектор, содержащий MGAT1 M. musculus, использовали для получения устойчиво трансформированного Hordeum vulgare, однодольного растения. Векторы, содержащие химерные гены Ubi: MGAT1 и Ubi:DGAT1, создали клонированием целых кодирующих областей MGAT1 M. musculus и DGAT1 A. thaliana, отдельно в pWVEC8-Ubi. Векторы, содержащие химерные гены Ubi:MGAT1 и Ubi:DGAT1, внедрили в штамм A. tumefaciens AGL1 с помощью стандартного приема электропорации. Трансформированные клетки Agrobacterium выращивали на твердой среде LB с добавлением канамицина (50 мг/л) и рифампицина (25 мг/л), а планшеты инкубировали при 28°C в течение двух дней. Одну колонию каждого образца использовали для инициации свежих культур.
Через 48 часов энергичного выращивания культуры Agrobacterium использовали для трансформации клеток в незрелых зародышах ячменя (сорт Golden Promise) в соответствии с опубликованными способами (Tingay et al., 1997; Bartlett et al., 2008) с некоторыми модификациями. Вкратце, зародыши длиной от 1,5 до 2,5 мм выделили из незрелых зерновок и удалили зародышевые оси. Полученные эксплантаты совместно выращивали в течение 2-3 дней с трансгенным Agrobacterium, а затем выращивали в темноте в течение 4-6 недель на среде, содержащей тиментин и гигромицин, с получением эмбриогенного каллюса, затем его перенесли на переходную среду в условиях слабого освещения на две недели. Затем каллюс перенесли в регенерационную среду для обеспечения возможности регенерации побегов и корней, затем перенесли в почву. Получили трансформированные растения, которые перенесли в теплицу. Кодирующая область MGAT1 конститутивно экспрессировалась под управлением промотора Ubi в клетках трансформированных растений. Получили трансгенные растения и выполнили анализ их тканей на содержание масла. Из-за низкого количества трансгенных событий, наблюдаемых при первой трансформации, из этих данных не было получено каких-либо статистически значимых выводов.
Кодирующую область мышиного гена MGAT2, кодон-оптимизированного для экспрессии в клетках растений, использовали вместо MGAT1 в конструктах, упомянутых выше, и внедрили в Hordeum, как описано выше. Вегетирующие ткани полученных трансгенных растений имеют повышенное содержание масла.
Экспрессия MGAT в клетках дрожжей
Химерный вектор, содержащий MGAT1 M. musculus, использовали для трансформации дрожжей, в данном примере Saccharomyces cerevisiae, грибкового микроба, подходящего для выработки масла путем ферментации. Генетический конструкт Gal1:MGAT1 получили вставкой целой кодирующей области конструкта, обозначенного 0954364_MGAT_pMA, содержащейся в фрагменте EcoRI, в pYES2 в сайте EcoRI, получив pJP3301. Точно так же, генетический конструкт Gal1:DGAT1, использованный в настоящем документе для сравнения, и отдельно кодирующий фермент DGAT1 A. thaliana получили вставкой целой кодирующей области DGAT1 A. thaliana в pYES2. Эти химерные векторы внедрили в штамм S. cerevisiae S288C с помощью теплового шока, и выполнили отбор трансформантов на планшетах с дрожжевой минимальной средой (YMM), содержащей 2% раффинозы в качестве единственного источника углерода. Культуры клонального инокулята поместили в жидкую YMM с 2% раффинозой в качестве единственного источника углерода. Экспериментальные культуры инокулировали ими в среде YMM. содержащей 1% NP-40, до начальной оптической плотности ОП600 около 0,3. Культуры выращивали при 28°C при встряхивании (около 100 об./мин,) до ОП600 около 1,0. В это время добавили галактозу до конечной концентрации 2% (вес/об.). Культуры выращивали при 25°C при встряхивании в течение еще 48 часов, затем собрали центрифугированием. Клеточный осадок на фильтре промыли водой, затем высушили замораживанием для классового фракционирования липидов и количественного анализа, описанного в Примере 1. Промотор Gal индуцибельно экспрессируется в трансформированных дрожжевых клетках, повышая содержание масла в клетках.
Кодирующую область мышиного гена MGAT2, кодон-оптимизированного для экспрессии в дрожжевых клетках, использовали вместо MGAT1 в конструктах, упомянутых выше, и внедрили в дрожжи. Полученные трансгенные клетки имеют повышенное содержание масла. Эти гены также внедрили в жировые дрожжи, Yarrowia lipolytica, для увеличения содержания масла.
Экспрессия MGAT в клетках водорослей Chlamydomonas reinhardtii
Химерный вектор, содержащий MGAT1 M. musculus, использовали для устойчивой трансформации клеток водорослей. Генетический конструкт, обозначенный 35S:MGAT1, получили клонированием кодирующей области MGAT1 в клонирующий вектор, содержащий кассету промотора вируса мозаики цветной капусты 35S и устойчивый к парамомицину ген (аминогликозид-O-фосфотрансфераза VIII), экспрессируемый промотором RBCS2 C. reinhardtii, 35S:MGAT1 внедрили по отдельности в логарифмическую культуру 5×107cc503, штамм с дефицитом клеточных стенок Chlamydomonas reinhardtii с помощью модифицированного способа стеклянных шариков (Kindle, 1990). Оба вектора содержат также вектор устойчивости BLE в качестве селектируемого маркерного гена. Вкратце, колонию не трансформированных клеток на TAP агаровом планшете, выдержанном при около 24°C, выращивали до около 5×106 клеток/мл в течение четырех дней, полученные клетки центрифугировали при 3000 g в течение 3 минут при комнатной температуре и повторно суспендировали для получения 5×107 клеток в 300 мкл среды TAP. Добавили 300 мкл стеклянных шариков диаметром 0,6 мм, 0,6 мкг плазмиды в 5 мкл и 100 мкл 20% ПЭГ с молекулярным весом 8000 и перемешивали смесь на вортексе с максимальной скоростью в течение 30 секунд, затем перенесли в 10 мл TAP и инкубировали в течение 16 часов при встряхивании в темноте. Клетки центрифугировали, повторно суспендировали в 200 мкл TAP, затем поместили на TAP планшеты, содержащие 5 мг/л зеоцина, и инкубировали в темноте в течение 3 недель. Трансформированные колонии пересеяли в свежий планшет с TAP+5 мг/л зеоцина, после чего они росли в стандартных условиях среды с зеоциновой селекцией. После сбора с помощью центрифугирования, клеточный осадок промыли водой, затем высушили замораживанием для классового фракционирования липидов и количественного анализа, как описано в Примере 1. Промотор 35S:MGAT1 конститутивно экспрессируется в трансформированных водорослевых клетках. Содержание масла в этих клетках существенно увеличилось.
Кодирующую область мышиного гена MGAT2, кодон-оптимизированного для экспрессии в клетках растений, использовали вместо MGAT1 в упомянутом выше конструкте и внедрили в Chlamydomonas. Содержание масла в полученных трансгенных клетках существенно увеличилось.
Экспрессия MGAT в устойчиво трансформированных Lupinus angustifolius
Химерный вектор, содержащий MGAT1 M. musculus, использовали для трансформации Lupinus angustifolius, бобового растения. Химерные векторы 35S:MGAT1 и 35S:DGAT1 в Agrobacterium использовали для трансформации L. angustifolius, как описано в публикации Pigeaire et al. (1997). Вкратце, эксплантаты верхушек побегов выращивали вместе с трансгенным Agrobacterium, затем тщательно смочили раствором PPT (2 мг/мл) и перенесли в среду для регенерации, не содержащую PPT. Многочисленные вспомогательные побеги, развившиеся из верхушек побегов, отрезали на среду, содержащую 20 мг/л PPT, а выжившие побеги перенесли в свежую среду, содержащую 20 мг/л PPT. Затем здоровые побеги перенесли в почву. Промотор 35S конститутивно экспрессируется в клетках трансформированных растений, повышая содержание масла в вегетирующих тканях и семенах. Специфический к семенам промотор использовали для дополнительного увеличения содержания масла в трансгенных семенах Lupinus.
Кодирующую область мышиного гена MGAT2, кодон-оптимизированного для экспрессии в клетках растения, использовали вместо MGAT1 в конструктах, упомянутых выше, и внедрили в Lupinus. Семена и вегетирующие ткани из полученных трансгенных растений имеют повышенное содержание масла.
Экспрессия MGAT в устойчиво трансформированных клетках Sorghum bicolor
Химерный вектор, содержащий MGAT1 M. musculus, использовали для устойчивой трансформации Sorghum bicolor, Ubi: MGAT1 и Ubi:DGAT1 в штамме A. tumefaciens AGL1 использовали для трансформации Sorghum bicolor, как описано в публикации Gurel et al. (2009). Agrobacteriumis сначала центрифугировали при 5000 об./мин, при 4°C в течение 5 минут и разбавили до ОП550=0,4 жидкой средой для совместного выращивания. Предварительно отделенные незрелые зародыши затем полностью покрыли суспензией Agrobacterium на 15 минут, а затем выращивали щитком вверх на среде для совместного выращивания в темноте в течение 2 дней при 24°C. Незрелые зародыши затем перенесли в среду для инициации каллюса (CIM) с 100 мг/л карбенициллина для ингибирования роста Agrobacterium и оставили на 4 недели. Затем ткани перенесли в среду для регенерации для образования побегов и корней. Промотор Ubi конститутивно экспрессируется в клетках трансформированных растений, увеличивая содержание масла по меньшей мере в вегетирующих тканях.
Кодирующую область мышиного гена MGAT2, кодон-оптимизированного для экспрессии в клетках растений, использовали вместо MGAT1 в упомянутых выше конструктах, и внедрили в Sorghum. Вегетирующие ткани из полученных трансгенных растений имеют повышенное содержание масла.
Экспрессия MGAT в устойчиво трансформированных растениях Glycine max
Химерный ген, кодирующий MGAT1 M. musculus, использовали для устойчивой трансформации Glycine max, другого бобового растения, которое может быть использовано для производства масла. 35S:MGAT1 в Agrobacterium использовали для трансформации G. Max, как описано в публикации Zhang et al. (1999), Agrobacterium совместно выращивали в течение трех дней с котиледонарными эксплантатами, полученными из пятидневных проростков. Затем эксплантаты выращивали на среде Gamborg B5 с добавлением 1,67 мг/л BAP и 5,0 мг/л глуфосината в течение четырех недель, после чего эксплантаты пересеяли в среду, содержащую основные и неосновные соли MS и витамины B5 (MS/B5), с добавлением 1,0 мг/л зеатин-рибозида, 0,5 мг/л GA3 и 0,1 мг/л IAA, дополненной 1,7 мг/л или 2,0 мг/л глуфосината. Выросшие побеги укоренили на среде для выращивания корней MS/B5 с добавлением 0,5 мг/л NAA без дополнительной глуфосинатной селекции. Промотор 35S конститутивно экспрессируется в клетках трансформированных растений, повышая содержание масла в вегетирующих тканях и семенах.
Кодирующую область мышиного гена MGAT2, кодон-оптимизированного для экспрессии в клетках растений, использовали вместо MGAT1 в упомянутых выше конструктах, и внедрили в Glycine. Вегетирующие ткани и семена из полученных трансгенных растений имеют повышенное содержание масла.
Экспрессия MGAT в устойчиво трансформированных Zea mays
Химерный ген, кодирующий MGAT1 M. Musculus, использовали для устойчивой трансформации Zea mays. Векторы, содержащие 35S:MGAT1 и 35S:DGAT1, использовали для трансформации Zea mays, как описано в публикации Gould et al. (1991). Вкратце, эксплантаты верхушек побегов выращивали вместе с трансгенным Agrobacterium в течение двух дней, затем перенесли на солевую среду MS, содержащую канамицин и карбенициллин. Через несколько циклов пересеивания самопроизвольно сформировались трансформированные побеги и корни, и их пересадили в грунт. Промотор 35S экспрессируется в клетках трансформированных растений, увеличивая содержание масла в вегетирующих тканях и семенах.
Кодирующую область мышиного гена MGAT2, кодон-оптимизированного для экспрессии в клетках растений, использовали вместо MGAT1 в конструктах, упомянутых выше, и внедрили в Zea mays. Вегетирующие ткани и семена из полученных трансгенных растений имеют повышенное содержание масла. Альтернативно, MGAT кодирующие области экспрессировали под управлением эндосперм-специфичного промотора, такого как зеиновый промотор, или специфичного для зародыша промотора, полученного из однодольного растения, для увеличения экспрессии и повышения содержания масла в семенах. Дополнительный химерный ген, кодирующий GPAT с активностью фосфатазы, такой как GPAT4 или GPAT6 A. thaliana внедрили в Zea mays в комбинации с MGAT, что дополнительно повышает содержание масла в семенах кукурузы.
Экспрессия MGAT в устойчиво трансформированном Elaeis guineensis (пальмовое масло)
Химерный ген, кодирующий MGAT1 M. Musculus, использовали для устойчивой трансформации Elaeis guineensis. Использовали химерные векторы, обозначенные Ubi:MGAT1 и Ubi:DGAT1 в Agrobacterium. Через 48 часов энергичного выращивания клетки использовали для трансформации Elaeis guineensis, как описано в публикации Izawati et al. (2009). Промотор Ubi конститутивно экспрессируется в клетках трансформированных растений, повышая содержание масла по меньшей мере в плодах и семенах, и они могут быть использованы для получения масла.
Кодирующую область мышиного гена MGAT2, кодон-оптимизированного для экспрессии в клетках растений, использовали вместо MGAT1 в конструктах, упомянутых выше, и внедрили в Elaeis. Семена из полученных трансгенных растений имеют повышенное содержание масла.
Экспрессия MGAT в устойчиво трансформированном Avena sativa (овес)
Химерный ген, кодирующий MGAT1 M. Musculus, использовали для устойчивой трансформации Avena sativa, другого однодольного растения. Химерные векторы, обозначенные Ubi:MGAT1 и Ubi:DGAT1, описанные выше и содержащие селектируемый маркер Ubi:BAR, использовали для трансформации Avena sativa, как описано в публикации Zhang et al. (1999).
Кодирующую область мышиного гена MGAT2, кодон-оптимизированного для экспрессии в клетках растений, использовали вместо MGAT1 в конструктах, упомянутых выше, и внедрили в Avena. Семена из полученных трансгенных растений имеют повышенное содержание масла.
Пример 7. Разработка MGAT с активностью DGAT
MGAT с измененной активностью DGAT, особенно с повышенной активностью DGAT и потенциально повышенной активностью MGAT, может быть разработана выполнением случайного мутагенеза, направленного мутагенеза или насыщающего мутагенеза на заданном гене (-ах) MGAT или путем воздействия на различные MGAT и/или DGAT гены ДНК-перестановкой. Функция DGAT может быть положительно исследована, например, с помощью дрожжевого штамма, для которого абсолютно необходима комплементация TAG-синтеза при подпитке свободными жирными кислотами, такого как штамм H1246, который содержит мутации в четырех генах (DGA1, LRO1, ARE1, ARE2). Трансформация MGAT вариантов в таком штамме с последующим обеспечением трансформированных дрожжей такой концентрацией свободных жирных кислот, которая препятствует комплементации за счет гена MGAT дикого типа, обеспечивает рост только вариантов с повышенной способностью к синтезу TAG из-за усиленной активности DGAT. Активность MGAT этих мутированных генов можно определить подпиткой меченым sn-1 или sn-2 MAG и количественным определением выработки меченого DAG. Несколько циклов направленной эволюции в комбинации с рациональным дизайном белка приводят к выработке нового MGAT гена с одинаковой активностью MGAT и DGAT.
Ген, кодирующий ацилтрансферазу MGAT1 M. musculus, подвергли допускающей ошибки ПЦР, используя Taq ДНК полимеразу в присутствии 0,15 мМ MnCl2 для внедрения случайных мутаций. Рандомизированные кодирующие области затем использовали в качестве мегапраймеров для амплификации полного вектора экспрессии дрожжей с помощью высокоточных условий реакции ПЦР. Секвенирование 9099 п.о. выделенной, мутированной ДНК выявило мутационную частоту около 0,8%, что соответствует 8 мутациям на один ген, или, в среднем, 5,3 аминокислотных замещений на полипептид. Полную мутированную библиотеку трансформировали в E. coli DH5α для хранения при -80°C и получения плазмиды. Размер библиотеки MGAT1 оценили в 3,8356E6 клонов. Копию библиотеки MGAT1 трансформировали в дрожжевой штамм H1246, получив библиотеку размером 3E6 клонов. Библиотеку MGAT1, а также отрицательный контроль pYES2, трансформированный в S. cerevisiae H1246, подвергли 8 циклам селекции, каждый из которых состоял из (повторного) разбавления культур в минимальной индукционной среде (1% раффинозы+2% галактозы; разбавление до ОП600=0,35-0,7) в присутствии жирной кислоты C18:1 при конечной концентрации 1 М. Отрицательные контроли состояли из идентичных культур, выращенных одновременно в минимальной среде, содержащей глюкозу (2%), и в отсутствие свободной жирной кислоты C18:1. Через 8 циклов селекции аликвоту выбранной библиотеки MGAT1 поместили на планшет на минимальную среду, содержащую глюкозу (2%). Вырастили в целом 120 колоний в 240 мкл минимальной индукционной среди в 96 микротитровальных планшетах и анализировали на выход нейтральных липидов, с помощью флуоресцентного анализа с красителем Nile Red, описанного в публикации Siloto et al. (2009). Минипрепараты плазмид получили из 113 клонов (= вершина 6%), которые демонстрировали наивысшие концентрации TAG.
Целую кодирующую область MGAT1 из выбранных клонов секвенировали для идентификации количества уникальных мутантов и для идентификации природы выбранных мутаций. Уникальные MGAT1 мутанты повторно трансформировали в H1246 S. cerevisiae для in vitro анализа MGAT и DGAT с помощью меченого MAG и C18:1 субстратов, соответственно (см. Пример 5). Обнаружили, что выбранные варианты MGAT1 демонстрируют повышенную активность DGAT, по сравнению с ацилтрансферазой дикого типа, при этом активность MGAT вероятно также увеличилась.
Варианты MGAT1, демонстрирующие повышенную активность MGAT и/или DGAT, использовали в качестве родителей в реакциях перестановки ДНК. Полученную библиотеку подвергли такой же системе селекции, как описано выше, что привело к дополнительному усилению общей активности ацилтрансферазы. Кроме того, к питательной среде добавляли другие свободные жирные кислоты, отличные от С18:1, для выбора MGAT1 вариантов, демонстрирующих измененные ацил-донорные особенности.
Пример 8. Конститутивная экспрессия диацилглицерин-ацилтрансферазы 2 A. thaliana в растениях
Экспрессия DGAT2 A. thaliana в дрожжах (Weselake et al., 2009) и в клетках насекомых (Lardizabal et al., 2001) не проявляет активности DGAT. Точно так же, DGAT2 не может дополнять DGAT1 нокаут A. thaliana (Weselake et al., 2009). Ферментную активность DGAT2 A. thaliana в тканях листьев определили с помощью временной системы экспрессии N. benthamiana, как описано в Примере 1. DGAT2 A. thaliana (доступ Q9ASU1) получили геномной ПЦР и клонировали в бинарный вектор экспрессии под управлением промотора 35S для образования 35S:DGAT2. Этот химерный вектор внедрили в штамм A. tumefaciens AGL1, а клетками этих из культур пропитали ткань листьев растения N. benthamiana в помещении для выращивания при 24°C, используя 35S:DGAT1 в качестве контроля. Выполнили несколько прямых пропиток этими образцами для сравнения при расположении с любой стороны одного листа. Эксперименты выполнили в трех экземплярах. После инфильтрации растения выращивали еще пять дней, затем диски листьев вынули и высушили замораживанием для классового фракционирования липидов и количественного анализа, описанного в Примере 1. Этот анализ показал, что обе DGAT1 и DGAT2 функционируют для увеличения концентраций масла в листьях Nicotiana benthamiana (Таблица 8).
Ткань листьев, трансформированная конструктом 35S:p19 (отрицательный контроль) содержала в среднем 25 мкг TAG/100 мг сухого веса листьев. Ткань листьев, трансформированная конструктами 35S:p19 и 35S:DGAT1 (положительный контроль) содержала в среднем 241 мкг TAG/100 мг сухого веса листьев. Ткань листьев, трансформированная конструктами 35S:p19 и 35S:DGAT2, содержала в среднем 551 мкг TAG/100 мг сухого веса листьев.
Описанные выше данные демонстрируют, что фермент DGAT2 A. thaliana более активен, чем фермент DGAT1 A. thaliana при промотировании накопления TAG в ткани листьев. Экспрессия гена DGAT2 привела к увеличению накопления TAG в ткани листьев на 229%, по сравнению с количеством TAG в случае сверхэкспрессии DGAT1, которое условно приняли за 100% (Фигура 9).
Использовали также временно трансформированные ткани листьев N. benthamiana, экспрессирующие только P19 (контроль), или P19 с любым из AtDGAT1 или AtDGAT2, для получения микросом для in vitro анализов ферментной активности. Биохимический анализ DGAT выполнили с использованием микросом, соответствующих 50 мкг белка, и добавляя 10 нмоль [14]C6:0-DAG и 5 нмоль ацил-CoA в 50 мМ буфере Hepes, pH 7,2, содержащем 5 мМ MgCl2 и 1% BSA в конечном объеме 100 мкл для каждого анализа. Анализы выполняли при 30°C в течение 30 минут. Экстрагировали общие липиды из каждого образца и загрузили образцы на ТСХ пластины, которые проявляли с использованием растворителя гексан:DEE:Hac (70:30:1 об.:об.:об.). Количество радиоактивности в пятнах DAG и TAG измерили с помощью PhosphorImage. Процент DAG, превращенного в TAG, рассчитали для каждого препарата микросом.
Некоторую эндогенную активность DGAT обнаружили в листьях N. benthamiana, поскольку контрольный анализ P19 показал низкие уровни выработки TAG. Экспрессия AtDGAT1 привела к повышенной активности DGAT относительно P19 контроля в случае добавления в анализ C18:1-CoA либо C18:2-CoA, но не в случае добавления C18:3-CoA, когда концентрации TAG для контроля P19 и AtDGAT1 были одинаковыми. Однако в всех микросомальных анализах при экспрессии AtDGAT2 в тканях листьев наблюдали более высокие уровни активности DGAT (выработка TAG), по сравнению с микросомами AtDGAT1. Более высокие уровни выработки TAG наблюдали при дополнении микросом с использованием C18:2-CoA или C18:3-CoA, чем в случае C18:1-CoA (Фигура 10). Это указывает на то, что DGAT2 обладает другим субстратным предпочтением, в частности, к C18:3-CoA (ALA), чем DGAT1.
Пример 9. Совместная экспрессия MGAT и GPAT в трансгенных семенах
Ученые Yang et al. (2010) описали две глицерин-3-фосфат-ацилтрансферазы (GPAT4 и GPAT6) из A.thaliana, которые обе имеют sn-2 предпочтение (то есть предпочтительно образуют sn-2 MAG, а не sn-1/3 MAG) и обладают активностью фосфатазы, и которые способны вырабатывать sn-2 MAG из G-3-P (Фигура 1). Было сделано предположение, что эти ферменты являются частью пути кутинового синтеза. GPAT4 и GPAT6 не экспрессируются в высокой степени в ткани семян. Комбинирование такой бифункциональной GPAT/фосфатазы с MGAT дает новый путь синтеза DAG с использованием G-3-P в качестве субстрата, который может заменять или дополнять стандартный путь Кеннеди синтеза DAG в растениях, особенно в масличных семенах, или в других клетках, что приводит к увеличению содержания масла, в частности, концентраций TAG.
Химерные ДНК, обозначенные pJP3382 и pJP3383, кодирующие GPAT4 и GPAT6 A. thaliana, соответственно, вместе с MGAT2 M. musculus для экспрессии в семенах растений получили первоначальной вставкой целой кодирующей области MGAT2, содержащейся в фрагменте SwaI, в pJP3362 в сайте SmaI, с получением pJP3378. pJP3362 представляет собой бинарный вектор экспрессии, содержащий пустые кассеты экспрессии FAE1 и FP1, и канамицин-устойчивый ген в качестве селектируемого маркера. GPAT4 A. thaliana амплифицировали из кДНК и клонировали в pJP3378 в сайте NotI с получением pJP3382, в котором GPAT4 экспрессируется процессированным промотором напина, FP1, а MGAT2 экспрессируется промотором FAE1 A. thaliana. Точно так же, GPAT6 A. thaliana амплифицировали из кДНК и клонировали в pJP3378 в сайте NotI, с получением pJP3384, в котором GPAT6 функционально связан с процессированным промотором напина, FP1, а MGAT2 экспрессируется промотором FAE1 A. thaliana. pJP3382 и pJP3383 трансформировали в A. thaliana (экотип Колумбия) способом погружения цветка. Семена из обработанных растений поместили на среду, содержащую антибиотик, канамицин, для выбора растений-потомков (растения Т1), которые были трансформированы. Трансгенные проростки перенесли в почву и выращивали в теплице. Определили экспрессию трансгенов в развившихся зародышах. Трансгенные растения с самым высоким уровнем экспрессии и которые демонстрировали соотношение 3:1 трансгенных: не трансгенных растений на линию, индикативное для одного локуса вставки трансгенов, выбрали и выращивали до зрелости. Из этих растений получили семена (Т2), которые содержали некоторое количество гомозиготных для трансгенов семян. 30-32 (растения Т2) из каждой линии выращивали в горшках с почвой в случайном расположении в теплице с контрольными растениями, и определили содержание липидов, содержание TAG и состав жирных кислот в полученных семенах. Общее содержание жирных кислот (по результатам определения общих FAME), в частности, содержание TAG в семенах, содержащих одновременно MGAT и GPAT4 или GPAT6, было существенно и значимо увеличено примерно на 3% (абсолютное значение) или примерно на 9% (относительное увеличение), по сравнению с контрольными образцами, и было увеличено по сравнению с семенами, содержащими только MGAT или только DGAT1 A. thaliana (Фигура 11).
Кодирующую область мышиного гена MGAT2, кодон-оптимизированного для экспрессии в клетках растений, внедрили в Brassica napus вместе с химерным геном, кодирующим GPAT4 Arabidopsis. Семена из полученных трансгенных растений собрали и анализировали некоторые из них. Данные этих предварительных анализов показали вариабельность содержания масла и состава жирных кислот, вероятно из-за выращивания растений в разное время и при разных условиях окружающей среды. Семена выращивали для получения растений-потомков, и собрали семена-потомки.
Пример 10. Проверка влияния GPAT4 и GPAT6 на MGAT-опосредованное увеличение TAG с помощью GPAT сайленсинга и мутации
Семейство GPAT является крупным, и все известные члены содержат два консервативных домена, домен plsC ацилтрансферазы и домен суперсемейства HAD-подобной гидролазы. Кроме того, все GPAT4-8 A. thaliana содержат N-концевую область, гомологичную домену фосфосерин-фосфатазы. Оба GPAT4 и GPAT6 A. thaliana содержат консервативные остатки, которые, как известно, критичны для фосфатазной активности (Yang et al., 2010).
Были разработаны вырожденные праймеры, основанные на консервативной аминокислотной последовательности GDLVICPEGTTCREP (SEQ ID NO:228), для амплификации фрагментов на GPAT N. benthamiana, которые экспрессируются в ткани листьев. 3' RACE выполняют с использованием этих праймеров и олиго-dT обратных праймеров на РНК, выделенной из ткани листьев N. benthamiana. GPAT с активностью фосфатазы (то есть GPAT4/6-подобные) идентифицируют по их гомологии с N-концевой доменной областью фосфосерин-фосфатазы, описанной выше. Управляемые 35S конструкты РНК интерференции, направленные на эти гены, получают и трансформируют в штамм A. tumefaciens AGL1. Точно так же, конструкт 35S:V2, содержащий белок V2 вирусного молчащего супрессора, трансформируют в штамм A. tumefaciens AGL1. Известно, что V2 подавляет нативный сайленсинг-механизм растения, обеспечивая эффективную временную экспрессию, но обеспечивая также возможность действия сайленсинга гена на основе РНК интерференции.
Затем сравнивают накопление TAG между временно трансформированными образцами листьев, пропитанными следующими смесями штаммов: 1) 35S:V2 (отрицательный контроль); 2) 35S:V2+35S:MGAT2 (положительный контроль); 3) 35S:V2+GPAT-РНКи; 4) 35S:V2+GPAT-РНКи+ 35S:MGAT2. Ожидается, что смесь 35S:V2+GPAT-РНКи+35S:MGAT2 приведет к меньшему накоплению TAG, чем образец 35S:V2+35S:MGAT2 из-за нарушенного синтеза sn-2 MAG в результате сайленсинга GPAT.
Такой же эксперимент выполняют с использованием GPAT4/6-подобных последовательностей A. thaliana и N. benthamiana, которые мутированы для удаления консервативных остатков, которые, как известно, критичны для активности фосфатазы (Yang et al., 2010). Эти мутированные гены (известные вместе как GPAT4/6-дельта) затем клонируют в 35S-управляемые бинарные векторы экспрессии и трансформируют в A. tumefaciens. Затем сравнивают накопление TAG между временно трансформированными образцами листьев, пропитанными следующими смесями штаммов: 1) 35S: p19 (отрицательный контроль); 2) 35S:p19+35S:MGAT2 (положительный контроль); 3) 35S:p19+GPAT4/6-дельта; 4) 35S:p19+ GPAT4/6-дельта+ 35S:MGAT2. Ожидается, что смесь 35S:p19+GPAT4/6-дельта+35S:MGAT2 приведет к меньшему накоплению TAG, чем образец 35S:p19+35S:MGAT2 из-за нарушенного синтеза sn-2 MAG в результате мутации GPAT. Хотя в этом эксперименте присутствуют нативные GPAT4/6-подобные гены N. benthamiana, ожидается, что высокая экспрессия конструктов GPAT4/6-дельта опередит эндогенные гены для доступа к субстрату G-3-P.
Пример 11. Конститутивная экспрессия диацилглицерин-ацилтрансферазы и фактора транскрипции WRI1 в клетках растений
Вектор, обозначенный 35S-pORE04, получили вставкой фрагмента PstI, содержащего промотор 35S, в сайт SfoI вектора pORE04 после обработки T4 ДНК полимеразой для затупления концов (Coutu et al., 2007). Получили генетический конструкт 35S: Arath-DGAT1, кодирующий диацилглицерин-ацилтрансферазу DGAT1 A. thaliana (Bouvier-Nave et al., 2000). В примере 3 публикации WO 2009/129582 описано создание AtDGAT1 в pXZP163. ПЦР-амплифицированный фрагмент с концами KpnI и EcoRV получили из pXZP163 и вставили в pENTR11 для получения pXZP513E. Целую кодирующую AtDGAT1 область pXZP513E, содержащуюся в фрагменте BamHI-EcoRV, вставили в 35S-pORE04 в сайте BamHI-EcoRV, получив pJP2078. Синтезировали синтетический фрагмент, Arath-WRI1, кодирующий фактор транскрипции WRI1 A.thaliana (Cernac and Benning, 2004), фланкированный ограничительными сайтами EcoRI, и кодон-оптимизированный для B. napus. Генетический конструкт, обозначенный 35S: Arath-WRI1, получили клонированием целой кодирующей области Arath-WRI1, фланкированной сайтами EcoRI, в 35S-pORE04 в сайте EcoRI, получив pJP3414. Экспрессию генов в ткани листьев N. benthamiana выполнили в соответствии с временной системой экспрессии, описанной в Примере 1.
Количественное определение концентраций TAG пропитанных листьев N. benthamiana с помощью Iatroscan показало, что комбинированная экспрессия генов DGAT1 и WRI1 A. thaliana привела к 4,5-кратному и 14,3-кратному увеличению содержания TAG, по сравнению с экспрессией WRI1 и отрицательным V2 контролем, соответственно (Таблица 9). Это соответствует среднему и максимально наблюдаемому выходу TAG в пересчете на сухой вес листьев, составляющему 5,7% и 6,51%, соответственно (Таблица 9 и Фигура 12). Увеличение содержания масла в листьях обусловлено не только активностью сверхэкспрессированной ацилтрансферазы DGAT1, что можно видеть по снижению концентраций TAG при сохранении WRI1 в комбинации. Более того, наблюдали синергетический эффект, составляющий 48% от общего увеличения TAG.
Оба конструкта DGAT1 и WRI1 привели также к увеличению концентраций олеиновой кислоты при снижении линолевой кислоты в фракциях TAG пропитанных листьев N. benthamiana (Таблица 10). Эти результаты подтверждают недавние открытия ученых Andrianov et al. (2010), которые описали подобные сдвиги в TAG, фосфолипидных и TFA липидных фракциях трансгенных табачных растений, трансформированных ацилтрансферазой DGAT1 A. thaliana. Однако при совместной экспрессии генов DGAT1 и WRI1 наблюдали синергетический эффект на накопление олеиновой кислоты в листьях N. benthamiana - на этот синергизм, по оценкам, приходится 52% от общего содержания олеиновой кислоты при экспрессии обоих генов. Неожиданные синергетические эффекты на накопление TAG и концентрацию олеиновой кислоты в трансгенных листьях N. benthamiana демонстрируют возможность одновременной повышающей регуляции биосинтеза жирных кислот и расходования ацила в неполярные липиды, такие как TAG в вегетирующих тканях, двух метаболических процессов, которые очень активны при в развитии масличных семян.
Повторили эксперимент временной экспрессии, за исключением того, что использовали P19 вирусный молчащий супрессор вместо V2 супрессора, и выполнили тщательное сравнение образцов из одного листа во избежание возможной вариабельности между листьями. Для этого химерный конструкт 35S:P19 для экспрессии белка P19 вирусного молчащего супрессора вируса кустистой карликовости томата (Wood et al., 2009) отдельно внедрили в GV3101 A. tumefaciens для совместной инфильтрации.
Количественная оценка концентраций TAG пропитанных листьев N. benthamiana с помощью Iatroscan в этом эксперименте выявила, что комбинированная временная экспрессия генов DGAT1 и WRI1 A. thaliana привела к 141-кратному увеличению содержания TAG, по сравнению с P19 отрицательным контролем (Фигура 13). При сравнении отдельной экспрессии DGAT1 и WRI1 в одном и том же листе, комбинированная пропитка обеспечила увеличение концентраций TAG в 17 и 5 раз, соответственно. И снова, совместная экспрессия обоих генов имела синергетический (больше, чем аддитивный) эффект на накопление масла в листьях, с синергетическим компонентом, составляющим 73% от общего увеличения TAG. Более высокая степень увеличения содержания TAG в этом эксперименте (в 141 раз), по сравнению с предыдущим экспериментом (в 14,3 раза) может быть обусловлена использованием молчащего супрессора P19, а не V2, и, следовательно, повышенной генной экспрессией из трансгенов.
В Таблице 11 показан состав жирных кислот в TAG. При совместной экспрессии генов DGAT1 и WRI1 в N. benthamiana, снова наблюдали синергетический эффект на степень накопления олеиновой кислоты в TAG фракции листьев. Это увеличение было в значительной степени обеспечено за счет среднецепочечных жирных кислот, пальмитиновой кислоты и стеариновой кислоты (Таблица 11). Содержание линолевой кислоты также увеличилось, что может быть объяснено более высокими концентрации субстрата олеиновой кислоты, доступного для эндогенной FAD2 Δ12-десатуразы. Индивидуальная экспрессия генов DGAT1 и WRI1 в N. benthamiana привела к промежуточным изменениям профиля TAG, без такого значительного увеличения содержания олеиновой кислоты. Кроме того, но в отличие от первого эксперимента, были обнаружены более высокие концентрации α-линоленовой кислоты (ALA), хотя это наблюдали в меньшей степени при совместной экспрессии DGAT1 и WRI1 в ткани листьев.
Наблюдаемый синергетический эффект экспрессии DGAT1 и WRI1 на биосинтез TAG более точно подтвердили сравнением внедрения в N. benthamiana обоих генов по отдельности или в комбинации, по сравнению с внедрением только гена P19 в качестве контроля в тот же лист. Это обеспечило преимущество уменьшения вариабельности между листьями. Кроме того, количество дублей увеличилось до 5, а образцы объединяли между различными листьями одного растения для улучшения точности данных. Результаты представлены в Таблице 12.
Таблица 8. Профиль жирных кислот и количественное определение TAG в трех экземплярах ткани листьев Nicotiana benthamiana, временно трансформированных конструктами 35S:p19, 35S:DGAT1 и 35S:DGAT2
1w13t
1d7
1d11
1d11
100 мг сухого веса
Таблица 9. Концентрации TAG в трех экземплярах ткани листьев Nicotiana benthamiana, временно трансформированных 35S:V2, 35S:DGAT1 и 35S:WRI1
1 Среднее для трех разных пропитанных листьев, по количественной оценке с помощью Iatroscan
2 Среднее отношение на основании непосредственного сравнения на одних и тех же листьях
Таблица 10. Состав жирных кислот в TAG, выработанных в тканях листьев Nicotiana benthamiana, временно трансформированных 35S:V2, 35S:DGAT1 и 35S:WRI1 (данные для пропитки в трех экземплярах)
Таблица 11. Состав жирных кислот в TAG, выработанных в тканях листьев N. benthamiana, временно трансформированных конструктами 35S:P19 (контроль), 35S:WRI1 и/или 35S:DGAT1
Таблица 12. Сравнение WRI1+DGAT1 вместе с одиночными генами
На основании индивидуальных эффектов обоих генов DGAT1 и WRI1 при экспрессии в N. benthamiana, при наличии лишь аддитивного эффекта, но без какого-либо синергетического эффекта, авторы настоящего изобретения ожидали получить концентрацию TAG на уровне 0,35 или в 35 раз больше, по сравнению с P19 отрицательным контролем. Однако внедрение обоих генов привело к концентрациям TAG, которые были в 129 раз выше, чем P19 контроль. На основании этих результатов авторы настоящего изобретения оценили аддитивный эффект и синергетический эффект на накопление TAG на уровне 26,9% и 73,1%, соответственно. Кроме того, при анализе состава жирных кислот в общих липидах образцов листьев с помощью ГХ, наблюдали синергетический эффект на концентрации C18:1Δ9 в TAG фракции листьев N. benthamiana, пропитанных WRI1 и DGAT1 (3 экземпляра каждого). Данные показаны в Таблице 11.
Для специфичной к семенам экспрессии комбинации WRI1+DGAT1, Arabidopsis thaliana трансформировали бинарным векторным конструктом, содержащим химерную ДНК, имеющую оба гена pFAE1::WRI1 и pCln2::DGAT1, или, для сравнения, одиночные гены pFAE1::WRI1 или pCln2::DGAT1. Из растений собрали семена T1. Определили содержание масла в семенах. Содержание масла в семенах увеличилось.
Пример 12. Конститутивная экспрессия моноацилглицерин-ацилтрансферазы и фактора транскрипции WRI1 в клетках растений
Химерную ДНК, кодирующую MGAT2 Mus musculus (Cao et al., 2003; Yen and Farese, 2003), и кодон-оптимизированную для B. napus синтезировали в компании Geneart. Генетический конструкт, обозначенный 35S:Musmu-MGAT2, получили вставкой целой кодирующей области 1022341_MusmuMGAT2, содержащейся в фрагменте EcoRI, в pJP3343 в сайте EcoRI, с получением pJP3347. Клонирование конструкта 35S: Arath-WRI1 описано в Примере 11. Временную экспрессию в ткани листьев N. benthamiana выполнили так, как описано в Примере 1.
При совместной экспрессии мышиной MGAT2 и вектора транскрипции WRI1 A. thaliana, средние концентрации TAG в листьях N. benthamiana увеличились в 3,3 раза, по сравнению с экспрессией только WRI1 (Таблица 13). Кроме того, экспрессия этих двух генов привела к небольшому (29%) синергетическому эффекту на накопление TAG в листьях. Концентрация TAG, полученных с геном MGAT2 в присутствии WRI1, составила 3,78%, по количественному анализу Iatroscan (Фигура 12). Такие же результаты, полученные с животными MGAT2 и растительными DGAT1 ацилтрансферазами в комбинации с WRI1 A. thaliana, позволяют предположить, что синергетический эффект может быть общим явлением при сверхэкспрессии WRI и ацилтрансфераз в вегетирующих тканях растения, не накапливающих масло.
Этот эксперимент повторили, внедрив конструкты для экспрессии V2+MGAT2, по сравнению с V2+MGAT2+WRI1, так что пропитанные образцы листьев объединяли для трех листьев одного растения, каждый для двух растений. В целом, каждая комбинация, таким образом, имела 6 повторных пропитываний. Это привело к меньшему стандартному отклонению, чем при объединении образцов листьев между различными растениями, как это было сделано в первых экспериментах. Данные этого эксперимента представлены в Таблице 14. Были подтверждены полученные ранее результаты (Таблица 13). Хотя абсолютные концентрации TAG различны (что характерно для анализа Benth, а также обусловлено различным объединением образцов), относительное увеличение TAG при совместной экспрессии WRI1 с V2+MGAT2 было одинаковым (2,45 и 2,65 раза).
Пример 13. Конститутивная экспрессия моноацилглицерин-ацилтрансферазы, диацилглицерин-ацилтрансферазы и фактора транскрипции WRI1 в клетках растений
Гены, кодирующие для диацилглицерин-ацилтрансферазы DGAT1 A. thaliana, мышиной моноацилглицерин-ацилтрансферазы MGAT2 и WRI1 A. thaliana, экспрессировали в различных комбинациях в ткани листьев N. benthamiana в соответствии с временной системой экспрессии, описанной в Примере 1. Подробное описание различных конструктов можно найти в Примерах 11 и 12.
Комбинированная экспрессии генов DGAT1, WRI1 и MGAT2 привела к почти 3-кратному дополнительному увеличению TAG, по сравнению с экспрессией двух последних (Таблица 15). Максимально наблюдаемый выход TAG составил 7,28%, по количественному анализу Iatroscan (Фигура 12). Концентрации TAG в листьях существенно не изменились при исключении из этой комбинации гена мышиной ацилтрансферазы MGAT2. Однако результаты, описанные в Примере 16, наглядно демонстрируют положительный эффект мышиной MGAT2 на биосинтез нейтральных липидов в листьях N. benthamiana, при экспрессии в комбинации с WRI1, DGAT1 и белком олеозина Sesamum indicum.
Таблица 13. Концентрации TAG в трех экземплярах ткани листьев Nicotiana benthamiana, временно трансформированной 35S:V2, 35S:MGAT2 и 35S:WRI1.
1 Среднее для трех разных пропитанных листьев, по количественной оценке с помощью Iatroscan
2 Среднее отношение на основании непосредственного сравнения на одних и тех же листьях
Таблица 14. Содержание TAG в пропитанных образцах листьев N. benthamiana
Таблица 15. Концентрации TAG в трех экземплярах ткани листьев Nicotiana benthamiana, временно трансформированных 35S:V2, 35S:MGAT2, 35S:DGAT1 и 35S:WRI1
гены
1 Среднее для трех разных пропитанных листьев, по количественной оценке с помощью Iatroscan
2 Среднее отношение на основании непосредственного сравнения на одних и тех же листьях
Дополнительные данные были получены из дополнительного эксперимента, в котором образцы листьев объединили между листьями одного растения, 6 повторов для каждого. Данные представлены в Таблице 16.
Таблица 16. Содержание TAG в пропитанных образцах листьев N. benthamiana
Пример 14. Конститутивная экспрессия моноацилглицерин-ацилтрансферазы, диацилглицерин-ацилтрансферазы, фактора транскрипции WRI1 и глицерин-3-фосфат-ацилтрансферазы в клетках растений
Генетический конструкт 35S:GPAT4 получили клонированием гена GPAT4 A. thaliana (Zheng et al., 2003) из общей РНК, выделенной из развивающихся стручков, затем выполнили вставку как EcoRI фрагмент в pJP3343, получив pJP3344. Другие конструкты описаны в Примерах 11 и 12. Временную экспрессию в ткани листьев N. benthamiana выполнили так, как описано в Примере 1.
Временная экспрессия ацилтрансферазы GPAT4 A. thaliana в комбинации с MGAT2, DGAT1 и WRI1 привела к небольшому снижению содержания TAG в листьях N. benthamiana, по результатам количественного определения с помощью Iatroscan (Таблица 17). Также было обнаружено, что концентрация TAG (5,78%) снизилась при включении GPAT4 в пропитывающую смесь (Фигура 12). Однако это открытие не исключает гипотезу синтеза sn2-MAG из G3P, катализируемого ацилтрансферазой GPAT4. Скорее оно позволяет предположить, что эта каталитическая стадия маловероятно является лимитирующей стадией в ткани листьев из-за высокой степени экспрессии эндогенного гена GPAT4 (Li et al., 2007). Более того, ацилтрансфераза GPAT8 A. thaliana демонстрирует аналогичный профиль экспрессии, что и GPAT4, и было показано, что она проявляет перекрывающееся действие (Li et al., 2007). В развивающихся семенах степени экспрессии GPAT4 и GPAT8 низкие. В результате совместная экспрессия GPAT4 в контексте семян может быть решающей для обеспечения достаточного количества субстрата sn2-MAG для гетерологично экспрессируемой ацилтрансферазы MGAT.
Таблица 17. Концентрации TAG в трех экземплярах ткани листьев Nicotiana benthamiana, трансформированных 35S:V2, 35S:MGAT2, 35S:DGAT1, 35S:WRI1 и 35S:GPAT4
Были получены дополнительные данные из следующего эксперимента, в котором образцы листьев объединили между листьями одного растения, 6 повторов каждого. Данные представлены в Таблице 18.
Таблица 18. Содержание TAG в пропитанных образцах листьев N. benthamiana
Пример 15. Конститутивная экспрессия моноацилглицерин-ацилтрансферазы, диацилглицерин-ацилтрансферазы, фактора транскрипции WRI1 и молчащего конструкта АГФазы-вмРНКи в клетках растений
Синтезировали фрагмент ДНК, соответствующий нуклеотидам 595-1187 мРНК, кодирующей малую субъединицу АГФазы Nicotiana tabacum (DQ399915) (Kwak et al., 2007). Фрагмент размером 593 п.о. 1118501_NtAGP сначала вырезали с помощью NcoI, обработали крупным фрагментом ДНК-полимеразы I (Klenow) с образованием 5' тупых концов, и наконец расщепили с помощью XhoI. Точно так же исходный вектор pENTR11-NCOI сначала расщепили с помощью BamHI, обработали крупным фрагментом ДНК-полимеразы I (Klenow) и вырезали с помощью XhoI. Лигирование вставки 1118501_NtAGP в pENTR11-NCOI привело к образованию исходного клона pENTR11-NCOI-NtAGP. LR-рекомбинация между исходным клоном pENTR11-NCOI-NtAGP и заданным вектором pHELLSGATE12 привела к образованию pTV35, бинарного вектора, содержащего кассету РНКи NtАГФазы под управлением промотора 35S. Другие конструкты описаны в Примерах 11 и 12. Временную экспрессию в ткани листьев N. benthamiana выполнили так, как описано в Примере 1.
Экспрессия молчащего конструкта АГФазы N. tabacum вместе с генами, кодирующими для MGAT2 и WRI, привела к 1,7-кратному увеличению концентраций TAG в листьях, по количественному анализу с Iatroscan (Таблица 19). В отсутствие ацилтрансферазы MGAT2 концентрации TAG упали почти в 3 раза. Следовательно, наблюдаемое увеличение TAG не может быть приписано только лишь к сайленсингу эндогенного гена АГФазы N. benthamiana. Неожиданно, использование MGAT2 вместо DGAT1 A. thaliana не привело к изменению концентраций TAG в пропитанных листьях N. benthamiana в комбинации с молчащим конструктом АГФазы N. tabacum. Следовательно, сайленсинг АГФазы N. benthamiana оказывает другой метаболический эффект на ацилтрансферазы MGAT и DGAT. Такое же различие наблюдали также в максимальных наблюдаемых концентрациях TAG с WRI1 и молчащим конструктом АГФазы в комбинации MGAT2 или DGAT1, которые составили 6,16% и 5,51% масла в листьях, соответственно (Фигура 12).
Таблица 19. Концентрации TAG в трех экземплярах ткани листьев Nicotiana benthamiana, временно трансформированных 35S:V2, 35S:MGAT2, 35S:DGAT1, 35S:WRI1 и 35S:АГФаза-вмРНКи
1 Среднее для трех разных пропитанных листьев, по количественной оценке с помощью Iatroscan;
2 Среднее отношение на основании непосредственного сравнения на одних и тех же листьях
Свехэкспрессия WRI1 и MGAT в комбинации с сайленсингом АГФазы особенно перспективна для повышения выхода масла в тканях, накапливающих крахмал. Примеры включают клубни, такие как картофельные, и эндосперм злаковых, и потенциально приводит к получению злаковых с повышенным содержанием масла в зернах (Barthole et al., 2011). Хотя гены АГФазы N. tabacum и N. benthamiana, вероятно, несут значительную идентичность последовательности, вероятно, что конструкт АГФаза-вмРНКи N. benthamiana обеспечит дополнительное повышение выхода TAG за счет улучшенной эффективности сайленсинга.
Получили дополнительные данные из следующего эксперимента, в котором образцы листьев объединяли между листьями одного растения, 6 повторов каждого. Данные представлены в Таблицах 19 и 20.
Таблица 20. Содержание TAG в пропитанных образцах листьев N. benthamiana
Пример 16. Конститутивная экспрессия моноацилглицерин-ацилтрансферазы, диацилглицерин-ацилтрансферазы, фактора транскрипции WRI1 и белка олеозина в клетках растений
Бинарный вектор pRSh1, содержащий ген, кодирующий для олеозина в семенах S. indicum (Scott et al., 2010) под управлением промотора 35S, приобрели у д-ра N. Roberts (AgResearch Limited, Новая Зеландия). Другие конструкты описаны в примерах 11 и 12. Временную экспрессию в ткани листьев N. benthamiana выполнили так, как описано в Примере 1.
При экспрессии кунжутного белка олеозина вместе с фактором транскрипции WRI A. thaliana и ацилтрансферазой MGAT2 M. musculus, концентрации TAG в листьях N. benthamiana, по результатам количественной оценки с Iatroscan, оказались в 2,2 раза выше (Таблица 21). Не было обнаружено никаких существенных изменений в профилях жирных кислот TAG (Таблица 22). Также наблюдали небольшое увеличение TAG при включении ацилтрансферазы DGAT1 A. thaliana DGAT1. По сравнению с отрицательным V2 контролем, комбинированная экспрессия WRI1, DGAT1 и кунжутного белка олеозина привела к 3-кратному увеличению так и максимальной наблюдаемой концентрации TAG 7,72% (Таблица 21, и Фигура 12). Концентрации TAG в листьях были дополнительно повышены на коэффициент 2,5, при включении ацилтрансферазы MGAT2. Это соответствует средней концентрации 5,7% и максимально наблюдаемой концентрации TAG 18,8%, в пересчете на сухой вес. Дополнительное увеличение TAG в листьях при включении MGAT2 наглядно демонстрирует положительный эффект этой ацилтрансферазы на биосинтез и накопление нейтральных липидов в трансгенных тканях листьев.
Этот эксперимент повторили с комбинацией генов для экспрессии V2 и V2+MGAT2+DGAT1+WRI1+олеозин, испытали в различных растениях N. benthamiana, при этом образцы объединяли между листьями одного растения, с 12 повторными пропитками для каждого случая. Данные представлены в Таблице 23. Повторные образцы также объединяли между листьями одного растения, с 6 дублями для каждой пропитки: данные представлены в Таблицах 24 и 25.
Хотя пропитка листьев N. benthamiana привела к повышенным концентрациям масла в листьях (TAG), не было обнаружено никакого существенного увеличения общего содержания липидов, что позволяет предположить, что произошло перераспределение жирных кислот из различных липидных пулов в TAG. Напротив, при совместной экспрессии гена MGAT2 с генами DGAT1, WRI1 и олеозина, общее содержание липидов увеличилось в 2,21 раза, демонстрируя нетто-увеличение синтеза липидов в листьях.
Пример 17. Конститутивная экспрессия моноацилглицерин-ацилтрансферазы, диацилглицерин-ацилтрансферазы, фактора транскрипции WRI1 и молчащего конструкта FAD2-вмРНКи в клетках растений
Получили кассету РНКи FAD2 N. benthamiana под управлением промотора 35S с помощью LR-рекомбинации в заданный вектор pHELLSGATE8 с получением вектора pFN033. Другие конструкты описаны в Примерах 11 и 12.
Таблица 21. Концентрации TAG в трех экземплярах ткани листьев Nicotiana benthamiana, трансформированных 35S:V2, 35S:MGAT2, 35S:DGAT1, 35S:WRI1 и 35S: олеозином
1 Среднее для трех разных пропитанных листьев, по количественной оценке с помощью Iatroscan
2 Среднее отношение на основании непосредственного сравнения на одних и тех же листьях
Таблица 22. Профили жирных кислот TAG в трех экземплярах ткани листьев Nicotiana benthamiana, временно трансформированных 35S:V2, 35S:MGAT2, 35S:DGAT1, 35S:WRI1 и 35S:олеозином
Таблица 23. Содержание TAG в пропитанных образцах листьев N. benthamiana
Таблица 24. Содержание TAG в пропитанных образцах листьев N. benthamiana
Таблица 25. Общее содержание жирных кислот в пропитанных образцах листьев N. benthamiana
Гены, кодирующие для мышиной моноацилглицерин-ацилтрансферазы MGAT2, диацилглицерин-ацилтрансферазы DGAT1 A. thaliana, WRI1 A. thaliana и шпилечный конструкт РНКи десатуразы Δ12-жирных кислот FAD2 N. benthamiana (Wood et al., руководство по получению), экспрессировали в комбинации в ткани листьев N. benthamiana с использованием временной системы экспрессии, описанной в Примере 1.
Наблюдали такие же изменения в составе жирных кислот TAG, полярных липидов и TFA в листьях N. benthamiana, пропитанных WRI1, MGAT2, DGAT1 и молчащим конструктом Fad2 (Таблицы 26-28). Во всех трех липидных фракциях концентрации олеиновой кислоты были еще более повышены и достигли почти 20% в полярных липидах, 40% в TFA и более 55% в TAG. Это увеличение обусловлено, по большей части, за счет линолевой кислоты, отражая сайленсинг-эффект на эндоплазматический ретикулюм FAD2 Δ12-десатуразы. TAG листьев также содержали меньшее количество α-линоленовой кислоты, тогда как концентрации в TFA и полярных липидах не изменились.
При повторении этих экспериментов и определении состава жирных кислот для TAG, полярных липидов и общих липидов, эти результаты (Таблица 29) согласовались с первым экспериментом.
Таблица 26. Профили жирных кислот в TAG трех экземпляров ткани листьев Nicotiana benthamiana, временно трансформированных 35S:V2, 35S:MGAT2, 35S:DGAT1, 35S:WRI1 и 35S:FAD2-вмРНКи
Таблица 27. Профили жирных кислот в полярных липидах, выделенных из трех экземпляров ткани листьев Nicotiana benthamiana, временно трансформированных 35S:V2, 35S:MGAT2, 35S:DGAT1, 35S:WRI1 и 35S:FAD2-вмРНКи
Таблица 28. Профили жирных кислот в общих липидах, выделенных из трех экземпляров ткани листьев Nicotiana benthamiana, временно трансформированых 35S:V2, 35S:MGAT2, 35S:DGAT1, 35S:WRI1 и 35S:FAD2-вмРНКи
Таблица 29. Состав жирных кислот в TAG, полярных липидах и общих липидах в пропитанных образцах листьев N. benthamiana
Пример 18. Экспрессия MGAT1 и MGAT2 Mus musculus в клетках Nicotiana benthamiana при устойчивой трансформации
Конститутивная экспрессия в N. benthamiana
Ферментная активность MGAT1 и MGAT2 M. musculus продемонстрирована в Nicotiana benthamiana. Химерные векторы 35S:Musmu-MGAT1 и 35S:Musmu-MGAT2 внедрили в штамм A. tumefaciens AGL1 с помощью стандартного приема электропорации и выращивали на твердой среде LB с добавлением канамицина (50 мг/л) и рифампицина (25 мг/л), и инкубировали при 28°C в течение двух дней. Для инициации свежей культуры использовали одну колонию. Через 48 часов выращивания при энергичной аэрации, клетки собрали центрифугированием при 2000x g и удалили надосадочную жидкость. Клетки повторно суспендировали в новом растворе, содержащем 50% LB и 50% среды MS с плотностью ОП600=0,5. Образцы листьев Nicotiana benthamiana, выращенных в стерильных условиях in vitro, отрезали и порезали на квадратные сегменты размером около 0,5-1 см2 с помощью острого скальпеля, погрузив в раствор A. tumefaciens. Разрезанные части листьев N. benthamiana, погруженные в A. tumefaciens, оставили стоять при комнатной температуре в течение 10 минут, затем насухо промокнули стерильной фильтровальной бумагой и перенесли на планшеты MS без добавок. После периода совместного выращивания в течение двух дней при 24°C, эксплантаты три раза промыли стерильной жидкой MS средой и, наконец, насухо промокнули стерильной фильтровальной бумагой и поместили на селективную отвержденную агаром среду MS с добавлением 1,0 мг/л бенциламинопурина (BAP), 0,25 мг/л индолуксусной кислоты (IAA), 50 мг/л канамицина и 250 мг/л цефотаксима, и инкубировали при 24°C в течение двух недель для обеспечения возможности развития побегов из трансформированных дисков листьев N.benthamiana. Для in vitro создания трансгенных растений здоровые зеленые побеги отрезали и перенесли в новые 200 мл горшки для выращивания тканей, содержащие отвержденную агаром среду MS с добавлением 25 мкг/л IAA и 50 мг/л канамицина, и 250 мг/л цефотаксима.
Экспрессию трансгенов MGAT1 и MGAT2 определили с помощью ПЦР в реальном времени. Выбрали высокоэкспрессирующие линии и собрали их семена. Эти семена выращивали непосредственно в почве, а сегрегирующую популяцию проростков собрали через четыре недели. Выбрали высокоэкспрессирующиеся события, а семена, полученные из этих растений, выращивали непосредственно в почве с получением сегрегирующей популяции из 30 проростков. Через три недели из каждого проростка взяли диски листьев для экстракции ДНК и последующей ПЦР для определения того, какие линии являются трансгенными, а какие имеют нулевую вероятность для трансгена. Затем популяцию собрали со всей надземной частью из каждого проростка, очистили от почвы и высушили замораживанием. Записали сухой вес каждого образца и общих выделенных липидов. TAG в этих образцах общих липидов количественно определили с помощью ТСХ-FID и определили соотношение TAG к внутреннему образцу (DAGE) в каждом образце (Фигура 14). Обнаружили, что средняя концентрация TAG в трансгенных проростках 35S:Musmu-MGAT2 линии 3347-19 была в 4,1 раза выше, чем средняя концентрация TAG в «нулевых» проростках. Событие с максимальным увеличением TAG имело в 7,3 раза более высокую концентрацию TAG, чем среднее значение для событий с нулевой вероятностью.
Конститутивная экспрессия в A. thaliana
Ферментную активность MGAT1 и MGAT2 M. musculus продемонстрировали в A. thaliana. Химерные векторы 35S:Musmu-MGAT1 и 35S:Musmu-MGAT2 вместе с пустым векторным контролем pORE04 трансформировали в A. thaliana способом погружения цветка, а семена из первичных трансформантов выбрали на канамициновой среде. Собрали семена Т2 из этих Т1 растений и определили TFA в семенах каждого растения (Фигура 15). Обнаружили, что среднее количество мг TFA/г семян составило 139±13 для контрольных линий pORE04 со средним значением 136,0, 152±14 для линий 35S:MGAT1 со средним значением 155,1 и 155±11 для линий 35S:MGAT2 со средним значением 154,7. Это представляет собой среднее увеличение TFA по сравнению с контрольным значением 9,7% для 35S:MGAT1 и 12,1% для 35S:MGAT2.
Пример 19. Дополнительные гены
Дополнительное увеличение содержания масла
Вместе с комбинациями, описанными выше, испытали дополнительные гены для определения возможности дополнительного увеличения содержания масла. Они включают следующие гены Arabidopsis: AT4G02280, синтаза сахарозы SUS3; AT2G36190, инвертаза CWINV4; AT3G13790, инвертаза CWINV1; AT1G61800, транслокатор глюкозы-6-фосфата:фосфата GPT2; AT5G33320, транспортер фосфо-енолпирувата PPT1; AT4G15530, пируват-ортофосфат-дикиназу пластид-PPDK; AT5G52920, пируват-киназу pPK-β1. Гены, кодирующие для этих ферментов, синтезировали и клонировали в конститутивный бинарный вектор экспрессии pJP3343 как фрагменты EcoRI для испытания в N. benthamiana.
При добавлении ряда генов к комбинации WRI1, DGAT1, MGAT2 и олеозина и экспрессии в листьях N. benthamiana, не наблюдали дополнительного увеличения концентрации TAG, а именно для: PDAT сафлора, PDAT1 Arabidopsis thaliana, DGAT2 Arabidopsis thaliana, калеозина Arabidopsis thaliana, олеозина арахиса, гемоглобина 2 Arabidopsis thaliana, iPLAh Homo sapiens, GPAT4 Arabidopsis thaliana, G3P дегидрогеназы E. coli, G3P дегидрогеназы дрожжей, касторового LPAAT2, бета-фруктофуранозидазы Arabidopsis thaliana (ATBFRUCT1, NM_112232), бета-фруктофуранозидазы Arabidopsis thaliana (cwINV4, NM_129177), что указывает на то, что активность ни одного из этих ферментов не является лимитирующей в листьях N. benthamiana при временной экспрессии. Это не указывает на то, что они не будут обладать действием в устойчиво трансформированных растениях, как в случае семян, или в других организмах.
Испытали другие дополнительные гены на аддитивную или синергетическую активность для повышения выработки масла. Они включают следующие генные модели Arabidopsis thaliana или их кодируемые белки, а также гомологи из других видов, которые сгруппированы по предполагаемой функции, и для которых ранее была показана повышающая регуляция в тканях с повышенным содержанием масла. Гены/белки, участвующие в расщеплении сахарозы: AT1G73370, AT3G43190, AT4G02280, AT5G20830, AT5G37180, AT5G49190, AT2G36190, AT3G13784, AT3G13790, AT3G52600. Гены/белки, участвующие в окислительном пентозо-фосфатном пути: AT3G27300, AT5G40760, AT1G09420, AT1G24280, AT5G13110, AT5G35790, AT3G02360, AT5G41670, AT1G64190, AT2G45290, AT3G60750, AT1G12230, AT5G13420, AT1G13700, AT5G24410, AT5G24420, AT5G24400, AT1G63290, AT3G01850, AT5G61410, AT1G71100, AT2G01290, AT3G04790, AT5G44520, AT4G26270, AT4G29220, AT4G32840, AT5G47810, AT5G56630, AT2G22480, AT5G61580, AT1G18270, AT2G36460, AT3G52930, AT4G26530, AT2G01140, AT2G21330, AT4G38970, AT3G55440, AT2G21170. Гены/белки, участвующие в гликолизе: AT1G13440, AT3G04120, AT1G16300, AT1G79530, AT1G79550, AT3G45090, AT5G60760, AT1G56190, AT3G12780, AT5G61450, AT1G09780, AT3G08590, AT3G30841, AT4G09520, AT1G22170, AT1G78050, AT2G36530, AT1G74030. Гены/белки, которые действуют как транспортеры пластид: AT1G61800, AT5G16150, AT5G33320, AT5G46110, AT4G15530, AT2G36580, AT3G52990, AT3G55650, AT3G55810, AT4G26390, AT5G08570, AT5G56350, AT5G63680, AT1G32440, AT3G22960, AT3G49160, AT5G52920. Гены/белки, участвующие в метаболизме малата и пирувата: AT1G04410, AT5G43330, AT5G56720, AT1G53240, AT3G15020, AT2G22780, AT5G09660, AT3G47520, AT5G58330, AT2G19900, AT5G11670, AT5G25880, AT2G13560, AT4G00570.
Получили конструкты, которые содержат последовательности, кодирующие эти белки-кандидаты, которыми пропитывали листья N. benthamiana, как в предыдущих экспериментах, и анализировали содержание и состав жирных кислот. Гены, которые способствуют увеличению содержания неполярных липидов, комбинировали с другими генами, как описано выше, главным образом с теми, которые кодируют MGAT, Wri1, DGAT1 и олеозин, и использовали для трансформации клеток растений.
Увеличение нестандартных жирных кислот
Испытали дополнительные гены вместе с комбинациями, описанными выше, для определения возможности увеличения нестандартных жирных кислот. Они включают следующие гены (представлены номера доступа GenBank), которые сгруппированы по предполагаемой функции, а также гомологи из других видов. Дельта-12 ацетиленазы ABC00769, CAA76158, AAO38036, AAO38032; дельта-12 конъюгазы AAG42259, AAG42260, AAN87574; дельта-12 десатуразы P46313, ABS18716, AAS57577, AAL61825, AAF04093, AAF04094; дельта-12 эпоксигеназы XP_001840127, CAA76156, AAR23815; дельта-12 гидроксилазы ACF37070, AAC32755, ABQ01458, AAC49010; и дельта-12 P450 ферменты, такие как AF406732.
Получили конструкты, которые содержат последовательности, кодирующие эти белки-кандидаты, которыми пропитывали листья N. benthamiana, как в предыдущих экспериментах, и анализировали содержание и состав жирных кислот. Нуклеотидные последовательности кодирующих областей могут быть кодон-оптимизированными для заданных видов-хозяев. Гены, которые способствуют увеличению содержания нестандартных жирных кислот, комбинировали с другими генами, описанными выше, главным образом, с теми, которые кодируют MGAT, WRI1, DGAT1 и олеозин, и использовали для трансформации клеток растений.
Пример 20. Устойчивая трансформация растения, включая Nicotiana tabacum, комбинациями генов, повышающих содержание масла
Существующий бинарный вектор экспрессии pORE04+11ABGBEC (предварительная заявка на патент США № 61/660392), который содержит промотор с двойной областью энхансера 35S, экспрессирующий канамицин-устойчивый ген NPTII и три кассеты генной экспрессии, использовали в качестве исходного вектора для получения нескольких конструктов, каждый из которых содержит комбинацию генов для устойчивой трансформации растений. Этот вектор модифицировали заменой экспрессируемых генов на гены, повышающие содержание масла, следующим образом. Сначала модифицировали pORE04+11ABGBEC вставкой интрон-прерванного гена олеозина кунжута, фланкированного сайтами NotI, из вектора pRSh1-PSP1 в сайты pORE04+11ABGBEC NotI с получением pJP3500. Затем pJP3500 модифицировали вставкой фрагмента кодон-оптимизированной ДНК, кодирующей ген WRL1 A. thaliana, в сайты EcoRI с получением pJP3501. pJP3501 дополнительно модифицировали вставкой фрагмента ДНК, кодирующего кодирующую область DGAT1 A. thaliana дикого типа, фланкированную сайтами AsiSI, в сайты AsiSI с получением pJP3502 (SEQ ID NO:409). Окончательную модификацию выполнили вставкой другой кассеты экспрессии, содержащей промотор с двойной областью энхансера 35S, кодирующий MGAT2 M. musculus, в качестве фрагмента StuI-ZraI в сайт SfoI pJP3502 с получением pJP3503 (SEQ ID NO:410). Кассету экспрессии MGAT2 вырезали из pJP3347 в сайтах StuI+ZraI. pJP3502 и pJP3503 использовали для устойчивой трансформации N. tabacum, как описано ниже. С помощью таких построений pJP3502 содержал кодирующие области WRL1 и DGAT1 A. thaliana, управляемые промотором малой субъединицы Rubisco A. thaliana (SSU), и промотором с двойной областью энхансера 35S, соответственно, а также кассету SSU: олеозина кунжута. T-ДНК область этого конструкта схематически изображена на Фигуре 16. Вектор pJP3503 дополнительно содержал кассету e35S: MGAT2. Этот конструкт схематически изображен на Фигуре 17. Нуклеотидная последовательность Т-ДНК области конструкта pJP3503 представлена как SEQ ID NO:412.
Устойчивая трансформация Nicotiana tabacum с помощью комбинаций генов
Бинарные векторы pJP3502 и pJP3503 по отдельности внедрили в штамм A. tumefaciens AGL1 с помощью стандартного приема электропорации. Трансформированные клетки выбрали и вырастили на LB-агаровой среде с добавлением канамицина (50 мг/л) и рифампицина (25 мг/л) и инкубировали при 28°C в течение двух дней. Одну колонию из каждого образца использовали для инициации свежих культур в бульон LB. Через 48 часов инкубации при энергичной аэрации клетки собрали центрифугированием при 2000 g и удалили надосадочную жидкость. Клетки повторно суспендировали при плотности ОП600=0,5 в свежей среде, содержащей 50% LB и 50% среды MS.
Образцы листьев N. tabacum сорта W38, выращенные в стерильных условиях in vitro, отрезали скальпелем и разрезали на части размером около 0,5-1 см2, погрузив в суспензию A. tumefaciens. Отрезанные части листьев оставили в суспензии A. tumefaciens при комнатной температуре на 15 минут, затем насухо промокнули стерильной фильтровальной бумагой и перенесли на планшеты MS без добавки антибиотика. После периода совместного выращивания в течение двух дней при 24°С эксплантаты три раза промыли стерильной жидкой средой MS, затем насухо промокнули стерильной фильтровальной бумагой и поместили на селективный MS агар с добавлением 1,0 мг/л бензиламинопурина (BAP), 0,5 мш/л индолуксусной кислоты (IAA), 100 мг/л канамицина и 200 мг/л цефотаксима. Планшеты инкубировали при 24°C в течение двух недель для обеспечения возможности развития побегов из трансформированных частей листьев N. tabacum.
Для получения укоренившихся трансгенных растений in vitro, здоровые зеленые побеги отрезали и поместили в MS-агаровую среду с добавлением 25 мкг/л IAA, 100 мг/л канамицина и 200 мг/л цефотаксима. После развития корней отдельные растения перенесли в почву и выращивали в теплице. Образцы листьев собрали на разных стадиях развития растения, включая до и во время цветения. Количественно определили общие жирные кислоты, полярные липиды и TAG, и определили их профили жирных кислот по ТСХ/ГХ, как описано в Примере 1.
Анализ трансформантов pJP3503
Для трансформации с pJP3503 («4-генный конструкт»), образцы листьев размером около 1 см2 получили из 30 первичных трансформантов до формирования цветочных почек и количественно определили концентрации TAG в образцах с помощью Iatroscan. Выбрали семь растений для дополнительного анализа, из которых пять продемонстрировали увеличение концентраций масла в листьях, а два продемонстрировали концентрации масла, по существу такие же, как и в растениях дикого типа. Высушенные замораживанием образцы листьев этих растений анализировали на общее содержание липидов и содержание TAG, а также на состав жирных кислот с помощью ТСХ и ГХ. Обнаружили, что трансформированные растения под номерами 4 и 29 обладают существенно повышенными концентрациями масла в листьях, по сравнению с диким типом, тогда как растение номер 21 продемонстрировало самые низкие концентрации TAG практически на уровне дикого типа (Таблица 30). Растения с номерами 11, 15 и 27 имели промежуточные концентрации масла в листьях. Обнаружили, что концентрации олеиновой кислоты в TAG обратно пропорциональны выходам TAG, что согласуется с результатами выполненного ранее эксперимента временной экспрессии в N. benthamiana.
Было обнаружено, что в трансформированных растениях с номерами 4 и 29 содержание масла в листьях (в процентах от сухого веса) существенно увеличилось во время цветения (Таблица 31). Данные в Таблице 31 показывают увеличение по меньшей мере в 1,7 и 2,4 раза для растений 4 и 29, соответственно. Таких изменений не наблюдали для растения 21, которое имело такую же концентрацию TAG, что и контроль дикого типа. Концентрации олеиновой кислоты в TAG фракциях, выделенных из каждого образца, следовали такой же схеме. На долю этой жирной кислоты пришлось до 22,1% от жирных кислот в TAG из растений 4 и 29, что в 17-18 больше, по сравнению с растением 21 и диким типом. Увеличение олеиновой кислоты сопровождалось повышением концентраций линолевой кислоты и пальмитиновой кислоты, тогда как концентрации α-линоленовой кислоты упали в 8 раз, по сравнению с концентрацией в растении 21 и в контроле дикого типа. В отличие от TAG, концентрации полярных липидов на стадии цветения немного снизились во всех трех линиях (Таблица 32). Изменения в концентрациях С18 мононенасыщенных и полиненасыщенных жирных кислот в фракциях полярных липидов трех линий были такими же, как и изменения состава TAG, хотя изменения олеиновой кислоты и линолевой кислоты были менее заметными. Существенные увеличения в общих липидах листьев наблюдали для линий 4 и 29 во время цветения, при этом концентрации достигли более 10% от сухого веса (Таблица 33). Концентрации общих липидов в листьях растения 21 до и во время цветения были такими же, что и концентрации, наблюдаемые в растениях дикого типа на той же стадии (Таблицы 33 и 35). Изменения в составе жирных кислот в общих липидах для всех трех растений были такими же в отношении состава жирных кислот TAG. Было обнаружено, что содержание масла в листьях растения 4 во время завязывания семян было дополнительно увеличено во время начала хлороза листьев. Наивысшие концентрации TAG листьев, обнаруженные на этой стадии, соответствовали 65-кратному увеличению по сравнению с листьями того же возраста растения 21 во время завязывания семян, и 130-кратному увеличению, по сравнению с такими же листьями цветущих растений дикого типа (Таблица 34; Фигура 18).
Повышенное содержание TAG в этом растении совпадает с повышенными концентрациями олеиновой кислоты. В отличие от растения 4, концентрации TAG в листьях в двух других первичных трансформантах и табаке дикого типа не увеличились или увеличились лишь незначительно после цветения и во время хлороза. Нижние листья растений 4 и 29 демонстрируют сниженные концентрации TAG при увядании. Во всех растения концентрации линолевой кислоты упали, тогда как концентрации α-линоленовой кислоты увеличивались с увеличением возраста листьев.
Согласуясь с повышенными концентрациями TAG, концентрации общих липидов в листьях растений 4 и 29 при завязывании семян дополнительно повысились, по сравнению с такими же листьями обоих растений при цветении (Таблицы 33 и 35). Наивысшая концентрация общих липидов, обнаруженная в растении 4 в пересчете на сухой вес, составила 15,8%, что эквивалентно 7,6- и 11,2-кратному увеличению, по сравнению с такими же листьями растения 21 и растений дикого типа, соответственно. Хотя состав жирных кислот в общих липидах листьев растения дикого типа и растения 21 был одинаковым, существенные отличия наблюдали в растениях 4 и 29. Эти изменения отражают изменения, обнаруженные в TAG обоих первичных трансформантов.
Интересно, что листья растений 4 и 29 до и во время завязывания семян характеризовались блестящей поверхностью, обеспечивая фенотипическое изменение, которое может служить в качестве фенотипа, который легко оценить визуально, что может облегчать определение времени сбора урожая для получения максимального содержания масла.
Таким образом, листья растений 4 и 29 быстро накапливали TAG во время цветения до момента завязывания семян. На последней стадии большинство листьев демонстрировали концентрации TAG от 7% до 13% в пересчете на сухой вес, по сравнению с 0,1% - 0,2% для линии 21. Эти наблюдаемые концентрации TAG и концентрации общих липидов значительно превышают концентрации, достигнутые учеными Andrianov et al., (2010), которые описали максимум 5,8% и 6,8% TAG в листьях N. tabacum при конститутивной экспрессии DGAT1 A. thaliana и индуцибельной экспрессии генов LEC2 A. thaliana.
Таблица 30. Процент TAG (весовой % от сухого веса листьев) и концентрации олеиновой кислоты (% от общих жирных кислот) в TAG, выделенных из листьев выбранных табачных растений, первично трансформированных pJP3503
Таблица 31. Концентрации TAG (весовой % от сухого веса листьев) и состав жирных кислот в TAG, выделенных из растений дикого типа и трех выбранных табачных растений, трансформированных pJP3503, до и во время цветения. Представленные данные представляют собой средние значения и стандартные отклонения для 2-3 независимых повторов
Таблица 32. Концентрации полярных липидов (весовой % от сухого веса листьев) и состав жирных кислот в полярных липидах ткани листьев из выбранных табачных растений, трансформированных pJP3503, до и во время цветения. Представленные данные представляют собой средние значения и стандартные отклонения для 2-3 независимых повторов, за исключением растения 21 (до цветения)
Таблица 33. Концентрации общих липидов (весовой % от сухого веса листьев) и состав жирных кислот в общих липидах листьев табачных растений, трансформированных pJP3503, непосредственно до и во время цветения. Данные демонстрируют средние значения для 2-3 образцов листьев
Таблица 34. Концентрации TAG (весовой % от сухого веса листьев) и состав жирных кислот TAG, выделенных из листьев различного возраста, после цветения, для трех выбранных табачных растений, трансформированных pJP3503
a: Образцы листьев взяли из дикого типа на стадии цветения и из трех первичных трансформантов pJP3503 во время завязывания семян.
b: стадии листа по цвету, обозначенные «G», зеленый; «YG», желто-зеленый; «Y», желтый
c: очень старый лист
Таблица 35. Выход общих липидов (весовой % от сухого веса листьев) и состав жирных кислот общих липидов, выделенных из листьев различного возраста дикого типа и трех выбранных табачных растений, трансформированных pJP3503
a: образцы взяли из растений, несущих многочисленные семянки, если не указано иное,b: до цветения, c: во время цветения
Анализ табачных растений, трансформированных pJP3502
Для трансформации с помощью pJP3502 («3-генный конструкт»), концентрацию сахарозы в MS-агаровой среде снизили до половины от стандартной концентрации до формирования достаточного каллюса, что способствовало выделению трансформантов, экспрессирующих WRI1. При трансформации с pJP3502 получили сорок один первичный трансформант и перенесли в теплицу. Образцы листьев разного возраста собрали во время цветения или на стадии завязывания семян (Таблица 36). Растения выглядели фенотипически нормальными, за исключением трех трансформантов, происходящих из того же каллюса в процедуре трансформации и поэтому, вероятно, из того же трансформационного события, которые были немного меньше и демонстрировали такой же фенотип блестящих листьев, как наблюдали для растения 4 с pJP3503 (выше), но в меньшей степени.
Образцы дисков листьев первичных трансформантов собрали во время цветения и количественно определили TAG, визуализируя йодным окрашиванием после ТСХ. Выбранные трансгенные растения, демонстрирующие повышенные концентрации TAG, по сравнению с контрольными растениями дикого типа, дополнительно более детально анализировали с помощью ТСХ и ГХ. Наивысшая концентрация TAG в молодых зеленых листьях была обнаружена в линии 8.1 и соответствовала 8,3% TAG в пересчете на сухой вес или приблизительно 83-кратное увеличение, по сравнению с листьями дикого типа того же возраста (Таблица 36). Желто-зеленые листья обычно содержали более высокое содержание масла, по сравнению с более молодыми зелеными листьями, с максимальными концентрациями TAG, наблюдаемыми в линии 14.1 (17,3% TAG в пересчете на сухой вес). Выполнили также количественное определение содержания общих липидов и состава жирных кислот общих липидов в листьях (Таблица 37).
Семена (семена Т1) собрали из первичных трансформантов на стадии созревания семян, и некоторые из них высеяли для получения Т1 растений. Предсказали, что эти растения будут сегрегирующими для данного трансгена, и, следовательно, ожидали некоторое количество «нулевых» сегрегантов в Т1 популяциях, которые могут служить в качестве подходящих отрицательных контролей в дополнение к известным растениям дикого типа, при выращивании в то же время и при тех же условиях. Анализировали 51 Т1 растение, полученное из первичного трансформанта 14.1, которое имело малокопийную вставку Т-ДНК, которое было возрастом 6-8 недель и высотой 10-25 см, вместе с 12 растениями дикого типа. Растения выглядели фенотипически нормальными, зелеными и здоровыми, и не были меньше, чем соответствующие растения дикого типа. Образцы листьев диаметром около 1 см получили из полностью распустившихся зеленых листьев. 30 растений Т1 продемонстрировали повышенные концентрации TAG в листьях, из них 8 растений продемонстрировали высокие концентрации TAG, примерно двукратную концентрацию TAG, по сравнению с первичным трансформантом 14.1 на той же стадии развития растения. Эти последние растения вероятно являются гомозиготными для трансгенов. Концентрации TAG и состав жирных кислот в TAG в листьях выбранных растений Т1 измерили с помощью загрузки липидов, выделенных из около 5 мг сухого веса ткани листьев, на каждую ТСХ полосу, данные представлены в Таблице 38.
Таблица 36. Концентрации TAG (масс. % от сухого веса листьев) и состав жирных кислот в TAG, выделенных из зеленых листьев десяти выбранных табачных растений, трансформированных с помощью pJP3502
a очень старое растение, имеющее только желтые листья
b завязывание семян («S»), цветение («F»), желтые или желтеющие листья («Y»)
Таблица 37. Общие липиды и состав жирных кислот в общих липидах, экстрагированных из желтых листьев из выбранных табачных растений, трансформированных с помощью pJP3502 (DGAT1+WRI1+олеозин)
Таблица 38. Концентрации TAG (весовой % от сухого веса листьев) и состав жирных кислот в TAG, выделенных из зеленых листьев из выбранных табачных растений Т1, трансформированных pJP3502
Генетические конструкты, пригодные для трансформации однодольных растений, получили заменой промоторов Arath-SSU в pJP3502 и pJP3503 на промоторы, активные в однодольных. Подходящие промоторы включают конститутивные вирусные промоторы из вирусов однодольных или промоторы, которые проявляют действие в трансгенном контексте в однодольных видах (например, промотор Ubi маиса, описанный в публикации Christensen et al., 1996). Точно так же, промоторы CaMV-35S в pJP3502 и pJP3503 заменили на промоторы, которые более активны в однодольных видах. Эти конструкты трансформировали в пшеницу, ячмень и маис, используя стандартные способы.
Виды мискантуса
Генетические конструкты для трансформации видов мискантуса получили заменой промоторов Arath-SSU в pJP3502 и pJP3503 на промоторы, более активные в Miscanthus. Подходящие промоторы включают конститутивные вирусные промоторы, убиквитиновый промотор (Christensen et al., 1996) или промоторы, которые, как было показано, проявляют функцию в трансгенном контексте в Miscanthus. Точно так же, промоторы CaMV-35S в pJP3502 и pJP3503 заменили на промоторы, которые более активны в Miscanthus. Новые конструкты трансформировали в Miscanthus с помощью способа бомбардировки микрочастицами, описанного авторами Wang et al., 2011.
Просо прутьевидное ( Panicum virgatum )
Генетические конструкты для трансформации проса прутьевидного получили заменой промоторов Arath-SSU в pJP3502 и pJP3503 на промоторы, более активные в просе прутьевидном. Подходящие промоторы включают конститутивные вирусные промоторы или промоторы, которые, как было показано, действуют в трансгенном контексте в просе прутьевидном (например, Mann et al., 2011). Точно так же, промоторы CaMV-35S в pJP3502 и pJP3503 заменили на промоторы, которые более активны в организме проса прутьевидного. Новые конструкты трансформировали в просо прутьевидное с помощью способа, опосредованного Agrobacterium, описанного в публикациях Chen et al., 2010 и Ramamoorthy and Kumar, 2012.
Сахарный тростник
Генетические конструкты для трансформации сахарного тростника получили заменой промоторов Arath-SSU в pJP3502 и pJP3503 на промоторы, более активные в сахарном тростнике. Подходящие промоторы включают конститутивные вирусные промоторы или промоторы, которые, как было показано, действуют в трансгенном контексте в сахарном тростнике (например, промотор Ubi маиса, описанный в публикации Christensen et al., 1996). Точно так же, промоторы CaMV-35S в pJP3502 и pJP3503 заменили на промоторы, которые более активны в сахарном тростнике. Новые конструкты трансформировали в сахарный тростник с помощью способа бомбардировки микрочастицами, описанного авторами Bower et al., 1996.
Слоновая трава
Генетические конструкты для трансформации Pennisetum purpureum получили заменой промоторов Arath-SSU в pJP3502 и pJP3503 на промоторы, более активные в слоновьей траве. Подходящие промоторы включают конститутивные вирусные промоторы или промоторы, которые, как было показано, обладают действием в трансгенном контексте в видах Pennisetum, таких как P. glaucum (например, промотор Ubi маиса, описанный в публикации Christensen et al., 1996). Точно так же, промоторы CaMV-35S в pJP3502 и pJP3503 заменили на промоторы, которые более активны в видах Pennisetum. Новые конструкты трансформировали в P. purpureum с помощью способа бомбардировки микрочастицами, описанного авторами Girgi et al., 2002.
Плевел
Генетические конструкты для трансформации Lolium perenne и других видов плевела получили заменой промоторов Arath-SSU в pJP3502 и pJP3503 на промоторы, более активные в плевеле. Подходящие промоторы включают конститутивные вирусные промоторы или промоторы, которые, как было показано, обладают действием в трансгенном контексте в видах Lolium (например, промотор Ubi маиса, описанный в публикации Christensen et al., 1996). Точно так же, промоторы CaMV-35S в pJP3502 и pJP3503 заменили на промоторы, которые более активны в видах Pennisetum. Новые конструкты трансформировали в Loliumperenne с помощью способа с использованием карбида кремния, описанного в публикации Dalton et al., 2002, или способа, опосредованного Agrobacterium, описанного в публикации Bettany et al., 2003.
pJP3502 и pJP3503 модифицировали для специфичной к семенам экспрессии генетических конструктов, заменив промоторы CaMV-35S и Arath-SSU (кроме кассеты селектируемого маркера) на специфичные к семенам промоторы, активные в заданных видах.
Канола
Генетические конструкты для трансформации Brassica napus получили заменой промоторов CaMV-35S и Arath-SSU в pJP3502 и pJP3503 на промоторы, более активные в каноле. Подходящие промоторы включают промоторы, которые, как было описано ранее, проявляют действие в трансгенном контексте в Brassica napus (например, промотор FAE1 A. thaliana, промотор напина Brassica napus, промоторы конлинин 1 и конлинин 2 Linum usitatissimum). Новые конструкты трансформировали в B. napus так, как описано ранее.
Соя ( Glycine max )
Генетический конструкт получили клонированием фрагмента PspOMI из синтезированного фрагмента ДНК, имеющей нуклеотидную последовательность, представленную в SEQ ID NO:415 (синергетическая вставка для сои; Фигура 19A), в бинарный вектор, такой как pORE04 в сайте NotI. Этот фрагмент содержит Arath-WRI1, экспрессируемый промотором Arath-FAE1, Arath-DGAT1, экспрессируемый промотором Linus-Cnl2, Musmu-MGAT2, экспрессируемый Linus-Cnl1, и Arath-GPAT4, экспрессируемый Linus-Cnl1. Дополнительный генетический конструкт получили заменой кодирующей области GPAT на кодирующую область олеозина. Дополнительный генетический конструкт получили делецией кассеты экспрессии MGAT.
Генетический конструкт, pJP3569 (Фигура 21), создали клонированием фрагмента SbfI-PstI из молекулы ДНК, имеющей нуклеотидную последовательность, представленную в SEQ ID NO:415, в сайт PstI pORE04. Этот конструкт содержал (i) кодирующую область, кодирующую фактор транскрипции WRI1 A. thaliana, кодон-оптимизированную для экспрессии в G. max, и экспрессируемую из промотора ингибитора трипсина Кунитца 3 G. max (Glyma-KTi3), (ii) кодирующую область, кодирующую DGAT2A Umbelopsis ramanniana (кодон-оптимизированную, как описано в публикации Lardizabal et al., 2008) и экспрессируемую из промотора альфа-субъединицы бета-конглицинина G. max (Glyma-b-конглицинин), и (iii) кодирующую область, кодирующую MGAT2 M. musculus, кодон-оптимизированную для экспрессии в G. max. Второй генетический конструкт, pJP3570, создали клонированием фрагмента SbfI-SwaI молекулы ДНК, имеющей нуклеотидную последовательность, представленную в SEQ ID NO:415, в pORE04 в сайтах EcoRV-PstI, с получением бинарного вектора, содержащего векторы, экспрессирующие фактор транскрипции WRI1 A. thaliana и фермент DGAT2A U. ramanniana. Точно так же, третий генетический конструкт, pJP3571, создали клонированием фрагмента AsiSI молекулы ДНК, имеющей нуклеотидную последовательность, представленную в SEQ ID NO:415, в сайт AsiSI pORE04, с получением бинарного вектора, содержащего ген, кодирующий фермент DGAT2A U. ramanniana enzyme. Четвертый генетический конструкт, pJP3572, создали клонированием фрагмента NotI молекулы ДНК, имеющей нуклеотидную последовательность, представленную в SEQ ID NO:415, в pORE04 в сайте NotI, с получением бинарного вектора, содержащего ген, экспрессирующий фактор транскрипции WRI1 A. thaliana. Пятый генетический конструкт, pJP3573, создали клонированием фрагмента SwaI молекулы ДНК, имеющей нуклеотидную последовательность, представленную в SEQ ID NO:415, в pORE04 в сайте EcoRV, с получением бинарного вектора, содержащего ген, кодирующий MGAT2 M. musculus.
Шестой генетический конструкт, pJP3580, создали заменой MGAT2 M. musculus на ген олеозина Sesamum indicum.
Каждый из этих шести конструктов использовали для трансформации сои, с помощью способов, описанных в Примере 6. Трансгенные растения, полученные трансформацией с каждым из этих конструктов, в частности, pJP3569, дали семена с повышенным содержанием масла.
Сахарная свекла
Векторы pJP3502 и pJP3503 (см. выше), использованные для трансформации табака, использовали для трансформации растений сахарной свеклы (Beta vulgaris) с помощью трансформации, опосредованной Agrobacterium, как описано авторами Lindsey & Gallois (1990). Эти растения вырабатывают значительно более высокие концентрации TAG в своих листьях, в такой же степени, что и табачные растения, полученные так, как описано выше. Трансгенные растения сахарной свеклы собрали в то время, когда их листья были еще зелеными или предпочтительно желто-зелеными, непосредственное перед началом увядания или на ранней стадии развития этого процесса, то есть пока содержание сахара в свекле было на высоком уровне, и после обеспечения возможности накопления TAG в листьях. Это обеспечило получение сахарной свеклы двойного назначения, которая пригодна для одновременного производства сахара из свеклы и липидов из листьев; липиды могут быть напрямую превращены в биодизельное топливо путем измельчения листьев и центрифугирования полученного материала для отделения масляной фракции, или могут быть использованы для непосредственного получения углеводов путем пиролиза лиственного материала.
Промоторы, которые активны в корнях (клубнях) сахарной свеклы, также используются для экспрессии трансгенов в клубнях.
Пример 21. Устойчивая трансформация Solanum tuberosum генами, повышающими содержание масла
pJP3502, промежуточный бинарный вектор экспрессии, описанный в предыдущем примере, модифицировали первоначальным вырезанием промотора SSU с помощью AscI+NcoI расщепления, и заменой его на промотор B33 картофеля, фланкированный AscI и NcoI, с образованием pJP3504. Промотор SSU в pJP3504 вместе с фрагментом гена WRL1 A. thaliana заменили в сайтах PspOMI на промотор B33 картофеля с тем же фрагментом гена WRL1 A. thaliana, фланкированным NotI-PspOMI, с получением pJP3506. pJP3347 добавили к pJP3506, как описано в представленном выше примере, с образованием pJP3507. Этот конструкт схематически изображен на Фигуре 20. Его последовательность представлена в SEQ ID NO:413. Этот конструкт использовали для трансформации картофеля (Solanum tuberosum) для повышения содержания масла в клубнях.
Пример 22. Гибридные ферменты GPAT-MGAT
Испытали ферментную активность слияний ферментов GPAT-MGAT для определения возможности повышения доступности GPAT-вырабатываемого MAG для активности MGAT. Сначала синтезировали подходящую линкерную область и клонировали в клонирующий вектор. Этот линкер содержал подходящие сайты для клонирования N-концевой (EcoRI-ZraI) и C-концевой кодирующей области (NdeI-SmaI или NdeI-PstI).
atttaaatgcggccgcgaattcgtcgattgaggacgtccctactagacctgctggacctcctcctgctacttactacgattctctcgctgtgcatatggtcagtcatgcccgggcctgcaggcggccgcatttaaat (SEQ ID NO:414)
Слияние GPAT4-MGAT2 (N-конец GPAT4 и С-конец MGAT2) получили первоначальным клонированием фрагмента ДНК, кодирующей GPAT4 A. thaliana, фланкированного сайтами MfeI и ZraI, и без С-концевого стоп-кодона, в сайты EcoRI-ZraI. Фрагмент ДНК, кодирующей MGAT2 M. musculus, фланкированный сайтами NdeI-PstI, затем клонировали в сайты NdeI-PstI для создания одной кодирующей последовательности GPAT4-MGAT2. Эту гибридную кодирующую последовательность затем клонировали как фрагмент NotI в pYES2 с получением pYES2::GPAT4-MGAT2, и в конститутивный бинарный вектор экспрессии pJP3343 с получением pJP3343::GPAT4-MGAT2.
Точно также, гибридизацию MGAT2-GPAT4 (N-конец MGAT2 и C-конец GPAT4) выполнили первоначальным клонированием фрагмента ДНК, кодирующей MGAT2 M. musculus, фланкированного сайтами EcoRI и ZraI, без С-концевого стоп-кодона, в сайты EcoRI-ZraI. Фрагмент ДНК, кодирующей GPAT4 A. thaliana, фланкированный сайтами NdeI-PstI, затем клонировали в сайты NdeI-PstI для создания одной кодирующей последовательности MGAT2-GPAT4. Эту гибридную кодирующую последовательность затем клонировали как фрагмент NotI в pYES2 с получением pYES2::MGAT2-GPAT4, и в конститутивный бинарный вектор экспрессии pJP3343 с получением pJP3343::MGAT2-GPAT4.
Дрожжевые векторы экспрессии испытали в дрожжах S. cerevisiae, а бинарные векторы испытали в N. benthamiana и сравнили по содержанию масла и составу с контрольными образцами с одной кодирующей областью.
Пример 23. Открытие новых последовательностей WRL1
Три новые последовательности WRL1 клонировали в pJP3343 и другие подходящие бинарные конститутивные векторы экспрессии, и испытали в N. benthamiana. Они включают гены, кодирующие Sorbi-WRL1 (из Sorghum bicolor; SEQ ID NO:334), Lupan-WRL1 (из Lupinus angustifolius; SEQ ID NO:335) и Ricco-WRL1 (из Ricinus communis; SEQ ID NO:336). Эти конструкты испытали в сравнении с геном, кодирующим WRI1 Arabidopsis, в анализе листьев N. benthamiana.
В качестве первоначальной стадии этого способа, частичный фрагмент кДНК, соответствующий WRL1, идентифицировали в базе данных EST развивающихся семян Lupinus angustifolius (NA-080818_Plate14f06.b1, SEQ ID NO:277). Затем выделили кДНК полной длины (SEQ ID NO:278), выполнив ПЦР с быстрой амплификацией 5'- и 3'-концов кДНК, используя вложенные праймеры и кДНК, выделенные из развивающихся семян Lupinus angustifolius. кДНК полной длины имела 1729 п.о. в длину, включая белковую кодирующую последовательность длиной 1284 п.о., кодирующую предсказанный полипептид из 428 аминокислот (SEQ ID NO:337). Затем полную кодирующую область кДНК WRL1 люпина полной длины ПЦР-амплифицировали с помощью прямых и обратных праймеров, которые были встроены в сайты рестрикции EcoRI, для облегчения клонирования в вектор pJP3343 под управлением промотора 35S в смысловой ориентации. Штаммом A. tumefaciens strain AGL1, несущим pJP3343-LuangWRL1, пропитали ткани листьев N. benthamiana, как описано в Примере 1. Затем диски листьев, временно экспрессирующие pJP3343-LuangWRL1 собрали и анализировали на содержание масла.
Пример 24. Сайленсинг гомолога CGI-58 в N. tabacum
Ученые James et al. (2010) описали, что сайленсинг гомолога CGI-58 A. thaliana приводит к 10-кратному накоплению TAG в листьях, в основном в виде липидных капель в цитозоле. Обнаружено также, концентрации галактолипидов повысились, тогда как концентрации большинства основных фосфолипидных частиц остались без изменений. Интересно, что концентрации TAG в семенах не изменились и, в отличие от других мутантов разрушения TAG, не наблюдали отрицательного влияния на прорастание семян.
Были обнаружены три транскрипта полной длины и два частичных транскрипта в транскриптоме N. benthamiana, демонстрирующих гомологию с геном CGI-58 A. thaliana. Область 434 п.о., которая содержится во всех пяти транскриптах, амплифицировали из выделенной РНК листьев N. benthamiana и клонировали с помощью LR-клонирования (Gateway) в заданный вектор pHELLSGATE12. Полученный вектор экспрессии, обозначенный pTV46, кодирует молекулу шпилечной РНК (дсРНК) для снижения экспрессии табачного гена, кодирующего гомолог CG1-58, и его использовали для трансформации N. tabacum, как описано в Примере 1, получив 52 первичных трансформанта.
Первичные трансформанты, демонстрирующие повышенные концентрации TAG в вегетирующих тканях, скрестили с гомозиготными линиями, описанными в Примере 20.
Пример 25. Сайленсинг малой субъединицы пирофосфорилазы АДФ-глюкозы (АГФазы) N. tabacum
Ученые Sanjaya et al. (2011) показали, что сайленсинг малой субъединицы АГФазы в комбинации со сверхэкспрессией WRI дополнительно увеличивает накопление TAG в проростках A. thaliana при снижении концентраций крахмала. Малую субъединицу АГФазы клонировали из цветочных почек (Kwak et al., 2007). Расшифрованная аминокислотная последовательность показала 87% идентичность с АГФазой A. thaliana. Синтезировали фрагмент размером 593 п.о. и клонировали в pHELLSGATE12 с помощью LR-клонирования (Gateway), получив бинарный вектор pTV35. Трансформацию N. tabacum выполнили так, как описано в Примере 1, и получили 43 первичных трансформанта.
Первичные трансформанты, демонстрирующие снижение общих концентраций крахмала в листьях, скрестили с гомозиготными линиями, описанными в Примерах 20 и 21. Кроме того, первичные трансформанты скрестили с гомозиготными линиями, которые являются результатом скрещивания линий, описанных в 20 и 21.
Пример 26. Получение и использование конструктов для генных комбинаций, содержащих индуцибельный промотор
Получили дополнительные генетические конструкты, используя систему индуцибельного промотора для осуществления экспрессии по меньшей мере одного из генов в комбинации генов, описанной выше, в частности, в pJP3503 и pJP3502. В модифицированных конструктах ген WRI1 экспрессируется индуцибельным промотором, таким как промотор alcA Aspergilus niger, в присутствии экспрессированного гена alcR Aspergilus niger. Альтернативно, экспрессировали DGAT с помощью индуцибельного промотора. Это является преимущественным при отсутствии необходимости максимального накопления TAG во всех временных точках в ходе развития. Система индуцибельного промотора или система промотора, контролируемая стадией развития, предпочтительно для движения фактора транскрипции, такого как WRI1, обеспечивает возможность возникновения фенотипа с высоким содержанием TAG на соответствующей стадии развития и последующего накопления TAG до высоких концентраций.
TAG можно дополнительно повысить совместной экспрессией факторов транскрипции, включая эмбриогенные факторы транскрипции, такие как LEC2 или BABY BOOM (BBM, Srinivasan et al., 2007). Они экспрессируются под управлением индуцибельных промоторов, как описано выше, и супер-трансформируются в трансгенных линиях или совместно трансформируются с WRI и DGAT.
pJP3590 получили клонированием спейсера MAR как фрагмента AatII в сайт AatII pORE04. pJP3591 получили клонированием второго спейсера MAR как фрагмента anKpnI в сайт KpnI pJP3590. pJP3592 получили клонированием фрагмента AsiSI-SmaI молекулы ДНК, имеющей нуклеотидную последовательность, представленную в SEQ ID NO:416 (12ABFJYC_pJP3569_insert; Фигура 19B), в сайты AsiSI-EcoRV pJP3591. pJP3596 получили клонированием PstI-фланкированной индуцибельной кассеты экспрессии, содержащей промотор alcA, экспрессирующий MGAT2 M. musculus и сигнал полиаденилирования лектина Glycine max, во внедренный сайт SbfI в pJP3592. Гигромицин-устойчивые версии pJP3592 и pJP3596 (pJP3598 и pJP3597, соответственно) получили заменой селектируемого маркерного гена NPTII на HPH фланкированный ген в сайтах FseI-AscI.
Эти конструкты использовали для трансформации тех же видов растений, которые описаны в Примере 20. Экспрессию из индуцибельного промотора повысили обработкой индуктором трансгенных растений после того, как они практически выросли, чтобы они могли накапливать повышенные концентрации TAG. Эти конструкты также супер-трансформировали в устойчиво трансформированные конструкты, уже содержащие конструкт, повышающий содержание масла, включая трехгенную или четырехгенную область ТДНК (SEQ ID NO:411 и SEQ ID NO:412, соответственно). Альтернативно, кассеты генной экспрессии из трехгенных и четырехгенных конструктов клонировали в сайты NotI pJP3597 и pJP3598 для получения комбинированной конститутивной и индуцибельной векторной системы для высокого синтеза жирных кислот и TAG, их накопления и хранения.
Кроме других индуцибельных промоторов, альтернатива заключается в том, что генная экспрессия может быть временно и пространственно ограничена с помощью промоторов, которые являются активными только во время определенных периодов развития или только в специфических тканях. Эндогенные химически индуцибельные промоторы также используются для ограничения экспрессии до конкретных диапазонов стадий развития.
Специалистам в данной области понятно, что могут быть сделаны многочисленные изменения и/или модификации настоящего изобретения, показанного в конкретных вариантах реализации, без отклонения от общей идеи или рамок настоящего изобретения, описанного в широком смысле. Следовательно, представленные варианты реализации следует рассматривать во всех отношениях как иллюстративные, а не ограничивающие.
В настоящей заявке заявляется приоритет по US 61/580590, поданной 27 декабря 2011 года, и US 61/718563, поданной 25 октября 2012 года, полное содержание каждой из которых включено в настоящий документ посредством ссылки.
Все публикации, рассмотренные и/или упомянутые в настоящем документе, включены в настоящий документ в полном объеме.
Любое рассмотрение документов, актов, материалов, устройств или тому подобного, которое включено в настоящее описание, представлено исключительно для целей представления контекста настоящего изобретения. Их не следует рассматривать как допущение того, что любой или все из этих вопросов являются частью известного уровня техники или общеизвестных знаний в области, к которой относится настоящее изобретение, по состоянию до даты приоритета каждого пункта формулы изобретения данной заявки.
ССЫЛКИ
Abdullah et al. (1986) Biotech. 4:1087.
Al-Mariri et al. (2002) Infect. Immun. 70:1915-1923.
Alemanno et al. (2008) Planta 227:853-866.
Almeida and Allshire (2005) TRENDS Cell Biol. 15:251-258.
Alonso et al. (2010) Green Chem. 12:1493-1513.
Alvarez et al. (2000) Theor. Appl. Genet. 100:319-327.
Andrianov et al. (2010) Plant Biotech. J. 8:277-287.
Barthole et al. (2011) Plant Sci. 185-186:33-39.
Bartlett et al. (2008) Plant Methods 4:22.
Baud et al. (2007) Plant J. 50:825-838.
Baumlein et al. (1991) Mol. Gen. Genet. 225:459-467.
Baumlein et al. (1992) Plant J. 2:233-239.
Benghezal et al. (2007) J. Biol. Chem. 282:30845-30855.
Bettany et al. (2003) Plant Cell Rep. 21:437-444.
Bligh and Dyer (1959) Canadian Journal of Biochemistry and Physiology 37:911-917.
Bohner et al. (1999) Plant J. 19:87-95.
Bourque (1995) Plant Sci. 105:125-149.
Boutilier et al. (2002) Plant Cell 14:1737-1749.
Bouvier-Nave et al. (2000) European Journal of Biochemistry/FEBS 267:85-96.
Bower et al. (1996) Mol. Breed. 2: 239-249.
Bradford (1976) Anal. Biochem. 72:248-254.
Broothaerts et al. (2005) Nature 433:629-633.
Broun et al. (1998) Plant J. 13:201-210.
Bruce et al. (2000) P. Plant Cell 12:65-80.
Buchanan-Wollaston (1994) Plant Physiol. 105:839-846.
Busk et al. (1997) Plant J. 11:1285-1295.
Cadwell and Joyce (1992) PCR Methods Appl. 2:28-33.
Cao et al. (2003) J. Biol. Chem. 278:13860-13866.
Cao et al. (2007) J. Lipid Res. 48:583-591.
Capuano et al. (2007) Biotechnol. Adv. 25:203-206.
Cernac and Benning (2004) Plant J. 40:575-585
Chen et al. (2010) Biotechnol.for Biofuels. 3:9.
Cheng et al. (1996) Plant Cell Rep. 15:653-657.
Cheng et al. (2003) J. Biol. Chem. 278, 13611-13614.
Chikwamba et al. (2003) Proc. Natl. Acad. Sci. U.S.A. 100:11127-11132.
Christensen and Quail (1996) Transgenic Res. 5:213-218.
Christie (1993) Advances in Lipid Methodology - Two, Oily Press, Dundee, pages 195-213.
Chung et al. (2006) BMC Genomics 7:120.
Clough and Bent (1998) Plant J. 16:735-743.
Coco et al. (2001) Nature Biotechnology 19:354-359.
Coco et al. (2002) Nature Biotechnology 20:1246-1250.
Comai et al. (2004) Plant J37: 778-786.
Corrado and Karali (2009) Biotechnol. Adv. 27:733-743.
Courvalin et al. (1995) Life Sci. 318:1207-1212.
Coutu et al. (2007) Transgenic Res. 16:771-781.
Crameri et al. (1998) Nature 391:288-291.
Dalton et al. (1998) Plant Science 132:31-43.
Dandik and Aksoy (1998) Fuel Process Technol. 57: 81-92.
Darji et al. (1997) Cell 91:765-775.
Dauk et al (2007) Plant Sci. 173:43-49.
Deshpande (1992) Appl. Biochem. Biotechnol. 36:227-234.
Dhadialla et al. (1998) Annu. Rev. Entomol. 43:545-569.
Dietrich et al. (1998) Nature Biotech. 18:181-185.
Dulermo and Nicaud (2011) Metab. Eng. 13:482-491.
Durrett et al. (2008) Plant J. 54:593-607.
Dyer et al. (2002) Plant Physiol. 130:2027-2038.
Eggert et al. (2005) Chembiochem 6:1062-1067.
Ellerstrom et al. (1996) Plant Mol. Biol. 32:1019-1027.
Endalew et al. (2011) Biomass and Bioenergy 35:3787-3809.
Felenbok (1991) J. Biotechnol. 17:11-17.
Fennelly et al. (1999) J. Immunol. 162:1603-1610.
Froissard et al. (2009) FEMS Yeast Res 9:428-438.
Fujimura et al. (1985) Plant Tissue Culture Lett. 2:74.
Gan (1995) Molecular characterization and genetic manipulation
of plant senescence. PhD thesis. University of Wisconsin, Madison.
Gan and Amasino (1995) Science 270:1986-1988
Gatz (1997) Annu. Rev. Plant Physiol. Plant Mol. Biol. 48:89-108.
Ghosal et al. (2007) Biochimica et Biophysica Acta 1771:1457-1463.
Ghosh et al. (2009) Plant Physiol. 151:869-881.
Girgi et al. (2002) Molecular Breeding 10:243-252.
Glevin et al. (2003) Microbiol. Mol. Biol. Rev. 67:16-37.
Goffman et al. (2005) Plant Physiol. 138:2269-2279.
Gong and Jiang (2011) Biotechnol. Lett. 33:1269-1284.
Gould et al. (1991) Plant Physiol. 95:426-434.
Grant et al. (1995) Plant Cell Rep. 15:254-258.
Greenwell et al. (2010) J. R. Soc. Interface 7:703-726.
Grillot-Courvalin et al. (1999) Curr. Opin. Biotech. 10(5):477-481.
Grillot-Courvalin et al. (1998) Nature Biotech. 16:862-866.
Gurel et al. (2009) Plant Cell Rep. 28:429-444.
Harayama (1998) Trends Biotechnol. 16: 76-82.
Haseloff and Gerlach (1988) Nature 334:585-591.
Hellinga (1997) Proc. Natl. Acad. Sci. 94:10015-10017.
Henikoff et al. (2004) Plant Physiol135: 630-636.
Hense et al. (2001) Cell Microbiol. 3:599-609.
Hershey and Stoner (1991) Plant Mol. Biol. 17:679-690.
Hinchee et al. (1988) Biotechnology 6:915-922.
Hirayama and Hujii (1965) Agricultural and Biological Chemistry 29:1-6.
Horvath et al. (2000) Proc. Natl. Acad. Sci. U.S.A. 97:1914-1919.
Huang (1996) Plant Physiol. 110:1055-1061.
Iwabuchi et al. (2003) J. Biol. Chem. 278:4603-4610.
Izawati et al. (2009) J. Oil Palm Res. 21:643-652.
James et al. (2010) Proc. Natl. Acad. Sci.USA 107:17833-17838.
Jepson et al. (1994) Plant Mol. Biol. 26:1855-1866.
Jézéquel et al. (2008) Biotechniques 45:523-532.
Joviet et al. (2004) Plant Physiol. Biochem. 42:501-509.
Karmakar et al. (2010) Bioresource Technology 101:7201-7210.
Kindle (1990) Proc. Nat. Acad. Sci. USA 87: 1228-1232.
Klein et al. (1998) Exp. Neurol. 150:183-194.
Knothe (2005) Fuel Process. Technol. 86:1059-1070.
Knothe and Steidley (2005) Fuel 84:1059-1065.
Koziel et al. (1996) Plant Mol. Biol. 32:393-405.
Kuhn et al. (2009) J. Biol. Chem. 284:34092-102.
Kunik et al. (2001) Proc. Natl. Acad. Sci. U.S.A. 98:1871-1876.
Kwak et al. (2007) Plant Physiol. 145:277-289.
Lacroix et al. (2008) Proc. Natl. Acad. Sci.U.S.A. 105: 15429-15434.
Lakshminarayana et al. (1984) JAOCS 61:1249-1253.
Lam et al. (2010) Biotechnol. Adv. 28:500-18.
Lardizabal et al. (2001) J. Biol. Chem. 276:38862-38869.
Lardizabal et al. (2008) Plant Physiol. 148: 89-96.
Larkin et al. (1996) Transgenic Res. 5:325-335.
Lee et al. (1998) Science 280:915-918.
Leung et al. (1989) Technique 1:11-15.
Li et al. (1996) FEBS Lett. 379:117-121.
Li et al. (2006) Phytochemistry 67: 904-915.
Li et al. (2007) Proc. Natl. Acad. Sci. U S A. 104:18339-44.
Lin et al. (2005) Plant Physiol. Biochem. 43:770-776.
Lindsey and Gallois (1990) Journal of Experimental Botany 41:529-536.
Liu et al. (2010a) Fuel 89:2735-2740.
Liu et al. (2010b) Plant Physiol. Biochem. 48: 9-15.
Lui et al. (2009) J. Agric. Food Chem. 57: 2308-2313.
Maher and Bressler (2007) Bioresource Technology 98:2351-2368.
Mann et al. (2011) BMC Biotechnol. 11:74.
Martinez and Jepson, Ecdysteroid agonist-inducible control of gene expression in plants. In Inducible Gene Expression in Plants. Edited by Reynolds PHS. New York: CABI Publishing;1999:23-41.
Martinez et al. (1999) Plant J. 19:97-106.
Matsuoka et al. (1994) Plant J. 6:311-319.
Meier et al. (1997) FEBS Lett. 415:91-95.
Mett et al. (1993) Proc. Natl. Acad. Sci. USA 90:4567-4571.
Millar and Waterhouse (2005). Funct Integr Genomics 5:129-135.
Murashige and Skoog (1962) Physiologia Plantarum 15:473-497.
Needleman and Wunsch (1970) J. Mol Biol. 45: 443-453
Ness et al. (2002) Nature Biotechnology 20:1251-1255.
Niedz et al. (1995) Plant Cell Reports 14:403-406.
Ostermeier et al. (1999) Nature Biotechnology 17:1205-1209.
Ow et al. (1986) Science 234:856-859.
Padidam (2003) Curr. Opin. Plant Biol. 6:169-77.
Padidam et al. (2003) Transgenic Res. 12:101-9.
Panekina (1978) Chemistry of Natural Compounds 14:33-36.
Parthibane et al. (2012) J. Biol. Chem. 287:1946-54.
Pasquinelli et al. (2005). Curr Opin Genet Develop 15:200-205.
Perez-Vich et al. (1998) JAOCS 75:547-555
Perriman et al. (1992) Gene 113:157-163.
Perrin et al. (2000) Mol Breed 6:345-352.
Perry and Harwood (1993) Phytochemistry33:329-333.
Phillips et al. (2002) Journal of Food Composition and Analysis 12:123-142.
Picard (1994) Cur. Top. Biotech. 5:511-515.
Pigeaire et al. (1997) Mol. Breed. 3:341-349.
Potenza et al. (2004) In Vitro Cell Dev. Biol. Plant 40:1-22.
Powell et al. (1996)Vaccines 183, Abstract.
Prasher et al. (1985) Biochem. Biophys. Res. Commun. 127:31-36.
Qiu et al. (2001) J. Biol. Chem. 276:31561-3156
Ramamoorthy and Kumar (2012) Plant Cell Rep. 31:1923-1931.
Riddiford et al. (2000) Vitam. Horm. 60:1-73.
Rossell and Pritchard (1991) Analysis of Oilseeds, Fats and Fatty Foods. Elsevier
Ruuska et al. (2002) Plant Cell 14:1191-1206.
Ryan et al. (1984) J. Am. Oil Chem. Soc. 61:1610-1619.
Saha et al. (2006) Plant Physiol. 141:1533-1543.
Sanjaya et al. (2011) Plant Biotech. J. 9:874-883.
Schaffner (1980) Proc. Natl. Acad. Sci. U.S.A. 77:2163-2167.
Science Publishers Ltd: London (Chapter 2, pp.48-53).
Scott et al. (2010) Plant Biotechnol. J. 8(8):912-27
Semwal et al. (2011) Bioresource Technology 102:2151-2161.
Senior (1998) Biotech. Genet. Engin. Revs. 15:79-119.
Shiau et al. (2001) Vaccine 19:3947-3956.
Shiina et al. (1997) Plant Physiol. 115:477-483.
Shimada and Hara-Nishimura (2010) Biol. Pharm. Bull. 33:360-363.
Shippy et al., (1999) Mol. Biotech. 12:117-129.
Sieber et al. (2001) Nature Biotechnology 19:456-460.
Siloto et al. (2009) Lipids 44:963-973.
Sizemore et al. (1995) Science 270:299-302.
Slade and Knauf (2005) Transgenic Res.14: 109-115.
Smith et al. (2000) Nature 407:319-320.
Srinivasan et al. (2007) Planta 225:341-51.
Stalker et al. 1988 Science 242: 419-423.
Stemmer (1994a) Proc. Natl. Acad. Sci. USA 91:10747-10751.
Stemmer (1994b) Nature 370(6488):389-391.
Stobart et al. (1997) Planta 203:58-66.
Tan et al. (2011) Plant Physiol. 156:1577-1588.
Taylor (1997) The Plant Cell 9:1245-1249.
Thillet et al. (1988) J. Biol. Chem 263:12500-12508.
Tingay et al. (1997) Plant J. 11:1369-1376.
Toriyama et al. (1986) Theor. Appl. Genet. 73:16-19.
Tumaney et al. (2001) J. Biol. Chem. 276:10847-10852.
Tzfira and Citovsky (2006) Curr. Opin. Biotech. 17:147-154.
Ulmasov et al. (1995) Plant Physiol. 108:919-927.
Unger et al. (2002) Transgenic Res. 11:455-465.
van de Loo et al. (1995) Proc Natl Acad Sci U S A. 92:6743-6747.
Voinnet et al. (2003) Plant J. 33:949-956.
Volkov et al. (1999) Nucleic Acids Research 27(18):e18.
Wang et al. (2011) J. Agric. Food Chem. 60:144-52.
Waterhouse et al. (1998). Proc. Natl. Acad. Sci. USA 95:13959-13964.
Weinmann et al. (1994) Plant J. 5:559-569.
Weiss (2003) Int. J. Med. Microbiol. 293:95-106.
Weselake et al. (2009) Biotechnology Advances 27:866-878.
Winans et al. (1988) Journal of Bacteriology 170:4047-4054.
Wood et al. (2009). Plant Biotech. J. 7: 914-924.
Wood et al., manuscript in preparation
Yang et al. (2003) Planta 216:597-603.
Yang et al. (2010) PNAS 107:12040-12045.
Yen and Farese (2003) J. Biol. Chem. 278:18532-18537.
Yen et al. (2002) Proc. Natl. Acad. Sci. U.S.A. 99:8512-8517.
Yen et al. (2005) J. Lipid Res. 46: 1502-1511.
Zhang et al. (1999a) Plant Cell Reports 18:959-966.
Zhang et al. (1999b) Plant Cell, Tissue and Organ Culture 56:37-46.
Zhao et al. (1998) Nature Biotechnology 16:258-261.
Zheng et al. (2003) The Plant Cell 15:1872-1887.
Zolotukhin et al. (1996) J. Virol. 70:4646-4654.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ЛИПИДОВ | 2012 |
|
RU2656996C2 |
| Способы получения липидов | 2011 |
|
RU2636344C2 |
| РАСТЕНИЯ С МОДИФИЦИРОВАННЫМИ ПРИЗНАКАМИ | 2017 |
|
RU2809117C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ ПРОМЫШЛЕННЫХ ПРОДУКТОВ ИЗ РАСТИТЕЛЬНЫХ ЛИПИДОВ | 2015 |
|
RU2743384C2 |
| АНАЛИЗ ДИАЦИЛГЛИЦЕРИН-АЦИЛТРАНСФЕРАЗЫ | 2005 |
|
RU2415946C2 |
| ГЕНЫ ДИАЦИЛГЛИЦЕРОЛ-АЦИЛТРАНСФЕРАЗЫ И ИХ ИСПОЛЬЗОВАНИЕ | 2010 |
|
RU2514655C2 |
| ГЛИЦЕРОЛ-3-ФОСФАТАЦИЛТРАНСФЕРАЗА | 2010 |
|
RU2499835C1 |
| ФЕРМЕНТАТИВНАЯ ОБРАБОТКА МАСЕЛ | 2004 |
|
RU2377307C2 |
| ДЕЛЬТА-5-ДЕСАТУРАЗА И ЕЕ ПРИМЕНЕНИЕ ДЛЯ ПОЛУЧЕНИЯ ПОЛИНЕНАСЫЩЕННЫХ ЖИРНЫХ КИСЛОТ | 2007 |
|
RU2469092C2 |
| ПОЛУЧЕНИЕ ДГК И ДРУГИХ ДЦ-ПНЖК В РАСТЕНИЯХ | 2012 |
|
RU2644241C2 |
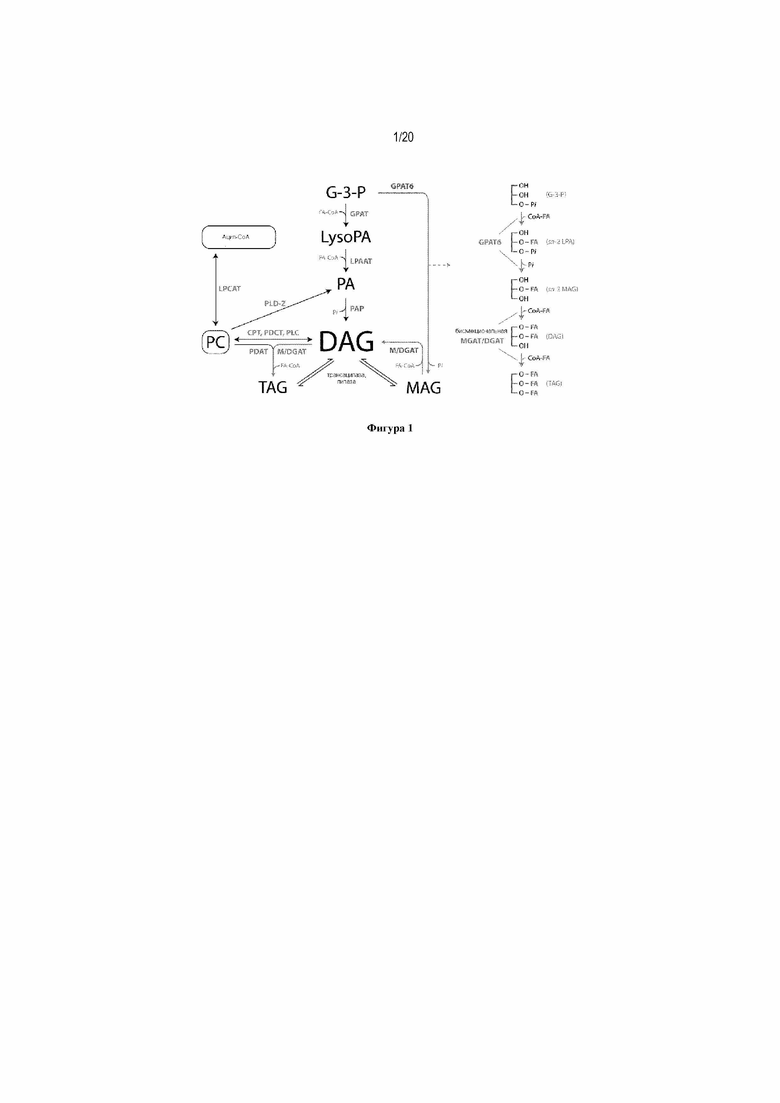

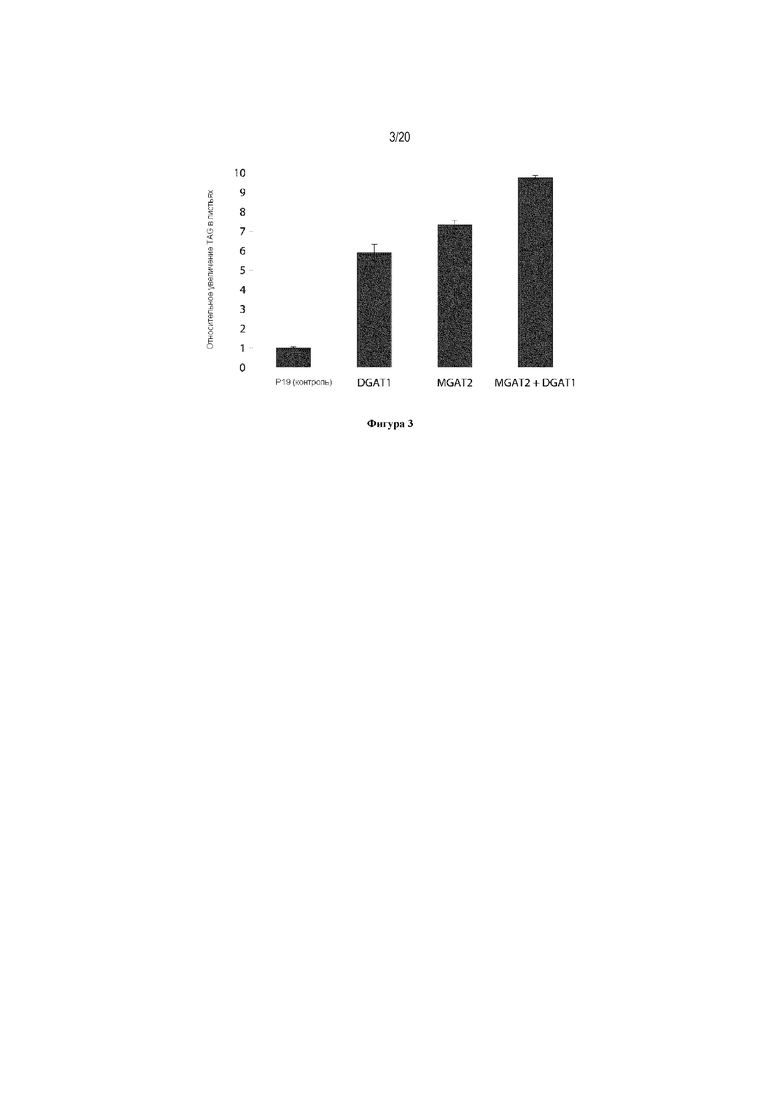
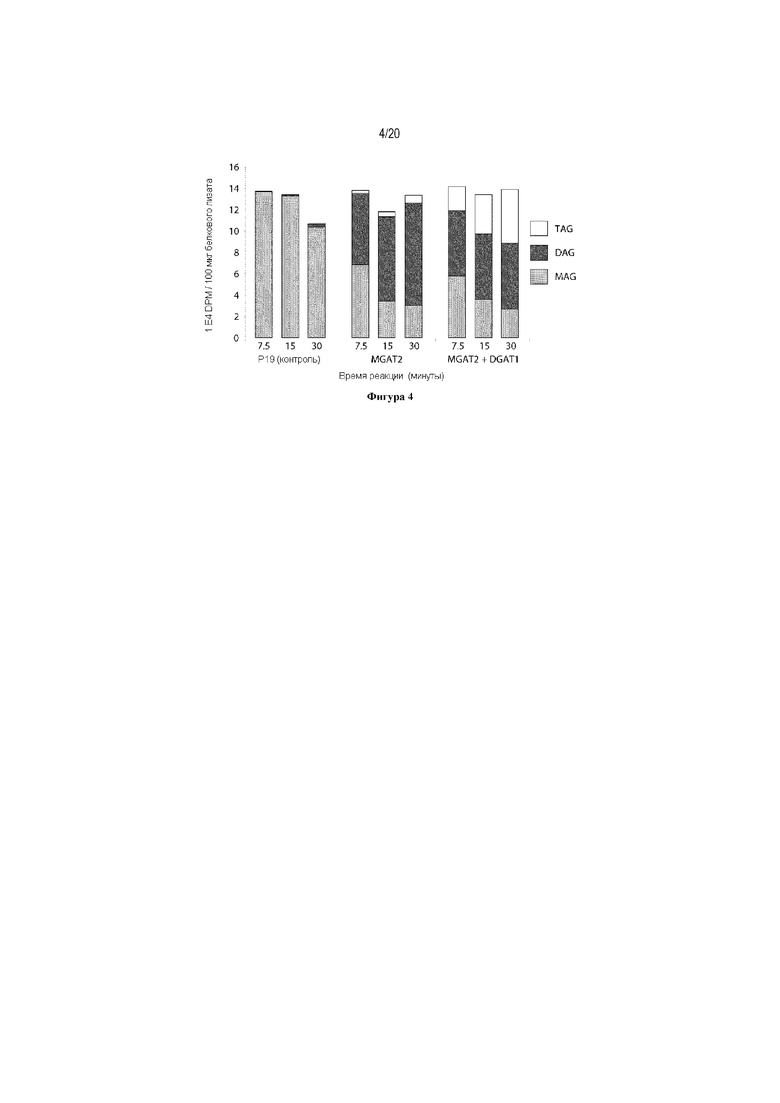
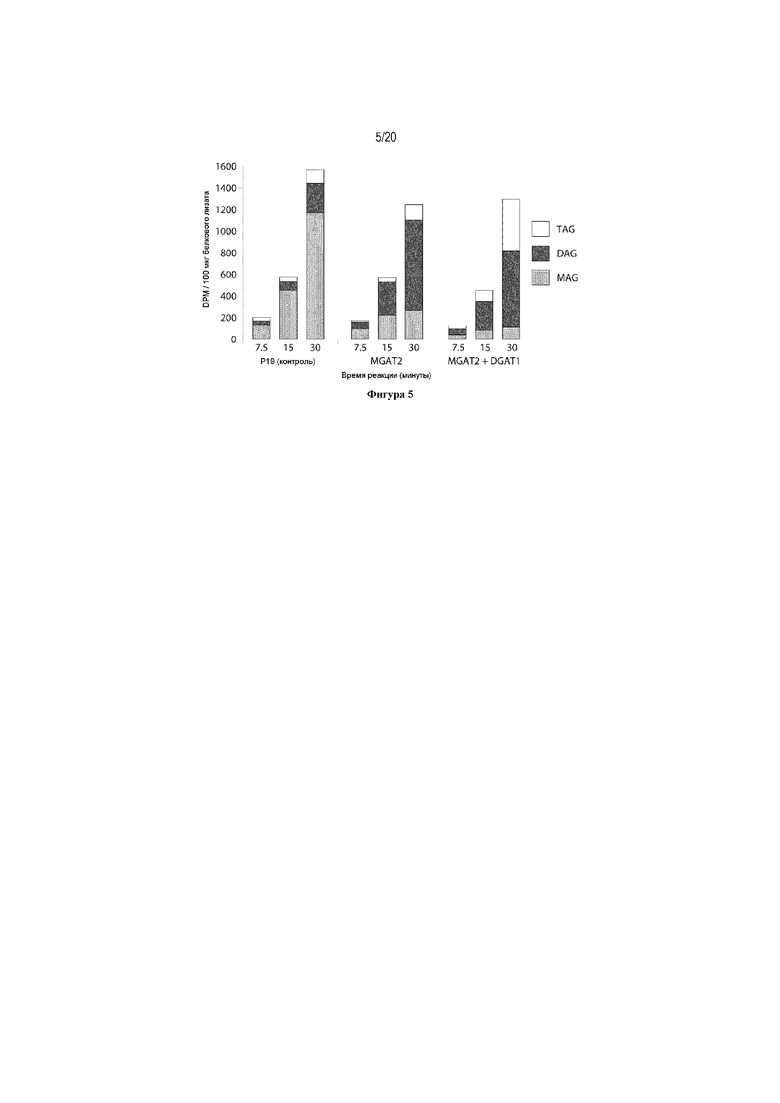
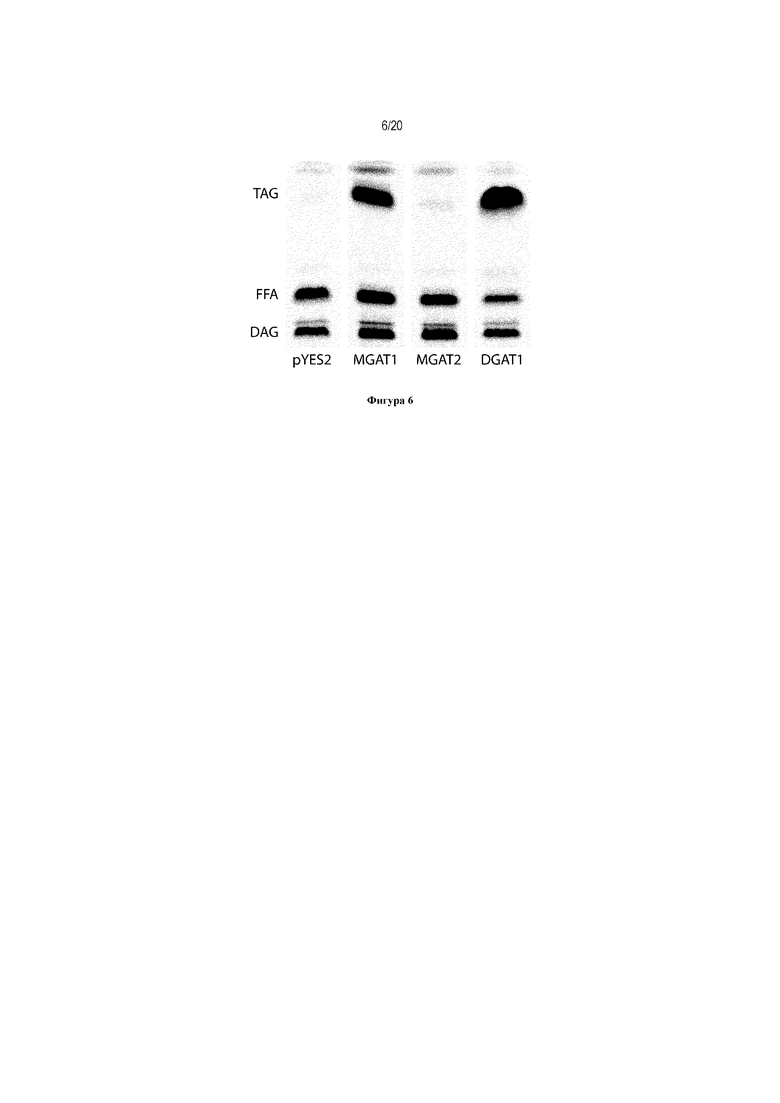
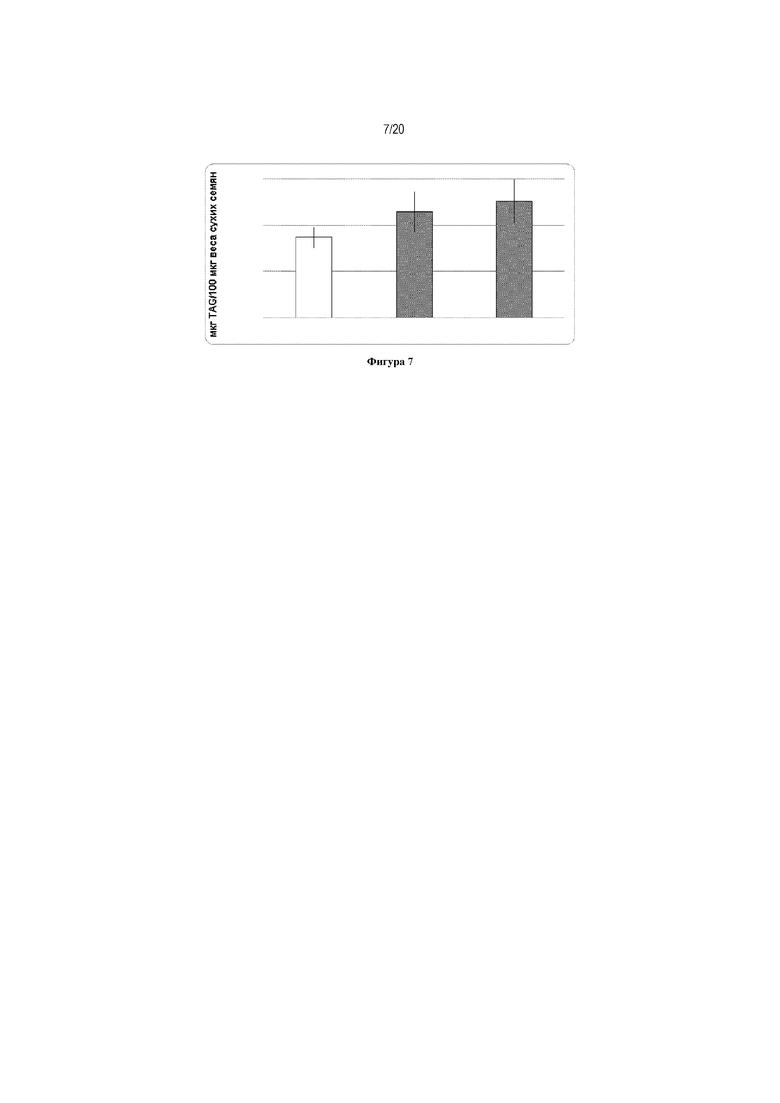
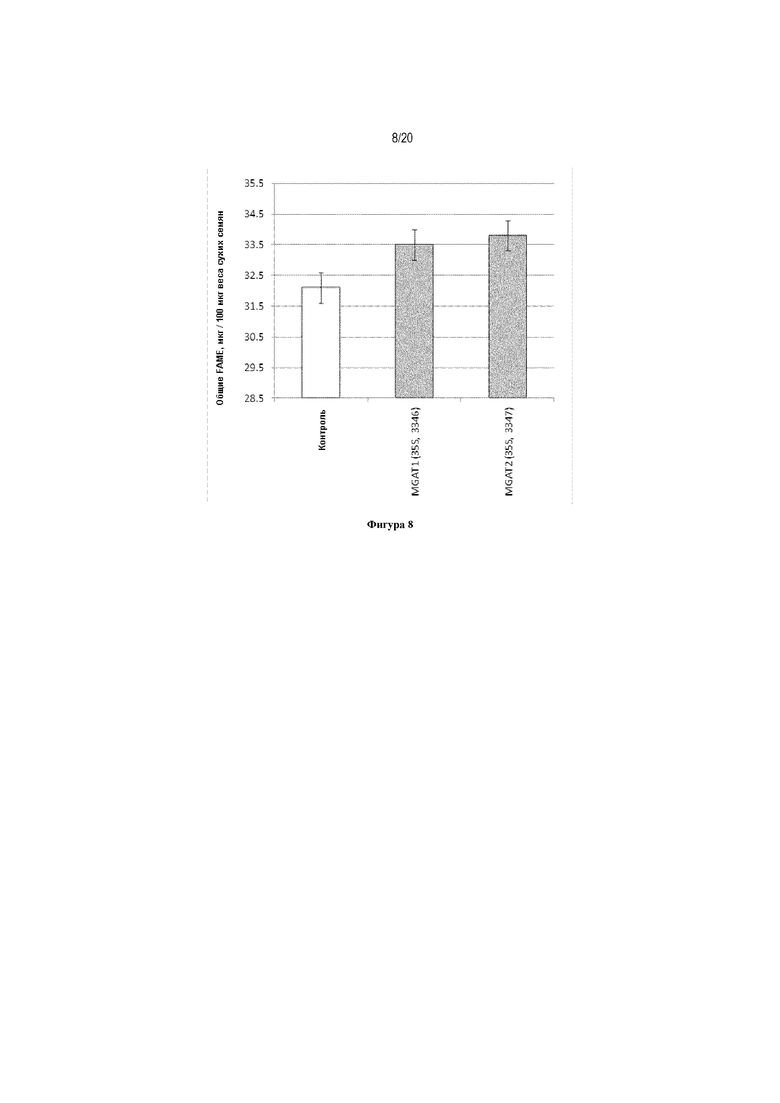
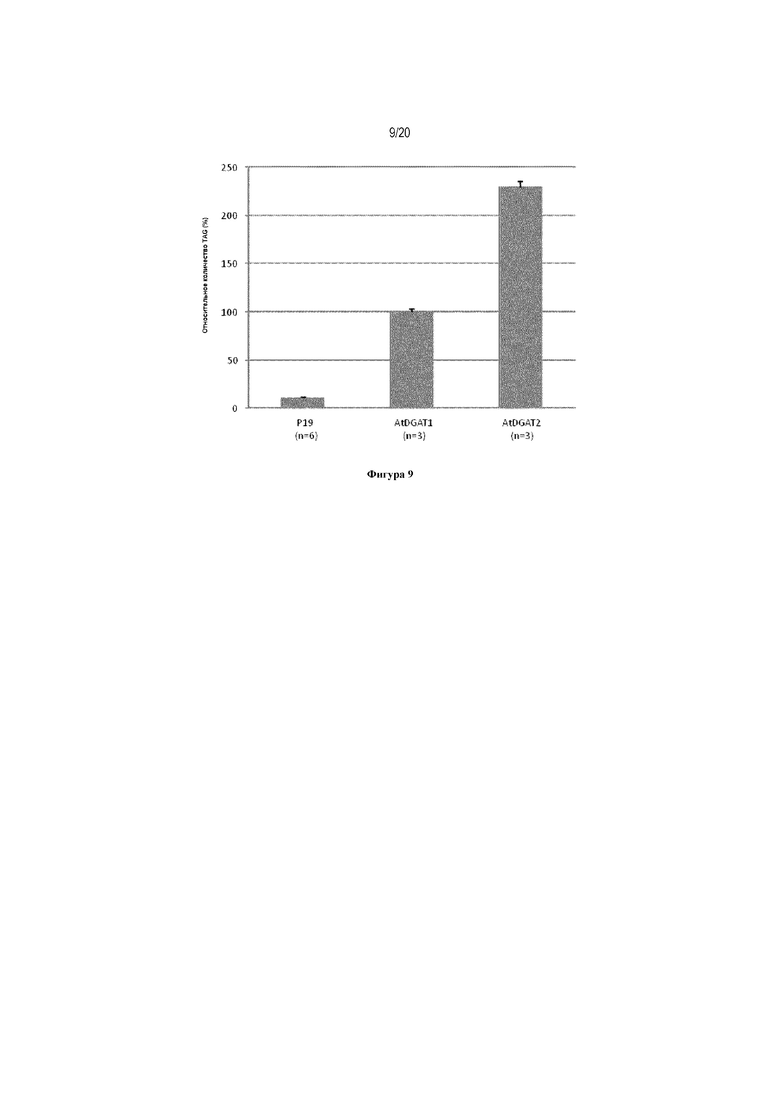

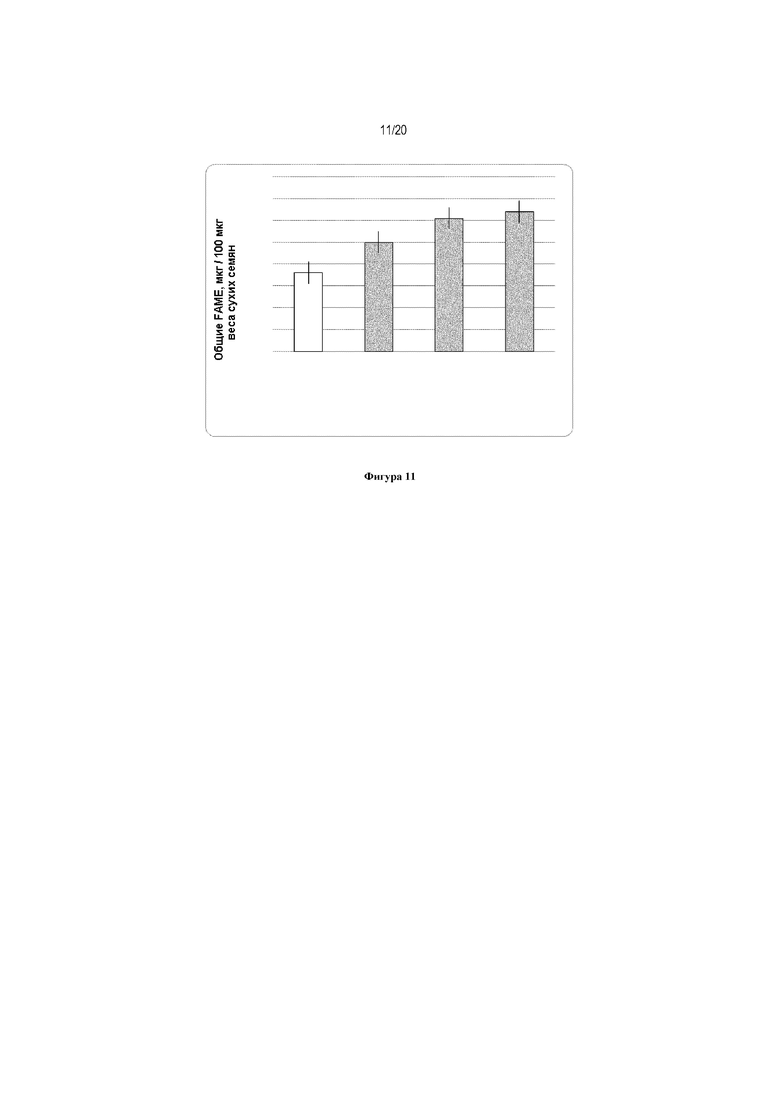

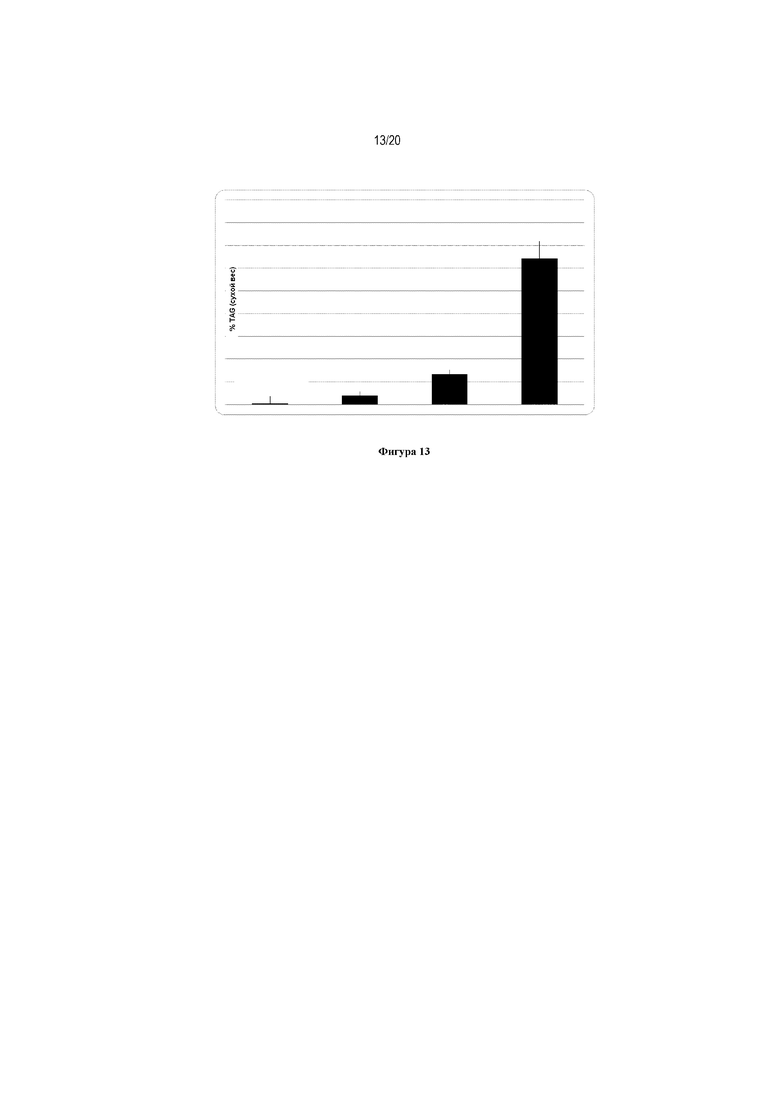


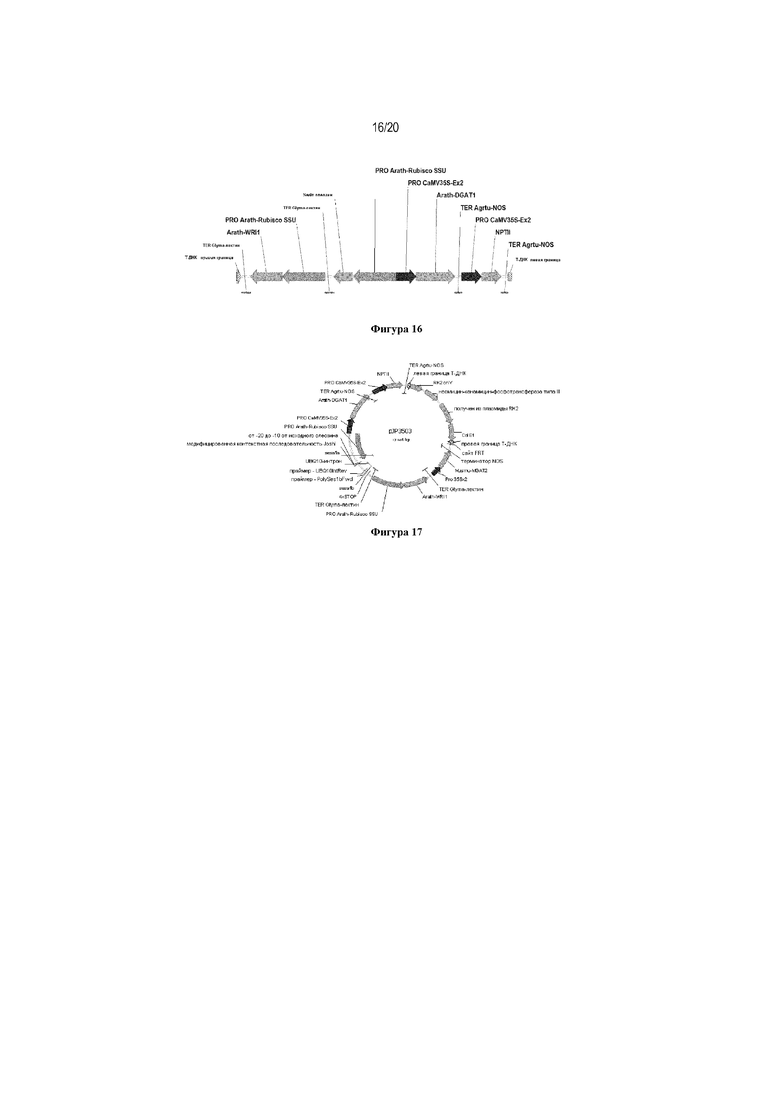

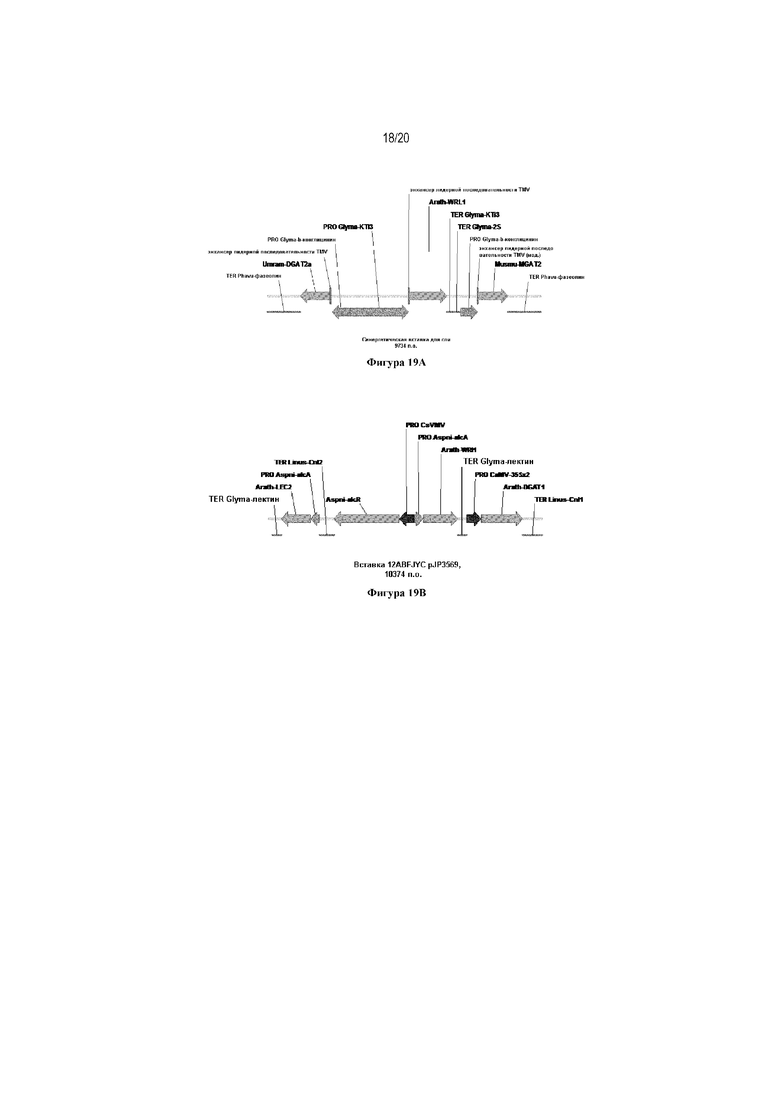

Изобретение относится к области биохимии, в частности к трансгенному растению, для получения неполярных липидов. Также раскрыты часть и семя трансгенного растения для получения неполярного липида, рекомбинантная клетка для получения неполярного липида. Раскрыт способ получения углеводного продукта, экстрагированного липида из указанного трансгенного растения, способ получения клетки, которая продуцирует повышенную концентрацию неполярного липида, способ получения синтетического дизельного топлива из указанного трансгенного растения. Изобретение позволяет увеличивать концентрацию неполярных липидов в трансгенном растении. 8 н. и 68 з.п. ф-лы, 22 ил., 38 табл., 26 пр.
1. Трансгенное растение для получения неполярных липидов, содержащее один или более экзогенных полинуклеотидов и имеющее повышенный уровень одного или более неполярных липидов по сравнению с соответствующим растением, не имеющим одного или более экзогенных полинуклеотидов, где один или более экзогенных полинуклеотидов содержат первый экзогенный полинуклеотид, который кодирует первый полипептид ацилтрансферазы жирной кислоты и один или более дополнительных экзогенных полинуклеотидов, кодирующих одно или более из следующего:
(i) двухцепочечную молекулу РНК, которая ингибирует экспрессию гена, кодирующего полипептид сахарозависимой триацилглицерин-липазы 1 (SDP1),
(ii) второй полипептид ацилтрансферазы жирных кислот или
(iii) полипептид, который стабилизирует один или более неполярных липидов, такой как олеозин,
где каждый из одного или более экзогенных полинуклеотидов функционально связан с промотором, который способен направлять экспрессию полинуклеотида в растении.
2. Растение по п. 1, где вегетирующая часть растения имеет общее содержание неполярных липидов 5-25% (масс./масс. из расчета на сухой вес).
3. Растение по п.1, которое представляет собой растение канолы, содержащее семена канолы, содержание масла в которых составляет по меньшей мере 45% по массе.
4. Растение по п.1, которое представляет собой растение кукурузы, содержащее семена кукурузы, содержание масла в которых составляет по меньшей мере 5% по массе.
5. Растение по п.1, которое представляет собой растение сои, содержащее семена сои, содержание масла в которых составляет по меньшей мере 20% по массе.
6. Растение по п.1, которое представляет собой растение арахиса, содержащее орехи арахиса, содержание масла в которых составляет по меньшей мере 50% по массе.
7. Растение по п.1, которое представляет собой растение подсолнечника, содержащее семена подсолнечника, содержание масла в которых составляет по меньшей мере 50% по массе.
8. Растение по п.1, которое представляет собой растение хлопчатника, содержащее семена хлопчатника, содержание масла в которых составляет по меньшей мере 41% по массе.
9. Растение по п.1, которое представляет собой сафлоровое растение, содержащее семена сафлора, содержание масла в которых составляет по меньшей мере 35% по массе.
10. Растение по п.1, которое представляет собой растение льна, содержащее семена льна, содержание масла в которых составляет по меньшей мере 36% по массе.
11. Растение по п.1, которое представляет собой растение Camelina sativa, содержащее семена Camelina sativa, содержание масла в которых составляет по меньшей мере 36% по весу.
12. Часть трансгенного растения по п.1 или 2 для получения неполярного липида, где часть содержит один или более экзогенных полинуклеотидов и имеющая повышенный уровень одного или более неполярных липидов, по сравнению с частью соответствующего растения, не имеющего одного или более экзогенных полинуклеотидов, где один или более экзогенных полинуклеотидов содержат первый экзогенный полинуклеотид, который кодирует первый полипептид ацилтрансферазы жирной кислоты, и один или более дополнительных экзогенных полинуклеотидов, кодирующих одно или более из следующего:
(i) двухцепочечную молекулу РНК, которая ингибирует экспрессию гена, кодирующего полипептид сахарозависимой триацилглицерин-липазы 1 (SDP1),
(ii) второй полипептид ацилтрансферазы жирных кислот или
(iii) полипептид, который стабилизирует один или более неполярных липидов, такой как олеозин,
где каждый из одного или более экзогенных полинуклеотидов функционально связан с промотором, который способен направлять экспрессию полинуклеотида в части растении.
13. Растение по п.1 или часть растения по п.12, которое обладает одной или обеими из следующих характеристик:
(i) по меньшей мере 20% (мол.%), по меньшей мере 22% (мол.%), по меньшей мере 30% (мол.%), по меньшей мере 40% (мол.%), по меньшей мере 50% (мол.%) или по меньшей мере 60% (мол.%), предпочтительно по меньшей мере 65% (мол.%) или по меньшей мере 66% (мол.%) от общих жирных кислот в содержании липидов в растении или части растения составляет олеиновая кислота, где олеиновая кислота находится в эстерифицированной или неэстерифицированной форме, и
(ii) по меньшей мере 20% (мол.%), по меньшей мере 22% (мол.%), по меньшей мере 30% (мол.%), по меньшей мере 40% (мол.%), по меньшей мере 50% (мол.%) или по меньшей мере 60% (мол.%), предпочтительно по меньшей мере 65% (мол.%) или по меньшей мере 66% (мол.%) от общих жирных кислот в содержании неполярных липидов в растении или части растения составляет олеиновая кислота, где олеиновая кислота находится в эстерифицированной форме в неполярном липиде.
14. Растение по п.1 или часть растения по п.12, которая является членом популяции или группы по меньшей мере из около 1000 таких растений или частей.
15. Растение по п.1, которое является частью популяции по меньшей мере из около 1000 растений, каждое из которых является растением по п.1, растущим в поле.
16. Часть растения по п.12, которая находится в группе по меньшей мере из около 1000 частей растений, каждая из которых является частью растения по п.12, где части растений собраны из растений, растущих в поле.
17. Растение по п.1 или часть растения по п.12, где применимо одно или более из следующего:
(i) вегетативная часть растения имеет общее содержание неполярных липидов по меньшей мере 7% (масс./масс. из расчета на сухой вес),
(ii) вегетативная часть растения имеет общее содержание неполярных липидов от 5 до 25% (масс./масс. из расчета на сухой вес),
(iii) общее содержание жирных кислот в липиде растения или части растения составляет по меньшей мере на 2% больше олеиновой кислоты и/или по меньшей мере на 2% меньше пальмитиновой кислоты, чем в липиде в соответствующем растении или части растения, не содержащей одного или более экзогенных полинуклеотидов,
(iv) общее содержание жирных кислот в неполярном липиде растения или части растения составляет по меньшей мере на 2% больше олеиновой кислоты и/или по меньшей мере на 2% меньше пальмитиновой кислоты, чем в неполярном липиде в соответствующем растении или части растения, не содержащей одного или более экзогенных полинуклеотидов,
(v) неполярный липид (липиды) содержит измененную концентрацию общих стеролов, предпочтительно свободных стеролов, стероиловых эфиров и/или стероил-гликозидов, и
(vi) неполярный липид содержит по меньшей мере 90% триацилглицеринов (TAG).
18. Часть растения по п.12, где часть растения представляет собой вегетирующую часть растения, такую как наземная часть растения или зеленая часть, такая как лист или стебель.
19. Растение по п.1 или часть растения по п.12, где растение представляет собой Acrocomia aculeate (пальма макауба), Arabidopsis thaliana, Aracinis hypogaea (арахис), Astrocaryum murumuru (мурумуру), Astrocaryum vulgare (тукума), Attalea geraensis (Indaia-rateiro), Attalea humilis (американская масличная пальма), Attalea oleifera (andaia), Attalea phalerata (урикури), Attalea speciosa (бабассу), Avena sativa (овес), Beta vulgaris (сахарная свекла), виды Brassica, такие как Brassica carinata, Brassica juncea, Brassica napobrassica, Brassica napus (канола), Camelina sativa (ложный лен), Cannabis sativa (конопля), Carthamus tinctorius (сафлор), Caryocar brasiliense (кариокар), Cocos nucifera (кокосовый орех), Crambe abyssinica (абиссинская капуста), Cucumis melo (дыня), Elaeis guineensis (африканская пальма), Glycine max (соя), Gossypium hirsutum (хлопок), виды Helianthus, такие как Helianthus annuus (подсолнечник), Hordeum vulgare (ячмень), Jatropha curcas (лекарственный орех), Joannesia princeps (ореховое дерево арара), виды Lemna (ряска), такие как Lemna aequinoctialis, Lemna disperma, Lemna ecuadoriensis, Lemna gibba (ряска горбатая), Lemna japonica, Lemna minor, Lemna minuta, Lemna obscura, Lemna paucicostata, Lemna perpusilla, Lemna tenera, Lemna trisulca, Lemna turionifera, Lemna valdiviana, Lemna yungensis, Licania rigida (ойтикика), Linum usitatissimum (лен), Lupinus angustifolius (люпин), Mauritia flexuosa (пальма бурити), Maximiliana maripa (пальма инайа), виды Miscanthus, такие как Miscanthus x giganteus и Miscanthus sinensis, виды Nicotiana (табак), такие как Nicotiana tabacum или Nicotiana benthamiana, Oenocarpus bacaba (bacaba-do-azeite), Oenocarpus bataua(patauã), Oenocarpus distichus (bacaba-de-leque), виды Oryza (рис), такие как Oryza sativa и Oryza glaberrima, Panicum virgatum (просо прутьевидное), Paraqueiba paraensis (марь), Persea amencana (авокадо), Pongamia pinnata (индийский бук), Populus trichocarpa, Ricinus communis (клещевина обыкновенная), виды Saccharum (сахарный тростник), Sesamum indicum (кунжут), Solanum tuberosum (картофель), виды Sorghum, такие как Sorghum bicolor, Sorghum vulgare, Theobroma grandiforum (купуасу), виды Trifolium, Trithrinax brasiliensis (бразильская игольчатая пальма), виды Triticum (пшеница), такие как Triticum aestivum и Zea mays (кукуруза).
20. Растение по п.1 или часть растения по п.12, где общее содержание стерола и/или композиции в неполярных липидах существенно отличается от общего содержания стерола и/или композиции в неполярных липидах в соответствующем растении или части растения, не содержащего одного или более экзогенных полинуклеотидов.
21. Растение по п.1 или часть растения по п.12, в котором повышенная концентрация одного или более неполярного липида (липидов) является такой, что применима одна или более или все из следующих характеристик:
(i) концентрация по меньшей мере на 0,5% больше в весовом выражении, чем концентрация в соответствующем растении или части растения, не содержащего одного или более экзогенных полинуклеотидов,
(ii) концентрация по меньшей мере на 1% больше в относительном выражении, чем в соответствующем растении или части растения, не содержащего одного или более экзогенных полинуклеотидов,
(iii) общее содержание неполярных липидов в растении или части растения по меньшей мере на 0,5% больше в весовом выражении, чем содержание в соответствующем растении или части растения, соответсвенно, не содержащего одного или более экзогенных полинуклеотидов,
(iv) общее содержание неполярных липидов в растении или части этого растения по меньшей мере на 1% больше в относительном выражении, чем содержание в соответствующем растении или части растения, соответвенно, не содержащего одного или более экзогенных полинуклеотидов, и
(v) концентрация одного или более неполярного липида (липидов) и/или общее содержание неполярных липидов в растении или части растения по меньшей мере на 0,5% больше в весовом выражении и/или по меньшей мере на 1% больше в относительном выражении, чем в соответствующем растении или части растения, соответсвенно, не содержащего одного или более экзогенных полинуклеотидов, и содержащего экзогенный полинуклеотид, кодирующий диацилглицерин-ацилтрансферазу DGAT1 Arabidopsis thaliana.
22. Растение по п.1 или часть растения по п.12, которое имеет следующие характеристики:
(i) содержание TAG, которое по меньшей мере на 10% больше в относительном выражении, чем содержание TAG, в соответствующем растении или части растения, не содержащего одного или более экзогенных полинуклеотидов, и/или
(ii) общее содержание полиненасыщенных жирных кислот (PUFA), которое уменьшено по сравнению с общим содержанием PUFA в соответствующем растении или части растения, не содержащего одного или более экзогенных полинуклеотидов.
23. Растение по п.1 или часть растения по п.12, которое содержит повышенный уровень PUFA по сравнению с уровнем PUFA в соответствующем растении или части растения, не содержащего одного или более экзогенных полинуклеотидов, где PUFA представляет собой эйкозадиеновую кислоту, арахидоновую кислоту (ARA), альфа-линоленовую кислоту (ALA), стеаридоновую кислоту (SDA), эйкозатриеновую кислоту (ETE), эйкозатетраеновую кислоту (ETA), эйкозапентаеновую кислоту (EPA), докозапентаеновую кислоту (DPA), докозагексаеновую кислоту (DHA) или комбинацию двух или более из них.
24. Растение по п.1 или часть растения по п.12, в котором полипептид ацилтрансфераза жирной кислоты имеет активность диацилглицерин-ацилтрансферазы (DGAT), активность моноацилглицерин-ацилтрансферазы (MGAT), активность глицерин-3-фосфат-ацилтрансферазы (GPAT), активность фосфолипид-диацилглицерин-ацилтрансферазы (PDAT) или активность ацилтрансферазы лизофосфатидной кислоты (LPAAT).
25. Растение по п.1 или часть растения по п.12, в котором полипептид ацилтрансфераза жирной кислоты имеет активность диацилглицерин-ацилтрансферазы (DGAT).
26. Растение по п.1 или часть растения по п.12, в отношении которого применима одна или обе из следующих характеристик:
(i) второй полипептид ацилтрансфераза жирной кислоты имеет активность диацилглицерин-ацилтрансферазы (DGAT), активность моноацилглицерин-ацилтрансферазы (MGAT) или активность глицерин-3-фосфат-ацилтрансферазы (GPAT) и
(ii) полипептид, который стабилизирует один или более неполярных липидов, представляет собой олеозин, такой как полиолеозин или калеозин, предпочтительно полиолеозин.
27. Растение по п.1 или часть растения по п.12, в котором один или более экзогенных полинуклеотидов кодируют одну или более или любую комбинацию из следующего:
(i) DGAT,
(ii) MGAT,
(iii) GPAT,
(iv) MGAT и DGAT,
(v) MGAT и GPAT,
(vi) DGAT и GPAT,
(vii) MGAT, GPAT и DGAT,
(viii) MGAT и олеозин,
(ix) GPAT и олеозин,
(x) DGAT и олеозин,
(xi) DGAT, MGAT и олеозин,
(xii) DGAT, GPAT и олеозин и
(xiii) MGAT, GPAT и олеозин,
где каждый экзогенный полинуклеотид функционально связан с промотором, который способен направлять экспрессию полинуклеотида в растении или части растения.
28. Растение или часть растения по п.27, в котором
(i) GPAT также обладает активностью фосфатазы для выработки MAG, такой как полипептид, имеющий аминокислотную последовательность GPAT4 или GPAT6 Arabidopsis, и/или
(ii) DGAT представляет собой DGAT1 или DGAT2, и/или
(iii) MGAT представляет собой MGAT1 или MGAT2.
29. Растение или часть растения по п.27, в отношении которого применима одна или более из следующих характеристик:
i) один или более экзогенных полинуклеотидов, кодирующих DGAT и олеозин, функционально связан с конститутивным промотором или промотором, активным в зеленых тканях растения, по меньшей мере до и вплоть до цветения, который способен направлять экспрессию полинуклеотида (полинуклеотидов) в растении или части растения,
ii) один или более экзогенных полинуклеотидов, кодирующих молекулу РНК, которая ингибирует экспрессию гена, кодирующего SDP1 триацилглицерин полипептид, функционально связан с конститутивным промотором, промотором активным в зеленых тканях растения, по меньшей мере до и вплоть до цветения, или с индуцибельным промотором, который способен направлять экспрессию полинуклеотида в растении или части растения, и
iii) один или более экзогенных полинуклеотидов, кодирующих MGAT, функционально связан с индуцибельным промотором, который способен направлять экспрессию полинуклеотида в растении или части растения.
30. Растение по п.1 или часть растения по п.12, в котором вегетативная растительная часть имеет общее содержание неполярных липидов по меньшей мере около 10%, более предпочтительно по меньшей мере около 11%, более предпочтительно по меньшей мере около 12%, более предпочтительно по меньшей мере около 13%, более предпочтительно по меньшей мере около 14% или более предпочтительно - по меньшей мере около 15% (масс./масс. из расчета на сухой вес).
31. Растение по п.1 или часть растения по п.12, в котором вегетативная часть растения имеет общее содержание TAG по меньшей мере около 7%, более предпочтительно по меньшей мере около 10%, более предпочтительно по меньшей мере около 11%, более предпочтительно по меньшей мере около 12%, более предпочтительно по меньшей мере около 13%, более предпочтительно по меньшей мере около 14%, более предпочтительно по меньшей мере около 15% или более предпочтительно по меньшей мере около 17% (масс./масс. из расчета на сухой вес).
32. Растение по п.1 или часть растения по п.12, в котором первый полипептид ацилтрансферазы жирных кислот представляет собой DGAT, такой как DGAT1, и где полипептид, который стабилизирует один или более неполярных липидов, представляет собой олеозин, где растение или часть растения обладает одной или более или всеми из следующих характеристик:
i) общее содержание липидов составляет по меньшей мере 8%, по меньшей мере 10%, по меньшей мере 12%, по меньшей мере 14% или по меньшей мере 15,5% по массе,
ii) имеет по меньшей мере в 3 раза, по меньшей мере в 5 раз, по меньшей мере в 7 раз, по меньшей мере в 8 раз или по меньшей мере в 10 раз более высокое общее содержание липидов в растении или части растения по сравнению с соответствующим растением или частью растения, не содержащего одного или более экзогенных полинуклеотидов,
iii) общее содержание TAG составляет по меньшей мере 10%, по меньшей мере 12,5%, по меньшей мере 15% или по меньшей мере 17% (масс./масс. из расчета на сухой вес),
iv) имеет по меньшей мере в 40 раз, по меньшей мере в 50 раз, по меньшей мере в 60 раз или по меньшей мере в 70 раз или по меньшей мере в 100 раз более высокое общее содержание TAG по сравнению с соответствующим растением или частью растения, не содержащего экзогенный(е) полинуклеотид(ы),
v) олеиновая кислота составляет по меньшей мере 15%, по меньшей мере 19% или по меньшей мере 22% (масс./масс. из расчета на сухой вес) жирных кислот в TAG,
vi) имеет по меньшей мере в 10 раз, по меньшей мере в 15 раз или по меньшей мере в 17 раз более высокую концентрацию олеиновой кислоты в TAG по сравнению с соответствующим растением или частью растения, не содержащего одного или более экзогенных полинуклеотидов,
vii) пальмитиновая кислота составляет по меньшей мере 20%, по меньшей мере 25%, по меньшей мере 30% или по меньшей мере 33% (мас.) жирных кислот в TAG,
viii) имеет по меньшей мере в 1,5 раза более высокий уровень пальмитиновой кислоты в TAG по сравнению с соответствующим растением или частью растения, не содержащего одного или более экзогенных полинуклеотидов,
ix) линолевая кислота составляет по меньшей мере 22%, по меньшей мере 25%, по меньшей мере 30% или по меньшей мере 34% (по массе) жирных кислот в TAG,
x) α-линоленовая кислота составляет менее 20%, менее 15%, менее 11% или менее 8% (по массе) жирных кислот в TAG и
xi) имеет по меньшей мере в 5 раз или по меньшей мере в 8 раз более низкую концентрацию α-линоленовой кислоты в TAG по сравнению с соответствующим растением или частью растения, не содержащего одного или более экзогенных полинуклеотидов.
33. Растение или часть растения по п.27, в котором экзогенный полинуклеотид, кодирующий DGAT, содержит одно или более из следующего:
i) нуклеотиды, последовательность которых представлена как любая из SEQ ID NO: 204-211, 338-346,
ii) нуклеотиды, кодирующие полипептид, содержащий аминокислоты, последовательность которых представлена как любая из SEQ ID NO: 83, 212-219, 347-355, или его биологически активный фрагмент,
iii) нуклеотиды, последовательность которых по меньшей мере на 30% идентична i) или ii), и
iv) полинуклеотид, который гибридизуется с любым из i) - iii) в жестких условиях.
34. Растение или часть растения по п.27, в котором экзогенный полинуклеотид, кодирующий MGAT, содержит одно или более из следующего:
i) нуклеотиды, последовательность которых представлена как любая из SEQ ID NO: 1- 44,
ii) нуклеотиды, кодирующие полипептид, содержащий аминокислоты, последовательность которых представлена как любая из SEQ ID NO: 45-82, или его биологически активный фрагмент,
iii) нуклеотиды, последовательность которых по меньшей мере на 30% идентична i) или ii), и
iv) полинуклеотид, который гибридизуется с любым из i) - iii) в жестких условиях.
35. Растение или часть растения по п.27, в котором экзогенный полинуклеотид, кодирующий GPAT, содержит одно или более из следующего:
i) нуклеотиды, последовательность которых представлена как любая из SEQ ID NO: 84-143,
ii) нуклеотиды, кодирующие полипептид, содержащий аминокислоты, последовательность которых представлена как любая из SEQ ID NO: 144-203, или его биологически активный фрагмент,
iii) нуклеотиды, последовательность которых по меньшей мере на 30% идентична i) или ii), и
iv) полинуклеотид, который гибридизуется с любым из i) - iii) в жестких условиях.
36. Растение или часть растения по п.27, в котором экзогенный полинуклеотид, кодирующий DGAT2, содержит одно или более из следующего:
i) нуклеотиды, последовательность которых представлена как любая из SEQ ID NO: от 204 до 211,
ii) нуклеотиды, кодирующие полипептид, содержащий аминокислоты, последовательность которых представлена как любая из SEQ ID NO: от 212 до 219, или его биологически активный фрагмент,
iii) нуклеотиды, последовательность которых по меньшей мере на 30% идентична i) или ii), и
iv) полинуклеотид, который гибридизуется с любым из пунктов i) - iii) в строгих условиях.
37. Растение или часть растения по п.27, в котором экзогенный полинуклеотид, кодирующий олеозин, содержит одно или более из следующего:
i) нуклеотиды, последовательность которых представлена как любая из SEQ ID NO: 389-408,
ii) нуклеотиды, кодирующие полипептид, содержащий аминокислоты, последовательность которых представлена как любая из SEQ ID NO: 362-338, или его биологически активный фрагмент,
iii) нуклеотиды, последовательность которых по меньшей мере на 30% идентична i) или ii), и
iv) полинуклеотид, который гибридизуется с любым из i) - iii) в жестких условиях.
38. Растение по п.1 или часть растения по п.12, которое содержит:
(i) одну или более введенных мутаций в гене, который кодирует эндогенный фермент в растении или части растения, и/или
(ii) экзогенный полинуклеотид, который понижающе регулирует выработку и/или активность эндогенного фермента в растении или части растения,
где каждый эндогенный фермент выбран из группы, состоящей из DGAT, sn-1 глицерин-3-фосфат-ацилтрансферазы (sn-1 GPAT), 1-ацил-глицерин-3-фосфат-ацилтрансферазы (LPAAT), ацил-CoA:лизофосфатидилхолин-ацилтрансферазы (LPCAT), фосфатазы фосфатидных кислот (PAP), фермента, участвующего в биосинтезе крахмала, такого как пирофосфорилаза (АДФ)-глюкозы (АГФаза), десатуразы жирных кислот, такой как десатураза жирных кислот Δ12 (FAD2), или комбинации двух или более из них.
39. Растение или часть растения по п.38, где процессированную молекулу РНК выделяют из двухцепочечной молекулы РНК.
40. Растение по п.1 или часть растения по п.12, в котором неполярный липид содержит специфическую PUFA, которая представляет собой EDA, ARA, SDA, ETA, EPA, DPA или DHA, причем концентрация специфической PUFA составляет по меньшей мере 1% от общего количества жирных кислот в неполярном липиде, или комбинацию двух из них.
41. Семя трансгенного растения по п. 1, где семя продуцирует неполярный липид и содержит один или более экзогенных полинуклеотидов, которые содержат первый экзогенный полинуклеотид, кодирующий первый полипептид ацилтрансферазы жирной кислоты, и один или более дополнительных экзогенных полинуклеотидов, кодирующих одно или нескольких из следующего:
(i) двухцепочечную молекулу РНК, которая ингибирует экспрессию гена, кодирующего полипептид сахарозависимой триацилглицерин-липазы 1 (SDP1),
(ii) второй полипептид ацилтрансферазы жирных кислот или
(iii) полипептид, который стабилизирует один или более неполярных липидов, такой как олеозин,
где каждый из одного или более экзогенных полинуклеотидов функционально связан с промотором, который способен направлять экспрессию полинуклеотида в растении.
42. Семя по п.41, которое содержит один или более экзогенных полинуклеотидов по п.27.
43. Рекомбинантная клетка трансгенного растения по п. 1, продуцирующая неполярный липид, где клетка содержит один или более экзогенных полинуклеотидов и имеющая повышенную концентрацию одного или нескольких неполярных липидов по сравнению с соответствующей клеткой, не содержащей одного или нескольких экзогенных полинуклеотидов, где один или более экзогенных полинуклеотидов содержат первый экзогенный полинуклеотид, который кодирует первый полипептид ацилтрансферазы жирной кислоты и один или более дополнительных экзогенных полинуклеотидов, кодирующих одно или более из следующего:
(i) двухцепочечную молекулу РНК, которая ингибирует экспрессию гена, кодирующего полипептид сахарозависимой триацилглицерин-липазы 1 (SDP1),
(ii) второй полипептид ацилтрансферазы жирных кислот или
(iii) полипептид, который стабилизирует один или более неполярных липидов, такой как олеозин,
где каждый из одного или более экзогенных полинуклеотидов функционально связан с промотором, который способен направлять экспрессию полинуклеотида в клетке растения.
44. Рекомбинантная клетка по п.43, которая обладает одной или более или всеми из следующих характеристик:
(i) если клетка представляет собой клетку вегетирующей части растения, то клетка имеет общее содержание неполярных липидов по меньшей мере 7% (мас./мас.),
(ii) если клетка представляет собой клетку вегетирующей части растения, то клетка имеет общее содержание неполярных липидов от 5 до 25% (мас./мас.),
(iii) общее содержание жирных кислот в неполярном липиде (липидах) составляет по меньшей мере на 2% больше олеиновой кислоты и/или по меньшей мере на 2% меньше пальмитиновой кислоты, чем в неполярном липиде (липидах) в соответствующей клетке, не содержащей одного или более экзогенных полинуклеотидов,
(iv) неполярный липид (липиды) содержит измененную концентрацию общих стеролов, предпочтительно свободных (не эстерифицированных) стеролов, стероиловых эфиров, стероил-гликозидов по сравнению с неполярным липидом (липидами) в соответствующей клетке, не содержащей одного или более экзогенных полинуклеотидов,
(v) неполярный липид (липидыы) содержит воски и/или восковые эфиры,
(vi) клетка представляет собой одного члена популяции или группы по меньшей мере из около 1000 таких клеток и
(vii) неполярный липид содержит по меньшей мере 90% триацилглицерина (TAG).
45. Способ получения углеводородного продукта, включающий следующие стадии:
i) получение растения по п.1, части растения по п.12 или рекомбинантной клетки по п.43 или 44 и
ii) либо
а) превращение по меньшей мере части липида в растении или части растения или в клетке со стадии i) в углеводородный продукт путем применения теплового, химического или ферментативного воздействия или любой их комбинации на липид in situ в растении, части растения или клетке, либо
b) физическую обработку растения, части растения или клетки со стадии i) и последующее или одновременное превращение по меньшей мере некоторого количества липида в растении, части растения или клетки в углеводородный продукт путем применения тепла, химического или ферментативного воздействия или любой их комбинации на липид в растении, части растения или клетке, и
iii) извлечение углеводородного продукта, где углеводородный продукт включает сложные эфиры жирных кислот, алканы, смесь алканов с более длинной цепью или алкены,
получая тем самым углеводородный продукт.
46. Способ по п.45, в котором стадия физической обработки растения или части растения включает одно или более из операций раскатывания, прессования, измельчения или помола растения или части растения.
47. Способ по п.45 или 46, дополнительно включающий стадии:
(а) экстрагирование, по меньшей мере, некоторого количества неполярных липидов, содержащихся в растении, части растения или клетке, в качестве неполярного липида, и
(b) выделение экстрагированного неполярного липида,
где стадии (а) и (b) выполняются до стадии превращения по меньшей мере некоторого количества липида в растении, части растения или клетке в углеводородный продукт.
48. Способ по п.47, в котором экстрагированный неполярный липид содержит триацилглицерины, где триацилглицерины составляют по меньшей мере 90%, предпочтительно по меньшей мере 95% экстрагированного липида.
49. Способ по п.45 или 46, в котором сложные эфиры жирных кислот включают сложные метиловые эфиры жирных кислот и/или этиловые эфиры жирных кислот.
50. Способ получения экстрагированного липида, включающий стадии:
i) получение растения по п.1, части растения по п.12 или рекомбинантной клетки по п.43 или 44,
ii) экстрагирование липида из растения, части растения или клетки и
iii) выделение экстрагированного липида,
получая тем самым экстрагированный липид.
51. Способ по п. 50, где часть растения представляет собой семя растения, а извлеченный липид представляет собой масло семян.
52. Способ по п. 50 или 51, который представляет собой способ получения экстрагированного масла канолы, где способ включает стадии:
i) получение семян канолы, содержащих по меньшей мере 45% масла семян в весовом выражении,
ii) экстрагирование масла из семян канолы и
iii) выделение масла, где выделенное масло содержит по меньшей мере 90% (мас./мас.) триацилглицеринов (TAG),
получая тем самым масло канолы.
53. Способ по п. 50 или 51, который представляет собой способ получения экстрагированного кукурузного масла, где способ включает стадии:
i) получение семян кукурузы, содержащих по меньшей мере 5% масла семян в весовом выражении,
ii) экстрагирование масла из семян кукурузы и
iii) выделение масла, где выделенное масло содержит по меньшей мере 90% (мас./мас.) триацилглицеринов (TAG),
получая тем самым кукурузное масло.
54. Способ по п. 50 или 51, который представляет собой способ получения экстрагированного соевого масла, где способ включает стадии:
i) получение семян сои, содержащих по меньшей мере 20% масла семян в весовом выражении,
ii) экстрагирование масла из семян сои и
iii) выделение масла, где выделенное масло содержит по меньшей мере 90% (мас./мас.) триацилглицеринов (TAG),
получая тем самым соевое масло.
55. Способ по п. 50 или 51, который представляет собой способ получения экстрагированного масла семян люпина, где способ включает стадии:
i) получение семян люпина, содержащих по меньшей мере 10% масла семян в весовом выражении,
ii) экстрагирование масла из семян люпина и
iii) выделение масла, где выделенное масло содержит по меньшей мере 90% (мас./мас.) триацилглицеринов (TAG),
получая тем самым масло семян люпина.
56. Способ по п. 50 или 51, который представляет собой способ получения экстрагированного арахисового масла, где способ включает стадии:
i) получение арахисовых орехов, содержащих по меньшей мере 50 масла семян в весовом выражении,
ii) экстрагирование масла из арахисовых орехов и
iii) выделение масла, где выделенное масло содержит по меньшей мере 90% (мас./мас.) триацилглицеринов (TAG),
получая тем самым арахисовое масло.
57. Способ по п. 50 или 51, который представляет собой способ получения экстрагированного подсолнечного масла, где способ включает стадии:
i) получение семян подсолнечника, содержащих по меньшей мере 50% масла семян в весовом выражении,
ii) экстрагирование масла из семян подсолнечника и
iii) выделение масла, где выделенное масло содержит по меньшей мере 90% (мас./мас.) триацилглицеринов (TAG),
получая тем самым подсолнечное масло.
58. Способ по п. 50 или 51, который представляет собой способ получения экстрагированного хлопкового масла, где способ включает стадии:
i) получение семян хлопчатника, содержащих по меньшей мере 41% масла семян в весовом выражении,
ii) экстрагирование масла из семян хлопчатника и
iii) выделение масла, где выделенное масло содержит по меньшей мере 90% (мас./мас.) триацилглицеринов (TAG),
получая тем самым хлопковое масло.
59. Способ по п. 50 или 51, который представляет собой способ получения экстрагированного сафлорового масла, где способ включает стадии:
i) получение семян сафлора, содержащих по меньшей мере 35% масла семян в весовом выражении,
ii) экстрагирование масла из семян сафлора и
iii) выделение масла, где выделенное масло содержит по меньшей мере 90% (мас./мас.) триацилглицеринов (TAG),
получая тем самым сафлоровое масло.
60. Способ по п. 50 или 51, который представляет собой способ получения экстрагированного льняного масла, где способ включает стадии:
i) получение семян льна, содержащих по меньшей мере 36% масла семян в весовом выражении,
ii) экстрагирование масла из семян льна и
iii) выделение масла, где выделенное масло содержит по меньшей мере 90% (мас./мас.) триацилглицеринов (TAG),
получая тем самым льняное масло.
61. Способ по п. 50 или 51, который представляет собой способ получения экстрагированного рыжикового масла, где способ включает стадии:
i) получение семян Camelina sativa, содержащих по меньшей мере 36% масла в весовом выражении,
ii) экстрагирование масла из семян Camelina sativa и
iii) выделение масла, где выделенное масло содержит по меньшей мере 90% (мас./мас.) триацилглицеринов (TAG),
получая тем самым рыжиковое масло.
62. Способ по п. 50 или 51, который включает в себя одну или более операций сушки, раскатывания, прессования, измельчения или помола растения или части растения и/или очистки экстрагированного липида или масла семян.
63. Способ по п. 50 или 51, в котором в процессе экстракции используют органический растворитель для выделения масла.
64. Способ по п. 50 или 51, который включает выделение экстрагированных липидов или масла путем его сбора в контейнер и/или выполнение одного или более из дегумирования, дезодорации, обесцвечивания, высушивания, фракционирования экстрагированных липидов или масла, удаления по меньшей мере некоторых восков и/или восковых эфиров из экстрагированных липидов или масла или анализа состава жирных кислот экстрагированных липидов или масла.
65. Способ по п. 50 или 51, в котором объем экстрагированных липидов или масла составляет по меньшей мере 1 литр.
66. Способ по п. 50 или 51, в отношении которого применима одна или более или все из следующих характеристик:
(i) экстрагированные липиды или масло содержат триацилглицерины, при этом триацилглицерины составляют по меньшей мере 90%, предпочтительно по меньшей мере 95% или 96% экстрагированных липидов или масла,
(ii) экстрагированные липиды или масло содержат свободные стеролы, стероиловые эфиры, стероил-гликозиды, воски или восковые эфиры или любую их комбинацию и
(iii) общее содержание стерола и/или композиции в экстрагированных липидах или масле существенно отличается от содержания стерола и/или композиции в экстрагированных липидах или масле, полученных из соответствующего растения, части растения или клетки, не содержащих одного или более экзогенных полинуклеотидов.
67. Способ по п. 50 или 51, где способ дополнительно включает превращение экстрагированных липидов или масла в углеводородный продукт, где углеводородный продукт включает сложные эфиры жирных кислот, алканы, смесь алканов с более длинной цепью, алкены, этанол, пропанол или бутанол.
68. Способ по п. 67, в котором сложные эфиры жирных кислот включают сложные метиловые эфиры жирных кислот и/или этиловые эфиры жирных кислот.
69. Способ по п.45 или 50, где содержание олеиновой кислоты составляет по меньшей мере 20% (мол.%), по меньшей мере 22% (мол.%), по меньшей мере 30% (мол.%), по меньшей мере 40% (мол.%), по меньшей мере 50% (мол.%) или по меньшей мере 60% (мол.%), предпочтительно по меньшей мере 65% (мол.%) или по меньшей мере 66% (мол.%) от общего содержания жирных кислот в экстрагированных липидах или масле.
70. Способ получения рекомбинантной клетки по п. 43, которая продуцирует повышенную концентрацию одного или более неполярных липидов, включающий следующие стадии:
а) введение в клетку одного или более экзогенных полинуклеотидов, которые содержат первый экзогенный полинуклеотид, кодирующий первый полипептид ацилтрансферазы жирной кислоты, и один или более дополнительных экзогенных полинуклеотидов, кодирующих одно или более из следующего:
(i) двухцепочечную молекулу РНК, которая ингибирует экспрессию гена, кодирующего полипептид сахарозависимой триацилглицерин-липазы 1 (SDP1),
(ii) второй полипептид ацилтрансферазы жирных кислот или
(iii) полипептид, который стабилизирует один или более неполярных липидов, такой как олеозин,
где каждый из одного или более экзогенных полинуклеотидов функционально связан с промотором, который способен направлять экспрессию полинуклеотида в клетке,
b) экспрессия одного или более экзогенных полинуклеотидов в клетке или в ее клетках-потомках,
c) анализ содержания липидов в клетке или клетках-потомках и
d) отбор клетки или клетки-потомка, имеющей повышенную концентрацию одного или более неполярных липидов по сравнению с соответствующей клеткой или клеткой-потомком, не содержащей одного или более экзогенных полинуклеотидов.
71. Способ по п.70, в котором один или более экзогенных полинуклеотидов являются такими, как определено в п.27.
72. Способ по п. 70 или 71, в котором один или более экзогенных полинуклеотидов стабильно интегрированы в геном клетки или клетки-потомка.
73. Способ по п.72, дополнительно включающий стадию регенерации трансгенного растения из клетки или клетки-потомка, включающей один или более экзогенных полинуклеотидов.
74. Способ по п.73, в котором стадию регенерации трансгенного растения проводят до стадии экспрессии одного или нескольких экзогенных полинуклеотидов в клетке или в ее клетке-потомке, и/или до стадии анализа содержания липидов в клетке или в клетке-потомке, и/или до стадии отбора клетки или клетки-потомка, имеющих повышенную концентрацию одного или нескольких неполярных липидов.
75. Способ по п. 73 или 74, который дополнительно включает стадию получения семян или растения-потомка из трансгенного растения, где семена или растение-потомок содержит один или более экзогенных полинуклеотидов.
76. Способ получения синтетического дизельного топлива, включающий:
i) превращение липида в растении по п.1 или части растения по п.12 в синтез-газ путем газификации и
ii) превращение синтез-газа в синтетическое дизельное топливо с использованием металлического катализатора или микробного катализатора.
| WO 20080157226 A2, 24.12.2008 | |||
| WO 20110062748 A1, 26.05.2011 | |||
| МОДИФИКАЦИЯ ЛИПИДОВ РАСТЕНИЙ И МАСЕЛ СЕМЯН ПУТЕМ ИСПОЛЬЗОВАНИЯ ДРОЖЖЕВЫХ ГЕНОВ SLC | 1996 |
|
RU2190665C2 |
Авторы
Даты
2023-10-03—Публикация
2012-12-21—Подача