ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
По настоящей заявке испрашивается приоритет на основании заявок на выдачу патента Японии № 2007-139046 (поданной 25 мая 2007 г.) и 2007-323965 (поданной 14 декабря 2007 г.).
Настоящее изобретение относится к новым генам ацилтрансферазы лизофосфатидной кислоты.
УРОВЕНЬ ТЕХНИКИ
Жирные кислоты являются важными компонентами липидов, таких как фосфолипиды и триацилглицерины. Жирные кислоты, содержащие две или более ненасыщенных связи, обобщенно называют полиненасыщенными жирными кислотами (PUFA), и известно, что к ним относятся арахидоновая кислота, дигомо-γ-линоленовая кислота, эйкозапентаеновая кислота и докозагексаеновая кислота. Сообщалось о различных физиологических активностях таких жирных кислот (непатентный документ 1).
Среди указанных кислот арахидоновая кислота привлекает внимание как промежуточный метаболит, превращаемый в простагландин, лейкотриен и т.д., и было предпринято множество попыток использовать арахидоновую кислоту в качестве материала для продуктов здорового питания и фармацевтических средств. Кроме того, обнаружено, что арахидоновая кислота содержится в материнском молоке и необходима для роста новорожденных, особенно для роста и развития головного мозга плода. По этой причине арахидоновая кислота также привлекает внимание в качестве ингредиента, необходимого для роста новорожденных с точки зрения питания, также как в случае DHA (докозагексаеновой кислоты).
Предполагается, что указанные полиненасыщенные жирные кислоты применимы в различных областях, но некоторые из них не могут быть синтезированы в организме животного. Таким образом, были разработаны микробиологические методики для получения полиненасыщенных жирных кислот посредством культивирования различных микроорганизмов. Также были предприняты другие попытки, чтобы получить полиненасыщенные жирные кислоты в растениях. Известно, что в таких случаях полиненасыщенные жирные кислоты накапливаются, например, в виде компонентов липидов хранения, таких как триацилглицерины, в клетках микроорганизмов или семенах растений.
Более конкретно, триацилглицерины образуются in vivo следующим образом. А именно, глицерол-3-фосфат ацилируется ацилтрансферазой глицерол-3-фосфата с образованием лизофосфатидной кислоты, которая затем дополнительно ацилируется ацилтрансферазой лизофосфатидной кислоты с образованием фосфатидной кислоты. Указанная фосфатидная кислота, в свою очередь, дефосфорилируется фосфатазой фосфатидной кислоты с образованием диацилглицерина, который затем ацилируется ацилтрансферазой диацилглицерина с образованием триацилглицерина. Также известно, что другие ферменты, такие как ацилCoA:холестерин-ацилтрансфераза и лизофосфатидилхолинацилтрансфераза, опосредованно вовлечены в биосинтез триацилглицеринов.
Как описано выше, известно, что реакция, в которой лизофосфатидная кислота (далее называемая «LPA» или «1-ацилглицерол-3-фосфат») ацилируется с образованием фосфатидной кислоты (далее называемой «PA» или «1,2-диацил-sn-глицерол-3-фосфат»), опосредована ацилтрансферазой лизофосфатидной кислоты (далее «LPAAT»).
Указанная LPAAT также известна как 1-ацилглицерол-3-фосфатацилтрансфераза (E.C. 2.3.1.51). До настоящего времени сообщалось о генах LPAAT нескольких организмов. В качестве гена LPAAT Escherichia coli клонирован ген plsC (непатентный документ 2). У грибов клонирован ген SLC1 Saccharomyces cerevisiae (непатентный документ 3). Подобным образом также были клонированы гены LPAAT животных и растений (патентный документ 1).
Что касается LPAAT у продуцирующего липиды гриба Mortierella alpina (далее также называемого «M. alpina»), то имеется сообщение, свидетельствующее, что микросомальная фракция такого гриба обладает активностью ацилтрансферазы лизофосфатидной кислоты (непатентный документ 4). Кроме того, сообщается о двух гомологах гена LPAAT M. alpina (патентные документы 2 и 3).
Патентный документ 1: международная публикация патента № WO2004/076617.
Патентный документ 2: публикация патента США № 2006/174376.
Патентный документ 3: публикация патента США № 2006/0094090.
Непатентный документ 1: Lipids, 39, 1147 (2004).
Непатентный документ 2: Mol. Gen. Genet., 232, 295-303, 1992.
Непатентный документ 3: J.B.C., 268, 22156-22163, 1993.
Непатентный документ 4: Biochemical Society Transactions, 28, 707-709, 2000.
Непатентный документ 5: J. Bacteriology, 180, 1425-1430, 1998.
Непатентный документ 6: J. Bacteriology, 173, 2026-2034, 1991.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ПРОБЛЕМЫ, РЕШАЕМЫЕ ИЗОБРЕТЕНИЕМ
Однако даже если гены LPAAT, о которых сообщалось ранее, введены и экспрессированы в клетках-хозяевах, композиции жирных кислот, продуцируемых хозяевами, ограничены вследствие субстратной специфичности экспрессированных ферментов. Поэтому существует необходимость в идентификации нового гена, который позволяет получить композицию жирных кислот, соотношение жирных кислот в которой отличается от композиции, о которой сообщалось ранее. В частности, существует необходимость в идентификации гена белка, который позволяет получать композицию жирных кислот, обогащенную полезными жирными кислотами.
СПОСОБЫ РЕШЕНИЯ ПРОБЛЕМ
Целью настоящего изобретения является получение белка или нуклеиновой кислоты, которые позволяют получать жиры и масла с требуемым соотношением жирных кислот и/или позволяют обогатить требуемыми жирными кислотами, в случае экспрессии или введения в клетки-хозяева.
Для достижения указанной выше цели авторы настоящего изобретения провели обширные и тщательные исследования. Во-первых, осуществили анализ EST на продуцирующем липиды грибе Mortierella alpina, чтобы выделить последовательности, высокоидентичные известным генам LPAAT. Затем, чтобы получить полную открытую рамку считывания (ORF), кодирующую LPAAT, гены клонировали, используя скрининг библиотеки кДНК или ПЦР. В результате попыток ввести такие гены в высокопролиферативные клетки-хозяева (например, дрожжевые клетки), чтобы таким образом получить требуемую композицию жирных кислот, авторы изобретения с успехом клонировали ген, относящийся к новой LPAAT с другой субстратной специфичностью, который позволяет продуцировать композицию жирных кислот, отличную от композиций, продуцируемых хозяевами, экспрессирующими обычные LPAAT, и который обеспечивает более высокое содержание арахидоновой кислоты в клетках-хозяевах по сравнению с клетками-хозяевами, которые не трансформированы геном. Такие исследования привели к осуществлению настоящего изобретения. А именно, настоящее изобретение представляет собой следующее.
(1) Нуклеиновая кислота, содержащая нуклеотидную последовательность, указанную в любом из пунктов (a)-(e) ниже:
(a) нуклеотидную последовательность, которая кодирует белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 2 или 4, и обладающий активностью ацилтрансферазы лизофосфатидной кислоты;
(b) нуклеотидную последовательность, которая может гибридизоваться в жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, состоящей из последовательности SEQ ID NO: 36 или 37, и которая кодирует белок, обладающий активностью ацилтрансферазы лизофосфатидной кислоты;
(c) нуклеотидную последовательность, которая состоит из нуклеотидной последовательности, которая на 67% или более идентична нуклеотидной последовательности, состоящей из последовательности SEQ ID NO: 36 или 37, и которая кодирует белок, обладающий активностью ацилтрансферазы лизофосфатидной кислоты;
(d) нуклеотидную последовательность, которая кодирует аминокислотную последовательность, на 69% или более идентичную аминокислотной последовательности, состоящей из последовательности SEQ ID NO: 2 или 4, и которая кодирует белок, обладающий активностью ацилтрансферазы лизофосфатидной кислоты; или
(e) нуклеотидную последовательность, которая может гибридизоваться в жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящий из аминокислотной последовательности, показанной в SEQ ID NO: 2 или 4, и которая кодирует белок, обладающий активностью ацилтрансферазы лизофосфатидной кислоты.
(2) Нуклеиновая кислота по п. (1), приведенному выше, которая содержит нуклеотидную последовательность, указанную в любом из пунктов (a)-(c) далее:
(a) нуклеотидную последовательность, которая кодирует белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением 1-10 аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 2 или 4, и обладающий активностью ацилтрансферазы лизофосфатидной кислоты;
(b) нуклеотидную последовательность, которая может гибридизоваться в условиях 2×SSC при 50°C с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, состоящей из последовательностей SEQ ID NO: 36 или 37, и которая кодирует белок, обладающий активностью ацилтрансферазы лизофосфатидной кислоты; или
(c) нуклеотидную последовательность, которая кодирует аминокислотную последовательность, на 90% или более идентичную аминокислотной последовательности, состоящей из последовательности SEQ ID NO: 2 или 4, и которая кодирует белок, обладающий активностью ацилтрансферазы лизофосфатидной кислоты.
(3) Нуклеиновая кислота, содержащая нуклеотидную последовательность, показанную в любом из пунктов (a)-(c) ниже, или ее фрагмент:
(a) нуклеотидную последовательность, показанную в SEQ ID NO: 36 или 37;
(b) нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности, показанной в SEQ ID NO: 2 или 4; или
(c) нуклеотидную последовательность, показанную в SEQ ID NO: 1 или 3.
(4) Нуклеиновая кислота, содержащая нуклеотидную последовательность, показанную в любом из пунктов (a)-(e) ниже:
(a) нуклеотидную последовательность, которая кодирует следующий белок:
белок, который состоит из аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 2 или 4, и который обладает способностью давать соотношение жирных кислот, обеспечивающее более высокий относительный показатель, по меньшей мере, для одного или нескольких из следующих компонентов i)-iv), показанных ниже, в соотношении жирных кислот у хозяина, экспрессирующего белок, чем в соотношении жирных кислот у хозяина, не экспрессирующего белок:
i) содержания олеиновой кислоты;
ii) отношения содержания пальмитолеиновой кислоты к содержанию пальмитиновой кислоты;
iii) отношения содержания олеиновой кислоты к содержанию пальмитиновой кислоты; и
iv) отношения общего содержания стеариновой кислоты и олеиновой кислоты к содержанию пальмитиновой кислоты;
(b) нуклеотидную последовательность, которая может гибридизоваться в жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, состоящей из последовательности SEQ ID NO: 36 или 37, и которая кодирует следующий белок:
белок, который обладает способностью давать соотношение жирных кислот, обеспечивающее более высокий относительный показатель, по меньшей мере, для одного или нескольких из следующих компонентов i)-iv), показанных ниже, в соотношении жирных кислот у хозяина, экспрессирующего белок, чем в соотношении жирных кислот у хозяина, не экспрессирующего белок:
i) содержания олеиновой кислоты;
ii) отношения содержания пальмитолеиновой кислоты к содержанию пальмитиновой кислоты;
iii) отношения содержания олеиновой кислоты к содержанию пальмитиновой кислоты; и
iv) отношения общего содержания стеариновой кислоты и олеиновой кислоты к содержанию пальмитиновой кислоты;
(c) нуклеотидную последовательность, которая состоит из нуклеотидной последовательности, на 67% или более идентичной нуклеотидной последовательности, состоящей из последовательности SEQ ID NO: 36 или 37, и которая кодирует следующий белок:
белок, который обладает способностью давать соотношение жирных кислот, обеспечивающее более высокий относительный показатель, по меньшей мере, для одного или нескольких из следующих компонентов i)-iv), показанных ниже, в соотношении жирных кислот у хозяина, экспрессирующего белок, чем в соотношении жирных кислот у хозяина, не экспрессирующего белок:
i) содержания олеиновой кислоты;
ii) отношения содержания пальмитолеиновой кислоты к содержанию пальмитиновой кислоты;
iii) отношения содержания олеиновой кислоты к содержанию пальмитиновой кислоты; и
iv) отношения общего содержания стеариновой кислоты и олеиновой кислоты к содержанию пальмитиновой кислоты;
(d) нуклеотидную последовательность, которая кодирует следующий белок:
белок, который состоит из аминокислотной последовательности, на 69% или более идентичной аминокислотной последовательности, состоящей из последовательности SEQ ID NO: 2 или 4, и который обладает способностью давать соотношение жирных кислот, обеспечивающее более высокий относительный показатель, по меньшей мере, для одного или нескольких из следующих компонентов i)-iv), показанных ниже, в соотношении жирных кислот у хозяина, экспрессирующего белок, чем в соотношении жирных кислот у хозяина, не экспрессирующего белок:
i) содержания олеиновой кислоты;
ii) отношения содержания пальмитолеиновой кислоты к содержанию пальмитиновой кислоты;
iii) отношения содержания олеиновой кислоты к содержанию пальмитиновой кислоты; и
iv) отношения общего содержания стеариновой кислоты и олеиновой кислоты к содержанию пальмитиновой кислоты;
(e) нуклеотидную последовательность, которая может гибридизоваться в жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящий из аминокислотной последовательности, показанной в SEQ ID NO: 2 или 4, и которая кодирует следующий белок:
белок, который обладает способностью давать соотношение жирных кислот, обеспечивающее более высокий относительный показатель, по меньшей мере, для одного или нескольких из следующих компонентов i)-iv), показанных ниже, в соотношении жирных кислот у хозяина, экспрессирующего белок, чем в соотношении жирных кислот у хозяина, не экспрессирующего белок:
i) содержания олеиновой кислоты;
ii) отношения содержания пальмитолеиновой кислоты к содержанию пальмитиновой кислоты;
iii) отношения содержания олеиновой кислоты к содержанию пальмитиновой кислоты; и
iv) отношения общего содержания стеариновой кислоты и олеиновой кислоты к содержанию пальмитиновой кислоты.
(5) Нуклеиновая кислота по пункту (4), указанному выше, которая содержит нуклеотидную последовательность, показанную в любом из пунктов (a)-(c) ниже:
(a) нуклеотидную последовательность, которая кодирует следующий белок:
белок, который состоит из аминокислотной последовательности с делецией, заменой или добавлением 1-10 аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 2 или 4, и который обладает способностью давать соотношение жирных кислот, обеспечивающее более высокий относительный показатель, по меньшей мере, для одного или нескольких из следующих компонентов i)-iv), показанных ниже, в соотношении жирных кислот у хозяина, экспрессирующего белок, чем в соотношении жирных кислот у хозяина, не экспрессирующего белок:
i) содержания олеиновой кислоты;
ii) отношения содержания пальмитолеиновой кислоты к содержанию пальмитиновой кислоты;
iii) отношения содержания олеиновой кислоты к содержанию пальмитиновой кислоты; и
iv) отношения общего содержания стеариновой кислоты и олеиновой кислоты к содержанию пальмитиновой кислоты;
(b) нуклеотидную последовательность, которая может гибридизоваться в условиях 2×SSC при 50°C с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, состоящей из последовательности SEQ ID NO: 36 или 37, и которая кодирует следующий белок:
белок, который обладает способностью давать соотношение жирных кислот, обеспечивающее более высокий относительный показатель, по меньшей мере, для одного или нескольких из следующих компонентов i)-iv), показанных ниже, в соотношении жирных кислот у хозяина, экспрессирующего белок, чем в соотношении жирных кислот у хозяина, не экспрессирующего белок:
i) содержания олеиновой кислоты;
ii) отношения содержания пальмитолеиновой кислоты к содержанию пальмитиновой кислоты;
iii) отношения содержания олеиновой кислоты к содержанию пальмитиновой кислоты; и
iv) отношения общего содержания стеариновой кислоты и олеиновой кислоты к содержанию пальмитиновой кислоты;
(c) нуклеотидную последовательность, которая кодирует следующий белок:
белок, который состоит из аминокислотной последовательности, на 90% или более идентичной аминокислотной последовательности, состоящей из последовательности SEQ ID NO: 2 или 4, и который обладает способностью давать соотношение жирных кислот, обеспечивающее более высокий относительный показатель, по меньшей мере, для одного или нескольких из следующих компонентов i)-iv), показанных ниже, в соотношении жирных кислот у хозяина, экспрессирующего белок, чем в соотношении жирных кислот у хозяина, не экспрессирующего белок:
i) содержания олеиновой кислоты;
ii) отношения содержания пальмитолеиновой кислоты к содержанию пальмитиновой кислоты;
iii) отношения содержания олеиновой кислоты к содержанию пальмитиновой кислоты; и
iv) отношения общего содержания стеариновой кислоты и олеиновой кислоты к содержанию пальмитиновой кислоты.
(6) Нуклеиновая кислота, содержащая нуклеотидную последовательность, показанную в любом из пунктов (a)-(e) ниже:
(a) нуклеотидную последовательность, которая кодирует следующий белок:
белок, который состоит из аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 2 или 4, и который обладает способностью обеспечивать более высокое содержание арахидоновой кислоты в клетках-хозяевах, экспрессирующих белок, содержащий данную аминокислотную последовательность, чем в клетках-хозяевах, не экспрессирующих белок;
(b) нуклеотидную последовательность, которая может гибридизоваться в жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, состоящей из последовательности SEQ ID NO: 36 или 37, и которая кодирует белок, обладающий способностью обеспечивать более высокое содержание арахидоновой кислоты в клетках-хозяевах, экспрессирующих белок, кодируемый нуклеотидной последовательностью, чем в клетках-хозяевах, не экспрессирующих белок;
(c) нуклеотидную последовательность, которая состоит из нуклеотидной последовательности, на 67% или более идентичной нуклеотидной последовательности, состоящей из последовательности SEQ ID NO: 36 или 37, и которая кодирует белок, обладающий способностью обеспечивать более высокое содержание арахидоновой кислоты в клетках-хозяевах, экспрессирующих белок, кодируемый нуклеотидной последовательностью, чем в клетках-хозяевах, не экспрессирующих белок;
(d) нуклеотидную последовательность, которая кодирует следующий белок:
белок, который состоит из аминокислотной последовательности, на 69% или более идентичной аминокислотной последовательности, состоящей из последовательности SEQ ID NO: 2 или 4, и который обладает способностью, обеспечивать более высокое содержание арахидоновой кислоты в клетках-хозяевах, экспрессирующих белок, содержащий данную аминокислотную последовательность, чем в клетках-хозяевах, не экспрессирующих белок; или
(e) нуклеотидную последовательность, которая может гибридизоваться в жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящий из аминокислотной последовательности, показанной в SEQ ID NO: 2 или 4, и которая кодирует белок, обладающий способностью обеспечивать более высокое содержание арахидоновой кислоты в клетках-хозяевах, экспрессирующих белок, чем в клетках-хозяевах, не экспрессирующих белок.
(7) Нуклеиновая кислота по п. (6), указанному выше, которая содержит нуклеотидную последовательность, показанную в любом из пунктов (a)-(c) ниже:
(a) нуклеотидную последовательность, которая кодирует белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением 1-10 аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 2 или 4, и обладающий способностью обеспечивать более высокое содержание арахидоновой кислоты в клетках-хозяевах, экспрессирующих белок, содержащий данную аминокислотную последовательность, чем в клетках-хозяевах, не экспрессирующих белок;
(b) нуклеотидную последовательность, которая может гибридизоваться в условиях 2×SSC при 50°C с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, состоящей из последовательности SEQ ID NO: 36 или 37, и которая кодирует белок, обладающий способностью обеспечивать более высокое содержание арахидоновой кислоты в клетках-хозяевах, экспрессирующих белок, кодируемый нуклеотидной последовательностью, чем в клетках-хозяевах, не экспрессирующих белок; или
(c) нуклеотидную последовательность, которая кодирует аминокислотную последовательность, на 90% или более идентичную аминокислотной последовательности, состоящей из последовательности SEQ ID NO: 2 или 4, и которая кодирует белок, обладающий способностью обеспечивать более высокое содержание арахидоновой кислоты в клетках-хозяевах, экспрессирующих белок, содержащий данную аминокислотную последовательность, чем в клетках-хозяевах, не экспрессирующих белок.
(8) Белок, описанный в пунктах (a) или (b) ниже:
(a) белок, который состоит из аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в последовательности SEQ ID NO: 2 или 4, и который обладает активностью ацилтрансферазы лизофосфатидной кислоты; или
(b) белок, который состоит из аминокислотной последовательности, на 69% или более идентичной аминокислотной последовательности, состоящей из последовательности SEQ ID NO: 2 или 4, и который обладает активностью ацилтрансферазы лизофосфатидной кислоты.
(9) Белок, описанный в пунктах (a) или (b) ниже:
(a) белок, который состоит из аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в последовательности SEQ ID NO: 2 или 4 и который обладает способностью давать соотношение жирных кислот, обеспечивающее более высокий относительный показатель, по меньшей мере, для одного или нескольких из следующих компонентов i)-iv), показанных ниже, в соотношении жирных кислот у хозяина, экспрессирующего белок, состоящий из данной аминокислотной последовательности, чем в соотношении жирных кислот у хозяина, не экспрессирующего белок:
i) содержания олеиновой кислоты;
ii) отношения содержания пальмитолеиновой кислоты к содержанию пальмитиновой кислоты;
iii) отношения содержания олеиновой кислоты к содержанию пальмитиновой кислоты; и
iv) отношения общего содержания стеариновой кислоты и олеиновой кислоты к содержанию пальмитиновой кислоты; или
(b) белок, который состоит из аминокислотной последовательности, на 69% или более идентичной аминокислотной последовательности, состоящей из последовательности SEQ ID NO: 2 или 4, и который обладает способностью давать соотношение жирных кислот, обеспечивающее более высокий относительный показатель, по меньшей мере, для одного или нескольких из следующих компонентов i)-iv), показанных ниже, в соотношении жирных кислот у хозяина, экспрессирующего белок, состоящий из данной аминокислотной последовательности, чем в соотношении жирных кислот у хозяина, не экспрессирующего белок:
i) содержания олеиновой кислоты;
ii) отношения содержания пальмитолеиновой кислоты к содержанию пальмитиновой кислоты;
iii) отношения содержания олеиновой кислоты к содержанию пальмитиновой кислоты; и
iv) отношения общего содержания стеариновой кислоты и олеиновой кислоты к содержанию пальмитиновой кислоты.
(10) Белок, описанный в пунктах (a) или (b) ниже:
(a) белок, который состоит из аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в последовательности SEQ ID NO: 2 или 4 и который обладает способностью обеспечивать более высокое содержание арахидоновой кислоты в клетках-хозяевах, экспрессирующих белок, состоящий из аминокислотной последовательности, чем в клетках-хозяевах, не экспрессирующих белок; или
(b) белок, который состоит из аминокислотной последовательности, на 69% или более идентичной аминокислотной последовательности, состоящей из последовательности SEQ ID NO: 2 или 4, и который обладает способностью обеспечивать более высокое содержание арахидоновой кислоты в клетках-хозяевах, экспрессирующих белок, состоящий из данной аминокислотной последовательности, чем в клетках-хозяевах, не экспрессирующих белок.
(11) Белок, состоящий из аминокислотной последовательности, показанной в последовательности SEQ ID NO: 2 или 4.
(12) Рекомбинантный вектор, содержащий нуклеиновую кислоту по любому из пп. (1)-(7), указанных выше.
(13) Трансформант, трансформированный рекомбинантным вектором по п. (12), указанному выше.
(14) Композиция жирных кислот, полученная культивированием трансформанта по п. (13) выше, в котором, по меньшей мере, один или несколько из показателей i)-iv), указанных ниже, в соотношении жирных кислот в данной композиции жирных кислот выше, чем в продукте культивирования, полученном при культивировании хозяина, который не трансформирован рекомбинантным вектором по п. (12), указанному выше:
i) содержание олеиновой кислоты;
ii) отношение содержания пальмитолеиновой кислоты к содержанию пальмитиновой кислоты;
iii) отношение содержания олеиновой кислоты к содержанию пальмитиновой кислоты; и
iv) отношение общего содержания стеариновой кислоты и олеиновой кислоты к содержанию пальмитиновой кислоты;
(15) Композиция жирных кислот, полученная культивированием трансформанта по п. (13), указанному выше, в котором содержание арахидоновой кислоты в композиции жирных кислот выше, чем в продукте культивирования, полученном при культивировании хозяина, который не трансформирован рекомбинантным вектором по п. (12), указанному выше.
(16) Способ получения композиции жирных кислот, который включает сбор композиции жирных кислот по п. (14) или (15), указанному выше, из продукта культивирования, полученного культивированием трансформанта по п. (13), указанному выше.
(17) Пищевой продукт, содержащий композицию жирных кислот по указанному выше п. (14) или (15).
ПРЕИМУЩЕСТВА ИЗОБРЕТЕНИЯ
LPAAT согласно настоящему изобретению обладает субстратной специфичностью, отличной от субстратной специфичности обычных LPAAT, и позволяет хозяину продуцировать композицию жирных кислот, соотношение жирных кислот в которой отличается от их соотношения в композициях жирных кислот, продуцируемых хозяевами, экспрессирующими обычные LPAAT. В результате LPAAT согласно настоящему изобретению обеспечивает получение липидов, обладающих требуемыми свойствами и эффектами, и применима в качестве подходящей для получения продуктов питания, косметических средств, фармацевтических препаратов, мыла и т.д.
Содержание арахидоновой кислоты в клетках-хозяевах, экспрессирующих LPAAT согласно настоящему изобретению, выше, чем содержание арахидоновой кислоты в клетках-хозяевах, не экспрессирующих LPAAT согласно настоящему изобретению. Предполагают, что композиция жирных кислот, полученная из продукта культивирования таких экспрессирующих LPAAT клеток, обеспечивает более высокий пищевой эффект и поэтому является предпочтительной.
Кроме того, LPAAT согласно настоящему изобретению позволяет улучшить способность продуцировать жирные кислоты и запасаемые липиды и поэтому является предпочтительной в качестве средства повышения продуктивности микроорганизмов и растений в отношении полиненасыщенных жирных кислот.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1 представляет собой дендрограмму, показывающую взаимосвязь между двумя гомологами LPAAT3 и LPAAT4 согласно настоящему изобретению и известными гомологами LPAAT1 и LPAAT2.
Фигура 2 показывает последовательность кДНК LPAAT3 согласно настоящему изобретению наряду с рассчитанной аминокислотной последовательностью.
Фигура 3 показывает последовательность кДНК LPAAT4 наряду с рассчитанной аминокислотной последовательностью.
На фигуре 4 показано сравнение последовательностей ДНК областей CDS LPAAT3 и LPAAT4.
На фигуре 5 показано сравнение рассчитанных аминокислотных последовательностей LPAAT3 и LPAAT4.
На фигуре 6 показаны рассчитанные аминокислотные последовательности LPAAT3p и LPAAT4p в сравнении с известными аминокислотными последовательностями.
НАИЛУЧШИЙ СПОСОБ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым генам ацилтрансферазы лизофосфатидной кислоты, полученным из рода Mortierella, характеризуемой ацилированием лизофосфатидной кислоты с образованием фосфатидной кислоты.
Ацилтрансфераза лизофосфатидной кислоты (LPAAT) согласно настоящему изобретению является ферментом, который катализирует реакцию, в которой лизофосфатидная кислота ацилируется с образованием фосфатидной кислоты. Донором ацила обычно является ацил-CoA, но донор не ограничен указанным. Акцептор ацила в реакции переноса ацила, катализируемой белком согласно настоящему изобретению, не ограничен LPA, и в качестве акцепторов ацила могут служить различные лизофосфолипиды.
LPA (в дальнейшем также называемый «1-ацил-sn-глицерол-3-фосфатом») согласно настоящему изобретению является определенным видом глицерофосфолипида. LPA представляет собой лизофосфолипид, имеющий только одну жирную кислоту, которая образуется при ацилировании гидроксильной группы в положении 1 (α-положении) глицерол-3-фосфата (далее также называемого «sn-глицерол-3-фосфатом»). LPA не только является промежуточным продуктом биосинтеза липидов, но также служит в качестве внутриклеточного и межклеточного липидного медиатора, имеющего очень широкий диапазон биологических и фармакологических эффектов, включая влияние на пролиферацию клеток, агрегацию тромбоцитов, сокращение гладких мышц и стимуляцию инвазии злокачественной опухоли.
Нуклеиновые кислоты согласно настоящему изобретению, кодирующие ацилтрансферазу лизофосфатидной кислоты.
Ацилтрансфераза лизофосфатидной кислоты (LPAAT) согласно настоящему изобретению охватывает LPAAT3 и LPAAT4. Соответствие между нуклеиновыми кислотами, кодирующими LPAAT3 и LPAAT4, суммированы на основании их кДНК, CDS, ORF и аминокислотных последовательностей в таблице 1 ниже.
А именно, последовательности, родственные LPAAT3 согласно настоящему изобретению, включают SEQ ID NO: 2 (аминокислотная последовательность LPAAT3), SEQ ID NO: 36 (последовательность, представляющая область ORF LPAAT3), SEQ ID NO: 8 (последовательность, представляющая CDS-область LPAAT3) и SEQ ID NO: 1 (нуклеотидная последовательность кДНК LPAAT3). Среди указанных последовательностей последовательность SEQ ID NO: 8 соответствует нуклеотидам 158-1147 SEQ ID NO: 1, тогда как последовательность SEQ ID NO: 36 соответствует нуклеотидам 158-1144 SEQ ID NO: 1 или нуклеотидам 1-987 SEQ ID NO: 8.
Подобным образом последовательности, родственные LPAAT4, включают SEQ ID NO: 4 (аминокислотная последовательность LPAAT4), SEQ ID NO: 37 (последовательность, представляющая область ORF LPAAT4), SEQ ID NO: 23 (последовательность, представляющая область CDS LPAAT4) и SEQ ID NO: 3 (нуклеотидная последовательность кДНК LPAAT4). Среди указанных последовательностей последовательность SEQ ID NO: 23 соответствует нуклеотидам 55-996 SEQ ID NO: 3, тогда как последовательность SEQ ID NO: 37 соответствует нуклеотидам 55-993 SEQ ID NO: 3 или нуклеотидам 1-939 SEQ ID NO: 23.
Нуклеиновые кислоты согласно настоящему изобретению охватывают однонитевые и двунитевые ДНК, а также комплементарные им РНК, которые могут быть либо природными, либо полученными искусственно. ДНК включают без ограничения геномные ДНК, кДНК, соответствующие геномным ДНК, химически синтезированные ДНК, ПЦР-амплифицированные ДНК, а также их сочетания и гибриды ДНК/РНК.
Предпочтительные варианты нуклеиновых кислот согласно настоящему изобретению содержат (a) нуклеотидную последовательность, показанную в SEQ ID NO: 36 или 37, (b) нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности, показанной в SEQ ID NO: 2 или 4, и (c) нуклеотидную последовательность, показанную в SEQ ID NO: 1 или 3.
Описанная выше нуклеотидная последовательность, показанная в SEQ ID NO: 36 или 37, нуклеотидная последовательность, кодирующая белок, состоящий из аминокислотной последовательности, показанной в SEQ ID NO: 2 или 4, и нуклеотидная последовательность, показанная в SEQ ID NO: 1 или 3, представляют собой последовательности, показанные в таблице 1.
Чтобы получить указанные нуклеотидные последовательности, можно использовать данные о нуклеотидных последовательностях EST или геномных ДНК организмов, обладающих активностью LPAAT, для поиска нуклеотидной последовательности, кодирующей белок с высокой идентичностью с известными белками, обладающими активностью LPAAT. Предпочтительными организмами, обладающими активностью LPAAT, являются продуцирующие липиды грибы, включая без ограничения M. alpina.
Для анализа EST сначала получают библиотеку кДНК. Что касается получения библиотеки кДНК, то можно обратиться к публикации «Molecular Cloning, A Laboratory Manual 3rd ed.» (Cold Spring Harbor Press (2001)). Альтернативно можно использовать коммерчески доступный набор для получения библиотеки кДНК. В качестве примера можно использовать следующие способы получения библиотеки кДНК, подходящие для настоящего изобретения. А именно, подходящий штамм M. alpina, продуцирующего липиды гриба, высевают в подходящую среду и предварительно инкубируют в течение соответствующего периода времени. Условия культивирования, подходящие для такого предварительного культивирования, включают, например, состав среды: 1,8% глюкоза, 1% дрожжевой экстракт и pH 6,0, период культивирования, составляющий 3 суток, и температуру культивирования 28°C. Затем продукт предварительного культивирования подвергают основному культивированию в подходящих условиях. В состав среды, подходящей для основного культивирования, могут входить, например, 1,8% глюкоза, 1% соевый порошок, 0,1% оливковое масло, 0,01% адеканол, 0,3% KH2PO4, 0,1% Na2SO4, 0,05% CaCl2·2H2O, 0,05% MgCl2·6H2O и pH 6,0. Условия культивирования, подходящие для основной культуры, могут представлять собой, например, культивирование в аэробных условиях с постоянным вращением при 300 об./мин, с аэрацией 1 vvm (объем подаваемого воздуха в минуту), 26°C в течение 8 суток. Во время культивирования может быть добавлено нужное количество глюкозы. Во время основного культивирования отбирают образцы продукта культивирования в соответствующих временных точках, из которых затем собирают клетки, чтобы получить суммарную РНК. Для получения суммарной РНК можно использовать известный способ, такой как способ на основе применения гидрохлорида гуанидина/CsCl. Полученная суммарная РНК может быть обработана с использованием коммерчески доступного набора для очистки поли(A)+РНК. Затем может быть получена библиотека кДНК с помощью коммерчески доступного набора. Затем определяют нуклеотидную последовательность любого клона из библиотеки кДНК, полученной таким образом, используя праймеры, которые конструируют в векторе, позволяющие определять нуклеотидную последовательность вставки. В результате можно определить EST. Например, в случае использования для получения библиотеки кДНК набора для клонирования ZAP-cDNA GigapackIII Gold (STRATAGENE) можно осуществлять направленное клонирование.
Идентичность нуклеотидных последовательностей ORF LPAAT3 и LPAAT4 составляет 66,6%. С другой стороны, существуют два известных гомолога LPAAT1 и LPAAT2 для LPAAT, полученной из M. alpina. Взаимосвязь между указанными двумя гомологами и двумя гомологами согласно настоящему изобретению показана на дендрограмме на фигуре 1. ORF LPAAT3 согласно настоящему изобретению имеет идентичность нуклеотидной последовательности, составляющую 34,3% и 47,0%, с такими известными LPAAT1 и LPAAT2, соответственно, тогда как ORF LPAAT4 имеет идентичность нуклеотидной последовательности, составляющую 34,6% и 47,3%, с такими известными LPAAT1 и LPAAT2, соответственно. Как видно на фигуре 1, LPAAT3 и LPAAT4 согласно настоящему изобретению значительно удалены от известных LPAAT в эволюционной классификации, и их функции также отличаются от функций известных LPAAT. А именно, как будет объяснено далее, LPAAT3 и LPAAT4 согласно настоящему изобретению имеют функции, полностью отличающиеся от функций известных LPAAT, так как они позволяют хозяину продуцировать композицию жирных кислот, соотношение жирных кислот в которой отличается от соотношения в композициях жирных кислот, продуцируемых хозяевами, экспрессирующими известные LPAAT, и так как содержание арахидоновой кислоты в клетках-хозяевах, экспрессирующих такие LPAAT согласно настоящему изобретению, выше, чем содержание арахидоновой кислоты в клетках-хозяевах, не экспрессирующих LPAAT согласно настоящему изобретению.
Следует отметить, что в том случае, когда анализ проводят с использованием BLASTX, нуклеотидные последовательности, кодирующие LPAAT3 и LPAAT4 согласно настоящему изобретению идентичны на 49,2% и 51,3%, соответственно, нуклеотидной последовательности (GB, № доступа XM_757480), кодирующей предполагаемый белок, полученный из Ustilago maydis 521 (фигура 1) (UM06426.1, номер доступа GB EAK87199), имеющий наименьшее E-значение.
Подобным образом, идентичность аминокислотных последовательностей LPAAT3 и LPAAT4 составляет 69,1%. LPAAT3 идентична по аминокислотной последовательности на 12,3% и 17,3% с известными LPAAT1 и LPAAT2, соответственно, тогда как LPAAT4 по аминокислотной последовательности идентична на 12,5% и 15,5% известным LPAAT1 и LPAAT2, соответственно. Следует отметить, что в том случае, когда анализ проводят с использованием BLASTP, аминокислотные последовательности LPAAT3 и LPAAT4 согласно настоящему изобретению имеют идентичность 36,2% и 36,7%, соответственно, с предполагаемым белком, полученным из Ustilago maydis 521 (фигура 1) (UM06426.1, № доступа GB EAK87199), имеющим наименьшее E-значение.
Настоящее изобретение также охватывает нуклеиновые кислоты, функционально эквивалентные нуклеиновой кислоте, содержащей приведенную выше нуклеотидную последовательность, показанную в SEQ ID NO: 36 или 37 (далее также называемую «нуклеотидной последовательностью согласно настоящему изобретению»), или нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности, показанной в SEQ ID NO: 2 или 4 (далее называемой «аминокислотной последовательностью согласно настоящему изобретению»). Подразумевается, что фраза «функционально эквивалентный» означает, что белок, кодируемый нуклеотидной последовательностью согласно настоящему изобретению, или белок, состоящий из аминокислотной последовательности согласно настоящему изобретению, обладает активностью LPAAT. Активность LPAAT может быть измерена известным способом, который проиллюстрирован ниже. А именно, получают фракцию микросом из дрожжевых клеток, трансформированных так, чтобы они экспрессировали LPAAT согласно настоящему изобретению, как описано, например, в J. Bacteriology, 173, 2026-2034 (1991). Затем к реакционному раствору, содержащему 0,44 мМ LPA, 0,36 мМ ацил-CoA, 0,5 мМ DTT, 1 мг/мл БСА и 2 мМ MgCl2 в трис-HCl (pH 7,5), добавляют микросомальную фракцию и подвергают взаимодействию при 28°C в течение соответствующего периода времени. Добавляют смесь хлороформ:метанол, чтобы остановить реакцию, с последующей экстракцией липидов. Полученные липиды фракционируют, используя тонкослойную хроматографию или другие способы, при этом можно определить количество PA, образуемого в указанной выше реакции. В результате более высокое количество образованного PA может быть показателем более высокой активности LPAAT. Например, обнаружено, что в штаммах, трансформированных таким способом, чтобы экспрессировать LPAAT3 или LPAAT4, увеличено количество линолевой кислоты (18:2), включенной во фракцию PA, в случае использования линолеоил-CoA в качестве ацил-CoA в указанной выше реакции. Таким образом, LPAAT3 и LPAAT4 можно считать ферментами, обладающими активностью LPAAT.
Кроме указанной активности LPAAT белок, кодируемый нуклеотидной последовательностью согласно настоящему изобретению, или белок, состоящий из аминокислотной последовательности согласно настоящему изобретению, может обладать способностью, приводить к соотношению жирных кислот, обеспечивающему более высокий относительный показатель, по меньшей мере, для одного или нескольких из следующих компонентов:
i) содержания олеиновой кислоты;
ii) отношения содержания пальмитолеиновой кислоты к содержанию пальмитиновой кислоты;
iii) отношения содержания олеиновой кислоты к содержанию пальмитиновой кислоты; и
iv) отношения общего содержания стеариновой кислоты и олеиновой кислоты к содержанию пальмитиновой кислоты;
в соотношении жирных кислот у хозяина, экспрессирующего белок, чем в соотношении жирных кислот у хозяина, не экспрессирующего белок (такой белок далее также называют «белком, обладающим способностью приводить к соотношению жирных кислот, как и LPAAT согласно настоящему изобретению»).
Конкретным примером является нуклеиновая кислота, содержащая нуклеотидную последовательность, кодирующую белок, обладающий способностью давать соотношение жирных кислот, обеспечивающее:
i) содержание олеиновой кислоты, составляющее 52% или более;
ii) отношение содержания пальмитолеиновой кислоты к содержанию пальмитиновой кислоты, составляющее 7,25 или выше;
iii) отношение содержания олеиновой кислоты к содержанию пальмитиновой кислоты, составляющее 9,94 или выше; и
iv) отношение общего содержания стеариновой кислоты и олеиновой кислоты к содержанию пальмитиновой кислоты, составляющее 10,72 или выше,
когда указанную выше нуклеотидную последовательность согласно настоящему изобретению встраивают в экспрессирующий вектор pYE22m (Biosci. Biotech. Biochem., 59, 1221-1228, 1995) и трансформируют дрожжевую клетку штамма Saccharomyces cerevisiae EH13-15 (Appl. Microbiol. Biotechnol., 30, 515-520, 1989), и полученный трансформант культивируют, чтобы собрать клетки, которые затем анализируют в отношении жирных кислот способами, описанными в примере 7 ниже. Более предпочтительной является нуклеиновая кислота, содержащая нуклеотидную последовательность, кодирующую белок, обладающий как активностью LPAAT, так и указанной выше способностью давать соотношение жирных кислот, как и LPAAT согласно настоящему изобретению. Следует отметить, что указанные соотношения жирных кислот могут немного варьировать, когда трансформанты культивируют в условиях культивирования, отличных от условий, используемых в указанных выше способах согласно примеру 7. Такие условия культивирования включают, например, температуру и время культивирования.
В объеме определения «функционально эквивалентный» в дополнение к активности LPAAT и способности давать соотношение жирных кислот такое же, как и LPAAT согласно настоящему изобретению, белок, кодируемый нуклеотидной последовательностью согласно настоящему изобретению, или белок, состоящий из аминокислотной последовательности согласно настоящему изобретению, может обладать способностью обеспечивать более высокое содержание арахидоновой кислоты в клетках-хозяевах, экспрессирующих белок, кодируемый нуклеотидной последовательностью согласно настоящему изобретению, или белок, состоящий из аминокислотной последовательности согласно настоящему изобретению, чем в клетках-хозяевах, не экспрессирующих белок (такой белок далее также называют «белком, обладающим способностью увеличивать внутриклеточное содержание арахидоновой кислоты, согласно настоящему изобретению»).
Определение арахидоновой кислоты будет приведено в разделе описания «Композиции жирных кислот согласно настоящему изобретению» далее. Как и в указанном выше случае, такая нуклеиновая кислота более конкретно представляет собой нуклеиновую кислоту, содержащую нуклеотидную последовательность, кодирующую белок, обладающий способностью давать соотношение жирных кислот, обеспечивающее более высокое внутриклеточное содержание арахидоновой кислоты, чем у хозяина, не экспрессирующего белок, когда нуклеотидную последовательность согласно настоящему изобретению встраивают в экспрессирующий вектор pYE22m и трансформируют дрожжевые клетки-хозяева, продуцирующие арахидоновую кислоту, штамма ARA3-1, который получен из штамма дрожжей Saccharomyces cerevisiae YPH499 посредством введения и экспрессии десатуразы жирных кислот Δ12, десатуразы жирных кислот Δ6, элонгазы жирных кислот Δ6 и элонгазы жирных кислот Δ5, и полученный трансформант культивируют, чтобы собрать клетки, которые затем анализируют в отношении жирных кислот способами, описанными в примере 7 ниже. Более предпочтительной является нуклеиновая кислота, содержащая нуклеотидную последовательность, кодирующую белок, обладающий как активностью LPAAT, так и способностью повышать внутриклеточное содержание арахидоновой кислоты, согласно настоящему изобретению.
Такие нуклеиновые кислоты, которые являются функционально эквивалентными нуклеиновым кислотам согласно настоящему изобретению, включают нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в любом из пунктов (a)-(e) ниже. Следует отметить, что при использовании для описания нуклеотидных последовательностей, перечисленных ниже, фраза «указанная выше активность согласно настоящему изобретению» означает «активность LPAAT и/или способность давать соотношение жирных кислот, как LPAAT согласно настоящему изобретению, и/или способность повышать внутриклеточное содержание арахидоновой кислоты согласно настоящему изобретению», определенные выше.
(a) Нуклеотидная последовательность, которая кодирует белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 2 или 4, и обладающий указанной выше активностью согласно настоящему изобретению.
Нуклеотидные последовательности, входящие в состав нуклеиновых кислот согласно настоящему изобретению, включают нуклеотидную последовательность, которая кодирует белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 2 или 4, и обладающий указанной выше активностью согласно настоящему изобретению.
Более конкретно, нуклеотидная последовательность представляет собой нуклеотидную последовательность, которая кодирует белок, состоящий из:
(i) аминокислотной последовательности с делецией одной или нескольких (предпочтительно одной или нескольких (например, 1-100, 1-50, 1-30, 1-25, 1-20, 1-15, 1-10, более предпочтительно 1-5)) аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 2 или 4;
(ii) аминокислотной последовательности с заменой другими аминокислотами одной или нескольких (предпочтительно одной ли нескольких (например, 1-100, 1-50, 1-30, 1-25, 1-20, 1-15, 1-10, более предпочтительно 1-5)) аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 2 или 4;
(iii) аминокислотной последовательности с добавлением одной или нескольких других (предпочтительно одной или нескольких (например, 1-100, 1-50, 1-30, 1-25, 1-20, 1-15, 1-10, более предпочтительно 1-5)) аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 2 или 4; или
(iv) аминокислотной последовательности с сочетанием модификаций (i)-(iii), указанных выше,
и обладающий указанной выше активностью согласно настоящему изобретению.
Среди указанных выше модификаций замена предпочтительно является консервативной, что означает замену определенного аминокислотного остатка другим остатком, имеющим сходные физические и химические свойства. Может быть осуществлена любая замена, при условии, что она существенно не изменяет структурные признаки исходной последовательности. Например, возможна любая замена, при условии, что введенные при замене аминокислоты не нарушают спираль, присутствующую в исходной последовательности, или не нарушают любой другой тип вторичной структуры, характеризующей исходную последовательность.
Консервативную замену обычно вводят посредством синтеза в биологических системах или посредством химического синтеза пептидов, предпочтительно в результате химического синтеза пептидов. В таком случае замены могут включать неприродные аминокислотные остатки, а также пептидомиметики и обратные или инвертированные формы аминокислотных последовательностей, в которых незамещенные области перевернуты или инвертированы.
Аминокислотные остатки классифицированы и перечислены ниже в группах взаимно замещаемых представителей, но не ограничены указанным:
Группа A: лейцин, изолейцин, норлейцин, валин, норвалин, аланин, 2-аминобутановая кислота, метионин, O-метилсерин, трет-бутилглицин, трет-бутилаланин и циклогексилаланин;
Группа B: аспарагиновая кислота, глутаминовая кислота, изоаспарагиновая кислота, изоглутаминовая кислота, 2-аминоадипиновая кислота и 2-аминосубериновая кислота;
Группа C: аспарагин и глутамин;
Группа D: лизин, аргинин, орнитин, 2,4-диаминобутановая кислота и 2,3-диаминопропионовая кислота;
Группа E: пролин, 3-гидроксипролин и 4-гидроксипролин;
Группа F: серин, треонин и гомосерин; и
Группа G: фенилаланин и тирозин.
Неконсервативная замена может заключаться в обмене представителя одного из указанных выше классов представителем другого класса. В данном случае, в целях сохранения биологических функций белков согласно настоящему изобретению, предпочтительно учитывают гидропатический индекс аминокислот (гидропатический аминокислотный индекс) (Kyte et al., J. Mol. Biol., 157: 105-131(1982)).
В случае неконсервативной замены аминокислотные замены также могут быть осуществлены на основе гидрофильности.
В описании и на чертежах в настоящей заявке нуклеотиды, аминокислоты и их сокращенные названия представляют собой названия согласно биохимической номенклатуре, утвержденной комиссией ИЮПАК-ИЮБ, или названия, обычно используемые в данной области, например, как описано в Immunology--A Synthesis (второе издание, под редакцией E.S. Golub и D.R. Gren, Sinauer Associates, Sunderland, Massachusetts (1991)). Кроме того, подразумевается, что аминокислоты, которые могут являться оптическими изомерами, представляют собой L-изомеры, если не оговорено особо.
Стереоизомеры (например, D-аминокислоты) указанных выше аминокислот, неприродные аминокислоты, такие как α,α-дизамещенные аминокислоты, N-алкиламинокислоты, молочная кислота и другие необычные аминокислоты также могут быть представителями, составляющими белки согласно настоящему изобретению.
Следует отметить, что при записи белка, используемой в настоящем описании, направление влево означает амино-концевое направление, а направление вправо означает направление к карбоксильному концу согласно стандартному использованию и договоренности.
Подобным образом, если не оговорено особо, левый конец однонитевых полинуклеотидных последовательностей является 5'-концом, а направление влево в двунитевых полинуклеотидных последовательностях называют 5'-направлением.
Специалисты в данной области могут сконструировать и получить соответствующие мутанты белков, описанных в настоящей публикации, используя способы, известные в данной области. Например, в случае целенаправленного воздействия на область, которая, по-видимому, является менее важной для биологической активности белка согласно настоящему изобретению, можно идентифицировать подходящую область в молекуле белка, структура которой может быть изменена без нарушения биологической активности белка согласно настоящему изобретению. Также можно идентифицировать остатки или области в молекуле, которые являются консервативными в сходных белках. Кроме того, также можно ввести консервативные аминокислотные замены в область, которая, по-видимому, является важной для биологической активности или структуры белка согласно настоящему изобретению, без нарушения биологической активности и без неблагоприятного влияния на полипептидную структуру белка. В частности, в настоящем изобретении, как показано в виде подчеркивания двойной чертой на фигуре 6, две аминокислотных последовательности LPAAT согласно настоящему изобретению содержат консенсусный мотив «HXXXXD (HX4D)» (консервативные аминокислотные остатки указаны *). Указанный мотив необходим для ацилтрансферазы глицеролипидов (J. Bacteriology, 180, 1425-1430, 1998) и также имеет важное значение для LPAAT согласно настоящему изобретению. Таким образом, мутанты согласно настоящему изобретению никоим образом не ограничены, при условии, что указанный выше консенсусный мотив сохранен, и указанная выше активность согласно настоящему изобретению не ограничена. В указанном выше консенсусном мотиве X означает любой аминокислотный остаток.
Специалисты в данной области могут провести так называемое структурно-функциональное исследование, в котором идентифицируют остатки в белке согласно настоящему изобретению и в сходном с ним пептиде, которые важны для биологической активности или структуры, и сравнивают аминокислотные остатки между двумя пептидами, таким образом предсказывают, какие остатки в белке, сходном с белком согласно настоящему изобретению, являются аминокислотными остатками, соответствующими остаткам, важным для биологической активности или структуры. Кроме того, могут быть выбраны химически сходные замены аминокислот для предсказанных таким образом аминокислотных остатков, чтобы тем самым выбрать мутант, который сохраняет биологическую активность белка согласно настоящему изобретению. Подобным образом специалисты в данной области также могут провести анализ трехмерной структуры и аминокислотной последовательности такого мутантного белка. Полученные таким образом результаты анализа затем можно использовать для прогнозирования выравнивания аминокислотных остатков по отношению к трехмерной структуре белка. Так как аминокислотные остатки, которые предположительно находятся на поверхности белка, могут быть вовлечены в важные взаимодействия с другими молекулами, то специалисты в данной области могут получить мутант, в котором такие аминокислотные остатки, предположительно расположенные на поверхности белка, не изменены, на основе результатов указанного выше анализа. Кроме того, специалисты в данной области также могут получить мутант, имеющий одну аминокислотную замену любого из аминокислотных остатков, составляющих белок согласно настоящему изобретению. Может быть проведен скрининг таких мутантов с помощью любого из известных анализов, чтобы собрать информацию об отдельных мутантах, которая в свою очередь позволяет оценить значение отдельных аминокислотных остатков, составляющих белок согласно настоящему изобретению, когда сравнение проводят в тех случаях, когда мутант, имеющий замену специфичного аминокислотного остатка, проявляет более низкую биологическую активность, чем активность белка согласно настоящему изобретению, когда такой мутант не проявляет биологической активности, или когда такой мутант обладает неподходящей активностью, ингибирующей биологическую активность белка согласно настоящему изобретению. Кроме того, на основании информации, полученной в таких обычных экспериментах, специалисты в данной области легко могут проанализировать аминокислотные замены, нежелательные для мутантов белка согласно настоящему изобретению, либо отдельно, либо в сочетании с другими мутациями.
Как описано выше, белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 2 или 4, может быть получен такими способами, как сайт-специфичный мутагенез, который описан в «Molecular Cloning, A Laboratory Manual 3rd ed.» (Cold Spring Harbor Press (2001)), «Current Protocols in Molecular Biology» (John Wiley and Sons (1987-1997), Kunkel (1985) Proc. Natl. Acad. Sci. USA 82: 488-92, и Kunkel (1988) Method. Enzymol. 85: 2763-6. Получение мутанта с такой мутацией, включая делецию, замену или добавление аминокислоты, можно осуществить, например, известными способами, такими как способ Кункеля или способ образования дуплекса с пробелами с использованием набора для введения мутаций на основе сайт-специфичного мутагенеза, такого как набор для сайт-специфичного мутагенеза QuikChangeTM (Stratagene), система сайт-специфичного мутагенеза GeneTailorTM (Invitrogen) или система сайт-специфичного мутагенеза TaKaRa (например, Mutan-K, Mutan-Super Express Km; Takara Bio Inc., Japan).
Способы, позволяющие получать делецию, замену или добавление одной или нескольких аминокислот в аминокислотных последовательностях белков, сохраняя при этом их активность, включают сайт-специфичный мутагенез, указанный выше, а также другие способы, такие как способы обработки гена мутагеном и способы, при которых ген избирательно расщепляют, чтобы удалить, заменить или добавить выбранный нуклеотид или нуклеотиды, и затем лигируют.
Предпочтительной нуклеотидной последовательностью, входящей в состав нуклеиновых кислот согласно настоящему изобретению, является нуклеотидная последовательность, которая кодирует белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением 1-10 аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 2 или 4, и обладающий активностью LPAAT.
Кроме того, нуклеотидные последовательности, входящие в состав нуклеиновых кислот согласно настоящему изобретению, также включают нуклеотидную последовательность, которая кодирует белок, состоящий из аминокислотной последовательности с делецией, заменой или добавлением 1-10 аминокислот в последовательности SEQ ID NO: 2 или 4, и обладающий указанной выше активностью согласно настоящему изобретению.
Не существует ограничения по количеству или сайтам аминокислотных мутаций или модификаций в белке согласно настоящему изобретению, при условии, что полученный мутант сохраняет активность LPAAT или способность давать соотношение жирных кислот, как и LPAAT согласно настоящему изобретению, или способность повышать внутриклеточное содержание арахидоновой кислоты согласно настоящему изобретению.
Активность LPAAT согласно настоящему изобретению или способность давать такое же соотношение жирных кислот, как и LPAAT согласно настоящему изобретению, или способность повышать внутриклеточное содержание арахидоновой кислоты согласно настоящему изобретению можно измерить известным способом. Например, смотри следующий документ: J.B.C., 265, 17215-17221, 1990.
«Активность LPAAT» согласно настоящему изобретению может быть измерена, например, следующим образом. Фракцию микросом получают из дрожжевых клеток, трансформированных для экспрессии LPAAT согласно настоящему изобретению, как описано, например, в J. Bacteriology, 173, 2026-2034 (1991). Затем к реакционному раствору, содержащему 0,44 мМ LPA, 0,36 мМ ацил-CoA, 0,5 мМ DTT, 1 мг/мл БСА и 2 мМ MgCl2 в 50 мМ трис-HCl (pH 7,5), добавляют указанную выше фракцию микросом и подвергают взаимодействию при 28°C в течение соответствующего периода времени. Добавляют смесь хлороформ:метанол, чтобы остановить реакцию, с последующей экстракцией липидов. Полученные липиды фракционируют, используя тонкослойную хроматографию или другие способы, при этом можно определить количество образуемого PA.
Подобным образом «способность давать соотношение жирных кислот, как в случае LPAAT» согласно настоящему изобретению можно измерить, например, следующим образом. К лиофилизированным клеткам, полученным способом согласно настоящему изобретению для получения композиции жирных кислот, добавляют смесь хлороформ:метанол, доведенную до подходящего соотношения, и перемешивают, затем проводят термическую обработку в течение соответствующего периода времени. Затем осуществляют центрифугирование, чтобы отделить клетки и собрать растворитель. Указанную операцию повторяют несколько раз. Затем липиды сушат соответствующим образом и добавляют растворитель, такой как хлороформ, чтобы растворить липиды. Соответствующую аликвоту такого образца обрабатывают способом на основе использования смеси хлороводородная кислота/метанол, получая из жирных кислот в клетках соответствующие сложные метиловые эфиры, с последующей экстракцией гексаном. После отгонки гексана жирные кислоты анализируют газовой хроматографией. Кроме того, «способность повышать внутриклеточное содержание арахидоновой кислоты» согласно настоящему изобретению также можно измерить, анализируя содержание арахидоновой кислоты указанным выше способом.
(b) Нуклеотидную последовательность, которая может гибридизоваться в жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, состоящей из последовательности SEQ ID NO: 36 или 37, и которая кодирует белок, обладающий указанной выше активностью согласно настоящему изобретению.
Нуклеотидные последовательности, входящие в состав нуклеиновых кислот согласно настоящему изобретению, включают нуклеотидную последовательность, которая может гибридизоваться в жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, состоящей из последовательности SEQ ID NO: 36 или 37, и которая кодирует белок, обладающий указанной выше активностью согласно настоящему изобретению. Последовательности SEQ ID NO: 36 или 37 и активность LPAAT описаны выше.
Чтобы получить указанную выше нуклеотидную последовательность, можно получить зонд из соответствующего фрагмента способом, известным специалистам в данной области, и такой зонд можно использовать в известным способах гибридизации, таких как гибридизация на колониях, гибридизация на бляшках или Саузерн-блоттинг, чтобы получить нуклеотидную последовательность из библиотеки кДНК, геномной библиотеки или тому подобной.
Что касается подробного описания способов гибридизации, можно указать публикации «Molecular Cloning, A Laboratory Manual 3rd ed.» (Cold Spring Harbor Press (2001); особенно разделы 6-7), «Current Protocols in Molecular Biology» (John Wiley and Sons (1987-1997); особенно разделы 6.3-6.4), «DNA Cloning 1: Core Techniques, A Practical Approach 2nd ed.» (Oxford University (1995); особенно раздел 2.10, где описаны условия гибридизации).
Жесткость гибридизации главным образом определяется условиями гибридизации, более предпочтительно условиями гибридизации и условиями промывки. Подразумевается, что термин «жесткие условия» в используемом в настоящем описании смысле включает условия умеренной или высокой жесткости.
Более конкретно, условия умеренной жесткости включают в себя, например, условия гибридизации от 1×SSC до 6×SSC при 42°C-55°C, более предпочтительно от 1×SSC до 3×SSC при 45°C-50°C, и наиболее предпочтительно 2×SSC при 50°C. В некоторых случаях, например, когда раствор для гибридизации содержит примерно 50% формамида, используют температуру, которая на 5°C-15°C ниже, чем указанная выше температура. Условия промывки могут представлять собой от 0,5×SSC до 6×SSC при 40°C-60°C. Во время гибридизации и промывки обычно можно добавлять от 0,05% до 0,2% SDS, предпочтительно примерно 0,1% SDS.
Условия высокой жесткости включают в себя гибридизацию и/или промывку при более высокой температуре и/или более низкой концентрации соли по сравнению с условиями умеренной жесткости. Например, условия гибридизации могут представлять собой от 0,1×SSC до 2×SSC при 55°C-65°C, более предпочтительно от 0,1×SSC до 1×SSC при 60°C-65°C, и наиболее предпочтительно 0,2×SSC при 63°C. Условия промывки могут представлять собой от 0,2×SSC до 2×SSC при 50°C-68°C и более предпочтительно 0,2×SSC при 60°C-65°C.
Условия гибридизации, в частности, используемые в настоящем изобретении, включают в себя без ограничения предварительную гибридизацию в 5×SSC, 1% SDS, 50 мМ трис-HCl (pH 7,5) и 50% формамиде при 42°C, инкубацию в течение ночи при 42°C в присутствии зонда для образования гибридов и последующие три промывки в 0,2×SSC, 0,1% SDS при 65°C в течение 20 минут.
Также можно использовать коммерчески доступный набор для гибридизации, в котором не применяют радиоактивные вещества в качестве зонда. Конкретные примеры включают гибридизацию с использованием набора для выявления нуклеиновых кислот DIG (Roche Diagnostics) или с использованием системы прямого мечения и регистрации ECL (Amersham).
Предпочтительной нуклеотидной последовательностью, которая входит в объем настоящего изобретения, является нуклеотидная последовательность, которая может гибридизоваться в условиях 2×SSC при 50°C с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, состоящей из последовательности SEQ ID NO: 36 или 37, и которая кодирует белок, обладающий активностью LPAAT.
(c) Нуклеотидная последовательность, которая состоит из нуклеотидной последовательности, на 67% или более идентичной нуклеотидной последовательности, состоящей из последовательности SEQ ID NO: 36 или 37, и которая кодирует белок, обладающий указанной выше активностью согласно настоящему изобретению.
Нуклеотидные последовательности, входящие в состав нуклеиновых кислот согласно настоящему изобретению, включают нуклеотидную последовательность, которая состоит из нуклеотидной последовательности, по меньшей мере, на 67% или более идентичной последовательности нуклеиновой кислоты, показанной в SEQ ID NO: 36 или 37, и которая кодирует белок, обладающий указанной выше активностью согласно настоящему изобретению.
Предпочтительными примерами являются нуклеиновые кислоты, содержащие нуклеотидную последовательность, которая, по меньшей мере, на 70%, более предпочтительно на 75%, еще более предпочтительно на 80% (например, на 85% или более, еще более предпочтительно на 90% или более, более предпочтительно на 95%, 98% или 99%) идентична последовательности нуклеиновой кислоты, показанной в SEQ ID NO: 36 или 37, и которая кодирует белок, обладающий указанной выше активностью согласно настоящему изобретению. Как описано выше, идентичность между LPAAT3 (SEQ ID NO: 36) и LPAAT4 (SEQ ID NO: 37) составляет 66,6%. К нуклеиновым кислотам согласно настоящему изобретению относятся нуклеиновые кислоты, которые, по меньшей мере, на 67% или более идентичны последовательности нуклеиновой кислоты, показанной в SEQ ID NO: 36 или 37, и которые сходны с двумя указанными последовательностями.
Идентичность в процентах между двумя последовательностями нуклеиновых кислот можно определить посредством визуального просмотра и с помощью математического расчета, или более предпочтительно с использованием компьютерной программы, чтобы сравнить информацию о последовательностях двух нуклеиновых кислот. Компьютерные программы для сравнения последовательностей включают, например, программу BLASTN (Altschul et al. (1990) J. Mol. Biol. 215: 403-10) версия 2.2.7, доступную для использования на веб-сайте Национальной медицинской библиотеки: http://www.ncbi.nlm.nih.gov/blast/bl2seq/bls.html, или алгоритм WU-BLAST 2.0. Установки стандартных параметров по умолчанию для WU-BLAST 2.0 описаны на следующем сайте в Интернете: http://blast.wustl.edu.
(d) Нуклеотидная последовательность, которая кодирует аминокислотную последовательность, имеющую идентичность 69% или более с аминокислотной последовательностью, состоящей из последовательности SEQ ID NO: 2 или 4, и которая кодирует белок, обладающий указанной выше активностью согласно настоящему изобретению.
Нуклеотидные последовательности, входящие в состав нуклеиновых кислот согласно настоящему изобретению, включают нуклеотидную последовательность, которая кодирует аминокислотную последовательность, имеющую идентичность 69% или более с аминокислотной последовательностью, состоящей из последовательности SEQ ID NO: 2 или 4, и которая кодирует белок, обладающий указанной выше активностью согласно настоящему изобретению. Белки, кодируемые нуклеиновыми кислотами согласно настоящему изобретению, также могут представлять собой белки, обладающие идентичностью с аминокислотной последовательностью LPAAT3 или LPAAT4, при условии, что они функционально эквивалентны белкам, обладающим указанной выше активностью согласно настоящему изобретению.
Конкретными примерами являются аминокислотные последовательности, имеющие идентичность, составляющую 70% или выше, предпочтительно 75% или выше, более предпочтительно 80%, более предпочтительно 85% или выше, еще более предпочтительно 90% (например, 95%, более предпочтительно 98%) с аминокислотной последовательностью, показанной в SEQ ID NO: 2 или 4. Как описано выше, идентичность аминокислотных последовательностей между LPAAT3 (SEQ ID NO: 2) и LPAAT4 (SEQ ID NO: 4) составляет 69,1%. Белки, кодируемые нуклеиновыми кислотами согласно настоящему изобретению, включают белки, по меньшей мере, на 69% или более идентичные аминокислотной последовательности, показанной в SEQ ID NO: 2 или 4, и сходные с двумя указанными последовательностями.
Предпочтительная нуклеотидная последовательность, входящая в состав нуклеиновых кислот согласно настоящему изобретению, представляет собой нуклеотидную последовательность, которая кодирует аминокислотную последовательность, имеющую идентичность, составляющую 90% или более, с аминокислотной последовательностью, состоящей из последовательности SEQ ID NO: 2 или 4, и которая кодирует белок, обладающий указанной выше активностью согласно настоящему изобретению. Более предпочтительной является нуклеотидная последовательность, которая кодирует аминокислотную последовательность, имеющую идентичность, составляющую 95% или более, с аминокислотной последовательностью, состоящей из последовательности SEQ ID NO: 2 или 4, и которая кодирует белок, обладающий указанной выше активностью согласно настоящему изобретению.
Идентичность в процентах между двумя аминокислотными последовательностями может быть определена посредством визуального просмотра и математического расчета. Альтернативно идентичность в процентах может быть определена с использованием компьютерной программы. Примеры такой компьютерной программы включают BLAST, FASTA (Altschul et al., J. Mol. Biol., 215: 403-410 (1990)) и ClustalW. В частности, различные условия (параметры) для поиска идентичности с помощью программы BLAST описаны Altschul et al. (Nucl. Acids. Res., 25, p.3389-3402, 1997) и общедоступны на веб-сайте Национального центра биотехнологической информации (NCBI) или в банке данных о ДНК Японии (DDBJ) (BLAST Manual, Altschul et al., NCB/NLM/NIH Bethesda, MD 20894; Altschul et al.). Также можно использовать такую программу, как компьютерная программа для обработки генетической информации GENETYX Ver.7 (Genetyx Corporation, Japan), DINASIS Pro (Hitachisoft, Japan) или Vector NTI (Infomax) для определения идентичности в процентах.
Некоторые схемы выравнивания аминокислотных последовательностей также могут приводить к совпадению конкретных коротких областей последовательностей, и также можно выявить область с очень высокой идентичностью последовательностей в такой небольшой выровненной области, даже когда нет значимой взаимосвязи между используемыми полноразмерными последовательностями. Кроме того, в случае алгоритма BLAST используют матрицу подсчета аминокислот BLOSUM62, и необязательно можно использовать следующие параметры: (A) введение фильтра, чтобы замаскировать участки запрашиваемой последовательности, которые имеют низкую композиционную сложность (которую определяют с использованием программы SEG Wootton и Federhen (Computers and Chemistry, 1993); также смотри Wootton and Federhen, 1996, “Analysis of compositionally biased regions in sequence databases”, Methods Enzymol., 266: 554-71), или участки, состоящие из коротких внутренних периодических повторов (которые определяют с помощью программы XNU Claverie и States (Computers and Chemistry, 1993)), и (B) предел статистической значимости для сообщаемых совпадений с последовательностями в базе данных или E-оценка (предполагаемая вероятность совпадений, обнаруживаемых только случайно согласно стохастической модели Karlin and Altschul, 1990; если статистическая значимость, приписываемая совпадению, превышает указанный предел E-значения, то о совпадении не сообщается).
(e) Нуклеотидная последовательность, которая может гибридизоваться в жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящий из аминокислотной последовательности, показанной в SEQ ID NO: 2 или 4, и которая кодирует белок, обладающий указанной выше активностью согласно настоящему изобретению.
Нуклеотидные последовательности, входящие в состав нуклеиновых кислот согласно настоящему изобретению, включают нуклеотидную последовательность, которая может гибридизоваться в жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящий из аминокислотной последовательности, показанной в SEQ ID NO: 2 или 4, и которая кодирует белок, обладающий указанной выше активностью согласно настоящему изобретению.
Такой белок, состоящий из аминокислотной последовательности, показанной в SEQ ID NO: 2 или 4, и условия гибридизации описаны выше. Нуклеотидные последовательности, входящие в состав нуклеиновых кислот согласно настоящему изобретению, включают нуклеотидную последовательность, которая может гибридизоваться в жестких условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящий из аминокислотной последовательности, показанной в SEQ ID NO: 2 или 4, и которая кодирует белок, обладающий указанной выше активностью согласно настоящему изобретению.
Нуклеиновые кислоты согласно настоящему изобретению также включают нуклеиновую кислоту, которая содержит нуклеотидную последовательность с делецией, заменой или добавлением одного или нескольких нуклеотидов в нуклеотидной последовательности, состоящей из последовательности SEQ ID NO: 36 или 37 и кодирующей белок, обладающий указанной выше активностью согласно настоящему изобретению. Более конкретно, также можно использовать нуклеиновую кислоту, которая содержит нуклеотидную последовательность, выбранную из:
(i) нуклеотидной последовательности с делецией одного или нескольких (предпочтительно одного или нескольких (например, 1-300, 1-250, 1-200, 1-150, 1-100, 1-50, 1-30, 1-25, 1-20, 1-15, 1-10, более предпочтительно 1-5)) нуклеотидов в нуклеотидной последовательности, показанной в SEQ ID NO: 36 или 37;
(ii) нуклеотидной последовательности с заменой другими нуклеотидами одного или нескольких (предпочтительно одного или нескольких (например, 1-300, 1-250, 1-200, 1-150, 1-100, 1-50, 1-30, 1-25, 1-20, 1-15, 1-10, более предпочтительно 1-5)) нуклеотидов в нуклеотидной последовательности, показанной в SEQ ID NO: 36 или 37;
(iii) нуклеотидной последовательности с добавлением одного или нескольких (предпочтительно одного или нескольких (например, 1-300, 1-250, 1-200, 1-150, 1-100, 1-50, 1-30, 1-25, 1-20, 1-15, 1-10, более предпочтительно 1-5)) нуклеотидов в нуклеотидной последовательности, показанной в SEQ ID NO: 36 или 37; или
(iv) нуклеотидной последовательности с любым сочетанием изменений, указанных в пунктах (i)-(iii) выше,
и кодирующую белок, обладающий указанной выше активностью согласно настоящему изобретению.
Предпочтительным вариантом нуклеиновых кислот согласно настоящему изобретению также является нуклеиновая кислота, содержащая нуклеотидную последовательность, указанную в любом из пунктов (a)-(c) ниже, или ее фрагмент:
(a) нуклеотидную последовательность, показанную в SEQ ID NO: 36 или 37;
(b) нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности, показанной в SEQ ID NO: 2 или 4; или
(c) нуклеотидную последовательность, показанную в SEQ ID NO: 1 или 3.
Указанные выше (a) нуклеотидная последовательность, показанная в SEQ ID NO: 36 или 37, (b) нуклеотидная последовательность, кодирующая белок, состоящий из аминокислотной последовательности, показанной в SEQ ID NO: 2 или 4, и (c) нуклеотидная последовательность, показанная в SEQ ID NO: 1 или 3 представлены в таблице 1. Фрагменты таких последовательностей могут быть либо природными, либо полученными искусственно, включая области, входящие в указанные выше нуклеотидные последовательности, т.е. ORF, CDS, биологическая активная область, область, используемая в качестве праймера, как описано далее, и область, которая может служить в качестве зонда.
Белки ацилтрансферазы лизофосфатидной кислоты согласно настоящему изобретению.
Белки согласно настоящему изобретению, которые могут быть либо природного происхождения, либо созданными искусственно, включают белок, состоящий из аминокислотной последовательности, показанной в SEQ ID NO: 2 или 4, и белки, функционально эквивалентные указанному белку. Такой белок, состоящий из аминокислотной последовательности, показанной в SEQ ID NO: 2 или 4, представляет собой такой же белок, как белок, описанный выше. Подразумевается, что термин «функционально эквивалентные белки» означает белки, обладающие «указанной выше активностью согласно настоящему изобретению», объяснение которой дано в разделе «Нуклеиновые кислоты согласно настоящему изобретению, кодирующие ацилтрансферазу лизофосфатидной кислоты», приведенном выше.
В настоящем изобретении белки, функционально эквивалентные белку, состоящему из аминокислотной последовательности, показанной в SEQ ID NO: 2 или 4, включают белок, описанный в пунктах (a) или (b) ниже:
(a) белок, который состоит из аминокислотной последовательности с делецией, заменой или добавлением одной или нескольких аминокислот в последовательности SEQ ID NO: 2 или 4 и который обладает указанной выше активностью согласно настоящему изобретению; или
(b) белок, который состоит из аминокислотной последовательности, на 69% или более идентичной аминокислотной последовательности, состоящей из последовательности SEQ ID NO: 2 или 4, и который обладает указанной выше активностью согласно настоящему изобретению.
Среди указанных выше последовательностей аминокислотная последовательность с делецией, заменой или добавлением одной или нескольких аминокислот в последовательности SEQ ID NO: 2 или 4 или аминокислотная последовательность, на 69% или более идентичная аминокислотной последовательности, состоящей из последовательности SEQ ID NO: 2 или 4, представляют собой последовательности, которые описаны в разделе «Нуклеиновые кислоты согласно настоящему изобретению, кодирующие ацилтрансферазу лизофосфатидной кислоты», приведенном выше. Подразумевается, что фраза «белок, который обладает указанной выше активностью согласно настоящему изобретению» также охватывает мутанты белка, кодируемого нуклеиновой кислотой, содержащей нуклеотидную последовательность SEQ ID NO: 36 или 37, или мутантные белки с различными модификациями, такими как замена, делеция или добавление одной или нескольких аминокислот в аминокислотной последовательности, показанной в SEQ ID NO: 2 или 4, а также модифицированные белки, боковые цепи аминокислот в которых или тому подобное модифицированы, и такие белки, слитые с другими белками, при условии, что такие белки обладают активностью LPAAT и/или способностью давать соотношение жирных кислот, как и LPAAT согласно настоящему изобретению, и/или способностью повышать внутриклеточное содержание арахидоновой кислоты согласно настоящему изобретению.
Белки согласно настоящему изобретению также могут быть получены искусственно способами химического синтеза, такими как Fmoc-способ (способ на основе флуоренилметилоксикарбонила) и tBoc-способ (способ на основе трет-бутилоксикарбонила). Кроме того, для химического синтеза можно использовать синтезаторы пептидов, доступные из Advanced ChemTech, Perkin Elmer, Pharmacia, Protein Technology Instrument, Synthecell-Vega, PerSeptive, Shimadzu Corporation (Japan) или от других производителей.
Клонирование нуклеиновых кислот LPAAT
Нуклеиновые кислоты LPAAT согласно настоящему изобретению могут быть клонированы, например, в результате скрининга из библиотеки кДНК с использованием подходящего зонда. Их также можно клонировать с помощью ПЦР-амплификации с подходящими праймерами и последующего лигирования в подходящий вектор. Полученные таким образом клоны затем могут быть субклонированы в другой вектор.
Например, можно использовать коммерчески доступные плазмидные векторы, включая pBlue-ScriptTM SK(+) (Stratagene), pGEM-T (Promega), pAmp (TM: Gibco-BRL), p-Direct (Clontech) и pCR2.1-TOPO (Invitrogen). В случае использования ПЦР-амплификации праймеры могут представлять собой любые области нуклеотидной последовательности, показанной, например, в SEQ ID NO: 1 или 3. В качестве примера можно использовать следующие праймеры из последовательности SEQ ID NO: 1:
I-1: 5'-GGATGTCATCAATGTCATCAATAGAG-3' (SEQ ID NO: 9) в качестве расположенного выше праймера; и
I-2: 5'-CTAACCCCCTCTTCCTCCACCAC-3' (SEQ ID NO: 10) в качестве расположенного ниже праймера,
или следующие праймеры из последовательности SEQ ID NO: 3:
B-1: 5'-CCTCGCAAAATGTATCGTGG-3' (SEQ ID NO: 15) в качестве расположенного выше праймера; и
B-2: 5'-GATGGGAAGTTGAGCTTGAATG-3' (SEQ ID NO: 16) в качестве расположенного ниже праймера. Затем осуществляют ПЦР на кДНК, полученной из клеток M. alpina, с использованием указанных выше праймеров и термофильной ДНК-полимеразы или тому подобной. Хотя такой способ легко может быть осуществлен специалистами в данной области согласно описанию, приведенному, например, в «Molecular Cloning, A Laboratory Manual 3rd ed.» (Cold Spring Harbor Press (2001)), в качестве примера можно указать следующие условия ПЦР, применимые для настоящего изобретения:
температура денатурации: 90-95°C;
температура отжига: 40-60°C;
температура элонгации: 60-75°C;
количество циклов: 10 или более циклов.
Полученные продукты ПЦР могут быть очищены известным способом, например, с использованием набора (например, GENECLEAN (Funakoshi Co., Ltd., Japan), наборы для очистки продуктов ПЦР QIAquick (QIAGEN), ExoSAP-IT (GE Healthcare Bio-Sciences)), фильтра из DEAE-целлюлозы или диализной трубки. В случае использования агарозного геля продукты ПЦР подвергают электрофорезу в агарозном геле, и фрагменты нуклеотидной последовательности вырезают из агарозного геля и затем очищают с помощью наборов GENECLEAN (Funakoshi Co., Ltd., Japan) или набора для экстракции из геля (QIAGEN), или способом замораживания-сдавливания и т.д.
Могут быть определены нуклеотидные последовательности клонированных нуклеиновых кислот с использованием секвенатора нуклеотидов.
Конструирование вектора для экспрессии LPAAT и получение трансформантов
Настоящее изобретение также относится к рекомбинантному вектору, содержащему нуклеиновую кислоту, кодирующую LPAAT3 или LPAAT4 согласно настоящему изобретению. Настоящее изобретение, кроме того, относится к трансформанту, трансформированному указанным выше рекомбинантным вектором.
Такой рекомбинантный вектор и трансформант можно получить следующим образом. А именно, плазмиду, несущую нуклеиновую кислоту, кодирующую LPAAT согласно настоящему изобретению, расщепляют ферментами рестрикции. Примеры ферментов рестрикции, доступных для применения, включают без ограничения EcoRI, KpnI, BamHI и SalI. После такого расщепления концы могут быть затуплены полимеразой T4. Отщепленный фрагмент нуклеотидной последовательности очищают электрофорезом в агарозном геле. Такой фрагмент нуклеотидной последовательности может быть интегрирован в экспрессирующий вектор известным способом, чтобы получить вектор для экспрессии LPAAT. Указанный экспрессирующий вектор вводят в хозяина, получая трансформант, который затем обеспечивает экспрессию требуемого белка.
В данном случае типы экспрессирующих векторов и хозяев никоим образом не ограничены, при условии, что они обеспечивают экспрессию требуемого белка. Примерами хозяина являются грибы, бактерии, растения, животные или их клетки. Грибы включают нитчатые грибы, такие как продуцирующие липиды грибы M. Alpina, и штаммы дрожжей, таких как Saccharomyces cerevisiae. Бактерии включают Escherichia coli (E. coli) и Bacillus subtilis. Подобным образом растения включают масличные растения, такие как рапс, соя, хлопчатник, сафлор и лен.
В качестве продуцирующих липиды штаммов можно использовать штаммы, описанные в MYCOTAXON, Vol. XLIV, NO. 2, pp. 257-265 (1992). Конкретными примерами являются микроорганизмы, относящиеся к роду Mortierella, примером которых служат микроорганизмы, относящиеся к подроду Mortierella, такие как Mortierella elongata IFO8570, Mortierella exigua IFO8571, Mortierella hygrophila IFO5941, Mortierella alpina IFO8568, ATCC16266, ATCC32221, ATCC42430, CBS219.35, CBS224.37, CBS250.53, CBS343.66, CBS527.72, CBS528.72, CBS529.72, CBS608.70, CBS754.68, а также микроорганизмы, относящиеся к подроду Micromucor, такие как Mortierella isabellina CBS194.28, IFO6336, IFO7824, IFO7873, IFO7874, IFO8286, IFO8308, IFO7884, Mortierella nana IFO8190, Mortierella ramanniana IFO5426, IFO8186, CBS112.08, CBS212.72, IFO7825, IFO8184, IFO8185, IFO8287, Mortierella vinacea CBS236.82. Особенно предпочтительным является Mortierella alpina.
Когда в качестве хозяина используют гриб, желательно, чтобы нуклеиновая кислота согласно настоящему изобретению могла сама реплицироваться в хозяине или имела структуру, способную встраиваться в хромосому гриба. Вместе с тем предпочтительно, чтобы нуклеиновая кислота дополнительно содержала промотор и терминатор. Когда в качестве хозяина используют M. alpina, примеры экспрессирующего вектора включают pD4, pDuraSC и pDura5. Можно использовать любой промотор, при условии, что он обеспечивает возможность экспрессии в хозяине, и примеры включают промоторы, полученные из M. alpina, такие как промотор гена гистона H4.1, промотор гена GAPDH (глицеральдегид-3-фосфатдегидрогеназы) и промотор гена TEF (фактор элонгации трансляции).
Способы введения рекомбинантного вектора в нитчатые грибы (например, M. alpina) включают электропорацию, способ на основе получения сферопластов и способы доставки частиц, а также прямую микроинъекцию ДНК в ядра. В случае использования ауксотрофного штамма хозяина могут быть отобраны штаммы, растущие на селективной среде, в которой отсутствуют питательные вещества, необходимые для штамма хозяина, с получением таким образом трансформированных штаммов. Альтернативно в том случае, когда для трансформации используют маркерный ген резистентности к лекарственному средству, культивирование можно осуществлять с использованием селективной среды, содержащей лекарственное средство, с получением таким образом колоний клеток, резистентных к лекарственному средству.
Когда в качестве хозяина используют дрожжи, примером экспрессирующего вектора является pYE22m. Альтернативно также можно использовать коммерчески доступные экспрессирующие векторы дрожжей, такие как pYES (Invitrogen) и pESC (STRATAGENE). Дрожжевые хозяева, подходящие для настоящего изобретения, включают без ограничения штамм Saccharomyces cerevisiae EH13-15 (trp1, MATα). Примерами промотора, доступного для применения, являются промоторы, полученные из дрожжей, или тому подобные, такие как промотор GAPDH, промотор gal1 и промотор gal10.
Способы введения рекомбинантного вектора в дрожжевые клетки включают способ на основе использования ацетата лития, электропорацию и способ с использованием сферопластов, а также опосредованную декстраном трансфекцию, преципитацию фосфатом кальция, опосредованную полибреном трансфекцию, слияние протопластов, инкапсулирование полинуклеотида(ов) в липосомы и прямую микроинъекцию ДНК в ядра.
Когда в качестве хозяина используют бактерию, такую как E. coli, примерами экспрессирующего вектора являются pGEX и pUC18, поставляемые Pharmacia. Примерами промотора, доступного для применения, являются промоторы, полученные из E. coli, фага, или тому подобные, такие как промотор trp, промотор lac, промотор PL и промотор PR. Способы введения рекомбинантного вектора в бактерии включают электропорацию и способы с использованием хлорида кальция.
Способ получения композиции жирных кислот согласно настоящему изобретению
Настоящее изобретение относится к способу получения композиции жирных кислот из указанного выше трансформанта, т.е. к способу получения композиции жирных кислот из продукта культивирования, полученного в результате культивирования указанного выше трансформанта, как более конкретно описано ниже. Однако способ согласно настоящему изобретению не ограничен описанным далее и может быть осуществлен любым другим общеизвестным способом.
Для культивирования организмов, трансформированных с целью экспрессии LPAAT, можно использовать любую среду, при условии, что она представляет собой раствор (среду) для культивирования, имеющий соответствующее значение pH и осмотическое давление, а также содержащий питательные вещества, необходимые для роста каждого хозяина, микроэлементы и биологические материалы, такие как сыворотка или антибиотики. Например, в случае дрожжевых клеток, трансформированных с целью экспрессии LPAAT, можно использовать среду SC-Trp, среду YPD, среду YPD5 или тому подобные среды без ограничения. Подробный состав среды проиллюстрирован на примере среды SC-Trp: 6,7 г основы азотного агара для дрожжей без аминокислот (DIFCO), 20 г глюкозы и 1,3 г порошка аминокислот (смесь 1,25 г сульфата аденина, 0,6 г аргинина, 3 г аспарагиновой кислоты, 3 г глутаминовой кислоты, 0,6 г гистидина, 1,8 г лейцина, 0,9 г лизина, 0,6 г метионина, 1,5 г фенилаланина, 11,25 г серина, 0,9 г тирозина, 4,5 г валина, 6 г треонина и 0,6 г урацила) на литр среды.
Можно использовать любые условия культивирования, при условии, что они подходят для роста хозяина и являются адекватными для поддержания образуемого фермента в стабильном состоянии. Более конкретно, отдельные условия могут быть скорректированы, включая степень анаэробности, длительность культивирования, температуру, влажность, статическое культивирование или культивирование при встряхивании. Культивирование можно осуществлять в одних и тех же условиях (одностадийная культура) или посредством так называемого двухстадийного или трехстадийного культивирования, используя два или более разных условий культивирования. Для крупномасштабного культивирования предпочтительной является двухстадийная культура или культура, полученная в результате осуществления большего количества стадий, вследствие высокой эффективности культивирования.
Чтобы подробно объяснить операции в случае применения способа согласно настоящему изобретению для получения композиции жирных кислот, культивирование в две стадии, при котором в качестве хозяина используют дрожжи, будет проиллюстрировано ниже в качестве примера. А именно, на стадии предварительного культивирования колонии, полученные как описано выше, высевают в среду, описанную выше (например, в среду SC-Trp), и культивируют, встряхивая при 30°C, в течение 2 суток. Затем на стадии основного культивирования раствор, полученный на стадии предварительного культивирования (500 мкл), добавляют к 10 мл среды YPD5 (2% дрожжевой экстракт, 1% полипептон, 5% глюкоза) и культивируют, встряхивая при 30°C, в течение 2 суток.
Композиции жирных кислот согласно настоящему изобретению
Настоящее изобретение также относится к композиции жирных кислот, которая представляет собой совокупность одной или нескольких жирных кислот в клетках, экспрессирующих LPAAT3 или LPAAT4 согласно настоящему изобретению. Такую композицию жирных кислот предпочтительно получают культивированием трансформанта, экспрессирующего LPAAT3 или LPAAT4 согласно настоящему изобретению. Жирные кислоты могут представлять собой свободные жирные кислоты или могут быть в виде триглицеридов, фосфолипидов и тому подобного. В частности, композиция жирных кислот согласно настоящему изобретению характеризуется наличием такого соотношения жирных кислот, которое обеспечивает более высокий относительный показатель, по меньшей мере, для одного или нескольких из следующих признаков:
i) содержания олеиновой кислоты;
ii) отношения содержания пальмитолеиновой кислоты к содержанию пальмитиновой кислоты;
iii) отношения содержания олеиновой кислоты к содержанию пальмитиновой кислоты; и
iv) отношения общего содержания стеариновой кислоты и олеиновой кислоты к содержанию пальмитиновой кислоты,
по сравнению с продуктом культивирования, полученным в результате культивирования хозяина, который не трансформирован рекомбинантным вектором согласно настоящему изобретению, или характеризуется наличием более высокого содержания арахидоновой кислоты по сравнению с продуктом культивирования, полученным в результате культивирования хозяина, который не трансформирован рекомбинантным вектором. Фраза «хозяин, который не трансформирован рекомбинантным вектором согласно настоящему изобретению» в используемом в настоящем описании смысле означает, например, хозяина, трансформированного пустым вектором, не несущим нуклеиновых кислот, описанных в разделе «Нуклеиновые кислоты согласно настоящему изобретению, кодирующие ацилтрансферазу лизофосфатидной кислоты». Следует отметить, что когда указанную выше композицию жирных кислот получают в разных условиях культивирования, соотношение жирных кислот может слегка варьировать, как описано в разделе «Нуклеиновые кислоты согласно настоящему зобретению, одирующие цилтрансферазу лизофосфатидной кислоты» выше.
Жирные кислоты, входящие в композицию жирных кислот согласно настоящему изобретению, относятся к неразветвленным или разветвленным монокарбоновым кислотам углеводов с длинной цепью, включая без ограничения миристиновую кислоту (тетрадекановую кислоту) (14:0), миристоленовую кислоту (тетрадеценовую кислоту)
(14:1), пальмитиновую кислоту (гексадекановую кислоту) (16:0), пальмитолеиновую кислоту (9-гексадеценовую кислоту) (16:1), стеариновую кислоту (октадекановую кислоту) (18:0), олеиновую кислоту (цис-9-октадеценовую кислоту) (18:1(9)), вакценовую кислоту (11-октадеценовую кислоту) (18:1(11)), линолевую кислоту (цис,цис-9, 12 октадекадиеновую кислоту) 18:2(9,12)), α-линоленовую ислоту 9,12,15-октадекатриеновую кислоту) (18:3(9,12,15)), γ-линоленовую кислоту (6,9,12-октадекатриеновую кислоту) (18:3(6,9,12)), стеаридоновую кислоту (6,9,12,15-октадекатетраеновую кислоту) (18:4(6,9,12,15)), арахиновую кислоту (эйкозановую кислоту) (20:0), (8,11-эйкозадиеновую кислоту) (20:2(8,11)), «mead acid» (5,8,11-эйкозатриеновую кислоту) (20:3(5,8,11)), дигомо-γ-линоленовую кислоту (8,11,14-эйкозатриеновую кислоту) (20:3(8,11,14)), арахидоновую кислоту (5,8,11,14-эйкозатетраеновую кислоту) (20:4(5,8,11,14)), эйкозатетраеновую кислоту (8,11,14,17-эйкозатетраеновую кислоту) (20:4(8,11,14,17)), эйкозапентаеновую кислоту (5,8,11,14,17-эйкозапентаеновую кислоту) (20:5(5,8,11,14,17)), бегеновую кислоту (докозановую кислоту) (22:0), (7,10,13,16-докозатетраеновую кислоту) (22:4(7,10,13,16)), (7,10,13,16,19-докозапентаеновую кислоту) (22:5(7,10,13,16,19)), (4,7,10,13,16-докозапентаеновую кислоту) (22:5(4,7,10,13,16)), (4,7,10,13,16,19-докозагексаеновую кислоту) (22:6(4,7,10,13,16,19)), лигноцериновую кислоту (тетрадокозановую кислоту) (24:0), ацетэруковую кислоту (цис-15-тетрадокозановую кислоту) (24:1) и церотовую кислоту (гексадокозановую кислоту) (26:0). Следует отметить, что указанные выше названия вещества являются общепринятыми названиями, определяемыми согласно биохимической номенклатуре ИЮПАК, и их систематические названия приведены в круглых скобках вместе с числами, показывающими количество атомов углерода и положения двойных связей.
Одним из отличительных признаков композиции жирных кислот согласно настоящему изобретению является высокое содержание арахидоновой кислоты. Арахидоновая кислота, вещество, представленное химическое формулой С20Н32О2 и имеющее молекулярную массу 304,47, является карбоновой кислотой, содержащей 20 атомов углерода и 4 двойных связи ([20:4 (n-6)]), которая согласно классификации является представителем серии (n-6). Арахидоновая кислота присутствует в виде важного фосфолипида (в частности, фосфатидилэтаноламина, фосфатидилхолина, фосфатидилинозитола) в мембранах клеток животных и в избытке присутствует в головном мозге. Кроме того, арахидоновая кислота служит в качестве исходного вещества для ряда эйкозаноидов (например, простагландина, тромбоксана, лейкотриена), образуемых в каскаде арахидоновой кислоты, а также имеет важное значение в качестве вторичного мессенджера при межклеточной передаче сигналов. С другой стороны, арахидоновая кислота синтезируется из линолевой кислоты в организме животных. Однако в зависимости от вида или возраста у некоторых животных такая функция не проявляется в достаточной степени, чтобы получить требуемое количество арахидоновой кислоты, или они не обладают функцией продуцирования арахидоновой кислоты. Таким образом, арахидоновая кислота должна поступать из источника пищи и ее можно считать незаменимой жирной кислотой.
Содержание арахидоновой кислоты в композиции жирных кислот согласно настоящему изобретению можно измерить, например, следующим образом. А именно, плазмиду для LPAAT3 или LPAAT4 согласно настоящему изобретению встраивают в такой вектор, как pDuraSC или pDura5MCS, как описано в примере 9, и трансформируют штамм M. alpina. Полученному трансформанту обеспечивают возможность для экспрессии и культивируют согласно способам, описанным в примере 9. Полученные таким образом культивируемые клетки используют для измерения содержания жирных кислот в клетках и/или содержания арахидоновой кислоты в среде, и т.д. Чтобы провести анализ содержания арахидоновой кислоты и т.д., например, жирные кислоты в полученных культивируемых клетках превращают в соответствующие метиловые эфиры жирных кислот способом на основе обработки хлороводородной кислотой/метанолом и затем экстрагируют гексаном. После отгонки гексана проводят анализ жирных кислот с использованием газовой хроматографии. Согласно указанному анализу обнаружено, что M. alpina, трансформированные LPAAT3 или LPAAT4 согласно настоящему изобретению, имеют не только высокое содержание жирных кислот в клетках, но также характеризуются высокой продукцией арахидоновой кислоты на единицу объема среды. Таким образом, композиция жирных кислот согласно настоящему изобретению, имеющая высокое содержание арахидоновой кислоты, является предпочтительной, так как обеспечивает эффективное потребление арахидоновой кислоты.
Композиция жирных кислот согласно настоящему изобретению может включать любое количество и любые типы жирных кислот, при условии, что она представляет собой сочетание одной или нескольких жирных кислот, выбранных из кислот, перечисленных выше.
Получают ли такую композицию жирных кислот согласно настоящему изобретению, т.е. экспрессируются ли LPAAT3 или LPAAT4 согласно настоящему изобретению, можно подтвердить, в основном, известным способом, например, в виде изменения соотношения жирных кислот в случае экспрессии LPAAT в дрожжевых клетках. А именно, к лиофилизированным клеткам, полученным способом согласно настоящему изобретению, описанным выше для получения композиции жирных кислот, добавляют смесь хлороформ:метанол, доведенную до нужного соотношения, и перемешивают, затем проводят термическую обработку в течение соответствующего периода времени. Затем проводят центрифугирование, чтобы отделить клетки и собрать растворитель. Указанную процедуру повторяют несколько раз. Затем липиды сушат соответствующим образом и добавляют растворитель, такой как хлороформ, чтобы растворить липиды. Соответствующую аликвоту такого образца обрабатывают способом на основе использования смеси хлороводородная кислота/метанол, превращая жирные кислоты в клетках в соответствующие сложные метиловые эфиры, с последующей экстракцией гексаном. После отгонки гексана жирные кислоты анализируют с помощью газовой хроматографии.
В результате, если получают композицию жирных кислот, имеющую указанное выше соотношение жирных кислот, и/или композицию жирных кислот, имеющую более высокое содержание арахидоновой кислоты, то можно определить, что получена композиция жирных кислот согласно настоящему изобретению. Следует отметить, что LPAAT согласно настоящему изобретению обеспечивает соотношение жирных кислот, которое отличается от соотношения жирных кислот в композиции жирных кислот в случае известных LPAAT, что свидетельствует о том, что LPAAT согласно настоящему изобретению обладает другой субстратной специфичностью, отличной от субстратной специфичности известных LPAAT.
Пищевые или другие продукты, содержащие композиции жирных кислот согласно настоящему изобретению
Настоящее изобретение также относится к пищевому продукту, содержащему указанную выше композицию жирных кислот. Композицию жирных кислот согласно настоящему изобретению можно применять обычным способом в таких целях, как производство пищевых продуктов, содержащих жиры и масла, а также производство исходных промышленных материалов (исходных материалов для косметических средств, фармацевтических средств (например, наружных препаратов для кожи), мыла и т.д.). Косметические средства (косметические композиции) или фармацевтические средства (фармацевтические композиции) могут быть приготовлены в виде дозированной формы, включая без ограничения растворы, пасты, гели, твердые вещества или порошки. Подобным образом, возможные формы пищевых продуктов включают такие фармацевтические препараты, как капсулы, а также переработанные пищевые продукты, такие как обычные продукты для жидкого питания, полупереваренные продукты для усиленного питания, продукты для элементного питания, питьевые препараты или препараты для энтерального введения питательных веществ, которые содержат композицию жирных кислот согласно настоящему изобретению в виде смеси с белками, сахарами, жирами, микроэлементами, витаминами, эмульгаторами, корригентами и т.д.
Кроме того, примеры пищевых продуктов согласно настоящему изобретению включают без ограничения пищевые добавки, продукты лечебного питания, функциональные продукты питания, продукты для детей, модифицированное молоко для новорожденных, модифицированное молоко для недоношенных детей и пищевые продукты для пожилых людей. Термин «пища» или «пищевой продукт» используют в настоящем описании в качестве общего названия съедобных материалов в форме твердых веществ, текучих веществ, жидкостей или их смесей.
Термин «пищевые добавки» относится к продуктам питания, обогащенным конкретными питательными ингредиентами. Термин «продукты лечебного питания» относится к пищевым продуктам, которые являются целебными или полезными для здоровья, и охватывает пищевые добавки, натуральные пищевые продукты и диетические продукты. Термин «функциональные продукты питания» относится к пищевым продуктам, дополняющим питательные ингредиенты, которые способствуют осуществлению функций регуляции организма. Функциональные продукты являются синонимом пищевых продуктов, специально используемых для поддержания здоровья. Термин «пищевые продукты для детей» относится к пищевым продуктам, которые получают дети примерно до 6-летнего возраста. Термин «продукты для пожилых людей» относится к пищевым продуктам, обработанным для облегчения переваривания и всасывания по сравнению с необработанными продуктами. Термин «модифицированное молоко для новорожденных» относится к модифицированному молоку, которое получают дети в возрасте примерно до одного года. Термин «модифицированное молоко для недоношенных детей» относится к модифицированному молоку, которое получают недоношенные дети в возрасте до 6 месяцев после рождения.
К указанным пищевым продуктам относятся натуральные продукты (обработанные жирами и маслами), такие как мясо, рыба и орехи; продукты с добавлением жиров и масел во время приготовления (например, продукты по-китайски, китайская лапша, супы); продукты, приготовленные с использованием жиров и масел в качестве нагревающей среды (например, темпура (жареные во фритюре рыба и овощи), жареные во фритюре продукты, жареный соевый творог, жареный рис по-китайски, пончики, жареные лепешки из теста по-японски (каринто)); продукты на основе жиров и масел или обработанные продукты с добавлением жиров и масел во время обработки (например, масло, маргарин, майонез, приправа, шоколад, лапша быстрого приготовления, карамель, печенье, лепешки, торт, мороженое); и продукты, опрыскиваемые или покрываемые жирами и маслами после приготовления (например, рисовые крекеры, сухое печенье, хлеб со сладкой соевой пастой). Однако пищевой продукт согласно настоящему изобретению не ограничен продуктами, содержащими жиры и масла, и другие примеры включают растительные пищевые продукты, такие как хлебобулочные изделия, лапша, блюда, приготовленные из риса, сладости (например, конфеты, жевательные резинки, gummies, таблетки, японские сладости), соевый творог и продукты его обработки; ферментированные пищевые продукты, такие как японское рисовое вино (саке), лекарственная настойка, сладкий херес (мирин), уксус, соевый соус и мисо (соевая паста); пищевые продукты животноводства, такие как йогурт, ветчина, бекон и колбаса; морепродукты, такие как рыбные лепешки (камабоко), жареные во фритюре рыбные лепешки (агетен) и лепешки из мяса акулы (ханпен); а также фруктовые напитки, безалкогольные напитки, спортивные напитки, алкогольные напитки и чай.
Способ оценки или селекции штаммов с использованием нуклеиновой кислоты, кодирующей LPAAT, или белка LPAAT согласно настоящему изобретению
Настоящее изобретение также относится к способу оценки или селекции продуцирующего липиды штамма с использованием нуклеиновой кислоты, кодирующей LPAAT, или белка LPAAT согласно настоящему изобретению. Подробное описание приведено ниже.
(1) Способ оценки
Одним из вариантов осуществления настоящего изобретения является способ оценки липид-продуцирующего штамма с использованием нуклеиновой кислоты, кодирующей LPAAT, или белка LPAAT согласно настоящему изобретению. В качестве первого примера указанного выше способа оценки согласно настоящему изобретению тестируемые продуцирующие липиды штаммы оценивают в отношении указанной выше активности согласно настоящему изобретению, используя праймеры или зонды, сконструированные на основе нуклеотидной последовательности согласно настоящему изобретению. Общие способы такой оценки известны и описаны, например, в международной публикации патента № WO 01/040514 или в JP 8-205900 A. Краткое описание такой оценки будет приведено ниже.
Сначала получают геном тестируемого штамма. Для получения генома можно использовать известную методику, такую как способ Херефорда или способ на основе использования ацетата калия (см., например, Methods in Yeast Genetics, Cold Spring Harbor Laboratory Press, p130 (1990)).
Праймеры или зонды конструируют на основе нуклеотидной последовательности согласно настоящему изобретению, предпочтительно последовательности SEQ ID NO: 36 или 37. Такие праймеры или зонды могут представлять собой любые области нуклеотидной последовательности согласно настоящему изобретению, и для их конструирования можно использовать известные способы. Количество нуклеотидов в полинуклеотиде, используемом в качестве праймера, обычно составляет 10 нуклеотидов или более, предпочтительно 15-25 нуклеотидов. Подобным образом, количество нуклеотидов, соответствующих области, фланкируемой праймерами, обычно составляет от 300 до 2000 нуклеотидов.
Праймеры или зонды, полученные как описано выше, используют для исследования того, содержит ли геном указанного выше тестируемого штамма последовательность, специфичную для нуклеотидной последовательности согласно настоящему изобретению. Последовательность, специфичная для нуклеотидной последовательности согласно настоящему изобретению, может быть выявлена с использованием известных способов. Например, полинуклеотид, содержащий часть или всю последовательность, специфичную для нуклеотидной последовательности согласно настоящему изобретению, или полинуклеотид, содержащий нуклеотидную последовательность, комплементарную указанной выше нуклеотидной последовательности, используют в качестве одного праймера, а полинуклеотид, содержащий часть или всю последовательность, расположенную выше или ниже данной последовательности, или полинуклеотид, содержащий нуклеотидную последовательность, комплементарную указанной выше нуклеотидной последовательности, используют в качестве другого праймера, чтобы амплифицировать нуклеиновые кислоты из тестируемого штамма с помощью ПЦР или другой методики с последующим определением наличия или отсутствия продуктов амплификации, молекулярной массы продуктов амплификации и т.д.
Условия ПЦР, подходящие для способа согласно настоящему изобретению, никоим образом не ограничены, и в качестве примера могут быть выбраны следующие условия:
температура денатурации: 90-95°C;
температура отжига: 40-60°C;
температура элонгации: 60-75°C;
количество циклов: 10 или более циклов.
Полученные продукты амплификации, которые являются продуктами реакции, могут быть разделены с помощью электрофореза в агарозном геле или тому подобным способом, чтобы определить молекулярную массу продуктов амплификации. Затем каждый продукт амплификации проверяют в отношении того, достаточна ли величина его молекулярной массы для того, чтобы охватить молекулу нуклеиновой кислоты, соответствующую области, специфичной для нуклеотидной последовательности согласно настоящему изобретению, при этом можно прогнозировать или провести оценку тестируемого штамма в отношении указанной выше активности согласно настоящему изобретению. Кроме того, если проводят анализ указанных выше продуктов амплификации в отношении их нуклеотидных последовательностей, как описано выше, то прогнозирование или оценка указанной выше активности согласно настоящему изобретению могут быть осуществлены более точно. Следует отметить, что оценку указанной выше активности согласно настоящему изобретению проводят такими же способами, как описанные выше способы.
В качестве другого примера указанного выше способа оценки согласно настоящему изобретению тестируемый штамм культивируют и измеряют уровень экспрессии LPAAT, кодируемой нуклеотидной последовательностью согласно настоящему изобретению (например, SEQ ID NO: 36 или 37), при этом тестируемый штамм можно оценить в отношении указанной выше активности согласно настоящему изобретению. Следует отметить, что уровень экспрессии LPAAT можно измерить посредством культивирования тестируемого штамма в соответствующих условиях и количественной оценки мРНК или белка LPAAT. Количественная оценка мРНК или белка может быть осуществлена известными способами, например, с использованием Нозерн-гибридизации или количественной ОТ-ПЦР для количественной оценки мРНК и Вестерн-блоттинга для количественной оценки белка (Current Protocols in Molecular Biology, John Wiley and Sons 1994-2003). Для оценки указанной выше активности также можно измерять соотношение жирных кислот и/или содержание арахидоновой кислоты в композиции жирных кислот, продуцируемой посредством LPAAT согласно настоящему изобретению. Способы измерения соотношения жирных кислот и/или содержания арахидоновой кислоты в композиции жирных кислот описаны выше.
(2) Способ селекции
Другой вариант осуществления настоящего изобретения относится к способу селекции продуцирующего липиды штамма с использованием нуклеиновой кислоты, кодирующей LPAAT, или белка LPAAT согласно настоящему изобретению. В качестве примера указанного выше способа селекции согласно настоящему изобретению тестируемые штаммы культивируют и измеряют уровень экспрессии нуклеотидной последовательности, кодирующей LPAAT, согласно настоящему изобретению (например, SEQ ID NO: 36 или 37), чтобы отобрать штамм с требуемым уровнем экспрессии, при этом может быть отобран штамм, обладающий требуемой активностью. Альтернативно, предварительно определяют типичный штамм, и такой типичный штамм и тестируемые штаммы культивируют и измеряют указанный выше уровень экспрессии с последующим сравнением уровней экспрессии в типичном штамме и каждом из тестируемых штаммов, при этом может быть отобран требуемый штамм. Более конкретно, например, типичный штамм и тестируемые штаммы культивируют в подходящих условиях и измеряют уровни экспрессии, чтобы отобрать тестируемый штамм с более высокой или более низкой экспрессией, чем типичный штамм, при этом может быть отобран штамм, обладающий требуемой активностью. Примеры требуемой активности включают уровень экспрессии LPAAT и/или соотношение жирных кислот, и/или содержание арахидоновой кислоты в композиции жирных кислот, продуцируемой благодаря LPAAT, которые могут быть измерены, как описано выше.
В качестве другого примера описанного выше способа селекции согласно настоящему изобретению тестируемые штаммы культивируют, чтобы отобрать штамм, в котором указанная выше активность согласно настоящему изобретению является высокой или низкой, при этом может быть отобран штамм, обладающий требуемой активностью. Примеры требуемой активности включают уровень экспрессии LPAAT и/или соотношение жирных кислот и/или содержание арахидоновой кислоты в композиции жирных кислот, продуцируемой благодаря LPAAT, которые могут быть измерены, как описано выше.
Примеры тестируемого штамма или типичного штамма, доступные для применения, включают без ограничения штамм, трансформированный указанным выше вектором согласно настоящему изобретению, штамм, модифицированный для подавления экспрессии указанной выше нуклеиновой кислоты согласно настоящему изобретению, штамм, модифицированный мутагенезом, и штамм, имеющий природную мутацию (мутации). Следует отметить, что активность LPAAT согласно настоящему изобретению, способность LPAAT давать соотношение жирных кислот согласно настоящему изобретению и способность повышать внутриклеточное содержание арахидоновой кислоты согласно настоящему изобретению можно измерить, например, способами, описанными в разделах «Нуклеиновые кислоты согласно настоящему изобретению, кодирующие ацилтрансферазу лизофосфатидной кислоты» и «Композиции жирных кислот согласно настоящему изобретению». Мутагенез можно осуществлять без ограничения физическими способами, включая ультрафиолетовое или радиоактивное излучение, или химическими способами, включая обработку таким агентом, как EMS (этилметансульфонат) или N-метил-N-нитрозогуанидин (смотри, например, Yasuji Oshima ed., Biochemistry Experiments vol. 39, Experimental Protocols for Yeast Molecular Genetics, pp. 67-75, Japan Scientific Societies Press).
Штаммы, используемые в настоящем изобретении в качестве типичных и тестируемых штаммов, включают без ограничения описанные выше продуцирующие липиды штаммы или дрожжевые штаммы. Более конкретно, типичный штамм или тестируемый штамм может представлять собой комбинацию любых штаммов, относящихся к разным родам и видам, и одновременно можно использовать один или несколько тестируемых штаммов.
Настоящее изобретение будет описано далее более подробно в виде следующих примеров, которые не следует считать ограничивающими объем настоящего изобретения.
Пример 1
(1) Анализ EST
Штамм M. alpina 1S-4 инокулировали в 100 мл среды (1,8% глюкоза, 1% дрожжевой экстракт, pH 6,0) и предварительно культивировали в течение 3 суток при 28°C. В сосуд для культивирования объемом 10 л (Able Co., Tokyo) загружали 5 л среды (1,8% глюкоза, 1% соевый порошок, 0,1% оливковое масло, 0,01% адеканол, 0,3% KH2PO4, 0,1% Na2SO4, 0,05% CaCl2·2H2O, 0,05% MgCl2·6H2O, pH 6,0) и инокулировали весь продукт предварительного культивирования с последующим культивированием в аэробных условиях с постоянным вращением при 300 об./мин, аэрации 1 vvm и 26°C в течение 8 суток. В 1, 2 и 3 день культивирования добавляли глюкозу в количестве, соответствующем 2%, 2% и 1,5%, соответственно. Клетки собирали на каждой стадии культивирования (1, 2, 3, 6 или 8 день), чтобы получить суммарную РНК способом с использованием гидрохлорида гуанидина/CsCl. Используя набор для очистки мРНК Oligotex-dT30<Super> (Takara Bio Inc., Japan), из суммарной РНК очищали поли(A)+РНК. Для каждой стадии готовили библиотеку кДНК, используя набор для клонирования ZAP-кДНК GigapackIII Gold (STRATAGENE), затем проводили однократный анализ последовательностей на 5'-конце кДНК (8000 клонов × 5 стадий). Полученные последовательности группировали. В результате получали примерно 5000 последовательностей.
(2) Поиск гомологов гена LPAAT
Нуклеотидные последовательности, полученные в результате анализа EST, исследовали по сравнению с аминокислотными последовательностями, зарегистрированным в GENEBANK, с помощью программы поиска гомологии BLASTX, чтобы выделить гомологи гена LPAAT. В результате обнаружили четыре последовательности гомологов LPAAT (SEQ ID NO: 1, 5, 6 и 7).
Белки, с которыми, как было обнаружено во время описанного выше поиска, указанные последовательности имели наибольшую идентичность, представляли собой следующие белки:
последовательность SEQ ID NO: 5, как было обнаружено, имеет наиболее высокую идентичность с полученным из Neurospora crassa предполагаемым белком, подобным 1-ацил-sn-глицерол-3-фосфатацилтрансферазе (GB, номер доступа EAA28956);
последовательность SEQ ID NO: 6, как было обнаружено, имеет наиболее высокую идентичность с полученным из Brassica napus предполагаемым белком, подобным 1-ацил-sn-глицерол-3-фосфатацилтрансферазе (GB, № доступа T07936);
последовательность SEQ ID NO: 1, как было обнаружено, имеют наиболее высокую идентичность с полученным из Emericella nidulans белком, подобным 1-ацил-sn-глицерол-3-фосфатацилтрансферазе, AtaAp (GB, № доступа AAD37345); и
последовательность SEQ ID NO: 7, как было обнаружено, обладает наиболее высокой идентичностью с полученным из S. cerevisiae белком 1-ацил-sn-глицерол-3-фосфатацилтрансферазы, Slc1p (GB, № доступа CAA98614).
Последовательности гомологов LPAAT M. alpina LPAAT, раскрытые в международной патентной публикации No. WO2004/087902 и в публикации патента США № US2006/0094090, сравнивали с полученными, как описано выше, последовательностями и показали, что последовательность SEQ ID NO: 5 является частичной последовательностью гомолога LPAAT1, а последовательность SEQ ID NO: 6 является частичной последовательностью гомолога LPAAT2.
Таким образом, ген последовательности SEQ ID NO: 5 идентифицировали как ген LPAAT1, ген последовательности SEQ ID NO: 6 идентифицировали как ген LPAAT2, ген последовательности SEQ ID NO: 1 идентифицировали как ген LPAAT3, и ген последовательности SEQ ID NO: 7 идентифицировали как ген LPAAT4.
Что касается указанных выше последовательностей, то библиотеки, из которых они происходят, и EST показаны в таблице 2. Следует отметить, что в таблице 2 клоны классифицированы по дням культивирования, в которые были получены библиотеки кДНК, являющиеся источниками таких клонов.
Пример 2
(1) Клонирование гомологов LPAAT
Последовательность SEQ ID NO: 1 содержит CDS длиной 990 п.н. (SEQ ID NO: 8) и может представлять собой последовательность, кодирующую полноразмерный ген LPAAT3. Рассчитанная аминокислотная последовательность белка (LPAAT3p), кодируемого указанным геном, показана в SEQ ID NO: 2. Для ПЦР-амплификации ДНК, содержащей такую последовательность ORF, получали следующие праймеры:
Праймер I-1: GGATGTCATCAATGTCATCAATAGAG (SEQ ID NO: 9); и
Праймер I-2: CTAACCCCCTCTTCCTCCACCAC (SEQ ID NO: 10).
Библиотеку кДНК, полученную на 3 день, использовали в качестве матрицы для осуществления ПЦР с праймерами I-1 и I-2, используя ExTaq (Takara Bio Inc., Japan). Устанавливали следующие условия ПЦР: 94°C в течение 2 минут, и 30 циклов при 94°C в течение 1 минуты, 54°C в течение 1 минуты и 72°C в течение 2 минут.
Амплифицированные фрагменты подвергали TA-клонированию с использованием набора для клонирования TOPO-TA (INVITROGEN CORPORATION). Для нескольких клонов подтверждали их нуклеотидные последовательности, и клон, который, как было обнаружено, содержал правильную нуклеотидную последовательность данного гена, конструировали в виде pCR-LPAAT3.
Последовательности SEQ ID NO: 5, 6 и 7, как было обнаружено, не содержат CDS, кодирующих гомолог LPAAT. Таким образом, для клонирования кДНК, кодирующих указанные полноразмерные гены, получали праймеры на основе каждой из указанных ниже последовательностей.
Праймеры, сконструированные на основе последовательности SEQ ID NO: 5:
Праймер 955-1: GGACGTGTCAAGGAAAAGGA (SEQ ID NO: 11)
Праймер 955-2: TCCTTCAGATGAGCCTCCTG (SEQ ID NO: 12)
Праймеры, сконструированные на основе последовательности SEQ ID NO: 6:
Праймер A-1: ggcgtccttctccacgtacttc (SEQ ID NO: 13)
Праймер A-2: gtgaaatacattccattctacg (SEQ ID NO: 14)
Праймеры, сконструированные на основе последовательности SEQ ID NO: 7:
Праймер B-1: CCTCGCAAAATGTATCGTGG (SEQ ID NO: 15)
Праймер B-2: GATGGGAAGTTGAGCTTGAATG (SEQ ID NO: 16)
Используя указанные праймеры, осуществляли ПЦР с помощью ExTaq (Takara Bio Inc., Japan), используя библиотеку кДНК, содержащую EST, входящие в состав последовательностей SEQ ID NO: 5, 6 или 7, в качестве матрицы. Полученные фрагменты ДНК подвергали TA-клонированию, используя набор для клонирования TOPO-TA (INVITROGEN CORPORATION), чтобы определить нуклеотидную последовательность для каждой вставки.
Результаты подтвердили, что фрагменты ДНК, содержащие нуклеотидные последовательности, охватывающие нуклеотиды 20-518 последовательности SEQ ID NO: 5, нуклеотиды 116-616 последовательности SEQ ID NO: 6 и нуклеотиды 159-687 последовательности SEQ ID NO: 7, были клонированы. Такие плазмиды были названы pCR-955-P, pCR-A-P и pCR-B-P, соответственно. Затем каждую из таких плазмид использовали в качестве матрицы для осуществления ПЦР с указанными выше праймерами. В ПЦР использовали ExTaq (Takara Bio Inc., Japan), но прилагаемую смесь dNTP заменяли смесью для мечения в реакции ПЦР (Roche Diagnostics) для мечения амплифицируемой ДНК дигоксигенином (DIG), при этом получали зонды для применения при скрининге библиотеки кДНК. Указанные зонды использовали для скрининга библиотек кДНК, из которых были получены EST, составляющие отдельные последовательности, с помощью анализа EST.
Устанавливали следующие условия гибридизации.
Буфер: 5×SSC, 1% SDS, 50 мМ трис-HCl (pH 7,5), 50% формамид.
Температура: 42°C (в течение ночи).
Условия промывки: в 0,2×SSC, 0,1% SDS при 65°C в течение 20 минут (повторяли три раза).
Регистрацию осуществляли, используя набор для выявления DIG-нуклеиновой кислоты (Roche Diagnostics). Из фаговых клонов, полученных в результате скрининга, извлекали плазмиды, используя эксцизию in vivo, чтобы получить плазмидную ДНК.
Нуклеотидная последовательность вставки из клона, полученного в результате скрининга кДНК, содержащей последовательность SEQ ID NO: 5, показана в SEQ ID NO: 17. Последовательность SEQ ID NO: 17 содержит CDS длиной 1254 п.н. между положениями 36 и 1289, что свидетельствует о том, что получена последовательность, кодирующая полноразмерный гомолог LPAAT1. Рассчитанная аминокислотная последовательность белка, кодируемого данным геном, показана в SEQ ID NO: 18. Плазмида, содержащая последовательность SEQ ID NO: 17, названа pB-LPAAT1.
Нуклеотидная последовательность наибольшей по размеру вставки среди клонов, полученных в результате скрининга кДНК, содержащей последовательность SEQ ID NO: 6, показана в SEQ ID NO: 19. Последовательность SEQ ID NO: 19 содержит CDS длиной 924 п.н. между положениями 26 и 949, что свидетельствует о том, что получена последовательность, кодирующая полноразмерный гомолог LPAAT2. Рассчитанная аминокислотная последовательность белка, кодируемого данным геном, показана в SEQ ID NO: 20. Плазмида, содержащая последовательность SEQ ID NO: 19, названа pB-LPAAT2.
Среди клонов, полученных в результате скрининга кДНК, содержащей последовательность SEQ ID NO: 7, для клона, имеющего вставку наибольшей длины, определили нуклеотидную последовательность, при этом показали, что указанный клон содержал нуклеотидную последовательность, охватывающую нуклеотиды 103-1148 последовательности SEQ ID NO: 1. Обнаружено, что указанная последовательность содержит последовательность, перекрывающуюся с последовательностью SEQ ID NO: 7, полученной ранее; при комбинировании указанных последовательностей получали последовательность, показанную в SEQ ID NO: 3. Последовательность SEQ ID NO: 3 содержит CDS длиной 942 п.н., показанную в SEQ ID NO: 23, что свидетельствует о том, что была получена последовательность, кодирующая полноразмерный гомолог LPAAT. Рассчитанная аминокислотная последовательность белка (LPAAT4p), кодируемого указанным геном, показана в SEQ ID NO: 4. Для ПЦР-амплификации ДНК, содержащей указанную область, получали следующие праймеры:
B-3: CATGTCCATAGGCTCTTCTAATCC (SEQ ID NO: 21); и
B-4: GTTTTACTCTTTCAGTGTCCTCC (SEQ ID NO: 22).
кДНК, полученную из клеток на 3 день, использовали в качестве матрицы для осуществления ПЦР с праймерами B-3 и B-4, используя ExTaq (Takara Bio Inc., Japan). Амплифицированные фрагменты подвергали TA-клонированию с pCR2.1-TOPO и подтверждали их нуклеотидные последовательности. Клон, который, как обнаружено, содержал правильную нуклеотидную последовательность данного гена, назван pCR-LPAAT4.
(2) Анализ последовательностей
Полученные таким образом последовательности кДНК гомологов LPAAT M. alpina подвергали анализу в отношении гомологии BLASTX, сравнивая их с аминокислотными последовательностями, зарегистрированными в GENEBANK. В результате аминокислотные последовательности, имеющие наименьшее E-значение, т.е. имеющие наибольшую идентичность с каждой из последовательностей, показаны ниже. Последовательности, имеющие наиболее высокую идентичность, анализировали с помощью clustalW, чтобы определить их идентичность с ORF каждой из последовательностей на уровне нуклеотидных и аминокислотных последовательностей, которые также показаны ниже.
Обнаружено, что последовательность SEQ ID NO: 17 имеет идентичность 51% на уровне нуклеотидной последовательности и 32,1% на уровне аминокислотной последовательности в сравнении с соответствующей областью полученного из Aspergillus nidulans предполагаемого белка, подобного 1-ацил-sn-глицерол-3-фосфатацилтрансферазе (GB, № доступа EAA60126).
Обнаружено, что последовательность SEQ ID NO: 19 имеет идентичность 53% на уровне нуклеотидной последовательности и 31% на уровне аминокислотной последовательности в сравнении с соответствующей область полученного из Magnaporthe grisea предполагаемого белка, подобного 1-ацил-sn-глицерол-3-фосфатацилтрансферазе (GB, № доступа EAA48685).
Обнаружено, что последовательности SEQ ID NO: 1 и 3 имеют идентичность 49% и 51% на уровне нуклеотидных последовательностей и 37% и 36% на уровне аминокислотных последовательностей, соответственно, в сравнении с соответствующей областью полученного из Ustilago maydis предполагаемого белка, подобного 1-ацил-sn-глицерол-3-фосфатацилтрансферазе (GB, № доступа EAK87199).
Последовательности SEQ ID NO: 17 и 19 также сравнивали с полученными из M. alpina известными гомологами LPAAT, т.е. геном LPAAT1 (WO2004/087902) и геном LPAAT2 (US2006/0094090), а также с рассчитанными аминокислотными последовательностями, кодируемыми такими генами. Последовательности, раскрытые в указанных выше документах, и последовательности, полученные из штамма M. alpina 1S-4 сравнивали друг с другом в соответствующих областях, подтвердили, что имела место 89% идентичность на уровне нуклеотидных последовательностей и 91% на уровне аминокислотных последовательностей в случае LPAAT1, при этом в случае LPAAT2 идентичность составляла 92% на уровне нуклеотидной последовательности и 98% на уровне аминокислотной последовательности.
Напротив, ни одна из последовательностей SEQ ID NO: 1-4 не имела значимо высокого уровня идентичности с известными нуклеотидными последовательностями и аминокислотными последовательностями, что свидетельствует о том, что они могут быть новыми генами LPAAT, полученными из M. alpina. Последовательности их кДНК и рассчитанные аминокислотные последовательности показаны на фигурах 2 и 3. Сравнение последовательностей ДНК областей ORF LPAAT3 и LPAAT4 показало идентичность на уровне 67% (фигура 4). Подобным образом, сравнение рассчитанных аминокислотных последовательностей белков LPAAT3p и LPAAT4p, кодируемых указанными генами, показало идентичность на уровне 69% (фигура 5).
Рассчитанные аминокислотные последовательности LPAAT3p и LPAAT4p сравнивали с известными аминокислотными последовательностями (фигура 6). Как показано подчеркиванием на фигуре, консенсусная последовательность HX4D глицеролипидацилтрансферазы (J. Bacteriology, 180, 1425-1430, 1998) является консервативной в LPAAT3p и LPAAT4p, как в случае известных белков LPAAT или их гомологов.
Среди аминокислотных последовательностей, показанных на фигуре 6, аминокислотная последовательность, указанная как gi_46101966 (SEQ ID NO: 40), получена из Ustilago maydis 521 (GB, № доступа EAK87199), аминокислотная последовательность, указанная как gi_5002178 (SEQ ID NO: 41), получена из Emericella nidulans (GB, № доступа AAD37345), аминокислотная последовательность, указанная как gi_6320151 (SEQ ID NO: 42), получена из Saccharomyces cerevisiae (GB, № доступа NP_010231), аминокислотная последовательность, указанная как gi_19115517 (SEQ ID NO: 43), получена из Schizosaccharomyces pombe 972h- (GB, № доступа NP_594605), и аминокислотная последовательность, указанная как gi_17564032 (SEQ ID NO: 44), получена из Caenorhabditis elegans (GB, № доступа NP_505578).
Пример 3
Измерение активности LPAAT
(1) Размножение штамма Δslc1:URA3
Чтобы получить CDS SLC1, известного как ген, ответственный за активность LPAAT у дрожжей, получали следующие праймеры:
праймер SLC1-1 ggtgaagggggaattcttc (SEQ ID NO: 45); и
праймер SLC1-2 atgtcgacgtggcttaatgcatc (SEQ ID NO: 46).
Чтобы получить геномную ДНК из штамма Saccharomyces cerevisiae S288C, указанный штамм высевали в среду YPD (10 мл) и культивировали, встряхивая при 30°C в течение 1 дня. Из 1,5 мл раствора для культивирования экстрагировали ДНК, используя набор Dr. GenTLE (для дрожжей) (Takara Bio Inc., Japan). ДНК использовали в качестве матрицы для амплификации CDS SLC1 в ПЦР с использованием праймеров SLC1-1 и SLC1-2. Полученный продукт ПЦР расщепляли ферментами рестрикции EcoRI и SalI, встраивали в EcoRI-SalI-сайт вектора pUC18, и затем подтверждали его нуклеотидную последовательность, получая плазмиду pUC-SLC1. Затем плазмиду pUC-SLC1 расщепляли ферментом рестрикции SalI, затем затупляли концы и осуществляли самолигирование, получая плазмиду pUC-SLC1-2.
Штамм, в котором отсутствует ген SLC1, получали следующим образом. Плазмиду pURA34 (JP 2001-120276 A) расщепляли ферментом рестрикции HindIII и концы затупляли, получая фрагмент ДНК длиной примерно 1,2 т.п.н., тогда как плазмиду pUC-SLC1-2 расщепляли ферментами рестрикции EcoRV и HincII, получая фрагмент ДНК длиной примерно 3,1 т.п.н. Полученные фрагменты ДНК лигировали, конструируя плазмиду pUCΔslc1:URA3. Штамм Saccharomyces cerevisiae YPH499 (STRATAGENE) трансформировали расщепленным ферментами EcoRI и HindIII фрагментом ДНК из плазмиды pUCΔslc1:URA3. Трансформированные штаммы подвергали скринингу на основании их способности расти на агаризованной среде SC-Ura (2% агар), содержащей в одном литре 6,7 г основы азотного агара для дрожжей без аминокислот (DIFCO), 20 г глюкозы и 1,3 г порошка аминокислот (смесь 1,25 г сульфата аденина, 0,6 г аргинина, 3 г аспарагиновой кислоты, 3 г глутаминовой кислоты, 0,6 г гистидина, 1,8 г лейцина, 0,9 г лизина, 0,6 г метионина, 1,5 г фенилаланина, 11,25 г серина, 0,9 г тирозина, 4,5 г валина, 6 г треонина и 1,2 г триптофана). Полученный трансформированный штамм назван штаммом Δslc1:URA3-1.
(2) Введение гена LPAAT в штамм Δslc1:URA3
Чтобы сконструировать вектор для экспрессии ScSLC1, pUC-SLC1 расщепляли ферментами рестрикции EcoRI и SalI и полученный фрагмент ДНК длиной 0,9 т.п.н. встраивали в сайт EcoRI-SalI вектора pYE22m, конструируя плазмиду pYE-ScSLC1.
Штамм Δslc1:URA3-1 трансформировали, соответственно, плазмидами pYE22m, pYELPAAT3, pYELPAAT4 и pYESLC1. Трансформированные штаммы подвергали скринингу на основании их способности расти на агаризованной среде SC-Trp,Ura (2% агар), содержащей в одном литре 6,7 г основы азотного агара для дрожжей без аминокислот (DIFCO), 20 г глюкозы и 1,3 г порошка аминокислот (смесь 1,25 г сульфата аденина, 0,6 г аргинина, 3 г аспарагиновой кислоты, 3 г глутаминовой кислоты, 0,6 г гистидина, 1,8 г лейцина, 0,9 г лизина, 0,6 г метионина, 1,5 г фенилаланина, 11,25 г серина, 0,9 г тирозина, 4,5 г валина и 6 г треонина).
Трансформированные штаммы, полученные с использованием соответствующих плазмид, названы штаммом C-3, штаммом LPAAT2-3, штаммом LPAAT3-3 и штаммом SLC1-3.
(3) Получение фракции микросом
Штаммы C-3, LPAAT3-3, LPAAT4-3 и SLC1-3 культивировали при встряхивании в жидкой среде SC-Trp,Ura (10 мл) при 30°C в течение 1 суток. Аликвоту объемом 1 мл из каждого раствора для культивирования инокулировали в жидкую среду SC-Trp,Ura (100 мл) и культивировали при 28°C в течение 1 суток. Клетки собирали центрифугированием и половину из них промывали стерилизованной водой и затем суспендировали в 5 мл буфера B (0,6 М сорбит, 5 мМ 2-(N-морфолино)этансульфоновая кислота (MES), 1 мМ KCl, 0,5 мМ этилендиаминтетрауксусная кислота (EDTA), 1 мМ фенилметилсульфонил (PMSF), pH 6,0). Клетки гомогенизировали при 16 кПа, используя френч-пресс, и центрифугировали при 20000×g в течение 1 часа при 4°C. Полученный надосадок снова центрифугировали при 100000×g в течение 1 часа при 4°C, и полученный осадок растворяли в буфере B, получая фракцию микросом. Концентрацию белка в каждом образце количественно определяли, используя раствор CBB для анализа белка (Nacalai Tesque, Inc., Japan).
(4) Измерение активности LPAAT
Активность LPAAT измеряли следующим образом. Реакционный раствор готовили в общем объеме 500 мкл, содержащем 100 мкг 1-олеоил-2-гидрокси-sn-глицеро-3-фосфата (LPA-18:1), 50 мкг линолеоил-кофермента A (18:2-CoA), 0,5 мМ дитиотреитола (DTT), 0,5 мг бычьего сывороточного альбумина (БСА), 2 мМ MgCl2, 50 мМ буфера трис-HCl (pH 7,5) и 100 мкл фракции микросом. После проведения реакции при 28°C в течение 10 минут добавляли смесь хлороформ:метанол (1:2, 1875 мкл), чтобы остановить реакцию. В качестве внутреннего стандарта добавляли 1,2-дигептадеканоил-sn-глицерофосфат (20 мкг). Липиды экстрагировали согласно способу, описанному Bligh and Dyer et al., и все фракционировали тонкослойной хроматографией (ТСХ). Для ТСХ использовали пластины силикагеля 60 (Merck and Co., Inc.) и растворитель для проявления хлороформ:метанол:уксусная кислота:вода = 170:25:25:4. Фракцию PA собирали соскабливанием и к ней добавляли дихлорметан (1 мл) и смесь 10% хлороводородная кислота/метанол (2 мл), превращая жирные кислоты в соответствующие метиловые эфиры способом на основе использования смеси хлороводородная кислота/метанол с последующей экстракцией гексаном. После отгонки гексана жирные кислоты анализировали газовой хроматографией, определяя количество линолевой кислоты в указанной фракции. Уровень линолевой кислоты во фракции PA во время указанной выше реакции показан в таблице ниже и выражен по отношению к белку в каждом растворе фермента.
Уровень линолевой кислоты во фракции PA по отношению к белку в растворе фермента (активность LPAAT)
Как показано выше, в штамме, трансформированном для экспрессии LPAAT3, LPAAT4 или SLC1, наблюдали увеличение количества линолевой кислоты (18:2), включенной в состав фракции PA во время указанной выше реакции, что свидетельствует о том, что LPAAT3 и LPAAT4 обладали активностью LPAAT.
Пример 4
Конструирование дрожжевого экспрессирующего вектора
Чтобы экспрессировать LPAAT1, LPAAT2, LPAAT3 и LPAAT4 в клетках дрожжей, конструировали дрожжевые экспрессирующие векторы следующим образом.
Чтобы экспрессировать LPAAT1 в клетках дрожжей, конструировали дрожжевой экспрессирующий вектор следующим образом. А именно, плазмиду Pb-LPAAT1 использовали в качестве матрицы для осуществления ПЦР с помощью следующих праймеров LPAAT1-6F (SEQ ID NO: 38) и LPAAT1-R1 (SEQ ID NO: 39), используя ExTaq (Takara Bio Inc., Japan).
LPAAT1-6F: TCTGAGATGGATGAATCCACCACCACCAC (SEQ ID NO: 38)
LPAAT1-R1: GTCGACTCAACCAGACGATACTTGCTGCAGAG (SEQ ID NO: 39)
Полученные фрагменты ДНК подвергали TA-клонированию с использованием набора для клонирования TOPO-TA (INVITROGEN), чтобы подтвердить нуклеотидную последовательность каждой вставки. Плазмида, несущая правильную нуклеотидную последовательность, названа pCR-LPAAT1. Полученную плазмиду расщепляли ферментами рестрикции EcoRI и SalI, получая фрагмент ДНК длиной примерно 1,3 т.п.н., который затем встраивали в EcoRI-SalI-сайт дрожжевого экспрессирующего вектора pYE22m, чтобы сконструировать плазмиду pYE-MALPAAT1.
Чтобы экспрессировать LPAAT2 в клетках дрожжей, конструировали дрожжевой экспрессирующий вектор следующим образом. А именно, плазмиду pB-LPAAT2 расщепляли ферментом рестрикции KpnI, концы затупляли обработкой щелочной фосфатазой и затем расщепляли ферментом рестрикции BamHI. Полученный фрагмент ДНК встраивали в дрожжевой экспрессирующий вектор pYE22m, который был расщеплен ферментом рестрикции SalI, подвергнут затуплению концов и затем расщеплен ферментом рестрикции BamHI. Полученная таким образом конструкция названа плазмидой pYE-MALPAAT2.
Чтобы экспрессировать LPAAT3 и LPAAT4 в клетках дрожжей, конструировали дрожжевые экспрессирующие векторы следующим образом. А именно, плазмиду pCR-LPAAT3 или pCR-LPAAT4 расщепляли ферментом рестрикции EcoRI, чтобы вырезать вставку, которую затем лигировали в EcoRI-сайт дрожжевого экспрессирующего вектора pYE22m. В каждом случае подтверждали ориентацию встроенного фрагмента ДНК, и конструкции, несущие соответствующие вставки в такой ориентации, чтобы вызвать транскрипцию ORF с промотора GAPDH pYE22m, названы pYE-MALPAAT3 и pYE-MALPAAT4, соответственно.
Пример 5
Трансформация дрожжей
Плазмиду pYE22m, pYE-MALPAAT1, pYE-MALPAAT2, pYE-MALPAAT3 или pYE-MALPAAT4 использовали для трансформации штамма дрожжей Saccharomyces cerevisiae EH13-15 (trp1, MATα) (Appl. Microbiol. Biotechnol., 30, 515-520, 1989) способом на основе использования ацетата лития. Трансформированные штаммы подвергали скринингу на основании их способности расти на агаризованной среде SC-Trp (2% агар), содержащей в одном литре 6,7 г основы азотного агара для дрожжей без аминокислот (DIFCO), 20 г глюкозы и 1,3 г порошка аминокислот (смесь 1,25 г сульфата аденина, 0,6 г аргинина, 3 г аспарагиновой кислоты, 3 г глутаминовой кислоты, 0,6 г гистидина, 1,8 г лейцина, 0,9 г лизина, 0,6 г метионина, 1,5 г фенилаланина, 11,25 г серина, 0,9 г тирозина, 4,5 г валина, 6 г треонина и 0,6 г урацила).
Пример 6
Культура дрожжей
Среди трансформированных штаммов, полученных с использованием каждого вектора, отбирали любые два штамма (штаммы c-1 и c-2, штаммы LPAAT1-1 и LPAAT1-2, штаммы LPAAT2-1 и LPAAT2-2, штаммы LPAAT3-1 и LPAAT3-2 или штаммы LPAAT4-1 и LPAAT4-2) и культивировали в следующих условиях.
А именно, на стадии предварительного культивирования петлю каждого дрожжевого штамма инокулировали из чашки в среду SC-Trp (10 мл) и культивировали, встряхивая при 30°C в течение 2 суток. На стадии основного культивирования раствор, полученный в результате предварительного культивирования (500 мкл), добавляли к 10 мл среды YPD5 (2% дрожжевой экстракт, 1% полипептон, 5% глюкоза) и культивировали, встряхивая при 30°C в течение 2 суток.
Пример 7
Анализ жирных кислот дрожжевых штаммов
Растворы дрожжей после культивирования центрифугировали, чтобы собрать клетки. После промывки 10 мл стерилизованной воды клетки снова собирали центрифугированием и подвергали лиофилизации. К лиофилизованным клеткам добавляли смесь хлороформ:метанол (2:1, 4 мл) и энергично перемешивали, затем инкубировали при 70°C в течение 1 часа. Клетки отделяли центрифугированием, чтобы собрать растворитель. К оставшимся клеткам снова добавляли смесь хлороформ:метанол (2:1, 4 мл) и такую же процедуру повторяли, собирая растворитель. После сушки липидов с использованием SpeedVac, добавляли 2 мл хлороформа, чтобы растворить липиды. Аликвоту данного образца объемом 200 мкл обрабатывали способом на основе использования хлороводородной кислоты/метанола, чтобы превратить жирные кислоты в клетках в соответствующие метиловые эфиры, с последующей экстракцией гексаном. После отгонки гексана жирные кислоты анализировали с помощью газовой хроматографии.
Полученные результаты показаны в таблице 4.
Соотношение жирных кислот в трансформированных штаммах (хозяин: EH13-15)
16:1
Дрожжевые штаммы, трансформированные четырьмя гомологами LPAAT, полученными из M. alpina, и контрольные дрожжевые штаммы сравнивали по соотношению жирных кислот. В соотношении жирных кислот LPAAT2-трансформированных дрожжей доля олеиновой кислоты немного возрастала по сравнению с контрольными штаммами, но различие было небольшим. С другой стороны, в соотношении жирных кислот LPAAT1-трансформированных дрожжей доля пальмитиновой кислота возрастала, но содержание пальмитолеиновой кислоты уменьшалось по сравнению с контрольными штаммами. Таким образом, отношение содержания пальмитолеиновой кислоты к содержанию пальмитиновой кислоты было ниже, чем в контрольных штаммах. Процентное содержание стеариновой кислоты и олеиновой кислоты было таким же, как в контрольных штаммах.
Напротив, в дрожжах, трансформированных LPAAT3 или LPAAT4, процентное содержание олеиновой кислоты увеличивалось на 10% или более по сравнению с контрольными штаммами, тогда как процентные содержания пальмитолеиновой кислоты и пальмитиновой кислоты увеличивались. Отношение пальмитолеиновой кислоты к пальмитиновой кислоте было выше, чем в контрольных штаммах.
Полученные результаты показывают, что четыре гомолога LPAAT, полученные из M. alpina, имели разную специфичность к ацильной группе субстрата, и поэтому штаммы дрожжей, трансформированных указанными генами, давали разные соотношения жирных кислот в случае разных гомологов. Результаты также показали, что можно выращивать организмы с требуемым соотношением жирных кислот в случае подбора указанных выше гомологов так, чтобы они подходили для предполагаемой цели.
Пример 8
Анализ экспрессии в штаммах дрожжей, продуцирующих арахидоновую кислоту
(1) Выведение штаммов дрожжей, продуцирующих арахидоновую кислоту
Чтобы вывести штаммы дрожжей (Saccharomyces cerevisiae), продуцирующих арахидоновую кислоту, конструировали следующие плазмиды.
Сначала кДНК, полученную из штамма M. alpina 1S-4, использовали в качестве матрицы для осуществления ПЦР с использованием ExTaq и набора праймеров Δ12-f и Δ12-r, Δ6-f и Δ6-r, GLELO-f и GLELO-r или Δ5-f и Δ5-r, амплифицируя при этом ген десатуразы жирных кислот Δ12, ген десатуразы жирных кислот Δ6, ген элонгазы жирных кислот GLELO или ген десатуразы жирных кислот Δ5 в штамме M. alpina 1S-4.
Δ12-f: TCTAGAatggcacctcccaacactattg (SEQ ID NO: 24)
Δ12-r: AAGCTTTTACTTCTTGAAAAAGACCACGTC (SEQ ID NO: 25)
Δ6-f: TCTAGAatggctgctgctcccagtgtgag (SEQ ID NO: 26)
Δ6-r: AAGCTTTTACTGTGCCTTGCCCATCTTGG (SEQ ID NO: 27)
GLELO-f: TCTAGAatggagtcgattgcgcaattcc (SEQ ID NO: 28)
GLELO-r: GAGCTCTTACTGCAACTTCCTTGCCTTCTC (SEQ ID NO: 29)
Δ5-f: TCTAGAatgggtgcggacacaggaaaaacc (SEQ ID NO: 30)
Δ5-r: AAGCTTTTACTCTTCCTTGGGACGAAGACC (SEQ ID NO: 31)
Указанные гены клонировали с использованием набора для клонирования TOPO-TA. Подтверждали нуклеотидные последовательности клонов, и клоны, содержащие нуклеотидные последовательности SEQ ID NO: 32-35, были названы плазмидами pCR-MAΔ12DS (содержащая нуклеотидную последовательность SEQ ID NO: 32), pCR-MAΔ6DS (содержащая нуклеотидную последовательность SEQ ID NO: 33), pCR-MAGLELO (содержащая нуклеотидную последовательность SEQ ID NO: 34) и pCR-MAΔ5DS (содержащая нуклеотидную последовательность SEQ ID NO: 35), соответственно.
С другой стороны, расщепленный HindIII фрагмент ДНК длиной примерно 1,2 т.п.н., полученный из плазмиды pURA34 (JP 2001-120276 A), встраивали в HindIII-сайт вектора pUC18, который был расщеплен ферментами рестрикции EcoRI и SphI, подвергнут затуплению концов и самолигированию. Клон, в котором EcoRI-сайт вектора находился с 5'-стороны от URA3, был назван pUC-URA3. Подобным образом, расщепленный ферментами SalI и XhoI фрагмент ДНК длиной примерно 2,2 т.п.н., полученный из YEp13, встраивали в SalI-сайт вектора pUC18, и клон, в котором EcoRI-сайт вектора был с 5'-стороны от LUE2, был назван pUC-LEU2.
Затем плазмиду pCR-MAΔ12DS расщепляли ферментом рестрикции HindIII и после образования тупых концов расщепляли ферментом рестрикции XbaI, получая фрагмент ДНК длиной примерно 1,2 т.п.н., в то время как вектор pESC-URA (STRATAGENE) расщепляли ферментом рестрикции SacI и после образования тупых концов дополнительно расщепляли ферментом рестрикции SpeI, получая фрагмент ДНК длиной примерно 6,6 т.п.н. Указанные фрагменты ДНК лигировали, получая плазмиду pESC-U-Δ12. Плазмиду pCR-MAΔ6DS расщепляли ферментом рестрикции XbaI и после образования тупых концов дополнительно расщепляли ферментом рестрикции HindIII, получая фрагмент ДНК длиной примерно 1,6 т.п.н., в то время как плазмиду pESC-U-Δ12 расщепляли ферментом рестрикции SalI и после образования тупых концов дополнительно расщепляли ферментом рестрикции HindIII, получая фрагмент ДНК длиной примерно 8 т.п.н. Полученный фрагменты ДНК лигировали, получая плазмиду pESC-U-Δ12:Δ6. Указанную плазмиду частично расщепляли ферментом рестрикции PvuII и полученный фрагмент длиной примерно 4,2 т.н. встраивали в SmaI-сайт pUC-URA3, получая плазмиду pUC-URA-Δ12:Δ6.
Подобным образом, плазмиду pCR-MAGLELO расщепляли ферментами рестрикции XbaI и SacI, получая фрагмент ДНК длиной примерно 0,95 т.п.н., тогда как вектор pESC-LEU (STRATAGENE) расщепляли ферментами рестрикции XbaI и SacI, получая фрагмент ДНК длиной примерно 7,7 т.п.н. Полученные фрагменты ДНК лигировали, получая плазмиду pESC-L-GLELO. Плазмиду pCR-MAΔ5DS расщепляли ферментом рестрикции XbaI и после образования тупых концов дополнительно расщепляли ферментом рестрикции HindIII, получая фрагмент ДНК длиной примерно 1,3 т.п.н., тогда как плазмиду pESC-L-GLELO расщепляли ферментом рестрикции ApaI и после образования тупых концов дополнительно расщепляли ферментом рестрикции HindIII, получая фрагмент ДНК длиной примерно 8,7 т.п.н. Полученные фрагменты ДНК лигировали, получая плазмиду pESC-L-GLELO:Δ5. Указанную плазмиду расщепляли ферментом рестрикции PvuII и полученный фрагмент длиной примерно 3,2 т.о. встраивали в SmaI-сайт pUC-LEU2, получая плазмиду pUC-LEU-GLELO:Δ5. Штамм Saccharomyces cerevisiae YPH499 (STRATAGENE) котрансформировали плазмидой pUC-URA-Δ12:Δ6 и плазмидой pUC-LEU-GLELO:Δ5. Трансформированные штаммы подвергали скринингу в отношении их способности расти на агаризованной среде SC-Leu,Ura (2% агар), содержащей в одном литре 6,7 г основы азотного агара для дрожжей без аминокислот (DIFCO), 20 г глюкозы и 1,3 г порошка аминокислот (смесь 1,25 г сульфата аденина, 0,6 г аргинина, 3 г аспарагиновой кислоты, 3 г глутаминовой кислоты, 0,6 г гистидина, 0,9 г лизина, 0,6 г метионина, 1,5 г фенилаланина, 11,25 г серина, 0,9 г тирозина, 4,5 г валина, 6 г треонина и 1,2 г триптофана). Среди полученных таким образом штаммов любой из штаммов обозначали как штамм ARA3-1.
(2) Получение и анализ трансформированных штаммов дрожжей, продуцирующих арахидоновую кислоту
Штамм ARA3-1 трансформировали, соответственно, плазмидами pYE22m, pYE-MALPAAT3 и pYE-MALPAAT4. Трансформированные штаммы подвергали скринингу в отношении их способности расти на агаризованной среде SC-Trp,Leu,Ura (2% агар), содержащей в одном литре 6,7 г основы азотного агара для дрожжей без аминокислот (DIFCO), 20 г глюкозы и 1,3 г порошка аминокислот (смесь 1,25 г сульфата аденина, 0,6 г аргинина, 3 г аспарагиновой кислоты, 3 г глутаминовой кислоты, 0,6 г гистидина, 0,9 г лизина, 0,6 г метионина, 1,5 г фенилаланина, 11,25 г серина, 0,9 г тирозина, 4,5 г валина и 6 г треонина). Любые штаммы, полученные таким образом, обозначали как ARA-C, ARA-LPAAT3 и ARA-LPAAT4, соответственно.
Полученные штаммы культивировали при 30°C в течение 1 суток в указанной выше жидкой среде SC-Trp,Leu,Ura (10 мл), 1 мл которой затем культивировали при 30°C в течение 2 суток в жидкой среде SG-Trp,Leu,Ura (10 мл), содержащей в одном литре 6,7 г основы азотного агара для дрожжей без аминокислот (DIFCO), 20 г галактозы и 1,3 г порошка аминокислот (смесь 1,25 г сульфата аденина, 0,6 г аргинина, 3 г аспарагиновой кислоты, 3 г глутаминовой кислоты, 0,6 г гистидина, 0,9 г лизина, 0,6 г метионина, 1,5 г фенилаланина, 11,25 г серина, 0,9 г тирозина, 4,5 г валина и 6 г треонина), с последующим анализом жирных кислот в клетках. В таблицах 5, 6 и 7 показано соотношение жирных кислот в клетках, содержание жирных кислот в клетках и содержание арахидоновой кислоты в клетках, соответственно.
Соотношение жирных кислот в трансформированных штаммах
Внутриклеточное содержание жирных кислот в трансформированных штаммах
Внутриклеточное содержание арахидоновой кислоты в трансформированных штаммах
В штамме ARA-LPAAT4 доли насыщенных жирных кислот, т.е. пальмитиновой кислоты и стеариновой кислоты, снижались, тогда как доли линолевой кислоты и арахидоновой кислоты увеличивались. С другой стороны, между ARA-LPAAT3 и контрольным штаммом наблюдали небольшое различие в соотношении жирных кислот, но внутриклеточное содержание жирных кислот увеличивалось в ARA-LPAAT3. То есть полученные результаты свидетельствуют, что не только содержание арахидоновой кислоты в клетках-хозяевах, экспрессирующих LPAAT3, но также и содержание арахидоновой кислоты в клетках-хозяевах, экспрессирующих LPAAT4, было выше, чем в контроле.
Кроме того, указанные трансформированные плазмидами штаммы культивировали (n=4 в каждом случае) при 30°C в течение 1 суток в указанной выше жидкой среде SC-Trp,Leu,Ura (10 мл), 1 мл которой затем инокулировали в жидкую среду SG-Trp,Leu,Ura (10 мл) и культивировали при 15°C в течение 7 суток, затем проводили анализ жирных кислот в клетках. В таблицах 8, 9 и 10 показано соотношение жирных кислот в клетках, содержание жирных кислот в клетках и содержание арахидоновой кислоты в клетках, соответственно.
Внутриклеточное содержание PUFA в трансформированных штаммах
Отношение (%) PUFA к суммарному внутриклеточному содержанию жирных кислот
Внутриклеточное содержание жирных кислот в трансформированных штаммах
Внутриклеточное содержание арахидоновой кислоты в трансформированных штаммах
В том случае, когда полученный из M. alpina LPAAT3 экспрессировали в клетках, продуцирующих арахидоновую кислоту, доли PUFA, включая линолевую кислоту, γ-линоленовую кислоту, DGLA и арахидоновую кислоту, увеличивались по сравнению с контролем. Подобным образом, внутриклеточное содержание жирных кислот также возрастало. С другой стороны, когда экспрессировали LPAAT4, полученный из M. alpina, доли линолевой кислоты и γ-линоленовой кислоты увеличивались, и доля арахидоновой кислоты также увеличивалась.
Пример 9
(1) Конструирование вектора для экспрессии в M. alpina
Для экспрессии в M. alpina использовали вектор pDuraSC, который обеспечивает возможность экспрессии требуемого гена с промотора GAPDH, и вектор pDuraMCS, который обеспечивает возможность экспрессии требуемого гена с промотора гистона.
Векторы для экспрессии LPAAT3 и LPAAT4 в клетках M. alpina конструировали следующим образом. Плазмиду pCR-LPAAT3 или pCR-LPAAT4 расщепляли ферментом рестрикции EcoRI, чтобы вырезать вставку, которую затем встраивали в EcoRI-сайт в сайте множественного клонирования вектора pDuraSC или pDura5MCS. Для каждого случая подтверждали ориентацию встроенной ДНК, и конструкции, несущие соответствующие вставки в такой ориентации, которая вызывает транскрипцию ORF с промотора каждого вектора, были названы плазмидой pDuraSC-LPAAT3, плазмидой pDuraSC-LPAAT4, плазмидой pDura5MCS-LPAAT3 и плазмидой pDura5MCS-LPAAT4, соответственно.
(2) Получение трансформированных штаммов M. alpina
Ауксотрофный по урацилу штамм Δura-3, полученный из M. Alpina, как описано в патентном документе (WO2005/019437, озаглавленный «Method of Breeding Lipid-Producing Fungus»), использовали в качестве хозяина и трансформировали указанными плазмидами способом доставки частиц. Для скрининга трансформированных штаммов использовали агаризованную среду SC (0,5% основы для азотного агара для дрожжей без аминокислот и сульфата аммония (Difco), 0,17% сульфата аммония, 2% глюкозы, 0,002% аденина, 0,003% тирозина, 0,0001% метионина, 0,0002% аргинина, 0,0002% гистидина, 0,0004% лизина, 0,0004% триптофана, 0,0005% треонина, 0,0006% изолейцина, 0,0006% лейцина, 0,0006% фенилаланина и 2% агара).
(3) Оценка трансформантов M. alpina
Каждый из полученных трансформированных штаммов инокулировали в 4 мл среды GY (2% глюкоза, 1% дрожжевой экстракт) и культивировали, встряхивая при 28°C в течение 3 или 4 суток. Клетки собирали фильтрованием и РНК экстрагировали, используя набор для растений RNeasy (QIAGEN). Для синтеза кДНК использовали систему для ОТ-ПЦР первой нити SuperScript (Invitrogen). Чтобы подтвердить экспрессию введенной конструкции и общую экспрессию для каждого гена, осуществляли ОТ-ПЦР, используя следующие наборы праймеров.
Штаммы, трансформированные плазмидой pDuraSC-LPAAT3
Праймеры, используемые для экспрессии с введенной конструкции:
праймер MaGAPDHpfw: CACACCACACATTCAACATC (SEQ ID NO: 47); и
праймер LAT3-2R: GAATCGTAGATATGGTTGTATCCAGCGCT (SEQ ID NO: 48).
Праймеры, используемые для суммарной экспрессии LPAAT3:
праймер LAT3-1F: CTGGCGGTCATCCTTGTTTTCTACCTG (SEQ ID NO: 49); и
праймер LAT3-2R (SEQ ID NO: 48).
Штаммы, трансформированные плазмидой pDuraSC-LPAAT4
Праймеры, используемые для экспрессии с введенной конструкции:
праймер MaGAPDHpfw (SEQ ID NO: 47); и
праймер LAT4-2R: GAATCATAGATGTGTGAGTATCCTTGCGA (SEQ ID NO: 50).
Праймеры, используемые для суммарной экспрессии LPAAT4:
праймер LAT4-1F: TTCTAATCCTGTCCTACTGGCAGCG (SEQ ID NO: 51); и
праймер LAT4-2R (SEQ ID NO: 50).
Штаммы, трансформированные плазмидой pDura5MCS-LPAAT3
Праймеры, используемые для экспрессии с введенной конструкции:
праймер PD4P: CGCATCCCGCAAACACACAC (SEQ ID NO: 52); и
праймер LAT3-2R (SEQ ID NO: 48).
Праймеры, используемые для суммарной экспрессии LPAAT3:
праймер LAT3-1F (SEQ ID NO: 49) и праймер LAT3-2R (SEQ ID NO: 48).
Штаммы, трансформированные плазмидой pDura5MCS-LPAAT4
Праймеры, используемые для экспрессии с введенной конструкции:
праймер PD4P (SEQ ID NO: 52) и праймер LAT4-2R (SEQ ID NO: 50).
Праймеры, используемые для суммарной экспрессии LPAAT4:
праймер LAT4-1F (SEQ ID NO: 51) и праймер LAT4-2R (SEQ ID NO: 50).
На основании результатов описанной выше ОТ-ПЦР были отобраны трансформанты, в которых наблюдали высокий уровень экспрессии каждого гена, как в случае экспрессии с введенной конструкции, так и в случае суммарной экспрессии: штаммы Gp-LPAAT3-3 и Gp-LPAAT3-29 из штаммов, трансформированных плазмидой pDuraSC-LPAAT3; штаммы Gp-LPAAT4-26 и Gp-LPAAT4-68 из штаммов, трансформированных плазмидой pDuraSC-LPAAT4; штамм Hp-LPAAT3-34 из штаммов, трансформированных плазмидой pDura5MCS-LPAAT3; и штаммы Hp-LPAAT4-26 и Hp-LPAAT4-31 из штаммов, трансформированных плазмидой pDura5MCS-LPAAT4.
Каждый из указанных штаммов культивировали, встряхивая в среде GY (4 мл) при 28°C, используя 125 об./мин, в течение 3 или 4 суток (n=3 в каждом случае). После завершения культивирования клетки собирали фильтрованием и подвергали лиофилизации. Часть (примерно 10-20 мг) высушенных клеток обрабатывали способом с использованием хлороводородной кислоты/метанола, чтобы превратить жирные кислоты в клетках в соответствующие метиловые эфиры, с последующей экстракцией гексаном. После отгонки гексана жирные кислоты анализировали газовой хроматографией. Внутриклеточное содержание жирных кислот и продукцию арахидоновой кислоты в расчете на объем среды суммировали в таблицах ниже.
Внутриклеточное содержание жирных кислот (%) в штаммах M. alpina с высоким уровнем экспрессии LPAAT3
Продукция ARA (г/л) в штаммах M. alpina с высоким уровнем экспрессии LPAAT3
Внутриклеточное содержание жирных кислот (%) в штаммах M. alpina с высоким уровнем экспрессии LPAAT4
Продукция ARA (г/л) в штаммах M. alpina с высоким уровнем экспрессии LPAAT4
Полученные результаты свидетельствуют о том, что все тестированные трансформированные штаммы M. alpina имели более высокое внутриклеточное содержание жирных кислот и более высокую продукцию арахидоновой кислоты в расчете на объем среды, чем в контроле.
ОТКРЫТЫЙ СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
SEQ ID NO: 9: праймер
SEQ ID NO: 10: праймер
SEQ ID NO: 11: праймер
SEQ ID NO: 12: праймер
SEQ ID NO: 13: праймер
SEQ ID NO: 14: праймер
SEQ ID NO: 15: праймер
SEQ ID NO: 16: праймер
SEQ ID NO: 21: праймер
SEQ ID NO: 22: праймер
SEQ ID NO: 24: праймер
SEQ ID NO: 25: праймер
SEQ ID NO: 26: праймер
SEQ ID NO: 27: праймер
SEQ ID NO: 28: праймер
SEQ ID NO: 29: праймер
SEQ ID NO: 30: праймер
SEQ ID NO: 31: праймер
SEQ ID NO: 38: праймер
SEQ ID NO: 39: праймер
SEQ ID NO: 45: праймер
SEQ ID NO: 46: праймер
SEQ ID NO: 47: праймер
SEQ ID NO: 48: праймер
SEQ ID NO: 49: праймер
SEQ ID NO: 50: праймер
SEQ ID NO: 51: праймер
SEQ ID NO: 52: праймер
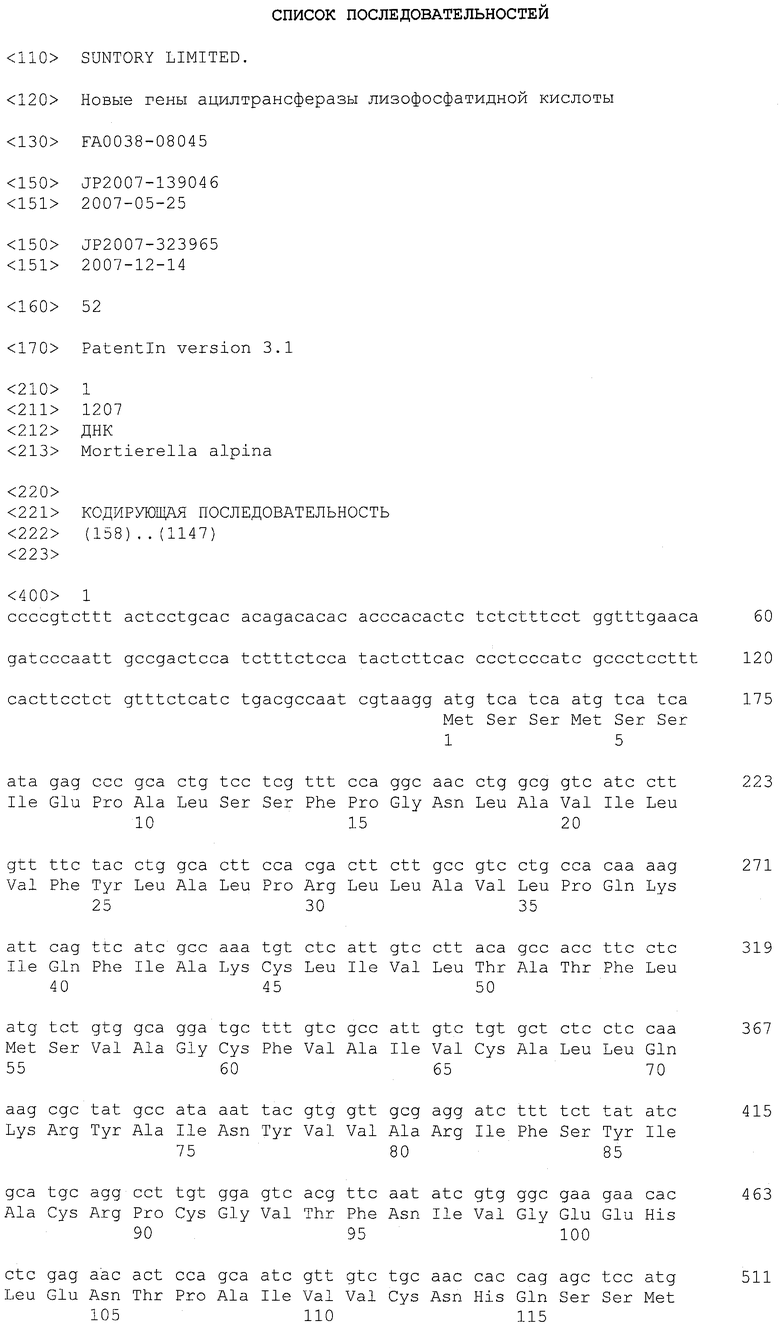

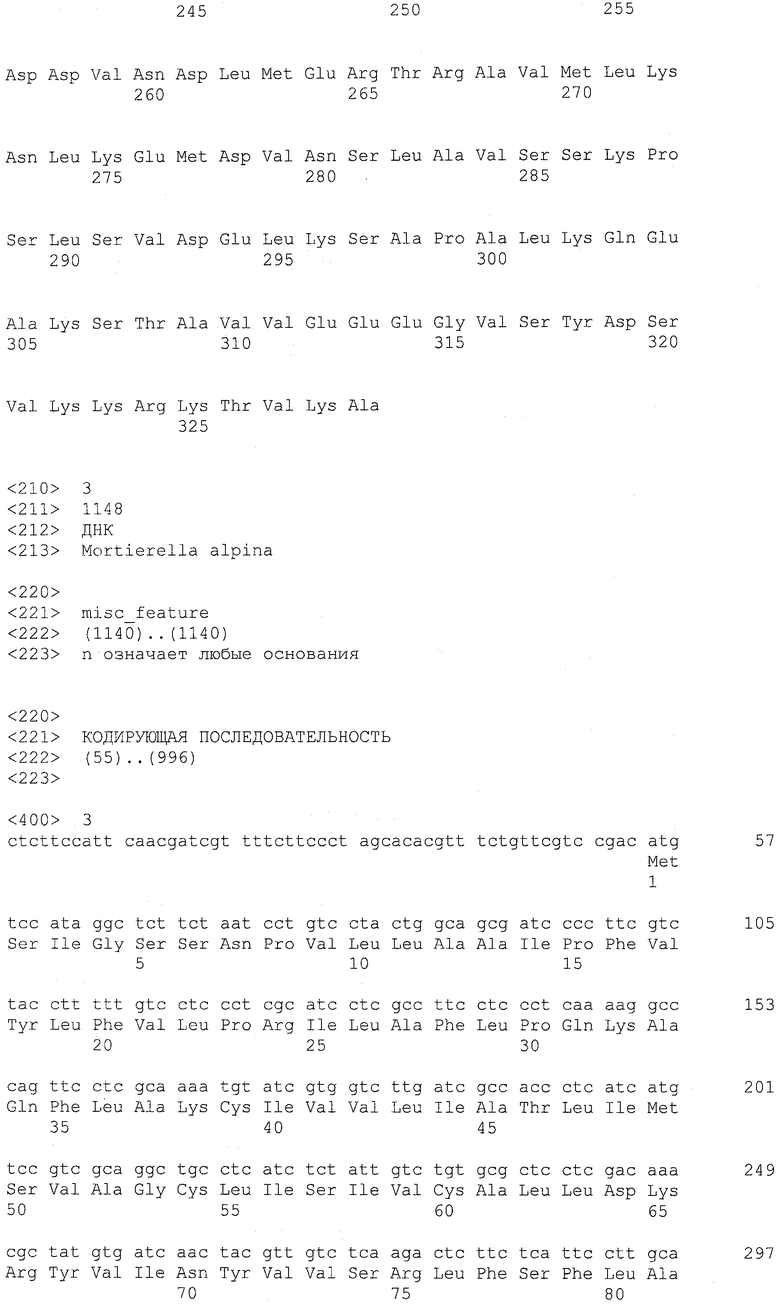




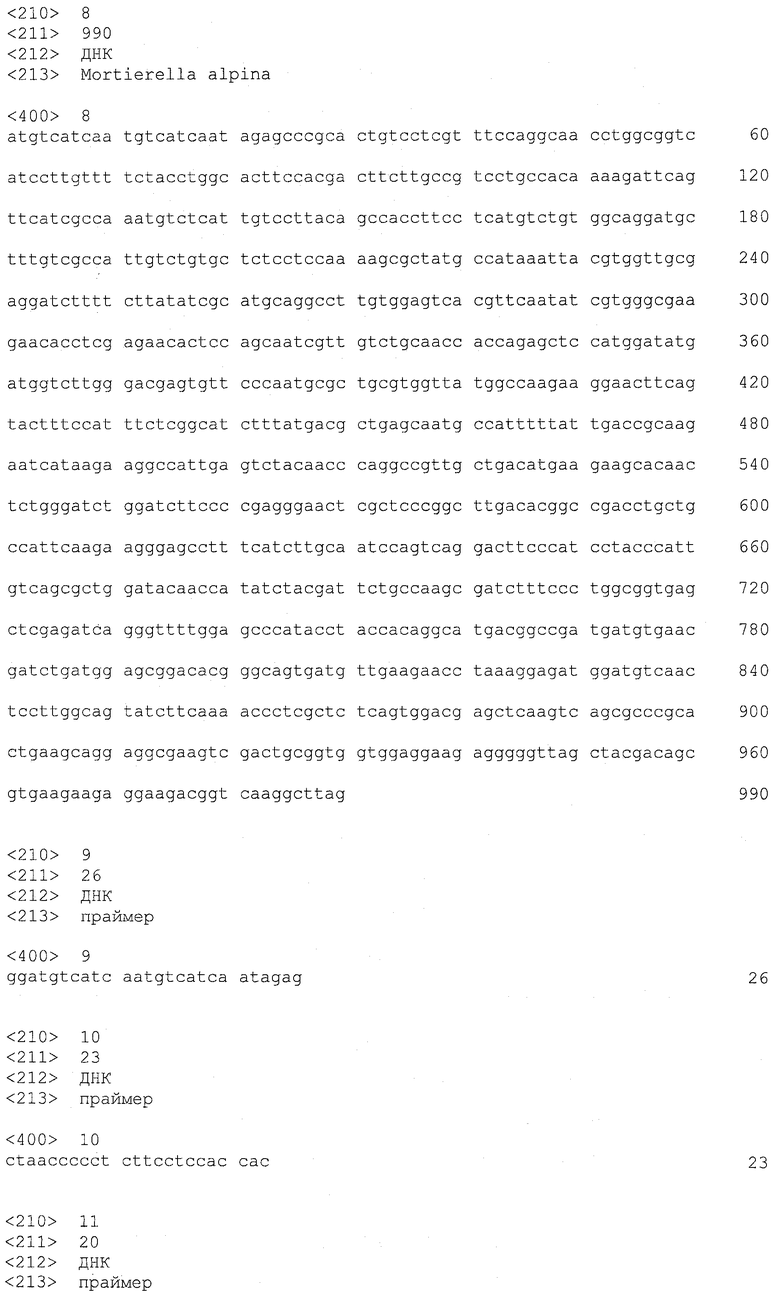



















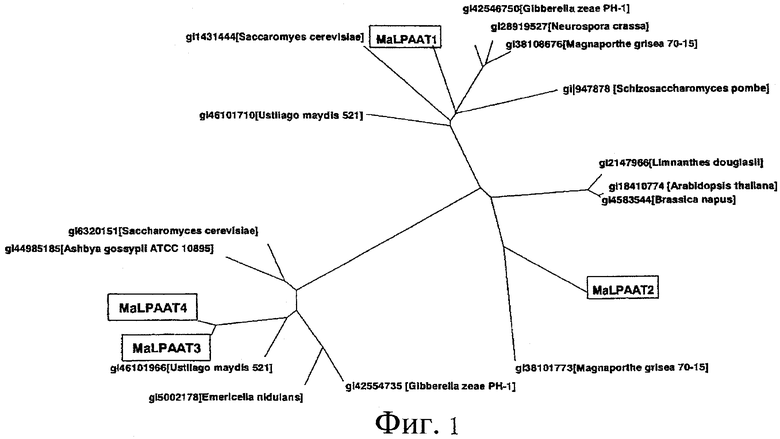





Настоящее изобретение относится к области молекулярной биологии и генетической инженерии и может быть использовано в пищевой промышленности. Из нитчатого гриба Mortierella alpina получены новые гены ацилтрансферазы лизофосфатидной кислоты (АТЛК). Определена кодирующая фермент нуклеотидная последовательность, описано конструирование содержащих ее экспрессионных векторов и включающих векторные конструкции по изобретению клеток-хозяев, а также получение рекомбинантных форм АТЛК, кодируемых новыми генами. 4 н.п. ф-лы, 14 табл., 6 ил., 9 пр.
1. Белок, обладающий активностью ацилтрансферазы лизофосфатидной кислоты, состоящий из аминокислотной последовательности SEQ ID NO:2 или 4.
2. Нуклеиновая кислота, которая кодирует белок по п.1.
3. Рекомбинантный вектор для экспрессии белка, обладающего активностью ацилтрансферазы лизофосфатидной кислоты, содержащий нуклеиновую кислоту по п.2.
4. Трансформант для продуцирования белка, обладающего активностью ацилтрансферазы лизофосфатидной кислоты, трансформированный рекомбинантным вектором по п.3.
| US 2006009402, 04.05.2006 | |||
| RU 2006108790 А, 10.10.2007 | |||
| BROWN et al., Phytochemistry, 61(5), 493-501, 2002. |
Авторы
Даты
2014-02-20—Публикация
2008-05-23—Подача