Изобретение относится к промышленной биотехнологии и предназначено для получения биосорбентов, в частности энтеросорбентов и гемосорбентов.
Известен способ получения энтеросорбентов (патент RU 99102628 С1), предусматривающий ферментацию нативной и/или выделенной из растительных тканей целлюлозы до получения микрокристаллической целлюлозы и обработку органическими растворителями с целью модификации размера частиц и сорбционной емкости. К недостаткам способа относится использование органических компонентов, запрещенных для применения внутрь, использование микрокристаллической целлюлозы, обладающей повышенной гигроскопичностью, что снижает сорбционную емкость препарата.
Следующий способ (патент RU 97113043 С1) получения композитных сорбентов на основе целлюлозных носителей заключается в предварительной обработке целлюлозы системой растворителей с последующим переводом носителя в труднорастворимые гексацианоферраты. Недостатками являются техническая сложность выполнения способа, использование дорогостоящих компонентов.
Наиболее близким к предлагаемому по технической сущности и достигаемому положительному эффекту является способ производства модифицированных целлюлозных материалов (патент RU 2256675, 2001.07.24), в котором целлюлозный материал при комнатной температуре пропитывают водным раствором 0,25-2,0 мас.% AgNO3 при соотношении целлюлозный материал: раствор AgNO3 1 г на 15-30 мл. Реакционную смесь нагревают при 85-150°С в течение 1-4 часов. Для увеличения содержания серебра в водный 0,25-2,0 мас.% раствор AgNO3 дополнительно вводят аммиак, глицерин, либо смесь аммиака и глицерина при концентрации аммиака 0,5-15 об.%, концентрации глицерина 20-50 мас.%, соотношение целлюлозный материал: водный раствор составляет 1 г на 15-30 мл, и нагревают реакционную смесь при 85-150°С в течение 1-4 часов. В качестве целлюлозного материала используют микрокристаллическую целлюлозу, хлопчатобумажное волокно, ткань и изделия из них, льняное волокно, полотно и изделия из них, хлопчатобумажный перевязочный материал. Недостатком является то, что полученная система используется для изготовления перевязочных материалов и не может быть использована для создания энтеро- и гемосорбентов.
Цель изобретения - повышение сорбционной емкости биосорбентов.
Для этого в предлагаемом способе получения биосорбента, предусматривающем иммобилизацию белка на целлюлозе, с последующей модификацией поверхности и стабилизацией биосорбента, в качестве белка используют β-казеин, который наносят на обводненную микрокристаллическую целлюлозу при температуре 30÷50°С в соотношении 1:5÷7 в виде 5÷15% раствора гидроксида натрия.
Перед проведением иммобилизации целлюлозу смачивают водой в соотношении 1:1÷5. В качестве газообразователя используют соли аммония и угольной кислоты в количестве 1÷3% по массе к микрокристаллической целлюлозе. При этом процесс ведут при перемешивании в течение 5÷10 мин и температуре 20÷25°С с последующей сушкой под вакуумом.
Стабилизацию проводят ацетоном или этиловым спиртом, подкисленным соляной кислотой до рН 4,6 в течение 2÷5 минут с последующей досушкой на воздухе.
Способ получения биосорбента заключается в следующем.
Для получения β-казеина в обезжиренное молоко в качестве высокомолекулярного осадителя (флокулянта) вносят 1÷2% раствор метилцеллюлозы в воде. Предварительно метилцеллюлозу вносят в теплую воду с температурой 50÷60°С до получения 1÷2% раствора. Смесь выдерживают 1 час. Температурный режим обусловлен следующими ограничениями. При температуре ниже 50°С и выше 60°С процесс коагуляции идет дольше.
Полученный коллоидный гель метилцеллюлозы вносят в обезжиренное молоко в соотношении 1÷2 по массе и термостатируют при 10÷15°С в течение 8÷10 часов. При внесении раствора метилцеллюлозы в меньшем количестве не происходит полного осаждения казеина, при увеличении же массовой доли раствора метилцеллюлозы выход казеина остается неизменным, а расход компонентов увеличивается. Расслоение белка и полисахарида при температуре ниже 10°С проходит частично. Выше 15°С разделение не происходит.
Данный способ концентрирования казеина основан на двух физико-химических явлениях: ограниченной термодинамической совместимости белков и полисахаридов в воде, а также более высоком осмотическом давлении раствора полисахарида по сравнению с осмотическим давлением раствора белка. Смешивание растворов белка и полисахарида в определенных концентрациях приводит к образованию двухфазной системы: нижняя фаза - концентрат казеина, верхняя - полисахаридная фаза. Через межфазную поверхность происходит перенос воды из раствора белка в раствор полисахарида до установления фазового равновесия, что обусловливает концентрирование казеина.
Нижний слой, содержащий казеин, отделяют на делительной воронке.
Выделенный β-казеин растворяют в 5÷15% растворе гидроксида натрия в отношении 1:5÷7. Согласно физико-химическим свойствам β-казеин является кислотным белком. Поэтому он будет растворяться в щелочах с небольшой концентрацией без денатурации. При концентрации гидроксида натрия ниже 5% β-казеин плохо растворяется, выше 15% - может наступить необратимая денатурация белка. 1 часть β-казеина растворяют не более чем в 7 частях раствора гидроксида натрия, потому что повышенный объем жидкости увеличивает процесс сушки.
Целлюлозу смачивают водой при отношении 1:1÷5. Повышенный объем жидкости также увеличивает процесс сушки. Растворение и смачивание компонентов необходимо для улучшения перемешивания.
В качестве газообразователя используют соли аммония и угольной кислоты в количестве 1÷3% по массе к микрокристаллической целлюлозе. Гидрокарбонат аммония при температуре легко разлагается на углекислый газ и воду, самопроизвольно удаляющиеся из смеси и не загрязняющие конечный продукт контаминантами. Массовая доля газообразователя ниже 1% недостаточна для модификации поверхности биофильтра. Увеличение же массовой доли свыше 3% не влияет на сорбционные свойства биофильтра, но увеличивает себестоимость и время сушки.
На чертеже изображена схема промышленного получения биосорбентов.
Раствор β-казеина и смоченную микрокристаллическую целлюлозу вносят (схема) в химический реактор (1), где происходит непрерывное перемешивание продукта. Через 30 минут в тот же реактор вносят газообразователь.
Перемешивание продолжают 15 минут. Влажную смесь с помощью объемного насоса (2) переносят в распылительную сушилку (3). Калорифер (6) поддерживает температуру не выше 50°С. При распылительной сушке гидрокарбонат аммония разлагается на компоненты, увеличивающие сорбционную поверхность биофильтра.
Сухой порошок с помощью циклона (7) и элеватора (9) помещают во второй химический реактор (10), обрабатывают в течение 2÷5 минут ацетоном или этиловым спиртом, подкисленным соляной кислотой до рН 4,6 в соотношении биосорбент: стабилизатор 10:1÷2. Использование ацетона, этилового спирта и соляной кислоты обусловлено разрешенным их применением в пищевой промышленности. Ацетон и спирт полностью легко удаляются из системы при дальнейшей сушке. Соляная кислота нейтрализует гидроксид натрия, образующаяся при этом соль хлорида натрия тоже применяется в пищевой промышленности и одновременно является консервантом. Выбранный рН 4,6 обусловлен изоэлектрической точкой осаждения β-казеина. Массовая доля вносимого стабилизатора свыше 2% не увеличивает стойкости продукта, а загрязняет его излишком соли. При обработке ниже 1% не происходит полного осаждения β-казеина и нейтрализации щелочи.
Окончательную сушку модифицированного и стабилизированного продукта проводят в вибрационной сушилке (11).
Готовый продукт представляет собой белый с кремовым оттенком порошок без запаха, со специфическим вкусом. Исследования сорбционной емкости биосорбента без модификации неорганическим газообразователем и с модификацией проводили на результатах анализа сорбируемого количества иодид-иона. Результаты представлены в таблицах 1, 2, 3.
Показатели сорбционной емкости биофильтра с массовой долей β-казеина 1%
Показатели сорбционной емкости биофильтра с массовой долей β-казеина 5%
Показатели сорбционной емкости биофильтра с массовой долей β-казеина 10%
На основе полученных данных рассчитывают изменение сорбционной емкости ΔS каждого биофильтра и среднее значение этого изменения по формулам (1) и (2), результаты представлены в таблицах 4, 5, 6.
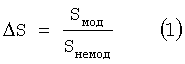
где Sмод - сорбционная емкость модифицированного биофильтра, ммоль/г;
Sнемод - сорбционная емкость немодифицированного биофильтра, ммоль/г;
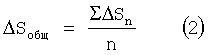
где ΔSn - изменение сорбционной емкости каждого определения;
n - число определений.
Показатели изменения сорбционной емкости биофильтра с массовой долей β-казеина 1%
Показатели изменения сорбционной емкости биофильтра с массовой долей β-казеина 5%
Показатели изменения сорбционной емкости биофильтра с массовой долей β-казеина 10%
Исходя из данных таблиц 4, 5, 6, сорбционная емкость биофильтров после модификации увеличивается в среднем в 3 раза.
В нерегулируемых условиях продолжительного хранения состав и характеристики биосорбентов не меняются в течение 1 года.
Предложенный способ поясняется конкретными примерами его использования.
Пример 1. 1 кг β-казеина растворяют в 5 л 5-15% раствора NaOH. Полученный раствор суспендируют при постоянном перемешивании со 100 кг микрокристаллической целлюлозы. Далее вносят 2 кг гидрокарбоната аммония. Полученную смесь сушат распылением при температуре 30÷50°С.
Приготовленный биосорбент обрабатывают в эмалированном химическом реакторе 10 л ацетона, подкисленного соляной кислотой до рН 4,6 ед. Повторная сушка проходит на вибрационной сушилке. Полученный таким образом биофильтр содержит по массе 1% β-казеина.
Пример 2. 1 кг β-казеина растворяют в 5 л 5-15% раствора NaOH. Полученный раствор суспендируют при постоянном перемешивании со 100 кг микрокристаллической целлюлозы. Далее вносят 2 кг гидрокарбоната аммония. Полученную смесь сушат распылением при температуре 30÷50°С.
Приготовленный биосорбент обрабатывают в эмалированном химическом реакторе 10 л этилового спирта, подкисленного соляной кислотой до рН 4,6 ед. Повторная сушка проходит на вибрационной сушилке. Полученный таким образом биофильтр содержит по массе 1% β-казеина.
Пример 3. 5 кг β-казеина растворяют в 5 л 5-15% раствора NaOH. Полученный раствор суспендируют при постоянном перемешивании со 100 кг микрокристаллической целлюлозы. Далее вносят 2 кг гидрокарбоната аммония. Полученную смесь сушат распылением при температуре 30÷50°С.
Приготовленный биосорбент обрабатывают в эмалированном химическом реакторе 10 л ацетона, подкисленного соляной кислотой до рН 4,6 ед. Повторная сушка проходит на вибрационной сушилке. Полученный таким образом биофильтр содержит по массе 5% β-казеина.
Пример 4. 5 кг β-казеина растворяют в 5 л 5-15% раствора NaOH. Полученный раствор суспендируют при постоянном перемешивании со 100 кг микрокристаллической целлюлозы. Далее вносят 2 кг гидрокарбоната аммония. Полученную смесь сушат распылением при температуре 30÷50°С.
Приготовленный биосорбент обрабатывают в эмалированном химическом реакторе 10 л этилового спирта, подкисленного соляной кислотой до рН 4,6 ед. Повторная сушка проходит на вибрационной сушилке. Полученный таким образом биофильтр содержит по массе 5% β-казеина.
Пример 5. 10 кг β-казеина растворяют в 5 л 5-15% раствора NaOH. Полученный раствор суспендируют при постоянном перемешивании со 100 кг микрокристаллической целлюлозы. Далее вносят 2 кг гидрокарбоната аммония. Полученную смесь сушат распылением при температуре 30÷50°С.
Приготовленный биосорбент обрабатывают в эмалированном химическом реакторе 10 л ацетона, подкисленного соляной кислотой до рН 4,6 ед. Повторная сушка проходит на вибрационной сушилке. Полученный таким образом биофильтр содержит по массе 10% β-казеина.
Пример 6. 10 кг β-казеина растворяют в 5 л 5-15% раствора NaOH. Полученный раствор суспендируют при постоянном перемешивании со 100 кг микрокристаллической целлюлозы. Далее вносят 2 кг гидрокарбоната аммония. Полученную смесь сушат распылением при температуре 30÷50°С.
Приготовленный биосорбент обрабатывают в эмалированном химическом реакторе 10 л этилового спирта, подкисленного соляной кислотой до рН 4,6 ед. Повторная сушка проходит на вибрационной сушилке. Полученный таким образом биофильтр содержит по массе 10% β-казеина.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ БИОЛОГИЧЕСКИ АКТИВНОЙ ДОБАВКИ К ПИЩЕ | 2003 |
|
RU2255609C2 |
| СПОСОБ ПОЛУЧЕНИЯ КОРМОВОГО СРЕДСТВА ИЗ РАСТИТЕЛЬНОГО СЫРЬЯ С ВЫСОКИМ СОДЕРЖАНИЕМ ОДРЕВЕСНЕВШЕЙ КЛЕТЧАТКИ | 2017 |
|
RU2666769C1 |
| ПРОДУКТ ЭНТЕРАЛЬНОГО ПИТАНИЯ "НУТРИЭН ДИАБЕТ" | 2004 |
|
RU2290823C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПЕКТИНА | 1992 |
|
RU2010540C1 |
| Сорбент на основе клетчатки бурых водорослей | 2016 |
|
RU2637436C1 |
| ТЕХНОЛОГИЧЕСКАЯ ЛИНИЯ ДЛЯ ПРОИЗВОДСТВА ПРОДУКТОВ ИЗ МОЛОЧНОЙ СЫВОРОТКИ | 1995 |
|
RU2100438C1 |
| МИЦЕЛЛЫ БЕЛКА МОЛОЧНОЙ СЫВОРОТКИ | 2007 |
|
RU2417622C2 |
| СПОСОБ ОЧИСТКИ ВОДНОГО РАСТВОРА, СОДЕРЖАЩЕГО СОЛЬ МЕДИ, ОТ ИОНОВ МЕДИ | 2012 |
|
RU2501745C2 |
| Биологически активная добавка к пище и способ ее получения | 2023 |
|
RU2825783C1 |
| СПОСОБ ПОЛУЧЕНИЯ ХЛОРКАЛЬЦИЕВОГО КАЗЕИНА | 2013 |
|
RU2528978C1 |
Изобретение относится к промышленной биотехнологии и предназначено для получения биосорбентов, в частности энтеросорбентов и гемосорбентов. Способ получения биосорбентов предусматривает приготовление раствора в 5÷15% растворе гидроксида натрия и внесение раствора в обводненную микрокристаллическую целлюлозу. Внесение газообразователя осуществляется во влажную смесь β-казеина и микрокристаллической целлюлозы в количестве 1÷3% по массе к микрокристаллической целлюлозе. Биофильтр стабилизируют ацетоном или этиловым спиртом, подкисленным до рН 4,6, и сушат. Способ позволяет обеспечить высокую ёмкость целевого продукта. 5 з.п. ф-лы, 1 ил., 6 табл.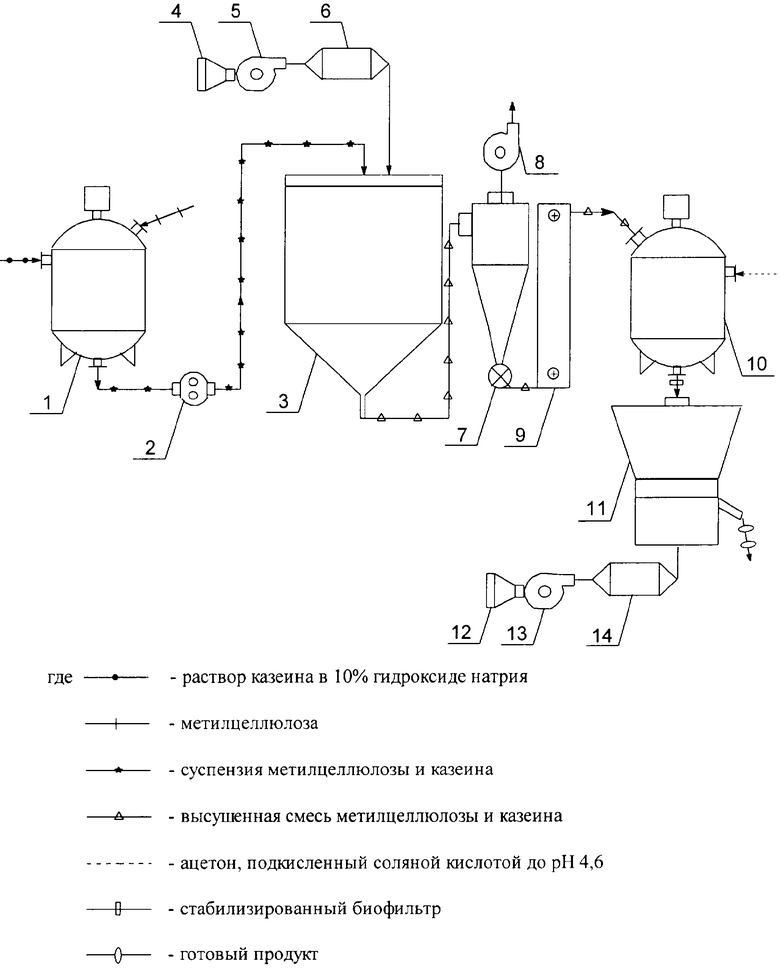
| Способ получения сорбента на основе целлюлозы | 1981 |
|
SU968039A1 |
| Способ получения сорбента для аффинной хроматографии | 1988 |
|
SU1578138A1 |
| СОРБЕНТ ДЛЯ ОТБОРА ПРОБ | 1995 |
|
RU2080916C1 |
| СОРБЕНТ ДЛЯ СВЯЗЫВАНИЯ ТИРОКСИНА | 1981 |
|
SU1281005A1 |
Авторы
Даты
2006-04-10—Публикация
2002-02-28—Подача