Область техники
Данная заявка относится к новым пролекарствам, их получению, их использованию для оральной доставки ингибиторов фруктозо-1,6-бисфосфатазы (ФБФаза, FBPase) и их использованию для лечения диабета и других заболеваний, где ингибирование глюконеогенеза, регулирование уровней глюкозы в крови, снижение депонирования гликогена или снижение уровней инсулина является полезным.
Предшествующий уровень техники
Органические соединения, которые являются заряженными при физиологическом рН, часто проявляют ограниченную оральную биодоступность, клеточную проницаемость и распределение в тканях (например, ЦНС). Эти свойства приписываются неспособности ионных соединений проникать через клеточные мембраны путем пассивной диффузии. Одна из стратегий, позволяющая обойти эту проблему, заключается в получении липофильных пролекарств, которые способны проникать через клеточные мембраны и впоследствии претерпевать превращение, сопровождаемое генерированием заряженного соединения. Превращение может быть результатом либо химической нестабильности, либо результатом протекания реакции, катализируемой ферментом.
Большое число структурно-различных пролекарств описано для фосфоновых кислот. Freeman and Ross in Progress in Medicinal Chemistry 34: 112-147 (1997). Самый большой класс обычно используемых пролекарств представляет ряд ацилоксиалкиловых сложных эфиров, который сначала использовали как стратегию пролекарства для карбоновых кислот, а затем в 1983 г. был применен для фосфатов Farquhar et al. J.Pharm. Sci, 72: 324 (1983). Впоследствии ацилоксиалкиловый сложный эфир был использован для доставки фосфоновых кислот через клеточные мембраны и повышения оральной биодоступности. Сообщается также об алкоксикарбонилоксиалкиловом сложном эфире, как близком варианте стратегии ацилоксиалкилового сложного эфира, применяемом для повышения оральной биодоступности.
Значительно меньший успех был достигнут в случае использования других классов фосфонатных пролекарств. В нескольких случаях сообщается об использовании ариловых сложных эфиров, в частности фениловых эфиров, для повышения биодоступности. DeLambert et al. J.Med. Chem. 37: 498 (1994). Кроме того, сообщается о фениловых сложных эфирах, содержащих сложный эфир карбоновой кислоты в орто-положении к фосфату. Khamnei and Torrence, J.Med. Chem. 39: 4109-4115 (1996). Сообщается о бензиловых сложных эфирах для образования исходной фосфоновой кислоты. В некоторых случаях можно ускорить гидролиз, используя заместители в орто- или пара-положении. Бензиловые аналоги с ацилированным фенолом или алкилированным фенолом могут образовывать фенольное соединение под действием ферментов, например эстераз, оксидаз и т.д., которое, в свою очередь, подвергается расщеплению по бензильной С-O-связи, образуя фосфорную кислоту и хинонметидное промежуточное соединение. Примеры данного класса пролекарств приводятся Mitchell et al., J.Chem. Soc. Perkin Trans. 12345 (1992); Brook et al. WO 91/19721. Были описаны и другие бензилсодержащие пролекарства, включающие группу, содержащую сложный эфир карбоновой кислоты, связанную с бензилметиленом. Glazier et al. WO 91/19721. Сообщается о тиосодержащих пролекарствах, используемых для внутриклеточной доставки фосфонатных лекарственных средств. Эти проэфиры содержат этилтиогруппу, в которой тиольная группа либо этерифицирована ацильной группой, либо соединена с другой тиольной группой с образованием дисульфида. Деэтерификация или восстановление дисульфида приводит к образованию промежуточного соединения, свободного от тио, которое затем распадается на фосфорную кислоту и эписульфид. Puech et al., Antiviral Res., 22: 155-174 (1993); Benzaria et al. J.Med. Chem. 39: 4958 (1996). Кроме того, сообщается о циклических фосфонатных сложных эфирах, как пролекарствах соединений, содержащих фосфор.
Кроме того, некоторые фосфорамидаты являются известными пролекарствами фосфонатов, однако они демонстрировали плохую оральную биодоступность. В некоторых случаях фосфорамидаты были весьма нестабильны в кислых условиях, что обсуждается как возможное объяснение их плохой оральной биодоступности (J.Med. Chem., 37: 1857-1864 (1994)). Аналогично имеются сообщения о недостаточной оральной биодоступности бисамидата аналога РМЕА (J.Med. Chem., 38: 1372-1379 (1995)). Другое пролекарство РМЕА состоит из амидата моноэфира глицина и фенилового сложного эфира (WO 95/07920).
Хотя имеются сообщения о разнообразных методологиях создания пролекарств фосфорных кислот, целью которых является достижение высокой степени доставки фосфорных кислот внутрь клеток, немногие из них, как известно, приводят к хорошей (достаточной) оральной биодоступности. В некоторых случаях пролекарства неустойчивы в желудочно-кишечном тракте (низкий рН, активность эстераз). В других случаях пролекарства слишком устойчивы и поэтому в недостаточной степени превращаются in vivo в исходное лекарственное средство.
В международных публикациях WO 98/39344, WO 98/39343, WO 98/139342 и WO 00/14095 описываются соединения, содержащие фосфорные кислоты и сложные эфиры, которые ингибируют фруктозо-1,6-бисфосфатазу.
Полное раскрытие публикаций и ссылок, указанных выше и в дальнейшем в данном описании, включено в данное описание посредством ссылки и допускается, что они могут не иметь отношения к предшествующему уровню техники.
Сущность изобретения
Данное изобретение относится к новым бисамидатным фосфонатам, которые являются сильнодействующими ингибиторами ФБФазы. В одном аспекте данные соединения обладают превосходной оральной биодоступностью по сравнению с соответствующими фосфоновыми кислотами. В другом аспекте, настоящее изобретение относится к in vitro и in vivo ингибирующей активности данных соединений в отношении ФБФазы. Другой аспект настоящего изобретения относится к клиническому применению данных ингибиторов ФБФазы как способ лечения или профилактики заболеваний, чувствительных к ингибированию глюконеогенеза и заболеваний, чувствительных к пониженным уровням глюкозы в крови.
В другом аспекте соединения используют также для лечения или профилактики заболеваний, связанных с избыточным депонированием гликогена и заболеваний, таких как сердечно-сосудистые заболевания, включая атеросклероз, ишемическую болезнь сердца, и заболеваний, таких как нарушения обмена веществ, например гиперхолестеринемия, гиперлипемия, которые усилены гиперинсулинемией и гипергликемией.
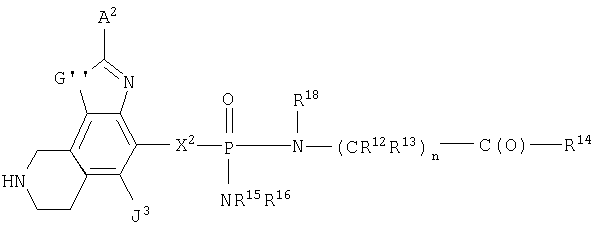
Кроме того, изобретение включает новые соединения, определенные ниже формулами I, X и XI, и способы использования данных соединений. В объем настоящего изобретения также включены обычные соли и пролекарства соединений формул I, X и XI.
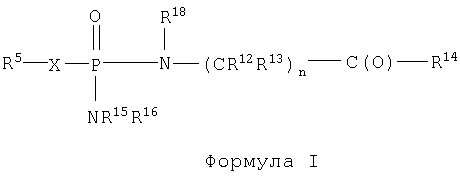
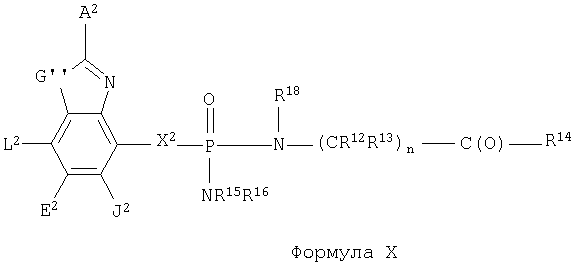
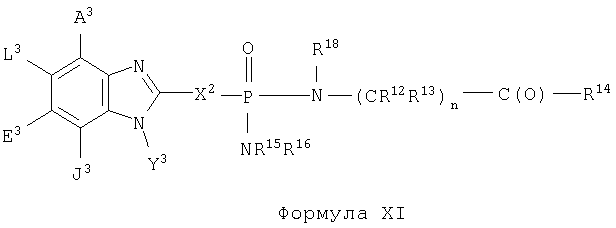
Поскольку данные соединения могут иметь асимметрические центры, настоящее изобретение охватывает также не только рацемические смеси этих соединений, но также и индивидуальные стереоизомеры. Настоящее изобретение включает также фармацевтически приемлемые и/или полезные соли соединений формул I, X и XI, включая аддитивные соли кислот. Кроме того, настоящее изобретение охватывает обычные пролекарства соединений формул I, X и XI.
Детальное описание изобретения
Определения
В соответствии с настоящим изобретением используемые в нем следующие термины имеют определенные ниже значения, если не оговорено особо иное.
Номенклатура групп X, X'', X2 и X3, используемая здесь в формулах I и XI, описывает группу, связанную с фосфонатом, и заканчивается группой, связанной с гетероароматическим кольцом. Например, когда Х представляет алкиламино, имеется в виду нижеследующая структура:
(гетероароматическое кольцо)-NR-алк-Р(О)(NR15R16) (NR18-(CR12R13)n-(C(O)-R14)
Аналогично А, В, С, D, Е, А", В", С", D", Е", A2, L2, Е2, J2, А3, L3, Е3 и J3 группы и другие заместители гетероароматического кольца описаны таким образом, что термин заканчивается группой, присоединенной к гетероароматическому кольцу. В общем, заместители названы так, что термин заканчивается группой в точке присоединения. Дефис до или после термина указывает на точку присоединения. Например, "-алкил-" относится к двухвалентному алкилу или алкилену.
Термин "арил" относится к ароматическим группам, которые имеют 5-14 кольцевых атомов и, по меньшей мере, одно кольцо, имеющее сопряженную пи-электронную систему, и включает карбоциклический арил, гетероциклический арил и биарильные группы, все из которых могут быть необязательно замещенными. Подходящие арильные группы включают фенил и фуран-2,5-диил.
Карбоциклические арильные группы представляют группы, где кольцевые атомы ароматического кольца являются атомами углерода. Карбоциклические арильные группы включают моноциклические карбоциклические арильные группы и полициклические или конденсированные соединения, такие как необязательно замещенные нафтильные группы.
Гетероциклические арильные или гетероарильные группы представляют группы, имеющие от 1 до 4 гетероатомов в качестве кольцевых атомов в ароматическом кольце, а остальные атомы кольца являются атомами углерода. Подходящие гетероатомы включают кислород, серу, азот и селен. Подходящие гетероарильные группы включают фуранил, тиенил, пиридил, пирролил, N-низший алкилпирролил, пиридил-N-оксид, пиримидил, пиразинил, имидазолил и т.п., все необязательно замещены.
Термин "аннелирование" или "аннелированный" относится к образованию дополнительной циклической части на существующей арильной или гетероарильной группе. Это есть форма необязательного замещения на арильной или гетероарильной группе. Вновь образованное кольцо может быть карбоциклическим или гетероциклическим, насыщенным или ненасыщенным и содержит 2-9 новых атомов, 0-3 из которых могут быть гетероатомами, взятыми из группы N, О и S. Аннелирование может включать атомы из группы Х в качестве части вновь образованного кольца. Например, выражение "вместе L2 и Е2 образуют аннелированную циклическую группу" включает
Термин "биарил" представляет арильные группы, содержащие более чем одно ароматическое кольцо, включающие как конденсированные кольцевые системы, так и арильные группы, замещенные другими арильными группами. Такие группы могут быть необязательно замещенными. Подходящие биарильные группы включают нафтил и бифенил.
Термин "алициклил" означает соединения, которые объединяют в себе характеристики алифатических и циклических соединений. Такие циклические соединения включают, но не ограничиваются ими, ароматические, циклоалкильные и соединенные мостиковой связью циклоалкильные соединения. Циклическое соединение включает гетероциклы. Циклогексенилэтил и циклогексилэтил представляют подходящие алициклические группы. Такие группы могут быть необязательно замещенными.
Термин "необязательно замещенный" или "замещенный" включает группы, замещенные одним-четырьмя заместителями, необязательно выбранными из низшего алкила, низшего арила, низшего аралкила, низшего алициклила, гидрокси, низшего алкокси, низшего арилокси, пергалоидалкокси, аралкокси, гетероарила, гетероциклоалкила, гетероарилокси, гетероарилалкила, гетероаралкокси, азидо, амино, гуанидино, амидино, галоида, низшего алкилтио, оксо, ацилалкила, карбоксиэфиров, карбоксила, -карбоксамидо, нитро, ацилокси, аминоалкила, алкиламиноарила, алкиларила, алкиламиноалкила, алкоксиарила, ариламино, аралкиламино, фосфоно, сульфонила, -карбоксамидоалкиларила, -карбоксамидоарила, гидроксиалкила, галоидалкила, алкиламиноалкилкарбокси-, аминокарбоксамидоалкила-, циано, низшего алкоксиалкила, низшего пергалоидалкила и арилалкилоксиалкила. "Замещенный арил" и "замещенный гетероарил" относится к арильным и гетероарильным группам, замещенным 1-2; 1-3 или 1-4 заместителями. В одном аспекте подходящие заместители арильных групп включают низший алкил, низший алкокси, низший пергалоидалкил, галоид, гидрокси и амино. "Замещенный" при описании R5 группы не включает аннелирование.
Термин "аралкил" относится к алкильной группе, замещенной арильной группой. Подходящие аралкильные группы включают бензил, пиколил и т.п. и могут быть необязательно замещенными. Термин "-аралкил-" относится к двухвалентной группе -арил-алкилен-. "Гетероарилалкил" относится к алкиленовой группе, замещенной гетероарильной группой.
Термин "-алкиларил-" относится к группе -алк-арил-, где "алк" представляет алкиленовую группу. "Низший -алкиларил-" относится к таким группам, где алкилен представляет низший алкилен.
Термин "низший", упоминаемый в связи с органическими радикалами или соединениями соответственно определяет таковые как содержащие до и включая 10, или до и включая 6, или один-четыре атома углерода. Такие группы могут иметь прямую цепь, разветвленную или циклическую.
Термины "ариламино" (а) и "аралкиламино" (b) соответственно относятся к группе -NRR', где соответственно (а) R представляет арил и R' представляет водород, алкил, аралкил или арил, и (b) R представляет аралкил и R' представляет водород или аралкил, арил, алкил.
Термин "ацил" относится к -C(O)R, где R представляет алкил и арил.
Термин "карбокси сложный эфир" относится к -С(О)OR, где R представляет алкил, арил, аралкил и алициклическую группу, все необязательно замещены.
Термин "карбоксил" относится к -С(О)ОН.
Термин "оксо" относится к =O в алкильной группе.
Термин "амино" относится к -NRR1, где R и R1 независимо выбраны из водорода, алкила, арила, аралкила и алициклической группы, все, кроме Н, необязательно замещены и R и R1 могут образовывать циклическую кольцевую систему.
Термин "карбониламино" и "-карбониламино-" относится к RCONR- и -CONR- соответственно, где каждый R представляет независимо водород или алкил.
Термин "галоген" или "галоид" относится к -F, -Cl, -Br и -I.
Термин "-оксиалкиламино-" относится к -О-алк-NR-, где "алк" представляет алкиленовую группу и R представляет Н или алкил.
Термин "-алкиламиноалкилкарбокси-" относится к группе -алк-NR-алк-C(О)-О, где "алк" представляет алкиленовую группу и R представляет Н или низший алкил.
Термин "-алкиламинокарбонил-" относится к группе -алк-NR-C(O)-, где "алк" представляет алкиленовую группу и R представляет Н или низший алкил.
Термин "-оксиалкил-" относится к группе -О-алк-, где "алк" представляет алкиленовую группу.
Термин "-алкилкарбоксиалкил-" относится к группе -алк-С(О)-О-алк-, где каждый "алк" представляет независимо алкиленовую группу.
Термин "алкил" относится к насыщенным алифатическим группам, включая группы с прямой цепью, разветвленной цепью и циклические группы. Алкильные группы могут быть необязательно замещенными. Подходящие алкильные группы включают метил, изопропил и циклопропил.
Термин "циклический алкил" или "циклоалкил" относится к алкильным группам, которые представляют циклические группы с 3-6 или 3-10 атомами. Подходящие циклические группы включают норборнил и циклопропил. Такие группы могут быть замещенными.
Термин "гетероциклил" и "гетероциклический алкил" относится к циклическим группам с 3-6 или 3-10 атомами, содержащим, по меньшей мере, один гетероатом. В одном аспекте данные группы содержат 1-3 гетероатома. Подходящие гетероатомы включают кислород, серу и азот. Гетероциклические группы могут быть присоединены через азот или через атом углерода в кольце. Подходящие гетероциклические группы включают пирролидинил, морфолино, морфолиноэтил и пиридил. Такие группы могут быть замещенными.
Термин "фосфоно" относится к -РО3R2, где R выбран из группы, состоящей из -Н, алкила, арила, аралкила и алициклической группы.
Термин "сульфонил" относится к -SO3R, где R представляет Н, алкил, арил, аралкил и алициклическую группу.
Термин "алкенил" относится к ненасыщенным группам, которые содержат, по меньшей мере, одну углерод-углеродную двойную связь, и включает группы с прямой цепью, разветвленной цепью и циклические группы. Алкенильные группы могут быть необязательно замещенными. Подходящие алкенильные группы включают аллил. "1-Алкенил" относится к алкенильным группам, где двойная связь находится между первым и вторым атомом углерода. Если 1-алкенильная группа связана с другой группой, например она представляет W заместитель, связанный с циклическим фосф(орамид)атом, тогда она присоединена к первому углероду.
Термин "алкинил" относится к ненасыщенным группам, которые содержат, по меньшей мере, одну углерод-углеродную тройную связь, и включает группы с прямой цепью, разветвленной цепью и циклические группы. Алкинильные группы могут быть необязательно замещенными. Подходящие алкинильные группы включают этинил. "1-Алкинил" относится к алкинильным группам, где тройная связь находится между первым и вторым атомом углерода. Если 1-алкинильная группа связана с другой группой, тогда она присоединена к первому углероду.
Термин "алкилен" относится к двухвалентной с прямой цепью, разветвленной цепью или циклической насыщенной алифатической группе.
Термин "-циклоалкилен-COOR3" относится к двухвалентной циклоалкильной группе или гетероциклической группе, содержащей 4-6 атомов в кольце, с 0-1 гетероатомом, выбранным из О, N и S. Циклоалкильная или гетероциклическая группа замещена -COOR3.
Термин "ацилокси" относится к сложноэфирной группе -O-C(O)R, где R представляет Н, алкил, алкенил, алкинил, арил, аралкил или алициклическую группу.
Термин "аминоалкил-" относится к группе NR2-алк-, где "алк" представляет алкиленовую группу и R выбран из Н, алкила, арила, аралкила и алициклила.
Термин "-алкил(гидрокси)-" указывает на положение -ОН по отношению к алкильной цепи. Когда указанный термин представляет Х группу, -ОН находится в положении α к атому фосфора.
Термин "алкиламиноалкил-" относится к группе алкил-NR-алк-, где каждый "алк" представляет независимо выбранный алкилен и R представляет Н или низший алкил. "Низший алкиламиноалкил-" относится к группам, где каждая алкиленовая группа представляет низший алкилен.
Термин "ариламиноалкил-" относится к группе арил-NR-алк-, где "алк" представляет алкиленовую группу и R представляет Н, алкил, арил, аралкил и алициклил. В "низшем ариламиноалкиле-" алкиленовая группа представляет низший алкилен.
Термин "алкиламиноарил-" относится к группе алкил-NR-арил-, где "арил" представляет двухвалентную группу и R представляет Н, алкил, аралкил и алициклил. В "низшем алкиламиноариле-" алкиленовая группа представляет низший алкил.
Термин "алкилоксиарил-" относится к арильной группе, замещенной алкилоксигруппой. В "низшем "алкилоксиариле-" алкильной группой является низший алкил.
Термин "арилоксиалкил-" относится к алкильной группе, замещенной арилоксигруппой.
Термин "аралкилоксиалкил-" относится к группе арил-алк-O-алк-, где "алк" представляет алкиленовую группу. "Низший аралкилоксиалкил-" относится к таким группам, где алкиленовые группы представляют низший алкилен.
Термин "-алкокси-" или "-алкилокси-" относится к группе -алк-O-, где "алк" представляет алкиленовую группу. Термин "алкокси-" относится к группе алкил-O-.
Термин "-алкоксиалкил-" или "-алкилоксиалкил-" относится к группе -алк-O-алк-, где каждый "алк" является независимо выбранной алкиленовой группой. В "низшем -алкоксиалкиле-" каждый алкилен представляет низший алкилен.
Термины "алкилтио-" и "-алкилтио-" относятся к группам алкил-S- и -алк-S- соответственно, где "алк" представляет алкиленовую группу.
Термин "-алкилтиоалкил-" относится к группе -алк-S-алк-, где каждый "алк" представляет независимо выбранную алкиленовую группу. В "низшем -алкилтиоалкиле" каждый алкилен представляет низший алкилен.
Термин "алкоксикарбонилокси-" относится к алкил-O-С(O)-O-.
Термин "арилоксикарбонилокси-" относится к арил-O-С(O)-O-.
Термин "алкилтиокарбонилокси-" относится к алкил-S-C(О)-О-.
Термин "-алкоксикарбониламино-" относится к -алк-O-С(O)-NR1-, где "алк" представляет алкилен и R1 включает -Н, алкил, арил, алициклил и аралкил.
Термин "-алкиламинокарбониламино" относится к -алк-NR1-С(О)-NR1-, где "алк" представляет алкилен и R1 независимо выбран из Н, алкила, арила, аралкила и алициклической группы.
Термины "амидо" или "карбоксамидо" относятся к NR2-C(O)- и RC(O)-NR1-, где R и R1 включают Н, алкил, арил, аралкил и алициклил. Термины не включают мочевину, -NR-C(O)-NR.
Термины "карбоксамидоалкиларил" и "карбоксамидоарил" относятся к арил-алк-NR'-С(О)- и ap-NRl-C(О)-алк- соответственно, где "ар" представляет арил и "алк" представляет алкилен, R1 и R включают Н, алкил, арил, аралкил и алициклил.
Термин "-алкилкарбоксамидо-" или "-алкилкарбониламино-" относится к группе -алк-С(O)N(R)-, где "алк" представляет алкиленовую группу, и R представляет Н или низший алкил.
Термин "-алкиламинокарбонил-" относится к группе -алк-NR-С(О)-, где "алк" представляет алкиленовую группу и R представляет Н или низший алкил.
Термин "аминокарбоксамидоалкил-" относится к группе NR2-C(O)-N(R)-алк-, где R представляет алкильную группу или Н и "алк" представляет алкиленовую группу. "Низший аминокарбоксамидоалкил-" относится к таким группам, где "алк" представляет низший алкилен.
Термин "тиокарбонат" относится к -O-C(S)-O-, либо в ациклической, либо в циклической группе.
Термин "гидроксиалкил" относится к алкильной группе, замещенной одним -ОН.
Термин "галоидалкил" относится к алкильной группе, замещенной одним галоидом, выбранным из группы I, Cl, Br, F.
Термин "циано" относится к -C≡N.
Термин "нитро" относится к -NO2.
Термин "ацилалкил" относится к алкил-С(О)-алк-, где "алк" представляет алкилен.
Термин "гетероарилалкил" относится к алкильной группе, замещенной гетероарильной группой.
Термин "-1,1-дигалоидалкил-" относится к Х группе, где 1 означает местоположение и поэтому галоиды находятся в α положении по отношению к атому фосфора.
Термин "пергалоид" относится к группам, где каждая С-Н связь заменена С-галоид связью в алифатической или арильной группе. Подходящие пергалоидалкильные группы включают -CF3 и -CFCl2.
Термин "гуанидино" относится как к -NR-C(NR)-NR2, так и к -N=C(NR2)2, где каждая R группа независимо выбрана из группы -Н, алкила, алкенила, алкинила,- арила и алициклила, все, кроме -Н, необязательно являются замещенными.
Термин "бидентат" относится к алкильной группе, которая присоединена своими концами к одному и тому же атому, образуя циклическую группу. Например, пропиленамин содержит бидентатную пропиленовую группу.
Термин "аминокислота природного происхождения" относится к альфа-аминокислотам, содержащим, по меньшей мере, один водород при альфа-углероде, и в том случае, когда альфа-углерод является хиральным, он имеет абсолютную конфигурацию S.
Термин "амидино" относится к -C(NR)-NR2, где каждая R группа независимо выбрана из группы -Н, алкила, алкенила, алкинила, арила и алициклической группы, причем все, кроме -Н, необязательно замещены.
Термин "фармацевтически приемлемая соль " включает соли соединений формулы IA и их пролекарств, полученные при комбинации соединения настоящего изобретения и органических или неорганических кислот или оснований. Подходящие кислоты включают хлористоводородную кислоту, бромистоводородную кислоту, уксусную кислоту, трифторуксусную кислоту, метансульфокислоту, п-толуолсульфокислоту и малеиновую кислоту.
Используемый здесь термин "пролекарство" относится к любому соединению, которое при введении в биологическую систему генерирует вещество - "лекарственное средство" (биологически активное соединение) в результате спонтанной химической реакции(ий), химической реакции(ий), катализируемой ферментом, и/или метаболической химической реакции(ий). Стандартные пролекарства получают, используя группы, присоединенные к функциональной группе, например НО-, HS-, НООС-, R2N-, связанной с ингибитором ФБФазы, которые отщепляются in vivo. Обычные пролекарства включают, но не ограничиваются ими, карбоксилатные эфиры, где группа представляет алкил, арил, аралкил, ацилоксиалкил, алкоксикарбонилоксиалкил, а также сложные эфиры гидроксила, тиола и аминов, где присоединенная группа 'представляет ацильную группу, алкоксикарбонил, аминокарбонил, фосфат или сульфат. Приведенные выше группы представляют иллюстративный, но не исчерпывающий ряд групп, и квалифицированный специалист в данной области может получить другие известные разновидности пролекарств. Такие пролекарства соединений формул I, X и XI входят в объем настоящего изобретения. Пролекарства должны претерпеть некоторую форму химического преобразования, чтобы получить соединение, которое биологически активно или представляет предшественник биологически активного соединения. В некоторых случаях пролекарство является биологически активным, но обычно в меньшей степени, чем лекарственное средство как таковое, и в этом случае указанное пролекарство служит для улучшения эффективности или безопасности благодаря улучшению оральной биодоступности, фармакодинамического периода полураспада и т.д.
Фосфороамидатные производные были исследованы как фосфатные пролекарства (например, McGuigan et al., J.Med. Chem., 1999, 42:393, и ссылки, цитируемые в данной публикации) и как фосфонатные пролекарства (Bischofberger et al., патент США 5798340, и ссылки, цитируемые в нем), представленные формулами G и Н.
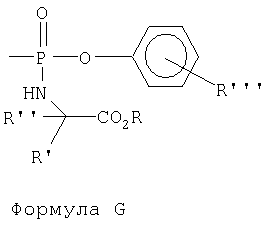
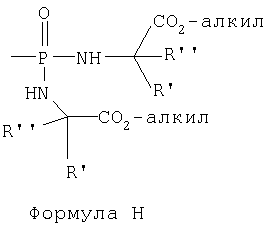
Кроме того, циклические фосфорамидаты были исследованы как фосфонатные пролекарства вследствие своей предполагаемой более высокой стабильности в сравнении с не-циклическими фосфорамидатами (например, Starrett et al., J.Med. Chem., 1994, 37:1857).
Имеются сообщения о другом типе нуклеотидного пролекарства как комбинации S-ацил-2-тиоэтилового эфира и фосфороамидата (Egron et al., Nucleosides & Nucleotlde, 1999, 18, 981), представленного формулой J.
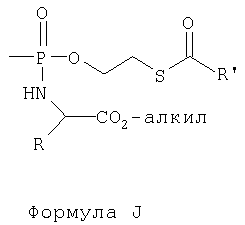
Термин "повышающий" относится к увеличению или улучшению конкретного свойства.
Термин "повышенная оральная биодоступность" относится к увеличению, по меньшей мере, на 50% абсорбции (всасывания) дозы исходного лекарственного средства или пролекарства (не из предлагаемого изобретения) из желудочно-кишечного тракта. В одном аспекте это увеличение составляет, по меньшей мере, 100%. Определение оральной биодоступности обычно относится к определениям пролекарства, лекарственного средства или метаболита лекарственного средства в крови, тканях или моче после орального введения, по сравнению с определениями после системного введения.
Термин "исходное лекарственное средство" относится к любому соединению, которое доставляет то же самое биологически активное соединение. Форма исходного лекарственного средства представляет М-Р(О)(ОН)2 и обычные пролекарства, такие как сложные эфиры.
Термин "метаболит лекарственного средства" относится к любому соединению, полученному in vivo или in vitro из исходного лекарственного средства, которое может включать биологически активное лекарственное средство.
Термин "фармакодинамический период полураспада" относится ко времени после введения лекарственного средства или пролекарства, когда наблюдается уменьшение наполовину определяемого фармакологического ответа. В одном аспекте период полураспада повышается, когда период полураспада увеличивается, по меньшей мере, на 50%.
Термин "биологически активное лекарство или средство" относится к химическому веществу, которое обеспечивает биологическое действие. Таким образом, активные лекарства или средства включают соединения, которые являются биологически активными в виде М-Р(О)(ОН)2.
Термин "ингибитор фруктозо-1,6-бисфосфатазы" относится к химическому веществу М-Р(О)(ОН)2, которое имеет значение ИК50 (IC50), равное или менее чем 50 мкМ, в отношении ФБФазы печени человека.
Термин "терапевтически эффективное количество" относится к количеству (лекарственного средства), которое оказывает благоприятное действие при лечении заболевания или состояния.
Соединения
Подходящие алкильные группы включают группы, содержащие от 1 до примерно 20 атомов углерода. Подходящие арильные группы включают группы, содержащие от 1 до примерно 20 атомов углерода. Подходящие аралкильные группы включают группы, содержащие от 2 до примерно 21 атома углерода. Подходящие ацилоксигруппы включают группы, содержащие от 1 до примерно 20 атомов углерода. Подходящие алкиленовые группы включают группы, содержащие от 1 до примерно 20 атомов углерода. Подходящие алициклические группы включают группы, содержащие от 3 до примерно 20 атомов углерода. Подходящие гетероарильные группы включают группы, содержащие от 1 до примерно 20 атомов углерода и от 1 до 4 гетероатомов, независимо выбранных из азота, кислорода, фосфора и серы. Подходящие гетероалициклические группы включают группы, содержащие от 2 до примерно 20 атомов углерода и от 1 до 5 гетероатомов, независимо выбранных из азота, кислорода, фосфора и серы.
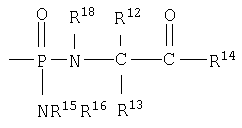
Один аспект изобретения относится к соединению формулы IA
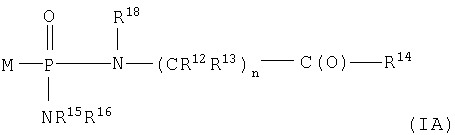
где соединения формулы IA превращаются in vivo или in vitro в М-РО3Н2, которое является ингибитором фруктозо-1,6-бисфосфатазы,
n равно целому числу от 1 до 3;
R2 выбран из группы -Н и -R3;
R3 выбран из группы, состоящей из алкила, арила, алициклила и аралкила;
каждый R12 и R13 независимо выбран из группы, состоящей из Н, низшего алкила, низшего арила, низшего аралкила, все необязательно замещенные, или R12 и R13 вместе связаны через 2-6 атомов, необязательно включающих 1-2 гетероатома, выбранных из группы, состоящей из О, N и S, с образованием циклической группы;
каждый R14 независимо выбран из группы, состоящей из -OR17, -N(R17)2, -NHR17, -NR2OR9 и -SR17;
R15 выбран из группы, состоящей из -Н, низшего алкила, низшего арила, низшего аралкила, или вместе с R16 связан через 2-6 атомов, необязательно включающих 1 гетероатом, выбранный из группы, состоящей из О, N и S;
R16 выбран из группы, состоящей из -(CR12R13)n-C(O)-R14, -Н, низшего алкила, низшего арила, низшего аралкила, или вместе с R15 связан через 2-6 атомов, необязательно включающих 1 гетероатом, выбранный из группы, состоящей из О, N и S;
каждый R17 независимо выбран из группы, состоящей из низшего алкила, низшего арила и низшего аралкила, все необязательно замещены, или R17 и R17 на N вместе связаны через 2-6 атомов, необязательно включающих 1 гетероатом, выбранный из группы, состоящей из О, N и S;
R18 независимо выбран из группы, состоящей из Н, низшего алкила, арила, аралкила, или вместе с R12 связан через 1-4 углеродных атома с образованием циклической группы;
каждый R19 независимо выбран из группы, состоящей из -Н, низшего алкила, низшего арила, низшего алициклила, низшего аралкила и COR3;
и его фармацевтически приемлемым солям.
Такие соединения, превращаемые в М-РО3Н2, включают соединения, которые имеют значение ИК50 в отношении фермента, ФБФазы, выделенного из печени человека, менее или равное 10 мкМ. Альтернативно значение ИК50 меньше или равно 1 мкМ. Такие соединения могут связываться с сайтом АМФ (АМР) ФБФазы.
В одном аспекте М представляет R5-X-, где R5 выбран из группы, состоящей из
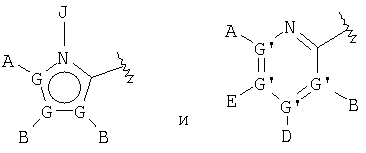
где каждый G независимо выбран из группы, состоящей из С, N, О, S и Se, и где только один G может представлять О, S или Se, и, самое большее, один G представляет N;
каждый G' независимо выбран из группы, состоящей из С и N, и где не более чем две G' группы представляют N;
А выбран из группы, состоящей из -Н, -NR4 2, -CONR4 2, -CO2R3, галоида, -S(O)R3, -SO2R3, алкила, алкенила, алкинила, пергалоидалкила, галоидалкила, арила, -CH2OH, -CH2NR4 2, -CH2CN, -CN, -C(S)NH2, -OR2, -SR2, -N3, -NHC(S)NR4 2, -NHAc, или отсутствует;
каждый В и D независимо выбран из группы, состоящей из -Н, алкила, алкенила, алкинила, арила, алициклила, аралкила, алкоксиалкила, -C(O)R11, -C(O)SR3, -SO2R11, -S(O)R3, -CN, -NR9 2, -OR3, -SR3, пергалоидалкила, галоида, -NO2, или отсутствует, все, кроме -Н, -CN, пергалоидалкила, -NO2 и галоида, необязательно замещены;
Е выбран из группы, состоящей из -Н, алкила, алкенила, алкинила, арила, алициклила, алкоксиалкила, -C(O)OR3, -CONR4 2, -CN, -NR9 2, -NO2, -OR3, -SR3, пергалоидалкила, галоида, или отсутствует, все, кроме -Н, -CN, пергалоидалкила и галоида, необязательно замещены;
J выбран из группы, состоящей из -Н, или отсутствует;
Х представляет необязательно замещенную связывающую группу, которая связывает R5 с атомом фосфора через 2-4 атома, включющих 0-1 гетероатом, выбранный из N, О и S, за исключением того, что если Х представляет мочевину или карбамат, тогда имеется 2 гетероатома, которые и определяют кратчайшее расстояние между R5 и атомом фосфора, и где атом, связанный с фосфором, является атомом углерода, и где Х выбран из группы, состоящей из -алкил(гидрокси)-, -алкинила-, -гетероарила-, -карбонилалкила-, -1,1-дигалоидалкила-, -алкоксиалкила-, -алкилокси-, -алкилтиоалкила-, -алкилтио-, -алкиламинокарбонила-, -алкилкарбониламино-, -алкоксикарбонила-, -карбонилоксиалкила-, -алкоксикарбониламино- и -алкиламинокарбониламино-, все необязательно замещены, при условии, что Х не замещен -COOR2, -SO3Н или -РО3R2 2;
R2 выбран из группы, состоящей из R3 и -Н;
R3 выбран из группы, состоящей из алкила, арила, алициклила и аралкила;
каждый R4 независимо выбран из группы, состоящей из -Н и алкила, или R4 и R4 вместе образуют циклоалкильную группу;
каждый R9 независимо выбран из группы, состоящей из -Н, алкила, арила, аралкила и алициклила, или R9 и R9 вместе образуют циклоалкильную группу;
R11 выбран из группы, состоящей из алкила, арила, -NR2 2 и -OR2;
и при условии, что
1) когда G' представляет N, тогда соответствующий А, В, D или Е отсутствует;
2) по меньшей мере, один из А и В или А, В, D и Е не выбран из группы, состоящей из -Н, или отсутствует;
3) когда G представляет N, тогда соответствующий А или В не является галоидом или группой, непосредственно связанной с G через гетероатом;
и его фармацевтически приемлемым солям.
В одном аспекте можно использовать следующие дополнительные условия:
4) когда R5 представляет шестичленное кольцо, тогда Х не является связующей группой из 2 атомов, необязательно замещенной-алкилокси- или необязательно замещенной-алкилтио-;
5) когда Х не является -гетероарильной- группой, тогда R5 не замещен двумя или несколькими арильными группами.
В одном аспекте настоящего изобретения соединения формулы IA имеют ИК50≤50 мкМ в отношении продуцирования глюкозы в выделенных печеночных клетках печени крысы.
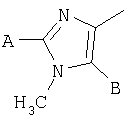
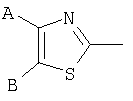
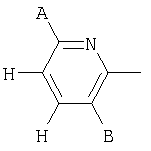
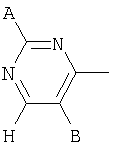
В одном аспекте соединения формулы IA могут быть выбраны из тех соединений, где М присоединен к
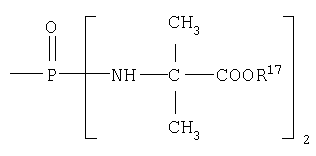
или
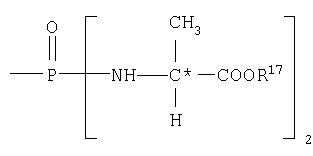
где R17 выбран из группы, состоящей из этила, изопропила, н-пропила и неопентила, и где С* имеет стереохимию S.
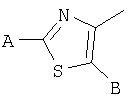
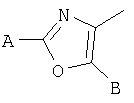
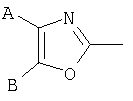
В тиазолах, в том случае, когда А" представляет -NH2, Х представляет фуран-2,5-диил, В" представляет -S(СН2)2СН3, или в том случае, когда А" представляет -NH2, D представляет фуран-2,5-диил, В" представляет -СН2-СН(СН3)2, тогда М может быть присоединен к

или

где R17 выбран из группы, состоящей из этила, изопропила, н-пропила и неопентила, и где С* имеет стереохимию S.
В одном аспекте соединения формулы IA могут быть выбраны из
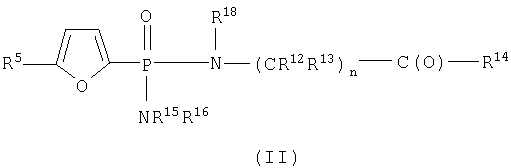
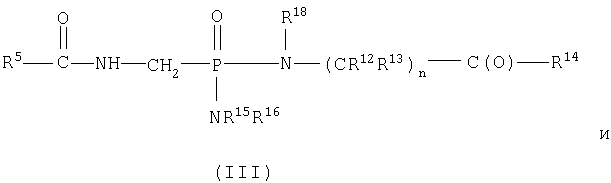
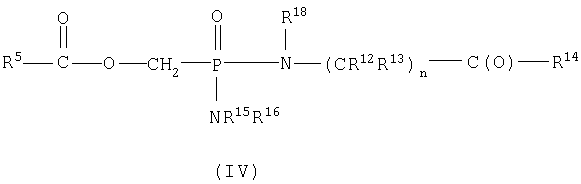
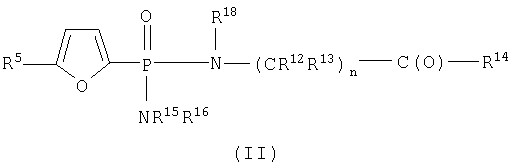
В пределах такой группы соединения формулы IA могут представлять соединения формул II или IV

В одном аспекте соединения имеют формулу IA, где М представляет
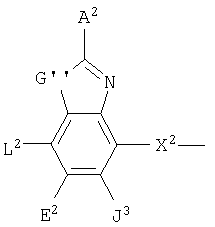
где G" выбран из группы, состоящей из -О- и -S-;
А2 выбран из группы, состоящей из -Н, -NR4 2, -NHAc, -OR2, -SR2, -C(O)NR4 2, галоида, -COR11, -CN, пергалоидалкила, C1-C6 алкила, C2-C6 алкенила и C2-C6 алкинила;
L2, Е2 и J2 выбраны из группы, состоящей из -NR4 2, -NHAc, -NO2, -Н, -OR2, -SR2, -C(O)NR4 2, галоида, -COR11, SO2R3, гуанидинила, амидинила, арила, аралкила, алкилоксиалкила, -SCN, -NHSO2R3, -SO2NR4 2, -CN, -S(O)R3, пергалоидацила, пергалоидалкила, пергалоидалкокси, C1-C6 алкил(ОН)-, C1-C6 алкил(SH), C1-C6 алкила, C2-C6 алкенила, C2-C6 алкинила, гетероарила и низшего алициклила, или L2 и Е2 или Е2 и J2 вместе образуют аннелированную циклическую группу;
X2 выбран из группы, состоящей из -CR2 2-, -CF2-, -CR2 2-O-, -CR2 2-S-, -С (О)-О-, -C(O)-S-, -C(S)-O-, -CH2-C(O)-O- и -CR2 2-NR20-, и где атомом, связанным с фосфором, является атом углерода, при условии, что X2 не замещен -COOR2, -SO3Н или -РО3R2 2;
R2 выбран из группы, состоящей из R3 и -Н;
R3 выбран из группы, состоящей из алкила, арила, алициклила и аралкила;
каждый R4 независимо выбран из группы, состоящей из -Н и алкила, или R4 и R4 вместе образуют циклоалкильную группу;
R11 выбран из группы, состоящей из алкила, арила, -NR2 2 и -OR2;
R20 выбран из группы, состоящей из низшего алкила, -Н и -COR2,
и их фармацевтически приемлемые соли.
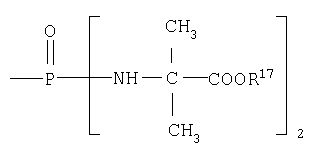
В одном аспекте бисфосфорамидатная часть соединений изобретения
может быть выбрана из группы, состоящей из
и
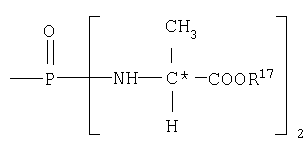
где R17 выбран из группы, состоящей из этила, изопропила, н-пропила, н-бутила и неопентила. В другом аспекте С* имеет стереохимию S.
Альтернативно такие соединения могут иметь формулу
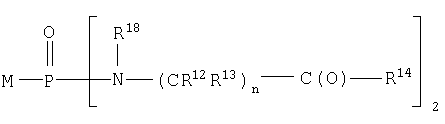
В одном аспекте изобретения М представляет
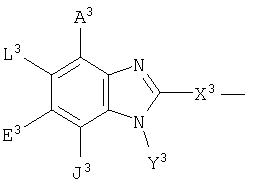
где А3, Е3 и L3 выбраны из группы, состоящей из -NR8 2, -NO2, -Н, -OR7, -SR7, -C(O)NR4 2, галоида, -COR11, -SO2R3, гуанидина, амидина, -NHSO2R3, -SO2NR4 2 -CN, сульфоксида, пергалоидацила, нергалоидалкила, пергалоидалкокси, C1-C5 алкила, C2-C5 алкенила, C2-C5 алкинила и низшего алициклила, или А3 и L3 вместе образуют циклическую группу, или L3 и Е3 вместе образуют циклическую группу, или Е3 и J3 вместе образуют циклическую группу, включающую арил, циклоалкил и гетероциклическую группу;
J3 выбран из группы, состоящей из NR8 2, -NO2, -H, -OR7, -SR7, -C(O)NR4 2, галоида, -COR11, -CN, сульфонила, сульфоксида, пергалоидалкила, гидроксиалкила, пергалоидалкокси, алкила, галоидалкила, аминоалкила, алкенила, алкинила; алициклила, арила и аралкила, или вместе с Y3 образует циклическую группу, включающую арил, циклоалкил и гетероциклоалкил;
X3 выбран из группы, состоящей из -алкил(гидрокси)-, -алкила-, -алкинила-, -арила-, -карбонилалкила-, -1,1-дигалоидалкила-, -алкоксиалкила-, -алкилокси-, -алкилтиоалкила-, -алкилтио-, -алкиламинокарбонила-, -алкилкарбониламино-, -алициклила-, -аралкила-, -алкиларила-, -алкоксикарбонила-, -карбонилоксиалкила-, -алкоксикарбониламино- и -алкиламинокарбониламино-, все необязательно замещены; при условии, что X3 не замещен -COOR2, -SO3Н или -PO3R2 2;
Y3 выбран из группы, состоящей из -Н, алкила, алкенила, алкинила, арила, алициклила, аралкила, арилоксиалкила, алкоксиалкила, -C(O)R3, -S(O)2R3, -C(O)-R11, -CONHR3, -NR2 2 и -OR3, все, кроме Н, необязательно замещены;
R2 выбран из группы, состоящей из R3 и -Н;
R3 выбран из группы, состоящей из алкила, арила, алициклила и аралкила;
каждый R4 независимо выбран из группы, состоящей из -Н и алкила, или R4 и R4 вместе образуют циклоалкильную группу;
R7 независимо выбран из группы, состоящей из -Н, низшего алкила, низшего алициклила, низшего аралкила, низшего арила и -C(O)R10;
R8 независимо выбран из группы, состоящей из -Н, низшего алкила, низшего аралкила, низшего арила, низшего алициклила, -C(O)R10, или вместе они образуют бидентатный алкил;
каждый R9 независимо выбран из группы, состоящей из -Н, -алкила, аралкила и алициклила, или R9 и R9 вместе образуют циклоалкильную группу;
R10 выбран из группы, состоящей из -Н, низшего алкила, -NH2, низшего арила и низшего пергалоидалкила;
R11 выбран из группы, состоящей из алкила, арила, -NR2 2 и -OR2,
и их фармацевтически приемлемые соли.
В одном аспекте можно использовать следующие условия:
a) когда X3 представляет алкил или алкен, тогда А3 представляет -N(R8 2);
b) X3 не является алкиламином и алкиламиноалкилом, замещенным сложными эфирами фосфоновых кислот и фосфоновыми кислотами, и
c) A3, L3, Е3, J3 и Y3 вместе могут образовать только 0-2 циклические группы.
В нижеследующей таблице, заявителями рассматривается любая (возможная) комбинация из нижеследующих групп Маркуша и групп, приведенных выше, для различных переменных.
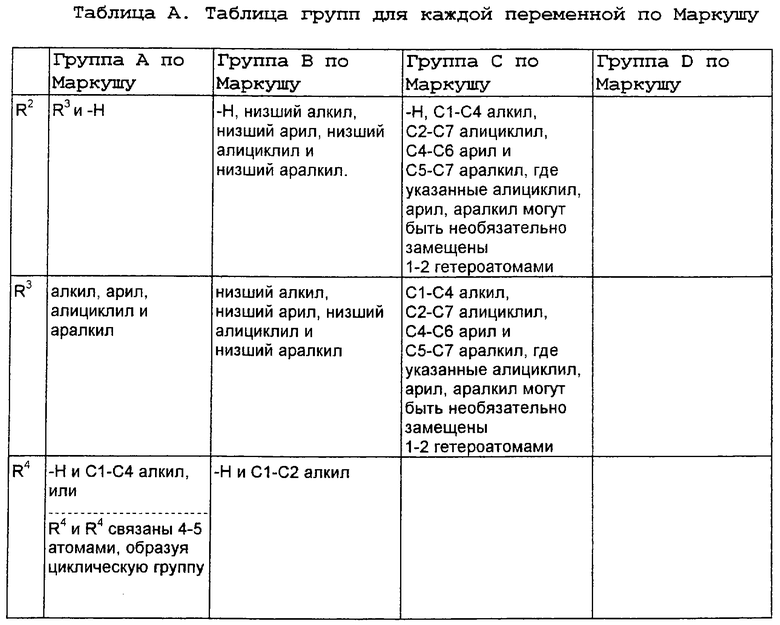
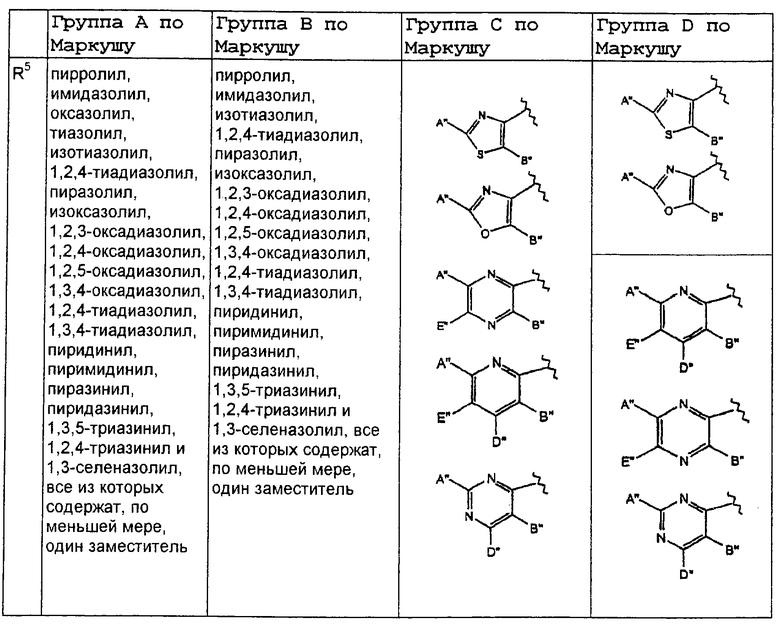
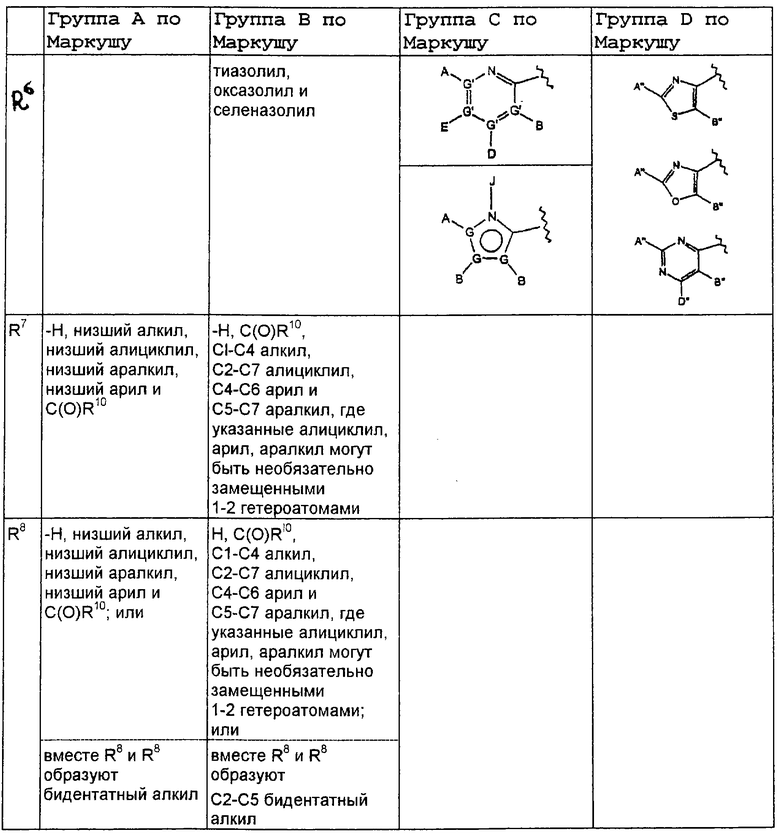
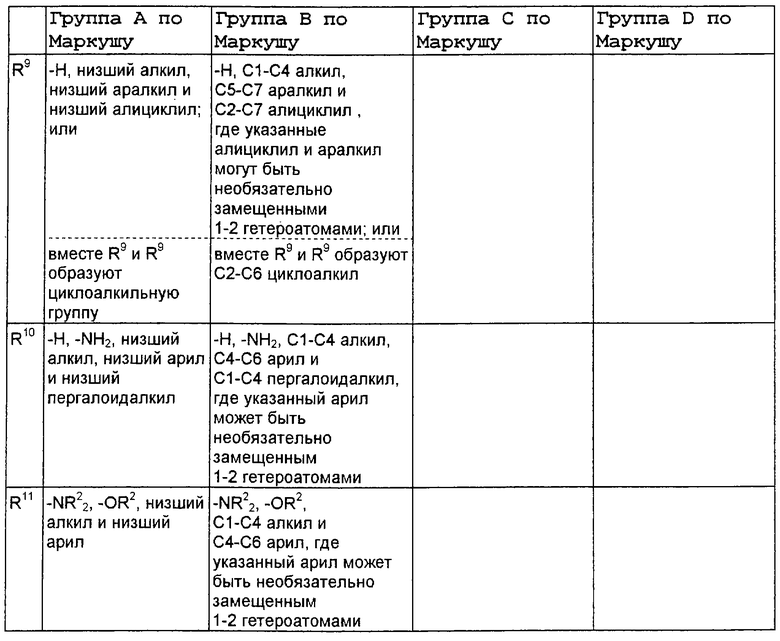
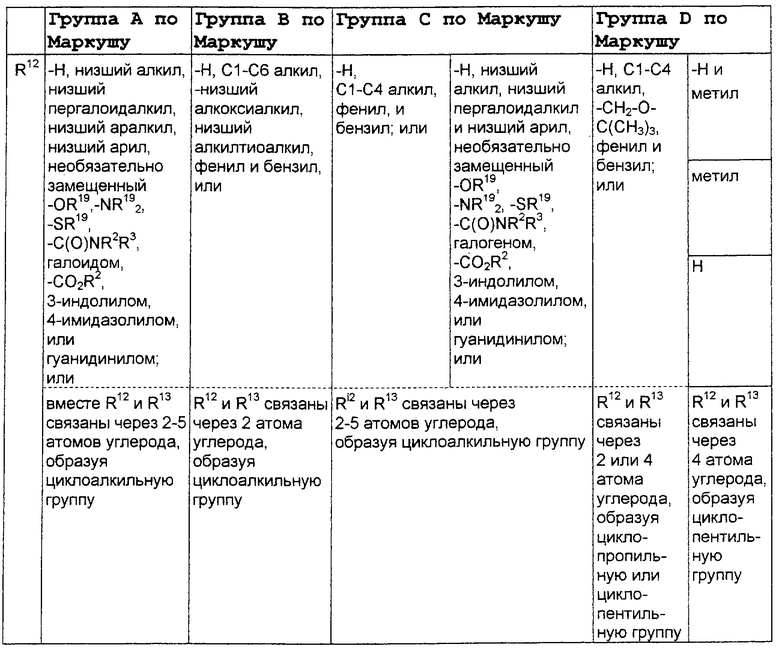
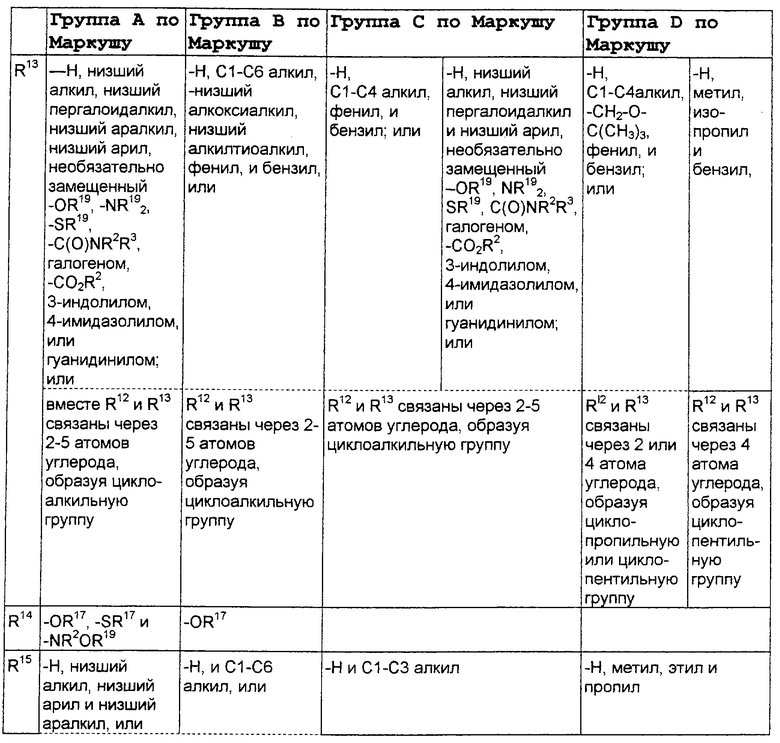
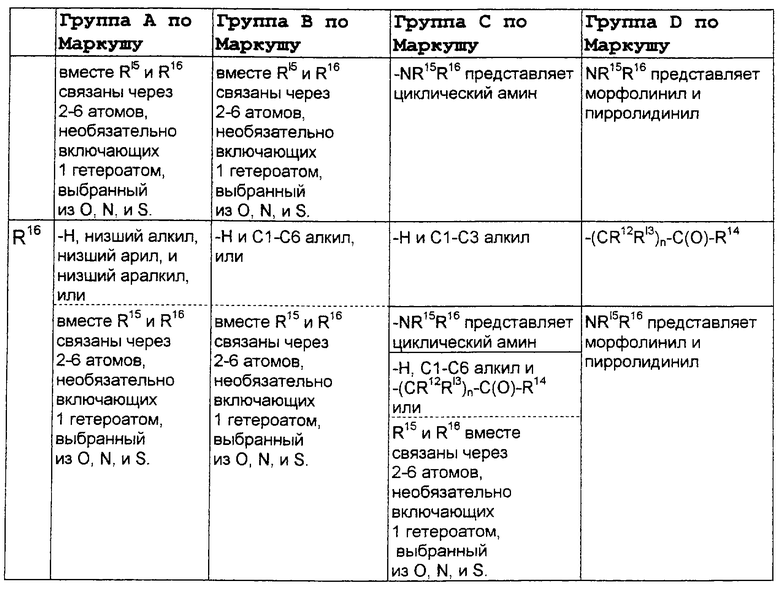
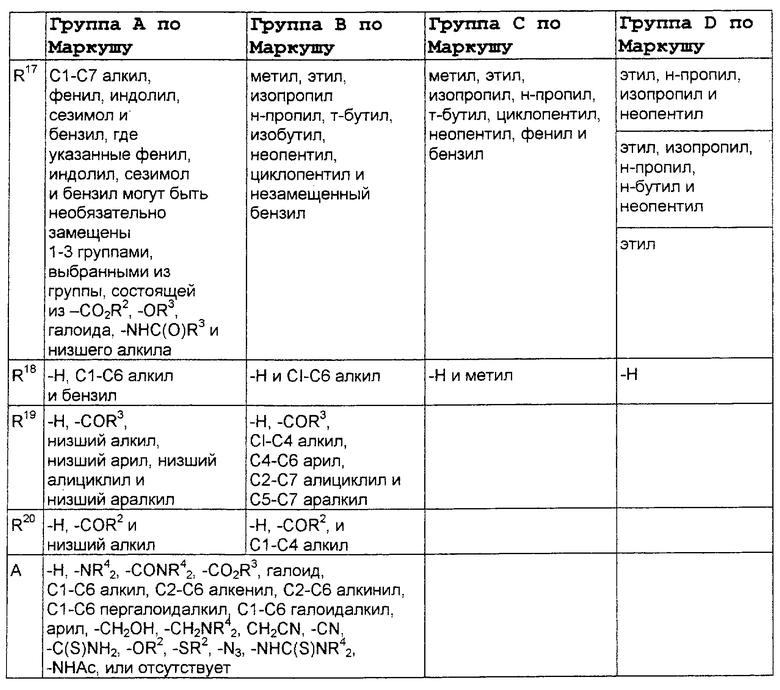
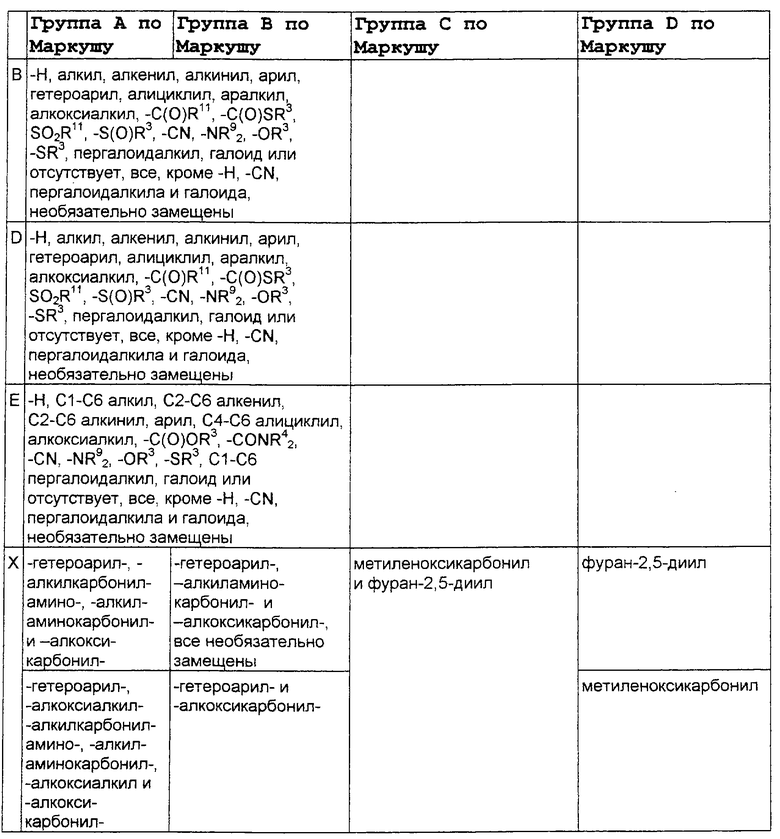
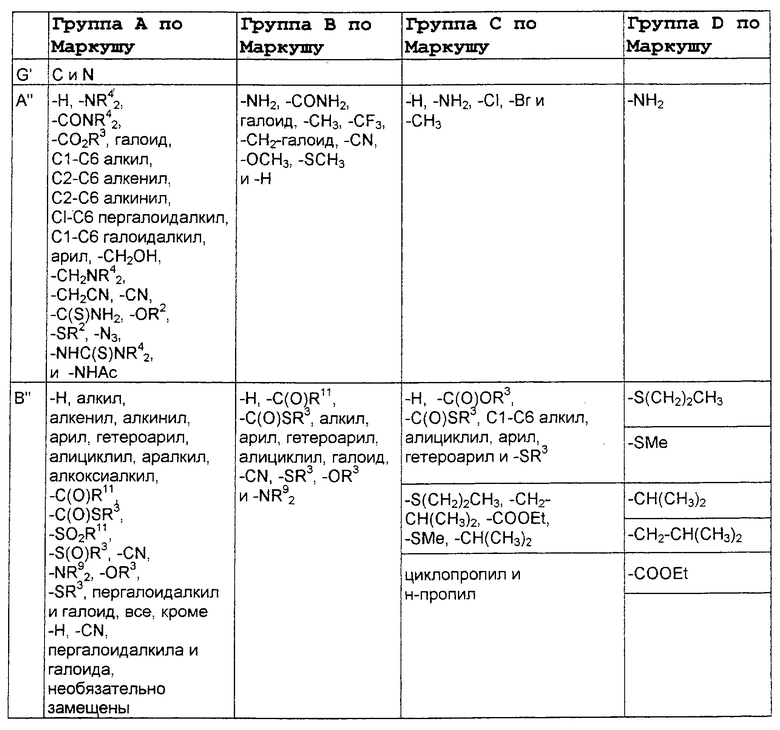
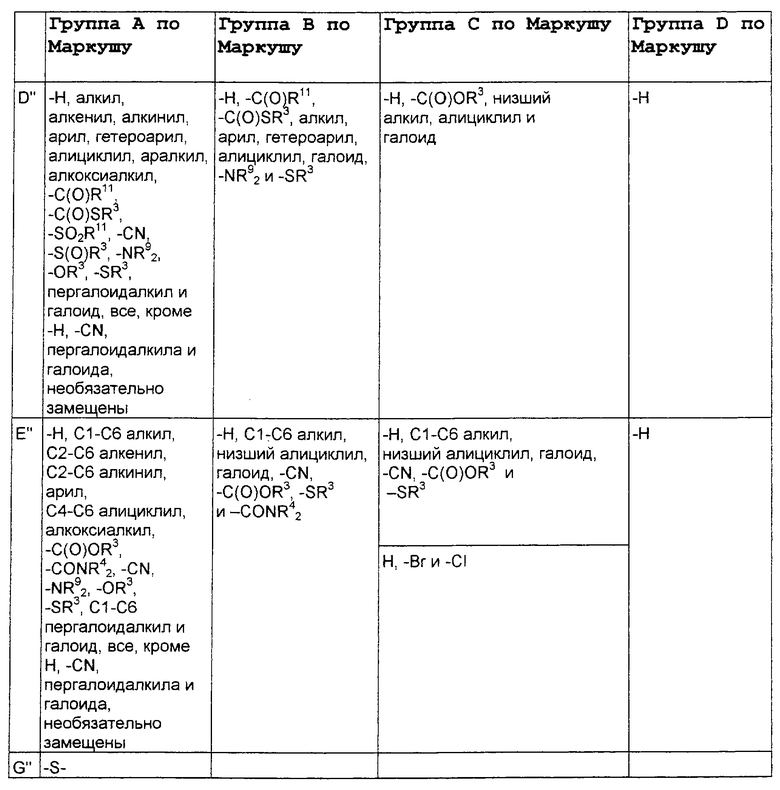
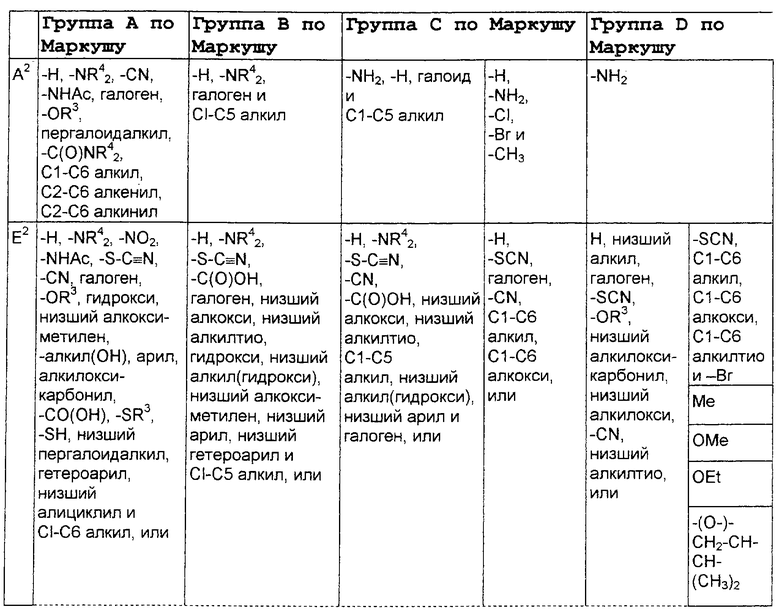
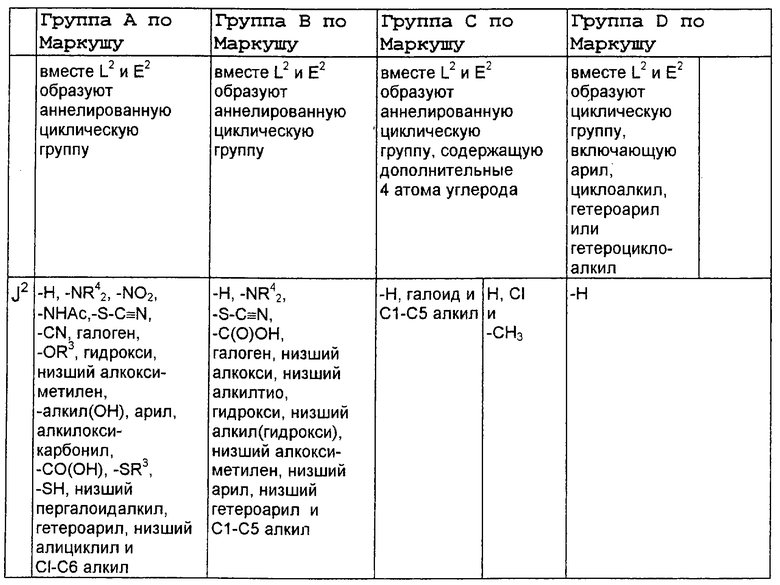
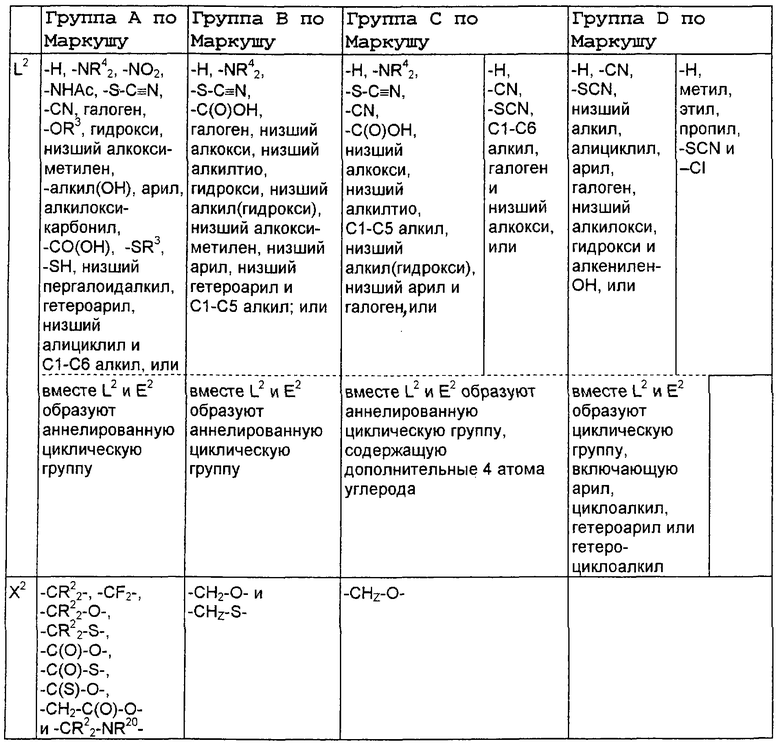
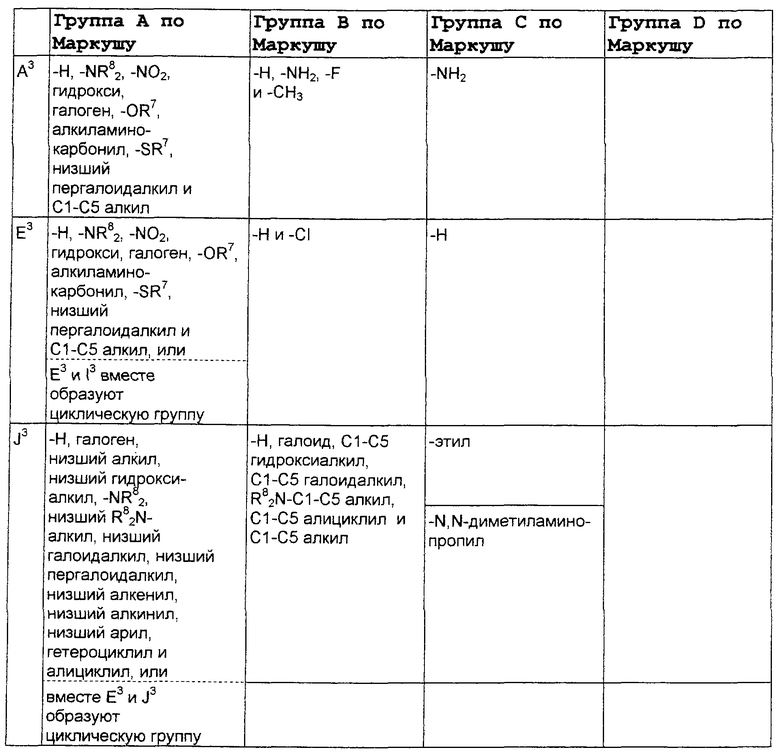
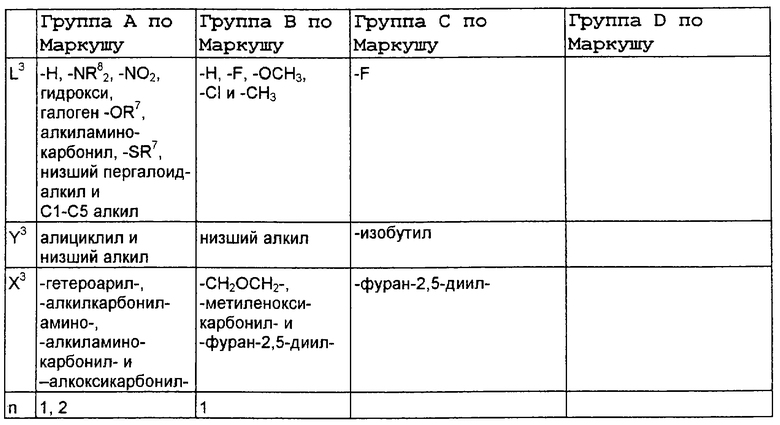
Соединения формулы IA могут иметь оральную биодоступность, по меньшей мере, 5%, а некоторые (из них) могут иметь оральную биодоступность, по меньшей мере, 10%.
Пролекарства настоящего изобретения могут иметь две изомерные формы по отношению к фосфору. В одном аспекте соединения изобретения не являются хиральными при фосфоре. В другом аспекте нет хирального центра в аминогруппах, присоединенных к фосфору. Пролекарства настоящего изобретения могут иметь изомеры при углероде, замещенном R12 и R13. Изобретение рассматривает смеси изомеров, а также индивидуальные стереоизомеры. Например, когда n равно 1 и R12 представляет H, углерод, связанный с R12 и R13, может иметь стереохимию R. В другом аспекте, когда n равно 1 и R12 представляет -H, углерод, связанный с R12 и R13, может иметь стереохимию S.
Настоящее изобретение включает соединения, определенные нижеследующими формулами: формула i, формула ii и формула iii, и они представлены в Таблице 1 в закодированном виде.
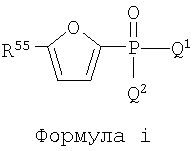
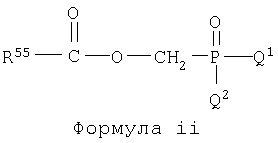
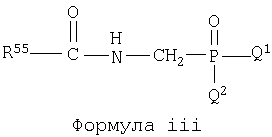
В приведенных выше формулах i, ii и iii R55 может быть замещен А и В. Соединения формул i, ii и iii указаны в Таблице 1 при помощи цифр, приписываемых R55, А, В, Q1 и Q2 в приведенных выше формулах i, ii и iii в соответствии со следующим условием;
Q1.Q2.R55.В.А. Для каждой части структуры, приписанные цифре, представлены в нижеследующих таблицах для R55, А, В, Q1 и Q2.
Переменная R55 подразделяется на две группы, причем каждая представлена четырьмя различными структурами.
Соединения формул i, ii и iii закодированы в Таблице 1, где частям R55 приписаны следующие цифры.
Группа 1:

Группа 2:
Частям А приписаны следующие цифры:
Частям В приписаны следующие цифры:
Переменные Q1 и Q2 подразделяются на три группы, причем каждая представлена восемью различными заместителями. Частям Q1 и Q2 приписаны следующие цифры.
Группа 1:
Q1 и Q2
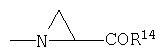
1. -NH-CH2-C(O)R14
2. -NH-СН(СН3)-С(O)R14
3. -NH-С(СН3)2-С(O)R14
4. -NH-С(СН3)2СН2-С(O)R14
5. -NH-СН(СН(СН3)2))-С(O)R14
6. -NH-CH(CH2(СН(СН3)2)))-С(О)R14
7. -NH-СН(СН2СН2SCH3)-С(O)R14
8. -NH-CH(CH2SCH2Ph)-C(O)R14
Группа 2:
Q1 и Q2
1. -NH-CH2CH2-C(О)R14
2. -NH-CH(CH2CH2COR14)-C(O)R14
3. -NH-CH(CH2COR14)-C(O)R14
4. -NH-CH(CH2CONH2)-C(O)R14
5. -NH-CH(COR14)CH2-C(O)R14
6. -NH-CH(CH2OR21)-C(O)R14
7. -NH-CH(CH2CH2COR14)-C(O)R14
8. NH-CH(CH2OH)-C(O)R14
Группа 3:
Q1 и Q2
1. -NH-CH(CH2-C6H5OH)-С(O)R14
2. -NH-С(циклопропил)-С(O)R14
3. -NH-С(циклопентил)-С(O)R14
4. -NH-С(циклогексил)-С(O)R14
5. -NH-CH(CH2Ph)-C(O)R14
6. -N(CH3)-CH2-C(O)R14
7. 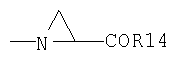
8. -NR22R23
где R14 выбран из группы, состоящей из ОМе, OEt, OBn, О-изоPr, O-неопентила, O-тBu, O-нPr, OPh, -N(Ме)2, оксиэтилен-N-морфолино, SMe, SEt; R21 представляет метил, этил, бензил и пропил; R22 представляет Н, Me, Et, Bn, Pr и Ph; R23 представляет Me, Et, Bn, Pr и Ph или R22 и R23 представляют морфолинил и пирролидинил.
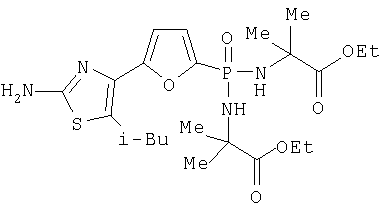
Таким образом, соединение 3.3.1.2.1 в группе 1 соответствует структуре, представленной ниже для формулы i:
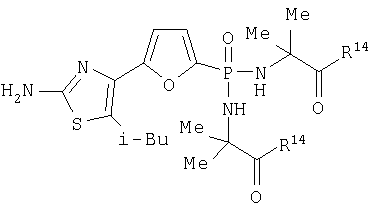
и когда R14 представляет этокси, соединение должно иметь следующую структуру:
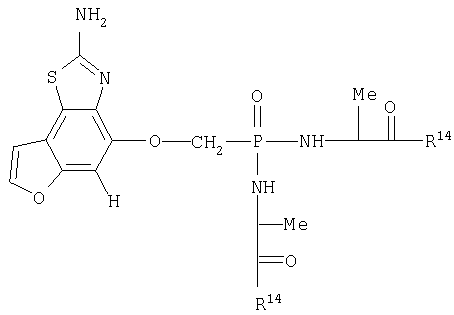
Цифры, обозначенные в Таблице 1, относятся также к соединениям бензотиазола и бензоксазола формулы X. Данные соединения представлены формулами iv и v.
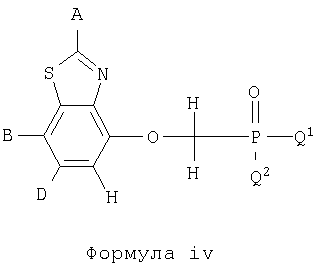
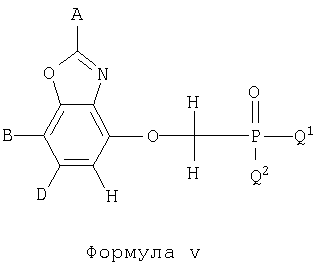
Соединения формул iv и v указаны в Таблице 1 при помощи цифр, приписываемых А, В, D, Q1 и Q2 в приведенных выше формулах iv и v в соответствии со следующим условием:
Q1.Q2.A.B.D. Для каждой части структуры, приписанные цифре, представлены в нижеследующих таблицах для А, В, D, Q1 и Q2.
Переменные Q1 и Q2 подразделяются на три группы, причем каждая представлена восемью различными заместителями.
Группа 1:
Частям Q1 и Q2 приписаны следующие цифры:
Q1 и Q2
1. -NH-CH2-C(O)R14
2. -NH-СН(CH3)-С(O)R14
3. -NH-С(CH3)2-С(O)R14
4. -NH-С(CH3)2СН2-С(O)R14
5. -NH-CH(CH(CH3)2))-C(O)R14
6. -NH-СН(СН2(СН(CH3)2)))-C(O)R14
7. -NH-СН(СН2СН2SCH3)-С(O)R14
8. -NH-CH(CH2SCH2Ph)-C(O)R14
Группа 2:
Q1 и Q2
1. -NH-CH2CH2-C(O)R14
2. -NH-CH(CH2CH2COR14)-С(О)R14
3. -NH-CH(CH2COR14)-C(O)R14
4. -NH-CH(CH2CONH2)-C(O)R14
5. -NH-OH(COR14)CH2-C(O)R14
6. -NH-CH(CH2OR21)-C(O)R14
7. -NH-CH(CH2CH2COR14)-С(O)R14
8. -NH-CH(CH2OH)-C(O)R14
Группа 3:
Q1 и Q2
1. -NH-CH(CH2-CH5OH)-C(O)R14
2. -NH-С(циклопропил)-C(O)R14
3. -NH-С(циклопентил)-С(O)R14
4. -NH-С(циклогексил)-С(O)R14
5. -NH-CH(CH2Ph)-C(O)R14
6. -N(СН3)-СН2-С(O)R14
7. 
8. -NR22R23
Переменная В подразделяется на три группы, причем каждая представлена восемью различными заместителями.
Группа 1:
Частям В приписаны следующие цифры:
Группа 2:
Группа 3:
Группа 3 для переменной В может быть объединена только с переменной Группы 3 для D.
Переменная D подразделяется на девять групп, причем каждая представлена четырьмя различными заместителями.
Группа 1:
Группа 2:
Переменная D заменяется частями, приписываемыми к следующим цифрам:
Группа 3:
Группа 4:
Группа 5:
Группа 6:
Группа 7:
Группа 8:
Группа 9:
Соединения формул iv и v закодированы в Таблице 1, где частям А приписаны следующие цифры:
где R14 выбран из групп, состоящих из ОМе, OEt, OBn, O-тBu, O-нPr, OPh, O-неопентила, -N(Me)2, оксиэтилен-N-морфолино, SMe, SEt; R21 представляет метил, этил, бензил и пропил; R22 представляет Н, Me, Et, Bn, Pr и Ph и R23 представляет Me, Et, Bn, Pr и Ph или R22 и R23 представляют морфолинил и пирролидинил.
Таким образом, соединение 2.2.1.7.4 из Группы 1 для В, D, Q1 и Q2 соответствует структуре, представленной ниже для формулы iv
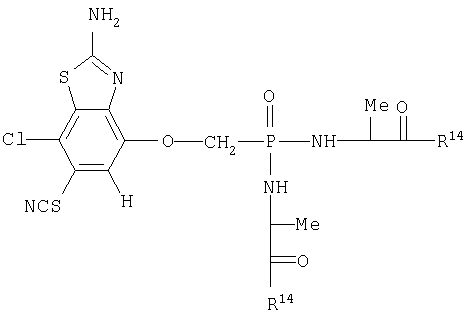
и когда R14 представляет этокси, структура должна иметь вид
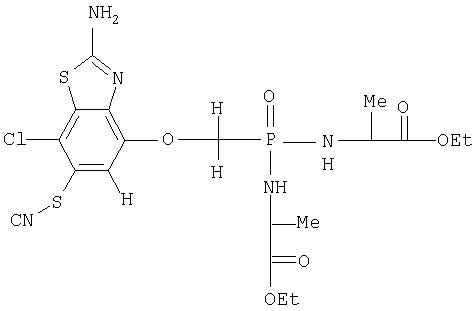
Аналогично в группе 3 для переменной В соединение 2.2.1.7.4 соответствует структуре, представленной ниже для формулы iv
и когда R14 представляет этокси, структура должна иметь вид
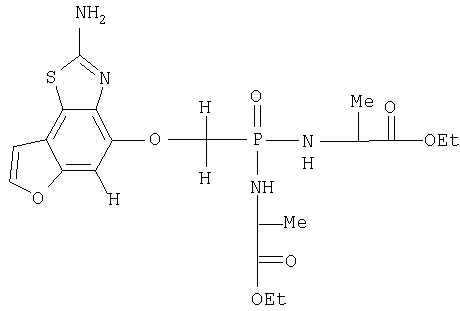

























Наилучший способ осуществления изобретения связан с соединениями под номерами примеров 50.6, 50.9, 50.15 и 50.20.
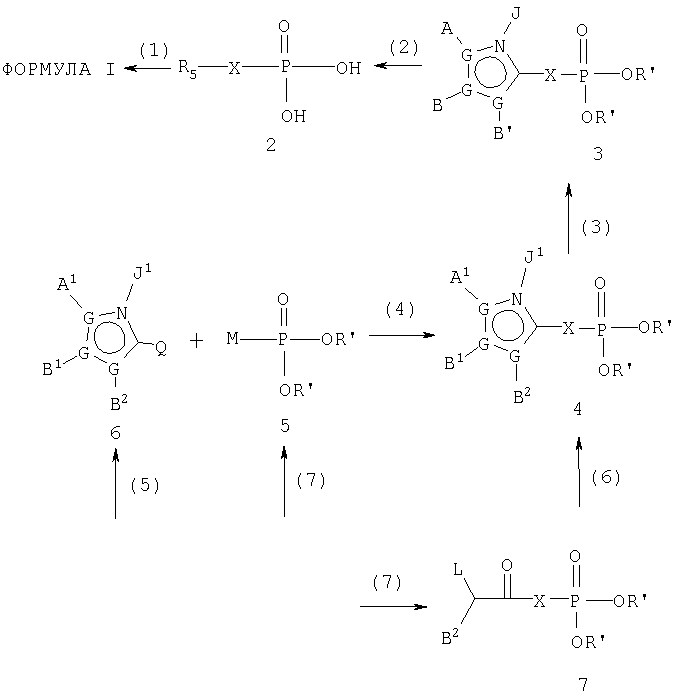
Раздел 1. Синтез соединений формулы I.
Синтез соединений, охватываемых настоящим изобретением, обычно включает некоторые или все из нижеследующих общих стадий: (1) получение фосфонатного пролекарства; (2) снятие защиты с фосфонатного сложного эфира; (3) модификация гетероцикла; (4) взаимодействие гетероцикла с фосфонатным компонентом; (5) образование гетероцикла; (6) замыкание кольца с целью образования гетероцикла с присутствующей фосфонатной частью и (7) получение полезных промежуточных соединений. Указанные стадии представлены на нижеследующей схеме для соединений формулы I, где R5 представляет 5-членное гетероароматическое кольцо. Соединения формулы I, где R5 представляет 6-членное гетероароматическое кольцо или другие гетероароматические кольца, получают аналогичным образом.
(1) Получение бисамидатного фосфоната
Общий синтез бис-фосфороамидатных пролекарств
В общем, бис-фосфороамидаты формулы I, где как -NR15R16, так и -N(R18)-(CR12R13)n-C(O)-R14 представляют остатки одной и той же аминокислоты, можно получить из активированных фосфонатов, например дихлорфосфоната, путем сочетания сложного эфира аминокислоты, например этилового эфира глицина, в присутствии или в отсутствие основания, например N-метилимидазола. Реакционноспособные дихлоридаты можно получить из соответствующей фосфоновой кислоты и хлорирующего агента, например тионилхлорида (Starrett et al., J.Med. Chem., 1994, 1857), оксалилхлорида (Stowell et al., Tetrahedron Lett., 1990, 31, 3261) или пентахлорида фосфора (Quast et al., Synthesis, 1974, 450). Кроме того, данные дихлоридаты можно получить из их соответствующих дисилиловых сложных эфиров (Bhongle et al., Synth. Commun., 1987, 7, 1071) и диалкиловых сложных эфиров (Still et al., Tetrahedron Lett., 1983, 24, 4405; Patois et al., Bull. Soc. Chim, Fr., 1993, 130, 485).
Альтернативно указанные бис-фосфороамидаты можно получить путем взаимодействия соответствующей фосфоновой кислоты со сложным эфиром аминокислоты, например этиловым эфиром глицина, в присутствии PPh3 и 2,2'-дипиридилдисульфида в пиридине, как изложено в международной публикации WO 95/07920 или Mukaiyama, Т. et al., J. Am. Chem. Soc., 1972, 94, 8528.
Синтез смешанных бис-фосфороамидатов формулы I, где -NR15R16 и -N(R18)-(CR12R13)nC(O)-R14 представляют сложные эфиры различных аминокислот или комбинацию сложного эфира аминокислоты и замещенного амина, можно получить непосредственным превращением через дихлоридат, как описано выше (последовательное добавление) с последующей очисткой желаемого продукта (например, колоночной хроматографией). Альтернативно указанные несимметричные бис-фосфороамидаты можно получить, исходя из соответствующего фосфонатного моноэфира, такого как фениловый сложный эфир или бензиловый сложный эфир, получая смешанный фосфоноамидный сложный эфир через хлоридат, с последующим гидролизом сложного эфира в условиях, где амидная связь устойчива. Полученный моноамид можно превратить в смешанный бисамид конденсацией со вторым сложным аминоэфиром или замещенным амином через хлоридат, как описано выше. Синтез таких сложных моноэфиров можно осуществить, используя опубликованный способ (ЕР 481214).
(2) Снятие защиты с фосфонатного сложного эфира
Соединения формулы 2 можно получить из фосфонатных сложных эфиров, используя известные условия расщепления фосфатных и фосфонатных сложных эфиров. Силилгалогениды обычно используют для расщепления различных фосфонатных сложных эфиров, и последующий гидролиз в мягких условиях полученных силилфосфонатных сложных эфиров дает требуемые фосфоновые кислоты. При необходимости для синтеза кислотных лабильных соединений можно использовать акцепторы кислоты (например, 1,1,1,3,3,3-гексаметилдисилазан, 2,6-лутидин и т.д.). Такие силилгалогениды включают хлортриметилсилан (Rabinowitz, J.Qrg. Chem., 1963, 28: 2975), бромтриметилсилан (McKenna et al., Tetrahedron Lett., 1977, 155) и иодтриметилсилан (Blackburn et al., J.Chem. Soc., Chem. Commun., 1978, 870). Альтернативно фосфонатные сложные эфиры могут быть расщеплены в сильно кислых условиях (например, HBr или HCl: Moffatt et al. Патент США 3524846, 1970). Помимо этого, указанные сложные эфиры могут быть расщеплены через дихлорфосфонаты, полученные обработкой сложных эфиров галогенирующими агентами (например, пентахлоридом фосфора, тионилхлоридом, BBr3: Pelchowicz et al., J.Chem. Soc., 1961, 238) с последующим гидролизом в воде с получением фосфоновых кислот. Ариловые и бензиловые фосфонатные сложные эфиры могут расщепляться в условиях гидрогенолиза (Lejczak et al., Synthesis, 1982, 412; Elliott et al., J.Med. Chem., 1985, 28: 1208; Baddiley et al., Nature, 1953, 171: 76) или в условиях восстановления в присутствии металла (Shafer et al., J.Am. Chem. Soc., 1977, 99: 5118). Кроме того, для расщепления различных фосфонатных сложных эфиров были использованы электрохимические условия (Shono et al., J.Org. Chem., 1979, 44: 4508) и пиролиз (Gupta et al., Synth. Commun., 1980, 20: 299).
(3) Модификация присутствующего гетероцикла
Синтез гетероциклов, входящих в состав раскрываемых в описании соединений, был тщательно исследован и изложен в многочисленных обзорах (см. раздел 4). Несмотря на преимущество, заключающееся в наличии требуемых заместителей в данных гетероциклах до синтеза соединений формулы 4, в некоторых случаях, требуемые заместители оказываются несовместимыми с последующими реакциями, и поэтому требуются модификации существующего гетероцикла в конце синтетической схемы с использованием обычной химии (Larock, Comprehensive organic transformations, VCH, New York, 1989; Trost, Comprehensive organic synthesis; Pergamon press, New York, 1991). Например, соединения формулы I, где А, А" или В представляют галоид или цианогруппу, можно получить из соответствующей аминогруппы превращением в диазониевую группу и реакцией с различными солями меди (I) (например, CuI, CuBr, CuCl, CuCN). Кроме того, галоиды можно ввести непосредственным галогенированием различных гетероциклов. Например, 5-незамещенные-2-аминотиазолы можно превратить в 2-амино-5-галоидтиазолы, используя различные реагенты (например, NIS, NBS, NCS). Кроме того, гетероарилгалогениды являются полезными промежуточными соединениями и часто легко превращаются в другие заместители (такие как А, А", В, В", С", D, D", E и E") путем реакций сочетания в присутствии переходного металла, таких как реакции Suzuki, Heck или Stille (Farina et al., Organic Reactions, Vol. 50; Wiley, New York, 1997; Mitchell, Synthesis, 1992, 808; Suzuki, Pure App. Chem., 1991, 63, 419; Heck Palladium Reagents in Organic Synthesis; Academic Press: San Diego, 1985). Соединения формулы I, где А представляет карбамоильную группу, могут быть образованы из их соответствующих алкиловых карбоксилатных сложных эфиров через аминолиз различными аминами, а для синтеза соединений формулы I, где А представляет -СН2OH группу или -СН2-галоидгруппу, используют обычные реакции, позволяющие модифицировать функциональную группу алкиловых карбоксилатных эфиров. Реакции замещения галоидгетероциклов (например, 2-бромтиазола, 5-бромтиазола) различными нуклеофилами (например, HSMe, НОМе и т.д.) представляют другой способ введения заместителей, таких как А, А", В и В". Например, замещение 2-хлортиазола метантиолом приводит к получению соответствующего 2-метилтиотиазола.
Предполагается, что, в случае необходимости, можно легко осуществить алкилирование атомов азота в гетероциклах (например, имидазолах, 1,2,4-триазолах и 1,2,3,4-тетразолах), используя, например, стандартные реакции алкилирования (алкилгалогенидом, аралкилгалогенидом, алкилсульфонатом али аралкилсульфонатом) или реакции Mitsunobu (спиртом).
(4) Взаимодействие гетероцикла с фосфонатным компонентом (когда соединения, раскрытые в настоящем изобретении, получают путем синтетического преобразования, вызывающего сочетание гетероцикла с компонентом фосфонатного диэфира).
В частности, для синтеза соединений формулы I подходят реакции сочетания, катализируемые переходным металлом, такие как реакции Stille или Suzuki. Реакции сочетания между гетероарилгалогенидом или трифлатом (например, 2-бромпиридином) и М-РО3R', где М представляет 2-(5-трибутилстаннил)фуранильную или 2-(5-боронил)фуранильную группу, в условиях реакции, катализируемой палладием (Farina et al., Organic Reactions, Vol. 50; Wiley, New York, 1997; Mitchell, Synthesis, 1992, 808; Suzuki, Pure App. Chem., 1991, 63, 419), дают соединения формулы I, где Х представляет фуран-2,5-диильную группу. Предполагается, что природа участников сочетания для данных реакций может быть реверсируема (например, сочетание триалкилстаннил- или боронилгетероциклов с галоид-Х-Р(O) (O-алкил)2). Кроме того, сообщается о реакциях сочетания между органостаннанами и алкенилгалогенидом или алкилтрифлатом, которые могут быть использованы для получения соединений формулы I, где Х представляет алкенильную группу. Реакцию Heck можно использовать для получения соединений формулы I, где Х представляет алкенильную группу (Heck Palladium Reagents in Organic Synthesis; Academic Press: San Diego, 1985). В частности, указанные реакции подходят для синтеза различной гетероароматики, как R5, для соединений формулы I, при условии доступности различных галогенированных гетероциклов, и указанные выше реакции, в частности, пригодны для параллельного синтеза (например, комбинаторного синтеза на твердой фазе (Bunin, В.A., The Combinatorial Index; Academic Press: San Diego, 1998) или в растворимой фазе (Flynn, D.L. et al., Curr. Op. Drug. Disc. Dev., 1998, 1, 1367)) для создания крупномасштабных комбинаторных библиотек. Например, этил-5-иод-2-фуранилфосфонат можно связать с полимером Wang в условиях, подходящих для реакции сочетания. Затем связанный с полимером 5-иод-2-[5-(О-этил-О-Wang's полимер)фосфоно]фуран можно подвергнуть реакциям Suzuki и Stille, катализируемым переходным металлом (как описано выше) с органоборанами и органооловом параллельным способом, с целью получения библиотек соединений формулы 3, где Х представляет фуран-2,5-диил.
Реакции замещения пригодны для сочетания гетероцикла с компонентом фосфонатного диэфира. Например, хлорангидрид циануровой кислоты может быть замещен диалкилмеркаптоалкилфосфонатами или диалкиламиноалкилфосфонатами с получением соединений формулы I, где R5 представляет 1,3,5-триазин, Х представляет алкилтио- или алкиламиногруппу. Кроме того, для сочетания гетероцикла с компонентом фосфонатного диэфира можно использовать реакции алкилирования. Например, гетероароматический тиол (например, 1,3,4-тиадиазол-2-тиол) можно алкилировать производным диалкилметилфосфоната (например, ICH2P(O)(OEt)2, TsOCH2P(O)(OEt)2, TfOCH2P(O)(OEt)2) с получением соединений формулы I, где Х представляет алкилтиогруппу. В другом аспекте реакции алкилирования гетероароматической карбоновой кислоты (например, тиазол-4-карбоновой кислоты) производным диалкилметилфосфоната (например, ICH2P(O)(OEt)2, TsOCH2P(O)(OEt)2, TfOCH2P(O)(OEt)2) приводят к получению соединений формулы I, где Х представляет алкоксикарбонильную группу, в то время как реакции алкилирования гетероароматической тиокарбоновой кислоты (например, тиазол-4-тиокарбоновой кислоты) производным диалкилметилфосфоната (например, ICH2P(O)(OEt)2, TsOCH2P(O)(OEt)2, TfOCH2P(O)(OEt)2) приводят к получению соединений формулы I, где Х представляет алкилтиокарбонильную группу. Замещения галоидалкилгетероциклов (например, 4-галоидалкилтиазола) нуклеофилами, содержащими фосфонатную группу (диэтилгидроксиметилфосфонат), используют для получения соединений формулы I, где Х представляет алкоксиалкильную или алкилтиоалкильную группу. Например, соединения формулы I, где Х представляет -СН2OCH2-группу, можно получить из 2-хлорметилпиридина или 4-хлорметилтиазола с использованием диалкилгидроксиметилфосфоната и подходящего основания (например, гидрида натрия). Возможно обращение природы нуклеофилов и электрофилов для реакций замещения, т.е. галоидалкил- и/или сульфонилалкилфосфонатные сложные эфиры можно подвергнуть реакции замещения гетероциклами, содержащими нуклеофил (например, 2-гидроксиалкилпиридин, 2-меркаптоалкилпиридин или 4-гидроксиалкилоксазол).
Кроме того, можно использовать известные реакции образования амидной связи (например, способ с использованием ацилгалогенида, способ смешанных ангидридов, карбодиимидный способ) для сочетания гетероароматической карбоновой кислоты с компонентом фосфонатного диэфира, что приводит к получению соединений формулы I, где Х представляет алкиламинокарбонильную или алкоксикарбонильную группу. Например, реакции сочетания тиазол-4-карбоновой кислоты с диалкиламиноалкилфосфонатом или диалкилгидроксиалкилфосфонатом приводят к получению соединений формулы I, где R5 представляет тиазол и Х представляет алкиламинокарбонильную или алкоксикарбонильную группу. Альтернативно можно реверсировать природу взаимодействующих реагентов, чтобы получить соединения формулы I, где Х представляет алкилкарбониламиногруппу. Например, в указанных реакционных условиях 2-аминотиазолы можно подвергнуть сочетанию с (RO)2Р(O)-алкил-CO2Н (например, диэтилфосфоноуксусной кислотой) с получением соединений формулы I, где R5 представляет тиазол и Х представляет алкилкарбониламиногруппу. Указанные выше реакции, кроме того, можно использовать для параллельного синтеза библиотек соединений посредством комбинаторной химии на твердой фазе или в растворимой фазе. Например,
HOCH2P(O)(OEt) (O-полимер),
H2NCH2P(O)(OEt) (O-полимер) и
НООССН2Р(O)(OEt) (O-полимер) (полученные с использованием известных способов) можно подвергнуть сочетанию с различными гетероциклами, используя указанные выше реакции, чтобы получить библиотеки соединений формулы 3, где Х представляет -С(O)ОСН2-, или -C(O)NHCH2-, или NHC(O)CH2-.
Можно также использовать реакции перегруппировки для получения соединений настоящего изобретения. Например, перегруппировка по Куртиусу тиазол-4-карбоновой кислоты в присутствии диалкилгидроксиалкилфосфоната или диалкиламиноалкилфосфоната приводит к получению соединений формулы I, где Х представляет алкиламинокарбониламино- или алкоксикарбониламиногруппу. Указанные выше реакции могут быть также адаптированы для комбинаторного синтеза различных библиотек соединений формулы 3. Например, реакции перегруппировки по Куртиусу между гетероциклической карбоновой кислотой и HOCH2P(O)(OEt) (O-полимер)ом или H2NCH2P(O)(OEt) (О-полимер)ом могут привести к получению библиотек соединений формулы I, где Х представляет -NHC(O)OCH2- или NHC(O)NHCH2-.
В случае соединений формулы I, где Х представляет алкильную группу, фосфонатную группу можно ввести, используя другие обычные способы образования фосфоната, такие как реакция Михаэлиса-Арбузова (Bhattacharya et al., Chem. Rev., 1981, 81: 415), реакция Михаэлиса-Беккера (Blackburn et al., J.Organomet. Chem., 1988, 348: 55), и реакции присоединения фосфора к электрофилу (такому как альдегиды, кетоны, ацилгалогениды, имины и другие карбонильные производные).
Фосфонатный компонент можно также ввести через реакции введения лития. Например, введение лития в 2-этинилпиридин с использованием подходящего основания, с последующим улавливанием образованного таким образом аниона диалкилхлорфосфонатом приводит к получению соединений формулы I, где R5 представляет пиридил, Х представляет 1-(2-фосфоно)этинильную группу.
(5) Образование гетероцикла
Хотя для синтеза соединений формулы I используют имеющиеся гетероциклы, при необходимости, можно также создать гетероциклы в результате взаимодействия, которые обеспечат соединения изобретения. В литературе было описано получение гетероциклов с использованием ряда условий реакций (Joule et al., Heterocyclic Chemistry; Chapman hall, London, 1995; Boger, Weinreb, Hetero Diels-Alder Methodology In Organic Synthesis; Academic press, San Diego, 1987; Padwa, 1,3-Dipolar Cycloaddltlon Chemistry; Wiley, New York, 1984; Katritzsky et al., Comprehensive Heterocyclic Chemistry; Pergamon press, Oxford; Newkome et al., Contemporary Heterocyclic Chemistry: Syntheses, Reaction and Applications; Wiley, New York, 1982; Syntheses of Heterocyclic Compounds; Consultants Bureau, New York). Некоторые из способов, которые используют для получения соединений настоящего изобретения, приведены в качестве примеров в нижеследующем обсуждении.
(i) Образование тиазолсодержащей кольцевой системы
Тиазолы, используемые для настоящего изобретения, легко получить, используя ряд основательно описанных реакций с образованием кольца (Metzger, Thiazole and Its derivatives, part 1 and part 2; Wiley & Sons, New York, 1979). В частности, для создания тиазолсодержащей кольцевой системы используют реакции циклизации тиоамидов (таких как тиоацетамид, тиомочевина) и альфа-галоидкарбонильных соединений (таких как альфа-галоидкетоны, альфа-галоидальдегиды). Например, реакции циклизации между тиомочевиной и 5-диэтилфосфоно-2-[(2-бром-1-оксо)алкил]фуранами используют для синтеза соединений формулы I, где R5 представляет тиазол, А представляет аминогруппу и Х представляет фуран-2,5-диильную группу; реакция циклизации между тиомочевиной и бромпируваталкиловым эфиром дает 2-амино-4-алкоксикарбонилтиазол, который используют для получения соединений формулы I, где R5 представляет тиазол и Х представляет алкиламинокарбонильную, алоксикарбонильную, алкиламинокарбониламино- или алкоксикарбониламиногруппу. Тиоамиды можно получить, используя реакции, описанные в литературе (Trost, Comprehensive organic synthesis. Vol. 6; Pergamon press, New York, 1991, pages 419-434), a альфа-галоидкарбонильные соединения легко доступны с использованием обычных реакций (Larock, Comprehensive organic transformations, VCH, New York, 1989). Например, амиды можно превратить в тиоамиды, используя реагент Лавессона или P2S5, и кетоны можно прогалогенировать с использованием различных галогенирующих реагентов (например, NBS, CuBr2).
(ii) Образование оксазолсодержащей кольцевой системы
Оксазолы, используемые для настоящего изобретения, можно получить, используя различные способы, описанные в литературе (Turchi, Oxazoles; Wiley & Sons, New York, 1986). Для создания оксазолсодержащих кольцевых систем можно использовать реакции между изоцианидами (например, тозилметилизоцианидом) и карбонильными соединениями (например, альдегидами и хлорангидридами карбоновых кислот) (van Leusen et al., Tetrahedron Lett., 1972, 2369). Альтернативно реакции циклизации амидов (например, мочевины, карбоксамидов) и альфа-галоидкарбонильных соединений обычно используют для образования оксазолсодержащей кольцевой системы. Например, реакции мочевины и 5-диэтилфосфоно-2-[(-2-бром-1-оксо)алкил]фуранов используют для синтеза соединений формулы I, где R5 представляет оксазол, А представляет аминогруппу и фуран-2,5-диильную группу. Для образования оксазолсодержащей кольцевой системы также используют реакции между аминами и имидатами (Meyers et al., J.Org. Chem., 1986, 51 (26), 5111).
(iii) Образование пиридинсодержащей кольцевой системы
Пиридины, используемые для синтеза соединений формулы I, можно получить, используя различные известные синтетические способы (Klingsberg, Pyridine and Its Derivatives; Interscience Publishers, New York, 1960-1984). 1,5-Дикарбонильные соединения или их эквиваленты могут быть подвергнуты взаимодействию с аммиаком или соединениями, которые могут образовывать аммиак, с получением 1,4-дигидропиридинов, которые легко дегидрируются до пиридинов. Когда ненасыщенные 1,5-дикарбонильные соединения или их эквиваленты (например, ионы пирилия) используют для взаимодействия с аммиаком, пиридины можно получить непосредственно. 1,5-Дикарбонильные соединения или их эквиваленты можно получить с использованием обычной химии. Например, 1,5-дикетоны доступны через ряд путей, таких как присоединение по Михаэлю енолята к енону (или предшественнику основания Манниха (Gill et al., J.Am. Chem. Soc., 1952, 74, 4923)), озонолиз предшественника циклопентена или реакция силилсодержащих енольных эфиров с 3-метоксиаллиловыми спиртами (Duhamel et al., Tetrahedron, 1986, 42, 4777). Когда один из карбонильных углеродов находится в состоянии кислотного окисления, тогда данный тип реакции обеспечивает 2-пиридоны, которые можно легко превратить в 2-галоидпиридины (Isler et al., Helv. Chim. Acta, 1955, 38, 1033) или 2-аминопиридины (Vorbruggen et al., Chem. Ber., 1984, 117, 1523). Альтернативно пиридин можно получить из альдегида, 1,3-дикарбонильного соединения и аммиака путем классического синтеза Ганча (Bossart et al., Angew. Chem. Int. Ed. Engl., 1981, 20, 762). Реакции 1,3-дикарбонильных соединений (или их эквивалентов) с 3-аминоенонами или 3-аминонитрилами были использованы для получения пиридинов (такие как синтез Guareschi, Mariella, Org. Synth., Coll, Vol. IV, 1963, 210). 1,3-Дикарбонильные соединения можно получить реакциями окисления соответствующих 1,3-диолов или продуктов реакции альдольной конденсации (Mukaiyama, Org. Reactions, 1982, 28, 203). Для синтеза пиридинов были также использованы реакции циклоприсоединения, например реакции циклоприсоединения между оксазолами и алкенами (Naito et al., Chem. Pharm. Bull, 1965, 13, 869) и реакции Дильса-Альдера между 1,2,4-триазинами и енаминами (Boger et al., J. Org. Chem., 1981, 46, 2179).
(iv) Образование пиримидинсодержащей кольцевой системы
Пиримидинсодержащие кольцевые системы, используемые для синтеза соединений формулы I, легко доступны (Brown, The pyrimidines; Wiley, New York, 1994). Один способ синтеза пиримидина включает сочетание 1,-3-дикарбонильного компонента (или его эквивалента) с фрагментом N-C-N. Выбор компонента N-C-N - мочевины (Sherman et al., Org. Synth., Coll. Vol. IV, 1963, 247), амидина (Kenner et al., J.Chem. Soc., 1943, 125) или гуанидина (Burgess, J.Org. Chem., 1956, 21, 97; VanAllan, Org. Synth., Coll. Vol. IV, 1963, 245) определяет замещение при С-2 в продуктах пиримидина. Данный способ, в частности, используют для синтеза соединений формулы I с различными А группами. В другом способе пиримидины можно получить реакциями циклоприсоединения, такими как реакции аза-Дильса-Альдера между 1,3,5-триазином и енамином или инамином (Boger et al., J.Org. Chem., 1992, 57, 4331 и приведенные там ссылки).
(v) Образование имидазолсодержащей кольцевой системы
Имидазолы, используемые для синтеза соединений формулы I, легко получают, используя целый ряд различных синтетических методов. Чтобы синтезировать имидазолы, используют различные реакции циклизации, такие как реакции между амидинами и альфа-галоидкетонами (Mallick et al., J.Am. Chem. Soc., 1984, 106 (23), 7252) или альфа-гидроксикетонами (Shi et al., Synthetic Comm., 1993, 23 (18), 2623), реакции между мочевиной и альфа-галоидкетонами и реакции между альдегидами и 1,2-дикарбонильными соединениями в присутствии аминов.
(vi) Образование изоксазолсодержащей кольцевой системы
Изоксазолы, используемые для синтеза соединений формулы I, легко синтезируют, используя различные методы (как, например, реакции циклоприсоединения между нитрилоксидами и алкинами или активными метиленовыми соединениями, оксимирование 1,3-дикарбонильных соединений или альфа,бета-ацетиленовых карбонильных соединений, или альфа,бета-дигалоидкарбонильных соединений и т.д.), и их можно использовать для синтеза оксазолсодержащей кольцевой системы (Grunanger et al., Isoxazoles; Wiley & Sons, New York, 1991). Например, реакции между алкинами и 5-диэтилфосфоно-2-хлороксимидофураном в присутствии основания (например, триэтиламина, основания Hunig's, пиридина) используют для синтеза соединений формулы I, где R5 представляет изоксазол и Х представляет фуран-2,5-диильную группу.
(vii) Образование пиразолсодержащей кольцевой системы
Пиразолы, используемые для синтеза соединений формулы I, легко получают, используя ряд способов (Wiley, Pyrazoles, Pyrazolines, Pyrazolidlnes, Jndazoies, and Condensed Rings; Interscience Publishers, New York, 1967), таких как реакции между гидразинами и 1,3-дикарбонильными соединениями или 1,3-дикарбонильными эквивалентами (например, одна из карбонильных групп заблокирована как енамин или кеталь, или ацеталь), и реакции присоединения гидразинов к акрилонитрилам с последующими реакциями циклизации (Dom et al., Org. Synth., 1973, Coll. Vol. V, 39). Реакцию 2-(2-алкил-3-N,N-диметиламино)акрилоил-5-диэтилфосфонофуранов с гидразинами используют для синтеза соединений формулы I, где R5 представляет пиразол, Х представляет фуран-2,5-диильную группу и В" представляет алкильную группу.
(viii) Образование 1,2,4-триазолсодержащей кольцевой системы
1,2,4-Триазолы, используемые для синтеза соединений формулы I, легко доступны благодаря различным методам (Montgomery, 1,2,4-Triazoles; Wiley, New York, 1981). Например, для синтеза 1,2,4-триазолов используют реакции между гидразинами и имидатами или тиоимидатами (Sui et al., Bioorg. Med. Chem. Lett., 1998, 8, 1929; Catarzi et al., J.Med. Chem., 1995, 38(2), 2196), реакции между 1,3,5-триазином и гидразинами (Grundmann et al., J.Org. Chem., 1956, 21, 1037) и реакции между аминогуанидином и сложными эфирами карбоновых кислот (Ried et al., Chem. Ber., 1968, 101, 2117).
(6) Замыкание кольца для образования гетероцикла с фосфонатом
Соединения формулы 4 также можно получить, используя реакцию замыкания кольца, чтобы создать гетероцикл из предшественников, которые содержат фосфонатный компонент. Например, реакции циклизации между тиомочевиной и 5-диэтилфосфоно-2-[(2-бром-1-оксо)алкил]фуранами используют для синтеза соединений формулы I, где R5 представляет тиазол, А представляет аминогруппу и Х представляет фуран-2,5-диильную группу. Оксазолы настоящего изобретения можно также получить, используя реакцию замыкания кольца. В этом случае реакции мочевины и 5-диэтилфосфоно-2-[(2-бром-1-оксо)алкил]фуранов используют для синтеза соединений формулы I, где R5 представляет оксазол, А представляет аминогруппу и X представляет фуран-2,5-диильную группу. Реакции между 5-диэтилфосфоно-2-фуральдегидом, алкиламином, 1,2-дикетоном и ацетатом аммония используют для синтеза соединений формулы I, где R5 представляет имидазол и Х представляет фуран-2,5-диильную группу. Указанные типы реакций замыкания кольца можно также использовать для синтеза пиридинов или пиримидинов, используемых в настоящем изобретении. Например, реакция 5-диэтилфосфоно-2-[3-диметиламино-2-алкил)акрилоил]фуранов и цианоацетамида в присутствии основания дает 5-алкил-3-циано-6-[2-(5-диэтилфосфоно)фуранил]-2-пиридоны (Jain et al., Tetrahedron Lett., 1995, 36, 3307). Последующее превращение указанных 2-пиридонов в соответствующие 2-галоидпиридины (см. ссылки, цитируемые в разделе 3 для модификаций гетероциклов) может привести к соединениям формулы I, где R5 представляет пиридин, А представляет группу галоида, Х представляет фуран-2,5-диильную группу и В представляет алкильную группу. Реакция 5-диэтилфосфоно-2-[3-диметиламино-2-алкил)акрилоил]фуранов и амидинов в присутствии основания дает 5-алкил-6-[2-(5-диэтилфосфоно)фуранил]пиримидины, которые могут привести к соединениям формулы I, где R5 представляет пиримидин, Х представляет фуран-2,5-диильную группу и В представляет алкильную группу.
(7) Получение различных предшественников, используемых для реакций циклизации
Промежуточные соединения, необходимые для синтеза соединений настоящего изобретения, обычно получают, используя либо имеющийся в литературе способ, либо модификацию известного способа. Синтезы некоторых промежуточных соединений, используемых для синтеза соединений настоящего изобретения, изложены в данном описании.
В частности, для синтеза соединений формулы I используют различные арилфосфонатные диалкиловые эфиры. Например, соединения формулы I, где Х представляет фуран-2,5-диильную группу, можно получить из целого ряда предшественников фуранила. Предполагается, что синтез других предшественников может протекать через некоторые или все из указанных стадий реакций и что для получения различных предшественников может возникнуть необходимость внесения изменений в эти реакции. 5-Диалкилфосфоно-2-фуранкарбонильные соединения (например, 5-диэтилфосфоно-2-фуральдегид, 5-диэтилфосфоно-2-ацетилфуран) подходят для синтеза соединений формулы I, где Х представляет фуран-2,5-диильную группу. Данные промежуточные соединения получают из фурана или производных фурана с использованием обычной химии, такой как реакции введения лития, защита карбонильных групп и снятие защиты с карбонильных групп. Например, введение лития в фуран с использованием известных способов (Gschwend Org. React., 1979, 26: 1) с последующим введением фосфорилирующих агентов (например, ClPO3R2) обеспечивает 2-диалкилфосфонофураны (например, 2-диэтилфосфонофуран). Данный способ можно также применить к 2-замещенному фурану (например, 2-фуранкарбоновой кислоте), чтобы получить 5-диалкилфосфоно-2-замещённый фуран (например, 5-диэтилфосфоно-2-фуранкарбоновую кислоту). Предполагается, что другие арилфосфонатные эфиры можно получить, используя такой подход или его модификацию. Альтернативно для получения арилфосфонатов используют другие способы, такие как реакции арилгалогенидов или трифлатов, катализируемые переходным металлом (Balthazar et al., J.Org. Chem., 1980, 45: 5425; Petrakis et al., J.Am. Chem. Soc., 1987, 109: 2831; Lu et al., Synthesis, 1987, 726). Арилфосфонатные сложные эфиры можно также получить из арилфосфатов в условиях реакции анионной перегруппировки (Melvin, Tetrahedron Lett., 1981, 22; 3375; Casteel et al., Synthesis, 1991, 691). Соли N-алкоксиарила с производными диалкилфосфоната щелочного металла обеспечивают другой общий синтез гетероарил-2-фосфонатных сложных эфиров (Redmore J.Org. Chem., 1970, 35: 4114).
Вторую стадию введения лития можно использовать для включения второй группы в арилфосфонатный диалкиловый сложный эфир, такой как альдегидная группа, триалкилстаннил- или галоидная группа, хотя с таким же успехом для введения указанных функциональностей (например, альдегидов) могут предполагаться и другие известные способы (например, реакция Вильсмайера-Хаака или реакция Раймера-Тимана для синтеза альдегида). На второй стадии введения лития ароматическое кольцо с введенным литием обрабатывают реагентами, которые либо непосредственно образуют требуемую функциональную группу (например, для альдегида, используя-ДМФ, HCO2R и т.д.), либо обрабатывают реагентами, которые приводят к образованию группы, которую в дальнейшем превращают в требуемую функциональную группу с использованием известной химии (например, спирты, сложные эфиры, нитрилы, алкены могут быть превращены в альдегиды). Например, введение лития в 2-диалкилфосфонофуран (например, 2-диэтилфосфонофуран) в нормальных условиях (например, LDA в ТГФ) с последующим улавливанием образованного таким образом аниона электрофилом (например, хлоридом или иодом трибутилолова) обеспечивает 5-функционализированный-2-диалкилфосфонофуран (например, 5-трибутилстаннил-2-диэтилфосфонофуран или 5-иод-2-диэтилфосфонофуран). Кроме того, предполагается, что последовательность данных реакций может быть реверсирована, т.е. сначала может быть введена альдегидная часть, а затем следует реакция фосфорилирования. Порядок проведения реакций обычно зависит от условий реакций и от защитных групп. Подразумевается также, что до фосфорилирования некоторые из указанных функциональных групп могут быть подвергнуты защите с использованием целого ряда общеизвестных способов (например, защита альдегидов в виде ацеталей, аминалей; защита кетонов в виде кеталей). После фосфорилирования защищенную функциональную группу деблокируют (Protective groups in Organic Synthesis, Greene, T.W., 1991, Wiley, New York). Например, защита 2-фуранальдегида в виде 1,3-пропандиолацеталя с последующей стадией введения лития (используя, например, LDA), улавливанием аниона диалкилхлорфосфатом (например, диэтилхлорфосфатом) и последующим снятием защиты с альдегида (в виде ацетальной функциональной группы) в нормальных условиях снятия защиты обеспечивает 5-диалкилфосфоно-2-фуральдегид (например, 5-диэтилфосфоно-2-фуральдегид). Другим примером является получение 5-кето-2-диалкилфосфонофуранов, которое включает следующие стадии: ацилирование фурана в условиях реакции Фриделя-Крафтса дает 2-кетофуран, последующая защита кетона в виде кеталей (например, 1,3-пропандиол-циклический кеталь) с последующей стадией введения лития, описанной выше, дает 5-диалкилфосфоно-2-фуранкетон, причем кетон является защищенным в виде 1,3-пропандиолциклического кеталя, и, наконец, снятие защиты с кетона (в виде кеталя), например, в кислых условиях дает 2-кето-5-диалкилфосфонофураны (например, 2-ацетил-5-диэтилфосфонофуран). Альтернативно 2-кетофураны можно синтезировать с использованием реакции, катализируемой палладием, между 2-триалкилстаннилфуранами (например, 2-трибутилстаннилфураном) и ацилхлоридом (например, ацетилхлоридом, изобутирилхлоридом). Фосфонатная часть может присутствовать в 2-триалкилстаннилфуранах (например, 2-трибутилстаннил-5-диэтилфосфонофуране).
2-Кето-5-диалкилфосфонофураны можно также получить из 5-диалкилфосфоно-2-фуранкарбоновой кислоты (например, 5-диэтилфосфоно-2-фуранкарбоновой кислоты) превращением кислоты в соответствующий ацилхлорид и с последующим добавлением реактива Гриньяра.
Кроме того, некоторые из описанных выше промежуточных соединений можно использовать для синтеза других полезных промежуточных соединений. Например, 2-кето-5-диалкилфосфонофуран может быть в дальнейшем превращен в 1,3-дикарбонильное производное, которое используют для получения пиразолов, пиридинов или пиримидинов. Реакция 2-кето-5-диалкилфосфонофурана (например, 2-ацетил-5-диэтилфосфонофурана) с диалкилацеталем диалкилформамида (например, диметилацеталем диметилформамида) дает 1,3-дикарбонильный эквивалент, как, например, 2-(3-диалкиламино-2-алкилакрилоил)-5-диалкилфосфонофуран (например, 2-(3-диметиламиноакрилоил-5-диэтилфосфонофуран).
Предполагается, что изложенные выше способы синтеза производных фурана могут быть либо непосредственно, либо с некоторыми изменениями применены к синтезу различных других полезных промежуточных соединений, таких как арилфосфонатные сложные эфиры (например, тиенилфосфонатные сложные эфиры, фенилфосфонатные сложные эфиры или пиридилфосфонатные сложные эфиры).
Понятно, что в случае осуществления адаптации изложенных выше синтетических способов для параллельного синтеза либо на твердой фазе, либо в растворе, чтобы обеспечить быстрое исследование взаимосвязи CAB (SAR) (взаимосвязь структура-активность) для ингибиторов ФБФазы, охватываемых настоящим изобретением, усовершенствование рассматриваемого способа для данных реакций окажется успешным.
Раздел 2. Синтез соединений формулы Х.
Синтез соединений, охватываемых настоящим изобретением, обычно включает некоторые или все из представленных ниже общих стадий: (1) получение фосфонатного пролекарства; (2) снятие защиты с фосфонатного сложного эфира; (3) образование гетероцикла; (4) введение фосфонатного компонента; (5) синтез производного анилина. Стадия (1) и стадия (2) были обсуждены в разделе 1, а рассмотрение стадии (3), стадии (4) и стадии (5) приводится ниже. Данные способы обычно применимы к соединениям формулы X.
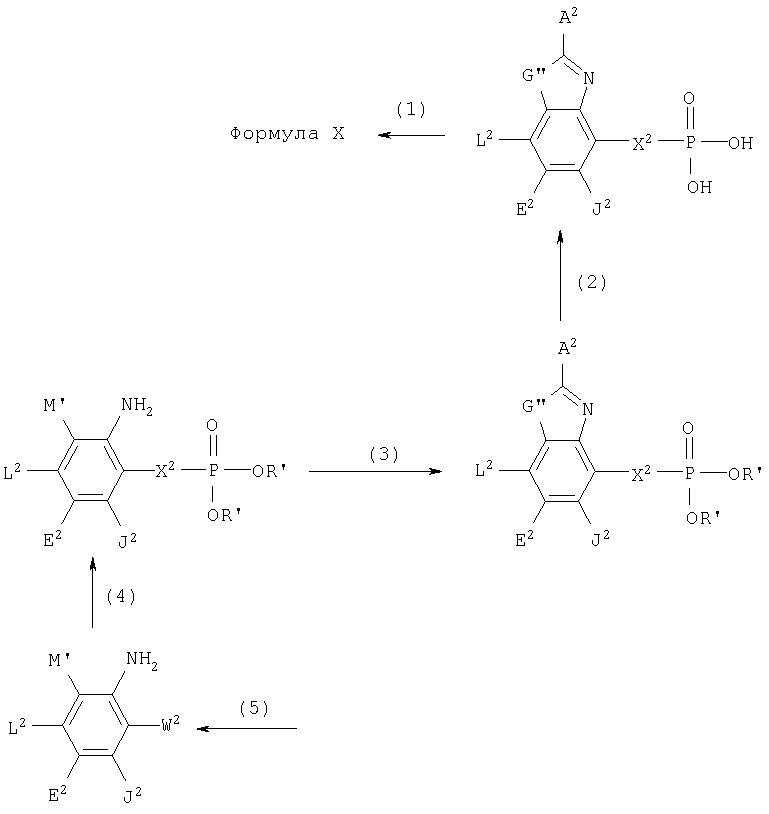
(3) Образование гетероцикла
(i) Бензотиазолсодержащая кольцевая система
Соединения формулы 3, где G"=S, т.е. бензотиазолы, можно получить, используя различные синтетические способы, описанные в литературе. Два из этих способов представлены в виде примеров, изложенных ниже. Один способ представляет собой модификацию коммерчески доступных производных бензотиазола с целью получения соответствующей функциональности на кольце бензотиазола. Другой способ заключается в аннелировании различных анилинов (например, соединений формулы 4), с целью образования тиазольной части бензотиазольного кольца. Например, соединения формулы 3, где G"=S, A2=NH2, L2, Е2, J2=H, X2=CH2O и R'=Et, можно получить из коммерчески доступного 4-метокси-2-аминотиазола через двустадийную последовательность: превращение 4-метокси-2-аминобензотиазола в 4-гидрокси-2-аминобензотиазол с реагентами, такими как BBr3 (Node, M. et al., J.Org. Chem. 45, 2243-2246, 1980) или AlCl3 в присутствии тиола (например, EtSH) (McOmie, J.F.W. et al., Org. Synth, Collect. Vol. V, 422, 1973) с последующим алкилированием фенольной группы диэтилфосфонометилтрифторметилсульфонатом (Phillion, D.P. et al., Tetrahedron Lett. 27, 1477-1484, 1986) в присутствии подходящего основания (например, NaH) в полярных апротонных растворителях (например, ДМФ) обеспечивает требуемое соединение.
Можно использовать несколько способов для превращения различных анилинов в бензотиазолы (Sprague, J.M; Land, A.H. Heterocycle. Compel. 5, 506-13, 1957). Например, 2-аминобензотиазолы (формула 3, где A=NH2) можно получить аннелированием соединений формулы 4, где W2=H, используя различные общие способы. Один способ включает обработку соответствующим образом замещенного анилина смесью KSCN и CuSO4 в метаноле с получением замещенного 2-аминобензотиазола (Ismail, I.A.; Sharp, D.E; Chedekel, M.R., J.Org. Chem. 45, 2243-2246, (1980). Альтернативно 2-аминобензотиазол можно также получить обработкой Br2 в присутствии KSCN в уксусной кислоте (Patil, D.G.; Chedekel, M.R., J.Org. Chem. 49, 997-1000, 1984). Данная реакция может быть выполнена в две стадии. Например, обработка замещенных фенилтиомочевин Br2 в CHCl3 дает замещенные 2-аминобензотиазолы (Patil, D.G., Chedekel, M.R., J.Org. Chem. 49, 997-1000 (1984). 2-Аминобензотиазолы можно также получить конденсацией орто-иоданилинов с тиомочевиной в присутствии Ni-катализатора (NiCl2(PPh3)2). (Takagi, К. Chem. Lett. 265-266, 1986).
Бензотиазолы можно подвергнуть электрофильному ароматическому замещению с получением 6-замещенных бензотиазолов (Sprague, J.M.; Land, A.H. Heterocycle. Compel. 5, 606-13, 1957). Например, бромирование соединения формулы 3, где G"=S, А2=NH2, L2, E2, J2=H, X2=CH2O и R'=Et бромом в полярных растворителях, таких как АсОН, дает соединение формулы 3, где Е2=Br.
Кроме того, соединения формулы 3, где А представляет галоид, Н, алкокси, алкилтио или алкил, можно получить из соответствующего аминосоединения (Larock, Comprehensive organic transformations, VCH, New York, 1989; Trost, Comprehensive organic synthesis; Pergamon press. New York, 1991).
(ii) Бензоксазолы
Соединения формулы 3, где G"=О, т.е. бензоксазолы, можно получить циклизацией орто-аминофенолов с подходящим реагентом, например галоидцианом (A=NH2; Alt, К. О. et al., J. Heterocyclic Chem. 12, 775, 1975) или уксусной кислотой (А=СН3; Saa, J. M.; J. Org. Chem. 57, 589-594, 1992), или триалкилортоформиатом (А=Н; Org. Prep. Proced, Int., 22, 613, 1990)).
(4) Введение фосфонатного компонента
Соединения формулы 4 (где X2=CH2O и R'=алкил) можно получить различными путями (например, используя алкилирование и реакции нуклеофильного замещения). Обычно соединения формулы 5, где М'=ОН, обрабатывают подходящим основанием (например, NaH) в полярном апротонном растворителе (например, ДМФ, ДМСО) и полученный феноксидный анион может быть алкилирован подходящим электрофилом, часто присутствующим фосфонатным компонентом (например, диэтилиодметилфосфонатом, диэтилтрифторметилсульфонометилфосфонатом, диэтил-п-метилтолуолсульфонометилфосфонатом). Способ алкилирования можно также применять к соединениям предшественника, соединениям формулы 5, где присутствует фенольная часть, и их можно алкилировать компонентом, содержащим фосфонат. Альтернативно соединения формулы 4 можно также получить путем реакции нуклеофильного замещения в соединениях предшественников, соединениях формулы 5, где галоидная группа, например фтор или хлор, присутствует в орто-положении к нитрогруппе. Например, соединение формулы 4 (где Х2=СН2О и R'=Et) можно получить из производного 2-хлор-1-нитробензола обработкой NaOCH2P(O) (OEt)2 в ДМФ. Аналогично можно получить соединения формулы 4, где Х2=-алкил-S- или -алкил-N-.
(5) Синтез производного анилина
Различные синтетические способы опубликованы для синтеза производных анилина, и данные способы могут быть применены для синтеза полезных промежуточных соединений, которые могут привести к получению соединений формулы X. Например, различные алкенильные или арильные группы можно ввести в бензольное кольцо с помощью реакций, катализируемых переходным металлом (Kasibhatla, S. R. et al., WO 98/39343 и ссылки, цитируемые там); анилины можно получить из их соответствующих нитропроизводных при помощи реакций восстановления (например, реакции гидрирования в присутствии 10% Pd/C или реакции восстановления с использованием SnCl2 в HCl (Patil, D.G.; Chedekel, M. R., J Org. Chem. 49, 997-1000, 1984)).
Раздел 3. Синтез соединений формулы XI.
В международной публикации WO 98/39343 описывается синтез фосфоновых кислот и сложных эфиров бензимидазолов формулы XI.
Бисамидатные фосфонаты настоящего изобретения можно получить, используя способы, описанные выше для соединений формулы I.
Композиции
Соединения настоящего изобретения вводят перорально при суммарной суточной дозе в диапазоне от примерно 0,01 мг/кг/доза до примерно 100 мг/кг/доза и от примерно 0,1 мг/кг/доза до примерно 10 мг/кг/доза. Рассматривается использование препаратов с высвобождением в зависимости от времени, чтобы регулировать скорость высвобождения активного ингредиента. Доза может вводиться в виде нескольких разделенных доз, повторяемых через определенные промежутки времени, как удобно. Когда используют другие способы введения (например, внутривенное введение), соединения вводят в пораженную болезнью ткань при скорости от 0,05 до 10 мг/кг/час и от 0,1 до 1 мг/кг/час. Такие скорости легко поддерживаются, когда соединения вводят внутривенно, как обсуждается ниже.
Для целей данного изобретения соединения могут вводиться различными путями, включая оральный, парентеральный, ингаляционное распыление, местно или ректально, с использованием композиций, содержащих фармацевтически приемлемые носители, адъюванты и наполнители. Используемый здесь термин "парентеральный" включает подкожные, внутривенные, внутримышечные и внутриартериальные инъекции с использованием различных методов вливания. Используемая здесь внутриартериальная и внутривенная инъекция включает введение через катетеры. Обычно предпочтительно оральное введение.
Фармацевтические композиции, содержащие активный компонент, могут быть в любой форме, подходящей для предполагаемого способа введения. При использовании, например, для орального применения могут быть получены таблетки, пилюли, лепешки, водные или масляные суспензии, диспергируемые порошки или гранулы, эмульсии, твердые или мягкие капсулы, сиропы или эликсиры. Композиции, предполагаемые для орального использования, можно получить по любому способу, известному в области получения фармацевтических композиций, и такие композиции могут содержать одно или несколько средств, включая подслащивающие вещества, ароматизаторы, красители и консерванты, для того чтобы обеспечить приятный для употребления препарат. Таблетки, содержащие активный компонент в смеси с нетоксичным фармацевтически приемлемым эксципиентом, который пригоден для получения таблеток, являются приемлемыми. Такие эксципиенты могут представлять, например, инертные разбавители, такие как карбонат кальция или натрия, лактоза, фосфат кальция или натрия; гранулирующие и дезинтегрирующие средства, такие как рисовый крахмал или альгиновая кислота; связующие средства, такие как крахмал, желатин или акация, и смазки, такие как стеарат магния, стеариновая кислота или тальк. Таблетки могут быть без покрытия или могут быть с покрытием, выполненным с использованием известных методов, включая микрокапсуляцию, чтобы замедлить дезинтеграцию и абсорбцию в желудочно-кишечном тракте и тем самым обеспечить пролонгированное действие на протяжении более длительного периода времени. Например, можно использовать вещество, обеспечивающее замедленное время выделения, такое как глицерилмоностеарат или глицерилдистеарат, как таковое или вместе с воском.
Композиции для орального использования могут быть представлены в виде твердых желатиновых капсул, где активный компонент смешан с инертным твердым разбавителем, например фосфатом кальция или каолином, или в виде мягких желатиновых капсул, где активный компонент смешан с водой или масляной средой, такой как арахисовое масло, жидкий парафин или оливковое масло.
Водные суспензии изобретения содержат активные вещества в смеси с эксципиентами, подходящими для получения водных суспензий. Такие эксципиенты включают суспендирующее средство, такое как натрийкарбоксиметилцеллюлоза, метилцеллюлоза, гидроксипропилметилцеллюлоза, альгинат натрия, поливинилпирролидон, трагакантовая камедь и аравийская камедь, и диспергирующие или увлажняющие средства, такие как фосфатид природного происхождения (например, лецитин), продукт конденсации алкиленоксида с жирной кислотой (например, полиоксиэтиленстеарат), продукт конденсации этиленоксида с длинноцепочечным алифатическим спиртом (например, гептадекаэтиленоксицетанол), продукт конденсации этиленоксида с неполным сложным эфиром жирной кислоты и гекситангидрида (например, полиоксиэтиленсорбитанмоноолеат). Водная суспензия может дополнительно содержать один или несколько консервантов, таких как этил- или н-пропил-п-гидроксибензоат, один или несколько красителей, один или несколько ароматизаторов и один или несколько подслащивающих веществ, таких как сахароза или сахарин.
Масляные суспензии могут быть составлены путем суспендирования активного компонента в растительном масле, таком как арахисовое масло, оливковое масло, кунжутное масло или кокосовое масло, или в минеральном масле, таком как жидкий парафин. Оральные суспензии могут содержать загуститель, такой как пчелиный воск, твердый парафин или цетиловый спирт. Чтобы получить приятный для употребления препарат, могут быть добавлены подслащивающие вещества, такие как вещества, представленные выше, и ароматизаторы. Такие композиции могут быть консервированы путем добавления антиоксиданта, такого как аскорбиновая кислота.
Диспергируемые порошки и гранулы изобретения, подходящие для получения водной суспензии при добавлении воды, обеспечивают активный компонент в смеси с диспергирующим или увлажняющим средством, суспендирующим средством и одним или несколькими консервантами. Подходящие диспергирующие или увлажняющие средства и суспендирующие средства иллюстрируются соответствующими веществами, указанными выше. Кроме того, могут присутствовать дополнительные эксципиенты, например подслащивающие вещества, ароматизаторы и красители.
Фармацевтические композиции изобретения могут быть в форме эмульсий масло-в-воде. Масляной фазой может быть растительное масло, такое как оливковое масло или арахисовое масло, минеральное масло, такое как жидкий парафин, или смесь из указанных выше. Подходящие эмульгирующие средства включают воски природного происхождения, такие как аравийская камедь и трагакантовая камедь, фосфатиды природного происхождения, такие как соевый лецитин, сложные эфиры или неполные сложные эфиры, полученные из жирных кислот и гекситангидрида, такие как сорбитанмоноолеат, и продукты конденсации неполных сложных эфиров с этиленоксидом, такие как полиэтиленсорбитанмоноолеат. Эмульсии могут дополнительно содержать подслащивающие вещества и ароматизаторы.
Сиропы и эликсиры могут быть составлены с подслащивающими веществами, такими как глицерин, сорбит или сахароза. Такие композиции могут дополнительно содержать успокоительное средство, консервант, ароматизатор или краситель.
Фармацевтические композиции изобретения могут быть в форме стерильного инъецируемого препарата, такого как стерильная инъецируемая водная или масляная суспензия. Суспензия может быть составлена согласно известному в данной области способу с использованием тех же самых подходящих диспергирующих или увлажняющих и суспендирующих средств, которые указывались выше. Стерильный инъецируемый препарат может быть стерильным инъецируемым раствором или суспензией в нетоксичном парентерально приемлемом разбавителе или растворителе, таком как раствор в 1,3-бутандиоле, или может быть в виде лиофилизованного порошка. Среди приемлемых наполнителей и растворителей, которые могут быть использованы, можно назвать воду, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или суспендирующей среды могут быть использованы стерильные жирные (с большим содержанием жира) масла. Для этой цели можно использовать любое мягкое жирное масло, включая синтетические моно- или диглицериды. Кроме того, жирные кислоты, такие как олеиновая кислота, могут быть аналогичным образом использованы при получении инъецируемых препаратов.
Количество активного компонента, которое может быть объединено с веществом носителя, чтобы получить единичную дозированную форму, будет варьироваться в зависимости от пациента, подлежащего лечению, и конкретного способа введения. Например, композиция, высвобождаемая во времени, предполагаемая для введения через рот людям, может содержать приблизительно от 1 до 1000 мг активного компонента, компаундированнного с соответствующим и подходящим количеством вещества носителя, которое может варьироваться от примерно 5 до примерно 95% от общей массы композиций. Можно получить фармацевтическую композицию, которая обеспечивает легко измеряемые количества для введения. Например, водный раствор, предназначенный для внутривенной инфузии, должен содержать от примерно 3 до 330 мкг активного компонента на миллилитр раствора для того, чтобы могла происходить инфузия подходящего объема при скорости примерно 30 мл/час.
Как отмечалось выше, композиции настоящего изобретения, подходящие для орального введения, могут быть представлены в виде дискретных единиц, таких как капсулы, крахмальные облатки или таблетки, каждая содержащая предварительно заданное количество активного компонента; в виде порошка или гранул; в виде раствора или суспензии в воде или неводной жидкости или в виде жидкой эмульсии масло-в-воде, или жидкой эмульсии вода-в-масле. Активный компонент может вводиться в виде шарика, электуария или пасты.
Таблетка может быть получена прессованием или формованием необязательно с одним или несколькими вспомогательными компонентами. Прессованные таблетки можно получить прессованием активного компонента на подходящей машине в свободнотекущей форме, такой как порошок или гранулы, необязательно смешанного со связующим (например, повидоном, желатином, гидроксипропилметилцеллюлозой), смазкой, инертным разбавителем, консервантом, дезинтегрантом (например, натрийкрахмалгликолятом, сшитым (межмолекулярно) повидоном, сшитой натрийкарбоксиметилцеллюлозой), поверхностно-активным веществом или диспергирующим средством. Формованные таблетки могут быть получены формованием в подходящей машине смеси порошкообразного соединения, увлажненного инертным жидким разбавителем. Таблетки могут быть необязательно покрыты или снабжены зарубками и могут быть составлены таким образом, чтобы обеспечить медленное или регулируемое высвобождение активного компонента из нее с использованием, например, гидроксипропилметилцеллюлозы в изменяющихся пропорциях, чтобы обеспечить желаемый профиль высвобождения активного компонента. Таблетки могут быть необязательно снабжены энтеросолюбильным покрытием, чтобы обеспечить высвобождение по частям кишечника, а не в желудке, особенно, когда активный компонент чувствителен к кислотному гидролизу.
Композиции, подходящие для местного применения во рту, включают лепешки, содержащие активной компонент в ароматизированной основе, обычно сахарозе и акации или трагаканте; пастилки, содержащие активный компонент в инертной основе, такой как желатин и глицерин или сахароза и акация, и жидкости для промывания рта, содержащие активный компонент в подходящем жидком носителе.
Композиции для ректального введения можно получить в виде суппозитория с подходящей основой, содержащей, например, масло какао или салицилат.
Композиции, подходящие для вагинального введения, могут быть представлены в виде пессария, тампонов, кремов, гелей, паст, пен или составов для распыления, содержащих, помимо активного компонента, такие носители, которые считаются в данной области подходящими.
Композиции, подходящие для парентерального применения, включают водные и неводные изотонические стерильные растворы для инъекций, которые могут содержать антиоксиданты, буферы, бактериостатические факторы и вещества, которые делают композицию изотонической по отношению к крови предполагаемого реципиента; водные и неводные стерильные суспензии, которые могут включать суспендирующие средства и загустители. Композиции могут быть представлены в виде герметизированных контейнеров для единичной дозы или многократных доз, например ампулы и пузырьки, и могут храниться в высушенном вымораживанием (лиофилизованном) состоянии, требующем только добавления стерильного жидкого носителя, например воды для инъекций, непосредственно перед использованием. Растворы и суспензии для инъекций можно получать из стерильных порошков, гранул и таблеток представленного ранее типа.
Подходящие композиции единичной дозировки включают композиции, содержащие суточную дозу или единицу, суточную субдозу или соответствующую часть данного заявляемого соединения, ингибитора фруктозо-1,6-бисфосфатазы.
Однако следует иметь в виду, что конкретный уровень дозы для любого конкретного пациента будет зависеть от ряда факторов, включая активность конкретного используемого соединения; возраст, массу тела, общее состояние здоровья, пол и режим питания индивидуума, подлежащего лечению; время и путь введения; скорость выделения; другие лекарственные препараты, которые вводились ранее и тяжесть конкретного заболевания, подвергающегося лечению, что очевидно для специалистов в данной области.
Полезность
Один аспект изобретения относится к новым бис-фосфорамидатным пролекарствам ингибиторов ФБФазы, которые повышают оральную биодоступность исходных лекарств.
Ингибиторы ФБФазы и их пролекарства могут быть использованы для лечения сахарного диабета, снижения уровней глюкозы в крови и ингибирования глюконеогенеза.
Ингибиторы ФБФазы и их пролекарства могут быть использованы для лечения заболеваний, ассоциированных с избыточным депонированием гликогена. Чрезмерные печеночные запасы гликогена обнаружены у пациентов с некоторыми заболеваниями, ассоциированными с депонированием гликогена. Поскольку косвенный путь обмена значительно способствует синтезу гликогена (Shulman, G.I., Phys. Rev. 72:1019-1035, 1992), ингибирование косвенного пути обмена (протекание глюконеогенеза) уменьшает сверхпродуцирование гликогена.
Кроме того, ингибиторы ФБФазы и их пролекарства могут быть использованы для лечения или профилактики заболеваний, ассоциированных с повышенными уровнями инсулина. Повышенные уровни инсулина связаны с повышенным риском сердечнососудистых осложнений и атеросклерозом (Folsom et al., Stroke, 25:66-73, 1994; Howard, G. et al., Circulation, 93:1809-1817, 1996). Предполагают, что ингибиторы ФБФазы и их пролекарства уменьшают послеобеденные уровни глюкозы путем повышения поглощения глюкозы печенью. Постулируется, что такой эффект происходит у индивидуумов, которые не являются диабетиками (или пре-диабетиками, т.е. без повышенного выброса печеночной глюкозы, "в дальнейшем ВПГ (HGO)", или уровней глюкозы в крови натощак). Увеличение поглощения глюкозы печенью будет уменьшать секрецию инсулина и тем самым снижать риск заболеваний или осложнений, которые возникают от повышения уровней инсулина.
Данные аспекты более подробно изложены ниже.
ПРИМЕРЫ
1. Синтез соединений формулы IA.
Пример 1
Получение 5-диэтилфосфоно-2-фуральдегида (1)
Стадия А. Раствор диэтилацеталя 2-фуральдегида (1 ммоль) в ТГФ обрабатывают н-BuLi (1 ммоль) при -78°С. По истечении 1 ч добавляют диэтилхлорфосфат (1,2 ммоль) и реакционную смесь перемешивают в течение 40 мин. Экстракция и упаривание дают коричневое масло.
Стадия В. Полученное коричневое масло обрабатывают 80% уксусной кислотой при 90°С в течение 4 ч. Экстракция и хроматография дают соединение 1 в виде прозрачного желтого масла. Альтернативно указанный выше альдегид можно получить из фурана, как описано ниже.
Стадия С. Раствор фурана (1 ммоль) в диэтиловом эфире обрабатывают TMEDA (N,N,N',N'-тетраметилэтилендиамин) (1 ммоль) и н-BuLi (2 ммоль) при -78°С в течение 0,5 ч. В реакционную смесь добавляют диэтилхлорфосфат (1,2 ммоль) и перемешивают в течение дополнительного часа. Экстракция и дистилляция дают диэтил-2-фуранфосфонат в виде прозрачного масла.
Стадия D. Раствор диэтил-2-фуранфосфоната (1 ммоль) в TBF обрабатывают LDA (1,12 ммоль, N,N-диизопропиламид лития) при -78°С в течение 20 мин. Добавляют метилформиат (1,5 ммоль) и реакционную смесь перемешивают в течение 1 ч. Экстракция и хроматография дают соединение 1 в виде прозрачного желтого масла. Предпочтительно указанный альдегид можно получать из 2-фуральдегида, как описано ниже.
Стадия Е. Раствор 2-фуральдегид а (1 ммоль) и N,N'-диметилэтилендиамина (1 ммоль) в толуоле кипятят с обратным холодильником, при этом собирая образующуюся воду посредством ловушки Дина-Старка. По истечении 2 ч растворитель удаляют в вакууме и остаток дистиллируют, получая фуран-2-(N,N'-диметилимидазолидин) в виде прозрачного бесцветного масла (Т.к. 59-61°С/3 мм Hg).
Стадия F. Раствор фуран-2- (N,N'-диметилимидазолидина) (1 ммоль) и TMEDA (1 ммоль) в ТГФ обрабатывают н-BuLi (1,3 ммоль) при температуре от -40 до -48°С. Реакционную смесь перемешивают при 0°С в течение 1,5 ч, затем охлаждают до -55°С и обрабатывают раствором диэтилхлорфосфата (1,1 ммоль) в ТГФ. После перемешивания при 25°С в течение 12 ч реакционную смесь упаривают и подвергают экстракции, получая 5-диэтилфосфонофуран-2-(N,N'-диметилимидазолидин) в виде коричневого масла.
Стадия G. Раствор 5-диэтилфосфонофуран-2-(N,N'-диметилимидазолидина (1 ммоль) в воде обрабатывают концентрированной серной кислотой до достижения рН 1. Экстракция и хроматография дают соединение 1 в виде прозрачного желтого масла.
Пример 2
Получение 5-диэтилфосфоно-2-1-[(1-оксо)алкил]фуранов и 6-диэтилфосфоно-2-[(1-оксо)алкил]пиридинов
Стадия А. Раствор фурана (1,3 ммоль) в толуоле обрабатывают 4-метилпентановой кислотой (1 ммоль), ангидридом трифторуксусной кислоты (1,2 ммоль) и эфиратом трифторида бора (0,1 ммоль) при 56°С в течение 3,5 ч. Охлажденную реакционную смесь гасят водным бикарбонатом натрия (1,9 ммоль), фильтруют через слой целита. Экстракция, упаривание и дистилляция дают 2-[(4-метил-1-оксо)пентил]фуран в виде коричневого масла (Т.к. 65-77°С/0,1 мм Hg).
Стадия В. Раствор 2-[(4-метил-1-оксо)пентил]фурана (1 ммоль) в бензоле обрабатывают этиленгликолем (2,1 ммоль) и п-толуолсульфокислотой (0,05 ммоль) при температуре кипения с обратным холодильником в течение 60 ч, удаляя при этом воду посредством ловушки Дина-Старка. Добавляют триэтилортоформиат (0,6 ммоль) и полученную смесь кипятят с обратным холодильником в течение еще часа. Экстракция и упаривание дают 2-(2-фуранил)-2-[(3-метил)бутил]-1,3-диоксолан в виде оранжевой жидкости.
Стадия С. Раствор 2-(2-фуранил)-2-[(3-метил)бутил]-1,3-диоксолана (1 ммоль) в ТГФ обрабатывают TMEDA (1 ммоль) и н-BuLi (1,1 ммоль) при -45°С и полученную реакционную смесь перемешивают при температуре от -5 до 0°С в течение 1 ч. Полученную реакционную смесь охлаждают до -45°С и переносят с помощью канюли в раствор диэтилхлорфосфата в ТГФ при -45°С. Реакционную смесь постепенно нагревают до температуры окружающей среды на протяжении 1,25 ч. Экстракция и упаривание дают 2-[(2-(5-диэтилфосфоно)фуранил]-2-[(3-метил)бутил]-1,3-диоксолан в виде темного масла.
Стадия D. Раствор 2-[(2-(5-диэтилфосфоно)фуранил]-2-[(3-метил)бутил]-1,3-диоксолана (1 ммоль) в метаноле обрабатывают 1N хлористоводородной кислотой (0,2 ммоль) при 60°С в течение 18 ч. Экстракция и дистилляция дают 5-диэтилфосфоно-2-[(4-метил-1-оксо)пентил]фуран (2.1) в виде светло-оранжевого масла (Т.к. 152-156°С/0,1 мм Hg).
В соответствии с указанной методикой получают следующие соединения.
(2.2) 5-Диэтилфосфоно-2-ацетилфуран. Т.к. 125-136°С/0,1 мм Hg.
(2.3) 5-Диэтилфосфоно-2-[(1-оксо)бутил]фуран. Т.к. 130-145°С/0,1 мм Hg.
Альтернативно данные соединения можно получить, используя следующие методики.
Стадия Е. Раствор 2-[(4-метил-1-оксо)пентил]фурана (1 ммоль), полученный как на стадии А) в бензоле обрабатывают N,N-диметилгидразином (2,1 ммоль) и трифторуксусной кислотой (0,05 ммоль) при кипячении с обратным холодильником в течение 6 ч. Экстракция и упаривание дают N,N-диметилгидразон 2-[(4-метил-1-оксо)пентил]фурана в виде коричневой жидкости.
Стадия F. N,N-Диметилгидразон 2-[(4-метил-1-оксо)пентил]фурана подвергают обработке в соответствии со стадией С, получая N,N-диметилгидразон 2-[(4-метил-1-оксо)пентил]-5-диэтилфосфонофурана в виде коричневой жидкости, которую обрабатывают хлоридом меди (II) (1,1 эквивалента) в смеси этанол-вода при 25°С в течение 6 ч. Экстракция и дистилляция дают соединение 2.1 в виде светло-оранжевого масла.
Некоторые из 5-диэтилфосфоно-2-[(1-оксо)алкил]фуранов получают, используя следующие способы.
Стадия G. Раствор соединения 1 (1 ммоль) и 1,3-пропандитиол (1,1 ммоль) в хлороформе обрабатывают эфиратом трифторида бора (0,1 ммоль) при 25°С в течение 24 ч. Упаривание и хроматография приводят к получению 2-(2-(5-диэтилфосфоно)фуранил)-1,3-дитиана в виде светло-желтого масла.
Раствор 2-(2-(5-диэтилфосфоно)фуранил)-1,3-дитиана (1 ммоль) в ТГФ охлаждают до -78°С и обрабатывают н-BuLi (1,2 ммоль). По истечении 1 ч при -78°С реакционную смесь обрабатывают циклопропанметилбромидом и реакционную смесь перемешивают при -78°С в течение еще часа. Экстракция и хроматография дают 2-(2-(5-диэтилфосфоно)фуранил)-2-циклопропанметил-1,3-дитиан в виде масла.
Раствор 2-(2-(5-диэтилфосфоно)фуранил)-2-циклопропанметил-1,3-дитиана (1 ммоль) в смеси ацетонитрил-вода обрабатывают [бис(трифтороацетокси)иодо]бензолом (2 ммоль) при 25°С в течение 24 ч. Экстракция и хроматография дают 5-диэтилфосфоно-2-(2-циклопропилацетил)фуран в виде светло-оранжевого масла.
В соответствии с указанной методикой получают следующие соединения.
(2.4) 5-Диэтилфосфоно-2-(2-этоксикарбонилацетил)фуран.
(2.5) 5-Диэтилфосфоно-2-(2-метилтиоацетил)фуран.
(2.6) 6-Диэтилфосфоно-2-ацетилпиридин.
Пример 3
Получение 4-[2-(5-фосфоно)фуранил]тиазолов, 4-[2-(6-фосфоно)пиридил]тиазолов и 4-[2-(5-фосфоно)фуранил]селеназолов
Стадия А. Раствор соединения 2.1 (1 ммоль) обрабатывают бромидом меди (II) (2,2 ммоль) при кипячении с обратным холодильником в течение 3 ч. Охлажденную реакционную смесь фильтруют и фильтрат упаривают досуха. Полученное темное масло очищают хроматографией, получая 5-диэтилфосфоно-2-[(2-бром-4-метил-1-оксо)пентил]фуран в виде оранжевого масла.
Стадия В. Раствор 5-диэтилфосфоно-2-[(2-бром-4-метил-1-оксо)пентил]фурана (1 ммоль) и тиомочевины (2 ммоль) в этаноле кипятят с обратным холодильником в течение 2 ч. Охлажденную реакционную смесь упаривают досуха и полученную желтую пену суспендируют в насыщенном водном растворе бикарбоната натрия (рН=8). Полученное желтое твердое вещество собирают фильтрованием, получая 2-амино-5-изобутил-4-[2-(5-диэтилфосфоно)фуранил]тиазол.
Стадия С. Раствор 2-амино-5-изобутил-4-[2-(5-диэтилфосфоно)фуранил]тиазола (1 ммоль) в метиленхлориде обрабатывают бромтриметилсиланом (10 ммоль) при 25°С в течение 8 ч. Реакционную смесь упаривают досуха и остаток суспендируют в воде. Полученное твердое вещество собирают фильтрованием, получая 2-амино-5-изобутил-4-[2-(5-фосфоно)фуранил]тиазол (3.1) в виде не совсем белого твердого вещества. Т.пл. > 250°С.
Анализ для C11H15N2O4PS+1,25HBr:
В соответствии с указанными выше методиками или в некоторых случаях с минимальными их изменениями, используя обычные химические реакции, получают следующие соединения.
(3.2) 2-Метил-5-изобутил-4-[2-(5-фосфоно)фуранил]тиазол.
Анализ для C12H16NO4PS+HBr+0,1CH2Cl2:
(3.3) 4-[2-(5-Фосфоно)фуранил]тиазол.
Анализ для C7H6NO4PS+0,65HBr:
(3.4) 2-Метил-4-[2-(5-фосфоно)фуранил]тиазол. Т.пл. 235-236°С.
Анализ для С8Н8NO4PS+0,25Н2О:
(3.5) 2-Фенил-5-изобутил-4-[2-(5-фосфоно)фуранил]тиазол.
Анализ для C17H18NO4PS+HBr:
(3.6) 2-Изопропил-4-[2-(5-фосфоно)фуранил]тиазол. Т.пл. 194-197°С.
Анализ для C10H12NO4PS:
(3.7) 5-Изобутил-4-[2-(5-фосфоно)фуранил]тиазол. Т.пл. 164-166°С.
Анализ для C11H14NO4PS:
(3.8) 2-Аминотиокарбонил-4-[2-(5-фосфоно)фуранил]тиазол. Т.пл. 189-191°С.
Анализ для С8Н7Н2O4PS2:
(3.9) 2-(1-Пиперидил)-5-изобутил-4-[2-(5-фосфоно)фуранил]тиазол.
Анализ для C16H23N2O4PS+1,3HBr:
(3.10) 2-(2-Тиенил)-5-изобутил-4-[2-(5-фосфоно)фуранил] тиазол.
Анализ для C15H16NO4PS2+0,75Н2О:
(3.11) 2-(3-Пиридил)-5-изобутил-4-[2-(5-фосфоно)фуранил]тиазол.
Анализ для C16H17N2O4PS+3,75HBr:
(3.12) 2-Ацетамидо-5-изобутил-4-[2-(5-фосфоно)фуранил]тиазол. Т.пл. 179-181°С.
Анализ для C13H17N2O5PS+0,25Н2O:
(3.13) 2-Амино-4-[2-(5-фосфоно)фуранил]тиазол.
Анализ для C7H7N2O4PS:
(3.14) 2-Метиламино-5-изобутил-4-[2-(5-фосфоно)фуранил]тиазол. Т.пл. 202-205°С.
Анализ для C12H17N2O4PS+0,5Н2O:
(3.15) 2-(N-Амино-N-метил)амино-5-изобутил-4-[2-(5-фосфоно)фуранил]тиазол. Т.пл. 179-181°С.
Анализ для C12H18N3O4PS+1,25HBr:
(3.16) 2-Амино-5-метил-4-[2-(5-фосфоно)фуранил]тиазол. Т.пл. 200-220°С.
Анализ для C8H9N2O4PS+0,65HBr:
(3.17) 2, 5-Диметил-4-[2-(5-фосфоно)фуранил]тиазол. Т.пл. 195°С (разл.).
Анализ для C9H10NO4PS+0,7HBr:
(3.18) 2-Аминотиокарбонил-5-изобутил-4-[2-(5-фосфоно)фуранил]тиазол.
Анализ для C12H15N2O4PS2+0,1HBr+0,3EtOAc:
(3.19) 2-Этоксикарбонил-4-[2-(5-фосфоно)фуранил]тиазол. Т.пл. 163-165°С.
Анализ для C10H10NO6PS+0,5Н2O:
(3.20) 2-Амино-5-изопропил-4-[2-(5-фосфоно)фуранил]тиазол.
Анализ для C10H13N2O4PS+1HBr:
(3.21) 2-Амино-5-этил-4-[2-(5-фосфоно)фуранил]тиазол. Т.пл. > 250°С.
Анализ для С9Н11N2O4PS:
(3.22) 2-Цианометил-4-[2-(5-фосфоно)фуранил]тиазол. Т.пл. 204-206°С.
Анализ для C9H7N2O4PS:
(3.23) 2-Аминотиокарбониламино-5-изобутил-4-[2-(5-фосфоно)фуранил]тиазол. Т.пл. 177-182°С.
Анализ для C12H16N3O4PS2+0,2 гексан + 0,3HBr:
(3.24) 2-Амино-5-пропил-4-[2-(5-фосфоно)фуранил]тиазол. Т.пл. 235-237°С.
Анализ для C10H13N2O4PS+0,3Н2O:
(3.25) 2-Амино-5-этоксикарбонил-4-[2-(5-фосфоно)фуранил]тиазол. Т.пл. 248-250°С.
Анализ для C10H11N2O6PS+0,1HBr:
(3.26) 2-Амино-5-метилтио-4-[2-(5-фосфоно)фуранил]тиазол. Т.пл. 181-184°С.
Анализ для C8H9N2O4PS2+0,4H2O:
(3.27) 2-Амино-5-циклопропил-4-[2-(5-фосфоно)фуранил]тиазол.
Анализ для C10H11N2O4PS+1H2O+0,75 HBr:
(3.28) 2-Амино-5-метансульфинил-4-[2-(5-фосфоно)фуранил]тиазол. Т.пл. > 250°С.
Анализ для C8H9N2O5PS2+0,35NaCl:
(3.29) 2-Амино-5-бензилоксикарбонил-4-[2-(5-фосфоно)фуранил]тиазол.
Анализ для C15H13N2O6PS+0,2H2O:
(3.30) 2-Амино-5-циклобутил-4-[2-(5-фосфоно)фуранил]тиазол.
Анализ для C11H13N2O4PS+0,15HBr+0,15Н2O:
(3.31) Гидробромид 2-амино-5-циклопропил-4-[2-(5-фосфоно)фуранил]тиазола.
Анализ для С10Н11N2O4PSBr+0,73HBr+0,15МеОН+0,5H2O:
(3.32) Дигидробромид 2-амино-5-[(N,N-диметил)аминометил]-4-[2-(5-фосфоно)фуранил]тиазола.
Анализ для С10Н16N3O4Br2PS+0,8CH2Cl2:
(3.33) 2-Амино-5-метоксикарбонил-4-[2-(5-фосфоно)фуранил]тиазол. Т.пл. 227°С (разл.).
Анализ для C9H9N2O6PS+0,1Н2O+0,2HBr:
(3.34) 2-Амино-5-этилтиокарбонил-4-[2-(5-фосфоно)фуранил]тиазол. Т.пл. 245°С (разл.).
Анализ для C10H11N2O5PS2:
(3.35) 2-Амино-5-пропилоксикарбонил-4-[2-(5-фосфоно)фуранил]тиазол. Т.пл. 245°С (разл.).
Анализ для C11H13N2O6PS:
(3.36) 2-Амино-5-бензил-4-[2-(5-фосфоно)фуранил]тиазол.
Анализ для C14H13N2O4PS+Н2O:
(3.37) Дигидробромид 2-амино-5-[(N,N-диэтил)аминометил]-4-[2-(5-фосфоно)фуранил]тиазола.
Анализ для C12H20N3O4Br2PS+0,1HBr+1,4МеОН:
(3.38) 2-Амино-5-[(N,N-диметил)карбамоил]-4-[2-(5-фосфоно)фуранил]тиазол.
Анализ для С10Н12N3O5PS+1,3HBr+1,0Н2O+0,3 ацетон:
(3.39) 2-Амино-5-карбоксил-4-[2-(5-фосфоно)фуранил]тиазол.
Анализ для C8H7N2O6PS+0,2HBr+0,1H2O:
(3.40) 2-Амино-5-изопропилоксикарбонил-4-[2-(5-фосфоно)фуранил]тиазол. Т.пл. 240°С (разл.).
Анализ для C11H13N2O6PS:
(3.41) 2-Метил-5-этил-4-[2-(5-фосфоно)фуранил]тиазол.
Анализ для C10H12O4PNS+0,75HBr+0,35Н2О:
(3.42) 2-Метил-5-циклопропил-4-[2-(5-фосфоно)фуранил]тиазол.
Анализ для C11H12NO4PS+0,3HBr+0,5CHCl3:
(3.43) 2-Метил-5-этоксикарбонил-4-[2-(5-фосфоно)фуранил]тиазол.
Анализ для C11H12NO6PS:
(3.44) 2-[(N-Ацетил)амино]-5-метоксиметил-4-[2-(5-фосфоно)фуранил]тиазол.
Анализ для С11Н13N2О6PS+0,15HBr:
(3.45) Дигидробромид 2-амино-5-(4-морфолинил)метил-4-[2-(5-фосфоно)фуранил]тиазола.
Анализ для C12H18Br2N3O5PS+0,25HBr:
(3.46) 2-Амино-5-циклопропилметоксикарбонил-4-[2-(5-фосфоно)фуранил]тиазол. Т.пл. 238°С (разл.).
Анализ для С12Н13N2O6PS:
(3.47) N,N-Дициклогексиламмонийная соль 2-амино-5-метилтио-4-[2-(5-фосфоно)фуранил]тиазола. Т.пл. >250°С.
Анализ для C8H9N2O4PS2+1,15C2H23N:
(3.48) 2-[(N-Дансил)амино]-5-изобутил-4-[2-(5-фосфоно)фуранил]тиазол.
Анализ для С23Н26N3О6PS2+0,5HBr:
(3.49) 2-Амино-5-(2,2,2-трифторэтил)-4-[2-(5-фосфоно)фуранил]тиазол.
Анализ для C9H8N2F3O4PS:
(3.50) 2-Метил-5-метилтио-4-[2-(5-фосфоно)фуранил]тиазол.
Анализ для С9Н10NO4PS2:
(3.51) Аммонийная соль 2-амино-5-метилтио-4-[2-(5-фосфоно)фуранил]тиазола.
Анализ для С8Н12N3O4PS2:
(3.52) 2-Циано-5-этил-4-[2-(5-фосфоно)фуранил]тиазол.
Анализ для C10H9N2O4PS:
(3.53) 2-Амино-5-гидроксиметил-4-[2-(5-фосфоно)фуранил]тиазол.
Анализ для C8H9N2O5PS:
(3.54) 2-Циано-5-изобутил-4-[2-(5-фосфоно)фуранил]тиазол.
Анализ для C12H13N2O4SP+0,09HBr:
(3.55) Гидробромид 2-амино-5-изопропилтио-4-[2-(5-фосфоно)фуранил]тиазола.
Анализ для C10H14BrN2O4PS2:
(3.56) 2-Амино-5-фенилтио-4-[2-(5-фосфоно)фуранил]тиазол.
Анализ для C13H11N2O4PS2:
(3.57) 2-Амино-5-трет-бутилтио-4-[2-(5-фосфоно)фуранил]тиазол.
Анализ для C11H15N2O4PS2+0,6CH2Cl2:
(3.58) Гидробромид 2-амино-5-пропилтио-4-[2-(5-фосфоно)фуранил]тиазола.
Анализ для C10H14 BrN2O4PS2:
(3.59) 2-Амино-5-этилтио-4-[2-(5-фосфоно)фуранил]тиазол.
Анализ для C9H11N2O4PS2+0,25HBr:
(3.60) 2-[(N-трет-Бутилоксикарбонил)амино]-5-метоксиметил-4-[2-(5-фосфоно)фуранил]тиазол.
Анализ для C14H19N2O7PS:
(3.61) 2-Гидрокси-4-[2-(5-фосфоно)фуранил]тиазол.
Анализ для C7H6NO5PS:
(3.62) 2-Гидрокси-5-этил-4-[2-(5-фосфоно)фуранил]тиазол.
Анализ для C9H10NO5PS:
(3.63) 2-Гидрокси-5-изопропил-4-[2-(5-фосфоно)фуранил]тиазол.
Анализ для C10H12NO5PS+0,1HBr:
(3.64) 2-Гидрокси-5-изобутил-4-[2-(5-фосфоно)фуранил]тиазол.
Анализ для C11H14NO5PS:
(3.65) 5-Этоксикарбонил-4-[2-(5-фосфоно)фуранил]тиазол.
Анализ для С10Н10NO6PS:
(3.66) 2-Амино-5-винил-4-[2-(5-фосфоно)фуранил]тиазол. Анализ для C9H9N2O4PS+0,28HCl:
(3.67) Гидробромид 2-амино-4-[2-(6-фосфоно)пиридил]тиазола.
(3.68) 2-Метилтио-5-изобутил-4-[2-(5-фосфоно)фуранил]тиазол. Анализ для C12H16NO4PS2:
(3.69) 2-Амино-5-изобутил-4-[2-(5-фосфоно)фуранил]тиазол.
Анализ для C11H15N2O4PS+0,1Н2O:
(3.70) 2-Амино-5-изобутил-4-[2-(5-фосфоно)фуранил]селеназол.
Анализ для C11H15N2O4PSe+0,14HBr+0,6EtOAc:
(3.71) 2-Амино-5-метилтио-4-[2-(5-фосфоно)фуранил]селеназол.
Анализ для C8H9N2O4PSSe+0,7HBr+0,2EtOAc:
(3.72) 2-Амино-5-этил-4-[2-(5-фосфоно)фуранил]селеназол.
Анализ для С9Н11N2O4PSe+HBr:
Пример 4
Получение 5-галоид-4-[2-(5-фосфоно)фуранил]тиазолов
Стадия А. Раствор 2-амино-4-[2-(5-диэтилфосфоно)фуранил]тиазола (полученного, как описано на стадии В примера 3) (1 ммоль) в хлороформе обрабатывают N-бромсукцинимидом (NBS) (1,5 ммоль) при 25°С в течение 1 ч. Экстракция и хроматография дают 2-амино-5-бром-4-[2-(5-диэтилфосфоно)фуранил]тиазол в виде коричневого твердого вещества.
Стадия В. 2-Амино-5-бром-4-[2-(5-диэтилфосфоно)фуранил]тиазол подвергают обработке, как на стадии С примера 3, получая 2-амино-5-бром-4-[2-(5-фосфоно)фуранил]тиазол (4.1) в виде желтого твердого вещества. Т.пл. > 230°С.
Анализ для С7Н6N2O4PSBr:
Следуя указанной выше методике, получают следующие соединения.
(4.2) 2-Амино-5-хлор-4-[2-(5-фосфоно)фуранил]тиазол.
Анализ для С7Н6N2O4PSCl:
(4.3) 2-Амино-5-иод-4-[2-(5-фосфоно)фуранил]тиазол.
Анализ для С7Н6N2O4PSI:
(4.4) 2,5-Дибром-4-[2-(5-фосфоно)фуранил]тиазол.
Анализ для С7Н4NO4PSBr2:
Пример 5
Получение 2-галоид-4-[2-(5-фосфоно)фуранил]тиазолов
Стадия А. Раствор 2-амино-5-изобутил-4-[2-(5-диэтилфосфоно)фуранил]тиазола (полученного, как описано на стадии В примера 3) (1 ммоль) в ацетонитриле обрабатывают бромидом меди (II) (1,2 ммоль) и изоамилнитритом (1,2 ммоль) при 0°С в течение 1 ч. Экстракция и хроматография дают 2-бром-5-изобутил-4-[2-(5-диэтилфосфоно)фуранил]тиазол в виде коричневого твердого вещества.
Стадия В. 2-Бром-5-изобутил-4-[2-(5-диэтилфосфоно)фуранил]тиазол подвергают обработке в соответствии со стадией С примера 3, получая 2-бром-5-изобутил-4-[2-(5-фосфоно)фуранил]тиазол (5.1) в виде желтого гигроскопичного твердого вещества.
Анализ для C11H13NO4PSBr:
В соответствии с вышеуказанной методикой получают следующие соединения.
(5.2) 2-Хлор-5-изобутил-4-[2-(5-фосфоно)фуранил]тиазол.
Анализ для C11H13NO4PSCl:
(5.3) 2-Бром-5-метилтио-4-[2-(5-фосфоно)фуранил]тиазол.
Анализ для C8H7NO4PS2Br:
Пример 6
Получение различных 2- и 5-замещенных 4-[2-(5-фосфоно)фуранил 3 тиазолов
Стадия А. Раствор 2-бром-5-изобутил-4-[2-(5-диэтилфосфоно)фуранил]тиазола (1 ммоль, полученного, как на стадии А примера 5) в ДМФ обрабатывают трибутил(винил)оловом (5 ммоль) и бис(трифенилфосфин)дихлоридом палладия (0,05 ммоль) при 100°С в атмосфере азота. По истечении 5 ч охлажденную реакционную смесь упаривают и остаток подвергают хроматографии, получая 2-винил-5-изобутил-4-[2-(5-диэтилфосфоно)фуранил]тиазол в виде желтого твердого вещества.
Стадия В. 2-Винил-5-изобутил-4-[2-(5-диэтилфосфоно)фуранил]тиазол подвергают обработке в соответствии со стадией С примера 3, получая 2-винил-5-изобутил-4-[2-(5-фосфоно)фуранил]тиазол (6.1) в виде желтого твердого вещества.
Анализ для C13H16NO4PS+1HBr+0,1H2O:
Указанный способ можно также использовать для получения различных 5-замещенных 4-[2-(5-фосфоно)фуранил]тиазолов из их соответствующих галогенидов.
Стадия С. 2-Амино-5-бром-4-[2-(5-диэтилфосфоно)фуранил]тиазол подвергают обработке в соответствии со стадией А, используя 2-трибутилстаннилфуран в качестве связующего реагента, с получением 2-амино-5-(2-фуранил)-4-[2-(5-диэтилфосфоно)фуранил]тиазола.
Стадия D. 2-Амино-5-(2-фуранил)-4-[2-(5-диэтилфосфоно)фуранил]тиазол подвергают обработке в соответствии со стадией С примера 3, получая 2-амино-5-(2-фуранил)-4-[2-(5-фосфоно)фуранил]тиазол (6.2), Т.пл. 190-210°С.
Анализ для C11H9N2O5PS+0,25HBr:
Нижеследующее соединение получают в соответствии с указанным выше способом.
(6.3) 2-Амино-5-(2-тиенил)-4-[2-(5-диэтилфосфоно)фуранил]тиазол.
Анализ для C11H9N2O4PS2+0,3EtOAc+0,11HBr:
Пример 7
Получение 2-этил-4-[2-(5-фосфоно)фуранил]тиазолов
Стадия А. Раствор 2-винил-5-изобутил-4-[2-(5-диэтилфосфоно)фуранил]тиазола (1 ммоль, полученного, как на стадии А примера 6) в этаноле обрабатывают палладием на углероде (0,05 ммоль) в атмосфере водорода (1 атм) в течение 12 ч. Реакционную смесь фильтруют, фильтрат упаривают и остаток очищают хроматографией, получая 2-этил-5-изобутил-4-[2-(5-диэтилфосфоно)фуранил]тиазол в виде желтой пены.
Стадия В. 2-Этил-5-изобутил-4-[2-(5-диэтилфосфоно)фуранил]тиазол подвергают обработке в соответствии со стадией С примера 3, получая 2-этил-5-изобутил-4-[2-(5-фосфоно)фуранил]тиазол (7.1) в виде желтого твердого вещества.
Анализ для C13H18NO4PS+1HBr:
Пример 8
Получение 4-фосфонометоксиметилтиазолов
Стадия А. Раствор диэтилгидроксиметилфосфоната (1 ммоль) в ДМФ обрабатывают гидридом натрия (1,2 ммоль) с последующей обработкой 2-метил-4-хлорметилтиазолом (1 ммоль) при 0°С и перемешивают при 25°С в течение 12 ч. Экстракция и хроматография дают 2-метил-4-диэтилфосфонометоксиметилтиазол.
Стадия В. 2-Метил-4-диэтилфосфонометоксиметилтиазол подвергают обработке в соответствии со стадией С примера 3, получая 2-метил-4-фосфонометоксиметилтиазол (8.1).
Анализ для C6H10NO4PS+0,5HBr+0,5H2O:
Стадия С. 2-Метил-4-диэтилфосфонометоксиметилтиазол подвергают обработке в соответствии со стадией А примера 4, а затем в соответствии со стадией С примера 3, получая 5-бром-2-метил-4-фосфонометоксиметилтиазол (8.2).
Анализ для С6Н9NO4PSBr+0,5HBr:
Стадия D. Раствор этил-2-[(N-Boc)амино]-4-тиазолкарбоксилата (1 ммоль) в CH2Cl2 (10 мл) охлаждают до -78°С и обрабатывают DIBAL-H (1М, 5 мл). Реакционную смесь перемешивают при -60°С в течение 3 ч и гасят суспензией NaF/H2O (1 г/мл). Полученную смесь фильтруют и фильтрат концентрируют, получая 2-[(N-Boc)амино]-4-гидроксиметилтиазол в виде твердого вещества.
Стадия Е. Раствор 2-[(N-Boc)амино]-4-гидроксиметилтиазола (1 ммоль) в ДМФ (10 мл) охлаждают до 0°С и обрабатывают NaH (1,1 ммоль). Смесь перемешивают при комнатной температуре в течение 30 мин, затем добавляют фосфонометилтрифторметансульфонат (1,1 ммоль). После перемешивания при комнатной температуре в течение 4 ч реакционную смесь упаривают досуха. Хроматография остатка дает 2-[(N-Boc)амино]-4-диэтилфосфонометоксиметилтиазол в виде твердого вещества.
Стадия F. 2-[(N-Boc)амино]-4-диэтилфосфонометоксиметилтиазол подвергают обработке в соответствии со стадией С примера 3, получая 2-амино-4-фосфонометоксиметилтиазол (8.3) в виде твердого вещества.
Анализ для C5H9N2O4PS+0,16HBr+0,1MeOH:
Пример 9
Получение 2-карбамоил-4-[2-(5-фосфоно)фуранил]тиазолов
Стадия А. Раствор 2-этоксикарбонил-5-изобутил-4-[2-(5-диэтилфосфоно)фуранил]тиазола (1 ммоль) в насыщенном метанольном растворе аммиака нагревают при 25°С в течение 12 ч. Упаривание и хроматография дают 2-карбамоил-5-изобутил-4-[2-(5-диэтилфосфоно)фуранил]тиазол в виде белого твердого вещества.
Стадия В. 2-Карбамоил-5-изобутил-4-[2-(5-диэтилфосфоно)фуранил]тиазол подвергают обработке в соответствии со стадией С примера 3, получая 2-карбамоил-5-изобутил-4-[2-(5-фосфоно)фуранил]тиазол (9.1) в виде твердого вещества. Т.пл. 185-186°С.
Анализ для C12H15N2O5PS:
Следуя указанной методике, получают следующее соединение.
(9.2) 2-Карбамоил-4-[2-(5-фосфоно)фуранил]тиазол. Т.пл. 195-200°С.
Анализ для С8Н7N2O5PS+0,25Н2O:
2-Этоксикарбонил-4-[2-(5-диэтилфосфоно)фуранил]тиазолы можно также превратить в другие 2-замещенные 4-[2-(5-фосфоно)фуранил]тиазолы.
Стадия С. Раствор 2-этоксикарбонил-4-[2-(5-диэтилфосфоно)фуранил]тиазола (1 ммоль) в метаноле обрабатывают борогидридом натрия (1,2 ммоль) при 25°С в течение 12 ч. Экстракция и хроматография дают 2-гидроксиметил-4-[2-(5-диэтилфосфоно)фуранил]тиазол.
Стадия D. 2-Гидроксиметил-4-[2-(5-диэтилфосфоно)фуранил]тиазол подвергают обработке в соответствии со стадией С примера 3, получая 2-гидроксиметил-4-[2-(5-фосфоно)фуранил]тиазол (9.3). Т.пл. 205-207°С.
Анализ для С8Н8NO5PS+0,25H2O:
Следуя указанной методике, получают следующее соединение.
(9.4) 2-Гидроксиметил-5-изобутил-4-[2-(5-фосфоно)фуранил]тиазол. Т.пл. 160-170°С.
Анализ для C12H16NO5PS+0,75HBr:
Стадия Е. Раствор 2-гидроксиметил-5-изобутил-4-[2-(5-диэтилфосфоно)фуранил]тиазола (1 ммоль) в метиленхлориде обрабатывают трибромидом фосфора (1,2 ммоль) при 25°С в течение 2 ч. Экстракция и хроматография дают 2-бромметил-5-изобутил-4-[2-(5-диэтилфосфоно)фуранил]тиазол.
Стадия F. 2-Бромметил-5-изобутил-4-[2-(5-диэтилфосфоно) фуранил]тиазол подвергают обработке в соответствии со стадией С примера 3, получая 2-бромметил-5-изобутил-4-[2-(5-фосфоно)фуранил]тиазол (9.5). Т.пл. 161-163°С.
Анализ для C12H15BrNO4PS+0,25HBr:
Следуя указанной методике, получают следующее соединение.
(9.6) 2-Бромметил-4-[2-(5-фосфоно)фуранил]тиазол. Т.пл. > 250°С.
Анализ для C8H7BrNO4PS:
Стадия G. Раствор 2-гидроксиметил-5-изобутил-4-[2-(5-диэтилфосфоно)фуранил]тиазола (1 ммоль) в метиленхлориде обрабатывают тионилхлоридом (1,2 ммоль) при 25°С в течение 2 ч. Экстракция и хроматография дают 2-хлорметил-5-изобутил-4-[2-(5-диэтилфосфоно)фуранил]тиазол.
Стадия Н. 2-Хлорметил-5-изобутил-4-[2-(5-диэтилфосфоно)фуранил]тиазол подвергают обработке в соответствии со стадией С примера 3, получая 2-хлорметил-5-изобутил-4-[2-(5-фосфоно)фуранил]тиазол (9.7). Т.пл. 160-162°С.
Анализ для C12H15ClNO4PS+0,45HBr:
Стадия I. Раствор 2-хлорметил-5-изобутил-4-[2-(5-фосфоно)фуранил]тиазола (1 ммоль) в ДМФ обрабатывают фталимидом калия (1,2 ммоль) при 25°С в течение 12 ч. Экстракция и хроматография дают 2-фталимидометил-5-изобутил-4-[2-(5-диэтилфосфоно)фуранил]тиазол.
Стадия J. 2-Фталимидометил-5-изобутил-4-[2-(5-диэтилфосфоно)фуранил]тиазол (1 ммоль) в этаноле обрабатывают гидразином (1,5 ммоль) при 25°С в течение 12 ч. Фильтрование, упаривание и хроматография дают 2-аминометил-5-изобутил-4-[2-(5-диэтилфосфоно)фуранил]тиазол.
Стадия К. 2-Аминометил-5-изобутил-4-[2-(5-диэтилфосфоно)фуранил]тиазол подвергают обработке в соответствии со стадией С примера 3, получая 2-аминометил-5-изобутил-4-[2-(5-фосфоно)фуранил]тиазол (9.8). Т.пл. 235-237°С.
Анализ для C12H17N2O4PS+0,205HBr:
Следуя указанным выше методикам или в некоторых случаях с минимальными изменениями их, получают следующие соединения.
(9.9) 2-Карбамоил-5-циклопропил-4-[2-(5-фосфоно)фуранил]тиазол.
Анализ для С11H11N2О5PS+0,15HBr:
(9.10) 2-Карбамоил-5-этил-4-[2-(5-фосфоно)фуранил]тиазол.
Анализ для C10H11N2O5PS+0,75Н2O:
Пример 10
Получение 4-[2-(5-фосфоно)фуранил]оксазолов и 4-[2-(5-фосфоно)фуранил]имидаэолов
Стадия А. Раствор 5-диэтилфосфоно-2-[(2-бром-4-метил-1-оксо)пентил]фуранила (1 ммоль) в т-BuOH обрабатывают мочевиной (10 ммоль) при кипячении с обратным холодильником в течение 72 ч. Фильтрование, упаривание и хроматография дают 2-амино-5-изобутил-4-[2-(5-диэтилфосфоно)фуранил]оксазол и 2-гидрокси-5-изобутил-4-[2-(5-диэтилфосфоно)фуранил]имидазол.
Стадия В. 2-Амино-5-изобутил-4-[2-(5-диэтилфосфоно)фуранил]оксазол подвергают обработке в соответствии со стадией С примера 3, получая 2-амино-5-изобутил-4-[2-(5-фосфоно)фуранил]оксазол (10.1). Т.пл. 250°С (разл).
Анализ для C11H15N2O5P:
Стадия С. 2-Гидрокси-5-изобутил-4-[2-(5-диэтилфосфоно)фуранил]имидазол подвергают обработке в соответствии со стадией С примера 3, получая 2-гидрокси-5-изобутил-4-[2-(5-фосфоно)фуранил]имидазол (10.14). Т.пл. 205°С (разл).
Анализ для C11H15N2O5P:
Альтернативно 4-[2-(5-фосфоно)фуранил]оксазолы и 4-[2-(5-фосфоно)фуранил]имидазолы можно получить следующим образом.
Стадия D. Раствор 5-диэтилфосфоно-2-[(2-бром-4-метил-1-оксо)пентил]фурана (1 ммоль) в уксусной кислоте обрабатывают ацетатом натрия (2 ммоль) и ацетатом аммония (2 ммоль) при 100°С в течение 4 ч. Упаривание и хроматография дают 2-метил-5-изобутил-4-[2-(5-диэтилфосфоно)фуранил]оксазол, 2-метил-4-изобутил-5-[2-(5-диэтилфосфоно)фуранил]оксазол и 2-метил-5-изобутил-4-[2-(5-диэтилфосфоно)фуранил]имидазол.
Стадия Е. 2-Метил-5-изобутил-4-[2-(5-диэтилфосфоно)фуранил]оксазол, 2-метил-4-изобутил-5-[2-(5-диэтилфосфоно)фуранил]оксазол и 2-метил-5-изобутил-4-[2-(5-диэтилфосфоно)фуранил]имидазол подвергают обработке в соответствии со стадией С примера 3, получая следующие соединения.
(10.18) Гидробромид 2-метил-4-изобутил-5-[2-(5-фосфоно)фуранил]оксазола. Т.пл. > 230°С.
Анализ для C12H17BrNO5P+0,4Н2O:
(10.19) Гидробромид 2-метил-5-изобутил-4-[2-(5-фосфоно)фуранил]оксазола.
Анализ для C12H17BrNO5P:
(10.21) Гидробромид 2-метил-5-изобутил-4-[2-(5-фосфоно)фуранил]имидазола.
Анализ для C12H18BrN2O4P+0,2NH4Br:
Альтернативно 4-[2-(5-фосфоно)фуранил]имидазолы можно получить следующим образом.
Стадия F. Раствор 5-диэтилфосфоно-2-(бромацетил)фурана (1 ммоль) в этаноле обрабатывают трифторацетамидином (2 ммоль) при 80°С в течение 4 ч. Упаривание и хроматография дают 2-трифторметил-4-[2-(5-диэтилфосфоно)фуранил]имидазол в виде масла.
Стадия G. 2-Трифторметил-4-[2-(5-диэтилфосфоно)фуранил]имидазол подвергают обработке в соответствии со стадией С примера 3, получая 2-трифторметил-4-[2-(5-фосфоно)фуранил]имидазол (10.22). Т.пл 188°С (разл.).
Анализ для С8Н6F3N2O4Р+0,5HBr:
Альтернативно 4,5-диметил-1-изобутил-2-[2-(5-фосфоно)фуранил]имидазол можно получить следующим образом.
Стадия Н. Раствор 5-диэтилфосфоно-2-фуральдегида (1 ммоль), ацетата аммония (1,4 ммоль), 3,4-бутандиона (3 ммоль) и изобутиламина (3 ммоль) в ледяной уксусной кислоте нагревают при 100°С в течение 24 ч. Упаривание и хроматография дают 4,5-диметил-1-изобутил-2-[2-(5-диэтилфосфоно)фуранил]имидазол в виде желтого твердого вещества.
Стадия I. 4,5-Диметил-1-изобутил-2-[2-(5-диэтилфосфоно)фуранил]имидазол подвергают обработке в соответствии со стадией С примера 3, получая 4,5-диметил-1-изобутил-2-[2-(5-фосфоно)фуранил]имидазол (10.23).
Анализ для C13H19N2O4P+1,35HBr:
Следуя указанным выше методикам или в некоторых случаях с некоторыми небольшими изменениями их, получают следующие соединения.
(10.2) 2-Амино-5-пропил-4-[2-(5-фосфоно)фуранил]оксазол. Т.пл. 250°С (разл).
Анализ для C10H13N2O5P:
(10.3) 2-Амино-5-этил-4-[2-(5-фосфоно)фуранил]оксазол.
Анализ для С9Н11N2O5Р+0,4Н2O:
(10.4) 2-Амино-5-метил-4-[2-(5-фосфоно)фуранил]оксазол.
Анализ для C8H9N2O5P+0,1Н2O:
(10.5) 2-Амино-4-[2-(5-фосфоно)фуранил]оксазол.
Анализ для C7H7N2O5P+0,6Н2O:
(10.6) Гидробромид 2-амино-5-изобутил-4-[2-(5-фосфоно)фуранил]оксазола.
Анализ для C11H16N2O5BrP+0,4Н2O:
(10.7) 2-Амино-5-фенил-4-[2-(5-фосфоно)фуранил]оксазол.
Анализ для C13H11N2O5P:
(10.8) 2-Амино-5-бензил-4-[2-(5-фосфоно)фуранил]оксазол.
Анализ для C14H13N2O5P+1,1H2O:
(10.9) 2-Амино-5-циклогексилметил-4-[2-(5-фосфоно)фуранил]оксазол.
Анализ для C14H19N2O5P+0,3Н2О:
(10.10) 2-Амино-5-аллил-4-[2-(5-фосфоно)фуранил]оксазол.
Анализ для С10Н11N2O5Р+0,4HBr+0,3Н2О:
(10.11) 5-Изобутил-4-[2-(5-фосфоно)фуранил]оксазол.
Анализ для C11H14NO5P:
(10.12) 2-Амино-5-бутил-4-[2-(5-фосфоно)фуранил]оксазол.
Анализ для C11H15N2O5P+0,2H2O:
(10.13) 5-Изобутил-4-[2-(5-фосфоно)фуранил]оксазол-2-он. Анализ для C11H14NO6P+0,39HBr:
(10.15) 5-Циклогексилметил-2-гидрокси-4-[2-(5-фосфоно)фуранил]имидазол.
Анализ для C14H19N2O5P+0,05HBr:
(10.16) 5-Бутил-2-гидрокси-4-[2-(5-фосфоно)фуранил].
Анализ для C11H15N2O5P+0,2Н2О:
(10.17) 5-Бензил-2-гидрокси-4-[2-(5-фосфоно)фуранил]имидазол.
Анализ для C14H13N2O5P:
(10.20) Гидробромид 2-метил-5-пропил-4-[2-(5-фосфоно)фуранил]имидазола.
Анализ для C11H16BrN2O4P+0,5Н2O:
(10.24) 2-Амино-5-(2-тиенилметил)-4-[2-(5-фосфоно)фуранил]оксазол.
Анализ для C12H11N2O5PS+0,9HBr:
(10.25) Гидробромид 2-диметиламино-5-изобутил-4-[2-(5-фосфоно)фуранил]оксазола.
Анализ для C13H20BrN2O5P+0,05HBr:
(10.26) 2-Изопропил-5-изобутил-4-[2-(5-фосфоно)фуранил]оксазол. Анализ для C14H20NO5P+0,8HBr:
(10.27) 2-Амино-5-этоксикарбонил-4-[2-(5-фосфоно)фуранил]оксазол. Т.пл. 245°С (разл.).
Анализ для С10Н11N2O7Р:
(10.28) Гидробромид 2-метиламино-5-изобутил-4-[2-(5-фосфоно)фуранил]оксазола.
Анализ для C12H18BrN2O5P+0,7Н2O:
(10.29) Гидробромид 2-этил-5-изобутил-4-[2-(5-фосфоно)фуранил]оксазола.
Анализ для C13H19BrNO5P:
(10.30) Гидробромид 2-этиламино-5-изобутил-4-[2-(5-фосфоно)фуранил]оксазола.
Анализ для С13Н20BrN2O5Р:
(10.31) 2-Винил-5-изобутил-4-[2-(5-фосфоно)фуранил]оксазол.
Анализ для C13H16NO5P+0,25HBr:
(10.32) 2-Амино-5-пентил-4-[2-(5-фосфоно)фуранил]оксазол.
Анализ для C12H17N2O5P+0,5Н2O:
(10.33) 2-Пентил-2-гидрокси-4-[2-(5-фосфоно)фуранил]имидазол.
Анализ для C12H17N2O5P:
(10.45) 2-Амино-5-метилтио-4-[2-(5-фосфоно)фуранил]оксазол. Т.пл. 196°С (разл.).
Анализ для C8H9N2O5PS:
(10.35) 2-Амино-5-бензилоксикарбонил-4-[2-(5-фосфоно)фуранил]оксазол. Т.пл. 230°С (разл.).
Анализ для C15H13N2O7P+0,7Н2O:
(10.36) 2-Амино-5-изопропилоксикарбонил-4-[2-(5-фосфоно)фуранил]оксазол. Т.пл. 221°С (разл.).
Анализ для C11H13N2O7P+0,9H2O:
(10.37) 2-Амино-5-метоксикарбонил-4-[2-(5-фосфоно)фуранил]оксазол. Т.пл. 240°С (разл.).
Анализ для С9Н9N2O7Р+0,3Н2О+0,1 ацетон:
(10.38) 2-Амино-5-[(N-метил)карбамоил]-4-[2-(5-фосфоно)фуранил]оксазол. Т.пл. 235°С (разл.).
Анализ для С9Н10N3О6Р:
(10.39) 2-Амино-5-этилтиокарбонил-4-[2-(5-фосфоно)фуранил]оксазол. Т.пл. 225°С (разл.).
Анализ для С10Н11N2О6PS:
(10.40) 2-Амино-5-изопропилтио-4-[2-(5-фосфоно)фуранил]оксазол.
Анализ для C10H13N2O5PS+0,2HBr:
(10.41) 2-Амино-5-фенилтио-4-[2-(5-фосфоно)фуранил]оксазол.
Анализ для C13H11N2O5PS+0,25HBr:
(10.42) 2-Амино-5-этилтио-4-[2-(5-фосфоно)фуранил]оксазол.
Анализ для C9H11N2O5PS+0,85HBr:
(10.43) 2-Амино-5-пропилтио-4-[2-(5-фосфоно)фуранил]оксазол.
Анализ для C10H13N2O5+H2O:
(10.44) 2-Амино-5-трет-бутилтио-4-[2-(5-фосфоно)фуранил]оксазол.
Анализ для C11H15N2O5PS+0,25HBr:
(10.34) 4,5-Диметил-2-[2-(5-фосфоно)фуранил]имидазол.
Анализ для C9H11N2O4P+1,25Н2O:
Пример 11
Получение N-алкилированных 4-[2-(5-фосфоно)фуранил]имидазолов и 4-[2-(5-фосфоно)фуранил]оксазолов
Стадия А. Суспензию карбоната цезия (1,5 ммоль) и 2-метил-5-изобутил-4-[2-(5-диэтилфосфоно)фуранил]имидазола (1 ммоль) в ДМФ обрабатывают иодметаном (1,5 ммоль) при 25°С в течение 16 ч. Экстракция и хроматография дают 1,2-диметил-4-изобутил-5-[2-(5-диэтилфосфоно)фуранил]имидазол и 1,2-диметил-5-изобутил-4-[2-(5-диэтилфосфоно)фуранил]имидазол.
Стадия В. 1,2-Диметил-4-изобутил-5-[2-(5-диэтилфосфоно) фуранил]имидазол и 1,2-диметил-5-изобутил-4-[2-(5-диэтилфосфоно)фуранил]имидазол подвергают обработке в соответствии со стадией С примера 3, получая следующее соединение.
(11.1) Гидробромид 1,2-диметил-5-изобутил-4-[2-(5-фосфоно)фуранил]имидазола.
Анализ для C13H20N2O4PBr+0,8Н2O:
Пример 12
Получение 2-[(2-(6-фосфоно)пиридил]пиридина
Стадия А. Раствор 2,2'-бипиридила (1 ммоль) в дихлорметане обрабатывают м-хлорпероксибензойной кислотой (2 ммоль) при 0°С и реакционную смесь перемешивают при 25°С в течение 2 ч. Экстракция и хроматография дают 2,2'-бипиридил-N-оксид.
Стадия В. (Redmore, D., J. Org. Chem., 1970, 35, 4114).
Раствор метилового эфира 2,2'-бипиридил-N-оксида (1 ммоль, полученного из диметилсульфата и 2,2'-бипиридил-N-оксида в диэтилфосфите) медленно добавляют при -30°С к раствору н-бутиллития (1 ммоль) в диэтилфосфите при -30°С. Полученную реакционную смесь перемешивают при 25°С в течение 12 ч. Экстракция и хроматография дают 2-[2-(6-диэтилфосфоно)пиридил]пиридин.
Стадия С. 2-[2-(6-Диэтилфосфоно)пиридил]пиридин подвергают обработке в соответствии со стадией С примера 3, получая 2-[2-(6-фосфоно)пиридил]пиридин (12.1). Т.пл. 158-162°С.
Анализ для С10Н9N2O3Р+0,5H2O+0,1HBr:
Пример 13
Получение 4,6-диметил-2-(фосфонометоксиметил)пиридина
Стадия А. Раствор 2,4,6-коллидина (1 ммоль) в четыреххлористом углероде обрабатывают NBS (5 ммоль) и дибензоилпероксидом (0,25 ммоль) при 80°С в течение 12 ч. Реакционную смесь охлаждают до 0°С и осадок отфильтровывают. Фильтрат концентрируют в вакууме. Хроматография дает 2-бромметил-4,6-диметилпиридин.
Стадия В. Раствор диэтилгидроксиметилфосфоната (1 ммоль)в толуоле обрабатывают гидридом натрия (1,1 ммоль) при 0°С и по истечении 15 мин добавляют 2-бромметил-4,6-диметилпиридин (1 ммоль). Спустя 3 ч реакционную смесь подвергают экстракции и хроматографии, получая 2-диэтилфосфонометил-4,6-диметилпиридин.
Стадия С. 2-Диэтилфосфонометил-4,6-диметилпиридин подвергают обработке в соответствии со стадией С примера 3, получая 4,6-диметил-2-(фосфонометоксиметил)пиридин (13.1).Т.пл. 109-112°С.
Анализ для C9H14NOP+1,0Н2O+0,5HBr:
Аналогично получают следующее соединение.
(13.2) 2-Амино-4-метил-5-пропил-6-фосфонометоксиметилпиримидин. Т.пл. 153-156°С.
Анализ для C10H18N3O4P+1,25Н2О+1,6HBr:
Пример 14
Получение диэтил-5-трибутилстаннил-2-фуранфосфоната
Раствор диэтил-2-фуранфосфоната (1 ммоль, полученного, как в стадии С примера 1) в ТГФ охлаждают при -78°С и переносят с помощью канюли в раствор N-изопропил-N-циклогексиламида лития в ТГФ при -78°С на протяжении 15 минут. Полученную смесь перемешивают при -78°С в течение 2 ч и переносят с помощью канюли в раствор хлорида трибутилолова (1 ммоль) в ТГФ при -78°С на протяжении 20 мин. Затем смесь перемешивают при -78°С в течение 1 ч и при 25°С в течение 12 ч. Экстракция и хроматография дают соединение (14) в виде светло-желтого масла.
Пример 15
Получение 6-[2-(5-фосфоно)фуранил]пиридинов
Стадия А. Раствор 2,6-дихлорпиридина (120 ммоль) в этаноле обрабатывают водным раствором аммика (28%, избыток) при 160-165°С в течение 60 ч в герметизированной пробирке. Экстракция и хроматография дают 2-амино-6-хлорпиридин в виде белого твердого вещества.
Стадия В. Раствор 2-амино-6-хлорпиридина (1 ммоль) и соединения 14 (1 ммоль) в п-ксилоле обрабатывают тетракис(трифенилфосфин)палладием (0,05 ммоль) при температуре кипения с обратным холодильником в течение 12 ч. Экстракция и хроматография дают 2-амино-6-[2-(5-диэтилфосфоно)фуранил] пиридин в виде светло-желтого твердого вещества.
Стадия С.
2-Амино-6-[2-(5-диэтилфосфоно)фуранил]пиридин подвергают обработке в соответствии со стадией С примера 3, получая 2-амино-6-[2-(5-фосфоно)фуранил]пиридин (15.1). Т.пл. 186-187°С.
Анализ для C9H9N2O4P+0,4HBr:
Стадия D. Раствор 2-амино-6-[2-(5-диэтилфосфоно)фуранил]пиридина (1 ммоль) в уксусной кислоте обрабатывают раствором брома в уксусной кислоте (1N, 1 ммоль) при 25°С в течение 0,5 ч. Упаривание и хроматография дают 2-амино-5-бром-6-[2-(5-диэтилфосфоно)фуранил]пиридин и 2-амино-3,5-дибром-6-[2-(5-диэтилфосфоно)фуранил]пиридин.
Стадия Е. 2-Амино-5-бром-6-[2-(5-диэтилфосфоно)фуранил]пиридин и 2-амино-3,5-дибром-6-[2-(5-диэтилфосфоно)фуранил]пиридин подвергают обработке в соответствии со стадией С примера 3, получая следующие соединения:
(15.2) 6-Амино-3-бром-2-[2-(5-фосфоно)фуранил]пиридин.
Анализ для С9Н8BrN2O4Р+0,7H2O+0,9HBr+0,12РhСН3:
(15.3) 6-Амино-3,5-дибром-2-[2-(5-фосфоно)фуранил]пиридин. Т.пл.. 233-235°С.
Анализ для С9Н7Br2N2O4Р+1,2HBr:
Стадия F. Раствор 2-амино-3,5-дибром-6-[2-(5-диэтилфосфоно)фуранил]пиридина (1 ммоль) в ДМФ обрабатывают трибутил(винил)оловом (1,2 ммоль) и тетракис(трифенилфосфин)палладием (0,2 ммоль) при 85°С в течение 4 ч. Упаривание и хроматография дают 2-амино-3,5-бис(винил)-6-[2-(5-диэтилфосфоно)фуранил]пиридин.
Стадия G. Раствор 2-амино-З,5-бис(винил)-6-[2-(5-диэтилфосфоно)фуранил]пиридина (1 ммоль) в этилацетате обрабатывают палладием на углероде (10%) при 25°С в атмосфере водорода (1 атм) в течение 12 ч. Фильтрование, упаривание и хроматография дают 2-амино-3,5-диэтил-6-[2-(5-диэтилфосфоно)фуранил]пиридин.
Стадия Н. 2-Амино-3,5-диэтил-6-[2-(5-диэтилфосфоно)фуранил]пиридин подвергают обработке в соответствии со стадией С примера 3, получая 2-амино-3,5-диэтил-6-[2-(5-фосфоно)фуранил]пиридин (15.4). Т.пл. 217-218°С.
Анализ для C13H17N2O4P+0,7Н2O+1,0HBr:
Стадия I. Раствор 2-амино-6-пиколина (1 ммоль) в 48% бромистоводородной кислоте (4,4 ммоль) обрабатывают бромом (3 ммоль) при 0°С в течение 1 ч. Затем добавляют водный раствор нитрита натрия и рекционную смесь перемешивают при 0°С в течение 0,5 ч. Затем добавляют водный раствор гидроксида натрия (9,4 ммоль) и реакционную смесь перемешивают при 25°С в течение 1 ч. Экстракция и хроматография дают 2,3-дибром-6-пиколин и 2,3,5-трибром-6-пиколин.
Стадия J. 2,3-Дибром-6-пиколин подвергают обработке в соответствии со стадией В примера 15 и затем в соответствии со стадией С примера 3, получая 5-бром-2-метил-6-[2-(5-фосфоно)фуранил]пиридин (15.5). Т.пл. 207-208°С.
Анализ для C10H9BrNO4P+0,6HBr:
Следуя указанным выше методикам или в некоторых случаях внося в них некоторые небольшие изменения, используя обычные химические реакции, получают следующие соединения.
(15.6) 2-[2-(5-Фосфоно)фуранил]пиридин. Т.пл. 220-221°С. Анализ для C9H8NO4P+0,1Н2O+0,45HBr:
(15.7) 2-Амино-3-нитро-6-[2-(5-фосфоно)фуранил]пиридин. Т.пл. 221-222°С.
Анализ для С9Н8N3О6Р+0,55HBr+0,02РhСН3:
(15.8) 2,3-Диамино-6-[2-(5-фосфоно)фуранил]пиридин. Т.пл. 150-153°С.
Анализ для С9Н10N3O4Р+1,5HBr+0,05РhСН3:
(15.9) 2-Хлор-6-[2-(5-фосфоно)фуранил]пиридин. Т.пл. 94-96°С.
Анализ для C9H7ClNO4P+0,25HBr:
(15.10) 3,5-Дихлор-2-[2-(5-фосфоно)фуранил]пиридин. Т.пл. 180-181°С.
Анализ для С9Н6ClNO4Р+0,7HBr:
(15.11) 3-Хлор-5-трифторметил-2-[2-(5-фосфоно)фуранил]пиридин. Т.пл. 253-254°С.
Анализ для C10H6ClF3NO4P:
(15.12) 2-Амино-3-этил-6-[2-(5-фосфоно)фуранил]пиридин. Т.пл. 220-221°С.
Анализ для C11H13N2O4P+0,6HBr+0,2Н2O:
(15.13) 6-Амино-3-этил-2-[2-(5-фосфоно)фуранил]пиридин.
Анализ для С11Н13N2O4Р+1,0HBr+0,3Н2O:
(15.14) 6-Амино-3-пропил-2-[2-(5-фосфоно)фуранил]пиридин. Т.пл. 252-253°С.
Анализ для C12H15N2O4P+1,0HBr+1,0Н2O+0,32РhСН3:
(15.15) 2,4-Диметил-3-бром-6-[2-(5-фосфоно)фуранил]пиридин. Т.пл. 232-233°С.
Анализ для С11Н11BrNO4Р+0,45HBr:
(15.16) 2-Хлор-4-амино-6-[2-(5-фосфоно)фуранил]пиридин.
Анализ для C9H8N2O4PCl+HBr+0,5SH2O+МеОН:
(15.17) 3-Гидрокси-2-[2-(5-фосфоно)фуранил]пиридин.
Анализ для C9H8NO5P+1,1HBr+0,3СН3Ph:
(15.19) 2-Амино-3-циклопропил-6-[2-(5-фосфоно)фуранил]пиридин.
Анализ для C12H13N2O4PCl+HBr+0,4Н2O:
(15.20) 2-Амино-5-циклопропил-6-[2-(5-фосфоно)фуранил]пиридин.
Анализ для C12H13N2O4P+HBr+0,7СН3Ph:
(15.21) 5-Амино-2-метокси-6-[2-(5-фосфоно)фуранил]пиридин.
Анализ для C10H11N2O5P+0,2H2O:
(15.22) 2-Метил-5-циано-6-[2-(5-фосфоно)фуранил]пиридин.
Анализ для C11H9N2O4P+0,75HBr+0,5Н2O+0,5MePh:
(15.23) 2-Амино-3,5-бис(циано)-4-метил-6-[2-(5-фосфоно)фуранил]пиридин.
Анализ для C12H9N4O4P+0,7Н2O:
(15.24) 2-Хлор-4-циано-6-[2-(5-фосфоно)фуранил]пиридин.
Анализ для C10H6N2O4PCl:
Пример 16
Получение 2-[2-(5-фосфоно)фуранил]пиримидинов и 4-[2-(5-фосфоно)фуранил]пиримидинов
Стадия А. Раствор 5-диэтилфосфоно-2-[(1-оксо)пентил]фурана в диметилацетале N,N-диметилформамида кипятят с обратным холодильником в течение 12 ч. Упаривание и хроматография дают диэтил-5-(2-пропил-3-N,N-диметиламино)акрилоил-2-фуранфосфонат.
Стадия В. Раствор диэтил-5-(2-пропил-3-N,N-диметиламино) акрилоил-2-фуранфосфоната (1 ммоль) в этаноле обрабатывают гидрохлоридом гуанидина (1,2 ммоль) и этоксидом натрия (1 ммоль) при 80°С в течение 12 ч. Реакционную смесь упаривают и остаток растворяют в воде. Водный раствор нейтрализуют HCl (2N) и концентрируют при пониженном давлении. Остаток выпаривают совместно с толуолом, получая 2-амино-5-пропил-4-[2-(5-этилфосфоно)фуранил]пиримидин в виде желтого твердого вещества.
Стадия С. 2-Амино-5-пропил-4-[2-(5-этилфосфоно)фуранил]пиримидин (1 ммоль) и тионилхлорид нагревают при кипячении с обратным холодильником в течение 2 ч. Реакционную смесь упаривают досуха, остаток растворяют в метиленхлориде и обрабатывают избытком пиридина и этанолом при 25°С в течение 12 ч. Упаривание и хроматография дают 2-амино-5-пропил-4-[2-(5-диэтилфосфоно)фуранил]пиримидин.
Стадия D. 2-Амино-5-пропил-4-[2-(5-диэтилфосфоно)фуранил]пиримидин подвергают обработке в соответствии со стадией С примера 3, получая 2-амино-5-пропил-4-[2-(5-фосфоно)фуранил]пиримидин (16.1). Т.пл. 258-259°С.
Анализ для C11H14N3O4P+1,33Н2O:
Следуя указанной методике получают соединение (16.2) - 2-амино-5-изобутил-4-[2-(5-фосфоно)фуранил]пиримидин. Т.пл. 218-220°С.
Анализ для C12H16N3O4P+0,75HBr+0,3РhСН3:
Альтернативно, следуя приведенным ниже методикам, можно получить другие 4-[2-(5-фосфоно)фуранил]пиримидины.
Стадия Е. Соединение 2.2 подвергают обработке в соответствии со стадией А примера 16, получая диэтил-5-(3-N,N-диметиламино)акрилоил-2-фуранфосфонат в виде оранжевого твердого вещества.
Стадия F. Раствор диэтил-5-(3-N,N-диметиламино)акрилоил-2-фуранфосфоната (1 ммоль), этанольный раствор этоксида натрия (2 ммоль) и гидрохлорид гуанидина (1,1 ммоль) нагревают при 55°С в течение 2 ч. Реакционную смесь охлаждают на бане со льдом и нейтрализуют 1N HCl. Упаривание и хроматография дают 2-амино-4-[2-(5-диэтилфосфоно)фуранил]пиримидин в виде желтого твердого вещества.
Стадия G. 2-Амино-4-[2-(5-диэтилфосфоно)фуранил]пиримидин подвергают обработке в соответствии со стадией С примера 3, получая 2-амино-4-[2-(5-фосфоно)фуранил]пиримидин (16.3). Т.пл. > 230°С.
Анализ для C8H8N3O4P+0,75Н2O+0,2HBr:
Стадия Н. Раствор 2-амино-4-[2-(5-диэтилфосфоно)фуранил]пиримидина (1 ммоль) в метаноле и хлороформе обрабатывают NBS (1,5 ммоль) при 25°С в течение 1 ч. Экстракция и хроматография дают 2-амино-5-бром-4-[2-(5-диэтилфосфоно)фуранил]пиримидин в виде желтого твердого вещества.
Стадия I. 2-Амино-5-бром-4-[2-(5-диэтилфосфоно)фуранил]пиримидин подвергают обработке в соответствии со стадиями F и G примера 15 с последующей обработкой в соответствии со стадией С примера 3, получая 2-амино-5-этил-4-[2-(5-фосфоно)фуранил]пиримидин (16.4). Т.пл. > 225°С.
Анализ для C10H12N3O4P+1,4Н2O+0,2HBr+0,25РhСН3:
Следуя указанным выше методикам или в некоторых случаях внося в них некоторые небольшие изменения, используя обычные химические реакции, получают следующие соединения.
(16.5) 2-[2-(5-Фосфоно)фуранил]пиримидин. Т.пл. 194-196°С.
Анализ для C8H7N2O4P+0,1Н2O+0,55HBr:
(16.6) 2-Амино-6-метил-4-[2-(5-фосфоно)фуранил]пиримидин. Т.пл. 238-239°С.
Анализ для С9Н10N3О4P+0,9HBr:
(16.7) 2-Метилтио-4-[2-(5-фосфоно)фуранил]пиримидин. Т.пл. 228-229°С.
Анализ для С9Н9N2O4PS+0,5Н2O:
(16.8) 2-Метил-4-[2-(5-фосфоно)фуранил]пиримидин. Т.пл. 206-212°С.
Анализ для C9H9N2O4P+0,9Н2О+0,25HBr:
(16.9) 4,6-Диметил-5-бром-2-[2-(5-фосфоно)фуранил]пиримидин. Т.пл. 251-252°С.
Анализ для С10Н10BrN2O4Р:
(16.10) 2-Амино-5-хлор-4-[2-(5-фосфоно)фуранил]пиримидин.
Анализ для С8Н7ClN3O4Р+0,5Н2О:
(16.11) 2-Амино-6-метилтио-4-[2-(5-фосфоно)фуранил]пиримидин.
Анализ для С9Н10N3O4PS+HBr:
(16.12) 2-Амино-5-бром-6-метилтио-4-[2-(5-фосфоно)фуранил]пиримидин.
Анализ для С9Н9N3O4PSBr+0,8HBr+0,2МеРh:
(16.13) 2-Амино-(4-морфолино)-4-[2-(5-фосфоно)фуранил]пиримидин. Т.пл. > 230°С.
Анализ для C12H15N4O5P+HBr+0,05MePh:
(16.14) 6-Амино-4-хлор-2-[2-(5-фосфоно)фуранил]пиримидин. Т.пл. > 230°С.
Анализ для С8Н7N3O4PCl+0,5Н2O:
Пример 17
Получение 2-[2-(5-фосфоно)фуранил]пиразинов и 2-[2-(5-фосфоно)фуранил]триазинов
Стадия А. Изложенные в примере 16 методики можно также применить к синтезу аналогов 2-[2-(5-фосфоно)фуранил]пиразина и 2-[2-(5-фосфоно)фуранил]триазина, а в некоторых случаях использовать их с некоторыми небольшими изменениями, применяя обычные химические способы.
В соответствии с этим получают следующие соединения.
(17.1) 2,5-Диметил-3-[2-(5-фосфоно)фуранил]пиразин. Т.пл. 212-213°С.
Анализ для C10H11N2O4P+0,75HBr:
(17.2) 2-Хлор-6-[2-(5-фосфоно)фуранил]пиразин. Т.пл. 204-205°С.
Анализ для C8H6ClN2O4P+0,3HBr+0,02РhСН3:
(17.3) 2-Амино-3-пропил-6-[2-(5-фосфоно)фуранил]пиразин. Т.пл. 227-228°С.
Анализ для C11H14N3O4P+0,7HBr:
(17.4) 2-Амино-6-[2-(5-фосфоно)фуранил]пиразин. Т.пл. 235-236°С.
Анализ для C8H8N3O4P+1,15Н2O+0,3РhСН3:
(17.5) 2-Амино-3-бром-6-[2-(5-фосфоно)фуранил]пиразин.
Анализ для С8Н7N3O4PBr+1HBr:
(17.6) 3-Метилтио-2-[2-(5-фосфоно)фуранил]пиразин.
Анализ для C9H9N2O4PS+0,3Н2O:
(17.7) 6-Амино-3-метилтио-2-[2-(5-фосфоно)фуранил]пиразин.
Анализ для С9Н10N3O4PS+1,5Н2O+1,7HBr+0,25МеРh:
(17.8) 6-Амино-5-метилтио-2-[2-(5-фосфоно)фуранил]пиразин.
Анализ для С9Н10N3O4PS+1,1HBr+0,05MePh:
(17.9) 6-Амино-5-метоксикарбонил-3-хлор-2-[2-(5-фосфоно)фуранил]пиразин.
Анализ для С10Н9N3О6PCl+0,3HBr+0,04MePh:
(17.10) Аммонийная соль 6-амино-3-метилтио-2-[2-(5-фосфоно)фуранил]пиразина.
Анализ для C9H13N4O4PS+0,8HBr:
(17.11) 2-Амино-4-фенил-6-[2-(5-фосфоно)фуранил]триазин.
Анализ для С13Н11N4O4Р+HBr+0,1EtOAc:
Пример 18
Получение аналогов с X, представляющим метоксикарбонил, метилтиокарбонил, метиламинокарбонил и метилкарбониламино
Получение 4-фосфонометоксикарбонилтиазолов и 4-фосфонометоксикарбонилоксазолов
Стадия А. Раствор 2-амино-4-этоксикарбонилтиазола (1 ммоль) в 1,4-диоксане (5 мл) обрабатывают ди-трет-бутилдикарбонатом (1,2 ммоль), TMEDA (0,1 ммоль) и DMAP (0,1 ммоль) при комнатной температуре. После перемешивания реакционной смеси в течение 20 ч ее упаривают досуха. Остаток подвергают экстракции, получая 2-[N-Boc(амино)]-4-этоксикарбонилтиазол в виде желтого твердого вещества.
Стадия В. Раствор 2-[N-Boc(амино)]-4-этоксикарбонилтиазола (1 ммоль) в смеси 2:1 EtOH:H2O (10 мл) обрабатывают NaOH (3N, 3 ммоль) и реакционную смесь перемешивают при 60°С в течение 4 ч. Реакционную смесь охлаждают до 0°С, нейтрализуют до рН 5 при помощи 3N HCl и полученное твердое вещество собирают фильтрованием, получая 2-[N-Boc(амино)]-4-карбоксилтиазол в виде белого твердого вещества.
Стадия С. Суспензию 2-[N-Boc(амино)]-4-карбоксилтиазола (1 ммоль) в СН2CL2 (5 мл) обрабатывают тионилхлоридом (4 ммоль) при комнатной температуре. После перемешивания в течение 4 ч реакционную смесь упаривают досуха. Остаток растворяют в CH2Cl2 (5 мл) и добавляют в раствор диэтил(гидроксиметил)фосфоната (1,5 ммоль) и пиридина (2 ммоль) в СН2Cl2 (5 мл) при 0°С. Реакционную смесь нагревают до комнатной температуры и перемешивают в течение 4 ч. Реакцию гасят водой и смесь подвергают экстракции, получая 2-[N-Boc(амино)]-4-диэтилфосфонометоксикарбонилтиазол в виде густого желтого масла.
Альтернативно сложноэфирную связь можно получить, используя метод смешанных ангидридов, как показано в следующих методиках.
Раствор 2-[N-Boc(амино)]-4-карбоксилтиазола (1 ммоль) в пиридине (5 мл) обрабатывают пара-толуолсульфонилхлоридом (2 ммоль), а затем диэтил(гидроксиметил)фосфонатом (2 ммоль) при комнатной температуре в течение 4 ч. Упаривание, экстракция и хроматография дают 2-[N-Boc(амино)]-4-диэтилфосфонометоксикарбонилтиазол в виде густого желтого масла.
Стадия D. Раствор 2-[N-Boc(амино)]-4-диэтилфосфонометоксикарбонилтиазола (1 ммоль) и анизола (0,1 ммоль) в метиленхлориде (5 мл) и трифторуксусной кислоты (5 мл) перемешивают при 0°С в течение 1 ч и при комнатной температуре в течение 1 ч. Упаривание, экстракция и хроматография дают 2-амино-4-диэтилфосфонометоксикарбонилтиазол в виде твердого вещества.
Стадия Е. 2-Амино-4-диэтилфосфонометоксикарбонилтиазол подвергают обработке в соответствии со стадией С примера 3, получая 2-амино-4-фосфонометоксикарбонилтиазол (18.1) в виде твердого вещества. Т.пл. > 240°С (разл.).
Анализ для C5H7N2O5PS:
Стадия F. Раствор 2-[N-Boc(амино)]-4-диэтилфосфонометоксикарбонилтиазола (1 ммоль) в CH2Cl2 (5 мл) обрабатывают бромом (2 ммоль) при комнатной температуре в течение 4 ч. Упаривание и экстракция дают 2-[N-Boc(амино)]-5-бром-4-диэтилфосфонометоксикарбонилтиазол в виде оранжевого масла, которое подвергают обработке в соответствии со стадией D примера 18, а затем в соответствии со стадией С примера 3, получая 2-амино-5-бром-4-фосфонометоксикарбонилтиазол (18.2) в виде твердого вещества. Т.пл. > 230°С (разл.).
Анализ для С5Н6N2O5PSBr:
Стадия G. Раствор 2-[N-Boc(амино)]-5-бром-4-диэтилфосфонометоксикарбонилтиазола (1 ммоль) и дихлорбис(трифенилфосфин)палладия (II) (0,1 ммоль) в ДМФ (5 мл) обрабатывают трибутил(винил)оловом (2,5 ммоль) и реакционную смесь перемешивают при 60°С в течение 2 ч. Растворитель удаляют и остаток поглощают EtOAc и перемешивают с 2 ммолями NaF в 5 мл воды в течение 1 ч. Экстракция и хроматография дают 2-[N-Boc(амино)]-5-винил-4-диэтилфосфонометоксикарбонилтиазол в виде желтого твердого вещества.
Стадия Н. Суспензию 2-[N-Boc(амино)]-5-винил-4-диэтилфосфонометоксикарбонилтиазола (1 ммоль) и 10% Pd/C (0,5 ммоль) в МеОН (5 мл) перемешивают в атмосфере Н2 (баллон) при комнатной температуре в течение 15 ч. Фильтрование и упаривание дают 2-[N-Boc(амино)]-5-этил-4-диэтилфосфонометоксикарбонилтиазол в виде желтого твердого вещества, которое подвергают обработке в соответствии со стадией D примера 18, а затем в соответствии со стадией С примера 3, получая 2-амино-5-этил-4-фосфонометоксикарбонилтиазол (18.3) в виде твердого вещества. Т.пл. > 230°С (разл.).
Анализ для С7Н11N2O5PS:
Стадия I. Раствор метилового эфира N-[бис(метилтио)метилен]глицина (1 ммоль) в безводном ТГФ (2 мл) добавляют к раствору т-BuOK (1,4 ммоль) в безводном ТГФ (10 мл) при -78°С и смесь перемешивают в течение 30 мин. Затем добавляют раствор этилизотиоцианата (1 ммоль) в безводном ТГФ (2 мл) и реакционную смесь перемешивают при -78°С в течение 30 мин и при комнатной температуре в течение 2 ч. Реакцию гасят водой. Экстракция и хроматография дают 2-метилтио-5-(N-этиламино)-4-метоксикарбонилтиазол в виде желтого твердого вещества, которое подвергают обработке в соответствии со стадиями В и С примера 18, а затем в соответствии со стадией С примера 3, получая 2-метилтио-5-(N-этиламино)-4-фосфонометоксикарбонилтиазол (18.4) в виде твердого вещества. Т.пл. > 200°С (разл.).
Анализ для C8H13N2O5PS2+0,1HBr:
Стадия J. Раствор 1 ммоля хлорангидрида 2-[N-Boc(амино)]-4-тиазолкарбоксилата (1 ммоль) и пиридина (2 ммоль) в СН2Cl2 (5 мл) охлаждают до -78°С и через раствор барботируют H2S (газ) в течение 10 мин. Реакционную смесь перемешивают при -78°С в течение 30 мин и затем нагревают до комнатной температуры. Смесь промывают 3N HCl. Органическую фазу отделяют, сушат и концентрируют, получая 2-[N-Boc(амино)]-4-тиазолтиокарбоновую кислоту в виде желтого твердого вещества.
Стадия К. Раствор полученной 2-[N-Boc(амино)]-4-тиазолтиокарбоновой кислоты (1 ммоль) в ТГФ (5 мл) охлаждают до -78°С и обрабатывают небольшими порциями NaH (2 ммоль). Спустя 10 мин реакционную смесь обрабатывают раствором диэтилфосфонометилтрифлата в ТГФ (5 мл). Реакционную смесь перемешивают при -78°С в течение 1 ч и затем гасят Н2О. Экстракция и хроматография дают 2-[N-Boc(амино)]-4-диэтилфосфонометилтиокарбонилтиазол в виде густого масла, которое подвергают обработке в соответствии со стадией D примера 18, а затем в соответствии со стадией С примера 3, получая 2-амино-4-фосфонометилтиокарбонилтиазол (18.5) в виде твердого вещества. Т.пл. > 230°С (разл.).
Анализ для C5H7N2O4PS2:
Получение 4-[(N-фосфонометил)карбамоил]тиазола, 3-[(N-фосфонометил)карбамоил]изотиазола и 2-[(N-фосфонометил)карбамоил]пиридина
Стадия L. Раствор 2-[N-Boc(амино)]-4-тиазолкарбоновой кислоты (1 ммоль) в ДМФ (5 мл) обрабатывают гидрохлоридом 1-(3-диметиламинопропил)-3-этилкарбодиимида (EDCI, 1,5 ммоль) и 1-гидроксилбензотриазолгидратом (HOBt, 1,5 ммоль) с последующим добавлением диэтиламинометилфосфоната (1,5 ммоль) при комнатной температуре в течение 24 ч. Реакционную смесь подвергают упариванию, экстракции и хроматографии, получая 2-[N-Boc(амино)]-4-[(N-диэтилфосфонометил)карбамоил]тиазол в виде белого твердого вещества, которое подвергают обработке в соответствии со стадией D примера 18, а затем в соответствии со стадией С примера 3, получая 2-амино-4-[(N-фосфонометил)карбамоил]тиазол (18.6) в виде светло-коричневого твердого вещества. Т.пл. > 245°С (разл.).
Анализ для С5Н8N3O4PS+1,05HBr:
Получение 2-[(N-фосфоноацетил)амино]тиазола и 2-[(N-фосфоноацетил)амино]пиридина
Стадия М. Раствор гидрохлорида 2-амино-4,5-диметилтиазола (2 ммоль) и диэтилфосфоноуксусной кислоты (1 ммоль) в ДМФ (5 мл) обрабатывают EDCI (1,5 ммоль), HOBt (1,5 ммоль) и триэтиламином (2 ммоль) при комнатной температуре в течение 24 ч. Реакционную смесь подвергают упариванию, экстракции и хроматографии, получая 2-[(N-диэтилфосфоноацетил)амино]-4,5-диметилтиазол в виде желтого твердого вещества, которое подвергают обработке в соответствии со стадией D примера 18, а затем в соответствии со стадией С примера 3, получая 4,5-диметил-2-[(N-фосфоноацетил)амино]тиазол (18.7) в виде светло-коричневого твердого вещества. Т.пл. > 250°С.
Анализ для C7H11N2O4PS:
Используя некоторые из описанных выше методик или некоторые из этих методик с внесенными в них небольшими изменениями, используя обычную химию, получают следующие соединения.
(18.8) 2-[(N-Фосфонометил)карбамоил]пиридин.
Анализ для С7Н9N2O4Р+HBr+0,67H2O:
(18.9) 2-[(N-фосфоноацетил)амино]пиридин.
Анализ для C7H9N2O4P+HBr+0,67Н2O:
(18.10) 4-Этоксикарбонил-2-[(N-фосфоноацетил)амино]тиазол.
Анализ для C8H11N2O6PS:
(18.11) 2-Амино-5-бром-4-[(N-фосфонометил)карбамоил]тиазол. Т.пл. 232°С (разл.).
Анализ для С5Н7N3O4PSBr+0,15HBr+0,1 гексан:
(18.12) 2-Амино-5-(2-тиенил)-4-[(N-фосфонометил)карбамоил]тиазол. Т.пл. 245°С (разл.).
Анализ для С9H10N3О4PS2+HBr+0,1EtOAc:
(18.13) 4,5-Дихлор-3-[(N-фосфонометил)карбамоил]изотиазол. Т.пл. 189-191°С.
Анализ для C5H5N2O4PSCl2:
(18.14) 2-Амино-5-бром-4-{[N-(1-фосфоно-1-фенил)метил] карбамоил}тиазол. Т.пл. > 250°С.
Анализ для С11Н11N3О4PSBr:
(18.15) 2-Амино-5-(2-тиенил)-4-фосфонометоксикарбонилтиазол. Т.пл. > 230°С (разл.).
Анализ для C9H9N2O5PS2:
(18.16) 2-Амино-5-бензил-4-фосфонометоксикарбонилтиазол. Т.пл. > 230°С (разл.).
Анализ для C12H13N2O5PS:
(18.17) 2-Метилтио-5-метиламине-4-фосфонометоксикарбонилтиазол.
Анализ для С7Н11N2O5PS2+0,2HBr:
(18.18) 2-Амино-5-этил-4-[(N-фосфонометил)карбамоил]тиазол. Т.пл. 180°С (разл).
Анализ для С7Н12N3O4PS2+HBr+0,4CH2Cl2:
(18.19) 2-Амино-5-изопропил-4-[(N-фосфонометил)карбамоил] тиазол. Т.пл. 247-250°С.
Анализ для C8H14N3O4PS:
(18.20) 2-Амино-5-изопропил-4-фосфонометоксикарбонилтиазол. Т.пл. > 230°С.
Анализ для С8Н13N2O5PS:
(18.21) 2-Амино-5-фенил-4-фосфонометоксикарбонилтиазол. Т.пл. > 230°С.
Анализ для C11H11N2O5PS:
(18.22) 2-Амино-4-фосфонометоксикарбонилоксазол.
Анализ для С5Н7N2О6Р+0,09HBr:
(18.23) 2-Амино-6-[(N-фосфоноацетил)амино]пиридин.
Анализ для С7Н10N3O4Р+1,1HBr+0,25МеОН:
(18.24) 2-Амино-5-метил-4-[(N-фосфонометил)карбамоил]тиазол. Т.пл. > 250°С.
Анализ для C6H10N3O4PS+0,06EtOAc:
(18.25) 2-Амино-3-бром-6-[(N-фосфоноацетил)амино]пиридин.
Анализ для С7Н9N3O4PBr+1,25HBr+0,8EtOAc:
(18.26) 2-Амино-3,5-дибром-6-[(N-фосфоноацетил)амино]пиридин.
Анализ для С7Н8N3O4PBr2+HBr+0,5EtOAc:
(18.27) 2-Амино-5-метил-4-фосфонометоксикарбонилтиазол. Т.пл. 230°С (разл.).
Анализ для С6Н9N2O5PS:
(18.28) 2-Амино-3,5-диэтил-6-[(N-фосфоноацетил)амино]пиридин. МС для С11Н18N3O4Р+Н: вычислено 288, найдено 288.
(18.29) 2-Амино-3,5-дибром-6-{[N-(2,2-дибром-2-фосфоно)ацетил]амино}пиридин.
Анализ для C7H6N3O4PBr4+0,5HBr+EtOAc:
(18.30) 2-Амино-5-изопропил-4-фосфонометоксикарбонилоксазол.
Анализ для C8H13N2O6P+0,2HBr:
(18.31) 2-Амино-5-[1-(2-циклогексилметил)этинил]-4-фосфонометоксикарбонилтиазол. Т.пл. 230°С (разл.).
Анализ для C14H19N2O5PS+0,1HBr:
(18.32) 2-Амино-5-[1-(4-циано)бутинил]-4-фосфонометоксикарбонилтиазол. Т.пл. 230°С (разл.).
Анализ для С10Н10N3О5PS+0,25HBr:
(18.33) 2-Амино-5-метил-4-фосфонометоксикарбонилоксазол.
Анализ для С6Н9N2O6Р+0,15HBr:
(18.34) 2-Амино-5-[1-(4-циано)бутил]-4-фосфонометоксикарбонилтиазол. Т.пл. 230°С (разл.).
Анализ для С10Н14N3O5PS:
(18.35) 2-Амино-5-пентил-4-фосфонометоксикарбонилоксазол.
Анализ для C10H17N2O6P:
(18.36) 2-[N-Boc(амино)]-4-[(2-фосфоно)этоксикарбонил]тиазол.
Анализ для C11H17N2O7PS:
(18.37) Гидробромид 2-амино-4-[(2-фосфоно)этоксикарбонил]тиазола.
Анализ для С6Н9N2O5PS+HBr:
(18.38) 2-Амино-5-бутил-4-фосфонометоксикарбонилоксазол.
Анализ для С9Н15N2О6Р:
(18.39) 2-Амино-5-[1-(1-оксо-2,2-диметил)пропил]-4-фосфонометоксикарбонилтиазол.
Анализ для C10H15N2O6PS:
(18.40) 2-Амино-5-пропил-4-фосфонометоксикарбонилоксазол.
Анализ для C8H13N2O6P+0,35EtOAc+0,05HBr:
(18.41) 2-Амино-5-пропил-4-фосфонометоксикарбонилтиазол. Т.пл. 134°С (разл.).
Анализ для C8H13N2O5PS:
(18.42) 2-Амино-5-пентил-4-фосфонометоксикарбонилтиазол. Т.пл. 130°С (разл.).
Анализ для С10Н17N2О5PS:
(18.43) 2-Амино-5-бром-4-фосфонометилтиокарбонилтиазол. Т.пл. 230°С (разл.). Анализ для С5Н6N2O5PS2Br:
(18.44) 2-Амино-5-(2-фуранил)-4-фосфонометоксикарбонилтиазол. Т.пл. 230°С (разл.).
Анализ для С9Н9N2O6PS:
(18.45) 2-Амино-5-этил-4-фосфонометоксикарбонилоксазол. Т.пл. 141°С (разл.).
Анализ для С7Н11N2O6Р:
(18.46) 5-Метил-4-[(N-фосфонометил)карбамоил]имидазол.
Анализ для С6Н10N3O4Р:
Пример 19
Получение 3-[2-(5-фосфоно)фуранил]пиразолов
Стадия А. Раствор диэтил-5-(2-изобутил-3-N,N-диметиламино)акрилоил-2-фуранфосфоната (1 ммоль, полученного в соответствии со стадией А примера 17) в этаноле обрабатывают гидразином (1,2 ммоль) при 80°С в течение 12 ч. Упаривание и хроматография дают 4-изобутил-3-[2-(5-диэтилфосфоно)фуранил]пиразол.
Стадия В. 4-Изобутил-3-[2-(5-диэтилфосфоно)фуранил]пиразол подвергают обработке в соответствии со стадией С примера 3, получая 4-изобутил-3-[2-(5-фосфоно)фуранил]пиразол
(19.1). Т.пл. 210-215°С.
Анализ для C11H15N2O4P:
Стадия С. 4-Изобутил-3-[2-(5-диэтилфосфоно)фуранил]пиразол подвергают обработке в соответствии со стадией А примера 11, получая 1-метил-4-изобутил-3-[2-(5-диэтилфосфоно)фуранил]пиразол.
Стадия D. 1-Метил-4-изобутил-3-[2-(5-диэтилфосфоно)фуранил]пиразол подвергают обработке в соответствии со стадией С примера 3, получая 1-метил-4-изобутил-3-[2-(5-фосфоно)фуранил]пиразол (19.2).
Анализ для C12H17N2O4P+0,85HBr+0,75Н2O:
Пример 20
Получение 3-[2-(5-фосфоно)фуранил]изоксазолов
Стадия А. Раствор 5-диэтилфосфоно-2-фуральдегида (1 ммоль) в этаноле обрабатывают гидроксиламином (1,1 ммоль) и ацетатом натрия (2,2 ммоль) при 25°С в течение 12 ч. Экстракция и хроматография дают 5-диэтилфосфоно-2-фуральдегидоксим.
Стадия В. Раствор 5-диэтилфосфоно-2-фуральдегидоксима (1 ммоль) в ДМФ обрабатывают N-хлорсукцинимидом (1,1 ммоль) при 25°С в течение 12 ч. Экстракция дает 5-диэтилфосфоно-2-хлороксимидофуран.
Стадия С. Раствор 5-диэтилфосфоно-2-хлороксимидофурана (1 ммоль) и этилпропиолата (5 ммоль) в диэтиловом эфире обрабатывают триэтиламином (2 ммоль) при 25°С в течение 12 ч. Экстракция и хроматография дают 5-этоксикарбонил-3-[2-(5-диэтилфосфоно)фуранил]изоксазол.
Стадия D. 5-Этоксикарбонил-3-[2-(5-диэтилфосфоно)фуранил]изоксазол подвергают обработке в соответствии со стадией А примера 9, а затем в соответствии со стадией С примера 3, получая 5-карбамоил-3-[2-(5-фосфоно)фуранил]изоксазол (20.1).
Т.пл. 221-225°С.
Анализ для С8Н7N2О6Р+0,25EtOH:
В соответствии с указанной методикой получают следующие соединения.
(20.2) 5-Этоксикарбонил-4-метил-3-[2-(5-фосфоно)фуранил]изоксазол. Т.пл. 150-152°С.
Анализ для C11H12NO7P+0,25Н2О+0,15HBr:
(20.3) 4,5-Бис(этоксикарбонил)-3-[2-(5-фосфоно)фуранил]изоксазол.
Анализ для C13H14NO9P:
(20.4) 5-Амино-4-этоксикарбонил-3-[2-(5-фосфоно)фуранил]изоксазол. Т.пл. 190°С (разл.).
Анализ для С10Н11N2O7Р+0,25HBr:
(20.5) 4,5-Бис(карбамоил)-3-[2-(5-фосфоно)фуранил]изоксазол. Т.пл. > 220°С.
Анализ для С9Н8N3О7Р:
(20.6) 4-Этоксикарбонил-5-трифторметил-3-[2-(5-фосфоно)фуранил]изоксазол.
Анализ для С11Н9F3NO7Р+0,25HBr:
(20.7) 5-Амино-4-(2-фурил)-3-[2-(5-фосфоно)фуранил]изоксазол. Т.пл. > 220°С.
Анализ для C12H9N2O7P+0,1AcOEt:
(20.8) 4-Амино-5-циано-3-[2-(5-фосфоно)фуранил]изоксазол.
Анализ для C8H6N3O5P+0,1H2O+0,2HBr:
(20.9) 4-Циано-5-фенил-3-[2-(5-фосфоно)фуранил]изоксазол.
Анализ для C14H9N2O5P+0,15HBr:
Пример 21
Получение 2-[2-(5-фосфоно)фуранил]тиазолов
Стадия А. Диэтил-5-трибутилстаннил-2-фуранфосфонат (14) и 2-бром-4-этоксикарбонилтиазол подвергают обработке в соответствии со стадией А примера 6, получая 4-этоксикарбонил-2-[2-(5-диэтилфосфоно)фуранил]тиазол.
Стадия В. 4-Этоксикарбонил-2-[2-(5-диэтилфосфоно)фуранил]тиазол подвергают обработке в соответствии со стадией А примера 9, а затем в соответствии со стадией С примера 3, получая 4-карбамоил-2-[2-(5-фосфоно)фуранил]тиазол (21.1). Т.пл. 239-240°С.
Анализ для C8H7N2O5PS+0,2Н2O:
Пример 22
Получение 4-(3,3-дифтор-3-фосфоно-1-пропил)тиазолов
Стадия А. Раствор 3-(трет-бутилдифенилсилилокси)-1-пропанола (1 ммоль) в метиленхлориде (7 мл) обрабатывают порошкообразными молекулярными ситами (4Å, 0,5 экв. мас./мас.) и хлорхроматом пиридиния (1,5 ммоль) при 0°С. Полученную смесь перемешивают при комнатной температуре в течение 2 ч, разбавляют диэтиловым эфиром (7 мл) и перемешивают при комнатной температуре в течение еще 30 мин. Фильтрование, упаривание и хроматография дают 3-(трет-бутилдифенилсилилокси)-1-пропаналь в виде прозрачного масла.
Стадия В. Раствор LDA (1,06 ммоль) в ТГФ обрабатывают раствором диэтилдифторметилфосфоната (1 ммоль) при -78°С в течение 45 мин. Затем реакционную смесь обрабатывают раствором 3-(трет-бутилдифенилсилилокси)-1-пропаналя (1,07 ммоль) в ТГФ и полученный раствор перемешивают при -78°С в течение еще 4 ч. Реакцию гасят фенилхлортиоформиатом (2,14 ммоль) и реакционную смесь подвергают экстракции и хроматографии, получая диэтил-4-(трет-бутилдифенилсилилокси)-3-фенокситиокарбонилокси-2,2-дифторбутилфосфонат в виде прозрачного масла.
Стадия С. Раствор диэтил-4-(трет-бутилдифенилсилилокси)-3-фенокситиокарбонилокси-2,2-дифторбутилфосфоната (1 ммоль) в толуоле (1 мл) обрабатывают гидридом три-н-бутилолова (1,5 ммоль) и AIBN (0,1 ммоль) и полученную реакционную смесь кипятят с обратным холодильником в течение 2 ч. Упаривание и хроматография дают диэтил-4-(трет-бутилдифенилсилилокси)-2,2-дифторбутилфосфонат в виде прозрачного масла.
Стадия Д. Раствор диэтил-4-(трет-бутилдифенилсилилокси)-2,2-дифторбутилфосфоната (1 ммоль) в метаноле (1 мл) обрабатывают хлористоводородной кислотой (4N, 4 ммоль) при 0°С и полученную реакционную смесь перемешивают при комнатной температуре в течение 2 ч. Упаривание и хроматография дают диэтил-4-гидрокси-2,2-дифторбутилфосфонат в виде прозрачного масла.
Стадия Е. Раствор полученного диэтил-4-гидрокси-2,2-дифторбутилфосфоната (1 ммоль) в ацетоне (10 мл) обрабатывают реагентом Джонса (10 ммоль) при 0°С в течение 30 мин. Реакцию гасят 2-пропанолом (10 мл) и полученную смесь фильтруют через слой целита. Упаривание фильтрата с последующей экстракцией дает диэтил-3-карбокси-2,3-дифторпропилфосфонат в виде масла.
Стадия F. Раствор диэтил-3-карбокси-2,3-дифторпропилфосфоната (1 ммоль) в тионилхлориде (3 мл) кипятят с обратным холодильником в течение 2 ч. Реакционную смесь упаривают досуха, остаток растворяют в диэтиловом эфире (1 мл) и обрабатывают эфирным раствором диазометана (10 ммоль) при 0°С в течение 30 мин. В реакционную смесь добавляют раствор HBr в уксусной кислоте (30%, 1 мл) и полученный раствор перемешивают при комнатной температуре в течение 1 ч. Реакционную смесь упаривают досуха и остаток растворяют в смеси ТГФ-EtOH (1:1,5 мл) и обрабатывают тиомочевиной (1 ммоль). Полученную реакционную смесь нагревают до 75°С в течение 1 ч. Упаривание с последующей экстракцией и хроматографией дает 2-амино-4-[1-(3-диэтилфосфоно-3,3-дифтор)пропил]тиазол в виде твердого вещества, которое подвергают обработке в соответствии со стадией С примера 3, получая 2-амино-4-[1-(3-фосфоно-3,3-дифтор)пропил]тиазол (22.1) в виде твердого вещества.
Анализ для C6H9N2O3PSF2+HBr:
Аналогичным способом получают 2-амино-5-метилтио-4-[1-(3-фосфоно-3,3-дифтор)пропил]тиазол (22,2). МС: m/е 305 (М+Н).
Пример 23
Получение 2-метилтио-5-фосфонометилтио-1,3,4-тиадиазола и 2-фосфонометилтиопиридина
Стадия А. Раствор 2-метилтио-1,3,4-тиадиазол-5-тиола (1 ммоль) в ТГФ (5 мл) обрабатывают гидридом натрия (60%, 1,1 ммоль) при 0°С и полученную смесь перемешивают при комнатной температуре в течение 30 мин. Затем реакционную смесь охлаждают до 0°С и обрабатывают диэтилфосфонометилтрифторметансульфонатом (1,1 ммоль). После перемешивания при комнатной температуре в течение 12 ч реакцию гасят насыщенным хлоридом аммония. Экстракция и хроматография дают 2-метилтио-5-диэтилфосфонометилтио-1,3,4-тиадиазол в виде масла.
Стадия В. 2-Метилтио-5-диэтилфосфонометилтио-1,3,4-тиадиазол подвергают обработке в соответствии со стадией С примера 3, получая 2-метилтио-5-фосфонометилтио-1,3,4-тиадиазол (23.1) в виде желтого твердого вещества.
Анализ для С4H7N2О3PS3+0,2HBr:
Альтернативно фосфонометилтиозамещенные гетероароматические соединения получают, используя нижеследующий способ, иллюстрируемый синтезом 2-фосфонометилтиопиридина.
Стадия С. Раствор 2,2'-дипиридилдисульфида (1 ммоль) в ТГФ обрабатывают три-н-бутилфосфином (1 ммоль) и диэтилгидроксиметилфосфонатом при 0°С. Полученный реакционный раствор перемешивают при комнатной температуре в течение 18 ч. Экстракция и хроматография дают 2-диэтилфосфонометилтиопиридин в виде желтого масла.
Стадия D. 2-Диэтилфосфонометилтиопиридин подвергают обработке в соответствии со стадией С примера 3, получая 2-фосфонометилтиопиридин (23.2) в виде желтого твердого вещества. Анализ для C6H8NO3PS+0,62HBr:
Пример 24
Получение 2-[(2-фосфоно)этинил]пиридина
Стадия А. Раствор 2-этинилпиридина (1 ммоль) в ТГФ (5 мл) обрабатывают LDA (1,2 ммоль) при 0°С в течение 40 мин. К реакционной смеси добавляют диэтилхлорфосфат (1,2 ммоль) и полученный реакционный раствор перемешивают при комнатной температуре в течение 16 ч. Реакцию гасят насыщенным хлоридом аммония, а затем подвергают экстракции и хроматографии, получая 2-[(2-диэтилфосфоно)этинил]пиридин в виде желтого масла.
Стадия В. 2-[(2-Диэтилфосфоно)этинил]пиридин подвергают обработке в соответствии со стадией С примера 3, получая 2-[1-(2-фосфоно)этинил]пиридин (24.1) в виде коричневого твердого вещества. Т.пл. 160°С (разл.), МС: m/е 184 (М+Н).
Пример 25
Получение 5-[2-(5-фосфоно)фуранил]тетразола
Стадия А. К смеси тетразола (1 ммоль) и порошкообразного К2СО3 (1,5 ммоль) в 1 мл ДМФ, охлажденной до 0°С, добавляют бензилхлорметиловый простой эфир (1,2 ммоль) и полученную смесь перемешивают в течение 30 мин при 0°С и затем в течение 16 ч при комнатной температуре. Смесь разбавляют водой и эфиром. Экстракция и хроматография дают 2-бензилоксиметилтетразол в виде бесцветного масла.
Стадия В. К раствору 2-бензилоксиметилтетразола (1 ммоль) и TMEDA (2 ммоль) в 3 мл диэтилового эфира при -78°С добавляют н-BuLi в гексанах (1 ммоль). Смеси дают возможность перемешиваться в течение 5 мин при -78°С и затем ее добавляют в предварительно охлажденный (-78°С) раствор (н-Bu)3SnCl (1 ммоль) в 2 мл диэтилового эфира. После перемешивания при -78°С в течение 30 мин реакционную смесь разбавляют водой и диэтиловым эфиром. Экстракция и хроматография дают 2-бензилоксиметил-5-(трибутилстаннил)тетразол в виде бесцветного масла.
Стадия С. Смесь 5-иод-2-диэтилфосфонофурана (1 ммоль), 2-бензилоксиметил-5-(трибутилстаннил)тетразола (1,05 ммоль), тетракис(трифенилфосфин)палладия (0) (0,03 ммоль) и иодида меди (I) (0,07 ммоль) в 3 мл толуола кипятят с обратным холодильником при 110°С в течение 20 ч. Упаривание и хроматография обеспечивают 2-бензилоксиметил-5-[2-(5-диэтилфосфоно)фуранил]тетразол в виде масла.
Стадия D. Смесь 2-бензилоксиметил-5-[2-(5-диэтилфосфоно)фуранил]тетразола (1 ммоль) и 6М HCl (1 мл) в 10 мл этанола нагревают при 70°С в течение 20 ч и затем растворитель концентрируют выпариванием, подщелачивают 1N NaOH и экстрагируют EtOAc. Водный слой подкисляют и экстрагируют EtOAc. EtOAc-экстракт упаривают, получая 5-[2-(5-диэтилфосфоно)фуранил]тетразол в виде твердого вещества, которое подвергают обработке в соответствии со стадией С примера 3, получая 5-[2-(5-фосфоно)фуранил]тетразол (25.1) в виде твердого вещества: Т.пл. 186-188°С.
Анализ для C5H5N4O4P+1,5Н2O:
Стадия Е.
Стадия 1. Смесь 5-[2-(5-диэтилфосфоно)фуранил]тетразола (1 ммоль), 1-иод-2-метилпропана (2 ммоль) и порошкообразного К2СО3 (2 ммоль) в 5 мл ДМФ перемешивают при 80°С в течение 48 ч и затем разбавляют CH2Cl2 и водой и слои разделяют. СН2Cl2-слой упаривают и объединяют с продуктом следующей реакции для проведения хроматографии.
Стадия 2. Водный слой стадии 1 подкисляют и экстрагируют EtOAc. Полученный экстракт упаривают и остаток нагревают при 80°С в 2 мл SOCl2 в течение 3 ч и затем растворитель выпаривают. Остаток растворяют в 5 мл СН2Cl2 и добавляют 0,3 мл NEt3 и 0,5 мл EtOH. После перемешивания в течение 1 ч при комнатной температуре смесь разбавляют СН2Cl2 и водой. Органический экстракт объединяют с СН2Cl2-слоем, полученным на стадии 1, и подвергают хроматографии, получая 1-изобутил-5-[2-(5-диэтилфосфоно)фуранил]тетразол и 2-изобутил-5-[2-(5-диэтилфосфоно)фуранил]тетразол, каждый в виде масла.
Стадия 3. 1-Изобутил-5-[2-(5-диэтилфосфоно)фуранил]тетразол подвергают обработке в соответствии со стадией С примера 3, получая 1-изобутил-5-[2-(5-диэтилфосфоно)фуранил]тетразол (25.2) в виде твердого вещества. Т.пл. 200-202°С.
Анализ для C9H13N4O4P:
Стадия F. Смесь 2-изобутил-5-[2-(5-диэтилфосфоно)фуранил]тетразола (1 ммоль) и TMSBr (10 ммоль) в 10 мл CH2Cl2 перемешивают при комнатной температуре в течение 16 ч. Растворитель выпаривают и остаток растворяют в смеси 10:1 СН3CN:вода, растворитель выпаривают и остаток осаждают из ацетона добавлением дициклогексиламина (2 ммоль), получая N,N-дициклогексиламмонийную соль 2-изобутил-5-[2-(5-фосфоно)фуранил]тетразола (25.3) в виде твердого вещества. Т.пл. 226-228°С.
Анализ для С9Н13N4O4Р+C12H23N:
Пример 26
Высокопроизводительный синтез различных 2-(5-фосфоно)фуранилзамещенных гетероароматических соединений
Стадия А. Аналогично методике стадии В примера 15 получают различные 2-(5-диэтилфосфоно)фуранилзамещенные гетероароматические соединения и некоторые из данных соединений используют для высокопроизводительного синтеза соединений, приведенных в Таблице 26.1 и Таблице 26.2.
Стадия В. Смесь 2-хлор-6-[2-(5-диэтилфосфоно)фуранил]пиридина (0,01 ммоль) и TMSBr (0,1 мл) в CH2Cl2 (0,5 мл) перемешивают при комнатной температуре в течение 16 ч и затем упаривают и разбавляют 0,5 мл смеси 9:1 СН3CN:вода. Упаривание дает 2-хлор-6-[2-(5-фосфоно)фуранил]пиридин.
Стадия С. Смесь 2-хлор-6-[2-(5-диэтилфосфоно)фуранил]пиридина (0,01 ммоль) и раствора свежеполученного пропоксида натрия в пропаноле (0,25М, 0,4 мл) выдерживают при 85°С в течение 14 ч. Реакционную смесь упаривают и остаток подвергают обработке в соответствии со стадией В примера 26, получая 2-пропилокси-6-[2-(5-фосфоно)фуранил]пиридин.
Стадия D. Смесь 2-хлор-6-[2-(5-диэтилфосфоно)фуранил]пиридина (0,01 ммоль) и 1-метилпиперазина (0,2 мл) в этиленгликоле (0,2 мл) нагревают при 145°С в течение 24 ч. Затем смесь разбавляют 0,5 мл СН3CN и 0,1 мл воды и затем добавляют 150 мг формиатной смолы Dowex 12-100. После 30-минутного перемешивания смолу отфильтровывают и промывают ДМФ (2×10 мл), СН3CN (2×10 мл) и затем смесью 9:1 СН3CN:вода (1×10 мл). Наконец, смолу перемешивают со смесью 9:1 ТФУ:вода в течение 30 мин, фильтруют и фильтрат упаривают. Полученный остаток подвергают обработке в соответствии со стадией В примера 26, получая 2-[1-(4-метил)пиперазинил]-6-[2-(5-фосфоно)фуранил]пиридин.
Стадия Е. Смесь 3-хлор-5-[2-(5-диэтилфосфоно)фуранил] пиразина (0,01 ммоль), 5-трибутилстаннилтиофена (0,04 ммоль), Pd(PPh3)4 (0,001 ммоль) и CuI (0,002 ммоль) в диоксане (0,5 мл) нагревают при 85°С в течение 16 ч, затем растворитель выпаривают. Полученный остаток и TMSBr (0,1 мл) в 0,5 мл СН2Cl2 перемешивают при комнатной температуре в течение 16 ч, затем упаривают и разбавляют 0,5 мл смеси 9:1 СН3CN:вода. К раствору добавляют 150 мг формиатной смолы Dowex 12-100 и после 30-минутного перемешивания смолу отфильтровывают и промывают ДМФ (2×10 мл), СН3CN (2×10 мл) и затем смесью 9:1 СН3CN:вода (1×10 мл). Наконец, смолу перемешивают со смесью 9:1 ТФУ:вода в течение 30 мин, фильтруют и фильтрат упаривают, получая 3-(2-тиенил)-5-[2-(5-фосфоно)фуранил]пиразин.
Стадия F. Смесь 3-хлор-5-[2-(5-диэтилфосфоно)фуранил]пиразина (0,01 ммоль), 1-гексина (0,04 ммоль), диизопропилэтиламина (0,1 ммоль), Pd(PPh3)4 (0,001 ммоль) и CuI (0,002 ммоль) в диоксане (0,5 мл) нагревают при 85°С в течение 16 ч, затем растворитель выпаривают. Полученный остаток подвергают обработке в соответствии со стадией В примера 26, получая 3-(1-гексин-1-ил)-5-[2-(5-фосфоно)фуранил]пиразин.
Получение карбоксиметилфосфонатной смолы
Стадия G. Раствор триметилфосфоноацетата (30,9 ммоль), 2-(триметилсилил)этанола (10,4 ммоль) и DMAP (3,1 ммоль) в толуоле (25 мл) кипятят с обратным холодильником в течение 48 ч в атмосфере N2. После охлаждения раствор разбавляют EtOAc и промывают 1N HCl, а затем водой. Органический раствор сушат над сульфатом натрия и концентрируют в вакууме, получая масло. Остаток обрабатывают LiI (10,4 ммоль) в 2-бутаноне (30 мл) и кипятят с обратным холодильником на протяжении ночи в атмосфере N2. Раствор разбавляют EtOAc, промывают 1N HCl, сушат над Na2SO4 и концентрируют в вакууме, получая SEM защищенный карбоксимонометилфосфонат в виде бесцветного масла.
Стадия Н. Гидроксиметилполистирол (2,35 ммоль) получают для связывания, объединяя с безводным ТГФ (40 мл), тщательно встряхивая в течение 20 мин и затем удаляя избыточный растворитель при помощи канюли. Такую процедуру повторяют 3 раза. Затем набухшую смолу суспендируют в ТГФ (40 мл) и DIPEA (21,2 ммоль). К смеси добавляют, при помощи канюли, раствор SEM защищенного карбоксимонометилфосфоната (полученного на стадии G) (7,1 ммоль), DIAD (7,1 ммоль) и трис(4-хлорфенил)фосфина (7,1 ммоль) в ТГФ (15 мл), который перемешивали в течение 15 мин перед добавлением. После встряхивания смеси на протяжении ночи под слоем N2 смолу отфильтровывают, промывают ТГФ (3×40 мл), ДМФ (3×40 мл) и снова ТГФ (3×40 мл), затем сушат в вакууме, получая 3,8 г связанной фосфонатной смолы.
Стадия I. К связанной фосфонатной смоле (2,41 ммоль) в ТГФ (100 мл) добавляют 1М TBAF в растворе ТГФ (12 мл). Смесь встряхивают на протяжении ночи, затем фильтруют и смолу промывают ТГФ (3×40 мл), получая требуемую карбоксиметилфосфонатную смолу в виде соли тетрабутиламмония.
Сочетание карбоксиметилфосфонатной смолы с гетероароматическим амином
Стадия I. В 2-миллилитровом сосуде объединяют гетероароматический амин (0,14 ммоль), смолу (0,014 ммоль), РуВОР (0,14 ммоль) и TEA (0,36 ммоль) в ДМФ (1,45 мл) и встряхивают в течение 48 ч при комнатной температуре. Затем обработанную смолу отфильтровывают, промывают ДМФ (3х) и CH2Cl2 (3х). Выделенную смолу снова суспендируют в CH2Cl2 (900 мкл), объединяют с TMSBr (100 мкл) и перемешивают в течение 6 ч. Смесь фильтруют, смолу промывают безводным CH2Cl2 (500 мкл) и фильтрат концентрируют в вакууме. К выделенному остатку добавляют раствор СН3CN/Н2О (9:1, 300 мкл). После встряхивания в течение 30 мин растворители удаляют, получая требуемые [{N-(фосфоно)ацетил]амино}замещенные гетероароматические аналоги. В соответствии с данными методиками синтезированы соединения 26.97-26.119 и 26.146-26.164, которые представлены в Таблице 26.1 и Таблице 26.2.
Получение аминометилфосфонатной смолы
Стадия К. К раствору диметилфталимидометилфосфоната (37 ммоль) в 2-бутаноне (150 мл) добавляют LiI (38,9 ммоль). После кипячения с обратным холодильником на протяжении ночи в атмосфере N2 раствор разбавляют EtOAc, промывают 1N HCl, сушат над MgSO4 и концентрируют в вакууме, получая монометилфталимидометилфосфонат в виде белого твердого вещества.
Стадия L. Как описано выше на стадии Н, монометилфталимидометилфосфонат подвергают сочетанию с гидроксиметилполистиролом, получая связанный со смолой фталимидометилфосфонатный монометиловый сложный эфир.
Стадия М. К связанному со смолой фталимидометилфосфонатному монометиловому сложному эфиру (6,8 ммоль) в ДМФ (7 мл) добавляют безводный гидразин (3 мл). После встряхивания при комнатной температуре в течение 24 ч смолу фильтруют, промывают ДМФ (3×10 мл), СН2Cl2 (3×10 мл) и затем сушат в вакууме, получая 832 мг требуемого связанного со смолой аминометилфосфонатного монометилового сложного эфира.
Сочетание различных гетероароматических карбоновых кислот со связанным со смолой аминометилфосфонатным монометиловым сложным эфиром
Стадия N. В 2-миллилитровой пробирке объединяют гетероароматическую карбоновую кислоту (0,2 ммоль), смолу (0,02 ммоль), EDC (0,2 ммоль) и НОВТ (0,2 ммоль) в ДМФ (0,5 мл) и встряхивают в течение 24 ч при комнатной температуре. Затем обработанную смолу фильтруют, промывают ДМФ (3х) и CH2Cl2 (3х). Выделенную смолу снова суспендируют в CH2Cl2 (500 мкл), объединяют с TMSBr (50 мкл) и смешивают в течение 6 ч. Смесь фильтруют, смолу промывают безводным CH2Cl2 (500 мкл) и фильтрат концентрируют в вакууме. К выделенному остатку добавляют раствор СН3CN/Н2О (9:1, 300 мкл). После встряхивания в течение 30 мин растворители удаляют, получая требуемые (N-фосфонометил)карбамоилзамещенные гетероароматические аналоги. В соответствии с данными методиками синтезированы соединения 26.120-26.145, которые представлены в Таблице 26.2.
Следующие соединения получают в соответствии с некоторыми из указанных выше методик или используя все описанные выше методики. Данные соединения были охарактеризованы методами ВЭЖХ (как описано ниже) и масс-спектрометрии (химическая ионизация при атмосферном давлении (APCI), отрицательный ион), и эти характеристические данные представлены в Таблице 26.1 и Таблице 26.2.
ВЭЖХ осуществляют, используя колонку YMC ODS-Aq, Aq-303-5, 250×4,6 мм ВД, размер частиц S-5 мкм, размер пор 120 Å, с УФ-детектором, установленным при 280 нм.
Программа элюирования ВЭЖХ: скорость потока 1,5 мл/мин.
время удержив. (мин)
найдено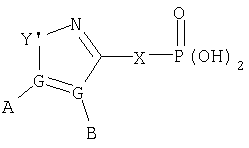
время удержив. (мин)
найдено
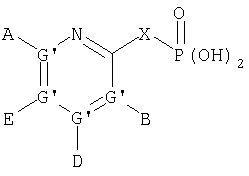
время удержив. (мин)
найдено
Раздел 2
Синтез соединений формулы X
Пример 27
Получение 2-амино-4-фосфонометилокси-6-бромбензотиазола
Стадия А. Раствор AlCl3 (5 ммоль) в EtSH (10 мл) охлаждают до 0°С и обрабатывают 2-амино-4-метоксибензотиазолом (1 ммоль). Смесь перемешивают при 0-5°С в течение 2 ч. Упаривание и экстракция дают 2-амино-4-гидроксибензотиазол в виде белого твердого вещества.
Стадия В. Смесь 2-амино-4-гидроксибензотиазола (1 ммоль) и NaH (1,3 ммоль) в ДМФ (5 мл) перемешивают при 0°С в течение 10 мин и затем обрабатывают диэтилфосфонометилтрифторметилсульфонатом (1,2 ммоль). После перемешивания при комнатной температуре в течение 8 ч реакционную смесь подвергают экстракции и хроматографии, получая 2-амино-4-диэтилфосфонометилоксибензотиазол в виде масла.
Стадия С. Раствор 2-амино-4-диэтилфосфонометилоксибензотиазола (1 ммоль) в АсОН (6 мл) охлаждают до 10°С и обрабатывают бромом (1,5 ммоль) в АсОН (2 мл). Спустя 5 мин смесь перемешивают при комнатной температуре в течение 2,5 ч. Желтый осадок собирают фильтрованием и промывают CH2Cl2, получая 2-амино-4-диэтилфосфонометилокси-6-бромбензотиазол.
Стадия D. Раствор 2-амино-4-диэтилфосфонометилокси-6-бромбензотиазола (1 ммоль) в CH2Cl2 (4 мл) обрабатывают TMSBr (10 ммоль) при 0°С. После перемешивания в течение 8 ч при комнатной температуре реакционную смесь упаривают досуха и остаток поглощают водой (5 мл). Полученный осадок собирают фильтрованием и промывают водой, получая 2-амино-4-фосфонометилокси-6-бромбензотиазол (27.1) в виде твердого вещества. Т.пл. > 220°С (разл.).
Анализ для C8H8N2O4PSBr:
Аналогично в соответствии с описанными выше методиками получают соединение (27.2) - 2-амино-4-фосфонометилоксибензотиазол. Т.пл. > 250°С (разл.).
Анализ для C8H9N2O4PS+0,4Н2О:
Пример 28
Получение 2-амино-4-фосфонометилокси-6-бром-7-хлорбензотиазола
Стадия А. Раствор 1-(2-метокси-5-хлорфенил)-2-тиомочевины (1 ммоль) в хлороформе (10 мл) охлаждают до 10°С и обрабатывают бромом (2,2 ммоль) в хлороформе (10 мл). Реакционную смесь перемешивают при 10°С в течение 20 мин и при комнатной температуре в течение 0,5 ч. Полученную суспензию нагревают при температуре кипения с обратным холодильником в течение 0,5 ч. Осадок собирают фильтрованием (промывают СН2Cl2), получая 2-амино-4-метокси-7-хлорбензотиазол, который подвергают обработке в соответствии со стадиями А, В, С и D примера 27, получая 2-амино-4-фосфонометокси-6-бром-7-хлорбензотиазол (28.1). Т.пл. > 220°С (разл.).
Анализ для С8Н7N2O4PSClBr:
Аналогично в соответствии с описанными выше методиками получают следующие соединения.
(28.2) 2-Амино-4-фосфонометокси-6-бром-7-метилбензотиазол. Т.пл. > 220°С (разл.).
Анализ для С9Н10N2O4PSBr:
(28.3) 2-Амино-4-фосфонометокси-7-метилбензотиазол. Т.пл. > 220°С (разл.).
Анализ для C9H11N2O4PS+1,0Н2O:
(28.4) 2-Амино-4-фосфонометокси-7-хлорбензотиазол. Т.пл. > 220°С (разл.).
Анализ для C8H8N2O4PSCl+0,1H2O:
Пример 29
Получение 2-амино-4-фосфонометокси-5,6,7,8-тетрагидронафто[1,2-d]тиазола
Стадия А. 3-Амино-2-гидрокси-5,6,7,8-тетрагидронафталин подвергают обработке в соответствии со стадией В примера 27, получая 3-амино-2-диэтилфосфонометилокси-5,6,7,8-тетрагидронафталин.
Стадия В. Раствор KSCN (16 ммоль) и CuSO4 (7,7 ммоль) в МеОН (10 мл) обрабатывают раствором 3-амино-2-диэтилфосфонометилокси-5,6,7,8-тетрагидронафталина (1 ммоль) в МеОН (5 мл) при комнатной температуре. Смесь нагревают при температуре кипения с обратным холодильником в течение 2 ч. Фильтрование, экстракция и хроматография дают 2-амино-4-диэтилфосфонометилокси-5,6,7,8-тетрагидронафто[1,2-d]тиазол в виде светло-коричневого твердого вещества.
Стадия С. 2-Амино-4-диэтилфосфонометилокси-5,6,7,8-тетрагидронафто[1,2-d]тиазол подвергают обработке в соответствии со стадией D примера 27, получая 2-амино-4-фосфонометокси-5,6,7,8-тетрагидронафто[1,2-d]тиазол (29.1). Т.лл. > 220°С (разл.).
Анализ для C12H15N2O4PS+0,5SH2O:
В соответствии с описанными выше методиками получают следующие соединения.
(29.2) 2-Амино-4-фосфонометокси[1,2-d]нафтотиазол. Т.пл. > 240°С (разл.).
Анализ для С12Н11N2О4PS+0,2HBr:
(29.3) 2-Амино-5,7-диметил-6-тиоцианато-4-фосфонометоксибензотиазол. Т.пл. > 240°С (разл.).
Анализ для С11Н12N3O4PS2+0,2СН2Cl2:
(29.4) Исходя из 2-гидрокси-5-фениланилина и используя ту же самую последовательность реакций, как указано выше, получали 2-амино-7-фенил-6-тиоцианато-4-фосфонометоксибензотиазол. Т.пл. > 250°С (разл.).
Анализ для C15H12N3O4PS2+0,2Н2O:
(29.5) Исходя из 2-гидрокси-3,5-дихлор-4-метиланилина и используя ту же самую последовательность реакций, как указано выше (за исключением того, что стадию циклизации осуществляют, используя B2, AcOH способ, т.е. стадию А примера 33), получают 2-амино-5,7-дихлор-6-метил-4-фосфонометоксибензотиазол. Т.пл. > 230°С (разл.).
Анализ для C9H9N2O4PSCl2:
(29.6) Исходя из 2-гидрокси-4-метоксикарбониланилина и используя ту же самую последовательность реакций, как указано выше, получают 2-амино-4-фосфонометокси-6-карбоксибензотиазол. Т.пл. > 230°С (разл.).
Анализ для С9Н9N2О6PS:
Пример 30
Получение 2-амино-7-метокси-6-тиоцианато-4-фосфонометоксибензотиазола
Стадия А. 2-Гидрокси-5-метоксинитробензол подвергают обработке в соответствии со стадией В примера 27, получая 2-диэтилфосфонометилокси-5-метоксинитробензол.
Стадия В. Раствор SnCl2 (4 ммоль) в свежеполученной метанольной HCl (10 мл) добавляют к холодному (0°С) раствору 2-диэтилфосфонометилокси-5-метоксинитробензола (1 ммоль) в МеОН (5 мл). Смесь нагревают до комнатной температуры и перемешивают в течение 3 ч. Упаривание, экстракция и хроматография дают 2-диэтилфосфонометилокси-5-метоксианилин.
Стадия С. 2-Диэтилфосфонометилокси-5-метоксианилин подвергают обработке в соответствии со стадией В примера 29, получая 2-амино-4-диэтилфосфонометилокси-6-тиоциано-7-метоксибензотиазол, который подвергают обработке в соответствии со стадией D примера 27, получая 2-амино-7-метокси-6-тиоцианато-4-фосфонометоксибензотиазол (30.1). Т.пл. > 170°С (разл.).
Анализ для C10H10N3O5PS2:
Аналогично в соответствии с указанными выше методиками получают следующие соединения.
(30.2) 2-Амино-5,6-дифтор-4-фосфонометоксибензотиазол. Т.пл. > 240°С (разл.).
Анализ для C8H7N2O4PSF2:
(30.3) 2-Амино-5-фтор-7-бром-4-фосфонометоксибензотиазол. Т.пл. > 190°С (разл.).
Анализ для C8H7N2O4PSBrF:
(30.4) 2-Амино-7-этоксикарбонил-4-фосфонометоксибензотиазол. Т.пл. > 240°С (разл.).
Анализ для С11Н13N2O6PS+0,2HBr+0,1ДМФ:
Пример 31
Получение 2-амино-7-бром-6-тиоцианато-4-фосфонометоксибензотиазола
Стадия А. Раствор 2-фтор-5-бромнитробензола (1 ммоль) в ДМФ (5 мл) охлаждают до 0°С и обрабатывают раствором свежеполученной натриевой соли диэтилгидроксиметилфосфоната (1,2 ммоль) в ДМФ (5 мл). Смесь перемешивают при комнатной температуре в течение 16 ч. Упаривание, экстракция и хроматография дают 2-диэтилфосфонометилокси-5-бромнитробензол.
Стадия В. 2-Диэтилфосфонометилокси-5-бромнитробензол подвергают обработке в соответствии со стадией В примера 30, стадией В примера 29 и стадией D примера 27, получая 2-амино-7-бром-6-тиоцианато-4-фосфонометоксибензотиазол (31.1). Т.пл. > 250°С (разл.).
Анализ для С9H7N3O4PS2Br:
Аналогично в соответствии с указанными выше методиками получают следующие соединения:
(31.2) 2-Амино-7-фтор-6-тиоцианато-4-фосфонометоксибензотиазол. Т.пл. > 136°С (разл.).
Анализ для C9H7N3O4PFS2+0,3HBr:
(31.3) Исходя из 2-фтор-4-хлорнитробензола и используя туже самую последовательность реакций, как указано выше, получают 2-амино-6-хлор-4-фосфонометоксибензотиазол. Т.пл. > 250°С (разл.).
Анализ для C8H8N2O4PSCl:
(31.4) Исходя из 2-фтор-4,5-дихлорнитробензола и используя ту же самую последовательность реакций, как указано выше, получают 2-амино-6,7-дихлор-4-фосфонометоксибензотиазол. Т.пл. > 250°С (разл.).
Анализ для C8H7N2O4PSCl2:
Пример 32
Получение 2-амино-7-гидроксиметил-6-тиоциано-4-фосфонометоксибензотиазола
Стадия А. 2-Хлор-5-формилнитробензол подвергают обработке в соответствии со стадией А примера 31, получая 2-диэтилфосфонометилокси-5-формилнитробензол.
Стадия В. Раствор 2-диэтилфосфонометилокси-5-формилнитробензола (1 ммоль) в метаноле (5 мл) обрабатывают 10% палладием на углероде (0,05 ммоль) в атмосфере водорода (1 атм) при комнатной температуре в течение 12 ч. Фильтрование с последующим упариванием дает 2-диэтилфосфонометилокси-5-гидроксиметиланилин, который подвергают обработке в соответствии со стадией В примера 29, а затем в соответствии со стадией D примера 27, получая 2-амино-7-гидроксиметил-6-тиоцианато-4-фосфонометоксибензотиазол (32,1). Т.пл. 181-184°С.
Анализ для C10H10N3O5PS2+0,35Н2О:
Подобную методику используют для получения следующих соединений.
(32.2) Исходя из 2-фтор-4-метилнитробензола и используя ту же самую последовательность реакций, как указано выше, получают 2-амино-6-метил-4-фосфонометоксибензотиазол. Т.пл. > 250°С (разл.).
Анализ для C9H11N2O4PS+0,2CH2Cl2:
(32.3) Исходя из 2-хлор-5-цианонитробензола и используя ту же самую последовательность реакций, как указано выше, получают 2-амино-7-циано-4-фосфонометоксибензотиазол. Т.пл. > 250°С (разл.).
Анализ для C9H8N3O4PS+0,9Н2O:
Пример 33
Получение 2-амино-6-бром-7-фтор-4-фосфонометоксибензотиазола
Стадия А. Раствор 2-диэтилфосфонометилокси-4-бром-5-фторанилина (1 ммоль, полученного как в примере 4, стадия В) и KSCN (2 ммоль) в АсОН (8 мл) охлаждают до 10°С и обрабатывают раствором брома (2 ммоль) в АсОН (5 мл). После перемешивания при комнатной температуре в течение 0,5 ч реакционную смесь упаривают досуха и остаток очищают хроматографией, получая 2-амино-7-фтор-6-бром-4-диэтилфосфонометилоксибензотиазол, который подвергают обработке в соответствии со стадией D примера 27, получая 2-амино-6-бром-7-фтор-4-фосфонометоксибензотиазол (33.1).
Анализ для C8H7N2O4PSBrF+0,1HBr:
Пример 34
Получение 2-амино-7-этил-6-тиоциано-4-фосфонометоксибензотиазола
Стадия А. Раствор 2-диэтилфосфонометилокси-5-бромнитробензола (1 ммоль, полученного как в примере 31, стадия А, из 2-фтор-5-бромнитробензола) в ДМФ (5 мл) обрабатывают трибутил(винил)оловом (1,2 ммоль) и бис(трифенилфосфин)дихлоридом палладия (0,1 ммоль) и смесь нагревают при 60°С в атмосфере азота в течение 6 ч. Упаривание и хроматография дают 2-диэтилфосфонометилокси-5-винилнитробензол в виде масла, которое подвергают обработке в соответствии со стадией В примера 31, стадией В примера 29 и Стадией D примера 27, получая 2-амино-7-этил-6-тиоциано-4-фосфонометоксибензотиазол (34.1). Т.пл. > 167°С (разл.).
Анализ для С11Н12N3O4PS2:
Подобную методику используют для получения следующих соединений.
(34.2) 2-Амино-7-пропил-6-тиоцианато-4-фосфонометоксибензотиазол. Т.пл. > 250°С (разл.).
Анализ для C12Hl4N3O4PS2:
Используют аллилтрибутилолово.
(34.3) 2-Амино-7-(2-фурил)-6-тиоцианато-4-фосфонометоксибензотиазол.
Анализ для С14Р11N3O5BrPS2+0,6MeOH:
Используют 2-фуранилтрибутилолово.
(34.4) 2-Амино-6-тиоцианато-7-(2-тиенил)-4-фосфонометоксибензотиазол. Т.пл. > 250°C (разл.).
Анализ для С13Н10N3О4PS3:
Используют 2-тиенилтрибутилолово.
(34.5) 2,5-Дифтор-4-бромнитробензол обрабатывают таким же путем, получая 2-амино-6-этил-7-фтор-4-фосфонометоксибензотиазол. Т.пл. > 250°С (разл.).
Анализ для C10H12N2O4PSF:
(34.6) 2,5-Дифтор-4-бромнитробензол обрабатывают 2-тиенилтрибутилоловом на второй стадии, получая 2-амино-7-фтор-6-[2-(5-тиоцианато)тиенил]-4-фосфонометоксибензотиазол. Т.пл. > 250°С (разл.).
Анализ для С13Н9N3O4PS3F+0,6Н2О:
Пример 35
Получение 2-амино-7-циклопропил-6-тиоцианато-4-фосфонометоксибензотиазола
Стадия А. Суспензию 2-диэтилфосфонометилокси-5-винилнитробензола (1 ммоль, полученного, как на стадии А примера 33) и Pd(OAc)2 (0,1 ммоль) в эфире (8 мл) обрабатывают раствором диазометана (полученного из 3,0 г 1-метил-3-нитро-1-нитрозогуанидина) в эфире при 0°С. После перемешивания при комнатной температуре в течение 20 ч реакционную смесь упаривают досуха и остаток подвергают хроматографии, получая 2-диэтилфосфонометилокси-5-циклопропилнитробензол, который подвергают обработке в соответствии со стадией В примера 30, стадией В примера 29 и стадией D примера 27, получая гидробромид 2-амино-7-циклопропил-6-тиоцианато-4-фосфонометоксибензотиазола (35.1).
Анализ для С12Н13N3O4PS2Br+0,1HBr:
Пример 36
Получение 2-амино-4-фосфонометокси-6-хлор-7-метилбензотиазола
Стадия А. 2-Метокси-4-хлор-5-метиланилин подвергают обработке в соответствии со стадиями А и В примера 27, стадией В примера 29 и стадией D примера 27, получая 2-амино-4-фосфонометокси-6-хлор-7-метилбензотиазол (36.1). Т.пл. > 250°С (разл.).
Анализ для C9H10N2O4PS2Cl+0,3Н2О+0,4HBr:
Аналогично в соответствии с указанными выше методиками получают соединение (36.2) - 2-амино-7-фенил-6-тиоцианато-4-фосфонометоксибензотиазол. Т.пл. > 250°С (разл.).
Анализ для C15H12N3O4PS2+0,2Н2O:
Пример 37
Получение 2-бром-4-диэтилфосфонометокси-5,6,7,8-тетрагидронафто[1,2-d]тиазола
Стадия А. Раствор 2-амино-4-диэтилфосфонометокси-5,6,7,8-тетрагидронафто[1,2-d]тиазола (1 ммоль) в СН3CN (4 мл) охлаждают до 0°С и обрабатывают CuBr2 (1,2 ммоль) с последующей обработкой изоамилнитритом (1,5 ммоль) капельным способом. Полученную темную смесь перемешивают в течение 3,5 ч. Упаривание и хроматография дают 2-бром-4-диэтилфосфонометокси-5,6,7,8-тетрагидронафто[1,2-d]тиазол в виде масла.
Стадия В. 2-Бром-4-диэтилфосфонометокси-5,6,7,8-тетрагидронафто[1,2-d]тиазол подвергают обработке в соответствии со стадией D примера 27, получая 2-бром-4-фосфонометокси-5,6,7,8-тетрагидронафто[1,2-d]тиазол (37.1) в виде твердого вещества. Т.пл. 220-230°С.
Анализ для C12H13NO4PSBr:
(37.2) Ту же самую методику используют для взаимодействия 2-амино-4-диэтилфосфонометокси-6-хлор-7-метилбензотиазола с CuCl2, получая 2-хлор-4-фосфонометокси-6-хлор-7-метилбензотиазол. Т.пл. > 250°С (разл.).
Анализ для C9H8NO4PSCl2+0,7HBr:
Пример 38
Получение 4-диэтилфосфонометокси-5,6,7,8-тетрагидронафто[1,2-d]тиазола
Стадия А. Раствор изоамилнитрита (1,5 ммоль) в ДМФ (1 мл) при 65°С обрабатывают 2-амино-4-диэтилфосфонометокси-5,6,7,8-тетрагидронафто[1,2-d]тиазолом (1 ммоль) в ДМФ (3 мл). Спустя 30 мин охлажденный реакционный раствор подвергают упариванию и хроматографии, получая 4-диэтилфосфонометокси-5,6,7,8-тетрагидронафто[1,2-d]тиазол в виде масла, которое подвергают обработке в соответствии со стадией D примера 27, получая 4-фосфонометокси-5,6,7,8-тетрагидронафто[1,2-d]тиазол (38.1) в виде твердого вещества. Т.пл. 215-220°С.
Анализ для C12H14NO4PS+1,3HBr:
(38.2) Ту же самую последовательность реакций используют для превращения 2-амино-4-диэтилфосфонометокси-6-хлор-7-метилбензотиазола в 4-фосфонометокси-6-хлор-7-метилбензотиазол. Т.пл. 195-198°С.
Анализ для C9H9NO4PSCl+0,5Н2O:
Пример 39
Получение 2-амино-4-фосфонометилтиобензотиазола
Стадия А. 2-Диэтилфосфонометилтиоанилин, полученный по стадии В примера 27, подвергают обработке в соответствии со стадией В примера 29, получая 2-амино-4-диэтилфосфонометилтиобензотиазол.
Стадия В. 2-Амино-4-диэтилфосфонометилтиобензотиазол подвергают обработке в соответствии со стадией D примера 34, получая 2-амино-4-фосфонометилтиобензотиазол (39.1) в виде пены.
Анализ для С8H10N2О3PS2+0,4H2O:
Пример 40
Получение 2-амино-7-гексил-6-тиоциано-4-фосфонометоксибензотиазола
Стадия А. Раствор 1 ммоля 2-диэтилфосфонометокси-5-бромнитробензола (полученного как в примере 30, стадия А) в диэтиламине (5 мл) обрабытывают 1-гексином (1,2 ммоль), CuI (0,1 ммоль) и бис(трифенилфосфин)дихлоридом палладия (0,1 ммоль) и смесь нагревают при 60°С в атмосфере азота в течение 14 ч. Упаривание и хроматография дают 2-диэтилфосфонометокси-5-(1-гексин)бензол в виде масла, которое подвергают обработке в соответствии со стадией В примера 32, стадией В примера 29 и стадией D примера 27, получая 2-амино-7-гексил-6-тиоциано-4-фосфонометоксибензотиазол.
(40.1) 2-Амино-6-тиоцианато-7-(н-гексил)-4-фосфонометоксибензотиазол. Т.пл. > 250°С (разл.).
Анализ для Cl5H20N3O4PS2:
Аналогично получают следующее соединение.
(40.2) Раствор 1 ммоля 2-диэтилфосфонометокси-5-бромнитробензола (полученного как в примере 30, стадия А) подвергают обработке в соответствии со стадией С примера 27, следуют аналогичной последовательности, как для соединения 40.1, получая 2-амино-6-метил-7-(н-гексил)-4-фосфонометоксибензотиазол. Т.пл. > 250°С (разл.).
Анализ для C15H23N2O4PS+0,25HBr:
Пример 41
Получение 2-амино-6-метокси-7-метил-4-фосфонометоксибензотиазола
Стадия А. Раствор 2-хлор-4-фтор-5-метилнитробензола (1 ммоль) в ДМФ (5 мл) обрабатывают свежим метоксидом натрия (1,1 ммоль) и смесь перемешивают в течение 6 ч. Упаривание и хроматография дают 2-хлор-4-метокси-5-метилнитробензол.
Стадия В. 2-Хлор-4-метокси-5-метилнитробензол подвергают обработке в соответствии со стадией А примера 31, стадией В примера 32, стадией А примера 33 и стадией D примера 27, получая 2-амино-6-метокси-7-метил-4-фосфонометоксибензотиазол (41.1). Т.пл. > 250°С (разл.).
Анализ для C10H13N2O4PS:
Аналогично получают следующие соединения.
(41.2) 2-Амино-7-метил-6-метилтио-4-фосфонометоксибензотиазол. Т.пл. > 250°С (разл.).
Анализ для C10H13N2O4PS2+0,45HBr:
(41.3) 2-Амино-6-этокси-7-метил-4-фосфонометоксибензотиазол. Т.пл. > 250°С (разл.).
Анализ для C11H15N2O5PS:
(41.4) 2-Амино-6-изобутокси-7-метил-4-фосфонометоксибензотиазол. Т.пл. > 250°С (разл.).
Анализ для C13H19N2O5PS+0,15HBr:
Пример 42
Получение 2-амино-6-этил-4-фосфонометоксибензотиааола
Стадия А. К раствору 1 ммоля 3-бромхлорбензола в 2 мл конц. H2SO4 добавляют 1,5 ммоля 79% HNO3 при -10°С. После перемешивания в течение 30 мин смесь выливают на смесь лед/вода. Желтый осадок отфильтровывают и сушат, получая смесь 2-хлор-4-бромнитробензола (требуемый) и 4-хлор-2-бромнитробензола.
Стадия В. 2-Хлор-4-бромнитробензол подвергают обработке в соответствии со стадией А примера 34, стадией В примера 32, стадией В примера 29 и стадией D примера 27, получая 2-амино-6-этил-4-фосфонометоксибензотиазол (42.1). Т.пл. > 220°С (разл.).
Анализ для C10H13N2O4PS+0,3HBr:
Аналогично получают соединение (42.2) - 2-амино-6-пропил-4-фосфонометоксибензотиазол. Т.пл. > 220°С (разл.).
Анализ для C11H15N2O4PS+0,2HBr:
Пример 43
Получение 2-амино-6-тио-7-этил-4-фосфонометоксибензотиазола
Стадия А. Раствор 1 ммоля 2-амино-6-тио-7-этил-4-диэтилфосфонометоксибензотиазола (для получения см. пример 34) в 3 мл 48% HBr в АсОН нагревают при 90°С в течение 16 ч. Растворитель удаляют и остаток промывают водой, получая 2-амино-6-тио-7-этил-4-фосфонометоксибензотиазол (43.1). Т.пл. > 220°С (разл.).
Анализ для C10H13N2O4PS2+0,2HBr:
Пример 44
Получение 2-амино-7-пропилокси-6-тиоциано-4-фосфонометоксибензотиазола
Стадия А. К раствору 1 ммоля 2-хлор-5-гидроксинитробензола в 5 мл ДМФ добавляют 1,2 ммоль NaH при 0°С. Спустя 3 мин добавляют аллилбромид и смесь перемешивают при комнатной температуре в течение 16 ч. Растворитель удаляют и остаток промывают водой и экстрагируют EtOAc, получая 2-хлор-5-пропенилоксинитробензол.
Стадия В. 2-Хлор-5-пропенилоксинитробензол подвергают обработке в соответствии со стадией А примера 31, стадией В примера 32, стадией А примера 33 и стадией D примера 27, получая 2-амино-7-пропилокси-6-тиоциано-4-фосфонометоксибензотиазол (44.1). Т.пл. > 220°С (разл.).
Анализ для C12H14N3O5PS2+0,15HBr+0,08Н2О:
Пример 45
Получение 2-амино-6-метокси-4-фосфонометоксибензотиазола
Стадия А. 2-Гидрокси-4-метоксинитробензол подвергают обработке в соответствии со стадией В примера 32, стадией В примера 21, стадией В примера 29, стадией D примера 21, получая 2-амино-6-метокси-4-фосфонометоксибензотиазол (45.1). Т.пл. > 230°С (разл.).
Анализ для C9H11N2O5PS+0,5Н2О:
Пример 46
2-Амино-7-этил-6-метил-4-фосфонометоксибензотиазол
Стадия А. 2-Фтор-4-метилнитробензол подвергают обработке в соответствии со стадией А примера 31, стадией С примера 27, стадией А примера 34, стадией В примера 32, стадией В примера 29, стадией D примера 27, получая (46.1) 2-амино-7-этил-6-метил-4-фосфонометоксибензотиазол. Т.пл. > 250°С (разл.).
Анализ для C11H15N2O4PS+0,1HBr:
Пример 47
2-Амино-7-бром-6-метил-4-фосфонометоксибензотиазол
Стадия А. 2-Фтор-4-метилнитробензол подвергают обработке в соответствии со стадией А примера 31, стадией С примера 27, стадией В примера 30, стадией А примера 33, стадией D примера 27, получая 2-амино-7-бром-6-метил-4-фосфонометоксибензотиазол (47.1). Т.пл. > 250°С (разл.).
Анализ для C9H10N2O4PSBr+0,3HBr:
Пример 48
2-Амино-7-фтор-6-метил-4-фосфонометоксибензотиазол
Стадия А. 2-Гидрокси-4-метил-5-фторнитробензол подвергают обработке в соответствии со стадией В примера 27, стадией В примера 32, стадией А примера 33, стадией D примера 27, получая (48.1) - 2-амино-7-фтор-6-метил-4-фосфонометоксибензотиазол. Т.пл. > 250°С (разл.).
Анализ для C9H10N2O4PSF+0,1HBr:
(48.2) Исходя из 2-гидрокси-5-хлор-4-метиланилина и используя последовательность реакций, как указано выше (за исключением того, что стадию восстановления NO2 проводят, используя метод SnCl2, т.е. стадию В примера 30), получают 2-амино-7-хлор-6-метил-4-фосфонометоксибензотиазол (48.2). Т.пл. > 250°С (разл.).
Анализ для C9H10N2O4PSCl+0,6Н2О:
Пример 49
2-Амино-6-бром-7-метокси-4-фосфонометоксибензотиазол
Стадия А. 2-Амино-4,7-диметоксибензотиазол [полученный из 1-(2,5-диметоксифенил)-2-тиомочевины с использованием методики стадии А примера 28] подвергают обработке в соответствии со стадией С, получая 2-амино-4,7-диметокси-6-бромбензотиазол.
Стадия В. К раствору 1 ммоля 2-амино-4,7-диметокси-6-бромбензотиазола в CH2Cl2 добавляют 2,2 ммоля BBr3 в CH2Cl2 при 0°С в течение 16 ч. Обработка водой и хроматография дают 2-амино-4-гидрокси-6-бром-7-метоксибензотиазол.
Стадия С. 2-Амино-4-гидрокси-6-бром-7-метоксибензотиазол подвергают обработке в соответствии со стадией В примера 27, стадией D примера 27, получая (49.1) - 2-амино-6-бром-7-метокси-4-фосфонометоксибензотиазол. Т.пл. > 250°С (разл.).
Анализ для C9H10N2O5PSBr:
Пример 50
Общая методика получения бис-фосфороамидных пролекарств
Образование дихлоридата
К суспензии 1 ммоля фосфоновой кислоты в 5 мл дихлорэтана добавляют 0,1 ммоль пиридина (или 0,1 ммоль ДМФ) с последующим добавлением 6 ммолей тионилхлорида и смесь кипятят с обратным холодильником в течение 2,5 ч. Растворитель и избыточный тионилхлорид удаляют при пониженном давлении и сушат, получая дихлоридат.
Реакция сочетания
Способ А: Неочищенный дихлоридат поглощают 5 мл сухого CH2Cl2 и добавляют 8 ммолей сложного эфира аминокислоты при 0°С. Полученной смеси дают возможность достигнуть комнатной температуры, при которой ее перемешивают в течение 16 ч. Реакционную смесь подвергают обработке водой и хроматографии.
Способ В: Неочищенный дихлоридат поглощают 5 мл сухого СН2Cl2 и добавляют смесь 4 ммолей сложного эфира аминокислоты и 4 ммолей N-метилимидазола при 0°С. Полученной смеси дают возможность достигнуть комнатной температуры, при которой ее перемешивают в течение 16 ч. Реакционную смесь подвергают обработке водой и хроматографии.
Таким способом получают следующие соединения.
(50.1) 2-Амино-5-изобутил-4-[2-(5-N,N-бис(диэтиловый эфир L-глутаминовой кислоты)фосфоноамидо)фуранил]тиазол.
Анализ для C29H45N4O10PS:
(50.2) 2-Амино-5-изобутил-4-[2-(5-N,N-бис(дибензиловый эфир L-аланина)фосфоноамидо)фуранил]тиазол.
Анализ для С31Н37N4O6PS:
(50.3) 2-Амино-5-изобутил-4-{2-[5-N,N-бис(бензилоксикарбонилметил)фосфонодиамидо]фуранил}тиазол.
Анализ для C19H25N4O6PS+0,3CH2Cl2:
(50.4) 2-Амино-5-изобутил-4-{2-[5-(N,N-бис(бензилоксикарбонилметил)фосфонодиамидо]фуранил}тиазол.
Анализ для С29Н33N4O6PS:
(50.5) 2-Амино-5-изобутил-4-{2-[5-(N,N'-бис((R)-1-метоксикарбонил)этил)фосфоноамидо]фуранил}тиазол.
Анализ для C19H29N4O6PS+0,6CH2Cl2:
(50.6) 2-Амино-5-изобутил-4-{2-[5-(N,N'-бис((S)-1-этоксикарбонил)этил)фосфоноамидо]фуранил}тиазол. Т.пл. 164-165°С.
Анализ для C21H33N4O6PS+0,61CH2Cl2:
(50.7) 2-Амино-5-изобутил-4-{2-[5-(N,N'-бис((трет-бутоксикарбонил)метил)фосфоноамидо]фуранил}тиазол.
Анализ для С23Н37Н4O6PS+0,15СН2Cl2:
(50.8) 2-Амино-5-изобутил-4-{2-[5-(N,N'-бис(этоксикарбонил)метил)фосфоноамидо]фуранил}тиазол.
Анализ для C19H29N4O6PS+0,1EtOAc+0,47CH2Cl2:
(50.9) 2-Амино-5-изобутил-4-{2-[5-(O-(2-бис(N-(1-метил-1-этоксикарбонил)этил)фосфоноамидо]фуранил}тиазол. Т.пл. 142-145°С.
Анализ для С23Н37N4O6PS:
(50.10) 2-Амино-5-изобутил-4-{2-[5-(N,N'-бис(этоксикарбонилметил)-N,N'-диметилфосфонамидо)]фуранил}тиазол.
Анализ для C21H33N4O6PS:
(50.11) 2-Амино-5-изобутил-4-{2-[5-(N,N'-бис((S)-1-бензилоксикарбонил-2-метил)пропил)фосфонамидо]фуранил}тиазол.
Анализ для С35Н45N4O6PS+0,5Н2О:
(50.12) 2-Амино-5-изобутил-4-{2-[5-(N,N'-бис((S)-1-метоксикарбонил-3-метил)бутил)фосфонамидо]фуранил}тиазол.
Анализ для С25Н41N4O6PS:
(50.13) 2-Амино-5-изобутил-4-{2-[5-(N,N-бис((R)-1-этоксикарбонил-2-(S-бензил))этил)фосфонамидо]фуранил}тиазол.
Анализ для C35H45N4O6PS3+0,4толуол:
(50.14) 2-Амино-5-изобутил-4-{2-[5-(N,N'-бис((S)-1-этоксикарбонил-3-(S-метил))бутил)фосфонамидо]фуранил}тиазол.
Анализ для C23H37N4O6PS3:
(50.15) 2-Амино-5-пропилтио-4-{2-[5-(N,N'-(1-((S)этоксикарбонил)этил)фосфонамидо]фуранил}тиазол.
Анализ для C20H31N4O6PS2:
(50.16) 2-Амино-5-изобутил-4-{2-[5-(N,N'-бис((S)-1-бензилоксикарбонил-2-метил)изобутил)фосфонамидо]фуранил}тиазол.
Анализ для C37H49N4O6PS:
(50.17) 2-Амино-5-изобутил-4-{2-[5-(N,N'-бис((S)-1-этоксикарбонил-3-метил)бутил)фосфонамидо]фуранил}тиазол.
Анализ для C27H45N4O6PS:
(50.18) 2-Амино-5-изобутил-4-{2-[5-(N,N'-бис((S)-1-этоксикарбонил-2-метил)пропил)фосфонамидо]фуранил}тиазол.
Анализ для С25Н41N4O6PS:
(50.19) 2-Амино-5-изобутил-4-{2-[5-(N,N'-бис((S)-1-этоксикарбонил-2-фенил)этил)фосфонамидо]фуранил}тиазол.
Анализ для С33Н41N4O6PS+0,15СН2Cl2:
(50.20) 2-Амино-5-пропилтио-4-{2-[5-(N,N'-(1-метилэтоксикарбонил)этил)фосфонамидо]фуранил}тиазол. Т.пл. 110-115°С.
Анализ для C22H35N4O6PS2+0,4HCl+0,5Et2O:
(50.21) 2-Амино-5-метилтио-4-{2-[5-(N,N'-бис(1-метил-1-этоксикарбонил)этил)фосфонамидо]фуранил}тиазол.
Анализ для С20Н31Н4O6PS2+0,5Н2O:
Пример 51
Общая методика для смешанных бис-фосфороамидатных пролекарств
К раствору неочищенного дихлоридата (1 ммоль, полученного как описано в примере 50) в 5 мл сухого СН2Cl2 добавляют амин (1 ммоль) с последующим добавлением 4-диметиламинопиридина (3 ммоль) при 0°С. Полученной смеси дают возможность нагреться до комнатной температуры и перемешивают в течение 1 ч. Реакционную смесь охлаждают снова до 0°С, затем добавляют сложный эфир аминокислоты (2 ммоль) и оставляют при комнатной температуры в течение 16 ч. Реакционную смесь обрабатывают водой и смешанное бис-фосфороамидатное пролекарство очищают колоночной хроматографией.
Таким же образом получают следующие соединения.
(51.1) 2-Амино-5-изобутил-4-{2-[5-(N-морфолино-N'-(1-метил-1-этоксикарбонил)этил)фосфонамидо]фуранил}тиазол. Т.пл. 182-183°С.
Анализ для С21Н33N4O5PS:
(51.2) 2-Амино-5-изобутил-4-{2-[5-(N-пирролидино-N'-(1-метил-1-этоксикарбонил)этил)фосфонамидо]фуранил}тиазол. Т.пл. 189-190°С.
Анализ для C21H33N4O4PS:
Пример 52
Синтез бис-фосфороамидного пролекарства с использованием способа Mukaiyama с некоторыми его изменениями (J. Am. Chem. Soc. 1972, 94, 8528).
К суспензии 1,0 ммоля фосфоновой кислоты и 2,0 ммолей соли сложного эфира аминокислоты (например, HCl соль этилового эфира аланина) в 9 мл пиридина, Et3N и 1,3-диметил-3,4,5,6-тетрагидро-2(1Н)-пиримидиона (DMPU) (1:1:1) добавляют предварительно перемешанный раствор 4 ммолей альдритиола и 4 ммолей PPh3 в 3 мл пиридина. Спустя 16 ч при 90°С растворители, пиридин и Et3N удаляют при пониженном давлении. Раствор оставшегося маслянистого неочищенного продукта разбавляют гексаном (100 мл) и подвергают очистке при помощи хроматографии.
Используя указанный способ, получают следующие соединения.
(52.1) 2-Амино-4-[(N,N'-(1-(S)-этоксикарбонил)этил)фосфонодиамидометокси]-5,6,7,8-тетрагидронафто[1,2-d]тиазол. Т.пл. 153-156°С.
Анализ для С22Н33N4O6PS:
(52.2) 2-Амино-5-изопропил-4-[(N,N'-(1-(S)-этоксикарбонил)этил)фосфонодиамидометоксикарбонил]тиазол.
Анализ для C18H31N4O7PS:
(52.3) 2-Амино-7-этил-5-фтор-1-изобутил-2-[5-({N,N'-(1-(S)-этоксикарбонил)этил}фосфонодиамидо)фуранил]бензимидазол.
Анализ для C27H39N5O6PF:
(52.4) 2-Амино-5-этоксикарбонил-4-[2-(5-({N,N'-(1-(S)-этоксикарбонил)этил}фосфоно)фуранил]тиазол.
Анализ для C20H29N4O8PS+0,3CH2Cl2:
(52.5) 2-Амино-4-[(N,N'-(1-(S)-этоксикарбонил)метил)фосфонодиамидометокси]-5,6,7,8-тетрагидронафто[1,2-d]тиазол. Т.пл. 177-178°С.
Анализ для С20Н29Н4O6PS:
(52.6) 2-Амино-5-изопропил-4-[(N,N'-(1-(S)-этоксикарбонил)метил)фосфонодиамидометоксикарбонил]тиазол. Т.пл. 122-125°С.
Анализ для С16Н27N4O7PS:
(52.7) 2-Амино-4-{N,N'-(1-(S)-этоксикарбонил)этил}фосфонометокси-6-бром-7-хлорбензотиазол. Т.пл. 210-212°С.
Анализ для C18H25N4O6PSBrCl:
(52.8) 2-Амино-5-пропилтио-4-{2-[5-(N,N'-бис(S)-1-метоксикарбонил-2-(трет-бутокси)этил)фосфоноамидо]фуранил}тиазол.
Анализ для С26Н43N4O8PS2:
(52.9) 2-Амино-5-пропилтио-4-{2-[5-(N,N'-бис(S)-1-этоксикарбонил-2-метилбутил)фосфонамидо]фуранил}тиазол.
Анализ для С26Н43N4O6PS2:
(52.10) 2-Амино-5-пропилтио-4-{2-[5-(N,N'-бис(S)-1-этоксикарбонил-2-метилпропил)фосфонамидо]фуранил}тиазол.
Анализ для C24H39N4O6PS2:
(52.11) 2-Амино-5-пропилтио-4-{2-[5-(N,N'-бис(S)-1-метоксикарбонил-2-(трет-бутокси)пропил)фосфонамидо]фуранил}тиазол.
Анализ для С28Н47Н4O6PS2:
(52.12) 2-Аминопропилтио-4-{2-[5-(N,N'-бис(1-этоксикарбонил)циклопентил)фосфонамидо]фуранил}тиазол.
Анализ для С26Н39N4O6PS2:
(52.13) 2-Амино-5-пропилтио-4-{2-[5-(N,N'-бис(S)-1-этоксикарбонил)пропилфосфонамидо]фуранил}тиазол.
Анализ для C22H35N4O6PS2:
(52.14) 2-Амино-4-{N,N'-(1-(S)-этоксикарбонил)этил}фосфонометокси-6-хлор-7-метилбензотиазол. Т.пл. 178-180°С.
Анализ для C19H28N4O6PSCl:
(52.15) 2-Амино-5-метилтио-4-{2-[5-(N,N'-бис((S)-1-этоксикарбонил)этил)фосфонамидо]фуранил}тиазол. Т.пл. 94-95°С.
Анализ для C18H27N4O6PS2:
(52.16) 2-Аминопропилтио-4-[2-{5-(N,N'-бис((S)-1-этоксикарбонил)бутил)фосфонамидо)}фуранил]тиазол.
Анализ для C24H39N4O6PS2:
(52.17) 2-Аминопропилтио-4-[2-{5-(N,N'-бис((S)-1-этоксикарбонил)циклогексанилметил)фосфонамидо)}фуранил]тиазол.
Анализ для C30H47N4O6PS2:
(52.18) 2-Амино-4-{N,N'-(1-(S)-этоксикарбонил)этил}фосфонометокси-6-метоксибензотиазол. Т.пл. 144-146°С.
Анализ для C19H29N4O7PS:
(52.19) 2-Амино-4-{N,N'-(этоксикарбонил)метил}фосфонометокси-6-метоксибензотиазол. Т.пл. 150-152°С.
Анализ для C17H25N4O7PS:
(52.20) 2-Амино-7-этил-4-{N,N'-(1-(S)-этоксикарбонил)этил}фосфонометокси-6-метилбензотиазол. Анализ для С21Н33N4O6PS:
(52.21) 2-Амино-4-{N,N'-(1-(S)-этоксикарбонил)этил}фосфонометокси-6-метилбензотиазол.
Анализ для C19H29N4O6PS:
(52.22) 2-Амино-4-{N,N'-(1-метил-1-этоксикарбонил)этил}фосфонометокси-6-хлор-7-метилбензотиазол. Т.пл. 170-172°С.
Анализ для С21Н32N4O6PSCl:
(52.23) 2-Амино-7-этил-4-{N,N'-бис(этоксикарбонилметил)}фосфонометокси-6-метилбензотиазол.
Анализ для C19H29N4O6PS:
(52.24) 2-Амино-4-{N,N'-бис(этоксикарбонилметил)}фосфонометокси-6-метилбензотиазол.
Анализ для C17H25N4O6PS+0,5Н2O:
(52.25) 2-Амино-5-пропилтио-4-{2-[5-(N,N'-бис((S)-1-трет-бутоксикарбонил)этил)фосфоноамидо)]фуранил}тиазол.
Анализ для C24H39N4O6PS2:
(52.26) 2-Амино-5-пропилтио-4-[2-{5-(N,N'-бис((S)-1-н-бутоксикарбонил)этил)фосфонамидо)}фуранил]тиазол.
Анализ для C24H39N4O6PS2:
(52.27) 2-Амино-5-этоксикарбонил-4-[2-(5-({N,N'-(1-(S)-этоксикарбонил)пропил}фосфоно)фуранил]тиазол.
Анализ для C22H33N4O8PS:
(52.28) 2-Амино-5-этоксикарбонил-4-[2-(5-({N,N'-(1-(S)-этоксикарбонил)бутил}фосфоно)фуранил]тиазол.
Анализ для C24H37N4O8PS:
(52.29) 2-Амино-5-этоксикарбонил-4-[2-(5-({N,N'-(1-этоксикарбонил)циклопентил}фосфоно)фуранил]тиазол.
Анализ для C26H37N4O8PS:
(52.30) 2-Амино-5-этоксикарбонил-4-[2-{5-(N,N'-бис(S)-1-этоксикарбонил-2-метилпропил)фосфонамидо}фуранил]тиазол.
Анализ для C24H37N4O8PS:
(52.31) 2-Амино-5-пропилтио-4-{2-[5-(N,N'-бис-кумарин)фосфонамидо]фуранил}тиазол.
Анализ для С28Н23N4O6PS2:
(52.32) 2-Амино-5-пропилтио-4-[2-{5-(N,N'-бис((S)-1-изопропоксикарбонил)этил)фосфонамидо)}фуранил]тиазол.
Анализ для C22H35N4O6PS2:
(52.33) 2-Амино-5-пропилтио-4-[2-{5-(N,N'-бис((S)-1-н-пропоксикарбонил)этил)фосфонамидо)}фуранил]тиазол.
Анализ для С22Н35N4O6PS2:
(52.34) 2-Амино-5-пропилтио-4-[2-{5-(N,N'-бис((S)-1-циклогептоксикарбонил)этил)фосфонамидо)}фуранил]тиазол. Анализ для С26Н39Н4O6PS2;
(52.35) 2-Амино-6-этил-7-фтор-4-{N,N'-(1-(S)-этоксикарбонил)этил}фосфонометоксибензотиазол.
Анализ для С20Н30N4O6PSF:
(52.36) 2-Амино-6-этил-7-фтор-4-{N,N'-(1-этоксикарбонил)метил}фосфонометоксибензотиазол.
Анализ для C18H26N4O6PSF:
(52.37) 2-Амино-7-бром-4-{N,N'-(1-(S)-этоксикарбонил)этил}фосфонометокси-6-метилбензотиазол.
Анализ для С19H28N4O6PSBr:
(52.38) 2-Амино-4-{N,N'-(1-этоксикарбонил)метилэтил}фосфонометокси-6-метилбензотиазол.
Анализ для С21Н33N4O6PS+0,5Н2O:
(52.39) 2-Амино-5-изобутил-4-[2-{5-(N,N'-бис((S)-1-(1-этоксикарбонил)пропил)фосфонамидо)}фуранил]тиазол.
Анализ для С23Н37N4O6PS:
(52.40) 2-Амино-5-пропилтио-4-[2-{5-(N,N'-бис((S)-1-циклогексилметоксикарбонил)этил)фосфонамидо)}фуранил]тиазол.
Анализ для С30Н47N4O6PS2:
(52.41) 2-Амино-5-изобутил-4-[2-{5-(1-этоксикарбонил)циклопентил)фосфонамидо)}фуранил]тиазол.
Анализ для С27Н41N4O6PS:
(52.42) 2-Амино-4-{N,N'-(1-этоксикарбонил)циклопентил}фосфонометокси-7-фтор-6-метилбензотиазол. Анализ для C26H38N4O6PSF+0,15Et2O:
(52.43) 2-Амино-5-изобутил-4-[2-{5-(N,N'-бис((S)-1-(1-неопентоксикарбонил)этил)фосфонамидо)}фуранил]тиазол.
Анализ для С27Н45N4O6PS+0,1H2O:
(52.44) 2-Амино-5-изобутил-4-{2-[5-(N,N'-бис(R,S)-1-(1-этоксикарбонил)этил)фосфонамидо)]фуранил}тиазол. Т.пл. 143-146°С.
Анализ для С21Н33N4O6PS:
(52.45) 2-Амино-5-изобутил-4-[2-{5-(N,N'-бис((S)-1-(1-изопропоксикарбонил)этил)фосфонамидо)}фуранил]тиазол.
Анализ для С23Н37N4O6PS:
(52.46) 2-Амино-5-изобутил-4-[2-{5-(N,N'-бис((S)-1-(1-пропоксикарбонил)этил)фосфонамидо)}фуранил]тиазол.
Анализ для С23Н37N4O6PS+0,1СН2Cl2:
(52.47) 2-Амино-5-изобутил-4-[2-{5-(N,N'-бис((S)-1-(1-изобутоксикарбонил)этил)фосфонамидо)}фуранил]тиазол.
Анализ для C25H4lN4O6PS:
(52.48) 2-Амино-5-пропилтио-4-{2-[5-(N,N'-бис((S)-1-этоксикарбонил)этил)фосфонамидо]фуранил}оксазол.
Анализ для C20H31N4O7PS:
(52.49) 2-Амино-5-пропилтио-4-{2-[5-(N,N'-бис-1-этоксикарбонил)метил)фосфонамидо]фуранил}оксазол.
Анализ для C18H27N4O7PS:
(52.50) 2-Амино-5-(изобутил-d9)-4-[2-{5-(N,N'-бис(S)-1-(1-этоксикарбонил)этилфосфонамидо}фуранил]тиазол.
Анализ для C2lH24D9N4O6SP:
Примеры использования способа изобретения включают следующее. Следует понимать, что данные примеры являются иллюстративными и что способ изобретения не ограничивается только данными примерами.
Для внесения четкости и краткости изложения в следующих ниже биологических примерах химические соединения обозначаются номером примера синтеза.
Соединение А представляет 4-амино-5-фтор-7-этил-1-изобутил-2-(2-фосфоно-5-фуранил)бензимидазол.
Соединение В представляет 4-амино-5-фтор-1-циклопропилметил-2-(2-фосфоно-5-фуранил)бензимидазол.
Соединение С представляет 2-амино-5-изобутил-4-{2-[N-(1-метил-1-карбокси)этилмонофосфонамидо]фуранил}тиазол.
Кроме того, следующие примеры испытания, которые могут быть полезны для идентифицирования соединений, ингибирующие глюконеогенез, включают следующие животные модели диабета.
i. Животные с панкреатическими β-клетками, разрушенными специфическими химическими цитотоксинами, такими как аллоксан или стрептозотоцин (например, мышь, крыса, собака и обезьяна, обработанные стрептозотоцином). Kodama, H., Fujita, M., Yamaguchi, I., Japanese Journal of Pharmacology 66, 331-336 (1994) (мышь); Youn, J.H., Kirn, J.K., Buchanan, T.A., Diabetes 43, 564-571 (1994) (крыса); Le Marchand, Y., Loten, E.G., Assimacopoulos-Jannet, F. et al. Diabetes 27, 1182-88 (1978) (собака); и Pitkin. R.M., Reynolds, W.A., Diabetes 19, 70-85 (1970) (обезьяна).
ii. Мутантные мыши, как например, линий C57BL/Ks db/db, C57BL/Ks db/db и C57BL/6J ob/ob от Jackson Laboratory, Bar Harbor, и другие, как например, желтые тучные, Т-КК, и Новозеландские тучные. Coleman, D.L., Hummel, К.Р., Diabetologia 3, 238-248 (1967) (C57BL/Ks db/db); Coleman, D.L., Diabetologia 14, 141-148 (1978) (C57BL/6J ob/ob); Wolff, G.L., Pitot, H.C., Genetics 73, 109-123 (1973) (желтые тучные); Dulin, W.E., Wyse, B.M., Diabetologia 6, 317-323 (1970) (Т-КК); and Bielschowsky, M., Bielschowsky, F. Proceedings of the University of Otago Medical School 31, 29-31 (1953) (Новозеландские тучные).
iii. Мутантные крысы, как, например, крыса линии Zucker fa/fa с приобретенным диабетом в результате обработки стрептозотоцином или дексаметазоном, диабетическая жирная крыса линии Zucker и жирная крыса линии Wistar (Kyoto). Stolz, K.J., Martin, R.J. Journal of Nutrition 112, 997-1002 (1982) (стрептозотоцин); Ogawa, A., Johnson, J.H., Ohnbeda, M., McAllister, C.T., Inman, L., Alam, Т., Unger, R.H., The Journal of Clinical Investigation 90, 497-504 (1992) (дексаметазон); Clark, J.B., Palmer, C.J., Shaw, W.N., Proceedings of the Society for Experimental Biology and Medicine 173, 68-75 (1983) (диабетическая жирная крыса линии Zucker); and Idida, H., Shino, A., Matsuo, Т. et al., Diabetes 36, 1045-1050 (1981) (жирная крыса линии Wistar (Kyoto)).
iv. Животные со спонтанным диабетом, как, например, китайский хомячок, морская свинка, новозеландский белый кролик и не-человекоподобные приматы, такие как макак резус и беличья обезьяна. Gerritsen, G.C., Cornel, M.A., Blanks, M.C., Proceedings of the Nutrition Society 40, 237-245 (1981) (китайский хомячок); Lang, C.M., Munger, B.L., Diabetes 25, 434-443 (1976) (морская свинка); Conaway, H.H., Brown, C.J., Sanders, L.L. et al. Journal of Heredity 71, 179-186 (1980) (новозеландский белый кролик); Hansen, B.C., Bodkin, M.L., Diabetologia 29, 713-719 (1986) (макак резус); и Davidson, I.W., Lang, C.M., Blackwell, W.L, Diabetes 16, 395-401 (1967) (беличья обезьяна).
v. Животные с диабетом, вызванным раскармливанием, такие как песчаная крыса, колючий рисовый хомячок, когтистая монгольская песчанка и крыса с диабетом (Cohen), вызванным сахарозой. Schmidt-Nielsen, К., Hainess, Н.В., Hackel, D.B., Science 143, 689-690 (1964) (песчаная крыса); Gonet, A.E., Stauffacher, W., Pictet, R. et al. Diabetologia 1, 162-171 (1965) (колючий рисовый хомячок); Boquist, L., Diabetologia 8, 274-282 (1972) (когтистая монгольская песчанка); и Cohen, A.M., Teitebaum, A., Saliteknik, R., Metabolism 21, 235-240 (1972) (крыса с диабетом, вызванным сахарозой (Cohen)).
vi. Любое другое животное с одной из следующих ниже характеристик или с комбинацией из следующих ниже характеристик, являющихся результатом генетической предрасположенности, генной инженерии, селективного бридинга, или химического индуцирования, или индуцирования путем раскармливания: повышенная толерантность к глюкозе, инсулинорезистентность, гипергликемия, ожирение, ускоренный глюконеогенез, увеличенный выброс глюкозы печенью.
Пример А. Ингибирование ФБФазы печени человека.
Штамм BL21 Е. coli, в котором клетки трансформированы плазмидой, кодирующей ФБФазу печени человека, получали от Dr. М. R. El-Maghrabi at the State University of New York at Stony Brook. Фермент обычно выделяли из 10 литров культуры рекомбинантной E.Coli, как описано (М. Gidh-Jain et al, 1994, The Journal of Biological Chemistry 269, pp 27732-27738). Ферментативную активность определяли спектрофотометрически в реакциях, которые сопрягают образование продукта (фруктозо-6-фосфат) с восстановлением бромида диметилтиазолдифенилтетразолия (МТТ) через NADP+ и феназинметосульфат (PMS), с использованием фосфоглюкозоизомеразы и глюкозо-6-фосфатдегидрогеназы в качестве связующих ферментов. Реакционные смеси (200 мкл) приготавливали в 96-луночных титрационных микропланшетах, и они состояли из 50 мМ Трис-HCl, рН 7,4, 100 мМ KCl, 5 мМ EGTA, 2 мМ MgCl2, 0,2 мМ NADP, 1 мг/мл БСА (BSA), 1 мМ МТТ, 0, 6 мМ PMS, 1 единица/мл фосфоглюкозоизомеразы, 2 единицы/мл глюкозо-6-фосфатдегидрогеназы, и 0,150 мМ субстрата (фруктозо-1,6-бисфосфат). Концентрации ингибитора варьировали от 0,01 мкМ до 10 мкМ. Реакции инициировали добавлением 0,002 единиц чистой пчФБФазы (hlFBPase) и контролировали в течение 7 минут при 590 нм при помощи спектрофотометра для прочтения планшетов (Molecular Devices Plate Reader) (37°C).
В таблице, представленной ниже, приведены значения ИК50 для нескольких полученных соединений. ИК50 для АМФ (AMP) составляет 1 мкМ.
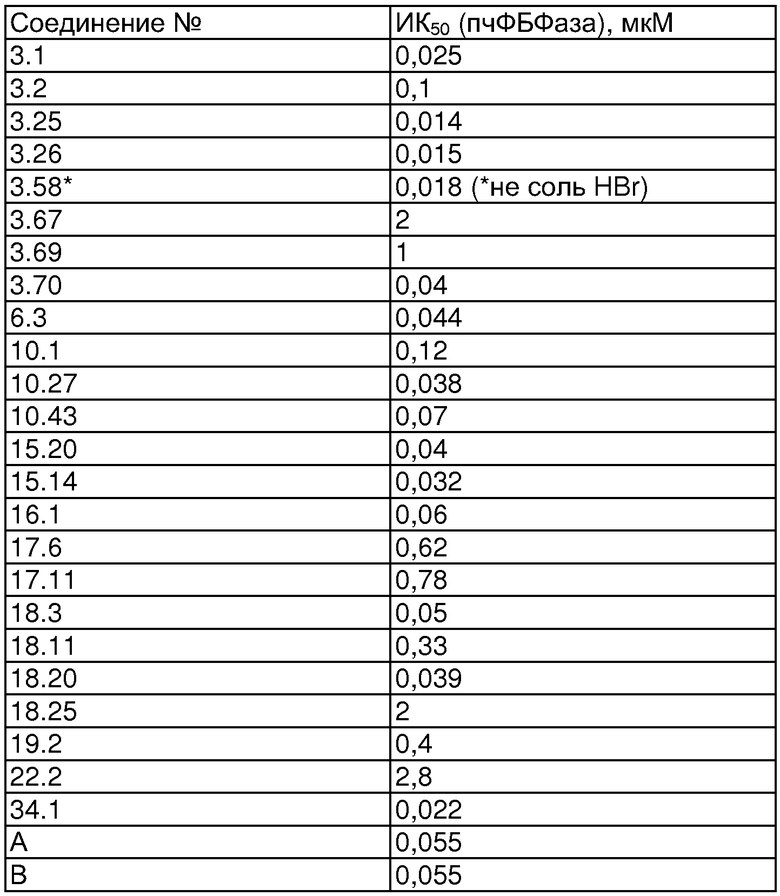
Ингибирование ФБФазы печени крысы
Штамм BL21 Е. coli, в котором клетки трансформированы плазмидой, кодирующей ФБФазу печени крысы, получали от Dr. М. R. El-Maghrabi at the State University of New York at Stony Brook. Рекомбинантную ФБФазу очищали, как описано (El-Maghrabi, M.R., and Pilkis, S.J. (1991) BioChem. Biophys. Res. Commun. 176, 137-144). Анализ фермента был идентичен анализу (определение ферементативной активности), изложенному выше для ФБФазы печени человека.
В таблице, представленной ниже, приведены значения ИК50 для нескольких полученных соединений. ИК50 для АМФ составляет 20 мкМ.
Пример В. Связывание сайта АМФ.
Чтобы оценить, связываются ли соединения с аллостерическим АМФ связывающим сайтом пчФБФазы, фермент инкубируют с меченным радиоактивным изотопом АМФ в присутствии ряда концентраций испытуемого соединения. Реакционные смеси состоят из 25 мМ 3H-АМФ (54 мКи/ммоль) и 0-1000 мМ испытуемого соединения в 25 мМ Трис-HCl, рН 7,4, 100 мМ KCl и 1 мМ MgCl2. 1,45 мг гомогенной ФБФазы (± нмоль) добавляют в последнюю очередь. После инкубации в течение 1 минуты АМФ, связанный с ФБФазой, отделяют от несвязанного АМФ при помощи устройства для центробежной ультрафильтрации ("Ultrafree-MC", Millipore), используемого в соответствии с инструкциями производителя. Используя жидкостной сцинтилляционный счетчик Бекмана, определяют количественно радиоактивность в аликвотах (100 мкл) верхнего отделения устройства (ретентат, который содержит фермент и метку) и нижнего отделения (фильтрат, который содержит несвязанную метку). Количество АМФ, связанного с ферментом, определяют путем сравнения счета в фильтрате (несвязанная метка) с общим счетом в ретентате.
Пример С. Ингибирование глюконеогенеза в печеночных клетках крысы.
Печеночные клетки получают от голодавших на протяжении ночи крыс линии Sprague-Dawley (250-300 г) в соответствии с методикой Berry и Friend (Berry, M.N, Friend, D.S., 1969, J. Cell. Blol. 43, 506-520), модифицированной Groen (Groen, А.К., Sips, H.J., Vervoorn, R.C., Tager, J,M., 1982, Eur. J. BioChem. 122, 87-93). Печеночные клетки (75 мг влажная масса/мл) инкубируют в 1 мл Krebs-бикарбонатного буфера, содержащего 10 мМ лактата, 1 мМ пирувата, 1 мг/мл БСА и концентрации испытуемого соединения от 1 до 500 мкМ.
Инкубирование осуществляют в атмосфере 95% кислорода, 5% диоксида углерода, в закрытых пробирках Фалкона на 50 мл, погруженных в сильно вибрирующую баню с водой (37°С). Спустя 1 час отбирают аликвоту (0,25 мл), переносят в пробирку Эппендорфа и центрифугируют. Затем 50 мкл супернатанта анализируют на содержание глюкозы, используя набор глюкозооксидазы Sigma, в соответствии с инструкциями производителя.
В представленной ниже таблице приводятся значения ИК50 для соединений, выбранных для данного испытания.
Пример D. Ингибирование продуцирования глюкозы и аккумуляция фруктоэо-1,6-бисфосфата в печеночных клетках крысы.
Изолированные печеночные клетки крысы получают, как описано в примере С, и инкубируют в условиях, идентичных изложенным выше. Реакции обрывают путем удаления аликвоты (250 мкл) суспензии клеток и пропуская ее через слой масла (0,8 мл смеси 4/1 силикон/минеральное масло) в слой 10% хлорной кислоты (100 мкл). После удаления слоя масла слой кислого экстракта клеток нейтрализуют добавлением 1/3 (по объему) смеси 3М КОН/3М KHCO3. После тщательного перемешивания и центрифугирования супернатант анализируют на содержание глюкозы, как описано в примере С, и, кроме того, на содержание фруктозо-1,6-бисфосфата. Фруктозо-1,6-бисфосфат анализируют спектрофотометрически, сопрягая его ферментативное превращение в глицерол-3-фосфат с окислением NADH, которое контролируют при 340 нм. Реакционные смеси (1 мл) состоят из 200 мМ Трис-HCl, рН 7,4, 0,3 мМ NADH, 2 единицы/мл глицерол-3-фосфатдегидрогеназы, 2 единицы/мл триозофосфатизомеразы и 50-100 мкл экстракта клеток. После 30-минутной предварительной инкубации при 37°С добавляют 1 единица/мл альдолазы и контролируют изменение поглощения до тех пор, пока не получат стабильное значение. В данной реакции окисляется 2 моля NADH на моль фруктозо-1,6-бисфосфата, присутствующего в клеточном экстракте.
Факт установления дозозависимого ингибирования продуцирования глюкозы, сопровождаемого дозозависимой аккумуляцией фруктозо-1,6-бисфосфата (субстрат ФБФазы), свидетельствует о том, что фермент-мишень, участвующий в глюконеогенезном пути метаболизма, ФБФаза, подвергается ингибированию.
Пример Е. Химическая стабильность.
Цель: оценить стабильность пролекарств 50.6, 50.9, 50.15 и 50.20 в забуференном фосфатом водном растворе при нейтральном рН.
Способы: раствор пролекарства с концентрацией 50 или 100 мкг/мл в буфере на основе фосфата калия при рН 7 (комнатная температура) анализируют ежедневно в течение вплоть до 10 дней. Пробы анализируют ВЭЖХ с обращенной фазой с использованием колонки Beckman Ultrasphere CI8 (4,6×250 мм). Колонку уравновешивают и элюируют градиентом от 50 мМ фосфата натрия, рН 5,5, до 70% ацетонитрила при скорости потока 1,5 мл/мин. Детектирование осуществляют при 300 или 315 нм, температура колонки 40°С. В этих условиях пролекарства хорошо отделяются от стандартов исходного соединения; время удерживания для пролекарств находится в диапазоне от 16 до 18 минут, в то время как исходные соединения, 3.1 и 3.58 (не соль HBr), элюируются на 9 и 10 минутах соответственно.
Результаты: пролекарства, подвергнутые оценке, демонстрируют хорошую стабильность при нейтральном рН. Было отмечено разложение пролекарств менее чем на 10% на протяжении 4-дневного периода инкубации. Таким образом, t90 (время 90% стабильности) для 50.6, 50.9, 50.15 и 50.20 при рН 7 составляло > 96 часов.
Пример F. Оценка оральной биодоступности у крысы.
Цель: оценить оральную биодоступность пролекарств способом (оценки) экскреции исходного соединения в моче у крысы.
Способы: пролекарства растворяют в смеси 10% этанол/90% полиэтиленгликоль (MB 400) и вводят при помощи зонда через рот при дозах от 10 до 40 мг/кг эквивалентов исходного соединения крысам линии Sprague Dawley (весом 220-240 г), подвергнутым 6-часовому голоданию. Исходные соединения обычно растворяют в деионизованной воде, нейтрализованной гидроксидом натрия, и затем вводят крысам, которые были анестезированы галотаном (halothane), через хвостовую вену при дозе ˜10 мг/кг. Затем крыс помещают в метаболические клетки и мочу собирают на протяжении 24 часов. Количество исходного соединения, выделенного в мочу, определяют анализом с помощью ВЭЖХ. Анализ осуществляют, как изложено в примере Е. Оральную биодоступность, выраженную в %, определяют путем сравнения содержания в моче исходного соединения, образованного из пролекарства, введенного орально, с содержанием исходного соединения в моче после внутривенного введения незамещенного исходного соединения.
Результаты: оральная биодоступность, оцененная в %, для выбранных пролекарств представлена ниже.
Пример G. Оральная фармакокинетика на крысах.
Цель: определить фармакокинетические параметры 50.6 и 50.9 (пролекарства 3.1), и 50.2 (пролекарство 3.58) после орального введения крысе.
Способы: пролекарства вводили орально при дозе 10 мг/кг накормленным крысам, которым были установлены катетеры в хвостовую артерию. В соответствующие промежутки времени после введения лекарственного средства, через катетеры, введенные в хвостовую вену, отбирали пробы крови. Из проб получали плазму центрифугированием и затем осаждали белок плазмы добавлением метанола до 60%. Метанольные экстракты осветляли центрифугированием и затем анализировали на содержание пролекарства и исходного соединения с помощью ВЭЖХ, как изложено в примере Е. Параметры фармакокинетики рассчитывали из профилей «концентрация в плазме исходного соединения-время» с использованием некомпартментного анализа (WinNonLin v, 1.1 программное обеспечение).
Результаты: пролекарства не определялись в плазме, что указывает на быстрое in vivo превращение их в соответствующие исходные соединения. Параметры фармакокинетики суммированы ниже.
Пример Н. Острая оральная эффективность у ZDF крысы.
Цель: определить эффект снижения уровня глюкозы в крови при быстром введении 50.6, 50.9 и 50.2 у диабетической жирной крысы линии Zucker (ZDF крыса).
Способы: ZDF крыс приобретали у Genetics Inc (Indianapolis, Indiana) в возрасте 8 недель. Животных содержали в стандартных условиях и обеспечивали кормом Purina 5008 и водой по желанию (ad libitum). Крыс отбирали в возрасте 10-12 недель с уровнями глюкозы в крови > 500 мг/дл и вводили им орально либо наполнитель (ПЭГ 400), либо пролекарство (60 мг/кг). Уровни глюкозы в крови контролировали через равные промежутки времени на протяжении 6 часов после дозирования. Отбирали пробы крови из разреза хвостовой вены и анализировали посредством анализатора глюкозы HemoCue (Hemocue, Mission Viejo, CA). Статистический анализ проводили, используя критерий Стьюдента. Представлены средние значения ± стандартная ошибка среднего.
Результаты: три пролекарства оказались эффективными при оральном введении, что подтверждается наблюдаемыми эффектами значительного снижения уровня глюкозы в крови (см. таблицу).
Пример I. Хроническая оральная эффективность у ZDF крысы.
Цель: определить влияние 50.6 на снижение уровня глюкозы в крови у ZDF крысы на протяжении 3 недель длительной оральной обработки.
Способы: ZDF крыс (в возрасте 10 недель) содержат либо на порошкообразном корме для крыс Purina 5008 (n=10), либо на таком же порошкообразном корме, дополненном 0,4% 50.6 (n=8). Проводят определения глюкозы в крови, как изложено в примере Е, в базовый момент времени и раз в неделю в дальнейшем на протяжении суммарно 3 недель. Статистический анализ проводили, используя критерий Стьюдента. Показаны средние значения ± стандартная ошибка среднего.
Результаты: как показано в таблице, эффективность сохраняется на протяжении 3-недельного периода обработки, с очевидным снижением уровня глюкозы в крови на 45% в группе, подвергнутой лечению лекарственным средством (относительно наполнителя), к концу исследования.
Пример J. Идентификация промежуточного соединения, образованного во время активации 50.6.
Превращение 50.6 оценивали в плазме крысы, обезьяны и человека посредством ВЭЖХ с обращенной фазой с использованием колонки Beckman Ultrasphere ODS (4,6×150 мм), снабженной колонкой Alltech All-Guard. Колонку уравновешивали 20 мМ фосфатом калия, рН 6,2, и элюировали с линейным градиентом 0-60% ацетонитрила на протяжении 20 минут при скорости потока 1,5 мл/мин и при температуре 40°С. УФ-поглощение контролировали при 300 нм. Экспозиция 50.6 (100 мкМ) в пробах плазмы приводила к образованию единственного метаболита. Метаболит имел то же самое время удерживания и УФ-спектр, как продукт, образовавшийся после инкубации пролекарства с эстеразой печени свиньи (Sigma Chemical Co, МО), свидетельствуя о том, что он представляет собой продукт реакции, катализируемой эстеразой. Метаболит, образовавшийся в плазме крысы, собирают и подвергают анализу методом масс-спектрометрии в Mass Consortium Corporation (San Diego. CA). Проба дает пик отрицательного иона при 372, указывая на то, что образовавшийся метаболит имеет молекулярную массу 373. Такая молекулярная масса соответствует молекулярной массе монофосфорамидатного промежуточного продукта. Промежуточный продукт, вероятно, образовался по механизму реакции, по которому пролекарство сначала претерпевает полную деэтерификацию, а затем внутримолекулярное, гидролитическое отщепление одного из аминоацильных заместителей. Образование постулированного монофосфорамидатного промежуточного продукта подтверждалось последующим синтезом синтетического стандарта (соединения С). Стандарт имел профиль ВЭЖХ и УФ, идентичный метаболиту, образовавшемуся в пробах плазмы.
Пример К. Метаболизм 50.6 в печеночных клетках человека.
Криоконсервированные печеночные клетки человека получают от Vitro Technologies и размораживают в соответствии с рекомендациями поставщика. Клетки инкубируют при 37°С в буфере на основе Krebs-бикарбоната, содержащем 50.6 при 10 мкМ. В различные моменты времени на протяжении 4 часов отбирают аликвоты клеток и экстрагируют добавлением метанола до 60%. Экстракты клеток осветляют центрифугированием и анализируют ВЭЖХ с обращенной фазой с использованием колонки Beckman Ultrasphere ODS (4,6×150 мм), снабженной колонкой Alltech All-Guard. Колонку уравновешивают 20 мМ фосфата калия, рН 6,2, и элюируют с линейным градиентом 0-60% ацетонитрила на протяжении 20 минут при скорости потока 1,5 мл/мин и при температуре 40°С. УФ-поглощение контролируют при 300 нм. 50.6, соединение С и 3.1 определяют количественно путем сравнения с аутентичными стандартами. Исчезновение 50.6 наступало быстро и практически полностью в пределах 60 минут инкубации. Определяли два метаболита 50.6: соединение С и 3.1. Начальная скорость образования 3.1 составляла 24 пмоль/миллион клеток/минута. Данное исследование указывает на то, что 50.6 превращается в активный ингибитор ФБФазы, 3.1, в интактных печеночных клетках человека.
Пример L. Взаимосвязь структура-активность фосфорамидазы печени человека.
Печень человека, приобретенную от Anatomic Gift Foundation (Laurel, MD), гомогенизируют в Krebs-бикарбонатном буфере и осветляют низкоскоростным центрифугированием. Метаболизм пролекарства оценивают в реакционных смесях, содержащих гомогенат печени человека (4 мг белка), 50 мМ Трис-HCl, рН 7,4, 10 мМ MgCl2 и 10 мМ дитиотреита. Через различные интервалы времени на протяжении 2 часов из реакционных смесей отбирают аликвоты и депротеинизируют добавлением метанола до 60%. После осветления центрифугированием метаболиты анализируют ВЭЖХ с обращенной фазой с использованием колонки Beckman Ultrasphere ODS (4,6×150 мм), снабженной колонкой Alltech All-Guard. Колонку уравновешивают 20 мМ фосфата калия, рН 6,2, и элюируют с линейным градиентом 0-60% ацетонитрила на протяжении 20 минут при скорости потока 1,5 мл/мин и температуре 40°С. Контролируют УФ-поглощение при 300 нм. Большая часть подвергнутых оценке пролекарств превращалась (в пределах 5 минут инкубации) через стадию, не лимитирующую скорость процесса, катализируемую эстеразой, в их монофосфорамидатную форму. Поэтому скорость появления фосфоновой кислоты, по существу, является отражением скорости конечной стадии расщепления, катализируемой фосфорамидатом. Ниже представлены результаты для характерных пролекарств, для которых стадия, катализируемая эстеразой, не является стадией, лимитирующей скорость процесса.
Результаты указывают на то, что фосфорамидаза печени человека быстро расщепляет связь фосфор-азот ряда субстратов фосфоновая кислота-моноамидат, тем самым высвобождая ингибитор ФБФазы - свободную фосфоновую кислоту. Наименьшая скорость расщепления связи P-N наблюдается в случае субстрата, содержащего вторичный амин, монофосфорамидата 50.10. Первая стадия в активации пролекарства, деэтерификация, катализируемая эстеразой, не является стадией, лимитирующей скорость процесса для большинства подвергнутых оценке субстратов.
Хотя в соответствии с патентным законодательством в описании проиллюстрированы различные варианты и технологические условия осуществления изобретения, их не следует рассматривать, как ограничение объема данного изобретения. Для специалистов в данной области очевидны модификации и изменения настоящего изобретения, не выходящие за рамки объема и существа настоящего изобретения. В связи с чем подразумевается, что объем данного изобретения должен определяться нижеследующей прилагаемой формулой изобретения, а не конкретными примерами, которые были представлены в качестве иллюстрации изобретения.
Изобретение относится к новым бисамидатным фосфонатным соединениям, являющимся ингибиторами фруктозо-1,6-бисфосфатазы. Описывается соединение формулы IA 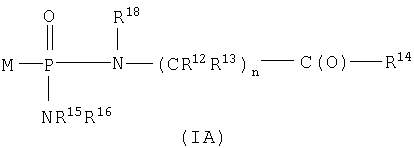 где соединения формулы IA превращаются in vivo или in vitro в М-РО3Н2, которое является ингибитором, фруктозо-1,6-бисфосфатазы, и где М представляет R5-X-, где R5 выбран из группы, состоящей из
где соединения формулы IA превращаются in vivo или in vitro в М-РО3Н2, которое является ингибитором, фруктозо-1,6-бисфосфатазы, и где М представляет R5-X-, где R5 выбран из группы, состоящей из 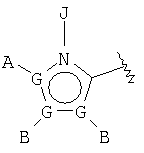 и
и 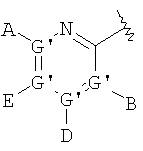
где каждый G независимо выбран из группы, состоящей из С, N, О, S и Se, и где только один G может быть О, S или Se, и самое большее один G представляет N; каждый G' независимо выбран из группы, состоящей из С и N, и где не более чем две G' группы представляют N; А выбран из группы, состоящей из -Н, -NR4 2, -CONR4 2, -CO2R3, галоида, -S(O)R3, -SO2R3, алкила, алкенила, алкинила, пергалоидалкила, галоидалкила, арила, -СН2ОН, -CH2NR4 2, -CH2CN, -CN, -C(S)NH2, -OR2, -SR2, -N3, -NHC(S)NR4 2, -NHAc, или отсутствует; каждый В и D независимо выбран из группы, состоящей из -Н, алкила, алкенила, алкинила, арила, алициклила, аралкила, алкоксиалкила, -С(O)R11, -C(O)SR11, SO2R11, -S(O)R3, -CN, -NR9 2, -OR3, -SR3, пергалоидалкила, галоида, -NO2, или отсутствует, все, кроме -H, -CN, пергалоидалкила, -NO2 и галоида, необязательно замещены; Е выбран из группы, состоящей из -Н, алкила, алкенила, алкинила, арила, алициклила, алкоксиалкила, C(O)OR3, -CONR4 2, -CN, -NR9 2, -NO2, -OR3, -SR3, пергалоидалкила, галоида, или отсутствует, все, кроме -H, -CN, пергалоидалкила и галоида, необязательно замещены; J выбран из группы, состоящей из -Н, или отсутствует; Х представляет необязательно замещенную связывающую группу, которая связывает R5 с атомом фосфора через 2-4 атома, включающих 0-1 гетероатом, выбранный из N, О и S, за исключением того, что если Х представляет мочевину или карбамат, тогда имеется 2 гетероатома, которые и определяют кратчайшее расстояние между R5 и атомом фосфора, и где атом, связанный с фосфором, является атомом углерода, и где Х выбран из группы, состоящей из -алкил(гидрокси)-, -алкинила-, -гетероарила-, -карбонилалкила-, -1,1-дигалоидалкила-, -алкоксиалкила-, -алкилокси-, -алкилтиоалкила-, -алкилтио-, -алкиламинокарбонила-, -алкилкарбониламино-, -алкоксикарбонила-, -карбонилоксиалкила-, -алкоксикарбониламино- и -алкиламинокарбониламино-, все необязательно замещены; при условии, что Х не замещен -COOR2, -SO3Н или -РО3R2 2; n равно целому числу от 1 до 3; R2 выбран из группы -R3 и -Н; R3 выбран из группы, состоящей из алкила, арила, алициклила и аралкила; каждый R4 независимо выбран из группы, состоящей из -Н и алкила, или вместе R4 и R4 образуют циклоалкильную группу; каждый R9 независимо выбран из группы, состоящей из -Н, алкила, арила, аралкила и алициклила, или вместе R9 и R9 образуют циклоалкильную группу; R11 выбран из группы, состоящей из алкила, арила, -NR2 2 и -OR2; каждый R12 и R13 независимо выбран из группы, состоящей из Н, низшего алкила, низшего арила, низшего аралкила, все необязательно замещены, или R12 и R13 вместе связаны через 2-6 атомов, необязательно включающих 1-2 гетероатома, выбранных из группы, состоящей из О, N и S, с образованием циклической группы; каждый R14 независимо выбран из группы, состоящей из -OR17, -N(R17)2, -NHR17, -NR2OR19 и -SR17; R15 выбран из группы, состоящей из -Н, низшего алкила, низшего арила, низшего аралкила, или вместе с R16 связан через 2-6-атомов, необязательно включающих 1 гетероатом, выбранный из группы, состоящей из О, N и S; R16 выбран из группы, состоящей из -(CR12R13)n-C(O)-R14, -Н, низшего алкила, низшего арила, низшего аралкила, или вместе с R15 связан через 2-6 атомов, необязательно включающих 1 гетероатом, выбранный из группы, состоящей из О, N и S; каждый R17 независимо выбран из группы, состоящей из низшего алкила, низшего арила и низшего аралкила, все необязательно замещены, или R17 и R17 на N вместе связаны через 2-6 атомов, необязательно включающих 1 гетероатом, выбранный из группы, состоящей из О, N и S; R18 независимо выбран из группы, состоящей из Н, низшего алкила, арила, аралкила, или вместе с R12 связан через 1-4 атома углерода, образуя циклическую группу; каждый R19 независимо выбран из группы, состоящей из -Н, низшего алкила, низшего арила, низшего алициклила, низшего аралкила и COR3; и при условии что: когда G' представляет N, тогда соответствующие А, В, D или Е отсутствуют; по меньшей мере, один из А и В или А, В, D и Е не выбран из группы, состоящей из -Н, или отсутствует; когда G представляет N, тогда соответствующий А или В не является галоидом или группой, непосредственно связанной с G через гетероатом; и его фармацевтически приемлемые соли. Также описываются способ лечения диабета или профилактики диабета, способ ингибирования фруктозо-1,6-бисфосфотазы, способ снижения уровня глюкозы в крови животного, способ лечения заболеваний, связанных с депонированием гликогена, способ ингибирования глюконеогенеза у животного и фармацевтическая композиция на основе соединений формулы IA. 10. н. и 59 з.п. ф-лы, 7 табл.
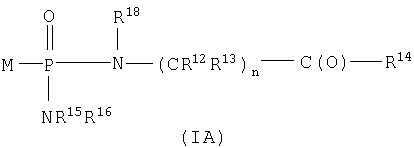
где соединения формулы IA превращаются in vivo или in vitro в М-РО3Н2, которое является ингибитором, фруктозо-1,6-бисфосфатазы, и где
М представляет R5-X-,
где
R5 выбран из группы, состоящей из
 и
и 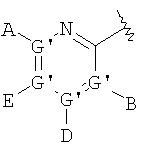
где
каждый G независимо выбран из группы состоящей из С, N, О, S и Se, и где только один G может быть О, S или Se, и, самое большее один G представляет N;
каждый G' независимо выбран из группы, состоящей из С и N, и где не более чем две G'группы представляют N;
А выбран из группы, состоящей из -Н, -NR4 2, -CONR4 2, -СО2R3, галоида, -S(O)R3, -SO2R3, алкила, алкенила, алкинила, пергалоидалкила, галоидалкила, арила, -СН2ОН, -CH2NR4 2, -CH2CN, -CN, -C(S)NH2, -OR2, -SR2, -N3, -NHC(S)NR4 2, -NHAc, или отсутствует;
каждый В и D независимо выбран из группы, состоящей из -Н, алкила, алкенила, алкинила, арила, алициклила, аралкила, алкоксиалкила,-С(O)R11, -C(O)SR3, SO2R11, -S(O)R3, -CN, -NR9 2, -OR3, -SR3, пергалоидалкила, галоида, -NO2, или отсутствует, все, кроме -H,-CN, пергалоидалкила, -NO2 и галоида, необязательно замещены;
Е выбран из группы, состоящей из -Н, алкила, алкенила, алкинила, арила, алициклила, алкоксиалкила, C(O)OR3, -CONR4 2, -CN, -NR9 2, -NO2, -OR3, -SR3, пергалоидалкила, галоида, или отсутствует, все, кроме -H, -CN, пергалоидалкила и галоида, необязательно замещены;
J выбран из группы, состоящей из -Н, или отсутствует;
Х представляет необязательно замещенную связывающую группу, которая связывает R5 с атомом фосфора через 2-4 атома, включающих 0-1 гетероатом, выбранный из N, О и S, за исключением того, что если Х представляет мочевину или карбамат, тогда имеется 2 гетероатома, которые и определяют кратчайшее растояние между R5 и атомом фосфора, и где атом, связанный с фосфором, является атомом углерода, и где Х выбран из группы, состоящей из -алкил(гидрокси)-, -алкинила-, -гетероарила-, -карбонилалкила-, -1,1-дигалоидалкила-, -алкоксиалкила-, -алкилокси-, -алкилтиоалкила-, -алкилтио-, алкиламинокарбонила-, -алкилкарбониламино-, -алкоксикарбонила-, карбонилоксиалкила-, -алкоксикарбониламино- и -алкиламинокарбониламино-, все необязательно замещены; при условии, что Х не замещен -COOR2, -SO3Н или -РО3R2 2;
n равно целому числу от 1 до 3;
R2 выбран из группы, состоящей из -R3 и -Н;
R3 выбран из группы, состоящей из алкила, арила, алициклила и аралкила;
каждый R4 независимо выбран из группы, состоящей из -Н и алкила, или вместе R4 и R4 образуют циклоалкильную группу;
каждый R9 независимо выбран из группы, состоящей из -Н, алкила, арила, аралкила и алициклила, или вместе R9 и R9 образуют циклоалкильную группу;
R11 выбран из группы, состоящей из алкила, арила, -NR2 2 и -OR2;
каждый R12 и R13 независимо выбран из группы, состоящей из Н, низшего алкила, низшего арила, низшего аралкила, все необязательно замещены, или R12 и R13 вместе связаны через 2-6 атомов, необязательно включающих 1-2 гетероатома, выбранных из группы, состоящей из О, N и S, с образованием циклической группы;
каждый R14 независимо выбран из группы, состоящей из -OR17, -N(R17)2, -NHR17, -NR2OR19 и -SR17;
R15 выбран из группы, состоящей из -Н, низшего алкила, низшего арила, низшего аралкила, или вместе с R16 связан через 2-6-атомов, необязательно включающих 1 гетероатом, выбранный из группы, состоящей из О, N и S;
R16 выбран из группы, состоящей из -(CR12R13)n-C(O)-R14, -Н, низшего алкила, низшего арила, низшего аралкила, или вместе с R15 связан через 2-6 атомов, необязательно включающих 1 гетероатом, выбранный из группы, состоящей из О, N и S;
каждый R17 независимо выбран из группы, состоящей из низшего алкила, низшего арила и низшего аралкила, все необязательно замещены, или R17 и R17 на N вместе связаны через 2-6 атомов, необязательно включающих 1 гетероатом, выбранный из группы, состоящей из О, N и S;
R18 независимо выбран из группы, состоящей из Н, низшего алкила, арила, аралкила, или вместе с R12 связан через 1-4 атома углерода, образуя циклическую группу;
каждый R19 независимо выбран из группы, состоящей из -Н, низшего алкила, низшего арила, низшего алициклила, низшего аралкила и COR3; и при условии что:
1) когда G' представляет N, тогда соответствующие А, В, D или Е отсутствуют;
2) по меньшей мере, один из А и В, или А, В, D и Е не выбран из группы, состоящей из -Н, или отсутствует;
3) когда G представляет N, тогда соответствующий А или В не является галоидом или группой, непосредственно связанной с G через гетероатом;
где термин «арил» относится к ароматическим группам, которые имеют 5-14 кольцевых атомов и, по меньшей мере, одно кольцо, имеющее сопряженную пи-электронную систему, и включает карбоциклический арил, гетероциклический арил и биарильные группы, все из которых могут быть необязательно замещенными, предпочтительно к фенилу и фуран-2,5-диилу;
термин «аралкил» относится к алкильной группе, замещенной арильной группой, подходящие аралкильные группы включают бензил, пиколил и т.п., и могут быть необязательно замещенными;
термин «алициклил» означает соединения, которые объединяют в себе характеристики алифатических и циклических соединений, которые включают необязательно замещенные ароматические, циклоалкильные и соединенные мостиковой связью циклоалкильные соединения, при этом циклические соединения включают гетероциклы;
термин «низший», упоминаемый в связи с органическими радикалами или соединениями, соответственно, определяет таковые как содержащие до и включая 10, или до и включая 6, или один-четыре атома углерода, при этом такие группы могут иметь прямую цепь, разветвленную или циклическую;
и его фармацевтически приемлемые соли.
Е выбран из группы, состоящей из -Н, C1-C6 алкила, C2-C6 алкенила, С2-С6 алкинила, арила, С4-С6 алициклила, алкоксиалкила, -C(O)OR3, -CONR4 2, -CN, -NR9 2, -OR3, -SR3, C1-С6 пергалоидалкила, галоида, или отсутствует, все, кроме -Н, -CN, пергалоидалкила и галоида, необязательно замещены; и каждый R4 независимо выбран из группы, состоящей -Н и C1-C2 алкила.


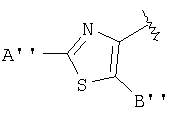
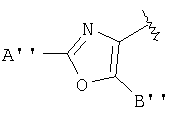
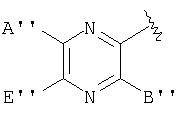
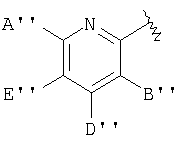
и
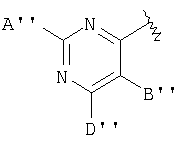
где А'' выбран из группы, состоящей из -Н, -NR4 2, -CONR4 2, -CO2R3, галоида, C1-С6 алкила, С2-С6 алкенила, C2-C6 алкинила, C1-C6 пергалоидалкила, С1-С6 галоидалкила, арила, -CH2OH, -CH2NR4 2, -CH2CN, -CN, -C(S)NH2, -OR2, -SR2, -N3, -NHC(S)NR4 2 и -NHAc;
В" и D" независимо выбраны из группы, состоящей из -Н, алкила, алкенила, алкинила, арила, гетероарила, алициклила, аралкила, алкоксиалкила, -C(O)R11, -C(O)SR3, -SO2R3, -S(O)R11, -CN, -NR9 2, -OR3, -SR3, пергалоидалкила и галоида, все, кроме -Н, -CN, пергалоидалкила и галоида, необязательно замещены;
Е" выбран из группы, состоящей из -Н, С1-С6 алкила, С2-С6 алкенила, C2-C6 алкинила, арила, С4-С6 алициклила, алкоксиалкила, -C(O)OR3, -CONR4 2, -CN, -NR9 2, -OR3, -SR3, C1-С6 пергалоидалкила и галоида, все, кроме -Н, -CN, пергалоидалкила и галоида, необязательно замещены; и каждый R4 независимо выбран из группы, состоящей -Н и C1-C2 алкила.
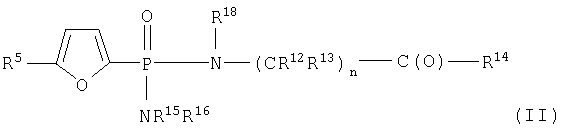
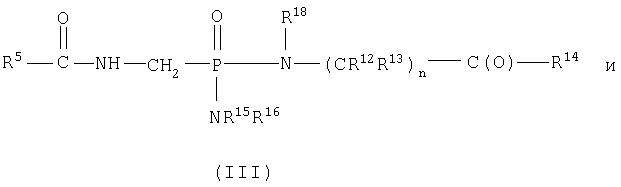
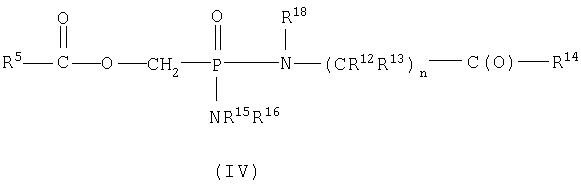
R14 выбран из группы, состоящей из -OR17, -SR17 и -NR2OR19;
R15 и R16 независимо выбраны из группы, состоящей из -Н и С1-С6 алкила, или R15 и R16 вместе связаны через 2-6 атомов, необязательно включающих 1 гетероатом, выбранный из группы, состоящей из О, N и S;
R17 выбран из группы, состоящей из C1-C7 алкила, фенила, индолила, сезимола и бензила, где указанный фенил, индолил, сезимол и бензил могут быть необязательно замещены 1-3 группами, выбранными из группы -CO2R2, -OR2, -NHC(O)R3, галоида и низшего алкила; и R18 выбран из группы, состоящей из -Н, С1-С6 алкила и бензила.
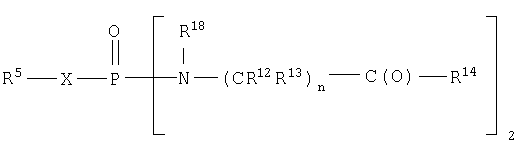
В" выбран из группы, состоящей из -Н, -C(O)R11, -C(O)SR3, алкила, арила, алициклила, галоида, -CN, -SR3, -OR3 и -NR9 2;
D" выбран из группы, состоящей из -Н, -C(O)R11, -C(O)SR3, -NR9 2, алкила, арила, алипиклила, галоида и -SR3;
Е" выбран из группы, состоящей из -Н, C1-C6 алкила, низшего алициклила, галоида, -CN, -C(O)OR3 и -SR3;
Х выбран из группы, состоящей из -гетероарила-, -алкоксикарбонила- и -алкиламинокарбонила-, все необязательно замещены;
R2 выбран из группы, состоящей из R3 и -Н;
R3 выбран из группы, состоящей из С1-С4 алкила, С4-С6арила, C2-C7 алициклила и С5-С7 аралкила, где указанные арил, алициклил и аралкил могут быть необязательно замещены 1-2 гетероатомами;
каждый R12 и R13 независимо выбран из группы, состоящей из -Н, C1-C4 алкила, -CH2O-С(СН3)3, фенила и бензила, или R12 и R13 вместе связаны через 2 или 4 атома углерода, образуя циклопропильную или циклопентильную группу;
n равно 1;
каждый R14 независимо выбран из группы, состоящей из -OR17, -SR17 и -NR2OR19;
R15 выбран из группы, состоящей из -Н, метила, этила, пропила;
R16 представляет -(CR12R13)n-C(O)-R14;
R17 выбран из группы, состоящей из C1-C7 алкила, фенила, индолила и бензила, где указанные фенил, индолил и бензил могут быть необязательно замещены 1-3 группами, выбранными из группы, состоящей из -CO2R2, -OR3, -NHC(O)R3, галоида и низшего алкила;
R18 выбран из группы, состоящей из -Н и метила; и
R19 выбран из группы -Н, C1-C4 алкила, С4-С6 арила, С2-С7 алициклила, С5-С7 аралкила, -COR3.
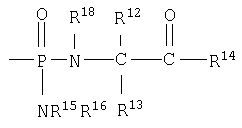
выбран из группы, состоящей из
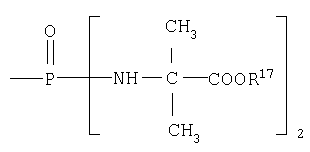
и
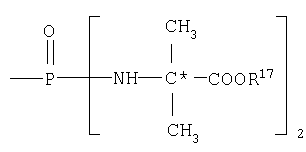
где R17 выбран из группы, состоящей из этила, изопропила, н-пропила и неопентила.

Х выбран из группы, состоящей из метиленоксикарбонила и фуран-2,5-диила, и их фармацевтически приемлемые соли.

представляет

где R17 выбран из группы, состоящей из этила, изопропила, н-пропила и неопентила.

представляет
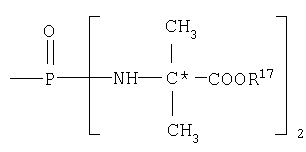
где С* имеет стереохимию S и где R17 выбран из группы, состоящей из этила, изопропила, н-пропила и неопентила.

представляет
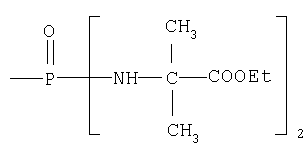

представляет

где С* имеет стереохимию S.

выбран из группы, состоящей из
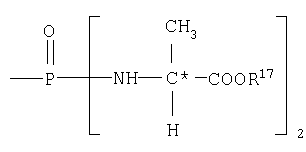
и

где R17 является этилом, н-пропилом, изопропилом и неопентилом и где С* имеет стереохимию S.

представляет
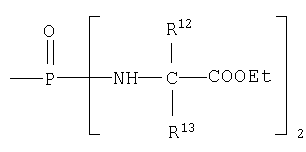
где R12 и R13 вместе образуют циклопентильную группу.

представляет
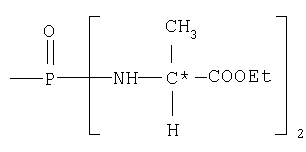
где С* имеет стереохимию S.

Х выбран из группы, состоящей из фуран-2,5-диила и метиленоксикарбонила, А"
представляет -NH2,
и их фармацевтически приемлемые соли.

А" представляет -NH2, Е" и D" представляют -Н, В" выбран из группы, состоящей из циклопропила и н-пропила, Х выбран из группы, состоящей из метиленоксикарбонила и фуран-2,5-диила,
и их фармацевтически приемлемые соли.

А" представляет -NH2, D" представляет -Н, В" выбран из группы, состоящей из н-пропила и циклопропила, Х выбран из группы, состоящей из фуран-2,5-диила и метиленоксикарбонила,
и их фармацевтически приемлемые соли.
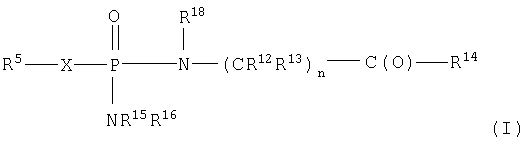
где R5 выбран из группы, состоящей из:
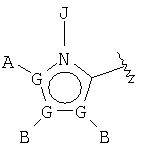 и
и 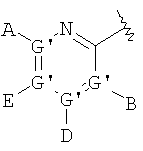
где каждый G независимо выбран из группы, состоящей из С, N, О, S и Se, и где только один G может представлять О, S или Se, и, самое большее, один G представляет N;
каждый G' независимо выбран из группы, состоящей из С и N, и где не более, чем две G* группы представляют N;
А выбран из группы, состоящей из -Н, -NR4 2, -CONR4 2, -CO2R3 галоида, -S(O)R3, -SO2R3, алкила, алкенила, алкинила, пергалоидалкила, галоидалкила, арила, -CH2OH, -CH2NR4 2, -CH2CN, -CN, -C(S)NH2, -OR2, -SR2, -N3, -NHC(S)NR4 2, -NHAc, или отсутствует;
каждый В и D независимо выбран из группы, состоящей из -Н, алкила, алкенила, алкинила, арила, алициклила, аралкила, алкоксиалкила, -C(O)R11, -C(O)SR3, SO2R11, -S(O)R3, -CN, -NR9 2, -OR3, -SR3, пергалоидалкила, галоида, -NO2, или отсутствует, все, кроме -Н, -CN, пергалоидалкила, -NO2 и галоида, необязательно замещены;
E выбран из группы, состоящей из -Н, алкила, алкенила, алкинила, арила, алициклила, алкоксиалкила, -C(O)OR3, -CONR4 2, -CN, -NR9 2, -NO2, -OR3, -SR3, пергалоидалкила, галоида, или отсутствует, все, кроме -Н, -CN, пергалоидалкила и галоида, необязательно замещены;
J выбран из группы, состоящей из -Н, или отсутствует;
Х представляет необязательно замещенную связывающую группу, которая связывает R5 с атомом фосфора через 2-4 атома, включающих 0-1 гетероатом, выбранный из N, О и S, за исключением того, что если Х представляет мочевину или карбамат, тогда имеется 2 гетероатома, которые и определяют кратчайшее расстояние между R5 и атомом фосфора, и где атом, связанный с фосфором, является атомом углерода, и где Х выбран из группы, состоящей из -алкил(гидрокси)-, -алкинила-, -гетероарила-, -карбонилалкила-, -1,1-дигалоидалкила-, -алкоксиалкила-, -алкилокси-, -алкилтиоалкила-, -алкилтио-, алкиламинокарбонила-, -алкилкарбониламино-, -алкоксикарбонила-, карбонилоксиалкила-, -алкоксикарбониламино- и -алкиламинокарбониламино-, все необязательно замещены; при условии, что Х не замещен -COOR2, -SO3Н или -РО3R2 2;
n равно целому числу от 1 до 3;
R2 выбран из группы, состоящей из R3 и -Н;
R3 выбран из группы, состоящей из алкила, арила, алициклила и аралкила;
каждый R4 независимо выбран из группы, состоящей из -Н и алкила, или R4 и R4 вместе образуют циклоалкильную группу;
каждый R9 независимо выбран из группы, состоящей из -Н, алкила, аралкила и алициклила, или вместе R9 и R9 образуют циклоалкильную группу;
R11 выбран из группы, состоящей из алкила, арила, -NR2 2 и -OR2;
каждый R12 и R13 независимо выбран из группы, состоящей из Н, низшего алкила, низшего арила, низшего аралкила, все необязательно замещены, или R12 и R13 вместе связаны через 2-6 атомов, необязательно включающих 1-2 гетероатома, выбранных из группы, состоящей из О, N и S, образуя циклическую группу;
каждый R14 независимо выбран из группы, состоящей из -OR17, -N(R17)2, -NHR17 2, -NR2OR19 и -SR17;
R15 выбран из группы, состоящей из -Н, низшего алкила, низшего арила, низшего аралкила, или вместе с R16 связан через 2-6 атомов, необязательно включающих 1 гетероатом, выбранный из группы, состоящей из О, N и S;
R16 выбран из группы, состоящей из -(CR12R13)n-C(O)-R14, -Н, низшего алкила, низшего арила, низшего аралкила, или вместе с R15 связан через 2-6 атомов, необязательно включающих 1 гетероатом, выбранный из группы, состоящей из О, N и S;
каждый R17 независимо выбран из группы, состоящей из низшего алкила, низшего арила и низшего аралкила, все необязательно замещены, или R17 и R17 на N вместе связаны через 2-6 атомов, необязательно включающих 1 гетероатом, выбранный из группы, состоящей из О, N и S;
R18 независимо выбран из группы, состоящей из Н, низшего алкила, арила, аралкила, или связан вместе с R12 через 1-4 атома углерода, образуя циклическую группу;
каждый R19 независимо выбран из группы, состоящей из -Н, низшего алкила, низшего арила, низшего алициклила, низшего аралкила и COR3;
и при условии что:
1) когда G' представляет N, тогда соответствующие А, В, D или Е отсутствуют;
2) по меньшей мере, один из А и В, или А, В, D и Е не выбран из группы, состоящей из -Н, или отсутствует;
3) когда G представляет N, тогда соответствующий А или В не является галоидом или группой, непосредственно связанной с G через гетероатом;
где термин «арил» относится к ароматическим группам, которые имеют 5-14 кольцевых атомов и, по меньшей мере, одно кольцо, имеющее сопряженную пи-электронную систему, и включает карбоциклический арил, гетероциклический арил и биарильные группы, все из которых могут быть необязательно замещенными, предпочтительно к фенилу и фуран-2,5-диилу;
термин «аралкил» относится к алкильной группе, замещенной арильной группой, подходящие аралкильные группы включают бензил, пиколил и т.п., и могут быть необязательно замещенными;
термин «алициклил» означает соединения, которые объединяют в себе характеристики алифатических и циклических соединений, которые включают необязательно замещенные ароматические, циклоалкильные и соединенные мостиковой связью циклоалкильные соединения, при этом циклические соединения включают гетероциклы;
термин «низший», упоминаемый в связи с органическими радикалами или соединениями, соответственно, определяет таковые как содержащие до и включая 10, или до и включая 6, или один-четыре атома углерода, при этом такие группы могут иметь прямую цепь, разветвленную или циклическую;
и его фармацевтически приемлемых солей.
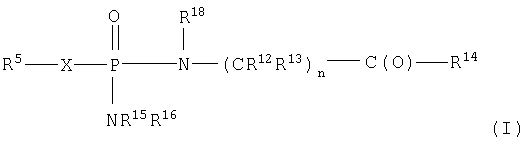
где R5 выбран из группы, состоящей из
 и
и 
где каждый G независимо выбран из группы, состоящей из С, N, О, S и Se, и где только один G может представлять О, S или Se, и, самое большее, один G представляет N;
каждый G' независимо выбран из группы, состоящей из С и N, и где не более чем две G' группы представляют N;
А выбран из группы, состоящей из -Н, -NR4 2, -CONR4 2, CO2R3, галоида, -S(O)R3, -SO2R3, алкила, алкенила, алкинила, пергалоидалкила, галоидалкила, арила, -CH2OH, -CH2NR4 2, -CH2CN, -CN, -C(S)NH2, -OR2, -SR2, -N3, -NHC(S)NR4 2, -NHAc, или отсутствует;
каждый В и D независимо выбран из группы, состоящей из -Н, алкила, алкенила, алкинила, арила, алициклила, аралкила, алкоксиалкила, -C(O)R11, -C(O)SR3, -SO2R11, -S(O)R3, -CN, -NR9 2, -OR3, -SR3, пергалоидалкила, галоида, -NO2, или отсутствует, все, кроме -Н, -CN, пергалоидалкила, -NO2 и галоида, необязательно замещены;
Е выбран из группы, состоящей из -Н, алкила, алкенила, алкинила, арила, алициклила, алкоксиалкила, -C(O)OR3, -CONR4 2, -CN, -NR9 2, -NO2, -OR3, -SR3, пергалоидалкила, галоида, или отсутствует, все, кроме -Н, -CN, пергалоидалкила и галоида, необязательно замещены;
J выбран из группы, состоящей из -Н, и отсутствует;
Х представляет необязательно замещенную связывающую группу, которая связывает R5 с атомом фосфора через 2-4 атома, включающих 0-1 гетероатом, выбранный из N, О и S, за исключением того, что если Х представляет мочевину или карбамат, тогда имеется 2 гетероатома, которые и определяют кратчайшее расстояние между R5 и атомом фосфора, и где атом, связанный с фосфором, является атомом углерода, и где Х выбран из группы, состоящей из -алкил(гидрокси)-, -алкинила-, -гетероарила-, -карбонилалкила-, -1,1-дигалоидалкила-, -алкоксиалкила-, -алкилокси-, -алкилтиоалкила-, -алкилтио-, -алкиламинокарбонила-, -алкилкарбониламино-, -алкоксикарбонила-, карбонилоксиалкила-, -алкоксикарбониламино- и -алкиламинокарбониламино-, все необязательно замещены; при условии, что Х не замещен -COOR2, -SO3Н или -РО3R2 2;
n равно целому числу от 1 до 3;
R2 выбран из группы, состоящей из R3 и -Н;
R3 выбран из группы, состоящей из алкила, арила, алициклила и аралкила;
каждый R4 независимо выбран из группы, состоящей из -Н и алкила, или вместе R4 и R4 образуют циклоалкильную группу;
каждый R9 независимо выбран из группы, состоящей из -Н, алкила, аралкила и алициклила, или вместе R9 и R9 образуют циклоалкильную группу;
R11 выбран из группы, состоящей из алкила, арила, -NR2 2 и -OR2;
каждый R12 и R13 независимо выбраны из группы, состоящей из Н, низшего алкила, низшего арила, низшего аралкила, все необязательно замещены, или R12 и R13 вместе связаны через 2-6 атомов, необязательно включающих 1-2 гетероатома, выбранных из группы, состоящей из О, N и S, образуя циклическую группу;
каждый R14 выбран независимо из группы, состоящей из -OR17, -N(R17)2, -NHR17 2, -NR2OR19 и -SR17;
R15 выбран из группы, состоящей из -Н, низшего алкила, низшего арила, низшего аралкила, или вместе с R16 связан через 2-6 атомов, необязательно включающих 1 гетероатом, выбранный из группы, состоящей из О, N и S;
R16 выбран из группы, состоящей из - (CR12R13)n-C(O)-R14, -H, низшего алкила, низшего арила, низшего аралкила, или вместе с R15 связан через 2-6 атомов, необязательно включающих 1 гетероатом, выбранный из группы, состоящей из О, N и S;
каждый R17 независимо выбран из группы, состоящей из низшего алкила, низшего арила, низшего аралкила, все необязательно замещены, или R17 и R17 на N вместе связаны через 2-6 атомов, необязательно включающих 1 гетероатом, выбранный из группы, состоящей из O, N и S;
R18 независимо выбран из группы, состоящей из Н, низшего алкила, арила, аралкила, или связан вместе с R12 через 1-4 атома углерода, образуя циклическую группу;
каждый R19 независимо выбран из группы, состоящей из -Н, низшего алкила, низшего арила, низшего алициклила, низшего аралкила и COR3;
и при условии что:
1) когда G' представляет N, тогда соответствующие А, В, D или Е отсутствуют;
2) по меньшей мере, один из А и В, или А, В, D и Е не выбран из группы, состоящей из -Н, или отсутствует;
3) когда G представляет N, тогда соответствующий А или В не является галоидом или группой, непосредственно связанной с G через гетероатом;
где термин «арил» относится к ароматическим группам, которые имеют 5-14 кольцевых атомов и, по меньшей мере, одно кольцо, имеющее сопряженную пи-электронную систему, и включает карбоциклический арил, гетероциклический арил и биарильные группы, все из которых могут быть необязательно замещенными, предпочтительно к фенилу и фуран-2,5-диилу;
термин «аралкил» относится к алкильной группе, замещенной арильной группой, подходящие аралкильные группы включают бензил, пиколил и т.п., и могут быть необязательно замещенными;
термин «алициклил» означает соединения, которые объединяют в себе характеристики алифатических и циклических соединений, которые включают необязательно замещенные ароматические, циклоалкильные и соединенные мостиковой связью циклоалкильные соединения, при этом циклические соединения включают гетероциклы;
термин «низший», упоминаемый в связи с органическими радикалами или соединениями, соответственно, определяет таковые как содержащие до и включая 10, или до и включая 6, или один-четыре атома углерода, при этом такие группы могут иметь прямую цепь, разветвленную или циклическую;
и его фармацевтически приемлемых солей.
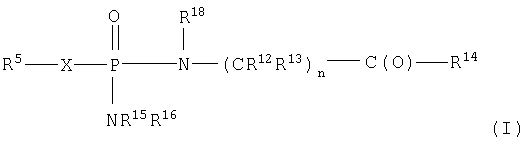
где R5 выбран из группы, состоящей из:
 и
и 
где
каждый G независимо выбран из группы, состоящей из С, N, О, S и Se, и где только один G может представлять О, S или Se, и, самое большее, один G представляет N;
каждый G' независимо выбран из группы, состоящей из С и N, и где не более, чем две G' группы представляют N;
А выбран из группы, состоящей из -Н, -NR4 2, -CONR4 2, -CO2R3 галоида, -S(O)R3 -SO2R3, алкила, алкенила, алкинила, пергалоидалкила, галоидалкила, арила, -CH2OH, -CH2NR4 2, -CH2CN, -CN, -C(S)NH2, -OR2, -SR2, -N3, -NHC(S)NR4 2, -NHAc, или отсутствует;
каждый В и D независимо выбраны из группы, состоящей из -Н, алкила, алкенила, алкинила, арила, алициклила, аралкила, алкоксиалкила, -C(O)R11, -C(O)SR3, -SO2R11, -S(O)R3, -CN, -NR9 2, -OR3, -SR3, пергалоидалкила, галоида, -NO2, или отсутствует, все, кроме -Н, -CN, пергалоидалкила, -NO2 и галоида, необязательно замещенные;
Е выбран из группы, состоящей из -Н, алкила, алкенила, алкинила, арила, алициклила, алкоксиалкила, -C(O)OR3, -CONR4 2, -CN, -NR9 2, -NO2, -OR3, -SR3, пергалоидалкила, галоида, или отсутствует, все, кроме -Н, -CN, пергалоидалкила и галоида, необязательно замещены;
J выбран из группы, состоящей из -Н, и отсутствует;
Х представляет необязательно замещенную связывающую группу, которая связывает R5 с атомом фосфора через 2-4 атома, включающих 0-1 гетероатом, выбранный из N, О и S, за исключением того, что если Х представляет мочевину или карбамат, тогда имеется 2 гетероатома, которые и определяют кратчайшее расстояние между R5 и атомом фосфора, и где атом, связанный с фосфором, является атомом углерода, и где Х выбран из группы, состоящей из -алкил(гидрокси)-, -алкинила-, -гетероарила-, -карбонилалкила-, -1,1-дигалоидалкила-, -алкоксиалкила-, -алкилокси-, -алкилтиоалкила-, -алкилтио-, -алкиламинокарбонила-, -алкилкарбониламино-, -алкоксикарбонила-, карбонилоксиалкила-, -алкоксикарбониламино- и -алкиламинокарбониламино-, все необязательно замещены; при условии, что Х не замещен -COOR2, -SO3Н или -РО3R2 2;
n равно целому числу от 1 до 3;
R2 выбран из группы, состоящей из R3 и -Н;
R3 выбран из группы, состоящей из алкила, арила, алициклила и аралкила;
каждый R4 независимо выбран из группы, состоящей из -Н и алкила, или вместе R4 и R4 образуют циклоалкильную группу;
каждый R9 независимо выбран из группы, состоящей из -Н, алкила, аралкила и алициклила, или вместе R9 и R9 образуют циклоалкильную группу;
R11 выбран из группы, состоящей из алкила, арила, -NR2 2 и -OR2;
каждый R12 и R13 независимо выбран из группы, состоящей из Н, низшего алкила, низшего арила, низшего аралкила, все необязательно замещены, или R12 и R13 вместе связаны через 2-6 атомов, необязательно включающих 1-2 гетероатома, выбранных из группы, состоящей из О, N и S, образуя циклическую группу;
каждый R14 выбран независимо из группы, состоящей из -OR17, -N(R17)2, -NHR17 2, -NR2OR19 и -SR17;
R15 выбран из группы, состоящей из -Н, низшего алкила, низшего арила, низшего аралкила, или вместе с R16 связан через 2-6 атомов, необязательно включающих 1 гетероатом, выбранный из группы, состоящей из О, N и S;
R16 выбран из группы, состоящей из -(CR12R13)n-C(O)-R14, -Н, низшего алкила, низшего арила, низшего аралкила, или вместе с R15 связан через 2-6 атомов, необязательно включающих 1 гетероатом, выбранный из группы, состоящей из О, N и S;
каждый R17 независимо выбран из группы, состоящей из низшего алкила, низшего арила и низшего аралкила, все необязательно замещены, или R17 и R17 на N вместе связаны через 2-6 атомов, необязательно включающих 1 гетероатом, выбранный из группы, состоящей из О, N и S;
R18 независимо выбран из группы, состоящей из Н, низшего алкила, арила, аралкила, или связан вместе с R12 через 1-4 атома углерода, образуя циклическую группу;
каждый R19 независимо выбран из группы, состоящей из -Н, низшего алкила, низшего арила, низшего алициклила, низшего аралкила и COR3;
и при условии, что:
1) когда G' представляет N, тогда соответствующий А, В, D или Е отсутствует;
2) по меньшей мере, один из А и В, или А, В, D и Е не выбран из группы, состоящей из -Н, или отсутствует;
3) когда G представляет N, тогда соответствующий А или В не является галоидом или группой, непосредственно связанной с G через гетероатом;
где термин «арил» относится к ароматическим группам, которые имеют 5-14 кольцевых атомов и, по меньшей мере, одно кольцо, имеющее сопряженную пи-электронную систему, и включает карбоциклический арил, гетероциклический арил и биарильные группы, все из которых могут быть необязательно замещенными, предпочтительно к фенилу и фуран-2,5-диилу;
термин «аралкил» относится к алкильной группе, замещенной арильной группой, подходящие аралкильные группы включают бензил, пиколил и т.п., и могут быть необязательно замещенными;
термин «алициклил» означает соединения, которые объединяют в себе характеристики алифатических и циклических соединений, которые включают необязательно замещенные ароматические, циклоалкильные и соединенные мостиковой связью циклоалкильные соединения, при этом циклические соединения включают гетероциклы;
термин «низший», упоминаемый в связи с органическими радикалами или соединениями, соответственно, определяет таковые как содержащие до и включая 10, или до и включая 6, или один-четыре атома углерода, при этом такие группы могут иметь прямую цепь, разветвленную или циклическую;
и его фармацевтически приемлемых солей.
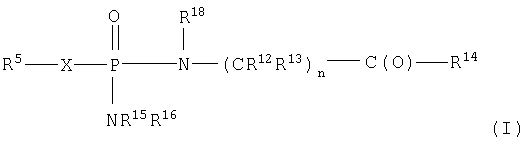
где R5 выбран из группы, состоящей из
 и
и 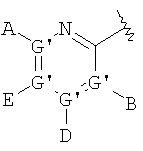
где каждый G независимо выбран из группы, состоящей из С, N, О, S и Se, и где только один G может представлять О, S или Se, и, самое большее, один G представляет N;
каждый G' независимо выбран из группы, состоящей из С и N, и где не более, чем две G' группы представляют N;
А выбран из группы, состоящей из -Н, -NR4 2, CONR4 2, -CO2R3, галоида, -S(O)R3, -SO2R3, алкила, алкенила, алкинила, пергалоидалкила, галоидалкила, арила, -CH2OH, -CH2NR4 2, -CH2CN, -CN, -C(S)NH2, -OR2, -SR2, -N3, -NHC(S)NR4 2, -NHAc, или отсутствует;
каждый В и D независимо выбран из группы, состоящей из -Н, алкила, алкенила, алкинила, арила, алициклила, аралкила, алкоксиалкила, -C(O)R11, -C(O)SR3, -SO2R11, -S(O)R3, -CN, -NR9 2, -OR3, -SR3, пергалоидалкила, галоида, -NO2, или отсутствует, все, кроме -Н, -CN, пергалоидалкила, -NO2 и галоида, необязательно замещены;
Е выбран из группы, состоящей из -Н, алкила, алкенила, алкинила, арила, алициклила, алкоксиалкила, -C(O)OR3, -CONR4 2, -CN, -NR9 2, -NO2, -OR3, -SR3, пергалоидалкила, галоида, или отсутствует, все, кроме -Н, -CN, пергалоидалкила и галоида, необязательно замещенные;
J выбран из группы, состоящей из -Н, и отсутствует;
Х представляет необязательно замещенную связывающую группу, которая связывает R5 с атомом фосфора через 2-4 атома, включающих 0-1 гетероатом, выбранный из N, О и S, за исключением того, что если Х представляет мочевину или карбамат, тогда имеется 2 гетероатома, которые и определяют кратчайшее расстояние между R5 и атомом фосфора, и где атом, связанный с фосфором, является атомом углерода, и где Х выбран из группы, состоящей из -алкил(гидрокси)-, -алкинила-, -гетероарила-, -карбонилалкила-, -1,1-дигалоидалкила-, -алкоксиалкила-, -алкилокси-, -алкилтиоалкила-, -алкилтио-, -алкиламинокарбонила-, -алкилкарбониламино-, -алкоксикарбонила-, карбонилоксиалкила-, -алкоксикарбониламино- и -алкиламинокарбониламино-, все необязательно замещены; при условии, что Х не замещен -COOR2, -SO3H или -PO3R2 2;
n равно целому числу от 1 до 3;
R2 выбран из группы, состоящей из R3 и -Н;
R3 выбран из группы, состоящей из алкила, арила, алициклила и аралкила;
каждый R4 независимо выбран из группы, состоящей из -Н и алкила, или вместе R4 и R4 образуют циклоалкильную группу;
каждый R9 независимо выбран из группы, состоящей из -Н, алкила, аралкила и алициклила, или вместе R9 и R9 образуют циклоалкильную группу;
R11 выбран из группы, состоящей из алкила, арила, -NR2 2 и -OR2;
каждый R12 и R13 независимо выбраны из группы, состоящей из Н, низшего алкила, низшего арила, низшего аралкила, все необязательно замещены, или R12 и R13 вместе связаны через 2-6 атомов, необязательно включающих 1-2 гетероатома, выбранных из группы, состоящей из О, N и S, образуя циклическую группу;
каждый R14 выбран независимо из группы, состоящей из -OR17, -N(R17)2, -NHR17 2, -NR2OR19 и -SR17;
R15 выбран из группы, состоящей из -Н, низшего алкила, низшего арила, низшего аралкила, или вместе с R16 связан через 2-6 атомов, необязательно включающих 1 гетероатом, выбранный из группы, состоящей из О, N и S;
R16 выбран из группы, состоящей из -(CR12R13)n-C(O)-R14, -Н, низшего алкила, низшего арила, низшего аралкила, или вместе с R15 связан через 2-6 атомов, необязательно включающих 1 гетероатом, выбранный из группы, состоящей из О, N и S;
каждый R17 независимо выбран из группы, состоящей из низшего алкила, низшего арила, низшего аралкила, все необязательно замещены, или R17 и R17 на N вместе связаны через 2-6 атомов, необязательно включающих 1 гетероатом, выбранный из группы, состоящей из О, N и S;
R18 независимо выбран из группы, состоящей из Н, низшего алкила, арила, аралкила, или вместе с R12 связан через 1-4 атома углерода, образуя циклическую группу;
каждый R19 независимо выбран из группы, состоящей из -Н, низшего алкила, низшего арила, низшего алициклила, низшего аралкила и COR3;
и при условии, что:
1) когда G' представляет N, тогда соответствующий А, В, D или Е отсутствует;
2) по меньшей мере, один из А и В, или А, В, D и Е не выбран из группы, состоящей из -Н, или отсутствует;
3) когда G представляет N, тогда соответствующий А или В не является галоидом или группой, непосредственно связанной с G через гетероатом;
где термин «арил» относится к ароматическим группам, которые имеют 5-14 кольцевых атомов и, по меньшей мере, одно кольцо, имеющее сопряженную пи-электронную систему, и включает карбоциклический арил, гетероциклический арил и биарильные группы, все из которых могут быть необязательно замещенными, предпочтительно к фенилу и фуран-2,5-диилу;
термин «аралкил» относится к алкильной группе, замещенной арильной группой, подходящие аралкильные группы включают бензил, пиколил и т.п., и могут быть необязательно замещенными;
термин «алициклил» означает соединения, которые объединяют в себе характеристики алифатических и циклических соединений, которые включают необязательно замещенные ароматические, циклоалкильные и соединенные мостиковой связью циклоалкильные соединения, при этом циклические соединения включают гетероциклы;
термин «низший», упоминаемый в связи с органическими радикалами или соединениями, соответственно, определяет таковые как содержащие до и включая 10, или до и включая 6, или один-четыре атома углерода, при этом такие группы могут иметь прямую цепь, разветвленную или циклическую;
и его фармацевтически приемлемых солей.
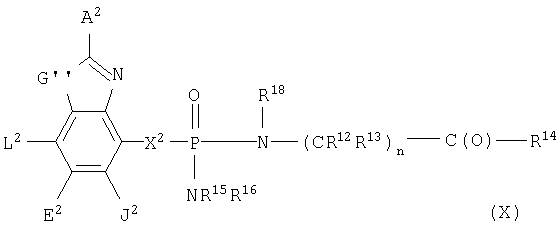
где
G" выбран из группы, состоящей из -О- и -S-;
А2 выбран из группы, состоящей из -Н, -NR4 2, -NHAc, -OR2, -SR2, -C(O)NR4 2, галоида, -COR11, -CN, пергалоидалкила, C1-С6 алкила, C2-C6 алкенила и C2-С6 алкинила;
L2, Е2 и J2 выбраны из группы, состоящей из -NR4 2, -NHAc, -NO2, -H, -OR2, -SR2, -C(O)NR4 2, галоида, -COR11, SO2R3, гуанидинила, амидинила, арила, аралкила, алкилоксиалкила, -SCN, -NHSO2R3, -SO2NR4 2, -CN, -S(O)R3, пергалоидацила, пергалоидалкила, пергалоидалкокси, С1-С6 алкил (ОН), C1-С6 алкил (SH), С1-С6 алкила, С2-С6 алкенила, C2-C6 алкинила, гетероарила и низшего алициклила, или вместе L2 и Е2 или Е2 и J2 образуют аннелированную циклическую группу;
Х2 выбран из группы, состоящей из -CR2 2-, -CF2-, -CR2 2-O-, -CR2 2-S-, -C(O)-O-, -C(O)-S-, -C(S)-O-, -CH2-C(O)-O- и -CR2 2-NR20- и где атомом, связанным с фосфором, является атом углерода; при условии, что Х2 не замещен -COOR2, -SO3Н или -РО3R2 2;
n равно целому числу от 1 до 3;
R2 выбран из группы, состоящей из R3 и -Н;
R3 выбран из группы, состоящей из алкила, арила, алициклила и аралкила;
каждый R4 независимо выбран из группы, состоящей из -Н и алкила, или вместе R4 и R4 образуют циклоалкильную группу;
R11 выбран из группы, состоящей из алкила, арила, -NR2 и -OR2;
каждый R12 и R13 независимо выбран из группы, состоящей из Н, низшего алкила, низшего арила, низшего аралкила, все необязательно замещенные, или вместе R12 и R13 связаны через 2-6 атомов, необязательно включающих 1-2 гетероатома, выбранных из группы, состоящей из О, N и S, образуя циклическую группу;
каждый R14 независимо выбран из группы, состоящей из -OR17, -N(R17)2, -NHR17, -NR2OR19 и -SR17;
R15 выбран из группы, состоящей из -Н, низшего алкила, низшего арила, низшего аралкила, или вместе с R16 связан через 2-6 атомов, необязательно включающих 1 гетероатом, выбранный из группы, состоящей из О, N и S;
R16 выбран из группы, состоящей из -(CR12R13)n-C(O)-R14, -Н, низшего алкила, низшего арила, низшего аралкила, или вместе с R15 связан через 2-6 атомов, необязательно включающих 1 гетероатом, выбранный из группы, состоящей из О, N и S;
каждый R17 независимо выбран из группы, состоящей из низшего алкила, низшего арила, низшего аралкила, все необязательно замещенные, или R17 и R17 на N вместе связаны через 2-6 атомов, необязательно включающих 1 гетероатом, выбранный из группы, состоящей из О, N и S;
R18 независимо выбран из группы, состоящей из Н, низшего алкила, арила, аралкила, или вместе с R12 связан через 1-4 атома углерода, образуя циклическую группу;
каждый R19 независимо выбран из группы, состоящей из -Н, низшего алкила, низшего арила, низшего алициклила, низшего аралкила и COR3;
R20 выбран из группы, состоящей из низшего алкила, -Н и -COR2;
где термин «арил» относится к ароматическим группам, которые имеют 5-14 кольцевых атомов и, по меньшей мере, одно кольцо, имеющее сопряженную пи-электронную систему, и включает карбоциклический арил, гетероциклический арил и биарильные группы, все из которых могут быть необязательно замещенными, предпочтительно к фенилу и фуран-2,5-диилу;
термин «аралкил» относится к алкильной группе, замещенной арильной группой, подходящие аралкильные группы включают бензил, пиколил и т.п., и могут быть необязательно замещенными;
термин «алициклил» означает соединения, которые объединяют в себе характеристики алифатических и циклических соединений, которые включают необязательно замещенные ароматические, циклоалкильные и соединенные мостиковой связью пиклоалкильные соединения, при этом циклические соединения включают гетероциклы;
термин «низший», упоминаемый в связи с органическими радикалами или соединениями, соответственно, определяет таковые как содержащие до и включая 10, или до и включая 6, или один-четыре атома углерода, при этом такие группы могут иметь прямую цепь, разветвленную или циклическую;
и его фармацевтически приемлемых солей.

где
G" выбран из группы, состоящей из -О- и -S-;
А2 выбран из группы, состоящей из -Н, -NR4 2, -NHAc, -OR2, -SR2, -C(O)NR4 2 галоида, -COR11, -CN, пергалоидалкила, C1-C6 алкила, С2-С6 алкенила и C2-С6 алкинила;
L2, Е2 и J2 выбраны из группы, состоящей из -NR4 2, -NHAc, -NO2, -H, -OR2, -SR2, -C(O)NR4 2, галоида, -COR11, SO2R3, гуанидинила, амидинила, арила, аралкила, алкилоксиалкила, -SCN, -NHSO2R3, -SO2NR4 2, -CN, -S(O)R3, пергалоидацила, пергалоидалкила, пергалоидалкокси, C1-С6 алкил(ОН), C1-С6 алкил(SH), C1-С6 алкила, C2-С6 алкенила, С2-С6 алкинила, гетероарила и низшего алициклила, или вместе L2 и Е2 или Е2 и J2 образуют аннелированную циклическую группу;
Х2 выбран из группы, состоящей из -CR2 2-, -CF2-, -CR2 2-O-, -CR2 2-S-, -C(O)-O-, -C(O)-S-, -C(S)-O-, -CH2-C(O)-O- и -CR2 2-NR20- и где атомом, связанным с фосфором, является атом углерода; при условии, что Х2 не замещен -COOR2, -SO3H или -PO3R2 2;
n равно целому числу от 1 до 3;
R2 выбран из группы, состоящей из R3 и -Н;
R3 выбран из группы, состоящей из алкила, арила, алициклила и аралкила;
каждый R4 независимо выбран из группы, состоящей из -Н и алкила, или вместе R4 и R4 образуют циклоалкильную группу;
R11 выбран из группы, состоящей из алкила, арила, -NR2 2 и -OR2;
каждый R12 и R13 независимо выбран из группы, состоящей из Н, низшего алкила, низшего арила, низшего аралкила, все необязательно замещенные, или R12 и R13 вместе связаны через 2-6 атомов, необязательно включающих 1-2 гетероатома, выбранных из группы, состоящей из О, N и S, образуя циклическую группу;
каждый R14 выбран независимо из группы, состоящей из -OR17, -N(R17)2, -NHR17, -NR2OR19 и -SR17;
R15 выбран из группы, состоящей из -Н, низшего алкила, низшего арила, низшего аралкила, или вместе с R16 связан через 2-6 атомов, необязательно включающих 1 гетероатом, выбранный из группы, состоящей из О, N и S;
R16 выбран из группы, состоящей из -(CR12R13)n-C(O)-R14, -Н, низшего алкила, низшего арила, низшего аралкила, или вместе с R15 связан через 2-6 атомов, необязательно включающих 1 гетероатом, выбранный из группы, состоящей из О, N и S;
каждый R17 независимо выбран из группы, состоящей из низшего алкила, низшего арила, низшего аралкила, все необязательно замещенные, или R17 и R17 на N вместе связаны через 2-6 атомов, необязательно включающих 1 гетероатом, выбранный из группы, состоящей из О, N и S;
R18 независимо выбран из группы, состоящей из Н, низшего алкила, арила, аралкила, или вместе с R12 связан через 1-4 атома углерода, образуя циклическую группу;
каждый R19 независимо выбран из группы, состоящей из -Н, низшего алкила, низшего арила, низшего алицикпила, низшего аралкила и COR3;
R20 выбран из группы, состоящей из низшего алкила, -Н и -COR2;
где термин «арил» относится к ароматическим группам, которые имеют 5-14 кольцевых атомов и, по меньшей мере, одно кольцо, имеющее сопряженную пи-электронную систему, и включает карбоциклический арил, гетероциклический арил и биарильные группы, все из которых могут быть необязательно замещенными, предпочтительно к фенилу и фуран-2,5-диилу;
термин «аралкил» относится к алкильной группе, замещенной арильной группой, подходящие аралкильные группы включают бензил, пиколил и т.п., и могут быть необязательно замещенными;
термин «алициклил» означает соединения, которые объединяют в себе характеристики алифатических и циклических соединений, которые включают необязательно замещенные ароматические, циклоалкильные и соединенные мостиковой связью циклоалкильные соединения, при этом циклические соединения включают гетероциклы;
термин «низший», упоминаемый в связи с органическими радикалами или соединениями, соответственно, определяет таковые как содержащие до и включая 10, или до и включая 6, или один-четыре атома углерода, при этом такие группы могут иметь прямую цепь, разветвленную или циклическую;
и его фармацевтически приемлемых солей.
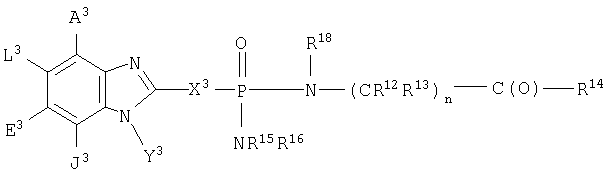
где А3, Е3 и L3 выбраны из группы, состоящей из -NR8 2, -NO2, -H, -OR7 -SR7, -C(O)NR4 2, галоида, -COR11, -SO2R3, гуанидина, амидина, -NHSO2R3, -SO2NR4 2, -CN, сульфоксида, пергалоидацила, пергалоидалкила, пергалоидалкокси, С1-С5 алкила, C2-C5 алкенила, C2-C5
алкинила и низшего алициклила, или вместе А3 и Е3 образуют циклическую группу, или вместе L3 и Е3 образуют циклическую группу, или вместе Е3 и J3 образуют циклическую группу, включающую арил, циклоалкил и гетероциклическую группу;
J3 выбран из группы, состоящей из -NR8 2, -NO2, -H, -OR7, -SR7, -C(O)NR4 2, галоида, -COR11, -CN, сульфонила, сульфоксида, пергалоидалкила, гидроксиалкила, пергалоидалкокси, алкила, галоидалкила, аминоалкила, алкенила, алкинила; алициклила, арила и аралкила, или вместе с Y3 образует циклическую группу, включающую арил, циклоалкил и гетероциклоалкил;
Х3 выбран из группы, состоящей из -алкил(гидрокси)-, -алкила-, -алкинила-, -арила-, -карбонилалкила-, -1,1-дигалоидалкила-, -алкоксиалкила-, -алкилокси-, -алкилтиоалкила-,
-алкилтио-, -алкиламинокарбонила-, -алкилкарбониламино-, -алициклила, -аралкила-,
-алкиларила-, -алкоксикарбонила-, -карбонилоксиалкила-, -алкоксикарбониламино- и
-алкиламинокарбониламино-, все необязательно замещены; при условии, что Х3 не замещен -COOR2, -SO3H или -РО3R2 2;
Y3 выбран из группы, состоящей из -Н, алкила, алкенила, алкинила, арила, алициклила, аралкила, арилоксиалкила, алкоксиалкила, -C(O)R3, -S(O)2R3, -C(O)-R11, -CONHR3, -NR2 2 и
-OR3, все, кроме Н, необязательно замещены;
n равно целому числу от 1 до 3;
R2 выбран из группы, состоящей из R3 и -Н;
R3 выбран из группы, состоящей из алкила, арила, алициклила и аралкила;
каждый R4 независимо выбран из группы, состоящей из -Н и алкила, или вместе R4 и R4 образуют циклоалкильную группу;
R7 независимо выбран из группы, состоящей из -Н, низшего алкила, низшего алициклила, низшего аралкила, низшего арила и -C(O)R10;
R8 независимо выбран из группы, состоящей из -Н, низшего алкила, низшего аралкила, низшего арила, низшего алициклила, -C(O)R10, или они вместе образуют бидентатный алкил;
каждый R9 независимо выбран из группы, состоящей из -Н, -алкила, аралкила и алициклила, или вместе R9 и R9 образуют циклоалкильную группу;
R10 выбран из группы, состоящей из -Н, низшего алкила,
-NH2, низшего арила и низшего пергалоидалкила;
R11 выбран из группы, состоящей из алкила, арила, NR2 2 и -OR2;
каждый R12 и R13 независимо выбран из группы, состоящей из -Н, низшего алкила, низшего арила, низшего аралкила, все необязательно замещены, или R12 и R13 вместе связаны через 2-6 атомов, необязательно включающих 1-2 гетероатома, выбранных из группы, состоящей из О, N и S, образуя циклическую группу;
каждый R14 независимо выбран из группы, состоящей из -OR17, -N(R17)2, -NHR17 2, -NR2OR19 и -SR17;
R15 выбран из группы, состоящей из -Н, низшего алкила, низшего арила, низшего аралкила, или вместе с R16 связан через 2-6 атомов, необязательно включающих 1 гетероатом, выбранный из группы, состоящей из О, N и S;
R16 выбран из группы, состоящей из -(CR12R13)n-C(O)-R14, -H, низшего алкила, низшего арила, низшего аралкила, или вместе с R15 связан через 2-6 атомов, необязательно включающих 1 гетероатом, выбранный из группы, состоящей из О, N и S;
каждый R17 независимо выбран из группы, состоящей из низшего алкила, низшего арила, низшего аралкила, все необязательно замещенные, или R17 и R17 на N вместе связаны через 2-6 атомов, необязательно включающих 1 гетероатом, выбранный из группы, состоящей из О, N и S;
R18 независимо выбран из группы, состоящей из Н, низшего алкила, арила, аралкила, или вместе с R12 связан через 1-4 атома углерода, образуя циклическую группу;
каждый R19 независимо выбран из группы, состоящей из -Н, низшего алкила, низшего арила, низшего алициклила, низшего аралкила и COR3;
где термин «арил» относится к ароматическим группам, которые имеют 5-14 кольцевых атомов и, по меньшей мере, одно кольцо, имеющее сопряженную пи-электронную систему, и включает карбоциклический арил, гетероциклический арил и биарильные группы, все из которых могут быть необязательно замещенными, предпочтительно к фенилу и фуран-2,5-диилу;
термин «аралкил» относится к алкильной группе, замещенной арильной группой, подходящие аралкильные группы включают бензил, пиколил и т.п., и могут быть необязательно замещенными;
термин «алициклил» означает соединения, которые объединяют в себе характеристики алифатических и циклических соединений, которые включают необязательно замещенные ароматические, циклоалкильные и соединенные мостиковой связью циклоалкильные соединения, при этом циклические соединения включают гетероциклы;
термин «низший», упоминаемый в связи с органическими радикалами или соединениями, соответственно, определяет таковые как содержащие до и включая 10, или до и включая 6, или один-четыре атома углерода, при этом такие группы могут иметь прямую цепь, разветвленную или циклическую;
и его фармацевтически приемлемых солей.
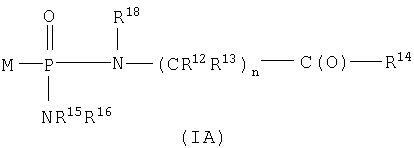
где соединения формулы IA превращаются in vivo или in vitro в М-РО3Н2, которое
является ингибитором, фруктозо-1,6-бисфосфатазы, и где
М представляет R5-X-,
где
R5 выбран из группы, состоящей из
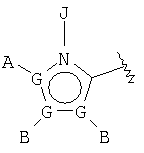 и
и 
где
каждый G независимо выбран из группы состоящей из С, N, О, S и Se, и где только один G может быть О, S или Se, и, самое большее один G представляет N;
каждый G' независимо выбран из группы, состоящей из С и N, и где не более чем две G' группы представляют N;
А выбран из группы, состоящей из -Н, -NR4 2, -CONR4 2, -CO2R3, галоида, -S(O)R3, -SO2R3, алкила, алкенила, алкинила, пергалоидалкила, галоидалкила, арила, -CH2OH, -CH2NR4 2, -CH2CN, -CN, -C(S)NH2, -OR2, -SR2, -N3, -NHC(S)NR4 2, -NHAc, или отсутствует;
каждый В и D независимо выбран из группы, состоящей из -Н, алкила, алкенила, алкинила, арила, алициклила, аралкила, алкоксиалкила,-С(O)R11, -C(O)SR3, SO2R11, -S(O)R3, -CN, -NR9 2, -OR3, -SR3, пергалоидалкила, галоида, -NO2, или отсутствует, все, кроме -Н, -CN, пергалоидалкила, -NO2 и галоида, необязательно замещены;
Е выбран из группы, состоящей из -Н, алкила, алкенила, алкинила, арила, алициклила, алкоксиалкила, C(O)OR3, -CONR4 2, -CN, -NR9 2, -NO2, -OR3 -SR3, пергалоидалкила, галоида, или отсутствует, все, кроме -Н, -CN, пергалоидалкила и галоида, необязательно замещены;
J выбран из группы, состоящей из -Н, или отсутствует;
Х представляет необязательно замещенную связывающую группу, которая связывает R5 с атомом фосфора через 2-4 атома, включающих 0-1 гетероатом, выбранный из N, О и S, за исключением того, что если Х представляет мочевину или карбамат, тогда имеется 2 гетероатома, которые и определяют кратчайшее растояние между R5 и атомом фосфора, и где атом, связанный с фосфором, является атомом углерода, и где Х выбран из группы, состоящей из -алкил(гидрокси)-, -алкинила-, -гетероарила-, -карбонилалкила-, -1,1-дигалоидалкила-, -алкоксиалкила-, -алкилокси-, -алкилтиоалкила-, -алкилтио-, -алкиламинокарбонила-, -алкилкарбониламино-, -алкоксикарбонила-, -карбонилоксиалкила-, -алкоксикарбониламино- и -алкиламинокарбониламино-, все необязательно замещены; при условии, что Х не замещен -COOR2, -SO3Н или -РО3R2 2;
n равно целому числу от 1 до 3;
R2 выбран из группы -R3 и -Н;
R3 выбран из группы, состоящей из алкила, арила, алициклила и аралкила;
каждый R4 независимо выбран из группы, состоящей из -Н и алкила, или вместе R4 и R4 образуют циклоалкильную группу;
каждый R9 независимо выбран из группы, состоящей из -Н, алкила, арила, аралкила и алициклила, или вместе R9 и R9 образуют циклоалкильную группу;
R11 выбран из группы, состоящей из алкила, арила, -NR2 2 и -OR2;
каждый R12 и R13 независимо выбран из группы, состоящей из Н, низшего алкила, низшего арила, низшего аралкила, все необязательно замещены, или R12 и R13 вместе связаны через 2-6 атомов, необязательно включающих 1-2 гетероатома, выбранных из группы, состоящей из О, N и S, с образованием циклической группы;
каждый R14 независимо выбран из группы, состоящей из -OR17, -N(R17)2, -NHR17, -NR2OR19 и -SR17;
R15 выбран из группы, состоящей из -Н, низшего алкила, низшего арила, низшего аралкила, или вместе с R16 связан через 2-6-атомов, необязательно включающих 1 гетероатом, выбранный из группы, состоящей из О, N и S;
R16 выбран из группы, состоящей из -(CR12R13)n-C(O)-R14, -Н, низшего алкила, низшего арила, низшего аралкила, или вместе с R15 связан через 2-6 атомов, необязательно включающих 1 гетероатом, выбранный из группы, состоящей из О, N и S;
каждый R17 независимо выбран из группы, состоящей из низшего алкила, низшего арила и низшего аралкила, все необязательно замещены, или R17 и R17 на N вместе связаны через 2-6 атомов, необязательно включающих 1 гетероатом, выбранный из группы, состоящей из О, N и S;
R18 независимо выбран из группы, состоящей из Н, низшего алкила, арила, аралкила, или вместе с R12 связан через 1-4 атома углерода, образуя циклическую группу;
каждый R19 независимо выбран из группы, состоящей из -Н, низшего алкила, низшего арила, низшего алициклила, низшего аралкила и COR3; и при условии, что:
1) когда G' представляет N, тогда соответствующие А, В, D или Е отсутствуют;
2) по меньшей мере, один из А и В, или А, В, D и Е не выбран из группы, состоящей из -Н, или отсутствует;
3) когда G представляет N, тогда соответствующий А или В не является галоидом или группой, непосредственно связанной с G через гетероатом;
где термин «арил» относится к ароматическим группам, которые имеют 5-14 кольцевых атомов и, по меньшей мере, одно кольцо, имеющее сопряженную пи-электронную систему, и включает карбоциклический арил, гетероциклический арил и биарильные группы, все из которых могут быть необязательно замещенными, предпочтительно к фенилу и фуран-2,5-диилу;
термин «аралкил» относится к алкильной группе, замещенной арильной группой, подходящие аралкильные группы включают бензил, пиколил и т.п., и могут быть необязательно замещенными;
термин «алициклил» означает соединения, которые объединяют в себе характеристики алифатических и циклических соединений, которые включают необязательно замещенные ароматические, циклоалкильные и соединенные мостиковой связью циклоалкильные соединения, при этом циклические соединения включают гетероциклы;
термин «низший», упоминаемый в связи с органическими радикалами или соединениями, соответственно, определяет таковые как содержащие до и включая 10, или до и включая 6, или один-четыре атома углерода, при этом такие группы могут иметь прямую цепь, разветвленную или циклическую;
и его фармацевтически приемлемых солей.
| Прибор для очистки паром от сажи дымогарных трубок в паровозных котлах | 1913 |
|
SU95A1 |
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
| RU 97108680 A, 27.04.1999. | |||
Авторы
Даты
2006-04-10—Публикация
2000-12-22—Подача