Объектами настоящего изобретения являются конъюгаты, способ их получения и применение этих конъюгатов для транспорта низкомолекулярных соединений и макромолекул через биологические мембраны, в особенности для транспорта молекул в клетки. Объектами настоящего изобретения являются также лекарственное и диагностическое средства, а также тест-наборы, в которых находятся или, соответственно, используются, эти конъюгаты.
Лимитирующим фактором для терапевтического использования молекул, место воздействия которых находится внутри клетки, часто является их недостаточное проникновение в клетку и неблагоприятное внутриклеточное распределение. Типичными примерами являются макромолекулы, как нуклеиновые кислоты, которые специфическим к последовательности образом связываются с клеточными ДНК или РНК и благодаря этому вызывают ингибирование экспрессии генов. Антисмысловые олигонуклеотиды представляют собой короткие одноцепочечные нуклеиновые кислоты, которые через пары оснований, согласно модели Уотсона-Крика, связываются с комплементарной мРНК, трансляцию которой в соответствующем протеине нужно ингибировать. Триплексобразующие олигонуклеотиды за счет так называемого "спаривания оснований по Hoogsteen" связываются в большую "борозду" двойной спирали ДНК с образованием тройной спирали, благодаря чему специфически к последовательности ингибируется транскрипция генов. Другими внутриклеточно действующими олигонуклеотидами являются, например, так называемые "Decoy"-олигонуклеотиды, которые имитируют места связывания факторов транскрипции. Путем обработки с помощью Decoy-олигонуклеотидов специфически к последовательности можно улавливать определенные факторы транскрипции и благодаря этому можно предотвращать активацию транскрипции. Другую группу внутриклеточно действующих олигонуклеотидов, химерапластов, используют для направленной коррекции генов (Cole-Strauss и др., Science, 273, 1386-1389 (1996)). Также для этой коррекции генов существенным является проникновение химерапласт-олигонуклеотида в клетку. Примерами других внутриклеточно действующих нуклеиновых кислот являются такие, которые взаимодействуют с клеточными ферментами, в особенности с теломеразами (Norton и др., Biotechn., 14, 615 (1996)). Следующим классом нуклеиновых кислот являются нуклеиновые кислоты, предпочтительно двухцепочечные ДНК, которые могут кодировать определенные протеины, внутриклеточно экспрессирующиеся с точки зрения генной терапии.
Например, проникновение олигонуклеотида in vitro в клетку, например, путем простого добавления олигонуклеотида в среду клеточной культуры, представляет собой относительно неэффективный процесс, так как фактически только небольшая часть добавленного олигонуклеотида проникает в клетку. Процесс проникновения длится многие часы и чаще всего лишь спустя 8-16 часов достигается "плато"-фаза. Считают, что проникновение олигонуклеотидов подобно процессу эндоцитоза. Общая проблема проникновения через эндоцитоз заключается, однако, в том, что большая часть олигонуклеотидов присутствует не в свободном состоянии в цитоплазме, а находится включенной в определенные клеточные структуры, лизосомы и эндосомы. Это распределение в виде точки в случае флуоресцентномаркированных олигонуклеотидов также можно в самом деле наблюдать флуоресцентномикроскопически. За счет этой везикулярной локализации концентрация свободного олигонуклеотида, который фактически доступен для гибридизации с мРНК, сильно снижена. Кроме того, в зависимости от типа клетки и имеющихся условий, вообще только определенная доля клеток "захватывает" олигонуклеотид. Поэтому для эффективного использования антисмысловых олигонуклеотидов их применяют в общих смесях с усилителями пенетрации, как, например, катионные липиды (Bennet и др., Mol. Pharmacol., 41, 1023 (1992)).
Задача настоящего изобретения состоит в увеличении проникновения в клетки молекул, в особенности макромолекул, как, например, олигонуклеотида.
Исследование проникновения в клетки олигонуклеотидов осуществляют, в общем, либо с помощью радиоактивномеченых, либо флуоресцентномаркированных олигонуклеотидов. Флуоресцентную маркировку олигонуклеотида осуществляют, например, путем введения во взаимодействие аминогруппы олигонуклеотида с флуоресцеинизотиоцианатом (FITC). Флуоресцеин можно вводить, например, в 3'-конец олигонуклеотида с помощью коммерчески доступного, дериватизированного флуоресцеином твердофазного носителя или в 5'-конец с помощью коммерчески доступного реагента флуоресцеинфосфитилирования. Во всех случаях связанный с олигонуклеотидом флуоресцеин благодаря карбоксильной группе находится в виде отрицательно заряженного структурного элемента, который является сильно флуоресцирующим.
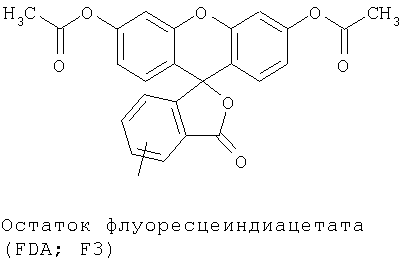
В противоположность флуоресцеину флуоресцеиндиацетат (FDA) представляет собой нейтральный витальный краситель, который только после расщепления обеих сложноэфирных групп и раскрытия лактонового кольца превращается в флуоресцирующий флуоресцеин, который, однако, в форме лактона еще не обладает никакой флуоресценцией.
Известно, что FDA (ниже называемый также как "F3") в виде нейтральной нефлуоресцирующей молекулы проникает в живые клетки за счет пассивной диффузии и внутриклеточно расщепляется эстеразами с образованием флуоресцирующего флуоресцеина (Breeuwer и др., Appl. Environ. Microbiol., 61, 1614 (1995); Maeda и др., Cell Struct. Funct., 7, 111 (1982)). До сих пор описаны только FDA-производные, которые содержат реакционноспособную аминогруппу, как, например, изотиоцианатную группу; эти FDA-производные используют для окрашивания внутриклеточных протеинов или клеточных компонентов. Сверх того, до сих пор не описаны никакие конъюгаты FDA с другими молекулами, соответственно, до сих пор также не описаны маркированные с помощью FDA олигонуклеотиды (конъюгаты из FDA и олигонуклеотида).
В цитоплазме FDA расщепляется эстеразами за счет маркировки с помощью FDA олигонуклеотида, поэтому можно определять долю "свободного" олигонуклеотида, то есть, сколько олигонуклеотида находится в цитоплазме и сколько доступно для гибридизации, по отношению к доле олигонуклеотида, который находится в везикулах ("включенный" олигонуклеотид) и поэтому недоступен для гибридизации. Вследствие, в целом, большого количества отрицательных зарядов в олигонуклеотиде и того факта, что маркированные с помощью FDA и маркированные флуоресцеином олигонуклеотиды (в случае, когда олигонуклеотид является одним и тем же) различаются только нетто-зарядом, можно было ожидать, что маркированные с помощью FDA и маркированные флуоресцеином олигонуклеотиды обладают очень похожим проникновением в клетку и распределением.
Однако, неожиданно показано, что маркированные с помощью FDA и маркированные флуоресцеином олигонуклеотиды отчетливо различаются в отношении их проникновения в клетки, а именно как в отношении продолжительности, так и в отношении эффективности проникновения олигонуклеотидов, и, сверх того, также в отношении локализации проникших олигонуклеотидов в клетке. Маркированный с помощью FDA олигонуклеотид проникает в клетки намного быстрее, чем соответствующий, маркированный флуоресцеином олигонуклеотид. В то время как проникновение радиоактивномеченых и маркированных флуоресцеином олигонуклеотидов требует нескольких часов, маркированные с помощью FDA олигонуклеотиды после ординарной инкубации, например, с человеческими клетками, уже спустя пять минут обнаруживают внутри клеток. Неожиданным также оказалось то, что маркированные с помощью FDA олигонуклеотиды проникают почти во все клетки (>90% клеток), в то время как в случае до сих пор описанных методов введения олигонуклеотидов или полинуклеотидов в клетки скорость проникновения, в общем, значительно ниже; часто там только примерно 30-60% клеток нагружаются олигонуклеотидами. Предпочтительным также является внутриклеточное распределение маркированных с помощью FDA олигонуклеотидов, которое намного равномернее. Это более равномерное распределение указывает на то, что олигонуклеотиды не находятся, как описано выше, большей частью в везикулах (например, в эндосомах, лизосомах), а распределены по всей клетке, то есть, находятся в цитозоли и в ядре; это является косвенным доказательством того, что большая часть находится в виде "свободного" олигонуклеотида. Только эти "свободные" олигонуклеотиды доступны для связывания с мишенью (молекула-мишень, нуклеиновая кислота-мишень) или в виде биологически активного вещества. Преимуществом также является то, что при использовании маркированных с помощью FDA олигонуклеогидов не наблюдают никакого повреждения клеток; в противоположность этому использование липокатионных усилителей пенетрации часто приводит к повреждениям клеточных мембран. Вследствие этих неожиданных свойств маркированные с помощью FDA олигонуклеотиды, по сравнению с до сих пор описанными методами введения в клетки олигонуклеотидов, соответственно, полинуклеотидов, обладают основным преимуществом, заключающимся в том, что они эффективнее могут проникать в клетки и там также лучше доступны. Благодаря этому маркированные с помощью FDA олигонуклеотиды обладают отчетливо повышенной биологической активностью. Благодаря повышенной биологической активности нужно использовать меньше олигонуклеотида. Благодаря этому и на основании того факта, что маркированный с помощью FDA олигонуклеотид эффективнее как в количественном отношении, так и по времени проникновения в клетку, снижаются (токсичные) побочные действия.
Неожиданно показано, что полезные свойства не ограничены маркированными с помощью FDA олигонуклеотидами, а практически каждая молекула за счет маркировки с помощью FDA, то есть благодаря тому, что транспортируемая молекула связана или конъюгирована с FDA ("FDA-конъюгат"), может эффективно проникать в клетку или транспортироваться через биологическую мембрану. Далее показано, что этот принцип не ограничен FDA-конъюгатами, а распространяется на все конъюгаты сложных ариловых эфиров, которые обладают определенной химической структурой. Настоящее изобретение, таким образом, относится к новому принципу транспорта молекул через биологические мембраны. Так как эти соединения до сих пор в уровне техники практически не описаны, объектом настоящего изобретения также являются соответствующие конъюгаты - транспортируемая молекула, связанная или, соответственно, конъюгированная со сложным ариловым эфиром определенной химической структуры. Эти конъюгаты нельзя получать известными способами; объектом настоящего изобретения поэтому является также способ получения конъюгатов.
Известны биообратимые O-ациларил-конъюгаты, которые предложены в качестве пролекарств на основе олигонуклеотидов (lyer и др., Bioorganic and Med. Chem. Lett., 7, 871-876 (1997)). Эти соединения - в случае, когда арильный остаток представляет собой шестичленное ароматическое кольцо - по своей химической структуре подобны предлагаемым согласно изобретению конъюгатам. В случае биообратимых O-ациларил-конъюгатов, гидролиз сложного эфира, однако, вызывает дестабилизацию связи между арильным остатком и фосфотриэфиром олигонуклеотида, так что биообратимый O-ациларил-конъюгат расщепляется на свои составные части, то есть на свободный олигонуклеотид и O-ациларильный остаток. Эта пролекарственная концепция служит для того, чтобы маскировать отрицательный заряд межнуклеотидфосфатного мостика и благодаря этому облегчать проникновение олигонуклеотида в клетку. В противоположность предлагаемым согласно изобретению конъюгатам, в случае этих пролекарств, однако, не установлено никакого ускоренного проникновения олигонуклеотидов в клетки и также никакого измененного внутриклеточного распределения олигонуклеотидов. Далее не сообщается о проникновении олигонуклеотидов в другие организмы. В противоположность этому в случае предлагаемых согласно изобретению конъюгатов сохраняется ковалентная связь между арильным остатком и олигонуклеотидом при проникновении в клетку; образование ковалентной связи между арильным остатком и олигонуклеотидом можно легко установить флуоресцентномикроскопически, а ароматическое звено, как, например, в случае FDA, лишь после расщепления сложного эфира обладает флуоресценцией.
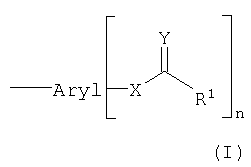
Объектом настоящего изобретения является конъюгат, который состоит по меньшей мере из одной транспортируемой молекулы и по меньшей мере одного арильного остатка формулы (I):
причем
арил означает группу, которая содержит по меньшей мере один ароматический цикл;
Х означает О или N; предпочтительно Х=О;
Y означает O, S или NH-R2; предпочтительно Y=О;
R1 означает замещенный или незамещенный (С1-С23)-алкильный остаток, который может быть линейным или разветвленным и может содержать двойные и/или тройные связи, например арилалкил;
R2 означает замещенный или незамещенный (C1-C18)-алкильный остаток, который может быть линейным или разветвленным и может содержать двойные и/или тройные связи; и
n означает целое число, больше или равное 1,
причем арильный остаток связан с транспортируемой молекулой либо непосредственно через химическую связь, либо опосредованно через химическую группу; причем химическая группа не является СН2-S-группой, когда связывание транспортируемой молекулы происходит через межнуклеотидфосфодиэфирную связь.
Транспортируемой молекулой может быть любая молекула. Транспортируемая молекула предпочтительно имеет молекулярную массу = 350 Дальтон. Одна форма осуществления изобретения относится к конъюгатам, в случае которых транспортируемой молекулой является макромолекула, например, с молекулярной массой = 500 Дальтон, предпочтительно >1000 Дальтон, особенно предпочтительно >2000 Дальтон или больше. Транспортируемая молекула может представлять собой также низкомолекулярное соединение, например, с молекулярной массой <500 Дальтон, предпочтительно с молекулярной массой от 350 до 500 Дальтон. Низкомолекулярное соединение может представлять собой мононуклеотид.
Транспортируемая молекула может относиться к различным химическим классам веществ, например, она может представлять собой биополимер, например полинуклеотид, предпочтительно олигонуклеотид, полипептид, предпочтительно пептид или протеин, пептид-нуклеиновую кислоту (PNA) или полиамид, который содержит три ароматических цикла: имидазол, пиррол и гидроксипиррол (Kielkopf и др., Science, 282, 111-115 (1998)), или полисахарид, предпочтительно олигосахарид, или одно из производных указанных выше соединений. Транспортируемая молекула может быть пептидным миметиком.
Полинуклеотиды, олигонуклеотиды и мононуклеотиды являются либо встречающимися в природе нуклеиновыми кислотами, либо их известными производными. Под производными понимают, в частности, производимые от транспортируемой молекулы, или конъюгата, соли, в особенности их физиологически приемлемые соли, и также, например, модифицированные, или соответственно, стабилизированные нуклеиновые кислоты.
Транспортируемая молекула может представлять собой ингибитор факторов транскрипции, как, например, NF-KВ, c-fos или c-jun; протеинов клеточного цикла, как, например, циклин D; киназ, как c-Src, тирозин- или МАР-киназы; внутриклеточных ионных каналов; иммунофилинов, как, например, протеины связывания FK506, пролил-4-гидроксилаза; топоизомераз, вирусных протеаз, протеинов устойчивости к многочисленным лекарственным средствам, фосфатаз, как, например, протеин-тирозин-фосфатаза.
Транспортируемая молекула может быть конъюгирована с одним или несколькими арильными остатками, например с двумя, тремя, четырьмя, пятью, шестью, семью, восемью, девятью, десятью, пятнадцатью, двадцатью или более арильными остатками.
Арильный остаток ("арильный остаток" означает в особенности арильный остаток формулы (I) и/или арильный остаток формулы (II)) может быть однократно или многократно связан с транспортируемой молекулой, причем связи могут быть локализованы в разных положениях арильного остатка. Если с транспортируемой молекулой связаны несколько арильных остатков, то они могут быть одинаковыми или различными.
Арильный остаток содержит арильную группу (в формулах (I) и (II) обозначается как "арил"); арильная группа может состоять из одного или нескольких циклов, причем, однако, по меньшей мере один из циклов имеет ароматическую природу. Арильная группа также может содержать гетероциклы, которые могут быть ароматическими. Арильная группа содержит, например, 1-8 или более циклов ("циклическая система"), предпочтительно 1, 2, 3, 4, 5, 6, 7 или 8 циклов. Отдельные циклы являются 3-7-членными, предпочтительно 5-6-членными. Примерами циклических систем являются фенильные, пиридинильные, пиримидинильные, пирролильные, фуранильные, тиофенильные циклы, 5-членные лактоны, 6-членные лактоны, спиролактоны, бензохиноны, циклогексадиенилы и циклогексенилы. Эти циклические системы, арильная группа или, соответственно, отдельные циклы арильной группы могут быть однократно или многократно замещены. По меньшей мере один из циклов арильной группы предпочтительно связан с ацильным остатком.
Арильная группа может отвечать, например, одной из формул: F1', F2', F3', F4', F6', F7', F8', F9', F10', F11'. Эти формулы представлены на фиг.1.
Арильный остаток может быть связан с транспортируемыми молекулами непосредственно или через химическую группу. Объектом изобретения является конъюгат, причем химическая группа вместе с арильным остатком отвечает формуле (II):
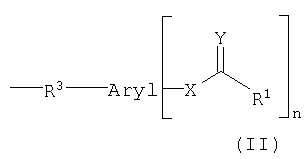
причем арил, X, Y и R1 имеют указанное выше значение и
R3 означает химическую группу, причем R3 предпочтительно означает группу -С(=O) или группу -NH-C(=S).
Примерами арильных остатков формулы (II) являются арильные остатки формул F1, F2, F3, F4, F5, F6, F7, F8, F9, F10 и F11; эти формулы представлены на фиг.2а и на фиг.2b.
Согласно особой форме выполнения транспортируемой молекулой является олигонуклеотид. Олигонуклеотид может быть сконструирован, например, полностью из нуклеотидов, как аденозинфосфат, гуанозинфосфат, инозинфосфат, цитидинфосфат, уридинфосфат и тимидинфосфат. Согласно другим формам осуществления изобретения олигонуклеотид, в случае необходимости, может содержать одну или несколько модификаций, например химические модификации. Олигонуклеотид может обладать несколькими одинаковыми и/или разными модификациями.
Примеры химических модификаций известны специалисту и описаны, например, в работах: Е.Uhlmann и A.Peyman, Chemical Reviews, 90, 543 (1990); "Protocols for Oligonukleotides and Analogs" Synthesis and Properties and Synthesis and Analytical Techniques, ред. S. Agrawal, изд. Humana Press, Totowa, США, 1993 г., и Hunziker и С. Leumann "Nucleic Acid Analogs: Synthesis and Properties" в книге "Современные методы синтеза" (ред. Beat Ernst и С. Leumann), изд. Helvetica Chimica Acta, Базель, с.331-417.
Химическая модификация олигонуклеотида, например, может включать:
а) полную или частичную замену диэфирных мостиков фосфорной кислоты, например, фосфортиоатными, фосфордитиоатными, NR1R'-фосфорамидатными, боранофосфатными, фосфат-(C1-C21)-O-алкилэфирными, фосфат-[(C6-C12)-арил-(C1-C21)-O-алкил]эфирными, (С1-С8)-алкилфосфонатными и/или (C6-C12)-арилфосфонатными мостиками, причем
R1 и R', независимо друг от друга, означают атом водорода, (C1-C18)-алкил, (С6-С20)-арил, (C6-C20)-арил-(C1-C8)-алкил, предпочтительно атом водорода, (C1-C8)-алкил и/или метоксиэтил, особенно предпочтительно атом водорода, (C1-C4)-алкил и/или метоксиэтил;
или
R1 и R' вместе с соединенным с ними атомом азота образуют 5-6-членный гетероцикл, который дополнительно может содержать другой гетероатом из ряда О, S, N;
b) полную или частичную замену 3'- и/или 5'-диэфирных мостиков фосфорной кислоты "дефосфо"-мостиками (описано, например, Е.Uhlmann и A.Peyman в книге " Methods in Molecular Biology", том 20, "Protocols for Oligonukleotides and Analogs", ред S. Agrawal, изд. Humana Press, Totowa, 1993, глава 16, с.355 и последующие), например, формацетальными, 3'-тиоформацетальными, метилгидроксиламиновыми, оксимными, метилендиметилгидразо-, диметиленсульфоновыми и/или силильными группами;
c) полное или частичное восстановление группы (Rückgrat) фосфата сахара, например, "морфолино"-олигомерами (описано, например, Е.Р. Stirchak и др., Nucleic Acids Res., 17, 6129 (1989); и J.Summerton и D. Weller, Antisence and Nucleic Acid Drug Dev., 1, 187-195 (1997)) и/или полиамиднуклеиновыми кислотами ("PNA") (описано, например, Р.Е. Nielson и др., Bioconj. Chem., 5, 3 (1994)) и/или фосфомоноэфирами нуклеиновых кислот ("PHONA") (описано, например, Peyman и др., Angew. Chem. Int. Ed. Engl., 35, 2632-2638 (1996));
d) полную и/или частичную замену β-D-2'-дезоксирибозных единиц, например, α-D-2'-дезоксирибозой, L-2'-дезоксирибозой, 2'-F-2'-дезоксирибозой, 2'-О-(С1-С6)-алкилрибозой, 2'-O-(C2-С6)-алкенилрибозой, 2'-[О-(C1-C6)-алкил-O-(C1-C6)-алкил]рибозой, 2'-NH2-2'-дезоксирибозой, β-D-ксилофуранозой, α-арабинозой, 2,4-дидезокси-β-D-эритрогексопиранозой, конформационно ограниченными аналогами сахара, как LNA (пространственно затрудненные нуклеиновые кислоты; Singh и др., Chem. Commun., 4, 455 (1998); Singh и др., Chem. Commun., 12, 1247 (1998)) и карбоциклическими (описано, например, Froehler, J. Am. Chem. Soc., 114, 8320 (1992)) и/или аналогами сахара с открытой цепью (описано, например, Vandendriessche и др.. Tetrahedron, 49, 7223 (1993)), и/или бициклическими аналогами сахара (описано, например, М. Tarkov и др., Helv. Chim. Acta, 76, 481 (1993));
е) модификацию или соответственно полную или частичную замену природных нуклеозидных оснований, например, 5-(гидроксиметил)урацилом, 5-аминоурацилом, псевдоурацилом, псевдоизоцитозином, дигидроурацилом, 5-(C1-C6)-алкилурацилом, 5-(С2-С6)-алкенилурацилом, 5-(С2-С6)-алкинилурацилом, 5-(C1-C6)-алкилцитоэином, 5-(С2-С6)-алкенилцитозином, 5-(С2-С6)-алкинилцитозином, 5-фторурацилом, 5-фторцитозином, 5-хлорурацилом, 5-хлорцитозином, 5-бромурацилом, 5-бромцитозином или 7-деаза-7-замещенными пуринами.
Химическая модификация олигонуклеотида включает, далее, связывание олигонуклеотида с одной или несколькими другими молекулами, которые благоприятно влияют на особые свойства олигонуклеотида, как, например, стабильность нуклеазы, сродство к последовательности-мишени и фармакокинетика, например, при гибридизации модифицированного олигонуклеотида с последовательностью-мишенью они действуют путем связывания и/или поперечной сшивки. Примерами таких других молекул являются поли-L-лиэин; интеркаляторы, как пирен, акридин, феназин и фенантридин; флуоресцирующие соединения, как флуоресцеин; кросс-линкеры, как псорален и азидопрофлавин; липофильные молекулы, как (C12-C20)-алкильные группы, предпочтительно (C12-C20)-алкильные группы; липиды, как 1,2-дигексадецил-гас-глицерин; стероиды, как холестерин или тестостерон; витамины, как витамин Е; поли- или олигоэтиленгликоль, (C12-C18)-алкилфосфатные диэфиры, предпочтительно (C14-C18)-алкилфосфатные диэфиры, и -O-CH2-СН (ОН)-О-(C12-C18)-алкильные группы, предпочтительно -O-CH2-СН (ОН)-О-(C12-C18)-алкильные группы. Эти другие молекулы могут быть конъюгированы с 5'- и/или 3'-концом и/или с внутренней частью последовательности, например, с нуклеозидным основанием. Способы получения такого рода модифицированных олигонуклеотидов известны специалистам в данной области и описаны, например, Е.Uhlmann и A.Peyman, Chem. Rev., 90, 543 (1990) и/или М. Manoharan "Antisense Research and Applications", ред. Crooke и Lebleu, CRC Press, Boca Raton, 1993, глава 17, с.303 и последующие; и/или в заявке ЕР-А-0552766.
Далее, согласно особой форме осуществления изобретения, олигонуклетид на 3'- и/или 5'-конце может обладать 3'-3'- и/или 5'-5'-инверсиями. Этот тип химической модификации известен специалистам в данной области и описан, например, М. Кода и др., J. Org. Chem., 56, 3757 (1991).
В случае конъюгата, который состоит из одного или нескольких олигонуклеотидов и одного или нескольких арильных остатков, предпочтительно формулы (I) или формулы [II), связывание (конъюгацию) арильных остатков с олигонуклеотидом можно осуществлять, например, по 5'-концу (А), по 3'-концу (F), по гетероциклическому основанию (Е и G), по сахару (С) или по межнуклеозидному мостику (В) олигонуклеотида. Связывание, например можно, однако, также осуществлять через ненуклеотидные структурные элементы, например случай (D). Эти примеры представлены на фиг.3.
Указанные модификации, соответственно, можно также конечно использовать в случае более длинных полинуклеотидов и, в общем и целом, в случае пригодных моно-, или соответственно, динуклеотидов, или соответственно, -нуклеозидов.
Олигонуклеотиды имеют длину, например, от 8 до 50 нуклеотидов, предпочтительно 10-20 нуклеотидов. Однако, также пригодны более длинные олигонуклеотиды, или соответственно, полинуклеотиды, например, длиной 50-10000 нуклеотидов, предпочтительно 100-1000 нуклеотидов, которые, в случае необходимости, могут быть также двухцепочечными.
Олигонуклеотиды могут иметь любую последовательность. Последовательность олигонуклеотида выбирают, или соответственно, обозначают, в зависимости от выбранной мишени, то есть, в случае, если мишенью является нуклеиновая кислота, то в зависимости от ее последовательности, или в случае, если мишенью является протеин, то в зависимости от нуклеотидной последовательности, которая кодирует этот протеин-мишень. Если, например, мишенью является вирус, например вирус цитомегалий (CMV), ВИЧ, вирус гепреса человека 1 (HSV-1), вирус герпеса человека 2 (HSV-2), вирус гриппа, VSV, вирус гепатита В или вирус папилломы, тогда олигонуклеотид может иметь, например, одну из следующих последовательностей:
a) против вируса цитомегалии:
последовательность №12: 5'-GCGTTTGCTCTTCTTCTTGCG-3'
b) против ВИЧ, например:
последовательность №13: 5'-ACACCCAATTCTGAAAATGG-3' или
последовательность №14: 5'-AGGTCCCTGTTCGGGCGCCA-3' или
c) против вируса герпеса человека 1, например, последовательность №15: 5'-GCGGGGCTCCATGGGGGTCG-3'
Мишенью может быть, например, протеин, который принимает участие в возникновении рака, или является ответственным за рост раковой опухоли. Примерами таких мишеней являются:
1) нуклеарные онкопротеины, как, например, c-myc, N-myc, c-myb, c-fos, c-fos/jun, PCNA, p120;
2) цитоплазматические/ассоциированные с мембраной онкопротеины, как, например, EJ-ras, c-Ha-ras, N-ras, rrg, bcl-2, cdc-2, c-raf-1, c-mos, c-src, c-abl, c-ets;
3) клеточные рецепторы, как, например, EGF-рецептор, Her-2, с-erbA, VEGF-рецептор (KDR-1), ретиноидные рецепторы, протеинкиназная регуляторная субъединица, c-fms, Tie-2, c-raf-1-киназа, РКС-альфа, протеинкиназа А (R1-альфа);
4) цитокины, факторы роста, внеклеточные матрицы, как, например, CSF-1, IL-6, IL-1a, IL-1b, IL-2, IL-4, IL-6, IL-8, bFGF, VEGF, миелобластин, фибронектин.
Олигонуклеотиды, которые направлены против таких мишеней, могут иметь, например, следующую последовательность оснований:
a) против c-Ha-ras, например:
последовательность №16: 5'-CAGCTGCAACCCAGC-3' или
последовательность №17: 5'-TATTCCGTCAT-S' или
последовательность №18: 5'-TTCCGTCATCGCTCCTCAGGGG-3'
b) против bFGF, например:
последовательность №19: 5'-GGCTGCCATGGTCCC-3'
c) против с-myc, например:
последовательность №20: 5'-GGCTGCTGGAGCGGGGCACAC-3'
последовательность №21: 5'-AACGTTGAGGGGCAT-3'
d) против c-myb, например:
последовательность №22: 5'-GTGCCGGGGTCTTCGGGC-3'
e) против c-fos, например:
последовательность №23: 5'-CGAGAACATCATCGTGG-3'
последовательность №24: 5'-GGAGAACATCATGGTCGAAAG-3'
последовательность №25: 5'-CCCGAGAACATCATGGTCGAAG-3'
последовательность №26: 5'-GGGGAAAGCCCGGCAAGGGG-3'
f) против р120, например:
последовательность №27: 5f-CACCCGCCTTGGCCTCCCAC-3'
g) против EGF-рецептора, например:
последовательность №28: 5'-GGGACTCCGGCGCAGCGC-3'
последовательность №29: 5'-GGCAAACTTTCTTTTCCTCC-3'
h) против супрессора опухоли р53, например:
последовательность №30: 5'-GGGAAGGAGGAGGATGAGG-3'
последовательность №31: 5'-GGCAGTCATCCAGCTTCGGAG-3'
i) против bcl-2
последовательность №32: 5'-TCTCCCAGCGTGCGCCAT-3'
k) против VEGF
последовательность №33: 5'-GCGCTGATAGACATCCATG
последовательность №34: 3'-CCAGCCCGGAGG-5',5'-GGAGGCCCGACC-3'
последовательность №35: 3'-CGGAGGCTTTGG-5',5'-GGTTTCGGAGGC-3'
последовательность №36: 3'-GATGGAGGTGGT-5',5'-TGGTGGAGGTAG-3'
последовательность №37: 3'-GGAGGTGGTACG-5',5'-GCATGGTGGAGG-3'
последовательность №38: 3'-GGTGGTACGGTT-5',5'-TTGGCATGGTGG-3'
последовательность №39: 3'-CACCAGGGTCCG-5',5'-GCCTGGGACCAC-3'
последовательность №40: 3'-CCAGGGTCCGAC-5',5'-CAGCCTGGGACC-3'
последовательность №41; 3'-AGGGTCCGACGT-5',5'-TGCAGCCTGGGA-3'
последовательность №42; 3'-GGGTCCGACGTG-5',5'-GTGCAGCCTGGG-3'
последовательность №43: 3'-GGTCCGACGTGG-5',5'-GGTGCAGCCTGG-3'
последовательность №44: 3'-CCGACGTGGGTA-5',5'-ATGGGTGCAGCC-3'
последовательность №45; 3'-GTAGAAGTTCGG-5',5'-GGCTTGAAGATG-3'
последовательность №46: 3'-ACGCCCCCGACG-5',5'-CCAGCCCCCGCA-3'
или
последовательность №47: 3'-CCCCCGACGACG-5',5'-GCAGCAGCCCCC-3'
l) против c-raf-киназы
последовательность №48: 5'-TCCCGCCTGTGACATGCATT
m) против РКС-альфа
последовательность №49: 5'-GTTCTCGCTGGTGAGTTTCA
n) против протеинкиназы А
последовательность №50: 5'-GCGTGCCTCCTCACTGGC
Если мишенью является интегрин или рецептор адгезии клетка-клетка, как, например, VLA-4, VLA-2, ICAM, VCAM или ELAM, то олигонуклеотид может иметь, например, одну из следующих последовательностей:
a) VLA-4, например:
последовательность №51: 5'-GCAGTAAGCATCCATATC-3'
b) ICAM-1, например:
последовательность №52: 5'-GCCCAAGCTGGCATCCGTCA
последовательность №53: 5'-СССССАССАСТТССССТСТС-3'
последовательность №54: 5'-СТСССССАССАСТТССССТС-3'
последовательность №55: 5'-GCTGGGAGCCATAGCGAGG-3'
c) ELAM-1, например:
последовательность №56: 5'-ACTGCTGCCTCTTGTCTCAGG-3'
последовательность №57: 5'-CAATCAATGACTTCAAGAGTTC-3'
d) альфа-интегрин (V)
последовательность №58: 5'-GCGGCGGAAAAGCCATCG
Если мишень представляет собой протеин, который является ответственным за пролиферацию или миграцию, или соответственно, принимает участие в этих процессах или этом процессе, как, например:
1) нуклеарные трансактиваторные протеины и циклины, как, например, c-myc, c-myb, c-fos, c-fos/jun, циклины и cdc-2-киназа;
2) митогены или факторы роста, как, например, PDGF, bFGF, VEGF, EGF, HB-EGF и TGF-β;
3) клеточные рецепторы, как, например, bFGF-рецептор, EGF-рецептор и PDGF-рецептор,
тогда олигонуклеотид может иметь, например, одну из следующих последовательностей оснований:
a) c-myb
последовательность №59: 5'-GTGTCGGGGTCTCCGGGC-3'
b) c-myc
последовательность №60: S'-CACGTTGAGGGGCAT-3'
c) cdc-2-киназа
последовательность №61: 5'-GTCTTCCATAGTTACTCA-3'
d) PCNA (нуклеарный антиген пролиферирующей клетки крысы)
последовательность №62: S'-GATCAGGCGTGCCTCAAA-3'
Если мишенью является, например, аденозин-А1-рецептор, аденозин-А3-рецептор, брадикинин-рецептор или IL-13, то возможна, например, последовательность оснований:
последовательность №63: 5'-GATGGAGGGCGGCATGGCGGG.
Были получены следующие олигонуклеотиды (5'→3'):
ON1: 5'-d(G*CGAC*GC*CAT*GAC*G*G) последовательность №1
ON2: 5'-d(C*GAC*GC*CAT*G*A*C) последовательность №2
ON3: 5'-d(A*T*GAC*GGAA*T*T*C) последовательность №3
ON4: 5'-d(TATTCCGTCAT) последовательность №4
ON5: 5'-(dA)20 последовательность №5
ON6: 5'-(dA)50 последовательность №6
ON7: 5'-(dA)80 последовательность №7
ON8: 5'-T*T*CC*AT*GG*TG*G*C последовательность №8
ON9: 5'-T*T*CA*CT*GT*GG*G*C последовательность №9
ON10: 5'-T*G*GC*GC*CG*GG*C*C последовательность №10
ON11: 5'-T*G*CC*GG*CC*GG*G*C последовательность №11
причем знак * указывает положения, в которых фосфодиэфирный мостик заменен фосфортиоатным межнуклеозидным мостиком.
Эти последовательности были превращены в следующие конъюгаты (КО):
KO_1: FS-Li1-ON1
KO_2: F0-Li1-ON1
KO_3: F3-Li1-ON2
KO_4: F0-Li1-ON2
KO_5: F3-Li1-ON3
KO_6: F9-Li1-ON3
KO_7: F2-Li1-ON3
KO_8: F0-Li1-ON3
KO_9: F3-Li1-ON3-родамин
KO_10: F9-Li1-ОN3-родамин
KO_11: F6-Li1-ОN3-родамин
KO_12: F0-Li1-ОN3-родамин
KO_13: F3-Li1-ON4
KO_14: F3-Li1-ON5
KO_15: F3-Li1-ON6
KO_16: F3-Li1-ON7
KO_17: F3-Li1-ON8
KO_18: F3-Li1-ON9
KO_19: F3-Li1-ON10
KO_20: F3-Li1-ON11
KO_21: F7-Li1-ON3
причем
"F1-F1" означают арильные остатки формул F1-F11 (см., например, фиг.2);
"Li1" означает 6-аминогексилфосфатный остаток, который связан с 5'-концом олигонуклеотида (см., например, Приложение 4);
"ON1-ON11" означают описанные олигонуклеотиды с последовательностями от последовательности №1 до последовательности №11;
и "родамин" означает обнаруживаемую наряду с флуоресцеином родаминовую маркировку на 3'-конце олигонуклеотида.
Объектом изобретения также является способ получения предлагаемых согласно изобретению конъюгатов. Изобретение относится к способу получения конъюгата, который содержит транспортируемую молекулу и по меньшей мере один арильный остаток, предпочтительно формул (I) или (II), причем:
a) получают транспортируемую молекулу, которая содержит реакционноспособную функциональную группу в положении, с которым должен быть связан арильный остаток;
b) получают арильный остаток и
c) транспортируемую молекулу вводят во взаимодействие с арильным остатком до получения конъюгата.
Реакционноспособной функциональной группой предпочтительно является аминогруппа, меркаптогруппа, хлорацетильная группа, изоцианатная группа, изотиоцианатная группа, карбоксильная группа, N-гидроксисукцинимидная группа или хлорангидридная группа карбоновой кислоты. Взаимодействие транспортируемой молекулы с арильным остатком осуществляют при значении рН≤7,5, особенно предпочтительно при значении рН≤7,3, более предпочтительно при значении рН около 7 или при более низком значении рН, например, при значении рН≤7, предпочтительно при значении рН≤6,5. В случае этих реакций сочетания все другие реакционноспособные группы перед реакцией нужно защищать с помощью известных специалистам в данной области защитных групп.
Согласно особой форме осуществления способа транспортируемой молекулой является полинуклеотид, олиногуклеотид или мононуклеотид.
Способ получения включает на первой стадии получение транспортируемой молекулы. В этой связи изобретение относится также к способу получения олигонуклеотидов. Олигонуклеотиды можно получать с помощью различных известных химических способов, как, например, описано F.Eckstein "Oligonucleotides and Analogues, A Practical Approach", изд. IRL Press, Оксфорд. Олигонуклеотиды можно также получать способами, которые включают, в случае необходимости, одну или несколько ферментативных стадий. Получение олигонуклеотидных конъюгатов в принципе описано в литературе (J.Goodchild, Bioconjugate Chem., 1, 165 (1990); S. Beaucage и R. lyer, Tetrahedron, 49, 1925 (1993); S. Agrawal "Methods in Molecular Biology", том 26: "Protocols for oligonucleotide Conjugates", (1994), Humana Press).
При синтезе олигонуклеотидных конъюгатов согласно формуле (I), однако, нужно обращать внимание на то, что они могут разлагаться в щелочной среде. Поэтому, например, при использовании общепринятых методов невозможен синтез маркированных с помощью FDA олигонуклеотидов в синтезаторе олигонуклеотидов, так как сложноэфирные группы FDA-группы уже гидролизовались бы при обработке аммиаком, которая необходима для отщепления олигонуклеотида от носителя и отщепления аминозащитных групп гетероциклических оснований. Поэтому олигонуклеотид сначала получают в незащищенной форме в виде предшественника и на последней стадии конденсируют с группой согласно формуле (I) (фиг.5). Предшественник олигонуклеотида обладает реакционноспособной или активируемой функциональной группой, которую затем дериватизируют известными специалисту способами с помощью реагента, который содержит предлагаемую согласно изобретению группу согласно формуле (I). В качестве реакционноспособных или, соответственно, активируемых функциональных групп используют, например, аминогруппы, меркаптогруппы, хлорацетильные группы, изо(тио)цианатные группы и карбоксильные группы.
Особенно легко можно вводить в олигонуклеотиды так называемые аминолинкеры с помощью коммерчески доступных реагентов. Аминолинкер-олигонуклеотиды затем, например, вводят во взаимодействие с реакционноспособными реагентами, которые содержат группу согласно формуле (I). Такими реакционноспособными реагентами являются, например, соответствующие изотиоцианаты. Группа согласно формуле (I) в этом случае связана через тиомочевинную группу (Приложение 4). Другими реакционноспособными реагентами являются, например, хлорангидриды карбоновых кислот. Мягкими реакционноспособными реагентами являются, например, N-гидроксисукцинимиды соответствующих карбоновых кислот. Активируемыми реагентами являются, например, соответствующие карбоновые кислоты, которые могут связывать с пептидными реагентами сочетания, как HBTU, TBTU или TOTU. В этом случае группа согласно формуле (I) связана через амидную функциональную группу. В принципе предлагаемые согласно изобретению группы формулы (I) можно вводить в любые положения олигонуклеотида. Предпочтительны указанные на фиг.3 положения.
Синтез модифицированных олигонуклеогидов осуществляют путем конструирования олигонуклеотидной цепи стандартными методами, как твердофазный синтез по фосфорамидитному способу, и дериватизации 5'-конца с помощью коммерчески доступного 5'-амино-модификатора С6 (например, фирма Eurogentec, Seraing, Бельгия).
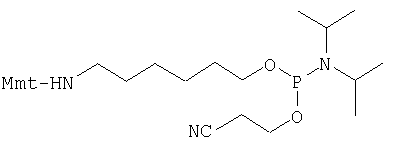
5'-Амино-модификатор С6 (Mmt = 4-монометокситритил)
После отщепления олигонуклеотидного производного от носителя и удаления всех основных лабильных защитных групп путем обработки аммиаком, монометокситритильную группу отщепляют путем обработки с помощью 80%-ной уксусной кислоты при температуре окружающей среды. Получают 5'-аминогексилфосфат-модифицированный олигонуклеотид. Аминогруппу этого олигонуклеотидного производного затем вводят во взаимодействие с FDA-изотиоцианатом в 0,2 М триэтиламмонийбикарбонатном буфере (ТВК-буфер) при рН=7 в диметилформамиде. Уже спустя примерно от двух до трех часов аминолинкер-олигонуклеотид полностью превращается в желательное FDA-производное (фиг.4). Взаимодействия с флуоресцеинизотиоцианатом обычно осуществляют при рН 8. При этом значении рН, однако, гидролизуется диацетат FDA-группы.
Естественно, также можно использовать другие аминолинкерные реагенты, как, например, 5'-амино-модификатор С3, 5'-амино-модификатор С12, 5'-амино-модификатор 5 или 5'-тиол-модификатор С6 (все выпускаются фирмой Eurogentec).
За счет использования твердых фаз 3'-амино-модификатора, как, например, 3'-амино-модификатор С3 CPG (фирма Eurogentec) можно получать олигонуклеотидные производные с 3'-аминоалкильной группой, которые затем вводят во взаимодействие с FDA-изотиоцианатом. Получают олигонуклеотидное производное, которое содержит связанную с 3'-концом предлагаемую согласно изобретению группу формулы (I).
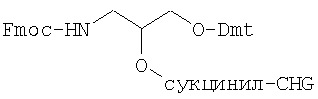
3'-амино-модификатор С3 CPG (Fmoc = флуоренилметоксикарбонил)
Для введения конъюгата в гетероциклическое основание нуклеозида можно использовать соответствующий амино-модификатор С6 dT (фирма Eurogentec), который производится из тимидина, в синтезе вместо обычного фосфорамидитного структурного элемента. По окончании синтеза олигонуклеотида трифторацетильную защитную группу отщепляют путем обработки аммиаком и свободную аминогруппу в растворе вводят во взаимодействие с FDA-изотиоцианатом.
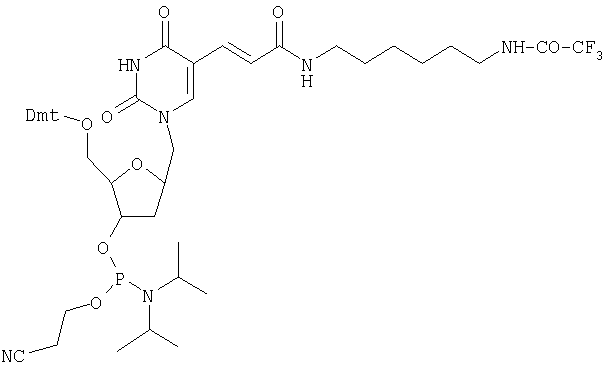
Амино-модификатор С6 dT
Подобным образом можно вводить предлагаемые согласно изобретению группы формулы (I) в любые положения олигонуклеотидов. Видно, что также возможно многократное введение одинаковых или различных групп.
Согласно способу получения конъюгатов, в котором транспортируемой молекулой является пептиднуклеиновая кислота (PNA), первичную аминогруппу аминоэтильной группы можно вводить во взаимодействие с FDA-изотиоцианатом. Согласно способу получения конъюгатов, в которых транспортируемой молекулой является полипептид, концевую аминогруппу полипептида или аминогруппы лизиновой боковой цепи можно использовать для введения во взаимодействие с FDA-изотиоцианатом.
Объектом настоящего изобретения является также применение конъюгатов, в особенности применение, которое основано на описанных полезных свойствах конъюгатов. Особой формой осуществления изобретения является применение конъюгатов для транспорта молекулы через биологическую мембрану. Изобретение относится также к применению арильных остатков, предпочтительно формул (I) или (II), для транспорта молекулы, с которой связан этот арильный остаток, для транспорта этой молекулы через биологическую мембрану. Биологическая мембрана предпочтительно является составной частью клетки, везикулы или органеллы.
Объектом настоящего изобретения является также способ транспорта молекулы через мембрану, причем:
a) получают конъюгат, в случае которого транспортируемая молекула связана по меньшей мере с одним арильным остатком формулы (I) или формулы (II), и
b) конъюгат инкубируют с мембраной.
В особенности, способ транспорта молекулы в клетку представляет собой способ, согласно которому:
a) получают конъюгат, в котором транспортируемая молекула связана по меньшей мере с одним арильным остатком формул (I) или (II), и
b) конъюгат инкубируют с клеткой,
после чего
c) конъюгат транспортируется в клетку без отщепления арильного остатка.
Это относится в особенности к способам, в которых клетка является эукариотной или прокариотной клеткой, например бактериальная клетка, дрожжевая клетка или клетка млекопитающего, предпочтительно клетка человека. Согласно особым формам осуществления клетка является патологически измененной клеткой, например опухолевой клеткой.
Повышенное проникновение в клетку конъюгатов наблюдали не только в случае клеток млекопитающих, но и также в случае других эукариот и даже прокариот.
Предлагаемые согласно изобретению конъюгаты исследовали с помощью микроскопа в отношении проникновения в живые клетки. Сначала исследовали маркированные с помощью FDA олигонуклеотиды на клеточную доступность KO_1 и KO_3. В качестве известных из уровня техники соединений использовали соответствующие маркированные с помощью флуоресцеина олигонуклеотиды KO_2 и KO_4. KO__1 и KO_3 (FDA-конъюгаты) в течение 5-10 минут проникали во все исследованные живые клеточные культуры животных, в то время как KO_2 и KO_4 (флуоресцеиновые конъюгаты) спустя это время не были обнаружены в живых клетках (таблица 1).
Хотя проникновение в бактерии и дрожжи происходит намного медленнее, чем в клетки млекопитающих, спустя два часа все-таки произошло проникновение предлагаемых согласно изобретению олигонуклеотидов в часть клеток, в то время как обычные, маркированные с помощью флуоресцеина олигонуклеотиды в этих условиях не проникли. Удивительно, что предлагаемые согласно изобретению олигонуклеотиды, в принципе, во все до сих пор исследованные организмы проникали лучше, чем известные олигонуклеотидные производные. Организмы охватывают, в частности, клетки животных, жгутиконосцы, дрожжи, грибки и бактерии (таблица 3).
Далее оказалось, что раковые клетки особенно хорошо "поглощают" олигонуклеотиды. Поэтому применение предлагаемых согласно изобретению олигонуклеотидов особенно пригодно для лечения опухолей. Маркированный с помощью FDA антисмысловой олигонуклеотид KO_1, который направлен против еg5, ингибировал пролиферацию клеток А549 уже путем добавки в среду, в то время как соответствующий немодифицированный антисмысловой олигонуклеотид ON 1 и маркированный флуоресцеином олигонуклеотид KO_2 ингибировали пролиферацию раковых клеток только после переведения в лекарственную форму с усилителями пенетрации, как клеточный фектин.
Изобретение относится к применению конъюгатов, в которых транспортируемой молекулой является олигонуклеотид, для гибридизации с одноцепочечными и/или двухцепочечными нуклеиновыми кислотами, например, ДНК (например гены, кДНК) и/или РНК (например, пре-мРНК, мРНК). Эти конъюгаты могут связываться также специфически к последовательности с внутриклеточными протеинами, как ферменты, например, полимеразы или теломеразы, или с факторами транскрипции. Изобретение относится, далее, к применению таких конъюгатов для модуляции, а также для полного или частичного ингибирования экспрессии определенных генов-мишеней, например, для полного или частичного ингибирования транскрипции и/или трансляции. Изобретение относится также к применению таких конъюгатов в качестве антисмысловых олигонуклеотидов, рибозимов, смысловых олигонуклеотидов, образующих тройную спираль олигонуклеотидов, химерапластов и/или Decoy-олигонуклеотидов. Сверх того, эти конъюгаты можно применять в качестве вспомогательных средств в молекулярной биологии.
Изобретение относится, далее, к применению олигонуклеотидов в качестве лекарственных и/или диагностических средств или, соответственно, к применению олигонуклеотидов для получения лекарственных и/или диагностических средств. Олигонуклеотиды в особенности можно использовать в лекарственных средствах, которые предназначены для профилактики и/или лечения заболеваний, протекающих с экспрессией, или соответственно, сверхпродуцированием определенных генов. Далее олигонуклеотиды можно использовать для диагноза, или соответственно, раннего распознавания таких заболеваний. Так как клеточная доступность для предлагаемых согласно изобретению олигонуклеотидов является очень хорошей, их можно использовать для диагностики in vivo, например, для гибридизации in situ с целыми органами или с интактным организмом.
Объектом изобретения является также лекарственное средство, которое содержит один или несколько конъюгатов согласно изобретению. Объектом изобретения является также диагностическое средство, которое содержит один или несколько конъюгатов согласно изобретению. Объектом изобретения является также тест-набор, который содержит один или несколько конъюгатов согласно изобретению.
Изобретение относится также к применению олигонуклеотидов для детектирования, разделения и амплификации нуклеиновых кислот и их аналогов. Конъюгаты особенно пригодны для обнаружения нуклеиновых кислот в клетках, в особенности в живых клетках. Эти клетки могут быть человеческого или животного происхождения. Конъюгаты особенно пригодны также для указанных в таблице 3 организмов, в особенности для обнаружения патогенных организмов. Предлагаемые согласно изобретению олигонуклеотиды можно использовать в известных технических вариантах амплификации нуклеиновых кислот, в особенности в LMPCR (опосредованная лигированием полимеразная цепная реакция), в "Invader Assay" (товарный знак, Third Wave technologies. Inc., Wisconsin), в TaqMan-системе (товарный знак) и во множественном генотипировании. Предпочтительным также является применение олигонуклеотидов для амплификации нуклеиновых кислот с помощью светоблока для проведения реакций (Light-Cycler), который позволяет осуществлять определение реального времени амплификации. Детектирование по принципу молекулярных "маяков", в случае которых флуоресцентный краситель в несвязанном состоянии не флуоресцирует, так как он "гасится" второй группой в олигомере, представляет собой дальнейшую возможность использования предлагаемых согласно изобретению олигонуклеотидов. Можно, например, FDA-производное (например, на 5'-конце олигонуклеотида) комбинировать с Dabcyl-остатком (например, конъюгированным на 3'-конце), который также после превращения FDA-производного в флуоресцеиновое производное гасит сигнал флуоресценции в несвязанном состоянии. Эти модифицированные с помощью FDA "маяки" посылали бы сигнал флуоресценции лишь после проникновения в клетку и гибридизации с мРНК-мишенью.
Изобретение относится также к применению олигонуклеотидов, соответственно, лекарственных средств, которые содержат эти олигонуклеотиды, для лечения заболеваний, в случае которых причиной являются или принимают участие определенные гены за счет сверхпродуцирования.
Лекарственные средства согласно настоящему изобретению можно применять, например, для лечения заболеваний, вызываемых вирусами, например вирусом цитомегалии, ВИЧ, вирусом герпеса 1, вирусом герпеса 2, вирусом гриппа, VSV, вирусом гепатита В или вирусом папилломы. Лекарственные средства согласно настоящему изобретению пригодны, например, также для лечения рака. Далее лекарственные средства согласно настоящему изобретению пригодны, например, для лечения заболеваний, на которые оказывают влияние интегрины или рецепторы адгезии клетка-клетка, например VLA-4, VLA-2, ICAM, VCAM или ELAM. Лекарственные средства согласно настоящему изобретению также пригодны, например, для предотвращения рестеноза, для лечения витилиго и других заболеваний, связанных с депигментацией или нарушением пигментации (например, кожи, волос, глаз), например альбинизма и псориаза; астмы.
К лекарственным средствам относятся, например, фармацевтические препараты, которые можно вводить
а) перорально, например, в форме таблеток, драже, твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий;
b) ректально, например, в форме суппозиториев, или
с) парентерально, например, в виде растворов для инъекций.
Для приготовления лекарственных средств конъюгаты, например, можно вводить в терапевтически инертные органические и/или неорганические носители; например, в качестве носителей для таблеток, драже и твердых желатиновых капсул можно использовать лактозу, кукурузный крахмал или его производные, жир и стеариновую кислоту или ее соли. В качестве носителей для растворов пригодны вода, многоатомные спирты, сахароза, инвертный сахар и глюкоза; для растворов для инъекций пригодны вода, спирты, многоатомные спирты, глицерин и растительные масла; для суппозиториев пригодны растительные и отвержденные масла, воски, жир и полужидкие многоатомные спирты. Лекарственные средства, кроме того, могут содержать консерванты, растворители, стабилизаторы, смачиватели, эмульгаторы, подслащивающие вещества, красители, вкусовые вещества, соли для изменения осмотического давления, буферы, покровные средства, антиоксиданты, а также, в случае необходимости, другие терапевтические биологически активные вещества.
Лекарственные средства предпочтительно применяют топически или локально, как, например, с помощью катетера или путем ингаляции, или вводят путем инъекций или инфузий. Для инъекции на основе конъюгата приготовляют лекарственную форму в виде жидкого раствора, предпочтительно в физиологически приемлемом буфере, как, например, раствор Хэнка или раствор Рингера. Конъюгат, однако, также можно использовать для получения твердой лекарственной формы и перед употреблением ее растворять или суспендировать. Для систематического введения дозировки предпочтительно составляют от примерно 0,01 мг/кг до примерно 50 мг/кг массы тела и в сутки.
Конъюгаты и/или их физиологически приемлемые соли можно вводить животному, предпочтительно млекопитающему, и в особенности человеку, в качестве лекарственного средства индивидуально, в виде смесей друг с другом или в виде фармацевтических композиций, которые применяют локально, чрескожно, парентерально или энтерально и которые в качестве активного компонента содержат эффективное количество по меньшей мере одного конъюгата, наряду с обычными, фармацевтически приемлемыми носителями и добавками. Композиции обычно содержат примерно от 0,1 масс.% до примерно 90 масс.% терапевтически эффективного соединения. Для лечения кожных заболеваний, как, например, псориаз или витилиго, предпочтительно локальное применение, например, в виде мазей, лосьонов или настоек, эмульсий, суспензий. Лекарственное средство получают само по себе известным образом (см., например, Remingtons Pharmaceutical Sciences, Mack Publ. Co., Eastin, PA), причем используют фармацевтически инертные неорганические и/или органические носители. Для приготовления пилюль, таблеток, драже и твердых желатиновых капсул можно использовать, например, лактозу, кукурузный крахмал и/или его производные, тальк, стеариновую кислоту и/или ее соли и т.д. Носителями для мягких желатиновых капсул и/или суппозиториев являются, например, жиры, воски, полутвердые и жидкие многоатомные спирты, природные и/или отвержденные масла и т.д. В качестве носителей для приготовления растворов и/или сиропов пригодны, например, вода, сахароза, инвертный сахар, глюкоза, многоатомные спирты и т.д. В качестве носителей для приготовления растворов для инъекций пригодны вода, спирты, глицерин, многоатомные спирты, растительные масла и т.д. В качестве носителей для микрокапсул, имплантатов и/или "палочек" пригодны сополимеры гликолевой кислоты и молочной кислоты. Сверх того пригодны липосомные лекарственные формы, которые известны специалистам в данной области (N. Weiner, Drug Develop. Ind. Pharm., 15, 1523 (1989); "Liposome Dermatics", изд. Springer, 1992), например, HVJ-липосомы (Hayashi, Gene Therapy, 3, 878 (1996)).
Наряду с биологически активными веществами и носителями лекарственное средство может содержать еще добавки, как, например, наполнители, расширители, порофоры, связующие, смазки, смачиватели, стабилизаторы, эмульгаторы, консерванты, подслащивающие вещества, красители, вкусовые вещества или ароматизаторы, загустители, разбавители, буферные вещества, далее растворители, и/или агенты растворения, и/или средства для достижения депо-эффекта, а также соли для изменения осмотического давления, покровные средства и/или антиоксиданты. Они могут также содержать два или несколько различных олигонуклеотидов и/или их физиологически приемлемых солей, а также, далее, наряду по меньшей мере с одним олигонуклеотидом они могут также содержать одно или несколько других терапевтически активных веществ. Дозу можно изменять в широких пределах и в каждом отдельном случае ее нужно приспосабливать к индивидуальным данным.
Описание чертежей
Фиг.1: представлены примеры арильных остатков формулы (I).
Фиг.2а и 2b: представлены примеры арильных остатков формулы (II).
Фиг.3: представлены различные примеры (А, В, С, D, Е, F, G) конъюгации между транспортируемой молекулой (здесь олигонуклеотид) и арильными остатками формулы (I); "R" означает остаток формулы (I); "В" означает гетероциклическое основание.
Фиг.4: показана возможность получения предлагаемого согласно изобретению конъюгата (здесь состоящего из FDA-изотиоцианата и олигонуклеотида).
Фиг.5: показано протекающее во времени проникновение конъюгата KO_5 в REH-клетки из среды, причем была использована один раз среда без сыворотки  и один раз среда с сывороткой
и один раз среда с сывороткой  . Проникновение в клетку определяли с помощью клеточного сортера с возбуждением флуоресценции (FACS).
. Проникновение в клетку определяли с помощью клеточного сортера с возбуждением флуоресценции (FACS).
Фиг.6: представлено определение проникновения в клетку КО_1 (FDA-конъюгат;  ) и KO_2 (FITC-олигомер;
) и KO_2 (FITC-олигомер;  ) путем измерения с помощью FACS. Начальная концентрация внеклеточного олигонуклеотидного конъюгата составляет 1 мкМ; О и
) путем измерения с помощью FACS. Начальная концентрация внеклеточного олигонуклеотидного конъюгата составляет 1 мкМ; О и  означают контроли.
означают контроли.
Фиг.7: зависимость от длин (олигонуклеотидов) трансфекции FDA-конъюгированных polyA-нуклеотидов в REH-клетки.
Фиг.8: сравнение проникновения в клетку конъюгатов флуоресцеин-диацетат-олигонуклеотид и флуоресцеин-дипивалат-олигонуклеотид;
К39: карбоксифлуоресцеиндиацетат (F3 равен FDA) из
примера 15
К41: карбоксифлуоресцеиндипивалат (F2) из примера
10.
Фиг.9: флуоресцентномикроскопическое исследование проникновения в клетку двукратно маркированного Су3-олигонуклеотид-F3-конъюгата [1 мкМ] при инкубации с REH-клетками. Проникновение спустя 4 часа: слева: флуоресцентная маркировка; в середине: цианиновый краситель; справа: фазово-контрастный снимок; вверху: олигонуклеотид К3; внизу: олигонуклеотид К34.
Примеры
Пример 1 Синтез олигонуклеотидов
Олигонуклеотиды синтезировали в автоматизированном ДНК-синтезаторе (Applied Biosystems, модель 380В или 394) при применении стандартной фосфорамидитной химии и окисления с помощью иода (F. Eckstein (ред.) "Oligonukleotides and Analogues, A Pratical Approach", IRL Press, Оксфорд, 1991). Для введения фосфортиоатных мостиков в смешанные фосфортиоат- и фосфодиэфир-олигонуклеотиды вместо иода окисляли с помощью TETD (тетраэтилтиурамдисульфид) или реагента Beaucage. После отщепления от твердого носителя (CPG или тентагель) и удаления защитных групп с помощью концентрированного раствора NH3 при температуре 55°С в течение 18 часов олигонуклеотиды сначала очищали путем осаждения бутанолом (Sawadogo, Van Dyke, Nucl. Acids Res., 19, 674 (1991)). Олигонуклеотиды очищали путем препаративного гель-электрофореза или FPLC. Затем получали натриевую соль путем осаждения из 0,5 М раствора NaCl с помощью 2,5 объемных частей этанола.
Анализ олигонуклеотидов осуществляли путем:
a) аналитического гель-электрофореза в: 20% акриламида, 8 М мочевины, 45 М трис-боратного буфера, рН 7,0; и/или
b) анализа путем высокоэффективной жидкостной хроматографии (ВЭЖХ): Waters GenPak FAX, градиент: СН3CN (400 мл), H2O (1,6 л), NaH2PO4 (3,1 г), NaCl (11,7 г), рН 6,8 (0,1 М NaCl), затем CH3CN (400 мл), Н2O (1,61 л), NaH2PO4 (3,1 г), NaCl (175,3 г), рН 6,8 (1,5 М NaCl); и/или
c) капиллярного гель-электрофореза (Beckmann Kapillare еСАР™, колонка с гелем U100P, длина 65 см, внутренний диаметр 100 мм, "окно" на расстоянии 15 см от одного конца; буфер: 140 мкМ Трис, 360 мМ борной кислоты, 7М мочевины; и/или
d) масс-спектрометрии с ионизацией электронным распылением.
Анализ олигонуклеотида показал, что он, в каждом случае, имеет чистоту выше 90%, чаще всего, однако, выше 95%.
Пример 2
Введение 5'-аминолинкера в олигонуклеотид
Олигонуклеотид конструировали как описано в примере 1. После присоединения последнего нуклеотида отщепляли диметокситритильную группу от 5'-конца. Свободную гидроксильную группу вводили во взаимодействие с коммерчески доступным 5'-амино-модификатором С6 (фирма Eurogentec, Seraing, Бельгия) при катализе с помощью тетразола, окисляли йодной водой. Затем олигонуклеотид отщепляли от носителя путем обработки с помощью концентрированного раствора аммиака при температуре 50°С в течение ночи и отщепляли все основные лабильные защитные группы в межнуклеозидных группах и аминогруппах гетероциклических оснований. На последней стадии отщепляли монометокситритильную защитную группу путем обработки в течение 3 часов с помощью 80%-ной уксусной кислоты при температуре окружающей среды. Полученный в результате олигонуклеотид анализировали, как описано в примере 1.
Пример 3
Конъюгация аминолинкер-олигонуклеотида с FDA-изотиоцианатом
10 OD (260) 5'-Аминолинкер-олигонуклеотида из примера 2 растворяли в 16 мкл 0,2 М триэтиламмонийбикарбонатного (ТВК) буфера и смешивали со 125 мкл диметилформамида (ДМФА). К этой смеси добавляли 1,5 мг FDA-изотиоцианата и смесь затем встряхивали в течение 3 часов в отсутствие света. Достижение превращения определяли путем анализа с помощью ВЭЖХ, затем добавляли 2 мкл 80%-ной уксусной кислоты и концентрировали в вакууме. После этого продукт очищали путем осаждения бутанолом. С помощью масс-спектрометрии с ионизацией электронным распылением устанавливали соответствующую молекулярную массу. Образцы всегда хранили при рН ниже 7, в связи с чем не происходило никакого гидролиза ароматического сложного эфира.
Пример 4
Синтез KO_1 (5'-F3-G*CGAC*GC*CAT*-GAC*G*G-3'; F3=FDA)
Олигонуклеотид конструировали исходя из CPG-носителя, который содержал связанным через 3'-конец 1 мкмоль дезоксигуанозина, как описано в примере 1. В обозначенных знаком * положениях окисление осуществляли с помощью реагента Beaucage, чтобы ввести фосфортиоатный мостик. Затем присоединяли 5'-амино-модификатор С6, как описано в примере 2. После удаления защитных групп с помощью концентрированного раствора аммиака и 80%-ной уксусной кислоты получали 96 OD (260) 5'-аминолинкер-G*CGAC*GC*CAT*GAC*G*G-3'.
10 OD (260) 5'-аминолинкер-олигонуклеотида затем, как описано в примере 3, вводили во взаимодействие с FDA-изотиоцианатом. После осаждения бутанолом получали 8 OD (260) желательного, маркированного с помощью FDA олигонуклеотида.
Масс-спектрометрия (ионизация электронным распылением) для динатриевой соли: 5395,93 (рассчитано для динатриевой соли: 5395,09).
Пример 5
Синтез KO_13 (5'-F3-TATTCCGTCAT-3')
Олигонуклеотид конструировали исходя из CPG-носителя, который содержал связанным через 3'-конец 1 мкмоль тимидина, как описано в примере 1. Все окисления осуществляли с помощью йодной воды. Затем присоединяли 5'-амино-модификатор С6, как описано в примере 2. После удаления защитных групп с помощью концентрированного раствора аммиака и 80%-ной уксусной кислоты получали 72 OD (260) 5'-аминолинкер-TATTCCGTCAT-3'. После очистки путем препаративного электрофореза в полиакриламидном геле получали 43 OD (260).
10 OD (260) 5'-аминолинкер-олигонуклеотида затем, как описано в примере 3, вводили во взаимодействие с FDA-изотиоцианатом. После осаждения бутанолом получали 9,1 OD (260) желательного, маркированного с помощью FDA олигонуклеотида.
Масс-спектрометрия (ионизация электронным распылением): 3934,1 (рассчитанная молекулярная масса: 3933,8).
Пример 6
Синтез KO_21 (5'-F7-A*T*GAC*GGAA*T*T*C)
Олигонуклеотид конструировали исходя из CPG-носителя, который содержал связанным через 3'-конец 1 мкмоль бензоилцитидина, как описано в примере 1. Все окисления осуществляли с помощью йодной воды. Затем присоединяли 5'-амино-модификатор С6, как описано в примере 2. После удаления защитных групп с помощью концентрированного раствора аммиака и 80%-ной уксусной кислоты получали 145 OD (260) 5'-аминолинкер-А*Т*GAC*GGAA*Т*Т*С-3'.
10 OD (260) 5'-аминолинкер-олигонуклеотида затем растворяли в 16 мкл 0,2 М ТВК-буфера, 95 мкл диметилформамида и вводили во взаимодействие с 30 мкл предварительно полученного активного сложного эфира п-ацетоксибензойной кислоты. Активный сложный эфир получали путем смешения 50 мкл 0,2 М раствора п-ацетоксибензойной кислоты с 50 мкл 0,3 М TBTU, соответственно, в диметилформамиде, и реакцию проводили в течение 1 часа при температуре окружающей среды. После протекания в течение 4 часов реакции аминолинкер-олигонуклеотида с активным сложным эфиром добавляли 2 мкл полуконцентрированной уксусной кислоты и концентрировали в вакууме. Избыточный реагент удаляли путем осаждения бутанолом. Получали 10,7 OD (260) желательного олигонуклеотидного конъюгата.
Масс-спектрометрия (ионизация электронным распылением): 4109,2 (рассчитанная молекулярная масса; 4108,2).
Пример 7
Исследование проникновения в клетки олигонуклеотидных конъюгатов
Для исследования проникновения в клетки 1 мл суспензии клеток в камере Bachofer в культуральной среде (или после промывки в забуференном фосфатом физиологическом растворе (PBS) в случае сред с собственной флуоресценцией) при контроле с помощью микроскопа смешивали с 1 мл 1 мкМ раствора олигонуклеотидного конъюгата, причем смешивание осуществляли с помощью пипетки и путем встряхиваний камеры. Микроскопию осуществляли с помощью прибора Zeiss Axiovert 135 TV (100 × Plan-Neofluar) по способу фазового контраста. В качестве флуоресцентного фильтра служили фильтры 09 (450-490/FT 510/LP 520)/HBO 59 W. В качестве стандарта использовали 2,4 мкМ раствор FDA (Aldrich Chem. Co., FW.416.39) в смеси ацетон/ PBS-буффер (1:100; объем/объем). В случае FDA-конъюгатов после проникновения можно прослеживать собственную флуоресценцию образовавшегося за счет расщепления сложного эфира флуоресцеинового лиганда. В случае нефлуоресцирующих лигандов, как ацетоксинафталинкарбоновая кислота, к олигонуклеотиду дополнительно присоединяли пригодную флуоресцентную метку (FITC, родамин, цианиновый краситель Dy 3 или Dy 5). Двойная маркировка, как в KO_9, служила для того, чтобы показать, что FDA не отщеплен от олигонуклеотида. Отдельные образцы оценивали спустя 2-120 минут после добавления олигонуклеотидного конъюгата. В случае REH-клеток флуресценцию отчетливо распознавали спустя 5-10 минут, в случае К562 и адгезивных клеток, а также клеток насекомых, происходило некоторое увеличение еще вплоть до 60 минут после добавления. В случае свободноживущих простейших проникновение продолжалось вплоть до 1 часа. В случае дрожжей проникновение происходило лишь после более продолжительного периода времени и негомогенно во все клетки. В споры грибков FDA-олигонуклеотидные конъюгаты проникали лучше, чем в клетки гиф. Результаты представлены в таблицах 1-3.
Пример 8
Исследование антипролиферативного действия олигонуклеотидных конъюгатов
REH-клетки (человеческая пре-В-клеточная лейкемия, DSM АСС 22) или опухолевые клетки А549 культивировали в оптимальной минимальной поддерживающей среде (OptiMEM) с 10% фетальной телячьей сыворотки (FKS; GIBCO-BRL) при температуре 37°С в присутствии 5% CO2. За день до начала опыта клетки пересевали таким образом, что спустя 24 часа могли достигать концентрации клеток примерно 1×106/мл. Олигонуклеотиды, соответственно, их конъюгаты, растворяли в дистиллированной воде с получением 1 мМ исходных растворов и хранили в холодильнике при температуре -20°С. Осуществляли посев клеток (1×106 клеток/мл в OptiMEM с 10% FKS) в 24-луночные планшеты. Для исследования олигонуклеотидные производные разводили до концентрации 2 мкМ (в OptiMEM без FKS). На одну лунку смешивали 100 мкл раствора олигонуклеотида и 100 мкл суспензии клеток (общий объем 200 мкл на лунку; концентрация олигонуклеотида 1 мкМ; концентрация сыворотки 5% FKS; концентрация клеток 0,5×106 клеток на мл). После инкубации в течение 4 часов при температуре 37°С и в присутствии 5% СО2 на лунку добавляли 800 мкл OptiMEM с 11% FKS (концентрация клеток теперь 1×105 клеток/мл; концентрация сыворотки теперь 10% FKS) и инкубировали дальше. После инкубации в течение 96 часов при температуре 37°С и в присутствии 5% CO2 определяли концентрацию клеток в Сазу 1 (фирма Schärfe). Для этого клетки в каждой лунке перемешивали путем 10-кратного всасывания и выдувания с помощью пипетки (1000 er) и тотчас разводили в соотношении 1:100 (при более сильном росте клеток в соотношении 1:200) с помощью Casyton. Определение средней величины плотности клеток осуществляли, соответственно, из трех идентично составленных образцов тестируемой смеси.
Пример 9
Синтез 5'-F4'(CO-NH)-A*T*GAC*GGAA*T*T*C
Олигонуклеотид конструировали исходя из CPG-носителя, который содержал связанным через 3'-конец 1 мкмоль N4-бензоилцитидина, как описано в примере 1. Окисления осуществляли с помощью йодной воды, соответственно, реагента Beaucage, для введения фосфортиоатного остатка (когда имеется знак * в последовательности). Затем присоединяли 5'-амино-модификатор С6, как описано в примере 2. После удаления защитных групп с помощью концентрированного раствора аммиака и 80%-ной уксусной кислоты получали 145 OD (260) 5'-аминолинкер-А*Т*GAC*GGAA*Т*Т*С-3'.
10 OD (260) 5'-аминолинкер-олигонуклеотида затем растворяли в 16 мкл 0,2 М ТВК-буфера, 95 мкл диметилформамида и вводили во взаимодействие с 12,5 мкл дихлорфлуоресцеиндиацетатгидроксисукцинимида (молекулярная масса: 626,36). После протекания в течение 3 часов реакции аминолинкер-олигонуклеотида с гидроксисукцинимидом добавляли 2 мкл полуконцентрированной уксусной кислоты и концентрировали в вакууме. После обессоливания через NAP-колонку™ (Pharmacia) осуществляли осаждение бутанолом. Получали 2,8 OD (260) желательного конъюгата олигонуклеотид-дихлорфторфлуоресцеиндиацетат.
Масс-спектрометрия (ионизация электронным распылением): 4403,3 (рассчитанная молекулярная масса: 4403,2).
Пример 10
Синтез 5'-F2'-(CO-NH)-A*T*GAC*GGAA*T*T*C
Олигомер 5'-аминолинкер-А*Т*GAC*ССАА*Т*Т*С-3' получали, как описано в примере 9. 10 OD (260) 5'-аминолинкер-олигонуклеотида растворяли в 16 мкл 0,2 М ТВК-буфера, 95 мкл диметилформамида и вводили во взаимодействие с 12,5 мкл карбоксифлуоресцеиндипивалатгидроксисукцинимида (молекулярная масса: 641,64). После протекания в течение 2 часов реакции аминолинкер-олигонуклеотида с гидроксисукцинимидом добавляли еще раз 12,5 мкл гидроксисукцинимида и оставляли реагировать в течение следующих двух часов. Затем добавляли 2 мкл полуконцентрированной уксусной кислоты и концентрировали в вакууме. После обессоливания через NAP-колонкуTM (Pharmacia) осуществляли осаждение бутанолом. Получали 8,1 OD (260) желательного конъюгата олигонуклеотид-флуоресцеиндипивалат.
Масс-спектрометрия (ионизация электронным распылением): 4472,9 (рассчитанная молекулярная масса: 4471,6).
Пример 11
Синтез 5'-F9-A*T*GAC*GGAA*T*T*C
Олигомер 5'-аминолинкер-А*Т*GAC*GGAA*T*T*C-3' получали, как описано в примере 9. 10 OD (260) 5'-аминолинкер-олигонуклеотида растворяли в 16 мкл 0,2 М ТВК-буфера, 95 мкл диметилформамида и вводили во взаимодействие с 25 мкл активного эфира ацетоксинафтилкарбоновой кислоты. Активный сложный эфир получали путем смешения 12,5 мкл 0,2 М раствора ацетоксинафтилкарбоновой кислоты (2,5 мг в 50 мкл диметилформамида) с 12,5 мкл TBTU (4 мг в 50 мкл диметилформамида) и реакцию проводили в течение 1 часа при температуре окружающей среды. После протекания в течение 17 часов реакции аминолинкер-олигонуклеотида с активным сложным эфиром добавляли 2 мкл полуконцентрированной уксусной кислоты и концентрировали в вакууме. После обессоливания через NAP-колонкуTM (Pharmacia) осуществляли осаждение бутанолом. Получали 8,5 OD (260) желательного олигонуклеотид-ацетоксинафтильного конъюгата.
Масс-спектрометрия (ионизация электронным распылением): 4158,2 (рассчитанная молекулярная масса: 4157,2).
Пример 12
Синтез 5'-F8-A*T*GAC*GGAA*T*T*C
Олигомер 5'-аминолинкер-А*Т*GAC*GGAA*Т*Т*С-3' получали, как описано в примере 9. 10 OD (260) 5'-аминолинкер-олигонуклеотида растворяли в 16 мкл 0,2 М ТВК-буфера, 95 мкл диметилформамида и вводили во взаимодействие с 25 мкл активного эфира ацетоксикумаринкарбоновой кислоты. Активный сложный эфир получали путем смешения 12,5 мкл 0,2 М раствора ацетоксикумаринкарбоновой кислоты (2,7 мг в 50 мкл диметилформамида) с 12,5 мкл TBTU (4 мг в 50 мкл диметилформамида) и реакцию проводили в течение 1 часа при температуре окружающей среды. После протекания в течение 17 часов реакции аминолинкер-олигонуклеотида с активным сложным эфиром добавляли 2 мкл полуконцентрированной уксусной кислоты и концентрировали в вакууме. После обессоливания через NAP-колонкуTM (Pharmacia) осуществляли осаждение бутанолом. Получали 8,0 OD (260) желательного олигонуклеотид-ацетоксикумаринового конъюгата.
Масс-спектрометрия (ионизация электронным распылением): 4178,5 (рассчитанная молекулярная масса: 4175,2).
Пример 13
Синтез 5'-F3-(dA)ndA*dA*dA (n=17, 47 и 77; F3=FDA)
Олигонуклеотиды конструировали исходя из CPG-носителя, который был дериватизирован по 3'-концу с помощью N6-бензолил-2'-дезоксиаденозина, как описано в примере 1. Окисления после первых обоих связываний осуществляли с помощью реагента Beaucage для введения фосфортиоатных остатков (в последовательности обозначено меткой *), все остальные окисления осуществляли с помощью йодной воды. Затем присоединяли 5'-амино-модификатор С6, как описано в примере 2. После удаления защитных групп с помощью концентрированного раствора аммиака и 80%-ной уксусной кислоты и очистки путем препаративного электрофореза в полиакриламидном геле получали 2,95 OD (260) 5'-аминолинкер-(dA)17dA*dA*dA, 4,9 OD (260) 5'-аминолинкер-(dA)47dA*dA*dA и 5 OD (260) 5'-аминолинкер-(dA)77dA*dA*dA.
5'-Аминолинкер-олигонуклеотиды, соответственно, растворяли в 8 мкл 0,2 М ТВК-буфера, 62 мкл диметилформамида и вводили во взаимодействие с 1,6 мкл FDA-изотиоцианата. После протекания в течение 3 часов реакции добавляли дальнейший FDA-изотиоцианат и оставляли реагировать еще в течение 2 часов. Затем добавляли 2 мкл полуконцентрированной уксусной кислоты и концентрировали в вакууме. После обессоливания через NAP-колонкуTM (Pharmacia) осуществляли осаждение бутанолом. Получали 1,5 OD (260) 5'-F3-(dA)17dA*dA*dA, 2,2 OD (260) 5'-F3-(dA)47dA*dA*dA и 0,9 OD (260) 5'-F3-(dA)77dA*dA*dA.
Пример 14
Синтез двукратно маркированного олигонуклеотида 5'-Сy3-A*T*GAC*GGAA*T*T*C-C6-F3 (F3=FDA)
Олигонуклеотид конструировали исходя из CPG-носителя, который позволяет вводить С6-аминолинкер в 3'-конец (Petrie и др., Bioconjugate Chem., 3, 85-87 (1992)), как описано в примере 1. Окисления осуществляли с помощью йодной воды, соответственно, реагента Beaucage, для введения фосфортиоатного остатка (когда в последовательности имеется метка *). После отщепления последней диметокситритильной защитной группы 5'-конец олигонуклеотида вводили во взаимодействие с Су3-СЕ-фосфорамидитом (фирма Glen Research, Sterlin, VA; номер по каталогу 10-5913-хх) и окисляли с помощью йодной воды. После удаления защитных групп с помощью концентрированного раствора аммиака (2 часа при температуре 70°С) получали 64 OD (260) сырого продукта. После очистки путем препаративного электрофореза в полиакриламидном геле получали 3,8 OD 5'-Сy3-А*Т*GAC*GGAA*Т*Т*С-С6-аминолинкер-3'. Из них 3,5 OD (260) растворяли в 8 мкл 0,2 М ТВК-буфера, 62 мкл диметилформамида и вводили во взаимодействие с 1,6 мкмоль FDA-изотиоцианата. После реакции в течение 3,5 часов аминолинкер-олигонуклеотида с гидроксисукцинимидом добавляли 1 мкл полуконцентрированной уксусной кислоты и концентрировали в вакууме. После обессоливания через NAP-колонкуTM (Pharmacia) осуществляли осаждение бутанолом. Получали 3,5 OD (260) желательного, двукратно маркированного олигонуклеотида 5'-Cy3-A*T*GAC*GGAA*T*T*C-C6-F3.
Масс-спектрометрия (ионизация электронным распылением): 4926,2 (рассчитанная молекулярная масса: 4927,1).
Пример 15
Синтез 5'-F3-A*T*GAC*GGAA*T*T*C (F3=FDA)
Олигомер 5'-аминолинкер-А*Т*GAC*GGAA*Т*Т*С-3' получали, как описано в примере 9. 10 OD (260) 5'-аминолинкер-олигонуклеотида растворяли в 16 мкл 0,2 М ТВК-буфера, 95 мкл диметилформамида и вводили во взаимодействие с 25 мкл FDA-изотиоцианата (5 мг в 100 мкл диметилформамида). После протекания в течение 3 часов реакции аминолинкер-олигонуклеотида с изотиоцианатом добавляли еще раз 5 мкл изотиоцианата и оставляли реагировать в течение следующих двух часов. Затем добавляли 2 мкл полуконцентрированной уксусной кислоты и концентрировали в вакууме. После обессоливания через NAP-колонкуTM (Pharmacia) осуществляли осаждение бутанолом. Получали 8,5 OD (260) желательного конъюгата олигонуклеотид-флуоресцеиндиацетат.
Масс-спектрометрия (ионизация электронным распылением): 4418,4 (рассчитанная молекулярная масса: 4418,5).
Пример 16
Сравнение проникновения в клетки олигонуклеотидных конъюгатов различной длины 5'-F3-(dA)ndA*dA*dA (n=17, 47 и 77; F3=FDA)
Определение проникновения в клетки конъюгатов различной длины и различной молекулярной массы, полученных согласно примеру 12, осуществляли, в принципе, как описано в примере 7 с REH-клетками. Определение количества осуществляли с помощью проточного цитометра. Спустя 60 минут относительные сигналы флуоресценции: для 5'-F3-(dA)17dA*dA*dA ("А20") равен 49; для 5'-F3-(dA)47dA*dA*dA ("А50") равен 34; и для 5'-'F3-(dA)77dA*dA*dA ("А80") равен 91. FDA-Конъюгат с самой большой олигонуклеотидной частью, состоящей из, в целом, 80 нуклеотидов, неожиданно наиболее эффективно проникал в REH-клетки.
Пример 17
Сравнение проникновения в клетки олигонуклеотидных конъюгатов с различной дериватизацией
Родственным флуоресцеиндиацетату (FDA) соединением является флуоресцеиндипивалат, который отличается повышенной устойчивостью сложноэфирных групп. Соответствующие олигонуклеотидные конъюгаты исследовали в проточном цитометре в отношении их проникновения в клетки. Более высокая устойчивость пивалата по отношению к щелочам и эстеразам приводит к уменьшенному проникновению в клетки соответствующего олигонуклеотидного конъюгата. Так, измеренная относительная флуоресценция для флуоресцеиндиацетатного конъюгата спустя 60 минут равна 195, в то время как для соответствующего флуоресцеиндипивалатного конъюгата она составляет только 55.
Пример 18
Исследование проникновения в клетки двукратно маркированного олигонуклеотидного конъюгата 5'-Cy3-A*T*GAC*GGAA*T*T*C-C6-FDA, полученного в примере 13
При исследовании в клеточном сортере с возбуждением флуоресценции (FACScan) обнаружено быстрое проникновение Сy3-олигонуклеотид-F3-конъюгата в REH-клетки. Обработка клеток с помощью комплекса олигонуклеотидный конъюгат/клеточный фектин приводит к подобному, однако, отчетливо более неравномерному проникновению. При этом на эффект FDA-конъюгата отчетливо накладывается эффект комплекса клеточный фектин-олигонуклеотид.
Далее нужно было исследовать совместную локализацию обоих различных групп маркеров в олигонуклеотиде при инкубации с клетками, чтобы исключить, что измеренная флуоресценция основана только на отщепленном FDA, соответственно, флуоресцеине. Сy3-Олигонуклеотид-F3-конъюгат содержал ковалентно связанными с 5'-концом цианиновый краситель и с 3'-концом FDA. На фиг.9 показана зеленая и красная флуоресценция после инкубации в течение 4 часов REH-клеток с Сy3-олигонуклеотид-F3-конъюгатом. Так как нужно наблюдать совместную локализацию обоих маркеров в клетках, нужно исходить из того, что олигонуклеотид проник в интактной форме. Гидролизу подверглись только ацетильные группы FDA-части, вероятно, с помощью эстераз, так как нефлуоресцирующий FDA-остаток, очевидно, превратился в флуоресцирующий флуоресцеиновый остаток. Проникновение Сy3/FDA-конъюгата произошло очень быстро, так как оба маркера смогли обнаружить уже спустя 7 минут после добавления.
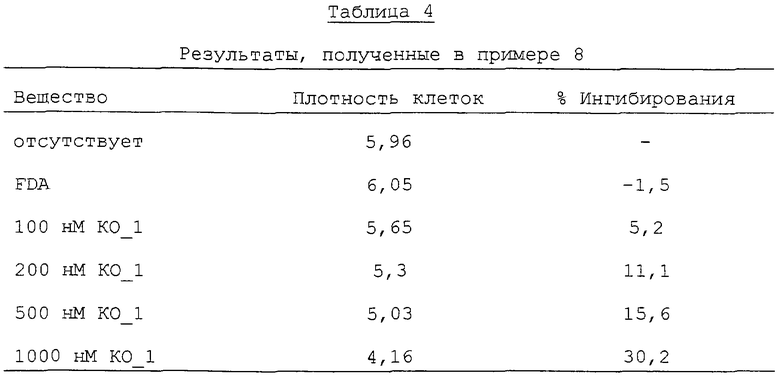
Олигонуклеотид-FDA-конъюгат KO_1 из примера 4 тестировали при четырех концентрациях на антипролиферативное действие в отношении опухолевых клеток А549. Пролиферацию ингибировали без добавления усилителя пенетрации. Соответствующий олигонуклеотид без F3-конъюгата (ON1) ингибирует пролиферацию только после комплексообразования с усилителем пенетрации (клеточный фектин, фирма Gibco-BRL). Результаты представлены в таблице 4.
где:
А: инкубация с маркированными с помощью FDA олигонуклеотидами KO_1 и KO_3
В: инкубация с маркированными флуоресцеином олигонуклеотидами KO_2 и KO_4
(+) слабое проникновение
+ средней силы проникновение
++ очень сильное проникновение
- никакого проникновения
* проникновение только в поврежденные клетки





























| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОТБОРА И ПОЛУЧЕНИЯ СЕЛЕКТИВНЫХ И МУЛЬТИСПЕЦИФИЧЕСКИХ ТЕРАПЕВТИЧЕСКИХ МОЛЕКУЛ С ЗАДАННЫМИ СВОЙСТВАМИ, ВКЛЮЧАЮЩИХ ПО МЕНЬШЕЙ МЕРЕ ДВЕ РАЗЛИЧНЫЕ НАЦЕЛИВАЮЩИЕ ГРУППИРОВКИ, И ИХ ПРИМЕНЕНИЯ | 2013 |
|
RU2644263C2 |
| НАНОКОМПОЗИТЫ ДИОКСИДА ТИТАНА ДЛЯ ИНАКТИВАЦИИ ВИРУСНОГО ГЕНОМА ВНУТРИ КЛЕТОК, СПОСОБ ИХ ПОЛУЧЕНИЯ | 2008 |
|
RU2444571C2 |
| КАТИОННЫЕ ОЛИГОНУКЛЕОТИДЫ, АВТОМАТИЗИРОВАННЫЕ СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ | 2006 |
|
RU2451022C2 |
| ОЛИГОНУКЛЕОТИДЫ ДЛЯ ИНГИБИРОВАНИЯ ЭКСПРЕССИИ EG5 ЧЕЛОВЕКА | 2000 |
|
RU2249458C2 |
| НАНОКОМПОЗИТ С АКТИВНЫМ ЛИГАНДОМ, СПОСОБ ЕГО ПРИГОТОВЛЕНИЯ И СПОСОБ АДРЕСНОЙ ИНАКТИВАЦИИ ВИРУСА ГРИППА ВНУТРИ КЛЕТКИ | 2012 |
|
RU2496878C1 |
| ПОЛИМЕРНЫЕ ОЛИГОНУКЛЕОТИДНЫЕ ПРОЛЕКАРСТВА | 2004 |
|
RU2394041C2 |
| СОЕДИНЕНИЯ И СПОСОБЫ ТРАНСМЕМБРАННОЙ ДОСТАВКИ МОЛЕКУЛ | 2016 |
|
RU2756569C1 |
| Химическое соединение с триазиновой группой и способ его получения | 2020 |
|
RU2799452C2 |
| ДОСТАВКА НУКЛЕИНОВЫХ КИСЛОТ | 1995 |
|
RU2160278C2 |
| СПОСОБ ПОЛУЧЕНИЯ ДНК-ЧИПОВ | 2003 |
|
RU2236467C1 |
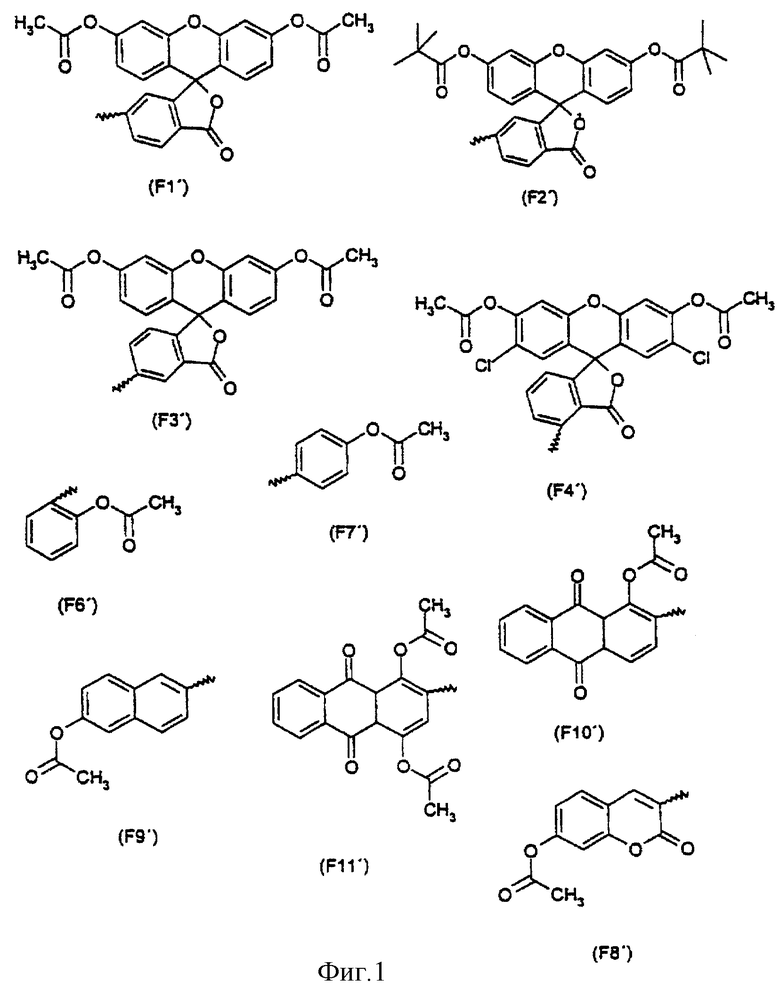
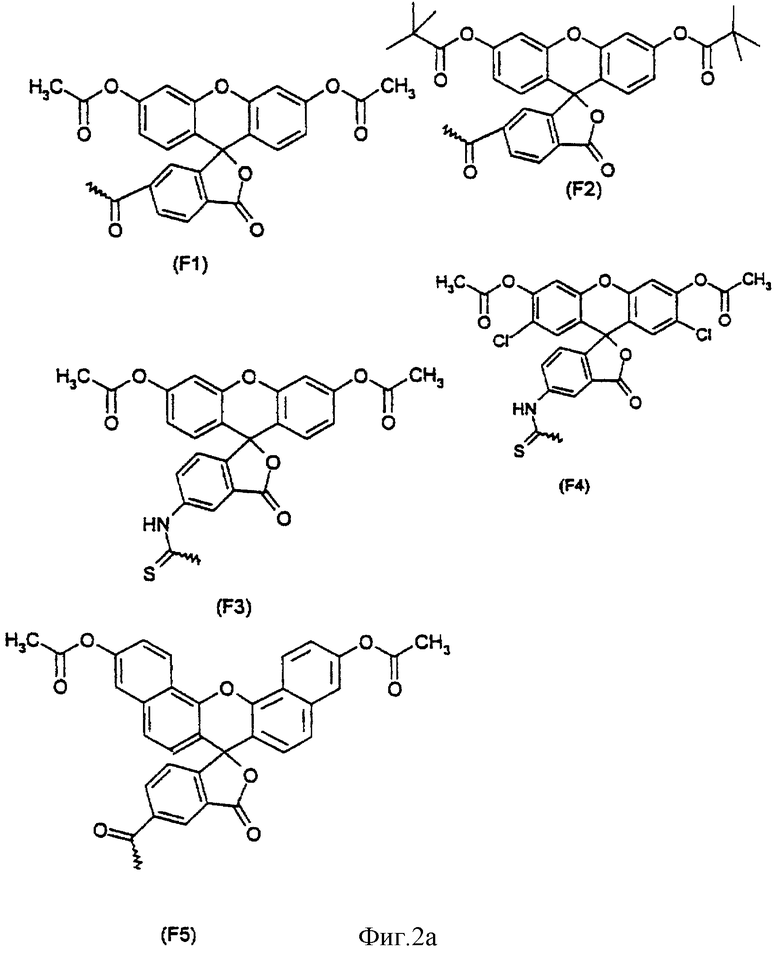
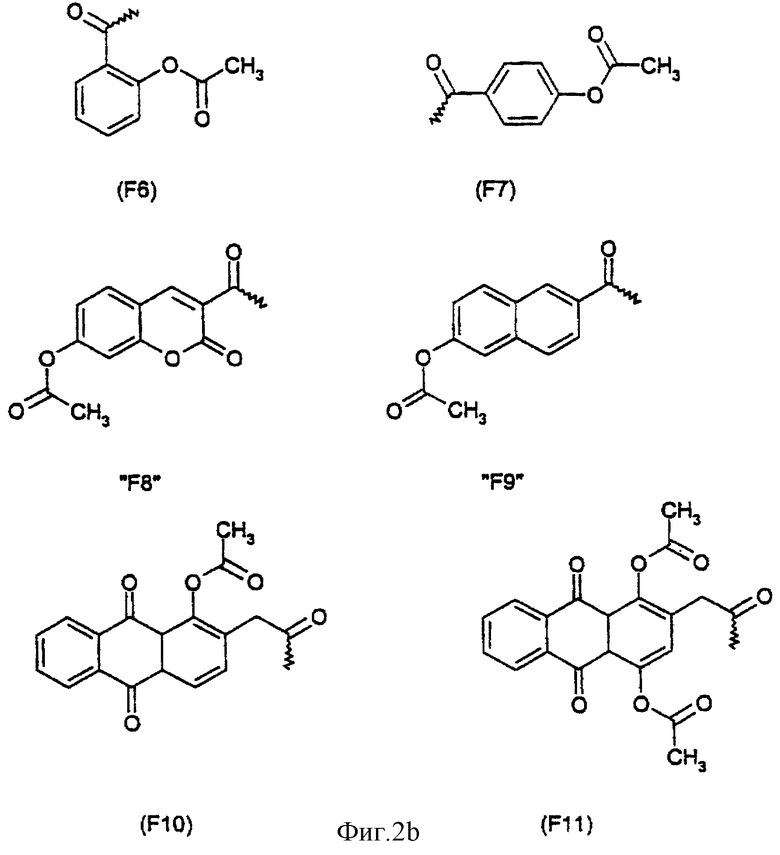
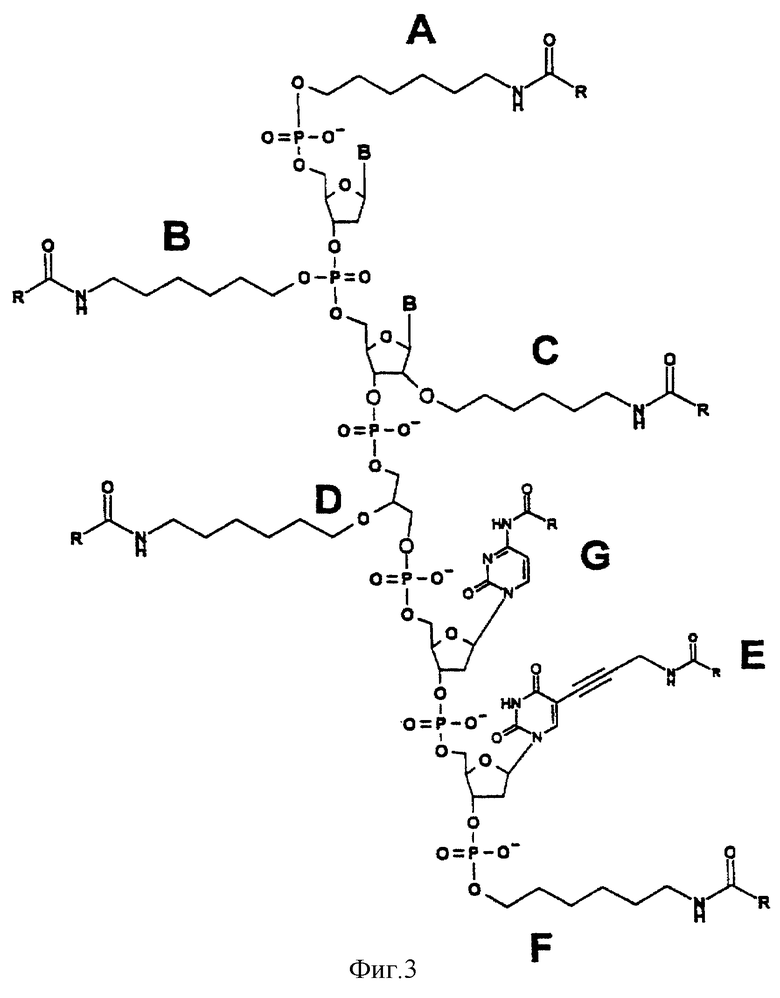
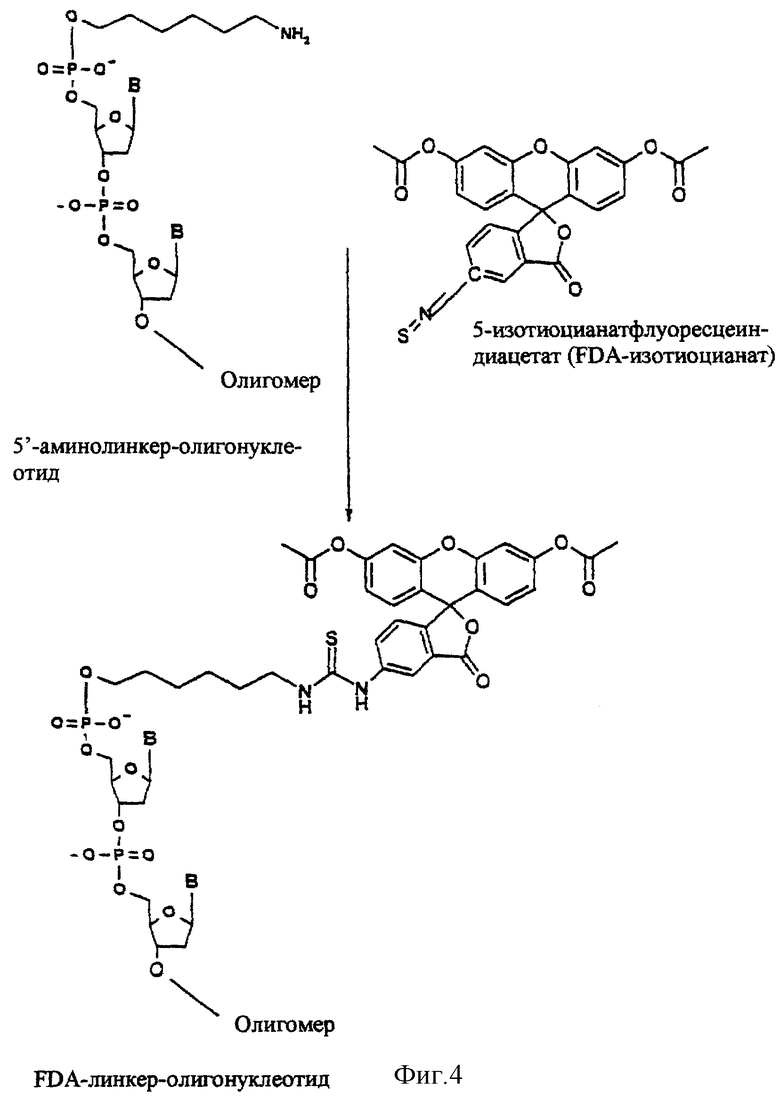
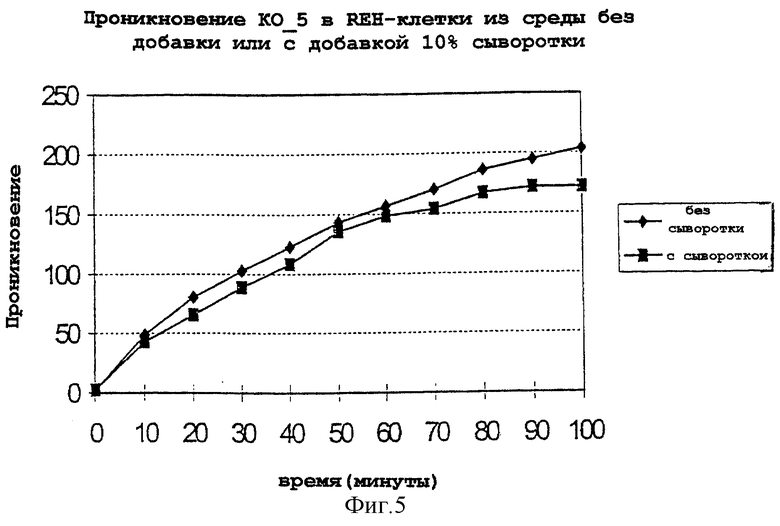
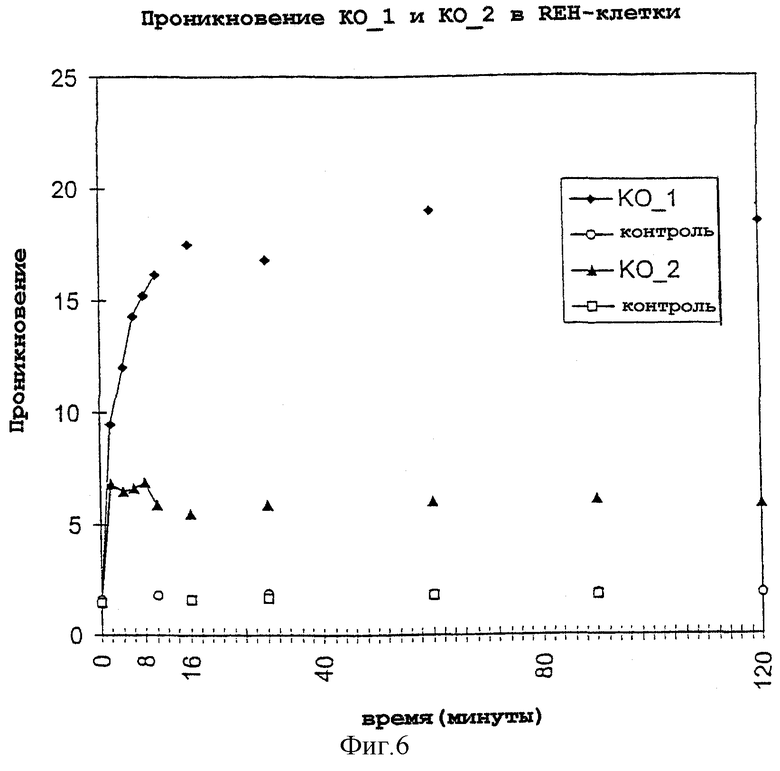
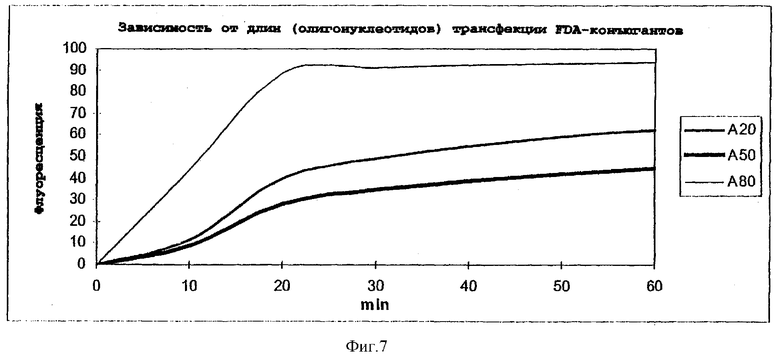
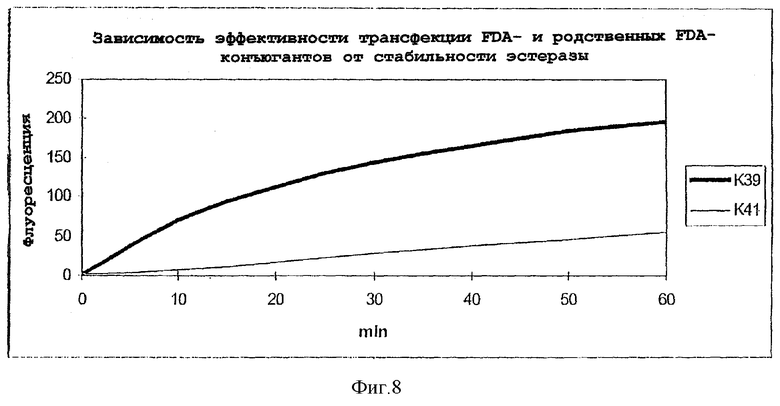
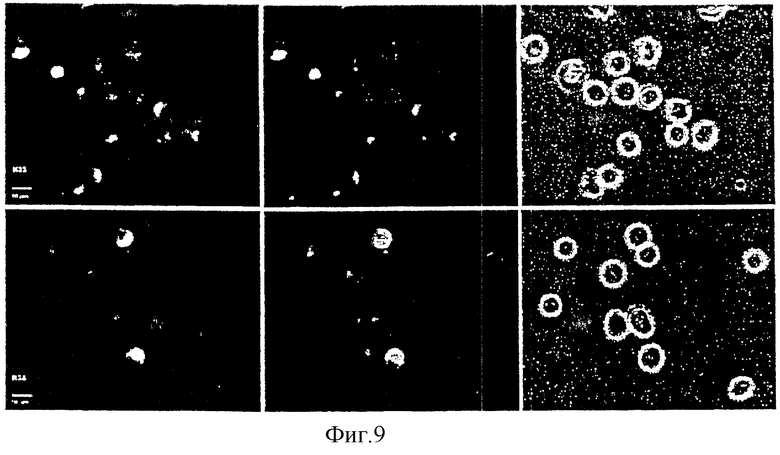
Изобретение относится к области медицины и касается конъюгатов, состоящих из транспортируемой через биологические мембраны молекулы, представляющей собой биополимер, пептид-нуклеиновую кислоту или полиамид, и арильного остатка, используемых для лечения заболеваний, обусловленных сверхпродуцированием определенных генов, способа их получения, способа транспорта молекулы через биологическую мембрану, лекарственного средства, способа получения лекарственного средства, диагностического средства и тест-набора на основе указанного конъюгата. 9 н. и 12 з.п. ф-лы, 9 ил., 6 табл.
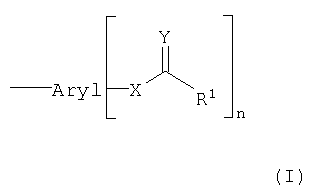
причем арил означает фенил, пиридил, пиримидил, пирролил, фуранил, тиофенил, 5-членный лактон, 6-членный лактон, спиролактон, бензохинон, циклогексадиенил или циклогексенил или циклическую систему, состоящую из 1-8 циклов;
Х означает О или N;
Y означает О, S или NH-R2;
R1 означает замещенный или незамещенный (С1-С23)-алкильный остаток, который может быть линейным или разветвленным и может содержать двойные и/или тройные связи;
R2 означает замещенный или незамещенный (C1-C18)-алкильный остаток, который может быть линейным или разветвленным и может содержать двойные и/или тройные связи; и
n 1 или 2,
при этом транспортируемая молекула представляет собой биополимер или пептид-нуклеиновую кислоту, или полиамид, который содержит три ароматических цикла: имидазол, пиррол и гидроксипиррол, с молекулярной массой ≤500 Дальтон или представляет собой мононуклеотид или олигонуклеотид с молекулярной массой ≤500 Дальтон,
причем арильный остаток связан с транспортируемой молекулой либо непосредственно через химическую связь, либо опосредованно через химическую группу; причем химическая группа не является СН2-S-группой, когда связывание транспортируемой молекулы происходив через межнуклеотидфосфодиэфирную связь.
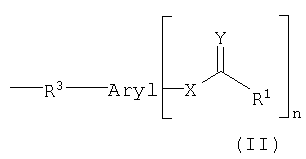
причем арил, X, Y и R1 имеют указанное выше значение;
R3 означает химическую группу, предпочтительно группу 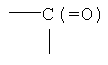 или группу
или группу 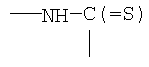 .
.
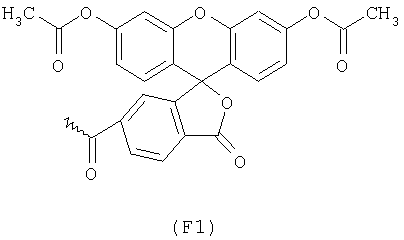
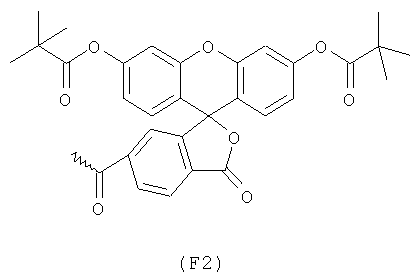
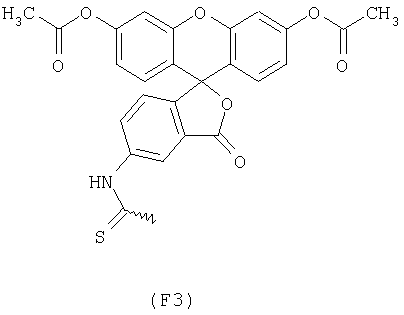
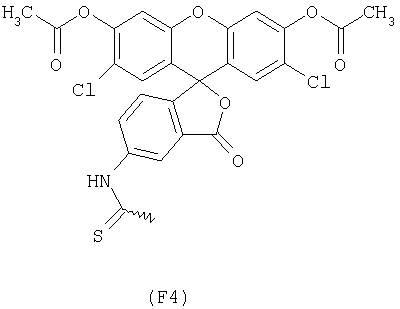
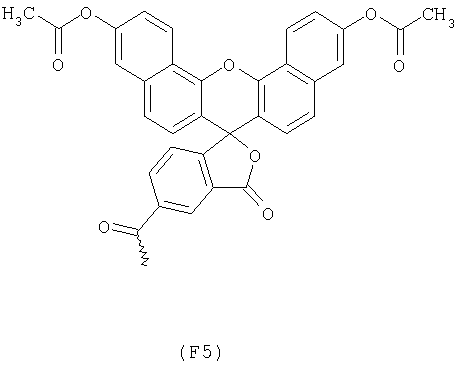
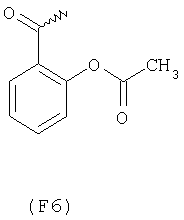
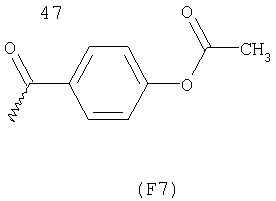
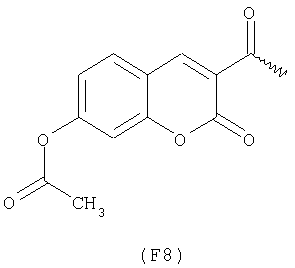
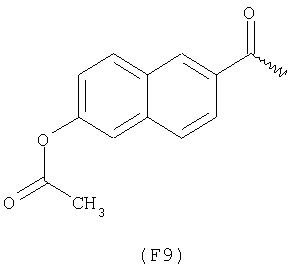
a) полинуклеотида, олигонуклеотида или мононуклеотида и
b) одного или нескольких арильных остатков формулы (I), где арильный остаток (арильные остатки) либо непосредственно через химическую связь, либо опосредованно через химическую группу связан (связаны) с 5'-концом, и/или 3'-концом, и/или одни-м или несколькими нуклеозидными основаниями, и/или одним или несколькими остатками сахаров, и/или одним или несколькими межнуклеозидными связями, причем химическая группа не является CH2-S-группой, если связывание происходит через межнуклеотидфосфодиэфирную связь.
| RU, 2127606, С1, 20.03.1999 | |||
| RU, 2094059, C1, 27.10.1997 | |||
| RU, 2113485, С1, 20.08.1998 | |||
| Прибор для очистки паром от сажи дымогарных трубок в паровозных котлах | 1913 |
|
SU95A1 |
Авторы
Даты
2006-05-10—Публикация
2000-07-20—Подача