Область техники, к которой относится изобретение
Настоящее изобретение относится, в основном, к генетическому заболеванию, наблюдаемому у представителей крупного рогатого скота, которое называется комплексной вертебральной мальформацией (CVM). Более конкретно, изобретение относится к молекулярным маркерам для идентификации потенциальных носителей рецессивного гена CVM у крупного рогатого скота и для идентификации местоположения гена CVM и его мутаций, ответственных за комплексную вертебральную мальформацию у крупного рогатого скота.
Предпосылки создания изобретения
Комплексная вертебральная мальформация (CVM) является наследственным вертебральным нарушением, выявленным у крупного рогатого скота молочного направления голштино-фризской (HF) породы черной и белой окраски. Это заболевание было недавно описано (Agerholm и соав., 2000). В Дании, все случаи, выявленные к настоящему времени (17 октября 2000 года), связывают генетически с первым племенным быком Carlin-M Ivanhoe Bell элитной голштинной породы из США. Согласно существующим данным, CVM выступает в качестве наследственного аутосомного рецессивного заболевания.
Заболевание характеризуется врожденным билатеральным симметричным артрогрипозом периферических суставов и мальформациями позвоночника, в основном, в шейно-грудном соединении, в сочетании с пониженным весом тела (Agerholm и соав., 1994).
Формально, имеются следующие важные свидетельства: во многих случаях шейная и/или грудная часть позвоночника является короткой. Умеренное билатеральное симметричное сокращение запястьевых суставов и значительное сокращение и супинация фаланго-пястного сустава (путового сустава) являются установленными фактами. Контракция и пронация фаланго-метатарзального сустава и слабое удлинение предплюсны также являются общеизвестными фактами. В большинстве случаев наблюдается неправильное направление позвоночника вблизи шейно-грудного соединения. В одних областях позвоночника может наблюдаться сколиоз, а в других областях позвоночника может присутствовать поражение ткани. Неправильное направление позвоночника часто выявляют путем исследования и пальпации позвоночника в месте расположения вентральной области. Однако поражения могут быть минимальными и ограничиваться до двух или нескольких позвонков. В таких случаях позвоночник может быть почти нормальной длины. Следовательно, рекомендуется радиологическое исследование позвоночника для исключения вертебральных мальформаций в тех случаях, когда имеется подозрение. То, что спиной мозг имеет нормальные размеры, обязано вертебральному каналу, который не имеет очевидных сокращений. Путем использования радиологии выявляют различные стадии комплексных вертебральных мальформаций, состоящих из полупозвонков, сращенных позвонков и позвонков, имеющих нарушенную форму, сколиоза и анкилоза. Это наилучшим образом демонстрируется последующим удалением дуговых позвонков. В некоторых случаях имеют место мальформации сердца, в основном в виде дефекта межжелудочковой перегородки и эксцентрической гипертрофии правого желудочка сердца. Могут появляться и мальформации больших сосудов. В легких присутствует фетальный ателектаз. Серозно-геморрагические жидкости присутствуют, в основном, в полости грудной клетки. Было отмечено множество других мальформаций, но они не представляли постоянных или обычных случаев. Часто обнаруживают нарушения, обусловленные дистоцией.
Мальформации наблюдаются в недоношенных плодах, как рожденных недоношенными телятах, так и мертворожденных телятах, рожденных в срок. Мальформации среди более взрослых телят еще не наблюдались. В основном, вес тела пониженный, и вес тела у телят, рожденных недоношенными, является более низким по сравнению с весом телят, рожденных в срок.
Кроме того, похоже, что наблюдается увеличение выкидышей у коров, осемененных спермой быков, являющихся носителями рецессивного гена. В настоящее время причина этого неизвестна.
На сегодняшний день, единственным средством доступным для диагноза CVM является патоанатомический диагноз на основе вышеописанного присутствия билатерального симметричного артрогрипоза периферических суставов и мальформаций позвоночника, в основном, в шейно-грудном соединении, в сочетании с пониженным весом тела. Однако, симметричные сокращения конечностей являются обычными и главными явлениями при вертебральных мальформациях у телят. Следовательно, существуют проблемы дифференциального диагноза, поскольку часто трудно установить различие между CVM и другими мальформациями.
Тот факт, что генетический дефект, похоже, распространяется за счет племенного быка Carlin-M Ivanhoe Bell, которого интенсивно использовали по всему миру, делает в значительной степени экономически важной необходимость исследовать, являются ли используемые в настоящее время или потенциальные племенные быки носителями дефекта.
Для того, чтобы получить оценку частоты появления животных, являющихся потенциальными носителями CVM среди популяции крупного рогатого скота Дании, авторы настоящего изобретения извлекли информацию относительно родословной по крупному рогатому скоту из датской национальной базы данных. За время этого извлечения (октябрь 2000 года) было зарегистрировано 919916 породистых коров и телок и 169821 породистых быков и телят самцов. Bell нарушение было обнаружено 707915 раз в родословных коров и телок и 161043 раза в родословных самцов. Ниже в Таблицах 1 и 2 показано количество случаев появления Bell нарушения в каждом поколении родословных.
Хотя эти величины включают также некоторое количество появления двойных и тройных Bell нарушений в родословных, данные ясно показывают, что большая часть крупного рогатого скота голштинной породы Дании являются потенциальными носителями рецессивного гена CVM. Очевидно, что проблема является необозримой в глобальном масштабе.
Таким образом, существует настоятельная потребность в индустрии крупного рогатого скота в генетическом тесте для того, чтобы осуществлять идентификацию представителей крупного рогатого скота различных пород, которые являются потенциальными носителями рецессивного гена CVM (например, до регистрируемого начала клинических симптомов).
До настоящего изобретения, микросателлитное картирование не применялось по отношению к гену, вызывающему вышеописанные комплексные вертебральные мальформации, которые не были выделены или охарактеризованы. Таким образом, для наилучшего понимания авторов изобретения, следует сказать, что способ диагностики согласно изобретению, описанный подробно ниже, не был ранее предложен или раскрыт.
Соответственно, настоящее изобретение, которое включает картирование локуса гена, вызывающего заболевание связанное с CVM, предусматривает тест ДНК на основе микросателлитных маркеров, расположенных на хромосоме ВТАЗ крупного рогатого скота. Способность теста определять статус носителя рецессивного гена животных, происходящих от племенного быка Bell, была подтверждена, что явствует из примеров, приводимых ниже.
Краткое описание изобретения
В своем наиболее широком аспекте, настоящее изобретение обеспечивает способ для детектирования присутствия в организме особи крупного рогатого скота генетического маркера, связанного с комплексной вертебральной мальформацией (CVM) крупного рогатого скота, включающий этапы обеспечения генетического материала крупного рогатого скота, и детектирование в генетическом материале присутствия или отсутствия, по меньшей мере, одного генетического маркера, который связывают с проявлением признаков заболевания комплексной вертебральной мальформацией крупного рогатого скота, или со специфичным нуклеотидным полиформизмом, который является причиной проявления признаков заболевания комплексной вертебральной мальформацией.
В другом аспекте, изобретение имеет отношение к диагностическому набору, который используют при детектировании присутствия в организме особи крупного рогатого скота, по меньшей мере, одного генетического маркера, связанного с комплексной вертебральной мальформацией (CVM) крупного рогатого скота, включающему, по меньшей мере, одну олигонуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO: 10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO: 13, SEQ ID NO: 14, SEQ ID NO: 15, SEQ ID NO: 16, SEQ ID NO: 33, SEQ ID NO: 34, SEQ ID NO: 35, SEQ ID NO: 36, SEQ ID NO: 37 и SEQ ID NO: 38, и их комбинаций. Кроме того, изобретение относится к способу диагностики, включающему диагностический набор для детектирования G/T полиморфизма в гене SLC35A3 крупного рогатого скота, являющемся каузальным и диагностическим для CVM у крупного рогатого скота.
Эти и другие варианты и преимущества настоящего изобретения будут более ясны специалистам при рассмотрении нижеследующих подробного описания, формулы изобретения и приложенных чертежей, на которых:
Фиг.1 представляет родословную, используемую для определения местоположения локуса комплексной вертебральной мальформации (CVM) крупного рогатого скота и гаплотипов пяти микросателлитных маркеров на хромосоме 3 крупного рогатого скота. Наиболее вероятные гаплотипы CVM показывают жирным шрифтом. Зачерненные квадраты представляют зараженных телят. Двойные линии между отцом и матерью обозначают петлю близкородственного спаривания. N относится к количеству животных. Для упрощения, генотипы тринадцати различных матерей не показывают.
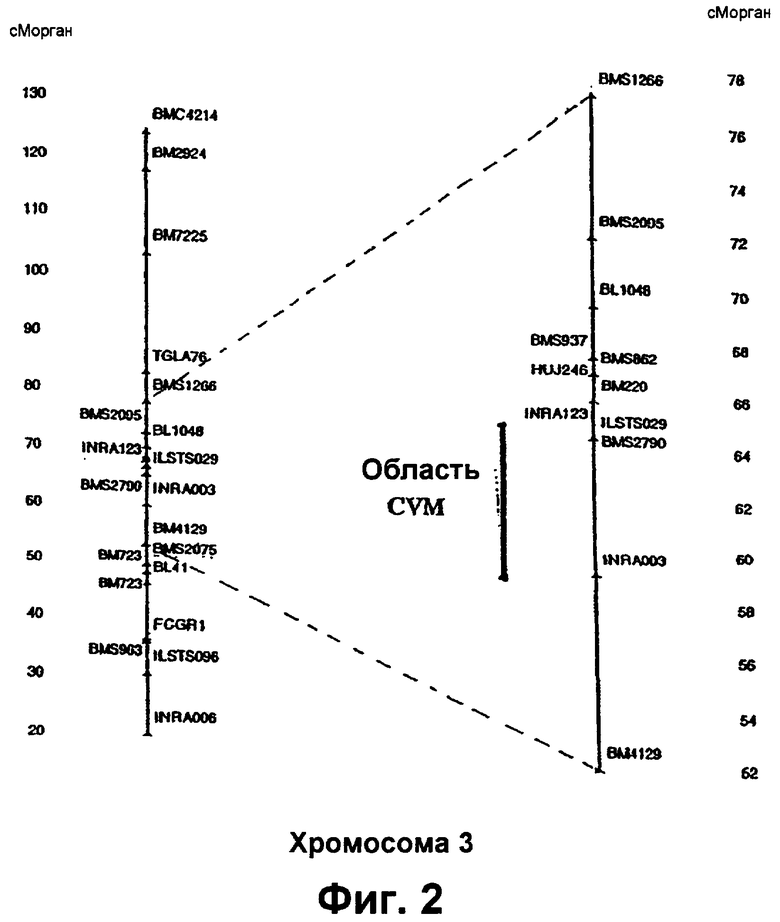
Фиг.2 представляет генетическую карту хромосомы 3 крупного рогатого скота. Цифры на боковых сторонах относятся к генетическим расстояниям, данным в сантиморганах (сМ) вдоль хромосомы. Местоположение локуса комплекса вертебральной мальформации (CVM) крупного рогатого скота определяется с наибольшей вероятностью.
Фиг.3 показывает относительное расстояние в сМ между 3 микросателлитными маркерами ILSTS029, BMS2790 и INRA003 (показаны на линии, обозначенной: Contig маркеры на хромосоме 3 крупного рогатого скота) на хромосоме 3 крупного рогатого скота, как показано исследовательским центром по мясным животным США (U.S. Meat Animal Research Center) (Kappes и соав., 1997). ВАС, содержащие эти 3 маркера, выделяли или с помощью гибридизации на фильтры с высокой плотностью реплики (ILSTS029 и INRA003), или с помощью ПЦР скринирования RPCI-42 библиотеки ВАС крупного рогатого скота (BMS2790). Идентифицированные ВАС показывают в виде черных полос и аннотируют номером планшета/номером лунки. Эти ВАС подвергали концевому секвенированию, используя праймеры SP6 и Т7, или секвенированию, используя праймеры, простирающиеся из микросателлитов. Полученными в результате последовательностями обдували хромосомы 1 человека, используя Ensemble Server при Sanger Centre. Величины приращения, полученные в результате исследования с помощью обдувания, показывают в виде цифровых значений на хромосоме 1 человека, а относительное расстояние между попаданиями дается в MB. Выбранные гены в области показывают в виде прямоугольников.
Фиг.4 показывает последовательность кДНК и трансляцию гена SLC35A3 (SEQ ID NO: 18), а также кодированную аминокислотную последовательность (SEQ ID NO: 17). Полиморфный нуклеотид в положении 559 и пораженный валин-180 показаны жирным шрифтом.
Фиг.5 показывает сравнение дедуцированной аминокислотной последовательности гена SLC35A3 коровы с последовательностями гена человека (АВ021981) (Ishida и соав., 1999) и гена собаки (AF057365) (Guillen и соав., 1998). Точки показывают остатки, которые соответствуют последовательности Bos Taurus. Штрихи показывают разрывы, которые введены, чтобы оптимизировать построение.
Фиг.6 показывает результаты, полученные при секвенировании области (от нуклеотида 544 до нуклеотида 572 гена SLC35A3, смотри Фиг.4), представляющие G/T полиморфизм в положении 559 при детерминации статуса CVM за счет секвенирования. Левая и правая панели показывают прямое и обратное секвенирование, соответственно. Верхний ряд (-/-) показывает секвенирование животного дикого типа, средний ряд показывает секвенирование носителя рецессивного гена (гетерозиготы), и нижний ряд показывает секвенирование зараженного животного.
Фиг.7 представляет картину, показывающую продукты аллель-специфической ПЦР (АС-ПЦР) от двух животных дикого типа, двух носителей рецессивного гена и двух слабых животных. Примечание: WT: животное дикого типа, С: носитель рецессивного гена, S: слабое животное, neg: негативный контроль, М: маркер (лэддер размера). Стрелки показывают продукты аллель-специфической ПЦР: С: 220 пар нуклеотидов, А: 98 пар нуклеотидов, Т: 340 пар нуклеотидов, G: 288 пар нуклеотидов.
Подробное описание изобретения
Одной из главных целей изобретения является обеспечение возможности идентификации комплексной вертебральной мальформации (CVM) у крупного рогатого скота, которой он подвержен. Это достигается способом, который детектирует присутствие генетического маркера, связанного с CVM крупного рогатого скота, в организме особей крупного рогатого скота. Более конкретно, генетический маркер может быть геном SLC35A3 крупного рогатого скота или, еще более конкретно, специфическим полиморфизмом в гене SLC35A3 крупного рогатого скота.
Так, как его используют здесь, термин "особь крупного рогатого скота" ("bovine subject") относится к крупному рогатому скоту любой породы. Таким образом, в термин включается любой из множества представителей коров или быков, либо самец, либо самка, и предполагается, что этим термином охватываются как взрослые, так и новорожденные животные. Термин не обозначает конкретно возраст. Одним из примеров особи крупного рогатого скота является представитель популяции крупного рогатого скота голштино-фризской породы.
Термин "генетический маркер" относится к вариабельной нуклеотидной последовательности (полиморфной), которая присутствует в геномной ДНК крупного рогатого скота на хромосоме и которую можно идентифицировать специфическими олигонуклеотидами. Такая изменчивая нуклеотидная последовательность является, например, различимой за счет амплификации нуклеотидной кислоты и представляет визуальную картину различий в размере или последовательности нуклеотидов, обязанных полиморфизму. В используемых вариантах, такие генетические маркеры можно идентифицировать с помощью нескольких технический приемов, известных специалистам в данной области, и эти приемы включают типирование микросателлитов или коротких тандемных повторов (STR), полиморфизм длин рестрикционных фрагментов (ПДРФ) (RFLP), детектирование сайтов делеции или инсерции и случайно амплифицированной полиморфной ДНК (RAPD), а также типирование полиморфизма единичного нуклеотида (SNP) способами, включающими полимеразную цепную реакцию длин рестрикционных фрагментов, гибридизацию аллель-специфического олигомера, анализы олигомер-специфического лигирования, мини-секвенирование, прямое секвенирование, анализы флуоресцентно-детектированной 5'-экзонуклеазы, и гибридизацию с PNA и LNA зондами и другие. Однако следует принять во внимание, что в соответствии с изобретением, могут быть применены и другие генетические маркеры и методики.
Как описано выше, "комплексная вертебральная мальформация крупного рогатого скота" (CVM) является наследственным вертебральным нарушением. К настоящему времени, это заболевание выявлено лишь у крупного рогатого скота молочного направления голштино-фризской (HF) породы черной и белой окраски; однако предполагается, что могут быть заражены и другие породы крупного рогатого скота. Заболевание недавно было описано Agerholm и соав., 2000. Соответственно, в настоящем контексте, CVM и признаки проявления заболевания комплексной вертебральной мальформацией должны пониматься как болезнь, являющаяся результатом клинических симптомов, ранее описанных здесь, и как было сообщено и определено Agerholm и соав., 2000.
Способ согласно изобретению включает обеспечение генетического материала крупного рогатого скота. Такой материал включает материал, содержащий ДНК крупного рогатого скота, который можно обеспечить любым традиционным способом или средством. Материал, содержащий ДНК крупного рогатого скота, можно, например, экстрагировать, выделить и очистить из крови (например, свежей или замороженной), образцов ткани (например, селезенки, буккальных мазков), образцов волос, содержащих фолликулярные клетки, и спермы.
Как было описано выше, способ настоящего изобретения включает также стадию выявления в генетическом материале присутствия или отсутствия генетического маркера, который связан с признаками проявления заболевания комплексной вертебральной мальформацией крупного рогатого скота.
Для выявления того, присутствует ли генетический маркер в генетическом материале, можно применять способы, хорошо известные специалистам в данной области, например способ амплификации нуклеиновой кислоты. Для определения того, связан ли генетически генетический маркер с проявлением признаков заболевания комплексной вертебральной мальформацией, можно применять количественный показатель сцепления генов (lod score). Количественный показатель сцепления генов, который также иногда называют Zmax, показывает вероятность (логарифм, степени вероятности) того, что локус генетического маркера и локус специфического гена сцеплены на конкретном расстоянии. Количественный показатель сцепления генов можно рассчитывать, например, путем применения компьютерной программы, такой как программы MLINK из пакета программ LINKAGE (Lathrop и соав., 1985). При величине количественного показателя сцепления генов, большем чем 3,0, считается, что имеется существенное доказательство связи между генетическим маркером и признаками проявления заболевания комплексной вертебральной мальформацией, или локусом гена.
В одном из вариантов изобретения, генетический маркер располагается на хромосоме ВТА3 крупного рогатого скота. Область хромосомы ВТА3 крупного рогатого скота, включающую генетические маркеры, которые используют в способе настоящего изобретения, показана на Фиг.2.
Соответственно, генетические маркеры, расположенные на хромосоме ВТАЗ крупного рогатого скота в области, фланкируемой и включающей полиморфные микросателлитные маркеры ВМ4129 и BMS1266, можно использовать согласно настоящему изобретению. В одном конкретном варианте, по меньшей мере, один генетический маркер располагается в области от около 59,5 сМ до около 67,9 сМ на хромосоме ВТА3 крупного рогатого скота.
В следующем используемом варианте, по меньшей мере, один генетический маркер располагается на хромосоме ВТАЗ крупного рогатого скота в области, фланкируемой и включающей полиморфные микросателлитные маркеры INRAA003 и BMS937.
В следующем варианте, по меньшей мере, один генетический маркер располагается на хромосоме ВТА3 крупного рогатого скота в области, фланкируемой и включающей полиморфные микросателлитные маркеры INRAA003 и ILSTS029.
В другом предпочтительном варианте, по меньшей мере, один генетический маркер выбирают из группы, состоящей из микросателлитных маркеров ВМ4129, INRAA003, BMS2790, ILSTS029, INRA123, ВМ220, HUJ246, BMS862, BMS937, BL1048, BMS2095 и BMS1266.
Как описывается в примерах, по меньшей мере, один генетический маркер может быть сцеплен с геном, являющимся причиной заболевания комплексной вертебральной мальформацией у крупного рогатого скота. Таким образом, в одном из вариантов, по меньшей мере, один генетический маркер располагается на хромосоме ВТАЗ крупного рогатого скота в области, фланкируемой и включающей полиморфные микросателлитные маркеры ВМ4129 и BMS1266, и генетически связан с проявлением признаков заболевания CVM или локусом гена CVM при величине количественного показателя сцепления генов, равной 3,0, такой как, по меньшей мере, равной 4,0, включающей, по меньшей мере, величину 5,0, такой как, по меньшей мере, равной 6,0, включающей, по меньшей мере, величину 7,0, такой как, по меньшей мере, равной 8,0, включающей, по меньшей мере, величину 9,0, такой как, по меньшей мере, равной 10,0, включающей, по меньшей мере, величину 11,0, такой как, по меньшей мере, равной 12,0.
Специфическое определение и локус вышеописанных полиморфных микросателлитных маркеров можно найти на генетической карте министерства сельского хозяйства США (USDA) (Kappes и соав., 1997).
Следует принять во внимание, что для того, чтобы выявить присутствие или отсутствие в организме особи крупного рогатого скота генетического маркера, связанного с CVM, можно применять, в соответствии с изобретением, большее количество генетических маркеров, чем один генетический маркер. Таким образом, по меньшей мере, один маркер может представлять комбинацию из двух или большего количества генетических маркеров, которые показали, что являются информативными, благодаря чему можно повышать точность тестирования. Соответственно, как следует также из нижеследующего примера, в комбинации можно использовать два или большее количество микросателлитных маркеров INRAA003, BMS2790, ILSTS029, INRA123, ВМ220, НUJ246, BMS862, BMS937.
В соответствии с изобретением, в Таблице 4 ниже описываются нуклеотидные последовательности пар праймеров для амплифицирования вышеописанных микросателлитных маркеров. Сравнительные карты (Solinas-Toldo и соав., 1995) показывают, что большая часть хромосомы ВТА3 крупного рогатого скота соответствует части хромосомы 1 (HSSA1) человека. Генетическое картирование локуса CVM, представленное здесь, делает возможным использование доступной информации, касающейся генов человека, и позволяет сконцентрировать усилия на поиске кандидатного гена для генов, присутствующих на хромосоме 1 человека. Это в значительной степени будет ограничивать количество кандидатных генов и облегчать поиск каузального гена CVM.
Генетические маркеры настоящего изобретения можно готовить, используя различные методологии, известные специалистам в данной области. Таким образом, должно быть понятно, что используя сведения, представленные здесь, нуклеотидные последовательности вышеописанных полиморфных микросателлитных маркеров хромосомы ВТА3 крупного рогатого скота были идентифицированы как генетически сцепленные с локусом гена CVM, и дополнительные маркеры для использования в способе настоящего изобретения можно генерировать из известных последовательностей или указанного местоположения на хромосоме ВТА3 крупного рогатого скота.
Например, используя карту, иллюстрированную на Фиг.2, область CVM хромосомы ВТА3 крупного рогатого скота можно подвергать микрорассечению, и фрагменты можно клонировать в векторы для выделения ДНК сегментов, которые можно испытывать на сцепление с локусом гена CVM. Альтернативно, с нуклеотидными последовательностями, представленными в Таблице 4, выделенные ДНК сегменты можно получать из области CVM за счет амплификации нуклеиновой кислоты (например, полимеразной цепной реакции) или за счет нуклеотидного секвенирования подходящей области хромосомы ВТАЗ крупного рогатого скота ("прогулка по хромосоме") ("chromosome walking").
Кроме того, вышеописанная гомология между хромосомой ВТАЗ крупного рогатого скота и хромосомой 1 (HSA1) человека показывает, что любая метка гена или экспрессированной последовательности, которую картируют на эту аналогичную область в организме человека, можно также картировать на область CVM хромосомы ВТАЗ крупного рогатого скота. Таким образом, гены или сохраненные последовательности, которые картируют на хромосоме HSA1 человека, можно анализировать на сцепление с локусом гена CVM, используя рутинные способы.
Генотипирование основывается на анализе геномной ДНК, которую можно обеспечить путем использования стандартных способов экстракции ДНК, как описано здесь. Когда геномную ДНК выделяют и очищают, можно использовать амплификацию нуклеиновой кислоты (например, полимеразную цепную реакцию) для амплификации области ДНК, соответствующей каждому генетическому маркеру, который будет использоваться в анализе для детектирования присутствия в организме особи крупного рогатого скота генетического маркера, связанного с CVM. Соответственно, диагностический набор для использования в таком варианте включает, в отдельной упаковке, по меньшей мере, одну олигонуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO:1, SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO: 10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ГО N0:16, SEQ ID NO:33, SEQ ID NO:34. SEQ ID NO:35, SEQ ID NO:36, SEQ ID NO:37 и SEQ ID NO: 38, и их комбинаций.
Идентификация мутации в гене SLC35A3 каузальном и диагностическом для CVM у крупного рогатого скота
Признавая установленным геномное местоположение гена CVM, границы которого определены полиморфными микросателлитными маркерами, проводилось исследование с целью идентификации структурного гена и каузальной мутации в нем; гена, который можно использовать в качестве основного генетического маркера для CVM.
Была идентифицирована последовательность, являющаяся частью генома человека, гомологичная по отношению к области CVM, которую называют областью между маркерами INRA003 и ILSTS029. Маркер BMS2790 располагается в этом интервале (Фиг.1). Первоначально были идентифицированы 5 различных клонов из библиотеки ВАС (бактериального антигенного комплекса) крупного рогатого скота (RPCI-42, сконструированной и сделанной доступной Р. De Jonge и сотрудниками), причем каждый из них включал моркеры INRA003, ILSTS029 или BMS2790. Используя информацию, касающуюся последовательностей, полученную от этих клонов ВАС, была идентифицирована, путем использования программы BLASTN на основе общедоступных баз данных о последовательностях, единичная область на хромосоме 1 человека, которая включает область гомологии по отношению к бактериальным антигенным комплексам, содержащим маркер. Эта область охватывает около 6 миллионов пар нуклеотидов и располагается в положении приблизительно 107,4-113,5 (Фиг.3) (просмотровое устройство ENSEMBL, The Sanger Centre).
Выделение и секвенирование кДНК гена SLC35A3
На основе гомологического местоположения гена SLC35A3 крупного рогатого скота между геном SLC35A3 человека разумного (homo sapiens) и геном SLC35A3 собаки домашней (canis familiaris), были сконструированы 2 олигонуклеотида (SL1F и SL8R) для амплификации почти полной кДНК гена SLC35A3 крупного рогатого скота, включая инициирующий кодон. ПЦР проводили на кДНК, выделенной из образцов ткани сердца, полученных от животного дикого типа, носителя рецессивного гена CVM, и зараженного животного, соответственно. Для получения последовательности 3' конца гена, полученный в результате ПЦР фрагмент подвергали секвенированию и, в результате, был сконструирован новый олигонуклеотид (SL5F). Для амплификации 3' конца гена SLC35A3, использовали олигонуклеотид SL5F в комбинации с олигонуклеотидом (bSLCBVIR), сконструированным путем использования общедоступной неполной последовательности EST крупного рогатого скота (банк данных, dbEST). Последовательность кДНК (SEQ ID NO: 18) и транслированная пептидная последовательность (SEQ ID NO: 17) гена SLC35A3 крупного рогатого скота показаны на Фиг.4. Белок, кодированный геном SLC35A3 крупного рогатого скота, содержит 326 аминокислот и обладает общей гомологией с семейством ранее известных белков, вовлеченных в транспорт нуклеотидных сахаров из цитозола в полость Гольджи аппарата. Ориентация, обозначенная на Фиг.5, показывает гомологию относительно белков SLC35A3, ранее описанных у человека (Ishida и соав., 1999) и у собаки (Guillen и соав., 1998).
Детектирование полиморфизма в гене SLC35A3
Для детектирования потенциальных проявлений полиморфизма в гене крупного рогатого скота SLC35A3 была проведена амплификация ПЦР гена, используя кДНК, выделенную из образцов ткани сердца, полученных от носителя рецессивного гена CVM и зараженного животного, соответственно. Секвенирование фрагмента, выделенного из зараженного животного, позволило обнаружить последовательность, идентичную дикому типу, за исключением того, что зараженное животное являлось гомозиготным для нуклеотида Т в нуклеотидном положении 559, по сравнению с животным дикого типа, являющимся гомозиготным для нуклеотида G в соответствующем положении (смотри Фиг.4). Секвенирование кДНК из животного, являющегося носителем CVM-дефекта, показало, что это животное является гетерозиготным, имеющим и Т и G нуклеотиды в положении 559.
Обмен G на Т в положении 559 воздействует на последовательность получающегося пептида в виде изменения валина в положении 180 на фенилаланин (смотри Фиг.4).
Типирование полиморфизма гена SLC35A3 с помощью анализа секвенирования ДНК
Фиг.6 показывает результаты, полученные при секвенировании фрагмента ПЦР, амплифицированного из геномной ДНК и включающего область (от 544 до 572 кДНК гена SLC35A3, для анализа величин смотри Фиг.4), которая содержит G/T мутацию. Левая и правая панели показывают прямое и обратное секвенирование, соответственно. Верхний ряд (отмеченный посредством -/-) показывает результат секвенирования ДНК животного дикого типа, причем показывает нуклеотид G в полиморфном положении, используя прямое секвенирование, а нуклеотид С показывает в аналогичном положении на другой цепи, используя обратное секвенирование (отмеченное посредством звездочек). Нижний ряд +/+ показывает результаты, полученные при секвенировании ДНК зараженного теленка, причем показывает нуклеотид Т в полиморфном положении, используя прямое секвенирование, а нуклеотид А показывает в аналогичном положении на другой цепи, используя обратное секвенирование (отмеченное звездочками). Гетерозигота (+/-) показана на средней панели и, как следовало ожидать, представляет смесь сигнала гена животного дикого типа и сигнала гена зараженного животного и, таким образом, содержит сигналы Т и G нуклеотидов, при использовании прямого секвенирования, и сигналы А и С нуклеотидов на другой цепи.
Все телята, зараженные CVM, являются гомозиготными для Т-аллеля
Проводилось генотипирование 39 телят, зараженных CVM, путем секвенирования продукта ПЦР, амплифицированного из геномной ДНК (смотри Фиг.6 и пример 6). Все эти животные оказались гомозиготными для Т-аллеля, подтверждая первоначальные результаты.
Т-аллель не находят у животных, не имеющих отношения к племенному быку Bell
Так как телята, зараженные CVM, были отмечены лишь в родословных, в которых широко использовали племенного быка Bell, было проведено исследование для выяснения, присутствовал ли Т-аллель у животных, не имевших отношения к племенному быку Bell. Используя возможность базы данных по крупному рогатому скоту Дании (Danish Cattle Database), 496 животных голштинной породы, не имеющих отношения к племенному быку Bell в их родословных, были идентифицированы и подвергнуты испытанию. Генотипирование этих животных проводили путем секвенирования продукта ПЦР, амплифицированного из геномной ДНК (смотри Фиг.6 и пример 6). Ни одно из этих животных не содержало Т-аллеля, и это приводило к заключению, что этот аллель находят исключительно в родословных животных, имеющих непосредственное отношение к племенному быку Bell.
С помощью секвенирования были также генотипированы более чем 326 не имеющих отношения к племенному быку Bell (по меньшей мере, за последние три поколения) животных из 12 различных пород. Все эти животные были гомозиготными для аллеля дикого типа (G-аллеля), демонстрируя вновь отсутствие CVM-связанного аллеля (Т-аллеля) в основной популяции крупного рогатого скота.
Типирование полиморфизма гена SLC35A3 с помощью анализа аллель-специфической ПЦР (АС-ПЦР) (AS-PCR)
Для того, чтобы эффективно типировать G/T полиморфизм, был усовершенствован анализ аллель-специфической ПЦР, использующий BIOLASE ромбовидную ДНК-полимеразу (BIOLASE Diamond DNA Polymerase) из биородословной (Bioline). Эта полимераза требует полной совместимости 3' конца праймера с матрицей, а несовместимость в этом положении приводит к отсутствию (или очень слабой) амплификации. Таким образом, имеется возможность сделать различие между животными дикого типа, животными - носителями рецессивного гена или слабыми животными путем идентификации присутствия или отсутствия аллель-специфических продуктов ПЦР (Фиг.7). Левая часть Фиг.7 показывает аллель-специфические продукты ПЦР кодирующей нити. Как ожидалось, животные дикого типа показывают амплификацию с G-специфическим праймером, но не с Т-специфическим праймером. Животные, носители рецессивного гена, показывают амплификацию обоих G- и Т-специфических праймеров, в то время как слабые животные показывают лишь амплификацию Т-специфического праймера. Правая часть Фиг.7 показывает аллель-специфические продукты ПЦР некодирующей нити, и, как ожидалось, характер рисунков такой же, как у кодирующей нити. Животные дикого типа являются гомозиготными С, животные, носители рецессивного гена, являются гетерозиготными С/А, а слабые животные являются гомозиготными А.
Используя вышеописанные результаты применения принципа позиционного кандидатного гена, был идентифицирован ген крупного рогатого скота, который является гомологичным гену SLC35A3 человека, кодирующему UDP-N-ацетилглюкозаминовый переносчик. Внутри этого гена идентифицировали G/T полиморфизм, который изменяет аминокислотную последовательность белка. Все зараженные телята, подвергнутые анализу (39), оказались гомозиготными для Т-аллеля (Т/Т), а все известные животные, носители рецессивного гена (108), оказались гетерозиготными для полиморфизма (G/T). Анализ более чем 500 животных голштинной породы, выбранных из числа не имеющих отношения к племенному быку Bell, не смог идентифицировать какое-либо из животных как имеющее Т-аллель. Были подвергнуты анализу более чем 1500 животных из числа имеющих в родословных племенного быка Bell, при этом ни одно из незараженных животных не оказалось гомозиготным для Т-аллеля. Кроме того, были подвергнуты анализу более чем 300 представителей крупного рогатого скота, выбранные из 12 различных пород, при этом ни у одного из этих животных не был выявлен в организме Т-аллель. В целом, исследования, описанные в настоящей заявке, демонстрируют, что Т-аллель присутствует в единичной копии у животных, которые являются носителями рецессивного гена CVM, и в двух копиях у животных, зараженных CVM. Детектирование Т-аллеля в положении 559 (при анализе величин на Фиг.4) является, следовательно, диагностическим для CVM и является идеальным для выявления носителей CVM-дефекта.
Так как G/T полиморфизм был идентифицирован как являющийся каузальным для CVM, любой генетический маркер, близко связанный с этим полиморфизмом, может являться диагностическим для CVM в популяции крупного рогатого скота. Соответственно, настоящее изобретение описывает способ для идентификации особи крупного рогатого скота, либо зараженной CVM, либо являющейся носителем рецессивного гена CVM, путем определения присутствия G/T полиморфизма в положении 559 гена SLC35A3 крупного рогатого скота, либо косвенно, путем анализа любых генетических маркеров, таких как микросателлиты, описанные здесь, связанных с геном SLC35A3 крупного рогатого скота, либо непосредственно путем анализа последовательностей гена SLC35A3 крупного рогатого скота, например, как описано выше и более подробно в примерах.
В пределах объема настоящего изобретения, следовательно, предлагается способ для детектирования и/или оценки присутствия генетического маркера, связанного с CVM крупного рогатого скота, у особи крупного рогатого скота для того, чтобы иметь возможность идентифицировать особи крупного рогатого скота зараженные CVM, или носителей рецессивного гена CVM. Стадии способа включают:
a) обеспечение генетического материала крупного рогатого скота, и
b) детектирование в указанном генетическом материале присутствия или отсутствия, по меньшей мере, одного генетического маркера, который связывают с проявлением признаков заболевания комплексной вертебральной мальформацией у крупного рогатого скота.
По меньшей мере, один генетический маркер связывают с геном, вызывающим заболевание CVM у крупного рогатого скота, причем указанный ген идентифицирован здесь как ген SLC35A3 крупного рогатого скота, который кодирует белок SLC35A3 крупного рогатого скота, включающий аминокислотную последовательность, которая представлена в виде SEQ ID NO: 17.
Более конкретно, настоящее изобретение относится к способу для детектирования CVM у крупного рогатого скота, где генетический маркер представляет полиморфизм единичного нуклеотида в положении, эквивалентном 559 положению нуклеотида последовательности SEQ ID NO: 18, причем указанный полиморфизм единичного нуклеотида является G/T полиморфизмом.
Кроме того, настоящая заявка описывает эффективный анализ для генотипирования настоящего полиморфизма, используя аллель-специфическую ПЦР. Это лишь один способ из группы способов для типирования полиморфизмов единичных нуклеотидов (SNPs), другие способы, которые можно применять, включают, но не ограничиваются ими, минисеквенирование, праймер-удлинение (primer-extension), пиросеквенирование, ПЦР-ПДРФ, аллель-специфическую амплификацию по типу катящегося кольца, праймер-удлинение с последующей MALDI-TOF масс-спектрометрией, а также набор других ферментативных способов и способов на основе гибридизации.
Фенотип, имеющий сходство с CVM, был продемонстрирован как существующий у мышей, мутированных в гене lunatic fringe (Evrad и соав., 1998). Аналогично телятам, зараженным CVM, мыши, гомозиготные для нулевой мутации в гене lunatic fringe, проявляют измененную сомитную сегментацию и структурирование, имея укороченный позвоночник, вертебральное и реберное сращение и неполностью сформированные позвонки (Evrad и соав., 1998). Похоже, что ген Fringe принимает участие в определении формирования контуров и сомитном структурировании путем модуляции активности рецепторов сложного локуса (notch receptors) (Klein и Arias, 1998; Moloney и соав., 2000; Bruckner и соав., 2000). Похоже, что модулирование активности сложного локуса опосредуется N-ацетилглюкозаминил-трансферазной активностью гена Fringe, который в Гольджи аппарате инициирует удлинение O-сцепленных фукозных остатков, прикрепленных к EGF-подобным последовательным повторам сложного локуса (Moloney и соав., 2000; Bruckner и соав., 2000).
Кроме того, так как ген SLC35A3 крупного рогатого скота является гомологичным гену SLC35A3 человека, он является согласно информации, приведенной здесь, наглядным для анализа кодирующей последовательности SLC35A3 гена человека, для каузальных и диагностических мутаций при изучении эволюционных дефектов человека, особенно включая сомитную сегментацию и структурирование.
Можно ожидать, что воздействие мутации на находящийся в Гольджи-аппарате N-ацетилглюкозаминильный переносчик (SLC35A3), нанося вред переносу ацетилглюкозамина из цитозола в полость Гольджи-аппарата, отбирает у семейства генов Fringe белки, предназначенные для их субстрата. Это может нанести вред способности гена Fringe модулировать активность сложного локуса и, следовательно, вызвать дефект сегментации, подобный CVM. Следовательно, это кажется вполне реальным, что мутация в гене SLC35A3, отдельно от того, что она является диагностической для CVM, является также мутацией, вызывающей этот широко распространенный генетический дефект.
Далее изобретение подробно описывают в следующих примерах:
Примеры
Пример 1
Генетическое картирование комплексной вертебральной мальформации (CVM)
Этот пример иллюстрирует местоположение локуса гена CVM на хромосоме ВТА3 крупного рогатого скота. Кроме того, этот вариант изобретения описывает идентификацию маркеров, сцепленных с локусом гена CVM, и, соответственно, характеризует область CVM хромосомы ВТА3 крупного рогатого скота.
Для того чтобы картировать локус ответственный за CVM, образцы получали из животных, которых использовали в исследованиях по улучшению породы. Коротко, в исследованиях по улучшению породы были отобраны приблизительно 300 коров и телок, ведущих происхождение от племенного быка Т Burma и осемененных спермой от племенного быка KOL Nixon. Было отобрано тринадцать зараженных телят на основании исследований, проведенных после их смерти, как описано у Agerholm и соав., 2000. Этих 13 телят, а также их родителей, в целом 28 животных, использовали в начальном геномном сканировании. Телят разделили на 4 поколения по отношению к их общему предку, чистопородному племенному быку Carlin-M Ivanhoe Bell.
Геномное сканирование проводили, включая все 29 аутосом, путем использования набора микросателлитных маркеров, выбранных на геномной карте министерства сельского хозяйства США (USDA) (Kappes и соав., 1997). Маркеры выбирали с двуточечными расстояниями от 10 до 20 сМ. В зонах, вызывавших сомнение из-за низкой информативности маркера, включали и типировали новые маркеры. В целом, использовали 194 маркера. Реакции ПЦР проводили дублированно в объеме 5 мкл ABI 877 PCR robot (Applied Biosystems) (Применяемые биосистемы), содержащем 12 нг геномной ДНК, буферного раствора 1 × ПЦР, 0,4 единицы (U) AmpliTag Gold (Applied Biosystems), 20 пмоль каждого праймера и 2,0 ммоля раствора MgCl2. Все маркеры вводили при одинаковых условиях проведения ПЦР: инкубация при 94°С в течение 12 минут для активизации фермента, 35 циклов при 94°С, по 30 сек; Та, 45 сек; при 72°С, в течение 20 сек, завершающаяся конечным удлинением при 72°С в течение 10 мин. В первые десять циклов Та снижалось от 67 до 58°С, один градус за один цикл, а в остающиеся 25 циклов Та фиксировали при 58°С. Продукты ПЦР собирали и в каждой дорожке (lane) на ABI 377 (Applied Biosystems) обрабатывали от 5-9 различных маркеров и гели подвергали анализу, используя сопутствующее программное обеспечение. Аллели определяли с помощью Genotyper программы (Версия 2.1, Applied Biosystems).
Для трех маркеров был рассчитан двухточечный количественный показатель сцепления генов путем применения компьютерной программы MLINK из пакета программ LINKAGE (Lathrop и соав., 1985). Из-за структуры родословной (Фиг.1) со множеством петель с близкородственным спариванием, родословная была разделена на тринадцать маленьких семейств, причем каждый зараженный теленок включал быка-производителя (KOL Nixon), корову-производительницу и корову-производительницу во втором поколении (Т Burma). Предполагалось, что заболевание рецессивно наследуется при полной пенетрантности генотипа.
Было обнаружено, что все три маркера имеют значительную величину сцепления. Наибольший количественный показатель сцепления генов (Z) наблюдали у маркера BMS2790 и маркера ILSTS029, с Z=10,35 при θ=0. Кроме того, соседний маркер INRA003 также имел значительное сцепление с локусом CVM (Таблица 3).
В соответствии с вышеприведенными результатами, локус CVM располагается на хромосоме ВТАЗ (Фиг.2) согласно генетической карте USDA (Kappes и соав., 1997).
Одиннадцать телят являлись гомозиготными для интервала, установленного маркерами INRA003, BMS2790, ILSTS029, BMS862 и HUJ246, в то время как лишь BMS2790 и ILSTS029 являлись гомозиготными у всех тринадцати телят, как показано на Фиг.1. Оказалось возможным конструировать гаплотипы этих маркеров, что позволяет нам установить с наибольшей вероятностью происхождение гаплотипа CVM (Фиг.1). Гаплотипы определяются размерами маркерных аллелей, число которых составляет от 1 до N, где 1 обозначает самый короткий аллель амплифицированного маркера, а N обозначает самый длинный аллель. Фактическая длина аллелей, связанных с CVM, у представителей крупного рогатого скота, имеющих отношение к быку Bell, является следующей:
INRA003 (аллель номер 3): 176 пар оснований;
BMS2790 (аллель номер 3): 118 пар оснований;
ILSTS029 (аллель номер 2): 164 пары оснований;
BMS862 (аллель номер 1): 130 пар оснований
HUJ246 (аллель номер 3): 262 пары оснований.
Фактическая длина аллелей будет зависеть от праймеров, используемых для амплификации маркера, и длины фрагментов, показанные выше, основываются на использовании праймеров, описанных в Таблице 4.
Кроме того, в исследование включили семнадцать дополнительных зараженных телят, из которых были взяты пробы, как часть датской программы по контролю генетических дефектов. Все зараженные животные имели, в качестве общего предка, чистопородного племенного быка Bell. ДНК экстрагировали из проб крови или спермы, используя стандартные способы.
17 телят и их матерей генотипировали 8 маркерами INRA003, BMS2790, ILSTS029, ВМ220, INRA123, BMS862, BMS937 и HUJ246, охватив область на хромосоме ВТАЗ от приблизительно 59,5 до 67,9 сМ, и, так как предполагалось, что ген CVM в дополнительных 17 телятах, подобно тому, как в первоначальных исследованиях по улучшению породы, унаследован от общего предка, племенного быка Bell, ожидалось, что аналогичная область идентичности за счет происхождения (IBD) существует у всех зараженных телят. Это также подтвердилось: у 17 из 17 телят хромосомный сегмент, определяемый маркерами INRA003 и BMS2790, был гомозиготным, обладая теми же самыми аллелями, как и у животных, подвергавшиеся исследованиям по улучшению породы. У двух из девятнадцати животных, гетерозиготность наблюдали в локусах ILSTS029 и BMS862, которую объясняли единичным рекомбинационным событием между BMS2790 и ILSTS029. Следовательно, на основе обобщенных результатов генотипирования было обнаружено, что генетический дефект, связанный с CVM, наиболее вероятно располагается в интервале, меньшем чем 6 сМ, фланкируемом маркерами INRA003 и ILSTS029, как иллюстрируется на Фиг.2, и обозначенном "область CVM".
Последовательности праймеров для применения 8 маркеров INRA003, BMS2790, ILSTS029, ВМ220, INRA123, BMS862, BMS937 и HUJ246, показаны в Таблице 4.
R: СТА AGA GTC GAA GGT GTG ACT AGG
SEQ ID NO: 2
R: ААА GAG TCG GAC ATT ACT GAG С
SEQ ID NO: 4
R: TGG ATT TAG ACC AGG GTT GG
SEQ ID NO: 6
R: AGA GAG САА СТС САС TGT GC
SEQ ID NO: 8
R: TAG GTA CCA TAG CCT AGC САА G
SEQ ID NO: 10
R: TGC CAT GTA GTA GCT GTG TGC
SEQ ID NO: 12
R: ATG GAA ААА ТАА GAT GTG GTA TGT G
SEQ ID NO: 14
R: CAT TAT CCC CTG ТСА САС ACC
SEQ ID NO: 16
Пример 2
Диагностический тест для идентификации носителей рецессивного гена CVM:
Диагностический тест для определения носителей рецессивного гена CVM крупного рогатого скота был поставлен путем выявления, являются ли потомки племенного быка Bell носителями гаплотипа, связанного с заболеванием.
Основой теста являлись 8 микросателлитных маркера INRA003, BMS2790, ILSTS029, ВМ220, INRA123, BMS862, BMS937 и HUJ246, и тест предназначался для распознавания специфических аллелей заболевания или гаплотипа (смотри Фиг.1) у животных, происходящих от быка Bell.
Таким образом, животных признавали носителями рецессивного гена, если они унаследовали аллели, связанные с заболеванием в области, установленной маркерами INRA003, BMS2790, ILSTS029 и ВМ220, от быка Bell или от животных, происходящих от быка Bell. Если животные не унаследовали связанный с заболеванием гаплотип от быка Bell или от животных, происходящих от быка Bell, считали, что они не являются носителями рецессивного гена. В случаях, когда гаплотип, унаследованный от быка Bell, был расщеплен рекомбинацией, животных обозначали как неопределимых. Были использованы четыре дополнительных маркера лишь тогда, когда объем информации, получаемой от тестируемых маркеров, уменьшился из-за невозможности сделать различие между наследственностью по материнской или отцовской линии.
Подобно всем генетическим тестам, которые базировались на сцепленных ДНК-маркерах, тест CVM страдал из-за недостатка, что событие двойной рекомбинации (одно событие на каждой стороне каузального гена, между геном и фланкирующим маркером) невозможно было детектировать. В рассматриваемом случае, это событие будет крайне редким, благодаря жесткому сцеплению между маркерами и геном CVM, и достоверность теста оценивается выше чем 99%.
Пример 3
Вырезание ткани и выделение РНК, а также синтез кДНК
Приблизительно 5 грамм ткани сердца вырезали из мертворожденных телят в пределах 3 часов их доставки, немедленно замораживали в жидком азоте и сохраняли при -80°С. Для выделения РНК использовали 250 мг ткани. РНК выделяли путем использования набора для выделения РНК от Stratagene (каталог 200345).
кДНК синтезировали путем смешивания 2,5 мкг полной РНК с 1 мкл олигонуклеотида (dT)12-18 (500 мкг/мл), 1 мкл смеси 10 мМ dNTP (дезоксинуклеозидтрифосфата) и H2O с получением конечного объема 12 мкл. Полученную смесь нагревали при 65°С в течение 5 мин, охлаждали на льду и подвергали центрифугированию в течение ограниченного времени. Вслед за добавлением 4 мкл 5 × буферного раствора первой цепи (first-strand buffer), 2 мкл 0,1 М раствора DTT (дитиотреитола) и 1 мкл Н2О, содержимое пермешивали и инкубировали при 42°С в течение 2 мин, после чего добавляли 1 мкл (200 единиц) Superscript II (GibcoBRL® Lifetechnologies) и инкубации позволяли продолжаться при 42°С в течение 1,5 часов. Реакцию инактивировали при 70°С в течение 15 мин. Для удаления РНК, кДНК инкубировали при 37°С в течение 20 мин с 1 единицей Rnase H (Roche Molecular Biochemicals).
Пример 4
Секвенирование гена SLC35A3:
Исходя из гомологического положения гена SLC35A3 между генами SLC35A3 homo sapiens and canis familiaris, конструировали 2 олигонуклеотида (SL1F и SL8R) для амплификации почти полной кДНК для гена SLC35A3 крупного рогатого скота, включая инициирующий кодон. Для получения 3' конца гена, имеющийся в результате ПЦР фрагмент секвенировали и конструировали новый олигонуклеотид (SL5F). Для амплификации 3' конца гена SLC35A3, олигонуклеотид SL5F использовали в комбинации с олигонуклеотидом (bSLCBVIR), основанием которого является опубликованная последовательность EST крупного рогатого скота.
Такие же условия ПЦР были применены для обоих наборов праймеров.
Рекции ПЦР проводили в GeneAmp® PCR System 9700 (Applied Biosystems) в конечном объеме 10 мкл, состоящем из 1 мкл 10×NH4 реакционного буферного раствора, 0,5 мкл раствора MgCl2 с концентрацией 50 мМ, 0,8 мкл of дезоксинуклеозидтрифосфатов (dNTPs) (по 2,5 мМ каждого), 5,65 мкл H2O, 1 мкл прямого и обратного праймера (5 пмоль каждого) и 0,05 мкл 5 единиц/мкл BIOTAQ ДНК-полимеразы (Bioline).
Пробная реакция ПЦР состояла из начальной стадии тепловой активации при 95°С в течение 2 мин с последующими 10 циклами денатурации в течение 30 сек при 95°С, отжига при 62°С в течение 30 сек (декременты - 0,5°С) и элонгации в течение 20 сек при 72°С, плюс дополнительных 30 циклов со стадией денатурации в течение 30 сек при 95°С, стадией отжига при 57°С в течение 30 сек и стадией элонгации при 72°С в течение 30 сек.
Для амплификации полной кДНК гена SLC35A3 использовали следующие праймеры:
Полную последовательность кДНК получали путем применения этих праймеров в четырех отдельных циклических реакциях секвенирования, используя очищенные продукты ПЦР в качестве матрицы. Продукты ПЦР чистили, используя SPIN-X® (Coming Incorporated) из 0.8%-ного агарозного геля Seakem. Циклические реакции секвенирования проводили в GeneAmp® PCR System 9700 (Applied Biosystems). Эти реакции включали начальную стадию при 96°С в течение 2 мин с последующими 99 циклами при 96°С в течение 10 сек, при 55°С в течение 5 сек и при 60°С в течение 4 мин. Продукты секвенирования осаждали двумя объемами этанола и 1/10 объема 3 М раствора NaAc (pH 5,5), промывали 70%-ным этанолом, ресуспендировали в 5 мкл загрузочного буферного раствора и выливали на 4%-ное акриламидные секвенирующие гели, используя автоматический секвенатор ABI377 automatic.
Последовательность кДНК гена SLC35A3 крупного рогатого скота показана на Фиг.4 (SEQ ID NO: 18).
Пример 5
Идентификация и выделение ВАС, содержащих микросателлитные маркеры Гибридизация фильтров:
Фильтры подвергали предварительной гибридизации в гибридизационном растворе (6×SSC (52,6 г NaCl, 26,46 г цитрата натрия на литр), 5×Denhardt (2 г фиколла (типа 400, Pharmacia), 5 г поливинилпирролидона, 5 г альбумина бычьей сыворотки (Fraction V, Sigma), 0,5%-й SDS (додецилсульфата натрия) и 50 мкг/мл SS-ДНК) при 65°С в течение 3 часов с вращением. Затем инкубировали 100 мкл олигонуклеотида, меченного по 5'-концу, с фильтрами в течение 16 часов при температуре 65°С. Для концевого мечения, 5 пмоль олигонуклеотида смешивали с 5 мкл (50 мкКи) гамма-32Р-АТР (специфическая активность > 5000 Ки/ммоль), 2 мкл 10 × киназного буферного раствора, 11 мкл Н2O и 1 мкл (10 единиц) Т4 полинуклеотид-киназы (New England Biolabs Inc.), и смесь инкубировали при 37°С в течение 1,5 часов с последующим кипячением в течение 5 мин до тепловой инактивации фермента. Меченый зонд представлял собой NaAc/этанол, осажденный путем использования общепринятых способов, и после промывания в 70% зтаноле, зонд повторно растворяли в 100 мкл Н2O. После гибридизации, фильтры промывали один раз промывочным раствором I [2×SSC (раствор хлорида и сульфата натрия), 0,2% SDS] и дважды при 65°С промывочным раствором II (0,1×SSC, 0,5% SDS), и экспонировали на пленку Kodak BIOMAX™ в течение 2 дней при температуре -80°С.
Для идентификации позитивных ВАС клонов маркеров ILSTS029 и INRA003, использовали следующие меченные по 5'-концу олигонуклеотиды:
ILSTS029 олигонуклеотиды: 5'-САС АСС GCT GTA CAG GAA ААА GTG TGC САА ССС TGG ТСТ ААА ТСС ААА АТС CAT TAT СТТ ССА
AGT АСА Т-3' (SEQ ID NO: 23)
INRA003 олигонуклеотиды: 5'-CGT ССС СТА TGC GCT ТАС ТАС АТА САС ТСА ААТ GGA ААТ GGG ААА ACT GGA GGT GTG TGA GCC ССА ТТТ А-3' (SEQ IO NO: 24)
Скринирование с помощью ПЦР библиотеки ВАС крупного рогатого скота
Пулы ВАС готовили из библиотеки ВАС и скринировали с помощью ПЦР. Реакции ПЦР выполняли в GeneAmp® PCR System 9700 (Applied Biosystems) в конечном объеме 10 мкл, состоящим из 1 мкл реакционного буферного раствора 10×NH4, 0,5 мкл 50 мМ раствора MgCl2, 0,8 мкл дезоксинуклеозидтрифосфатов (dNTPs) (2,5 мМ каждого), 5,65 мкл Н2O, 1 мкл прямого и обратного праймера (5 пмоль каждого) и 0,05 мкл 5 единиц/мкл ДНК-полимеразы BIOTAQ (Bioline).
Для идентификации с помощью ПЦР гена BMS2790, содержащего клоны ВАС, использовали следующие праймеры:
BMS2790F: 5'-AAG АСА AGG ACT TTC AGC СС-3' (SEQ ID NO: 25)
BMS2790R: 5'-ААА GAG TCG GAC ATT ACT GAG C-3' (SEQ ID NO: 26)
Пробная реакция ПЦР состояла из начальной стадии тепловой активации при 95°С в течение 2 мин с последующими 10 циклами денатурации в течение 30 сек при 95°С, отжига при 70°С течение 30 сек (декременты - 0,5°С) и элонгации в течение 20 сек при 72°С, плюс дополнительных 30 циклов со стадией денатурации в течение 30 сек при 95°С, стадией отжига при 65°С в течение 30 сек и стадией элонгации при 72°С в течение 20 сек.
Выделение и секвенирование ДНК комплекса бактериальных антигенов (ВАС) ДНК ВАС готовили согласно Qiagens Large Construct Kit, и приблизительно 1 мкг ДНК ВАС использовали в качестве матрицы для цикла секвенирования, выполняемого с BigDye™ Terminator Cycle Sequencing Kit (РЕ Applied Biosystems). Реакции циклического секвенирования выполняли в конечном объеме 6 мкл, содержащем 1 мкл смеси Big Dye™ Terminator, 1 мкл праймера (5 пмолей), 1 мкл реакционного буферного раствора и 2 мкл Н2O. Циклические реакции секвенирования проводили в GeneAmp® PCR System 9700 (Applied Biosystems) и включали начальную стадию при 96°С в течение 2 мин с последующими 130 циклами при 96°С в течение 10 сек, при 55°С в течение 5 сек и при 60°С в течение 4 мин. Продукты секвенирования осаждали двумя объемами этанола и 1/10 объемами 3 М раствора NaAc (pH 5,5), промывали 70%-ным этанолом, ресуспендировали в 2 мкл загрузочного буферного раствора и обрабатывали на 4%-ных акриламидных секвенирующих гелях, используя автоматический секвенатор ABI377.
Секвенирующие праймеры:
Пример 6
Определение статуса CVM путем секвенирования:
Реакции ПЦР (2 мкл очищенной геномной ДНК (матрица/образец), 2 мкл 10×ПЦР буферного раствора, 2 мкл 25 мМ раствора MgCl2, 3,3 мкл 0,2 мМ раствора каждого dNTP (Ultrapure dNTP, 27-2033-01; Amersham Pharmacia Biotech), 6 пмоль праймера (прямого: CBFEX1, 5'-GGC CCT CAG АТТ СТС-3') (SEQ ID NO: 31); обратного: CBTEXR, 5'-GTT GAA TGT TTC TTA-3') (SEQ ID NO: 32), 0,165 единиц Taq полимеразы (Biotaq, M95801B; Bioline), добавление dH2O до полного объема) проводили при отсутствии масляного компонента в 96-луночных планшетах, используя Primus HT (MWG Biotech AG). Условия циклов: при 95°С в течение 120 сек, 35×[при 95°С в течение 60 сек, при 60°С в течение 30 сек, при 72°С в течение 110 сек]. Очистку после реакции осуществляли путем гель-фильтрации (Millipore Filtration System) с супертонкодисперсным Sephadex G-50 (17-0041-01, Amersham Pharmacia Biotech), проводимой согласно рекомендациям производителя, используя 50 мкл dH2O для конечного элюирования образца. Реакции прямого и обратного секвенирования проводили с теми же праймерами, которые использовали для генерирования продукта ПЦР (2 мкл продукта ПЦР, 8 мкл секвенирующей смеси (Sequencing Mix), 0,6 мкл 6 пмольного раствора праймера (смотри выше), добавление dH2O до объема 20 мкл; с DYEnamic ET Dye Terminator Cycle Sequencing Kit (Набор для циклического секвенирования DYEnamic ET Dye Terminator) (US81095). После проведения тепловых циклов (30×[при 95°С в течение 20 сек, при 55°С в течение 15 сек, при 60°С в течение 70 сек]) образцы чистили с помощью гель-фильтрации, в основном, как описано выше, и анализировали на MegaB АСЕ 1000 (Amersham Pharmacia Biotech), используя матрицу для продолжительного считывания LPA и следующие условия секвенирования: инъекция в течение 90 сек при напряжении 3 кВ и проведение секвенирования в течение 35 мин при напряжении 9 кВ.
Пример 7
Анализ аллель-специфической ПЦР:
Праймеры конструировали из последовательности кДНК и четыре аллель-специфических праймера конструировали так, чтобы они имели 3' основание в положении мутации.
Последовательности праймеров:
C_rev_link*: 5'-aat get act act att agt aga att gat gcc ace ttt tca gct cgc gcc cca aat gaa aat ata
Праймер C_rev_link содержит линкерную последовательность из фага М13 (показанного в регистре строчных букв). Этот линкер добавляли для получения более длинного продукта ПЦР с тем, чтобы иметь возможность сделать мультиплексными С- и А-праймеры в одной реакции ПЦР. 3' основание в положении мутации показывают жирным шрифтом. С- и А-праймеры являются специфическими для аллеля дикого типа, в то время как Т- и А- специфические праймеры являются специфическими для мутации.
Праймерные пары:
С-и А-специфический мультиплекс: Fwd + A_rev + C_rev_link (нижняя цепь)
Т-специфическая реакция: T _fwd + Rev (верхняя цепь)
G-специфическая реакция: G _fwd + Rev (верхняя цепь)
Условия аллель-специфической ПЦР:
Каждую реакцию ПЦР проводили в объеме 10 мкл, содержащем 20-100 нг геномной ДНК, 0,025 единиц/мкл ромбовидной ДНК-полимеразы BIOLASE, 0,75 мМ дезоксинуклеозидтрифосфатов (dNTPs), 3 мМ раствора MgCl2, 0,25 пмоля/мкл праймера (0,125 пмоля/мкл двух обратных праймеров в мультиплексе) в буферном растворе IxNH4" (Bioline). ПЦР проводили в GeneAmp® PCR System 9700 (РЕ Applied Biosystems) при следующих условиях: при 95°С в течение 4 мин, 35 циклов при 94°С в течение 30 сек, при 62°С (при 56°С для Т- и G-реакции) при линейном возрастании на 80% в течение 30 сек, и при 72°С в течение 30 сек с последующим конечным удлинением при 72°С в течение 7 мин и сохранением при 4°С. За ПЦР следовал электрофорез в 2%-ном агарозном геле при напряжении 200 В в течение 30 мин.
Результаты анализа аллель-специфической ПЦР двух представителей животных дикого типа, двух животных носителей рецессивного заболевания, и двух слабых животных показаны на Фиг.7.
Источники информации
1. Agerholm JS, Bendixen, С., Andersen O., Ambjerg, J. (2000). LK meddelelser октябрь, 2000.
2. Barendse W, Vaiman D, Kemp SJ, Sugimoto Y, Armitage SM, Williams JL, Sun HS, Eggen A, Agaba M, Aleyasin SA, Band M, Bishop MD, Buitkamp J, Byrne K, Collins F, Cooper L, Coppettiers W, Denys B, Drinkwater RD, Easterday K, Elduque C, Ennis S, Erhardt G, Li L, Lil L (1997). Карта генетического сцепления средней плотности генома крупного рогатого скота (A medium-density genetic linkage map of the bovine genome), Mamm Genome 8, 21-28.
3. Bruckner, K., Perez, L., Clausen, H., & Cohen, S., (2000). Гликозилтрансферазная активность гена Fringe модулирует Notch-Delta взаимодействия (Glycosyltransfecase activity of Fringe modulates Notch-Delta interactions) Nature 406, стр.411-415.
4. Evrad, Y.A., Lun, Y., Aulehia, A., Gan, L., & Johnson, R.L. (1998). Ген Lunatic fringe - основной медиатор сомитной сегментации и структурирования (Lunatic fringe is an essential mediator of somite segmentation and patterning). Nature 394, стр. 377-381.
5. Guillen, E., Abeijon, С., & Hirschberg, С.В. (1998). Переносчик UDP-N-ацетилглюкозамина в Гольджи-аппарате млекопитающих: Молекулярное клонирование с помощью фенотипической коррекции дрожжевого мутанта (Mammalian Golgi apparatus UDP-N-acetylglucosamine transporter: Molecular cloning by phenotypic correction of a yeast mutant). Proc. Natl. Acad. Sci.USA. 95, стр.7888-7892.
6. Ishida, N.. Yoshioka, S., Chiba, Y., Takeuchi, M., & Kawakita, M. (1999). Молекулярное клонирование и функциональная экспрессия переносчика UDP-N-ацетилглюкозамина в Гольджи-аппарате человека (Molecular cloning and functional expression of the human golgi UDP-N-acetylglucosamine transporter). J. Biochem. 126, стр.68-77.
7. Kappes SM, Keele JW, Stone RT, McGraw RA, Sonstegard TS, Smith TP, Lopez-Corrales NL, Beattie CW (1997). Карта сцепления во втором поколении генома крупного рогатого скота (A second-generation linkage map of the bovine genome). Genome Res 7, 235-249.
8. Klein, Т., & Arias, M. (1998). Взаимодействие между Delta, Serrate и Fringe модулируют активность сложного локуса в период развития крыльев у дрозофилы (Interactions among Delta, Serrate and Fringe modulate Notch activity during drosophila wing development). Development 125, стр.2951-2962.
9. Lathrop GM, Lalouel JM, Julier C, Ott J (1985). Анализ многолокусного сцепления у человека: Детектирование сцепления и оценка рекомбинации (Multilocus linkage analysis in humans: detection of linkage and estimation of recombination). Am. J. Hum. Genet 37, 482-498.
10. Moloney, DJ., Panin, V.M., Johnston, S.H., Chen, J., Shao, L., Wilson, Y., Stanley, P., h-vine, K.D., Haltiwanger, R.S., & Vogt, T.F. (2000). Ген Fringe является гликозилтрансферазой, которая модифицирует сложный локус (Fringe is a glycosyltransferase that modifies Notch). Nature 406, стр.369-375.
11. Solinas-Toldo S, Lengauer С, Fries R (1995). Геномная карта для сравнения геномов человека и крупного рогатого скота (Comparative genome map of human and cattle Genomics) 27, 489-496.
















Изобретение относится к способу идентификации носителей рецессивного гена комплексных вертебральных мальформаций у крупного рогатого скота. Предложенный способ предусматривает идентификацию присутствия генетического маркера, локализованного на хромосоме ВТАЗ крупного рогатого скота в области фланкируемой и включающей полиморфные микросателлитные маркеры ВМ4129 и BSM1266. Данные маркеры связаны с комплексной вертебральной мальформацией (CVM) крупного рогатого скота. Кроме того, предложен диагностический набор для осуществления такого способа. Способ позволяет идентифицировать животных с рецессивным геном CVM, a также животных, являющихся носителями данного заболевания. Изобретение может быть использовано в животноводстве. 2 н. и 25 з.п. ф-лы, 4 табл., 7 ил.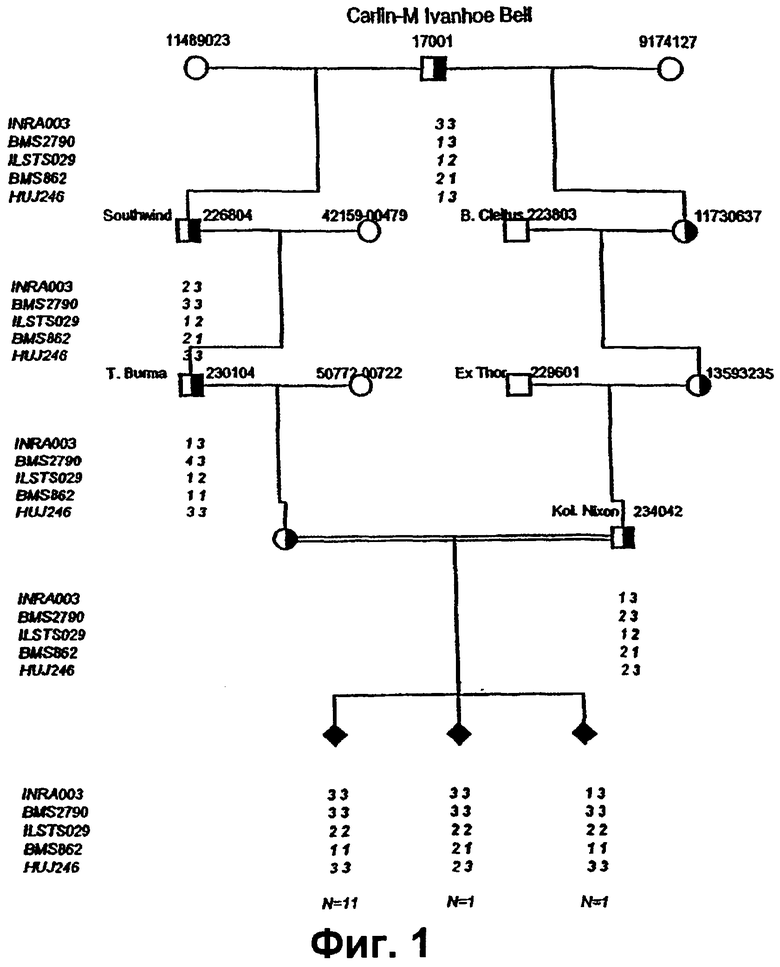
Приоритет по пунктам и признакам:
Пункты 1-12 и 18-26 от 16.11.2000 PA 2000 01717
Пункты 13-17 от 15.05.2001 PA 2001 00765
Пункт 27 имеет двойной приоритет. Признаки, направленные на последовательности SEQ ID NO: 1-16 имеют приоритет по заявке РА 2000 01717 от 16.11.2000, а признаки направленные на последовательности SEQ ID NO:33-38 имеют приоритет по заявке РА 2001 00765 от 15.05.2001.
| AGERHOLM J.S | |||
| et al | |||
| Complex vertebral malformations in Holstein calves, LK MEDDELELSER, October 2000, pages 1-4. |
Авторы
Даты
2006-05-20—Публикация
2001-11-15—Подача