Изобретение относится к способу получения новых производных малеимидов с ароматическими и гетероароматическими заместителями в положениях 3 и 4, которые представляют значительный интерес в нескольких областях. Среди 3,4-ди-индолилмалеимидов найдены антибиотики, такие как стауроспорин и ребеккамицин, и средства, обладающие высокой антираковой и антидиабетической активностью. Так, например, N-диметиламинопропил-3,4-ди-индолилмалеимид (1), бис-индолилмалеимиды (2) и (3) являются сильными антагонистами для протеинкиназы С(РКС) (Toullec D., Pianetti P., et al., J. Biol. Chem. 1991, 266, 15771, Bit R.A., Davis P.D., et al., J.Med.Chem., 1993, 36, 21, Jirousek M.R., Gillig J.R et al., J.Med.Chem., 1996, 39, 2664).
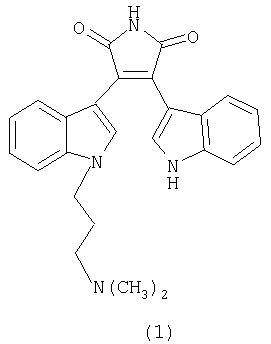
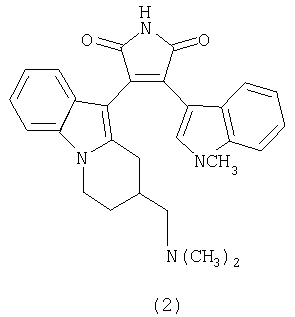
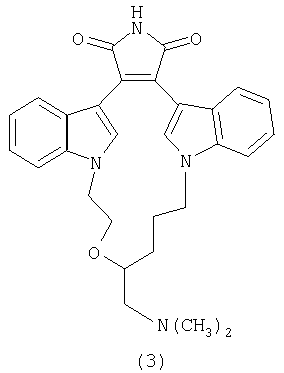
С другой стороны, ряд 3,4-дигетарилзамещенных малеимидов обладают отличными фотохромными характеристиками и могут найти применение в компьютерной технике. (Краюшкин М.М., Ширинян В.З., Беленький Л.И., Шимкин А.А., Мартынкин А.Ю., Ужинов Б.М., Ж. орган. химии 2002, 38, 1390).
Известно несколько способов синтеза 3,4-диарил(гетарил)малеимидов. Реакцией арилметилцианидов с алкоголятом и иодом получают производное 1,2-дицианостильбена (4), (схема 1),
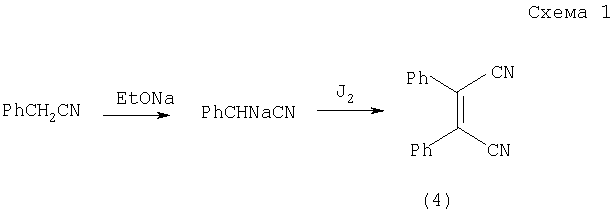
которое подвергается далее омылению в водно-щелочном растворе и при подкислении дикарбоновая кислота образует ангидрид (5), схема 2 (Chalanay L., Knoevenagel E., Ber. 1892, 25, 285),
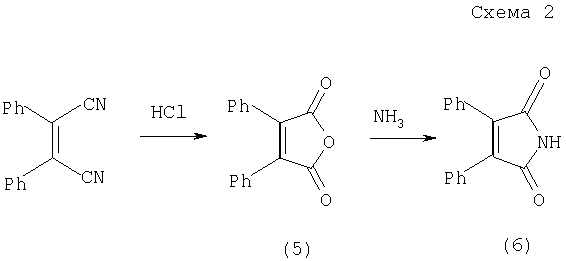
который при обработке аммиаком или аминами переходит в малеимид (6).
Недостатком указанного способа является плохая воспроизводимость результатов, т.к. получающийся динитрил в щелочных условиях легко подвергается полимеризации, а также труднодоступность исходных нитрилов, в особенности в гетероциклическом ряду, и многостадийность этого способа, что затрудняет получение целого ряда 3,4-диарил(гетарил)малеимидов.
Известен также способ, основанный на использовании производных арилуксусных кислот, который заключается в конденсации их хлорангидридов с арилглиоксалилацетамидами (Yamaguchi T., Uchida К., Irie M., J Amer.Chem.Soc., 1997. 119, 6066, Uchida К., Kido Y., Yamaguchi Т., Irie M., Bull. Chem. Soc. Japan, 1998. 71, 1101). (схема 3)
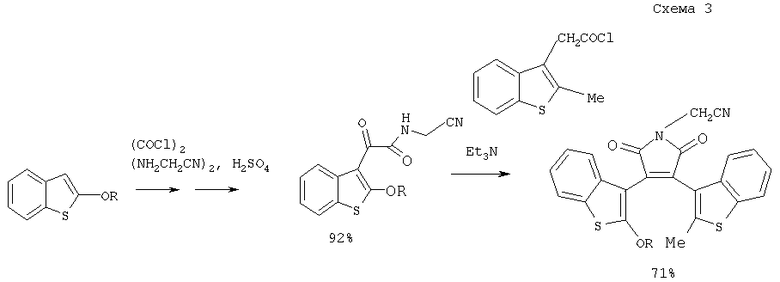
Недостатком этого способа является многостадийность и необходимость сложного синтеза исходных реагентов, что также затрудняет получение целого ряда 3,4-диарил(гетарил)малеимидов.
Другой способ синтеза, примененный к получению природных алкалоидов - полицитринов А и В
заключается в окислении соответствующих 3,4-диарилпиррол-2,5-дикарбоновых кислот (схема 4), которые в свою очередь получаются окислительной димеризацией арилпировиноградных кислот с последующим замыканием пиррольного цикла с аммиаком (Terpin A., Polborn К., Steglich W., Tetrahedron, 1995, 51 (36), 9941).
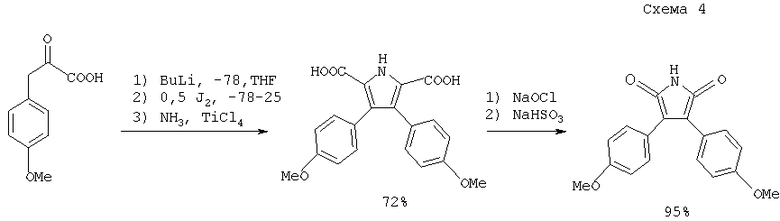
К недостатку указанного способа синтеза относится трудная доступность исходных арилпировиноградных кислот. Кроме того, этим способом могут быть получены только симметричные продукты.
Производные 3,4-ди(3-индолил)-малеимидов получают реакцией 3,4-дихлор- или 3,4-диброммалеимидов с N-MgBr-индолами (Faul M.M., Sullivan K.A., Winneroski L.L., Synthesis, 1995, 1511) в смеси толуола с эфиром и ТГФ (5:1:1). Однако этот способ пригоден лишь для N-MgBr-производных индола, для которых характерно протекание замещения с переносом реакционного центра в положение 3 индольного цикла. Для других ароматических и гетероароматических производных такая реакция неосуществима.
Известен также способ синтеза 3,4-ди(2,5-диметил-3-тиенил)-1-бутилмалеимида взаимодействием 2,5-диметилтиофена с дихлоридом квадратной кислоты в условиях реакции Фриделя-Крафтса и окислении полученного циклобутен-1,2-диона перекисью водорода по Байеру-Виллигеру (Ширинян В.З., Краюшкин M.M., Беленький Л.И., Воронцова Л.Г., Старикова З.А., Мартынкин А.Ю., Иванов В.Л., Ужинов Б.М., ХГС, 2001, с.81, Краюшкин M.M., Ширинян В.З., Беленький Л.И., Шадронов А.Ю., Воронцова Л.Г., Старикова З.А., Изв. АН сер. хим., 2002 (8), с.1392).
Последующее взаимодействие полученного малеинового ангидрида с аминами приводит к получению конечного продукта (Краюшкин M.M., Ширинян В.З., Беленький Л.И., Шимкин А.А., Мартынкин А.Ю., Ужинов Б.М., Ж. орган. химии 2002, 38, 1390) (схема 5)
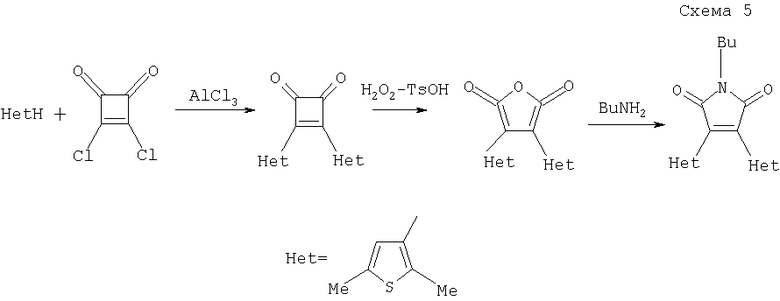
К недостаткам этого способа следует отнести необходимость использования малодоступного дихлорида квадратной кислоты, а также недостаточная стабильность промежуточных циклобутен-1,2-дионов, что затрудняет получение других 3,4-диарил(гетарил)-малеимидов.
Целью данного изобретения является получение новых производных 3,4-диарил(гетарил)-малеимидов, которые могут найти применение в качестве фотохромов, удобным и доступным способом с высоким выходом.
Заявленный способ получения 3,4-диарил(гетарил)-малеимидов заключается во взаимодействии арил(гетарил)-бороновой кислоты с легкодоступным N-замещенным 3,4-диброммалеимидом или 3-бром-4-арил(гетарил)малеимидом с использованием в качестве катализатора комплекса палладия в присутствии основания в среде растворителя. В литературе неизвестен аналогичный способ получения ди-арил(гетарил)малеимидов из дибром- или дихлормалеимидов. В общем виде этот способ изображен на схеме 6
Схема 6
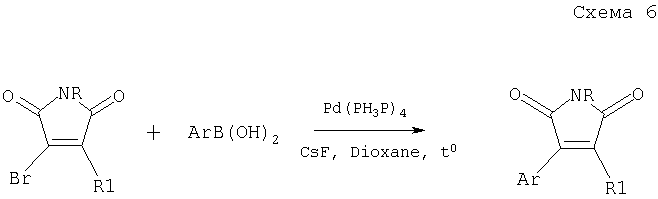
где R=С1-С4-алкил или бензил или фенил.
R1=Br или арил, такой как фенил или нафтил, замещенные алкилом, алкокси-, или галогеном; гетарил, незамещенный или замещенный, такой как тиенил, бензотиенил-, фурил-, бензофурил- пирролил-, или индолил-, где заместителями являются алкил, алкокси-, алкилтио-, атом галогена или трифторметил.
Ar= арил, такой как фенил или нафтил, замещенный алкилом, алкокси- или галогеном; гетарил, незамещенный или замещенный, такой как тиенил-, бензотиенил-, фурил, бензофурил- пирролил- или индолил-, где заместителями являются алкил, алкокси-, алкилтио-, атом галогена или трифторметил, за исключением 3,4-ди(2,5-диметил-3-тиенил)-1-бутилмалеимида,
3,4-Диброммалеимиды являются легкодоступными веществами и получаются бромированием малеимида или N-замещенных малеимидов с высокими выходами (Choi D.S., Huang S., Huang M., Barnard T.S., Adams R.D., Seminario J.M., Tour J.M, J.Org. Chem., 1998, 63, 2646).
Арил(гетарил)бороновые кислоты также легко получаются из соответствующих реактивов Гриньяра или литийорганических соединений действием триалкилборатов. Многие из бороновых кислот являются готовыми реактивами.
Оптимальным соотношением дибромида и бороновой кислоты является небольшой избыток бороновой кислоты - от 2,1 до 2,2 моля бороновой кислоты на моль дибромида.
В качестве катализатора в этой реакции используют комплексные соединения палладия, такие, например, как тетракис(трифенилфосфин) палладий. Пригодны также и другие комплексы палладия, в том числе и такие, которые не чувствительны к кислороду воздуха, например, палладацикл, полученный из Li2PdCl4 и N,N-дициклогексилфурилтиоамида, строения (7) (Xiong Z., J.Org.Chem., 2004, 69 (19), 3337).
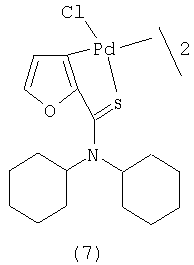
Количество катализатора берется до 4% мол., считая на моль дибромида. Меньшее количество катализатора приводит к уменьшению выхода, большее количество не влияет на выход и потому нецелесообразно.
В качестве основания в этой реакции могут быть использованы карбонаты, гидрокарбонаты и фосфаты щелочных металлов - натрия, калия, цезия, однако наилучшие результаты дает фторид цезия.
В таблице показана зависимость выхода конечного продукта от основания на примере реакции N-бутил-3,4-диброммалеимида с 2-метилбензотиенил-3-бороновой кислотой
Весьма существенным является количество основания. Установлено, что его количество не должно быть меньше 2,5-молей для 3-бром-4-арил(гетарил)-малеимида и меньше 5 молей на моль для 3,4-диброммалеимида, в противном случае выход резко снижается.
В качестве растворителя пригодны такие растворители, как простые диалкиловые эфиры, диметоксиэтан, циклические эфиры, такие как тетрагидрофуран и диоксан, ацетонитрил, диметилсульфоксид. Наиболее подходящим растворителем, позволяющим проводить реакцию с оптимальными выходами, оказался диоксан, из которого удаляют кислород путем неоднократного охлаждения под вакуумом и размораживания под инертным газом.
Эти условия проведения реакции являются оптимальными и для получения смешанных 3,4-диарил(гетарил)малеимидов, исходя из 3-бром-4-арил(гетарил)малеимидов.
Так, например, 3-бром-4-(N-трет.бутоксикарбонил-2-метил-3-индолил)-N-бутилмалеимид(8) при взаимодействии с арилбороновыми кислотами дает смешанные дигетарилмалеимиды (10-12). Аналогично из монобромида (9) образуется малеимид (13) (схема 7)
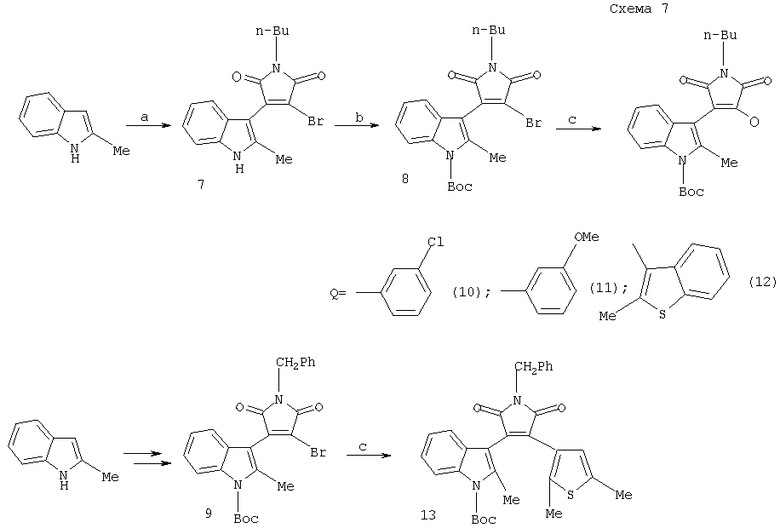
a.) LiN(SiMe3)2, THF, then 2 or 3,4-дибромо-1-бензилмалеимид. b.) Boc2O, DMAP, THF. c.) 1,15 mol ArB(OH)2, 4 mol% Pd (Ph3Р)4, 4 mol CsF.
DMAP - 4-диметиламинопиридин
Boc - трет.бутоксикарбонил
THF - тетрагидрофуран
В реакции используется небольшой избыток (1.1-1,2 - моля на моль) арилбороновой кислоты ArBr(ОН)2 по отношению к монобромидам 8 и 9. Количество катализатора, в качестве которого обычно берется тетракис-трифенилфосфинпалладий, не превышает 4% мол. Реакция проводится также в таком растворителе, как диоксан, в присутствии основания. Оптимальным основанием в этом случае также является фторид цезия CsF, количество которого оказывает существенное влияние на выход. Его необходимо брать не менее 2,5 молей на моль бромида.
Изобретение иллюстрируется следующими примерами, которыми не ограничивается существо заявки.
Пример 1
2-метилбензотиофен-3-бороновая кислота (1).
К раствору 2-метил-3-бромбензотиофена (8.6 г, 37 ммоль) в 100 мл ТГФ при -78°С, в атмосфере аргона, добавляют 27 мл 1.6 М раствора n-BuLi в гексане. Перемешивают при этой температуре 15 мин и затем в один прием добавляют 15.3 мл (13.07 г, 56 ммоль) трибутилбората. Перемешивают еще 1 час при -78°С, убирают охлаждающую баню и оставляют на ночь. Добавляют 5 мл МеОН, после чего упаривают реакционную смесь на роторном испарителе, следя, чтобы температура бани не поднималась выше +50°С. Добавляют 100 мл Et2O и, при охлаждении льдом, смесь 5 мл концентрированной HCl и 35 мл воды. Перемешивают 1 час. Отделяют эфирный слой, а водную фазу экстрагируют Et2O (3×20 мл). Объединенные эфирные фазы промывают водой, а затем 5% NaOH (4×20 мл). Щелочной раствор промывают Et2O (2×20 мл), охлаждают льдом до -5°С и подкисляют при перемешивании 10 мл концентрированной HCl. Выделившуюся бороновую кислоту отфильтровывают, промывают небольшим количеством воды и высушивают в эксикаторе. Выход 5.81 г (80%). Вещество не обладает четкой температурой плавления и, согласно данным ПМР и масс-спектров, представляет собой циклический тримерный ангидрид (2-метилбензотиофен-3-бороксин).
1H NMR (300 MHz) (здесь и далее в CDCl3) δ 3.05 (s, 3H), 7.23-7.43 (m, 3H), 8.55 (d, J=7.8 Hz, 1H).
MS m/z: 523 (M+1); 522 (M+); 173; 148; 147.
Найдено: С, 62.42; Н, 4.43; S, 18.50%. С27Н21В3О3S3. Вычислено: С, 62.12; Н, 4.05; S, 18.42%.
Пример 2
2,5-Диметил-3-тиенилбороновая кислота (1a).
Получают из 2,5-диметил-3-йодтиофена описанным выше способом с выходом 76%. Т.пл. 180-183°С. Согласно данным ПМР и масс-спектров существует в виде циклического тримерного ангидрида.
1H NMR (250 MHz) δ 2.45 (s, 3H), 2.82 (s, 3H), 7.09 (s, 1H).
MS m/z: 416 (M+3), 415 (M+2), 414 (M+1), 413 (M+), 137, 111.
Найдено: С, 52.32; Н, 5.23; S, 23.50%. С18H21В3О3S3. Вычислено: С, 52.22; Н, 5.11; S23.23%.
Пример 3
Кросс-сочетание бороновых кислот с 3,4-дибром-1-бутилмалеимидом; общая методика.
В трехгорлую круглодонную колбу, снабженную обратным холодильником и вводом аргона, помещают 3,4-дибромо-1-бутилмалеимид (2), бороновую кислоту (2.2 моль на 1 моль дибромида), 4 мол.% Pd(Ph3Р)4, CsF (5 моль на 1 моль дибромида), 1,4-диоксан (100 мл/1 г бороновой кислоты). Реакционную смесь кипятят в атмосфере аргона, при интенсивном перемешивании на магнитной мешалке, в течение указанного времени, после чего выливают в воду, экстрагируют CHCl3, промывают органическую фазу водой, высушивают Na2SO4, отгоняют хлороформ на роторном испарителе. Остаток очищают с помощью флэш-хроматографии на SiO2
Пример 4
3,4-ди (2-метил-3-бензотиенил)-1-бутилмалеимид (3).
Получают из 2-метил-бензотиофен-3-бороновой кислоты (1) (2.0 г, 11 ммоль), 3,4-дибром-1-бутилмалеимида (2) (1.62 г, 5.2 ммоль), CsF (3.95 г, 26 ммоль), Pd(Ph3Р)4 (0.24 г) в 200 мл диоксана. Реакционную смесь кипятят 4 часа. Продукт выделяют в виде оранжевых кристаллов, после затирания с Et2O остатка, полученного упариванием хлороформного экстракта. Промывают холодным Et2O и высушивают в эксикаторе. Выход 1.77 г (76%). Т.пл. 172-173°С.
1H NMR (300 MHz) δ 1.02 (t, J=8.5 Hz, 3H), 1.40-1.56 (m, 2H), 1.70-1.83 (m, 2H), 2.08 (s, 3H), 2.28 (s, 3H), 3.74 (t, J=8.2Hz, 2H), 7.06 (t, J=9.1 Hz, 1H), 7.15-7.35 (m, 4H), 7.45 (d, J=7.4Hz, 1H), 7.64-7.72 (m, 2H).
MS m/z: 447 (M+2); 446(M+1); 445(M+); 384; 318; 56; 43.
Найдено: С, 70.30; Н, 5.27; N, 3.35%. С26Н23NO2S2. Вычислено: С, 70.08; Н, 5.20; N, 3.14%.
Пример 5
3,4-ди(3-хлорфенил)-1-бутилмалеимид (5).
Получают из 3-хлорфенилбороновой кислоты (0.55 г, 3.5 ммоль), 3,4-дибром-1-бутилмалеимида (2) (0.5 г, 1.6 ммоль), CsF (1.22 г, 8.0 ммоль), Pd(Ph3P)4 (0.075 г) в 40 мл диоксана. Реакционную смесь кипятят 30 мин. Продукт выделяют в виде лимонно-желтых кристаллов, после затирания с Et2O остатка, полученного упариванием хлороформного экстракта. Промывают холодным Et2O и высушивают в эксикаторе. Выход 0.58 г (96%). Тпл 92-95°С.
1H NMR (300 MHz) δ 0.96 (t, J=8.5 Hz, 3H), 1.34-1.48 (m, 2H), 1.62-1.73 (m, 2H), 3.66 (t, J=8.3 Hz, 2H), 7.29-7.35 (m, 2H), 7.35-7.42 (m, 1Н), 7.52 (s, 1Н).
MS m/z: 375 (М+2); 374 (М+1); 373 (М+); 331; 246; 176; 56.
Найдено: С, 64.28; Н, 4.27; N, 3.65%. С20Н17Cl2NO2. Вычислено: С, 64.18; Н, 4.58; N, 3.74%.
Пример 6
3,4-ди (4-метоксифенил)-1-бутилмалеимид (6).
Получают из 4-метоксифенилбороновой кислоты (0.53 г, 3.4 ммоль), 3,4-дибром-1-бутилмалеимида (2) (0.5 г, 1.6 ммоль), CsF (1.22 г, 8.0 ммоль), Pd(Ph3Р)4 (0.075 г) в 40 мл диоксана. Реакционную смесь кипятят 1.5 часа. После хроматографии на SiO2 (гексан - EtOAc 6/1) получают 0.57 г (98%) продукта в виде светло-желтых кристаллов. Тпл 110-114°С.
1H NMR (300 MHz) δ 0.97 (t, J=8.5Hz, 3H), 1.34-1.46 (m, 2H), 1.62-1.73 (m, 2H), 3.64 (t, J=8.3Hz, 2H), 3.84 (s, 6H), 6.87 (d, J=10.0Hz, 4H), 7.49 (d, J=10.1Hz, 4H).
MS m/z: 366 (M+1); 365 (M+); 238; 223; 152; 133; 43.
Найдено: С, 72.28; Н, 6.27; N, 3.65%. С22Н23NO4. Вычислено: С, 72.31; Н, 6.33 N 3.83%.
Пример 7
3-(2-метил-3-индолил)-4-бром-1-бутилмалеимид (7).
К раствору 2-метилиндола (1.01 г, 7.7 ммоль) в 24 мл THF, добавляют по каплям 16 мл 20% раствора LiN(SiMe3)2 в THF. Раствор перемешивают 15 мин при этой температуре, после чего при -20°С, в Ar атмосфере, добавляют по каплям раствор 3,4-дибромо-1-бутилмалеимида (2.4 г, 7.7 ммоль) в 24 мл THF. Реакционной смеси дают дойти до комнатной температуры, выливают в 90 мл 0.2 н HCl, экстрагируют EtOAc (3×30 мл). Органическую фазу промывают 5% NaHCO3 (30 мл), водой (3×20 мл), насыщенным раствором NaCl, высушивают MgSO4. После отгонки растворителя получают 2.55 г (92%) 3-(2-метил-3-индолил)-4-бромо-1-бутилмалеимида в виде хроматографически чистого (ТСХ, гексан-этилацетат 4/1) темно-красного масла.
1H NMR (300 MHz) δ 0.96 (t, J=6.6 Hz, 3H), 1.32-1.48 (m, 2H), 1.62-1.77 (m, 2H), 2.49 (s, 3H), 3.67 (t, J=7.5Hz, 2H), 7.15-7.25 (m, 2H), 7.31 (t, J=10Hz, 1H), 7.49 (d, J=7.7Hz, 1Н), 8.44 (уш.с., 1Н).
MS m/z: 363 (M+2); 362 (M+1); 361 (M+); 262; 182; 154; 108; 57.
Найдено: С, 56.42; Н, 4.53; N, 7.59%. C17H17BrN2O2. Вычислено: С, 56.52; Н, 4.74; N, 7.75%.
Пример 8
3-(1-трет.-бутоксикарбонил-2-метил-3-индолил)-4-бром-1-бутилмалеимид (8).
К раствору 3-(2-метил-3-индолил)-4-бром-1-бутилмалеимида (2.5 г, 7 ммоль) в 100 мл THF добавляют 50 мг4-диметиламинопиридина и, по каплям, в течение 10 мин раствор Вос2O (2.0 г, 9.1 ммоль) в 20 мл THF. Реакционную смесь перемешивают при комнатной температуре до исчезновения исходного продукта (ТСХ, гексан-этилацетат 4/1) - 1 час. THF отгоняют на роторном испарителе, к остатку добавляют 10 мл МеОН и трут стеклянной палочкой до начала кристаллизации. Потом добавляют 10 мл МеОН и интенсивно перемешивают на магнитной мешалке 5 ч. Желтый осадок продукта отфильтровывают и промывают небольшим количеством холодного МеОН. После высушивания в эксикаторе получают 3.03 г (95%) 3-(1-трет.-бутоксикарбонил-2-метил-3-индолил)-4-бром-1-бутилмалеимида в виде ярко желтого порошка с т.пл 90-94°С.
1H NMR (250 MHz) δ 0.96 (t, J=8.6 Hz, 3H), 1.30-1.47 (m, 2H), 1.59-1.69 (m, 2H), 1.70 (s, 9Н), 2.58 (s, 3H), 3.67 (t, J=7.7 Hz, 2H), 7.20-7.35 (m, 3H), 8.12 (d, J=7.9 Hz, 1H).
MS m/z: 461 (M+); 406; 361; 281; 182; 154:57.
Найдено: С, 57.40; Н, 5.57; N, 6.29%. C22H25BrN2O4: Вычислено:: С, 57.28; Н, 5.46; N, 6.07%.
Пример 9
3-(1-трет.-бутоксикарбонил-2-метил-3-индолил)-4-бром-1-бензилмалеимид (9).
К раствору 2-метилиндола (2.62 г, 20 ммоль) в 70 мл THF при -20°С, в атмосфере аргона, добавляют по каплям 42 мл 20% раствора LiN(SiMe3)2 в THF. Раствор перемешивают 30 мин при этой температуре, после чего добавляют по каплям раствор 3,4-дибром-1-бензилмалеимида (7.0 г, 20 ммоль) в 70 мл THF. Реакционной смеси дают дойти до комнатной температуры, выливают в 200 мл 0.2 н. HCl, экстрагируют этилацетатом (3×50 мл). Органическую фазу промывают 5% NaHCO3 (50 мл), водой (3×30 мл), насыщенным раствором NaCl, высушивают MgSO4. Упаривают растворитель на роторном испарителе, остаток растворяют в 100 мл THF добавляют 0.1 г 4-диметиламинопиридина и по каплям, в течение 10 мин раствор Вос2O (5.0 г, 23 ммоль) в 30 мл THF. Реакционную массу перемешивают 1 час, упаривают на роторном испарителе. После флэш-хроматографии на SiO2 (гексан - EtOAc, 10/1) получают 7.0 г (70%) 3-(1-трет.-бутоксикарбонил-2-метил-3-индолил)-4-бром-1-бензилмалеимида в виде светло-желтых кристаллов с Т.пл 150-154°С.
1H NMR (250 MHz) δ 1.71 (s, 9H), 2.58 (s, 3H), 4.82 (s, 2H), 7.20-7.50 (m, 8H), 8.12 (d, J=7.9Hz, 1H).
MS m/z: 497 (M+2); 496(М+1); 495 (М+); 395; 91; 57.
Найдено: С, 60.62; Н, 4.55; N, 5.47%. С25Н23BrN2O4. Вычислено: С, 60.62; Н, 4.68; N, 5.65%.
Пример 10
Кросс-сочетание бороновых кислот с 3-(1-трет.-бутоксикарбонил-2-метил-3-индолил)-4-бром-1-бутил(1-бензил)малеимидами, общая методика.
В трехгорлую круглодонную колбу, снабженную обратным холодильником и вводом аргона, помещают 3-(1-трет.-бутоксикарбонил-2-метил-3-индолил)-4-бром-1-бутилмалеимид (8), (или 3-(1-трет.-бутоксикарбонил-2-метил-3-индолил)-4-бром-1-бензилмалеимид (9)), бороновую кислоту (1.15 моль на 1 моль бромида), 4 мол.% Pd(Ph3P)4, CsF (4 моль на 1 моль бромида), 1,4-диоксан (100 мл/ 1 г бороновой кислоты). Реакционную смесь кипятят в атмосфере аргона при интенсивном перемешивании на магнитной мешалке в течение указанного времени, после чего выливают в воду, экстрагируют CHCl3, промывают органическую фазу водой, высушивают Na2SO4, отгоняют хлороформ на роторном испарителе. Остаток очищают с помощью флэш-хроматографии на SiO2.
Пример 11
3-(1-трет.-бутоксикарбонил-2-метил-3-индолил)-4-(3-хлорфенил)-1-бутилмалеимид (10).
Получают из 3-хлорфенилбороновой кислоты (0.16 г, 1.0 ммоль), малеимида (8) (0.42 г, 0.9 ммоль), CsF (0.57 г, 3,6 ммоль), Pd(Ph3Р)4 (0.04 г) в 20 мл диоксана. Реакционную смесь кипятят 1 час. После хроматографии на SiO2 (гексан - EtOAc 14/1) получают 0.32 г (71%) продукта в виде оранжевого масла.
1H NMR (250 MHz) δ 0.96 (t, J=8.0Hz, 3Н), 1.39-1.50 (м, 2Н), 1.60-1.79 (м, 2Н), 1.70 (с, 9Н), 2.42 (с, 3Н), 3.70 (т, J=8.0Hz, 2Н), 6.92-7.40 (м, 6Н), 7.70 (с, 1Н), 8.12 (д, J=8.9 Hz, 1H).
MS m/z: 492 (М+); 395; 394; 393; 392; 265; 131; 57; 43.
Найдено: С, 68.41; Н, 5.70; N, 5.54%. C28H29CIN2O4. Вычислено: С, 68.22; Н, 5.93; N, 5.68%.
Пример 12
3-(1-трет.-бутоксикарбонил-2-метил-3-индолил)-4-(3-метоксифенил)-1-бутилмалеимид (11).
Получают из 3-метоксифенилбороновой кислоты (0.16 г, 1 ммоль), 3-(1-трет.-бутоксикарбонил-2-метил-3-индолил)-4-бром-1-бутилмалеимида (8) (0.42 г, 0.9 ммоль), CsF (0.57 г, 3,6 ммоль), Pd(Ph3P)4 (0.04 г) в 20 мл диоксана. Реакционную смесь кипятят 2 часа. После хроматографии на SiO2 (гексан - EtOAc 10/1) получают 0.4 г (90%) продукта в виде оранжевого масла.
1H NMR (250 MHz) δ 0.96 (t, J=8.0Hz, 3Н), 1.37-1.49 (m, 2H), 1.61-1.75 (m, 2H), 1.69 (s, 9H), 2.41 (s, 3Н), 3.51 (s, 3Н), 3.69 (t, J=8.0Hz, 2H), 6.85 (m, 1H), 6.97-7.29 (m, 7H), 8.12 (d, J=9.0 Hz, 1H).
MS m/z: 489 (M+1); 488 (M+); 389; 388; 365; 372; 261; 218; 133; 57; 43.
Найдено: С, 71.35; Н, 6.76; N, 5.65%. С29Н32N2O5. Вычислено: С, 71.29; Н, 6.60; N, 5.73%.
Пример 13
3-(1-трет.-бутоксикарбонил-2-метил-3-индолил)-4-(2-метил-3-бензотиенил)-1-бутилмалеимид (12).
Получают из 2-метил-бензотиофен-3-бороновой кислоты (1) (1.09 г, 6.2 ммоль), 3-(1-трет.-бутоксикарбонил-2-метил-3-индолил)-4-бром-1-бутилмалеимида (8) (2.507 г, 5.4 ммоль), CsF (3.80 г, 25 ммоль), Pd(Ph3Р)4 (0.25 г) в 200 мл диоксана.
Реакционную смесь кипятят 5 часов. После хроматографии на SiO2 (гексан - EtOAc 14/1) получают 2.40 г (83%) продукта в виде оранжевого масла.
1H NMR (250 MHz) δ 1.02 (t, J=8.5 Hz, 3H), 1.39-1.51 (m, 2H), 1.65 (s, 9H), 1.69-1.83 (m, 2H), 2.12-2.40 (три уш.с, 6Н), 3.74 (t, J=8.0Hz, 2H), 7.10-7.45 (m, 6H), 7.15-7.35 (m, 4H), 7.69 (d, J=8.9Hz, 1H), 8.02 (s, J=9.0 Hz, 2H).
MS m/z: 528 (M+); 472; 429; 315; 286; 101.
Найдено: С, 70.30; Н, 6.27; N, 5.35%. С31Н32N2O4S. Вычислено: С, 70.43; Н, 6.10; N, 5.30%.
Пример 14
3(1-трет.-бутоксикарбонил-2-метил-3-индолил)-4-(2,5-диметил-3-тиенил)-1-бензилмалеимид (13).
Получают из 2,5-диметил-3-тиенилбороновой кислоты (0.95 г, 6.1 ммоль), 3-(1-трет.-бутоксикарбонил-2-метил-3-индолил)-4-бром-1-бензилмалеимида (9) (2.57 г, 5.2 ммоль), CsF (3.2 г, 21 ммоль), Pd(Ph3Р)4 (0.24 г) в 150 мл диоксана. Реакционную смесь кипятят 2 часа. После флэш-хроматографии на SiO2 (гексан - Et2O, 10/1) получают 2.32 г (85%) продукта 13 в виде светло-желтых кристаллов с Т.пл. 130-135°С.
1H NMR (250 MHz) δ 1.69 (s, 9H), 1.79 (s, 3H), 2.36 (s, 3H), 2.39 (s, 3H), 4.82 (s, 2H), 6.80 (s, 1H), 7.0-7.40 (m, 6H), 7.48 (d, J=6.5 Hz, 2H), 8.09 (d, J=7.2Hz, 1H).
MS m/z: 527 (M+1); 526 (M+); 427; 91.
Найдено: С, 70.56; Н, 5.76; N, 5.55%. С31Н30N2O4S. Вычислено:: С, 70.70; Н, 5.74; N, 5.32%.
Заявляемый способ получения диарил(гетарил)малеимидов позволяет получить соединения, обладающие фотохромными свойствами. Так, например, 3,4-ди(2-метил-3-бензотиенил)-1-бутилмалеимид (3) и 3-(2-трет.-бутоксикарбонил-3-индолил)-4-(2-метил-3-бензотиенил)-1-бутилмалеимид (12) претерпевают термически необратимую, но фотохимически обратимую циклизацию при облучении УФ-светом с длиной волны 330 нм. Обратный переход происходит при действии света с длиной волны 550 нм (см. чертеж). Такой переход может быть осуществлен многократно, что позволяет использовать этот процесс для записи информации.
| название | год | авторы | номер документа |
|---|---|---|---|
| АМИНОСПИРТОВЫЕ ПРОИЗВОДНЫЕ | 2005 |
|
RU2399614C2 |
| ПЕПТИДНЫЕ МАКРОЦИКЛЫ ПРОТИВ ACINETOBACTER BAUMANNII | 2016 |
|
RU2729609C2 |
| БИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, СПОСОБ ПОДАВЛЕНИЯ СЛИПАНИЯ ТРОМБОЦИТОВ И КОМПОЗИЦИЯ ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1996 |
|
RU2169146C2 |
| СОЕДИНЕНИЯ ДИГИДРОПИРИМИДИН-2-ОНА И ИХ МЕДИЦИНСКОЕ ПРИМЕНЕНИЕ | 2015 |
|
RU2770061C2 |
| АРИЛСУЛЬФОНИЛМЕТИЛЬНЫЕ ИЛИ АРИЛСУЛЬФОНАМИДНЫЕ ПРОИЗВОДНЫЕ АРОМАТИЧЕСКИХ СОЕДИНЕНИЙ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ЛЕЧЕНИЯ РАССТРОЙСТВ, ВОСПРИИМЧИВЫХ К ЛЕЧЕНИЮ ЛИГАНДАМИ ДОФАМИНОВЫХ D РЕЦЕПТОРОВ, С ИХ ПОМОЩЬЮ | 2005 |
|
RU2442781C2 |
| БИ-АРИЛ-МЕТА-ПИРИМИДИНОВЫЕ ИНГИБИТОРЫ КИНАЗ | 2006 |
|
RU2597364C2 |
| БИ-АРИЛ-МЕТА-ПИРИМИДИНОВЫЕ ИНГИБИТОРЫ КИНАЗ | 2006 |
|
RU2589878C2 |
| ЗАМЕЩЕННЫЕ [1,2,4]ТРИАЗОЛО[4,3-a]ПИРИДИНЫ, ПРОЯВЛЯЮЩИЕ СВОЙСТВА АНТАГОНИСТОВ АДЕНОЗИНОВЫХ А2А РЕЦЕПТОРОВ, И ИХ ПРИМЕНЕНИЕ | 2013 |
|
RU2534804C1 |
| ПЕРВИЧНЫЕ КАРБОКСАМИДЫ В КАЧЕСТВЕ ИНГИБИТОРОВ BТK | 2014 |
|
RU2708395C2 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ОСНОВЕ ПРОИЗВОДНЫХ 4-ЗАМЕЩЕННЫХ-3-(3-ДИАЛКИЛАМИНОМЕТИЛ-ИНДОЛ-1-ИЛ)МАЛЕИМИДОВ | 2006 |
|
RU2388759C2 |
Изобретение относится к способу получения 3,4-диарил(гетарил)малеимидов формулы (I)
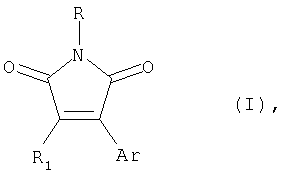
где R=C1-С4-алкил или бензил или фенил; R1=Br или арил, такой как фенил или нафтил, замещенные алкилом, алкокси-, или галогеном; гетарил, незамещенный или замещенный, такой как тиенил, бензотиенил-, фурил-, бензофурил- пирролил-, или индолил-, где заместителями являются алкил, алкокси-, алкилтио-, атом галогена или трифторметил; Ar = арил, такой как фенил или нафтил, замещенный алкилом, алкокси- или галогеном; гетарил, незамещенный или замещенный, такой как тиенил-, бензотиенил-, фурил, бензофурил- пирролил- или индолил-, где заместителями являются алкил, алкокси, алкилтио-, атом галогена или трифторметил, за исключением 3,4-ди(2,5-диметил-3-тиенил)-1-бутилмалеимида,отличающийся тем, что арил(гетарил)бороновая кислота, формулы ArB(ОН)2 (II), где Ar имеет вышеуказанные значения, подвергают взаимодействию с N-замещенным 3,4-диброммалеимидом формулы (III)
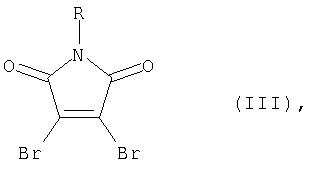
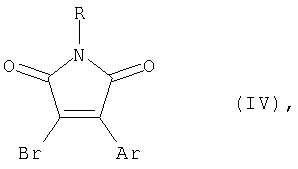
или N-замещенным 3-бром-4-арил(гетарил)малеимидом формулы (IV), где R и Ar имеют вышеуказанные значения, с использованием палладиевого катализатора в присутствии основания в среде органического растворителя, а также к ряду новых производных 3,4-диарил(гетарил)малеимидов, которые обладают фотохромными свойствами. 2 н. и 5 з.п. ф-лы, 2 ил.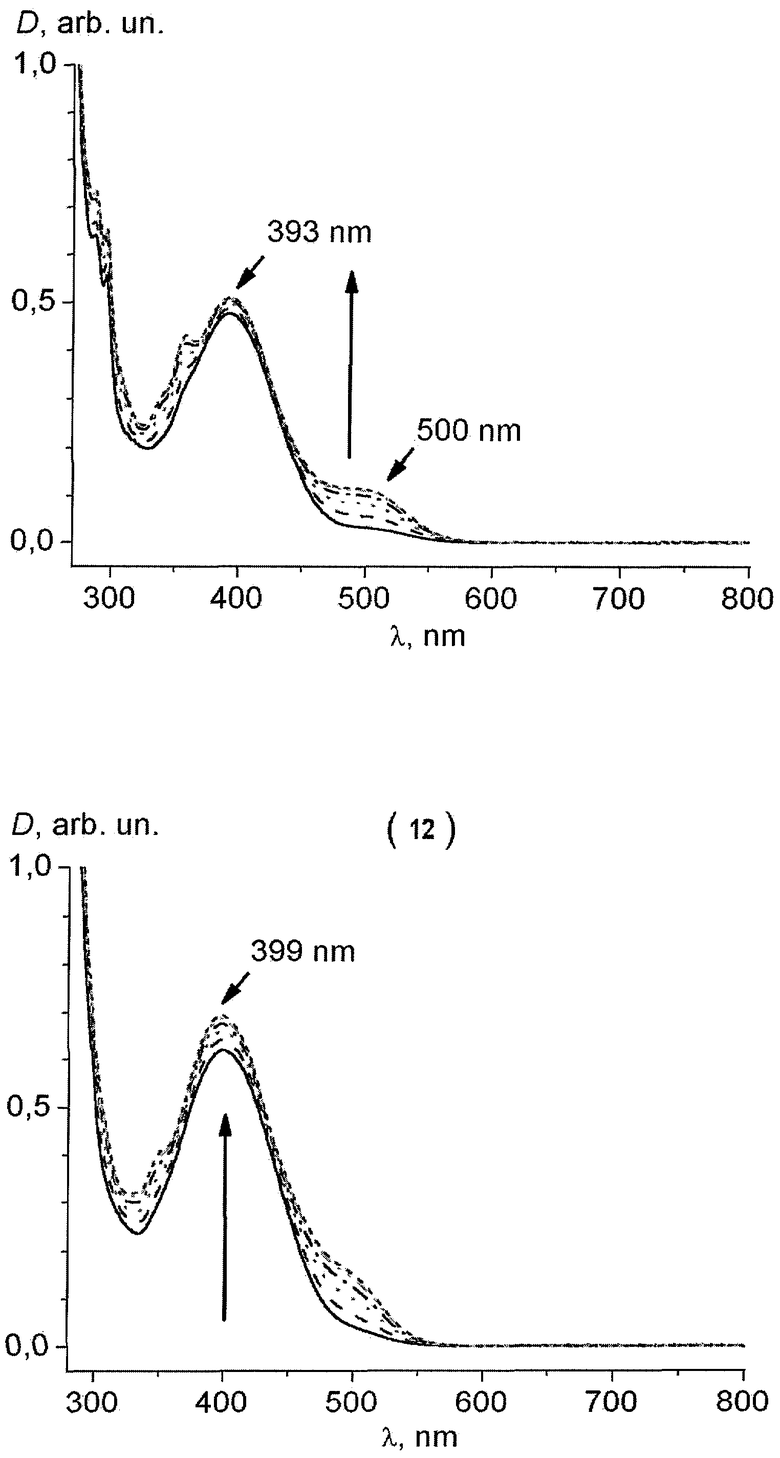
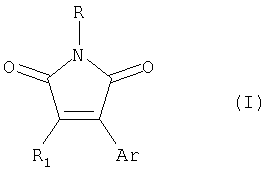
где R - C1-С4-алкил или бензил, или фенил;
R1 - Br или арил, такой, как фенил или нафтил, замещенные алкилом, алкокси- или галогеном; гетарил, незамещенный или замещенный, такой, как тиенил, бензотиенил-, фурил-, бензофурил-, пирролил- или индолил-, где заместителями являются алкил, алкокси-, алкилтио-, атом галогена или трифторметил;
Ar - арил, такой, как фенил или нафтил, замещенный алкилом, алкокси- или галогеном; гетарил, незамещенный или замещенный, такой, как тиенил-, бензотиенил-, фурил, бензофурил-пирролил- или индолил-, где заместителями являются алкил, алкокси-, алкилтио-, атом галогена или трифторметил, за исключением 3,4-ди(2,5-диметил-3-тиенил)-1-бутилмалеимида,
отличающийся тем, что арил(гетарил)бороновая кислота формулы
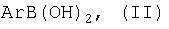
где Ar имеет вышеуказанные значения,
подвергают взаимодействию с N-замещенным 3,4-диброммалеимидом формулы (III)
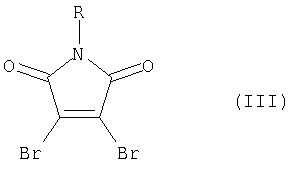
или N-замещенным 3-бром-4-арил(гетарил)малеимидом формулы (IV)
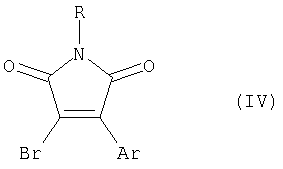
где R и Ar имеют вышеуказанные значения,
с использованием палладиевого катализатора в присутствии основания в среде органического растворителя.
| Краюшкин М.М | |||
| и др., ЖорХ, 2002, 38, с.1380 | |||
| Yamaguchi Т | |||
| et al, JACS, 1997, 119, с.6066 | |||
| Faul М.М | |||
| et al, Synthesis, 1995, c.81 | |||
| EP 1236716 A1, 04.09.2002 | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Способ получения @ -замещенных 3-циклоалкилсульфонилпирролидиндионов-2,5 | 1981 |
|
SU1156594A3 |
Авторы
Даты
2006-06-27—Публикация
2005-02-04—Подача