Область техники
Настоящее изобретение относится к микробиологической промышленности, в частности к способу продукции аминокислот. В частности, настоящее изобретение касается использования нового фермента, устойчивого к ингибированию по принципу обратной связи, вовлеченного в биосинтез цистеина. Более конкретно, настоящее изобретение касается нового мутантного фермента серинацетилтрансферазы, штаммов E.coli, содержащих этот фермент, и способа продукции L-цистеина методом ферментации с использованием этих штаммов.
Описание предшествующего уровня техники
Традиционно L-аминокислоты получают в промышленном масштабе методом ферментации с использованием штаммов микроорганизмов, полученных из природных источников или их мутантов, специально модифицированных для увеличения продукции L-аминокислот.
Для увеличения продукции L-аминокислот обычно используется, например, амплификация генов биосинтеза путем трансформации микроорганизма рекомбинантной ДНК (смотри, например, патент США 4,278,765). Подобные методики основаны на увеличении активностей ферментов, вовлеченных в биосинтез аминокислот, и/или устранении чувствительности целевого фермента к ингибированию продуцируемой аминокислотой или ее побочными продуктами по принципу обратной связи (смотри, например, выложенную заявку Японии №56-18596 (1981), заявку РСТ 95/16042 или патенты США 5,661,012 и 6,040,160).
Биосинтез L-цистеина из L-серина в клетках бактерии Е.coli катализируется ферментом сериновой ацетилтрансферазой, кодируемой геном cysE и изозимами А и В O-ацетилсеринтиоллиазы, кодируемые генами cysK и cysM соответственно. Серинацетилтрансфераза (SAT; EC2.3.1.30) катализирует образование О-ацетил-L-серина из ацетил-СоА и L-серина и играет регуляторную роль в процессе биосинтеза цистеина благодаря способности к ингибированию по принципу обратной связи L-цистеином (Escherichia coli and Salmonella, Second Edition, Editor in Chief: F.C.Neidhardt, ASM Press, Washington D.C, 1996).
Denk D. и Bock А. получили мутантную форму фермента SAT из Esherichia coli, менее чувствительную к ингибированию по принципу обратной связи, чем природная SAT (J.Gen.Microbiol., 1987, 133 (Pt 3), 515-25). Мутантный ген cysE отличался от природного гена заменой одного основания в положении 767, что приводило к замене метионина 256 на изолейцин в белке. Такой мутант экскретировал L-цистеин.
Как замена природного Met-256 остальными 19 аминокислотными остатками в SAT, кодируемой геном cysE из E.coli, так и введение терминирующего кодона для укорочения 256-273 С-концевой области белка приводит в большинстве случаев к возникновению фенотипа устойчивости к ингибированию по принципу обратной связи (fbr фенотип), при этом мутантные белки SAT обладают сниженным уровнем активности по сравнению с природной SAT (Nakamuri S. et al. AEM, vol.64, p.1607-1611, 1998). Штаммы, содержащие плазмиды с этими мутантными cysE генами, продуцируют до 200 мг/л смеси цистеина и цистина.
Многочисленные мутанты SAT из Е.coli, устойчивые к ингибированию по принципу обратной связи, были получены ПЦР рандомизированным мутагенезом.
Идентифицированные мутации распределялись по всей аминокислотной последовательности, при этом у всех полученных мутантных ферментов SAT уровень специфической активности был снижен по сравнению с активностью природного фермента (Takagi, H. et al, FEBS Lett., 1999, 452, 323-327).
Важная роль С-концевой области SAT в процессе ингибирования по принципу обратной связи L-цистеином была также показана Mino К. и др. (Biosci. Biotechnol. Biochem. 1999, 63, 1, 168-179). Укороченный фермент SAT, полученный из природной SAT путем делетирования 20 аминокислотных остатков с С-конца фермента, разрезанного между Ser253 и Met254, оказался менее чувствительным к ингибированию по принципу обратной связи в сравнении с природным ферментом SAT.
Также было показано, что L-цистеин может продуцироваться бактерией, принадлежащей к роду Escherichia и характеризующейся одновременно супрессированной системой деградации L-цистеина, как, например, цистеиндесульфогидраза со сниженной активностью в клетке, и наличием SAT с повышенной устойчивостью к ингибированию по принципу обратной связи, как, например, мутантная SAT с заменой одного аминокислотного остатка, соответствующего 256 аминокислоте - метионину в природной SAT, на другую аминокислоту (патентная заявка Японии JP 11155571 А2).
Описана мутантная сериновая ацетилтрансфераза со сниженной по сравнению с природным ферментом чувствительностью к ингибированию L-цистеином, содержащая мутации в следующих положениях аминокислотной последовательности - 97-100, 164-169, 237, 239-240, 245-259 и 267-269 или делеции в С-концевой области аминокислотной последовательности в положениях 237-240, 245-259 и 267-269 (патент США 6,218,168). Лучшими характеристиками обладает мутантная SAT, кодируемая двойным мутантным аллелем cysEXIV, имеющим замену А на G в позиции 721, что приводит к мутации - замене Thr167 на Аlа167, и замене ATG на TAG в позиции 988-990, приводящей к возникновению стоп-кодона вместо Met256, демонстрирующая высокую устойчивость к цистеину (Кi>1000 μM) в сочетании с относительно высокой активностью (0,453 μМ/мин × мг). Штамм JM15, трансформированный аллелем cysEXIV, продуцировал 2,3 г/л L-цистеина после 48 часов ферментационного feed-batch процесса. Но максимальная продукция L-цистеина (3,9 г/л) была получена у мутантного аллеля cysEDel_255 с укороченной С-концевой областью (18 аминокислот).
Как правило, ферменты с фенотипом устойчивости к ингибированию по принципу обратной связи (fbr) возникают в результате замены аминокислотного остатка в одном или нескольких местах аминокислотной последовательности и подобные замены приводят к понижению активности фермента.
Таким образом, недостатком мутантных ферментов, полученных подобным образом, является пониженная активность этих мутантных ферментов в сравнении с активностью природных ферментов.
Краткое описание изобретения
В настоящем изобретении описывается конструирование ферментов, устойчивых к ингибированию по принципу обратной связи и обладающих высокой активностью, играющих ключевую роль в биосинтезе цистеина в Е.coli.
В настоящем изобретении предлагается новый процесс получения большого количества мутантных генов cysE путем полной рандомизации фрагмента гена cysE. Одновременные замены некоторых аминокислотных остатков фрагмента аминокислотной последовательности, в котором могут находиться fbr мутации, могут привести к образованию мутантных белков с уровнем активности, близким к природному, вследствие более точного соответствия трехмерной структуры фермента. Таким образом, было осуществлено настоящее изобретение, описанное ниже.
Что предоставляет настоящее изобретение:
(1) Мутантная серинацетилтрансфераза, в которой последовательность аминокислот, соответствующая положениям с 89 по 96 в последовательности природной серинацетилтрансферазы, содержит одну или несколько мутаций, и в которой ингибирование L-цистеином по принципу обратной связи ослаблено;
(2) Мутантная серинацетилтрансфераза по п.1, в которой последовательность аминокислот, соответствующая положениям с 89 по 96 в последовательности природной серинацетилтрансферазы, заменена любой из последовательностей аминокислот SEQ ID NO:3 - SEQ ID NO:8, и в которой ингибирование L-цистеином по принципу обратной связи ослаблено;
(3) Мутантная серинацетилтрансфераза по п.1 или п.2, где природной сериновой ацетилтрансферазой является серинацетилтрансфераза из Escherichia coli;
(4) Мутантная серинацетилтрансфераза по любому из пп.1-3, которая включает делеции, замены, вставки или добавления одной или нескольких аминокислот в одном или нескольких положениях, кроме положений с 89 по 96, и исключая тройной мутант с заменами Asn на Lys в позиции 51, Arg на His в позиции 91 и His на Tyr в позиции 233, и в которой ингибирование L-цистеином по принципу обратной связи ослаблено;
(5) ДНК, кодирующая мутантную сериновую ацетилтрансферазу по любому из пп.1-4;
(6) Бактерия, принадлежащая к роду Escherichia, которая трансформирована с помощью ДНК по п.5 и обладает способностью к продукции L-цистеина;
(7) Способ продукции L-цистеина, который включает стадии выращивания бактерии по п.6 в питательной среде с целью продукции и накопления L-цистеина в питательной среде и выделения L-цистеина из культуральной жидкости.
SAT, содержащая любую из fbr мутаций, описанных выше, может упоминаться как «мутантная SAT», ДНК, кодирующая мутантную SAT, может упоминаться как «мутантный ген cysE», SAT, не содержащая мутации, может упоминаться как «природная SAT».
Далее настоящее изобретение будет разъяснено более детально.
1. Мутантная SAT и мутантный ген cysE.
В соответствии с данными анализа трехмерной структуры SAT, полученными авторами настоящего изобретения, были обнаружены новые области SAT, ответственные за взаимодействие фермента с L-цистеином и определяющие степень чувствительности SAT к L-цистеину (смотри пример 1).
Последовательная селекция и отбор рекомбинантных клонов, несущих мутантные гены cysE, клонированные в экспрессирующем векторе, позволяют выбрать fbr варианты мутантной SAT с различным уровнем их биологической активности, вплоть до уровня активности дерепрессированного природного (wt) SAT.
Мутантная SAT и мутантный ген cysE были получены в процессе мутагенеза путем рандомизации определенного фрагмента. Для того чтобы получить множественные мутации в гене cysE, была проведена рандомизация фрагмента из 24 нуклеотидов гена cysE, кодирующего область от Arg89 до Asp96 аминокислотной последовательности SAT (смотри ниже). За один прием рандомизировались две соседние аминокислоты, следовательно, 89-96 область белка была рандомизирована в результате 4 последовательных экспериментов.
Последовательная селекция и отбор рекомбинантных клонов, несущих мутантные гены cysE, клонированные в экспрессирующем векторе, позволяют выбрать fbr варианты мутантной SAT с различным уровнем их биологической активности, вплоть до уровня активности дерепрессированного природного (wt) SAT. В качестве природного фермента SAT может быть упомянута SAT из E.coli (EC-Number 2.3.1.30; SEQ ID NO:2).
Последовательности аминокислот мутантной SAT с подходящим fbr фенотипом были выявлены в настоящем изобретении. Вследствие этого мутантная SAT может быть получена на основе указанных последовательностей путем введения мутаций в природный ген cysE с использованием традиционных методов, таких как ПЦР (полимеразная цепная реакция; ссылка на White, T.J. et al., Trends Genet., 5, 185 (1989)) с использованием затравок, синтезированных на основе нуклеотидной последовательности указанного гена. В качестве природного гена cysE может быть упомянут ген cysE из E.coli (нуклеотиды с 3779368 по 3780189 в последовательности GenBank с инвентарным номером NC_000913.1; gi:16127994). Гены, кодирующие SAT, из других микроорганизмов могут быть получены таким же образом.
Последовательность аминокислот с 89 по 96 в мутантной SAT согласно настоящему изобретению содержит одну или несколько мутаций. Предпочтительно аминокислотная последовательность области мутантной SAT с 89 по 96 в настоящем изобретении соответствует любой из последовательностей с SEQ ID NO:3 по SEQ ID NO:8. Соответствующая последовательность аминокислот мутантной SAT в настоящем изобретении, в которой Val-95 и Asp-96 заменены на Arg-95 и Pro-96, Gly-95 и Gly-96 или Leu-95 и Pro-96; Ala-94 заменен на Thr; Arg-89 заменен на Pro; Arg-89 и Thr-90 заменены на Ser-89 и Leu-90; а также природная SAT из E.coli представлены в Таблице 1. Примеры последовательностей нуклеотидов, кодирующих указанные последовательности аминокислот также приведены в Таблице 1.
Мутантная SAT может содержать делеции, замены, вставки и добавления одной или нескольких аминокислот в одном или нескольких положениях, кроме положений с 89 по 96, при условии, что активность SAT сохраняется. Термин «активность SAT» означает активность по катализу реакции переноса ацетогруппы с ацетил-СоА на L-серин. Активность SAT может быть измерена, например, с помощью метода, описанного Kredich, N.M. и Tomkins, G.M. (J. Biol. Chem. 1966, 241, 21, 4955-4965). Тройной мутант с заменами Asn на Lys в положении 51, Arg на His в положении 91 и His на Туг в положении 233 исключается, поскольку был описан ранее Takagi, H. и др. (FEBS Lett., 1999, 452, 323-327).
Число «нескольких» аминокислот различно в зависимости от положения или типа остатка аминокислоты в трехмерной структуре белка. Это объясняется следующими причинами. Например, некоторые аминокислоты являются в достаточной степени взаимозаменяемыми и отличия в этих аминокислотах не влияют в значительной степени на трехмерную структуру белка. Следовательно, мутантной SAT согласно настоящему изобретению может быть мутантная SAT, у которой степень гомологии не ниже чем 30-50%, предпочтительно 50-70%, по отношению ко всем остаткам аминокислот, составляющим SAT согласно настоящему изобретению, и которая обладает fbr активностью SAT.
В настоящем изобретении «последовательность аминокислот, соответствующая положениям с 89 по 96» означает последовательность аминокислот, соответствующую последовательности аминокислот в положении с 89 по 96 в аминокислотной последовательности природной SAT из E.coli. Положение остатка аминокислоты может быть изменено. Например, если какой-либо остаток аминокислоты добавлен в N-концевой участок, то остаток аминокислоты, находившийся ранее в положении 89, оказывается в положении 90. В таком случае остаток аминокислоты, соответствующий первоначальному положению 89, рассматривается как остаток аминокислоты в положении 90 согласно настоящему изобретению.
ДНК, кодирующая практически такой же белок, как мутантная SAT, описанная выше, может быть получена, например, путем модификации последовательности нуклеотидов методом сайт-специфического мутагенеза таким образом, что белок, кодируемый подобной ДНК, будет в определенном положении содержать делеции, замены, вставки или добавления одного или нескольких остатков аминокислот. ДНК, модифицированная описанным выше способом, может быть получена традиционным способом мутагенеза. К мутагенезу относится метод обработки ДНК, содержащей ген cysE, in vitro, например, с помощью гидроксиламина, и метод обработки микроорганизма, например бактерии, принадлежащей к роду Escherichia и содержащей ген cysE, УФ-светом или мутирующим агентом, таким как N-метил-N'-нитро-N-нитрозогуанидин (NTG) и азотистая кислота, обычно используемым для подобного рода обработок.
К делециям, заменам, вставкам или добавлениям нуклеотидов, описанным выше, относятся мутации, которые встречаются в природных условиях (мутанты или варианты), например, в случае индивидуальных или родовых и видовых различий бактерий, содержащих SAT.
ДНК, кодирующая практически такой же белок, как мутантная SAT, может быть получена путем выделения ДНК, которая гибридизуется с ДНК, содержащей последовательность известного гена cysE (SEQ ID NO:1) или его часть, используемой в качестве зонда в жестких условиях, и которая кодирует белок, обладающий активностью SAT, из содержащей мутантную SAT клетки, являющейся объектом мутагенеза.
Термин «жесткие условия» обозначает условия, при которых образуется так называемый специфический гибрид (дуплекс), а неспецифический - не образуется. Четко описать эти условия с помощью численных значений довольно трудно. Однако, например, жесткими условиями являются такие условия, при которых молекулы ДНК, обладающие высокой гомологией, например ДНК, обладающие гомологией друг с другом не менее 50%, гибридизуются, а ДНК с меньшей гомологией - не гибридизуются. В качестве альтернативы примером жестких условий являются условия, при которых ДНК гибридизуются друг с другом при концентрации солей, соответствующей обычной концентрации при отмывке в ходе гибридизации по Саузерну, т.е. 60°С, 1×SSC, 0.1% SDS, предпочтительно 0.1×SSC, 0.1% SDS.
В число генов, которые гибридизуются в описанных выше условиях, включаются гены, содержащие стоп-кодон внутри кодирующего участка гена, а также те, которые кодируют неактивный белок вследствие мутаций в активном центре. Однако подобные затруднения могут быть легко разрешены путем лигирования гена в коммерчески доступный вектор для экспрессии и изучения в экспрессированном белке активности SAT.
2. Бактерия, принадлежащая к роду Escherichia, согласно настоящему изобретению.
Бактерией, принадлежащей к роду Escherichia, согласно настоящему изобретению является бактерия, принадлежащая к роду Escherichia, в которую введен мутантный ген cysE, описанный выше. Примером бактерии, принадлежащей к роду Escherichia, является Е.coli.
Термин «бактерия, обладающая способностью к продукции L-цистеина» означает бактерию, обладающую способностью накапливать L-цистеин в питательной среде, когда указанная бактерия культивируется согласно настоящему изобретению в питательной среде. Способность к продукции L-цистеина может быть передана или улучшена путем селекции. Термин «бактерия, обладающая способностью к продукции L-цистеина» в настоящем изобретении означает бактерию, которая способна к продукции и накоплению L-цистеина в питательной среде в количествах, превышающих накопление L-цистеина у природных и родительских штаммов. Природный штамм Е.coli может быть представлен штаммами Е.coli MG1655, К-12 и подобными им.
Мутантный ген cysE может быть введен, например, путем трансформации бактерии, принадлежащей к роду Escherichia, рекомбинантной ДНК, содержащей вектор, функционирующий в бактерии, принадлежащей к роду Escherichia, и мутантный ген cysE. Мутантный ген cysE также может быть введен заменой гена cysE на мутантный ген cysE в хромосоме.
Примерами векторов, которые можно использовать для введения мутантного гена cysE, являются плазмидные векторы, такие как pBR322, pMW118, pUC19 или подобные им, фаговые векторы, такие как 11059, lBF101, M13mp9 или подобные им, и транспозоны, такие как Mu, Тn10, Тn5 или подобные им.
Введение ДНК в бактерию, принадлежащую к роду Escherichia, может быть осуществлено, например, по методу D.A.Morrison (Methods in Enzymology, 68, 326 (1979)) или методом, в котором бактериальная клетка - реципиент обрабатывается хлоридом кальция для увеличения проницаемости для ДНК (Mandel, M. and Higa, A., J.Mol.Biol. 53, 159 (1970)) или подобным им методом.
Количество продуцируемого L-цистеина может быть увеличено путем введения мутантного ген cysE в бактерию - продуцент, принадлежащую к роду Escherichia, как описано выше. Кроме того, способность к продукции L-цистеина может быть придана бактерии, в которую мутантный ген cysE уже введен.
Примерами бактерий, принадлежащих к роду Escherichia, обладающих способностью к продукции L-цистеина, являются штамм E.coli JM15, трансформированный различными аллелями cysE, кодирующими устойчивую к ингибированию по принципу обратной связи сериновую ацетилтрансферазу (патент США 6,218,168), штамм E.coli W3110, обладающий повышенной экспрессией генов, кодирующих белок, способный к экскреции токсичных для клетки соединений (патент США 5,972,663), штаммы Е.coli, содержащие цистеиновую десульфогидразу со сниженной активностью (патентная заявка Японии 11155571 А2), штамм Е.coli W3110, с повышенной активностью позитивного регулятора транскрипции цистеинового регулона, кодируемого геном cysB (заявка РСТ WO 0127307 A1), и подобные им штаммы.
3. Способ согласно настоящему изобретению.
Способ согласно настоящему изобретению включает в себя способ продукции L-цистеина, включающий стадии культивирования бактерий, согласно настоящему изобретению, в питательной среде с целью продукции и накопления L-цистеина в питательной среде и выделения L-цистеина из культуральной жидкости.
В способе согласно настоящему изобретению выращивание бактерии, принадлежащей к роду Escherichia, накопление и выделение L-цистеина из культуральной жидкости может быть осуществлено способом, подобным способу, традиционно используемому для продукции аминокислот методом ферментации с использованием бактерий. Питательная среда для выращивания может быть как синтетической, так и натуральной, при условии, что она содержит источники углерода, азота и серы, минеральные соединения и, если необходимо, питательные добавки в количестве, необходимом для роста бактерии. Источники углерода включают в себя различные углеводы, такие как глюкоза и сахароза, и различные органические кислоты. В зависимости от способности к их усвоению используемыми бактериями могут быть использованы спирты, такие как этанол и глицерин. В качестве источников азота используются аммиак, различные соли аммония, такие как сульфат аммония, другие соединения азота, такие как амины, природные источники азота, такие как пептон, гидролизат соевых бобов и микробный ферментализат. В качестве источников серы используются сульфаты и тиосульфаты. В качестве минеральных соединений используются однозамещенный фосфат калия, сульфат магния, хлорид натрия, сульфат железа, сульфат марганца, карбонат кальция.
При необходимости в среду могут быть добавлены и некоторые другие соединения. Например, если для роста микроорганизмам требуется метионин (метиониновая ауксотрофность), достаточное количество метионина может быть добавлено в среду культивирования.
Выращивание проводят предпочтительно в аэробных условиях, таких как взбалтывание и аэрация с перемешиванием. Температура культуры обычно поддерживается от 20°С до 42°С, предпочтительно от 37°С до 40°С. Значение рН находится в пределах от 5 до 9, предпочтительно в пределах от 6.5 до 7.2. рН среды может быть скорректировано аммиаком, карбонатом кальция, различными кислотами, основаниями и буферами. Обычно выращивание в течение от 1 до 5 дней приводит к накоплению целевой аминокислоты в культуральной жидкости.
Выделение целевой аминокислоты может быть осуществлено путем удаления из питательной среды после выращивания нерастворимых компонент, таких как клетки, методом центрифугирования или фильтрации на мембране, с последующим выделением и очисткой целевой аминокислоты методами ионного обмена, концентрации и фракционной кристаллизации или подобными им.
Краткое описание чертежей.
На Фиг.1. показана схема конструирования затравок SEQ ID NO:16 и 17.
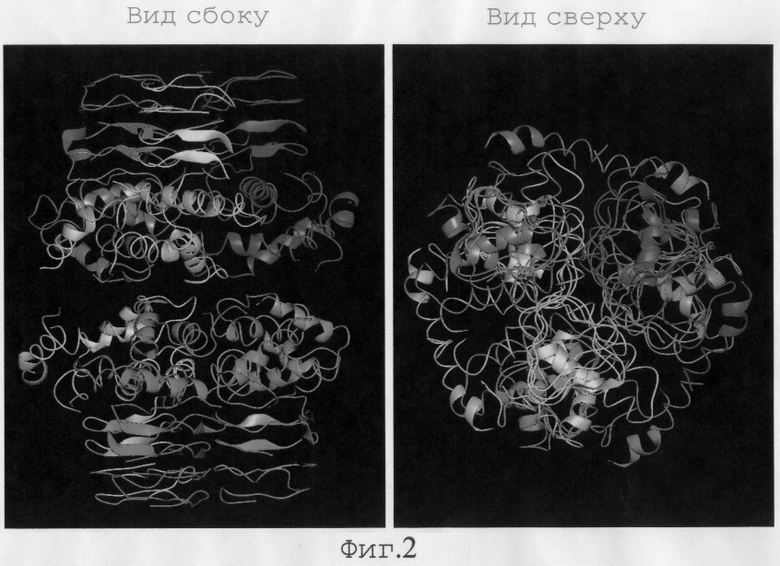
На Фиг.2. показана олигомерная структура SAT.
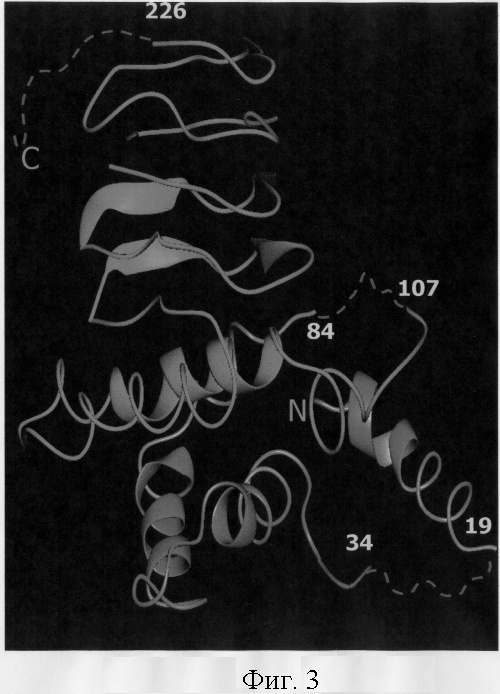
На Фиг.3. показана трехмерная структура субъединицы SAT.
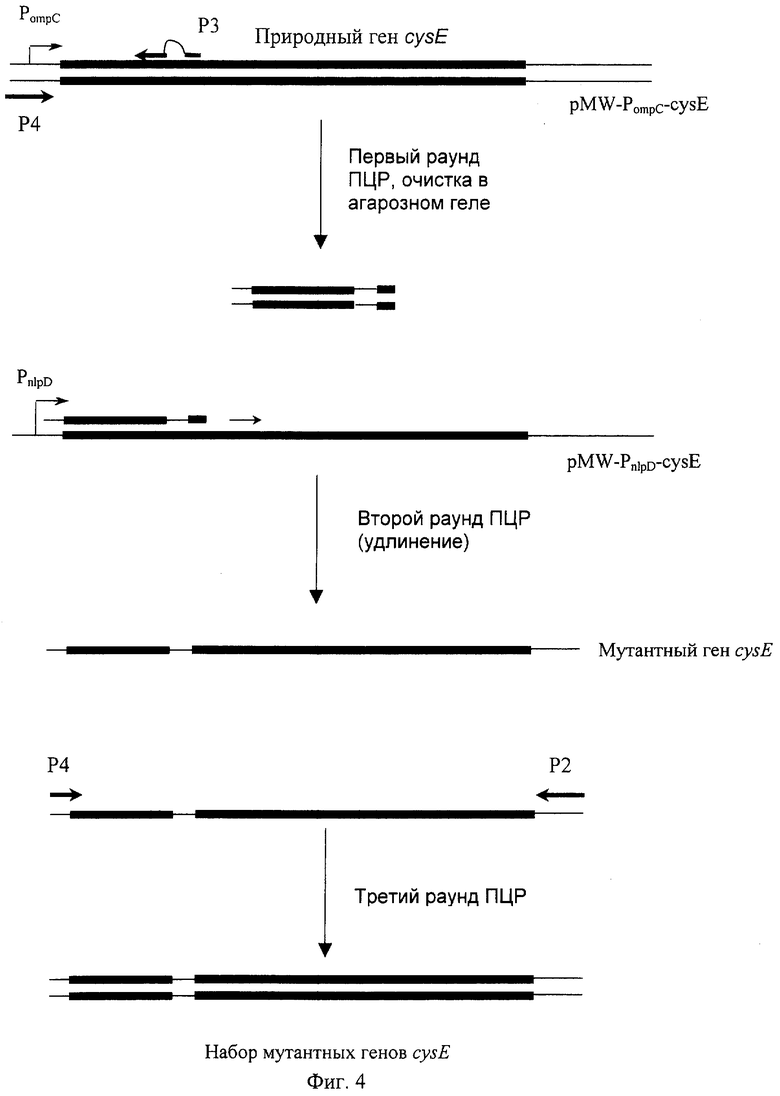
На Фиг.4. показана схема конструирования набора мутантных генов cysE.
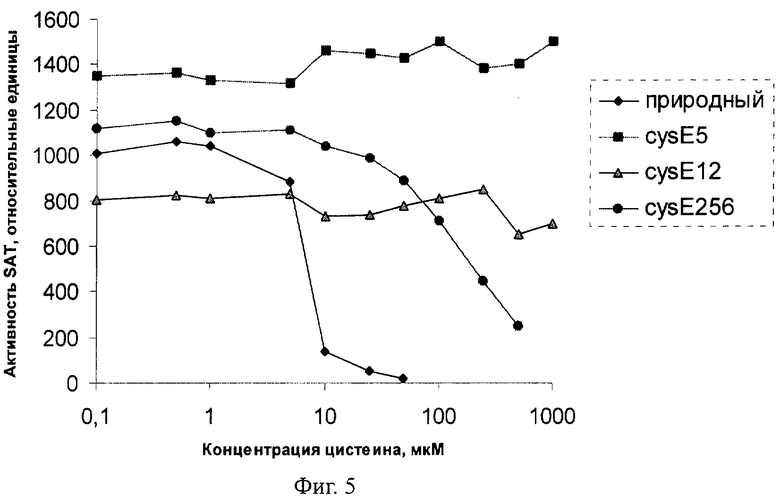
На Фиг.5. показаны каталитические характеристики мутантных SAT.
Наилучший способ осуществления изобретения.
Настоящее изобретение будет детальнее разъяснено со ссылкой на следующие примеры.
Пример 1. Трехмерная структура SAT.
Определение трехмерной структуры SAT было проведено следующим образом.
1. Получение и очистка селенометионил SAT.
Для продукции рекомбинантной SAT в Escherichia coli на основе вектора pQE*, полученного путем модификации экспрессионного вектора E.coli рQЕ30 (Qiagen), была сконструирована плазмида для экспрессии гена cysE гена, кодирующего SAT.
Был проведен ПЦР с использованием рQЕ30 в качестве матрицы и олигонуклеотидных затравок SEQ ID NO:15 и 16, синтезированых на основе нуклеотидной последовательности вектора рQЕ30 (www.qiagen.com). Затравка SEQ ID NO:16 содержит сайт узнавания рестриктазы SphI и нуклеотидные замены, указанные на Фиг.1. Уникальный амплифицированный фрагмент длиной 150 нуклеотидов был обработан рестриктазами XhoI и SphI, в результате чего получили фрагмент длиной в 80 нуклеотидов, который был клонирован в вектор pQE30, предварительно обработанный этими же рестриктазами. Полученная в результате плазмида pQE* содержит сайт узнавания рестриктазы SphI, совпадающий с месторасположением кодона инициации транскрипции, вместо последовательности, кодирующей 6 последовательно расположенных His аминокислотных остатков и сайта BamHI.
Фрагмент ДНК, содержащий ген cysE был получен путем амплификации в ходе ПЦР с использованием геномной ДНК из E.coli DH5α в качестве матрицы и олигонуклеотидов SEQ ID NO:17 и 18, синтезированых на основе нуклеотидной последовательности гена cysE (GenBank инвентарный номер М15745) в качестве затравок. Затравка SEQ ID NO:17 содержит сайт узнавания рестриктазы SphI и нуклеотидные замены, указанные на Фиг.1. Затравка SEQ ID NO:18 содержит сайт узнавания рестриктазы BamHI на 5'-конце.
Уникальный амплифицированный фрагмент длиной в 840 bp был обработан рестриктазами SphI и HindIII, а затем лигирован с большим фрагментом плазмиды pQE*, предварительно расщепленной этими же рестриктазами, с образованием рекомбинантной плазмиды pQE-SAT. В результате в рекомбинантной SAT природный остаток серина, кодируемый триплетом TGG в позиции 2, был заменен на пролин, кодируемый триплетом CCG.
Клетки Е.coli B834/DE3 (Novagen Co., США), содержащие плазмиду, экспрессирующую SAT, pQE-SAT, выращивались в течение одной ночи при 37°С в L-бульоне [20 г/л бакто триптона, 10 г/л бакто дрожжевого экстракта, 20 г/л NaCl] с ампициллином (5 мкг/мл). Далее этот посевной материал переносился в среду М9 [15.1 г/л Na2HPO4·12Н2O, 3 г/л КН2PO4, 0.5 г/л NaCl, 1 г/л NH4Cl, 4 г/л глюкозы, 2 мл 1 М MgSO4, 1 мл 1 М CaCl2, 1 мл FeCl3 (3.5 мг/мл), 2.4 мл тиамина (1 мг/мл)] с селенометионином (40 мкг/мл), содержащей ампициллин (50 мкг/мл). Дальнейшая культивация проводилась при температутре 37°С. Когда оптическая плотность культуры при длине волны в 560 нм достигла 0.6, в среду добавили 1 мМ изопропил-1-бета-D-галакто-пиранозид для индукции экспрессии селенометионил SAT. Выращенные клетки осадили центрифугированием.
Осадок клеток ресуспендировали в растворе, состоящем из 50 мМ трис(гидроксиметил)аминометан гидрохлорида, 2 мМ (±)-дитиотреитола, 5 мМ динатриевого этилендиаминтетраацетат дигидрата и разрушили с помощью ультразвука. Супернатант инкубировали в течение 10 минут при 60°С, после чего остудили на льду в течение 10 минут. Нерастворимую фракцию удалили центрифугированием. Селенометионил SAT, содержащуюся в растворимой фракции, дополнительно очистили, осадив сульфатом аммония, и снова перевели в растворимое состояние в растворе из 50 мМ трис(гидроксиметил)аминометан гидрохлорида, 2 мМ (±)-дитиотреитола, 5 мМ динатриевого этилендиаминтетраацетат дигидрата. После этого полученный раствор нанесли на анион-обменную колонку (ResourceQ 6 мл, Amersham Pharmacia Biotech, Tokyo, Japan), уравновешенную 50 мМ трис(гидроксиметил)аминометан гидрохлоридом, рН7.5, 2 мМ (±)-дитиотритолом и 5 мМ динатриевым этилендиаминтетраацетат дигидратом. После этого колонку отмыли тем же буфером в объеме, равном 1 объему колонки, селенометионил SAT элюировали в линейном градиенте хлорида натрия от 0 до 1 М объемом, превышающим 10 объемов колонки, со скоростью потока 6 мл/мин. Элюированные фракции сохраняли. После добавления сульфата аммония раствор перенесли на хроматографическую колонку гидрофобного взаимодействия (HiPrep 16/10 Butyl; Amersham Pharmacia Biotech, Tokyo, Japan), уравновешенную раствором 0.75 М сульфата аммония, 50 мМ трис(гидроксиметил)аминометан гидрохлорида, рН 7.5, 2 мМ (±)-дитиотреитола и 5 мМ динатрий этилендиаминтетраацетат дигидратом. После того как колонку отмыли тем же буфером в объеме, равном 1 объему колонки, селенометионил SAT элюировали в линейном градиенте сульфата аммония с 0.75 до 0 М объемом, равным более 10 объемов колонки, со скоростью потока 5 мл/мин. Для вытеснения буфера собранные фракции подвергли диализу в растворе 50 мМ трис(гидроксиметил)аминометан гидрохлорида, рН7.5, 2 мМ (±)-дитиотреитола и 5 мМ динатрий этилендиаминтетраацетат дигидрата.
2. Кристаллизация
Была произведена кристаллизация селенометионил SAT. В течение 5 дней были выращены кубические кристаллы до необходимого для дифракции рентгеновских лучей размера (0.2×0.2×0.2 мм).
3. Сбор и обработка данных
Данные аномальной дисперсии излучений с множественной длиной волны (MAD) кристаллов селенометионил SAT были получены в результате использования детектора Quantam 4R CCD (ADSC), настроенного на световой луч 6В на Photon Factory of the National Laboratory for High Energy Physics, Tsukuba, Japan. Перед началом записи результатов дифракции рентгеновских лучей был снят спектр флуоресценции рентгеновских лучей для определения оптимальной длины волны, используемой для получения данных MAD. Во время измерения спектра флуоресценции рентгеновских лучей и сбора данных кристаллы селенометионил SAT были подвергнуты быстрому охлаждению при 95 К после уравновешивания крио-растворителем, содержащим 35 v/v% 2-метил-2,4-пентанедиол, 0.1 М 2-(N-морфолино)этансульфоновой кислоты - NaOH (pH6.2), и 1 мМ L-цистеина. Данные были получены при длине волны рентгеновского излучения 0.9791 Å (точка перегиба кривой спектра флуоресценции, f' минимум), 0.9789 Å (f'' максимум), 0.9500 Å (длина волны удаленного жесткого рентгеновского излучения) и при 1.0500 Å (длина волны удаленного мягкого рентгеновского излучения). Все четыре набора данных были получены при изучении одного и того же кристалла, при этом расстояние между кристаллом и детектором составляло 220 мм с использованием 1.0° колебаний на одно изображение. Полученные данные дифракции были обработаны программой DPS/MOSFLM (Rossman, M.G. and van Beek, С.G. (1999) Acta Crystallogr. Sect. D55, 1631-1640). Кристалл селенометионил SAT вызывал диффракцию излучения при разрешении до 2.7 Е. Кристалл принадлежит к пространственной группе R3, с параметрами кристаллической решетки а=101.2 Å, с=223.2 Å. Кристалл состоит из четырех молекул селенометионил SAT (молекулы А, В, С и D) на одну ассиметричную единицу, с содержанием растворителя 35.3%.
<4> MAD фазирование и улучшение раздела фаз.
Данные, полученные с помощью MAD, были сопоставлены, используя ССР4 (Beiley, S. (1994) Acta Crystallogr. Sect. D50, 760-763) программы SCALEIT. Девятнадцать из 36 ожидаемых в ассиметричной структуре положений Se были определены с помощью программы SOLVE (Terwilliger, Т.С. and Berendzen, J. (1996) Acta Crystallogr. Sect. D52, 743-748). Изначально раздел фаз MAD отсчитывался с использованием программы MLPHARE в ССР4. Итоговое значение составило 0.541 (40.0-2.7 Å resolution).
Определение границы раздела фаз MAD было усовершенствовано с использованием программы DM в ССР4. Сначала производили процедуру поэтапного сглаживания границы белок-растворитель при условии 30% содержания растворителя, с использованием разрешения 40.0-2.7 Å. Несмотря на то, что карта электронной плотности показывала относительно четкую границу белок-растворитель, качество изображения оставалось недостаточно качественным и интерпретировалось с трудом. Интерпретация карты электронной плотности и построение модели производили с помощью программы QUANTA (Accelrys Inc.) на графической рабочей станции Octane (Silicon Graphics Inc.).
На следующем этапе граница раздела фаз была обнаружена еще более точно с помощью процедуры молекулярного усреднения. Параметры некристаллографической симметрии (NCS) были изначально определены путем наложения позиций атомов Se. Молекулы А и В и молекулы С и D были распределены по некристаллографическим осям симметрии 2-го порядка соответственно. Молекулы А и С и молекулы В и D были по 1/2 трансляции распределены вдоль кристаллографической с-оси соответственно. Параметры NCS были уточнены во время проведения процедуры молекулярного усреднения при разрешении 40.0-2.7 Å. Процедура молекулярного усреденения была благополучно завершена, в результате были существенно улучшены значения для основного коэффициента характеристики комбинированных фаз (0.644) и коэффициент корреляции (0.617→0.868).
Карта была исправлена и позволила увидеть множество вторичных структур. На этой карте и была сконструирована трехмерная структура селенометионил SAT.
<5> Трехмерная структура SAT
На Фиг.2 показана олигомерная структура SAT. Как видно на Фиг.2, SAT образует гексамер с симметрией по 32-точкам. Димеры, соотносимые с тремя некристаллографическими осями симметрии 2-го порядка, соотносятся и с кристаллографической осью симметрии 3-го порядка.
На Фиг.3 изображена трехмерная структура субъединицы SAT. Субъединица SAT состоит из двух доменов. N-концевой домен состоит из нескольких α-спиралей и образует структуру α домена. Спирали в N-концевых доменах в гексамере SAT плотно взаимодействуют друг с другом, играя, таким образом, важную роль в стабилизации гексамера. Структура С-концевого домена - это левые параллельные β-изгибы (LβH). Структура LβH сворачивается в большую закрученную призму, как бы загибаясь в левую спираль вокруг поверхности призмы. Поверхности структуры LβH формируются тремя плоскими параллельными β-слоями. В структуре гексамера SAT существуют обширные полости между смежными LβH структурными доменами, которые соотносятся с кристаллографической осью симметрии 3-го порядка. Большое количество аминокислотных остатков, ответственных за потерю чувствительности SAT к ингибированию по принципу обратной связи (Takagi, H. et al. (1999) FEBS Lett. 452, 323-327), равномерно распределены внутри этой полости. Таким образом, эта полость может играть важную роль в процессе ингибирования по принципу обратной связи. Поскольку область, содержащая аминокислотные остатки 89-96, также находится внутри этой полости, именно эта область и была выбрана для мутагенеза.
Пример 2. Получение мутантных SAT, содержащих рандомизированную область 89-96 аминокислотной последовательности.
<1> Мутагенез путем рандомизации определенного фрагмента.
Сначала были сконструированы две плазмиды - pMW-PompC и pMW-PnlpD.
Плазмида pMW-PompC была получена путем клонирования 0.3 т.п.о. фрагмента ДНК с промотерной областью гена ompC по сайтам PaeI-SalI вектора pMW118. Фрагмент ДНК был получен путем амплификации с помощью ПЦР с затравками Р4 (SEQ ID NO:19) и Р6 (SEQ ID NO:20) и хромосомной ДНК из Е.coli штамм MG1655 в качестве матрицы.
Плазмида pMW-PnlpD была получена путем клонирования фрагмента ДНК длиной 0.3kb с промоторной областью гена nlpD по сайтам PaeI-SalI вектора pMW118. Фрагмент ДНК был получен путем амплификации с помощью ПЦР с затравками Р5 (SEQ ID NO:21) и Р6 (SEQ ID NO:22) и хромосомной ДНК из штамма Е.coli MG1655 в качестве матрицы.
Природный ген cysE целиком был получен с помощью ПЦР с затравками Р1 (SEQ ID NO:23) и Р2 (SEQ ID NO:24) и хромосомной ДНК из штамма Е.coli MG1655 в качестве матрицы. Полученный фрагмент ДНК (0.83 т.п.о.) был клонирован по сайтам SalI-XbaI плазмид pMW-PompC и pMW-PnlpD, в результате чего были получены плазмиды pMW-PompC-cysE и pMW-PnlpD-cysE соответственно.
ДНК-полимераза Pyrobest™, применяемая для ПЦР амплификации, была получена от Takara Shuzo Co. (Japan) и использовалась в условиях, рекомендумых производителем.
Для создания набора мутантных cysE генов с рандомизированной с 285 по 291 нуклеотид областью, в первом раунде был амплифицирован с помощью ПЦР фрагмент cysE гена, кодирующий последовательность с 1 по 102 аминокислотный остаток SAT. ПЦР осуществлялась с использованием плазмиды pMW-PompC-cysE в качестве матрицы, затравки Р3 (SEQ ID NO:25), содержащей 6 рандомизированных нуклеотидов и затравки Р4 (SEQ ID NO:19), гомологичной последовательности промотерной области гена отрС (смотри Фиг.1). Фиксированная 3'-концевая последовательность из 19 нуклеотидов затравки Р3 полностью гомологична нуклеотидной последовательности гена cysE после кодона Asp-96 и фиксированная 5'-концевая последовательность из 20 нуклеотидов затравки полностью гомологична нуклеотидной последовательности гена cysE до кодона Val-95. Также затравка Р3 содержит 6 рандомизированных нуклеотидов, обозначенных в SEQ ID NO:25 буквами "n". 20 нг плазмиды pMW-PompC-cysE были добавлены в качестве матрицы в раствор для ПЦР (50 мкл), содержащий обе затравки в концентрации 10 пмоль. Было проведено 25 циклов ПЦР (96°С в течение 0.4 мин, 60°С в течение 0.4 мин, 72°С в течение 1 мин) на термоциклере ДНК модели 2400 (Perkin-Elmer Co., Foster City, California, USA). Фрагмент ДНК длиной 0.3 т.п.о. был получен в течение 25 циклов амплификации с помощью ПЦР.
Во втором раунде амплификации полученный ранее фрагмент ДНК длиной 0,3 т.п.о. был очищен методом электрофореза в агарозном геле и использован в качестве затравки для того, чтобы нарастить этот фрагмент до полной последовательности гена cysE. Было проведено 10 циклов амплификации (96°С в течение 1 мин, 40°С в течение 1 мин, 72°С в течение 0.5 мин). Для того чтобы предотвратить амплификацию природного гена cysE в третьем раунде амплификации, в качестве матрицы использовалась плазмида pMW-PnlpD-cysE.
В третьем раунде ПЦР 10 мкл полученной реакционной смеси были добавлены к 40 мкл свежего раствора, содержащего 50 пмоль затравки Р4 (SEQ ID NO:19), гомологичной последовательности промоторной области гена ompC (смотри Фиг.4), и затравки Р2 (SEQ ID NO:24), и затем были проведены дополнительные 15 циклов (94°С в течение 0.5 мин, 57°С в течение 0.5 мин, 72°С в течение 2 мин).
Фрагменты ДНК длиной 0,83 т.п.о., кодирующие набор мутантных вариантов гена cysE, были очищены методом электрофореза в агарозном геле, затем расщеплены рестриктазами SalI и XbaI, после чего лигированы в вектор pMW-PompC; предварительно расщепленный теми же рестриктазами.
Около 100 нг полученной ДНК - плазмиды pMW-PompC-cysE (рандомизированный) были использованы для трансформации клеток - реципиентов Е.coli.
<2> Отбор новых мутантных генов cysE
В дальнейших экспериментах в качестве штамма-реципиента использовался штамм Е.coli LE392 cysE::K.mR. Этот штамм был получен из штамма Е.coli LE392 (J. Sambrook et al., Molecular Cloning, 1989) в результате разрушения гена cysE. Разрушение гена cysE было осуществлено путем введения гена устойчивости к канамицину с использованием штамма JC7623, как это описано у Kushner, S.R., H.Nagaishi and A.J.Clark. (Proc. Natl. Acad. Sci. USA, 1972, 69: 1366-1370).
Штамм-реципиент Е.coli LE392 cysE::KmR был трансформирован смесью рекомбинантных плазмид pMW-PompC-cysE(рандомизированный). Мугантные гены cysE, кодирующие активную SAT, были отобраны по комплементации хромосомной мутации cysE в штамме Е.coli LE392 cysE::KmR на чашках с агаризованной М9, содержащей 0.5% глюкозы и 50 мг/л метионина.
Все полученные клоны были проверены на способность к кормлению цистеиновых ауксотрофов, в результате было отобрано 15 вариантов. Из этих клонов были выделены плазмиды и в них были определены последовательности ДНК структурной части гена cysE методом терминации цепи ДНК дидезоксинуклеотидами. Для определения уровня активности SAT цистеиновый ауксотроф LE392 cysE::KmR повторно трансформировали этими плазмидами.
Мутантный ген cysE (cysE256) с точечной нуклеотидной заменой в позиции 767, выражающийся в замене метионина 256 на изолейцин (Denk D. and Bock A., J. Gen. Microbiol., 1987, 133 (Pt 3), 515-25) был получен с помощью стандартной методики сайт-направленного мутагенеза.
Пример 3. Влияние замен аминокислотных остатков на каталитические свойства SAT.
Каталитические свойства полученных мутантных SAT определялись с помощью модифицированного метода, описанного Kredich, N.M. и Tomkins, G.M. (J. Biol. Chem., 1966, 241, 21, 4955-4965). Ацетил коэнзим А и другие используемые реактивы были от Sigma Chemical Co. (St. Louis, МО, USA).
Для определения активности мутантной SAT клетки Е.coli LE392 cysE::KmR, содержащие рекомбинантные плазмиды, выращивались в 5 мл среды М9 до поздней стадии экспоненциальной фазы, промывались 0,14 М раствором NaCl и ресуспендировались в 2 мл буфера (рН 7.5), состоящем из 50 мМ фосфата калия и 100 мМ KCl. Клетки обработали ультразвуком и отделили осадок центрифугированием при 13000 об/мин. Фракцию белка, содержащую SAT осадили 5-ю объемами насыщенного (NH4)2SO4 и осадок растворили в 2 мл буфера (рН 7.5), состоящего из 50 мМ фосфата калия и 100 мМ KCl. В полученный раствор добавили 0.1 мл реакционной смеси (500 мМ Tris-HCl (рН 8.5), 5 мМ L-серина, 0.1 мМ ацетил коэнзима А) и инкубировали при 37°С в течение 10 мин. Рекцию остановили добавлением 0.3 мл этанола с последующим центрифугированием при 13000 об/мин. 0.95 мл из 0.24 мМ раствора DTNB (5,5-дитио-би-2-нитробензоат) добавили в супернатант и инкубировали смесь в течение 15 мин. Уровень активности SAT оценивали измерением поглощения при длине волны 412 нм.
Полученные данные представлены в Таблице 2 и на Фиг.5.
Как видно из Таблицы 2 и Фиг.5, полученный мутантный ген cysE, в особенности cysE5, cysE12, cysE15 и cysE1, кодирует мутантную SAT, не чувствительную к ингибированию по принципу обратной связи L-цистеином. Такие мутантные SAT, полностью устойчивые к ингибированию L-цистеином по принципу обратной связи, способствуют продукции L-цистеина в бактериях-продуцентах L-цистеина.
Пример 4. Влияние усиления экспрессии мутантного гена cysE на продукцию L-цистеина.
Штамм Е.coli MG1655 (ВКПМ В-6195) использовался как родительский штамм для оценки влияния усиления экспрессии мутантного гена cysE на продукцию L-цистеина.
В штамм Е.coli MG1655 были независимо введены плазмида pMW-PompC-cysEX (содержащая мутантный ген cysEX, описанный в патенте США 6,218,168) и плазмида pMW-PompC-cysE5. Полученные штаммы MG1655/pMW-PompC-cysEX и MG1655/pMW-cysE5 выращивали ночь на роторной качалке при 34°С в 2 мл питательного бульона с ампициллином 100 мг/л. 0.2 мл полученных культур внесли в пробирки 20×200 мм с 2 мл ферментационной среды, содержащей ампициллин (100 мг/л), и культивировали при 34°С в течение 42 часов на роторной качалке (250 об/мин). Использовался следующий состав ферментационной среды: (NH4)2SO4 - 15.0 г/л, КН2PO4 - 1.5 г/л, MgSO4 - 1.0 г/л, СаСО3 - 20.0 г/л, тиамина - 0.1 мг/л, питательный бульон - 1%, глюкоза - 4%, L-метионин - 300 мг/л и Na2S2O3 - 0.5 г/л.
После окончания ферментации количество накопленного в среде L-цистеина определялось при помощи метода, описанного Gaitonde, M.K. (Biochem. J., 104: 2, 627-33 (1967)). Полученные данные представлены в Таблице 3.
Из данных, приведенных в Таблице 3, следует, что повышенная экспрессия мутантного гена cysE5 увеличивает продукцию цистеина указанным штаммом Е.coli MG1655 в большей степени, чем ген cysEX.








| название | год | авторы | номер документа |
|---|---|---|---|
| БАКТЕРИЯ, ПРИНАДЛЕЖАЩАЯ К РОДУ ESCHERICHIA, - ПРОДУЦЕНТ L-ЦИСТЕИНА И СПОСОБ ПОЛУЧЕНИЯ L-ЦИСТЕИНА | 2003 |
|
RU2275425C2 |
| МУТАНТНАЯ N-АЦЕТИЛГЛУТАМАТ СИНТАЗА (ВАРИАНТЫ), ФРАГМЕНТ ДНК, ШТАММ БАКТЕРИИ Escherichia coli - ПРОДУЦЕНТ АРГИНИНА (ВАРИАНТЫ) И СПОСОБ ПОЛУЧЕНИЯ L-АРГИНИНА | 2001 |
|
RU2215783C2 |
| МУТАНТНАЯ ФОСФОРИБОЗИЛПИРОФОСФАТСИНТЕТАЗА, ФРАГМЕНТ ДНК, БАКТЕРИЯ РОДА ESCHERICHIA - ПРОДУЦЕНТ L-ГИСТИДИНА И СПОСОБ ПРОДУКЦИИ L-ГИСТИДИНА | 2004 |
|
RU2282660C2 |
| НОВАЯ МУТАНТНАЯ КАРБАМОИЛФОСФАТСИНТЕТАЗА И СПОСОБ ПРОДУКЦИИ СОЕДИНЕНИЙ - ПРОИЗВОДНЫХ КАРБАМОИЛФОСФАТА | 2001 |
|
RU2264459C2 |
| МУТАНТНАЯ АЦЕТОЛАКТАТСИНТАЗА И СПОСОБ ПРОДУКЦИИ РАЗВЕТВЛЕННЫХ L-АМИНОКИСЛОТ | 2006 |
|
RU2355763C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-ЦИСТЕИНА С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ СЕМЕЙСТВА ENTEROBACTERIACEAE | 2010 |
|
RU2458981C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-ТРЕОНИНА С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ ESCHERICHIA, В КОТОРОЙ ИНАКТИВИРОВАН ОПЕРОН mazEF | 2005 |
|
RU2313573C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТ С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ ESCHERICHIA | 2005 |
|
RU2311454C2 |
| БАКТЕРИЯ, ПРИНАДЛЕЖАЩАЯ К РОДУ Escherichia, В КОТОРОЙ ИНАКТИВИРОВАН ГЕН pnp, - ПРОДУЦЕНТ L-ТРЕОНИНА, И СПОСОБ ПОЛУЧЕНИЯ L-ТРЕОНИНА | 2005 |
|
RU2330883C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-ТРЕОНИНА С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ ESCHERICHIA, В КОТОРОЙ ИНАКТИВИРОВАН ГЕН hipA | 2005 |
|
RU2320718C2 |

Изобретение относится к биотехнологии. L-цистеин получают культивированием бактерии рода Escherichia, которая трансформирована ДНК, кодирующим мутантную серинацетилтрансферазу. Причем указанная мутантная серинацетилтрансфераза имеет одну или несколько мутаций в природной последовательности серинацетилтрансферазы из Е.coli, в положениях с 89 по 96 и ингибирование L-цистеином по принципу обратной связи в которой ослаблено. Заявленное изобретение позволяет получить L-цистеин с высокой степенью эффективности. 4 н. и 2 з.п. ф-лы, 5 ил., 3 табл.
| US 6218168, 17.04.2001 | |||
| ФРАГМЕНТ ДНК ИЗ ESCHERICHIA COLI, ОПРЕДЕЛЯЮЩИЙ ПОВЫШЕННУЮ ПРОДУКЦИЮ L-АМИНОКИСЛОТ (ВАРИАНТЫ), И СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТ | 1999 |
|
RU2175351C2 |
Авторы
Даты
2006-07-10—Публикация
2003-12-05—Подача