Уровень техники
Область техники
Настоящее изобретение относится к микробиологической промышленности, в частности к способу получения L-цистеина с использованием бактерии семейства Enterobacteriaceae, которая модифицирована таким образом, что в ней усилена экспрессия одного или нескольких генов, кодирующих глутаредоксины и глутатионредуктазу.
Предшествующий уровень техники
Традиционно L-аминокислоты в промышленном масштабе могут быть получены методом ферментации с использованием штаммов микроорганизмов, полученных из природных источников, или их мутантов. Обычно микроорганизмы модифицированы для того, чтобы увеличить продукцию L-аминокислот.
Описано множество методов увеличения продукции L-аминокислот, например, путем трансформации микроорганизма рекомбинантной ДНК (см., например, патент США 4278765). Другие методы основаны на повышении активности ферментов, вовлеченных в биосинтез аминокислот и/или уменьшении чувствительности целевого фермента к ингибированию продуцируемой L-аминокислотой по типу обратной связи (см., например, заявка РСТ WO95/16042 или патенты США № 4346170; 5661012; и 6040160).
Неорганический сульфат ( S+VI) in vivo восстанавливается до сульфита (
S+VI) in vivo восстанавливается до сульфита ( S+IV) с помощью фосфоаденилилсульфатредуктазы (PAPS-редуктаза). Мутант Escherichia coli, лишенный глутатионредуктазы и глутаредоксинов (gor-grxA-grxB-grxC-), практически не растет на сульфате. С помощью метода, основанного на тиолспецифичном флуоресцентном алкилировании и гель-электрофорезе, было показано, что глутатионилированная PAPS-редуктаза восстанавливается до глутаредоксинов через монотиольный механизм. Обратимое глутатионилирование может регулировать активность PAPS-редуктазы in vivo (Lillig С.Н. et al., J Biol Chem.; 278(25):22325-30 (2003)).
S+IV) с помощью фосфоаденилилсульфатредуктазы (PAPS-редуктаза). Мутант Escherichia coli, лишенный глутатионредуктазы и глутаредоксинов (gor-grxA-grxB-grxC-), практически не растет на сульфате. С помощью метода, основанного на тиолспецифичном флуоресцентном алкилировании и гель-электрофорезе, было показано, что глутатионилированная PAPS-редуктаза восстанавливается до глутаредоксинов через монотиольный механизм. Обратимое глутатионилирование может регулировать активность PAPS-редуктазы in vivo (Lillig С.Н. et al., J Biol Chem.; 278(25):22325-30 (2003)).
Глутаредоксины представляют собой повсеместно распространенные белки, которые катализируют восстановление дисульфидов (S-S-белки) или смешанных дисульфидов, образующихся между белками и глутатионом (GSH) (белок-S-SG) в сопряженной системе с GSH, NADPH и GSH-редуктазой. Глутаредоксины могут таким образом рассматриваться как восстановители дисульфидов через GSH. Бактерия Е.coli обладает тремя глутаредоксинами (Grx1, Grx2 и Grx3) и двумя тиоредоксинами (Trx1, Trx2). Grx3 (9 кДа, кодируемый геном grxC) был вьщелен из мутанта E.coli, полностью дефектного по Grx1 и Trx1. Grx1 и Grx3 идентичны по последовательности на 33% и имеют сходную структуру (тиоредоксиновую/глутаредоксиновую складку). Grx3 может восстанавливать RR1a (рибонуклеотидредуктаза класса 1а из Е.coli) с 5% каталитической эффективностью Grx1. Grx2 и Grx3, по-видимому, не участвуют в восстановлении сульфата до сульфита, которое катализируется в Е.coli PAPS-редуктазой. Было показано, что штамм дикого типа и штамм trxB-grxC- демонстрируют одинаковые темпы роста на богатой LB-среде, что дает основания предполагать, что Е.coli может восполнять основные нарушения тиоредоксинового/глутаредоксинового путей, когда в полной мере обеспечена питательными веществами. На минимальной среде М9 дикий тип и мутант trxB-grxC- росли также одинаковыми темпами, a trxA-grxC- рос очень медленно и достигал более низкого окончательного уровня роста (Vlamis-Gardikas А. et al., J Biol Chem.; 277(13):10861-8(2002)).
Предполагается, что Grx3, связанный с клеточным GSH, является третьей системой доноров водорода в отсутствие тиоредоксина и классического глутаредоксина (Grx1). При обычных условиях, очевидно, что Grx3 должен иметь другие функции в клетке (Aslund F. et al., PNAS, 91, 9813-7(1994)).
Транскрипция gor индуцируется H2O2, картирован предполагаемый OxyR-сайт связывания и начало OxyR-регулируемого транскрипта перед геном gorA из Е.coli (Toledano М.В. et al., Cell, 78, 897-909 (1994)).
Было установлено, что ген gor регулируется не только через OxyR, но также с помощью rpoS. Было обнаружено, что в стационарной фазе rpoS регулирует не только ферментативную активность gor, но также и транскрипционную активность. Отсутствие указанного выше белка увеличивает устойчивость Е.coli к некоторым веществам окислительного стресса, таким как Н2О2 и NEM (N-этилмалеимид). Поэтому, вероятно, что gor не функционирует как типичный антиоксидант (Becker-Hapak М. and Eisenstark A., FEMS Microbiology Letters 134(1), 39-44 (1995)).
Совместная экспрессия нескольких генов в Е.coli измерялась с помощью обратной транскрипции-мультиплексной флуоресцентной ПЦР. Было показано, что транскрипция gorA активируется по мере роста бактерии дикого типа. GorA был активирован в течение экспоненциальной фазы роста. Максимальная индукция составила 4.6. Обработка Н2О2 стимулировала экспрессию гена gorA, ранее идентифицированного в качестве компонента OxyR регулона. Индукция посредством Н2О2 была значительно быстрее и являлась обратимой реакцией, и имела место быть при OxyR-зависимом и σS-независимом типе. NaCl индуцировал экспрессию генов, контролируемых OxyR(Michán С. et al., J Bacteriol.; 181(9):2759-64 (1999)).
Оценивалась экспрессия до 16 генов Е.coli, кодирующих компоненты и глутаредоксиновой, и тиоредоксиновой систем и компоненты OxyR и SoxRS регулонов. Была продемонстрирована обратная зависимость между экспрессией nrdAB
и экспрессией генов, кодирующих компоненты и глутаредоксиновой (grxA, gorA) и тиоредоксиновой (trxB, trxC) систем (Prieto-Alamo M.J. et al., J Biol Chem.; 275(18):13398-405 (2000)).
Для изучения роли в защите от окислительного стресса и редоксзависимого формирования фотосинтетических комплексов были сконструированы мутанты с нарушениями в компонентах глутатион-глютаредоксиновой (GSH/Grx) системы Rhodobacter capsulatus. Отсутствие гена глутаредоксина 3 (grxC) или гена глутатионсинтетазы В (gshB) приводило к замедлению темпов роста при аэробных условиях и повышению чувствительности к окислительному стрессу, подтверждающему роль GSH/Grx системы в защите от окислительного стресса. Оба мутанта были высокочувствительны к дисульфидному стрессу, что показывает значительный вклад системы GSH/Grx в тиолдисульфидную оксилительно-восстановительную буферную систему цитоплазмы. Как и мутации в тиоредоксиновой системе, мутации в GSH/Grx системе влияли на формирование редокс-зависимых фотосинтетических комплексов в R. capsulatus. Экспрессия генов глутаредоксина1 grxC, gshB, grxA и глутатионредуктазы gorA, кодирующих компоненты GSH/Grx системы, не индуцировалась окислительным стрессом. Мутации в генах grxC и/или gshB, и/или trxC (тиоредоксин 2) влияли на экспрессию этих генов, демонстрируя тем самым взаимодействие различных систем защиты от окислительного стресса. OxyR и SoxRS регулоны контролируют экспрессию многих генов, вовлеченных в защиту от окислительного стресса у Е.coli в ответ на Н2О2 и супероксид, соответственно. Полученные данные и известная геномная последовательность R.capsulatus дают основания полагать, что у R.capsulatus SoxRS система отсутствует, но существует другой супероксид-чувствительный регулятор. В то же время, экспрессия gorA и grxA регулируется Н2О2 в Е.coli, но не в R.capsulatus, таким образом, OxyR регулоны двух этих видов совершенно разные (Li K. et al., J Bacteriol.; 186(20):6800-8 (2004)).
Из Salmonella typhimurium LT2 были выделены мутанты, имеющие нарушения в цистеинсинтазе А или В, или в обеих. Родительские штаммы были способны расти на минимальной среде, содержащей сульфат, сульфит, сульфид или тиосульфат в качестве источника серы. Мутанты без цистеинсинтазы В были не способны расти на тиосульфате, в то время как мутанты без цистеинсинтазы А росли с незначительными различиями в темпе роста на четырех вышеупомянутых источниках неорганической серы. Мутанты без обеих цистеинсинтаз не росли на среде, содержащей какой-либо из анализируемых источников неорганической серы. Выделение цистеинсинтазы В сопровождалось выделением и S-сульфоцистеинсинтазы. Кроме того, обе эти активности также вместе трансдуцировались. Указанные активности, вероятно, ассоциированы с геном cysM и могут с высокой частотой кодрансдуцироваться с геном cysK. Исходя из этих результатов можно сделать вывод о том, что тиосульфат ассимилируется только через S-сульфоцистеин только с помощью S-сульфоцистеинсинтазы (Nakamura Т. et al., J.Bacteriology, 156(2), 656-62 (1983)).
Метаболизм S-сульфоцистеина изучался в S.typhimurium. С эксперимента с подпиткой мутантов, нуждающихся в сульфите и сульфиде, было установлено, что указанная аминокислота превращается в цистеин и сульфит, и служит единственным источником серы. В первичных экстрактах были выявлены две различные NADPH-зависимые системы, способные участвовать в метаболизме S-сульфоцистеина. Обе системы были очищены и идентифицированы как глутатион-глутатионредуктаза и тиоредоксин-тиоредоксинредуктаза (Funane K. et al., Agric. Biol. Chem., 51(5), 1247-56 (1987)).
Но в настоящее время нет данных об усилении экспрессии одного или более генов, кодирующих глутаредоксины и глутатионредуктазу, с целью продукции L-цистеина бактерией семейства Enterobacteriaceae.
Описание изобретения
Целью настоящего изобретения является увеличение продуктивности штаммов-продуцентов L-цистеина, и предоставление способа получения L-цистеина с использованием указанных штаммов.
Данная цель была достигнута за счет обнаружения того факта, что усиление экспрессии одного или более генов среди генов, кодирующих глутаредоксины и глутатионредуктазу, может увеличивать продукцию L-цистеина.
Настоящее изобретение предоставляет бактерию, принадлежащую к семейству Enterobacteriaceae, в частности бактерию, принадлежащую к роду Pantoea или Escherichia, обладающую повышенной способностью к продукции L-цистеина.
Целью настоящего изобретения является предоставление бактерии семейства Enterobacteriaceae - продуцента L-цистеина, отличающейся тем, что указанная бактерия модифицирована таким образом, что в ней усилена экспрессия одного или более генов среди генов, кодирующих глутаредоксины и глутатионредуктазу.
Также целью настоящего изобретения является предоставление описанной выше бактерии, отличающейся тем, что указанная бактерия принадлежит к роду Pantoea.
Также целью настоящего изобретения является предоставление описанной выше бактерии, отличающейся тем, что указанная бактерия принадлежит к роду Escherichia.
Также целью настоящего изобретения является предоставление описанной выше бактерии, отличающейся тем, гены, кодирующие глутаредоксины, выбраны из группы, включающей ген grxC из Pantoea ananatis, ген grxB из Escherichia coli и ген grxC из Escherichia coli.
Также целью настоящего изобретения является предоставление описанной выше бактерии, отличающейся тем, что ген, кодирующий глутатионредуктазу, является геном gorA.
Также целью настоящего изобретения является предоставление описанной выше бактерии, отличающейся тем, что экспрессия указанного(ых) гена(ов) усилена за счет увеличения числа копий указанного(ых) гена(ов).
Также целью настоящего изобретения является предоставление описанной выше бактерии, отличающейся тем, что экспрессия указанного(ых) гена(ов) усилена за счет модификации последовательности, контролирующей экспрессию, таким образом, что экспрессия указанного(ых) гена(ов) усилена.
Также целью настоящего изобретения является предоставление описанной выше бактерии, отличающейся тем, что природный(ые) промотор(ы) указанного(ых) гена(ов) замещен(ы) более сильным(ыми) промотором(ами).
Также целью настоящего изобретения является предоставление способа получения L-цистеина, который включает выращивание бактерии в питательной среде, содержащей тиосульфат, и выделение L-цистеина из культуральной жидкости с целью его продукции и накопления.
Также целью настоящего изобретения является предоставление описанного выше способа получения L-цистеина, отличающегося тем, что в указанной бактерии усилена экспрессия генов, вовлеченных в биосинтез L-цистеина.
Настоящее изобретение более детально описано ниже.
Подробное описание наилучшего способа осуществления изобретения
1. Бактерия согласно настоящему изобретению
Бактерией, согласно настоящему изобретению, является бактерия, принадлежащая к семейству Enterobacteriaceae - продуцент L-цистеина, модифицированная таким образом, что экспрессия одного или более генов среди генов, кодирующих глутаредоксины и глутатионредуктазу, указанной бактерией усилена.
Согласно настоящему изобретению, термин «бактерия - продуцент L-цистеина» означает бактерию, способную производить и накапливать L-цистеин в среде, когда такая бактерия культивируется в питательной среде.
Термин «бактерия - продуцент L-цистеина» также означает бактерию, способную производить и накапливать в культуральной среде L-цистеин в количествах, больших, чем природный или родительский штаммы, например Pantoea, такие как Pantoea ananatis {Enterobacter agglomerans) штаммы AJ13355 (FERM BP-6614), AJ13356 (FERM BP-6615), AJ13601 (FERM BP-7207), SC17 (патент США 7090998), или Е.coli, такие как Е.coli K-12. Термин «бактерия - продуцент L-цистеина» также означает, что микроорганизм способен производить и накапливать в среде L-цистеин в концентрациях не меньше, чем 0,5 г/л, и, более предпочтительно, не меньше, чем 1,0 г/л.
Семейство Enterobacteriaceae включает бактерии, относящиеся к родам Escherichia, Enterobacter, Erwinia, Klebsiella, Pantoea, Photorhabdus, Providencia, Salmonella, Serratia, Shigella, Morganella, Yersinia и другие. В особенности предпочтительны бактерии, отнесенные к семейству Enterobacteriaceae согласно классификации базы данных NCBI (National Center for Biotechnology Information, ttp://www.ncbi.nlm.nih.gov/Taxonomy/Browser/wwwtax.cgi?id=91347). Предпочтительны бактерии, принадлежащие к роду Escherichia или Pantoea.
Термин «бактерия, относящаяся к роду Pantoea)) означает, что бактерия относится к роду Pantoea согласно системе классификации, известной специалисту в области микробиологии. Некоторые виды Enterobacter agglomerans недавно были переклассифицированы в Pantoea agglomerans, Pantoea ananatis, Pantoea stewartii или другие аналогичные, на основании нуклеотидного анализа последовательности 16S РНК, и других (Int. J. Syst. Bacteriol., 43, 162-173 (1993)).
Термин «бактерия, принадлежащая к роду Escherichia)) означает, что бактерия относится к роду Escherichia в соответствии с классификацией, известной специалисту в области микробиологии. Среди примеров бактерий, принадлежащих к роду Escherichia, но не ограничивающихся ими, может быть упомянута бактерия Escherichia coli (Е.coli).
Круг бактерий, принадлежащих к роду Escherichia, которые могут быть использованы в настоящем изобретении, не ограничен каким-либо образом, однако, например, бактерии, описанные в книге Neidhardt F.C. et al. (Escherichia coli and Salmonella typhimurium, American Society for Microbiology, Washington D.C., 1208, Таблица 1), могут быть включены в число бактерий согласно настоящему изобретению.
Фраза "бактерия была модифицирована таким образом, что экспрессия гена усилена" означает, что уровень экспрессии гена в модифицированной бактерии выше, чем в немодифицированном штамме, например штамме дикого типа. Примерами такой модификации могут служить увеличение числа копий экспрессируемого(ых) гена(ов) в пересчете на клетку или повышение уровня экспрессии гена(ов) и другие. Количество копий экспрессируемого гена можно измерить, например, с помощью рестрикции хромосомной ДНК и последующей гибридизацией по Саузерну, с использованием зонда, сконструированного на основе нуклеотидной последовательности гена, флуоресцентной гибридизации in situ (FISH) и подобных методов. Уровень экспрессии генов может быть измерен с помощью различных методов, включая гибридизацию по Нозерну, количественную ОТ - ПЦР (RT-PCR) и подобные им. В качестве контроля могут служить штаммы дикого типа, например, Pantoea ananatis FERM ВР-6614.
Термин «экспрессия» означает образование белкового продукта, кодируемого геном.
Фраза «последовательность, контролирующая экспрессию» относится к нуклеотидным последовательностям, локализованным перед, внутри или после кодирующего участка, контролирующим транскрипцию и/или экспрессию кодирующего участка во взаимодействии с аппаратом белкового биосинтеза клетки. Данная фраза обычно используется для обозначения промоторов, сайтов связывания рибосом (RBS), операторов и/или других элементов генома, участвующих в регуляции уровня экспрессии гена.
Усиление экспрессии гена может быть достигнуто за счет введения нескольких копий гена в бактериальную хромосому, например, с помощью метода гомологичной рекомбинации, Mu-интеграции, или других подобных методов. Например, один акт Mu-интеграции позволяет ввести в бактериальную хромосому до 3-х копий гена.
Увеличение числа копий гена также может быть достигнуто за счет введения нескольких копий гена в хромосомную ДНК бактерии. Для того чтобы ввести несколько копий гена в бактериальную хромосому, может быть осуществлена гомологичная рекомбинация с использованием последовательности, несколько копий которой присутствуют в качестве мишени в хромосомной ДНК. Последовательности, имеющие несколько копий в хромосомной ДНК, включают, но не ограничиваются ими, повторяющуюся ДНК, или инвертированные повторы на концах подвижных элементов. Также возможно ввести ген в транспозон и обеспечить его перемещение для введения нескольких копий гена в хромосомную ДНК.
Усиление экспрессии гена, согласно настоящему изобретению, может быть достигнуто помещением фрагмента ДНК под контроль более сильного, чем природный, промотора. Например, lac-промотор, trp-промотор, trc-промотор, PR, или PL промоторы фага λ, известны как сильные промоторы. Сильный промотор может быть использован совместно с увеличением числа копий гена. Термин "природный промотор" означает существующую в природном организме область ДНК, расположенную перед открытой рамкой считывания (ORF - opened reading frame) гена/кластера генов и способствующую экспрессии этого гена/кластера генов. Сила промотора определяется частотой акта инициации синтеза РНК.
Также действие промотора может быть усилено, например, введением мутаций в промотор для повышения уровня транскрипции гена, расположенного после указанного промотора. Кроме того, известно, что на трансляционную способность РНК оказывают значительное влияние замены некоторых нуклеотидов между сайтом связывания рибосом (RBS-ribosome binding site) и стартовым кодоном, а главным образом, последовательности, расположенные непосредственно перед стартовым кодоном. Например, в зависимости от природы трех предшествующих стартовому кодону нуклеотидов, наблюдается 20-кратное различие в уровне экспрессии (Gold et al., Annu. Rev. Microbiol., 35, 365-403, 1981; Hui et al., EMBO J., 3, 623-629, 1984).
Более того, возможно введение нуклеотидной замены в промоторный район гена в бактериальной хромосоме, приводящее к усилению функционирования промотора. Изменение контролирующей экспрессию последовательности может быть осуществлено, например, таким же способом, как осуществляется процедура замены гена с использованием термочувствительной плазмиды, описанная в заявке РСТ WO 00/18935 и заявке Японии JP 1-215280 А.
Ген grxB из Е.coli кодирует белок глутаредоксин 2. Ген grxC из Е.coli кодирует белок глутаредоксин 3. Ген gorA из Е.coli кодирует белок глутатионредуктазу. Глутатионредуктаза катализирует реакцию восстановления дисульфидглутатиона: дисульфидглутатион + НАДФН + Н+ <=> 2 глутатион + NADP+.
Нуклеотидная последовательность генов gorA, grxB и grxC из Е.coli уже определена. Ген gorA (синонимы: ECK3485, b3500; нуклеотиды с 3644322 по 3645674 в последовательности, представленной в базе данных GenBank с инвентарным номером NC_000913.2; gi: 16131372) расположен между генами yhiR и dinQ на хромосоме бактерии Е. coli K12. Ген grxB (синонимы: ECK1049, b1064; нуклеотиды, комплементарные нуклеотидам в позиции с 1122630 по 1123277; в последовательности, представленной в базе данных GenBank с инвентарным номером NC_000913.2; gi: 16129027) расположен между генами yceB и mdtH на хромосоме бактерии Е. coli K12. Ген grxC (синонимы: ECK3600, b3610, yibM; нуклеотиды, комплементарные нуклеотидам в позиции с 3782214 по 3782465; в последовательности, представленной в базе данных GenBank с инвентарным номером NC_000913,2; gi: 16131481) расположен между генами secB и yibN на хромосоме бактерии Е. coli K12.
Нуклеотидные последовательности генов gorA и grxC из Р. ananatis до сих пор не были известны. Нуклеотидная последовательность гена grxC из Р. ananatis представлена в SEQ ID NO: 1. Нуклеотидная последовательность remgorA из Р. ananatis представлена в SEQ ID NO: 2.
В связи с тем, что последовательности ДНК могут различаться среди видов и штаммов рода Pantoea или Escherichia, гены gorA, grxB и grxC не ограничиваются последовательностями, представленными в SEQ ID NO: I, SEQ ID NO: 2 или в базе данных GenBank, и могут включать гены, гомологичные указанным выше генам.
Таким образом, гены gorA, grxB и grxC могут быть вариантами, которые гибридизуются при жестких условиях с нуклеотидными последовательностями, представленными в SEQ ID NO: I, SEQ ID NO: 2 или в GenBank, или с зондами, которые могут быть синтезированы на основе указанных нуклеотидных последовательностей. «Жесткие условия» включают такие условия, при которых специфические гибриды, например, гибриды со степенью гомологии не менее 60%, предпочтительно, не менее 70%, более предпочтительно, не менее 80%, еще более предпочтительно, не менее 90%, наиболее предпочтительно, не менее 95%, образуются, а неспецифические гибриды, например, гибриды со степенью гомологии ниже вышеуказанной - не образуются. Практическим примером жестких условий является однократная или многократная отмывка, предпочтительно двух- или трехкратная, при концентрации солей, соответствующей стандартным условиям отмывки при гибридизации по Саузерну, например, I×SSC, 0.1% SDS, предпочтительно 0.1×SSC, 0.1% SDS, при 60°С.
Продолжительность отмывки зависит от типа используемой для блоттинга мембраны и, как правило, рекомендуется производителем. Например, рекомендуемая продолжительность отмывки для нейлоновой мембраны Hybond™ N + (Amersham) при жестких условиях составляет 15 минут. Предпочтительна двух- или трехкратная отмывка. Длина зонда может быть выбрана в зависимости от условий гибридизации, обычно она составляет от 100 п.н. до 1 т.п.н.
Методы получения плазмидной ДНК, расщепления и дотирования ДНК, трансформации, подбора олигонуклеотидов в качестве праймеров и другие подобные методы являются обычными методами, хорошо известными для специалиста в указанной области техники. Перечисленные методы описаны в Sambrook, J. and Russell D., "Molecular Cloning A Laboratory Manual, Third Edition", Cold Spring Harbor Laboratory Press (1989).
2. Способ согласно настоящему изобретению.
Способом продукции L-цистеина является способ, включающий стадии культивирования бактерии согласно настоящему изобретению в питательной среде, содержащей тиосульфат в качестве источника серы, с целью накопления L-цистеина в питательной среде и выделения L-цистеина из культуральной жидкости.
Согласно настоящему изобретению, выращивание бактерии, выделение из культуральной жидкости и очистка L-цистеина могут быть осуществлены ферментативными способами, традиционно используемыми для аминокислоты, которая продуцируется бактерией.
Питательная среда для выращивания может быть как синтетической, так и натуральной, при условии, что она содержит источники углерода, азота, минеральные соединения и, если необходимо, питательные добавки в количестве, необходимом для роста бактерии. Источники углерода включают в себя различные углеводы, такие как глюкоза и сахароза, и различные органические кислоты. В зависимости от способа ассимиляции используемых бактерий, могут быть использованы спирты, такие как этанол и глицерин. В качестве источников азота используются аммиак, различные соли аммония, такие как сульфат аммония, другие соединения азота, такие как амины, природные источники азота, такие как пептон, гидролизат соевых бобов и микробный ферментолизат. В качестве источников серы, согласно настоящему изобретению, используются сульфат аммония, сульфат магния, сульфат железа, сульфат марганца и подобные им. В качестве минеральных соединений используются однозамещенный фосфат калия, хлорид натрия, хлорид кальция, соли магния, соли железа, соли марганца и подобные им. В качестве витаминов используются тиамин, дрожжевой экстракт и подобные им.
Выращивание проводят предпочтительно в аэробных условиях, таких как взбалтывание и аэрация с перемешиванием, при температуре от 20°С до 40°С, предпочтительно от 30°С до 38°С. Значение pH обычно варьирует в пределах от 5 до 9, предпочтительно в пределах от 6.5 до 7.2. pH среды может быть скорректирован аммиаком, карбонатом кальция, различными кислотами, основаниями и буферами. Обычно, выращивание в течение от 1 до 5 дней приводит к накоплению целевой L-аминокислоты в культуральной жидкости.
После выращивания, нерастворимые компоненты, такие как клетки, могут быть удалены из питательной среды методом центрифугирования или фильтрации на мембране, после чего целевая L-аминокислота может быть выделена и очищена методами ионного обмена, концентрации или кристаллизации.
Краткое описание рисунков
На Фигуре 1 изображены последовательности природного промотора Pnlp и промотора Pnlp8.
На Фигуре 2 изображена конструкция плазмиды pM12-ter(thr).
На Фигуре 3 изображена конструкция интегративной кассеты intJS.
На Фигуре 4 изображена конструкция плазмиды pMIV-5JS.
Примеры
Настоящее изобретение будет более подробно описано ниже со ссылкой на следующие не ограничивающие настоящее изобретение Примеры.
Пример 1. Конструкция штамма с усиленной экспрессией гена cysM
1. Конструкция штамма P.ananatis EYPSG8
ДНК-фрагмент, содержащий промотор гена nlpD из Е.coli, был получен с помощью ПЦР. Хромосомная ДНК штамма Е.coli MG1655 (АТСС 700926) была использована в качестве матрицы, в качестве праймеров использовали P1 (SEQ ID No:6) и Р2 (SEQ ID No:7). Праймер P1 (SEQ ID No:6) содержит сайт для рестриктазы SalI на 5'-конце. Праймер Р2 (SEQ ID No:7) содержит сайт для рестриктазы PaeI на 5'-конце. Условия ПЦР были следующими: денатурация 3 мин при 95°С; условия для первых двух циклов: 1 мин при 95°С, 30 с при 50°С, 40 с при 72°С; условия для последующих 25 циклов: 20 с при 94°С, 20 с при 55°С, 15 сек при 72°С; финальная элонгация: 5 мин при 72°С. Амплифицированный ДНК-фрагмент имел длину около 0, 2 т.п.н., его очистка осуществлялась с помощью агарозного гель-электрофореза. Затем очищенный фрагмент обрабатывался эндонуклеазами PaeI и SalI. Полученный ДНК-фрагмент лигировали с плазмидой pMIV-5JS (конструирование плазмиды pMIV-5JS описано в Справочном примере 1), предварительно обработанной эндонуклеазами PaeI и SalI. Смесь для лигирования инкубировали в течение ночи при 4°С и затем использовали для трансформации штамма Е.coli MG1655 методом электропорации. Полученные трансформанты высевали на LB-агар с ампициллином (50 мг/л), чашки инкубировали в течение ночи при 37°С до образования различимых индивидуальных колоний. Из полученных трансформантов выделяли плазмиды и анализировали с помощью рестрикционного анализа. Полученная плазмида содержала промотор гена nlpD из Е.coli, и была названа pMIV-Pnlp0.
ДНК-фрагмент, содержащий терминатор гена rrnB из Е.coli, был получен с помощью ПЦР. Хромосомная ДНК штамма Е.coli MG1655 была использована в качестве матрицы, в качестве праймеров использовали олигонуклеотиды Р3 (SEQ ID No:8) и Р4 (SEQ ID No:9). Праймер Р3 (SEQ ID Nо:8) содержит сайт для рестриктазы XbaI на 5'-конце. Праймер Р4 (SEQ ID No:8) содержит сайт для рестриктазы BamHI на 5'-конце. Условия ПЦР были следующими: денатурация 3 мин при 95°С; условия для первых двух циклов: 1 мин при 95°С, 30 с при 50°С, 40 с при 72°С; условия для последующих 25 циклов: 20 с при 94°С, 20 с при 59°С, 15 сек при 72°С; финальная элонгация: 5 мин при 72°С. Амплифицированный ДНК-фрагмент имел длину около 0,3 т.п.н., его очистка осуществлялась с помощью агарозного гель-электрофореза. Затем очищенный фрагмент обрабатывали эндонуклеазами BamHI и XbaI. Полученный ДНК-фрагмент лигировали с плазмидой pMIV-Pnlp0, предварительно обработанной эндонуклеазами BamHI и XbaI. Смесь для лигирования инкубировали в течение ночи при 4°С и затем использовали для трансформации штамма Е.coli MG1655 методом электропорации. Полученные трансформанты высевали на LB-агар с ампициллином (50 мг/л), чашки инкубировали в течение ночи при 37°С до образования различимых индивидуальных колоний. Из полученных трансформантов выделяли плазмиды и анализировали с помощью рестрикционного анализа. Полученная плазмида содержала терминатор гена rrnB Е.coli, и была названа pMIV-Pnlp0-ter.
ДНК-фрагмент, содержащий ген yeaS из Е.coli, был получен с помощью ПЦР. Хромосомная ДНК штамма Е.coli MG1655 была использована в качестве матрицы, в качестве праймеров использовали олигонуклеотиды Р5 (SEQ ID No:10) и Р6 (SEQ ID No: 11). Праймер Р5 (SEQ ID No:10) содержит сайт для рестриктазы SalI на 5'-конце. Праймер Р6 (SEQ ID No: 11) содержит сайт для рестриктазы XbaI на 5'-конце. Условия ПЦР были следующими: денатурация 3 мин при 95°С; условия для первых двух циклов: 1 мин при 95°С, 30 с при 50°С, 40 с при 72°С; условия для последующих 25 циклов: 20 с при 94°С, 20 с при 55°С, 15 с при 72°С; финальная элонгация: 5 мин при 72°С. Амплифицированный ДНК-фрагмент имел длину около 0,7 т.п.н., его очистка осуществлялась с помощью агарозного гель-электрофореза. Затем очищенный фрагмент обрабатывали эндонуклеазами SalI и XbaI. Полученный ДНК-фрагмент лигировали с плазмидой pMIV-Pnlp0-ter, предварительно обработанной эндонуклеазами SalI и XbaI. Смесь для лигирования инкубировали в течение ночи при 4°С и затем использовали для трансформации штамма Е.coli MG1655 методом электропорации. Полученные трансформанты высевали на LB-агар с ампициллином (50 мг/л), чашки инкубировали в течение ночи при 37°С до образования различимых индивидуальных колоний. Из полученных трансформантов выделяли плазмиды и анализировали с помощью рестрикционного анализа. Полученная плазмида содержала ген yeaS из Е.coli, и была названа pMIV-Pnlp0-yeaS3.
Затем была выполнена рандомизация района -10 промотора PnlpD и селекция промотора Pnlp8. 3'-конец промотора PnlpD был получен с помощью ПЦР-амплификации. Плазмиду pMIV-Pnlp0 использовали в качестве матрицы, а в качестве праймеров использовали олигонуклеотиды P1 (SEQ ID No:6) и Р7 (SEQ ID No: 12). Праймер Р7 содержит случайные нуклеотиды, указанные в последовательности SEQ ID NO: 12 обозначением "n" (для А или G, или С или Т), и сайт для рестриктазы BglII на 5'-конце. Условия ПЦР были следующими: денатурация 3 мин при 95°С; условия для первых двух циклов: 1 мин при 95°С, 30 с при 50°С, 40 с при 72°С; условия для последующих 25 циклов: 20 с при 94°С, 20 с при 60°С, 15 сек при 72°С; финальная элонгация: 5 мин при 72°С. 5'-конец промотора PnlpD был получен с помощью ПЦР-амплификации. Плазмиду pMIV-Pnlp0 использовали в качестве матрицы, а в качестве праймеров использовали олигонуклеотиды Р2 (SEQ ID No:7) и Р8 (SEQ ID No: 13). Праймер Р8 содержит случайные нуклеотиды, указанные в последовательности SEQ ID NO: 13 обозначением "n" (для А или G, или С, или Т), и сайт для рестриктазы BglII на 5'-конце. Условия ПЦР были следующими: денатурация 3 мин при 95°С; условия для первых двух циклов: 1 мин при 95°С, 30 с при 50°С, 40 с при 72°С; условия для последующих 25 циклов: 20 с при 94°С, 20 с при 60°С, 15 с при 72°С; финальная элонгация: 5 мин при 72°С. Оба амплифицированных ДНК-фрагмента очищали с помощью агарозного гель-электрофореза. Затем полученные фрагменты обрабатывали эндонуклеазой BglII с последующим лигированием фрагментов в эквимолярном соотношении. Смесь для лигирования инкубировали в течение ночи при 4°С и затем использовали в качестве матрицы для следующей реакции ПЦР, в качестве праймеров использовали олигонуклеотиды P1 (SEQ ID No:6) и P2 (SEQ ID No:7). Условия ПЦР были следующими: денатурация 3 мин при 95°С; условия для первых двух циклов: 1 мин при 95°С, 30 с при 50°С, 40 с при 72°С; условия для последующих 12 циклов: 20 с при 94°С, 20 с при 60°С, 15 с при 72°С; финальная элонгация: 5 мин при 72°С.
Амплифицированный ДНК-фрагмент имел длину около 0,2 т.п.н., его очистка осуществлялась с помощью агарозного гель-электрофореза. Затем очищенный фрагмент обрабатывали эндонуклеазами PaeI и SalI. Далее, полученный ДНК-фрагмент лигировали с плазмидой pMIV-Pnlp0-yeaS3, предварительно обработанной эндонуклеазами PaeI и SalI. Смесь для лигирования инкубировали в течение ночи при 4°С и затем использовали для трансформации штамма Е.coli MG1655 методом электропорации. Полученные трансформанты высевали на LB-агар с ампициллином (50 мг/л), чашки инкубировали в течение ночи при 37°С до образования различимых индивидуальных колоний. Из полученных трансформантов выделяли плазмиды и анализировали с помощью рестрикционного анализа. Полученная плазмида содержала промотор Pnlp8 (Фиг.1), и была названа pMIV-Pnlp8-yeaS7.
Затем плазмиду pMIV-Pnlp8-yeaS7 обрабатывали эндонуклеазой HindIII с последующей очисткой и добавлением большого фрагмента ДНК-полимеразы I (фрагмент Кленова). Полученный ДНК-фрагмент очищали и обрабатывали эндонуклеазой NcoI. Далее полученный ДНК-фрагмент очищали и лигировали в эквимолярном соотношении с плазмидой pMW-Pomp-cysE5 (pMT-Pomp-cysE5 была получена из pMIV-Pomp-cysE5 путем клонирования фрагмента XbaI-Eco88I, обработанного фрагментом Кленова, из pACYC-184 (tet-R) по PvuI сайту плазмиды pMIV-Pomp-cysE5; плазмида pMIV-Pomp-cysE5 была получена путем субклонирования фрагмента PaeI+SacI из pMW-Pomp-cysE5 (см. заявку РСТ WO 2005007841), по тем же сайтам плазмиды pMIV-5JS), предварительно обработанной эндонуклеазами SmaI и NcoI. Смесь для лигирования инкубировали в течение ночи при 4°С и затем использовали для трансформации штамма Е.coli MG1655 методом электропорации. Полученные трансформанты высевали на LB-агар с ампициллином (50 мг/л), чашки инкубировали в течение ночи при 37°С до образования различимых индивидуальных колоний. Из полученных трансформантов выделяли плазмиды и анализировали с помощью рестрикционного анализа. Полученные плазмиды содержали ген cysE5, и были названы pMIV-EY2. Для подтверждения исправности cysE5 аллеля в полученных трансформантах была измерена ферментативная активность серинацетилтрансферазы.
Следующим этапом была интеграция генов cysE5 и yeaS в хромосому штамма SC17 P.ananatis (патент США 6596517). Плазмида рМН10 (Зименков Д. и др., Биотехнология, 6, 1-22 (2004)) была использована для трансформации штамма SC17 P.ananatis методом электропорации. Полученные трансформанты высевали на LB-агар с канамицином (20 мг/л), чашки инкубировали в течение ночи при 30°С до образования различимых индивидуальных колоний. Полученный штамм SC17/pMH10 дважды пересевали. Затем с помощью метода электропорации проводили трансформацию бактерий P.ananatis полученного штамма SC17/pMH10 (этот штамм растет при 30°С) плазмидой pMIV-EY2. Полученные трансформанты подвергали тепловому шоку при высокой температуре (42°С, 20 минут) и высевали на LB-агар, содержащий хлорамфеникол (20 мг/л), чашки инкубировали в течение ночи при 39°С до образования различимых индивидуальных колоний. Около 50 клонов пересевали при 39°С, и каждый из них засевался в 1 мл LA-среды и инкубировали 48 часов при 39°С. После инкубации все 50 вариантов тестировали на утрату плазмид рМН10 и pMIV-EY2, и отбирали варианты, устойчивые к хлорамфениколу (20 мг/л), но чувствительные к канамицину (20 мг/л) и ампициллину (50 мг/л). Желаемые интегранты были идентифицированы с помощью ПЦР анализа с праймерами Р1 и Р6. Полученная линия штаммов была названа EY01-EY50, все из них были проверены на способность продуцировать цистеин в пробирках для ферментации. Для дальнейших экспериментов был отобран наилучший продуцент - штамм EY19.
Чтобы избавить штамм P.ananatis EY19 от устойчивости к хлорамфениколу, EY19 был трансформирован плазмидой pMT-Int-Xis2 (WO 2005/010175) методом электропорации. Полученные трансформанты высевали на LB-агар с тетрациклином (10 мг/л), чашки инкубировали в течение ночи при 30°С до образования различимых индивидуальных колоний. Желаемые трансформанты были идентифицированы за счет отбора вариантов, чувствительных к хлорамфениколу (20 мг/л). Такой «вылеченный» штамм был назван EY19(s).
Следующим этапом была замена у штамма EY19(s) промоторного района cysPTWA-генов промоторным районом Pnlp8. ПЦР была выполнена с использованием плазмиды pMIV-Pnlp8 -yeaS7 в качестве матрицы и праймерами P1 and Р2. Условия ПЦР были следующими: денатурация 3 мин при 95°С; условия для первых двух циклов: 1 мин при 95°С, 30 с при 50°С, 40 с при 72°С; условия для последующих 20 циклов: 20 с при 94°С, 20 с при 59°С, 15 с при 72°С; финальная элонгация: 5 мин при 72°С. Амплифицированный ДНК-фрагмент имел длину около 0,2 т.п.н., его очистка осуществлялась с помощью агарозного гель-электрофореза. Затем очищенный фрагмент обрабатывался фрагментом Кленова. После этого, полученный ДНК-фрагмент лигировали в эквимолярном соотношении с плазмидой pMW118-(λattL-Kmr-λattR) (Справочный пример 2), предварительно обработанной эндонуклеазой XbaI и фрагментом Кленова. Смесь для лигирования инкубировали в течение ночи при 4°С и затем использовали для трансформации штамма Е.coli MG1655 методом электропорации. Полученные трансформанты высевали на LB-агар с канамицином (20 мг/л), чашки инкубировали в течение ночи при 37°С до образования различимых индивидуальных колоний. Из полученных трансформантов выделяли плазмиды из и анализировали с помощью рестрикционного анализа. Полученная плазмида, содержащая промотор Pnlp, была названа pMW-Km-Pnlp8. Затем проводили ПЦР с использованием плазмиды pMW-Km-Pnlp8 в качестве матрицы и праймерами Р9 (SEQ ID No: 14) и P10 (SEQ ID No: 15). Условия ПЦР были следующими: денатурация 3 мин при 95°С; условия для первых двух циклов: 1 мин при 95°С, 30 с при 50°С, 40 с при 72°С; условия для последующих 30 циклов: 20 с при 94°С, 20 с при 54°С, 90 с при 72°С; финальная элонгация: 5 мин при 72°С. Полученный ДНК-фрагмент длиной около 1,6 т.п.н. очищали с помощью агарозного гель-электрофореза и использовали для трансформации штамма P.ananatis SC17(0) методом электропорации. Трансформанты высевали на LB-агар с канамицином (20 мг/л), чашки инкубировали в течение ночи при 34°С до образования различимых индивидуальных колоний. Желаемые трансформанты были идентифицированы с помощью ПЦР с праймерами P11 (SEQ ID No: 16) и Р12 (SEQ ID No: 17). Полученный штамм был назван SC17-Pnlp8-PTWA. Из штамма SC17-Pnlp8-PTWA выделяли хромосомную ДНК, 10 мкг которой использовали для трансформации штамма P.ananatis EY19(s) методом электропорации. Полученные трансформанты высевали на LB-агар с канамицином (20 мг/л), чашки инкубировали в течение ночи при 34°С до образования различимых индивидуальных колоний. Желаемые трансформанты были идентифицированы с помощью ПЦР с праймерами Р11 и Р12. Полученный штамм был назван EYP197. Чтобы избавиться от устойчивости штамма P.ananatis EY19 к канамицину, штамм EY19 был трансформирован плазмидой pMT-Int-Xis2 методом электропорации. Полученные трансформанты высевали на LB-агар с тетрациклином (10 мг/л), чашки инкубировали при 30°С в течение ночи до образования различимых индивидуальных колоний. Желаемые трансформанты были идентифицированы отбором вариантов, чувствительных к канамицину (20 мг/л). Такой «вылеченный» штамм был назван EY197(s).
Мутация N348A была введена с помощью сайт-специфического мутагенеза. Для этого, 3'-конец гена serA (с мутацией) был получен с помощью ПЦР-амплификации хромосомной ДНК штамма SC17 с праймерами Р13 (SEQ ID No: 18) и Р14 (SEQ ID No: 19), a 5'-конец гена serA был получен ПЦР-амплификацией хромосомной ДНК штамма SC17 с праймерами Р15 (SEQ ID No:20) и Р16 (SEQ ID No:21). Оба праймера Р14 (SEQ ID No:19) и P16 (SEQ ID No:21) содержат сайт для рестриктазы Smal на 5'-конце. Условия для первой ПЦР были следующими: денатурация 3 мин при 95°С; условия для первых двух циклов: 1 мин при 95°С, 30 с при 50°С, 40 с при 72°С; условия для последующих 25 циклов: 20 с при 94°С, 20 с при 60°С, 60 с при 72°С; финальная элонгация: 5 мин при 72°С. Условия для второй ПЦР были следующими: денатурация 3 мин при 95°С; условия для первых двух циклов: 1 мин при 95°С, 30 с при 50°С, 40 с при 72°С; условия для последующих 20 циклов: 20 с при 94°С, 20 с при 60°С, 20 сек при 72°С; финальная элонгация: 5 мин при 72°С. Оба амплифицированных ДНК-фрагмента очищали с помощью агарозного гель-электрофореза и обрабатывали эндонуклеазой SmaI. Далее полученные ДНК-фрагменты лигировали в эквимолярном соотношении. Смесь для лигирования инкубировали в течение ночи при 4°С и использовали в качестве матрицы для последующей ПЦР (с праймерами Р13 и Р15). Праймер Р13 (SEQ ID No: 18) содержит сайт для рестриктазы SalI на 5'-конце. Праймер Р15 (SEQ ID No:20) содержит сайт для рестриктазы XbaI на 5'-конце. Условия ПЦР были следующими: денатурация 3 мин при 95°С; условия для первых двух циклов: 1 мин при 95°С, 30 с при 50°С, 40 с при 72°С; условия для последующих 15 циклов: 20 с при 94°С, 20 с при 60°С, 75 с при 72°С; финальная элонгация: 5 мин при 72°С. Амплифицированный ДНК-фрагмент имел длину около 1,3 т.п.н., его очистку осуществляли с помощью агарозного гель-электрофореза. Полученный фрагмент обрабатывали эндонуклеазами SalI и XbaI. После рестрикции ДНК-фрагмент лигировали в эквимолярном соотношении с плазмидой pMIV-Pnlp8-ter, предварительно обработанной эндонуклеазами SalI и XbaI. Смесь для лигирования инкубировали в течение ночи при 4°С и затем использовали для трансформации штамма Е.coli MG1655 методом электропорации.
Полученные трансформанты высевали на LB-агар с ампициллином (50 мг/л), чашки инкубировали в течение ночи при 37°С до образования различимых индивидуальных колоний. Из полученных трансформантов выделяли плазмиды и анализировали с помощью секвенирования. Полученная плазмида, содержащая ген serA с мутацией N348A, была названа pMIV-Pnlp8-serA348.
Следующим этапом была интеграция аллеля serA348 в хромосому штамма P.ananatis SC17. ДНК плазмиды pMIV-Pnlp8-serA348 была использована для трансформации штамма P.ananatis SC17/pMH10 (этот штамм растет при 30°С) методом электропорации. Полученные трансформанты подвергали тепловому шоку (20 минут при 42°С) и высевали на LB-агар с хлорамфениколом (20 мг/л), чашки инкубировали в течение ночи при 39°С до образования различимых индивидуальных колоний. Около 50 клонов пересевали при 39°С, и каждый из них засевали в 1 мл LA-среды и инкубировали 48 часов при 39°С. После инкубации все 50 вариантов тестировали на отсутствие плазмид рМН10 и pMIV-Pnlp8-serA348, отбирали варианты, устойчивые к хлорамфениколу (20 мг/л), но чувствительные к канамицину (20 мг/л) и ампициллину (50 мг/л). Желаемые интегранты были идентифицированы с помощью ПЦР-анализа с праймерами Р1 и Р15. Во всех полученных вариантах была измерена специфическая активность фосфоглицератдегидрогеназы (PGD), и для последующих экспериментов был отобран вариант SC17int-serA348 с наибольшей активностью.
Следующим этапом был перенос интегрированной копии serA348 в штамм EYP197(s).
Из штамма SC17int-serA348 была выделена хромосомная ДНК, 10 мкг которой были использованы для трансформации штамма P.ananatis EYP197(s) методом электропорации. Полученные трансформанты высевали на LB-агар с хлорамфениколом (20 мг/л), чашки инкубировали в течение ночи при 34°С до образования различимых индивидуальных колоний. Желаемые трансформанты были идентифицированы ПЦР-анализом с праймерами Р1 и Р15. Полученный штамм был назван EYPS1976.
Следующим этапом было введение делеции gcd в штамм EYPS1976. Чтобы избавиться от устойчивости штамма P.ananatis EYPS1976 к хлорамфениколу, штамм EYPS1976 был трансформирован плазмидой pMT-Int-Xis2 методом электропорации. Полученные трансформанты высевали на LB-агар с тетрациклином (10 мг/л), чашки инкубировали в течение ночи при 30°С до образования различимых индивидуальных колоний. Желаемые трансформанты были идентифицированы отбором вариантов, чувствительных к хлорамфениколу (20 мг/л). Такой вылеченный штамм был назван EY1976(s).
Штамм P.ananatis SC17(0) (патентная заявка России RU 2006134574), в котором ген gcd делетирован, был сконструирован с помощью метода, впервые разработанного Datsenko K.А., Wanner B.L. (Proc. Natl. Acad. Sci. USA, 2000, 97(12), 6640-6645), называемого "Red-зависимая интеграция". ДНК-фрагмент, содержащий кассету устойчивости к канамицину KmR был получен методом ПЦР с использованием праймеров Р17 (SEQ ID NO: 22) и Р18 (SEQ ID NO: 23) и плазмиды pMW118-attL-Km-attR-ter_rrnB (Справочный пример 2) в качестве матрицы. Полученный ПЦР-продукт очищали с помощью агарозного гель-электрофореза и использовали для электропорации штамма P.ananatis SC17(0), содержащего плазмиду pKD46 с температур-зависимой репликацией. Плазмида pKD46 (Datsenko K.А. and Wanner B.L., Proc. Natl. Acad. Sci. USA, 2000, 97:12:6640-45) несет ДНК-фрагмент фага λ размером 2154 нуклеотида (хромосомная позиция: 31088 - 33241 последовательности с инвентарным номером J02459 в базе GenBank), и содержит гены Red-зависимой гомологичной рекомбинации фага (гены γ, β и ехо-гены), находящиеся под контролем индуцируемого арабинозой промотора ParaB. Плазмида pKD46 необходима для интеграции ПЦР-продукта в хромосому штамма SC17(0). Мутанты с делетированным геном gcd и маркированные геном Km-устойчивости были проверены с помощью ПЦР. Для проверки использовали локус-специфические праймеры Р19 (SEQ ID NO: 3) и Р20 (SEQ ID NO: 4). ПЦР-продукт, полученный в реакции с клетками родительского штамма SC17(0)gcd+ в качестве матрицы, имел длину 2560 п.н. ПЦР-продукт, полученный в реакции с клетками мутантного штамма в качестве матрицы, имел длину 1541 п.н. Мутантный штамм был назван SC17(0)Δgcd::Km.
Из штамма SC17Δgcd::Km была выделена хромосомная ДНК, 10 мкг выделенной ДНК использовали для трансформации штамма P.ananatis EYPS1976(s) методом электропорации. Полученные трансформанты высевали на LB-агар с канамицином (20 мг/л), чашки инкубировали в течение ночи при 34°С до образования различимых индивидуальных колоний. Желаемые трансформанты были идентифицированы с помощью ПЦР-анализа с праймерами Р17 (SEQ ID No:22) и PI8 (SEQ ID No:23). Полученный штамм был назван EYPSG8.
Чтобы избавиться от устойчивости штамма P.ananatis EYPSG8 к канамицину, штамм EYPSG8 был трансформирован плазмидой pMT-Int-Xis2 методом электропорации. Полученные трансформанты высевали на LB-агар с тетрациклином (10 мг/л), чашки инкубировали при 30°С в течение ночи до образования различимых индивидуальных колоний. Желаемые трансформанты были идентифицированы отбором вариантов, чувствительных к канамицину (20 мг/л). Такой вылеченный штамм был назван EYPSG8(s).
2. Конструкция штамма EYPSGint1M2
Штамм EYPSGint1M2 был получен за счет интеграции гена cysM из Е.coli в хромосому EYPSG8(s). На первом этапе интеграция cysM была осуществлена в результате мини-µ интеграции плазмиды pMIV-Pnlp1-cysM (Справочный пример 3) в хромосому штамма SC17 с использованием µ-транспозазы, содержащейся в плазмиде рМН10 (как описано выше). Полученная конструкция (int(Pnlp1-cysM)) была перенесена из штамма SC17 в штамм EYPSG8 методом хромосомной трансформации с использованием CmR маркера для селекции. Полученный штамм SC17 int (PompC-cysE5-Pnlp8-yeaS)Pnlp8-cysPTWAint(Pnlp8-serA348)Agcdint(Pnlp1-cysM)) был назван EYPSGint1M2 и после вылечивания от маркера устойчивости к антибиотику использовался для дальнейших экспериментов.
Пример 3. Активность S-сульфоцистеинредуктазы и глутатионредуктазы штаммов SC17/pMIV-grxC и SC17/pMIV-gorA
Чтобы оценить способность генов grxC и gorA из P.ananatis увеличивать активность S-сульфоцистеинредуктазы и глутатионредуктазы, штамм SC17 был трансформирован плазмидами pMIV-grxC (Справочный пример 4) и pMIV-gorA (Справочный пример 4), в результате были получены штаммы SC17/pMIV-grxC и SC17/pMIV-gorA, соответственно.
Клетки штаммов SC17, SC17/pMIV-grxC и SC17/pMIV-gorA из ночных культур, выращенных в среде М9 с соответствующими добавками, разводили свежей средой в соотношении 1:20 и выращивали при 34°С. Клетки собирали на поздней экспоненциальной фазе (примерно 6 часов). Собранные клетки однократно отмывали солевым раствором, ресуспендировали в 50 мМ Tris-HCl, pH 7.0,2 мМ DTT и разрушали ультразвуком. Растворимую фракцию белка использовали в качестве белкового препарата для измерения активности S-сульфоцистеинредуктазы и глутатионредуктазы.
S-сульфоцистеинредуктаза вместе со своим кофактором, глутатионом (GSH), катализирует восстановление S-сульфоцистеина до цистеина и сульфита, с получением окисленной формы глутатиаона (GSSG). Методы для измерения активности основывались на сопряжении указанной реакции с глутатионредуктазой, которая вместе со своим кофактором, НАДФН, катализирует восстановление окисленного глутатиона (GSSG) до глутатиона (GSH). Используемый метод являлся спектрофотометрическим измерением, при котором окисление НАДФН до НАДФ+ контролировалось по снижению абсорбции при 340 нм. Единица измерения активности S-сульфоцистеинредуктазы может быть выражена в пересчете на окисление НАДФН или восстановление GSSG, так как их молярное соотношение равно 1:1.
Реакционная смесь (1 мл) содержала: 100 мМ Tris-HCl, pH 7.5, 0.125 мМ NADPH, 0.1 мМ глутатиона (GSH, восстановленная форма), 1 ед. глутатионредуктазы (Sigma G3664), 2 мМ S-сульфоцистеина и препарат фермента. Реакцию инициировали добавлением S-сульфоцистеина и проводили при 20°С. Одна единица S-сульфоцистеинредуктазы определялась как количество фермента, необходимого для катализа восстановления одного микромоля НАДФН в минуту при pH 7.5 и 20°С. Продукт реакции (цистеин) определяли с помощью ВЭЖХ.
Глутатионредуктаза измерялась спектрофотометрически методом Carsberg (Carlberg I., Mannervik В., Glutathione reductase. Meth. Enzymol., 113, 485-490 (1985)).
Результаты измерений представлены в Таблице 1. Как видно из Таблицы 1, штамм SC17/pMIV-grxC демонстрировал большую активность S-сульфоцистеинредуктазны по сравнению с SC17 и SC17/pMIV-gorA; SC17/pMIV-gorA демонстрировал большую активность глутатионредуктазы по сравнению с SC17 и SC17/pMIV-grxC.
Пример 4. Продукция L-цистеина штаммами P.ananatis 1. Продукция L-цистеина штаммами P.ananatis, трансформированными плазмидами, несущими гены grxC и gorA из P.ananatis, и гены grxB и grxC из Е.coli.
Чтобы оценить влияние усиления экспрессии генов grxC и gorA из P.ananatis, и генов grxB и grxC из Е.coli, на продукцию L-цистеина, штамм P.ananatis EYPSGint1M2 был трансформирован плазмидами pMIV-grxC, pMIV-gorA и pMIV-AC (Справочный пример 4), и pMIV-grxB(Ec), и pMIV-grxC(Ec) (Справочный пример 6), с получением штаммов EYPSGint1M2/pMIV-grxC, EYPSGint1M2/pMIV-gorA, EYPSGint1M2/pMIV-AC, EYPSGint1M2/pMIV-grxB(Ec) и EYPSGint1M2/pMIV-grxC(Ec), соответственно.
Штаммы P.ananatis EYPSGint1M2, EYPSGint1M2/pMIV-grxC, EYPSGint1M2/pMIV-gorA, EYPSGint1M2/pMIV-AC, EYPSGint1M2/pMIV-grxB(Ec) и EYPSGint1M2/pMIV-grxC(Ec) выращивали в течение 17 часов при 34°С на L-агаре. Затем клетки приблизительно с 30 см2 поверхности чашки высевали в 500-мл колбы с L-средой (50 мл) и культивировали с аэрацией в течение 5 часов при 32°С. После этого культуры пересевали в 450 мл среды для ферментации в Jar-ферментеры (Marubisi) и культивировали при 30°С, pH 7,4 (с контролем водного NH3 (~4,66М)), DO2>25% (с перемешиванием при 900 об/мин).
После культивирования количество накопленного в среде L-цистеина устанавливали методом, описанным Gaitonde М.K. (Biochem J.; 104(2):627-33(1967)), со следующими модификациям: 150 мкл образца смешивали со 150 мкл 1М H2SO4, инкубировали 5 мин при 20°С, затем к смеси добавляли 700 мкл Н2О, 150 мкл полученной смеси переносили в новую пробирку и добавляли 800 мкл раствора А(1М Tris pH 8.0, 5 мМ DTT), полученную смесь инкубировали в течение 5 мин при 20°С, центрифугировали в течение 10 мин при 13000 об/мин, затем 100 мкл смеси переносили в 20×200-мм пробирки, добавляли 400 мкл H2O, 500 мкл ледяной уксусной кислоты и 500 мкл раствора В (0,63 г нингидрина; 10 мл ледяной уксусной кислоты; 10 мл 36% HCl), смесь инкубировали в течение 10 мин на водяной бане, затем добавляли 4,5 мл этанола и измеряли OD560. Концентрацию цистеина рассчитывали по формуле С(цис г/л)=11.3* OD560. Результаты измерений представлены в Таблице 2. Как видно из Таблицы 2, штаммы EYPSGint1M2/pMIV-grxC, EYPSGint1M2/pMIV-gorA, EYPSGint1M2/pMIV-AC, EYPSGint1M2/pMIV-grxB(Ec) и EYPSGint1M2/pMIV-grxC(Ec) демонстрировали большее количество накопленного L-цистеина по сравнению с EYPSGint1M2. Кроме того, использование генов gorA, grxB или grxC приводило к значительному снижению накопления побочного продукта, S-сульфоцистеина. Наиболее значительный эффект снижения накопления S-сульфоцистеина наблюдался у штамма, трансформированного двумя генами gorA и grxC одновременно.
Состав среды для ферментации (г/л) был следующим:
Стерилизация групп (А, В, С и D) проводилась отдельно для предотвращения неблагоприятных взаимодействий во время стерилизации.
Добавление тиосульфата осуществлялось через отдельный насос, активирующийся совместно со щелочным насосом (тиосульфат добавляли в объеме, эквивалентном добавленному 4,6 N NH4OH).
2. Продукция L-цистеина штаммами P.ananatis с интегрированными копиями генов grxC и gorA
Чтобы оценить влияние усиления экспрессии генов grxC и gorA на продукцию L-цистеина, были также сконструированы штаммы P.ananatis EYPSGint1M2intAC и EYPSGint1M2Pnlp8-grxC.
Интеграция генов grxC и gorA была осуществлена в результате мини-µu интеграции (с помощью µu-транспозазы, содержащейся в плазмиде рМН10) плазмиды pMIV-AC в хромосому штамма SC17. Полученная конструкция (intAC) была перенесена из штамма SC17 в штамм EYPSGint1M2 методом хромосомной трансформации. Полученный штамм был назван EYPSGint1M2intAC.
Помоторный район гена grxC в хромосоме штамма EYPSGint1M2 был заменен промоторным районом Pn1p8 с помощью метода Red-зависимой интеграции. ДНК-фрагмент для Red-зависимой интеграции был получен методом ПЦР с праймерами P31(SEQ ID No:42) и P32(SEQ ID No:43) и ДНК плазмиды pMW-Km-Pnlp8-cysE (Справочный пример 5) в качестве матрицы. Полученный штамм был назван EYPSGint1M2Pnlp8-grxC.
Штаммы P.ananatis EYPSGint1M2, EYPSGint1M2intAC и EYPSGint1M2Pnlp8-grxC культивировали, как описано выше, количество L-цистеина, накопленного в среде, определяли с помощью метода, описанного выше. Результаты измерений представлены в Таблице 3. Как видно из Таблицы 3, EYPSGint1M2intAC и EYPSGint1M2Pnlp8-grxC накапливали большее количество L-цистеина по сравнению с EYPSGint1M2.
Пример 5. Продукция L-цистеина штаммами Е.coli
Чтобы оценить влияние усиления экспрессии генов grxC и grxC из Е.coli на продукцию L-цистеина, были сконструированы штаммы Е.coli MT/pACYC-DES/pMIV-grxB и MT/pACYC-DES/pMIV-grxC.
Для этого, штамм Е.coli MT/pACYC-DES (европейский патент ЕР 1528108 В1) был трансформирован плазмидами pMIV-grxB и pMIV-grxC (см. Справочный пример 6), с получением штаммов MT/pACYC-DES/pMIV-grxB и MT/pACYC-DES/pMIV-grxC, соответственно.
Штаммы MT/pACYC-DES, MT/pACYC-DES/pMIV-grxB и MT/pACYC-DES/pMIV-grxC культивировали в течение ночи с взбалтыванием при 34°С в 2 мл питательного бульона с добавлением 100 мг/л ампициллина и 25 мкг/мл стрептомицина. 0.2 мл полученных культур высевали в 2 мл среды для ферментации, содержащей хлорамфеникол (30 мг/л) и ампициллин (100 мг/л), в 20×200 мм пробирки, и выращивали при 34°С в течение 42 часов на ротационном шейкере при 250 об/мин. Состав среды для ферментации был следующим: 15.0 г/л (NH4)2SO4, 1.5 г/л KH2PO4, 1.0 г/л MgSO4, 20.0 г/л СаСО3, 0.1 мг/л тиамина, 1% LB, 6% глюкозы, 100 мг/л L-метионина и 3 г/л Na2S2O3.
После культивирования количество накопленного в среде L-цистеина определяли методом, описанным Gaitonde, М.К. (Biochem. J., 104:2, 627-33 (1967)). Полученные результаты представлены в Таблице 4. Как видно из Таблицы 4, штаммы MT/pACYC-DES/pMIV-grxB и MT/pACYC-DES/pMIV-grxC накапливали большее количество L-цистеина по сравнению с MT/pACYC-DES. Штамм MT/pACYC-DES/pMIV-grxC также накапливал меньшее количество S-сульфоцистеина по сравнению с MT/pACYC-DES.
Справочный пример 1. Конструирование плазмиды pMIV5JS
Плазмида PMIV-5JS была сконструирована согласно нижеприведенной схеме. Во-первых, плазмида рМ12 была сконструирована с помощью интеграции in vivo Mu-зависимой интеграционной кассеты в плазмиду pMW1, полученную из pMW119 (Фиг.2). Были синтезированы две терминаторные олигонуклеотидные последовательности, комплементарные друг другу (SEQ ID NO: 32 и SEQ ID NO: 33). Терминатор thrL был получен с помощью отжига этих синтетических олигонуклеотидов в прямом (SEQ ID NO: 32) и обратном направлениях (SEQ ID NO: 33). Терминатор thrL был фланкирован сайтами HindIII и PstI. Затем, с помощью инсерции синтетической терминаторной последовательности Ter(thr) в рМ12, предварительно обработанную рестриктазами Hindlll и Mph1103I, была сконструирована плазмида pM12-ter(thr) (Фиг.2).
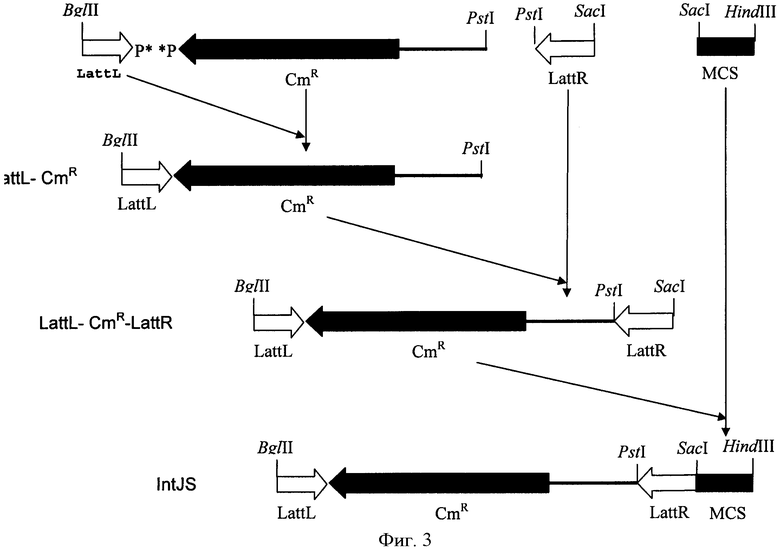
Интегративной кассеты intJS была сконструирована следующим образом (Фиг.3):
а) фрагмент LattL длиной 0.12 т.п.н. был получен с помощью ПЦР-амплификации с использованием прямого праймера (SEQ ID NO: 34) (сайт узнавания рестриктазы BglII выделен), и фосфорилированного обратного праймера (SEQ ID NO: 35). В качестве матрицы была использована плазмида pMW118-attL-tet-attR-ter_rrnB (WO 2005/010175);
b) CmR-фрагмент длиной 1.03 т.п.н. был получен с помощью ПЦР-амплификации с использованием фосфорилированного прямого праймера (SEQ ID NO: 36) и обратного праймера (SEQ ID NO: 37) (сайт узнавания рестриктазы PstI выделен). В качестве матрицы была использована плазмида pACYC184;
c) LattR-фрагмент длиной 0.16 т.п.н. был получен за счет ПЦР-амплификации с использованием прямого праймера (SEQ ID NO: 38) (сайт узнавания рестриктазы PstI выделен), и фосфорилированного обратного праймера (SEQ ID NO: 39) (сайт узнавания рестриктазы SacI выделен). В качестве матрицы была использована плазмида pMW118-attL-tet-attR-ter_rrnB;
d) фрагменты LattL и CmR были лигированы и полученный фрагмент длиной 1.15 т.п.н. был очищен;
e) фрагменты LattL-CmR и LattR были обработаны рестриктазой PstI, лигированы, полученный фрагмент LattL-CmR-LattR длиной 1.31 т.п.н. был очищен;
f) двухцепочечный фрагмент ДНК длиной 70 п.н., содержащий множественный сайт клонирования (MCS), был получен путем ренатурации двух синтезированных олигонуклеотидов: олигонуклеотида, последовательность которого указана в SEQ ID NO: 40, и олигонуклеотида, имеющего комплементарную SEQ ID NO: 40 последовательность;
g) фрагменты LattL-CmR-LattR и MCS были обработаны рестриктазой SacI, лигированы, и полученная кассета LattL-CmR-LattR-MCS, длиной 1.38 т.п.н., была очищена.
На последнем этапе фрагмент LattL-CmR-LattR-MCS был обработан рестриктазами BglII и HindIII и клонирован в плазмиду pM12-ter(thr), предварительно обработанную BamHI и HindIII, для получения плазмиды pMIV-5JS (Фиг.4).
Справочный пример 2. Конструирование плазмиды pMW118-(λattL-Kmr-λattR).
Плазмида pMW118-(λattL-Kmr-λattR) была сконструирована на основе плазмиды pMWl 18-attL-Tc-attR (WO 2005/010175) путем замещения маркера устойчивости к тетрациклину на ген устойчивости к канамицину, взятый из плазмиды pUC4K (Vieira J. and Messing J., Gene, 19(3): 259-68 (1982)).
С этой целью, большой фрагмент EcoRI - HindIII плазмиды pMW118-attL-Tc-attR был лигирован с двумя фрагментами плазмиды pUC4K: HindIII - PstI фрагментом (676 п.н.) и EcoRI - HindIII фрагментом (585 п.н.).
Базовый фрагмент pMW118-attL-Tc-attR был получен дотированием следующих четырех ДНК-фрагментов:
1) фрагмент BglII-EcoRI (114 п.н.), содержащий сайт attL (SEQ ID NO: 44), был получен с помощью ПЦР-амплификации соответствующего района хромосомы (содержащего профаг λ) Е.coli W3350 с использованием праймеров Р33 и Р34 (SEQ ID NOS: 45 и 46) (эти праймеры содержали дополнительные сайты узнавания для эндонуклеаз BglII и EcoRI);
2) фрагмент PstI-HindIII (182 п.н.), содержащий сайт attR (SEQ ID NO: 47), был получен с помощью ПЦР-амплификации соответствующего района хромосомы (содержащего профаг λ) Е.coli W3350 с использованием праймеров Р35 и Р36 (SEQ ID NOS: 48 и 49) (эти праймеры содержали дополнительные сайты узнавания для эндонуклеаз PstI и HindIII);
3) большой фрагмент BglII-HindIII (3916 п.н.) плазмиды pMW118-ter_rrnB. Плазмида pMW118-ter_rrnB была получена лигированием следующих трех фрагментов:
1 - большой ДНК-фрагмент (2359 п.н.), несущий фрагмент AatII-EcoRI плазмиды pMW118, был получен следующим образом: pMW118 была обработана рестриктазой EcoRI, обработана фрагментом Кленова ДНК-полимеразы I и затем рестриктазой AatII;
2 - малый фрагмент AatII-BglII (1194 п.н.) вектора pUC19, несущий ген устойчивости к ампициллину bla (ApR), был получен с помощью ПЦР-амплификации соответствующего района вектора pUC19 с использованием праймеров Р37 и Р38 (SEQ ID NOS: 50 и 51) (эти праймеры содержали дополнительные сайты узнавания для эндонуклеаз AatII и BglII);
3 - малый фрагмент BglII-PstlIol (363 п.н.) транскрипционного терминатора ter_rrnB был получен с помощью ПЦР-амплификации соответствующего района хромосомы Е.coli MG1655 с использованием праймеров Р39 и Р40 (SEQ ID NOS: 52 и 53) (эти праймеры содержали дополнительные сайты узнавания для эндонуклеаз BglII и PstI);
4) малый фрагмент EcoRI-PstI (1388 п.н.) (SEQ ID NO: 54) плазмиды pML-Tc-ter_thrL, несущий ген устойчивости к тетрациклину и терминатор транскрипции ter_thrL; плазмида pML-Tc-ter_thrL была получена в два этапа:
- плазмида pML-ter_thrL была получена за счет обработки плазмиды pML-MCS (Машко С.В. и др, Биотехнология, 2001, no. 5, 3-20) рестриктазами XbaI и BamHI, с последующим лигированием большого фрагмента (3342 п.н.) с фрагментом XbaI-BamHI (68 п.н.), несущим терминатор ter_thrL, полученный ПЦР-амплификацией соответствующего района хромосомы Е.coli MG1655 с использованием олигонуклеотидов Р41 и P42(SEQ ID NOS: 55 и 56) в качестве праймеров (эти праймеры содержали дополнительные сайты узнавания для эндонуклеаз XbaI и BamHI);
- плазмида pML-Tc-ter_thrL была получена за счет обработки плазмиды pML-ter_thrL рестриктазами KpnI и XbaI, фрагментом Кленова ДНК-полимеразы I и лигированием с малым фрагментом EcoRI-Van91I (1317 п.н.) вектора pBR322, несущего ген устойчивости к тетрациклину (pBR322 был обработан рестриктазами EcoRI и Van91I,a затем фрагментом Кленова ДНК-полимеразы I).
Справочный пример 3. Конструирование плазмиды pMIV-Pnlp1-cysM
Промоторный район гена nlpD из P.ananatis был амплифицирован с помощью ПЦР с праймерами Р21 (SEQ ID NO: 5) и Р22 (SEQ ID NO: 24) и хромосомной ДНК штамма SC17 в качестве матрицы. Полученный ДНК-фрагмент длиной около 0,2 т.п.н. kb был очищен с помощью агарозного гель-электрофореза и обработан эндонуклеазами PaeI и SalI с последующим лигированием с плазмидой pMIV-5JS, предварительно обработанной теми же эндонуклеазами.
Терминаторный район гена rrnB из Е.coli был амплифицирован методом ПЦР с примерами Р23 (SEQ ID NO: 25) и Р24 (SEQ ID NO: 26) и хромосомной ДНК штамма MG1655 в качестве матрицы. Полученный ДНК-фрагмент длиной около 0,25 т.п.н. был очищен с помощью агарозного гель-электрофореза и обрабатан эндонуклеазами XbaI и BamHI с последующим лигированием с полученной на предыдущем этапе плазмидой, предварительно обработанной теми же эндонуклеазами.
Ген cysM из Е.coli был амплифицирован методом ПЦР с примерами Р25 (SEQ ID NO: 27) и Р26 (SEQ ID NO: 28) и хромосомной ДНК штамма MG1655 в качестве матрцы. Полученный ДНК-фрагмент длиной около 1,1 т.п.н. был очищен с помощью агарозного гель-электрофореза и обрабатан эндонуклеазами SalI and XbaI, с последующим лигированием с полученной на предыдущем этапе плазмидой, предварительно обработанной теми же эндонуклеазами. Таким образом, была получена плазмида pMIV-Pnlp1-cysM.
Справочный пример 4. Конструирование плазмид pMIV-grxC, pMIV-gorA и pMIV-AC
Ген grxC из P.ananatis был амплифицирован с помощью ПЦР с праймерами Р27 (SEQ ID NO: 29) и Р28 (SEQ ID NO: 30) и хромосомной ДНК штамма SC17 в качестве матрицы. Ген gorA из P.ananatis был амплифицирован с помощью ПЦР с праймерами Р29 (SEQ ID NO: 31) и Р30 (SEQ ID NO: 41) и хромосомной ДНК штамма SC17 в качестве матрицы. Каждый из полученных генов был клонирован в pMIV-5JS (по SalI и XbaI сайтам). Таким образом, были получены плазмиды pMIV-grxC и pMIV-gorA, соответственно.
Плазмиды, несущие оба гена grxC и gorA были сконструированы следующим образом. Плазмида pMIV-grxC была обработана эндонуклеазой HindIII, после этого обработана фрагментом Кленова ДНК-полимеразы I с последующей обработкой эндонуклеазой NcoI. Полученный 1,3 т.п.н. ДНК-фрагмент с геном grxC был очищен и лигирован с плазмидой pMIV-gorA, предварительно обработанной эндонуклеазами SmaI и NcoI. Плазмида, содержащая оба гена grxC и gorA, была названа pMIV-AC.
Справочный пример 5. Конструирование плазмиды pMW-Km-Pnlp8-cvsE
Ген cysE из P.ananatis был амплифицирован с помощью ПЦР с хромосомы штамма SC17 с использованием праймеров Р43 (SEQ ID NO: 57) и Р44 (SEQ ID NO: 58). Праймер Р43 (SEQ ID No:57) содержит сайт для рестриктазы SalI на 5'-конце. 0,9 т.п.н. фрагмент был выделен и обработан эндонукдеазой SalI.
Промотор Pnlp8 был амплифицирован с помощью ПЦР с плазмиды pMIV-Pnlp8-yeas7 с использованием праймеров Р45 (SEQ ID NO: 59) и Р46 (SEQ ID NO: 60). Праймер Р45 (SEQ ID No:59) содержит сайт для рестриктазы SalI на 5'-конце. 0,3 т.п.н. фрагмент был выделен и обработан эндонуклеазой SalI и лигирован с описанным выше фрагментом, содержащим ген cysE. Смесь для лигирования использовали в качестве матрицы для ПЦР с праймерами Р44 (SEQ ID NO: 58) и Р46 (SEQ ID NO: 60).
Полученный 1,2 т.п.н. фрагмент был выделен и обработан фрагментом Кленова и клонирован в плазмидный вектор pMW118-(λattL-Kmr-λattR) (Справочный пример 2), предварительно обработанный рестриктазой XbaI и фрагментом Кленова. Полученная плазмида была названа pMW-Km-Pnlp8-cysE.
Справочный пример 6. Конструирование плазмид pMIV-grxB(Ec) и pMIV-grxC(Ec).
Ген grxB из Е.coli был амплифицирован с помощью ПЦР с праймерами Р47 (SEQ ID NO: 61) и Р48 (SEQ ID NO: 62) и хромосомной ДНК штамма Е.coli MG1655 в качестве матрицы. Полученный ген был клонирован в pMIV-5JS (по XhoI и XbaI сайтам). Таким образом, была получена плазмида pMIV-grxB(Ec).
Ген grxC из Е.coli был амплифицирован с помощью ПЦР с праймерами Р49 (SEQ ID NO: 63) и Р50 (SEQ ID NO: 64) и хромосомной ДНК штамма E.coli MG1655 в качестве матрицы. Полученный ген был клонирован в pMIV-5JS (по XhoI и XbaI сайтам). Таким образом, была получена плазмида pMIV-grxC(Ec).
Хотя указанное изобретение описано в деталях со ссылкой на Наилучший способ осуществления изобретения, для специалиста в указанной области техники очевидно, что могут быть внесены различные изменения и произведены эквивалентные замены, и такие изменения и замены не выходят за рамки настоящего изобретения. Каждому из упомянутых выше документов соответствует ссылка, и все цитируемые документы являются частью описания настоящего изобретения.




















Настоящее изобретение относится к биохимии. Описана бактерия - продуцент L-цистеина, относящаяся к роду Pantoea или Escherichia семейства Enterobacteriaceae, модифицированная таким образом, что в ней усилена экспрессия одного или более генов, выбранных из группы, состоящей из кодирующих глутаредоксины генов grxC и grxB, и гена, кодирующего глутатионредуктазу {gorA). Предложен способ получения L-цистеина, включающий выращивание указанной бактерии в питательной среде, содержащей тиосульфат, и выделение L-цистеина из культуральной жидкости. Изобретение позволяет увеличить выход L-цистеина. 2 н. и 7 з.п. ф-лы, 4 табл., 4 ил., 5 пр.
1. Бактерия - продуцент L-цистеина, относящаяся к роду Pantoea или Escherichia семейства Enterobacteriaceae и модифицированная таким образом, что в ней усилена экспрессия одного или более генов, выбранных из группы, состоящей из:
кодирующих глутаредоксины генов grxC и grxB и гена, кодирующего глутатионредуктазу.
2. Бактерия по п.1, отличающаяся тем, что ген grxC является геном из Pantoea ananatis или Escherichia coli.
3. Бактерия по п.1, отличающаяся тем, что ген grxB является геном из Escherichia coli.
4. Бактерия по п.1, отличающаяся тем, что ген, кодирующий глутатионредуктазу, является геном gorA(gor) из Pantoea ananatis.
5. Бактерия по любому из пп.1-4, отличающаяся тем, что экспрессия указанного(ых) гена(ов) усилена за счет увеличения числа копий указанного(ых) гена(ов).
6. Бактерия по любому из пп.1-4, отличающаяся тем, что экспрессия указанного(ых) гена(ов) усилена за счет модификации последовательности(ей), контролирующей(их) экспрессию указанного(ых) гена(ов).
7. Бактерия по п.6, отличающаяся тем, что природный(е) промотор(ы) указанного(ых) гена(ов) замещен(ы) более сильным(и) промотором(ами).
8. Способ получения L-цистеина, который включает выращивание бактерии по любому из пп.1-7 в питательной среде, содержащей тиосульфат, и выделение L-цистеина из культуральной жидкости с целью продукции и накопления L-цистеина.
9. Способ по п.8, отличающийся тем, что в указанной бактерии усилена экспрессия генов, вовлеченных в биосинтез L-цистеина.
| CHRISTOPHER HORST LILLIG et al., "Redox Regulation of 3-Phosphoadenylylsulfate Reductase from Escherichia coli by Glutathione and Glutaredoxins", THE JOURNAL OF BIOLOGICAL CHEMISTRY, Vol.278, No.25, Issue of June 20, pp.22325-22330, 2003 | |||
| CHRISTOPHER HORST LILLIG et al., "New Thioredoxins and Glutaredoxins as Electron Donors of |
Авторы
Даты
2012-08-20—Публикация
2010-03-04—Подача