Предпосылки создания изобретения
Настоящее изобретение относится к способу повышения содержания глутамата в растениях и/или семенах, к растению или/или семенам, имеющим повышенное содержание глутамата, к применению растения и/или семян, имеющих повышенное содержание глутамата, для получения пищевых продуктов и к пищевым продуктам, содержащим растение и/или семена, имеющие повышенное содержание глутамата.
В основном глутамат обычно присутствует в белках и известен как вкусовой ингредиент, содержащийся в томатах, соевых бобах, фасоли адзуки, фасоли широкой, фасоли обыкновенной, горохе и т.п., а также в пищевых продуктах, полученных при ферментации соевых бобов, и т.п. Глутамат синтезируется на ранней стадии биосинтеза аминокислот в высших растениях и служит в качестве донора аминогруппы для большинства аминокислот, таких как аланин, глицин, серин, пролин и аргинин. Глутамин и аспарагин, синтезируемые в листьях, переносятся в семена через ситовидные трубки и используются для синтеза указанных выше основных аминокислот после синтеза глутамата. Считается, что ферменты, которые переносят аминогруппу глутамина, функционируют в обособленных компартментах тканей, таких как покрытие семян, жидкость эмбрионального мешка и семядоли, в соответствии со значением каждой функции, которая строго регулируется. Исходя из этого, повышение содержания свободного глутамата в растениях представляет собой непростую задачу, поскольку глутамат является донором аминогруппы для различных протекающих in vivo реакций, включая синтез белка, причем он метаболизируется через пути биосинтеза, которые подвергаются многообразной и сложной регуляции. В особенности считается трудной задача повышения содержания той или иной аминокислоты в свободной форме, поскольку аминокислоты запасаются в основном в виде белка. Фактически к настоящему времени имеется лишь несколько отчетов по фактам такого рода. Указанные отчеты включают, например, данные о том, что содержание свободного глутамата в корнях табака и кукурузе повышается при введении генов глутаматдегидрогеназы, и данные о том, что в семенах сои накапливается свободный лизин, когда ген, кодирующий белок с высоким содержанием лизина избыточно экспрессируется в листьях.
Аланинаминотрансфераза известна как один из ферментов, связанных с метаболизмом глутамата. Указанный фермент катализирует реакцию переноса аминогруппы от L-аланина к α-кетоглутарату и обратную реакцию. Данный фермент составляет часть указанной выше системы метаболизма глутамата. Известно также, что указанный фермент обладает каталитической активностью в реакции переноса аминогруппы от аланина к глиоксилату, а также от глутамата к глиоксилату для синтеза глицина (Biochem. J. 195: 235-239, 1981). С другой стороны, предполагается, что аланинаминотрансфераза, имеющаяся в пероксисомах, обладает глутамат-глиоксилат-аминотрансферазной активностью, а именно: активностью по синтезу α-кетоглутарата и глицина с использованием глутамата и глиоксилата в качестве субстратов [Nogichi Т. and HAYASHI S., Boichem. J. 195: 235-239 (1981); Orzechowski et al., Acta Biochem. Pol.: 447-457 (1999); and Orzechowski et al., Acta Physiol. Plant 21: 331-334 (1999)]. Однако роль активности аланинаминотрансферазы и глутамат-глиоксилат-аминотрансферазы в повышении или снижении содержания глутамата в растениях все еще не выяснена, и нет сообщений, в которых рассматривалась хотя бы возможность того, что содержание глутамата в растениях или семенах может быть действительно повышено методами генной инженерии с использованием генов, кодирующих белки, которые обладают аланинаминотрансферазной и глутамат-глиоксилат-аминотрансферазной активностью.
Краткое описание сущности изобретения
Объектом настоящего изобретения является разработка способа повышения содержания глутамата в растении и/или семенах, к растению и/или семенам, имеющим повышенное содержание глутамата, к применению растения и/или семян, имеющих повышенное содержание глутамата, для получения пищевых продуктов и к пищевым продуктам, содержащим растения и/или семена с повышенным содержанием глутамата.
Авторы настоящего изобретения обнаружили, что содержание глутамата в растениях и/или семенах может быть повышено путем ингибирования активности глутамат-глиоксилат-аминотрансферазы (ГГТ). Настоящее изобретение было сделано на основании указанного открытия.
Более конкретно, настоящее изобретение относится к способу повышения содержания глутамата в растениях и/или семенах путем удаления или снижения активности ГГТ и к растениям и/или семенам, в которых активность ГГТ отсутствует или снижена, и в особенности к растениям и/или семенам, имеющим более высокий уровень глутамата, чем соответствующие растения дикого типа, культивируемые в тех же условиях.
В частности, настоящее изобретение относится к способу повышения содержания глутамата в растениях и/или семенах путем удаления или снижения активности ГГТ за счет ингибирования функции генов, кодирующих белок с активностью ГГТ, и к растениям, характеризующимся отсутствием или сниженной активностью ГГТ, в частности к растениям и семенам, характеризующимся отсутствием активности ГГТ или сниженной активностью ГГТ и имеющим уровень глутамата выше, чем таковой у соответствующих растений дикого типа, культивируемых в тех же условиях.
Краткое описание чертежей
На фиг.1 приведено сравнение аминокислотных последовательностей аланинаминотрансферазы (AlaAT: то же, что и ГГТ) из Arabidopsis thaliana. Звездочки показывают положения, в которых аминокислоты идентичны.
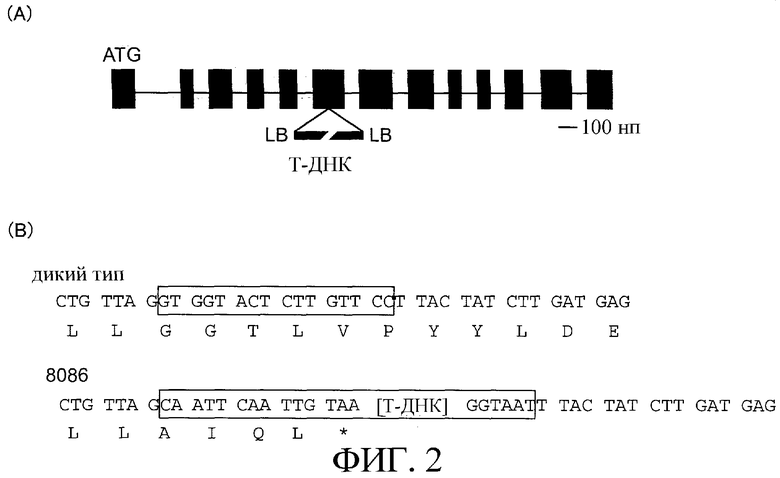
На фиг.2 показано положение введенной метки. (А) представляет собой схематическое описание структуры генома AlaAT1 и положение введенной метки. Прямоугольники показывают экзон, а линия указывает интрон. (В) нуклеотидная последовательность и аминокислотная последовательность для варианта дикого типа (WT) показаны сверху, а внизу показана нуклеотидная последовательность, в которую встроена Т-ДНК, и соответствующая ей аминокислотная последовательность для линии 8046. Прямоугольники показывают участок, замещенный встроенной Т-ДНК.
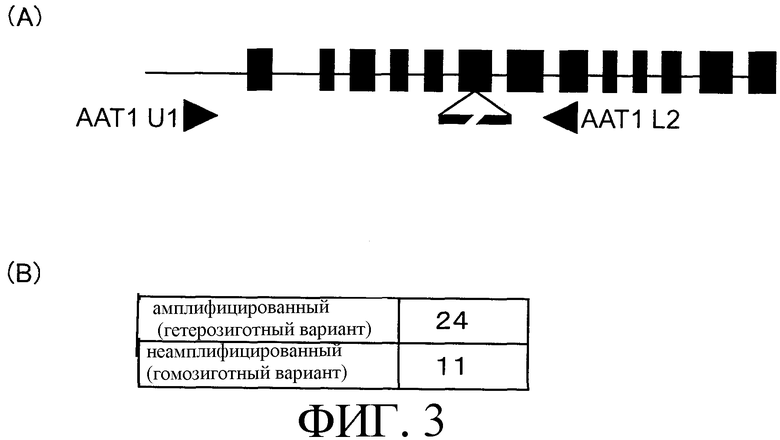
На фиг.3 (А) показано положение праймеров, которые используются для отбора гомозигот. (В) показано соотношение гомозигот и гетерозигот при сегрегации.
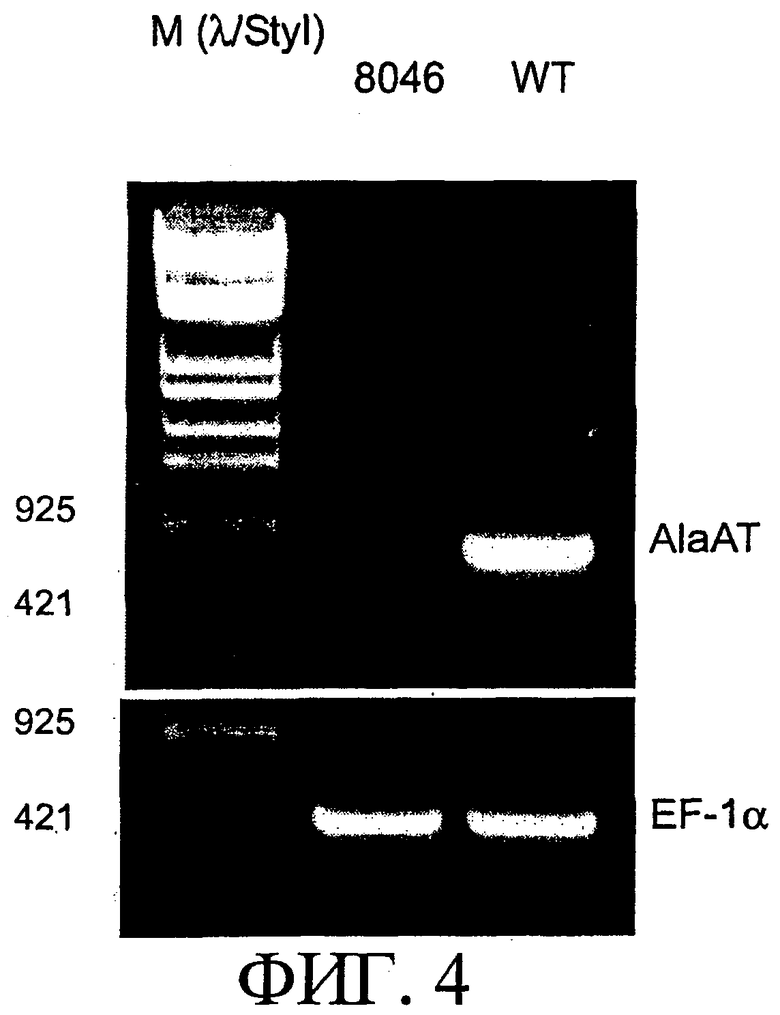
На фиг.4 показана экспрессия гена AlaAT1 на уровне м-РНК методом ОТ-ПЦР. WT: дикий тип, 8046: гомозиготная линия AlaAT1 со встроенной меткой.
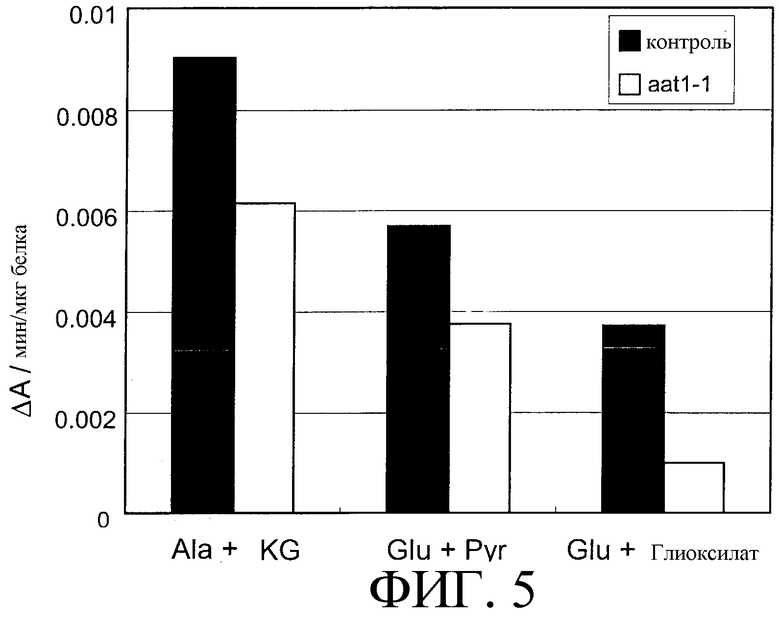
На фиг.5 показана ферментативная активность в линии aat1-1 со встроенным tag. Ala+αKG, Glu+Pyr и Glu+глиоксилат указывают активности по катализу реакций Ala+αKG→Glu+Pyr, Glu+Pyr→Ala+αKG и Glu+глиоксилат→Glu+αKG соответственно. Активности определяют как изменение величины поглощения (ΔА) при длине волны 340 нм в минуту в расчете на 1 мкг белка, сопряженной с реакцией окисления НАДН.
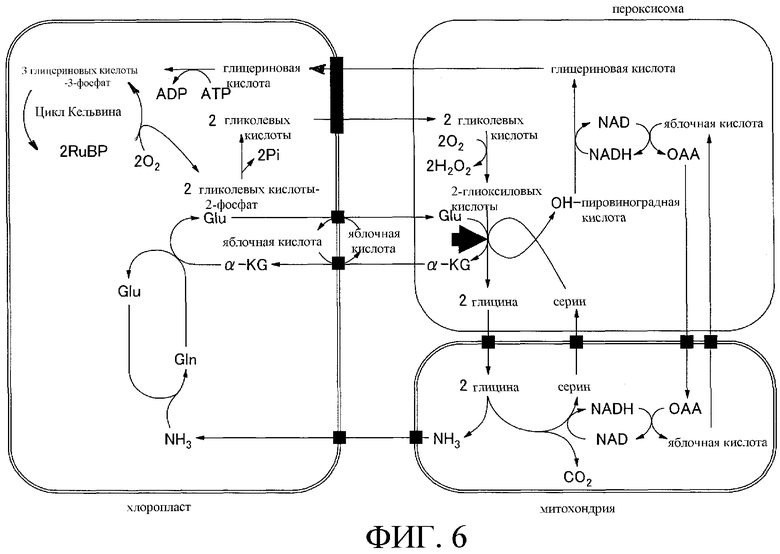
На фиг.6 показан схематический путь фотодыхания в высших растениях. Стрелка указывают реакцию, которую катализирует глутамат-глиоксилат-аминотрансфераза.
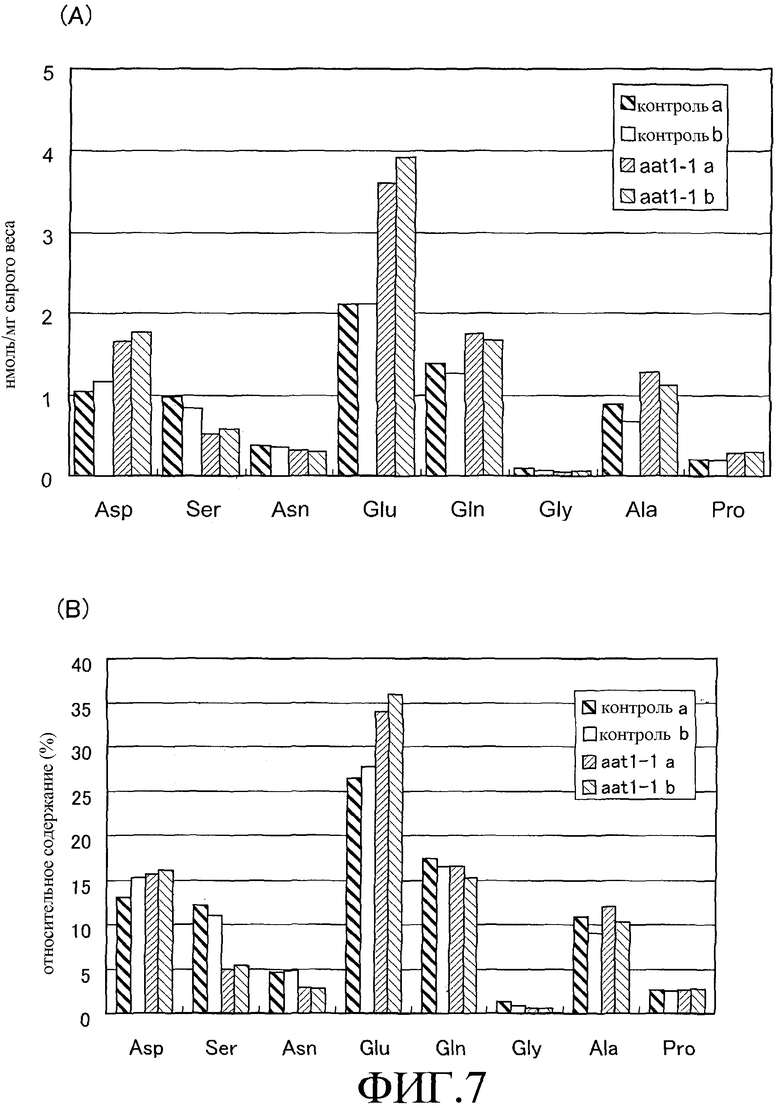
На фиг.7 показано содержание аминокислот в проростках, культивируемых в течение 2 недель на среде PNS, содержащей 1% сахарозы. А: содержание аминокислот в расчете на сырой вес, В: соотношение к совокупности аминокислот. Контроль: растение дикого типа, aat1-1: линия 8046, растение линии AlaAT со встроенным tag.
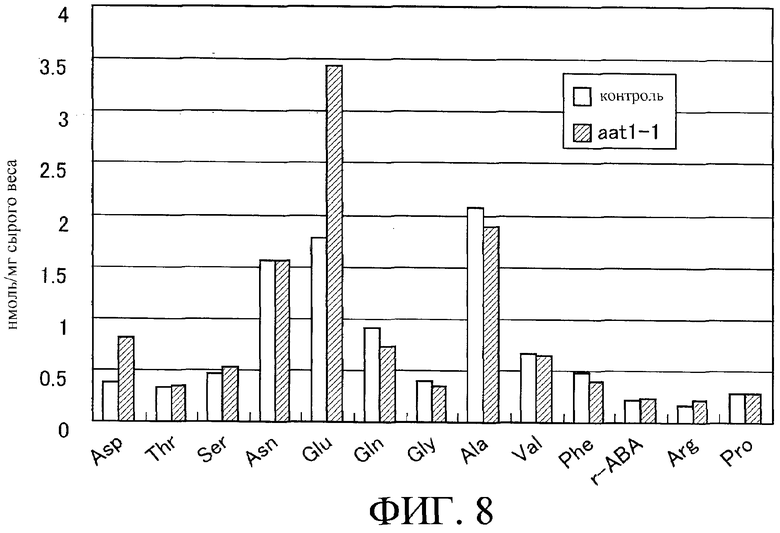
На фиг.8 показано содержание аминокислот (нмоль/мг сырой вес) в семенах линии aat1-1.
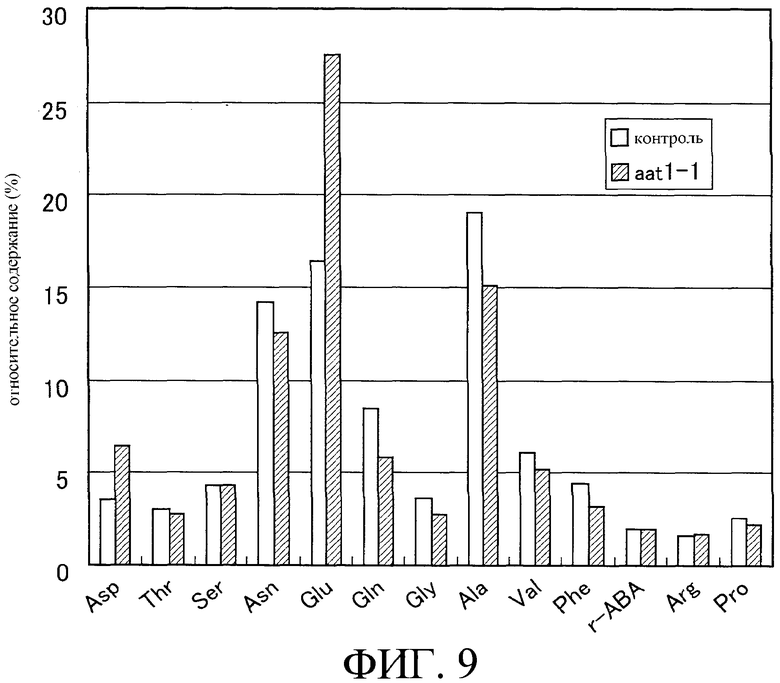
На фиг.9 показано относительное содержание аминокислот (%) в семенах линии aat1-1.
Описание предпочтительных вариантов осуществления изобретения
Объектом настоящего изобретения является повышение содержания глутамата в растениях и/или семенах. Указанная цель может быть достигнута за счет удаления или снижения активности ГГТ.
В одном варианте осуществления настоящего изобретения ингибируют функции гена, кодирующего GT. Термин "функция гена, кодирующего глутамат-глиоксилат-аминотрансферазу (или ГГТ)" в контексте настоящего изобретения означает функцию гена по экспрессии глутамат-глиоксилат-аминотрансферазы, имеющей активность глутамат-глиоксилат-аминотрансферазы дикого типа. Соответственно выражение "функция гена, кодирующего глутамат-глиоксилат-аминотрансферазу (или ГГТ), ингибируется" включает, например, случай, при котором сам ген нарушен, случай, при котором экспрессия гена ингибируется на уровне транскрипции или трансляции, или случай, при котором ген модифицируется и в результате этого экспрессируемый белок не обладает активностью ГГТ дикого типа.
Делеция или снижение активности ГГТ путем ингибирования функции генов, кодирующих ГГТ, могут быть достигнуты, например, за свет разрушения генов ГГТ или трансформирования растений генетическими конструкциями с целью ингибирования экспрессии.
Цель настоящего изобретения может быть достигнута путем удаления или снижения активности ГГТ, как указано выше. Ферментативная активность может быть удалена или снижена на любом из указанных уровней: на уровне транскрипции, на уровне трансляции и на уровне белка. Так, например, растение, имеющее сниженную активность, может быть подвергнуто скринингу путем акклиматизации растения к различным условиям роста с определением активности ГГТ с использованием способа, который будет описан ниже. Возможно также удалить или снизить активность путем модификации или разрушения гена, кодирующего ГГТ в растительном геноме. Возможно также удалить или снизить активность ГГТ с помощью метода, использующего введение антисмысловой цепи ДНК, или метода совместной супрессии. В настоящем изобретении в особенности предпочтителен способ разрушения гена ГГТ с точки зрения стабильности достигаемых свойств. Такое разрушение гена может быть достигнуто путем встраивания транспозона, встраивания Т-ДНК или за счет мутагенеза при обработке мутагеном, таким как EMS. Обычные методики разрушения гена путем встраивания транспозона или Т-ДНК или путем обработки мутагеном известны специалистам в данной области. В том случае, когда доступна созданная библиотека растительных генов с разрывами, желательная трансформация растения может быть легко достигнута путем скрининга библиотеки в поисках растений, содержащих разрывы в генах ГГТ. Такая библиотека коммерчески доступна.
В сравнении с растениями дикого типа, растущими в тех же условиях, растения согласно настоящему изобретению содержат не более примерно 80%, предпочтительно не более примерно 50% и более предпочтительно не более примерно 30% активности ГГТ на той же стадии развития в любом белке из всей совокупности, на сырой вес или в листьях.
Делеция или снижение активности ГГТ согласно настоящему изобретению предпочтительно происходят в пероксисоме, в частности в пероксисоме в фотосинтезирующей ткани. Фотосинтезирующая ткань может быть любой тканью, в которой осуществляется фотосинтез в обычных условиях культивирования, такая как листья, стебли и стручки.
Таким образом, в сравнении с растениями дикого типа, растущими в тех же условиях, растения, в которых содержание глутамата повышено способом согласно настоящему изобретению, характеризуются наличием не более примерно 80%, предпочтительно не более примерно 50% и более предпочтительно не более примерно 30%, активности ГГТ в общем белке, экстрагированном предпочтительно из фотосинтезирующей ткани, более предпочтительно из пероксисомы в фотосинтезирующей ткани, от активности ГГТ в ткани или во внутриклеточных органах на сырой вес или от активности ГГТ в ткани или внутриклеточных органах в листе растения дикого типа.
Термин "глутамат-глиоксилат-аминотрансфераза" в контексте настоящего описания обозначает белок, обладающий глутамат-глиоксилат-аминотрансферазной активностью, которая может быть сокращенно обозначена как ГГТ. Термин "гены, кодирующие глутамат-глиоксилат-аминотрансферазу", в контексте настоящего описания включает фрагменты нуклеиновой кислоты, кодирующие белок, обладающий глутамат-глиоксилат-аминотрансферазной активностью.
Гены ГГТ, используемые в качестве мишени в настоящем изобретении, могут быть также получены из растений. Так например, данные о последовательности оснований ДНК в ГГТ генах, могут быть получены при поиске в базе данных с использованием ключевого слова "аланинаминотрансфераза". При наличии информации о последовательности может быть получена кДНК полной длины посредством ОТ-ПЦР, 5'-RACE и 3'-RACE. Можно также получить кДНК при скрининге библиотеки кДНК путем гибридизации с соответствующим зондом на основании имеющейся информации о последовательности. Зонды, используемые для скрининга, могут быть получены в соответствии с данными об аминокислотной последовательности или последовательности оснований ДНК для ГГТ.
Согласно настоящему изобретению предпочтительно, чтобы введенный ГГТ находился в пероксисоме, в частности в пероксисоме в фотосинтезирующих тканях, как описано выше. Локализация ГГТ в пероксисоме может быть установлена на основании наличия N-концевой последовательности или С-концевой последовательности, характерных для белка, локализованного в пероксисоме. Можно также подтвердить локализацию путем слияния репортерного гена, такого как GFP или GUS, с геном ГГТ, имеющимся в пероксисоме, с последующей экспрессией ГГТ в клетке и определением результатов экспрессии. По другому способу локализация может быть подтверждена при обнаружении экспрессированной метки ГГТ с помощью специфического антитела.
В случае доступности библиотеки растений с разрушенными генами растения согласно настоящему изобретению могут быть получены при скрининге в данной библиотеке растений с разрушенным геном ГГТ. Путем соответствующего сочетания праймеров и зондов можно также установить, как указанные ГГТ гены были разрушены в таких растениях. Способы скрининга и анализа известны в технике и в качестве ссылки можно указать приведенную ниже, например, работу (Shokubutsu no Genome Kenkyu Protocol (Protocol of Study of Plant genome) (опубликовано Shujunsha)). Но даже если такая библиотека недоступна, при использовании методов генной инженерии, таких как использование траспозона и Т-ДНК, можно получить указанные растения с разрушенным геном, в частности растения, имеющие разрушенные ГГТ гены, или растения, дефектные по ГГТ активности или с подавленной ГГТ активностью по каким-либо другим причинам.
Конструкции нуклеиновых кислот, используемые для получения растений с разрушенным геном в данном варианте осуществления настоящего изобретения, могут быть получены по известному в технике способу. Используемые для этого средства молекулярной биологии, которые включают процедуры создания конструкций нуклеиновых кислот, выделения и определения их последовательностей, можно найти в литературе, в частности в руководстве Самбрука с соавт. (Sambrook et al., Molecular cloning-Laboratory manual. Edition 2, Cold Spring Harbor Laboratory Press). Для получения конструкций нуклеиновой кислоты, используемых согласно настоящему изобретению, в ряде случаев может потребоваться амплификация гена по методу ПЦР. Относительно метода ПЦР можно отметить метод Аусубела с соавт. (F.M.Ausubel et al. (eds.). Current Protocols in Molecular Biology, John Wiley & Sons, Inc. (1994)).
Разрушение гена в растении может быть осуществлено способом, в основном известным из уровня техники. Так, например, геномный ген ГГТ может быть предпочтительно разрушен как мишень с использованием транспозона или Т-ДНК. Создание генетической конструкции, пригодной для осуществления данного способа, не представляет собой проблему для специалистов в данной области. Основные методики разрушения гена транспозоном или Т-ДНК описаны, например, в руководстве Plant molecular biology manual (2nd, S.В.Gelvin and R.A.Schilper).
Нет каких-либо ограничений относительно способа введения конструкции нуклеиновой кислоты в указанном выше варианте осуществления настоящего изобретения. Может быть выбран любой способ введения генов в растительные клетки или целиком в растение, известный специалистам в данной области, в зависимости от природы растения-хозяина. Так, например, для введения генов может использоваться Agrobacterium, а также способы электропорации или бомбардировки частицами. В случае использования Agrobacterium вводимую последовательность в основном встраивают между левой и правой границами последовательностей Т-ДНК. Соответствующие способы разработки и конструирования вектора трансформации на основе Т-ДНК известны из уровня техники. Кроме того, из уровня техники также известны условия, необходимые для инфицирования конкретного растения с помощью Agrobacterium, несущего такую конструкцию нуклеиновой кислоты. В ряду таких методик и указанных условий можно привести в качестве ссылки работу ″Cell Technology (дополнительный том) Model Shokubutsu no Jikken Protocol; Ine, Shiroinunazuna Hen (Experiment Protocol for Model Plants; Edition of Rice Plants and Arabidopsis thaliana)", опубликованную Shujunsha (1996).
Хотя виды растений, которые могут быть объектом генной манипуляции, конкретно не ограничиваются, предпочтительны такие виды растений, которые легко культивируются, могут быть трансформированы и для которых можно установить регенерационные системы. Кроме растений, имеющих указанные выше характерные свойства, предпочтительными для настоящего изобретения являются такие виды растений, в отношении которых разработана методика их масштабного культивирования и которые имеют высокую ценность с точки зрения использования их в качестве пищи. Такие растения включают, кроме Arabidopsis thaliana, выполняющего роль модельного растения, такие растения, как рис, шпинат, капуста, латук, салат, сельдерей, огурцы, томаты, кормовые бобы, соя, фасоль адзуки, обыкновенная фасоль и горох.
Далее из генетически модифицированных растительных клеток отбирают трансформанты, что дает нужные клетки. Выбор может быть также проведен на основании экспрессии маркерных генов, присутствующих в конструкции нуклеиновой кислоты, используемой для трансформации. Так, например, в том случае, когда маркерными генами являются гены лекарственной устойчивости, отбор может проводиться путем культивирования или выращивания полученных после генетической манипуляции растений на культуральной среде, содержащей подходящую концентрацию антибиотика или гербицида. В том случае, когда маркерными генами являются гены β-глюкуронидазы или гены люциферазы, трансформанты могут быть отобраны при скрининге соответствующей активности. Из идентифицированных трансформантов, таких как протопласты, каллусы и экспланты, могут быть восстановлены целиком растения. Для регенерации может быть использован любой способ, известный специалистам в данной области для каждого растения-хозяина. Полученные таким образом растения могут культивироваться обычным способом или, иными словами, в тех же условиях, что и нетрансформированные растения, или в условиях, пригодных для соответствующих трансформантов. Для идентификации трансформированных растений, содержащих конструкции нуклеиновой кислоты согласно настоящему изобретению, в дополнение к указанному выше способу отбора маркерных генов могут использоваться другие методы молекулярной биологии. В частности, растения согласно настоящему изобретению, имеющие сниженную ГГТ активность, предпочтительно защищают от действия интенсивного света, что позволяет избежать ингибирования роста.
Для обнаружения разрушений целевых генов или наличия или отсутствия вставок рекомбинантной ДНК и содержащих их структур могут использоваться такие методы, как саузерн-гибридизация, ПЦР, нозерн-блоттинг или ОТ-ПЦР.
Далее определяют количество белка ГГТ, активность ГГТ и уровень мРНК для ГГТ в полученных таким образом трансформированных растениях. Так, например, количество белка может быть определено по методу вестерн-блоттинга или аналогичному методу, а количество мРНК может быть определено по методу нозерн-блоттинга, с использованием количественной ОТ-ПЦР и т.п. Активность ГГТ может быть определена обычным способом (Plant Physiol. 99: 1520-1525). Например, активность ГГТ в фотосинтезирующей ткани может быть определена при проведении лиофильной сушки фотосинтезирующей ткани данного растения, такой как листья, в жидком азоте, путем распыления замороженной ткани, суспендирования полученного порошка в соответствующем экстрагирующем буфере, таком как буфер, содержащий 100 мМ Трис-HCl (рН 7,3) или 10 мМ ДТТ, при ультрафильтрации полученной суспензии и проведении впоследствии анализа образца по указанному выше методу (Plant Physiol. 99: 1520-1525). Активность ГГТ, локализованная в пероксисоме, может быть определена при выделении пероксисом обычным способом (Plant Physiol. 43: 705-713, J. Biol. Chem. 243: 5179-5184, Plant Physiol. 49: 249-251 или аналогичным способом) с последующим определением активности по указанной выше методике. Указанные методики известны из уровня техники.
Полученные растения оценивают на содержание глутамата. Содержание глутамата может быть определено, например, путем распыления растительного организма или его части, с получением при этом экстракта и последующего исследования экстракта с помощью обычного аминокислотного анализатора. Так, например, аминокислоты могут быть экстрагированы при добавлении 500 мкл 80% этанола к образцу (к растению целиком или его части), при распылении образца в смесителе для клеток ММ 300 (QIAGEN) с последующей обработкой полученного продукта температурой 80°С в течение 10 минут. Указанные продукты центрифугируют и затем упаривают на роторном испарителе. Оставшийся образец растворяют в 0,02 н. HCl с получением образца для анализа. Образец пропускают через фильтр с размером пор 0,22 мкм для удаления примесей. В ходе аминокислотного анализа содержание аминокислот может быть определено с помощью аминокислотного анализатора LS-8800 (HITACHI). Содержание глутамата в растительном организме может быть определено на основании увеличения уровня глутамата в общем пуле аминокислот, на основании содержания глутамата в расчете на сырой вес или на основании содержания глутамата в конкретной ткани, предпочтительно в фотосинтезирующей ткани, такой как лист, в сравнении с теми растениями дикого типа, которые растут в тех же условиях, и необязательно данные по содержанию глутамата в растении могут быть подвергнуты статистической обработке. В том случае, когда увеличение содержания глутамата является статистически значимым по меньшей мере по одному из названных показателей (например, когда увеличение является статистически значимым на уровне значимости 5% (р<0,05)), можно считать, что содержание глутамата значительно повышается в сравнении с его содержанием в растениях дикого типа, растущих в тех же условиях.
Согласно способу по изобретению содержание глутамата (относительное содержание глутамата в общем пуле аминокислот) в растении повышается по меньшей мере примерно в 1,2 раза, обычно примерно от 1,2 до 2,5 раз относительно уровня глутамата в растительном организме дикого типа, культивируемого в тех же условиях, и содержание глутамата в расчете на сырой вес повышается по меньшей мере примерно в 1,2 раза, обычно примерно от 1,2 до 3 раз.
После идентификации повышенного содержания глутамата в трансформированном растении можно определить, являются ли полученные свойства генетически стабильными. С этой целью растения культивируют в обычных условиях освещения, получают от них семена и анализируют характер и распределение признаков в потомстве. В том случае, когда подавление роста растений является резко выраженным в обычных условиях освещения, растение может выращиваться в условиях слабого освещения, например, при интенсивности 30 мкмоль м-2 s-1, или в условиях высокой концентрации CO2, например, при концентрации 0,7% и в условиях обычного освещения, и далее может быть подвергнут анализу на наличие соответствующих характеристик. Наличие или отсутствие введенных конструкций нуклеиновых кислот, их положений и их экспрессия в потомстве могут быть проанализированы таким же способом, как и в случае первичных трансформантов.
Трансформанты, которые характеризуются повышенным содержанием глутамата, могут быть либо гетерозиготными, либо гомозиготными, причем как в отношении последовательности, полученной из конструкций нуклеиновых кислот, интегрированных в геномы, так и в отношении разрушенных генов. При необходимости могут быть получены либо гетерозиготы, либо гомозиготы путем, например, перекрестного опыления. Последовательности, полученные из конструкций нуклеиновых кислот, интегрированных в геномы, расщепляются в потомстве согласно закону Менделя. В этой связи для достижения целей настоящего изобретения предпочтительно использовать гомозиготные растения в силу стабильности признаков в этом случае. Хотя растения согласно настоящему изобретению могут выращиваться в обычных условиях культивирования, желательно использовать для этого как можно более сильное освещение, с тем чтобы избежать подавления роста.
При получении семян согласно настоящему изобретению особенно предпочтительно культивировать гомозиготные растения и далее собирать от них семена. Гомозиготные растения могут быть отобраны при повторном культивировании последовательных поколений растения, до тех пор, пока не будет наблюдаться разделение интересующих фенотипов или, иными словами, когда можно будет получить гомозиготные растения путем отбора линии, демонстрирующей во всех потомствах требуемый фенотип. Гомозиготы могут быть отобраны методами ПЦР или саузерн-анализа. Если эта цель настоящего изобретения достигается путем встраивания транспозона или Т-ДНК, то подходящими для использования являются именно такие методики молекулярной биологии.
Семена согласно настоящему изобретению могут быть получены при культивировании растения, в котором отсутствует или снижена активность ГГТ, в частности растения, в котором доказано наличие повышенного уровня глутамата, полученного по указанному выше методу в обычных условиях культивирования, при последующем отборе от него семян. Например, растение, которое является гомозиготным по разрушенному гену ГГТ, культивируют в обычных условиях и собирают от него семена. Предпочтительно растение согласно настоящему изобретению культивируют в условиях освещенности примерно от 30 до 70 мкмоль м-2 s-1 и собирают от него семена, что дает семена согласно настоящему изобретению. При определении содержания глутамата в растении по указанному выше способу можно подтвердить, что семена согласно настоящему изобретению характеризуются более высоким содержанием глутамата, чем семена соответствующего растения дикого типа, культивируемого в тех же условиях.
Растения и семена согласно настоящему изобретению могут использоваться в качестве пищевых продуктов и пищевых материалов таким же образом, как и соответствующие растения и семена дикого типа. В этой связи растения и семена согласно настоящему изобретению могут использоваться в качестве пищевых продуктов или непосредственно, или после приготовления или обработки традиционными способами. В особенности предпочтительными являются такие пищевые продукты, в случае которых желательно иметь вкус, усиленный глутаматом, такие как соусы, соевое мясо (ферментированная соевая паста), томатный кетчуп, соевый сыр (ферментированная соя), супы и закуски.
Приведенные ниже примеры дополнительно иллюстрируют способ получения растения согласно настоящему изобретению, осуществляемый посредством скрининга библиотеки растений с разрушенными генами из Arabidopsis thaliana, а также характеристик полученных растений и семян. Специалистам в данной области очевидно, что растения согласно настоящему изобретению, их семена и способ получения согласно настоящему изобретению не ограничиваются только конкретным растением Arabidopsis thaliana.
Примеры
Пример 1. Получение ГГТ-дефектной линии Arabidopsis thaliana
(1) Культивирование растений
В качестве основной среды для растений используют неорганическое соли PNS (Mol. Gen. Genet. 204: 430-433) или MS (Physiol Plant 15: 473-479), содержащие 1% (вес/объем) сахарозы, 0,05% (вес/объем) MES [2-(N-морфолино)этансульфоновая кислота] и 0,8% (вес/объем) агара. При культивировании на асбесте в качестве источника питательных компонентов используют только неорганические соли PNS.
(2) Получение праймеров для скрининга ГГТ-дефектных линий
AlaAT гены получают на основании информации о генах аланинаминотрансферазы (AlaAT) из Arabidopsis thaliana. AlaAT гены в настоящем описании фигурируют также под названием ГГТ гены.
На основании приведенных в Интернете данных оценивают количество копий для AlaAT и ее последовательность и получают праймеры. В соответствии с данными поисков, проведенных с использованием ключевых слов "аланинаминотрансфераза" и "Arabidopsis" было обнаружено, что в геноме присутствуют по меньшей мере 4 копии генов, которые предпочтительно относятся к аланинаминотрансферазе.
В Genbank соответствующие гены имеют следующие номера хранения АС005292 (F26F24.16), АС011663 (F5A18.24), АС016529 (T10D10.20) и АС026479 (Т13М22.3). Гены обозначаются как AlaAT1, 2, 3 и 4 соответственно. На фиг.1 приведено сравнение полученных аминокислотных последовательностей. Аминокислотная последовательность AlaAT1 представлена в SEQ ID NO:1 в перечне последовательностей. В соответствии с информацией, найденной в EST, количество AlaAT1 является, предположительно, наивысшим среди 4 копий и соответственно ожидается, что эффект от разрушения такого гена будет наиболее выраженным. ПЦР праймеры для скрининга линий разрушенным геном получают на основании последовательности AlaAT1 (таблица 1). Указанные праймеры были обозначены в соответствии с системой, предложенной компанией Kazusa DNA Laboratory.
ПЦР праймеры для скрининга линий с разрушенными генами
(3) Выделение линий AlaAT с разрушенными генами
Скрининг по AlaAT в библиотеке Arabidopsis thaliana с разрушенными генами проводят по системе, предложенной компанией Kazusa DNA Laboratory. Скрининг проводят по процедуре, описанной в руководстве: Plant Cell Engineering Series 14 "Shokubutsu no Genoma Kenkyu Protocol (Protocol of Study of Plant Genome)", 2-4 с (опубликованной Sgujunsha).
При первичном скрининге в качестве праймера с генной стороны используют (AAT1U/AAT1L) и (00L/02L/03L/04L/05L/06L/00R/02R/03R/04R/05R/06R) - в качестве праймеров для метки в соответствующих пулах. Связь между использованными праймерами для метки и соответствующими пулами показана в таблице 2.
Связь между праймерами для метки и пулами
Использованная полимераза представляет собой ЕХ-taq (TAKARA). 20 мкл реакционного раствора содержат примерно 38,4 нг (примерно 100 пг×384) матричной ДНК, 10 пмоль праймера для метки, 10 пмоль праймера для гена, 2 мкл 10× буфера, 5 нмоль дНТФ и 0,5 Ед. Ex-taq. Цикл проведения ПЦР включает обработку при 94°С в течение 45 секунд, при 52°С в течение 45 секунд и при 72°С в течение 3 минут. После обработки в течение повторных 35 циклов 10 мкл ПЦР-продукта отделяют электрофорезом на 1% агарозном геле. Амплифицированные фрагменты ДНК выявляют при окрашивании этидиумбромидом. Гель денатурируют погружением в денатурирующий раствор (1,5М NaCl, 0,5M NaOH) в течение 20 минут. Затем гель погружают на 20 минут в нейтрализующий раствор [0,5М Tris-HCl (pH 8,0), 1,5М NaCl]. После блоттинга на мембране-Hybond N+ (Amersham Pharmacia Biotech) с использованием 20×SSC (3М NACl, 0,3M цитрат натрия) ДНК фиксируют на мембране посредством поперечного сшивания при УФ облучении. Гибридизацию и выявление проводят с использованием соответствующего набора AlkPhos-Direct DNA detection kit (Amersham Pharmacia Biotech) по прилагающейся к нему инструкции. Температура гибридизации составляет 65°С. ПЦР проводят с использованием AATIU/AAT1L в качестве зондов и геномной ДНК в качестве матрицы. Амплифицированные фрагменты очищают с использованием GFX ДНК для ПЦР и набора для очистки Gel Band (Amersham Pharmacia Biotech).
При первичном скрининге берут в виде одного пула смесь ДНК, экстрагированной из 384 независимых линий со встроенной меткой. 54 пула (384×54=20736 линий) подвергают ПЦР. Продукты амплификации подвергают саузерн-блоттингу для подтверждения амплификации целевого продукта. Пул R0035, имеющий положительные результаты в первичном скрининге, подвергают вторичному скринингу. Для проведения ПЦР во вторичном скрининге используют сочетание праймеров AAT1U/00L и AAT1L/00L, которое дало положительные результаты при первичном скрининге. При вторичном скрининге выявляется, что метка AlaAT1 была встроена в одну линию, линию 8046.
(4) Определение локализации введенной метки
В качестве матрицы используют ДНК, экстрагированную из линии, в которой было доказано наличие введенной метки. ПЦР проводят с использованием двух наборов праймеров (AAT1U/00L и AAT1L/00L). Амплифицированные фрагменты клонируют с получением вектора pGEM T-easy (Promega). Для секвенирования используют секвенатор ДНК ABI PRISMTM 377 DNA sequencer (PERKIN ELMER).
Было показано, что метка встроена в шестой экзон при одновременной делении участка размером 16 нп и что 176-GGTLV-180 был замещен 176-AIQL (конец)-180 путем встраивания последовательности метки. Локализация введенной метки и прилегающих последовательностей показана на фиг.2.
Пример 2. Анализ свойств ГГТ-дефектной линии
(1) Отбор, гомозигот
Т2 семена линии, в отношении которой было подтверждено наличие встроенной метки, помещают в MS среду, содержащую 10 мг/л гигромицина. Через три недели полученные проростки переносят на асбест и из образцов розеточных листьев размером 5 мм×5 мм экстрагируют ДНК. Экстракцию проводят по методу Ли (Li, Plant J. 8: 457-463). Для идентификации гомозигот проводят ПЦР с праймерами (AAT1U/AAT1L2), фланкирующими метку. Осуществляют 30 циклов ПЦР, проводя денатурацию при температуре 94°С в течение 30 секунд, отжиг при температуре 57°С в течение 30 секунд и элонгацию при 72°С в течение 60 секунд. Для контроля в качеств матрицы используют геномную ДНК дикого типа. Аликвоту ПЦР-продукта отделяют электрофорезом на 1% агарозном геле. Гомозиготы обнаруживаются в 11 линиях из используемых для анализа 35 линий (фиг.3).
(2) Выявление экспрессии ГГТ
Полученные гомозиготные линии подвергают ОТ-ПЦР с использованием их потомства для подтверждения разрушения гена. Семена гомозигот высевают на среде MS, содержащей 10 мг/л гигромицина, и подтверждают, что все индивидуальные растения обладают устойчивостью. Экстрагируют суммарную RHK из проростков с использованием ISOGEN (ген Nippon) через две недели после посева. После обработки ДНКазой с последующей обратной. транскрипцией с использованием олиго-дТ праймера и superscript II (GIBCO) проводят ПЦР с праймерами (ААТ1 RTU/AAT1 RTL), фланкирующими метку, используя в качестве матрицы синтезированную одноцепочечную кДНК. Проводят 28 циклов ПЦР, после чего проводят денатурацию при 94°С в течение 30 секунд, отжиг при температуре 57°С в течение 30 секунд и элонгацию проводят при 72°С в течение 60 секунд. Для контроля используют EF1-α (EFU/EFL). Аликвоту ПЦР-продукта отделяют электрофорезом на 1% агарозном геле. В линии со встроенной меткой не обнаруживается мРНК полной длины для AlaAT1 (фиг.4). На основании полученных результатов линия со встроенной меткой была обозначена как "aat1-1" и была использована для проведения указанного ниже анализа.
(3) Влияние интенсивности света на линию aat1-1 со встроенной меткой
Семена линии aat1-1 со встроенной меткой высевают в почву и культивируют в условиях обычной силы света (примерно 70 мкмоль m-2 s-1) со световым периодом 16 часов и темновым периодом 8 часов.
Отбирают надземные части 20 проростков, полученных в указанных выше условиях, и определяют их вес при тройном повторе. Вычисляют среднее значение. Было показано, что отсутствуют значительные различия в росте в условиях слабого освещения (примерно 30 мкмоль m-2 s-1), тогда как в условиях обычной силы света рост серьезно подавляется (таблица 3). Указанные результаты позволят предположить, что линия aat1-1 подверглась фотоингибированию, вызванному неполным фотодыханием.
Влияние интенсивности света
Относительный вес
(4) Ферментативная активность линии aat1-1 со встроенной меткой
Для определения ферментативной активности экстрагируют белок из проростков, растущих в условиях освещения с интенсивностью 70 мкмоль m-2 s-1 в течение 2 недель после высева на среду MS. Растение (сырой вес примерно 200 мг) замораживают в жидком азоте и затем ткань из него дробят с помощью ступки и пестика. К нему добавляют 1 мл экстрагирующего раствора [100 mM Tris-HCl (рН 7,3), 10 mM ДТТ] и полученную смесь центрифугируют при 15000 об/мин в течение 10 минут для удаления нерастворимого материала. Процесс повторяют 3 раза. Затем проводят обессоливание с использованием фильтра UFV5BGCOO (Millipore) для ультрафильтрации. 0,5 мл экстракта концентрируют в 10 раз путем центрифугирования со скоростью 10000 об/мин в течение 45 минут. После разбавления экстрактом до концентрации 1/10 указанный процесс повторяют 3 раза. Определяют концентрацию белка с помощью набора для определения белка (Bio-Rad). Добавляют экстракт, содержащий 10% глицерина, так чтобы получить конечную концентрацию 2 мг на 1 мл экстракта, что дает неочищенный экстракт, который используют для дальнейшего определения ферментативной активности.
Активность реакции Ala (аланин) + αKG (α-кетоглутарат) → Glu (глутамат) + Pyr (пируват) определяют в виде изменения ОП при длине волны 340 нм при сопряжении данной реакции с реакцией окисления НАДН с использованием ЛДГ (ЕС 1.1.1.27). Для проведения реакции используют 10 мг неочищенного экстракта на 600 мкл реакционного раствора [100 мМ Tris-HCl (pH 7,3), 100 мМ Ala, 0,11 мМ пиридоксаль-5-фосфата, 0,11 мМ НАДН, 15 мМ αKG, 80 мМ NH4Cl, 1200 Ед/л ЛДГ (SIGMA L2375)].
Реакционную способность в реакции Glu+Pyr→Ala+αKG и Glu+глиоксилат→глицин (Gly)+αKG определяют в виде изменения величины ОП при длине волны 340 нм при сопряжении данной реакции с реакцией окисления НАДН с использованием НАД+ - ГДГ (ЕС 1.4.1.3). Для проведения реакции используют 10 мг неочищенного экстракта на 600 мкл реакционного раствора [100 мМ Трис-HCl (pH 7,3), 100 мМ Glu, 0,11 мМ пиридоксаль-5-фосфата, 0,11 мМ НАДН, 15 мМ Pyr, 1200 Ед/л ГДГ (G2501)]. В том случае, когда в качестве акцептора аминогруппы используют глиоксилат, берут тот же самый реакционный раствор, с тем исключением, что Pyr заменяют глиоксилатом.
На фиг.5 приведены значения соответствующих активностей. Было обнаружено, что во всех трех реакциях, которые, как считается, катализируются AlaAT, реакционная способность в линии aat1-1 снижена. Было также показано, что каталитическая активность реакции переноса аминогруппы от глутамата к глиоксилату, а именно ГГТ активность, значительно снижена в линии aat1-1.
Таким образом, при сочетании данных по ростовому ингибированию в условиях сильного освещения с результатами определения ферментативной активности показано, что в физиологических условиях AlaAT1 в значительной мере вовлекается в реакцию синтеза глицина из глиоксилата по гликолатному пути, который представляет собой фактически путь фотодыхания (по стрелке на фиг.6).
(5) Аминокислотный анализ aat1-1 со встроенной меткой
Для определения содержания аминокислот проводят их экстракцию из проростков, полученных при росте в условиях интенсивности освещения 70 мкмоль m-2 s-1 течение 2 недель после высева на среду MS. Растения (сырой вес примерно 40 мг) замораживают в жидком азоте и затем хранят при -80°С. К замороженному образцу добавляют 500 мкл 80% этанола. Ткань дробят в дробилке для клеток ММ 300 (GIAGEN) и затем обрабатывают при температуре 80°С в течение 10 минут для экстракции аминокислот. После проведения центрифугирования при 15000 об/мин в течение 10 минут отбирают супернатант. К полученному осадку добавляют 500 мкл 80% этанола при 80°С и смесь тщательно перемешивают и затем обрабатывают при температуре 80°С еще в течение 10 минут. После центрифугирования при 15000 об/мин в течение 10 минут отбирают супернатант, который представляет собой аминокислотный экстракт. 1 мл аминокислотного экстракта упаривают при пониженном давлении до полного удаления этанола и воды. К полученному образцу добавляют 300 мкл 0,02 н. HCl. После перемешивания в вихревом смесителе с последующим центрифугированием отбирают полученный супернатант.
Примеси удаляют пропусканием через фильтр с размером 0,22 мкм, получая образец для анализа. Аминокислотный анализ проводит с помощью аминокислотного анализатора LS-8800 (HITACHI). Данные по содержанию главных аминокислот (нмоль/мг сырого веса) и их относительному количеству в общем пуле аминокислот показаны на фиг.7. Результаты анализов показывают, что аккумулированное количество глутамата повышается в линии aat1-1 (фиг.7).
<Свободный текст с перечнем последовательностей>
SEQ ID NO: 2-NO: 20: ПЦР праймеры
Пример 3. Определение содержания аминокислот в проростках линии aat1-1 со встроенной меткой
(1) Культивирование растений линии aat1-1
Семена линии aat1-1 со встроенной меткой и контрольное растение. Со1-0 высевают на твердой среде MS и культивируют в определенных условиях освещения (70 мкмоль m-2 s-1), световым периодом 16 часов и темновым периодом 8 часов в течение 3 недель, и затем высаживают на минеральную вату. Минеральную вату, на которую были высажены растения Co1-0, и минеральную вату, на которую были высажены растения линии aat1-1, помещают на один и тот же поднос. Один раз в неделю указанным растениям дают удобрения в виде раствора PNS. Собирают семена и после тщательной сушки в эксикаторе подготавливают их для определения аминокислот. Затем проводят аминокислотный анализ.
(2) Анализ аминокислот в семенах линии aat1-1
Примерно 10 мг сухих семян и 500 мкл в 80% этанола переносят в пробирку емкостью 2 мл и семена тщательно разбивают в дробилке для клеток ММ300 (QIAGEN) и затем обрабатывают при температуре 80°С в течение 10 минут для экстракции аминокислот. После центрифугирования при 15000 об/мин в течение 10 минут отбрасывают супернатант. К полученному осадку добавляют 500 мкл 80% этанола и смесь тщательно перемешивают и затем обрабатывают при температуре 80°С в течение 10 минут. После центрифугирования при 15000 об/мин в течение 10 минут отбирают супернатант, который представляет собой образец аминокислотного экстракта.
Один мл аминокислотного экстракта упаривают на роторном испарителе при пониженном давлении до полного удаления этанола и воды. К высушенному до твердого состояния образцу добавляют пятьсот мкл стерильной воды и 500 мкл диэтилового эфира и все тщательно перемешивают. После центрифугирования при 15000 об/мин в течение 5 минут удаляют верхний слой (эфирную фазу). Водную фазу центрифугируют при пониженном давлении до полного удаления воды. После обработки в эксикаторе к образцу добавляют триста мкл 0,02 н. HCl. Образец перемешивают в вихревом смесителе и центрифугируют, после чего супернатант отбрасывают. Примеси удаляют пропусканием супернатанта через фильтр с размером 0,22 мкм, получая образец для аминокислотного анализа. Аминокислоты анализируют с использованием аминокислотного анализатора LS-8800 (HITACHI). На фиг.8 и 9 приведены данные по содержанию основных аминокислот (нмоль/мг сырого веса) и их относительному количеству (%) в общем содержании аминокислот.
Результаты анализов показывают, что количество глутамата в семенах повышено.
В соответствии с настоящим изобретением содержание глутамата в растениях и/или их семенах может быть повышено, и, исходя из этого, могут быть получены растения и/или семена, имеющие повышенный уровень глутамата. Таким образом, в соответствии с настоящим изобретением становится возможным повысить содержание глутамата в пригодных для употребления в пищу растениях, таких как шпинат, капуста, латук и томаты, а также в их плодах, а также содержание глутамата в пригодных для употребления в пищу семенах растений, таких как соевые бобы, фасоль адзуки, фасоль широкая, фасоль обыкновенная и горох. В результате может быть улучшен вкус указанных растений и/или их семян. Кроме того, вкус пищи, приготовленной с использованием таких растений и семян, может быть также улучшен.
Перечень последовательностей приведен в конце описания.











Изобретение относится к генной инженерии растений и пищевой промышленности. В растении ингибируют активность глутамат-глиоксилат-аминотрансферазы путем нарушения функции кодирующего ее гена. Благодаря ингибированию активности данного фермента уровень глутамата в модифицированном растении оказывается выше, чем в соответствующем растении дикого типа, в том числе в его семенах, которое выращено в таких же условиях. Семена и другие части модифицированного растения могут быть использованы для получения пищевого продукта. 10 н. и 21 з.п. ф-лы, 9 ил., 3 табл.
| АСТА BIOCHIMICA POLONICA, v.46, №2, 1999, р.447-557 | |||
| BIOCHEMICAL JOURNAL, v.201, 1982, p.209-214. |
Авторы
Даты
2006-07-20—Публикация
2002-07-04—Подача