Область изобретения
Настоящее изобретение относится к белку, ассоциированному с устойчивостью к болезни, кодирующему этот белок гену и их применению в области биотехнологии для регулирования устойчивости растений к болезни.
Предпосылки изобретения
Хлопчатник представляет собой важную товарную культуру в Китае, и хлопчатобумажные ткани занимают ведущее положение в торговле на экспорт Китая. Вертициллезный вилт представляет собой самое серьезное заболевание хлопчатника в Китае с круглогодичной площадью распространения более чем три-четыре миллиона гм2, что составляет более чем 70% всей площади полей хлопчатника. Он обычно вызывает сокращение урожая на 20%-30% и 60%-70% на сильно зараженном поле или даже потерю урожая. Ежегодная потеря хлопка, вызванная вертициллезным вилтом, достигает одного миллиона тонн, и качество хлопкового волокна сильно снижается в результате болезни. В настоящее время для Gossypium hirsutum, выращиваемого в крупном масштабе в Китае, трудно достичь высокого уровня устойчивости к вертициллезному вилту. Gossypium barbadense, хотя и является устойчивым к вертициллезному вилту, не может выращиваться на больших территориях вследствие низкой урожайности, чувствительности к фузариозному вилту, потребности в высокой суммарной температуре и так далее. С 1950 года селекционеры хлопчатника в Китае предпринимали попытки включить гены устойчивости к болезни из Gossypium barbadense в Gossypium hirsutum путем кроссбридинга с тем, чтобы культивировать разновидности с высокой устойчивостью к вертициллезному вилту и высокой урожайностью, но все они потерпели неудачу. Liu Haiyang et al. (2012) сообщили, что среди 120 разновидностей, высаженных на основной территории культивирования хлопчатника и региональных опытных площадях, только одна характеризовалась как между устойчивостью к вертициллезному вилту и устойчивостью к болезни, а остальные были устойчивыми или чувствительными разновидностями. Следовательно, необходимо клонировать ген, ассоциированный с устойчивостью к болезни, из Gossypium barbadense и ввести такой ген в высокоурожайный Gossypium hirsutum с помощью подхода генетической модификации для культивирования высокоурожайных и устойчивых к Verticillium dahliae разновидностей. Это будет иметь большое значение в увеличении производства хлопка, повышении дохода фермеров, обеспечении безопасности хлопчатника в Китае и стимулировании развития национальной экономики.
Основные вредители и болезни хлопчатника включают фузариозный вилт, вертициллезный вилт и Helicoverpa armigera (хлопковая совка). Вертициллезный вилт не только имеет большую территорию распространения, но кроме того характеризуется увеличивающейся площадью с серьезной степенью поражения болезнью. Сильные патогенные штаммы, вызывающие опадение листьев, вызывают главным образом разрушительные повреждения, и 71,9% штаммов, вызывающих опадение листьев, являются сильными патогенными бактериями. С 1993 года вертициллезный вилт часто вспыхивал в Китае. В 2003 году крупномасштабная вспышка вертициллезного вилта произошла на площадях, занятых Gossypium hirsutum, в китайской Хуанхэ, реке Янцзы и западной территории одновременно. В 2006 году вертициллезный вилт поразил плантации хлопчатника в Jiluyu (китайские провинции Hebei, Shandong и Henan), и более чем 70% общей площади выращивания хлопчатника в этих провинциях было охвачено болезнью в тяжелой степени. В настоящее время автономная область Xinjiang стала главной областью производства хлопка в Китае, и с ростом популярности капельного орошения под пленкой частота эпизодов вертициллезного вилта также быстро увеличивается.
Заболевание вертициллезным вилтом не только снижает продукцию хлопкового волокна, но также серьезно влияет на качество хлопка. Вертициллезный вилт обычно подразделяют на пять степеней от Степени 0 до Степени IV, и для измерения устойчивости разновидности к болезни обычно используют индекс болезни. В отношении вертициллезного вилта индексы болезни 0-10, 11-20, 21-35 и выше 35 указывают на высокую устойчивость, устойчивость к болезни, толерантность к болезни и чувствительность к болезни, соответственно. После того как хлопчатник инфицирован, число семенных коробочек, завязавшихся на отдельном растении, будет значительно уменьшено вследствие недостатка снабжения питательными веществами. Когда болезнь переходит в серьезную форму, число семенных коробочек, завязавшихся на отдельном растении, составляет менее 50% от такового в нормальных условиях (когда число семенных коробочек, завязавшихся на отдельном растении, составляет примерно 18). В таком случае, даже если семенные коробочки не опадают, масса отдельной семенной коробочки будет значительно уменьшена. Было подсчитано, что вспышка вертициллезного вилта в 2003 году снизила продукцию хлопкового волокна на 230 миллионов килограмм, что вызвало прямые экономические потери около 3 миллиардов юаней. После этого вертициллезный вилт вызывал каждый год в Китае экономические потери более 1 миллиарда юаней. После инфицирования хлопчатник с высокой устойчивостью будет характеризоваться значительным ухудшением качества волокна, включая уменьшенную на 20% общую тонину, уменьшенную на 22% прочность и уменьшенную на 2 мм длину. Возбудителем вертициллезного вилта в Китае является Verticillium dahlia. Однажды попав в почву, эти бактерии выживают на протяжении более 20 лет. Поэтому вертициллезный вилт известен как "рак" хлопчатника. Вертициллезный вилт привлекает внимание в Китае к исследованию и борьбе с ним с 1972 года, но до сих пор над ним все еще нет эффективного контроля. В настоящее время борьба с вертициллезным вилтом по существу включает химическую борьбу, биологическую борьбу, сельскохозяйственный контроль и контроль, основанный на селекции на устойчивость к болезни. Химическая борьба дает определенный контролирующий эффект, но также несет серьезное загрязнение в окружающую среду. Биологическая борьба с использованием Trchoderma spp. дает определенный контролирующий эффект, но однако эффект такой биологической борьбы в большой степени зависит от условий окружающей среды. А сельскохозяйственного контроля, связанного с длительным севооборотом, трудно достичь в Китае. Контроль, основанный на селекции на устойчивость к болезни, целью которого является культивирование устойчивых к заболеванию разновидностей, представляет собой самый рентабельный подход. Следовательно, наиболее рентабельное решение проблемы устойчивости хлопчатника к вертициллезному вилту заключается в клонировании гена, ассоциированного с устойчивостью к вертициллезному вилту, культивировании новых разновидностей хлопчатника с помощью подходов генетической модификации и усилении устойчивости к вертициллезному вилту.
Применение подхода генетической модификации для создания новых ресурсов зародышевой плазмы и культивирования устойчивых к болезни разновидностей представляет собой самый рентабельный подход к борьбе с вертициллезным вилтом. Gossypium barbadense L., который является высокоустойчивым к вертициллезному вилту, хотя и содержит ген, ассоциированный с устойчивостью к болезни, не может выращиваться на больших территориях из-за его низкой урожайности. И его ген устойчивости трудно интегрировать в геном Gossypium hirsutum путем кроссбридинга. Следовательно, наилучшее решение состоит в клонировании гена, ассоциированного с устойчивостью к вертициллезному вилту, из Gossypium barbadense, трансформации этим геном Gossypium hirsutum L. и культивировании разновидностей с высокой урожайностью и высокой устойчивостью к вертициллезному вилту. Современная молекулярная генетика позволяет клонировать гены, ассоциированные с устойчивостью к болезням. За последние годы исследователи по всему миру достигли определенного прогресса в клонировании гена устойчивости к вертициллезному вилту (ген R), трансформации антимикробного гена широкого спектра и трансформации гена, ассоциированного с устойчивостью к болезни, из Gossypium barbadense. Вышеупомянутое исследование расширяет спектр источников генов устойчивости к вертициллезному вилту и закладывает основы для культивирования генетически модифицированных разновидностей, устойчивых к вертициллезному вилту. Кроме того, за последние годы при глубоком изучении механизма взаимодействия между растениями и патогенами было обнаружено, что PTI (РАМР (ассоциированный с возбудителем молекулярный паттерн)-активируемый иммунитет, иммунный ответ растения, индуцированный внеклеточным патогенным фактором) и ETI (эффектор-активируемый иммунитет, иммунный ответ, индуцированный внутриклеточным эффекторным фактором) представляют собой два пути активации иммунного ответа у растений. В отношении исследований вертициллезного вилта голландские ученые впервые подтвердили, что механизм PTI может быть применен к устойчивости растений к Verticillium dahliae, в то время как о механизме внутриклеточной устойчивости к вертициллезному вилту до сих пор не сообщалось.
Краткое изложение сущности изобретения
Техническая задача, которую решает настоящее изобретение, заключается в усилении устойчивости растения к болезни.
Для решения вышеизложенной технической задачи в настоящем изобретении предложен белок.
Белок по настоящему изобретению носит название VdAL и представляет собой белок согласно следующим (а), (б), (в) или (г):
а) белок, имеющий аминокислотную последовательность, представленную аминокислотами 1-264 в SEQ ID NO: 1;
б) белок, ассоциированный с устойчивостью к болезни и полученный после того, как аминокислотная последовательность, представленная аминокислотами 1-264 в SEQ ID NO: 1 в Перечне последовательностей, претерпела замену, и/или делецию, и/или добавление одного или нескольких аминокислотных остатков;
в) белок, имеющий аминокислотную последовательность, представленную в SEQ ID NO: 1; и
г) белок, ассоциированный с устойчивостью к болезни и полученный после того, как аминокислотная последовательность, представленная в SEQ ID NO: 1 в Перечне последовательностей, претерпела замену, и/или делецию, и/или добавление одного или нескольких аминокислотных остатков,
где SEQ ID NO: 1 состоит из 287 аминокислот, и аминокислоты 265-287 в SEQ ID NO: 1 представляют собой аминокислотную последовательность FLAG.
Для облегчения очистки белка (а) к амино-концу или карбокси-концу белка, представленного в SEQ ID NO: 1 в Перечне последовательностей, может быть присоединена метка (tag), представленная в Таблице 1.
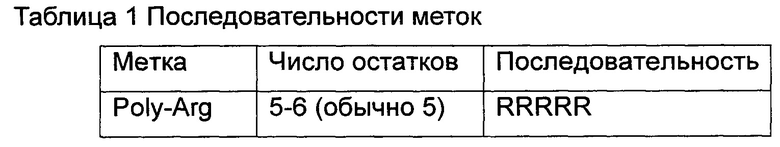
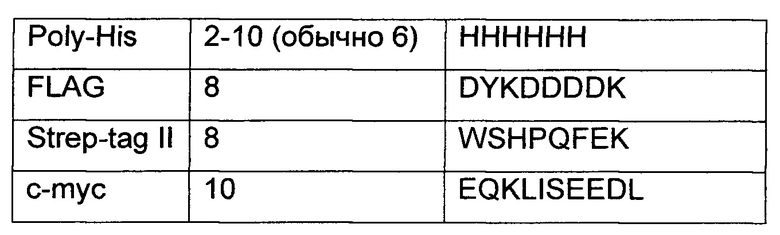
VdAL согласно (б) или (г) выше может быть синтезирован искусственно или получен путем синтеза кодирующих его генов и затем биологической экспрессии. Ген, кодирующий VdAL согласно (б) выше, может быть получен после того, как кодон(ы) одного или нескольких аминокислотных остатков вырезаны из последовательности ДНК, представленной нуклеотидами 1-792 в SEQ ID NO: 2 в Перечне последовательностей, и/или после введения миссенс-мутации одного или нескольких ее оснований, и/или после того, как кодирующая последовательность метки, представленной в Таблице 1, лигирована с ее 5'-концом и/или 3'-концом.
Для решения вышеизложенной технической задачи в настоящем изобретении дополнительно предложен биоматериал, содержащий VdAL.
Биоматериал, предложенный в настоящем изобретении, который ассоциирован с VdAL, представляет собой любой, выбранный из группы, состоящей из следующих (Б1) - (Б22):
Б1) молекула нуклеиновой кислоты, кодирующая VdAl;
Б2) экспрессионная кассета, содержащая молекулу нуклеиновой кислоты согласно (Б1);
Б3) рекомбинантный вектор, содержащий молекулу нуклеиновой кислоты согласно (Б1);
Б4) рекомбинантный вектор, содержащий экспрессионную кассету согласно (Б2);
Б5) рекомбинантный микроорганизм, содержащий молекулу нуклеиновой кислоты согласно (Б1);
Б6) рекомбинантный микроорганизм, содержащий экспрессионную кассету согласно (Б2);
Б7) рекомбинантный микроорганизм, содержащий рекомбинантный вектор согласно (Б3);
Б8) рекомбинантный микроорганизм, содержащий рекомбинантный вектор согласно (Б4);
Б9) линия генетически модифицированных растительных клеток, содержащих молекулу нуклеиновой кислоты согласно (Б1);
Б10) линия генетически модифицированных растительных клеток, содержащих экспрессионную кассету согласно (Б2);
Б11) линия генетически модифицированных растительных клеток, содержащих рекомбинантный вектор согласно (Б3);
Б12) линия генетически модифицированных растительных клеток, содержащих рекомбинантный вектор согласно (Б4);
Б13) генетически модифицированная растительная ткань, содержащая молекулу нуклеиновой кислоты согласно (Б1);
Б14) генетически модифицированная растительная ткань, содержащая экспрессионную кассету согласно (Б2);
Б15) генетически модифицированная растительная ткань, содержащая рекомбинантный вектор согласно (Б3);
Б16) генетически модифицированная растительная ткань, содержащая рекомбинантный вектор согласно (Б4);
Б17) генетически модифицированный орган растения, содержащий молекулу нуклеиновой кислоты согласно (Б1);
Б18) генетически модифицированный орган растения, содержащий экспрессионную кассету согласно (Б2);
Б19) генетически модифицированный орган растения, содержащий рекомбинантный вектор согласно (Б3);
Б20) генетически модифицированный орган растения, содержащий рекомбинантный вектор согласно (Б4);
Б21) генетически модифицированное растение, содержащее молекулу нуклеиновой кислоты согласно (Б1), и
Б22) генетически модифицированное растение, содержащее экспрессионную кассету согласно (Б2).
В вышеупомянутом биоматериале молекула нуклеиновой кислоты согласно (Б1) представляет собой ген, представленный:
1) молекулой кДНК (комплементарная ДНК) или ДНК с нуклеотидной последовательностью, представленной нуклеотидами 1-792 в SEQ ID NO: 2 в Перечне последовательностей;
2) молекулой кДНК или ДНК, которая имеет 75% или более идентичности с нуклеотидной последовательностью, определенной в (1), и кодирует VdAl;
3) молекулой кДНК или ДНК, которая гибридизуется в строгих условиях с нуклеотидной последовательностью, определенной в (1), и кодирует VdAl;
4) молекулой кДНК или ДНК с нуклеотидной последовательностью, представленной в SEQ ID NO: 2 в Перечне последовательностей;
5) молекулой кДНК или ДНК, которая имеет 75% или более идентичности с нуклеотидной последовательностью, определенной в (4), и кодирует VdAl, или
6) молекулой кДНК или ДНК, которая гибридизуется в строгих условиях с нуклеотидной последовательностью, определенной в (4), и кодирует VdAl.
Молекула нуклеиновой кислоты может представлять собой ДНК, такую как кДНК, геномная ДНК и рекомбинантная ДНК. Или, альтернативно, молекула нуклеиновой кислоты также может представлять собой РНК, такую как мРНК и гяРНК (гетерогенная ядерная РНК).
SEQ ID NO: 2 состоит из 864 нуклеотидов, кодирующих аминокислотную последовательность, представленную в SEQ ID NO: 1. Нуклеотиды 793-864 в SEQ ID NO: 2 кодируют FLAG, представленный аминокислотами 265-287 в SEQ ID NO: 1, и нуклеотиды 1-792 SEQ в ID NO: 2 кодируют белок, представленный аминокислотами 1-264 в SEQ ID NO: 1.
Специалист средней квалификации в данной области техники может легко получить мутацию нуклеотидной последовательности, кодирующей VdAL, по настоящему изобретению, используя известные подходы, такие как направленное изменение и точечная мутация. Все те нуклеотиды, которые были искусственно модифицированы и имеют 75% или более идентичности с нуклеотидной последовательностью VdAL, выделенной в настоящем изобретении, при условии, что они кодируют VdAL и обладают функцией VdAL, представляют собой нуклеотидные последовательности, полученные в настоящем изобретении, и эквивалентны последовательности по настоящему изобретению.
Как его используют здесь, термин "идентичность" относится к сходству последовательности с последовательностью природной нуклеиновой кислоты. "Идентичность" означает, что нуклеотидная последовательность имеет 75% или более, 85% или более, 90% или более или 95% или более сходства с нуклеотидной последовательностью, кодирующей белок, состоящий из аминокислотной последовательности, представленной в SEQ ID NO: 1 или представленной аминокислотами 1-264 в SEQ ID NO: 1 по настоящему изобретению. Идентичность может быть оценена невооруженным глазом или с помощью компьютерного программного обеспечения. При использовании компьютерного программного обеспечения идентичность между двумя или более последовательностями может быть выражена в форме процентного отношения (%), которое можно использовать для оценки идентичности между релевантными последовательностями.
В вышеописанном биоматериале строгие условия включают гибридизацию при 68°С в 2-кратном буфере SSC (высокосолевой цитратный буфер) с 0,1% SDS (додецилсульфат натрия) с последующей двукратной промывкой мембраны по 5 мин. каждый раз, и затем гибридизацию при 68°С в 0,5-кратном буфере SSC с 0,1% SDS с последующей двукратной промывкой мембраны по 15 мин. каждый раз или, альтернативно, гибридизацию при 65°С в 0,1-кратном буфере SSPE (или 0,1-кратном буфере SSC) с 0,1% SDS с последующей промывкой мембраны.
Вышеуказанная идентичность 75% или более может составлять 80%, 85%, 90%, 95% идентичности или более.
В вышеописанном биоматериале экспрессионная кассета (экспрессионная кассета гена VdAL) или (Б2), содержащая молекулу нуклеиновой кислоты, кодирующую VdAL, относится к ДНК, способной экспрессировать VdAL в клетке-хозяине. ДНК может содержать не только промотор, который инициирует транскрипцию гена VdAL, но также может содержать терминатор, который останавливает транскрипцию гена VdAL. Экспрессионная кассета может дополнительно содержать энхансерную последовательность. Промоторы, которые можно использовать в настоящем изобретении, включают конститутивные промоторы, тканеспецифические, органоспецифические промоторы и промоторы, зависимые от стадии развития, и индуцибельные промоторы, но не ограничиваются ими. Примеры промоторов включают конститутивный промотор 35S вируса мозаики цветной капусты, индуцируемые повреждением промоторы из томатов, промотор лейцин-аминопептидазы ("LAP," Chao et al. (1999) Plant Physiol 120: 979-992); химически индуцируемые промоторы из табака, промотор связанного с патогенезом белка 1 (PR1) (индуцируемый салициловой кислотой и ВТН (S-метиловый эфир бензотиадиазол-7-карботиокислоты)); промотор ингибитора II (PIN2) протеазы томата или промотор LAP (все они могут быть индуцированы метилжасмонатом); промотор гена теплового шока (US 5187267); промотор, индуцируемый тетрациклином (US 5057422); промоторы, специфичные для семени, такие как промотор pF128, специфичный для семени проса (Setaria italica) (CN 101063139 В (с номером документа CN 200710099169.7)), промоторы, специфичные к запасному белку семени (например промоторы фазеолина, напина, олеозина и бета-конглицина сои (Beachy et al. (1985) EMBO J. 4: 3047-3053)), но не ограничиваются ими. Их можно использовать по отдельности или в комбинации с другими растительными промоторами. Все процитированные ссылки включены в данное описание посредством ссылки во всей своей полноте. Подходящие терминаторы транскрипции включают терминатор нопалин-синтазы агробактерий (терминатор NOS), терминатор 35S вируса мозаики цветной капусты (CaMV), терминатор tml, терминатор rbcS Е9 гороха и терминатор нопалин- и октопин-синтазы, но не ограничиваются ими (см., например, Odell et al. (I958) Nature, 313: 810; Rosenberg et al. (1987) Gene, 56: 125; Guerineau et al. (1991) Mol. Gen. Genet, 262: 141; Proudfoot (1991) Cell, 64: 671; Sanfacon et al. Genes Dev., 5: 141; Mogen et al. (1990) Plant Cell, 2: 1261; Munroe et al. (1990) Gene, 91: 151; Ballad et al. Nucleic acids Res., 17: 7891; и Joshi et al. (1987) Nucleic acid Res., 15: 9627).
Существующий вектор экспрессии можно использовать для конструирования рекомбинантного вектора, содержащего экспрессионную кассету гена VdAL. Растительный вектор экспрессии содержит бинарные векторы Agrobacterium tumefaciens, вектор, который можно использовать для микропроекционной бомбардировки у растений, и тому подобное, такие как рАНС25, pBin438, pCAMBIA1302, pCAMBIA2301, pCAMBIA1301, pCAMBIA1300, рВ1121, pCAMBIA1391-Ха или pCAMBIA1391-Xb (CAMBIA). Растительный вектор экспрессии также может содержать 3'-нетранслируемый участок чужеродного гена, то есть может быть включен сигнал полиаденилирования и любой другой фрагмент ДНК, вовлеченный в процессинг мРНК или экспрессию гена. Сигнал полиаденилирования может приводить к полиаденилированию 3'-конца мРНК-предшественника. Например, плазмидный ген, индуцируемый корончатым галлом агробактерий (Ti) (такой как ген Nos нопалин-синтазы), и 3'-концевые транскрибируемые нетранслируемые участки растительного гена (такого как ген запасного белка сои) все имеют похожую функцию. Когда ген по настоящему изобретению используют для конструирования растительного вектора экспрессии, также можно использовать энхансеры, включая энхансеры трансляции или энхансеры транскрипции. Энхансерные участки, которые могут представлять собой инициирующий кодон ATG, инициирующий кодон в прилегающем участке или им подобные, должны быть идентичны рамке считывания кодирующей последовательности так, чтобы обеспечить корректную трансляцию полной последовательности. Сигнал контроля трансляции и инициирующий кодон, которые имеют широкое разнообразие источников, могут быть как природными, так и синтетическими. Участок инициации трансляции может быть получен из участка инициации транскрипции или структурного гена. Для облегчения идентификации и скрининга генетически модифицированных растительных клеток или растений используемый растительный вектор экспрессии может быть преобразован, например, путем добавления гена, который может экспрессироваться в растении и может кодировать фермент для продукции окраски или синтеза люминесцентного соединения (такого как ген GUS и ген люциферазы), маркерного гена устойчивости к антибиотикам (такого как ген nptll, который придает устойчивость к канамицину и родственным антибиотикам, ген bar, который придает устойчивость к гербициду фосфинотрицину, ген hph, который придает устойчивость к антибиотику гигромицину, ген dhfr, который придает устойчивость к метотрексату, и ген EPSPS, который придает устойчивость к глифосату), маркерного гена устойчивости к химическому реагенту (такого как ген устойчивости к гербицидам) или гена маннозо-6-фосфат изомеразы, который обеспечивает способность метаболизировать маннозу. Для безопасности генетически модифицированных растений они могут быть трансформированы непосредственно посредством негативного скрининга без какого-либо селективного маркерного гена.
В вышеописанном биоматериале вектор может представлять собой плазмиду, космиду, фаг или вирусный вектор.
В вышеописанном биоматериале микроорганизм может представлять собой дрожжи, бактерии, водоросли или грибы, например Agrobacterium.
В вышеописанном биоматериале генетически модифицированный орган растения может представлять собой семя генетически модифицированного растения. Генетически модифицированное растение (например кукуруза) может включать семя, каллус, интактное растение и клетку. Генетически модифицированная кукуруза может включать семя, каллус, интактное растение и клетку.
В одном воплощении настоящего изобретения ген, кодирующий VdAL (то есть молекулу ДНК, представленную нуклеотидами 1-792 в SEQ ID NO: 2), вводят в Agrobacterium tumefaciens GV3101 с помощью рекомбинантного вектора, содержащего экспрессионную кассету гена, кодирующего VdAL. Рекомбинантный вектор представляет собой рекомбинантный вектор pSPTOI-VdAL, полученный путем замены фрагмента между сайтами распознавания Sal I и Kpn I в pSPT01 на молекулу ДНК, представленную нуклеотидами 1-792 в SEQ ID NO: 2. pSPT01-VdAL экспрессирует белок VdAL, представленный в SEQ ID NO: 1.
В другом воплощении настоящего изобретения ген, кодирующий VdAL (то есть молекулу ДНК, представленную нуклеотидами 1-792 в SEQ ID NO: 2), вводят в Agrobacterium tumefaciens GV3101 с помощью рекомбинантного вектора, содержащего экспрессионную кассету гена, кодирующего VdAL. Рекомбинантный вектор представляет собой рекомбинантный вектор pCAMBIA1300-Super-VdAL, полученный путем замены фрагмента между сайтами распознавания Pst I и Kpn I в pCAMBIA1300-Super на молекулу ДНК, представленную нуклеотидами 1-792 в SEQ ID NO: 2. pCAMBIA1300-Super-VdAL экспрессирует белок VdAL, представленный в SEQ ID NO: 1.
Для решения вышеизложенной технической задачи в настоящем изобретении дополнительно предложено применение VdAL или биоматериала в:
а) регуляции устойчивости растения к болезни или
б) культивировании устойчивого к болезни генетически модифицированного растения.
В вышеуказанном применении растение может представлять собой двудольное растение или однодольное растение.
В вышеуказанном применении устойчивость к болезни может представлять собой устойчивость к вертициллезному вилту.
В вышеуказанном применении растение может представлять собой двудольное растение или однодольное растение, и устойчивость к болезни может представлять собой устойчивость к вертициллезному вилту.
В вышеуказанном применении двудольное растение может представлять собой растение Gossypium. Растение Gossypium может представлять собой хлопчатник. В частности, хлопчатник может представлять собой SGK9708-41.
Для решения вышеизложенной технической задачи в настоящем изобретении дополнительно предложен способ культивирования устойчивого к болезни генетически модифицированного растения.
Способ культивирования устойчивого к болезни генетически модифицированного растения, предложенный в настоящем изобретении, включает стадию введения гена, кодирующего VdAL, в растение-реципиент для получения устойчивого к болезни генетически модифицированного растения, обладающего более высокой устойчивостью к болезни, чем растение-реципиент.
В вышеуказанном способе ген, кодирующий VdAL, может представлять собой молекулу ДНК с кодирующей последовательностью, представленной нуклеотидами 1-792 в SEQ ID NO: 2 в Перечне последовательностей.
В вышеуказанном способе растение может представлять собой двудольное растение и/или однодольное растение.
В вышеуказанном способе устойчивость к болезни может представлять собой устойчивость к вертициллезному вилту.
В вышеуказанном способе ген, кодирующий VdAL, может представлять собой молекулу ДНК с кодирующей последовательностью, представленной нуклеотидами 1-792 в SEQ ID NO: 2 в Перечне последовательностей, и растение может представлять собой двудольное растение и/или однодольное растение.
В вышеуказанном способе ген, кодирующий VdAL, может представлять собой молекулу ДНК с кодирующей последовательностью, представленной нуклеотидами 1-792 в SEQ ID NO: 2 в Перечне последовательностей, и устойчивость к болезни может представлять собой устойчивость к вертициллезному вилту.
В вышеуказанном способе растение может представлять собой двудольное растение и/или однодольное растение, и устойчивость к болезни может представлять собой устойчивость к вертициллезному вилту.
В вышеуказанном способе ген, кодирующий VdAL, может представлять собой молекулу ДНК с кодирующей последовательностью, представленной нуклеотидами 1-792 в SEQ ID NO: 2 в Перечне последовательностей; растение может представлять собой двудольное растение и/или однодольное растение; и устойчивость к болезни может представлять собой устойчивость к вертициллезному вилту.
В вышеуказанном способе ген, кодирующий VdAL, также может представлять собой молекулу ДНК с кодирующей последовательностью, представленной в SEQ ID NO: 2 в Перечне последовательностей.
В вышеуказанном способе двудольное растение может представлять собой растение Gossypium. Растение Gossypium может представлять собой хлопчатник. В частности, хлопчатник может представлять собой sGK9708-41.
В одном воплощении настоящего изобретения ген, кодирующий VdAL (то есть молекулу ДНК, представленную в SEQ ID NO: 2), вводят в растение-мишень с помощью рекомбинантного вектора экспрессии гена VdAL, содержащего экспрессионную кассету гена VdAL.
В вышеуказанном способе ген VdAL может быть сначала модифицирован следующим образом и затем введен в семенное растение-реципиент для того, чтобы достичь эффекта лучшей экспрессии.
На начальном этапе модификация и оптимизация могут быть выполнены в соответствии с фактическими требованиями так, чтобы обеспечить возможность эффективной экспрессии гена. Например, в зависимости от предпочтительного кодона растения-реципиента кодон гена VdAL по настоящему изобретению может быть изменен с сохранением его аминокислотной последовательности с тем, чтобы привести его в соответствие с предпочтением растения. В процедуре оптимизации желательно сохранять определенное содержание GC в оптимизированной кодирующей последовательности так, чтобы наилучшим образом достигать высокого уровня экспрессии введенного гена в растении, где содержание GC может составлять 35%, более чем 45%, более чем 50% или более чем примерно 60%.
Кроме того, последовательность гена, соседняя со стартовым метионином, может быть модифицирована для обеспечения эффективной инициации трансляции. Для модификации может быть использована, например, эффективная последовательность, известная для растения.
Более того, для облегчения экспрессии гена VdAL в растениях может быть выполнено лигирование с промоторами экспрессии различных растений. Промоторы могут включать конститутивные, индуцибельные, регулируемые по времени, регулируемые в зависимости от стадии развития, регулируемые химически, промоторы с тканевой оптимизацией и тканеспецифические промоторы. Выбор промотора варьирует в зависимости от требований ко времени и месту экспрессии и также зависит от вида - мишени. Например, специфический промотор экспрессии ткани или органа зависит от того, в какой период развития требуется рецептор. Несмотря на то, что было подтверждено, что многие промоторы, полученные из двудольных растений, являются функциональными в однодольных растениях и наоборот, желательно выбирать промоторы двудольных растений для экспрессии в двудольных растениях и промоторы однодольных растений для экспрессии в однодольных растениях.
Дополнительно, для улучшения эффективности экспрессии гена по настоящему изобретению также может быть выполнено лигирование с подходящим терминатором транскрипции, таким как tml, полученный из CaMV, и Е9, полученный из rbcS. С геном по настоящему изобретению может быть лигирован любой доступный терминатор, для которого известно, что он функционирует в растении.
Более того, может быть введена энхансерная последовательность, такая как последовательность интрона (например из Adhl или bronzel) и вирусная лидерная последовательность (например из TMV (вирус табачной мозаики), MCMV (вирус хлоротической пятнистости кукурузы) или AMV (вирус мозаичности люцерны)).
Рекомбинантный вектор экспрессии, имеющий ген VdAL, может быть введен в растительную клетку с помощью традиционного биотехнологического средства, такого как Ti-плазмида, вектор в виде растительного вируса, прямая конверсия ДНК, микроинъекция и электропорация (Weissbach, 1998, "Method for Plant Molecular Biology VIII," Academy Press, New York, pp. 411-463; Geiserson and Corey, 1998, Plant Molecular Biology (2nd Edition)).
Следует понимать, что в вышеуказанном способе генетически модифицированное растение включает не только генетически модифицированное растение первого поколения, полученное в результате трансформации растения-мишени геном VdAL, но также его потомство. Что касается генетически модифицированного растения, то ген может репродуцироваться в пределах вида генетически модифицированного растения и также может быть перенесен в другие разновидности этого же вида, особенно коммерческие варианты, с помощью традиционных технических средств выращивания. Генетически модифицированное растение может представлять собой семя, каллус, интактное растение или клетку.
Для решения вышеизложенной технической задачи в настоящем изобретении дополнительно предложен продукт для регуляции устойчивости растений к болезни.
Продукт для регуляции устойчивости растений к болезни, предложенный в настоящем изобретении, содержит VdAL или биоматериал.
Активный ингредиент продукта для регуляции устойчивости растений к болезни может представлять собой VdAL или биоматериал.
Продукт для регуляции устойчивости растений к болезни может быть получен посредством осуществления следующих стадий:
культивирование рекомбинантного микроорганизма для экспрессии кодирующего гена и получение рекомбинантной микробной культуры, экспрессирующей VdAL; и
разрушение микроорганизма в микробной культуре для получения биологического агента.
Для решения вышеизложенной технической задачи в настоящем изобретении дополнительно предложено применение этого продукта в регуляции устойчивости растений к болезни.
В вышеуказанном применении растение представляет собой двудольное растение и/или однодольное растение. Двудольное растение может представлять собой растение Gossypium. Растение Gossypium может представлять собой хлопчатник. В частности, хлопчатник может представлять собой SGK9708-41.
В настоящем изобретении вертициллезный вилт может представлять собой болезнь, вызванную штаммом V991.
Краткое описание графических материалов
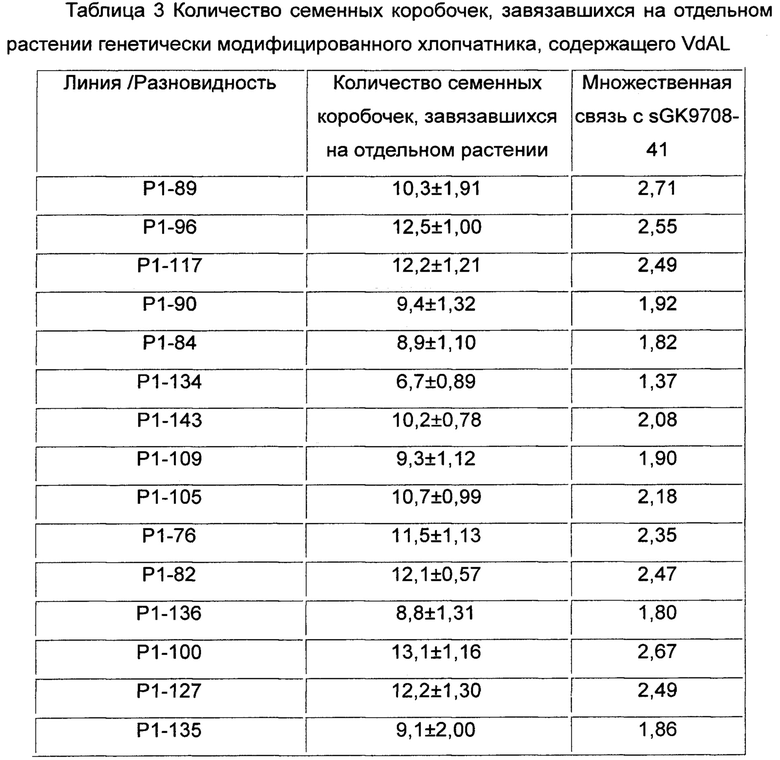
На Фиг. 1 показаны индексы вертициллезного вилта нескольких линий генетически модифицированного хлопчатника, содержащего VdAL, где WT, FCK и RCK представляют собой sGK9708-41, SCRC28 и GK44, соответственно;
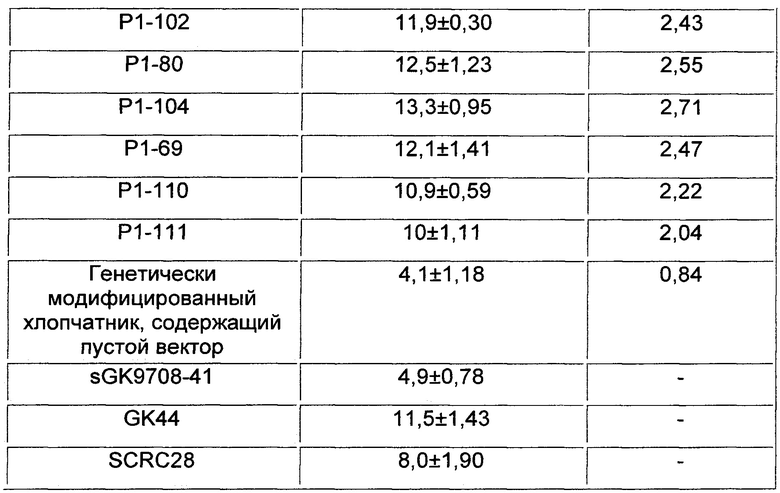
На Фиг. 2 показано количество семенных коробочек на отдельном растении нескольких линий генетически модифицированного хлопчатника, содержащего VdAL, где WT, YCK и RCK представляют собой SGK9708-41, SCRC28 и GK44, соответственно;
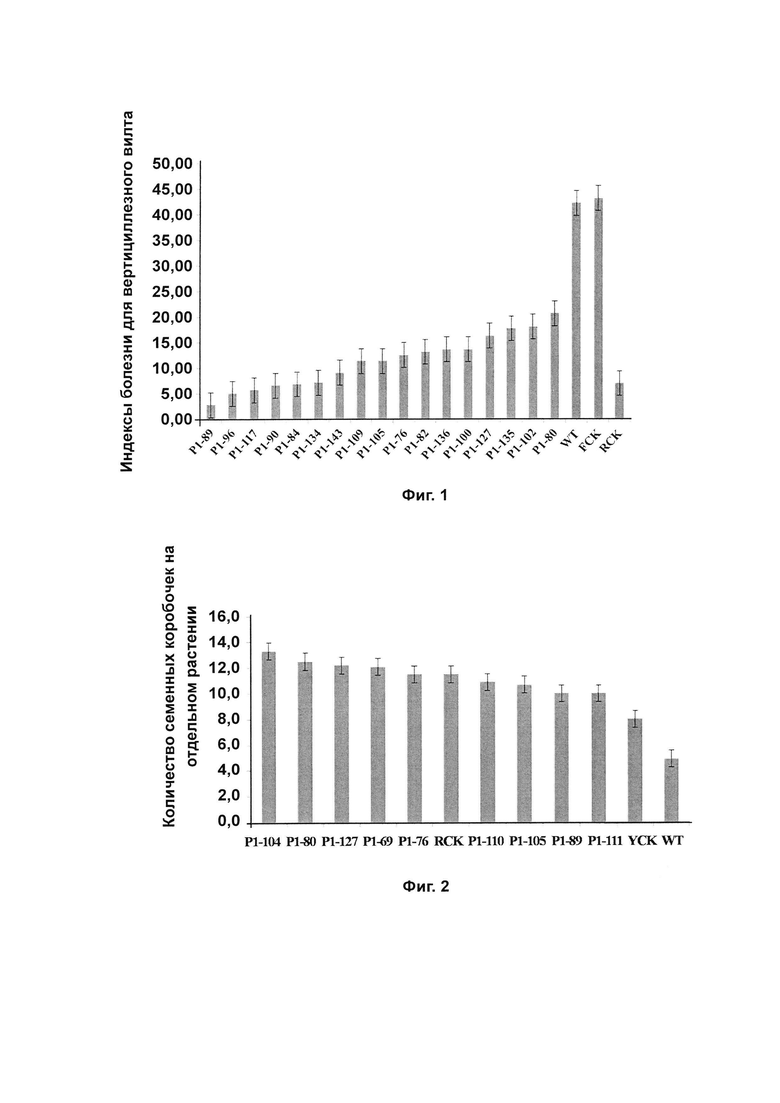
Фиг. 3 демонстрирует аспекты устойчивости к вертициллезному вилту генетически модифицированного Arabidopsis thaliana, содержащего VdAL, где на (А) представлены генетически модифицированные линии 2 и 3 Arabidopsis thaliana, содержащие VdAL, поколения Т3; на (Б) показаны уровни транскрипции гена VdAL у генетически модифицированных линий 2 и 3 Arabidopsis thaliana, содержащих VdAL, поколения Т3, определенные методом полуколичественной ПЦР; на (В) представлен характер роста генетически модифицированных линий 2 и 3 Arabidopsis thaliana, содержащих VdAL, поколения Т3 после инокулирования хлопчатника Verticillium dahlia; и на (Г) показаны индексы болезни генетически модифицированного линий 2 и 3 Arabidopsis thaliana, содержащих VdAL, поколения Т3;
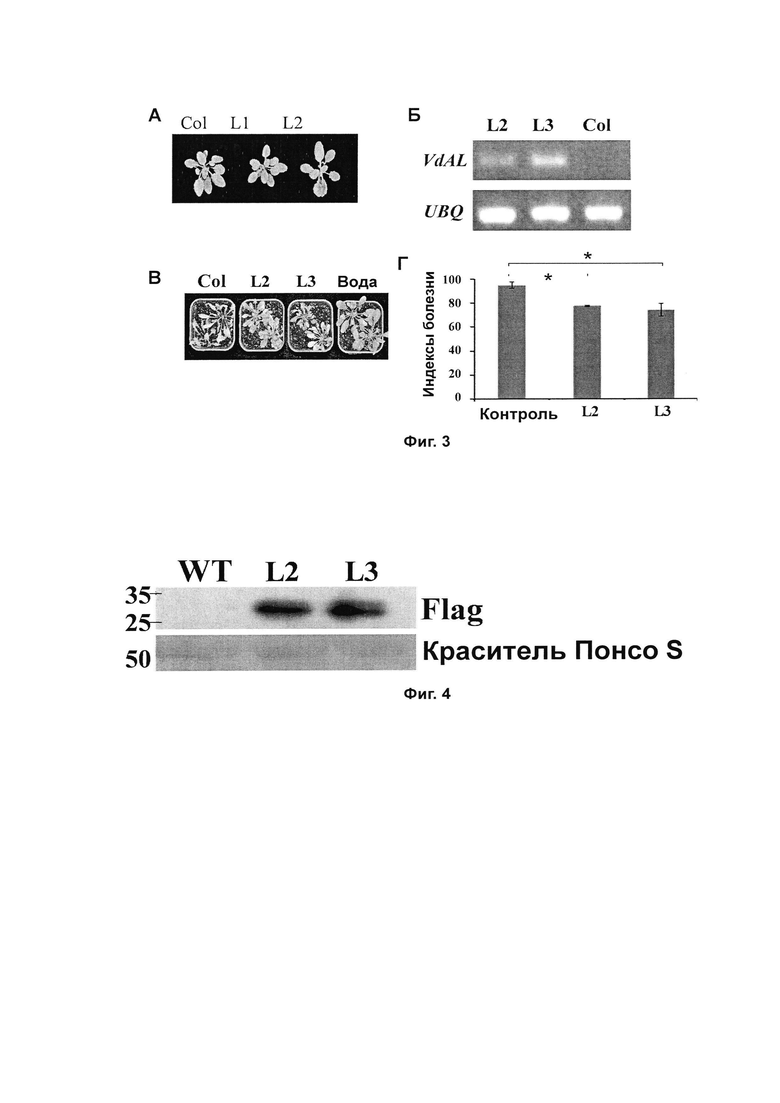
Фиг. 4 демонстрирует определение экспрессии белка VdAL методом вестерн-блоттинга у генетически модифицированных линий 2 и 3 Arabidopsis thaliana, содержащих VdAL, поколения Т3; и
На Фиг. 5 представлены результаты по детекции гена VdAL методом вестерн-блоттинга у линий Р1-89 генетически модифицированного хлопчатника, содержащего VdAL.
Подробное описание воплощений
Настоящее изобретение будет описано более подробно со ссылкой на конкретные примеры, которые приведены исключительно для иллюстрации настоящего изобретения, но не предназначены каким-либо образом ограничивать объем настоящего изобретения.
Экспериментальные подходы, показанные в следующих примерах, являются традиционными походами, если не указано иное.
Все материалы, реагенты и тому подобное, используемые в следующих примерах, имеются в продаже, если не указано иное.
Verticillium dahlia в следующих примерах относится к штамму V991 (Qi Junsheng & Li Huaifang, "A New Detection Method of Wilting Induction by Phytotoxin from V. dahliae on Cotton through Leaf Pricking and Spreading," Cotton Science, 2016, 18 (4): 228-232), который может быть получен в открытом доступе в Китайском Сельскохозяйственном Университете (то есть, от заявителя). Этот биоматериал может быть использован только для целей повторения экспериментов, имеющих отношение к настоящему изобретению, и не может быть использован для других целей.
GK44, используемый в следующих примерах, является продуктом Shandong Jinqiu Seed Industry Co., Ltd.
SCRC28, используемый в следующих примерах, является продуктом Shandong Nongxing Seed Industry Co., Ltd.
sGK9708-41, используемый в следующих примерах, является продуктом Xinjiang Cotton-Seed Industry Co., Ltd.
Arabidopsis thaliana Col, используемый в следующих примерах, является продуктом Salk Institute for Biological Studies.
Vector pSPT01, используемый в следующих примерах, представляет собой pSPT01 из Примера 1 заявки на патент Китая No. 201010521702.6 (опубликованной как CN 101962658 A). pSPT01 создан на основе pCambia1300, где промотор гена-мишени представляет собой "супер промотор" с добавленной за промотором последовательностью Flag, и ген-репортер заменен на ген tfdA.
Вектор pCAMBIA1300-Super, используемый в следующих примерах, представляет собой pCAMBIA1300-Super из Примера 1 заявки на патент Китая No. 201010521702.6 (опубликована как CN 101962658 A). pCAMBIA1300-Super представляет собой вектор, полученный после того, как промотор CaMV35S в pCAMBIA1300 (GenBank No.: FJ362601.1) заменили на суперсильный промотор и модифицировали сайт расщепления ферментом рестрикции в рСАМВIА1300.
Agrobacterium tumefaciens GV3101, используемый в следующих примерах, представляет собой продукт Beijing Jiuzhou Tian Rui Technology Co., Ltd.
Пример 1
В этом примере было подтверждено, что белок VdAL, ассоциированный с устойчивостью к болезни, может усиливать устойчивость хлопчатника к болезни.
I. Конструирование генетически модифицированного хлопчатника, содержащего VdAL
Процедура 1 Конструирование рекомбинантного вектора и рекомбинантного штамма
Молекула ДНК, представленная нуклеотидами 1-792 в SEQ ID NO: 2 в Перечне последовательностей, то есть ген VdAL, кодирующий белок, ассоциированный с устойчивостью к болезни, была синтезирована искусственно. Последовательность между сайтами распознавания Sal I и Kpn I вектора pSPT01 заменили на молекулу ДНК, представленную нуклеотидами 1-792 в SEQ ID NO: 2 в Перечне последовательностей (то есть ген VdAL, кодирующий белок, ассоциированный с устойчивостью к болезни), а другие последовательности pSPT01 оставили без изменений с получением рекомбинантного вектора, получившего название pSPT01-VdAL. Рекомбинантный вектор pSPT01-VdAL экспрессирует ассоциированный с устойчивостью к болезни белок VdAL, представленный в SEQ ID NO: 1 в Перечне последовательностей.
SEQ ID NO: 2 состоит из 864 нуклеотидов, кодирующих аминокислотную последовательность, представленную в SEQ ID NO: 1. Нуклеотиды 793-864 в SEQ ID NO: 2 кодируют FLAG, представленный аминокислотами 265-287 в SEQ ID NO: 1; и нуклеотиды 1-792 SEQ ID NO: 2 кодируют белок, представленный аминокислотами 1-264 в SEQ ID NO: 1.
pSPT01-VdAL вводили в Agrobacterium tumefaciens GV3101 с получением рекомбинантного штамма, который получил название A-pSPT01-VdAL.
pSPT01 вводили в Agrobacterium tumefaciens GV3101 с получением рекомбинантного штамма с пустым вектором, и полученный в результате рекомбинатный штамм получил название A-pSPT01.
Процедура 2. Создание генетически модифицированного хлопчатника, устойчивость которого к болезни связана с белком VdAL
На стадии (1) A-pSPT01-VdAL из процедуры 1 сеяли штрихом на твердую среду YEB, содержащую канамицин в конечной концентрации 50 мкг/мл и рифампицин в конечной концентрации 50 мкг/мл, активировали и культивировали в течение 48 ч при 28°С для получения отдельных колоний.
На стадии (2) отдельную колонию, полученную на стадии (1), отбирали и инокулировали в 5 мл жидкой среды YEB, содержащей канамицин в конечной концентрации 50 мкг/мл и рифампицин в конечной концентрации 50 мкг/мл, и встряхивали в течение 12 ч при 28°С с получением бактериального раствора.
На стадии (3) 2 мл бактериального раствора, полученного на стадии (2), инокулировали в 500 мл жидкой среды YEB, содержащей канамицин в конечной концентрации 50 мкг/мл и рифампицин в конечной концентрации 50 мкг/мл, встряхивали на вибрационном столе при 28°С и культивировали до ОП600, равной 0,8-1,0, с получением бактериального раствора.
На стадии (4) бактериальный раствор, полученный на стадии (3), центрифугировали при 4000 об/мин в течение 10 минут при комнатной температуре с получением бактериального осадка.
На стадии (5) бактериальный осадок, полученный на стадии (4), ресуспендировали в 200 мл раствора 1/2 MS (среда Мурасиге-Скуга), в который было добавлено 15 мкл Silwet-77, с последующим перемешиванием до гомогенного состояния с получением инфицирующего раствора Agrobacterium tumefaciens.
На стадии (6) цветочные почки разновидности хлопчатника sGK9708-41 (2,4-D-чувствительная линия) изолировали путем упаковки в мешки. Инфицирующий раствор Agrobacterium tumefaciens со стадии (5) распрыскивали на упакованные в мешки цветочные почки на следующие сутки в период времени от 8 до 9 часов. Затем цветочные почки, опрысканные инфицирующим раствором Agrobacterium tumefaciens, упаковывали в мешки для защиты от света и трансформированные цветочные почки отмечали красными веревками. Далее эта линия представляла собой генетически модифицированную линию генерации Т0. Эту генетически модифицированную линию продолжали до генерации Т4 (путем самоопыления в каждой генерации). Проводили скрининг каждой генерации с помощью 2,4-D с получением следующих генетически модифицированных линий хлопчатника генерации Т4: Р1-89, Р1-96, Р1-117, Р1-90, Р1-84, Р1-134, Р1-143, Р1-109, Р1-105, Р1-76, Р1-82, Р1-136, Р1-100, Р1-127, Р1-135, Р1102, Р1-80, Р1-104, Р1-69, Р1-110, Р1-125 и Р1-111, содержащих VdAL.
На стадии (7) у содержащих VdAL генетически модифицированных линий хлопчатника генерации Т4, полученных на стадии (6), определяли ген VdAL на геномном уровне. Разновидность хлопчатника sGK9708-41 использовали в качестве эталона дикого типа с парой праймеров ATGCTTTCTCTCCAGACCGC и GAGATTTGCCGGCGGCGGTG. Результаты показали, что продукты ПЦР всех содержащих VdAL генетически модифицированных линий хлопчатника поколения Т4, полученных на стадии (6), имеют целевые полосы размера 792 п. н., что указывает на то, что все содержащие VdAL генетически модифицированные линии хлопчатника поколения Т4, полученные на стадии (6), имеют ген VdAL.
На стадии (8) методом полуколичественной ПЦР идентифицировали экспрессию гена VdAL у содержащих VdAL генетически модифицированных линий хлопчатника поколения Т4, полученных на стадии (6). Разновидность хлопчатника sGK9708-41 использовали в качестве эталона дикого типа с парой праймеров ATGCTTTCTCTCCAGACCGC и GAGATTTGCCGGCGGCGGTGT. UBQ использовали в качестве внутреннего эталона с парой праймеров CCCTGGCTGATTACATC и TGGTGTCAGTGGGTTCAATG. Результаты показали, что продукты ПЦР каждой из содержащих VdAL генетически модифицированных линий хлопчатника поколения Т4 имеют целевые полосы, что указывает на то, что каждая из содержащих VdAL генетически модифицированных линий хлопчатника поколения Т4, полученных на стадии (6), экспрессировала ген VdAL.
На стадии (9) методом вестерн-блоттинга определяли экспрессию белка VdAL у содержащих VdAL генетически модифицированных линий хлопчатника поколения Т4, полученных на стадии (6). Разновидность хлопчатника sGK9708-41 использовали в качестве эталона дикого типа. Использовали антитело-метку (Cat. No. АВ003-01А, продукт Shanghai Nearshore Technology Co. LTD/Sinobio Biotech Co., Ltd.). Белок метили раствором красителя Понсо S, и корректировали его загружаемое количество таким образом, чтобы обеспечить одинаковое количество белка на разных треках. Результаты показаны на Фиг. 5. Результаты показали, что каждая из содержащих VdAL генетически модифицированные линий хлопчатника поколения Т4, полученных на стадии (6), экспрессирует белок VdAl.
A-pSPT01-VdAL заменяли на A-pSPT01 в соответствии со стадиями (1)-(6), а другие стадии оставляли без изменений. Получали генетически модифицированный хлопчатник, содержащий пустой вектор, и обозначали его как "генетически модифицированный хлопчатник, содержащий пустой вектор".
II. Идентификация устойчивости к болезни генетически модифицированного хлопчатника, содержащего VdAL
Генетически модифицированный хлопчатник, содержащий VdAL, инокулировали Verticillium dahliae, и оценивали устойчивость растения к болезни после инокуляции в показателях индекса вертициллезного вилта и количества семенных коробочек, завязавшихся на его отдельных растениях. Эксперимент повторяли три раза, каждый раз включая следующие конкретные стадии.
Verticillium dahliae хлопчатника инокулировали в питомник болезни на поле провинции Shandong для получения питомника болезни с гомогенно распределенными штаммами V991. Генетически модифицированные линии хлопчатника Р1-89, Р1-96, Р1-117, Р1-90, Р1-84, Р1-134, Р1-143, Р1-109, Р1-76, Р1-82, Р1-136, Р1-100, Р1-127, Р1-135, Р1-102, Р1-80, Р1-104, Р1-69, Р1-110 и Р1-111, содержащие VdAL, и генетически модифицированный хлопчатник, содержащий пустой вектор, полученный выше, разновидность хлопчатника sGK9708-41, устойчивую к вертициллезному вилту разновидность хлопчатника GK44 и высокоурожайную разновидность хлопчатника SCRC28 высаживали в вышеуказанный питомник болезни, соответственно, по 30 растений для каждой линии.
Частоту случаев болезни хлопчатника классифицировали следующим образом во время его стадии цветения и образования семенных коробочек и рассчитывали индекс вертициллезного вилта и относительный контролирующий эффект хлопчатника (см. Таблицу 2 и Фиг. 1):
Степень 0: отсутствуют больные листья;
Степень I: 0,1% - 25% больных листьев;
Степень II: 25% (не включая) - 50% больных листьев;
Степень III: 50% (не включая) - 75% больных листьев; и
Уровень IV: более чем 75% больных листьев.
Индекс болезни = (1 × число растений со Степенью I+2 × число растений со Степенью II+3 × число растений со Степенью III+4 × число растений со Степенью IV) / (4 × общее число исследованных растений) × 100.
Относительный контролирующий эффект (%) = (индекс болезни sGK9708-41 - индекс болезни генетически модифицированного хлопчатника, содержащего VdAL) / индекс болезни sGK9708-41 × 100% (относительный контролирующий эффект sGK9708-41 был определен как 0)).
Число семенных коробочек, завязавшихся на отдельном растении хлопчатника, подсчитывали в конце стадии образования семенных коробочек. Результаты представлены в Таблице 3 и на Фиг. 2.
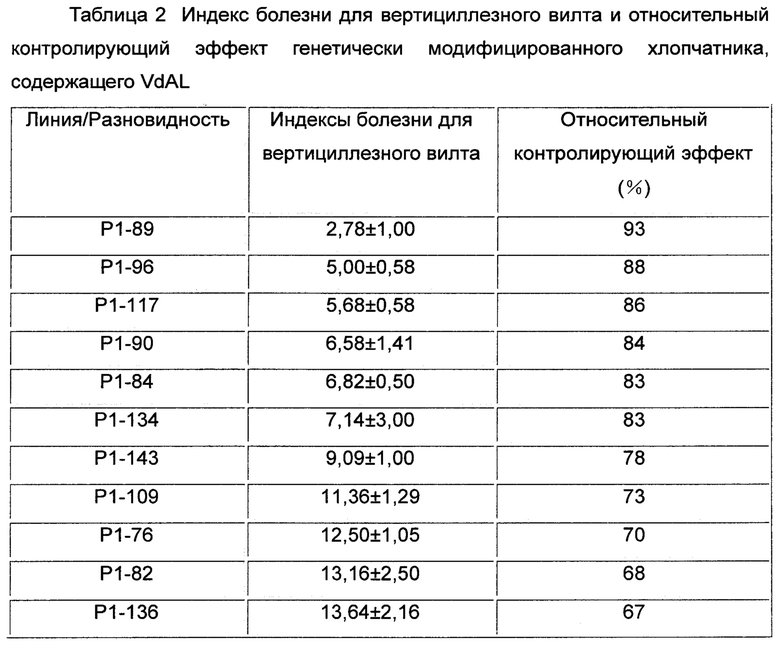
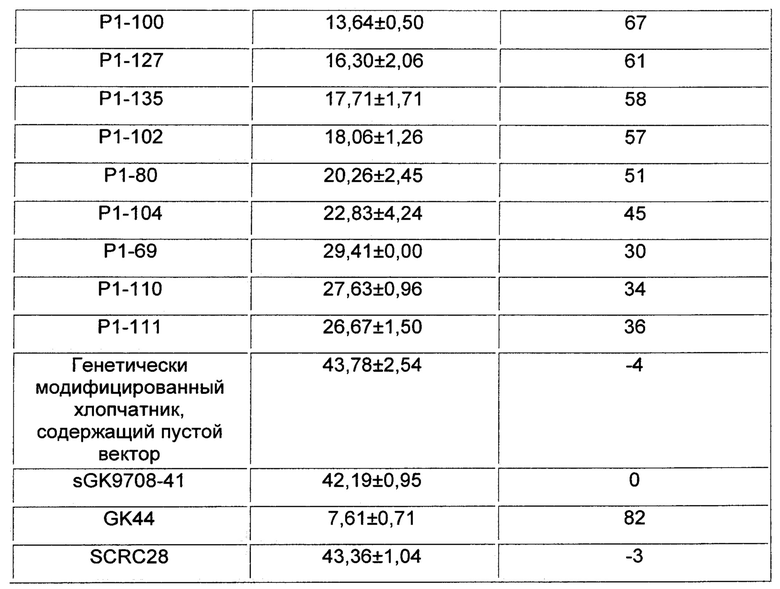
Результаты показали, что разновидность хлопчатника sGK9708-41 не имела существенных отличий от генетически модифицированного хлопчатника, содержащего пустой вектор в показателях индекса вертициллезного вилта. Индексы вертициллезного вилта для каждой из содержащих VdAL генетически модифицированных линий хлопчатника были ниже, чем индекс вертициллезного вилта разновидности хлопчатника дикого типа sGK9708-41, а также ниже, чем индекс вертициллезного вилта высокоурожайной разновидности хлопчатника SCRC28. Индексы вертициллезного вилта для некоторых линий (таких как Р1-89, Р1-96, Р1-117, Р1-90, Р1-84 и Р1-134) были даже ниже, чем индекс вертициллезного вилта устойчивой к вертициллезному вилту разновидности хлопчатника GK44. Относительный контролирующий эффект разновидности хлопчатника sGK9708-41 не имел существенных отличий от относительного контролирующего эффекта генетически модифицированного хлопчатника, содержащего пустой вектор. Относительный контролирующий эффект каждой из содержащих VdAL генетически модифицированных линий хлопчатника был выше, чем относительный контролирующий эффект разновидности хлопчатника дикого типа sGK9708-41, а также выше, чем относительный контролирующий эффект высокоурожайной разновидности хлопчатника SCRC28. Относительный контролирующий эффект некоторых линий (таких как Р1-89, Р1-96, Р1-117, Р1-90, Р1-84 и Р1-134) составлял более 80%, что больше, чем даже относительный контролирующий эффект устойчивой к вертициллезному вилту разновидности хлопчатника GK44.
Результаты показали, что VdAL по настоящему изобретению может усиливать устойчивость к вертициллезному вилту у растения.
Примечание: "-" означает, что сравнение не проводили.
Результаты показали, что не было существенных различий в показателях количества семенных коробочек на отдельном растении между разновидностью хлопчатника sGK9708-41 и генетически модифицированным хлопчатником, содержащим пустой вектор. Количество семенных коробочек на отдельном растении каждой из содержащих VdAL генетически модифицированных линий хлопчатника было больше, чем количество семенных коробочек на отдельном растении разновидности хлопчатника дикого типа sGK9708-41. Количество семенных коробочек на отдельном растении содержащих VdAL генетически модифицированных линий хлопчатника Р1-89, Р1-96, Р1-117, Р1-90, Р1-84, Р1-134, Р1-143, Р1-109, Р1-105, Р1-76, Р1-82, Р1-136, Р1-100, Р1-127, Р1-135, Р1-102, Р1-80, Р1-104, Р1-69, Р1-110 и Р1-111 было больше, чем количество семенных коробочек на отдельном растении высокоурожайной разновидности хлопчатника SCRC28. Количество семенных коробочек на отдельном растении некоторых линий (таких как Р1-96, Р1-117, Р1-82, Р1-100, Р1-127, Р1-102, Р1-80, Р1-104 и Р1-69) было больше, чем количество семенных коробочек на отдельном растении устойчивой к вертициллезному вилту разновидности хлопчатника GK44. Результаты показали, что VdAL по настоящему изобретению может усиливать устойчивость растения к вертициллезному вилту и уменьшать влияние вертициллезного вилта на урожай хлопка.
Пример 2
В этом примере было подтверждено, что белок VdAL, ассоциированный с устойчивостью к болезни, может усиливать устойчивость к болезни у Arabidopsis thaliana.
I. Конструирование генетически модифицированного Arabidopsis thaliana, содержащего VdAL
Процедура 1 Конструирование рекомбинантного вектора и рекомбинантного штамма
Молекула ДНК, представленная нуклеотидами 1-792 в SEQ ID NO: 2 в Перечне последовательностей, то есть ген VdAL, ассоциированный с устойчивостью к заболеванию, был синтезирован искусственно. Последовательность между сайтами распознавания Pst I и Kpn I вектора pCAMBIA1300-Super заменили молекулой ДНК, представленной нуклеотидами 1-792 в SEQ ID NO: 2 в Перечне последовательностей (то есть геном VdAL, ассоциированным с устойчивостью к болезнью), а другие последовательности pCAMBIA1300-Super оставили без изменений, с получением рекомбинантного вектора, названного pCAMBIA1300-Super-VdAL. Рекомбинантный вектор pCAMBIA1300-Super-VdAL экспрессирует белок, представленный в SEQ ID NO: 1 в Перечне последовательностей.
SEQ ID NO: 2 состоит из 864 нуклеотидов, кодирующих аминокислотную последовательность, представленную в SEQ ID NO: 1. Нуклеотиды 793-864 в SEQ ID NO: 2 кодируют FLAG, представленный аминокислотами 265-287 в SEQ ID NO: 1, а нуклеотиды 1-792 в SEQ ID NO: 2 кодируют белок, представленный аминокислотами 1-264 в SEQ ID NO: 1.
pCAMBIA1300-Super-VdAL вводили в Agrobacterium tumefaciens GV3101 с получением рекомбинантного штамма, который получил название А-pCAMBIAl 287-Super-VdAL.
pCAMBIA1300-Super вводили в Agrobacterium tumefaciens GV3101 с получением рекомбинантного штамма с пустым вектором, и полученный в результате рекомбинантный штамм получил название A-pCAMBIA1300-Super.
Процедура 2 Конструирование генетически модифицированного Arabidopsis thaliana, содержащего ген VdAL, ассоциированный с устойчивостью к болезни
На стадии (1) рекомбинантный штамм A-pCAMBIA1300-Super-VdAL из процедуры 1 сеяли штрихом на твердую среду YEB, содержащую канамицин в конечной концентрации 50 мкг/мл и рифампицин в конечной концентрации 50 мкг/мл, активировали и культивировали в течение 48 ч при 28°С с получением отдельных колоний.
На стадии (2) отдельную колонию, полученную на стадии (1), отбирали и инокулировали в 5 мл жидкой среды YEB, содержащей канамицин в конечной концентрации 50 мкг/мл и рифампицин в конечной концентрации 50 мкг/мл, и встряхивали в течение 12 ч при 28°С с получением бактериального раствора.
На стадии (3) 2 мл бактериального раствора, полученного на стадии (2), инокулировали в 500 мл жидкой среды YEB, содержащей канамицин в конечной концентрации 50 мкг/мл и рифампицин в конечной концентрации 50 мкг/мл, встряхивали на вибрационном столе при 28°С и культивировали до ОП600=0,8-1,0 с получением бактериального раствора.
На стадии (4) бактериальный раствор, полученный на стадии (3), центрифугировали при 4000 об./мин в течение 10 минут при комнатной температуре с получением бактериального осадка.
На стадии (5) бактериальный осадок, полученный на стадии (4), ресуспендировали в 200 мл 1/2 раствора MS, в который было добавлено 15 мкл Silwet-77, с последующим перемешиванием до гомогенного состояния с получением инфицирующего раствора Agrobacterium tumefaciens.
На стадии (6) соцветия Arabidopsis thaliana Col на стадии цветения на 30 сек погружали в инфицирующий раствор Agrobacterium tumefaciens, полученный на стадии (5), а затем вынимали и культивировали при комнатной температуре в течение 24 ч в темноте с получением инфицированного Arabidopsis thaliana.
На стадии (7) инфицированный Arabidopsis thaliana, полученный на стадии (6), культивировали при комнатной температуре в течение 24 ч при слабом освещении, а затем культивировали при 22°С с циклом чередования света и темноты 16 часов освещения/8 часов темноты. Такое растение представляло собой генетически модифицированное растение генерации Т0. Генетически модифицированное растение размножали до генерации Т3 (путем самоопыления в каждой генерации). Проводили скрининг каждой генерации с гигромицином с получением линий 2 и 3 генетически модифицированного Arabidopsis thaliana, содержащего VdAL, генерации T3 (см. А на Фиг. 3).
На стадии (8) на геномном уровне идентифицировали ген VdAL у линий 2 и 3 генетически модифицированного Arabidopsis thaliana, содержащего VdAL, генерации Т3, полученного на стадии (7). Arabidopsis thaliana Col использовали в качестве образца дикого типа с парой праймеров ATGCTTTCTCTCCAGACCGCAGC и TAGCGCAGTTACGATCAGGGTCG. Результаты показали, что продукты ПЦР обеих линий 2 и 3 демонстрируют целевые полосы размером 403 п. н., что указывает на то, что обе линии 2 и 3 имеют ген VdAL.
На стадии (9) методом полуколичественной ПЦР определяли экспрессию гена VdAL у линий 2 и 3 генетически модифицированного Arabidopsis thaliana, содержащего VdAL, генерации Т3, полученного на стадии (7). Arabidopsis thaliana Col использовали в качестве образца дикого типа с парой праймеров GCAACATCACCCTTCGTACT и CAGACTGGTTGCCGAAGAA. UBQ использовали в качестве внутреннего стандарта с парой праймеров CCCTGGCTGATTACATC и TGGTGTCAGTGGGTTCAATG (см. Б на Фиг. 3). Результаты показали, что продукты ПЦР обеих линий 2 и 3 имеют целевые полосы, что указывает на то, что обе линии 2 и 3 экспрессируют ген VdAL.
На стадии (10) методом вестерн-блоттинга определяли экспрессию гена VdAL у линий 2 и 3 генетически модифицированного Arabidopsis thaliana, содержащего VdAL, генерации Т3, полученного на стадии (7). Arabidopsis thaliana Col использовали в качестве образца дикого типа. Использовали антитело-flag (Cat. No. АВ003-01А, продукт Shanghai Nearshore Technology Co. LTD/Sinobio Biotech Co., Ltd.). Белок метили раствором красителя Понсо S и корректировали его загружаемое количество таким образом, чтобы обеспечить одинаковое количество белка на разных треках. Результаты показаны на Фиг. 4. Результаты показали, что обе линии 2 и 3 экспрессировали белок VdAL.
A-pCAMBIA1300-Super-VdAL заменяли на A-pCAMBIA1300-Super в соответствии со стадиями (1)-(7), а другие стадии оставляли без изменений. Получали генетически модифицированный Arabidopsis thaliana с пустым вектором, и обозначали его как "генетически модифицированный Arabidopsis thaliana, содержащий пустой вектор".
II. Определение устойчивости к болезни генетически модифицированного Arabidopsis thaliana, содержащего VdAL
Генетически модифицированный Arabidopsis thaliana, содержащий VdAL, инокулировали Verticillium dahliae и оценивали устойчивость растения к болезни с помощью индекса вертициллезного вилта растения. Эксперимент повторяли три раза, каждый раз включая следующие конкретные стадии.
Споры Verticillium dahliae ресуспендировали в стерильной дистиллированной воде с получением суспензии спор с концентрацией 1×106 К.О.Е/мл. Линию 2 генетически модифицированного Arabidopsis thaliana, содержащего VdAL, полученную на стадии (1), вымачивали в суспензии спор в течение 30 сек и затем культивировали при 22°С с циклом чередования света и темноты 16 часов освещения/8 часов темноты в течение 21 суток с получением обработанной линии 2, всего 30 растений.
Линию 2 генетически модифицированного Arabidopsis thaliana, содержащего VdAL, со стадии (1), заменяли на линию 3 генетически модифицированного Arabidopsis thaliana, содержащего VdAL, со стадии (1), Col, и генетически модифицированный Arabidopsis thaliana, содержащий пустой вектор, полученный на стадии (1), соответственно, а другие стадии оставляли без изменений, с получением линии 3, обработанной Col, и обработанного генетически модифицированного Arabidopsis thaliana, содержащего пустой вектор, соответственно.
Штамм 2 генетически модифицированного Arabidopsis thaliana, содержащего VdAL со стадии (1), заменяли на Col, контроль, не являющийся генетически модифицированным, и суспензию спор заменяли на стерильную дистиллированную воду, другие стадии оставляя без изменений, для получения контрольной линии, Col, погруженного в воду.
Индексы болезни (см. В и Г на Фиг. 3) обработанной линии 2, обработанной линии 3, обработанного Col, обработанного генетически модифицированного Arabidopsis thaliana, содержащего пустой вектор, и эталонного Col, погруженного в воду, рассчитывали согласно следующим критериям, соответственно:
Степень 0: отсутствуют заболевшие листья;
Степень I: 0,1% - 25% заболевших листьев;
Степень II: 25% (не включая) - 50% заболевших листьев;
Степень III: 50% (не включая) - 75% заболевших листьев; и
Уровень IV: более чем 75% заболевших листьев.
Индексы болезни рассчитывали в соответствии со следующей формулой: индекс болезни = [Σ степеней болезни × количество растений / (общее количество растений × самая высокая степень болезни)] × 100.
Результаты показали, что не было значительных различий в показателях индекса болезни между Col и генетически модифицированным Arabidopsis thaliana, содержащим пустой вектор. Индекс болезни Col составлял 95±2,6; индекс болезни линии 2 составлял 76±1,6, 80% от индекса для Col; индекс болезни линии 3 составлял 74±5,4, 78% от индекса для Col; и индекс болезни эталонного Col, погруженного в воду, составлял 0. Индексы болезни как линии 2, так и линии 3 были значительно ниже, чем индекс болезни Col. Результаты показали, что VdAL может усиливать устойчивость растения к вертициллезному вилту.
Промышленная применимость
Эксперименты показали, что VdAL (белок, ассоциированный с устойчивостью к болезни) и кодирующий его ген могут усиливать способность растения сопротивляться вертициллезному вилту. Каждый из индексов вертициллезного вилта генетически модифицированных линий хлопчатника, содержащих VdAL, был ниже, чем индекс вертициллезного вилта разновидности хлопчатника sGK9708-41 дикого типа, а также ниже, чем индекс вертициллезного вилта высокоурожайной разновидности хлопчатника SCRC28. Каждый из индексов вертициллезного вилта генетически модифицированного хлопчатника линий Р1-89, Р1-96, Р1-117, Р1-90, Р1-84 и Р1-134, содержащих VdAL, был даже ниже, чем индекс вертициллезного вилта устойчивой к вертициллезному вилту разновидности хлопчатника GK44. Каждый из относительных контролирующих эффектов генетически модифицированных линий хлопчатника, содержащих VdAL, был выше, чем относительный контролирующий эффект разновидности хлопчатника sGK9708-41 дикого типа, а также выше, чем относительный контролирующий эффект высокоурожайной разновидности хлопчатника SCRC28. Каждый из относительных контролирующих эффектов генетически модифицированных линий хлопчатника Р1-89, Р1-96, Р1-117, Р1-90, Р1-84 и Р1-134, содержащих VdAL, составлял более 80%, что больше, чем даже относительный контролирующий эффект устойчивой к вертициллезному вилту разновидности хлопчатника GK44.
VdAL (белок, ассоциированный с устойчивостью к болезни) и кодирующий его ген по настоящему изобретению могут усиливать способность растения сопротивляться вертициллезному вилту и уменьшать действие вертициллезного вилта на урожай хлопка. Количество семенных коробочек, завязавшихся на каждом отдельном растении линий генетически модифицированного хлопчатника, содержащих VdAL, было больше, чем количество семенных коробочек, завязавшихся на отдельном растении разновидности хлопчатника sGK9708-41 дикого типа. Также количество семенных коробочек, завязавшихся на каждом отдельном растении генетически модифицированного хлопчатника линий Р1-89, Р1-96, Р1-117, Р1-90, Р1-84, Р1-134, Р1-143, Р1-109, Р1-105, Р1-76, Р1-82, Р1-136, Р1-100, Р1-127, Р1-135, Р1-102, Р1-80, Р1-104, Р1-69, Р1-110 и Р1-111, содержащих VdAL, было больше, чем количество семенных коробочек, завязавшихся на отдельном растении высокоурожайной разновидности хлопчатника SCRC28. Количество семенных коробочек, завязавшихся на каждом отдельном растении генетически модифицированного хлопчатника линий Р1-96, Р1-117, Р1-82, Р1-100, Р1-127, Р1-102, Р1-80, Р1-104 и Р1-69, содержащих VdAL, было даже больше, чем количество семенных коробочек, завязавшихся на отдельном растении устойчивой к вертициллезному вилту разновидности хлопчатника GK44.
Эти эксперименты показали, что VdAL (белок, ассоциированный с устойчивостью к болезни) и кодирующий его ген по настоящему изобретению можно использовать для усиления устойчивости растения к болезни.
| название | год | авторы | номер документа |
|---|---|---|---|
| БЕЛКИ, СВЯЗАННЫЕ С ФОРМОЙ ЗЕРЕН И ЛИСТЬЕВ РИСА, ГЕНЫ, КОДИРУЮЩИЕ УКАЗАННЫЕ БЕЛКИ, И ИХ ПРИМЕНЕНИЯ | 2010 |
|
RU2553206C2 |
| ГЕН, ОБУСЛОВЛИВАЮЩИЙ УСТОЙЧИВОСТЬ РАСТЕНИЙ К БОЛЕЗНЯМ, И ЕГО ПРИМЕНЕНИЕ | 1997 |
|
RU2252960C2 |
| СПОСОБ ПОВЫШЕНИЯ УСТОЙЧИВОСТИ ИЛИ ТОЛЕРАНТНОСТИ К НЕМАТОДАМ РАСТЕНИЯ И ЕГО ПОТОМСТВА, КОНСТРУКЦИЯ ДНК, КОДИРУЕМЫЙ ЕЮ СЛИТЫЙ ПРОТЕИН, ПОВЫШАЮЩИЙ УСТОЙЧИВОСТЬ К НЕМАТОДАМ РАСТЕНИЯ И ЕГО ПОТОМСТВА | 1998 |
|
RU2230787C2 |
| НОВЫЕ ГЕНЫ РАСТЕНИЙ И ИХ ПРИМЕНЕНИЕ | 2000 |
|
RU2241749C2 |
| Белок устойчивости к гербицидам, кодирующий его ген и их применение | 2016 |
|
RU2692553C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЛИПИДОВ | 2012 |
|
RU2656996C2 |
| Белок устойчивости к гербицидам, кодирующие его гены и их применение | 2016 |
|
RU2681162C1 |
| Способы получения липидов | 2011 |
|
RU2636344C2 |
| ЭНХАНСЕР ПАЛОЧКОВИДНОГО ВИРУСА САХАРНОГО ТРОСТНИКА (SCBV) И ЕГО ПРИМЕНЕНИЕ В ФУНКЦИОНАЛЬНОЙ ГЕНОМИКЕ РАСТЕНИЙ | 2013 |
|
RU2639517C2 |
| РЕГУЛИРУЮЩИЙ ВЫСОТУ РАСТЕНИЙ ГЕН И ЕГО ПРИМЕНЕНИЯ | 2008 |
|
RU2458132C2 |



Изобретение относится к области биохимии, в частности к белку, способному усиливать устойчивость растения к вертициллезному вилту, а также молекуле нуклеиновой кислоты, его кодирующей. Также раскрыты рекомбинантный вектор экспрессии, рекомбинантный микроорганизм, генетически модифицированная линия растительных клеток, генетически модифицированный каллус, генетически модифицированное семя растения, генетически модифицированное растение, содержащие вышеуказанную молекулу нуклеиновой кислоты. Изобретение также относится к способу культивирования генетически модифицированного растения, устойчивого к вертициллезному вилту, включающему стадию введения гена, кодирующего вышеуказанный белок. Изобретение позволяет эффективно усиливать устойчивость растения к вертициллезному вилту. 11 н. и 14 з.п. ф-лы, 5 ил., 3 табл., 2 пр.
1. Белок, способный усиливать устойчивость растения к вертициллезному вилту, представленный:
а) аминокислотной последовательностью, представленной аминокислотами 1-264 в SEQ ID NO: 1, или
б) аминокислотной последовательностью, представленной в SEQ ID NO: 1, возможно содержащей по ее амино-концу или карбокси-концу метку (tag), выбранную из RRRRR (Poly-Arg), НННННН (Poly-His), DYKDDDDK (FLAG), WSHPQFEK (Strep-tag II) или EQKLISEEDL (c-myc).
2. Молекула нуклеиновой кислоты, кодирующая белок по п. 1, представленная:
1) молекулой кДНК или ДНК, имеющей нуклеотидную последовательность, представленную нуклеотидами 1-792 в SEQ ID NO: 2;
2) молекулой кДНК или ДНК, которая гибридизуется в строгих условиях с нуклеотидной последовательностью, определенной в (1), и кодирует белок по п. 1;
3) молекулой кДНК или ДНК, имеющей нуклеотидную последовательность, представленную в SEQ ID NO: 2; или
4) молекулой кДНК или ДНК, которая гибридизуется в строгих условиях с нуклеотидной последовательностью, определенной в (3), и кодирует белок по п. 1.
3. Рекомбинантный вектор экспрессии, содержащий молекулу нуклеиновой кислоты по п. 2.
4. Рекомбинантный микроорганизм для экспрессии белка, способного усиливать устойчивость растения к вертициллезному вилту, содержащий молекулу нуклеиновой кислоты по п. 2 или рекомбинантный вектор экспрессии по п. 3.
5. Рекомбинантный микроорганизм по п. 4, представляющий собой дрожжи, бактерии, водоросли или грибы.
6. Рекомбинантный микроорганизм по п. 4, представляющий собой Agrobacterium tumefaciens.
7. Генетически модифицированная линия растительных клеток для экспрессии белка, способного усиливать устойчивость растения к вертициллезному вилту, клетки которой содержат молекулу нуклеиновой кислоты по п. 2 или рекомбинантный вектор экспрессии по п. 3.
8. Генетически модифицированная линия растительных клеток по п. 7, представляющая собой линию клеток Gossypium или линию клеток Arabidopsis.
9. Генетически модифицированная линия растительных клеток по п. 7, представляющая собой линию клеток хлопчатника или линию клеток Arabidopsis thaliana.
10. Генетически модифицированный каллус растения, который экспрессирует белок, способный усиливать устойчивость растения к вертициллезному вилту, содержащий молекулу нуклеиновой кислоты по п. 2 или рекомбинантный вектор экспрессии по п. 3.
11. Генетически модифицированный каллус растения по п. 10, представляющий собой каллус Gossypium или каллус Arabidopsis.
12. Генетически модифицированный каллус растения по п. 11, представляющий собой каллус хлопчатника или каллус Arabidopsis thaliana.
13. Генетически модифицированное семя растения, устойчивое к вертициллезному вилту, содержащее молекулу нуклеиновой кислоты по п. 2 или рекомбинантный вектор экспрессии по п. 3.
14. Генетически модифицированное семя растения по п. 13, представляющее собой семя Gossypium или семя Arabidopsis.
15. Генетически модифицированное семя растения по п. 13, представляющее собой семя хлопчатника или семя Arabidopsis thaliana.
16. Генетически модифицированное растение, устойчивое к вертициллезному вилту, содержащее молекулу нуклеиновой кислоты по п. 2 или рекомбинантный вектор экспрессии по п. 3.
17. Генетически модифицированное растение по п. 16, представляющее собой Gossypium или Arabidopsis.
18. Генетически модифицированное растение по п. 16, представляющее собой хлопчатник или Arabidopsis thaliana.
19. Применение белка по п. 1 в усилении устойчивости растения к вертициллезному вилту.
20. Применение белка по п. 1 в культивировании генетически модифицированного растения, устойчивого к вертициллезному вилту.
21. Применение по п. 19 или 20, где растение представляет собой двудольное или однодольное растение.
22. Способ культивирования генетически модифицированного растения, устойчивого к вертициллезному вилту, включающий стадию введения гена, кодирующего белок по п. 1, в растение-реципиент с получением устойчивого к указанной болезни генетически модифицированного растения, обладающего более высокой устойчивостью к болезни, чем растение-реципиент.
23. Способ по п. 22, где ген, кодирующий белок по п. 1, представляет собой молекулу ДНК, имеющую кодирующую последовательность, представленную нуклеотидами 1-792 в SEQ ID NO: 2.
24. Способ по п. 22, где растение представляет собой двудольное растение или однодольное растение.
25. Способ по п. 22, где ген, кодирующий белок по п. 1, представляет собой молекулу ДНК, имеющую кодирующую последовательность, представленную нуклеотидами 1-792 в SEQ ID NO: 2, и растение представляет собой двудольное растение или однодольное растение.
| WANG JY et al., VdNEP, an elicitor from Verticillium dahliae, induces cotton plant wilting, Appl Environ Microbiol, 2004, Vol.70, N.8, 4989-4995 | |||
| WANG B | |||
| et al., The purification and characterization of a novel hypersensitive-like response-inducing elicitor from Verticillium dahliae that induces resistance responses in tobacco, Appl Microbiol Biotechnol, 2012, Vol.93, N.1, pp.191-201 | |||
| СПОСОБ БОРЬБЫ С ВИЛТОМ ХЛОПЧАТНИКА | 1991 |
|
RU2025976C1 |
Авторы
Даты
2019-04-11—Публикация
2016-01-04—Подача