Настоящее изобретение было сделано при поддержке правительства согласно договору № W-7405-ENG-36, подтверждающему поддержку, оказываемую Министерством энергетики США руководству Калифорнийского университета, и согласно договору № DE-AC52-06NA25396, подтверждающему поддержку, оказываемую Министерством энергетики США службе Los Alamos National Security, LLC. Правительство имеет определенные права на настоящее изобретение.
Родственные заявки
Настоящая заявка заявляет приоритет предварительной заявки на патент США №61/190,520, поданной 29 августа 2008 г.
Уровень техники
Так как население земли растет, а пригодные сельскохозяйственные земельные участки продолжают подвергаться разрушению или иным повреждениям, необходимость в более эффективных и рациональных сельскохозяйственных системах является одной из первостепенных проблем, стоящих перед человеческой расой. Повышение урожайности, содержания белка и скорости роста растений представляют собой основные задачи, которые надлежит решить в процессе развития сельскохозяйственных систем, которые могут более эффективно способствовать решению поставленной проблемы.
За последние годы необходимость в улучшенных технологиях производства сельскохозяйственных культур только возросла, так как урожайность в случае многих хорошо развитых сельскохозяйственных культур имеет склонность к уменьшению. Многие сельскохозяйственные показатели зависят от времени, причем затраты и доход зависят от скорости оборота сельскохозяйственных культур или от срока вывода продукта на рынок. Поэтому, быстрый рост растения представляет собой экономически важную задачу для многих отраслей сельскохозяйственной деятельности, связанных с ценными зерновыми культурами, овощами, ягодами и другими фруктами.
Генная инженерия играла и продолжает играть все более и более важную, однако, все еще спорную роль в развитии рациональных сельскохозяйственных технологий. Большое число генно-модифицированных растений и связанных с ними технологий уже было разработано за последние годы, многие из которых уже широко применяются в настоящее время (Factsheet: Genetically Modified Crops in the United States, Pew Initiative on Food and Biotechnology, August 2004, (pewagbiotech.org/resources/factsheets)). Распространение трансгенных сортов растений является сегодня весьма значительным и сильно возросло, по сравнению с 2006 годом, когда количество акров земли, засеянной трансгенными растениями, составляло около 250 миллионов.
В то время как технологии получения трансгенных растений постепенно распространяются, особенно в США, Канаде и Австралии, во многих областях мира, особенно в Европе, внедрение генно-модифицированных растений происходит очень медленно. Поэтому, согласно целям развития рационального и эффективного сельского хозяйства, существует заинтересованность в развитие генно-модифицированных растений, которые позволяют избежать проблем, связанных с введением токсинов и других потенциально опасных веществ в растения и/или окружающую среду. Существует также заинтересованность в минимизации затрат на решение необходимых задач, таких как повышение толерантности к гербицидам, устойчивости к пестицидам и заболеваниям, и повышение общего получаемого урожая. Соответственно существует необходимость в трансгенных растениях, которые могут удовлетворять указанным требованиям.
Цель, связанная с быстрым ростом растений, была достигнута посредством многочисленных исследований различных регулирующих рост систем, многие из которых остаются до конца не изученными. В частности, регуляторные механизмы растения, которые координируют метаболизм углерода и азота, все еще не до конца ясны. Предполагается, что эти регуляторные механизмы оказывают фундаментальное влияние на рост и развитие растения.
Метаболизм углерода и азота в фотосинтезирующих организмах должен регулироваться координирующим образом для обеспечения эффективного применения ресурсов растения и энергии. В настоящее время известны подробности некоторых стадий метаболизма углерода и азота и метаболические пути, которые представляют собой подсистемы более больших систем. В фотосинтезирующих организмах метаболизм углерода начинается с фиксации CO2, которая происходит посредством двух больших процессов, названных как С-3 и С-4 метаболизм. В растениях с С-3 метаболизмом, фермент рибулозобисфосфаткарбоксилаза (RuBisCo) катализирует объединение CO2 с рибулозобисфосфатом с получением 3-фосфоглицерата, трехуглеродного соединения (С-3), которое применяется растением для синтеза содержащих углерод соединений. В растениях с С-4 метаболизмом, CO2 объединяется с фосфоенолпируватом, с образованием кислот, содержащих четыре углерода (С-4), в ходе реакции, катализируемой фосфоенолпируваткарбоксилазой. Кислоты переносятся к клеткам обкладки сосудистых пучков, где они декарбоксилируются с выделением CO2, который затем объединяется с рибулозобисфосфатом посредством той же самой реакции, которая применяется в С-3 растениях.
В ходе многочисленных исследований было обнаружено, что различные метаболиты важны при регуляции метаболизма азота в растениях. Эти соединения включают малат органической кислоты, а также аминокислоты глутамин и глутаминовая кислота. Азот ассимилируется фотосинтезирующими организмами через действие фермента глутаминсинтетаза (GS), который катализирует объединение аммиака с глутаминовой кислотой, с образованием глутамина. GS играет ключевую роль в ассимиляции азота в растениях, путем катализа связывания аммиака с глутаминовой кислотой, с образованием глутамина в ходе АТФ-зависимой реакции (Miflin and Habash, 2002, Journal of Experimental Botany, Vol.53, No. 370, pp.979-987). GS также реассимилирует аммиак, высвободившийся в результате фотореспирации и распада белков и соединений, несущих азот. GS ферменты можно разделить на два общих класса, одни из которых представлен цитоплазматической формой (GS1) и другой пластидной (то есть, хлоропластной) формой (GS2).
Предшествующая работа показала, что повышенные уровни экспрессии GS1 приводят к повышенным уровням активности GS и повышенному росту растения, хотя отчеты противоречивы. Например, Fuentes et al. сообщил, что управляемая промотором CaMV S35 сверхэкспрессия Alfalfa GS1 (цитоплазматическая форма) в растениях табака, приводила к повышенным уровням экспрессии GS и активности GS в листовой ткани, повышенному росту при азотном голодании, но не оказывала влияния на рост при оптимальных условиях удобрения азотом (Fuentes et al., 2001, J. Exp. Botany 52: 1071-81). Temple et al. сообщили, что трансгенные растения табака, сверхэкспрессирующие кодирующую последовательность Alfalfa GS1 полной длины, обладали значительно повышенными уровнями GS транскрипта и GS полипептида, которые объединялись в активный фермент, но ни о каком фенотипическом влиянии на рост не сообщалось (Temple et al., 1993, Molecular and General Genetics 236: 315-325). Corruzi et al. сообщили, что трансгенные растения табака, сверхэкспрессирующие трансген цитозольной GS1 гороха под контролем CaMV S35 промотора, показали повышенную активность GS, повышенные уровни белка цитозольной GS и улучшенные характеристики роста (патент США №6,107,547). Unkefer et al. совсем недавно сообщили, что трансгенные растения табака, сверэкспрессирующие Alfalfa GS1 в листовых тканях, которые были исследованы на предмет повышенной «от листа к корню» активности GS после генетического расщепления путем самоопыления, с достижением увеличенного числа копий трансгена GS1, как было обнаружено, продуцируют повышенные уровни 2-гидрокси-5-оксопролина в их листовых частях, что, как обнаружили, приводит к заметно повышенным скоростям роста, по сравнению с растениями табака дикого типа (смотрите патенты США №6,555,500, 6,593,275 и 6,831,040).
Unkefer et al. обнаружили, что применение 2-гидрокси-5-оксопролина (также известного как 2-оксоглутарамат) улучшает рост растений (Патенты США №6,555,500; 6,593,275; 6,831,040). В частности, Unkefer et al. обнаружили, что повышенные концентрации 2-гидрокси-5-оксопролина в листовых тканях (относительно корневых тканей) запускает каскад событий, которые приводят к улучшенным характеристикам роста растений. Unkefer et al. описали способы, посредством которых концентрация 2-гидрокси-5-оксопролина в листовых частях может быть увеличена, для того чтобы запустить события, приводящие к улучшенным характеристикам роста растений, особенно, путем нанесения раствора 2-гидрокси-5-оксопролина непосредственно на листовые части растения и сверхэкспрессии глутаминсинтетазы непосредственно в тканях листьев.
Ферменты трансаминазы и гидролиазы, как известно, участвующих в синтезе 2-гидрокси-5-оксопролина в организме животных, были обнаружены в тканях печени и почек животных (Cooper and Meister, 1977, CRC Critical Reviews in Biochemistry, pages 281-303; Meister, 1952, J. Biochem. 197: 304). В растениях биохимический синтез 2-гидрокси-5-оксопролина уже известен, но плохо описан. Более того, функция 2-гидрокси-5-оксопролина в растениях и значение размера его залежей (концентрации в ткани) неизвестны. Наконец, из уровня техники нельзя получить никакие конкретные данные в отношении того, что трансаминаза(ы) или гидролаза(ы) могут существовать и/или быть активны при катализе синтеза 2-гидрокси-5-оксопролина в растениях, и из уровня техники нельзя получить сведения ни о каких выделенных или описанных трансаминазах растений.
Сущность изобретения
Настоящее изобретение относится к трансгенным растениям, показывающим существенно повышенные скорости роста, более высокий урожай семян и плодов/стручков, более раннее или более продуктивное цветение, более эффективную утилизацию азота, повышенную толерантности к высокосолевым условиям и увеличенный выход биомассы. В одном варианте выполнения настоящего изобретения, трансгенные растения модифицированы таким образом, что обеспечивается сверхэкспрессия как глутамин-фенилпируват-трансаминазы (GPT), так и глутаминсинтетазы (GS). GPT+GS дважды трансгенные растения по настоящему изобретению проявляют улучшенные характеристики роста, причем линии ТО генерации показывают увеличение биомассы по сравнению с аналогами дикого типа от 50% до 300%. Генерации, полученные путем полового скрещивания и/или самоопыления, как правило, обладают даже лучшими характеристиками, причем некоторые дважды трансгенные растения достигают поразительного четырехкратного увеличения биомассы по сравнению с растениями дикого типа. Подобным образом, урожай цветков и плодов или стручков также значительно улучшается, причем линии ТО поколения, как правило, показывают увеличение 50%-70%, по сравнению с аналогами дикого типа, а в некоторых случаях достигается увеличение 100%. Трансгенные растения, проявляющие такие улучшенные фенотипические характеристики роста, были успешно генерированы через спектр отдельных видов растений, с применением различных методик трансформации, различных экспрессионных векторов и промоторов, и гетерологичных и гомологичных трансгенных последовательностей из различных видов, в настоящем документе многочисленные примеры приводятся. Настоящее изобретение, таким образом, раскрывает фундаментальную революционную методику, посредством которой можно оказать положительное влияние на развитие практически всех областей сельского хозяйства.
Заявители обнаружили, что фермент глутамин-фенилпируват-трансаминаза (GPT) является катализатором синтеза 2-гидрокси-6-оксопролина (2-оксоглутарамата) в растениях. 2-Оксоглутарамат являются мощным сигнальным метаболитом, который регулирует функции большого числа генов, вовлеченных в аппарат фотосинтеза, участвующих в фиксации углерода и метаболизме азота. В настоящем изобретении раскрываются выделенные молекулы нуклеиновой кислоты, кодирующие GPT, и впервые заявляется, что кодируемый фермент непосредственно участвует в синтезе 2-гидрокси-5-оксопролина. Этот объект настоящего изобретения описывается через раскрытие GPT полинуклеотидов, кодирующих GPT нескольких видов, включая Arabidopsis, Виноград, Рис, Сою, Ячмень, Бамбук и нерастительный гомолог из Полосатой Перцины, большая часть которых экспрессируется в виде рекомбинантных GPT и, как подтверждается, обладает GPT активностью.
Настоящее изобретение, кроме того, раскрывает трансгенные растения, которые экспрессируют как GPT трансген, так и GS трансген. Экспрессия этих двух трансгенов в таких "дважды трансгенных" растениях приводит к значительно повышенной скорости фиксации диоксида углерода и к эффекту чрезвычайно усиленного роста, так как эти растения показывают очень значительные и даже потрясающе увеличенные скорости роста и урожаи цветов/плодов/стручков/семян. Также обеспечиваются способы получения таких трансгенных растений с усиленным ростом.
Путем предпочтительно увеличения концентрации сигнального метаболита 2-оксоглутарамата (то есть, в листовых тканях), трансгенные растения по настоящему изобретению способны производить более высокий урожай за более короткие периоды времени, и поэтому возможно обеспечить в сельскохозяйственной промышленности повышенную продуктивность для широкого ряда сельскохозяйственных культур. Важно отметить, что в отличие от многочисленных трансгенных растений, описанных на сегодняшний день, согласно настоящему изобретению применяются природные растительные гены, кодирующие природный растительный фермент. Улучшенные характеристики роста трансгенных растений по настоящему изобретению достигаются, по существу, путем введения дополнительной GPT и GS ферментативной способности в растения. Таким образом, трансгенные растения по настоящему изобретению не экспрессируют какие-либо токсические вещества, гормоны роста, продукты вирусных или бактериальных генов и, таким образом, свободны от многого из того, что ранее препятствовало одобрению трансгенных растений в некоторых частях мира.
В одном варианте выполнения настоящего изобретения, настоящее изобретение обеспечивает трансгенное растение, содержащее GPT трансген и GS трансген, где указанный GPT трансген и указанный GS трансген операбельно связано с растительным промотором. В конкретном варианте выполнения настоящего изобретения, GS трансген представляет собой GS1 трансген. В другом конкретном варианте выполнения настоящего изобретения, GPT трансген кодирует полипептид, имеющий аминокислотную последовательность, выбранную из группы, состоящей из (a) SEQ ID NO:2; SEQ ID NO:9; SEQ ID NO:15, SEQ ID NO:19, SEQ ID NO:21, SEQ ID NO 24, SEQ ID NO:30, SEQ ID NO:31, SEQ ID NO:32, SEQ ID NO:33, SEQ ID NO:34, SEQ ID NO:35 и SEQ ID NO:36, и (b) аминокислотной последовательности, которая, по меньшей мере, на 75% идентична аминокислотной последовательности SEQ ID NO:2; SEQ ID NO:9; SEQ ID NO:15, SEQ ID NO:19, SEQ ID NO:21, SEQ ID NO 24, SEQ ID NO:30, SEQ ID NO:31, SEQ ID NO:32, SEQ ID NO:33, SEQ ID NO:34, SEQ ID NO:35 и SEQ ID NO:36 и имеет GPT активность. В другом конкретном варианте выполнения настоящего изобретения, GS трансген кодирует полипептид, имеющий аминокислотную последовательность, выбранную из группы, состоящей из (a) SEQ ID NO:4 и SEQ ID NO:7 из остатка 11, и (b) аминокислотной последовательности, которая, по меньшей мере, на 75% идентична SEQ ID NO:4 или SEQ ID NO:7. В некоторых вариантах выполнения настоящего изобретения, трансгены GPT и GS включаются в геном растения. Трансгенное растение по настоящему изобретению может быть односемядольным или двудольным растением
Настоящее изобретение также заявляет потомство любой генерации трансгенных растений по настоящему изобретению, где указанное потомство содержит GPT трансген и GS трансген, а также семена любой генерации трансгенных растений по настоящему изобретению, где указанные семена содержат указанный GPT трансген и указанный GS трансген. Трансгенные растения по настоящему изобретению могут проявлять одну или более улучшенных характеристик скорости роста, по сравнению с аналогами дикого типа или нетрансформированными растениями, включая, но без ограничения к этому, повышенную скорость роста, увеличенный выход биомассы, увеличенный урожай семян, урожай цветков или бутонов, урожай плодов или стручков, листья большего размера, и многие также проявляют повышенные уровни GPT и/или GS активности, и/или повышенные уровни 2-оксоглутарамата. В некоторых вариантах выполнения настоящего изобретения, трансгенные растения по настоящему изобретению показывают повышенную эффективность использования азота или повышенную толерантность к засоленной почве или солевым условиям.
Способы получения трансгенных растений по настоящему изобретению и их семян также раскрываются в настоящем изобретении, включая способы получения растений, обладающих свойствами усиленного роста, увеличенной эффективности использования азота и повышенной толерантности к прорастанию или росту в засоленной почве или солевых условиях, относительно аналогов дикого типа или нетрансформированных растений.
Краткое описание чертежей
Материалы патента или заявки на патент содержат, по меньшей мере, один чертеж, выполненный в цвете. Копии патента или публикации заявки на патент с цветным чертежом (чертежами) будут предоставлены в случае требования и оплаты необходимой пошлины.
На ФИГ.1. показана ассимиляция азота и биосинтез 2-оксоглутарамата, приведена схема метаболического пути.
На ФИГ.2. приведена фотография, показывающая сравнение трансгенных растений табака, сверхэкспрессирующих либо GS1, либо GPT, по сравнению с растением табака дикого типа. Слева на право: растение дикого типа, Alfalfa GS1 трансген, Arabidopsis GPT трансген. Смотрите примеры 3 и 5, приведенные ниже.
На ФИГ.3. приведена фотография, показывающая сравнение трансгенных растений томата Micro-Tom, сверхэкспрессирующих либо GS1, либо GPT, по сравнению с растением томата дикого типа. Слева на право: растение дикого типа, Alfalfa GS1 трансген, Arabidopsis GPT трансген. Смотрите примеры 4 и 6, приведенные ниже.
На ФИГ.4. приведены фотографии, показывающие сравнение размеров листа для дикого типа и GS1 или GPT трансгенных растений табака. А: Сравнение листьев GS1 трансгенного табака (базальный лист) и дикого типа (верхний лист). В: Сравнение листьев GPT трансгенного табака (базальный лист) и дикого типа (верхний лист).
На ФИГ.5. приведены фотографии, показывающие сравнение трансгенных растений табака, полученных в результате различных скрещиваний между GS1 и GPT трансгенными линиями табака, с диким типом и однократно трансгенными растениями. А-С: Кросс 2, 3 и 7, соответственно. Смотрите пример 7 ниже.
На ФИГ.6. приведены фотографии, показывающие сравнение размеров листьев растения дикого типа и кроссов между GS1 и GPT трансгенными растениями табака. А: Сравнение листьев GSXGPT Кросса 3 (базальный лист) и дикого типа (верхний лист). В: Сравнение листьев GSXGPT Кросса 7 (базальный лист) и дикого типа (верхний лист). Смотрите пример 7 ниже.
На ФИГ.7. приведена фотография трансгенного растения перца (справа) и контрольного растения перца дикого типа (слева), показывающая больший выход плодов перца в случае трансгенного растения по сравнению с контрольным растением дикого типа. Смотрите пример 8 ниже.
На ФИГ.8. приведено сравнение трансгенных растений фасоли (несколько трансгенных линий, экспрессирующих Arabidopsis GPT и GS трансгены) и контрольных растений фасоли дикого типа. Вверху слева: высота растения в различные дни; Вверху справа: число бутонов; Внизу слева: число цветков; Внизу справа: число бобовых стручков. Дикий тип является контролем, и 2А, 4А и 5В представляют собой линии трансгенных растений. Смотрите пример 9 ниже.
На ФИГ.9. Приведена фотография трансгенного растения фасоли (справа) и контрольного растения фасоли дикого типа (слева), показывающая усиленный рост трансгенного растения относительно контрольного растения дикого типа. Трансгенная линия, экспрессирующая трансгены Arabidopsis GPT и GS. Смотрите пример 9 ниже.
ФИГ.10. Бутоны, цветки и стручки трансгенных растений фасоли по сравнению с контрольными растениями фасоли дикого типа (трансгенная линия, экспрессирующая трансгены винограда GPT и Arabidopsis GS). Смотрите пример 10 ниже.
ФИГ.11. Фотография трансгенного растения фасоли (справа) и контрольного растения фасоли дикого типа (слева), демонстрирующая усиленный рост трансгенного растения по сравнению с контрольным растением дикого типа. Трансгенная линия экспрессирует трансгены винограда GPT и Arabidopsis GS. Смотрите пример 10 ниже.
На ФИГ.12. Приведены трансгенные растения Вигны линии А по сравнению с контрольными растениями Вигны дикого типа (трансгенная линия, экспрессирующая трансгены Arabidopsis GPT и GS), видно, что трансгенные растения растут быстрее, и цветки и стручки образуются быстрее по сравнению с контрольными растениями дикого типа. (А) Измерения относительной высоты и длины листьев на 21 мая, (В) Относительное число трехлистных листов и бутонов на 28 июня, (С) Относительное число цветков, бутонов и стручков на 22 июня. Смотрите пример 11 ниже.
ФИГ.13. Фотография трансгенного растения Вигны линии А (справа) и контрольного растения Вигны дикого типа (слева), показывающая повышенный рост трансгенного растения по сравнению с контрольным растением дикого типа. Трансгенная линия, экспрессирующая трансгены Arabidopsis GPT и GS. Смотрите пример 11 ниже.
ФИГ.14. Трансгенные растения Вигны линии G по сравнению с контрольными растениями Вигны дикого типа (трансгенная линия, экспрессирующая трансген GPT из винограда и Arabidopsis GS трансген), как видно, трансгенные растения растут быстрее, и цветки и стручки образуются раньше, по сравнению с контрольными растениями дикого типа. (А) высота растений, (В) число цветков и стручков (С) число листовых почек и трехлистных л истов. Смотрите пример 12 ниже.
ФИГ.15. Фотография трансгенного растения Вигны линии G (справа) и контрольного растения Вигны дикого типа (слева), как видно, трансгенные растения обладают повышенным ростом по сравнению с растениями дикого типа. Трансгенная линия экспрессирует трансген GPT из винограда и Arabidopsis GS трансген. Смотрите пример 12 ниже.
ФИГ.16. Фотография трансгенного растения Канталупы (справа) и контрольного растения Канталупы дикого типа (слева), демонстрирующая повышенный рост трансгенного растения относительно контрольного растения дикого типа. Трансгенная линия экспрессирует трансгены Arabidopsis GPT и GS. Смотрите пример 14 ниже.
ФИГ.17. Фотография трансгенных растений тыквы обыкновенной (справа) и контрольных растений тыквы обыкновенной дикого типа (слева), демонстрирующая повышенный рост трансгенных растений относительно контрольных растений дикого типа. Трансгенная линия экспрессирует трансгены Arabidopsis GPT и GS. Смотрите пример 15 ниже.
ФИГ.18. Фотография трансгенных растений Arabidopsis (справа) и контрольных растений Arabidopsis дикого типа (слева), демонстрирующая повышенный рост трансгенных растений по сравнению с контрольными растениями дикого типа. Трансгенная линия экспрессирует трансгены Arabidopsis GPT и GS. Смотрите пример 16 ниже
ФИГ.19. Трансгенные растения томата, экспрессирующие трансгены Arabidopsis GPT и GS по сравнению с контрольными растениями томата дикого типа. (А) Фотография листьев трансгенного растения томата (справа) по сравнению с листьями контрольного растения дикого типа (слева), демонстрирующая более большие листья в случае трансгенного растения. (В) Фотография трансгенных растений томата (справа) и контрольных растений дикого типа (слева), демонстрирующая повышенный рост трансгенных растений по сравнению с контрольными растениями дикого типа. Смотрите пример 17 ниже.
На ФИГ.20. Приведена фотография трансгенного растения Camelina (справа) и контрольного растения Camelina дикого типа (слева), демонстрирующая повышенный рост трансгенного растения относительно контрольного растения дикого типа. Трансгенная линия экспрессирует трансгены Arabidopsis GPT и GS. Смотрите пример 18 ниже.
Подробное описание изобретения
ОПРЕДЕЛЕНИЯ
Если иного не указано, все термины, известные из области техники, системы обозначения и другая научная терминология, применяемые в настоящем документе, как предполагается, имеют значения в общем понятные специалистам в области техники, к которой относится настоящее изобретение. В некоторых случаях термины с понятными, в общем, значениями определяются в настоящем документе для ясности и/или для удобной ссылки, и включение таких определений в настоящий документ не должно истолковываться как существенное отличие указанных терминов от терминов, которые, в общем, известны из области техники. Методики и процедуры, описанные в настоящем документе или на которые приводятся ссылки в настоящем документе, в целом хорошо понятны и обычно применяются при использовании специалистами в данной области техники обычной способов, таких как, например, широко применяемые способы молекулярного клонирования, описанные у Sambrook et al., Molecular Cloning: A Laboratory Manual 3rd. edition (2001) Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y.; Current Protocols in Molecular Biology (Ausbel et al., eds., John Wiley & Sons, Inc. 2001; Transgenic Plants: Methods and Protocols (Leandro Pena, ed., Humana Press, 1st edition, 2004); и, Agrobacterium Protocols (Wan, ed., Humana Press, 2nd edition, 2006). Соответственно, процедуры, включающие применение коммерчески доступных наборов и реагентов, в общем, осуществляются согласно протоколам и/или параметрам, указанным производителем, если иного не оговаривается.
Термин "нуклеиновая кислота" относится к дезоксирибонуклеотидам или рибонукпеотидам и их полимерам ("полинуклеотидам") либо в одно-, либо в двуспиральной форме. Если нет специального ограничения, термин "полинуклеотид" охватывает нуклеиновые кислоты, содержащие известные аналоги природных нуклеотидов, которые имеют подобные свойства связывания, как и упомянутая нуклеиновая кислота и подвергаются метаболизму подобным образом, что и нуклеотиды природного происхождения. Если иного не указано, конкретная последовательность нуклеиновой кислоты также подразумеваемым образом охватывает ее консервативно модифицированные варианты (например, замены, связанные с вырожденностью генетического кода) и комплементарные последовательности, а также последовательность, указанную однозначно. Так, замены, связанные с вырожденностью генетического кода, можно осуществлять, получая последовательности, в которых третье положение одного или нескольких (или всех) кодонов заменено смешанным основанием и/или дезоксиинозиновыми остатками (Batzer et al., 1991, Nucleic Acid Res. 19: 5081; Ohtsuka et al., 1985 J. Biol. Chem. 260: 2605-2608; and Cassol et al., 1992; Rossolini et al., 1994, Mol. Cell. Probes 8: 91-98). Термин нуклеиновая кислота применяется взаимозаменяемо с терминами ген, кДНК и мРНК, кодируемые геном.
Термин "промотор" относится к регуляторным последовательностям нуклеиновой кислоты или последовательностям, которые направляют транскрипцию операбельно связанной нуклеиновой кислоты. Как применяется в настоящем документе, термин "растительный промотор" представляет собой промотор, который функционирует в растениях. Промоторы включают необходимые последовательности нуклеиновой кислоты рядом с сайтом инициации транскрипции, таким как, например, в случае промотора полимеразы типа II, элемент ТАТА. Промотор также необязательно включает элементы, такие как дистальный энхансер или репрессор, которые могут быть расположены на расстоянии до нескольких тысяч пар оснований от сайта транскрипции. "Конститутивный" промотор представляет собой промотор, который активен при большинстве условий окружающей среды и условий проведения эксперимента. "Индуцируемый" промотор представляет собой промотор, который активен при регулировании условий окружающей среды и условий проведения эксперимента. Термин "операбельно связанный" относится к функциональной связи между последовательностью, регулирующей экспрессию нуклеиновой кислоты (такой как промотор, или массив сайтов связывания факторов транскрипции), и второй последовательностью нуклеиновой кислоты, где последовательность, регулирующая экспрессию направляет транскрипцию нуклеиновой кислоты по второй последовательности.
Термины "полипептид", "пептид" и "белок" в контексте настоящего описания используют взаимозаменяемо для обозначения полимера, состоящего из аминокислотных остатков. Эти термины применимы к аминокислотным полимерам, в которых один или несколько аминокислотных остатков представляют собой искусственный полученный химическим путем миметик соответствующей встречающейся в естественных условиях аминокислоты, а также к встречающимся в естественных условиях аминокислотным полимерам и не встречающимся в естественных условиях аминокислотным полимерам.
Термин "аминокислота" относится к встречающимся в естественных условиях и синтетическим аминокислотам, а также к аминокислотным аналогам и аминокислотным миметикам, которые функционируют аналогично встречающимся в естественных условиях аминокислотам. Встречающиеся в естественных условиях аминокислоты представляют собой аминокислоты, кодируемые генетическим кодом, а также аминокислоты, которые впоследствии модифицируются, например, гидроксипролин, гамма-карбоксиглутамин и O-фосфосерин. Понятие «аминокислотные аналоги» относится к соединениям, которые имеют такую же основную химическую структуру, что и встречающаяся в естественных условиях аминокислота, т.е. имеют атом углерода в альфа-положении, который связан с водородом, карбоксильной группой, аминогруппой и R-группой, например гомосерин, норлейцин, метионинсульфоксид и метионинметилсульфоний. Такие аналоги несут модифицированные R-группы (например, норлейцин) или модифицированный пептидный каркас, но сохраняют такую же химическую структуру, что и встречающаяся в естественных условиях аминокислота. Понятие «аминокислотные миметики» относится к химическим соединениям, которые имеют структуру, отличную от общей химической структуры аминокислоты, но которые функционируют аналогично встречающейся в естественных условиях аминокислоте.
Аминокислоты могут упоминаться в настоящем документе либо посредством общеизвестных трехбуквенных символов, либо путем однобуквенных символов, рекомендованных ИЮПАК-ИЮБ Комиссией по биохимической номенклатуре. Нуклеотиды, подобным образом, могут упоминаться посредством общеизвестных однобуквенных кодов.
Термин "растение" включает целое растение, органы растения (например, листья, стебли, цветки, корни, репродуктивные органы, зародыши и их части и т.д.), сеянцы, семена, клетки растения и его потомство. Класс растений, которые могут применяться в способе по настоящему изобретению, в общем, представляет собой класс высших растений, поддающихся методике трансформации, включая скрытосеменные растения (односемядольные и двудольные растения), а также голосемянные растения. Сюда относятся растения различных уровней плоидности, включая полиплоиды, диплоиды, гаплоиды и гемизиготные.
Термины "GPT полинуклеотид" и "GPT нуклеиновая кислота" применяются в настоящем документе взаимозаменяемо, и относятся к полинуклеотидной последовательности, полной или частичной длины, гена, который кодирует полипептид, участвующий в катализе синтеза 2-оксоглутарамата, и включает полинуклеотиды, содержащие как транслируемые (кодирующие), так и нетранслируемые последовательности, а также их комплементы. Термин "GPT кодирующая последовательность" относится к части гена, который транскрибируется и кодирует GPT белок. Термин "целевая последовательность" относится к аминотерминальной части белка, которая направляет белок в субклеточный компартмент клетки, такой как хлоропласт в растительной клетке. GPT полинуклеотиды кроме того определяются их способностью к гибридизации при определенных с GPT полинуклеотидами, раскрытыми в настоящем документе, или с ПЦР продуктами, полученными из них.
"GPT трансген" представляет собой молекулу нуклеиновой кислоты, содержащую GPT полинуклеотид, который является экзогенным для трансгенного растения, или зародыша, органа или семени растения, содержащего молекулу нуклеиновой кислоты, или который является экзогенным для предка трансгенного растения, содержащего GPT полинуклеотид, его зародыша, органа или семени.
Термины "GS полинуклеотид" и "GS нуклеиновая кислота" применяются в настоящем документе взаимозаменяемо, и относятся к полинуклеотидной последовательности, полной или частичной длины, гена, который кодирует белок глутаминсинтетазу и включает полинуклеотиды, содержащие как транслируемые (кодирующие), так и нетранслируемые последовательности, так же как и их комплементы. Термин "GS кодирующая последовательность" относится к части гена, которая транскрибируется и кодирует GS белок. Термины "GS1 полинуклеотид" и "GS1 нуклеиновая кислота" применяются в настоящем документе взаимозаменяемо, и относятся к полинуклеотидной последовательности, полной или частичной длины, гена, который кодирует белок глутаминсинтетазу изоформы 1, и включает полинуклеотиды, содержащие как транслируемые (кодирующие), так и нетранслируемые последовательности, так же как и их комплементы. Термин "GS1 кодирующая последовательность" относится к части гена, которая транскрибируется и кодирует GS1 белок.
"GS трансген" представляет собой молекулу нуклеиновой кислоты, содержащую GS полинуклеотид, который является экзогенным для трансгенного растения, или зародыша, органа или семени растения, содержащего молекулу нуклеиновой кислоты, или который является экзогенным для предка трансгенного растения, содержащего GS полинуклеотид, его зародыша, органа или семени. "GS1 трансген" представляет собой молекулу нуклеиновой кислоты, содержащую GS1 полинуклеотид, который является экзогенным для трансгенного растения, или зародыша, органа или семени растения, содержащего молекулу нуклеиновой кислоты, или который является экзогенным для предка трансгенного растения, содержащего GS1 полинуклеотид, его зародыша, органа или семени.
Примеры GPT полинуклеотидов по настоящему изобретению приведены в настоящем документе, и включают GPT кодирующую последовательность для GPT Arabidopsis, риса, ячменя, бамбука, сои, винограда и полосатой перцины.
GPT полинуклеотиды частичной длины включают полинуклеотидные последовательности, кодирующие усеченные на N- или С-концах GPT, зрелые GPT (без целевой последовательности), а также последовательности, кодирующие домены GPT. Примеры GPT полинуклеотидов, кодирующих усеченные на N-конце GPT включают -30, -45 и -56 конструкции Arabidopsis, в которых исключены кодирующие последовательности для первых 30, 45 и 56 аминокислот, соответственно, в структуре GPT полной длины согласно SEQ ID NO:2.
При применении GPT полинуклеотидов по настоящему изобретению для получения трансформированных клеток и трансгенных растений, специалист в данной области техники может определить, что вставленная полинуклеотидная последовательность может и не быть идентичной, а быть только "по существу идентичной" последовательности гена, из которого она произошла, как определено ниже. Термин "GPT полинуклеотид" в частности охватывает такие по существу идентичные варианты. Подобным образом, специалист в данной области техники может определить, что в результате вырожденности генетического кода, ряд полинуклеотидных последовательностей будет кодировать один и тот же полипептид, и это означает, что все такие полинуклеотидные последовательности входят в объем термина GPT полинуклеотид. Кроме того, этот термин, в частности, включает последовательности (определенные ниже), по существу идентичные GPT полинуклеотидной последовательности, раскрытой в настоящем документе, и те, которые кодируют полипептиды, которые либо представляют собой мутанты GPT полипептидов дикого типа, либо сохраняют функцию GPT полипептида (например, происходят в результате консервативных замещений аминокислот в GPT полипептиде). Термин "GPT полинуклеотид", таким образом, также включает такие по существу идентичные варианты.
Термин "консервативно модифицированные варианты" применяется как к аминокислотным последовательностям, так и к последовательностям нуклеиновых кислот. В отношении конкретных последовательностей нуклеиновых кислот, консервативно модифицированные варианты относятся к тем нуклеиновым кислотам, которые кодируют идентичные или по существу идентичные аминокислотные последовательности, или в случае, когда нуклеиновая кислота не кодирует аминокислотную последовательность, к по существу идентичным последовательностям. Из-за вырожденности генетического кода, большое число функционально идентичных нуклеиновых кислот кодируют любой данный белок. Например, кодоны GCA, GCC, GCG и GCU все кодируют аминокислоту аланин. Таким образом, в каждом положении, где аланин определен кодоном, этот кодон может быть изменен на любой из соответствующих кодонов без изменения закодированного полипептида. Такие вариации нуклеиновых кислот "молчащие вариации" представляют собой один из видов консервативно модифицированных вариантов. Каждая последовательность нуклеиновой кислоты по настоящему изобретению, которая кодирует полипептид, также описывает каждый возможную молчащую вариацию нуклеиновой кислоты. Специалист в данной области техники определит, что каждый кодон в нуклеиновой кислоте (за исключением AUG, который представляет собой кодон только для метионина, и TGG, который представляет собой кодон только для триптофана) может быть модифицирован с получением функционально идентичной молекулы. Соответственно, каждая молчащая вариация нуклеиновой кислоты, которая кодирует полипептид, подразумевается в каждой описанной последовательности.
В отношении аминокислотных последовательностей, специалисту в данной области техники известно, что отдельные замещения, делеции или добавления в последовательности нуклеиновой кислоты, пептида, полипептида или белка, которые приводят к изменению, удалению или добавлению одной аминокислоты или небольшой доли аминокислот в закодированной последовательности, представляют собой "консервативно модифицированный вариант", где изменение приводит к замещению аминокислоты на химически подобную аминокислоту. Таблицы консервативных замещений, в которых приведены функционально подобные аминокислоты, хорошо известны в данной области техники. Такие консервативно модифицированные варианты, кроме того, не исключают полиморфные варианты, межвидовые гомологи и аллели, предлагаемые в изобретении.
Каждая из приведенных ниже 8 групп содержит аминокислоты, которые являются консервативными заменами друг друга:
1) аланин (А), глицин (G);
2) аспарагиновая кислота (D), глутаминовая кислота (Е);
3) аспарагин (N), глутамин (Q);
4) аргинин (R), лизин (K);
5) изолейцин (I), лейцин (L), метионин (М), валин (V);
6) фенилаланин (F), тирозин (Y), триптофан (W);
7) серин (S), треонин (Т) и
8) цистеин (С), метионин (М) (см., например, Creighton, Proteins (1984)).
Макромолекулярные структуры такие как полипептидные структуры могут быть определены в терминах различных уровней организации. Для общего рассмотрения этой организации смотрите, например, Alberts et al., Molecular Biology of the Cell (3rd ed., 1994) and Cantor and Schimmel, Biophysical Chemistry Part I: The Conformation of Biological Macromolecules (1980). Термин "первичная структура" относится к аминокислотной последовательности конкретного пептида. Термин "Вторичная структура" относится к локально расположенным, трехразмерным структурам внутри полипептида. Эти структуры в общем известны как домены. Домены представляют собой части полипептида, которые образуют компактную единицу полипептида и имеют в длину, как правило, от около 25 до около 500 аминокислот. Типичные домены состоят из секций более низкой организации, таких как участки β-слоя и α-спирали. Термин "третичная структура" относится к завершенной трехразмерной структуре полипептидного мономера. Термин "четвертичная структура" относится к трехразмерной структуре, образованной нековалентным соединением независимых третичных элементов. Анизотропные составляющие также известны как энергетические составляющие.
Термин "выделенное" относится к веществу, которое в основном или существенно сводно от компонентов, которые, как правило, сопутствуют веществу в том виде, в котором оно обнаруживается в его нативном или естественном состоянии. Однако, термин "выделенный", как подразумевается, не относится к компонентам, присутствующим в электрофоретическом геле или другой среде разделения. Выделенный компонент свободен от такой среды разделения и находится в форме, готовой для использования в другом применении или уже используемой в новом/новой применении/среде. "Выделенное" антитело представляет собой антитело, которое было идентифицировано и выделено и/или восстановлено из компонентов его окружающей среды в естественных условиях. Загрязняющие компоненты его естественной окружающей среды представляют собой вещества, которые будут препятствовать диагностическим или терапевтическим применениям антитела, и могут включать ферменты, гормоны и белковые или небелковые растворенные вещества. В предпочтительных вариантах выполнения настоящего изобретения антитело очищено (1) на более чем 95 мас.% от массы антитела, как определено с помощью метода Лоури, и наиболее предпочтительно более чем на 99 мас.% (2) до степени, достаточной для получения, по меньшей мере, 15 остатков N-концевой или внутренней аминокислотной последовательности путем применения секвенатора с вращающемся стаканом, или (3) до гомогенности посредством электрофореза в полиакриламидном геле, в присутствии додецилсульфата натрия (SDS-PAGE) в восстанавливающих или невосстанавливающих условиях, применяя кумасси голубой или, предпочтительно, серебрянку. Выделенные антитела включают антитело in situ внутри рекомбинатных клеток, поскольку, по меньшей мере, один компонент естественной окружающей среды антитела не будет присутствовать. Обычно, однако, выделенное антитело получают путем, по меньшей мере, одной стадии очистки.
Термин "гетерологичный" при применении в отношении частей нуклеиновой кислоты указывает на то, что нуклеиновая кислота содержит две или более последовательностей, которые, как обнаружено, в природе не находятся в одинаковой степени родства друг с другом. Например, нуклеиновая кислота, как правило, продуцируется рекомбинантно, имея две или более последовательностей из неродственных генов, упорядоченных для создания новой функциональной нуклеиновой кислоты, например, нуклеиновой кислоты, кодирующей белок из одного источника и кодирующей пептидную последовательность из другого источника. Подобным образом, гетерологичный белок указывает на то, что белок содержит две или более последовательности, которые, как обнаружено, в природе не находятся в одинаковой степени родства друг с другом (например, гибридный белок).
Термины "идентичный" или " процент идентичности", в контексте двух или более нуклеиновых кислот или полипептидных последовательностей, относится к двум или более последовательностям или подпоследовательностям, которые являются одинаковыми или имеют определенный процент аминокислотных остатков или нуклеотидов, которые являются одинаковыми (то есть, около 70% идентичности, предпочтительно 75%, 80%, 85%, 90%, или 95% идентичности для определенной области, при сравнении и выравнивании для максимального соответствия в окне сравнения или в предназначенной для этого области, как измерено с применением алгоритмов сравнения последовательностей, или путем ручного выравнивания и визуального контроля. Это определение также относится к комплементу тестируемой последовательности, который имеет значительную комплементарность последовательностей или подпоследовательностей, когда тестируемая последовательность существенно идентична контрольной последовательности. Это определение также относится к комплементу тестируемой последовательности, который имеет значительную комплементарность последовательностей или подпоследовательностей, когда тестируемая последовательность существенно идентична контрольной последовательности.
Когда процент идентичности последовательности применяется в отношении полипептидов, было выявлено, что положения остатков, которые неидентичны, часто отличаются благодаря консервативному замещению аминокислот, когда аминокислотные остатки замещаются на другие аминокислотные остатки с подобными химическими свойствами (например, заряд или гидрофобность), и поэтому функциональные свойства полипептида не изменяются. Когда последовательности отличаются засчет консервативных замещений, процент идентичности последовательности может быть повышен, для того, чтобы ввести поправку на консервативную природу замещения.
Для сравнения последовательностей, как правило, одна последовательность выполняет функции контрольной последовательности, с которой сравнивается тестируемая последовательность. При применении алгоритма сравнения последовательностей, тестируемая и контрольная последовательности вводятся в компьютер, при необходимости обозначаются координаты последовательностей, и обозначаются параметры программы алгоритма сравнения последовательностей. Могут применяться установленные по умолчанию параметры программы, или могут быть обозначены альтернативные параметры. Алгоритм сравнения последовательностей затем вычисляет процент идентичности тестируемой последовательности по отношению к контрольной последовательности, на основе параметров программы.
В контексте настоящего описания понятие «окно сравнения» относится к фрагменту, содержащему любое количество следующих непрерывно друг за другом положений, выбранных из группы, содержащей от 20 до 600, как правило, от около 50 до около 200, более часто от около 100 до около 150 положений, в которых последовательность можно сравнить с контрольной последовательностью с таким же числом смежных положений после оптимального выравнивания двух последовательностей. Способы выравнивания последовательностей для сравнения хорошо известны из уровня техники. Оптимальное выравнивание последовательностей для сравнения может проводиться, например, с помощью алгоритма локальной гомологии Смита-Уотермана, 1981, Adv. Appl. Math. 2:482, путем алгоритма сопоставления гомологии Нидлемана-Вунша, 1970, J. Mol. Biol. 48:443, способом поиска сходства Пирсона-Липмана, 1988, Proc. Nat'l. Acad. Sci. USA 85:2444, с помощью компьютеризированных воплощений этих алгоритмов (GAP, BESTFIT, FASTA, и TFASTA в пакете программ the Wisconsin Genetics, Genetics Computer Group, 575 Science Dr., Madison, WI), или путем ручного выравнивания и визуального обследования (смотрите, например, Current Protocols in Molecular Biology (Ausubel et al., eds. 1995 supplement)).
Предпочтительными примерами алгоритмов, которые подходят для определения процента идентичности последовательностей и подобия последовательностей, являются BLAST и BLAST 2.0 алгоритмы, которые описываются в Altschul et al., 1977, Nuc. Acids Res. 25:3389-3402 и Altschul et al., 1990, J. Mol. Biol. 215:403-410, соответственно. BLAST и BLAST 2.0, как правило, применяются с параметрами, установленными по умолчанию и описанными в настоящем документе, для определения процента идентичности последовательностей для нуклеиновых кислот и белков по настоящему изобретению. Программное обеспечение для осуществления BLAST анализов является общедоступным благодаря Национальному центру биотехнологической информации (NCBI). Этот алгоритм включает сначала идентификацию высокобалльных пар последовательностей (HSP) идентификацией коротких слов длины W в запрашиваемой последовательности, которые либо совпадают, либо удовлетворяют некоторому положительно оцениваемому пороговому баллу Т при сопоставлении со словом той же самой длины в последовательности базы данных. Т обозначается как бальный порог соседних слов (Altschul et al., выше). Эти первоначальные хиты (совпадения) соседних слов действуют в качестве стартовых точек для нахождения более длинных HSP, содержащих их. Хиты слов распространяются в обоих направлениях вдоль каждой из двух сравниваемых последовательностей до тех пор, пока может увеличиваться кумулятивный балл сопоставления. Кумулятивные баллы вычисляются с применением, для нуклеотидных последовательностей, параметров М (поощрительный балл для пары совпадающих остатков; всегда >0) и N (штрафной балл за несовпадающие остатки; всегда <0). Для аминокислотных последовательностей, матица весов применяется для вычисления кумулятивного балла. Распространение хитов слов останавливают, когда: кумулятивный балл сопоставления падает в Х раз от максимальной достигнутой величины; кумулятивный балл идет к нулю или ниже; или достигается конец любой последовательности. Параметры W, Т и Х алгоритма BLAST определяют чувствительность и скорость сопоставления. Программа BLAST (для нуклеотидных последовательностей) использует по умолчанию длину слова (W) 11, ожидание (Е) 10, М=5, N=-4 и сравнение обеих цепей. Для аминокислотных последовательностей, программа BLAST использует по умолчанию длину слова (W) 3 и ожидание (Е) 10, сопоставления матрицы оценки BLOSUM62 (см. Henikoff and Henikoff, Proc. Natl. Acad. Sci. USA 89:10915 (1989)) (В) 50, ожидание (Е) 10, М=5, N=-4 и сравнение обеих цепей.
Затем алгоритм BLAST выполняет статистический анализ сходства между двумя последовательностями (см., например, Karlin and Altschul, Proc. Natl. Acad. Sci. USA 90:5873-5787 (1993)). Одной мерой сходства, обеспечиваемой алгоритмом BLAST, является наименьшая вероятность суммы (Р(N)), которая обеспечивает указание вероятности, с которой будет происходить случайным образом совпадение между двумя нуклеотидными или аминокислотными последовательностями. Например, аминокислотная последовательность считается сходной с белком, таким как протеаза, если наименьшая вероятность суммы в сравнении тестируемой аминокислотной последовательности с белком, таким как аминокислотная последовательность протеазы, является менее чем около 0,2, более предпочтительно менее чем около 0,01 и наиболее предпочтительно менее чем около 0,001.
Фраза "жесткие условия гибридизации" относится к условиям, при которых зонд будет гибридизоваться до его целевой подпоследовательности, как правило, в сложной смеси нуклеиновой кислоты, но не до других последовательностей. Жесткие условия зависят от последовательности и различаются в различных средах. Более длинные последовательности, в частности, гибридизуются при более высоких температурах. Обширное руководство по гибридизации нуклеиновых кислот можно обнаружить в Tijssen, Techniques in Biochemistry and Molecular Biology-Hybridization with Nucleic Probes, "Overview of principles of hybridization and the strategy of nucleic acid assays" (1993). В общем, весьма жесткие условия выбираются на около 5-10°С ниже точки плавления (Tm) конкретной последовательности при определенной ионной силе рН. Условия низкой жесткости, в целом, выбираются на около 15-30°С ниже Tm. Tm представляет собой температуру (при определенной ионной силе, рН, и концентрации нуклеиновых кислот) при которой 50% зондов, комплементарных целевой последовательности, гибридизуются до целевой последовательности при равновесии (так как целевые последовательности присутствуют в избытке, при Tm, 50% зондов действует при равновесии). Жесткие условия представляют собой те, при которых концентрация соли меньше, чем около 1.0 М ионов натрия, как правило, концентрация составляет от около 0.01 до 1.0 М ионов натрия (или других солей) при рН 7.0-8.3 и температуре, по меньшей мере, около 30°С для коротких зондов (например, 10-50 нуклеотидов) и, по меньшей мере, около 60°С для длинных зондов (например, больше чем 50 нуклеотидов). Жесткие условия могут также достигаться путем добавления дестабилизирующих средств, таких как формамид. Для селективной или специфичной гибридизации положительным сигналом является, по меньшей мере, двукратная фоновая гибридизация, предпочтительно, десятикратная фоновая гибридизация.
Нуклеиновые кислоты, которые не гибридизуются друг до друга в жестких условиях, однако, являются по существу идентичными, если полипептиды, которые они кодируют, являются по существу идентичными. Это случается, например, когда копия нуклеиновой кислоты создается с применением максимальной вырожденности кодонов, разрешенной генетическим кодом. В таких случаях, нуклеиновые кислоты обычно гибридизуются при условиях гибридизации умеренной жесткости.
Геномные ДНК или кДНК, содержащие GPT полинуклеотиды, могут быть идентифицированы в стандартных южных блотах в жестких условиях, применяя GPT полинуклеотидные последовательности, раскрытые в настоящем документе. С этой целью, подходящие жесткие условия для таких гибридизаций представляют собой те, которые включают гибридизацию в буфере из 40% формамида, 1М NaCl, 1% SDS при 37°С, и, по меньшей мере, одну промывку в 0.2 Х SSC при температуре, по меньшей мере, около 50°С, как правило, от около 55°С до около 60°С, в течение 20 минут, или в эквивалентных условиях. Положительная гибридизация, по меньшей мере, в два раза больше фоновой. Специалисты в данной области техники легко определят, что альтернативные условия гибридизации и промывки могут применяться для обеспечения условий подобной жесткости.
Следующее указание на то, что два полинуклеотида являются по существу идентичными состоит в том, что контрольная последовательность, амплифицированная парой олигонуклеотидных праймеров, может затем применяться в качестве зонда при жестких условиях для выделения тестируемой последовательности из кДНК или геномной библиотеки, или для идентификации тестируемой последовательности в, например, северном или южном блоте.
Трансгенные растения:
Настоящее изобретение раскрывает новые трансгенные растения, проявляющие, по существу, улучшенные агрономические характеристики, включая более быстрый рост, более высокую массу сырой ткани зрелых растений и более высокую общую биомассу, более раннее и более обильное цветение, и больший урожай плодов, стручков и семян. Трансгенные растения по настоящему изобретению получают путем введения в растение одной или более экспрессируемых генетических конструкций, способных управлять экспрессией одного или более полинуклеотидов, кодирующих глутаминсинтетазу(СЗ) и глутамин-фенилпируват-трансаминазу (GPT). В примерном варианте выполнения настоящего изобретения получают родительские линии с одним трансгеном, несущие кодирующую последовательность либо GPT, либо GS1 трансгена, они предпочтительно самоопыляются пока не становятся гомозиготными по трансгену, и затем скрещиваются с получением растений потомства, содержащих оба трансгена.
В подходящих вариантах трансформации по настоящему изобретению, одна или более копий экспрессируемой генетической конструкции встраиваются в геном растения-хозяина, обеспечивая, таким образом, повышенную GS и GPT ферментативную способность в растении, что приводит к повышенному синтезу 2-оксоглутарамата, который в свою очередь передает сигнал для экспрессии метаболического гена, приводя к усиленному росту растения и улучшению других агрономических характеристик. 2-оксоглутарамат представляет собой метаболит, который является крайне сильнодействующим эффектором генной экспрессии, метаболизма и роста растения (патент США №. 6,555,500), и который может играть центральную роль в координации систем метаболизма углерода и азота (Lancien et al., 2000, Enzyme Redundancy and the Importance of 2-Oxoglutarate in Higher Plants Ammonium Assimilation, Plant Physiol. 123: 817-824). Смотрите также схематический 2-оксоглутараматный путь, показанный на ФИГ.1.
В качестве одного объекта настоящего изобретения, изобретатели выделили молекулу нуклеиновой кислоты, кодирующую фермент Arabidopsis глутамин-фенилпируват-трансаминазу (GPT) (смотрите Пример 1 ниже), и впервые продемонстрировали, что экспрессированный рекомбинантный фермент является активным и способен катализировать синтез сигнального метаболита 2-оксоглутарамата (смотрите Пример 2 ниже). Далее, изобретатели впервые продемонстрировали, что сверхэкспрессия гена глутаминтрансаминазы из Arabidopsis в трансформированном гетерологическом растении приводит к увеличению скоростей фиксации CO2 и улучшенным характеристикам роста (смотрите Пример 3 ниже).
Предшествующая работа Заявителей продемонстрировала, что сверхэкспрессия гена GS1 из Alfalfa под контролем сильного конститутивного промотора приводит к трансгенным растениям табака с более высокими уровнями активности GS в листьях. Эти растения опережают своих аналогов дикого типа по скорости роста, более быстро фиксируют CO2, содержат повышенные концентрации общего белка, а также повышенные концентрации глутамина и 2-оксоглутарамата, и показывают повышенные скорости усвоения нитрата через их корни.
Как изложено в настоящем документе (смотрите Пример 3 ниже), сверхэкспрессия трансгена, содержащего Arabidopsis кодирующую последовательность GPT полной длины в трансгенных растениях табака также приводит к более быстрой фиксации CO2 и повышенным уровням общего белка, глутамина и 2-оксоглутарамата. Эти трансгенные растения также растут быстрее, чем растения дикого типа (ФИГ.2). Подобным образом, в проведенных ранее исследованиях с растением томата (смотрите Пример 4 ниже), растения томата, трансформированные Arabidopsis GPT трансгеном, показали значительно усиленную скорость роста, улучшенное цветение и урожай семян по сравнению с контрольными растениями дикого типа (смотрите ФИГ.3 и Пример 4 ниже).
В одном конкретном варианте выполнения настоящего изобретения, с помощью приведенных в настоящем документе ниже Примеров 3, 5 и 7 показано, что первый набор родительских линий растений табака с одним трансгеном, несущих Alfalfa GS1 ген, включая 5' и 3' нетранслируемые области, получили с применением Agrobacterium-опосредованной генной трансформации, при селективном давлении, вместе со скринингом на фенотип с самым быстрым ростом, и самоопыления до гомозиготности трансгена/фенотипа (смотрите Пример 5 ниже). Второй набор родительских линий растения табака с одним трансгеном, несущих Arabidopsis кодирующую последовательность GPT полной длины, получили таким же образом (смотрите Пример 3 ниже). Растения с высокой скоростью роста, отобранные для каждой из родительских линий, были затем подвергнуты половому скрещиванию, с получением линий потомства (смотрите Пример 7 ниже).
Потомство, полученное от многочисленных скрещиваний Arabidopsis GS1 и GPT трансгенных растений табака, показывает намного более хорошие и удивительно высокие скорости роста по сравнению с родительскими линиями с одним трансгеном, а также и по сравнению с растениями дикого типа. На ФИГ.5 показаны фотографии потомства с двумя трансгенами, полученного в результате GS1 Х GPT скрещиваний растений с одним трансгеном, по сравнению с растениями дикого типа и родительскими растениями с одним трансгеном. На ФИГ.6 показаны фотографии, позволяющие сравнить размеры листьев потомства с двумя трансгенами и растений дикого типа. В процессе проведения экспериментов наблюдали, что скорости роста этих трансгенных растений с двумя трансгенами на 200%-300% выше, по сравнению с растениями дикого типа (смотрите Пример 7 ниже). Более того, уровни общей биомассы существенно выше для растений с двумя трансгенами, причем масса сырой ткани всего растения в два-три раза больше массы сырой ткани растения дикого типа. Подобным образом увеличиваются урожаи семян в трансгенных растениях с двумя трансгенами, причем образуется в два-три раза больше семянок, по сравнению с растениями дикого типа, и общие урожаи семян превышают урожаи для растений дикого типа на 300-400%.
Помимо трансгенных растений табака, упомянутых выше, в настоящем документе приведены примеры различных других видов трансгенных растений, содержащих GPT и GS трансгены. Как показано в настоящем документе, трансгенные растения, обладающие улучшенными характеристиками роста, были получены для двух видов Томата (смотрите Примеры 4 и 17), Перца (Пример 8), Фасоли (Примеры 9 и 10), Вигны (Примеры 11 и 12), Alfalfa (Пример 13), Канталупы (Пример 14), Тыквы (Пример 15), Arabidopsis (Пример 16) и Camilena (Пример 18). Эти трансгенные растения по настоящему изобретению были получены с применением широкого числа методик, применяя Agrobacterium-опосредованные каллюсы, трансформацию методом «floral dip», инокуляцию семян, инокуляцию стручков, и прямую инокуляцию цветков, а также их комбинации, и половые скрещивания растений с одним трансгеном, примеры чего приведены в настоящем документе. Различные GPT и GS трансгены успешно применялись при получении трансгенных растений по настоящему изобретению, как показано в настоящем документе.
Настоящее изобретение также обеспечивает способы получения трансгенного растения, имеющего усиленный рост и другие улучшенные агрономические характеристики. В одном варианте выполнения настоящего изобретения, способ получения трансгенного растения, имеющего усиленный рост и другие улучшенные агрономические характеристики, содержит введение в клетку растения экспрессионной кассеты, содержащей молекулу нуклеиновой кислоты, кодирующей GPT трансген, под контролем подходящего промотора, способного управлять экспрессией трансгена, с получением трансформированной клетки растения, и получая трансгенное растение, которое экспрессирует закодированный GPT. В другом варианте выполнения настоящего изобретения способ получения трансгенного растения, имеющего усиленный рост и другие улучшенные агрономические характеристики, содержит введение в клетку растения одной или более конструкций нуклеиновой кислоты или экспрессионных кассет, содержащих молекулы нуклеиновой кислоты, кодирующей GPT трансген и GS трансген, под контролем одного или более подходящих промоторов (и, необязательно, других регуляторных элементов), способных управлять экспрессией трансгенов, с получением, таким образом, трансформированной клетки растения, и получая трансгенное растение, которое экспрессирует GPT и GS трансгены.
На основании результатов, изложенных в настоящем документе, ясно, что любое число GPT и GS полинуклеотидов может применяться для получения трансгенных растений по настоящему изобретению. Как GS1, так и GPT белки являются весьма консервативными среди различных видов растений, и из экспериментальных данных, приведенных в настоящем документе, очевидно, что близкородственные нерастительные GPT могут применяться также хорошо (например, Danio rerio GPT). В отношении GPT, множество GPT полинуклеотидов, происходящих из различных видов, как было показано, активны и полезны в качестве GPT трансгенов. Подобным образом, различные GS полинуклеотиды могут применяться, включая, но без ограничения к этому, любую растительную GS1, кодирующую полинуклеотид, который генерирует GS активность в клетке-хозяине, трансформированной экспрессируемой GS1 конструкцией.
В конкретном варианте выполнения настоящего изобретения, GPT трансген представляет собой GPT полинуклеотид, кодирующий GPT, происходящую из Arabidopsis, такую как GPT последовательностей SEQ ID NO:2, SEQ ID NO:21 и SEQ ID NO:30, и GS трансген представляет собой GS полинуклеотид, кодирующий происходящий из Alfalfa GS1 (то есть, SEQ ID NO:4) или происходящий из Arabidopsis GS1 (SEQ ID NO:7). GPT трансген может кодироваться нуклеотидной последовательностью SEQ ID NO:1; нуклеотидной последовательностью на, по меньшей мере, 75% и более предпочтительно на, по меньшей мере, 80% идентичной SEQ ID NO:1 и кодирующей полипептид, имеющий GPT активность; нуклеотидной последовательностью, кодирующей полипептид SEQ ID NO:2, или полипептид, имеющий на, по меньшей мере, 75% и более предпочтительно на, по меньшей мере, 80% идентичную последовательность и имеющий GPT активность; и нуклеотидной последовательностью, кодирующей полипептид SEQ ID NO:2, усеченный на его аминоконцах на от 30 до 56 аминокислотных остатков, или полипептид, имеющий на, по меньшей мере, 75% и более предпочтительно на, по меньшей мере, 80% идентичную последовательность и имеющий GPT активность. GS1 трансген может кодироваться полинуклеотидом SEQ ID NO:3 или SEQ ID NO:6 или нуклеотидной последовательностью на, по меньшей мере, 75% и более предпочтительно на, по меньшей мере, 80% идентичной SEQ ID NO:3 или SEQ ID NO:6, и кодирующей полипептид, имеющий GPT активность; и нуклеотидной последовательностью, кодирующей полипептид SEQ ID NO:4 или 7, или полипептид, имеющий на, по меньшей мере, 75% и более предпочтительно на, по меньшей мере, 80% идентичную последовательность и имеющий GS активность.
В другом конкретном варианте выполнения настоящего изобретения, GPT трансген представляет собой GPT полинуклеотид, кодирующий происходящую из винограда GPT, такую как GPT винограда с последовательностью SEQ ID NO:9 и SEQ ID NO:31, и GS трансген представляет собой GS1 полинуклеотид. GPT трансген может кодироваться нуклеотидной последовательностью SEQ ID NO:8; нуклеотидной последовательностью на, по меньшей мере, 75% и более предпочтительно на, по меньшей мере, 80% идентичной SEQ ID NO:8, и кодирующей полипептид, имеющий GPT активность; нуклеотидной последовательностью, кодирующей полипептид SEQ ID NO:9 или SEQ ID NO:31, или полипептид, имеющий на, по меньшей мере, 75% и более предпочтительно на, по меньшей мере, 80% идентичную последовательность и имеющий GPT активность.
В еще одном конкретном варианте выполнения настоящего изобретения, GPT трансген представляет собой GPT полинуклеотид, кодирующий происходящую из Риса GPT, такую как GPT риса с последовательностями SEQ ID NO:11 и SEQ ID NO:32, и GS трансген представляет собой GS1 полинуклеотид. GPT трансген может кодироваться нуклеотидной последовательностью SEQ ID NO:10; нуклеотидной последовательностью на, по меньшей мере, 75% и более предпочтительно на, по меньшей мере, 80% идентичной SEQ ID NO:10, и кодирующей полипептид, имеющий GPT активность; нуклеотидной последовательностью, кодирующей полипептид SEQ ID NO:11 или SEQ ID NO:32, или полипептид, имеющий на, по меньшей мере, 75% и более предпочтительно на, по меньшей мере, 80% идентичную последовательность и имеющий GPT активность.
В еще одном конкретном варианте выполнения настоящего изобретения, GPT трансген представляет собой GPT полинуклеотид, кодирующий происходящую из Сои GPT, такую как GPT сои с последовательностями SEQ ID NO:13, SEQ ID NO:33 или SEQ ID NO:33 с изолейцином на N-концах последовательности, и GS трансген представляет собой GS1 полинуклеотид. GPT трансген может кодироваться нуклеотидной последовательностью SEQ ID NO:12; нуклеотидной последовательностью на, по меньшей мере, 75% и более предпочтительно на, по меньшей мере, 80% идентичной SEQ ID NO:12, и кодирующей полипептид, имеющий GPT активность; нуклеотидной последовательностью, кодирующей полипептид SEQ ID NO:13 или SEQ ID NO:33 или SEQ ID NO:33 с изолейцином на N-концах последовательности, или полипептид, имеющий на, по меньшей мере, 75% и более предпочтительно на, по меньшей мере, 80% идентичную последовательность и имеющий GPT активность.
В еще одном конкретном варианте выполнения настоящего изобретения, GPT трансген представляет собой GPT полинуклеотид, кодирующий происходящую из ячменя GPT, такую как GPT ячменя с последовательностями SEQ ID NO:15 и SEQ ID NO:34, и GS трансген представляет собой GS1 полинуклеотид. GPT трансген может кодироваться нуклеотидной последовательностью SEQ ID NO:14; нуклеотидной последовательностью на, по меньшей мере, 75% и более предпочтительно на, по меньшей мере, 80% идентичной SEQ ID NO:14, и кодирующей полипептид, имеющий GPT активность; нуклеотидной последовательностью, кодирующей полипептид SEQ ID NO:15 или SEQ ID NO:34, или полипептид, имеющий на, по меньшей мере, 75% и более предпочтительно на, по меньшей мере, 80% идентичную последовательность и имеющий GPT активность.
В еще одном конкретном варианте выполнения настоящего изобретения, GPT трансген представляет собой GPT полинуклеотид, кодирующий происходящую из полосатой перцины GPT, такую как GPT полосатой перцины с последовательностями SEQ ID NO:17 и SEQ ID NO:35, и GS трансген представляет собой GS1 полинуклеотид. GPT трансген может кодироваться нуклеотидной последовательностью SEQ ID NO:16; нуклеотидной последовательностью на, по меньшей мере, 75% и более предпочтительно на, по меньшей мере, 80% идентичной SEQ ID NO:16, и кодирующей полипептид, имеющий GPT активность; нуклеотидной последовательностью, кодирующей полипептид SEQ ID NO:17 или SEQ ID NO:35, или полипептид, имеющий на, по меньшей мере, 75% и более предпочтительно на, по меньшей мере, 80% идентичную последовательность и имеющий GPT активность.
В еще одном конкретном варианте выполнения настоящего изобретения, GPT трансген представляет собой GPT полинуклеотид, кодирующий происходящую из Бамбука GPT, такую как GPT Бамбука SEQ ID NO:36, и GS трансген представляет собой GS1 полинуклеотид. GPT трансген может кодироваться нуклеотидной последовательностью, кодирующей полипептид SEQ ID NO:36, или полипептид, имеющий на, по меньшей мере, 75% и более предпочтительно на, по меньшей мере, 80% идентичную последовательность и имеющий GPT активность.
Другие GPT поинуклеотиды, подходящие для применения в качестве GPT трансгенов при практическом осуществлении настоящего изобретения, могут быть получены различными путями, как будет по достоинству оценено специалистами в данной области техники, проверенными на способность управлять экспрессией GPT с GPT активностью в рекомбинантной экспрессионной системе (то есть Е.coli (смотрите Примеры 20-23), во временной in planta экспрессионной системе (смотрите Пример 19), или в трансгенном растении (смотрите Примеры 1-18).
Трансгенные конструкции/экспрессионные вектора
Для того чтобы получить трансгенные растения по настоящему изобретению, кодирующая ген последовательность для желательного трансгена(ов) должна быть включена в конструкцию нуклеиновой кислоты (также взаимозаменяемо упоминается в настоящем документе как (трансгенный) экспрессионный вектор, экспрессионная кассета, экспрессионная конструкция или экспрессируемая генетическая конструкция), которая может управлять экспрессией трансгенной последовательности в трансформированных клетках растения. Такие конструкции нуклеиновой кислоты, несущие трансген(ы), о котором(ых) идет речь, могут вводиться в клетку или клетки растения, с применением ряда известных в данной области техники способов, включая, но без ограничения к этому, электропорацию, бомбардировку ДНК или биолистические подходы, микроинъекцию, или посредством применения различных основанных на ДНК векторов, таких как Agrobactenum tumefaciens и Agrobacterium rhizogenes векторы. Сразу после введения в трансформированную клетку растения, конструкция нуклеиновой кислоты может управлять экспрессией введенного трансгена(ов) (то есть, GPT), либо временным либо стабильным образом. Стабильная экспрессия предпочтительна, и она достигается путем применения трансформационных векторов, подходящих для растений, которые способны управлять хромосомной интеграцией трансгенной конструкции. Сразу после того как клетка растения была успешно трансформирована, она может быть культивирована для получения трансгенного растения.
Известно большое число экспрессионных векторов, подходящих для управления конститутивной или индуцированной экспрессией вставленных генов в трансформированных растениях. Кроме того, известны различные временные экспрессионные вектора и системы. В большей степени подходящие экспрессионные вектора выбираются для применения в конкретном способе генной трансформации (смотрите ниже). Говоря в общем, типичный растительный экспрессионный вектор для получения трансгенных растений будет содержать представляющий интерес трансген под регуляторным контролем промотора экспрессии, селектируемый маркер для помощи в отборе трансформантов и последовательность терминатора транскрипции.
Более конкретно, основные элементы конструкции нуклеиновой кислоты для применения при получении трансгенных растений по настоящему изобретению представляют собой: подходящий промотор, способный управлять функциональной экспрессией трансгена(ов) в трансформированной клетке растения, трансген(ы) (то есть, GPT кодирующая последовательность), операбельно связанный(ые) с промотором, предпочтительно подходящую последовательность терминации транскрипции (то есть, терминатор гена фермента нопалинсинтазы), операбельно связанную с трансгеном и иногда другие элементы, полезные для контроля экспрессии трансгена, а так же один или более генов селектируемых маркеров, подходящих для отбора целевого трансгенного продукта (то есть, гены антибиотической резистентности).
Так как Agrobacterium tumefaciens является первичной трансформационной системой, применяемой для получения трансгенных растений, существует множество векторов, предназначенных для агробактериальной трансформации. Для стабильной трансформации, агробактериальные системы используют "бинарные" вектора, которые позволяют работать с плазмидами как в Е.coli, так и в агробактериях, и, как правило, содержат один или более селектируемый маркер для определения трансформированных растений (Hellens et al., 2000, Technical focus: A guide to Agrobacterium binary 77 vectors. Trends Plant Sci 5:446-451). Бинарные вектора для применения в агробактериальных трансформационных системах, как правило, содержат границы Т-ДНК, сайты множественного клонирования, репликационные функции для Escherichia coli и A. tumefaciens, и селектируемый маркер и репортерные гены.
Так называемые "супербинарные" векторы обеспечивают более высокую эффективность трансформации, и, как правило, содержат дополнительные гены вирулентности из Ti (Komari et al., 2006, Methods Mol. Biol. 343: 15-41). Супербинарные гены, как правило, применяются в растениях, которые проявляют более низкую эффективность трансформации, как например, злаковые. Такие дополнительные гены вирулентности включают, но без ограничения к этому, virB, virE и virG (Vain et al., 2004, The effect of additional virulence genes on transformation efficiency, transgene integration and expression in rice plants using the pGreen/pSoup dual binary vector system. Transgenic Res. 13: 593-603; Srivatanakul et al., 2000, Additional virulence genes influence transgene expression: transgene copy number, integration pattern and expression. J. Plant Physiol. 157, 685-690; Park et al., 2000, Shorter T-DNA or additional virulence genes improve Agrobacterium-mediated transformation. Theor. Appl. Genet. 101, 1015-1020; Jin et al., 1987, Genes responsible for the supervirulence phenotype of Agrobacterium tumefaciens A281. J. Bacteriol. 169: 4417-4425).
В вариантах выполнения настоящего изобретения, приведенных в настоящем документе (смотрите Примеры ниже), применяются экспрессионные вектора, в которых вставленный(ые) трансген(ы) помещен(ы) под контролем конститутивного CaMV 35S промотора и RuBisCo промотора. Ряд экспрессионных векторов, которые используют CaMV 35S и RuBsCo промотор известны и/или коммерчески доступны и/или могут быть получены с помощью специалистов в данной области техники. Кроме того, множество промоторов, подходящих для управления экспрессией трансгена, известны и могут применяться при осуществлении настоящего изобретения на практике, как описано далее.
Растительные промоторы
В данной области техники известно большое число промоторов, которые действуют в растениях. При составлении GPT и GS трансгенных конструкций выбранным(ыми) промотором(ами) могут быть конститутивные неспецифические промоторы, как например, Cauliflower Mosaic Virus 35S рибосомальный промотор (CaMV 35S промотор), который широко применяется для экспрессии трансгенов в растениях. Примеры других сильных конститутивных промоторов включают, но без ограничения к этому, промотор гена актина 1 риса, CaMV 19S промотор, промотор гена нопалинсинтазы из Ti-плазмиды, промотор гена алкогольдегидрогеназы и промотор гена сахарозсинтазы.
Альтернативно, в некоторых вариантах выполнения настоящего изобретения, может быть предпочтительным выбирать промотор на основе желательных растительных клеток, которые должны быть трансформированы трансгенной конструкцией, желательного уровня экспрессии трансгена, желательного тканевого и субклеточного компартмента для экспрессии трансгена, целевой стадии развития и тому подобного.
Например, когда желательна экспрессия в фотосинтетических тканях и компартментах, может применяться промотор гена рибулозобисфосфаткарбоксилазы (RuBisCo). В приведенных ниже примерах, экспрессируемые конструкции нуклеиновой кислоты, содержащие GPT и GS1 трансгены под контролем промотора томата RuBisCo, были получены и применялись при получении трансгенных растений или для анализа на GPT активность in planta или в Е.coli.
Когда желательна экспрессия в семенах, могут применяться промотры генов различных белков, хранящихся в семенах. Для экспрессии в плодах, может применяться плодспецифичный промотор, такой как томат 2А11. Примеры других тканеспецифичных промоторов включают промоторы, кодирующие лектин (Vodkin et al., 1983, Cell 34:1023-31; Lindstrom et al., 1990, Developmental Genetics 11: 160-167), зерновую алькогольдегидрогеназу 1 (Vogel et al, 1989, J. Cell. Biochem. (Suppl. 0) 13:Part D; Dennis et al., 1984, Nucl. Acids Res., 12(9): 3983-4000), зерновые светоулавливающие комплексы (Simpson, 1986, Science, 233: 34-38; Bansal et al., 1992, Proc. Natl. Acad. Sci. USA, 89: 3654-3658), зерновой белок теплового шока (Odell et al., 1985, Nature, 313: 810-812; Rochester et al., 1986, EMBO J., 5: 451-458), малую субъединицу карбоксилазы RuBP гороха (Poulsen et al., 1986, Mol. Gen. Genet., 205(2): 193-200; Cashmore et al., 1983, Gen. Eng. Plants, Plenum Press, New York, pp 29-38), маннопинсинтазу Ti-плазмиды и нопалинсинтазу Ti-плазмиды (Langridge et al., 1989, Proc. Natl. Acad. Sci. USA, 86: 3219-3223), халкон-изомеразу петунии (Van Tunen et al., 1988, EMBO J. 7(5): 1257-1263), обогащенный глицином белок 1 фасоли (Keller et al., 1989, EMBO J. 8(5): 1309-1314), усеченную CaMV 35s (Odell et al., 1985, выше), пататин картофеля (Wenzler et al., 1989, Plant Mol. Biol. 12: 41-50), корневую клетку (Conkling et al., 1990, Plant Physiol. 93: 1203-1211), кукурузный зеин (Reina et al., 1990, Nucl. Acids Res. 18(21): 6426; Kriz et al., 1987, Mol. Gen. Genet. 207(1): 90-98; Wandelt and Feix, 1989, Nuc. Acids Res. 17(6): 2354; Langridge and Feix, 1983, Cell 34: 1015-1022; Reina et al., 1990, Nucl. Acids Res. 18(21): 6426), глобулин-1 (Belanger and Kriz, 1991, Genetics 129: 863-872), α-тубулин (Carpenter et al., 1992, Plant Cell 4(5): 557-571; Uribe et al., 1998, Plant Mol. Biol. 37(6): 1069-1078), cab (Sullivan, et al., 1989, Mol. Gen. Genet. 215(3): 431-440), Фосфоенолпируваткарбоксилазу (PEPCase) (Hudspeth and Grula, 1989, Plant Mol. Biol. 12: 579-589), R генный комплекс (Chandler et al., 1989, The Plant Cell 1: 1175-1183), халкон-синтазу (Franken et al., 1991, EMBO J. 10(9): 2605-2612) и промоторы глутаминсинтетазы (U.S. Pat. No. 5,391,725; Edwards et al., 1990, Proc. Natl. Acad. Sci. USA 87: 3459-3463; Brears et al., 1991, Plant J. 1(2): 235- 244).
В дополнение к конститутивным промоторам, различные индуцируемые промоторные последовательности могут применяться в случаях, когда желательно регулировать экспрессию трансгена, в то время как трансгенное растение растет, созревает, цветет и т.д. Примеры таких индуцируемых промоторов включают промоторы генов теплового шока, генов, отвечающих за защитные функции (то есть, фенилаланин-аммиак-лиаза; смотрите, например, Bevan et al., 1989, EMBO J. 8(7): 899-906), генов, отвечающих за процессы заживления ран (то есть, гены белков клеточной стенки), химически индуцибельных генов (то есть, нитратредуктаза, хитиназа) и индуцибельных темнотой генов (то есть аспарагинсинтетаза; смотрите, например, патент США №5,256,558). Также ряд растительных ядерных генов активируются светом, включая семейства генов, кодирующие главные хлорофилл а/b связывающие белки (cab), а также малую субъединицу рибулозо-1,5-бисфосфат-карбоксилазы (rbcS) (смотрите, например, Tobin and Silverthorne, 1985, Annu. Rev. Plant Physiol. 36: 569-593; Dean et al., 1989, Annu. Rev. Plant Physiol. 40: 415-439.).
Другие индуцибельные промоторы включают АВА- и тургор-индуцибильные промоторы, промотор гена ауксин-связывающего белка (Schwob et al., 1993, Plant J. 4(3); 423-432), промотор гена UDP-глюкозы флавоноид-глюкозилтрансфераза (Ralston et al., 1988, Genetics 119(1): 185-197); промотор ингибитора MPI протеиназы (Cordero et al., 1994, Plant J. 6(2): 141-150), промотор гена глицеральдегид-3-фосфатдегидрогеназы (Kohler et al., 1995, Plant Mol. Biol. 29(6): 1293-1298; Quigley et al., 1989, J. Mol. Evol. 29(5): 412-421; Martinez et al.,1989, J. Mol. Biol. 208(4): 551-565) и светоиндуцибильного промотора пластидного гена глутаминсинтетазы гороха (патент США №5,391,725; Edwards et al., 1990, выше).
Растительные промоторы, применяемые в трансгенных растениях, рассматриваются в Potenza et al., 2004, In Vitro Cell. Devel. Biol - Plant. 40(1): 1-22. Синтетические растительные промоторы рассматриваются, например, в Venter, M., 2007, Trends Plant Sci., 12(3): 118-124.
Трансген глутамин-фенилпируват-трансаминазы (GPT)
Настоящее изобретение впервые раскрывает, что растения содержат фермент глутамин-фенилпируват-трансаминазу (GPT), который непосредственно участвует в синтезе сигнального метаболита 2-гидрокси-5-оксопролина. До настоящего времени, не описывались растительные глутамин-фенилпируват-трансаминазы с определенной функцией. Заявители выделили и протестировали последовательности, кодирующие GPT полинуклеотид, происходящий из некоторых видов растений и животных, и успешно включили ген в гетерологичное трансгенное растение-хозяин, которое проявляет заметно улучшенные характеристики роста, включая более быстрый рост, более высокое содержания листового белка, повышенную активность глутаминсинтетазы в листовых тканях и более высокие скорости фиксации CO2.
При осуществлении настоящего изобретения на практике, GPT ген выступает в качестве одного из, по меньшей мере, двух трансгенов, введенных в трансгенные растения по настоящему изобретению, причем другим является ген глутаминсинтетазы (смотрите ниже).
Ожидается, что все виды растений содержат GPT, который участвует в том же самом метаболическом пути, включая биосинтез сигнального метаболита 2-гидрокси-5-оксопролина. Таким образом, при практическом осуществлении настоящего изобретения, любой растительный ген, кодирующий GPT гомолог или его функциональные варианты, может применяться при получении трансгенных растений по настоящему изобретению. Более того, установлено структурное подобие между различными белковыми структурами растительного GPT и предполагаемого (и биологически активного) GPT гомолога из Danio rerio (полосатая перцина) (смотрите Пример 22), поэтому и другие нерастительные GPT гомологи могут применяться при получении GPT трансгенов для применения при получении трансгенных растений по настоящему изобретению.
При индивидуальном сравнении (путем BLAST выравнивания) с последовательностью зрелого белка Arabidopsis, SEQ ID NO:30, следующие значения гомологичности и идентичности последовательностей (BLAST "положительность", включая подобные аминокислоты) наблюдались для следующих последовательностей зрелого белка GPT:
Подчеркивая консервативную природу структуры белка GPT для большинства видов растений, консервативность структуры, наблюдаемая для вышеуказанных видов растений, сохранялась и для нечеловеческих предполагаемых GPT из полосатой перцины и Chlamydomonas. В случае полосатой перцины, степень идентичности очень высока (83% идентичности аминокислотной последовательности зрелой Arabidopsis GPT с последовательностью SEQ ID NO:30, и 92% гомологичности, принимая во внимание подобные аминокислотные остатки). Зрелая GPT полосатой перцины была подтверждена путем ее экспрессии в Е.coli, и была продемонстрирована биологическая активность (синтез 2-оксоглутарамата). Для того чтобы определить являются ли предполагаемые GPT гомологи подходящими для получения трансгенных растений по настоящему изобретению с усиленным ростом, прежде всего необходимо экспрессировать их кодирующую последовательность в E.coli или другом подходящем хозяине, и определить синтезируется ли сигнальный метаболит 2-оксоглутарамат на повышенных уровнях (смотрите Примеры 19-23). Если такое увеличение наблюдается, кодирующая последовательность может затем быть введена как в гомологичное растение-хозяин, так и в гетерологичное растение-хозяин, и оцениваются характеристики роста. С этой целью может применяться любой анализ, в ходе которого можно специфично определить 2-оксоглутарамат, включая, но без ограничения к этому, ЯМР и ВЭЖХ анализы, описанные в Примере 2 ниже. Кроме того, могут применяться анализы, в ходе которых непосредственно измеряется активность GPT, такие как анализ активности GPT, описанный в Примере 7.
Любая растительная GPT с активностью синтеза 2-оксоглутарамата может применяться для трансформации растительных клеток, для того, чтобы получить трансгенные растения по настоящему изобретению. Оказывается, что существует высокий уровень структурной гомологии среди видов растений, который, как оказывается, охватывает и двудольные растения, что очевидно, благодаря близкой гомологии между различными растительными GPT белками и предположительным GPT гомологом из перцины полосатой. Поэтому, различные растительные GPT гены могут применяться для получения трансгенных растений с усиленным ростом для разнообразия гетерологичных видов растений. Кроме того, GPT трансгены, экспрессируемые в гомологичном растении, как ожидается, так же приведут к желательным характеристикам усиленного роста (то есть, глутаминтрансаминаза риса сверхэкспрессируется в трансгенных растениях риса), хотя возможно, что регуляция внутри гомологичной клетки может ослаблять экспрессию трансгена некоторым образом, чего может не происходить в гетерологичной клетке.
Трансген глутаминсинтетазы (GS):
При осуществлении изобретения на практике, ген глутаминсинтетазы (GS) функционирует как один из, по меньшей мере, двух трансгенов, включенных в трансгенные растения по настоящему изобретению (причем GPT представляет собой второй из двух трансгенов).
Глутаминсинтетаза играет ключевую роль в метаболизме азота у растений, а также животных и бактерий. GS фермент катализирует добавление аммиака к глутамату с синтезом глутамина в АТФ-зависимой реакции. GS ферменты из разных видов показывают весьма консервативные аминокислотные остатки, которые рассматриваются, как имеющие важное значение для функции активного сайта, что указывает на то, что GS ферменты действуют подобным образом (смотрите Eisenberg et al., Biochimica et Biophysica Acta, 1477:122 145, 2000).
GS распределяется в различных субклеточных положениях (хлоропласт и цитоплазма) и обнаруживается в различных растительных тканях, включая лист, корень, побег, семена и плоды. Существует две основные изоформы растительной GS: цитоплазматическая изоформа (GS1) и пластидная (хлоропластная) изоформа (GS2). GS2 в основном обнаруживается в ткани листа и участвует в ассимиляции аммиака, производимого при фотореспирации или путем восстановления нитрата. GS1 в основном обнаруживается в тканях листа и корня, как правило существует в ряде различных изоформ у высших растений, и участвует в ассимиляции аммиака, получаемого при всех других физиологических процессах (Coruzzi, 1991, Plant Science 74: 145-155; McGrath and Coruzzi, 1991, Plant J. 1(3): 275-280; Lam et al., 1996, Ann. Rev. Plant Physiol. Plant Mot. Biol. 47: 569-593; Stitt, 1999, Curr. Op. Plant Biol. 2: 178-186; Oliveira et al., 2001, Brazilian J. Med. Biol. Res. 34: 567-575). Множество GS генов связано со сложным набором промоторов, которые способны экспрессировать GS в органе и ткани специфическим образом, а также зависимым от факторов окружающей среды образом.
Растительная глутаминсинтетаза состоит из восьми субъединиц, и нативный фермент в растениях имеет молекулярную массу в интервале от 320 до 380 кДа, причем каждая субъединица имеет молекулярную массу в интервале от 38 до 45 кДа. GS1 гены некоторых растений, особенно растений семейства бобовых, были клонированы и упорядочены (Tischer et al., 1986, Mol Gen Genet. 203: 221-229; Gebhardt et al., 1986, EMBO J. 5: 1429-1435; Tingey et al., 1987, EMBO J. 6: 1-9; Tingey et al., 1988, J Biol Chem. 263: 9651-9657; Bennett et al., 1989, Plant Mol Biol. 12: 553-565; Boron and Legocki, 1993, Gene 136: 95-102; Roche et al., 1993, Plant Mol Biol. 22: 971-983; Marsolier et al., 1995, Plant Mol Biol. 27: 1-15; Temple et al., 1995, Mol Plant-Microbe Interact. 8: 218-227). Все, как было обнаружено, кодируются ядерными генами (смотрите, Morey et al., 2002, Plant Physiol. 128(1): 182-193).
Хлоропластная GS2, как оказывается, кодируется одним геном, тогда как различные цитоплазматические изоформы GS1 кодируются мультигенными семействами (Tingey et al., 1987, выше; Sakamoto et al., 1989, Plant Mol. Biol. 13: 611-614; Brears et al, 1991, выше; Li et al., 1993, Plant Mol. Biol., 23: 401-407; Dubois et al., 1996, Plant Mol. Biol., 31: 803-817; Lam et al., 1996, выше). GS1 мультигенные семейства, как оказывается, кодируют различные субъединицы, которые могут объединяться с образованием гомо- или гетерооктамеров, и различные члены проявляют уникальную экспрессионную модель, позволяя предположить, что эти члены, представляющие собой гены, регулируются различным образом, что может быть связано с различными функциональными ролями, которые глутаминсинтетаза играет в общем метаболизме азота (Gebhardt et al., 1986, выше; Tingey et al., 1987, выше; Bennett et al., 1989, выше; Walker and Coruzzi, 1989, выше; Peterman and Goodman, 1991, Mol Gen Genet. 1991:330:145-154.; Marsolier et al., 1995, выше; Temple et al., 1995, выше; Dubois et al., 1996, выше).
В одном варианте выполнения настоящего изобретения, последовательность, кодирующая GS1 ген, применяется для получения GS трансгенных конструкций. В конкретных вариантах выполнения настоящего изобретения, далее описываются в примерах ниже, последовательность, кодирующая Alfalfa или Arabidopsis GS1 ген, применяется для получения трансгенной конструкции, которая может применяться для получения трансгенного растения, экспрессирующего GS1 трансген. В качестве примера, такая конструкция может применяться для трансформации агробактерий. Трансформированные агробактерии затем применяются для получения Т0 трансгенных растений. Пример 5 демонстрирует получение Т0 GS1 трансгенных растений табака, с применением этого подхода. Подобным образом, Примеры 6 и 17 демонстрируют получение Т0 GS1 трансгенных растений томата, Пример 8 демонстрирует получение Т0 GS1 трансгенных растений перца, Примеры 9 и 10 демонстрируют получение Т0 GS1 трансгенных растений фасоли, Примеры 11 и 12 демонстрируют получение Т0 GS1 трансгенных растений вигны, Пример 13 демонстрирует получение Т0 GS1 трансгенных растений alfalfa, Пример 14 демонстрирует получение Т0 GS1 трансгенных растений канталупы, Пример 15 демонстрирует получение Т0 GS1 трансгенных растений тыквы, Пример 16 демонстрирует получение Т0 GS1 трансгенных растений Arabidopsis, и Пример 18 демонстрирует получение Т0 GS1 трансгенных растений канталупы.
Терминаторы транскрипции:
В предпочтительных вариантах выполнения настоящего изобретения 3' последовательность терминации транскрипции встроенная ниже по ходу транскрипции трансгена для того чтобы управлять терминацией транскрипции и позволить корректировать полиадениляцию мРНК транскрипта. Подходящими терминаторами транскрипции являются те, которые, как известно, функционируют в растениях, включая, но без ограничения к этому, гены нопалинсинтазы (NOS) и октопинсинтазы (OCS) Agrobacterium tumefaciens, T7 транскрипт из гена октопинсинтазы, 3' конец генов ингибитора протеазы I или II из картофеля или томата, CaMV 35S терминатор, tml терминатор и rbcS E9 терминатор из гороха. Кроме того, может применяться природный терминатор транскрипции гена. В конкретных вариантах выполнения настоящего изобретения, описанных с помощью приведенных ниже примеров, применяется терминатор транскрипции нопалинсинтазы.
Селекционные маркеры:
Селекционные маркеры, как правило, вводятся в трансгенные экспрессионные вектора для обеспечения средств для отбора трансформантов. В то время как доступны различные типы маркеров, как правило, применяются различные маркеры негативного отбора, включая те, которые подтверждают резистентность к средству селекции, которое ингибирует или убивает нетрансформированные клетки, так как важные гены устойчивы к антибиотикам (таким как канамицин, гентамицин, анамицин, гигромицин и гигромицин В) или устойчивы к гербицидам (таким как сульфонилмочевина, глуфосинат, фосфинотрицин и глифосат). Скринируемые маркеры включают, например, гены, кодирующие β-глюкуронидазу (Jefferson, 1987, Plant Mol. Biol. Rep 5: 387-405), гены, кодирующие люциферазу (Ow et al., 1986, Science 234: 856-859) и различные гены, кодирующие белки, участвующие в продуцировании или регуляции антоцианиновых пигментов (Смотрите, например, патент США 6,573,432). Е.coli ген глюкуронидазы (gus, gusA или uidA) стал широко применяемым селекционным маркером в трансгенике растений, в основном, благодаря стабильности фермента глюкуронидазы, высокой чувствительности и легкому обнаружению (например, флуорометрический метод, спектрофотометрический метод и различные гистохимические методы). Более того, существует по существу не обнаруживаемая глюкуронидаза в большинстве видов высших растений.
Трансформационные способы и системы:
Различные способы введения трансгенных экспрессионных векторных конструкций по настоящему изобретению в растения и клетки растения хорошо известны специалистам в данной области техники, и могут применяться любые способы, подходящие для трансформации целевых растений и клеток растений.
Agrobacterium-опосредованная трансформации, возможно, является наиболее общим способом, применяемым в трансгенике растений, и протоколы Agrobacterium-опосредованной трансформации большого числа растений широко описаны в литературе (смотрите, например, Agrobacterium Protocols, Wan, ed., Humana Press, 2nd edition, 2006). Agrobacterium tumefaciens представляет собой грам-отрицательную почвенную бактерию, которая приводит к образованию опухолей (заболевание корневой рак) у большого числа двудольных видов, через вставку небольшого сегмента опухоль-индуцирующей ДНК (Т-ДНК", 'переносимая ДНК') в клетку растения, который случайным образом встраивается в геном растения, и который, в конечном счете, может стать стабильно встроенным в геном этого растения. Непосредственно повторяющиеся ДНК последовательности, называемые границами Т-ДНК, определяют левый и правый концы Т-ДНК. Т-ДНК может быть физически отделена от остальной части Ti-плазмиды, с получением 'бинарной векторной' системы.
Агробактериальная трансформация может применяться для стабильно трансформирующихся двудольных растений, однодольных растений и их клеток (Rogers et al., 1986, Methods Enzymol., 118: 627-641; Hernalsteen et al., 1984, EMBO J., 3: 3039-3041; Hoykass-Van Slogteren et al., 1984, Nature, 311: 763-764; Grimsley et al., 1987, Nature 325: 167-1679; Boulton et al., 1989, Plant Mol. Biol. 12: 31-40; Gould et al., 1991, Plant Physiol. 95: 426-434). Известны различные способы введения ДНК в Agrobacteria, включая электропорацию, способы замораживания/оттаивания и трипарентальное скрещивание. Наиболее эффективный способ размещения чужеродной ДНК в Agrobacterium представляет собой электропорацию (Wise et al., 2006, Three Methods for the Introduction of Foreign DNA into Agrobacterium, Methods in Molecular Biology, vol. 343: Agrobacterium Protocols, 2/e, volume 1; Ed., Wang, Humana Press Inc., Totowa, NJ, pp.43-53). Кроме того, принимая во внимание, что большой процент Т-ДНК не интегрируется, Agrobacterium-опосредованная трансформация может применяться для получения переходной экспрессии трансгена посредством транскрипционной способности неинкорпорированных молекул трансгенной конструкции (Helens et al., 2005, Plant Methods 1:13).
Большое число векторов и способов агробактериальной трансформации уже описаны (Karimi et al., 2002, Trends Plant Sci. 7(5): 193-5), и многие такие векторы могут быть получены коммерческим путем (например, Invitrogen, Carlsbad, CA). Кроме того, постоянно увеличивается число доступных "открытых источников" векторов агробактериальной трансформации (например, pCambia векторы; Gambia, Canberra, Australia). Смотрите, также приведенную в настоящем документе выше подглаву «Трансгенные конструкции». В конкретном варианте выполнения настоящего изобретения, описанном далее в примерах, основанный на pMON316 вектор применяли в трансформационных системах листовых дисков по Horsch et. al. (Horsch et al., 1995, Science 227: 1229-1231) для получения трансгенных растений табака и томата с усиленным ростом.
Другие общеизвестные способы трансформации, которые могут применяться при получении трансгенных растений по настоящему изобретению, включают, но без ограничения к этому, микропроекционную бомбардировку или биолистические способы трансформации, протопластную трансформацию голой ДНК кальцием, полиэтиленгликолем (PEG) или электропорацию (Paszkowski et al., 1984, EMBO J. 3: 2727-2722; Potrykus et al., 1985, Mol. Gen. Genet. 199: 169-177; Fromm et al., 1985, Proc. Nat. Acad. Sci. USA 82: 5824-5828; Shimamoto et al., 1989, Nature, 338: 274-276.
Биолистическая трансформация включает инъекцию миллионов металлических частиц, покрытых ДНК, в целевые клетки или ткани, применяя биолистическое устройство (или "генную пушку"), некоторые виды которого доступны для приобретения коммерческим путем. Внутри клетки ДНК элюируется с частиц, и часть может стабильно инкорпорироваться в одну или более клеточных хромосом (смотрите Kikkert et al., 2005, Stable Transformation of Plant Cells by Particle Bombardment/Biolistics, in: Methods in Molecular Biology, vol. 286: Transgenic Plants: Methods and Protocols, Ed. L. Pena, Humana Press Inc., Totowa, NJ).
Электропорация - это методика, в ходе которой применяются короткие высокоинтенсивные электрические поля для обратимой пермеабилизации липидных бислоев клеточных мембран (смотрите, например, Fisk and Dandekar, 2005, Introduction and Expression of Transgenes in Plant Protoplasts, in: Methods in Molecular Biology, vol. 286: Transgenic Plants: Methods and Protocols, Ed. L. Pena, Humana Press Inc., Totowa, NJ, pp.79-90; Fromm et al., 1987, Electroporation of DNA and RNA into plant protoplasts, in Methods in Enzymology, Vol.153, Wu and Grossman, eds., Academic Press, London, UK, pp.351-366; Joersbo and Brunstedt, 1991, Electroporation: mechanism and transient expression, sTa6nuu,a transformation and biological effects in plant protoplasts. Physiol. Plant. 81, 256-264; Bates, 1994, Genetic transformation of plants by protoplast electroporation. Mol. Biotech. 2: 135-145; Dillen et al., 1998, Electroporation-mediated DNA transfer to plant protoplasts and intact plant tissues for transient gene expression assays, in Cell Biology, Vol.4, ed., Cells, Academic Press, London, UK, pp.92-99). Суть методики состоит в создании водных пор в клеточной мембране, которые имеют достаточно большой размер, для того чтобы позволить молекулам ДНК (и другим макромолекулам) проникать в клетку, где трансгенная экспрессионная конструкция (как Т-ДНК) может быть стабильно включена в растительную геномную ДНК, приводя к получению трансформированных клеток, из которых могут быть получены трансгенные растения.
Новые способы трансформации включают так называемые "floral dip" способы, которые обеспечивают простоту применения, не предъявляя требований к растительной тканевой культуре, как это происходит в случае других повсеместно применяемых методик трансформации (Bent et al., 2006, Arabidopsis thaliana Floral Dip Transformation Method, Methods Mol Biol, vol. 343: Agrobacterium Protocols, 2/e, volume 1; Ed., Wang, Humana Press Inc., Totowa, NJ, pp.87-103; Clough and Bent, 1998, Floral dip: a simplified method for Agrobacterium-mediated transformation of Arabidopsis thaliana, Plant J. 16: 735-743). Однако, за исключением Arabidopsis, эти способы не находят широкого применения для широкого спектра различных видов растений. Кратко, трансформация «floral dip» выполняется путем окунания цветущих растений в соответствующий штамм Agrobacterium tumefaciens или распыления этого штамма на цветущие растения. Семена, собранные с этих Т0 растений затем выращивают с проведением селекции для идентификации трансгенных T1 растений. Пример 16 демонстрирует «floral dip» инокуляцию Arabidopsis, с получением трансгенных растений Arabidopsis.
Другие способы трансформации включают те, в которых развивающиеся семена или рассада растений трансформируются, с применением векторов, таких как агробактериальные векторы. Например, как показано в Примере 8, такие вектора могут применяться для трансформации развивающихся семян путем инъекции суспензии или смеси вектора (то есть, Agrobacteria) непосредственно в семенную камеру развивающихся стручков (то есть, стручков перца, стручков фасоли, стручков гороха и тому подобного). Рассада может быть трансформирована, как это описано для Alfalfa в Примере 13. Прорастающие семена могут быть трансформированы, как это описано для Camelina в Примере 18. Внутриплодовые способы, в которых вектор вводится посредством инъекции в плод или развивающийся плод, могут применяться, как это описано для дыни Канталупы в Примере 14 и для тыквы обыкновенной в Примере 15.
Еще одни способы трансформации включают те, в которых структура цветка является мишенью для инокуляции вектора, такие как способы инокуляции цветка, описанные для фасоли в Примерах 9 и 10, гороха в Примерах 11 и 12 и томата в Примере 17.
Вышеизложенные методики трансформации растения могут применяться для введения трансгенов в ряд различных растительных клеток и тканей, включая, но без ограничения к этому, целые растения, экспланты (органы и ткани), включая хлоропласты, цветущие ткани и клетки, протопласты, меристемные клетки, каллюс, незрелые эмбрионы и гаметы, такие как микроспоры, пыльца, спермии и яйцеклетки, тканевые культивируемые клетки любого из вышеизложенных, любые другие клетки, из которых может быть получено плодородное регенерированное трансгенное растение. Калюс возникает из тканевых источников, включая, но без ограничения к этому, незрелые эмбрионы, апикальные меристемы рассады, микроспоры и тому подобное. Клетки, способные к пролиферации как каллюс, также представляют собой реципиентные клетки для генетической трансформации.
Способы регенерации растений из трансформированных растительных клеток, тканей или органов, хорошо известны и описаны для множества различных видов растений.
Как проиллюстрировано, трансформированные ростки (полученные из трансформированных клеток или тканей) культивируют в питательной среде, подходящей для развития корневой системы, дополненной селективным агентом, применяемым при трансформации (то есть, антибиотик, такой как канамицин. Сразу после развития корневой системы, трансформированные растения переносят в почву и дают им возможность расти до состояния зрелого растения. При цветении, зрелые растения предпочтительно самоопыляются (самооплодотворяются), и полученные семена собирают и применяют для получения последующих поколений. Примеры 3-6 показывают регенерацию трансгенных растений табака и томата.
Т0 трансгенные растения могут применяться для получения последующих поколений (например, T1, T2, и т.д.) путем самоопыления первичных или вторичных трансформантов, или путем полового скрещивания первичных или вторичных трансформантов с другими растениями (трансформированными или нетрансформированными). Например, как описано в Примере 7, приведенном ниже, отдельные растения, сверхэкспрессирующие Alfalfa GS1 ген и обладающие улучшенными характеристиками по сравнению с растениями дикого типа, были скрещены с отдельными растениями, сверхэкспрессирующими Arabidopsis GPT ген и обладающими улучшенными характеристиками по сравнению с растениями дикого типа, путем простого полового скрещивания, применяя ручной перенос пыльцы. Реципрокные кроссы были сделаны таким образом, что каждое растение служило в качестве мужской особи в одном ряде кроссов, и каждое растение служило в качестве женской особи во втором ряде кроссов. В ходе стадии роста растения до зрелого состояния, растения, как правило, исследуют на фенотип роста, скорость фиксации СО2 и т.д. (смотрите следующий раздел).
Отбор трансгенных растений с усиленным ростом:
Трансгеннные растения могут подвергаться селекции, скринингу и могут быть охарактеризованы с помощью стандартных методик. Предпочтительные трансгенные растения по настоящему изобретению проявляют одну или более фенотипических характеристик, указывающих на усиленный рост и/или другие желательные агрономические признаки. Трансгенные растения как правило регенерируются при селективном давлении, для того чтобы отобрать трансформанты прежде, чем создавать следующие поколения трансгенных растений. Кроме того, используемое селективное давление может применяться и в отношении поколений, следующих за Т0 поколением, чтобы обеспечить присутствие желательной трансгенной экспрессионной конструкции или кассеты.
Т0 трансформированные растительные клетки, каллюсы, ткани или растения могут быть идентифицированы и выделены путем селекции и скрининга по набору генов и/или фенотипическим характеристикам, закодированным маркерными генами, содержащимися в трансгенной экспрессионной конструкции, применяемой для трансформации. Например, селекция может проводиться путем выращивания потенциально трансформированных растений, тканей или клеток в питательной среде, содержащей подавляющее количество антибиотика или гербицида, к которому трансформирующая генетическая конструкция может обеспечивать резистентность. Кроме того, трансформированные растительные клетки, ткани и растения могут быть идентифицированы посредством скрининга по активности маркерных генов (т.е. β-глюкуронидазы), которые могут присутствовать в трансгенной экспрессионной конструкции.
Различные физические и биохимические способы, которые могут применяться для идентификации растений, содержащих желательную трансгенную экспрессионную конструкцию, также известны. Примеры таких способов включают Саузерн-блот анализ или различные способы амплификации нуклеиновых кислот (то есть, ПЦР) для идентификации трансгена, трансгенной экспрессионной конструкции или ее элементов, Нозерн-блоттинг, S1 рибонуклеазный анализ, ПЦР амплификация с обратной транскриптазой (ОТ-ПЦР) для обнаружения и определения РНК продуктов транскрипции и гель-электрофорез белков, Вестерн-блоттинг, иммунопреципитация, ферментный иммунологический анализ и подобные способы могут применяться для идентификации белков закодированных и экспрессированных трансгеном.
В другом подходе, уровни экспрессии генов, белков и/или метаболических соединений, которые, как известно, модулируются посредством экспрессии трансгена в целевом растении, могут применяться для идентификации трансформантов. В одном варианте выполнения настоящего изобретения, повышенные уровни сигнального метаболита 2-оксоглутарамата могут применяться для скрининга на желательные трансформанты, как показано в примерах. Подобным образом, повышенные уровни GPT и/или GS активности могут быть оценены, как показано в Примерах.
В конце концов, трансформированные растения по настоящему изобретению могут скринироваться на усиленный рост и/или другие желательные агрономические характеристики. На самом деле, некоторая степень фенотипического скрининга, в общем, желательна для идентификации трансформированных линий с более высокими скоростями роста, наивысшим урожаем семян, и т.д., особенно когда выбирают растения для последующего самоопыления, скрещивания и обратного скрещивания. В этих целях могут применяться различные параметры, включая, но без ограничения к этому, скорости роста, общую массу сырой ткани, сухой вес, урожай семян и плодов (количество, масса), размеры семян и/или семенных коробочек, урожай семенных коробочек (например, количество, масса), размеры листьев, размеры растений, усиленное цветение, период времени до начала цветения, общее содержание белка (в семенах, плодах, растительных тканях), содержание конкретного белка (то есть, GS), содержание азота, свободная аминокислота и специфические уровни метаболического соединения (то есть, 2-оксоглутарамата). В общем, эти фенотипические измерения сравнивают с полученными для родоначальной идентичной или аналогичной растительной линии, нетрансформированного идентичного или аналогичного растения, или идентичного или аналогичного растения дикого типа (то есть, нормальное или родоначальное соединение). Предпочтительно, по меньшей мере, первоначально, измерения выбранной фенотипической характеристики (характеристик) в целевом трансгенном растении осуществляют параллельно с измерением такой же характеристики (характеристик) в нормальном или родоначальном соединении. Как правило, множество растений применяются для установления фенотипической привлекательности и/или фенотипического превосходства трансгенного растения в отношении любой конкретной фенотипической характеристики.
Предпочтительно, выбираются первичные трансформанты, и затем они применяются для получения T1 и последующих генераций путем самоопыления (самооплодотворения), до тех пор, пока трансгенный генотип сохраняет способность передавать признак потомству (то есть, растение является гомозиготным в отношении трансгена). На самом деле, это осуществляется путем скрининга каждой генерации на желательные признаки и самоопыления растений, у которых были обнаружены желательные признаки, часто повторно (то есть 3 или 4 генераций). Как показано в настоящем документе, линии трансгенных растений, полученные размножением посредством, по меньшей мере, одного полового скрещивания (Табак, Arabidopsis, Томат), проявляют более высокие активности трансгенного продукта, по сравнению с линиями, которые не были получены путем полового размножения и сопутствующего увеличения числа копий трансгена.
Стабильные трансгенные линии могут подвергаться скрещиванию и обратному скрещиванию для получения разновидностей с любым числом желательных признаков, включая признаки, заложенные трансгенами, многочисленными копиями трансгена и т.д. Кроме того, стабильные трансгенные растения могут затем быть генетически модифицированы, путем трансформации таких растений следующими трансгенами или дополнительными копиями первоначального трансгена. Также рассматриваются трансгенные растения, полученный посредством единичного события трансформации, в ходе которого вводятся множество копий данного трансгена или множество трансгенов. Различные обычные способы размножения хорошо известны специалистам в данной области техники (смотрите, например, Breeding Methods for Cultivar Development, Wilcox J. ed., American Society of Agronomy, Madison Wis. (1987)).
В качестве еще одного объекта, настоящее изобретение раскрывает трансгенные растения, отличающиеся повышенной эффективностью использования азота. Эффективность использования азота может выражаться как выход растения на данное количество азота. В приведенных в настоящем документе примерах, все трансгенные и контрольные растения получали одинаковые растворы азота в одинаковых количествах. Все трансгенные растения отличались более высоким выходом, и, таким образом, имели более высокую эффективность использования азота.
В качестве еще одного объекта настоящее изобретение раскрывает трансгенные растения и их семена с повышенной толерантностью к высокосолевым условиям роста. Этот объект настоящего изобретения показан в Примере 24, в котором описывается прорастание семян трансгенного растения табака в условиях с очень высоким содержанием соли (200 мМ NaCl). В то время как семена аналогичного растения табака дикого типа прорастали при скорости, в среднем, только около 10%, семена трансгенного растения табака достигли почти той же скорости прорастания, которая достигается в бессолевых условиях как семенами трансгенных растений, так и семенами растений дикого типа, или около 92%.
ПРИМЕРЫ
Различные объекты настоящего изобретения далее описываются и иллюстрируются посредством примеров, которые, однако, не предназначены для ограничения объема настоящего изобретения.
ПРИМЕР 1: Выделение гена глутамин-фенилпируват-трансаминазы (GPT) из ARABIDOPSIS:
При попытке обнаружить месторасположение растительного фермента, который непосредственно участвует в синтезе сигнального метаболита 2-оксоглутарамат, заявители предположили, что предполагаемый растительный фермент может иметь некоторую степень структурного родства с человеческим белком, который был охарактеризован, как участвующий в синтезе 2-оксоглутарамата. Человеческий белок, глутамин трансаминаза K (Е.С. 2.6.1.64) (также упоминаемый в литературе как цистеинконъюгат β-лиаза, кинуренин-аминотрансфераза, глутамин-фенилпируват-трансаминаза и под другими названиями), как было показано, участвует в процессинге цистеинконъюгатов галогенированных ксенобиотиков (Perry et al., 1995, FEBS Letters 360:277-280). Однако, человеческая цистеинконъюгат β-лиаза скорее проявляет детоксирующую активность в организме человека и животных, чем обладает активностью, связанной с участием в ассимиляции азота (Cooper and Meister, 1977, выше). Тем не менее, возможное участие этого белка в синтезе 2-оксоглутарамат представляет большой интерес.
Применяя белковую последовательность человеческой цистеинконъюгат β-лиазы, поиск по TIGR Arabidopsis базе данных белковых последовательностей позволил выявить одну потенциально родственную последовательность, полипептид, закодированный частичной последовательностью Arabidopsis локуса при At1q77670, причем около 36% последовательности обладает гомологией/идентичностью для выровненных областей.
Полная кодирующая область гена была затем амплифицирована из библиотеки кДНК Arabidopsis (Стратаген) с помощью следующей пары праймеров:
5'-CCCATCGATGTACCTGGACATAAATGGTGTGATG-3' [SEQ ID NO:37]
5'-GATGGTACCTCAGACTTTTCTCTTAAGCTTCTGCTTC-3' [SEQ ID NO:38]
Эти праймеры предназначены для включения Cla I (ATCGAT) и Kpn I (GGTACC) сайтов рестрикции с целью облегчения субклонировния последовательности в экспрессионные вектора для генерации трансгенных растений. Фермент Takara ExTaq ДНК-полимераза применялась для проведения высокоточной ПЦР при следующих условиях: первоначальное денатурирование при 94°С в течение 4 минут, 30 циклов при 94°С в течение 30 секунд, отжиг при 55°С в течение 30 секунд, удлинение при 72°С в течение 90 секунд, конечное удлинение при 72°С в течение 7 минут. Продукт амплификации подвергли действию Cla I и Kpn I ферментов рестрикции, выделили с помощью электрофореза в агарозном геле, и лигировали в вектор pMon316 (Rogers, et. al. 1987 Methods in Enzymology 153:253-277), который содержит 35S конститутивный промотор вируса мозаики цветной капусты (CaMV, также CMV) и 3' терминатор нопалинсинтазы (NOS). Продукт лигирования трансформировали в DH5α клетки, и установили последовательности трансформантов для проверки вставки.
кДНК размером 1.3 тысяч пар нуклеотидов (kb) выделили, и определили его последовательность, и обнаружили, что он кодирует белок полной длины составляющий 440 аминокислот в длину, включая предполагаемую хлоропластную сигнальную последовательность.
ПРИМЕР 2: Получение биологически активной рекомбинантной ARABIDOPSIS глутамин-фенилпируват трансаминазы (GPT):
Для того чтобы проверить способен ли белок, кодируемый кДНК, выделенной как описано в Примере 1, приведенном выше, катализировать синтез 2-оксоглутарамата, кДНК экспрессировали в E.coli, очистили и исследовали его способность синтезировать 2-оксоглутарамат, применяя стандартный способ.
ЯМР анализ 2-оксоглутарамата:
Кратко, полученный очищенный белок добавили к реакционной смеси, содержащей 150 мМ Трис-HCl, рН 8.5, 1 мМ бета-меркаптоэтанола, 200 мМ глутамина, 100 мМ глиоксилата и 200 мкМ пиридоксаль-5'-фосфата. Реакционную смесь, без добавления тестируемого белка, применяли в качестве контроля. Тестируемую и контрольную реакционные смеси инкубировали при 37°С в течение 20 часов, и затем осветлили центрифугированием с удалением осажденного материала. Супернатанты проанализировали на наличие и количество 2-оксоглутарамата, применяя 13С ЯМР с аутентичным синтезированным химическим путем 2-оксоглутараматом в качестве контроля. Продуктами реакции являются 2-оксоглутарамат и глицин, в то время как количество субстратов (глутамина и глиоксилата) сильно уменьшилось. Циклический 2-оксоглутарамат дает отдельный сигнал, который можно легко отличить от глутаминового предшественника с открытой цепью.
ВЭЖХ анализ 2-оксоглутарамата:
При альтернативном анализе GPT активности применяется ВЭЖХ для определения присутствия 2-оксоглутарамата, следуя модификации Calderon et al., 1985, J Bacteriol 161(2): 807-809. Кратко, модифицированный экстракционный буфер содержит 25 мМ Трис-HCl рН 8.5, 1 мМ EDTA, 20 мкМ FAD, 10 мМ Цистеина и около 1.5% (об/об) меркаптоэтанола. Образцы ткани, взятые у тестируемого материла (то есть растительной ткани), добавляли к экстракционному буферу при соотношении около 1/3 (масс./об), инкубировали в течение 30 минут при 37°С, и остановили реакцию с помощью 200 мкл 20% ТСА. По истечению около 5 минут, анализируемую смесь центрифугировали, и супернатант применяли для определения количества 2-оксоглутарамата с помощью ВЭЖХ, применяя ION-300 7.8 мм ID Х 30 см L колонку, с подвижной фазой 0.01 Н H2SO4, скоростью потока около 0.2 мл/мин, при 40°С. Впрыскиваемый объем составлял около 20 мкл, и время удерживания составляло от 38 до 39 минут. Обнаружение проводилось при помощи УФ излучения с длиной волны 210 нм.
Результаты проведения ЯМР анализа:
Настоящий эксперимент позволил определить, что тестируемый белок способен катализировать синтез 2-оксоглутарамата. Поэтому эти данные указывают на то, что выделенная кДНК кодирует глутамин-фенилпируват-трансаминазу, которая непосредственно участвует в синтезе 2-оксоглутарамата в растениях. Соответственно, тестируемый белок может быть обозначен как Arabidopsis глутамин-фенилпируват-трансаминаза или "GPT".
Нуклеотидная последовательность последовательности, кодирующей Arabidopsis GPT. приведена в Таблице последовательностей, SEQ ID NO. 1. Транслируемая аминокислотная последовательность GPT белка показана как SEQ ID NO. 2.
ПРИМЕР 3: Создание трансгенных растений табака, сверхэкспрессирующих ARABIDOPSIS GPT:
Создание экспрессионного растительного вектора pMON-PJU:
Кратко, растительный экспрессионный вектор pMon316-PJU был сконструирован следующим образом. Выделенную кДНК, кодирующую Arabidopsis GPT (Пример 1), клонировали в Clal-Kpnl полилинкерный сайт pMON316 вектора, который содержит GPT гене под контролем конститутивного 35S промотора вируса мозаики цветной капусты (CaMV) и терминатор транскрипции нопалинсинтазы. Ген резистентности к канамицину включили для обеспечения селектируемого маркера
Agrobacterium-опосредованные трансформации растений:
pMON-PJU и контрольный вектор pMon316 (без вставки ДНК) перенесли в штамм pTiTT37ASE Agrobacterium tumefaciens, применяя стандартный метод электропорации (McCormac et al., 1998, Molecular Biotechnology 9: 155-159), с последующим нанесением на LB пластины, содержащие антибиотики спектиномицин (100 мкг/мл) и канамицин (50 мкг/мл). Резистентные к антибиотикам колонии агробактерий исследовали с помощью ПЦР на содержание в них плазмиды.
Растения табака (Nicotiana tabacum cv. Xanthi) трансформировали с применением pMON-PJU трансформированных агробактерий, применяя систему трансформации листового диска по Horsch et. al. (Horsch et al., 1995, Science 227: 1229-1231). Кратко, стерильные листовые диски инокулировали и культивировали в течение двух дней, затем перенесли в селективную MS среду, содержащую 100 мг/мл канамицина и 500 мг/мл клафарана. Трансформанты подтверждали по их способности формировать корни в селективной среде.
Получение GPT трансгенных растений табака:
Из стерильных листовых сегментов получили каллюс на Murashige & Skoog (M&S) среде, из которой выходили наружу ростки трансформантов. Эти ростки затем переносили в селекционную среду, позволяющую формирование корневой системы (M&S среда с канамицином в качестве средства селекции). Здоровые трансформированные растения табака с развитой корневой системой затем перенесли в почву и дали им возможность развиться до зрелого состояния, при цветении растения самоопылялись, и полученные семена собрали. В процессе стадии роста растения исследовали на фенотип роста и скорость фиксации CO2 для многих молодых трансгенных растений.
Получение Т1 и Т2 генерации GPT трансгенных растений:
Семена, собранные у Т0 генерации трансгенных растений табака, прорастали на M&S среде, содержащей канамицин (100 мг/л) для определения трансгена. По меньшей мере, каждое четвертое из семян не прорастало на этой среде (канамицин, как ожидается, ингибирует прорастание семян без резистентности, которые могли бы быть получены в результате нормальной генетической сегрегации гена), и более чем половина прорастающих семян была исключена, так как они показали чувствительность (даже умеренную) к канамицину.
Выживающие растения (T1 генерация) бурно разрастались, и эти растения самоопылялись с получением семян для T2 генерации. Семена от T1 генерации прорастали на MS среде, дополненной канамицином (10 мг/л) для определения линий трансформантов. Через 14 дней они были перенесены в песок с добавлением питательного раствора Хогланда четвертной концентрации с 25 мМ нитрата калия. Семенам обеспечили рост при 24°C с фотопериодом 16 часов света и 8 часов темноты, с интенсивностью света 900 микромолей на метр квадратный на секунду. Урожай собрали через 14 дней после переноса в песок.
Характеристика GPT трансгенных растений:
Собранные трансгенные растения (как GPT трансгены, так и векторные контрольные трансгены) проанализировали на активность глутаминсинтетазы в корне и листе, массу сырой ткани всего растения, общий белок в корне и листе, и скорость фиксации CO2 (Knight et al., 1988, Plant Physiol. 88: 333). Нетрансформированные растения A. tumefaciens дикого типа анализировали по тем же самым параметрам для того, чтобы установить базовый контроль.
Результаты определения характеристик роста приведены в Таблице I ниже. Дополнительно, фотография GPT трансгенного растения в сравнении с контрольным растением дикого типа показана на ФИГ.2 (вместе с GS1 трансгенным растением табака, смотрите Пример 5). По всем проанализированным параметрам, GPT трансгенные растения табака показали улучшенные характеристики роста. В частности, GPT трансгенные растения показали увеличение скорости фиксации CO2 более чем на 50%, и увеличение активности глутаминсинтетазы в ткани листа более чем в два раза, по сравнению с контрольными растениями дикого типа. Кроме того, GS соотношение лист: корень увеличилось почти в три раза в трансаминазных трансгенных растениях по сравнению с контролем дикого типа. Масса сырой ткани и количество общего белка увеличились в трансгенных растениях на около 50% и 80% (лист) соответственно по отношению к контролю дикого типа. Эти данные демонстрируют, что растения табака, сверхэкспрессирующие Arabidopsis GPT трансген, достигают значительно усиленного роста и увеличенной скорости фиксации CO2.
ПРИМЕР 4: Получение трансгенных растений томата, несущих ARABIDOPSIS GPT трансген:
Трансгенные растения томата Lycopersicon esculentum (Micro-Tom Tomato), несущие Arabidopsis GPT трансген, были получены, с применением векторов и способов, описанных в Примере 3. Т0 трансгенные растения томата генерировали и выращивали до зрелости. Данные по характеристикам начального роста GPT трансгенных растений томата приведены в Таблице II. Трансгенные растения показали значительное увеличение скорости роста, усиление цветения и увеличение урожая семян по сравнению с контрольными растениями дикого типа. Кроме того, у трансгенных растений развилось множество главных стеблей, тогда как у растений дикого типа развивался только один главный стебель. Фотография GPT трансгенного растения томата, в сравнении с растением дикого типа, приведена на ФИГ.3 (вместе с GS1 трансгенными растениями томата, смотрите Пример 6).
ПРИМЕР 5: Получение трансгенных растений табака, сверхэкспрессирующих ALFALFA GS1:
Получение растительного экспрессионного вектора pGS111:
Трансгенные растения табака, сверхэкспрессирующие Alfalfa GS1 ген, получали, как описано ранее (Temple et al., 1993, Mol. Gen. Genetics 236: 315-325). Кратко, растительный экспрессионный вектор pGS111 составляли путем вставки кодирующей последовательности полной длины, вместе с протяженными областями как 5', так и 3' нетранслируемых областей Alfalfa GS1 гена [SEQ ID NO:3] (DasSarma at al., 1986, Science, Vol 232, Issue 4755, 1242-1244) в pMON316 (Rogers et al., 1987, выше), помещения трансгена под контролем конститутивного 35S промотора вируса мозаики цветной капусты (CaMV) и терминатора транскрипции нопалинсинтазы (NOS). Ген резистентности к канамицину был включен для обеспечения селектируемого маркера.
Получение GS1 трансформантов:
pGS111 перенесли в штамм pTiTT37ASE Agrobacterium tumefaciens, применяя трипарентальное скрещивание, как описано (Rogers et al., 1987, выше; Unkefer et al., U.S. Patent No. 6,555,500). Nicotiana tabacum cv. Xanthi трансформировали pGS111 трансформированными агробактериями, применяя трансформационную систему листового диска по Horsch et. al. (Horsch et al., 1995, Science 227: 1229-1231). Трансформанты подвергали селекции и регенерации на MS среде, содержащей 100 мкг/мл канамицина. Корневая система ростков развивалась в той же самой среде (с канамицином, без гормонов), и затем ростки переносили в среду почва:перлит:вермикулит (3:1:1), выращивали до зрелости и обеспечивали возможность самоопыления. Собирали семена этой Т0 генерации, и последующие генерации получали самоопылением и последующей селекцией с применением канамицина. Растения с наилучшим ростом применяли для получения Т3 потомства для скрещивания с наилучшими линиями, сверхэкспрессирующими GPT, определенными как показано в Примере 3. Фотография GS1 трансгенного растения и его сравнение с контрольным растением дикого типа показаны на ФИГ.2 (вместе с GPT трансгенным растением табака, смотрите Пример 3)
ПРИМЕР 6: Получение трансгенных растений томата, несущих ALFALFA GS1 трансген:
Трансгенные растения томата Lycopersicon esculentum (Micro-Tom Tomato), несущие Alfalfa GS1 трансген, получали, применяя вектор, описанный в Пример 5, и протокол трансформации по существу раскрывается в (Sun et al., 2006. Plant Cell Physiol. 46(3) 426-31). T0 трансгенные растения томата генерировали и выращивали до зрелости. Данные по характеристикам начального роста GPT трансгенных растений томата представлены в Таблице III. Трансгенные растения показали значительное увеличение скорости роста, ускорение цветения и увеличение урожая по сравнению с контрольными растениями дикого типа. Кроме того, у трансгенных растений развилось множество главных стеблей, тогда как у растений дикого типа развивался только один главный стебель. Фотография GS1 трансгенного растения томата, в сравнении с растением дикого типа, приведена на ФИГ.3 (вместе с GPT трансгенными растениями томата, смотрите Пример 4).
ПРИМЕР 7: Получение трансгенных растений табака, несущих GS1 и GPT трансгены:
При попытке определить может ли комбинация GS1 и GPT трансгенов в одном трансгенном растении приводить к таким улучшениям, при которых рост и другие агрономические характеристики могут быть усилены, был проведен ряд половых скрещиваний между высокопродуктивными линиями трансгенных растений с одним трансгеном (GS1 или GPT). Полученные результаты являются просто потрясающими, так как эти кроссы повторно генерировали растения потомства, имеющие удивительные и ранее не наблюдаемые увеличения скоростей роста, выхода биомассы и урожая семян.
Материалы и способы:
Трансгенные растения табака с одним трансгеном, сверхэкспрессирующие GPT или GS,1 получили, как описано в Примерах 3 и 4, соответственно. Несколько наиболее быстрорастущих линий GPT трансгенных растений Т2 генерации скрещивали с наиболее быстрорастущими линиями GS1 трансгенных растений ТЗ генерации, применяя реципрокные скрещивания. Потомство затем подвергали селекции на содержащей канамицин среде M&S, как описано в Примере 3, и исследовали рост, цветение и выход семян растений.
Тканевые экстракты для определения GPT и GS активностей: тканевый экстракт для определения GPT активности экстрагировали из сырой ткани растения после измельчения в 100 мМ холодной Трис-HCl, рН 7.6, содержащей 1 мМ этилендиаминтетрауксусной кислоты, 200 мМ пиридоксальфосфата и 6 мМ меркаптоэтанола при соотношении: 3 мл на грамм ткани. Экстракт осветляли путем центрифугирования и применяли в анализе. Тканевый экстракт для определения GS активности экстрагировали из сырой ткани растения после измельчения в 50 мМ холодного имидазола, рН 7.5, содержащего 10 мМ MgCl2 и 12.5 мМ меркаптоэтанола при соотношении: 3 мл на грамм ткани. Экстракт осветляли путем центрифугирования и применяли в анализе. GPT активность анализировали как описано в Calderon and Mora, 1985, Journal Bacteriology 161: 807-809. GS активность измеряли как описано в Shapiro and Stadtmann, 1970, Methods in Enzymology 17A: 910-922. Оба анализа включали инкубацию с субстратами и кофактором при соответствующем рН. Обнаружение проводили с помощью ВЭЖХ.
Результаты:
Приводятся два вида представления результатов. Первый: конкретные характеристики роста приведены в Таблицах IV.A и IV. В (биомасса, выход семян, скорость роста, GS активность, GPT активность, 2-оксоглутараматная активность и т.д.). Второй: фотографии растений потомства и их листьев показаны в сравнении с растениями с одним трансгеном и растениями дикого типа и их листьями на ФИГ.5 и ФИГ.6, где видно, что растения с двумя трансгенами показывают намного более большие размеры всего растения, намного более большие листья и более раннее и/или более обильное цветение по сравнению с родоначальными растениями с одним трансгеном или контрольными растениями дикого типа.
Как видно из Таблицы IV.A, растения потомства с двумя трансгенами, составляющие эти кроссы, показали удивительное увеличение общей биомассы (масса сырой ткани), причем масса сырой ткани лежала в интервале 45-89 грамма на отдельное растение потомства, по сравнению с 19-24 граммами на отдельное растение дикого типа, то есть среднее значение увеличения является двух- или трехкратным, и являются высокопроизводительными, так как наблюдается удивительное четырехкратное увеличение биомассы по сравнению с растениями дикого типа. Принимая во внимание значения, полученные для 24 растений потомства с двумя трансгенами, средняя биомасса для одного растения была в около 2.75 выше среднего значения биомассы для контрольных растений дикого типа. Четыре линии потомства показали увеличение средней массы сырой ткани на одно растение в около 2.5 раз, тогда как две линии показали трехкратное увеличение массы сырой ткани по сравнению с растениями дикого типа.
По сравнению с линиями поколений с одним трансгеном, дважды трансгенные растения потомства показали более чем аддитивное усиление роста. Тогда как GPT линии с одним трансгеном показали 50% увеличение биомассы по сравнению с диким типом, и GS1 линии с одним трансгеном показали 66% увеличения, растения потомства показали увеличение почти 200% по сравнению с растениями дикого типа.
Подобным образом, растения потомства, несущие два трансгена, зацветали раньше и более интенсивно, чем родительские линии дикого типа и родительские линии с одним трансгеном, и образовывалось намного больше семенных коробочек, а также семян в целом на растение. Принимая во внимание данные, приведенные в Таблице IV.A, в среднем, у дважды трансгенного потомства образовывалось в два раза больше семенных коробочек по сравнению с растениями дикого типа, причем у двух из высокопродуктивных растений образовывалось число семенных коробочек более чем в три раза превышающее число семенных коробочек у растений дикого типа. Общий выход семян растений потомства, измеренный по отношению к массе растения, был в два-четыре раза выше, чем для растений дикого типа.
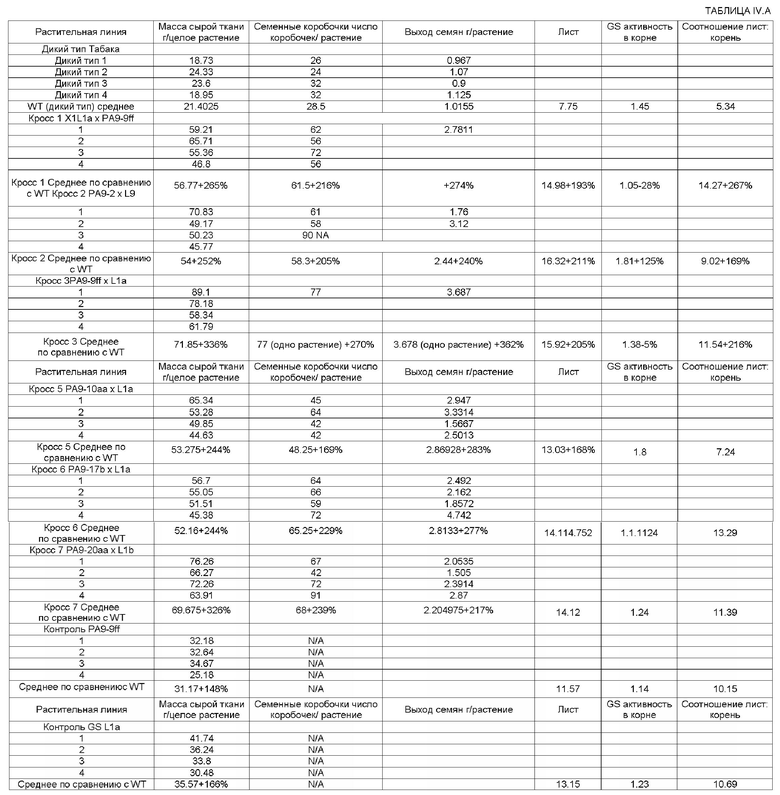
Таблица IV.В показывает скорость роста, биомассу и выход и биохимические характеристики линии XX (линия 3 далее самоопыляется), по сравнению с линией с одним трансгеном, экспрессирующей GS1, и контрольным растением табака дикого типа. Все параметры значительно улучшились для трансгенных растений, несущих два трансгена (Линия XX). Необходимо отметить, что 2-оксоглутараматная активность была выше почти в 17 раз, и выход семян и лиственной биомассы был в три раза выше для растений линии XX по сравнению с контрольными растениями
ПРИМЕР 8: Получение дважды трансгенных растений перца с двумя трансгенами GS1 и GPT:
В этом примере, растения перца Big Jim chili (сорт New Mexico) трансформировали Arabidopsis GPT кодирующей последовательностью SEQ ID NO:1 полной длины под контролем CMV 35S промотора, и Arabidopsis GS1 кодирующей последовательностью, включенной в SEQ ID NO:6, под контролем RuBisCo промотра, применяя Agrobacterium-опосредованный перенос в семенные коробочки. Через 3 дня семена собрали и применяли для трансформации Т0 растений и скринировали на наличие трансформантов. Полученные дважды трансгенные растения показали более высокое число коробочек, более высокие скорости роста и более значительную биомассу по сравнению с контрольными растениями.
Материалы и способы:
Растения перца Solanaceae Capisicum ("Big Jim" сорт) трансформировали Arabidopsis GPT кодирующей последовательностью SEQ ID NO:1 полной длины под контролем CMV 35S промотора внутри экспрессионного вектора pMON (смотрите Пример 3), и Arabidopsis GS1 кодирующей последовательностью, включенной в SEQ ID NO:6, под контролем RuBisCo промотора внутри экспрессионного вектора pCambia 1201 (Tomato rubisco rbcS3C промотор: Kyozulka et al., 1993, Plant Physiol. 103: 991-1000; SEQ ID NO:22; векторная конструкция SEQ ID NO:6), применяя Agrobacterium-опосредованный перенос в семенные коробочки.
В этом и последующих примерах Gambia 1201 или 1305.1 векторы были сконструированы согласно стандартным способам клонирования (Sambrook et al., 1989, выше, Saiki et al., 1988, Science 239: 487-491). Вектор снабдили 35S CaMV промотором; этот промотор заменили на RcbS-3С промотор из томата для контроля экспрессии целевого гена. Векторы Gambia 1201 содержат гены селектируемого маркера резистентности к бактериальному хлорфениколу и растительному гигромицину. Векторы Gambia 1305.1 содержат гены селектируемого маркера резистентности к бактериальному хлорфениколу и гигромицину.
Трансгенные экспрессионные векторы pMON (GPT трансген) и pCambia 1201 (GS трансген) перенесли в выделенные культуры штамма LBA4404 Agrobacterium tumefaciens, применяя стандартный способ электропорации (McCormac et al., 1998, Molecular Biotechnology 9:155-159).
Трансформированные агробактерии отобрали на среде, содержащей 50 мкг/мл либо стрептомицина для pMON конструкций, либо хлорамфеникола для Cambia конструкций. Трансформированные клетки агробактерии выращивали на LB культуральной среде, содержащей 25 мкг/мл антибиотика в течение 36 часов. В конце 36 часового периода роста клетки собрали путем центрифугирования, и клетки для каждой трансформации ресуспендировали в 100 мл LB бульона без антибиотика.
Растения перца затем трансформировали смесью полученных суспензий клеток агробактерии, применяя протокол трансформации, в котором агробактерию вводили путем инъекции непосредственно в семенную камеру развивающихся стручков. Кратко, в развивающиеся коробочки вводили путем инъекции 200 мл смеси для того, чтобы инокулировать незрелые семена агробактерией, по существу, как описано (Wang and Waterhouse, 1997, Plant Mol. Biol. Reporter 15: 209-215). Для того, чтобы индуцировать вирулентность агробактерии и улучшить эффективность трансформации, 10 мкг/мл ацетосирингонона добавили к культурам агробактерии до инокуляции стручков (смотрите, Sheikholeslam and Weeks, 1986, Plant Mol. Biol. 8: 291-298).
Применяя шприц, в стручки ввели инъекцию количества векторной смеси агробактерии с запасом, и инкубировали в течение около 3 дней. Семена затем собрали и дали им возможность прорастать, и за развивающимися растениями наблюдали в отношении их фенотипических характеристик, включая рост и резистенотность к антибиотикам. Растения, несущие трансгены, были зелеными, тогда как нетрансформированные растения показали признаки хлороза на концах листьев. Сильные растущие трансформанты затем культивировали и сравнили с растениями перца дикого типа, выращенными при идентичных условиях.
Результаты:
Результаты представлены на ФИГ.7 и в Таблице V. ФИГ.7 показывает фотографию GPT+GS дважды трансгенного растения перца, по сравнению с контрольным растением, выращенным в течение такого же периода времени при идентичных условиях. Эта фотография показывает огромный выход перца трансгенной линии по сравнению с контрольным растением.
Таблица V показывает выход биомассы и GS активность, а также результаты трансгенного генотипирования для трансгенной линии, по сравнению с контролем дикого типа. На основании данных, приведенных в Таблице V, видно, что дважды трансгенные растения потомства, показали невероятное увеличение общей биомассы (масса сырой ткани), причем масса сырой ткани лежит в интервале от 393 до 662 г на одно трансгенное растение, по сравнению с массой сырой ткани в среднем 328 г для растения дикого типа. Трансгенная линия А5 продуцирует общую биомассу, более чем в два раза больше, по сравнению с контрольными растениями. Более того, выход растений перца трансгенных линий был весьма улучшенным, по сравнению с растениями дикого типа, и они были на 50% больше, чем контрольные растения (в среднем). Необходимо отметить, что, одна из трансгенных линий продуцировала в два раза больше растений, чем контрольные растения в среднем.
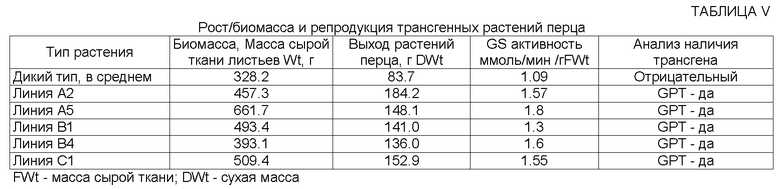
ПРИМЕР 9: Получение дважды трансгенных растений фасоли, несущих ARABIDOPSIS GS1 и GPT трансгены:
В этом примере, растения желтой восковой фасоли (Phaseolus vulgaris) трансформировали Arabidopsis GPT кодирующей последовательностью SEQ ID NO:1 полной длины под контролем CMV 35S промотора внутри экспрессионного вектора pCambia 1201, и Arabidopsis GS1 кодирующей последовательностью, включенной в SEQ ID NO:6, под контролем RuBisCo промотора внутри экспрессионного вектора pCambia 1201, применяя опосредованный агробактерией перенос в цветки.
Материалы и способы:
Трансгенные экспрессионные вектора pCambia 1201-GPT (включая конструкцию SEQ ID NO:27) и pCambia 1201-GS (включая конструкцию SEQ ID NO:6) трансформировали выделенными культурами штамма LBA4404 Agrobacterium tumefaciens, применяя стандартный способ электропорации (McCormac et al., 1998, Molecular Biotechnology 9: 155-159). Трансформированные агробактерии отобрали на среде, содержащей 50 мкг/мл хлорамфеникола. Трансформированные клетки агробактерии выращивали на LB культуральной среде, содержащей 25 мкг/мл антибиотика в течение 36 часов. В конце 36 часового периода роста клетки собрали путем центрифугирования, и клетки от каждой трансформации ресуспендировали в 100 мл LB бульона без антибиотика.
Растения фасоли затем трансформировали смесью полученных суспензий клеток агробактерий, применяя протокол трансформации, согласно которому агробактерию вводили путем инъекции непосредственно в структуру цветка (Yasseem, 2009, Plant Mol. Biol. Reporter 27: 20-28). Для того чтобы индуцировать вирулентность агробактерий и улучшить эффективность трансформации, 10 мкг/мл ацетосирингонона добавили к культурам агробактерий перед инокуляцией цветка. Кратко, как только цветки зацвели, внешняя структура, инкапсулирующая репродуктивные органы, была аккуратно открыта пинцетом, для того чтобы обеспечить введение смеси агробактерий, которую добавили к структуре цветка, в количестве, достаточном для заполнения пыльника.
Растения выращивали до развития стручков фасоли, и семена собрали для генерации трансгенных растений. Трансгенные растения затем выращивали вместе с контрольными растениями фасоли при идентичных условиях, фотографировали и определяли фенотипические характеристики. Скорости роста измеряли как для трансгенных растений, так и для контрольных растений. В этом и в других примерах, активность глутаминсинтетазы (GS) измеряли согласно способам по Shapiro и Stadtmann, 1970, Methods in Enzymology 17A: 910-922; и активность глутамин-фенилпируват-трансаминазы (GPT) оценивали согласно способам по Calderon et al., 1985, J. Bacteriol. 161: 807-809. Смотрите подробности в Пример 7 (Способы) приведенном выше.
Результаты:
Результаты представлены на ФИГ.8, ФИГ.9 и в Таблице VI.
ФИГ.8 показывает данные по скорости роста GPT+GS трансгенной линии А фасоли по сравнению с контрольными растениями, включая высоту растений в различные дни в ходе культивации, а также число бутонов, цветков и стручков. Эти данные показали, что GPT+GS дважды трансгенные растения фасоли превосходят по росту аналогичные им контрольные растения. Трансгенные растения вырастали более высокими, показывали более раннее цветение и продуцировали большее количество бутонов и цветков, и раньше развивали стручки и продуцировали большее число стручков, по сравнению с контрольными растениями дикого типа.
Таблица VI показывает выход стручков фасоли, GPT и GS активность, а также статус антибиотической резистентности для трансгенных линий по сравнению с контролем дикого типа (среднее по нескольким здоровым контрольным растениям; контрольные растения, которые недостаточно хорошо росли, были исключены из анализа). На основании данных, приведенных в Таблице VI, дважды трансгенные растения потомства показали существенное увеличение биомассы стручков (масса сырой ткани) по сравнению с контрольными растениями, с выходом биомассы стручков выше 200 г на трансгенное растение, по сравнению с 127 г, в среднем, на растение дикого типа, что составляет увеличение выхода стручков дважды трансгенных растений более чем на 60%, по сравнению с контрольным растением (растениями).
Наконец, ФИГ.9 показывает фотографию GPT+GS дважды трансгенного растения фасоли по сравнению с контрольным растением, выращенным в течение такого же периода времени при идентичных условиях, показывая повышенный рост для трансгенного растения.
ПРИМЕР 10: получение дважды трансгенных растений фасоли, несущих трансгены GS1 из ARABIDOPSIS и GPT из винограда:
В этом примере растения желтой восковой фасоли (Phaseolus vulgaris) трансформировали кодирующей последовательностью GPT винограда полной длины, включенной в SEQ ID NO:8, под контролем RuBisCo промотра внутри экспрессионного вектора pCambia 1305.1, и Arabidopsis GS1 кодирующей последовательностью, включенной в SEQ ID NO:6, под контролем RuBisCo промотора внутри экспрессионного вектора pCambia 1201, применяя опосредованный агробактерией перенос в развивающиеся стручки.
Материалы и способы:
Трансгенные экспрессионные вектора pCambia 1201-СРТ(виноград) (включая конструкцию SEQ ID NO:8) и pCambia 1201-GS (включая конструкцию SEQ ID NO:6) перенесли в выделенные культуры штамма LBA4404 Agrobacterium tumefaciens, применяя стандартный способ электропорации (McCormac et al., 1998, Molecular Biotechnology 9: 155-159). Трансформированные агробактерии отобрали на среде, содержащей 50 мкг/мл хлорамфеникола. Трансформированные клетки агробактерии выращивали на LB культуральной среде, содержащей 25 мкг/мл антибиотика, в течение 36 часов. В конце 36 часового периода роста клетки собрали путем центрифугирования, и клетки от каждой трансформации ресуспендировали в 100 мл LB бульона без антибиотика.
Растения фасоли затем трансформировали смесью полученных суспензий клеток агробактерий, применяя протокол трансформации, согласно которому агробактерию вводили путем инъекции непосредственно в структуру цветка. Для того чтобы индуцировать вирулентность агробактерий и улучшить эффективность трансформации 10 мкг/мл ацетосирингонона добавили к культурам агробактерий перед инокуляцией цветка. Кратко, как только цветки зацвели, внешняя структура, инкапсулирующая репродуктивные органы, была аккуратно открыта пинцетом, для того чтобы обеспечить введение смеси агробактерий, которую добавили к структуре цветка, в количестве, достаточном для заполнения пыльника.
Растения выращивали до развития стручков фасоли, и семена собрали для генерации трансгенных растений. Трансгенные растения выращивали вместе с контрольными растениями фасоли при идентичных условиях, фотографировали и определяли фенотипические характеристики. Скорости роста определяли как для трансгенных растений, так и для контрольных.
Результаты:
Результаты показаны на ФИГ.10, ФИГ.11 и в Таблице VII.
ФИГ.10 показывает данные по скорости роста GPT+GS трансгенной линии G растений фасоли, по сравнению с контрольными растениями, где, в частности, указаны данные по числу бутонов, цветков и стручков. Эти данные показывают, что GPT+GS дважды трасгенные растения превосходят по росту их аналогов дикого типа. Необходимо отметить, что трансгенные растения продуцируют существенно больше стручков, чем контрольные растения дикого типа.
Таблица VII показывает данные по выходу стручков и статус антибиотической резистентности для трансгенных линий по сравнению с контрольными растениями дикого типа (среднее для нескольких здоровых контрольных растений; контрольные растения, которые недостаточно хорошо росли, были исключены из анализа). На основании данных, приведенных в Таблице VII, видно, что дважды трансгенные растения потомства показывают существенно увеличенную биомассу стручков фасоли (масса сырой ткани) по сравнению с контрольными растениями, причем выход биомассы стручков составляет 200.5 г. (линия G1) и 178 г (линия G2) на одно трансгенное растение, по сравнению со 158 граммами, в среднем, на одно растение дикого типа, что составляет увеличение выхода стручков дважды трансгенных растений около 27%, по сравнению с контрольными растениями.
Наконец, ФИГ.11 показывает фотографию GPT+GS дважды трансгенных растений фасоли по сравнению с контрольными растениями, выращенными в течение такого же периода времени при идентичных условиях. Трансгенное растение показывает существенное увеличение размера и биомассы, листья большего размера и более эффективное цветение по сравнению с контрольным растением.
ПРИМЕР 11: получение дважды трансгенных растений вигны, несущих ARABIDOPSIS GS1 и GPT трансгены:
В этом примере, обычные растения вигны трансформировали Arabidopsis GPT кодирующей последовательностью SEQ ID NO:1 полной длины под контролем CMV 35S промотора внутри экспрессионного вектора рМОМ, и Arabidopsis GS1 кодирующей последовательностью, включенной в SEQ ID NO:6, под контролем RuBisCo промотора внутри экспрессионного вектора pCambia 1201, применяя Agrobacterium-опосредованные перенос в цветки. Материалы и способы соответствуют Примеру 9, смотрите выше.
Результаты:
Результаты представлены на ФИГ.12 и 13, и в Таблице VI. ФИГ.12 показывает относительные скорости роста для GPT+GS трансгенной линии А Вигны и контрольного растения Вигны дикого типа для некоторых интервалов в ходе культивации, включая измерения (ФИГ.12А) высоты и длины листа, (ФИГ.12В) трехлистников и бутонов, и (ФИГ.12С) цветков, бутонов и стручков. Эти данные показывают, что GPT+GS дважды трансгенные растения Вигны превосходят по росту их аналогов, представляющих собой контрольные растения. Трансгенные растения росли быстрее и были более высокими, имели более длинные листья и более высокую скорость образования стручков и цветков, по сравнению с контрольными растениями дикого типа.
Таблица VIII показывает выход стручков, GPT и GS активность, а также статус резистентности к антибиотикам для трансгенных линий по сравнению с контролем дикого типа (среднее по нескольким здоровым контрольным растениям; контрольные растения, которые недостаточно хорошо росли были исключены из анализа). По данным, приведенным в Таблице VIII видно, что дважды трансгенные растения показали существенное увеличение биомассы стручков (масса сырой ткани стручков) по сравнению с контрольными растениями, причем средний выход биомассы стручков для трансгенных растений на около 52% выше по сравнению с выходами, измеренными для контрольного растения (растений).
Наконец, ФИГ.13 показывает фотографию GPT+GS дважды трансгенных растений фасоли по сравнению с контрольными растениями, выращенными в течение такого же периода времени при идентичных условиях, показывая увеличенную биомассу и выход стручков для трансгенных растений по сравнению с контрольными растениями дикого типа.
ПРИМЕР 12: получение дважды трансгенных растений Вигны, несущих трансгены GS1 из ARABIDOPSIS и GPT из винограда:
В этом примере обычные растения Вигны трансформировали кодирующей последовательностью, включенной в SEQ ID NO:8, полной длины GPT винограда под контролем RuBisCo промотора внутри экспрессионного вектора pCambia 1305.1 (включая конструкцию SEQ ID NO:8), и Arabidopsis GS1 кодирующей последовательностью, включенной в SEQ ID NO:6, под контролем RuBisCo промотора внутри экспрессионного вектора pCambia 1201 (включая конструкцию SEQ ID NO:6), применяя опосредованный агробактерией перенос в цветки. Материалы и способы соответствуют примеру Пример 11, смотрите выше.
Результаты:
Результаты представлены на ФИГ.14 и 15, и в Таблице IX.
ФИГ.14 показывает относительные скорости роста для GPT+GS трансгенной линии G Вигны и контрольного растения Вигны дикого типа. Эти данные показывают, что трансгенные растения выше (ФИГ.14А), продуцируют существенно большее число цветков, бутонов и стручков (ФИГ.14В), и более быстро развивают трехлистники и листовые почки (ФИГ.14С).
Таблица IX показывает выход стручков, GPT и GS активность, а также статус резистентности к антибиотикам для трансгенных линий по сравнению с контролем дикого типа (среднее по нескольким здоровым контрольным растениям; контрольные растения, которые недостаточно хорошо росли, были исключены из анализа). По данным, приведенным в Таблице IX, видно, что дважды трансгенные растения показали существенное увеличение биомассы стручков (масса сырой ткани стручков) по сравнению с контрольными растениями, причем средний выход биомассы стручков для трансгенных растений на около 70% выше, по сравнению с выходами, измеренными для контрольного растения (растений).
Наконец, ФИГ.15 показывает фотографию GPT+GS дважды трансгенных растений фасоли, по сравнению с контрольными растениями, выращенными в течение такого же периода времени при идентичных условиях, показывая увеличенную биомассу и размер листьев для трансгенных растений, по сравнению с контрольными растениями дикого типа.
ПРИМЕР 13: получение дважды трансгенных растений ALFALFA, несущих трансгены ARABIDOPSIS GS1 и GPT:
В этом примере обычные растения Alfalfa (Medicago sativa, var Ladak) трансформировали Arabidopsis GPT кодирующей последовательностью SEQ ID NO:1 полной длины под контролем CMV 35S промотора внутри экспрессионного вектора pMON316 (смотрите Пример 3, выше), и Arabidopsis GS1 кодирующей последовательностью, включенной в SEQ ID NO:6, под контролем RuBisCo промотора внутри экспрессионного вектора pCambia 1201 (включая конструкцию SEQ ID NO:6), применяя опосредованный агробактерией перенос в сеянцы. Агробактериальные вектора и смеси получали для инокуляции прорастающих растений, как описано в Примере 11, смотрите выше.
Инокуляция прорастающих растений:
Когда прорастающие растения Alfalfa составляли менее около 1/2 дюйма в длину их обернули бумажным полотенцем, которое было пропитано смесью агробактерий, содержащих обе трансгенные конструкции. Прорастающие растения оставляли в бумажных полотенцах на два-три дня, извлекли и высадили в почву. Полученную ТО и контрольные растения затем выращивали в течение первых 30 дней в камере культивирования, после этого культивировали в теплице и затем собрали на 42 день после всхода. На этот момент цветки наблюдались только у трансгенных растений, так как у растений дикого типа наблюдались только незрелые бутоны. Растения охарактеризовали по цветению и общей биомассе.
Результаты:
Результаты представлены в Таблице X. Данные показывают, что трансгенные растения Alfalfa растут быстрее, зацветают раньше, и выход биомассы в среднем выше на около 62% по сравнению с контрольными растениями.
ПРИМЕР 14: получение дважды трансгенных растений Канталупы, несущих трансгены ARABIDOPSIS GS1 и GPT:
В этом примере растения Канталупы (Cucumis melo var common) трансформировали Arabidopsis GPT кодирующей последовательностью SEQ ID NO:1 полной длины под контролем CMV 35S промотора внутри экспрессионного вектора pMON316 (смотрите Пример 3, выше), и Arabidopsis GS1 кодирующей последовательностью, включенной в SEQ ID NO:6, под контролем RuBisCo промотора внутри экспрессионного вектора pCambia 1201 (включая конструкцию SEQ ID NO:6), применяя опосредованный агробактерией перенос посредством инъекции в развивающиеся плоды дыни. Агробактериальные вектора и смеси получили путем инокуляций плодов дыни, как описано в Примере 8, приведенном выше. Инокуляцию развивающихся плодов дыни осуществляли, как описано в Примере 8. Растения охарактеризовали по статусу цветения и по общей биомассе, по сравнению с контрольными растениями дикого типа, выращенными при идентичных условиях.
Результаты представлены на ФИГ.16 и в Таблице XI. Согласно данным, приведенным в Таблице XI, трансгенные растения показывают существенное увеличение биомассы листов растений, по сравнению с контрольными растениями, со средним увеличением биомассы на 63%. Более того, наблюдалось значительное увеличение выхода цветков и бутонов для всех пяти трансгенных линий. У контрольных растений, в среднем, не наблюдалось цветков и только 5 бутонов. Напротив, у трансгенных растений наблюдалось от 2 до 5 цветков на растение, и от 21 до 30 бутонов на растение, указывая на существенно более высокую скорость роста и более высокий выход цветков. Увеличенный выход цветков, как и следовало ожидать, связывают с соответствующим более высоким выходом плодов дынь для трансгенных растений. На основании ФИГ.16 (фотография сравнения трансгенных растений Канталупы с контрольными растениями Канталупы), трансгенные растения Канталупы показывают потрясающее увеличение высоты, общей биомассы и статуса цветения по сравнению с контрольными растениями.
ПРИМЕР 15: получение дважды трансгенных растений тыквы обыкновенной, несущих трансгены ARABIDOPSIS GS1 и GPT:
В этом примере обычные растения тыквы обыкновенной (Cucurbita maxima) трансформировали Arabidopsis GPT кодирующей последовательностью SEQ ID NO:1 полной длины под контролем CMV 35S промотора внутри экспрессионного вектора pMON316 (смотрите Пример 3, выше), и Arabidopsis GS1 кодирующей последовательностью, включенной в SEQ ID NO:6, под контролем RuBisCo промотора внутри экспрессионного вектора pCambia 1201 (включая конструкцию SEQ ID NO:6), применяя опосредованный агробактерией перенос посредством инъекции в развивающиеся плоды тыквы, по существу как описано в Примере 14, приведенном выше. Трансгенные и контрольные растения тыквы обыкновенной выращивали при идентичных условиях до появления бутонов у контрольных растений, затем все растения охарактеризовали по статусу цветения и общей биомассе.
Результаты представлены на ФИГ.17 и в Таблице XII. На основе данных, приведенных в Таблице XII, можно сделать вывод, что трансгенные растения показывают существенное увеличение биомассы листьев растений the по сравнению с контрольными растениями, причем средний выход биомассы на 67% выше контрольных растений. Более того, увеличение выхода цветков наблюдалось у четырех из пяти трансгенных линий по сравнению с контролем. У контрольных растений наблюдалось около 4 бутонов at sacrifice (в среднем). Напротив, у четырех трансгенных линий растений наблюдалось от 8 до 15 бутонов на растение, что составляет увеличение выхода от около двух до около четырех раз.
ФИГ.17 (фотография сравнения трансгенных растений тыквы обыкновенной с контрольными растениями) показывает, что трансгенные растения тыквы обыкновенной проявляют существенное увеличение размера растения, общей биомассы, числа и размера листьев, по сравнению с контрольными растениями.
ПРИМЕР 16: получение дважды трансгенных растений ARABIDOPSIS, несущих трансгены ARABIDOPSIS GS1 и GPT:
В этом примере растения Arabidopsis thaliana трансформировали усеченной последовательностью, кодирующей Arabidopsis GPT, SEQ ID NO:18, под контролем промотора CMV 35S внутри экспрессионного вектора pMON316 (смотрите Пример 3, выше), и после этого трансгенные растения трансформировали Arabidopsis GS1 кодирующей последовательностью, включенной в SEQ ID NO:6, под контролем RuBisCo промотора внутри экспрессионного вектора pCambia 1201 (включая конструкцию SEQ ID NO:6), применяя опосредованный агробактерией "floral dip" перенос как описано (Harrison et al., 2006, Plant Methods 2:19-23; Clough and Bent, 1998, Plant J. 16:735-743). Акробактериальные вектора pMON316, несущие GPT, и pCambia 1201, несущие GS1, были получены, как описано в Примерах 3 и 11 соответственно.
Трансформацию двух различных культур агробактерий либо pMon 316 + Arabidopsis GTP конструкцией, либо Gambia 1201 + Arabidopsis GS конструкцией осуществили путем электропорации, применяя способ по Weigel и Glazebrook 2002. Трансформированные агробактерий затем выращивали с отбором по антибиотику, собирали путем центрифугирования, ресуспендировали в LB бульоне с антибиотиком и применяли при осуществлении способа «floral dip» в соцветии Arabidopsis. Полученные способам «Floral dip» растения Arabidopsis выращивали до зрелости, позволили им самоопылица, и собирали семена. Семена от двух растений, обработанных способом «Floral dip», сначала выращивали на среде, содержащей 20 мкг/мл канамицина, и с помощью последующих обычных селекционных процедур, выживающие сеянцы переносили в среду, содержащую 20 мкг гигромицина. Растения (3), выжившие в процессе селекции по двум антибиотикам, самоопылились, и семена собрали. Семена генерации Т1 прорастали на MS среде, содержащей 20 мкг/мл гигромицина, и выжившим сеянцам позволили вырасти до состояния зрелого растения, самоопылиться, и собрали семена. Семена генерации Т2 применяли для исследования последующего роста.
Результаты представлены на ФИГ.18 и в Таблице XIII. Согласно Таблице XIII, в которой представлены данные по шести трансгенным растениям Arabidopsis (усредненные), трансгенные растения демонстрируют повышенные уровни активности как GPT, так и GS. GPT активность была выше в двадцать раз по сравнению с контрольными растениями. Более того, масса сырой ткани трансгенных растений в среднем также была в четыре раза выше по сравнению с контрольными растениями (в среднем). Фотография молодых трансгенных растений Arabidopsis, по сравнению с контрольными растениями Arabidopsis дикого типа, выращенными при идентичных условиях, приведена на ФИГ.18 и показывает единообразное и очень существенное увеличение роста/биомассы для трансгенных растений по сравнению с контрольными растениями.
ПРИМЕР 17: получение трансгенных растений томата, несущих ARABIDOPSIS GPT и GS1 трансгены:
В этом примере растения томата (Solanum lycopersicon, сорт "Money Maker") трансформировали Arabidopsis GPT кодирующей последовательностью SEQ ID NO:1 полной длины под контролем CMV 35S промотора внутри экспрессионного вектора pMON316 (смотрите Пример 3, выше), и Arabidopsis GS1 кодирующей последовательностью, включенной в SEQ ID NO:6, под контролем RuBisCo промотора внутри экспрессионного вектора pCambia 1201 (включая конструкцию SEQ ID NO:6). Трансгенные растения томата с одним трансгеном (GPT) генерировали и выращивали до цветения, по существу, как описано в Примере 4. Arabidopsis GS1 трансген затем ввели в Т0 растения с одним трансгеном, применяя опосредованный агробактерией перенос посредством инъекции непосредственно в цветки (как описано в Примере 8). Трансгенные и контрольные растения томата выращивали при идентичных условиях и охарактеризовали по характеристикам фенотипа роста. Полученные Т0 дважды трансгенные растения затем выращивали до зрелости, фотографировали вместе с контрольными растениями томата и определяли фенотипические характеристики.
Результаты представлены на ФИГ.19 и в Таблице XIX. Из Таблицы XIX видно, что дважды трансгенные растения томата показывают существенное увеличение биомассы листьев растения по сравнению с контрольными растениями, причем увеличение выхода биомассы в среднем составляет 45%, по сравнению с контрольными растениями. Более того, также наблюдалось увеличение выхода плодов томата на 70% для трансгенных линий по сравнению с контрольными растениями (например, 51 томат собрали от линии 4С, напротив, в среднем, у контрольных растений собирали в среднем около 30 томатов). У трансгенных растений наблюдался намного более высокий уровень активности GPT (например, линия 4С показало около 32-кратное увеличение активности GPT, по сравнению с активностью GPT, измеренной в среднем для контрольных растений). GS активность также была выше у трансгенных растений по сравнению с контрольными (почти в два раза для линии 4С).
Что касается фенотипа роста, как видно на ФИГ.19, у трансгенных растений томата развиваются листья существенно большего размера по сравнению с контрольными растениями (ФИГ 19А). Кроме того, можно увидеть, что трансгенные растения томата существенно больше, выше и обладают большей общей биомассой (смотрите ФИГ.19В).
ПРИМЕР 18: получение трансгенных растений CAMILENA, несущих трансгены ARABIDOPSIS GPT и GS1:
В этом примере растения Camelina (Camelina sativa, Var MT 303) трансформировали Arabidopsis GPT кодирующей последовательностью SEQ ID NO:1 полной длины под контролем промотора RuBisCo внутри экспрессионного вектора pCambia 1201, и Arabidopsis GS1 кодирующей последовательностью, включенной в SEQ ID NO:6, под контролем RuBisCo промотора внутри экспрессионного вектора pCambia 1201, применяя Agrobacterium-опосредованный перенос в прорастающие семена, согласно способу, описанному в Chee et al., 1989, Plant Physiol. 91: 1212-1218. Агробактериальные векторы и смеси получили для инокуляции семян, как описано в Примере 11, приведенном выше.
Трансгенные и контрольные растения Camelina выращивали при идентичных условиях (30 дней в камере для проращивания семян, и затем перенесли в теплицу для культивации), в течение 39 дней, и охарактеризовали по биомассе, характеристикам роста и стадии цветения.
Результаты представлены в Таблице XX и на ФИГ.20. Согласно Таблице XX, видно, что общая биомасса в трансгенных растениях, в среднем, почти в два раза больше биомассы контрольных растений. Диаметр листового полога также значительно увеличился у трансгенных растений. ФИГ.20 показывает фотографию трансгенных растений Camelina в сравнении с контролем. Трансгенные растения заметно больше и показывают улучшенное цветение.
ПРИМЕР 19: Активность GPT трансгена ячменя в растениях
В этом примере предполагаемая кодирующая последовательность GPT ячменя была выделена и экспрессирована из трансгенной конструкции, применяя in planta анализ транзиентной экспрессии. Биологически активная рекомбинантная GPT ячменя была продуцирована, и катализировала повышенный синтез 2-оксоглутарамата, что было подтверждено ВЭЖХ. Кодирующая последовательность GPT ячменя (Hordeum vulgare) была определена и синтезирована. ДНК последовательность кодирующей последовательности GPT ячменя, применяемой в этом примере, соответствует SEQ ID NO:14, и аминокислотная последовательность кодируемого GPT белка представляет собой SEQ ID NO:15.
Кодирующую последовательность GPT ячменя вставили в вектор 1305.1 cambia, и перенесли в LBA404 штамм Agrobacterium tumefaciens, применяя стандартный способ электропорации (McCormac et al., 1998, Molecular Biotechnology 9: 155-159), затем поместили на LB пластины, содержащие гигромицин (50 мкг/мл). Колонии агробактерий с резистентностью к антибиотикам были отобраны для анализа.
Анализ транзиентной экспрессии листьев табака состоял в инъекции суспензии трансформированных агробактерий (1.5-2.0 OD 650) в быстрорастущие листья табака. Интрадермальные инъекции делали в сетку на поверхности листа для подвергания значительной поверхности листа агробактериям. Затем растения росли в течение 3-5 дней, после чего ткань была экстрагирована, как описано для всех других тканных экстрактов, и была измерена активность GPT.
GPT активность в инокулированной ткани листа (1217 наномоль/гFWt/ч) была в три раза выше, по сравнению с GPT активностью, измеренной в тканях листьев контрольных растений (407 наномоль/гFWt/ч), что указывает на то, что Hordeum GPT конструкция управляет экспрессией биологически активной GPT в трансгенном растении.
ПРИМЕР 20: Выделение и экспрессия кодирующей последовательности рекомбинантного гена GPT риса и анализ биологической активности
В этом примере предполагаемая кодирующая последовательность GPT риса была выделена и экспрессирована в E.coli. Биологически активная рекомбинантная GPT риса была продуцирована и катализировала повышенный синтез 2-оксоглутарамата, что подтверждено ВЭЖХ.
Материалы и способы:
Кодирующая последовательность GPT риса и экспрессия в E.coli:
Кодирующая последовательность GPT риса (Oryza sativa) была определена и синтезирована, вставлена в РЕТ28 вектор и экспрессирована в Е.coli. Кратко, клетки Е.coli трансформировали экспрессионным вектором, и трансформанты выращивали всю ночь в LB бульоне, разбавленном до оптической плотности (OD) 0.4, экспрессию индуцировали изопропил-В-D-тиогалактозидом (0.4-микромолярный), выращивали в течение 3 часов и собрали. Всего 25 Х 106 клеток проанализировали на биологическую активность, применяя ЯМР анализ, приведен ниже. Нетрансформированные клетки Е.coli дикого типа проанализировали в качестве контроля. В качестве дополнительного контроля применяли клетки E.Coli, трансформированные пустым вектором.
ДНК последовательность кодирующей последовательности GPT риса, применяемая в этом примере, соответствует SEQ ID NO:10, и закодированная аминокислотная последовательность GPT белка соответствует SEQ ID NO:11.
ВЭЖХ анализ 2-оксоглутарамата:
ВЭЖХ применяли для определения продуцирования 2-оксоглутарамата GPT-сверхэкспрессирующими клетками E.coli, следуя модификации Calderon et al., 1985, J Bacteriol 161(2): 807-809. Кратко, применяли модифицированный экстракционный буфер, содержащий 25 мМ Tris-HCl pH 8.5, 1 мМ EDTA, 20 мкМ пиридоксальфосфата, 10 мМ Цистеина и около 1.5% (об./об.) меркаптоэтанола. Образцы (лизат клеток E.coli, 25 Х 106 клеток) добавили к экстракционному буферу при соотношении около 1/3 (мас./об.), инкубировали в течение 30 минут при 37°С, и остановили, применяя 200 мкл 20% ТСА. Через около 5 минут анализируемую смесь центрифугировали, и супернатант применяли для количественного определения 2-оксоглутарамата с помощью ВЭЖХ, применяя ION-300 7.8 мм ID Х 30 см L колонку, с подвижной фазой 0.01 Н H2SO4, скоростью потока около 0.2 мл/мин, при 40°С. Впрыскиваемый объем составлял около 20 мкл, и время удерживания составляло от 38 до 39 минут. Обнаружение проводилось при помощи УФ излучения с длиной волны 210 нм.
Сравнение посредством ЯМР анализа с аутентичным 2-оксоглутараматом применяли для подтверждения, что Arabidopisis последовательность полной длины экспрессирует GPT с активностью синтеза 2-оксоглутарамата. Кратко, аутентичный 2-оксоглутарамат (структура, подтвержденная ЯМР) получили путем химического синтеза, для подтверждения результатов ВЭЖХ анализа, приведенного выше, путем подтверждения, что продукт анализа (молекула, синтезированная в ответ на экспрессированный GPT) и аутентичный 2-оксоглутарамат элюируются при одинаковом времени удерживания. Кроме того, при смешивании вместе, продукт анализа и аутентичное соединение элюируются с появлением единичного пика. Кроме того, подтверждение результатов ВЭЖХ анализа также включает мониторинг исчезновения субстрата глутамина, при этом было показано, что существует молярная стехиометрия 1:1 между расходом глутамина и продуцированным 2-оксоглутараматом. Методика анализа всегда включает два контроля, один без фермента и второй без глутамина. Первый показывает, что продуцирование 2-оксоглутарамата зависит от наличия фермента, а второй показывает, что продуцирование 2-оксоглутарамата зависит от субстрата глутамина.
Результаты:
Экспрессия кодирующей последовательности GPT риса SEQ ID NO:10 привела к сверхэкспрессии рекомбинантного белка GPT, имеющего биоактивность, связанную с катализом синтеза 2-оксоглутарамата. В частности, 1.72 наномоля 2-оксоглутарамата наблюдалось в клетках Е.coli, сверхэкспрессирующих рекомбинантную GPT риса, по сравнению с только 0.02 наномолями 2-оксоглутарамата в контрольных клетках Е.coli, то есть 86-кратное увеличение уровня активности по сравнению с контролем.
ПРИМЕР 21: Выделение и экспрессия кодирующей последовательности рекомбинантного гена GPT сои и анализ биологической активности
В этом примере предполагаемая кодирующая последовательность GPT сои была выделена и экспрессирована в Е.coli. Биологически активная рекомбинантная GPT сои была продуцирована и катализировала повышенный синтез 2-оксоглутарамата, что подтверждено ВЭЖХ.
Материалы и способы:
Кодирующая последовательность GPT сои и экспрессия в Е.coli:
Кодирующая последовательность GPT сои (Glycine max) была определена и синтезирована, вставлена в РЕТ28 вектор и экспрессирована в E.coli. Кратко, клетки E.coli трансформировали экспрессионным вектором, и трансформанты выращивали всю ночь в LB бульоне, разбавленном до оптической плотности (OD) 0.4, экспрессию индуцировали изопропил-В-D-тиогалактозидом (0.4-микромолярный), выращивали в течение 3 часов и собрали. Всего 25 Х 106 клеток проанализировали на биологическую активность, применяя ВЭЖХ анализ, приведен ниже. Нетрансформированные клетки E.coli дикого типа проанализировали в качестве контроля. В качестве дополнительного контроля применяли клетки E.Coli, трансформированные пустым вектором.
ДНК последовательность кодирующей последовательности GPT сои, применяемая в этом примере, соответствует SEQ ID NO:12, и закодированная аминокислотная последовательность GPT белка соответствует SEQ ID NO:13.
ВЭЖХ анализ 2-оксоглутарамата:
ВЭЖХ применяли для определения продуцирования 2-оксоглутарамата GPT-сверхэкспрессирующими клетками E.coli, как описано в Примере 20, приведенном выше.
Результаты:
Экспрессия кодирующей последовательности GPT сои SEQ ID NO:12 привела к сверхэкспрессии рекомбинантного белка GPT, имеющего биоактивность, связанную с катализом синтеза 2-оксоглутарамата. В частности, 31.9 наномоля 2-оксоглутарамата наблюдалось в клетках Е.coli, сверхэкспрессирующих рекомбинантную GPT сои, по сравнению с только 0.02 наномолями 2-оксоглутарамата в контрольных клетках Е.coli, то есть почти 1600-кратное увеличение уровня активности по сравнению с контролем.
ПРИМЕР 22: Выделение и экспрессия кодирующей последовательности рекомбинантного гена GPT полосатой перцины и анализ биологической активности
В этом примере предполагаемая кодирующая последовательность GPT полосатой перцины была выделена и экспрессирована в Е.coli. Биологически активная рекомбинантная GPT полосатой перцины была продуцирована и катализировала повышенный синтез 2-оксоглутарамата, что подтверждено с помощью ВЭЖХ.
Материалы и способы:
Кодирующая последовательность GPT полосатой перцины и экспрессия в Е.coli:
Кодирующая последовательность GPT полосатой перцины (Danio rerio) была определена и синтезирована, вставлена в РЕТ28 вектор и экспрессирована в Е.coli. Кратко, клетки Е.coli трансформировали экспрессионным вектором, и трансформанты выращивали всю ночь в LB бульоне, разбавленном до оптической плотности (OD) 0.4, экспрессию индуцировали изопропил-B-D-тиогалактозидом (0.4-микромолярный), выращивали в течение 3 часов и собрали. Всего 25 Х 106 клеток проанализировали на биологическую активность, применяя ВЭЖХ анализ, приведен ниже. Нетрансформированные клетки E.coli дикого типа проанализировали в качестве контроля. В качестве дополнительного контроля применяли клетки Е.Coli, трансформированные пустым вектором.
ДНК последовательность кодирующей последовательности GPT полосатой перцины, применяемая в этом примере, соответствует SEQ ID NO:16, и закодированная аминокислотная последовательность GPT белка соответствует SEQ ID NO:17.
ВЭЖХ анализ 2-оксоглутарамата:
ВЭЖХ применяли для определения продуцирования 2-оксоглутарамата GPT-сверхэкспрессирующими клетками Е.coli, как описано в Примере 20, приведенном выше.
Результаты:
Экспрессия кодирующей последовательности GPT полосатой перцины SEQ ID NO: 12 привела к сверхэкспрессии рекомбинантного белка GPT, имеющего биоактивность, связанную с катализом синтеза 2-оксоглутарамата. В частности, 28.6 наномоля 2-оксоглутарамата наблюдалось в клетках Е.coli, сверхэкспрессирующих рекомбинантную GPT полосатой перцины, по сравнению с только 0.02 наномолями 2-оксоглутарамата в контрольных клетках E.coli, то есть более чем 1400-кратное увеличение уровня активности по сравнению с контролем.
ПРИМЕР 23: Получение и экспрессия кодирующей последовательности рекомбинантного усеченного гена GPT ARABIDOPSIS и анализ биологической активности
В этом примере две различные усеченные Arabidopsis GPT кодирующие последовательности были получены и экспрессированы в Е.coli, для того, чтобы оценить активность GPT белков, в которых предполагаемый хпоропластный сигнальный пептид отсутствует или подвергается усечению. Рекомбинантные усеченные GPT белки, соответствующие Arabidopsis GPT аминокислотной последовательности SEQ ID NO:2 полной длины, усеченной с удалением первых 30-ти аминотерминальных аминокислотных остатков, или первых 45-ти аминотерминальных аминокислотных остатков, были успешно экспрессированы и показали биологическую активность при катализе повышенного синтеза 2-оксоглутарамата, что подтверждено с помощью ВЭЖХ.
Материалы и способы:
Усеченные кодирующие последовательности Arabidopsis GPT и экспрессия в in Е.coli:
ДНК кодирующая последовательность усечения Arabidopsis thaliana GPT кодирующей последовательности SEQ ID NO:1 была определена, синтезирована, вставлена в РЕТ28 вектор и экспрессирована в E.coli. ДНК последовательность усеченной Arabidopsis GPT кодирующей последовательности, применяемая в этом Примере, соответствует SEQ ID NO:20 (-45 АА конструкция), и соответствующая усеченная аминокислотная последовательность GPT белка соответствует SEQ ID NO:21. Кратко, E.coli клетки были трансформированы экспрессионным вектором, и трансформанты выращивали всю ночь в LB бульоне, разбавленном до оптической плотности 0.4, экспрессию индуцировали изопропил-В-D-тиогалактозидом (0.4-микромолярный), выращивали в течение трех часов и собрали. Всего 25 Х 106 клеток проанализировали на биологическую активность, применяя ВЭЖХ, как описано в Примере 20. Нетрансформированные Е.coli клетки дикого типа проанализировали в качестве контроля. В качестве дополнительного контроля применяли клетки E.coli, трансформированные пустым вектором.
Экспрессия усеченной -45 Arabidopsis GPT кодирующей последовательности SEQ ID NO:20 привела к сверхэкспресии биологически активного рекомбинантного белка GPT (биологическая активность катализа синтеза 2-оксоглутарамата). В частности, 16.1 наномоля 2-оксоглутарамата наблюдалось в клетках Е.coli, сверхэкспрессирующих усеченную -45 GPT, по сравнению с только 0.02 наномолями 2-оксоглутарамата в контрольных клетках E.coli, то есть более чем 800-кратное увеличение уровня активности по сравнению с контролем. Для сравнения, кодирующая последовательность гена Arabidopsis полной длины, экспрессированная в тех же клетках Е.coli, при проведении анализа показала 2.8 наномоля 2-оксоглутарамата, или, грубо, менее чем одну пятую от активности, наблюдаемой для усеченного рекомбинантного GPT белка.
ПРИМЕР 24: ПРОРАСТАНИЕ GPT + GS ТРАНСГЕННЫХ СЕМЯН ТАБАКА. ТОЛЕРАНТНОСТЬ К ВЫСОКИМ КОНЦЕНТРАЦИЯМ СОЛИ
В этом примере семена дважды трансгенной линии табака ХХ-3 (Кросс 3 в Таблице 4, смотрите Пример 7) протестировали, исследуя прорастание семян, для того чтобы оценить толерантность к высоким концентрациям соли.
Материалы и способы:
Семена табака растений дикого типа и ХХ-3 популяций подвергли стерилизации (5% отбеливающего раствора в течение 5 минут, и затем промывка 10% этанолом в течение 3 минут) и промыли стерильной дистиллированной водой. Стерилизованные семена затем поместили на среду Мурасиге-Скуга (10% агарозы) без сахарозы, и содержащую либо 0, либо 200 мМ NaCl. Семена росли в темноте в течение двух дней, и затем 6 дней при фотопериоде 16:8 при 24°С. На восьмой день скорость прорастания определили путем измерения процента семян по отношению к контролю или трансгенным растениям, которые проросли.
Результаты:
Результаты представлены в Таблице XXI, приведенной ниже. Скорость прорастания для семян линии трансгенных растений, при нулевом содержании соли, была такой же, как и для семян контрольных растений дикого типа. Напротив, скорость прорастания для семян линии трансгенных растений при очень высоком содержании соли намного превышала скорость прорастания для контрольных семян дикого типа. Тогда как более 81% семян трансгенных растений проросли в условиях высокого содержания соли, только около 9% семян контрольных растений дикого типа проросли за тот же период времени. Эти данные показывают, что трансгенные семена способны прорастать очень хорошо при высоких концентрациях соли, что является важным признаком при росте растений в областях с возрастающей концентрацией соли в воде и/или почве.
Все публикации, патенты и заявки на патент, приведенные в настоящем документе, включены в настоящий документ посредством ссылки, как если бы было специально указано, что каждая отдельная публикация или патентная заявка была включены посредством ссылки.
Объем настоящего изобретения не ограничивается вариантами выполнения настоящего изобретения, представленными в настоящем документе, которые предназначены только для иллюстрации отдельных объектов настоящего изобретения, и которые находят функциональные эквиваленты в объеме настоящего изобретения. Различные модификации вариантов и способов настоящего изобретения, в дополнение к описанным в настоящем документе, будут очевидны специалистам в данной области техники на основании предшествующего описания и знаний в данной области техники, и поэтому они также входят в объем настоящего изобретения. Такие модификации или другие варианты выполнения настоящего изобретения могут быть осуществлены на практике без отклонения от сущности и объема настоящего изобретения.
Таблица последовательностей:
SEQ ID NO:1 Arabidopsis глутамин-фенилпируват-трансаминазы ДНК кодирующая последовательность:


SEQ ID NO:2 Arabidopsis GPT аминокислотная последовательность

SEQ ID NO:3 Alfalfa GS1 ДНК кодирующая последовательность (прописные буквы) с 5' и 3' нетранслируемыми последовательностями (показано строчными буквами).


SEQ ID NO:4 Alfalfa GS1 аминокислотная последовательность

SEQ ID NO:5 Alfalfa GS1 ДНК кодирующая последовательность (прописные буквы) с 5' и 3' нетранслируемыми последовательностями (показано строчными буквами) и векторные последовательности от Clal до Smal/Sspl и от Sspl/Smal до Sall/Xhol (строчные буквы, подчеркнуто).


SEQ ID NO:6 Arabidopsis GS1 кодирующая последовательность Gambia 1201 вектор + rbcSSC + arabidopsis GS1 (выделенный полужирным шрифтом ATG - это сайт инициации),

SEQ ID NO:7 Arabidopsis GS1 аминокислотная последовательность Векторные последовательности на N-концах показаны курсивом

SEQ ID NO:8 ДНК последовательность, кодирующая GPT винограда Показано Gambia 1305.1 с (3' концом) rbcS3C + Vitis vinifera GPT (виноград). Выделенный полужирным шрифтом ATG представляет собой сайт инициации, круглые скобки показывают catl интрон, и подчеркнутый actagt представляет собой spel сайт клонирования, применяемый для сплайсинга в GPT ген.


SEQ ID NO:9 аминокислотная последовательность GPT винограда

SEQ ID NO:10 ДНК кодирующая последовательность GPT риса GPT кодон риса, оптимизированный для экспрессии в E.coli; нетранслируемые последовательности показаны строчными буквами


SEQ ID NO:11 аминокислотная последовательность GPT риса включает аминотерминальные аминокислоты MW для клонирования и His tag последовательности из pet28 вектора, показано курсивом.


SEQ ID NO:12 ДНК кодирующая последовательность GPT сои ТОРО 151D WITH SOYBEAN для экспрессии в E.coli
От стартового кодона. Векторные последовательности выделены курсивом

SEQ ID NO:13 аминокислотная последовательность GPT сои. Транслированный белковый продукт, векторные последовательности показаны курсивом

SEQ ID NO:14 ДНК кодирующая последовательность GPT ячменя. Кодирующая последовательность от сайта инициации с удаленным интроном


SEQ ID NO:15 аминокислотная последовательность GPT ячменя. Транслированная последовательность от сайта инициации (удаленный интрон)


SEQ ID NO:16 ДНК кодирующая последовательность GPT полосатой перцины Danio rerio последовательность, предназначенная для экспрессии в Е.coli. Выделенные полужирным шрифтом и курсивом нуклеотиды добавлены для клонирования или из pET28b вектора.


SEQ ID NO:17 аминокислотная последовательность GPT полосатой перцины Аминокислотная последовательность Danio rerio клонированная и экспрессированная в Е.coli (выделенные полужирным шрифтом и курсивом аминокислоты добавляются из вектора/ для клонирования и His tag на С-конце)

SEQ ID NO:18 ДНК последовательность усеченной Arabidopsis GPT -30 конструкции Arabidopsis GPT кодирующая последовательность с 30 аминокислотами, удаленными из целевой последовательности.

SEQ ID NO:19 аминокислотная последовательность усеченной Arabidopsis GPT -30 конструкции


SEQ ID NO:20: ДНК последовательность усеченной Arabidopsis GPT -45 конструкции Arabidopsis GPT кодирующая последовательность с 45 удаленными остатками в целевой последовательности

SEQ ID NO:21: аминокислотная последовательность усеченной Arabidopsis GPT -45 конструкции

SEQ ID NO:22: промотор томата Rubisco TOMATO RuBisCo rbcSSC промоторная последовательность от Kpnl до Ncol


SEQ ID NO:23: ДНК кодирующая последовательность GPT бамбука

SEQ ID NO:24: аминокислотная последовательность GPT бамбука

SEQ ID NO:25: 1305.1 + rbcS3C промотор + catl интрон с GPT геном риса.
Cambia 1305.1 с (3' концом) rbcS3C + GPT кодирующая последовательность риса. Подчеркнутый ATG представляет собой сайт инициации, круглые скобки показывают catl интрон, и подчеркнутый actagt представляет собой spel сайт клонирования, применяемый для сплайсинга в ген риса.


SEQ ID NO:26: ПОСЛЕДОВАТЕЛЬНОСТЬ GPT ЯЧМЕНЯ В ВЕКТОРЕ Cambia 1305.1 с (3' концом) rbcS3C + hordeum IDI4 кодирующая последовательность. Подчеркнутый ATG представляет собой сайт инициации, круглые скобки показывают catl интрон, и подчеркнутый actagt представляет собой spel сайт клонирования, применяемый для сплайсинга в hordeum ген.


SEQ ID NO:27 Gambia 1201 + Arabidopsis GPT кодирующая последовательность (35S промотор из CaMV показан курсивом)


SEQ ID NO:28 Gambia p1305.1 с (3' концом) rbcS3C + Arabidopsis GPT кодирующая последовательность. Подчеркнутый ATG представляет собой сайт инициации, круглые скобки обозначают catl интрон, и подчеркнутый actagt представляет собой сайт клонирования, применяемый для сплайсинга в Arabidopsis ген.


SEQ ID NO:29 Arabidpsis GPT кодирующая последовательность (зрелый белок, нецелевая последовательность)

SEQ ID NO:30 Arabidpsis GPT аминокислотная последовательность (зрелый белок, нецелевая последовательность)

SEQ ID NO:31 аминокислотная последовательность GPT винограда (зрелый белок, нецелевая последовательность)

SEQ ID NO:32 аминокислотная последовательность GPT риса (зрелый белок, нецелевая последовательность)

SEQ ID NO:33 аминокислотная последовательность GPT сои (-1 зрелый белок, нецелевая последовательность)

SEQ ID NO:34 аминокислотная последовательность GPT ячменя (зрелый белок, нецелевая последовательность)
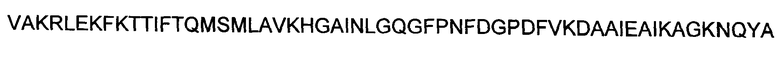

SEQ ID NO:35 аминокислотная последовательность GPT полосатой перцины (зрелый белок, нецелевая последовательность)

SEQ ID NO:36 аминокислотная последовательность GPT бамбука (зрелый белок, нецелевая последовательность)



















































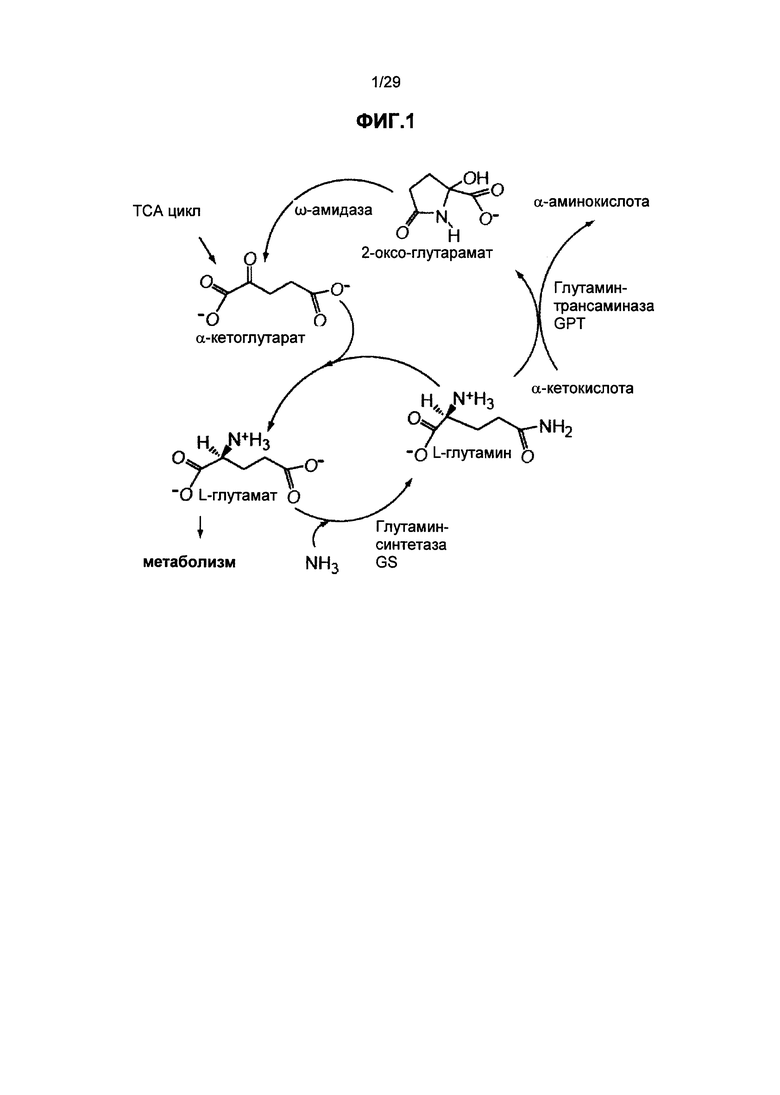



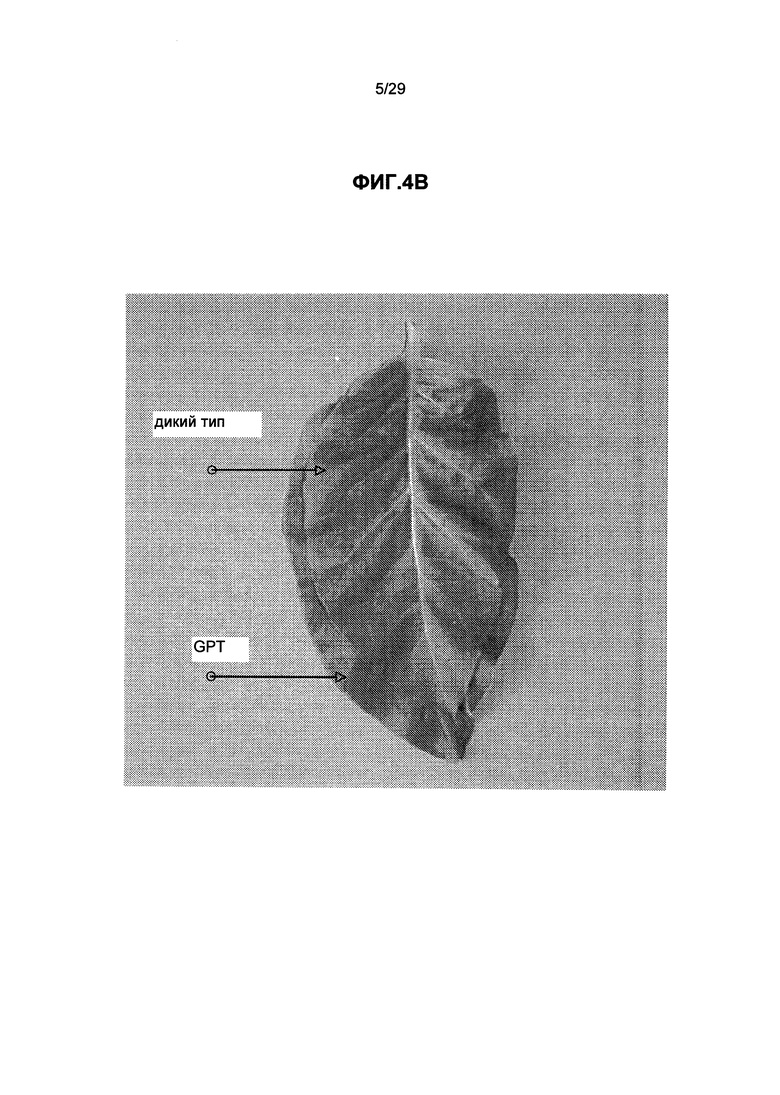






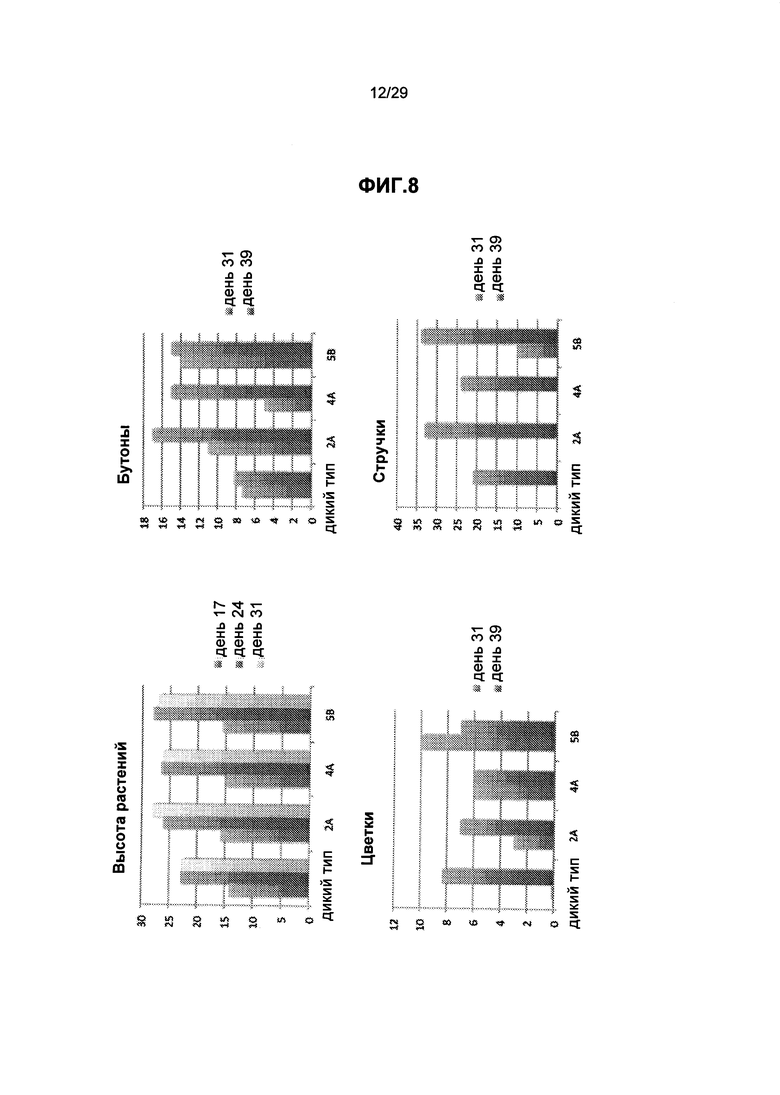



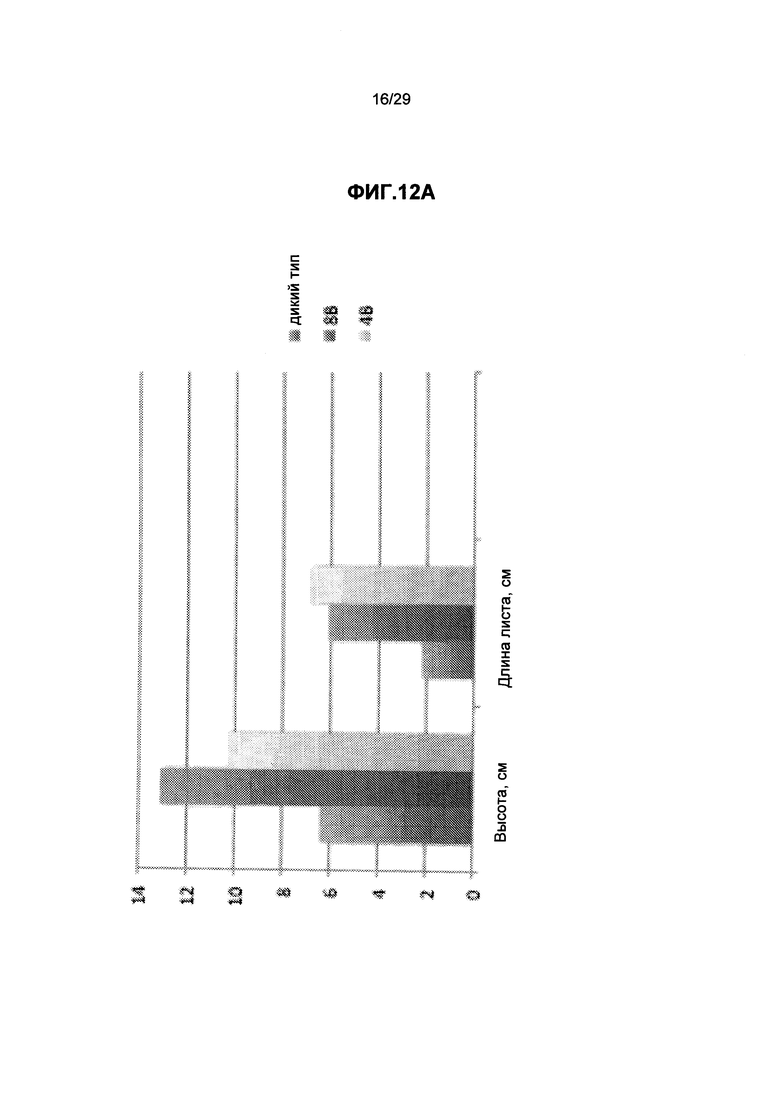
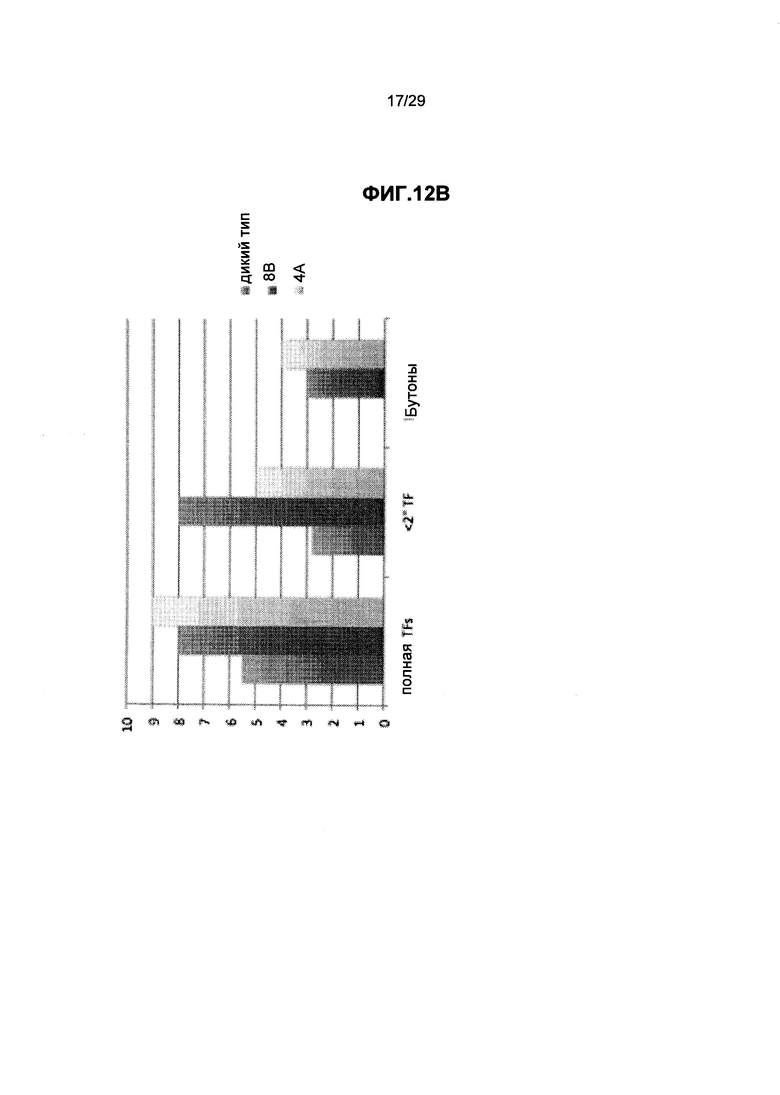
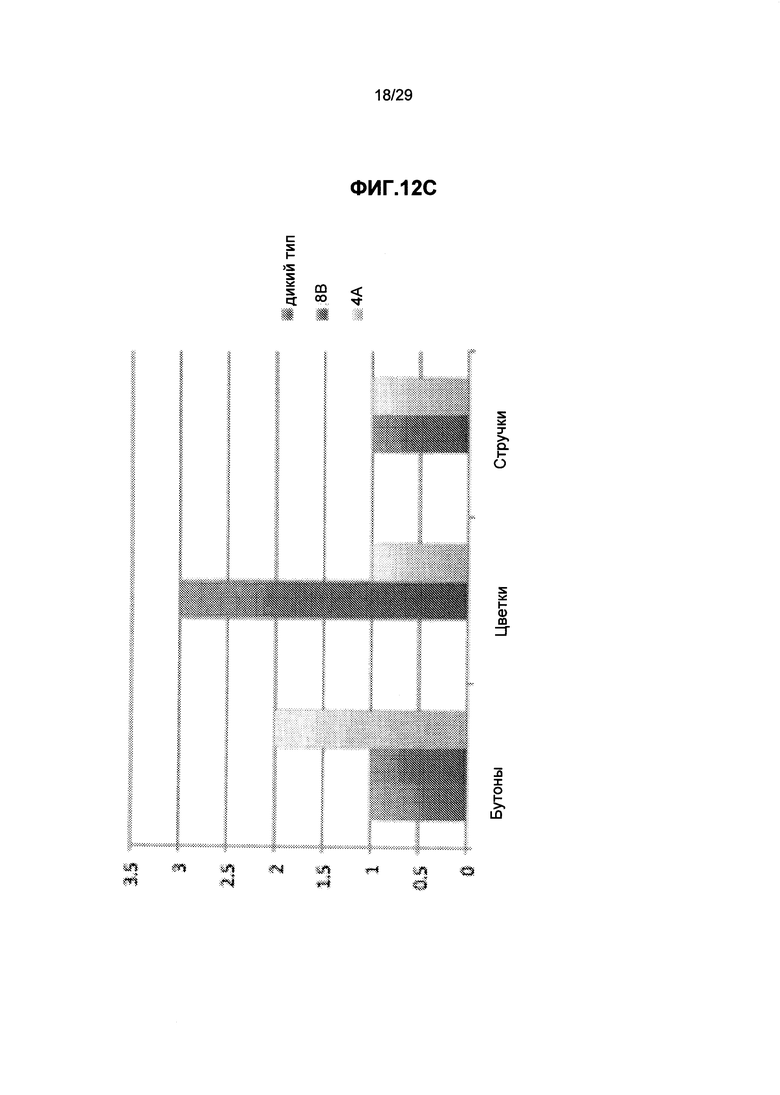


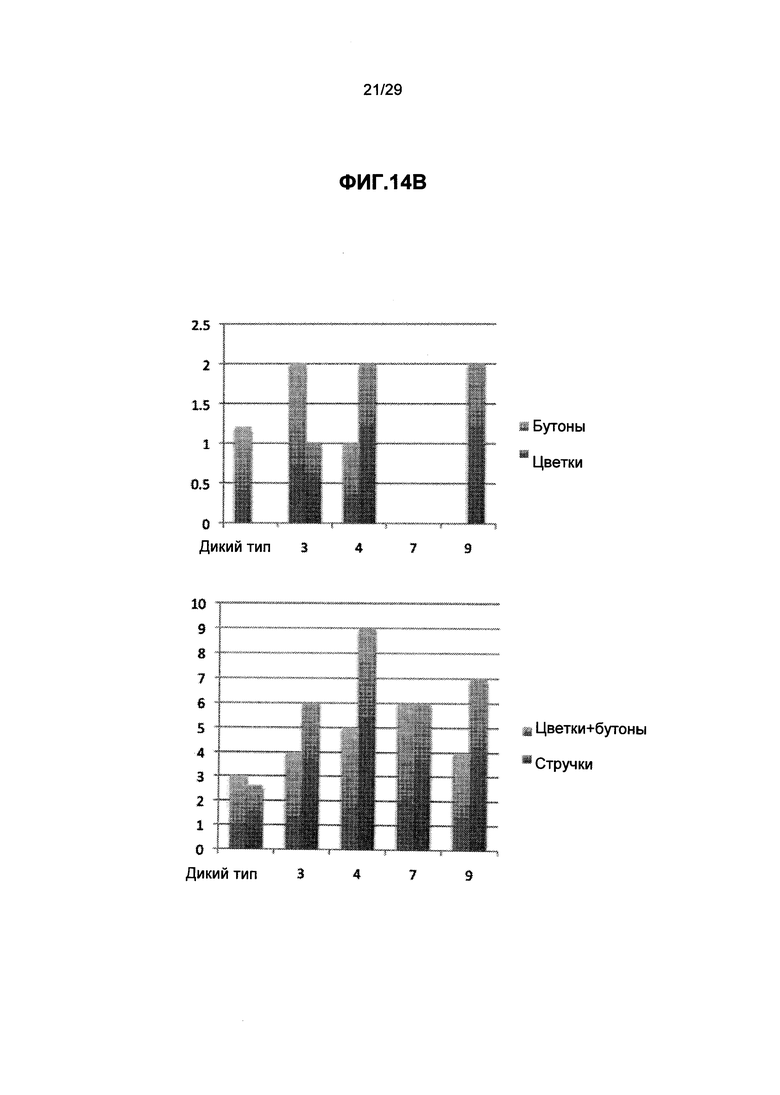








Изобретение относится к области биохимии, в частности к трансгенному растению, которое демонстрирует увеличенную биомассу по сравнению с аналогом дикого типа или нетрансформированным растением, содержащему трансген глутамин-фенилпируват-трансаминазы и трансген глутаминсинтетазы, где каждый GPT трансген и GS трансген операбельно связан с растительным промотором, а также к семени для его получения. Также раскрыты способы получения трансгенных растений, имеющих увеличенную продукцию 2-оксоглутарамата с использованием трансгена глутамин-фенилпируват-трансаминазы и трансгена глутаминсинтетазы. Изобретение позволяет эффективно получать трансгенное растение с увеличенной биомассой. 5 н. и 35 з.п. ф-лы, 20 ил., 16 табл., 24 пр.
1. Трансгенное растение, содержащее трансген глутамин-фенилпируват-трансаминазы (GPT) и трансген глутаминсинтетазы (GS), где каждый GPT трансген и GS трансген операбельно связан с растительным промотором,
где трансгенное растение демонстрирует увеличенную биомассу по сравнению с аналогом дикого типа или нетрансформированным растением;
где трансген GPT кодирует полипептид, имеющий аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO: 2; SEQ ID NO: 9; SEQ ID NO: 11, SEQ ID NO: 13, SEQ ID NO: 15, SEQ ID NO: 17, SEQ ID NO: 19, SEQ ID NO:21, и
где GS трансген кодирует полипептид, имеющий аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO: 4 и SEQ ID NO: 7.
2. Трансгенное растение по п. 1, где GS трансген представляет собой GS1 трансген.
3. Трансгенное растение по п. 1 или 2, где GPT и GS трансгены встраиваются в геном растения.
4. Трансгенное растение по п. 3, где трансгенное растение представляет собой односемядольное растение.
5. Трансгенное растение по п. 3, где трансгенное растение представляет собой двудольное растение.
6. Трансгенное семя для получения растения, обладающего увеличенной биомассой, содержащее трансген глутамин-фенилпируват-трансаминазы (GPT) и трансген глутаминсинтетазы (GS), где каждый GPT трансген и GS трансген операбельно связан с растительным промотором,
где растение, выросшее из трансгенного семени, демонстрирует увеличенный выход биомассы по сравнению с аналогом дикого типа или нетрансформированным растением;
где трансген GPT кодирует полипептид, имеющий аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO: 2; SEQ ID NO: 9; SEQ ID NO: 11, SEQ ID NO: 13, SEQ ID NO: 15, SEQ ID NO: 17, SEQ ID NO: 19, SEQ ID NO: 21, и
где GS трансген кодирует полипептид, имеющий аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO: 4 и SEQ ID NO: 7.
7. Способ получения трансгенных растений, имеющих увеличенную продукцию 2-оксоглутарамата посредством трансформации растений трансгенами, которые кодируют ферменты пути синтеза 2-оксоглутамата, для увеличения таким образом биомассы трансгенных растений по сравнению с аналогом дикого типа или нетрансформированным растением, содержащий:
(a) введение трансгена глутамин-фенилпируват-трансаминазы (GPT) в растения;
(b) введение трансгена глутаминсинтетазы (GS) в растения;
(c) экспрессию трансгена GPT и трансгена GS в трансгенные растения; и
(d) отбор трансгенного растения, имеющего повышенную биомассу по сравнению с растением того же вида, которое не содержит трансген GPT или трансген GS, где указанное трансгенное растение продуцирует больше 2-оксоглутамата относительно растения того же вида, которое не содержит трансген GPT или трансген GS,
где трансген GPT кодирует полипептид, имеющий аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO: 2; SEQ ID NO: 9; SEQ ID NO: 11, SEQ ID NO: 13, SEQ ID NO: 15, SEQ ID NO: 17, SEQ ID NO: 19, SEQ ID NO:21, и
где GS трансген кодирует полипептид, имеющий аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO: 4 и SEQ ID NO: 7.
8. Способ по п. 7, где трансгенное растение содержит по меньшей мере одну дополнительную характеристику роста, выбранную из группы, состоящей из более раннего цветения, более ранней бутонизации, увеличенной высоты растения, усиленного цветения, усиленной бутонизации, большего размера листьев, увеличенного урожая плодов или стручков и увеличенного урожая семян.
9. Способ по п. 7, дополнительно содержащий сбор семян у трансгенного растения и отбор семян, которые демонстрируют улучшенное прорастание в условиях с очень высоким содержанием соли.
10. Способ по п. 9, дополнительно содержащий выращивание растения из отобранных таким образом семян, демонстрирующих улучшенное прорастание в условиях с очень высоким содержанием соли, и сбор семян у этого растения.
11. Способ по п. 7, где трансген GPT содержит GPT кодирующую последовательность, которая гибридизуется с GPT полинуклеотидом, который кодирует полипептид, имеющий аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO: 2; SEQ ID NO: 9; SEQ ID NO: 11; SEQ ID NO: 13; SEQ ID NO: 15, SEQ ID NO: 17; SEQ ID NO: 19, SEQ ID NO: 21, при условиях гибридизации, которые включают гибридизацию в буфере из 40% формамида, 1М NaCl, 1% SDS при 37°C и по меньшей мере одну промывку в 0.2 X SSC при температуре по меньшей мере около 50°С в течение 20 минут.
12. Способ по п. 7, где трансгенное растение представляет собой табак, томат, перец, фасоль, вигну, люцерну, канталупу, тыкву и рыжик посевной.
13. Способ по п. 7, где трансгенное растение имеет увеличенное соотношение лист: корень GPT активности по сравнению с растением того же вида, которое не содержит трансген GPT или трансген GS.
14. Способ по п. 7, где трансгенное растение имеет увеличенное соотношение лист: корень GS активности по сравнению с растением того же вида, которое не содержит трансген GPT или трансген GS.
15. Способ по п. 7, где трансгенное растение имеет увеличенное соотношение лист: корень 2-оксоглутомата по сравнению с растением того же вида, которое не содержит трансген GPT или трансген GS.
16. Трансгенное растение по п. 1, где трансгенное растение содержит по меньшей мере одну дополнительную характеристику роста по сравнению с аналогом дикого типа или нетрансформированным растением, выбранную из группы, состоящей из более раннего цветения, более ранней бутонизации, увеличенной высоты растения, усиленного цветения, усиленной бутонизации, большего размера листьев, увеличенного урожая плодов или стручков и увеличенного урожая семян.
17. Трансгенное растение по п. 1, где трансгенное растение имеет увеличенное соотношение лист: корень GPT активности по сравнению с растением того же вида, которое не содержит трансген GPT или трансген GS.
18. Трансгенное растение по п. 1, где трансгенное растение имеет увеличенное соотношение лист: корень GS активности по сравнению с растением того же вида, которое не содержит трансген GPT или трансген GS.
19. Трансгенное растение по п. 1, где трансгенное растение имеет увеличенное соотношение лист: корень 2-оксоглутомата по сравнению с растением того же вида, которое не содержит трансген GPT или трансген GS.
20. Трансгенное семя по п. 6, где растение, выращенное из семян, проявляет повышенную толерантность к соли или солевым условиям.
21. Трансгенное семя по п. 6, где GPT и GS трансгены включены в геном трансгенного семени.
22. Трансгенное семя по п. 6, где трансгенное семя является однодольным.
23. Трансгенное семя по п. 6, где трансгенное семя является двудольным.
24. Способ получения трансгенных растений, имеющих увеличенную продукцию 2-оксоглутарамата посредством трансформации клеток растения трансгенами, которые кодируют ферменты пути синтеза 2-оксоглутамата, для увеличения таким образом биомассы трансгенных растений по сравнению с аналогом дикого типа или нетрансформированным растением, содержащий:
(a) введение трансгена глутамин-фенилпируват-трансаминазы (GPT) в первое множество растений с получением первого множества трансгенных растений;
(b) введение трансгена глутаминсинтетазы (GS) во второе множество растений с получением второго множества трансгенных растений;
(c) отбор первого растения из первого множества трансгенных растений или их потомства, причем указанное растение содержит GPT трансген;
(d) отбор второго растения из второго множества трансгенных растений или их потомства, причем указанное растение содержит GS трансген;
(е) скрещивание указанного первого растения с указанным вторым растением с получением дважды трансгенного потомства, содержащего указанный GPT трансген и указанный GS трансген,
где указанное дважды трансгенное потомство продуцирует больше 2-оксоглутамата относительно растения того же вида, которое не содержит трансген GPT или трансген GS,
где трансген GPT кодирует полипептид, имеющий аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO: 2; SEQ ID NO: 9; SEQ ID NO: 11, SEQ ID NO: 13, SEQ ID NO: 15, SEQ ID NO: 17, SEQ ID NO: 19, SEQ ID NO:21, и
где GS трансген кодирует полипептид, имеющий аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO: 4 и SEQ ID NO: 7.
25. Способ по п. 24, где трансген GPT содержит GPT кодирующую последовательность, которая гибридизуется с GPT полинуклеотидом, который кодирует полипептид, имеющий аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO: 2; SEQ ID NO: 9; SEQ ID NO: 11; SEQ ID NO: 13; SEQ ID NO: 15, SEQ ID NO: 17; SEQ ID NO: 19, SEQ ID NO: 21, при условиях гибридизации, которые включают гибридизацию в буфере из 40% формамида, 1М NaCl, 1% SDS при 37°С и по меньшей мере одну промывку в 0.2 X SSC при температуре по меньшей мере около 50°С в течение 20 минут.
26. Способ по п. 24, где указанное дважды трансгенное потомство содержит по меньшей мере одну дополнительную характеристику роста, выбранную из группы, состоящей из увеличенной биомассы, более раннего цветения, более ранней бутонизации, увеличенной высоты растения, усиленного цветения, усиленной бутонизации, большего размера листьев, увеличенного урожая плодов или стручков и увеличенного урожая семян.
27. Способ по п. 24, дополнительно содержащий опыление потомства указанного первого множества трансгенных растений до стадии отбора указанного первого растения из потомства первого множества трансгенных растений.
28. Способ по п. 24, дополнительно содержащий опыление потомства указанного второго множества трансгенных растений до стадии отбора указанного второго растения из потомства второго множества трансгенных растений.
29. Способ по п. 24, где первые и вторые множества растений представляют собой табак, томат, перец, фасоль, вигну, люцерну, канталупу, тыкву и рыжик посевной.
30. Способ по п. 24, где дважды трансгенное потомство имеет увеличенное соотношение лист: корень GPT активности по сравнению с растением того же вида, которое не содержит трансген GPT или трансген GS.
31. Способ по п. 24, где дважды трансгенное потомство имеет увеличенное соотношение лист: корень GS активности по сравнению с растением того же вида, которое не содержит трансген GPT или трансген GS.
32. Способ по п. 24, где дважды трансгенное потомство имеет увеличенное соотношение лист: корень 2-оксоглутомата по сравнению с растением того же вида, которое не содержит трансген GPT или трансген GS.
33. Способ получения трансгенных растений, имеющих увеличенную продукцию 2-оксоглутарамата посредством трансформации клеток растения трансгенами, которые кодируют ферменты пути синтеза 2-оксоглутамата, для увеличения таким образом биомассы трансгенных растений по сравнению с аналогом дикого типа или нетрансформированным растением, содержащий:
(а) введение (i) трансгена глутамин-фенилпируват-трансаминазы (GPT) и (ii) трансгена глутаминсинтетазы (GS) в первое множество клеток растения;
(b) регенерацию множества трансгенных растений из клеток растений; и
(c) отбор трансгенного растения, имеющего улучшенные характеристики роста по сравнению с растением того же вида, которое не содержит трансген GPT или трансген GS, где указанное трансгенное растение продуцирует больше 2-оксоглутамата относительно растения того же вида, которое не содержит трансген GPT или трансген GS,
где трансген GPT содержит GPT кодирующую последовательность, которая гибридизуется с GPT полинуклеотидом, который кодирует полипептид, имеющий аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO: 2; SEQ ID NO: 9; SEQ ID NO: 11; SEQ ID NO: 13; SEQ ID NO: 15, SEQ ID NO: 17; SEQ ID NO: 19, SEQ ID NO: 21, при условиях гибридизации, которые включают гибридизацию в буфере из 40% формамида, 1М NaCl, 1% SDS при 37°С и по меньшей мере одну промывку в 0.2 X SSC при температуре по меньшей мере около 50°С в течение 20 минут,
GS трансген кодирует полипептид, имеющий аминокислотную последовательность, выбранную из группы, состоящей из: SEQ ID NO: 4 и SEQ ID NO: 7.
34. Способ по п. 33, где улучшенные характеристики роста выбираются из группы, состоящей из увеличенной биомассы, более раннего цветения, более ранней бутонизации, увеличенной высоты растения, усиленного цветения, усиленной бутонизации, большего размера листьев, увеличенного урожая плодов или стручков и увеличенного урожая семян.
35. Способ по п. 33, где трансгенное растение представляет собой табак, томат, перец, фасоль, вигну, люцерну, канталупу, тыкву и рыжик посевной.
36. Способ по п. 33, где трансгенное растение имеет увеличенное соотношение лист: корень GPT активности по сравнению с растением того же вида, которое не содержит трансген GPT или трансген GS.
37. Способ по п. 33, где трансгенное растение имеет увеличенное соотношение лист: корень GS активности по сравнению с растением того же вида, которое не содержит трансген GPT или трансген GS.
38. Способ по п. 33, где трансгенное растение имеет увеличенное соотношение лист: корень 2-оксоглутомата по сравнению с растением того же вида, которое не содержит трансген GPT или трансген GS.
39. Способ по п. 33, дополнительно содержащий сбор семян трансгенного растения и отбор семени, которое демонстрирует улучшенное прорастание в условиях повышенного содержания соли.
40. Способ по п. 33, дополнительно содержащий прорастание растения из семени, демонстрирующего улучшенное прорастание в условиях повышенного содержания соли, и сбор его семян.
Авторы
Даты
2016-04-20—Публикация
2009-08-31—Подача