Область техники, к которой относится изобретение
[0001]
Настоящее изобретение относится к новому азаиндольному производному, обладающему селективным JAK3-ингибиторным эффектом, и к фармацевтической композиции, содержащей азаиндольное производное в качестве активного ингредиента.
Уровень техники
[0002]
Известно, что JAK3, также как и JAK1, JAK2 и TYK2, представляет собой не-рецепторную тирозиновую киназу, относящуюся к JAK семейству, и что JAK3 вовлечена в передачу сигналов различных цитокинов.
JAK1, JAK2 и TYK2 экспрессируются во множестве различных тканей, тогда как экспрессия JAK3 в основном ограничивается лимфоцитами, такими как T-клетки, B-клетки и природные киллерные клетки. JAK1- и JAK2-дефицитные мыши являются эмбрионально летальными или умирают сразу же после рождения, тогда как у JAK3-дефицитных мышей или людей развивается тяжелый комбинированный иммунодефицит из-за дисфункции лимфоцитов.
[0003]
Считают, что ингибитор JAK3 ингибирует сигналы шести типов цитокинов (т.е. IL-2, IL-4, IL-7, IL-9, IL-15, и IL-21), специфически подавляя, таким образом, функцию лимфоцитов, таких как T-клетки или B-клетки, которые играют важную роль в иммунной системе. Таким образом, ожидается, что ингибитор JAK3 может представлять собой эффективное терапевтическое средство от заболеваний, связанных с активацией указанных выше клеток, при минимальном проявлении побочных эффектов (Непатентная литература 1 и 2).
Сообщалось о том, что примеры заболевания, которое можно лечить ингибитором JAK3, включают аутоиммунное заболевание (ревматоидный артрит, системная красная волчанка, склеродерма, полимиозит-дерматомиозит, синдром Шегрена, болезнь Бехчета и т.д.), аллергическое заболевание (бронхиальная астма, аллергический ринит/сенная лихорадка, атопический дерматит, пищевая аллергия, анафилаксия, лекарственная аллергия, крапивница, конъюнктивит и т.д.), заболевание нервной системы (рассеянный склероз, болезнь Альцгеймера и т.д.), воспалительное заболевание кишечника (язвенный колит, болезнь Крона), псориаз, контактный дерматит, диабет, заболевание брюшной полости, вирусное инфекционное заболевание, острый респираторный дистресс-синдром (ARDS), болезнь трансплантат-против-хозяина (GVHD), отторжение трансплантата, гематологическое злокачественное заболевание (лимфома, лейкоз) и другие злокачественные опухоли (Непатентная литература 3-8).
[0004]
Более того, Тофацитиниб (Pfizer), ингибитор JAK3, используется в качестве терапевтического средства от ревматоидного артрита в клинических условиях. Сообщалось о том, что этот ингибитор JAK3 обладает низкой селективностью в отношении JAK3, и что, таким образом, вызываются побочные эффекты (повышение уровня липидов, анемия, нейтропения, иммуносепрессия и т.д.) в результате ингибирования JAK1 и JAK2 (Непатентная литература 9).
Кроме того, азаиндольное производное, содержащее циклический заместитель в 4-положении, и азаиндольное производное, содержащее циклические заместители в 3- и 5-положениях были описаны как ингибиторы JAK. Однако эти азаиндольные производные обладают низкой селективностью в отношении JAK3, и их ингибиторная активность является недостаточной (Патентная литература 1 и 2).
Перечень цитируемых документов
Патентная литература
[0005]
[Патентная литература 1] Международная публикация № WO 2006/127587
[Патентная литература 2] Международная публикация № WO 2006/004984
Непатентная литература
[0006]
[Непатентная литература 1] Immunol Rev. 2009; 228 (1): 273-87.
[Непатентная литература 2] Int J Biochem Cell Biol. 2009; 41 (12): 2376-9.
[Непатентная литература 3] Trends Pharmacol Sci. 2004; 25 (11): 558-62.
[Непатентная литература 4] J Clin Immunol. 2013; 33 (3): 586-94.
[Непатентная литература 5] PLoS One. 2012; 7 (2): e31721.
[Непатентная литература 6] Cancer Discov. 2012; 2 (7): 591-7.
[Непатентная литература 7] Ann Rheum Dis. 2004; 63 (Suppl II): ii67-ii71.
[Непатентная литература 8] Bull Korean Chem Soc. 2011; 32 (3): 1077-1079.
[Непатентная литература 9] J Med Chem. 2010; 53 (24): 8468-84.
Сущность изобретения
Техническая задача
[0007]
Целью настоящего изобретения является обеспечение нового соединения, которое селективно и сильно ингибирует JAK3, или его соли и фармацевтической композиции, содержащей такое соединение.
Решение задачи
[0008]
В результате тщательного изучения, направленного на достижение указанной выше цели, авторами настоящего изобретения было обнаружено, что группа соединений, которые содержат азаиндол в качестве основной структуры, содержат циклоалкенильную группу в 4-положении и, кроме того, содержат циклический заместитель в 3-положении, обладает селективной ингибиторной активностью в отношении JAK3. Более того, авторами настоящего изобретения было обнаружено, что соединение по настоящему изобретению обладает отличным эффектом подавления роста мононуклеарных клеток периферической крови человека (далее указаны как PBMC), и затем было подтверждено, что соединение является полезным в качестве фармацевтического средства для лечения различных заболеваний с вовлечением JAK3 (в частности, аутоиммунного заболевания). Кроме того, авторы настоящего изобретения подтвердили, что соединение по настоящему изобретению обладает отличной всасываемостью при пероральном введении и является полезным в качестве перорального фармацевтического продукта, завершив, таким образом, создание настоящего изобретения.
[0009]
Настоящее изобретение обеспечивает следующее [1]-[21].
[0010]
[1] Соединение следующей формулы (I) или его соль:
[0011]
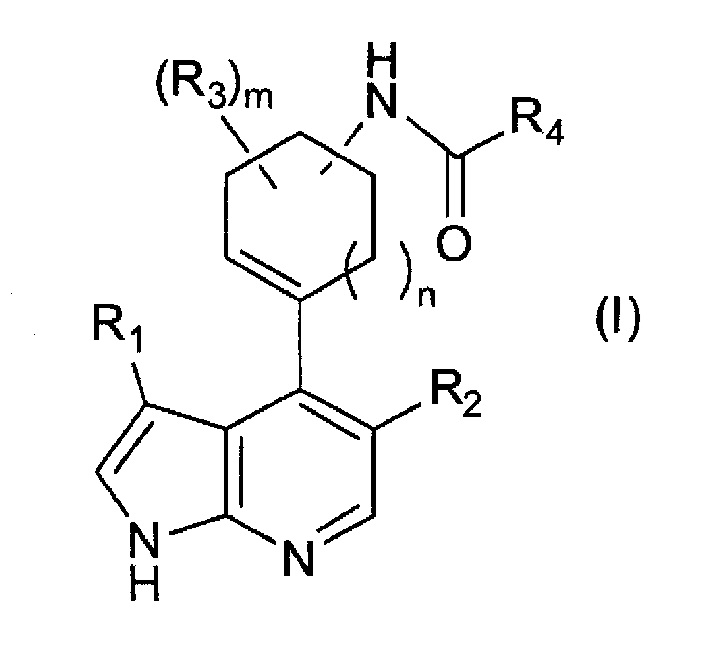 ,
,
[0012]
где
R1 представляет собой необязательно замещенную C4-C10 циклоалкильную группу, необязательно замещенную C4-C10 циклоалкенильную группу, необязательно замещенную C4-C10 циклоалкинильную группу, необязательно замещенную C6-C14 ароматическую углеводородную группу или необязательно замещенную 4-10-членную насыщенную или ненасыщенную гетероциклическую группу;
R2 представляет собой атом водорода, атом галогена, гидроксигруппу, цианогруппу, нитрогруппу, -C(=O)Rx, -C(=O)ORx, -C(=O)N(Rx)(Ry), -N(Rx)(Ry), -NRxC(=O)Ry, -NRxS(=O)2Ry, -NRxC(=O)ORy, -NRxC(=O)N(Ry)(Rz), -NRxS(=O)2N(Ry)(Rz), -OC(=O)Rx, -OC(=O)ORx, -OC(=O)N(Rx)(Ry), -SRx, -S(=O)2Rx, -S(=O)2ORx, необязательно Rb-замещенную C1-C6 алкильную группу, необязательно Rb-замещенную C2-C6 алкенильную группу, необязательно Rb-замещенную C2-C6 алкинильную группу, необязательно Rb-замещенную C1-C6 алкоксигруппу, необязательно Rc-замещенную C3-C10 циклоалкильную группу, необязательно Rc-замещенную C6-C14 ароматическую углеводородную группу или необязательно Rc-замещенную 4-10-членную насыщенную или ненасыщенную гетероциклическую группу;
R3 представляет собой атом галогена, аминогруппу, гидроксигруппу, цианогруппу, нитрогруппу, C1-C6 алкильную группу, C2-C6 алкенильную группу, C2-C6 алкинильную группу или C1-C6 алкоксигруппу;
R4 представляет собой необязательно Rb-замещенную C2-C6 алкенильную группу или необязательно Rb-замещенную C2-C6 алкинильную группу;
Rb представляет собой атом галогена, аминогруппу, гидроксигруппу, цианогруппу, нитрогруппу, C1-C6 алкоксигруппу, ди- или моно-(C1-C6 алкил)аминогруппу или 4-10-членную насыщенную или ненасыщенную гетероциклическую группу;
Rc представляет собой атом галогена, аминогруппу, гидроксигруппу, цианогруппу, нитрогруппу, оксогруппу, иминогруппу, N-оксидную группу, C1-C6 алкильную группу, C2-C6 алкенильную группу, C2-C6 алкинильную группу, C1-C6 алкоксигруппу или ди- или моно-(C1-C6 алкил)аминогруппу;
Rx, Ry и Rz, которые являются одинаковыми или отличными друг от друга, представляют собой каждый атом водорода, C1-C6 алкильную группу, C1-C6 галогеналкильную группу, C2-C6 алкенильную группу, C2-C6 алкинильную группу, C3-C10 циклоалкильную группу, C6-C14 ароматическую углеводородную группу или 4-10-членную насыщенную или ненасыщенную гетероциклическую группу;
m представляет собой целое число, имеющее значение от 0 до 3; и
n представляет собой целое число, имеющее значение от 0 до 2.
[0013]
[2] Соединение в соответствии с пунктом [1] или его соль, где группа, которой C4-C10 циклоалкильная группа, C4-C10 циклоалкенильная группа, C4-C10 циклоалкинильная группа, C6-C14 ароматическая углеводородная группа или 4-10-членнаянасыщенная или ненасыщенная гетероциклическая группа, которая представлена как R1, необязательно замещена, представляет собой Ra, и Ra представляет собой атом галогена, гидроксигруппу, цианогруппу, нитрогруппу, оксогруппу, N-оксидную группу, -C(=O)Rx, -C(=O)ORx, -C(=O)N(Rx)(Ry), -C(=O)SRx, -C(=S)ORx, -C(=O)ON(Rx)(Ry), -N(Rx)(Ry), -NRxC(=O)Ry, -NRxS(=O)2Ry, -NRxC(=O)ORy, -NRxC(=O)N(Ry)(Rz), -NRxS(=O)2N(Ry)(Rz), -N(Rx)-ORy, =NRx, =N-ORx, -OC(=O)Rx, -OC(=S)Rx, -OC(=O)ORx, -OC(=O)N(Rx)(Ry), -OC(=S)ORx, -SRx, -S(=O)2Rx, -S(=O)2ORx, -S(=O)2N(Rx)(Ry), необязательно Rb-замещенную C1-C6 алкильную группу, необязательно Rb-замещенную C2-C6 алкенильную группу, необязательно Rb-замещенную C2-C6 алкинильную группу, необязательно Rb-замещенную C1-C6 алкоксигруппу, необязательно Rc-замещенную C3-C10 циклоалкильную группу, необязательно Rc-замещенную C6-C14 ароматическую углеводородную группу или необязательно Rc-замещенную 4-10-членную насыщенную или ненасыщенную гетероциклическую группу.
[3] Соединение в соответствии с пунктом [1] или [2] или его соль, где R1 представляет собой необязательно Ra-замещенную C5-C7 циклоалкенильную группу, необязательно Ra-замещенную C6-C10 ароматическую углеводородную группу или необязательно Ra-замещенную моноциклическую 4-7-членную ненасыщенную гетероциклическую группу, содержащую 1-3 гетероатома, выбранных из группы, состоящей из N, S и O.
[4] Соединение в соответствии с любым из пунктов [1]-[3] или его соль, где R1 представляет собой циклопентенильную группу, циклогексенильную группу, фенильную группу, фуранильную группу, 1H-пиразолильную группу, тиазолильную группу, оксазолильную группу, изоксазолильную группу, 1,3,4-тиадиазолильную группу, 1,2,4-оксадиазолильную группу, 1,3,4-оксадиазолильную группу, пиридильную группу, дигидропиранильную группу, дигидрофуранильную группу или 4,5-дигидро-1,3,4-оксадиазолильную группу, и циклоалкенильная группа, ароматическая углеводородная группа и ненасыщенная гетероциклическая группа необязательно замещены группой Ra.
[5] Соединение в соответствии с любым из пунктов [1]-[4] или его соль, где R1 представляет собой циклопентенильную группу, циклогексенильную группу, фенильную группу, фуранильную группу, 1H-пиразолильную группу, тиазолильную группу, оксазолильную группу, изоксазолильную группу, 1,3,4-тиадиазолильную группу, 1,2,4-оксадиазолильную группу, 1,3,4-оксадиазолильную группу, пиридильную группу, дигидропиранильную группу, дигидрофуранильную группу или 4,5-дигидро-1,3,4-оксадиазолильную группу, и циклоалкенильная группа, ароматическая углеводородная группа и ненасыщенная гетероциклическая группа необязательно замещены группой, выбранной из группы, состоящей из атома галогена, аминогруппы, гидроксигруппы, оксогруппы, N-оксидной группы, формильной группы, C1-C6 алкильной группы (которая необязательно замещена группой, выбранной из группы, состоящей из гидроксигруппы и ди- или моно-(C1-C6 алкил)аминогруппы), C1-C6 алкоксигруппы (которая необязательно замещена атомом галогена), и 4-10-членной насыщенной гетероциклической группы.
[6] Соединение в соответствии с любым из пунктов [1]-[5] или его соль, где R1 представляет собой циклопентенильную группу; циклогексенильную группу; фенильную группу; фуранильную группу, которая необязательно замещена группой, выбранной из группы, состоящей из формильной группы и C1-C6 алкильной группы (которая необязательно замещена группой, выбранной из группы, состоящей из гидроксигруппы и ди- или моно-(C1-C6 алкил)аминогруппы); 1H-пиразолильную группу, которая необязательно замещена группой, выбранной из группы, состоящей из C1-C6 алкильной группы и 4-10-членной насыщенной гетероциклической группы; тиазолильную группу; оксазолильную группу; изоксазолильную группу; 1,3,4-тиадиазолильную группу; 1,2,4-оксадиазолильную группу; 1,3,4-оксадиазолильную группу, которая необязательно замещена C1-C6 алкильной группой; пиридильную группу, которая необязательно замещена группой, выбранной из группы, состоящей из атома галогена, аминогруппы, гидроксигруппы, N-оксидной группы, C1-C6 алкильной группы (которая необязательно замещена гидроксигруппой) и C1-C6 алкоксигруппы (которая необязательно замещена атомом галогена); дигидропиранильную группу; дигидрофуранильную группу; или 4,5-дигидро-1,3,4-оксадиазолильную группу, которая необязательно замещена группой, выбранной из группы, состоящей из оксогруппы и C1-C6 алкильной группы.
[7] Соединение в соответствии с любым из пунктов [1]-[6] или его соль, где R2 представляет собой атом водорода, цианогруппу, -C(=O)ORx, -C(=O)N(Rx)(Ry), необязательно Rb-замещенную C1-C6 алкильную группу, необязательно Rb-замещенную C1-C6 алкокси группу или необязательно Rc-замещенную моноциклическую 4-7-членную ненасыщенную гетероциклическую группу, содержащую 1-3 гетероатома, выбранных из группы, состоящей из N, S и O.
[8] Соединение в соответствии с любым из пунктов [1]-[7] или его соль, где R2 представляет собой атом водорода; циано группу; (C1-C6 алкокси)карбонильную группу; карбамоильную группу; ди- или моно-(C1-C6 алкил)карбамоильную группу; C1-C6 алкильную группу, которая необязательно замещена группой, выбранной из группы, состоящей из гидроксигруппы, C1-C6 алкоксигруппы, ди- или моно-(C1-C6 алкил)аминогруппы и 4-10-членной насыщенной гетероциклической группы; C1-C6 алкоксигруппу; или моноциклическую 5- или 6-членную полностью ненасыщенную гетероциклическую группу, содержащую 1-3 N атома, которая необязательно замещена C1-C6 алкильной группой.
[9] Соединение в соответствии с любым из пунктов [1]-[8] или его соль, где m имеет значение 0, n имеет значение 0 или 1, R4 представляет собой C2-C6 алкенильную группу или C2-C6 алкинильную группу, и
в формуле (I) следующая структура:
представляет собой любую из следующих структур:
[0014]
[10] Соединение в соответствии с любым из пунктов [1]-[9] или его соль, где
R1 представляет собой циклопентенильную группу; циклогексенильную группу; фенильную группу; фуранильную группу, которая необязательно замещена группой, выбранной из группы, состоящей из формильной группы и C1-C6 алкильной группы (которая необязательно замещена группой, выбранной из группы, состоящей из гидроксигруппы и ди- или моно-(C1-C6 алкил)аминогруппы); 1H-пиразолильную группу, которая необязательно замещена группой, выбранной из группы, состоящей из C1-C6 алкильной группы и 4-10-членной насыщенной гетероциклической группы; тиазолильную группу; оксазолильную группу; изоксазолильную группу; 1,3,4-тиадиазолильную группу; 1,2,4-оксадиазолильную группу; 1,3,4-оксадиазолильную группу, которая необязательно замещена C1-C6 алкильной группой; пиридильную группу, которая необязательно замещена группой, выбранной из группы, состоящей из атома галогена, аминогруппы, гидроксигруппы, N-оксидной группы, C1-C6 алкильной группы (которая необязательно замещена гидроксигруппой) и C1-C6 алкоксигруппы (которая необязательно замещена атомом галогена); дигидропиранильную группу; дигидрофуранильную группу; или 4,5-дигидро-1,3,4-оксадиазолильную группу, которая необязательно замещена группой, выбранной из группы, состоящей из оксогруппы и C1-C6 алкильной группы,
R2 представляет собой атом водорода; цианогруппу; (C1-C6 алкокси)карбонильную группу; карбамоильную группу; ди- или моно-(C1-C6 алкил)карбамоильную группу; C1-C6 алкильную группу, которая необязательно замещена группой, выбранной из группы, состоящей из гидроксигруппы, C1-C6 алкоксигруппы, ди- или моно-(C1-C6 алкил)аминогруппы и 4-10-членной насыщенной гетероциклической группы; C1-C6 алкоксигруппу; или моноциклическую 5- или 6-членную полностью ненасыщенную гетероциклическую группу, содержащую 1-3 N атома, которая необязательно замещена C1-C6 алкильной группой,
m имеет значение 0, n имеет значение 0 или 1, R4 представляет собой C2-C6 алкенильную группу, и
в формуле (I) следующая структура:
представляет собой любую из следующих структур:
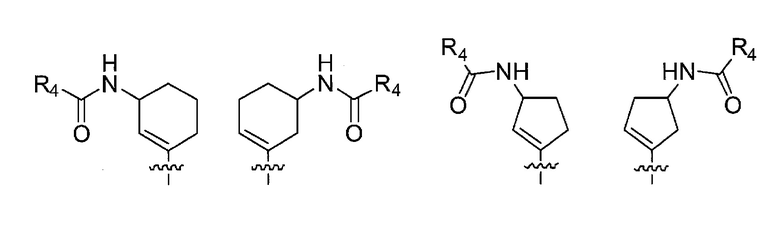
[11] Соединение в соответствии с любым из пунктов [1]-[10] или его соль, где соединение представляет собой любое из соединений, представленных ниже в (1)-(11):
(1) N-(3-(3-фенил-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид,
(2) N-(3-(3-(1H-пиразол-4-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид,
(3) N-(3-(3-(2-метоксипиридин-3-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид,
(4) N-(3-(3-(фуран-2-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид,
(5) N-(3-(3-(4-(гидроксиметил)фуран-2-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид,
(6) N-(3-(3-(2,5-дигидрофуран-3-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид,
(7) N-(3-(3-(оксазол-5-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид,
(8) N-(3-(3-(1,3,4-оксадиазол-2-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид,
(9) (S)-N-(3-(3-(1,3,4-оксадиазол-2-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид,
(10) N-(3-(3-(1,3,4-оксадиазол-2-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклопент-3-ен-1-ил)акриламид, и
(11) (S)-N-(3-(3-(изоксазол-5-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид.
[0015]
[12] Ингибитор JAK3, содержащий в качестве активного ингредиента соединение в соответствии с любым из пунктов [1]-[11] или его соль.
[13] Фармацевтическая композиция, содержащая соединение в соответствии с любым из пунктов [1]-[11] или его соль.
[14] Фармацевтическая композиция в соответствии с пунктом [13], где фармацевтическая композиция представляет собой фармацевтическую композицию для лечения заболевания, в которое вовлечена JAK3.
[15] Средство для профилактики и/или лечения ревматоидного артрита или рассеянного склероза, содержащее в качестве активного ингредиента соединение в соответствии с любым из пунктов [1]-[11] или его соль.
[16] Соединение в соответствии с любым из пунктов [1]-[11] или его соль для лечения заболевания, в которое вовлечена JAK3.
[17] Соединение в соответствии с любым из пунктов [1]-[11] или его соль для профилактики и/или лечения ревматоидного артрита или рассеянного склероза.
[18] Применение соединения в соответствии с любым из пунктов [1]-[11] или его соли для получения лекарственного средства для лечения заболевания, в которое вовлечена JAK3.
[19] Применение соединения в соответствии с любым из пунктов [1]-[11] или его соли для получения лекарственного средства для профилактики и/или лечения ревматоидного артрита или рассеянного склероза.
[20] Способ профилактики и/или лечения заболевания, в которое вовлечена JAK3, включающий введение соединения в соответствии с любым из пунктов [1]-[11] или его соли.
[21] Способ профилактики и/или лечения ревматоидного артрита или рассеянного склероза, включающий введение соединения в соответствии с любым из пунктов [1]-[11] или его соли.
[Полезные эффекты изобретения]
[0016]
Настоящее изобретение обеспечивает новое азаиндольное производное, полезное в качестве селективного ингибитора JAK3, которое имеет показанную выше формулу (I), или его соль.
Было обнаружено, что соединение по настоящему изобретению или его соль обладает отличной селективной JAK3-ингибиторной активностью и подавляет рост человеческих PBMC, связанный с JAK3 сигналами. Кроме того, соединение по настоящему изобретению обладает отличной всасываемостью при пероральном введении, и таким образом, является полезным в качестве фармацевтического средства для перорального введения. Соответственно, соединение по настоящему изобретению или его соль может предотвратить и/или лечить заболевание, в которое вовлечена JAK3, такое как ревматоидный артрит и рассеянный склероз, не имея при этом тяжелых побочных эффектов, вызываемых JAK1 и JAK2 (повышение уровня липидов, анемия, нейтропения, иммуносепрессия и т.д.).
Описание вариантов осуществления
[0017]
Соединение по настоящему изобретению, имеющее показанную выше формулу (I), представляет собой соединение, которое содержит азаиндол в качестве основной структуры, содержит циклоалкенильную группу в 4-положении и, кроме того, содержит циклический заместитель в 3-положении, и оно является новым соединением, которое не было описано ни в каком из указанных выше ссылочных документов.
[0018]
Что касается заместителей в настоящем описании, "Cx-Cy" означает заместитель, в котором количество атомов углерода в алкильной части или алкокси части составляет от X до Y. Например, "C1-C6 алкильная группа" означает алкильную группу, содержащую от 1 до 6 атомов углерода, и "(C1-C6 алкокси)карбонильная группа" означает карбонильную группу, с которой связывается алкоксигруппа, содержащая от 1 до 6 атомов углерода. Кроме того, "X-Y-членный" означает, что количество атомов, образующих кольцо (количество кольцевых членов), составляет от X до Y. Например, "4-10-членная насыщенная гетероциклическая группа" означает насыщенную гетероциклическую группу, содержащую от 4 до 10 кольцевых членов.
В настоящем описании конкретные примеры "атома галогена" включают атом фтора, атом хлора, атом брома и атом иода.
В настоящем описании "алкильная группа" представляет собой линейную или разветвленную насыщенную углеводородную группу, и конкретные примеры алкильной группы включают метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, изобутильную группу, втор-бутильную группу, трет-бутильную группу, н-пентильную группу и н-гексильную группу.
[0019]
В настоящем описании "алкенильная группа" представляет собой линейную или разветвленную ненасыщенную углеводородную группу, содержащую по меньшей мере одну углерод-углеродную двойную связь, и конкретные примеры алкенильной группы включают винильную группу, аллильную группу, 1-пропенильную группу, 1-метилвинильную группу, 1-бутенильную группу, 2-бутенильную группу и 3-бутенильную группу.
[0020]
В настоящем описании "алкинильная группа" представляет собой линейную или разветвленную ненасыщенную углеводородную группу, содержащую по меньшей мере одну углерод-углеродную тройную связь, и конкретные примеры алкинильной группы включают этинильную группу, 1-пропинильную группу, 2-пропинильную группу, 1-бутинильную группу, 2-бутинильную группу и 3-бутинильную группу.
[0021]
В настоящем описании "галогеналкильная группа" представляет собой группу, в которой от одного до всех атомов водорода выше описанной алкильной группы замещены атомами галогена, и конкретные примеры галогеналкильной группы включают монофторметильную группу, дифторметильную группу, трифторметильную группу, 1-фторэтильную группу, 2-фторэтильную группу, 1,1-дифторэтильную группу, 1,2-дифторэтильную группу и 2,2-дифторэтильную группу.
[0022]
В настоящем описании "алкоксигруппа" представляет собой оксигруппу, с которой связывается описанная выше алкильная группа, и конкретные примеры алкоксигруппы включают метокси группу, этоксигруппу, н-пропоксигруппу, изопропоксигруппу, н-бутоксигруппу, изобутоксигруппу и трет-бутоксигруппу.
[0023]
В настоящем описании "циклоалкильная группа" представляет собой моноциклическую или полициклическую насыщенную углеводородную группу, и конкретные примеры циклоалкильной группы включают циклопропильную группу, циклобутильную группу, циклопентильную группу, циклогексильную группу, циклогептильную группу, декалильную группу и адамантильную группу.
[0024]
В настоящем описании "циклоалкенильная группа" представляет собой моноциклическую или полициклическую ненасыщенную углеводородную группу, содержащую по меньшей мере одну углерод-углеродную двойную связь, и конкретные примеры циклоалкенильной группы включают циклобутенильную группу, циклопентенильную группу, циклогексенильную группу и циклогептенильную группу.
[0025]
В настоящем описании "циклоалкинильная группа" представляет собой моноциклическую или полициклическую ненасыщенную углеводородную группу, содержащую по меньшей мере одну углерод-углеродную тройную связь, и конкретные примеры циклоалкинильной группы включают циклобутинильную группу, циклопентинильную группу, циклогексинильную группу и циклогептинильную группу.
[0026]
В настоящем описании "ди- или моно-алкиламиногруппа" представляет собой аминогруппу, в которой один или два атома водорода замещены описанными выше алкильными группами, и конкретные примеры ди- или моно-алкиламиногрупп включают метиламиногруппу, диметиламиногруппу, этилметиламиногруппу и изопропиламиногруппу.
[0027]
В настоящем описании "алкилкарбонильная группа" представляет собой карбонильную группу, с которой связывается описанная выше алкильная группа, и конкретные примеры алкилкарбонильной группы включают ацетильную группу и пропионильную группу.
В настоящем описании "алкоксикарбонильная группа" представляет собой карбонильную группу, с которой связывается описанная выше алкоксигруппа, и конкретные примеры алкоксикарбонильной группы включают метоксикарбонильную группу и этоксикарбонильную группу.
[0028]
В настоящем описании "ди- или моно-алкилкарбамоильная группа" представляет собой карбонильную группу, с которой связывается описанная выше ди- или моно-алкиламиногруппа, и конкретные примеры ди- или моно-алкилкарбамоильной группы включают метилкарбамоильную группу, диметилкарбамоильную группу, этилметилкарбамоильную группу и изопропилкарбамоильную группу.
В настоящем описании "алкилкарбониламиногруппа" представляет собой аминогруппу, в которой один атом водорода замещен описанной выше алкилкарбонильной группой, и конкретные примеры алкилкарбониламиногруппы включают ацетамидную группу и пропионамидную группу.
В настоящем описании "алкоксикарбониламиногруппа" представляет собой аминогруппу, в которой один атом водорода замещен описанной выше алкоксикарбонильной группой, и конкретные примеры алкоксикарбониламиногруппы включают метоксикарбониламиногруппу и этоксикарбониламиногруппу.
В настоящем описании "алкилкарбонилоксигруппа" представляет собой оксигруппу, с которой связывается описанная выше алкилкарбонильная группа, и конкретные примеры алкилкарбонилоксигруппы включают ацетоксигруппу и пропионилоксигруппу.
В настоящем описании "алкоксикарбонилоксигруппа" представляет собой оксигруппу, с которой связывается описанная выше алкоксикарбонильная группа, и конкретные примеры алкоксикарбонилоксигруппы включают метоксикарбонилоксигруппу и этоксикарбонилоксигруппу.
В настоящем описании "ди- или моно-алкилкарбамоилоксигруппа" представляет собой оксигруппу, с которой связывается описанная выше ди- или моно-алкилкарбамоильная группа, и конкретные примеры ди- или моно-алкилкарбамоилоксигруппы включают метилкарбамоилоксигруппу и диметилкарбамоилоксигруппу.
В настоящем описании "алкилтиогруппа" представляет собой меркаптогруппу, в которой атом водорода замещен описанной выше алкильной группой, и конкретные примеры алкилтиогруппы включают метилтиогруппу и этилтиогруппу.
В настоящем описании "алкилсульфонильная группа" представляет собой сульфонильную группу, с которой связывается описанная выше алкильная группа, и конкретные примеры алкилсульфонильной группы включают метилсульфонильную группу и этилсульфонильную группу.
В настоящем описании "алкоксисульфонильная группа" представляет собой сульфонильную группу, с которой связывается описанная выше алкоксигруппа, и конкретные примеры алкоксисульфонильной группы включают метоксисульфонильную группу и этоксисульфонильную группу.
В настоящем описании "алкилсульфонамидная группа" представляет собой аминогруппу, в которой один атом водорода замещен описанной выше алкилсульфонильной группой, и конкретные примеры алкилсульфонамидной группы включают метилсульфонамидную группу и этилсульфонамидную группу.
В настоящем описании "ди- или моно-алкилсульфамоильная группа" представляет собой сульфонильную группу, с которой связывается описанная выше ди- или моно-алкиламиногруппа, и конкретные примеры ди- или моно-алкилсульфамоильной группы включают N-метилсульфамоильную группу и N,N-диметилсульфамоильную группу.
В настоящем описании "ди- или моно-алкилсульфамоиламиногруппа" представляет собой аминогруппу, в которой один атом водорода замещен описанной выше ди- или моно-алкилсульфамоильной группой, и конкретные примеры ди- или моно-алкилсульфамоиламиногруппы включают N-метилсульфамоиламиногруппу и N,N-диметилсульфамоиламиногруппу.
[0029]
В настоящем описании "ароматическая углеводородная группа" представляет собой моноциклическую или полициклическую ароматическую углеводородную группу, и она может представлять собой группу, в которой только некоторые кольца демонстрируют ароматичность. Конкретные примеры включают фенильную группу, нафтильную группу и тетрагидронафтильную группу.
[0030]
В настоящем описании "насыщенная гетероциклическая группа" представляет собой моноциклическую или полициклическую насыщенную гетероциклическую группу, содержащую гетероатом, выбранный из группы, состоящей из N, S и O, и конкретные примеры насыщенной гетероциклической группы включают пирролидинильную группу, пиперидинильную группу, пиперазинильную группу, гексаметилениминогруппу, морфолиногруппу, тиоморфолиногруппу, гомопиперазинильную группу, оксетанильную группу, тетрагидрофуранильную группу и тетрагидропиранильную группу.
[0031]
В настоящем описании "ненасыщенная гетероциклическая группа" представляет собой моноциклическую или полициклическую полностью ненасыщенную гетероциклическую группу, содержащую гетероатом, выбранный из группы, состоящей из N, S и O (далее также указана как "полностью ненасыщенная гетероциклическая группа"), или частично ненасыщенную гетероциклическую группу (далее также указана как "частично ненасыщенная гетероциклическая группа"). Конкретные примеры полностью ненасыщенной гетероциклической группы включают имидазолильную группу, тиенильную группу, фуранильную группу, пирролильную группу, оксазолильную группу, изоксазолильную группу, тиазолильную группу, изотиазолильную группу, тиадиазолильную группу, оксадиазолильную группу, пиразолильную группу, триазолильную группу, тетразолильную группу, пиридильную группу, пиразильную группу, пиримидинильную группу, пиридазинильную группу, индолильную группу, изоиндолильную группу, индазолильную группу, триазолопиридильную группу, бензимидазолильную группу, бензоксазолильную группу, бензотиазолильную группу, бензотиенильную группу, бензофуранильную группу, пуринильную группу, хинолильную группу, изохинолильную группу, хиназолинильную группу и хиноксалильную группу. Конкретные примеры частично ненасыщенной гетероциклической группы включают дигидропиранильную группу, дигидрофуранильную группу, дигидрооксадиазолильную группу, метилендиоксифенильную группу, этилендиоксифенильную группу и дигидробензофуранильную группу.
[0032]
В настоящем описании Ra представляет собой атом галогена, гидроксигруппу, цианогруппу, нитрогруппу, оксогруппу, N-оксидную группу, -C(=O)Rx, -C(=O)ORx, -C(=O)N(Rx)(Ry), -C(=O)SRx, -C(=S)ORx, -C(=O)ON(Rx)(Ry), -N(Rx)(Ry), -NRxC(=O)Ry, -NRxS(=O)2Ry, -NRxC(=O)ORy, -NRxC(=O)N(Ry)(Rz), -NRxS(=O)2N(Ry)(Rz), -N(Rx)-ORy, =NRx, =N-ORx, -OC(=O)Rx, -OC(=S)Rx, -OC(=O)ORx, -OC(=O)N(Rx)(Ry), -OC(=S)ORx, -SRx, -S(=O)2Rx, -S(=O)2ORx, -S(=O)2N(Rx)(Ry), необязательно Rb-замещенную C1-C6 алкильную группу, необязательно Rb-замещенную C2-C6 алкенильную группу, необязательно Rb-замещенную C2-C6 алкинильную группу, необязательно Rb-замещенную C1-C6 алкоксигруппу, необязательно Rc-замещенную C3-C10 циклоалкильную группу, необязательно Rc-замещенную C6-C14 ароматическую углеводородную группу или необязательно Rc-замещенную 4-10-членную насыщенную или ненасыщенную гетероциклическую группу.
Когда группа, представленная как Ra, замещена группой Rb или Rc, заместители Rb и Rc могут быть одинаковыми или отличными друг от друга, и количество заместителей конкретно не ограничивается. Количество Rb или Rc предпочтительно составляет от 1 до 5, более предпочтительно от 1 до 3, и особенно предпочтительно 1 или 2.
[0033]
В настоящем описании Rb представляет собой атом галогена, аминогруппу, гидроксигруппу, цианогруппу, нитрогруппу, C1-C6 алкоксигруппу, ди- или моно-(C1-C6 алкил)аминогруппу или 4-10-членную насыщенную или ненасыщенную гетероциклическую группу.
[0034]
В настоящем описании Rc представляет собой атом галогена, аминогруппу, гидроксигруппу, цианогруппу, нитрогруппу, оксогруппу, иминогруппу, N-оксидную группу, C1-C6 алкильную группу, C2-C6 алкенильную группу, C2-C6 алкинильную группу, C1-C6 алкоксигруппу или ди- или моно-(C1-C6 алкил)аминогруппу.
[0035]
В настоящем описании Rx, Ry и Rz, которые являются одинаковыми или отличными друг от друга, представляют собой каждый атом водорода, C1-C6 алкильную группу, C1-C6 галогеналкильную группу, C2-C6 алкенильную группу, C2-C6 алкинильную группу, C3-C10 циклоалкильную группу, C6-C14 ароматическую углеводородную группу или 4-10-членную насыщенную или ненасыщенную гетероциклическую группу.
[0036]
В соединении по настоящему изобретению формулы (I), R1 представляет собой необязательно замещенную C4-C10 циклоалкильную группу, необязательно замещенную C4-C10 циклоалкенильную группу, необязательно замещенную C4-C10 циклоалкинильную группу, необязательно замещенную C6-C14 ароматическую углеводородную группу или необязательно замещенную 4-10-членную насыщенную или ненасыщенную гетероциклическую группу.
[0037]
Группа, с которой C4-C10 циклоалкильная группа, C4-C10 циклоалкенильная группа, C4-C10 циклоалкинильная группа, C6-C14 ароматическая углеводородная группа или 4-10-членная насыщенная или ненасыщенная гетероциклическая группа, которая представлена как R1, необязательно замещена, предпочтительно представляет собой Ra, и примеры Ra включают атом галогена, гидроксигруппу, цианогруппу, нитрогруппу, оксогруппу, N-оксидную группу, -C(=O)Rx, -C(=O)ORx, -C(=O)N(Rx)(Ry), -C(=O)SRx, -C(=S)ORx, -C(=O)ON(Rx)(Ry), -N(Rx)(Ry), -NRxC(=O)Ry, -NRxS(=O)2Ry, -NRxC(=O)ORy, -NRxC(=O)N(Ry)(Rz), -NRxS(=O)2N(Ry)(Rz), -N(Rx)-ORy, =NRx, =N-ORx, -OC(=O)Rx, -OC(=S)Rx, -OC(=O)ORx, -OC(=O)N(Rx)(Ry), -OC(=S)ORx, -SRx, -S(=O)2Rx, -S(=O)2ORx, -S(=O)2N(Rx)(Ry), необязательно Rb-замещенную C1-C6 алкильную группу, необязательно Rb-замещенную C2-C6 алкенильную группу, необязательно Rb-замещенную C2-C6 алкинильную группу, необязательно Rb-замещенную C1-C6 алкоксигруппу, необязательно Rc-замещенную C3-C10 циклоалкильную группу, необязательно Rc-замещенную C6-C14 ароматическую углеводородную группу и необязательно Rc-замещенную 4-10-членную насыщенную или ненасыщенную гетероциклическую группу.
[0038]
В "необязательно замещенной C4-C10 циклоалкильной группе", представленной как R1, "C4-C10 циклоалкильная группа" предпочтительно представляет собой C4-C7 циклоалкильную группу, более предпочтительно C5-C7 циклоалкильную группу, еще более предпочтительно циклопентильную группу или циклогексильную группу, и особенно предпочтительно циклогексильную группу.
В "необязательно замещенной C4-C10 циклоалкильной группе", представленной как R1, заместитель предпочтительно представляет собой Ra, более предпочтительно атом галогена или необязательно Rb-замещенную C1-C6 алкильную группу, и особенно предпочтительно атом галогена или C1-C6 алкильную группу. Количество заместителей конкретно не ограничивается и предпочтительно равно 0, то есть группа является незамещенной, или от 1 до 3, и особенно предпочтительно, когда группа является незамещенной.
[0039]
В "необязательно замещенной C4-C10 циклоалкенильной группе", представленной как R1, "C4-C10 циклоалкенильная группа" предпочтительно представляет собой C4-C7 циклоалкенильную группу, более предпочтительно C5-C7 циклоалкенильную группу, еще более предпочтительно циклопентенильную группу или циклогексенильную группу, и особенно предпочтительно циклогексенильную группу.
В "необязательно замещенной C4-C10 циклоалкенильной группе", представленной как R1, заместитель предпочтительно представляет собой Ra, более предпочтительно атом галогена, гидроксигруппу, оксогруппу или необязательно Rb-замещенную C1-C6 алкильную группу, более предпочтительно атом галогена, гидроксигруппу, оксогруппу или C1-C6 алкильную группу, и особенно предпочтительно гидроксигруппу или оксогруппу. Количество заместителей конкретно не ограничивается и предпочтительно равно 0, то есть группа является незамещенной, или от 1 до 3, и особенно предпочтительно, когда группа является незамещенной или содержит 1 заместитель.
[0040]
В "необязательно замещенной C4-C10 циклоалкинильной группе", представленной как R1, "C4-C10 циклоалкинильная группа" предпочтительно представляет собой C4-C7 циклоалкинильную группу, более предпочтительно C5-C7 циклоалкинильную группу, еще более предпочтительно циклопентинильную группу или циклогексинильную группу, и особенно предпочтительно циклогексинильную группу.
В "необязательно замещенной C4-C10 циклоалкинильной группе", представленной как R1, заместитель предпочтительно представляет собой Ra, более предпочтительно атом галогена или необязательно Rb-замещенную C1-C6 алкильную группу, и особенно предпочтительно атом галогена или C1-C6 алкильную группу. Количество заместителей конкретно не ограничивается и предпочтительно равно 0, то есть группа является незамещенной, или от 1 до 3, и особенно предпочтительно, когда группа является незамещенной.
[0041]
В "необязательно замещенной C6-C14 ароматической углеводородной группе", представленной как R1, "C6-C14 ароматическая углеводородная группа" предпочтительно представляет собой C6-C10 ароматическую углеводородную группу, более предпочтительно фенильную группу или нафтильную группу, и особенно предпочтительно фенильную группу.
В "необязательно замещенной C6-C14 ароматической углеводородной группе", представленной как R1, заместитель предпочтительно представляет собой Ra, более предпочтительно атом галогена или необязательно Rb-замещенную C1-C6 алкильную группу, и особенно предпочтительно атом галогена или C1-C6 алкильную группу. Количество заместителей конкретно не ограничивается и предпочтительно равно 0, то есть группа является незамещенной, или от 1 до 3, и особенно предпочтительно, когда группа является незамещенной.
[0042]
В "необязательно замещенной 4-10-членной насыщенной гетероциклической группе", представленной как R1, "4-10-членная насыщенная гетероциклическая группа" предпочтительно представляет собой моноциклическую или полициклическую 4-10-членную насыщенную гетероциклическую группу, содержащую 1-3 гетероатома, выбранных из группы, состоящей из N, S и O, более предпочтительно моноциклическую 4-7-членную насыщенную гетероциклическую группу, содержащую 1-3 гетероатома, выбранных из группы, состоящей из N, S и O, и еще более предпочтительно пирролидинильную группу, пиперидинильную группу, пиперазинильную группу, гексаметилениминогруппу, морфолиногруппу, тиоморфолиногруппу, гомопиперазинильную группу, оксетанильную группу, тетрагидрофуранильную группу или тетрагидропиранильную группу.
В "необязательно замещенной 4-10-членной насыщенной гетероциклической группе", представленной как R1, заместитель предпочтительно представляет собой Ra, более предпочтительно атом галогена или необязательно Rb-замещенную C1-C6 алкильную группу, и особенно предпочтительно атом галогена или C1-C6 алкильную группу. Количество заместителей конкретно не ограничивается и предпочтительно равно 0, то есть группа является незамещенной, или от 1 до 3, и особенно предпочтительно, когда группа является незамещенной.
[0043]
В "необязательно замещенной 4-10-членной ненасыщенной гетероциклической группе", представленной как R1, "4-10-членная ненасыщенная гетероциклическая группа" предпочтительно представляет собой моноциклическую или полициклическую 4-10-членную ненасыщенную гетероциклическую группу, содержащую 1-3 гетероатома, выбранных из группы, состоящей из N, S и O, более предпочтительно моноциклическую 4-7-членную ненасыщенную гетероциклическую группу, содержащую 1-3 гетероатома, выбранных из группы, состоящей из N, S и O, еще более предпочтительно имидазолильную группу, тиенильную группу, фуранильную группу, пирролильную группу, оксазолильную группу, изоксазолильную группу, тиазолильную группу, изотиазолильную группу, тиадиазолильную группу, оксадиазолильную группу, пиразолильную группу, триазолильную группу, пиридильную группу, пиразильную группу, пиримидинильную группу, пиридазинильную группу, дигидропиранильную группу, дигидрофуранильную группу или дигидрооксадиазолильную группу, более предпочтительно фуранильную группу, 1H-пиразолильную группу, 4H-пиразолильную группу, тиазолильную группу, оксазолильную группу, изоксазолильную группу, 1,2,3-тиадиазолильную группу, 1,2,4-тиадиазолильную группу, 1,3,4-тиадиазолильную группу, 1,2,3-оксадиазолильную группу, 1,2,4-оксадиазолильную группу, 1,3,4-оксадиазолильную группу, пиридильную группу, 3,4-дигидро-2H-пиранильную группу, 3,6-дигидро-2H-пиранильную группу, 2,3-дигидрофуранильную группу, 2,5-дигидрофуранильную группу, 2,5-дигидро-1,3,4-оксадиазолильную группу или 4,5-дигидро-1,3,4-оксадиазолильную группу, еще более предпочтительно фуранильную группу, 1H-пиразолильную группу, тиазолильную группу, оксазолильную группу, изоксазолильную группу, 1,3,4-тиадиазолильную группу, 1,2,4-оксадиазолильную группу, 1,3,4-оксадиазолильную группу, пиридильную группу, 3,6-дигидро-2H-пиранильную группу, 2,5-дигидрофуранильную группу или 4,5-дигидро-1,3,4-оксадиазолильную группу, еще более предпочтительно фуранильную группу, 1H-пиразолильную группу, тиазолильную группу, оксазолильную группу, 1,3,4-тиадиазолильную группу, 1,3,4-оксадиазолильную группу, пиридильную группу, 3,6-дигидро-2H-пиранильную группу, 2,5-дигидрофуранильную группу или 4,5-дигидро-1,3,4-оксадиазолильную группу, и особенно предпочтительно фуранильную группу, 1H-пиразолильную группу, оксазолильную группу, 1,3,4-тиадиазолильную группу, 1,3,4-оксадиазолильную группу, пиридильную группу, 2,5-дигидрофуранильную группу или 4,5-дигидро-1,3,4-оксадиазолильную группу.
В "необязательно замещенной 4-10-членной ненасыщенной гетероциклической группе", представленной как R1, заместитель предпочтительно представляет собой Ra, более предпочтительно атом галогена, аминогруппу, гидроксигруппу, оксогруппу, N-оксидную группу, -C(=O)Rx, необязательно Rb-замещенную C1-C6 алкильную группу, необязательно Rb-замещенную C1-C6 алкоксигруппу или необязательно Rc-замещенную 4-10-членную насыщенную гетероциклическую группу, еще более предпочтительно атом галогена; аминогруппу; оксогруппу; N-оксидную группу; формильную группу; C1-C6 алкильную группу, необязательно замещенную группой, выбранной из группы, состоящей из гидроксигруппы и ди- или моно-(C1-C6 алкил)аминогруппы; C1-C6 алкоксигруппу, необязательно замещенную атомом галогена; или 4-10-членную насыщенную гетероциклическую группу, и особенно предпочтительно атом галогена; оксогруппу; C1-C6 алкильную группу, необязательно замещенную гидроксигруппой; или C1-C6 алкоксигруппу. Количество заместителей конкретно не ограничивается и предпочтительно равно 0, то есть группа является незамещенной, или от 1 до 3, и особенно предпочтительно, когда группа является незамещенной или содержит 1 или 2 заместителя.
[0044]
R1 в настоящем изобретении предпочтительно представляет собой необязательно замещенную C4-C10 циклоалкенильную группу, необязательно замещенную C6-C14 ароматическую углеводородную группу или необязательно замещенную моноциклическую или полициклическую 4-10-членную ненасыщенную гетероциклическую группу, содержащую 1-3 гетероатома, выбранных из группы, состоящей из N, S и O,
более предпочтительно необязательно Ra-замещенную C4-C10 циклоалкенильную группу, необязательно Ra-замещенную C6-C14 ароматическую углеводородную группу или необязательно Ra-замещенную моноциклическую или полициклическую 4-10-членную ненасыщенную гетероциклическую группу, содержащую 1-3 гетероатома, выбранных из группы, состоящей из N, S и O,
еще более предпочтительно необязательно Ra-замещенную C5-C7 циклоалкенильную группу, необязательно Ra-замещенную C6-C10 ароматическую углеводородную группу или необязательно Ra-замещенную моноциклическую 4-7-членную ненасыщенную гетероциклическую группу, содержащую 1-3 гетероатома, выбранные из группы, состоящей из N, S и O,
более предпочтительно циклопентенильную группу, циклогексенильную группу, фенильную группу, фуранильную группу, 1H-пиразолильную группу, тиазолильную группу, оксазолильную группу, изоксазолильную группу, 1,3,4-тиадиазолильную группу, 1,2,4-оксадиазолильную группу, 1,3,4-оксадиазолильную группу, пиридильную группу, дигидропиранильную группу, дигидрофуранильную группу или 4,5-дигидро-1,3,4-оксадиазолильную группу (где циклоалкенильная группа, ароматическая углеводородная группа и ненасыщенная гетероциклическая группа необязательно замещены группой Ra),
более предпочтительно циклопентенильную группу, циклогексенильную группу, фенильную группу, фуранильную группу, 1H-пиразолильную группу, тиазолильную группу, оксазолильную группу, изоксазолильную группу, 1,3,4-тиадиазолильную группу, 1,2,4-оксадиазолильную группу, 1,3,4-оксадиазолильную группу, пиридильную группу, дигидропиранильную группу, дигидрофуранильную группу или 4,5-дигидро-1,3,4-оксадиазолильную группу (где циклоалкенильная группа, ароматическая углеводородная группа и ненасыщенная гетероциклическая группа необязательно замещены группой, выбранной из группы, состоящей из атома галогена, аминогруппы, гидроксигруппы, оксогруппы, N-оксидной группы, формильной группы, C1-C6 алкильной группы (которая необязательно замещена группой, выбранной из группы, состоящей из гидроксигруппы и ди- или моно-(C1-C6 алкил)аминогруппы), C1-C6 алкоксигруппы (которая необязательно замещена атомом галогена) и 4-10-членной насыщенной гетероциклической группы),
еще более предпочтительно циклопентенильную группу; циклогексенильную группу; фенильную группу; и фуранильную группу, необязательно замещенную группой, выбранной из группы, состоящей из формильной группы и C1-C6 алкильной группы (которая необязательно замещена гидроксигруппой и ди- или моно-(C1-C6 алкил)аминогруппой); 1H-пиразолильную группу, необязательно замещенную группой, выбранной из группы, состоящей из C1-C6 алкильной группы и 4-10-членной насыщенной гетероциклической группы; тиазолильную группу; оксазолильную группу; изоксазолильную группу; 1,3,4-тиадиазолильную группу; 1,2,4-оксадиазолильную группу; 1,3,4-оксадиазолильную группу, необязательно замещенную C1-C6 алкильной группой; пиридильную группу, необязательно замещенную группой, выбранной из группы, состоящей из атома галогена, аминогруппы, гидроксигруппы, N-оксидной группы, C1-C6 алкильной группы (которая необязательно замещена гидрокси группой) и C1-C6 алкоксигруппы (которая необязательно замещена атомом галогена); дигидропиранильную группу; дигидрофуранильную группу; и 4,5-дигидро-1,3,4-оксадиазолильную группу, необязательно замещенную группой, выбранной из группы, состоящей из оксогруппы и C1-C6 алкильной группы, и
особенно предпочтительно фенильную группу; фуранильную группу, необязательно замещенную C1-C6 алкильной группой (которая необязательно замещена гидроксигруппой); 1H-пиразолильную группу; оксазолильную группу; 1,3,4-тиадиазолильную группу; 1,3,4-оксадиазолильную группу; пиридильную группу, необязательно замещенную группой, выбранной из группы, состоящей из атома галогена и C1-C6 алкоксигруппы; дигидрофуранильную группу; и 4,5-дигидро-1,3,4-оксадиазолильную группу, необязательно замещенную группой, выбранной из группы, состоящей из оксогруппы и C1-C6 алкильной группы.
[0045]
В соединении по настоящему изобретению формулы (I), R2 представляет собой атом водорода, атом галогена, гидроксигруппу, цианогруппу, нитрогруппу, -C(=O)Rx, -C(=O)ORx, -C(=O)N(Rx)(Ry), -N(Rx)(Ry), -NRxC(=O)Ry, -NRxS(=O)2Ry, -NRxC(=O)ORy, -NRxC(=O)N(Ry)(Rz), -NRxS(=O)2N(Ry)(Rz), -OC(=O)Rx, -OC(=O)ORx, -OC(=O)N(Rx)(Ry), -SRx, -S(=O)2Rx, -S(=O)2ORx, необязательно Rb-замещенную C1-C6 алкильную группу, необязательно Rb-замещенную C2-C6 алкенильную группу, необязательно Rb-замещенную C2-C6 алкинильную группу, необязательно Rb-замещенную C1-C6 алкоксигруппу, необязательно Rc-замещенную C3-C10 циклоалкильную группу, необязательно Rc-замещенную C6-C14 ароматическую углеводородную группу или необязательно Rc-замещенную 4-10-членную насыщенную или ненасыщенную гетероциклическую группу.
[0046]
Группа "-C(=O)Rx", представленная как R2, предпочтительно представляет собой формильную группу или (C1-C6 алкил)карбонильную группу, более предпочтительно формильную группу, ацетильную группу или пропионильную группу, и особенно предпочтительно формильную группу.
Группа "-C(=O)ORx", представленная как R2, предпочтительно представляет собой карбоксигруппу или (C1-C6 алкокси)карбонильную группу, более предпочтительно метоксикарбонильную группу или этоксикарбонильную группу, и особенно предпочтительно метоксикарбонильную группу.
Группа "-C(=O)N(Rx)(Ry)", представленная как R2, предпочтительно представляет собой карбамоильную группу (-C(=O)NH2) или ди- или моно-(C1-C6 алкил)карбамоильную группу, и особенно предпочтительно карбамоильную группу, метилкарбамоильную группу или диметилкарбамоильную группу.
Группа "-N(Rx)(Ry)", представленная как R2, предпочтительно представляет собой аминогруппу или ди- или моно-(C1-C6 алкил)аминогруппу, более предпочтительно аминогруппу, метиламиногруппу или диметиламиногруппу, и особенно предпочтительно аминогруппу.
Группа "-NRxC(=O)Ry", представленная как R2, предпочтительно представляет собой формамидную группу или (C1-C6 алкил)карбониламино группу, более предпочтительно формамидную группу, ацетамидную группу или пропионамидную группу, и особенно предпочтительно формамидную группу.
Группа "-NRxS(=O)2Ry", представленная как R2, предпочтительно представляет собой гидросульфониламиногруппу (-NH-S(=O)2H) или (C1-C6 алкил)сульфонамидную группу, более предпочтительно гидросульфониламиногруппу, метилсульфонамидную группу или этилсульфонамидную группу, и особенно предпочтительно гидросульфониламиногруппу.
Группа "-NRxC(=O)ORy", представленная как R2, предпочтительно представляет собой карбоксиаминогруппу (-NH-C(=O)OH) или (C1-C6 алкокси)карбониламиногруппу, более предпочтительно карбоксиаминогруппу, метоксикарбониламиногруппу или этилкарбониламиногруппу, и особенно предпочтительно карбоксиаминогруппу.
Группа "-NRxC(=O)N(Ry)(Rz)", представленная как R2, предпочтительно представляет собой уреидогруппу (-NH-C(=O)NH2) или ди- или моно-(C1-C6 алкил)уреидогруппу, более предпочтительно уреидогруппу, 3-метилуреидогруппу или 3,3-диметилуреидогруппу, и особенно предпочтительно уреидогруппу.
Группа "-NRxS(=O)2N(Ry)(Rz)", представленная как R2, предпочтительно представляет собой сульфамоиламиногруппу (-NH-S(=O)2NH2) или ди- или моно-(C1-C6 алкил)сульфамоиламиногруппу, более предпочтительно сульфамоиламиногруппу, N-метилсульфамоиламиногруппу или N,N-диметилсульфамоиламиногруппу, и особенно предпочтительно сульфамоиламиногруппу.
Группа "-OC(=O)Rx", представленная как R2, предпочтительно представляет собой формилоксигруппу или (C1-C6 алкил)карбонилоксигруппу, более предпочтительно формилоксигруппу, ацетоксигруппу или пропионилоксигруппу, и особенно предпочтительно формилоксигруппу.
Группа "-OC(=O)ORx", представленная как R2, предпочтительно представляет собой карбоксиоксигруппу или (C1-C6 алкокси)карбонилоксигруппу, более предпочтительно карбоксиоксигруппу, метоксикарбонилоксигруппу или этоксикарбонилоксигруппу, и особенно предпочтительно карбоксиоксигруппу.
Группа "-OC(=O)N(Rx)(Ry)", представленная как R2, предпочтительно представляет собой карбамоилоксигруппу (-OC(=O)NH2) или ди- или моно-(C1-C6 алкил)карбамоилоксигруппу, более предпочтительно карбамоилоксигруппу, метилкарбамоилоксигруппу или диметилкарбамоилоксигруппу, и особенно предпочтительно карбамоилоксигруппу.
Группа "-SRx", представленная как R2, предпочтительно представляет собой меркаптогруппу или (C1-C6 алкил)тиогруппу, более предпочтительно меркаптогруппу, метилтиогруппу или этилтиогруппу и особенно предпочтительно меркаптогруппу.
Группа "-S(=O)2Rx", представленная как R2, предпочтительно представляет собой (C1-C6 алкил)сульфонильную группу, более предпочтительно метилсульфонильную группу или этилсульфонильную группу и особенно предпочтительно метилсульфонильную группу.
Группа "-S(=O)2ORx", представленная как R2, предпочтительно представляет собой сульфогруппу (-S(=O)2OH) или (C1-C6 алкокси)сульфонильную группу, более предпочтительно сульфогруппу, метоксисульфонильную группу или этоксисульфонильную группу и особенно предпочтительно сульфогруппу.
В "необязательно Rb-замещенной C1-C6 алкильной группе", представленной как R2, "C1-C6 алкильная группа" предпочтительно представляет собой C1-C4 алкильную группу, более предпочтительно метильную группу или этильную группу и особенно предпочтительно метильную группу.
В "необязательно Rb-замещенной C1-C6 алкильной группе", представленной как R2, Rb предпочтительно представляет собой гидроксигруппу, C1-C6 алкоксигруппу, ди- или моно-(C1-C6 алкил)аминогруппу или 4-10-членную насыщенную гетероциклическую группу, более предпочтительно гидроксигруппу, C1-C6 алкоксигруппу, ди- или моно-(C1-C6 алкил)аминогруппу или моноциклическую 5- или 6-членную насыщенную гетероциклическую группу, содержащую 1-3 гетероатома, выбранных из группы, состоящей из N и O, и особенно предпочтительно гидроксигруппу, C1-C6 алкоксигруппу, ди- или моно-(C1-C6 алкил)аминогруппу или морфолиногруппу. Количество Rb конкретно не ограничивается и предпочтительно равно 0, то есть группа является незамещенной, или от 1 до 3, и особенно предпочтительно 1.
[0047]
В "необязательно Rb-замещенной C2-C6 алкенильной группе", представленной как R2, "C2-C6 алкенильная группа" предпочтительно представляет собой C2-C4 алкенильную группу, и особенно предпочтительно винильную группу.
В "необязательно Rb-замещенной C2-C6 алкенильной группе", представленной как R2, Rb предпочтительно представляет собой атом галогена. Количество Rb конкретно не ограничивается и предпочтительно равно 0, то есть группа является незамещенной, или от 1 до 3, и особенно предпочтительно, когда группа является незамещенной.
[0048]
В "необязательно Rb-замещенной C2-C6 алкинильной группе", представленной как R2, "C2-C6 алкинильная группа" предпочтительно представляет собой C2-C4 алкинильную группу, и особенно предпочтительно этинильную группу.
В "необязательно Rb-замещенной C2-C6 алкинильной группе", представленной как R2, Rb предпочтительно представляет собой атом галогена. Количество Rb конкретно не ограничивается и предпочтительно равно 0, то есть группа является незамещенной, или от 1 до 3, и особенно предпочтительно, когда группа является незамещенной.
[0049]
В "необязательно Rb-замещенной C1-C6 алкоксигруппе", представленной как R2, "C1-C6 алкоксигруппа" предпочтительно представляет собой C1-C4 алкоксигруппу, более предпочтительно метоксигруппу или этоксигруппу, и особенно предпочтительно метоксигруппу.
В "необязательно Rb-замещенной C1-C6 алкоксигруппе", представленной как R2, Rb предпочтительно представляет собой атом галогена. Количество Rb конкретно не ограничивается и предпочтительно равно 0, то есть группа является незамещенной, или от 1 до 3, и особенно предпочтительно, когда группа является незамещенной.
[0050]
В "необязательно Rc-замещенной C3-C10 циклоалкильной группе", представленной как R2, "C3-C10 циклоалкильная группа" предпочтительно представляет собой C4-C7 циклоалкильную группу, более предпочтительно C5-C7 циклоалкильную группу, еще более предпочтительно циклопентильную группу или циклогексильную группу, и особенно предпочтительно циклогексильную группу.
В "необязательно Rc-замещенной C3-C10 циклоалкильной группе", представленной как R2, Rc предпочтительно представляет собой атом галогена. Количество Rc конкретно не ограничивается и предпочтительно равно 0, то есть группа является незамещенной, или от 1 до 3, и особенно предпочтительно, когда группа является незамещенной.
[0051]
В "необязательно Rc-замещенной C6-C14 ароматической углеводородной группе", представленной как R2, "C6-C14 ароматическая углеводородная группа" предпочтительно представляет собой C6-C10 ароматическую углеводородную группу, более предпочтительно фенильную группу или нафтильную группу, и особенно предпочтительно фенильную группу.
В "необязательно Rc-замещенной C6-C14 ароматической углеводородной группе", представленной как R2, Rc предпочтительно представляет собой атом галогена. Количество Rc конкретно не ограничивается и предпочтительно равно 0, то есть группа является незамещенной, или от 1 до 3, и особенно предпочтительно, когда группа является незамещенной.
[0052]
В "необязательно Rc-замещенной 4-10-членной насыщенной гетероциклической группе", представленной как R2, "4-10-членная насыщенная гетероциклическая группа" предпочтительно представляет собой моноциклическую или полициклическую 4-10-членную насыщенную гетероциклическую группу, содержащую 1-3 гетероатома, выбранных из группы, состоящей из N, S и O, более предпочтительно моноциклическую 4-7-членную насыщенную гетероциклическую группу, содержащую 1-3 гетероатома, выбранных из группы, состоящей из N и O, еще более предпочтительно пирролидинильную группу, пиперидинильную группу, пиперазинильную группу, гексаметилениминогруппу, морфолиногруппу, гомопиперазинильную группу, оксетанильную группу, тетрагидрофуранильную группу или тетрагидропиранильную группу, и особенно предпочтительно морфолиногруппу.
В "необязательно Rc-замещенной 4-10-членной насыщенной гетероциклической группе", представленной как R2, Rc предпочтительно представляет собой атом галогена. Количество Rc конкретно не ограничивается и предпочтительно равно 0, то есть группа является незамещенной, или от 1 до 3, и особенно предпочтительно, когда группа является незамещенной.
[0053]
В "необязательно Rc-замещенной 4-10-членной ненасыщенной гетероциклической группе", представленной как R2, "4-10-членная ненасыщенная гетероциклическая группа" предпочтительно представляет собой моноциклическую или полициклическую 4-10-членную ненасыщенную гетероциклическую группу, содержащую 1-3 гетероатома, выбранных из группы, состоящей из N, S и O, более предпочтительно моноциклическую 4-7-членную ненасыщенную гетероциклическую группу, содержащую 1-3 гетероатома, выбранных из группы, состоящей из N, S и O, еще более предпочтительно моноциклическую 5- или 6-членную полностью ненасыщенную гетероциклическую группу, содержащую 1-3 N атома, более предпочтительно имидазолильную группу, пиразолильную группу, триазолильную группу, пиридильную группу, пиразильную группу, пиримидинильную группу или пиридазинильную группу, еще более предпочтительно пиразолильную группу, и особенно предпочтительно 1H-пиразолильную группу.
В "необязательно Rc-замещеннй 4-10-членной ненасыщенной гетероциклической группе", представленной как R2, Rc предпочтительно представляет собой атом галогена или C1-C6 алкильную группу, и особенно предпочтительно C1-C6 алкильную группу. Количество Rc конкретно не ограничивается и предпочтительно равно 0, то есть группа является незамещенной, или от 1 до 3, и особенно предпочтительно, когда группа является незамещенной или содержит 1 заместитель.
[0054]
R2 в настоящем изобретении предпочтительно представляет собой атом водорода, цианогруппу, -C(=O)ORx, -C(=O)N(Rx)(Ry), an необязательно Rb-замещенную C1-C6 алкильную группу, необязательно Rb-замещенную C1-C6 алкоксигруппу или необязательно Rc-замещенную моноциклическую 4-7-членную ненасыщенную гетероциклическую группу, содержащую 1-3 гетероатома, выбранных из группы, состоящей из N, S и O,
более предпочтительно атом водорода; цианогруппу; (C1-C6 алкокси)карбонильную группу; карбамоильную группу; ди- или моно-(C1-C6 алкил)карбамоильную группу; C1-C6 алкильную группу, необязательно замещенную группой, выбранной из группы, состоящей из гидроксигруппы, C1-C6 алкоксигруппы, ди- или моно-(C1-C6 алкил)аминогруппы и 4-10-членной насыщенной гетероциклической группы; C1-C6 алкоксигруппу; или моноциклическую 5- или 6-членную полностью ненасыщенную гетероциклическую группу, содержащую 1-3 N атома, которая необязательно замещена C1-C6 алкильной группой,
еще более предпочтительно атом водорода; цианогруппу; C1-C6 алкоксигруппу; или пиразолильную группу, необязательно замещенную C1-C6 алкильной группой, и
особенно предпочтительно атом водорода.
[0055]
В соединении по настоящему изобретению формулы (I), R3 представляет собой атом галогена, аминогруппу, гидроксигруппу, цианогруппу, нитрогруппу, C1-C6 алкильную группу, C2-C6 алкенильную группу, C2-C6 алкинильную группу или C1-C6 алкоксигруппу.
[0056]
В настоящем изобретении R3 предпочтительно представляет собой атом галогена или C1-C6 алкильную группу, и особенно предпочтительно атом галогена.
В настоящем изобретении количество R3, которое указано как m, предпочтительно составляет от 0 до 2, более предпочтительно 0 или 1, и особенно предпочтительно 0, то есть отсутствие замещения.
[0057]
В соединении по настоящему изобретению формулы (I), R4 представляет собой необязательно Rb-замещенную C2-C6 алкенильную группу или необязательно Rb-замещенную C2-C6 алкинильную группу.
В "необязательно Rb-замещенной C2-C6 алкенильной группе", представленной как R4, "C2-C6 алкенильная группа" предпочтительно представляет собой C2-C4 алкенильную группу, более предпочтительно винильную группу, аллильную группу, 1-пропенильную группу, 1-метилвинильную группу, 1-бутенильную группу, 2-бутенильную группу или 3-бутенильную группу, еще более предпочтительно винильную группу или 1-пропенильную группу, и особенно предпочтительно винильную группу.
В "необязательно Rb-замещенной C2-C6 алкенильной группе", представленной как R4, Rb предпочтительно представляет собой атом галогена, аминогруппу, C1-C6 алкоксигруппу или ди- или моно-(C1-C6 алкил)аминогруппу, более предпочтительно атом галогена или C1-C6 алкоксигруппу, и особенно предпочтительно атом галогена. Количество Rb конкретно не ограничивается и предпочтительно равно 0, то есть группа является незамещенной, или от 1 до 3, и особенно предпочтительно, когда группа является незамещенной.
[0058]
"Необязательно Rb-замещенная C2-C6 алкинильная группа", представленная как R4, предпочтительно представляет собой C2-C4 алкинильную группу, более предпочтительно этинильную группу, 1-пропинильную группу или 1-бутинильную группу, еще более предпочтительно этинильную группу или 1-пропинильную группу, и особенно предпочтительно этинильную группу.
В "необязательно Rb-замещенной C2-C6 алкинильной группе", представленной как R4, Rb предпочтительно представляет собой атом галогена, аминогруппу, C1-C6 алкоксигруппу или ди- или моно-(C1-C6 алкил)аминогруппу, более предпочтительно атом галогена или C1-C6 алкоксигруппу, и особенно предпочтительно атом галогена. Количество Rb конкретно не ограничивается и предпочтительно равно 0, то есть группа является незамещенной, или от 1 до 3, и особенно предпочтительно, когда группа является незамещенной.
[0059]
В настоящем изобретении R4 предпочтительно представляет собой C2-C6 алкенильную группу или C2-C6 алкинильную группу, более предпочтительно C2-C4 алкенильную группу или C2-C4 алкинильную группу, еще более предпочтительно винильную группу, 1-пропенильную группу, этинильную группу или 1-пропинильную группу, более предпочтительно винильную группу или этинильную группу, и особенно предпочтительно винильную группу.
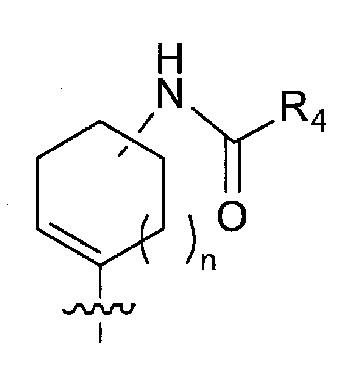
[0060]
Значение n в настоящем изобретении предпочтительно равно 0 или 1, и особенно предпочтительно 1.
[0061]
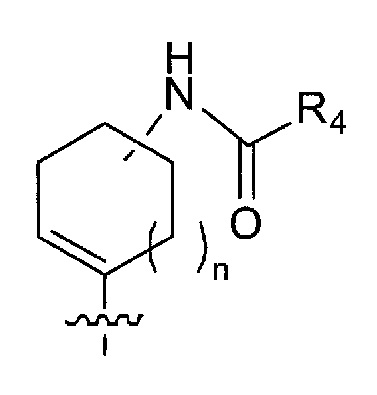
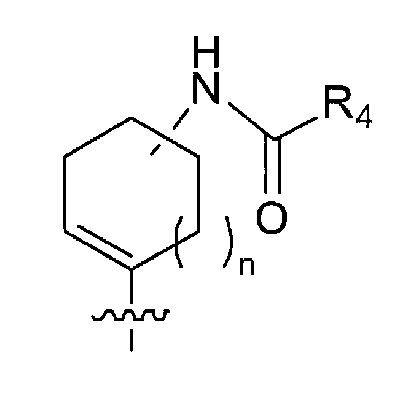
В соединении по настоящему изобретению, имеющем формулу (I), следующая структура
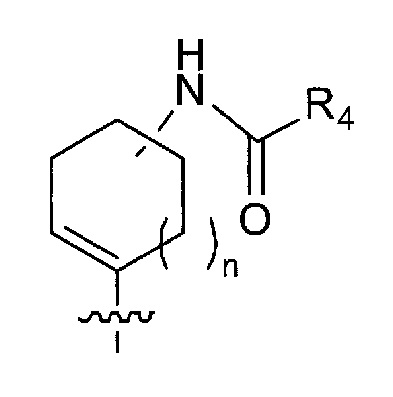
предпочтительно представляет собой следующие структуры (1)-(7).
[0062]
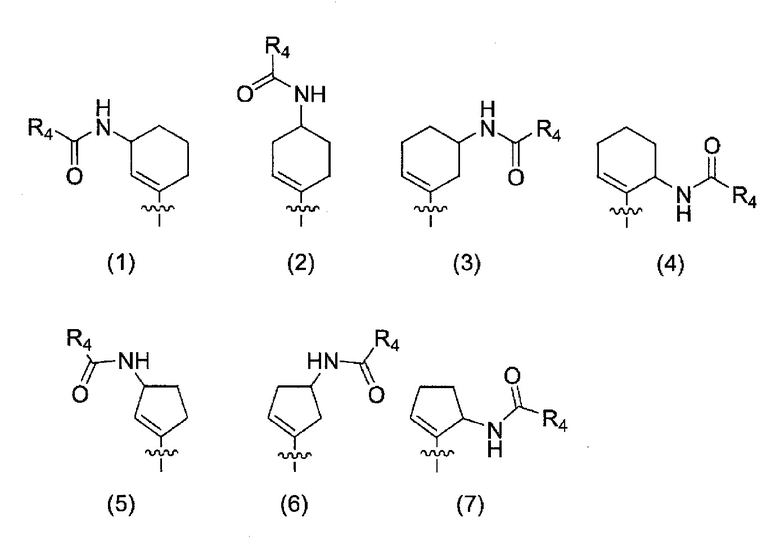
[0063]
Из этих структур, структуры (1), (3), (5) и (6) являются более предпочтительными, структуры (1) и (3) являются еще более предпочтительными, и структура (3) является особенно предпочтительной.
[0064]
Предпочтительным соединением по настоящему изобретению является соединение, в котором R1 представляет собой необязательно Ra-замещенную C4-C10 циклоалкенильную группу, необязательно Ra-замещенную C6-C14 ароматическую углеводородную группу или необязательно Ra-замещенную моноциклическую или полициклическую 4-10-членную ненасыщенную гетероциклическую группу, содержащую 1-3 гетероатома, выбранных из группы, состоящей из N, S и O,
R2 представляет собой атом водорода, цианогруппу, -C(=O)ORx, -C(=O)N(Rx)(Ry), необязательно Rb-замещенную C1-C6 алкильную группу, необязательно Rb-замещенную C1-C6 алкоксигруппу или необязательно Rc-замещенную моноциклическую 4-7-членную ненасыщенную гетероциклическую группу, содержащую 1-3 гетероатома, выбранных из группы, состоящей из N, S и O,
m имеет значение 0, n имеет значение 0 или 1, R4 представляет собой C2-C6 алкенильную группу или C2-C6 алкинильную группу,
Ra представляет собой атом галогена, гидроксигруппу, цианогруппу, нитрогруппу, оксогруппу, N-оксидную группу, -C(=O)Rx, -C(=O)ORx, -C(=O)N(Rx)(Ry), -C(=O)SRx, -C(=S)ORx, -C(=O)ON(Rx)(Ry), -N(Rx)(Ry), -NRxC(=O)Ry, -NRxS(=O)2Ry, -NRxC(=O)ORy, -NRxC(=O)N(Ry)(Rz), -NRxS(=O)2N(Ry)(Rz), -N(Rx)-ORy, =NRx, =N-ORx, -OC(=O)Rx, -OC(=S)Rx, -OC(=O)ORx, -OC(=O)N(Rx)(Ry), -OC(=S)ORx, -SRx, -S(=O)2Rx, -S(=O)2ORx, -S(=O)2N(Rx)(Ry), an необязательно Rb-замещенную C1-C6 алкильную группу, необязательно Rb-замещенную C2-C6 алкенильную группу, необязательно Rb-замещенную C2-C6 алкинильную группу, необязательно Rb-замещенную C1-C6 алкоксигруппу, необязательно Rc-замещенную C3-C10 циклоалкильную группу, необязательно Rc-замещенную C6-C14 ароматическую углеводородную группу или необязательно Rc-замещенную 4-10-членную насыщенную или ненасыщенную гетероциклическую группу,
Rb представляет собой атом галогена, аминогруппу, гидроксигруппу, цианогруппу, нитрогруппу, C1-C6 алкоксигруппу, ди- или моно-(C1-C6 алкил)аминогруппу или 4-10-членную насыщенную или ненасыщенную гетероциклическую группу,
Rc представляет собой атом галогена, аминогруппу, гидроксигруппу, цианогруппу, нитрогруппу, оксогруппу, иминогруппу, N-оксидную группу, C1-C6 алкильную группу, C2-C6 алкенильную группу, C2-C6 алкинильную группу, C1-C6 алкоксигруппу или ди- или моно-(C1-C6 алкил)аминогруппу, и
Rx, Ry и Rz, которые являются одинаковыми или отличными друг от друга, представляют собой каждый атом водорода, C1-C6 алкильную группу, C1-C6 галогеналкильную группу, C2-C6 алкенильную группу, C2-C6 алкинильную группу, C3-C10 циклоалкильную группу, C6-C14 ароматическую углеводородную группу или 4-10-членную насыщенную или ненасыщенную гетероциклическую группу.
[0065]
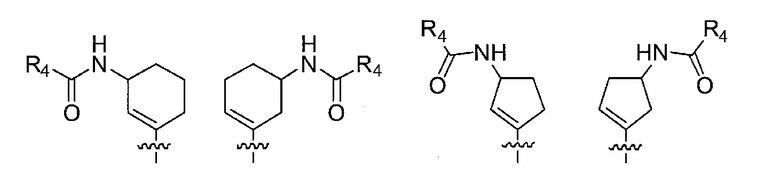
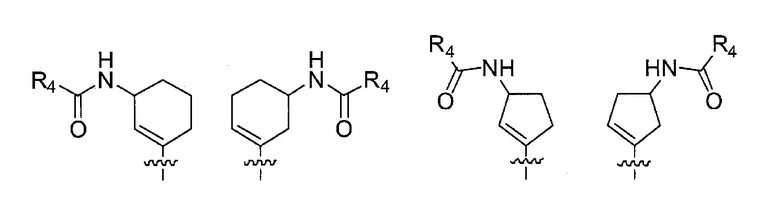
Соединение по настоящему изобретению более предпочтительно представляет собой соединение, в котором R1 представляет собой необязательно Ra-замещенную C5-C7 циклоалкенильную группу, необязательно Ra-замещенную C6-C10 ароматическую углеводородную группу или необязательно Ra-замещенную моноциклическую 4-7-членную ненасыщенную гетероциклическую группу, содержащую 1-3 гетероатома, выбранных из группы, состоящей из N, S и O,
R2 представляет собой атом водорода; цианогруппу; (C1-C6 алкокси)карбонильную группу; карбамоильную группу; ди- или моно-(C1-C6 алкил)карбамоильную группу; C1-C6 алкильную группу, необязательно замещенную группой, выбранной из группы, состоящей из гидроксигруппы, C1-C6 алкоксигруппы, ди- или моно-(C1-C6 алкил)аминогруппы и 4-10-членной насыщенной гетероциклической группы; C1-C6 алкоксигруппу; или моноциклическую 5- или 6-членную полностью ненасыщенную гетероциклическую группу, содержащую 1-3 N атома, которая необязательно замещена C1-C6 алкильной группой,
m имеет значение 0, n имеет значение 0 или 1, R4 представляет собой C2-C6 алкенильную группу, и
в формуле (I) следующая структура:
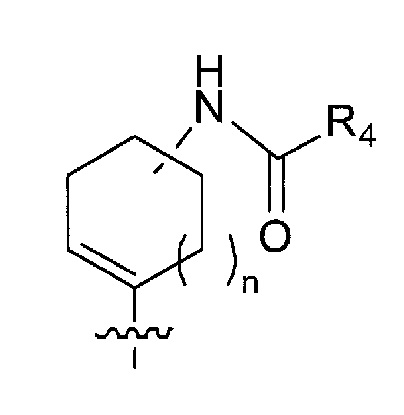
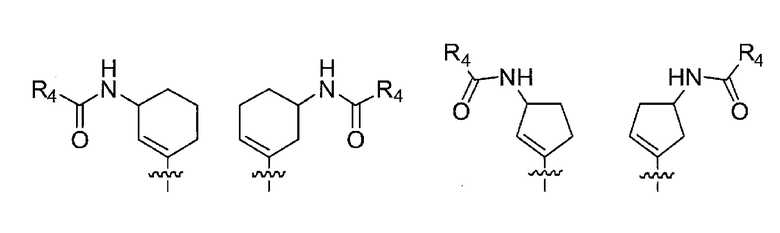
представляет собой любую из следующих структур:
Ra представляет собой атом галогена, гидроксигруппу, цианогруппу, нитрогруппу, оксогруппу, N-оксидную группу, -C(=O)Rx, -C(=O)ORx, -C(=O)N(Rx)(Ry), -C(=O)SRx, -C(=S)ORx, -C(=O)ON(Rx)(Ry), -N(Rx)(Ry), -NRxC(=O)Ry, -NRxS(=O)2Ry, -NRxC(=O)ORy, -NRxC(=O)N(Ry)(Rz), -NRxS(=O)2N(Ry)(Rz), -N(Rx)-ORy, =NRx, =N-ORx, -OC(=O)Rx, -OC(=S)Rx, -OC(=O)ORx, -OC(=O)N(Rx)(Ry), -OC(=S)ORx, -SRx, -S(=O)2Rx, -S(=O)2ORx, -S(=O)2N(Rx)(Ry), необязательно Rb-замещенную C1-C6 алкильную группу, необязательно Rb-замещенную C2-C6 алкенильную группу, необязательно Rb-замещенную C2-C6 алкинильную группу, необязательно Rb-замещенную C1-C6 алкоксигруппу, необязательно Rc-замещенную C3-C10 циклоалкильную группу, необязательно Rc-замещенную C6-C14 ароматическую углеводородную группу или необязательно Rc-замещенную 4-10-членную насыщенную или ненасыщенную гетероциклическую группу,
Rb представляет собой атом галогена, аминогруппу, гидроксигруппу, цианогруппу, нитрогруппу, C1-C6 алкоксигруппу, ди- или моно-(C1-C6 алкил)аминогруппу или 4-10-членную насыщенную или ненасыщенную гетероциклическую группу,
Rc представляет собой атом галогена, аминогруппу, гидроксигруппу, цианогруппу, нитрогруппу, оксогруппу, иминогруппу, N-оксидную группу, C1-C6 алкильную группу, C2-C6 алкенильную группу, C2-C6 алкинильную группу, C1-C6 алкоксигруппу или ди- или моно-(C1-C6 алкил)аминогруппу, и
Rx, Ry и Rz, которые являются одинаковыми или отличными друг от друга, представляют собой каждый атом водорода, C1-C6 алкильную группу, C1-C6 галогеналкильную группу, C2-C6 алкенильную группу, C2-C6 алкинильную группу, C3-C10 циклоалкильную группу, C6-C14 ароматическую углеводородную группу или 4-10-членную насыщенную или ненасыщенную гетероциклическую группу.
[0066]
Соединение по настоящему изобретению еще более предпочтительно представляет собой соединение, в котором R1 представляет собой необязательно Ra-замещенную циклопентенильную группу, циклогексенильную группу, фенильную группу, фуранильную группу, 1H-пиразолильную группу, тиазолильную группу, оксазолильную группу, изоксазолильную группу, 1,3,4-тиадиазолильную группу, 1,2,4-оксадиазолильную группу, 1,3,4-оксадиазолильную группу, пиридильную группу, дигидропиранильную группу, дигидрофуранильную группу или 4,5-дигидро-1,3,4-оксадиазолильную группу,
R2 представляет собой атом водорода; цианогруппу; (C1-C6 алкокси)карбонильную группу; карбамоильную группу; ди- или моно-(C1-C6 алкил)карбамоильную группу; C1-C6 алкильную группу, необязательно замещенную группой, выбранной из группы, состоящей из гидроксигруппы, C1-C6 алкоксигруппы, ди- или моно-(C1-C6 алкил)аминогруппы и 4-10-членной насыщенной гетероциклической группы; C1-C6 алкоксигруппу; или моноциклическую 5- или 6-членную полностью ненасыщенную гетероциклическую группу, содержащую 1-3 N атома, которая необязательно замещена C1-C6 алкильной группой,
m имеет значение 0, n имеет значение 0 или 1, R4 представляет собой C2-C6 алкенильную группу, и
в формуле (I) следующая структура:
представляет собой любую из следующих структур:
Ra представляет собой атом галогена, гидроксигруппу, цианогруппу, нитрогруппу, оксогруппу, N-оксидную группу, -C(=O)Rx, -C(=O)ORx, -C(=O)N(Rx)(Ry), -C(=O)SRx, -C(=S)ORx, -C(=O)ON(Rx)(Ry), -N(Rx)(Ry), -NRxC(=O)Ry, -NRxS(=O)2Ry, -NRxC(=O)ORy, -NRxC(=O)N(Ry)(Rz), -NRxS(=O)2N(Ry)(Rz), -N(Rx)-ORy, =NRx, =N-ORx, -OC(=O)Rx, -OC(=S)Rx, -OC(=O)ORx, -OC(=O)N(Rx)(Ry), -OC(=S)ORx, -SRx, -S(=O)2Rx, -S(=O)2ORx, -S(=O)2N(Rx)(Ry), необязательно Rb-замещенную C1-C6 алкильную группу, необязательно Rb-замещенную C2-C6 алкенильную группу, необязательно Rb-замещенную C2-C6 алкинильную группу, необязательно Rb-замещенную C1-C6 алкоксигруппу, необязательно Rc-замещенную C3-C10 циклоалкильную группу, необязательно Rc-замещенную C6-C14 ароматическую углеводородную группу или необязательно Rc-замещенную 4-10-членную насыщенную или ненасыщенную гетероциклическую группу,
Rb представляет собой атом галогена, аминогруппу, гидроксигруппу, цианогруппу, нитрогруппу, C1-C6 алкоксигруппу, ди- или моно-(C1-C6 алкил)аминогруппу или 4-10-членную насыщенную или ненасыщенную гетероциклическую группу,
Rc представляет собой атом галогена, аминогруппу, гидроксигруппу, цианогруппу, нитрогруппу, оксогруппу, иминогруппу, N-оксидную группу, C1-C6 алкильную группу, C2-C6 алкенильную группу, C2-C6 алкинильную группу, C1-C6 алкоксигруппу или ди- или моно-(C1-C6 алкил)аминогруппу, и
Rx, Ry и Rz, которые являются одинаковыми или отличными друг от друга, представляют собой каждый атом водорода, C1-C6 алкильную группу, C1-C6 галогеналкильную группу, C2-C6 алкенильную группу, C2-C6 алкинильную группу, C3-C10 циклоалкильную группу, C6-C14 ароматическую углеводородную группу или 4-10-членную насыщенную или ненасыщенную гетероциклическую группу.
[0067]
Соединение по настоящему изобретению более предпочтительно представляет собой соединение, в котором R1 представляет собой циклопентенильную группу, циклогексенильную группу, фенильную группу, фуранильную группу, 1H-пиразолильную группу, тиазолильную группу, оксазолильную группу, изоксазолильную группу, 1,3,4-тиадиазолильную группу, 1,2,4-оксадиазолильную группу, 1,3,4-оксадиазолильную группу, пиридильную группу, дигидропиранильную группу, дигидрофуранильную группу или 4,5-дигидро-1,3,4-оксадиазолильную группу, которая необязательно замещена группой, выбранной из группы, состоящей из атома галогена, аминогруппы, гидроксигруппы, оксогруппы, N-оксидной группы, формильной группы, C1-C6 алкильной группы (которая необязательно замещена группой, выбранной из группы, состоящей из гидроксигруппы и ди- или моно-(C1-C6 алкил)аминогруппы), C1-C6 алкоксигруппы (которая необязательно замещена атомом галогена) и 4-10-членной насыщенной гетероциклической группы,
R2 представляет собой атом водорода; цианогруппу; (C1-C6 алкокси)карбонильную группу; карбамоильную группу; ди- или моно-(C1-C6 алкил)карбамоильную группу; C1-C6 алкильную группу, необязательно замещенную группой, выбранной из группы, состоящей из гидроксигруппы, C1-C6 алкоксигруппы, ди- или моно-(C1-C6 алкил)аминогруппы и 4-10-членной насыщенной гетероциклической группы; C1-C6 алкоксигруппу; или моноциклическую 5- или 6-членную полностью ненасыщенную гетероциклическую группу, содержащую 1-3 N атома, которая необязательно замещена C1-C6 алкильной группой,
m имеет значение 0, n имеет значение 0 или 1, R4 представляет собой C2-C6 алкенильную группу, и
в формуле (I) следующая структура:
представляет собой любую из следующих структур:
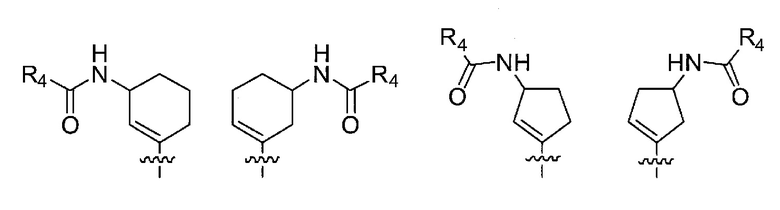
[0068]
Соединение по настоящему изобретению особенно предпочтительно представляет собой соединение, в котором R1 представляет собой циклопентенильную группу; циклогексенильную группу; фенильную группу; фуранильную группу, необязательно замещенную группой, выбранной из группы, состоящей из формильной группы и C1-C6 алкильной группы (которая необязательно замещена группой, выбранной из группы, состоящей из гидрокси группы и ди- или моно-(C1-C6 алкил)аминогруппы); 1H-пиразолильную группу, необязательно замещенную группой, выбранной из группы, состоящей из C1-C6 алкильной группы и 4-10-членной насыщенной гетероциклической группы; тиазолильную группу; оксазолильную группу; изоксазолильную группу; 1,3,4-тиадиазолильную группу; 1,2,4-оксадиазолильную группу; 1,3,4-оксадиазолильную группу, необязательно замещенную C1-C6 алкильной группой; пиридильную группу, необязательно замещенную группой, выбранной из группы, состоящей из атома галогена, аминогруппы, гидроксигруппы, N-оксидной группы, C1-C6 алкильной группы (которая необязательно замещена гидроксигруппой) и C1-C6 алкоксигруппы (которая необязательно замещена атомом галогена); дигидропиранильную группу; дигидрофуранильную группу; или 4,5-дигидро-1,3,4-оксадиазолильную группу, необязательно замещенную группой, выбранной из группы, состоящей из оксогруппы и C1-C6 алкильной группы,
R2 представляет собой атом водорода; цианогруппу; (C1-C6 алкокси)карбонильную группу; карбамоильную группу; ди- или моно-(C1-C6 алкил)карбамоильную группу; C1-C6 алкильную группу, необязательно замещенную группой, выбранной из группы, состоящей из гидроксигруппы, C1-C6 алкоксигруппы, ди- или моно-(C1-C6 алкил)аминогруппы и 4-10-членной насыщенной гетероциклической группы; C1-C6 алкоксигруппу; или моноциклическую 5- или 6-членную полностью ненасыщенную гетероциклическую группу, содержащую 1-3 N атома, которая необязательно замещена C1-C6 алкильной группой,
m имеет значение 0, n имеет значение 0 или 1, R4 представляет собой C2-C6 алкенильную группу, и
в формуле (I) следующая структура:
представляет собой любую из следующих структур:
[0069]
Конкретные примеры предпочтительного соединения по настоящему изобретению включают:
(1) N-(3-(3-фенил-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 1),
(2) N-(3-(3-(1H-пиразол-4-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 3),
(3) N-(3-(3-(2-метоксипиридин-3-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 6),
(4) N-(3-(3-(фуран-2-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 12),
(5) N-(3-(3-(4-(гидроксиметил)фуран-2-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 14),
(6) N-(3-(3-(2,5-дигидрофуран-3-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 34),
(7) N-(3-(3-(оксазол-5-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 48),
(8) N-(3-(3-(1,3,4-оксадиазол-2-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 49),
(9) (S)-N-(3-(3-(1,3,4-оксадиазол-2-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 55),
(10) N-(3-(3-(1,3,4-оксадиазол-2-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклопент-3-ен-1-ил)акриламид (Соединение 57), and
(11) (S)-N-(3-(3-(изоксазол-5-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 59).
[0070]
Далее будут описаны способы получения соединения в соответствии с настоящим изобретением.
Соединение по настоящему изобретению формулы (I) можно получить, например, следующими Способами получения A-E.
[0071]
<Способ получения A>
[0072]
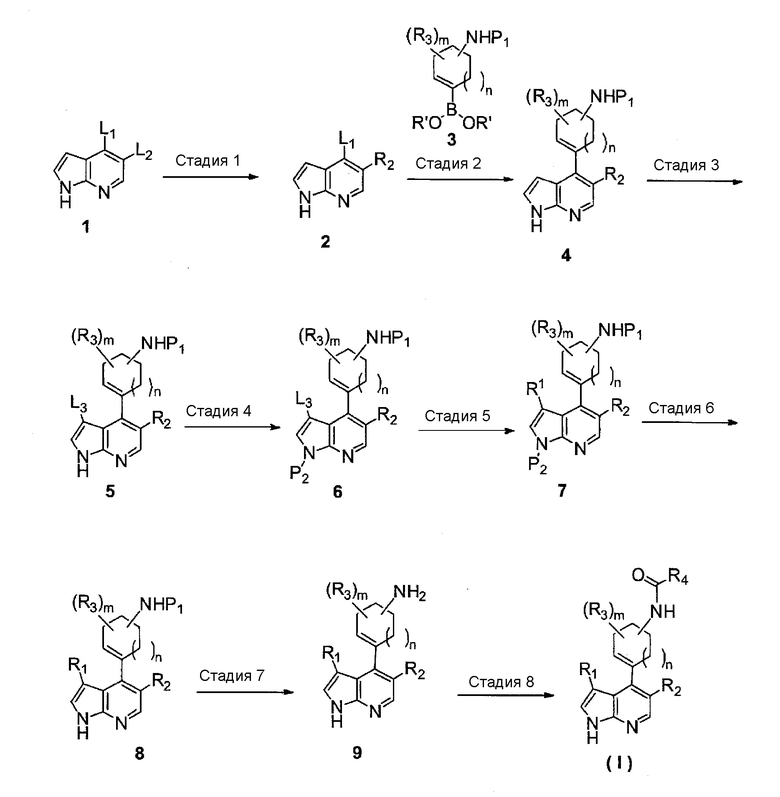
[0073]
где L1, L2 и L3, которые являются одинаковыми или отличными друг от друга, представляют собой каждый удаляемую группу, P1 и P2 представляют собой каждый защитную группу, и другие символы имеют значения, описанные выше.
[0074]
(Стадия 1)
Эта стадия представляет собой способ, обеспечивающий возможность взаимодействия соединения формулы 1 с арилбороновой кислотой или эфиром арилбороновой кислоты или с ненасыщенный гетероцикл-бороновой кислотой или эфиром ненасыщенный гетероцикл-бороновой кислоты, каждый из которых представляет собой коммерчески доступный продукт или может быть получен известным способом, в соответствии с реакцией сочетания, когда L2 в соединении формулы 1 содержит удаляемую группу, такую как галоген, для получения соединения формулы 2.
[0075]
Эту стадию, как правило, можно осуществить в соответствии с известным способом (например, Chemical Reviews, Vol. 95, p. 2457, 1995), и ее можно осуществить, например, в присутствии катализатора на основе переходного металла и основания, в растворителе, который не оказывает негативного влияния на реакцию.
[0076]
Арилбороновую кислоту или эфир арилбороновой кислоты или ненасыщенный гетероцикл-бороновую кислоту или эфир ненасыщенный гетероцикл-бороновой кислоты можно использовать в количестве от 1 до 10 эквивалентов, и предпочтительно от 1 до 3 эквивалентов, в расчете на количество соединения формулы 1 (1 моль).
[0077]
Примеры катализатора на основе переходного металла, используемого в реакции, включают палладиевые катализаторы (например, ацетат палладия, хлорид палладия и тетракис(трифенилфосфин)палладий) и никелевые катализаторы (например, хлорид никеля). При необходимости, к катализатору добавляют лиганд (например, трифенилфосфин и три-трет-бутилфосфин), и оксид металла (например, оксид меди и оксид серебра) и т.п. можно использовать в качестве сокатализатора. Количество катализатора на основе переходного металла, которое можно использовать, варьирует в зависимости от типа катализатора, и катализатор на основе переходного металла используют в количестве, как правило, от около 0,0001 до 1 моль, и предпочтительно от около 0,0 от 1 до 0,5 моль, в расчете на количество соединения формулы 1 (1 моль). Лиганд используют в количестве, как правило, от около 0,000 от 1 до 4 моль, и предпочтительно от около 0,0 от 1 до 2 моль, в расчете на количество соединения формулы 1 (1 моль), и сокатализатор используют в количестве, как правило, от около 0,0001 до 4 моль, и предпочтительно от около 0,01 до 2 моль, в расчете на количество соединения формулы 1 (1 моль).
[0078]
Примеры основания включают органические амины (например, триметиламин, триэтиламин, диизопропилэтиламин, N-метилморфолин, 1,8-диазабицикло[5,4,0]ундец-7-ен, пиридин и N,N-диметиланилин), соли щелочных металлов (например, гидрокарбонат натрия, гидрокарбонат калия, карбонат натрия, карбонат калия, карбонат цезия, фосфат натрия, фосфат калия, гидроксид натрия и гидроксид калия), гидриды металлов (например, гидрид калия и гидрид натрия), алкоксиды щелочных металлов (например, метоксид натрия, этоксид натрия, трет-бутоксид натрия и трет-бутоксид калия) и дисилазиды щелочных металлов (например, дисилазид лития, дисилазид натрия и дисилазид калия). Основание используют, как правило, в количестве от 0,1 до 10 моль, и предпочтительно примерно от 1 до 5 моль, в расчете на количество соединения формулы 1 (1 моль).
[0079]
Растворитель конкретно не ограничивается, при условии, что он не оказывает негативного влияния на реакцию. Примеры растворителя включают углеводороды (например, бензол, толуол и ксилол), галогенированные углеводороды (например, хлороформ и 1,2-дихлорэтан), нитрилы (например, ацетонитрил), простые эфиры (например, диметоксиэтан и тетрагидрофуран), спирты (например, метанол и этанол), апротонные полярные растворители (например, диметилформамид, диметилсульфоксид и гексаметилфосфорамид), воду и смеси таких растворителей.
Время реакции составляет от 0,1 до 100 часов, и предпочтительно от 0,5 до 24 часов. Температура реакции составляет от 0°C до температуры кипения растворителя, и предпочтительно от 0°C до 150°C.
Полученное таким образом соединение формулы 2 может быть выделено и очищено с использованием известных процедур выделения и очистки, или его можно использовать на следующей стадии без такого выделения и очистки.
[0080]
(Стадия 2)
Эта стадия представляет собой способ, обеспечивающий возможность взаимодействия соединения формулы 2 с соединением формулы 3, которое представляет собой коммерчески доступный продукт или может быть получено известным способом, в соответствии с реакцией сочетания, для получения соединения формулы 4. Эту стадию можно осуществить таким же способом, как способ, импользуемый на Стадии 1.
[0081]
(Стадия 3)
Эта стадия представляет собой способ галогенирования соединения формулы 4 с получением соединения формулы 5. Галогенирование можно осуществить, например, способом с использованием фтора, хлора, брома, иода и т.д. или способом с использованием N-хлорсукцинимида, N-бромсукцинимида или N-иодсукцинимида. В этой реакции способ с использованием N-хлорсукцинимида, N-бромсукцинимида, N-иодсукцинимида и т.д. является предпочтительным.
[0082]
Такой N-хлорсукцинимид, N-бромсукцинимид, N-иодсукцинимид и т.д. можно использовать в количестве от 1 до 10 эквивалентов, и предпочтительно от 1 до 3 эквивалентов, в расчете на количество соединения формулы 4 (1 моль).
[0083]
Растворитель конкретно не ограничивается, при условии, что он не оказывает негативного влияния на реакцию. Примеры растворителя включают углеводороды (например, бензол, толуол и ксилол), галогенированные углеводороды (например, хлороформ и 1,2-дихлорэтан), нитрилы (например, ацетонитрил), простые эфиры (например, диметоксиэтан и тетрагидрофуран), спирты (например, метанол и этанол), апротонные полярные растворители (например, диметилформамид, диметилсульфоксид и гексаметилфосфорамид), воду и смеси таких растворителей.
Время реакции составляет от 0,1 до 100 часов, и предпочтительно от 0,5 до 24 часов. Температура реакции составляет от 0°C до температуры кипения растворителя, и предпочтительно от 0°C до 100°C.
Полученное таким образом соединение формулы 5 может быть выделено и очищено с использованием известных процедур выделения и очистки, или его можно использовать на следующей стадии без такого выделения и очистки.
[0084]
(Стадия 4)
Эта стадия представляет собой способ введения защитной группы в соединение формулы 5 с получением соединения формулы 6. Защиту можно осуществить широко известным способом, например, способом, описанным в Protective Groups in Organic Synthesis, T. W. Greene, John Wiley & Sons (1981), или эквивалентным способом. В этой реакции толуолсульфонатная группа, бензолсульфонатная группа, метансульфонатная группа, 2-(триметилсилил)этоксиметильная группа, метоксиметильная группа, тритильная группа и т.п. являются предпочтительными.
[0085]
Примеры защитной группы, используемой в этой реакции, включают толуолсульфонилхлорид, бензолсульфонилхлорид, метансульфонилхлорид, 2-(хлорметокси)этилтриметилсилан, хлор(метокси)метан и тритилхлорид. Такую защитную группу используют в количестве, как правило, примерно от 1 до 100 моль, и предпочтительно примерно от 1 до 10 моль, в расчете на количество соединения формулы 5 (1 моль).
[0086]
Примеры основания включают органические амины (например, триметиламин, триэтиламин, диизопропилэтиламин, N-метилморфолин, 1,8-диазабицикло[5,4,0]ундец-7-ен, пиридин и N,N-диметиланилин), соли щелочных металлов (например, гидрокарбонат натрия, гидрокарбонат калия, карбонат натрия, карбонат калия, карбонат цезия, фосфат натрия, фосфат калия, гидроксид натрия и гидроксид калия), гидриды металлов (например, гидрид калия и гидрид натрия), алкоксиды щелочных металлов (например, метоксид натрия, этоксид натрия, трет-бутоксид натрия и трет-бутоксид калия) и дисилазиды щелочных металлов (например, дисилазид лития, дисилазид натрия и дисилазид калия). Основание используют, как правило, в количестве от 0,1 до 100 моль, и предпочтительно примерно от 1 до 10 моль, в расчете на количество соединения формулы 5 (1 моль).
[0087]
Растворитель конкретно не ограничивается, при условии, что он не оказывает негативного влияния на реакцию. Примеры растворителя включают углеводороды (например, бензол, толуол и ксилол), галогенированные углеводороды (например, хлороформ и 1,2-дихлорэтан), нитрилы (например, ацетонитрил), простые эфиры (например, диметоксиэтан и тетрагидрофуран), спирты (например, метанол и этанол), апротонные полярные растворители (например, диметилформамид, диметилсульфоксид и гексаметилфосфорамид), воду и смеси таких растворителей.
Время реакции составляет от 0,1 до 100 часов, и предпочтительно от 0,5 до 24 часов. Температура реакции составляет от 0°C до температуры кипения растворителя, и предпочтительно от 0°C до 100°C.
Полученное таким образом соединение формулы 6 может быть выделено и очищено с использованием известных процедур выделения и очистки, или его можно использовать на следующей стадии без такого выделения и очистки.
[0088]
(Стадия 5)
Эта стадия представляет собой способ, обеспечивающий возможность взаимодействия соединения формулы 6 с арилбороновой кислотой или эфиром арилбороновой кислоты или с ненасыщенный гетероцикл-бороновой кислотой или эфиром ненасыщенный гетероцикл-бороновой кислоты, каждый из которых представляет собой коммерчески доступный продукт или может быть получен известным способом, в соответствии с реакцией сочетания, или обеспечивающий возможность взаимодействия соединения формулы 6 с оловоорганическим соединением, которое представляет собой коммерчески доступный продукт или может быть получено известным способом, в соответствии с реакцией сочетания для получения соединения формулы 7.
Эту стадию можно осуществить таким же способом, как способ, импользуемый на Стадии 1.
[0089]
(Стадия 6)
Эта стадия представляет собой способ удаления защитной группы P2 соединения формулы 7 с получением соединения формулы 8. Удаление защиты можно осуществить широко известным способом, например, способом, описанным в Protective Groups in Organic Synthesis, T. W. Greene, John Wiley & Sons (1981), или эквивалентным способом.
[0090]
Примеры защитной группы включают группу пара-толуолсульфоновой кислоты и триметилсилилэтоксиметильную группу. Когда используют группу пара-толуолсульфоновой кислоты в качестве защитной группы, предпочтительно используют, например, гидроксид лития, гидроксид натрия, гидроксид калия, тетрабутиламмонийфторид и т.д. Такую защитную группу используют, как правило, в количестве от 0,5 до 100 моль, и предпочтительно примерно от 1 до 10 моль, в расчете на количество соединения формулы 7 (1 моль).
Более того, когда защитная группа P2 представляет собой триметилсилилэтоксиметильную группу или тритильную группу, предпочтительно используют гидроксид лития, гидроксид натрия, гидроксид калия, тетрабутиламмонийфторид, кислоту (например, хлористоводородную кислоту, трифторуксусную кислоту, уксусную кислоту и серную кислот) и т.п. Такую защитную группу используют, как правило, в количестве от 0,5 до 100 моль, и предпочтительно примерно от 1 до 10 моль, в расчете на количество соединения формулы 7 (1 моль).
[0091]
Растворитель, используемый в реакции, конкретно не ограничивается, при условии, что он не оказывает негативного влияния на реакцию. Примеры растворителя, используемого в реакции, включают спирты (например, метанол), углеводороды (например, бензол, толуол и ксилол), галогенированные углеводороды (например, метилен хлорид, хлороформ и 1,2-дихлорэтан), нитрилы (например, ацетонитрил), простые эфиры (например, диметоксиэтан и тетрагидрофуран), апротонные полярные растворители (например, N,N-диметилформамид, диметилсульфоксид и гексаметилфосфорамид) и их смеси.
Время реакции составляет от 0,1 до 100 часов, и предпочтительно от 0,5 до 24 часов. Температура реакции составляет от 0°C до температуры кипения растворителя, и предпочтительно от 0°C до 100°C.
Полученное таким образом соединение формулы 8 может быть выделено и очищено с использованием известных процедур выделения и очистки, или его можно использовать на следующей стадии без такого выделения и очистки.
[0092]
(Стадия 7)
Эта стадия представляет собой способ удаления защитной группы для аминогруппы соединения формулы 8, с получением соединения формулы 9. Удаление защиты можно осуществить широко известным способом, например, способом, описанным в Protective Groups in Organic Synthesis, T. W. Greene, John Wiley & Sons (1981), или эквивалентным способом.
[0093]
Примером такой защитной группы является трет-бутилоксикарбонил. Когда трет-бутилоксикарбонильную группу используют в качестве защитной группы, например, удаление защиты предпочтительно осуществляют в кислотных условиях. Примеры кислоты включают хлористоводородную кислоту, уксусную кислоту, трифторуксусную кислоту, серную кислоту и толуолсульфоновую кислоту. Кислоту предпочтительно используют в количестве примерно от 1 до 100 эквивалентов в расчете на количество соединения формулы 8 (1 моль).
[0094]
Растворитель, используемый в реакции, конкретно не ограничивается, при условии, что он не оказывает негативного влияния на реакцию. Примеры растворителя, используемого в реакции, включают спирты (например, метанол), углеводороды (например, бензол, толуол и ксилол), галогенированные углеводороды (например, метилен хлорид, хлороформ и 1,2-дихлорэтан), нитрилы (например, ацетонитрил), простые эфиры (например, диметоксиэтан и тетрагидрофуран), апротонные полярные растворители (например, N,N-диметилформамид, диметилсульфоксид и гексаметилфосфорамид) и их смеси.
Время реакции составляет от 0,1 до 100 часов, и предпочтительно от 0,5 до 24 часов. Температура реакции составляет от 0°C до 100°C, и предпочтительно от 0°C to 50°C.
Полученное таким образом соединение формулы 9 может быть выделено и очищено с использованием известных процедур выделения и очистки, или его можно использовать на следующей стадии без такого выделения и очистки.
[0095]
(Стадия 8)
Эта стадия представляет собой способ, обеспечивающий возможность взаимодействия аминогруппы соединения формулы 9 с карбоновой кислотой, представленной как R4-COOH, или с галогенангидридом кислоты, представленным как R4-C(=O)-L (где L представляет собой атом хлора или атом брома), в соответствии с реакцией амидирования с получением, таким образом, соединения по настоящему изобретению формулы (I).
[0096]
Когда используют карбоновую кислоту, представленную как R4-COOH, эту карбоновую кислоту используют, как правило, в количестве от 0,5 до 10 моль, и предпочтительно примерно от 1 до 5 моль, в расчете на количество соединения формулы 9 (1 моль), в присутствии агента конденсации. Следует отметить, что карбоновая кислота представляет собой коммерчески доступный продукт или может быть получена в соответствии с известным способом.
[0097]
Примеры агента конденсации включают N,N'-дициклогексилкарбодиимид (DCC), N,N'-диизопропилкарбодиимид (DIC), 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид (WSC), дифенилфосфорилазид (DPPA), бензотриазол-1-ил-окситрисдиметиламинофосфоний гексафторфосфат (BOP), бензотриазол-1-ил-окситрипирролидинофосфоний гексафторфосфат (PyBOP), 7-азабензотриазол-1-илокситриспирролидинофосфоний фосфат (PyAOP), бромтриспирролидинофосфоний гексафторфосфат (BroP), хлортрис(пирролидин-1-ил)фосфоний гексафторфосфат (PyCroP), 3-(диэтоксифосфорилокси)-1,2,3-бензотриазин-4(3H)-он (DEPBT), O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилуроний гексафторфосфат (HATU) и 4-(5,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолин гидрохлорид (DMTMM). Примеры добавки, используемой в реакции, включают 1-гидроксибензотриазол (HOBt), 1-гидрокси-7-азабензотриазол (HOAt) и N-гидроксисукцинимид (HOSu). Такое вещество используют, как правило, в количестве от 1 до 100 моль, и предпочтительно примерно от 1 до 10 моль, в расчете на количество соединения формулы 9 (1 моль).
[0098]
Кроме того, можно добавить основание, при необходимости. Примеры такого основания включают органические амины (например, триметиламин, триэтиламин, диизопропилэтиламин, N-метилморфолин, 1,8-диазабицикло[5,4,0]ундец-7-ен, пиридин и N,N-диметиланилин), соли щелочных металлов (например, гидрокарбонат натрия, гидрокарбонат калия, карбонат натрия, карбонат калия, карбонат цезия, фосфат натрия, фосфат калия, гидроксид натрия и гидроксид калия), гидриды металлов (например, гидрид калия и гидрид натрия) и алкоксиды щелочных металлов (например, метоксид натрия, этоксид натрия, трет-бутоксид натрия и трет-бутоксид калия). Основание используют, как правило, в количестве от 1 до 100 моль, и предпочтительно примерно от 1 до 10 моль, в расчете на количество соединения формулы 9 (1 моль).
[0099]
Растворитель, используемый в реакции, конкретно не ограничивается, при условии, что он не оказывает негативного влияния на реакцию. Примеры растворителя, используемого в реакции, включают спирты (например, метанол), углеводороды (например, бензол, толуол и ксилол), галогенированные углеводороды (например, метиленхлорид, хлороформ и 1,2-дихлорэтан), нитрилы (например, ацетонитрил), простые эфиры (например, диметоксиэтан и тетрагидрофуран), апротонные полярные растворители (например, N,N-диметилформамид, диметилсульфоксид и гексаметилфосфорамид) и их смеси.
Время реакции составляет от 0,1 до 100 часов, и предпочтительно от 0,5 до 24 часов. Температура реакции составляет от 0°C до температуры кипения растворителя, и предпочтительно от 0°C до 100°C.
[0100]
Когда используют галогенангидрид кислоты, представленный как R4-C(=O)-L (где L представляет собой атом хлора или атом брома), галогенангидрид кислоты используют, как правило, в количестве от 0,5 до 10 моль, и предпочтительно примерно от 1 до 5 моль, в расчете на количество соединения формулы 9 (1 моль). Следует отметить, что галогенангидрид кислоты представляет собой коммерчески доступный продукт или может быть получен в соответствии с известным способом.
[0101]
Кроме того, можно добавить основание, при необходимости. Примеры такого основания включают органические амины (например, триметиламин, триэтиламин, диизопропилэтиламин, N-метилморфолин, 1,8-диазабицикло[5,4,0]ундец-7-ен, пиридин и N,N-диметиланилин), соли щелочных металлов (например, гидрокарбонат натрия, гидрокарбонат калия, карбонат натрия, карбонат калия, карбонат цезия, фосфат натрия, фосфат калия, гидроксид натрия и гидроксид калия), гидриды металлов (например, гидрид калия и гидрид натрия) и алкоксиды щелочных металлов (например, метоксид натрия, этоксид натрия, трет-бутоксид натрия и трет-бутоксид калия). Основание используют, как правило, в количестве от 1 до 100 моль, и предпочтительно примерно от 1 до 10 моль, в расчете на количество соединения формулы 9 (1 моль).
[0102]
Растворитель, используемый в реакции, конкретно не ограничивается, при условии, что он не оказывает негативного влияния на реакцию. Примеры растворителя, используемого в реакции, включают спирты (например, метанол), углеводороды (например, бензол, толуол и ксилол), галогенированные углеводороды (например, метиленхлорид, хлороформ и 1,2-дихлорэтан), нитрилы (например, ацетонитрил), простые эфиры (например, диметоксиэтан и тетрагидрофуран), апротонные полярные растворители (например, N,N-диметилформамид, диметилсульфоксид и гексаметилфосфорамид) и их смеси.
Время реакции составляет от 0,1 до 100 часов, и предпочтительно от 0,5 до 24 часов. Температура реакции составляет от 0°C до температуры кипения растворителя, и предпочтительно от 0°C до 100°C.
Полученное таким образом соединение по настоящему изобретению формулы (I) может быть выделено и очищено с использованием известных процедур выделения и очистки, таких как концентрирование, концентрирование под вакуумом, кристаллизация, экстракция растворителем, повторное осаждение или хроматография.
[0103]
Более того, в Способе получения A "связывание азаиндольного скелета с соединением формулы 3", "введение R1 в азаиндольный скелет" и "удаление защитной группы P1 и введение -C(=O)-R4" осуществляют в указанном порядке. Однако этот порядок можно изменить. А именно, соединение также можно синтезировать, осуществляя в следующем порядке "введение R1 в азаиндольный скелет", "связывание азаиндольного скелета с соединением формулы 3" и "удаление защитной группы P1 и введение -C(=O)-R4." В частности, соединение формулы 2 подвергают отдельным стадиям, осуществляя в следующем порядке Стадию 3, Стадию 4, Стадию 5 и Стадию 2, так, чтобы оно могло быть преобразовано в соединение формулы 7. Условия, применимые для каждой стадии, являются такими, которые описаны выше. Кроме того, соединение также можно синтезировать, осуществляя в следующем порядке "связывание азаиндольного скелета с соединением формулы 3", "удаление защитной группы P1 и введение -C(=O)-R4" и "введение R1 в азаиндольный скелет". В частности, соединение формулы 6 подвергают отдельным стадиям, осуществляя в следующем порядке Стадию 7, Стадию 8, Стадию 5 и Стадию 6, так, чтобы оно могло быть преобразовано в соединение по настоящему изобретению формулы (I).
[0104]
Кроме того, в подходящем промежуточном соединении в Способе получения A один заместитель, представленный как R2, можно преобразовать в другой заместитель, представленный как R2. Например, формильную группу можно преобразовать в метильную группу, замещенную ди- или моно-алкиламиногруппой, формильную группу можно преобразовать в гидроксиметильную группу, сложноэфирную группу можно преобразовать в карбоксигруппу, и сложноэфирную группу можно преобразовать в амидную группу. Преобразование заместителей не ограничивается этим, и также включены преобразования, описанные в известных публикациях и т.п. Преобразование заместителя R2 из соединения формулы 7 в соединение формулы 8 показано в Способе получения B, и преобразование заместителя R2 из соединения формулы 8 в соединение формулы 9 показано в Способах получения C и D. Преобразование R2 не ограничивается этими промежуточными соединениями, и это можно осуществить подходящим образом.
[0105]
Кроме того, на Стадии 5 Способа получения A, описан способ введения R1 в азаиндольный скелет. Вместо этого способа, R1 также может быть образован из формильной группы. Такой способ будет описан в Способе получения E.
[0106]
<Способ получения B>
Способ получения B представляет собой способ осуществления преобразования заместителя R2 из соединения формулы 7 в соединение формулы 8, с получением, таким образом, соединения по настоящему изобретению формулы (I).
[0107]
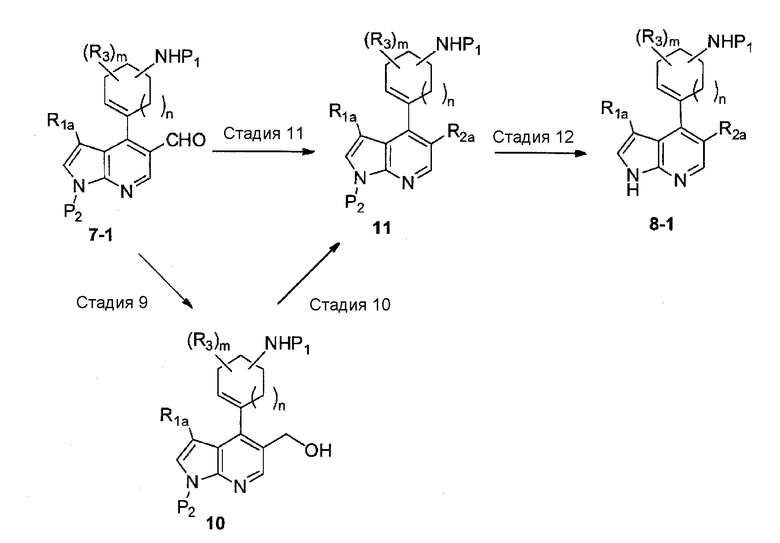
[0108]
Преобразование заместителя в этом способе получения представляет собой преобразование формильной группы в метильную группу, замещенную ди- или моно-алкиламиногруппой. Соединение формулы 7-1 представляет собой соединение формулы 7, в котором R2 представляет собой формильную группу. Заместитель R1a представляет собой заместитель, не содержащий никаких формильных групп в своем заместителе Rx, среди заместителей, определенных как R1. Заместитель R2a представляет собой метильную группу, замещенную ди- или моно-алкиламиногруппой, среди заместителей, определенных как R2. Другие символы имеют такие же значения, которые определены выше.
[0109]
(Стадия 9)
Эта стадия представляет собой способ, в котором соединение формулы 7-1 подвергают реакции восстановления, приводя к преобразованию в гидроксиметильную группу, для получения соединения формулы 10.
[0110]
Примеры восстановителя включают гидриды щелочных металлов (например, борогидрид натрия, борогидрид лития, цианоборогидрид натрия, триацетоксиборогидрид натрия и литийалюминийгидрид), комплексные соединения водорода с металлами (например, натрий бис(2-метоксиэтокси)алюминий гидрид и диизобутилалюминий гидрид) и комплексы с бораном (комплекс боран-тетрагидрофуран, комплекс боран-пиридин и т.д.). Восстановитель используют в количестве, как правило, от около 0,1 до 100 моль, и предпочтительно примерно от 1 до 10 моль, в расчете на количество соединения формулы 7-1 (1 моль).
[0111]
Растворитель конкретно не ограничивается, при условии, что он не оказывает негативного влияния на реакцию. Примеры растворителя включают углеводороды (например, бензол, толуол и ксилол), галогенированные углеводороды (например, хлороформ и 1,2-дихлорэтан), нитрилы (например, ацетонитрил), простые эфиры (например, диметоксиэтан и тетрагидрофуран), спирты (например, метанол и этанол), апротонные полярные растворители (например, диметилформамид, диметилсульфоксид и гексаметилфосфорамид), воду и смеси таких растворителей.
Время реакции составляет от 0,1 до 100 часов, и предпочтительно от 0,5 до 24 часов. Температура реакции составляет от 0°C до температуры кипения растворителя, и предпочтительно от 0°C до 100°C.
Полученное таким образом соединение формулы 10 может быть выделено и очищено с использованием известных процедур выделения и очистки, или его можно использовать на следующей стадии без такого выделения и очистки.
[0112]
(Стадия 10)
Эта стадия представляет собой способ, в котором соединение формулы 10 подвергают реакции Мицунобу, с получением соединения формулы 11.
[0113]
Примеры реагента Мицунобу, используемого в реакции, включают диэтилазодикарбоксилат и диизопропилазодикарбоксилат. Реагент Мицунобу, как правило, используют в количестве примерно от 1 до 100 моль, и предпочтительно примерно от 1 до 10 моль, в расчете на количество соединения формулы 10 (1 моль).
[0114]
Примеры фосфинового реагента, используемого в реакции, включают трифенилфосфин, трибутилфосфин и трифурилфосфин. Фосфиновый реагент, как правило, используют в количестве примерно от 1 до 100 моль, и предпочтительно примерно от 1 до 10 моль, в расчете на количество соединения формулы 10 (1 моль).
[0115]
Растворитель конкретно не ограничивается, при условии, что он не оказывает негативного влияния на реакцию. Примеры растворителя включают углеводороды (например, бензол, толуол и ксилол), галогенированные углеводороды (например, хлороформ и 1,2-дихлорэтан), нитрилы (например, ацетонитрил), простые эфиры (например, диметоксиэтан и тетрагидрофуран), спирты (например, метанол и этанол), апротонные полярные растворители (например, диметилформамид, диметилсульфоксид и гексаметилфосфорамид), воду и смеси таких растворителей.
Время реакции составляет от 0,1 до 100 часов, и предпочтительно от 0,5 до 24 часов. Температура реакции составляет от 0°C до температуры кипения растворителя, и предпочтительно от 0°C до 100°C.
Полученное таким образом соединение формулы 11 может быть выделено и очищено с использованием известных процедур выделения и очистки, или его можно использовать на следующей стадии без такого выделения и очистки.
[0116]
(Стадия 11)
Эта стадия представляет собой способ, обеспечивающий возможность взаимодействия соединения формулы 7-1 с аминами, которые являются коммерчески доступными продуктами или которые можно получить известным способом, в соответствии с реакцией восстановительного аминирования с использованием восстановителя для получения соединения формулы 11.
[0117]
Примеры восстановителя, используемого в реакции, включают гидриды металлов, такие как борогидрид натрия, борогидрид лития, цианоборогидрид натрия, триацетоксиборогидрид натрия, литийалюминийгидрид, натрий бис(2-метоксиэтокси)алюминий гидрид, комплекс боран-тетрагидрофуран или диизобутилалюминийгидрид. Более того, при необходимости можно добавить и использовать минеральные кислоты, такие как хлористоводородная кислота или бромистоводородная кислота, органические кислоты, такие как уксусная кислота, пара-толуолсульфоновая кислота или трифторметансульфоновая кислота, или кислоты Льюиса, такие как тетрахлорид титана или трифторметансульфонат иттербия. Восстановитель используют, как правило, в количестве от 0,5 до 100 моль, и предпочтительно примерно от 0,5 до 10 моль, в расчете на количество соединения формулы 7-1 (1 моль). Кислоту используют, как правило, в количестве от 0,5 до 100 моль, и предпочтительно примерно от 1 до 10 моль, в расчете на количество соединения формулы 7-1 (1 моль).
[0118]
Растворитель конкретно не ограничивается, при условии, что он не оказывает негативного влияния на реакцию. Примеры растворителя включают углеводороды (например, бензол, толуол и ксилол), галогенированные углеводороды (например, хлороформ и 1,2-дихлорэтан), нитрилы (например, ацетонитрил), простые эфиры (например, диметоксиэтан и тетрагидрофуран), спирты (например, метанол и этанол), апротонные полярные растворители (например, диметилформамид, диметилсульфоксид и гексаметилфосфорамид), воду и смеси таких растворителей.
Время реакции составляет от 0,1 до 100 часов, и предпочтительно от 0,5 до 24 часов. Температура реакции составляет от 0°C до температуры кипения растворителя, и предпочтительно от 0°C до 100°C.
Полученное таким образом соединение формулы 11 может быть выделено и очищено с использованием известных процедур выделения и очистки, или его можно использовать на следующей стадии без такого выделения и очистки.
[0119]
(Стадия 12)
Эта стадия представляет собой способ удаления защитной группы P2 соединения формулы 11 с получением соединения формулы 8-1. Эту стадию можно осуществить таким же способом, как способ, импользуемый на Стадии 6.
[0120]
Полученное таким образом соединение формулы 8-1 обрабатывали таким же способом, как в случае преобразования соединения формулы 8 в соединение по настоящему изобретению формулы (I) в Способе получения A, с получением, таким образом, соединения по настоящему изобретению формулы (I).
[0121]
<Способ получения C>
Способ получения C представляет собой способ осуществления преобразования заместителя R2 из соединения формулы 8 в соединение формулы 9 с получением, таким образом, соединения по настоящему изобретению формулы (I).
[0122]
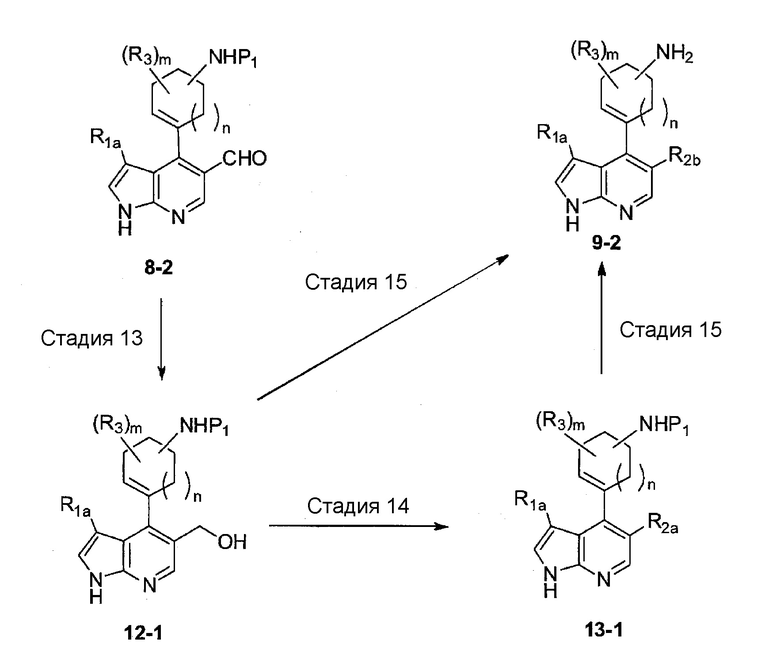
[0123]
Преобразование заместителя представляет собой преобразование формильной группы в метильную группу, замещенную ди- или моно-алкиламиногруппой, и преобразование формильной группы в гидроксиметильную группу. Соединение формулы 8-2 представляет собой соединение формулы 8, в котором R2 представляет собой формильную группу. Заместитель R2b представляет собой гидроксиметильную группу или метильную группу, замещенную ди- или моно-алкиламиногруппой, среди заместителей, определенных как R2. Другие символы имеют такие же значения, которые определены выше.
[0124]
(Стадия 13)
Эта стадия представляет собой способ, в котором формильную группу соединения формулы 8-2 подвергают реакции восстановления с преобразованием ее, таким образом, в гидроксиметильную группу, с получением соединения формулы 12-1. Эту стадию можно осуществить таким же способом, как способ, импользуемый на Стадии 9.
[0125]
(Стадия 14)
Эта стадия представляет собой способ, в котором соединение формулы 12-1 подвергают реакции Мицунобу, с получением соединения формулы 13-1. Эту стадию можно осуществить таким же способом, как способ, импользуемый на Стадии 10.
[0126]
(Стадия 15)
Эта стадия представляет собой способ удаления защитной группы для аминогруппы соединения формулы 12-1 или соединения формулы 13-1, для получения соединения формулы 9-2. Эту стадию можно осуществить таким же способом, как способ, импользуемый на Стадии 7.
Полученное таким образом соединение формулы 9-2 может быть выделено и очищено с использованием известных процедур выделения и очистки, или его можно использовать на следующей стадии без такого выделения и очистки.
[0127]
Полученное таким образом соединение формулы 9-2 обрабатывали таким же способом, как в случае преобразования соединения формулы 9 в соединение по настоящему изобретению формулы (I) в Способе получения A, с получением, таким образом, соединения по настоящему изобретению формулы (I).
[0128]
<Способ получения D>
Способ получения D представляет собой способ осуществления преобразования заместителя R2 из соединения формулы 8 в соединение формулы 9, с получением, таким образом, соединения по настоящему изобретению формулы (I).
[0129]
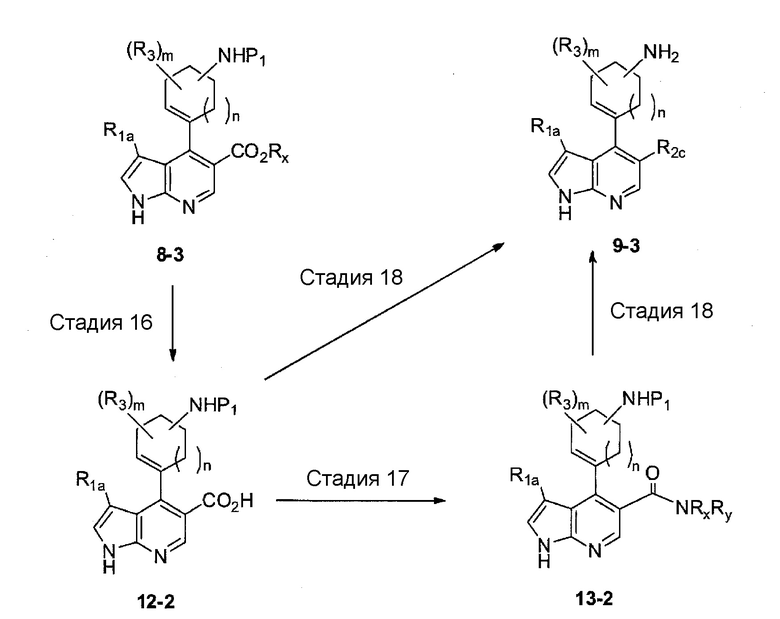
[0130]
Соединение формулы 8-3 представляет собой соединение формулы 8, в котором R2 представляет собой сложноэфирную группу C(=O)ORx. Преобразование заместителя представляет собой преобразование сложноэфирной группы в карбоксигруппу и амидную группу. Заместитель R2c представляет собой карбоксигруппу или группу, представленную как -C(=O)-N(Rx)(Ry), среди заместителей, определенных как R2. Другие символы имеют такие же значения, которые определены выше.
[0131]
(Стадия 16)
Эта стадия представляет собой способ, в котором соединение формулы 8-3 подвергают реакции гидролиза в щелочных условиях, для получения соединения формулы 12-2.
Примеры основания, которое предпочтительно используют в реакции, включают гидрокарбонат натрия, карбонат натрия, карбонат калия, карбонат цезия, гидроксид натрия, гидроксид калия и гидроксид лития. Основание, как правило, используют в количестве от 0,5 до 100 моль, и предпочтительно примерно от 1 до 10 моль, в расчете на количество соединения формулы 8-3 (1 моль).
Растворитель конкретно не ограничивается, при условии, что он не оказывает негативного влияния на реакцию. Примеры растворителя включают воду, метанол, этанол, изопропанол, тетрагидрофуран, 1,4-диоксан и N,N-диметилформамид. Эти растворители можно использовать отдельно или в комбинации. Время реакции составляет от 0,1 до 100 часов, и предпочтительно от 0,5 до 24 часов. Температура реакции составляет от 0°C до температуры кипения растворителя, и предпочтительно от 0°C до 100°C. Полученное таким образом соединение формулы 12-2 может быть выделено и очищено с использованием известных процедур выделения и очистки, или его можно использовать на следующей стадии без такого выделения и очистки.
[0132]
(Стадия 17)
Эта стадия представляет собой способ, в котором соединение формулы 12-2 и амин подвергают реакции амидирования с получением соединения формулы 13-2.
[0133]
Амидирование можно осуществить широко известным способом. Примером такого широко известного способа является способ, обеспечивающий возможность взаимодействия соединения формулы 12-2 с соответствующим амином в присутствии агента конденсации (см. "Peptide Gosei no Kiso to Jikken (Base and Experiments of Peptide Synthesis)" (Nobuo IZUMIYA, et al., Maruzen, 1983)). Полученное таким образом соединение формулы 13-2 может быть выделено и очищено с использованием известных процедур выделения и очистки, или его можно использовать на следующей стадии без такого выделения и очистки.
[0134]
(Стадия 18)
Эта стадия представляет собой способ удаления защитной группы для аминогруппы соединения формулы 12-2 или соединения формулы 13-2, для получения соединения формулы 9-3. Эту стадию можно осуществить таким же способом, как способ, импользуемый на Стадии 7. Полученное таким образом соединение формулы 9-3 может быть выделено и очищено с использованием известных процедур выделения и очистки, или его можно использовать на следующей стадии без такого выделения и очистки.
[0135]
<Способ получения E>
[0136]
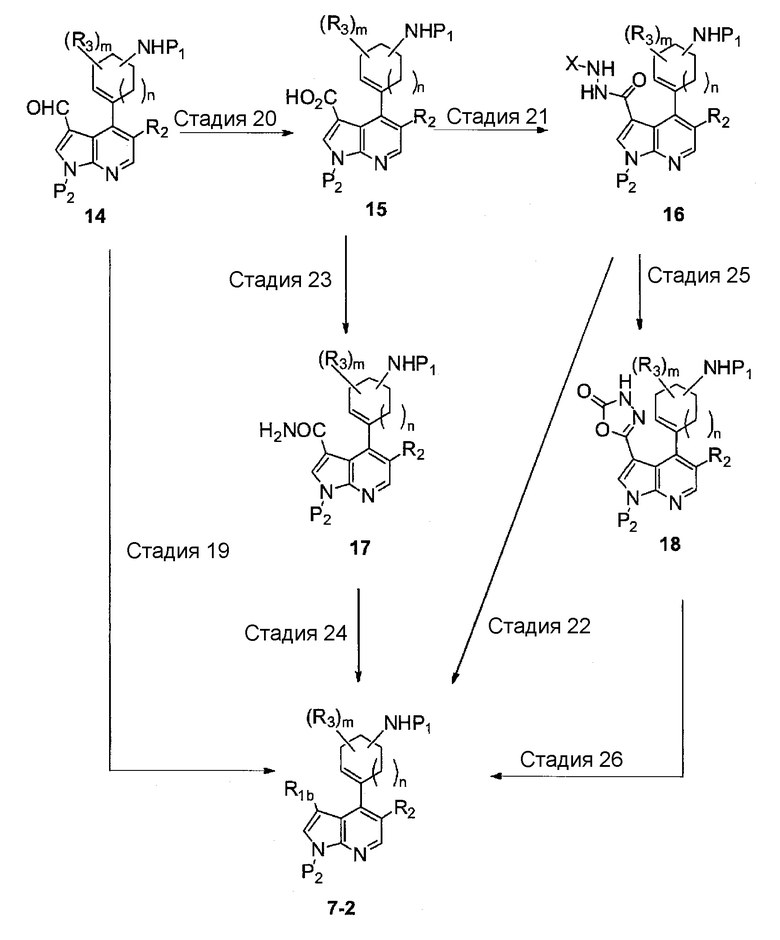
[0137]
Способ получения E представляет собой способ преобразования соединения формулы 14, содержащего формильную группу в качестве заместителя азаиндола, в соединение формулы 7-2, содержащее R1, через преобразование формильной группы. R1b представляет собой оксазол-5-ильную группу, 4-метил-5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ильную группу, 1,3,4-оксадиазол-2-ильную группу или 1,2,4-оксадиазол-5-ильную группу, среди заместителей, представленных как R1. Соединение формулы 14 можно получить из коммерчески доступного 4-хлор-1H-пирроло[2,3-b]пиридин-3-карбальдегида или т.п. через Стадию 2 и Стадию 4. Другие символы имеют такие же значения, которые определены выше.
[0138]
(Стадия 19)
Эта стадия представляет собой способ, обеспечивающий возможность воздействия соединением формулы 14 на пара-толилсульфонилметилизоцианид в щелочных условиях для образования оксазольного кольца, чтобы получить соединение формулы 7-2.
Пара-толилсульфонилметилизоцианид, как правило, используют в количестве от 1 до 100 моль, и предпочтительно примерно от 1 до 10 моль, в расчете на количество соединения формулы 14 (1 моль).
[0139]
Либо органическое основание либо неорганическое основание можно использовать в данном способе в качестве основания. Примеры органического основания включают алкиламины, такие как дициклогексиламин, диизопропиламин, диэтиламин, триэтиламин, трибутиламин или диизопропилэтиламин, алкиланилины, такие как N,N-диметиланилин, гетероциклические амины, такие как пиперидин, пирролидин, 2,2,6,6-тетраметилпиперидин, морфолин, пиперазин, имидазол, 1-этилпиперидин, 4-метилморфолин, 1-метилпирролидин, 1,4-диазабицикло[2.2,2]октан или 1,8-диазабицикло[5.4.0]-7-ундецен, четвертичные аммониевые соли, такие как бензилтриэтиламмонийхлорид или метилтриоктиламмонийхлорид, и диамины, такие как N,N,N',N'-тетраметилэтилендиамин. Примеры неорганического основания включают гидроксид натрия, гидроксид калия, карбонат натрия, карбонат калия, гидрокарбонат натрия и гидрокарбонат калия. Основание, как правило, используют в количестве от 0,5 до 10 моль, и предпочтительно примерно от 1 до 5 моль, в расчете на количество соединения формулы 14 (1 моль).
[0140]
Растворитель, используемый в реакции, конкретно не ограничивается, при условии, что он не оказывает негативного влияния на реакцию. Примеры растворителя, используемого в реакции, включают спирты (например, метанол), углеводороды (например, бензол, толуол и ксилол), галогенированные углеводороды (например, метиленхлорид, хлороформ и 1,2-дихлорэтан), нитрилы (например, ацетонитрил), простые эфиры (например, диметоксиэтан и тетрагидрофуран), апротонные полярные растворители (например, N,N-диметилформамид, диметилсульфоксид и гексаметилфосфорамид) и их смеси.
Время реакции составляет от 0,1 до 100 часов, и предпочтительно от 0,5 до 24 часов. Температура реакции составляет от 0°C до температуры кипения растворителя, и предпочтительно от 0°C до 100°C.
Полученное таким образом соединение формулы 7-2 может быть выделено и очищено с использованием известных процедур выделения и очистки, или его можно использовать на следующей стадии без такого выделения и очистки.
[0141]
(Стадия 20)
Эта стадия представляет собой способ, в котором соединение формулы 14 подвергают реакции окисления, с получением соединения формулы 15.
Окисление можно осуществить широко известным способом, например, способом, описанным в "5th edition, Jikken Kagaku Koza 17, Yuki Kagobutsu no Gosei V, Sanka Hanno (5th Edition, Experimental Chemistry Seminar 17, Synthesis of Organic Compounds V, Oxidation Reaction)," edited by the Chemical Society of Japan (2005), или эквивалентным способом. В этой реакции предпочтительно используют окисление методом Пинника (например, Tetrahedron 1981, 37, 2091).
Полученное таким образом соединение формулы 15 может быть выделено и очищено с использованием известных процедур выделения и очистки, или его можно использовать на следующей стадии без такого выделения и очистки.
[0142]
(Стадия 21)
Эта стадия представляет собой способ, в котором соединение формулы 15 и гидразины, которые являются коммерчески доступными продуктами или которые можно получить известным способом, подвергают реакции конденсации с дегидратацией, для получения соединения формулы 16. Примеры гидразинов, используемых на этой стадии, включают гидразин моногидрат и формилгидразин. Эту стадию можно осуществить в соответствии с известным способом с использованием обычного агента конденсации, с получением соединения формулы 16.
Эту стадию можно осуществить таким же способом, как способ, импользуемый на Стадии 8.
Полученное таким образом соединение формулы 16 может быть выделено и очищено с использованием известных процедур выделения и очистки, или его можно использовать на следующей стадии без такого выделения и очистки.
[0143]
(Стадия 22)
Эта стадия представляет собой способ преобразования ацилгидразидной группы соединения формулы 16 в 1,3,4-оксадиазольное кольцо, с получением соединения формулы 7-2.
Эту стадию можно осуществить в соответствии с широко известными способами (например, J. Med. Chem, Vol. 34, p. 2060, 1991, Tetrahedron Letters, vol. 49, p. 879, 2008, J. Med. Chem., vol. 52, p. 6270, 2009). Соединение формулы 7-2 можно синтезировать, например, путем взаимодействия триэтилортоформиата, триэтилортоацетата, триэтилортопропионата, ангидрида кислоты, ацетилхлорида или т.п. с соединением формулы 16, и такое соединение, как правило, используют в количестве от 1 до 100 моль, и предпочтительно примерно от 1 до 10 моль, в расчете на количество соединения формулы 16 (1 моль).
[0144]
При необходимости можно добавить кислоту Льюиса, которая включает минеральные кислоты, такие как хлористоводородная кислота или бромистоводородная кислота, и органические кислоты, такие как уксусная кислота, пара-толуолсульфоновая кислота или трифторметансульфоновая кислота. Кислоту, как правило, используют в количестве от 0,0 от 1 до 100 моль, и предпочтительно от около 0,05 до 10 моль, в расчете на количество соединения 16 (1 моль).
[0145]
Растворитель, используемый в реакции, конкретно не ограничивается, при условии, что он не оказывает негативного влияния на реакцию. Примеры растворителя, используемого в реакции, включают спирты (например, метанол), углеводороды (например, бензол, толуол и ксилол), галогенированные углеводороды (например, метиленхлорид, хлороформ и 1,2-дихлорэтан), нитрилы (например, ацетонитрил), простые эфиры (например, диметоксиэтан и тетрагидрофуран), апротонные полярные растворители (например, N,N-диметилформамид, диметилсульфоксид и гексаметилфосфорамид) и их смеси. Полученное таким образом соединение формулы 7-2 может быть выделено и очищено с использованием известных процедур выделения и очистки, или его можно использовать на следующей стадии без такого выделения и очистки.
[0146]
(Стадия 23)
Эту стадию можно осуществить таким же способом, как способ, импользуемый на Стадии 14.
Полученное таким образом соединение формулы 17 может быть выделено и очищено с использованием известных процедур выделения и очистки, или его можно использовать на следующей стадии без такого выделения и очистки.
[0147]
(Стадия 24)
Эта стадия представляет собой способ преобразования амидной группы соединения формулы 17 в 1,2,4-оксадиазольное кольцо для получения соединения формулы 7-2.
Эту стадию можно осуществить таким же способом, как способ, импользуемый на Стадии 22.
Полученное таким образом соединение формулы 7-2 может быть выделено и очищено с использованием известных процедур выделения и очистки, или его можно использовать на следующей стадии без такого выделения и очистки.
[0148]
(Стадия 25)
Эта стадия представляет собой способ преобразования ацилгидразидной группы соединения формулы 16 в 1,3,4-оксадиазолоновое кольцо для получения соединения формулы 18. Соединение формулы 18 можно синтезировать, например, путем взаимодействия карбонилимидазола, фосгена или т.п. с соединением формулы 16.
Эту стадию можно осуществить таким же способом, как способ, импользуемый на Стадии 22.
Полученное таким образом соединение формулы 18 может быть выделено и очищено с использованием известных процедур выделения и очистки, или его можно использовать на следующей стадии без такого выделения и очистки.
[0149]
(Стадия 26)
Эта стадия представляет собой способ, в котором соединение формулы 18 подвергают реакции алкилирования в присутствии основания с получением соединения формулы 7-2.
Алкилирование можно осуществить широко известным способом.
Полученное таким образом соединение формулы 7-2 может быть выделено и очищено с использованием известных процедур выделения и очистки, или его можно использовать на следующей стадии без такого выделения и очистки.
Полученное таким образом соединение формулы 7-2 может быть преобразовано в соединение по настоящему изобретению формулы (I) таким же способом, как способ получения соединения по настоящему изобретению формулы (I) из соединения формулы 7 в Способе получения A.
[0150]
Соединение по настоящему изобретению легко можно выделить и очистить в соответствии с обычными способами разделения. Примеры таких способов включают экстракцию растворителем, перекристаллизацию, препаративную обращенно-фазовую высоко-эффективную жидкостную хроматографию, колоночную хроматографию и препаративную тонкослойную хроматографию.
[0151]
Когда соединение по настоящему изобретению содержит изомеры, такие как оптический изомер, стереоизомер, региоизомер, ротационный изомер или таутомер, такие изомеры и их смеси все включены в соединение по настоящему изобретению. Например, когда соединение по настоящему изобретению содержит оптический изомер, оптический изомер, полученный в результате разделения рацемической смеси, также включен в соединение по настоящему изобретению.
[0152]
Соединение по настоящему изобретению или его соль может представлять собой кристалл. Даже если кристаллическая форма представляет собой отдельную форму или полиморфную смесь, кристалл включен в соединение по настоящему изобретению или его соль. Такой кристалл можно получить путем кристаллизации этого соединения в соответствии с известным способом кристаллизации. Соединение по настоящему изобретению или его соль может быть либо в форме сольвата (например, гидрата), либо в несольватированной форме, и обе такие формы включены в соединение по настоящему изобретению или его соль. Соединения, меченные изотопами (например, дейтерием, 3H, 13C, 14C, 35S и 125I) или т.п., также включены в соединение по настоящему изобретению или его соль.
[0153]
Пролекарство соединения по настоящему изобретению или его соли означает соединение, которое преобразуется в соединение по настоящему изобретению или его соль в результате взаимодействия с ферментом, желудочной кислотой или т.п. в физиологических условиях in vivo; а именно, соединение, которое подвергается ферментативному окислению, восстановлению, гидролизу и т.д., таким образом, что оно превращается в соединение по настоящему изобретению или его соль, или соединение, которое подвергается гидролизу или т.п. под воздействием желудочной кислоты или т.п., таким образом, что оно превращается в соединение по настоящему изобретению или его соль. Более того, такое пролекарство соединения по настоящему изобретению или его соли также может представлять собой соединение, которое превращается в соединение по настоящему изобретению или его соль в физиологических условиях, как описано в "Iyakuhin no Kaihatsu (Development of Pharmaceutical Products)," Vol. 7, Bunshi Sekkei (Molecular Designing), pp. 163-198, published by Hirokawa Shoten, 1990.
[0154]
Соль соединения по настоящему изобретению конкретно не ограничивается, при условии, что она является фармацевтически приемлемой, и это означает соль, традиционно используемую в области органической химии. Примеры такой соли включают соли, такие как основно-аддитивная соль по карбоксигруппе, когда соединение по настоящему изобретению содержит карбоксигруппу, или кислотно-аддитивная соль по аминогруппе или оснóвной гетероциклической группе, когда соединение по настоящему изобретению содержит аминогруппу или оснóвную гетероциклическую группу.
Примеры основно-аддитивной соли включают: соли щелочных металлов, такие как натриевая соль или калиевая соль; соли щелочно-земельных металлов, такие как кальциевая соль или магниевая соль; аммониевые соли; и соли органических аминов, такие как соль триметиламина, соль триэтиламина, соль дициклогексиламина, соль этаноламина, соль диэтаноламина, соль триэтаноламина, соль прокаина и соль N,N'-дибензилэтилендиамина.
Примеры кислотно-аддитивной соли включают: соли неорганических кислот, такие как гидрохлорид, сульфат, нитрат, фосфат или перхлорат; соли органических кислот, такие как ацетат, формиат, малеат, фумарат, тартрат, цитрат, аскорбат или трифторацетат; и сульфонаты, такие как a метансульфонат, изетионат, бензолсульфонат или п-толуолсульфонат.
[0155]
Соединение по настоящему изобретению или его соль обладает более высокой селективной ингибиторной активностью в отношении JAK3, чем в отношении JAK1 и JAK2. Кроме того, соединение по настоящему изобретению или его соль обладает отличным действием по подавлению роста человеческих PBMC. Поскольку соединение по настоящему изобретению или его соль обладает отличной JAK3-ингибиторной активностью, оно является полезным в качестве фармацевтического средства для профилактики или лечения заболевания, в которое вовлечена JAK3. Более того, поскольку соединение по настоящему изобретению или его соль обладает отличной селективностью в отношении JAK3, оно является полезным в качестве фармацевтического средства с уменьшенными побочными эффектами, вызываемыми JAK1 и JAK2 (т.е. повышение уровня липидов, анемия, нейтропения, иммуносепрессия и т.д.). "Заболевание, в которое вовлечена JAK3" представляет собой заболевание, частота случаев возникновения которого снижается, и симптомы которого достигают ремиссии, уменьшается их тяжесть и/или полностью излечиваются путем делеции, супрессии и/или ингибирования функции JAK3. Примеры такого заболевания, в которое вовлечена JAK3, включают аутоиммунное заболевание (ревматоидный артрит, системная красная волчанка, склеродерма, полимиозит/дерматомиозит, синдром Шегрена, болезнь Бехчета и т.д.), аллергическое заболевание (бронхиальная астма, аллергический ринит/сенная лихорадка, атопический дерматит, пищевая аллергия, анафилаксия, лекарственная аллергия, крапивница, конъюнктивит и т.д.), заболевание нервной системы (рассеянный склероз, болезнь Альцгеймера и т.д.), воспалительне заболевание кишечника (язвенный колит, болезнь Крона), псориаз, контактный дерматит, диабет, заболевание брюшной полости, вирусное инфекционное заболевание, острый респираторный дистресс-синдром (ARDS), болезнь трансплантат-против-хозяина (GVHD), отторжение трансплантата, гематологическое злокачественное заболевание (лимфома, лейкоз) и другие злокачественные опухоли. Из этих заболеваний предпочтительными являются псориаз, болезнь трансплантат-против-хозяина, рассеянный склероз, воспалительное заболевание кишечника, системная красная волчанка и ревматоидный артрит, и более предпочтительным является ревматоидный артрит или рассеянный склероз.
[0156]
Когда соединение по настоящему изобретению или его соль используют в качестве фармацевтического средства, фармацевтический носитель при необходимости можно смешать с соединением, и можно получить различные лекарственные формы в зависимости от профилактических или лечебных целей. Лекарственная форма, которая может быть получена, может представлять собой любую из форм, таких как пероральное средство, препарат для инъекции, суппозиторий, мазь, средство для ингаляции, пластырь и т.п. Поскольку соединение по настоящему изобретению или его соль обладает отличной всасываемостью при пероральном введении, пероральное средство является предпочтительным. Эти лекарственные формы можно получить традиционными методами формулирования, которые известны специалистам в данной области.
[0157]
В качестве таких фармацевтических носителей используют различные типы органических или неорганических веществ-носителей, которые традиционно используют для получения прапаратов. Такой носитель смешивают в качестве эксципиента, связующего, разрыхлителя или смазывающего вещества в твердый препарат, а также смешивают в качестве растворителя, солюбилизирующего вещества, суспендирующего вещества, агента тоничности, буфера, успокаивающего средства и т.п. в жидкий препарат. Кроме того, при необходимости также можно использовать добавки для получения препаратов, такие как антисептик, антиоксидант, краситель, подсластитель или стабилизатор.
[0158]
При получении твердого препарата для перорального применения, эксципиент и, при необходимости, эксципиент, связующее, разрыхлитель, смазывающее вещество, краситель, отдушку и т.п. добавляют к соединению по настоящему изобретению, и затем обычным способом можно получить таблетку, таблетку с покрытием, гранулу, порошкообразное средство, капсулу и т.п.
[0159]
При получении препарата для инъекций, агент регулирования pH, буфер, стабилизатор, агент тоничности, местный анестетик и т.п. добавляют к соединению по настоящему изобретению, и затем обычным способом можно получить препарат для подкожной, внутримышечной и внутривенной инъекции.
[0160]
Количество соединения по настоящему изобретению для смешивания в каждую из указанных выше стандартных лекарственных форм не является постоянным, и оно зависит от симптомов пациента, для которого должно применяться соединение, или лекарственной формы или т.п. Как правило, соединение по настоящему изобретению желательно использовать при дозе приблизительно от 0,05 до 1000 мг на стандартную лекарственную форму в случае перорального средства, и при дозе приблизительно от 0,0 от 1 до 500 мг в случае инъекции, и при дозе приблизительно от 1 до 1,000 мг в случае суппозитория.
[0161]
Применяемая доза лекарственного средства, имеющего указанную выше лекарственную форму, варьируется в зависимости от симптомов, массы тела, возраста, пола и т.п. пациента, и она не может быть безоговорочно определена. Соединение по настоящему изобретению, как правило, можно применять при дозе приблизительно от 0,05 до 5000 мг, и предпочтительно от 0,1 до 1000 мг, на взрослого пациента (масса тела: 50 кг) в день. Эту дозу предпочтительно вводят пациенту раз в сутки или в виде дробных 2 или 3 доз.
[Примеры]
[0162]
Далее настоящее изобретение будет описано подробно в следующих примерах. Однако эти примеры не предназначены для ограничения объема настоящего изобретения. Различные типы реагентов, используемых в примерах, являются коммерчески доступными продуктами, если не указано иное. Для хроматографии на силикагеле использовали Biotage SNAP Cartridge Ultra от компании Biotage, и для хроматографии на оснóвном силикагеле использовали Biotage SNAP Cartridge KP-NH от компании Biotage.
Для препаративной тонкослойной хроматографии использовали Kieselgel TM60F254, Art. 5744 от компании Merck или NH2 Silica Gel 60F254 Plate Wako от компании Wako Pure Chemical Industries, Ltd.
Для 1H-ЯМР использовали AL400 (400 МГц) от компании JEOL, Mercury (400 МГц) от компании Varian или Inova (400 МГц) от компании Varian, и измерение осуществляли с использованием тетраметилсилана в качестве стандарта. Кроме того, для масс-спектрометрического анализа использовали Micromass ZQ или SQD от компании Waters, и измерение осуществляли в соответствии с методом электрораспылительной ионизации (ESI) или методом химической ионизации при атмосферном давлении (APCI). Реакции в условиях микроволнового облучения осуществляли с использованием Initiator от компании Biotage.
Аббревиатуры имеют следующие значения.
[0163]
Ссылочный Пример 1
Ссылочный Пример 1(1a) 5-((трет-Бутоксикарбонил)амино)циклогекс-1-ен-1-ил трифторметансульфонат
Ссылочный Пример 1(1b) 3-((трет-Бутоксикарбонил)амино)циклогекс-1-ен-1-ил трифторметансульфонат
Трет-Бутил (3-оксоциклогексил)карбамат (5,0 г) и N-фенил-бис(трифторметансульфонимид) (11,0 г) растворяли в ТГФ (100 мл) и полученный раствор затем охлаждали до -78°C. Затем к реакционному раствору добавляли раствор 2,0 M диизопропиламида лития в ТГФ (26,0 мл), температуру смешанного раствора повышали до 0°C и смешанный раствор затем перемешивали в течение 30 минут. Затем к реакционной смеси добавляли 0,5 M водный раствор гидросульфата калия для разбавления и полученный раствор затем экстрагировали этилацетатом. Собранный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат) с получением каждого из соединения Ссылочного Примера 1(1a) (4,39 г, выход: 54%) и соединения Ссылочного Примера 1(1b) (2,00 г, выход: 25%).
Ссылочный Пример 1(1a): 1H ЯМР(CDCl3) δ: 5,84- 5,74 (м, 1H), 4,74-4,46 (м, 1H), 4,06-3,85 (м, 1H), 2,77-2,63 (м, 1H), 2,38-2,18 (м, 3H), 1,90-1,80 (м, 1H), 1,66-1,53 (м, 1H), 1,45 (с, 9H)
ESI-MS m/z 346(MH+)
Ссылочный Пример 1(1b): 1H ЯМР(CDCl3) δ: 5,79-5,72 (м, 1H), 4,70-4,50 (м, 1H), 4,47-4,33 (м, 1H), 2,40-2,25 (м, 2H), 1,94-1,67 (м, 3H), 1,56-1,49 (м, 1H), 1,45 (с, 9H)
ESI-MS m/z 346(MH+)
[0164]
Ссылочный Пример 1(2a) трет-Бутил (3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)циклогекс-3-ен-1-ил)карбамат
DMF (90 мл) добавляли к соединению Ссылочного Примера 1(1a) (9,25 г), 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолану) (10,2 г) и ацетату калия (3,95 г), с последующим замещением азотом. Затем к смеси добавляли PdCl2(dppf)CH2Cl2 (980 мг) и полученную смесь затем перемешивали при 80°C в течение 14 часов. Затем реакционную смесь охлаждали до комнатной температуры и затем к смеси добавляли этилацетат и воду. Затем полученную смесь фильтровали через Целит. Фильтрат экстрагировали этилацетатом и затем собранный органический слой промывали водой и затем насыщенным солевым раствором. Полученное вещество сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат) с получением представляющего интерес продукта (6,51 г, выход: 75%).
1H ЯМР(CDCl3) δ: 6,56-6,51 (м, 1H), 4,58-4,41 (м, 1H), 3,80-3,62 (м, 1H),2,58-2,41 (м, 1H), 2,31-2,13 (м, 2H), 1,98-1,77 (м, 2H), 1,54-1,47 (м, 1H), 1,44 (с, 9H), 1,25 (с, 12H)
ESI-MS m/z 324(MH+)
[0165]
Ссылочный Пример 1(2b) трет-Бутил (3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)циклогекс-2-ен-1-ил)карбамат
Представляющий интерес продукт получали в соответствии со Ссылочным Примером 1(2a), за исключением того, что использовали соединение Ссылочного Примера 1(1b) вместо соединения Ссылочного Примера 1(1a).
1H ЯМР(CDCl3) δ: 6,40-6,32 (м, 1H), 4,53 (д, J=7,3 Гц, 1H), 4,27-4,14 (м, 1H), 2,11-2,02 (м, 2H), 1,97-1,83 (м, 1H), 1,68-1,52 (м, 2H), 1,49-1,44 (м, 1H), 1,44 (с, 9H), 1,26 (с, 12H)
ESI-MS m/z 324(MH+)
[0166]
Ссылочный Пример 2
Ссылочный Пример 2(1a) 4-((трет-Бутоксикарбонил)амино)циклопент-1-ен-1-ил трифторметансульфонат
Ссылочный Пример 2(1b) 3-((трет-Бутоксикарбонил)амино)циклопент-1-ен-1-ил трифторметансульфонат
В атмосфере азота, ТГФ раствор (114 мл) 1,0 M гексаметилдисилазида лития добавляли к ТГФ (100 мл) и полученную смесь затем охлаждали до -78°C. К реакционному раствору добавляли раствор трет-бутил (3-оксоциклопентил)карбамата (9,0 г) в ТГФ (100 мл) в течение 10 минут. Затем к смеси добавляли N-фенил-бис(трифторметансульфонимид) (19,4 г) и температуру полученной смеси затем повышали до 0°C, с последующим перемешиванием в течение 10 минут. Затем к реакционной смеси добавляли воду, толуол и 5 M водный раствор гидроксида натрия и полученную смесь затем перемешивали при комнатной температуре в течение 30 минут. Затем реакционную смесь экстрагировали толуолом. Собранный органический слой последовательно промывали 0,5 M водным раствором гидросульфата калия, насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором и сушили над безводным сульфатом натрия, с последующим концентрированием под вакуумом. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат) с получением каждого из соединения Ссылочного Примера 2(1a) (8,61 г, выход: 58%) и соединения Ссылочного Примера 2(1b) (4,31 г, выход: 29%).
Ссылочный Пример 2(1a): 1H ЯМР(CDCl3) δ: 5,62-5,56 (м, 1H), 4,87-4,67 (м, 1H), 4,49-4,23 (м, 1H), 3,07-2,76 (м, 2H), 2,50-2,40 (м, 1H), 2,32-2,20 (м, 1H), 1,45 (с, 9H)
ESI-MS m/z 332(MH+)
Ссылочный Пример 2(1b): 1H ЯМР(CDCl3) δ: 5,68-5,61 (м, 1H), 4,89-4,70 (м, 1H), 4,69-4,48 (м, 1H), 2,75-2,43 (м, 3H), 1,84-1,66 (м, 1H), 1,45 (с, 9H)
ESI-MS m/z 332(MH+)
[0167]
Ссылочный Пример 2(2a) трет-Бутил (3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)циклопент-3-ен-1-ил)карбамат
Представляющий интерес продукт получали в соответствии со Ссылочным Примером 1(2a), за исключением того, что использовали соединение Ссылочного Примера 2(1a) вместо соединения Ссылочного Примера 1(1a).
1H ЯМР(CDCl3) δ: 6,50-6,45 (м, 1H), 4,76-4,58 (м, 1H), 4,37-4,19 (м, 1H),2,86-2,70 (м, 2H), 2,37-2,22 (м, 2H), 1,43 (с, 9H), 1,27 (с, 12H)
ESI-MS m/z 310(MH+)
[0168]
Ссылочный Пример 2(2b) трет-Бутил (3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)циклопент-2-ен-1-ил)карбамат
Представляющий интерес продукт получали в соответствии со Ссылочным Примером 1(2a), за исключением того, что использовали соединение Ссылочного Примера 2(1b) вместо соединения Ссылочного Примера 1(1a).
1H ЯМР(CDCl3) δ: 6,42-6,32 (м, 1H), 4,84-4,69 (м, 1H), 4,58-4,39 (м, 1H),2,58-2,46 (м, 1H), 2,44-2,25 (м, 2H), 1,55-1,47 (м, 1H), 1,44 (с, 9H), 1,27 (с, 12H)
ESI-MS m/z 310(MH+)
[0169]
Ссылочный Пример 3
Ссылочный Пример 3(1) трет-Бутил ((1S,3R)-3-гидроксициклогексил)карбамат
(1R,3S)-3-Аминоциклогексанол (13,7 г) растворяли в 2-метилтетрагидрофуране (140 мл) и затем к полученному раствору добавляли насыщенный водный раствор гидрокарбоната натрия (70 мл). Затем к реакционной смеси добавляли ди-трет-бутилдикарбонат (27,5 г) при 0°C и полученную смесь затем перемешивали при комнатной температуре в течение 16 часов. Затем к реакционной смеси добавляли воду для разбавления и полученную смесь затем экстрагировали 2-метилтетрагидрофураном. Собранный органический слой промывали насыщенным водным раствором хлорида аммония, насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором и сушили над безводным сульфатом натрия, с последующим концентрированием под вакуумом. Полученное твердое вещество промывали гептаном с получением представляющего интерес продукта (22,7 г, выход: 89%).
1H ЯМР(CDCl3) δ: 4,82-4,58 (м, 1H), 3,82-3,66 (м, 1H), 3,63-3,40 (м, 1H),2,25-2,11 (м, 1H), 1,93-1,74 (м, 3H), 1,62-1,55 (м, 1H), 1,44 (с, 9H), 1,39-1,04 (м, 4H)
ESI-MS m/z 216(MH+)
[0170]
Ссылочный Пример 3(2) (S)-трет-Бутил (3-оксоциклогексил)карбамат
Соединение Ссылочного Примера 3(1) (21,5 г) растворяли в этилацетате (200 мл) и затем 1-метил-2-азаадамантан N-оксил (166 мг), 5 M водный раствор бромида натрия (6 мл) и насыщенный водный раствор гидрокарбоната натрия (100 мл) последовательно добавляли к полученному выше раствору. Затем к смешанному раствору добавляли 10% водный раствор гипохлорита натрия (100 мл) при 0°C и полученную смесь затем перемешивали в течение 1 часа. Затем к реакционной смеси добавляли 10% водный раствор гидросульфита натрия при 0°C и полученную смесь разбавляли 10% водным раствором карбоната калия и затем экстрагировали этилацетатом. Собранный органический слой промывали раствором 1 M хлористоводородной кислоты, насыщенным водным раствором гидрокарбоната натрия, водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия, с последующим концентрированием под вакуумом. Полученное твердое вещество промывали диизопропиловым эфиром-гептаном с получением представляющего интерес продукта (19,4 г, выход: 91%).
1H ЯМР(CDCl3) δ: 4,67-4,35 (м, 1H), 4,05-3,77 (м, 1H), 2,76-2,64 (м, 1H),2,43-2,19 (м, 3H), 2,14-1,92 (м, 2H), 1,79-1,64 (м, 2H), 1,44 (с, 9H)
ESI-MS m/z 214(MH+)
[0171]
Ссылочный Пример 3(3) (S)-5-((трет-Бутоксикарбонил)амино)циклогекс-1-ен-1-ил трифторметансульфонат
Раствор соединения Ссылочного Примера 3(2) (32,3 г) в ТГФ (160 мл) добавляли по каплям к раствору бис(триметилсилил)амида натрия (60,5 г) в ТГФ (780 мл), охлажденному до -78°C, и реакционную смесь затем перемешивали в течение 30 минут. К реакционной смеси добавляли N-фенил-бис(трифторметансульфонимид) (64,3 г) при -78°C и полученную смесь затем перемешивали в течение 30 минут. Затем температуру реакционной смеси повышали до 0°C и смесь снова перемешивали в течение 2 часов. Затем к реакционной смеси добавляли воду и 1 M водный раствор гидроксида натрия, температуру полученной смеси затем повышали до комнатной температуры и смесь затем экстрагировали толуолом. Собранный органический слой промывали 1 M водным раствором гидросульфата калия, насыщенным водным раствором гидрокарбоната натрия, водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия, с последующим концентрированием под вакуумом. К полученному остатку добавляли гептан и осажденное твердое вещество собирали фильтрованием и затем промывали гептаном с получением представляющего интерес продукта (41,6 г, выход: 79%).
1H ЯМР(CDCl3) δ: 5,84-5,74 (м, 1H), 4,74-4,46 (м, 1H), 4,06-3,85 (м, 1H),2,77-2,63 (м, 1H), 2,38-2,18 (м, 3H), 1,90-1,80 (м, 1H), 1,66-1,53 (м, 1H), 1,45 (с, 9H)
ESI-MS m/z 346(MH+)
[0172]
Ссылочный Пример 3(4) (S)-трет-Бутил (3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)циклогекс-3-ен-1-ил)карбамат
К толуольному (450 мл) раствору соединения Ссылочного Примера 3(3) (32,8 г) последовательно добавляли бис(пинаколато)дибор (26,5 г), ацетат калия (28,0 г), трифенилфосфин (2,49 г) и PdCl2(PPh3)2 (3,33 г). Температуру полученной смеси повышали до 60°C и смесь затем перемешивали в атмосфере азота в течение 4 часов. Затем реакционную смесь охлаждали до комнатной температуры, затем к смеси добавляли толуол и после этого полученную смесь фильтровали через Целит. Фильтрат промывали 1 M водным раствором гидроксида натрия, раствором 1 M хлористоводородной кислоты, насыщенным водным раствором гидрокарбоната натрия, водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия, с последующим концентрированием под вакуумом. К полученному остатку добавляли этилацетат-гептан и активированный уголь и полученную смесь оставляли на 1 час и затем фильтровали через Целит. Фильтрат концентрировали при пониженном давлении и затем к полученному остатку добавляли циклогексан-гептан. Осажденное твердое вещество собирали фильтрованием и затем промывали смесью циклогексан-гептан с получением представляющего интерес продукта (21,3 г, выход: 69%).
1H ЯМР(CDCl3) δ: 6,56-6,51 (м, 1H), 4,58-4,41 (м, 1H), 3,80-3,62 (м, 1H),2,58-2,41 (м, 1H), 2,31-2,13 (м, 2H), 1,98-1,77 (м, 2H), 1,54-1,47 (м, 1H), 1,44 (с, 9H), 1,25 (с, 12H)
ESI-MS m/z 324(MH+)
[0173]
Таблица 1
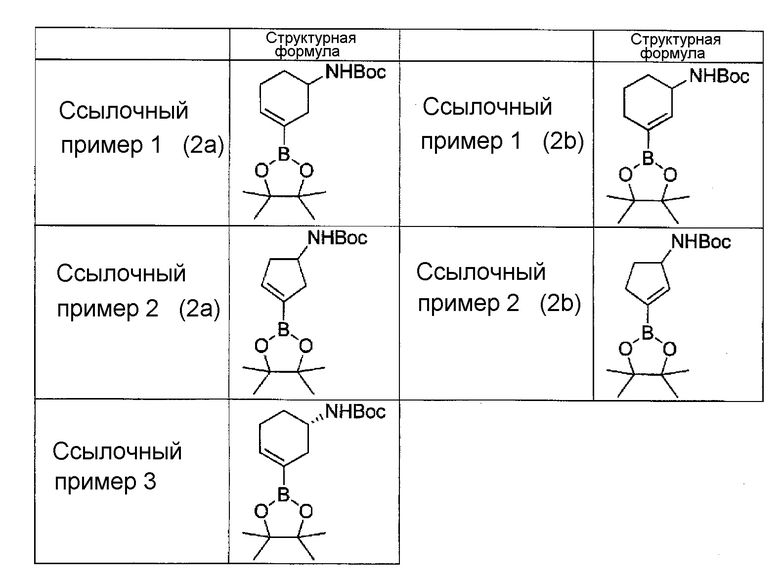
[0174]
Пример 1
Пример 1(1) трет-Бутил (3-(3-иод-1-тозил-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)карбамат (Соединение 1(1))
К 4-бром-1H-пирроло[2,3-b]пиридину (2,00 г) добавляли соединение Ссылочного Примера 1(2a) (4,60 г) и трикалий фосфат (5,41 г), 1,4-диоксан (20 мл) и воду (3,3 мл), с последующим замещением азотом, и затем к реакционной смеси добавляли PdCl2(dppf)CH2Cl2 (746 мг). Полученную смесь перемешивали при 100°C в течение 5 часов. Затем реакционную смесь охлаждали до комнатной температуры и затем к смеси добавляли этилацетат и воду. Затем полученную смесь фильтровали через Целит. Фильтрат затем экстрагировали этилацетатом и собранный органический слой затем промывали водой и затем насыщенным солевым раствором. Полученное вещество сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (хлороформ:метанол) с получением соответствующего продукта сочетания. Полученный продукт сочетания подвергали последующему взаимодействию без дополнительной очистки.
DMF (30 мл) добавляли к полученному продукту сочетания и полученную смесь затем охлаждали до 0°C. Затем к смеси добавляли N-иодсукцинимид (2,52 г) и полученную смесь затем перемешивали при 0°C в течение 30 минут. Затем к реакционной смеси добавляли 0,5 M водный раствор гидросульфита натрия и полученную смесь затем экстрагировали этилацетатом. Собранный органический слой промывали водой и затем насыщенным солевым раствором. Полученное вещество сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (хлороформ:метанол) с получением соответствующего иод-содержащего продукта. Полученный иод-содержащий продукт подвергали последующему взаимодействию без дополнительной очистки.
DMF (30 мл) добавляли к полученному иод-содержащему продукту и полученную смесь затем охлаждали до 0°C. Затем к реакционной смеси добавляли 60% гидрид натрия (1,02 г) и затем пара-толуолсульфонилхлорид (2,33 г) и полученную смесь затем перемешивали при 0°C в течение 30 минут. Затем к реакционной смеси добавляли ледяную воду и водный слой затем экстрагировали этилацетатом. Собранный органический слой промывали водой и затем насыщенным солевым раствором. Полученное вещество сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат) с получением представляющего интерес продукта (3,49 г, выход: 58%).
1H ЯМР(CDCl3) δ: 8,35 (д, J=4,9 Гц, 1H), 8,10 (д, J=8,5 Гц, 2H), 7,89 (с, 1H), 7,30 (д, J=8,5 Гц, 2H), 6,94 (д, J=4,9 Гц, 1H), 5,72-5,67 (м, 1H), 4,75-4,59(м, 1H), 4,11-3,97 (м, 1H), 2,70-2,60 (м, 1H), 2,40-2,32 (м, 2H), 2,39 (с, 3H), 2,22-2,09 (м, 1H), 2,04-1,94 (м, 1H), 1,75-1,62 (м, 1H), 1,44 (с, 9H)
ESI-MS m/z 594(MH+)
[0175]
Пример 1(2) N-(3-(3-Фенил-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 1)
К соединению 1(1) (100 мг), фенилбороновой кислоте (31,0 мг) и трикалий фосфату (89,2 мг) добавляли 1,4-диоксан (1,8 мл) и воду (0,3 мл), с последующим замещением азотом. Затем к реакционной смеси добавляли PdCl2(dppf)CH2Cl2 (12,3 мг) и полученную смесь затем перемешивали при 100°C в течение 2 часов. Затем реакционную смесь охлаждали до комнатной температуры и к смеси добавляли этилацетат и воду. Затем полученную смесь фильтровали через Целит. Фильтрат экстрагировали этилацетатом и собранный органический слой промывали водой и затем насыщенным солевым раствором. Полученное вещество сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении.
К полученному остатку добавляли ТГФ (1,0 мл) и раствор 1,0 M тетрабутиламмонийфторида в ТГФ (1,0 мл) и полученную смесь затем перемешивали при комнатной температуре в течение 4 часов. Затем реакционную смесь концентрировали при пониженном давлении и очищали хроматографией на силикагеле (хлороформ:метанол) с получением соответствующего продукта сочетания. Полученный продукт сочетания подвергали последующему взаимодействию без дополнительной очистки.
К полученному продукту сочетания добавляли метанол (1 мл) и раствор 4 M хлористоводородной кислоты в 1,4-диоксане (1 мл) и полученную смесь затем перемешивали при комнатной температуре в течение 30 минут. Затем реакционную смесь концентрировали при пониженном давлении. В атмосфере азота к реакционной смеси добавляли дихлорметан (2 мл) и диизопропилэтиламин (0,2 мл) и полученную смесь затем охлаждали до 0°C. Затем к реакционной смеси добавляли акрилоилхлорид (0,02 мл) и полученную смесь перемешивали в течение 30 минут. Затем к реакционной смеси добавляли последовательно водный раствор аммиака, хлороформ и метанол и полученную смесь перемешивали при комнатной температуре в течение 1 часа. Затем реакционную смесь экстрагировали хлороформом и собранный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (хлороформ:метанол) с получением указанного в заголовке соединения (38,1 мг, выход: 66%).
1H ЯМР(CDCl3-CD3OD) δ: 8,19 (д, J=5,1 Гц, 1H), 7,46-7,23 (м, 6H), 6,93 (д, J=5,1 Гц, 1H), 6,30-6,20 (м, 1H), 6,11 (дд, J=10,2, 16,8 Гц, 1H), 5,69-5,58 (м, 1H), 5,54-5,41 (м, 1H), 4,14-3,92 (м, 1H), 2,60-2,45 (м, 1H), 2,12-1,98 (м, 1H), 1,96-1,66 (м, 3H), 1,49-1,31 (м, 1H)
ESI-MS m/z 344(MH+)
[0176]
Пример 2 N-(3-(3-(Пиридин-4-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 2)
Указанное в заголовке соединение получали в соответствии с Примером 1(2), за исключением того, что использовали 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин вместо фенилбороновой кислоты.
1H ЯМР(CDCl3-CD3OD) δ: 8,60-8,41 (м, 2H), 8,34-8,16 (м, 1H), 7,57-7,42 (м, 1H), 7,38-7,27 (м, 2H), 7,06-6,94 (м, 1H), 6,36-6,08 (м, 2H), 5,72-5,58 (м, 1H), 5,55-5,36 (м, 1H), 4,22-4,00 (м, 1H), 2,78-2,60 (м, 1H), 2,22-1,75 (м, 4H), 1,58-1,37 (м, 1H)
ESI-MS m/z 345(MH+)
[0177]
Пример 3 N-(3-(3-(1H-Пиразол-4-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 3)
Указанное в заголовке соединение получали в соответствии с Примером 1(2), за исключением того, что использовали трет-бутил 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразол-1-карбоксилат вместо фенилбороновой кислоты.
1H ЯМР(DMSO-d6) δ: 12,73 (шир.с, 1H), 11,74 (д, J=1,8 Гц, 1H), 8,16 (д, J=4,8 Гц, 1H), 7,97 (д, J=7,3 Гц, 1H), 7,62 (шир.с, 1H), 7,46-7,42 (м, 2H), 6,86 (д, J=4,8 Гц, 1H), 6,23 (дд, J=10,2, 17,2 Гц, 1H), 6,06 (дд, J=2,4, 17,2 Гц, 1H), 5,56 (дд, J=2,4, 10,2 Гц, 1H), 5,40 (шир.с, 1H), 3,91-3,77 (м, 1H), 2,42 (дд,J=4,6, 16,7 Гц, 1H), 2,22-1,94 (м, 3H), 1,84-1,72 (м, 1H), 1,50-1,35 (м, 1H)
ESI-MS m/z 334(MH+)
[0178]
Пример 4 N-(3-(3-(Пиридин-3-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 4)
Указанное в заголовке соединение получали в соответствии с Примером 1(2), за исключением того, что использовали пиридин-3-илбороновую кислоту вместо фенилбороновой кислоты.
1H ЯМР(DMSO-d6) δ: 12,06 (шир.с, 1H), 8,52 (д, J=1,8 Гц, 1H), 8,46 (дд, J=1,8,4,8 Гц, 1H), 8,24 (д, J=4,8 Гц, 1H), 8,01 (д, J=7,3 Гц, 1H), 7,71-7,66 (м, 2H), 7,37 (дд, J=4,8, 7,3 Гц, 1H), 6,96 (д, J=4,8 Гц, 1H), 6,24 (дд, J=10,1, 17,0 Гц, 1H), 6,08 (дд, J=2,4, 17,0 Гц, 1H), 5,57 (дд, J=3,7, 10,1 Гц, 1H), 5,18 (шир.с, 1H), 3,89-3,76 (м, 1H), 2,58-2,53 (м, 1H), 2,21 (ддд, J=2,6, 9,2, 16,9 Гц, 1H), 1,80-1,65 (м, 3H), 1,44-1,28 (м, 1H)
ESI-MS m/z 345(MH+)
[0179]
Пример 5 N-(3-(3-(6-(Гидроксиметил)пиридин-3-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 5)
Указанное в заголовке соединение получали в соответствии с Примером 1(2), за исключением того, что использовали (6-(гидроксиметил)пиридин-3-ил)бороновую кислоту вместо фенилбороновой кислоты.
1H ЯМР(CDCl3) δ: 8,49 (с, 1H), 8,28 (д, J=4,8 Гц, 1H), 7,70 (дд, J=2,2, 7,7 Гц,1H), 7,46 (д, J=7,7 Гц, 1H), 7,39 (с, 1H), 6,92 (д, J=4,8 Гц, 1H), 6,27 (дд, J=1,6, 16,9 Гц, 1H), 6,09 (дд, J=10,3, 16,9 Гц, 1H), 5,93-5,83 (м, 1H), 5,62 (дд, J=1,6, 10,3 Гц, 1H), 5,58 (шир.с, 1H), 4,87-4,78 (м, 2H), 3,80-3,69 (м, 2H), 2,32 (дд, J=3,7, 16,9 Гц, 1H), 2,21-2,08 (м, 1H), 2,03-1,75 (м, 4H)
ESI-MS m/z 375(MH+)
[0180]
Пример 6 N-(3-(3-(2-Метоксипиридин-3-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 6)
Указанное в заголовке соединение получали в соответствии с Примером 1(2), за исключением того, что использовали (2-метоксипиридин-3-ил)бороновую кислоту вместо фенилбороновой кислоты.
1H ЯМР(DMSO-d6) δ: 11,83 (д, J=2,2 Гц, 1H), 8,18 (д, J=5,1 Гц, 1H), 8,11 (дд, J=1,8, 4,8 Гц, 1H), 8,06 (д, J=7,7 Гц, 1H), 7,60 (дд, J=1,8, 7,0 Гц, 1H), 7,45 (д, J=2,2 Гц, 1H), 7,01 (дд, J=5,1, 7,0 Гц, 1H), 6,90 (д, J=5,1 Гц, 1H), 6,24 (дд,J=10,3, 17,2 Гц, 1H), 6,09 (дд, J=2,6, 17,2 Гц, 1H), 5,58 (дд, J=2,6, 10,3 Гц, 1H), 5,08 (шир.с, 1H), 3,76 (с, 3H), 2,55-2,48 (м, 1H), 2,31-2,14 (м, 1H), 1,72-1,44 (м, 3H), 1,39-1,14 (м, 1H)
ESI-MS m/z 375(MH+)
[0181]
Пример 7 N-(3-(3-(4-Метоксипиридин-3-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 7)
Указанное в заголовке соединение получали в соответствии с Примером 1(2), за исключением того, что использовали 4-метокси-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин вместо фенилбороновой кислоты.
1H ЯМР(DMSO-d6) δ: 11,86 (д, J=2,2 Гц, 1H), 8,41 (д, J=5,5 Гц, 1H), 8,29 (с, 1H), 8,18 (д, J=5,1 Гц, 1H), 8,07 (д, J=7,7 Гц, 1H), 7,46 (д, J=2,2 Гц, 1H), 7,04 (д, J=5,5 Гц, 1H), 6,90 (д, J=5,1 Гц, 1H), 6,24 (дд, J=9,9, 16,9 Гц, 1H), 6,09 (дд, J=2,2, 16,9 Гц, 1H), 5,58 (дд, J=2,2, 9,9 Гц, 1H), 5,08 (шир.с, 1H), 3,75 (с, 3H), 2,55-2,48 (м, 1H), 2,29-2,16 (м, 1H), 1,71-1,48 (м, 3H), 1,36-1,17 (м, 1H)
ESI-MS m/z 375(MH+)
[0182]
Пример 8 N-(3-(3-(2-Гидроксипиридин-3-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 8)
Указанное в заголовке соединение получали в соответствии с Примером 1(2), за исключением того, что использовали (2-гидроксипиридин-3-ил)бороновую кислоту вместо фенилбороновой кислоты.
1H ЯМР(DMSO-d6) δ: 11,74 (д, J=2,2 Гц, 1H), 11,47 (шир.с, 1H), 8,16 (д, J=5,1 Гц, 1H), 8,06 (д, J=7,3 Гц, 1H), 7,50 (д, J=2,2 Гц, 1H), 7,31 (д, J=6,6 Гц, 2H),6,88 (д, J=5,1 Гц, 1H), 6,30 (дд, J=9,9, 17,6 Гц, 1H), 6,21 (т, J=6,6 Гц, 1H), 6,09 (дд, J=2,2, 17,6 Гц, 1H), 5,57 (дд, J=2,2, 9,9 Гц, 1H), 5,30 (шир.с, 1H), 3,93 (шир.с, 1H), 2,70-2,56 (м, 1H), 2,38-2,24 (м, 1H), 1,96-1,68 (м, 3H), 1,52-1,33 (м, 1H)
ESI-MS m/z 361(MH+)
[0183]
Пример 9 N-(3-(3-(5-Формилфуран-2-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 9)
Указанное в заголовке соединение получали в соответствии с Примером 1(2), за исключением того, что использовали (5-формилфуран-2-ил)бороновую кислоту вместо фенилбороновой кислоты.
1H ЯМР(CDCl3) δ: 10,96 (шир.с, 1H), 9,55 (с, 1H), 8,33 (д, J=5,1 Гц, 1H), 7,73(с, 1H), 7,36 (д, J=3,7 Гц, 1H), 7,02 (д, J=5,1 Гц, 1H), 6,59 (д, J=3,7 Гц, 1H), 6,36-6,14 (м, 3H), 5,64 (дд, J=1,8, 9,9 Гц, 1H), 5,59 (шир.с, 1H), 4,40 (шир.с, 1H), 2,85-2,76 (м, 1H), 2,53-2,38 (м, 1H), 2,30-2,14 (м, 1H), 2,10-1,99 (м, 1H), 1,97-1,85 (м, 1H), 1,62-1,40 (м, 1H)
ESI-MS m/z 362(MH+)
[0184]
Пример 10 N-(3-(3-(5-(Гидроксиметил) фуран-2-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 10)
Метанол (1 мл) добавляли к соединению 9 (15 мг) и полученную смесь затем охлаждали до 0°C. Затем к реакционной смеси добавляли борогидрид натрия (2 мг) и полученную смесь затем перемешивали в течение 5 минут. Затем к реакционной смеси добавляли насыщенный солевой раствор и полученную смесь затем экстрагировали хлороформом. Экстракт сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (метанол:хлороформ) с получением указанного в заголовке соединения (13 мг, выход: 87%).
1H ЯМР(CDCl3) δ: 10,19 (шир.с, 1H), 8,28-8,22 (м, 1H), 7,52-7,35 (м, 1H), 6,90-6,86 (м, 1H), 6,37 (т, J=2,9 Гц, 1H), 6,32-6,21 (м, 2H), 6,09-6,01 (м, 1H), 5,75 (шир.с, 2H), 5,70-5,55 (м, 1H), 4,68-4,66 (м, 2H), 4,22-4,11 (м, 1H), 2,52-2,44 (м, 1H), 2,30-2,24 (м, 1H), 2,06-1,80 (м, 3H), 1,53-1,43 (м, 1H)
ESI-MS m/z 364(MH+)
[0185]
Пример 11 N-(3-(3-(5-(Гидроксиметил)пиридин-3-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 11)
Соединение получали в соответствии с Примером 1(2), за исключением того, что использовали (5-формилпиридин-3-ил)бороновую кислоту вместо фенилбороновой кислоты. Затем указанное в заголовке соединение получали в соответствии с Примером 10, за исключением того, что использовали полученное выше соединение вместо соединения 9.
1H ЯМР(DMSO-d6) δ: 12,03 (с, 1H), 8,40 (д, J=2,2 Гц, 1H), 8,38 (д, J=2,2 Гц, 1H), 8,22 (д, J=5,1 Гц, 1H), 8,01 (д, J=7,3 Гц, 1H), 7,65 (д, J=2,6 Гц, 1H), 7,59 (т, J=2,0 Гц, 1H), 6,94 (д, J=5,1 Гц, 1H), 6,21 (дд, J=9,9, 16,9 Гц, 1H), 6,06(дд, J=2,2, 16,9 Гц, 1H), 5,55 (дд, J=2,2, 9,9 Гц, 1H), 5,32 (т, J=5,5 Гц, 1H), 5,22 (шир.с, 1H), 4,58 (д, J=5,5 Гц, 2H), 3,85-3,68 (м, 1H), 2,46-2,40 (м, 1H), 2,16 (ддд, J=2,4, 9,3, 16,9 Гц, 1H), 1,82-1,63 (м, 3H), 1,40-1,26 (м, 1H)
ESI-MS m/z 375(MH+)
[0186]
Пример 12 N-(3-(3-(Фуран-2-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 12)
DMF (1,0 мл) добавляли к соединению 1(1) (100 мг) и трибутил(фуран-2-ил)станнану (90 мг), с последующим замещением азотом. Затем к реакционной смеси добавляли PdCl2(PPh3)2 (12,0 мг) и полученную смесь затем перемешивали в условиях нагревания при 100°C в течение 2 часов. Затем к реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и этилацетат и полученную смесь перемешивали и затем фильтровали через Целит. Фильтрат экстрагировали этилацетатом и собранный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении.
Полученный остаток растворяли в ТГФ (1 мл), затем к полученному раствору добавляли раствор 1,0 M тетрабутиламмонийфторида в ТГФ (1 мл). Полученную смесь перемешивали при комнатной температуре в течение 5 часов. Затем к реакционной смеси добавляли 0,067 M фосфатный буферный раствор (pH 7,4) и полученную смесь затем экстрагировали этилацетатом. Собранный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат) с получением соответствующего продукта сочетания.
Полученный продукт сочетания подвергали последующему взаимодействию без дополнительной очистки.
К полученному продукту сочетания добавляли метанол (1 мл) и раствор 4 M хлористоводородной кислоты в 1,4-диоксане (1 мл) и полученную смесь затем перемешивали при комнатной температуре в течение 30 минут. Затем реакционную смесь концентрировали при пониженном давлении. В атмосфере азота к реакционной смеси добавляли дихлорметан (2 мл) и диизопропилэтиламин (0,2 мл) и полученную смесь затем охлаждали до 0°C. Затем к реакционной смеси добавляли акрилоилхлорид (0,02 мл) и полученную смесь перемешивали в течение 30 минут. Затем к реакционной смеси добавляли последовательно водный раствор аммиака, хлороформ и метанол и полученную смесь перемешивали при комнатной температуре в течение 1 часа. Затем реакционную смесь экстрагировали хлороформом и собранный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (хлороформ:метанол) с получением указанного в заголовке соединения (40,3 мг, выход: 72%).
1H ЯМР(CDCl3-CD3OD) δ: 8,23-8,15 (м, 1H), 7,54-7,42 (м, 2H), 6,99-6,88 (м, 1H), 6,49-6,42 (м, 1H), 6,39-6,22 (м, 2H), 6,22-6,05 (м, 1H), 5,69-5,56 (м, 2H), 4,35-4,15 (м, 1H), 2,74-2,59 (м, 1H), 2,16 (д, J=9,3 Гц, 3H), 1,96-1,81 (м, 1H), 1,69-1,52 (м, 1H)
ESI-MS m/z 334(MH+)
[0187]
Пример 13 N-(3-(3-(Тиазол-5-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 13)
Указанное в заголовке соединение получали в соответствии с Примером 12, за исключением того, что использовали 5-(трибутилстаннил)тиазол вместо трибутил(фуран-2-ил)станнана.
1H ЯМР(CDCl3-CD3OD) δ: 8,82 (с, 1H), 8,23 (д, J=5,1 Гц, 1H), 7,70 (с, 1H), 7,46(с, 1H), 6,97 (д, J=5,1 Гц, 1H), 6,28-6,12 (м, 2H), 5,68-5,62 (м, 1H), 5,56-5,49 (м, 1H), 4,20-4,05 (м, 1H), 2,71-2,58 (м, 1H), 2,14-1,78 (м, 3H), 1,52-1,38 (м, 1H), 1,35-1,19 (м, 1H)
ESI-MS m/z 351(MH+)
[0188]
Пример 14
Пример 14(1) трет-Бутил (3-(3-(4-формилфуран-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)карбамат (Соединение 14(1))
1,4-Диоксан (5,4 мл) и воду (0,9 мл) добавляли к соединению 1(1) (300 мг), (4-формилфуран-2-ил)бороновой кислоте (99 мг), трикалий фосфату (268 мг) и PdCl2(dppf)CH2Cl2 (37 мг) и полученную смесь затем перемешивали при 95°C в течение 7 часов. Затем к реакционной смеси добавляли воду и полученную смесь затем экстрагировали этилацетатом. Собранный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат) с получением представляющего интерес продукта (110 мг, выход: 39%).
ESI-MS m/z 562(MH+)
[0189]
Пример 14(2) N-(3-(3-(4-(Гидроксиметил) фуран-2-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 14)
ТГФ (0,5 мл), метанол (0,5 мл) и 2 M водный раствор гидроксида натрия (0,3 мл) добавляли к соединению 14(1) (50 мг) и полученную смесь затем перемешивали при комнатной температуре в течение 30 минут. Затем к реакционной смеси добавляли насыщенный водный раствор хлорида аммония и полученную смесь затем экстрагировали хлороформом. Экстракт сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении.
Полученный остаток растворяли в метаноле (1,5 мл) и полученный раствор затем охлаждали до 0°C. К реакционной смеси добавляли борогидрид натрия (4,6 мг) и полученную смесь затем перемешивали в течение 10 минут. Затем к реакционной смеси добавляли насыщенный солевой раствор и полученную смесь затем экстрагировали хлороформом. Экстракт сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (хлороформ:метанол) с получением соответствующего спиртового продукта. Полученный спиртовой продукт подвергали последующему взаимодействию без дополнительной очистки.
TFA (1 мл) добавляли дихлорметановому раствору (1 мл) полученного спиртового продукта и полученную смесь затем перемешивали при комнатной температуре в течение 40 минут. Затем реакционную смесь концентрировали при пониженном давлении. К полученному остатку добавляли дихлорметан (2 мл) и диизопропилэтиламин (0,2 мл) и полученную смесь затем охлаждали до 0°C. К реакционной смеси добавляли акрилоилхлорид (7 мкл) и полученную смесь затем перемешивали в течение 15 минут. Затем к реакционной смеси добавляли водный раствор аммиака и полученную смесь затем перемешивали при комнатной температуре в течение 1 часа. Затем реакционную смесь экстрагировали хлороформом и собранный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (хлороформ:метанол) с получением указанного в заголовке соединения (15 мг, выход: 48%).
1H ЯМР(DMSO-d6) δ: 10,70 (шир.с, 1H), 8,21 (д, J=4,8 Гц, 1H), 7,47 (с, 1H), 7,43 (с, 1H), 6,89 (д, J=4,8 Гц, 1H), 6,44 (с, 1H), 6,29-6,22 (м, 1H), 6,04 (дд,J=10,6, 16,5 Гц, 2H), 5,81 (шир.с, 1H), 5,64-5,59 (м, 1H), 4,57 (с, 2H), 4,21-4,05 (м, 1H), 2,44-2,22 (м, 2H), 2,17-1,79 (м, 4H)
ESI-MS m/z 364(MH+)
[0190]
Пример 15 N-(3-(3-(4-((Диметиламино)метил)фуран-2-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 15)
Дихлорэтан (3 мл) и раствор 2,0 M диметиламина в ТГФ (0,53 мл) добавляли к соединению 14(1) (100 мг) и полученную смесь затем перемешивали в течение 10 минут. Затем к реакционной смеси добавляли уксусную кислоту (0,06 мл) и триацетоксиборогидрид натрия (377 мг) и полученную смесь затем перемешивали в течение 20 минут. Затем к реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и полученную смесь экстрагировали хлороформом. Экстракт сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении.
Полученный остаток растворяли в ТГФ (1 мл) и затем к полученному выше раствору добавляли метанол (1 мл) и 2 M водный раствор гидроксида натрия (1 мл). Полученную смесь перемешивали при комнатной температуре в течение 30 минут. Затем к реакционной смеси добавляли насыщенный водный раствор хлорида аммония и полученную смесь экстрагировали хлороформом. Экстракт сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (хлороформ:метанол) с получением соответствующего продукта, защитная группа которого удалена. Полученный продукт, у которого была удалена защитная группа, подвергали последующему взаимодействию без дополнительной очистки.
Дихлорметан (3 мл) и TFA (1 мл) добавляли к полученному продукту, у которого была удалена защитная группа, и полученную смесь затем перемешивали при комнатной температуре в течение 30 минут. Затем реакционную смесь концентрировали при пониженном давлении. К полученному остатку добавляли ацетонитрил (1,5 мл), воду (1,5 мл) и диизопропилэтиламин (0,15 мл) и полученную смесь затем охлаждали до 0°C. К реакционной смеси добавляли акрилоилхлорид (25 мкл) и полученную смесь затем перемешивали в течение 30 минут. Затем к реакционной смеси добавляли водный раствор аммиака и полученную смесь затем перемешивали при комнатной температуре в течение 30 минут. Затем реакционную смесь экстрагировали хлороформом и собранный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (хлороформ:метанол) с получением указанного в заголовке соединения (4 мг, выход: 6%).
1H ЯМР(CDCl3) δ: 10,44 (шир.с, 1H), 8,29 (д, J=5,1 Гц, 1H), 7,49 (с, 1H), 7,39(с, 1H), 6,95 (д, J=5,1 Гц, 1H), 6,38 (с, 1H), 6,31 (дд, J=2,2, 16,9 Гц, 1H), 6,12 (дд, J=10,6, 16,9 Гц, 1H), 5,90 (шир.с, 1H), 5,67-5,62 (м, 2H), 4,44-4,28 (м, 1H), 3,34 (с, 2H), 2,79-2,64 (м, 1H), 2,30 (с, 6H), 2,25-2,04 (м, 3H), 1,95-1,62 (м, 2H)
ESI-MS m/z 391(MH+)
[0191]
Пример 16 N-(3-(3-(4-((Изопропиламино)метил)фуран-2-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 16)
Указанное в заголовке соединение получали в соответствии с Примером 15, за исключением того, что использовали изопропиламин вместо диметиламина.
1H ЯМР(CDCl3) δ: 10,72 (шир.с, 1H), 8,29 (д, J=5,1 Гц, 1H), 7,50 (с, 1H), 7,40(с, 1H), 7,27 (с, 1H), 6,93 (д, J=5,1 Гц, 1H), 6,38-6,25 (м, 2H), 6,12 (дд, J=10,3, 16,9 Гц, 1H), 6,01 (д, J=7,7 Гц, 1H), 5,68-5,54 (м, 1H), 4,45-4,21 (м, 1H), 3,75-3,60 (с, 2H), 2,96-2,88 (м, 1H), 2,76-2,60 (м, 1H), 2,26-2,01 (m,3H), 1,99-1,78 (м, 1H), 1,78-1,52 (м, 1H), 1,16-1,11 (д, 6H)
ESI-MS m/z 405(MH+)
[0192]
Пример 17
Пример 17(1) трет-Бутил (3-(3-иод-5-метокси-1-тозил-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)карбамат (Соединение 17(1))
Представляющий интерес продукт получали в виде бесцветного твердого вещества в соответствии с Примером 1(1), за исключением того, что использовали 4-хлор-5-метокси-1H-пирроло[2,3-b]пиридин вместо 4-бром-1H-пирроло[2,3-b]пиридина.
1H ЯМР(CDCl3) δ: 8,15-8,11 (м, 1H), 8,07 (д, J=8,3 Гц, 2H), 7,86-7,82 (м, 1H), 7,30 (д, J=8,3 Гц, 2H), 5,66-5,58 (м, 1H), 4,13-3,93(м, 1H), 3,92-3,87(м, 3H), 2,83-2,69 (м, 1H), 2,48-2,15 (м, 6H), 1,98-1,78 (м, 2H), 1,49-1,41 (м, 9H)
ESI-MS m/z 624(MH+)
[0193]
Пример 17(2) N-(3-(3-(Фуран-2-ил)-5-метокси-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 17)
Указанное в заголовке соединение получали в соответствии с Примером 12, за исключением того, что использовали соединение 17(1) вместо соединения 1(1).
1H ЯМР(CDCl3-CD3OD) δ: 8,04-7,96 (м, 1H), 7,54-7,38 (м, 2H), 6,49-6,37 (м, 1H), 6,36-6,09 (м, 3H), 5,72-5,57 (м, 1H), 5,53-5,36 (м, 1H), 4,43-4,22 (м, 1H), 3,98-3,81 (м, 3H), 2,72-1,62 (м, 6H)
ESI-MS m/z 364(MH+)
[0194]
Пример 18
Пример 18(1) 4-Хлор-5-(1-метил-1H-пиразол-4-ил)-1H-пирроло[2,3-b]пиридин (Соединение 18(1))
1,4-Диоксан (15 мл), 2 M водный раствор карбоната натрия (3 мл) и PdCl2(dppf)CH2Cl2 (122 мг) добавляли к 4-хлор-5-иод-1H-пирроло[2,3-b]пиридину (835 мг) и 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразолу (749 мг) и температуру полученной смеси затем повышали до 100°C, с последующим перемешиванием в течение 13 часов. Затем к реакционной смеси добавляли воду для разбавления и полученную смесь затем экстрагировали этилацетатом. Собранный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (хлороформ:метанол) с получением представляющего интерес продукта (573 мг, выход: 82%).
ESI-MS m/z 233(MH+)
[0195]
Пример 18(2) трет-Бутил (3-(3-иод-5-(1-метил-1H-пиразол-4-ил)-1-тозил-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)карбамат (Соединение 18(2))
Представляющий интерес продукт получали в соответствии с Примером 1(1), за исключением того, что использовали соединение 18(1) вместо 4-бром-1H-пирроло[2,3-b]пиридина.
ESI-MS m/z 674(MH+)
[0196]
Пример 18(3) N-(3-(3-(Фуран-2-ил)-5-(1-метил-1H-пиразол-4-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 18)
Указанное в заголовке соединение получали в соответствии с Примером 12, за исключением того, что использовали соединение 18(2) вместо соединения 1(1).
1H ЯМР(DMSO-d6) δ: 11,97 (шир.с, 1H), 8,32-8,22 (м, 1H), 8,00-7,83 (м, 2H), 7,68-7,57 (м, 3H), 6,49 (д, J=1,8 Гц, 1H), 6,34 (т, J=2,6 Гц, 1H), 6,21-6,08 (м, 1H), 6,06-5,97 (м, 1H), 5,52 (дд, J=2,6, 9,9 Гц, 1H), 5,44-5,32 (м, 1H), 3,96-3,69 (м, 4H), 2,29-1,98 (м, 2H), 1,96-1,65 (м, 3H), 1,33 (dq, J=5,3, 11,7 Гц, 1H)
ESI-MS m/z 414(MH+)
[0197]
Пример 19 N-(3-(5-(1-Метил-1H-пиразолo-4-ил)-3-(пиридин-3-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 19)
Указанное в заголовке соединение получали в соответствии с Примером 1(2), за исключением того, что использовали соединение 18(2) вместо соединения 1(1) и использовали 3-пиридинбороновую кислоту вместо фенилбороновой кислоты.
1H ЯМР(DMSO-d6) δ: 11,96 (шир.с, 1H), 8,52-8,45 (м, 2H), 8,32-8,24 (м, 1H), 7,92-7,73 (м, 2H), 7,72-7,62 (м, 1H), 7,57 (д, J=4,4 Гц, 1H), 7,53 (д, J=2,6 Гц, 1H), 7,37 (ддд, J=1,8, 5,0, 7,4 Гц, 1H), 6,17-6,07 (м, 1H), 6,00 (дд, J=2,6, 17,2 Гц, 1H), 5,50 (дд, J=1,5, 9,9 Гц, 1H), 5,42-5,27 (м, 1H), 3,84 (д, J=7,3 Гц, 3H), 3,71-3,34 (м, 1H), 2,19-2,03 (м, 1H), 2,03-1,80 (м, 2H), 1,74-1,46 (м, 2H), 1,29-1,12 (м, 1H)
ESI-MS m/z 425(MH+)
[0198]
Пример 20
Пример 20(1) Метил 4-(5-((трет-бутоксикарбонил)амино)циклогекс-1-ен-1-ил)-3-иод-1-тозил-1H-пирроло[2,3-b]пиридин-5-карбоксилат (Соединение 20(1))
Представляющий интерес продукт получали в соответствии с Примером 1(1), за исключением того, что использовали метил 4-хлор-1H-пирроло[2,3-b]пиридин-5-карбоксилат вместо 4-бром-1H-пирроло[2,3-b]пиридина.
ESI-MS m/z 652(MH+)
[0199]
Пример 20(2) Метил 4-(5-((трет-бутоксикарбонил)амино)циклогекс-1-ен-1-ил)-3-(фуран-2-ил)-1H-пирроло[2,3-b]пиридин-5-карбоксилат (Соединение 20(2))
DMF (5 мл) добавляли к соединению 20(1) (375 мг) и трибутил(фуран-2-ил)станнану (0,217 мл), с последующим замещением азотом. Затем к реакционной смеси добавляли PdCl2(PPh3)2 (40,0 мг) и температуру полученной смеси повышали до 120°C, с последующим перемешиванием в течение 3 часов. Затем к реакционной смеси добавляли насыщенный водный раствор хлорида аммония для разбавления и полученную смесь затем экстрагировали этилацетатом. Собранный органический слой промывали водой, насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором и сушили над безводным сульфатом натрия, с последующим концентрированием под вакуумом, с получением соответствующего продукта сочетания. Полученный продукт сочетания подвергали последующему взаимодействию без дополнительной очистки.
ТГФ (10 мл) и ТГФ раствор (5 мл) 1,0 M тетрабутиламмонийфторида добавляли к полученному продукту сочетания и полученную смесь затем перемешивали при комнатной температуре в течение 2 часов. Затем к реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия для разбавления и полученную смесь затем экстрагировали этилацетатом. Собранный органический слой промывали водой и затем насыщенным солевым раствором, сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат) с получением представляющего интерес продукта (187 мг, выход: 74%).
ESI-MS m/z 438(MH+)
[0200]
Пример 20(3) Метил 4-(5-акриламидциклогекс-1-ен-1-ил)-3-(фуран-2-ил)-1H-пирроло[2,3-b]пиридин-5-карбоксилат (Соединение 20)
Метанол (0,5 мл) и раствор 4 M хлористоводородной кислоты в 1,4-диоксане (2 мл) добавляли к соединению 20(2) (44,0 мг) и полученную смесь затем перемешивали при комнатной температуре в течение 30 минут. Затем реакционную смесь концентрировали при пониженном давлении. В атмосфере азота к смеси добавляли дихлорметан (1,5 мл), этанол (0,5 мл) и диизопропилэтиламин (0,11 мл) и полученную смесь затем охлаждали до 0°C. К реакционной смеси добавляли акрилоилхлорид (0,010 мл) и полученную смесь затем перемешивали в течение 30 минут. Затем к реакционной смеси добавляли метанольный раствор 7 M аммиака и полученную смесь затем перемешивали при комнатной температуре в течение 1 часа. Затем к реакционной смеси добавляли воду для разбавления и полученную смесь затем экстрагировали раствором 20% этанола в хлороформе. Собранный органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (хлороформ:метанол) с получением указанного в заголовке соединения (23,7 мг, выход: 60%).
1H ЯМР(DMSO-d6) δ: 12,37 (шир.с, 1H), 8,69 (с, 1H), 8,01 (шир.с, 1H), 7,73 (д, J=2,6 Гц, 1H), 7,69 (шир.с, 1H), 6,55-6,49 (м, 1H), 6,39 (д, J=2,6 Гц, 1H),6,20 (дд, J=10,1, 17,0 Гц, 1H), 6,06 (дд, J=2,2, 16,9 Гц, 1H), 5,55 (дд, J=2,2,9,9 Гц, 1H), 5,32-5,14 (м, 1H), 4,04-3,91 (м, 1H), 3,81 (с, 3H), 2,37-2,00 (м, 3H), 1,94-1,64 (м, 2H), 1,60-1,28 (м, 1H)
ESI-MS m/z 392(MH+)
[0201]
Пример 21
Пример 21(1) трет-Бутил (3-(5-карбамоил-3-(фуран-2-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)карбамат (Соединение 21(1))
Метанол (1 мл) и 1 M водный раствор гидроксида натрия (1 мл) добавляли к соединению 20(2) (92 мг) и температуру полученной смеси затем повышали до 80°C, с последующим перемешиванием в течение 13 часов. Затем реакционную смесь охлаждали до 0°C и затем к смеси добавляли раствор 1 M хлористоводородной кислоты для разбавления. Затем полученную смесь экстрагировали раствором 20% этанола в хлороформе. Собранный органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении с получением соответствующей карбоновой кислоты. Полученную карбоновую кислоту подвергали последующему взаимодействию без дополнительной очистки.
DMF (2 мл), хлорид аммония (45,0 мг), диизопропилэтиламин (0,183 мл) и HBTU (159 мг) добавляли к полученной карбоновой кислоте и температуру полученной смеси затем повышали до 80°C, с последующим перемешиванием в течение 3 часов. Затем к реакционной смеси добавляли воду для разбавления и полученную смесь затем экстрагировали раствором 20% этанола в хлороформе. Собранный органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (хлороформ:метанол) с получением представляющего интерес продукта (77,2 мг, выход: 87%).
ESI-MS m/z 423(MH+)
[0202]
Пример 21(2) 4-(5-Акриламидциклогекс-1-ен-1-ил)-3-(фуран-2-ил)-1H-пирроло[2,3-b]пиридин-5-карбоксамид (Соединение 21)
Этанол (0,5 мл) и раствор of 4 M хлористоводородной кислот в 1,4-диоксане (2 мл) добавляли к соединению 21(1) (77,2 мг) и полученную смесь затем перемешивали при комнатной температуре в течение 10 минут. Затем реакционную смесь концентрировали при пониженном давлении. В атмосфере азота к смеси добавляли этанол (1,8 мл) и диизопропилэтиламин (0,160 мл) и полученную смесь затем охлаждали до 0°C. К реакционной смеси добавляли раствор 2 M акрилоилхлорида в ацетонитриле (0,100 мл) и полученную смесь затем перемешивали в течение 30 минут. Затем к реакционной смеси добавляли метанольный раствор 7 M аммиака и полученную смесь затем перемешивали при комнатной температуре в течение 30 минут. Затем к реакционной смеси добавляли воду для разбавления и полученную смесь затем экстрагировали раствором 20% этанола в хлороформе. Собранный органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (хлороформ:метанол) с получением указанного в заголовке соединения (45,4 мг, выход: 66%).
1H ЯМР(DMSO-d6) δ: 12,16 (шир.с, 1H), 8,34 (с, 1H), 8,02 (шир.с, 1H), 7,92 (шир.с, 1H), 7,69 (д, J=2,9 Гц, 1H), 7,67 (д, J=1,1 Гц, 1H), 7,48 (шир.с, 1H), 6,51 (дд, J=1,8, 2,9 Гц, 1H), 6,39 (д, J=2,9 Гц, 1H), 6,19 (дд, J=9,9, 17,2 Гц, 1H), 6,07 (дд, J=2,2, 16,9 Гц, 1H), 5,55 (дд, J=2,6, 9,9 Гц, 1H), 5,37 (шир.с, 1H), 3,92 (шир.с, 1H), 2,38-2,06 (м, 2H), 2,01-1,92 (м, 2H), 1,81-1,44 (м, 2H)
ESI-MS m/z 377(MH+)
[0203]
Пример 22 4-(5-Акриламидциклогекс-1-ен-1-ил)-3-(фуран-2-ил)-N-метил-1H-пирроло[2,3-b]пиридин-5-карбоксамид (Соединение 22)
Указанное в заголовке соединение получали в соответствии с Примерами 21(1) и 21(2), за исключением того, что использовали метанольный раствор 40% метиламина вместо хлорида аммония.
1H ЯМР(DMSO-d6) δ: 12,16 (шир.с, 1H), 8,47-8,19 (м, 2H), 7,99 (д, J=7,3 Гц, 1H), 7,70 (д, J=2,6 Гц, 1H), 7,66 (д, J=1,1 Гц, 1H), 6,51 (дд, J=1,8, 3,3 Гц, 1H), 6,38 (д, J=2,9 Гц, 1H), 6,21 (дд, J=9,9, 16,9 Гц, 1H), 6,13-6,05 (м, 1H), 5,56 (дд, J=2,2, 9,9 Гц, 1H), 5,34 (шир.с, 1H), 3,92 (шир.с, 1H), 2,75 (д, J=4,4 Гц, 3H), 2,25 (д, J=15,8 Гц, 1H), 2,16-2,03 (м, 1H), 2,03-1,89 (м, 2H), 1,81-1,49 (м, 1H)
ESI-MS m/z 391(MH+)
[0204]
Пример 23 4-(5-Акриламидциклогекс-1-ен-1-ил)-3-(фуран-2-ил)-N,N-диметил-1H-пирроло[2,3-b]пиридин-5-карбоксамид (Соединение 23)
Указанное в заголовке соединение получали в соответствии с Примерами 21(1) и 21(2), за исключением того, что использовали раствор 2 M диметиламина в ТГФ вместо хлорида аммония.
1H ЯМР(DMSO-d6) δ: 12,19 (шир.с, 1H), 8,10 (с, 1H), 7,93 (шир.с, 1H), 7,74 (д, J=2,7 Гц, 1H), 7,67 (с, 1H), 6,53 (дд, J=1,7, 3,2 Гц, 1H), 6,41 (д, J=3,2 Гц, 1H), 6,21 (дд, J=9,9, 17,2 Гц, 1H), 6,08 (дд, J=2,3, 17,2 Гц, 1H), 5,57 (дд, J=2,4, 10,2 Гц, 1H), 5,43 (шир.с, 1H), 3,86 (шир.с, 1H), 2,99 (с, 3H), 2,78 (шир.с, 3H), 2,22 (шир.с, 1H), 2,03 (шир.с, 3H), 1,71 (шир.с, 1H), 1,44 (шир.с, 1H)
ESI-MS m/z 405(MH+)
[0205]
Пример 24
Пример 24(1) трет-Бутил (3-(5-формил-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)карбамат (Соединение 24(1))
1,4-Диоксан (20 мл), 2 M водный раствор карбоната натрия (6 мл) и Pd(PPh3)4 (318 мг) добавляли к 4-хлор-1H-пирроло[2,3-b]пиридин-5-карбальдегиду (1,00 г) и соединению Ссылочного Примера 1(2a) (1,96 г) и температуру полученной смеси затем повышали до 100°C, с последующим перемешиванием в течение 14 часов. Затем к реакционной смеси добавляли воду для разбавления и полученную смесь затем экстрагировали хлороформом. Собранный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (хлороформ:метанол) с получением представляющего интерес продукта (1,70 г, выход: 91%).
ESI-MS m/z 342(MH+)
[0206]
Пример 24(2) трет-Бутил (3-(5-формил-3-иод-1-тозил-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)карбамат (Соединение 24(2))
DMF (5 мл) добавляли к соединению 24(1) (341 мг) и полученную смесь затем охлаждали до 0°C. Затем к реакционной смеси добавляли N-иодсукцинимид (247 мг) и полученную смесь затем перемешивали в течение 1 часа. Затем к реакционной смеси добавляли 10% водный раствор гидросульфита натрия при 0°C и полученную смесь затем разбавляли насыщенным водным раствором гидрокарбоната натрия и затем экстрагировали этилацетатом. Собранный органический слой промывали водой и затем насыщенным солевым раствором. Полученное вещество сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (хлороформ:метанол) с получением соответствующего иод-содержащего продукта. Полученный иод-содержащий продукт подвергали последующему взаимодействию без дополнительной очистки.
К полученному иод-содержащему продукту добавляли DMF (5 мл) и полученную смесь затем охлаждали до 0°C. Затем к реакционной смеси добавляли 60% гидрид натрия (96,0 мг). Полученную смесь перемешивали при комнатной температуре в течение 30 минут и затем к реакционной смеси добавляли пара-толуолсульфонилхлорид (229 мг) при 0°C. Полученную смесь перемешивали при комнатной температуре в течение 1 часа. Затем к реакционной смеси добавляли насыщенный водный раствор хлорида аммония для разбавления и полученную смесь затем экстрагировали этилацетатом. Собранный органический слой промывали водой и затем насыщенным солевым раствором. Полученное вещество сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат) с получением представляющего интерес продукта (352 мг, выход: 57%).
ESI-MS m/z 622(MH+)
[0207]
Пример 24(3) трет-Бутил (3-(5-формил-3-(фуран-2-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)карбамат (Соединение 24(3))
DMF (3 мл) добавляли к соединению 24(2) (186 мг) и трибутил(фуран-2-ил)станнану (0,113 мл), с последующим замещением азотом. Затем к реакционной смеси добавляли PdCl2(PPh3)2 (21,0 мг) и температуру полученной смеси затем повышали до 120°C, с последующим перемешиванием в течение 3 часов. Затем к реакционной смеси добавляли насыщенный водный раствор хлорида аммония для разбавления и полученную смесь затем экстрагировали этилацетатом. Собранный органический слой промывали водой, насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором, сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении с получением соответствующего продукта сочетания. Полученный продукт сочетания подвергали последующему взаимодействию без дополнительной очистки.
ТГФ (6 мл) и раствор 1,0 M тетрабутиламмонийфторида в ТГФ (2 мл) добавляли к полученному продукту сочетания и полученную смесь затем перемешивали при комнатной температуре в течение 2 часов. Затем к реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия для разбавления и полученную смесь затем экстрагировали этилацетатом. Собранный органический слой промывали водой и затем насыщенным солевым раствором. Полученное вещество сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат) с получением представляющего интерес продукта (110 мг, выход: 90%).
ESI-MS m/z 408(MH+)
[0208]
Пример 24(4) трет-Бутил (3-3-(фуран-2-ил)-5-(гидроксиметил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)карбамат (Соединение 24(4))
Метанол (3 мл) добавляли к соединению 24(3) (55,0 мг) и полученную смесь затем охлаждали до 0°C. К реакционной смеси добавляли борогидрид натрия (22,0 мг) и полученную смесь затем перемешивали при комнатной температуре в течение 1 часа. Затем к реакционной смеси добавляли насыщенный водный раствор хлорида аммония при 0°C для разбавления и полученную смесь затем экстрагировали этилацетатом. Собранный органический слой промывали водой, насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором и сушили над безводным сульфатом натрия, с последующим концентрированием под вакуумом. Полученный остаток очищали хроматографией на силикагеле (хлороформ:метанол) с получением представляющего интерес продукта (53,2 мг, выход: 96%).
ESI-MS m/z 410(MH+)
[0209]
Пример 24(5) N-(3-(3-(Фуран-2-ил)-5-(гидроксиметил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 24)
Этанол (0,5 мл) и раствор 4 M хлористоводородной кислоты в 1,4-диоксане (2 мл) добавляли к соединению 24(4) (53,2 мг) и полученную смесь затем перемешивали при комнатной температуре в течение 30 минут. Затем реакционную смесь концентрировали при пониженном давлении. В атмосфере азота к смеси добавляли дихлорметан (1,5 мл), этанол (0,5 мл) и диизопропилэтиламин (0,114 мл) и полученную смесь затем охлаждали до 0°C. К реакционной смеси добавляли акрилоилхлорид (0,012 мл) и полученную смесь затем перемешивали в течение 30 минут. Затем к реакционной смеси добавляли метанольный раствор 7 M аммиака и полученную смесь затем перемешивали при комнатной температуре в течение 1 часа. Затем к реакционной смеси добавляли воду для разбавления и полученную смесь затем экстрагировали раствором 20% этанола в хлороформе. Собранный органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (хлороформ:метанол) с получением указанного в заголовке соединения (22,9 мг, выход: 49%).
1H ЯМР(DMSO-d6) δ: 11,90 (шир.с, 1H), 8,28 (д, J=6,2 Гц, 1H), 8,01 (д, J=7,7 Гц, 1H), 7,65 (д, J=7,3 Гц, 1H), 7,62-7,58 (м, 1H), 6,52-6,47 (м, 1H), 6,37 (т, J=2,4 Гц, 1H), 6,24-6,14 (м, 1H), 6,05 (дд, J=2,2, 16,9 Гц, 1H), 5,54 (дд, J=2,2, 9,9 Гц, 1H), 5,45-5,33 (м, 1H), 5,04 (тд, J=5,4, 18,2 Гц, 1H), 4,63-4,45 (м, 2H), 3,92 (шир.с, 1H), 2,33-2,06 (м, 3H), 2,05-1,92 (м, 1H), 1,77 (с, 1H), 1,59-1,27 (м, 1H)
ESI-MS m/z 364(MH+)
[0210]
Пример 25
Пример 25(1) трет-Бутил (3-(5-формил-3-иод-1-((2-(триметилсилил)этокси)метил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)карбамат (Соединение 25(1))
DMF (3,2 мл) добавляли к соединению 24(1) (215 мг) и полученную смесь затем охлаждали до 0°C. К реакционной смеси добавляли N-иодсукцинимид (156 мг) и полученную смесь затем перемешивали в течение 1 часа. Затем к реакционной смеси добавляли 10% водный раствор гидросульфита натрия при 0°C и полученную смесь затем разбавляли насыщенным водным раствором гидрокарбоната натрия и затем экстрагировали этилацетатом. Собранный органический слой промывали водой и затем насыщенным солевым раствором. Полученное вещество сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат) с получением соответствующего иод-содержащего продукта. Полученный иод-содержащий продукт подвергали последующему взаимодействию без дополнительной очистки.
DMF (3,2 мл) добавляли к полученному иод-содержащему продукту и полученную смесь затем охлаждали до 0°C. Затем к реакционной смеси добавляли 60% гидрид натрия (60,0 мг). Полученную смесь перемешивали при комнатной температуре в течение 30 минут и к реакционной смеси затем добавляли 2-(триметилсилил)этоксиметилхлорид (0,134 мл) при 0°C. Полученную смесь перемешивали при комнатной температуре в течение 1 часа. Затем к реакционной смеси добавляли насыщенный водный раствор хлорида аммония для разбавления и полученную смесь затем экстрагировали этилацетатом. Собранный органический слой промывали водой и затем насыщенным солевым раствором. Полученное вещество сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат) с получением представляющего интерес продукта (190 мг, выход: 50%).
ESI-MS m/z 598(MH+)
[0211]
Пример 25(2) трет-Бутил (3-(3-(фуран-2-ил)-5-(гидроксиметил)-1-((2-(триметилсилил)этокси)метил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)карбамат (Соединение 25(2))
DMF (3,2 мл) добавляли к соединению 25(1) (190 мг) и трибутил(фуран-2-ил)станнану (0,120 мл), с последующим замещением азотом. Затем к реакционной смеси добавляли PdCl2(PPh3)2 (22,0 мг) и температуру полученной смеси затем повышали до 120°C, с последующим перемешиванием в течение 3 часов. Затем к реакционной смеси добавляли насыщенный водный раствор хлорида аммония для разбавления и полученную смесь затем экстрагировали этилацетатом. Собранный органический слой промывали водой и затем насыщенным солевым раствором, сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении с получением соответствующего продукта сочетания. Полученный продукт сочетания подвергали последующему взаимодействию без дополнительной очистки.
К полученному продукту сочетания добавляли метанол (2,5 мл) и полученную смесь затем охлаждали до 0°C. К реакционной смеси добавляли борогидрид натрия (37,0 мг) и полученную смесь затем перемешивали при комнатной температуре в течение 1 часа. Затем к реакционной смеси добавляли насыщенный водный раствор хлорида аммония при 0°C и полученную смесь затем экстрагировали этилацетатом. Собранный органический слой промывали водой, насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором и сушили над безводным сульфатом натрия, с последующим концентрированием под вакуумом. Полученный остаток очищали хроматографией на силикагеле (хлороформ:метанол) с получением представляющего интерес продукта (117 мг, выход: 68%).
ESI-MS m/z 540(MH+)
[0212]
Пример 25(3) трет-Бутил (3-(3-(фуран-2-ил)-5-(метоксиметил)-1-((2-(триметилсилил)этокси)метил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)карбамат (Соединение 25(3))
DMF (1 мл) добавляли к соединению 25(2) (54,0 мг) и полученную смесь затем охлаждали до 0°C. Затем к реакционной смеси добавляли 60% гидрид натрия (10,0 мг). Полученную смесь перемешивали при комнатной температуре в течение 30 минут и затем к реакционной смеси добавляли иодметан (0,008 мл) при 0°C. Полученную смесь перемешивали при комнатной температуре в течение 4 часов. Затем к реакционной смеси добавляли насыщенный водный раствор хлорида аммония для разбавления и полученную смесь затем экстрагировали этилацетатом. Собранный органический слой промывали водой и затем насыщенным солевым раствором. Полученное вещество сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат) с получением представляющего интерес продукта (26,1 мг, выход: 47%).
ESI-MS m/z 554(MH+)
[0213]
Пример 25(4) N-(3-(3-(Фуран-2-ил)-5-(метоксиметил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 25)
ТГФ (1 мл) и ТГФ раствор (0,235 мл) 1,0 M тетрабутиламмонийфторида добавляли к соединению 25(3) (26,1 мг) и температуру полученной смеси затем повышали до 70°C, с последующим перемешиванием в течение 4 часов. Затем к реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия для разбавления и полученную смесь затем экстрагировали этилацетатом. Собранный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат) с получением соответствующего продукта, защитная группа которого удалена. Полученное соединение подвергали последующему взаимодействию без дополнительной очистки.
Этанол (0,5 мл) и раствор 4 M хлористоводородной кислоты в 1,4-диоксане (2 мл) добавляли к полученному продукту, у которого была удалена защитная группа, и полученную смесь затем перемешивали при комнатной температуре в течение 10 минут. Затем реакционную смесь концентрировали при пониженном давлении. В атмосфере азота к смеси добавляли ТГФ (0,5 мл), насыщенный водный раствор гидрокарбоната натрия (0,5 мл) и диизопропилэтиламин (0,013 мл) и полученную смесь затем охлаждали до 0°C. К реакционной смеси добавляли 2 M раствор акрилоилхлорида в ацетонитриле (0,021 мл) и полученную смесь затем перемешивали при комнатной температуре в течение 30 минут. Затем к реакционной смеси добавляли воду для разбавления и полученную смесь затем экстрагировали хлороформом. Собранный органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (хлороформ:метанол) с получением указанного в заголовке соединения (10,4 мг, выход: 58%).
1H ЯМР(DMSO-d6) δ: 11,98 (шир.с, 1H), 8,23 (д, J=2,2 Гц, 1H), 7,99 (дд, J=7,5,18,9 Гц, 1H), 7,66 (дд, J=1,1, 9,2 Гц, 1H), 7,62 (д, J=2,6 Гц, 1H), 6,53-6,48(м, 1H), 6,38 (дд, J=3,1, 6,8 Гц, 1H), 6,27-6,13 (м, 1H), 6,10-6,00 (м, 1H), 5,54 (тд, J=2,9, 9,9 Гц, 1H), 5,40 (д, J=15,8 Гц, 1H), 4,55-4,39 (м, 1H), 4,37-4,26 (м, 1H), 3,93 (шир.с, 1H), 3,25 (д, J=10,6 Гц, 3H), 2,29-2,17 (м, 2H), 2,15-1,95 (м, 2H), 1,87-1,71 (м, 1H), 1,57-1,42 (м, 1H)
ESI-MS m/z 378(MH+)
[0214]
Пример 26
Пример 26(1) трет-Бутил (3-(5-((диметиламино)метил)-3-(фуран-2-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)карбамат (Соединение 26(1))
ТГФ (1,1 мл), раствор 2 M диметиламина в ТГФ (0,067 мл) и трифенилфосфин (35,0 мг) добавляли к соединению 24(4) (45,8 мг) и затем к смеси добавляли диизопропилазодикарбоксилат (0,026 мл) при 0°C. Полученную смесь перемешивали при комнатной температуре в течение 17 часов. Затем к реакционной смеси добавляли воду для разбавления и полученную смесь затем экстрагировали раствором 20% этанола в хлороформе. Собранный органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (хлороформ:метанол) с получением представляющего интерес продукта (12,4 мг, выход: 25%).
[0215]
Пример 26(2) N-(3-(5-((Диметиламино)метил)-3-(фуран-2-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 26)
Этанол (0,5 мл) и раствор 4 M хлористоводородной кислотв в 1,4-диоксане (2 мл) добавляли к соединению 26(1) (12,4 мг) и полученную смесь затем перемешивали при комнатной температуре в течение 10 минут. Затем реакционную смесь концентрировали при пониженном давлении. В атмосфере азота к смеси добавляли этанол (1 мл) и диизопропилэтиламин (0,049 мл) и полученную смесь затем охлаждали до 0°C. К реакционной смеси добавляли раствор 2 M акрилоилхлорида в ацетонитриле (0,017 мл) и полученную смесь затем перемешивали в течение 1 часа. Затем к реакционной смеси добавляли метанольный раствор 7 M аммиака и полученную смесь затем перемешивали при комнатной температуре в течение 30 минут. Затем к реакционной смеси добавляли воду для разбавления и полученную смесь затем экстрагировали раствором 20% этанола в хлороформе. Собранный органический слой сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией с основным силикагелем (этилацетат:метанол) с получением указанного в заголовке соединения (7,3 мг, выход: 66%).
1H ЯМР(DMSO-d6) δ: 11,90 (шир.с, 1H), 8,21 (д, J=2,2 Гц, 1H), 7,96 (дд, J=7,7,16,9 Гц, 1H), 7,65 (тд, J=0,9, 10,3 Гц, 1H), 7,57 (т, J=2,7 Гц, 1H), 6,49 (ддд, J=1,8, 3,0, 7,6 Гц, 1H), 6,36 (дд, J=3,1, 8,6 Гц, 1H), 6,27-6,13 (м, 1H), 6,10-6,00 (м, 1H), 5,59-5,49 (м, 1H), 5,36 (д, J=19,1 Гц, 1H), 3,93 (д, J=8,1 Гц, 1H), 3,59-3,47 (м, 1H), 3,27-3,11 (м, 1H), 2,34-2,16 (м, 3H), 2,14-2,09 (м, 6H), 2,08-1,88 (м, 2H), 1,84-1,70 (м, 1H)
ESI-MS m/z 391(MH+)
[0216]
Пример 27 N-(3-(3-(Фуран-2-ил)-5-(морфолинометил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 27)
Указанное в заголовке соединение получали в соответствии с Примерами 26(1) и 26(2), за исключением того, что использовали морфолин вместо раствора 2 M диметиламина в ТГФ.
1H ЯМР(DMSO-d6) δ: 11,92 (шир.с, 1H), 8,18 (д, J=18,0 Гц, 1H), 7,95 (т, J=8,6 Гц, 1H), 7,65 (д, J=7,0 Гц, 1H), 7,58 (дд, J=2,6, 6,2 Гц, 1H), 6,49 (тд, J=2,5, 10,7 Гц, 1H), 6,37 (дд, J=2,9, 15,4 Гц, 1H), 6,28-6,13 (м, 1H), 6,10-5,99 (м, 1H), 5,59-5,49 (м, 1H), 5,39 (д, J=11,4 Гц, 1H), 3,93 (шир.с, 1H), 3,70-3,57 (м, 1H), 3,57-3,42 (м, 4H), 3,19 (д, J=12,5 Гц, 1H), 2,43-2,17 (м, 7H), 2,14-1,91 (м, 2H), 1,77 (шир.с, 1H)
ESI-MS m/z 433(MH+)
[0217]
Пример 28
Пример 28(1) N-(3-(3-Иод-1-тозил-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 28(1))
Метанол (60 мл) и раствор 4 M хлористоводородной кислоты в 1,4-диоксане (10 мл) добавляли к соединению 1(1) (5,91 г) и полученную смесь затем перемешивали при комнатной температуре в течение 2 часов. Затем реакционную смесь концентрировали при пониженном давлении и затем добавляли к концентрату дихлорметан (60 мл) и диизопропилэтиламин (8,89 мл). Полученную смесь охлаждали до 0°C. К реакционной смеси добавляли акрилоилхлорид (1,13 мл) и полученную смесь затем перемешивали при 0°C в течение 30 минут. Затем к реакционной смеси добавляли последовательно водный раствор аммиака, хлороформ и метанол и полученную смесь затем перемешивали при комнатной температуре в течение 1 часа. Затем реакционную смесь экстрагировали хлороформом. Собранный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат) с получением представляющего интерес продукта (3,90 г, выход: 72%).
1H ЯМР(CDCl3) δ: 8,34 (д, J=4,9 Гц, 1H), 8,09 (д, J=8,5 Гц, 2H), 7,89 (с, 1H), 7,29 (д, J=8,5 Гц, 2H), 6,94 (д, J=4,9 Гц, 1H), 6,33-6,27 (м, 1H), 6,14-6,05(м, 1H), 5,85 (шир.д, J=6,1 Гц, 1H), 5,76-5,71 (м, 1H), 5,66-5,62 (м, 1H), 4,54-4,39 (м, 1H), 2,77-2,65 (м, 1H), 2,45-2,34 (м, 4H), 2,25-2,12 (м, 1H), 2,07-1,96 (м, J=1,0 Гц, 1H), 1,85-1,70 (м, 2H)
ESI-MS m/z 548(MH+)
[0218]
Пример 28(2) N-(3-(3-(1-Метил-1H-пиразол-4-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 28)
1,4-Диоксан (1,2 мл) и воду (0,2 мл) добавляли к соединению 28(1) (36,7 мг), 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразолу (21,0 мг) и трикалий фосфату (35,6 мг), с последующим замещением азотом. Затем к реакционной смеси добавляли PdCl2(dppf)CH2Cl2 (4,9 мг) и полученную смесь затем перемешивали при 100°C в течение 1 часа. Затем реакционную смесь охлаждали до комнатной температуры и затем к смеси добавляли этилацетат и воду. Полученную смесь фильтровали через Целит. Фильтрат экстрагировали этилацетатом и собранный органический слой затем промывали водой и затем насыщенным солевым раствором. Полученное вещество сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении.
К полученному остатку добавляли ТГФ (0,5 мл) и раствор 1,0 M тетрабутиламмонийфторида в ТГФ (0,5 мл) и полученную смесь затем перемешивали при комнатной температуре в течение 14 часов. Затем реакционную смесь концентрировали при пониженном давлении и затем к концентрату добавляли 0,067 M фосфатный буферный раствор (pH 7,4). Водный слой экстрагировали этилацетатом. Собранный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (хлороформ:метанол) с получением указанного в заголовке соединения (14,0 мг, выход: 60%).
1H ЯМР(CDCl3-CD3OD) δ: 8,21-8,12 (м, 1H), 7,46-7,38 (м, 2H), 7,27-7,23 (м, 1H), 6,90-6,84 (м, 1H), 6,30-6,11 (м, 2H), 5,66-5,57 (м, 2H), 4,11-3,99 (м, 1H), 3,96 (с, 3H), 2,59-2,45 (м, 1H), 2,26-1,76 (м, 4H), 1,59-1,39 (м, 1H)
ESI-MS m/z 348(MH+)
[0219]
Пример 29 N-(3-(3-(1-(Оксетан-3-ил)-1H-пиразол-4-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид
Указанное в заголовке соединение получали в соответствии с Примером 28(2), за исключением того, что использовали 1-(оксетан-3-ил)-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразол вместо 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола.
1H ЯМР(CDCl3-CD3OD) δ: 8,22-8,16 (м, 1H), 7,62 (с, 1H), 7,56 (с, 1H), 7,29 (с, 1H), 6,89 (д, J=5,1 Гц, 1H), 6,30-6,21 (м, 1H), 6,14 (дд, J=10,2, 17,1 Гц, 1H), 5,67-5,50 (м, 3H), 5,16-5,07 (м, 4H), 4,03-3,85 (м, 1H), 2,64-2,50 (м, 1H), 2,05 (д, J=1,0 Гц, 3H), 1,91-1,79 (м, 1H), 1,56-1,39 (м, 1H)
ESI-MS m/z 390(MH+)
[0220]
Пример 30 N-(3-(3-(циклогекс-1-ен-1-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 30)
Указанное в заголовке соединение получали в соответствии с Примером 28(2), за исключением того, что использовали 2-(циклогекс-1-ен-1-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан вместо 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола.
1H ЯМР(CDCl3-CD3OD) δ: 8,20-8,04 (м, 1H), 7,20-7,09 (м, 1H), 6,93-6,82 (м, 1H), 6,37-6,22 (м, 1H), 6,21-6,09 (м, 1H), 5,93-5,79 (м, 1H), 5,76-5,54 (м, 2H), 4,36-4,22 (м, 1H), 2,88-2,69 (м, 1H), 2,48-1,98 (м, 8H), 1,68 (м, 5H)
ESI-MS m/z 348(MH+)
[0221]
Пример 31 N-(3-(3-(3,6-Дигидро-2H-пиран-4-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 31)
Указанное в заголовке соединение получали в соответствии с Примером 28(2), за исключением того, что использовали 2-(3,6-дигидро-2H-пиран-4-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан вместо 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола.
1H ЯМР(CDCl3-CD3OD) δ: 8,20-8,07 (м, 1H), 7,23-7,15 (м, 1H), 6,91-6,82 (м, 1H), 6,34-6,07 (м, 2H), 5,94-5,81 (м, 1H), 5,78-5,58 (м, 2H), 4,41-4,17 (м, 3H), 4,04-3,80 (м, 2H), 2,74-2,58 (м, 1H), 2,51-2,23 (м, 5H), 2,09 -1,91 (м, 1H), 1,70-1,51 (м, 1H)
ESI-MS m/z 350(MH+)
[0222]
Пример 32 N-(3-(3-(3-Оксоциклогекс-1-ен-1-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 32)
Указанное в заголовке соединение получали в соответствии с Примером 28(2), за исключением того, что использовали 3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)циклогекс-2-енон вместо 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола.
1H ЯМР(CDCl3-CD3OD) δ: 8,24 (д, J=4,9 Гц, 1H), 7,67 (с, 1H), 7,06 (д, J=4,9 Гц,1H), 6,44-6,20 (м, 2H), 5,95 (с, 1H), 5,74-5,52 (м, 2H), 4,51-4,25 (м, 1H), 3,06-2,61 (м, 3H), 2,59-2,43 (м, 2H), 2,41-2,04 (м, 5H), 2,00-1,81 (м, 1H), 1,78-1,56 (м, 1H)
ESI-MS m/z 362(MH+)
[0223]
Пример 33 N-(3-(3-(Циклоциклопент-1-ен-1-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 33)
Указанное в заголовке соединение получали в соответствии с Примером 28(2), за исключением того, что использовали 2-(циклопент-1-ен-1-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан вместо 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола.
1H ЯМР(CDCl3-CD3OD) δ: 8,13 (д, J=4,9 Гц, 1H), 7,37 (с, 1H), 6,90 (д, J=4,9 Гц,1H), 6,27 (дд, J=1,7, 17,1 Гц, 1H), 6,16 (дд, J=10,0, 17,1 Гц, 1H), 5,87-5,80(м, 1H), 5,76-5,70 (м, 1H), 5,65 (дд, J=1,7, 10,0 Гц, 1H), 4,34-4,19 (м, 1H), 2,54 (м, 4H), 2,43-2,19 (м, 4H), 2,07-1,93 (м, 3H), 1,72-1,55 (м, 1H)
ESI-MS m/z 334(MH+)
[0224]
Пример 34 N-(3-(3-(2,5-Дигидрофуран-3-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 34)
Указанное в заголовке соединение получали в соответствии с Примером 28(2), за исключением того, что использовали 2-(2,5-дигидрофуран-3-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан вместо 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола.
1H ЯМР(CDCl3-CD3OD) δ: 8,18 (д, J=4,9 Гц, 1H), 7,35 (с, 1H), 6,93 (д, J=4,9 Гц,1H), 6,29 (дд, J=2,0, 17,1 Гц, 1H), 6,18 (дд, J=9,8, 17,1 Гц, 1H), 5,92-5,81 (м, 2H), 5,65 (дд, J=2,0, 9,8 Гц, 1H), 4,92-4,78 (м, 4H), 4,38-4,21 (м, 1H),2,80-2,68 (м, 1H), 2,46-2,24 (м, 3H), 2,08-1,94 (м, 1H), 1,75-1,59 (м, 1H)
ESI-MS m/z 336(MH+)
[0225]
Пример 35 N-(3-(3-(4,5-Дигидрофуран-3-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 35)
Указанное в заголовке соединение получали в соответствии с Примером 28(2), за исключением того, что использовали 2-(4,5-дигидрофуран-3-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан вместо 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола.
1H ЯМР(CDCl3-CD3OD) δ: 8,14 (д, J=5,1 Гц, 1H), 7,20 (с, 1H), 6,89 (д, J=5,1 Гц,1H), 6,52-6,45 (м, 1H), 6,28 (дд, J=1,7, 16,8 Гц, 1H), 6,17 (дд, J=10,2, 16,8Гц, 1H), 5,92-5,85 (м, 1H), 5,65 (дд, J=1,7, 10,2 Гц, 1H), 4,55-4,42 (м, 2H), 4,38-4,25 (м, 1H), 3,00-2,89 (м, 2H), 2,82-2,68 (м, 1H), 2,46-2,23 (м, 3H), 2,10-2,00 (м, 1H), 1,80-1,65 (м, 1H)
ESI-MS m/z 336(MH+)
[0226]
Пример 36 N-(3-(3-(6-Метоксипиридин-3-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 36)
Указанное в заголовке соединение получали в соответствии с Примером 28(2), за исключением того, что использовали (6-метоксипиридин-3-ил)бороновую кислоту вместо 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола.
1H ЯМР(CDCl3) δ: 11,09 (шир.с, 1H), 8,31 (д, J=5,1 Гц, 1H), 8,07 (д, J=2,6 Гц,1H), 7,59 (дд, J=2,6, 8,4 Гц, 1H), 7,39 (с, 1H), 6,95 (д, J=5,1 Гц, 1H), 6,80 (д, J=8,4 Гц, 1H), 6,36-6,25 (м, 2H), 5,97 (д, J=8,4 Гц, 1H), 5,64 (дд, J=3,7, 8,1 Гц, 1H), 5,41-5,28 (м, 1H), 4,38-4,27 (м, 1H), 3,99 (с, 3H), 2,78-2,73(м, 1H), 2,24-1,94 (м, 4H), 1,89-1,69 (м, 1H)
ESI-MS m/z 375(MH+)
[0227]
Пример 37 N-(3-(3-(6-Фторпиридин-3-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 37)
Указанное в заголовке соединение получали в соответствии с Примером 28(2), за исключением того, что использовали (6-фторпиридин-3-ил)бороновую кислоту вместо 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола.
1H ЯМР(CDCl3) δ: 11,75 (с, 1H), 8,33 (д, J=4,8 Гц, 1H), 8,11 (с, 1H), 7,82-7,74 (м, 1H), 7,46 (с, 1H), 7,00-6,95 (м, 2H), 6,37-6,24 (м, 2H), 6,03-5,92 (м, 1H), 5,68-5,64 (м, 1H), 5,33 (шир.с, 1H), 4,30 (т, J=7,1 Гц, 1H), 2,82-2,63 (м, 1H), 2,27-2,05 (м, 1H), 2,11-1,91 (м, 2H), 1,87-1,71 (м, 2H)
ESI-MS m/z 363(MH+)
[0228]
Пример 38 N-(3-(3-(2-Фторпиридин-3-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 38)
Указанное в заголовке соединение получали в соответствии с Примером 28(2), за исключением того, что использовали (2-фторпиридин-3-ил)бороновую кислоту вместо 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола.
1H ЯМР(CDCl3) δ: 11,34 (шир.с, 1H), 8,34 (д, J=4,8 Гц, 1H), 8,19-8,15 (м, 1H), 7,83 (ддд, J=2,0, 7,2, 9,4 Гц, 1H), 7,49 (с, 1H), 7,31-7,27 (м, 1H), 7,01 (д, J=4,8 Гц, 1H), 6,45-6,33 (м, 2H), 6,13 (д, J=8,4 Гц, 1H), 5,68 (дд, J=2,9, 8,4 Гц, 1H), 5,21 (т, J=3,7 Гц, 1H), 4,47-4,36 (м, 1H), 3,01-2,91 (м, 1H), 2,35 (дд, J=4,0, 17,2 Гц, 1H), 1,94 (шир.с, 1H), 1,89-1,79 (м, 1H), 1,77-1,58 (м, 1H), 1,56-1,37 (м, 1H)
ESI-MS m/z 363(MH+)
[0229]
Пример 39 N-(3-(3-(6-Аминопиридин-3-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 39)
Указанное в заголовке соединение получали в соответствии с Примером 28(2), за исключением того, что использовали (6-аминопиридин-3-ил)бороновую кислоту вместо 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола.
1H ЯМР(DMSO-d6) δ: 11,79 (д, J=2,2 Гц, 1H), 8,18 (д, J=5,1 Гц, 1H), 8,03 (д, J=7,3 Гц, 1H), 7,85 (д, J=2,6 Гц, 1H), 7,44 (д, J=2,6 Гц, 1H), 7,26 (дд, J=2,6, 8,4 Гц, 1H), 6,89 (д, J=5,1 Гц, 1H), 6,44 (д, J=8,4 Гц, 1H), 6,26 (дд, J=10,3, 17,2 Гц, 1H), 6,08 (дд, J=2,2, 17,2 Гц, 1H), 5,83 (с, 2H), 5,57 (дд, J=2,2, 10,3 Гц, 1H), 5,22 (шир.с, 1H), 4,01-3,81 (м, 1H), 2,58-2,52 (м, 1H), 2,28-2,14 (м, 1H), 1,96-1,66 (м, 3H), 1,53-1,32 (м, 1H)
ESI-MS m/z 360(MH+)
[0230]
Пример 40 N-(3-(3-(6-(Дифторметокси)пиридин-3-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 40)
Указанное в заголовке соединение получали в соответствии с Примером 28(2), за исключением того, что использовали 2-(дифторметокси)-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин вместо 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола.
1H ЯМР(CDCl3) δ: 11,77 (шир.с, 1H), 8,31 (д, J=5,1 Гц, 1H), 8,11 (д, J=2,6 Гц,1H), 7,70 (дд, J=2,6, 8,2 Гц, 1H), 7,67-7,28 (м, 2H), 6,96-6,92 (м, 2H), 6,32 (дд, J=1,5, 16,9 Гц, 1H), 6,18 (дд, J=10,1, 16,9 Гц, 1H), 5,88 (д, J=8,2 Гц, 1H), 5,65 (дд, J=1,5, 10,1 Гц, 1H), 5,35 (шир.с, 1H), 4,29-4,11 (м, 1H), 2,73- 2,68 (м, 1H), 2,39 (шир.с, 1H), 2,19-2,07 (м, 1H), 2,06-1,91 (м, 1H), 1,88-1,73 (м, 1H), 1,60-1,40 (м, 1H)
ESI-MS m/z 411(MH+)
[0231]
Пример 41 N-(3-(3-(2-(Дифторметокси) пиридин-3-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 41)
Указанное в заголовке соединение получали в соответствии с Примером 28(2), за исключением того, что использовали 2-(дифторметокси)-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин вместо 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола.
1H ЯМР(CDCl3) δ: 10,35 (шир.с, 1H), 8,30 (д, J=5,1 Гц, 1H), 8,17 (дд, J=1,8, 4,8 Гц, 1H), 7,67 (дд, J=1,8, 7,3 Гц, 1H), 7,65-7,27 (м, 1H), 7,19 (дд, J=4,8, 7,3 Гц, 1H), 6,96 (д, J=5,1 Гц, 1H), 6,30 (дд, J=1,5, 16,9 Гц, 1H), 6,11 (дд, J=10,3, 16,9 Гц, 1H), 5,65 (дд, J=1,5, 10,3 Гц, 1H), 5,49 (д, J=8,1 Гц, 1H), 5,35 (шир.с, 1H), 4,14-4,04 (м, 1H), 2,72 (дд, J=4,8, 17,2 Гц, 1H), 2,53-2,27 (м, 1H), 2,27-2,12 (м, 1H), 2,10-1,94 (м, 1H), 1,92-1,67 (м, 1H), 1,45-1,33 (м, 1H)
ESI-MS m/z 411(MH+)
[0232]
Пример 42 N-(3-(3-(2-Аминопиридин-3-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 42)
Указанное в заголовке соединение получали в соответствии с Примером 28(2), за исключением того, что использовали (2-аминопиридин-3-ил)бороновую кислоту вместо 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола.
1H ЯМР(CDCl3) δ: 9,50 (шир.с, 1H), 8,31 (д, J=5,1 Гц, 1H), 8,07 (дд, J=1,6, 4,9 Гц, 1H), 7,46 (д, J=5,5 Гц, 1H), 7,34 (с, 1H), 6,95 (д, J=5,1 Гц, 1H), 6,77 (т, J=5,7 Гц, 1H), 6,37 (д, J=16,5 Гц, 1H), 5,69 (д, J=11,7 Гц, 1H), 5,35 (шир.с,1H), 4,58-4,09 (м, 2H), 2,91 (шир.с, 1H), 2,35-2,28 (м, 1H), 1,92-1,75 (м, 1H), 1,54-1,33 (м, 3H)
ESI-MS m/z 360(MH+)
[0233]
Пример 43 3-(4-(5-Акриламидциклогекс-1-ен-1-ил)-1H-пирроло[2,3-b]пиридин-3-ил)пиридин 1-оксид (Соединение 43)
DMF (1,5 мл) добавляли к соединению 28(1) (100 мг) и 3-(трибутилстаннил)пиридин 1-оксиду (100 мг), с последующим замещением азотом. Затем к реакционной смеси добавляли PdCl2(PPh3) (12,8 мг) и полученную смесь затем перемешивали в условиях нагревания при 100°C в течение 6 часов. Затем реакционную смесь охлаждали до комнатной температуры и к реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и хлороформ. Полученную смесь перемешивали и затем фильтровали через Целит. Фильтрат экстрагировали хлороформом и собранный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (хлороформ:метанол) с получением соответствующего продукта сочетания. Полученный продукт сочетания подвергали последующему взаимодействию без дополнительной очистки.
ТГФ (0,8 мл) и ТГФ раствор (0,8 мл) 1,0 M тетрабутиламмонийфторида добавляли к полученному продукту сочетания и полученную смесь затем перемешивали при комнатной температуре в течение 1 часа. Затем к реакционной смеси добавляли 0,067 M фосфатный буферный раствор (pH 7,4) и полученную смесь затем экстрагировали хлороформом. Собранный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (хлороформ:метанол) с получением указанного в заголовке соединения (4,3 мг, выход: 7%).
1H ЯМР(CDCl3-CD3OD) δ: 8,35-8,03 (м, 3H), 7,57-7,36 (м, 3H), 7,04 (т, J=4,9Гц, 1H), 6,36-6,17 (м, 2H), 5,69-5,54 (м, 1H), 5,44-5,28 (м, 1H), 4,43-4,18 (м, 1H), 2,93-2,73 (м, 1H), 2,30-1,74 (м, 4H), 1,65-1,45 (м, 1H)
ESI-MS m/z 361(MH+)
[0234]
Пример 44 4-(4-(5-Акриламидциклогекс-1-ен-1-ил)-1H-пирроло[2,3-b]пиридин-3-ил)пиридин 1-оксид (Соединение 44)
Указанное в заголовке соединение получали в соответствии с Примером 43, за исключением того, что использовали 4-(трибутилстаннил)пиридин 1-оксид вместо 3-(трибутилстаннил)пиридин 1-оксида.
1H ЯМР(CDCl3-CD3OD) δ: 8,35-8,15 (м, 3H), 7,54 (с, 1H), 7,46-7,33 (м, 2H), 7,03 (д, J=5,1 Гц, 1H), 6,27 (дд, J=2,0, 17,1 Гц, 1H), 6,18 (дд, J=9,8, 17,1 Гц,1H), 5,64 (дд, J=2,0, 9,8 Гц, 1H), 5,59-5,53 (м, 1H), 4,19-3,96 (м, 1H), 2,80-2,56 (м, 1H), 2,26-1,79 (м, 5H)
ESI-MS m/z 361(MH+)
[0235]
Пример 45
Пример 45(1) 4-Хлор-3-иод-1-тозил-1H-пирроло[2,3-b]пиридин-5-карбонитрил (Соединение 45(1))
DMF (9 мл) и гидроксид калия (589 мг) добавляли к 4-хлор-1H-пирроло[2,3-b]пиридин-5-карбонитрилу (533 мг) и полученную смесь затем перемешивали при комнатной температуре в течение 20 минут. Затем к реакционной смеси добавляли иод (1,14 г) и полученную смесь снова перемешивали при комнатной температуре в течение 2 часов. Затем к реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия для разбавления и полученную смесь затем экстрагировали этилацетатом. Собранный органический слой промывали 10% водным раствором тиосульфата натрия и затем насыщенным солевым раствором и сушили над безводным сульфатом натрия, с последующим концентрированием под вакуумом, с получением соответствующего иод-содержащего продукта. Полученный иод-содержащий продукт подвергали последующему взаимодействию без дополнительной очистки.
К полученному иод-содержащему продукту добавляли DMF (9 мл) и полученную смесь затем охлаждали до 0°C. Затем к реакционной смеси добавляли 60% гидрид натрия (144 мг). Полученную смесь перемешивали при комнатной температуре в течение 10 минут и затем к реакционной смеси добавляли пара-толуолсульфонилхлорид (858 мг) при 0°C. Полученную смесь перемешивали при комнатной температуре в течение 2 часов. Затем к реакционной смеси добавляли насыщенный водный раствор хлорида аммония и осажденное твердое вещество собирали фильтрованием и затем промывали этилацетатом и водой, с получением представляющего интерес продукта (767 мг, выход: 56%).
1H ЯМР(CDCl3) δ: 8,59 (с, 1H), 8,09-8,06 (м, 3H), 7,34 (д, J=8,0 Гц, 2H), 2,41 (с, 3H)
ESI-MS m/z 458(MH+)
[0236]
Пример 45(2) 4-Хлор-3-(фуран-2-ил)-1-тозил-1H-пирроло[2,3-b]пиридин-5-карбонитрил (Соединение 45(2))
DMF (10 мл) добавляли к соединению 45(1) (458 мг) и трибутил(фуран-2-ил)станнану (0,35 мл), с последующим замещением азотом. Затем к реакционной смеси добавляли PdCl2(PPh3) (35 мг) и температуру полученной смеси затем повышали до 100°C, с последующим перемешиванием в течение 15 часов. Затем к реакционной смеси добавляли насыщенный водный раствор хлорида аммония для разбавления и полученную смесь затем экстрагировали этилацетатом. Собранный органический слой промывали водой, насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором и сушили над безводным сульфатом натрия, с последующим концентрированием под вакуумом. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат) с получением представляющего интерес продукта (348 мг, выход: 88%).
1H ЯМР(CDCl3) δ: 8,62 (с, 1H), 8,10 (д, J=8,5 Гц, 2H), 8,08 (с, 1H), 7,55 (дд, J=0,7, 1,7 Гц, 1H), 7,34 (д, J=8,5 Гц, 2H), 6,69 (дд, J=0,7, 3,4 Гц, 1H), 6,52 (дд, J=1,7, 3,4 Гц, 1H), 2,42 (с, 3H)
ESI-MS m/z 398(MH+)
[0237]
Пример 45(3) N-(3-(5-Циано-3-(фуран-2-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 45)
1,4-Диоксан (3,0 мл) и воду (0,5 мл) добавляли к соединению 45(2) (80 мг), соединению Ссылочного Примера 1(2a) (156 мг) и трикалий фосфату (175 мг), с последующим замещением азотом. Затем к реакционной смеси добавляли PdCl2(dppf)CH2Cl2 (24,0 мг) и полученную смесь затем перемешивали при 100°C в течение 1 часа. Затем реакционную смесь охлаждали до комнатной температуры и затем к смеси добавляли этилацетат и воду. Полученную смесь затем фильтровали через Целит. Фильтрат экстрагировали этилацетатом и собранный органический слой промывали водой и затем насыщенным солевым раствором. Полученное вещество сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении.
Кполученному остатку добавляли ТГФ (1 мл) и ТГФ раствор (1 мл) 1,0 M тетрабутиламмонийфторида и полученную смесь затем перемешивали при комнатной температуре в течение 1 часа, с последующим концентрированием под вакуумом. К остатку добавляли 0,067 M фосфатный буферный раствор (pH 7,4) и полученную смесь затем экстрагировали этилацетатом. Собранный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (хлороформ:метанол) с получением соответствующего продукта сочетания. Полученный продукт сочетания подвергали последующему взаимодействию без дополнительной очистки.
К полученному продукту сочетания добавляли метанол (1 мл) и раствор 4 M хлористоводородной кислоты в 1,4-диоксане (1 мл) и полученную смесь затем перемешивали при комнатной температуре в течение 30 минут. Затем реакционную смесь концентрировали при пониженном давлении. В атмосфере азота к реакционной смеси добавляли дихлорметан (3 мл) и диизопропилэтиламин (0,3 мл) и полученную смесь затем охлаждали до 0°C. Затем к реакционной смеси добавляли акрилоилхлорид (0,03 мл) и полученную смесь затем перемешивали в течение 20 минут. К реакционной смеси добавляли последовательно водный раствор аммиака, хлороформ и метанол и полученную смесь затем перемешивали при комнатной температуре в течение 1 часа. Затем реакционную смесь экстрагировали хлороформом и собранный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (хлороформ:метанол) с получением указанного в заголовке соединения (52,2 мг, выход: 44%).
1H ЯМР(CDCl3-CD3OD) δ: 8,51 (с, 1H), 7,63-7,53 (м, 2H), 6,50 (дд, J=2,0, 3,2 Гц, 1H), 6,41 (дд, J=0,7, 3,2 Гц, 1H), 6,28 (дд, J=1,7, 17,1 Гц, 1H), 6,16 (дд, J=10,2, 17,1 Гц, 1H), 5,78-5,70 (м, 1H), 5,65 (дд, J=1,7, 10,2 Гц, 1H), 4,38 -4,26 (м, 1H), 2,68-2,53 (м, 1H), 2,36-2,07 (м, 3H), 1,91-1,72 (м, 2H)
ESI-MS m/z 359(MH+)
[0238]
Пример 46 N-(3-(5-Циано-3-(фуран-2-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклопент-3-ен-1-ил)акриламид (Соединение 46)
Указанное в заголовке соединение получали в соответствии с Примером 45(3), за исключением того, что использовали соединение Ссылочного Примера 2(2a) вместо соединения Ссылочного Примера 1(2a).
1H ЯМР(CDCl3-CD3OD) δ: 8,53 (с, 1H), 7,61-7,46 (м, 2H), 6,50-6,42 (м, 1H), 6,39-6,06 (м, 3H), 5,78-5,60 (м, 2H), 4,77-4,62 (м, 1H), 3,08-2,68 (м, 2H), 2,67-2,37 (м, 2H)
ESI-MS m/z 345(MH+)
[0239]
Пример 47
Пример 47(1) 4-Хлор-1-тозил-1H-пирроло[2,3-b]пиридин-3-карбальдегид (Соединение 47(1))
DMF (50 мл) добавляли к 4-хлор-1H-пирроло[2,3-b]пиридин-3-карбальдегиду (1,81 г) и полученную смесь затем охлаждали до 0°C. Затем к реакционной смеси добавляли 60% гидрид натрия (1,2 г) и полученную смесь затем перемешивали в течение 30 минут. Затем к реакционной смеси добавляли пара-толуолсульфонилхлорид (3,43 г) и полученную смесь затем перемешивали в течение 1 часа. Затем к реакционной смеси последовательно добавляли лед и воду и полученную смесь затем перемешивали в течение 30 минут. Затем реакционную смесь фильтровали и остаток промывали водой, с получением представляющего интерес продукта (3,28 г, выход: 98%).
ESI-MS m/z 335(MH+)
[0240]
Пример 47(2) трет-Бутил (3-(3-формил-1-тозил-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)карбамат (Соединение 47(2))
1,4-Диоксан (44 мл) и 2 M водный раствор карбоната натрия (6,57 мл) добавляли к соединению 47(1) (2,20 г), соединению Ссылочного Примера 1(2a) (2,34 г) и Pd(PPh3)4 (1,14 мг), с последующим замещением азотом. Затем реакционную смесь перемешивали при 100°C в течение 10 часов. Затем к реакционной смеси добавляли воду и полученную смесь затем экстрагировали этилацетатом. Собранный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат) с получением представляющего интерес продукта (2,05 г, выход: 63%).
ESI-MS m/z 496(MH+)
[0241]
Пример 47(3) 4-(5-((трет-Бутоксикарбонил)амино)циклогекс-1-ен-1-ил)-1-тозил-1H-пирроло[2,3-b]пиридин-3-карбоновая кислота (Соединение 47(3))
трет-Бутанольный раствор (25 мл) и 2-метил-2-бутен (1,71 мл) добавляли к соединению 47(2) (1,0 г) и затем к смеси добавляли водный раствор (10 мл) хлорита натрия (1,37 г) и дигидрофосфат натрия (970 мг) при охлаждении на льду. Полученную смесь перемешивали в течение 1,5 часов. Затем реакционную смесь концентрировали при пониженном давлении и затем экстрагировали хлороформом. Собранный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат), с получением представляющего интерес продукта (1,09 г, выход: 99%).
ESI-MS m/z 512(MH+)
[0242]
Пример 47(4) трет-Бутил (3-(3-(1,2,4-оксадиазол-5-ил)-1-тозил-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)карбамат (Соединение 47(4))
DMF (10 мл), HATU (1,48 г) и диизопропилэтиламин (0,66 мл) добавляли к соединению 47(3) (500 мг) и полученную смесь затем перемешивали в течение 10 минут. Затем к реакционной смеси добавляли водный раствор аммиака (0,81 мл) и полученную смесь затем перемешивали в течение 5 минут. Затем к реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и полученную смесь затем экстрагировали этилацетатом. Собранный органический слой последовательно промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия, с последующим концентрированием под вакуумом. Полученный остаток очищали хроматографией на силикагеле (метанол:хлороформ), с получением соответствующего карбамоильного продукта (380 мг, выход: 78%).
К полученному карбамоильному продукту добавляли N,N-диметилформамиддиметилацеталь (3 мл) и полученную смесь затем перемешивали при 80°C в течение 40 минут. Затем реакционную смесь концентрировали при пониженном давлении. К полученному остатку добавляли 1 M водный раствор гидроксида натрия (0,28 мл), гидроксиамин гидрохлорид (20 мг) и уксусную кислоту (1,8 мл) и полученную смесь затем перемешивали при комнатной температуре в течение 20 часов и затем перемешивали при 60°C в течение 4 часов. Затем реакционную смесь перемешивали при комнатной температуре в течение 15 часов. Затем реакционную смесь концентрировали при пониженном давлении и полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат) с получением представляющего интерес продукта (32 мг, выход: 20%).
ESI-MS m/z 536(MH+)
[0243]
Пример 47(5) N-(3-(3-(1,2,4-Оксадиазол-5-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 47)
Дихлорметан (1 мл) и TFA (0,30 мл) добавляли к соединению 47(4) (27 мг) и полученную смесь затем перемешивали при комнатной температуре в течение 20 минут. Затем реакционную смесь концентрировали при пониженном давлении. К этанольному раствору (1 мл) полученного остатка добавляли диизопропилэтиламин (25 мкл) и полученную смесь затем охлаждали до 0°C. Затем к реакционной смеси добавляли акрилоилхлорид (5 мкл) и полученную смесь затем перемешивали в течение 10 минут. Затем к реакционной смеси добавляли насыщенный солевой раствор и полученную смесь затем экстрагировали хлороформом. Экстракт сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (хлороформ:метанол) с получением соответствующего акриламидного продукта. Полученный акриламидный продукт подвергали последующему взаимодействию без дополнительной очистки. К полученному акриламидному продукту последовательно добавляли ТГФ (0,5 мл), метанол (0,5 мл) и 2 M водный раствор гидроксида натрия (0,3 мл) и полученную смесь затем перемешивали при комнатной температуре в течение 1 часа. Затем к реакционной смеси добавляли насыщенный водный раствор хлорида аммония и полученную смесь затем экстрагировали хлороформом. Экстракт сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали препаративной тонкослойной хроматографией (хлороформ:метанол) с получением указанного в заголовке соединения (2 мг, выход: 12%).
1H ЯМР(DMSO-d6) δ: 12,59 (шир.с, 1H), 11,71 (шир.с, 1H), 8,28 (д, J=5,1 Гц, 1H), 8,23 (д, J=2,9 Гц, 1H), 8,15 (д, J=6,6 Гц, 1H), 7,01 (д, J=5,1 Гц, 1H), 6,30(дд, J=10,1, 17,0 Гц, 1H), 6,10 (дд, J=2,2, 17,0 Гц, 1H), 5,59-5,54 (м, 2H), 4,16-4,07 (м, 1H), 2,58 (дд, J=4,0, 16,5 Гц, 1H), 2,22 (шир.с, 3H), 1,87-1,80 (м, 1H), 1,38-1,31 (м, 1H)
ESI-MS m/z 336(MH+)
[0244]
Пример 48
Пример 48(1) 4-Хлор-1-((2-(триметилсилил)этокси)метил)-1H-пирроло[2,3-b]пиридин-3-карбальдегид (Соединение 48(1))
DMF (78 мл) добавляли к 4-хлор-1H-пирроло[2,3-b]пиридин-3-карбальдегиду (1,41 г) и полученную смесь затем охлаждали до 0°C. Затем к реакционной смеси добавляли 60% гидрид натрия (625 мг) и полученную смесь затем перемешивали в течение 30 минут. Затем к реакционной смеси добавляли 2-(хлорметокси)этилтриметилсилан (2,07 мл) и полученную смесь затем перемешивали в течение 1 часа. Затем к реакционной смеси добавляли насыщенный водный раствор хлорида аммония и полученную смесь затем экстрагировали этилацетатом. Собранный органический слой последовательно промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия, с последующим концентрированием под вакуумом. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат) с получением представляющего интерес продукта (2,03 г, выход: 84%).
ESI-MS m/z 311(MH+)
[0245]
Пример 48(2) трет-Бутил (3-(3-формил-1-((2-(триметилсилил)этокси)метил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)карбамат (Соединение 48(2))
1,4-Диоксан (15 мл) и 2 M водный раствор карбоната натрия (4,5 мл) добавляли к соединению 48(1) (1,4 г), соединению Ссылочного Примера 1(2a) (2,19 г) и Pd(PPh3)4 (520 мг). В атмосфере азота смесь перемешивали при 90°C в течение 14 часов. Затем к реакционной смеси добавляли воду и полученную смесь затем экстрагировали этилацетатом. Собранный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат) с получением представляющего интерес продукта (1,78 г, выход: 84%).
1H ЯМР(CDCl3) δ: 10,06 (с, 1H), 8,35 (д, J=4,8 Гц, 1H), 8,09 (с, 1H), 7,03 (д, J=4,8 Гц, 1H), 5,81 (с, 1H), 5,74 (с, 2H), 5,37 (шир.с, 1H), 4,10-4,02 (м, 1H), 3,61 (дд, J=7,7, 8,8 Гц, 2H), 2,82-2,65 (м, 1H), 2,47-2,21 (м, 3H), 1,98-1,76 (м, 2H), 1,47 (с, 9H), 0,98-0,89 (м, 2H), -0,03 (с, 6H)
ESI-MS m/z 472(MH+)
[0246]
Пример 48(3) трет-Бутил (3-(3-(оксазол-5-ил)-1-((2-(триметилсилил)этокси)метил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)карбамат (Соединение 48(3))
Метанол (2,5 мл), п-толуолсульфонилметилизоцианид (65 мг) и карбонат калия (46 мг) добавляли к соединению 48(2) (120 мг) и полученную смесь затем перемешивали при нагревании до температуры кипения с обратным холодильником в течение 28 часов. Затем реакционную смесь концентрировали при пониженном давлении и полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат) с получением представляющего интерес продукта (54 мг, выход: 42%).
1H ЯМР(CDCl3) δ: 8,35 (д, J=4,8 Гц, 1H), 8,00 (с, 1H), 7,57 (с, 1H), 7,08 (с, 1H), 6,98 (д, J=4,8 Гц, 1H), 5,73 (с, 2H), 5,53 (шир.с, 1H), 4,71 (шир.с, 1H), 3,95 (шир.с, 1H), 3,64-3,58 (м, 2H), 2,76 (д, J=16,9 Гц, 1H), 2,25-1,99 (м, 3H), 1,93-1,79 (м, 1H), 1,62 (д, J=7,0 Гц, 1H), 1,47 (с, 9H), 0,98-0,91 (м, 2H), -0,04 (с, 9H)
ESI-MS m/z 511(MH+)
[0247]
Пример 48(4) N-(3-(3-(Оксазол-5-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 48)
ТГФ (2 мл) и раствор 1,0 M тетрабутиламмонийфторида в ТГФ (1 мл) добавляли к соединению 48(3) (52 мг) и полученную смесь затем перемешивали при 60°C в течение 21 часов. Затем к реакционной смеси добавляли 0,067 M фосфатный буферный раствор (pH 7,4) и полученную смесь затем экстрагировали этилацетатом. Собранный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат) с получением соответствующего продукта, защитная группа которого удалена. Полученный продукт, у которого была удалена защитная группа, подвергали последующему взаимодействию без дополнительной очистки.
К полученному продукту, у которого была удалена защитная группа, добавляли метанольный раствор (2 мл) и раствор 4 M хлористоводородной кислоты в 1,4-диоксане (1 мл) и полученную смесь затем перемешивали при комнатной температуре в течение 1 часа. Затем реакционную смесь концентрировали при пониженном давлении. К раствору полученного остатка в дихлорметане (3 мл) добавляли диизопропилэтиламин (0,15 мл) и полученную смесь затем охлаждали до 0°C. К реакционной смеси добавляли акрилоилхлорид (15 мкл) и полученную смесь затем перемешивали в течение 30 минут. Затем к реакционной смеси добавляли водный раствор аммиака и полученную смесь затем перемешивали при комнатной температуре в течение 2 часов. Затем реакционную смесь экстрагировали хлороформом и собранный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (хлороформ:метанол) с получением указанного в заголовке соединения (13 мг, выход: 38%).
1H ЯМР(CDCl3) δ: 8,29 (д, J=4,8 Гц, 1H), 7,97 (с, 1H), 7,56 (с, 1H), 7,05 (с, 1H), 6,96 (д, J=4,8 Гц, 1H), 6,31 (дд, J=1,5, 16,9 Гц, 1H), 6,13 (дд, J=9,9, 16,9Гц, 1H), 5,91-5,81 (м, 1H), 5,66 (дд, J=1,5, 9,9 Гц, 1H), 5,60 (шир.с, 1H), 4,34-4,26 (м, 1H), 2,75 (д, J=18,7 Гц, 1H), 2,24-2,04 (м, 3H), 2,00-1,82 (м, 1H), 1,68-1,54 (м, 1H)
ESI-MS m/z 335(MH+)
[0248]
Пример 49
Пример 49(1) 4-(5-((трет-Бутоксикарбонил)амино)циклогекс-1-ен-1-ил)-1-((2-(триметилсилил)этокси)метил)-1H-пирроло[2,3-b]пиридин-3-карбоновая кислота (Соединение 49(1))
трет-Бутанол (30 мл) и 2-метил-2-бутен (5,4 мл) добавляли к соединению 48(2) (1,24 г) и затем к полученной смеси добавляли водный раствор (12 мл) хлорита натрия (2,88 г) и дигидрофосфат натрия (2,23 г) при охлаждении на льду. Полученную смесь перемешивали в течение 1,5 часов. Затем реакционную смесь концентрировали при пониженном давлении и затем экстрагировали хлороформом. Собранный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат) с получением представляющего интерес продукта (1,15 г, выход: 90%).
1H ЯМР(DMSO-d6) δ: 12,18 (с, 1H), 8,31 (с, 1H), 8,28 (д, J=4,8 Гц, 1H), 6,99 (д, J=4,8 Гц, 1H), 6,80 (д, J=7,7 Гц, 1H), 5,67 (с, 2H), 5,54-5,50 (м, 1H), 3,87- 3,67 (м, 1H), 3,60-3,50 (м, 2H), 2,47-2,34 (м, 1H), 2,24-2,08 (м, 3H), 1,97-1,77 (м, 1H), 1,62-1,42 (м, 1H), 1,40-1,35 (м, 9H), 0,85-0,79 (м, 2H), -0,09 - -0,11 (м, 9H)
ESI-MS m/z 488(MH+)
[0249]
Пример 49(2) трет-Бутил (3-(3-(гидразинкарбонил)-1-((2-(триметилсилил)этокси)метил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)карбамат (Соединение 49(2))
DMF (6 мл), HATU (975 мг) и диизопропилэтиламин (0,15 мл) добавляли к соединению 49(1) (300 мг) и полученную смесь затем перемешивали в течение 10 минут. Затем к реакционной смеси добавляли гидразин моногидрат (0,18 мл) и полученную смесь затем перемешивали в течение 15 минут. Затем к реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и полученную смесь затем экстрагировали этилацетатом. Собранный органический слой последовательно промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия, с последующим концентрированием под вакуумом. Полученный остаток очищали хроматографией на силикагеле (хлороформ:метанол) с получением представляющего интерес продукта (283 мг, выход: 92%).
1H ЯМР(CDCl3) δ: 8,32 (д, J=4,8 Гц, 1H), 7,84 (с, 1H), 7,44 (шир.с, 1H), 6,96 (д, J=4,8 Гц, 1H), 5,91 (шир.с, 1H), 5,69 (с, 2H), 5,65-5,56 (м, 1H), 4,51-4,20 (м, 2H), 4,09-4,00 (м, 1H), 3,60-3,54 (м, 2H), 2,80-2,52 (м, 1H), 2,43-2,23 (м, 2H), 2,20-2,09 (м, 1H), 1,89-1,79 (м, 2H), 1,46 (с, 9H), 0,97-0,88 (м, 2H), -0,05 (с, 9H)
ESI-MS m/z 502(MH+)
[0250]
Пример 49(3) трет-Бутил (3-(3-(1,3,4-оксадиазол-2-ил)-1-((2-(триметилсилил)этокси)метил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)карбамат (Соединение 49(3))
Триэтилортоформиат (2 мл) добавляли к соединению 49(2) (283 мг) и полученную смесь затем перемешивали при нагревании до температуры кипения с обратным холодильником в течение 1,5 часов. Затем реакционную смесь концентрировали при пониженном давлении и полученный остаток затем очищали хроматографией на силикагеле (метанол:хлороформ) с получением представляющего интерес продукта (250 мг, выход: 87%).
1H ЯМР(CDCl3) δ: 8,50 (с, 1H), 8,38 (д, J=5,1 Гц, 1H), 8,03 (с, 1H), 7,04 (д, J=5,1 Гц, 1H), 5,77 (с, 2H), 5,57-5,47 (м, 2H), 4,15-4,03 (м, 1H), 3,64-3,58 (м, 2H), 2,92-2,78 (м, 1H), 2,36-2,26 (м, 1H), 2,17-2,09 (м, 2H), 1,90-1,70 (м, 2H), 1,50-1,44 (м, 9H), 0,98-0,88 (м, 2H), -0,04 (с, 9H)
ESI-MS m/z 512(MH+)
[0251]
Пример 49(4) N-(3-(3-(1,3,4-Оксадиазол-2-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 49)
ТГФ (5 мл) и раствор 1 M тетрабутиламмонийфторида в ТГФ (3 мл) добавляли к соединению 49(3) (240 мг) и полученную смесь затем перемешивали при 60°C в течение 16 часов. Затем к реакционной смеси добавляли 0,067 M фосфатный буферный раствор (pH 7,4) и полученную смесь затем экстрагировали этилацетатом. Собранный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (метанол:хлороформ) с получением соответствующего продукта, защитная группа которого удалена. Полученный продукт, у которого была удалена защитная группа, подвергали последующему взаимодействию без дополнительной очистки.
К полученному продукту, у которого была удалена защитная группа, добавляли гексафторизопропанол (1,5 мл) и полученную смесь затем перемешивали в микроволновой печи при 145°C в течение 1,5 часов. Затем реакционную смесь концентрировали при пониженном давлении. К этанольному раствору (4 мл) полученного остатка добавляли диизопропилэтиламин (0,11 мл) и полученную смесь затем охлаждали до 0°C. К реакционной смеси добавляли акрилоилхлорид (32 мкл) и полученную смесь затем перемешивали в течение 5 минут. Затем к реакционной смеси добавляли водный раствор аммиака и полученную смесь затем перемешивали при комнатной температуре в течение 5 минут. Затем реакционную смесь экстрагировали хлороформом и собранный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (хлороформ:метанол) с получением указанного в заголовке соединения (43 мг, выход: 28%).
1H ЯМР(DMSO-d6) δ: 12,64 (шир.с, 1H), 9,29 (с, 1H), 8,31 (д, J=5,1 Гц, 1H), 8,21 (с, 1H), 8,19 (д, J=7,7 Гц, 1H), 7,05 (д, J=5,1 Гц, 1H), 6,34 (дд, J=10,3, 16,9 Гц, 1H), 6,10 (дд, J=2,2, 16,9 Гц, 1H), 5,58 (дд, J=2,2, 10,3 Гц, 1H), 5,42-5,36 (м, 1H), 4,16-4,04 (м, 1H), 2,71-2,58 (м, 1H), 2,30-2,20 (м, 1H), 2,07-1,99 (м, 2H), 1,86-1,75 (м, 1H), 1,65-1,51 (м, 1H)
ESI-MS m/z 336(MH+)
[0252]
Пример 50 N-(3-(3-(5-Метил-1,3,4-оксадиазол-2-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 50)
Указанное в заголовке соединение получали в соответствии с Примером 49, за исключением того, что использовали триэтилортоацетат вместо триэтилортоформиата.
1H ЯМР(CDCl3) δ: 10,90 (шир.с, 1H), 8,44 (д, J=8,8 Гц, 1H), 8,39 (д, J=5,1 Гц,1H), 8,02 (с, 1H), 7,08 (д, J=5,1 Гц, 1H), 6,71 (дд, J=10,3, 16,9 Гц, 1H), 6,37(дд, J=2,0, 16,9 Гц, 1H), 5,63-5,58 (м, 2H), 4,82-4,66 (м, 1H), 2,96 (тдд, J=2,3, 4,4, 17,0 Гц, 1H), 2,63 (с, 3H), 2,35 (д, J=17,2 Гц, 1H), 2,29-1,97 (м, 3H), 1,85-1,69 (м, 1H)
ESI-MS m/z 350(MH+)
[0253]
Пример 51 N-(3-(3-(5-Этил-1,3,4-оксадиазол-2-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 51)
Указанное в заголовке соединение получали в соответствии с Примером 49, за исключением того, что использовали триэтилортопропионат вместо триэтилортоформиата.
1H ЯМР(CDCl3) δ: 11,42 (шир.с, 1H), 8,49 (д, J=8,4 Гц, 1H), 8,40 (д, J=5,1 Гц,1H), 8,05 (с, 1H), 7,08 (д, J=5,1 Гц, 1H), 6,77 (дд, J=10,3, 16,9 Гц, 1H), 6,37(дд, J=2,2, 16,9 Гц, 1H), 5,64-5,58 (м, 2H), 4,79-4,67 (м, 1H), 2,99-2,91(м, 3H), 2,37 (д, J=17,2 Гц, 1H), 2,31-2,01 (м, 3H), 1,81-1,69 (м, 1H), 1,47 (т, J=7,5 Гц, 3H)
ESI-MS m/z 364(MH+)
[0254]
Пример 52
Пример 52(1) трет-Бутил (3-(3-(5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)-1-((2-(триметилсилил)этокси)метил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)карбамат (Соединение 52(1))
ТГФ (3 мл) добавляли к соединению 49(2) (282 мг) и полученную смесь затем охлаждали до 0°C. К реакционной смеси добавляли карбонилдиимидазол (273 мг) и триэтиламин (1 мл) и полученную смесь затем перемешивали при комнатной температуре в течение 2 часов. Затем к реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и полученную смесь затем экстрагировали этилацетатом. Собранный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (метанол:хлороформ) с получением представляющего интерес продукта (270 мг, выход: 91%).
1H ЯМР(CDCl3) δ: 10,76 (шир.с, 1H), 9,15 (шир.с, 1H), 8,37 (д, J=5,1 Гц, 1H),7,97 (с, 1H), 7,44 (д, J=7,0 Гц, 1H), 7,01 (д, J=4,8 Гц, 1H), 6,44 (шир.с, 1H), 5,74 (с, 2H), 5,59 (д, J=5,1 Гц, 1H), 4,28-3,88 (м, 1H), 3,63-3,57 (м, 2H), 2,93-2,74 (м, 1H), 2,53-1,87 (м, 4H), 1,54-1,46 (м, 10H), 0,95 (дд, J=7,5, 9,0 Гц, 2H), -0,04 (с, 9H)
ESI-MS m/z 528(MH+)
[0255]
Пример 52(2) N-(3-(3-(5-Оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 52)
Указанное в заголовке соединение получали в соответствии с Примером 49(4), за исключением того, что использовали соединение 52(1) вместо соединения 49(3).
1H ЯМР(DMSO-d6) δ: 12,49 (шир.с, 1H), 12,29 (шир.с, 1H), 8,28 (д, J=5,1 Гц, 1H), 8,10 (д, J=7,7 Гц, 1H), 8,05 (с, 1H), 7,03 (д, J=5,1 Гц, 1H), 6,26 (дд, J=10,6, 16,9 Гц, 1H), 6,09 (дд, J=1,8, 16,9 Гц, 1H), 5,64-5,50 (м, 2H), 4,16-3,98 (м, 1H), 2,60 (дд, J=4,9, 16,3 Гц, 1H), 2,31-2,08 (м, 3H), 1,95-1,80 (м, 1H), 1,68-1,53 (м, 1H)
ESI-MS m/z 352(MH+)
[0256]
Пример 53
Пример 53(1) трет-Бутил (3-(3-(4-метил-5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)-1-((2-(триметилсилил)этокси)метил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)карбамат (Соединение 53(1))
DMF (1,2 мл) и карбонат калия (37 мг) добавляли к соединению 52(1) (131 мг) и полученную смесь затем перемешивали в течение 15 минут. Затем к реакционной смеси добавляли иодметан (0,015 мл) и полученную смесь затем перемешивали при комнатной температуре в течение 20 минут. Затем к реакционной смеси добавляли воду и полученную смесь затем экстрагировали этилацетатом. Собранный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (метанол:хлороформ) с получением представляющего интерес продукта (120 мг, выход: 89%).
1H ЯМР(CDCl3) δ: 8,36 (д, J=4,8 Гц, 1H), 7,93 (с, 1H), 7,02 (д, J=4,8 Гц, 1H), 5,73 (с, 2H), 5,69-5,65 (м, 1H), 5,12 (д, J=8,8 Гц, 1H), 4,24-4,08 (м, 1H), 3,62-3,51 (м, 5H), 2,94-2,77 (м, 1H), 2,33-2,16 (м, 3H), 2,02-1,87 (м, 1H), 1,82-1,69 (м, 1H), 1,45 (с, 9H), 0,97-0,90 (м, 2H), -0,04 (с, 9H)
ESI-MS m/z 542(MH+)
[0257]
Пример 53(2) N-(3-(3-(4-Метил-5-оксо-4,5-дигидро-1,3,4-оксадиазол-2-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 53)
Указанное в заголовке соединение получали в соответствии с Примером 49(4), за исключением того, что использовали соединение 53(1) вместо соединения 49(3).
1H ЯМР(DMSO-d6) δ: 12,56 (шир.с, 1H), 8,28 (д, J=4,8 Гц, 1H), 8,13-8,08 (м, 2H), 7,01 (д, J=4,8 Гц, 1H), 6,23 (дд, J=10,3, 17,2 Гц, 1H), 6,08 (дд, J=2,6, 17,2 Гц, 1H), 5,62-5,53 (м, 2H), 4,29-3,96 (м, 1H), 3,43 (с, 3H), 2,62-2,52 (м, 1H), 2,33-2,13 (м, 3H), 1,90-1,86 (м, 1H), 1,69-1,50 (м, 1H)
ESI-MS m/z 366(MH+)
[0258]
Пример 54
Пример 54(1) трет-Бутил (3-(3-(1,3,4-тиадиазол-2-ил)-1-((2-(триметилсилил)этокси)метил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)карбамат (Соединение 54(1))
DMF (4 мл), HATU (624 мг) и диизопропилэтиламин (0,28 мл) добавляли к соединению 49(1) (200 мг) и полученную смесь затем перемешивали в течение 10 минут. Затем к реакционной смеси добавляли формогидразид (148 мг) и полученную смесь затем перемешивали в течение 30 минут. Затем к реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и полученную смесь затем экстрагировали этилацетатом. Собранный органический слой последовательно промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия, с последующим концентрированием под вакуумом. Полученный остаток очищали хроматографией на силикагеле (хлороформ:метанол) с получением ацилгидразидного продукта (166 мг, выход: 76%). К полученному ацилгидразидному продукту добавляли ТГФ (5 мл) и реагент Лоуссона (380 мг) и полученную смесь затем перемешивали при 60°C в течение 2 часов. Затем к реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия. Полученную смесь экстрагировали этилацетатом и сушили над безводным сульфатом натрия, с последующим концентрированием под вакуумом. Полученный остаток очищали хроматографией на силикагеле (метанол:хлороформ) с получением представляющего интерес продукта (19 мг, выход: 12%).
ESI-MS m/z 528(MH+)
[0259]
Пример 54(2) N-(3-(3-(1,3,4-Тиадиазол-2-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 54)
ТГФ (1 мл) и раствор 1,0 M тетрабутиламмонийфторида в ТГФ (0,29 мл) добавляли к соединению 54(1) (19 мг) и полученную смесь затем перемешивали при 60°C в течение 15 часов. Затем к реакционной смеси добавляли 0,067 M фосфатный буферный раствор (pH 7,4) и полученную смесь затем экстрагировали этилацетатом. Собранный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (метанол:хлороформ) с получением соответствующего соединения, защитная группа которого удалена. Полученное соединение, у которого была удалена защитная группа, подвергали последующему взаимодействию без дополнительной очистки.
К полученному продукту, у которого была удалена защитная группа, добавляли дихлорметан (0,5 мл) и TFA (1 мл) и полученную смесь затем перемешивали при комнатной температуре в течение 5 минут. Затем реакционную смесь концентрировали при пониженном давлении. Диизопропилэтиламин (3 мкл) добавляли к этанольному раствору (0,5 мл) полученного остатка и полученную смесь затем охлаждали до 0°C. К реакционной смеси добавляли акрилоилхлорид (0,6 мкл) и полученную смесь затем перемешивали в течение 5 минут. Затем к реакционной смеси добавляли водный раствор аммиака и полученную смесь затем перемешивали при комнатной температуре в течение 5 минут. Затем реакционную смесь экстрагировали хлороформом и собранный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (хлороформ:метанол) с получением указанного в заголовке соединения (1 мг, выход: 7%).
1H ЯМР(CDCl3) δ: 9,09 (с, 1H), 8,40 (д, J=5,1 Гц, 1H), 7,82 (с, 1H), 7,65 (д, J=8,4 Гц, 1H), 7,10 (д, J=5,1 Гц, 1H), 6,73 (дд, J=10,3, 17,2 Гц, 1H), 6,39 (дд, J=1,8, 17,2 Гц, 1H), 5,64 (дд, J=1,8, 10,3 Гц, 1H), 5,34 (шир.с, 1H), 4,78-4,62 (м, 1H), 3,02-2,98 (м, 1H), 2,36 (д, J=16,1 Гц, 1H), 2,12-1,82 (м, 3H), 1,47-1,29 (м, 1H)
ESI-MS m/z 352(MH+)
[0260]
Пример 55
Пример 55(1) 4-Хлор-1-тритил-1H-пирроло[2,3-b]пиридин-3-карбальдегид (Соединение 55(1))
DMF (50 мл) добавляли к 4-хлор-1H-пирроло[2,3-b]пиридин-3-карбальдегиду (1,81 г) и полученную смесь затем охлаждали до 0°C. Затем к реакционной смеси добавляли 60% гидрид натрия (1,2 г) и полученную смесь затем перемешивали в течение 30 минут. Затем к реакционной смеси добавляли тритилхлорид (5,02 г) и полученную смесь затем перемешивали при комнатной температуре в течение 40 минут. Затем реакционную смесь охлаждали до 0°C и к смеси последовательно добавляли лед и воду, с последующим перемешиванием в течение 30 минут. Затем реакционную смесь фильтровали и остаток затем промывали водой. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат) с получением представляющего интерес соединения (1,49 г, выход: 35%).
1H ЯМР(DMSO-d6) δ: 10,32 (с, 1H), 8,09 (с, 1H), 7,97 (д, J=5,1 Гц, 1H), 7,37-7,29 (м, 9H), 7,15-7,12 (м, 7H)
ESI-MS m/z 423(MH+)
[0261]
Пример 55(2) 4-Хлор-1-тритил-1H-пирроло[2,3-b]пиридин-3-карбоновая кислота (Соединение 55(2))
Представляющий интерес продукт (1,45 г, выход: 98%) получали в соответствии с Примером 49(1), за исключением того, что использовали соединение 55(1) вместо соединения 48(2).
1H ЯМР(DMSO-d6) δ: 12,38 (шир.с, 1H), 7,91-7,88 (м, 2H), 7,36-7,27 (м, 9H), 7,21 (д, J=5,1 Гц, 1H), 7,15-7,08 (м, 6H)
ESI-MS m/z 439(MH+)
[0262]
Пример 55(3) 4-Хлор-1-тритил-1H-пирроло[2,3-b]пиридин-3-карбогидразид (Соединение 55(3))
Представляющий интерес продукт (267 мг, выход: 86%) получали в соответствии с Примером 49(2), за исключением того, что использовали соединение 55(2) вместо соединения 49(1).
1H ЯМР(DMSO-d6) δ: 9,42 (с, 1H), 7,88 (д, J=5,1 Гц, 1H), 7,59 (с, 1H), 7,36-7,24 (м, 9H), 7,18-7,10 (м, 7H), 4,38 (д, J=4,0 Гц, 2H)
ESI-MS m/z 453(MH+)
[0263]
Пример 55(4) 2-(4-Хлор-1-тритил-1H-пирроло[2,3-b]пиридин-3-ил)-1,3,4-оксадиазол (Соединение 55(4))
Представляющий интерес продукт получали в соответствии с Примером 49(3), за исключением того, что использовали соединение 55(3) вместо соединения 49(2).
1H ЯМР(DMSO-d6) δ: 9,30 (с, 1H), 8,00 (д, J=5,1 Гц, 1H), 7,93 (с, 1H), 7,38-7,27 (м, 10H), 7,20-7,13 (м, 6H)
ESI-MS m/z 463(MH+)
[0264]
Пример 55(5) (S)-трет-Бутил (3-(3-(1,3,4-оксадиазол-2-ил)-1-тритил-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)карбамат (Соединение 55(5))
В атмосфере азота, 1-бутанол (43 мл) и воду (17 мл) добавляли к соединению 55(4) (850 мг), соединению Ссылочного Примера 3 (711 мг), ацетату палладия(II) (82 мг), 2-дициклогексилфосфино-2',6'-диметоксибифенилу (301 мг) и трикалий фосфату (780 мг) и полученную смесь затем перемешивали при 110°C в течение 42 часов. Затем к реакционной смеси добавляли насыщенный солевой раствор. Полученную смесь экстрагировали этилацетатом и сушили над безводным сульфатом натрия, с последующим концентрированием под вакуумом. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат) с получением представляющего интерес продукта (800 мг, выход: 70%).
1H ЯМР(CDCl3) δ: 8,46 (с, 1H), 8,00 (д, J=4,8 Гц, 1H), 7,85 (с, 1H), 7,31-7,27 (м, 9H), 7,24-7,16 (м, 6H), 6,85 (д, J=4,8 Гц, 1H), 5,54 (шир.с, 1H), 5,41 (д, J=8,1 Гц, 1H), 4,05 (шир.с, 1H), 2,88-2,76 (м, 1H), 2,36-2,22 (м, 1H), 2,12-2,07 (м, 2H), 1,89-1,70 (м, 2H), 1,47 (с, 9H)
ESI-MS m/z 624(MH+)
[0265]
Пример 55(6) (S)-N-(3-(3-(1,3,4-Оксадиазол-2-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 55)
TFA (1 мл) добавляли к соединению 55(5) (100 мг) и полученную смесь затем перемешивали при комнатной температуре в течение 30 минут. Затем реакционную смесь концентрировали при пониженном давлении. К полученному остатку добавляли 2 M водный раствор карбоната натрия и полученную смесь затем экстрагировали смешанным растворителем этанол/хлороформ. Экстракт сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. К полученному остатку добавляли Этанол (0,8 мл), воду (0,8 мл) и диизопропилэтиламин (54 мкл) и полученную смесь затем охлаждали до 0°C. К реакционной смеси добавляли акрилоилхлорид (14 мкл) и полученную смесь затем перемешивали в течение 5 минут. Затем к реакционной смеси добавляли насыщенный солевой раствор и полученную смесь затем экстрагировали хлороформом. Экстракт сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (хлороформ:метанол) с получением указанного в заголовке соединения (38 мг, выход: 70%).
1H ЯМР(DMSO-d6) δ: 12,64 (шир.с, 1H), 9,29 (с, 1H), 8,31 (д, J=5,1 Гц, 1H), 8,21 (с, 1H), 8,19 (д, J=7,7 Гц, 1H), 7,05 (д, J=5,1 Гц, 1H), 6,34 (дд, J=10,3, 16,9 Гц, 1H), 6,10 (дд, J=2,2, 16,9 Гц, 1H), 5,58 (дд, J=2,2, 10,3 Гц, 1H), 5,42-5,36 (м, 1H), 4,16-4,04 (м, 1H), 2,71-2,58 (м, 1H), 2,30-2,20 (м, 1H), 2,07-1,99 (м, 2H), 1,86-1,75 (м, 1H), 1,65-1,51 (м, 1H)
ESI-MS m/z 336(MH+)
[0266]
Пример 56 N-(3-(3-(1,3,4-Оксадиазол-2-ил)-1H-пирроло[2,3-b]пиридин-4-ил)хлоргекс-2-ен-1-ил)акриламид (Соединение 56)
1,4-Диоксан (2,4 мл) и воду (0,4 мл) добавляли к соединению 55(4) (100 мг), соединению Ссылочного Примера 1(2b) (98 мг), ацетату палладия(II) (4,8 мг), 2-дициклогексилфосфино-2',4',6'-триизопропилбифенилу (20,6 мг) и дикарбонату натрия (45,8 мг) и полученную смесь затем перемешивали при 130°C в течение 90 минут с использованием микроволнового реактора. Затем к реакционной смеси добавляли воду и полученную смесь затем экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (гексан:этилацетат) с получением продукта сочетания. Полученный продукт сочетания подвергали последующему взаимодействию без дополнительной очистки.
TFA (1 мл) добавляли к полученному продукту сочетания и полученную смесь затем перемешивали при комнатной температуре в течение 20 минут. Затем реакционную смесь концентрировали при пониженном давлении. Полученный остаток очищали хроматографией с основным силикагелем (хлороформ:метанол) с получением аминового продукта. Полученный аминовый продукт подвергали последующему взаимодействию без дополнительной очистки.
К полученному аминовому продукту добавляли метиленхлорид (2,0 мл) и диизопропилэтиламин (0,30 мл) и полученную смесь затем охлаждали до 0°C. К реакционной смеси добавляли акрилоилхлорид (0,022 мл) и полученную смесь затем перемешивали в течение 30 минут. Затем к реакционной смеси добавляли последовательно водный раствор аммиака, хлороформ и метанол и полученную смесь затем перемешивали при комнатной температуре в течение 1 часа. Затем реакционную смесь экстрагировали хлороформом и собранный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (хлороформ:метанол) с получением указанного в заголовке соединения (38,1 мг, выход: 66%).
1H ЯМР (CDCL3-CD3OD) δ: 8,52 (с, 1H), 8,32 (д, J=4,9 Гц, 1H), 8,04 (с, 1H), 7,03 (д, J=4,9 Гц, 1H), 6,41-6,27 (м, 2H), 5,72-5,61 (м, 2H), 4,76-4,65 (м, 1H), 2,32-2,22 (м, 2H), 2,04-1,82 (м, 3H), 1,80-1,67 (м, 1H)
ESI-MS m/z 336(MH+)
[0267]
Пример 57 N-(3-(3-(1,3,4-Оксадиазол-2-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклопент-3-ен-1-ил)акриламид (Соединение 57)
Указанное в заголовке соединение получали в соответствии с Примером 56, за исключением того, что использовали соединение Ссылочного Примера 2(2a) вместо соединения Ссылочного Примера 1(2b).
1H ЯМР (CDCL3-CD3OD) δ: 8,58 (с, 1H), 8,31 (д, J=4,9 Гц, 2H), 8,07 (с, 1H), 7,07 (д, J=4,9 Гц, 1H), 6,58-6,45 (м, 1H), 6,39-6,28 (м, 1H), 5,72-5,57 (м, 2H), 4,92-4,78 (м, 1H), 3,26-3,12 (м, 1H), 3,04-2,89 (м, 1H), 2,82-2,72 (м, 1H), 2,51-2,41 (м, 1H)
ESI-MS m/z 322(MH+)
[0268]
Пример 58 N-(3-(3-(1,3,4-Оксадиазол-2-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклопент-2-ен-1-ил)акриламид (Соединение 58)
Указанное в заголовке соединение получали в соответствии с Примером 56, за исключением того, что использовали соединение Ссылочного Примера 2(2b) вместо соединения Ссылочного Примера 1(2b).
1H ЯМР (CDCL3-CD3OD) δ: 8,60 (с, 1H), 8,32 (д, J=4,9 Гц, 1H), 8,08 (с, 1H), 7,09 (д, J=4,9 Гц, 1H), 6,47-6,28 (м, 2H), 5,72-5,60 (м, 2H), 5,27-5,17 (м, 1H), 2,94-2,83 (м, 1H), 2,70-2,45 (м, 2H), 2,02-1,91 (м, 1H)
ESI-MS m/z 322(MH+)
[0269]
Пример 59(1) 5-(4-Хлор-1-(фенилсульфонил)-1H-пирроло[2,3-b]пиридин-3-ил)изоксазол (Соединение 59(1))
Этанол (5 мл) добавляли к (E)-1-(4-хлор-1-(фенилсульфонил)-1H-пирроло[2,3-b]пиридин-3-ил)-3-(диметиламино)проп-2-ен-1-ону (250 мг) и гидрохлориду гидроксиамина (53 мг) и полученную смесь затем перемешивали при 80°C в течение 2 часов. Затем к реакционной смеси добавляли воду и полученную смесь затем экстрагировали этилацетатом. Экстракт сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученное твердое вещество промывали этилацетатом и диизопропиловым эфиром с получением представляющего интерес продукта (191 мг, выход: 83%).
1H-ЯМР (CDCl3) δ: 8,38 (д, J=5,5 Гц, 1H), 8,34 (д, J=1,8 Гц, 1H), 8,26 (д, J=8,4 Гц, 2H), 8,22 (с, 1H), 7,65 (т, J=7,7 Гц, 1H), 7,54 (дд, J=8,4, 7,7 Гц, 2H), 7,29 (д, J=5,5 Гц, 1H), 6,68 (д, J=1,8 Гц, 1H)
ESI-MS m/z 360(MH+)
[0270]
Пример 59(2) (S)-N-(3-(3-(Изоксазол-5-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид (Соединение 59)
Указанное в заголовке соединение получали в соответствии с Примером 45(3), за исключением того, что использовали соединение 59(1) вместо соединения 45(2).
1H-ЯМР (CDCl3) δ: 11,34 (шир.с, 1H), 8,36-8,29 (м, 2H), 7,68 (с, 1H), 7,04 (д, J=5,1 Гц, 1H), 6,55-6,43 (м, 2H), 6,40-6,31 (м, 2H), 5,67-5,63 (м, 1H), 5,51-5,46 (м, 1H), 4,66-4,57 (м, 1H), 2,98-2,88 (м, 1H), 2,37-2,28 (м, 1H), 2,16-2,08 (м, 1H), 1,96-1,75 (м, 3H)
ESI-MS m/z 335(MH+)
[0271]
Сравнительный пример 1
4-(Циклогекс-1-ен-1-ил)-1H-пирроло[2,3-b]пиридин
Соединение 30, описанное в Международной публикации № WO 2006/127587, синтезировали в соответствии со способом, описанным в этой публикации.
[0272]
Сравнительный пример 2
4-(Циклопент-1-ен-1-ил)-1H-пирроло[2,3-b]пиридин
Соединение 27, описанное в Международной публикации № WO 2006/127587, синтезировали в соответствии со способом, описанным в этой публикации.
Сравнительный пример 3
2-Метил-4-(5-фенил-1H-пирроло[2,3-b]пиридин-3-ил)тиазол
Соединение I-1, описанное в Международной публикации № WO 2006/004984, синтезировали в соответствии со способом, описанным в этой публикации.
[0273]
Далее показаны структурные формулы соединений, описанных в Примерах 1-59 и Сравнительных примерах 1-3.
[0274]
Таблица 2
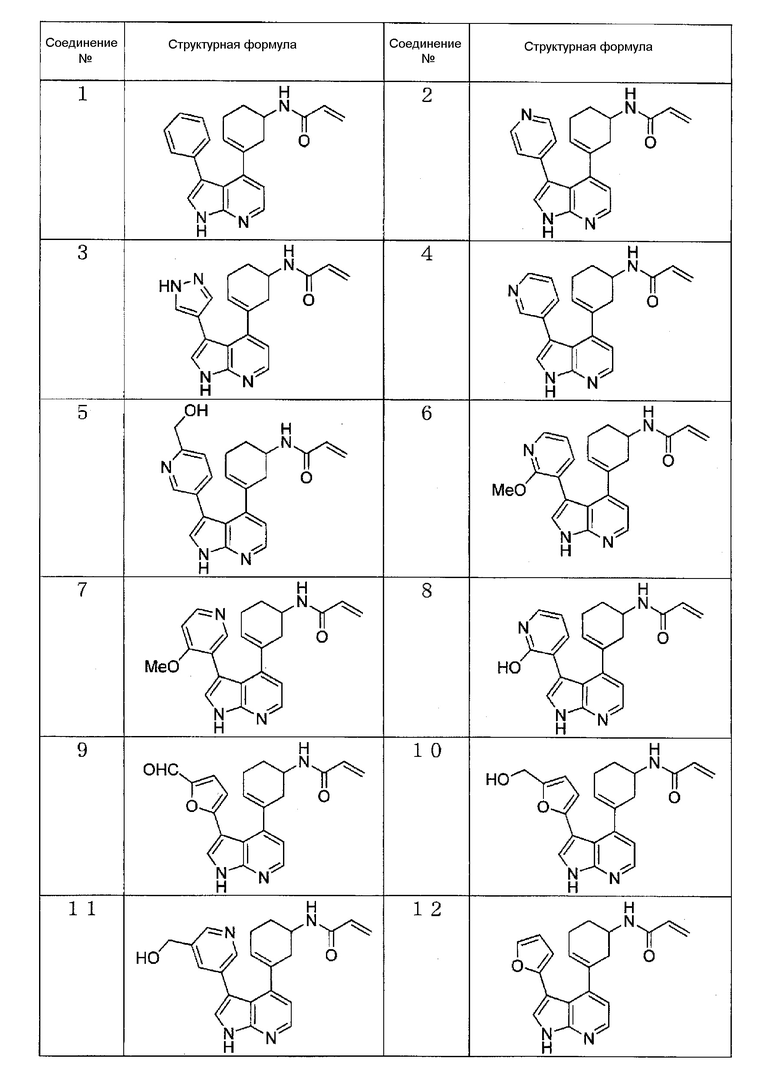
[0275]
Таблица 3
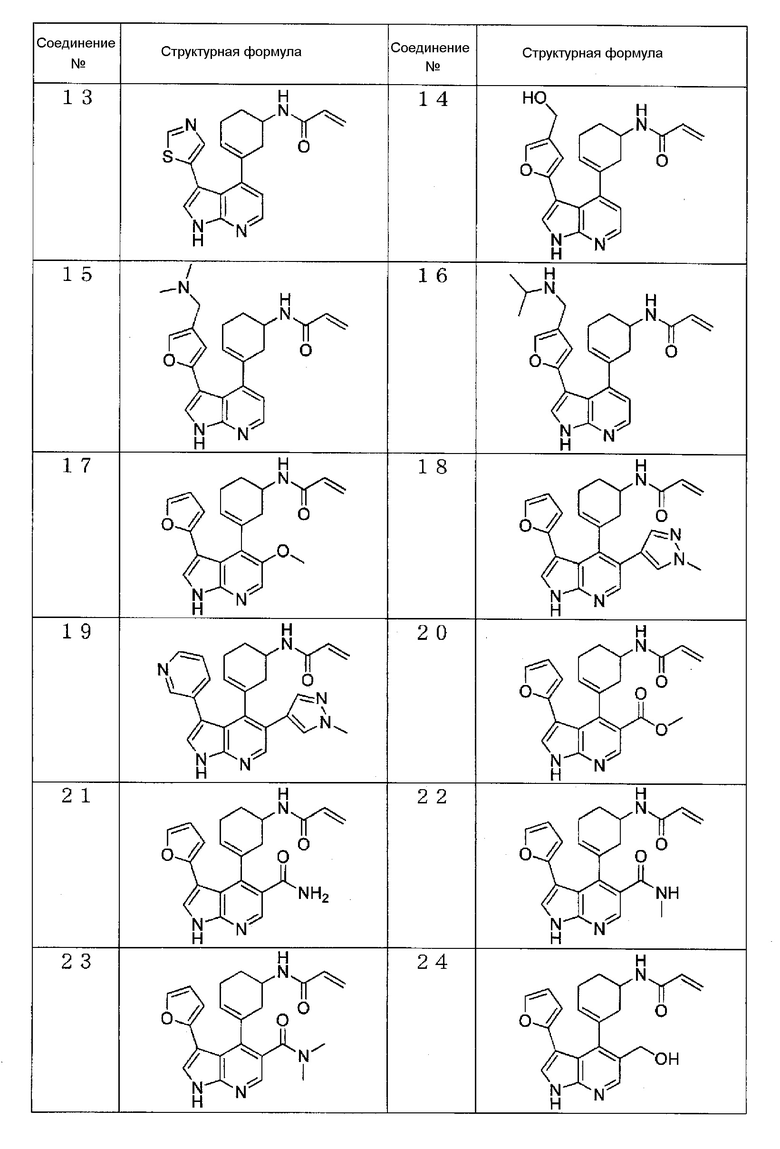
[0276]
Таблица 4
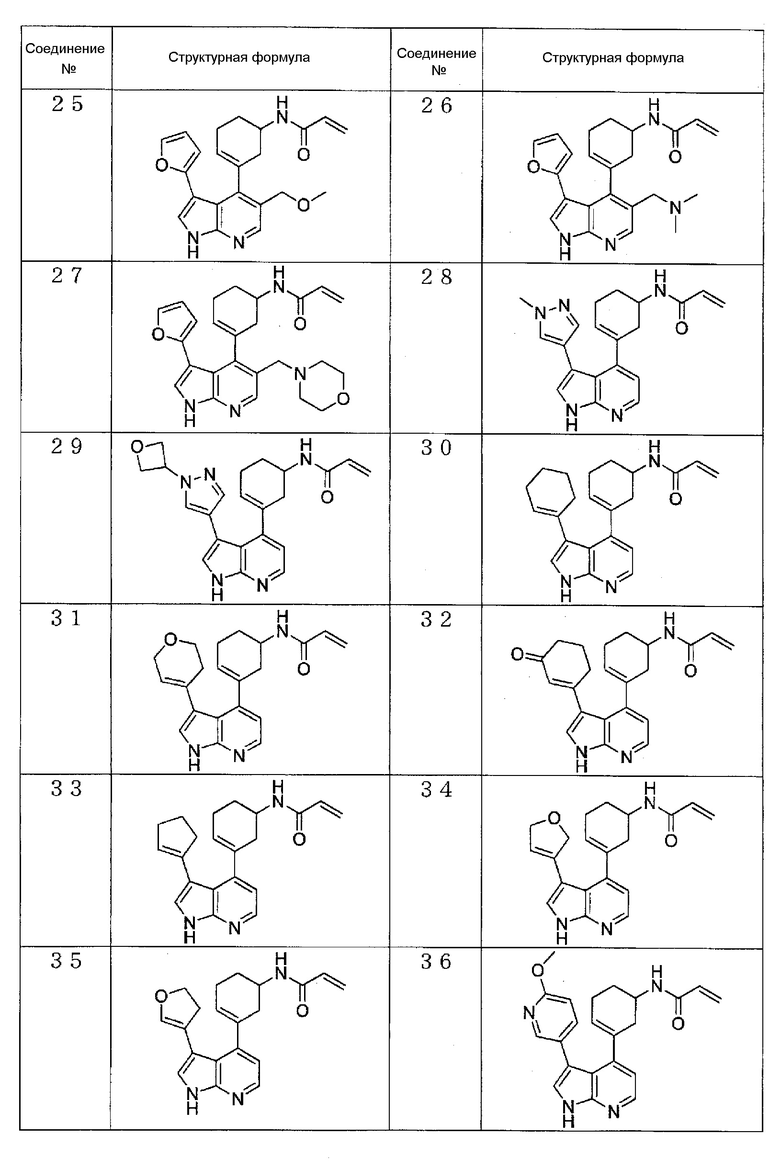
[0277]
Таблица 5
[0278]
Таблица 6
[0279]
[0280]
Примеры испытаний
Соединение в соответствии с настоящим изобретением оценивали с использованием следующих методов испытаний:
[0281]
Пример испытаний 1 Испытание ингибирования активностей различных JAK киназ (in vitro)
1) Измерение JAK1 киназа-ингибиторной активности
Измеряли активность соединения по настоящему изобретению, направленную на ингибирование активности JAK1 киназы.
Из материалов для измерения этой ингибиторной активности, пептидный субстрат и киназный белок получали следующим образом. В качестве такого пептидного субстрата закупали пептидный субстрат для набора для анализа QSS AssistTM JAK1-MSA (Carna Biosciences, Inc.). В качестве такого киназного белка закупали очищенный рекомбинатный человеческий JAK1 белок (Carna Biosciences, Inc.).
Способ для измерения ингибиторной активности представляет собой следующий. Сначала соединения по настоящему изобретению каждое растворяли в диметилсульфоксиде (DMSO) и затем получали серийные разведения с использованием DMSO. Затем полученный в результате серийного разведения раствор соединения (конечная концентрация DMSO после киназной реакции: 5,0%) или DMSO (конечная концентрация: 5,0%) смешивали с раствором, содержащим пептидный субстрат (конечная концентрация: 1 мкМ), хлорид магния (конечная концентрация: 5 мМ) и АТФ (конечная концентрация: 75 мкМ), в буфере для киназной реакции (20 мМ HEPES (pH 7,5), 2 мМ дитиотреитола и 0,01% Triton X-100). Затем JAK1 белок добавляли к смешанному раствору и полученную смесь затем инкубировали при 25°C в течение 120 минут для осуществления киназной реакции. К реакционному раствору добавляли EDTA до конечной концентрации 30 мМ, для завершения реакции. В завершение, с использованием LabChip EZ Reader II (Perkin Elmer Corp.) нефосфорилированный пептидный субстрат (S) и фосфорилированный пептид (P) подвергали микроканальному капиллярному элетрофорезу, чтобы отделить друг от друга два пептида и затем осуществить их детекцию. Количество реакции фосфорилирования определяли на основании высоты пиков S и P, и концентрацию соединения, способную ингибировать 50% реакции фосфорилирования, определяли как IC50 значение (нМ). Полученные данные показаны в таблице ниже.
[0282]
2) Измерение JAK2 киназа-ингибиторной активности
Измеряли активность соединения по настоящему изобретению, направленную на ингибирование активности JAK2 киназы.
Из материалов для измерения этой ингибиторной активности, пептидный субстрат и киназный белок получали следующим образом. В качестве такого пептидного субстрата закупали FL-Пептид 22 (Perkin Elmer Corp.). В качестве такого киназного белка закупали очищенный рекомбинатный человеческий JAK2 белок (Carna Biosciences, Inc.).
Способ для измерения ингибиторной активности представляет собой следующий. Сначала получали серийные разведения соединения по настоящему изобретению таким же способом, как описано выше в разделе, относящемся к JAK1. Этот полученный в результате серийного разведения раствор (конечная концентрация DMSO после киназной реакции: 5,0%) или DMSO (конечная концентрация: 5,0%) смешивали с раствором, содержащим пептидный субстрат (конечная концентрация: 1 мкМ), хлорид магния (конечная концентрация: 10 мМ) и АТФ (конечная концентрация: 10 мкМ), в буфере для киназной реакции (15 мМ Трис (pH 7,5), 2 мМ дитиотреитола и 0,01% Tween 20). Затем к смешанному раствору добавляли JAK2 белок и полученную смесь затем инкубировали при 25°C в течение 80 минут для осуществления киназной реакции. К реакционному раствору добавляли EDTA до конечной концентрации 30 мМ для завершения реакции. После завершения реакции осуществляли измерение и анализ данных такими же способами, как описанные выше в разделе, относящемся к JAK1.
[0283]
3) Измерение JAK3 киназа-ингибиторной активности
Измеряли активность соединения по настоящему изобретению, направленную на ингибирование активности JAK3 киназы.
Из материалов для измерения этой ингибиторной активности, пептидный субстрат и киназный белок получали следующим образом. В качестве такого пептидного субстрата закупали пептидный субстрат для набора для анализа QSS AssistTM JAK3-MSA (Carna Biosciences, Inc.). В качестве такого киназного белка закупали очищенный рекомбинатный человеческий JAK3 белок (Carna Biosciences, Inc.).
Способ для измерения ингибиторной активности представляет собой следующий. Сначала получали серийные разведения соединения по настоящему изобретению таким же способом, как описано выше в разделе, относящемся к JAK1. Этот полученный в результате серийного разведения раствор (конечная концентрация DMSO после киназной реакции: 5,0%) или DMSO (конечная концентрация: 5,0%) смешивали с раствором, содержащим пептидный субстрат (конечная концентрация: 1 мкМ), хлорид магния (конечная концентрация: 5 мМ) и АТФ (конечная концентрация: 5 мкМ), в буфере для киназной реакции (20 мМ HEPES (pH 7,5), 2 мМ дитиотреитола и 0,01% Triton X-100). Затем к смешанному раствору добавляли JAK3 белок и полученную смесь затем инкубировали при 25°C в течение 80 минут для осуществления киназной реакции. К реакционному раствору добавляли EDTA до конечной концентрации 30 мМ для завершения реакции. После завершения реакции осуществляли измерение и анализ данных такими же способами, как описанные выше в разделе, относящемся к JAK1.
В результате было обнаружено, что, как показано в Таблице 8 ниже, соединение по настоящему изобретению или его соль обладает более высокой JAK3-ингибиторной активностью, чем активность каждого из соединений, описанных в Патентной литературе 1 и 2, и обладает чрезвычайно высокой селективностью в отношении JAK3.
[0284]
[0285]
Пример испытаний 2 Испытание, касающееся роста мононуклеарных клеток периферической крови человека (PBMC)
Измеряли активность соединения по настоящему изобретению, направленную на ингибирование IL-2-зависимой реакции роста человеческих PBMC, вызываемой JAK3 (Arthritis Rheum. 2010; 62(8): 2283-93).
С использованием среды, содержащей 10 мкг/мл PHA-M (Sigma) (которая представляет собой RPMI-1640 (Sigma), содержащую 10% человеческую сыворотку типа AB (MP Biomedicals)), человеческие PBMC (C.T.L.) (плотность клеток: 1×106 клеток/мл), культивировали при 37°C в сосуде для культивирования, содержащем 5% диоксида углерода, в течение 3 дней. Затем культуру промывали при помощи RPMI-1640 четыре раза и к полученной культуре затем добавляли среду (RPMI-1640, содержащая 10% человеческую сыворотку типа AB) для получения клеточной суспензии. Клетки (1×104 клеток/лунка) и серийно разведенное соединение по настоящему изобретению добавляли в каждую лунку 96-луночного микропланшета с U-образным дном и полученную смесь затем культивировали при 37°C в сосуде для культивирования, содержащем 5% диоксида углерода, в течение 30 минут. После завершения культивирования к культуре добавляли рекомбинатный человеческий IL-2 (Peprotech) до конечной концентрации 2 нг/мл и полученную смесь затем пересмешивали при 37°C в сосуде для культивирования, содержащем 5% диоксида углерода, в течение 2 дней (1×104 клеток/100 мкл/каждая лунка). После завершения культивирования полученное вещество оставляли при комнатной температуре на 30 минут и затем добавляли 100 мкл CellTiter-Glo Luminescent Cell Viability Assay (Promega) с последующим перемешиванием. Затем реакционную смесь оставляли на 10 минут и затем измеряли количество люминесценции, происходящей из живых клеток в каждой лунке, с использованием считывающего устройства для микропланшетов (TECAN). Рассчитывали процент ингибирования соединением клеточного роста, вызванного IL-2 стимуляцией, и концентрацию соединения, способную ингибировать 50% клеточного роста, определяли как значение IC50 (нМ). Полученные данные показаны в таблице ниже.
[0286]
В результате было обнаружено, что соединение по настоящему изобретению или его соль обладает более сильным эффектом ингибирования роста PBMC, чем эффект каждого из соединений, описанных в Патентной литературе 1-3.
[0287]
[0288]
Пример испытаний 3 Терапевтический эффект на ревматоидный артрит
Использовали коллаген-индуцированный артрит, который представляет собой мышиную экспериментальную модель для ревматоидного артрита. Клинические симптомы артрита оценивали в баллах, полученные баллы использовали в качестве показателей, и было подтверждено действие соединения по настоящему изобретению при пероральном введении. Шестинедельным самцам DBA/1 мышей (Charles River Laboratories Japan, Inc.) вводили 100 мкл/животное раствор (эмульсию), который был получен путем смешивания 4 мг/мл раствора бычьего коллагена типа 2 (Collagen Research Center) с полным адъювантом Фрейнда (DIFCO) в равных количествах, через дорсальную внутрикожную инъекцию (первичная иммунизация). Через двадцать один день после первичной иммунизации мышам вводили 100 мкл/животное раствор (эмульсию), который был получен путем смешивания 4 мг/мл раствора бычьего коллагена типа 2 (Collagen Research Center) с неполным адъювантом Фрейнда (DIFCO) в равных количествах, через внутрикожную инъекцию в основание хвоста (бустер), чтобы индуцировать артрит (Arthritis Rheum 2010; 62 (8): 2283-93). Через семь дней после дня введения бустерной дозы (который определяют как День 0) соединение по настоящему изобретению постоянно вводили мышам в течение 13 дней путем перорального введения два раза в день. В День 7, День 9, День 12, День 15 и День 19 клинические симптомы артрита оценивали в баллах путем наблюдения невооруженным глазом, и затем было подтверждено действие соединения по настоящему изобретению. Клинические симптомы для каждой конечности оценивали в баллах (0: без изменений, 1: один опухший палец, 2: два или более опухших пальца, 3: опухшая плюсна, 4: опухание всех пальцев, а также опухший кистевой сустав или голеностопный сустав) и общий балл, полученный из оценки четырех конечностей, использовали в качесте оценки индивидуальной мыши (наивысший балл: 16).
В результате было обнаружено, что соединение по настоящему изобретению показало отличный терапевтический эффект на ревматоидный артрит.
[0289]
Пример испытаний 4 Терапевтический эффект на рассеянный склероз
Использовали экспериментальный аутоиммунный энцефаломиелит, который представляет собой мышиную экспериментальную модель для рассеянного склероза. Восьми-недельным самцам SJL/J мышей (Charles River Laboratories Japan, Inc.) вводили смешанный раствор (эмульсию), который был получен путем смешивания изотонического водного раствора (1 мг/мл) пептида (Toray Research Center, Inc.), соответствующего 139-151 остаткам протеолипидного белка, с полным адъювантом Фрейнда (DIFCO), содержащим 4 мг/мл убитой Mycobacterium tuberculosis (H37Ra), в равных количествах, через внутрикожную инъекцию в количестве 100 мкл каждая в два участка дорсальной части каждой мыши, чтобы вызвать энцефаломиелит. Через семь дней после дня иммунизации (который определяют как День 0) соединение по настоящему изобретению постоянно вводили мышам в течение 4 недель путем перорального введения два раза в день. В День 0, День 2, День 5 и Дни 7-35 клинические симптомы энцефаломиелита наблюдали невооруженным глазом, и затем было подтверждено действие соединения по настоящему изобретению. Наблюдаемые клинические симптомы оценивали в баллах (0: отсутствие симптомов, 1: ослабленный хвост, 1,5: полное опущение хвоста, 2: атаксия, 3: легкий паралич задних конечностей, 3,5: легкий паралич задних конечностей, 4: полный паралич задних конечностей, 4,5: паралич четырех конечностей, умирание, 5: смерть).
В результате было обнаружено, что соединение по настоящему изобретению показало отличный терапевтический эффект на рассеянный склероз.
[0290]
Пример испытаний 5 Оценка всасываемости при пероральном введении
Соединение по настоящему изобретению суспендировали или растворяли в 0,5% HPMC и полученную суспензию или раствор вводили BALB/cA мышам путем перорального введения. Через 0,5, 1, 2, 4 и 6 часов после завершения перорального введения кровь собирали из глазного дна каждой мыши для получения плазмы. Концентрацию соединения в полученной плазме измеряли при помощи ЖХМС и затем оценивали всасываемость при пероральном введении.
В результате было обнаружено, что после завершения перорального введения соединение по настоящему изобретению присутствовало в достаточной концентрации в плазме, и что соединение показало хорошую всасываемость при пероральном введении.
| название | год | авторы | номер документа |
|---|---|---|---|
| АЗАБИЦИКЛОСОЕДИНЕНИЕ И ЕГО СОЛЬ | 2010 |
|
RU2565078C2 |
| ПРОИЗВОДНЫЕ 1-ФЕНИЛ-2-ПИРИДИНИЛАЛКИЛЬНЫХ СПИРТОВ В КАЧЕСТВЕ ИНГИБИТОРОВ ФОСФОДИЭСТЕРАЗЫ | 2012 |
|
RU2626956C2 |
| ПРОИЗВОДНЫЕ 2-ИМИНОПИРРОЛИДИНА | 2002 |
|
RU2270192C2 |
| КОНДЕНСИРОВАННОЕ ХИНОЛИНОВОЕ ПРОИЗВОДНОЕ И ЕГО ПРИМЕНЕНИЕ | 2005 |
|
RU2384571C2 |
| МОДУЛЯТОРЫ АТФ-СВЯЗЫВАЮЩИХ ТРАНСПОРТЕРОВ | 2010 |
|
RU2552353C2 |
| ЗАМЕЩЕННЫЕ ПИРРОЛЫ, АКТИВНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗ | 2013 |
|
RU2666538C2 |
| 5-ФТОРПИРИМИДИНОВЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ФУНГИЦИДОВ | 2009 |
|
RU2522430C2 |
| ЗАМЕЩЕННЫЕ ПУРИНОВЫЕ И 7-ДЕАЗАПУРИНОВЫЕ СОЕДИНЕНИЯ | 2011 |
|
RU2606514C2 |
| ТРИЦИКЛИЧЕСКИЕ ПИРРОЛО ПРОИЗВОДНЫЕ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗЫ | 2012 |
|
RU2591191C2 |
| ИНГИБИТОРЫ БРОМДОМЕНА | 2012 |
|
RU2671571C1 |
Изобретение относится к азаиндольному производному формулы (1)или его соли:
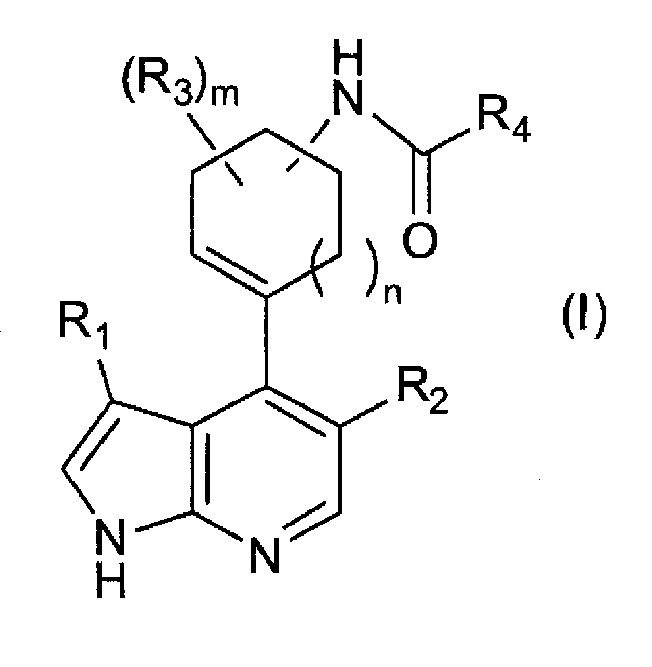 ,
,
где R1 представляет собой циклопентенильную группу; циклогексенильную группу; фенильную группу; фуранильную группу, которая необязательно замещена группой, выбранной из группы, состоящей из формильной группы и C1-C6 алкильной группы (которая необязательно замещена группой, выбранной из группы, состоящей из гидроксигруппы и ди- или моно-(C1-C6 алкил)аминогруппы); 1H-пиразолильную группу, которая необязательно замещена группой, выбранной из группы, состоящей из C1-C6 алкильной группы и оксетанильной группы; тиазолильную группу; оксазолильную группу; изоксазолильную группу; 1,3,4-тиадиазолильную группу; 1,2,4-оксадиазолильную группу; 1,3,4-оксадиазолильную группу, которая необязательно замещена C1-C6 алкильной группой; пиридильную группу, которая необязательно замещена группой, выбранной из группы, состоящей из атома галогена, аминогруппы, гидроксигруппы, N-оксидной группы, C1-C6 алкильной группы (которая необязательно замещена гидроксигруппой) и C1-C6 алкоксигруппы (которая необязательно замещена атомом галогена); дигидропиранильную группу; дигидрофуранильную группу; или 4,5-дигидро-1,3,4-оксадиазолильную группу, которая необязательно замещена группой, выбранной из группы, состоящей из оксогруппы и C1-C6 алкильной группы, R2 представляет собой атом водорода; цианогруппу; (C1-C6 алкокси)карбонильную группу; карбамоильную группу; ди- или моно-(C1-C6 алкил)карбамоильную группу; C1-C6 алкильную группу, которая необязательно замещена группой, выбранной из группы, состоящей из гидроксигруппы, C1-C6 алкокси группы, ди- или моно-(C1-C6 алкил)аминогруппы и морфолинильной группы; C1-C6 алкоксигруппу; или пиразолильную группу, которая необязательно замещена C1-C6 алкильной группой, m имеет значение 0, n имеет значение 0 или 1, R4 представляет собой C2-C6 алкенильную группу, и в формуле (I) следующая структура:
представляет собой любую из следующих структур:
Заявленные соединения обладают селективным JAK3-ингибиторным эффектом. 6 н. и 3 з.п. ф-лы, 9 табл., 59 пр.
1. Соединение следующей формулы (I) или его соль:
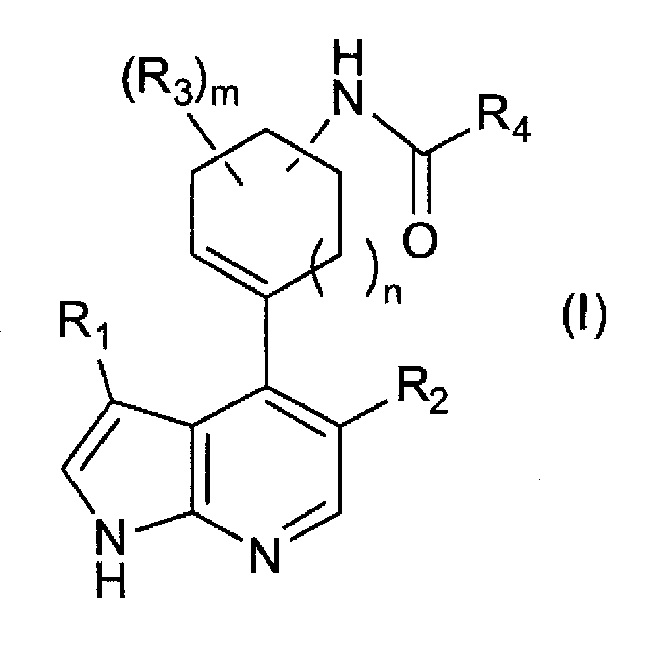 ,
,
где
R1 представляет собой
циклопентенильную группу;
циклогексенильную группу;
фенильную группу;
фуранильную группу, которая необязательно замещена группой, выбранной из группы, состоящей из формильной группы и C1-C6 алкильной группы (которая необязательно замещена группой, выбранной из группы, состоящей из гидроксигруппы и ди- или моно-(C1-C6 алкил)аминогруппы);
1H-пиразолильную группу, которая необязательно замещена группой, выбранной из группы, состоящей из C1-C6 алкильной группы и оксетанильной группы;
тиазолильную группу;
оксазолильную группу;
изоксазолильную группу;
1,3,4-тиадиазолильную группу;
1,2,4-оксадиазолильную группу;
1,3,4-оксадиазолильную группу, которая необязательно замещена C1-C6 алкильной группой;
пиридильную группу, которая необязательно замещена группой, выбранной из группы, состоящей из атома галогена, аминогруппы, гидроксигруппы, N-оксидной группы, C1-C6 алкильной группы (которая необязательно замещена гидроксигруппой) и C1-C6 алкоксигруппы (которая необязательно замещена атомом галогена);
дигидропиранильную группу;
дигидрофуранильную группу; или
4,5-дигидро-1,3,4-оксадиазолильную группу, которая необязательно замещена группой, выбранной из группы, состоящей из оксогруппы и C1-C6 алкильной группы,
R2 представляет собой
атом водорода;
цианогруппу;
(C1-C6 алкокси)карбонильную группу;
карбамоильную группу;
ди- или моно-(C1-C6 алкил)карбамоильную группу;
C1-C6 алкильную группу, которая необязательно замещена группой, выбранной из группы, состоящей из гидроксигруппы, C1-C6 алкоксигруппы, ди- или моно-(C1-C6 алкил)аминогруппы и морфолинильной группы;
C1-C6 алкоксигруппу; или
пиразолильную группу, которая необязательно замещена C1-C6 алкильной группой,
m имеет значение 0, n имеет значение 0 или 1, R4 представляет собой C2-C6 алкенильную группу, и
в формуле (I) следующая структура:
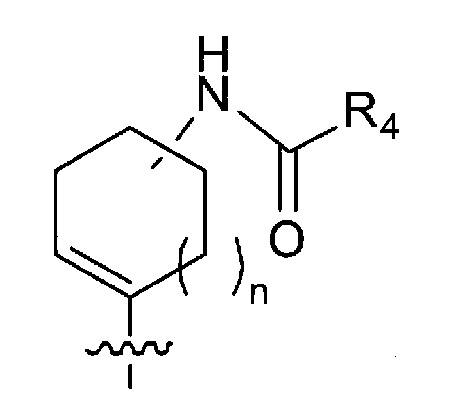
представляет собой любую из следующих структур:
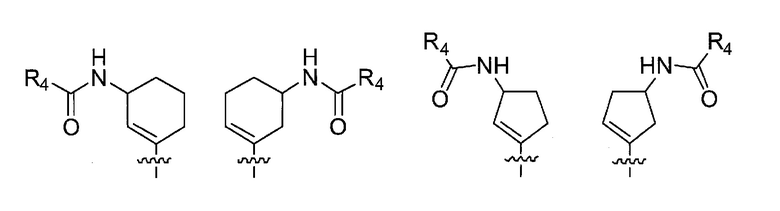
2. Соединение или его соль по п.1, где соединение представляет собой любое из соединений, представленных ниже в (1)-(11):
(1) N-(3-(3-фенил-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид,
(2) N-(3-(3-(1H-пиразол-4-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид,
(3) N-(3-(3-(2-метоксипиридин-3-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид,
(4) N-(3-(3-(фуран-2-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид,
(5) N-(3-(3-(4-(гидроксиметил)фуран-2-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид,
(6) N-(3-(3-(2,5-дигидрофуран-3-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид,
(7) N-(3-(3-(оксазол-5-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид,
(8) N-(3-(3-(1,3,4-оксадиазол-2-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид,
(9) (S)-N-(3-(3-(1,3,4-оксадиазол-2-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид,
(10) N-(3-(3-(1,3,4-оксадиазол-2-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклопент-3-ен-1-ил)акриламид и
(11) (S)-N-(3-(3-(изоксазол-5-ил)-1H-пирроло[2,3-b]пиридин-4-ил)циклогекс-3-ен-1-ил)акриламид.
3. Ингибитор JAK3, включающий в качестве активного ингредиента соединение или его соль по п.1 или 2.
4. Фармацевтическая композиция для лечения заболевания, связанного с JAK3, включающая соединение или его соль по п.1 или 2 в дозе приблизительно от 0,05 до 5000 мг .
5. Средство для профилактики и/или лечения ревматоидного артрита или рассеянного склероза, включающее в качестве активного ингредиента соединение или его соль по п.1 или 2.
6. Соединение или его соль по п.1 или 2 для применения в лечении заболевания, связанного с JAK3.
7. Соединение или его соль по п.1 или 2 для применения в профилактике и/или лечении ревматоидного артрита или рассеянного склероза.
8. Применение соединения или его соли по п.1 или 2 для получения лекарственного средства для лечения заболевания, связанного с JAK3.
9. Применение соединения или его соли по п.1 или 2 для получения лекарственного средства для профилактики и/или лечения ревматоидного артрита или рассеянного склероза.
| WO 2004099205 A1 18.11.2004 | |||
| ПИРРОЛОПИРИДИНЫ, ПОЛЕЗНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕИНКИНАЗЫ | 2006 |
|
RU2435769C2 |
Авторы
Даты
2018-04-04—Публикация
2015-02-04—Подача