Область техники, к которой относится изобретение
Данное изобретение относится к производным пиразола, применимым в качестве промежуточных соединений для получения агрохимикатов и медикаментов.
Уровень техники
В качестве способа получения производного изоксазолина, применимого в качестве гербицида, например японская выложенная патентная заявка № 308857/2002 раскрывает примеры получения производных изоксазолина, имеющих кольцо пиразола, где исходный материал, имеющий кольцо изоксазолина, подвергают взаимодействию с гидратом гидросульфида натрия с последующим взаимодействием с 4-бромметил-5-хлор-1-фенил-3-трифторметил-1Н-пиразолом в присутствии карбоната калия и Rongalit.
Цель изобретения - предоставить полезные промежуточные соединения для получения указанных производных изоксазолина и способы получения этих промежуточных соединений.
Описание изобретения
В результате всесторонних исследований для решения указанных проблем авторы данного изобретения обнаружили, что указанные производные изоксазолина могут быть получены более эффективно и легко при использовании в качестве промежуточных соединений специфических производных пиразола, получение которых возможно из легкодоступных исходных материалов. Таким образом, они реализовали то, что производные пиразола становятся промежуточными соединениями, чрезвычайно полезными в производстве указанных производных изоксазолина и, следовательно, создали изобретение.
А именно, данное изобретение решает указанные проблемы следующими изобретениями от (1) до (15).
Производное пиразола, представленное общей формулой (1) или его соль:
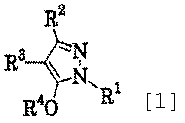
где R1 означает С1-С6 алкилгруппу, R2 означает С1-С3 галогеналкилгруппу, R3 означает атом водорода, С1-С3 алкилгруппу, которая может быть замещена одним или несколькими заместителями, выбранными из следующей группы заместителей α, или формилгруппу, R4 означает атом водорода или С1-С3 галогеналкилгруппу, при условии, что R4 представляет С1-С3 галогеналкилгруппу в случае, когда R3 означает атом водорода или формилгруппу, и R4 представляет атом водорода или С1-С3 галогеналкилгруппу в случае, когда R3 означает С1-С3 алкилгруппу, которая может быть замещена одним или несколькими заместителями, выбранными из следующей группы заместителей α; "Группа заместителей α" - атомы галогена, группа -SH, группа -SC(=NH)NH2.
(2) Производное пиразола или его соль по п. (1), где R4 означает С1-С3 галогеналкилгруппу.
(3) Производное пиразола или его соль по п. (1), где R3 означает С1-С3 алкилгруппу и R4 означает атом водорода.
(4) Производное пиразола или его соль по п. (1), где R3 означает метилгруппу, которая может быть замещена одним или несколькими заместителями, выбранными из группы заместителей а.
(5) Производное пиразола или его соль по п.(1), где R3 означает метилгруппу.
(6) Способ получения производного пиразола, представленного общей формулой [2], включающий стадию взаимодействия соединения, представленного общей формулой [1], с соединением, представленным общей формулой [2]:

где R1 и R2 имеют те же значения, которые указаны выше, R5 означает С1-С3 алкилгруппу, фенилгруппу, которая может быть замещена, или бензилгруппу, которая может быть замещена, и R6 означает С1-С3 алкилгруппу.
(7) Способ получения производного пиразола, представленного общей формулой [6], включающий стадию взаимодействия соединения, представленного общей формулой [4], с соединением, представленным общей формулой [5], в присутствии основания:
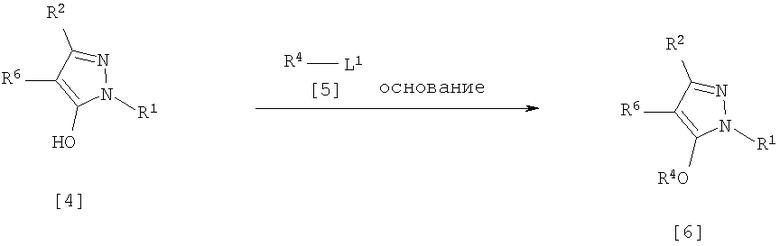
где R1, R2, R4 и R6 имеют те же значения, которые указаны выше, и L1 означает уходящую группу, которая является более реакционноспособной, чем атом галогена, остающийся после галогеналкилирования, и представляет атом галогена, С1-С3 алкилсульфонилоксигруппу, С1-С3 галогеналкилсульфонилоксигруппу, фенилсульфонилоксигруппу, которая может быть замещена, или бензилсульфонилоксигруппу, которая может быть замещена, и тому подобное.
(8) Способ получения производного пиразола, представленного общей формулой [6], включающий стадию взаимодействия соединения, представленного общей формулой [4], с трифенилфосфином, соединением, представленным общей формулой [7], и азосоединением [8]:
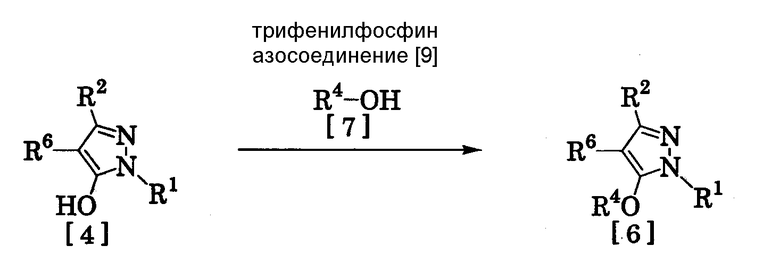
где R1, R2, R4 и R6 имеют те же значения, которые указаны выше.
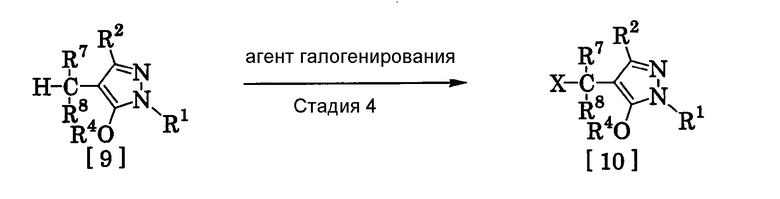
(9) Способ получения производного пиразола, представленного общей формулой [10], включающий стадию взаимодействия соединения, представленного общей формулой [9], с агентом галогенирования:

где R1, R2 и R4 имеют те же значения, которые указаны выше, R7 и R8, каждый, означают атом водорода или С1-С3 алкилгруппу и Х означает атом галогена.
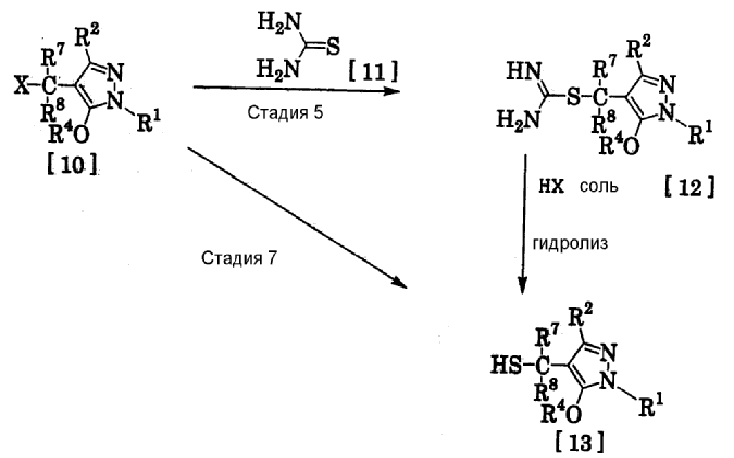
(10) Способ получения производного пиразола, представленного общей формулой [12], включающий стадию взаимодействия соединения, представленного общей формулой [10], с соединением, представленным общей формулой [11]:

где R1, R2, R4, R7, R8 и X имеют те же значения, которые указаны выше.
(11) Способ получения производного пиразола, представленного общей формулой [13], где соединение, представленное общей формулой [12] по п.(10), подвергают гидролизу.
(12) Способ получения производного пиразола, представленного общей формулой [13], где соединение, представленное общей формулой [10] по п.(10), подвергают взаимодействию с сульфидом.
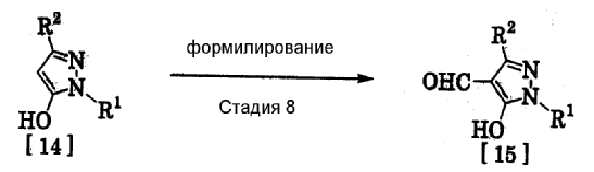
(13) Способ получения производного пиразола, представленного общей формулой [15], включающий стадию формилирования соединения, представленного общей формулой [14]:
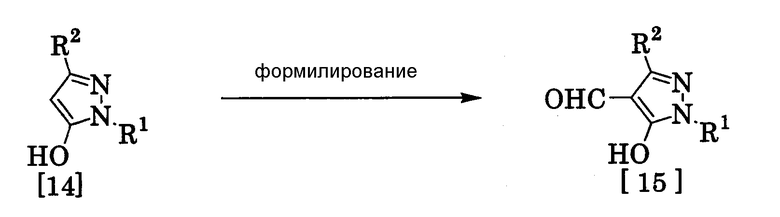
где R1 и R2 имеют те же значения, которые указаны выше.
(14) Способ получения производного пиразола, представленного общей формулой [17], включающий стадию взаимодействия соединения, представленного общей формулой [16], с соединением, представленным общей формулой [5], в присутствии основания:
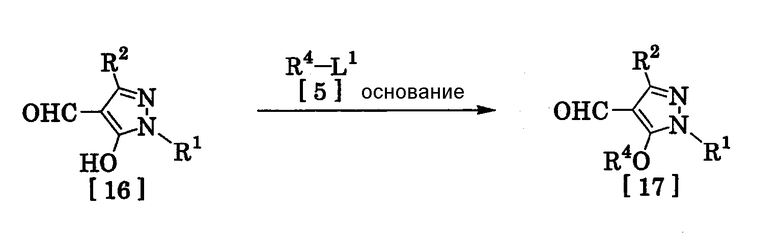
где R1, R2, R4 и L1 имеют те же значения, которые указаны выше.
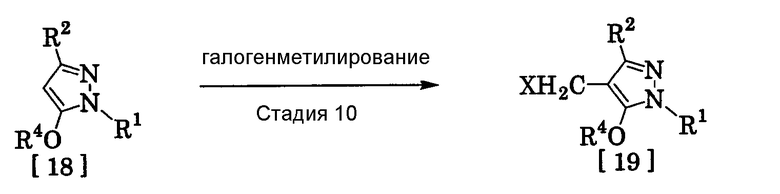
(15) Способ получения производного пиразола, представленного общей формулой [19], включающий стадию галогенметилирования соединения, представленного общей формулой [18]:
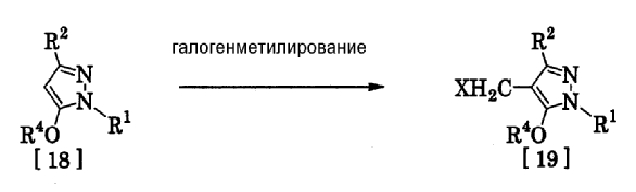
где R1, R2, R4 и Х имеют те же значения, которые указаны выше.
В связи с этим, определения терминов, используемых в данном описании, даны ниже.
Выражение "С1-С6" и тому подобное указывает, что заместитель, появляющийся после выражения, имеет от 1 до 6 атомов углерода в случае "С1-С6".
Атом галогена относится к атому фтора, атому хлора, атому брома или атому иода.
С1-С3 алкилгруппа относится, если не определено иным образом, к линейной или разветвленной алкилгруппе, имеющей от 1 до 3 атомов углерода, и примеры ее включают метилгруппу, этилгруппу, н-пропилгруппу, изопропилгруппу и тому подобное.
С1-С6 алкилгруппа относится, если не определено иным образом, к линейной или разветвленной алкилгруппе, имеющей от 1 до 6 атомов углерода, и примеры ее включают метилгруппу, этилгруппу, н-пропилгруппу, изопропилгруппу, н-бутилгруппу, изобутилгруппу, втор-бутилгруппу, трет-бутилгруппу, н-пентилгруппу, изопентилгруппу, неопентилгруппу, н-гексилгруппу, изогексилгруппу, 3,3-диметилбутилгруппу и тому подобное.
С1-С3 галогеналкилгруппа относится, если не определено иным образом, к линейной или разветвленной алкилгруппе, имеющей от 1 до 3 атомов углерода, которая замещена 1-7 атомами галогена, которые являются одинаковыми или отличающимися один от другого, и примеры ее включают фторметилгруппу, хлорметилгруппу, бромметилгруппу, дифторметилгруппу, трифторметилгруппу, дихлорфторметилгруппу, хлордифторметилгруппу, 2,2-дифторэтилгруппу, 2,2,2-трифторэтилгруппу, пентафторэтилгруппу, 1-фтор-1-метилэтилгруппу, 1-трифторметил-2,2,2-трифторэтилгруппу и тому подобное.
С1-С4 алкилсульфонилоксигруппа относится к (С1-С4 алкил)-SO2-O- группе, где алкилгруппа имеет те же значения, которые указаны выше, и примеры ее включают метансульфонилоксигруппу, этансульфонилоксигруппу и тому подобное.
С1-С3 галогеналкилсульфонилоксигруппа относится к (С1-С3 галогеналкил)-SO2-O- группе, где галогеналкилгруппа имеет те же значения, которые указаны выше, и примеры ее включают трифторметансульфонилоксигруппу, трихлорметансульфонилоксигруппу и тому подобное.
"Группа, которая может быть замещена," в фенилгруппе (которая может быть замещена), фенилсульфонилоксигруппе (которая может быть замещена), бензилгруппе (которая может быть замещена) или бензилсульфонилоксигруппе (которая может быть замещена) относится к группе, которая может быть замещена, например, атомом галогена, С1-С10 алкилгруппой, С1-С4 галогеналкилгруппой, С1-С10 алкоксиалкилгруппой, С1-С10 алкоксигруппой, С1-С10 алкилтиогруппой, С1-С10 алкилсульфонилгруппой, ацилгруппой, С1-С10 алкоксикарбонилгруппой, цианогруппой, карбамоилгруппой (ее атом азота может быть замещен С1-С10 алкилгруппами, которые могут быть одинаковыми или отличающимися друг от друга), нитрогруппой или аминогруппой (ее атом азота может быть замещен С1-С10 алкилгруппами, С1-С6 ацилгруппами, С1-С4 галогеналкилкарбонилгруппами, С1-С10 алкилсульфонилгруппами и С1-С4 галогеналкилсульфонилгруппами, которые могут быть одинаковыми или отличающимися друг от друга).
Соль является солью соединения общей формулы [I], в структуре которого присутствует гидроксильная группа, группа
-SH, группа SC(=NH)NH2 или тому подобное, с металлом, или органическим основанием, или с минеральной кислотой или с органической кислотой. Металл в этом случае включает щелочные металлы, такие как натрий и калий, и щелочноземельные металлы, такие как магний и кальций. Органическое основание включает триэтиламин и диизопропиламин. Минеральная кислота включает хлористоводородную кислоту, бромистоводородную кислоту, серную кислоту и тому подобное. Органическая кислота включает уксусную кислоту, метансульфоновую кислоту, паратолуолсульфоновую кислоту и тому подобное.
Наилучший вариант осуществления изобретения
Далее, типичные примеры производных пиразола, представленных общей формулой [I], или их солей (соединения по изобретению) показаны в таблицах с 1 по 11. Однако соединения по данному изобретению не ограничиваются приведенными примерами.
Следующие обозначения в таблицах в данном описании представляют соответствующие группы, как показано ниже.
Me: метилгруппа
Et: этилгруппа
Pr-n: н-пропилгруппа
Pr-i: изопропилгруппа
Bu-n: н-бутилгруппа
Bu-i: изобутилгруппа
Bu-s: втор-бутилгруппа
Bu-t: трет-бутилгруппа
Pen-n: н-пентилгруппа
Hex-n: н-гексилгруппа
Когда соединение по данному изобретению содержит гидроксильную группу в качестве заместителя, могут существовать соединения, имеющие кето-енольные таутомеры. Любые таутомеры и любые их смеси включены в соединения по данному изобретению.


Соединения по изобретению, представленные общей формулой [1], могут быть получены, например, следующими способами получения, но способ получения их не ограничивается такими способами.
Далее будет описан каждый из способов получения подробно.
<Способ получения 1>
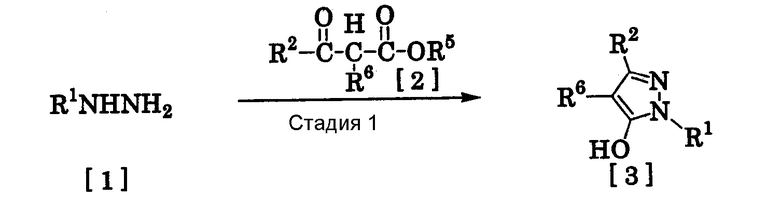
где R1 и R2 имеют те же значения, которые указаны выше, R5 означает С1-С3 алкилгруппу, фенилгруппу, которая может быть замещена, или бензилгруппу, которая может быть замещена, и R6 означает С1-С3 алкилгруппу.
(Стадия 1)
Соединение, представленное общей формулой [3], может быть получено при взаимодействии соединения, представленного общей формулой [1], с соединением, представленным общей формулой [2], в растворителе или в отсутствие растворителя (предпочтительно в подходящем растворителе) в присутствии кислотного катализатора или без него.
Что касается температуры реакции, все реакции проводят при температуре от -50°С до температуры кипения реакционной смеси, предпочтительно в температурных пределах от -20°С до 100°С, и реакция может быть завершена в течение периода от 0,5 часа до 72 часов, хотя период изменяется в зависимости от соединений.
Что касается количеств реагентов, которые должны быть использованы в реакции, количество соединения, представленного общей формулой [2], равно 1-3 эквивалентам и, когда кислотный катализатор используют, количество кислотного катализатора равно 0,01-2 эквивалентам, все по отношению к 1 эквиваленту соединения, представленного общей формулой [1].
Примеры растворителя включают простые эфиры, такие как диоксан, тетрагидрофуран и диметоксиэтан; галогенированные углеводороды, такие как дихлорэтан, тетрахлорид углерода, хлорбензол и дихлорбензол; амиды, такие как N,N-диметилацетамид, N,N-диметилформамид и N-метил-2-пирролидинон; соединения серы, такие как диметилсульфоксид и сульфолан; ароматические углеводороды, такие как бензол, толуол и ксилол; спирты, такие как метанол, этанол, н-пропанол, 2-пропанол, н-бутанол и 2-метил-2-пропанол; карбоновые кислоты, такие как муравьиная кислота и уксусная кислота; воду; и их смеси. Количество растворителя, которое должно быть использовано, находится в соотношении от 0,1 до 20 литров, предпочтительно от 0,1 до 5 литров, растворителя на 1 моль соединения, представленного общей формулой [1].
Примеры кислотного катализатора включают минеральные кислоты, такие как хлористоводородная кислота, бромистоводородная кислота и серная кислота; и органические кислоты, такие как муравьиная кислота, уксусная кислота, метансульфоновая кислота и паратолуолсульфоновая кислота.
<Способ получения 2>

где R1, R2, R4 и R6 имеют те же значения, которые указаны выше, и L1 означает уходящую группу, которая является более реакционноспособной, чем атом галогена, остающийся после галогеналкилирования, и представляет атом галогена, С1-С3 алкилсульфонилоксигруппу, С1-С3 галогеналкилсульфонилоксигруппу, фенилсульфонилоксигруппу, которая может быть замещена, бензилсульфонилоксигруппу, которая может быть замещена, или тому подобное, например, она представляет атом хлора или атом брома, когда R4 означает группу CHF2, и представляет атом хлора, атом брома, атом иода, паратолуолсульфонилоксигруппу, трифторметансульфонилоксигруппу, метансульфонилоксигруппу или тому подобное, когда R4 означает группу CH2CF3.
(Стадия 2)
Соединение, представленное общей формулой [6], может быть получено при взаимодействии соединения, представленного общей формулой [4], с соединением, представленным общей формулой [5], в растворителе или в отсутствие растворителя (предпочтительно в подходящем растворителе) в присутствии катализатора или без него в присутствии основания.
Что касается температуры реакции, все реакции проводят при температуре от 0°С до температуры кипения реакционной смеси, предпочтительно в температурных пределах от 0°С до 100°С, и реакция может быть завершена в течение периода от 0,5 часа до 24 часов, хотя период изменяется в зависимости от соединений.
Что касается количеств реагентов, которые должны быть использованы в реакции, количество соединения, представленного общей формулой [5], равно 1-5 эквивалентам, предпочтительно 1-3 эквивалентам, количество основания равно 1-20 эквивалентам, предпочтительно 1-10 эквивалентам, и количество катализатора равно 0,01-2,0 эквивалентам, предпочтительно 0,01-0,5 эквивалента, все по отношению к 1 эквиваленту соединения, представленного общей формулой [4].
Примеры оснований включают карбонаты щелочных металлов, такие как карбонат натрия и карбонат калия; гидрокарбонаты щелочных металлов, такие как гидрокарбонат натрия и гидрокарбонат калия; гидроксиды щелочных металлов, такие как гидроксид натрия и гидроксид калия; гидриды щелочных металлов, такие как гидрид калия и гидрид натрия; алкоголяты щелочных металлов, такие как этоксид натрия и метоксид натрия; и органические основания, такие как 1,8-диазабицикло[5,4,0]-7-ундецен, триэтиламин и пиридин.
Примеры растворителя включают простые эфиры, такие как диоксан, тетрагидрофуран и 1,2-диметоксиэтан; галогенированные углеводороды, такие как дихлорэтан, тетрахлорид углерода, хлорбензол и дихлорбензол; амиды, такие как N,N-диметилацетамид, N,N-диметилформамид и N-метил-2-пирролидинон; соединения серы, такие как диметилсульфоксид и сульфолан; ароматические углеводороды, такие как бензол, толуол и ксилол; спирты, такие как метанол, этанол, н-пропанол, 2-пропанол, н-бутанол и 2-метил-2-пропанол; кетоны, такие как ацетон и метилэтилкетон; нитрилы, такие как ацетонитрил; воду; и их смеси. Количество растворителя, которое должно быть использовано, находится в соотношении от 0,1 до 20 литров, предпочтительно от 0,1 до 5 литров, растворителя на 1 моль соединения, представленного общей формулой [4].
Примеры катализатора включают простые краун-эфиры, такие как 18-краун-6 и 15-краун-5; соли четвертичного аммония, такие как бромид тетра-н-бутиламмония и бромид бензилтриметиламмония, и соли четвертичного фосфония, такие как бромид тетра-н-бутилфосфония.
<Способ получения 3>

где R1, R2, R4 и R6 имеют те же значения, которые указаны выше.
(Стадия 3)
Соединение, представленное общей формулой [6], может быть получено при взаимодействии соединения, представленного общей формулой [4], с соединением, представленным общей формулой [7], в присутствии азосоединения [8] и трифенилфосфина в растворителе в соответствии со способом, описанным в Synthesis, 1981, 1-28.
Эту реакцию проводят обычно при температуре реакции от -30 до 100°С в течение времени от 10 минут до 24 часов.
Что касается количеств реагентов, которые должны быть использованы в реакции, желательно, чтобы количество соединения, представленного общей формулой [7], было 1-1,5 эквивалента, количество азосоединения [8] 1-1,5 эквивалента и количество трифенилфосфина 1-1,5 эквивалента, все по отношению к 1 эквиваленту соединения, представленного общей формулой [4], но указанные количества могут необязательно изменяться в зависимости от условий реакции.
Примеры растворителя включают простые эфиры, такие как диоксан и тетрагидрофуран; галогенированные углеводороды, такие как 1,2-дихлорэтан, тетрахлорид углерода, хлорбензол и дихлорбензол; амиды, такие как N,N-диметилацетамид, N,N-диметилформамид и N-метил-2-пирролидинон; соединения серы, такие как диметилсульфоксид и сульфолан; ароматические углеводороды, такие как бензол, толуол и ксилол; нитрилы, такие как ацетонитрил, и их смеси. Количество растворителя, которое должно быть использовано, находится в соотношении от 0,1 до 20 литров, предпочтительно от 0,1 до 5 литров, растворителя на 1 моль соединения, представленного общей формулой [4].
Примеры азосоединения [8] включают диэтилазодикарбоксилат, диизопропилазодикарбоксилат и тому подобное.
<Способ получения 4>
где R1, R2 и R4 имеют те же значения, которые указаны выше, R7 и R8, каждый, означают атом водорода или С1-С3 алкилгруппу и Х означает атом галогена.
(Стадия 4)
Соединение, представленное общей формулой [10], может быть получено при взаимодействии соединения, представленного общей формулой [9], с агентом галогенирования в растворителе в присутствии катализатора или без него. На этой стадии реакция может быть проведена при облучении светом. Кроме того, чтобы уловить кислоту, образующуюся в качестве побочного продукта, реакция может быть проведена в присутствии основания.
Эту реакцию проводят обычно при температуре реакции от 20 до 150°С в течение времени от 10 минут до 48 часов.
Что касается количеств реагентов, которые должны быть использованы в реакции, количество агента галогенирования желательно 1-10 эквивалентов по отношению к 1 эквиваленту соединения, представленного общей формулой [9], но количества могут необязательно изменяться в зависимости от условий реакции. Количество катализатора равно 0,01-3,0 эквивалентам, предпочтительно 0,01-1,5 эквивалента.
Примеры агента галогенирования включают галогены, такие как бром и хлор; N-галогенсукцинимиды, такие как N-бромсукцинимид и N-хлорсукцинимид; соли пиридина, такие как пербромид пиридиния; сульфурилхлорид, 1,3-бром-5,6-диметилгидантоин и тому подобное.
Примеры растворителя включают галогенированные углеводороды, такие как 1,2-дихлорэтан, тетрахлорид углерода, хлорбензол, фторбензол и дихлорбензол; бензол; карбоновые кислоты, такие как муравьиная кислота и уксусная кислота; воду; и их смеси. Количество растворителя, которое должно быть использовано, находится в соотношении от 0,1 до 20 литров, предпочтительно от 0,1 до 5 литров, растворителя на 1 моль соединения, представленного общей формулой [9].
Примеры катализатора включают пероксид бензоила, раствор пероксида водорода, α,α'-азобисизобутиронитрил и их смеси.
Примеры оснований включают гидроксиды щелочных металлов, такие как гидроксид натрия и гидроксид калия; карбонаты щелочных металлов, такие как карбонат натрия и карбонат калия; гидрокарбонаты щелочных металлов, такие как гидрокарбонат натрия и гидрокарбонат калия, и тому подобное.
<Способ получения 5>
где R1, R2, R4, R7, R8 и Х имеют те же значения, которые указаны выше.
(Стадия 5)
Соединение, представленное общей формулой [12], может быть получено при взаимодействии соединения, представленного общей формулой [10], с соединением, представленным общей формулой [11], (тиомочевина) в растворителе.
Что касается количеств реагентов, которые должны быть использованы, количество соединения, представленного общей формулой [11], желательно от 1 до 1,5 эквивалентов по отношению к 1 эквиваленту соединения общей формулы [10], но оно может необязательно изменяться в зависимости от условий реакции.
Примеры растворителя включают простые эфиры, такие как диоксан и тетрагидрофуран; галогенированные углеводороды, такие как дихлорэтан, тетрахлорид углерода, хлорбензол и дихлорбензол; ароматические углеводороды, такие как бензол, толуол и ксилол; амиды, такие как N,N-диметилацетамид, N,N-диметилформамид и N-метил-2-пирролидинон; спирты, такие как метанол, этанол и 2-пропанол; нитрилы, такие как ацетонитрил; кетоны, такие как ацетон и метилэтилкетон; воду; и их смеси. Количество растворителя, которое должно быть использовано, находится в соотношении от 0,1 до 20 литров, предпочтительно от 0,1 до 5 литров, растворителя на 1 моль соединения, представленного общей формулой [10].
(Стадия 6)
Соединение, представленное общей формулой [13], может быть получено гидролизом соединения, представленного общей формулой [12], в растворителе в присутствии основания или без него. На этой стадии соединение может быть получено в присутствии восстановителя или без него или в потоке инертного газа. Более того, соединение, представленное общей формулой [13], может быть использовано в следующей реакции без выделения и очистки.
Что касается количеств реагентов, которые должны быть использованы, количество основания желательно 1-10 эквивалентов по отношению к 1 эквиваленту соединения общей формулы [12], но оно может необязательно изменяться в зависимости от условий реакции.
Примеры растворителя включают простые эфиры, такие как диоксан и тетрагидрофуран; галогенированные углеводороды, такие как дихлорэтан, тетрахлорид углерода, хлорбензол и дихлорбензол; ароматические углеводороды, такие как бензол, толуол и ксилол; амиды, такие как N,N-диметилацетамид, N,N-диметилформамид и N-метил-2-пирролидинон; соединения серы, такие как диметилсульфоксид и сульфолан; нитрилы, такие как ацетонитрил; спирты, такие как метанол, этанол и 2-пропанол; кетоны, такие как ацетон и метилэтилкетон; воду; и их смеси. Количество растворителя, которое должно быть использовано, находится в соотношении от 0,1 до 20 литров, предпочтительно от 0,1 до 5 литров, растворителя на 1 моль соединения, представленного общей формулой [12].
Примеры оснований включают карбонаты щелочных металлов, такие как карбонат натрия и карбонат калия; гидроксиды щелочных металлов, такие как гидроксид натрия и гидроксид калия; гидрокарбонаты щелочных металлов, такие как гидрокарбонат натрия и гидрокарбонат калия; алкоголяты щелочных металлов, такие как этоксид натрия и метоксид натрия, и органические основания, такие как 1,8-диазабицикло[5,4,0]-7-ундецен.
Примеры восстановителя включают боргидрид натрия и тому подобное.
Примеры инертного газа включают азот, аргон и тому подобное.
(Стадия 7)
Соединение, представленное общей формулой [13], может быть получено при взаимодействии соединения, представленного общей формулой [10], с сульфидом в растворителе в присутствии основания или без него. На этой стадии соединение может быть получено в присутствии восстановителя или без него или в потоке инертного газа. Более того, соединение, представленное общей формулой [13], может быть использовано в следующей реакции без выделения и очистки.
Что касается количеств реагентов, которые должны быть использованы, желательно, чтобы количество сульфида было 1-5 эквивалентов и количество основания желательно 1-10 эквивалентов, все по отношению к 1 эквиваленту соединения общей формулы [10], но это может необязательно изменяться в зависимости от условий реакции.
Примеры растворителя включают простые эфиры, такие как диоксан и тетрагидрофуран; галогенированные углеводороды, такие как дихлорэтан, тетрахлорид углерода, хлорбензол и дихлорбензол; ароматические углеводороды, такие как бензол, толуол и ксилол; амиды, такие как N,N-диметилацетамид, N,N-диметилформамид и N-метил-2-пирролидинон; соединения серы, такие как диметилсульфоксид и сульфолан; нитрилы, такие как ацетонитрил; спирты, такие как метанол, этанол и 2-пропанол; кетоны, такие как ацетон и метилэтилкетон; воду; и их смеси. Количество растворителя, которое должно быть использовано, находится в соотношении от 0,1 до 20 литров, предпочтительно от 0,1 до 5 литров, растворителя на 1 моль соединения, представленного общей формулой [10].
Примеры сульфида включают сульфиды щелочных металлов, такие как сульфид натрия и сульфид калия; гидросульфиды щелочных металлов, такие как гидросульфид натрия и гидросульфид калия; сульфид водорода, сульфид аммония, тиоацетат натрия, тиоацетат калия и тому подобное.
Примеры оснований включают карбонаты щелочных металлов, такие как карбонат натрия и карбонат калия; гидроксиды щелочных металлов, такие как гидроксид натрия и гидроксид калия; гидриды щелочных металлов, такие как гидрид калия и гидрид натрия; алкоголяты щелочных металлов, такие как этоксид натрия и метоксид натрия, и органические основания, такие как 1,8-диазабицикло[5,4,0]-7-ундецен.
В качестве восстановителя и инертного газа могут быть названы те же, что и на стадии 6 способа получения 5.
<Способ получения 6>
где R1 и R2 имеют те же значения, которые указаны выше.
(Стадия 8)
Соединение, представленное общей формулой [15], может быть получено при взаимодействии соединения, представленного общей формулой [14], с N,N-диметилформамидом в растворителе или без растворителя в присутствии фосфорилхлорида, фосгена или тионилхлорида в соответствии со способом Vilsmeier, описанным в Org. Synth., Vol. IV, 831 (1963), или при взаимодействии соединения, представленного общей формулой [14], с дигалогенметиловым простым эфиром в растворителе в присутствии кислоты Льюиса с последующим гидролизом в соответствии со способом, описанным в Chem. Ber., 93, 88 (1960).
Эту реакцию обычно проводят при температуре от -40 до 150оС в течение времени от 10 минут до 24 часов.
Что касается количеств реагентов, которые должны быть использованы в реакции, желательно, чтобы количество фосфорилхлорида, фосгена, тионилхлорида, N,N-диметилформамида, кислоты Льюиса или дигалогенметилового простого эфира было 1-1,5 эквивалента по отношению к 1 эквиваленту соединения общей формулы [14], но количество может необязательно изменяться в зависимости от условий реакции.
Примеры кислоты Льюиса включают тетрахлорид титана, тетрахлорид олова, хлорид цинка, хлорид алюминия, бромид цинка и тому подобное.
Примеры дигалогенметилового простого эфира включают дихлорметиловый простой эфир и тому подобное.
Примеры растворителя включают галогенированные углеводороды, такие как дихлорэтан, тетрахлорид углерода и хлороформ; алифатические углеводороды, такие как гексан и гептан; простые эфиры, такие как диоксан и тетрагидрофуран; карбоновые кислоты, такие как уксусная кислота; амиды, такие как N,N-диметилформамид; дисульфид углерода, и их смеси. Количество растворителя, которое должно быть использовано, находится в соотношении от 0,1 до 20 литров, предпочтительно от 0,2 до 5 литров, растворителя на 1 моль соединения, представленного общей формулой [14].
<Способ получения 7>

где R1, R2, R4 и L1 имеют те же значения, которые указаны выше.
(Стадия 9)
Соединение, представленное общей формулой [17], может быть получено при взаимодействии соединения, представленного общей формулой [16], с соединением, представленным общей формулой [5], в растворителе или без растворителя (предпочтительно в подходящем растворителе), в присутствии катализатора или без него, в присутствии основания.
Что касается температуры реакции, все реакции проводят при температуре от 0°С до температуры кипения реакционной смеси, предпочтительно в температурных пределах от 0°С до 100°С, и реакция может быть проведена в течение периода от 0,5 часа до 24 часов, хотя период изменяется в зависимости от соединений.
Что касается количеств реагентов, которые должны быть использованы в реакции, количество соединения, представленного общей формулой [5], равно 1-5 эквивалентам, предпочтительно 1-3 эквивалентам, количество основания равно 1-20 эквивалентам, предпочтительно 1-10 эквивалентам, и количество катализатора равно 0,01-2,0 эквивалентам, предпочтительно 0,01-0,5 эквивалента, все по отношению к 1 эквиваленту соединения, представленного общей формулой [16].
В качестве растворителя, основания и катализатора могут быть упомянуты те же, что и на стадии 2 способа получения 2.
<Способ получения 8>
где R1, R2, R4 и Х имеют те же значения, которые указаны выше.
(Стадия 10)
Соединение, представленное общей формулой [19], может быть получено при взаимодействии соединения, представленного общей формулой [18], с галогенидом водорода и формальдегидом или параформальдегидом в растворителе в присутствии кислоты Льюиса или без нее в соответствии со способом, описанным в Org. Synth., Vol. III, 557 (1955) или в J. Amer. Chem. Soc., 72, 2216 (1950), или при взаимодействии соединения, представленного общей формулой [18], с галогенметиловым простым эфиром в растворителе или без растворителя в присутствии кислоты Льюиса в соответствии со способом, описанным в J. Amer. Chem. Soc., 97, 6155 (1975).
Эту реакцию проводят обычно при температуре от -40 до 150оС в течение времени от 10 минут до 24 часов.
Что касается количеств используемых реагентов, желательно, чтобы количество галогенида водорода было от 1 до 2 эквивалентов, количество формальдегида или параформальдегида от 1 до 2 эквивалентов, количество кислоты Льюиса от 1 до 2 эквивалентов и количество галогенметилового простого эфира было от 1 до 2 эквивалентов, все по отношению к 1 эквиваленту соединения общей формулы [18]. Однако указанные количества могут необязательно изменяться в зависимости от условий реакции.
Примеры кислоты Льюиса включают тетрахлорид титана, хлорид цинка, хлорид алюминия, бромид цинка и тому подобное.
Примеры галогенида водорода включают хлорид водорода, бромид водорода и иодид водорода.
Примеры галогенметилового простого эфира включают хлорметилметиловый простой эфир, бромметилметиловый простой эфир и тому подобное.
Примеры растворителя включают галогенированные углеводороды, такие как дихлорэтан, тетрахлорид углерода и хлороформ; алифатические углеводороды, такие как гексан и гептан; простые эфиры, такие как диоксан и тетрагидрофуран; карбоновые кислоты, такие как уксусная кислота; дисульфид углерода и их смеси. Количество растворителя, которое должно быть использовано, находится в соотношении от 0,1 до 20 литров, предпочтительно от 0,1 до 5 литров, растворителя на 1 моль соединения, представленного общей формулой [18].
В этой связи, соединение, представленное общей формулой [18], может быть получено превращением атома водорода соответствующего соединения, где R4 означает атом водорода, в R4 в соответствии со способом получения 2 или 3.
Далее следует пояснение способов получения соединений по изобретению конкретно. Представлены также физические свойства соединений по изобретению, полученных в соответствующих примерах или полученных в соответствии с соответствующими примерами. Примеры приведены.
Пример 1
Получение 1-трет-бутил-5-дифторметокси-3-трифторметил-1Н-пиразола (Соединение по изобретению № 021)
К раствору 10,4 г (50,0 ммоль) 1-трет-бутил-5-гидрокси-3-трифторметил-1Н-пиразола в 50 мл N,N-диметилформамида добавляют 7,6 г (55,0 ммоль) безводного карбоната калия при комнатной температуре. При перемешивании реакционного раствора в него вводят избыточное количество хлордифторметана при 80°С. После подтверждения исчезновения исходного материала введение хлордифторметана прекращают и реакционный раствор охлаждают до комнатной температуры. После этого реакционный раствор выливают в воду и экстрагируют диизопропиловым простым эфиром. Полученный органический слой промывают водой и сушат над безводным сульфатом магния. Растворитель удаляют выпариванием при пониженном давлении и остаток перегоняют при пониженном давлении, получая 10,8 г (выход: 83,7%) 1-трет-бутил-5-дифторметокси-3-трифторметил-1H-пиразола в виде желтой жидкости.
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 6,53 (1Н, т, J=71,9 Гц), 6,14 (1Н, с), 1,63 (9Н, с).
Пример 2
Получение 1-трет-бутил-5-(2,2-дифторэтокси)-3-трифторметил-1Н-пиразола (Соединение по изобретению № 022)
К раствору 50,0 г (240,2 ммоль) 1-трет-бутил-5-гидрокси-3-трифторметил-1Н-пиразола в 1000 мл тетрагидрофурана добавляют 75,6 г (288,2 ммоль) трифенилфосфина и 23,7 г (288,8 ммоль) 2,2-дифторэтанола при комнатной температуре с последующим перемешиванием. При охлаждении льдом 58,3 г (288,3 ммоль) диизопропилазодикарбоксилата добавляют в реакционный раствор с последующим 5-часовым перемешиванием. После подтверждения завершения реакции реакционный раствор выливают в воду и экстрагируют диэтиловым простым эфиром. Полученный органический слой промывают водой и сушат над безводным сульфатом магния. Растворитель удаляют выпариванием при пониженном давлении и остаток перегоняют при пониженном давлении, получая 38,2 г (выход: 58,4%) 1-трет-бутил-5-(2,2-дифторэтокси)-3-трифторметил-1Н-пиразола.
Температура кипения: от 98 до 100°C/6 кПа (45 ммHg)
Показатель преломления (nD 20): 1,3921
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 6,10 (1Н, тт, J=3,8, 54,5 Гц), 5,84 (1Н,с), 4,25 (2Н, дт, J=3,8, 13,0 Гц), 1,60 (9Н, с).
Пример 3
Получение 1-трет-бутил-4-хлорметил-5-(2,2-дифторэтокси)-3-трифторметил-1Н-пиразола (Соединение по изобретению № 141)
К раствору 13,6 г (50,0 ммоль) 1-трет-бутил-5-(2,2-дифторэтокси)-3-трифторметил-1Н-пиразола в 50 мл уксусной кислоты добавляют 5,0 г (чистота: 90%, 150,0 ммоль) параформальдегида и 20,5 г (150,0 ммоль) хлорида цинка при комнатной температуре с последующим перемешиванием. Кроме того, избыточное количество хлорида водорода вводят в реакционный раствор при охлаждении льдом, затем перемешивают в течение 1 часа. После подтверждения завершения реакции реакционный раствор выливают в воду и экстрагируют диэтиловым простым эфиром. Полученный органический слой промывают водой и сушат над безводным сульфатом магния. Растворитель удаляют выпариванием при пониженном давлении и проводят анализ газовой хроматографией, получая подтверждение образования 1-трет-бутил-4-хлорметил-5-(2,2-дифторэтокси)-3-трифторметил-1H-пиразола в количестве 50,1%.
Пример 4
Получение 5-гидрокси-1-метил-3-трифторметил-1Н-пиразол-4-карбальдегида (Соединение по изобретению №281)
К 16,6 г (100,0 ммоль) 5-гидрокси-1-метил-3-трифторметил-1H-пиразола в 15,4 г N,N-диметилформамида добавляют 16,2 г (105,0 ммоль) оксихлорида фосфора при 0°С, затем перемешивают в течение 1 часа при комнатной температуре. Кроме того, все перемешивают при 100°С в течение 1 часа. После подтверждения завершения реакции реакционный раствор выливают в воду и рН доводят до 10 или более 25% раствором гидроксида натрия и затем водный слой промывают этилацетатом. рН полученного водного слоя доводят до около 4 насыщенным раствором лимонной кислоты и затем экстрагируют диэтиловым простым эфиром. Полученный органический слой промывают водой и насыщенным солевым раствором последовательно и затем сушат над безводным сульфатом магния. Растворитель удаляют выпариванием при пониженном давлении и остаток очищают колоночной хроматографией на силикагеле, получая 4,5 г (выход: 23,2%) 5-гидрокси-1-метил-3-трифторметил-1Н-пиразол-4-карбальдегида.
Пример 5
Получение 5-дифторметокси-1-метил-3-трифторметил-1Н-пиразол-4-карбальдегида (Соединение по изобретению № 026)
К 1,7 г (8,8 ммоль) 5-гидрокси-1-метил-3-трифторметил-1Н-пиразола в 20 мл тетрагидрофурана добавляют 2,5 г (43,8 ммоль) порошкообразного гидроксида калия и 0,14 г (0,44 ммоль) бромида тетрабутиламмония при комнатной температуре с последующим перемешиванием. Кроме того, хлордифторметан вводят в реакционный раствор до тех пор, пока реакционная система не насытится им. После этого все перемешивают при комнатной температуре в течение ночи. После подтверждения завершения реакции реакционный раствор выливают в воду и экстрагируют диэтиловым простым эфиром. Полученный органический слой промывают водой и насыщенным солевым раствором последовательно и затем сушат над безводным сульфатом магния. Растворитель удаляют выпариванием при пониженном давлении и проводят анализ газовой хроматографией, получая подтверждение образования 5-дифторметокси-1-метил-3-трифторметил-1Н-пиразол-4-карбальдегида в количестве 8,8%.
Пример 6
Получение 1,4-диметил-5-гидрокси-3-трифторметил-1Н-пиразола (Соединение по изобретению № 036)
К раствору 20,9 г (454,2 ммоль) метилгидразина в 500 мл этанола добавляют по каплям при перемешивании 90,0 г (454,2 ммоль) этил-4,4,4-трифтор-2-метил-3-оксобутаноата при охлаждении льдом так, чтобы температура не превышала 10°C. После завершения добавления по каплям все перемешивают при комнатной температуре в течение 30 минут. Затем 10 мл концентрированной хлористоводородной кислоты добавляют в реакционный раствор и перемешивают в течение 2 суток при кипячении с обратным холодильником. После подтверждения завершения реакции растворитель удаляют выпариванием при пониженном давлении. К остатку добавляют воду, затем экстрагируют этилацетатом. Полученный органический слой промывают водой и насыщенным солевым раствором последовательно и затем сушат над безводным сульфатом магния. Растворитель удаляют выпариванием при пониженном давлении, и остаток промывают н-гексаном, получая 61,0 г (выход: 74,6%) 1,4-диметил-5-гидрокси-3-трифторметил-1Н-пиразола в виде белых кристаллов (температура плавления: 148-151°C).
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 3,70 (3Н, д), 1,99 (3Н, д).
Температура плавления: 148-151°C
Пример 7
Получение 5-дифторметокси-1,4-диметил-3-трифторметил-1Н-пиразола (Соединение по изобретению № 076)
В 78,6 г (436,4 ммоль) 1,4-диметил-5-гидрокси-3-трифторметил-1Н-пиразола в 500 мл 2-пропанола добавляют 153,1 г (2728,6 ммоль) порошкообразного гидроксида калия при комнатной температуре с последующим перемешиванием. Кроме того, избыточное количество хлордифторметана вводят в реакционный раствор при перемешивании. После этого температура реакции сразу повышается до 70°C за счет экзотермического тепла и затем возвращается к комнатной температуре через 2 часа. После подтверждения завершения реакции реакционный раствор выливают в воду и экстрагируют этилацетатом. Полученный органический слой промывают водой и насыщенным солевым раствором последовательно и затем сушат над безводным сульфатом магния. Растворитель удаляют выпариванием при пониженном давлении и остаток перегоняют, получая 88,9 г (выход: 88,5%) 5-дифторметокси-1,4-диметил-3-трифторметил-1Н-пиразола в виде бесцветной прозрачной жидкости.
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 6,52 (1Н, т, J=71,5 Гц), 3,78 (3Н, с), 2,07 (3Н, с).
Температура кипения: 98-100°C/6 кПа (45 мм Hg)
Показатель преломления (nD 20): 1,3921
Пример 8
Получение 4-бромметил-5-дифторметокси-1-метил-3-трифторметил-1Н-пиразола (Соединение по изобретению № 151)
К раствору 11,5 г (50,0 ммоль) 5-дифторметокси-1,4-диметил-3-трифторметил-1Н-пиразола в 50 мл тетрахлорида углерода добавляют 9,8 г (55,0 ммоль) N-бромсукцинимида и 0,41 г (2,5 ммоль) α,α'-азобисизобутиронитрила с последующим нагреванием и кипячением с обратным холодильником при перемешивании. Реакционный раствор подвергают облучению светом с использованием внешнего источника в течение 1 часа. После подтверждения завершения реакции реакционный раствор выливают в воду и экстрагируют хлороформом. Полученный органический слой промывают водой и насыщенным солевым раствором последовательно и затем сушат над безводным сульфатом магния. Растворитель удаляют выпариванием при пониженном давлении, получая 17,8 г (чистота: 72,0%, выход: 82,7%) 4-бромметил-5-дифторметокси-1-метил-3-трифторметил-1Н-пиразола.
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 6,73 (1Н, т, J=71,5 Гц), 4,39 (2Н, с), 3,82 (3Н, д).
Показатель преломления (nD 20): 1,4401
Пример 9
Получение 4-бромметил-5-дифторметокси-1-метил-3-трифторметил-1Н-пиразола (Соединение по изобретению № 151)
К раствору 0,50 г (2,17 ммоль) 5-дифторметокси-1,4-диметил-3-трифторметил-1Н-пиразола в 5 мл тетрахлорида углерода добавляют 0,90 г (5,64 ммоль) брома и небольшое количество пероксида бензоила с последующим нагреванием и кипячением с обратным холодильником при перемешивании. Реакционный раствор подвергают облучению светом с использованием внешнего источника в течение 2 часов и 30 минут. После завершения реакции проводят анализ газовой хроматографией, получая подтверждение образования 4-бромметил-5-дифторметокси-1-метил-3-трифторметил-1Н-пиразола в количестве 80,2%.
Пример 10
Получение гидробромида 2-(5-дифторметокси-1-метил-3-трифторметил-1Н-пиразол-4-илметил)изотиомочевины (Соединение по изобретению № 197)
К раствору 19,1 г (чистота: 75,0%, 46,3 ммоль) 4-бромметил-5-дифторметокси-1-метил-3-трифторметил-1Н-пиразола в 30 мл этанола добавляют 3,5 г (46,3 ммоль) тиомочевины, затем в течение 1 часа нагревают и кипятят с обратным холодильником при перемешивании. Растворитель удаляют выпариванием при пониженном давлении и остаток промывают смешанным растворителем из этилацетата и н-гексана, получая 13,8 г (выход: 77,5%) гидробромида 2-(5-дифторметокси-1-метил-3-трифторметил-1Н-пиразол-4-илметил)изотиомочевины в виде белых кристаллов (температура плавления: 130-131°C).
1Н-ЯМР (CDCl3+DMSO-d6/TMS δ (м.д.)): 9,21 (2Н, шир.), 9,12 (2Н, шир.), 6,92 (1Н, т, J=71,2 Гц), 4,40 (2Н, с), 3,83 (3Н, с).
Пример 11
Получение (5-дифторметокси-1-метил-3-трифторметил-1Н-пиразол-4-ил)метантиола (Соединение по изобретению № 216)
К раствору 1,00 г (2,60 ммоль) гидробромида 2-(5-дифторметокси-1-метил-3-трифторметил-1Н-пиразол-4-илметил) изотиомочевины в 2 мл N,N-диметилформамида добавляют 0,43 г (3,12 ммоль) безводного карбоната калия и 1 мл воды с последующим перемешиванием в течение 1 часа при комнатной температуре. После подтверждения завершения реакции реакционный раствор выливают в воду и экстрагируют диэтиловым простым эфиром. Полученный органический слой промывают водой и затем сушат над безводным сульфатом магния. Растворитель удаляют выпариванием при пониженном давлении, получая 0,66 г (чистота: 84,9%, выход: 82,4%) (5-дифторметокси-1-метил-3-трифторметил-1Н-пиразол-4-ил)метантиола.
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 6,72 (1Н, т, J=71,7 Гц), 3,81 (3Н, с), 3,63 (2Н, с), 3,20 (1Н, шир.).
Пример 12
Получение (5-дифторметокси-1-метил-3-трифторметил-1Н-пиразол-4-ил)метантиола (Соединение по изобретению № 216)
К раствору 1,55 г (5,00 ммоль) 4-бромметил-5-дифторметокси-1-метил-3-трифторметил-1Н-пиразола в 10 мл этанола добавляют 0,48 г (чистота: 70,0%, 6,00 ммоль) н-гидрата гидросульфида натрия с последующим перемешиванием в течение 1 часа при комнатной температуре. После завершения реакции проводят анализ газовой хроматографией, получая подтверждение образования (5-дифторметокси-1-метил-3-трифторметил-1Н-пиразол-4-ил)метантиола в количестве 40,0%.
Пример 13
Получение 4-хлорметил-5-дифторметокси-1-метил-3-трифторметил-1Н-пиразола (Соединение по изобретению № 123)
К раствору 11,5 г (50,0 ммоль) 5-дифторметокси-1,4-диметил-3-трифторметил-1Н-пиразола в 50 мл тетрахлорида углерода добавляют 10,1 г (75,0 ммоль) сульфурилхлорида и 0,8 г (5,0 ммоль) α,α'-азобисизобутиронитрила с последующим нагреванием и кипячением с обратным холодильником при перемешивании. Реакционный раствор снаружи облучают светом в течение 11 часов. После подтверждения завершения реакции реакционный раствор выливают в воду и экстрагируют хлороформом. Полученный органический слой промывают водой и насыщенным солевым раствором последовательно и затем сушат над безводным сульфатом магния. Растворитель удаляют выпариванием при пониженном давлении и остаток очищают колоночной хроматографией на силикагеле, получая 4,8 г (чистота: 83,4%, выход: 30,3%) 4-хлорметил-5-дифторметокси-1-метил-3-трифторметил-1Н-пиразола в виде бесцветной прозрачной жидкости
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 6,69 (1Н, т, J=71,5 Гц), 4,51 (2Н, с), 3,82 (3Н, с).
Показатель преломления (nD 20): 1,4157
Пример 14
Получение 4-хлорметил-5-дифторметокси-1-метил-3-трифторметил-1Н-пиразола (Соединение по изобретению № 123)
К раствору 1,00 г (4,35 ммоль) 5-дифторметокси-1,4-диметил-3-трифторметил-1Н-пиразола в 10 мл тетрахлорида углерода добавляют 0,55 г (6,52 ммоль) гидрокарбоната натрия с последующим нагреванием и кипячением с обратным холодильником при перемешивании. Реакционный раствор облучают с поверхности светом и газообразный хлор вводят в подходящем количестве, в то время как количество образовавшегося целевого соединения полтверждают газовой хроматографией. После завершения реакции проводят анализ газовой хроматографией, получая подтверждение образования 4-хлорметил-5-дифторметокси-1-метил-3-трифторметил-1Н-пиразола в количестве 61,7%.
Пример 15
Получение гидрохлорида 2-(5-дифторметокси-1-метил-3-трифторметил-1Н-пиразол-4-илметил)изотиомочевины (Соединение по изобретению № 178)
К раствору 3,7 г (чистота: 83,4%, 11,7 ммоль) 4-хлорметил-5-дифторметокси-1-метил-3-трифторметил-1Н-пиразола в 20 мл этанола добавляют 0,8 г (11,1 ммоль) тиомочевины с последующим перемешиванием при комнатной температуре в течение ночи и дополнительным нагреванием и перемешиванием при 50°C в течение 1 часа. Растворитель удаляют выпариванием при пониженном давлении и остаток промывают н-гексаном, получая 3,8 г (выход: 96,4%) гидрохлорида 2-(5-дифторметокси-1-метил-3-трифторметил-1Н-пиразол-4-илметил)изотиомочевины в виде белых кристаллов (температура плавления: 117-119°C).
Пример 16
Получение 1-этил-5-гидрокси-4-метил-3-трифторметил-1Н-пиразола (Соединение по изобретению № 037)
К раствору 1,2 г (20,0 ммоль) этилгидразина в 20 мл этанола добавляют по каплям при перемешивании 4,4 г (20,0 ммоль) этил-4,4,4-трифтор-2-метил-3-оксобутаноата при охлаждении льдом так, чтобы температура в реакционной системе не превышала 10°C. После добавления по каплям все перемешивают при комнатной температуре в течение 30 минут. Затем 1 мл концентрированной хлористоводородной кислоты добавляют в реакционный раствор и в течение 2 суток перемешивают и кипятят с обратным холодильником. После подтверждения завершения реакции растворитель удаляют выпариванием при пониженном давлении. К остатку добавляют воду, затем экстрагируют этилацетатом. Полученный органический слой промывают водой и насыщенным солевым раствором последовательно и затем сушат над безводным сульфатом магния. Растворитель удаляют выпариванием при пониженном давлении и остаток промывают н-гексаном, получая 2,8 г (выход: 71,8%) 1-этил-5-гидрокси-4-метил-3-трифторметил-1Н-пиразола в виде белых кристаллов (температура плавления: 150-152°C).
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 6,78 (1Н, шир.), 4,06 (2Н, кв), 1,98 (3Н, д), 1,37 (3Н, т).
Пример 17
Получение 5-гидрокси-4-метил-1-изопропил-3-трифторметил-1Н-пиразола (Соединение по изобретению № 038)
К раствору 7,4 г (100,0 ммоль) изопропилгидразина в 100 мл этанола добавляют по каплям при перемешивании 23,3 г (чистота: 85,0%, 100,0 ммоль) этил-4,4,4-трифтор-2-метил-3-оксобутаноата при охлаждении льдом так, чтобы температура в реакционной системе не превышала 10°C. После добавления по каплям все перемешивают при комнатной температуре в течение 30 минут. Затем 1 мл концентрированной хлористоводородной кислоты добавляют в реакционный раствор и в течение следующих 2 суток перемешивают при кипячении с обратным холодильником. После подтверждения завершения реакции растворитель удаляют выпариванием при пониженном давлении. К остатку добавляют воду, а затем экстрагируют этилацетатом. Полученный органический слой промывают водой и насыщенным солевым раствором последовательно и затем сушат над безводным сульфатом магния. Растворитель удаляют выпариванием при пониженном давлении и остаток промывают н-гексаном, получая 18,1 г (выход: 87,0%) 5-гидрокси-4-метил-1-изопропил-3-трифторметил-1Н-пиразола в виде белых кристаллов (температура плавления: 150-153°C).
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 4,58 (1Н, м), 1,98 (3Н, д), 1,44 (6Н, д).
Пример 18
Получение 5-дифторметокси-4-метил-1-изопропил-3-трифторметил-1Н-пиразола (Соединение по изобретению № 084)
К 17,1 г (82,1 ммоль) 5-гидрокси-4-метил-1-изопропил-3-трифторметил-1Н-пиразола в 100 мл 2-пропанола добавляют 23,0 г (410,7 ммоль) порошкообразного гидроксида калия при комнатной температуре с последующим перемешиванием. Более того, перемешивание продолжают, в то время как избыточное количество хлордифторметана вводят в реакционный раствор. После этого температура реакции сразу повышается до 70°C за счет экзотермического тепла и затем возвращается к комнатной температуре через 2 часа. После подтверждения завершения реакции реакционный раствор выливают в воду и экстрагируют этилацетатом. Полученный органический слой промывают водой и насыщенным солевым раствором последовательно и затем сушат над безводным сульфатом магния. Растворитель удаляют выпариванием при пониженном давлении и остаток перегоняют, получая 15,9 г (выход: 75,0%) 5-дифторметокси-4-метил-1-изопропил-3-трифторметил-1Н-пиразола в виде бесцветной прозрачной жидкости
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 6,52 (1Н, т, J=71,5 Гц), 4,58 (1Н, м), 1,98 (3Н, д), 1,44 (6Н, д).
Температура кипения: 84-86°C/3,33 кПа (25 мм Hg)
Показатель преломления (nD 20): 1,3974
Пример 19
Получение 4-бромметил-5-дифторметокси-1-изопропил-3-трифторметил-1Н-пиразола (Соединение по изобретению № 158)
К раствору 10,3 г (40,0 ммоль) 5-дифторметокси-4-метил-1-изопропил-3-трифторметил-1Н-пиразола в 40 мл тетрахлорида углерода добавляют 7,8 г (44,0 ммоль) N-бромсукцинимида и 0,3 (2,0 ммоль) α,α'-азобисизобутиронитрила с последующим нагреванием и кипячением с обратным холодильником при перемешивании. Реакционный раствор облучают с поверхности светом в течение 1 часа. После подтверждения завершения реакции реакционный раствор выливают в воду и экстрагируют хлороформом. Полученный органический слой промывают водой и насыщенным солевым раствором последовательно и затем сушат над безводным сульфатом магния. Растворитель удаляют выпариванием при пониженном давлении и остаток очищают колоночной хроматографией на силикагеле, получая 5,5 г (выход: 40,7%) 4-бромметил-5-дифторметокси-1-изопропил-3-трифторметил-1Н-пиразола.
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 6,72 (1Н, т, J=71,9 Гц), 4,62 (1Н, м), 4,40 (2Н, с), 1,47 (6Н, д, J=6,8 Гц).
Показатель преломления (nD 20): 1,4383
Пример 20
Получение 1,4-диметил-5-(2,2,2-трифторэтокси)-3-трифторметил-1Н-пиразола (Соединение по изобретению № 079)
К раствору 4,4 г (24,4 ммоль) 1,4-диметил-5-гидрокси-3-трифторметил-1Н-пиразола в 50 мл N,N-диметилформамида добавляют 5,1 г (36,6 ммоль) безводного карбоната калия и 6,3 г (26,8 ммоль) 2,2,2-трифторэтилтрифторметансульфоната, затем в течение 3 часов перемешивают при комнатной температуре. После подтверждения завершения реакции реакционный раствор выливают в воду и экстрагируют этилацетатом. Полученный органический слой промывают водой и насыщенным солевым раствором последовательно и затем сушат над безводным сульфатом магния. Растворитель удаляют выпариванием при пониженном давлении, получая 6,1 г (выход: 95,3%) 1,4-диметил-5-(2,2,2-трифторэтокси)-3-трифторметил-1Н-пиразола в виде бледно-желтой жидкости.
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 4,41 (2Н, кв), 3,74 (3Н, д), 2,08 (3Н, д).
Показатель преломления (nD 20): 1,3872
Пример 21
Получение 5-(2,2-дифторэтокси)-1,4-диметил-3-трифторметил-1Н-пиразола (Соединение по изобретению № 078)
К раствору 9,0 г (50,0 ммоль) 1,4-диметил-5-гидрокси-3-трифторметил-1Н-пиразола в 50 мл тетрагидрофурана добавляют 14,4 г (55,0 ммоль) трифенилфосфина и 4,5 г (55,0 ммоль) 2,2-дифторэтанола при комнатной температуре с последующим перемешиванием. Кроме того, 12,3 г (60,0 ммоль) диизопропилазодикарбоксилата добавляют туда же при охлаждении льдом с последующим перемешиванием при комнатной температуре в течение ночи. После подтверждения завершения реакции реакционный раствор выливают в воду и экстрагируют этилацетатом. Полученный органический слой промывают водой и насыщенным солевым раствором последовательно и затем сушат над безводным сульфатом магния. Растворитель удаляют выпариванием при пониженном давлении и остаток очищают колоночной хроматографией на силикагеле, получая 6,8 г (выход: 55,7%) 1,4-диметил-5-(2,2-дифторэтокси)-3-трифторметил-1Н-пиразола в виде бледно-желтой жидкости.
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 6,05 (1Н, тт, J=3,8, 54,3 Гц), 4,27 (2Н, дт, J=3,8, 13,5 Гц), 3,73 (3Н, с), 2,08 (3Н, д).
Показатель преломления (nD 20): 1,4070
Пример 22
5-Гидрокси-4-метил-1-н-пропил-3-трифторметил-1Н-пиразол
(Соединение по изобретению № 039)
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 8,75 (1Н, шир.), 3,94 (2Н, т), 1,96 (3Н, д), 1,77 (2Н, м), 0,88 (3Н, т).
Температура плавления: 133-134°C
Пример 23
1-н-Бутил-5-гидрокси-4-метил-3-трифторметил-1Н-пиразол
(Соединение по изобретению № 040)
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 7,73 (1Н, шир.), 3,98 (2Н, т), 1,97 (3Н, д), 1,74 (2Н, м), 1,29 (2Н, м), 0,91 (3Н, т).
Температура плавления: 132-133°C
Пример 24
1-трет-Бутил-5-гидрокси-4-метил-3-трифторметил-1Н-пиразол
(Соединение по изобретению № 043)
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 5,45 (1Н, шир.), 1,97 (3Н, д), 1,60 (9Н, с).
Температура плавления: 159-160°C
Пример 25
5-Дифторметокси-4-метил-1-этил-3-трифторметил-1Н-пиразол
(Соединение по изобретению № 080)
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 6,49 (1Н, т, J=71,9 Гц), 4,10 (2Н, кв), 2,07 (3Н, д), 1,42 (3Н, т).
Температура кипения: 88-91°C/3,73 кПа (28 мм Hg)
Показатель преломления (nD 20): 1,3971
Пример 26
1-Этил-4-метил-5-(2,2,2-трифторэтокси)-3-трифторметил-1Н-пиразол (Соединение по изобретению № 083)
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 4,42 (2Н, кв), 4,07 (2Н, кв), 2,09 (3Н, д), 1,41 (3Н, т).
Пример 27
4-Метил-1-изопропил-5-(2,2,2-трифторэтокси)-3-трифторметил-1Н-пиразол (Соединение по изобретению № 087)
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 4,55 (1Н, м), 4,41 (2Н, кв), 2,08 (3Н, д), 1,45 (6Н, д).
Пример 28
4-Метил-1-н-пропил-5-(2,2,2-трифторэтокси)-3-трифторметил-1Н-пиразол (Соединение по изобретению № 090)
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 4,41 (2Н, кв), 3,97 (2Н, т), 2,09 (3Н, д), 1,84 (2Н, м), 0,91 (3Н, т).
Пример 29
1-н-Бутил-4-метил-5-(2,2,2-трифторэтокси)-3-трифторметил-1Н-пиразол (Соединение по изобретению № 093)
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 4,41 (2Н, кв), 4,00 (2Н, т), 2,09 (3Н, д), 1,80 (2Н, м), 1,30 (2Н, м), 0,93 (3Н, т).
Пример 30
1-трет-Бутил-4-метил-5-(2,2,2-трифторэтокси)-3-трифторметил-1Н-пиразол (Соединение по изобретению № 102)
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 4,43 (2Н, кв), 2,09 (3Н, д), 1,59 (9Н, с).
Пример 31
4-Этил-1-метил-5-дифторметокси-3-трифторметил-1Н-пиразол (Соединение по изобретению № 105)
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 6,50 (1Н, т, J=71,7 Гц), 3,78 (3Н, с), 2,51 (2Н, кв), 1,15 (3Н, т).
Показатель преломления (nD 20): 1,4021
Пример 32
4-Бромметил-1-метил-5-(2,2-дифторэтокси)-3-трифторметил-1Н-пиразол (Соединение по изобретению № 153)
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 6,11 (1Н, тт, J=3,5, 54,2 Гц), 4,52 (2Н, дт, J=3,5, 13,5 Гц), 4,43 (2Н, с), 3,76 (3Н, с).
Показатель преломления (nD 20): 1,4490
Пример 33
4-Бромметил-1-метил-5-(2,2,2-трифторэтокси)-3-трифторметил-1Н-пиразол (Соединение по изобретению № 154)
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 4,68 (2Н, кв), 4,41 (2Н, с), 3,77 (3Н, с).
Показатель преломления (nD 20): 1,3872
Пример 34
4-Бромметил-5-дифторметокси-1-этил-3-трифторметил-1H-пиразол (Соединение по изобретению № 155)
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 6,73 (1Н, т, J=71,7 Гц), 4,40 (2Н, с), 4,13 (2Н, кв), 1,46 (3Н, т).
Пример 35
4-Бромметил-1-трет-бутил-5-(2,2-дифторэтокси)-3-трифторметил-1Н-пиразол (Соединение по изобретению № 168)
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 6,15 (1Н, тт, J=3,7, 54,1 Гц), 4,56 (2Н, дт, J=3,7, 13,4 Гц), 4,45 (2Н, с), 1,60 (9Н, с).
Пример 36
Гидробромид 2-(5-(2,2-дифторэтокси)-1-метил-3-трифторметил-1Н-пиразол-4-илметил)изотиомочевины (Соединение по изобретению № 199)
1Н-ЯМР (CD3OD/TMS δ (м.д.)): 6,26 (1Н, тт, J=3,4, 53,9 Гц), 4,51 (2Н, дт, J=3,2, 14,1 Гц), 4,41 (2Н, с), 3,78 (3Н, с).
Пример 37
Гидробромид 2-(5-(2,2,2-трифторэтокси)-1-метил-3-трифторметил-1Н-пиразол-4-илметил)изотиомочевины (Соединение по изобретению № 200)
Температура плавления: 128-131°C
Пример 38
Гидробромид 2-(5-дифторметокси-1-этил-3-трифторметил-1Н-пиразол-4-илметил)изотиомочевины (Соединение по изобретению № 201)
Температура плавления: 139-141°C
Пример 39
Гидробромид 2-(5-дифторметокси-1-изопропил-3-трифторметил-1Н-пиразол-4-илметил)изотиомочевины (Соединение по изобретению 204)
Температура плавления: 146-148°C
Пример 40
(5-Дифторметокси-1-изопропил-3-трифторметил-1Н-пиразол-4-ил)метантиол (Соединение по изобретению № 223)
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 6,72 (1Н, т, J=72,2 Гц), 4,60 (1Н, м), 3,62 (2Н, с), 1,46 (6Н, д).
В дополнение к указанным соединениям, в отношении соединений, указанных номерами в следующей таблице, подтверждены их физические свойства и данные инструментального анализа.
Следующее будет пояснением получения производных изоксазолина (описанных в японской выложенной патентной заявке № 308857/2002) с использованием соединений по изобретению, представленных общей формулой [1], в качестве промежуточных соединений и гербицидного действия производных изоксазолина.
Вначале будет пояснено получение производных изоксазолина (описанных в японской выложенной патентной заявке № 308857/2002) с использованием соединений по изобретению, представленных общей формулой [1].
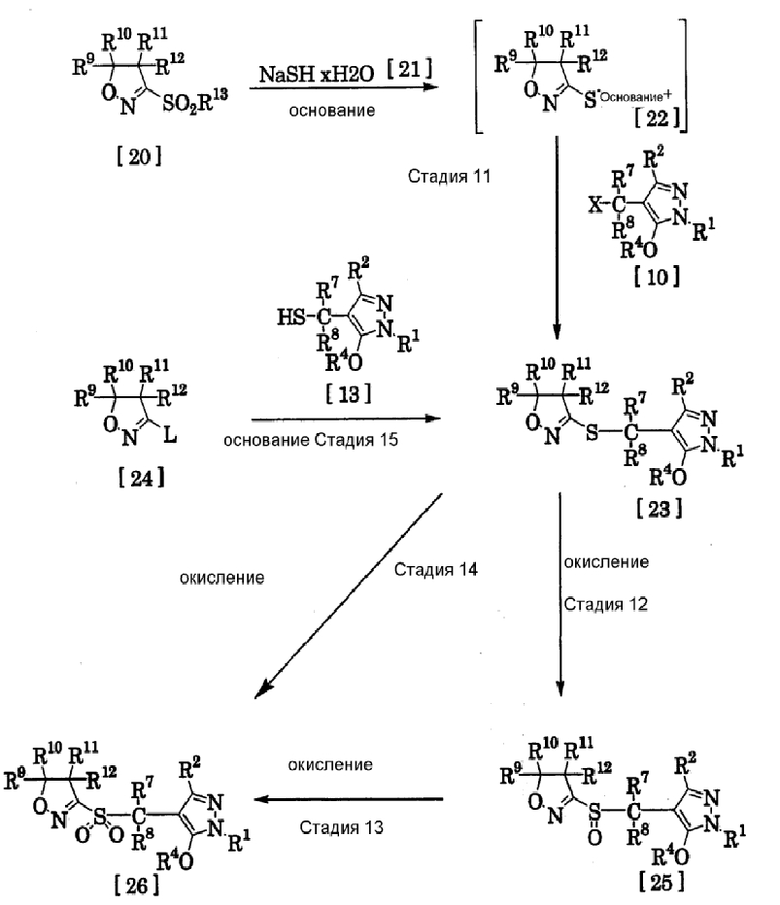
где R1, R2, R4, R7, R8 и Х имеют те же значения, которые указаны выше, R9 и R10 являются одинаковыми или отличающимися друг от друга, и каждый означает атом водорода, алкилгруппу, циклоалкилгруппу или циклоалкилалкилгруппу, или R9 и R10 объединены вместе с атомом углерода, к которому они присоединены, с образованием С3-С7 спиро-кольца, R11 и R12 являются одинаковыми или отличающимися друг от друга, и каждый означает атом водорода, алкилгруппу или циклоалкилгруппу, или R11 и R12 объединены вместе с атомом углерода, к которому они присоединены, с образованием С3-С7 спиро-кольца, и дополнительно R9, R10, R11 и R12 могут образовывать 5-8-членное кольцо вместе с атомом углерода, связанным с ними. R13 означает С1-С4 алкилгруппу, фенилгруппу, которая может быть замещена, или бензилгруппу, которая может быть замещена, и L означает уходящую группу, такую как атом галогена, С1-С4 алкилсульфонилгруппа, фенилсульфонилгруппа, которая может быть замещена, или бензилсульфонилгруппа, которая может быть замещена.
Следующее будет пояснять каждую стадию указанных выше способов получения производных изоксазолина.
(Стадия 11)
Производное сульфида, представленное общей формулой [23], может быть получено при взаимодействии соединения, представленного общей формулой [20], с гидратом гидросульфида натрия, представленным общей формулой [21], в растворителе или без растворителя (предпочтительно в подходящем растворителе) в присутствии основания до образования соли меркаптана, представленной общей формулой [22], в реакционной системе и затем взаимодействием соли меркаптана [22], которую не разделяют, с производным галогена, представленным общей формулой [10], которое является соединением по изобретению (необязательно реакцию проводят в атмосфере инертного газа, или может быть добавлен восстановитель).
(Стадия 12)
Производное сульфоксида, представленное общей формулой [25], может быть получено при взаимодействии производного сульфида, представленного общей формулой [23], с окислителем в подходящем растворителе.
(Стадия 13)
Производное сульфона, представленное общей формулой [26], может быть получено при взаимодействии производного сульфоксида, представленного общей формулой [25], с окислителем в подходящем растворителе.
(Стадия 14)
Производное сульфона, представленное общей формулой [26], может быть получено при взаимодействии производного сульфида, представленного общей формулой [23], с подходящим количеством окислителя в подходящем растворителе без выделения производного сульфоксида, представленного общей формулой [25].
(Стадия 15)
Производное сульфида, представленное общей формулой [23], может быть получено при взаимодействии соединения, представленного общей формулой [24], с производным меркаптана, представленным общей формулой [13], которое является соединением по изобретению, в растворителе или без растворителя (предпочтительно в подходящем растворителе) в присутствии основания (необязательно, реакцию проводят в атмосфере инертного газа или может быть добавлен восстановитель). Производное меркаптана, представленное общей формулой [13], которое является соединением по изобретению, может быть также получено в реакционной системе способом, описанным на стадиях 6 или 7 способа получения 5, и затем может быть использовано.
Следующее будет конкретно пояснять получение производных изоксазолина (описанных в японской выложенной патентной заявке № 308857/2002) с использованием соединений по изобретению, представленных общей формулой [1], со ссылкой на справочные примеры.
<Справочный пример 1>
Получение 3-(5-дифторметокси-1-метил-3-трифторметил-1Н-пиразол-4-илметилтио)-5,5-диметил-2-изоксазолина
1) К раствору 6,7 г (35,0 ммоль) 3-этансульфонил-5,5-диметил-2-изоксазолина в 50 мл N,N-диметилформамида добавляют 5,6 г (чистота: 70%, 70,0 ммоль) гидросульфида натрия с последующим перемешиванием в течение 1 часа при комнатной температуре. После этого туда добавляют 4,8 г (35,0 ммоль) карбоната калия и 10,8 г (35,0 ммоль) 4-бромметил-5-дифторметокси-1-метил-3-трифторметил-1Н-пиразола с последующим перемешиванием при комнатной температуре в течение ночи. После подтверждения завершения реакции реакционный раствор выливают в воду и экстрагируют этилацетатом. Полученный органический слой промывают водой и насыщенным солевым раствором и затем сушат над безводным сульфатом магния. Растворитель удаляют выпариванием при пониженном давлении и остаток очищают колоночной хроматографией на силикагеле, получая 7,3 г (выход: 57,9%) 3-(5-дифторметокси-1-метил-3-трифторметил-1Н-пиразол-4-илметилтио)-5,5-диметил-2-изоксазолина в виде белых кристаллов (температура плавления: 39-40°C).
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 6,72 (1Н, т, J = 72,0 Гц), 4,19 (2Н, с), 3,81 (3Н, с), 2,78 (2Н, с), 1,42 (6Н, с).
2) К раствору 1,93 г (5,00 ммоль) гидробромида 2-(5-дифторметокси-1-метил-3-трифторметил-1Н-пиразол-4-илметил) изотиомочевины в 10 мл этанола добавляют 0,48 г (12,00 ммоль) гидроксида натрия и 10 мл воды с последующим перемешиванием в течение 30 минут при комнатной температуре. Туда же добавляют 0,67 г (5,00 ммоль) 3-хлор-5,5-диметил-2-изоксазолина при комнатной температуре с последующим перемешиванием в течение еще 12 часов при кипячении с обратным холодильником. После подтверждения завершения реакции растворитель удаляют выпариванием при пониженном давлении. Полученный остаток выливают в воду и экстрагируют этилацетатом. Полученный органический слой промывают водой и затем сушат над безводным сульфатом магния. Растворитель удаляют выпариванием при пониженном давлении и остаток очищают колоночной хроматографией на силикагеле, получая 1,02 г (выход: 56,7%) 3-(5-дифторметокси-1-метил-3-трифторметил-1Н-пиразол-4-илметилтио)-5,5-диметил-2-изоксазолина.
3) К раствору 1,93 г (5,00 ммоль) гидробромида 2-(5-дифторметокси-1-метил-3-трифторметил-1Н-пиразол-4-илметил) изотиомочевины в 10 мл этанола добавляют 0,83 г (6,00 ммоль) безводного карбоната калия и 5 мл воды с последующим перемешиванием в течение 30 минут при комнатной температуре. Туда же добавляют раствор 0,95 г (5,00 ммоль) 3-этансульфонил-5,5-диметил-2-изоксазолина в 5 мл N,N-диметилформамида и 0,83 г (6,00 ммоль) безводного карбоната калия при комнатной температуре с последующим перемешиванием в течение еще 3 часов при 50°C. После подтверждения завершения реакции растворитель удаляют выпариванием при пониженном давлении. Полученный остаток выливают в воду и экстрагируют этилацетатом. Полученный органический слой промывают водой и затем сушат над безводным сульфатом магния. Растворитель удаляют выпариванием при пониженном давлении и остаток очищают колоночной хроматографией на силикагеле, получая 1,55 г (выход: 86,1%) 3-(5-дифторметокси-1-метил-3-трифторметил-1Н-пиразол-4-илметилтио)-5,5-диметил-2-изоксазолина.
<Справочный пример 2>
Получение 3-(5-дифторметокси-1-метил-3-трифторметил-1Н-пиразол-4-илметансульфинил)-5,5-диметил-2-изоксазолина
К раствору 6,2 г (17,3 ммоль) 3-(5-дифторметокси-1-метил-3-трифторметил-1Н-пиразол-4-илметилтио)-5,5-диметил-2-изоксазолина в 40 мл хлороформа добавляют 3,4 г (чистота: 70%, 13,8 ммоль) м-хлорпербензойной кислоты при охлаждении льдом с последующим перемешиванием в течение 1 часа. После этого все дополнительно перемешивают при комнатной температуре в течение 3 часов. После подтверждения завершения реакции реакционный раствор выливают в воду и экстрагируют хлороформом. Полученный органический слой промывают водным раствором гидросульфита натрия, водным гидрокарбонатом натрия, водой и насыщенным солевым раствором последовательно и затем сушат над безводным сульфатом магния. Растворитель удаляют выпариванием при пониженном давлении и полученное твердое вещество промывают н-гексаном, получая 4,1 г (выход: 63,2%) 3-(5-дифторметокси-1-метил-3-трифторметил-1Н-пиразол-4-илметансульфинил)-5,5-диметил-2-изоксазолина в виде белого порошка (температура плавления: 112-114°C).
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 6,95 (1Н, кв, J=69,5, 74,4 Гц), 4,16 (2Н, с), 3,85 (3Н, с), 3,11 (2Н, кв, J=17,2 Гц), 1,52 (6Н, д, J=5,5 Гц).
<Справочный пример 3>
Получение 3-(5-дифторметокси-1-метил-3-трифторметил-1Н-пиразол-4-илметансульфонил)-5,5-диметил-2-изоксазолина
К раствору 7,3 г (20,3 ммоль) 3-(5-дифторметокси-1-метил-3-трифторметил-1Н-пиразол-4-илметилтио)-5,5-диметил-2-изоксазолина в 50 мл хлороформа добавляют 12,5 г (чистота: 70%, 50,8 ммоль) м-хлорпербензойной кислоты при охлаждении льдом с последующим перемешиванием в течение 1 часа. После этого все дополнительно перемешивают при комнатной температуре в течение ночи. После подтверждения завершения реакции реакционный раствор выливают в воду и экстрагируют хлороформом. Полученный органический слой промывают водным раствором гидросульфита натрия, водным гидрокарбонатом натрия, водой и насыщенным солевым раствором последовательно и затем сушат над безводным сульфатом магния. Растворитель удаляют выпариванием при пониженном давлении и полученное твердое вещество промывают н-гексаном, получая 6,4 г (выход: 80,6%) 3-(5-дифторметокси-1-метил-3-трифторметил-1Н-пиразол-4-илметансульфонил)-5,5-диметил-2-изоксазолина в виде белого порошка (температура плавления: 129-130°C).
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 6,83 (1Н, т, J=71,9 Гц), 4,60 (2Н, с), 3,88 (3Н, с), 3,11 (2Н, с), 1,52 (6Н, с).
<Справочный пример 4>
3-(5-Дифторметокси-1-этил-3-трифторметил-1Н-пиразол-4-илметансульфонил)-5,5-диметил-2-изоксазолин
Температура плавления: 98-100°C
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 6,83 (1Н, т, J=72,0 Гц), 4,60 (2Н, с), 4,19 (2Н, кв), 3,11 (2Н, с), 1,51 (6Н, с), 1,49 (3Н, с).
<Справочный пример 5>
3-(5-Дифторметокси-1-изопропил-3-трифторметил-1H-пиразол-4-илметансульфонил)-5,5-диметил-2-изоксазолин
Показатель преломления (nD 20): 1,4621
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 6,83 (1Н, т, J=72,1 Гц), 4,70 (1Н, м), 4,60 (2Н, с), 3,10 (2Н, с), 1,52 (6Н, с), 1,49 (6Н, с).
<Справочный пример 6>
3-(5-Дифторметокси-1-н-пропил-3-трифторметил-1H-пиразол-4-илметансульфонил)-5,5-диметил-2-изоксазолин
Показатель преломления (nD 20): 1,4629
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 6,82 (1Н, т, J=71,7 Гц), 4,60 (2Н, с), 4,09 (2Н, т), 3,10 (2Н, с), 1,92 (2Н, м), 1,52 (6Н, с), 0,94 (3Н, т).
<Справочный пример 7>
3-(1-изобутил-5-дифторметокси-3-трифторметил-1H-пиразол-4-илметансульфонил)-5,5-диметил-2-изоксазолин
Показатель преломления (nD 20): 1,4601
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 6,81 (1Н, т, J=71,7 Гц), 4,60 (2Н, с), 3,94 (2Н, д), 3,10 (2Н, с), 2,30 (1Н, м), 1,51 (6Н, м), 0,92 (6Н, д).
<Справочный пример 8>
3-(5-Дифторметокси-1-метил-3-трифторметил-1Н-пиразол-4-илметансульфонил)-5-этил-5-метил-2-изоксазолин
Температура плавления: 77-78°C
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 6,83 (1Н, т, J=71,9 Гц), 4,60 (2Н, с), 3,88 (3Н, с), 3,09 (2Н, АВкв, J=17,4 Гц, Δν=46,7 Гц), 1,78 (2Н, кв), 1,47 (3Н, с), 0,98 (3Н, т).
<Справочный пример 9>
3-(5-Дифторметокси-1-метил-3-трифторметил-1Н-пиразол-4-илметансульфонил)-5-метил-5-циклопропил-2-изоксазолин
Температура плавления: 96-98°C
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 6,83 (1Н, т, J=71,9 Гц), 4,59 (2Н, с), 3,88 (3Н, с), 3,13 (2Н, АВкв, J=17,3 Гц, Δν=53,4 Гц), 1,48 (3Н, с), 1,14 (1Н, м), 0,36-0,58 (4Н, м).
<Справочный пример 10>
7-(5-Дифторметокси-1-метил-3-трифторметил-1Н-пиразол-4-илметансульфонил)-5-окса-6-азаспиро[3,4]-6-октен
Температура плавления: 149-151°C
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 6,83 (1Н, т, J=71,9 Гц), 4,58 (2Н, с), 3,87 (3Н, с), 3,40 (2Н, с), 2,62 (2Н, м), 2,27 (2Н, м), 1,91 (1Н, м), 1,67 (1Н, м).
<Справочный пример 11>
3-(5-Дифторметокси-1-метил-3-трифторметил-1Н-пиразол-4-илметансульфонил)-2-изоксазолин
Температура плавления: 115-117°C
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 6,83 (1Н, т, J=71,7 Гц), 4,66 (2Н, т), 4,61 (2Н, с), 3,88 (3Н, с), 3,37 (2Н, т).
<Справочный пример 12>
6-(5-Дифторметокси-1-метил-3-трифторметил-1Н-пиразол-4-илметансульфонил)-4-окса-5-азаспиро[2,4]-5-гептен
Температура плавления: 125-126°C
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 6,83 (1Н, т, J=71,9 Гц), 4,61 (2Н, с), 3,88 (3Н, с), 3,42 (2Н, с), 1,31 (2Н, т), 0,91 (2Н, т).
<Справочный пример 13>
3-[1-(5-дифторметокси-1-метил-3-трифторметил-1Н-пиразол-4-ил)этансульфонил]-5,5-диметил-2-изоксазолин
Показатель преломления (nD 20): 1,4657
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 6,92 (1Н, м), 4,83 (1Н, кв), 3,88 (3Н, с), 3,07 (2Н, д), 1,83 (3Н, д), 1,50 (6Н, д).
<Справочный пример 14>
3-(5-Дифторметокси-1-метил-3-трифторметил-1Н-пиразол-4-илметансульфонил)-3a,4,5,6,7,7a-гексагидробензо[d]изоксазол
Температура плавления: 97-98°C
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 6,84 (1Н, т, J=72,0 Гц), 4,69 (1Н, м), 4,61 (2Н, с), 3,88 (3Н, с), 3,48 (1Н, м), 1,26-2,17 (9Н, м).
<Справочный пример 15>
3-(5-Дифторметокси-1-метил-3-трифторметил-1Н-пиразол-4-илметансульфонил)-5-метил-2-изоксазолин
Температура плавления: 106-107°C
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 6,83 (1Н, т, J=71,9 Гц), 5,05 (1Н, м), 4,60 (2Н, с), 3,88 (3Н, с), 3,44 (1Н, дд), 2,96 (1Н, дд), 1,48 (3Н, д).
<Справочный пример 16>
3-(5-Дифторметокси-1-метил-3-трифторметил-1Н-пиразол-4-илметансульфонил)-5-изопропил-2-изоксазолин
Температура плавления: 85-86°C
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 6,83 (1Н, т, J=71,7 Гц), 4,67 (1Н, м), 4,59 (2Н, с), 3,88 (3Н, с), 3,30 (1Н, дд), 3,08 (1Н, дд), 1,97 (1Н, м), 0,98 (6Н, дд).
<Справочный пример 17>
3-(5-Дифторметокси-1-метил-3-трифторметил-1Н-пиразол-4-илметансульфонил)-4,5,5-триметил-2-изоксазолин
Показатель преломления (nD 20): 1,4646
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 6,84 (1Н, т, J=71,9 Гц), 4,61 (2Н, кв), 3,88 (3Н, с), 3,36 (1Н, кв), 1,44 (3Н, с), 1,38 (3Н, с), 1,30 (3Н, д).
<Справочный пример 18>
3-(5-Дифторметокси-1-метил-3-трифторметил-1Н-пиразол-4-илметансульфонил)-4-метил-2-изоксазолин
Показатель преломления (nD 20): 1,4673
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 6,83 (1Н, т, J=71,8 Гц), 4,71 (1Н, т), 4,62 (2Н, кв), 4,25 (1Н, т), 3,88 (3Н, с), 3,81 (1Н, м), 1,44 (3Н, д).
<Справочный пример 19>
3-[1-(5-Дифторметокси-1-метил-3-трифторметил-1Н-пиразол-4-ил)пропан-1-сульфонил]-5,5-диметил-2-изоксазолин
Показатель преломления (nD 20): 1,4669
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 6,91 (1Н, т, J=72,9 Гц), 4,60 (1Н, кв), 3,89 (3Н, с), 3,05 (2Н, д), 2,30 (2Н, м), 1,49 (6Н, д), 0,94 (3Н, т).
<Справочный пример 20>
3-[5-(2,2,2-Трифторэтокси)-1-метил-3-трифторметил-1Н-пиразол-4-илметансульфонил]-5,5-диметил-2-изоксазолин
Температура плавления: 93-95°C
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 4,68 (2Н, кв), 4,59 (2Н, с), 3,84 (3Н, с), 3,12 (2Н, с), 1,53 (6Н, с).
<Справочный пример 21>
3-[5-(2,2-Дифторэтокси)-1-метил-3-трифторметил-1Н-пиразол-4-илметансульфонил]-5,5-диметил-2-изоксазолин
Температура плавления: 89-91°C
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 6,11 (1Н, тт, J=3,5, 54,4 Гц), 4,58 (2Н, с), 4,48 (2Н, дт, J=3,7, 15,3 Гц), 3,88 (3Н, с), 3,11 (2Н, с), 1,52 (6Н, с).
<Справочный пример 22>
3-[1-трет-бутил-5-(2,2-дифторэтокси)-3-трифторметил-1Н-пиразол-4-илметансульфонил]-5,5-диметил-2-изоксазолин
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 6,14 (1Н, тт, J=3,9, 54,4 Гц), 4,61 (2Н, с), 4,54 (2Н, дт, J=3,6, 13,4 Гц), 3,08 (2Н, с), 1,63 (9Н, с), 1,51 (6Н, с).
<Справочный пример 23>
3-[5-(2,2-Дифторэтокси)-1-изопропил-3-трифторметил-1Н-пиразол-4-илметансульфонил]-5,5-диметил-2-изоксазолин
Температура плавления: 88-89°C
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 6,11 (1Н, тт, J=3,4, 54,6 Гц), 4,58-4,65 (3Н, м), 4,47 (2Н, дт, J=3,7, 13,4 Гц), 3,10 (2Н, с), 1,52 (6Н, с), 1,46 (6Н, д).
<Справочный пример 24>
3-[1-Этил-5-(2,2-дифторэтокси)-3-трифторметил-1Н-пиразол-4-илметансульфонил]-5,5-диметил-2-изоксазолин
Показатель преломления (nD 20): 1,4687
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 6,11 (1Н, тт, J=3,7, 54,5 Гц), 4,58 (2Н, с), 4,48 (2Н, дт, J=3,7, 13,4 Гц), 4,16 (2Н, кв), 3,10 (2Н, с), 1,52 (6Н, с), 1,47 (3Н, т).
<Справочный пример 25>
3-[5-(2,2-Дифторэтокси)-1-н-пропил-3-трифторметил-1Н-пиразол-4-илметансульфонил]-5,5-диметил-2-изоксазолин
Показатель преломления (nD 20): 1,4658
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 6,11 (1Н, тт, J=3,7, 54,3 Гц), 4,59 (2Н, с), 4,47 (2Н, дт, J=3,7, 13,5 Гц), 4,04 (2Н, т), 3,09 (2Н, т), 1,90 (2Н, м), 1,52 (6Н, с), 0,94 (3Н, т).
<Справочный пример 26>
3-[5-(2,2,2-Трифторэтокси)-1-изопропил-3-трифторметил-1Н-пиразол-4-илметансульфонил]-5,5-диметил-2-изоксазолин
Температура плавления: 109-110°C
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 4,55-4,70 (5Н, м), 3,11 (2Н, с), 1,52 (6Н, с), 1,49 (6Н, д).
<Справочный пример 27>
3-[5-(2,2,2-Трифторэтокси)-1-н-пропил-3-трифторметил-1Н-пиразол-4-илметансульфонил]-5,5-диметил-2-изоксазолин
Температура плавления: 49-51°C
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 4,68 (2Н, кв), 4,59 (2Н, с), 4,04 (2Н, т), 3,11 (2Н, с), 1,88 (2Н, м), 1,52 (6Н, с), 0,94 (3Н, т).
<Справочный пример 28>
3-[1-н-бутил-5-(2,2,2-трифторэтокси)-3-трифторметил-1Н-пиразол-4-илметансульфонил]-5,5-диметил-2-изоксазолин
Показатель преломления (nD 20): 1,4533
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 4,67 (2Н, кв), 4,59 (2Н, с), 4,07 (2Н, т), 3,10 (2Н, с), 1,84 (2Н, м), 1,52 (6Н, с), 1,35 (2Н, м), 0,95 (3Н, т).
<Справочный пример 29>
3-[1-Этил-5-(2,2,2-трифторэтокси)-3-трифторметил-1Н-пиразол-4-илметансульфонил]-5,5-диметил-2-изоксазолин
Температура плавления: 84-86°C
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 4,68 (2Н, кв), 4,59 (2Н, с), 4,14 (2Н, кв), 3,11 (2Н, с), 1,52 (6Н, с), 1,47 (3Н, т).
<Справочный пример 30>
3-[1-трет-бутил-5-(2,2,2-трифторэтокси)-3-трифторметил-1Н-пиразол-4-илметансульфонил]-5,5-диметил-2-изоксазолин
Температура плавления: 91-92°C
1Н-ЯМР (CDCl3/TMS δ (м.д.)): 4,77 (2Н, кв), 4,60 (2Н, с), 3,11 (2Н, с), 1,63 (9Н, с), 1,52 (6Н, с).
Следующее будет пояснением гербицидного действия, проявляемого соединением, представленным общей формулой [26], (производное изоксазолина, описанное в японской выложенной патентной заявке № 308857/2002), которое может быть получено с использованием производного пиразола, представленного общей формулой [1], или его соли (соединение по изобретению).
При применении соединения, представленного общей формулой [26] (производное изоксазолина, описанное в японской выложенной патентной заявке № 308857/2002), в качестве гербицида соединение может быть использовано само по себе, может быть также использовано в составе, таком как дуст, смачиваемый порошок, эмульгируемый концентрат, текучий состав, микрогранула, гранула и тому подобное, полученном смешиванием с носителем, поверхностно-активным веществом, диспергирующим агентом, вспомогательным агентом или тому подобным, которые обычно используются для приготовления состава.
Примеры носителя, который должен быть использован для состава, включают твердые носители, такие как тальк, бентонит, глина, каолин, диатомовая земля, белая сажа, вермикулит, карбонат кальция, гашеная известь, кварцевый песок, сульфат аммония и мочевина; жидкие носители, такие как изопропиловый спирт, ксилол, циклогексан и метилнафталин, и тому подобное.
Примеры поверхностно-активного вещества и диспергирующего агента включают соли металлов алкилбензолсульфоновых кислот, соли металлов динафтилметандисульфоновой кислоты, соли сложных эфиров сульфатов спиртов, соли алкиларилсульфоновой кислоты, соли лигносульфоновой кислоты, гликолевый простой эфир полиоксиэтилена, алкилариловые простые эфиры полиоксиэтилена, моноалкилаты полиоксиэтиленангидросорбита и тому подобное. Примеры вспомогательного агента включают карбоксиметилцеллюлозу, полиэтиленгликоль, гуммиарабик и тому подобное. При применении его разбавляют до подходящей концентрации и затем распыляют или наносят непосредственно.
Соединение, представленное общей формулой [26], может быть применено распылением на листья, нанесением на почву, нанесением на поверхность воды или тому подобным образом. Количество активного ингредиента, которое должно быть введено в смесь, соответственно определяют согласно необходимости. Когда получают порошок или гранулы, количество может быть соответственно определено в пределах от 0,01 до 10% по массе, предпочтительно от 0,05 до 5% по массе. Когда получают эмульгируемый концентрат или смачиваемый порошок, количество может быть, соответственно, определено в пределах от 1 до 50% по массе, предпочтительно от 5 до 30% по массе. Когда получают текучий состав, количество может быть, соответственно, определено в пределах от 1 до 40% по массе, предпочтительно от 5 до 30% по массе.
Количество соединения, представленного общей формулой [26], которое должно быть нанесено в качестве гербицида, изменяется в зависимости от вида используемого соединения, целевого сорняка, тенденции появления всходов сорняков, условий окружающей среды, формы, которая должна быть использована, и тому подобного. Когда соединение используют само по себе, как в случае порошка или гранул, количество, соответственно, определяют в пределах от 1 г до 50 кг, предпочтительно от 10 г до 10 кг на 1 гектар в расчете на активный ингредиент. Когда соединение используют в жидкой форме, как в случае эмульгируемого концентрата, смачиваемого порошка или текучего состава, количество, соответственно, определяют в пределах от 0,1 до 50000 м.д., предпочтительно от 10 до 10000 м.д.
Соединение, представленное общей формулой [26], может быть смешано при необходимости с инсектицидом, фунгицидом, другим гербицидом, агентом, регулирующим рост растения, удобрением и тому подобным.
Следующее будет пояснением способа получения составов конкретно со ссылкой на типичные примеры составов. Виды соединений и добавок и соотношения, в которых их смешивают, не являются ограничительными и могут изменяться в широких пределах. В следующем описании "части" относятся к частям по массе.
<Справочный пример состава 1> Смачиваемый порошок
К 10 частям соединения, представленного общей формулой [26], примешивают и распыляют 0,5 части полиоксиэтиленоктилфенилового простого эфира, 0,5 части натриевой соли продукта конденсации формалина и β-нафталинсульфоновой кислоты, 20 частей диатомовой земли и 69 частей глины, получая тем самым смачиваемый порошок.
<Справочный пример состава 2> Текучий состав
В 69 частях воды диспергируют 20 частей грубораспыленного соединения, представленного общей формулой [26]. К этому добавляют четыре части сульфата фенилового простого эфира полиоксиэтилена, модифицированного стиролом, 7 частей этиленгликоля и добавляют 200 м.д. силикона AF-118N (производимого Asahi Kasei Corporation) по отношению к составленному продукту. Полученную смесь перемешивают в течение 30 минут в высокоскоростном смесителе и затем измельчают в мельнице для тонкого мокрого помола, чтобы получить текучий состав.
<Справочный пример состава 3> Эмульгируемый концентрат
К 30 частям соединения, представленного общей формулой [26], добавляют 60 частей смеси равных объемов ксилола и изофорона и 10 частей смеси поверхностно-активных веществ, алкилата полиоксиэтиленангидросорбита, полиоксиэтиленалкиларилового полимера и алкиларилсульфоната. Полученную смесь тщательно перемешивают, чтобы получить эмульгируемый концентрат.
<Справочный пример состава 4> Гранула
Десять частей воды добавляют к 10 частям соединения, представленного общей формулой [26], 80 частям наполнителя, в котором тальк и бентонит смешаны в соотношении 1:3, 5 частям белой сажи и 5 частям смеси поверхностно-активных веществ, алкилата полиоксиэтиленангидросорбита, полиоксиэтиленалкиларилового полимера и алкиларилсульфоната. Полученную смесь тщательно смешивают до образования пасты. Пасту экструдируют через сито с ячейками, имеющими диаметр 0,7 мм. Экструдат сушат и затем режут на длину от 0,5 до 1 мм, чтобы получить гранулы.
Далее следует пояснение эффектов соединения, представленного общей формулой [26], со ссылкой на примеры испытаний.
<Справочный пример испытания 1> Испытание гербицидного эффекта путем обработки почвы рисового поля
Почву рисового поля набивают в пластмассовый горшок 100 см2 и подвергают взмучиванию. Затем высевают семена Echinochloa oryzicola Vasing и Monochoria vaginalis var. plantaginea и заполняют водой на глубину 3 см. На следующий день каждый смачиваемый порошок, полученный в соответствии с примером состава 1, разбавляют водой и капают на поверхность воды. Применяемое количество смачиваемого порошка - 250 г или 1000 г на 1 гектар в расчете на активный ингредиент. Затем выращивают в теплице и гербицидный эффект смачиваемого порошка проверяют на 21 день после обработки в соответствии со стандартами, показанными в таблице 13. Результаты показаны в таблице 14.
пример №
(г а.и./га)
Vasing
var. plantaginea
<Справочный пример испытания 2> Испытание гербицидного эффекта путем обработки почвы поля
Почву поля набивают в пластмассовый горшок 80 см2. Семена Echinochloa crus-galli var. crus-galli и Setaria viridis высевают и затем покрывают той же почвой. Каждый смачиваемый порошок, полученный в соответствии с примером состава 1, разбавляют водой и равномерно разбрызгивают с помощью малого распылителя на поверхность почвы в количестве 1000 литров на 1 гектар, так что количество каждого активного ингредиента становится 250 г или 1000 г на 1 гектар. Затем проводят выращивание в теплице и гербицидный эффект исследуют на 21-й день после обработки в соответствии со стандартами, показанными в таблице 13. Результаты показаны в таблице 15.
пример №
viridis
<Справочный пример испытания 3> Испытание гербицидного эффекта путем обработки лиственного покрова поля
Песок набивают в пластмассовый горшок 80 см2. Семена Echinochloa crus-galli var. crus-galli и Setaria viridis высевают. Выращивание проводят в теплице в течение 2 недель. Каждый смачиваемый порошок, полученный в соответствии с примером состава 1, разбавляют водой и разбрызгивают с помощью малого распылителя на все листья указанных растений в количестве 1000 литров на 1 гектар, так что количество каждого активного ингредиента становится 250 г или 1000 г на 1 гектар. Затем проводят выращивание в теплице и гербицидный эффект исследуют на 14-й день после обработки в соответствии со стандартами, показанными в таблице 13. Результаты показаны в таблице 16.
пример №
ингредиента (г а.и./га)
var. crus-galli
viridis
Промышленная применимость
Согласно данному изобретению предложены производные пиразола, представленные общей формулой [1] или их соли, которые применимы в качестве промежуточных соединений для получения производных изоксазолина, имеющих превосходное гербицидное действие (описанных в японской выложенной патентной заявке № 308857/2002). Применение соединений по изобретению в качестве промежуточных соединений дает возможность удобного получения производных изоксазолина, имеющих превосходное гербицидное действие и описанных в японской выложенной патентной заявке № 308857/2002, с более короткими стадиями (меньшим числом стадий) с хорошими общими выходами. Поэтому соединения по изобретению являются весьма полезными.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНОЕ ИЗОКСАЗОЛИНА И ГЕРБИЦИД, СОДЕРЖАЩИЙ ЕГО В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА | 2002 |
|
RU2286989C2 |
| ИЗОКСАЗОЛИНОВЫЕ ПРОИЗВОДНЫЕ И ГЕРБИЦИДЫ, СОДЕРЖАЩИЕ ИХ В КАЧЕСТВЕ АКТИВНЫХ ИНГРЕДИЕНТОВ | 2000 |
|
RU2237664C2 |
| ПРОИЗВОДНЫЕ КАРБАМАТА И ФУНГИЦИД СЕЛЬСКОГО ХОЗЯЙСТВА | 2000 |
|
RU2228328C2 |
| СПОСОБ ПОЛУЧЕНИЯ 5-ГИДРОКСИ-4-ТИОМЕТИЛПИРАЗОЛЬНОГО СОЕДИНЕНИЯ | 2005 |
|
RU2386619C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННОГО АНИЛИНОВОГО СОЕДИНЕНИЯ (ВАРИАНТЫ) И ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ | 2001 |
|
RU2292338C2 |
| СПОСОБ ПОЛУЧЕНИЯ СОЕДИНЕНИЯ 5-АЛКОКСИ-4-ГИДРОКСИМЕТИЛПИРАЗОЛА | 2007 |
|
RU2451677C2 |
| ФТОРАЛКИЛИРУЮЩИЙ АГЕНТ | 2015 |
|
RU2716008C2 |
| ПРОИЗВОДНЫЕ МАЛОНОНИТРИЛА И ИХ ПРИМЕНЕНИЕ | 2005 |
|
RU2362769C2 |
| ПРОИЗВОДНЫЕ ПИРРОЛОПИРИМИДИНА И ПИРРОЛОПИРИДИНА, ЗАМЕЩЕННЫЕ ЦИКЛИЧЕСКОЙ АМИНОГРУППОЙ КАК АНТАГОНИСТЫ CRF | 2005 |
|
RU2385321C2 |
| ИНГИБИТОР EGFR И ЕГО ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ | 2015 |
|
RU2702631C2 |
Описываются производные пиразола общей формулы [1]

где R1 означает С1-С6 алкилгруппу, R2 означает С1-С3 галогеналкилгруппу, R3 означает атом водорода, С1-С3 алкилгруппу, которая может быть замещена одним или несколькими заместителями, выбранными из группы заместителей а, или формилгруппу, и R4 означает атом водорода или С1-С3 галогеналкилгруппу (при условии, что R4 представляет С1-С3 галогеналкилгруппу в случае, когда R3 означает водород или формилгруппу, и R4 представляет водород или С1-С3 галогеналкилгруппу в случае, когда R3 означает С1-С3 алкилгруппу, которая может быть замещена одним или несколькими заместителями, выбранными из группы заместителей a), a также способы получения указанных производных, которые являются промежуточными соединениями для получения производных изоксазолина, имеющих превосходную гербицидную активность и селективность в отношении культурных растений и сорняков. 11 н. и 4 з.п. ф-лы, 16 табл.

где R1 означает С1-С6 алкилгруппу, R2 означает С1-С3 галогеналкилгруппу, R3 означает атом водорода, С1-С3 алкилгруппу, которая может быть замещена одним или несколькими заместителями, выбранными из следующей группы заместителей α, или формилгруппу, R4 означает атом водорода, С1-С3 галогеналкилгруппу при условии, что R4 представляет С1-С3 галогеналкилгруппу в случае, когда R3 означает водород или формилгруппу, и R4 представляет водород или С1-С3 галогеналкилгруппу в случае, когда R3 означает С1-С3 алкилгруппу, которая может быть замещена одним или несколькими заместителями, выбранными из следующей группы заместителей α;
группа заместителей α - атомы галогена, группа -SH, группа -SC(=NH)NH2.
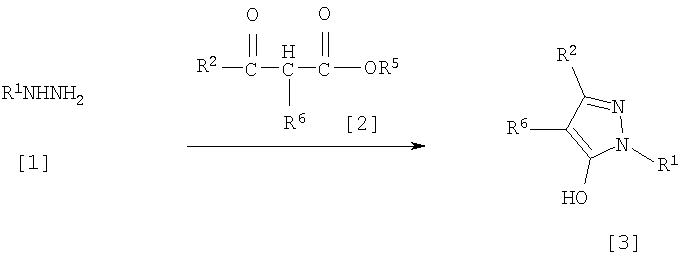
где R1 и R2 имеют те же значения, которые указаны выше, R5 означает С1-С3 алкилгруппу, фенилгруппу, которая может быть замещена, или бензилгруппу, которая может быть замещена, и R6 означает С1-С3 алкилгруппу.
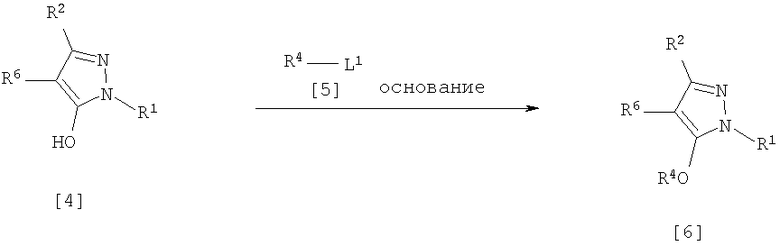
где R1, R2, R4 и R6 имеют те же значения, которые указаны выше, и L1 означает уходящую группу, которая является более реакционноспособной, чем атом галогена, остающийся после галогеналкилирования, и представляет атом галогена, С1-С3 алкилсульфонилоксигруппу, С1-С3 галогеналкилсульфонилоксигруппу, фенилсульфонилоксигруппу, которая может быть замещена, или бензилсульфонилоксигруппу, которая может быть замещена, и тому подобное.

где R1, R2, R4 и R6 имеют те же значения, которые указаны выше.
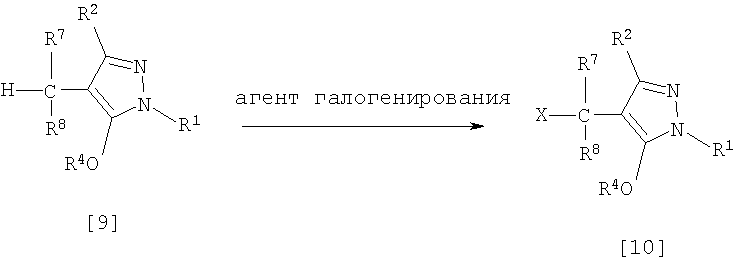
где R1, R2 и R4 имеют те же значения, которые указаны выше, R7 и R8, каждый, означают атом водорода или С1-С3 алкилгруппу и Х означает атом галогена.
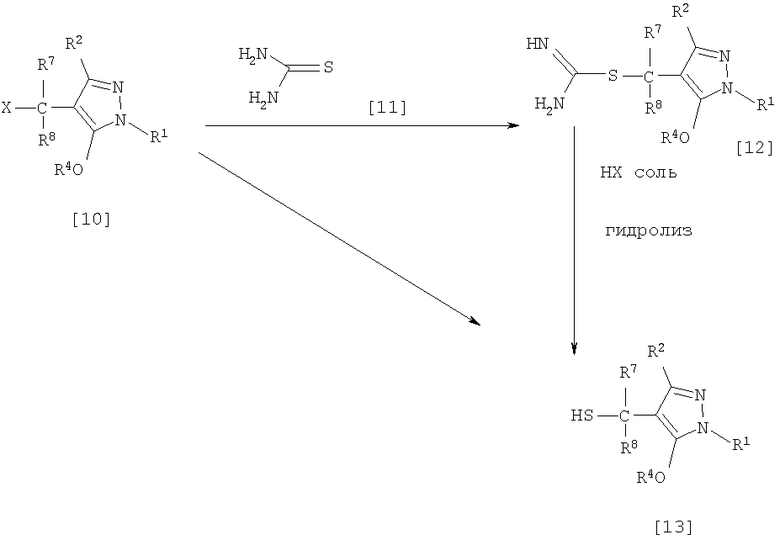
где R1, R2, R4, R7, R8 и Х имеют те же значения, которые указаны выше.

где R1 и R2 имеют те же значения, которые указаны выше.

где R1, R2, R4 и L1 имеют те же значения, которые указаны выше.

где R1, R2, R4 и X имеют те же значения, которые указаны выше.
| US 5763359 А, 09.06.1998 | |||
| Нет F | |||
| et al | |||
| Synthesis of N-(Perfluoro-t-butyl)pyrazoles from Hexafluoroacetone Azine by Trifluoromethyl Group Migration, J.C.S.CHEM | |||
| COMM., 1979, (18), p.792, 793 | |||
| US 5536701 А, 16.07.1996 | |||
| Gaede B.J | |||
| et al | |||
| Novel Perfluoroalkyl-Substituted Pyrazoles, J | |||
| Heterocyclic Chem., 1993, 30 (1), р.49-54 | |||
| Hamper B.C | |||
| et al. |
Авторы
Даты
2008-01-27—Публикация
2003-07-31—Подача