Настоящее изобретение относится к способу получения замещенного анилинового соединения, которое может использоваться в качестве промежуточного соединения в производстве, например, химикатов для сельского хозяйства и лекарственных препаратов.
В настоящее время известно, что некоторые из сульфонанилидных производных, содержащих 4,6-диметоксипирмидин, обладают высокой гербицидной активностью (см. японский патент JP-A-11-60562 и международную публикацию WO00/06553). Кроме того, также известно, что при получении указанных производных замещенное анилиновое соединение применяют в качестве основного промежуточного соединения.
К настоящему времени описаны способы получения замещенного анилинового соединения, которое является основным промежуточным соединением для сульфонанилидного производного, обладающего высокой гербицидной активностью (см. японский патент JP-A-7-48359, международную публикацию WO96/41799). Каждый указанный способ осуществляется реакцией, которая является невыгодной для производства; поэтому желательно разработать способ, посредством которого можно выгодно производить в промышленности указанный замещенный анилин.
Для решения вышеуказанной проблемы заявитель настоящего изобретения провел соответствующее исследование. В результате исследования было обнаружено, что заданное замещенное анилиновое соединение может быть получено взаимодействием, например, (пиримидин-2-ил)-2-пропанонового соединения с гидразиновым соединением в присутствии кислоты с образованием замещенного индольного соединения, окисления замещенного индольного соединения, приводящего к раскрытию индольного кольца с получением ацетанилидного соединения, и восстановления ацетанилидного соединения предпочтительно боргидридом натрия или деацетилирования амидного фрагмента, то есть, полученные данные свидетельствуют о том, что обозначенная выше проблема может быть решена. Полученные данные позволили завершить настоящее изобретение.
Настоящее изобретение подробно описано ниже.
Указанная выше проблема решена, главным образом, при включении следующих изобретений с [1] по [14].
[1] Способ получения замещенного анилинового соединения, представленного следующей общей формулой (6):
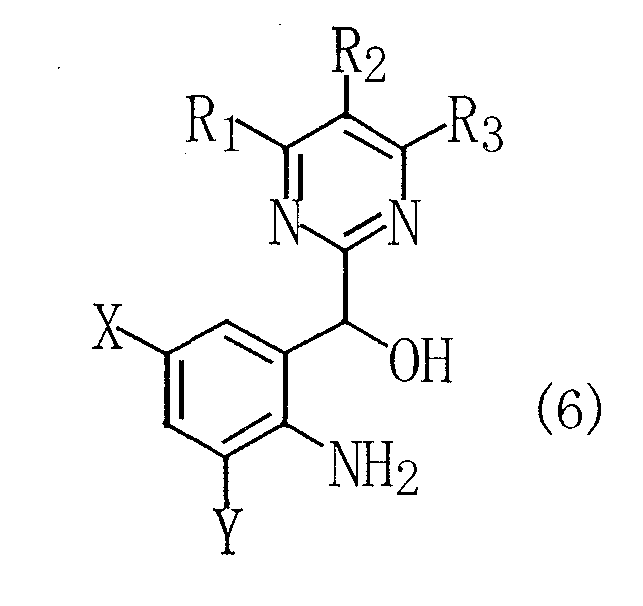
(где R1, R2 и R3 каждый независимо означает алкильную группу, алкоксигруппу, алкоксиалкильную группу, галогеналкильную группу, карбоксильную группу, алкоксикарбонильную группу, алкилкарбоксамидную группу, нитрогруппу, арильную группу, арилалкильную группу, арилоксигруппу, атом галогена или атом водорода; и X и Y каждый независимо означает атом водорода, алкильную группу, алкоксигруппу, алкоксиалкильную группу, галогеналкильную группу, карбоксильную группу, алкоксикарбонильную группу или атом галогена), отличающийся тем, что способ включает окисление замещенного индольного соединения, представленного следующей общей формулой (3):
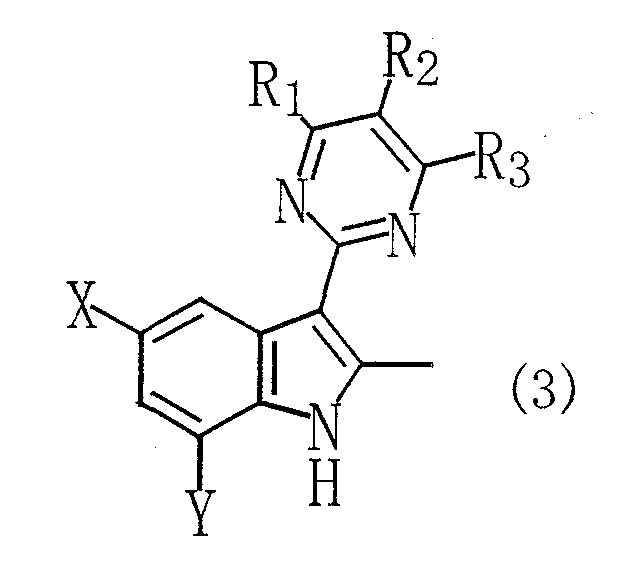
(где R1, R2, R3, X и Y имеют такие же определения, как даны выше), приводящее к раскрытию индольного кольца с получением ацетанилидного соединения, представленного следующей общей формулой (4):
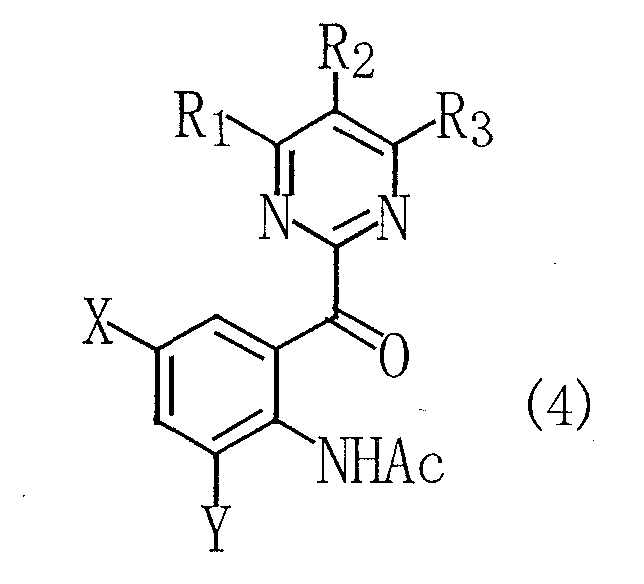
(где R1, R2, R3, X и Y имеют такие же определения, как даны выше; и Ас является ацетильной группой), и обработку данного соединения посредством восстановления и деацетилирования.
[2] Способ получения замещенного анилинового соединения, представленного следующей общей формулой (6):

(где R1, R2 и R3 каждый независимо означает алкильную группу, алкоксигруппу, алкоксиалкильную группу, галогеналкильную группу, карбоксильную группу, алкоксикарбонильную группу, алкилкарбоксамидную группу, нитрогруппу, арильную группу, арилалкильную группу, арилоксигруппу, атом галогена или атом водорода; и X и Y каждый независимо означает атом водорода, алкильную группу, алкоксигруппу, алкоксиалкильную группу, галогеналкильную группу, карбоксильную группу, алкоксикарбонильную группу или атом галогена), отличающийся тем, что способ включает окисление замещенного индольного соединения, представленного следующей общей формулой (3):

(где R1, R2, R3, X и Y имеют такие же определения, как даны выше), приводящее к раскрытию индольного кольца с получением ацетанилидного соединения, представленного следующей общей формулой (4):

(где R1, R2, R3, X и Y имеют такие же определения, как даны выше; и Ас является ацетильной группой), восстановление данного соединения с получением 2-(пиримидин-2-илгидроксиметил)ацетанилидного соединения, представленного следующей общей формулой (5):
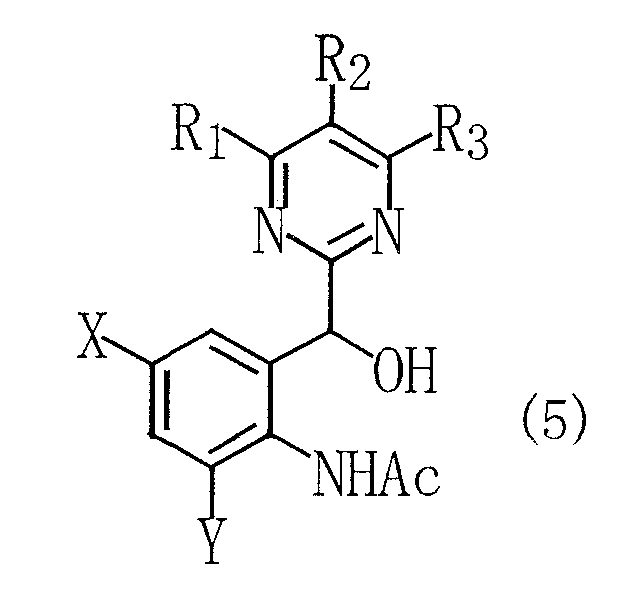
(где R1, R2, R3, X, Y и Ac имеют такие же определения, как даны выше), и последовательно проведение деацетилирования.
[3] Способ получения замещенного анилинового соединения, представленного следующей общей формулой (6):

(где R1, R2 и R3 каждый независимо означает алкильную группу, алкоксигруппу, алкоксиалкильную группу, галогеналкильную группу, карбоксильную группу, алкоксикарбонильную группу, алкилкарбоксамидную группу, нитрогруппу, арильную группу, арилалкильную группу, арилоксигруппу, атом галогена или атом водорода; и X и Y каждый независимо означает атом водорода, алкильную группу, алкоксигруппу, алкоксиалкильную группу, галогеналкильную группу, карбоксильную группу, алкоксикарбонильную группу или атом галогена), отличающийся тем, что способ включает окисление замещенного индольного соединения, представленного следующей общей формулой (3):

(где R1, R2, R3, X и Y имеют такие же определения, как даны выше), приводящее к раскрытию индольного кольца с получением ацетанилидного соединения, представленного следующей общей формулой (4):

(где R1, R2, R3, X и Y имеют такие же определения, как даны выше; и Ас является ацетильной группой), восстановление данного соединения без его выделения с получением 2-(пиримидин-2-илгидроксиметил)ацетанилидного соединения, представленного следующей общей формулой (5):

(где R1, R2, R3, X, Y и Ас имеют такие же определения, как даны выше), и последовательно проведение деацетилирования.
[4] Способ получения замещенного анилинового соединения, представленного следующей общей формулой (6):

(где R1, R2 и R3 каждый независимо означает алкильную группу, алкоксигруппу, алкоксиалкильную группу, галогеналкильную группу, карбоксильную группу, алкоксикарбонильную группу, алкилкарбоксамидную группу, нитрогруппу, арильную группу, арилалкильную группу, арилоксигруппу, атом галогена или атом водорода; и X и Y каждый независимо означает атом водорода, алкильную группу, алкоксигруппу, алкоксиалкильную группу, галогеналкильную группу, карбоксильную группу, алкоксикарбонильную группу или атом галогена), отличающийся тем, что способ включает окисление замещенного индольного соединения, представленного следующей общей формулой (3):

(где R1, R2, R3, X и Y имеют такие же определения, как даны выше), приводящее к раскрытию индольного кольца с получением ацетанилидного соединения, представленного следующей общей формулой (4):

(где R1, R2, R3, X и Y имеют такие же определения, как даны выше; и Ас является ацетильной группой), деацетилирование данного соединения с получением аминосоединения, представленного следующей общей формулой (7):

(где R1, R2, R3, X и Y имеют такие же определения, как даны выше), и последующее проведение восстановления.
[5] Способ получения замещенного анилинового соединения согласно любому из вышеуказанных способов 1-4, где замещенное индольное соединение, представленное следующей общей формулой (3):

(где R1, R2 и R3 каждый независимо означает алкильную группу, алкоксигруппу, алкоксиалкильную группу, галогеналкильную группу, карбоксильную группу, алкоксикарбонильную группу, алкилкарбоксамидную группу, нитрогруппу, арильную группу, арилалкильную группу, арилоксигруппу, атом галогена или атом водорода; и X и Y каждый независимо означает атом водорода, алкильную группу, алкоксигруппу, алкоксиалкильную группу, галогеналкильную группу, карбоксильную группу, алкоксикарбонильную группу или атом галогена), получают путем взаимодействия, в присутствии кислоты, 2-(пиримидин-2-ил)-2-пропанонового соединения, представленного следующей общей формулой (1):

(где R1, R2 и R3 имеют такие же определения, как даны выше), с гидразиновым соединением, представленным следующей общей формулой (2):
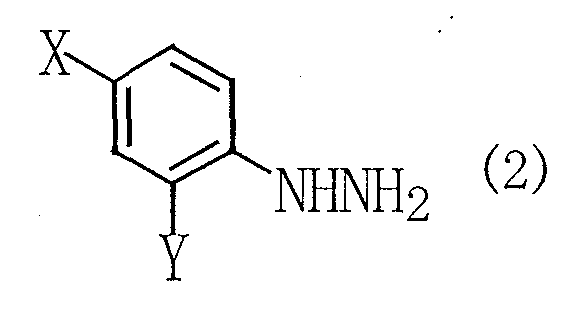
(где Х и Y имеют такие же определения, как даны выше).
[6] Способ получения аминосоединения, представленного следующей общей формулой (7):

(где R1, R2 и R3 каждый независимо означает алкильную группу, алкоксигруппу, алкоксиалкильную группу, галогеналкильную группу, карбоксильную группу, алкоксикарбонильную группу, алкилкарбоксамидную группу, нитрогруппу, арильную группу, арилалкильную группу, арилоксигруппу, атом галогена или атом водорода; и X и Y каждый независимо означает атом водорода, алкильную группу, алкоксигруппу, алкоксиалкильную группу, галогеналкильную группу, карбоксильную группу, алкоксикарбонильную группу или атом галогена), отличающийся тем, что способ включает окисление замещенного индольного соединения, представленного следующей общей формулой (3):

(где R1, R2, R3, X и Y имеют такие же определения, как даны выше), приводящее к раскрытию индольного кольца с получением ацетанилидного соединения, представленного следующей общей формулой (4):

(где R1, R2, R3, X и Y имеют такие же определения, как даны выше; и Ас является ацетильной группой), и деацетилирование данного соединения.
[7] Способ получения 2-(пиримидин-2-илгидроксиметил)ацетанилидного соединения, представленного следующей общей формулой (5):

(где R1, R2 и R3 каждый независимо означает алкильную группу, алкоксигруппу, алкоксиалкильную группу, галогеналкильную группу, карбоксильную группу, алкоксикарбонильную группу, алкилкарбоксамидную группу, нитрогруппу, арильную группу, арилалкильную группу, арилоксигруппу, атом галогена или атом водорода; и X и Y каждый независимо означает атом водорода, алкильную группу, алкоксигруппу, алкоксиалкильную группу, галогеналкильную группу, карбоксильную группу, алкоксикарбонильную группу или атом галогена; и Ас является ацетильной группой), отличающийся тем, что способ включает окисление замещенного индольного соединения, представленного следующей общей формулой (3):

(где R1, R2, R3, X и Y имеют такие же определения, как даны выше), приводящее к раскрытию индольного кольца с получением ацетанилидного соединения, представленного следующей общей формулой (4):

(где R1, R2, R3, X и Y имеют такие же определения, как даны выше; и Ас является ацетильной группой), и восстановление данного соединения.
[8] Способ получения 2-(пиримидин-2-илгидроксиметил)ацетанилидного соединения, представленного следующей общей формулой формулой (5):

(где R1, R2 и R3 каждый независимо означает алкильную группу, алкоксигруппу, алкоксиалкильную группу, галогеналкильную группу, карбоксильную группу, алкоксикарбонильную группу, алкилкарбоксамидную группу, нитрогруппу, арильную группу, арилалкильную группу, арилоксигруппу, атом галогена или атом водорода; и X и Y каждый независимо означает атом водорода, алкильную группу, алкоксигруппу, алкоксиалкильную группу, галогеналкильную группу, карбоксильную группу, алкоксикарбонильную группу или атом галогена; и Ас является ацетильной группой), отличающийся тем, что способ включает окисление замещенного индольного соединения, представленного следующей общей формулой (3):

(где R1, R2, R3, X и Y имеют такие же определения, как даны выше), приводящее к раскрытию индольного кольца с получением ацетанилидного соединения, представленного следующей общей формулой (4):

(где R1, R2, R3, X, Y и Ас имеют такие же определения, как даны выше), и восстановление данного соединения без его выделения.
[9] Способ получения замещенного индольного соединения, представленного следующей общей формулой (3):

(где R1, R2 и R3 каждый независимо означает алкильную группу, алкоксигруппу, алкоксиалкильную группу, галогеналкильную группу, карбоксильную группу, алкоксикарбонильную группу, алкилкарбоксамидную группу, нитрогруппу, арильную группу, арилалкильную группу, арилоксигруппу, атом галогена или атом водорода; и X и Y каждый независимо означает атом водорода, алкильную группу, алкоксигруппу, алкоксиалкильную группу, галогеналкильную группу, карбоксильную группу, алкоксикарбонильную группу или атом галогена), отличающийся тем, что способ включает взаимодействие, в присутствии кислоты, (пиримидин-2-ил)-2-пропанонового соединения, представленного следующей общей формулой (1):

(где R1, R2 и R3 имеют такие же определения, как даны выше), с гидразиновым соединением, представленным следующей общей формулой (2):

(где X и Y имеют такие же определения, как даны выше).
[10] Способ получения ацетанилидного соединения, представленного следующей общей формулой (4):

(где R1, R2 и R3 каждый независимо означает алкильную группу, алкоксигруппу, алкоксиалкильную группу, галогеналкильную группу, карбоксильную группу, алкоксикарбонильную группу, алкилкарбоксамидную группу, нитрогруппу, арильную группу, арилалкильную группу, арилоксигруппу, атом галогена или атом водорода; и X и Y каждый независимо означает атом водорода, алкильную группу, алкоксигруппу, алкоксиалкильную группу, галогеналкильную группу, карбоксильную группу, алкоксикарбонильную группу или атом галогена; и Ас является ацетильной группой), отличающийся тем, что способ включает окисление замещенного индольного соединения, представленного следующей общей формулой (3):

(где R1, R2, R3, X и Y имеют такие же определения, как даны выше), приводящее к раскрытию индольного кольца.
[11] Способ получения аминосоединения, представленного следующей общей формулой (7):

(где R1, R2 и R3 каждый независимо означает алкильную группу, алкоксигруппу, алкоксиалкильную группу, галогеналкильную группу, карбоксильную группу, алкоксикарбонильную группу, алкилкарбоксамидную группу, нитрогруппу, арильную группу, арилалкильную группу, арилоксигруппу, атом галогена или атом водорода; и X и Y каждый независимо означает атом водорода, алкильную группу, алкоксигруппу, алкоксиалкильную группу, галогеналкильную группу, карбоксильную группу, алкоксикарбонильную группу или атом галогена), отличающийся тем, что способ включает деацетилирование ацетанилидного соединения, представленного следующей общей формулой (4):

(где R1, R2, R3, X и Y имеют такие же определения, как даны выше; и Ас является ацетильной группой).
[12] Способ получения замещенного анилинового соединения, представленного следующей общей формулой (6):

(где R1, R2 и R3 каждый независимо означает алкильную группу, алкоксигруппу, алкоксиалкильную группу, галогеналкильную группу, карбоксильную группу, алкоксикарбонильную группу, алкилкарбоксамидную группу, нитрогруппу, арильную группу, арилалкильную группу, арилоксигруппу, атом галогена или атом водорода; и X и Y каждый независимо означает атом водорода, алкильную группу, алкоксигруппу, алкоксиалкильную группу, галогеналкильную группу, карбоксильную группу, алкоксикарбонильную группу или атом галогена), отличающийся тем, что способ включает восстановление аминосоединения, представленного следующей общей формулой (7):

(где R1, R2, R3, X и Y имеют такие же определения, как даны выше).
[13] Способ получения 2-(пиримидин-2-илгидроксиметил)ацетанилидного соединения, представленного следующей общей формулой (5):

(где R1, R2 и R3 каждый независимо означает алкильную группу, алкоксигруппу, алкоксиалкильную группу, галогеналкильную группу, карбоксильную группу, алкоксикарбонильную группу, алкилкарбоксамидную группу, нитрогруппу, арильную группу, арилалкильную группу, арилоксигруппу, атом галогена или атом водорода; и X и Y каждый независимо означает атом водорода, алкильную группу, алкоксигруппу, алкоксиалкильную группу, галогеналкильную группу, карбоксильную группу, алкоксикарбонильную группу или атом галогена; и Ас является ацетильной группой), отличающийся тем, что способ включает восстановление ацетанилидного соединения, представленного следующей общей формулой (4):

(где R1, R2, R3, X, Y и Ас имеют такие же определения, как даны выше).
[14] Способ получения замещенного анилинового соединения, представленного следующей общей формулой (6):

(где R1, R2 и R3 каждый независимо означает алкильную группу, алкоксигруппу, алкоксиалкильную группу, галогеналкильную группу, карбоксильную группу, алкоксикарбонильную группу, алкилкарбоксамидную группу, нитрогруппу, арильную группу, арилалкильную группу, арилоксигруппу, атом галогена или атом водорода; и X и Y каждый независимо означает атом водорода, алкильную группу, алкоксигруппу, алкоксиалкильную группу, галогеналкильную группу, карбоксильную группу, алкоксикарбонильную группу или атом галогена), отличающийся тем, что способ включает деацетилирование 2-(пиримидин-2-илгидроксиметил)ацетанилидного соединения, представленного следующей общей формулой (5):

(где R1, R2, R3, X и Y имеют такие же определения, как даны выше; и Ас является ацетильной группой).
Настоящее изобретение подробно описано ниже.
В способе согласно настоящему изобретению, описанному в пункте [1] (в данном тексте термин "способ согласно настоящему изобретению" имеет одно и то же значение, если не указано особо), применяют замещенное индольное соединение, представленное общей формулой (3), в качестве сырого материала. Указанное замещенное индольное соединение, представленное общей формулой (3), может быть получено взаимодействием (пиримидин-2-ил)-2-пропанонового соединения, представленного общей формулой (1), с гидразиновым соединением, представленным общей формулой (2), в присутствии кислоты. Следовательно, вначале описывают стадию (стадия 1) получения замещенного индольного соединения, представленного общей формулой (3).
Прежде всего описаны (пиримидин-2-ил)-2-пропаноновое соединение, представленное общей формулой (1), и гидразиновое соединение, представленное общей формулой (2), которые используют в качестве сырых материалов.
В (пиримидин-2-ил)-2-пропаноновом соединении, представленном общей формулой (1), R1, R2 и R3 каждый может независимо содержать от 1 до 6 атомов углерода (в данном тексте, атомы углерода, когда их количество составляет, например, от 1 до 6 атомов углерода, представлены аббревиатурой "С1-С6") и представлять собой (С1-С6)алкильную группу с прямой или разветвленной цепью, такую как метильная группа, этильная группа, н-пропильная группа, изопропильная группа, н-бутильная группа, втор-бутильная группа, трет-бутильная группа, н-пентильная группа, н-гексильная группа или тому подобное; (С1-С6)алкоксигруппу с прямой или разветвленной цепью, такую как метоксигруппа, этоксигруппа, н-пропоксигруппа, изопропоксигруппа или тому подобное; (С1-С6)алкокси(С1-С6)алкильную группу с прямой или разветвленной цепью, такую как метоксиметильная группа, метоксиэтильная группа, этоксиэтильная группа или тому подобное; (С1-С6)галогеналкильную группу с прямой или разветвленной цепью, такую как фторметильная группа, дифторметильная группа, трифторметильная группа или тому подобное; карбоксильную группу; (С1-С6)алкоксикарбонильную группу с прямой или разветвленной цепью, такую как метоксикарбонильная группа, этоксикарбонильная группа или тому подобное; (С1-С6)алкилкарбоксамидную группу с прямой или разветвленной цепью, такую как метилкарбоксамидная группа, этилкарбоксамидная группа или тому подобное; нитрогруппу; арильную группу, такую как фенильная группа или тому подобное; арил(С1-С6)алкильную группу с прямой или разветвленной цепью, такую как фенилметильная группа, фенилэтильная группа или тому подобное; арилоксигруппу, такую как феноксигруппа, нафтоксигруппа или тому подобное; атом галогена, такой как атом брома, атом хлора, атом фтора, атом йода или тому подобное; или атом водорода.
Поэтому в качестве (пиримидин-2-ил)-2-пропанонового соединения, представленного общей формулой (1), используемого на стадии 1, следует особо упомянуть, например, 1-(пиримидин-2-ил)-2-пропанон, 1-(4,6-диметилпиримидин-2-ил)-2-пропанон, 1-(4,6-диметоксипиримидин-2-ил)-2-пропанон, 1-(4,6-диметокси-5-метилпиримидин-2-ил)-2-пропанон, 1-(4,6-диметокси-5-этилпиримидин-2-ил)-2-пропанон, 1-(4,6-диметокси-5-нитропиримидин-2-ил)-2-пропанон, 1-(4,6-дихлорпиримидин-2-ил)-2-пропанон, 1-(4,6-диметокси-5-этоксикарбонилпиримидин-2-ил)-2-пропанон и 1-(4,6-диэтоксипиримидин-2-ил)-2-пропанон. (Пиримидин-2-ил)-2-пропаноновое соединение, представленное общей формулой (1), имеет таутомеры, и любой из таутомеров может быть использован в способе согласно настоящему изобретению. Однако в настоящем описании структура соединения изображена в виде 2-пропанонового производного, как видно в общей формуле (1), и названием соединения является 2-пропаноновое производное, как видно выше.
Указанные (пиримидин-2-ил)-2-пропаноновые соединения, представленные общей формулой (1), являются известными соединениями или соединениями, которые могут быть получены из сырого материала, такого как 2-фенилсульфонил-4,6-диметилпиримидин или тому подобное, согласно способу, например, описанному в публикации Chemical & Pharmaceutical Bulletin, p. 152 (1982). (Пиримидин-2-ил)-2-пропаноновое соединение, представленное общей формулой (1), включает в себя новые соединения, например, 1-(4,6-диметоксипиримидин-2-ил)-2-пропанон, и данное соединение является сырым материалом, используемым в получении замещенного анилинового соединения, представленного общей формулой (6).
Между тем, в общей формуле (2) X и Y каждый независимо может представлять собой (С1-С6)алкильную группу с прямой или разветвленной цепью, такую как метильная группа, этильная группа, н-пропильная группа, изопропильная группа, н-бутильная группа, втор-бутильная группа, трет-бутильная группа, н-пентильная группа, н-гексильная группа или тому подобное; (С1-С6)алкоксигруппу с прямой или разветвленной цепью, такую как метоксигруппа, этоксигруппа, н-пропоксигруппа, изопропоксигруппа или тому подобное; (С1-С6)алкокси(С1-С6)алкильную группу с прямой или разветвленной цепью, такую как метоксиметильная группа, метоксиэтильная группа, этоксиэтильная группа или тому подобное; (С1-С6)галогеналкильную группу с прямой или разветвленной цепью, такую как фторметильная группа, дифторметильная группа, трифторметильная группа или тому подобное; карбоксильную группу; (С1-С6)алкоксикарбонильную группу с прямой или разветвленной цепью, такую как метоксикарбонильная группа, этоксикарбонильная группа или тому подобное; атом галогена, такой как атом брома, атом хлора, атом фтора, атом йода или тому подобное; или атом водорода.
Поэтому в качестве гидразинового соединения, представленного общей формулой (2), используемого на стадии 1, следует особо упомянуть, например, фенилгидразин, 2-метилфенилгидразин, 4-метилфенилгидразин, 2,4-диметилфенилгидразин, 2-этилфенилгидразин, 4-этилфенилгидразин, 4-изопропилфенилгидразин, 2-метоксифенилгидразин, 4-метоксифенилгидразин, 2-метоксиметилфенилгидразин, 4-метоксиметилфенилгидразин, 4-трифторметилфенилгидразин, 2-гидразинбензойную кислоту, 4-метоксикарбонилфенилгидразин и 2-хлорфенилгидразин.
Гидразиновое соединение, представленное общей формулой (2), может находиться в свободной форме или в виде соли (например, в виде хлоргидрата или сульфата).
Гидразиновое соединение, представленное общей формулой (2), является известным соединением или соединением, которое может быть получено из соответствующего сырого анилина согласно способу, например, описанному в публикации Journal of Organic Chemistry, p. 2849 (1972).
В этой связи из гидразиновых соединений, представленных общей формулой (2), 2-метоксиметилфенилгидразин является новым соединением.
На стадии 1 для получения замещенного индольного соединения, представленного общей формулой (3), молярное соотношение гидразинового соединения, представленного общей формулой (2), и (пиримидин-2-ил)-2-пропанонового соединения, представленного общей формулой (1), может находиться на любом уровне для осуществления взаимодействия между двумя соединениями. Однако (пиримидин-2-ил)-2-пропаноновое соединение, представленное общей формулой (1), используют в количестве, например, обычно от 0,5 до 3 молей, предпочтительно 1-2 моля на моль гидразинового соединения, представленного общей формулой (2).
На стадии 1 получение замещенного индольного соединения, представленного общей формулой (3), осуществляют с применением кислоты. В качестве примеров используемой кислоты могут быть минеральные кислоты, такие как хлористоводородная кислота, серная кислота и тому подобное; уксусные кислоты, такие как уксусная кислота, трифторуксусная кислота и тому подобное; кислоты Льюиса, такие как хлористый цинк, трехфтористый бор и тому подобное; сульфоновые кислоты, такие как р-толуолсульфокислота и тому подобное; фосфорные кислоты, такие как полифосфорная кислота и тому подобное; галогенные соединения фосфора, такие как треххлористый фосфор и тому подобное; и кислые ионообменные смолы, такие как Amberlist и тому подобное. Применение кислоты Льюиса, такой как хлористый цинк, трехфтористый бор или тому подобное, является предпочтительным. Количество кислоты, применяемой на стадии, может быть любым количеством, поскольку она не разлагает образованное замещенное индольное соединение, представленное общей формулой (3); однако количество может составлять от 0,001 до 10 молей, предпочтительно от 0,1 до 2 молей на моль гидразинового соединения, представленного общей формулой (2).
Стадию 1 получения замещенного индольного соединения, представленного общей формулой (3), можно выполнить в достаточной мере даже в условиях без растворителя, но можно провести с использованием растворителя. Растворитель, применяемый в данной реакции, может быть любым растворителем, при условии, что он не влияет на реакцию. В этой связи можно упомянуть, например, ароматические углеводороды, такие как толуол, ксилол, хлорбензол и тому подобное; галогенированные алифатические углеводороды, такие как дихлорметан, хлороформ и тому подобное; сложные эфиры уксусной кислоты, такие как метилацетат, этилацетат, бутилацетат и тому подобное; апротонные полярные растворители, такие как диметилформамид, диметилацетамид, N-метилпирролидон, тетраметилмочевина, гексаметилфосфотриамид (НМРА) и тому подобное; растворители типа простого эфира, такого как диэтиловый эфир, тетрагидрофуран, диоксан и тому подобное; и алифатические углеводороды, такие как пентан, н-гексан и тому подобное. Ароматические углеводороды, такие как толуол и тому подобное, являются предпочтительными. Указанные растворители могут быть использованы в виде одного растворителя или в виде смешанного растворителя с любым составом смеси. Можно использовать любое количество растворителя, поскольку оно позволяет достаточное перемешивание реакционной системы, но количество обычно составляет от 0,5 до 20 литров, предпочтительно от 1 до 10 литров на моль гидразинового соединения, представленного общей формулой (2).
Температура реакции, применяемая на стадии 1 получения замещенного индольного соединения, представленного общей формулой (3), составляет, например, от 0°С до температуры флегмы используемого растворителя, предпочтительно от 0°С до 120°С.
Особого ограничения относительно времени проведения реакции, используемого на стадии 1 получения замещенного индольного соединения, представленного общей формулой (3), не существует, однако предпочтительное время проведения реакции составляет от 0,5 часа до 12 часов.
Замещенное индольное соединение, представленное общей формулой (3), которое может быть получено на стадии 1, является новым соединением и используется в качестве промежуточного соединения для сульфонанилидного производного, которое, как известно, обладает высокой гербицидной активностью и является эффективным.
Способ согласно настоящему изобретению включает стадию (стадия 2) окисления индольного кольца у полученного выше замещенного индольного соединения, представленного общей формулой (3), приводящего к раскрытию кольца с получением замещенного ацетанилидного соединения, представленного общей формулой (4), а также стадии последовательной обработки ацетанилидного соединения, представленного общей формулой (4), посредством восстановления и деацетилирования с получением конечного продукта, т.е. замещенного анилинового соединения, представленного общей формулой (6). Любая из реакций восстановления и деацетилирования может быть проведена первой. Поэтому описание дано в следующем порядке, после стадии 2 следует стадия (стадия 3) взаимодействия ацетанилидного соединения, представленного общей формулой (4), с предпочтительным боргидридом натрия с получением 2-(пиримидин-2-илгидроксиметил)ацетаинидного соединения, представленного общей формулой (5), и стадия (стадия 4) деацетилирования амидного фрагмента 2-(пиримидин-2-илгидроксиметил)ацетанилидного соединения, представленного общей формулой (5), полученного на стадии 3, при этом получают конечный продукт, т.е. замещенное анилиновое соединение, представленное общей формулой (6).
Стадия 2 представляет собой стадию окисления замещенного индольного соединения, представленного общей формулой (3), полученного на стадии 1, приводящего к раскрытию индольного кольца с получением замещенного ацетанилидного соединения, представленного общей формулой (4). В этой связи в общей формуле (3) R1, R2, R3, X и Y имеют такие же определения, как даны выше.
Окислителем, применяемым на стадии 2, может служить озон; неорганические перекиси, такие как перекись водорода и тому подобное; органические перекиси, такие как надуксусная кислота, надбензойная кислота, m-хлорнадбензойная кислота и тому подобное; окиси металлов, такие как перманганат калия, перйодат натрия, вольфрамат натрия, молибдат аммония и тому подобное; и воздух. Предпочтительным является озон. Указанные окислители могут обеспечить достаточное взаимодействие даже при использовании окислителей в виде одного окислителя, но могут быть применены в любом составе смеси. На стадии окисления данного способа окислитель может использоваться в любом количестве, при условии, что окислитель не разрушает образованное замещенное ацетанилидное соединение, представленное общей формулой (4), но обычно количество составляет от 0,1 до 20 молей, предпочтительно от 1 до 10 молей на моль замещенного индольного соединения, представленного общей формулой (3).
На стадии 2 реакцию обычно осуществляют с использованием растворителя. Может быть использован любой растворитель, при условии, что он не влияет на реакцию. В этой связи следует упомянуть, например, сложные эфиры уксусной кислоты, такие как метилацетат, этилацетат, бутилацетат и тому подобное; галогенированные алифатические углеводороды, такие как дихлорметан, хлороформ и тому подобное; ароматические углеводороды, такие как толуол, ксилол, хлорбензол и тому подобное; алифатические углеводороды, такие как пентан, н-гексан и тому подобное; апротонные полярные растворители, такие как формамид, диметилформамид, диметилацетамид и тому подобное; нитрилы, такие как ацетонитрил и тому подобное; растворители типа простого эфира, такие как диэтиловый эфир, тетрагидрофуран, диоксан, диглим и тому подобное; спирты, такие как метанол, этанол и тому подобное; карбоновые кислоты, такие как уксусная кислота и тому подобное; кетоны, такие как ацетон, метилизобутилкетон и тому подобное; и вода. Растворители могут быть использованы в виде одного растворителя или в виде смешанного растворителя любого состава смеси. Может быть использовано любое количество растворителя, при условии, что оно обеспечивает достаточное перемешивание реакционной системы, но количество обычно составляет от 0,5 до 20 литров, предпочтительно от 1 до 10 литров на моль замещенного индольного соединения, представленного общей формулой (3).
Температура реакции на стадии 2 может составлять, например, от -20°С до температуры флегмы используемого растворителя, но предпочтительной является температура от -10°С до 60°С.
Особых ограничений в отношении времени проведения реакции на стадии 2 не имеется. Однако предпочтительное время проведения реакции составляет от 0,5 часа до 12 часов.
Замещенные ацетанилидные соединения, представленные общей формулой (4), полученные на стадии 2, являются новыми соединениями и применяются в качестве промежуточного соединения для сульфонанилидного производного, которое применяют, как известно, в качестве гербицида.
Таким образом, может быть получено замещенное ацетанилидное соединение, представленное общей формулой (4).
В качестве ацетанилидного соединения, представленного общей формулой (4), следует особо упомянуть, например, 2-(4,6-диметоксипиримидин-2-илкарбонил)ацетанилид, 2-(4,6-диметоксипиримидин-2-илкарбонил)-6-метилацетанилид, 2-(4,6-диметоксипиримидин-2-илкарбонил)-6-этилацетанилид, 2-(4,6-диметоксипиримидин-2-илкарбонил)-6-метоксиметилацетанилид, 2-(4,6-диметоксипиримидин-2-илкарбонил)-4-метилацетанилид, 2-(4,6-диметоксипиримидин-2-илкарбонил)-4-этилацетанилид, 2-(4,6-диметоксипиримидин-2-илкарбонил)-4-метоксиметилацетанилид, 2-(4,6-диметоксипиримидин-2-илкарбонил)-4-хлорацетанилид, 2-(4,6-диметоксипиримидин-2-илкарбонил)-6-хлорацетанилид, 2-(4,6-диметоксипиримидин-2-илкарбонил)-4-фторацетанилид и 2-(4,6-диметоксипиримидин-2-илкарбонил)-6-фторацетанилид.
Замещенное ацетанилидное соединение, представленное общей формулой (4), полученное на стадии 2, можно впоследствии использовать на стадии 3 без выделения или очистки. То есть замещенное индольное соединение, представленное общей формулой (3), подвергают окислению и раскрытию кольца на стадии 2 посредством, например, озона или тому подобного и последовательно подвергают восстановлению на стадии 3, описанному позднее, посредством предпочтительно боргидрида натрия в одном и том же сосуде; тем самым 2-(пиримидин-2-илгидроксиметил)ацетанилидное соединение, представленное общей формулой (5), может быть легко получено и последующая обработка используемого окислителя является также легкой. Поэтому с точки зрения легкости проведения процесса и так далее предпочтительно в промышленном масштабе применять способ, включающий в себя стадию такого окисления и раскрытия кольца и стадию такого восстановления непрерывно в одном и том же сосуде.
Далее будет описана стадия 3.
Стадия 3 представляет собой стадию восстановления ацетанилидного соединения, представленного общей формулой (4), предпочтительно посредством боргидрида натрия с получением 2-(пиримидин-2-илгидроксиметил)ацетанилидного соединения, представленного общей формулой (5). В данном случае в общей формуле (4) R1, R2, R3, X и Y имеют такие же определения, как даны выше.
На стадии 3 молярное соотношение замещенного ацетанилидного соединения, представленного общей формулой (4), и боргидрида натрия может находиться на любом уровне, однако количество боргидрида натрия может составлять от 0,5 до 20 молей, предпочтительно от 1 до 10 молей на моль замещенного ацетанилидного соединения.
Реакцию на стадии 3 обычно проводят с использованием растворителя. Используемый на стадии 3 растворитель может быть любым растворителем, при условии, что он не влияет на реакцию. В этой связи следует упомянуть, например, ароматические углеводороды, такие как толуол, ксилол, хлорбензол и тому подобное; сложные эфиры уксусной кислоты, такие как метилацетат, этилацетат, бутилацетат и тому подобное; спирты, такие как метанол, этанол, 1-пропанол, 2-пропанол, 1-бутанол и тому подобное; апротонные полярные растворители, такие как диметилформамид, диметилацетамид и тому подобное; растворители типа простого эфира, такие как диэтиловый эфир, тетрагидрофуран, диоксан и тому подобное; алифатические углеводороды, такие как пентан, н-гексан и тому подобное; полиэтиленгликоли, такие как полиэтиленгликоль (PEG)-400 и тому подобное; и воду. Растворители могут быть использованы в виде одного растворителя или в виде смешанного растворителя любого состава смеси. Может быть использовано любое количество растворителя, при условии, что он позволяет достаточное перемешивание реакционной системы, но количество обычно составляет от 0,5 до 20 литров, предпочтительно от 1 до 10 литров на моль замещенного ацетанилидного соединения, представленного общей формулой (4).
Температура реакции на стадии 3 может составлять, например, от -15°С до температуры флегмы используемого растворителя, но предпочтительной является температура от -5°С до 60°С.
Особых ограничений в отношении времени проведения реакции на стадии 3 не имеется, но предпочтительным временем проведения реакции является от 0,5 часа до 24 часов.
В данном случае на стадии 3 предпочтительно использовать боргидрид натрия из-за стабильности реагента, а также по причине того, что реагент используют также для последующей обработки применяемого на стадии 2 окислителя, который осуществляет окислительное раскрытие кольца замещенного индольного соединения. Однако восстановление на стадии 3 не ограничивается только восстановлением боргидридом натрия и может быть проведено, например, путем каталитического гидрирования (в качестве катализатора могут быть использованы палладий на угле [Pd/C], платина на угле [Pt/C], катализатор Ренея (например, никель Ренея) или обычно используемый для каталитического восстановления металлический катализатор), восстановление литийалюминийгидридом или восстановление дибораном.
2-(Пиримидин-2-илгидроксиметил)ацетанилидное соединение, представленное общей формулой (5), полученное на стадии 3, может как таковое быть использовано на следующей стадии 4 без выделения.
Далее описывается проведение стадии 4.
На стадии 4 2-(пиримидин-2-илгидроксиметил)ацетанилидное соединение, представленное общей формулой (5), полученное на стадии 3, подвергают деацетилированию амидного фрагмента с получением заданного конечного соединения, т.е. замещенного анилинового соединения, представленного общей формулой (6). В данном случае в общей формуле (5) R1, R2, R3, X и Y имеют такие же определения, как даны выше.
Указанное деацетилирование предпочтительно осуществляют с использованием основания ввиду стабильности заданного продукта.
В качестве основания, применяемого в реакции на стадии 4, следует упомянуть, например, гидроокиси щелочных металлов, такие как гидроокись натрия, гидроокись калия и тому подобное; гидроокиси щелочноземельных металлов, такие как гидроокись бария и тому подобное; карбонаты, такие как карбонат калия, карбонат натрия и тому подобное; и органические амины, такие как 1,8-диазабицикло[5.4.0]ундец-7-ен и тому подобное. Из перечисленных оснований предпочтительными являются гидроокиси щелочных металлов, такие как гидроокись натрия, гидроокись калия и тому подобное.
Количество используемого на стадии 4 основания может находиться на любом уровне, при условии, что оно не разрушает образованное замещенное анилиновое соединение, представленное общей формулой (6). Однако количество обычно составляет от 0,1 до 30 молей, предпочтительно от 0,5 до 10 молей на моль 2-(пиримидин-2-илгидроксиметил)ацетанилидного соединения, представленного общей формулой (5).
Реакцию на стадии 4 можно осуществлять с использованием растворителя. Растворитель, который применяют на стадии 4, не является критическим, при условии, что он не ухудшает взаимодействие. В этой связи следует упомянуть, например, ароматические углеводороды, такие как толуол, ксилол, хлорбензол и тому подобное; спирты, такие как метанол, этанол и тому подобное; апротонные полярные растворители, такие как диметилформамид, диметилацетамид и тому подобное; растворители типа простого эфира, такие как диэтиловый эфир, тетрагидрофуран, диоксан и тому подобное; алифатические углеводороды, такие как пентан, н-гексан и тому подобное; полиэтиленгликоли, такие как полиэтиленгликоль (PEG)-400 и тому подобное; и воду. Растворители могут быть использованы в виде одного растворителя или в виде смешанного растворителя любого состава смеси. Может быть использовано любое количество растворителя, при условии, что обеспечивается достаточное перемешивание реакционной системы, но количество обычно составляет от 0,5 до 20 литров, предпочтительно от 1 до 10 литров на моль 2-(пиримидин-2-илгидроксиметил)ацетанилидного соединения, представленного общей формулой (5).
Температура реакции на стадии 4 может составлять, например, от -15°С до температуры флегмы используемого растворителя, однако предпочтительно температура составляет от -5°С до 100°С.
Время проведения реакции на стадии 4 не является существенным фактором, однако предпочтительно оно составляет от 0,5 часа до 24 часов.
Как описано ранее, любая из реакций восстановления и деацетилирования ацетанилидного соединения, представленного общей формулой (4), может быть осуществлена первой. Поэтому далее описываются в следующем порядке стадия (стадия 5) деацетилирования ацетанилидного соединения, представленного общей формулой (4), с получением аминосоединения, представленного общей формулой (7), и стадия (стадия 6) восстановления аминосоединения, представленного общей формулой (7), с получением конечного продукта, т.е. замещенного анилинового соединения, представленного общей формулой (6).
Стадия 5 представляет собой стадию проведения сольволиза замещенного ацетанилидного соединения, представленного общей формулой (4), которое получено на стадии 2, с использованием кислоты с получением аминосоединения, представленного общей формулой (7).
Примерами кислоты, используемой на стадии 5, могут служить минеральные кислоты, такие как хлористоводородная кислота, серная кислота и тому подобное; кислоты Льюиса, такие как трехфтористый бор и тому подобное; уксусные кислоты, такие как уксусная кислота, трифторуксусная кислота и тому подобное; сульфоновые кислоты, такие как р-толуолсульфокислота и тому подобное; и кислые ионообменные смолы, такие как Amberlist и тому подобное. Предпочтительными кислотами являются хлористоводородная кислота или серная кислота.
Может быть использовано любое количество кислоты, используемой на стадии 5, при условии, что она не разрушает образованное аминосоединение, представленное общей формулой (7), однако количество кислоты обычно составляет от 0,1 до 10 молей, предпочтительно от 0,5 до 5 молей на моль замещенного ацетанилидного соединения, представленного общей формулой (4).
Реакцию на стадии 5 осуществляют в присутствии растворителя. В качестве растворителя могут служить вода и С1-С6 спирты от с прямой или разветвленной цепью, такие как этанол, метанол и тому подобное. Количество растворителя может составлять 1 моль или более на моль замещенного ацетанилидного соединения, представленного общей формулой (4), и может быть, например, обычно от 0,1 до 10 литров, предпочтительно от 0,5 до 10 литров на моль замещенного ацетанилидного соединения, представленного общей формулой (4). Количество растворителя различается в зависимости от типа и количества кислоты, используемой на стадии 5, но может быть таким, что рН реакционной системы становится приблизительно 4 или меньше, предпочтительно 2 или меньше, более предпочтительно 1 или меньше.
Реакция на стадии 5 может протекать в достаточной степени при использовании одного из вышеперечисленных растворителей. Однако реакцию также можно осуществлять путем дальнейшего добавления другого растворителя.
Растворитель, который используют для добавления к реакционной смеси на стадии 5, может быть любым растворителем, при условии, что он не ослабляет реакцию сольволиза на стадии 5. В этой связи следует упомянуть, например, ароматические углеводороды, такие как толуол, ксилол, хлорбензол и тому подобное; апротонные полярные растворители, такие как диметилформамид, диметилацетамид и тому подобное; растворители типа простого эфира, такие как диэтиловый эфир, тетрагидрофуран, диоксан и тому подобное; алифатические углеводороды, такие как пентан, н-гексан и тому подобное; нитрилы, такие как ацетонитрил и тому подобное; и полиэтиленгликоли, такие как полиэтиленгликоль (PEG)-400 и тому подобное. Указанные растворители могут быть использованы в виде одного типа растворителя или в виде смеси двух или более типов растворителей.
Когда реакцию на стадии 5 осуществляют с использованием спирта в качестве растворителя, спирт может взаимодействовать с карбонильной группой заданного продукта и может быть образовано ацетальное соединение. В таком случае добавляют воду в присутствии кислоты или реакционную смесь выливают в воду и перемешивают в течение периода времени от нескольких минут до 48 часов, тем самым удаление ацеталя можно легко осуществить и заданный продукт может быть получен.
Может быть использовано любое количество растворителя, при условии, что растворитель позволяет достаточное перемешивание реакционной системы, однако количество может составлять от 0,5 до 5 литров, предпочтительно от 1 до 3 литров на моль замещенного ацетанилидного соединения, представленного общей формулой (4).
Температура реакции на стадии 5 может составлять, например, от 0°С до температуры флегмы используемого растворителя и предпочтительно составляет от 0 до 120°С.
Время проведения реакции на стадии 5 не является существенным, однако предпочтительно оно составляет от 0,5 часа до 24 часов.
Стадия 6 представляет собой стадию восстановления полученного выше аминосоединения, представленного общей формулой (7), посредством боргидрида натрия с получением конечного продукта, т.е. замещенного анилинового соединения, представленного общей формулой (6). Схема реакции и условия ее проведения являются примерно такими, как на стадии 3.
Полученный таким образом конечный продукт, т.е. замещенное анилиновое соединение, представленное общей формулой (6), становится важным промежуточным продуктом в производстве химикатов для сельского хозяйства и лекарственных препаратов.
Кроме того, настоящее изобретение также представляет новые соединения. Как описано ранее, из гидразиновых соединений, представленных общей формулой (2), 2-метоксиметилфенилгидразин является новым соединением и может быть получен из соответствующего сырого анилина согласно, например, способу, описанному в публикации Journal of Organic Chemistry, p. 2849 (1972).
Кроме того, из (пиримидин-2-ил)-2-пропаноновых соединений представленное общей формулой (1), 1-(4,6-диметоксипиримидин-2-ил)-2-пропанон, является новым соединением и может быть получен из сырого материала, такого как 2-фенилсульфонил-4,6-диметоксипиримидин или тому подобного, согласно, например, способу, описанному в публикации Chemical & Pharmaceutical Bulletin, p. 152 (1982). Данное соединение имеет таутомеры, и все таутомеры включены в настоящее изобретение.
Кроме того, замещенное индольное соединение, представленное общей формулой (3), является новым соединением и может быть получено посредством стадии 1. В данном случае, в общей формуле (3) R1, R2, R3, X и Y имеют такие же определения, как даны выше.
В следующей таблице 1 приведены примеры замещенного индольного соединения, представленного общей формулой (3). Однако соединение согласно настоящему изобретению не ограничивается только указанными примерами и включает в себя все соединения, представленные общей формулой (3).
Между тем, символы, показанные в таблице 1, имеют следующие значения (то же самое относится к следующим таблицам).
Me: метильная группа
Et: этильная группа
MOM: метоксиметильная группа
MeO: метоксигруппа
EtO: этоксигруппа
i-Pr: изопропильная группа
COOMe: метоксикарбонильная группа
NO2: нитрогруппа
CF3: трифторметильная группа
NHAc: ацетамидная группа
Кроме того, замещенное ацетанилидное соединение, представленное общей формулой (4), также является новым соединением и может быть получено посредством стадии 2. В данном случае, в общей формуле (3) R1, R2, R3, X и Y и Ас имеют такие же определения, как даны выше.
В следующей таблице 2 приведены примеры замещенного ацетанилидного соединения, представленного общей формулой (4).
Кроме того, 2-(пиримидин-2-илгидроксиметил)ацетанилидное соединение, представленное общей формулой (5), также является новым соединением и может быть получено посредством стадии 3 [или прямо из замещенного индольного соединения, представленного общей формулой (3), без посредства замещенного ацетанилидного соединения, представленного общей формулой (4)]. В данном случае в общей формуле (5) R1, R2, R3, X и Y и Ас имеют такие же определения, как даны выше.
В следующей таблице 3 приведены примеры 2-(пиримидин-2-илгидроксиметил)ацетанилидного соединения, представленного общей формулой (5). Однако соединение согласно настоящему изобретению не ограничивается указанными примерами и включает в себя все соединения, представленные общей формулой (5).
Ниже приведен пример схемы реакции получения сульфонанилидного соединения (которое может стать гербицидом) из замещенного анилинового соединения, представленного общей формулой (6), которое получают из соединения, представленного общей формулой (1), через соединения различных общих формул.

Как показано в вышеприведенной схеме реакции, способ согласно настоящему изобретению и соединение согласно настоящему изобретению являются весьма подходящими для производства сульфонанилидного соединения, которое используют в качестве эффективного ингредиента гербицида.
Далее способ получения соединения согласно настоящему изобретению описывается более конкретно посредством примеров. В примерах показатель преломления n20 D указывает на то, что показатель преломления измеряли при 20°С с использованием натриевой D линии. Газовую хроматографию проводили, используя колонку G-250 (40 м) [продукт компании (Zai) Kagaku Busshitsu Hyoka Kenkyu Kiko (прежде, Kagakuhin Kensa Kyokai). Высокоэффективную жидкостную хроматографию проводили, используя колонку YMC-A312 (продукт K.K. YMC), и в качестве элюента использовали смесь ацетонитрил/0,05% раствор фосфорной кислоты.
Пример 1
Получение 2-метоксиметилфенилгидразина
В 50 мл концентрированной хлористоводородной кислоты растворяли 6,86 г (50 ммоль) 2-метоксиметиланилина. Раствор охлаждали до -10°С. Кроме того, к раствору добавляли по каплям раствор нитрита натрия (4,14 г, 60 ммоль), растворенного в воде (50 мл), при этом температуру поддерживали от -10°С до 0°С. Затем добавляли по каплям раствор 44,6 г (235 ммоль) двухлористого олова, растворенного в концентрированной хлористоводородной кислоте (50 мл), при указанной выше температуре в течение 1 часа. По окончании добавления раствора по каплям перемешивание выполняли при постепенном увеличении температуры приблизительно до 20°С. Затем добавляли по каплям 10% водный раствор гидроокиси натрия для достижения рН раствора, равного 14, после чего осуществляли экстракцию толуолом. Толуольный слой промывали водой и концентрировали при пониженном давлении, используя роторный испаритель, с получением 5,40 г (35,5 ммоль) жидкого 2-метоксиметилфенилгидразина. Выход: 71%.
МС m/e 152 (M+)
ЯМР (CDCl3/TMS), δ (м.д.):
3,8 (с, 3Н), 4,46 (с, 2Н), от 7,1 до 7,4 (м, 7Н)
ИК (пластина NaCl, см-1): 3350 (NH)
Пример 2
Получение 1-(4,6-диметоксипиримидин-2-ил)-2-пропанона
В реактор помещали 16,0 г (0,4 моль) 60% гидрида натрия, 400 мл THF и 43,6 г (0,2 моль) 4,6-диметокси-2-метансульфонилпиримидина. Содержимое реактора нагревали до 30°С. Кроме того, в реактор добавляли по каплям 39,4 г (0,68 моль) ацетона с последующим проведением реакции в течение 2 часов. По окончании реакции добавляли 350 мл воды и проводили экстракцию 500 мл этилацетата. Этилацетатный слой концентрировали. Концентрат подвергали дистилляции при пониженном давлении с получением 8,8 г (44,9 ммоль) 1-(4,6-диметоксипиримидин-2-ил)-2-пропанона. Показатель преломления n20 D: 1,5181.
МС m/e: 196 (M+)
ЯМР (CDCl3/TMS), δ (м.д.):
2,03 (с), 2,26 (с), 3,86 (с), 3,91 (с, 6Н), 5,40 (с), 5,73 (с), 5,91 (с, 1Н).
Пример 3 (стадия 1)
Получение 3-(4,6-диметоксипиримидин-2-ил)-2-метил-7-этилиндола
В реактор загружали 2,4 г (12,2 ммоль) 1-(4,6-диметоксипиримидин-2-ил)-2-пропанона, 1,7 г (9,98 ммоль) хлоргидрата 2-этилфенилгидразина, 1,4 г (10,2 ммоль) хлористого цинка и 10 мл толуола с последующим кипячением с обратным холодильником в течение 2 часов. По окончании реакции реакционную смесь охлаждали до комнатной температуры. Кроме того, добавляли воду и этилацетат и фазы разделяли. Этилацетатный слой концентрировали. Концентрат подвергали разделению с помощью колоночной хроматографии на силикагеле (растворитель для разделения: смесь н-гексан/этилацетат) с получением 2,38 г (8,01 ммоль) 3-(4,6-диметоксипиримидин-2-ил)-2-метил-7-этилиндола. Выход: 80,3%. Точка плавления: от 90,3 до 94,8°С.
МС m/e: 297 (M+)
ЯМР (CDCl3/TMS), δ (м.д.):
1,38 (т, 3Н), 2,87 (кв, 2Н), 2,96 (с, 3Н), 4,08 (с, 6Н), 5,85 (с, 1Н), 7,03 (д, 1Н), 7,18 (т, 1Н), 8,18 (широкий с, 1Н), 8,57 (д, 1Н).
Пример 4 (стадия 2)
Получение 2-(4,6-диметоксипиримидин-2-илкарбонил)-6-этилацетанилида
В реактор загружали 0,7 г (2,4 ммоль) 3-(4,6-диметоксипиримидин-2-ил)-2-метил-7-этилиндола и 10 мл этилацетата. Затем впускали озон при температуре от 0°С до 10°С в течение 2 часов. По окончании реакции реакционную смесь нагревали до комнатной температуры и концентрировали. В результате получали 0,75 г (2,3 ммоль) 2-(4,6-диметоксипиримидин-2-илкарбонил)-6-этилацетанилида, Выход: 95%. Точка плавления: от 139,3 до 142,3°С.
МС m/e: 329 (M+)
ЯМР (CDCl3/TMS), δ (м.д.):
1,25 (т, 3Н), 2,17 (с, 3Н), 2,69 (кв, 2Н), 3,95 (с, 6Н), 6,16 (с, 1Н), от 7,2 до 7,3 (м, 1Н), от 7,4 до 7,6 (м, 2Н), 8,95 (широкий с, 1Н).
Пример 5 (стадия 3)
Получение 2-(4,6-диметоксипиримидин-2-илгидроксиметил)-6-этилацетанилида
В реактор помещали 1,0 г (3,03 ммоль) 2-(4,6-диметоксипиримидин-2-илкарбонил)-6-этилацетанилида и 20 мл этанола. Содержимое реактора охлаждали до 5°С или ниже. Затем добавляли 0,13 г (3,65 ммоль) боргидрида натрия и перемешивали при той же температуре в течение 1 часа. Затем, реакционную смесь нагревали до комнатной температуры. По окончании реакции добавляли водный раствор хлористого аммония и проводили экстракцию этилацетатом. Органический слой концентрировали с получением 0,82 г (2,48 ммоль) 2-(4,6-диметоксипиримидин-2-илгидроксиметил)-6-этилацетанилида. Выход: 82%. Точка плавления: от 143 до 147°С.
МС m/e: 331 (M+)
ЯМР (CDCl3/TMS), δ (м.д.):
1,24 (т, 3Н), 2,22 (с, 3Н), 2,64 (кв, 2Н), 3,97 (с, 6Н), 4,88 (д, 1Н), 5,89 (д, 1Н), 5,95 (с, 1Н), от 7,2 до 7,5 (м, 3Н), 9,25 (широкий с, 1Н).
Пример 6 (стадия 4)
Получение 2-(4,6-диметоксипиримидин-2-илгидроксиметил)-6-этиланилина
В реактор помещали 0,1 г (0,30 ммоль) 2-(4,6-диметоксипиримидин-2-илгидроксиметил)-6-этилацетанилида, 2 мл метанола и 2 мл воды. Перемешивание осуществляли при 70°С в течение 6 часов. По окончании реакции проводили высокоэффективную жидкостную хроматографию. В результате получали 2-(4,6-диметоксипиримидин-2-илгидроксиметил)-6-этиланилина с выходом 65%.
Пример 7 (стадия 1)
Получение 3-(4,6-диметоксипиримидин-2-ил)-2-метил-7-метоксиметилиндола
В реактор загружали 6,2 г (31,6 ммоль) 1-(4,6-диметоксипиримидин-2-ил)-2-пропанона, 4,8 г (31,5 ммоль) 2-метоксиметилфенилгидразина, 4,76 г (34,9 ммоль) хлористого цинка и 60 мл толуола. Реакционную смесь кипятили с обратным холодильником в течение 2 часов. По окончании реакции реакционную смесь охлаждали до комнатной температуры. Затем добавляли воду и этилацетат и фазы разделяли. Этилацетатный слой концентрировали. Образованные кристаллы промывали диизопропиловым эфиром с получением 4,57 г (14,6 ммоль) 3-(4,6-диметоксипиримидин-2-ил)-2-метил-7-метоксиметилиндола. Выход: 46%.
МС m/e: 313 (M+)
ЯМР (CDCl3/TMS), δ (м.д.):
2,95 (с, 3Н), 3,34 (с, 3Н), 4,06 (с, 6Н), 4,74 (с, 2Н), 5,81 (с, 1Н), от 7,0 до 7,1 (м, 3Н), 8,65 (д, 1Н).
Полученный 3-(4,6-диметоксипиримидин-2-ил)-2-метил-7-метоксиметилиндол может быть использован в реакции на стадии 2 на основе примера 4.
Пример 8 (стадия 2)
Получение 2-(4,6-диметоксипиримидин-2-илкарбонил)-6-метоксиметилацетанилида
В реактор помещали 1,0 г (31,9 ммоль) 3-(4,6-диметоксипиримидин-2-ил)-2-метил-7-метоксиметилиндола и 40 мл этилацетата. В указанную смесь впускали озон при температуре от 0°С до 10°С в течение 4 часов. По окончании реакции содержимое реактора нагревали до комнатной температуры и концентрировали. Остаток подвергали колоночной хроматографии на силикагеле (растворитель для разделения: смесь н-гексан/этилацетат) с получением 0,40 г (11,6 ммоль) 2-(4,6-диметоксипиримидин-2-илкарбонил)-6-метоксиметилацетанилида. Точка плавления: от 147 до 150°С. Выход: 36,4%.
МС m/e: 345 (M+)
ЯМР (CDCl3/TMS), δ (м.д.):
2,13 (с, 3Н), 3,39 (с, 3Н), 3,94 (с, 6Н), 4,47 (с, 2Н). 6,15 (с, 1Н), 7,26 (т, 1Н), 7,60 (д, 2Н), 7,63 (д, 1Н), 9,29 (широкий, 1Н).
Полученный 2-(4,6-диметоксипиримидин-2-илкарбонил)-6-метоксиметилацетанилид может быть использован в реакции на стадии 3 согласно примеру 5.
Пример 9 (непрерывная процедура на стадии 3 и стадии 4 в одном и том же реакторе)
Получение 2-(4,6-диметоксипиримидин-2-илкарбонил)-6-метоксиметиланилина
В реактор помещали 1,0 г (2,9 ммоль) 2-(4,6-диметоксипиримидин-2-илкарбонил)-6-метоксиметилацетанилида и 20 мл этанола с последующим охлаждением до 5°С или ниже. Затем в реактор помещали 0,5 г (13,5 ммоль) боргидрида натрия. Перемешивание выполняли при той же температуре в течение 1 часа. Затем смесь нагревали до комнатной температуры. По окончании реакции добавляли водный раствор хлористого аммония и проводили экстракцию этилацетатом. Органический слой концентрировали. К остатку добавляли 20 мл воды и 0,4 г (7,1 ммоль) гидроокиси калия с последующим перемешиванием при 70°С в течение 2 часов. По окончании реакции реакционную смесь охлаждали до комнатной температуры и добавляли 50 мл этилацетата и 50 мл воды для осуществления экстракции. Органический слой концентрировали и концентрат подвергали колоночной хроматографии на силикагеле (растворитель для разделения: смесь н-гексан/этилацетат) с получением 0,35 г (1,48 ммоль) 2-(4,6-диметоксипиримидин-2-илгидроксиметил)-6-метоксиметиланилина. Выход: 51%.
Пример 10 (стадия 1)
Получение 3-(4,6-диметоксипиримидин-2-ил)-2-метилиндола
В 10 мл толуола растворяли 1,61 г (8,2 ммоль) 1-(4,6-диметоксипиримидин-2-ил)-2-пропанона и 1,08 г (10 ммоль) фенилгидразина. К раствору добавляли 1,36 г (10 ммоль) хлористого цинка с последующим кипячением с обратным холодильником в течение 1 часа. Реакционную смесь оставляли охлаждаться и затем добавляли этилацетат и воду, чтобы растворить всю реакционную смесь. Маслянистый слой промывали водой, отделяли и сушили над солью Глаубера. Образованный маслянистый слой концентрировали при пониженном давлении с получением твердого вещества оранжевого цвета. Твердое вещество перекристаллизовывали из метанола с получением 1,37 г (5,1 ммоль) 3-(4,6-диметоксипиримидин-2-ил)-2-метилиндола. Выход: 62%. Точка плавления: от 182 до 184°С.
МС m/e: 269 (M+)
ЯМР (CDCl3/TMS), δ (м.д.):
2,94 (с, 3Н), 4,06 (с, 6Н), 5,81 (с, 1Н), 7,1 (м, 2Н), 7,3 (м, 1Н), 8,7 (м, 1Н)
ИК (KBr, см-1): 3490 (NH), 1570
Полученный 3-(4,6-диметоксипиримидин-2-ил)-2-метилиндол может быть использован в реакции на стадии 2 согласно примеру 4 или примеру 8.
Пример 11 (стадия 2)
Получение 2-(4,6-диметоксипиримидин-2-илкарбонил)ацетанилида
В реактор загружали 0,8 г (3,0 ммоль) 3-(4,6-диметоксипиримидин-2-ил)-2-метилиндола, 30 мл ацетона и 8 мл воды. Затем добавляли 1,5 г (9,9 ммоль) перманганата калия и 2,29 г (10,7 ммоль) перйодата натрия и взаимодействие осуществляли при комнатной температуре в течение 12 часов. По окончании реакции смесь фильтровали. Фильтрат подвергали экстрагированию этилацетатом. Этилацетатный слой концентрировали. Остаток промывали изопропиловым эфиром с получением 0,57 г (1,9 ммоль) 2-(4,6-диметоксипиримидин-2-илкарбонил)ацетанилида. Выход: 63%.
МС m/e: 301 (M+)
ЯМР (CDCl3/TMS), δ (м.д.):
2,28 (с, 3Н), 3,96 (с, 6Н), 6,16 (с, 1Н), 7,06 (т, 1Н), 7,27 (широкий, 1Н), 7,59 (д, 1Н), 8,78 (д, 1Н)
ИК (KBr, см-1): 3270 (NH), 1700, 1660 (С=О)
Полученный 2-(4,6-диметоксипиримидин-2-илкарбонил)ацетанилид может быть использован в реакции на стадии 3 согласно примеру 5 или примеру 9.
Пример 12 (стадия 1)
Получение 3-(4,6-диметоксипиримидин-2-ил)-2,7-диметилиндола
В 20 мл толуола растворяли 0,77 г (3,9 ммоль) 1-(4,6-диметоксипиримидин-2-ил)-2-пропанона и 0,69 г (4,3 ммоль) хлоргидрата 2-метилфенилгидразина. К раствору добавляли 0,64 г (4,7 ммоль) хлористого цинка с последующим кипячением с обратным холодильником в течение 2 часов. Реакционную смесь оставляли охлаждаться и затем добавляли этилацетат и воду, чтобы растворить всю реакционную смесь. Маслянистый слой промывали водой, отделяли и сушили над солью Глаубера. Образовавшийся маслянистый слой концентрировали при пониженном давлении, используя роторный испаритель, с получением твердого вещества оранжевого цвета. Твердое вещество обрабатывали смесью этилацетат/н-гексан с получением 0,38 г (1,34 ммоль) 3-(4,6-диметоксипиримидин-2-ил)-2,7-диметилиндола. Выход: 34%. Точка плавления: от 145 до 147°С.
МС m/e: 283 (M+)
ЯМР (CDCl3/TMS), δ (м.д.):
2,47 (с, 3Н), 2,90 (с, 3Н), 4,05 (с, 6Н), 5,83 (с, 1Н), 6,98 (д, 1Н), 7,13 (т, 1Н), 8,15 (д, 1Н), 8,50 (д, 1Н)
ИК (см-1): 3350 (NH)
Полученный 3-(4,6-диметоксипиримидин-2-ил)-2,7-диметилиндол может быть использован в реакции на стадии 2 согласно примеру 4, или примеру 8, или примеру 12.
Пример 13 (стадия 2)
Получение 2-(4,6-диметоксипиримидин-2-илкарбонил)ацетанилида
В реактор помещали 1,0 г (3,7 ммоль) 3-(4,6-диметоксипиримидин-2-ил)-2-метилиндола, 30 мл ацетона и 15 мл воды. В реактор добавляли 3,0 г (19 ммоль) перманганата калия и взаимодействие осуществляли при комнатной температуре в течение 12 часов. По окончании реакции реакционную смесь подвергали газовой хроматографии. В результате получали 2-(4,6-диметоксипиримидин-2-илкарбонил)ацетанилида с выходом 74%, исходя из его доли от общей площади пиков.
Пример 14 (стадия 2)
Получение 2-(4,6-диметоксипиримидин-2-илкарбонил)-6-метилацетанилида
В реактор помещали 283 мг (1,0 ммоль) 3-(4,6-диметоксипиримидин-2-ил)-2,7-диметилиндола и 15 мл ацетона. В реактор добавляли 790 мг (5,0 ммоль) перманганата калия и 214 мг (1,0 ммоль) перйодата натрия и взаимодействие осуществляли в течение 12 часов. По окончании реакции реакционную смесь фильтровали. Фильтрат экстрагировали этилацетатом. Этилацетатный слой концентрировали. Остаток промывали изопропиловым эфиром с получением 80 мг (0,25 ммоль) 2-(4,6-диметоксипиримидин-2-илкарбонил)-6-метилацетанилида. Выход: 25%. Точка плавления: от 151 до 153°С.
МС m/e: 315 (M+)
ЯМР (CDCl3/TMS), δ (м.д.):
2,47 (с, 3Н), 2,90 (с, 3Н), 4,05 (с, 6Н), 5,83 (с, 1Н), 6,98 (д, 1Н), 7,13 (т, 1Н), 8,15 (широкий, 1Н), 8,50 (д, 1Н).
Полученный 2-(4,6-диметоксипиримидин-2-илкарбонил)-6-метилацетанилид может быть использован в реакции на стадии 3 согласно примеру 5 или примеру 9.
Пример 15 (стадия 2)
Получение 2-(4,6-диметоксипиримидин-2-илкарбонил)ацетанилида
В реактор помещали 0,27 г (10 ммоль) 3-(4,6-диметоксипиримидин-2-ил)-2-метилиндола и 10 мл этилацетата. Затем впускали озон при температуре от 0°С до 10°С в течение 3 часов. По окончании реакции реакционную смесь нагревали до комнатной температуры и концентрировали. Остаток подвергали газовой хроматографии. В результате получали 2-(4,6-диметоксипиримидин-2-илкарбонил)ацетанилид с выходом 88%, исходя из его доли от общей площади пиков.
Пример 16 (стадия 2)
Получение 2-(4,6-диметоксипиримидин-2-илкарбонил)-6-метилацетанилида
В реактор помещали 3-(4,6-диметоксипиримидин-2-ил)-2,7-диметилиндол и этилацетат. Затем впускали озон при температуре от 0°С до 10°С в течение 3 часов. По окончании реакции реакционную смесь нагревали до комнатной температуры и концентрировали. Остаток подвергали газовой хроматографии. В результате получали 2-(4,6-диметоксипиримидин-2-илкарбонил)-6-метилацетанилид с выходом 63%, исходя из его доли от общей площади пиков.
Пример 17 (стадия 2)
Получение 2-(4,6-диметоксипиримидин-2-илкарбонил)-6-этилацетанилида
В реактор помещали 0,5 г (1,7 ммоль) 3-(4,6-диметоксипиримидин-2-ил)-2-метил-7-этилиндола, 10 мл ацетона и 5 мл воды. В реактор добавляли перманганат калия и перйодат натрия и перемешивали при комнатной температуре для осуществления взаимодействия. Реакционную смесь подвергали газовой хроматографии. В результате получали 2-(4,6-диметоксипиримидин-2-илкарбонил)-6-этилацетанилид с выходом 47%, исходя из его доли от общей площади пиков.
Пример 18 (стадия 3)
Получение 2-(4,6-диметоксипиримидин-2-илгидроксиметил)-6-метоксиметилацетанилида
В реактор помещали 1,7 г (4,9 ммоль) 2-(4,6-диметоксипиримидин-2-илкарбонил)-6-метоксиметилацетанилида и 20 мл этанола. Содержимое реактора охлаждали до 5°С или ниже. В реактор добавляли 0,4 г (10,8 ммоль) боргидрида натрия и смесь перемешивали при той же температуре в течение 1 часа для осуществления взаимодействия. Затем смесь нагревали до комнатной температуры. По окончании реакции добавляли водный раствор хлористого аммония и осуществляли экстрагирование этилацетатом. Органический слой концентрировали с получением 1,32 г (3,8 ммоль) 2-(4,6-диметоксипиримидин-2-илгидроксиметил)-6-метоксиметилацетанилида. Выход: 78%. Точка плавления: от 79 до 82°С.
МС m/e: 347 (M+)
ЯМР (CDCl3/TMS), δ (м.д.):
2,24 (с, 3Н), 3,38 (с, 3Н), 3,97 (с, 6Н), 4,45 (кв, 2Н), 4,87 (д, 1Н), 5,90 (д, 1Н), от 7,2 до 7,3 (м, 1Н), 7,46 (д, 2Н), 9,41 (широкий с, 1Н).
Полученный 2-(4,6-диметоксипиримидин-2-илгидроксиметил)-6-метоксиметилацетанилид может быть использован в реакции на стадии 4 согласно примеру 6.
Пример 19 (непрерывная процедура на стадии 2 и стадии 3 в одном и том же реакторе)
Получение 2-(4,6-диметоксипиримидин-2-илгидроксиметил)-6-этилацетанилида
В реактор помещали 1,0 г (3,37 ммоль) 3-(4,6-диметоксипиримидин-2-ил)-2-метил-7-этилиндола и 20 мл этилацетата. Содержимое реактора охлаждали до 5°С или ниже. Затем впускали озон при температуре от 0°С до 10°С в течение 2 часов. По окончании реакции добавляли 20 мл этанола. Кроме того, добавляли 0,25 г (6,76 ммоль) боргидрида натрия и перемешивали в течение 1 часа. По окончании реакции реакционную смесь нагревали до комнатной температуры. Для проведения экстрагирования добавляли водный раствор хлористого аммония и этилацетат. Органический слой концентрировали и концентрат подвергали колоночной хроматографии на силикагеле (растворитель для разделения: смесь н-гексан/этилацетат) с получением 0,26 г (0,79 ммоль) 2-(4,6-диметоксипиримидин-2-илгидроксиметил)-6-этилацетанилида. Выход: 27,4%.
Полученный 2-(4,6-диметоксипиримидин-2-илгидроксиметил)-6-этилацетанилид может быть использован в реакции на стадии 4 согласно примеру 6.
Пример 20 (непрерывная процедура на стадии 3 и стадии 4 в одном и том же реакторе)
Получение 2-(4,6-диметоксипиримидин-2-илгидроксиметил)-6-метоксиметиланилина
В реактор помещали 1,0 г (2,9 ммоль) 2-(4,6-диметоксипиримидин-2-илкарбонил)-6-метоксиметилацетанилида, полученного в соответствии с примером 8, и 20 мл этанола. Содержимое реактора охлаждали до 5°С или ниже. В реактор добавляли 0,5 г (13,5 ммоль) боргидрида натрия с последующим перемешиванием при той же температуре в течение 1 часа. Затем смесь нагревали до комнатной температуры. По окончании реакции добавляли водный раствор хлористого аммония и осуществляли экстрагирование этилацетатом. Органический слой концентрировали. К остатку добавляли 20 мл метанола и 1,5 г (26,8 ммоль) гидроокиси калия. Смесь перемешивали при 70°С в течение 2 часов. По окончании реакции реакционную смесь охлаждали до комнатной температуры и добавляли 50 мл этилацетата и 50 мл воды для проведения экстрагирования. Органический слой концентрировали. Концентрат подвергали колоночной хроматографии на силикагеле (растворитель для разделения: смесь н-гексан/этилацетат) с получением 0,24 г (0,79 ммоль) 2-(4,6-диметоксипиримидин-2-илгидроксиметил)-6-метоксиметиланилина. Выход: 27,1%.
ЯМР (CDCl3/TMS), δ (м.д.):
3,31 (с, 3Н), 3,94 (с, 6Н), 4,51 (дд, 2Н), 4,66 (широкий с, 1Н), 5,15 (широкий с, 2Н), 5,84 (с, 1Н), 5,93 (с, 1Н), 6,71 (т, 1Н), от 6,7 до 6,8 (м, 1Н), от 6,9 до 7,1 (м, 1Н), от 7,2 до 7,3 (м, 1Н).
Пример 21 (непрерывная процедура на стадии 2 и стадии 3 в одном и том же реакторе)
Получение 2-(4,6-диметоксипиримидин-2-илгидроксиметил)-6-метоксиметилацетанилида
В реактор помещали 1,0 г (3,19 ммоль) 3-(4,6-диметоксипиримидин-2-ил)-2-метил-7-метоксиметилиндола и 20 мл этилацетата. Содержимое реактора охлаждали до 5°С или ниже. Затем впускали озон при температуре от 0°С до 10°С в течение 3 часов. По окончании реакции добавляли 20 мл этанола. Кроме того, добавляли 0,5 г (13,5 ммоль) боргидрида натрия с последующим перемешиванием в течение 1 часа. По окончании реакции реакционную смесь нагревали до комнатной температуры и добавляли водный раствор хлористого аммония и этилацетат для проведения экстрагирования. Органический слой концентрировали. Концентрат подвергали колоночной хроматографии с получением 0,18 г (0,52 ммоль) 2-(4,6-диметоксипиримидин-2-илгидроксиметил)-6-метоксиметилацетанилида. Выход: 16,3%.
Полученный 2-(4,6-диметоксипиримидин-2-илгидроксиметил)-6-метоксиметилацетанилид может быть использован в реакции на стадии 4 в соответствии с примером 6.
Пример 22 (стадия 5)
Получение 2-(4,6-диметоксипиримидин-2-илкарбонил)анилина
В реактор помещали 0,57 г (1,9 ммоль) 2-(4,6-диметоксипиримидин-2-илкарбонил)ацетанилида, 10 мл метанола и 5 мл 6 N хлористоводородной кислоты с последующим кипячением с обратным холодильником в течение 1 часа. По окончании реакции реакционную смесь подщелачивали гидроокисью натрия, после чего проводили экстрагирование этилацетатом. Этилацетатный слой концентрировали. Остаток подвергали газовой хроматографии. В результате было подтверждено образование 2-(4,6-диметоксипиримидин-2-илкарбонил)анилина. Превращение: 100% (исходя из его доли от общей площади пиков при газовой хроматографии). Пример 23 (стадия 5)
Получение 2-(4,6-диметоксипиримидин-2-илкарбонил)-6-метоксиметиланилина
В реакторе смешивали 50 мл метанола и 10 мл концентрированной серной кислоты. В реактор добавляли 1,0 г (2,9 ммоль) 2-(4,6-диметоксипиримидин-2-илкарбонил)-6-метоксиметилацетанилида с последующим кипячением с обратным холодильником при 65°С в течение 4 часов. Затем реакционную смесь оставляли охлаждаться до комнатной температуры. Затем добавляли 50 мл воды и перемешивали при температуре приблизительно 20°С в течение ночи. По окончании реакции реакционную смесь выливали в воду и проводили экстрагирование этилацетатом. Этилацетатный слой концентрировали. Остаток подвергали колоночной хроматографии с получением 0,30 г (1 ммоль) 2-(4,6-диметоксипиримидин-2-илкарбонил)-6-метоксиметиланилина. Выход: 34%.
Пример 24 (непрерывная процедура на стадии 2 и стадии 5 в одном и том же реакторе)
Получение 2-(4,6-диметоксипиримидин-2-илкарбонил)анилина
В реактор помещали 0,60 г (22 ммоль) 3-(4,6-диметоксипиримидин-2-ил)-2-метилиндола и 20 мл этилацетата. В реактор впускали озон при температуре от 0°С до 10°С в течение 4 часов. Для подтверждения исчезновения 3-(4,6-диметоксипиримидин-2-ил)-2-метилиндола и завершения реакции проводили тонкослойную хроматографию. Затем реакционную смесь нагревали до комнатной температуры и концентрировали. К концентрату добавляли 20 мл метанола и 5 мл 6 N хлористоводородной кислоты и нагревали с обратным холодильником в течение 1 часа. По окончании реакции реакционную смесь охлаждали до комнатной температуры. Затем добавляли 100 мл воды. Смесь подщелачивали водным раствором гидроокиси натрия и проводили экстрагирование этилацетатом. Органический слой концентрировали. Концентрат подвергали колоночной хроматографии с получением 0,26 г (10 ммоль) 2-(4,6-диметоксипиримидин-2-илкарбонил)анилина. Выход: 46%.
МС m/e: 259 (M+)
ЯМР (CDCl3/TMS), δ (м.д.):
3,99 (с, 6Н), 6,18 (с, 1Н), 6,42 (широкий, 2Н), от 6,5 до 6,6 (м, 1Н). 6,70 (д, 1Н), от 7,2 до 7,3 (м, 1Н). 7,40 (д, 1Н).
Пример 25 (стадия 1)
Получение 5-хлор-3-(4,6-диметоксипиримидин-2-ил)-2-метилиндола
К 80 мл толуола добавляли 8,0 г (40 ммоль) 1-(4,6-диметоксипиримидин-2-ил)-2-пропанона и 7,9 г (44 ммоль) хлоргидрата 4-хлорфенилгидразина. К смеси добавляли 6,54 г (48 ммоль) хлористого цинка. Затем смесь кипятили с обратным холодильником в течение 2 часов. Реакционную смесь оставляли охлаждаться. Затем добавляли этилацетат и воду, чтобы растворить всю реакционную смесь. Органический слой промывали водой, отделяли и сушили над солью Глаубера. Отделенный органический слой концентрировали при пониженном давлении, используя роторный испаритель, с получением 10,2 г (33,7 ммоль) 5-хлор-3-(4,6-диметоксипиримидин-2-ил)-2-метилиндола. Выход: 84%. Точка плавления: от 179 до 181°С.
МС m/e: 303 (M+) ЯМР (CDCl3/TMS), δ (м.д.):
2,91 (с, 3Н), 4,04 (с, 6Н), 5,82 (с, 1Н), 7,1 (м, 1Н), 7,3 (м, 1Н), 8,7 (м, 1Н)
ИК (KBr, см-1): 3510 (NH), 1580
Пример 26 (стадия 2)
Получение 4-хлор-2-(4,6-диметоксипиримидин-2-илкарбонил)ацетанилида
В реактор помещали 6,1 г (20 ммоль) 5-хлор-3-(4,6-диметоксипиримидин-2-ил)-2-метилиндола, 200 мл ацетона и 100 мл воды. В реактор добавляли 19,0 г (120 ммоль) перманганата калия и 8,6 г (40 ммоль) перйодита натрия. Реакцию осуществляли при комнатной температуре в течение 16 часов. По окончании реакции проводили фильтрование. Фильтрат экстрагировали этилацетатом. Этилацетатный слой кконцентрировали. Концентрат очищали колоночной хроматографией на силикагеле (смесь н-гексан/этилацетат = 4/1) с получением 1,8 г (5,4 ммоль) 4-хлор-2-(4,6-диметоксипиримидин-2-илкарбонил)ацетанилида. Выход: 27%. Точка плавления: от 142 до 144°С.
МС m/e: 335 (M+)
ЯМР (CDCl3/TMS), δ (м.д.):
2,27 (с, 3Н), 3,98 (с, 6Н), 6,20 (с, 1Н), 7,56 (кв, 1Н), 7,69 (м, 1Н), 8,76 (д, 1Н)
ИК (KBr, см-1): 3320 (NH), 1700, 1660 (С=О)
Пример 27 (стадия 3)
Получение 4-хлор-2-(4,6-диметоксипиримидин-2-илгидроксиметил)ацетанилида
В реактор помещали 1,00 г (3,0 ммоль) 4-хлор-2-(4,6-диметоксипиримидин-2-илкарбонил)ацетанилида и 20 мл этанола. Содержимое реактора охлаждали до 5°С или ниже. В реактор добавляли 0,25 г (6,6 ммоль) боргидрида натрия. Смесь перемешивали при той же температуре в течение 1 часа. Затем температуру повышали до комнатной температуры. По окончании реакции добавляли водный раствор хлористого аммония и проводили экстрагирование этилацетатом. Органический слой концентрировали. Концентрат очищали колоночной хроматографией на силикагеле (смесь н-гексан/этилацетат = 1/1) с получением 0,69 г (2,0 ммоль) 4-хлор-2-(4,6-диметоксипиримидин-2-илгидроксиметил) ацетанилида. Выход: 68%. Точка плавления: от 121 до 123°С.
ЯМР (CDCl3/TMS), δ (м.д.):
2,22 (с, 3Н), 3,98 (с, 6Н), 4,89 (д, 1Н), 5,81 (д, 1Н), 5,89 (с, 1Н), 7,2 (м, 1Н), 7,5 (м, 1Н), 7,8 (д, 1Н), 9,72 (широкий, 1Н)
ИК (KBr, см-1): 3430 (NH), 3300 (ОН), 1700, 1600 (С=O).
Пример 28 (стадия 1)
Получение 3-(4,6-диметоксипиримидин-2-ил)-5-метокси-2-метилиндола
К 80 мл толуола добавляли 8,0 г (40 ммоль) 1-(4,6-диметоксипиримидин-2-ил)-2-пропанона и 7,7 г (44 ммоль) хлоргидрата 4-метоксифенилгидразина. К смеси добавляли 6,0 г (44 ммоль) хлористого цинка. Затем реакционную смесь кипятили с обратным холодильником в течение 2 часов. Реакционную смесь оставляли охлаждаться. К реакционной смеси добавляли этилацетат и воду, чтобы растворить всю реакционную смесь. Маслянистый слой промывали водой, отделяли и сушили над солью Глаубера. Отделенный органический слой концентрировали при пониженном давлении, используя роторный испаритель, с получением 8,0 г (26,7 ммоль) 3-(4,6-диметоксипиримидин-2-ил)-5-метокси-2-метилиндола в виде твердого вещества оранжевого цвета. Выход: 67%. Кроме того, осуществляли перекристаллизацию из толуола. Точка плавления: от 182 до 184°С.
МС m/e: 299 (M+)
ЯМР (CDCl3/TMS), δ (м.д.):
2,87 (с, 3Н). 3,89 (с, 3Н), 4,07 (с, 6Н), 5,84 (с, 1Н), 6,9 (м, 1Н), 7,2 (м, 1Н). 8,2 (широкий, 1Н), 8,7 (с, 1Н).
ИК (см-1): 3340 (NH), 1570.
Пример 29 (стадия 2)
Получение 2-(4,6-диметоксипиримидин-2-илкарбонил)-4-метоксиацетанилида
В реактор помещали 6,0 г (20 ммоль) 3-(4,6-диметоксипиримидин-2-ил)-5-метокси-2-метилиндола, 200 мл ацетона и 100 мл воды. В реактор добавляли 19,0 г (120 ммоль) перманганата калия и 8,6 г (40 ммоль) перйодата натрия. Взаимодействие осуществляли при комнатной температуре в течение 16 часов. По окончании реакции проводили фильтрование. Фильтрат экстрагировали этилацетатом. Этилацетатный слой концентрировали. Остаток очищали колоночной хроматографией на силикагеле (смесь н-гексан/этилацетат = 4/1) с полученим 0,9 г (2,7 ммоль) 2-(4,6-диметоксипиримидин-2-илкарбонил)-4-метоксиацетанилида. Выход: 14%. МС m/e: 331 (M+)
ЯМР (CDCl3/TMS), δ (м.д.):
2,25 (с, 3Н), 3,74 (с, 3Н), 3,96 (с, 6Н), 6,17 (с, 1Н), от 7,1 до 7,2 (м, 2Н), 8,7 (д, 1Н)
ИК (см-1): 3250 (NH), 1690, 1650 (С=О).
Пример 30 (стадия 3)
Получение 2-(4,6-диметоксипиримидин-2-илгидроксиметил)-4-метоксиацетанилида
В реактор помещали 0,66 г (2,0 ммоль) 2-(4,6-диметоксипиримидин-2-илкарбонил)-4-метоксиацетанилида и 10 мл этанола. Содержимое реактора охлаждали до 5°С или ниже. В реактор добавляли 0,17 г (4,4 ммоль) боргидрида натрия. Смесь перемешивали при той же температуре в течение 1 часа. Затем смесь нагревали до комнатной температуры. По окончании реакции добавляли водный раствор хлористого аммония и проводили экстрагирование этилацетатом. Органический слой концентрировали. Концентрат очищали колоночной хроматографией на силикагеле (смесь н-гексан/этилацетат = 2/3) с получением 0,55 г (1,6 ммоль) 2-(4,6-диметоксипиримидин-2-илгидроксиметил)-4-метоксиацетанилида. Выход: 82%. Точка плавления: от 122°С до 125°С.
ЯМР (CDCl3/TMS), δ (м.д.):
2,21 (с, 3Н), 3,80 (с, 3Н), 3,97 (с, 6Н), 4,87 (д, 1Н), 5,84 (д, 1Н), 5,96 (с, 1Н), 6,8 (м, 1Н), 7,07 (д, 1Н), 7,69 (кв, 1Н), 9,49 (широкий, 1Н).
ИК (см-1): 3470 (NH), 3250 (ОН), 1670, 1600 (С=О).
Пример 31 (стадия 6)
Получение 2-(4,6-диметоксипиримидин-2-илгидроксиметил)-6-метоксиметиланилина
В реактор помещали 1,0 г (0,0033 моль) 2-(4,6-диметоксипиримидин-2-ил)карбонил-6-метоксиметиланилина и 50 мл этанола. В реактор добавляли 0,125 г (0,0033 моль) боргидрида натрия при охлаждении льдом (10°С или ниже). Смесь перемешивали при комнатной температуре в течение 2 часов. По окончании реакции к реакционной смеси добавляли насыщенный водный раствор хлористого аммония для подкисления смеси. Затем добавляли этилацетат для осуществления экстрагирования. Органический слой промывали водой и насыщенным водным раствором хлористого натрия в указанном порядке. Затем органический слой сушили над безводным сульфатом натрия и концентрировали с получением 0,91 г (0,0030 моль) 2-(4,6-диметоксипиримидин-2-илгидроксиметил)-6-метоксиметиланилина. Выход: 90%. Полученный 2-(4,6-диметоксипиримидин-2-илгидроксиметил)-6-метоксиметиланилин подвергали инструментальному анализу и показали, что данные соответствовали данным для соединений, описанных в примерах.
Промышленное применение
Согласно настоящему изобретению получено 2-(пиримидин-2-илгидроксиметил)ацетанилидное соединение, которое является важным промежуточным продуктом для сульфонанилидного соединения, проявляющего превосходное гербицидное действие, а также представлен промышленный способ получения замещенного анилинового соединения с использованием указанного выше ацетанилидного соединения в качестве промежуточного продукта.
| название | год | авторы | номер документа |
|---|---|---|---|
| АЗОТСОДЕРЖАЩЕЕ ГЕТЕРОЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2011 |
|
RU2533708C2 |
| ИЗОКСАЗОЛИНОВЫЕ ПРОИЗВОДНЫЕ И ГЕРБИЦИДЫ, СОДЕРЖАЩИЕ ИХ В КАЧЕСТВЕ АКТИВНЫХ ИНГРЕДИЕНТОВ | 2000 |
|
RU2237664C2 |
| СОЕДИНЕНИЕ ЦИКЛИЧЕСКОГО АМИНА | 2005 |
|
RU2379307C2 |
| ПРОИЗВОДНОЕ ИЗОКСАЗОЛИНА И ГЕРБИЦИД, СОДЕРЖАЩИЙ ЕГО В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА | 2002 |
|
RU2286989C2 |
| НОВОЕ БИЦИКЛИЧЕСКОЕ ГЕТЕРОЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ | 2009 |
|
RU2518073C2 |
| ПРОИЗВОДНЫЕ НИКОТИНОВОЙ КИСЛОТЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ГЕРБИЦИДНАЯ КОМПОЗИЦИЯ | 1994 |
|
RU2133746C1 |
| ПРОИЗВОДНЫЕ ПИРИМИДИНА, СПОСОБ БОРЬБЫ С СОРНЯКАМИ И ГЕРБИЦИДНЫЙ СОСТАВ | 1990 |
|
RU2041214C1 |
| ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ПИРИДИНСУЛЬФОНАМИДА, ГЕРБИЦИДНАЯ КОМПОЗИЦИЯ, ПРОИЗВОДНЫЕ ПИРИДИНСУЛЬФОНАМИДА | 1992 |
|
RU2054427C1 |
| СОЕДИНЕНИЕ, СОДЕРЖАЩИЕ КОЛЬЦО ПИРИДИНА, И СПОСОБ ПОЛУЧЕНИЯ ГАЛОГЕНИРОВАННОГО ПРОИЗВОДНОГО ПИКОЛИНА И ПРОИЗВОДНОГО ТЕТРАЗОЛИЛОКСИМА | 2011 |
|
RU2512344C1 |
| ПРОИЗВОДНЫЕ СУЛЬФОНАМИДОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ, КОМПОЗИЦИЯ И СПОСОБ УНИЧТОЖЕНИЯ СОРНЯКОВ | 1992 |
|
RU2266904C2 |
Настоящее изобретение относится к новому, промышленно применимому, способу получения замещенного анилинового соединения, представленного следующей общей формулой (6), которое может быть использовано в качестве промежуточного продукта, в производстве химикатов в сельском хозяйстве и лекарственных средств. В общей формуле (6)

R1, R2 и R3 каждый независимо означает алкильную группу, алкоксигруппу, алкоксиалкильную группу, галогеналкильную группу, карбоксильную группу, алкоксикарбонильную группу, алкилкарбоксамидную группу, нитрогруппу, арильную группу, арилалкильную группу, арилоксигруппу, атом галогена или атом водорода; и Х и Y каждый независимо означает атом водорода, алкильную группу, алкоксигруппу, алкоксиалкильную группу, галогеналкильную группу, карбоксильную группу, алкоксикарбонильную группу или атом галогена. Способ включает в себя окисление замещенного индольного соединения, представленного следующей общей формулой (3):
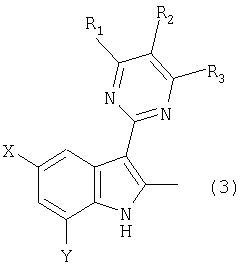
(где R1, R2, R3, Х и Y имеют такие же определения, как даны выше), приводящее к раскрытию индольного кольца с получением ацетанилидного соединения, представленного следующей общей формулой (4)
 ,
,
где R1, R2, R3, Х и Y имеют такие же определения, как даны выше; и Ас является ацетильной группой, и обработку данного соединения посредством восстановления и деацетилирования. Изобретение также относится к новым промежуточным продуктам. 8 н. и 13 з.п. ф-лы, 3 табл.

где R1, R2 и R3 каждый независимо означает алкильную группу, алкоксигруппу, алкоксиалкильную группу, галогеналкильную группу, карбоксильную группу, алкоксикарбонильную группу, алкилкарбоксамидную группу, нитрогруппу, атом галогена или атом водорода; и Х и Y каждый независимо означает атом водорода, алкильную группу, алкоксигруппу, алкоксиалкильную группу, галогеналкильную группу, карбоксильную группу, алкоксикарбонильную группу или атом галогена,
отличающийся тем, что способ включает окисление замещенного индольного соединения, представленного следующей общей формулой (3):

где R1, R2, R3, Х и Y имеют такие же определения, как даны выше, приводящее к раскрытию индольного кольца с получением ацетанилидного соединения, представленного следующей общей формулой (4):
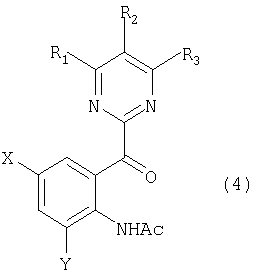
где R1, R2 и R3, Х и Y имеют такие же определения, как даны выше; Ас является ацетильной группой, и обработку данного соединения посредством восстановления и деацетилирования при условии, что хотя бы один из R1, R2 и R3 означает нитрогруппу, при этом восстановление карбонильной группы проводят с использованием в качестве восстанавливающего агента NaBH4.

и последовательно проводят деацетилирование.

где R1, R2, R3, Х и Y имеют такие же определения, как даны выше, и с последующим его восстановлением.

где R1, R2 и R3 каждый независимо означает алкильную группу, алкоксигруппу, алкоксиалкильную группу, галогеналкильную группу, карбоксильную, алкоксикарбонильную группу, алкилкарбоксамидную группу, нитрогруппу, атом галогена или атом водорода; и Х и Y каждый независимо означает атом водорода, алкильную группу, алкоксигруппу, алкоксиалкильную группу, галогеналкильную группу, карбоксильную группу, алкоксикарбонильную группу или атом галогена,
получают взаимодействием (пиримидин-2-ил)-2-пропанонового соединения, представленного следующей общей формулой (1):

где R1, R2 и R3 имеют такие же определения, как даны выше,
с гидразиновым соединением, представленным следующей общей формулой (2):

где Х и Y имеют такие же определения, как даны выше,
в присутствии кислоты.

где R1, R2 и R3 каждый независимо означает алкильную группу, алкоксигруппу, алкоксиалкильную группу, галогеналкильную группу, карбоксильную группу, алкоксикарбонильную группу, алкилкарбоксамидную группу, нитрогруппу, атом галогена или атом водорода; и Х и Y каждый независимо означает атом водорода, алкильную группу, алкоксигруппу, алкоксиалкильную группу, галогеналкильную группу, карбоксильную группу, алкоксикарбонильную группу или атом галогена,
отличающийся тем, что способ включает окисление замещенного индольного соединения, представленного следующей общей формулой (3):

где R1, R2, R3, Х и Y имеют такие же определения, как даны выше, приводящее к раскрытию индольного кольца с получением ацетанилидного соединения, представленного следующей общей формулой (4):

где R1, R2, R3, Х и Y имеют такие же определения, как даны выше; Ас является ацетильной группой,
и деацетилирование данного соединения.

где R1, R2 и R3 каждый независимо означает алкильную группу, алкоксигруппу, алкоксиалкильную группу, галогеналкильную группу, карбоксильную группу, алкоксикарбонильную группу, алкилкарбоксамидную группу, нитрогруппу, атом галогена или атом водорода; Х и Y каждый независимо означает атом водорода, алкильную группу, алкоксигруппу, алкоксиалкильную группу, галогеналкильную группу, карбоксильную группу, алкоксикарбонильную группу или атом галогена; Ас является ацетильной группой, отличающийся тем, что способ включает окисление замещенного индольного соединения, представленного следующей общей формулой (3):

где R1, R2, R3, Х и Y имеют такие же определения, как даны выше,
приводящее к раскрытию индольного кольца с получением ацетанилидного соединения, представленного следующей общей формулой (4):

где R1, R2, R3, X, Y и Ас имеют такие же определения, как даны выше,
и восстановление данного соединения, при условии, что хотя бы один из R1, R2 и R3 означают нитрогруппу, при этом восстановление карбонильной группы проводят с использованием в качестве восстанавливающего агента NaBH4.

где R1, R2, R3, Х и Y имеют такие же определения, как даны выше,
приводящее к раскрытию индольного кольца.

где R1, R2, R3, Х и Y имеют такие же определения, как даны выше; Ас означает ацетильную группу.

получают путем восстановления ацетанилидного соединения, представленного следующей общей формулой (4):

где R1, R2, R3, X, Y и Ас имеют такие же определения, как даны выше.

где R1, R2, R3, Х и Y имеют такие же определения, как даны выше, Ас является ацетильной группой.



где R1, R2 и R3 каждый независимо означает C1-6алкильную группу, C1-6алкоксигруппу, С1-6алкоксиС1-6алкильную группу, C1-6галогеналкильную группу, карбоксильную группу, C1-6алкоксикарбонильную группу, C1-6алкилкарбоксамидную группу, нитрогруппу, атом галогена или атом водорода; Х и Y каждый независимо означает атом водорода, C1-6алкильную группу, C1-6алкоксигруппу, С1-6алкоксиС1-6алкильную группу, C1-6галогеналкильную группу, карбоксильную группу, C1-6алкоксикарбонильную группу или атом галогена.

где R1, R2 и R3 каждый независимо означает C1-6алкильную группу, C1-6алкоксигруппу, C1-6алкоксиалкильную группу, галогенС1-6алкильную группу, карбоксильную группу, C1-6алкоксикарбонильную группу, С1-6алкилкарбоксамидную группу, нитрогруппу, атом галогена или атом водорода; и Х и Y каждый независимо означает атом водорода, C1-6алкильную группу, C1-6алкоксигруппу, С1-6алкоксиС1-6алкильную группу, C1-6галогеналкильную группу, карбоксильную группу, C1-6алкоксикарбонильную группу или атом галогена; Ас является ацетильной группой, при условии, что когда R1, R2 и R3 представляют водород, Х не является атомом хлора.

где R1, R2 и R3 каждый независимо означает C1-6алкильную группу, C1-6алкоксигруппу, C1-6алкоксиалкильную группу, C1-6галогеналкильную группу, карбоксильную группу, C1-6алкоксикарбонильную группу, C1-6алкилкарбоксамидную группу, нитрогруппу, атом галогена или атом водорода; и Х и Y каждый независимо означает атом водорода, C1-6алкильную группу, C1-6алкоксигруппу, С1-6алкоксиС1-6алкильную группу, С1-6галогеналкильную группу, карбоксильную группу, C1-6алкоксикарбонильную группу или атом галогена; Ас является ацетильной группой, при условии, что когда R1, R2 и R3 представляют водород, Х не является атомом хлора.
Приоритет по пунктам:
| ЩИТОВОЙ ДЛЯ ВОДОЕМОВ ЗАТВОР | 1922 |
|
SU2000A1 |
| ЩИТОВОЙ ДЛЯ ВОДОЕМОВ ЗАТВОР | 1922 |
|
SU2000A1 |
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
| ARCHER GILES A | |||
| et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| J | |||
| Med | |||
| Chem | |||
| Шеститрубный элемент пароперегревателя в жаровых трубках | 1918 |
|
SU1977A1 |
| Гребной винт с переменным шагом | 1925 |
|
SU1312A1 |
| DE 1929910 A, 02.01.1970 | |||
| RU 94022258 A, 20.04.1996. | |||
Авторы
Даты
2007-01-27—Публикация
2001-10-15—Подача