Область техники, к которой относится изобретение
Настоящее изобретение относится к 1,2,4 триазольному производному или его нетоксичной соли, способу его получения и фармацевтической композиции, содержащей указанное производное в качестве активного ингредиента.
Уровень техники
Большинство нестероидных противовоспалительных агентов ответственны за блокирование фермента циклооксигеназы (СОХ) или простагландин G/H синтазы, таким образом уменьшая воспаление, боль или лихорадку. Кроме того, они ингибируют сокращение матки, вызванное гормонами, а также ингибируют развитие некоторых типов раковых заболеваний. Циклооксигеназа-1 (СОХ-1) была впервые обнаружена у быков. СОХ-1 в основном экспрессируется в различных типах клеток. В отличие от СОХ-1, циклооксигеназа 2 (СОХ-2) представляет собой недавно обнаруженную изоформу циклооксигеназы, которая легко индуцируется митогеном, эндотоксином, гормоном, фактором роста или цитокином.
Простагландин представляет собой мощный медиатор различных патологических и физиологических процессов. СОХ-1 играет важные физиологические роли, такие как высвобождение эндогенного простагландина, поддержание физической формы, функционирование желудка и почечное кровообращение. С другой стороны, СОХ-2 индуцируется воспалительным фактором, гормоном, фактором роста или цитокином. Поэтому СОХ-2 вовлечен с патологические процессы простагландина, в отличие от основного СОХ-1. В этом отношении, избирательно действующие ингибиторы СОХ-2 продуцируют редкие и не сильные побочные эффекты с точки зрения механизма действия, по сравнению с обычными нестероидными противовоспалительными агентами. Кроме того, они уменьшают воспаление, боль и лихорадку и ингибируют сокращение матки, вызванное гормонами, а также рост некоторых типов опухолей. В частности, они эффективны при уменьшении побочных эффектов, таких как желудочно-кишечная и почечная интоксикация. Кроме того, они ингибируют синтез контрактильного простаноида, таким образом, приводя к супрессии сокращения гладких мышц. Поэтому они могут предотвращать преждевременные роды, нерегулярную менструальность, астму и эозинофильное заболевание.
Недавно сообщалось, что нестероидные противовоспалительные агенты эффективны при лечении рака толстой кишки [European Journal of Cancer, Vol.37, p.2302, 2001], рака простаты [Urology, Vol.58, p.127, 2001] и слабоумия [Ехр. Opin. Invest. Drugs, Vol.9, p.671, 2000].
Кроме того, ожидается, что селективные ингибиторы СОХ-2 могут быть эффективны при лечении остеопороза и глаукомы. Полезность селективного СОХ-2 ингибитора подробно описана John Vane, "Towards a Better Aspirin" in Nature, Vol.367, p.215-216, 1994; Bruno Battistini, Regina Botting и Y.S. Bakhle, "COX-1 и СОХ-2: Toward the Development of More Selective NSAIDs" in Drug News и Perspectives, Vol.7, p.501-512, 1994; David B. Reitz и Karen Seibert, "Selective Ciclooxygenase Inhibitors" in Annual Reports in Medicinal Chemistry, James A. Bristol, Editor, Vol.30, p.179-188, 1995.
Были известны различные селективные ингибиторы СОХ-2, имеющие различные структуры. Среди них, селективный СОХ-2 ингибитор, имеющий диариловую гетероциклическую структуру, то есть трициклическую структуру был широко изучен, как потенциальный кандидат. Диариловая гетероциклическая структура имеет центральное кольцо и сульфонамидную или метилсульфоновую группу, присоединенную к одному из арильных колец. Исходное соединение, имеющее такую диариловую гетероциклическую структуру представляет собой Dup697 [Bioorganic & Medicinal Chemistry Letters, Vol.5, p.2123, 1995]. SC-58635, имеющее пиразольное кольцо (Journal of Medicinal Chemistry, Vol.40, p.1347, 1997) и МК-966, имеющее фураноновое кольцо (WO 95/00501), были выявлены как производные Dup697.
Один из селективных СОХ-2 ингибиторов, Целекоксиб (Celecoxib) формулы 58 раскрыт в U.S. 5466823. Целекоксиб представляет собой замещенное пиразолилбензолсульфонамидное производное.
Формула 58

Другой селективный СОХ-2 ингибитор, Рофекоксиб (Rofecoxib) формулы 59 раскрыт в WO 95/00501. Рофекоксиб имеет диарилгетероциклическую структуру с центральным фураноновым кольцом.
Формула 59
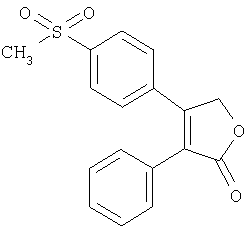
Валдекоксиб (Valdecoxib) формулы 60 в качестве другого селективного СОХ-2 ингибитора раскрыт в U.S. 5633272. Валдекоксиб имеет фенилсульфонамидный остаток на центральном изоксазольном кольце.
Формула 60

Селективные СОХ-2 ингибиторы, описываемые формулами с 58 по 60, являются эффективными противовоспалительными терапевтическими агентами с меньшими и более редкими побочными эффектами по сравнению с обычными нестероидными противовоспалительными агентами.
Сущность изобретения
Задачей настоящего изобретения является обеспечение 1,2,4-триазольного производного формулы 1 или его нетоксичной соли.
Другой задачей настоящего изобретения является обеспечение способа получения 1,2,4-триазольного производного или его нетоксичной соли.
Другой задачей настоящего изобретения является обеспечение фармацевтических композиций, содержащих 1,2,4-триазольное производное или его нетоксичной соли в качестве активного ингредиента при лечении лихорадки, боли и воспаления
Еще другой задачей настоящего изобретения является обеспечение фармацевтической композиции, содержащей 1,2,4-триазольное производное или его нетоксичной соли в качестве активного ингредиента при лечении раковых опухолей и слабоумия.
Предпочтительный способ осуществления изобретения
Согласно одному из аспектов настоящего изобретения обеспечивается получение 1,2,4-триазольного производного формулы 1:
Формула 1
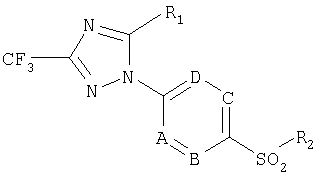
где R1 представляет собой С3-С6циклоалкильную группу; С3-С6циклоалкенильную группу; фенильную группу; фенильную группу, замещенную одной или более групп, выбранных из группы, состоящей из С1-С6алкильной группы, C1-C6галогеналкильной группы, C1-С6алкоксигруппы, C1-С6галогеналкоксигруппы, галогеновой группы, аминогруппы, моноалкиламиногруппы, диалкиламиногруппы, нитрогруппы и цианогруппы; стиренильной группы; C1-С6алкоксистиренильной группы; или пиридильной группы;
R2 представляет собой метильную или аминогруппу; и
А, В, С и D независимо представляют собой углерод или азот;
или их нетоксичную соль.
1,2,4-Триазольное производное формулы 1 может находиться в виде нетоксичной соли. Термин, "нетоксичная соль", как используется в настоящем описании, относится к фармацевтически приемлемой, нетоксичной соли, включая органическую соль и неорганическую соль.
Неорганическая соль 1,2,4-триазольного производного формулы 1 включает неорганическую соль алюминия, аммония, кальция, меди, железа, лития, магния, марганца, калия, натрия или цинка без ограничения. Неорганическая соль аммония, кальция, калия или натрия является предпочтительной.
Органическая соль 1,2,4-триазольного производного формулы 1 включает органическую соль первичного, вторичного или третичного амина, замещенного амина, который присутствует в природе или циклического амина, или соли основной ионообменной смолы без ограничения. Примеры соли основной ионообменной смолы включают без ограничения соль аргинина, бетаина, кофеина, холина, N,N-дибензилэтилендиамина, диэтиламина, 2-диэтиламиноэтанола, 2-диметиламиноэтанола, этаноламина, этилендиамина, N-этилморфолина, N-этилпиперидина, N-метилглюкамина, глюкамина, глюкозамина, гистидина, N-(2-гидроксиэтил)пиперидина, N-(2-гидроксиэтил)пирролидина, изопропиламина, лизина, метилглюкамина, морфолина, пиперазина, пиперидина, смолы полиамина, прокаина, пурина, триэтиламина, триметиламина и трипропиламина.
1,2,4-Триазольное производное формулы 1 может находиться в виде соли органической кислоты или соли неорганической кислоты.
Примеры соли органической кислоты или соли неорганической кислоты 1,2,4-триазольного производного формулы 1 включают без ограничения, соль уксусной кислоты, адипиновой кислоты, аспарагиновой кислоты, 1,5-нафталиндисульфоновой кислоты, бензолсульфоновой кислоты, бензойной кислоты, камфоросульфоновой кислоты, лимонной кислоты, 1,2-этандисульфоновой кислоты, этансульфоновой кислоты, этилендиаминотетрауксусной кислоты, фумаровой кислоты, глюкогептоновой кислоты, глюконовой кислоты, глутаминовой кислоты, йодисто-водородной кислоты, бромисто-водородной кислоты, соляной кислоты, изетионовой кислоты, молочной кислоты, малеиновой кислоты, яблочной кислоты, миндальной кислоты, метансульфоновой кислоты, муциновой (слизевой) кислоты, 2-нафталиндисульфоновой кислоты, азотной кислоты, щавелевой кислоты, пентотеновой кислоты, фосфорной кислоты, пивалриковой кислоты, пропионовой кислоты, салициловой кислоты, стеариновой кислоты, янтарной кислоты, серной кислоты, винной кислоты, п-толуолсульфоновой кислоты, ундекановой кислоты и 10-ундеценовой кислоты. Соль янтарной кислоты, бромисто-водородной кислоты, соляной кислоты, малеиновой кислоты, метансульфоновой кислоты, фосфорной кислоты, серной кислоты или винной кислоты является предпочтительной.
Предпочтительная группа 1,2,4-триазольного производного настоящего изобретения является следующей:
1-(4-метансульфонилфенил)-5-фенил-3-трифторметил-1Н-[1,2,4]триазол;
5-(4-бромфенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол;
5-(3-бромфенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол;
5-(4-фторфенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол;
5-(3,5-дихлор-4-метоксифенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол;
5-(4-хлорфенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол;
5-(3,4-дихлорфенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол;
5-(3,4-диметоксифенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол;
5-(3,4-дифторфенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол;
1-(4-метансульфонилфенил)-5-(4-метоксифенил)-3-трифторметил-1Н-[1,2,4]триазол;
5-(3,4-диметоксифенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол;
1-(4-метансульфонилфенил)-5-п-толил-3-трифторметил-1Н-[1,2,4]триазол;
5-(3,4-диметилфенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол;
5-(3-хлор-4-метилфенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол;
5-(4-хлор-3-метилфенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол;
5-(3-хлор-4-метоксифенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол;
5-(4-хлор-3-метоксифенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол;
5-(3-фтор-4-метилфенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол;
5-(4-фтор-3-метилфенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол;
5-(3-фтор-4-метоксифенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол;
1-(4-метансульфонилфенил)-3-трифторметил-5-(4-трифторметил)-1Н-[1,2,4]триазол;
5-(4-этоксифенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол;
1-(4-метансульфонилфенил)-5-(4-трифторметоксифенил)-3-трифторметил-1Н-[1,2,4]триазол;
5-(4-трет-бутилфенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол;
5-(4-цианофенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол;
5-[4-(N-метиламино)-фенил]-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол;
5-[4-(N,N-диметиламино)-фенил]-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол;
5-(4-аминофенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол;
5-(3-трифторметилфенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол;
5-(3-метоксифенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол;
1-(4-метансульфонилфенил)-5-м-толил-3-трифторметил-1Н-[1,2,4]триазол;
1-(4-метансульфонилфенил)-5-о-толил-3-трифторметил-1Н-[1,2,4]триазол;
5-(2-бромфенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол;
5-(2-метоксифенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол;
5-(2,4-дифторфенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол;
5-(2,5-дифторфенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол;
5-(2,4,5-трифторфенил)-1-(4-метансульфонилфенил-3-трифторметил-1Н-[1,2,4]триазол;
5-(2,3-дихлорфенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол;
5-(2,4-дихлорфенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол;
5-(3,5-дифторфенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол;
5-(3,5-диметоксифенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол;
5-(2,4-диметоксифенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол;
5-(3,4,5-триметоксифенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол;
5-(2-фтор-4-трифторметилфенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол;
5-(2-хлор-4-нитрофенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол;
5-(2,4-дихлор-5-фторфенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол;
5-(3-фтор-4-метилфенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол;
5-бензо[1,3]диоксол-5-ил-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол;
5-метансульфонил-2-[3-трифторметил-5-(трифторметилфенил)-[1,2,4]триазол-1-ил]пиридин;
5-метансульфонил-2-[3-трифторметил-5-(4-этоксифенил)-[1,2,4]триазол-1-ил]пиридин;
5-метансульфонил-2-[3-трифторметил-5-(4-трифторметоксифенил)-[1,2,4]триазол-1-ил]пиридин;
5-метансульфонил-2-[3-трифторметил-5-(4-трет-бутилфенил)-[1,2,4]триазол-1-ил]пиридин;
5-метансульфонил-2-[3-трифторметил-5-(4-цианофенил)-[1,2,4]триазол-1-ил]пиридин;
5-метансульфонил-2-[3-трифторметил-5-(4-аминофенил)-[1,2,4]триазол-1-ил]пиридин;
5-метансульфонил-2-[3-трифторметил-5-(4-N-метиламинофенил)-[1,2,4]триазол-1-ил]пиридин;
5-метансульфонил-2-[3-трифторметил-5-(4-N,N-диметиламинофенил)-[1,2,4]триазол-1-ил]пиридин;
5-метансульфонил-2-[3-трифторметил-5-(3-метилфенил)-[1,2,4]триазол-1-ил]пиридин;
5-метансульфонил-2-[3-трифторметил-5-(3-трифторметилфенил)-[1,2,4]триазол-1-ил]пиридин;
5-метансульфонил-2-[3-трифторметил-5-(3-метоксифенил)-[1,2,4]триазол-1-ил]пиридин;
5-метансульфонил-2-[3-трифторметил-5-(2,4-дифторфенил)-[1,2,4]триазол-1-ил]пиридин;
5-метансульфонил-2-[3-трифторметил-5-(2,5-дифторфенил)-[1,2,4]триазол-1-ил]пиридин;
5-метансульфонил-2-[3-трифторметил-5-(2,4,5-трифторфенил)-[1,2,4]триазол-1-ил]пиридин;
5-метансульфонил-2-[3-трифторметил-5-(2,3-дихлорфенил)-[1,2,4]триазол-1-ил]пиридин;
5-метансульфонил-2-[3-трифторметил-5-(2,4-дихлорфенил)-[1,2,4]триазол-1-ил]пиридин;
5-метансульфонил-2-[3-трифторметил-5-(3,5-дифторфенил)-[1,2,4]триазол-1-ил]пиридин;
5-метансульфонил-2-[3-трифторметил-5-(3,5-диметоксифенил)-[1,2,4]триазол-1-ил]пиридин;
5-метансульфонил-2-[3-трифторметил-5-(2,4-диметоксифенил)-[1,2,4]триазол-1-ил]пиридин;
5-метансульфонил-2-[3-трифторметил-5-(3,4,5-трифторфенил)-[1,2,4]триазол-1-ил]пиридин;
5-метансульфонил-2-[3-трифторметил-5-(2-фтор-4-трифторметилфенил)-[1,2,4]триазол-1-ил]пиридин;
5-метансульфонил-2-[3-трифторметил-5-(2-хлор-4-нитрофенил)-[1,2,4]триазол-1-ил]пиридин;
5-метансульфонил-2-[3-трифторметил-5-(2,4-дихлор-5-фторфенил)-[1,2,4]триазол-1-ил]пиридин;
5-метансульфонил-2-[3-трифторметил-5-(3-фтор-4-метилфенил)-[1,2,4]триазол-1-ил]пиридин;
2-(5-бензо[1,3]диоксол-5-ил-3-трифторметил-[1,2,4]триазол-1-ил)-5-метансульфонилпиридин;
3-[2-(4-метансульфонилфенил)-5-трифторметил-2Н-[1,2,4]триазол-3-ил]пиридин;
4-[2-(4-метансульфонилфенил)-5-трифторметил-2Н-[1,2,4]триазол-3-ил]пиридин;
5-циклогексил-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол;
5-циклогексен-1-ил-1-(4-метансульфонилфенил)-3-трифтор-1Н-[1,2,4]триазол;
4-(5-фенил-3-трифторметил-[1,2,4]триазол-1-ил)бензолсульфонамид;
4-[5-(4-бромфенил)-3-трифторметил-[1,2,4]триазол-1-ил)бензолсульфонамид;
4-[5-(4-фторфенил)-3-трифторметил-[1,2,4]триазол-1-ил]бензолсульфонамид;
4-[5-(3,4-дифторфенил)-3-трифторметил-[1,2,4]триазол-1-ил]бензолсульфонамид;
4-[5-(4-хлорфенил)-3-трифторметил-[1,2,4]триазол-1-ил]бензолсульфонамид;
4-[5-(3,4-дихлорфенил)-3-трифторметил-[1,2,4]триазол-1-ил]бензолсульфонамид;
4-[5-(4-метоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]бензолсульфонамид;
4-[5-(3,4-диметоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]бензолсульфонамид;
4-(5-п-толил-3-трифторметил-[1,2,4]триазол-1-ил)бензолсульфонамид;
4-[5-(3,4-диметилфенил)-3-трифторметил-[1,2,4]триазол-1-ил]бензолсульфонамид;
4-[5-(3-хлор-4-метилфенил)-3-трифторметил-[1,2,4]триазол-1-ил]бензолсульфонамид;
4-[5-(4-хлор-3-метилфенил)-3-трифторметил-[1,2,4]триазол-1-ил]бензолсульфонамид;
4-[5-(3-хлор-4-метоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]бензолсульфонамид;
4-[5-(4-хлор-3-метоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]бензолсульфонамид;
4-[5-(3-фтор-4-метилфенил)-3-трифторметил-[1,2,4]триазол-1-ил]бензолсульфонамид;
4-[5-(4-фтор-3-метилфенил)-3-трифторметил-[1,2,4]триазол-1-ил]бензолсульфонамид;
4-[5-(3-фтор-4-метоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]бензолсульфонамид;
4-[5-(3,5-дихлор-4-метоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]бензолсульфонамид;
4-[3-трифторметил-5-(4-трифторметилфенил)-[1,2,4]триазол-1-ил]бензолсульфонамид;
4-[3-трифторметил-5-(4-этоксифенил)-[1,2,4]триазол-1-ил]бензолсульфонамид;
4-[3-трифторметил-5-(4-трифторметоксифенил)-[1,2,4]триазол-1-ил]бензолсульфонамид;
4-[3-трифторметил-5-(4-трет-бутилфенил)-[1,2,4]триазол-1-ил]бензолсульфонамид;
4-[3-трифторметил-5-(4-цианофенил)-[1,2,4]триазол-1-ил]бензолсульфонамид;
4-[3-трифторметил-5-(4-аминофенил)-[1,2,4]триазол-1-ил]бензолсульфонамид;
4-[3-трифторметил-5-(4-N-метиламинофенил)-[1,2,4]триазол-1-ил]бензолсульфонамид;
4-[3-трифторметил-5-(4-N,N-диметиламинофенил)-[1,2,4]триазол-1-ил]бензолсульфонамид;
4-[3-трифторметил-5-м-толил-[1,2,4]триазол-1-ил]бензолсульфонамид;
4-[3-трифторметил-5-(3-трифторметилфенил)-[1,2,4]триазол-1-ил]бензолсульфонамид;
4-[3-трифторметил-5-(3-метоксифенил)-[1,2,4]триазол-1-ил]бензолсульфонамид;
4-[3-трифторметил-5-(2-бромфенил)-[1,2,4]триазол-1-ил]бензолсульфонамид;
4-[3-трифторметил-5-(2-метоксифенил)-[1,2,4]триазол-1-ил]бензолсульфонамид;
4-[3-трифторметил-5-(2,4-дифторфенил)-[1,2,4]триазол-1-ил]бензолсульфонамид;
4-[3-трифторметил-5-(2,5-дифторфенил)-[1,2,4]триазол-1-ил]бензолсульфонамид;
4-[3-трифторметил-5-(2,4,5-трифторфенил)-[1,2,4]триазол-1-ил]бензолсульфонамид;
4-[3-трифторметил-5-(2,3-дихлорфенил)-[1,2,4]триазол-1-ил]бензолсульфонамид;
4-[3-трифторметил-5-(2,4-дихлорфенил)-[1,2,4]триазол-1-ил]бензолсульфонамид;
4-[3-трифторметил-5-(3,5-диметоксифенил)-[1,2,4]триазол-1-ил]бензолсульфонамид;
4-[3-трифторметил-5-(2,4-диметоксифенил)-[1,2,4]триазол-1-ил]бензолсульфонамид;
4-[3-трифторметил-5-(3,4,5-трифторфенил)-[1,2,4]триазол-1-ил]бензолсульфонамид;
4-[3-трифторметил-5-(2-фтор-4-трифторметилфенил)-[1,2,4]триазол-1-ил]бензолсульфонамид;
4-[3-трифторметил-5-(2-хлор-4-нитрофенил)-[1,2,4]триазол-1-ил]бензолсульфонамид;
4-[3-трифторметил-5-(2,4-дихлор-5-фторфенил)-[1,2,4]триазол-1-ил]бензолсульфонамид;
4-[3-трифторметил-5-(3-фтор-4-метилфенил)-[1,2,4]триазол-1-ил]бензолсульфонамид;
4-(5-бензо[1,3]диоксол-5-ил-3-трифторметил-[1,2,4]триазол-1-ил)бензолсульфонамид;
4-(5-пиридин-3-ил-3-трифторметил-[1,2,4]триазол-1-ил)бензолсульфонамид;
4-(5-пиридин-4-ил-3-трифторметил-[1,2,4]триазол-1-ил)бензолсульфонамид;
4-(5-циклогексил-3-трифторметил-[1,2,4]триазол-1-ил)бензолсульфонамид;
4-(5-циклогексен-1-ил-3-трифторметил-[1,2,4]триазол-1-ил)бензолсульфонамид;
5-метансульфонил-2-(5-фенил-3-трифторметил-[1,2,4]триазол-1-ил)пиридин;
2-[5-(4-бромфенил)-3-трифторметил-[1,2,4]триазол-1-ил]-5-метансульфонилпиридин;
2-[5-(4-фторфенил)-3-трифторметил-[1,2,4]триазол-1-ил]-5-метансульфонилпиридин;
2-[5-(3,4-дифторфенил)-3-трифторметил-[1,2,4]триазол-1-ил]-5-метансульфонилпиридин;
2-[5-(4-хлорфенил)-3-трифторметил-[1,2,4]триазол-1-ил]-5-метансульфонилпиридин;
2-[5-(3,4-дихлорфенил)-3-трифторметил-[1,2,4]триазол-1-ил]-5-метансульфонилпиридин;
5-метансульфонил-2-[5-(4-метоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридин;
2-[5-(3,4-диметоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]-5-метансульфонилпиридин;
5-метансульфонил-2-(5-п-толил-3-трифторметил-[1,2,4]триазол-1-ил)пиридин;
2-[5-(3,4-диметилфенил)-3-трифторметил-[1,2,4]триазол-1-ил]-5-метансульфонилпиридин;
2-[5-(3-хлор-4-метилфенил)-3-трифторметил-[1,2,4]триазол-1-ил]-5-метансульфонилпиридин;
2-[5-(4-хлор-3-метилфенил)-3-трифторметил-[1,2,4]триазол-1-ил]-5-метансульфонилпиридин;
6-[5-(3-хлор-4-метоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридин-3-амид сульфоновой кислоты;
6-[5-(4-хлор-3-метоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридин-3-амид сульфоновой кислоты;
6-[5-(3-фтор-4-метилфенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридин-3-амид сульфоновой кислоты;
6-[3-трифторметил-5-(4-трифторметилфенил)-[1,2,4]триазол-1-ил]пиридин-3-амид сульфоновой кислоты;
6-[3-трифторметил-5-(4-этоксифенил)-[1,2,4]триазол-1-ил]пиридин-3-амид сульфоновой кислоты;
6-[3-трифторметил-5-(4-трифторметоксифенил)-[1,2,4]триазол-1-ил]пиридин-3-амид сульфоновой кислоты;
6-[3-трифторметил-5-(4-трет-бутилфенил)-[1,2,4]триазол-1-ил]пиридин-3-амид сульфоновой кислоты;
6-[3-трифторметил-5-(4-цианофенил)-[1,2,4]триазол-1-ил]пиридин-3-амид сульфоновой кислоты;
6-[3-трифторметил-5-(4-аминофенил)-[1,2,4]триазол-1-ил]пиридин-3-амид сульфоновой кислоты;
6-[3-трифторметил-5-(4-N-метиламинофенил)-[1,2,4]триазол-1-ил]пиридин-3-амид сульфоновой кислоты;
6-[3-трифторметил-5-(4-N,N-диметиламинофенил)-[1,2,4]триазол-1-ил]пиридин-3-амид сульфоновой кислоты;
6-[3-трифторметил-5-м-толил-[1,2,4]триазол-1-ил]пиридин-3-амид сульфоновой кислоты;
6-[3-трифторметил-5-(3-метоксифенил)-[1,2,4]триазол-1-ил]пиридин-3-амид сульфоновой кислоты;
6-[3-трифторметил-5-(3-трифторметилфенил)-[1,2,4]триазол-1-ил]пиридин-3-амид сульфоновой кислоты;
6-[3-трифторметил-5-(2-бромфенил)-[1,2,4]триазол-1-ил]пиридин-3-амид сульфоновой кислоты;
6-[3-трифторметил-5-(2-метоксифенил)-[1,2,4]триазол-1-ил]пиридин-3-амид сульфоновой кислоты;
6-[3-трифторметил-5-(2,4-дифторфенил)-[1,2,4]триазол-1-ил]пиридин-3-амид сульфоновой кислоты;
6-[3-трифторметил-5-(2,5-дифторфенил)-[1,2,4]триазол-1-ил]пиридин-3-амид сульфоновой кислоты;
6-[3-трифторметил-5-(3,5-дифторфенил)-[1,2,4]триазол-1-ил]пиридин-3-амид сульфоновой кислоты;
6-[3-трифторметил-5-(2,4,5-трифторфенил)-[1,2,4]триазол-1-ил]пиридин-3-амид сульфоновой кислоты;
6-[3-трифторметил-5-(2-фтор-4-трифторметилфенил)-[1,2,4]триазол-1-ил]пиридин-3-амид сульфоновой кислоты;
6-[3-трифторметил-5-(2,4-диметоксифенил)-[1,2,4]триазол-1-ил]пиридин-3-амид сульфоновой кислоты;
6-[3-трифторметил-5-(3,4,5-триметоксифенил)-[1,2,4]триазол-1-ил]пиридин-3-амид сульфоновой кислоты;
6-[3-трифторметил-5-(2-хлор-4-нитрофенил)-[1,2,4]триазол-1-ил]пиридин-3-амид сульфоновой кислоты;
6-[3-трифторметил-5-(2,4-дифтор-5-фторфенил)-[1,2,4]триазол-1-ил]пиридин-3-амид сульфоновой кислоты;
6-[3-трифторметил-5-(3-фтор-4-метилфенил)-[1,2,4]триазол-1-ил]пиридин-3-амид сульфоновой кислоты;
2-[5-(4-фтор-3-метилфенил)-3-трифторметил-[1,2,4]триазол-1-ил]-5-метансульфонилпиридин;
2-[5-(3-фтор-4-метоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]-5-метансульфонилпиридин;
2-[5-(3,5-дихлор-4-метоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]-5-метансульфонилпиридин;
5-метансульфонил-2-((3-пиридинил)-3-трифторметил-[1,2,4]триазол-1-ил))пиридин;
5-метансульфонил-2-((4-пиридинил)-3-трифторметил-[1,2,4]триазол-1-ил))пиридин;
2-(5-циклогексил-3-трифторметил-[1,2,4]триазол-1-ил)-5-метансульфонилпиридин;
2-(5-циклогексен-1-ил-3-трифторметил-[1,2,4]триазол-1-ил)-5-метансульфонилпиридин;
6-(5-фенил-3-трифторметил-[1,2,4]триазол-1-ил)пиридин-3-амид сульфоновой кислоты;
6-[5-(4-бромфенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридин-3-амид сульфоновой кислоты;
6-[5-(4-фторфенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридин-3-амид сульфоновой кислоты;
6-[5-(3,4-дифторфенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридин-3-амид сульфоновой кислоты;
6-[5-(4-хлорфенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридин-3-амид сульфоновой кислоты;
6-[5-(3,4-дихлорфенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридин-3-амид сульфоновой кислоты;
6-[5-(4-метоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридин-3-амид сульфоновой кислоты;
6-[5-(3,4-диметоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридин-3-амид сульфоновой кислоты;
6-(5-п-толил-3-трифторметил-[1,2,4]триазол-1-ил)пиридин-3-амид сульфоновой кислоты;
6-[5-(3,4-диметилфенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридин-3-амид сульфоновой кислоты;
6-[5-(3-хлор-4-метилфенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридин-3-амид сульфоновой кислоты;
6-[5-(4-хлор-3-метилфенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридин-3-амид сульфоновой кислоты;
6-[5-(3-хлор-4-метоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридин-3-амид сульфоновой кислоты;
6-[5-(4-хлор-3-метоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридин-3-амид сульфоновой кислоты;
6-[5-(3-фтор-4-метилфенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридин-3-амид сульфоновой кислоты;
6-[5-(4-фтор-3-метилфенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридин-3-амид сульфоновой кислоты;
6-[5-(3-фтор-4-метоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридин-3-амид сульфоновой кислоты;
6-[5-(3,5-дихлор-4-метоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридин-3-амид сульфоновой кислоты;
6-(5-пиридин-3-ил-3-трифторметил-[1,2,4]триазол-1-ил)пиридин-3-амид сульфоновой кислоты;
6-(5-пиридин-4-ил-3-трифторметил-[1,2,4]триазол-1-ил)пиридин-3-амид сульфоновой кислоты;
6-(5-циклогексил-3-трифторметил-[1,2,4]триазол-1-ил)пиридин-3-амид сульфоновой кислоты;
6-(5-циклогексен-1-ил-3-трифторметил-[1,2,4]триазол-1-ил)пиридин-3-амид сульфоновой кислоты;
2-метансульфонил-5-(5-фенил-3-трифторметил-[1,2,4]триазол-1-ил)пиридин;
5-[5-(4-бромфенил)-3-трифторметил-[1,2,4]триазол-1-ил]-2-метансульфонилпиридин;
5-[5-(4-фторфенил)-3-трифторметил-[1,2,4]триазол-1-ил]-2-метансульфонилпиридин;
5-[5-(3,4-дифторфенил)-3-трифторметил-[1,2,4]триазол-1-ил]-2-метансульфонилпиридин;
5-[5-(4-хлорфенил)-3-трифторметил-[1,2,4]триазол-1-ил]-2-метансульфонилпиридин;
5-[5-(3,4-дихлорфенил)-3-трифторметил-[1,2,4]триазол-1-ил]-2-метансульфонилпиридин;
2-метансульфонил-5-[5-(4-метоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридин;
5-[5-(3,4-диметоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]-2-метансульфонилпиридин;
2-метансульфонил-5-(5-п-толил-3-трифторметил-[1,2,4]триазол-1-ил)пиридин;
5-[5-(3,4-диметилфенил)-3-трифторметил-[1,2,4]триазол-1-ил]-2-метансульфонилпиридин;
5-[5-(3-хлор-4-метилфенил)-3-трифторметил-[1,2,4]триазол-1-ил]-2-метансульфонилпиридин;
5-[5-(4-хлор-3-метилфенил)-3-трифторметил-[1,2,4]триазол-1-ил]-2-метансульфонилпиридин;
5-[5-(3-хлор-4-метоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]-2-пиридин-2-амид сульфоновой кислоты;
5-[5-(4-хлор-3-метоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридин-2-амид сульфоновой кислоты;
5-[5-(3-фтор-4-метилфенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридин-2-амид сульфоновой кислоты;
5-[5-(4-фтор-3-метилфенил)-3-трифторметил-[1,2,4]триазол-1-ил]-2-метансульфонилпиридин;
5-[5-(3-фтор-4-метоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]-2-метансульфонилпиридин;
5-[5-(3,5-дихлор-4-метоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]-2-метансульфонилпиридин;
5-(5-циклогексил-3-трифторметил-[1,2,4]триазол-1-ил)-2-метансульфонилпиридин;
5-(5-циклогексен-1-ил-3-трифторметил-[1,2,4]триазол-1-ил)-2-метансульфонилпиридин;
5-(5-фенил-3-трифторметил-[1,2,4]триазол-1-ил)пиридин-2-амид сульфоновой кислоты;
5-[5-(4-бромфенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридин-2-амид сульфоновой кислоты;
5-[5-(4-фторфенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридин-2-амид сульфоновой кислоты;
5-[5-(3,4-дифторфенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридин-2-амид сульфоновой кислоты;
5-[5-(4-хлорфенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридин-2-амид сульфоновой кислоты;
5-[5-(3,4-дихлорфенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридин-2-амид сульфоновой кислоты;
5-[5-(4-метоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридин-2-амид сульфоновой кислоты;
5-[5-(3,4-диметоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридин-2-амид сульфоновой кислоты;
5-(5-п-толил-3-трифторметил-[1,2,4]триазол-1-ил)пиридин-2-амид сульфоновой кислоты;
5-[5-(3,4-диметилфенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридин-2-амид сульфоновой кислоты;
5-[5-(3-хлор-4-метилфенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридин-2-амид сульфоновой кислоты;
5-[5-(4-хлор-3-метилфенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридин-2-амид сульфоновой кислоты;
5-[5-(3-хлор-4-метоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридин-2-амид сульфоновой кислоты;
5-[5-(4-хлор-3-метоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]-пиридин-2-амид сульфоновой кислоты;
5-[5-(3-фтор-4-метилфенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридин-2-амид сульфоновой кислоты;
5-[5-(4-фтор-3-метилфенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридин-2-амид сульфоновой кислоты;
5-[5-(3-фтор-4-метоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридин-2-амид сульфоновой кислоты;
5-[5-(3,5-дихлор-4-метоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридин-2-амид сульфоновой кислоты;
5-(5-пиридин-3-ил-3-трифторметил-[1,2,4]триазол-1-ил)пиридин-2-амид сульфоновой кислоты;
5-(5-пиридин-4-ил-3-трифторметил-[1,2,4]триазол-1-ил)пиридин-2-амид сульфоновой кислоты;
5-(5-циклогексил-3-трифторметил-[1,2,4]триазол-1-ил)пиридин-2-амид сульфоновой кислоты;
5-(5-циклогексен-1-ил-3-трифторметил-[1,2,4]триазол-1-ил)пиридин-2-амид сульфоновой кислоты;
3-метансульфонил-6-(5-фенил-3-трифторметил-[1,2,4]триазол-1-ил)пиридазин;
3-[5-(4-бромфенил)-3-трифторметил-[1,2,4]триазол-1-ил]-6-метансульфонилпиридазин;
3-[5-(4-фторфенил)-3-трифторметил-[1,2,4]триазол-1-ил]-6-метансульфонилпиридазин;
3-[5-(3,4-дифторфенил)-3-трифторметил-[1,2,4]триазол-1-ил]-6-метансульфонилпиридазин;
3-[5-(4-хлорфенил)-3-трифторметил-[1,2,4]триазол-1-ил]-6-метансульфонилпиридазин;
3-[5-(3,4-дихлорфенил)-3-трифторметил-[1,2,4]триазол-1-ил]-6-метансульфонилпиридазин;
3-метансульфонил-6-[5-(4-метоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридазин;
3-[5-(3,4-диметоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]-6-метансульфонилпиридазин;
3-метансульфонил-6-(5-п-толил-3-трифторметил-[1,2,4]триазол-1-ил)пиридазин;
3-[5-(3,4-диметилфенил)-3-трифторметил-[1,2,4]триазол-1-ил]-6-метансульфонилпиридазин;
3-[5-(3-хлор-4-метилфенил)-3-трифторметил-[1,2,4]триазол-1-ил]-6-метансульфонилпиридазин;
3-[5-(4-хлор-3-метилфенил)-3-трифторметил-[1,2,4]триазол-1-ил]-6-метансульфонилпиридазин;
3-[5-(3-хлор-4-метоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]-6-метансульфонилпиридазин;
3-[5-(4-хлор-3-метоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]-6-метансульфонилпиридазин;
3-[5-(3-фтор-4-метилфенил)-3-трифторметил-[1,2,4]триазол-1-ил]-6-метансульфонилпиридазин;
3-[5-(4-фтор-3-метилфенил)-3-трифторметил-[1,2,4]триазол-1-ил]-6-метансульфонилпиридазин;
3-[5-(3-фтор-4-метоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]-6-метансульфонилпиридазин;
3-[5-(3,5-дихлор-4-метоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]-6-метансульфонилпиридазин;
3-метансульфонил-6-(5-пиридин-3-ил-3-трифторметил-[1,2,4]триазол-1-ил)пиридазин;
3-метансульфонил-6-(5-пиридин-4-ил-3-трифторметил-[1,2,4]триазол-1-ил)пиридазин;
3-(5-циклогексил-3-трифторметил-[1,2,4]триазол-1-ил)-6-метансульфонилпиридазин;
3-(5-циклогексен-1-ил-3-трифторметил-[1,2,4]триазол-1-ил)-6-метансульфонилпиридазин;
6-(5-фенил-3-трифторметил-[1,2,4]триазол-1-ил)пиридазин-3-амид сульфоновой кислоты;
6-[5-(4-бромфенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридазин-3-амид сульфоновой кислоты;
6-[5-(4-фторфенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридазин-3-амид сульфоновой кислоты;
6-[5-(3,4-дифторфенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридазин-3-амид сульфоновой кислоты;
6-[5-(4-хлорфенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридазин-3-амид сульфоновой кислоты;
6-[5-(3,4-дихлорфенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридазин-3-амид сульфоновой кислоты;
6-[5-(4-метоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридазин-3-амид сульфоновой кислоты;
6-[5-(3,4-диметоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридазин-3-амид сульфоновой кислоты;
6-(5-п-толил-3-трифторметил-[1,2,4]триазол-1-ил)пиридазин-3-амид сульфоновой кислоты;
6-[5-(3,4-диметилфенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридазин-3-амид сульфоновой кислоты;
6-[5-(3-хлор-4-метилфенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридазин-3-амид сульфоновой кислоты;
6-[5-(4-хлор-3-метилфенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридазин-3-амид сульфоновой кислоты;
6-[5-(3-хлор-4-метоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридазин-3-амид сульфоновой кислоты;
6-[5-(4-хлор-3-метоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридазин-3-амид сульфоновой кислоты;
6-[5-(3-фтор-4-метилфенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридазина-3-амид сульфоновой кислоты;
6-[5-(4-фтор-3-метилфенил)-3-трифторметил-[1,2,4]триазол-1-ил]пирадазина-3-амид сульфоновой кислоты;
6-[5-(3-фтор-4-метоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридазин-3-амид сульфоновой кислоты;
6-[5-(3,5-дихлор-4-метоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридазин-3-амид сульфоновой кислоты;
6-(5-пиридин-3-ил-3-трифторметил-[1,2,4]триазол-1-ил)пиридазин-3-амид сульфоновой кислоты;
6-(5-пиридин-4-ил-3-трифторметил-[1,2,4]триазол-1-ил)пиридазин-3-амид сульфоновой кислоты;
6-(5-циклогексил-3-трифторметил-[1,2,4]триазол-1-ил)пиридазин-3-амид сульфоновой кислоты;
6-(5-циклогексен-1-ил-3-трифторметил-[1,2,4]триазол-1-ил)пиридазин-3-амид сульфоновой кислоты;
5-метансульфонил-2-(5-фенил-3-трифторметил-[1,2,4]триазол-1-ил)пиримидина;
2-[5-(4-бромфенил)-3-трифторметил-[1,2,4]триазол-1-ил]-5-метансульфонилпиримидина;
2-[5-(4-фторфенил)-3-трифторметил-[1,2,4]триазол-1-ил]-5-метансульфонилпиримидина;
2-[5-(3,4-дифторфенил)-3-трифторметил-[1,2,4]триазол-1-ил]-5-метансульфонилпиримидина;
2-[5-(4-хлорфенил)-3-трифторметил-[1,2,4]триазол-1-ил]-5-метансульфонилпиримидина;
2-[5-(3,4-дихлорфенил)-3-трифторметил-[1,2,4]триазол-1-ил]-5-метансульфонилпиримидина;
5-метансульфонил-2-[5-(4-метоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиримидина;
2-[5-(3,4-диметоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]-5-метансульфонилпиримидина;
5-метансульфонил-2-(5-п-толил-3-трифторметил-[1,2,4]триазол-1-ил)пиримидина;
2-[5-(3,4-диметилфенил)-3-трифторметил-[1,2,4]триазол-1-ил]-5-метансульфонилпиримидина;
2-[5-(3-хлор-4-метилфенил)-3-трифторметил-[1,2,4]триазол-1-ил]-5-метансульфонилпиримидина;
2-[5-(4-хлор-3-метилфенил)-3-трифторметил-[1,2,4]триазол-1-ил]-5-метансульфонилпиримидина;
2-[5-(3-хлор-4-метоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]-5-метансульфонилпиримидина;
2-[5-(4-хлор-3-метоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]-5-метансульфонилпиримидина;
2-[5-(3-фтор-4-метилфенил)-3-трифторметил-[1,2,4]триазол-1-ил]-5-метансульфонилпиримидина;
2-(5-фенил-3-трифторметил-[1,2,4]триазол-1-ил)пиримидин-5-амид сульфоновой кислоты;
2-[5-(4-бромфенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиримидин-5-амид сульфоновой кислоты;
2-[5-(4-фторфенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиримидин-5-амид сульфоновой кислоты;
2-[5-(3,4-дифторфенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиримидин-5-амид сульфоновой кислоты;
2-[5-(4-хлорфенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиримидин-5-амид сульфоновой кислоты;
2-[5-(3,4-дихлорфенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиримидин-5-амид сульфоновой кислоты;
2-[5-(4-метоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиримидин-5-амид сульфоновой кислоты;
2-[5-(3,4-диметоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиримидин-5-амид сульфоновой кислоты;
2-(5-п-толил-3-трифторметил-[1,2,4]триазол-1-ил)пиримидин-5-амид сульфоновой кислоты;
2-[5-(3,4-диметилфенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиримидин-5-амид сульфоновой кислоты;
2-[5-(3-хлор-4-метилфенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиримидин-5-амид сульфоновой кислоты;
2-[5-(4-хлор-3-метилфенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиримидин-5-амид сульфоновой кислоты;
2-[5-(3-хлор-4-метоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиримидин-5-амид сульфоновой кислоты;
2-[5-(4-хлор-3-метоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиримидин-5-амид сульфоновой кислоты;
2-[5-(3-фтор-4-метилфенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиримидин-5-амид сульфоновой кислоты;
5-стирил-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол; или
5-[2-(4-метоксифенил)-винил]-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазола.
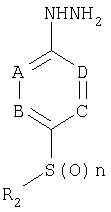
В соответствии с другим аспектом настоящего изобретения обеспечивается амидразоновое производное в качестве промежуточного соединения формулы 4 для синтеза 1,2,4-триазольного производного формулы 1:
Формула 4

где R2, A, B1, С и D имеют значение, как определено в формуле 1, и n является целым числом от 0 до 2.
В соответствии с другим аспектом настоящего изобретения обеспечивается способ получения 1,2,4-триазольного производного формулы 1 или его нетоксичной соли, включающий взаимодействие амидразонового производного формулы 4а с ацилхлоридом формулы 5 в присутствии основания.
Формула 4а

Формула 5

где R1, R2, А, В, С и D имеют значение, как определено в формуле 1.
В соответствии с другим аспектом настоящего изобретения обеспечивается способ получения 1,2,4-триазольного производного формулы 1 или его нетоксичной соли, включающий взаимодействие амидразонового производного формулы 4b с ацилхлоридом формулы 5, в присутствии основания и окисления полученного соединения окислителем, выбранным из группы, состоящей из гексагидрата монопероксифталата магния (ММРР), м-хлорпероксибензойной кислоты (МСРВА) и пероксимоносульфата калия.
Формула 4b

где R2, А, В, С и D имеют значение, как определены в формуле 1 и m имеет значение 0 или 1.
Упомянутые выше реакции, предпочтительно проводят в полярном растворителе. Примеры полярного растворителя включают без ограничения диметилформамид, 1,4-диоксан, диметилсульфоксид, N-метилпирролидинон или м-ксилол.
Реакции предпочтительно проводят в интервале температур от -10 до 110°С. Время реакции определяют в зависимости от реагентов. Как правило, требуется время реакции от 10 минут до 36 часов.
Когда реакции завершены, полученные продукты экстрагируют водой и органическим растворителем, таким как этилацетат, дихлорметан, тетрагидрофуран и другими, чтобы удалить соли. Сырые экстракты очищают с помощью хроматографии на колонке с силикагелем, с получением конечных продуктов.
Основания, используемые в настоящем описании, являются органическими основаниями или неорганическими основаниями. Предпочтительными органическими основаниями являются триэтиламин, триметиламин, трипропиламин, пиридин или имидазол. Предпочтительными неорганическими основаниями являются ацетат натрия, гидроксид натрия, гидрид натрия, гидроксид калия, карбонат натрия или карбонат калия. Пиридин является наиболее предпочтительным.
Реакцию окисления предпочтительно проводят в дихлорметане в присутствии окислителя. Предпочтительными окислителями являются ММРР, МСРВА или пероксимоносульфат калия.
В соответствии с другим аспектом настоящего изобретения обеспечивается способ получения соединения формулы 1b, включающий взаимодействие соединения формулы 1а с гидроксиламином или его солью в присутствии сильного основания и кислоты Льюиса.
Формула 1а
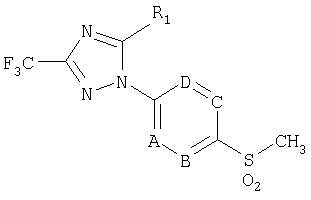
Формула 1b

где R1, А, В, С и D имеют значение, как определено в формуле 1.
В соответствии с другим аспектом настоящего изобретения обеспечивается способ получения 1,2,4-триазольного производного формулы 1b или его нетоксичной соли, включающий взаимодействие соединения формулы 6а с гидроксиламином или его солью в присутствии сильного основания и кислоты Льюиса и окисления полученного продукта, используя окислитель, выбранный из группы, состоящей из ММРР, МСРВА и пероксимоносульфата калия.
Формула 6а

где R1, А, В, С и D имеют значение, как определено в формуле 1 и k имеет значение 1 или 0.
Предпочтительной солью гидроксиламина является сульфат гидроксиламина, гидрохлорид гидроксиламина, фосфат гидроксиламина, нитрат гидроксиламина или сульфонат гидроксиламина.
Для того чтобы получить соединение, в котором R2 представляет собой аминогруппу в формуле 1, вначале соединение формулы 1а или соединение формулы 6а дегидрируют в тетрагидрофурановом растворителе или эфире при температуре в интервале от -78 до 80°С в присутствии сильного основания, такого как алкиллития, ариллития, хлоралкилмагния или хлорарилмагния. Затем, полученное соединение подвергают взаимодействию с кислотой Льюиса, такой как боралкил, борарил, алкилалюминий и арилалюминий в интервале температур от -78 до 80°С, с последующим аминированием, используя сульфат гидроксиламина. Предпочтительно, используют сульфат гидроксиламина, потому что, когда используют избыток сульфата гидроксиламина, побочные реакции являются минимальными и остаток сульфата гидроксиламина и побочный продукт легко удаляют при экстракции. После выделения сырой экстракт очищают с помощью хроматографии на колонке, что обеспечивает получение продукта, имеющего желательную сульфонамидную группу.
В соответствии с другим аспектом настоящего изобретения обеспечивается способ получения соединения формулы 4, включающий взаимодействие гидразинового производного формулы 2 с трифторацетимидином формулы 3 в присутствии основания.
Формула 2
Формула 3

где R2, А, В, С, D и n имеют значение, как определено в формуле 4.
Реакцию проводят в растворителе. Предпочтительным растворителем является метанол или смесь растворителей метанола и тетрагидрофурана. Реакцию предпочтительно проводят в интервале температур от -10 до 66°С. Время реакции определяют в зависимости от реагентов. Предпочтительно время реакции составляет от 10 минут до 48 часов.
Когда реакцию полностью завершают, полученную реакционную смесь экстрагируют водой и органическим растворителем, таким как этилацетат, дихлорметан, тетрагидрофуран и другими, чтобы удалить соли. Сырой экстракт очищают с помощью хроматографии на колонке с силикагелем, что дает соединение формулы 4.
Основание, которое используют в настоящем изобретении представляет собой органическое основание или неорганическое основание. Предпочтительно, органическое основание представляет собой триэтиламин, триметиламин, трипропиламин, пиридин, или имидазол. Предпочтительно, неорганическое основание представляет собой ацетат натрия, гидроксид натрия, гидрид натрия, гидроксид калия, карбонат натрия или карбонат калия. Более предпочтительно используют триэтиламин.
Все сырые продукты, полученные по упомянутой выше реакции, очищают с помощью обычных последующих процессов обработки, например, хроматографией и перекристаллизацией, что, таким образом, дает конечные продукты.
Способ получения соединения формулы 1 выражается следующей схемой 1:
Схема 1
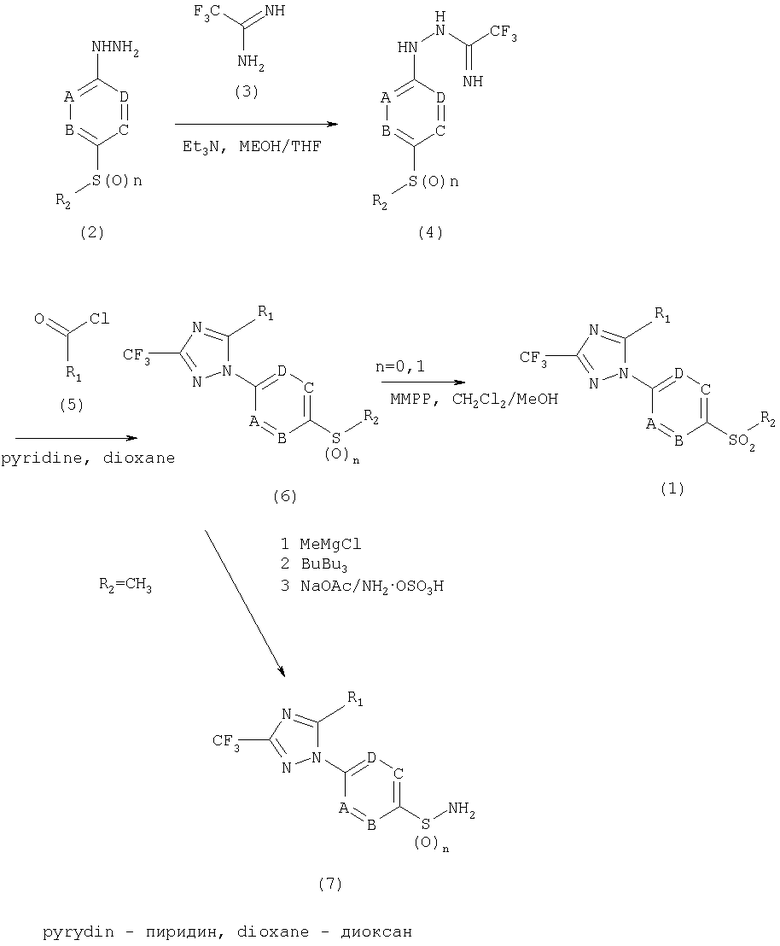
где R1, R2, A, B, C, D и n имеют значение, как определено выше.
В качестве гидразинового производного, используемого в схеме 1, применяют гидрохлорид 4-гидразинбензолсульфонамида, который может быть получен от фирмы Maybridge (United Kingdom). Другие производные гидразина могут быть синтезированы сами по себе или в виде их гидрохлоридов в соответствии с известными методиками [Tetrahedron Letters, vol.28, No42, p.4933, 1987; U.S. Patent No. 4204870; The Journal of Organic Chemistry, vol.56, No16, p.4974, 1991; EP 1104759; and Tetrahedron, vol.48, No21, p.6791, 1989]. Методики синтеза основных производных гидразина, представлены на схемах с 2 по 5.
Схема 2
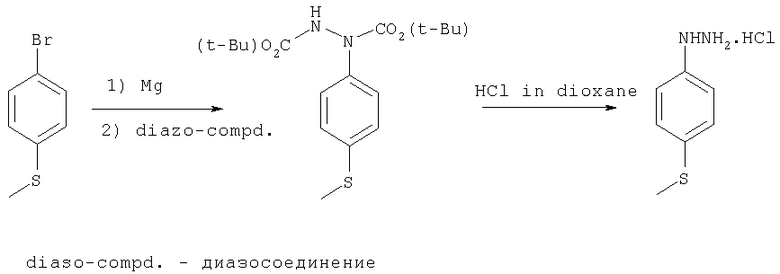
На схеме 2,4-бромтиоанизол обрабатывают магнием, что обеспечивает получение соединение Гриньяра. Соединение Гриньяра взаимодействует с диазосоединением, а затем с хлористым водородом, чтобы, таким образом, получить гидрохлоридную соль производного гидразина.
Схема 3

На схеме 3 пиридиновое производное взаимодействует с моногидратом гидразина, что обеспечивает получение 2-гидразинпиридинового производного.
Схема 4
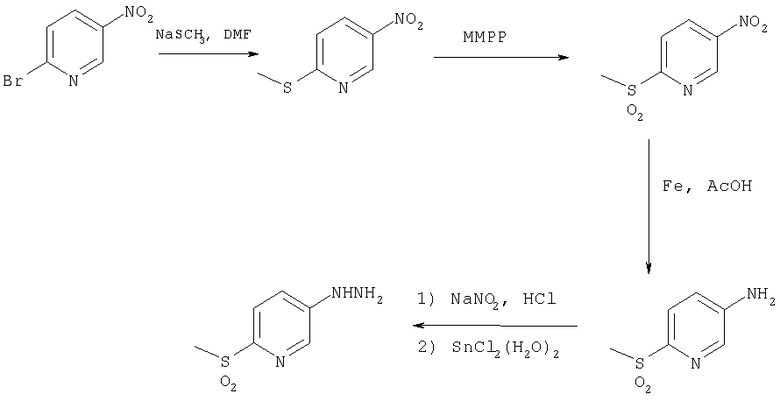
На схеме 4 нитрозамещенное пиридиновое производное восстанавливают до аминозамещенного пиридинового производного. Затем гидразиновую группу вводят в аминозамещенное пиридиновое производное, что обеспечивает получение 3-гидразинопиридинового производного.
Схема 5
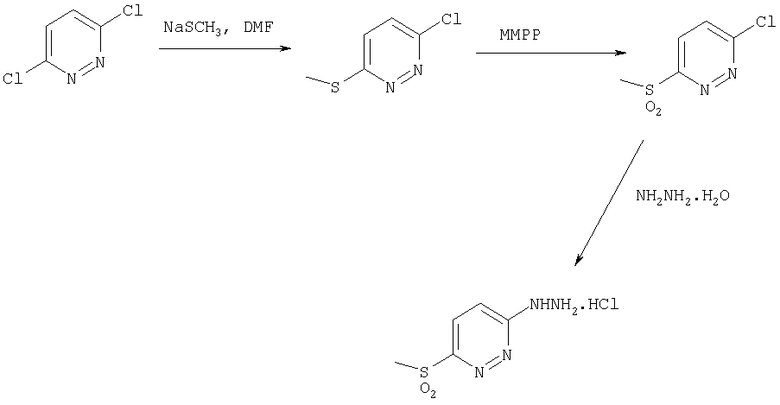
На схеме 5 2-гидразинпиридазиновое производное получают из 2,5-дихлорпиридазина в соответствии с аналогичной методикой, представленной на схеме 3.
В методиках получения соединений настоящего изобретения условия реакции, такие как типы и количества растворителя, основания и реагенты являются без ограничения теми, как упомянуто выше. Понятно, что средний специалист в данной области может легко получить соединения настоящего изобретения с помощью любой комбинации методик синтеза, как описано в описании или раскрыто в уровне техники.
В соответствии с другим аспектом настоящего изобретения обеспечивается фармацевтическая композиция, содержащая терапевтически эффективное количество 1,2,4-триазольного производного или его нетоксичной соли в качестве активного ингредиента и фармацевтически приемлемого носителя для лечения лихорадки, боли и воспаления.
Фармацевтическая композиция содержит соединение формулы 1 или его нетоксичную соль тогда, когда она представляет собой селективный ингибитор циклооксигеназы-2. Поэтому фармацевтическая композиция может быть использована как жаропонижающий, аналгезирующий и противовоспалительный агент с минимальными побочными эффектами.
Обычные нестероидные противовоспалительные агенты неселективно ингибируют ферменты синтеза простагландина, циклооксигеназу-1 и циклооксигеназу-2. Поэтому могут появиться различные побочные эффекты.
С другой стороны, соединение формулы 1 и его нетоксичная соль селективно ингибируют циклооксигеназу-2. Поэтому побочные эффекты обычных нестероидных жаропонижающих, болеутоляющих и противовоспалительных агентов могут быть уменьшены.
Фармацевтическая композиция настоящего изобретения включает соединение формулы 1 и/или его нетоксичную соль и фармацевтически приемлемый носитель или инертный наполнитель. Поэтому фармацевтическая композиция может использоваться как заместитель обычных нестероидных противовоспалительных агентов. В частности, вследствие уменьшения побочных эффектов обычных нестероидных жаропонижающих, болеутоляющих и противовоспалительных агентов, фармацевтическая композиция настоящего изобретения, полезна для лечения пациентов с язвенной болезнью, гастритом, региональным энтеритом, неспецифическим язвенным колитом, дивертикулитом, гастроррагией или гипопротромбинемией.
Фармацевтическая композиция настоящего изобретения может использоваться для лечения всех воспалительных заболеваний, связанных с патологическим простагландином, и особенно она полезна при лечении остеоартрита и ревматоидного артрита, которые требуют больших доз нестероидных противовоспалительных агентов.
Фармацевтическая композиция настоящего изобретения может применяться в форме взрослой дозировки от 1 мг/день до 1000 мг/день соединения формулы 1. Адекватную дозу определяют в зависимости от степени серьезности заболевания.
В соответствии с еще одним аспектом настоящего изобретения обеспечивается фармацевтическая композиция, включающая терапевтически эффективное количество 1,2,4-триазольного производного формулы 1 или его нетоксичный соли и фармацевтически приемлемый носитель для лечения рака и слабоумия.
Недавно сообщалось, что нестероидные противовоспалительные агенты эффективны при лечении рака толстой кишки [European Journal of Cancer, Vol.37, p.2302, 2001], рака простаты [Urology, Vol.58, p.127, 2001] и слабоумия [Exp.Opin. Invest. Drugs, Vol.9, p.671, 2000]. Поэтому понятно, что фармацевтическая композиция настоящего изобретения как нестероидный противовоспалительный агент, может также использоваться при лечении этих заболеваний.
Фармацевтическая композиция настоящего изобретения может применяться в форме взрослой дозировки от 1 мг/день до 1000 мг/день соединения формулы 1 или его нетоксичной соли. Адекватную дозировку определяют в зависимости от степени серьезности заболевания.
Фармацевтическая композиция настоящего изобретения может вводиться в виде таблетки, шипучей таблетки, капсулы, гранулы, порошка, таблетки с пролонгированным действием, капсул с замедленным высвобождением (одинарная единица состава или кратная единица состава), внутривенного и внутримышечного инъекционного раствора, раствора инъекции, суспензии или свечи или в других подходящих формах дозировки.
Формы фармацевтических доз с замедленным высвобождением содержат активные ингредиенты с или без начальной загрузочной дозы. Они представляют собой полностью или частично формы фармацевтических доз с замедленным высвобождением, с контролируемым вводом активных ингредиентов.
Предпочтительно, фармацевтическая композиция применяется перорально.
Фармацевтическая композиция, кроме того, включает фармацевтически приемлемый инертный наполнитель и/или разбавитель, и/или адъювант в фармацевтически эффективных количествах.
Примеры инертного наполнителя и адъюванта включают желатин, натуральный сахар, такой как сахароза и лактоза, лецитин, пектин, крахмал, такой как кукурузный крахмал и амилозу, циклодекстрин и производную циклодекстрина, декстран, поливинилпирролидон, поливинилацетат, гуммиарабик, аргининовую кислоту, ксилозу, тальк, салициловую кислоту, гидрофосфат кальция, целлюлозу, производную целлюлозы, такую как метилцеллюлоза, метоксипропилцеллюлоза, гидроксипропилметилцеллюлоза и фталат гидроксипропилметилцеллюлозы, жирные кислоты, имеющие от 12 до 22 атомов углерода, эмульгирующий агент, масло и жир, в частности, растительный эфир глицерина и эфир полиглицерина насыщенных жирных кислот, одноатомный спирт, многоатомный спирт, полигликоль, такой как полиэтиленгликоль, алифатический спирт, имеющий от 1 до 20 атомов углерода или алифатически насыщенный или сложный эфир ненасыщенной жирной кислоты, имеющий от 2 до 22 атомов углерода с многоатомными спиртами, такими как гликоль, глицерин, диэтиленгликоль, 1,2 пропиленгликоль, сорбит и маннит.
Другие подходящие адъюванты включают разрыхлитель. Примеры разрыхлителей включают перекрестно-сшитый поливинилпирролидон, карбоксиметильный натриевый крахмал, натриевую соль карбоксиметилцеллюлозы и микрокристаллическую целлюлозу. Может также использоваться агент для покрытия таблетки, который традиционно используется в этой области. Примеры агента для покрытия таблетки включают акриловую кислоту и/или метакриловую кислоту и/или эфирный полимер или его сополимер, зеин, этилцеллюлозу, сукцинат этилцеллюлозы и шеллак.
Пластификаторы, подходящие для агента покрытия таблетки, представляют собой эфир лимонной кислоты и эфир винной кислоты, глицерин и эфир глицерина, или полиэтиленгликоль с различными длинами цепи.
Жидкая композиция, такая как раствор и суспензия, готовится в воде или физиологически приемлемом органическом растворителе, таком как этиловый спирт и алифатический спирт.
Жидкая фармацевтическая композиция может, кроме того, включать консервант, такой как сольват калия, метил-4-гидроксибензоат и пропил-4-гидроксибензоат, антиоксидант, такой как аскорбиновая кислота и ароматизатор, такой как мятное масло.
Кроме того, при составе жидкой фармацевтической композиции может использоваться обычный солюбилизирующий агент или эмульгатор, такой как поливинилпирролидон и полисольват 80.
Другие примеры подходящих инертных наполнителей и адъювентов раскрыты в Dr.H.P. Fielder, "Lexikon der Hilfsstoffe fur Pharmazie, Kosmetik und angrenzende Gebiete" [Энциклопедия вспомогательных средств для фармацевтики, косметики и связанных областей].
В дальнейшем, настоящее изобретение будет описано более конкретно на примерах. Однако последующие примеры представлены только для иллюстраций и, таким образом, настоящее изобретение не ограничено указанными примерами.
Пример 1
N-(4-Метилсульфанилфенил)трифторацетамидразон
Формула 8

Гидрохлорид 4-метилсульфанилфенилгидразина (1,0 г (5,24 ммоль)) растворяют в 40 мл смеси растворителей 1:1 метанола и тетрагидрофурана и по каплям добавляют 0,80 мл (5,76 ммоль) триэтиламина. Реакционную смесь перемешивают при комнатной температуре в течение 30 минут и по каплям добавляют 0,90 г (6,81 ммоль) 85% трехфтористый ацетимидин. Реакционную смесь перемешивают при комнатной температуре в течение 24 часов. Когда реакция полностью завершена, в реакционную смесь добавляют воду и этилацетат. Водный слой дважды экстрагируют этилацетатом. Объединенный органический слой один раз промывают насыщенным раствором хлорида натрия, сушат над безводным сульфатом магния и фильтруют при пониженном давлении. Полученный сырой продукт очищают с помощью флеш-хроматографии на колонке (смесь этилацетат/н-гексан = 2/8), что дает 0,88 г названного соединения в виде жидкости (выход 67%).
1H-ЯМР (400 МГц, CDCl3): δ 2,55 (с, 3Н), 5,45 (с, 2Н, уширенный), 7,40 (д, 2Н, J=8,0 Гц), 7,60 (д, 2Н, J=8,0 Гц), 9,70 (с, 1Н).
Пример 2
N-(5-Метансульфонилпиридин-2-ил)трифторацетамидразон
Формула 9

205 мг (выход 54%) названного соединения в виде твердого вещества получают в соответствии с методикой, аналогичной методике получения соединения в примере 1, за исключением того, что используют 300 мг (1,34 ммоль) гидрохлорида 5-метансульфонилпиридин-2-ил гидразина, вместо гидрохлорида метилсульфанилфенилгидразина.
1Н-ЯМР (400 МГц, CDCl3): δ 2,90 (с, 3Н), 5,65 (с, 2Н, уширенный), 6,95 (дд, 1Н, J1=9,0 Гц, J2=2,8 Гц), 7,80 (дд, 1Н, J1=9,0 Гц, J2=2,0 Гц), 9,70 (д, 1Н, J=2,8 Гц), 9,75 (с, 1Н).
Пример 3
N-(2-Метансульфонилпиридин-5-ил)трифторацетамидразон
Формула 10

194 мг (выход 51%) названного соединения в виде твердого вещества получают в соответствии с методикой, аналогичной методике получения соединения в примере 1, за исключением того, что используют 300 мг (1,34 ммоль) гидрохлорида 2-метансульфонилпиридин-5-ил гидразина, вместо гидрохлорида 4-метилсульфанилфенилгидразина.
1Н-ЯМР (400 МГц, CDCl3): δ 3,35 (с, 3Н), 5,65 (с, 2Н, уширенный), 6,95 (дд, 1Н, J1=9,0 Гц, J2=2,8 Гц), 7,80 (дд, 1Н, J1=9,0 Гц, J2=2,0 Гц), 9,70 (д, 1Н, J=2,8 Гц), 9,75 (с, 1Н).
Пример 4
N-(6-Метансульфонилпиридазин-3-ил)трифторацетамидразон
Формула 11

0,8 г (выход 64%) названного соединения в виде твердого вещества получают в соответствии с методикой, аналогичной методике получения соединения в примере 1, за исключением того, что используют 1,0 г (4,45 ммоль) гидрохлорида 6-метансульфонилпиридазин-3-ил-гидразина, вместо гидрохлорида 4-метилсульфанилфенилгидразина.
1H-ЯМР (400 МГц, CDCl3): δ 3,45 (с, 3Н), 7,15 (с, 2Н, уширенный), 7,45 (д, 1Н, J=9.5 Гц), 8,00 (д. 1Н, J=9,5 Гц), 10,80 (с, 1Н).
Пример 5
N-(4-Сульфонамидофенил)трифторацетамидразон
Формула 12

0,9 г (выход 68%) названного соединения в виде твердого вещества получают в соответствии с методикой, аналогичной методике получения соединения в примере 1, за исключением того, что используют 1,0 г (4,47 ммоль) гидрохлорида 4-гидразинбензолсульфонамида, вместо гидрохлорида 4-метилсульфанилфенилгидразина.
1Н-ЯМР (400 МГц, CDCl3): δ 5,45 (с, 2Н, уширенный), 7,31 (с, 2Н), 7,40 (д, 2Н, J=8,0 Гц), 7,60 (д, 2Н, J=8,0 Гц), 9,70 (с, 1Н).
Пример 6
1-(4-Метилсульфанилфенил)-5-п-толил-3-трифторметил-1Н-[1,2,4]триазол
Формула 13
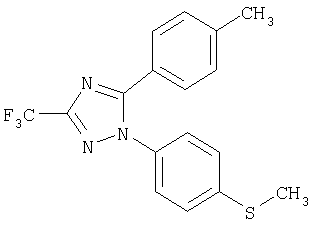
220 мг (0,88 ммоль) N-(4-метилсульфанилфенил)трифторацетамидразона растворяют в 5 мл 1,4-диоксана и по каплям добавляют 0,08 мл (0,97 ммоль) пиридина. Реакционную смесь перемешивают при комнатной температуре в течение 10 минут и по каплям добавляют 150 мг (0,97 ммоль) п-толуоилхлорида. Реакционную смесь перемешивают при температуре кипения с обратным холодильником в течение 24 часов. Когда реакция полностью завершена, реакционную смесь охлаждают до комнатной температуры и туда добавляют воду и этилацетат. Водный слой дважды экстрагируют этилацетатом. Объединенный органический слой один раз промывают насыщенным раствором хлорида натрия и сушат над безводным сульфатом магния и фильтруют при пониженном давлении. Полученный сырой продукт очищают с помощью флеш-хроматографии на колонке (смесь этилацетат/н-гексан = 2:8), что дает 210 мг названного соединения в виде масла (выход 65%).
1Н-ЯМР (400 МГц, CDCl3): δ 2,35 (с, 3Н), 2,55 (с, 3Н), 7,15 (д, 2Н, J=8,0 Гц), 7,20-7,30 (м, 4Н), 7,45 (д, 2Н, J=8,0 Гц).
Пример 7
1-(4-Метилсульфанилфенил)-5-фенил-3-трифторметил-1Н-[1,2,4]триазол
Формула 14
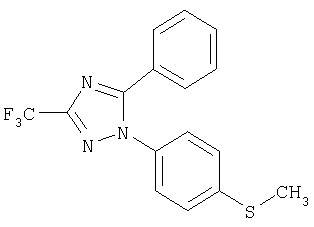
210 мг (выход 71%) названного соединения в виде масла получают в соответствии с методикой, аналогичной методике получения соединения в примере 6, за исключением того, что используют 140 мг (0,97 ммоль) бензоилхлорида, вместо п-толуоилхлорида. Названное соединение используют на следующей стадии без дальнейшей очистки.
Пример 8
5-(4-Хлорфенил)-1-(4-метилсульфанилфенил)-3-трифторметил-1Н-[1,2,4]триазол
Формула 15

210 мг (выход 65%) названного соединения в виде масла получают в соответствии с методикой, аналогичной методике получения соединения в примере 6, за исключением того, что используют 170 мг (0,97 ммоль) 4-хлорбензоилхлорида, вместо п-толуоилхлорида. Названное соединение используют на следующей стадии без дальнейшей очистки или идентификации.
Пример 9
5-(4-Бромфенил)-1-(4-метилсульфанилфенил)-3-трифторметил-1Н-[1,2,4]триазол
Формула 16

280 мг (выход 76%) названного соединения в виде масла получают в соответствии с методикой, аналогичной методике получения соединения в примере 6, за исключением того, что используют 213 мг (0,97 ммоль) 4-бромбензоилхлорида, вместо п-толуоилхлорида. Названное соединение используют на следующей стадии без дальнейшей очистки или идентификации.
Пример 10
1-(4-Метилсульфанилфенил)-5-(4-метоксифенил)-3-трифторметил-1Н-[1,2,4]триазол
Формула 17

203 мг (выход 69%) названного соединения в виде масла получают в соответствии с методикой, аналогичной методике получения соединения в примере 6, за исключением того, что используют 165 мг (0,97 ммоль) п-анизоилхлорида, вместо п-толуоилхлорида. Названное соединение используют на следующей стадии без дальнейшей очистки или идентификации.
Пример 11
5-(3-Бромфенил)-1-(4-метилсульфанилфенил)-3-трифторметил-1Н-[1,2,4]триазол
Формула 18

280 мг (выход 76%) названного соединения в виде масла получают в соответствии с методикой, аналогичной методике получения соединения в примере 6, за исключением того, что используют 213 мг (0,97 ммоль) 3-бромбензоилхлорида, вместо п-толуоилхлорида. Названное соединение используют на следующей стадии без дальнейшей очистки или идентификации.
Пример 12
5-(3-Хлорфенил)-1-(4-метилсульфанилфенил)-3-трифторметил-1Н- [1,2,4]триазол
Формула 19
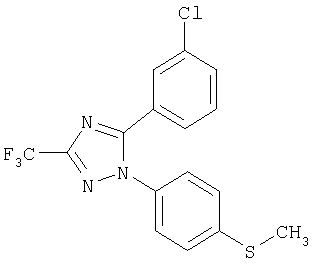
182 мг (выход 72%) названного соединения в виде масла получают в соответствии с методикой, аналогичной методике получения соединения в примере 6, за исключением того, что используют 170 мг (0,97 ммоль) 3-хлорбензоилхлорида, вместо п-толуоилхлорида. Названное соединение используют на следующей стадии без дальнейшей очистки или идентификации.
Пример 13
5-(3-Трифторметилфенил)-1-(4-метилсульфанилфенил)-3-трифторметил-1Н-[1,2,4]триазол
Формула 20

209 мг (выход 64%) названного соединения в виде масла получают в соответствии с методикой, аналогичной методике получения соединения в примере 6, за исключением того, что используют 202 мг (0,97 ммоль) 3-трифторметилбензоилхлорида, вместо п-толуоилхлорида. Названное соединение используют на следующей стадии без дальнейшей очистки или идентификации.
Пример 14
5-(2,4-Диметоксифенил)-1-(4-метилсульфанилфенил)-3-трифторметил-1Н-[1,2,4]триазол
Формула 21

188 мг (выход 54%) названного соединения в виде масла получают в соответствии с методикой, аналогичной методике получения соединения в примере 6, за исключением того, что используют 195 мг (0,97 ммоль) 2,4-диметоксибензоилхлорида, вместо п-толуоилхлорида. Названное соединение используют на следующей стадии без дальнейшей очистки или идентификации.
Пример 15
5-Стирил-1-(4-метилсульфанилфенил)-3-трифторметил-1Н-[1,2,4]триазол
Формула 22
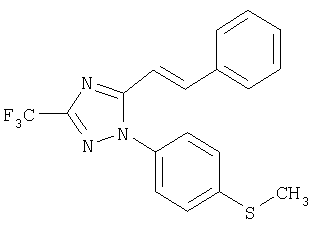
232 мг (выход 73%) названного соединения в виде масла получают в соответствии с методикой, аналогичной методике получения соединения в примере 6, за исключением того, что используют 161 мг (0,97 ммоль) цинамоилхлорида, вместо п-толуоилхлорида. Названное соединение используют на следующей стадии без дальнейшей очистки или идентификации.
Пример 16
5-[2-(4-Метоксифенил)винил]-1-(4-метилсульфанилфенил)-3-трифторметил-1Н-[1,2,4]триазол
Формула 23

189 мг (выход 55%) названного соединения в виде масла получают в соответствии с методикой, аналогичной методике получения соединения в примере 6, за исключением того, что используют 191 мг (0,97 ммоль) 4-метоксицинамоилхлорида, вместо п-толуоилхлорида. Названное соединение используют на следующей стадии без дальнейшей очистки или идентификации.
Пример 17
5-(4-Этоксифенил)-1-(4-метилсульфанилфенил)-3-трифторметил-1Н-[1,2,4]триазол
Формула 24
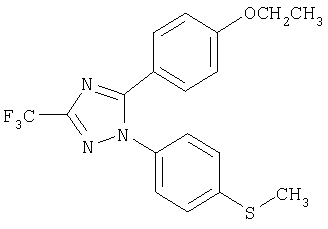
243 мг (выход 73%) названного соединения в виде масла получают в соответствии с методикой, аналогичной методике получения соединения в примере 6, за исключением того, что используют 181 мг (0,97 ммоль) 4-этоксибензоилхлорида, вместо п-толуоилхлорида. Названное соединение используют на следующей стадии без дальнейшей очистки или идентификации.
Пример 18
5-(4-Трет-бутилфенил)-1-(4-метилсульфанилфенил)-3-трифторметил-1Н-[1,2,4]триазол
Формула 25

282 мг (выход 82%) названного соединения в виде масла получают в соответствии с методикой, аналогичной методике получения соединения в примере 6, за исключением того, что используют 193 мг (0,97 ммоль) 4-трет-бутилбензоилхлорида, вместо п-толуоилхлорида. Названное соединение используют на следующей стадии без дальнейшей очистки или идентификации.
Пример 19
5-(4-Цианофенил)-1-(4-метилсульфанилфенил)-3-трифторметил-1Н-[1,2,4]триазол
Формула 26
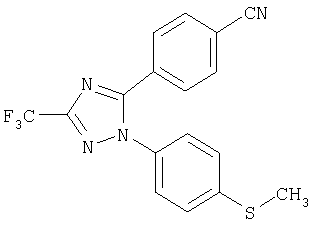
165 мг (выход 52%) названного соединения в виде масла получают в соответствии с методикой, аналогичной методике получения соединения в примере 6, за исключением того, что используют 163 мг (0,97 ммоль) 4-цианобензоилхлорида, вместо п-толуоилхлорида. Названное соединение используют на следующей стадии без дальнейшей очистки или идентификации.
Пример 20
5-(4-Нитро-2-хлорфенил)-1-(4-метилсульфанилфенил)-3-трифторметил-1Н-[1,2,4]триазол
Формула 27

248 мг (выход 68%) названного соединения в виде масла получают в соответствии с методикой, аналогичной методике получения соединения в примере 6, за исключением того, что используют 213 мг (0,97 ммоль) 4-нитро-2-хлорбензоилхлорида, вместо п-толуоилхлорида. Названное соединение используют на следующей стадии без дальнейшей очистки или идентификации.
Пример 21
5-(3-Хлор-4-метоксифенил)-1-(4-метилсульфанилфенил)-3-трифторметил-1Н-[1,2,4]триазол
Формула 28
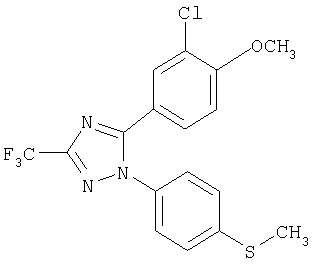
215 мг (выход 61%) названного соединения в виде масла получают в соответствии с методикой, аналогичной методике получения соединения в примере 6, за исключением того, что используют 200 мг (0,97 ммоль) 3-хлор-4-метоксибензоилхлорида, вместо п-толуоилхлорида. Названное соединение используют на следующей стадии без дальнейшей очистки или идентификации.
Пример 22
5-Бензо[1,3]диоксол-5-ил-1-(4-метилсульфанилфенил)-3-трифторметил-1Н-[1,2,4]триазол
Формула 29

206 мг (выход 59%) названного соединения в виде масла получают в соответствии с методикой, аналогичной методике получения соединения в примере 6, за исключением того, что используют 180 мг (0,97 ммоль) бензо[1,3]диоксол-5-ил карбонилхлорида, вместо п-толуоилхлорида. Названное соединение используют на следующей стадии без дальнейшей очистки или идентификации.
Пример 23
4-[2-(4-Метилсульфанилфенил)-5-трифторметил-2Н-[1,2,4]триазол-3-ил]пиридин
Формула 30

121 мг (выход 41%) названного соединения в виде масла получают в соответствии с методикой, аналогичной методике получения соединения в примере 6, за исключением того, что используют 138 мг (0,97 ммоль) изоникотинилхлорида, вместо п-толуоилхлорида. Названное соединение используют на следующей стадии без дальнейшей очистки или идентификации.
Пример 24
1-(4-Метансульфонилфенил)-5-п-толил-3-трифторметил-1Н-[1,2,4]триазол
Формула 31

310 мг (0,89 ммоль) 1-(4-метилсульфанилфенил)-5-п-толил-3-трифтор-1Н-[1,2,4]триазола растворяют в смеси растворителя дихлорметана (10 мл) и метанола (2 мл) и медленно по каплям добавляют 710 мг (1,16 ммоль) 80% ММРР. Реакционную смесь перемешивают при комнатной температуре в течение 8 часов. Когда реакция полностью завершена, реакционную смесь фильтруют. Фильтрат промывают гидрокарбонатом натрия и насыщенным раствором хлорида натрия (1х каждый), сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Полученный сырой продукт очищают с помощью флеш-хроматографии на колонке (смесь этилацетат/н-гексан = 7:3), что дает 308 мг (выход 91%) названного соединения в виде твердого вещества.
1Н-ЯМР (400 МГц, CDCl3): δ 2,45 (с, 3Н), 3,15 (с, 3Н), 7,23 (д, 2Н, J=8,2 Гц), 7,38 (д, 2Н, J=8,2 Гц), 7,63 (д, 2Н, J=8,7 Гц), 8,03 (д, 2Н, J=8,7 Гц).
Температура плавления: 176-178°С.
Пример 25
1-(4-Метансульфонилфенил)-5-фенил-3-трифторметил-1Н-[1,2,4]триазол
Формула 32

283 мг (выход 86%) названного соединения в виде твердого вещества получают в соответствии с методикой, аналогичной методике получения соединения в примере 24, за исключением того, что используют 300 мг (0,89 ммоль) 1-(4-метилсульфанилфенил)-5-фенил-3-трифтор-1Н-[1,2,4]триазола, вместо 1-(4-метилсульфанилфенил)-5-п-толил-3-трифтор-1Н-[1,2,4]триазола.
1Н-ЯМР (400 МГц, CDCl3): δ 3,15 (с, 3Н), 7,42-7,48 (м, 2Н), 7,50-7,55 (м, 3Н), 7,63 (д, 2Н, J=8,6 Гц), 8,03 (д, 2Н, J=8,6 Гц).
Температура плавления: 153-154°С.
Пример 26
5-(4-Хлорфенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол
Формула 33

294 мг (выход 82%) названного соединения в виде твердого вещества получают в соответствии с методикой, аналогичной методике получения соединения в примере 24, за исключением того, что используют 330 мг (0,89 ммоль) 5-(4-хлорфенил)-1-(4-метилсульфанилфенил)-3-трифтор-1Н-[1,2,4]триазол, вместо 1-(4-метилсульфанилфенил)-5-п-толил-3-трифтор-1Н-[1,2,4]триазола.
1H-ЯМР (400 МГц, CDCl3): δ 3,15 (с, 3Н), 7,40-7,50 (м, 4Н), 7,60 (д, 2Н, J=6,7 Гц), 8,03 (д, 2Н, J=6,7 Гц).
Температура плавления: 190-192°С.
Пример 27
5-(4-Бромфенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н- [1,2,4]триазол
Формула 34

365 мг (выход 92%) названного соединения в виде твердого вещества получают в соответствии с методикой, аналогичной методике получения соединения в примере 24, за исключением того, что используют 370 мг (0,89 ммоль) 5-(4-бромфенил)-1-(4-метилсульфанилфенил)-3-трифтор-1Н-[1,2,4]триазола, вместо 1-(4-метилсульфанилфенил)-5-п-толил-3-трифтор-1Н-[1,2,4]триазола.
1Н-ЯМР (400 МГц, CDCl3): δ 3,15 (с, 3Н), 7,35 (д, 2Н, J=8,5 Гц), 7,50-7,60 (м, 4Н), 8,03 (д, 2Н, J=6,3 Гц).
Температура плавления: 198-199°С.
Пример 28
1-(4-Метансульфонилфенил)-5-(4-метоксифенил)-3-трифторметил-1Н-[1,2,4]триазол
Формула 35
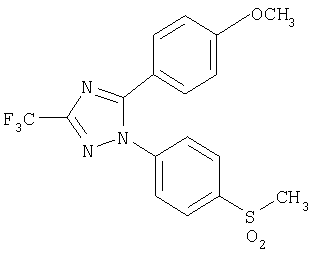
300 мг (выход 85%) названного соединения в виде твердого вещества получают в соответствии с методикой, аналогичной методике получения соединения в примере 24, за исключением того, что используют 325 мг (0,89 ммоль) 1-(4-метилсульфанилфенил)-5-(4-метоксифенил)-3-трифтор-1Н-[1,2,4]триазола, вместо 1-(4-метилсульфанилфенил)-5-п-толил-3-трифтор-1 Н-[1,2,4]триазола.
1Н-ЯМР (400 МГц, CDCl3): δ 3,15 (с, 3Н), 3,90 (с, 3Н), 6,90 (д, 2Н, J=6,9 Гц), 7,35 (д, 2Н, J=6,9 Гц), 7,65 (д, 2Н, J=8,7 Гц), 8,03 (д, 2Н, J=8,7 Гц).
Температура плавления: 155-156°С.
Пример 29
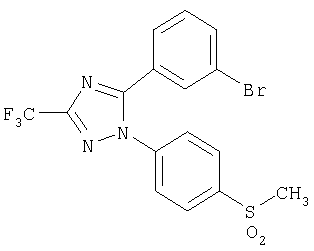
5-(3-Бромфенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол.
Формула 36
365 мг (выход 92%) названного соединения в виде твердого вещества получают в соответствии с методикой, аналогичной методике получения соединения в примере 24, за исключением того, что используют 370 мг (0,89 ммоль) 5-(3-бромфенил)-1-(4-метилсульфанилфенил)-3-трифтор-1Н-[1,2,4]триазола, вместо 1-(4-метилсульфанилфенил)-5-п-толил-3-трифтор-1H-[1,2,4]триазола.
1H-ЯМР (400 МГц, CDCl3): δ 3,15 (с, 3Н), 7,35-7,72 (м, 6Н), 7,92 (д, 2Н, J=8,7 Гц).
Температура плавления: 195-196°С.
Пример 30
5-(3-Хлорфенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол
Формула 37
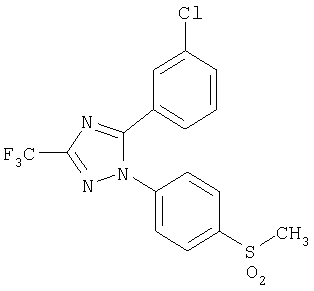
326 мг (выход 91%) названного соединения в виде твердого вещества получают в соответствии с методикой, аналогичной методике получения соединения в примере 24, за исключением того, что используют 330 мг (0,89 ммоль) 5-(3-хлорфенил)-1-(4-метилсульфанилфенил)-3-трифтор-1Н-[1,2,4]триазола, вместо 1-(4-метилсульфанилфенил)-5-п-толил-3-трифтор-1Н-[1,2,4]триазола.
1Н-ЯМР (400 МГц, CDCl3): δ 3,11 (с, 3Н), 7,00 (д, 1Н, J=9,0 Гц), 7,28 (м, 1Н), 7,35 (д, 1Н, J=9,0 Гц), 7,62 (с, 1Н), 7,64 (д, 2Н, J=9,2 Гц), 8,09 (д, 2Н, J=9,2 Гц).
Температура плавления: 188-190°С.
Пример 31
5-(3-Трифторметилфенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол
Формула 38
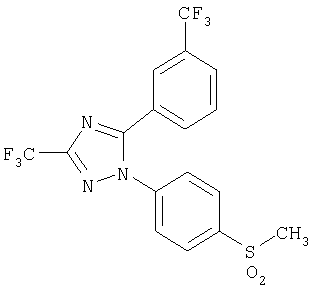
340 мг (выход 88%) названного соединения в виде твердого вещества получают в соответствии с методикой, аналогичной методике получения соединения в примере 24, за исключением того, что используют 360 мг (0,89 ммоль) 5-(3-трифторметилфенил)-1-(4-метилсульфанилфенил)-3-трифтор-1Н-[1,2,4]триазола, вместо 1-(4-метилсульфанилфенил)-5-п-толил-3-трифтор-1Н-[1,2,4]триазола.
1Н-ЯМР (400 МГц, CDCl3): δ 3,10 (с, 3Н), 7,56 (м, 1Н), 7,61-7,64 (м, 3Н), 7,79 (д, 1H, J=4,0 Гц), 7,86 (с, 1Н), 8,09 (д, 2Н, J=8,8 Гц).
Температура плавления: 135-137°С.
Пример 32
5-(2,4-Диметоксифенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол
Формула 39

357 мг (выход 94%) названного соединения в виде твердого вещества получают в соответствии с методикой, аналогичной методике получения соединения в примере 24, за исключением того, что используют 350 мг (0,89 ммоль) 5-(2,4-диметоксифенил)-1-(4-метилсульфанилфенил)-3-трифтор-1Н-[1,2,4]триазола, вместо 1-(4-метилсульфанилфенил)-5-п-толил-3-трифтор-1Н-[1,2,4]триазола.
1Н-ЯМР (400 МГц, CDCl3): δ 3,11 (с, 3Н), 3,26 (с, 3Н), 3,84 (с, 3Н), 6,34 (д, 1Н, J=2,4 Гц), 6,66 (дд, 1Н, J=8,4 Гц, J=2,4 Гц), 7,58 (д, 1Н, J=8,4 Гц), 7,69 (д, 2Н, J=8,8 Гц), 7,98 (д, 2Н, J=8,8 Гц).
Температура плавления: 110-112°С.
Пример 33
5-Стирил-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол
Формула 40
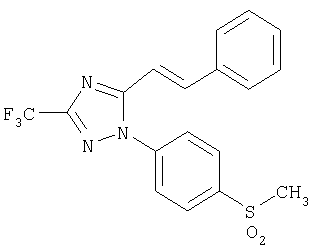
287 мг (выход 82%) названного соединения в виде твердого получают в соответствии с методикой, аналогичной методике получения соединения в примере 24, за исключением того, что используют 320 мг (0,89 ммоль) 5-стирил-1-(4-метилсульфанилфенил)-3-трифтор-1Н-[1,2,4]триазола, вместо 1-(4-метилсульфанилфенил)-5-п-толил-3-трифтор-1Н-[1,2,4]триазола.
1Н-ЯМР (400 МГц, CDCl3): δ 3,15 (с, 3Н), 6,83 (д, 1H, J=15,9 Гц), 7,39-7,41 (м, 3Н), 7,52-7,54 (м, 2Н), 7,82 (д, 2Н, J=8,6 Гц), 8,01 д, 1Н, J=15,9 Гц), 8,21 (д, 2Н, J=8,6 Гц).
Температура плавления: 168-170°С.
Пример 34
5-[2-(4-Метоксифенил)винил]-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол
Формула 41
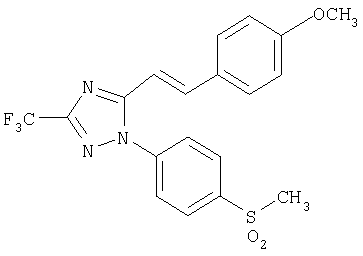
340 мг (выход 91%) названного соединения в виде твердого вещества получают в соответствии с методикой, аналогичной методике получения соединения в примере 24, за исключением того, что используют 378 мг (0,89 ммоль) 5-[2-(4-метоксифенил)винил]-1-(4-метилсульфанилфенил)-3-трифторметил-1Н-[1,2,4]триазола, вместо 1-(4-метилсульфанилфенил)-5-п-толил-3-трифтор-1Н-[1,2,4]триазола.
1H-ЯМР (400 МГц, CDCl3): δ 3,17 (с, 3Н), 3,85 (с, 3H), 6,75 (д, 1Н, J=15,9 Гц), 6,96 (д, 2Н, J=8,7 Гц), 7,50 (д, 2Н, J=8,7 Гц), 7,82 (д, 2Н, J=8,6 Гц), 7,95 (д, 1Н, J=15,9 Гц), 8,21 (д, 2Н, J=8,6 Гц).
Пример 35
5-(4-Этоксифенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол
Формула 42

300 мг (выход 82%) названного соединения в виде твердого вещества получают в соответствии с методикой, аналогичной методике получения соединения в примере 24, за исключением того, что используют 337 мг (0,89 ммоль) 5-(4-этоксифенил)-1-(4-метилсульфанилфенил)-3-трифторметил-1Н-[1,2,4]триазола, вместо 1-(4-метилсульфанилфенил)-5-п-толил-3-трифтор-1Н-[1,2,4]триазола.
1Н-ЯМР (400 МГц, CDCl3): δ 1,45 (т, 3Н, J=7,0 Гц), 3,15 (с, 3Н), 4,10 (д, 2H, J=7,0 Гц), 6,91 (д, 2H, J=8,9 Гц), 7,45 (д, 2H, J=8,9 Гц), 7,65 (д, 2H, J=8,7 Гц), 8,05 (д, 2H, J=8,7 Гц).
Температура плавления: 152-154°С.
Пример 36
5-(4-трет-Бутилфенил)-1-(4-метансульфонилфенил)-3-трифторметил-1 Н-[1,2,4]триазол
Формула 43

343 мг (выход 91%) названного соединения в виде твердого вещества получают в соответствии с методикой, аналогичной методике получения соединения в примере 24, за исключением того, что используют 348 мг (0,89 ммоль) 5-(4-трет-бутилфенил)-1-(4-метилсульфанилфенил)-3-трифторметил-1Н-[1,2,4]триазола, вместо 1-(4-метилсульфанилфенил)-5-п-толил-3-трифтор-1Н-[1,2,4]триазола.
1Н-ЯМР (400 МГц, CDCl3): δ 1,30 (с, 9Н), 3,15 (с, 3Н), 7,40-7,50 (м, 4Н), 7,68 (д, 2Н, J=9,0 Гц), 8,08 (д, 2Н, J=9,0 Гц).
Температура плавления: 81-82°С.
Пример 37
5-(4-Цианофенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол
Формула 44

320 мг (выход 92%) названного соединения в виде твердого вещества получают в соответствии с методикой, аналогичной методике получения соединения в примере 24, за исключением того, что используют 320 мг (0,89 ммоль) 5-(4-цианофенил)-1-(4-метилсульфанилфенил)-3-трифторметил-1Н-[1,2,4]триазола, вместо 1-(4-метилсульфанилфенил)-5-п-толил-3-трифтор-1Н-[1,2,4]триазола.
1Н-ЯМР (400 МГц, CDCl3): δ 3,15 (с, 3Н), 7,64 (д, 2Н, J=8,8 Гц), 7,68 (д, 2Н, J=8,8 Гц), 7,75 (д, 2Н, J=8,7 Гц), 8,13 (д, 2Н, J=8,7 Гц).
Температура плавления: 109-111°С.
Пример 38
5-(4-Нитро-2-хлорфенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол
Формула 45

314 мг (выход 79%) названного соединения в виде твердого вещества получают в соответствии с методикой, аналогичной методике получения соединения в примере 24, за исключением того, что используют 369 мг (0,89 ммоль) 5-(4-нитро-2-хлорфенил)-1-(4-метилсульфанилфенил)-3-трифторметил-1Н-[1,2,4]триазола, вместо 1-(4-метилсульфанилфенил)-5-п-толил-3-трифтор-1Н-[1,2,4]триазола.
1H-ЯМР (400 МГц, CDCl3): δ 3,15 (с, 3Н), 7,51 (д, 2Н, J=8,6 Гц), 7,83 (д, 1Н, J=9,0 Гц), 7,97 (д, 2Н, J=8,6 Гц), 8,29 (д, 1Н, J=9,0 Гц), 8,32 (c, 1Н).
Температура плавления: 110-111°С.
Пример 39
5-(3-Хлор-4-метоксифенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол
Формула 46

319 мг (выход 83%) названного соединения в виде твердого вещества получают в соответствии с методикой, аналогичной методике получения соединения в примере 24, за исключением того, что используют 356 мг (0,89 ммоль) 5-(3-хлор-4-метоксифенил)-1-(4-метилсульфанилфенил)-3-трифторметил-1Н-[1,2,4]триазола, вместо 1-(4-метилсульфанилфенил)-5-п-толил-3-трифтор-1Н-[1,2,4]триазола.
1H-ЯМР (400 МГц, CDCl3): δ 3,15 (с, 3Н), 3,95 (с, 3Н), 6,90 (д, 1Н, J=8,6 Гц), 7,25 (дд, 1Н, J1=8,6 Гц, J2=2,5 Гц), 7,75 (дд, 2Н, J1=6,8 Гц, J2=2,0 Гц), 7,76 (д, 1Н, J=2,5 Гц), 8,08 (дд, 2Н, J1=8,6 Гц, J2=2,0 Гц).
Пример 40
5-Бензо[1,3]диоксол-5-ил-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазол
Формула 47

322 мг (выход 88%) названного соединения в виде твердого вещества получают в соответствии с методикой, аналогичной методике получения соединения в примере 24, за исключением того, что используют 337 мг (0,89 ммоль) 5-бензо[1,3]диоксол-5-ил-1-(4-метилсульфанилфенил)-3-трифторметил-1Н-[1,2,4]триазола, вместо 1-(4-метилсульфанилфенил)-5-п-толил-3-трифтор-1Н-[1,2,4]триазола.
1Н-ЯМР (400 МГц, CDCl3): δ 3,15 (с, 3Н), 6,05 (с, 2Н), 6,82 (д, 1Н, J=7,5 Гц), 6,97-7,02 (м, 2Н), 7,65 (д, 2Н, J=8,6 Гц), 8,05 (д, 2Н, J=8,6 Гц).
Пример 41
4-[2-(4-Метансульфонилфенил)-5-трифторметил-2Н-[1,2,4]триазол-3-ил]пиридин
Формула 48

244 мг (выход 72%) названного соединения в виде твердого вещества получают в соответствии с методикой, аналогичной методике получения соединения в примере 24, за исключением того, что используют 299 мг (0,89 ммоль) 4-[2-(4-метилсульфанилфенил)-5-трифторметил-2Н-[1,2,4]триазол-3-ил]пиридина, вместо 1-(4-метилсульфанилфенил)-5-п-толил-3-трифтор-1Н-[1,2,4]триазола.
1Н-ЯМР (400 МГц, CDCl3): δ 3,15 (с, 3Н), 7,45 (д, 2Н, J=6,0 Гц), 7,65 (д, 2Н, J=8,0 Гц), 8,10 (д, 2Н, J=8,0 Гц), 8,75 (д, 2Н, J=6,0 Гц).
Температура плавления: 180-182°С.
Пример 42
4-(5-п-Толил-3-трифторметил-[1,2,4]триазол-1-ил)бензолсульфонамид
Формула 49

120 мг (0,32 ммоль) 1-(4-Метансульфонилфенил)-5-п-толил-3-трифтор-1Н-[1,2,4]триазола растворяют в 2 мл безводного тетрагидрофурана и температуру реакции доводят до 0°С. По каплям добавляют 0,18 мл (0.54 ммоль) 3 М раствора метилмагний хлорида в тетрагидрофуране и температуру реакции повышают до комнатной температуры. Реакционную смесь перемешивают при той же температуре в течение 3 часов. По каплям добавляют 0,9 мл (0,90 ммоль) 1 М раствора трибутилборана в тетрагидрофуране и нагревают до температуры кипения с обратным холодильником в течение 18 часов. Температуру реакции снижают до 0°С. Затем медленно добавляют раствор, в котором 150 мг (1,34 ммоль) гидроксиламина-O-сульфоновой кислоты и 2,56 мг (3,20 ммоль) натриевой соли уксусной кислоты растворены в 2 мл воды, и реакционную смесь перемешивают при комнатной температуре в течение 3 часов. Когда реакция полностью завершена, добавляют воду и этилацетат и затем перемешивают. Потом полученный раствор трижды экстрагируют этилацетатом. Объединенный органический слой один раз промывают насыщенным раствором хлорида натрия, сушат над безводным сульфатом магния, фильтруют при пониженном давлении и концентрируют при пониженном давлении. Полученный сырой продукт очищают с помощью флеш-хроматографии на колонке (смесь этилацетат/н-гексан = 7/3), что дает 63 мг (выход 52%) названного соединения в виде твердого вещества.
1H-ЯМР (400 МГц, DMSO-d6): δ 2,45 (с, 3Н), 7,20 (д, 2Н, J=8,2 Гц), 7,35 (д, 2Н, J=8,2 Гц), 7,52 (с, 2Н), 7,70 (д, 2Н, J=6,6 Гц), 7,98 (д, 2Н, J=6,6 Гц).
Температура плавления: 245-247°С.
Пример 43
4-[5-(4-Метоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]бензолсульфонамид
Формула 50
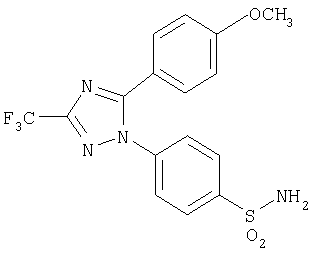
68 мг (выход 53%) названного соединения в виде твердого вещества получают в соответствии с методикой, аналогичной методике получения соединения в примере 42, за исключением того, что используют 127 мг (0,32 ммоль) 1-(4-метилсульфанилфенил)-5-(4-метоксифенил)-3-трифтор-1Н-[1,2,4]триазола, вместо 1-(4-метансульфонилфенил)-5-п-толил-3-трифтор-1Н-[1,2,4]триазола.
1Н-ЯМР (400 МГц, DMSO-d6): δ 3,85 (с, 3Н), 6,96 (д, 2Н, J=6,9 Гц), 7,45 (д, 2Н, J=6,9 Гц), 7,55 (с, 2Н), 7,75 (д, 2Н, J=8,6 Гц), 7,95 (д, 2Н, J=8,6 Гц).
Температура плавления: 251-253°С.
Пример 44
4-[5-(4-Бромфенил)-3-трифторметил-[1,2,4]триазол-1-ил]бензолсульфонамид
Формула 51

250 мг (0,88 ммоль) N-(4-сульфонамидофенил)трифторацетамидразона растворяют в 5 мл 1,4-диоксана и по каплям добавляют 0,08 мл (0,97 ммоль) пиридина. Реакционную смесь перемешивают при комнатной температуре в течение 10 минут и по каплям добавляют 212 мг (0,97 ммоль) 4-бромбензоилхлорида. Реакционную смесь нагревают до температуры кипения с обратным холодильником в течение 24 часов. Когда реакция полностью завершена, реакционную смесь охлаждают до комнатной температуры и туда добавляют воду и этилацетат. Водный слой дважды экстрагируют этилацетатом. Объединенный органический слой один раз промывают насыщенным раствором хлорида натрия, сушат над безводным сульфатом магния и фильтруют при пониженном давлении. Полученный сырой продукт очищают с помощью флеш-хроматографии на колонке (смесь этилацетат/н-гексан = 1/1), что дает 208 мг (выход 53%) названного соединения в виде масла.
1H-ЯМР (400 МГц, CDCl3): δ 4,95 (уширенный, с, 2Н), 7,39 (д, 2Н, J=8,7 Гц), 7,58-7,62 (м, 4Н), 8,05 (д, 2Н, J=8,7 Гц).
Пример 45
2-[5-(4-Бромфенил)-3-трифторметил-[1,2,4]триазол-1-ил]-5-метансульфонилпиридин
Формула 52

130 мг (0,46 ммоль) N-(5-метансульфонилпиридин-2-ил)трифторацетамидразона растворяют в 5 мл 1,4-диоксана и по каплям добавляют 0,04 мл (0,51 ммоль) пиридина. Реакционную смесь перемешивают при комнатной температуре в течение 10 минут и по каплям добавляют 115 мг (0,51 ммоль) 4-бромбензоилхлорида. Реакционную смесь перемешивают при температуре 110°С с обратным холодильником в течение 24 часов. Когда реакция полностью завершена, реакционную смесь охлаждают до комнатной температуры и туда добавляют воду и этилацетат. Водный слой дважды экстрагируют этилацетатом. Объединенный органический слой один раз промывают насыщенным раствором хлорида натрия, сушат над безводным сульфатом магния и фильтруют при пониженном давлении. Полученный сырой продукт очищают с помощью флеш-хроматографии на колонке (смесь этилацетат/н-гексан = 3:7), что дает 107 мг (выход 52%) названного соединения в виде твердого вещества.
1Н-ЯМР (400 МГц, CDCl3): δ 3,42 (с, 3Н), 7,55 (д, 2Н, J=6,7 Гц), 7,70 (д, 2Н, J=6,7 Гц), 8,15 (д, 1Н, J=8,5 Гц), 8,65 (дд, 1Н, J1=8,5 Гц, J2=2,1 Гц), 8,95 (д, 1Н, J=2,1 Гц).
Температура плавления: 143-145°С.
Пример 46
2-[5-(4-Метоксифенил)-3-трифторметил-[1.2.4]триазол-1-ил]-5-метансульфонилпиридин
Формула 53
108 мг (выход 59%) названного соединения в виде твердого вещества получают в соответствии с методикой, аналогичной методике получения соединения в примере 45, за исключением того, что используют 87 мг (0,51 ммоль) п-анизоилхлорида, вместо 4-бромбензоилхлорида.
1Н-ЯМР (400 МГц, CDCl3): δ 3,25 (с, 3Н), 3,85 (с, 3Н), 6,90 (д, 2Н, J=6,8 Гц), 7,50 (д, 2Н, J=6,7 Гц), 7,95 (д, 1Н, J=8,5 Гц), 8,45 (дд, 1Н, J1=8,5 Гц, J2=2,1 Гц), 8,95 (д, 1H, J=2,1 Гц).
Температура плавления: 138-139°С.
Пример 47
2-Метансульфонил-5-[5-(4-бромфенил)-3-трифторметил-[1,2,4]триазол-1-ил] пиридин
Формула 54

130 мг (0,46 ммоль) N-(2-метансульфонилпиридин-5-ил)трифторацетамидразона растворяют в 5 мл 1,4-диоксана и по каплям добавляют 0,04 мл (0,51 ммоль) пиридина, Реакционную смесь перемешивают при комнатной температуре в течение 10 минут и по каплям добавляют 115 мг (0,51 ммоль) 4-бромбензоилхлорида. Реакционную смесь перемешивают при температуре 110°С с обратным холодильником в течение 24 часов. Когда реакция полностью завершена, реакционную смесь охлаждают до комнатной температуры и туда добавляют воду и этилацетат. Водный слой дважды экстрагируют этилацетатом. Объединенный органический слой один раз промывают насыщенным раствором хлорида натрия, сушат над безводным сульфатом магния и фильтруют при пониженном давлении. Полученный сырой продукт очищают с помощью флеш-хроматографии на колонке (смесь этилацетат/н-гексан = 3:7), что дает 107 мг (выход 52%) названного соединения в виде твердого вещества.
1H-ЯМР (400 МГц, CDCl3): δ 3,42 (с, 3Н), 7,55 (д, 2Н, J=6,7 Гц), 7,70 (д, 2Н, J=6,7 Гц), 8,22 (д, 1Н, J=8,5 Гц), 8,55 (дд, 1Н, J1=8,5 Гц, J2=2,1 Гц), 8,95 (д, 1Н, J=2,1 Гц).
Температура плавления: 141-143°С.
Пример 48
2-Метансульфонил-5-[5-(4-метоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридин Формула 55

108 мг (выход 59%) названного соединения в виде твердого вещества получают в соответствии с методикой, аналогичной методике получения соединения в примере 47, за исключением того, что используют 87 мг (0,51 ммоль) п-анизоилхлорида, вместо 4-бромбензоилхлорида.
1H-ЯМР (400 МГц, CDCl3): δ 3,25 (с, 3Н), 3,85 (с, 3Н), 6,90 (д, 2Н, J=6,8 Гц), 7,50 (д, 2Н, J=6,7 Гц), 7,85 (д, 1Н, J=8,5 Гц), 8,35 (дд, 1Н, J1=8,5 Гц, J2=2,1 Гц), 8,90 (д, 1Н, J=2,1 Гц).
Температура плавления: 136-137°С.
Пример 49
3-[5-(4-Бромфенил)-3-трифторметил-[1,2,4]триазол-1-ил]-6-метансульфонилпиридазин
Формула 56
310 мг (1,09 ммоль) N-(6-метансульфонилпиридазин-3-ил)трифторацетамидразона растворяют в 10 мл 1,4-диоксана и по каплям добавляют 0,10 мл (1,20 ммоль) пиридина. Реакционную смесь перемешивают при комнатной температуре в течение 10 минут и по каплям добавляют 264 мг (1,20 ммоль) 4-бромбензоилхлорида. Реакционную смесь перемешивают при температуре 110°С с обратным холодильником в течение 24 часов. Когда реакция полностью завершена, реакционную смесь охлаждают до комнатной температуры и туда добавляют воду и этилацетат. Водный слой дважды экстрагируют этилацетатом. Объединенный органический слой один раз промывают насыщенным раствором хлорида натрия, сушат над безводным сульфатом магния и фильтруют при пониженном давлении. Полученный сырой продукт очищают с помощью флеш-хроматографии на колонке (смесь этилацетат/н-гексан = 3:7), что дает 220 мг (выход 45%) названного соединения в виде твердого вещества.
1H-ЯМР (400 МГц, CDCl3): δ 3,42 (с, 3Н), 7,55 (д, 2Н, J=8,5 Гц), 7,62 (д, 2Н, J=8,5 Гц), 8,38 (д, 1Н, J=9,0 Гц), 8,45 (д, 1Н, J=9,0 Гц).
Температура плавления: 174-181°С.
Пример 50
3-[5-(4-Метоксифенил)-3-трифторметил-[1.2.4]триазол-1-ил]-6-метансульфонилпиридазин
Формула 57

183 мг (выход 42%) названного соединения в виде твердого вещества получают в соответствии с методикой, аналогичной методике получения соединения в примере 49, за исключением того, что используют 205 мг (0,51 ммоль) п-анизоилхлорида, вместо 4-бромбензоилхлорида.
1Н-ЯМР (400 МГц, CDCl3): δ 3,42 (с, 3Н), 3,85 (с, 3Н), 6,85 (д, 2Н, J=6,8 Гц), 7,55 (д, 2Н, J=6,8 Гц), 8,20 (д, 1Н, J=9,1 Гц), 8,35 (д, 1Н, J=9,1 Гц).
Температура плавления: 185-186°С.
Эксперименты
1. Оценка селективной СОХ-2 ингибирующей активности
1) Способ
Чтобы фармакологически определить селективную СОХ-2 ингибирующую активность, измеряют процент ингибирования СОХ-1 и СОХ-2 соединениями по настоящему изобретению, приведенных в примерах, с помощью следующих методик.
а. Исследование СОХ-1 ингибирующей активности, используя U-937
Лимфотические клетки человека U-937 (Korean Cell Line Bank, Seoul, Korea, Accession Number: 21593) культивируют и центрифугируют. Собранные клетки разбавляют с помощью HBSS (х1, сбалансированный солевой раствор Хенкса) до концентрации 1×106 клеток/мл. 1 мл разбавленного клеточного раствора помещают в каждую лунку 12-ячеечных планшетов, 5 мкл 1 мкМ раствора тестируемого соединения в ДМСО и 5 мкл ДМСО как контроль добавляют в лунки. Лунки инкубируют в СО2 инкубаторе при температуре 37°С в течение 15 минут. Отдельно, 10 мМ сохраняемого раствора арахидоновой кислоты в этиловом спирте, разбавляют в десять раз в этаноле, чтобы получить 1 мМ раствор арахидоновой кислоты. Арахидоновая кислота действует как субстрат. Добавляют 10 мкл 1 мМ раствора арахидоновой кислоты в каждую лунку и инкубируют в CO2 инкубаторе при температуре 37°С в течение 30 минут. Клеточный раствор в каждой лунке помещают в центрифужную тестовую пробирку и центрифугируют со скоростью 10000 об/мин при температуре 4°С в течение 5 минут. Концентрацию PGE2 в собранных клетках и супернанте определяют количественно с помощью моноклонального набора (Cayman Chemicals). Рассчитывают процент ингибирования PGE2 в группе тестируемых обработанных соединением клеток, по отношению к группе клеток, обработанных ДМСО. Основываясь на рассчетных значениях оцененивают СОХ-1 ингибирующую активность.
b. Исследование СОХ-2 ингибирующей активности, используя клеточную линию RAW 264.7
2×106 клеток клеточной линии RAW 264.7 (Korean Cell Line Bank, Seoul, Korea, Accession Number. 40071) помещают в каждую из лунок 12-ячеечных планшетов. Каждый планшет обрабатывают 250 мкМ аспирина и инкубируют при температуре 37°С в течение 2 часов. После замещения культуральной среды на новую культуральную среду новую культуральную среду обрабатывают тестируемым соединением (10 нМ) и инкубируют в течение 30 минут. Затем каждую лунку обрабатывают интерфероном ((100 единиц/мл) и липолисахаридом (LPS, 100 нг/мл) и инкубируют в течение 18 часов. Культуральную среду перемещают в другие тестовые пробирки. Концентрацию PGE2 определяют количественно с помощью EIA набора (Cayman Chemicals).
2) Результаты испытаний
Результаты тестов представлены в Таблице 1 ниже. Процент ингибирования СОХ был рассчитан согласно следующему уравнению:
Процент ингибирования = (концентрация PGE2 в тестируемом необработанном образце соединения) - концентрация PGE2 в тестируемом обработанном образце соединения)/(концентрация PGE2 в тестируемом необработанном образце соединения)×100
Процент ингибирования циклооксигеназы (СОХ)
3) Оценка
Результаты тестов, полученные in vitro относительно процентов ингибирования СОХ-1 и СОХ-2, внесены в Таблицу 1.
Как показано в Таблице 1, соотношение ингибирования (%) СОХ-1 к СОХ-2 в примерах 24 и 50 были равны или выше, чем в ссылке на Вальдекоксиб. Это указывает на то, что селективное ингибирование СОХ-1 до СОХ-2 настоящим соединением то же самое или превосходит соединения по ссылке. В частности, в случае
1-(4-метансульфонилфенил)-5-(4-метоксифенил)-3-трифтор-1Н-[1,2,4]триазола из примера 28,
1-(4-метансульфонилфенил)-5-(4-этоксифенил)-3-трифтор-1Н-[1,2,4]триазола из примера 35,
5-(3-хлор-4-метоксифенил)-1-(4-метансульфонилфенил)-3-трифторметил-1H-[1,2,4]триазола из примера 39,
5-бензо[1,3]диоксол-5-ил-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазола из примера 40,
4-[5-(4-бромфенил)-3-трифторметил-[1,2,4]триазол-1-ил]бензолсульфонамида из примера 44,
2-[5-(4-бромфенил)-3-трифторметил-[1,2,4]триазол-1-ил]-5-метансульфонилпиридина из примера 45, и
2-[5-(4-метоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]-5-метансульфонилпиридина из примера 46, СОХ-2 ингибирующая активность была значительно выше по сравнению с данными ссылки. В то же самое время, СОХ-1 ингибирующая активность была аналогичной или ниже, чем в ссылке. Таким образом, следует отметить, что указанные соединения имеют превосходную селективность.
Все соединения из примеров, кроме соединений примеров 47, 49, и 50 показали СОХ-2 ингибирующую активность выше, чем в ссылке. Основываясь на этом результате, следует также отметить, что настоящее соединение снижает побочные эффекты за счет повышения селективности и улучшает эффективность при лечении лихорадки, боли и воспаления по сравнению с соединением из ссылки.
2. Тест на отек лапы крыс, вызванный каррагеном
1) Способ
За день испытания, крысы были отобраны в каждую группу так, чтобы средний вес тела был по возможности одинаковым и крыс не кормили до дня испытания. В день тестирования крысам вводили орально тестируемые соединения и контрольный продукт. Через час объем (V0h) заранее определенной части левой задней ноги крысы измеряют с помощью плетизмометра. В левую заднюю ногу крысы подкожно вводят 100 мкл 1% раствора каррагена, используя шприц, объемом 1 мл. Спустя три часа после инъекции каррагена, снова измеряют объем (V3h) заранее определенной левой задней ноги крысы. Изменения, связанные с опухолью ноги (Т3h-Т0h) в группе крыс, обработанных тестируемым соединением, сравнивают с группой крыс, обработанных контрольным продуктом. Предполагая, что процент ингибирования группы крыс, обработанных контрольным продуктом, равен 0%, определяют процент ингибирования каждого тестируемого соединения при отеке.
2) Результаты испытаний
Результаты испытаний представлены в Таблице 2 ниже.
Ингибирующий эффект (процент ингибирования) циклооксигеназы (СОХ)
3) Оценка
Результаты тестов, полученных in vitro относительно процентов ингибирования СОХ внесены в Таблицу 2.
Как показано в Таблице 2, процент ингибирования соединений в примерах с 27 по 46 против СОХ был почти тем же самым или выше, чем у Селекоксиба. Это указывает на то, что соединения настоящего изобретения имеют почти ту же самую или более высокую СОХ ингибирующую эффективность по сравнению с Селекоксибом. В частности, в случае
1-(4-метансульфонилфенил)-5-(4-этоксифенил)-3-трифтор-1Н-[1,2,4]триазола из примера 35,
4-[5-(4-метоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]бензолсульфонамида из примера 43,
4-[5-(4-бромфенил)-3-трифторметил-[1,2,4]триазол-1-ил]бензолсульфонамида из примера 44, и
2-[5-(4-метоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]-5-метансульфонилпиридина из примера 46, СОХ ингибирующая эффективность была значительно выше по сравнению с Селекоксибом.
Кроме того, все соединения из примеров, кроме соединения из примера 34, показали ту же самую или более высокую ингибирующую эффективность в отношении СОХ по сравнению с Селекоксибом. Поэтому, следует отметить, что соединения настоящего изобретения имеют лучшую эффективность при лечении лихорадки, боли и воспаления.
Промышленная применимость
Как следует из упомянутого выше описания, настоящее изобретение обеспечивает 1,2,4 триазольное производное или его нетоксичную соль, способ его получения и фармацевтическую композицию, содержащую производное или соль в качестве активного ингредиента. Фармацевтическая композиция эффективна при лечении лихорадки, боли и воспаления. В частности, в результате уменьшения побочных эффектов, вызываемых обычными нестероидными противовоспалительными агентами, фармацевтическая композиция полезна для лечения пациентов с заболеванием пептической язвы, гастритом, регионарными энтеритами, язвенными колитами, дивертикулитами, гастроррагией или гипопротромбинемией.
В то время как настоящее изобретение, в частности, раскрыто и описано со ссылкой на его типичные воплощения, среднему специалисту в данной области будет ясно, что могут быть сделаны различные изменения по форме и в деталях изобретения, без отступления от духа и области исследования настоящего изобретения, как определено в соответствии с следующей формулой изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ 5-АРИЛ-1Н-1,2,4-ТРИАЗОЛА И СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2000 |
|
RU2249588C2 |
| ТРИЦИКЛИЧЕСКИЕ АЗОТСОДЕРЖАЩИЕ ПРОИЗВОДНЫЕ ИМИДАЗО[4,5-с]ПИРИДИНА, ОБЛАДАЮЩИЕ ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ РЕЦЕПТОРА ГИСТАМИНА 4 (hH4R) | 2012 |
|
RU2628074C2 |
| ТРИАЗОЛОПИРИДИНОВЫЕ СОЕДИНЕНИЯ-ИНГИБИТОРЫ JAK И СПОСОБЫ | 2009 |
|
RU2561104C2 |
| ПРОИЗВОДНЫЕ ПИРИДИНА И ПИРИМИДИНА В КАЧЕСТВЕ АНТАГОНИСТОВ mGluR2 | 2007 |
|
RU2451673C2 |
| Трициклическое бензоксабороловое соединение, способ его получения и его применение | 2014 |
|
RU2639153C2 |
| СПОСОБ ЛЕЧЕНИЯ ВОСПАЛЕНИЯ ИЛИ СВЯЗАННОГО С ВОСПАЛЕНИЕМ ЗАБОЛЕВАНИЯ У СОБАК | 1996 |
|
RU2253456C2 |
| БЛОКАТОРЫ НАТРИЕВЫХ КАНАЛОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ | 2013 |
|
RU2645711C2 |
| ПРОИЗВОДНЫЕ 8-МЕТОКСИ[1,2,4]ТРИАЗОЛО[1,5-a]ПИРИДИНА И ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ НА ИХ ОСНОВЕ | 2002 |
|
RU2297416C2 |
| КОНДЕНСИРОВАННЫЕ ТРИАЗОЛАМИНЫ В КАЧЕСТВЕ МОДУЛЯТОРОВ Р2Х7 | 2010 |
|
RU2533122C2 |
| ПРОИЗВОДНОЕ 5-МЕТОКСИ-8-АРИЛ-[1,2,4]ТРИАЗОЛ[1,5-а]ПИРИДИНА, ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ЕГО ОСНОВЕ | 2002 |
|
RU2298009C2 |
Описывается новое триазольное производное общей формулы I

где R1 представляет собой фенильную группу, необязательно замещенную одной или двумя группами, выбранными из C1-С6 алкильной группы, C1-С6 галогеналкильной группы, C1-С6 алкоксигруппы, C1-С6 галогеналкоксигруппы, галогеновой группы, нитрогруппы или цианогруппы; стиренильную группу; C1-С6 алкоксистиренильную группу; или пиридильную группу; R2 представляет собой метильную или аминогруппу; и А и В являются углеродом; С и D независимо представляют собой углерод или азот; и его нетоксичная соль, фармацевтическая композиция на их основе, способы получения новых соединений, новые промежуточные продукты формулы
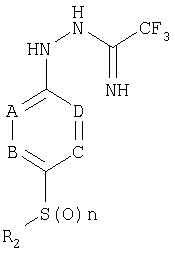
где R2, А, В, С, D имеют значения, указанные выше и n является целым числом от 0 до 2, и способ их получения. Соединения I обладают противовоспалительной активностью и потенциально могут быть использованы при лечении лихорадки, боли и воспаления. 8 н. и 1 з.п. ф-лы, 2 табл.

где R1 представляет собой фенильную группу, необязательно замещенную одной или двумя группами, выбранными из C1-С6 алкильной группы, C1-С6 галогеналкильной группы, C1-С6 алкоксигруппы, галогеновой группы, нитрогруппы или цианогруппы; стиренильную группу; C1-С6 алкоксистиренильную группу; или пиридильную группу;
R2 представляет собой метильную или аминогруппу;
А и В являются углеродом;
С и D независимо представляют собой углерод или азот,
или его нетоксичная соль.
1-(4-метансульфонилфенил)-5-фенил-3-трифторметил-1Н-[1,2,4]триазола;
5-(4-хлорфенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазола;
5-(4-бромфенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазола;
1-(4-метансульфонилфенил)-5-(4-метоксифенил)-3-трифторметил-1Н-[1,2,4]триазола;
5-(3-бромфенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазола;
5-(3-хлорфенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазола;
5-(3-трифторметилфенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазола;
5-(2,4-диметоксифенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазола;
5-(стирил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазола;
5-[2-(4-метансульфонилфенил)винил]-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазола;
5-(4-этоксифенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазола;
5-(4-тет.-бутилфенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазола;
5-(4-цианофенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазола;
5-(4-нитро-2-хлорфенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазола;
5-(4-хлор-4-метоксифенил)-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4] триазола;
5-бензо[1,3]диоксол-5-ил-1-(4-метансульфонилфенил)-3-трифторметил-1Н-[1,2,4]триазола;
4-[2-(4-метансульфонил)-5-трифторметил-2Н-[1,2,4]триазол-3-ил]пиридина;
4-(5-п-толил-3-трифторметил-[1,2,4]триазол-1-ил]бензол-сульфониламида;
4-[5-(4-метоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]бензолсульфониламида;
4-[5-(4-бромфенил)-3-трифторметил-[1,2,4]триазол-1-ил]бензолсульфониламида;
2-[5-(4-бромфенил)-3-трифторметил-[1,2,4]триазол-1-ил]-5-метансульфонилпиридина;
2-[5-(4-метоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]-5-метансульфонилпиридина;
2-метансульфонил-5-[5-(4-бромфенил)-3-трифторметил-[1,2,4]триазол-1-ил]пиридина;
2-метансульфонил-5-[5-(4-метоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]-пиридина;
3-[5-(4-бромфенил)-3-трифторметил-[1,2,4]триазол-1-ил]-6-метансульфонилпиридазина;
3-[5-(4-метоксифенил)-3-трифторметил-[1,2,4]триазол-1-ил]-6-метансульфонилпиридазина,
или его нетоксичной соли.

где R2, А, В, С, D имеют значения, определенные в п.1;
n является целым числом от 0 до 2.

или его нетоксичной соли, заключающийся в том, что амидразоновое производное формулы 4а

взаимодействует с ацилхлоридом формулы 5

в присутствии основания,
где R1, R2, А, В, С, и D имеют значения, определенные в п.1.

или его нетоксичной соли, включающий взаимодействие амидразонового производного формулы 4b

с ацилхлоридом формулы 5

в присутствии основания и окисление полученного соединения окислителем, таким, как гексагидрат монопероксифталата магния (ММРР),
где R1, R2, А, В, С, и D имеют значения, определенные в п.1, и m имеет значение 0.
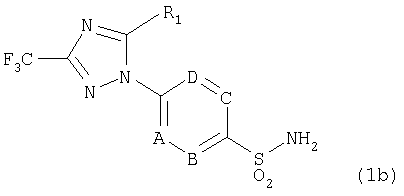
включающий взаимодействие соединения формулы 1а
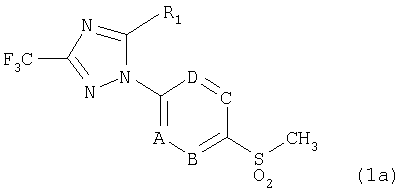
с гидроксиламином или его солью в присутствии сильного основания и кислоты Льюиса,
где R1, А, В, С, и D имеют значения, определенные в п.1.

или его нетоксичной соли, включающий взаимодействие соединения формулы 6а

с гидроксиламином или его солью в присутствии сильного основания и кислоты Льюиса и окисление полученного соединения окислителем, таким, как ММРР,
где, R1, А, В, С, и D имеют значения, определенные в п.1, и k имеет значение 0.

включающий взаимодействие производного гидразина формулы 2

с трифторацетимидином формулы 3
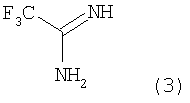
в присутствии основания,
где R2, А, В, С, и D имеют значения, определенные в п.1, и n является целым числом от 0 до 2.
| ЕР 1099695 А1, 16.05.2001 | |||
| US 5466823 А, 14.11.1995 | |||
| Гидравлическая стойка шахтной крепи | 1985 |
|
SU1273580A2 |
| ПРОИЗВОДНЫЕ ТРИАЗОЛА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ИНСЕКТИЦИДНОЕ И АКАРИЦИДНОЕ СРЕДСТВО | 1994 |
|
RU2131421C1 |
| 1-ФЕНИЛ-3-АЛКИЛ-5-(O-ОКСИФЕНИЛ)-1,2,4-ТРИАЗОЛЫ, ОБЛАДАЮЩИЕ ТРАНКВИЛИЗИРУЮЩИМ И АНТИГИПОКСИЧЕСКИМ ДЕЙСТВИЕМ, И 1-ФЕНИЛ-3-Н-БУТИЛ-5-(О-ОКСИФЕНИЛ)-1,2,4-ТРИАЗОЛ, ОБЛАДАЮЩИЙ ТРАНКВИЛИЗИРУЮЩИМ, АНТИГИПОКСИЧЕСКИМ И АНАЛЬГЕТИЧЕСКИМ ДЕЙСТВИЕМ | 1983 |
|
SU1280851A1 |
| ПРОИЗВОДНЫЕ 5-АРИЛ-1Н-1,2,4-ТРИАЗОЛА И СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2000 |
|
RU2249588C2 |
Авторы
Даты
2006-11-27—Публикация
2003-06-17—Подача