Настоящее изобретение относится к замещенным производным азолонов, которые являются мощными агентами против Helicobacter. US - 4791111 описывает азолоны, которые имеют строение, сходное со строением соединений настоящего изобретения, и которые являются промежуточными соединениями при получении [[4-[4-(4-фeнил-1- пиперазинил)феноксиметил] -1,3-диоксолан-2-ил]метил]-1H- имидазолов и -1H-1,2,4-триазолов.
В US - 4931444 описывают замещенные производные азолонов, обладающие ингибирующей 5- липоксигеназу активностью. Соединения настоящего изобретения отличаются от них полезной активностью против Helicobacter.
Для уничтожения Helicobacter в организме двойная терапия, включающая раздельное введение двух антибиотиков, не является удовлетворительной в силу одной или более следующих причин: малая скорость уничтожения, многочисленные побочные эффекты и развитие устойчивости у Helicobacter. Показано, что тройная терапия, включающая введение двух антибиотиков и соединения висмута, является эффективной, но предъявляет к пациенту повышенные требования и также скомпрометирована побочными эффектами. Настоящие соединения имеют то преимущество, что их можно применять в монотерапии для уничтожения Helicobactег pylori и родственных видов.
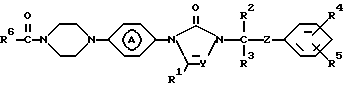
Настоящее изобретение относится к соединениям формулы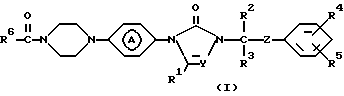
их фармацевтически приемлемым солям присоединения кислот и стереохимически изомерным формам,
где: Y представляет CH или N;
R1, R2 и R3 каждый независимо представляет водород или C1-4алкил;
R4 и R5 каждый независимо представляет водород, галоген, C1-4алкил, C1-4алкилокси, гидрокси, трифторметил, трифторметилокси или дифторметилокси;
R6 представляет водород или
R6 представляет фенил, необязательно замещенный галогеном; пиридинил; фуранил; тиенил; 3-хлорбензо[б]тиен-2-ил; трифторметил; C1-4алкилоксикарбонил; дигалофенилциклопропанил; C3-6циклоалкил; адамантил; C2-6алкенил, необязательно замещенный галогенфенилом; или C1-4алкил, необязательно замещенный галогеном, фенилом, галогенфенилом, дигалогенфенилом, фенилокси, пиперидинилом, пирролидинилом, пиперазинилом, C1-4алкилпиперазинилом, C1-4алкилкарбонилпиперазинилом, C1-4алкилоксикарбонилпиперазинилом, фталимино, амино, моно- или ди(C1-20)алкиламино или C3-6циклоалкиламино; Z представляет C=O или CHOH; и
является радикалом формулы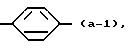

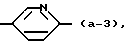
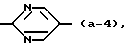
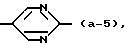
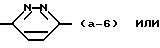
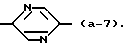
Употребляемые в настоящем документе определения галогены обозначают фтор, хлор, бром и йод; C1-4алкил обозначает насыщенные углеводородные радикалы с прямой и разветвленной цепью, содержащей от 1 до 4 атомов углерода, такие как, например, метил, этил, пропил, 1-метилэтил, бутил, 1-метилпропил, 2-метилпропил и 1,1-диметилэтил; C1-6алкил обозначает C1-4алкильные радикалы, как определено выше в настоящем документе, и их более высокие гомологи, содержащие от 5 до 6 атомов углерода, такие как, например, пентил или гексил; C1-20алкил обозначает C1-4алкильные радикалы, как определено выше в настоящем документе, и их более высокие гомологи, содержащие от 5 до 20 атомов углерода; C3-6циклоалкил является общим названием для циклопропила, циклобутила, циклопентила и циклогексила; C1-6алкенил обозначает углеводородные радикалы с прямой и разветвленной цепью, содержащей одну или две двойные связи, и содержащие от 2 до 6 атомов углерода.
Употребляемый в настоящем документе термин фармацевтически приемлемая соль присоединения кислоты обозначает нетоксичные, терапевтически активные формы - соли присоединения кислот, которые могут образовываться соединениями формулы (I). Соединения формулы (I), обладающие основными свойствами, могут превращаться в соответствующие терапевтически активные, нетоксичные соли присоединения кислот путем действия на свободное основание подходящим количеством соответствующей кислоты, согласно обычным методикам. Подходящие кислоты включают, например, неорганические кислоты, такие как галогеноводородные кислоты, например хлористоводородная или бромистоводородная кислота; серная; азотная; фосфорная и подобные кислоты; или органические кислоты, такие как, например, уксусная, пропановая, оксиуксусная, молочная, пировиноградная, щавелевая, малоновая, янтарная, малеиновая, фумаровая, яблочная, винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламеновая, салициловая, п-аминосалициловая, памоевая и подобные кислоты. Термин соль присоединения, употребляемый в настоящем документе, также включает сольваты, которые соединения формулы (I), а также их соли могут образовывать. Такими сольватами являются, например, гидраты, алкоголяты и т.п.
Термин стереохимические изомерные формы, употребляемый в настоящем документе, обозначает различные изомерные, а также конформационные формы, которые могут иметь соединения формулы (I). Если не указывается или не упоминается иное, химическое обозначение соединений обозначает смесь всех возможных стереохимически или конформационно изомерных форм; причем указанная смесь содержит все диастереоизомеры, энантиомеры и/или конформеры основной молекулярной структуры. Все стереохимически измерные формы соединений формулы (I), как в чистом виде, так и в виде смеси друг с другом, следует рассматривать в объеме настоящего изобретения.
Абсолютная конфигурация каждого хирального центра может обозначаться стереохимическими значками R и S.
Для соединений, имеющих два хиральных центра, соответственно используются стереохимические обозначения R* и S* в соответствии с правилами химических обозначений (Chemical Substance Name Selection Manual (CA), издание 1982, том III, глава 20).
Некоторые соединения согласно настоящему изобретению могут существовать в различных таутомерных формах, и все такие таутомерные формы следует рассматривать как находящиеся в объеме настоящего изобретения.
Первую группу соединений, представляющих интерес, составляют соединения формулы (I), в которых R4 является галогеном, а R5 является водородом.
Вторую группу соединений, представляющих интерес, составляют соединения формулы (I), в которых
является радикалом формулы (a-1) или (a-2).
Третью группу соединений, представляющих интерес, составляют соединения формулы (I), в которых Y является N, а R1 является водородом.
Четвертую группу соединений, представляющих интерес, составляют соединения формулы (I), в которых R2 является C1-4алкилом, a R3 является водородом.
Пятую группу соединений, представляющих интерес, составляют соединения формулы (I), в которых R6 является пиридинилом, фенилом, галогенфенилом, бензилом, C3-6циклоалкилом, C1-4алкилоксикарбонилом, метилом или трифторметилом.
Предпочтительными соединениями являются соединения формулы (I), в которых
R1, R3 и R5 - являются водородом;
R2 является C1-4алкилом;
R4 является галогеном и
Y является N.
Более предпочтительными соединениями являются соединения формулы (I), в которых
R1, R3 и R5 являются водородом;
R2 является этилом;
R4 является галогеном;
Y является N;
R6 является пиридинилом, фенилом, галогенфенилом, бензилом, C3-6 циклоалкилом, C1-4алкилоксикарбонилом, метилом или трифторметилом; и
является радикалом формулы (а-1) или (а-2).
Наиболее предпочтительными соединениями являются 1-[4-[2-[1-(4- xлopбeнзoил)пpoпил]-2,3-дигидpo-3-oкco-4H-1,2,4-триазол-4- ил]фенил]-4-(циклопропилкарбонил)пиперазин; 1-(4-хлорбензоил) - 4-[5-[2-[1-(4-хлорбензоил) пропил] -2,3-дигидро-3-оксо-4H-1, 2, 4-триазол-4-ил]-2-пиридинил]пиперазин;
1-бензоил-4-[4-[2-[1- [4-хлорфенил)гидроксиметил] пропил]-2,3-дигидро-3-оксо- 4H-1,2,4-триазол-4-ил]фенил]пиперазин; 1-(4-хлорбензоил)-4- [4-[2-[1-[(4-хлорфенил)гидроксиметил] пропил] -2,3-дигидро- 3-оксо-4H-1,2,4-триазол-4-ил] фенил] пиперазин; их фармацевтически приемлемые соли присоединения кислот и стереохимически изомерные формы.
Аналогичные методики получения соединений, таких как соединения формулы (I) по настоящему изобретению, описаны в US-4791111 и US-4931444.
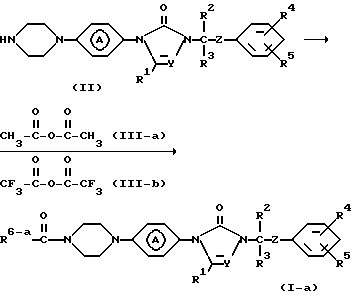
Соединения формулы (I) могут быть получены путем N-алкилирования промежуточного соединения формулы (II) реагентом формулы (III), где L является реакционной удаляемой группой, такой как, например, галоген, ди(C1-4алкил)амино и т.п.
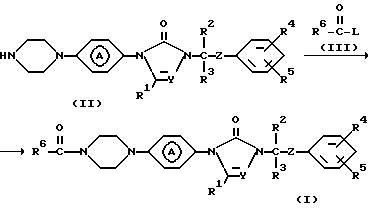
Вышеупомянутое N-алкилирование можно осуществить обычным путем в подходящем растворителе и в присутствии подходящего основания. Подходящими растворителями являются, например, биполярные апротонные растворители, например N,N-диметилформамид, N,N-диметилацетамид, 1,3-диметил-2-имидазолидинон; ароматические растворители, например бензол, метилбензол; эфир, например 1,1'-оксибисэтан, тетрагидрофуран, 1-метокси-2-пропанол; галогенированные углеводороды, например дихлорметан, трихлорметан или смеси таких растворителей.
Подходящими основаниями являются, например, бис(триметилсилил)амид натрия, гидроксид натрия, карбонаты или гидрокарбонаты щелочных и щелочноземельных металлов, например карбонат натрия или калия; или органические основания, например триэтиламин и подобные основания.
Соединения формулы (I), в которых R6 представляет метил или трифторметил; причем указанный R6 представлен R6-a, а указанные соединения - формулой (I-a), можно получить путем взаимодействия промежуточного соединения формулы (II) и уксусного ангидрида (III-a) или трифторуксусного ангидрида (III-b) в реакционно инертном растворителе, например дихлорметане, толуоле и т.п., необязательно, в присутствии основания, например карбонатов или гидрокарбонатов щелочных и щелочноземельных металлов, например карбоната натрия или калия.
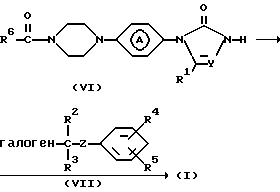
Соединения формулы (I) также можно получить путем N- алкилирования промежуточного соединения формулы (VI) реагентом формулы (VII) в подходящем растворителе и в присутствии подходящего основания.
Соединения формулы (I) могут также превращаться друг в друга с помощью следующих известных специалистам методик для трансформации функциональных групп.
Например, соединения формулы (I), в которых R6 представляет C1-4алкил, замещенный пиперидинилом, пирролидинилом, пиперазинилом, C1-4алкилпиперазинилом, C1-4алкилкарбонилпиперазинилом, C1-4алкилоксикарбонилпиперазинилом, амино, моно- или ди(C1-20)алкиламино или C3-6циклоалкиламино; причем указанные заместители представлены R7, а указанные соединения - формулой (I-b), могут быть получены посредством взаимодействия соединения формулы (I-с) и реагента формулы (IV) в реакционно инертном растворителе, например N,N-диметилформамиде.
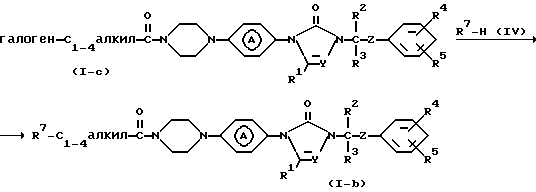
Далее, соединения формулы (I), в которых Z представляет C=O, могут превращаться в соединения формулы (I), в которых Z представляет CHOH, с помощью следующих известных специалистам методик восстановления. Например, указанное восстановление можно удобно провести с помощью взаимодействия с гидридом металла или комплексным гидридом металла, например боргидридом натрия, цианборгидридом натрия и т.п. в воде, 1-метилпирролидиноне, ацетонитриле, в спиртовой среде, например метаноле, этаноле или в эфире, например тетрагидрофуране, 1,4-диоксане или в смеси таких растворителей. Альтернативно, указанное восстановление можно провести путем взаимодействия с гидроборатом трис(1-метилэтокси) калия, гидроборатом трис(1-метилпропил) натрия или гидроборатом трис(1-метилпропил) калия в реакционно инертном растворителе, например тетрагидрофуране или N,N-диметилформамиде.
Необязательно, реакцию соединения формулы (I-с) с реагентом формулы (IV) и восстановление, описанное выше, можно осуществлять в едином реакционном сосуде.
И наконец, чистые изомерные формы соединений формулы (I) можно разделить в смеси с помощью стандартных способов разделения. В частности, энантиомеры можно разделить с помощью колоночной хроматографии с использованием хиральной стационарной фазы, такой как подходящие производные целлюлозы, например три (диметилкарбамоил) целлюлоза (Chiralcel OD® ) и подобных хиральных стационарных фаз.
Во всех ранее описанных и последующих реакциях продукты реакции можно выделять из реакционной среды и, если это необходимо, подвергать дальнейшей очистке согласно обычным методикам, хорошо известным специалистам.
Промежуточные соединения формулы (II) можно получить путем взаимодействия соединения формулы (V) и кислоты, например бромистоводородной кислоты и т.п.
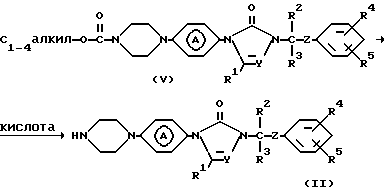
Промежуточные соединения формулы (VI) можно получить согласно методике, описанной выше для получения соединений формулы (I) из промежуточных соединений формулы (II).
Соединения формулы (I) и их фармацевтически приемлемые соли присоединения кислот и стереохимически изомерные формы обладают полезной фармакологической активностью против видов Helicobacter, например Helicobacter pylori, Helicobacter mustelae, Helicobacter fellis и т.п., особенно Helicobacter pylori.
Особенно важным в этом контексте является открытие того, что настоящие соединения демонстрируют ингибирующую активность в отношении роста Helicobacter, а также бактерицидной активностью в отношении указанной бактерии. Бактерицидный эффект в отношении Helicobacter определяли на суспензиях культур с помощью методики, описанной в Antimicrob. Agents Chemother., 1991, том 35, стр. 869 - 872.
Интересная отличительная особенность настоящих соединений связана с их высокоспецифичной активностью против Hеlicobacter. Соединения формулы (I), как оказалось, не обладают ингибирующей активностью в отношении любого из следующих видов: Campylobacter jejuni, Campylobacter coli, Campylobacter fetus, Campylobacter sputorum, Vibrio spp., Staphylococcus aureus и Escherichia coli в концентрациях до 10-5 М.
Важным ценным качеством настоящих соединений является их пролонгированная активность против H. pylori при pH ниже нейтральной. Активность при низких значениях pH in vitro может указывать на то, что на соединение не оказывает неблагоприятного влияния кислая среда желудка in vivo.
Таким образом, настоящие соединения рассматриваются как ценные терапевтические лекарственные средства для лечения теплокровных животных, в частности людей, страдающих от заболеваний или состояния, связанных с Helicobacter. Примерами указанных заболеваний или состояний являются гастриты, язвы желудка и двенадцатиперстной кишки и рак желудка.
С точки зрения их анти-Helicobacter свойств настоящие соединения могут быть помещены в различные фармацевтические формы для различных способов введения. Для изготовления фармацевтических композиций по настоящему изобретению эффективное количество конкретного соединения, в форме основания или соли присоединения, в качестве активного ингредиента комбинируют в виде гомогенной смеси с фармацевтически приемлемым носителем, который может принимать самый разнообразный вид в зависимости от желательной для введения формы препарата. Желательно, чтобы эти фармацевтические композиции находились в виде стандартных доз, удобных, предпочтительно, для перорального, ректального или парентерального введения. Например, при изготовлении композиций в форме для перорального введения можно использовать любое из обычных фармацевтических веществ, такое как, например, вода, гликоли, масла, спирты и т. п. , в случае жидких препаратов для перорального введения, таких как суспензии, сиропы, эликсиры и растворы; или твердые носители, такие как крахмалы, сахара, каолин, смазывающие агенты, связывающие агенты, разрыхлители и т.п., в случае порошков, пилюль, капсул и таблеток. Для парентеральных композиций носитель обычно включает стерильную воду, по меньшей мере, в большей части, хотя можно включать и другие ингредиенты, например, для усиления растворимости. Например, можно изготавливать растворы для инъекций, в которых носитель включает солевой раствор, раствор глюкозы или смесь растворов соли и глюкозы. Можно изготавливать также суспензии для инъекций и в этом случае использовать подходящие жидкие носители, суспендирующие агенты и т.п.
Если фармацевтическую композицию изготавливают в форме водного раствора, то соединения формулы (I), которые обладают малой растворимостью, можно преобразовать в форму соли и добавить сорастворитель, который смешивается с водой и является физиологически приемлемым, например диметилсульфоксид и т. п. , или соединения формулы (I) можно солюбилизировать подходящим носителем, например циклодекстрином (ЦД) или, в частности, производным циклодекстрина, таким как производные циклодекстрина, описанные в US-3459731, EP-A-149197 (24 июля 1985), EP-A-197571 (15 октября 1986), US-4535152 или WO 90/12035 (18 октября 1990). Подходящими производными циклодекстрина являются α-, β-, γ- циклодекстрины или их эфиры и смешанные эфиры, в которых одна или более гидроксильных групп в глюкозных остатках в циклодекстрине замещены следующими группами: C1-6алкил, особенно, метил, этил или изопропил; гидроксиC1-6алкил, особенно, гидроксиэтил, гидроксипропил или гидроксибутил; карбоксиC1-6алкил, особенно, карбоксиметил или карбоксиэтил; C1-6алкил-карбонил, особенно, ацетил; C1-6алкилоксикарбонилC1-6алкил или карбоксиC1-6алкилоксиC1-6алкил, особенно, карбоксиметоксипропил или карбоксиэтоксипропил; C1-6алкилкарбонилоксиC1-6алкил, особенно 2-ацетилоксипропил. Особенно заслуживающими внимания в качестве комплексообразующих агентов и/или солюбилизирующих агентов являются β - ЦД, 2,6-диметил -β-ЦД, 2-гидроксиэтил -β-ЦД, 2-гидроксэтил -γ-ЦД, и 2-гидроксипропил -γ-ЦД и (2-карбоксиметокси)- пропил -β-ЦД, а особенно, 2-гидроксипропил -β- ЦД.
Термин смешанный эфир означает производные циклодекстрина, в которых, по меньшей мере, две гидроксильные группы циклодекстрина этерифицированы различными группами, такими как, например, гидроксипропил или гидроксиэтил.
Среднее молярное замещение (МЗ) использовали в качестве измерения среднего количества молей алкокси единиц на моль гликозных остатков (ангидроглюкозы). Величину МЗ можно определить с помощью различных аналитических методик, таких как ядерный магнитный резонанс (ЯМР), масс-спектрометрия (МС) и инфракрасная спектроскопия (ИК). В зависимости от используемого способа анализа для каждого конкретного производного циклодекстрина могут быть получены слегка отличающиеся друг от друга величины. У гидроксиалкильных производных циклодекстрина, используемых для композиций по настоящему изобретению, величина МЗ по результатам масс-спектрометрии находится в пределах от 0,125 до 10, в частности от 0,3 до 3 или от 0,3 до 1.5. Предпочтительно величина МЗ варьирует приблизительно от 0,3 до 0.8, в частности приблизительно от 0,35 до 0,5, и особенно предпочтительно приблизительно 0,4. Величины МЗ, определенные с помощью ЯМР или ИК, предпочтительно варьируют от 0,3 до 1, в частности от 0,55 до 0,75.
Средняя степень замещения (СЗ) относится к среднему количеству замещенных гидроксильных групп на моль глюкозных остатков. Величину СЗ можно определить с помощью различных аналитических методик, таких как ядерный магнитный резонанс (ЯМР), масс-спектрометрия (МС) и инфракрасная спектроскопия (ИК). В зависимости от используемого способа анализа для каждого конкретного производного циклодекстрина могут быть получены слегка отличающиеся друг от друга величины. У производных циклодекстрина, используемых для композиций по настоящему изобретению, величина СЗ по результатам МС находится в пределах от 0,125 до 3, в частности от 0,2 до 2 или от 0,2 до 1,5. Предпочтительно величина СЗ варьирует приблизительно от 0,2 до 0,7, в частности приблизительно от 0,35 до 0,5, и особенно предпочтительно приблизительно 0,4. Величины СЗ, определенные с помощью ЯМР или ИК, предпочтительно варьируют от 0,3 до 1, в частности от 0,55 до 0,75.
Более конкретно, гидроксиалкильные производные β- и γ- циклодекстрина для использования в композициях по настоящему изобретению являются частично замещенными производными циклодекстрина, в которых средняя степень алкилирования при гидроксильных группах в различных положениях глюкозных остатков составляет приблизительно от 0% до 20% для 3 положения, от 2% до 70% для 2 положения и приблизительно от 5% до 90% для 6 положения. Предпочтительно количество незамещенных β- и γ- циклодекстринов составляет менее 5% от общего содержания циклодекстрина и, в частности, составляет менее 1,5%. Другим особенно интересным производным циклодекстрина является произвольно метилированный β- циклодекстрин.
Наиболее предпочтительными производными циклодекстрина для использования в композициях по настоящему изобретению являются частично замещенные эфиры или смешанные эфиры β- циклодекстрина, имеющие в качестве заместителей гидроксипропил, гидроксиэтил и, в особенности, 2-гидроксипропил и/или 2-(1-гидроксипропил).
Наиболее предпочтительным производным циклодекстрина для использования в композициях по настоящему изобретению является гидроксипропил -β- циклодекстрин, имеющий МЗ в пределах от 0,35 до 0,50 и содержащий менее 1,5% незамещенного β- циклодекстрина. Величины МЗ, определенные с помощью ЯМР или ИК, предпочтительно варьируют от 0,55 до 0,75.
Для удобства применения и стандартности дозировок особенно выгодно создавать вышеупомянутые фармацевтические композиции в форме стандартных дозированных единиц. Стандартная дозированная единица, упоминаемая в настоящем описании и формуле изобретения, относится к физически дискретным единицам, удобным в качестве стандартных дозировок, причем каждая единица содержит строго определенное количество активного ингредиента, рассчитанное для обеспечения желаемого терапевтического эффекта, в сочетании с требующимся фармацевтическим носителем. Примерами таких стандартных дозированных единиц являются таблетки (включая таблетки с засечками и таблетки в оболочке), капсулы, пилюли, пакетики с порошком, облатки, растворы или суспензии для инъекций и т.п., а также упаковки из множества этих изолированных единиц.
С точки зрения полезности настоящих соединений для лечения заболеваний, связанных с Helicobacter, очевидно, что настоящее изобретение обеспечивает способ лечения теплокровных животных, в частности людей, страдающих от заболеваний, связанных с Helicobacter, который включает в себя системное введение фармацевтически эффективного количества соединения формулы (I), его фармацевтически приемлемой соли присоединения или стереохимически изомерной формы, в смеси с фармацевтическим носителем. В еще одном аспекте настоящего изобретения рассматриваемые соединения применяются в качестве лекарственного средства.
В общем, предполагается, что эффективное суточное количество составит от 0,05 мг/кг до 50 мг/кг веса тела, предпочтительно от 0,1 мг/кг до 30 мг/кг веса тела и наиболее предпочтительно от 0,5 мг/кг до 10 мг/кг веса тела.
Очевидно, что указанное эффективное суточное количество может быть уменьшено или увеличено, в зависимости от реакции пациента, подвергаемого лечению, и/или в зависимости от оценки терапевта, назначающего соединения настоящего изобретения. Таким образом, указанные выше эффективные пределы являются только руководством и не предназначены для ограничения в какой бы то ни было степени объема или применения настоящего изобретения.
Необязательно, в сочетании с соединениями по настоящему изобретению могут вводиться другие активные соединения, используемые для уничтожения Helicobacter. Введение можно осуществлять раздельно (т.е. одновременно или последовательно) или различные лекарственные средства могут объединяться в одну лекарственную форму. Подходящими соединениями для комбинированной терапии являются соединения висмута, например субцитрат висмута, субсалицилат висмута и т. п., антибиотики, например ампициллин, амоксициллин, кларитромицин и т.п., антагонисты H2-рецепторов, например циметидин, ранитидин и т. п. , и, в частности, ингибиторы протонного насоса, например омепразол, ланзопразол, пантопразол и т. п. Для перечисленных соединений, которые могут быть полезными для комбинированной терапии с соединениями формулы (I), эффективное суточное количество будет составлять от 0,05 мг/кг до 50 мг/кг веса тела.
Экспериментальная часть
Далее в настоящем документе "ДМФ" означает N,N-диметилформамид, "ДМСО" означает диметилсульфоксид и "ТГФ" означает тетрагидрофуран.
Пример 1
а) Смесь (±)-этил 4-[4-[2-[1-(4- хлорбензоил)пропил]-2,3-дигидро-3-оксо-4H-1,2,4-триазол-4- ил]фенил]-1-пиперазинкарбоксилата (15 г) в 48% водном растворе бромистоводородной кислоты (150 мл) перемешивали и нагревали с обратным холодильником в течение 6 часов, а затем перемешивали в течение ночи. Смесь выпаривали, остаток растворяли в CH2Cl2 и промывали NaHCO3/H2О. Органический слой высушивали, фильтровали и растворитель выпаривали. Остаток растворяли в 2-пропаноле и кристаллизовали в соль хлористоводородной кислоты (1: 2) в 2-пропаноле. Осадок отфильтровывали и перекристаллизовывали из CH3CN, получая 7,9 г (2,2%) (±)-2-[1-(4-хлорбензоил)пропил]-2,4-дигидро-4-[4- (1-пиперазинил)фенил]-3H-1,2,4-триазол-3-он.дигидрохлорида. моногидрата; т.пл. 175,9oC (промежуточное соединение 1).
б) Гидроксид натрия (4 г), растворенный в воде (20 мл) добавляли к смеси промежуточного соединения (1) (6 г) в CH2Cl2 (180 мл) и смесь перемешивали в течение 30 минут. Добавляли по каплям бензолацетилхлорид (2,3 г) в CH2Cl2 (20 мл) и смесь перемешивали при 20oC в течение 2 часов. Добавляли воду и слои разделяли. Органический слой высушивали, фильтровали и растворитель выпаривали. Остаток кристаллизовали из 2-пропанола. Осадок отфильтровывали и высушивали, получая 4,7 г (59%) (±)-1-[4-[2-[1-(4-xлopбeнзoил)пpoпил]-2,3-дигидро-3- оксо-4H-1,2,4-триазол-4-ил]фенил]-4-(фенилацетил) пиперазина; т. пл. 172oC (соединение 1).
Пример 2
Смесь уксусного ангидрида (10,2 г), промежуточного соединения (1) (10 г) и карбоната натрия (10,6 г) в толуоле (200 мл) перемешивали и нагревали с обратным холодильником в течение ночи. Смесь охлаждали, добавляли воду и разделяли слои. Органический слой высушивали, фильтровали и растворитель выпаривали. Остаток кристаллизовали из 2- пропанола и высушивали, получая 8 г (89%) (±)-1-ацетил-4-[4-[2-[1-(4-хлорбензоил)пропил] -2,3-дигидро- 3-оксо-4H-1,2,4-триазол-4-ил]фенил]пиперазина; т. пл. 125oC (соединение 2).
Пример 3
Смесь соединения (27) (2 г) в ДМФ (100 мл) перемешивали при 40oC. По каплям добавляли 1 М K[OCH(CH3)2] 3BH в ТГФ (11 мл) и смесь перемешивали в течение ночи. Смесь выливали в воду и перемешивали в течение 2 часов. Осадок отфильтровывали и очищали посредством колоночной хроматографии на силикагеле (элюент: CH2Cl2/CH3OH 98/2). Чистые фракции собирали и выпаривали. Остаток стирали с этилацетатом/диизопропиловым эфиром, получая 1 г (51%) (±)-(R*, R*)-1-[5-[2-[1-[(4-хлорфенил) гидроксиметил]пропил]-2,3-дигидро-3-оксо-4H-1,2,4- триазол-4-ил] -2-пиридинил] -4-триазол-4-ил]2- пиридинил]-4-(2-пиридинилкарбонил)пиперазин; т.пл. 210oC (соединение 3).
Пример 4
Смесь соединения (16) (0,35 г) в 1-пропанамине (0,5 мл) и ДМФ (2 мл) перемешивали при комнатной температуре в течение ночи. Смесь очищали посредством ЖХВР на силикагеле (элюент: от CH2Cl2 100 до CH2Cl2/CH3OH 90/10 в течение 20 минут и при 120 мл/в минуту и до CH3OH 100 спустя 20 минут). Нужную фракцию собирали и выпаривали, получая раствор 0,22 г (±)-4-[5-[2-[1-(4-хлорбензоил) пропил]-2,3-дигидро-3-оксо-4H-1,2,4-триазол-4-ил]-2- пиридинил] -1-[(пропиламино)ацетил]пиперазина в ДМСО (21 мл) (60,6%) (соединение 4).
Пример 5
Смесь соединения (16) (0,25 г) в 1-пропанамине (0,25 мл) и ДМФ (1,5 мл) перемешивали в течение 1 часа. Добавляли 1 M K[OCH(CH3)2]3BH в ТГФ (1,5 мл) и смесь перемешивали в течение 1 часа. Добавляли раствор NH4Cl (0,25 мл), смесь перемешивали в течение 1 часа, а затем очищали посредством ЖХВР на силикагеле (элюент: от CH2Cl2/CH3OH 90/10 до CH2Cl2/CH3OH 70/30 в течение 20 минут и при 120 мл/в минуту). Нужную фракцию собирали и выпаривали, получая раствор 0,09 г (±)-(R*,R*)-4-[5- [2-[1-[(4-хлорфенил)гидроксиметил]пропил] -2,3-дигидро-3- оксо-4H-1,2,4-триазол-4-ил]-2-пиридинил]-1- (пропиламино)ацетил]пиперазина в ДМСО (8,5 мл) (32,2%) (соединение 5).
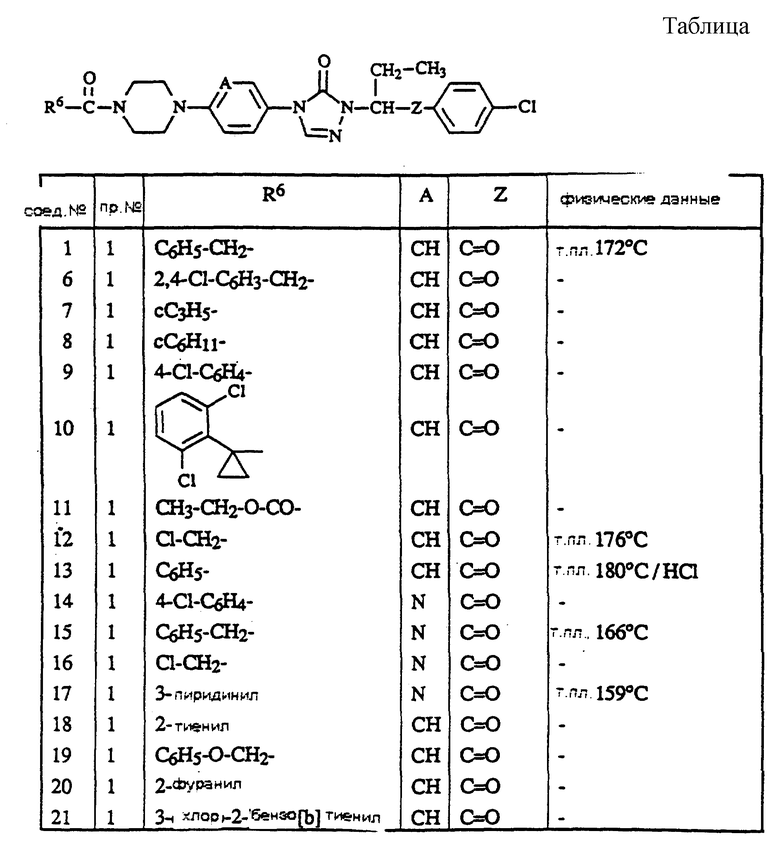
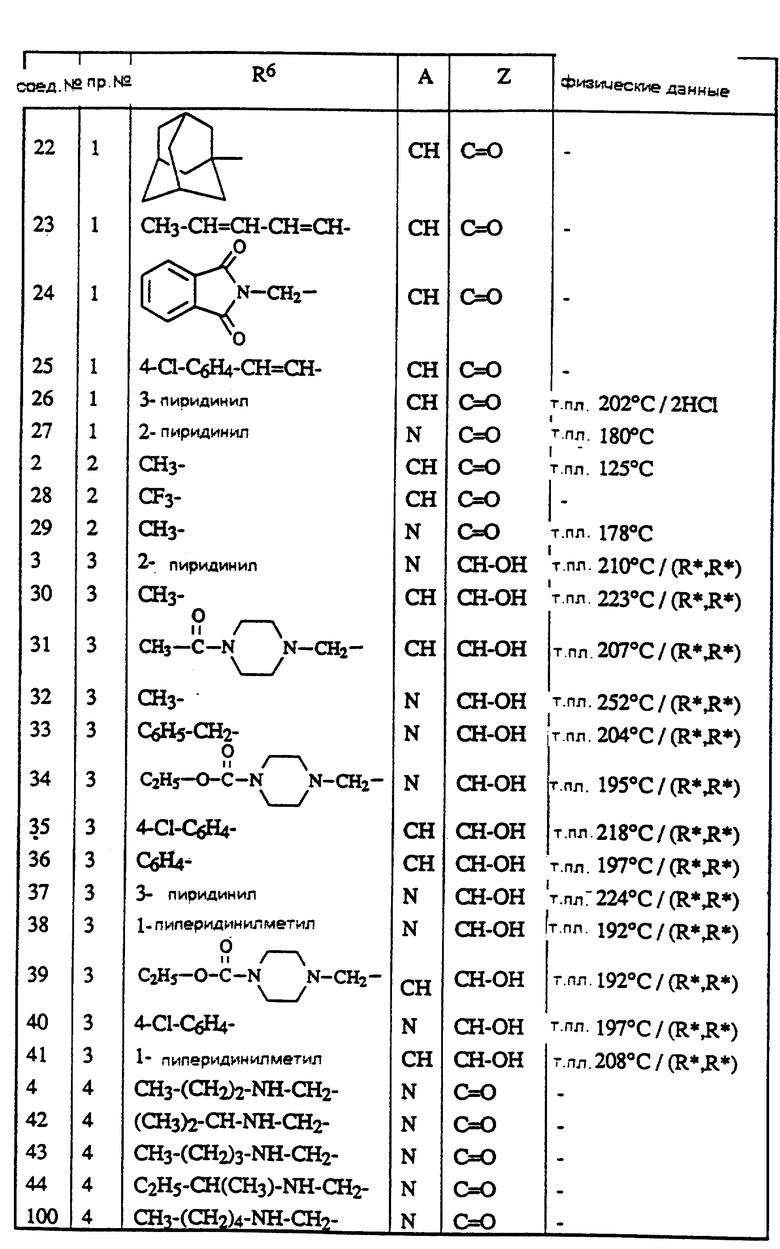
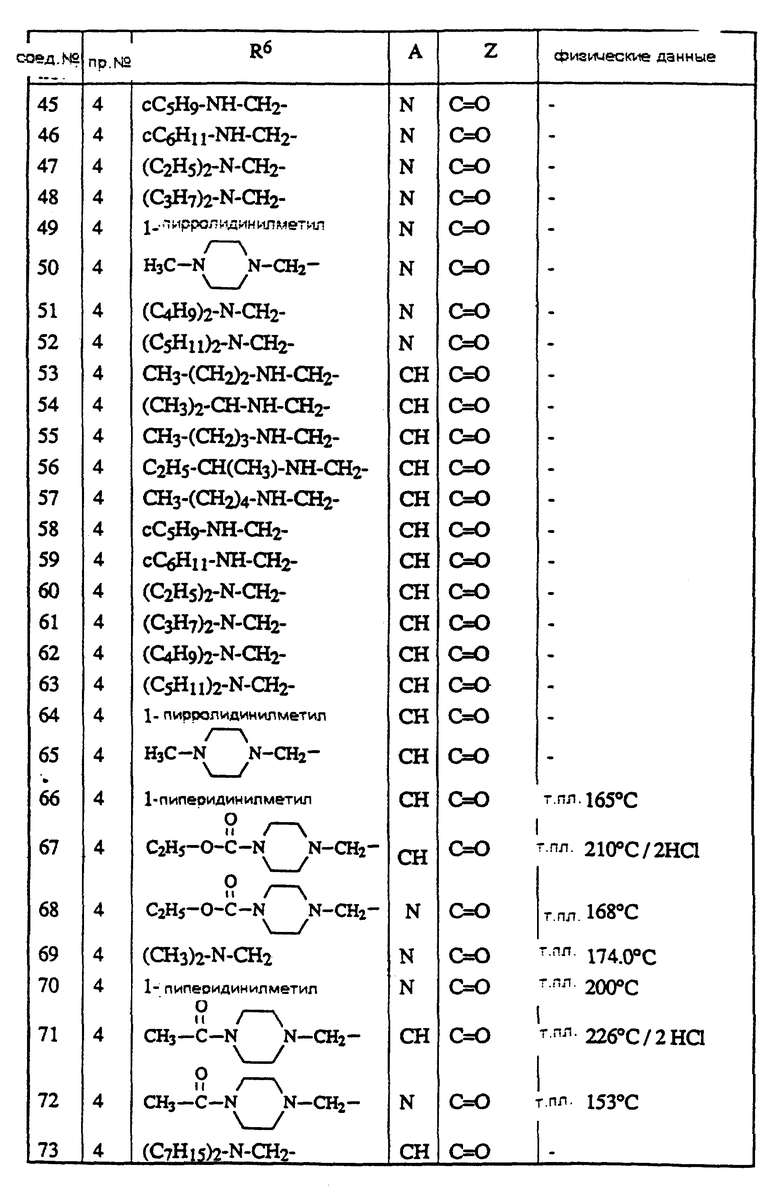
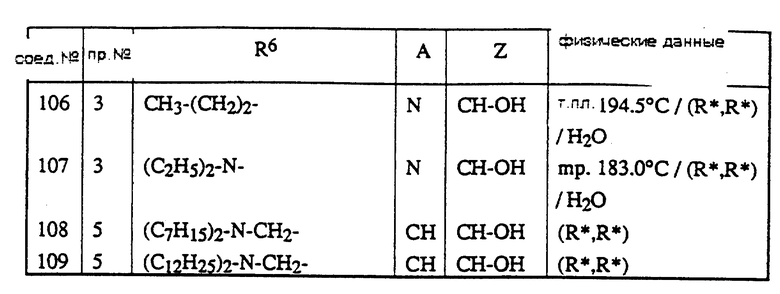
Соединения, приведенные в таблице, были получены согласно одной из описанных выше методик.
Фармакологический пример
Активность испытуемых соединений против Helicobacter оценивали с помощью следующей тест-процедуры in vitro.
Пример 10
Активность испытуемых соединений против Helicobacter
Активность испытуемых соединений против Helicobacter pylori определяли в отношении стандартного набора из 5 штаммов H.pylori, полученных из клинического материала. Минимальные ингибирующие концентрации (МИК) определяли путем измерения активности уреазы H.pylori после обработки растущих культур бактерий антимикробными агентами.
Испытуемые соединения растворяли в ДМСО до концентрации 10-3 М. Также изготавливали разведение 10-4 в ДМСО. 10 мкл объемы этих растворов с помощью пипеток помещали в лунки планшетов Repli (®Sterilin). Лунки, содержавшие только ДМСО, включали в каждый планшет Repli в качестве контролей. В каждую серию тестов в качестве эталонов для сравнения включали ампициллин ((+)-6-[(1-амино-2-фенилацетил) амино]-3,3-диметил-7-оксо-4-тиа-1-азабицикло[3,2,0] гептан-2- карбоксильная кислота, тригидрат) и метронидазол (2-метил-5-нитро- 1H-имидазол-1-этанол). (Эти соединения испытывали в конечных концентрациях 10-5, 10-6, 10-7 и 10-8 М). Тестовые планшеты хранили до использования при 4oC. Пять штаммов H.pylori поддерживали пересеванием на 10% кровяном агаре каждые 2-3 дня.
Бактерии выращивали при 37oC в атмосфере, содержавшей 5% кислорода, 10% CO2 и 85% азота. Суспензии Helicobacter pylori для инокулятов получали на бульоне из настоя сердечной и мозговой ткани и доводили до поглощения 1,5 ± 0,3 при 530 нм.
Свежеприготовленный 10% кровяной агар с температурой 45oC в объеме 1 мл добавляли в лунки тестовых планшетов, разводя, таким образом, испытуемые соединения до 10-5 и 10-6. Среде позволяли остыть, затем пипеткой помещали 10 мкл объемы бактериальной суспензии на поверхность агара. Планшеты инкубировали в течение 48 часов при 37oC в микроаэрофильной атмосфере, описанной выше. Для облегчения чтения планшетов и гарантии того, что любой рост в среде действительно является H.pylori, предпочтение отдавали высокой активности в отношении мочевины, уникальной для этих видов. После 48 часов инкубации 1 мл объемы бульона, содержавшего уреазу, осторожно добавляли в каждую лунку планшетов Repli и планшеты инкубировали при 37oC в течение 2 часов. Затем 110 мкл образцы жидкостей из каждой лунки пипеткой переносили в лунки 96-луночных микротитрационных планшетов. Пурпурный цвет интерпретировали как рост, желто-оранжевый - как отсутствие роста H.pylori. Таким способом достигалась точка, начиная с которой ингибирующие эффекты невозможно определить. Все соединения, показавшие активность при любой из двух концентраций, подвергали испытанию с дальнейшими разведениями для определения МИК и с более широким спектром бактериальных видов как организмов-мишеней. Таким способом было установлено, что величины МИК для соединений 1, 3,7-9, 11, 12, 14, 17-20, 27, 28, 30, 33, 35-37, 40, 102, 105 и 106 равны или составляют менее 1 мкМ.
Примеры композиций
"Активный ингредиент" (АИ) в приведенных примерах относится к соединению формулы (I), его фармацевтически приемлемой соли присоединения кислоты или стереохимически изомерной форме.
Пример 11
Капли для перорального введения
500 граммов АИ растворяли в 0,5 л 2-оксипропановой кислоты и 1,5 л полиэтиленгликоля при 60~ 80oC. После охлаждения до 30~40oC добавляли 35 л полиэтиленгликоля и смесь тщательно перемешивали. Затем добавляли раствор 1750 граммов сахарин-натрия в 2,5 л очищенной воды. При перемешивании добавляли 2,5 л корригента со вкусом какао и полиэтиленгликоль q.S. до объема 50 л, в результате чего получали раствор для пероральных капель, содержавший 10 мг/мл АИ. Полученным раствором наполняли подходящие контейнеры.
Пример 12
Капсулы
20 граммов АИ, 6 граммов лаурилсульфата натрия, 56 граммов крахмала, 56 граммов лактозы, 0,8 грамма коллоидного диоксида кремния и 1,2 грамма стеарата магния интенсивно смешивали друг с другом. Полученной смесью затем наполняли 1000 подходящих твердых желатиновых капсул, которые содержали по 20 мг активного ингредиента.
Пример 13
Таблетки с пленочным покрытием
Изготовление ядра таблетки
Смесь 100 грамма АИ, 570 граммов лактозы и 200 граммов крахмала тщательно перемешивали, а затем увлажняли раствором 5 граммов додецилсульфата натрия и 100 граммов поливинилпирролидона в 200 мл воды. Влажную порошковую смесь просеивали, высушивали и вновь просеивали. Добавляли 100 граммов микрокристаллической целлюлозы и 15 граммов гидрогенизированного растительного масла. Смесь хорошо перемешивали и прессовали в таблетки, получая 10 000 таблеток по 10 мг активного ингредиента каждая.
Покрытие
К раствору 10 граммов метилцеллюлозы в 75 мл денатурированного этанола добавляли раствор 5 граммов этилцеллюлозы в 150 мл дихлорметана. Затем добавляли 75 мл дихлорметана и 2,5 мл 1,2,3-пропантриола. 10 граммов полиэтиленгликоля расплавляли и растворяли в 75 мл дихлорметана. Последний раствор добавляли к предыдущему, а затем добавляли 2,5 грамма октадеканоата магния, 5 граммов поливинилпирролидона и 30 мл концентрированной суспензии красителя и все вместе гомогенизировали. Ядра таблеток покрывали полученной таким способом смесью в машине для нанесения покрытия.
Пример 14
Суппозитории
3 грамма АИ растворяли в растворе 3 граммов 2,3-дигидроксибутандикислоты в 25 мл полиэтиленгликоля 400. Совместно расплавляли 12 граммов поверхностно-активного вещества и триглицеридов q.S. до 300 граммов. Последнюю смесь хорошо перемешивали с предыдущим раствором. Полученную таким способом смесь выливали в формы при температуре 37 - 38oC, получая 100 суппозиториев с содержанием в каждом 30 мг/мл АИ.

Описываются новые ацильные производные азолонов общей формулы (1), где значения R1-R6, A, Y, Z указаны в п. 1 формулы изобретения, их фармацевтически приемлемые соли присоединения кислот и стереохимически изомерные формы, которые являются мощными агентами против микроорганизма Helicobacter. Описываются также способ их получения, композиции, включающие указанные соединения, способы их получения и применение этих соединений в качестве лекарственного средства. 4 с. и 4 з.п.ф-лы, 1 табл.

их фармацевтически приемлемые соли присоединения кислот и стереохимически изомерные формы,
где Y представляет N;
R1 и R3 каждый представляет водород;
R2 - С1-4-алкил;
R4 - водород;
R5 - галоген,
R6 - водород, фенил, необязательно замещенный галогеном; пиридинил; или С1-4-алкил, необязательно замещенный галогеном, фенилом, галогенфенилом, пиперидинилом, С1-4-алкилкарбонилпиперазинилом, С1-4-алкилоксикарбонилпиперазинилом, или ди(С1-20)-алкиламино;
Z представляет С=О или СНОН; и
является радикалом формулы
2. Соединение по п.1, отличающееся тем, что R6 представляет фенил, необязательно замещенный галогеном; пиридинил, или С1-4-алкил, необязательно замещенным галогеном, фенилом, галогенфенилом, пиперидинилом, С1-4-алкилкарбонилпиперазинилом, С1-4-алкилоксикарбонилпиперазинилом, или ди(С1-20)-алкиламино.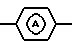
является радикалом формулы (а-1) или (а-2).
1-(4-хлорбензоил)-4-[5-[2-[1-(4-хлорбензоил)пропил] -2,3-дигидро-3-оксо-4Н-1,2,4-триазол-4-ил]-2-пиридинил]пиперазин;
1-бензоил-4-[4-[1-[(4-хлорфенил)гидроксиметил] пропил] -2,3-дигидро-3-оксо-4Н-1,2,4-триазол-4-ил]фенил]пиперазин;
1-(4-хлорбензоил)-4-[4-[2-[1-[(4-хлорфенил)гидроксиметил]пропил]-2,3-дигидро-3-оксо-4Н-1,2,4-триазол-4-ил]фенил]пиперазин;
их фармацевтически приемлемые соли присоединения кислот и стереохимически изомерные формы.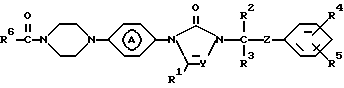
где R1, R2, R3, R4, R5, R6, Y, Z и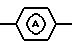
определены в п.1,
их фармацевтически приемлемых солей присоединения кислот и стереохимически изомерных форм, отличающийся тем, что соединение общей формулы II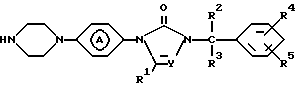
значения радикалов R1, R2, R3, R4, R5, Y, Z и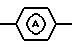
определены выше, подвергают N-ацилированию реагентом общей формулы III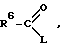
R6 имеет указанное выше значение;
L обозначает реакционную удаляемую группу,
в подходящем растворителе и в присутствии подходящего основания, с последующим, в случае необходимости, превращением соединения формулы I в соль присоединения кислоты посредством воздействия фармацевтически приемлемой кислоты.
| EP, 0331232 A, 06.09.1989 | |||
| WO, 94/18978 A, 01.09.1994 | |||
| US, 4931444, 06.05.1990 | |||
| SU, 793397, 05.11.1980. |
Авторы
Даты
2000-07-10—Публикация
1995-07-05—Подача