Рецидивирующий (возвратный) респираторный папилломатоз (РРП) - наиболее часто встречающаяся опухоль дыхательных путей, занимающая первое место среди причин возникновения хронической обструкции гортани у детей. Несмотря на то, что папиллома является доброкачественной опухолью, у детей в связи с частым рецидивированием, бурным ростом и анатомической узостью просвета гортани заболевание клинически протекает тяжело, с явлениями стеноза дыхательных путей, который при неоказании своевременной помощи может привести к летальному исходу.
Этиологическим фактором РРП является вирус папилломы человека (ВПЧ). В настоящее время определено более 70 типов вируса, однако, по данным литературы, при идентификации ДНК ВПЧ в биопсийном материале большинства больных РРП определяются, в основном, генотипы вируса 6, 11, 16 и 18. Данные, приводимые в литературе по сравнительной распространенности различных субтипов ВПЧ у детей, их взаимосвязи с тяжестью заболевания и влиянию на эффективность противорецидивного лечения весьма противоречивы.
По данным литературы, в США частота возникновения РРП составляет приблизительно 2350 новых случаев в год у детей и 3600 - у взрослых (0,6-4,3 на 100000 и 1,6-3,8 на 100000 соответственно). В Дании частота РРП составляет 3,84 на 100000, в том числе у детей -3,62 на 100000 и у взрослых - 3,94 на 100000 населения.
В клинике восстановительной хирургии гортани ДГКБ св. Владимира (клиническая база научной группы НИЦ ММА им. И.М.Сеченова) в 2002 г находилось на лечении 182 ребенка страдающих РРП; ежегодно в клинику госпитализируется 15-30 новых больных. В целом в Российской Федерации ежегодно регистрируется около 4000 новых случаев папилломатоза гортани у детей и взрослых.
Лечение детей с РРП представляет собой нерешенную проблему. Основным методом лечения является хирургическое удаление папиллом, заключающееся в удалении папиллом дыхательных путей микроинструментами, лазером или ультразвуком под контролем современной оптики. Однако изолированное использование хирургических методов не предотвращает развития последующих рецидивов заболевания. Более того, повторные операции зачастую приводят к развитию рубцового стеноза гортани, приводя к глубокой инвалидности. Кроме того, рост папиллом на голосовых складках приводит к возникновению выраженных нарушений голосовой функции, вплоть до афонии, обуславливая и множество психологических и социальных проблем, а также вызывая стойкие дезадаптивные изменения личности ребенка.
В связи с этим на протяжении последних десятилетий активно проводится поиск возможностей повышения эффективности лечения РРП. В настоящее время наиболее эффективным является применение, наряду с хирургическим методом, препаратов интерферона (ИФН). Данные об эффективности применения препаратов ИФН разноречивы. По результатам различных авторов, эффект от ИФН-терапии составляет от 20% до 50%. Кроме того, использование рекомбинантных ИФН имеет существенные экономические, социальные и медицинские недостатки: высокая стоимость препаратов, необходимость внутримышечных инъекций 3 раза в неделю в течение 1-2 лет и более, возможные побочные эффекты.
Наиболее перспективными представляются разработки таких новых методик лечения РРП как иммунотерапия с помощью вакцин.
Фармацевтическая компания «Стрессген Биотехнологии» (Stressgen Biotechnologies corp.) разработала терапевтическую вакцину для лечения РРП. Основой вакцины является гибридный рекомбинантный белок, состоящий из онкобелка Е7 ВПЧ 16 типа и белка «теплового шока» из M.tuberculosis Hsp 65 (патент США 6524825, Чу Н.Рандалл, Миззен Ли, Ву Хуаченг Билл. Иммунные ответы на антигены ВПЧ, вызываемые композициями, которые представляют собой ВПЧ антиген и стресс-белок либо экспрессионный вектор, способный к экспрессии указанных белков. (Chu N.Randall, Mizzen Lee, Wu Huacheng Bill. Immune responses against HPV antigens elicited by compositions comprising an HPV antigen and stress protein or an expression vector capable of expression of these proteins). Данное техническое решение может быть указано в качестве ближайшего аналога-прототипа.
Недавно были опубликованы результаты клинических испытаний этой вакцины. Трехкратное применение вакцины в дозе 500 мкг позволило более чем на 40% увеличить интервал между рецидивами.
Однако полной остановки рецидивов авторам добиться не удалось. По нашему мнению, неудачи в применении вакцины обусловлены тем, что в состав вакцины входит онкобелок Е7 ВПЧ 16-го типа, тогда как РРП вызывается в основном ВПЧ 11 и 6 типов. Причем как было показано нами, в специально проведенных исследованиях, в биопсийном материале больных РРП преимущественно обнаруживается ВПЧ 11 типа. Кроме того, ВПЧ 11 типа вызывает заболевание с более агрессивным течением. Таким образом, применение онкобелка Е7 16-го типа фармацевтической компанией «Стрессген Биотехнологии» (Stressgen Biotechnologies corp.) было не вполне оправдано. Достачно сравнить аминокислотные последовательности белков Е7 тип 11 и 16, чтобы убедиться в отсутствии выраженной гомологии между ними, а следовательно, и перекрестных антигенных детерминант. Поэтому трудно ожидать выраженного лечебного эффекта при терапии РРП, вызванного ВПЧ 11 типа, вакциной, сконструированной на основе белка Е7 16 типа. По нашему мнению, для иммунотерапии РРП следует использовать Е7 11 типа, что позволит достичь максимального эффекта. Причем аналогичный эффект следует ожидать при использовании нашей вакцины в случае терапии РРП, обусловленного ВПЧ 6 типа, так как между ними имеется выраженная гомология. Для улучшения иммуногенных свойств онкобелка Е7 компания «Стрессген Биотехнологии» (Stressgen Biotechnologies corp.) использовала белок «теплового шока» Hsp 65.
Задача настоящего изобретения - получение рекомбинантного белка, препарата на его основе, имеющего улучшенные иммунологические характеристики, а также более эффективного способа иммунотерапии.
Задача решается новым препаратом, созданным на основе рекомбинантного белка состоящего из онкобелка Е7 ВПЧ 11 типа и белка «теплового шока» из M.tuberculosis Hsp 70, и ее использованием для иммунотерапии рецидивирующего папилломатоза.
Рекомбинантный гибридный белок характеризуется тем, что состоит из онкобелка Е7 ВПЧ 11 типа с последовательностью SEQ №2 и белка «теплового шока» из M.tuberculosis Hsp 70, и получен с помощью плазмиды pQE30-E711-dnaK в клетках E.coli.
Препарат содержит синтезированный указанный рекомбинантный гибридный белок в эффективном количестве и фармацевтически приемлемый носитель. В качестве носителя могут быть любые приемлемые для введения иммуногенного белка основы, в частности, могут быть использованы гидроокись алюминия, маннитол, полиоксидоний. Под эффективным количеством следует понимать количество, которое должно быть достаточным для лечения или профилактики. Оно будет зависеть от возраста, пола, веса, состояния пациента. Эффективное количество предпочтительно составляет от 100 до 2500 мкг. Препарат обладает высокой степенью стандартности, слабой реактогенностью.
Разработан также способ иммунотерапии рецидивирующего папилломатоза гортани, согласно которому пациенту внутрикожно вводят препарат против папилломовируса человека в количестве 0,1-2,5 мг белка в одной дозе, при необходимости с повторным введением препарата через две недели.
По нашим данным, Hsp 70 имеет лучшие иммуномодулирующие характеристики, которые не зависят от типа HLA. Разработанный препарат дает лучшие клинические результаты, а именно: значительно увеличивает интервал между рецидивами, и может быть использован при вакцинации неоднородной человеческой популяции, а также при тяжелых формах заболевания.
Изобретение может быть проиллюстрировано следующими примерами его осуществления.
Пример 1.
Типирование вирусов папилломы у пациентов с диагнозом РРП.
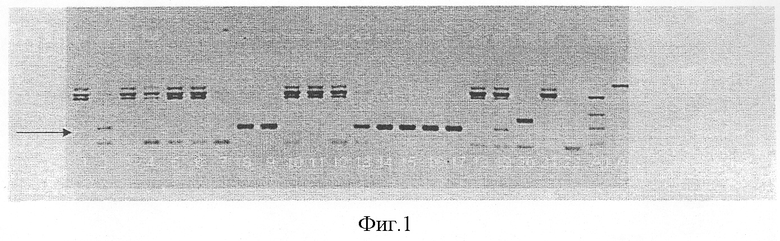
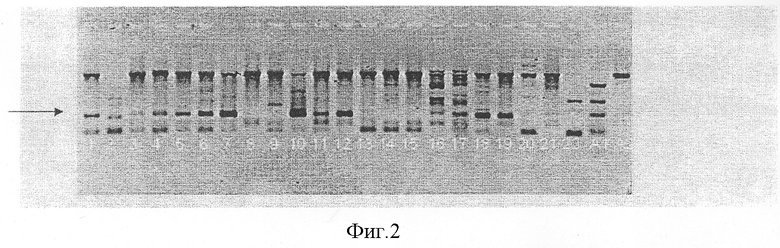
Послеоперационный материал от пациентов с диагнозом РРП использовался для определения типов ВПЧ. ДНК ВПЧ удалось определить у всех 26 детей (в том числе первичный результат был подтвержден при повторном исследовании у всех 3 детей, обследованных двухкратно). Изолированное инфицирование 11 типом вируса обнаружено у 15 пациентов (57,7%); изолированное инфицирование 6 типом вируса обнаружено у 7 детей (26,9%); остальные 4 ребенка (15,4%) оказались инфицированными и 6 и 11 типами ВПЧ одновременно (Фиг.1 и 2). Инфицирования 16 и 18 типами ВПЧ ни в одном случае выявлено не было.
На фиг.1 представлена фотография агарозных гелей при исследовании папиллом ВПЧ 6 типа. (Стрелкой показаны целевые бенды. Поскольку праймеры были подобраны для последующего синтеза белков Е7 ВПЧ 6 и 11 типов, они дали дополнительные бенды с геномной ДНК человека).
На фиг.2 представлена фотография агарозных гелей при исследовании папиллом ВПЧ 11 типа. (Стрелкой показаны целевые бенды. Поскольку праймеры были подобраны для последующего синтеза белков Е 7 ВПЧ 6 и 11 типов, они дали дополнительные бенды с геномной ДНК человека).
Пример 2.
Сравнительный анализ аминокислотных последовательностей онкобелков Е7 ВПЧ 6, 11 и 16 типов.
Alignment of E7 протеинов, ВПЧ 6 and 11
Е7 ВПЧ6 SEQ №1
MHGRHVTLKDIVLDLQPPDPVGLHCYEQLVDSSEDEVDEVDGQDSQPLKQHYQIVTCCCG
Е7 ВПЧ11 SEQ №2
MHGRLVTLKDIVLDLQPPDPVGLHCYEQLEDSSEDEVDKVDKQDAQPLTQHYQILTCCCG
E7 ВПЧ6 SEQ №3 CDSNVRLWQCTETDIREVQQLLLGTLNIVCPICAPKT
E7 ВПЧ11 SEQ №4 CDSNVRLWECTDGDIRQLQDLLLGTLNIVCPICAPKP
Multiple alignment of E7 proteins, ВПЧ 6, 11 and 16
E7 ВПЧ6
MHGRHVTLKDIVLDLQPPDPVGLHCYEQLVDSSEDEVDEVDGQDSQPLKQHYQIVTCC
Е7 ВПЧ11
MHGRLVTLKDIVLDLQPPDPVGLHCYEQLEDSSEDEVDKVDKQDAQPLTQHYQILTCC
E7 ВПЧ16
MHGDTPTLHEYMLDLQPETTDLYCYEQLNDSSEEEDEIDGPAGQAEPDRAHYNIVTFC
E7 ВПЧ6 CGCDSNVRLWQCTETDIREVQQLLLGTLN1VCPICAPKT
E7 ВПЧ11 CGCDSNVRLWECTDGDIRQLQDLLLGTLNIVCPICAPKP
E7 ВПЧ16 CKCDSTLRLCVQSTHVDIRTLEDLLMGTLGIVCPICSQKP
Пример 3
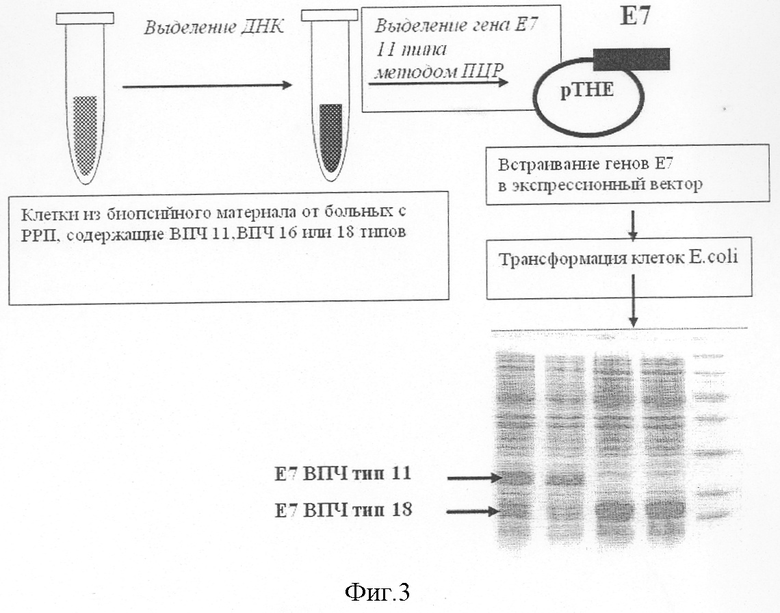
Конструирование рекомбинантной вакцины, кодирующей синтез гибридного белка Е7 11-Hsp 70 (см. фиг.3).
Пример 4
Получение продуцента гибридного белка, содержащего Е7 пептид ВПЧ 11 типа и DnaK (HSP70) М.tuberculosis.
1. ПЦР-амплификация гена Е7 вируса папилломы человека 11 типа.
В качестве матрицы был использован предоставленный препарат геномной ДНК клинического образца, прошедший предварительную проверку на присутствие ДНК 11 типа вируса папилломы человека.
ПЦР амплификацию проводили с помощью праймеров:
Инициирующий кодон находится в одной рамке считывания с последовательностью 6HIS tag, терминирующий кодон отсутствует.
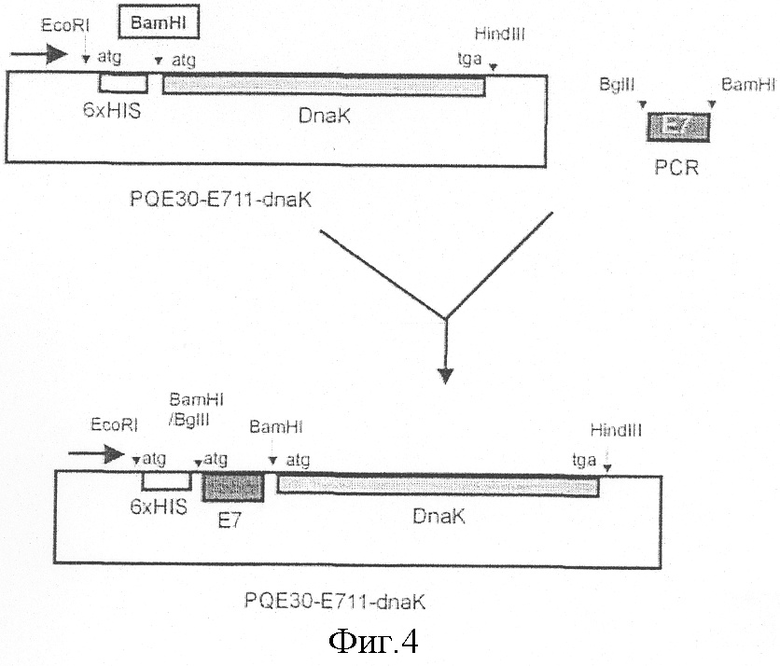
2. Клонирование последовательности гена Е7 в рекомбинантном векторе-продуценте DnaK.
Был использован ранее полученный вектор pQESO-dnaK-Y (см. схему на фиг.4), обеспечивающий экспрессию белка DnaK, слитого с последовательностью 6HIS на N-конце. ПЦР фрагмент гена Е7 был обработан рестриктазами BamHI и BgIII и клонирован в BamHI сайте плазмиды pQE30-dnaK-Y. Рекомбинанты, имеющие вставку в правильной ориентации, были идентифицированы при помощи рестрикционного анализа. Схема конструкции приводится на прилагаемом фиг.4. Следует отметить, что рекомбинантная плазмида pQE30-Е711-dnaK обеспечивает продукцию гибридного белка 6HIS-Е7(тип 11)-DnaK.
3. Выращивание штамма продуцента белка Е7 ВПЧ тип 11 и DnaK(HSP70) M.tuberculosis.
Для культивирования штамма продуцента используют питательную среду Лурия-Бертани состава:
На 10 л берут 100 г триптона, 50 г дрожжевого экстракта, 100 г натрия хлорида и бакто агар. К стерилизованной среду добавляют ампициллин до конечной концентрации 50 мг/мл. Инкубируют среду с штаммом при 37°С в течение ночи.
4. Продукция Е7(11)-DnaK
Синтез гибридного белка E7(11)-DnaK индуцировали при помощи IPTG следующим способом:
Ночную культуру DLT1270/ pQE30-E711-dnaK, выращенную в LB-бульоне, разводили 1:100 и выращивали в LB-бульоне (среда Лурия-Бертани) на качалке до плотности OD600-0.5.
Затем вносили 0.1 mM IPTG и продолжали выращивание в течение 3 часов.
Продукцию белка контролировали при помощи SDS-PAGE. Наблюдали синтез белка ожидаемой молекулярной массы.
5. Выделение рекомбинантного гибридного белка, состоящего из онкобелка Е7 ВПЧ 11 типа с последовательностью SEQ №2 и белка «теплового шока» из M.tuberculosis Hsp 70, и полученного с помощью плазмиды pQE30-E711-dnaK в клетках E.coli.
Сырьем служит биомасса рекомбинантного штамма E.coli.
Рекомбинантный белок, по мере роста штамма, накапливается в протоплазме в виде телец включения.
Получение и отмывка телец включения.
К клеточной биомассе Е.coli добавляли раствор А: 50 mM Tris (121.14 г/моль) 0.5 М, NaCl (58.44 г/моль), 5 mM EDTA (372.2 г/моль), 1% неионного детергента Nonidet P-40, ImM PMSF (174.2 г/моль). pH=7.5±0.3
Получали гомогенный раствор, который подвергали обработке ультразвуком на дезинтеграторе B.Braun (USA).
Обработанный ультразвуком раствор суспензии центрифугировали на центрифуге Beckman J2-21, при 10000 RPM, при +4°С, в течение 10 мин. Супернатант отбрасывали. К осадку (тельца включения) добавляли раствор В: 50 mM Tris (121.14 г/моль), 0.5 М NaCl (58.44 г/моль), 4 mM EDTA (372.2 г/моль), 2М мочевина (60.06 г/моль), 0.5 mM PMSF (174.2 г/моль), 0.05% Nonidet P-40 (w/w), pH=7.5±0.3, гомогенизировали его и центрифугировали в том же режиме.
Обработку раствором В повторяли 2 раза при тех же параметрах.
Затем, тельца включения были обработаны 2 раза так же раствором С: 50 mM Tris (121.14 г/моль), 0.5 М NaCl (58.44 г/моль), 1.5 mM EDTA (372.2 г/моль), 2 М мочевина (60.06 г/моль).
Растворение отмытых телец включения и рефолдинг целевого продукта.
К полученному осадку (тельца включения) добавляли раствор Д: 25 mM Tris (121.14 г/моль), 0.25 М NaCl (58.44 г/моль), 8М мочевина (60.06 г/моль), 10 mM DTT (154.24 г/моль), рН=8.0±0.2 с последующим гомогенизированием.
Полученную смесь обрабатывали ультразвуком на дезинтеграторе B.Braun (USA).
После соникации, раствор декантировали, и центрифугировали на центрифуге Beckman J2-21, ротор Beckman JA-14, при 12000 RPM, при +4°С, в течение 20 мин.
Осадок отбрасывали, а супернатант декантировали. Раствор телец включения ставили на магнитную мешалку, подавали раствор PBS: 0.1 М Na2HPO4 (142 г/моль), 1.45 М NaCl (58.44 г/моль), рН=7.5±0.2 и перемешивали.
Полученный раствор подвергали тангенциальной ультрафильтрации с одновременным диализом на раствор PBS. Раствор был сконцентрирован.
На фиг.5 и 6 представлена экспрессия гибридного белка, состоящего из онкобелка Е7 ВПЧ 11 типа с последовательностью SEQ №2 и белка «теплового шока» из M.tuberculosis Hsp 70, и полученного с помощью плазмиды pQE30-E711-dnaK в клетках E.coli.
Пример 5
Изготовление лекарственной формы вакцины.
Очищенный рекомбинантный белок смешивается с препаратом гидроокиси алюминия (в соотношении на 1 мг белка 0,4 мг гидроокиси алюминия), тщательно перемешивается в мягких условиях в течение 20 минут. После этого суспензия центрифугируется при 5000 оборотах/мин, супернатант собирается и используется для измерения остаточного белка. Осадок, представлющий собой гидроокись алюминия с сорбированным белком, суспендируется в фосфатном буфере и разливается по флаконам. Концентрация белка в одной дозе составляет 0,5 мг.
Пример 6
Очищенный рекомбинантный белок в концентрации 2,5 мг в мл фосфатного буфера разливается во флаконы по 0,2 мл, содержащих 10 мг маннитола, и лиофилизирируется. Каждый флакон содержит 0,5 мг белка.
Пример 7
Способ иммунотерапии возвратного папилломатоза гортани.
Реакция на введение вакцинных препаратов чрезвычайно индивидуальна, что обусловлено особенностями организации основного комплекса гистосовместимости. В связи с этим каждый случай введения препарата требует индивидуально подхода и объективных лабораторных критериев эффективности проводимой терапии. В качестве таких критериев использован уровень антителогенеза в сыворотке пациентов после введения каждой очередной дозы препарата и показатель активации гиперчувствительности замедленного типа (ГЗТ) в отношении белка Е7. Этот параметр оценивали с помощью кожной пробы путем внутрикожного введения 10 мкг пептидов, содержащих антигенные детерминанты белка Е7. 12 пациентов с диагнозом «респираторный рецидивирующий папилломатоз» вакцинировались внутрикожно одной дозой препарата, полученного по примеру 1 и 4 пациента - препаратом по примеру 2. Повторное введение препарата проводилась через две недели. У всех пациентов определяли титр специфических антител и оценивали уровень ГЗТ. У 8 пациентов регистрировали достаточный уровень антителогенеза и уровень ГЗТ. У 8 пациентов эти показатели были недостаточно выражены, в связи с этим им был рекомендован повторный курс введения препарата. После двух вакцинаций препаратом с интервалом 2 недели показатели антителогенеза и кожная проба достигли необходимого уровня. Наблюдение за пациентами в течение года показало отсутствие рецидивов заболевания.


Изобретение относится к области медицины и касается препаративных форм, которые могут быть использованы для иммунотерапии рецидивирующего папилломатоза гортани. Сущность изобретения заключается в разработке рекомбинантного гибридного белка, состоящего из онкобелка Е7 ВПЧ 11 типа с последовательностью SEQ №2 и белка «теплового шока» из M.tuberculosis Hsp 70, полученного с помощью плазмиды pQE30-E711-dnaK в клетках E.coli. Препарат против рецидивирующего папилломовируса человека содержит рекомбинантный гибридный белок в эффективном количестве и фармацевтически приемлемый носитель. Способ иммунотерапии рецидивирующего папилломатоза гортани, заключающийся в том, что пациенту внутрикожно вводят указанный препарат. Преимущество изобретения заключается в разработке нового препарата, имеющего улучшенные иммунологические характеристики. 3 н.п. ф-лы, 6 ил.
| US 6524825 A, 25.02.2003 | |||
| US 6797491 A, 28.09.2004 | |||
| US 6153201 A, 28.11.2000 | |||
| US 6900035 A, 31.05.2005. |
Авторы
Даты
2006-12-27—Публикация
2005-07-27—Подача