Изобретение относится к новым производным в ряду 2,9-дизамещен-ных имидазо[1,2-а]бензимидазола, а именно к солям 9-замещенных 2-галогенфенилимидазо[1,2-а]бензимидазолов общей формулы
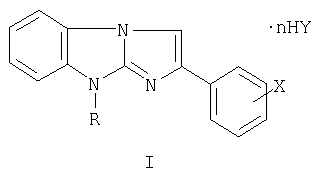
где R=C1-С6-алкил-, аллил-, бензил- и замещенный бензил-, диалкиламино-алкил; Х=F, Cl, Br в о-, м-, п-положениях фенильного ядра, дигалогены в 3,4-, 2,4-, 3,5- и в других положениях фенильного ядра; Y=Cl, Br, NO3, SO4, (СООН)2, (СН2СООН)2, СН3С6Н4SO3Н и другие фармацевтически приемлемые кислотные остатки, n=0-2 (за исключением соединений с R=(CH2)2NEt2, Х-Br или Cl, Y=Cl, n=2; R=(CH2)2NMe2, X=Y=Cl, n=2), и к промежуточным продуктам их синтеза, а именно к галогенидам 1-замещенных 3-галогенфенацил-2-аминобензимидазолия общей формулы II
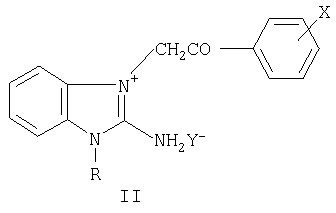
где R=C1-С6-алкил-, аллил-, бензил- и замещенный бензил-, диалкиламино-алкил; Х=F, Cl, Br в о-, м-, п-положениях фенильного ядра, дигалогены в 3,4-, 2,4-, 3,5- и в других положениях фенильного ядра; Y=Cl, Br, I (за исключением соединений с R=(CH2)2Net2, X=Br или Cl, Y=Br; R=(CH2)2NMe2, X=Cl, Y=Br), обладающим гемореологическими свойствами.
В качестве средства фармакологической коррекции нарушений реологии крови лидирующее положение занимает препарат пентоксифиллин (Регистр лекарственных средств России. Энциклопедия лекарств. РЛС-Патент, 2005, с.691-692; Н.Hikiami, H.Goto, N.Sekiya et al. Phytomedicine, 2003, v.10, №6-7, р.459-466; А.М.Зудин, Г.С.Кротовский, А.Е.Котов и др., Нарушение реологических свойств крови и их коррекция при посттромбофлебическом синдроме, Хирургия, 2004, №2, с.33-36). Препарат угнетает активность фосфодиэстеразы (приводя к увеличению внутриклеточной концентрации АТФ и цАМФ) и усиливает активность магний-зависимой протеинкиназы (Н.Hikiami, Н.Goto, N.Sekiya, N.Hattori, I.Sakakibara, Y.Shimada, K.Terasawa, Comparative efficacy of Keishi-bukuryo-gan and pentoxifylline on RBC deformability in patients with "oketsu" syndrome, Phytomedicine, 2003, №10, p.459-466). Эти эффекты проявляются в виде улучшения деформируемости и снижении агрегации эритроцитов, расслаблении гладкомышечных клеток сосудов (умеренная вазодилатация) и снижении агрегации тромбоцитов (А.С.Духанин, Ф.Р.Губаева. Фармакологическая регуляция активности тромбоцитов. Эксперим. и клин. фармакология, 1998, №4, с.66-71). Однако выраженные побочные действия - нарушение сознания, судороги, расстройства зрения, аритмии, атония кишечника, холестатический гепатит, кишечные кровотечения, кожные геморрагии, лейкопения, тромбоцитопения, гипофибриногенемия - ограничивают объем использования данного препарата в клинической практике (Регистр лекарственных средств России. Энциклопедия лекарств. РЛС-Патент, 2005, с.691-692; D.L.Dawson, Q.Zheng, S.A.Worthy, B.Charles, D.V.Bradley, Failure of pentoxifylline or cilostazol to improve blood and plasma viscosity, fibrinogen, and erythrocyte deformability in claudication, Angiology, 2002, №53, p.509-520).
Был также разработан более эффективный аналог пентоксифиллина - пропентофиллин, который оказывает влияние на несколько реологических параметров - улучшение деформируемости эритроцитов (селективное торможение фосфодиэстераз I, II, IV, увеличение внутриклеточного цАМФ), а также ингибирование агрегации тромбоцитов (L.Rossignol, M. Plantavid, Н.Chap, L.Douste-Blazy, Effect of pentoxifylline and propentofylline on the turnover of poliphosphoinositides of the erythrocyte membrane and on the metabolism of arachidonic acid on platelets, Pathol. Biol., 1988, №36, p.1073-1075). Однако проведение клинических испытаний показали высокий уровень токсичности пропентофиллина и в 2000 году. Европейский комитет по патентованным медицинским продуктам отозвал у производителей лицензию на данный препарат (В.П.Фисенко, А.П.Дрожжин, М.Т.Абидов. Анализ наиболее перспективных исследований по созданию новых лекарственных средств. Научный центр экспертизы и государственного контроля лекарственных средств Минздрава России, 2000, 48 с.).
В ряду 2,9-дизамещенных имидазо[1,2-а]бензимидазола известен дигидрохлорид 2-(4-бромфенил)-9-диэтиламиноэтилимидазо[1,2-а]бензимидазола, проявляющий гипотензивные и противовоспалительные свойства (Симонов А.М., Ковалев Г.В., Анисимова В.А. и др., Авт. свид. №566588 (СССР), M.кл2. А 61 К 31/475; Бюл. изобр., 1977, №28; Ковалев Г.В., Анисимова В.А., Симонов А.М. и др., Хим.-фарм. журнал, 1979, т.13, №8, с.57-62).
В ряду 2,9-дизамещенных имидазо[1,2-а]бензимидазола и промежуточных галогенидов 1-замещенных 3-фенацил-2-аминобензимидазолия неизвестны соединения, проявляющие гемореологические свойства.
Техническим результатом изобретения являются новые соединения в ряду 2,9-дизамещенных имидазо[1,2-а]бензимидазолов, а также в ряду промежуточных продуктов их синтеза, проявляющие неизвестное для данных классов соединений гемореологическое действие, более эффективное, чем действие лидирующего в этом виде активности известного препарата "пентоксифиллин".
Технический результат достигается соединениями формулы I и II, синтез которых заключается во взаимодействии 1-замещенных 2-аминобензимидазолов с Bz-галогензамещенными фенацилгалогенидами и дальнейшей циклизации промежуточно образующихся галогенидов 1-замещенных 3-галогенфенацил-2-аминобензимидазолия II до 2-галогенфенилимидазо[1,2-а]-бензимидазолов и переводе трициклических оснований в фармацевтически приемлемые соли I.

где R, X, Y, n принимают значения, указанные выше.
Строение всех синтезированных соединений доказано элементным анализом, ИК- и ЯМР 1Н спектрами. В ИК-спектрах солей II, снятых в вазелиновом масле, имеются полосы поглощения карбонильной группы в области 1700-1710 см-1, а также две полосы валентных колебаний первичной аминогруппы в области 3150-3350 см-1, что указывает на существование этих соединений в кристаллическом состоянии в виде солей 2-аминобензимидазолия. В спектрах ЯМР 1H этих солей наблюдаются двухпротонные синглетные сигналы (δ 6,0-6,2), которые соответствуют поглощению метиленовых протонов бензоилметильных радикалов. Сигналы протонов аминогруппы (2Н) проявляются в виде узких синглетов с δ 8,50-9,50. Перечисленные сигналы отсутствуют в спектрах трициклических оснований I.
Ниже приведены примеры методик синтеза предлагаемых соединений.
Пример 1. Стадия 1. Бромид 2-амино-3-(4-бромфенацил)-1-(2-ди-этиламиноэтил)бензимидазолия (IIa). В горячий раствор 2,32 г (10 ммоль) 2-амино-1-(2-диэтиламиноэтил)бензимидазола в 50 мл ацетона вносят 2,78 г (10 ммоль) 4-бромфенацилбромида. Смесь перемешивают до растворения последнего, нагревают до начала выпадения осадка и оставляют стоять в течение 4-6 ч при комнатной температуре. Затем выпавший осадок отфильтровывают, тщательно промывают ацетоном. Выход 4,82 г (94,5%), т.пл. 224°С (разл). Лит. т.пл. 224°С. Найдено, %: С 49,44; Н 5,09; Br 31,40; N 11,04. C21H26Br2N4O. Вычислено, %: С 49,43; Н 5,14; Br 31,32; N 10,98.
По такой методике синтезированы и другие четвертичные соли II на основе 1-замещенных 2-аминобензимидазолов и Bz-галогензамещенных фенацилбромидов. Эти соли в основном хроматографически чистые и их вводят в реакции циклизации без дополнительной очистки.
Стадия 2. Дигидробромид 2-(4-бромфенил)-9-(2-диэтиламиноэтил)имидазо[1,2-а]бензимидазола (Ia). Кипятят 5 ммоль бромида IIа в 100 мл воды до полного протекания реакции (3-5 ч, контроль - ТСХ). Затем раствор подщелачивают до рН 8-9 и выделившееся основание экстрагируют хлороформом. Экстракт пропускают через слой Al2О3 (элюент - CHCl3). Остаток после испарения CHCl3 из элюата растворяют в ацетоне и подкисляют раствор конц. HBr до рН 1-2. Выход 91,3%, т.пл. 263-264°С (разл., EtOH). Спектр ЯМР 1H, δ, м.д.: 1,35 (6Н, т, 2СН3); 3,32 (4Н, к, N(СН2)2); 3,63 (2Н, т, N(СН2)2); 5,14 (2Н, т, NCH2); 7,47 (2Н, дт, 2',6'-Н); 7,62 (2Н, д, 3',5'-Н); 7,85-8,24 (4Н, м, аром. Н); 8,60 (1Н, с, 3-Н); 11,77 (1Н, ушир. с, N+H); H+ в обмене. Найдено, %: С 44,07; Н 4,35; Br 41,71; N 9,90. C21H23BrN4·2HBr. Вычислено, %:С 44,00; Н 4,40; Br 41,82; N 9,78.
Пример 2. Стадия 1. Бромид 2-амино-3-(4-бромфенацил)-1-(2-пиперидиноэтил)бензимидазолия (IIб). Получен исходя из 2-амино-1-(2-пиперидиноэтил)бензимидазола и 4-бромфенацилбромида. Выход 96,05%, т.пл. 204°С (разл.). Найдено, %: С 50,48; Н 4,92; Br 30,70; N 10,87. C22H26Br2N4O. Вычислено, %: С 50,59; Н 5,02; Br 30,60; N 10,73.
Стадия 2. Динитрат 2-(4-бромфенил)-9-(2-пиперидиноэтил)имидазо-[1,2-а]бензимидазола (Iб). Синтезирован кипячением бромида IIб в воде (см. пример 1, стадия 2), выделением циклического основания и получением динитрата 16 подкислением ацетонового раствора основания ацетоновым раствором NHO3. Выход 78,6%, т.пл. 176-177°С (разл., 2-РгОН). Спектр ЯМР 1Н, δ, м.д.: 1,35-2,14 (6Н, м, -(СН2)3-); 2,82-3,07 (4Н, м, N(CH2)2); 3,53 (2Н, т, NCH2); 5,17 (2Н, т, NCH2); 7,44 (2Н, дт, 2',6'-Н); 7,60 (2Н, д, 3',5'-Н); 7,81-8,19 (4Н, м, аром. Н); 8,55 (1Н, с, 3-Н); 11,84 (1Н, ушир. с, N+Н); H+ в обмене. Найдено, %: С 48,11; Н 4,55; Br 14,60; N 15,33. С22Н23BrH4·2HNO3. Вычислено, %: С 48,10; Н 4,59; Br 14,54; N 15,30.
Пример 3. Стадия 1. Бромид 2-амино-1-(2-диэтиламиноэтил)-3-(3-бромфенацил)бензимидазолия (IIв). Получен аналогично бромиду 1а исходя из 2-амино-1-(2-диэтиламиноэтил)бензимидазола и 3-бромфенацилбромида. Выход 89,25%. Т.пл. 186-188°С (разл.). Найдено, %: С 49,35; Н 5,19; Br 31,19; N 11,21. C21H26Br2N4O. Вычислено, %: С 49,43; Н 5,14; Br 31,32; N 10,98.
Стадия 2. Дигидрохлорид 2-(3-бромфенил)-9-(2-диэтиламиноэтил)имидазо[1,2-а]бензимидазола (Iв). Получен при подкислении ацетонового раствора, выделенного в результате циклизации основания I конц. HCl до рН 2-3. Выход 89,6%, т.пл. 269-271°С (разл., EtOH-Н2O). Спектр ЯМР 1Н, δ, м.д.: 1,33 (6Н, т, 2СН3); 3,25 (4Н, к, N(CH2)2); 3,60 (2Н, т, NCH2); 5,07 (2Н, т, NCH2); 7,11-8,17 (8Н, м, аром. Н); 8,52 (1Н, с, 3-Н); 11,45 (1Н, ушир. с, N+H); Н+ в обмене. Найдено, %: С 52,05; Н 5,18; Br 16,55; Cl 14,68; N 11,54. C21H23BrN4·2HCl. Вычислено, %: С 52,09; Н 5,20; Br 16,50; Cl 14,64; N 11,57.
Пример 4. Стадия 1. Бромид 2-амино-1-(2-диметиламиноэтил)-3-(4-хлорфенацил)бензимидазолия (IIг). Синтезирован исходя из 2-амино-1-(2-диметиламиноэтил)бензимидазола и 4-хлорфенацилбромида. Выход 88,64%, т.пл. технич. образца 187-189°С (разл.). Лит. т.пл. 219°С (разл.). Найдено, %: С 52,10; Н 5,17; Br 18,20; Cl 8,17; N 12,74. C19H22BrClN4O. Вычислено, %: С 52,13; Н 5,07; Br 18,25; Cl 8,10; N 12,80.
Стадия 2. Динитрат 9-(2-диметиламиноэтил)-2-(4-хлорфенил)имидазо-[1,2-а]бензимидазола (Iг). Получен подкислением ацетонового раствора циклического основания I, выделенного после кипячения бромида IIг в воде, раствором HNO3 в ацетоне. Выход 86,8%, т.пл. 164-165°С (разл., CH3CN). Спектр ЯМР 1Н, δ, м.д.: 3,04 (6Н, с, N(CH3)2); 3,75 (2Н, т, СН3); 5,18 (2Н, т, СН2); 7,25 (2Н, т, 3',5'-Н); 7,53 (2Н, дт, 2',6'-Н); 7,93-8,20 (4Н, м, аром. Н); 8,61 (1Н, с, 3-Н); 11,85 (1Н, ушир. с, N+H); Н+ в обмене. Найдено, %: С 49,23; Н 4,64; Cl 7,45; N 18,32. C19H19ClN4·2HNO3. Вычислено, %: С 49,13; Н 4,56; Cl 7,53; N 18,10.
Пример 5. Стадия 1. Бромид 2-амино-1-(2-диэтиламиноэтил)-3-(4-хлорфенацил)бензимидазолия (IIд). Получен исходя из 2-амино-1-(2-ди-этиламиноэтил)бензимидазола и 4-хлорфенацилбромида. Выход 90,32%, т.пл. 196-198°С (разл.). Лит. т.пл. 196-197°С (разл.).Найдено, %: С 54,11; Н 5,69; Br 17,23; Cl 7,68; N 12,09. С21Н26BrClN4O. Вычислено, %: С 54,15; Н 5,63; Br 17,15; Cl 7,61; N 12,03.
Стадия 2. Динитрат 9-(2-диэтиламиноэтил)-2-(4-хлорфенил)имидазо[1,2-а]бензимидазола (Iд). Синтезирован аналогично динитрату Iг. Выход 88,4%, т.пл. 169-171°С (разл., СН3CN). Спектр ЯМР 1Н, δ, м.д.: 1,37 (6Н, т, 2СН3); 3,31 (4Н, к, N(CH2)2); 3,64 (2Н, т, NCH2); 5,17 (2Н, т, NCH2); 7,32-8,24 (8Н, м, аром. Н); 8,60 (1Н, с, 3-Н); 11,78 (1Н, ушир. с, N+H); H+ в обмене. Найдено, %: С 51,34; Н 5,19; Cl 7,04; N 17,32. C21H23ClN4·2HNO3. Вычислено, %: С 51,17; Н 5,11; Cl 7,19; N 17,05.
Пример 6. Стадия 1. Бромид 2-амино-1-(2-пиперидиноэтил)-3-(4-хлорфенацил)бензимидазолия (IIe). Получен по стандартной методике из 2-амино-1-(2-пиперидиноэтил)бензимидазола и 4-хлорфенацилбромида. Выход 95,8%, т.пл. 194-195°С (разл). Найдено, %: С 55,25; Н 5,48; Br 16,77; Cl 7,50; N 11,78. C22H26BrClN4O. Вычислено, %: С 55,30; Н 5,55; Br 16,72; Cl 7,42; N 17,73.
Стадия 2. Дигидрохлорид 9-(2-пиперидиноэтил)-2-(4-хлорфенил)имидазо[1,2-а]бензимидазола (Ie). Дигидрохлорид выделен в результате подкисления раствора циклического основания (т.пл. 112-113°С) в спирте конц. HCl. Выход 92,6%, т.пл. 285-286°С (разл., 60% EtOH). Спектр ЯМР 1Н, δ, м.д.: 1,36-2,00 (6Н, м, -(СН2)3-); 3,11-3,54 (4Н, м, N(CH2)2); 3,64 (2Н, т, NCH2); 4,97 (2Н, т, NCH2); 7,24-8,10 (8Н, м, аром. Н); 8,50 (1Н, с, 3-Н); 11,08 (1Н, ушир. с, N+Н); H+ в обмене. Найдено, %: С 58,54; Н 5,50; Cl 23,48; N 12,48. С22Н23ClN4·2HCl. Вычислено, %: С 58,48; Н 5,58; С 123,54; N 12,40.
Пример 7. Стадия 1. Бромид 1-аллил-2-амино-3-(4-хлорфенацил)-бензимидазолия (IIж). Получен с выходом 96,3% при взаимодействии эквимолярных количеств 1-аллил-2-аминобензимидазола и 4-хлорфенацилбромида в ацетоне. Т.пл. 247-248°С (разл., EtOH). Найдено, %: С 53,17; Н 4,23; Br 19,67; Cl 8,77; N 10,33. С18Н17BrClN3O. Вычислено, %: С 53,16; Н 4,21; Br 19,65; Cl 8,72; N 10,33.
Стадия 2. Гидробромид 9-аллил-2-(4-хлорфенил)имидазо[1,2-а]бензимидазола (IIж). Кипятят 0,01 моль бромида IIж в 30 мл конц. HCl в течение 1,5-2 ч. Осадок после охлаждения реакционной массы отфильтровывают, промывают небольшим количеством ледяной воды и ацетоном. Затем суспендируют полученную соль в 20 мл воды, нагревают и подщелачивают раствором аммиака. Охлаждают, осадок 9-аллил-2-(4-хлорфенил)имидазо[1,2-а]бензимидазола отфильтровывают, сушат на воздухе. Выход 86,6%. Т.пл. 134-135°С (2-PrOH). Найдено, %: С 70,21; Н 5,01; Cl 11,50; N 13,68. С18Н14ClN3. Вычислено, %: С 70,25; Н 4,58; Cl 11,52; N 13,65.
Гидробромид Iж получен действием конц. HBr на полученное основание в спирте. Выход 89,7%. Т.пл. 249-250°С (разл., EtOH). Спектр ЯМР 1H δ, м.д.: 4,91 (2Н, д, NCH2); 5,18-5,59 (2Н, дд, СН2); 5,97-6,15 (1Н, м, СН); 6,93-8,25 (8Н, м, аром. Н); 8,55 (1Н, с, 3-Н); Н+ в обмене. Найдено, %: С 55,59; Н 3,92; Br 20,60; Cl 9,07; N 10,82. С18Н14ClN3·HBr. Вычислено, %: С 55,62; Н 3,89; Br 20,56; Cl 9,12; N 10,81.
Пример 8. Стадия 1. Бромид 2-амино-1-(2-диэтиламиноэтил)-3-(2-хлорфенацил)бензимидазолия (IIз). Выход 84,2%. Т.пл. 174-175°С (разл.). Найдено, %: С 54,04; Н 5,74; Br 17,5; Cl 7,54; N 12,23. C21Н26BrClN4O. Вычислено, %: с 54,15; Н 5,63; Br 17,15; Cl 7,61; N 12,03.
Стадия 2. Толуолсульфонат 9-(2-диэтиламиноэтил)-2-(2-хлорфенил)имидазо[1,2-а]бензимидазола моногидрат (Iз). Циклизацию соли Из проводят кипячением в воде. Толуолсульфонат получают, смешивая эквивалентные количества насыщенных ацетоновых растворов основания 2-хлорфенилимидазо[1,2-а]бензимидазола и 4-толуолсульфокислоты. Выход 77,5%, т.пл. 120-121°С (СН3CN). Спектр ЯМР 1Н, δ, м.д.: 1,33 (6Н, т, 2СН3); 2,55 (3Н, с, СН3); 3,23 (4Н, к, N(CH2)2); 3,51 (2Н, т, NCH2); 4,95 (2Н, т, NCH2); 7,21-8,43 (12Н, м, аром. Н); Н+ в обмене. Найдено, %: С 60,21; Н 6,07; Cl 6,45; N 10,20; S 5,63. С21Н23ClN4·С7Н8O3S·Н2O. Вычислено, %: С 60,37; Н 5,97; Cl 6,36; N 10,06; S 5,75.
Пример 9. Стадия 1. Бромид 2-амино-1-метил-3-(4-фторфенацил)-бензимидазолия (IIи) получен взаимодействием эквимолярных количеств 2-амино-1-метилбензимидазола и 4-фторфенацилбромида. Выход 97,5%, т.пл. 319-320°С (разл.). Найдено, %: С 52,79; Н 4,20; Br 21,86; F 5,20; N 11,44. C16H15BrFN3O. Вычислено, %: С 52,76; Н 4,15; Br 21,94; F 5,22; N 11,54.
Стадия 2. Гидрохлорид 9-метил-2-(4-фторфенил)имидазо[1,2-а]бензимидазола (Iи). Нагревают смесь 3,64 г (10 ммоль) бромида 1-метил-3-(4-фторфенацил)бензимидазолия, 2 г мелкорастертого Na2CO3, 100 мл EtOH и 20 мл Н2O до полного протекания реакции (15-20 часов, контроль - ТСХ). Затем спирт упаривают, к остатку прибавляют 30 мл воды, осадок отфильтровывают, промывают водой и сушат на воздухе. Полученное основание очищают от примесей, сидящих на старте, с помощью колоночной хроматографии (γ-Al2О3, элюент - CHCl3). Остаток (хроматографически чистое основание, т.пл. 126-127°С) после испарения CHCl3 из элюата растворяют в ацетоне и получают соль подкислением ацетонового раствора конц. HCl. Выход 87,9%, т.пл. 240-241°С (EtOH-Н2O). Спектр ЯМР 1H δ, м.д.: 4,06 (3Н, с, СН3); 7,33 (2Н, т, 3',5'-Н); 7,41-7,64 (2Н, м, 2',6'-Н); 7,73-8,11 (4Н, м, аром. Н); 8,58 (1Н, с, 3-Н); Н+ в обмене. Найдено, %: С 63,55; Н 4,44; Cl 11,86; F 6,32; N 13,83. C16H12FN3·HCl Вычислено, %: С 63,69; Н 4,34; Cl 11,75; F 6,30; N 13,92.
Пример 10. Стадия I. Бромид 2-амино-1-бутил-3-(4-фторфенацил)-бензимидазолия (IIк). Получен взаимодействием эквимолярных количеств 2-амино-1-бутилбензимидазола и 4-фторфенацилбромида в ацетоне. Выход 96,06%, т.пл. 231-232°С (разл). Найдено, %: С 56,25; Н 5,17; Br 19,77; F 4,62; N 10,38. C19H21BrFN3O. Вычислено, %: С 56,17; Н 5,21; Br 19,67; F 4,68; N 10,34.
Стадия 2. Гидрохлорид 9-бутил-2-(4-фторфенил)имидазо[1,2-а]бензимидазола (Iк) синтезирован кипячением бромида IIк в водно-спиртовом растворе в присутствии Na2СО3 и последующем переводе полученного циклического основания в гидрохлорид с помощью конц. HCl. Выход 84,0%, т.пл. 234-235°С (EtOH). Спектр ЯМР 1Н, δ, м.д.: 0,98 (3Н, т, СН3); 1,47 (2Н, секст, СН2); 1,91 (2Н, кв, СН2); 4,67 (2Н, т, NCH;); 7,26 (2Н, т, 3',7'-Н); 7,48 (2Н, дт, 2',6'-Н); 7,72-8,20 (4Н, м, аром. Н); 8,60 (1Н, с, 3-Н); H+ в обмене. Найдено, %: С 66,45; Н 5,50; Cl 10,11; F 5,59; N 12,25. C19H18FN3·HCl. Вычислено, %: С 66,37; Н 5,57; Cl 10,21; F 5,53; N 12,22.
Пример 11. Стадия 1. Хлорид 1-аллил-2-амино-3-(4-фторфенацил)-бензимидазолия (IIл). Смесь 0,69 г (4 ммоль) 1-аллил-2-аминобензимидазола и 0,70 г (4 ммоль) ω-хлор-4-фторацетофенона в 15 мл СН3CN кипятят до полного протекания реакции (8 ч, контроль - ТСХ). Охлаждают, осадок отфильтровывают, промывают ацетонитрилом. Выход 1,30 г (93,3%), т.пл. 254°С. Найдено, %: С 65,47; Н 5,07; Cl 10,21; F 5,55; N 12,13. C18H17ClFN3O. Вычислено, %: С 65,52; Н 4,96; Cl 10,25; F 5,49; N 12,15.
Стадия 2. Гидрохлорид 9-аллил-2-(4-фторфенил)имидазо[1,2-а]бензимидазола (Iл). Полученный хлорид IIл обрабатывают раствором 22% NH4OH при комнатной температуре. Через 3-4 часа видоизменившийся осадок отфильтровывают, промывают водой, сушат на воздухе. Выход 1-аллил-2-имино-3-(4-фторфенацил)бензимидазолина количественный, т.пл. 157-158°С. В открытой пробирке нагревают полученное основание до температуры 170°С и выдерживают до полного протекания реакции циклизации (15-20 мин). После охлаждения плав растворяют в минимальном количестве CHCl3, раствор пропускают через слой Al2О3, элюируя конечный трицикл хлороформом. Элюат упаривают до небольшого объема и подкисляют раствором HCl в 2-PrOH. Выпавший осадок гидрохлорида Iл отфильтровывают, промывают ацетоном. Выход 89,7%, т.пл. 245-246°С (разл., EtOH-Н2О). Спектр ЯМР 1Н, δ, м.д.: 4,87 (2Н, д, NCH2); 5,16-5,61 (2Н, дд, СН2); 5,94-6,17 (1Н, м, СН); 6,90-8,14 (8Н, м, аром. Н); 8,48 (1Н, с, 3-Н); Н+ в обмене. Найдено, %: С 66,00; Н 4,53; Cl 10,75; F 5,87; N 12,85. C18H14FN3·HCl. Вычислено, %: С 66,04; Н 4,62; Cl 10,69; F 5,81; N 12,84.
Пример 12. Стадия 1. Бромид 2-амино-1-бензил-3-(4-фторфенацил)-бензимидазолия (IIм) получен исходя из 2-амино-1-бензилбензимидазола и 4-фторфенацилбромида. Выход 95,0%, т.пл. 293-295°С (разл.). Найдено, %: С 60,00; Н 4,44; Br 18,25; F 4,37; N 9,48. C22H19BrFN3O. Вычислено, %: С 60,01; Н 4,35; Br 18,18; F 4,31; N 9,54.
Стадия 2. Гидрохлорид 9-бензил-2-(4-фторфенил)имидазо[1,2-а]бензимидазола (Iм) синтезирован кипячением бромида IIм в водно-спиртовом растворе в присутствии Na2СО3 и последующим переводом полученного циклического основания в гидрохлорид Iм. Выход 92,8%, т.пл. 248-250°С (EtOH-Н2O). Спектр ЯМР 1Н, δ, м.д.: 5,78 (2Н, с, СН2); 7,21-8,13 (13Н, м, аром. Н); 8,50 (1Н, с, 3-Н); H+ в обмене. Найдено, %: С 69,89; Н 4,59; Cl 9,31; F 5,11; N 11,10. C22H16FN3·HCl Вычислено, %: С 69,93; Н 4,53; Cl 9,38; F 5,03; N 11,13.
Пример 13. Стадия 1. Бромид 2-амино-1-(4-метилбензил)-3-(4-фтор-фенацил)бензимидазолия (IIн) получен в результате взаимодействия 2-амино-1-(4-метилбензил)бензимидазола и 4-фторфенацилбромида в ацетоне. Выход 88,1%, т.пл. >245°С (разл.). Найдено, %: С 60,70; Н 4,69; Br 17,65; F 4,16; N 9,31. С23Н21BrFN3О. Вычислено, %: С 60,80; Н 4,66; Br 17,59; F 4,18; N 9,25.
Стадия 2. Нитрат 9-(4-метилбензил)-2-(4-фторфенил)имидазо[1,2-а]бензимидазола (Iн) синтезирован кипячением бромида IIн в водно-спиртовом растворе в присутствии Na2СО3. Полученное основание кристаллизуют из ацетонитрила, выделяя 9-(4-метилбензил)-2-(4-фторфенил)имидазо[1,2-а]бензимидазол. Выход 94,8%, т.пл. 171-172°С (CH3CN). Спектр ЯМР 1Н, δ, м.д.: 2,24 (ЗН, с, СН3); 5,39 (2Н, с, СН2); 7,08-7,37 (4Н, м, аром. Н); 7,64 (2Н, дд, 6,7-Н); 7,89 (2Н, т, 5,8-Н); 8,16 (1Н, с, 3-Н). Найдено, %: С 77,70; Н 5,05; F 4,41; N 11,84. C23H18FN3. Вычислено, %: С 77,73; Н 5,10; F 4,35; N 11,82. Основание растворяют в EtOH и подкисляют раствором HNO3 в EtOH. Выход 92,4%, т. пл. 170-171°С (разл.). Найдено, %: С 66,00; Н 4,54; F 4,50; N 13,43. С23Н18FN3·HNO3. Вычислено, %: С 66,02; Н 4,58; F 4,54; N 13,39.
Пример 14. Стадия I. Бромид 2-амино-1-(4-трет-бутилбензил)-3-(4-фторфенацил)бензимидазолия (IIo) получен исходя из 2-амино-1-(4-трет-бутилбензил)бензимидазола и 4-фторфенацилбромида. Выход 93,5%, т.пл. 272-273°С (разл.). Найдено, %: С 62,87; Н 5,55; Br 16,11; F 3,85; N 8,42. С26Н27BrFN3О. Вычислено, %: С 62,91; Н 5,48; Br 16,10; F 3,83; N 8,46.
Стадия 2. Гидробромид 9-(4-трет-бутилбензил)-2-(4-фторфенил)имидазо[1,2-а]бензимидазола (Io). Бромид IIо циклизуют в водно-спиртовом растворе в присутствии Na2СО3 до основания 9-(4-трет-бутилбензил)-2-(4-фторфенил)имидазо[1,2-а]бензимидазола. Выход 92,7%, т.пл. 165-166°С (СН3CN). Спектр ЯМР 1Н, δ, м.д.: 1,22 (9Н, с, С(СН3)3); 5,40 (2Н, с, СН2); 7,14-7,42 (4Н, с, аром. Н); 7,64 (2Н, дд, 6,7-Н); 7,90 (2Н, т, 5,8-Н); 8,17 (1Н, с, 3-Н). Найдено, %: С 78,50; Н 6,11; F 4,81; N 10,58. C26H24FN3. Вычислено, %: С 78,56; Н 6,09; F 4,78; N 10,57. Основание растворяют в EtOH и подкисляют концентрированной HBr. Выход 91,8%, т.пл. 269-270°С (разл., EtOH). Найдено, %: С 65,33; Н 5,24; Br 16,63; F 4,02; N 8,78. С26Н24FN3·HBr. Вычислено, %: С 65,28; Н 5,27; Br 16,70; F 3,97; N 8,78.
Пример 15. Стадия 1. Бромид 2-амино-3-(4-фторфенацил)-1-(4-хлор-бензил)бензимидазолия (IIп) получен по стандартной методике из эквимолярных количеств 2-амино-1-(4-хлорбензил)бензимидазола и 4-фторфенацилбромида в ацетоне. Выход 92,4%, т.пл. >285°С (разл.). Найдено, %: С 55,58; Н 3,80; Br 16,88; Cl 7,52; F 4,02; N 8,80. С22Н18BrClFN3О. Вычислено, %: С 55,66; Н 3,82; Br 16,83; Cl 7,47; F 4,00; N 8,85.
Стадия 2. Гидрохлорид 9-(4-хлорбензил)-2-(4-фторфенил)имидазо[1,2- а]бензимидазола (Iп). Циклизацию бромида IIп проводят в водно-спиртовом растворе в присутствии Na2CO3. Выход основания 9-(4-хлорбензил)-2-(4-фторфенил)имидазо[1,2-а]бензимидазола 87,9%, т.пл. 187-188°С (EtOH). Спектр ЯМР 1H, δ, м.д.: 5,45 (2Н, с, СН2); 7,12-7,50 (4Н, м, аром. Н); 7,66 (2Н, дд, 6,7-Н); 7,88 (2Н, т, 5,8-Н); 8,17 (1Н, с, 3-Н). Найдено, %: С 70,29; Н 4,05; Cl 9,39; F 5,11; N 11,16. C22H15ClFN3. Вычислено, %: С 70,31; Н 4,02; Cl 9,43; F 5,06; N 11,18. Основание растворяют в ЕЮН и подкисляют концентрированной HCl. Выход 94,3%, т. пл. 266-268°С (разл., EtOH). Найдено, %: С 64,05; Н 3,85; Cl 17,27; F 4,62; N 10,21. C22H15ClFN3·HCl. Вычислено, %: С 64,09; Н 3,91; Cl 17,20; F 4,61; N 10,19.
Пример 16. Стадия 1. Бромид 2-амино-(2-диметиламиноэтил)-3-(4-фторфенацил)бензимидазолия (IIp). Получен исходя из 2-амино-1-(2-диметиламиноэтил)бензимидазола и 4-фторфенапилбромида. Выход 80,95%, т.пл. 207-208°С (разл.). Найдено, %: С 54,10; Н 5,31; Br 18,81; F 4,55; N 13,25. C19H22BrFN4O. Вычислено, %: С 54,17; Н 5,26; Br 18,97; F 4,51; N 13,30.
Стадия 2. Дигидрохлорид 9-(2-диметиламиноэтил)-2-(4-фторфенил)имидазо[1,2-а]бензимидазола (Ip). Синтезирован кипячением бромида IIp в воде, выделением циклического основания и переводе его в дигидрохлорид. Выход 63,3%, т.пл. 236-237°С (EtOH). Спектр ЯМР 1Н, δ, м.д.: 2,96 (6Н, с, Н(СН3)2); 3,68 (2Н, т, СН2); 5,11 (2Н, т, СН2); 7,28 (2Н, т, 3',5'-Н); 7,49 (2Н, дт, 2',6'-Н); 7,91-8,17 (4Н, м, аром. Н); 8,58 (1Н, с, 3-Н); 11,52 (1Н, ушир. с, N+Н); H+ в обмене. Найдено, %: С 57,59; Н 5,42; Cl 17,88; F 4,90; N 14,20. C19H19FN4· 2HCl. Вычислено, %: С 57,73; Н 5,35; Cl 17,94; F 4,81; N 14,17.
Пример 17. Стадия 1. Хлорид 2-амино-1-диэтиламиноэтил-3-(4-фторфенацил)бензимидазолия (IIc). Получен аналогично хлориду IIл из 2-амино-1-диэтиламиноэтилбензимидазола и ω-хлор-4-фторацетофенона в СН3CN. Выход 95,6%, т.пл. 194°С. Найдено, %: С 62,33; Н 6,51; Cl 8,70; F 4,75; N 13,77. C21H26ClFN4O. Вычислено, %: С 62,29; Н 6,47; Cl 8,76; F 4,69; N 13,84.
Стадия 2. Дигидрохлорид 9-диэтиламиноэтил-2-(4-фторфенил)имидазо[1,2-а]бензимидазола (Ic). Кипятят 0,81 г (2 ммоль) соли IIc в 50 мл воды до полного протекания реакции (3-5 ч, контроль - ТСХ). Затем раствор подщелачивают и выделившееся основание экстрагируют хлороформом. Экстракт пропускают через слой Al2О3 (элюент - CHCl3). Остаток после испарения CHCl3 из элюата растворяют в ацетоне и подкисляют раствором HCl в 2-PrOH, получая дигидрохлорид Ic. Выход 0,66 г (78,3%), т.пл. 239-240°С (2-PrOH-EtOH, 4:1). Спектр ЯМР 1Н, δ, м.д.: 1,28 (6Н, т, 2СН3); 3,32 (4Н, к, N(CH2)2); 3,67 (2Н, т, NCH2); 5,04 (2Н, т, NCH2); 7,23-8,15 (8Н, м, аром. Н); 8,55 (1Н, с, 3-Н); 11,12 (1Н, ушир. с, N+Н); H+ в обмене. Найдено, %: С 59,56; Н 6,00; Cl 16,80; F 4,41; N 13,23. C21H23FN4·2HCl. Вычислено, %: С 59,58; Н 5,95; Cl 16,75; F 4,49; N 13,23.
Пример 18. Стадия 1. Бромид 2-амино-1-(2-диэтиламиноэтил)-3-(4-фторфенацил)бензимидазолия (IIт). Получен исходя из 2-амино-1-(2-диэтиламиноэтил)бензимидазола и 4-фторфенацилбромида. Выход 91,76%, т.пл. 187-188°С. Найдено, %: С 56,19; Н 5,88; Br 17,90; F 4,27; N 12,44. C21H26BrFN4O. Вычислено, %: С 56,13; Н 5,83; Br 17,78; F 4,23; N 12,47.
Стадия 2. Дигидробромид 9-(2-диэтиламиноэтил)-2-(4-фторфенил)имидазо[1,2-а]бензимидазола (Iт). Выделенное после кипячения бромида IIт в воде циклическое основание переводят в дигидрохлорид с помощью раствора HCl в 2-РгОН. Выход 91,8%, т.пл. 265-267°С (разл., EtOH). Спектр ЯМР 1H δ, м.д.: 1,31 (6Н, т, 2СН3); 3,35 (4Н, к, N(CH2)2); 3,70 (2Н, т, NCH2); 5,09 (2Н, т, NCH2); 7,19-8,10 (8Н, м, аром. Н); 8,71 (1Н, с, 3-Н); 11,53 (1Н, ушир. с, N+H); Н+ в обмене. Найдено, %: С 49,22; Н 4,97; Br 31,18; F 3,76; N 10,87. C21H23FN4·2HBr. Вычислено, %: С 49,23; Н 4,92; Br 31,20; F 3,71; N 10,94.
Пример 19. Стадия 1. Бромид 2-амино-1-(2-пирролидиноэтил)-3-(4-фторфенацил)бензимидазолия (IIу). Получен обычным путем из 2-амино-1-(2-пирролидиноэтил)бензимидазола и 4-фторфенацилбромида в ацетоне. Выход 88,8%, т.пл. 179-180°С. Найдено, %: С 56,34; Н 5,45; Br 17,68; F 4,36; N 12,56. C21H24BrFN4O. Вычислено, %: С 56,38; Н 5,41; Br 17,86; F 4,25; N 12,52.
Стадия 2. Дигидрохлорид 9-(2-пирролидиноэтил)-2-(4-фторфенил)имидазо[1,2-а]бензимидазола (Iу). Синтезирован аналогично дигидрохлориду Iт. Выход 81,63%, т.пл. 257-258°С (разл., 2-РгОН). Спектр ЯМР 1H, δ, м.д.: 2,08 (4Н, кв, -(СН3)2-); 3,31 (2Н, т, NCH2); 3,64 (2Н, т, NCH2); 3,76 (2Н, т, NCH2); 5,17 (2Н, т, NCH2); 7,21 (2Н, т, 3',5'-Н); 7,47 (2Н, дт, 2',6'-Н); 7,86-8,20 (4Н, м, аром. Н); 8,48 (1Н, с, 3-Н); 12,40 (1Н, ушир. с, N+H); H+ в обмене. Найдено, %: С 59,79; Н 5,60; Cl 16,78; F 4,44; N 13,39. C21H21FN4·2HCl Вычислено, %: С 59,86; Н 5,50; Cl 16,83; F 4,51; N 13,30.
Пример 20. Стадия I. Бромид 2-амино-1-(2-пиперидиноэтил)-3-(4-фторфенацил)бензимидазолия (IIф) получен при взаимодействии 2-амино-1-(2-пиперидиноэтил)бензимидазола и 4-фторфенацилбромида в ацетоне. Выход 92,7%, т.пл. 185-186°С. Найдено, %: С 57,30; Н 5,68; Br 17,25; F 4,06; N 12,25. C22H26BrFN4O. Вычислено, %: С 57,27; Н 5,68; Br 17,32; F 4,12; N 12,14.
Стадия 2. Дигидрохлорид 9-(2-пиперидиноэтил)-2-(4-фторфенил)имидазо[1,2-а]бензимидазола (Iф) синтезирован аналогично соли Iт. Выход 90,6%, т.пл. 260-262°С (EtOH). Спектр ЯМР 1H δ, м.д.: 1,38-2,18 (6Н, м, -(СН2)3-); 2,87-3,17 (4Н, м, N(CH2)2); 3,59 (2Н, т, NCH2); 5,22 (2Н, т, NCH2); 7,24 (2Н, т, 3',5'-Н); 7,48 (2Н, дт, 2',6'-Н); 7,86-8,32 (4Н, м, аром. Н); 8,53 (1Н, с, 3-Н); 11,92 (1Н, ушир. с, N+H); Н+ в обмене. Найдено, %: С 60,73; Н 5,73; Cl 16,37; F 4,33; N 12,84. C22H23FN4·2HCl. Вычислено, %: С 60,69; Н 5,79; Cl 16,29; F 4,36; N 12,87.
Пример 21. Стадия 1. Бромид 2-амино-1-диметиламиноэтил-3-(3,4-дихлорфенацил)бензимидазолия (IIx). Получен исходя из 2-амино-1-(2-ди-метиламиноэтил)бензимидазола и 3,4-дихлорфенацилбромида в ацетоне. Выход 83,2%, т.пл. 187-188°С (разл.). Найдено, %: С 48,45; Н 4,52; Br 16,78; Cl 14,95; N 11,91. C19H21BrCl2N4O. Вычислено, %: С 48,33; Н 4,48; Br 16,92; Cl 15,02; N 11,86.
Стадия 2. Дигидрохлорид 9-(2-диметиламиноэтил)-2-(3,4-дихлорфенил)-имидазо[1,2-а]бензимидазола (Ix). Кипятят 0,81 г (2 ммоль) соли IIх в 50 мл воды до полного протекания реакции (1,5-2 ч, контроль - ТСХ). Затем раствор подщелачивают и выделившееся основание экстрагируют хлороформом. Экстракт пропускают через слой Al2О3 (элюент - CHCl3). Основание после испарения CHCl3 из элюата кристаллизуют из изооктана, получая 9-диметиламиноэтил-2-(3,4-дихлорфенил)имидазо[1,2-а]бензимидазол. Выход 90,8%, т.пл. 130°С. Спектр ЯМР 1H δ, м.д.: 3,02 (6Н, с, N(CH3)2); 3,75 (2Н, т, СН2); 5,17 (2Н, т, СН2); 7,49 (2Н, дт, 5',6'-Н); 7,68 (1Н, д, 2'-Н); 7,94 (1Н, к, 8-Н); 8,14 (2Н, дд, 6,7-Н); 8,28 (1Н, т, 5-Н); 8,67 (1Н, с, 3-Н); 12,04 (1Н, ушир. с, N+H); Н+ в обмене. Найдено, %: С 61,17; Н 4,80; Cl 14,24; N 16,89. C19H18Cl2N4. Вычислено, %: С 61,13; Н 4,86; Cl 14,27; N 16,83. Полученное основание растворяют в ацетоне и подкисляют раствор конц. HCl. Выход 86,75%. Т.пл. 254-256°С (EtOH-H2O). Найдено, %: С 50,90; Н 4,96; Cl 31,60; N 12,54. C19H20Cl2N4·2HCl Вычислено, %: С 50,91; Н 4,95; Cl 31,64; N 12,50.
Пример 22. Стадия 1. Бромид 2-амино-3-(3,4-дихлорфенацил)-1-(2-диэтиламиноэтил)бензимидазолия (IIц) получен исходя из 2-амино-1-(2-диэтиламиноэтил)бензимидазола и 3,4-дихлорфенацилбромида. Выход 95,0%, т.пл. 190°С. Найдено, %: С 50,44; Н 5,14; Br 15,85; Cl 14,21; N 11,24. C21H25BrCl2N4O. Вычислено, %: С 50,42; Н 5,04; Br 15,97; Cl 14,17; N 11,20.
Стадия 2. Дигидрохлорид 2-(3,4-дихлорфенил)-9-(2-диэтиламиноэтил)-имидазо[1,2-а]бензимидазола (Iц) синтезирован кипячением бромида IIц в воде, выделением циклического основания и переводе его в дигидрохлорид. Выход 83,4%, т.пл. 254-256°С (разл., EtOH). Спектр ЯМР 1H δ, м.д.: 1,36 (6Н, т, 2СН3); 3,33 (4Н, к, N(CH2)2); 3,64 (2Н, т, NCH2); 5,17 (2Н, т, NCH2); 7,47 (2Н, дт, 5',6'-Н); 7,67 (1Н, д, 2'-Н); 7,91 (1Н, к, 8-Н); 8,10 (2Н, дд, 6,7-Н); 8,25 (1Н, т, 5-Н); 8,65 (1Н, с, 3-Н); 11,98 (1Н, ушир. с, N+Н); H+ в обмене. Найдено, %: С 53,23; Н 5,02; Cl 29,98; N 11,77. C21H22Cl2N4·2HCl Вычислено, %: С 53,18; Н 5,10; Cl 29,90; N 11,82.
Пример 23. Стадия 1. Бромид 2-амино-3-(3,4-дихлорфенацил)-1-(2-пирроидиноэтил)бензимидазолия (IIч) получен взаимодействием эквимолярных количеств 2-амино-1-(2-пирролидиноэтил)бензимидазола и 3,4-дихлорфенацилбромида в ацетоне. Выход 86,5%, т.пл. 187-188°С. Найдено, %: С 50,67; Н 4,53; Br 16,11; Cl 14,24; N 11,22. С21Н23BrCl2N4O. Вычислено, %: С 50,62; Н 4,65; Br 16,04; Cl 14,23; N 11,24.
Стадия 2. Дигидрохлорид 2-(3,4-дихлорфенил)-9-(2-пирролидиноэтил)-имидазо[1,2-а]бензимидазола (Iч) синтезирован аналогично дигидрохлориду Iт. Выход 78,6%, т.пл. 227-228°С (СН3CN). Спектр ЯМР 1Н, δ, м.д.: 2,14 (4Н, кв, -(СН2)2-); 3,37 (2Н, т, NCH2); 3,68 (2Н, т, NCH2); 3,80 (2Н, т, NCH2); 5,15 (2Н, т, NCH2); 7,45 (2Н, дт, 5',6'-Н); 7,64 (1Н, д, 2'-Н); 7,89 (1Н, к, 8-Н); 8,12 (2Н, дд, 6,7-Н); 8,28 (1Н, т, 5-Н); 8,71 (1Н, с, 3-Н); 12,03 (1Н, ушир. с, N+H); Н+ в обмене. Найдено, %: С 53,34; Н 4,77; Cl 30,40; N 11,79. C21H20Cl2N4·2HCl. Вычислено, %: С 53,41; Н 4,70; Cl 30,33; N 11,86.
Пример 24. Стадия I. Бромид 2-амино-3-(3,4-дихлорфенацил)-1-(2-пиперидиноэтил)бензимидазолия (IIш) получен исходя из 2-амино-1-(2-пиперидиноэтил)бензимидазола и 3,4-дихлорфенацилбромида. Выход 89,84%, т.пл. 190-191°С. Найдено, %: С 51,20; Н 4,99; Br 15,54; Cl 13,84; N 11,00. С22Н25BrCl2N4O Вычислено, %: С 51,28; Н 4,92; Br 15,60; Cl 13,84; N 10,94.
Стадия 2. Дигидрохлорид 2-(3,4-дихлорфенил)-9-(2-пиперидиноэтил)-имидазо[1,2-а]бензимидазола (Iш) синтезирован аналогично дигидрохлориду Iт. Выход 74,7%, т.пл. 227-228°С (EtOH). Спектр ЯМР 1Н, δ, м.д.: 1,30-1,98 (6Н, м, -(СН2)3-); 2,85-3,45 (4Н, м, N(CH2)2); 3,62 (2Н, т, NCH2); 5,05 (2Н, т, NCH2); 7,40 (2Н, дт, 5',6'-Н); 7,65-7,98 (4Н, м, аром. Н); 8,17 (1Н, с, 8-Н); 8,52 (1Н, с, 3-Н); 10,87 (1Н, ушир. с, N+H); H+ в обмене. Найдено, %: С 54,28; Н 4,89; Cl 29,20; N 11,52. С22Н22Cl2N4·2HCl. Вычислено, %: С 54,24; Н 4,97; Cl 29,16; N 11,52.
Пример 25. Стадия 1. Бромид 2-амино-3-(2,4-дихлорфенацил)-1-(2-диэтиламиноэтил)бензимидазолия (IIщ) получен обычным путем из 2-амино-1-(2-диэтиламиноэтил)бензимидазола и 2,4-дихлорфенацилбромида в ацетоне. Выход 87,2%, т.пл. 196-197°С (разл.). Найдено, %: С 50,44; Н 5,14; Br 15,85; Cl 14,21; N 11,24. C21H25BrCl2N4O. Вычислено, %: С 50,42; Н 5,04; Br 15,97; Cl 14,17; N 11,20.
Стадия 2. Гидробромид 2-(2,4-дихлорфенил)-9-(2-диэтиламиноэтил)имидазо[1,2-а]бензимидазола (Iщ). Кипятят 1,00 г (2 ммоль) бромида IIщ в 50 мл воды до полного протекания реакции (3-5 ч, контроль - ТСХ). Реакционную смесь охлаждают выпавший осадок отфильтровывают, промывают холодной водой и сушат на воздухе. Выход 0,94 г (97,5%), т.пл. 221-222°С (EtOH). Спектр ЯМР 1Н, δ, м.д.: 1,29 (6Н, т, 2СН3); 3,21 (4Н, к, N(CH2)2); 3,51 (2Н, т, NCH2); 5,11 (2Н, т, NCH2); 7,10-8,40 (8Н, м, аром. Н); H+ в обмене. Найдено, %: С 50,40; Н 5,10; Br 16,00; Cl 14,13; N 11,17. C21H23Cl2N4·HBr. Вычислено, %: С 50,42; Н 5,04; Br 15,97; Cl 14,17; N 11,20.
Пример 26. Оксалат 9-(2-пиперидиноэтил)-2-(4-хлорфенил)имидазо-[1,2-а]бензимидазола (Ië). Выделен при действии спиртового раствора эквивалентного количества щавелевой кислоты на ацетоновый раствор основания Ie (см. пример 6, стадия 2). Выход 89,11%. Т.пл. 233-234°С (EtOH). Спектр ЯМР 1Н, δ, м.д.: 1,40-2,05 (6Н, м, -(СН2)3-); 3,10-3,51 (4Н, м, N(CH2)2); 3,59 (2Н, т, NCH2); 5,07 (2Н, т, NCH2); 7,27-8,14 (8Н, м, аром. Н); 8,55 (1Н, с, 3-Н); 11,25 (1Н, ушир. с, N+Н); Н+ в обмене. Найдено, %: С 61,50; Н 5,33; Cl 7,61; N 11,90. С22Н23ClN4·(COOH)2. Вычислено, %: С 61,47; Н 5,37; Cl 7,56; N 11,95.
Пример 27. Сукцинат 9-(2-пиперидиноэтил)-2-(4-хлорфенил)имидазо-[1,2-а]бензимидазола (Iы). Получен при смешении ацетонового раствора выделенного в результате циклизации основания Ie со спиртовым раствором эквивалентного количества янтарной кислоты. Выход 84,2%. Т.пл. 195-196°С (СН3CN-2-PrOH). Спектр ЯМР 1H δ, м.д.: 1,38-2,11 (6Н, м, -(СН2)3-); 2,81-3,50 (8Н, м, N(CH2)2+(CH2COO)2); 3,65 (2Н, т, NCH2); 4,88 (2Н, т, NCH2); 7,19-8,00 (8Н, м, аром. Н); 8,34 (1Н, с, 3-Н); Н+ в обмене. Найдено, %: С 62,75; Н 5,80; Cl 7,20; N 11,42. С22Н23ClN4·С4Н6O4. Вычислено, %: С 62,84; Н 5,88; Cl 7,13; N 11,27.
Пример 28. Стадия 1. Бромид 2-амино-3-(2,4-дихлорфенацил)-1-(2-пиперидиноэтил)бензимидазолия (IIэ). Получен при взаимодействии эквимолярных количеств 2-амино-1-(2-пиперидиноэтил)бензимидазола и 2,4-дихлорфенацилбромида в ацетоне. Выход 88,7%, т.пл. 207-208°С (разл.). Найдено, %: С 50,44; Н 5,14; Br 15,85; Cl 14,21; N 11,24. C21H25BrCl2N4O. Вычислено, %: С 50,42; Н 5,04; Br 15,97; Cl 14,17; N 11,20.
Стадия 2. Гидробромид 2-(2,4-дихлорфенил)-9-(2-пиперидиноэтил)имидазо[1,2-а]бензимидазола (Iэ). Выделен в результате кипячения бромида IIэ в воде до полного протекания циклизации и охлаждения реакционной массы. Выход 98,1%, т.пл. 275-276°С (разл., EtOH). Спектр ЯМР 1H δ, м.д.: 1,14-1,79 (6Н, м, -СН2)3); 2,18-3,05 (6Н, м, N(СН2)3); 4,36 (2Н, т, NCH2); 7,11-8,32 (8Н, м, аром. Н); H+ в обмене. Найдено, %: С 53,40; Н 4,75; Br 16,20; Cl 14,29; N 11,36. С22Н23Cl2N4·HBr. Вычислено, %: С 53,46; Н 4,69; Br 16,16; Cl 14,35; N 11,34.
Пример 29. Стадия 1. Хлорид 2-амино-3-(2,4-дихлорфенацил)-1-(2-пиперидиноэтил)бензимидазолия (IIю) получен при кипячении эквимолярных количеств 2-амино-1-пиперидиноэтилбензимидазола и ω,2,4-трихлорацетофенона в СН3CN. Выход 83,9%, т.пл. 266-267°С (разл.). Найдено, %: С 56,44; Н 5,37; Сl 22,66; N 12,00. С22Н25Cl3N4O. Вычислено, %: С 56,48; Н 5,39; Cl 22,73; N 11,98.
Стадия 2. Дигидрохлорид 2-(2,4-дихлорфенил)-1-пиперидиноэтилимидазо[1,2-а]бензимидазол (Iю). Циклизацию хлорида IIю проводят в кипящей воде, выделенное трициклическое основание с помощью конц. HCl переводят в дигидрохлорид Iю. Выход 92,7%. Т.пл. 283-284°С (разл., 90% EtOH). Спектр ЯМР 1Н, δ, м.д.: 1,17-1,84 (6Н, м, -(СН2)3-); 2,21-3,21 (6Н, м, (СН2)3); 4,40 (2Н, т, NCH2); 7,15-8,36 (8Н, м, аром. Н); Н+ в обмене. Найдено, %: С 54,30; Н 5,03; Cl 29,12; N 11,55. С22Н22ClN4·HCl. Вычислено, %: С 54,34; Н 4,97; Cl29,16; N 11,53.
Пример 30. Сульфат 9-(2-диэтиламиноэтил)-2-(4-хлорфенил)имидазо[1,2-а]бензимидазола (Iя). Спиртовой раствор основания Iд (т.пл. 86-87°С), описанного в примере 5, подкисляют до рН 1-2 разбавленным ацетоновым раствором H2SO4. Осадок отделяют и тщательно промывают ацетоном. Выход 99,4%. Т.пл. 230-232°С (разл., EtOH-H2O). Найдено, %: С 54,22; Н 5,47; Cl 7,60; N 12,00; S 6,94. C21H23ClN4·H2SO4. Вычислено, %: С 54,25; Н 5,42; Cl 7,62; N 12,05; S 6,90.
Пример 31. Исследование гемореологических свойств.
Методы исследования. Синдром повышенной вязкости крови моделировали с помощью гипертермии (Плотников М.Б. Колтунов А.А., Алиев О.И., Бюлл. эксп. биол. и мед., 1996, №9, с.274-275), с использованием крови кроликов. Для этого пробы в объеме 1 мл помещали в термостат и инкубировали в течение 1 часа при температуре 42,5°С. Забор крови производили из ушной вены кролика в пластиковые пробирки с 3,8% раствором натрия цитрата в соотношении 1:9. Величину гематокрита определяли по стандартной методике при центрифугировании капилляров с образцами крови на микрогемоцентрифуге МГЦ-8 (8000 об/мин, 3 минуты) как отношение протяженности в центрифужном капилляре столбика эритроцитов к столбику плазмы. Производили стандартизацию образцов крови к единому гематокриту 45% путем добавления или изъятия необходимого количества плазмы. В качестве препарата сравнения был выбран пентоксифиллин (Aventis, Германия), который длительное время используется в клинике как корректор реологических нарушений. Исследуемые вещества и пентоксифиллин в концентрациях 10, 50, 100, 500 мкмоль/л добавляли в пробы крови за 15 минут до начала инкубации. В контрольные образцы добавлялось 10 мкл теплого (37°С) физиологического раствора (0,89% раствор натрия хлорида). Вязкость проб крови измеряли до и после инкубации.
Измерение вязкости крови производили на вискозиметре АКР-2 (Rus-Can Research Ltd., Россия), принцип действия которого основан на методе ротационной вискозиметрии со свободно плавающим цилиндром-ротором ((Н.А.Добровольский, Ю.М.Лопухин, А.С.Парфенов и др. Реологические исследования в медицине: Сб. науч. тр., М.: НИХ РАМН, 1998, с.45-51.). Для определения вязкости проба крови в объеме 0,84 мл дозирующей пипеткой переносили в измерительную кювезу, туда же помещали ротор-поплавок и кювезу устанавливали на 10 минут в блок термостата прибора. После термостабилизации кювезу переносили в измерительную ячейку и после установления показаний (неизменное значение в течение 45 секунд после его последней смены) результат анализа считывали с цифрового табло. Исследовали вязкость крови при следующих скоростях сдвига 300, 200, 100, 50, 30, 20, 10, 5, 3 с-1 (обратных секунд), моделирующих различную интенсивность кровотока в сосудах. Вязкость крови измеряли в сантипу азах (сП). Вязкость крови суммарно отражает деформабильность эритроцитов, агрегатное состояние красных клеток крови и содержание фибриногена крови (Ройтман Е.В., Гематология и трансфузиология, 1996, №3, с.36-40). Влияние веществ на агрегацию эритроцитов оценивали по индексу агрегации, рассчитываемому как отношение вязкости крови при скорости сдвига 3 обратных секунды (с-1) к вязкости крови при 100 с-1 (Dintenfass L., Aging, 1989, №1, p.99-125).
Расчет ингибирующего влияния соединения на агрегацию эритроцитов проводили по формуле: ИнАЭ=100-(В/А)×100%; где:
А - степень агрегации эритроцитов без изучаемого соединения;
В - степень агрегации эритроцитов после инкубации суспензии с изучаемыми соединениями.
Для некоторых активных соединений и препарата сравнения - пентоксифиллина - были изучены концентрационные зависимости эффекта и методом нелинейного регрессионного анализа рассчитаны показатели концентраций, вызывающих снижение индекса агрегации эритроцитов на 20% - ЭК20 (Духанин А.С., Губаева Ф.Р., Эксперим. и клинич. фармакология, 1998, №4, с.66-71).
Острую токсичность исследуемого соединения изучали на белых беспородных мышах-самцах массой 18-22 г при внутрибрюшинном введении. Гибель животных регистрировали в течение двух недель. Расчет величины ЛД50 производили по методу Прозоровского (Прозоровский В.Б. и соавт., Фармакол. и токсикол, 1978, №4, с.497-502). В качестве объективного показателя условной широты терапевтического действия использовали условный терапевтический индекс соединений, который определяли делением показателя острой токсичности LD50 на показатель эффективной концентрации соединения ЕС20.
Статистическую обработку данных производили с использованием t-парного критерия Стьюдента и ANOVA (Newman-Keuls post-hoc test) в программном обеспечении Statistica 5.0.
Результаты испытаний. Термостатирование образцов крови приводило к выраженным реологическим нарушениям и отчетливому изменению показателей вязкости: при скорости сдвига 300 с-1 вязкость крови увеличилась на 17,3%, при скорости сдвига 3 с-1 - на 28,5% по сравнению с образцами крови, не подвергшимися воздействию гипертермии, а увеличение индекса агрегации прогретых эритроцитов достоверно составило 20,74%.
Под влиянием исследованных веществ (Iч, Ip, Iт, Iу, Iи, Iк, Iм) наблюдали значимое снижение вязкости крови при скорости сдвига 300 с-1 (табл.1), что свидетельствует об улучшении деформабельности эритроцитов под действием этих веществ.
При низкой скорости сдвига 3 с-1 большинство изученных соединений также оказывали достоверное влияние на вязкость крови в сторону ее уменьшения. Таким образом, для 9-замещенных 2-галогенфенилимидазо[1,2-а]-бензимидазолов установлено антиагрегантное действие в отношении эритроцитов, при этом соединения Iч, Ip, Iт, Iу достоверно превосходили по величине активности препарат сравнения - пентоксифиллин.
Влияние 2-галогенфенилзамещенных производных имидазобензимидазола (в концентрации 100 мкмоль/л) на вязкостные характеристики образцов крови кроликов с экспериментальным синдромом повышенной вязкости крови in vitro (M±m).
Концентрационная зависимость гемореологической активности некоторых изученных соединений
50
500
20,78
34,02
50
500
25,74
38,48
50
500
23,16
49,90
50
500
22,86
28,34
50
500
28,07
43,61
50
500
32,33
47,03
50
500
10,49
28,13
Показатели острой токсичности, эффективной концентрации и условного терапевтического индекса 2-галогенфенилзамещенных имидазобензимидазола.
Были изучены концентрационные зависимости активности некоторых соединений (табл.2). Как видно из таблицы, уровень гемореологической активности исследуемых веществ значительно превышает таковой препарата сравнения. При этом наблюдается четкая зависимость величины эффекта соединений от их концентрации в пробах.
При экспериментальном определении EC20 установлено, что соединения Iц, Iч, Ip, It, IIт, Iy превосходят по уровню гемореологической активности пентоксифиллин в 6,05; 16,35; 14,91; 7,25; 5,33; 23,17 раз соответственно (табл.3).
Показатели острой токсичности (LD50) для мышей при внутрибрюшинном введении этих соединений и вычисленные показатели индексов относительной безопасности (условный терапевтический индекс) для изученных соединений также приведены в табл.3. По последней величине вещества Iц, Iч, Ip, Iт, IIт, Iy превосходили препарат сравнения в 2,37; 8,18; 5,71; 3,34; 2,14; 10,65 раз соответственно.
Таким образом, уровень гемореологической активности солей 9-замещенных 2-галогенфенилимидазо[1,2-а]бензимидазолов и промежуточных продуктов их синтеза значительно превышает активность пентоксифиллина. При этом наблюдается четкая зависимость величины эффекта от концентрации.
| название | год | авторы | номер документа |
|---|---|---|---|
| СОЛИ 9-(2-МОРФОЛИНОЭТИЛ)-2-(4-ФТОРФЕНИЛ)ИМИДАЗО[1,2-a]БЕНЗИМИДАЗОЛА И СОЛИ 9-АМИНОЭТИЛЗАМЕЩЕННЫХ 2-(4-ФТОРФЕНИЛ)ИМИДАЗО[1,2-a]БЕНЗИМИДАЗОЛА, ПРОЯВЛЯЮЩИЕ ОБЕЗБОЛИВАЮЩЕЕ ДЕЙСТВИЕ | 2009 |
|
RU2412187C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ КАППА-ОПИОИДНОЙ АГОНИСТИЧЕСКОЙ АКТИВНОСТЬЮ | 2009 |
|
RU2413512C1 |
| 9-Замещенные-2-бифенилимидазо[1,2-а]бензимидазолы и их фармацевтически приемлемые соли, обладающие антиоксидантными и антирадикальными свойствами | 2017 |
|
RU2649979C1 |
| ГИДРОБРОМИД 9-(2-ДИЭТИЛАМИНОЭТИЛ)-2-ФЕНИЛИМИДАЗО [1,2-а] БЕНЗИМИДАЗОЛА, ПРОЯВЛЯЮЩИЙ СВОЙСТВА АНТАГОНИСТА СЕРОТОНИНОВЫХ 5-HT-РЕЦЕПТОРОВ | 2005 |
|
RU2285006C1 |
| ПРОИЗВОДНЫЕ 1-(2-АРИЛОКСИЭТИЛ)- И 1-БЕНЗИЛЗАМЕЩЕННЫХ 3-(2-ГИДРОКСИЭТИЛ)-2-ИМИНОБЕНЗИМИДАЗОЛИНА, ОБЛАДАЮЩИЕ АНТИБАКТЕРИАЛЬНОЙ И ПРОТИСТОЦИДНОЙ АКТИВНОСТЬЮ | 2012 |
|
RU2513993C2 |
| 1,3-ДИЗАМЕЩЕННЫЕ 2-ИМИНОБЕНЗИМИДАЗОЛИНА, ОБЛАДАЮЩИЕ АНТИБАКТЕРИАЛЬНЫМ ДЕЙСТВИЕМ | 2009 |
|
RU2423355C2 |
| 1-[ω-АРИЛОКСИАЛКИЛ(БЕНЗИЛ)]ЗАМЕЩЕННЫЕ 2-АМИНОБЕНЗИМИДАЗОЛЫ, ОБЛАДАЮЩИЕ АКТИВНОСТЬЮ В ОТНОШЕНИИ ВИРУСА ГРИППА | 2012 |
|
RU2570906C2 |
| ДИГИДРОХЛОРИД 1-(3-ПИРРОЛИДИНОПРОПИЛ)-2-(4-ФТОРОФЕНИЛ)ИМИДАЗО[1,2-a]-БЕНЗИМИДАЗОЛА, ОБЛАДАЮЩИЙ МЕСТНОАНЕСТЕЗИРУЮЩИМ ДЕЙСТВИЕМ | 2006 |
|
RU2312107C1 |
| СОЛИ 9-ω-АРИЛОКСИАЛКИЛ-2,3-ДИГИДРОИМИДАЗО[1,2-А]БЕНЗИМИДАЗОЛА, ОБЛАДАЮЩИЕ МЕСТНОАНЕСТЕЗИРУЮЩИМ ДЕЙСТВИЕМ | 2003 |
|
RU2233279C1 |
| 1-ОМЕГА-АРИЛОКСИАЛКИЛ- И 1-БЕНЗИЛЗАМЕЩЕННЫЕ 2-ИМИНОБЕНЗИМИДАЗОЛИНЫ И ИХ ФАРМАКОЛОГИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, ОБЛАДАЮЩИЕ ПРОТИСТОЦИДНОЙ И АНТИМИКРОБНОЙ АКТИВНОСТЬЮ | 2012 |
|
RU2514196C1 |
Изобретение относится к новым солям в ряду 9-замещенных 2-галогенфенилимидазо[1,2-а]бензимидазолов общей формулы I:
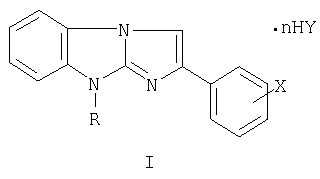
где R=С1-С6-алкил-, аллил-, бензил- и замещенный бензил-, диалкиламино-алкил; X=F, Cl, Br в о-, м-, п-положениях фенильного ядра, дигалогены в 3,4-, 2,4-, 3,5- и в других положениях фенильного ядра; Y=Cl, Br, NO3, SO4, (СООН)2, (СН2СООН)2, СН3С6Н4SO3Н и другие фармацевтически приемлемые кислотные остатки, n=0-2 (за исключением соединений с R=(CH2)2NEt2, Х=Br или Cl, Y=Cl, n=2; R=(CH2)2NMe2, X=Y=Cl, n=2), и к промежуточным продуктам их синтеза, а именно к галогенидам 1-замещенных 3-галогенфенацил-2-аминобензимидазолия общей формулы II:
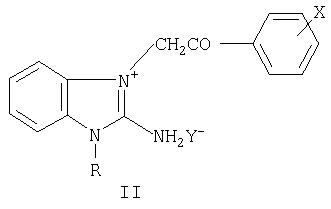
где Р=С1-С6-алкил-, аллил-, бензил- и замещенный бензил-, диалкиламино-алкил; X=F, Cl, Br в о-, м-, п-положениях фенильного ядра, дигалогены в 3,4-, 2,4-, 3,5- и в других положениях фенильного ядра; Y=Cl, Br, I (за исключением соединений с R=(CH2)2NEt2, X=Br или Cl, Y=Br; R=(CH2)2NMe2, X=Cl, Y=Br), обладающие гемореологическими свойствами. Технический результат - получены новые биологически активные соединения, обладающие гемореологическими свойствами. 2 н.п. ф-лы, 3 табл.
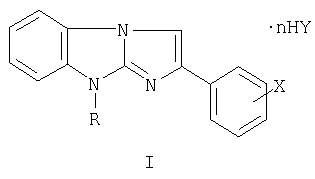
где R - С1-С6-алкил-, аллил-, бензил- и замещенный бензил-, диалкиламино-алкил;
X - F, Cl, Br в о-, м-, п-положениях фенильного ядра, дигалогены в 3,4-, 2,4-, 3,5- и в других положениях фенильного ядра;
Y - Cl, Br, NO3, SO4, (СООН)2, (CH2COOH)2, СН3С6H4SO3Н и другие фармацевтически приемлемые кислотные остатки;
n=0-2 (за исключением соединений с R - (CH2)2NEt2; X - Br или Cl; Y - Cl; n=2; R - (CH2)2NMe2; X - Y=Cl, n=2),
обладающие гемореологическими свойствами.
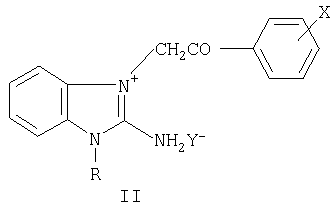
где R - С1-С6-алкил-, аллил-, бензил- и замещенный бензил-, диалкиламино-алкил;
X - F, Cl, Br в о-, м-, п-положениях фенильного ядра, дигалогены в 3,4-, 2,4-, 3,5- и в других положениях фенильного ядра;
Y - Cl, Br, I (за исключением соединений с R - (CH2)2NEt2; X - Br или Cl; Y - Br; R - (CH2)2NMe2; X - Cl; Y - Br), обладающие гемореологическими свойствами.
| Ogura Haruo et al, Journal of Medicinal Chemistry, 1972, 15(9), p.923-6, RN 38645-47-5, RN 38645-48-6 | |||
| ANISIMOVA V.A | |||
| et al, Pharmaceutical Chemistry Journal, 2002, 36(12), p.637-642, RN 638209-73-1 | |||
| US 3732243 А, 08.05.1973 | |||
| RU 20058142 C1, 20.04.1996. |
Авторы
Даты
2006-12-27—Публикация
2005-05-23—Подача