Изобретение относится к медицинской химии и сельскому хозяйству, а именно к препаратам, используемым для борьбы с инфекционными заболеваниями людей, животных и растений.
Известны фторпроизводные 3-карбоксихинолонов-4 (фторхинолоновые антибиотики), обладающие антибактериальным действием и применяющиеся в медицинской и ветеринарной практике, однако эти соединения имеют серьезные побочные эффекты [1].
Известны также хлорарилоксиалкилпроизводные бензимидазола [2-9], выбранные нами в качестве прототипа и обладающие широким спектром антибактериального действия. Наиболее активные из них 1-[4-(4-хлорфенокси)бутил-1H-1,3-бензимидазол и 1-[5-(2,4-дихлорфенокси)амил]-1H-1,3-бензимидазол имеют показатели МИК 25-35 мкг/мл для Staphylococcus aureus A 15091 и МИК > 128 мкг/мл - для Salmonella typhi O-901.
Однако многолетнее использование известных антибактериальных препаратов, например, нитрофурановых (таких как фурацилин, фуразолидон и др.) и антибиотиков (ампициллин, окситетрациклин и др.) привело и продолжает приводить к появлению резистентных штаммов, что ставит перед фармакологией весьма актуальную задачу обновления ассортимента применяемых лекарственных средств антимикробного действия.
Цель данного изобретения - синтез новых соединений бензимидазольного ряда с высокой антибактериальной активностью, в том числе и против резистентных штаммов микроорганизмов, с целью расширения арсенала веществ, воздействующих на живой организм.
Поставленная цель достигается синтезом новых соединений формулы I, обладающих антимикробным действием.
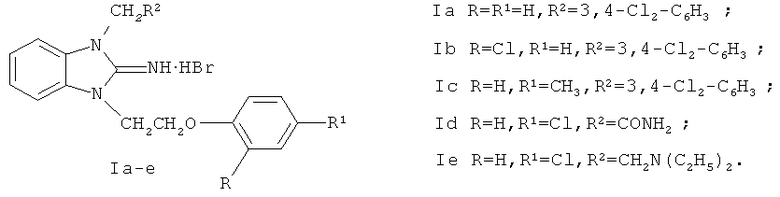
Соединения формулы Ia-d получены алкилированием 2-аминобензимидазола (II) [10] β-арилоксиэтилбромидом и его галогензамещенными производными (III) с последующей кватернизацией образующихся 1-(β-арилокси)этил-2-аминобензимидазолов (IV) 3,4-дихлорбензилбромидом (для Ia-с) и хлорацетамидом (для Id) по следующей схеме:
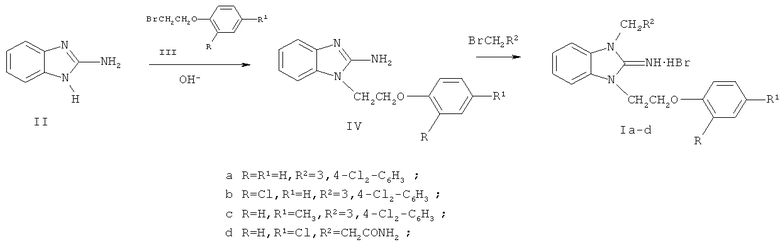
Соединение Ie получают из 1-[β-(N,N-диэтиламино)этил]-2-аминобензимидазола (V) [11] путем его кватернизации β-(4-хлорфенокси)этилбромидом (VI):
ПРИМЕРЫ СИНТЕЗОВ
Гидробромид 2-имино-1-(β-фенокси)этил-3-(3,4-дихлорбензил)бензимидазолина (Ia).
Стадия 1. 1-[β-Фенокси)этил-2-аминобензимидазол (IVa).
К раствору 1,33 г (10 ммоль) 2-аминобензимидазола (II) и 1,3 г (20 ммоль) KОН (в расчете на 85% содержание KОН) в 1,5 мл воды добавляют 10 мл ацетона и в полученную двухфазную систему порциями вносят 2,0 г (10 ммоль) β-феноксиэтилбромида (IIIa) так, чтобы температура реакционной массы не превышала 15°С. По окончании прибавления смесь перемешивают 2 часа при 40°С, охлаждают, отделяют ацетоновый слой, ацетон упаривают на роторном испарителе до половины объема, а затем реакционную массу выливают в 20 мл воды. Выпавшие слегка розоватые кристаллы амина IVa отфильтровывают, промывают 5 мл воды. Выход 2,0 г (79%). Т.пл. 167-168°С (из i-PrOH).
Спектр ЯМР 1Н (300 МГц), δ, м.д. (CDCl3): 4,28 (т, 2Н, NCH2); 4,36 (т, 2Н, ОСН2), 4,96 (с, 2Н, NH2); 6,82 (д, 2Н, о-Н ArO,); 6,95 (т, 1Н, p-Н ArO); 7,08-7,16 (м, 4Н, m-Н ArO + 5,6-Н бензимидазола); 7,22-7,48 (м, 1Н, 7-Н бензимидазола); 7,44 (д, 1Н, 4-Н бензимидазола).
Найдено (%): С 69,89; Н 5,99; N 16,40.
C15H15N3O. Вычислено (%): С 71,13; Н 5,97; N 16,59.
Стадия 2. Гиробромид 2-имино-1-(β-фенокси)этил-3-(3,4-дихлорбензил)бензимидазолина (Ia).
Сплавляют 1,26 г (5 ммоль) 1-(β-фенокси)этил-2-аминобензимидазола (IVa) и 1,2 г (5 ммоль) 3,4-дихлорбензилбромида при 110°С в течение 1 часа. По охлаждении плав обрабатывают 10 мл ацетона и фильтруют 2,1 г (85%) четвертичной соли Ia. Бесцветные кристаллы с т.пл. 251-251,5°С (из СН3ОН).
Спектр ЯМР 1Н, (300 МГц), δ, м.д. в DMSO-d6: 4,32 (т, 2Н, NCH 2CH2OAr). J=5); 4,70 (т, 2Н, CH 2Bn), 5,02 (т, 2Н, CH2 CH 2OAr, J=5); 6,75 (д, 2Н, о-Н ArO, J=8.9); 6,90 (т, 1Н, p-Н ArO); 7,18-7,34 [м, 5Н, 2 m-Н ArO + 5,6-Н бензимидазола) + m-Н Bn)]; 7,42-4,50 (м, 2Н, о-Н Bn); 7,60-7,70 (м, 2Н, 4,7-Н бензимидазола); 9,25 (с, 2Н, NH2).
Найдено (%): С 53.22; Н 4.32; N 8.79.
C22H20BrCl2N3O. Вычислено (%): С 53.57; Н 4.09; N 8.52.
Гидробромид 2-имино-1-[β-(2-хлорфенокси)этил]-3-(3,4-дихлорбензил)бензимидазолина (Ib).
Стадия 1. 1-[β-(2-Хлорфенокси)этил]-2-аминобензимидазол (IVb).
Соединение получают из 2-аминобензимидазола (II) и β-(2-хлорфенокси)этилбромида (IIIb) аналогично 1-(β-фенокси)этил-2-аминобензимидазолу (IVa) с выходом 86%. Т.пл. 218-219°С (из i-PrOH).
Спектр ЯМР 1Н (300 МГц), 5, м.д. (CDCl3): 4,25 (т, 2Н, NCH2); 4,38 (т, 2Н, ОСН2), 4,90 (с, 2Н, NH2); 6,75 (д, 1Н, о-Н ArO,); 6,90 (т, 1Н, р-Н ArO); 7,05 -7,18 (м, 5Н, m-Н ArO + 5,6,7-Н бензимидазола); 7,44 (д, 1Н, 4-Н бензимидазола).
Найдено (%): С 62,94; Н 5,06; Cl 11.90; N 14,40.
C15H14ClN3O. Вычислено (%): С 62,61; Н 4,90; Cl 12,32; N 14,60.
Стадия 2. Гидробромид 2-имино-1-[β-(2-хлорфенокси)этил]-3-(3,4-дихлорбензил)бензимидазолина(Ib).
Сплавляют 1,45 г (5 ммоль) 1-[(β-(2-хлорфенокси)этил]-2-амино-бензимидазола (IVb) и 1,2 г (5 ммоль) 3,4-дихлорбензилхлорида при 140°С в течение 1,5 часов. Плав по охлаждении обрабатывают 10 мл ацетона и отфильтровывают 2,0 г (77%) гидробромида 2-имино-1-[β-(2-хлорфенокси)этил]-3-(3,4-дихлор6ензил)бензимидазолина (Ib). Бесцветные кристаллы с т.пл. 261-262°С (из смеси этанол : диметилформамид 10:1).
Спектр ЯМР 1Н, (300 МГц), δ, м.д. (DMSO-d6): 5,55 (с, 2Н, NCH 2CH2OAr); 4,38 (т, 2Н, NCH 2Bn); 4,78 (т, 2Н, CH 2OAr); 7,04 (д, 1Н, о-Н ArO); 6,88 (т, 1Н, p-Н ArO); 7,18-7,32 (м, 5Н, m-Н ArO + o-H Bn + m-Н Bn + 7-Н бензимидазола); 7,48 [(д, 2Н, 5,6-Н бензимидазола)]; 7,65 (д, 1Н, р-Н Bn); 7,22 (д, 1Н, 4-Н бензимидазола); 9,32 (с, 2Н, NH2).
Найдено (%): С 49,79; Н 3,26; N 7,55.
C22H19BrCl3N3O. Вычислено (%): С 50,08; Н 3,63; N 7,96.
Гидробромид 2-имино-1-[β-(4-толилокси)этил]-3-(3,4-дихлорбензил)бензимидазолина (Ic).
Стадия 1. 1-[β-(4-Толилокси)этил]-2-аминобензимидазол (IVc). Алкилируют 2-аминобензимидазол (II) β-(4-толилокси)этилбромидом (IIIc) в ацетоне в присутствие KОН аналогично синтезу 1-(β-фенокси)этил-2-аминобензимидазола (IVa) с выходом 74%. Бесцветные кристаллы с т.пл. 147-148°C(i-PrOH).
Спектр ЯМР 1Н, (300 МГц), δ, м.д. (CDCl3): 2,22 (с, 3H, Me); 4,24 (т, 2Н, NCH2); 4,34 (т, 2Н, ОСН2), 4,92 (с, 2Н, NH2); 6,70 (д, 2Н, o-Н ArO,); 7,00-7,18 (м, 5Н, m-Н ArO + 5,6,7-Н бензимидазола); 7,42 (д, 1Н, 4-Н бензимидазола).
Найдено (%): С 71,65; Н 6,12; N 15,49.
C16H17N3O. Вычислено (%): С 71,89; Н 6,41; N 15,72.
Стадия 2. Гидробромид 2-имино-1-[β-(4-толилокси)этил]-3-
(3,4-дихлорбензил)бензимидазолина (Ic).
Соединение получают аналогично соли Ia из 1-[β-(4-толилокси)этил]-2-аминобензимидазола (IVc) и 3,4-дихлорбензилбромида с выходом 92%. Бесцветные кристаллы с т.пл. 294 - 295°С (из этанола).
Спектр ЯМР 1Н, (300 МГц), δ, м.д. (DMSO-d6): 2,22 (с, 3Н, Me); 4,68 (т, 2Н, NCH 2CH2OAr); 4,24 (т, 2Н, NCH 2Bn); 5,55 (с, 2Н, CH2 CH 2OAr); 6,98 (д, 2Н, о-Н, ArO); 6,62 (д, 2Н, m-Н ArO); 7,18-7,50 (м, 5Н, о-Н Bn + m-Н Bn + 5,6-Н бензимидазола); 7,60-7,64 (м, 2Н, 4,7-Н бензимидазола); 9,22-9,34 (уш. с, 2Н, NH2).
Найдено (%): С 54.20; Н 4,16; N 8,00.
C23H22BrCl2N3O. Вычислено (%): С 54,46; Н 4,37; N 8,28.
Гидрохлорид 2-имино-1-(4-хлорфенокси)этил-3-карбоксамидометилбензимидазолина (Id).
Стадия 1. 1-[β-(4-Хлорфенокси)этил]-2-аминобезимидазол(IVc).
Соединение IVc получают из 2-аминобензимидазола (II) и β-(4-хлорфенокси)этилбромида (IIId) аналогично 1-(β-фенокси)этил-2-аминобензимидазолу (IVa) с выходом 89%. Т.пл. 183-184°С (MeCN).
Спектр ЯМР 1Н, (300 МГц), δ, м.д. (CDCl3): 4,25 (т, 2Н, NCH2); 4,38 (т, 2Н, ОСН2), 4,90 (с, 2Н, NH2); 6,75 (д, 2Н, о-Н ArO,); 7,05-7,18 (м, 5Н, m-H ArO + 5,6,7-Н бензимидазола); 7,44 (д, 1Н, 4-Н бензимидазола).
Найдено (%): С 62,94; Н 5,06; Cl 11.90; N 14,40.
C15H14ClN3O. Вычислено (%): С 62,61; Н 4,90; Cl 12,32; N 14,60.
Стадия 2. Гидрохлорид 2-имино-1-(4-хлорфенокси)этил-3-карбоксамидометилбензимидазолина(Id).
Смесь 1,45 г (5 ммоль) 2-амино-1-(4-хлорфенокси)этилбензимидазола (IVd) и 0,66 г (7 ммоль) хлорацетамида в 25 мл толуола кипятят 2 часа, охлаждают, а выпавший бесцветный осадок отфильтровывают и тщательно промывают ацетоном. Получают белоснежные кристаллы с т.пл. 257-260°С (из диметилформамида). Выход 1,36 г (71,5%).
Спектр ЯМР 1Н (300 МГц), δ, м.д. (DMSO-d6): 4,28 (т, 2Н, NCH2); 4,62 (т, 2Н, CH2O); 4,88 (т, 2Н, СН2СО); 6,82 (д, 2Н, о-Н ArO); 7,28-7,34 (м, 4Н, m-Н ArO + 5,6-Н бензимидазола); 7,37 (д, 1Н, 7-Н бензимидазола); 7,48 (с, 1Н, CONH); 7,64 (д, 1Н, 4-Н бензимидазола); 7,86 (с, 1Н, CONH); 9,26 (с, 2Н, 2-NH2).
Найдено (%): С 53,22; Н 4,40; N 14,25.
C17H18Cl2N4O2. Вычислено (%): С 53,56; Н 4.76; N 14,69.
Гидробромид 1-[β-(4-хлорфенокси)этил)-3-[β-(N,N-диэтиламино)этил]-2-иминобензимидазолина (Ie).
Стадия 1. 1-[β-(N,N-Диэтиламино)этил]-2-аминобензимидазол (V) получают из 2-аминобензимидазола (II) и гидрохлорида β-(N,N-диэтиламино)этилхлорида аналогично 1-(β-фенокси)этил-2-аминобензимидазолу (IVa) с выходом 87%, т.пл. 138-138,5°С. Т. пл. лит. 136-137°С [11].
Стадия 2. Гидробромид 1-[β-(4-хлорфенокси)этил]-3-[β-(N,N-диэтиламино)этил] -2-иминобензимидазолина (Ie).
Смесь 2,35 г (10 ммоль) 2-амино-1-[β-(N,N-диэтиламино)этил]бензимидазола (V) и 2,35 г (10 ммоль) β-(4-хлорфенокси)этилбромида (VI) в 20 мл этанола кипятят 4 часа. По охлаждении осадок отфильтровывают, промывают ацетоном, высушивают. Выход 3,8 г (81%). Белоснежные мелкие кристаллы с т.пл. 239-240,5°С (из этанола).
Спектр ЯМР 1Н (300 МГц), δ, м.д. (DMSO-d6): 0,75 (т, 6Н, 2(СН2 СН 3)); 2,31 - 2,50 [м, 4Н, 2(СН 2СН3)]; 2,72 (т, 2Н, CH 2N(C2H5)2); 4,25 (м, 4Н, NCH 2CH2O+NCH 2CH2N); 4,70-4,78 (м, 2Н, CH 2O); 6,73 (д, 2Н, о-Н ArO); 7,15 (д, 2Н, m-Н ArO); 7,25 (т, 2Н, 5,6-Н бензимидазола); 7,38 (т, 1Н, 7-Н бензимидазола); 7,55 (д, 1Н, 4-Н бензимидазола).
Найдено (%): С 53,89; Н 5,70; N 11,62.
C21H28BrClN4O. Вычислено (%): С 53,91; Н 6.03; N 11,98.
ИСПЫТАНИЕ АНТИБАКТЕРИАЛЬНОЙ АКТИВНОСТИ 1,3-ДИЗАМЕЩЕННЫХ 2-ИМИНОБЕНЗИМИДАЗОЛИНОВ I.
Антимикробная активность изучена в секторе синтеза ГНУ СКЗНИВИ (г.Новочеркасск). Ранее соединения нигде не применялись.
В качестве тест-культур для проверки антимикробной активности препаратов использовали три стандартных штамма бактерий (Escherichia coli АТСС 25922, Pseudomonas aeruginosa АТСС 27853, Staphylococcus aureus АТСС25923), применяющиеся для определения антимикробной активности химиотерапевтических препаратов. Помимо этих трех штаммов, в работе были использованы Е.coli 078 (полевой штамм), St.aureus Р-209, Ps.aeruginosa (полевой штамм) и клинические изоляты, обладающие, как правило, более высоким патогенетическим потенциалом. Всего в работе было использовано шестнадцать штаммов десяти видов бактерий: пять грамотрицательных (Escherichia coli, Citrobacter freundii, Shigella dysenteria, Klebsiella pneumonia, Pseudomonas aeruginosa) и пять грамположительных (Staphylococcus aureus, Staphylococcus epidermidis, Enterococcus faecalis, Streptococcus sp., Corynebacterium sp). Культуры выращивали в течение суток при 37°С на агаризованной питательной среде Luria-Bertani (LB). Для выращивания штаммов Enterococcus sp. и Streptococcus sp. к среде добавляли гемолизированную кровь барана. Исходные суспензии, содержащие 109 микробных клеток (м.кл.) в 1 мл забуференного физиологического раствора (ЗФР), готовили по оптическому стандарту плотности (Государственный научно-исследовательский институт стандартизации и контроля медицинских и биологических препаратов им. А.Н. Тарасевича) из суточной агаровой культуры. Суспензии титровали методом десятикратных серийных разведений в ЗФР.
Для тестирования антимикробной активности изучаемых веществ использовали классический метод двукратных серийных разведений [12, 13] в плотной питательной среде LB, к которой добавляли препараты, растворенные в ДМСО, в концентрации 200 - 6,3 мкг/мл. В качестве контроля использовали среду LB без препаратов, а также среду, содержащую, вместо препаратов, максимальное количество ДМСО, использованное в эксперименте. Суспензии бактерий, содержащие 107 микробных клеток в ЗФР, высевали на пластины агара, содержащего разные концентрации препаратов, в количестве 0,1 мл. Результаты учитывали после 1-3-суточного термостатирования при 37°С. МИК препаратов определяли по минимальной концентрации вещества в среде, на которой отсутствовал рост анализируемых бактерий.
Изучение антимикробных свойств соединений Ia-с проводились также по методике Миловановой С. Н. [14] способом двухкратных серийных разведений в плотной или жидкой питательной среде. Бактериальная нагрузка составляла 500 тысяч микробных тел в 1 мл. Приготовленную взвесь бактерий объемом 2 мл добавляли в пробирки с различными концентрациями исследуемого вещества объемом 2 мл. Таким образом, учитываемая микробная нагрузка составила 250 тысяч микробных тел в 1 мл. Пробирки инкубировали в термостате в течение 18 часов при 37°С. Контролем служили пробирки, содержащие 2 мл питательной среды и 2 мл взвеси бактерий с концентрацией 500 тысяч микробных тел в 1 мл.
В качестве контроля в экспериментах по определению антибактериальной активности исследуемых веществ использовали следующие коммерческие препараты: антибиотики ампициллин, канамицин, окситетрациклин и фуразолидон.

Судя по приведенным в таблице данным, наибольшую антибактериальную активность проявили вещества Ia и Ic, которые с разной эффективностью действовали на грамположительные и на грамотрицательные бактерии. Соединение Ie - гидробромид 2-имино-1-[β-(N,N-диэтиламино)]этил-3-(4-хлорфеноксиэтил) бензимидазолина проявляло сопоставимую активность в отношении обеих групп бактерий (МИК 25-50 мкг/мл). А препарат Ic, МИК действия которого на S. aureus (1,0 мкг/мл) была меньше, чем у ампициллина, фуразолидона, канамицина и окситетрациклина, был менее активен в отношении E.coli.
Изучена «острая» токсичность базового соединения Ia на белых крысах массой 180-200 граммов при внутрижелудочном введении суспензии препарата с помощью зонда. Установлено, что LD50 этого препарата составляет 300 мг/кг массы тела, что позволяет отнести предлагаемое соединение к среднетоксичным.
ИСТОЧНИКИ ИНФОРМАЦИИ

| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЛЕЧЕНИЯ КОКЦИДИОЗА (ЭЙМЕРИОЗА) СЕЛЬСКОХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ И ПТИЦ | 2011 |
|
RU2477129C1 |
| 1-ОМЕГА-АРИЛОКСИАЛКИЛ- И 1-БЕНЗИЛЗАМЕЩЕННЫЕ 2-ИМИНОБЕНЗИМИДАЗОЛИНЫ И ИХ ФАРМАКОЛОГИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, ОБЛАДАЮЩИЕ ПРОТИСТОЦИДНОЙ И АНТИМИКРОБНОЙ АКТИВНОСТЬЮ | 2012 |
|
RU2514196C1 |
| 1-[ω-АРИЛОКСИАЛКИЛ(БЕНЗИЛ)]ЗАМЕЩЕННЫЕ 2-АМИНОБЕНЗИМИДАЗОЛЫ, ОБЛАДАЮЩИЕ АКТИВНОСТЬЮ В ОТНОШЕНИИ ВИРУСА ГРИППА | 2012 |
|
RU2570906C2 |
| ПРОИЗВОДНЫЕ 1-(2-АРИЛОКСИЭТИЛ)- И 1-БЕНЗИЛЗАМЕЩЕННЫХ 3-(2-ГИДРОКСИЭТИЛ)-2-ИМИНОБЕНЗИМИДАЗОЛИНА, ОБЛАДАЮЩИЕ АНТИБАКТЕРИАЛЬНОЙ И ПРОТИСТОЦИДНОЙ АКТИВНОСТЬЮ | 2012 |
|
RU2513993C2 |
| СОЛИ 9-ЗАМЕЩЕННЫХ 2-ГАЛОГЕНФЕНИЛИМИДАЗО [1,2-a]БЕНЗИМИДАЗОЛОВ И ГАЛОГЕНИДЫ 1-ЗАМЕЩЕННЫХ 3-ГАЛОГЕНФЕНАЦИЛ-2-АМИНОБЕНЗИМИДАЗОЛИЯ, ОБЛАДАЮЩИЕ ГЕМОРЕОЛОГИЧЕСКИМИ СВОЙСТВАМИ | 2005 |
|
RU2290404C1 |
| СОЛИ 9-(2-МОРФОЛИНОЭТИЛ)-2-(4-ФТОРФЕНИЛ)ИМИДАЗО[1,2-a]БЕНЗИМИДАЗОЛА И СОЛИ 9-АМИНОЭТИЛЗАМЕЩЕННЫХ 2-(4-ФТОРФЕНИЛ)ИМИДАЗО[1,2-a]БЕНЗИМИДАЗОЛА, ПРОЯВЛЯЮЩИЕ ОБЕЗБОЛИВАЮЩЕЕ ДЕЙСТВИЕ | 2009 |
|
RU2412187C1 |
| 9-Замещенные-2-бифенилимидазо[1,2-а]бензимидазолы и их фармацевтически приемлемые соли, обладающие антиоксидантными и антирадикальными свойствами | 2017 |
|
RU2649979C1 |
| 11-(4-трет-Бутилбензил)- и фенацилзамещённые 2, 3, 4, 5-тетрагидро[1, 3]диазепино [1, 2-а]бензимидазола, обладающие анксиолитической активностью | 2016 |
|
RU2629022C1 |
| СРЕДСТВО, ИНГИБИРУЮЩЕЕ Na+/H+-ОБМЕН, И ГАЛОГЕНИДЫ 1-ДИАЛКИЛАМИНОЭТИЛ-3-[ЗАМЕЩЕННЫЙ(ДИЗАМЕЩЕННЫЙ) ФЕНАЦИЛ]-2-АМИНОБЕНЗИМИДАЗОЛИЯ | 2013 |
|
RU2518741C1 |
| СОЛИ-10-ω-АРИЛОКСИАЛКИЛ-2,3,4,10-ТЕТРАГИДРОПИРИМИДО[1,2-A]БЕНЗИМИДАЗОЛА, ОБЛАДАЮЩИЕ МЕСТНОАНЕСТЕЗИРУЮЩИМ ДЕЙСТВИЕМ | 2003 |
|
RU2233280C1 |
Настоящее изобретение относится к новым производным бензимидазола общей формулы I и к их фармакологически приемлемым солям, где Ib R=Cl, R1=Н, R2=3,4-Cl2-С6Н3; Ic R=Н, R1=СН3, R2=3,4-Cl2-С6Н3; Id R=Н, R1=Cl, R2=CONH2; Х=Cl-, Br-, обладающим антибактериальным действием. Технический результат: получены новые производные бензимидазола, обладающие высокой антибактериальной активностью. 1 табл.
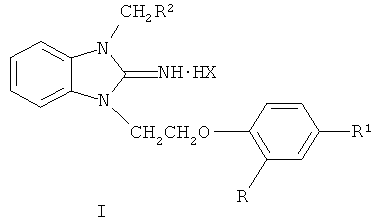
1,3-Дизамещенные 2-иминобензимидазолина и их фармакологически приемлемые соли формулы I
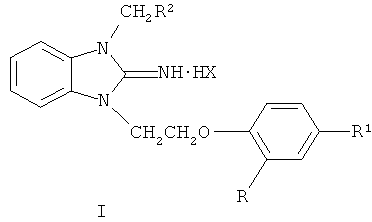
Ib R=Cl, R1=H, R2=3,4-Cl2-С6Н3;
Ic R=Н, R1=СН3, R2=3,4-Cl2-С6Н3;
Id R=H, R1=Cl, R2=CONH2;
Х=Cl-, Br-,
обладающие антибактериальной активностью.
| Устройство для импульсного регулирования скорости электродвигателя постоянного тока последовательного возбуждения | 1971 |
|
SU474090A1 |
| REGISTRY STN RN: 1158527-92-4 (введено 16.06.2009) | |||
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
| БИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ ГУАНИДИНА И ИХ ТЕРАПЕВТИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ | 2002 |
|
RU2282622C2 |
Авторы
Даты
2011-07-10—Публикация
2009-09-17—Подача