Изобретение относится к медицинской химии и сельскому хозяйству, а именно к препаратам, используемым для борьбы с инфекционными заболеваниями людей, животных и растений.
Известны фторпроизводные 3-карбоксихинолонов-4 (фторхинолоновые антибиотики), обладающие антибактериальным действием и применяющиеся в медицинской и ветеринарной практике, однако, эти соединения имеют серьезные побочные эффекты [1].
Известны также хлорарилоксиалкилпроизводные бензимидазола [2-9], обладающие антибактериальным действием. Наиболее активные из них 1-[4-(4-хлорфенокси)бутил-1Н-1,3-бензимидазол и 1-[5-(2,4-дихлорфенокси)амил]-1Н-1,3-бензимидазол имеют показатели МИК 25-35 мкг/мл для Staphylococcus aureus A 15091 и МИК>128 мкг/мл - для Salmonella typhi O-901.
Известны 1,3-дизамещенные 2-иминобензимидазолина, обладающие антибактериальным действием [10], выбранные нами в качестве прототипа.
Однако эти соединения высокоактивны только против граммположительных бактерий и сравнительно токсичны.
Цель данного изобретения - синтез производных 2-иминобензимидазолина с высокой антибактериальной и протистоцидной активностью, а также расширение арсенала средств, воздействующих на живой организм.
Поставленная цель достигается синтезом соединений формулы 1а-л, обладающих антимикробным и протистоцидным действием.
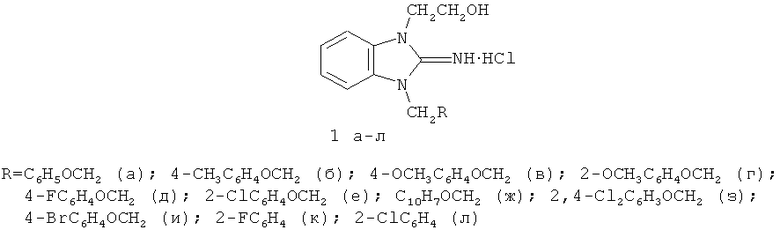
Гидрохлориды 1-(2-арилоксиэтил)- и 1-бензилзамещенных 3-(2-гидроксиэтил)-2-иминобензимидазолина (1а-л) получены в две стадии:
1 стадия - алкилирование 2-аминобензимидазола (2) [11] 2-арилоксиэтилбромидами (синтезированны аналогично методике [12]) или 2-замещенными бензилбромидами (3);
2 стадия - образующиеся на первой стадии 2-амино-1-(2-арилоксиэтил)-или 1-(2-галогенбензил)бензимидазолы (4) вводят в реакцию с этиленхлоргидрином:
ПРИМЕРЫ СИНТЕЗОВ
Общая методика синтеза гидрохлоридов 1-(2-арилоксиэтил)- и 1-бензилзамещенных 3-(2-гидроксиэтил)- 2-иминобензимидазолинов (1а-л)
СТАДИЯ 1.
1-Замещенные 2-аминобензимидазола (4).
Исходные амины бензимидазольного ряда 4 могут быть получены 2 способами.
Способ 1.
К раствору 1,3 г (10 ммоль) 2-аминобензимидазола 2 и 1,3 г (20 ммоль) KОН (в расчете на 85% содержание KОН) в 1,5 мл воды добавляют 10 мл ацетона и в полученную двухфазную систему при интенсивном перемешивании порциями вносят 10 ммоль замещенного 2-арилоксиэтилбромида так, чтобы температура реакционной массы не превышала 25°С. По окончании прибавления смесь перемешивают 2,5 часа при 45°С, охлаждают, отделяют ацетоновый слой, водно-щелочной слой еще дважды встряхивают с ацетоном (10 мл × 2), а ацетоновые фракции объединяют и упаривают ацетон на роторном испарителе до объема -10 мл. Ацетоновый экстракт выливают в 20 мл воды, а выпавшие при этом светло-розовые кристаллы амина отфильтровывают и промывают 5 мл воды, а затем высушивают их при комнатной температуре.
По этой методике получены следующие 1-замещенные 2-аминобензимидазола:
1-(2-Феноксиэтил)-2-аминобензимидазол (4а)
Синтезирован нами ранее [13].
Исходные вещества: 2-аминобензимидазол и 2-феноксиэтилбромид.
1-[2-(4-Метилфеноксиэтил)]-2-аминобензимидазол (4б)
Синтезирован нами ранее [10].
Исходные вещества: 2-аминобензимидазол и 2-(4-метилфенокси)этилбромид.
1-[2-(4-Метоксифеноксиэтил)]-2-аминобензимидазол (4в)
Исходные вещества: 2-аминобензимидазол и 2-(4-метоксифенокси)этилбромид.
Выход 67%. Светло розовые кристаллы с т.пл. 150-151°С (из изопропанола). Найдено (%): С 67,49; Н 5,88; N 14,49. C16H17N3O2. Вычислено (%): С 67,83; Н 6,05; N 14,83. Спектр ЯМР 1H, (300 МГц), δ, м.д. (CDCl3): 3,72 (с, 3Н, ОМе); 4,24 (т, 2Н, NCH2); 4,34 (т, 2Н, ArOCH2), 4,92 (с, 2Н, NH2); 6,74-6,80 (м, 4Н, ArO); 7,05-7,18 (м, 3Н, 5,6,7-Н бензимидазольного фрагмента); 7,45 (д, 1Н, 4-Н бензимидазольного фрагмента).
1-[2-(2-Метоксифеноксиэтил)]-2-аминобензимидазол (4г)
Исходные вещества: 2-аминобензимидазол и 2-(2-метоксифенокси)этилбромид.
Выход 71%. Слегка розоватые кристаллы с т.пл. 209-210°С (из изопропанола). Найдено (%): С 67,49; Н 5,88; N 14,49. C16H17N3O2. Вычислено (%): С 67,83; Н 6,05; N 14,83. Спектр ЯМР 1H (300 МГц), δ, м.д. (CDCl3): 3,65 (с, 3Н, ОМе); 4,25 (т, 2Н, NCH2); 4,32 (т, 2Н, ArOCH2), 4,92 (с, 2Н, NH2); 6,70-6,82 (м, 4Н, ArO); 7,05-7,15 (м, 3Н, 5,6,7-Н бензимидазольного фрагмента); 7,42 (д, 1Н, 4-Н бензимидазольного фрагмента).
1-[2-(4-Фторфеноксиэтил)]-2-аминобензимидазол (4д)
Исходные вещества: 2-аминобензимидазол и 2-(4-фторфенокси)этилбромид.
Выход 69%. Розоватые кристаллы с т.пл. 195-196,5°С (из изопропанола). Найдено (%): С 65,94; Н 5,06; N 15,10. C15H14FN3O. Вычислено (%): С 66,41; Н 5,20; N 15,49. Спектр ЯМР 1H (300 МГц), δ, м.д. (CDCl3): 4,26 (т, 2Н, NCH2); 4,39 (т, 2Н, ArOCH2), 5,15 (уш.с, 2Н, NH2); 6,75 (д, 2Н, орто-H ArO,); 6.85-6.96 (м, 2Н, мета-H ArO); 7,10-7,20 (м, 3Н, 5,6,7-Н бензимидазольного фрагмента); 7,41 (д, 1Н, 4-Н бензимидазольного фрагмента).
1-[2-(2-Хлорфеноксиэтил)]-2-аминобензимидазол (4е)
Синтезирован по методике [10].
Исходные вещества: 2-аминобензимидазол и 2-(2-хлорфенокси)этилбромид.
Выход 86%. Бесцветные кристаллы с т.пл. 218-219°С (из изопропанола). Найдено (%): С 62,94; Н 5,06; С1 11.90; N 14,40. C15H14ClN3O. Вычислено (%): С 62,61; Н 4,90; С112,32; N 14,60. Спектр ЯМР 1Н, (300 МГц), δ, м.д. (CDCl3): 4,25 (т, 2Н, NCH2); 4,38 (т, 2Н, ArCH2), 4,90 (с, 2Н, NH2); 6,75 (д, 1Н, орто-H ArO,); 6,90 (д, 1H, пара-H ArO); 7,05-7,18 (м, 5Н, мета-H ArO + 5,6,7-Н бензимидазольного фрагмента); 7,44 (д, 1Н, 4-Н бензимидазольного фрагмента).
Способ 2.
Смесь 0,67 г КОН, 1,31 г (10 ммоль) 2-аминобензимидазола, 15 мл ДМСО тщательно перемешивают при 35°С 15 минут. К полученной натриевой соли бензимидазола прикалывают 10 ммоль алкилирующего агента с такой скоростью, чтобы температура реакции не превышала 50°С/ Реакционную массу выдерживают при этой температуре 30 минут, охлаждают и постепенно вливают в 40 мл воды. При этом выпавший в процессе реакции обильный кристаллический осадок сначала растворяется, а затем выпадает ватообразный объемный осадок 1-замещенного 2-аминобензимидазола, который фильтруют, промывают 5% раствором KОН, водой и высушивают.
По этой методике получены следующие 1-замещенные 2-аминобензимидазола:
1-[2-(Нафтокси-1)этил]-2-аминобензимидазол (4ж)
Исходные вещества: 2-аминобензимидазол и 2-(нафтокси-1)этилбромид. Выход 74%. Бесцветные кристаллы с т.пл. 239°С (из бутанола). Найдено (%): С 79,25; Н 5,30; N 15,22. C18H15N3. Вычислено (%): С 79,10; Н 5,53; N 15,37. Спектр ЯМР 1H (300 МГц), δ, м.д. (DMSO-d6): 4,50 (с, 4Н, 2СН2); 4,92 (с, 2Н, NH2); 6,80 (д, 1Н, 1-Н нафталинового фрагмента); 7,08-7,20 (м, 3Н, 5,6-Н бензимидазольного фрагмента + 1Н нафталинового фрагмента; 7,41-7,50 (м, 5Н, нафталинового фрагмента); 7,78 (д, 1Н, 7-Н бензимидазольного фрагмента); 8,05 (д, 1Н, 4-Н бензимидазольного фрагмента).
1-[2-(2,4-Дихлорфеноксиэтил)]-2-аминобензимидазол (4з)
Исходные вещества: 2-аминобензимидазол и 2-(2,4-дихлорфенокси)этилбромид. Выход 72%. Белоснежные пластины с т.пл. 198,5-200°С (из смеси изопропанол: диметилформамид 10:1). Найдено (%): С 55,58; Н 3,96; N 12,62. C15H13Cl2N3O. Вычислено (%): С 55,92; Н 4,07; N 13,04. Спектр ЯМР 1H (300 МГц), δ, м.д. (CDCl3): 4,28 (т, 2Н, NCH2); 4,40 (т, 2Н, ArOCH2), 4,95 (с, 2Н, NHa); 6,75 (д, 1Н, орто-H ArO,); 7,05-7,18 (м, 5Н, 2 мета-Н ArO + 5,6,7-Н бензимидазольного фрагмента); 7,44 (д, 1Н, 4-Н бензимидазольного фрагмента).
1-[2-(4-Бромфеноксиэтил)]-2-аминобензимидазол (4и)
Исходные вещества: 2-аминобензимидазол и 2-(4-бромфеноксиэтил)бромид.
Выход 79%. Белоснежные пластинки с т.пл. 167-168°С (из изопропанола). Найдено (%): С 53,88; Н 4,06; Br 23,72; N 12,35. C15H14BrN3O. Вычислено (%): С 54,23; Н 4,25; Br 24,05; N 12,65. Спектр ЯМР 1Н, (300 МГц), δ, м.д. (CDCl3): 4,25 (т, 2Н, NCH2); 4,38 (т, 2Н, ОСН2), 5,20 (уш. с, 2Н, NH2); 6,74 (д, 2Н, орто-Н ArO,); 7,05-7,20 (м, 5Н, 2 мета-H ArO + 5,6,7-Н бензимидазольного фрагмента); 7,45 (д, 1Н, 4-Н бензимидазольного фрагмента).
1-(2-Фторбензил)-2-аминобензимидазол (4к)
Исходные вещества: 2-аминобензимидазол и 2-фторбензилбромид.
Выход 1,73 г (72%). Белоснежные пластины с т.пл. 184-185°С (из ацетонитрила). Найдено (%): С 69,31; Н 4,66; N 17,20. C14H12FN3. Вычислено (%): С 69,70; Н 5,01; N 17,42. Спектр ЯМР 1H, (300 МГц), δ, м.д. (CDCl3): 4,55 (уш. с, 2Н, NH2); 5,19 (с, 2Н, СН2); 7,05-7,16 (м, 6Н, 1 орто- Н и 2 мета-Н Bn + 5,6,7-Н бензимидазольного фрагмента); 7,26 (д, 1Н, орто-H Bn); 7,44 (д, 1Н, 4-Н бензимидазольного фрагмента).
1-(2-Хлорбензил)-2-аминобензимидазол (4 л)
Исходные вещества: 2-аминобензимидазол и 2-хлорбензилбромид. Выход 77%. Бесцветные кристаллы с т.пл. 159-160°С (из изопропанола). Найдено (%): С 65,00; Н 4,70; N 16,10. C14H12ClN3. Вычислено (%): С 65,25; Н 4,69; N 16,30. Спектр ЯМР 1H, (300 МГц), δ, м.д. (CDCl3): 4,70 (уш. с, 2Н, NH2); 5,20 (с, 2Н, СН2); 7,10-7,25 (м, 6Н, 1 орто- и 2 мета-Н Bn + 5,6,7-Н бензимидазольного фрагмента); 7,22-7,34 (м, 2Н, napa-R Bn); 7,42 (д, 1Н, 4-H бензимидазольного фрагмента).
СТАДИЯ 2.
1-(2-Арилоксиэтил)- и 1-бензилзамещенные 3-(2-гидроксиэтил)-2-иминобензимидазолина.
К нагретому до 60°С раствору 10 ммоль 1-замещенного 2-аминобензимидазола в 20 мл растворителя (указан при описании каждого соединения) прибавляют 1,6 г (20 ммоль, 1,3 мл) этиленхлоргидрина и кипятят 2-3 часа. Затем отфильтровывают гидрохлориды 1-замещенного 2-имино-3-(2-гидрокси) этилбензимидазолина 1а-л, тщательно промывают осадок этанолом (5 мл × 2) и высушивают.
По вышеописанной методике получены следующие гидрохлориды 1-(2-арилоксиэтил)- и 1-бензилзамещенные 3-(2-гидроксиэтил)-2-иминобензимидазолина 1а-л.
1-(2-Феноксиэтил)-2-имино-3-(2-гидроксиэтил)бензимидазолина гидрохлорид (1а)
Получен из 1-(2-феноксиэтил)-2-аминобензимидазола и этиленхлоргидрина при кипячении в этаноле с выходом 76%. Бесцветные мелкие кристаллы с т.пл. 263-264°С (из этанола). Найдено (%): С 61,82; Н 5,62; С 110,24; N 12,31. C17H20ClN3O2. Вычислено (%): С 61,17; Н 6,04; Cl 10,62; N 12,59. Спектр ЯМР 1H, (300 МГц), δ, м.д. (DMSO-d6): 3,22 (т, 2Н, СН2ОН); 4.25-4,38 (м, 4Н+NCH2CH2OH+NCH2OAr); 4,65 (т, 2Н, CH2OAr); 5,10 (уш.с, 1Н, ОН); 6,80 (д, 2Н, орто-H Ar); 6,86 (т, 1Н, пара-Н ArO); 7,20-7.30 (м, 2Н, Ph, м-Н) (т, 2Н, 5,6-Н бензимидазолинового фрагмента); 7,26 (т, 2Н, мета-Н Ar); 7,58 (д, 1Н, 7-Н бензимидазолинового фрагмента); 7,62 (д, 1Н, 4-Н бензимидазолинового фрагмента); 9,10 (с, 2Н, =N+H2).
1-[2-(4-Метилфеноксиэтил)]-2-имино-3-(2-гидроксиэтил)бензимидазолина гидрохлорид (1б)
Получен из 1-[2-(4-метилфеноксиэтил)]-2-аминобензимидазола и этиленхлогидрина в этаноле с выходом 66%. Белоснежные мелкие кристаллы с т.п. 208-210°С (из метанола). Найдено (%): С 61,79; Н 5,94; Cl 10,01; N 12,00. C18H22ClN3O2. Вычислено (%): С 62,15; Н 6,38; С 110,19; N 12,08. Спектр ЯМР 1Н, (300 МГц), δ, м.д. (DMSO-d6): 3,00 (с, 3Н, СН3); 3,85 (т, 2Н, CH2OH); 4,32 (т, 2Н, NCH2CH2OAr); 4,38 (т, 2Н, HCH2CH2OH); 4,60 (т, 2Н, CH2OAr); 4,97 (уш.с, 1Н, ОН); 6,68 (д, 2Н, орто-Н Ar); 6,85-7,02 (м, 2Н, 5,6-Н бензимидазолинового фрагмента); 7,26 (д, 2Н, мета-H Ar); 7,42-7.58 (м, 2Н, 4,7-Н бензимидазолинового фрагмента); 9, 50 (уш. с, 2Н, =N+H2).
1-[2-(4-Метоксифеноксиэтил)]-2-имино-3-(2-гидроксиэтил)бензимидазолина гидрохлорид (1в)
Получен при кипячении 1-[2-(4-метоксифеноксиэтил)]-2-аминобензимидазола и этиленхлоргидрина в толуоле с выходом 71%. Бесцветные кристаллы с т.пл. 211,5-213°С (из метанола). Найдено (%): С 59,78; Н 5,80; Cl 9,48; N 11,12. C18H22ClN3O3. Вычислено (%): С 59,42; Н 6,09; Cl 9,74; N 11,55. Спектр ЯМР 1Н, (300 МГц), δ, м.д. (DMSO-d6): 3,65 (с, 3Н, ОСН3); 3,78 (т, 2Н, CH2OH); 4,25 (т, 2Н, NCH2CH2OH); 4,36 (т, 2Н, NCH2CH2OAr); 4,65 (т, 2Н, CH2OAr); 5,03 (уш.с, 1Н, ОН); 6,68-6.80 (м, 4Н, 2 орто-H Ar + 5,6-Н бензимидазолинового фрагмента); 7,26 (т, 2Н, 2 мета-H Ar); 7,45-7.57 (м, 2Н, 4,7-Н бензимидазолинового фрагмента); 4.50 (уш. с, 2Н, =N+H2).
1-[2-(2-Метоксифеноксиэтил)]-2-имино-3-(2-гидроксиэтил)бензимидазолина гидрохлорид (1г)
Синтезирован из 1-[2-(2-метоксифеноксиэтил)]-2-аминобензимидазола и этиленхлоргидрина в толуоле с выходом 78%. Бесцветный мелкий порошок с т.пл 210-211°С (из этанола). Найдено (%): С 59,66; Н 5,72; Cl 9,50; N 11,23. C18H22ClN3O3. Вычислено (%): С 59,42; Н 6,09; Cl 9,74; N 11,55. Спектр ЯМР 1H, (300 МГц), δ, м.д. (DMSO-d6): 3,75 (с, 3Н, ОСН3); 3,88 (т, 2Н, СН2ОН); 4,26 (т, 2Н, NCH2CH2OH); 4,46 (т, 2Н, NCH2CH2OAr); 4,66 (т, 2Н, CH2OAr); 4,95 (уш.с, 1Н, ОН); 6,45-6,60 (м, 4Н, орто- и пара-Н Ar + 5,6-Н бензимидазолинового фрагмента); 7,20-7,35 (т, 2Н, мета-Н Ar); 7,45-7,55 (дд, 2Н, 4,7-Н бензимидазолинового фрагмента); 9,50 (уш. с, 2Н, =N+H2).
1-[β-(4-Фторфеноксиэтил)]-2-имино-3-(2-гидроксиэтил)бензимидазолина гидрохлорид (1д).
Получен из 1-[2-(4-фторфеноксиэтил)]-2-аминобензимидазола и этиленхлоргидрина в метаноле с выходом 69%. Т.пл. 244-245,5°С (из этанола). Найдено (%): С 57,79; Н 5,00; N 11,58. C17H19FN3ClO2. Вычислено (%): С 58,04; Н 5,44; N 11,94. Спектр ЯМР 1H, (300 МГц), δ, м.д. (DMSO-d6): 3,72 (т, 2Н, CH2OH); 4,30 (дд, 4Н+NCH2CH2OH+NCH2CH2OAr); 4,70 (д, 2Н, CH2OAr); 5,10 (уш.с, 1Н, ОН); 6,80 т, (2Н, орто-H Ar); 6.90 (т, 2Н, 5,6-Н бензимидазолинового фрагмента); 7,25 (т, 2Н, мета-H Ar); 7,50 (дд, 2Н, 4,7-Н бензимидазолинового фрагмента); 9,55 (уш. с, 2Н, =N+H2).
1-[2-(2-Хлорфеноксиэтил)]-2-имино-3-(2-гидроксиэтил)бензимидазолина гидрохлорид (1е)
Получают из 1-[(2-хлорфеноксиэтил)]-2-аминобензимидазола и этиленхлоргидрина при кипении в диметилформамиде с выходом 84%. Бесцветные кристаллы с т.пл. 240-241,5°С (из этанола). Найдено (%): С 59,66; Н 5,72; Cl 19,00; N 11,11. C17H19Cl2N3O2. Вычислено (%): С 55,45; Н 5,20; Cl 19,25; N 11,41. Спектр ЯМР 1Н, (300 МГц), δ, м.д. (DMSO-d6): 3,72 (т, 2Н, CH2OH); 4,30-4,50 (м, 4Н, NCH2CH2OH+NCH2CH2OAr); 4,75 (т, 2Н, CH2OAr); 5,00 (с, 1Н, ОН); 6,95 (д, 1Н, орто-H, Ar); 7,00 (т, 1Н, пара-H Ar); 7,15-7,30 (м, 4Н, мета-H ArO + 5,6-Н бензимидазолинового фрагмента); 7,40-7.55 (м, 1Н, 7-Н бензимидазольного фрагмента); 7,68 (д, 1Н, 4-Н бензимидазолинового фрагмента); 9,45 (с, 2Н, =N+H2).
1-[2-(Нафтокси-1)этил]-2-имино-3-(2-гидроксиэтил)бензимидазолина гидрохлорид (1ж)
Получают из 1-[2-(нафтокси-1)этил]-2-аминобензимидазола и этиленхлоргидрина при кипении в диметилформамиде с выходом 82%. Бесцветные кристаллы с т.пл. 290-291,5°С (из смеси метанол: ДМФА 1:1). Найдено (%): С 56,45; Н 5,12; N 12,00. C16H17Cl2N3O. Вычислено (%): С 56,82; Н 5,07; N 12,42. Спектр ЯМР 1Н, (300 МГц), δ, м.д. (DMSO-d6): 3,82 (т, 2Н, CH2OH); 4,30 (т, 2Н, NCH2Ar); 4,40 (т, 2Н, NCH2CH2OH); 4,70 (т, 2Н, CH2Ar); 5,02 (уш.с, 1Н, ОН); 6,80 (д, 3Н, 1-Н нафталинового фрагмента + 5,6-Н бензимидазольного фрагмента); 7,08 (м, 1Н, 1Н нафталинового фрагмента; 7,41-7,50 (м, 5Н, нафталинового фрагмента); 7,45 (д, 1Н, 7-Н бензимидазольного фрагмента); 7,55 (д, 1Н, 4-Н бензимидазольного фрагмента); 9,50 (уш. с, 2Н, =N+H2).
1-[2-(2,4-Дихлорфеноксиэтил)]-2-имино 3-(2-гидроксиэтил)бензимидазолина гидрохлорид (1з)
Синтезируют из 1-[2-(2,4-дихлорфеноксиэтил)]-2-аминобензимидазола и этиленхлоргидрина в диметилформамиде. Бесцветные кристалл с т.пл. 231,5-232,5°С (из смеси этанол: диметилфорамид 5: 1). Найдено (%): С 50,28; Н 4,12; Cl 26,11; N 10,14. C17H18Cl3N3O2. Вычислено (%): С 50,70; Н 4,51; Cl 26,41; N 10,43. Спектр ЯМР 1H, (300 МГц), δ, м.д. (DMSO-d6): 3,78 (т, 2Н, NCH2CH2OAr); 4.40 (т, 2Н, NCH2CH2OH); 4,52 (т, 2Н, CH2OH); 4,71 (т, 2Н, CH2OAr); 5,00 (уш.с, 1Н, ОН); 6,82 (д, 2Н, орто-Н OAr); 7,18-7,30 (м, 4Н, 2 мета-H ArO + 5,6-Н бензимидазолинового фрагмента); 7,61 (д, 1Н, 7-Н бензимидазолинового фрагмента); 7,75 (д, 1Н, 4-Н бензимидазолинового фрагмента); 9,65 (уш.с, 2Н, =N+H2).
1-[2-(4-Бромфеноксиэтил)]-2-имино-3-(2-гидроксиэтил)бензимидазолина гидрохлорид (1и)
Синтезирован из 1-[2-(4-бромфеноксиэтил)]-2-аминобензимидазола и этиленхлоргидрина в диметилформамиде с выходом 88%. Белоснежные мелкие кристаллы с т.пл. 237-238°С (из смеси этанол: ДМФА 5:1). Найдено (%): С 59,66; Н 5,72; N 11,11. C17H19BrCl2N3O2. Вычислено (%): С 55,45; Н 5,20; N 11,41. Спектр ЯМР 1Н, (300 МГц), δ, м.д. (DMSO-d6): 3,75 (т, 2Н, СН2ОН); 4,30 (т, 2Н, NCH2CH2OH); 4,45 (т, 2Н, NCH2CH2OAr); 4,75 (т, 2Н, CH2OAr); 5,0 (уш.с, 1Н, ОН); 6,75 (д, 2Н, орто-H, Ar); 7,18-7,30 (м, 4Н, 2 мета-H ArO + 5,6-Н бензимидазолинового фрагмента); 7,45 (д, 1Н, 7-Н бензимидазолинового фрагмента); 7,55 (д, 1Н, 4-Н бензимидазольного фрагмента); 9.70 (уш.с, 2Н, =N+H2).
1-(2-Фторбензил)-2-имино-3-(2-гидроксиэтил)бензимидазолина гидрохлорид (1к)
Получают из 1-(2-фторбензил)-2-аминобензимидазола и этиленхлоргидрина с выходом 78%. Т.пл. 261-262°С (этанол: ДМФА 1:1). Найдено (%): С 59,45; Н 5,00; N 12,80. C16H17FN3O. Вычислено (%): С 29,72; Н 5.33; N 13.06. Спектр ЯМР 1H, (300 МГц), δ, м.д. (DMSO-d6): 3,75 (т, 2Н, СН2ОН); 4,40 (т, 2Н, NCH2Ar); 4,90 (уш.с, 1Н, ОН); 5,60 (т, 2Н, NCH2CH2OH): 7,05-7,35 (м, 7Н, 4Н Bn + 5,6,7-Н бензимидазолинового фрагмента); 7,58 (д, 1Н, 4-Н бензимидазолинового фрагмента); 9,62 (уш. с, 2Н, =N+H2).
1-(2-Хлорбензил)-2-имино-3-(2-гидроксиэтил)бензимидазолина гидрохлорид (1л)
Получают из 2-амино-1-(2-хлорбензил)бензимидазола и этиленхлоргидрина при кипении в диметилформамиде с выходом 84%. Бесцветные кристаллы с т.пл. 240-241,5°С (из этанола). Найдено (%): С 56,45; Н 5,12; N 12,00. C16H17Cl2N3O. Вычислено (%): С 56,82; Н 5,07; N 12,42. Спектр ЯМР 1H, (300 МГц), 6, м.д. (DMSO-d6): 3,80 (т, 2Н, CH2OH); 4,46 (т, 2Н, NCH2Ar); 5,02 (уш.с, 1Н, ОН); 5,54 (т, 2Н, NCH2CH2OH); 7,10-7,30 (м, 7Н, 4Н Bn + 5,6,7-Н бензимидазолинового фрагмента); 7,50 (д, 1H, 4-Н бензимидазолинового фрагмента); 9,50 (уш. с, 2Н, =N+H2).
ИСПЫТАНИЕ АНТИБАКТЕРИАЛЬНОЙ И ПРОТИСТОЦИДНОЙ АКТИВНОСТИ 1,3-ДИЗАМЕЩЕННЫХ 2-ИМИНОБЕНЗИМИДАЗОЛИНОВ 1а-л.
Антимикробная активность изучена в секторе синтеза ГНУ СКЗНИВИ (г.Новочеркасск).
В качестве тест-культур для проверки антимикробной активности препаратов использовали два стандартных штамма бактерий - Staphylococciis aiireus ATCC25923, Eschenchia coli ATCC 25922.
Изучение антимикробных свойств соединений 1а-л проводились по методике Миловановой С.Н. [14] способом двухкратных серийных разведений в жидкой питательной среде. Приготовленную взвесь бактерий объемом 2 мл с концентрацией 500 тысяч микробных тел в 1 мл вносили в пробирки с раствором исследуемых веществ различной концентрации объемом 2 мл. Таким образом, учитываемая микробная нагрузка составила 250 тысяч микробных тел в 1 мл. Пробирки инкубировали в термостате в течение 18 часов при 37°С. Контролем служили пробирки, содержащие питательную среду и бактерии в концентрации 250 тысяч микробных тел в 1 мл (положительный контроль). Отрицательным контролем служили пробирки с питательной средой (без бактерий). В качестве тест-организмов использовали штаммы бактерий E.coli 078 (полевой штамм) и St.aurens P-209. В качестве препарата сравнения применяли ципрофлоксацин.
Протистоцидную активность изучали на простейших Colpoda stemii.
Активность веществ определяли в убывающих разведениях от 1000,0 до 0,5 мкг/мл при постоянной нагрузке 3-суточной культурой простейших. Контролем жизнеспособности культуры служила среда, используемая для приготовления разведении веществ. Препаратом сравнения служил кокцидиостатик байкокс.
Токсичность соединений 1a-л.
Исследования токсичности соединения 1г показали, что вещества указанного строения относятся к среднетоксичным (ЛД50 составляет 0,3 г/кг массы тела для лабораторных крыс).
СПИСОК ЛИТЕРАТУРЫ
1. М.Д.Машковский. Лекарственные средства. Издание 15, М., 2006, с.842.
2. A.Khalafi-Nezhad, M.N.Soltani Rad, H.Mohabatkar, Z.Asrari, B.Hemmateenejad, Bioorg. Med. Chem., 2005, v.13, p.1931.
3. H.C.Neu, Science, 1992, v.257, p.1073.
4. D.Niccolai, L.Tarsi. R.J.Thomas, Chem. Commim., 1997, p.2333.
5. C.Hansch, T.Fujita. J.Am.Chem.Soc., 1964, 86, p.5176.
6. G.Antolini, A.Boaaoli, C.Ghiron, G.Kennedy, T.Rossi, A.Ursini, Bioorg. Med. Chem. Lett., 1999, v.9, p.1023.
7. A.Karakurt, S.Dalkara, M.Ozalp, S.Ozbey, E.Kendi, J.P.Stables, Enr. J.Med. Cto., 2001, v.36, p.421.
8. S.Khabnadideh, Z.Rezaei, A.Khalafi-Nezhad, R.Bahrmajafi, R.Mohamadi, A.A.Farrokhroz. Bioorg. Med. Chem. Lett., 2003, v.13, p.2863.
9. P.Vanelle, J.Meuche, J.Maldonado, M.P.Crozet, F.Delmas, P.Timon-David, Eur. J.Med.Chem., 2000, v.35, p.157.
10. Морковник А.С., Диваева Л.Н., Зубенко А.А., Подладчикова О.Н., Фетисов Л.Н., Акопова А.Р. Пат. РФ №2423355, 2011.
11. А.М.Симонов, А.Н.Ломакин. Журн. ВХО им. Менделеева, 1963, т.8, с.234.
12. Рубцов М.В., Байчиков А.Г. Синтетические химико-фармацевтические препараты. Изд-во «Медицина», Москва, 1971, с.86,
13. A.S.Morkovmk, L.N.Divaeva, K.A.Lyssenko, I.S.Vasilchenko, Mendeleev Comm., 2005, v.15, p.133.
14. Л.С.Страчунский, С.Н.Козлов, Современная антимикробная химиотерапия: руководство для врачей, М., 2002.
15. Першин Г.Н. Методы экспериментальной химиотерапии (практическое руководство), М., 1971.
16. Методы экспериментальной химиотерапии, М., «Медицина», 1971, с.100-106.
| название | год | авторы | номер документа |
|---|---|---|---|
| 1-[ω-АРИЛОКСИАЛКИЛ(БЕНЗИЛ)]ЗАМЕЩЕННЫЕ 2-АМИНОБЕНЗИМИДАЗОЛЫ, ОБЛАДАЮЩИЕ АКТИВНОСТЬЮ В ОТНОШЕНИИ ВИРУСА ГРИППА | 2012 |
|
RU2570906C2 |
| 1-ОМЕГА-АРИЛОКСИАЛКИЛ- И 1-БЕНЗИЛЗАМЕЩЕННЫЕ 2-ИМИНОБЕНЗИМИДАЗОЛИНЫ И ИХ ФАРМАКОЛОГИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, ОБЛАДАЮЩИЕ ПРОТИСТОЦИДНОЙ И АНТИМИКРОБНОЙ АКТИВНОСТЬЮ | 2012 |
|
RU2514196C1 |
| 1,3-ДИЗАМЕЩЕННЫЕ 2-ИМИНОБЕНЗИМИДАЗОЛИНА, ОБЛАДАЮЩИЕ АНТИБАКТЕРИАЛЬНЫМ ДЕЙСТВИЕМ | 2009 |
|
RU2423355C2 |
| СПОСОБ ЛЕЧЕНИЯ КОКЦИДИОЗА (ЭЙМЕРИОЗА) СЕЛЬСКОХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ И ПТИЦ | 2011 |
|
RU2477129C1 |
| Производные 1,4-диоксида хиноксалин-2-карбонитрила, ингибирующие рост опухолевых клеток | 2016 |
|
RU2640304C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-АЛКИЛЗАМЕЩЕННЫХ СЕМИКАРБАЗИДОВ | 2018 |
|
RU2670622C1 |
| СОЛИ 9-ЗАМЕЩЕННЫХ 2-ГАЛОГЕНФЕНИЛИМИДАЗО [1,2-a]БЕНЗИМИДАЗОЛОВ И ГАЛОГЕНИДЫ 1-ЗАМЕЩЕННЫХ 3-ГАЛОГЕНФЕНАЦИЛ-2-АМИНОБЕНЗИМИДАЗОЛИЯ, ОБЛАДАЮЩИЕ ГЕМОРЕОЛОГИЧЕСКИМИ СВОЙСТВАМИ | 2005 |
|
RU2290404C1 |
| 9-Замещенные-2-бифенилимидазо[1,2-а]бензимидазолы и их фармацевтически приемлемые соли, обладающие антиоксидантными и антирадикальными свойствами | 2017 |
|
RU2649979C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-(1-АДАМАНТИЛКАРБОНИЛ)-1,2-ДИГИДРОНАФТО[2,1-b]ФУРАНОВ | 2011 |
|
RU2495033C2 |
| ЦИНКОВЫЕ КОМПЛЕКСЫ 5-[2-ГИДРОКСИ(ТОЗИЛАМИНО)БЕНЗИЛИДЕНАМИНО]-2-(2-ТОЗИЛАМИНОФЕНИЛ)-1АЛКИЛБЕНЗИМИДАЗОЛОВ, ОБЛАДАЮЩИЕ ФОТОЛЮМИНЕСЦЕНТНОЙ АКТИВНОСТЬЮ | 2013 |
|
RU2532904C1 |
Настоящее изобретение относится к средству, обладающему антибактериальной и протистоцидной активностью, на основе
гидрохлорида формулы (1а-л) 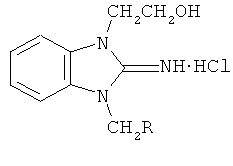 , где R=C6H5OCH2 (a); 4-CH3C6H4OCH2 (б); 4-OCH3C6H4OCH2 (в); 2-OCH3C6H4OCH2 (г); 4-FC6H4OCH2 (д); 2-ClC6H4OCH2 (e); C10H7OCH2 (ж); 2,4-Cl2C6H3OCH2 (з); 4-BrC6H4OCH2 (и); 2-FC6H4 (к); 2-ClC6H4 (л). Технический результат: получено новое средство, обладающие антибактериальной и протистоцидной активностью, в частности, в отношении бактерий Staphylococcus aureus, Escherichia coli и умеренную простоцидную активность в отношении простейших Colpoda steinii. 1 табл.
, где R=C6H5OCH2 (a); 4-CH3C6H4OCH2 (б); 4-OCH3C6H4OCH2 (в); 2-OCH3C6H4OCH2 (г); 4-FC6H4OCH2 (д); 2-ClC6H4OCH2 (e); C10H7OCH2 (ж); 2,4-Cl2C6H3OCH2 (з); 4-BrC6H4OCH2 (и); 2-FC6H4 (к); 2-ClC6H4 (л). Технический результат: получено новое средство, обладающие антибактериальной и протистоцидной активностью, в частности, в отношении бактерий Staphylococcus aureus, Escherichia coli и умеренную простоцидную активность в отношении простейших Colpoda steinii. 1 табл.
Антибактериальное и протистоцидное средство на основе гидрохлорида формулы (1а-л)

обладающие антибактериальной и протистоцидной активностью в эффективном количестве.
| Da Settimo A., et al: “Synthesis and anti-inflammatory properties of 2-aminobenzimidazole derivatives”, Farmaco, 47 (10), pp.1293-1313, 1992 | |||
| Wu, Jian-Sung, et al: “Discovery on non-glycoside sodium-dependent glucose co-transporter 2 (SGLT2) inhibitors by ligand-based virtual screening”, Journal of Medicinal Chemistry, |
Авторы
Даты
2014-04-27—Публикация
2012-03-21—Подача