Изобретение относится к области медицины, в частности к способам обработки трансплантатов клапанов сердца и сосудов, выполняемым для повышения их биосовместимости и профилактики кальциноза.
Из литературы известно, что одной из основных причин реопераций у взрослых больных и высокой смертности у пациентов в раннем детском возрасте является кальцификация аллотрансплантатов клапанов сердца. Считается, что кальциноз аллотрансплантатов клапанов сердца связан с гибелью клеток донора, в результате которой образуются центры минерализации ткани. Причем иммунный ответ против клеток донора может способствовать усилению кальциноза. Поэтому для того, чтобы уменьшить иммунный ответ на трансплантат, уменьшить кальциноз трансплантата, способствовать репопуляции ткани клетками реципиента и, соответственно, ее регенерации, в последние годы предлагается разрушать клетки донора в трансплантатах клапанов сердца (включая аллотрансплантаты и ксенотрансплантаты), а также в трансплантатах сосудов (см. J.Vase. Sugr. 1994, v.19, p.446-456; Ann. Thorac. Surg. 2001, v.71 (5 Suppl) p.S428-432).
Известен способ обработки трансплантатов для сердечно-сосудистой хирургии, в котором для снижения иммуногенности ткани и повышения ее биосовместимости обеспечивают гибель клеток донора путем инкубации в гипотонической среде и разрушение нуклеиновых кислот в растворах, содержащих ферменты нуклеазы (см. Sem. Thorac. Cardiovasc. Surg. 1999, vol.4 (Suppl 1), p.194-200).
Недостатком способа является то, что согласно результатам экспериментов на лабораторных животных такая обработка снижает иммуногенность, но не предотвращает кальциноз стенок кровеносных сосудов, например аорты, фрагмент которой является частью трансплантатов аортальных клапанов сердца. Кальциноз трансплантатов клапанов сердца, обработанных этим способом, был причиной нарушения работы имплантированных клапанов при клинических испытаниях.
Известен способ обработки тканей, содержащих коллаген, в котором для снижения иммуногенности и улучшения регенерации трансплантатов их обрабатывают до имплантации так, что удаляют все неколлагеновые компоненты, включая клетки, остатки погибших клеток, и другие компоненты тканевого матрикса, такие как протеогликаны, гликозаминогликаны, используя для этого щелочи, хелатирующие агенты, кислоты и соли (см.: патент США N 5993844, 30-11-1999). Согласно этому изобретению коллагеновый матрикс после удаления неколлагеновых компонентов сохраняет структурную организацию, целостность и способность к ремоделированию, т.е. не препятствует миграции в него клеток реципиента, ответственных за поддержание нативности ткани. Способ исключает применение детергентов и ферментов, которые отрицательно влияют на биоремоделирование коллагенового матрикса, предназначенного для имплантации.
Недостатком способа является то, что предложенная обработка направлена на удаление из тканевого матрикса не только клеток и их остатков, но также гликозаминогликанов, которые участвуют в защите ткани от кальциноза. Кроме того, коллаген является значительной составляющей поверхности миофибробластов и гладкомышечных клеток, и поэтому невозможно удалить клетки и ее составляющие, не удаляя коллаген. Следовательно, предложенная обработка не может не влиять на структуру коллагенового матрикса, подобно ферментативной обработке, а это, как известно, сохраняет кальциноз и поэтому препятствует регенерации тканевой структуры, ограничивает срок функционирования трансплантатов.
Наиболее близким, принятым за прототип, является способ обработки тканей аллотрансплантатов клапанов сердца, согласно которому для уменьшения иммуногенности и ускорения их регенерации за счет обеспечения условий, вызывающих гибель клеток донора перед посевом аутологичных клеток до имплантации, ткани инкубируют в фосфатно-солевом растворе, содержащем трипсин (0.25%) и этилендиаминтетрауксусную кислоту (ЭДТА) (0,02%), при рН 7,4 и температуре 37°С в течение 2 суток, затем отмывают от трипсина и ЭДТА и помещают в фосфатно-солевой раствор до посева на них клеток реципиента (см.: Circulation, 2002, sept.4; 106 [suppl.I]; I-63-I-68).
Недостатком способа является то, что, обеспечивая снижение иммуногенности и способствуя заселениию тканей трансплантата аутологичными клетками, он не приводит в достаточной мере к снижению кальциноза трансплантата, что ограничивает его биосовместимость. Клеточная гибель инициируется в таких условиях, которые не препятствуют зарождению центров кальциноза. Образовавшиеся в ходе гибели клеток центры кальциноза обеспечивают минерализацию бесклеточных трансплантатов даже после посева аутологичных клеток реципиента.
Задачей настоящего изобретения является создание способа обработки трансплантатов для сердечно-сосудистой хирургии, который, вызывая гибель клеток донора, предотвращает их кальциноз в организме реципиента и повышает тем самым биосовместимость трансплантатов.
Поставленная задача достигается тем, что в известном способе, включающем инкубацию тканей до имплантации в физиологическом солевом растворе с агентами, вызывающими гибель клеток донора, согласно предлагаемому изобретению трансплантаты инкубируют в солевом растворе без ионов кальция и фосфатов, содержащем хелаторы кальция в концентрации, достаточной для инициации гибели клеток донора и ингибирования центров кальциноза, и дигитонин. При этом в качестве хелаторов ионов кальция используют ЭДТА в концентрации от 0,2% до 2% либо цитрат натрия в концентрации от 1 до 2,5%, а для повышения эффективности гибели клеток донора добавляют дигитонин в концентрации до 0,1% и инкубируют трансплантаты при значении рН раствора в диапазоне от 5,0 до 7,4 и при температуре в диапазоне от 10 до 37°С в течение 2-4 суток.
В предпочтительном для полного предотвращения кальциноза варианте способа трансплантаты инкубируют в солевом растворе, содержащем 0,4% ЭДТА, 0,02% дигитонина при рН 6,0 при комнатной температуре (20-25°С) в течение 2 суток.
Применение для инкубации солевого раствора без ионов кальция и фосфатов, который содержит также хелаторы ионов кальция в высоких концентрациях и дигитонин, обеспечивает не только гибель клеток, но и эффективное связывание ионов кальция в процессе клеточной гибели, что предотвращает накопление фосфатов кальция в митохондриях и тем самым препятствует зарождению центров кальциноза ткани. Хелаторы ионов кальция при высоких концентрациях инициируют апоптотическую клеточную гибель и, кроме того, связывая ионы кальция в околоклеточном микроокружении, препятствуют локальному накоплению фосфатов кальция в митохондриях и зарождению центров кальциноза. Отсутствие ионов фосфатов и кальция в инкубационном растворе также препятствует образованию центров кальциноза во время гибели клеток. Дигитонин повышает эффективность клеточной гибели, связываясь с холестерином плазматической мембраны, в результате чего нарушается ее целостность и обеспечивается быстрая некротическая гибель клеток. Указанные в заявляемом способе значения рН солевого раствора необходимы для эффективного снижения кальциноза, поскольку минерализация фосфатов кальция и, соответственно, кальциноз ткани усиливается при щелочных рН, а при низких значениях рН (ниже 5,0) повышается вероятность конформационных перестроек белков тканевого матрикса, которые также будут способствовать минерализации кальция. Заявляемый способ может работать в широком диапазоне температур.
В предлагаемом варианте спрособа, обеспечивающем полное предотвращение кальциноза, дигитонин вызывает быструю некротическую гибель клеток, а отсутствие ионов фосфатов, кальция и наличие хелатора кальция ЭДТА в инкубационном солевом растворе при рН 6,0 и комнатной температуре (20-25°С) препятствуют зарождению центров кальциноза в погибающих клетках. Ниже представлены примеры реализации предложенного способа подготовки трансплантатов.
Пример 1.
Фрагменты стенки аорты свиньи, которые согласно люминесцентному анализу содержали до обработки живые гладкомышечные и эндотелиальные клетки, инкубировали при 20°С в течение 2 суток в солевом растворе без ионов кальция и фосфатов, содержащем 0,8% хлористого натрия, 0,4% ЭДТА, 0,25% органического буфера HEPES, рН 7,4, антибиотики гентамицин (400 мг/л) и флуканазол (20 мг/л) для обеспечения стерильности. ЭДТА в указанной концентрации применяли для того, чтобы инициировать гибель клеток, а также для того, чтобы хелатировать кальций и препятствовать образованию центров минерализации кальция во время гибели клеток. После инкубации фрагменты в течение 1 суток отмывали в забуференном солевом растворе (рН 7,4) без ионов кальция и фосфатов при 20°С, три раза меняя раствор на свежий для удаления ЭДТА. Согласно люминесцентному микроскопическому анализу после такой обработки клетки во фрагментах не менее 5 суток оставались живыми. Однако, если после обработки фрагменты помещали в питательную среду Игла с кальцием при 37°С, клетки в ткани начинали погибать в первые два часа и через 8 часов все клетки погибали. Аналогичная ситуация была после имплантации этих фрагментов крысам под кожу. Следовательно, инкубация, выполненная в соответствии с заявляемым способом, запускала гибель клеток, и реализация этой гибели осуществлялась при наличии субстратов.
Второй набор фрагментов стенок аорты свиньи инкубировали в дистиллированной воде и в физиологическом растворе, содержащем рибонуклеазу (20 мкг/мл) и дезоксирибонуклеазу (0,2 мг/мл) согласно известному способу (см.: Sem Thorac Cardiovasc Surg 1999, vol.4 (Suppl 1), p.194-200). Третий и четвертый наборы фрагментов обрабатывали с применением протеолитического фермента трипсина (0,25%) и ЭДТА (0,02%), с последующей обработкой рибонуклеазой (20 мкг/мл) и дезоксирибонуклеазой (0,2 мг/мл) в соответствии с другим известным способом (см.: Eur. J Vasc. Endovasc. Surg., 2000, vol.19, p.381-386) либо без обработки нуклеазами, как в способе, принятом за прототип. Второй и третий наборы не содержали после обработок ни живых, ни погибших клеток. В четвертом наборе все клетки после обработки были погибшими.
Пятый набор фрагментов сохраняли 3 суток при 4°С в питательной среде RPMI 1640 (рН 7,4) и использовали в качестве контрольных трансплантатов с живыми клетками донора. После этой инкубации эндотелиальные и гладкомышечные клетки во фрагментах оставались живыми.
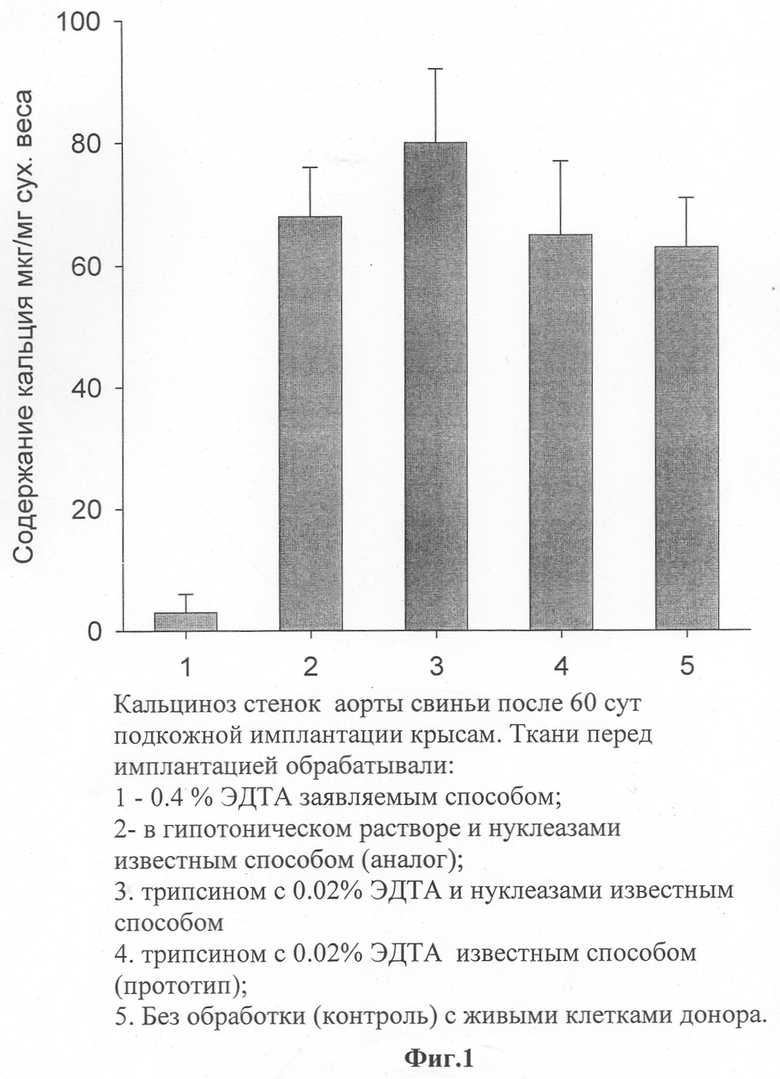
Фрагменты стенок аорты после обработок помещали в пористые камеры из нержавеющей стали с размером пор 40 мкм и имплантировали крысам линии Wistar под кожу в область спины. После 2 месяцев фрагменты эксплантировали из крыс и определяли в них содержание минерализованного кальция методом атомной абсорбционной спектроскопии. На фиг.1 приведены данные о содержании кальция в трансплантатах, обработанных известными способами, вызывающими разрушение или только гибель клеток донора, и заявляемым способом, вызывающим гибель клеток и препятствующим зарождению центров минерализации. Кроме того, представлены данные о минерализации фрагментов, содержащих живые клетки донора. Видно, что при обработке известными способами кальциноз имплантированных крысам фрагментов аорты свиньи не уменьшался. После обработки трансплантатов заявляемым способом в физиологическом растворе без кальция и фосфатов, содержащем ЭДТА в высокой концентрации (0,4%), при 37°С и рН 7,4, содержание минерализованного кальция в трансплантатах уменьшалось с 70 мг/г сухого веса ткани (необработанные трансплантаты) до 6,1 мг/г сухого веса ткани. Таким образом, применение предложенного способа путем обеспечения гибели клеток донора при высокой концентрации хелатора кальция ЭДТА, эффективно препятствующей зарождению центров минерализации, позволило значительно предотвратить кальциноз трансплантатов стенок аорты свиньи в крысах.
Пример 2.
Первую часть фрагментов стенок аорты свиньи инкубировали 2 суток при 20°С в забуференном органическим буфером HEPES (0,25%, рН 6,0) солевом растворе хлористого натрия (0,8%) без ионов кальция и фосфатов, содержащем 0,4% ЭДТА, 0,02% дигитонина, гентамицин (400 мг/л) и флуканазол (20 мг/л). Затем фрагменты отмывали 1 сутки в аналогичном физиологическом растворе, но без ЭДТА и дигитонина, меняя три раза раствор на свежий с целью удаления ЭДТА и дигитонина из фрагментов. После обработки все клетки во фрагментах были погибшими, но ядра клеток оставались в ткани. Следовательно, применяемая обработка не удаляла остатки погибших клеток из ткани. Второй набор фрагментов инкубировали 2 суток при 37°С в питательной среде Игла с кальцием с добавлением дигитонина (0,02%), гентамицина (400 мг/л) и флуконазола (20 мг/л) при рН 7,4. Затем дигитонин удаляли из фрагментов отмывкой солевым раствором, как и в первом наборе фрагментов. Во втором наборе фрагментов все клетки после обработки были погибшими и оставались во фрагментах ткани. Для этого набора фрагментов не предпринималось попыток ингибировать образование зародышей минерализации во время гибели клеток. Третий набор фрагментов сохраняли 2 суток при 4°С в питательной среде Игла (рН 7,4) с кальцием и использовали в качестве контрольных трансплантатов с живыми клетками донора, как в первом примере. После такой инкубации все клетки во фрагментах оставались живыми.
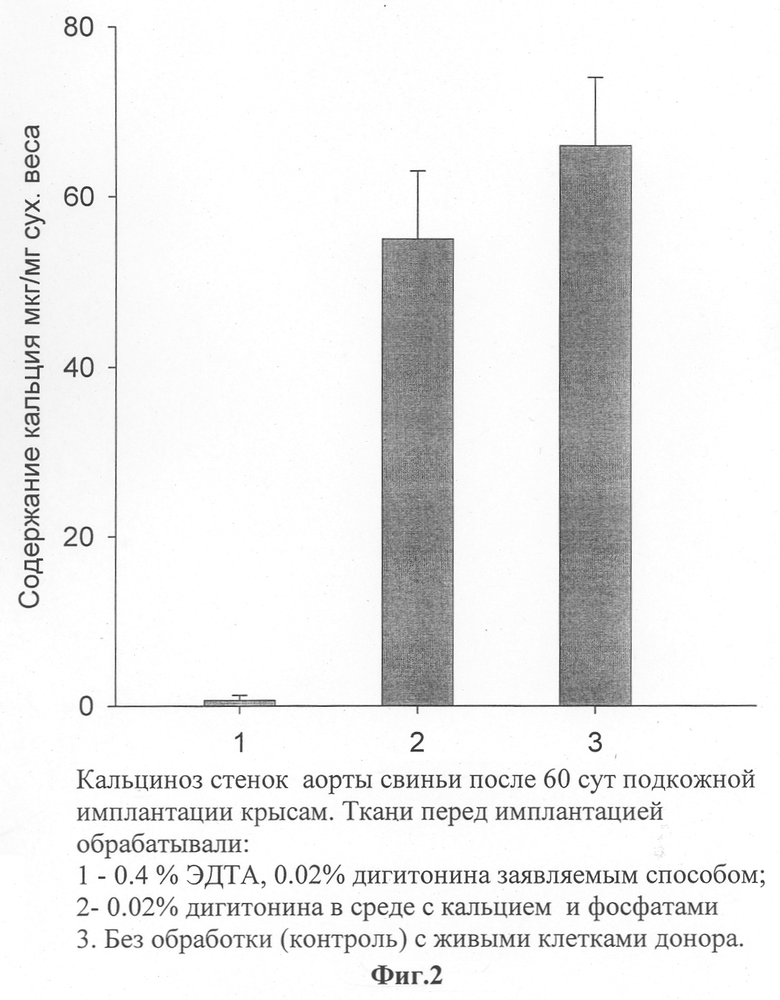
Кальциноз трансплантатов изучали так же, как и в первом примере, методом подкожной имплантации крысам. После 2 месяцев фрагменты эксплантировали из крыс и измеряли в них содержание минерализованного кальция методом атомной абсорбционной спектроскопии. На фиг.2 представлены данные о содержании кальция в трансплантатах с живыми клетками донора (контроль), в трансплантатах, обработанных только дигитонином, когда вызывали гибель клеток, но не ингибировали образование центров минерализации, и в трансплантатах, подготовленных заявляемым способом. Видно, что после обработки трансплантатов, вызывающей гибель клеток, но не препятствующей образованию центров минерализации, кальциноз был такой же активный, как в трансплантатах с живыми клетками донора. После обработки трансплантатов, выполненной в соответствии с заявляемым способом, кальциноз трансплантатов подавлялся полностью. Таким образом, заявляемый способ обработки трансплантатов, в котором сочетается обеспечение гибели клеток и ингибирование возникновения центров минерализации, вызывал полное подавление кальциноза трансплантатов.
Пример 3.
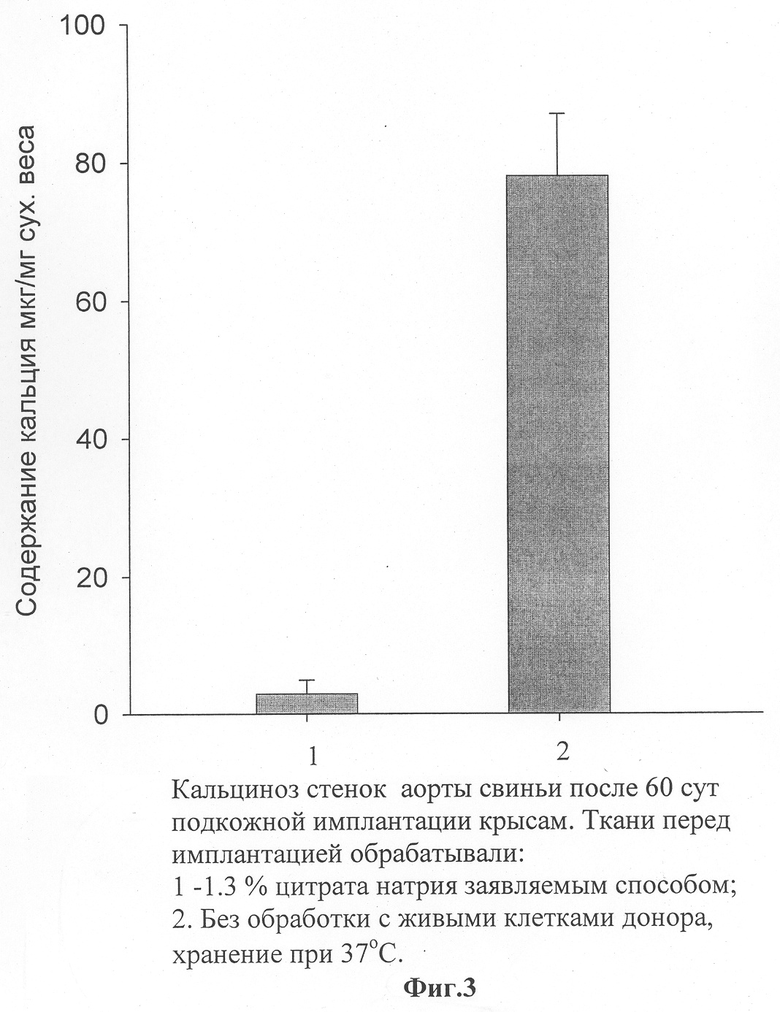
Часть фрагментов стенок аорты свиньи инкубировали 2 суток при 20°С в забуференном (рН 6,0) физиологическом растворе без ионов кальция и фосфатов, содержащем 1,3% цитрата натрия, гентамицин (400 мг/л) и флуканазол (20 мг/л). Затем фрагменты отмывали в течение суток в аналогичном растворе, но без цитрата натрия, меняя три раза раствор на свежий с целью удаления цитрата из фрагментов. Цитрат применяли для того, чтобы инициировать гибель клеток, а также для того, чтобы хелатировать кальций и тем самым препятствовать образованию центров минерализации кальция во время гибели клеток. Люминесцентный анализ показал, что клетки в обработанных фрагментах, помещенных в отмывочном растворе, оставались живыми длительное время, не менее 5 суток. Однако если после обработки фрагменты помещали в питательную среду Игла с кальцием при 37°С, клетки в ткани начинали погибать в первые два часа и через 8 часов все клетки были погибшими. Аналогичная ситуация была после имплантации этих фрагментов крысам под кожу. Второй набор фрагментов инкубировали 3 дня в питательной среде Игла с кальцием при 37°С (контроль). Клетки после такой инкубации оставались живыми как до инкубации. Кальциноз трансплантатов изучали так же, как и в первых двух примерах, используя широко известную модель подкожной имплантации крысам. Фрагменты стенок аорты свиньи эксплантировали из крыс после 2 месяцев имплантации и измеряли в них содержание минерализованного кальция методом атомной абсорбционной спектроскопии. На фиг.3 представлены данные о содержании кальция в трансплантатах с живыми клетками донора (контроль), а также в трансплантатах, подготовленных согласно предлагаемому способу. Согласно полученным результатам обработка цитратом вызывала эффективное уменьшение содержания минерализованного кальция в трансплантатах до 1,7 мг/г сухого веса ткани, в то время как трансплантат с живыми клетками без обработки кальцифицировался значительно (65 мг/г сухого веса ткани).
Таким образом, приведенные примеры показывают, что заявляемый способ обработки трансплантатов, в котором обеспечивают гибель клеток донора до или после имплантации и ингибируют возникновение центров минерализации, предотвращает кальциноз трансплантатов.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОВЫШЕНИЯ БИОСОВМЕСТИМОСТИ ТРАНСПЛАНТАТОВ КЛАПАНОВ СЕРДЦА И СОСУДОВ | 2012 |
|
RU2499611C1 |
| СПОСОБ ПОВЫШЕНИЯ БИОСОВМЕСТИМОСТИ ПЕРИКАРДИАЛЬНЫХ БИОМАТЕРИАЛОВ ДЛЯ РЕКОНСТРУКТИВНОЙ ХИРУРГИИ | 2018 |
|
RU2678966C1 |
| Способ обработки трансплантатов для сердечно-сосудистой хирургии с использованием суб- и сверхкритического диоксида углерода | 2022 |
|
RU2796364C1 |
| СПОСОБ ОБРАБОТКИ ТКАНЕЙ ТРАНСПЛАНТАТОВ ДЛЯ СЕРДЕЧНО-СОСУДИСТОЙ ХИРУРГИИ | 2002 |
|
RU2231997C2 |
| СПОСОБ ИЗГОТОВЛЕНИЯ АЛЛОГЕННЫХ ТРАНСПЛАНТАТОВ ПРИСЕРДЕЧНЫХ СОСУДОВ С КЛАПАНАМИ | 2010 |
|
RU2445940C1 |
| МНОГОМЕРНЫЙ БИОМАТЕРИАЛ И СПОСОБ ЕГО ПРИГОТОВЛЕНИЯ | 2010 |
|
RU2542430C2 |
| Тканеинженерная конструкция для восполнения объема костной ткани челюстно-лицевой области | 2019 |
|
RU2729365C1 |
| Тканебиоинженерная конструкция для восполнения объема костной ткани челюстных костей | 2022 |
|
RU2809154C1 |
| Клеточная культура и биотрансплантат для регенерации костной ткани на ее основе | 2018 |
|
RU2721532C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТКАНЕСПЕЦИФИЧЕСКОГО МАТРИКСА ДЛЯ ТКАНЕВОЙ ИНЖЕНЕРИИ ПАРЕНХИМАТОЗНОГО ОРГАНА | 2013 |
|
RU2539918C1 |
Изобретение относится к области медицины, в частности к способам обработки трансплантатов клапанов сердца и сосудов с целью повышения их биосовместимости путем профилактики кальциноза. Способ обработки трансплантатов для сердечно-сосудистой хирургии состоит в том, что для предотвращения кальциноза трансплантаты инкубируют в солевом растворе без ионов кальция и фосфатов, содержащем хелаторы кальция в концентрации, достаточной для инициации гибели клеток донора и предотвращения образования центров кальциноза, при этом в качестве хелаторов кальция используют этилендиаминтетрауксусную кислоту в концентрации от 0,2 до 2% или цитрат натрия в концентрации от 1 до 2,5%, а для повышения эффективности гибели клеток донора применяют дигитонин в концентрации до 0,1% и инкубацию проводят при значениях рН солевого раствора в диапазоне 5,0-7,5 и температуре от 10 до 37°С в течение 2-4 суток. Изобретение обеспечивает создание способа обработки трансплантатов для сердечно-сосудистой хирургии, который, вызывая гибель клеток донора, предотвращает их кальциноз в организме реципиента и повышает тем самым биосовместимость трансплантатов. 1 з.п. ф-лы, 3 ил.
| CEBOTARI S | |||
| et al | |||
| Construction of autologous human heart valves based on an acellular allograft matrix, Circulation | |||
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| Способ и прибор для проверки индикаторов и т.п. циферблатных приборов | 1943 |
|
SU65827A1 |
| US 5993844 А, 30.11.1999 | |||
| СПОСОБ ОБРАБОТКИ БИОЛОГИЧЕСКИХ ПРОТЕЗОВ ДЛЯ СЕРДЕЧНО-СОСУДИСТОЙ ХИРУРГИИ | 1996 |
|
RU2122321C1 |
| WO 9732472 A1, 12.09.1997 | |||
| СПОСОБ И УСТРОЙСТВО ОТПРАВКИ СИГНАЛА ДЛЯ ЗАПРОСА О ПЛАНИРОВАНИИ | 2009 |
|
RU2439858C1 |
Авторы
Даты
2007-01-20—Публикация
2004-07-09—Подача