Изобретение относится к гуминовым веществам и может использоваться для изучения их физико-химических свойств, взаимодействия с биологическими объектами и распределения в тканях биологических объектов.
Введение тритиевой метки в молекулы биологически активных веществ с помощью бомбардировки твердых мишеней атомарным тритием (МТАТ), полученным при диссоциации молекул трития на вольфрамовой проволоке, впервые было предложено в работе [Шишков А.В., Филатов Э.С., Симонов Е.Ф. и др. // Докл. АН СССР. 1976. Т.228. С.1237-1241]. С помощью данного метода можно получать меченые соединения самых разных классов, в том числе биологические макромолекулы. Подбирая условия введения метки, можно добиться того, чтобы меченые соединения получались с приемлемой удельной радиоактивностью, а побочные процессы, модифицирующие исходное соединение, были минимизированы. С помощью хроматографических методов очистки меченого продукта достигалась радиохимическая чистота получаемых препаратов, соответствующая современным требованиям (≥97%). Полученные с помощью МТАТ меченые белки, полисахариды и синтетические блок-сополимеры использовали для изучения растворимости ферментов в неполярных органических растворителях [V.M.Mozhaev, K.G.Poltevsky, V.I.Slepnev, G.A.Badun, A.V.Levashov. Homogeneous solutions of hydrophilic enzymes in nonpolar organic solvents. New systems for fundamental studies and biocatalytic transformations. // FEBS. 1991. V.292, N 1-2. Р.159-161], для исследования иммобилизации ферментов на хитозане и его производных [I.A.Veselova, D.L.Grigor'eva, T.N.Shekhovtsova, V.I.Korobkov, G.A.Badun. Using different polysaccharides and alkaline phosphatase immobilization. // Proceedings of Biocatalysis-2000: Fundamentals and Applications. Moscow. 2000 (June 10-15). P.173], для исследования взаимодействия плюроников с липидными мембранами липосом и клеток крови [Melik-Nubarov N.S., Pomaz O.O., Dorodnych T.Y., Badun G.A., Ksenofontov A.L., Schemchukova O.B., Arzhakov S.A. Interaction of tumor and normal blood cells with ethylene oxide and propylene oxide block copolymers. // FEBS Lett. 1999. V.446. N.1. P.194-198], [Krylova O.O., Melik-Nubarov N.S., Badun G.A., Ksenofontov A.L., Menger F.M., Yaroslavov A.A. Pluronic L61 Accelerates Flip-Flop and Transbilayer Doxorubicin Permeation. // Chemistry. 2003. V.9, N16. P.3930-3936].
Кроме того, бомбардировку атомарным тритием биологических макромолекул и их комплексов используют для исследования их структуры, причем условия воздействия таковы, что сохраняется структура и функциональная активность сложных биологических образований [Shishkov A.V., Goldanskii V.I., Baratova L.A., Fedorova N.V., Ksenofontov A.L., Zhirnov O.P., Galkin A.V. The in situ spatial arrangement of the influenza A virus matrix protein M1 assessed by tritium bombardment. // Proc. Natl. Acad. Sci. USA. 1999. V.96. N.14. P.7827-7830], [Agafonov D.E., Kolb V.A., Spirin A.S. Proteins on ribosome surface: Measurements of protein exposure by hot tritium bombardment technique. // Proc. Natl. Acad. Sci. USA. 1997. V.94. N.24. P.12892-12897], [Baratova L.A, Efimov A.V., Dobrov E.N., Feodorova N.V., Hunt R., Badun G.A., Ksenofontov A.L., Torance L., Järvekülg L. In Situ Spatial Organisation of Potato Virus A coat protein subunits assessed by tritium bombardment. // Journal of Virology, 2001. V.75, N 20, Р.9696-9702], [Dobrov E.N., Badun G.A., Lukashina E.V., Fedorova N.V., Ksenofontov A.L., Fedoseev V.M., Baratova L.A. Tritium planigraphy comparative structural study of tobacco mosaic virus and its mutant with altered host specificity. // Eur. J. Biochem. 2003. V.270. N16. P.3300-3308].
Сопоставление с другими методами
Исследование свойств компонентов гуминовых веществ (ТВ) и их поведения в различных системах, в том числе и биологических, удобно проводить, используя радиоактивную метку [Northcott, G.L.; Jones, К.С. Experimental approaches and analytical techniques for determining organic compound bound residues in soil and sediment. // Environ. Pollut., 2000, V. 108(1), P.19-43]. В большинстве случаев используют конкретные изотопномеченные химические соединения, которые образуют различные комплексы или ассоциаты с ГВ [Kang K.H., Dec J., Park H., Bollag J.M. Transformation of the fungicide cyprodinil by a laccase of Trametes villosa in the presence of phenolic mediators and humic acid. // Water Res 2002 Nov; 36(19): 4907-4915 ], [Xu F., Bhandari A. Retention and extractability of phenol, cresol, and dichlorophenol exposed to two surface soils in the presence of horseradish peroxidase enzyme. // J Agric Food Chem 2003 Jan 1;51(1):183-188], [Ertunc Т., Hartlieb N., Berns A., Klein W., Schaeffer A. Investigations on the binding mechanism of the herbicide simazine to dissolved organic matter in leachates of compost. // Chemosphere 2002 Nov; 49(6): 597-604], [Drzyzga O., Bruns-Nagel D., Gorontzy Т., Blotevogel K.H., von Low E. Anaerobic incorporation of the radiolabeled explosive TNT and metabolites into the organic soil matrix of contaminated soil after different treatment procedures. // Chemosphere 1999 Apr; 38(9): 2081-2095]. Делались попытки введения различных радионуклидов непосредственно в ГВ. В большинстве случаев для этого использовали меченные 14С соединения и с их помощью исследовали процесс образования гуминоподобных веществ (ГПВ) [Dec J., Haider К., Bollag J.M. Release of substituents from phenolic compounds during oxidative coupling reactions. // Chemosphere 2003 Jul; 52(3): 549-556], [Kappler, Andreas; Ji, Rong; Brune, Andreas. Synthesis and characterization of specifically 14C-labeled humic model compounds for feeding trials with soil-feeding termites. // Soil Biol. Biochem. 2000. V.32(8-9), P.1271-1280], [Ji, Rong; Kappler, Andreas; Brune, Andreas. Transformation and mineralization of synthetic HC-labeled humic model compounds by soil-feeding termites. // Soil Biol. Biochem., 2000. V.32(8-9), P.1281-1291]. Использовали для введения радиоактивной метки также и технеций-99m [Rossler, D.; Franke, К.; Suss, R.; Becker, E.; Kupsch, H. Synthesis and chromatographic characterization of [Tc-99m]technetium-humic acid species. // Radiochim. Acta, 2000. V.88(2), P.95-100], иод-131, индий-111. Основная проблема, которая должна быть решена в этом случае, - это выбор радионуклида и путей его введения так, чтобы не менялись физико-химические характеристики препаратов, а распределение радионуклида по «молекулярным ансамблям» препаратов адекватно отражало свойства ГВ, причем меченые препараты должны сохранять свои свойства в течение достаточно длительного времени. Важно также, чтобы процедура введения радиоактивной метки была универсальной, быстрой и относительно недорогой. Исходя из сказанного, видится перспективным использовать для получения меченых ГВ в качестве метящего агента радиоактивный изотоп водорода тритий. Водород - это неотъемлемая составляющая любой органической молекулы, содержание его в ГВ колеблется от 3 до 6%. Меченные тритием соединения благодаря уникальным ядерно-химическим свойствам трития (период полураспада 12.3 года, максимальная энергия бета-излучения 18.6 кэВ) находят широкое применение в химических и биохимических исследованиях. Имеется большой набор методов, позволяющих вводить тритий в органические молекулы [Isotopes in the Physical and Biochemical Sciences. V.1. Labelled Compounds. Edited by Buncel E. and Jones J.R.: Elsevier. N-Y. USA. 1991], [Evans E.A. Tritium and its compounds. London. Butterworths. 1966], [Moran, et al. Low pressure tritiation of molecules. United States Patent 4313911], [Zolotarev et al. Method for preparing biologically active organic compound labelled with hydrogen isotope. United States Patent 5026909]. Однако большинство способов предполагает введение метки в индивидуальные химические соединения. Делалась попытка использовать каталитический изотопный обмен для получения меченных тритием торфяных ГВ, которые использовали для исследования их распределения по органам крыс [Wang С., Wang Z., Yang С., Wang W., Peng A. The evidence for the incorporation of fulvic acid into the bone and cartilage of rats. // Sci. Total Environ. 1996. V.191. N 3. Р.197-202]. Однако в данной публикации отсутствует информация о характеристиках меченых препаратов.
Наиболее близким к заявленному является способ введения трития в гуминовые и гуминоподобные вещества взаимодействием этих веществ с содержащим тритий агентом. Здесь делалась попытка ввести тритий в ГВ торфа восстановлением -СНО групп с помощью КВ3H4 [Pefferkorn E., Widmaier J., Elfarissi F. Aluminium ions at polyelectrolyte interface. II. Role in surface-area-exclusion chromatography of humic acid. // Colloid Polym. Sci. 2001. V.279. P.439-497]. Удельная радиоактивность меченых препаратов оказалась в этом случае около 4 кБк/г, что не является достаточно высокой активностью для многих применений. Равномерность введения трития также не была исследована.
Была поставлена задача создания способа введения трития в гуминовые и гуминоподобные вещества так, что равномерность распределения тритиевой метки и ее активность была бы более высокой.
Поставленная задача была решена настоящим изобретением.
В способе получения меченых тритием гуминовых и гуминоподобных веществ взаимодействием гуминовых и гуминоподобных веществ с содержащим тритий агентом согласно изобретению в качестве содержащего тритий агента используют атомарный тритий, полученный при термической каталитической диссоциации трития на вольфрамовой проволоке при давлении 0,3-0,6 Па, перед взаимодействием гуминовые и гуминоподобные вещества наносят на стенки реакционного сосуда лиофилизацией их водных растворов, а термическую диссоциацию производят импульсами 5-10 с при температуре вольфрамовой проволоки 1900-2000 К.
Таким образом, предлагается способ введения трития в гуминовые и гуминоподобные вещества, в котором при обработке атомарным тритием, полученным при термической каталитической диссоциации трития на вольфраме при низком (0.5 Па) давлении, подвергаются не индивидуальные химические соединения, а готовые препараты, нанесенные на стенки реакционного сосуда лиофилизацией их водных растворов. Время обработки ограничивается короткими импульсами (10 с), температура вольфрамовой проволоки ограничивается диапазоном 1900-2000 К. Выбранные условия введения трития обеспечивают равномерное замещение водорода на тритий в любых доступных положениях обрабатываемых молекул.
Важным этапом получения меченого препарата является стадия удаления лабильной метки, проводить которую предлагается в фосфатном буфере с концентрацией 0.028 М при рН 6.8 с помощью диализа через мембраны соответствующего размера (MWCO от 500 до 12000 Да) в течение не менее 24 суток при 4°С. Подбором размера пор мембраны минимизируются потери препарата во время диализа и сохраняется молекулярно-массовое распределение.
На заключительном этапе приготовления меченого образца проводится анализ распределения метки по его компонентам с помощью эксклюзионной хроматографии. Контроль равномерности введения тритиевой метки осуществляется с помощью сравнения профилей выхода с колонки исходного и меченого препаратов по УФ-поглощению при 254 нм, а также по профилю радиоактивности меченого препарата.
Получаемые таким способом препараты ГВ предлагается использовать при изучении их взаимодействия с различными биологическими объектами.
ПРИМЕРЫ
Пример 1. 1 мл водного раствора ГК угля с концентрацией 0.26 мг/мл равномерно распределили на стенках реакционного сосуда объемом 600 см3 и заморозили с помощью жидкого азота. Воду удалили лиофилизацией под вакуумом, собирая ее в ловушке с жидким азотом. Сосуд с мишенью присоединили к специальной вакуумной системе, удалили воздух до остаточного давления 0.001 Topp. Затем охладили стенки реакционного сосуда жидким азотом и продолжили вакуумирование до остаточного давления 0.00005 Topp. С помощью специального натекателя из палладия в реакционный сосуд напустили водород-тритиевую смесь с содержанием трития 35% до давления 0.004 Topp. Нагрели вольфрамовую проволоку, находящуюся в центре реакционного сосуда, до температуры 2000 К с помощью переменного электрического тока. Время нагревания проволоки составило 10 с. Остаточный газ откачали с помощью диффузионного насоса уже без охлаждения реакционного сосуда жидким азотом.
Обработанную тритием мишень ГК угля растворили в 2 мл 0.028 М фосфатного буфера рН 6.8. Его радиоактивность оказалась равной 258 МБк. Раствор поместили в пластиковую пробирку и закрыли диализной мембраной MWCO 2000 Да. Диализную очистку препарата проводили в течение 28 суток против 1 л фосфатного буфера с его периодической заменой и измерением радиоактивности. Радиоактивность раствора меченого препарата составила 63 МБк.
Для оценки идентичности исходного и меченого препарата, очищенного от лабильной метки, провели их гель-хроматографическое фракционирование на хроматографической системе Abimed, включающей в себя: ВЭЖХ насос, автосамплер, стеклянную колонку (⊘15 мм, L=25 см), спектрофотометрический УФ-детектор, коллектор фракций, плату АЦП для регистрации аналитического сигнала и регистрирующий компьютер. Колонку заполняли гелем "Toyopearl" TSK HW-55S (Toso-Haas, Япония) с диапазоном фракционирования 1000-200000 Да по полидекстранам. В качестве подвижной фазы использовали 0.028 М фосфатный буфер с рН 6.8. Объем элюируемой пробы составлял 1 мл, скорость элюирования 1 мл/мин.
Профили УФ-поглощения исходного и меченого препаратов практически совпали (см. чертеж). Одновременно с гель-хроматографическим анализом проводили его фракционирование, собирая фракции по 1.5 мл. Радиоактивность собранных фракций измеряли с помощью жидкостного сцинтилляционного счета. Полученный профиль по радиоактивности совпал с профилем по УФ-поглощению (см. чертеж). В препарате отсутствовали радиоактивные продукты со временем удержания, отличным от исходного препарата. В результате проведенного анализа было найдено, что раствор содержал 0.25 мг ГК угля. Удельная радиоактивность препарата оказалась равной 254 ГБк/г.
Пример 2. Подготовку препарата ГК угля к введению трития провели так же, как в Примере 1. С помощью специального натекателя из палладия в реакционный сосуд напустили водород-тритиевую смесь с содержанием трития 35% до давления 0.004 Topp. Нагрели вольфрамовую проволоку, находящуюся в центре реакционного сосуда, до температуры 2000 К с помощью переменного электрического тока. Время нагревания проволоки составило 10 с. Остаточный газ откачали с помощью диффузионного насоса до давления 0.0005 Topp, затем напустили новую порцию водород-тритиевой смеси. Повторили нагрев вольфрамовой проволоки электрическим током до 2000 К в течение 10 с, после чего откачали остаточный газ уже без охлаждения реакционного сосуда жидким азотом.
Обработанную тритием мишень ГК угля растворили в 2 мл 0.028 М фосфатного буфера рН 6.8. Его радиоактивность оказалась равной 444 МБк. Раствор поместили в пластиковую пробирку и закрыли диализной мембраной MWCO 2000 Да. Диализную очистку препарата проводили так же, как в Примере 1. Радиоактивность раствора меченого препарата составила в конце диализной очистки 15.8 МБк.
Оценка идентичности исходного и меченого препарата с помощью гель-хроматографического анализа была сделана так же, как в Примере 1. Профили по УФ-поглощению исходного и меченого препаратов и профиль по радиоактивности меченого препарата полностью совпали. В результате проведенного анализа было найдено, что раствор содержал 0.23 мг ГК угля. Удельная радиоактивность препарата оказалась равной 69 ГБк/г.
Пример 3. Препарат ГК угля подготовили к введению трития так же, как в Примерах 1 и 2. Водород-тритиевую смесь с содержанием трития 35% напускали до давления 0.004 Topp. Вольфрамовую проволоку нагревали до температуры 2000 К с помощью переменного электрического тока. Время нагревания проволоки составило 10 с. Остаточный газ откачали с помощью диффузионного насоса до давления 0.0005 Topp, затем напустили новую порцию водород-тритиевой смеси. Такую процедуру повторили 4 раза. Суммарное время нагрева вольфрамовой проволоки составило 40 с.
Обработанную тритием мишень ГК угля растворили в 2 мл 0.028 М фосфатного буфера рН 6.8. Его радиоактивность оказалась равной 924 МБк. Раствор поместили в пластиковую пробирку и закрыли диализной мембраной MWCO 2000 Да. Диализную очистку препарата проводили так же, как в Примерах 1 и 2. Радиоактивность раствора меченого препарата составила в конце диализной очистки 44 МБк.
Оценка идентичности исходного и меченого препарата с помощью гель-хроматографического анализа была сделана так же, как в Примерах 1 и 2. Профили по УФ-поглощению исходного и меченого препаратов и профиль по радиоактивности меченого препарата полностью совпали. В результате проведенного анализа было найдено, что раствор содержал 0.22 мг ГК угля. Удельная радиоактивность препарата оказалась равной 200 ГБк/г.
Пример 4. 1 мл водного раствора ГК угля с концентрацией 0.3 мг/мл равномерно распределили на стенках реакционного сосуда объемом 400 см3 и заморозили с помощью жидкого азота. Дальнейшая подготовка препарата к введению тритиевой метки осуществлялась аналогично Примеру 1. С помощью специального натекателя из палладия в реакционный сосуд напустили водород-тритиевую смесь с содержанием трития 43% до давления 0.004 Торр. Нагрели вольфрамовую проволоку, находящуюся в центре реакционного сосуда, до температуры 1880 К с помощью переменного электрического тока. Время нагревания проволоки составило 10 с. Остаточный газ откачали с помощью диффузионного насоса уже без охлаждения реакционного сосуда жидким азотом.
Мишень растворили в 1,5 мл 0,028 М фосфатного буфера рН 6,8. Его радиоактивность оказалась равной 178 МБк. Удаление лабильной метки проводили в течение 25 суток через мембрану MWCO 2000 Да. Хроматографический анализ проводили аналогично описанию в Примере 1. Профили по УФ-поглощению исходного и меченого препаратов и профиль по радиоактивности меченого препарата полностью совпали. Удельная радиоактивность препарата оказалась равной 153 ГБк/г.
Примеры 5-6. Препараты ГК угля готовили к введению тритиевой метки аналогично Примеру 4. Нагревание вольфрамовой проволоки осуществляли до 1750 и 1610 К в течение 10 с. Радиоактивность раствора после растворения мишени составила 60 и 39 МБк. После удаления лабильной метки в течение 25 дней проводили хроматографический анализ аналогично Примеру 1. Профили по УФ-поглощению исходного и меченого препаратов и профиль по радиоактивности меченого препарата полностью совпали. Удельная радиоактивность препаратов оказалась равной 42 и 17 ГБк/г.
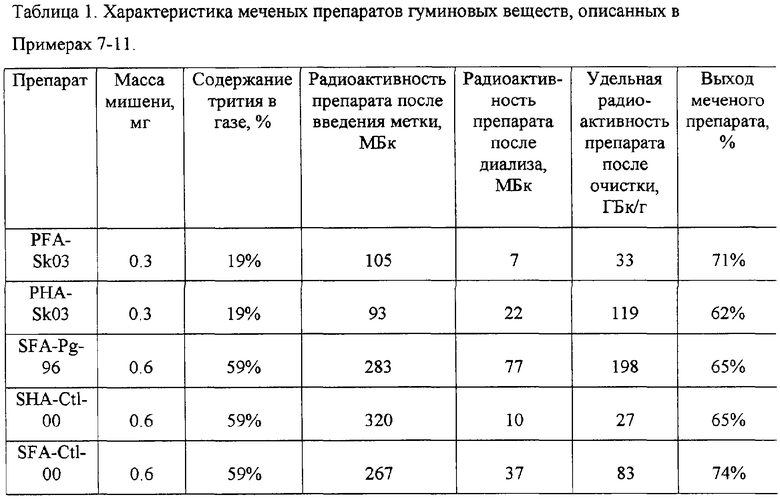
Примеры 7-11. Мишени препаратов гуминовых кислот торфа PHA-Sk03, фульфокислот торфа PFA-Sk03, гуминовых кислот почв SHA-Ctl-00, фульфокислот почв SFA-Ctl-00 и SFA-Pg-96 готовили в реакционных сосудах объемом 600 см3 аналогично описанию Примера 1. Для введения трития использовали водород-тритиевую смесь при давлении 0.004 Topp. Время нагревания вольфрамовой проволоки составляло 10 с, температура вольфрамовой проволоки поддерживали равной 2000 К. Растворение мишеней, диализную очистку и хроматографический анализ проводили, как описано ранее. Данные по количеству вещества, взятого на приготовление мишеней, по составу водород-тритиевой смеси и радиоактивности препаратов на разных стадиях очистки приведены в таблице 1. Для всех препаратов получено хорошее совпадение выходящих с колонки профилей по поглощению при 254 нм для исходных и меченых препаратов, а также профиля радиоактивности меченого препарата.
Примеры 12-13. Мишени препаратов гуминоподобного вещества лигфола-16 (продукт гидролиза древесного лигнина) готовили лиофилизацией 1 мл раствора с концентрацией 0,64 г/л на стенках реакционных сосудах объемом 600 см3 и вводили тритиевую метку аналогично описанию в Примере 1. Для удаления метки из лабильных положений использовали два подхода: меченый препарат длительно выдерживали при 4°С и затем проводили его лиофилизацию; меченый препарат очищали с помощью диализа при 4°С, как описано в Примере 1.
При гель-хроматографическом фракционировании исходного и меченых препаратов было найдено, что кривая элюирования меченого препарата, очищенного путем лиофилизации, практически идентична исходному препарату. Как в исходном препарате, так и в меченом аналоге, наблюдается явно выраженное плечо в области низких молекулярных масс, что свидетельствовало о присутствии низкомолекулярной составляющей в данном препарате лигфола. В то же время, профиль элюирования препарата, очищенного с помощью диализа, существенно отличается от исходного. Максимум кривой элюирования диализованного препарата был сдвинут в сторону больших молекулярных масс. При этом практически отсутствовало плечо в области низких молекулярных масс. Кроме того, площадь пика свидетельствовала о значительной (33%) потере препарата при диализе. Указанный характер изменений объясним тем, что низкомолекулярные соединения, входящие в состав препарата, были удалены при диализной очистке. В то же время для обоих меченых препаратов наблюдалось хорошее совпадение профилей их выхода по УФ-поглощению и по радиоактивности, что свидетельствовало о равномерном распределении трития по компонентам препаратов. В таблице 2 приведены основные характеристики меченых препаратов лигфола.
Пример 14. Определение фактора бионакопления ГК угля бактериями. Для определения фактора бионакопления ГК угля бактериями тетрациклин-устойчивый штамм грамотрицательной бактерии Escherichia coli наращивали путем глубинного культивирования при 37°С в среде М9 (Na2HPO4×12H2O 15.1 г/л, КН2PO4 3.0 г/л, NaCl 0.5 г/л, NH4Cl 1.0 г/л, MgSO4×12H2O 0.5 г/л, CaCl2 5.6 мг/л, глюкоза 0.25 г/л) в течение 10-14 часов. Автоклавирование сред проводили при 120°С в течение 30 мин. Стерилизацию растворов глюкозы, солей кальция и магния и препарата ГК угля проводили путем фильтрования через мембранный фильтр с размером пор 20 мкм; указанные компоненты добавляли в среду раздельно. В качестве бактериостатического агента использовали тетрациклин в концентрации 30 мг/л, его добавляли в среду непосредственно перед инокуляцией. рН среды устанавливали 7.5 с использованием NaOH.
В питательную среду добавляли немеченый препарат ГК угля в концентрациях 5-50 мг/л и меченый препарат ГК угля для создания удельной радиоактивности растворов 1500-2000 Бк/мл. Затем суспензию бактерий центрифугировали при 5000 об/мин в течение 30 мин и в супернатанте определяли равновесную концентрацию ГК угля. Далее супернатант заменяли эквивалентным объемом среды М9, бактерии ресуспендировали и в полученной суспензии определяли количество ГК угля, сорбированного бактериями.
Рост бактерий контролировали по поглощению при 600 нм (OD600). Сначала для серии суспензий с различным содержанием бактерий измеряли OD600 и сырой вес бактерий, который определяли путем взвешивания осадка, образующегося при центрифугировании суспензии бактерий при 5000 об/мин в течение 30 мин. Затем рассчитывали зависимость сырого веса бактерий от OD600:
Вес бактерий (г/л)=2.5167×OD600+3.2158.
Далее вес бактерий рассчитывали по полученной зависимости.
На основании полученных данных строили изотермы сорбции ГК угля бактериями и рассчитывали фактор бионакопления, как тангенс угла наклона изотермы. Полученный фактор бионакопления составил 3.2 л/кг.
Пример 15. Определение количества ГК угля, поступившего в клетки бактерий. Для определения количества ГК угля, поступившего внутрь клеток бактерий, проводили наращивание бактерий Е.coli, как описано в Примере 14. Отделение бактерий от культуральной среды осуществляли путем центрифугирования при 5000 об/мин в течение 30 мин. Супернатант заменяли эквивалентным объемом среды М9, осадок бактерий ресуспендировали и по удельной радиоактивности супернатанта определяли количество ГК угля, сорбированного бактериями. Затем в суспензии проводили лизис бактериальных клеток путем добавления хлороформа. Суспензию с разрушенными клетками вновь подвергали центрифугированию при 5000 об/мин в течение 30 мин, отделяя таким образом дебрис от внутреннего содержимого клеток. На основании удельной радиоактивности супернатанта рассчитывали количество ГК угля, поступившего в клетки. Оказалось, что в клетки бактерий поступает 50% от общего количества препарата, сорбируемого клетками.

| название | год | авторы | номер документа |
|---|---|---|---|
| МЕЧЕННЫЕ ТРИТИЕМ НАНОАЛМАЗЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2013 |
|
RU2538862C2 |
| СПОСОБ УВЕЛИЧЕНИЯ РАДИОАКТИВНОСТИ МЕЧЕННЫХ ТРИТИЕМ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ ПРИ ИХ ПОЛУЧЕНИИ С ПОМОЩЬЮ МЕТОДА ТЕРМИЧЕСКОЙ АКТИВАЦИИ ТРИТИЯ | 2011 |
|
RU2499785C2 |
| СПОСОБ ПОЛУЧЕНИЯ ВЫСОКОМЕЧЕННОГО ТРИТИЕМ ОКСИДА ГРАФЕНА | 2022 |
|
RU2813551C1 |
| СПОСОБ ПОЛУЧЕНИЯ МЕЧЕННЫХ ТРИТИЕМ НАНОАЛМАЗОВ | 2017 |
|
RU2672741C1 |
| Способ очистки препаратов гуминовых кислот от золы | 2022 |
|
RU2786742C1 |
| Способ введения тритиевой метки в органические соединения | 1981 |
|
SU1089080A1 |
| СПОСОБ ПОЛУЧЕНИЯ МЕЧЕННЫХ ТРИТИЕМ БЕЛКОВ | 2017 |
|
RU2671411C1 |
| СПОСОБ ПОЛУЧЕНИЯ N-ФЕНИЛЗАМЕЩЕННЫХ ТРИЦИКЛИЧЕСКИХ АЗОТИСТЫХ СОЕДИНЕНИЙ, МЕЧЕННЫХ ТРИТИЕМ | 2010 |
|
RU2439059C1 |
| КРЕМНЕГУМИНОВЫЙ ПОЧВЕННЫЙ МЕЛИОРАНТ | 2012 |
|
RU2524956C1 |
| СПОСОБ ПОЛУЧЕНИЯ КРАТНОМЕЧЕННОГО ТРИТИЕМ ПО α-ПОЛОЖЕНИЮ АМИНОКИСЛОТНЫХ ФРАГМЕНТОВ ГЕКСАПЕПТИДА | 1988 |
|
SU1736126A3 |
Описан способ получения меченых тритием гуминовых и гуминоподобных веществ взаимодействием гуминовых и гуминоподобных веществ с содержащим тритий агентом, причем в качестве содержащего тритий агента используют атомарный тритий, полученный при термической каталитической диссоциации трития на вольфрамовой проволоке при давлении 0,3-0,6 Па. Перед взаимодействием гуминовые и гуминоподобные вещества наносят на стенки реакционного сосуда лиофилизацией их водных растворов. Термическую диссоциацию производят импульсами 5-10 с при температуре вольфрамовой проволоки 1900-2000 К. Изобретение позволяет осуществить равномерное введение трития в гуминовые и гуминоподобные вещества и достичь удельную радиоактивность препарата, составляющую 69-254 ГБк/г. 2 табл., 1 ил.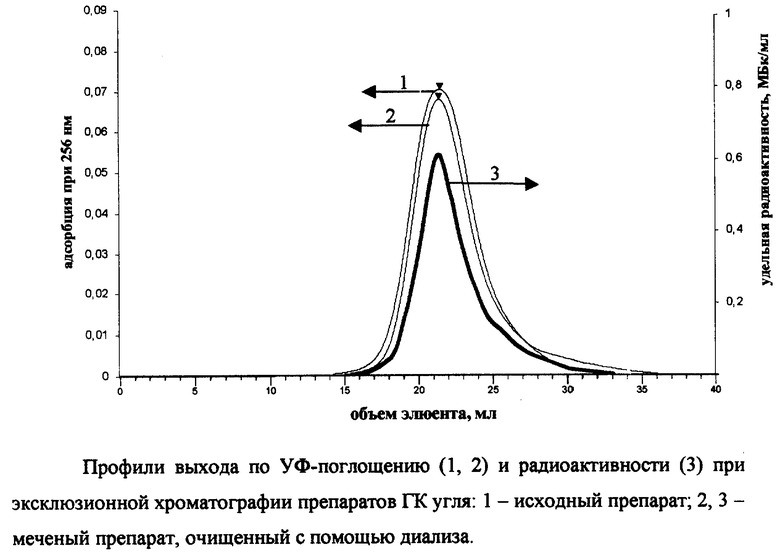
Способ получения меченных тритием гуминовых и гуминоподобных веществ взаимодействием гуминовых и гуминоподобных веществ с содержащим тритий агентом, отличающийся тем, что в качестве содержащего тритий агента используют атомарный тритий, полученный при термической каталитической диссоциации трития на вольфрамовой проволоке при давлении 0,3-0,6 Па, перед взаимодействием гуминовые и гуминоподобные вещества наносят на стенки реакционного сосуда лиофилизацией их водных растворов, а термическую диссоциацию производят импульсами 5-10 с при температуре вольфрамовой проволоки 1900-2000 К.
| Peffekorn E | |||
| et al, Colloid Polym | |||
| Sci | |||
| Перекатываемый затвор для водоемов | 1922 |
|
SU2001A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Способ получения меченного тритием гуанозин-5-трифосфата | 1971 |
|
SU404348A1 |
| СПОСОБ ПОЛУЧЕНИЯ МЕЧЕННЫХ ТРИТИЕМ ЛИНЕЙНЫХ ПЕПТИДОВ И ГЛИКОПЕПТИДОВ | 1983 |
|
SU1545503A3 |
Авторы
Даты
2007-03-20—Публикация
2005-12-19—Подача