Изобретение относится к биотехнологии и касается штамма боррелий, являющихся возбудителем иксодовых клещевых боррелиозов (ИКБ). Штамм может быть использован для изготовления препаратов для диагностики и профилактики ИКБ, а также для оценки протективной и специфической активности лечебных и профилактических препаратов, например антибиотиков, вакцин.
Иксодовые клещевые боррелиозы (болезнь Лайма) определяются как группа природно-очаговых трансмиссивных антропозоонозов, возбудителями которых являются бактерии рода Borrelia, объединенные в комплекс Borrelia burgdorferi s.l., а переносчиком - клещи рода Ixodes. В комплекс Borrelia burgdorferi s.l. объединены около десятка генетически и антигенно близких видов боррелий, однако патогенность для человека доказана для трех из них:
В.burgdorferi s.s., B.garinii, B.afzelii. Существуют значительные отличия в спектре возбудителей ИКБ различных очагов. Так, например, на территории Северной Америки циркулирует только В.burgdorferi s.s., в Европе и европейской части России обнаружены все три вида возбудителя, но доминирует B.afzelii, а в Сибири чаще обнаруживается B.garinii [1, 2, 3].
Разработанные в настоящее время диагностические препараты на основе штаммов В.burgdorferi s.s. и B.afzelii далеко не всегда эффективны на территориях, где доминирует B.garinii, несмотря на значительное родство. Поэтому актуальной задачей является подбор штаммов основных видов возбудителей ИКБ для создания адекватных диагностических и профилактических препаратов.
Штамм Borrelia garinii BgVir-1 депонирован в Коллекции Государственного научно-исследовательского института стандартизации и контроля медицинских биологических препаратов им. Л.А.Тарасевича под №276.
Штамм Borrelia garinii BgVir-1 был изолирован из клеща I.persulcatus, отловленного в природе, в Томской области в 1999 году. Изоляцию проводили путем посева комплекса внутренних органов на селективную среду. Идентификацию проводили по культурально-морфологическим и генетическим признакам. Отобран по культуральным и иммунологическим свойствам. Штамм синтезирует комплекс корпускулярного и растворимых антигенов, вызывающих иммуногенез и реагирующих со специфическими антителами.
Клетки спиралевидные (фиг.1), средняя длина 20,3±1,5 мкм, средний диаметр клеток 0,217±0,003 мкм, среднее число витков протоплазматического цилиндра 8,5±0,5. Грамотрицательны. Микроаэрофилы. Хемоорганотрофы. Клетки окружены поверхностной оболочкой, наружной мембраной. Вокруг протоплазматического цилиндра обвиты 8-18 периплазматических жгутиков. Клетки активно подвижны. Расположены одиночно или образуют клубки в виде перепутанных нитей или ватных комочков по 5-50 клеток. Бактерии размножаются путем бинарного деления клеток пополам, спор не образуют. Оптимальная температура роста 33±1°С, предельные 27-37°С. После внесения штамма в среду количество жизнеспособных бактерий достигает максимальной величины к 10-14 суткам культивирования и составляет 10-10 в 1 мл.
В реакции непрямой иммунофлюоресценции (РНИФ) бактерии реагировали с сыворотками больных ИКБ в титрах, равных или в 2-4 раза выше, чем штамм сравнения Borrelia afzelii Ip21 (Научно-исследовательский институт эпидемиологии и микробиологии им. Н.Ф.Гамалеи, г.Москва) [4].
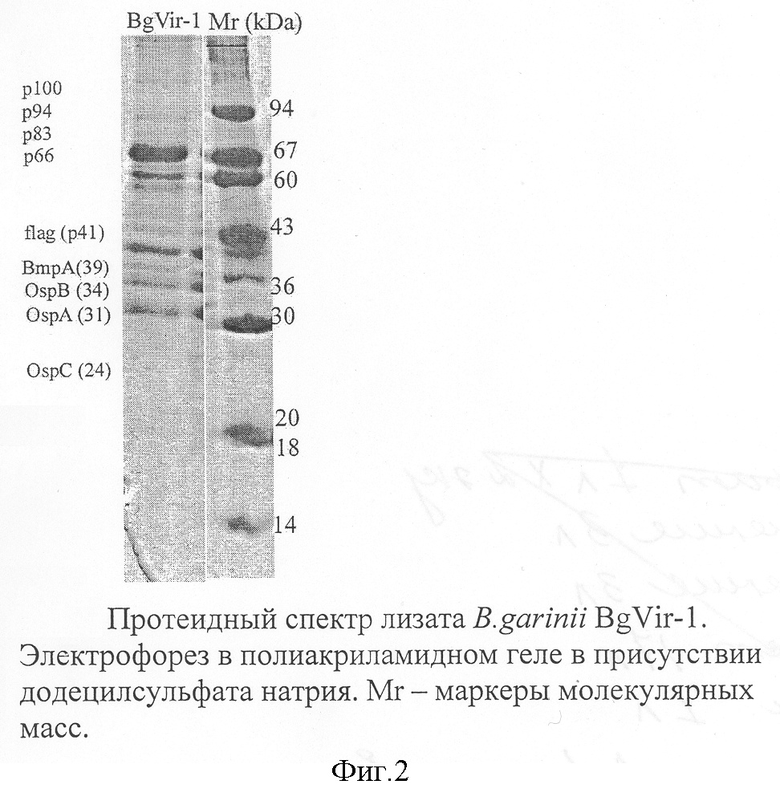
Штамм синтезирует все основные специфические и неспецифические иммуногенные белки боррелий из группы B.burgdorferi s.l. (фиг.2). Это позволяет использовать его для производства диагностических препаратов и вакцин.
Пример 1.
Предварительно законсервированный посевной материал, содержащий бактериальную суспензию штамма BgVir-1, высевают в среду культивирования. Культивируют 14 суток. Полученную бактериальную суспензию осаждают центрифугированием и отмывают от культуральной среды.
Полученный корпускулярный антиген можно использовать, сорбируя на предметное стекло, для проведения реакции непрямой иммунофлюоресценции с сыворотками крови больных для диагностики ИКБ.
Пример 2.
Корпускулярный антиген боррелий штамма BgVir-1 обрабатывают ультразвуком в присутствии неионных детергентов. С помощью ионообменной хроматографии очищают от неспецифических белков. Полученную смесь очищенных растворимых специфических антигенов B.burgdorferi s.l. можно использовать для проведения иммуноферментного анализа сывороток больных с целью выявления специфических антител.
Пример 3.
Корпускулярный антиген боррелий штамма BgVir-1 обрабатывают ультразвуком в присутствии неионных детергентов. С помощью ионообменной хроматографии очищают от неспецифических, пирогенных и артрогенных компонентов. Полученную смесь растворимых антигенов боррелий можно использовать для иммунизации человека или животных с целью профилактики ИКБ.
Пример 4.
Линейных мышей, чувствительных к возбудителям ИКБ, иммунизируют вакциной против ИКБ. Затем для оценки эффективности иммунизации, мышам вводят суспензию живых боррелий штамма BgVir-1. Факт заражения мыши фиксируют по клиническим признакам или с помощью лабораторных методов (бактериологических, иммунологических, молекулярно-генетических). Доля незараженных мышей прямо зависит от эффективности иммунизации.
Пример 5.
Диагностика иксодовых клещевых боррелиозов (ИКБ) путем детекции специфических антител в крови больных методом реакции непрямой иммунофлюоресценции (РНИФ).
Производственный штамм Borrelia garinii BgVir-1 культивируют, накапливая до концентрации 106-107 микробных клеток в 1 мл, и отмывают от культуральной среды, используя центрифугирование.
Полученный корпускулярный антиген наносят на обезжиренное предметное стекло сушат при комнатной температуре (0,015 мл на лунку).
На предметное стекло с антигеном наносят 0,015 мл предварительно разведенного исследуемого материала (сыворотки крови больного), используя для каждого разведения отдельную лунку. Стекло помещают во влажную камеру и инкубируют при t=37,5±0,5°C в течение 30-40 минут. После окончания инкубации стекло промывают дистиллированной водой.
Помещают стекло в фосфатный буферный раствор на 10-15 мин, затем ополаскивают дистиллированной водой и сушат под струей воздуха.
Наносят 0,015 мл смеси рабочего разведения сыворотки против иммуноглобулинов человека, меченной флюоресцеина изотиоционатом (ФИТЦ), и раствора альбумина, меченного родамином. Стекло помещают во влажную камеру и инкубируют при t=37,5±0,5°C в течение 30-40 минут. После окончания инкубации стекло промывают дистиллированной водой.
Помещают предметное стекло в фосфатный буферный раствор на 10-15 мин, затем промывают дистиллированной водой и сушат под струей воздуха.
Препараты исследуют в люминесцентном микроскопе типа «ЛЮМАМ» или иных конструкций, допускающих наблюдение в отраженном свете, с водноиммерсионным объективом.
При просмотре препаратов оценку результатов проводят на основании яркости и тона свечения микробных клеток антигена. Отчетливо выраженная зеленая флуоресценция большинства изолированно расположенных микробных клеток оценивается как положительный результат. Слабая зеленовато-красная флуоресценция или почти полное отсутствие флуоресценции слабо различимых в препарате боррелий оценивается как отрицательный результат. Наибольшее разведение тестируемой сыворотки, для которого наблюдается положительный результат, рассматривается как ее титр.
Выявлении антител против боррелий в титре 1:40 и выше свидетельствует об инфицировании возбудителями ИКБ или о перенесенной инфекции в прошлом.
Окончательная лабораторная верификация диагноза проводится путем повторного исследования пары сыворотки крови, взятых с интервалом в 14-21 сут. Положительным результатом считают нарастание титра специфических антител не менее чем в 4 раза.
Пример 6.
Диагностика иксодовых клещевых бьоррелиозов путем детекции специфических антител класса G в крови больных методом иммуноферментного анализа (ИФА).
Корпускулярный антиген боррелий штамма BgVir-1 (полученный, как описано в Примере 1) обрабатывают ультразвуком в присутствии неионных детергентов. Методами экстракции и очистки получают фракции, содержащие специфичные антигены боррелий в концентрации 77-87% от общей концентрации белка (табл.1).
Полученную смесь очищенных растворимых специфических антигенов боррелий вносят в лунки планшетов для ИФА, инкубируют в течение 12 ч при 4-10°С. Планшет промывают фосфатно-солевым буферным раствором.
В лунки планшета с иммобилизированными антигенами боррелий вносят по 100 мкл предварительно разведенной сыворотки крови человека с подозрением на ИКБ. Инкубируют при температуре 37°С в течение 1 ч. После завершения инкубации промывают лунки планшета 4 раза промывочным раствором.
Затем в лунки вносят по 100 мкл раствора конъюгата пероксидазы хрена с антителами против иммуноглобулинов человека. Инкубируют при температуре 37°С в течение 1 ч. После окончания срока инкубации промывают стрипы 4 раза.
Вносят в каждую лунку по 100 мкл субстратного раствора (перекись водорода и тетраметилбензидин). Планшет помещают в защищенное от света место на 10 мин при температуре 20-25°С. Останавливают реакцию внесением в каждую лунку 50 мкл стоп-реагента (раствор серной кислоты).
Сразу после остановки реакции измеряют оптическую плотность раствора относительно воздуха при длине волны 450 нм с помощью планшетного фотометра (ридера). Рассчитывают критическую величину оптической плотности (ОПкрит, Cut-off).
Результат исследования образца считают положительным, если соответствующее ему значение оптической плотности превышает величину ОПкрит. За титр специфических антител принимают наибольшее разведение исследуемого образца, при котором регистрируется положительный результат.
Обнаружение антител класса G против возбудителей ИКБ в исследуемой пробе свидетельствует об инфицировании возбудителями ИКБ или о перенесенной инфекции в прошлом.
Увеличение титра специфических антител при исследовании парных проб в 4 и более раз свидетельствует о заболевании (или обострении) ИКБ. Парные пробы рекомендуется брать с интервалом 14-21 сут.
Пример 7.
Изготовление препарата для профилактики ИКБ (вакцины).
Производственный штамм боррелий (BgVir-1,4 пассаж) культивировали в среде BSK-H в течение 14 сут до концентрации 106-107 1/мл. Инактивировали, очищали от культуральной среды, обрабатывали ультразвуком в присутствии неионных детергентов. Очищают с помощью ионообменной хроматографии от неспецифических, пирогенных и артрогенных компонентов. Полученную смесь растворимых антигенов боррелий можно использовать для иммунизации человека или животных с целью профилактики ИКБ.
Беспородных мышей весом 18-20 г иммунизировали путем подкожной инокуляции 0,5 мл суспензии антигенов боррелий 3-кратно с интервалом 2 сут. В качестве контроля использовали 0,9% раствор NaCl.
Уровень гуморального иммунитета против возбудителей ИКБ определяли с помощью метода ИФА и путем выявления боррелиацидных антител in vitro.
В ИФА в качестве иммуносорбента использовали лизат B.garinii.
Для выявления боррелиацидных антител из прогретой, стерилизованной сыворотки иммунизированной мыши получали серийные разведения в планшете, к ней добавляли культуру тест-штамма (BgVir-1) и источник комплемента (сыворотка морской свинки). Культивирование проводили в планшетах при 33°С в течение 5 сут. За титр боррелиацидных антител принимали максимальное разведение сыворотки, подавлявшее рост тест-штамма.
Оптическая плотность в лунках, соответствующих иммунизированным животным, была в 2-9 раз выше, чем в контрольных (табл.2). Титры боррелиацидных антител сывороток иммунизированных мышей варьировал от 1:80 до 1:320. Титр контрольной сыворотки (от неиммунизированной мыши) был 1:20.
Результаты обоих методов хорошо коррелировали между собой.
Т.о. на лабораторных животных была продемонстрирована возможность получения препарата для профилактики ИКБ.
Пример 8.
Оценка протективной активности профилактических препаратов (вакцин).
Беспородных мышей весом 9-10 г иммунизировали путем подкожной инокуляции 0,5 мл суспензии антигенов боррелий 3-кратно с интервалом 2 сут. В качестве контроля использовали 0,9% раствор NaCl.
Затем для оценки эффективности иммунизации мышам подкожно вводили 0,2 мл суспензии живых боррелий штамма BgVir-1. Факт заражения мыши фиксировали путем детекции ДНК возбудителя в селезенке и головном мозге животных методом ПЦР. Доля незараженных мышей прямо зависит от эффективности иммунизации (табл.3).
Результаты лабораторных испытаний наборов для диагностики ИКБ, созданных на основе штамма B.garinii BgVir-1.
Лабораторные испытания набора для выявления антител против боррелий методом РНИФ
Для оценки чувствительности наборов мы использовали панель сывороток крови больных ИКБ. Диагноз был установлен клинически и подтвержден одним из лабораторных методов - выявление ДНК боррелий методом полимеразной цепной реакции (ПЦР), выявление специфических антител методом ИФА, выявление специфических антител к боррелиям методом Вестерн-блот. Все 36 проб дали положительный результат (чувствительность 100%) (табл.4).
Самой существенной проблемой разработки иммунологических тестов для диагностики ИКУБ являются неспецифические реакции с сыворотками крови больных различными спирохетозами (сифилис, лептоспироз и т.д.). Поэтому на эту категорию больных обращалось особое внимание. При исследовании 20 сывороток крови больных сифилисом с подтвержденным клиническим диагнозом (получены из Томского областного кожно-венерологического диспансера), 4 пробы дали положительный результат в НРИФ. Таким образом, специфичность набора при исследовании данных проб сыворотки составила 80% (табл.4).
Для оценки специфичности мы также исследовали 19 проб крови детей, проходивших обследование в медицинском диагностическом центре НПО «Вирион» с подозрением на описторхоз и лямблиоз. Все они дали отрицательный результат (специфичность 100%) (табл.4).
В течение 2003-04 гг. набор для выявления антител против боррелий методом РНИФ испытывали в условиях лаборатории медицинского диагностического центра НПО «Вирион». Были проведены исследования 12638 проб крови людей, обратившихся после присасывания клещей или по направлению врача для проведения дифференциальной диагностики. Из них 846 проб крови принадлежали 474 больным с клиническим диагнозом «ИКБ» (или микст КЭ и ИКБ). В зависимости от срока после инфицирования положительные результаты у них были получены в 50-80% случаев.
Среди 11792 проб крови людей, не заболевших впоследствии, только в 15,5% были обнаружены антитела против боррелий в диагностическом титре. Что может быть результатом успешной антибиотикопрофилактики или следствием неточного клинического диагноза.
Лабораторные испытания набора для выявления антител класса G против боррелий методом ИФА
Проведена апробация набора на панелях сывороток больных ИКБ, другими заболеваниями, здоровых доноров и людей, пострадавших от присасывания клеща, выбран метод расчета порогового значения оптической плотности.
В аппробации набора использовали:
- Панель 1: сыворотки крови больных ИКБ (42 пробы). Диагноз был установлен клинически. У ряда пациентов подтвержден другими методами. Пробы получены из медицинского диагностического центра НПО «Вирион».
- Панель 2: сыворотки крови людей с присасыванием клеща в анамнезе, с положительными результатами НРИФ, но без клинического диагноза ИКБ (84 пробы). Пробы получены из медицинского диагностического центра НПО «Вирион».
- Панель 3: сыворотки крови относительно здоровых детей, обследовавшихся с подозрением на гастроэнтерологическую патологию (84 пробы). Пробы получены из медицинского диагностического центра НПО «Вирион».
- Панель 4: сыворотки крови относительно здоровых взрослых доноров (58 проб). Пробы получены из донорского отделения НПО «Вирион».
- Панель 5: сыворотки крови больных сифилисом (57 проб). Все пациенты имели диагноз «первичный сифилис». Пробы получены из Томского областного кожно-венерологического диспансера.
- Панель 6: сыворотки крови больных гемобластозами (31 проба). Среди них 10 проб от больных лимфомой, 2 - миелодиспластическим синдромом, 3 - миеломой, 9 - множественной миеломой, 1 - острым лейкозом, 3 - хроническим лейкозом, 3 - диагноз неизвестен. Пробы получены из гематологического отделения Томской областной клинической больницы.
- Панель 7: сыворотки крови больных диссеминированными заболеваниями соединительной ткани и другими заболеваниями суставов (18 проб). Среди них 1 проба от больного первичным остеоартрозом, 1 - подагрой, 1 - псориатической артропатией, 9 - ревматоидным артритом, 1 - ревматоидной полимиалгией, 1 - ревматоидным полиартритом, 3 - системной красной волчанкой, 1 - спондилоартритом. Пробы получены из ревматологического отделения Томской областной клинической больницы.
Чувствительность метода вычисляли как долю положительных результатов среди проб от больных (с подозрением) ИКБ людей (панели 1, 2). Специфичность метода вычисляли как долю отрицательных результатов среди проб от людей, не болеющих (не болевших) ИКБ (отдельно для каждой панели 3-7). Общую специфичность вычисляли как долю отрицательных результатов среди общего пула проб из панелей 3-7. Ожидаемую специфичность вычисляли, стандартизуя специфичность, полученную отдельно для каждой панели, по заболеваемости данной патологией в Томской области.
Набор демонстрировал достаточную специфичность (табл.5).
В группах практически здоровых детей, больных гемобластовыми и диссеминированными заболеваниями соединительной ткани набор продемонстрировал 100% специфичность. В группах взрослых здоровых доноров и больных сифилисом выявлялись положительные результаты. Отчасти это вызвано тем, что панели формировались из крови жителей эндемичных районов и многие из них (жители сельской местности) подвергались присасыванию клещей. В связи с тем, что в этих группах невозможно было собрать полный эпидемиологический анамнез, мы не могли провести дискриминацию проб по признаку «присасывания клеща в анамнезе». Тем не менее, и в этих группах набор показал достаточную специфичность. Общая специфичность составила 96%, а ожидаемая стандартизованная - 98,3%.
Нами была оценена чувствительность относительно других методов (наборов), выявляющих специфические антитела. Чувствительность относительно набора для ИФА другого производителя составила 85,7%, а относительно иммуноблота - 100% (табл.6).
Литература
1. Guiqing Wang, Alje P. Van Dam, Ira Schwartz, and Dankert. Molecular Typing of Borrelia burgdorferi Sensu Lato: Taxonomic, Epidemiological, and Clinical Implications // Clinical Microbiology Reviews, 1999. - Vol.12. - №4. - p.633-653.
2. Лобзин Ю.В., Усков А.Н., Козлов С.С. Лайм-боррелиоз (иксодовые клещевые боррелиозы). - СПб: «Издательство Фолиант», 2000. - 160 с.
3. Стронин О.В., Епанчинцев А.А., Гольцова Н.А., Власова Н.М., Миллер А.А., Хаснатинов М.А., Беликов С.И., Данчинова Г.А. Видовое разнообразие возбудителей иксодовых клещевых боррелиозов на территории Томской области//Актуальные вопросы разработки, производства и применения иммунобиологических и фармацевтических препаратов: материалы Всероссийской научной конференции, посвященной 100-летию со дня основания Томского «НПО «Вирион» (16-17 июня 2004 г, г.Томск, Россия). - Томск: «Изд-во «Красное знамя», 2004. - с.227-233.
4. Коренберг Э.И. Насонов В.А. Методические указания по эпидемиологии, диагностике, клинике и профилактике болезни Лайма. - М.: МЗ СССР, 1991. - 61 с.
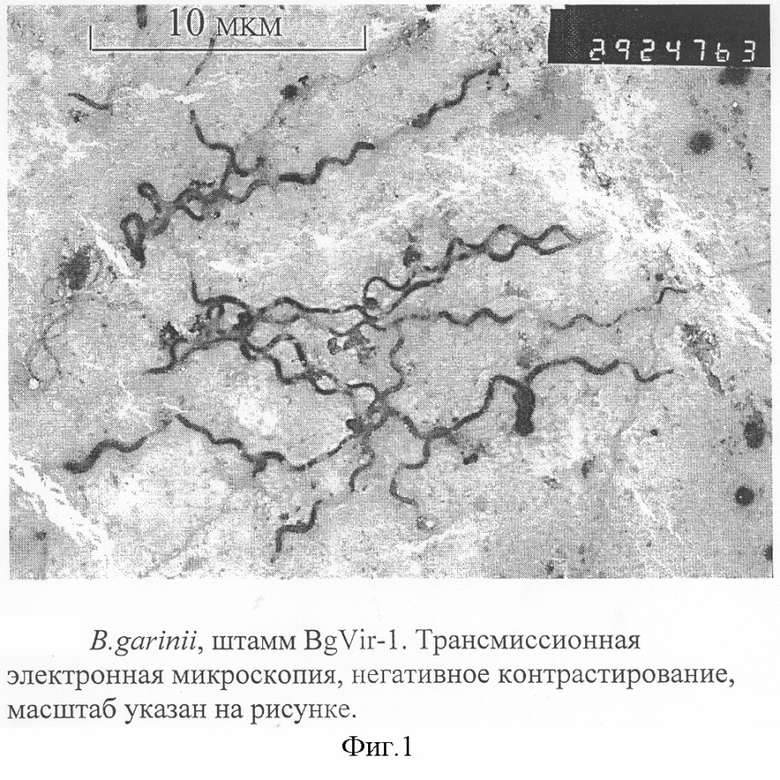
Изобретение относится к биотехнологии. Штамм бактерий Borrelia garinii BgVir-1 хранится в коллекции культур микроорганизмов НПО «Вирион» под №276. Штамм синтезирует все основные иммуногенные белки боррелий из группы В.burgd orferi s l., что позволяет использовать его для производства диагностических препаратов и вакцины. 6 табл., 2 ил.
Штамм Borrelia garinii BgVir-1 (коллекция культур микроорганизмов НПО «Вирион» под №37), используемый для производства препаратов для диагностики и профилактики иксодовых клещевых боррелиозов и для оценки протективной и специфической активности профилактических и лечебных препаратов.
| КОРЕНБЕРГ Э.И | |||
| и др., Методические указания по эпидемиологии, диагностике, клинике и профилактические болезни Лайма, М., МЗ СССР, 1991, 61 с | |||
| СТРОНИН О.В | |||
| и др., Видовое разнообразие возбудителей иксодовых клещевых боррелиозов на территории Томской области, Актуальные вопросы разработки, производства и применения иммунобиологических и |
Авторы
Даты
2007-03-20—Публикация
2005-01-19—Подача