Область техники, к которой относится изобретение
Изобретение касается способов оценки связывания биополимеров, в частности способов оценки связывания зондов и мишеней, содержащих нуклеотидные основания и/или аминокислоты.
Уровень техники
На протяжении многих лет было известно, что биологические молекулы можно выделять и характеризовать путем воздействия на образец электрическим полем.
Вероятно, электрофорез является наиболее известным примером метода выделения и характеризации, основанным на влиянии электрических полей на биологические молекулы. При гель-электрофорезе электрическое поле прилагается к однородному матриксу или гелю, состоящему, к примеру, из полиакриламида. Смеси, нанесенные на один из концов геля, мигрируют через гель в соответствии с их размером и взаимодействием с электрическим полем. Подвижность зависит от уникальных характеристик вещества, таких как конформация, размер и заряд. На подвижность можно воздействовать, изменяя размеры пор геля, например, при образовании градиента концентрации или рН, или при изменении состава буфера (рН, SDS, DOC, глицин, соль). Одно- и двумерный гель-электрофорез является довольно обычным методом в большинстве исследовательских лабораторий. Исследуемые вещества могут быть очищены пропусканием через гель и/или физической экстракцией из геля.
Разработанный совсем недавно процесс, в котором электрическое поле прилагается к биологическому образцу, раскрыт в US Patent №5824477 на имя Stanley. В патенте Stanley описан процесс обнаружения присутствия или отсутствия заданной последовательности нуклеиновой кислоты в образце. Процесс включает: (а) денатурацию двухцепочечной нуклеиновой кислоты образца путем подачи напряжения на образец через электроды в растворе; (b) гибридизацию денатурированной нуклеиновой кислоты с олигонуклеотидным зондом к данной последовательности; (с) определения того, произошла ли гибридизация. В патенте Stanley описано приложение электрического поля к анализируемому образцу с ограниченной целью денатурации анализируемой последовательности.
Более известный тип анализа гибридизации основывается на применении флуоресцентных метящих агентов. В наиболее общей форме анализы, основанные на интенсивности флуоресценции, обычно включают контактирование мишени с содержащим флуорофор зондом, отделение несвязавшегося зонда от связавшегося зонда и детекцию флуоресценции в отмытом образце. Гомогенные анализы превосходят такие базовые анализы в том, что они не требуют стадии отмывки или обеспечения подложки в виде нежидкостной фазы.
В некоторых анализах применяются интеркалирующие флуорофоры для детекции гибридизации нуклеиновых кислот на основании способности таких флуорофоров к связыванию между цепями нуклеиновой кислоты в гибридизационном комплексе.
Например, в US Patent №5824557 на имя Burke et al. раскрыт способ и набор для детекции и количественного определения молекул нуклеиновой кислоты. Предпочтительное воплощение основывается на интеркалировании красителя в двойную спираль двухцепочечной нуклеиновой кислоты или в одноцепочечную нуклеиновую кислоту. Краситель флуоресцирует после интеркалирования, и интенсивность прямо пропорциональна количеству нуклеиновой кислоты в образце. Хотя способ Burke et al. и считается полезным для измерения содержания нуклеиновой кислоты в образце, неспецифическое связывание между интеркалирующим агентом и нуклеиновой кислотой, на котором основывается этот способ, делает его бесполезным для определения специфического связывания, особенно в условиях присутствия дуплексов нуклеиновой кислоты, не являющейся мишенью
В US Patent №5814447 на имя Ishiguro et al. раскрыт способ анализа, претендующий на усовершенствование анализов, основанных на неспецифическом взаимодействии между интеркалирующими агентами и дуплексами нуклеиновых кислот, таких как способ Burke et al. и более ранний анализ, раскрытый Ishiguro et al. в Japanese Patent Public Disclosure №237000/1993. Эта предшествующая разработка включала добавление интеркалирующего флуорохрома, обладающего способностью к повышению интенсивности флуоресценции при интеркаляции, к раствору образца перед тем, как специфический участок нуклеиновой кислоты-мишени амплифицировали методом ПЦР, и измерение интенсивности флуоресценции в реакционном растворе через заданные промежутки времени для обнаружения и количественного определения нуклеиновой кислоты-мишени до амплификации. В патенте №5814447 предпринята попытка усовершенствования предшествующей разработки путем обеспечения способа анализа с улучшенной специфичностью, отличающегося тем, что зонд представлен одноцепочечным олигонуклеотидом, меченным интеркалирующим флуорохромом, который должен интеркалировать в комплементарный участок связывания между нуклеиновой кислотой-мишенью и одноцепочечным олигонуклеотидным зондом.
В продолжающихся поисках более чувствительных, точных и быстрых методов анализа одна исследовательская группа разработала способ, включающий анализ эффектов электрического поля на интенсивность флуоресценции гибридизационных дуплексов нуклеиновых кислот, см. US Patent Application №08/807901 filed February 27, 1997, и US Patent №6060242. Исследователи показали, что интенсивность флуоресценции дуплекса с мисматчем по одной паре оснований отличалась от интенсивности флуоресценции совершенно спаренного дуплекса. Таким образом, эта заявка претендует на раскрытие способа детекции нуклеотидной последовательности, в котором электрическое поле прилагается к жидкой среде перед или одновременно со стадией детекции, и изменение интенсивности флуоресценции в зависимости от электрического поля детектируется как признак того, гибридизируется проба с полностью комплементарной нуклеотидной последовательностью или с неполностью комплементарной нуклеотидной последовательностью.
Несмотря на предшествующие разработки, в этой области продолжает существовать необходимость в простом, высокочувствительном, эффективном и быстром способе анализа взаимодействия меду нуклеиновыми кислотами и/или аналогами нуклеиновых кислот.
Все цитируемые ссылки включены в настоящее изобретении путем отсылки во всей полноте.
Раскрытие изобретения
Изобретение предусматривает способ анализа последовательность-специфичной гибридизации, который включает:
обеспечение мишени, включающей, по меньшей мере, одну биополимерную последовательность-мишень;
обеспечение зонда, включающего, по меньшей мере, одну биополимерную последовательность-зонд;
добавление зонда и мишени в среду связывания для обеспечения тестируемого образца;
подачу первого стимула (стимулирующего воздействия) на тестируемый образец для обеспечения первого стимулированного тестируемого образца;
детекцию первого сигнала от первого стимулированного тестируемого образца, при этом первый сигнал коррелирует со сродством связывания между зондом и мишенью;
подачу второго стимула на первый стимулированный тестируемый образец для обеспечения второго стимулированного тестируемого образца;
детекцию второго сигнала от второго стимулированного тестируемого образца, при этом второй сигнал коррелирует со сродством связывания между зондом и мишенью;
сравнение первого сигнала и второго сигнала для выполнения анализа;
причем в тестируемом образце обеспечивают, по меньшей мере, одну метку, и первый стимул, второй стимул, первый сигнал и второй сигнал представляют собой электромагнитное излучение, при условии, что в случае, когда первый стимул и второй стимул представляют собой фотонное излучение, то промежуточный электронный стимул подается на тестируемый образец после первого стимула и перед вторым стимулом, а в случае, когда первый стимул и второй стимул представляют собой электронное излучение, то первый сигнал и второй сигнал представляют собой электрический ток.
Также предусматривается способ анализа последовательность-специфичной гибридизации, который включает:
обеспечение мишени;
обеспечение зонда, при этом, по меньшей мере, один из зонда или мишени содержит, по меньшей мере, одну биополимерную последовательность;
добавление зонда и мишени в среду связывания для обеспечения тестируемого образца;
подачу первого стимула на тестируемый образец для обеспечения первого стимулированного тестируемого образца;
детекцию первого сигнала от первого стимулированного тестируемого образца, при этом первый сигнал коррелирует со сродством связывания между зондом и мишенью;
подачу второго стимула на первый стимулированный тестируемый образец для обеспечения второго стимулированного тестируемого образца;
детекцию второго сигнала от второго стимулированного тестируемого образца, при этом второй сигнал коррелирует со сродством связывания между зондом и мишенью;
сравнение первого сигнала и второго сигнала для выполнения анализа;
причем в тестируемом образце обеспечивается, по меньшей мере, одна метка, и первый стимул, второй стимул, первый сигнал и второй сигнал представляют собой электромагнитное излучение, при условии, что в случае, когда первый стимул и второй стимул представляют собой фотонное излучение, то промежуточный электронный стимул подается на тестируемый образец после первого стимула и перед вторым стимулом, а в случае, когда первый стимул и второй стимул представляют собой электронное излучение, то первый сигнал и второй сигнал представляют собой электрический ток.
Краткое описание чертежей
Далее изобретение будет описано в сочетании со следующими чертежами, на которых одинаковые цифры обозначают одинаковые элементы.
Фиг.1А и 1В представляют собой графики зависимости тока от времени и комплементарности.
Фиг.1C и 1D представляют собой графики зависимости тока от температуры и комплементарности.
Фиг.2А, 2В, 2С, 3А и 3В представляют собой графики зависимости тока от температуры, комплементарности и дополнительных факторов.
Фиг.4 представляет собой график зависимости тока от времени и комплементарности.
Фиг.5А, 5В, 5С и 6 представляют собой спектры интенсивности флуоресценции.
Осуществление изобретения
Изобретение предусматривает быстрый, чувствительный, экологически дружественный и безопасный способ анализа связывания между мишенью и зондом, в котором мишень включает последовательность нуклеиновой кислоты или последовательность аналога нуклеиновой кислоты, и зонд включает последовательность нуклеиновой кислоты или последовательность аналога нуклеиновой кислоты. Анализ по изобретению также подходит для анализа связывания между мишенью и зондом, в котором мишень и/или зонд включает аминокислотную последовательность. Таким образом, изобретение подходит для анализа связывания биополимеров, что в применении к настоящему изобретению означает последовательность, содержащую, по меньшей мере, две аминокислоты, аналог аминокислот, нуклеиновые кислоты, аналог нуклеиновых кислот и/или их комбинации.
В отличие от некоторых предшествующих методов в данной области способ по изобретению позволяет обнаруживать не только наличие специфического связывания, но также дает качественную и количественную информацию относительно природы связывания между зондом и мишенью. Так, в воплощениях, включающих анализ связывания нуклеотидных оснований с нуклеотидными основаниями, изобретение дает возможность отличить совершенное соответствие от мисматча (ошибочного спаривания) по одной паре оснований, мисматча по двум парам оснований, мисматча по трем парам оснований, делеции одной пары оснований, делеции двух пар оснований и делеции трех пар оснований.
Воплощения изобретения включают калибровку измеренного сигнала (например, электрического тока и/или интенсивности флюоресценции) для смеси первый зонд-мишень против сигнала того же типа от других зондов в комбинации с той же самой мишенью, при этом каждый из этих других зондов отличается от первого зонда, по меньшей мере, одним основанием.
В определенных воплощениях к образцу подается слабое напряжение перед или в момент измерения сигнала. Как правило, напряжение выбирают таким образом, чтобы оно было достаточно сильным для дестабилизации партнеров гибридизации с ошибочным спариванием оснований (мисматчи), но не настолько, чтобы дестабилизировать партнеров гибридизации с совершенным соответствием. В некоторых предпочтительных воплощениях напряжение составляет от около 1 В до около 20 В.
Можно построить калибровочную кривую, на которой величина измеряемого сигнала (например электрического тока и/или интенсивность флуоресценции) является функцией сродства связывания между мишенью и зондом. Поскольку сродство связывания между мишенью и множеством разных зондов изменяется в зависимости от числа ошибочно спаренных оснований в анализируемых образцах, природы ошибочного спаривания (мисматча) (например, A-G против А-С против T-G против Т-С и т.д.), расположения ошибочно спаренных оснований в пределах гибридизационного комплекса и т.п., то способ анализа по изобретению можно использовать для секвенирования мишени.
Измеряемый сигнал может представлять собой, к примеру, электропроводность. В таких воплощениях сродство связывания между зондом и мишенью прямо коррелирует с величиной сигнала. Так, электропроводимость возрастает вместе с возрастанием степени соответствия между зондом и мишенью, предпочтительно в интервале 0-2 мисматча и/или делеции включительно, более предпочтительно в интервале 0-3 мисматча и/или делеции включительно.
В других воплощениях измеряемый сигнал может представлять собой интенсивность флуоресценции флуорофора, включенного в тестируемый образец. В таких воплощениях сродство связывания между зондом и мишенью может быть прямо или обратно пропорционально интенсивности в зависимости от того, сигнализирует ли флуорофор о гибридизации тушением сигнала или усилением сигнала. Так, интенсивность флуоресценции, исходящей от интеркалирующих агентов, прямо коррелирует со сродством связывания зонда и мишени, тогда как в воплощениях с применением неинтеркалирующих флуорофоров, ковалентно связанных с зондом, интенсивность обратно коррелирует со сродством связывания зонда и мишени. Интенсивность флуоресценции возрастает (или уменьшается у неинтеркалирующих флуорофоров) с увеличением степени соответствия оснований между зондом и мишенью, предпочтительно в интервале 0-2 мисматча и/или делеции включительно, более предпочтительно в интервале 0-3 мисматча и/или делеции включительно.
Хотя авторы изобретения ранее раскрыли преимущества измерения интенсивности флуоресценции для анализа гибридизации последовательностей, содержащих нуклеиновые основания (см. US Patent Application №09/468679, filed December 21, 1999), и преимущества измерения интенсивности флуоресценции для анализа связывания пептид:нуклеиновая кислота (см. US Patent Application №09/224505, filed December 31, 1998) и связывания пептид:пептид (см. US Patent Application №09/344525, filed June 25, 1999), однако приложение электрического поля к образцу, по-видимому, повышает разрешающую способность метода, как видно из приведенного ниже примера 6.
Более того, в особенно предпочтительных воплощениях изобретения анализ включает измерение, по меньшей мере, двух сигналов от образца. Первый сигнал предпочтительно представляет собой интенсивность флуоресценции, а второй сигнал предпочтительно выбирают из нескольких измерений электропроводности (или наоборот).
В предпочтительных воплощениях с многократным измерением первый сигнал может быть таким же, как второй сигнал, или может отличаться от него. Когда первый и второй измеряемый сигналы одинаковы, то второй сигнал можно откалибровать по первому сигналу и/или по тому же эталонному(ным) сигналу(ам), что использовался(ись) для калибровки первого сигнала. Кроме того, на тестируемый образец предпочтительно подается, по меньшей мере, один стимул, изменяющий условия, после измерения первого сигнала и перед измерением второго сигнала. Стимул предпочтительно достаточен для заметного изменения связывания, как показывает хотя бы один сигнал. При анализе связывания между нуклеиновыми основаниями по изобретению стимул предпочтительно достаточен для значительного воздействия на несовершенно комплементарную гибридизацию между зондом и мишенью и недостаточен для значительного воздействия на совершенную комплементарную гибридизацию между зондом и мишенью.
В определенных воплощениях изобретения подается, по меньшей мере, один стимул один раз или несколько раз. Стимул может подаваться непрерывно или прерывистым образом. Стимул может подаваться до, во время и/или после детекции сигнала.
К подходящим стимулам относятся, к примеру, фотонное излучение (типа лазерного излучения) и/или электронное. Детектируемые сигналы могут быть, например, фотонными и/или электронными.
Например, в особенно предпочтительном воплощении изобретения первый измеряемый сигнал представляет собой доэлектризационную интенсивность флуоресценции (то есть интенсивность, измеренную перед подачей изменяющего условия напряжения на тестируемый образец) и второй измеряемый сигнал представляет собой послеэлектризационную интенсивность флуоресценции (то есть интенсивность, измеренную во время или после подачи изменяющего условия напряжения на тестируемый образец).
Дополнительные измерения в предыдущих воплощениях повышают надежность анализа и дают возможность немедленно провести повторное тестирование подозрительных результатов. Не согласующиеся результаты, по меньшей мере, двух измерений, как правило, требуют повторного тестирования.
Изобретение дает возможность количественно определить сродство связывания между зондом и мишенью. Такая информация может оказаться ценной для многих применений, включая разработку антисмысловых препаратов с оптимизированными характеристиками связывания.
В отличие от предшествующих методов анализ по изобретению предпочтительно является гомогенным. Анализ может проводиться без отделения комплекса зонд-мишень от свободного зонда и мишени перед определением величины измеряемого сигнала. Анализ не требует стадии разделения в геле, что позволяет сильно увеличить производительность тестирования. Количественные анализы являются простыми и точными. Вследствие этого анализ связывания экономит много времени и средств и легко может быть автоматизирован. Кроме того, он позволяет быстро определить такие параметры связывания, как буфер, рН, концентрация ионов, температура, время инкубации, относительные концентрации зонда и мишени, концентрацию интеркалирующего агента, длину последовательности мишени, длину последовательности зонда и возможную потребность в кофакторах.
Анализ может проводиться, к примеру, в растворе в лунках, на непроницаемой поверхности или на биочипе. В некоторых воплощениях по меньшей мере один из зонда и мишени прикреплен к субстрату, поверхности, перегородке, мембране или электроду.
Более того, анализ по изобретению предпочтительно проводится без добавления тушителя сигнала на мишени или на зонде.
В предпочтительных воплощениях изобретения специфически обнаруживается гибридизация с образованием тройного комплекса (триплекса) или четверного комплекса (квадруплекса) между зондом и двухцепочечной мишенью, при этом отпадает необходимость в денатурации мишени. Образование и/или стабилизация триплексов и квадруплексов усиливается в присутствии интеркалирующего агента в тестируемом образце. Например, см. патентные заявки US Patent Application №09/885731, подана 20 июня 2001 г., и US Patent Application having the Attorney Docket №E1047/20057, озаглавленную "Parallel or antiparallel, homologous or complementary binding of nucleic acids or analogues thereof to form duplex, triplex or quadruplex complexes", подана 20 июля 2001 г..
К подходящим зондам, содержащим нуклеиновые основания, для анализа по изобретению относятся одноцепочечная ДНК (оцДНК), РНК, ПНК и другие аналоги нуклеиновых кислот с незаряженным или частично заряженным остовом. Хотя в определенных воплощениях предпочтительны антипараллельные зонды, они также могут быть параллельными. Предпочтительны последовательности зонда длиной от 8 до 20 оснований, так как именно в этом интервале находятся наименьшие уникальные последовательности ДНК прокариот и эукариот. Особенно предпочтительны зонды из 12-18 оснований, так как именно такова длина наименьших уникальных последовательностей в геноме человека. В некоторых воплощениях наиболее предпочтительны зонды из 6-30 оснований. Однако можно использовать и множество более коротких зондов для обнаружения нуклеотидной последовательности, содержащей в себе несколько не являющихся уникальными последовательностей-мишеней, сочетание которых позволяет однозначно идентифицировать нуклеотидную последовательность. Длину зонда можно выбрать так, чтобы она соответствовала длине мишени.
Подходящие зонды, содержащие аминокислоты, могут включать одну аминокислоту, один аналог аминокислоты, аналог пептида, пептидоид, пептидомиметик, пептид, дипептид, трипептид, полипептид, белок или комплекс из нескольких белков. В некоторых воплощениях зонд является аналогом нуклеиновой кислоты, содержащим, по меньшей мере, либо незаряженный остов, либо частично заряженный остов, либо катионный компонент, либо поперечно-сшивающий агент, либо поперечно-сшивающую боковую цепь или аналог нуклеиновых оснований.
Изобретение не требует применения радиоактивных зондов, которые небезопасны, требуют много труда и времени и должны постоянно возобновляться. Зонды по изобретению предпочтительно безопасны в применении и стабильны в течение многих лет. Соответственно, зонды можно получать или заказывать в больших количествах и хранить.
В тех воплощениях изобретения, в которых мишень включает аминокислоты, мишень предпочтительно включает пептидную последовательность или последовательность аналога пептида, к примеру, дипептида, трипептида, полипептида, белка или комплекса из нескольких белков. Более предпочтительно мишень представлена белком, имеющим, по меньшей мере, один рецепторный сайт для зонда.
В тех воплощениях изобретения, в которых мишень включает нуклеиновые основания, мишени предпочтительно имеют длину от 8 до 3,3×109 пар оснований и могут представлять собой последовательности одноцепочечных или двухцепочечных нуклеиновых кислот или их аналогов.
Предпочтительно ни зонд, ни мишень не являются мечеными, но в альтернативных воплощениях имеется интеркалирующий агент, ковалентно связанный с зондом. В таких воплощениях интеркалирующий агент предпочтительно связан с зондом по любому из концов.
В других воплощениях интеркалирующий агент не связан ковалентно с зондом, однако он может встраиваться между зондом и мишенью во время анализа, в некотором смысле связываясь с зондом нековалентным образом.
К предпочтительным интеркалирующим агентам для применения в изобретении относятся, к примеру, YOYO-1, ТОТО-1, бромид этидия, гомодимер-1 этидия, гомодимер-2 этидия и акридин. В общем, интеркалирующий агент - это молекула, способная интер-калировать (встраиваться) между цепями двойного, тройного и/или четверного комплекса нуклеиновых кислот. В предпочтительных воплощениях интеркалирующий агент (или его компонент), по существу, не флуоресцирует в отсутствие нуклеиновых кислот и флуоресцирует при интеркаляции и возбуждении излучением соответствующей длины волны, проявляя усиление флуоресценции в 100-10000 раз при интеркаляции в двойной или тройной комплекс нуклеиновых кислот.
В альтернативных воплощениях интеркалирующий агент может проявлять смещение длины волны флуоресценции при интеркаляции и возбуждении излучением соответствующей длины волны. Точная длина волны флуоресценции может зависеть от структуры интеркалируемой нуклеиновой кислоты, например, ДНК или РНК, дуплекс или триплекс и т.д.
Длину волны возбуждения выбирают (опытным путем и/или на основании общего знания) так, чтобы она соответствовала максимуму возбуждения используемого флуорофора, и она предпочтительно составляет от 200 до 1000 нм. Интеркалирующие агенты предпочтительно выбирают так, чтобы длина волны испускания составляла от 200 до 1000 нм. В предпочтительных воплощениях применяется аргоновый лазер для облучения флуорофора светом с длиной волны в пределах от 400 до 540 нм, а детекция флуоресценции осуществляется в пределах от 500 до 750 нм.
Анализ по изобретению может осуществляться в широком диапазоне температур, например от 5°С до 85°С. Некоторые предшествующие способы анализа требуют повышенных температур, что увеличивает стоимость и продолжительность анализа. С другой стороны, изобретение может осуществляться при комнатной температуре или ниже (например, при температуре ниже 25°С).
Анализ по изобретению чрезвычайно чувствителен, что устраняет необходимость в проведении ПЦР-амплификации мишени. Например, по крайней мере, в воплощениях с измерением интенсивности флуоресценции можно анализировать образец объемом 20 мкл, содержащий около 10 фемтомоль мишени и 10 фемтомоль зонда. Воплощения изобретения достаточно чувствительны для анализа мишени в концентрации 5×10-9 М, предпочтительно в концентрации не более 5×10-10 М. Воплощения изобретения достаточно чувствительны для применения зондов в концентрации 5×10-9 М, предпочтительно в концентрации не более 5×10-10 М.
При измерении проводимости можно различить образцы, содержащие всего лишь 1 пмоль зонда и 1 пмоль мишени в 40 микролитрах. Уменьшение объема образца позволит применять еще меньшие количества зонда и мишени.
Разумеется, вышеуказанные значения не следует понимать так, будто этот метод не позволяет обнаруживать более высокие концентрации.
Допускаются широкие пределы концентраций интеркалирующего агента при каждой из тестируемых концентраций зонда и мишени. Например, при гибридизации 5×10-10 М зонда и 5×10-10 М мишени оптимальная концентрация интеркалирующего агента YOYO-1 составляет от 25 нМ до 2,5 нМ. При концентрации 5×10-9 М зонда и мишени предпочтительная концентрация YOYO-1 составляет от 1000 нМ до 100 нМ.
Чувствительность анализа достаточна для того, чтобы отличить комплекс зонд-мишень с мисматчем по одной паре оснований от комплекса с мисматчем по двум парам оснований и предпочтительно комплекса зонд-мишень с мисматчем по двум парам оснований от комплекса с мисматчем по трем парам оснований. Конечно, чувствительность метода достаточна для того, чтобы отличить совершенно спаренный комплекс зонд-мишень от любого из вышеуказанных комплексов с мисматчем оснований.
Средой для связывания может служить любая стандартная среда, пригодная для хранения нуклеотидов и/или белков, см., например, Sambrook et al., "Molecular Cloning: A Lab Manual", Vol.2 (1989). Например, жидкая среда может содержать нуклеотиды, воду, буферы и соли в стандартных концентрациях.
Гибридизация между комплементарными основаниями происходит в широком диапазоне условий, отличающихся температурой, концентрацией соли, ионной силой и составом буфера. Примеры таких условий и способы их применения известны в данной области.
Предпочтительно гибридизационные комплексы образуются при температуре от 15°С до 25°С в течение от 1 минуты до 5 минут. Большая продолжительность реакции не требуется, но инкубация в течение нескольких часов не наносит вреда гибридизационным комплексам.
Существует возможность (хотя в этом и нет необходимости, особенно в воплощениях, содержащих интеркалирующий агент) облегчить гибридизацию в растворе применением определенных реагентов. Предпочтительные примеры таких реагентов включают белки, связывающие одноцепочечные НК, такие как белок Rec А, белок гена 32 фага Т4, связывающий одноцепочечные НК белок Е.coli, белки, связывающиеся в области большой и малой бороздок нуклеиновых кислот, двухвалентные ионы, поливалентные ионы, виологен и такие интеркалирующие вещества, как бромид этидия, актиномицин D, псорален и ангелицин. Такие способствующие реагенты могут оказаться полезными при работе в экстремальных условиях, например, при необычных значениях рН или чрезвычайно высоких температурах.
Анализ по изобретению может применяться, к примеру, для идентификации доступных участков в свернутых нуклеотидных последовательностях, для определения числа ошибочно спаренных пар оснований в гибридизационном комплексе и для картирования генома.
В тех воплощениях, в которых детекция интенсивности флуоресценции выполняется с использованием интеркалирующего агента, интенсивность возрастает с повышением сродства связывания между зондом и мишенью. В тех воплощениях, в которых детекция интенсивности флуоресценции выполняется с использованием неинтеркалирующего флуорофора, интенсивность уменьшается при повышении сродства связывания между зондом и мишенью. Независимо от того, интеркалирует флуорофор или нет, данный метод не требует измерения поляризации флуоресценции в отличие от методов с ипользованием флоуресцентной анизотропии.
Далее изобретение будет раскрыто более подробно на нижеследующих примерах, однако следует иметь в виду, что настоящее изобретение не ограничивается ими.
ПРИМЕРЫ
Пример 1
50-мерные смысловые и антисмысловые последовательности одноцепочечных ДНК-мишеней (оцДНК), происходящих из экзона 10 гена кистозного фиброза человека (Nature 380, 207 (1996), синтезировали на ДНК-синтезаторе (Expedite 8909, PerSeptive Biosystems) и очищали методом ВЭЖХ. Комплементарные олигонуклеотиды в эквимолярных количествах денатурировали при 95°С в течение 10 мин и постепенно отжигали по мере понижения температуры до 21°С на протяжении 1,5 часов. Олигонуклеотиды из двухцепочечной ДНК (дцДНК) растворяли в б/д Н2О до концентрации 1 пмоль/мкл.
Последовательность смысловой цепи ДНК-мишени дикого типа (SEQ ID No.1): 5'-TGG CAC CAT TAA AGA AAA TAT CAT CTT TGG TGT TTC СТА TGA TGA ATA TA-3'.
Последовательность антисмысловой цепи ДНК-мишени дикого типа (SEQ ID No.1): 5'-TAT ATT CAT CAT AGG AAA CAC CAA AGA TGA TAT TTT CTT TAA TGG TGC CA-3'.
Расчетная температура плавления (Tm)дцДНК SEQ ID No.1 равна 65,2°С.
SEQ ID No.2 - это последовательность 50-мерной мутантной дцДНК-мишени, идентичная ДНК-мишени дикого типа (SEQ ID No.1) за исключением мутации по одной паре оснований (подчеркнуто) в положении аминокислоты 507, у которой последовательность CAT дикого типа была изменена на CGT.
Последовательность смысловой цепи SEQ ID No.2: 5'-TGG CAC CAT TAA AGA AAA TAT CGT CTT TGG TGT TTC СТА TGA TGA ATA TA-3'.
Последовательность антисмысловой цепи SEQ ID No.2: 5'-TAT ATT CAT CAT AGG AAA CAC CAA AGA CGA TAT TTT CTT TAA TGG TGC CA-3'.
Расчетная температура плавления (Тm)дцДНК SEQ ID No.2 равна 66,0°С.
SEQ ID No.3 - это последовательность 50-мерной мутантной дцДНК-мишени, идентичная ДНК-мишени дикого типа (SEQ ID No.1), за исключением мутации по двум последовательным парам оснований (подчеркнуто) в положении аминокислот 506 и 507, в котором последовательность CAT смысловой цепи дикого типа была изменена на ACT.
Последовательность смысловой цепи SEQ ID No.3: 5'-TGG CAC CAT TAA AGA AAA TAT ACT CTT TGG TGT TTC СТА TGA TGA ATA TA-3'.
Последовательность антисмысловой цепи SEQ ID No.3: 5'-TAT ATT CAT CAT AGG AAA CAC CAA AGA GTA TAT TTT CTT TAA TGG TGC CA-3'.
Расчетная температура плавления (Тm) дцДНК SEQ ID No.2 равна 65,2°С.
ПНК-зонды, используемые в примерах, были синтезированы, очищены методом ВЭЖХ и проверены методом масс-спектроскопии фирмой Commonwealth Biotechnologies, Inc. (Richmond, VA, США). ПНК-зонды сначала растворяли в 0,1% TFA (трифторуксусной кислоте) до концентрации 10 мг/мл, а затем разбавляли до 1 мг/мл добавлением б/д H2O. Конечные запасные растворы ПНК в б/д Н2O доводили до концентрации 1 пмоль/мкл.
Зонд №1 - это 15-мерный антипараллельный ПНК-зонд, сконструированный таким образом, что он полностью комплементарен отрезку в 15 нуклеотидов смысловой цепи 50-мерной ДНК-мишени дикого типа (SEQ ID No.1), перекрывая положения аминокислот 505-510 (Nature 380, 207 (1996)). Зонд имел следующую структуру (SEQ ID No.8):
5'-Н-САС CAA AGA TGA TAT-Lys-CONH2-3'.
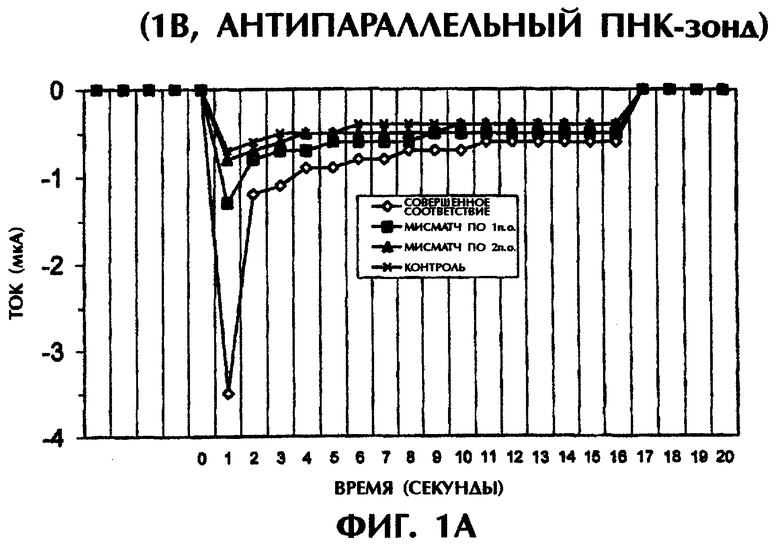
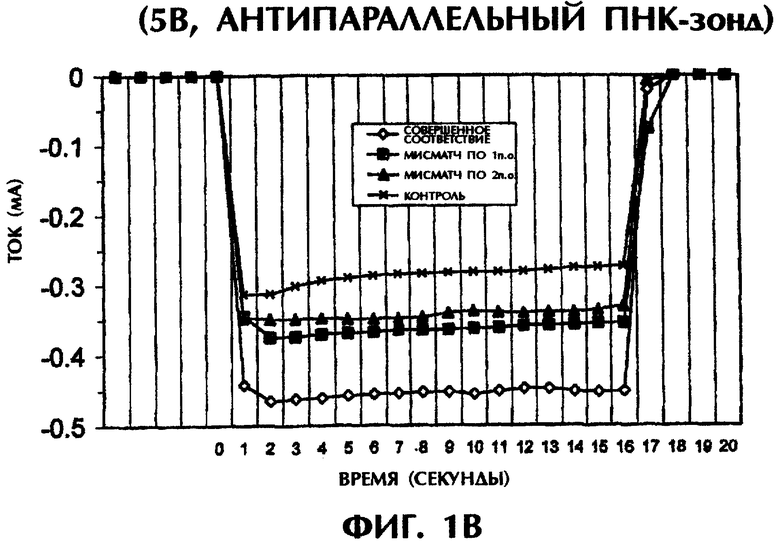
Реакционная смесь для гибридизации (80 мкл) имела следующий состав: 2 пмоль дцДНК-мишени, 2 пмоль ПНК-зонда, 0,5×ТВЕ и 250 нМ ДНК-интеркалирующего агента YOYO-1 (Molecular Probes, Eugene, OR, USA). Образцы помещали в 3 мм кварцевую кювету и подвергали электризации напряжением в 1 или 5 В (постоянный ток) в течение 15 секунд. Амперометрический анализ заключался в регистрации тока при подаче напряжения на раствор. В каждый раствор помещали датчик температуры для измерения температуры во время амперометрического измерения. При напряжении в 1 В наблюдался пик тока в течение первых 2 сек электризации. Сила тока резко падала в течение следующих 13 сек. В опытах с применением 5 В возникали токи, которые оставались сравнительно стабильными в течение всего времени электризации (15 сек).
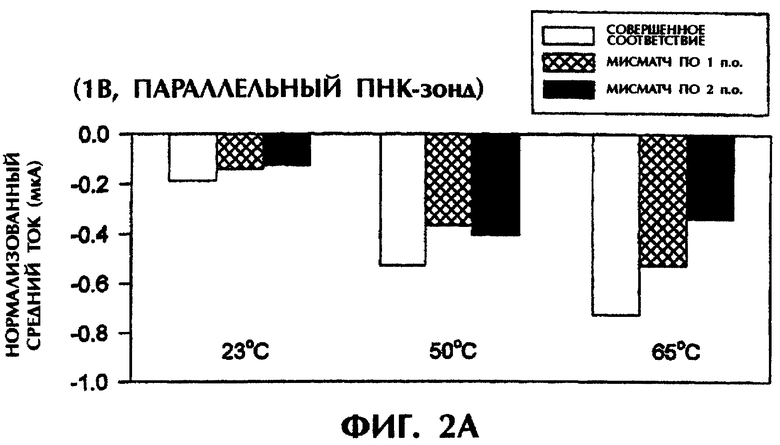
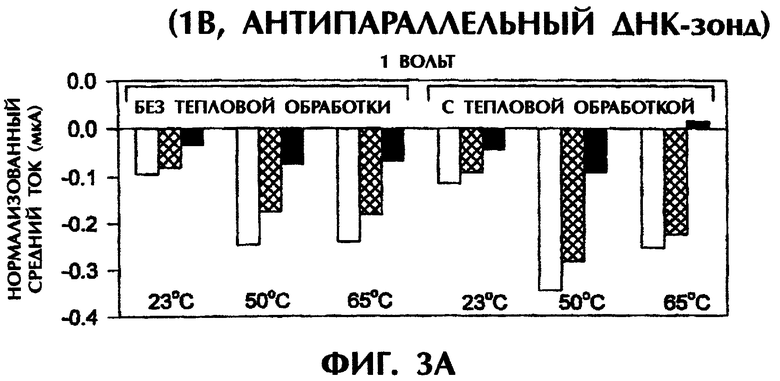
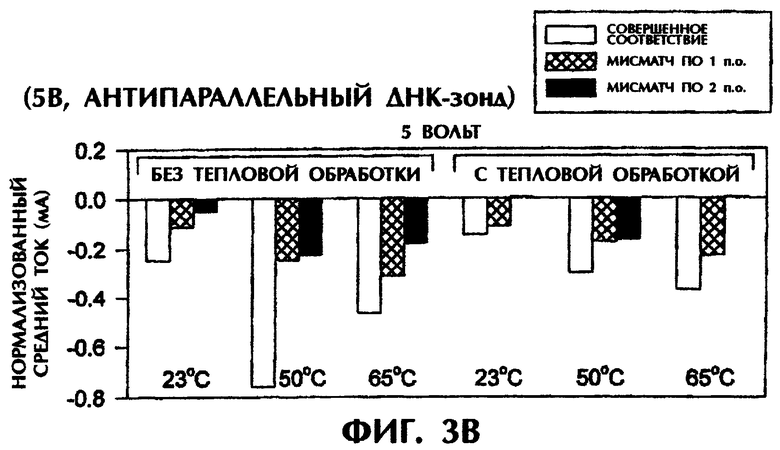
Проводили серию экспериментов, в которых регистрировали электропроводность в отсутствие ДНК или ПНК (контроль) либо при реакции SEQ ID No.1 дикого типа, мутантной SEQ ID No.2 или мутантной SEQ ID No.3 с антипараллельным ПНК-зондом №1. На фиг.1А и 1В представлены графики данных по электропроводности в индивидуальных опытах. На фиг.1А приведены результаты применения электризации в 1 В, а на фиг.1В - электризации в 5 В. Гибридные триплексы из двухцепочечной ДНК и ПНК, состоящие из совершенно комплементарных последовательностей (SEQ ID No.1 + зонд №1), позволяли максимально интеркалировать YOYO-1, давая самые высокие значения электропроводности (что выражается на фигурах в виде отрицательных значений тока) в течение всех 15 сек приложения 1 В. При триплексной гибридизации антипараллельного ПНК-зонда и дцДНК с мисматчем по одной паре оснований (п.о.) (SEQ ID No.2 + зонд №1) и дцДНК с мисматчем по 2 п.о. (SEQ ID No.3 + зонд №1) нормализованные значения пиковой электропроводности были на 79% и 96% меньше, соответственно, чем у совершенно спаренного триплексного гибрида дцДНК:ПНК (SEQ ID No.1 + зонд №1) за первую секунду подачи напряжения (фиг.1А). Близкое процентное снижение проводимости между совершенно комплементарными триплексами и триплексами с мисматчами пар оснований были получены при усреднении значений проводимости за все 15 сек подачи напряжения. На фиг.1А гибриды дцДНК:ПНК с мисматчем по 1 п.о. и 2 п.о. давали снижение среднего значения проводимости на 65% и 91% соответственно, чем у совершенно спаренного гибрида дцДНК:ПНК. Все опыты, представленные на фиг.1А, проводились при комнатной температуре (23°С). С возрастанием степени несоответствия между зондом и двухцепочечной мишенью уменьшалась степень интеркаляции YOYO-1 и снижалась проводимость. Эти соотношения наблюдались и при повторении подобных опытов с применением более высокого напряжения (5 В). При подаче напряжения в 5 В нормализованные средние значения проводимости для триплекса дцДНК:ПНК с мисматчем по 1 п.о. (SEQ ID No.2 + зонд №1) и триплекса дцДНК:ПНК с мисматчем по 2 п.о. (SEQ ID No.3 + зонд №1) были на 52% и 67% ниже соответственно, чем у совершенно спаренного триплекса дцДНК:ПНК (SEQ ID No.3 + зонд №1) (фиг.1В). Представленные на фиг.1В опыты проводились при комнатной температуре (23°С).
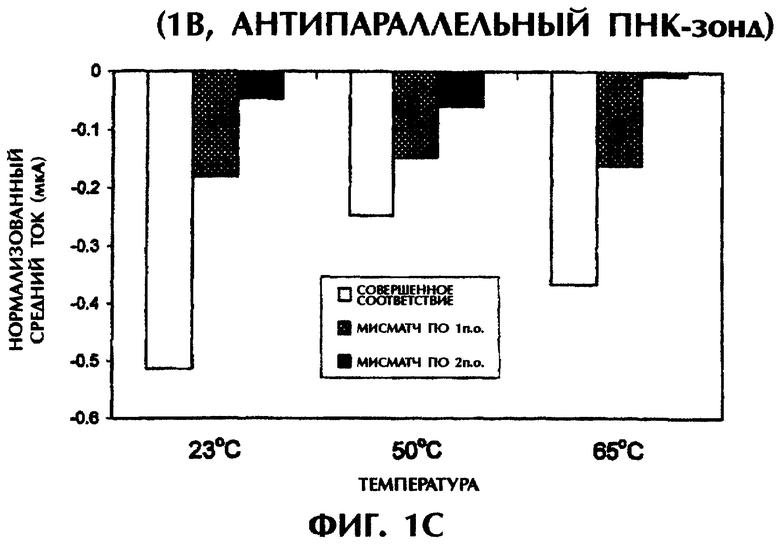
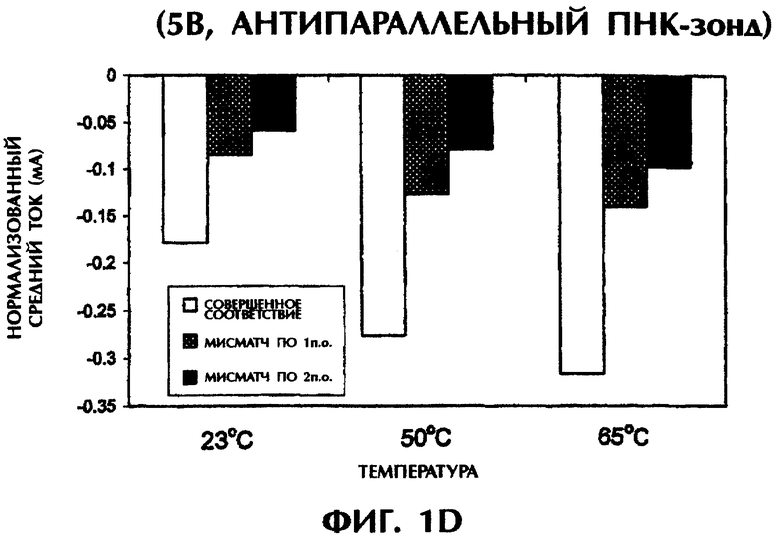
При повторении этих опытов при повышении температуры до 50°С и 65°С наблюдались сходные амперометрические величины. При 50°С подача 1 В в течение 15 сек на совершенно спаренный триплекс дцДНК:ПНК (SEQ ID No.1 + зонд №1) вызывала средний ток в -0,25 мкА по сравнению со значениями в -0,15 мкА (снижение на 40%) и -0,06 мкА (снижение на 76%) для триплекса дцДНК:ПНК с мисматчем по 1 п.о. (SEQ ID No.2 + зонд №1) и триплекса дцДНК:ПНК с мисматчем по 2 п.о. (SEQ ID No.3 + зонд №1) соответственно (фиг.1C). При 65°С отмечались близкие результаты при электрическом воздействии в 1 В в течение 15 сек. Совершенно спаренные гибриды нуклеиновых кислот давали средний ток в -0,37 мкА по сравнению с -0,16 мкА (снижение на 57%) и -0,01 мкА (снижение на 97%) у гибридов с мисматчем по 1 п.о. и по 2 п.о. соответственно (фиг.1C). Подача 5 В при высоких температурах давала аналогичные результаты. Если в опытах, проводившихся при 50°С, получали средние значения тока в -0,27 мА, -0,13 мА (снижение на 52%) и -0,08 мА (снижение на 70%) для совершенно спаренных гибридов, гибридов с мисматчем по 1 п.о. и по 2 п.о. соответственно, то в опытах, проводившихся при 65°С, получали средние значения тока в -0,31 мА, -0,14 мА (снижение на 55%) и -0,10 мА (снижение на 68%) соответственно, в тех же самых соответствующих трех группах (фиг.1D). Во всех предыдущих опытах дцДНК не подвергали денатурации перед образованием триплексов с антипараллельным зондом №1.
Аналогичные эксперименты проводили при различных температурах после нагревания гибридизационных смесей до 65°С и немедленного охлаждения. После охлаждения до комнатной температуры (23°) подача 1 В в течение 15 сек на совершенно спаренный образец (SEQ ID No.1 + зонд №1) давала среднее значение тока в -0,18 мкА. По сравнению с этим наблюдались значения в -0,06 мкА (снижение на 67%) и -0,05 мкА (снижение на 72%) соответственно для триплекса дцДНК:ПНК с мисматчем по 1 п.о. (SEQ ID No.2 + зонд №1) и триплекса дцДНК:ПНК с мисматчем по 2 п.о. (SEQ ID No.3 + зонд №1) (данные не приводятся). При охлаждении образцов от 65°С до 50°С отмечались близкие результаты при последующей подаче 1 В в течение 15 сек. Совершенно спаренный образец (SEQ ID No.1 + зонд №1) давал средний ток в -0,23 мкА по сравнению с -0,11 мкА (снижение на 52%) и -0,01 мкА (снижение на 96%) у образцов с мисматчем по 1 п.о. и по 2 п.о. соответственно (данные не приводятся). При подаче 5 В после охлаждения до 23°С или 50°С средние значения тока для совершенно спаренного триплексного гибрида (SEQ ID No.1 + зонд №1), для триплекса с мисматчем по 1 п.о. (SEQ ID No.2 + зонд №1) и триплекса с мисматчем по 2 п.о. (SEQ ID No.3 + зонд №1) составили -0,15 мА, -0,09 мА (снижение на 40%) и -0,07 мА (снижение на 53%) соответственно при 23°С, и -0,23 мА, -0,09 мА (снижение на 61%) и -0,09 мА (снижение на 61%) соответственно при 50°С (данные не приводятся).
Предварительная обработка гибридизационных смесей при 65°С (значение Тm для 50-мерных дцДНК-последовательностей) с последующим охлаждением не оказывало значительного влияния на различия в проводимости между совершенно спаренными триплексами дцДНК:ПНК и триплексами с мисматчем по 1 п.о. или 2 п.о. при измерении непосредственно при 23°С или 50°С (без предварительного нагревания до 65°С) при использовании антипараллельного ПНК-зонда. Очевидно, антипараллельный ПНК-зонд в присутствии ДНК-интеркалятора YOYO-1 способен образовывать триплексные структуры с дцДНК-мишенями. Применение слабых электрических воздействий (1 В или 5 В) позволяет отличить совершенно спаренные триплексы дцДНК:ПНК от триплексов с мутациями по 1 п.о. или 2 п.о. без предварительной денатурации этих последовательностей.
Пример 2
Как показывает фиг.2, амперометрический анализ по изобретению также позволяет отличить совершенно спаренные триплексные гибриды дцДНК:ПНК от триплексов с мисматчем по 1 п.о. или 2 п.о. при использовании ПНК-зонда, находящегося в параллельной ориентации относительно последовательности ДНК-мишени. Зонд №2 - это 15-мерный ПНК-зонд, последовательность которого идентична последовательности зонда №1, однако он был синтезирован таким образом, чтобы он соответствовал параллельной ориентации ДНК-мишени вместо обычной антипараллельной ориентации. Зонд №2 имел следующую структуру (SEQ ID No.9):
5'-Н-ТАТ AGT AGA AAC CAC-Lys-CONH2-3'.
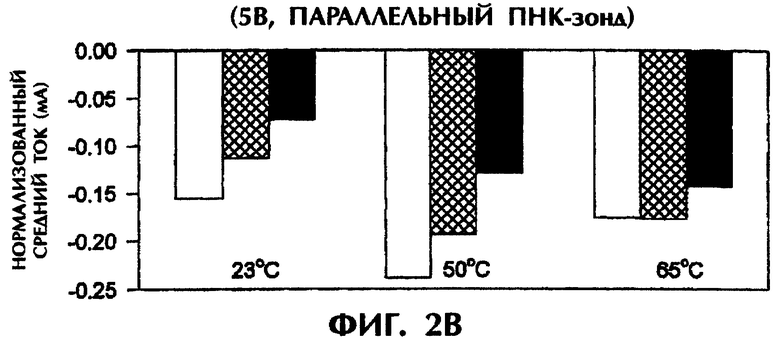
Эксперименты проводились в условиях измерения, идентичных условиям, описанным в примере 1, с единственным отличием в том, что использовался зонд №2 вместо зонда №1. При подаче 1 В средняя сила тока для триплекса дцДНК:ПНК с мисматчем по 1 п.о. (SEQ ID No.2 + зонд №2) и триплекса дцДНК:ПНК с мисматчем по 2 последовательным п.о. (SEQ ID No.3 + зонд №2) была на 25% и 32% меньше при 23°С соответственно, на 30% и 23% меньше при 50°С соответственно и на 28% и 53% меньше при 65°С соответственно, чем для совершенно спаренного триплекса дцДНК:ПНК (SEQ ID No.1 + зонд №2) при тех же температурах (фиг.2А).
Близкие результаты были получены при подаче 5 В (вместо 1 В) в течение 15 сек. Совершенно спаренные гибриды дцДНК:ПНК при 23°С, 50°С и 65°С давали средний ток в -0,15 мА, -0,24 мА и -0,17 мА соответственно (фиг.2В). Неполностью комплементарные триплексы с мисматчем по 1 п.о. и 2 п.о. давали средние значения тока, которые были меньше на 27% (-0,11 мА) и 53% (-0,07 мА) соответственно при 23°С, меньше на 21% (-0,19 мА) и 46% (-0,13 мА) соответственно при 50°С и не менялись (-0,17 мА) или были на 18% меньше (-0,14 мА) соответственно при 65°С, чем в образцах с совершенно спаренным гибридом (фиг.2В).
Приведенные на фиг.2А и 2В результаты свидетельствуют, что при использовании параллельного ПНК-зонда №2 отличия между совершенно спаренными триплексами дцДНК:ПНК и триплексами с мисматчем по 1 п.о. или 2 п.о. были менее выражены, чем при использовании антипараллельного ПНК-зонда №1 (фиг.1).
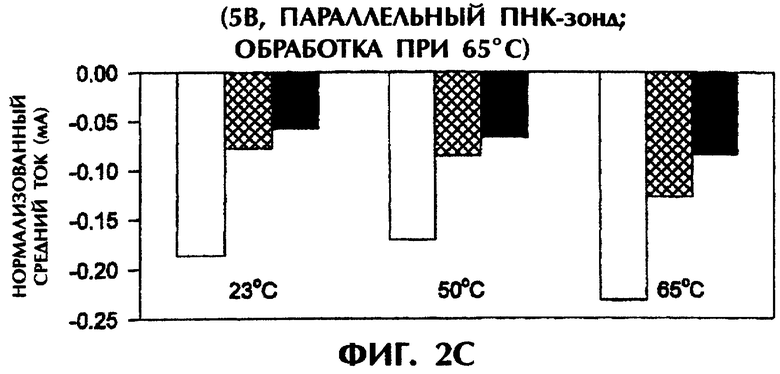
Однако в экспериментах с параллельным зондом №2 и подачей 5 В после нагревания образцов до 65°С и немедленного охлаждения амперометрические измерения показали усиление отличий в сигналах между совершенно спаренными триплексами дцДНК:ПНК и триплексами с мисматчем по 1 п.о. или 2 п.о. (фиг.2С). Совершенно спаренные гибриды (SEQ ID No.1 + зонд №2), гибриды с мисматчем по 1 п.о. (SEQ ID No.2 + зонд №2) и гибриды с мисматчем по 2 п.о. дали средние значения проводимости в -0,19 мА, -0,08 мА и -0,06 мА соответственно при 23°С, -0,17 мА, -0,09 мА и -0,07 мА соответственно при 50°С и -0,23 мА, -0,13 мА и -0,08 мА соответственно при 65°С. Это соответствует уменьшению проводимости на 58% и 68% при 23°С, на 47% и 59% при 50°С и на 43% и 65% при 65°С в образцах с мисматчем по 1 п.о. и 2 п.о., соответственно, по сравнению с совершенно комплементарными образцами (фиг.2С).
Таким образом, как антипараллельные, так и параллельные ПНК-зонды способны выявлять отличия между совершенно комплементарными дцДНК-мишенями и неполностью комплементарными дцДНК-мишенями, содержащими мутации по 1 п.о. или 2 п.о.
Пример 3
Зонд №3 - это 15-мерный оцДНК-зонд, последовательность и ориентация которого идентичны 15-мерному антипараллельному ПНК-зонду №1 (SEQ ID No.8). Зонд №3 имел следующую структуру:
5'-САС САА AGA TGA ТАТ-3'.
Специфичность амперометрического метода далее исследовали, подвергая реакции оцДНК-зонд №3 с 50-мерными последовательностями дцДНК-мишени дикого типа и мутантной мишени в отсутствие предварительной денатурации. Условия измерения были идентичны тем, что описаны в примере 1.
Образование триплексов дцДНК:оцДНК, усиленное ДНК-интеркалирующим агентом YOYO-1, проводили между 30°С и 65°С. При подаче 1 В совершенно спаренный триплекс ДНК, состоящий из SEQ ID No.1 + зонда №3, давал самые высокие значения проводимости (фиг.3А). Напротив, комбинации неполностью комплементарных зонда и мишени, дающих мисматч по 1 п.о. (SEQ ID No.2 + зонд №3) и мисматч по 2 последовательным п.о. (SEQ ID No.3 + зонд №3) давали средние значения проводимости, которые были на 14% и 64% меньше при 23°С, на 30% и 70% меньше при 50°С и на 25% и 72% меньше при 65°С соответственно, чем у совершенно комплементарных последовательностей при тех же температурах (фиг.3А). Подача более высокого напряжения (5 В) на эти образцы приводила к возникновению больших отличий при амперометрии между совершенно спаренными и ошибочно спаренными образцами, чем при подаче 1 В, особенно при низких температурах. После подачи 5 В в течение 15 сек средние значения тока у триплекса ДНК с мисматчем по 1 п.о. и триплекса ДНК с мисматчем по 2 п.о. были на 54% и 78% меньше соответственно при 23°С, на 68% и 70% меньше соответственно при 50°С и на 33% и 61% меньше соответственно при 65°С, чем у совершенно спаренных триплексов ДНК при тех же температурах (фиг.3В).
В аналогичных экспериментах с электрическим воздействием гибридизационные смеси нагревали до 65°С и либо держали при этой температуре, либо немедленно охлаждали до 50°С или 23°С перед подачей 1 В или 5 В. Подача 1 В в течение 15 сек на совершенно спаренный триплекс ДНК (SEQ ID No.1 + зонд №3) давала самые высокие значения проводимости при 23°С, 50°С и 65°С (фиг.3А). Триплексы ДНК, содержавшие мисматч по 1 п.о. (SEQ ID No.2 + зонд №3) или мисматч по 2 п.о. (SEQ ID No.3 + зонд №3) обладали меньшей проводимостью на 21% и 63% соответственно при 23°С, на 18% и 74% соответственно при 50°С и на 12% и 106% соответственно при 65°С (фиг.3А). Аналогичным образом при подаче 5 В в течение 15 сек на подвергавшиеся нагреванию образцы средние значения проводимости у триплексов ДНК с мисматчем по 1 п.о. и с мисматчем по 2 п.о. уменьшались на 24% и 104% соответственно при 23°С, на 42% и 44% соответственно при 50°С и на 38% и 102% соответственно при 65°С по сравнению со средними значениями проводимости в присутствии совершенно спаренных триплексов ДНК (фиг.3В).
Тот факт, что антипараллельный ПНК-зонд (фиг.1) и оцДНК-зонд (фиг.3) проявляли одинаковое поведение при амперометрическом анализе, свидетельствует, что остов нуклеиновой кислоты, используемой в качестве зонда, не имеет особого значения. Присутствие YOYO-1 позволяет дцДНК-мишеням и оцДНК-зондам принимать конформацию тройной спирали, способную вызвать возникновение различных электрических зарядов в зависимости от степени комплементарности последовательностей мишени и зонда в растворе. С возрастанием степени несоответствия между зондом и мишенью уровень проводимости уменьшается, что доказывает надежность амперометрического метода при использовании природного ДНК-зонда в отсутствие предварительной денатурации.
Пример 4
В амперометрических анализах, представленных в примерах 1-3, в раствор, содержащий гибридизационную смесь, добавляли ДНК-интеркалирующий агент YOYO-1. Интеркаляция YOYO-1 способствует образованию триплексов дцДНКЛНК и триплексов дцДНК:оцДНК. В примере 4 исследовали возможность использования интеркалирующего агента, ковалентно присоединенного к оцДНК-зонду, в амперометрическом анализе.
Акридин является альтернативным интеркалятором дцДНК, который также обладает способностью к интеркаляции в структуры нуклеиновых кислот типа триплекса, приводя к стабилизации образования тройной спирали, см., например, Kukreti et al., "Extension of the range of DNA sequences available for triple helix formation: stabilization of mismatched triplexes by acridine-containing oligonucleotides", 25 Nucleic Acids Research 4264-4270 (1997). оцДНК-зонд, содержащий молекулу акридина (Glen Research, Sterling, VA, USA), ковалентно присоединенную по 3'-концу, был синтезирован на ДНК-синтезаторе (Expedite 8909, PerSeptive Biosystems) и очищен методом ВЭЖХ.
Зонд №4 - это 15-мерный оцДНК-зонд, последовательность и ориентация которого идентичны 15-мерному зонду №3 (вследствие чего его последовательность и ориентация также идентичны 15-мерному антипараллельному ПНК-зонду №1 (SEQ ID No.8), но с добавлением молекулы акридина в 3'-положении. Зонд имел следующую структуру:
5'-САС САА AGA TGA ТАТ-акридин-3'.
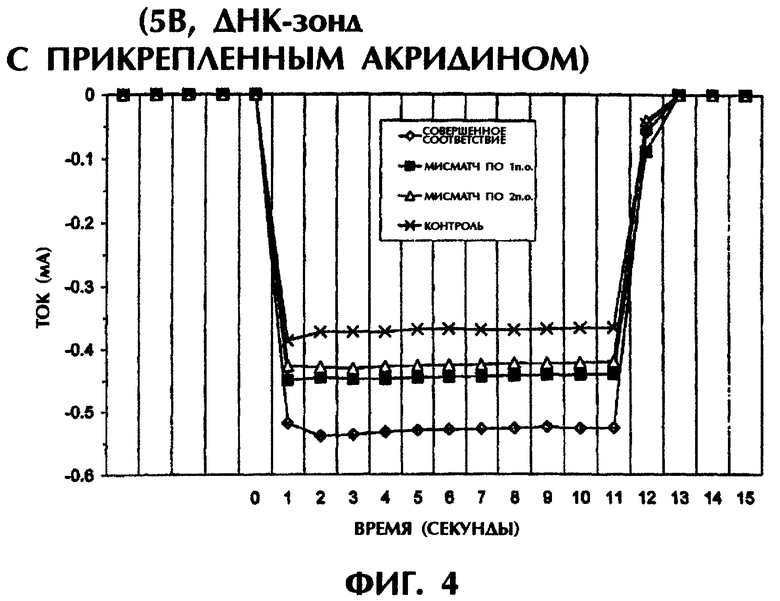
Реакционная смесь для гибридизации (80 мкл) имела следующий состав: 2 пмоль дцДНК-мишени, 2 пмоль оцДНК-зонда №4 и 0,5×ТВЕ. Образцы помещали в 3 мм кварцевую кювету и подвергали электризации в 5 В (постоянный ток) в течение 11 сек при 23°С. Силу тока и температуру регистрировали, как описано в примере 1.
Как видно из фиг.4, оцДНК-зонд №4 был способен гибридизоваться с 50-мерной совершенно соответствующей дцДНК-мишенью (SEQ ID No.1) в результате стабильной интеркаляции ковалентно привязанной молекулы акридина, давая средний ток в -0,53 мА. По сравнению с этим менее устойчивые триплексы ДНК с мисматчем по 1 п.о. (SEQ ID No.2 + зонд №4) или с мисматчем по 2 п.о. (SEQ ID No.3 + зонд №4) давали средние значения тока, которые были на 52% и 66% меньше, чем у совершенно спаренного триплекса ДНК после нормализации относительно контрольного значения (зонд №4 без ДНК-мишени) (фиг.4).
Таким образом, акридин, присоединенный к оцДНК-зонду, был столь же эффективен, как и несвязанный YOYO-1 в образовании тройной спирали ДНК, давая различные электрические токи в зависимости от степени комплементарности последовательностей мишени и зонда в амперометрическом анализе.
Пример 5
15-мерные смысловые и антисмысловые последовательности оцДНК-мишени, происходящей из экзона 10 гена кистозного фиброза человека, синтезировали, очищали и отжигали, как описано в примере 1. дцДНК-олигонуклеотиды растворяли в б/д Н2О до концентрации 1 пмоль/мкл.
SEQ ID No.4 - это 15-мерная последовательность дцДНК-мишени, происходящая из SEQ ID No.1, сконструированная таким образом, что она была полностью комплементарна зонду №1.
Последовательность смысловой цепи ДНК-мишени дикого типа (SEQ ID No.4): 5'-АТА ТСА ТСТ TTG GTG-3'.
Последовательность антисмысловой цепи ДНК-мишени дикого типа (SEQ ID No.4): 5'-CAC CAA AGA TGA TAT-3'.
Расчетная температура плавления (Тm) дцДНК SEQ ID No.4 равна 40,0°С.
SEQ ID No.5 - это 15-мерная последовательность мутантной дцДНК-мишени, идентичная ДНК-мишени дикого типа (SEQ ID No.4) за исключением мутации по одной паре оснований (подчеркнуто), в которой последовательность ТТТ дикого типа была изменена на ТАТ.
Последовательность смысловой цепи мутантной ДНК-мишени (SEQ ID No.5): 5'-АТА ТСА ТСТ ATG GTG-3'.
Последовательность антисмысловой цепи мутантной ДНК-мишени (SEQ ID No.5): 5'-САС CAT AGA TGA TAT-3'.
Расчетная температура плавления (Тm) дцДНК SEQ ID No.5 равна 40,0°С.
SEQ ID No.6 - это 15-мерная последовательность мутантной дцДНК-мишени, идентичная ДНК-мишени дикого типа (SEQ ID No.4) за исключением мутации по двум последовательным парам оснований (подчеркнуто), в которой последовательность АТС дикого типа была изменена на GGC.
Последовательность смысловой цепи мутантной ДНК-мишени (SEQ ID No.6): 5'-АТА TCGGCT TTG GTG-3'.
Последовательность антисмысловой цепи мутантной ДНК-мишени (SEQ ID No.6): 5'-САС САА AGCCGA ТАТ-3'.
Расчетная температура плавления (Тm) дцДНК SEQ ID No.6 равна 44,0°С.
SEQ ID No.7 - это 15-мерная последовательность мутантной дцДНК-мишени, идентичная ДНК-мишени дикого типа (SEQ ID No.4) за исключением мутации по трем отдельным парам оснований (подчеркнуто), в которой каждая из трех мутаций по 1 п.о. отделена 3 парами оснований. Последовательности АТС, ТСТ и TGG были изменены на АСС, ТАТ и TAG соответственно.
Последовательность смысловой цепи мутантной ДНК-мишени (SEQ ID No.7): 5'-АТА ССА ТАТ ТТА GTG-3'.
Последовательность антисмысловой цепи мутантной ДНК-мишени (SEQ ID No.7): 5'-САС ТАА АТА TGG ТАТ-3'.
Расчетная температура плавления (Тm) дцДНК SEQ ID No.7 равна 38,0°С.
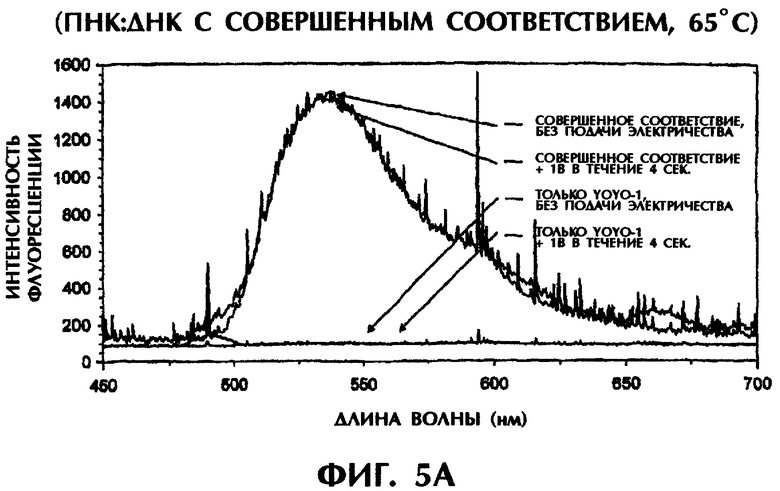
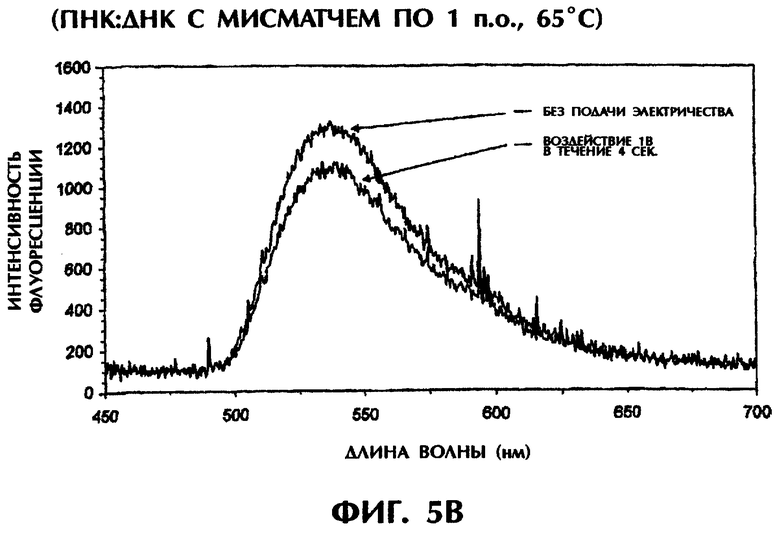
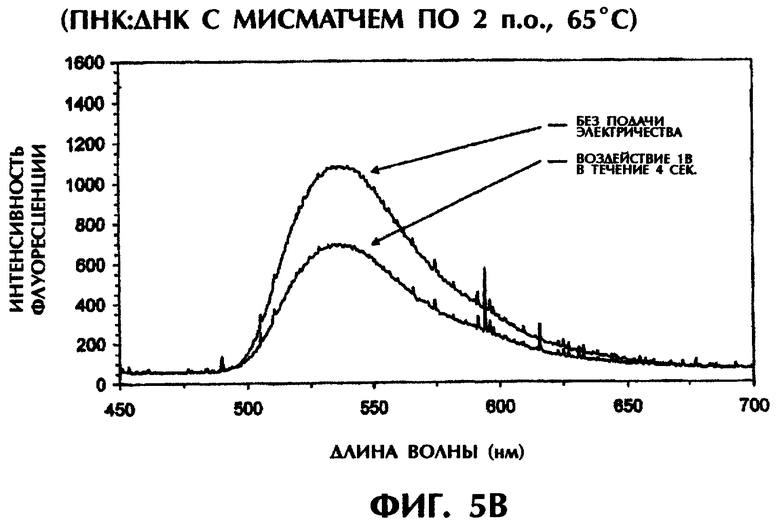
Реакционная смесь для гибридизации (80 мкл) имела следующий состав: 2 пмоль дцДНК-мишени, 2 пмоль параллельного ПНК-зонда №2, 0,5×ТВЕ и 250 нМ ДНК-интеркалирующего агента YOYO-1. Реакционные смеси инкубировали при 95°С в течение 5-10 мин для денатурации, а затем держали при 65°С до измерения. Образцы помещали в кварцевую кювету, облучали лучом аргонового лазера при длине волны 488 нм и регистрировали испускание флуоресценции при 65°С. Параллельно проводили измерение температуры с помощью контролируемого компьютерной программой датчика температуры, помещаемого непосредственно в каждый образец. Максимум интенсивности флуоресценции наблюдался при длине волны 536 нм, что служит показателем интеркаляции YOYO-1 в гибриды ПНК:ДНК. В качестве второго метода после первоначального облучения лазером каждого образца те же самые образцы подвергали электризации 1 В (постоянный ток) в течение 4 сек. В последнюю секунду электризации образцы вторично облучали аргоновым лазером и регистрировали испускание флуоресценции при 65°С. Интенсивность флуоресценции наносили на график зависимости от длины волны для каждого анализируемого образца.
Гибриды оцДНК:ПНК, состоящие из совершенно комплементарных последовательностей (SEQ ID No.4 + зонд №2), позволяли максимально интеркалировать YOYO-1, давая самую высокую интенсивность флуоресценции (фиг.5А). Интенсивность флуоресценции у гибрида оцДНК:ПНК с мисматчем по 1 п.о. (SEQ ID No.5 + зонд №2), гибрида оцДНК:ПНК с мисматчем по 2 последовательным п.о. (SEQ ID No.5 + зонд №2) и гибрида оцДНК:ПНК с мисматчем по 3 отдельным п.о. (SEQ ID No.6 + зонд №2) вся была ниже, чем у совершенно спаренного гибрида оцДНК:ПНК при 65°С (фиг.5 и неприведенные данные). С возрастанием степени несоответствия между зондом и мишенью степень интеркаляции YOYO-1 уменьшалась и, следовательно, снижалась интенсивность флуоресценции. В отсутствие ДНК или ПНК (только YOYO-1) отмечался лишь фоновый уровень флуоресценции (фиг.5А).
Когда совершенно спаренные гибриды оцДНК:ПНК подвергали электрическому воздействию в 1 В в течение 4 сек при 65°С, интенсивность флоуресценции оставалась сравнительно постоянной, уменьшаясь всего лишь на 2% (фиг.5А). Напротив, подача 1 В на неполностью комплементарные дуплексы, содержащие мисматч по 1 п.о. (фиг.5В), мисматч по 2 п.о. (фиг.5С) или мисматч по 3 п.о. (данные не приводятся), приводила к уменьшению интенсивности флуоресценции на 18%, 39% и 71% соответственно по сравнению с такими же образцами, облученными в отсутствие электрического воздействия. Электрическое воздействие слабой силы (1 В) дополнительно уменьшало стабильность гибридов оцДНК:ПНК с мисматчами пар оснований. С уменьшением комплементарности последовательности между зондом и мишенью интенсивность флуоресценции резко снижалась при электрическом воздействии, что обеспечивало очень надежный и точный второй способ анализа для различения между совершенно спаренными последовательностями и последовательностями с мутациями по 1 п.о., 2 п.о. или 3 п.о.
Пример 6
Гибридизационный анализ в примере 5 проводился после денатурации последовательностей дцДНК-мишени, и в нем измерялось образование гибрида оцДНК:ПНК при температуре выше температуры плавления (Тm) дцДНК-мишени. В примере 6 будет продемонстрирована надежность анализа по интенсивности флуоресценции в отсутствие и в присутствии электрического воздействия для различения между совершенным соответствием и мисматчами пар оснований без необходимости в предварительной денатурации.
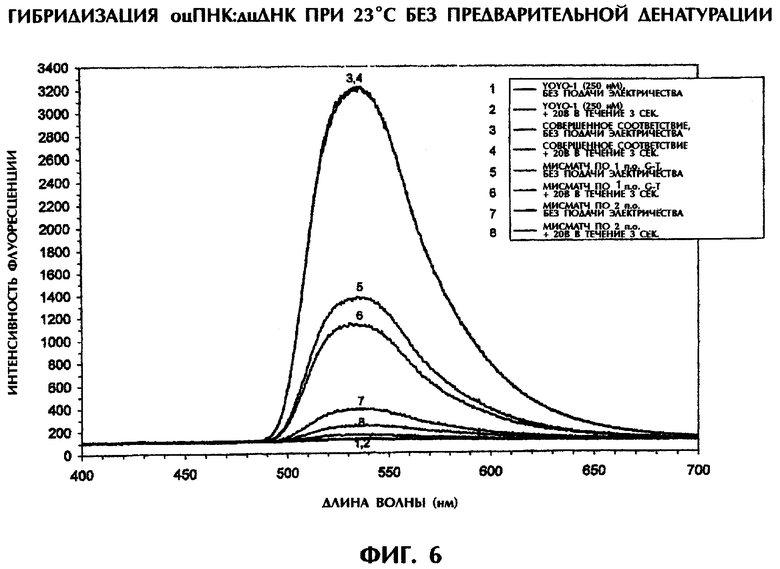
Реакционная смесь для гибридизации (80 мкл) имела следующий состав: 4 пмоль дцДНК-мишени, 4 пмоль антипараллельного ПНК-зонда №1, 0,5×ТВЕ и 250 нМ ДНК-интеркалирующего агента YOYO-1. Образцы помещали в кварцевую кювету, облучали лучом аргонового лазера при длине волны 488 нм в течение 80 мсек и регистрировали испускание флуоресценции при 23°С. Параллельно проводили измерение температуры с помощью контролируемого компьютерной программой датчика температуры, помещаемого непосредственно в каждый образец. Максимум интенсивности флуоресценции наблюдался при длине волны 536 нм, что служит показателем интеркаляции YOYO-1 в гибриды ПНК:ДНК. В качестве второго анализа после первоначального облучения лазером каждого образца те же самые образцы подвергали электризации в 20 В (постоянный ток) в течение 4 сек. Сразу после 3 сек электризации образцы вторично облучали аргоновым лазером в течение 80 мсек и регистрировали испускание флуоресценции при 23°С. Интенсивность флуоресценции наносили на график зависимости от длины волны для каждого анализируемого образца.
Образование триплексов дцДНК:ПНК, усиленное ДНК-интеркалирующим агентом YOYO-1, происходило при 23°С. Самая высокая интенсивность флуоресценции наблюдалась при гибридизации 50-мерной дцДНК-мишени дикого типа (SEQ ID No.1) с 15-мерным антипараллельным ПНК-зондом №1 (фиг.6). По сравнению с этим интенсивность флуоресценции у триплекса дцДНК:ПНК с мисматчем по 1 п.о. (SEQ ID No.2 + зонд №1) и триплекса дцДНК:ПНК с мисматчем по 2 последовательным п.о. (SEQ ID No.3 + зонд №1) была на 60% и 91% ниже соответственно, чем у совершенно спаренного триплекса дцДНК:ПНК при 23°С (фиг.6). В отсутствие ДНК или ПНК в реакционной смеси, содержащей YOYO-1, отмечался только фоновый уровень флуоресценции.
Различия в интенсивности флуоресценции между полностью комплементарными триплексами и триплексами с мисматчем по 1 п.о. или 2 п.о. были значительно большими, чем между совершенно комплементарными дуплексами и неполностью комплементарными дуплексами (ср. фиг.5 и 6). Очевидно, анализ образования триплексов по интенсивности флуоресценции обладает большей дискриминирующей способностью при выявлении мисматчей пар оснований.
Более того, возможна еще лучшая дискриминация между последовательностями дикого типа и мутантными последовательностями при вторичном электрическом воздействии. При воздействии 20 В в течение 3 сек на идеально спаренные триплексы дцДНК:ПНК спектр флуоресценции был практически идентичен спектру такого же образца, не подвергавшегося электрическому воздействию (фиг.6). Однако при воздействии 20 В в течение 3 сек на неполностью комплементарные триплексы, содержащие мисматч по 1 п.о. и мисматч по 2 п.о., интенсивность флуоресценции была на 23% и 71% ниже соответственно, чем в таких же образцах, подвергавшихся облучению в отсутствие электрического воздействия (фиг.6). Электрическое воздействие в 20 В не влияло на стабильность совершенно комплементарных триплексов, но уменьшало стабильность триплексов дцДНК:ПНК, содержащих мисматчи пар оснований, в такой степени, которая зависела от степени комплементарности последовательности между зондом и мишенью. Следовательно, применение электрического воздействия при анализе по интенсивности флуоресценции обеспечивает еще более надежный способ анализа для различения между последовательностями дикого типа и последовательностями с мутациями по 1 п.о. или 2 п.о. без их предварительной денатурации.
Несмотря на то, что изобретение описано подробно и на конкретных примерах, специалисты в этой области должны понимать, что в нем можно осуществлять различные изменения и модификации, не отходя от его духа и не выходя за его рамки.
Изобретение относится к области молекулярного анализа и может быть использовано для последовательность-специфичного анализа биополимеров, содержащих основания нуклеиновых кислот. Анализ последовательность-специфичного связывания проводят на основании сравнения данных о сродстве последовательность-специфичного связывания мишени и зонда, содержащих биополимерную последовательность. Указанные данные получают на основании калибровки сигналов, испускаемых комплексом мишени и зонда в результате подачи на него стимулов, представляющих собой флуоресцентное излучение или электрическое напряжение. Применение изобретения обеспечивает быстрый, чувствительный, экологически дружественный и безопасный способ анализа связывания мишени и зонда, включающих биополимерную последовательность, содержащую основания нуклеиновых кислот. 2 н. и 20 з.п. ф-лы, 14 ил.
обеспечение мишени, включающей, по меньшей мере, одну биополимерную последовательность-мишень, содержащую нуклеиновые основания;
обеспечение зонда, включающего, по меньшей мере, одну биополимерную последовательность-зонд, содержащую нуклеиновые основания;
добавление указанного зонда и указанной мишени в среду связывания для обеспечения тестируемого образца;
подачу первого стимула (стимулирующего воздействия) на указанный тестируемый образец для получения первого стимулированного тестируемого образца;
детекцию первого сигнала от указанного первого стимулированного тестируемого образца, при этом указанный первый сигнал коррелирует со сродством последовательность-специфичного связывания между указанным зондом и указанной мишенью;
калибровку указанного первого сигнала относительно эталонного сигнала;
определение на основании указанной калибровки первого сигнала первого вычисления указанного сродства последовательность-специфического связывания;
подачу второго стимула на указанный первый стимулированный тестируемый образец для обеспечения второго стимулированного тестируемого образца;
детекцию второго сигнала от указанного второго стимулированного тестируемого образца, при этом указанный второй сигнал коррелирует со сродством последовательность-специфичного связывания между указанным зондом и указанной мишенью; и
калибровку указанного второго сигнала относительно второго эталонного сигнала;
определение на основании указанной калибровки второго сигнала второго вычисления указанного сродства последовательность-специфического связывания и
сравнение указанного первого вычисления указанного сродства последовательность-специфического связывания и указанного второго вычисления указанного сродства последовательность-специфического связывания для выполнения анализа;
причем
(a) (i) указанный первый стимул является электрическим напряжением, указанный первый сигнал представляет собой электрическую характеристику, указанный второй стимул является возбуждающим излучением и указанный второй сигнал представляет собой интенсивность флуоресценции или
(ii) указанный первый стимул является возбуждающим излучением, указанный первый сигнал представляет собой интенсивность флуоресценции, указанный второй стимул является электрическим напряжением и указанный второй сигнал представляет собой электрическую характеристику; и
(b) к указанной среде связывания добавляют, по меньшей мере, один флуорофор, свободный от указанного зонда и свободный от указанной мишени, и/или, по меньшей мере, один флуорофор ковалентно связан с указанным зондом.
подачу, по меньшей мере, одного дополнительного стимула на указанный второй стимулированный тестируемый образец для обеспечения дополнительно стимулированного тестируемого образца, где указанный, по меньшей мере, один дополнительный стимул представляет собой электрическое напряжение или возбуждающее излучение, прилагаемое к указанному второму стимулированному тестируемому образцу после детекции указанного второго сигнала от указанного второго стимулированного тестируемого образца;
детекцию, по меньшей мере, одного дополнительного сигнала от указанного дополнительно стимулированного тестируемого образца для проведения третьего вычисления указанного сродства последовательность-специфичного связывания, при этом указанный, по меньшей мере, один дополнительный сигнал представляет собой электрическую характеристику или интенсивность флуоресценции, коррелирующие с указанным сродством последовательность-специфичного связывания между указанным зондом и указанной мишенью; и
сравнение указанного первого вычисления указанного сродства последовательность-специфичного связывания, указанного второго вычисления указанного сродства последовательность-специфичного связывания и указанного третьего вычисления указанного сродства последовательность-специфичного связывания для выполнения анализа.
обеспечение мишени, включающей, по меньшей мере, одну биополимерную последовательность-мишень, содержащую нуклеиновые основания;
обеспечение зонда, включающего, по меньшей мере, одну биополимерную последовательность-зонд, содержащую нуклеиновые основания;
добавление указанного зонда и указанной мишени в среду связывания для обеспечения тестируемого образца;
облучение указанного тестируемого образца возбуждающим излучением;
измерение доэлектризационной интенсивности флуоресценции указанного тестируемого образца;
подачу напряжения к указанному тестируемому образцу;
дополнительное облучение указанного тестируемого образца возбуждающим излучением во время или после указанной подачи напряжения;
измерение послеэлектризационной интенсивности флуоресценции указанного тестируемого образца во время или после указанного дополнительного облучения и
сравнение указанной доэлектризационной интенсивности флуоресценции с указанной послеэлектризационной интенсивностью флуоресценции для определения, отличается ли указанная биополимерная последовательность-мишень от указанной биополимерной последовательности-зонда на 0, 1, 2 или 3 п.о. для выполнения таким образом анализа;
причем (а) указанный способ осуществляют без отделения комплексов зонд-мишень от свободных зондов и мишеней и (b) к указанной среде связывания добавляют, по меньшей мере, один флуорофор, свободный от указанного зонда и свободный от указанной мишени, и/или, по меньшей мере, один флуорофор ковалентно связан с указанным зондом.
| NUCLEIC ACIDS RES | |||
| Электрическое сопротивление для нагревательных приборов и нагревательный элемент для этих приборов | 1922 |
|
SU1997A1 |
| ANAL CHEM | |||
| Прибор для охлаждения жидкостей в зимнее время | 1921 |
|
SU1994A1 |
| J MOL DIAGN | |||
| Перекатываемый затвор для водоемов | 1922 |
|
SU2001A1 |
Авторы
Даты
2007-03-20—Публикация
2002-07-15—Подача