ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к композициям и способам для направленного воздействия на последовательности нуклеиновых кислот и их модификации, используя программируемый молекулярный комплекс.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Основной областью, представляющей интерес в биологии и медицине, является направленное изменение геномных нуклеотидных последовательностей. Такие изменения включают вставку, делецию и замену эндогенных хромосомных последовательностей нуклеиновых кислот. В прошлом были предприняты другими попытки изменить геномные последовательности с помощью различных методов.
Направленное воздействие на ген является биотехнологическим средством, требуемым для манипуляции с геномом или функциональной модификации генома. Направленное воздействие на ген может вызвать изменение в конкретном месте в геноме, которое может быть или может не быть связано с кодирующими последовательностями.
В случае направленного воздействие на ген, заданный эндогенный ген или другая заданная эндогенная последовательность нуклеиновой кислоты или направленно подвергается расщеплению, приводящему к делеции, мутации, вставке или замене, или направленно подвергается химической модификации согласно направленной функциональной модификации гена. Одним преимуществом направленного воздействия на ген по сравнению с ненаправленным получением трансгенного организма является возможность модифицировать или делетировать существующие геномные последовательности без вставки чужеродной ДНК, или в альтернативном случае поместить чужеродную донорную ДНК, посредством вставки или замены, в заданный локус. Преимущественно быть способным к манипулированию таким образом последовательностью без излишних последовательностей, поскольку они нежелательны для животноводов, фермеров, потребителей и регуляторных органов, и хотя было предложено множество способов избегания таких последовательностей, каждый страдает своими собственными недостатками.
Стратегии направленного воздействия на ген в эукариотах зависят от двух клеточных механизмов репарации разрыва дцРНК: гомологичной рекомбинации (HR) и путей репарации с использованием негомологичного соединения концов (NHEJ). При NHEJ вставки гена зависят от существования разрыва дцДНК, который может происходить случайно (например, благодаря излучению или окислительному повреждению) или быть наведенным нуклеазой, такой как TALE нуклеаза (TALEN), мегануклеаза или нуклеаза с белковым доменом «цинковые пальцы» (ZFN). HR могут быть индуцированы разрывами дцДНК. При HR, разрыв дцДНК не является необходимым, но может увеличить эффективность в случае его нахождения вблизи сайта рекомбинации.
Были проведены обширные исследования направленного воздействия на ген с использованием HR, которое работает достаточно эффективно во многих организмах, таких как бактерии, дрожжи и примитивные растения, мох. HR также использовалась в высших организмах, таких как дрозофила, мыши и люди. Коэффициенты HR в этих организмах составляют приблизительно 10-6 и могут быть увеличены до более 10-2, при HR с содействием, с помощью создания геноспецифического DSB. Низкие коэффициенты трансформаций являются одной из причин, почему эти способы не являются распространенными в генотерапии или программах по селекции.
Были предложены различные методы модификации нуклеиновых кислот in-vivo, и их можно разделить на методы на основе ферментов и методы на основе нуклеотидов. Как правило, в методах на основе ферментов используется ДНК-связывающий белок, который обладает как требуемой каталитической активностью, так и способностью к связыванию с желаемой последовательностью-мишенью посредством взаимодействия белок-нуклеиновая кислота таким образом, который схож с рестриктазами. Примеры включают мегануклеазы, которые представляют собой встречающиеся в природе или сконструированные, расщепляющие редкие последовательности ферменты, нуклеазы с белковым доменом «цинковые пальцы» (ZFN) или нуклеазы, подобные активаторам транскрипции (TALEN), которые содержат каталитическую нуклеазную субъединицу FokI, связанную с модифицированным ДНК-связывающим доменом, и могут разрезать каждую одну заданную последовательность. В ZFN связывающий домен состоит из цепей аминокислот, свертывающихся в специализированные домены «цинковые пальцы». В TALEN, также, 34-аминокислотные повторы, происходящие из факторов транскрипции, свертываются в большой ДНК-связывающий домен. В случае направленного воздействия на ген эти ферменты могут расщеплять геномную ДНК с образованием двухцепочечного разрыва (DSB) или создавать одноцепочечный разрыв, который может быть репарирован с помощью одного из двух путей репарации, негомологичного соединения концов (NHEJ) или гомологичной рекомбинации (HR). Потенциально путь NHEJ может приводить к специфическим мутациям, делециям, вставкам или событиям замены. Путь HR приводит к замене подвергаемой направленному воздействию последовательности доставляемой донорной последовательностью. Одним из недостатков этих методов на основе лишь белков является необходимость в продолжительной и трудоемкой разработке и обеспечении отличного белка для каждой желаемой последовательности-мишени. Другие недостатки включают отчасти ограниченное подмножество нуклеотидных триплетов или последовательностей, распознаваемых ZFN и мегануклеазами, соответственно. Кроме того, даже ZFN с шестью белковыми доменами «цинковые пальцы», который очень трудно сконструировать, ограничивается сайтом связывания, состоящим лишь из 18 нуклеотидов, и поскольку 18 нуклеотидов статистически недостаточно для придания специфичности последовательности на протяжении последовательности, или сложности, всего генома, они должны предоставляться в виде гетеродимеров. Кроме того, природа ZFN и TALEN требует скрининга на предмет функциональности, и даже удачные нуклеазы могут демонстрировать слабую эффективность направленного воздействия на ген.
В случае методов на основе нуклеотидов в организм доставляются нуклеиновые кислоты, и эндогенные процессы осуществляют репарацию ДНК или направленное воздействие на ген через гомологичную рекомбинацию без содействия или интеграцию олигонуклеотида в геном. Эти нуклеиновые кислоты могут доставляться, используя вирусные векторы, плазмидные векторы, Т-ДНК векторы и двухцепочечные ДНК-олигонуклеотиды. Более короткие нуклеотиды, называемые образующими тройную спираль олигонуклеотидами (TFO), используются для исправления ошибок спаривания на основе олигонуклеотидов, и можно добиться исправления точечных мутаций или исправления вплоть до 4 нуклеотидов. Существует достаточное доказательство, что эти методы к тому же зависят от образования DSB, которые могут быть случными, случайно индуцированными или локально индуцированными ферментативными или химическими модификациями посредством ферментов или реакционно-способных химических веществ, ковалентно связанных с доставляемой нуклеиновой кислотой. Двухцепочечные разрывы (DSB) в ДНК необходимы для HR. Специфические предсуществующие DSB не являются необходимыми, но увеличивают эффективность. Природные разрывы в ДНК располагаются случайным образом и являются редкими, и, таким образом, эффективность должна быть низкой (10-6). DSB можно наугад индуцировать с помощью ионизирующего излучения или окисляющих химических веществ, увеличивая эффективность ценой генотоксичности. При усовершенствовании этой системы, в прошлом была выполнена HR с содействием или репарация, используя неферментативное расщепление ДНК с помощью химической модификации конца нуклеиновой кислоты. Эти модификации включают EDTA-Fe или фотоактивируемый Псорален и были использованы для получения специфического в отношении последовательности DSB в дцДНК после включения in vitro с образованием тройной спирали. В дополнительном методе используются олигонуклеотиды, или модифицированные олигонуклеотиды, происходящие из одноцепочечной ДНК (оцДНК), иначе известные как «короткие синтетические одноцепочечные олигодезоксинуклеотиды (ODN или ssODN). Однако, хотя методы на основе олигонуклеотидов могут приводить к относительно эффективным точечным мутациям в геномах клеток млекопитающих, они ограничиваются этим способом корректировки.
Конъюгаты олигонуклеотид-фермент являются комбинацией двух методов, включающей нуклеиновую кислоту, ковалентно связанную in-vitro с каталитическим ферментом до доставки конъюгата в организм. Эти методы, в отличие от методов на основе только ферментов, являются модульными, позволяя готовить конъюгаты, нацеленные на многообразие последовательностей-мишеней. Основным недостатком конъюгатов олигонуклеотид-фермент является то, что они не могут подвергаться самосборке in vivo, в силу чего сильно ограничивается их применимость для корректировки генома in vivo. Дополнительным решающим недостатком таких систем, известных в данной области техники, является то, что при использованиях этих конъюгатов ферментный компонент является активным в виде мономера, и поэтому любое связывание фермента с нуклеиновой кислотой, специфическое или нет, будет приводить к расщеплению. Такое неспецифическое расщепление очень уменьшает безопасность таких систем, поскольку они могли бы ввести нежелательные изменения/мутации в нежелательных местах.
Неконъюгированные системы олигонуклеотид-белок также использовались для расщепления субстрата оцДНК. В этой системе рестриктаза класса-IIS, FokI, которая расщепляет вне сайта распознавания, использовалась in vitro, вместе с образующим структуру «шпильки» олигонуклеотидом, который воспроизводит последовательность распознавания FokI, с ферментом PolIk и dNTP для создания двухцепочечного участка ДНК, праймером для которой служит олигонуклеотид, подвергаемый расщеплению. В этой системе расщепляется не только запланированная последовательность, но любой встречающийся в природе сайт для FokI будет распознаваться, и последовательность, примыкающая к нему, будет расщепляться. Поскольку FokI характеризуются состоящим из лишь 5 нуклеотидов сайтом распознавания, это означает, что существуют тысячи потенциальных сайтов расщепления в целом геноме, что делает эту систему непригодной для корректировки генома.
У высших растений и людей, в отличие от других организмов, в случае которых HR может использоваться для направленного воздействия на ген, путь NHEJ является преобладающим эндогенным механизмом. Механизмы репарации ДНК в растениях не допускают эффективную HR между донорной и хромосомной ДНК. Действительно, общепризнано, что молекулы чужеродной донорной ДНК, которые часто доставляют с помощью генетической трансформации с использованием Agrobacterium, распознаются путем негомологичного соединения концов (NHEJ) у растений, который приводит к их случайной интеграции по всему геному хозяина. Таким образом, самые современные методы трансформации растений не считаются направленным воздействием на ген, поскольку в этих методах последовательности случайно встраиваются в геном и, в качестве нежелательного побочного эффекта, могут разрушать существующий ген, и часто встраиваются во множестве копий, или содержат нежелательные остатки плазмидных, маркерных или бактериальных последовательностей.
В способах индукции специфических разрывов дцДНК, применимых для HR с содействием и направленного NHEJ, используется экспрессия нуклеаз in vivo. Они включают разрезающие редкие последовательности нуклеазы (редкие «резчики»), такие как мегануклеазы или химерные мегануклеазы, происходящие из самонаводящихся эндонуклеаз, специально созданные рекомбинантные эндонуклеазы с белковыми доменами «цинковые пальцы» (ZFN) или специально созданные рекомбинантные TAL нуклеазы-эффекторы. В этих методах распознание расщепляемого сайта-мишени достигается посредством взаимодействия белкового домена или субъединицы, который естественно распознает специфическую нуклеотидную последовательность, или специально сконструирован для распознания специфической нуклеотидной последовательности, и не основано на гибридизации полинуклеотид-полинуклеотид или спаривании оснований. Например, нуклеазы с белковыми доменами «цинковые пальцы» представляют собой химерные белки, сконструированные в виде гибридов между нуклеазной субъединицей FokI и синтетическими доменами «цинковые пальцы» (ZF). Нуклеазы с белковыми доменами «цинковые пальцы» не содержат относящийся к нуклеиновой кислоте компонент. Разработаны ZFN, которые специфически распознают нуклеотидные триплеты благодаря комбинации из нескольких мотивов ZF. Нельзя сконструировать ZFN, которые распознают все последовательности вследствие присущей им способности распознавать только ограниченное подмножество нуклеотидных триплетов. Использование гетеродимеров ZFN, в соответствии с котором две различных ZFN, которые неактивны в виде мономера, доставляются вместе, оказывает положительный эффект на специфичность, хотя это осложняет дальнейшую разработку и уменьшает выбор последовательностей-мишеней. ZFN также использовались для создания искусственных факторов транскрипции как для активации, так и для репрессии генов, для изменения регуляции генов. Однако такие факторы транскрипции на основе «цинковых пальцев» не могут связываться со всеми последовательностями, являясь ограниченными по размеру сайта распознавания и ограниченными несколькими специфическими тринуклеотидными мотивами, и, таким образом, не могут использоваться для активации или супрессии всех возможных генов.
Например, Schierling и др. описывают новую платформу для нуклеаз с белковыми доменами «цинковые пальцы» со специфическим в отношении последовательности элементом расщепления. Например, Eisenschmidt K и др. описывают запрограммированную рестрикционную эндонуклеазу для очень специфического расщепления ДНК. Например, WO 2006/027099 направлена на конъюгаты с ферментами с программируемой специфичностью, которые реагируют с ДНК очень специфическим образом.
Kubo и др., например, описывают контролирование внутриклеточной доставки олигонуклеотидов с помощью сигнальных пептидов и генетической экспрессии в клетках человека. Jinek и др. описывают программируемую, направляемую сдвоенной РНК ДНК-эндонуклеазу в адаптивном антибактериальном иммунитете.
WO 2012/129373, например, направлена на способы создания трансгенного локуса сложного признака.
Тем не менее, в данной области техники все еще существует неудовлетворенная потребность в безопасных, надежных, модульных и недорогих композициях и способах, которые делают возможным специфическое направленное воздействие и модификацию последовательностей нуклеиновых кислот-мишеней in-vivo.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящим изобретением обеспечиваются композиции и способы для направленного воздействия и модификации последовательностей нуклеиновых кислот, in-vivo or in-vitro. В соответствии с некоторыми вариантами осуществления новый составной программируемый молекулярный комплекс (нуклеопротеиновый комплекс), обеспечиваемый здесь, используется для точной, надежной и экономически эффективной корректировки или функциональной модификации заданной последовательности нуклеиновой кислоты-мишени.
В некоторых вариантах осуществления молекулярный комплекс, раскрытый здесь, используется для направленного воздействия на ген и/или направленной функциональной модификации гена, в том числе, но без ограничения, создания разрывов в одной или двух цепях нуклеиновой кислоты-мишени для вызова появления мутации гена, делеции, замены гена и интеграции чужеродной молекулы нуклеиновой кислоты, или для его химической, конформационной или биологической функциональной модификации.
В соответствии с некоторыми вариантами осуществления молекулярный комплекс, раскрытый здесь, включает a) химерный полипептид (который может кодироваться полинуклеотидной молекулой), при этом химерный полипептид включает: (i) функциональный (эффекторный) домен (FD), способный к модификации сайта-мишени; и (ii) связующий домен (LD); и (b) придающую специфичность нуклеиновую кислоту (SCNA), при этом SCNA включает: (i) нуклеотидную последовательность, комплементарную участку нуклеиновой кислоты-мишени, фланкирующему сайт-мишень; и (ii) участок распознавания, способный к специфическому присоединению к связующему домену полипептида; в силу чего в результате сборки полипептида и SCNA в клетке-хозяине/мишени образуется функциональный, программируемый, нуклеопротеиновый комплекс, способный к специфическому модифицированию нуклеиновой кислоты-мишени в сайте-мишени.
В некоторых вариантах осуществления настоящим изобретением обеспечивается преимущественная композиция, включающая белковый эффекторный модуль (элемент) (или молекулу нуклеиновой кислоты, кодирующую его) и программирующий/нацеливающий относящийся к нуклеиновой кислоте элемент, которые могут подвергаться самосборке in-vivo в специфический, активный, модифицирующий нуклеиновую кислоту молекулярный нуклеопротеиновый комплекс. В этом комплексе, нуклеиновая кислота, также называемая здесь «программирующим компонентом», «программирующим олигонуклеотидом» или «придающей специфичность нуклеиновой кислотой» (SCNA), обеспечивает специфичность и способности молекулярного комплекса к связыванию с нуклеиновой кислотой-мишенью через спаривание оснований указанной придающей специфичность нуклеиновой кислоты и нуклеиновой кислоты-мишени. Белковый эффекторный компонент или модуль этого комплекса предназначен для связывания/присоединения к определяющей специфичность нуклеиновой кислоте с помощью химического компонента, присоединенного к олигонуклеотиду, модификации нуклеотида или нуклеотидов в олигонуклеотиде, последовательности специфического распознавания в олигонуклеотиде и т.п., или их комбинаций. Преимущественно, раскрытые здесь композиции и способы придают более высокую специфичность с широким диапазоном желаемых последовательностей-мишеней, являются менее генотоксичными, с использованием модулей (элементов) при их сборке, надежными, с использованием одной платформы без специализации, удобными для независимого применения вне специализированных головных центров, и характеризуются более короткими временными рамками разработки и сниженными затратами.
Активность белкового модуля может приводить к модификации последовательности нуклеиновой кислоты-мишени и/или функциональной модификации нуклеиновой кислоты-мишени. Модификация нуклеиновой кислоты-мишени может включать, но без ограничения, мутацию, делецию, вставку, замену, связывание, расщепление, одноцепочечный разрыв, метилирование, ацетилирование, лигирование, рекомбинацию, раскручивание спирали, химическую модификацию, мечение, активацию и инактивацию, или любые их комбинации. Функциональная модификация нуклеиновой кислоты-мишени может приводить к, но без ограничения, изменениям активации транскрипции, инактивации транскрипции, альтернативному сплайсингу, реконфигурации структуры хроматина, инактивации патогена, инактивации вируса, изменению клеточной локализации, компартментализации нуклеиновой кислоты и т.п., или их комбинациям. Любое корректирующее действие или другая модификация, осуществляемое белковым компонентом, направлено или наведено на запланированную (заданную) специфическую нуклеиновую кислоту-мишень в результате его связи с придающей специфичность нуклеиновой кислотой. Преимущественно, что использование каждого одного типа белкового компонента может сочетаться с неограниченным набором нуклеотидных последовательностей определяющих специфичность нуклеиновых кислот вместе или раздельно, чтобы сделать возможным схожее действие на различные участки запланированной нуклеиновой кислоты-мишени. Это позволяет преодолеть недостатки способов уровня техники, в результате обеспечения универсальных, надежных и экономически эффективных способов и композиций для модификации заданных последовательностей нуклеиновых кислот-мишеней. Таким образом, при использовании в одном вместилище или организме, только один тип белка должен обеспечиваться вместе с любой комбинацией или множеством типов определяющих специфичность нуклеиновых кислот. Это также включает возможность одновременного использования более одного типа белкового компонента с более чем одним типом определяющих специфичность нуклеиновых кислот.
В соответствии с некоторыми вариантами осуществления раскрытый здесь комплекс является модульным и может подвергаться самосборке в клетке-мишени или in vivo, или in vitro, что делает возможным обеспечение одного типа белкового компонента в данный момент времени вместе с одним или множеством определяющих специфичность олигонуклеотидов. Кроме того, в некоторых вариантах осуществления белковый компонент может быть доставлен в желаемую клетку(и) и экспрессирован in vivo, ожидая доставку любой соответствующей SCNA в более поздний момент времени. В некоторых вариантах осуществления белковый компонент и SCNA могут доставляться одновременно, или по существу одновременно. Таким образом, комбинация белкового компонента и SCNA, предпочтительно внутри желаемой клетки-мишени, может осуществлять индукцию специфических геномных двухцепочечных разрывов (DSB) или любую другую желаемую модификацию нуклеиновой кислоты, in vivo. Способы настоящего изобретения не ограничиваются введением точечных мутаций в нуклеиновую кислоту-мишень, поскольку молекулярный компонент может осуществлять направленное воздействие на любую последовательность нуклеиновой кислоты или пару последовательностей, осуществлять разрез/рестрикцию/расщепление в непосредственной близости от них и в результате делетировать небольшой или большой участок нуклеиновой кислоты, или осуществлять разрез/рестрикцию/расщепление последовательности для инициации удаления, или вставки, или замены любой последовательности нуклеиновой кислоты.
Преимущественно, что настоящее изобретение, в его вариантах осуществления, впервые раскрывает экспрессию белкового компонента in-vivo и его связывание/присоединение к SCNA в результате самосборки in-vivo с образованием молекулярного комплекса in-vivo, без необходимости предварительного ковалентного/химического связывания белкового компонента с нацеливающей нуклеиновой кислотой. В соответствии с вариантами осуществления настоящего изобретения, в отличие от известной в данной области технике системы на основе олигонуклеотидов, связанная с белком SCNA предназначена не для функционирования в качестве донора, а скорее в качестве придающего специфичность компонента, и не становится частью модифицированной нуклеиновой кислоты. Кроме того, в некоторых вариантах осуществления настоящего изобретения SCNA может быть экспрессирована in vivo так, что вызывается сборка всех компонентов молекулярного комплекса с использованием одного приема доставки. Кроме того, в соответствии с некоторыми вариантами осуществления эффекторный белок может быть сконструирован так, чтобы он был активным только после его димеризации (т.е. он должен образовать димер, чтобы быть активным), в соответствии с чем димеризацию можно контролировать из условия, чтобы активный димер мог образовываться, лишь когда он является направленным/запрограммированным с помощью SCNA и связывается со своим сайтом-мишенью, например, когда расстояния между молекулами - мономерными партнерами (белками) димера является достаточно определенным. Таким образом, преимущественно, молекулярный комплекс активируется только в запланированном для него сайте-мишени, в силу чего увеличивается специфичность и надежность. В соответствии с дальнейшими вариантами осуществления один белковый компонент может быть экспрессирован для образования/продуцирования гомодимеров, при этом каждый является запрограммированным/направленным с помощью отличного олигонуклеотида, придающего специфичность. Кроме того, поскольку вирусные экспрессионные системы, которые известны в данной области техники для использования для экспрессии белков in-vivo, часто ограничиваются продукцией одного белка из-за ограничений по размеру и часто являются единственными для схожих вирусов из-за перекрестного иммунитета, использование одного белкового компонента обладает, таким образом, важным преимуществом для этого способа доставки. Кроме того, в отличие от других способов, известных в данной области техники (таких как ZFN и мегануклеазы), которые характеризуются ограниченным подмножеством последовательностей распознавания, программирующие олигонуклеотиды (SCNA), раскрытые здесь, имеют безграничный набор последовательностей, таким образом, по-видимому, достигая чрезвычайной специфичности в отношении последовательности в геномах с высокой сложностью. Кроме того, поскольку множество программирующих олигонуклеотидов можно обеспечить вместе с одним белковым эффекторным компонентом, можно модифицировать более чем одну мишень в одно и то же время, что дает дополнительные преимущества по сравнению с известными в данной области техники способами. Это может применяться, например, для быстрого нокаута множества генов или для вставки нескольких различных признаков в различные положения, или мечения нескольких различных положений одной донорной нуклеотидной меткой.
В соответствии с некоторыми вариантами осуществления, поскольку незапрограммированный белковый компонент (т.е. белок, не присоединенный/не связанный с программирующим олигонуклеотидом) не обладает или обладает очень низким сродством к нуклеиновым кислотам-мишеням, преимущественно достигается увеличенная специфичность и безопасность и уменьшенная генотоксичность. Как подробно описано выше, эффектор или каталитический домен белкового компонента является активным только после димеризации, в соответствии с чем по крайней мере два программирующих олигонуклеотида (SCNA) должны связаться с фланкирующими мишень последовательностями для вызова димеризации белка и его активации. Два достаточно длинных программирующих олигонуклеотида могут придать очень высокую теоретическую специфичность, необходимую в геномах с высокой сложностью, посредством создания обширной комплементарности с сайтами связывания. Поскольку незапрограммированный экспрессируемый белок не обладает сродством к нуклеиновой кислоте-мишени, он не связывается и/или не модифицирует нуклеиновую кислоту-мишень. Таким образом, в случае применений, когда, например, программирующие олигонуклеотиды доставляются отдельно в клетку-мишень (которая уже экспрессирует незапрограммированный белковый компонент), или в условиях, когда олигонулеотиды истощены в клетке-мишени (например, в результате разведения или деградации), неспецифическое расщепление не происходит, в силу чего увеличивается безопасность и уменьшается генотоксичность.
Таким образом, в соответствии с вариантами осуществления настоящего изобретения, как направленное негомологичное соединение концов (NHEJ), так гомологичная рекомбинация (HR) с содействием может использоваться специфически и программируемым образом для достижения одного или более из следующего:
1. Мутирования последовательности ДНК посредством расщепления внутри нее, создания двухцепочечного разрыва (DSB), который подвергается деградации до некоторой степени под действием эндогенных нуклеаз и снова лигированию с помощью эндогенного механизма репарации ДНК - NHEJ для создания или делеции в рамке считывания и/или мутации со сдвигом рамки считывания ДНК. В отличие от линий на основе вставки T-ДНК или транспозона растений, этот способ делеции и мутации эндогенного гена не оставляет после себя чужеродную ДНК, и растение можно было бы назвать нетрансгенным согласно некоторым определениям. При NHEJ один или более нуклеотидов может быть также добавлен в DSB на основе еще не охарактеризованного эндогенного механизма, в результате чего достигается по существу тот же эффект сдвига рамки считывания или мутации.
2. Делеции участка последовательности ДНК посредством расщепления двух последовательностей, фланкирующих его, которые подвергаются снова лигированию с помощью эндогенного механизма репарации ДНК - NHEJ, или с помощью HR с содействием посредством расщепления в или вблизи последовательности, которая делетируется, и обеспечения донорной ДНК, которая впоследствии подвергается рекомбинации с мишенью, и которая содержит последовательности, фланкирующие последовательность, которая делетируется из мишени.
3. Вставки донорной нуклеиновой кислоты в DSB посредством расщепления нуклеиновой кислоты-мишени и либо обеспечения донорной ДНК, которая непосредственно подвергается лигированию в гэпе с помощью механизма NHEJ, либо предпочтительно обеспечения донора, который гомологичен концам гэпа, подвергаемого рекомбинации и лигированию в гэпе с помощью HR с содействием.
4. Замены последовательности нуклеиновой кислоты мишени посредством расщепления обеих последовательностей, фланкирующих ее, и обеспечения встраиваемой донорной нуклеиновой кислоты, которая или подвергается лигированию с фланкирующей мишень последовательностью с помощью NHEJ, или предпочтительно подвергается рекомбинации и лигированию с помощью HR, посредством добавления последовательностей, схожих с нуклеиновой кислотой-мишенью, или последовательностей, фланкирующих ее, на концы донора.
В соответствии с некоторыми вариантами осуществления, и без желания ограничиться какой-либо теорией или механизмами, преимущества композиций и способов, раскрытых здесь, включают создание общей схемы конструирования ферментативного комплекса, которая может быть направлена на неограниченную выборку последовательностей. После оптимизации белкового компонента с конкретной целью (например, расщепления дцДНК), этот же белок может использоваться с неограниченной выборкой последовательностей программирующих нуклеиновых кислот (SCNA). Таким образом, разнообразие последовательностей-мишеней, на которые воздействуют, достигается посредством разработки SCNA, без необходимости в трудной и трудоемкой повторной разработке и оптимизации белка, которая присуща другим методам, известным в данной области техники, например, TALEN, ZFN и мегануклеазам, в случае которых сам белок должен быть изменен и адаптирован для каждой последовательности-мишени. Разработка и приготовление синтетических SCNA является относительно простой, быстрой и относительно недорогой. В некоторых вариантах осуществления этого изобретения также возможно продуцирование SCNAs in-vivo, что устраняет необходимость доставки в клетку химически синтезированных SCNA. Кроме того, можно разработать SCNA, которые подвергаются спариванию оснований с почти любой желаемой последовательностью-мишенью, и, таким образом, можно направить молекулярный комплекс на почти любую последовательность-мишень. Кроме того, несколько последовательностей-мишеней могут использоваться в одной и той же клетке одновременно. Например, при корректировке функций, при которой требуется более чем один сайт расщепления, например, делетировании или замене конкретных участков нуклеиновой кислоты, посредством просто обеспечения четырех различных SCNA и одного белкового компонента.
В соответствии с некоторыми вариантами осуществления, таким образом, обеспечивается нуклеопротеиновая композиция для модификации заданного сайта-мишени в последовательности нуклеиновой кислоты-мишени в клетке-мишени, при этом композиция включает: (а) молекулу полинуклеотида, кодирующую полипептид, или полипептид, при этом указанный полипептид включает: (i) функциональный (эффекторный) домен (FD), способный к модифицированию указанного сайта-мишени, при этом функциональный домен лишен сайта специфического связывания нуклеиновой кислоты; и (ii) связующий домен (LD), способный к взаимодействию с придающей специфичность нуклеиновой кислотой (SCNA), при этом связующий домен лишен сайта специфического связывания нуклеиновой кислоты-мишени; и (b) придающую специфичность нуклеиновую кислоту (SCNA) или нуклеиновую кислоту, кодирующую SCNA, при этом SCNA включает: (i) нуклеотидную последовательность, комплементарную участку нуклеиновой кислоты-мишени, фланкирующему сайт-мишень; и (ii) участок распознавания, способный к специфическому присоединению к связующему домену полипептида с высоким сродством связывания; в соответствии с чем в результате сборки полипептида и SCNA внутри клетки-мишени образуется функциональный нуклеопротеиновый комплекс, способный к специфической модификации указанной нуклеиновой кислоты-мишени в сайте-мишени.
В некоторых вариантах осуществления функциональный домен включает каталитический домен. В некоторых вариантах осуществления полипептид, кроме того, включает домен субклеточной локализации.
В некоторых вариантах осуществления модификацию нуклеиновой кислоты-мишени выбирают из мутации, делеции, вставки, замены, связывания, расщепления, создания двухцепочечного разрыва, одноцепочечного разрыва, метилирования, ацетилирования, лигирования, рекомбинации, раскручивания спирали, химической модификации, мечения, активации и инактивации.
В соответствии с некоторыми вариантами осуществления SCNA включает молекулу нуклеиновой кислоты, выбираемую из группы, состоящей из одноцепочечной ДНК, одноцепочечной РНК, двухцепочечной РНК, модифицированной ДНК, модифицированной РНК, закрытой нуклеиновой кислоты (LNA) и пептидо-нуклеиновой кислоты (PNA), или их комбинации.
В некоторых вариантах осуществления участок распознавания в SCNA включает модификацию, выбираемую из 5ʹ-концевой модификации, 3ʹ-концевой модификации и внутренней модификации. В некоторых вариантах осуществления химическую модификацию выбирают из группы, состоящей из модификации нуклеотида и добавления ненуклеотидного компонента. В некоторых вариантах ненуклеотидный компонент выбирают из биотина, флуоресцеина, аминолинкеров, олигопептидов, аминоаллила, молекулы красителя, флуорофоров, дигоксигенина, акридита, аденилирования, азида, NHS-эфира (N-гидроксисукцинимидного эфира), холестерил-TEG (триэтиленгликоля), алкинов, фоторазрушаемого биотина, тиола, дитиола. В некоторых вариантах осуществления модификацию нуклеотида выбирают из группы, состоящей из фосфата, 2-аминопурина, Тримера-20, 2,6-диаминопурина, 5-бромдезоксиуридина, дезоксиуридина, инвертированного dT, дидезоксинуклеотидов, 5-метилдезоксицитидина, дезоксиинозина, 5-нитроиндола, 2-О-метил-РНК-оснований, изо-dC, изо-dG, фтор-модифицированных оснований и фосфоротиоатных связей. В некоторых вариантах осуществления модификацию выбирают из группы, состоящей из модификации нуклеотида, биотина, флуоресцеина, аминолинкеров, олигопептидов, аминоаллила, молекулы красителя, флуорофоров, дигоксигенина, акридита, аденилирования, азида, NHS-эфира, холестерил-TEG, алкинов, фоторазрушаемого биотина, тиола, дитиола, модифицированных оснований, фосфата, 2-аминопурина, Тримера-20, 2,6-диаминопурина, 5-бромдезоксиуридина, дезоксиуридина, инвертированного dT, дидезоксинуклеотидов, 5-метилдезоксицитидина, дезоксиинозина, 5-нитроиндола, 2-О-метил-РНК-оснований, изо-dC, изо-dG, фтор-модифицированных оснований и фосфоротиоатных связей, и белков, ковалентно связанных в результате их взаимодействия со специфическими нуклеотидными последовательностями. В некоторых вариантах осуществления белки, ковалентно связанные в результате их взаимодействия со специфическими нуклеотидными последовательностями, можно выбрать, но без ограничения, из белка VirD2 Agrobacterium, VPg пикорнавирусов, топоизомеразы, белка А фага φX174, белка A* φX и любых их вариантов.
В некоторых вариантах осуществления присоединение/связывание/ассоциация между модификацией в SCNA и связующим доменом является результатом взаимодействия пары партнеров по связыванию, выбираемого из нековалентного взаимодействия пары партнеров по связыванию, выбираемой, но без ограничения, из пар биотин-авидин; биотин-стрептавидин; биотин-модифицированные формы авидина; белок-белок; взаимодействий белок-нуклеиновая кислота; взаимодействий лиганд-рецептор; взаимодействий лиганд-субстрат; антитело-антиген; одноцепочечное антитело-антиген; антитело или одноцепочечное антитело-гаптен; гормон-связывающийся с гормоном белок; рецептор-агонист; рецептор-антагонист рецептора; IgG-белок A; фермент-кофактор фермента; фермент-ингибитор фермента; одноцепочечная ДНК-VirE2; StickyC-дцДНК; RISC-РНК; белок оболочки вируса-нуклеиновая кислота; одноцепочечный Fv-фрагмента антитела против флуоресцеина (анти-FAM ScFV) - флуоресцеин; одноцепочечный Fv-фрагмент иммуноглобулина против DIG (анти-DIG-ScFv) - дигоксигенин (DIG) и VirD2 Agrobacterium - связывающийся с VirD2 белок; и любых их вариантов.
В некоторых вариантах осуществления участок распознавания в SCNA включает нуклеотидный мотив, способный к специфическому присоединению/связыванию/ассоциации со связующим доменом химерного белка. В некоторых вариантах осуществления присоединение/связывание/ассоциацию между нуклеотидным мотивом и связующим доменом выбирают, но без ограничения, из таковых между парами белок «цинковые пальцы» - мотив для белкового домена «цинковые пальцы»; домен распознавания рестриктазы - последовательность распознавания рестриктазой; ДНК-связывающий домен фактора транскрипции - ДНК-мотив; репрессор - оператор; лейциновая молния - промотор; спираль-петля-спираль - домен E-бокс; РНК-связывающие мотивы, включающие домены с богатыми аргинином мотивами, домены белка αβ, домены с мотивом распознавания РНК (RRM), домены K-гомологии, мотивы связывания двухцепочечной РНК, РНК-связывающие белковые домены «цинковые пальцы» и ферменты, мишенью которых является РНК, - узнаваемая специфическая последовательность РНК; белок rev ВИЧ - «Ножка» IIB отвечающего на rev элемента (RRE) ВИЧ; основной связывающий домен Tat бычьего вируса иммунодефицита (BIV) - петлевой участок 1 последовательности трансдействующего отвечающего элемента (TAR) BIV; N-белки фага λ, φ21 и P22 - «шпильки» петли бокса-B в сайтах N-использования (nut) в соответствующих им РНК.
В соответствии с некоторыми вариантами осуществления обеспечивается способ модифицирования заданного сайта-мишени в последовательности нуклеиновой кислоты-мишени с помощью программируемого нуклеопротеинового молекулярного комплекса, который включает стадии: a) доставки последовательности нуклеиновой кислоты, кодирующей программируемый химерный белок (полипептид), или белка (полипептида) в клетку-хозяина; b) доставки молекулы придающей специфичность нуклеиновой кислоты (SCNA) или нуклеиновой кислоты, кодирующей SCNA, в указанную клетку-хозяина; c) связывания указанного химерного белка с SCNA, в силу чего химерный белок нацеливается на заданную последовательность нуклеиновой кислоты-мишени в клетке-хозяине, с образования активного запрограммированного нуклеопротеинового комплекса; и d) допуска модификации заданного сайта-мишени последовательности нуклеиновой кислоты-мишени с помощью указанного активного запрограммированного нуклеопротеинового молекулярного комплекса.
В некоторых вариантах осуществления обеспечивается способ модифицирования заданного сайта-мишени в последовательности нуклеиновой кислоты-мишени с помощью программируемого нуклеопротеинового молекулярного комплекса, который включает стадии:
a. доставки последовательности нуклеиновой кислоты, кодирующей программируемый химерный полипептид, в клетку-хозяина, при этом указанный химерный полипептид включает:
(i) функциональный домен, способный к модифицированию указанного сайта-мишени, при этом функциональный домен лишен сайта специфического связывания нуклеиновой кислоты; и
(ii) связующий домен, способный к взаимодействию с придающей специфичность нуклеиновой кислотой, при этом связующий домен лишен сайта специфического связывания нуклеиновой кислоты-мишени;
b. доставки молекулы придающей специфичность нуклеиновой кислоты (SCNA) или нуклеиновой кислоты, кодирующей SCNA, в указанную клетку-хозяина, при этом указанная молекула SCNA включает:
(i) нуклеотидную последовательность, комплементарную участку нуклеиновой кислоты-мишени, фланкирующему сайт-мишень; и
(ii) участок распознавания, способный к специфическому присоединению к связующему домену полипептида с высоким сродством связывания;
причем экспрессия полипептида в клетке, содержащей SCNA, создает возможность для присоединения указанного химерного полипептида к SCNA, образуя активный запрограммированный нуклеопротеиновый комплекс, в силу чего химерный белок нацеливается на заданную последовательность нуклеиновой кислоты-мишень в клетке-хозяине, допускается модификация заданного сайта-мишени последовательности нуклеиновой кислоты-мишени с помощью указанного активного запрограммированного нуклеопротеинового молекулярного комплекса.
В некоторых вариантах осуществления нуклеиновой кислотой-мишенью является ДНК. В некоторых вариантах осуществления ДНК-мишенью является геномная ДНК. В некоторых вариантах осуществления последовательностью нуклеиновой кислоты-мишенью является последовательность экстрахромосомной нуклеиновой кислоты. В некоторых вариантах осуществления являющаяся мишенью последовательность экстрахромосомной нуклеиновой кислоты находится в органелле, выбираемой из группы, состоящей из митохондрии, хлоропласта, амилопласта и хромопласта. В некоторых вариантах осуществления последовательностью нуклеиновой кислоты-мишени является последовательность вирусной нуклеиновой кислоты. В некоторых вариантах осуществления последовательностью нуклеиновой кислоты-мишени является последовательность прокариотической нуклеиновой кислоты. В некоторых вариантах осуществления последовательностью нуклеиновой кислоты-мишени является синтетическая последовательность нуклеиновой кислоты.
В некоторых вариантах осуществления модификацию выбирают из мутации, делеции, вставки, замены, связывания, расщепления, создания двухцепочечного разрыва, одноцепочечного разрыва, метилирования, ацетилирования, лигирования, рекомбинации, раскручивания спирали, химической модификации, мечения, активации и инактивации.
В некоторых вариантах осуществления химерный белок (полипептид) включает белковый компонент, обладающий модифицирующей нуклеиновую кислоту активностью. В некоторых вариантах осуществления химерный белок включает белковый компонент, содержащий функциональный модификатор нуклеиновой кислоты, причем функциональную модификацию выбирают из группы, состоящей из активации транскрипции, инактивации транскрипции, сайленсинга РНК-транскрипта, альтернативного сплайсинга РНК, реконфигурации структуры хроматина, инактивации внутриклеточного паразита и вируса и изменения клеточной локализации или компартментализации указанной последовательности нуклеиновой кислоты-мишени.
В некоторых вариантах осуществления SCNA включает молекулу, выбираемую из группы, состоящей из одноцепочечной ДНК, одноцепочечной РНК, двухцепочечной РНК, модифицированной ДНК, модифицированной РНК, закрытой нуклеиновой кислоты (LNA) и пептидо-нуклеиновой кислоты (PNA), или их комбинаций. В некоторых вариантах осуществления SCNA включает определяющую специфичность последовательность, сформированную так, что она специфически взаимодействует с нуклеиновой кислотой-мишенью. Взаимодействие между SCNA и нуклеиновой кислотой-мишенью осуществляется через спаривание оснований, выбираемое из группы, состоящей из спаривания оснований с образованием полной двойной спирали, спаривания оснований с образованием частичной двойной спирали, спаривания оснований с образованием полной тройной спирали, спаривания оснований с образованием частичной тройной спирали и D-петель или разветвленных форм, образуемых в результате указанного спаривания оснований.
В дополнительных вариантах осуществления SCNA включает участок распознавания, сформированный так, что он ассоциируется/связывается/соединяется со связующим доменом химерного белка. В некоторых вариантах осуществления участок распознавания включает модификацию, выбираемую из группы, состоящей из 5ʹ-концевой модификации, 3ʹ-концевой модификации и внутренней модификации. Модификацию можно выбрать, но без ограничения, из модификации нуклеотида, биотина, флуоресцеина, аминолинкеров, олигопептидов, аминоаллила, молекулы красителя, флуорофоров, дигоксигенина, акридита, аденилирования, азида, NHS-эфира, холестерил-TEG, алкинов, фоторазрушаемого биотина, тиола, дитиола, модифицированных оснований, фосфата, 2-аминопурина, Тримера-20, 2,6-диаминопурина, 5-бромдезоксиуридина, дезоксиуридина, инвертированного dT, дидезоксинуклеотидов, 5-метилдезоксицитидина, дезоксиинозина, 5-нитроиндола, 2-О-метил-РНК-оснований, изо-dC, изо-dG, фтор-модифицированных оснований и фосфоротиоатных связей, и белков, ковалентно связанных в результате их взаимодействия со специфическими нуклеотидными последовательностями. Белки, ковалентно связанные в результате их взаимодействия со специфическими нуклеотидными последовательностями, выбирают из белка VirD2 Agrobacterium, VPg пикорнавирусов, топоизомеразы, белка А фага φX174, белка A* φX и любых их вариантов.
В некоторых вариантах осуществления ассоциация/связывание/соединение между модификацией в SCNA и связующим доменом является результатом нековалентного взаимодействия пары партнеров по связыванию, выбираемой из пар биотин-авидин; биотин-стрептавидин; биотин-модифицированные формы авидина; взаимодействий белок-белок; взаимодействий белок-нуклеиновая кислота; взаимодействий лиганд-рецептор; взаимодействий лиганд-субстрат; взаимодействий антитело-антиген; одноцепочечное антитело-антиген; одноцепочечное антитело-антиген; антитело или одноцепочечное антитело-гаптен; гормон-связывающийся с гормоном белок; рецептор-агонист; рецептор-антагонист рецептора; одноцепочечный Fv-фрагмента антитела против флуоресцеина (анти-FAM ScFV) - флуоресцеин; одноцепочечный Fv-фрагмент иммуноглобулина против DIG (анти-DIG-ScFv) - дигоксигенин (DIG); IgG-белок A; фермент-кофактор фермента; фермент-ингибитор фермента; одноцепочечная ДНК-VirE2; StickyC-дцДНК; RISC-РНК; белок оболочки вируса-нуклеиновая кислота и VirD2 Agrobacterium - связывающийся с VirD2 белок; и любых их вариантов.
В некоторых вариантах осуществления связывание/связь между последовательностью придающей специфичность нуклеиновой кислотой и связующим доменом белкового компонента ковалентно создается in vivo. В некоторых вариантах осуществления ковалентная связь связующего домена с SCNA является результатом биологического взаимодействия VirD2 Agrobacterium - последовательность правого края или любые их вариантов, и создается в бактерии, включающей Agrobacterium.
В некоторых вариантах осуществления участок распознавания включает нуклеотидный мотив, способный к взаимодействию/соединению/связыванию со связующим доменом химерного белка. В некоторых вариантах осуществления пару партнеров по взаимодействию выбирают из пар белок «цинковые пальцы» - мотив для белкового домена «цинковые пальцы»; домен распознавания рестриктазы - последовательность распознавания рестриктазой; ДНК-связывающий домен фактора транскрипции - ДНК-мотив; репрессор - оператор; лейциновая молния - промотор; спираль-петля-спираль - домен E-бокс; РНК-связывающие мотивы, включающие домены с богатыми аргинином мотивами, домены белка αβ, домены с мотивом распознавания РНК (RRM), домены K-гомологии, мотивы связывания двухцепочечной РНК, РНК-связывающие белковые домены «цинковые пальцы» и ферменты, мишенью которых является РНК, - узнаваемая специфическая последовательность РНК; белок rev ВИЧ - «Ножка» IIB отвечающего на rev элемента (RRE) ВИЧ; основной связывающий домен Tat бычьего вируса иммунодефицита (BIV) - петлевой участок 1 последовательности трансдействующего отвечающего элемента (TAR) BIV; N-белки фага λ, φ21 и P22 - «шпильки» петли бокса-B в сайтах N-использования (nut) в соответствующих им РНК.
В соответствии с некоторыми вариантами осуществления заданная последовательность нуклеиновой кислоты-мишени связана с генетическим признаком, и модификация приводит к изменениям транскрипции или трансляции генетического элемента, в результате технической процедуры, выбираемой из группы, состоящей из стабильного замещения, нокаута, временного или постоянного увеличения, выключения, снижения экспрессии и сдвига рамки считывания. В некоторых вариантах осуществления генетический признак модифицируется при корректировке самой последовательности генетического элемента, регулирующих ее последовательностей, генов, регулирующих представляющий интерес ген, или регулирующих их последовательностей в регуляторной цепи событий.
В соответствии с дальнейшими вариантами осуществления обеспечивается нуклеопротеиновый комплекс, причем в результате физической связи белкового компонента с относящимся к придающей специфичность нуклеиновой кислоте компонентом образуется запрограммированный функциональный комплекс. В некоторых вариантах осуществления физическая связь между связующим доменом белкового компонента и SCNA основана на аффинном взаимодействии, выбираемом из группы, состоящей из взаимодействий лиганд-рецептор, лиганд-субстрат, водородных связей, сил Ван-дер-Ваальса, ионных связей и гидрофобного взаимодействия.
В соответствии с некоторыми вариантами осуществления обеспечивается клетка-хозяин, имеющая заданную генетическую модификацию в заданном сайте-мишени, созданную с помощью раскрытого здесь способа. В некоторых вариантах осуществления клеткой-хозяином может быть клетка любого типа, например, но без ограничения, клетка позвоночного животного, клетка млекопитающего, клетка человека, клетка животного, клетка растения, клетка беспозвоночного, клетка круглого червя, клетка насекомого и стволовая клетка.
В соответствии с некоторыми вариантами осуществления обеспечивается трансгенный организм или нокаутный организм, имеющий заданную генетическую модификацию, созданную с помощью раскрытого здесь способа. В некоторых вариантах осуществления организмом является растение или животное.
В соответствии с некоторыми вариантами осуществления, обеспечивается способ лечения генетического заболевания организма, включающий введение в клетку организма нуклеопротеинового программируемого молекулярного комплекса.
В соответствии с некоторыми вариантами осуществления обеспечивается клетка-хозяин, включающая:
a) полипептид, включающий: (i) функциональный домен, способный к модифицированию сайта-мишени в последовательности нуклеиновой кислоты-мишени в клетке, при этом функциональный домен лишен сайта специфического связывания нуклеиновой кислоты; и (ii) связующий домен, который способен к взаимодействию с придающей специфичность нуклеиновой кислотой и лишен сайта специфического связывания нуклеиновой кислоты-мишени; и
b) придающую специфичность нуклеиновую кислоту (SCNA), включающую:
(i) нуклеотидную последовательность, комплементарную участку нуклеиновой кислоты-мишени, фланкирующему сайт-мишень; и (ii) участок распознавания, способный к специфическому присоединению к связующему домену полипептида;
в соответствии с чем в результате сборки полипептида и SCNA в клетке-хозяине образуется функциональный нуклеопротеиновый комплекс, способный к специфическому модифицированию нуклеиновой кислоты-мишени в сайте-мишени.
В некоторых вариантах осуществления обеспечивается клетка-хозяин, содержащая: (a) молекулу полинуклеотида, кодирующую полипептид, при этом полипептид включает: (i) функциональный домен, способный к модифицированию сайта-мишени в последовательности нуклеиновой кислоты-мишени в клетке, при этом функциональный домен лишен сайта специфического связывания нуклеиновой кислоты; и (ii) связующий домен, который способен к взаимодействию с придающей специфичность нуклеиновой кислотой и лишен сайта специфического связывания нуклеиновой кислоты-мишени; и (b) придающую специфичность нуклеиновую кислоту (SCNA), включающую: (i) нуклеотидную последовательность, комплементарную участку нуклеиновой кислоты-мишени, фланкирующему сайт-мишень; и (ii) участок распознавания, способный к специфическому присоединению к связующему домену полипептида; в соответствии с чем в результате сборки полипептида и SCNA в клетке-хозяине образуется функциональный нуклеопротеиновый комплекс, способный к специфическому модифицированию нуклеиновой кислоты-мишени в сайте-мишени.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1A-B представляют собой схематические рисунки, на которых представлены элементы/компоненты программируемого молекулярного комплекса, в соответствии с некоторыми вариантами осуществления.
Фиг. 2A-B представляют собой схематические рисунки, на которых представлена сборка программируемого молекулярного комплекса, в соответствии с некоторыми вариантами осуществления.
На фиг. 3 представлен с использованием пространственного моделирования пример молекулярного комплекса, разработанного для расщепления заданной ядерной последовательность дцДНК-мишени, в соответствии с некоторыми вариантами осуществления.
Фиг. 4A-B представляют собой схематические рисунки (масштаб не выдержан) приводимого в качестве примера способа сборки компонентов программируемого молекулярного комплекса на нуклеиновой кислоте-мишени, в соответствии с некоторыми вариантами.
Фиг. 5 представляет собой схему, демонстрирующую доставку программируемого молекулярного комплекса в клетку, используя in-vitro полученные SCNA, в соответствии с некоторыми вариантами осуществления.
Фиг. 6 представляют собой общую схему, демонстрирующую доставку программируемого молекулярного комплекса в клетку, используя in-vivo продуцированную SCNA, в соответствии с некоторыми вариантами осуществления.
Фиг. 7A-B представляют собой схемы, на которых представлены неограничивающие примеры доставки относящегося к программирующей нуклеиновой кислоте компонента молекулярного комплекса в клетку, используя SCNA в виде одноцепочечной ДНК, продуцированную в Agrobacterium, (фиг. 7A) и бактериальную систему секреции (фиг. 7В), в соответствии с некоторыми вариантами осуществления.
Фиг. 8A-B являются схематическим иллюстрациями, демонстрирующими доставку программирующего компонента программируемого молекулярного комплекса в клетку, используя SCNA-РНК, продуцированные с использованием Agrobacterium (фиг. 8A) или с использованием автономно реплицирующегося вектора, такого как вирус (фиг. 8B), в соответствии с некоторыми вариантами осуществления.
На фиг. 9 представлена схематическая иллюстрация (масштаб не выдержан) неограничивающего примера транспортного средства или вектора для одновременной доставки композиции, включающей компоненты, необходимые для сборки программируемого молекулярного комплекса, в восприимчивую эукариотическую клетку-мишень за один прием доставки, в соответствии с некоторыми вариантами осуществления.
Фиг. 10 является схематической иллюстрацией (масштаб не выдержан), демонстрирующей использование запрограммированного молекулярного комплекса для создания мутации в нуклеиновой кислоте-мишени, в соответствии с некоторыми вариантами осуществления.
Фиг. 11 является схематической иллюстрацией (масштаб не выдержан), демонстрирующей использование запрограммированного молекулярного комплекса для вставки одного или множества нуклеотидов в нуклеиновую кислоту-мишень, используя доставляемую донорную нуклеиновую кислоту, в соответствии с некоторыми вариантами осуществления.
Фиг. 12 является схематической иллюстрацией (масштаб не выдержан), демонстрирующей использование запрограммированного молекулярного комплекса для замены одного или множества нуклеотидов в нуклеиновой кислоте-мишени, используя доставляемую донорную нуклеиновую кислоту, в соответствии с некоторыми вариантами осуществления.
Фиг. 13 является схематической иллюстрацией (масштаб не выдержан), демонстрирующей использование запрограммированного молекулярного комплекса для создания делеции одного или множества следующих друг за другом нуклеотидов из нуклеиновой кислоты-мишени, в соответствии с некоторыми вариантами осуществления.
Фиг. 14 является схематической иллюстрацией (масштаб не выдержан), демонстрирующей использование запрограммированного молекулярного комплекса для замены одного или множества нуклеотидов в нуклеиновой кислоте-мишени, используя доставляемую донорную нуклеиновую кислоту, в соответствии с некоторыми вариантами осуществления.
На фиг. 15 представлена схематическая иллюстрация неограничивающего примера транспортного средства или вектора (масштаб не выдержан) для одновременной доставки в восприимчивую эукариотическую клетку-мишень белка программируемого молекулярного комплекса (PMCP) вместе с последовательностью-мишенью для проверки его активности, в соответствии с некоторыми вариантами осуществления, и как подробно описано в примере 10.
На фиг. 16 представлен схематический рисунок (масштаб не выдержан) параметров для эмпирического определения оптимального расстояния между парами SCNA и для проверки способности различных типов запрограммированных молекулярных комплексов к специфическому расщеплению ДНК-мишени, как подробно описано в примере 12.
ПОДРОБНОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
В соответствии с некоторыми вариантами осуществления обеспечиваются композиции и способы для модификации заданной нуклеиновой кислоты-мишени. В частности, раскрыты способы модифицирования последовательности-мишени in-vivo, используя композицию, которая включает программируемый молекулярный комплекс. Программируемый молекулярный комплекс (также называемый здесь «нуклеопротеиновым комплексом») включает белковый компонент (также называемый здесь «программируемым компонентом») и относящийся к нуклеиновой кислоте компонент (также называемый здесь «придающей специфичность нуклеиновой кислотой» (SCNA) или «программирующей нуклеиновой кислотой»). В соответствии с некоторыми вариантами осуществления компоненты молекулярного комплекса подвергаются самосборке in-vivo в живой клетке, организме, ткани, каллусе, органе или его части, или дифференцированной, или нет, в присутствии последовательности(ей) нуклеиновой кислоты-мишени с образованием активного, запрограммированного функционального молекулярного комплекса.
Следует понимать, что используемая здесь терминология предназначена лишь для описания конкретных вариантов осуществления и, как предполагается, не является ограничивающей. Необходимо отметить, что используемые в описании и прилагаемой формуле изобретения формы единственного числа «a», «an» и «the» включают ссылки на множественное число, если контекстом не установлено иное.
В случае приведения здесь диапазона числовых значений, однозначно предусматривается каждое промежуточное значение между ними с той же степенью точности. Например, в случае диапазона 6-9 предусматриваются значения 7 и 8 помимо 6 и 9, а в случае диапазона 6,0-7,0 однозначно предусматриваются значения 6,0, 6,1, 6,2, 6,3, 6,4, 6,5, 6,6, 6,7, 6,8, 6,9 и 7,0.
ОПРЕДЕЛЕНИЯ
Приблизительно
Используемый здесь термин «приблизительно» относится к +/-10%.
Введение
«Введение» направлено на обеспечение субъекта фармацевтическим средством или композицией и включает, но без ограничения, введение медицинским работником и самостоятельное введение.
«Парентеральное введение» означает введение не через кишечник. Парентеральное введение включает, но без ограничения, подкожное введение, внутривенное введение или внутримышечное введение.
«Подкожное введение» означает введение непосредственно под кожу.
«Внутривенное введение» означает введение в вену.
«Внутриопухолевое введение» означает введение в опухоль.
«Химиоэмболизация» означает процедуру, при которой хирургически или механически блокируют кровоснабжение опухоли, и химиотерапевтические средства вводят непосредственно в опухоль.
Антисмысловые
Используемый здесь термин «антисмысловые» относится к нуклеотидным последовательностям, которые комплементарны специфической последовательности ДНК или РНК. Термин «антисмысловая цепь» используется в отношении цепи нуклеиновой кислоты, которая комплементарна «смысловой» цепи. Антисмысловые молекулы можно продуцировать любым способом, включая синтез с использованием лигирования представляющего интерес гена(ов) в обратной ориентации с вирусным промотором, который делает возможным синтез комплементарной цепи. После введения в клетку, эта транскрибированная цепь объединяется с природными последовательностями, продуцируемыми клеткой, с образованием дуплексов. Эти дуплексы затем блокируют или дальнейшую транскрипцию, или трансляцию. Таким образом можно создать мутантные фенотипы.
Автономно реплицирующиеся векторы
«Автономно реплицирующиеся векторы», как здесь определяют, включают любую природную или неприродную последовательность нуклеиновой кислоты, способную к репликации внутри хозяина, включая, но без ограничения, вирусы, модифицированные вирусы, некоторые рекомбинантные векторы и плазмиды, репликоны и внутриклеточные паразиты.
Клетка
«Клетка», как здесь определяют, включает любой тип клетки, прокариотическую или эукариотическую клетку, выделенную или нет, подвергнутую культивированию или нет, дифференцированную или нет, и включает также организации клеток на более высоком уровне, такие как ткани, органы, каллусы, организмы или их части. Приводимые в качестве примеры клетки включают, но без ограничения, клетки позвоночных животных, клетки млекопитающих, клетки человека, клетки растений, клетки животных, клетки беспозвоночных, клетки круглых червей, клетки насекомых, стволовые клетки и т.п.
Комплемент
«Комплемент» или «комплементарный», как здесь используется, означает спаривание оснований по Уотсону-Крику (например, A-T/U и C-G) или хугстиновское спаривание оснований между нуклеотидами или аналогами нуклеотидов молекул нуклеиновых кислот. Полный комплемент или полностью комплементарный может означать 100% комплементарное спаривание оснований между нуклеотидами или аналогами нуклеотидов молекул нуклеиновых кислот. Частичная комплементарность может означать составляющую менее 100% комплементарность, например, составляющую 80% комплементарность.
Вектор для доставки
Термин «вектор для доставки» или «вектoры для доставки» предназначен для любого вектора для доставки, который можно использовать в настоящем изобретении для осуществления контакта с клетками или доставки во внутрь клеток или субклеточных компартментов агентов/химических веществ и молекул (белков или нуклеиновых кислот), необходимых в настоящем изобретении. Он включает, но без ограничения, векторы для трансдукции, липосомные векторы для доставки, плазмидные векторы для доставки, вирусные векторы для доставки, бактериальные векторы для доставки, векторы для доставки лекарственных средств, химические носители, полимерные носители, липоплексы, полиплексы, дендримеры, микропузырьки (контрастные средства для ультразвуковой визуализации), наночастицы, эмульсии или другие соответствующие векторы для переноса. Эти векторы для доставки позволяют доставлять молекулы, химические вещества, макромолекулы (гены, нуклеиновую кислоту(ы), белки) или другие векторы, такие как плазмиды и T-ДНК. Эти векторы для доставки являются носителями молекул.
Доза
«Доза», как здесь используется, означает определенное количество фармацевтического средства, предоставляемое при одном введении. В некоторых вариантах осуществления дозу можно вводить в виде двух или более болюсов, таблеток или инъекций. Например, в некоторых вариантах осуществления, когда желательным является подкожное введение, желаемая доза требует объем, который нелегко обеспечить с помощью одной инъекции. В таких вариантах осуществления можно использовать две или более инъекций для достижения желаемой дозы. В некоторых вариантах осуществления дозу можно вводить в виде двух или более инъекций для минимизации реакции в месте инъекции у индивидуума.
Унифицированная доза
«Унифицированная доза», как здесь используется, означает форму, в которой предоставляется фармацевтическое средство. В некоторых вариантах осуществления унифицированной дозой является пузырек, содержащий лиофилизированный олигонуклеотид. В некоторых вариантах осуществления унифицированной дозой является пузырек, содержащий воссозданную форму олигонуклеотида.
Донорная нуклеиновая кислота
Термин «донорная нуклеиновая кислота» определяется здесь как любая нуклеиновая кислота, доставляемая в организм или вместилище для встраивания или подвергания рекомбинации полностью или частично в (с) последовательность(ю)-мишень посредством механизмов репарации ДНК, или гомологичной рекомбинации (HR), или посредством негомологичного соединения концов (NHEJ).
Продолжительность
«Продолжительность», как здесь используется, означает период времени, во время которого длится активность или событие. В некоторых вариантах осуществления продолжительность лечения является периодом времени, во время которого вводят дозы фармацевтического средства или фармацевтической композиции.
Экспрессионный вектор
«Экспрессионный вектор», как здесь используется, означает любую нуклеиновую кислоту, предназначенную для искусственного кодирования экзогенного белка или белков в клетке-хозяине. Примеры экспрессионных векторов включают плазмидную ДНК, T-ДНК, вирусную РНК, оцДНК или дцДНК, репликоны, автономно реплицирующиеся векторы, линейную оцДНК, линейную дцДНК, продукты полимеразы φ, РНК-транскрипт, замыкающуюся в круг РНК, а в некоторых применениях этого изобретения геномную ДНК или органелльную ДНК, трансфецированную в клетку-хозяина.
Фрагмент
«Фрагмент» используется здесь для указания на неполноразмерную часть нуклеиновой кислоты или полипептида. Таким образом, сам фрагмент является также нуклеиновой кислотой или полипептидом, соответственно.
Ген
«Ген», как здесь используется, может быть природным (например, геномным) или синтетическим геном, включающим регулирующие транскрипцию и/или трансляцию последовательности и/или кодирующую область и/или нетранслируемые последовательности (например, интроны, 5ʹ- и 3ʹ-нетранслируемые последовательности). Кодирующей областью гена может быть нуклеотидная последовательность, кодирующая аминокислотную последовательность или функциональную РНК, такую как тРНК, рРНК, каталитическая РНК, киРНК, микроРНК или антисмысловая РНК. Геном может также быть мРНК или кДНК, соответствующая кодирующим областям (например, экзоны и микроРНК), необязательно включающая 5ʹ- или 3ʹ-нетранслируемые последовательности, связанные с нею. Ген может также представлять собой молекулу амплифицированной нуклеиновой кислоты, полученную in vitro, включающую всю и часть кодирующей области и/или 5ʹ- или 3ʹ- нетранслируемые последовательности, связанные с нею.
Направленное воздействие на ген
«Направленное воздействие на ген» используется здесь как любой генетический метод, который вызывает появление постоянного изменения в последовательности нуклеиновой кислоты-мишени, в том числе делеции, вставки, мутации и замены нуклеотидов в последовательности-мишени.
Геномная модификация
«Геномная модификация» используется здесь как любая модификация, порожденная в геноме, или хромосоме, или экстрахромосомной ДНК, или органелльной ДНК организма в результате направленного воздействия на ген или функциональной модификации гена.
Клетка-хозяин
«Клетка-хозяин», как здесь используется, может представлять собой встречающуюся в природе клетку или трансформированную клетку, которая может содержать вектор. Клетками-хозяевами могут быть подвергаемые культивированию клетки, экспланты, клетки in vivo и т.п. Клетками-хозяевами могут быть прокариотические клетки, такие как E. coli, или эукариотические клетки, такие как клетки растений, дрожжевые клетки, клетки насекомых, земноводных или млекопитающих, такие как CHO и HeLa. В соответствии с некоторыми вариантами осуществления указанная клетка-хозяин является целой или не целой, дифференцированной или недифференцированной, клеткой в организме, органе, ткани или каллусе.
Идентичность
«Идентичные» или «идентичность, как здесь используются в связи с двумя или более последовательностей нуклеиновых кислот или полипептидов, означают, что последовательности имеют определенный процент остатков, которые являются одинаковыми на протяжении определенного участка. Процент можно рассчитать с помощью оптимального совмещения двух последовательностей, сравнения двух последовательностей на протяжении определенного участка, определения числа положений, в которых идентичный остаток встречается в обеих последовательностях, для получения числа совпадающих положений, деления числа совпадающих положений на общее число положений в определенном участке, и умножения результата на 100 для получения процента идентичности последовательностей. В случаях, когда две последовательности имеют различные длины, или совмещение приводит к одному или более смещенных концов, и определенный участок сравнения включает только одну последовательность, остатки одной последовательности включают в знаменатель, но не в числитель при расчете. При сравнении ДНК и РНК, тимин (T) и урацил (U) могут считаться эквивалентными. Расчет идентичности можно выполнить вручную или с использованием алгоритма для сравнения последовательностей с помощью компьютера, такого как BLAST или BLAST 2.0.
Ингибировать
«Ингибировать», как здесь используется, может означать предотвращать, подавлять, угнетать, уменьшать или устранять.
In-vitro
«In-vitro» определяется здесь как искусственная среда снаружи оболочек (мембран) целого или не целого, дифференцированного или недифференцированного, живого организма, органа, ткани, каллуса или клетки. В некоторых вариантах осуществления термин «in-vitro» означает не внутри жизнеспособной клетки.
In-vivo
«In-vivo» определяется здесь как внутри целого или не целого, дифференцированного или недифференцированного, организма, органа, ткани, каллуса или клетки.
Наборы
Набор, как здесь используется, может включать описанные здесь композиции вместе со всякими или всеми из следующих: реагентами для исследования, буферами, зондами и/или праймерами, и стерильным солевым раствором или другой фармацевтически приемлемой основой для эмульсии и суспензии. Кроме того, наборы могут включать инструктивные материалы, содержащие указания (например, протоколы) в отношении осуществления на практике описанных здесь способов.
Метка
«Метка», как здесь используется, означает композицию, поддающуюся обнаружению с использованием спектроскопических, фотохимических, биохимических, иммунохимических, химических или других физических способов. Например, применимые метки включают 32P, флуоресцентные красители, электронно-плотные реагенты, ферменты (например, которые обычно используются в ELISA), биотин, дигоксигенин или гаптены и другие молекулы, который можно сделать обнаруживаемыми. Метка может быть включена в нуклеиновые кислоты и белки в любом положении.
Несоответствие
«Несоответствие» означает нуклеотидное основание первой нуклеиновой кислоты, которое не способно к спариванию с нуклеотидным основанием в соответствующем положении второй нуклеиновой кислоты.
Модифицированный олигонуклеотид
«Модифицированный олигонуклеотид», как здесь используется, означает одигонуклеотид, имеющий одну или более модификаций относительно встречающегося в природе конца, сахара, нуклеотидного основания и/или межнуклеозидной связи.
Модуляция
«Модуляция», как здесь используется, означает флуктуации функции и/или активности и/или структуры. В некоторых вариантах осуществления модуляция означает увеличение экспрессии гена. В некоторых вариантах осуществления модуляция означает уменьшение экспрессии гена.
Мутант
«Мутант, как здесь используется, относится к последовательности, у которой утрачена по крайней мере часть функциональности последовательности, например, изменения последовательности промоторного или энхансерного района будут оказывать влияние по крайней мере частично на экспрессию кодирующей последовательности в организме. Используемый здесь термин «мутация» относится к любому изменению последовательности нуклеиновой кислоты, которое может происходить, например, в результате делеции, добавления, замены или перестановки. Мутация может также оказывать влияние на одно или более действий, в которые вовлечена последовательность. Например, изменение последовательности ДНК может приводить к синтезу измененной мРНК и/или белка, которая(ый) является активной, частично активной или неактивной.
Нуклеиновая кислота
«Последовательность нуклеиновой кислоты» или «олигонуклеотид», или «полинуклеотид», как здесь используется, означает по крайней мере два нуклеотида, ковалентно связанных вместе. Изображение одной цепи также определяет последовательность комплементарной цепи. Таким образом, нуклеиновая кислота также охватывает комплементарную цепь изображенной одной цепи. Множество вариантов нуклеиновой кислоты может использоваться для той же цепи, что и заданная нуклеиновая кислота. Таким образом, нуклеиновая кислота также охватывает по существу идентичные нуклеиновые кислоты и их комплементы. Одна цепь обеспечивает зонд, который может гибридизоваться с последовательностью-мишенью в жестких условиях гибридизации. Таким образом, нуклеиновая кислота также охватывает зонд, который гибридизуется в жестких условиях гибридизации.
Нуклеиновые кислоты могут быть одноцепочечными или двухцепочечными, или могут содержать части и двухцепочечной, и одноцепочечной последовательности. Нуклеиновой кислотой может быть ДНК, как геномная, так и кДНК, РНК или гибрид, в случае которого нуклеиновая кислота может содержать комбинации дезоксирибо- и рибонуклеотидов и комбинации оснований, включающих урацил, аденин, тимин, цитозин, гуанин, инозин, ксантин, гипоксантин, изоцитозин и изогуанин. Нуклеиновые кислоты можно получить с помощью методов химического синтеза или с помощью рекомбинантных методов. Нуклеиновая кислота будет, как правило, содержать фосфодиэфирные связи, хотя могут быть включены аналоги нуклеиновой кислоты, которые могут содержать по крайней мере одну отличную связь, например, фосфорамидатную, фосфоротиоатную, фосфородитиоатную или O-метилфосфороамидитную связи и остовы и связи пептидо-нуклеиновых кислот. Другие нуклеиновые кислоты-аналоги включают НК с положительно заряженными остовами; неионными остовами и не содержащими рибозу остовами, в том числе те, которые описаны в патентах США с № 5235033 и 5034506, которые включены посредством ссылки. Нуклеиновые кислоты, содержащие один или более не встречающихся в природе или модифицированных нуклеотидов, также включены в одно определение нуклеиновых кислот. Модифицированные аналоги нуклеотидов могут находиться, например, на 5ʹ-конце и/или 3ʹ-конце молекулы нуклеиновой кислоты. Репрезентативные примеры аналогов нуклеотидов могут быть выбраны из рибонуклеотидов, модифицированных по сахару или остову. Однако следует отметить, что также модифицированные по нуклеотидному основанию рибонуклеотиды, т.е. рибонуклеотиды, содержащие вместо встречающегося в природе нуклеотидного основания не встречающееся в природе нуклеотидное основание, такое как уридины или цитидины, модифицированные в 5-положении, например, 5-(2-амино)пропилуридин, 5-бромуридин; аденозины и гуанозины, модифицированные в 8-положении, например, 8-бромгуанозин; деазануклеотиды, например, 7-деазааденозин; O- и N-алкилированные нуклеотиды, например, N6-метиладенозин, являются подходящими. 2ʹ-OH-группа может быть замещена группой, выбираемой из H, OR, R, галогена, SH, SR, NH2, NHR, NR2 или CN, причем R представляет собой C1-C6 алкил, алкенил или алкинил, а галоген представляет собой F, Cl, Br или I. Модифицированные нуклеотиды также включают нуклеотиды, конъюгированные с холестерином через, например, гидроксипролинольную связь. Модификации рибозофосфатного остова могут быть сделаны по ряду причин, например, для увеличения стабильности и полупериода существования таких молекул в физиологических средах, для увеличения диффузии через клеточные мембраны, или в качестве зондов на биочипе. Модификация остова может также повысить устойчивость к деградации, например, в жестких эндоцитозных условиях клеток. Модификация остова может уменьшить клиренс нуклеиновых кислот с помощью гепатоцитов, например, в печени. Можно приготовить смеси встречающихся в природе нуклеиновых кислот и аналогов; альтернативно можно приготовить смеси различных аналогов нуклеиновых кислот и смеси встречающихся в природе нуклеиновых кислот и аналогов.
Функционально связанный
«Функционально связанный, как здесь используется, может означать, что экспрессия гена находится под контролем промотора, с которым он пространственно соединен. Промотор может быть расположен 5ʹ (выше) или 3ʹ (ниже) от гена, находящегося под его контролем. Расстояние между промотором и геном может быть приблизительно таким же, как расстояние между этим промотором и геном, который он контролирует в гене, из которого происходит промотор. Как это известно в данной области техники, изменение этого расстояния может быть обеспечено без утраты функции промотора.
Промотор
«Промотор», как здесь используется, может означать синтетическую молекулу или молекулу природного происхождения, которая способна к обеспечению, активации или увеличению экспрессии нуклеиновой кислоты в клетке. Промотор может включать одну или более специфических, регулирующих транскрипцию последовательностей для дополнительного увеличения экспрессии и/или для изменения пространственной экспрессии и/или временной экспрессии того же. Промотор может также включать дистальный энхансер или элементы-репрессоры, которые могут находиться на расстоянии вплоть до нескольких тысяч пар оснований от места начала транскрипции. Промотор может происходить из источников, включающих вирусы, бактерии, грибы, растения, насекомые и животные. Промотор может регулировать экспрессию компонента гена конститутивно, или дифференциально, учитывая клетку, ткань или орган, в которой имеет место экспрессия, или учитывая стадию развития, на которой имеет место экспрессия, или в ответ на внешние стимулы, такие как физиологические стрессы, патогены, ионы металлов или индукторы. Репрезентативные примеры промоторов включают промотор бактериофага T7, промотор бактериофага T3, промотор SP6, промотор-оператор lac, промотор tac, поздний промотор SV40, ранний промотор SV40, промотор RSV-LTR, промотор IE CMV, промотор 35S CaMV, промотор NOS, промоторы генов белков теплового шока, регулируемыми стероидами промоторы, металл-регулируемые промоторы, специфические для семян промоторы и промоторы убиквитина растений.
Рекомбинантные клетки-хозяева
«Рекомбинантные клетки-хозяева» относятся к клеткам, которые были трансформированы векторами, сконструированными с использованием методов рекомбинантных ДНК.
Селектируемый маркер
«Селектируемый маркер», как здесь используется, может означать любой ген, который придает фенотип являющейся хозяином клетке, ткани, органу, каллусу или организму, в которой(ом) он экспрессируется для облегчения их идентификации и/или отбора тех из них, которые трансфецированы или трансформированы генетической конструкцией. Репрезентативные примеры селектируемых маркеров включают ген устойчивости к ампициллину (AmpR), ген устойчивости к тетрациклину (TcR), бактериальный ген устойчивости к канамицину (KanR), ген устойчивости к зеоцину, ген AURI-C, который придает устойчивость к антибиотику ауреобазидину A, ген устойчивости к фосфинотрицину (Bar), ген неомицин-фосфотрансферазы (nptII), ген устойчивости к гигромицину, ген β-глюкуронидазы (GUS), ген хлорамфеникол-ацетилтрансферазы (CAT), кодирующий зеленый флуоресцентный белок (GFP) ген и ген люциферазы. В некоторых вариантах осуществления этого изобретения селектируемый маркер можно создать в результате модификации эндогенного гена, например, аннулирования рецептора хемокинов, экспрессируемого и представленного на поверхности клетки, когда мутация этого гена приводит к мутации со сдвигом рамки считывания и может быть затем подвергнута негативной селекции с использованием антитела, или, например, мутация W568L в гене ацетолактатсинтазы табака, которая приводит к устойчивости к гербицидам хлорсульфурону и имазаквину.
Жесткие условия гибридизации
«Жесткие условия гибридизации», как здесь используются, означают условия, при которых первая последовательность нуклеиновой кислоты (например, зонд) будет гибридизоваться со второй последовательностью нуклеиновой кислоты (например, мишенью), например, в сложной смеси нуклеиновых кислот. Жесткие условия зависят от последовательности и будут отличаться в различных обстоятельствах. Можно выбрать жесткие условия, которые на приблизительно 5-10°C ниже температуры плавления (Tm) для конкретной последовательности при заданной ионной силе и pH. Tm может быть температурой (при заданной ионной силе, pH и концентрации нуклеиновой кислоты), при которой 50% зондов, комплементарных мишени, гибридизуется с последовательностью мишени при равновесии (поскольку последовательности мишени присутствуют из избытке, при Tm, 50% зондов захвачено при равновесии).
Жесткими условиями могут быть условия, при которых концентрация соли составляет менее чем приблизительно 1,0M иона натрия, например, концентрация, составляющая приблизительно 0,01-1,0M иона натрия (или других солей), при pH 7,0-8,3, а температура составляет по крайней мере приблизительно 30°C в случае коротких зондов (например, приблизительно 10-50 нуклеотидов) и по крайней мере приблизительно 60°C в случае длинных зондов (например, более чем приблизительно 50 нуклеотидов). Жесткие условия можно также получить с помощью добавления дестабилизирующих агентов, таких как формамид. В случае избирательной или специфической гибридизации положительный сигнал может в по крайней мере 2-10 раз превышать фоновую гибридизацию. Приводимые в качестве примера жесткие условия гибридизации включают следующие: 50% формамида, 5x SSC и 1% SDS, инкубация при 42°C, или 5x SSC, 1% SDS, инкубация при 65°C, с отмывкой в 0,2x SSC и 0,1% SDS при 65°C.
Комплементарные
«Комплементарные», как здесь используются, означают, что первая последовательность идентична на по крайней мере 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 97%, 98% или 99% комплементу второй последовательности на протяжении участка из 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100 или более нуклеотидов, или что две последовательности гибридизуются в жестких условиях гибридизации.
По существу идентичные
«По существу идентичные», как здесь используются, означают, что первая и вторая последовательности идентичны на по крайней мере 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 97%, 98% или 99% на протяжении участка из 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100 или более нуклеотидов или аминокислот, или, что качается нуклеиновых кислот, если первая последовательность по существу комплементарна комплементу второй последовательности.
Нуклеиновая кислота-мишень
«Нуклеиновая кислота-мишень» или «последовательность-мишень», как здесь используется, является любой желаемой заданной последовательностью нуклеиновой кислоты, на которую воздействуют, в том числе, но без ограничения, кодирующими или некодирующими последовательностями, экзонами или интронами, регуляторными последовательностями, межгенными последовательностями, синтетическими последовательностями и последовательностями внутриклеточных паразитов. В некоторых вариантах осуществления нуклеиновая кислота-мишень находится в являющейся мишенью клетке, ткани, органе или организме. Нуклеиновая кислота-мишень включает сайт-мишень, который включает один или более нуклеотидов внутри последовательности-мишени, которые являются модифицированными в любой степени с помощью раскрытых здесь способов и композиций. Например, сайт-мишень может включать один нуклеотид. Например, сайт-мишень может включать 1-300 нуклеотидов. Например, сайт-мишень может включать приблизительно 1-100 нуклеотидов. Например, сайт-мишень может включать приблизительно 1-50 нуклеотидов. Например, сайт-мишень может включать приблизительно 1-35 нуклеотидов. В некоторых вариантах осуществления нуклеиновая кислота-мишень может включать более одного сайта-мишени, который может быть идентичным или отличным.
Направленнная функциональная модификация гена
Термины «направленная функциональная модификация гена» и «модификация гена-мишени» предназначены для любого генетического метода, который приводит к постоянному или временному изменению нуклеиновой кислоты-мишени, в том числе, но без ограничения, делеции, вставке, мутации, замене, одноцепочечному разрыву, метилированию, ацетилированию, лигированию, рекомбинации, раскручиванию спирали, химической модификации, мечению, активации, инактивации и репрессии одного или более нуклеотидов в последовательности-мишени.
Терапия
«Терапия», как здесь используется, означает способ лечения заболевания. В некоторых вариантах осуществления терапия включает, но без ограничения, химиотерапию, хирургическую резекцию, трансплантацию и/или химиоэмболизацию.
Трансгенный организм
Этот термин предназначен для организма, содержащего одну или более модификаций гена-мишени в своем геноме, внесенную с помощью раскрытых здесь композиций и способов. Например, модификацию выбирают из вставки, мутации, замены одного или более нуклеотидов, одноцепочечного разрыва, метилирования, ацетилирования, лигирования, рекомбинации, раскручивания спирали, химической модификации, мечения, активации, инактивации и/или репрессии. Организмом может быть организм любого типа, например, человек, животное, растение и т.п.
Транзиторная экспрессия
«Транзиторная экспрессия» или «транзиторно экспрессирующий», как здесь используется, может относиться к транскрипции или трансляции с обеспечиваемой нуклеиновой кислоты в целом или не целом, дифференцированном или недифференцированном, организме, органе, ткани, каллусе или клетке, при этом указанная экспрессия является ограниченной вследствие неинтеграции обеспечиваемой нуклеиновой кислоты в стабильные нуклеиновые кислоты организма, органа, ткани, каллуса или клетки, включающие геном или органелльные нуклеиновые кислоты. Векторы для транзиторной экспрессии включают обеспечиваемые линейные или замкнутые в круг оцДНК, дцДНК или РНК, плазмиды, автономно реплицирующиеся векторы, вирусы, in-vitro транскрипты, T-ДНК, синтетические нуклеиновые кислоты и их модифицированные производные. Таким образом, хотя транзиторная экспрессия является ненаследуемой по определению, вектор может экспрессироваться постоянно в линиях клеток и автономно переноситься от клетки к клетке из-за репликации нуклеиновой кислоты вне хромосомы или органелльного генома.
Лечить
«Лечить» или «лечение», используемый здесь при ссылке на защиту субъекта от состояния, может означать предотвращение, подавление, угнетение или устранение состояния. Предотвращение состояния включает введение субъекту композиции, описанной здесь, до возникновения состояния. Подавление состояния включает введение субъекту композиции после вызова состояния, но до его клинического проявления. Угнетение состояния включает введение субъекту композиции после клинического проявления состояния, так что состояние ослабляется или предотвращается его ухудшение. Устранение состояния включает введение субъекту композиции после клинического проявления состояния, так что субъект более не страдает состоянием.
Вариант
«Вариант», как здесь используется со ссылкой на нуклеиновую кислоту, означает (i) часть нуклеиновой кислоты, на которую ссылаются; (ii) комплемент нуклеотидной последовательности, на которую ссылаются, или ее части; (iii) нуклеиновую кислоту, которая по существу идентична нуклеиновой кислоте, на которую ссылаются, или ее комплементу; или (iv) нуклеиновую кислоту, которая гибридизуется в жестких условиях с нуклеиновой кислотой, на которую ссылаются, ее комплементом или последовательностью, по существу идентичной ей.
Вектор
«Вектор», как здесь используется, означает последовательность нуклеиновой кислоты, используемую с целью доставки нуклеиновой кислоты. Вектор может использоваться в этом изобретении для осуществления генетической трансформации, экспрессии белка, транскрипции РНК или для использования непосредственно в качестве донора для гомологичной рекомбинации или негомологичного соединения концов. Вектором может быть плазмидная ДНК, T-ДНК, вирусная РНК, оцДНК или дцДНК, репликоны, автономно реплицирующиеся векторы, линейная или замкнутая в круг оцДНК, линейная или замкнутая в круг дцДНК, разветвленные продукты полимеразы φ, нуклеиновые кислоты в виде дендримеров, РНК-транскрипт, замкнутая в круг РНК, бактериофаг, бактериальная искусственная хромосома или дрожжевая искусственная хромосома, а в некоторых применениях этого изобретения геномная или органелльная ДНК, перенесенная в клетку-хозяина. Вектором может быть или не реплицирующийся, самореплицирующийся экстрахромосомный вектор или вектор, который интегрируется в геном хозяина.
Дикий тип
Используемый здесь термин последовательность «дикого типа» относится к кодирующей, некодирующей или пограничной последовательности, которая является аллельной формой последовательности, которая выполняет природную или нормальную для этой последовательности функцию. Последовательности дикого типа включают множество аллельных форм родственной последовательности, например, множество аллелей последовательности дикого типа может кодировать молчащие или консервативные замены в последовательности белка, которую кодирует кодирующая последовательность.
В соответствии с некоторыми вариантами осуществления композиция, включающая программируемый молекулярный комплекс, который включает белковый (полипептидный) компонент и относящийся к нуклеиновой кислоте компонент, подвергается самосборке in-vivo в живой клетке, организме, ткани, каллусе, органе или его части в присутствии последовательности(ей) нуклеиновой кислоты-мишени с образованием активных, запрограммированных функциональных молекулярных комплексов.
В соответствии с некоторыми вариантами осуществления можно сконструировать различные запрограммированные молекулярные комплексы, которые постоянно или временно модифицируют существующую или возможную эукариотическую, прокариотическую, синтетическую, относящуюся к внутриклеточному паразиту или вирусную последовательность-мишень, такую как последовательность, обнаруживаемая в геноме, ядре, хромосоме, цитоплазме, органелле, или экстрахромосомная нуклеиновая кислота. Модификация мишени, осуществляемая под действием молекулярного комплекса, включает наследуемые и ненаследуемые, постоянные и временные изменения/модификации. В некоторых вариантах осуществления мишень состоит из нуклеиновой кислоты, связанной с представляющим интерес генетическим признаком, который полезно было бы изменить. Изменения последовательности, подвергнутой направленному воздействию, включают, например, но без ограничения, стабильную делецию, мутацию, вставку нуклеиновых кислот и замену последовательности, подвергнутой направленному воздействию, другой последовательностью нуклеиновой кислоты, нокаут, сдвиг рамки считывания или любое изменение каким-либо образом транскрипции или трансляции гена, регулирующих его последовательностей, генов, регулирующих представляющий интерес ген, или регулирующих последовательностей в регуляторной цепи событий. Постоянные изменения нуклеиновой кислоты-мишени включают, например, корректировку генетического материала или изменения последовательности, такие как мутация, делеция, вставка, замена и рекомбинация в нуклеиновой кислоте. Временные изменения нуклеиновой кислоты-мишени включают, например, связывание, расщепление, одноцепочечный разрыв, раскручивание спирали, активацию, инактивацию, химическую модификацию, метилирование, ацетилирование и мечение нуклеиновой кислоты-мишени. Модификация мишени включает, например, функциональную модификацию мишени, которая может приводить в клетке к изменениям активации транскрипции, инактивации транскрипции, сайленсингу РНК, альтернативному сплайсингу РНК, реконфигурации структуры хроматина, инактивации внутриклеточного паразита и изменения клеточной локализации или компартментализации нуклеиновой кислоты-мишени.
В соответствии с некоторыми вариантами осуществления, и без желания ограничиться какой-либо теорией или механизмом, разработка программируемого молекулярного комплекса основывается на его способности к самосборке, его способности к направленному воздействию на заданную запланированную последовательность в нуклеиновой кислоте-мишени и его способности воздействовать на последовательность-мишень заданным образом. Компоненты комплекса являются модульными и приспосабливаемыми, что быть подходящими для 1) конкретных типов требуемого молекулярного действия, 2) мишени и 3) желаемого способа доставки нуклеиновой кислоты, используемого для ее экспрессии in-vivo. Способы и композиции настоящего изобретения обладают несколькими преимущества по сравнению с другими системами, известными в данной области техники. Например, белковые компоненты комплексы являются неактивными в виде мономеров, и только соответствующее расстояние, в пределах ограниченного диапазона, между двумя олигонуклеотидами SCNA, которые связываются с нуклеиновой кислотой-мишенью в заданной последовательности, будет приводить к такому расположению эффекторных доменов белковых компонентов, что они будут подвергаться димеризации и будут способны к специфическому воздействию на желаемый, заданный сайт-мишень. Такая установка, в соответствии с которой только димеры запрограммированных молекулярных комплексов (т.е. комплекса, который включает белковый компонент, связанный с SCNA, которая связывается с нуклеиновой кислотой-мишенью), уменьшает или полностью устраняет потенциальное расщепление вне сайта или неспецифическое расщепление, поскольку сам белковый компонент не связывается с нуклеиновой кислотой-мишенью и не функционирует в виде мономера.
В соответствии с некоторыми вариантами осуществления конструируется активная часть (функциональный домен) молекулярного комплекса, который активируется только после димеризации функционального домена белкового компонента. Конструируется незапрограммированный белковый компонент, который практически не обладает или обладает низким неспецифическим сродством к последовательности нуклеиновой кислоты и к сайту-мишени. Таким образом, хотя в случае всех типов модификаций необходимо экспрессировать один тип мономера белкового компонента, для минимальных действий точечных модификаций, таких как, например, точечная мутация, опосредованная нуклеазным доменом, или в альтернативном случае точечное метилирование, опосредованное метилазным доменом, должны присутствовать две SCNA, которые предназначены для связывания с последовательностями, фланкирующими сайт-мишень, чтобы влиять на соответствующее расстояние между белками и допустить и их связывание, и их димеризацию друг с другом. Это преимущественно увеличивает специфичность комплекса в отношении последовательности. В некоторых вариантах осуществления для корректировки действий делетирования и замены может потребоваться расщепление одновременно двух различных сайтов, фланкирующих представляющий интерес участок. В таком варианте осуществления, даже в этом случае необходимо экспрессировать только один экзогенный белковый компонент вместе с четырьмя SCNA. Когда олигонуклеотиды истощаются, или в результате разведения, или в результате деградации, незапрограммированный экспрессированный белок не обладает сродством к нуклеиновой кислоте-мишени и будет прекращать воздействовать на нее (т.е. в этом случае прекращать расщепление нуклеиновой кислоты-мишени).
В соответствии с некоторыми вариантами осуществления белковый (полипептидный) компонент можно экспрессировать в виде отдельных полипептидов или в виде одного непрерывного белка (полипептида). В некоторых вариантах осуществления белковый компонент (составляющая) может иметь один или более идентифицируемых доменов, идентифицируемых в соответствии со структурой и/или функцией (применимостью). В некоторых вариантах осуществления один структурный домен может иметь более одного домена применимости, т.е. выделяемый структурный домен может обладать несколькими функциями. В соответствии с некоторыми вариантами осуществления белковый компонент может включать один или более следующих структурных доменов и/или доменов применимости: a) «эффекторный домен» (функциональный домен), который может взаимодействовать с нуклеиновой кислотой-мишенью и в результате оказывать воздействие на нее; и/или b) «связующий домен», которые может непосредственно или опосредованно специфически связываться с SCNA; и/или c) «домен клеточной локализации»; и/или d) междоменные соединители или спейсеры; и любую их комбинацию.
В соответствии с некоторыми вариантами осуществления «эффекторный домен» (также называемый здесь «функциональным доменом») взаимодействует с нуклеиновой кислотой-мишенью после сборки молекулярного комплекса и оказывает запланированный эффект на последовательность-мишень. В некоторых, приводимых в качестве примера вариантах осуществления этот домен обладает ферментативной или каталитической функцией, включая модифицирующую нуклеиновую кислоту активность. В некоторых вариантах осуществления этот домен может происходить из активных доменов, происходящих из целых, или частей, или модифицированных частей белков с известной функцией, таких как ДНК-связывающий белок, нуклеаза, метилаза, связывающийся с метилированной ДНК фактор, фактор транскрипции, фактор реконструкции хроматина, полимераза, деметилаза, ацетилаза, деацетилаза, киназа, фосфатаза, интеграза, рекомбиназа, лигаза, топоизомераза, гираза и хеликаза. В некоторых вариантах осуществления функциональный домен можно сконструировать посредством слияния аминокислотной последовательности(ей) активных доменов, происходящих из целых, или частей, или модифицированных частей белков с известной функцией, таких как ДНК-связывающий белок, нуклеаза, метилаза, связывающийся с метилированной ДНК фактор, фактор транскрипции, фактор реконструкции хроматина, полимераза, деметилаза, ацетилаза, деацетилаза, киназа, фосфатаза, интеграза, рекомбиназа, лигаза, топоизомераза, гираза и хеликаза. В некоторых вариантах осуществления в случае эффекторного домена, который является нуклеазой или происходить из нее, ДНК-связывающий домен распознавания нуклеазы может быть удален. Например, когда эффекторный домен происходит из нуклеазы FokI, домены распознавания сайта для FokI и связывания с ним отсутствуют в эффекторном домене белкового компонента. В некоторых вариантах осуществления эффекторный домен лишен сайта специфического связывания нуклеиновой кислоты-мишени, т.е. он не может специфически связываться со специфической последовательностью-мишенью.
В соответствии с некоторыми вариантами осуществления «связующий домен» предназначен для непосредственного или опосредованного связывания/присоединения SCNA (и в особенности участка распознавания в SCNA). Связывание/присоединение между связующим доменом и SCNA может быть прямым или непрямым через, например, модификацию SCNA. Присоединение/связывание/соединение между связующим доменом и SCNA делает возможным in vivo сборку SCNA с белковым компонентом. В некоторых вариантах осуществления связующий домен конструируют посредством слияния аминокислотной последовательности белкового компонента с аминокислотами, включающими домен, который специфически связывается с нуклеотидной последовательностью или химическим или биологическим элементом в придающей специфичность нуклеиновой кислоте. Физическое взаимодействие между связующим доменом и придающей специфичность нуклеиновой кислотой может быть обусловлено, но без ограничения, аффинностью вследствие одного или более из следующих типов взаимодействий: взаимодействий лиганд-рецептор, лиганд-субстрат, водородных связей, сил Ван-дер-Ваальса, ковалентных связей, образуемых in-vivo, ионных связей и гидрофобного взаимодействия. Примеры нековалентного связывания включает одно или более, или фрагменты или части или модифицированные формы, из следующего: примеры пар партнеров по связыванию: биотин-авидин; биотин-стрептавидин; биотин-модифицированные формы авидина; белок-белок; нуклеиновая кислота-белок; лиганд-рецептор; субстрат-лиганд; антиген-антиген; антиген-одноцепочечное антитело; гаптен-антитело или одноцепочечное антитело; гормон-связывающийся с гормоном белок; агонист-рецептор; антагонист рецептора-рецептор; белок А-IgG; кофактор фермента-фермент; ингибитор фермента-фермент; одноцепочечная ДНК-VirE2; дцДНК-StickyC; РНК-белок семейства Argonaute; дцРНК-белок семейства РНазыIII; нуклеиновая кислота-белок оболочки вируса и VirD2 Agrobacterium или его часть - связывающийся с VirD2 белок; и любых их вариантов, в соответствии с чем каждая придающая специфичность нуклеиновая кислота и каждый связующий домен включает один из членов пары. В приводимом в качестве примера варианте осуществления связующий домен содержит одноцепочечный Fv-фрагмент антитела, способный к связыванию с красителем флуоресцеином, который в свою очередь химически связан через линкер с 5ʹ-концом или 3ʹ-концом придающей специфичность нуклеиновой кислоты, таким образом создавая возможность для ассоциации белкового компонента с относящимся к нуклеиновой кислоте компонентом программируемого комплекса. В некоторых вариантах осуществления связующий домен происходит из восьмого тройного спирального повтора PUF5-связывающего элемента C. elegans, а придающая специфичность нуклеиновая кислота (SCNA) содержит последовательность РНК, представленную в SEQ ID NO: 1 (CUCUGUAUCUUGU), на одном из ее концов или достаточно близко от него. В этом варианте осуществления белок и SCNA непосредственно объединяются без необходимости в химической модификации SCNA, что делает возможным ее биосинтез in-vivo в виде транскрипта и, таким образом, делает возможной in-vivo ассоциацию белкового компонента и относящегося к нуклеиновой кислоте компонента программируемого комплекса. В некоторых, приводимых в качестве примера вариантах осуществления последовательность/молекула РНК, способная к образованию вторичных или третичных структур (таких как петля «шпилька»), находящаяся в SCNA, взаимодействует со связующим доменом белкового компонента, который представляет собой связующий домен, который связывается с РНК-мотивом, происходящий из белков TAT вирусов (таких как ВИЧ, бычий вирус иммунодефицита т.п.). В некоторых, приводимых в качестве примера вариантах осуществления 20-нуклеотидная связывающаяся последовательность шпильки РНК бокса-B из бактериофага φ21 находится в SCNA и способна к связыванию/присоединению своего партнера - связующего домена белкового компонента, который происходит из РНК-связывающего белка (RBP) - N-белка бактериофага φ21. В другом, приводимом в качестве примера варианте осуществления, который позволяет продуцировать SCNA in-vivo, связующий домен происходит из белка, который связывается с белком VirD2 Agrobacterium, включая VirD2-связывающие белки, обнаруживаемые в бактериях, включая VBP1, VBP2 и VBP3 и искусственные одноцепочечные антитела, предназначенные для связывания с VirD2. В этом варианте осуществления SCNA продуцируется в виде оцДНК из T-ДНК в Agrobacterium, где она ковалентно связывается на своем 5ʹ-конце с тирозином 29 VirD2, который необходим для ковалентной связи, в соответствии с чем ковалентная связь возникает in-vivo. Катализ происходит в бактерии, и комплекс впоследствии экспортируется из бактерии благодаря бактериальной системе секреции в эукариотическую клетку, включая клетки целого или не целого растения, животного и человека, их ткани, каллусы и органы. В этом варианте осуществления VirD2-связывающий домен в связующем домене связывается с белком VirD2, прикрепленным к SCNA, что делает возможной ассоциацию белкового компонента и относящегося к нуклеиновой кислоте компонента программируемого комплекса. В этом варианте осуществления можно было бы разработать модификации VirD2, экспрессируемого в бактерии, которые могли бы уменьшить интеграцию ДНК и могли бы принести пользу во избежание неспецифической интеграции ДНК. Примеры ковалентной связи, образуемой in vivo в организме-мишени, включают, соответственно, в участке распознавания в SCNA и связующем домене, один или более, фрагментов или частей или модифицированных форм, но без ограничения, из следующих примеров пар партнеров по связыванию, спаренных с помощью символа - тире: последовательность RB T-ДНК GTTTACCCGCCAATATATCCTGTCA (SEQ ID NO: 2) - VirD2 Agrobacterium; РНК пикорнавирусов - VPg; ДНК - топоизомераза; происходящая из фага φX174 последовательность в оцДНК - белок А фага φX174 или белок A* φX, и т.п. В одном приводимом в качестве примера варианте осуществления такого in-vivo присоединения SCNA к связующему домену, синтетический олигонуклеотид-оцДНК, содержащий последовательность RB на своем 5ʹ-конце или вблизи него, доставляют в клетку, где она встречается с белковым компонентом. Белок содержит часть VirD2, способную к расщеплению последовательности RB, и впоследствии связывается с остальной частью олигонуклеотида, содержащей последовательность TCA на своем 5ʹ-конце, соответствующий спейсер и последовательность, подвергающуюся спариванию оснований с мишенью, таким образом эффективно «программируя» молекулярный комплекс in-vivo. В некоторых вариантах осуществления связующий домен лишен сайта специфического связывания нуклеиновой кислоты-мишени, т.е. он не может специфически связываться со специфической последовательностью-мишенью.
В соответствии с некоторыми вариантами осуществления «домен клеточной локализации», который может отнести белковый компонент или запрограммированный белковый компонент или собранный комплекс к определенному клеточному или субклеточному местоположению, может необязательно быть частью белкового компонента. Домен клеточной локализации можно сконструировать посредством слияния аминокислотной последовательности белкового компонента с аминокислотами, включающими домен, включающий сигнал ядерной локализации (NLS); митохондриальную лидерную последовательность (MLS); хлоропластную лидерную последовательность и/или последовательности, предназначенные для переноса или вывода или отнесения белка в содержащую нуклеиновую кислоту органеллу, клеточный компартмент или любое подразделение клетки. В некоторых, приводимых в качестве примера вариантах осуществления организм является эукариотическим, и домен клеточной локализации включает домен ядерной локализации (NLS), который делает возможным проход белка в ядро и геномную ДНК в нем. Последовательность указанного NLS может включать любую функциональную, положительно заряженную последовательность NLS, включая, например, последовательность SV40NLS - PKKKRKV (SEQ ID NO: 3). В другом, приводимом в качестве примера варианте осуществления этот домен состоит из лидерной последовательности, создающей возможность для ввода белкового компонента или запрограммированного нуклеопротеина в органеллу, что создает возможность для желаемой модификации органелльной ДНК с помощью этого комплекса. В другом, приводимом в качестве примера варианте осуществления последовательность, происходящая из дрожжевого митохондриального Cox4p (MLSLRQSIRFFKPATRTLCSSRYLL (SEQ ID NO: 4)), или последовательность, происходящая из митохондриальной лидерной последовательность (MLS) малатдегидрогеназы человека (MLSALARPASAALRRSFSTSAQNNAKVAVLGAS (SEQ ID NO: 5)) или происходящая из синтазы липоевой кислоты Arabidopsis (NCBI Ref. Seq. ID: NP 179682.1, обозначенная здесь как SEQ ID NO: 6: MHSRSALLYRFLRPASRCFSSSS), может использоваться для локализации комплекса в митохондриальном матриксе для модификации митохондриальной ДНК. Одно применение этой заявки может включать лечение наследуемых по материнской линии дефектов митохондриальной ДНК у различных эукариот, таких как синдром хронической прогрессирующей внешней офтальмоплегии у людей. Другим примером является индукция дефектов для вызова мужской стерильности у растений, используемых для создания гибридных растений. В одном варианте осуществления митохондриальная мишень представляет собой АТФазу и воспроизводит функцию локуса pcf в Petunia.
В соответствии с дальнейшими вариантами осуществления необязательные различные междоменные соединители или спейсеры разработаны для допуска желаемого действия комплекса, служа в качестве молекулярных адаптеров или шарниров. Квалифицированные в данной области техники специалисты могут предвидеть множество таких соединителей. Выбор соединителя может влиять на специфичность запрограммированного молекулярного комплекса, оказывая влияние на зону нуклеиновой кислоты-мишени в радиусе действия активного центра функционального домена. В одном, приводимом в качестве примера варианте осуществления Cʹ связующего домена и Nʹ функционального домена нежестко соединяют с помощью аминокислот GGSGG (SEQ ID NO: 7), охватывающих приблизительно 15 ангстрем. В другом варианте осуществления используют жесткий α-спиральный линкер с аминокислотами NIHHVTWHMDFP (SEQ ID NO: 8), охватывающими приблизительно 16 ангстрем. В другом варианте осуществления используют жесткий спиральный линкер с аминокислотами PNSLIVP (SEQ ID NO: 9), охватывающими приблизительно 16,88 ангстрем. В другом варианте осуществления используют беспорядочно скрученный линкер с аминокислотами TGLDSP (SEQ ID NO: 10), охватывающими приблизительно 15,55 ангстрем. Дополнительные аминокислоты, кодируемые сайтами для рестриктаз, могут быть добавлены в междоменный соединитель для облегчения замены белковых модулей (например, GSLE (SEQ ID NO: 11), кодирующие BamHI/XhoI).
В соответствии с некоторыми вариантами осуществления относящийся к нуклеиновой кислоте компонент молекулярного комплекса, называемый здесь «придающей специфичность нуклеиновой кислотой» (SCNA) или «программирующей нуклеиновой кислотой», включает одну или более частей (участков) и функций. Одна часть (участок) определяет участок-мишень, подвергаемый воздействию, и содержит определяющую специфичность последовательность. Определяющая специфичность последовательность в SCNA определяет ее специфичность в отношении нуклеиновой кислоты-мишени посредством спаривании оснований. В результате этого спаривания может образовываться, например, но без ограничения, полная или частичная двойная спираль, полная или частичная тройная спираль, D-петли и разветвленные формы, и это спаривание может быть результатом образования водородных связей или хугстиновских водородных связей или их комбинаций. В некоторых вариантах осуществления определяющая специфичность последовательность способна к взаимодействию с нуклеиновыми кислотами-мишенями, в участках, которые находятся вблизи сайта-мишени или фланкируют его. В некоторых вариантах осуществления определяющая специфичность последовательность SCNA не связывается/не взаимодействует с сайтом-мишенью. В некоторых вариантах осуществления определяющая специфичность последовательность может включать любое число нуклеотидов. Например, длина определяющей специфичность последовательности может составлять приблизительно 3-200 нуклеотидов. Например, длина определяющей специфичность последовательности может составлять приблизительно 10-100 нуклеотидов. Например, длина определяющей специфичность последовательности может составлять приблизительно 15-50 нуклеотидов. Например, длина определяющей специфичность последовательности может превышать приблизительно 18 нуклеотидов.
В соответствии с некоторыми вариантами осуществления второй частью SCNA является участок (часть) распознавания, который представляет собой участок, который может специфически связывать/присоединять/распознавать связующий домен белкового компонента. В некоторых вариантах осуществления этот участок распознавания может быть и/или включать модификацию(ей) или последовательность(ью) распознавания связующего домена (также называемой здесь нуклеотидным мотивом SCNA или связывающейся со связующим доменом нуклеотидной последовательностью SCNA). Участок распознавания может быть неотъемлемой частью или может быть связанным (например, ковалентно) с определяющей специфичность последовательностью, и может состоять из последовательности или модификации, которая делает возможным связывание SCNA со связующим доменом белкового компонента, как детализировано выше.
В некоторых вариантах осуществления в состав SCNA входят, но без ограничения, молекулы следующих типов: одноцепочечная ДНК, одноцепочечная РНК, двухцепочечная РНК, модифицированная ДНК, модифицированная РНК, закрытая нуклеиновая кислота (LNA), пептидо-нуклеиновая кислота (PNA) и любые их комбинации. В некоторых вариантах осуществления SCNA может, кроме того, включать, одну или множество модификаций, которые могут увеличить ее стабильность, увеличить ее специфичность в отношении мишени, изменить ее сродство к нуклеиновым кислотам и/или сделать возможным ее связывание со связующим доменом комплекса. Модификации могут располагаться на ее 5ʹ-конце, ее 3ʹ-конце, в виде спейсеров и/или внутри SCNA. Приводимые в качестве примера модификации включают, но без ограничения, модификации нуклеотидов, биотин, флуоресцеин, аминолинкеры, олигопептиды, аминоаллил, молекулу красителя, флуорофоры, дигоксигенин, акридит, аденилирование, азид, NHS-эфир, холестерил-TEG, алкины, фоторазрушаемый биотин, тиол, дитиол, модифицированные основания, фосфат, 2-аминопурин, Тример-20, 2,6-диаминопурин, 5-бромдезоксиуридин, дезоксиуридин, инвертированный dT, дидезоксинуклеотиды, 5-метилдезоксицитидин, дезоксиинозин, 5-нитроиндол, 2-О-метил-РНК-основания, изо-dC, изо-dG, фтор-модифицированные основания, фосфоротиоатные связи и белок VirD2 Agrobacterium и части указанного VirD2 и модификации VirD2.
В соответствии с некоторыми вариантами осуществления SCNA может, кроме того, включать необязательную спейсерную последовательности, которая может использоваться для оптимизации молекулярных расстояний и степеней свободы, необходимых для объединения связующего домена и нуклеиновой кислоты-мишени. В некоторых вариантах осуществления длина спейсерной последовательности может составлять приблизительно 0-100 нуклеотидов. Например, длина спейсера может составлять приблизительно 0-6 нуклеотидов.
В соответствии с некоторыми вариантами осуществления SCNA можно создать химически и/или биологически, in-vitro и in-vivo, а модификация может быть предсинтезированной или добавленной после синтеза. В некоторых приводимых в качестве примера вариантах осуществления SCNA создана химически и состоит из фосфоротиоат-модифицированной оцДНК, которая модифицирована на одном из ее концов посредством присоединения молекулы красителя C6-флуоресцеина. Эту SCNA, следовательно, доставляют в клетку (например, с помощью бомбардировки частицами, трансфекции с использованием полиэтиленгликоля, липосом, вирусных частиц, карборундных нитевидных кристаллов и/или электропорации), где она встречается с белковым компонентом молекулярного комплекса, который включает связующий домен, включающий одноцепочечный Fv-фрагмент антитела, способный к связыванию красителя флуоресцеина, таким образом программируя молекулярный комплекс и доставляя/направляя комплекс к запланированной для него нуклеотидной последовательности-мишени. В соответствии с некоторыми вариантами осуществления SCNA не связывается/не взаимодействует с сайтом-мишенью.
Теперь ссылаются на фиг. 1A-B, которые представляют собой схематические рисунки (масштаб не выдержан), на которых представлены элементы/компоненты программируемого молекулярного комплекса, в соответствии с некоторыми вариантами осуществления. На схематических рисунках (масштаб не выдержан) фиг. 1A-B представлена молекула программируемого белкового компонента в виде мономера и две молекулы придающих специфичность нуклеиновых кислот (SCNA). Как показано на фиг. 1A-B, белковым компонентом является полипептид (цепь аминокислот), скомпонованный в несколько структурных/функциональных доменов: связующий домен (LD), функциональный или эффекторный домен (FD); необязательный домен клеточной локализации (CLD) и необязательный междоменный соединитель(и) (IDC), каждый из которых определен по его роли в молекулярном комплексе. Функцией связующего домена является связывание с SCNA. Функцией эффекторного домена является взаимодействие с нуклеиновой кислотой-мишенью и структурная модификация сайта-мишени и/или модификация его функции и/или функции всей нуклеиновой кислоты-мишени. Функцией необязательного домена клеточной локализации является отнесение белкового комплекса к тому же клеточному или субклеточному компартменту, что и компартмент, в котором находится нуклеиновая кислота-мишень. Функцией необязательных междоменных соединителей является допуск оптимальных молекулярных расстояний и степеней свободы между доменами для соответствующего функционирования комплекса. SCNA состоят из нуклеотидной цепи или модифицированной нуклеотидной цепи (в форме гребня) и включают модификацию, предпочтительно на одном из ее концов, (представленную на фиг. 1A в виде черного овала) для связывания с белковым компонентом, или последовательность, (называемую нуклеотидным мотивом SCNA или связывающейся со связующим доменом нуклеотидной последовательностью, или последовательностью или сегментом распознавания связующего домена, которая представлена на фиг. 1B, помеченный стрелкой гребень), которая может связываться со связующим доменом белкового компонента. В неограничивающем примере, представленном на фиг. 1A-B, определяющая специфичность часть SCNA является одноцепочечной. В некоторых вариантах осуществления SCNA может образовывать двухцепочечные сегменты/участки (в результате самоотжига, например, образуя петли шпильки). Специфичность SCNA в отношении заданной последовательности нуклеиновой кислоты-мишени достигается благодаря участку подвергаемых спариванию оснований нуклеиновых кислот или модифицированных нуклеиновых кислот (спариванию оснований с нуклеиновой кислотой-мишенью, в форме гребня), также называемому вариабельной последовательностью, который может включать любое число нуклеотидов, например, 3-200 нуклеотидов, или любые их диапазоны. Например, длина может составлять 10-100 нуклеотидов. Например, длина может составлять по крайней мере 18 нуклеотидов. Может присутствовать необязательные последовательности спейсеров (спейсерная последовательность, в форме гребня) для оптимизации молекулярных расстояний и степеней свободы, необходимых для объединения связующего домена и нуклеиновой кислоты-мишени. В некоторых вариантах осуществления длина спейсерных последовательностей может составлять приблизительно 0-100 нуклеотидов. Например, длина спейсера может составлять приблизительно 0-6 нуклеотидов. Действие или эффект функционального домена белкового компонента, которое возникает после связывания с SCNA связующего домена и димеризации и его последующей колокализации на нуклеиновой кислоте-мишени, изображено в виде символа молнии («Действие/Эффект»).
Теперь ссылаются на фиг. 2A-B, которые представляют собой схематические рисунки, на которых представлена сборка программируемого молекулярного комплекса, в соответствии с некоторыми вариантами осуществления. На схематических рисунках (масштаб не выдержан) фиг. 2А-В представлен способ сборки компонентов программируемого молекулярного комплекса на нуклеиновой кислоте-мишени. В примере, представленном на фиг. 2A-B, два мономера белка связываются с двумя различными SCNA, при этом каждая из них имеет отличную детерминанту специфичности в своем вариабельном участке последовательности. Эти SCNA подвергаются спариванию оснований и связываются с заданными гомологичными последовательностями в нуклеиновой кислоте-мишени (помеченной на фигурах как «нуклеиновая кислота-мишень»). В результате этого спаривания оснований может образоваться двойная или тройная спираль с нуклеиновой кислотой-мишенью, в зависимости от того, является мишень двух- или одноцепочечной (представлена на этих фигурах в виде дцДНК). Обе SCNA могут связываться или с одной и той же цепью, или с противоположными цепями, в соответствии с требованием, на оптимизированном расстоянии. SCNA могут связываться с белковым связующим доменом благодаря модификации на их конце (фиг. 2A) или благодаря нуклеотидному мотиву SCNA (фиг. 2B). После сборки функциональный домен оказывает свой эффект на заданный сайт-мишень (помеченной как «сайт-мишень») в нуклеиновой кислоте-мишени.
Теперь ссылаются на фиг. 3, на которой представлен с использованием пространственного моделирования пример молекулярного комплекса, разработанного для расщепления заданной ядерной последовательность дцДНК-мишени, в соответствии с некоторыми вариантами осуществления. Запрограммированный, подвергнутый димеризации белковый компонент представлен в связи с являющейся его мишенью дцДНК (A, представленной частично). Каждый мономер белкового компонента состоит из функционального домена, происходящего из субъединицы нуклеазы FokI (B); домена клеточной локализации, происходящего из SV40NLS (C); связующего домена, происходящего из одноцепочечного Fv-фрагмента антитела против флуоресцеина (анти-FAM ScFV, D), и междоменного соединителя (E). Показано, что каждый связующий домен (D) связан с придающей специфичность нуклеиновой кислотой, SCNA оцДНК (F, представленной частично) через ее модификатор - молекулу 6-карбокси-флуоресцеина (G), который ковалентно связан с концом каждой SCNA. Предполагаемые сайты расщепления (сайт-мишень) дцДНК-мишени (представленные в виде шаров в спиральном остове) помечены стрелками 300A-B. Каждая SCNA изображена здесь в виде образующей частичную тройную спираль, занимающую большую бороздку фланкирующей мишень последовательности дцДНК.
Теперь ссылаются на фиг. 4A-B, которые представляют собой схематические рисунки (масштаб не выдержан) приводимого в качестве примера способа сборки компонентов программируемого молекулярного комплекса на нуклеиновой кислоте-мишени, в соответствии с некоторыми вариантами. Как показано в неограничивающих примерах, представленных на фиг. 4A-B, два мономера белкового компонента связывают две различные SCNA (SCNA1, SCNA2), при этом каждая из них имеет отличную детерминанту специфичности в вариабельном участке последовательности. Как показано на фигурах, обе SCNA находятся в одной нуклеиновой кислоте и соединены с помощью последовательности с неопределенной последовательностью или длиной, которая не подвергается спариванию оснований с мишенью, называемой здесь «соединителем SCNA». Соединитель SCNA может включать любую последовательность нуклеотидов, любой длины (X(n)). В некоторых вариантах осуществления X(n) означает неопределенную длину РНК-нуклеотидов, соединяющих два придающих специфичность участка друг с другом. В некоторых вариантах осуществления, в случае линейной ДНК, вероятная оптимальная длина (n) составляет приблизительно, например, 10-100 нуклеотидов. Например, длина составляет приблизительно 35-73 нуклеотидов. Например, длина превышает приблизительно 70 нуклеотидов. Например, длина меньше, чем приблизительно 35 нуклеотидов. Эти SCNA подвергаются спариванию оснований и связываются с заданными гомологичными (соответствующими) последовательностями в нуклеиновой кислоте-мишени. В результате этого спаривания оснований может образоваться двойная или тройная спираль с нуклеиновой кислотой-мишенью, в зависимости от того, является мишень двух- или одноцепочечной (в примере, представленном на фиг. 4А-В, дцДНК). В некоторых вариантах осуществления обе SCNA могут связываться или с одной и той же цепью, или с противоположными цепями нуклеиновой кислоты-мишени в соответствии с требованием, на расстоянии, оптимизированном для достижения желаемого результата. В некоторых вариантах осуществления только одна нуклеиновая кислота, содержащая сдвоенные, соединенные SCNA, необходима для нацеливания на сайт-мишень, располагаясь по обе стороны от обоих концов сайта-мишени. В некоторых вариантах осуществления SCNA могут связываться с сайтом связывания связующего домена (углублением в связующем домене) белкового компонента благодаря нуклеотидным мотивам SCNA в обеих SCNA (помеченным в виде гребней в сайте связывания связующего домена, фиг. 4А) или благодаря модификации на обоих концах (черные овалы в сайте связывания связующего домена, фиг. 4В). После сборки функциональный домен может оказывать свой эффект на сайт-мишень в нуклеиновой кислоте-мишени.
В соответствии с некоторыми вариантами осуществления способы доставки SCNA в организм или клетку включают множество способов, известных квалифицированным в данной области техники специалистам, и являются, как правило, способами, оптимальными для типа организма или клетки, используемого в соответствующем случае. Они могут включать доставку нуклеиновой кислоты с помощью биологических методов: инфицирования, используя автономно реплицирующиеся векторы, инфицирования или трансдукции трансгенными вирусами, включая использование разрушенных или неполных вирусов, инокуляции, доставки Т-ДНК Agrobacterium, селекции, скрещивания, пересадки, переноса органеллы, переноса хромосомы, слияния клеток; методов поглощения с использованием химических веществ: использования агентов для трансфекции, DEAE-декстрана, фосфата кальция, искусственных липидов, дендримеров, полимеров (ПЭГ и т.д.), белков/пептидов, вирусоподобных частиц; механических методов: бомбардировки, инъекции/микроинъекции, вдавливания, нитевидных кристаллов; и электрического метода электропорации, и любого метода, который изменяет клеточную плазматическую мембрану, позволяя нуклеиновым кислотам активно или пассивно поступать в клетку.
В соответствии с некоторыми вариантами осуществления способы доставки нуклеиновой кислоты, кодирующей белковый модуль, в организм или клетку включают множество способов, известных квалифицированным в данной области техники специалистам, и являются, как правило, способами, оптимальными для типа организма или клетки, используемого в соответствующем случае. Они могут включать доставку нуклеиновой кислоты посредством скрещивания организма с трансгенным организмом, содержащим ген, или с помощью биологических методов: инфицирования, используя автономно реплицирующиеся векторы, инфицирования или трансдукции трансгенными вирусами, включая использование разрушенных или неполных вирусов, инокуляции, доставки Т-ДНК Agrobacterium, пересадки, переноса органеллы, переноса хромосомы, слияния клеток; методов поглощения с использованием химических веществ: использования агентов для трансфекции, DEAE-декстрана, фосфата кальция, искусственных липидов, дендримеров, полимеров (ПЭГ и т.д.), белков/пептидов, вирусоподобных частиц; механических методов: бомбардировки, инъекции/микроинъекции, вдавливания, нитевидных кристаллов; и электрического метода электропорации, и любого метода, который изменяет клеточную плазматическую мембрану, позволяя нуклеиновым кислотам активно или пассивно поступать в клетку.
В соответствии с некоторыми вариантами осуществления способы доставки «донорной ДНК», в подгруппе применений, при которых требуется такая ДНК, включающей вставку гена или замену гена, включают методы, схожие с теми, которые описаны для доставки нуклеиновой кислоты, которая кодирует белковый модуль. Эта ДНК может быть или одноцепочечной, двухцепочечной, или частично двухцепочечной, линейной или замкнутой в круг. Эта ДНК может доставляться в одном векторе или в нескольких векторах, вместе или отдельно от нуклеиновой кислоты, кодирующей белковый компонент молекулярного комплекса, и от определяющей специфичность, программирующей нуклеиновой кислоты. Таким образом, нуклеиновые кислоты могут доставляться, выбирая из соответствующих вышеупомянутых методов доставки, в растение или часть растения, в ткань или орган растения, такой как зародыш, пыльца, яйцеклетка, пыльник, рыльце, целый цветок, семядоля, листок, корень, стебель, черешок, в изолированные клетки растения, такие как протопласты, или в дифференцированные или недифференцированные ткань, каллус или клетки растения. В некоторых вариантах осуществления нуклеиновые кислоты могут доставляться в гриб, включая одноклеточные и многоклеточные грибы, и член царства животных, включая беспозвоночных (таких как членистоногие и круглые черви), позвоночных (таких как птицы, рыбы, млекопитающие, пресмыкающиеся и земноводные), и части этих организмов, в том числе органы, культивируемые органы, ткани, культивируемые ткани, изолированные клетки, культуры клеток, линии клеток и стволовые клетки, такие как эмбриональные стволовые клетки человека или гемопоэтические стволовые клетки человека.
Теперь ссылаются на фиг. 5, которая представляет собой схематическую иллюстрацию, демонстрирующую возможные варианты доставки программируемого молекулярного комплекса в клетку, используя in-vitro полученные SCNA, в соответствии с некоторыми вариантами осуществления. Представлена общая схема для выбора соответствующего метода доставки. Молекулу нуклеиновой кислоту, кодирующую белковый компонент, выбирают из левого столбца и доставляют, используя подходящие методы, выбираемые из следующих двух столбцов. Синтетическую SCNA доставляют посредством методов, выбираемых из тех, которые представлены в двух правых столбцах. Внутри клетки-мишени нуклеиновая кислота, кодирующая белок, осуществляет экспрессию белка в результате его трансляции in-vivo с молекулы РНК-матрицы. Если доставленная молекула нуклеиновой кислоты состоит из дцРНК, она может сначала транскрибироваться в РНК (с использованием намеченного промотора). Если доставленная молекула нуклеиновой кислоты состоит из оцДНК, она может сначала дополняться до дцДНК, а затем транскрибироваться. Если доставленная молекула нуклеиновой кислоты состоит из РНК, например, РНК, кодирующей вирус, или другого автономно реплицирующегося вектора, она может проходить через репликацию через «минус»-цепь до трансляции. Транслированный белок может затем локализоваться в желаемом субклеточном компартменте, в соответствии с его сигналом локализации (в случае его присутствия). SCNA могут доставляться одновременно или отдельно от молекулы нуклеиновой кислоты, кодирующей белковый компонент, с помощью того же или отличного метода доставки. После колокализации SCNA, белкового компонента и нуклеиновой кислоты-мишени в клетке, они могут собираться с образованием активного молекулярного димерного комплекса. Донорная ДНК, в соответствии с требованиями, может также доставляться отдельно или одновременно.
Теперь ссылаются на фиг. 6, которая является общей схемой, демонстрирующей доставку программируемого молекулярного комплекса в клетку, используя in-vivo продуцируемую SCNA, в соответствии с некоторыми вариантами осуществления. Молекулу нуклеиновой кислоту, кодирующую белковый компонент, выбирают из левого столбца и доставляют, используя подходящие методы, выбираемые из следующих трех столбцов. In-vivo продуцируемые SCNA кодируются молекулой нуклеиновой кислоты, предусмотренной для этой цепи и введенной в клетку, используя эти же методы. Молекулы нуклеиновых кислот, кодирующие белковый компонент и/или SCNA, могут доставляться по отдельности или одновременно. В клетке нуклеиновая кислота, кодирующая SCNA, экспрессирует SCNA в результате транскрипции и расщепления нуклеиновой кислоты. Если доставленная молекула нуклеиновой кислоты состоит из дцРНК, она может сначала транскрибироваться в РНК с использованием намеченного промотора. Если доставленная молекула нуклеиновой кислоты состоит из оцДНК, она может сначала дополняться до дцДНК, а затем транскрибироваться. Если доставленная молекула нуклеиновой кислоты состоит из РНК, например, РНК, кодирующей вирус, или другого автономно реплицирующегося вектора, она может проходить через репликацию через «минус»-цепь. Внутри клетки нуклеиновая кислота, кодирующая белок, экспрессируется через его трансляцию in-vivo с молекулы РНК, продуцированной способом, схожим с таковым, описанным для SCNA. Транслированный белок может затем локализоваться в желаемом субклеточном компартменте, в соответствии с его сигналом локализации (в случае его присутствия). Молекулы нуклеиновых кислот, кодирующие белковый компонент, и/или молекулы нуклеиновых кислот, кодирующие SCNA, могут доставляться одновременно (в одно и то же время) или по отдельности, с использованием одинаковых или различных методов доставки. После колокализации SCNA, белкового компонента и нуклеиновой кислоты-мишени в клетке, они могут собираться с образованием активного молекулярного димерного комплекса. Донорная ДНК, в соответствии с требованиями, может также доставляться отдельно или одновременно.
В соответствии с некоторыми вариантами осуществления биологический синтез in-vivo SCNA может быть выполнен несколькими путями, такими как, но без ограничения: (a) использование Agrobacterium для синтеза и нуклеиновой кислоты, и связывающегося со связующим доменом компонента, в этом примере VirD2, который также катализирует их ковалентную связь. К тому же Agrobacterium способствует переносу в клетку оцДНК, ковалентно связанной с VirD2, (b) использование Agrobacterium для переноса T-ДНК в клетку, при этом указанная T-ДНК включает промоторы, управляющие синтезом в клетке SCNA в виде РНК, имеющих домен РНК, который связывается со связующим доменом комплекса после их встречи. Таким образом, комплекс, экспрессированный в клетке-мишени, собирается благодаря взаимодействию РНК-белок, (c) использование автономно реплицирующихся векторов, включая вирусы и экспрессионные векторы на основе вирусов, для доставки репликона в клетку, при этом указанный репликон включает субгеномные промоторы, управляющие синтезом SCNA в виде РНК, имеющих домен РНК, который связывается со связующим доменом комплекса после их встречи. Таким образом, комплекс, экспрессированный в клетке-мишени, собирается благодаря взаимодействию РНК-белок.
Теперь ссылаются на фиг. 7A-B, которые представляют собой схематические рисунки (масштаб не выдержан), на которых представлены неограничивающие примеры доставки SCNA в клетку, используя одноцепочечную ДНК, продуцированную в Agrobacterium. На фиг. 7A представлен неограничивающий пример использования Agrobacterium для продукции SCNA в виде оцДНК, связываемой с белком, VirD2, in vivo, на ее 5ʹ-конце. Как показано в этом примере, направляющую вариабельную последовательность SCNA встраивают в сайт множественного клонирования (MCS) в плазмиде, способной к репликации в Agrobacterium. Затем Agrobacterium трансформируют этой плазмидой. Последовательность правого края (RB) Ti-плазмиды в плазмиде расщепляется, и оцДНК связывается белком VirD2 в бактерии. 3 нуклеотида последовательности RB оставляются на 5ʹ последовательности после расщепления, и 21 нуклеотид последовательности левого края (LB) Ti-плазмиды оставляются после расщепления на 3ʹ последовательности. Последовательность LB может, кроме того, способствовать стабилизации SCNA и скринингу на предмет нежелательных событий интеграции. Мутированные формы агробактерий (например, те, в которых отсутствует VirE1 или VirE2, или с частичной функциональностью VirD2) применимы для ингибирования нежелательных событий интеграции. К тому же Agrobacterium экспортирует T-ДНК, включающую SCNA, связанную с VirD2, в клетку. На фиг. 7В представлен неограничивающий пример использования бактериальной системы секреции для доставки SCNA в клетку-хозяина. Одну или множество агробактерий, трансформированных различными T-ДНК, кодирующими различные последовательности SCNA, используют для инфицирования одной клетки. Связанная с VirD2 SCNA в виде оцДНК, созданная таким образом в бактерии и экспортированная в клетку-хозяина, может затем встретиться и связаться со связующим доменом белкового компонента благодаря взаимодействию между белком VirD2 и VirD2-связывающим доменом в связующем домене в клетке-хозяине. Пример такого связывающегося с VirD2 связующего домена включает искусственный одноцепочечный Fv-фрагмент антитела, созданный против VirD2. SCNA может, таким образовать, осуществлять сборку молекулярного комплекса на нуклеиновой кислоте-мишени.
Теперь ссылаются на фиг. 8A-B, которые являются схематическим иллюстрациями, демонстрирующими доставку SCNA в клетку, используя SCNA в виде РНК, продуцированные внутри клетки-хозяина, с доставленной с помощью Agrobacterium T-ДНК (фиг. 8A) или с нуклеиновой кислоты, доставленной с помощью автономно реплицирующегося вектора, такого как вирус (фиг. 8B). SCNA в виде РНК, представленные на этих фигурах, включают мотив SCNA-РНК (помеченный в виде гребней), который может связываться с соответствующим РНК-связывающим мотивом связующего домена белкового компонента. Как показано на фиг. 8A, последовательности SCNA вставлены в сайт множественного клонирования (MCS) в плазмиде, способной к репликации в Agrobacterium и содержащей соответствующие эукариотические промоторы для транскрипции одной или множества SCNA - РНК в инфицированной клетке. Фиг. 8B: Последовательность(и) SCNA вставлена(ы) в геном вируса или происходящего из вируса автономно реплицирующегося вектора, каждая из них под контролем субгеномного (sg) промотора для транскрипции одной или множества SCNA - РНК в инфицированной клетке. В неограничивающих примерах, представленных на фиг. 8A-B, молекулу нуклеиновой кислоты, кодирующую белковый компонент, можно доставить в клетку-мишень заранее, вместе с (одновременно) или после доставки молекулы нуклеиновой кислоты, кодирующей SCNA. Когда белковый компонент и SCNA экспрессируются в клетке, происходит сборка молекулярного комплекса на нуклеиновой кислоте-мишени.
Теперь ссылаются на фиг. 9, на которой представлена схематическая иллюстрация (масштаб не выдержан) неограничивающего примера транспортного средства или вектора для одновременной доставки композиции, включающей компоненты, необходимые для сборки программируемого молекулярного комплекса, в восприимчивую эукариотическую клетку-мишень за один прием доставки, в соответствии с некоторыми вариантами осуществления. В случае неограничивающего примера, представленного на фиг. 9, желательным действием является замена геномного участка ДНК (нуклеиновой кислоты-мишени) заданной последовательностью «донорной кассетой». Соответственно, домены белкового компонента включают: функциональный домен, происходящий из нуклеазы и обладающий активностью расщепления нуклеиновых кислот; домен клеточной локализации, который представляет собой сигнал ядерной локализации (NLS); и связующий домен, способный распознавать и связывать РНК-мотив в SCNA. В примере, представленном на фиг. 9, используют биологическую систему доставки. Agrobacterium трансформируют плазмидным вектором, таким как плазмида (800), который содержит различные функциональные/структурные последовательности, такие как бактериальный селектируемый маркер, различные сайты начала репликации (E. coli-ori, pSa Ori), последовательность LB, промоторные районы (обозначенные как (P)), экспрессирующая белковый компонент последовательность (включающая инициирующий кодон ATG и стоп-кодон в рамке считывания), сайт-терминатор (T), множество транскрибирующих SCNA кассет (представленное в виде четырех транскрибирующих SCNA кассет, каждая из которых включает последовательности промотора и терминатора), донорная кассета и сайт RB. Плазмидный вектор (трансфецированную Agrobacterium) затем приводят в контакт с клетками организма-мишенями. Agrobacterium затем образует T-ДНК из района между последовательностями правого края (RB) и левого края (LB) и секретирует ее в эукариотическую клетку. оцДНК T-ДНК доставляется в ядро, комплементируется in-vivo, чтобы стать дцДНК, и транскрибируется в РНК с совместимых промоторов (P) в плазмиде. Образованный таким образом транскрипт для белкового компонента транслируется с образованием намеченного белка. Транскрипты с транскрибирующей SCNA кассеты, которые включают последовательность РНК-мотива, связываются доменом, связывающим специфическую последовательность РНК, в белковом компоненте. Донорная кассета содержит достаточно длинную последовательность, которая может подвергаться рекомбинации с нуклеиновой кислотой-мишенью в присутствии двухцепочечного разрыва (DSB), образованного рядом с сайтом рекомбинации. SCNA предназначены для направленной доставки и гибридизации с последовательностями, фланкирующими замещаемую последовательность. В некоторых вариантах осуществления схожая плазмида, в которой отсутствуют последовательности границ, или линейная ДНК со схожей конструкцией может, кроме того, использоваться для трансфекции клеток в небиологической системе доставки, с тем же результатом.
В соответствии с некоторыми вариантами осуществления, и как детализировано выше, изменения/модификации в подвергнутой направленному воздействию последовательности включают, например, но без ограничения, стабильную делецию, мутацию, вставку нуклеиновых кислот и замену подвергнутой направленному воздействию последовательности другой последовательностью нуклеиновой кислоты, нокаут, сдвиг рамки считывания или любое изменение каким-либо образом транскрипции или трансляции гена, регулирующих его последовательностей, генов, регулирующих представляющий интерес ген, или регулирующих их последовательностей в регуляторной цепи событий.
Теперь ссылаются на фиг. 10, которая является схематической иллюстрацией (масштаб не выдержан), демонстрирующей использование запрограммированного молекулярного комплекса для создания мутации в нуклеиновой кислоте-мишени, в соответствии с некоторыми вариантами осуществления. Как показано в неограничивающем примере, представленном на фиг. 10, функциональный домен белкового компонента происходит из нуклеазы, и мутацию в сайте-мишени в нуклеиновой кислоте-мишени получают посредством создания разрыва дцДНК (DSB) в нуклеиновой кислоте-мишени в заданном положении. SCNA-запрограммированные молекулярные комплексы подвергаются самосборке в результате спаривания оснований SCNA с соответствующей последовательностью-мишенью в нуклеиновой кислоте-мишени. После сборки компонентов комплекса, функциональный домен подвергается димеризации, и активируется нуклеаза, расщепляющая сайт-мишень, который находится, в этом примере, в центре или вблизи него, между двумя молекулами SCNA, тем самым создавая DSB (например, DSB может иметь 4-нуклеотидные 5ʹ-концевые избыточности, такие как те, которые создаются рестриктазой FokI). Клеточные механизмы репарации посредством негомологичного соединения концов (NHEJ) пытаются репарировать DSB и при осуществлении этого могут: 1) осуществить идеальное лигирование - в то время как комплекс может продолжать снова расщеплять ту же последовательность для повторных попыток осуществить мутацию до истощения компонентов комплекса, 2) добавить один или множество нуклеотидов, тем самым увеличивая расстояние между SCNA и аннулируя димеризацию функционального домена, тем самым прекращая действие комплекса, или 3) удалить один или множество нуклеотидов (образ «разносчика»), тем самым уменьшая расстояние между SCNA и аннулируя димеризацию функционального домена, тем самым прекращая действие комплекса. Когда любой из вариантов 2 или 3 имеет место в клетке, получают мутацию.
Теперь ссылаются на фиг. 11, которая является схематической иллюстрацией (масштаб не выдержан), демонстрирующей использование запрограммированного молекулярного комплекса для вставки одного или множества нуклеотидов в нуклеиновую кислоту-мишень, используя доставляемую донорную нуклеиновую кислоту, в соответствии с некоторыми вариантами осуществления. Как показано в неограничивающем примере, представленном на фиг. 11, функциональный домен белкового компонента происходит из нуклеазы, и разрыв дцДНК (DSB) в нуклеиновой кислоте-мишени в заданном положении (сайте-мишени) способствует процессу гомологичной рекомбинации (HR). SCNA-запрограммированные молекулярные комплексы подвергаются самосборке в результате спаривания оснований SCNA с соответствующей последовательностью-мишенью. После сборки компонентов комплекса, функциональный домен подвергается димеризации, и активируется нуклеаза, тем самым расщепляя нуклеиновую кислоту-мишень в сайте-мишени, который может находиться, например, в центре или вблизи него, между двумя молекулами SCNA, тем самым создавая DSB. Донорная DNA содержит последовательность, которая должна быть вставлена, и достаточно длинные участки нуклеотидов, фланкирующие эту последовательность, которые по существу идентичны последовательности-мишени, фланкирующей запланированное место DSB. Эти фланкирующие последовательности могут затем подвергаться рекомбинации (X) с нуклеиновой кислотой-мишенью благодаря клеточному процессу HR, таким образом осуществляя замену заданного участка нуклеотидов в нуклеиновой кислоте-мишени и в действительности осуществляя вставку желаемой последовательности. После рекомбинации и вставки заданной донорной последовательности, расстояние между SCNA увеличивается, таким образом мешая димеризации функционального домена, тем самым прекращая действие комплекса. В тех случаях, когда происходит идеальное перелигирование с помощью NHEJ, активированный запрограммированный комплекс может продолжать снова расщеплять ту же последовательность для повторных попыток осуществления вставки.
Теперь ссылаются на фиг. 12, которая является схематической иллюстрацией (масштаб не выдержан), демонстрирующей использование запрограммированного молекулярного комплекса для замены, вставки и/или делеции одного или множества нуклеотидов в нуклеиновой кислоте-мишени, используя доставляемую донорую нуклеиновую кислоту, в соответствии с некоторыми вариантами осуществления. Как показано в неограничивающем примере, представленном на фиг. 12, функциональный домен белкового компонента происходит из нуклеазы, и разрыв дцДНК (DSB) в нуклеиновой кислоте-мишени в заданном положении (сайте-мишени) способствует процессу гомологичной рекомбинации (HR). SCNA-запрограммированные молекулярные комплексы подвергаются самосборке в результате спаривания оснований SCNA с заданной последовательностью-мишенью. После сборки компонентов комплекса, функциональный домен подвергается димеризации, и активируется нуклеаза, расщепляющая нуклеиновую кислоту-мишень в сайте-мишени, который может находиться, например, в центре или вблизи него, между двумя молекулами SCNA, тем самым создавая DSB. Донорная DNA содержит экзогенную последовательность, которая должна быть вставлена вместо эндогенной последовательности-мишени, которая должна быть удалена, а также достаточно длинные участки нуклеотидов, фланкирующие эту экзогенную последовательность, которые по существу идентичны последовательности-мишени, фланкирующей запланированную последовательность, которая должна быть удалена. Эти фланкирующие последовательности могут затем подвергаться рекомбинации (X) с ДНК-мишенью благодаря клеточному процессу HR, таким образом осуществляя замену участка ДНК в ДНК-мишени и в действительности осуществляя замену желаемой эндогенной последовательности желаемой экзогенной последовательностью. После успешной рекомбинации и замены желаемой экзогенной последовательностью сайты связывания SCNA в нуклеиновой кислоте-мишени могут быть аннулированы в соответствии с замыслом, таким образом завершая действие комплекса. В тех случаях, когда происходит идеальное перелигирование с помощью NHEJ, комплекс может продолжать снова расщеплять ту же последовательность для повторных попыток осуществления рекомбинации.
Теперь ссылаются на фиг. 13, которая является схематической иллюстрацией (масштаб не выдержан), демонстрирующей использование запрограммированного молекулярного комплекса для создания делеции одного или множества следующих друг за другом нуклеотидов из нуклеиновой кислоты-мишени, в соответствии с некоторыми вариантами осуществления. Как показано в неограничивающем примере, представленном на фиг. 13, функциональный домен белкового компонента происходит из нуклеазы, и делецию получают посредством создания двух разрывов дцДНК (DSB) в нуклеиновой кислоте-мишени в двух заданных положениях. SCNA-запрограммированные молекулярные комплексы подвергаются самосборке в результате спаривания оснований SCNA с соответствующими последовательностями-мишенями. После сборки компонентов комплекса, функциональные домены подвергаются димеризации, и активируются нуклеазы, расщепляющие нуклеиновую кислоту-мишень в сайте-мишени, который может находиться в центре или вблизи него между каждой парой молекул SCNA, тем самым создавая DSB. Одновременное или последовательное расщепление обоих сайтов по существу исключает или делетирует последовательность посередине. Клеточные механизмы репарации посредством негомологичного соединения концов (NHEJ) пытаются репарировать DSB и при осуществлении этого могут: 1) осуществить идеальное лигирование ДНК-мишени, фланкирующей делетированную последовательность, в то время как активированный комплекс может продолжать снова расщеплять ту же последовательность до истощения компонентов комплекса (левая панель); 2) осуществить идеальное перелигирование каждого отдельного DSB - в то время как комплекс может продолжать снова расщеплять ту же последовательность для повторных попыток осуществить делецию до истощения компонентов комплекса; 3) удалить один или множество нуклеотидов (образ «разносчика», правая панель) из гэпа DSB, таким образом уменьшая расстояние между SCNA и аннулируя димеризацию функционального домена, тем самым прекращая действие комплекса; или 4) добавить один или множество нуклеотидов в гэп DSB, таким образом увеличивая расстояние между SCNA и аннулируя димеризацию функционального домена, тем самым прекращая действие комплекса.
Теперь ссылаются на фиг. 14, которая является схематической иллюстрацией, демонстрирующей использование запрограммированного молекулярного комплекса для замены одного или множества нуклеотидов в нуклеиновой кислоте-мишени, используя доставляемую донорную нуклеиновую кислоту, в соответствии с некоторыми вариантами осуществления. Как показано в неограничивающем примере, представленном на фиг. 14, функциональный домен белкового компонента происходит из нуклеазы, и замену получают посредством создания двух разрывов дцДНК (DSB) в нуклеиновой кислоте-мишени в двух заданных положениях (сайта-мишенях), создавая делецию, и доставки линейной или линеаризованной донорной ДНК для заполнения гэпа. SCNA-запрограммированные молекулярные комплексы подвергаются самосборке в результате спаривания оснований SCNA с соответствующими последовательностями-мишенями. После сборки компонентов комплекса, функциональные домены подвергаются димеризации, и активируются нуклеазы, расщепляющие мишень в центре или вблизи него между каждой парой молекул SCNA, тем самым создавая DSB. Одновременное или последовательное расщепление обоих сайтов по существу исключает или делетирует участок последовательности посередине. Клеточные механизмы репарации посредством негомологичного соединения концов (NHEJ) пытаются репарировать DSB и при осуществлении этого могут: 1) выполнить идеальную пару лигирований донора в мишень, аннулируя димеризацию функционального домена, тем самым завершая действие комплекса; 2) осуществить идеальное лигирование последовательности нуклеиновой кислоты-мишени, фланкирующей делетированную последовательность, - тогда как комплекс может продолжать снова расщеплять ту же последовательность для повторных попыток осуществить замену до истощения компонентов комплекса; 3) осуществить идеальное перелигирование каждого отдельного DSB, тогда как комплекс может продолжать снова расщеплять ту же последовательность для повторных попыток осуществить замену до истощения компонентов комплекса; 4) удалить один или множество нуклеотидов из гэпа DSB, таким образом уменьшая расстояние между SCNA и аннулируя димеризацию функционального домена, тем самым прекращая действие комплекса; или 5) добавить один или множество нуклеотидов в гэп DSB, таким образом увеличивая расстояние между SCNA и аннулируя димеризацию функционального домена, тем самым прекращая действие комплекса.
Генетические заболевания
В соответствии с некоторыми вариантами осуществления композиции и способы настоящего изобретения могут использоваться для замены любой геномной последовательности гомологичной, неидентичной последовательностью. Например, мутантную геномную последовательность можно заменить на ее аналог дикого типа, тем самым обеспечивая способы лечения, например, генетического заболевания, наследственных нарушений, рака и аутоиммунного заболевания. Подобным образом одну аллель гена можно заменить на отличную аллель, используя раскрытые здесь способы. Приводимые в качестве примера генетические заболевания включают, но без ограничения, хондродистрофию, цветовую слепоту, недостаточность кислой мальтазы, приобретенные иммунные недостаточности, недостаточность аденозин-деамилазы (OMIM № 102700), адренолейкодистрофию, синдром Экарди, недостаточность альфа-I-антитрипсина, альфа-талассемию, синдром нечувствительности к андрогенам, синдром Аперта, аритмогенную дисплазию правого желудочка, атаксию-телеангиэктазию, синдром Барта, бета-талассемию, синдром невуса красно-голубого пузырчатого, болезнь Канавана, хронический гранулематоз (CGD), синдром кошачьего крика, муковисцидоз, болезнь Деркума, врожденную эктодермальную дисплазию, анемию Фанкони, оссифицирующую врожденную фибродисплазию, синдром умственной отсталости, галактоземию, болезнь Гоше, генерализованный ганглиозидоз (например, GM1), гемохроматоз, гемоглобинопатии (например, серповидно-клеточную анемию, миссенс-мутацию в 6-ом кодоне цепи бета-глобина гемоглобина С, альфа-талассемию, бета-талассемию), гемофилию, болезнь Хантингтона, мукополисахаридоз I типа, гипофосфатазию, синдром Клайнфелтера, болезнь Краббе-Бенеке, синдром Лангера-Гиедиона, недостаточность адгезии лейкоцитов (LAD, OMIM № 116920), лейкодистрофию, синдром удлиненного интервала QT, лизосомные болезни накопления (например, болезнь Гоше, GM1, болезнь Фабри и болезнь Тея-Сакса), синдром Марфана, синдром Мебиуса, мукополисахаридоз (например, болезнь Хантера, болезнь Гурлера), наследственный онихоартроз, несахарный почечный диабет, нейрофиброматоз, болезнь Нимана-Пика, незавершенный остеогенез, порфирию, синдром Прадера-Вилли, прогерию, синдром Протея, ретинобластому, синдром Ретта, синдром Рубенштейна-Тэйби, синдром Санфилиппо, тяжелый комбинированный иммунодефицит (SCID), синдром Швачмана, серповидно-клеточную анемию, синдром Смита-Магениса, синдром Стиклера, болезнь Тея-Сакса, синдром тромбоцитопении с отсутствием лучевой кости (TAR), мандибулофациальный дизостоз, трисомию, туберозный склероз, синдром Турнера, нарушение орнитинового цикла, цереброретинальный ангиоматоз, синдром Ваарденбурга, синдром Вильямса, болезнь Вильсона-Коновалова, синдром Вискотта-Олдрича, X-связанный лимфопролиферативный синдром (XLP, OMIM № 308240).
Следующие примеры представлены для более полной иллюстрации некоторых вариантов осуществления настоящего изобретения. Однако их никоим образом не следует рассматривать как ограничение широкого объема настоящего изобретения.
ПРИМЕРЫ
ПРИМЕР 1 - In-vivo система в качестве биоанализа для регулировки компонентов молекулярного комплекса:
В этом примере описывается биоанализ, подходящий для проверки и оптимизации изменений при разработке и использовании программируемого молекулярного комплекса, например, для проверки его активности в различных организмах или клетках, для проверки различных способов доставки и для проверки корректирующих действий мутации, замены, делеции и вставки.
Эксперименты, представленные в примерах ниже, предназначены для детектирования направленного воздействия на ген и специфического расщепления с помощью композиции программируемого молекулярного комплекса, который включает модифицированную нуклеазу в качестве эффекторного домена белкового компонента.
Используются репортерные системы визуализации, основанные на репарации стоп-кодона, который размещен внутри кодирующей репортер последовательности. Репортером в этих примерах является зеленый флуоресцентный белок (GFP). После направленного воздействия, двухцепочечные разрывы (DSB), образованные активированным комплексом, подвергаются репарации, (вероятно, благодаря пути с использованием NHEJ, приведенного в качестве примера на фиг. 10), что приводит к аннулированию стоп-кодона и восстановлению активности GFP. Этот анализ может, таким образом, дать хорошее представление об эффективности направленного воздействия на ген. Этот анализ также известен как анализ «STOP GFP». Этот визуальный анализ предназначен для направленного воздействия на плазмидную или геномную ДНК in- vivo. В следующих примерах используется биоанализ на основе протопластов Arabidopsis. В описанном биоанализе вышеупомянутые репортерные системы доставляются в протопласты на плазмиде, доставляемой вместе с плазмидой, экспрессирующей белковый компонент молекулярного комплекса in-vivo и доставляемой вместе с парой придающих специфичность нуклеиновых кислот (SCNA) в виде оцДНК, модифицированных, в этом примере, с использованием (NHS-эфир-)-дигоксигенина (DIG) на конце. Вторая модификация для защиты от экзонуклеазы, (фосфоротиоат), добавлена на противоположный конец (здесь помеченный звездочкой). Используемые здесь плазмидные векторы включают промоторы растений.
Последовательность и свойства белка
Молекулярный комплекс, разработанный для этого применения, состоит из двух последовательностей гомологичных нуклеиновых кислот для определения специфичности (SCNA) и компонента в виде химерного белка, содержащего нуклеазу, который связывается с SCNA in vivo. Результирующее расщепление заданного сайта-мишени (стоп-кодона) нуклеиновой кислоты-мишени (кодирующей GFP последовательности) приводит к желаемой ее мутации, с помощью эндогенных процессов. Программируемый молекулярный комплекс в этом примере состоит из 2 идентичный мономеров белкового компонента и двух различных молекул SCNA (как схематически проиллюстрировано на фиг. 1A и 2A). В этом примере белковый компонент содержит аминокислотную последовательность, модифицированную исходя из нуклеазного домена FokI, в качестве функционального домена; аминокислотную последовательность, заимствованную из одноцепочечного Fv-фрагмента (scFv) иммуноглобулина против DIG (дигоксигенина) (DIG-ScFv), схожую с той, которая описана в (Huston et. al, 1988), в качестве связующего домена; SV40NLS (SEQ ID NO: 3, PKKKRKV) в качестве домена ядерной локализации и ~15A междоменный соединитель (SEQ ID NO: 7, GGSGG). Последовательность нуклеиновой кислоты, кодирующую белковый компонент, встраивают в подходящие экспрессионные векторы (векторы на основе pUC (pSAT)), включающие промотор NOS или 35S.
In-vivo связывание между придающей специфичность нуклеиновой кислотой и связующим доменом белкового компонента, в этом примере, является результатом нековалентного взаимодействия, которое можно описать как взаимодействие антитело-антиген; одноцепочечное антитело-антиген; взаимодействие антитело или одноцепочечное антитело-гаптен.
В этом примере концевой модификацией нуклеиновой кислоты - SCNA является связанный с NHS-эфиром дигоксигенин (DIG), который присоединен в 5ʹ или 3ʹ положении олигонуклеотида SCNA.
Аминокислотная последовательность (однобуквенный код) белкового компонента молекулярного комплекса (NLS-нуклеазная последовательность FokI с ScFv против дигоксигенина) определена в SEQ ID NO: 12 и кодируется последовательностью, представленной в SEQ ID NO: 13.
Свойства и последовательность SCNA
Длина SCNA комплементарного, подвергающегося спариванию оснований с мишенью олигонуклеотида составляет предпочтительно по крайней мере 18 оснований. SCNA может также содержать небольшое число (например, 1-6, в одном примере - 6, в другом примере - 2) не подвергающихся спариванию оснований с мишенью нуклеотидов (Nʹ) с любым составом последовательности, которые могут служить в качестве спейсера между концевым модификатором DIG-NHS и комплементарными мишени нуклеотидами. Как детализировано выше, поскольку гистоны занимают малые бороздки ДНК в хромосомной ДНК, могут существовать некоторые ограничения в отношении расстояния между SCNA. Таким образом, SCNA предпочтительно разрабатывают так, чтобы они помещались в большую бороздку ДНК-мишени, посредством изменения расстояния между SCNA, для допуска ориентации спирали мишени, которая допускает связывание связующих доменов подвергаемого димеризации программируемого молекулярного комплекса. Выбор междоменного соединителя между глобулярным функциональным доменом и связующим доменом (в представленном здесь примере - GSLEGGSGG (SEQ ID NO: 14)) также влияет на оптимальное расстояние между SCNA, поскольку он или ограничивает, или допускает движение в «шарнире» между этими двумя доменами. Добавление не подвергающихся спариванию оснований с мишенью нуклеотидов («Nʹ») изменяет и расстояние между SCNA и угловую ориентацию спирали мишени, поскольку оно изменяет гибкость SCNA относительно белка и спирали. Эти не подвергаемые спариванию нуклеотиды не удерживаются в большой бороздке ДНК-мишени.
Результаты пространственных измерений, сделанных на основе компьютерных пространственных моделей для системы анти-DIG-ScFv-NHS-эфир-DIG с междоменным линкером GSLEGGSGG (SEQ ID NO: 14), представленной в этом примере, привели к заключению, что предполагаемое оптимальное расстояние между SCNA составляет, в присутствии 2 Nʹ в SCNA, приблизительно 23-26 нуклеотидов. Расщепление, как предсказывают, будет происходить приблизительно ±2 нуклеотида слева и справа от 11-ого, 12-ого или 13-ого нуклеотида, считая от последнего нуклеотида, гибридизующегося с SCNA, с любой стороны, учитывая 5ʹ-концевую избыточность из 4-оснований, создаваемую в результате расщепления дцДНК подвергнутой димеризации конструкцией. Этот критерий означает, что, если подвергаемой направленному воздействию последовательностью является, например, 24-нуклеотидная последовательность:
AAAAAAAAAAYYYYYYYYYXXXXXXYYYYYYYYYCCCCCCCCCC, где Y+X представляет собой число нуклеотидов между сайтами, подвергающими спариванию оснований с SCNA, то сконструированные SCNA подвергаются спариванию оснований с областями A и C, и расщепление, приводящее к DSB, происходит в или вблизи области X. SCNA могут быть комплементарны или смысловой, или антисмысловой цепи, но предпочтительно выбирают те, которые подвергаются спариванию оснований со смысловой (нетранскрибируемой) последовательностью. Обе SCNA могут подвергаться спариванию оснований с одной и той же цепью, поскольку белковый компонент находится на «ближайшем конце» SCNA, который определяется 5ʹ или 3ʹ модификацией праймера, находящейся на «ближайшем конце» (как продемонстрировано на фиг. 2A). Оптимизация расстояния между SCNA, а также предпочтительная цепь, является одним из нескольких критериев, проверяемых в этом биоанализе.
Нуклеиновая кислота-мишень (кодирующая GFP последовательность), содержащая сайт-мишень (стоп-кодон, (TAG)), включает нуклеотидную последовательность, представленную в SEQ ID NO: 15 («STOP-GFP»), в которой стоп-кодон TAG находится в положении нуклеотида 878:
Донор mCherry для примеров 1B и 1C включает кодирующую последовательность без промоторов и терминаторов, представленную в SEQ ID NO: 16:
На следующую последовательность сайта-мишени оказывается направленное воздействие в примерах с 1A по 1C включительно:
Примеры 1A-C последовательность - «первая мишень»:
GTCGACAACTAGTCCAGATCT (SEQ ID NO: 17)
Последовательности SCNA
Обозначениями модификаций являются: фосфоротиоатные связи=*; 5ʹ DIG=/5DigN/; 3ʹDIG=/3DigN/).
Проверенные комбинации спаренных SCNA для «первой мишени» примеров 1A-1C:
Гибридизующиеся со смысловой цепью SCNA:
GFP_918_SR1: /5DigN/NNNNNNGTGTCCAAGGGCGAGGAGCTG*T; (только нуклеиновые кислоты определены здесь как SEQ ID NO: 18)
GFP_896_SL1: T*TTACGAACGATAGCCATGGCCNNNNNN/3DigN/ (только нуклеиновые кислоты определены здесь как SEQ ID NO: 19)
Вторая комбинация спаренных, гибридизующихся со смысловой цепью SCNA, используя 24-п.о. гэп-мишень и более короткий линкер SCNA, в соответствии с результатами предсказаний:
GFP_920_SR1: /5DigN/NNGTCCAAGGGCGAGGAGCTGTT*C (только нуклеиновые кислоты определены здесь как SEQ ID NO: 20)
GFP_895_SL1: A*TTTACGAACGATAGCCATGGCNN/3DigN/ (только нуклеиновые кислоты определены здесь как SEQ ID NO: 21)
Гибридизующиеся с антисмысловой цепью SCNA:
GFP_918_ASR1: C*AGCTCCTCGCCCTTGGAGACNNNNNN/3DIGN/ (только нуклеиновые кислоты определены здесь как SEQ ID NO: 22)
GFP_896_ASL1: /5DIGN/NNNNNNGGCCATGGCTATCGTTCGTA*A (только нуклеиновые кислоты определены здесь как SEQ ID NO: 23)
Вторая комбинация спаренных, гибридизующиеся с антисмысловой цепью SCNA, используя 24-п.о. гэп-мишень и более короткий линкер SCNA, в соответствии с результатами предсказаний:
GFP_920_ASR1: G*AACAGCTCCTCGCCCTTGGACNN/3DIGN/ (только нуклеиновые кислоты определены здесь как SEQ ID NO: 24)
GFP_895_ASL1: /5DIGN/NNGCCATGGCTATCGTTCGTAAA*T (только нуклеиновые кислоты определены здесь как SEQ ID NO: 25)
Комбинации пар гибридизующихся со смысловой и антисмысловой цепями SCNA:
GFP_918_SR1: /5DigN/NNNNNNGTGTCCAAGGGCGAGGAGCTG*T (только нуклеиновые кислоты определены здесь как SEQ ID NO: 18)
GFP_896_ASL1: /5DIGN/NNNNNNGGCCATGGCTATCGTTCGTA*A (только нуклеиновые кислоты определены здесь как SEQ ID NO: 23)
Вторая комбинация спаренных, гибридизующихся с антисмысловой цепью SCNA, используя 24-п.о. гэп-мишень и более короткий линкер SCNA, в соответствии с результатами предсказаний:
GFP_920_SR1: /5DigN/NNGTCCAAGGGCGAGGAGCTGTT*C/ (только нуклеиновые кислоты определены здесь как SEQ ID NO: 20)
GFP_895_ASL1: /5DIGN/NNGCCATGGCTATCGTTCGTAAA*T (только нуклеиновые кислоты определены здесь как SEQ ID NO: 25)
GFP_918_ASR1: C*AGCTCCTCGCCCTTGGAGACNNNNNN/3DIGN/ (только нуклеиновые кислоты определены здесь как SEQ ID NO: 22)
GFP_896_SL1: T*TTACGAACGATAGCCATGGCCNNNNNN/3DigN/ (только нуклеиновые кислоты определены здесь как SEQ ID NO: 19)
Вторая комбинация спаренных, гибридизующихся с антисмысловой цепью SCNA, используя 24-п.о. гэп-мишень и более короткий линкер SCNA, в соответствии с результатами предсказаний:
GFP_920_SL1: A*TTTACGAACGATAGCCATGGCNN/3DigN/ (только нуклеиновые кислоты определены здесь как SEQ ID NO: 21)
GFP_895_ASR1: G*AACAGCTCCTCGCCCTTGGACNN/3DIGN/ (только нуклеиновые кислоты определены здесь как SEQ ID NO: 24)
«Первая мишень» для примера 1C идентична мишени для примера 1A и 1B.
«Вторя мишень» для примера 1C: GACTCTAAGCTTGGGTCTAGA (SEQ ID NO: 26)
SCNA для примера 1C:
Комбинация SCNA, используя 24-п.о. гэп-мишень и короткий линкер SCNA:
Гибридизующиеся со смысловой цепью:
GFP_1658_SR: /5DIGN/NNTCCGCAAAAATCACCAGTCTC*T (только нуклеиновые кислоты определены здесь как SEQ ID NO: 27)
GFP_1633_SL: G*CATGGACGAGCTGTACAAGTCNN/3DIGN/ (только нуклеиновые кислоты определены здесь как SEQ ID NO: 28)
Гибридизующиеся с антисмысловой цепью:
GFP_1658_ASR: A*GAGACTGGTGATTTTTGCGGANN/3DIGN/ (только нуклеиновые кислоты определены здесь как SEQ ID NO: 29)
GFP_1633_ASL: /5DIGN/NNGACTTGTACAGCTCGTCCATG*C (только нуклеиновые кислоты определены здесь как SEQ ID NO: 30)
Как в случае SCNA для «первой мишени» примера 1A-C, эти четыре SCNA для «второй мишени» примера 1C могут спариваться, используя одну «левую» (L) и одну «правую» (R) SCNA из вышеприведенного списка.
Доставка
Постановка биоанализа: Приготовление протопластов Arabidopsis основывается на Wu et. al. (Wu et. al, 2009):
Материал растений: Arabidopsis, выращенные в условиях 16-ч дневного оптимального света (150 микроЭйнштейн.м-2.сек-1) при 22°C.
Листья: растения возрастом 3-5 недель (Ширина ~2cm, Длина ~5 см).
Рабочие растворы:
Ферментный раствор: 1% целлюлазы, 0,25% Мацерозима, 0,4M маннит, 10 мМ CaCl2, 20 мМ KCl, 0,1% BSA, 20 мМ MES pH 5,7. Нагревайте при 50-55°C в течение 10 минут для инактивации протеаз, а затем профильтруйте. Используйте свежеприготовленный раствор - 10 мл/7-10 очищенных листьев (1-5 г)/планшет.
Модифицированный раствор W5: 154 мМ NaCl, 125 мМ CaCl2, 5 мМ KCl, 5 мМ глюкоза, 2 мМ MES pH 5,7. Промойте дважды с использованием 25 мл/планшет, + двойная промывка 3 мл для трансфекции+ресуспендирование в 1 мл.
Модифицированный раствор MMg: (раствор для ресуспендирования): 0,4M маннит, 15 мМ MgCl2, 4 мМ MES pH 5,7.
Модифицированный буфер для трансфекции TEAMP (раствор ПЭГ): 40% ПЭГ с М.м. 4000, 0,1M CaCl2, 0,2М маннит объем = 1:1 200 мкл протопластов в MMg + объем ДНК.
BSA: 1% BSA
Рабочий протокол:
1. Предварительно нагрейте водяную баню до 50-55°C, охладите центрифугу с роторами с корзинами (swing-out), охладите W5 и MMg, и отрежте кончики.
2. Приготовьте свежие, покрытые BSA планшеты (1,25 мл 1% BSA/лунку в воде, инкубируйте на лабораторном столе до готовности)
3. Приготовьте свежий ферменный раствор 10 мл/обработку.
4. Отберите 7-10 листьев, не должны быть влажными. 10 листьев будут давать ~4-5 трансформаций.
5. Наклейте на верхний эпидермис ленту Time®, на нижний эпидермис - прозрачную ленту (скотч). Это легче сделать без перчаток. Легче очистить, если черешок приклеен только к ленте Time®.
6. Поместите 10 мл свежего ферментного раствора, пропущенного через 0,22 мкм-фильтр, в каждую чашку Петри.
7. Очистите и выбросите прозрачную ленту. Перенесите сторону с лентой с Time® времени в чашку Петри
8. Осторожно встряхивайте на шейкере с платформой со скорость 40 об/мин в течение 20-60 мин при свете до высвобождения протопластов (проверяйте эмпирически)
9. Осуществите центрифугирование в 50-мл пробирках при 100 × g 3 мин в роторе с корзинами (swing-out).
10. Промойте дважды с использованием 25 мл холодного раствора W5.
11. Поместите на лед на 30 мин, осуществите подсчет за это время в гемоцитометре, используя оптический микроскоп.
12. Осуществите центрифугирование и ресуспендирование в растворе MMg до 2-5 × 105 клеток/мл (приблизительно 1 мл).
Трансфекция:
1. Приготовьте свежий раствор ПЭГ для трансфекции в 2-мл пробирке.
2. Вылейте BSA из 6-луночных планшетов и высушите.
3. Смешайте ~5×104 протопластов (2×104-1×105) в 0,2 мл раствора MMg со смесью плазмидной ДНК-мишени, экспрессирующей белковый компонент плазмидной ДНК и оцРНК-SCNA до всего 30-40 мкг при комнатной температуре в 15-мл круглодонных пробирках (с герметическим колпачком с защелкой).
4. Добавьте равный объем (0,2 мл протопластов+средний объем приготовления) свежего раствора ПЭГ.
5. Инкубируйте при комнатной температуре в течение 5 мин.
6. Промойте, медленно добавляя 3 мл раствора W5, 1 мл за раз, и смешивая.
7. Осуществите центрифугирование при 100 x g в роторе с корзинами (swing-out) в течение 1 мин
8. Повторите промывку и осаждение.
9. Ресуспендируйте в 1 мл раствора W5.
10. Налейте в покрытые BSA планшеты.
11. Выращивайте протопласты в условиях 16-ч дневного оптимального света (150 микроЭйнштейн⋅м-2⋅сек-1) при 22°C, заменяя среды в соответствии с необходимостью.
Протопласты, суспендированные в растворе W5, подвергают скринингу в отношении GFP/mCherry активности через 3 дня после трансфекции, используя автоматический проточный цитометр (FACS). GFP детектируют посредством возбуждения при 488 нм с эмиссией, детектируемой с использованием 530/30 фильтра. Возбуждение mCherry осуществляют при 561 нм с детектированием эмиссии с использованием 610/20 фильтра. Устанавливают пороговую величину и коэффициенты коррекции для исключения любых ошибочных результатов.
Пример 1A: Точечная мутация в результате индуцированного DSB.
В этом примере расщепление мишени приводит к двухцепочечному разрыву (DSB) в плазмидной ДНК-мишени. Этот DSB в соответствии с разработкой создается в месте стоп-кодона, который расщепляется и подвергается репарации с помощью механизма репарации с использованием NHEJ, как представлено на приведенной в качестве примера иллюстрации фиг. 10 (мутации). NHEJ имеет тенденцию к созданию мутаций, и некоторые из этих мутаций могут аннулировать стоп-кодон и восстановить открытую рамку считывания, приводя к открытой рамке считывания (ORF) для активного GFP. GFP затем детектируют с помощью микроскопии или проточного цитометра (FACS), что делает возможным измерение эффективности системы и сравнение между переменными для ее улучшения.
Направленно воздействуя на трансген STOP-GFP, предварительно стабильно введенный в геном Arabidopsis (вместо плазмиды), можно регенерировать растения с модифицированным геномом из экспрессирующих GFP протопластов.
Пример 1B: Специфическая интеграция в индуцированный геномный DSB.
Как в примере 1A, последовательность стоп-кодона в рамке считывания GFP подвергают направленному воздействию запрограммированного молекулярного комплекса. В случае этого применения добавляют донорную линейную дцДНК, включающую лишенный промотора, лишенный терминатора ген-репортер Cherry, содержащий только кодирующую последовательность (CDS). После описанной трансфекции, экспрессирующие mCherry протопласты детектируют по флуоресценции в красном диапазоне с помощью микроскопии или проточного цитометра (FACS), что делает возможным измерение эффективности системы и сравнение между переменными для ее улучшения. Возбуждение mCherry осуществляют при 561 нм с детектированием эмиссии с использованием 610/20 фильтра. Поскольку донорная ДНК содержит mCherry без промотора, его активность может быть достигнута при захвате промотора. Таким образом, подвергаемая направленному воздействию, кодирующая GFP кассета расщепляется с образованием DSB, в который может быть лигирована любая линейная ДНК. Поскольку доставляется избыточное количество линейной дцДНК с кодирующей mCherry последовательностью, она захватывается в DSB, что является, в некоторых случаях, причиной трансляции в рамке считывания белка mCherry. Подвергнутые направленному воздействию плазмиды с такой специфической вставкой mCherry в подвергнутую направленному воздействию последовательность GFP, кроме того, анализируют с помощью ПЦР с использованием следующих праймеров: одного, связывающегося с последовательностью плазмидной ДНК-мишенью, и одного, связывающегося со вставленной ДНК:
35SF: CTATCCTTCGCAAGACCCTTCC (SEQ ID NO: 31)
mCherryR: TTATCTTGTACAGCTCGTCCAT (SEQ ID NO: 32)
Так же, кассету бактериальной устойчивости к антибиотику (кодирующую NPT-II кассету, без начала репликации) доставляют в протопласты в виде линейной дцДНК. Эта ДНК встраивается в кодирующую mCherry последовательность примеров 1B и 1C, и ее подвергают скринингу посредством экстракции тотальной ДНК из протопластов, трансформирования включающих ДНК плазмид со вставками и без них в E. coli, и выращивания их на среде, содержащей канамицин. Устойчивые бактерии содержат плазмиды, которые захватали кодирующую NPT-II кассету. Для оценки специфичности вставки в заданный сайт GFP-мишени, сайт GFP-мишени подвергают амплификации с помощью ПЦР с использованием праймеров, охватывающих ожидаемое место вставки. Специфическая вставка является причиной значительного сдвига размера продукта ПЦР в агарозном геле. Эффективность встраивания рассчитывают делением числа устойчивых к канамицину колоний на число устойчивых к ампициллину колоний (устойчивость к ампициллину кодируется на плазмиде-мишени) в эксперименте с использованием высева в двух повторах. Специфичность рассчитывают, повторяя эксперимент с не включением или заменой компонентов программируемого молекулярного комплекса (например, SCNA направленного воздействия на GFP) и сравнивая с экспериментами без модификаций.
Пример 1C: Замена гена через механизм репарации с использованием NHEJ.
В этом примере кодирующую GFP последовательность заменяют кодирующей mCherry последовательностью через эндогенное NHEJ. Чтобы делетировать большой участок ДНК-мишени через стратегию с использованием NHEJ, создают два DSB. Для нацеливания на начало и конец кодирующей GFP последовательности, два набора SCNA используют вместе с кодирующей mCherry линейной донорной дцДНК. Поскольку донорная ДНК содержит mCherry без промотора, его активность может быть получена при захвате промотора. Следовательно, подвергнутая направленному воздействию, кодирующая GFP кассета может захватить кодирующую mCherry последовательность. mCherry анализируют с помощью FACS или микроскопа при возбуждении при 561 нм с детектированием эмиссии с использованием 610/20 фильтров.
mCherry-позитивные протопласты подвергают сортировке с помощью FACS и впоследствии подвергают экстракции ДНК, осуществляют непосредственную трансформацию тотальной ДНК, которая включает плазмиды, в E. coli, выращивание на содержащих антибиотик средах, и выполняют две реакции ПЦР для каждой бактериальной колонии с использованием двух наборов праймеров:
35SF: CTATCCTTCGCAAGACCCTTCC (SEQ ID NO: 31)
mCherryR: TTATCTTGTACAGCTCGTCCAT (SEQ ID NO: 32)
и
35S-T-R-SEQ:CCCTATAAGAACCCTAATTCCC (SEQ ID NO: 33)
mCherryF: ATGGTGAGCAAGGGCGAGGA (SEQ ID NO: 34)
Колонии, которые порождают продукт амплификации в обеих реакциях ПЦР, содержат плазмиду, которая была подвергнута направленному воздействию в протопластах Arabidopsis для вызова события соответствующим образом ориентированной замены через путь репарации с использованием NHEJ, затем секвенируют для подтверждения.
При направленном воздействии на трансген GFP, ранее стабильно введенный в геном Arabidopsis (вместо плазмиды), такую прямую трансформацию E. coli не выполняют. Вместо этого, геномную ДНК из отдельных протопластов амплифицируют непосредственно с помощью ПЦР, используя указанные праймеры. Альтернативно, растения с модифицированным геномом можно регенерировать из не экспрессирующих GFP, экспрессирующих mCherry протопластов, части которых можно так же проанализировать.
Пример 2. Индукция двухцепочечного разрыва ДНК, мутация и вставка в геном однодольных растений, относящихся к хлебным знакам.
Направленное воздействие на IPK1 в кукурузе для нокаута.
Ген IPK1 кодирует инзитол-1,3,4,5,6-пентакисфосфат 2-киназу, которая участвует в биосинтезе фитата в семенах кукурузы. Фитат, при вскармливании не относящегося к жвачным животным домашнего скота, является антипищевым компонентом, который вносит вклад в загрязнение фосфором окружающей среды. Направленное воздействие на IPK1 может уменьшить фосфор в семенах на 75%. Два паралогичных гена IPK кукурузы обыкновенной, идентичные по последовательности на 98%, существуют в геноме кукурузы. В этом примере последовательность IPK1 на основе идентификационного номера в Genebank EF447274 подвергается направленному воздействию.
Сайт-мишень в нуклеотидной последовательности-мишени:
В экзоне 2 IPK1: TTCTCAAGTCATGAGCAACTC (SEQ ID NO: 35)
Последовательность и свойства белка
Результирующее расщепление заданного сайта-мишени IPK1 с помощью запрограммированного молекулярного комплекса приводит е его мутации или к вставке донорной ДНК в DSB, созданный с помощью запрограммированного комплекса, в соответствии с желанием, которой способствуют эндогенные процессы. Программируемый молекулярный комплекс здесь состоит из 2 идентичных мономеров белкового компонента и двух различных молекул SCNA. В этом примере белковый компонент идентичен таковому примера 1.
В этом примере концевой модификацией нуклеиновой кислоты - SCNA является связанный с NHS-эфиром дигоксигенин (DIG), который присоединен в 5ʹ или 3ʹ положении олигонуклеотида.
Свойства и последовательность SCNA
Конструктивная разработка SCNA является по существу такой, которая описана в примере 1. Длина SCNA комплементарного, подвергающегося спариванию оснований с мишенью олигонуклеотида составляет предпочтительно по крайней мере 18 оснований. SCNA может также содержать небольшое число (например, 1-6, в одном примере - 6, в другом примере - 2) не подвергающихся спариванию оснований с мишенью нуклеотидов (Nʹ) с любым составом последовательности, которые служат в качестве спейсера между концевым модификатором DIG-NHS и комплементарными мишени нуклеотидами.
Нуклеотидные последовательности SCNA, фланкирующие сайт-мишень IPK1.
Были проверены следующих «R» и «L» SCNA, используя 21-п.о. гэп-мишень.
IPK1-SR-1710: /5DIGN/NNNNNNCTGTGGGGCCATATCCCAGAA*C (только нуклеиновые кислоты определены здесь как SEQ ID NO: 36)
IPK1-SL-1688: G*CGGGCACCGAGTTGTATTGTANNNNNN/3DIGN/ (только нуклеиновые кислоты определены здесь как SEQ ID NO: 37)
IPK1-ASR-1710: G*TTCTGGGATATGGCCCCACAGNNNNNN/3DIGN/ (только нуклеиновые кислоты определены здесь как SEQ ID NO: 38)
IPK1-ASL-1688: /5DIGN/NNNNNNTACAATACAACTCGGTGCCCG*C (только нуклеиновые кислоты определены здесь как SEQ ID NO: 39)
Вторая комбинация спаренных «R» и «L» SCNA, используя 24-п.о. гэп-мишень и более короткий линкер SCNA, в соответствии с результатами предсказаний:
IPK1-SR-1712: /5DigN/NNGTGGGGCCATATCCCAGAAC*T (только нуклеиновые кислоты определены здесь как SEQ ID NO: 40)
IPK1-SL-1687: A*GCGGGCACCGAGTTGTATTGTNN/3DigN/ (только нуклеиновые кислоты определены здесь как SEQ ID NO: 41)
IPK1-ASL-1687: /5DigN/NNACAATACAACTCGGTGCCCGC*T (только нуклеиновые кислоты определены здесь как SEQ ID NO: 42)
IPK1-ASR-1712: A*GTTCTGGGATATGGCCCCACNN/3DigN/ (только нуклеиновые кислоты определены здесь как SEQ ID NO: 43)
SCNA включают модифицированную оцДНК. Обозначениями модификаций являются: фосфоротиоатные связи=*; 5ʹ DIG=/5DigN/; 3ʹDIG=/3DigN/).
Эксперимент 2A: Нокаут IPK1 и экспрессия GFP в протопластах.
В этом примере проверяют геномный DSB в растениях кукурузы и специфическую интеграцию последовательности GFP в ген IPK1, порождающую нокаут-мутацию и экспрессию GFP в локусе IPK1. Запрограммированный молекулярный комплекс образует геномный DSB в последовательности IPK1, инициируя интеграцию донорной ДНК в последовательность IPK1 через гомологичную рекомбинацию.
Этот пример, 2A, выполняют на протопластах кукурузы, которые анализируют с помощью FACS в отношении GFP активности.
Рабочий протокол:
Приготовление протопластов:
Анализ транзиторной экспрессии, используя мезофильные протопласты кукурузы (Sheen, 2001), используют вместе с индуцированной электропорацией доставкой нуклеиновых кислот помимо или альтернативно протокола(у) индуцированной полибреном доставки:
Трансфекция на основе (Antonelli & Stadler, 1989):
Свежевыделенные протопласты (приблизительно 2×106) инкубируют в течение приблизительно 6-12 ч с приблизительно 20-50 мкг ДНК для трансфекции, включающей SCNA в виде модифицированных оцДНК, плазмиду, кодирующую белковый компонент, донорную ДНК (где применимо), и 30 мкг поликатиона Полибрена (гексадиметрина бромида). В конце инкубационного периода смесь для трансфекции разбавляют добавлением среды для роста, и клетки затем инкубируют еще в течение приблизительно 30 ч до исследования на предмет транзиторной экспрессии гена:
1. Приготовьте протопласты, и ресуспендируйте 2×106 клеток в 0,5 мл среды для роста на основе Murashige Skoog с 8% маннита (MS2D8M).
2. Для каждого эксперимента готовьте свежий маточный раствор полибрена (Aldrich) (10 мг/мл в забуференном фосфатом солевом растворе, pH 7,0). Он является очень гигроскопическим химическим веществом, и касающиеся безопасности инструкции производителя должны строго применяться. Маточный раствор затем разводят для получения конечной концентрации, составляющей 30 мкг полибрена в 0,1 мл MS2D8M.
3. Желаемую концентрацию ДНК для трансфекции - плазмидной ДНК и SCNA в виде модифицированных оцДНК - суспендируют в 0,4 мл MS2D8M.
4. Смешайте 0,1 мл раствора полибрена (30 мкг) с ресуспендированными протопластами и перенесите в 60-мм чашку Петри.
5. Сразу же добавьте (по каплям) 0,4 мл суспензии ДНК. Смесь протопласт/полибрен/ДНК (общий объем = 1,0 мл) осторожно вращают (25 об/мин) на ротационном шейкере в течение 15 мин и затем инкубируют (в стационарном состоянии) при 28°C в течение 6 ч.
6. После инкубации в течение 6 ч разведите вышеуказанную смесь 4,0 мл MS2D8M, герметизируйте чашку Петри и следуйте процедурам для анализа транзиторной экспрессии гена или для отбора стабильных трансфектантов.
Детекция:
Трансфецированные протопласты кукурузы, суспендированные в растворе MS2D8M, анализируют с помощью проточного цитометра, используя клеточный сортинг с возбуждением флуоресценции (FACS), через 3 дня после трансфекции с использованием полибрена. GFP детектируют посредством возбуждения при 488 нм с эмиссией, детектируемой с использованием 530/30 фильтра. Устанавливают пороговую величину и коэффициенты коррекции для исключения любых ошибочных результатов. FACS используют для отделения подвергнутых направленному воздействию клеток для дальнейшего анализа.
Протопласты подвергают анализу посредством экстракции геномной ДНК и ее амплификации с помощью ПЦР, используя праймеры 1F и 1R, представленные ниже, и осуществляют последующее расщепление BspHI продукта ПЦР. Нерасщепляемые BspHI продукты более-менее схожего с диким типом размера являются результатом событий точного направленного воздействия вместе с неточным перелигированием, продукты ПЦР большего размера являются результатом вставок в сайт-мишень, как требуется.
Праймер 1F: GAGCTAGATAGCAGATGCAGAT (SEQ ID NO: 44)
Праймер 2R: CTCCAGAAAATCCCTAGAAACA (SEQ ID NO: 45)
Альтернативно, продукт ПЦР подвергают ферментативному анализу для детектирования мутаций на основе расщепления CEL I, в соответствии с инструкциями в наборе для детектирования мутаций SURVEYOR (Transgenomics, США). Этот анализ используется для оценки эффективности мутирования ДНК IPK1 посредством направленного воздействия на ген с помощью запрограммированного молекулярного комплекса.
Донорная последовательность для эксперимента 2A: GFP слит с последовательностью IPK1, и, таким образом, экспрессия GFP может произойти только в результате гомологичной рекомбинации (HR). Последовательность всей донорной последовательность является такой, которая представлена в SEQ ID NO: 46. Последовательностью, гомологичной IPK1, необходимой для рекомбинации, являются нуклеотиды 1-621 и 1960-2610 SEQ ID NO: 46, и GFP-кассета кодируется нуклеотидами 622-1959.
Эксперимент 2B: Нокаут IPK и вставка Bar, доставка в каллусы
В этом эксперименте проверяют геномный DSB в растениях кукурузы и специфическую интеграцию гена устойчивости к гербициду bar, придающему устойчивость к биалафосу (фосфинотрицину; глюфосинату аммония; его аналогам или коммерческим гербицидам, таким как Basta, Bayer Crop Science), в ген IPK1, порождающую нокаут-мутацию и экспрессию bar в локусе IPK1. Запрограммированный молекулярный комплекс образует геномный DSB в последовательности IPK1, инициируя интеграцию донорной ДНК в последовательность IPK1 через гомологичную рекомбинацию.
Этот пример выполняют на кукурузных каллусах, которые трансфецируют с помощью бомбардировки ДНК, а затем выращивают в условиях отбора с использованием биалафоса (Basta).
Рабочий протокол:
1. Образование эмбриогенного каллуса: незрелые эмбрионы 1,6 мм - 1,8 мм (Растения A188XB73 или A188XB84), условия поста: свет 10 микроЭйнштейн⋅м-2⋅сек-1 24°C в среде N6, содержащей 2 мг/л глицина, 2,9 г/л L-пролина, 100 мг/л гидролизата казеина, 13,2 мг/л дикамбы или 1 мг/л 2,4D, 20 г/л сахарозы, pH 5,8. Загущенная с использованием 2 г/л Gelgro.
2. Бомбардировка плазмидной ДНК и SCNA-модифицированных оцДНК в каллусы на основе метода, использованного (Gordon-Kamm et. al, 1990).
3. Перенос каллусов в условия роста, описанные в примере 2A, с конечной концентрацией = 2,5 мг/л биалафоса в среде (B0178 Gold Biotechnology, 1328 Ashby Rd., St. Louis, MO 63132 U.S.A.).
4. Каллусы перемещают в новую среду каждые 2 недели.
5. Каллусы, выращиваемые в течение 2 месяцев на биалафосе, устойчивы к гербициду и могут быть подвергнуты анализу с использованием ПЦР или регенерации.
6. Регенерированные растения и устойчивы к Basta, и имеют уменьшенные уровни фитата.
Детекция и анализ:
Каллусы, подвергнутые бомбардировке SCNA-модифицированными оцДНК, плазмидой, кодирующей белковый компонент программируемого молекулярного комплекса, и донорной ДНК, содержащей экспрессионную кассету с CDS гена устойчивости bar, выращивают в среде для регенерации, содержащей 2,5 мг/л биалафоса. Только каллусы, которые включают клетки, в которых кодирующая последовательность гена bar интегрирована в локус IPK1 благодаря HR, способны расти в этих условиях, по этой причине материал растения, все еще разрастающийся спустя 1 месяц на этой среде, считается модифицированным по геному, как требуется.
В соответствии с этой разработки, в то время как кассета устойчивости bar интегрируется в геном с помощью HR, чтобы функционировать соответствующим образом, кодирующая дифтерийный токсин А Corynebacterium (DT-A) кассета является автономной кассетой, которая экспрессирует DT-A в условиях теплового шока (HS) (42°C). Соответственно, для дальнейшего анализа, каллусы делят на HS-индуцируемые кассусы и неиндуцируемые каллусы. Только каллусы, которые содержат идеальное событие HR, не экспрессируют DT-A. Каллусы, которые содержат случайным образом интегрированную плазмиду, которая содержит и донорную ДНК, и кодирующую DT-A кассету, экспрессируют DT-A и, следовательно, погибают.
Кроме того, каллусы подвергают анализу с помощью ПЦР, используя праймеры 1F и 1R, представленные в примере 2A, с последующим расщеплением продукта, как указано выше, с использованием BspHI.
Донорная последовательность для эксперимента 2B:
Плазмида-донор содержит как кассету устойчивости bar, которая встраивается в сайт расщепления IPK1, так и кодирующую DT-A кассету, которая не должна подвергаться рекомбинации с локусом IPK1, в качестве маркера события неспецифической интеграции. Кассета устойчивости bar фланкирована последовательностями, гомологичными IPK1 (нуклеотидами 1-621 и 2338-2988 SEQ ID NO: 47), необходимыми для HR, в то время как кодирующая DT-A кассета находится вне сайта, фланкированного гомологичными последовательностями. Кассета bar (нуклеотиды 622-2337 SEQ ID NO: 47) содержит конститутивный промотор 35S CaMv; CDS гена bar Streptomyces hygroscopicus для фосфинотрицин-ацетилтрасферазы, придающей устойчивость к глюфосинату аммония (нуклеотиды 1526-2078 SEQ ID NO: 47); и терминатор NOS - 3ʹ от CDS bar.- Полная донорная последовательность 2В представлена в SEQ ID NO: 47.
В той же плазмиде, вторая кассета, кодирующая дифтерийный токсин A, DT-A, (из GenBank: AB535096.1) под контролем индуцируемого тепловым шоком промотора (HS-промотором Arabidopsis HSP18.2 из GenBank: X17295.1) и с окончанием терминатором NOS, имеет последовательность, представленную в SEQ ID NO: 48.
ПРИМЕР 3. Индукция заданных хромосомных двухцепочечных разрывов (DSB) в живых клетках Arabidopsis.
Фермент фитоендесатураза (PDS) участвует в превращении фитоена в зета-каротин при биосинтезе каротиноида. Разрушение фитоендесатуразы Arabidopsis приводит к фенотипу альбиноса и карликовости. Этот фенотип объясняется нарушенным биосинтезом хлорофилла, каротиноида и гиббереллина. Таким образом, мутация в этом гене является фенотипически выявляемой.
Эксперимент 3A:
В этом примере специфически индуцируют хромосомный двухцепочечный разрыв (DSB) в эндогенном гене PDS для создания точечной мутации через сдвиг рамки считывания, таким образом выключения функцию гена, используя эндогенный путь с использованием NHEJ.
Эксперимент 3B:
В этом примере специфически индуцируют хромосомный двухцепочечный разрыв (DSB) в эндогенном гене PDS для создания вставки донорной последовательность mCherry в эндогенную последовательность PDS для нокаута PDS с помощью гомологичной рекомбинации, используя программируемый молекулярный комплекс.
Для примеров 3A-3B используют биоанализ на основе протопластов Arabidopsis. В этом биоанализе в протопласты доставляется плазмида, экспрессирующая белковый компонент молекулярного комплекса in-vivo, и совместно доставляется пара придающих специфичность нуклеиновых кислот (SCNA) в виде оцДНК, модифицированных, в этом примере, с использованием флуоресцеина (6-карбокси-флуоресцеина, 6-FAM) на конце, при этом каждая SCNA имеет такую модификацию или на 3ʹ-конце, или на 5ʹ-конце (/36-FAM/ и /56-FAM/, соответственно). На противоположный конец добавлена вторая модификация для защиты от экзонуклеазы, такая как фосфоротиоат, которая может быть внутренними фосфоротиатными связями для защиты от экзонуклеазы. В этом примере последовательность, кодирующую белковый компонент, и донорную ДНК доставляют одновременно на одной плазмиде, используя протокол для трансфекции с использованием ПЭГ (Wu et. al, 2009). Модифицированные оцДНК-SCNA получают синтетически и доставляют вместе с плазмидой, используя ПЭГ, как указано выше.
Последовательность и свойства белка
В этом примере белковый компонент, кодируемый плазмидой, содержит аминокислотную последовательность, заимствованную из нуклеазного домена FokI, в качестве функционального домена; аминокислотную последовательность, заимствованную из одноцепочечного Fv-фрагмента (scFv) иммуноглобулина против флуоресцеина (номера доступа в базе данных о структуре белков - 1X9Q, 1FLR_H), в качестве связующего домена; SV40NLS (PKKKRKV: SEQ ID NO: 3) в качестве домена ядерной локализации и ~15A междоменный соединитель (GGSGG: SEQ ID NO: 7).
Таким образом, белковый компонент молекулярного комплекса, описанный в этом примере, имеет аминокислотную последовательность, представленную в SEQ ID NO: 49, и кодируется нуклеотидной последовательностью, представленной в SEQ ID NO: 50.
Придающая специфичность нуклеиновая кислота (SCNA) этого примера модифицирована посредством добавления флуоресцеин-ScFv/6-FAM, 6-карбоксифлуоресцеин - флуоресцеин dT, который включает C6-линкер, на один конец каждой SCNA.
Свойства и последовательность SCNA
Конструкция SCNA по существу идентична той, которая описана в примере 1. Длина SCNA комплементарного, подвергающегося спариванию оснований с мишенью олигонуклеотида составляет предпочтительно по крайней мере 18 оснований. SCNA может также содержать небольшое число (например, 1-6, в одном примере - 6, в другом примере - 2) не подвергающихся спариванию оснований с мишенью нуклеотидов (N) с любым составом последовательности, которые служат в качестве спейсера между концевым модификатором 6-FAM и комплементарными мишени нуклеотидами.
Последовательность-мишень:
Последовательностью-мишенью является: GTCCTGCTAAGCCTTTGAAAG (SEQ ID NO: 51), находящаяся в экзоне 2 последовательности PDS Arabidopsis (GI:5280985, ген dl3145c, ID белка = "CAB10200.1).
Варианты последовательностей SCNA:
Мишенями SCNA может быть любая из двух цепей, таким образом, для представленной мишени существуют 4 варианта пар SCNA:
Гибридизующиеся со смысловой цепью (S) SCNA:
PDS-SL1-846: GCATCCTTCCGTAGTGCTCCTCNNNNNN/36-FAM/ (только нуклеиновые кислоты определены здесь как SEQ ID NO: 52)
PDS-SR1-868: /56-FAM/NNNNNNTTGTAATTGCTGGTGCTGGTAT (только нуклеиновые кислоты определены здесь как SEQ ID NO: 53)
Гибридизующиеся с антисмысловой цепью (AS) SCNA:
PDS-ASL1-846: /56-FAM/NNNNNNGAGGAGCACTACGGAAGGATGC (только нуклеиновые кислоты определены здесь как SEQ ID NO: 54)
PDS-ASR1-868: ATACCAGCACCAGCAATTACAANNNNNN/36-FAM/ (только нуклеиновые кислоты определены здесь как SEQ ID NO: 217)
SCNA для разнородных цепей:
PDS-SL1-846: GCATCCTTCCGTAGTGCTCCTCNNNNNN/36-FAM/ (только нуклеиновые кислоты определены здесь как SEQ ID NO: 52)
PDS-ASR1-868: ATACCAGCACCAGCAATTACAANNNNNN/36-FAM/ (только нуклеиновые кислоты определены здесь как SEQ ID NO: 217)
PDS-SR1-868: /56-FAM/NNNNNNTTGTAATTGCTGGTGCTGGTAT (только нуклеиновые кислоты определены здесь как SEQ ID NO: 53)
PDS-ASL1-846: /56-FAM/NNNNNNGAGGAGCACTACGGAAGGATGC (только нуклеиновые кислоты определены здесь как SEQ ID NO: 54)
Второй набор комбинаций спаренных «R» и «L» SCNA, используя 24-п.о. гэп-мишень и более короткий линкер SCNA, в соответствии с результатами предсказаний:
PDS-SL2-845: TGCATCCTTCCGTAGTGCTCCTNN/36-FAM/ (только нуклеиновые кислоты определены здесь как SEQ ID NO: 55)
PDS-SR2-870: /56-FAM/NNGTAATTGCTGGTGCTGGTATGT (только нуклеиновые кислоты определены здесь как SEQ ID NO: 56)
PDS-ASL2-845: /56-FAM/NNAGGAGCACTACGGAAGGATGCA (только нуклеиновые кислоты определены здесь как SEQ ID NO: 57)
PDS-ASR2-870: ACATACCAGCACCAGCAATTACNN/36-FAM/ (только нуклеиновые кислоты определены здесь как SEQ ID NO: 58)
PDS-SL2-845: TGCATCCTTCCGTAGTGCTCCTNN/36-FAM/ (только нуклеиновые кислоты определены здесь как SEQ ID NO: 55)
PDS-ASR2-870: ACATACCAGCACCAGCAATTACNN/36-FAM/ (только нуклеиновые кислоты определены здесь как SEQ ID NO: 58)
PDS-SR2-870: /56-FAM/NNGTAATTGCTGGTGCTGGTATGT (только нуклеиновые кислоты определены здесь как SEQ ID NO: 56)
PDS-ASL2-845: /56-FAM/NNAGGAGCACTACGGAAGGATGCA (только нуклеиновые кислоты определены здесь как SEQ ID NO: 57)
/56-FAM/ символизирует 5ʹ-модификацию в оцДНК-SCNA, включающую 6-FAM (6-карбокси-флуоресцеин). /36-FAM/ символизирует 3ʹ-модификацию в оцДНК-SCNA, включающую 6-FAM (6-карбокси-флуоресцеин). N символизирует любой нуклеотид.
Донорной последовательностью является DONOR PD-MCHERRY-S, имеющий последовательность, представленную в SEQ ID NO: 59 (кодирующая mCherry ORF соответствует нуклеотидам 662-1372 SEQ ID NO: 59).
Доставка
Постановка биоанализа: Приготовление протопластов Arabidopsis основывается на (Wu et. al, 2009) и схоже с таковым примера 1 с различиями в стадии трансфекции:
Трансфекция:
1. Приготовьте свежий раствор ПЭГ для трансфекции в 2-мл пробирке.
2. Вылейте BSA из 6-луночных планшетов и высушите.
3. Смешайте ~5×104 протопластов (2×104-1×105) в 0,2 мл раствора MMg со смесью донорной плазмидной ДНК (в соответствующих случаях), экспрессирующей белковый компонент плазмидной ДНК и оцРНК-SCNA до всего 30-40 мкг при комнатной температуре в 15-мл круглодонных пробирках (с герметическим колпачком с защелкой). В альтернативном случае донорную ДНК и экспрессирующую белковый компонент ДНК конструируют и доставляют в одной плазмиде.
4. Добавьте равный объем (0,2 мл протопластов+средний объем приготовления) свежего раствора ПЭГ.
5. Инкубируйте при комнатной температуре в течение 5 мин.
6. Промойте, медленно добавляя 3 мл раствора W5, 1 мл за раз, и смешивая.
7. Осуществите центрифугирование при 100 × g в роторе с корзинами (swing-out) в течение 1 мин.
8. Повторите промывку и осаждение.
9. Ресуспендируйте в 1 мл раствора W5.
10. Налейте в покрытые BSA планшеты.
11. Выращивайте протопласты в условиях 16-ч дневного оптимального света (150 микроЭйнштейн.м-2.сек-1) при 22°C, заменяя среды в соответствии с необходимостью.
Анализ
В эксперименте 3A, ДНК из объединенных протопластов анализируют с помощью ПЦР и анализа рестрикционных фрагментов продукта ПЦР.
ПЦР выполняют с использованием праймеров:
ПЦР-праймера 2F: TGGTTGTGTTTGGGAATGTTTCT (SEQ ID NO: 60); и
ПЦР-праймера 2R: TATCCAAAAGATATCTTCCAGTAAAC (SEQ ID NO: 61)
Отмена расщепления рестриктазой DdeI в по крайней мере части амплифицированной ДНК указывает на успешное в по крайней мере некоторой степени направленное воздействие на ген и направленную мутацию геномной матрицы.
В эксперименте 3B донорная ДНК, кодирующая mCherry, сливается в рамке считывания с эндогенным геном PDS. мРНК, продуцируемая с этого гена, кодирует разорванный PDS, слитый с полным mCherry, за которым сразу же следует стоп-кодон («PD-mCherry»). Протопласты, суспендированные в растворе W5, подвергают скринингу в отношении активности mCherry через 3 дня после трансфекции, используя устройство - автоматический проточный цитометр (FACS). Протопласты с модифицированным PDS детектируют с помощью анализа с использованием FACS, причем вставку mCherry-донора можно детектировать по флуоресценции mCherry, используя длину волны для возбуждения = 561 нм и детектирование эмиссии при 590-630 нм. Устанавливают пороговую величину и коэффициенты коррекции для исключения любых ошибочных результатов.
Определение дополнительных характеристик в обоих экспериментах осуществляют посредством регенерации протопластов на подходящих средах и исследования их последующей фенотипической характеристики, причем обесцвеченные растения или каллусы означают успешное направленное воздействие на ген.
ПРИМЕР 4. In-vivo направленное воздействие на геномную ДНК и замена гена в двудольном растении табака.
Замена гена ALS в табаке и создание устойчивых к гербицидам растений: Ацетолактатсинтаза (ALS) является ферментом в путях биосинтеза валина, лейцина и изолейцина в растениях. Мутации в этом гене приводят к устойчивости к нескольким гербицидам. Например, установлено, что мутации в гене SuRB в табаке обеспечивают устойчивости к следующим гербицидам: S647T - имазаквину, P191A - хлорсульфурону, W568L - хлорсульфурону и имазаквину.
В этом примере, мишенью является ALS табака, чтобы заменить ген дикого типа на мутированный вариант, приводящий к устойчивости к гербициду, посредством замены гены, опосредованной гомологичной рекомбинацией с содействием.
Экспрессию и сборку запрограммированного молекулярного комплекса в растениях табака выполняют здесь в две стадии. Доставку белкового компонента осуществляют посредством инфицирования растения табака вирусным вектором для экспрессии белка на основе вируса погремковости табака, таким как вектор, модифицированный исходя из pTRV2 (Vainstein et. al, 2011) для доставки и экспрессии программируемого белкового компонента в полевых условиях.
Доставку SCNA в растения, экспрессирующие белковый компонент, осуществляют посредством инфицирования растений Agrobacterium, содержащими T-ДНК, кодирующую и пару РНК-SCNA, и донорную последовательность.
РНК-SCNA в этом примере связывается со связующим доменом белкового компонента молекулярного комплекса, используя 20-нуклеотидную связывающуюся последовательность шпильки РНК бокса-B из бактериофага φ21 (SEQ ID NO: 62: 5ʹ-UUCACCUCUAACCGGGUGAG-3ʹ) в качестве «нуклеотидного мотива SCNA», схематически представленную в качестве примера на фиг. 1B.
Связующий домен в этом примере происходит из РНК-связывающего белка (RBP) - N-белка бактериофага φ21 (SEQ ID NO: 63: Nʹ-GTAKSRYKARRAELIAER-Cʹ). В примере, представленном здесь, шпилька находится не на мишени, а на SCNA, и действие связывающего белка, таким образом, не ограничивается сайтом специфического распознавания в самой РНК-мишени, но использоваться для направленного воздействия на любую последовательность, в том числе ДНК, в зависимости исключительно от вариабельной последовательности, подвергающейся спариванию оснований с мишенью, SCNA рядом с невариабельной RBP-связывающей шпилькой.
Нуклеиновой кислотой (геном) - мишенью в этом примере является SuRB (№ доступа в GenBank GI:19778), а желаемой аминокислотной мутацией является P191A - придающая устойчивость к хлорсульфурону. Таким образом:
Неизмененная исходная последовательность: GGTCAAGTGCCACGTAGGATG (SEQ ID NO: 64)
Индуцированная мутация: GGTCAAGTGGCGCGCAGGATG (SEQ ID NO: 65)
Последовательности компонентов белковой составляющей:
Компоненты:
1. N-белок бактериофага φ21 (SEQ ID NO: 63: GTAKSRYKARRAELIAER) на или вблизи Nʹ-конце(а), поскольку в полноразмерном N-белке РНК-связывающий пептид находится на N-конце.
2. Нуклеаза FokI

3. SV40-NLS: (SEQ ID NO: 67: MPKKKRKV)
4. Междоменные соединители: различные полиаминокислотные линкеры проверяют в отношении оптимального действия запрограммированного молекулярного комплекса.
В этом примере проверяют два возможных варианта белковой сборки:
1. Первый вариант, (представленный в SEQ ID NO: 68), в котором N-белок (NP) φ21 установлен на Nʹ-конце белкового компонента программируемой молекулярной конструкции, а сигнал ядерной локализации, SV40NLS, находится на Cʹ-конце, и междоменным линкером является GGSGG (SEQ ID NO: 7). Эта белковая сборка кодируется последовательностью нуклеиновой кислоты, представленной в SEQ ID NO: 69.
Пространственные измерения, сделанные на основе компьютерных пространственных моделей для варианта Nʹ NP φ21 вместе с системой шпильки РНК бокса-B и междоменным линкером GGSGG (SEQ ID NO: 7), как представлено в этом примере, привели к заключению, что предполагаемое оптимальное расстояние между SCNA составляет, в присутствии одного «Nʹ» в SCNA, приблизительно 26-30 нуклеотидов. Расщепление, как предсказывают, будет происходить приблизительно ±2 нуклеотида слева и справа от 13-ого - 17-ого нуклеотида, считая от последнего нуклеотида, гибридизующегося с SCNA, с любой стороны, учитывая 5ʹ-концевую избыточность из 4-оснований, создаваемую в результате расщепления дцДНК подвергнутой димеризации конструкцией. Этот критерий означает, что, если подвергаемой направленному воздействию последовательностью является 28-нуклеотидная последовательность в этом примере:
AAAAAAAAAYYYYYYYYYYXXXXXXXYYYYYYYYYYCCCCCCCCCC,
где Y+X представляет собой число нуклеотидов между сайтами, подвергающими спариванию оснований с SCNA, то сконструированные SCNA подвергаются спариванию оснований с областями A и C, и расщепление, приводящее к DSB, происходит в или вблизи области X. SCNA могут быть комплементарны или смысловой, или антисмысловой цепи, но предпочтительно выбирают те, которые подвергаются спариванию оснований со смысловой (нетранскрибируемой) последовательностью. Обе SCNA могут подвергаться спариванию оснований с одной и той же цепью, поскольку белковый компонент находится на «ближайшем конце» SCNA, который определяется 5ʹ или 3ʹ модификацией праймера, находящейся на «ближайшем конце».
Варианты последовательностей SCNA:
SCNA подвергаются спариванию оснований с последовательностями, фланкирующими сайт-мишень, который должен быть расщеплен, в любой из двух цепей, таким образом, для представленной мишени, используя 28-п.о. гэп-мишень: существуют 4 варианта пар SCNA:
Пара гибридизующихся со смысловой цепью (S) SCNA:
SuRB_P191_SR1 586:
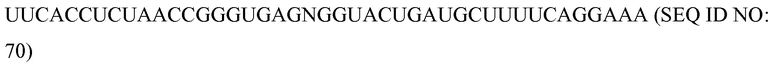
SuRB_P191_SL1 557:
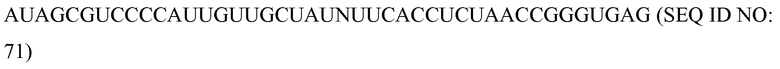
Пара гибридизующихся с антисмысловой цепью (AS) SCNA:
SuRB_P191_ASR1 586:
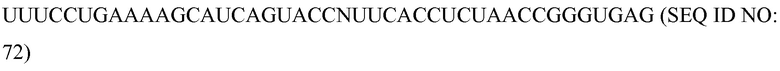
SuRB_P191_ASL1 557:
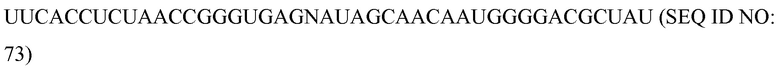
И все комбинации гибридизующихся со смысловой и антисмысловой цепями пар, всегда выбирая одну правую (R) и одну левую (L) SCNA:
В этом примере проверен второй вариант белковой сборки, в которой N-белок (NP) φ21 установлен на Cʹ-конце белкового компонента, а SV40NLS - на Nʹ-конце. В этой конструкции используется междоменный соединитель с последовательностью GGSGGESK (SEQ ID NO: 74).
Собранный программируемый белковый компонент на основе NP φ21 этого примера имеет аминокислотную последовательность, представленную в SEQ ID NO: 75, и кодируется последовательностью нуклеиновой кислоты, представленной в SEQ ID NO: 76.
Результаты пространственных измерений, сделанных на основе компьютерных пространственных моделей для варианта Cʹ NP φ21 вместе с системой шпильки РНК бокса-B и междоменным линкером GGSGGESK (SEQ ID NO: 74), как представлено в этом примере, привели к заключению, что предполагаемое оптимальное расстояние между SCNA составляет, в присутствии одного «N» в SCNA, приблизительно 22-24 нуклеотидов. Расщепление, как предсказывают, будет происходить приблизительно ±2 нуклеотида слева и справа от 11-ого, 12-ого или 13-ого нуклеотида, считая от последнего нуклеотида, гибридизующегося с SCNA, с любой стороны, учитывая 5ʹ-концевую избыточность из 4-оснований, создаваемую в результате расщепления дцДНК подвергнутой димеризации конструкцией. Этот критерий означает, что, если подвергаемой направленному воздействию последовательностью является, например, 23 нуклеотидная последовательность: AAAAAAAAAAYYYYYYYYXXXXXXXYYYYYYYYCCCCCCCCCC, где Y+X представляет собой число нуклеотидов между сайтами, подвергающими спариванию оснований с SCNA, то сконструированные SCNA подвергаются спариванию оснований с областями A и C, и расщепление, приводящее к DSB, происходит в или вблизи области X. SCNA могут быть комплементарны или смысловой, или антисмысловой цепи, но предпочтительно выбирают те, которые подвергаются спариванию оснований со смысловой (нетранскрибируемой) последовательностью. Обе SCNA могут подвергаться спариванию оснований с одной и той же цепью, поскольку белковый компонент находится на «ближайшем конце» SCNA, который определяется 5ʹ или 3ʹ модификацией праймера, находящейся на «ближайшем конце».
Варианты последовательностей SCNA:
SCNA подвергаются спариванию оснований с последовательностями, фланкирующими сайт-мишень, который должен быть расщеплен, в любой из двух цепей, используя 31-п.о. гэп-мишень, что приводит к 4 вариантам пар SCNA:
Пара гибридизующихся со смысловой цепью (S) SCNA:
SuRB_P191_SR1-588:
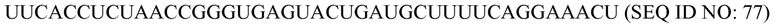
SuRB_P191_SL1-556:
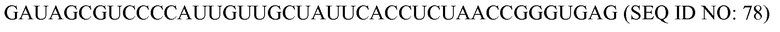
Пара гибридизующихся с антисмысловой цепью (AS) SCNA:
SuRB_P191_ASR1-588:
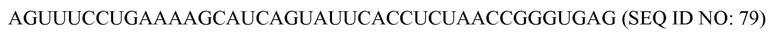
SuRB_P191_ASL1-556:
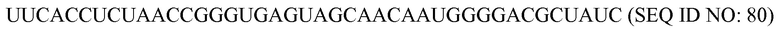
Комбинации гибридизующихся со смысловой и антисмысловой цепями пар:
SuRB_P191_SR1-588:
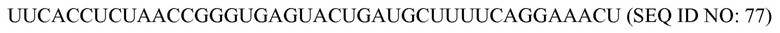
SuRB_P191_ASLl-556:
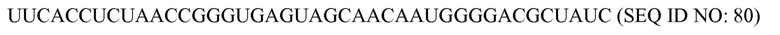
SuRB_P191_SL1-556:
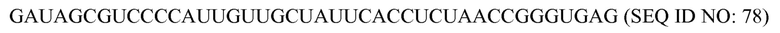
SuRB_P191_ASR1-588:
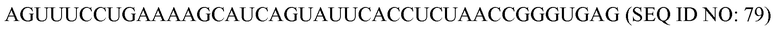
Второй набор комбинаций спаренных «R» и «L» SCNA, используя 23-п.о. гэп-мишень и короткий линкер (один N) SCNA, в соответствии с результатами предсказаний:
Гибридизующиеся со смысловой цепью (S):
SURB_P191_SR2-584:
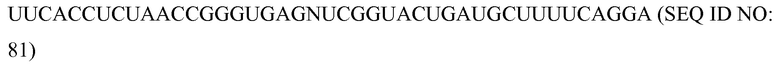
SURB_P191_SL2-560:

Гибридизующиеся с антисмысловой цепью (AS):
SuRB_P191_ASR2-584:
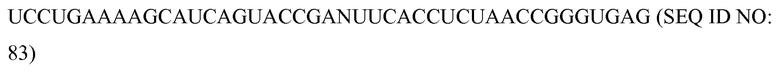
SuRB_P191_ASL2-560:
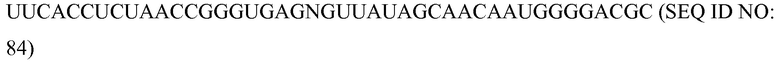
Или комбинации «R» и «L» SCNA из второго набора.
UUCACCUCUAACCGGGUGAG (SEQ ID NO: 62) является 20-нуклеотидой связывающейся последовательностью шпильки РНК бокса-B из бактериофага φ21 и функционирует в качестве связывающегося со связующим доменом сегмента SCNA (схематически помеченного как «нуклеотидный мотив SCNA» на фиг. 1B).
Кодирующая последовательность ALS SURB CDS (неизмененная) представлена в SEQ ID NO: 85.
DONOR1 P191A: донор имеет измененную нуклеотидную последовательность, чтобы создать мутацию с заменой пролина на аланин (P191A) и чтобы сделать возможным рестрикционный анализ. Последовательность этого донора представлена как SEQ ID NO: 86. Измененная последовательность является последовательностью, соответствующей нуклеотидам 544-591 SEQ ID NO: 86.
Способ:
В этом примере являющиеся природными хозяевами растения петуньи, растения Nicotiana tabacum или N. benthamiana сначала инфицируют вектором на основе pTRV или основе pTRVdelta2b (Vainstein et. al., 2011), который предназначен для экспрессии, в этом примере, программируемой молекулярной конструкции под контролем вирусного субгеномного промотора. Через приблизительно 5-21 день после инфицирования листья растений собирают, и сок растений, используемый здесь в качестве инокулята, экстрагируют посредством раздавливания листьев в фосфатном буфере (20 мМ, pH 6,8), необязательно дополненном неионным ПАВ, таким как Silwet L-77 (приблизительно 0,015%). За осветлением раствора с помощью центрифугирования и/или марли необязательно следует пропускание через 0,22 мкм фильтр. Фильтрование необходимо в случае инъекции в растения, выращиваемые из культуры тканей. Одновременно, часть листа анализируют в отношении стабильности вирусной конструкции посредством экстракции РНК, обратной транскрипции РНК, используя праймер 3ʹ от сайта вставки чужеродного гена, амплификации кДНК с помощью ПЦР, используя праймеры, охватывающие сайт вставки чужеродного гена, и электрофореза одновременно с аналогично амплифицированной с помощью ПЦР плазмиды pTRV, первоначально использованной для инокуляции. Растения табака-мишени, возрастом приблизительно 1 месяц, затем инфицируют посредством легкого истирания их листьев с использованием карбида кремния и натирания соком поверхности листьев. Эти растения можно выращивать in-vitro или иначе. Самореплицирующийся вектор на основе TRV, несущий программируемый молекулярный комплекс, инфицирует растения и распространяется системно на листья, меристему и не подвергнутые инфицированию ткани и органы. Когда указанный комплекс все еще является незапрограммированным, он является неактивным в качестве нуклеазы.
После системного распространения по всему растению (через приблизительно 5-7 дней) самореплицирующегося вектора на основе TRV, следовательно, экспрессирующего программируемый белковый компонент молекулярного комплекса, листовые пластины иссекают в стерильных условиях. Транзиторную экспрессию в листовых пластинах осуществляют способом, схожим с таковым (Gallois & Marinho, 1995). Вкратце, пластины подвергают вакуум-инфильтрации с использованием подходящего штамма Agrobacterium (например, EHA105), предварительно трансформированного одной бинарной плазмидой (например, pRCS, pSOUP+pGreen, или другим подходящим бинарным вектором), кодирующей между ее последовательностями RB и LB одну из комбинаций двух транскриптов SCNA SuRB_P191, представленную выше (смотрите также фиг. 9 и фиг. 8A ради схематических иллюстраций), под контролем двух, идентичных или отличных, конститутивных промоторов растений, таких как CaMV 35S или NOS или OCS, и несущей также последовательность Donorl P191A. SCNA транскрибируются после импортирования T-цепи в клетку, собираются вместе с программируемым белком с образованием запрограммированного молекулярного комплекса, который затем импортируется в ядро, где он специфически осуществляет расщепление DSB в локусе SurB в геномной ДНК табака. Донорная ДНК из T-ДНК затем подвергается рекомбинации с геном SurB вблизи этого DSB, вызывая желаемую мутацию. Листовые пластины помещают в селективную среду, содержащую 420 нМ хлорсульфурон, как описано Kochevenko (Kochevenko & Willmitzer, 2003) в подробном протоколе, представленном ниже. Agrobacterium уничтожают с помощью подходящего антибиотика (карбенициллин 250 мкг/мл+ванкомицин 250 мкг/мл), и каллусам, развивающимся из листовых пластин, позволяют образовывать корни, превращающиеся в устойчивые к гербициду растения с модифицированным геномом. Регенерирующиеся растения подвергают скринингу на предмет устойчивости к хлорсульфурону в среде Murashige и Skoog, содержащей 420 нМ хлорсульфурон, как описано Kochevenko и др. Только растения, которые растут на хлорсульфуроне, имеют измененный ген ALS, что означает, что ALS был подвергнут направленному воздействию запрограммированного молекулярного комплекса, и что донор подвергся соответствующей рекомбинации в соответствующее положение.
Анализ, позволяющий принять решение в отношении успешных событий замены гена, осуществляют посредством проведения ПЦР на геномной ДНК, экстрагированной из частей регенерированных растений табака. В измененной последовательности сайт для рестриктазы AgeI аннулирован, а сайты для BssHII и KpnI добавлены. Таким образом, амплификация с помощью ПЦР фрагмента, охватывающего сайт замены в гене SuRB, и расщепление фрагмента ПЦР с помощью AgeI, BssHII и KpnI дает диагностическую характеристику, позволяющую опознать успешную замену гена. Эти растения затем скринируют для устранения тех, которые имеют нежелательную интегрированную T-ДНК, посредством экстракции ДНК и амплификации с помощью ПЦР не относящегося к SuRB участка кодирующей SCNA T-ДНК.
Подробный протокол для трансформации с использованием Agrobacterium:
1. Получите 2 мл ночной культуры Agrobacterium (трансформированной бинарной плазмидой, кодирующей транскрипты SCNA и несущей донорную ДНК).
2. Ресуспендируйте в 4 мл среды для индукции (1 л: 10,5 г K2HPО4, 4,5 г KH2PО4, 1 г (NH4)2SО4, 0,5 г цитрата натрия, 1 г глюкозы, 4 г фруктозы, 4 г глицерина, 0,12 г MgSО4, 1,95 г MES pH 5,6), добавьте ацетосирингон до конечной концентрации = 100 мкМ.
3. Выращивайте при 30°C в течение 6 ч.
4. Соберите бактерии с помощью центрифугирования при 3000 × g в течение 5 мин.
5. Ресуспендируйте в среде для инфильтрации (10 мМ MgSО4, 10 мМ MES pH 5,6), содержащей 200 мкМ ацетосирингон до конечной ОП600=0,4.
6. Возьмите листовые пластины диаметром = 4-12 мм и инкубируйте в растворе для бактериальной инфильтрации (стадии 5) в течение 30 мин.
7. Поместите листовые пластины в среду для регенерации (1 л: 4,3 г MS, 30 г сахарозы, 100 мг миоинозита, pH 5,6, 10 г агара, добавьте NAA и BA до конечной концентрации - 100 мкг/л NAA и 3 мг/л BA). Инкубируйте в течение 48 ч при 20-25°C.
8. Переместите листовые пластины в новую среду для регенерации, содержащую антибиотик карбенициллин (0,3 мг) и гербицид хлорсульфурон (420 нМ). Перемещайте в новую среду каждый 21 день.
9. Отрежьте корни больше чем 10 мм и переместите в 1/2 MS среду для укоренения (1 л: 2,15 г MS, 10 г сахарозы, 0,5 г MES pH=5,7 с использованием KOH, 10 г агара).
ПРИМЕР 5. Направленная химическая модификация ДНК, используя запрограммированный молекулярный комплекс.
В этом примере проверяют специфическое метилирование ДНК в заданном положении.
Метилирование ДНК катализируют ДНК-метилтрансферазы, которые переносят метильную группу (-CH3) с S-аденозил-L-метионина в C-5 положение остатков цитозина. Три активных ДНК-метилтрансферазы, DNMT1, DNMT3A и DNMT3B, были идентифицированы у людей и мышей. Метилированием в этих примерах является метилирование ДНК в цитозине последовательности CpG. Эти ферменты относятся к классу S-аденозилметионин-зависимых метилтрансфераз (SAM или AdoMet-MTase), классу I; AdoMet-MTase являются ферментами, которые используют S-аденозил-L-метионин (SAM или AdoMet) в качестве субстрата для переноса метильной группы, создавая продукт S-аденозил-L-гомоцистеин (AdoHcy).
DNMT3A
Оба семейства метилтрансфераз DNMT1 и DNMT3 содержат высококонсервативные C-5 метилтрансферазные мотивы на своих C-концах, но они не демонстрируют схожесть последовательностей своих N-концевых районов. DNMT3A также связывается с деацетилазами и пополняется последовательность-специфическим репрессором для сайленсинга транскрипции. DNMT3A связывается с гистон-деацетилазой HDAC1, используя свой домен гомологии ATRX. Этот домен DNMT3A представляет собой домен независимого репрессора транскрипции, для действий которого, относящихся к сайленсингу, требуется HDAC активность. DNMT3A действует в качестве белка-корепрессора, обладающего деацетилазной активностью, и может быть направлена на специфические регуляторные центры благодаря своей связи с ДНК-связывающим фактором транскрипции. DNMT3A также кооперирует с RP58 для репрессии транскрипции зависимым от метилирования образом. В этом примере метилтрансферазная активность локализуется в специфическом локусе, используя SCNA.
В этом примере часть Cʹ DNMT3A используется для конструирования программируемого молекулярного комплекса на основе метилтрансферазы. Домены PWWP, которые направляют DNMT3A в перицентрический гетерохроматин, белковые домены «цинковые пальцы», домены ADD, район ATRX, который является причиной ее связи с гистон-деацетилазой HDAC1, и вся регуляторная Nʹ-часть белка удалены, сохраняя район, включающий район AdoMet_MTase (www.uniprot.org Q9Y6K1). C-концы DNMT3A и B содержат каталитический домен. В DNMT3A активным центром является C710 (нумерация основана на транслированном белке с № доступа в GenBank - AF067972.2).
DNMT3A образует гетеротетрамерный комплекс DNMT3L:DNMT3A:DNMT3A:DNMT3L. DNMT3L является неактивным в качестве метилазы, а DNMT3A может подвергаться димеризации и является активным без DNMT3L. DNMT3A является функциональным в гомодимерной форме. Комплекс демонстрирует специфические контакты на стыке гомодимера DNMT3A (стыке димера), и димеризация приводи к разделению двух активных центров ферментов одним поворотом спирали, в случае ДНК B-формы. Таким образом, димер запрограммированного молекулярного комплекса, локализованный в специфическом локусе с помощью SCNA, может вызывать метилирование цитоцинов в сайтах CpG с интервалом приблизительно 10-11 пар оснований. Для дальнейшего ограничения взаимодействий DNMT3A с DNMTL в этом примере используют мутацию R729A в C-концевом районе AdoMet_MTase. Мутанты DNMT3A, которые образуют димеры вместо тетрамеров на ДНК, являются R771A, E733A, R729A, F732A и Y735A.
Для проверки способности молекулярного комплекса этого примера к выполнению направленного специфического метилирования заданной последовательность ДНК используют плазмиду в качестве нуклеиновой кислоты-мишени. Направленное метилирование в различных положениях гена, кодирующего mCherry, в обеих цепях проверяют на плазмиде pSAT6-mCherry с помощью чувствительного к метилированию рестрикционного анализа.
Детектирование трансфецированных клеток осуществляют с помощью анализа с использованием FACS с использованием возбуждения при длине волны = 561 нм и детектирования эмиссии с использованием 610/20 фильтра.
Конструирование белкового компонента:
В этом примере белок, кодируемый доставляемой плазмидой, содержит аминокислотную последовательность, заимствованную из района AdoMet_Mtase, содержащую каталитический центр метилтрансферазы, на основе ДНК (цитозин-5)-метилтрансфеоазы 3A (DNMT3A PDB с № доступа 2QRV используют для прояснения пространственной структуры). Мутацию, R729 или R771 (на основе нумерации транслированного белка с № доступа в GenBank -AF067972.2) добавляют для аннулирования тетрамеризации с регуляторным DNMTL без нарушения димеризации DNMT3A или уменьшения Kcat. Аминокислотная последовательность (транслированная в соответствии с № доступа в GenBank - AF067972.2) метилтрансферазного района этого примера представлена в SEQ ID NO: 87 (DNMT3A AdoMet_Mtase район R729A).
Аминокислотную последовательность, заимствованную из одноцепочечного Fv-фрагмента (scFv) иммуноглобулина против флуоресцеина (номеры доступа в базе данных о структуре белков - 1X9Q, 1FLR_H), используют в этом примере в качестве связующего домена; SV40NLS (PKKKRKV: SEQ ID NO: 3) используют в качестве домена ядерной локализации, и междоменные соединители, такие как гибкий междоменный соединитель (SEQ ID NO. 14: GSLEGGSGG), используют в этом примере для их присоединения. Белковый компонент имеет аминокислотную последовательность, представленную в SEQ ID NO: 88, кодируемую нуклеотидной последовательностью, представленной в SEQ ID NO: 89.
Последовательность-мишень для анализа метилирования основывается на кодирующей mCherry кассете, клонированной в сайт MCS pSAT6-MCS (AY818383.1 GI:56553596), и включает нуклеотидную последовательность, представленную в SEQ ID NO: 90. Кодирующей mCherry последовательностью (cds) является таковая, соответствующая нуклеотидам 952-1671 SEQ ID NO: 90.
Последовательности SCNA, используемые в этом эксперименте:
SL898: TCGAGCTCAAGCTTCGAATTCTNNNNNN/36-FAM/ (только нуклеиновые кислоты определены здесь как SEQ ID NO: 91).
SR951: /56-FAM/NNNNNNGATGGTGAGCAAGGGCGAGGAG (только нуклеиновые кислоты определены здесь как SEQ ID NO: 92).
3ʹ- и 5ʹ-6FAM (6-карбокси-флуоресцеин) сайты связывания связующего домена помечены /36-FAM/ и /56-FAM/, соответственно. Хотя одна SCNA достаточна для метилирования ДНК, можно использовать более одной SCNA с соответствующим пространственным расположение, которое допускает димеризацию белка, для увеличения специфичности.
Экспериментальная процедура
Стратегия двойного инфицирования используется для допуска экспрессии белкового компонента молекулярного комплекса до введения SCNA и ДНК-мишени.
Приготовление протопластов Arabidopsis основывается на (Wu et. al, 2009) и схоже с таковым примера 1 с различиями в стадии трансфекции:
Трансфекция:
1. Приготовьте свежий раствор ПЭГ для трансфекции в 2-мл пробирке.
2. Вылейте BSA из 6-луночных планшетов и высушите.
3. Смешайте ~5×104 протопластов (2×104-1×105) в 0,2 мл раствора MMg с приблизительно 20 мкг экспрессирующей белковый компонент плазмидной ДНК при комнатной температуре в 15-мл круглодонных пробирках (с герметическим колпачком с защелкой).
4. Добавьте равный объем (0,2 мл протопластов+средний объем приготовления) свежего раствора ПЭГ.
5. Инкубируйте при комнатной температуре в течение 5 мин.
6. Промойте, медленно добавляя 3 мл раствора W5, 1 мл за раз, и смешивая.
7. Осуществите центрифугирование при 100 x g в роторе с корзинами (swing-out) в течение 1 мин.
8. Повторите промывку и осаждение.
9. Ресуспендируйте в 1 мл раствора W5.
10. Налейте в покрытые BSA планшеты.
11. Выращивайте протопласты в условиях 16-ч дневного оптимального света (150 микроЭйнштейн⋅м-2⋅сек-1) при 22°C, заменяя среды в соответствии с необходимостью.
12. Через приблизительно 16 часов осуществляют повторную трансфекцию этих клеток, повторяя стадии 1-11 с заменой плазмиды стадии 3 плазмидой, кодирующей mCherry-мишень, и соответствующими SCNA (всего приблизительно 20 мкг).
13. Экспрессию mCherry и состояние метилирования экстрагированных плазмид анализируют через 48 часов.
Анализ
Анализ состояния метилирования CpG в ДНК-мишени выполняют двумя способами:
A) Расщепленную ДНК из объединенных протопластов анализируют с помощью амплификации с использованием ПЦР. Расщепление выполняют, используя чувствительные к метилированию рестриктазы SmaI (CCCGGG), SalI (GTCGAC) или SacII (CCGCGG). Кластер для SmaI, SalI, SacII используется в качестве сайта CpG для метилазы. Динуклеотиды CpG подчеркнуты. Метилированная ДНК не расщепляется этими ферментами. Таким образом, последовательность MCS, охватывающую сайты расщепления этих ферментов, амплифицируют, и с помощью количественной ПЦР определяют продукт, отражающий показатель эффективности метилирования, в сравнении с образцами, в которых отсутствуют компоненты молекулярного комплекса или нарочно содержатся неспецифические SCNA, почти не амплифицируемыми вследствие полного расщепления, являющегося результатом отсутствия метилирования.
B) ДНК из объединенных протопластов превращают в бисульфит до амплификации с помощью ПЦР, клонирования и секвенирования, для анализа состояния метилирования ряда являющихся мишенями и не являющихся мишенями контрольных последовательностей. Бисульфидное секвенирование выполняют, как описано в EZ DNA Methylation-Gold Kit (ZYMO, США), подходящем для детектирования метилированных ДНК, и используют для дальнейшего анализа.
ПРИМЕР 6. Направленная геномная модификация у людей: делеция гена CCR5 в гемопоэтических стволовых клетках человека.
Рецептор C-C хемокинов типа 5 (CCR5, № доступа в GenBank - NT_022517.18) является рецептором хемокинов, экспрессируемым и представленным на поверхности T-клеток, макрофагов, дендритных клеток и микроглии. Мутация этого гена - CCR5-Δ32, которая состоит из делеции 32 оснований, приводит к мутации со сдвигом рамки считывания, которая вводит 31 новую аминокислоту на C-конец усеченного белка, и придает устойчивость к вирусу натуральной оспы и некоторым типам вируса иммунного дефицита человека (ВИЧ). Эта аллель обнаруживается у приблизительно 10% европейцев, но является редко встречающейся в других группах.
В следующем примере CCR5 или часть этого гена делитируют из гемопоэтических стволовых клеток (HSC), выделенных из ВИЧ-инфицированных пациентов, которые не имеют Δ32 аллель.
Белковый компонент состоит из функционального домена на основе нуклеазы (модифицированного FokI-нуклеазного домена, указанного выше) и связывающегося с РНК-мотивом связующего домена (происходящего из минимального пептида ТАТ ВИЧ белка ТАТ ВИЧ SGPRPRGTRGKGRRIRR (SEQ ID NO: 93), причем связующий домен белкового компонента связывается с особой последовательностью РНК UUCAGCUCGUGUAGCUCAUUAGCUCCGAGCU (SEQ ID NO: 94), которая является петлей 1 TAR ВИЧ. Доставку нуклеиновой кислоты, кодирующей белковый компонент, выполняют одновременно с доставкой придающей специфичность нуклеиновой кислотой (SCNA) с использованием аденовирусного вектора, для их транзиторной экспрессии. Аденовирусы не интегрируются в геном хозяина.
После введения и экспрессии в клетках-мишенях (HSC), молекулярные комплексы самостоятельно собираются на гене CCR5-мишени, что делает возможной димеризацию белковых компонентов и расщепление последовательности CCR5, с вызовом делеции части этого гена, как запланировано. После этой генетической модификации, созданные таким образом HSC с модифицированным геном или их потомки аутологично снова трансплантируют пациенту. Клетки, которые были модифицированы, обогащают посредством отбора с помощью удаления клеток, представляющих CCR5, до трансплантации. Из этих HSC развиваются Т-клетки и макрофаги с модифицированным CCR5, становясь устойчивыми к ВИЧ-инфекции. Большую часть аденовируса и компонентов молекулярного комплекса, которые завершили свою функцию, отделяют от HSC до трансплантации.
Функционального предотвращения представления CCR5 можно достичь благодаря этой системе несколькими различными путями, используя различные типы SCNA и локализации, как подробно описано ниже:
В аллели Δ32 отсутствуют 32 нуклеотида на 3ʹ кодирующей CCR5 последовательности, что приводит к делеции со сдвигом рамки считывания. Делетированной последовательностью является: TTCCATACAGTCAGTATCAATTCTGGAAGAA (SEQ ID NO: 95). Для делетирования этой последовательности из экспрессирующих CCR5 клеток используют SCNA, происходящие из следующих последовательностей (представленных без модификации для связывания со связующим доменом):
ATCAATTCTGGAAGAATTTCCA (SEQ ID NO: 96);
TCATTACACCTGCAGCTCTCAT (SEQ ID NO: 97).
В этом примере, если для модификации для связывания со связующим доменом транскрибированной SCNA используется TAR ВИЧ, полными последовательностями SCNA являются:
Вариант 1 расстояния между SCNA, используя 16-п.о. гэп-мишень и не используя внутренний «N» линкер для SCNA:
CCR5_D32_SR_3321:
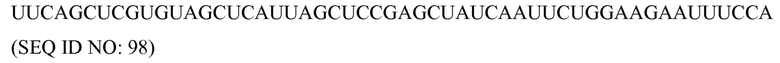
CCR5_D32_SL_3304:
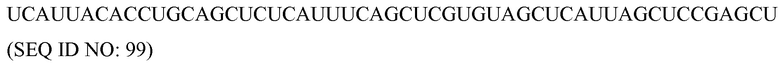
Вариант 2 расстояния между SCNA, используя 27-п.о. гэп-мишень и 2 «N» линкер:
CCR5_D32_SR_3319:
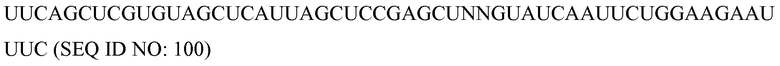
CCR5_D32_SL_3291:

Эти SCNA разработаны, чтобы сделать возможной модификацию/расщепление в последовательности-мишени TTTCCATACAGTCAGTATCAATTCTGGAAGAA (SEQ ID NO: 102). Расщепление и создание DSB, опосредованные только этими парами, могут, в некоторых случаях, благодаря эндогенным механизмам, вызывать мутацию, которая приводит к сдвигу рамки считывания. Чтобы сделать более широкие делеции в гене CCR5, используют пары SCNA, направлено воздействующие на по крайней мере две мишени в CCR5:
Делецию по существу всей кодирующей CCR5 последовательности индуцируют, используя связывающиеся с районом ATG CCR5 SCNA (ATG SCNA) и связывающиеся с районом стоп-кодона CCR5 SCNA (STOP SCNA), одновременно.
ATG SCNA:
Подвергаемая направленному воздействию область между SCNA (ATG подчеркнут):

Вариант 1 расстояния между SCNA, используя 31-п.о. гэп-мишень и не используя внутренний «N» линкер для SCNA:
CCR5_SR_2779:
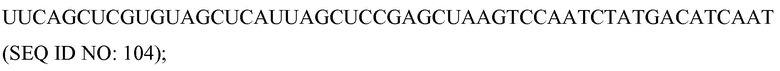
CCR5_ SL_2747:
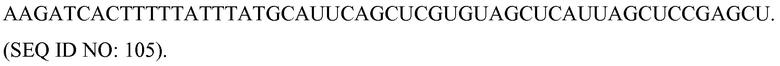
Вариант 2 расстояния между SCNA, на основе результатов вычислений, используя 27-п.о. гэп-мишень и 2 «N» линкер:
CCR5_SR_2777:
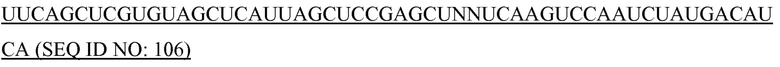
CCR5_SL_2749:

STOP SCNA:
Подвергаемая направленному воздействию область между SCNA (стоп-кодон подчеркнут):
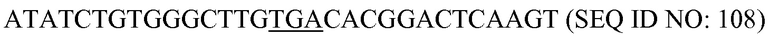
Вариант 1 расстояния между SCNA, используя 31-п.о. гэп-мишень и не используя внутренний «N» линкер для SCNA:
CCR5_SR_3884:
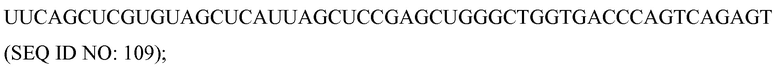
CCR5_SL_3802:
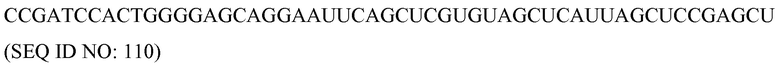
Вариант 2 расстояния между SCNA, на основе результатов вычислений, используя 27-п.о. гэп-мишень и 2 «N» линкер:
CCR5_SR_3833:
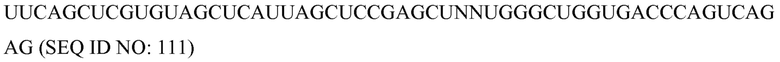
CCR5_SL_3805:

Белковый компонент молекулярного комплекса экспрессируется через нуклеотидную последовательность, содержащуюся в экспрессионной системе на основе аденовируса, такой как система 3 на основе аденовируса Adeno-XTM (Clontech Laboratories (CA, США)), и используется в соответствии с инструкциями производителя. Альтернативно, белковый компонент доставляется с помощью трансфекции «голой» РНК.
Аминокислотная последовательность белкового компонента для этого примера:
Функциональный домен, происходящий из субъединицы нуклеазы FokI (указанной выше).
Связующий домен: минимальный пептид ТАТ ВИЧ SGPRPRGTRGKGRRIRR (SEQ ID NO: 93).
Домен ядерной локализации: сигнал ядерной локализации (NLS) - домен SV40 (SV40NLS).
Субъединица нуклеазы FokI:

SV40NLS: MPKKKRKV (SEQ ID NO: 67);
Пептид ТАТ BIV: SGPRPRGTRGKGRRIRR (SEQ ID NO: 93).
Междоменный соединитель: GSGGSGP (SEQ ID NO: 113)
Собранный программируемый белковый компонент на основе TAT ВИЧ этого примера имеет аминокислотную последовательность, представленную в SEQ ID NO: 114, которая кодируется последовательностью нуклеиновой кислоты, представленной в SEQ ID NO: 115.
Пространственные измерения, сделанные на основе компьютерных пространственных моделей для системы ВИЧ-TAT-TAR с междоменным линкером GGSGGGP (SEQ ID NO: 116), используемым в этом примере, привели к заключению, что предполагаемое оптимальное расстояние между SCNA составляет, в присутствии 2 Nʹ в SCNA, приблизительно 26-28 нуклеотидов. Расщепление, как предсказывают, будет происходить приблизительно ±2 нуклеотида слева и справа от 12-ого, 13-ого или 14-ого нуклеотида, считая от последнего нуклеотида, гибридизующегося с SCNA, с любой стороны, учитывая 5ʹ-концевую избыточность из 4-оснований, создаваемую в результате расщепления дцДНК подвергнутой димеризации конструкцией. Этот критерий означает, что, если, в этом примере, подвергаемой направленному воздействию последовательностью является 27-нуклеотидная последовательность:
AAAAAAAAAAYYYYYYYYYYXXXXXXXYYYYYYYYYYCCCCCCCCCC, где Y+X представляет собой число нуклеотидов между сайтами, подвергающими спариванию оснований с SCNA, то сконструированные SCNA подвергаются спариванию оснований с областями A и C, и расщепление, приводящее к DSB, происходит в или вблизи области X (сайте-мишени). SCNA могут быть комплементарны или смысловой, или антисмысловой цепи, но предпочтительно выбирают те, которые подвергаются спариванию оснований со смысловой (нетранскрибируемой) последовательностью. Обе SCNA могут подвергаться спариванию оснований с одной и той же цепью, поскольку белковый компонент находится на «ближайшем конце» SCNA, который определяется 5ʹ или 3ʹ модификацией праймера, находящейся на «ближайшем конце».
Детектирование и отбор не экспрессирующих/не представляющих CCR5 клеток в сравнении с экспрессирующими CCR5 клетками дикого типа выполняют с помощью анализа с использованием FACS, используя моноклональное мышиное антитело против CCR5 человека (R&D systems, каталожный № FABSP1).
ПРИМЕР 7. Программируемый, направленный на спаривание основание с нуклеиновой кислотой активатор транскрипции
В этом примере в качестве биоанализа используют систему с использованием протопластов в однодольной кукурузе (Marrs & Urioste, 1995; Rhodes et. al, 1988). В этой системе протопласты кукурузы подвергают электропорации для введения плазмиды для транзиторной экспрессии. Эти протопласты можно затем регенерировать, если это желательно.
В этом примере белковый компонент, состоящий из домена активатора транскрипции Gal4, за исключением UAS-связывающего домена, и связующего домена, состоящего из ScFv против флуоресцеина, вместе с флуоресцеин-модифицированной SCNA, используют для активации экспрессии гена-репортера. В этом примере ДНК-связывающий домен Gal4 удален и заменен на связующий домен белкового компонента.
В этом примере используют две репортерных плазмиды, которые могут экспрессировать GFP (вариант 1) или β-глюкоронидазу (GUS, вариант 2), только если активатор транскрипции связывается с последовательностью 5ʹ от бокса TATA. В этом примере этой последовательностью является 6X-UAS, которую, как известно, активирует белок Gal4.
Во втором примере последовательности UAS удаляют из нуклеиновой кислоты-мишени, и SCNA связывается в положении минус 62 (в сайте, находящемся 3ʹ от бокса ТАТА на расстоянии=62 нуклеотидам от него), таким образом достигая по существу то же эффекта, но без какого-либо природного промотора. В системе биоанализа с использованием протопластов кукурузы белковый компонент, представленный ниже, и SCNA можно трасфецировать вместе, используя электропорацию.
Аминокислотная последовательность белкового компонента, включающая Nʹ домен активации Gal4 с направленной доставкой в ядро, слитый через междоменный соединитель с ScFv против флуоресцеина, определена здесь как SEQ ID NO: 132 и кодируется нуклеотидной последовательностью, представленной в SEQ ID NO: 157.
В первом примере используется плазмида-мишень с 6 повторами UAS:
Плазмида-мишень содержит, в следующем порядке (5ʹ→3ʹ), промоторный район с 6 UAS, за которым следует бокс TATA, и определена здесь в SEQ ID NO: 180:
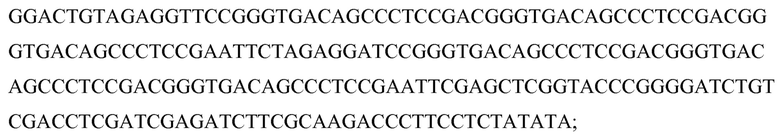
Спейсер, имеющий последовательность:
AGGAAGTTCATTTCATTTGGRGAGGACACGCTGAACC (SEQ ID NO: 192);
Вариант 1: Кодирующая GFP последовательность представлена в SEQ ID NO: 193.
Вариант 2: Кодирующая β-глюкоронидазу (GUS) последовательность представлена в SEQ ID NO: 194.
Последовательность 35S-терминатора:
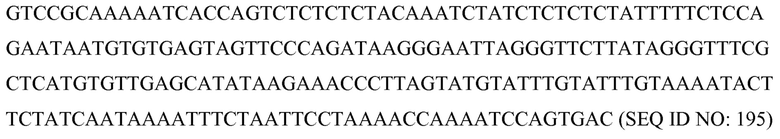
Две различных ориентации SCNA обеспечиваются в отдельных экспериментах, чтобы выбрать более эффективную из двух: связывающуюся с UAS-последовательностью SCNA
Гибридизующаяся со смысловой цепью: CGGGTGACAGCCCTCCGANNNNNN/36-FAM/ (только нуклеиновые кислоты представлены здесь в SEQ ID NO: 196)
Гибридизующаяся с антисмысловой цепью:/5-6FAM/NNNNNNTCGGAGGGCTGTCACCCG (только нуклеиновые кислоты представлены здесь в SEQ ID NO: 197)
Концевой модификацией SCNA является 6-карбокси-флуоресцеин (6FAM). 5ʹ или 3ʹ модификация представлена как /5-6FAM/ или /3-6FAM/, соответственно. N представляет собой любой нуклеотид.
Во втором примере используется плазмида-мищень, в которой отсутствует промотор для контролирования экспрессии гена-репортера:
Плазмида-мишень содержит, в следующем порядке, остовную последовательность плазмиды, за которой следует бокс TATA:
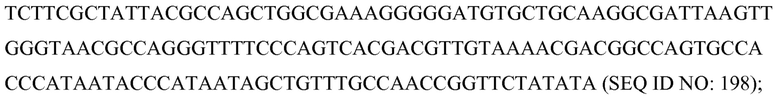
Спейсерная последовательность (SEQ ID NO: 199):
AGGAAGTTCATTTCATTTGGRGAGGACACGCTGAACC;
Вариант 1: Открытая рамка считывания GFP, представленная в SEQ ID NO: 200.
Вариант 2: Кодирующая β-глюкоронидазу (GUS) последовательность, представленная в SEQ ID NO: 201.
Последовательность 35S-терминатора(SEQ ID NO: 202):
Используются две различных ориентации SCNA:
SCNA: варианты (минус 62):
GCCAGGGTTTTCCCAGTCACGANNNNNN/36-FAM/ (только нуклеиновые кислоты представлены здесь в SEQ ID NO: 203)
/5-6FAM/NNNNNNTCGTGACTGGGAAAACCCTGGC (только нуклеиновые кислоты представлены здесь в SEQ ID NO: 204)
Протопласты кукурузы проверяют в отношении экспрессии GFP (вариант 1), используя микроскопический метод или метод с использованием проточной цитометрии. GFP-позитивные клетки указывают на функционирование запрограммированного комплекса. Процент GFP-позитивных клеток позволяет рассчитать относительные эффективности между экспериментами, проводимыми для улучшения различных параметров системы. Отсутствие GFP в клетках, в которых отсутствуют соответствующие компоненты комплекса (например, используя контрольные неспецифические SCNA), позволяет определить пределы специфичности.
Протопласты кукурузы проверяют в отношении экспрессии GUS (вариант 2) посредством окрашивания клеток X-Gluc в 0,45M манните и инкубации в течение ночи при 37°C, и детектирования, используя микроскоп. GUS-позитивные клетки (с голубым окрашиванием) указывают на функционирование запрограммированного комплекса. Процент GUS-позитивных клеток позволяет рассчитать относительные эффективности между экспериментами, проводимыми для улучшения различных параметров системы. Отсутствие GUS в клетках, в которых отсутствуют соответствующие компоненты комплекса (например, используя контрольные неспецифические SCNA), позволяет определить пределы специфичности.
ПРИМЕР 8: Направленное воздействие на ген в органелльной ДНК.
У эукариот органеллы, такие как митохондрии и пластиды, содержат свои собственные геномы. Кроме того, в растениях они могут также содержать субгеномные, замкнутые в круг ДНК. Модификация митохондриальной ДНК может применяться для лечения заболевания у человека и для сельскохозяйственных применений, межу прочим. Проблемы в случае этих модификаций включают, между прочими техническими проблемами, доставку и активацию довольно эффективной, последовательность-специфической системы, необходимой для корректировки гена в органелле.
PCF у петуньи
Цитоплазматическая мужская стерильность (CMS) является ценным признаком у растений, широко используемым коммерческими компаниями, занимающимися производством семян, в качестве способа защиты их линий семян. Таким образом, преимущественным является или восстановление CMS в существующих линиях, или создание CMS в новых линиях. Цитоплазматическая мужская стерильность может быть обусловлена неспособностью растений продуцировать функциональные пыльники, пыльцу или мужские гаметы в результате специфических ядерных и митохондриальных взаимодействий. В представленных здесь примерах используют охарактеризованный признак цитоплазматической мужской стерильности у петуньи, причиной которого является сочетанная делеция и вставка в ген atp9 в митохондриальной ДНК, который кодирует субъединицу 9 АТФазы. Это приводит к нарушению функции перемещения протона у михоходриального, включающего АТФазу мультибелкового комплекса, приводящему к мужской стерильности.
Белковый компонент программируемого молекулярного комплекса этого примера в соответствии с замыслом содержит сигнал митохондриальной локализации для обеспечения локализации запрограммированного молекулярного комплекса внутри митохондрий. Другие способы переноса нуклеиновых кислот в митохондрии включают использование липосом или электропорации. Митохондрии в растениях, и в особенности в растениях семейства Пасленовых, которое включает петунью, активно импортируют ДНК через комплекс пор с модуляцией проницаемости. Процесс ограничивается двухцепочечной ДНК, но не характеризуется очевидной специфичностью в отношении последовательности. Донорную последовательности можно доставить, например, или в виде линейных очищенных фрагментов ПЦР, линеаризованных плазмид, или в виде замкнутых в круг плазмид, в зависимости от способа доставки. Экспрессия с плазмид, электропорированных в изолированные митохондрии пшеницы, например, является очень эффективной при использовании сочетаемого с митохондриями промотора, такого как 882 п.о. митохондриальный промотор cox II T. timopheevi, содержащего район инициации, описанный (Hanic-Joyce and Gray, 1991).
Отбор клеток, содержащих событие замены или вставки, можно осуществить с использованием кодируемого донорной ДНК оперона устойчивости к хлорамфениколу.
В следующих примерах (8A-8C) белковый компонент включает:
Связующий домен, происходящий из пептида ТАТ ВИЧ, включающего аминокислотную последовательность 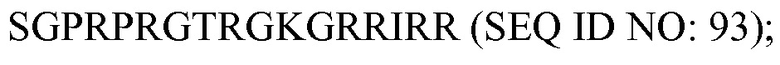
Функциональный домен, происходящий из нуклеазы FokI, включающий аминокислотную последовательность

Домен клеточной локализации, происходящий из синтазы липоевой кислоты Arabidopsis и включающий аминокислотную последовательность MHSRSALLYRFLRPASRCFSSSS (SEQ ID NO: 6), которая является сигналом митохондриальной локализации (MLS).
Междоменный соединитель: GSGGSGP (SEQ ID NO: 113)
Собранный программируемый белковый компонент на основе ТАТ ВИЧ этого примера имеет аминокислотную последовательность, представленную в SEQ ID NO: 205, которая кодируется нуклеотидной последовательностью, представленной в SEQ ID NO: 206.
Результаты пространственных измерений, сделанных на основе компьютерных пространственных моделей для системы ВИЧ-TAT-TAR с междоменным линкером GGSGGGP (SEQ ID NO: 116), этого примера, показывают, что предполагаемое оптимальное расстояние между SCNA составляет, в присутствии 2 «Nʹ» в SCNA, приблизительно 26-28 нуклеотидов. Расщепление, как предсказывают, будет происходить приблизительно ±2 нуклеотида слева и справа от 12-ого, 13-ого или 14-ого нуклеотида, считая от последнего нуклеотида, гибридизующегося с SCNA, с любой стороны, учитывая 5ʹ-концевую избыточность из 4-оснований, создаваемую в результате расщепления дцДНК подвергнутой димеризации конструкцией. Этот критерий означает, что, если подвергаемой направленному воздействию последовательностью является, например, следующая 27-нуклеотидная последовательность:
AAAAAAAAAAYYYYYYYYYYXXXXXXXYYYYYYYYYYCCCCCCCCCC, где Y+X представляет собой число нуклеотидов между сайтами, подвергающими спариванию оснований с SCNA, то сконструированные SCNA подвергаются спариванию оснований с областями A и C, и расщепление, приводящее к DSB, происходит в или вблизи области X. SCNA могут быть комплементарны или смысловой, или антисмысловой цепи, но предпочтительно выбирают те, которые подвергаются спариванию оснований со смысловой (нетранскрибируемой) последовательностью. Обе SCNA могут подвергаться спариванию оснований с одной и той же цепью, поскольку белковый компонента находится на «ближайшем конце» SCNA, который определяется 5ʹ или 3ʹ модификацией праймера, находящейся на «ближайшем конце».
SCNA - последовательность РНК, связывающаяся со связующим доменом, используемая в этом примере, происходит из петли 1 TAR ВИЧ, включающей последовательность нуклеиновой кислоты UUCAGCUCGUGUAGCUCAUUAGCUCCGAGCU (SEQ ID NO: 117). Таким образом, SCNA может или непосредственно доставляться в изолированные митохондрии (с помощью электропорации митохондрий в присутствии ДНК, кодирующей SCNA под контролем бактериального промотора), или доставляться в цитоплазму (с помощью опосредованной Agrobacterium транзиторной транскрипции) и «втягиваться» в митохондрии белковым компонентом, связанным с ней и включающим MLS.
После экспрессии программируемого молекулярного комплекса митохондрии изолируют, и донорную ДНК трансфецируют в изолированные митохондрии.
Выполняют следующие примеры, при этом каждый из них имеет 2 возможных варианта расстояний между SCNA:
1. Создание фенотипа CMS без донорной ДНК DNA (8A).
2. Направленное воздействие на atp9 с созданием pcf-подобного мутанта, используя донорную ДНК с устойчивостью к хлорамфениколу (8B).
3. Восстановление фенотипа pcf (CMS), реформируя ATP9 и восстанавливая фертильность и одновременно используя донорную ДНК с устойчивостью к хлорамфениколу(8C).
Последовательности нуклеиновых кислот-мишени для этих примеров включают:
«ATP9»: субъединица 9 митохондриальной АТФ-синтазы Petunia hybrida X Petunia axillaris subsp. Parodii, № доступа в GenBank Y00609.1 GI:297475.
«pcf»: Цитоплазматическая мужская стерильность (CMS) у Petunia axillaris subsp. Parodii, связанный с CMS слитый белок (CMS-afp), субъединица 3 НАДН-дегидрогеназы (nad3), и гены рибосомных белков S12 (rpsl2), полные cds; митохондриальные, № доступа в GenBank M16770.1 GI: 1256946.
Пример 8A. Направленная ДНК-мутация в органелльной ДНК, без изолирования органелл. Направленное воздействие на ATP9 с образованием мутации, которая является причиной CMS в результате создания нефункционального белка ATP9.
Разрабатывают SCNA, которые образуют один DSB в сайте-мишени, который подвергается репарации с помощью пути репарации с использованием NHEJ, создавая сдвиги рамки считывания в части кодирующей последовательность.
Сайт-мишень в ATP9: GCAAAACAATTATTTGGTTATGCCATTTTGG (SEQ ID NO: 118).
Вариант 1 расстояния между SCNA, 31-п.о. гэп-мишень:
Фланкирующие сайт-мишень в ATP9 SCNA:
ATP9_ASL_705:
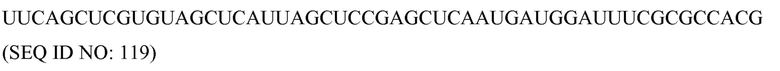
ATP9_ASR_737:
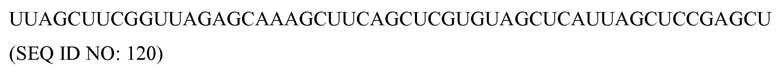
Вариант 2 расстояния между SCNA, используя 27-п.о. гэп-мишень:
ATP9_ASL_707:
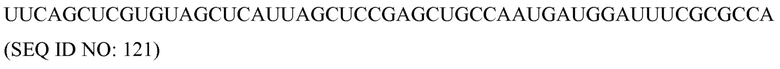
ATP9_ASR_735:
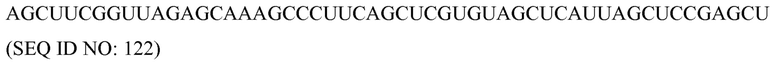
Листья петуньи трансфецируют, используя стандартный способ инфильтрации листьев, известный в данной области техники, Agrobacterium, содержащими T-ДНК, происходящую из бинарного плазмидного вектора, кодирующего белковый компонент, и РНК-SCNA (как схематически представлено на фиг. 8A). После трансфекции компоненты запрограммированного молекулярного комплекса экспрессируются в цитоплазме, самостоятельно собираются, а затем относятся в митохондрии с помощью митохондриального аппарата импортирования, благодаря MLS, выставленного на поверхности белкового компонента. Запрограммированный молекулярный комплекс (включающий белковый компонент и направляющую SCNA) затем оказывает направленное воздействие на ген ATP9 в митохондриальной ДНК, таким образом порождая мутированные митохондрии.
Для анализа, через 48 часов после трансфекции, ДНК очищают из растений, и последовательность ATP9 амплифицируют с помощью ПЦР, используя праймеры:
ATP9atgF: ATGTTAGAAGGTGCAAAATCAA (SEQ ID NO: 123)
ATP9p2R: CTAACGGACTTGGAATACGAAT (SEQ ID NO: 124)
Продукт ПЦР затем подвергают ферментативному анализу для детектирования мутаций на основе расщепления CEL I (SURVEYOR Mutation Detection Kit (Transgenomics, США)). Этот анализ используется для оценки эффективности мутирования митохондриальной ДНК посредством направленного воздействия на ген с помощью запрограммированного молекулярного комплекса.
Пример 8B. Направленная ДНК-вставка в органелльную ДНК.
В этом примере ATP9 подвергают направленному воздействию для образования pcf-подобного мутанта посредством вставки донорной ДНК, содержащей селектируемый маркер хлорамфеникол в локус ATP9.
Способ: Как и в примере 8A, листья петуньи трансфецируют, используя стандартный способ инфильтрации листьев, Agrobacterium, содержащими T-ДНК, происходящую из бинарного плазмидного вектора, кодирующего белковый компонент запрограммированного молекулярного комплекса, и SCNA. После трансфекции компоненты запрограммированного молекулярного комплекса экспрессируются в цитоплазме, самостоятельно собираются, а затем относятся в митохондрии с помощью митохондриального аппарата импортирования, благодаря MLS, выставленного на поверхности белкового компонента. Через приблизительно 12-72 ч инфильтрированные листья используют для приготовления митохондрий. Пдазмидный вектор и линейный продукт ПЦР, включающий донорную ДНК этого примера, доставляют с помощью электропорации в изолированные митохондрии. Подвергнутые электропорации митохондрии затем трансплантируют в свежие протопласты петуньи с помощью микроинъекции. Подвергнутые инъекции протопласты регенерируют на селекционных средах с хлорамфениколом, которые позволяют выживать только PCF-подобным митохондриям в клетках.
Донорная ДНК примера 8B (atp9, измененный до pcf-подобного) представлена в SEQ ID NO: 125:
Результаты и анализ:
Запрограммированный молекулярный комплекс расщепляет ген atp9 в его кодирующей последовательности, 3ʹ от района, гомологичного pcf. Это приводит к гомологичной рекомбинации (HR) между pcf-подобным донором и расщепленным геном atp9. Таким образом вновь создается pcf генотип мужской стерильности в митохондриальном геноме. Кроме того, донор содержит кассету устойчивости к хлорамфениколу, делающей возможным отбор митохондрий, устойчивых к хлорамфениколу. Подвергнутые инъекции протопласты, которые способны к регенерации на селективных средах, содержащих хлорамфеникол, содержат ДНК-модифицированные, подвергнутые направленному воздействию митохондрии. Каллусы, происходящие из этих протопластов, способны к корневой дифференциации, и, в конечном счете, образуются целые растения, что приводит к регенированным растениям, содержащим только подвергнутые направленному воздействию митохондрии. Таким образом, получают растения петуньи с мужской стерильностью посредство регенерации растений из каллусов, содержащих устойчивые к хлорамфениколу митохондрии.
Пример 8С. Направленная ДНК-замена в органелльной ДНК.
В этом примере мутант pcf подвергается направленному воздействию для образования последовательности активного восстановленного ATP9, используя донорную ДНК, содержащую устойчивость к хлорамфениколу.
В этом примере донорная ДНК предназначена для интеграции с помощью HR в локус pcf, создавая стоп-кодон, для воссоздания интактного белка ATP9, лишенного излишней аминокислотной последовательности, являющейся причиной связанного с pcf нарушения. Кассету устойчивости к хлорамфениколу (AY230218.1 GI:30267504) в донорной ДНК используют для отбора восстановленных митохондрий. CDS в доноре находится в конструкции на основе оперона. Хлорамфеникольная последовательность представлена строчными буквами с подчеркиванием.
Способ: Плазмидный вектор, включающий донорную ДГК этого примера, SCNA, представленные в примере 8C, и белковый компонент примера 8A доставляют с помощью электропорации в изолированные митохондрии, в этом примере на одной плазмиде, схожей по конструкции с той, которая схематически представлена на фиг. 9.
Как и в примере 8B, подвергнутые электропорации митохондрии трансплантируют в протопласты петуньи с помощью микроинъекции. Протопласты засевают в селективные среды с хлорамфениколом. Каллусы, происходящие из этих протопластов, способны к корневой дифференциации (Frearson et. al., 1973), и, в конечном счете, образуются целые растения, что приводит к регенированным растениям, содержащим только подвергнутые направленному воздействию митохондрии. Эти растения петуньи скринируют на предмет мужской стерильности.
Последовательности примера 8С:
Сайт-мишень в pcf:
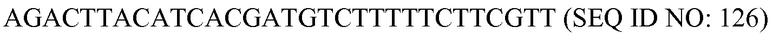
SCNA, фланкирующие сайт-мишень:
Вариант 1 расстояния между SCNA, используя 31-п.о. гэп-мишень:
CMS_ASL_704:
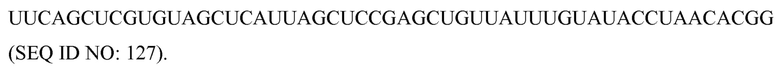
CMS_ASR_736:
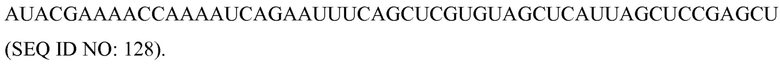
Вариант 2 расстояния между SCNA, на основе результатов вычислений, используя 27-п.о. гэп-мишень:
CMS_ASL_706
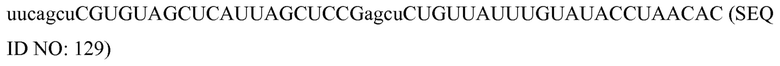
CMS_ASR_734
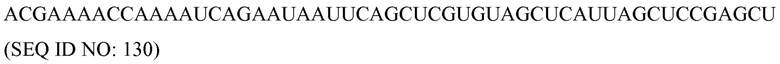
Последовательность донора примера 8C представлена в SEQ ID NO: 131.
ПРИМЕР 9: Модификация генома клеток млекопитающих: предотвращение опосредованной рецептором FAS гибели.
Рецептор FAS (FasR), также известный как антиген 1 апоптоза (APO-1, APT, TNFRSF6, CD95), является белком, который у людей кодируется геном TNFRSF6, находящимся на хромосоме 10 у людей (№ доступа в GenBank NC_000010 REGION: 90750288..90775542 GPC_ 000000034 VERSION NC_000010.10 GI:224589801). Рецептор Fas является рецептором смерти, представленным на поверхности клеток, который приводит к запрограммированной гибели клеток (апоптозу) при образовании индуцирующего смерть сигнального комплекса (DISC) после связывания лиганда. Закрепленный на мембране тример Fas-лиганда на поверхности расположенной рядом клетки вызывают тримеризацию рецептора Fas. Fas-лиганд или FasL (CD95L) является трансмембранным белком гомотримерного типа II. Растворимый FasL менее активен, чем его связанный с мембраной аналог и не индуцирует тримеризацию рецептора и образование DISC. После последующей агрегации домена смерти (DD), рецепторный комплекс подвергается интернализации и инициирует каскад событий через каспазы, в конечном счете, приводящий к деградации ДНК, пузырению мембраны и другим признакам апоптоза. Это событие может также воспроизводиться при связывании являющегося агонистом антитела против FasR, используемого здесь в примере.
Известно восемь вариантов сплайсинга FasR, которые транслируются в семь изоформ белка. Индуцирующий апоптоз рецептор Fas является дублированной изоформой 1 и трансмембранным белком типа 1. Белок Fas содержит 319 аминокислот, разделен на 3 домена: экстраклеточный домен, трансмембранный домен и цитоплазматический домен. Экстраклеточный домен содержит 157 аминокислот и богат остатками цистеина. Трансмембранный и цитоплазматический домены содержат 17 и 145 аминокислот, соответственно. Экзоны с 1 по 5 включительно кодируют экстраклеточный район, который может взаимодействовать с тримером FasR. Экзон 6 кодирует трансмембранный район. Экзоны 7-9 кодируют цитоплазматический район.
Последовательность и свойства белка
Белковый компонент является компонентом, описанным в примере 3.
Таким образом, белковый компонент молекулярного комплекса, описываемого в этом примере, имеет аминокислотную последовательность, представленную в SEQ ID NO: 49.
Придающая специфичность нуклеиновая кислота (SCNA) этого примера модифицирована посредством добавления флуоресцеин-ScFv/6-FAM, 6-карбоксифлуоресцеин - флуоресцеин dT, который включает C6-линкер, на один конец каждой SCNA.
Свойства и последовательность SCNA
Длина SCNA комплементарного, подвергающегося спариванию оснований с мишенью олигонуклеотида составляет предпочтительно по крайней мере 18 оснований. SCNA может также содержать небольшое число (например, 0-6, в этом примере - 6) не подвергающихся спариванию оснований с мишенью нуклеотидов (Nʹ) с любым составом последовательности, которые служат в качестве спейсера между концевым модификатором 6-FAM и комплементарными мишени нуклеотидами.
Результаты пространственных измерений, сделанных на основе компьютерных пространственных моделей для системы анти-флуоресцеин-ScFv-6-FAM с междоменным линкером GGSGG (SEQ ID NO: 7), используемой в этом примере, привели к заключению, что предполагаемое оптимальное расстояние между SCNA составляет, в присутствии 2 «Nʹ» в SCNA, приблизительно 23-26 нуклеотидов. Расщепление, как предсказывают, будет происходить приблизительно ±2 нуклеотида слева и справа от 11-ого, 12-ого или 13-ого нуклеотида, считая от последнего нуклеотида, гибридизующегося с SCNA, с любой стороны, учитывая 5ʹ-концевую избыточность из 4-оснований, создаваемую в результате расщепления дцДНК подвергнутой димеризации конструкцией. Этот критерий означает, что, если подвергаемой направленному воздействию последовательностью является, например, эта 24-нуклеотидная последовательность:
AAAAAAAAAAYYYYYYYYYXXXXXXYYYYYYYYYCCCCCCCCCC, где Y+X представляет собой число нуклеотидов между сайтами, подвергающими спариванию оснований с SCNA, то сконструированные SCNA подвергаются спариванию оснований с областями A и C, и расщепление, приводящее к DSB, происходит в или вблизи области X. SCNA могут быть комплементарны или смысловой, или антисмысловой цепи, но предпочтительно выбирают те, которые подвергаются спариванию оснований со смысловой (нетранскрибируемой) последовательностью. Обе SCNA могут подвергаться спариванию оснований с одной и той же цепью, поскольку белковый компонент находится на «ближайшем конце» SCNA, который определяется 5ʹ или 3ʹ модификацией праймера, находящейся на «ближайшем конце».
Последовательность сайта-мишени:
Примерами последовательностей-мишеней являются:
Экзон 1 начинается в положении 347, последовательностью-мишенью является GGGCATCTGGACCCTCCTACC (SEQ ID NO: 133)
А) SCNA:
Вариант 1 расстояния между SCNA, 21-п.о. гэп-мишень
SL351: A*GGATTGCTCAACAACCATGCTNNNNNN/36-FAM/ (только нуклеиновые кислоты представлены здесь в SEQ ID NO: 134)
SR373: /56-FAM/NNNNNNTCTGGTGAGCCCTCTCCTGCC*C (только нуклеиновые кислоты представлены здесь в SEQ ID NO: 135)
Вариант 2 расстояния между SCNA, на основе результатов вычислений, используя 24-п.о. гэп-мишень и более короткий "N" линкер для SCNA:
SL349: G*GAGGATTGCTCAACAACCATGNN/36-FAM/ (только нуклеиновые кислоты представлены здесь в SEQ ID NO: 136)
SR374: /56-FAM/NNCTGGTGAGCCCTCTCCTGCCC*G (только нуклеиновые кислоты представлены здесь в SEQ ID NO: 137)
Экзон 2 начинается в положении 12499, последовательностью-мишенью является TACGTCTGTTGCTAGATTATC (SEQ ID NO: 138)
В) SCNA:
Вариант 1 расстояния между SCNA, 21-п.о. гэп-мишень:
SL12503: A*TGCTTTTATTTTACAGGTTCTNNNNNN/36-FAM/ (только нуклеиновые кислоты представлены здесь в SEQ ID NO: 139)
SR12525: /56-FAM/NNNNNNGTCCAAAAGTGTTAATGCCCA*A (только нуклеиновые кислоты представлены здесь в SEQ ID NO: 140)
Вариант 2 расстояния между SCNA, на основе результатов вычислений, используя 24-п.о. гэп-мишень и более короткий "N" линкер для SCNA:
SL12501: TCATGCTTTTATTTTACAGGTTNN/36-FAM/ (только нуклеиновые кислоты представлены здесь в SEQ ID NO: 141)
SR12526: /56-FAM/NNTCCAAAAGTGTTAATGCCCAA*G (только нуклеиновые кислоты представлены здесь в SEQ ID NO: 142)
Экзон 2-мишень для рестрикционного анализа: CAGTTGAGACTCAGAACTTGG (SEQ ID NO: 143)
C) SCNA:
Вариант 1 расстояния между SCNA, 21-п.о. гэп-мишень
SL12595: G*GAATTGAGGAAGACTGTTACTANNNNNN/36-FAM/ (только нуклеиновые кислоты представлены здесь в SEQ ID NO: 144)
SR12617: /56-FAM/NNNNNNAAGGCCTGCATCATGATGGCCAATTCT*C (только нуклеиновые кислоты представлены здесь в SEQ ID NO: 145)
Вариант 2 расстояния между SCNA, на основе результатов вычислений, используя 24-п.о. гэп-мишень и более короткий "N" линкер для SCNA:
SL12594: G*GAATTGAGGAAGACTGTTACTNN/36-FAM/ (только нуклеиновые кислоты представлены здесь в SEQ ID NO: 146)
SR12619: /56-FAM/NNGGCCTGCATCATGATGGCCAA*T (только нуклеиновые кислоты представлены здесь в SEQ ID NO: 147)
Праймеры для анализа примера C:
FAS_E2F: CATGCTTTTATTTTACAG (SEQ ID NO: 148)
FAS_E2R: CTGTGACTTTCACTGTAATC (SEQ ID NO: 149)
В результате амплификации с помощью ПЦР мишени с использованием этих праймеров образуется (в случае немодифицированной ДНК) продукт ПЦР размером 227 п.о., расщепляемый DdeI с образованием фрагментом размером 127 п.о. и 100 п.о. Расщепления DdeI отменяется в результате точного направленного воздействия.
Экзон 9-мишень: CAATTGTGAATTCACATAGAA (SEQ ID NO: 150)
D) SCNA:
Вариант 1 расстояния между SCNA, 21-п.о. гэп-мишень
SL24524: G*GTGTCATATTATACAATATTTNNNNNN/36-FAM/ (только нуклеиновые кислоты представлены здесь в SEQ ID NO: 151)
SR24546: /56-FAM/NNNNNNAACATTAAATTATAATGTTTG*A (только нуклеиновые кислоты представлены здесь в SEQ ID NO: 152)
Вариант 2 расстояния между SCNA, на основе результатов вычислений, используя 24-п.о. гэп-мишень и более короткий "N" линкер для SCNA:
SL24522: T*TGGTGTCATATTATACAATATNN/36-FAM/ (только нуклеиновые кислоты представлены здесь в SEQ ID NO: 153)
SR24547: /56-FAM/NNACATTAAATTATAATGTTTGA*C (только нуклеиновые кислоты представлены здесь в SEQ ID NO: 154)
Праймеры для анализа примера D:
FAS_E9F CTTTGTTTATAACTCTGAGAAG (SEQ ID NO: 155)
FAS_E9R TCAAAATGCTTTTGATGCCTGA (только нуклеиновые кислоты представлены здесь в SEQ ID NO: 156)
В результате амплификации с помощью ПЦР мишени с использованием этих праймеров образуется (в случае немодифицированной ДНК) продукт ПЦР размером 240 п.о., расщепляемый EcoRI с образованием фрагментом размером 134 п.о. и 106 п.о. Расщепления EcoRI отменяется в результате точного направленного воздействия.
/56-FAM/ и /36-FAM/ символизируют 5ʹ-модификацию или 3ʹ-модификацию, соответственно, в SCNA-оцДНК, включающей 6-FAM (6-карбокси-флуоресцеин). N символизирует любой нуклеотид. Фосфоротиоатные связи изображены звездочкой (*).
Хотя каждая пара SCNA может вызвать мутацию, которая выводит из действия рецептор FAS, делеция всего участка ДНК, являющаяся результатом направленного воздействия на более чем один сайт в гене, может полностью блокировать активность FasR. Таким образом, например, использование SCNA в примерах A-C может привести к мутациям, аннулирующим активность FasR, в то время как использование любых из этих SCNA вместе с SCNA примера D приводит к значительной делеции генома, которая аннулирует активность FasR.
Анализ:
Биоанализ для детектирования индуцированной специфической мутации в геномной ДНК человека является следующим: Клетки HeLa и Jurkat трансфецируют плазмидой, кодирующей белковый компонент программируемого молекулярного комплекса, вместе с соответствующими SCNA-оцДНК, используя агенты для трансфекции (Miris, США), TransIT-HeLaMONSTER или TransIT-LTl для приготовления смеси с плазмидной ДНК и TransIT-Oligo для приготовления смеси с SDCNA-оцДНК. После инкубации в течение отведенного времени, оба ряда приготовленных смесей ДНК-агент для трансфекции применяют одновременно к клеткам, для направленного воздействия на хромосомный FasR. Для определения эффективности направленного воздействия на ген проверяют чувствительность клеток к FasL в протоколе, модифицированном исходя из (Kotlo et. al., 2003). Трансфецированные клетки высевают в двух повторах за 20-24 ч до обработки комбинацией 200 нг/мл являющегося агонистом антитела против FasR (мАт против FasR, клон 2R2, каталожный № MC-121, Kamiya Biomedical Company) или моноклональным антителом против CD95 (клон 7C11, каталожный № PN IM2387 Beckman-Coulter) и необязательно сенсибилизатором, таким как Dicumarol, 100 мкмоль. Через семнадцать часов после обработки определяют количество жизнеспособных, не окрашивающихся трипановым синим клеток, которые остаются прикрепленными к планшету после промывки PBS, или в альтернативном случае выполняют окрашиванием с исключением иодида пропидия для оценки интактных живых клеток с помощью проточной цитометрии (FACS). Клетки, в которых ген FAS был подвергнут направленному воздействию и отключен, не проходят через процесс индукции гибели, не окрашиваются, а точнее размножаются. Таким образом, с помощью сравнения индуцированных, подвергнутых специфическому воздействию клеток с подвергнутыми неспецифическому воздействию клетками (например, без SCNA или с использованием не относящихся к FAS SCNA) оценивают успех направленного воздействия на ген в клетках человека. Остающиеся в живых или отсортированные с помощью FACS линии клеток анализируют с помощью амплификации с использованием ПЦР геномной ДНК в подвергнутых направленному воздействию районах FasR с последующим анализом рестрикционных фрагментов и секвенированием для идентификации индуцированных мутаций.
ПРИМЕР 10: Корректирование плазмидной ДНК-последовательности in-vivo. Модификация устойчивости к антибиотику.
Этот пример предназначен для биоанализа, подходящего для проверки и корректировки пермутаций при основной разработке программируемого молекулярного комплекса; для проверки его применимости в различных организмах и клетках; для проверки различных способов доставки и для проверки корректирующий действий мутации, замены, делеции и вставки.
Бактериальные гены селектируемых маркеров используются для определения эффективности направленного воздействия на ген при направленном воздействии на плазмидную ДНК.
В этих примерах используется биоанализ на основе протопластов Arabidopsis. В этом биоанализе в протопласты доставляют репортерную систему и молекулярный комплекс на плазмиде, доставляемой совместно с спаренными SCNA-оцДНК, модифицированными дигоксигенином (NHS-эфир) (DIG) на конце, при этом одна SCNA имеет такую модификацию на 3ʹ-конце, а другая - на 5ʹ-конце. На противоположный конец может быть добавлена вторая модификация для защиты от экзонуклеазы, такая как фосфоротиоат.
Последовательность и свойства белка
Белковым компонентом является компонент, описанный в примере 1.
В этом примере концевой модификацией нуклеиновой кислоты - SCNA является связанный с NHS-эфиром дигоксигенин (DIG), который присоединен в 5ʹ или 3ʹ положении олигонуклеотида.
Аминокислотная последовательность (однобуквенный код) белкового компонента молекулярного комплекса (NLS-нуклеазная последовательность FokI с ScFv против дигоксигенина) представлена в SEQ ID NO: 12.
Свойства и последовательность SCNA
Длина SCNA комплементарного, подвергающегося спариванию оснований с мишенью олигонуклеотида составляет предпочтительно по крайней мере 18 оснований. SCNA может также содержать небольшое число (например, 1-6, в одном примере - 6, в другом примере - 2) не подвергающихся спариванию оснований с мишенью нуклеотидов (Nʹ) с любым составом последовательности, которые служат в качестве спейсера между концевым модификатором DIG-NHS и комплементарными мишени нуклеотидами.
Результаты пространственных измерений, сделанных на основе компьютерных пространственных моделей для системы анти-DIG-ScFv-NHS-эфир-DIG с междоменным линкером GSLEGGSGG (SEQ ID NO: 14), как представлено в этом примере, привели к заключению, что предполагаемое оптимальное расстояние между SCNA составляет, в присутствии 2 Nʹ в SCNA, приблизительно 23-26 нуклеотидов. Расщепление, как предсказывают, будет происходить приблизительно ±2 нуклеотида слева и справа от 11-ого, 12-ого или 13-ого нуклеотида, считая от последнего нуклеотида, гибридизующегося с SCNA, с любой стороны, учитывая 5ʹ-концевую избыточность из 4-оснований, создаваемую в результате расщепления дцДНК подвергнутой димеризации конструкцией. Этот критерий означает, что, если подвергаемой направленному воздействию последовательностью является, например, эта 24-нуклеотидная последовательность:
AAAAAAAAAAYYYYYYYYYXXXXXXYYYYYYYYYCCCCCCCCCC, где Y+X представляет собой число нуклеотидов между сайтами, подвергающими спариванию оснований с SCNA, то сконструированные SCNA подвергаются спариванию оснований с областями A и C, и расщепление, приводящее к DSB, происходит в или вблизи области X. SCNA могут быть комплементарны или смысловой, или антисмысловой цепи, но предпочтительно выбирают те, которые подвергаются спариванию оснований со смысловой (нетранскрибируемой) последовательностью. Обе SCNA могут подвергаться спариванию оснований с одной и той же цепью, поскольку белковый компонент находится на «ближайшем конце» SCNA, который определяется 5ʹ или 3ʹ модификацией праймера, находящейся на «ближайшем конце».
Анализ для детектирования:
Плазмида-мишень pTGD (схематически представленная на фиг. 15) включает 4 основных части:
1. Являющаяся мишенью кассета устойчивости к ампициллину (AmpR).
2. Конститутивная кассета устойчивости к канамицу (Km) (KanR) для отбора.
3. Начало репликации (ori).
4. Включающая кодирующую белковый компонент программируемого молекулярного комплекса последовательность кассета (PMCP), включающая промотор, подходящий для проверки организма, в этом примере, растений.
5. T1 и T2 - мишени-последовательности 1 и 2.
Эта плазмида увеличивается в числе в бактериальных клетках, таких как клетки E. coli. В этом примере SCNA, пдазмиду-мишень pTGD, кодирующую белковый компонент программируемого молекулярного комплекса, и донорную ДНК (в примерах 10B, 10C) доставляют в протопласты Arabidopsis. Через 48 часов после трансфекции ДНК экстрагируют из трансфецированных протопластов (набор A1120, Promega Corp.) и трансформируют в бактериальные компетентные клетки E. coli (набор L3002, Promega Corp.). Трансфецированные клетки распределяют по чашкам со средой LB, содержащей канамицин в концентрации = 100 мкг/мл. Колонии выращивают в течение приблизительно 16 ч при 37°C. Затем колонии переносят в виде реплики на чашки с LB с ампициллином (100 мкг/мл) или тетрациклином (100 мкг/мл) и выращивают в течение еще 16 ч при 37°C.
Анализ:
Посчитывают колонии от каждой реплики. Число устойчивых к камамицину колоний означает общее число плазмид, которое также представляет собой общее число мишеней. Колонии, которые не являются устойчивыми к ампициллину, являются колониями, которые содержат плазмиду, успешно подвергнутую направленному воздействию, подтверждая корректирующие действия «мутации» или «делеции». Колонии, устойчивые к тетрациклину, но не к ампициллину, представляют собой интеграцию донорной ДНК в плазмиду-мишень с помощью NHEJ, подтверждая корректирующие действия «замены». Колонии, которые являются устойчивыми и к ампициллину, и к тетрациклину, являются колониями, содержащими плазмиды, которые были подвергнуты воздействию, в которых произошла интеграция донора в последовательность-мишень AmpR, но не произошла ее замена, подтверждая корректирующие действия «вставки».
Плазмиды затем подвергают ПЦР и анализу последовательности для подтверждения результатов с использованием праймеров:
A961F: TAGGGCGCTGGCAAGTGTAG (SEQ ID NO: 158)
A2161R: CATAACACCCCTTGTATTAC (SEQ ID NO: 159)
Эксперименты:
Пример 10A - Направленная мутация в кассете AmpR.
Анализ для детектирования выполняют, по существу как описано выше («анализ для детектирования»), со следующими дополнительными подробностями: Плазмиду pTGD трансфецируют вместе с SCNA, фланкирующими последовательность 1-мишень (SEQ ID NO: 161), в протоплазмы Arabidopsis. ДНК очищают и трансформируют в компетентные клетки E. coli, которые распределяют по чашке со средой LB с Kan. Делают реплику на чашку с LB с AMP. Колонии, которые утратили устойчивость к AMP, содержат подвергнутую направленному воздействию плазмиду.
Пример 10B
Анализ для детектирования выполняют, по существу как описано выше («анализ для детектирования»), со следующими дополнительными подробностями: Плазмиду pTGD трансфецируют вместе с SCNA, фланкирующими последовательность 1-мишень, или донорной линейной дцРНК, придающей устойчивость к тетрациклину (Tet), полученной в виде продукта ПЦР, в протоплазмы Arabidopsis. ДНК очищают и трансформируют в компетентные клетки E. coli, которые распределяют по чашке со средой LB с Kan. Делают реплику и на чашку с LB с AMP, и на чашку с LB с Tet. Колонии, которые утратили устойчивость к AMP, содержат подвергнутую направленному воздействию плазмиду. Колонии, устойчивые к Tet, представляют плазмиды, содержащие специфически интегрированную донорную ДНК.
Пример 10C
Анализ для детектирования выполняют, по существу как описано выше («анализ для детектирования»), со следующими дополнительными подробностями: Плазмиду pTGD трансфецируют вместе с SCNA, направленными против последовательности 1-мишени, и SCNA против последовательности 2-мишени (SEQ ID NO: 170), вместе придающей устойчивость к тетрациклину (Tet) донорной ДНК в протоплазмы Arabidopsis. ДНК очищают и трансформируют в компетентные клетки E. coli, которые распределяют по чашке со средой LB с Kan. Делают реплику на чашку с LB с AMP и на чашку с LB с Tet. Колонии, которые утратили устойчивость к AMP, содержат подвергнутую направленному воздействию плазмиду. Колонии, устойчивые к Tet, представляют специфически интегрированную донорную ДНК. Чувствительные к AMP колонии подвергают анализу с помощью ПЦР с использованием праймеров A961F и A2161R.
Колонии, которые содержат плазмиду, включающую TetR-донор (приблизительно 1,9 т.п.о) вместо AMP (приблизительно 860 п.о.) последовательности-мишени, служат доказательством событий замены гена.
Колонии, чувствительные и к AMP, и к Tet, служат доказательством делеции гена через NHEJ.
Колонии, устойчивые и к Tet, и к AMP, содержат плазмиду, включающую TetR-донор без делеции кассеты устойчивости к Amp, и служат доказательством направленной интеграции или «вставки» донора.
Доставка
Постановка биоанализа: Приготовление протопластов Arabidopsis основывается на Wu и др. (2009) и схоже с таковым примера 1 с различиями в стадии трансфекции:
Трансфекция:
1. Приготовьте свежий раствор ПЭГ для трансфекции в 2-мл пробирке.
2. Вылейте BSA из 6-луночных планшетов и высушите.
3. Смешайте ~5×104 протопластов (2×104-1×105) в 0,2 мл раствора MMg со смесью плазмиды, включающей плазмидную ДНК-мишень и экспрессирующую белковый компонент ДНК, оцРНК-SCNA и донорной линейной дцДНК до всего 30-40 мкг при комнатной температуре в 15-мл круглодонных пробирках (с герметическим колпачком с защелкой).
4. Добавьте равный объем (0,2 мл протопластов+средний объем приготовления) свежего раствора ПЭГ.
5. Инкубируйте при комнатной температуре в течение 5 мин.
6. Промойте, медленно добавляя 3 мл раствора W5, 1 мл за раз, и смешивая.
7. Осуществите центрифугирование при 100 x g в роторе с корзинами (swing-out) в течение 1 мин.
8. Повторите промывку и осаждение.
9. Ресуспендируйте в 1 мл раствора W5.
10. Налейте в покрытые BSA планшеты.
11. Выращивайте протопласты в условиях 16-ч дневного оптимального света (150 микроЭйнштейн⋅м-2⋅сек-1) при 22°C, заменяя среды в соответствии с необходимостью.
Протопласты затем подвергают экстракции ДНК, как описано в анализе для детектирования.
Подвергаемая направленному воздействию кассета AmpR представлена в SEQ ID NO: 160.
Выбирают пары SCNA: одну левую (L) или одну правую (R), независимо от смысловой (S) или антисмысловой (AS) цепи: Выбор комбинации пары SCNA является проверяемым параметром в эксперименте.
Последовательность-мишень T1 в кассете AMPR: TATGAGTATTCAACATTTCCG (SEQ ID NO: 161) (инициирующий кодон ATG подчеркнут)
Набор 1 SCNA, мишенью которых является АМР:
Вариант 1 - использование 21-п.о. гэпа-мишени:
pTGD_130_SL: A*ATAATATTGAAAAAGGAAGAGNNNNNN/3DIGN/ (только нуклеиновые кислоты представлены здесь в SEQ ID NO: 162)
pTGD_152_SR: /5DIGN/NNNNNNTGTCGCCCTTATTCCCTTTTT*T (только нуклеиновые кислоты представлены здесь в SEQ ID NO: 163)
pTGD_130_ASL: /5DIGN/NNNNNNCTCTTCCTTTTTCAATATTAT*T (только нуклеиновые кислоты представлены здесь в SEQ ID NO: 164)
pTGD_152_ASR: A*AAAAAGGGAATAAGGGCGACANNNNNN/3DIGN/ (только нуклеиновые кислоты представлены здесь в SEQ ID NO: 165)
Вариант 2 - спаренные комбинации, используя 24-т.о. гэп-мишень и более короткий линкер для SCNA, в соответствии с результатами предсказаний:
AMP_129_SL: C*AATAATATTGAAAAAGGAAGANN/3DIGN/ (только нуклеиновые кислоты представлены здесь в SEQ ID NO: 166)
AMP_154_SR: /5DIGN/NNTCGCCCTTATTCCCTTTTTTG*C (только нуклеиновые кислоты представлены здесь в SEQ ID NO: 167)
AMP_129_ASL: /5DIGN/NNTCTTCCTTTTTCAATATTATT*G (только нуклеиновые кислоты представлены здесь в SEQ ID NO: 168)
AMP_154_ASR: G*CAAAAAAGGGAATAAGGGCGANN/3DIGN/ (только нуклеиновые кислоты представлены здесь в SEQ ID NO: 169)
Последовательность-мишень T2 в кассете AMPR: AGCATTGGTAACTGTCAGACC (SEQ ID NO: 170)
Набор 2 SCNA, мишенью которых является АМР:
Вариант 1 - использование 21-п.о. гэпа-мишени:
pTGD_981_SL: G*AGATAGGTGCCTCACTGATTANNNNNN/3DIGN/ (только нуклеиновые кислоты представлены здесь в SEQ ID NO: 171)
pTGD_1003_SR: /5DIGN/NNNNNNAAGTTTACTCATATATACTTT*A (только нуклеиновые кислоты представлены здесь в SEQ ID NO: 172)
pTGD_981_ASL: /5DIGN/NNNNNNTAATCAGTGAGGCACCTATCT*C (только нуклеиновые кислоты представлены здесь в SEQ ID NO: 173)
pTGD_1003_ASR: T*AAAGTATATATGAGTAAACTTNNNNNN/3DIGN/ (только нуклеиновые кислоты представлены здесь в SEQ ID NO: 174)
Вариант 2 - спаренные комбинации, используя 24-т.о. гэп-мишень и более короткий линкер для SCNA, в соответствии с результатами предсказаний:
AMP_980_SL: T*GAGATAGGTGCCTCACTGATTNN/3DIGN/ (только нуклеиновые кислоты представлены здесь в SEQ ID NO: 175)
AMP_1005_SR: /5DIGN/NNGTTTACTCATATATACTTTAG*A (только нуклеиновые кислоты представлены здесь в SEQ ID NO: 176)
AMP_980_ASL: /5DIGN/NNAATCAGTGAGGCACCTATCTC*A (только нуклеиновые кислоты представлены здесь в SEQ ID NO: 177)
AMP_1005_ASR: T*CTAAAGTATATATGAGTAAACNN/3DIGN/ (только нуклеиновые кислоты представлены здесь в SEQ ID NO: 178)
Донор:
Донорная последовательность, кодирующая устойчивость к тетрациклину, из вектора для клонирования pSoup, EU048870.1 GI: 155733614 представлена в SEQ ID NO: 179.
ПРИМЕР 11: Конструирование программируемого молекулярного комплекса, который действует с парой соединенных последовательностей SCNA.
В этой примере разработан программируемый молекулярный комплекс, который функционирует с одной молекулой нуклеиновой кислоты, включающей две связывающиеся с последовательностью-мишенью последовательности нуклеиновых кислот, здесь названными соединенной парой придающих специфичность последовательностей нуклеиновых кислот (последовательностей SCNA), как схематически иллюстрируется на фиг. 4A и 4B.
В этом примере нарушенная последовательность GFP-мишень репарируется в результате удаления или мутации стоп-кодона. Результирующе расщепление заданной мишени-GFP приводит к точечной мутации, которая может восстановить активность GFP.
В этих примерах используется биоанализ на основе протопластов Arabidopsis, в котором в протопласты доставляется репортерная система (плазмида-мишень), экспрессирующая белковый компонент плазмида, которые доставляются или вместе, в примере 12A (со схематической иллюстрацией на фиг. 4A), с нуклеиновой кислотой, кодирующей РНК, состоящей из двух последовательностей SCNA, модифицированных, в этом примере, с использованием 20-нуклеоитидной, связывающей последовательности РНК-шпильки бокса-B из бактериофага φ21 (SEQ ID NO: 62: 5ʹ-UUCACCUCUAACCGGGUGAG-3ʹ), и «соединителя SCNA», не гибридизующегося с мишенью участка нуклеотидов неопределенной последовательности или длины, при этом одна SCNA имеет такую модификацию на 3ʹ-конце, а другая - на 5ʹ-конце молекулы РНК. РНК-SCNA в этом примере связываются со связующим доменом белкового компонента двух молекулярных комплексов, используя 20-нуклеоитидную, связывающую последовательность РНК-шпильки бокса-B из бактериофага φ21 (5ʹ-UUCACCUCUAACCGGGUGAG-3ʹ (SEQ ID NO: 62), или вместе, в примере 11B (со схематической иллюстрацией на фиг. 4В), с модифицированной оцРНК-SCNA, содержащей последовательность, в этом примере, модифицированную на обоих 5ʹ- и 3ʹ-концах посредством добавления концевых молекул дигоксигенина (NHS-эфира) (DIG), и «соединитель для SCNA», не гибридизующийся с мишенью участок нуклеотидов неопределенной последовательности или длины.
Последовательность и свойства белка
Белковый компонент в примере 11A содержит аминокислотную последовательность, происходящую из нуклеазного домена FokI, в качестве функционального домена, связующий домен, происходящий из РНК-связывающего белка (RBP) N-белка бактериофага φ21 (SEQ ID NO: 63: Nʹ-GTAKSRYKARRAELIAER-Cʹ), SV40NLS (PKKKRKV: SEQ ID NO: 3) в качестве домена ядерной локализации и междоменный соединитель (SEQ ID NO: 14: GSLEGGSGG).
Белковый компонент в примере 11В содержит аминокислотную последовательность, заимствованную из нуклеазного домена FokI, в качестве функционального домена; аминокислотную последовательность, заимствованную из одноцепочечного Fv-фрагмента иммуноглобулина (scFv) против DIG (DIG-ScFv), схожую с той, которая описана в (Huston et. al, 1988), в качестве связующего домена; SV40NLS (PKKKRKV: SEQ ID NO: 3) в качестве домена ядерной локализации и междоменный соединитель (SEQ ID NO: 14: GSLEGGSGG).
Концевыми модификациями нуклеиновых кислот - SCNA являются связанный с помощью NHS-эфира дигоксигенин (DIG) и присоединены к обоим 5ʹ и 3ʹ положениям олигонуклеотида.
Пример 11A: Последовательность белкового компонента программируемого молекулярного комплекса на основе N-белка бактериофага φ21:
Компоненты:
N-белок бактериофага φ21 (SEQ ID NO: 63: GTAKSRYKARRAELIAER) на или вблизи Nʹ-конце(а), поскольку в полноразмерном N-белке РНК-связывающий пептид находится на N-конце.
Нуклеаза FokI

SV40-NLS: (PKKKRKV: SEQ ID NO: 3)
Междоменные соединители: различные полиаминокислотные линкеры проверяют в отношении оптимального функционирования запрограммированного молекулярного комплекса.
Аминокислотная последовательность белкового компонента молекулярного комплекса: В этом примере N-белок (NP) φ21 (с аминокислотной последовательностью, представленной в SEQ ID NO: 68), установлен на Nʹ-конце белкового компонента программируемой молекулярной конструкции, а сигнал ядерной локализации, SV40NLS, находится на Cʹ-конце, и междоменным линкером является GGSGG (SEQ ID NO: 7).
Пример 11B: Аминокислотная последовательность (однобуквенный код) белкового компонента молекулярного комплекса (NLS-нуклеаза FokI c ScFv против дигоксигенина), представлена в SEQ ID NO: 12.
Свойства и последовательность SCNA
Длина SCNA комплементарного, подвергающегося спариванию оснований с мишенью олигонуклеотида может быть любой заданной длиной. Например, длина составляет по крайней мере 18 оснований. SCNA может также содержать небольшое число (предпочтительно 0-6, более предпочтительно 1-2) не подвергающихся спариванию оснований с мишенью нуклеотидов (Nʹ) с любым составом последовательности, которые служат в качестве спейсера между А) концевым модификатором РНК-шпилькой бокса-В φ21 в примере 11A или B) концевым модификатором DIG-NHS в примере 12B и комплементарными нуклеотидами. В этих примерах SCNA соединены с помощью не подвергающейся спариванию оснований с мишенью последовательности, обозначенной как «соединитель SCNA» на фиг. 14 или X(n) в последовательностях этого примера. X(n) означает неопределенную длину РНК-нуклеотидов, соединяющих два придающих специфичность участка друг с другом. В случае линейной ДНК, вероятная оптимальная длина (n) составляет приблизительно 35-76 нуклеотидов, хотя применимы более длинные (больше 73 нуклеотидов) или более короткие (4-34 нуклеотида) соединители SCNA. В представленных здесь примерах n=40 нуклеотидов.
SCNA могут быть комплементарны или смысловой, или антисмысловой цепи, но предпочтительно выбирают те, которые подвергаются спариванию оснований со смысловой (нетранскрибируемой) последовательностью, хотя два варианта представлены здесь для каждого примера. Обе последовательности SCNA могут подвергаться спариванию оснований с одной и той же цепью, поскольку белковый компонент находится на «ближайшем конце» SCNA, который определяется 5ʹ или 3ʹ модификацией праймера, находящейся на «ближайшем конце».
Содержащая «STOP GFP»-мишень плазмида для анализов примеров 11A и 11B содержит последовательность нуклеиновой кислоту, представленную в (SEQ ID NO: 181).
Пример 11A: (на основе NP φ21)
Сконструированы гибридизующиеся со смысловой или антисмысловой цепью сдвоенные SCNA:
Гибридизующиеся со смысловой цепью, соединенные SCNA:
GFP-921SR-X(n)-892SL BOXBPHI
UUCACCUCUAACCGGGUGAGNUCCAAGGGCGAGGAGCUGUUCA (SEQ ID NO: 207)-X(n)-ACCAUUUACGAACGAUAGCCAUNUUCACCUCUAACCGGGUGAG (определенная как SEQ ID NO: 208).
Гибридизующиеся с антисмысловой цепью, соединенные SCNA:
GFP-921ASR-X(n)-892ASL BOXBPHI
UUCACCUCUAACCGGGUGAGNAUGGCUAUCGUUCGUAAAUGGU (SEQ ID NO: 209)-X(n)-UGAACAGCUCCUCGCCCUUGGANUUCACCUCUAACCGGGUGAG (SEQ ID NO: 210)
20-нуклеотидная последовательность PHI бокса-В 5ʹ-UUCACCUCUAACCGGGUGAG-3ʹ (SEQ ID NO: 62) подчеркнута. Придающие специфичность последовательности в сдвоенной SCNA помечены на схематических рисунках фиг. 4A-B как SCNA1 и SCNA2. Nʹ означают короткий участок (0-6) любых нуклеотидов, X(n) означает не подвергающийся гибридизации с мишенью участок нуклеотидов неопределенной последовательности или длины (соединитель SCNA).
Пример 11B:
Сконструированы гибридизующиеся со смысловой или антисмысловой цепью сдвоенные SCNA:
Гибридизующиеся со смысловой цепью, соединенные SCNA:
GFP-919SR-X(n)-894SL-DIG
/5DigN/NNTGTCCAAGGGCGAGGAGCTGTT (только нуклеиновые кислоты определены здесь как SEQ ID NO: 211)
-X(n)-CATTTACGAACGATAGCCATGGNN/3DigN/ (только нуклеиновые кислоты определены здесь как SEQ ID NO: 212)
Гибридизующиеся с антисмысловой цепью, соединенные SCNA:
GFP-919ASR-X(n)-894ASL-DIG
/5DigN/NNCCATGGCTATCGTTCGTAAATG (только нуклеиновые кислоты определены здесь как SEQ ID NO: 213)
-X(n)-AACAGCTCCTCGCCCTTGGACANN/3DigN/ (только нуклеиновые кислоты определены здесь как SEQ ID NO: 214)
Обозначениями модификаций являются обозначения, используемые на веб-сайте Integrated DNA Technology (IDT) (5ʹDIG=/5DigN/; 3ʹDIG=/3DigN/), X(n) означает не подвергающийся гибридизации с мишенью участок нуклеотидов неопределенной последовательности или длины (соединитель SCNA).
Доставка
Постановка биоанализа: Приготовление протопластов Arabidopsis основывается на Wu и др. (Wu et. al, 2009) и схоже с таковым примера 1 с различиями в стадии трансфекции:
Трансфекция:
1. Приготовьте свежий раствор ПЭГ для трансфекции в 2-мл пробирке.
2. Вылейте BSA из 6-луночных планшетов и высушите.
3. Смешайте ~5×104 протопластов (2×104-1×105) в 0,2 мл раствора MMg со смесью плазмиды, включающей плазмидную ДНК - мишень и экспрессирующую белковый компонент ДНК, и экспрессирующей сдвоенную SCNA плазмиды (в случае примера 12А) или содержащей сдвоенную SCNA оцДНК (в случае примера 12В) до всего 30-40 мкг при комнатной температуре в 15-мл круглодонных пробирках (с герметическим колпачком с защелкой).
4. Добавьте равный объем (0,2 мл протопластов + средний объем приготовления) свежего раствора ПЭГ.
5. Инкубируйте при комнатной температуре в течение 5 мин.
6. Промойте, медленно добавляя 3 мл раствора W5, 1 мл за раз, и смешивая.
7. Осуществите центрифугирование при 100 × g в роторе с корзинами (swing-out) в течение 1 мин.
8. Повторите промывку и осаждение.
9. Ресуспендируйте в 1 мл раствора W5.
10. Налейте в покрытые BSA планшеты.
11. Выращивайте протопласты в условиях 16-ч дневного оптимального света (150 микроЭйнштейн⋅м-2⋅сек-1) при 22°C, заменяя среды в соответствии с необходимостью.
Протопласты затем подвергают FACS или экстракции ДНК, как описано ниже.
Результаты: Точечная мутация в результате индуцированного DSB.
В этом примере расщепление мишени с помощью молекулярного комплекса приводит к двухцепочечному разрыву (DSB) в плазмидной ДНК-мишени. Этот DSB создается в месте стоп-кодона, который расщепляется и подвергается репарации с помощью эндогенного механизма репарации с использованием NHEJ. NHEJ имеет тенденцию к созданию мутаций, и некоторые из этих мутаций могут аннулировать стоп-кодон и восстановить открытую рамку считывания, приводя к открытой рамке считывания (ORF) для активного GFP. GFP затем детектируют с помощью микроскопии или проточного цитометра (FACS), что делает возможным измерение эффективности системы и сравнение между переменными для ее улучшения.
Анализ:
Эффективность направленного воздействия на ген определяют в виде процента GFP-позитивных клеток. Протопласты, суспендированные в растворе W5, подвергают скринингу в отношении GFP активности через 3 дня после трансфекции, используя автоматический проточный цитометр (FACS). GFP детектируют посредством возбуждения при 488 нм с эмиссией, детектируемой с использованием 530/30 фильтра. Устанавливают пороговую величину и коэффициенты коррекции для исключения любых ошибочных результатов.
Последовательностью-мишенью является стоп-кодон вместе с диагностическим рестрикционным сайтом (SpeI ACTAGT, стоп-кодон подчеркнут) в кодирующей GFP последовательности. После успешного направленного воздействия, стоп-кодон и диагностический рестрикционный сайт аннулируются в результате делеции, вставки или события точечной мутации. Репарация в конкретной рамке может также восстановить экспрессию GFP. Анализ проводят с помощью FACS, как описано здесь ниже, или посредством очистки плазмидной ДНК из протопластов, используя набор для минимального приготовления плазмиды (Bioneer K3030), как указано ниже: протопласты в растворе W5 осаждают и лизируют, добавляя 250 мкл буфера 1 и приступая к протоколу, изложенному для бактериальных осадков в инструкциях производителя. Район между SCNA амплифицируют, исходя из результирующего препарата плазмиды, с помощью ПЦР. Продукты ПЦР исчерпывающе расщепляют SpeI. После электрофореза нерасщепленные продукты вырезают из геля, клонируют в вектор для клонирования T/A (pUC57/T Fermentas), и отдельные клоны секвенируют для детектирования событий различных мутаций.
ПРИМЕР 12. Биоанализ для определения оптимальных расстояний между SCNA.
Для определения оптимальных расстояний между SCNA от потенциальных сайтов-мишеней, для каждого отличного типа мишени или типа программируемого молекулярного комплекса, создают ряд плазмид-мишеней (pTARGET-STOPGFP(n), фиг. 16), содержащих нарушенную, кодирующую GFP-репортер последовательность (STOP-GFP). В искусственную Nʹ лидерную последовательность и в кодирующую GFP последовательность (CDS) вставляют две SCNA-связывающие последовательности (SCNAbs), которые фланкируют последовательность-мишень, переменных длин, образуя ряд плазмид, названных pTARGET-STOPGFP(1-8) (фиг. 16). Вставки, приведенные на фиг. 16, осуществляют, используя рестриктазы NcoI и MscI. Последовательностью-мишенью является стоп-кодон вместе с диагностическим рестрикционным сайтом (SpeI ACTAGT (SEQ ID NO: 215) или BclI TGATCA (SEQ ID NO: 216), стоп-кодон подчеркнут) в искусственной Nʹ лидерной последовательности.
Другие компоненты плазмиды включают 1) промотор, функционально связанный с кодирующей GFP последовательностью. Анализ можно проводить в различных эукариотах. В этом примере промотор растения, такой как NosP, используется для проведения эксперимента в протопластах Arabidopsis. 2) пару сайтов связывания SCNA (SCNA1bs и SCNA2bs); 3) сайт-мишень, содержащий стоп-кодон; 4) кодирующую GFP последовательность и 5) последовательность терминатора транскрипции, в этом примере NosT.
Схематический рисунок (масштаб не выдержан), представленный на фиг. 16, иллюстрирует набор из восьми, приводимых в качестве примера конструкций в ряде плазмид pTarget-STOPGFP(n), содержащих нарушенную кодирующую репортер-зеленый флуоресцентный белок (GFP) последовательность (STOPGFP), где «n» означает порядковый номер, приведенный в таблице фиг. 16. Границы ряда вставок переменной длины и состава устанавливают сайт для рестриктазы NcoI, охватывающий инициирующий кодон, и сайт для MscI на противоположном конце. SCNA1bs находится в GFP-искусственной Nʹ лидерной последовательности, а SCNA2bs находится в кодирующей GFP последовательности. Последовательностью-мишенью является стоп-кодон вместе с диагностическим рестрикционным сайтом (SpeI ACTAGT (SEQ ID NO: 215) или BclI TGATCA (SEQ ID NO: 216), стоп-кодон подчеркнут) и сдвигом рамки считывания (за исключением n=5) в искусственной Nʹ лидерной последовательности. Последовательности спейсеров между сайтами-мишенями представлены в примере 12. В таблице, «n» означает порядковый номер плазмиды. Представлено расстояние между SCNAbs в парах оснований (п.о.), а затем соответствующий диагностический рестрикционный сайт в круглых скобках. Представлены места желаемого расщепления в верхней и нижней цепях, в связи с ожидаемыми 5ʹ-избыточностями из 4 п.о., где числа ±2 находятся во вставках нуклеотидов с четным номером, а числа ±3 - во вставках с нечетным номером, вследствие неопределенности, вызванной установкой каталитического положения «на» нуклеотиде вместо между нуклеотидами. В некоторых случаях расщепления эндогенные механизмы репарации могут быть причиной неидеальной репарации, являющейся причиной делеции, мутации или добавления нематричных нуклеотидов. Некоторые из этих репарированных последовательностей могут вызывать аннулирование стоп-кодона и диагностического рестрикционного сайта вместе со сдвигом рамки считывания, что приводит к восстановлению экспрессии GFP. Минимальные события восстановления, добавление или делеция нуклеотидов или точечные мутации, представлены в крайнем справа столбе таблицы.
Последовательность распознавания связывающейся с SCNA1 последовательности во вставке:
Последовательность распознавания связывающейся с SCNA2 последовательности в кодирующей GFP последовательности:
Как приведено на фиг. 16:
NcoI/MscI вставка для n=1:
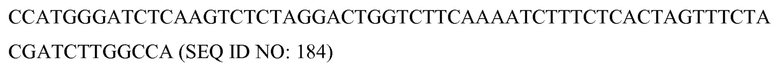
NcoI/MscI вставка для n=2:
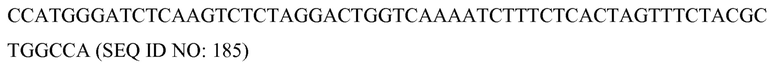
NcoI/MscI вставка для n=3:
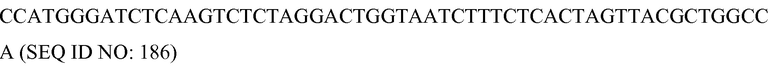
NcoI/MscI вставка для n=4:
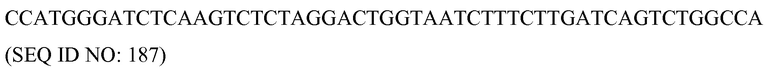
NcoI/MscI вставка для n=5:
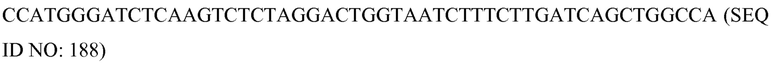
NcoI/MscI вставка для n=6:
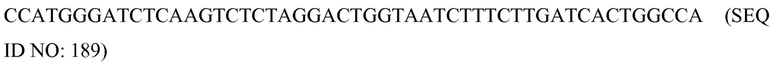
NcoI/MscI вставка для n=7:
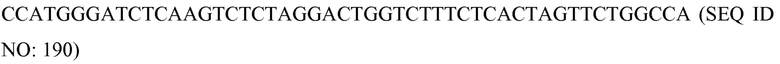
NcoI/MscI вставка для n=8:
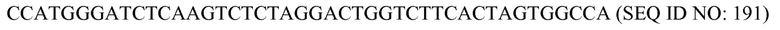
Каждый молекулярный комплекс котрансфецируют в протопласты Arabidopsis, как описано здесь ниже:
Доставка
Постановка биоанализа: Приготовление протопластов Arabidopsis основывается на (Wu et. al, 2009) и схоже с таковым примера 1 с различиями в стадии трансфекции:
Трансфекция:
1. Приготовьте свежий раствор ПЭГ для трансфекции в 2-мл пробирке.
2. Вылейте BSA из 6-луночных планшетов и высушите.
3. Смешайте ~5×104 протопластов (2×104-1×105) в 0,2 мл раствора MMg со смесью донорной плазмидной ДНК (в соответствующих случаях), экспрессирующей белковый компонент плазмидной ДНК и оцРНК-SCNA до всего 30-40 мкг при комнатной температуре в 15-мл круглодонных пробирках (с герметическим колпачком с защелкой). В альтернативном случае донорную ДНК и экспрессирующую белковый компонент ДНК конструируют и доставляют в одной плазмиде.
4. Добавьте равный объем (0,2 мл протопластов+средний объем приготовления) свежего раствора ПЭГ.
5. Инкубируйте при комнатной температуре в течение 5 мин.
6. Промойте, медленно добавляя 3 мл раствора W5, 1 мл за раз, и смешивая.
7. Осуществите центрифугирование при 100 x g в роторе с корзинами (swing-out) в течение 1 мин.
8. Повторите промывку и осаждение.
9. Ресуспендируйте в 1 мл раствора W5.
10. Налейте в покрытые BSA планшеты.
11. Выращивайте протопласты в условиях 16-ч дневного оптимального света (150 микроЭйнштейн.м-2.сек-1) при 22°C, заменяя среды в соответствии с необходимостью.
Анализ:
Эффективность направленного воздействия на ген каждой формы молекулярного комплекса проверяют на ряде пдазмид pTARGET-STOPGFP(n).
После успешного направленного воздействия, стоп-кодон и диагностический рестрикционный сайт аннулируются в результате делеции, вставки или события точечной мутации (фиг. 16). Репарация в конкретной рамке может также восстановить экспрессию GFP (фиг. 16). Анализ проводят с помощью FACS или посредством очистки плазмидной ДНК из протопластов, используя набор для минимального приготовления плазмиды (Bioneer K3030), как указано ниже: протопласты в растворе W5 осаждают и лизируют, добавляя 250 мкл буфера 1 и приступая к протоколу, изложенному для бактериальных осадков в инструкциях производителя. Район «спейсера» амплифицируют, исходя из результирующего препарата плазмиды, с помощью ПЦР. Продукты ПЦР исчерпывающе расщепляют SpeI (37°C) или BclI (50°C) сообразно обстоятельствам. После электрофореза нерасщепленные продукты вырезают из геля, клонируют в вектор для клонирования T/A (pUC57/T Fermentas), и отдельные клоны секвенируют для детектирования событий различных мутаций.
Эффективность направленного воздействия на ген определяют затем в виде процента GFP-позитивных клеток. Протопласты, суспендированные в растворе W5, подвергают скринингу в отношении GFP активности через 3 дня после трансфекции, используя автоматический проточный цитометр (FACS). GFP детектируют посредством возбуждения при 488 нм с эмиссией, детектируемой с использованием 530/30 фильтра. Устанавливают пороговую величину и коэффициенты коррекции для исключения любых ошибочных результатов.
Включаемыми в эксперимент контролями являются 1) использование необоснованных (не подвергающихся спариванию оснований) SCNA для контролирования неспецифического связывания, 2) использование pTARGET-STOPGFP, в которой отсутствует один сайт связывания в мишени, для контролирования недимерного действия, 3) использование pTARGET-GFP, схожей плазмиды без стоп-кодона, нарушающего GFP, и с наличием GFP в рамке считывания в качестве положительного контроля, 4) использование pTARGET-STOP-I-SceI-GFP, плазмиды, схожей с pTARGET-STOPGFP, но содержащей сайт для рестриктазы I-SceI вблизи стоп-кодона, нарушающего GFP, вместе с pSAT4-NLS-I-SceI, плазмидой, экспрессирующей рестриктазу I-Scel с ядерной локализацией в клетках растений, в качестве сравнительной гетерологичной системы-контроля.
Вышеприведенное описание конкретных вариантов осуществления будет настолько полно раскрывать общую природу настоящего изобретения, что другие могут, используя современный уровень знания, легко модифицировать и/или адаптировать для различных применений такие конкретные варианты осуществления без чрезмерного экспериментирования и без выхода за рамки базовой идеи, и по этой причине такие адаптации и модификации должны быть и, как подразумевается, включены в значение и ряд эквивалентов раскрытых вариантов осуществления. Хотя настоящее изобретение было описано в сочетании с его конкретными вариантами осуществления, ясно, что множество альтернатив, модификаций и вариаций будет очевидно для квалифицированных в данной области техники специалистов. Соответственно, предполагается включение всех такие альтернатив, модификаций и вариаций, которые находятся в пределах сущности и широкого объема прилагаемой формулы изобретения.
СПИСОК ЛИТЕРАТУРЫ
1. Schierling В, DannemannN, Gabsalilow L, Wende W, Cathomen T, Pingoud A. (2012). A novel zinc-finger nuclease platform with a sequence-specific cleavage module. Nucleic Acids Res. 2012 Mar;40 (6): 2623-38.
2. Eisenschmidt K, Lanio T, Simoncsits A, Jeltsch A, Pingoud V, Wende W, Pingoud A. (2005). Developing a programmed restriction endonuclease for highly specific DNA cleavage. Nucleic Acids Res. 2005 Dec 14; 33 (22): 7039-47.
3. Kubo T, Kanno К, Ohba H, Rumiana В, Fujii M. (2004). Control of intracellular delivery of oligonucleotides by signal peptides and genetic expression in human cells. Nucleic Acids Symp Ser (Oxf). 2004; (48): 303-4.
4. Jinek M, Chylinski K, Fonfara I, Hauer M, Doudna JA, Charpentier E. (2012). A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 2012 Aug 17; 337 (6096): 816-21.
5. Hanic-Joyce PJ, Gray MW (1991) Accurate transcription of a plant mitochondrial gene in vitro. Mol Cell Biol 11: 2035-2039
6. Vainstein A, Marton I, Zuker A, Danziger M, Tzfira T (2011) Permanent genome modifications in plant cells by transient viral vectors. Trends in Biotechnology 29: 363-369.
7. Gallois P, Marinho P (1995) Leaf disk transformation using Agrobacterium tumefaciens-expression of heterologous genes in tobacco. Methods Mol Biol 49: 39-48.
8. Kochevenko A, Willmitzer L (2003) Chimeric RNA/DNA oligonucleotide-based site-specific modification of the tobacco acetolactate syntase gene. Plant Physiol 132: 174-184.
9. Marrs KA, Urioste JC (1995) Transient Gene Expression Analysis in Electroporated Maize Protoplasts. Vol. 55, pp 133-145.
10. Kotlo KU, Yehiely F, Efimova E, Harasty H, Hesabi B, Shchors K, Einat P, Rozen A, Berent E, Deiss LP (2003) Nrf2 is an inhibitor of the Fas pathway as identified by Achillesʹ Heel Method, a new function-based approach to gene identification in human cells. Oncogene 22: 797-806.
11. Huston JS, Levinson D, Mudgett-Hunter M, Tai MS, Novotny J, Margolies MN, Ridge RJ, Bruccoleri RE, Haber E, Crea R, et. al. (1988) Protein engineering of antibody binding sites: recovery of specific activity in an anti-digoxin single-chain Fv analogue produced in Escherichia coli. Proc Natl Acad Sci U S A 85: 5879-5883.
12. Wu FH, Shen SC, Lee LY, Lee SH, Chan MT, Lin CS (2009) Tape-Arabidopsis Sandwich - a simpler Arabidopsis protoplast isolation method. Plant Methods 5:16.
13. Antonelli NM, Stadler J (1989) Chemical methods for direct gene transfer to maize protoplasts: I. Efficient transient expression after treatment with the polycation Polybrene Maize News letter 63: 21-22.
14. Sheen J (2001) Signal transduction in maize and Arabidopsis mesophyll protoplasts. Plant Physiol 127: 1466-1475.
15. Gordon-Kamm WJ, Spencer TM, Mangano ML, Adams TR, Daines RJ, Start WG, OʹBrien JV, Chambers SA, Adams WR, Jr., Willetts NG, Rice ТВ, Mackey CJ, Krueger RW, Kausch AP, Lemaux PG (1990) Transformation of Maize Cells and Regeneration of Fertile Transgenic Plants. Plant Cell 2: 603-618.
| название | год | авторы | номер документа |
|---|---|---|---|
| НАПРАВЛЕННАЯ МОДИФИКАЦИЯ МАЛАТДЕГИДРОГЕНАЗЫ | 2013 |
|
RU2658437C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ ХАНТИНГТОНА | 2014 |
|
RU2693891C1 |
| ФУНКЦИОНАЛЬНЫЕ ЛОКУСЫ FAD2 И СООТВЕТСТВУЮЩИЕ СПЕЦИФИЧНЫЕ ДЛЯ САЙТА-МИШЕНИ СВЯЗЫВАЮЩИЕСЯ БЕЛКИ, СПОСОБНЫЕ ИНДУЦИРОВАТЬ НАПРАВЛЕННЫЕ РАЗРЫВЫ | 2013 |
|
RU2656158C2 |
| ЛОКУСЫ FAD3 ДЛЯ ВЫПОЛНЕНИЯ ОПЕРАЦИЙ И СООТВЕТСТВУЮЩИЕ СВЯЗЫВАЮЩИЕСЯ СО СПЕЦИФИЧЕСКИМИ САЙТАМИ-МИШЕНЯМИ БЕЛКИ, СПОСОБНЫЕ К ВЫЗОВУ НАПРАВЛЕННЫХ РАЗРЫВОВ | 2013 |
|
RU2665811C2 |
| БЫСТРЫЙ НАПРАВЛЕННЫЙ АНАЛИЗ СЕЛЬСКОХОЗЯЙСТВЕННЫХ КУЛЬТУР ДЛЯ ОПРЕДЕЛЕНИЯ ДОНОРНОЙ ВСТАВКИ | 2014 |
|
RU2668819C2 |
| ДНК-СОДЕРЖАЩИЕ ПОЛИНУКЛЕОТИДЫ И РУКОВОДЯЩИЕ ПОСЛЕДОВАТЕЛЬНОСТИ ДЛЯ СИСТЕМ CRISPR ТИПА V И СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2021 |
|
RU2832314C1 |
| НУКЛЕАЗА PaCas9 | 2018 |
|
RU2706298C1 |
| ЛОКУСЫ ФУНКЦИОНАЛЬНОСТИ FAD2 И СООТВЕТСТВУЮЩИЕ СПЕЦИФИЧНЫЕ К УЧАСТКУ-МИШЕНИ СВЯЗЫВАЮЩИЕ БЕЛКИ, СПОСОБНЫЕ ИНДУЦИРОВАТЬ НАПРАВЛЕННЫЕ РАЗРЫВЫ | 2013 |
|
RU2656159C2 |
| ГИБРИДНЫЕ ДНК/РНК-ПОЛИНУКЛЕОТИДЫ CRISPR И СПОСОБЫ ПРИМЕНЕНИЯ | 2016 |
|
RU2713328C2 |
| ИСКУССТВЕННАЯ МОДИФИКАЦИЯ ГЕНОМА ДЛЯ РЕГУЛЯЦИИ ЭКСПРЕССИИ ГЕНА | 2018 |
|
RU2767201C2 |





















































































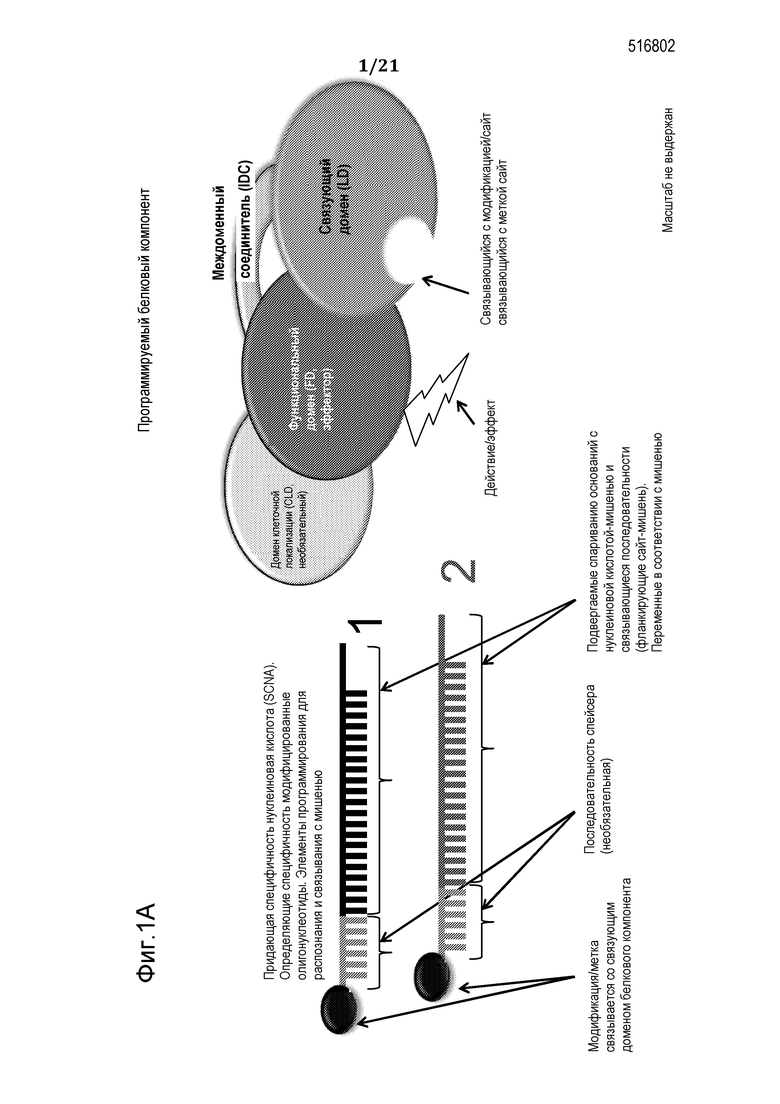
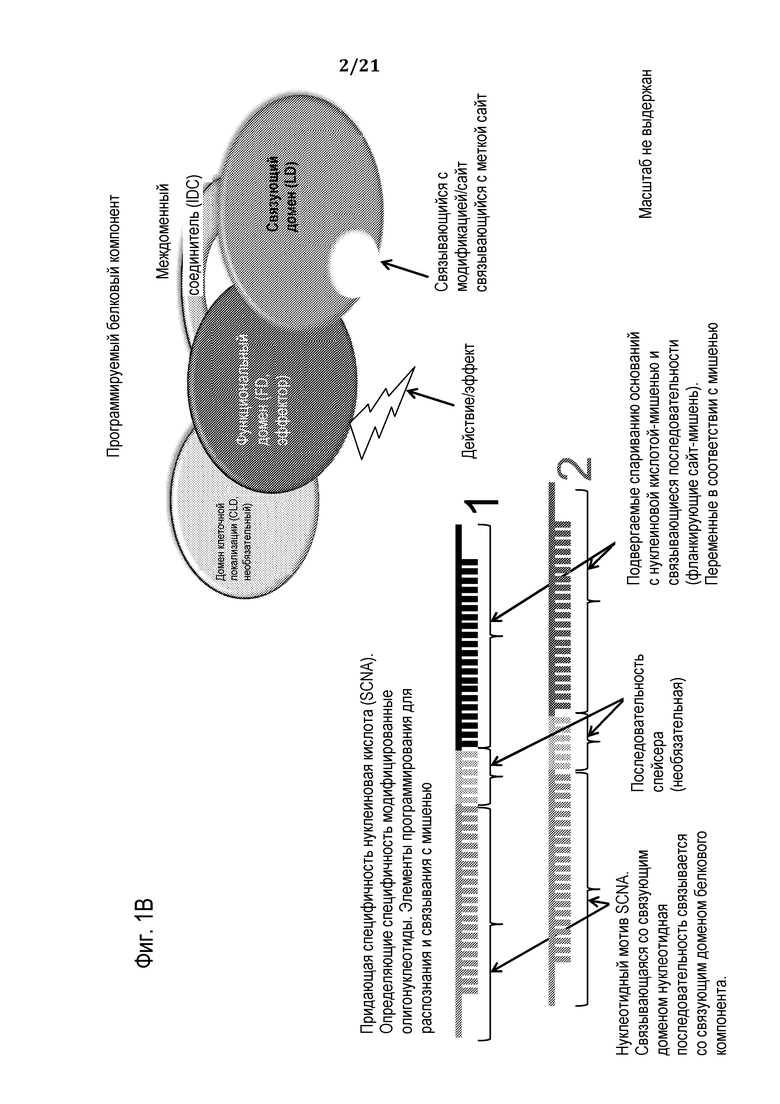
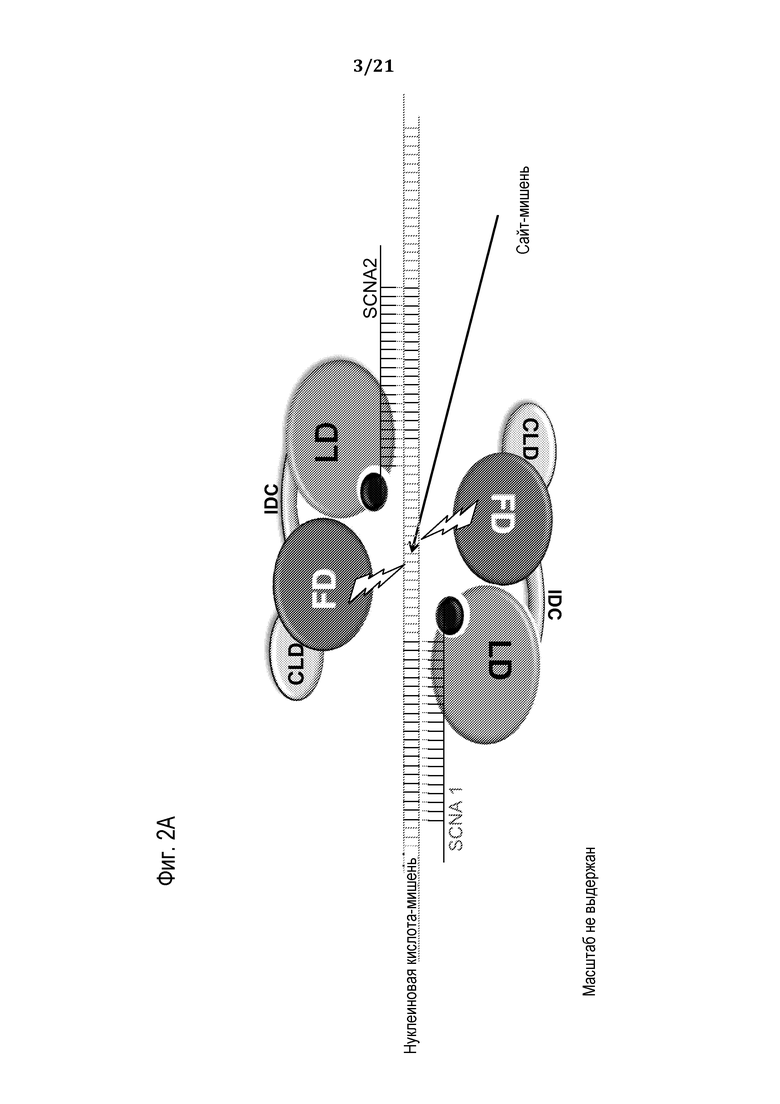
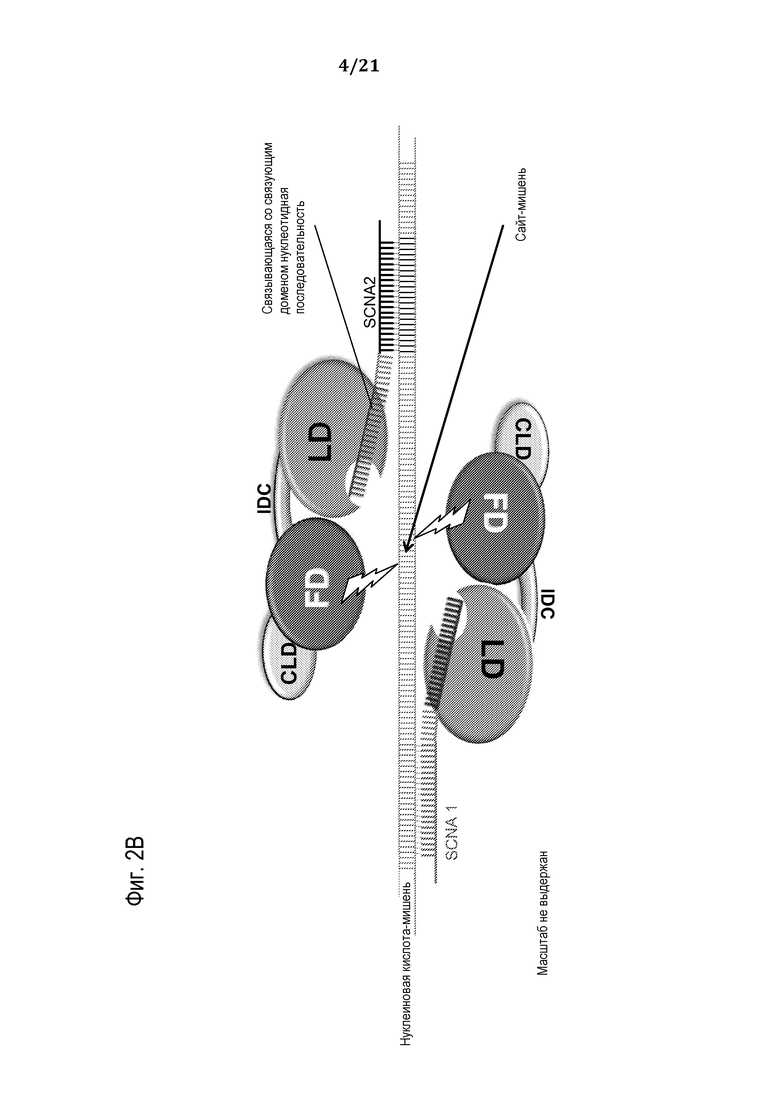
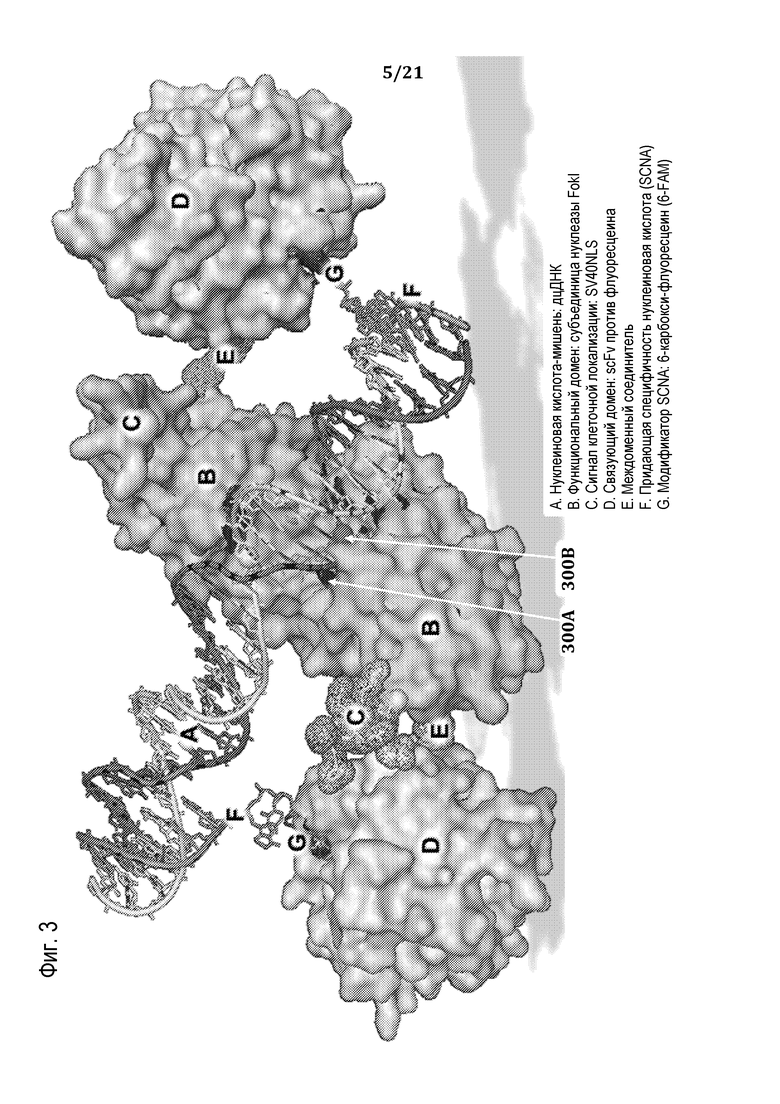
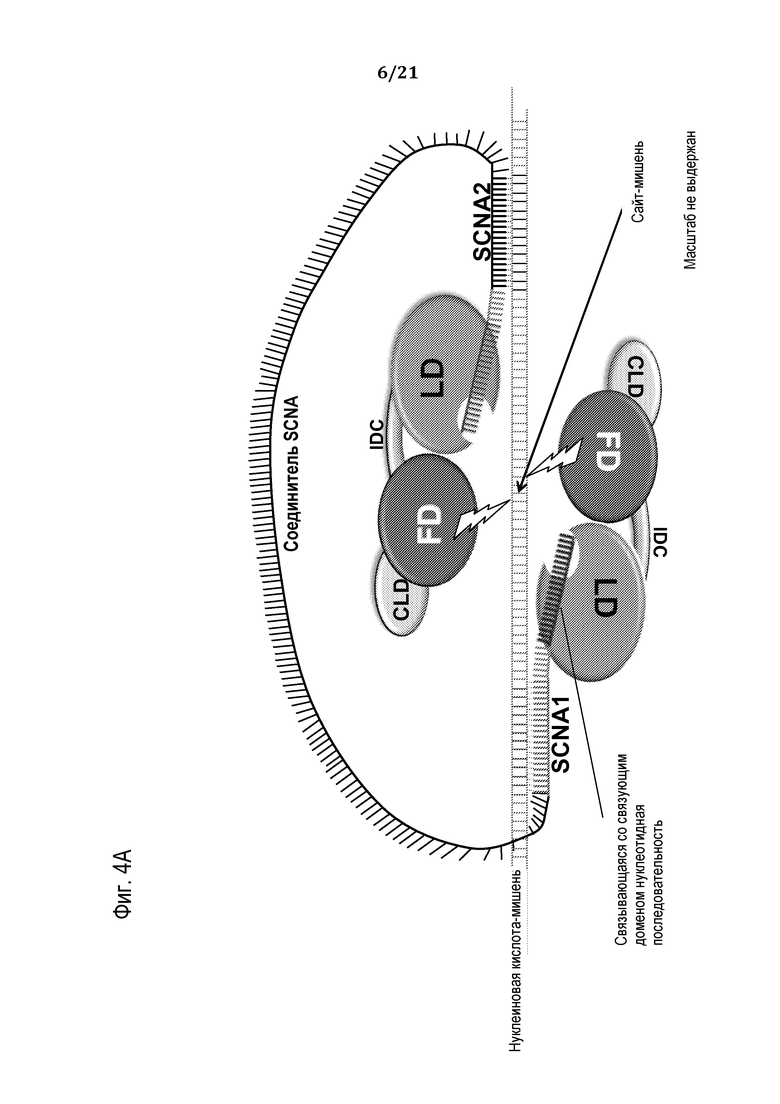
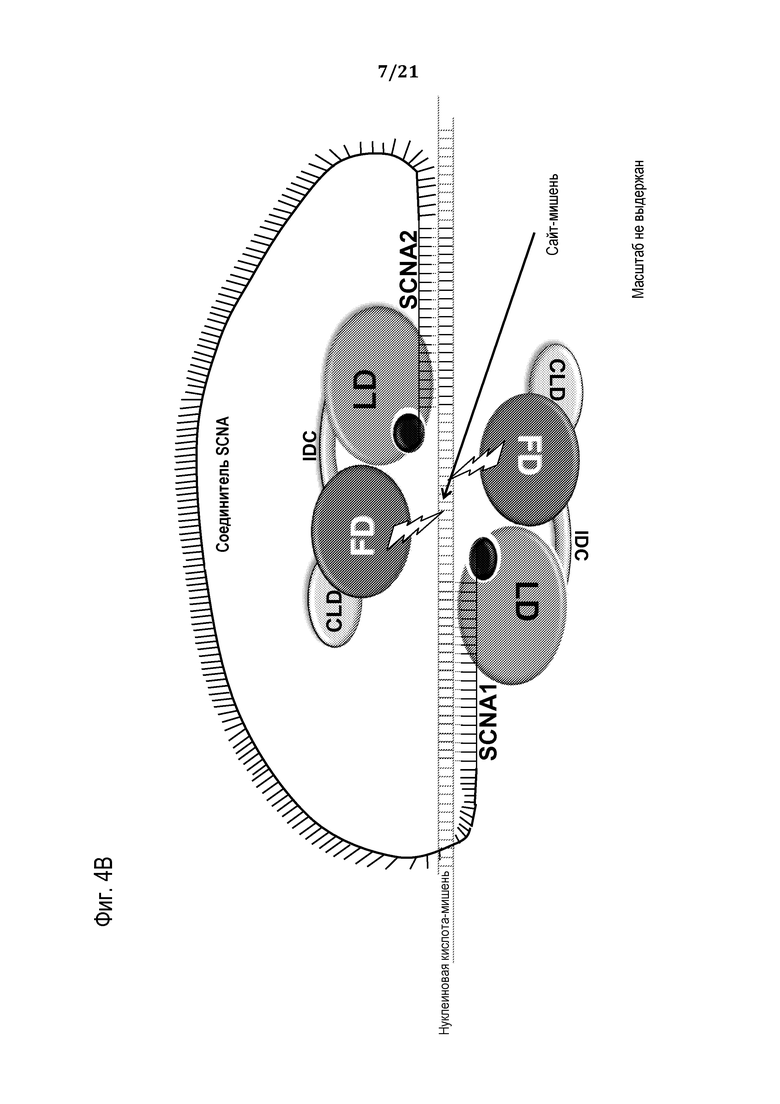
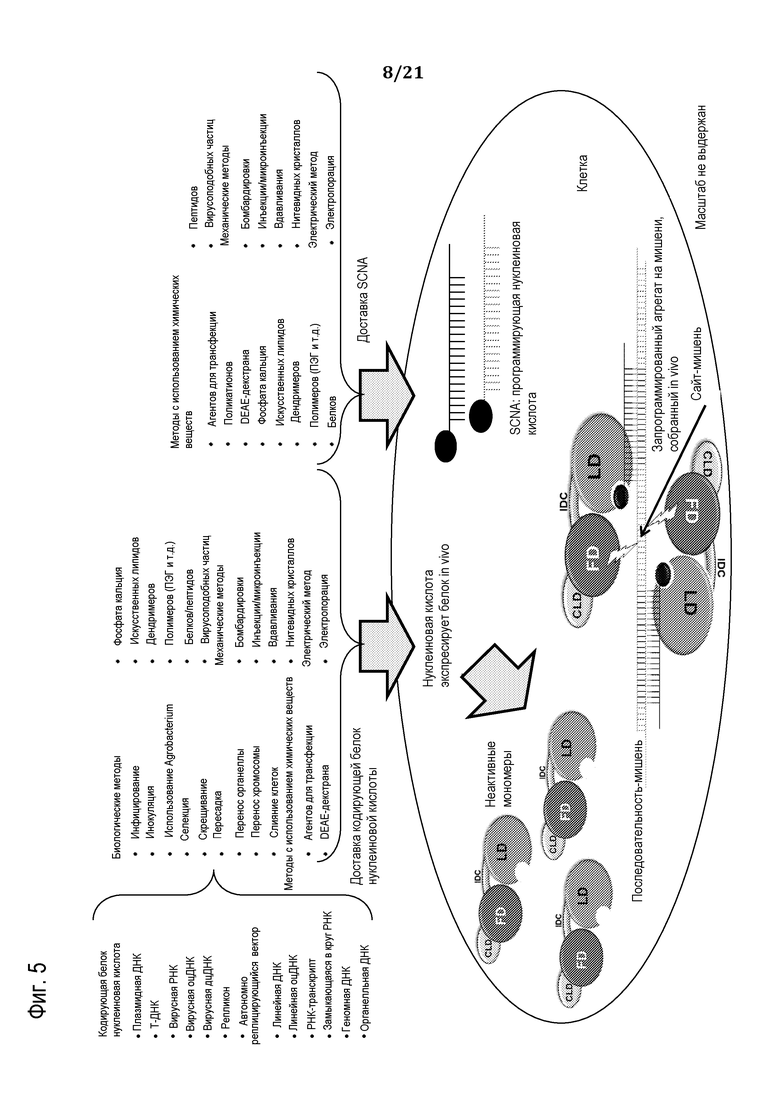
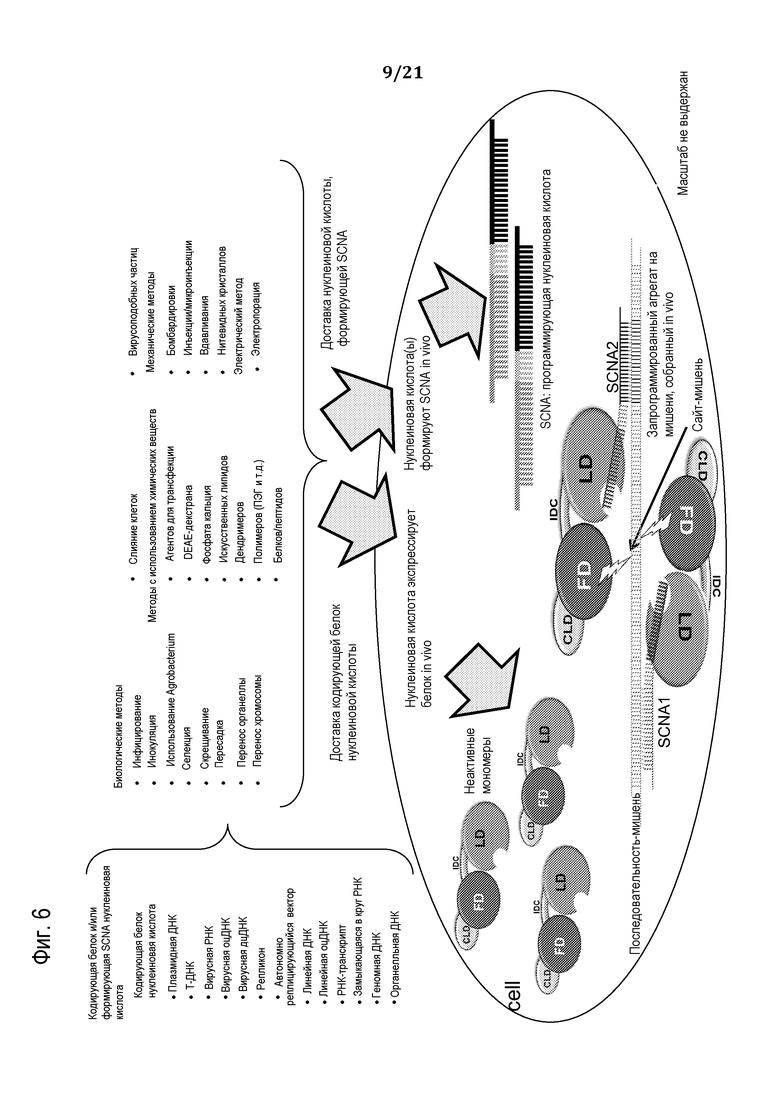
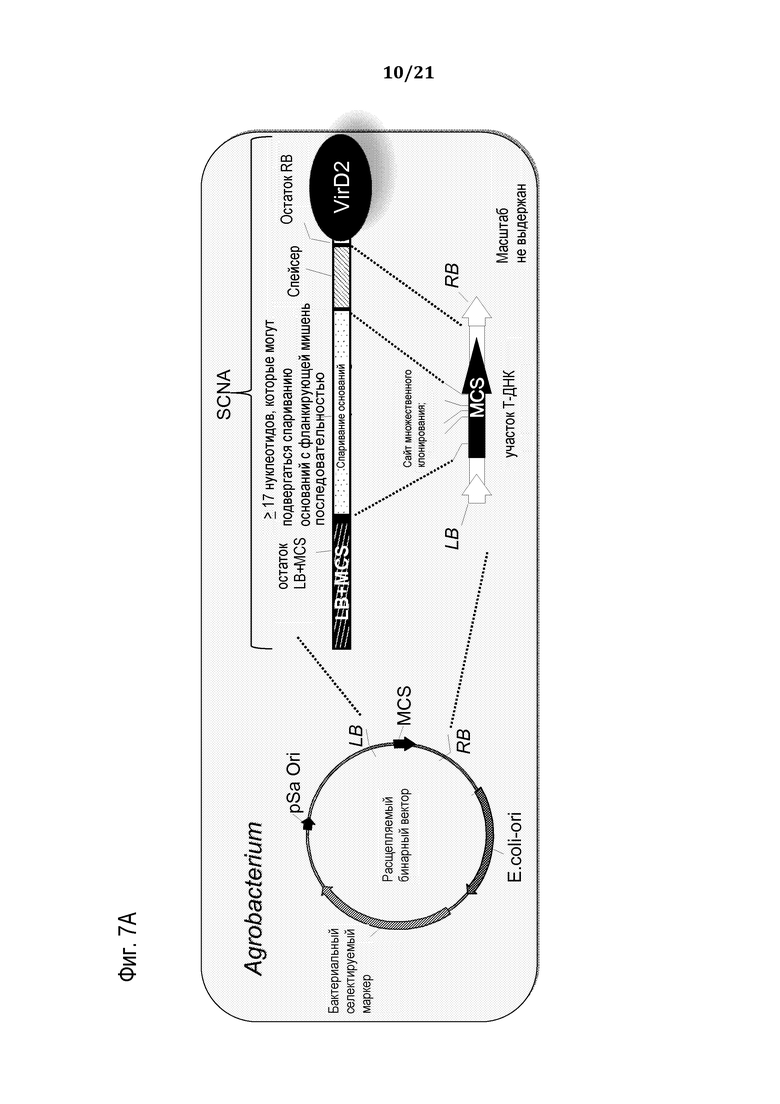
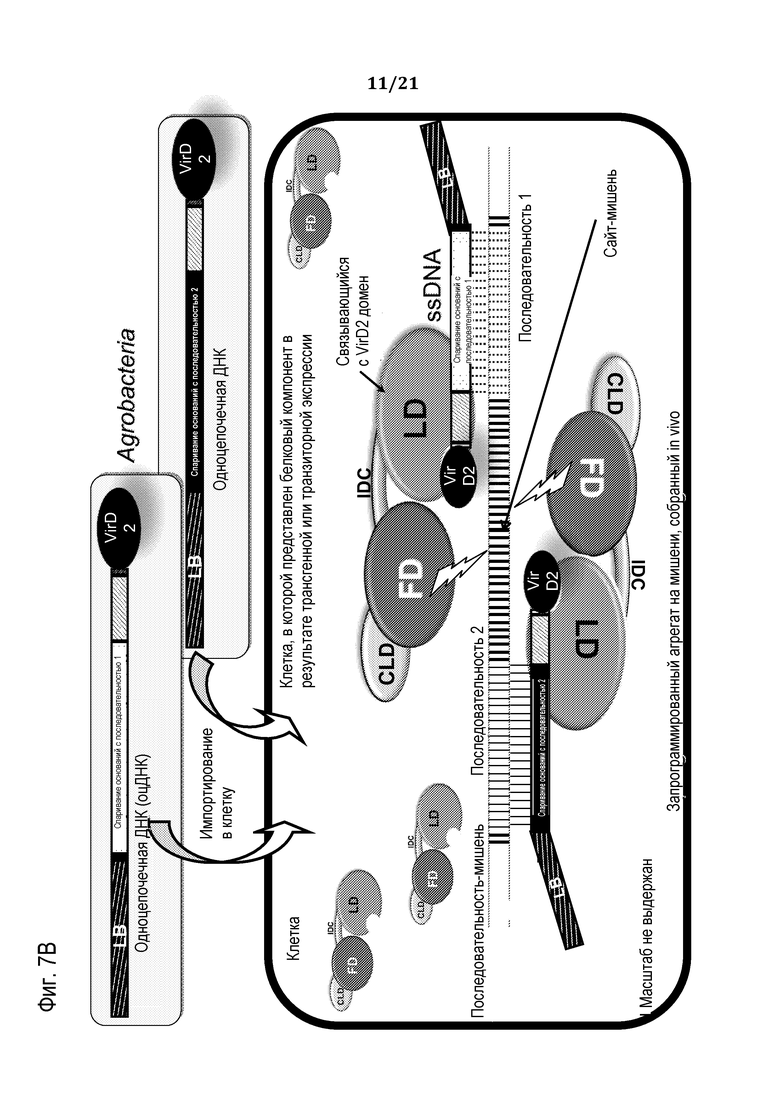
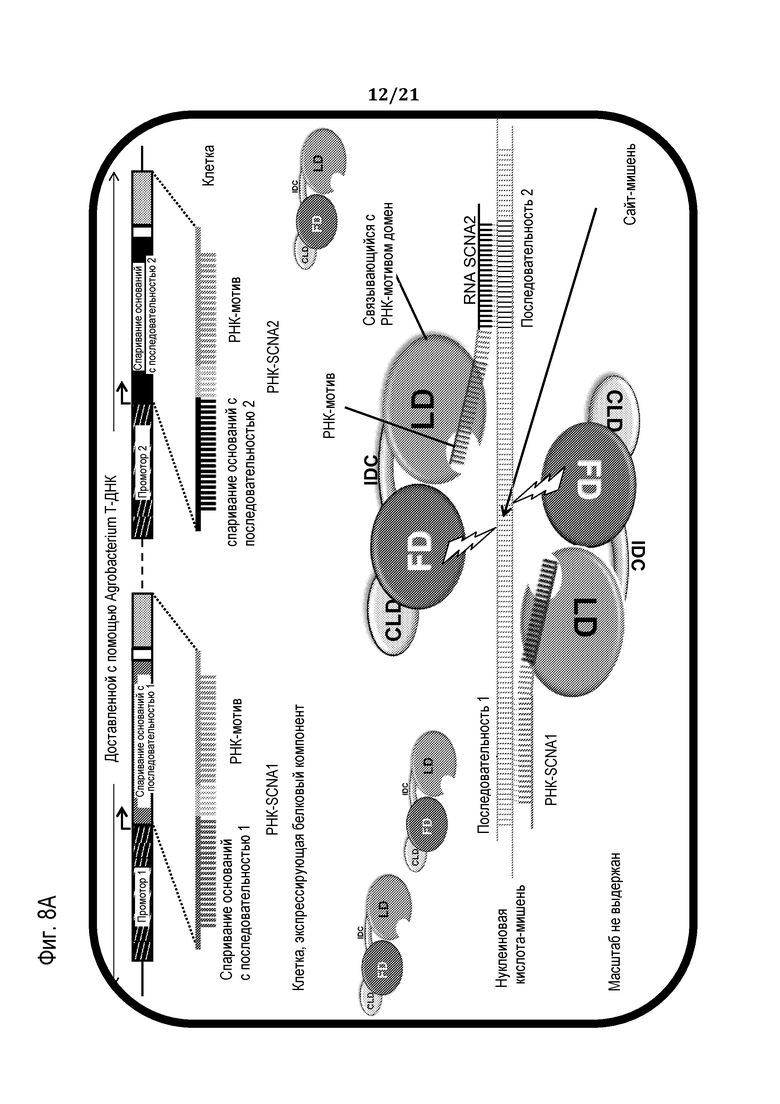
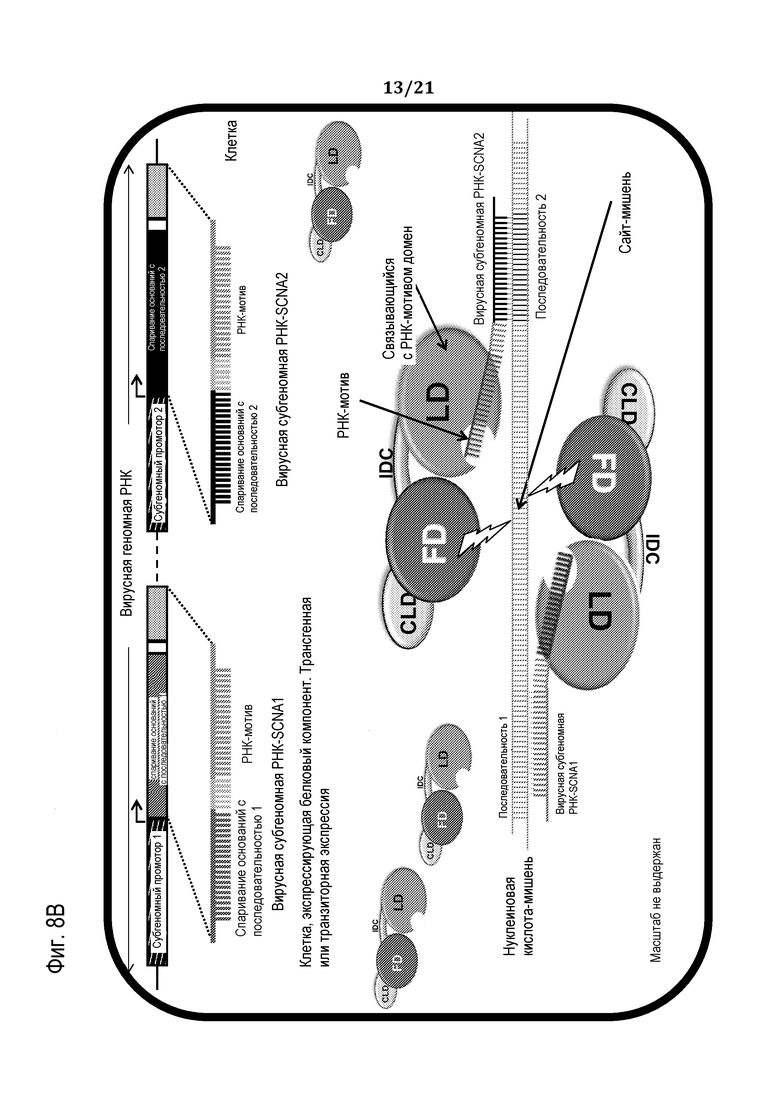
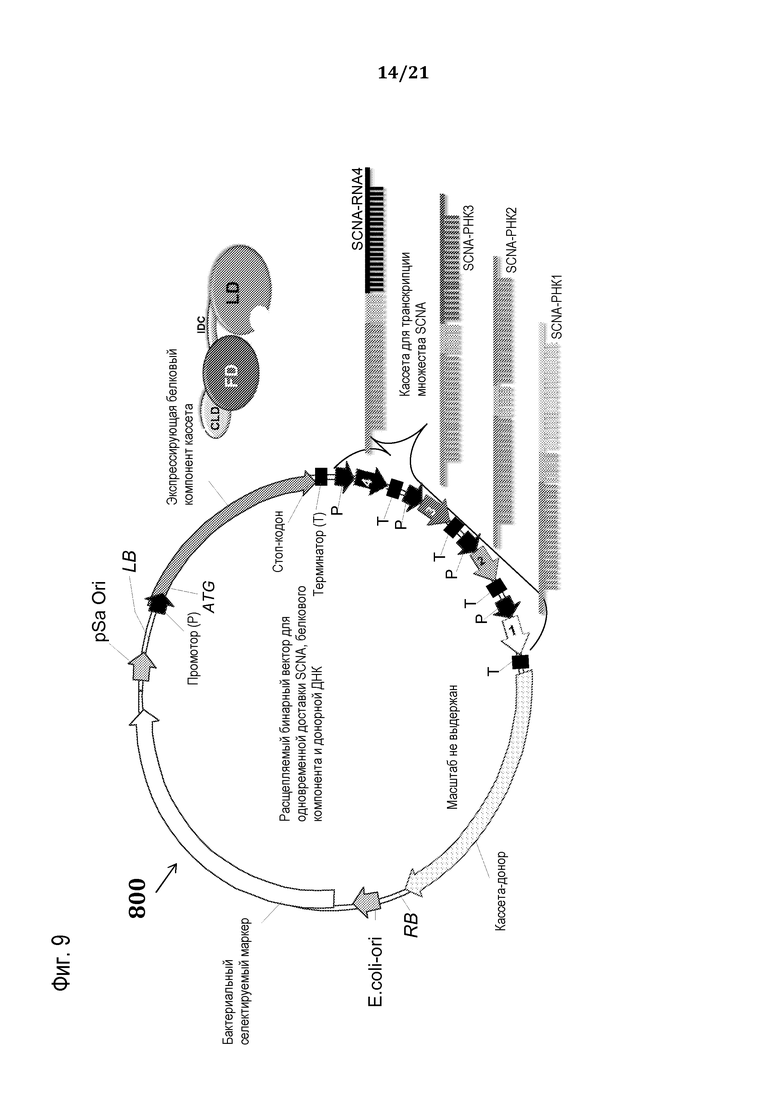
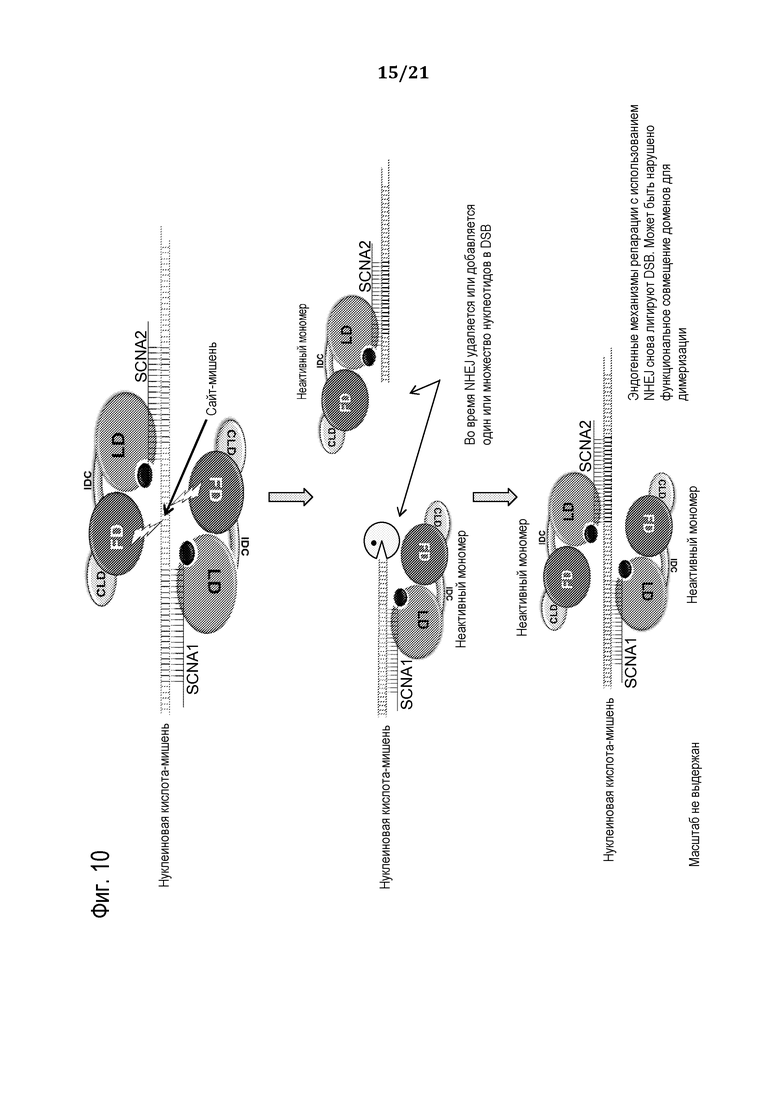
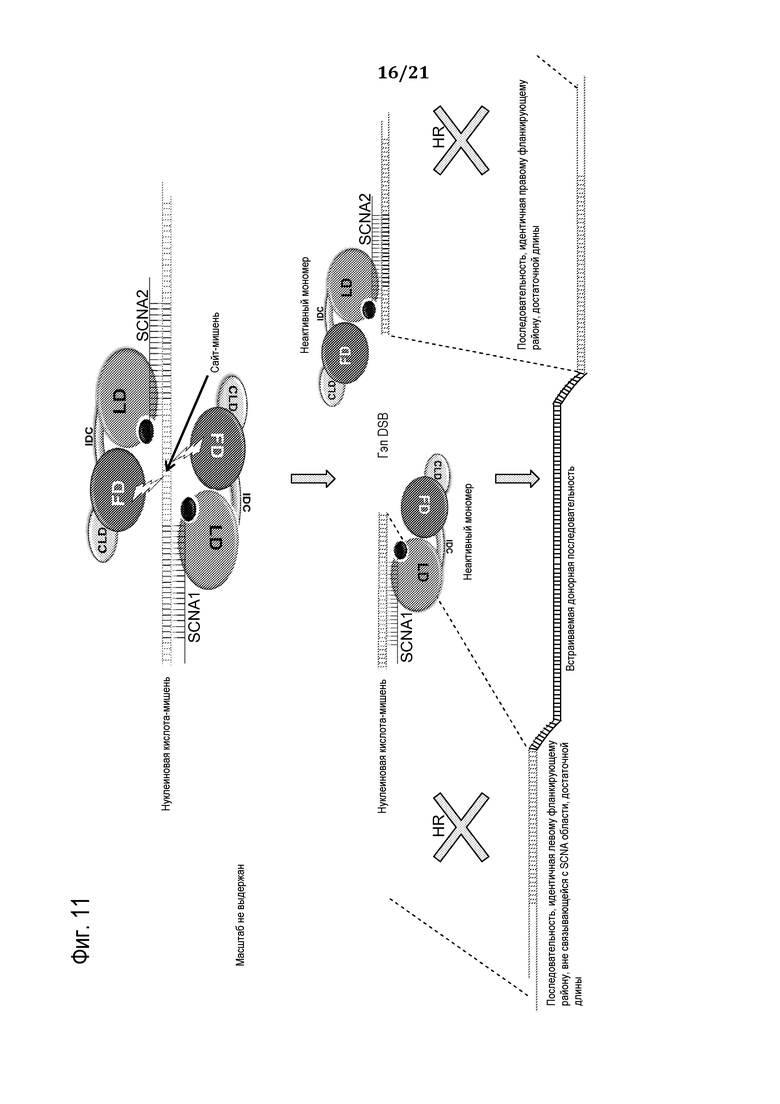
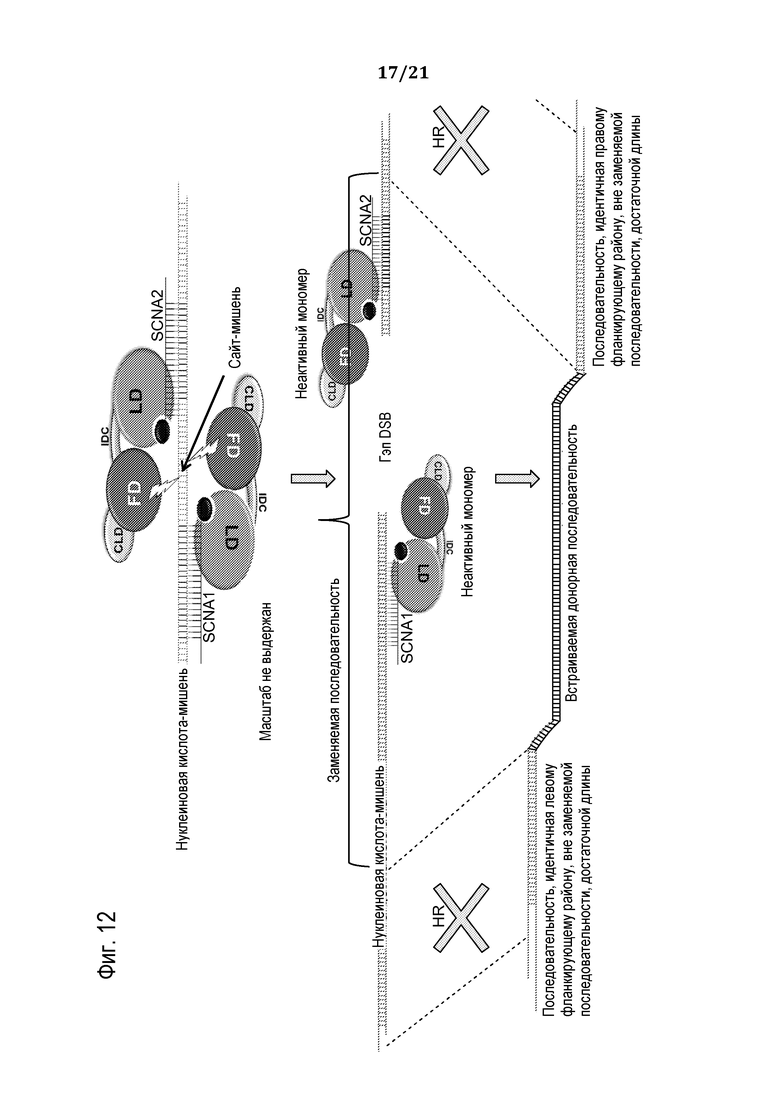
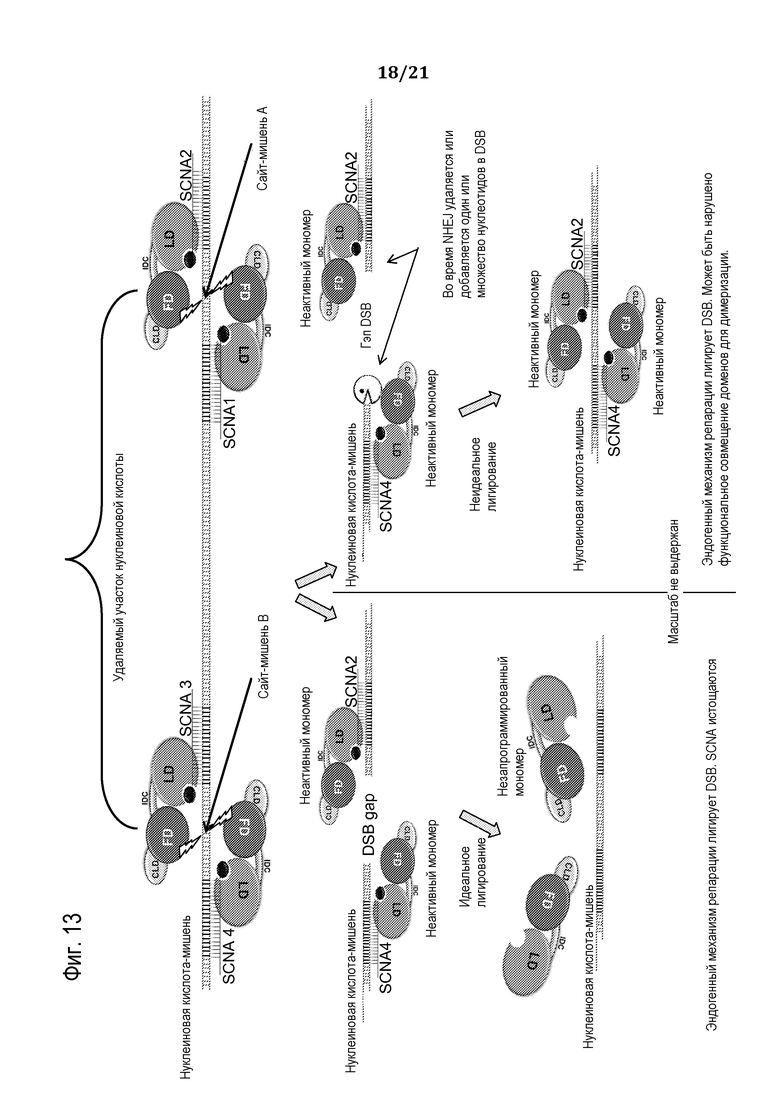
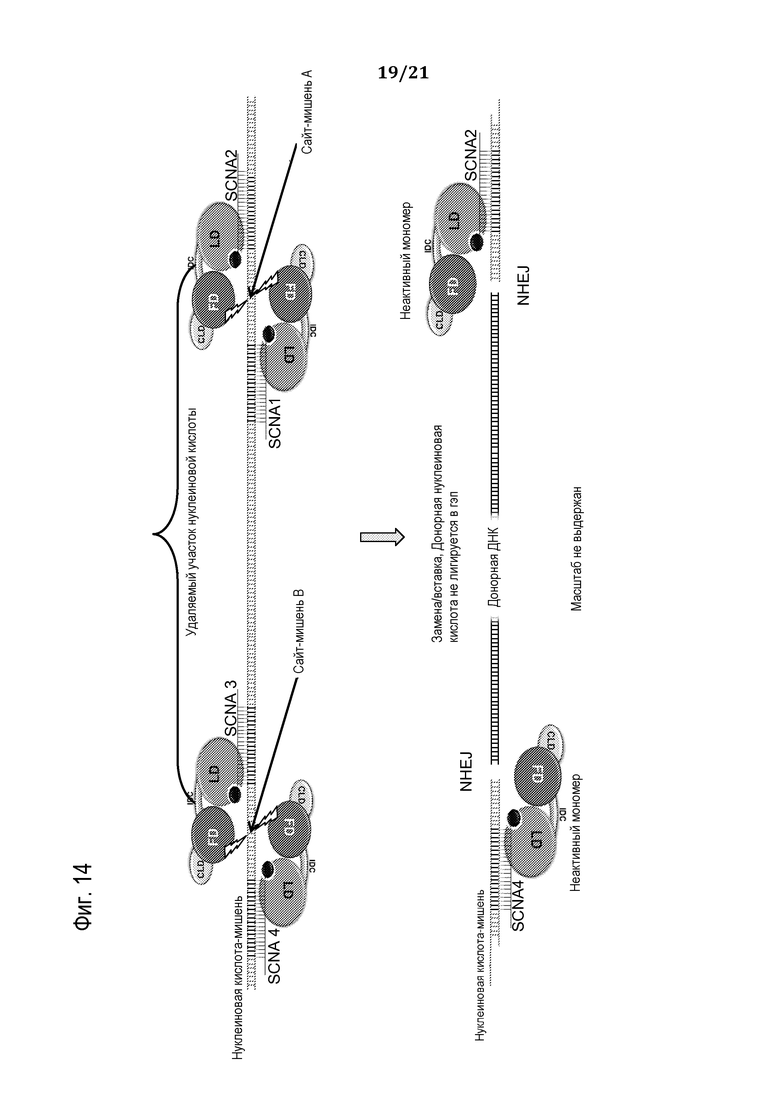
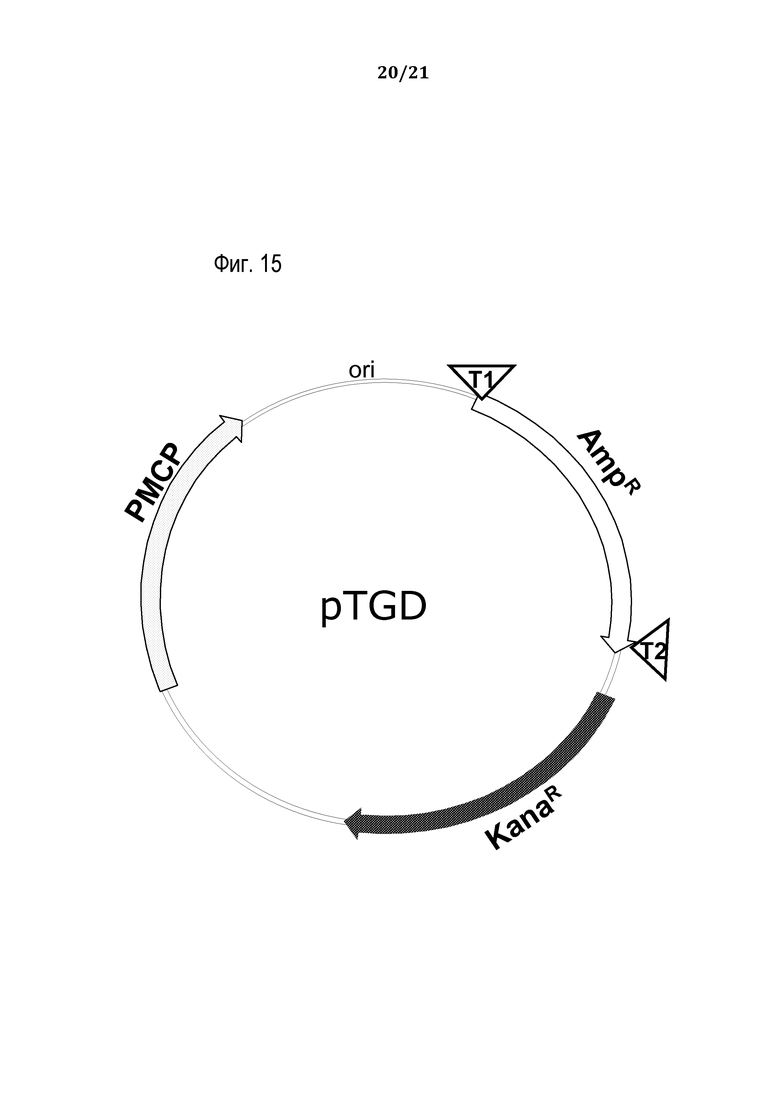
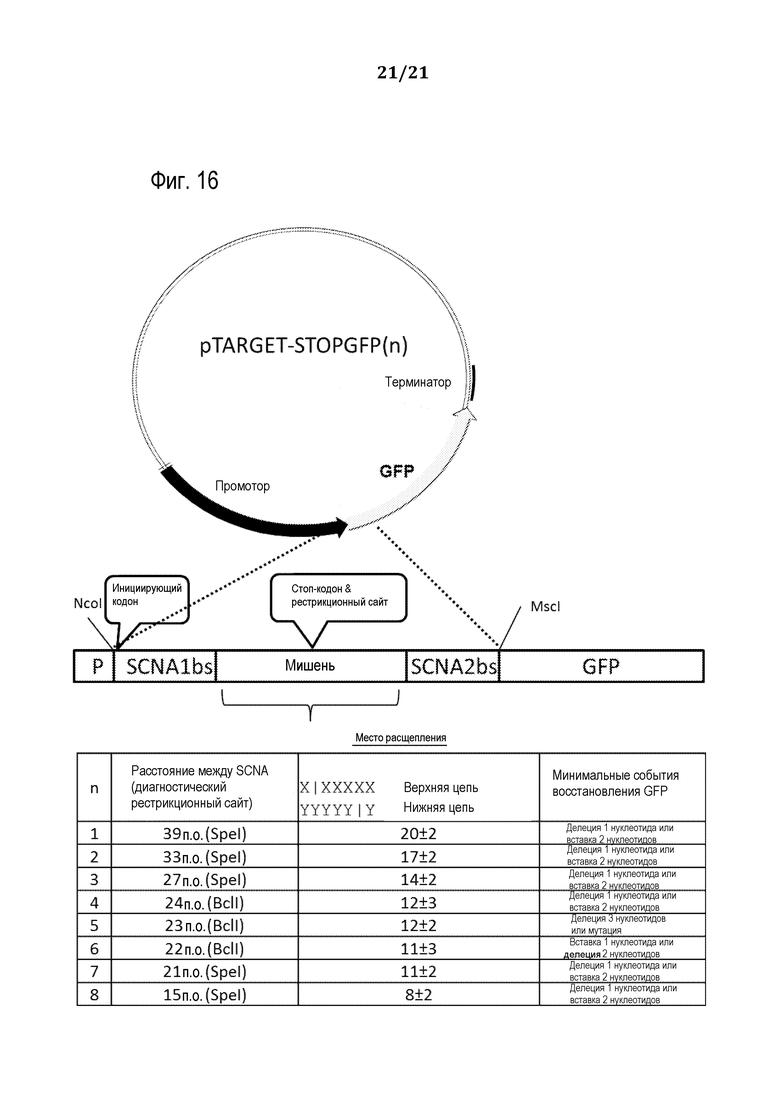
Изобретение относится к биотехнологии. Описан способ модифицирования заданного сайта-мишени в последовательности нуклеиновой кислоты-мишени в клетке-хозяине с помощью программируемого нуклеопротеинового молекулярного комплекса. В клетку-хозяин доставляют программируемый полипептид или последовательность нуклеиновой кислоты, кодирующую программируемый полипептид. Указанный полипептид содержит функциональный домен, способный к модифицированию указанного сайта-мишени, лишенный сайта специфического связывания нуклеиновой кислоты и связующий домен, способный к взаимодействию с придающей специфичность нуклеиновой кислотой (SCNA), где связующий домен лишен сайта специфического связывания нуклеиновой кислоты-мишени. Также доставляют молекулу придающей специфичность нуклеиновой кислоты (SCNA), включающую по меньшей мере 18 нуклеотидов, или нуклеиновую кислоту, кодирующую SCNA. Молекула SCNA содержит нуклеотидную последовательность, комплементарную участку нуклеиновой кислоты-мишени, и участок распознавания, способный к специфическому присоединению к связующему домену программируемого полипептида. Наличие полипептида в клетке-хозяине, содержащей SCNA, создает возможность для присоединения указанного полипептида к SCNA, образуя активный запрограммированный нуклеопротеиновый комплекс. В силу этого активный запрограммированный нуклеопротеиновый комплекс нацеливается на сайт-мишень в последовательности нуклеиновой кислоты-мишени в клетке-хозяине, что способствует модификации сайта-мишени с помощью указанного активного запрограммированного нуклеопротеинового комплекса. Также представлена композиция, содержащая такой комплекс и соответствующие векторы. Программируемый нуклеопротеиновый молекулярный комплекс способен специфически модифицировать и/или корректировать сайт-мишень в последовательности нуклеиновой кислоты-мишени и/или модифицировать функцию последовательности нуклеиновой кислоты-мишени. 4 н. и 29 з.п. ф-лы, 16 ил., 12 пр.
1. Способ модифицирования заданного сайта-мишени в последовательности нуклеиновой кислоты-мишени в клетке-хозяине с помощью программируемого нуклеопротеинового молекулярного комплекса, включающий доставку в клетку-хозяина:
a) программируемого полипептида или последовательности нуклеиновой кислоты, кодирующей программируемый полипептид, при этом указанный полипептид содержит:
(i) функциональный домен, способный к модифицированию указанного сайта-мишени, при этом функциональный домен лишен сайта специфического связывания нуклеиновой кислоты; и
(ii) связующий домен, способный к взаимодействию с придающей специфичность нуклеиновой кислотой (SCNA), при этом связующий домен лишен сайта специфического связывания нуклеиновой кислоты-мишени;
b) молекулы придающей специфичность нуклеиновой кислоты (SCNA), включающей по меньшей мере 18 нуклеотидов, или нуклеиновой кислоты, кодирующей SCNA, при этом указанная молекула SCNA содержит:
(i) нуклеотидную последовательность, комплементарную участку нуклеиновой кислоты-мишени, и
(ii) участок распознавания, способный к специфическому присоединению к связующему домену программируемого полипептида;
причем наличие полипептида в клетке-хозяине, содержащей SCNA, создает возможность для присоединения указанного полипептида к SCNA, образуя активный запрограммированный нуклеопротеиновый комплекс, в силу чего активный запрограммированный нуклеопротеиновый комплекс нацеливается на сайт-мишень в последовательности нуклеиновой кислоты-мишени в клетке-хозяине, что способствует модификации сайта-мишени с помощью указанного активного запрограммированного нуклеопротеинового комплекса.
2. Способ по п. 1, в котором указанной нуклеиновой кислотой-мишенью является ДНК.
3. Способ по п. 2, в котором указанной ДНК-мишенью является геномная ДНК.
4. Способ по п. 3, в котором геномная ДНК-мишень эукариотического происхождения.
5. Способ по любому из пп. 1-4, в котором функциональный домен выбран из нуклеазы, метилазы, связывающегося с метилированной ДНК фактора, фактора транскрипции, фактора реконструкции хроматина, полимеразы, деметилазы, ацетилазы, деацетилазы, киназы, фосфатазы, интегразы, рекомбиназы, лигазы, топоизомеразы, гиразы, хеликазы, дестабилизирующей двойной спирали и FokI без сайта специфического связывающего нуклеиновой кислоты.
6. Способ по любому из пп. 1-4, в котором указанной последовательностью нуклеиновой кислоты-мишени является последовательность экстрахромосомной нуклеиновой кислоты, выбираемая из группы, состоящей из нуклеиновых кислот митохондрии, хлоропласта, амилопласта и хромопласта.
7. Способ по любому из пп. 1-4, в котором указанную последовательность нуклеиновой кислоты-мишени выбирают из последовательности вирусной нуклеиновой кислоты, последовательности прокариотической нуклеиновой кислоты и синтетической последовательности нуклеиновой кислоты.
8. Способ по любому из пп. 1-4, в котором указанную модификацию выбирают из группы, состоящей из мутации, делеции, вставки, замены, связывания, создания двухцепочечного разрыва, одноцепочечного разрыва, метилирования, ацетилирования, лигирования, рекомбинации, раскручивания спирали, химической модификации, мечения, активации, инактивации и репрессии.
9. Способ по любому из пп. 1-4, в котором указанная SCNA включает молекулу нуклеиновой кислоты, выбираемую из группы, состоящей из одноцепочечной ДНК, одноцепочечной РНК, двухцепочечной РНК, модифицированной ДНК, модифицированной РНК, закрытой нуклеиновой кислоты (LNA) и пептидонуклеиновой кислоты (PNA) или их комбинаций.
10. Способ по любому из пп. 1-4, в котором взаимодействие между SCNA и нуклеиновой кислотой-мишенью осуществляется через спаривание оснований.
11. Способ по любому из пп. 1-4, в котором участок распознавания в SCNA включает РНК вторичной или третичной структуры.
12. Способ по любому из пп. 1-4, в котором участок распознавания в SCNA содержит нуклеотидный мотив, способный к взаимодействию со связующим доменом полипептида.
13. Способ по любому из пп. 1-4, в котором взаимодействие между модификацией SCNA и указанным связывающим доменом является взаимодействием нуклеиновой кислоты с белком.
14. Способ по любому из пп. 1-4, в котором взаимодействие между нуклеотидным мотивом и связывающим доменом является взаимодействием РНК-связывающего мотива связующего домена со структурой РНК.
15. Способ по любому из пп. 1-4, в котором связывающий домен содержит полипептид, который связывается со структурным мотивом РНК в SCNA.
16. Композиция программируемого нуклеопротеинового молекулярного комплекса для обеспечения модификации сайта-мишени, содержащая:
а) программируемый полипептид, при этом указанный полипептид содержит:
(i) функциональный домен, способный к модифицированию указанного сайта-мишени, при этом функциональный домен лишен сайта специфического связывания нуклеиновой кислоты; и
(ii) связующий домен, способный к взаимодействию с придающей специфичность нуклеиновой кислотой (SCNA), при этом связующий домен лишен сайта специфического связывания нуклеиновой кислоты-мишени;
b) молекулу придающей специфичность нуклеиновой кислоты (SCNA), включающую по меньшей мере 18 нуклеотидов, где указанная молекула SCNA включает:
(i) нуклеотидную последовательность, комплементарную участку нуклеиновой кислоты-мишени, и
(ii) участок распознавания, способный к специфическому присоединению к связующему домену программируемого полипептида;
причем наличие полипептида в клетке-хозяине, содержащей SCNA, создает возможность для присоединения указанного полипептида к SCNA, образуя активный запрограммированный нуклеопротеиновый комплекс, в силу чего активный запрограммированный нуклеопротеиновый комплекс нацеливается на сайт-мишень в последовательности нуклеиновой кислоты-мишени в клетке-хозяине, что способствует модификации сайта-мишени с помощью указанного активного запрограммированного нуклеопротеинового комплекса.
17. Композиция по п. 16, в которой указанной нуклеиновой кислотой-мишенью является ДНК.
18. Композиция по п. 17, в которой указанной ДНК-мишенью является геномная ДНК.
19. Композиция по п. 18, в которой геномная ДНК-мишень эукариотического происхождения.
20. Композиция по любому из пп. 16-19, в которой функциональный домен выбран из нуклеазы, метилазы, связывающегося с метилированной ДНК фактора, фактора транскрипции, фактора реконструкции хроматина, полимеразы, деметилазы, ацетилазы, деацетилазы, киназы, фосфатазы, интегразы, рекомбиназы, лигазы, топоизомеразы, гиразы, хеликазы, дестабилизирующей двойной спирали и FokI без сайта специфического связывающего нуклеиновой кислоты.
21. Композиция по любому из пп. 16-19, в которой указанной последовательностью нуклеиновой кислоты-мишени является последовательность экстрахромосомной нуклеиновой кислоты, выбираемая из группы, состоящей из нуклеиновых кислот митохондрии, хлоропласта, амилопласта и хромопласта.
22. Композиция по любому из пп. 16-19, в которой указанную последовательность нуклеиновой кислоты-мишени выбирают из последовательности вирусной нуклеиновой кислоты, последовательности прокариотической нуклеиновой кислоты и синтетической последовательности нуклеиновой кислоты.
23. Композиция по любому из пп. 16-19, в которой указанную модификацию выбирают из группы, состоящей из мутации, делеции, вставки, замены, связывания, создания двухцепочечного разрыва, одноцепочечного разрыва, метилирования, ацетилирования, лигирования, рекомбинации, раскручивания спирали, химической модификации, мечения, активации, инактивации и репрессии.
24. Композиция по любому из пп. 16-19, в которой указанная SCNA включает молекулу нуклеиновой кислоты, выбираемую из группы, состоящей из одноцепочечной ДНК, одноцепочечной РНК, двухцепочечной РНК, модифицированной ДНК, модифицированной РНК, закрытой нуклеиновой кислоты (LNA) и пептидонуклеиновой кислоты (PNA) или их комбинаций.
25. Композиция по любому из пп. 16-19, в которой взаимодействие между SCNA и нуклеиновой кислотой-мишенью осуществляется через спаривание оснований.
26. Композиция по любому из пп. 16-19, в которой участок распознавания в SCNA включает РНК вторичной или третичной структуры.
27. Композиция по любому из пп. 16-19, в которой участок распознавания в SCNA содержит нуклеотидный мотив, способный к взаимодействию со связующим доменом полипептида.
28. Композиция по любому из пп. 16-19, в которой взаимодействие между модификацией SCNA и указанным связывающим доменом является взаимодействием нуклеиновой кислоты с белком.
29. Композиция по любому из пп. 16-19, в которой взаимодействие между нуклеотидным мотивом и связывающим доменом является взаимодействием РНК-связывающего мотива связующего домена со структурой РНК.
30. Композиция по любому из пп. 16-19, в которой связывающий домен содержит полипептид, который связывается со структурным мотивом РНК в SCNA.
31. Композиция по любому из пп. 16-19, в которой физическое взаимодействие между связующим доменом белкового компонента и участком распознавания в относящемся к придающей специфичность нуклеиновой кислоте компоненте образует запрограммированный функциональный комплекс в клетке-мишени.
32. Вектор для обеспечения модификации сайта-мишени, включающий:
a) нуклеотидную последовательность, кодирующую программируемый полипептид, где указанный программируемый полипептид включает:
(i) функциональный домен, способный к модифицированию указанного сайта-мишени, при этом функциональный домен лишен сайта специфического связывания нуклеиновой кислоты; и
(ii) связующий домен, способный к взаимодействию с придающей специфичность нуклеиновой кислотой, при этом связующий домен лишен сайта специфического связывания нуклеиновой кислоты-мишени.
33. Вектор для обеспечения модификации сайта-мишени, включающий нуклеиновую кислоту, кодирующую придающую специфичность нуклеиновую кислоту (SCNA), где указанная SCNA включает по меньшей мере 18 нуклеотидов, включая:
(i) нуклеотидную последовательность, комплементарную участку нуклеиновой кислоты-мишени, и
(ii) участок распознавания, способный к специфическому присоединению к связующему домену программируемого полипептида.
| WO 2011017315 A3, 10.02.2011 | |||
| Насос для кухни типа "Примус" | 1934 |
|
SU42675A1 |
Авторы
Даты
2018-08-03—Публикация
2012-12-16—Подача