Предпосылки создания изобретения
Область техники, к которой относится изобретение
Изобретение относится, вообще, к области регуляции роста клеток и пролиферативных заболеваний. Конкретнее, настоящее изобретение относится к мутантам генов RB-1 и р53 и терапевтическому применению таких мутантов.
Описание известного уровня техники
Регуляция клеточной пролиферации является комплексным процессом с участием многих взаимодействующих компонентов. Растет клетка или нет зависит от баланса экспрессии негативнодействующих и позитивнодействующих генов - регуляторов роста. Негативнодействующими генами-регуляторами являются гены, которые, когда экспрессированы или предоставлены клетке, ведут к супрессии роста клеток. Позитивнодействующими генами-регуляторами являются гены, которые, когда экспрессированы или предоставлены клетке, стимулируют пролиферацию.
В последнее время идентифицированы несколько генов-регуляторов, негативно действующих на рост клеток, названных опухолевыми генами-супрессорами, которые оказывают негативное действие на клеточную пролиферацию. К этим генам относятся, но не ограничиваются перечисленным, ген ретинобластомы человека RB-1 и ген р53. Отсутствие инактивации некоторых из этих негативных генов-регуляторов роста коррелирует с некоторыми типами рака.
Ген ретинобластомы человека RB-1 является прототипом этого класса генов-супрессоров опухолей, у которого отсутствие обоих аллелей гена в клетке или ингибирование экспрессии гена или его генного продукта будет приводить к опухолевой или аномальной клеточной пролиферации. На молекулярном уровне потеря инактивации обоих аллелей RB-1 участвует в клиническом проявлении опухолей, таких как ретинобластома, и клинически родственных опухолей, таких как остеосаркомы, фибросаркомы, саркомы мягких тканей и меланомы. Кроме того, потеря функции RB-1 также ассоциирована с другими типами первичного рака, такими как первичный мелкоклеточный рак легких, рак мочевого пузыря, рак молочной железы, цервикальный рак и рак предстательной железы.
Опухолевые гены-супрессоры Rb и р53 подавляют пролиферацию раковых и нераковых клеток
Показано, что реинтродукция кДНК дикого типа RB-1 или р53 частично восстанавливает нормальную регуляцию роста, так как реинтродуцированные гены вызывают задержку роста или ретардацию во многих различных типах опухолевых клеток. Определение гена Rb как гена супрессии опухолей исходит из того факта, что инактивация аллеля Rb-гена является предрасположением к развитию рака. Однако супрессирующее действие на рост гена Rb не ограничивается опухолевыми клетками. Нормальные клетки, у которых имеется две копии, могут испытать задержку роста или ретардацию при введении дополнительных копий гена Rb при некоторых условиях роста. Подобным образом, имеются данные о способности дикого типа р53 подавлять рост нераковых клеток. Таким образом, стадия, регулируемая Rb и р53, не может непосредственно влиять на туморогенный фенотип, а влияют также стадии, которые регулируют рост опухолей и нормальных клеток.
Механизм патологической пролиферации нормальных клеток
Существует множество патологических клеточно-пролиферативных состояний, для которых необходимы новые способы, обеспечивающие благоприятное лечение. Такие патологические состояния могут иметь место почти во всех типах клеток, способных к аномальной клеточной пролиферации. К числу указанных типов клеток, которые обнаруживают патологический или аномальный рост, относятся (1) фибробласты, (2) васкулярные эндотелиальные клетки и (3) эпителиальные клетки. Из вышесказанного можно видеть, что существует потребность в способах лечения локальных или распространенных патологических состояний во всех или почти во всех органах и тканях индивидуума.
Например, только в случае глаза, новые методы могут использоваться при лечении такого разнообразия патологических болезненных состояний, которые являются следствием аномальной пролиферации нормальных, доброкачественных или злокачественных опухолевых клеток или тканей, включая, но не ограничиваясь перечисленным, фибропролиферативные, вазопролиферативные и/или относящиеся к опухолевым заболеваниям глаза: ретинопатии преждевременного развития, пролиферативной витреоретинопатии, пролиферативной диабетической ретинопатии, капиллярной гемангиомы, хороидальных неоваскулярных сетей, субретинальных неоваскулярных сетей, сенильной дегенерации желтого пятна вследствие субретинальной неоваскуляризации, корнеальной неоваскуляризации, сморщивания желтого пятна вследствие эпиретинальной мембранной пролиферации, катаракты взрослых вследствие нуклеарного склероза, волокнистого врастания после травмы или операции, оптических нервных глиом, ангиоматозных сетчаток, неоваскулярной глаукомы, кавернозной гемангиомы, покраснения радужки, пролиферативной (серповидных клеток) ретинопатии, снижения роста эпителия (epitelial downgrowth) после глазной операции или повреждения глаза, пленки вторичной катаракты, папилломы, ретинальной неоваскуляризации при талассемии, субретинальной неоваскуляризации вследствие эластичности псевдоксантомы, и нейрофиброматоза типа 1 и 11, ретинобластомы, увеальной меланомы и ложной опухоли глазницы. Другие заболевания с пролиферацией доброкачественных клеток, для которых полезно настоящее изобретение, включают, но не ограничиваются перечисленным, псориаз, ихтиоз, папилломы, базилиомы, плоскоклеточный рак и синдром Стивенса-Джонсона.
Следует отметить, что в случае нормальных клеток уже существуют два нормальных аллеля каждого из Rb-гена и гена р53, и уже эти белки дикого типа не в состоянии предохранить клетки от пролиферации, когда клетки обеспечены факторами роста, как, например, в условиях роста культуры ткани. Нерегулируемая пролиферация других покоящихся клеток при патологических состояниях также является следствием воздействия на клетки факторов роста, индуцированных патологическими состояниями (см. ниже). Например, нерегулируемая пролиферация кровеносных сосудов глаза при талассемии может привести к отслоению сетчатки, если пролиферацию не остановить. Введение дополнительных копий гена Rb или гена р53 в такие клетки может или не может быть достаточным для подавления роста клеток. На самом деле, введение экзогенного гена Rb во многие опухолевые клетки только замедляет скорость роста клеток вместо полного его прекращения. Ранее описанные клеточные линии, такие как Saos-2 и DU145, являются хорошими примерами этого явления. Может потребоваться ввести гораздо больше копий гена, и это, с одной стороны, затрудняет контроль за числом копий, которое необходимо ввести или может быть введено. С другой стороны, воздействие факторов роста может привести к инактивации экспрессированных Rb-белков.
Регуляция активности Rb-белка посредством фосфорилирования
Если инактивация генов-супрессоров роста является существенной стадией при снятии ограничения на рост клеток, должны существовать механизмы, посредством которых активность этих генных продуктов регулируется таким образом, что клетка может пролиферировать под контролем. Возможно, что экспрессия данного гена-супрессора роста может регулироваться количественно или качественно. В случае гена Rb отношение уровня равновесного состояния белка к клеточному объему постоянно во всем клеточном цикле. Такая потеря изменения концентрации Rb-белка наводит на мысль, что должны существовать другие механизмы, с помощью которых клетка может регулировать активность этого белка. Имеется ряд данных, показывающих, что активность Rb-белка (pRb) регулируется степенью его фосфорилирования. Различные факторы, стимулирующие или подавляющие рост, проявляют свое действие через отклонение от нормы фосфорилирования продуктов генов-супрессоров роста, таких как Rb-белок. Доказательство роли факторов стимуляторов роста при индукции фосфорилирования Rb-белков получены из результатов исследований, что Rb-белки в покоящихся клетках существуют в недостаточно фосфорилированной форме. Кроме того, когда покоящиеся клетки стимулированы к пролиферации при воздействии либо сыворотки, либо факторов роста, таких как EGF (эпидерамальный фактор роста), вместе с инсулином и трансферрином, преобладающей формой Rb-белка была недостаточно фосфорилированная в G1, но становящаяся гиперфосфорилированной форма, когда клетки попадают на границу G1/S и клеток. Эти данные наводят на мысль, что Rb-белок является мишенью каскада сигнальной трансдукции, вызванной сывороткой или факторами роста. В конечном счете, фибробласты стареющего человека неспособны отвечать на стимулирующие пролиферацию действия факторов роста, также неспособны фосфорилировать Rb-белок.
Также имеются доказательства роли факторов ингибирования роста в супрессирующем механизме фосфорилирования Rb-белков. Когда активно растущие лейкозные или нейробластомные клетки обрабатывают ретиноевой кислотой или витамином D3, отличными от ДМСО индуцирующими дифференцировку реагентами, обнаружено, что Rb-белки являются недостаточно фосфорилированными перед преднамеренной задержкой роста на ранней стадии G1 и стимулированы к дифференцировке. Кроме того, обработка эпителильных клеток легкого паракринным ингибирующим рост трансформирующим полипептиды фактором роста бета 1 (TGFβ-1) ведет к снижению регуляции фосфорилирования Rb-белка и сопутствующей задержке клеточного роста в позднем Gl. Все вместе эти факты приводят к мысли, что недостаточно фосфорилированная форма Rb-белка активно супрессирует клетки от перехода границы G1/S, и что киназа (S), активированная в Gl, может инактивировать Rb-белок, так что клетки могут перемещаться в S-фазу.
В то время как удаление Rb-гена посредством делеции или мутации допускало рост в опухолевых клетках, удаление ограничения на рост в нормальных клетках, имеющих нормальную экспрессию Rb-гена, достигается зависимой от клеточного цикла посттрансляционной модификацией их генного продукта, т.е. Rb-белка (pRb). Rb-белок существует в полифосфорилированных формах, и факты предполагают, что недостаточно фосфорилированная форма является активной формой. Например, большой Т-антиген SV40 преимущественно связывается с недостаточно фосфорилированной формой Rb-белка. Фосфорилирование Rb-белка отделяет его от большого Т-антигена SV40, и только недостаточно фосфорилированные формы pRb связываются и ингибируют транскрипцию из Е2-промотора. Таким образом, недостаточно фосфорилированная форма Rb-белка активно супрессирует рост клеток, в то время как клеточная пролиферация ассоциируется с гиперфосфорилированием Rb-белка. Различные факторы стимулирования или ингибирования роста могут проявить свое действие посредством нарушения фосфорилирования Rb-белка. Следовательно, хотя нормальная клетка может экспрессироваться Rb-белками, она может быть индуцирована к росту, когда подвергается действию соответствующих факторов роста, какие можно обнаружить при различных условиях роста, в том числе, при патологических состояниях. При некоторых патологических состояниях другая нормальная клетка может быть, нежелательно, индуцирована к пролиферации. Пролиферация нормальных покоящихся фибробластов в глазах при диабетической ретинопатии является примером такой нежелательной индукции роста клеток. Оставшись необработанными, пролиферирующие фибробласты будут, в конечном счете, достигать сетчатки и приводить к ее быстрому отслаиванию.
Активация белка р53
Подобно гену Rb, инактивация или мутация гена р53 часто наблюдается в опухолевых и неопухолевых клеточных линиях. Белок дикого типа р53 также негативно регулируется, когда он связывается с вирусными антигенами, такими как большой Т-антиген SV40. Белок р53 функционирует как фактор транскрипции и связывается со специфическими ДНК-последовательностями. Способность белка дикого типа р53 связываться с ДНК критична для его правильного функционирования. В мутанте р53 теряется способность белка связываться со специфическими ДНК-мишенными последовательностями или активировать транскрипцию, что приводит к мысли о важности такой активности для супрессивной функции белка. Однако недавно также показано, что активность связывания специфической ДНК-последовательности белка р53 является скрытой. Вновь синтезированный белок р53 инактивен в том отношении, что не может связываться со своей специфической ДНК-последовательностью, если белок не модифицирован. Одним из сайтов модификации являются аминокислотные остатки 365-393 у С-конца. Эта область является сайтом присоединения РНК-группы, так же, как и связывания с бактериальными хитшоковыми белками dnaK. Связывание антитела Раb421 с аминокислотными остатками 365-389 активирует белок посредством изменения его конформации, так что он может связываться со своей специфической ДНК-последовательностью.
Различия в типе функции pRb и р53
Хотя как Rb, так и р53 считаются опухолевыми супрессорными генами, тип их действия весьма различен. Ранее получены данные, что эти два гена могут работать различными путями. Мышиные нули (null) для гена Rb эмбрионально летальны, в то время как мышиные нули для гена р53 развиваются нормально, хотя они более восприимчивы к развитию рака. На клеточном уровне можно замедлить или задержать рост раковых клеток, которые лишены р53, посредством сверхэкспрессии гена Rb даже при отсутствии экзогенного р53. С другой стороны, клетки, лишенные Rb, восприимчивы к эффекту супрессии роста гена р53. На молекулярном уровне р53 и pRb взаимодействуют с различными белками-мишенями и ДНК-последовательностями (прямо или косвенно).
Применение генов Rb и р53 в терапии
Хотя эти два белка различаются по типу действия, они подобны в одном отношении, т.е. в сверхэкспрессии активных форм двух белков при экспериментальных условиях, приводящих в супрессии или запаздыванию роста клеток. Зная, что рост клеток регулируется экспрессией генов-супрессоров, таких как pRb и р53, и что их белкам необходимо находиться в активной конформации, чтобы функционировать, желательно иметь активные формы указанных генов для генной терапии. В случае pRb заново синтезированные белки недостаточно фосфорилированы и являются активными. Инактивация может иметь место, когда на клетки действуют факторы роста. Было бы желательно иметь мутантные формы pRb, которые могут оставаться в активной форме и быть устойчивыми к инактивации путем фосфорилирования. В случае р53 вновь синтезированный белок является инактивным в том отношении, что не может связываться с ДНК, если он не модифицирован. При генной терапии весьма необходимо иметь мутантные формы гена р53, белок которого уже активен даже без дополнительной модификации. В конечном счете, так как эти два белка имеют различные типы действия, было бы желательно использовать при терапии сочетание как генов Rb, так и генов р53, с тем, чтобы мутации или условия роста, которые представляют устойчивость клетки к эффекту супрессии роста одного гена, могут быть допустимыми для другого.
При известном уровне техники сохраняется нехватка опухолевых супрессорных генов, мутированных таким образом, чтобы генный продукт (белок) являлся перманентно активным и мог функционировать даже если на клетку действуют факторы роста. Конкретнее, при известном уровне техники недостаточно эффективных и функционально мутированных форм генов р53 и Rb. Известный уровень техники также недостаточно применяет одновременно дикий тип и/или мутантные формы генов Rb и р53 при раковых и нераковых клеточно-пролиферативных заболеваниях.
Краткое изложение сущности изобретения
В одном своем аспекте, настоящее изобретение относится к общему подходу к лечению несоответствующего или патологического роста клеток, который происходит при заболеваниях, связанных с пролиферацией нераковых клеток, а также с пролиферацией раковых клеток. Конкретнее, настоящее изобретение относится к способам лечения патофизиологических клеточно-пролиферативных заболеваний посредством введения мутированных генов-супрессоров роста и/или генных продуктов, т.е. мутированных белков.
Один из вариантов осуществления настоящего изобретения относится к изолированной молекуле ДНК, при этом указанная молекула является синтетическим мутированным геном Rb, кодирующим мутированный функционально активный белок ретинобластомы.
Другой вариант осуществления настоящего изобретения относится к изолированной молекуле ДНК, при этом указанная молекула является синтетическим мутированным геном р53, кодирующим мутированный функционально активный белок р53.
Другой вариант осуществления настоящего изобретения относится к новой плазмиде, содержащей функционально активный мутант ретинобластомы или гена р53.
И еще один вариант осуществления настоящего изобретения относится к способу последовательного или одновременного введения дикого типа и/или активных мутантов как гена Rb, так и гена р53 в терапевтических целях.
Другие варианты осуществления настоящего изобретения относятся к способам лечения патологических клеточно-пролиферативных заболеваний, включающим введение, совместно или последовательно, в нераковую пролиферирующую клетку мутированного гена Rb и мутированного гена р53.
Кроме того, дается способ лечения индивидуумов с заболеваниями, характеризующимися злокачественными клетками, включающий введение, совместно или последовательно, в пролиферирующую раковую клетку мутированного гена Rb и мутированного гена р53.
Еще один вариант осуществления настоящего изобретения относится к способу индуцирования апоптоза, включающему стадию введения в клетку мутантного белка р53 настоящего изобретения.
Еще один вариант осуществления настоящего изобретения относится к способу лечения опухолевой клетки с мутацией белка циклина, включающему стадию введения в клетку белка по п.39.
Другие и дополнительные аспекты, признаки и преимущества настоящего изобретения будут очевидны из последующего описания предлагаемых предпочтительных вариантов осуществления изобретения, приведенных с целью пояснения.
Краткое описание чертежей.
На фиг.1 показано обнаружение области гомологии между pRb и р53 посредством иммунопреципитации клеточных белков с использованием поликлональных антител против Rb RBl-Ab #18 и #20.
На фиг.2 (А, Б) показано подтверждение области гомологии между pRb и р53 посредством иммунопреципитации клеточного белка с использованием поликлональных антител против Rb RBl-Ab #18 и #20.
Фиг. 3 показывает способность мутантных белков р53 Р1, Р3 и Р5 связывать специфические ДНК-последовательности в отсутствие Раb421.
На фиг.4 (А-Г) приводится анализ методом двухмерного картирования картины фосфорилирования мутантных Rb-белков по сравнению с белками дикого типа: (А) меченные белки in vivo, (В) меченные белки in vitro.
На фиг.5 (А, Б) показаны связывание белка ретинобластомы с большим Т-антигеном SV40 и диссоциация комплекса посредством фосфорилирования.
На фиг.6 приводится анализ методом двухмерного картирования двух различных форм фосфорилированного белка ретинобластомы (которые связаны большим Т-антигеном SV40 и которые им не связаны).
На фиг. 7 (А, Б) проводится анализ методом двухмерного картирования - изменения картины фосфорилирования белка ретинобластомы при различных условиях роста.
Фиг.8 (А, Б) показывает способность мутанта Rb m89 подавлять рост нормальной клетки WS1.
Фиг.9 (А, Б) показывает способность мутанта Rb m89 подавлять рост клеточной линии опухоли мочевого пузыря TCCSUP.
На фиг. 10 приводится принципиальная схема как белка дикого типа р53, показывающая домен F и домен R, так и белка мутантного р53, показывающая домен F и домен R.
Фиг.11 показывает, что мутантный р53-белок способен связывать специфические ДНК-последовательности.
Фиг. 12 (А, Б) показывает, что области гомологии регулируют доступность С-конца р53, так что специфические сайты не фосфорилированы.
Фиг. 13 показывает, что мутанты с областью гомологии р53 транскрипционно активны in vivo. Фиг.13А показывает, что мутанты р53 области гомологии р3 или р5 в консервативных аминокислотах активны при промоторной транскрипционной активации. Фиг.13Б показывает, что для всех конструкций р53 используются равные количества белков.
Фиг. 14 показывает, что синтетический мутант р53 индуцирует апоптоз в клеточной линии рака легких Н358. Фиг.14А относится к дикому типу р53 без цисплатина; фиг. 14Б относится к дикому типу р53 с добавлением цисплатина; фиг. 14В относится к мутанту р53 Р4 без цисплатина; фиг.14Г - к мутанту р53 Р4 с добавлением цисплатина; фиг.14Д относится к мутанту р53 Р5 без цисплатина; и фиг.14Е относится к мутанту р53 Р5 с добавлением цисплатина.
Подробное описание изобретения
Определения
Термин "функциональная экспрессия гена" включает супрессию транскрипции гена, деградацию генного транскрипта (премРНК), ингибирование сплайсинга, деструкцию мРНК, предупреждение трансляции мРНК, предупреждение посттрансляционных модификаций белка, деструкцию белка или ингибирование нормальной функции белка.
Термин "трансфектированная плазмида" относится к бактериальной плазмиде, которая содержит мутированный ретинобластомный ген или ген р53, которые вносят (трансфектируют) в выбранную клетку.
Термин "генная терапия" включает инсерцию части или всего гена, ДНК-конструкции, РНК или генного продукта в клетку, группу клеток, ткань, патологическое изменение, орган или организм с целью модуляции генной экспрессии и/или функции генного продукта.
Термин "профилактическая генная терапия" включает гены, которые можно использовать для частичного или полного ингибирования или предупреждения заболевания и распространения заболевания, а также включает гены, которые можно использовать для восполнения или замены отсутствующего или недостаточного негативного роста в клетке, тканях или зародышах.
Термин "клеточно-пролиферативное заболевание" относится к любому заболеванию человека или животного или к нарушению, поражающему любой один или сочетание органов, полостей или частей тела, которое отличается единственной или множественной местной аномальной пролиферацией клеток, групп клеток или ткани (тканей), доброкачественных или злокачественных.
Термин "прокариот" охватывает все бактерии, которые можно трансформировать ДНК для экспрессии рекомбинантных молекул настоящего изобретения.
Термин "эукариот" относится ко всем дрожжам, грибам, животным или растительным клеткам, которые можно трансформировать ДНК для экспрессии рекомбинантных молекул настоящего изобретения.
ДНК для ДНК-конструкций настоящего изобретения может быть синтетической или может происходить от млекопитающего любого вида. Все, что от нее требуется - это чтобы генетическая последовательность для генов Rb или р53 функционально экспрессировалась в прокариотном или эукариотном организме. Предпочтительной является синтетическая ДНК.
Молекула рекомбинантной ДНК, кодирующей ДНК-конструкции настоящего изобретения, может использоваться для трансформации хозяина с использованием любых методов, хорошо известных специалистам в этой области техники.
Способы получения гибридных, операбельно связанных генов и их экспрессия в бактериях известны и описаны, например, в патенте США 4366246, включенном в настоящее изобретение в качестве ссылки. Генные конструкции и методы, описанные в нем, могут использоваться для создания ДНК-конструкций настоящего изобретения и трансфекции в прокариотные или эукариотные организмы-хозяева.
Прокариотными хозяевами могут являться грамотрицательные, а также грамположительные бактерии, такие как Е. coli, S. tymphimurium, Serratia marcescens и Bacillus subtilis. Эукариотными хозяевами могут быть дрожжи, такие как Pichia pastoris, или клетки млекопитающих.
Как правило, экспрессионные векторы, содержащие промоторные последовательности, которые облегчают эффективную транскрипцию вставленного ДНК-фрагмента, используют в соединении с хозяином. Обычно экспрессионный вектор содержит ориджин репликации, промотор (промоторы), терминатор (терминаторы), а также специфические гены, которые способны обеспечить фенотипную селекцию в трансформированных клетках. Трансформированные хозяева могут быть ферментированы и культивированы способами, известными в технике для достижения оптимального роста клеток.
Примерами промоторов, которые можно использовать в изобретении, являются, но не ограничиваются перечисленным, человеческий β-актиновый промотор, металлотиониновый промотор, ориджин SV40 репликации, промотор MMTV LTR и промотор MuLV LTR. Примеры некоторых плазмид или бактериофагов, которые могут использоваться в изобретении, перечислены в работе Maniatis с сотр., Molecular Cloning, Cold Spring Harbor Laboratories, 1982, и специалистам в этой области техники известны и могут быть установлены другие плазмиды.
Ген является ДНК-последовательностью, которая кодирует через свою матрицу или матричную РНК последовательность аминокислот, характеризующую специфический пептид. Название кДНК включает гены, из которых удалены интроны. Термин "рекомбинантная ДНК" (рДНК) относится к молекуле, которая рекомбинирована путем сплайсинга последовательностей кДНК или геномной ДНК in vitro.
Клонирующим "проводником" является плазмида или фаговая ДНК или другая ДНК-последовательность, которая способна к репликации в клетке-хозяине, которая характеризуется одним или небольшим числом эндонуклеазных сайтов узнавания, у которых такие ДНК-последовательности могут быть вырезаны определенным образом без потери существенной биологической функции ДНК, и которые содержат маркер, подходящий для использования при идентификации трасформированных клеток. Маркерами, например, являются устойчивость к тетрациклину или устойчивость к ампициллину. Слово "вектор" иногда используется для обозначения клонирующего "проводника".
Экспрессионный "проводник" является проводником, подобным клонирующему проводнику, но который способен на экспрессию данного структурного гена в хозяине, обычно, под контролем определенных регуляторных последовательностей.
Термин "индивидуум" относится к животным и людям.
Термин "биологическое ингибирование" или "ингибирование" роста пролиферирующих клеток обозначает частичное или полное ингибирование, а также относится к снижению степени пролиферации или роста клеток. Доза биологического ингибирования мутантов настоящего изобретения может быть определена путем оценки действия испытываемых элементов на рост мишенной злокачественной или аномально пролиферирующей клетки в культуре ткани, на рост опухоли у животных и в клеточной культуре, или любым другим методом, известным специалистам в этой области техники.
Используемый здесь термин "консервативная гомологичная область" относится к аминокислотной области, которая гомологична между Rb и р53, как показано в табл. 1.
Введение белков настоящего изобретения может быть осуществлено местным, внутриглазным, парентеральным, пероральным, интраназальным, внутривенным, внутримышечным, подкожным или любым другим способом. Предпочтительным способом введения при лечении глазных болезней является внутриглазная или окологлазная инъекция. Предпочтительным способом введения при лечении кожных клеточно-пролиферативных заболеваний является топическое нанесение или подкожная инъекция.
При другом варианте осуществления изобретения ДНК-конструкции настоящего изобретения могут быть доставлены непосредственно в очаг пролиферативного заболевания. В случае глазной пролиферативной болезни ДНК-конструкции настоящего изобретения могут быть инъецированы непосредственно в глаз. ДНК-конструкции настоящего изобретения могут быть доставлены в основные места заболевания во внутренние органы, в полости тела и т.п. с использованием формирователей изображения, применяемых для направления инъекционной иглы непосредственно в место заболевания. ДНК-конструкции настоящего изобретения также можно вводить в места заболевания во время хирургического вмешательства.
Дозировка вводимой ДНК зависит от возраста, клинической стадии и степени заболевания или генетического предрасположения индивидуума, локализации, массы, вида сопутствующего лечения, если таковое используется, и природы патологического или малигнизированного состояния. Система эффективной доставки, полезная при способе настоящего изобретения, может использоваться в таких формах, как капсулы, таблетки, жидкие растворы, суспензии или эликсиры для перорального введения, или в стерильных жидких формах, таких как растворы, суспензии или эмульсии. Предпочтительно используют любой инертный носитель, такой как физиологический раствор или забуференный фосфатом физиологический раствор, или любой такой носитель, в котором соединения, используемые в способе настоящего изобретения, растворяются в подходящей степени.
Для внутриглазной доставки и для доставки в другие локализованные места заболевания системы доставки, полезные при способе настоящего изобретения, могут использоваться предпочтительно в таких жидких стерильных формах, как растворы, суспензии или эмульсии. Для местного применения они могут использоваться в такой форме как мази, кремы или спреи. Используется предпочтительно любой инертный носитель, такой как физиологический раствор или забуференный фосфатом физиологический раствор, или любой такой носитель, в котором соединения, используемые в способе настоящего изобретения, растворяются в подходящей степени.
Для локального введения в клетки введение может осуществляться любым способом, известным специалистам в этой области техники, включая, но не ограничиваясь перечисленным, трансфекцию, электропорацию, микроинъекцию клеток, или в таких носителях, как липосомы, липофектин, или просто как ДНК или РНК. ДНК настоящего изобретения можно доставлять с помощью известных систем доставки генов, таких как, например, но не ограничиваясь перечисленным, ретровирусные векторы (Gil-boa (1982) J. Virology 44:845; Hocke (1986) Nature 320: 275; Wilson et al., Proc. Natl. Acad. Sci. USA 85:3014), система вируса осповакцины (Chakrabatry et al., (1985) Mol. Cell Biol. 5:3403), или с помощью других систем доставки ДНК (Yates et al., (1985) Nature 313:812), известных специалистам в этой области техники. Указанные ссылки являются только примерами. Чтобы специфически доставить или трансфектировать клетки, которые являются аномально пролиферирующими, и сберечь неделящиеся клетки, предпочтительно использовать ретровирусную систему доставки, известную специалистам. Так как для интеграции ретровирусной ДНК требуется репликация ДНК хозяина, и ретровирус будет неспособен к саморепликации из-за потери ретровирусных генов, необходимых для его жизненного цикла, применение такой ретровирусной системы доставки в настоящем изобретении будет нацеливать указанные антипролиферативные элементы на аномально пролиферирующие клетки и будет оберегать неделящиеся нормальные клетки от любого вторжения.
Мутантные белки настоящего изобретения могут вводиться в любом биологически эффективном носителе. Биологически эффективными носителями могут быть ретровирусы, липосомы и любое другое устройство для трансфекции, способное ввести чужеродные белки в геном клетки. Такие устройства для трансфекции известны специалистам в этой области техники. Носителем также может быть любой агент или растворитель, с которым совмещаются конструкции настоящего изобретения, и которые в вводимых количествах нетоксичны для индивидуумов или клеток, которые подвергаются лечению.
Паталогические клеточно-пролиферативные состояния, которые лечат
Существует множество патологических раковых и нераковых клеточно-пролиферативных состояний, для которых способ настоящего изобретения даст терапевтическую пользу. Такие патологические состояния могут встречаться почти во всех типах клеток, способных к аномальной клеточной пролиферации. К числу типов клеток, которые обнаруживают патологический или аномальный рост, относятся (1) фибробласты, (2) васкулярные эндотелиальные клетки и (3) эпителиальные клетки. Из вышесказанного видно, что способ настоящего изобретения полезен при лечении местных или распространенных патологических состояний во всех, или почти во всех, органах и тканях индивидуума.
Например, только в случае глаза, способ настоящего изобретения можно использовать для лечения такого широкого спектра патологических болезненных состояний, вызванных аномальной пролиферацией нормальных (доброкачественных) или злокачественных клеток или тканей, в который входят, и не ограничиваются перечисленным, следующие фибропролиферативные, вазопролиферативные и/или относящиеся к опухолевым болезням глаза: ретинопатия преждевременного развития, пролиферативная витреоретинопатия, пролиферативная диабетическая ретинопатия, капиллярная гемангиома, хороидальные неоваскулярные сети, сенильная дегенерация желтого пятна вследствие субретинальной реваскуляризации, корнеальная неоваскуляризация, сморщивание желтого пятна вследствие эпиретинальной мембранной пролиферации, катаракты взрослых вследствие нуклеарного склероза, волокнистое врастание после травмы или операции, оптические нервные глиомы, ангиоматозная сетчатка, неоваскулярная глаукома, кавернозная гемангиома, покраснение радужки, пролиферативная (серповидных клеток) ретинопатия, снижение роста эпителия (epitelial downgrowth) после глазной операции или повреждения глаза, пленка вторичной катаракты, папиллома, ретинальная неоваскуляризация при талассемии, субретинальная неоваскуляризация вследствие эластичности псевдоксантомы и нейрофиброматоз типа 1 и 11, ретинобластома, увеальная меланома и ложная опухоль глазницы. Другие заболевания с пролиферацией доброкачественных клеток, для которых полезно настоящее изобретение, включают, но не ограничиваются перечисленным, псориаз, ихтиоз, папилломы, базалиомы, плоскоклеточный рак и синдром Стивенса-Джонсона.
Вообще, настоящее изобретение применимо ко всем формам рака, включая, но не ограничиваясь перечисленным, раковые заболевания, к которым причастна инактивация гена Rb и/или гена р53, такие как остеосаркома, саркомы мягких тканей, меланомы, фибросаркомы, ретинобластома, рак молочной железы, мочевого пузыря, цервикальный рак, рак легких, толстой кишки, яичников, почек, поджелудочной железы и предстательной железы. Кроме того, новые мутантные белки р53 могут использоваться для индукции апоптоза в различных клетках. Таким образом, настоящее изобретение также относится к способу индуцирования апоптоза, включающему стадию введения нового мутантного белка р53 настоящего изобретения.
Кроме того, настоящее изобретение относится к способу лечения опухолевой клетки с мутацией белка циклина, включающему стадию введения в клетку нового мутантного белка р53 настоящего изобретения. Типичные мутации, например транслокации, амплификации циклина D1, циклина D2 или циклина D3, можно лечить новыми мутантными белками р53 настоящего изобретения.
Пример 1
Конформация, определяющая область, консервативную между pRb и р53
Настоящее изобретение раскрывает консервативный гомологичный структурный домен, который регулирует конформации двух продуктов опухолевых генов-супрессоров Rb и р53, допуская, таким образом, создание мутантов этих генов и способы их применения. Таким образом, настоящее изобретение относится к изолированной молекуле ДНК, при этом указанная молекула является мутированным геном-супрессором роста. В одном предпочтительном варианте осуществления настоящего изобретения мутированный ген-супрессор роста является мутированным геном Rb. В другом предпочтительном варианте осуществления настоящего изобретения мутированный ген-супрессор роста представляет собой мутированный ген р53.
В попытке разобраться во взаимодействии между pRb и его клеточными мишенями появились антитела к различным гидрофильным участкам белка Rb. Так как различные участки белка Rb могут взаимодействовать с различными белками, необходимо индуцировать антитела ко многим различным областям, так что некоторые из антител будут разрушать белковый комплекс белка Rb и его мишеней, не препятствуя их взаимодействию. Из панели поликлональных антител против Rb, индуцированных против синтетических пептидов с последовательностями, соответствующими различным гидрофильным доменам, два (Rbl-Ab18 и Rbl-Ab20) последовательно разрушаются, кроме белка Rb-белок с молекулярной массой 53 кД (фиг. 1А, полосы 1, 2, 8 и 9). Эти два антитела получают как предназначенные против того же синтетического пептида р5. Появление белка в 53 кД специфично для антисывороток против р5. Антисыворотки против других областей, например Rbl-Ab В (фиг.1, полосы 4-5) и Rbl-Ab С (фиг.1, полосы 6-7) не образуют иммунопреципитата белка в 53 кД, хотя они еще распознают белок Rb. Вследствие схожести молекулярной массы этого белка и р53, оказывается, что это и есть сам белок р53. Иммунопреципитация клеточных линий Раb122 - моноклональным антителом против р53 - показывает, что р53 в самом деле имеет точно такую же молекулярную массу, как белок в 53 кД (полоса 10). Кроме того, если р53 сначала удален из клеточного лизата с Раb122, ни Rbl-Ab18, ни Rbl-Ab20 не могут образовывать иммунопреципитат белка в 53 кД, хотя они еще могут образовать преципитат белка Rb (полоса 11). Чтобы дополнительно подтвердить, что белок в 53 кД действительно является р53, осуществляют иммунопреципитацию на нескольких клеточных линиях, которые экспрессированы не эндогенным белком р53 и/или не белком Rb. Во всех случаях (полосы 12-20) антитело в самом деле может распознать белок р53 в присутствии или в отсутствие гена р53 в этих клеточных линиях. Кроме того, иммунопреципитация р53 не зависит от присутствия или отсутствия белка Rb, что наводит на мысль, что комплекс не образуется, и что белок р53 распознается непосредственно антителами.
Чтобы окончательно показать, что белок р53 разделяет общий антигенный домен с белком Rb, начинают поиск аминокислотной последовательности белка р53, соответствующую Р5-области белка Rb. Если трехмерная структурная информация сохранилась в этих двух белках и в пептиде Р5, может существовать соответствующая область в белке Р53. Кроме того, пептид с таким консервативным антигенным доменом должен блокировать иммунопреципитацию Р53 RBl-Ab18 или RBl-Ab20. Осуществляют иммунопреципитацию белков Rb и р53 Rbl-Ab18 (фиг.2А) в присутствии различного количества этих пептидов. Один из таких пептидов - F19 - полностью блокирует иммунопреципитацию р53 Rbl-Ab18 при самой низкой испытанной концентрации (10 ug/мл) (фиг.2А, полосы 12-14). Также такую же концентрацию Rb-пептида р5 используют для блокирования преципитации (полосы 1 и 2). Напротив, все другие пептиды р53 не в состоянии блокировать иммунопреципитацию р53 Rbl-Ab 18 даже при концентрациях в 50-100 раз выше (полосы 3-11).
Область р5 и F19 является не единственной областью, которая показывает структурную гомологию между белками Rb и р53. Идентифицированы по меньшей мере две другие области при визуальном и компьютерном поиске. В табл. 1 указываются для сравнения области гомологии Rb и р53.
Хотя эти области могут показаться короткими, те аминокислоты, которые гомологичны у pRb и р53, являются также наиболее консервативными аминокислотами при эволюции в р53 (нет доступных данных для последовательности Rb в различных видах). Такая высокая степень гомологии между двумя супрессорными белками приводит к мысли, что эти области могут обладать важными функциями. Схематический чертеж положения областей гомологии в pRb и р53 дается на фиг. 2Б. В р53 все три области образуют кластер в С-конце белка, а в pRb области 1 и 3 образуют кластер в N-концевой половине, в то время как область Р5 находится в С-концевой половине. Однако как в р53, так и в pRb эти три области все локализованы вне известных доменов, которые важны для функции супрессии белков. Если эти области не являются ответственными за физическое взаимодействие, может быть, что они ответственны за регуляцию процесса взаимодействия. Так как это важно, чтобы иметь активные белки pRb и р53 для подавления нежелательного роста клеток, в равной степени важно иметь средства регуляции снижения их активности с тем, чтобы клетки могли пролиферировать. Присутствие в этих продуктах двух генов-супрессоров роста консервативных доменов может обеспечить их согласованную регуляцию. В самом деле, как показано ниже, оказывается, что эти области гомологии образуют домен, который определяет конформации двух указанных белков. А именно, разрыв этого домена посредством мутации в остатках консервативных аминокислот (подчеркнуты в приведенной выше табл. 1) любой из трех областей предоставляет двум белкам активную конформацию. Напротив, мутации в неконсервативных аминокислотах в этих областях эффекта не имеют.
Пример 2
На фиг.10 дается схематическое изображение конформации р53 дикого типа и мутанта. Описаны два домена - домен F (функция) и домен R (регуляция). Домен F является областью р53, содержащей пять доменов, сохраняющихся у позвоночных разных видов. Встречающаяся в природе мутация в одном из этих пяти доменов приводит к инактивации функции дикого типа р53. Настоящее изобретение показывает, что указанный домен F доступен в мутанте Rb/p53, но не в диком типе, с важными функциональными последствиями. Домен R представляет С-концевой мотив, который как раз находится вне домена, необходимого для связывания р53 со специфическими ДНК-последовательностями. Этот домен содержит домен гомологии Rb/p53 р1, р3, р5. Домен R замаскирован в мутанте Rb/p53, но не в диком типе, с важными функциональными последствиями, как подробно описывается в настоящем изобретении. Фиг.10 представляет схему как белка дикого типа р53, показывая домен F и домен R, так и белок мутанта р53, показывая домен F и домен R. На фиг.3 показано, что синтетический мутант р53 связывается со специфическими ДНК-последовательностями, что означает, что синтетический мутант р53 принимает конформацию, отличную от конформации дикого типа. Таким образом, связывающий ДНК домен синтетического мутанта р53 также может быть способным связываться с другими белками, которые не могут связываться с доменом F.
Пример 3
Области Р1, Р3, Р5 регулируют конформацию р53 и способность связывания ДНК
Способность р53 активировать транскрипцию тесно связана с его способностью связывать ДНК. Мутант р53, обнаруженный в раковых клеточных линиях, неспособен связываться с ДНК и неспособен активировать транскрипцию. Белок Р53 способен связываться со специфической ДНК-последовательностью в присутствии антитела Раb421. Тщательная проверка эпитопа Рab421 показывает, что он перекрывается областью Р3. Эпитоп, узнанный Раb421 (см. фиг.3), представляет собой последние четыре аминокислотных остатка в области Р3. Оказывается, что блокирование этой полной области Р3 антителом (Раb421) существенно изменяет конформацию белка, допуская связывание белка р53 со специфической ДНК-последовательностью. Следовательно, проверка связывания ДНК дает удобный способ испытания роли Р3 и других гомологичных областей Р1 и Р5 в управлении конформацией белка Р53. Как показано на фиг.3, хотя дикий тип р53 неспособен связываться со своей специфической ДНК-последовательностью (полоса 1), он связывается в присутствии антитела Pab421 (полоса 2). Когда консервативные аминокислоты областей либо Р1 (полоса 3), либо Р3 (полосы 5 и 7), либо Р5 (полоса 9) р53 мутированы, получающиеся в результате белки мутантов р53 способны связываться с ДНК даже в отсутствие Раb421. Получающийся в результате комплекс сверхсдвигается после связывания с Раb421 (полосы 4, 8 и 10 для P1, Р3, Р5 соответственно). Этот сверхсдвиг указывает, что область Р3 в этих мутантах еще способна связываться с антителами, и что способность мутантов связывать ДНК в отсутствие Раb421 не является следствием мутации в области Р3. Действительно, связывание антител Раb1801 вне этого С-концевого домена также допускает сверхсдвиг комплекса. Мутант, использованный на полосах 7 и 8, мутировав в первых 4 аминокислотных остатках области Р3, и это, очевидно, не влияет на связывание Раb421 с белком. Мутант, использованный на полосах 5 и 6, мутирован в консервативных аминокислотах последних 4 остатков в области Р3, и это разрушает связывание Раb421 с белком. Мутация в неконсервативных аминокислотах не обнаруживает эффекта, белки ведут себя, по существу, так же, как дикий тип. Таким образом, конформация белков мутантов р53 меняется на активную форму, когда области гомологии разрушены мутацией.
Примеры 3-7 настоящего изобретения демонстрируют (1) способность мутантного р53 связываться со специфическими ДНК-последовательностями; (2) способность мутантного р53 связываться с циклином Dl, D2 и D3; (3) способность мутанта р53 противодействовать фосфорилированию циклином A/cdk2-киназой в остатке серина 315; (4) способность мутантного р53 активировать транскрипцию in vivo; и (5) способность синтетического мутанта р53 индуцировать апоптоз опухолевых клеток при использовании в сочетании с химиотерапевтическим средством цисплатином.
Пример 4
Настоящее изобретение показывает, что р53 способен связываться с циклином Dl, D2 и D3. Разрегулированная экспрессия циклина D родственна развитию различных опухолей, в том числе лейкоза и опухоли молочной железы. Чтобы показать связывание р53 с циклином D, создают соответствующие рекомбинантные бакуловирусы и коинфицируют в клетки sf9. Копреципитация описывается фиг.11, где показано, что белок мутантного р53 способен связывать специфические ДНК-последовательности. Белок р53 осаждается с использованием моноклонального антитела Рab1801. Как показано на фиг.11, р53 дикого типа (полоса 1) неспособен связываться с каким-либо из трех циклинов Ds, когда они коэкспрессированы in vivo в инфицированных клетках sf9 (полосы 2, 3, 4). Напротив мутантная форма р53, в которой утрачены области р3 и р5 (полоса 5), способна связываться с циклином Dl (полоса 2), D2 (полоса 3) и D3 (полоса 4). Таким образом, мутация областей гомологии Rb/p53 приводит, в результате, к выставлению функционального домена р53, так что белок р53 способен взаимодействовать со своей связывающей мишенной ДНК и белками. Настоящее изобретение также показывает, что один из таких белков является фотоонкогенным продуктом - циклином Dl, 2 и 3, и разрегулированная экспрессия важна для онкогенеза.
Пример 5
Помимо активации (выставления) функционального домена р53, конформационные изменения, вызванные мутацией области Rb/p53, также приводят к специфическому изменению конформации
домена R в С-конце. А именно, сериновый остаток 315 не фосфорилируется какой-либо циклинзависимой киназой как дикий тип. Фиг.12 показывает, что области гомологии регулируют выставление С-конца р53, так что специфические сайты не фосфорилируются.
Белки р53 экспрессируются в бактериях. Аликвоту бактерий метят 35S-цистеином и метионином для количественного определения. Равные количества очищенного р53 (фиг.12Б) смешивают с циклином A:cdk 2 в буфере для фосфорилирования, содержащем 32P-ATP (аденозин-5'-трифосфат). Реакции фосфорилирования осуществляют при комнатной температуре в течение 30 мин. Белки р53 затем преципитируют с Раb1801. Как можно видеть на фиг.12А, р53 фосфорилируется сильно, в то время как синтетический мутант Р53, мутированный в остатках консервативных аминокислот в домене Р3 (полоса 3С или Р5 (полоса 5С), не фосфорилируется, если вообще фосфорилируется. В противоположность этому, мутация в остатках неконсервативных аминокислот даже в областях Р3 (3U) или в Р5 (5U) не оказывает действия на фосфорилирование белка. Двухмерное картирование фосфопептидов подтверждает, что серин-315 является основным остатком, который фосфорилируется.
Пример 6
Чтобы продемонстрировать функциональные свойства мутантов в областях гомологии, клеточную линию рака легких человека Н358, в которой отсутствуют эндогенные белки р53, котрансфектируют мутантами р53 и репортерной конструкцией, в которой САТ-ген находится под контролем CON.-последовательности р53, содержащей сайт консенсусного связывания. Фиг.13 показывает, что мутанты в области гомологии р53 транскрипционно активны in vivo. Как показано на фиг. 13А, мутанты р53 в области гомологии Р3 или Р5 в консервативных аминокислотах активны при промотировании транскрипции из промотора с сайтом связывания р53, и величина транскрипционной активации мутантами равна или несколько выше, чем активации диким типом. Напротив, мутант р4 (который мутирован в пятом консервативном функциональном домене) уничтожает способность р53 связывать циклин D или ДНК, и полностью дефектен при промотировании транскрипции. В середине фиг.13А полоса 0 представляет контроль, при котором используется только вектор без вставки р53. Как и ожидалось, промотирования транскрипции обнаружить не удалось. Во всех конструкциях р53 используют равные количества белков, как показано на фиг.13Б.
Пример 7
Показано, что внесение р53 дикого типа является эффективным при индукции апоптоза опухолевых клеток, когда одного лечения химиотерапевтическими средствами недостаточно, чтобы остановить рост опухоли. Чтобы показать, что синтетический мутант р53 индуцирует апоптоз, используют клеточную линию рака легких Н358, которая лишена эндогенного белка р53 вследствие инактивирующей мутации. Для сравнения, партию той же клеточной линии трансфектируют или диким типом, или мутантом Р4 (который, как показано рядом критериев, инактивен). Фиг. 14 показывает, что синтетический мутант р53 индуцирует апоптоз в клеточной линии рака легких Н358. Как показано посредством иммуноокрашивания с моноклональным антителом против р53 Раb122 (фиг.14А, 14В и 14Д), приблизительно 5% клеток Н358, трансфектированных диким типом, мутантами Р4 или Р5, соответственно показывают экспрессию белков р53 в ядре. (Сравните плотное окрашивание клеточных ядер и недостаточное окрашивание в окружающих клетках). После обработки клеток химиотерапевтическим средством c-DDP (цисплатин) в течение двух недель большинство клеток, которые экспрессируют дикий тип (фиг. 14Б) или мутант р53 р5 (фиг.14Е), претерпевают апоптоз и распадаются. В противоположность этому, клетки, экспрессируюшие инактивный мутант р53 р4 (фиг. 14Г), продолжают существовать и даже пролиферируют до большего числа, чем до обработки. Таким образом, настоящее изобретение показывает, что мутантный р53 р5 индуцирует апоптоз при сочетании с химиотерапевтической обработкой.
Пример 8
Таким образом, настоящее изобретение демонстрирует, что области гомологии p53/pRb (P1, Р3 и Р5) контролируют конформации белка р53 одновременно двумя путями. Во-первых, выставляется функциональный домен (домен F), который необходим для супрессии роста клеток и индукции апоптоза, когда области гомологии Rb/p53 в С-конце модифицированы или мутированы. Выставление функционально важной центральной области этих мутантных р53-белков показано их усилившейся, по сравнению с белком дикого типа, способностью связываться со специфическими белками и ДНК-последовательностями. Во-вторых, мутация гомологичных областей также вызывает конформационные изменения в С-концевых областях. Иными словами, домен R становится скрытым, так что способность р53 фосфорилироваться по серину 315 пропадает. Кроме того, выявление С-концевых доменов, необходимых для ренатурационной активности двухцепочечной ДНК/РНК, контролируется областью Р3, так как блокирование Р3-области Раb421 допускает трансляцию мРНК р53. Эта ренатурирующая активность предупреждает трансляцию вновь синтезированной мРНК р53. Следовательно, мутации любой из областей Р1, Р3 или Р5 в консервативных аминокислотах приводят, в результате, к конформации р53, при которой обнаруживаются различные виды активности, которые, как известно, являются важными для такой функции белков, как супрессия роста. Конформационные изменения не специфичны для любого одного определенного действия.
Пример 9
Изменение в регулировании фосфорилирования белков Rb, мутированных в области гомологии
Существует несколько способов различать активные и инактивные конформации белка pRb. Активный белок Rb недостаточно фосфорилирован и может подавлять рост клетки. Инактивный белок Rb сильно фосфорилирован. Если домен гомологии влияет на активную и инактивную конформацию pRb, мутация в областях Р1, Р3, Р5 должна влиять на способность белка подавлять рост клеток и его фосфорилирование соответственно. Области Р1, Р3 и Р5 pRb мутируют по отдельности в остатках консервативных аминокислот и проверяют способность мутантов подавлять рост клеток. Все мутанты способны подавлять рост трансфектированных клеток. Способность Rb-мутанта m89-0, который мутирован в остатках консервативных аминокислот в области Р5, подавлять рост нормальных и раковых клеток показана в двух примерах, приведенных ниже. Так как активность pRb регулируется фосфорилированием, если консервативная область сохраняет pRb в инактивной конформации, мутация области Р5 должна обладать ингибирующим действием на фосфорилирование мутантного Rb, так что белок является активным.
Существуют клеточные линии, которые лишены экспрессии pRB из-за мутации обоих аллелей RB-1, и такие клеточные линии подвержены также другим мутациям, которые придают им устойчивость к супрессирующему действию трансфетированного гена Rb. Клеточная линия цервикального рака С33А и субпопуляция Saos-2 являются такими клеточными линиями. Эти клеточные линии, следовательно, обычно допускают экспрессию мутантных белков, а клетки остаются жизнеспособными, допуская экстракцию более чем достаточного количества белка для проверки состояния фосфорилирования. Мутант Р5 HuAcPr-1-neo-PS С, мутированный в остатках консервативных аминокислот в области Р5, трансфектируют, следовательно, в эти клетки, и получают стабильные клеточные линии посредством одной клеточной очистки. Картина фосфорилирования мутантного pRb, выделенного из очищенной мутантной клеточной линии Saos-2#89, сравнивают с картиной фосфорилирования pRb дикого типа, экстрагированного из Rb дикого типа, трансфектированной и очищенной клеточной линии Saos-2#84. Иммунопреципитация pRb из S-фазы Saos-2#84 (дикий тип) и Saos-2#89 (мутант) показывает, что pRb дикого типа фосфорилирован сильно, в то время как мутантный pRb фосфорилирован недостаточно. Это приводит к мысли, что мутант pRb P5 остается в активной конформации, даже если клетки находятся в S-фазе. Таким образом, мутант P5 принимает конформацию, которая устойчива к фосфорилированию в определенных областях. Следует отметить, что белок еще фосфорилирован в других, функционально несущественных местах.
Так как одномерный анализ с помощью SDS-PAGE (электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия) обнаруживает только, что белок фосфорилирован недостаточно, но не показывает природу недофосфорилирования, осуществляют двухмерный анализ фосфопептидов меченного 32p pRb с использованием двух различных протеаз - трипсина и химотрипсина. Сравнение 2-мерных карт обнаруживает, что существует 2 сайта S10a и S10b, которые являются последовательно недофосфорилированными в мутанте при сравнении с диким типом (фиг.4А). Чтобы показать, что различие в картине фосфорилирования является следствием действительного различия в конформации белков, а не изменения ферментной специфичности in vivo, сравнивают картины фосфорилирования белков in vitro. Дикий тип и мутантный pRb фосфорилируют с использованием киназного препарата, который состоит из киназ, ассоциированных с циклином. Мечение in vitro зависит от ассоциированной с циклином киназы, так как антитела против киназы блокируют фосфорилирование. Фосфорилированный in vitro pRb анализируют с помощью 2-мерного петидного картирования, и, как показано на фиг. 4Б, в мутанте не используются те же сайты фосфорилирования. Следовательно, даже при поступлении более чем достаточного количества ферментов и оптимальных условиях фосфорилирования, при которых pRB дикого типа фосфорилируется до предела, мутантный pRb совершенно устойчив в сайтах фосфорилирования S10a и S10b. Изменение фосфорилирования по S10a и S10b является, следовательно, следствием врожденного различия конформации белков дикого типа и мутантных белков, а не изменения ферментной специфичности in vivo.
Пример 10
Белки Rb, мутированные в области гомологии, являются активными
Корреляция фосфорилирования в сайтах S10a и S10b с активностью pRb
Приведенные ниже данные демонстрируют, что изменения при фосфорилировании в S10a и S10b соотносятся со способностью pRb связывать большой Т-антиген SV40. Для исследования фосфорилирования in vitro белок Rb выделяют из клеток sf9, инфицированных рекомбинантным Rb-бакуловирусом, в котором полиэдронный ген частично замещен Rb-геном. Замечено, что в условиях высокого титра инфекции, хотя большинство экстрагированных белков Rb становится неспособным к связыванию большого Т-антигена SV40 путем фосфорилирования, небольшая часть белков Rb остается связанной с большим Т-антигеном. Это связывание показано на фиг.5. Белок Rb и большой Т-антиген SV40 получают из меченных 35S клеток SF9, инфицированных соответствующими бакуловирусами и обработанными киназами in vitro. Полоса 1 показывает, что экстрагированные белки Rb состоят из недостаточно фосфорилированных форм, а также из гиперфосфорилированных форм, и некоторые белки связаны с большим Т-антигеном. Большой Т-антиген может связывать только недофосфорилированную форму белка RB (полоса 2 и полоса 3). Фосфорилирование такого комплекса большой T:Rb различными количествами Rb-киназы (полосы 3-6) освобождают большую часть Rb-белка от большого Т-антигена. Такую форму RB-белков можно обозначить RB-E (Е=выставленный критический сайт). Однако приблизительно 20-30% Rb-белка (обозначенные RB-H) (Н=скрытый критический сайт) остаются прочно связанными с большим Т-антигеном, и весь комплекс может быть разрушен антителом против большого Т-антигена. Наиболее важно, что хотя возрастающее количество Rb-киназы может фосфорилировать Rb-белок в его наименее мигрирующей форме (сравните полосы 4-6 и полосы 8-10), гиперфосфорилированный Rb-белок остается связанным с большим Т-антигеном. Что преципитация этих Rb-белков не является следствием неспецифического поглощения белка А агарозой, видно при сравнении полосы 6 с полосой 2. Приблизительно 70% Rb-белка освобождается от большого Т-антигена. Этот освобожденный Rb-белок не является следствием неспецифической деградации белка, как показывает тот факт, что если реакционная смесь осаждается антителами против Rb, все Rb-белки разрушаются (как видно по полосам 8, 9 и 10). Способность различных форм Rb-белка связываться с большим Т-антигеном также видна из полос 8, 9 и 10, в которых меньшее количество большого Т-антигена приносится вниз Rb-белком.
Эти результаты совмещаются с присутствием двух классов сайтов фосфорилирования в белке Rb, причем один критичен для инактивации Rb-белка, так что он не может связываться с большим Т-антигеном, в то время как другие могут фосфорилироваться без воздействия на связь. Имеется 17 потенциальных сайтов фосфорилирования (S/TPXX) для Rb-киназного комплекса. Чтобы показать, что сайты фосфорилирования важны для инактивации Rb-белка, осуществляют анализ с помощью 2-мерного картирования Rb-белка, который остается связанным с большим Т-антигеном SV40 (RB-H), и тех белков, которые свободны от большого Т-антигена SV40 после фосфорилирования (RB-E). Должно существовать различие в сайтах фосфорилирования между этими двумя формами Rb-белка, если отделение Rb от большого Т-антигена является результатом фосфорилирования. Как показано на фиг.6, не обнаружено фосфорилирования S10a и S10b в pRb, который остается белком, связанным с большим Т-антигеном.
Мутация в консервативных аминокислотах в области Р5 приводит белок в активную конформацию. Фосфорилирование по S10a и S10b является функцией клеточного цикла и коррелирует со способностью клетки к пролиферации.
Пример 11
Фосфорилирование в S10a и S10b pRb и рост клеток
Приведенные ниже данные показывают, что изменение фосфорилирования по S10a и S10b регулируется в клеточном цикле зависимо. Надежно подтверждено, что выставление клеток, нормальных или раковых, для TGF-β часто приводит к остановке роста. Роль Rb при супрессии роста клеток описана ранее. Чтобы показать роль TGF-β при фосфорилировании pRb, используют клеточную линию рака молочной железы MDAMB231, рост которой можно прекратить путем обработки TGF-β. Состояние пролиферации клеток контролируют посредством поглощения содержащего тритий тимидина, а картину фосфорилирования меченного 32P pRb анализируют с помощью 2-мерного картирования пептидов. Показательно, что pRb из клеток, рост которых остановлен TGF-β, не фосфорилирован по сайтам S10a и S10b (фиг.7). Однако, когда клетки освобождаются от TGF-β, S10a и S10b снова фосфорилируются. Таким образом, pRb-белок который активен при росте блокированных клеток, не фосфорилируется по S10a и S10b. Что такое обратимое фосфорилирование специфично не только для эффекта супрессии роста TGF-β, показывает тот факт, что подобная картина фосфорилирования S10a и S10b обнаруживается также в pRb, выделенном из клеток, рост которых замедляется посредством депривации сыворотки. После "подкормки" либо сывороткой, либо факторами роста, S10a и S10b снова фосфорилируются. Кроме того, S10a и S10b не фосфорилируются в pRb, выделенном из клеток, рост которых замедлен ретиноевой кислотой. Следовательно, функционально критические сайты S10a и S10b в белке pRb могут подвергаться обратимому фосфорилированию при различных условиях роста.
Пример 12
Мутанты гена Rb и гена р53
Таким образом, как для Rb, так и для р53, мутация области гомологии дает, в результате, белки, принимающие конформацию, которая придает им активность. Примеры конформационно активных мутантов Rb и р53 и их применения при супрессии роста клеток приводятся ниже. Для белка Rb описаны два класса мутантов: (1) мутанты в регуляторной или гомологичной области и (2) мутанты в сайтах фосфорилирования. Для белка р53 описаны мутанты в области гомологии.
Фосфоаминокислотный анализ гиперфосфорилированных Rb-белков показывает, что аминокислоты серин и треонин фосфорилированы. В Rb-белке имеется 79 сериновых и 55 треониновых остатков. Из них 17 обнаружены в мотиве (S/TPXX) - потенциальном сайте фосфорилирования для сdс2-киназы. Известно, что cdc2-киназа и родственные киназы способны фосфорилировать Rb-белок.
Представляется, что существуют два класса сайтов фосфорилирования в белке Rb, причем один из них критичен для инактивации Rb-белка, так что он не может связываться с большим Т-антигеном, в то время как другие могут фосфорилироваться без влияния на связывание. Поскольку существует по меньшей мере 17 потенциальных сайтов фосфорилирования (S/TPXX) для Rb-киназного комплекса, некоторые могут быть важными для инактивации Rb-белка. Этими 17 сайтами фосфорилирования являются Т005, S230, S249, Т252, Т356, Т373, S567, S608, S612, Т773, S780, S788, S795, S807, S811, Т821, Т826, где Т и S обозначают треонин и серин соответственно, а следующее за ними число означает номер остатка аминокислоты в Rb - белке.
Мутированный ген ритинобластомы мутирован предпочтительно одним из двух различных способов, которые оба влияют на способность белка фосфорилироваться. Во-первых, ген можно мутировать путем замены аминокислот в консервативных гомологичных областях Rb-гена. Предпочтительно консервативную гомологичную область Rb-гена выбирают из группы, состоящей из P1, P3 и Р5, как описано здесь. Представительные примеры мутированных Rb-генов, которые кодируют мутированный Rb-белок, показаны в послед. 1 и 2. Специалист в этой области техники, знающий о значении консервативных гомологичных доменов для фосфорилирования белков, может легко построить другие мутированные Rb-гены, которые кодируют другие нужные мутированные Rb-белки.
Другой способ предупреждения фосфорилирования и, следовательно, инактивации Rb-белка состоит в том, что указанный ген мутируют путем замены аминокислот в сайтах фосфорилирования. Сайты фосфорилирования выбирают предпочтительно из группы, состоящей из сайтов Т005, S230, S249, Т252, Т373, S567, S608, S612, Т773, S780, S788, S795, S807, S811, Т821 и Т826. В сокращениях для обозначения перечисленных выше сайтов фосфорилирования S относится к серину, Т - к треонину, а число обозначает место расположения аминокислоты в последовательности Rb-белка. Для фосфорилирования описанных здесь мутантов каждый из треониновых или сериновых остатков мутируют в аланин в отдельных плазмидах. Как установлено ранее, существует по меньшей мере 2 класса сайтов фосфорилирования, один из которых является функционально важным для инактивации pRb. Следовательно, один или несколько мутантов, созданных как описано выше, должны сводить на нет фосфорилирование мутантного pRb и предупреждать его инактивацию.
Другие варианты осуществления настоящего изобретения также относятся к плазмидам, содержащим ДНК, кодирующую мутированные Rb-белки. Кроме того, также идет речь о плазмиде, приспособленной для экспрессии в рекомбинантной клетке, содержащей ДНК, кодирующую мутированный Rb-белок - послед. 1, и регуляторные элементы, необходимые для экспрессии кДНК в клетке, и плазмиде, адаптированной для экспрессии в рекомбинантной клетке, содержащей ДНК, кодирующую мутированный Rb-белок - послед. 2, и регуляторные элементы, необходимые для экспрессии кДНК в клетке.
Пример 12
Мутанты гена р53
В другом варианте осуществления настоящего изобретения мутированный ген-супрессор роста представляет собой мутированнный ген р53. Предпочтительно ген р53 мутируют путем замены аминокислот в консервативных гомологичных областях гена р53 (подчеркнуты в приведенной выше табл. 1). Подобным образом, консервативную гомологичную область гена р53 выбирают из группы, состоящей из P1, P3 и Р5. Мутанты могут составляться из мутаций либо одной из Р1, P3 или Р5, или в любом сочетании (включая мутации всех трех областей). Кроме того, мутанты, в которых утрачены С-концевые аминокислотные остатки 295-393, еще активны при связывании со специфической ДНК-последовательностью.
Пример 13
Применение мутантов pRb и р53 для супрессии роста клеток
Настоящее изобретение также описывает новые трансфектированные клетки, например трансфектированную клетку, содержащую изолированную ДНК-молекулу по п. 1, которая кодирует мутированный Rb-белок. Кроме того, настоящее изобретение относится к устойчиво трансфектированным клеткам, экспрессирующим мутированный Rb-ген, кодирующий мутированный Rb-белок. Предпочтительно трансфектированные клетки настоящего изобретения содержат мутированный Rb-ген, содержащий нуклеотидную последовательность, кодирующую мутированный Rb-белок, показанную в послед. 1 или в послед. 2. Кроме того, настоящее изобретение также относится к устойчиво трансфектированной клетке, экспрессирующей мутированный ген р53, кодирующий мутированный белок р53.
Настоящее изобретение также относится к способу лечения паталогических клеточнопролиферативных заболеваний, включающему введение в нераковую пролиферирующую клетку ДНК-молекулы мутированного гена-супрессора роста. Введенная молекула, в одном из вариантов осуществления настоящего изобретения, представляет собой мутированный ген Rb или р53. Ген мутируют путем замены аминокислот в консервативных гомологичных областях Rb-гена, или указанный ген мутируют путем замены аминокислот в сайтах фосфорилирования. Консервативные гомологичные области и сайты фосфорилирования являются теми же, какие описаны выше.
Как правило, этот способ можно использовать для лечения любого клеточнопролиферативного заболевания. Характерными примерами неракового клеточнопролиферативного заболевания являются псориаз, доброкачественные пролиферативные кожные заболевания, ихтиоз, папиллома, базалиома, плоскоклеточный рак, фибропролиферативные заболевания, вазопролиферативные заболевания и дерматопролиферативные заболевания.
Настоящее изобретение также относится к способу лечения у индивидуумов заболеваний с малигнизированными клетками, включающему введение в пролиферирующую раковую клетку ДНК-молекулы мутированного гена Rb или р53. Эти мутированные гены создаются так, как описано выше.
Вообще способ лечения заболеваний со злокачественными клетками подобен лечению нераковых клеточнопролиферативных заболеваний. Характерными примерами заболеваний, вызванных пролиферирующими раковыми клетками, являются, но не ограничиваются перечисленными, остеосаркома, фибросаркома, ретинобластома, рак молочной железы, мочевого пузыря, цервикальный рак, рак легких, толстой кишки, яичников, почек, панкреатической железы и предстательной железы.
Согласно способу настоящего изобретения можно управлять клеточным пролиферативным процессом путем введения мутантного RB- или р53-белка, чтобы предупредить или ингибировать аномальную пролиферацию при самых разных клеточнопролиферативных заболеваниях. Управление пролиферативным процессом может осуществляться посредством включения в мишенную пролиферирующую клетку ДНК-конструкции, которая кодирует элемент мутантного RB- или р53-белка.
Настоящее изобретение также относится к способу лечения фокальных клеточнопролиферативных заболеваний, включающему введение мутированного Rb- или р53-гена в пролиферирующие клетки. Вообще пролиферирующая клетка может являться случаем таких характерных заболеваний, как фибропролиферативные, вазопролиферативные и относящиеся к опухолевым заболеваниям глаз.
В другом варианте осуществления настоящего изобретения сайт фосфорилирования Rb-гена мутируют перед введением в клетку. Существует 17 потенциальных сайтов фосфорилирования в Rb-белке. Мутация сериновых или треониновых кодирующих последовательностей в кДНК Rb в аланин или валин или другие остатки будет, следовательно, приводить к получению перманентно активного Rb-белка, который не может инактивироваться фосфорилированием. Иными словами, клетка-хозяин не будет способна инактивировать Rb-белок путем фосфорилирования. Включение такого мутированного Rb-гена в клетку будет, следовательно, приводить к замедлению роста. Все указанные мутанты субклонированы в человеческий β-актиновый промоторный вектор. Для субклонирования кДНК Rb полную открытую рамку считывания лигируют с синтетическим линкером, содержащим сайт BamH1 в 5'-конце, и синтетическим линкером, содержащим ААТААА в сайте BamH1 в 3'-конце. Получающийся в результате фрагмент BаmН1 субклонируют в сайт BamН1 вектора и отбирают клон с правильной ориентацией.
Пример 14
Получение мутантов m89-0 и m88-0 р5
Чтобы создать мутант 89-0, пару ДНК-олигонуклеотидных затравок (Pm1 и QM1), содержащих область 'P5', которую мутируют, и пару олигонуклеотидов, фланкирующих область 'Р5' (Р3 и Q3), синтезируют с использованием синтезатора для синтеза олигонуклеотидов с парой ПЦР АВ1 в соответствии с инструкциями изготовителя. Используя в качестве матрицы кДНК Rb дикого типа, осуществляют 40 циклов полимеразной цепной реакции (ПЦР) с затравками Р3 и Qm1. В другой пробирке осуществляют 40 циклов полимеразной цепной реакции с затравками Pm1 и Q3. После завершения реакции отбирают небольшую аликвоту продукта реакции из первой пробирки и осуществляют 80 циклов ПЦР в присутствии избытка затравки Р3. Подобным образом во второй пробирке осуществляют 80 циклов ПЦР в присутствии избытка затравки Q3. Преимущественно одноцепочечные продукты реакций из этих двух пробирок затем соединяют и продолжают действие затравки в течение 20 циклов. Получающийся в результате двухцепочечный продукт, содержащий теперь мутированную область Р5, субклонироуют в экспрессионную плазмиду Rb HuBAcpr-1-neo-PQ (m89-0) в сайтах Mlu 1 и Hind 3. Получающаяся в результате плазмида имеет мутированную область Р5, показанную ниже, с подчеркнутыми мутированными аминокислотами. К870 и Н890 относятся к аминокислотным остаткам лизина и гистидина в позициях 870 и 890, соответственно в Rb-белке. Подобным образом создают m88-0.
Rb дикого типа: - K870PLKKLRFDIEGSDEADGSKH890
Мутант Rb m89-0: - K870PLKKLRFDIEASAEVDASIH890
Мутант Rb m88-0: - K870LLIKPRYDTEGSDEADGSKH890
Пример 15
Действие трансфектированных плазмид на человеческую фибробластную клеточную линию
Влияние ретинобалстомной кДНК на рост клеток показывают через трансфекцию мутантом m89-0 в линию нормальных человеческих фибробластов WS1. Ген для большого Т-антигена SV40 используют для трансфекции в качестве контроля. Затем, чтобы контролировать эффективность трансфекции, трансфектируют плазмиду pPVUO-Neo, которая содержит ген для большого Т-антигена SV40. Кроме того, в качестве контроля используют инактивную мутантную форму Rb-гена "HuBAcpr-l-neo-Pl6". Для трансфекции по 100 мкг каждой из плазмидных ДНК смешивают со 107 экспоненциально выросшими клетками WS1 в конечном объеме 0,8 мл среды RPMI 1640 (Gibco) с добавлением 10% FCS в ячейке камеры для электропорации Cell-PoratorTM (BRL). Электропорацию осуществляют при 200 В и 1180 мкФ. Электропорированным клеткам дают возможность восстановиться при комнатной температуре в течение 10 мин и затем разбавляют в RPMI 1640 с добавлением 10% фетальной телячьей сыворотки (FCS), и высевают на планшеты при плотности клеток 2Х104 клеток/см2. Клеткам дают возможность закрепиться и расти в той же среде в течение двух суток. После этого среду заменяют на RPMI 1640+10% FCS+15 ug/мл G418 (GIBKO). Каждые три дня берут планшеты (при двукратном повторе) для гистоиммунохимического окрашивания с использованием либо кроличьих поликлональных антител против Rb-белка RB1-ABA1 (фиг.8А), либо мышиного моноклонального антитела против большого Т-антигена SV40 Pab101 (фиг. 8Б). Как можно видеть из фиг.8А, через 13 суток после трансфекции и селекции в среде G418 клетки WS1, экспрессирующие трансфектированную плазмиду кДНК Rb m89-0, интенсивно окрашиваются антителами против Rb-белка. Однако клетки, которые экспрессируют Rb-белок, остаются в виде отдельных клеток и не делятся. В противоположность этому, клетки, которые экспрессируют трансфектированный большой Т-антиген SV40 (SVLT), продолжают делиться на колонии, как показано на фиг.8Б группой клеток, окрашенных положительно мышиным антителом против SVLT. Таким образом, сверхэкспрессия кДНК Rb m89-0 в клетке ведет к полной остановке клеточного роста нормальных клеток WS1. Клетки, трансфектированные инактивной формой Rb HuβAcpr-l-neo-P16, не супрессированы и делятся на колонии.
Пример 16
Действие трансфектированных плазмид на клеточную линию рака мочевого пузыря
Мутантные плазмиды m89-0 и HuβAcpr-l-neo-Pl6 также трансфектируют в клетки рака мочевого пузыря человека TCCSUP, которые не содержат эндогенного Rb-белка, с использованием тех же процедур, какие описаны выше. Используемые плазмиды, методология трансфекции и иммуноокрашивания идентичны описанным выше.
Как можно видеть из фиг.9А, клетки, экспрессирующие трансфектированную кДНК m89-0, перестают делиться. В противоположность этому, клетки, экспрессирующие трансфектированную HuβAcpr-l-neo-P16, делятся с образованием колоний (фиг. 9Б). Сверхэкспрессия Rb кДНК m89-0 ведет к серьезному запаздыванию роста опухолевых клеток in vitro.
Пример 17
Помимо мутантов в областях гомологии между Rb и р53, создают мутации в р53. В табл. II приведены неполные аминокислотные последовательности р53 дикого типа и полученных мутантов по консервативным аминокислотам. Кроме того, в табл. II приводится ДНК-последовательность, соответствующая мутантной аминокислотной последовательности. Чтобы получить мутанты, синтезируют и отжигают вместе две затравки. Осуществляют ПЦР, как описано выше. Как показано выше, изменение областей Р1, Р3 и Р5 приводит к изменению конформации белка р53, так что он теперь способен связываться непосредственно со своей мишенной ДНК-последовательностью.
Пример 18
Генерация рекомбинантного ретровируса, содержащего мутантный Rb-ген
Фрагмент Hind III/Bam HI, содержащий полную кодирующую область мутантного Rb#89, субклонируют в сайты Hind III/BgIII в ретровирусном векторе. Получающиеся в результате плазмидные векторы трансфектируют в клеточную линию Psi-2. Среду, использованную для выращивания трансфектированных клеток, инфицируют в другую клеточную линию РА317. Клетки, которые продуцируют рекомбинантный вирус, отбирают в G418 и собранный из среды ретровирус концентрируют и очищают с градиентом сахарозы. Мутанты гена р53 испытывают идентичным способом.
Пример 19
Действие вируса GlNaSvRb89 на клеточную пролиферацию в глазах
Индуцируют у кроликов экспериментальную пролиферативную ретинопатию стекловидного тела (PVR) путем инъекции кроличьих фибробластов и индукции местной раны. Эта процедура состоит из индуцирования раны в конечности и инъецирования 2Х105 кроличьих фибробластов в стекловидное тело под общим наркозом. После операции кролик получает местно мазь, содержащую антибиотик.
Рекомбинантные ретровирусы с мутантным Rb- или р53-геном инъецируют животным в стекловидное тело (2Х105 клеток/кролика) под общим наркозом. Сначала проверяют локальную толерантность вирусов путем оценки максимальной дозировки вируса (концентрации вируса, которую используют, и объем инъекции вируса). Ретровирусы уже применяли для инъекции под сетчатку мышам, как сообщается, без побочных эффектов (Turner and Cepko, Nature 328:132, 1987). При всех последующих обработках будет использоваться максимальная дозировка, которая не будет вызывать побочных эффектов.
Рост клеток in vivo контролируют с помощью фотографии. Степень отслаивания сетчатки сравнивают с контрольной группой, где инъецировали только ретровирус, содержащий 1-галактозидазный ген. Дополнительно рост клеток in vivo контролируют посредством прижизненного мечения бромодезоксиуридином (BrdU). За один час до эйтаназии кролику дают 50 мг/кг BrdU внутривенно, чтобы пометить пролиферирующие клетки. После эйтаназии клетки анализируют на включение в их ДНК BrdU путем иммуноокрашивания с антителами к BrdU. Одновременно также осуществляют иммуноокрашивание клеток с антителами против белка Rb или р53 или белка 1-галактозидазы, чтобы оценить эффективность инфекции.
Оптимальное время подавления ретровирусом роста инъецированных клеток оценивают с помощью инъекции вируса в разное время после индукции PVR. Также определяют действие стекловидного тела на эффективность инфекции в кроличьих фибробластах. Также определяют время задержки присоединения этих вирусов к кроличьим фибробластам. Время задержки присоединения этих вирусов к кроличьим фибробластам, которые стимулированы факторами роста фибробластов для увеличения скорости роста, также определяют.
Все патенты и публикации, упомянутые в настоящем описании, свидетельствуют об уровне специалистов в этой области техники, к которым обращено изобретение. Все патенты и публикации включены в настоящее в качестве ссылок в той же степени, как если бы для каждой отдельной публикации было конкретно указано, что она включена в качестве ссылки.
Специалистам в этой области техники легко понять, что настоящее изобретение хорошо адаптируется для осуществления целей и получения упомянутых конечных результатов и преимуществ, которые ему присущи. Представленные примеры вместе со способами, процедурами, обработками, молекулами и конкретными соединениями, описанными здесь, являются характерными примерами предпочтительных вариантов осуществления настоящего изобретения, являются именно примерами и не предназначены для ограничения объема изобретения. Специалисты в этой области техники используют изменения в них и другое применение, которые заключены в сущности изобретения, которая определяется объемом притязаний формулы изобретения.











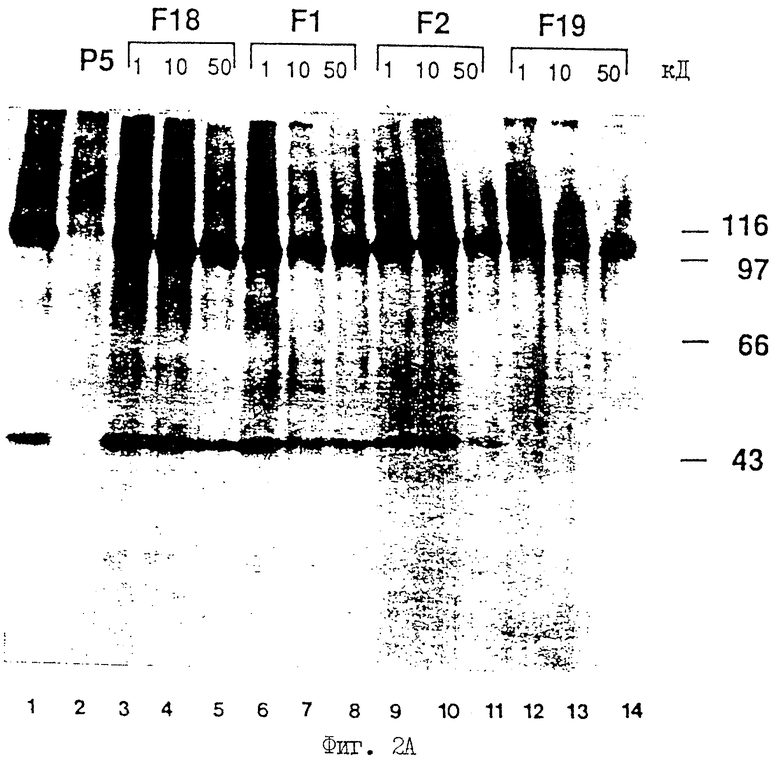
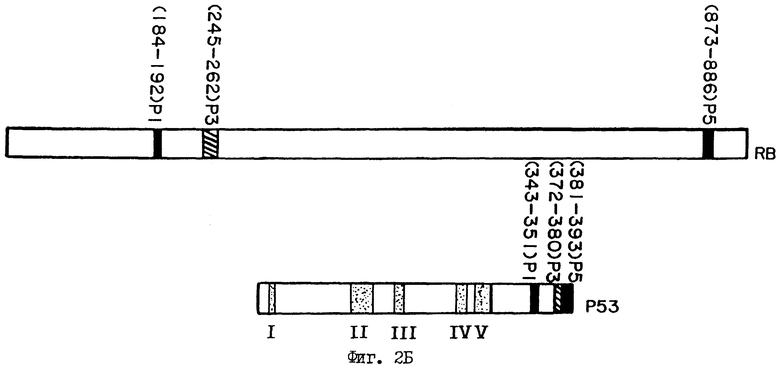

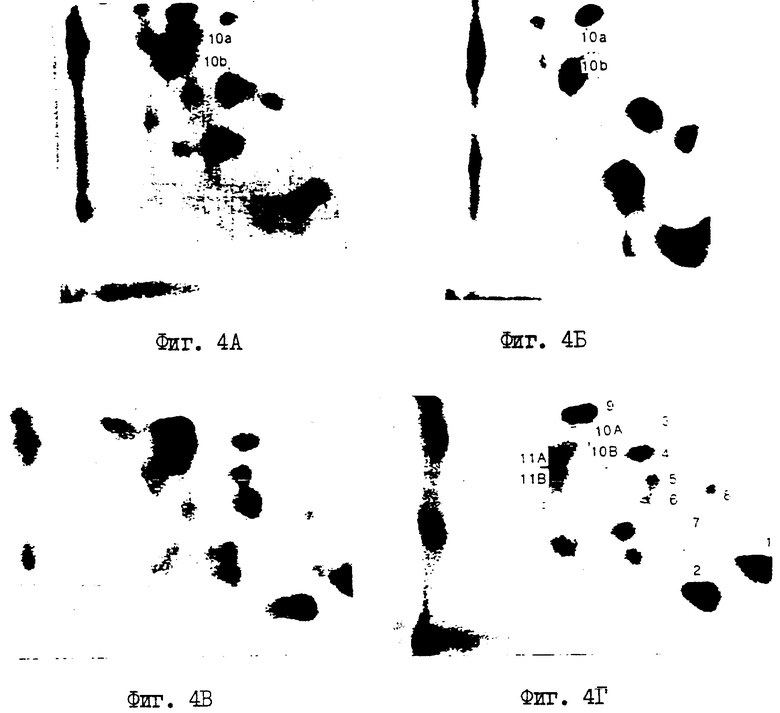
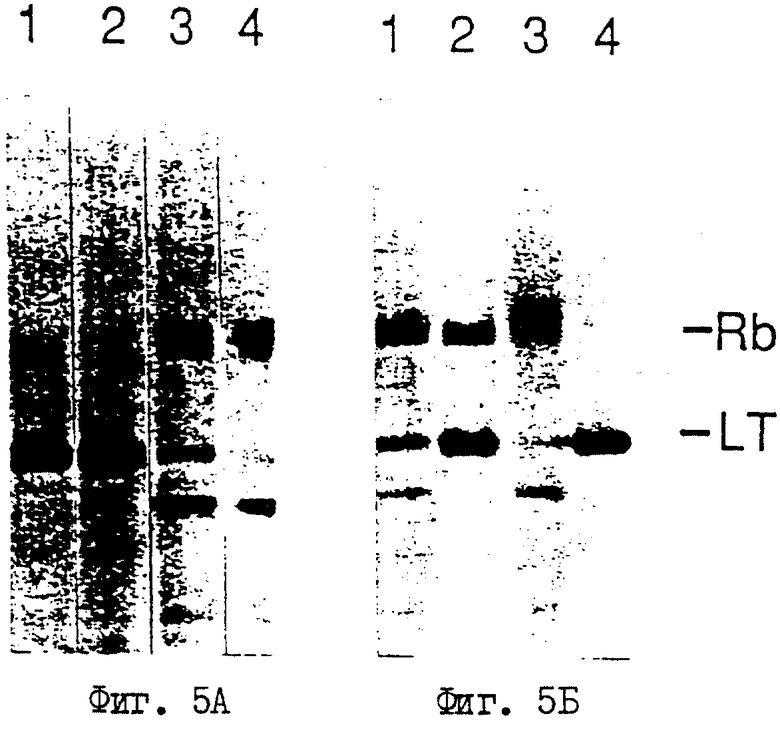
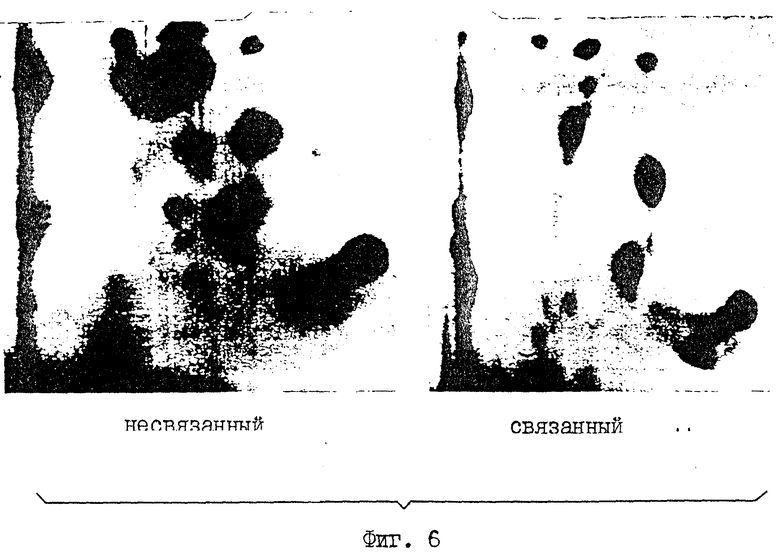
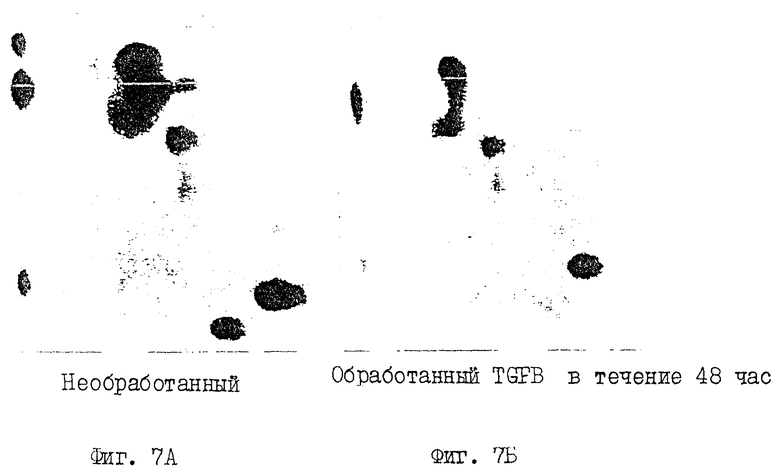


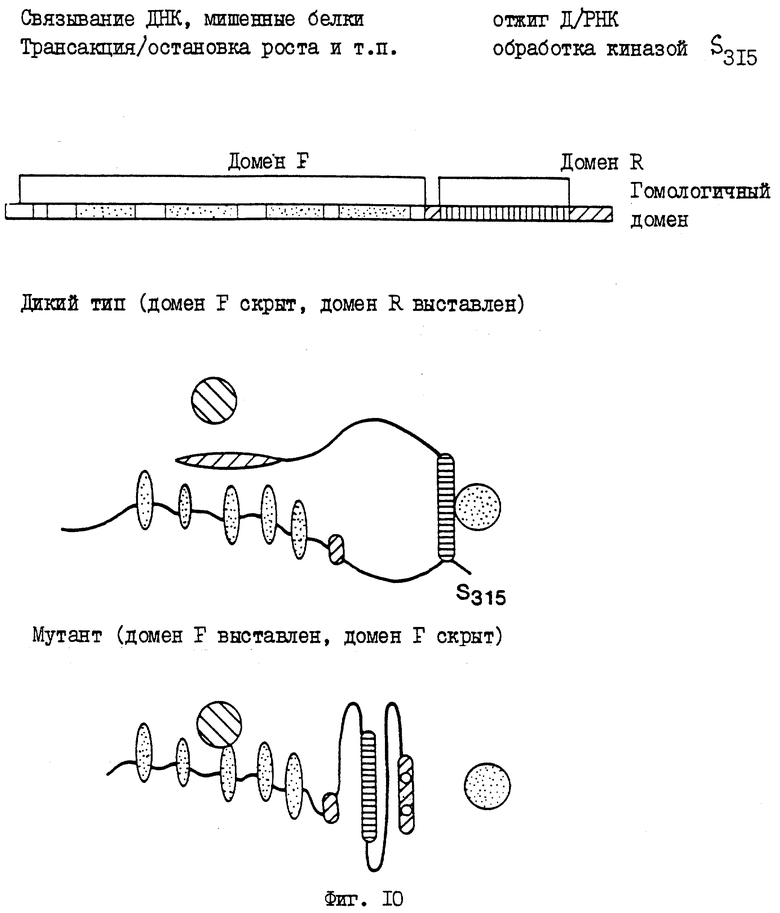
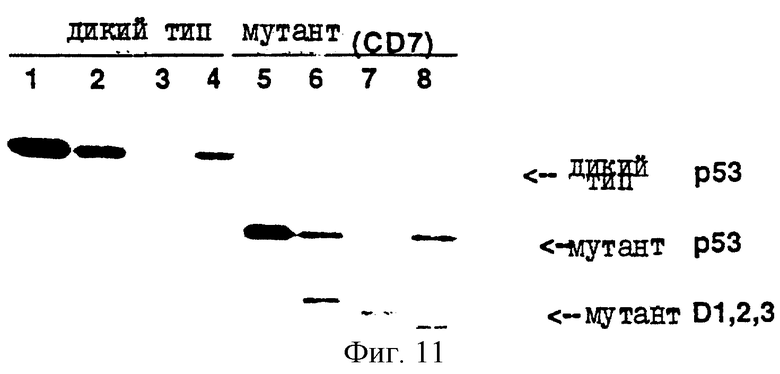
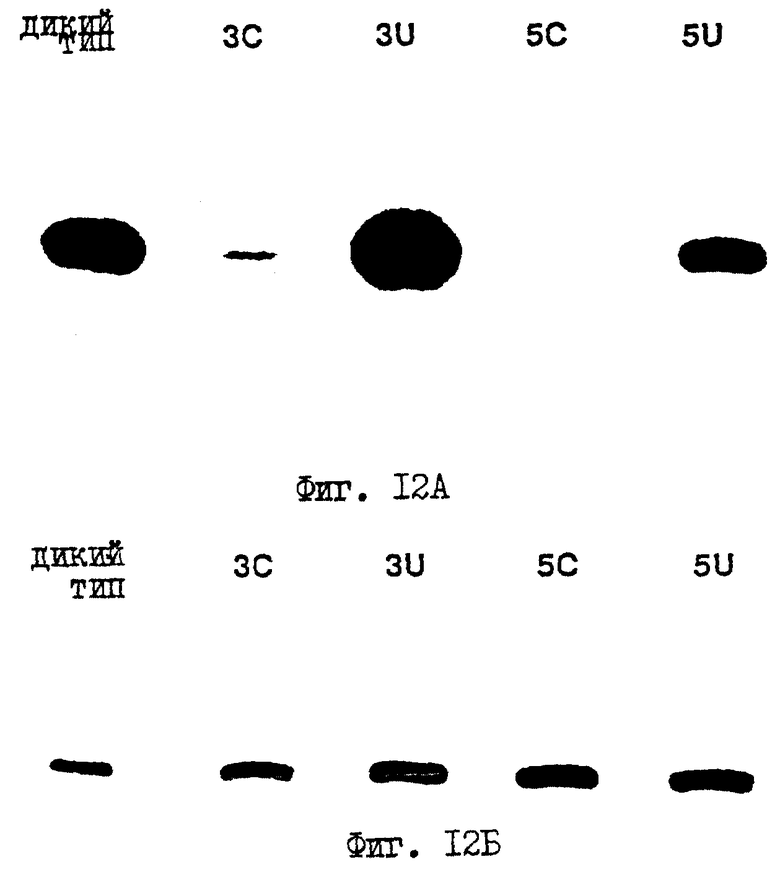
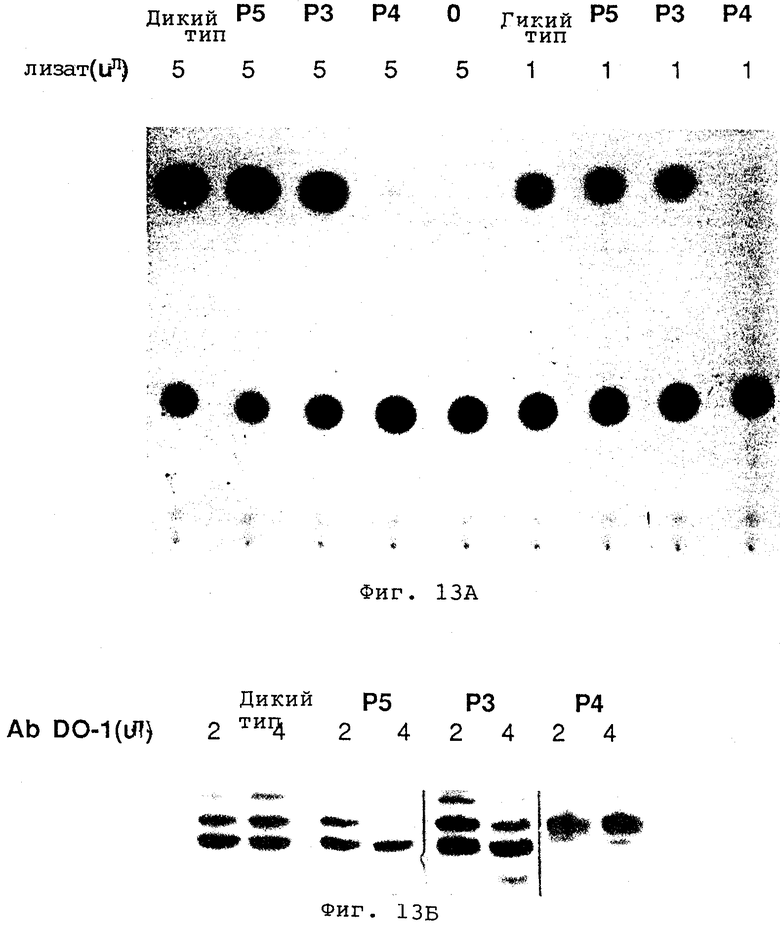
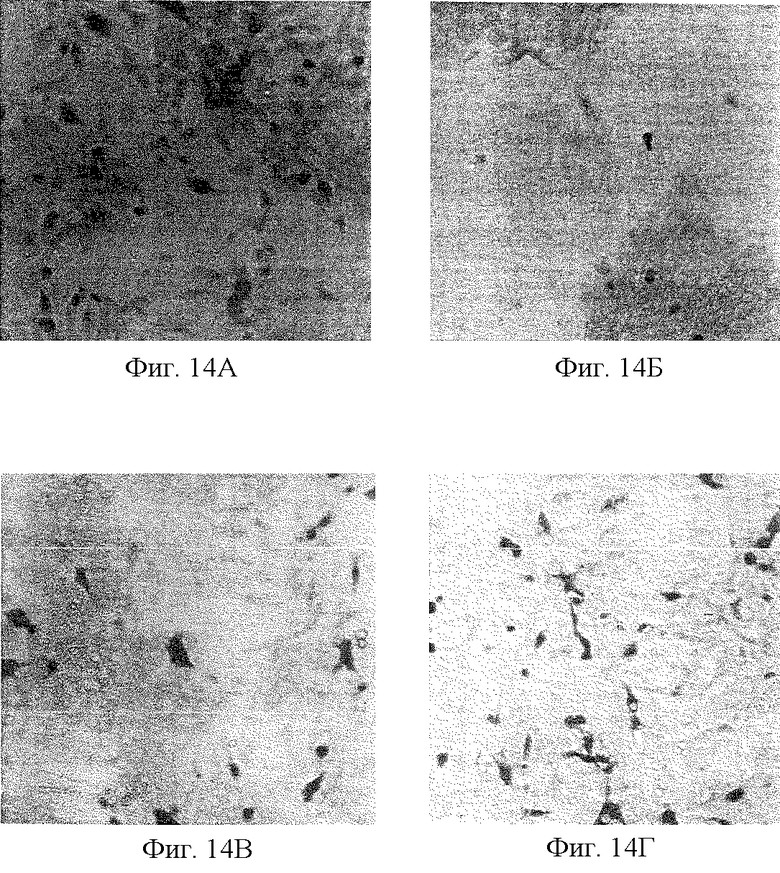
Изобретение относится к области регуляции роста клеток. Синтетический мутантный ген Rb и p53 мутированы путем изменения нуклеотидов, кодирующих аминокислоты в консервативных гомологичных областях на кодирующие неконсервативные аминокислоты. Аминокислотные последовательности приведены в описании. Мутированные области содержат то же количество, больше или меньше аминокислот, чем области дикого типа. Синтетический мутантный ген Rb мутирован путем изменения нуклеотидной последовательности, которая кодирует аминокислоты в сайтах фосфорилирования белка Rb. Плазмида сконструирована на основе плазмиды Rb HuBa cpr-1-neo-PQ с включением в нее синтетического мутантного гена Rb или p53. Клеточную пролиферацию ингибируют введением в незлокачественную пролиферирующую клетку этих плазмид. Ретинобластомный белок кодируется синтетическим мутантным геном Rb. Ретинобластомный белок p53 кодируется синтетическим мутантным геном p53. В клетку вводят ретинобластомный белок p53 для индуцирования апоптоза. Пролиферацию опухолевой клетки с мутацией циклинового белка ингибируют введением в клетку ретинобластомного белка p53. Изобретение позволяет лечить патологические клеточнопролиферативные состояния. 11 с. и 6 з.п. ф-лы, 14 ил., 2 табл.
| ПРИЖИМНОЕ УСТРОЙСТВО ДЛЯ МАГНИТНОГО НОСИТЕЛЯ | 0 |
|
SU293266A1 |
| WO 8906703, A1, 27.07.1989 | |||
| WO 9109114, A1, 27.06.1991 | |||
| WO 9514777, A1, 01.06.1995 | |||
| WO 9516771, A1, 22.06.1995 | |||
| WO 9601907, A1, 25.01.1996 | |||
| US 5382510, А, 17.01.1995 | |||
| МАНИАТИС Г | |||
| и др | |||
| Методы генетической инженерии | |||
| - М.: Мир, 1984, стр | |||
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
Авторы
Даты
2002-11-10—Публикация
1995-12-22—Подача